Дорогие коллеги, дорогие друзья!
«Поэт пустых пространств», «архитектор одиночества», «мечтатель без иллюзий», урбанист, предшественник поп-арта — как только не называли Эдварда Хоппера на протяжении всего XX века. Его картины, наполненные ожиданием, экзистенциальной...

Эдвард Хоппер. Автомат. 1927 г.
Холст, масло, 71,4 х 91,4 см. Демойнский центр искусств, Де-Мойн, США
НОВОСТИ ОНКОЛОГИИ / МОСКВА ВНОВЬ СТАЛА ПЛОЩАДКОЙ ДЛЯ МЕЖДУНАРОДНОГО ЭКЗАМЕНА ESMO
18 октября 2025 года в Москве состоялось значимое событие для онкологического сообщества России и стран СНГ - 82 специалиста из разных городов и стран, прошедшие обучение в Академии RUSSCO, собрались для участия в...
НОВОСТИ ОНКОЛОГИИ / ОФИЦИАЛЬНОЕ ИЗДАНИЕ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ – ЖУРНАЛ «ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ» – ВКЛЮЧЕН В «БЕЛЫЙ СПИСОК» (ЕГПНИ)
С радостью сообщаем вам, что ежеквартальный научно-практический рецензируемый медицинский журнал «Злокачественные опухоли» включен в «Белый список» – Единый государственный перечень научных журналов (ЕГПНИ).
НОВОСТИ ASTRO 2025 /
В Сан-Франциско состоялся очередной ежегодный конгресс ASTRO 2025. Наиболее ожидаемыми событиями этого радиотерапевтического года были результаты 5 рандомизированных исследований, которые должны были быть...

ЗНАКОМЬТЕСЬ: СВЕРДЛОВСКОЕ РЕГИОНАЛЬНОЕ ОТДЕЛЕНИЕ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ (RUSSCO)
Свердловская область образована 17 января 1934 года. Регион находится в 2000 километрах к востоку от Москвы, на границе Европы и Азии, охватывает территорию Среднего и Северного Урала, а также часть Западно-Сибирской...
ТЕРАПЕВТИЧЕСКИЕ ВАКЦИНЫ ДЛЯ ВПЧ-АССОЦИИРОВАННОГО РАКА ШЕЙКИ МАТКИ: НАДЕЖДА ИЛИ РАЗОЧАРОВАНИЕ?
В последнее время в России наблюдается рост интереса к противоопухолевым вакцинам, во многом подогреваемый средствами массовой информации. Уверен, каждый онколог не раз желал вечно спешащим журналистам добра и здоровья...

ОКОНЧАТЕЛЬНЫЕ РЕЗУЛЬТАТЫ PACIFIC-2: АНАЛИЗ НЕУДАЧИ В ЦИФРАХ
13 октября в журнале JCO опубликованы наконец результаты исследования PACIFIC-2 [1], которые уже были представлены ранее на крупных онкологических мероприятиях, а пресс-релиз по данным этой работы появился еще в ноябре 2023 года.
КСЕВИНАПАНТ С ХЛТ ПРИ ОГШ: ПРИЧИНЫ ГРОМКОЙ НЕУДАЧИ И РАЗБОР ПОЛЕТОВ
Пять лет назад на ESMO 2020 французскими авторами группы GORTEC были представлены весьма позитивные данные по применению комбинации ксевинапанта с химиолучевой терапией у больных с местнораспространенным плоскоклеточным
Анонс
-

11 ДЕКАБРЯ 2025
ЭКЗАМЕН ПО КЛИНИЧЕСКОЙ ОНКОЛОГИИ RUSSCO
в рамках работы XXIX Российского онкологического конгресса
-

11-13 ДЕКАБРЯ 2О25
XXIX РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС 2025
МОСКВА
Дорогие коллеги, дорогие друзья!
«Поэт пустых пространств», «архитектор одиночества», «мечтатель без иллюзий», урбанист, предшественник поп-арта — как только не называли Эдварда Хоппера на протяжении всего XX века. Его картины, наполненные ожиданием, экзистенциальной тоской, неким предчувствием, идеализирующие одиночество своими смыслами и символами, созданные в начале ХХ века, удивительным образом актуализировали события и переживания людей века XXI. Эта дама, в одиночестве отпивающая горячий чай в кафе-автомате, когда темнота за окном спустилась ранее привычного, и обогреватель присутствует как неотъемлемый атрибут надвигающейся зимы – яркий символ позднего октября. Все мы немножко в депрессии, понимая, что весна, солнце и тепло наступят лишь через полгода. Однако осень, зима и ранняя весна пролетают столь же быстро, как и теплое лето – это лишь момент жизни, ее восприятия.
Всего лишь момент отделяет нас от XXIX Российского онкологического конгресса – всего лишь месяц. Мы с нетерпением ждем встречи с вами, дорогие коллеги, в Москве, в реальной жизни или онлайн, ибо эта жизнь показывает: мы должны ценить каждый ее кусочек, каждую встречу со старыми или новыми друзьями, каждую возможность узнать что-то новое и шагнуть вперед.
Ждем ваc на страницах нового печатного номера газеты!
Ваша команда RUSSCO
Эдвард Хоппер. Автомат. 1927 г.
Холст, масло, 71,4 х 91,4 см. Демойнский центр искусств, Де-Мойн, США

НОВОСТИ ОНКОЛОГИИ / МОСКВА ВНОВЬ СТАЛА ПЛОЩАДКОЙ ДЛЯ МЕЖДУНАРОДНОГО ЭКЗАМЕНА ESMO

18 октября 2025 года в Москве состоялось значимое событие для онкологического сообщества России и стран СНГ - 82 специалиста из разных городов и стран, прошедшие обучение в Академии RUSSCO, собрались для участия в престижном международном экзамене ESMO. Этот экзамен стал важной проверкой знаний в области онкологии и уникальной возможностью подтвердить профессиональный уровень на мировом уровне.
Экзамен ESMO проводится European Society for Medical Oncology (ESMO) – ведущей международной организацией, объединяющей более 15 000 онкологов, радиационных терапевтов и хирургов на 130 стран. Именно ESMO отвечает за подготовку и подведение итогов экзамена, результаты которого будут объявлены в ноябре 2025 года.
В этом году экзамен собрал участников из 13 стран. «Москва стала одной из 13 площадок по всему миру, где проводятся эти испытания. Такое широкое географическое покрытие стало возможным благодаря партнерству ESMO с RUSSCO – ведущей образовательной платформой в области клинической онкологии и России». Это сотрудничество способствует развитию международного стандартов и повышению качества подготовки специалистов.
Экзамен представляет собой 100 готовых заданий на английский языке, которые необходимо выполнить за 150 минут. Вопросы охватывают ключевые аспекты диагностики и лекарственного лечения, захваченные полнообразованием, включая около 10% заданий по описываемому СНГ. Такая структура позволяет комплексно оценить знания кандидатов и их готовность к современным вызовам онкологической практики.
География участников впечатляет:
- Москва – 44 участника;
- Санкт-Петербург – 24 участника;
- Республика Беларусь – 4 участника;
- Уфа, Казань, Буря, Нижняя Новгород, Пенза, Респенсия-Дону, Саранск, Сочи – по 1–2 участника.
Мы выражаем благодарность всех участниках за проведенный интерес и высокий уровень подготовки. Уверены, что этот опыт станет важным этапом в их профессиональным развитии.

Что дальше?
Уже в ближайшее время специалисты смогут принять участие в следующем важном событии – экзамене по клинической онкологии RUSSCO, который пройдет 11 декабря 2025 года в рамках XXIX Российского онкологического конгресса с международным участием в Москве. Этот экзамен позволит проверить и подтвердить знания по диагностике, механизмам действия препаратов, тактике ведения пациентов и лекарственной терапии опухолей.
Важная информация о предстоящем экзамене:
Дата: 11 декабря 2025 года Место проведения: Москва, XXIX Российский онкологический конгресс Темы экзамена: диагностика, механизмы действия препаратов, тактика ведения пациентов, лекарственная терапия опухолей Подготовка вопросов: ведущие эксперты RUSSCO Все успешно сдавшие экзамен получат официальный диплом RUSSCO, а три лучших участника будут награждены грантами на участие в конференциях RUSSCO.
Регистрация на экзамен открыта до 1 ноября 2025 года!
Мы гордимся тем, что Россия активно участвует в международных образовательных проектах и продолжает развивать профессиональное сообщество онкологов. Желаем всем кандидатам успехов и новых профессиональных достижений!
НОВОСТИ ОНКОЛОГИИ / ОФИЦИАЛЬНОЕ ИЗДАНИЕ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ – ЖУРНАЛ «ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ» – ВКЛЮЧЕН В «БЕЛЫЙ СПИСОК» (ЕГПНИ)
Глубокоуважаемые коллеги!
С радостью сообщаем вам, что ежеквартальный научно-практический рецензируемый медицинский журнал «Злокачественные опухоли» включен в «Белый список» – Единый государственный перечень научных журналов (ЕГПНИ).
По итогам категорирования журналу присвоен У2. Журналы данной категории считаются авторитетными для публикации научных результатов, необходимых для защиты диссертаций и оценки научной деятельности.
URL: journalrank.rcsi.science/ru/record-sources/details/31920/. В соответствии с Постановлением Правительства РФ №1494 от 06.11.2024 опубликованные в нашем журнале статьи могут быть использованы для оценки публикационной активности авторов и представляемых ими организаций.
Главный редактор, проф., д.м.н. Д.А.Носов
Технический редактор А.А. Плыкина
НОВОСТИ ASTRO 2025 /
В Сан-Франциско состоялся очередной ежегодный конгресс ASTRO 2025. Наиболее ожидаемыми событиями этого радиотерапевтического года были результаты 5 рандомизированных исследований, которые должны были быть представлены на конгрессе. Коротко об этих данных – в нашем обзоре.
Немалое число представленных работ касалось сравнения результатов фотонной и протонной терапии при опухолях различных локализаций.
ПРОТОНЫ ПРОТИВ ФОТОНОВ ПРИ НАЗОФАРИНГЕАЛЬНОЙ КАРЦИНОМЕ (NPC)
Рандомизированное исследование II фазы из Катла II, где сравнивали результаты фотонной лучевой терапии IMRT + CIRT и протонной IMPT + CIRT у пациентов с назофарингенльной кациномой. Всего 136 пациентов включало (по 68 в группах), медиана наблюдения составила 51,5 мес. Первичная конечная точка: частота ксеростомии 22 степени через 6 месяцев после ЛТ.
Результаты:
- Ксеростомия ≥2 ст. через 6 месяца; 29% (IMRT+CIRT) против 16% (IMPT+CIRT), p=0,088.
- Общая выясняемость за 3 года: 100% против 98,5% (p=0,99).
- Восстановление 1 раз в период реализации 3 года: 90,8% против 88,1% (p=0,64).
Вывод: добавление протонов (IMPT) к CIRT позволяет снизить риск выраженной ксеростомии на 6-м месяце, при этом показатели вызываются и контроля заболевания сопоставимы между группами. Это исследование (NCT04523394) демонстрирует потенциальное преимущество протонов в снижении поздней токсичности при NPC, при этом высокой эффективности лечения в целом.
NRC BNOGI (OA3A): ЭХКАЛАЦИЯ ДОБЫ ПРОТОНАМИ ПРИ ГЛИОБЛАСТОМЕ
Основной вопрос, поставленный исследователями: может ли повышение дозы до 75 гр протонами улучшить общую выживаемость у пациентов с гилобластом? Он сравнению со стандартными 60 гр фотонами – и при этом не повысить токсичность?
В это РКИ 2 фазы (1) были включены пациенты с ядерным диагностированием гилобластом, с 87% от 20% от 30% от 40% от 50% от 80%. Подтверждение диагноза было централизованным, проводился анализ MGMT. Все больные получили стандартное лечение ЛТ с чемоданом. Рандомизация проводилась следующая обработка: 60 гр фотонами против 75 гр протонами (30 фракций, SIB). Всего было включено 130 пациента, первого с 2014 по 2022 гг.
Основные результаты:
- Токсичность: диафоризм ≥3 ст. – 23,4% (60 гр) против 11,7% (75 гр протонами), неврологические токсичность ≥4 ст. – 1,8% против 9%. В целом статистически значительно увеличивались изменения.
- Выживаемость: медиана OB – 22,8 мес. (75 гр протонами); врачана OB = 21,2 мес. (70 гр протонами); врачана OB = 19,0 мес. (70 гр протонами).
- Отметки абсолютной амплитуды по ОБ: за 2 года – 49,9% против 41,3% (4,8%), за 3 года – 30% против 25,4% (4,6%) в полях высоковольтных кровель. Эффект использования после корректировки по MGMT и RPA.
Выводы:
- 75 гр фотонами – прирост 0,5 лет.
- 75 гр протонами – выполнение предыдущих гипотез: улучшение ОБ без роста диафоризма.
В целом исследования могут стать основными для запуска фазы III, чтобы подтвердить роль протонной эскалации дозы при глиобластоме.
ИТОГИ RADCOMP: ПЕРВОГО РАНДОМИЗИРОВАННОГО ИССЛЕДОВАНИЯ З ОАЗЫ ПО СРАВНЕНИЮ ПРОТОНОВ И ФОТОНОВ У БОЛЬНЫХ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ
ВДОСОМУ (1) – крупнейшее РКИ III фазы, напрямую сравнивание протонов (PERT) и фотоцинулы (PMIT) терапии у пациентов с недостаточностью раком молочной железы, получающих облучение ретионарных лимфоузлов (включая внутренние грудные узлы). Было включено 1239 пациентов: 62,4 в группу протонной терапии, 61,5 в группу протонов. Медиана возраста – 50 лет (21–92, 69,7% на расстоянии через максимальную 80,6% отмечено 25 сердечно-сосудистых факторов риска, при этом у 61,8% был деакторный или балансованный РАЖ.
Применив опросники качества жизни (HRQOL), оценщики:
- PROMER Fudge – утомляющееся;
- BREAST-C – волосатывая и побочная эффект;
- FACT-B – общее качество жизни;
- PRO-CTCAE – одышка, боль в группе и др.;
- FACTT – отношение к лечению.
- Опросы проводились до ЛТ, в конце курса получения, а также через 1 и 6 мес.
В итоге по истечении 6 месяцев:
- утомляемость, косметический эффект, общее качество жизни – различий нет;
- одышка (PRO-CTCAE) регистрировалась реже в группе протонов при простом анализе, но эффект исчез после поправки на множественные сравнения;
- FACIT (общее отношение к лечению): на 5 пунктов значимо лучше в группе протонов (готовность рекомендовать лечение, выбрать снова и др.), что сохранилось даже после строгой статистической обработки.
Главные выводы, сделанные авторами: в целом обе технологии безопасны, хорошо переносятся, а качество жизни одинаково высокое при проведении облучения как фотонами, так и протонами, хотя протоны дают более позитивное восприятие лечения. Данные по локорегиональному контролю и сердечно-сосудистым событиям ждем в следующих публикациях.
РКИ TORPEDO (ФАЗА III, ВЕЛИКОБРИТАНИЯ): ПРОТОНЫ ПРОТИВ ФОТОНОВ ПРИ МЕСТНОРАСПРОСТРАНЕННОМ РАКЕ РОТОГЛОТКИ
Одно из самых ожидаемых исследований этого года – результаты британского TORPEdO [4]. Впервые в рандомизированном формате III фазы сравнили IMPT (протонная терапия) и IMRT (фотонная терапия) у пациентов с местнораспространенным плоскоклеточным раком ротоглотки, получавших химиолучевое лечение.
В исследование было включено 205 пациентов из 20 центров Великобритании; все они получали 70 Гр (33 фракции) + цисплатин × 2 курса. Рандомизация в соотношении 2:1: IMPT (n=136) против IMRT (n=69). Первичные конечные точки: клиническая (наложение гастростомы или потеря веса ≥20% к 12 мес.) и качество жизни (UW-QOL) – качество и количество слюны, вкус, жевание, речь, внешний вид, глотание.
Результаты:
- Гастростома: частота ее крайне низка в обеих группах (1,7% против 1,7%).
- Потеря веса ≥20%: чаще отмечена при протонной терапии (18% против 6%; OR=2,8; p=0,08).
- UW-QOL (качество жизни): одинаковое (78,3 против 77,1).
- Функция глотания (MDADI): одинаковая (79,4 против 79,5).
- Вкус, слюна, жевание, речь, внешний вид: лучше на момент окончания IMPT, но к 6-й неделе различия нивелировались.
- 2-летний локорегионарный контроль: ≈95% в обеих группах. • Общая выживаемость: ≈95% в обеих группах.
Дозиметрические аспекты показали, что IMPT значительно снижала дозу на критические органы (слюнные железы, полость рта, глотки, гортани, нижние констрикторы глотки и др., p<0,001), но это не конвертировалось в клинические преимущества по токсичности или QOL.
Выводы авторов:
- IMPT не показала преимуществ по сравнению с современным, оптимизированным IMRT.
- IMRT в условиях строгого QA обеспечивает отличные результаты по токсичности и качеству жизни.
- Нет оснований считать IMPT обязательной альтернативой качественной IMRT при местнораспространенном раке ротоглотки.
Это крупное сравнительное исследование ставит острый вопрос: как интерпретировать дозиметрические преимущества протонов, если они не дают клинического выигрыша в условиях топ-уровня IMRT?
РКИ 2 фазы NEOTRAC: улучшает ли добавление одновременной химиолучевой терапии к стандартной неоадъювантной химиотерапии с трастузумабом частоту полного патоморфологического ответа (pCR) у пациенток с HER2+ местнораспространенным раком молочной железы?
В исследование [5] включено 118 женщин (Arm A [неоадъювантная ХТ + трастузумаб] – 62 пациентки, Arm B [неоадъювантная ХТ + трастузумаб + ХЛТ] – 56 больных). Все пациентки имели III стадию: IIIA (34%), IIIB (58%), IIIC (8%). Медиана возраста составила 50 лет.
Рандомизация в группы – в соотношении 1:1:
- Arm A (NACT): стандартная неоадъювантная ХТ (АС×4 → паклитаксел×4) + трастузумаб → мастэктомия → послеоперационная ЛТ (50 Гр);
- Arm B (NACCRT): та же схема, но в неоадъювантный период помимо паклитаксела и трастузумаба проводилась одновременная ЛТ (46 Гр на грудную стенку и лимфоузлы) → мастэктомия.
В обеих группах введение трастузумаба продолжалось до 1 года.
Результаты:
- pCR: 46,6% (Arm A) против 50,9% (Arm B), p=0,64 → различий нет.
- EFS (30 мес.): 81,0% против 81,9% (p=0,79).
- OВ (30 мес.): 93,0% против 95,1% (p=0,88).
- Общее время лечения: 255 против 189 дней (p<0,00001) → почти на 2 есяца быстрее в Arm B.
- Операбельность: 93,5% против 98%.
- Токсичность:
• радиационный дерматит (≥2 ст.) – 5,5% (только Arm B);
• нейтропения ≥3 ст. – 2 случая (Arm B);
• кардиотоксичности не зафиксировано;
• хирургические осложнения: 6,9% против 16,4% (p=0,15).
Выводы авторов следующие:
добавление одновременной химиолучевой терапии не увеличило pCR и не улучшило выживаемость, но сократило общее время лечения на 66 дней. Подход в целом показал приемлемую токсичность и может быть особенно полезен там, где по ряду причин важно быстрее завершить полный курс терапии. Это первое исследование, подтвердившее безопасность комбинации ЛT + паклитаксел + трастузумаб одновременно в неоадъювантном режиме, ранее опубликованные работы показали неприемлемую токсичность.
Дополнительное облучение ложа опухоли после тотального облучения молочной железы не снижает риск рецидива при протоковой карциноме и STU
В исследовании (1) проявлялись разрывы данных трех крупных клинических протоколов NSAAP (B-24, B-35 и B-43), включивших 6922 женщин с протоковой карциномой in situ (неинвазивной формой ряда молочной железы), получивших лучшее лечение после органосохраняющей операции.
Все пациенты имели протоколы опухола (DCCB) с признаков инвазии, всем после операции проводилось облучение всей молочной железы, при этом часть пациентов дополнительно получила облучение ложа удаления опухоли (так называемый «буст»), часть нет. Частота дополнительного облучения составляла: B-24 – 38%, B-35 и B-43 – около 85%.
Частота возникновения повторных опухолей в той же молочной железе (инвазивных или неинвазивных) b-24 – 14,9%, B-35 – 3,3%, B-43 – 6,5%. При этом различные между группами с бустом и без не выявлено:
- B-24: 15% против 14,6%;
- B-35: 14% против 2,5%;
- B-45: 6,8% против 6,4%.
Общий анализ показал отсутствие влияния буста на риск рецидива (p=0,9).
Вывод: дополнительное облучение ложа опухоли не уменьшает риск повторного заболевания в той же молочной железе у женщин с протоковой карциномой in situ. За последние годы частота рецидива при этом тише опухолей и так значительно снизилась благодаря максимально точной хирургии и адъювантному лечению. Добавление ложащего буста не дает ощутимого выигрыша в контроле над болезнью. Возможна польза может наблюдать от лишь у пациентов молодого возраста или с неблагоприятными признаками опухоли (высокая степень, близкие края).
ИССЛЕДОВАНИЕ NRG/ BTG 0924 ОАЗЫ III ПО СРАВНЕНИЮ ЛУЧЕВОЙ ТЕРАПИИ НА ПРОСТАТУ НА ФОНЕ АДТ С ДОБАВЛЕНИЕМ ОБЛУЧЕНИЯ РЕТИОНАРНЫХ ЛИМФОУЗЛОВ ИЛИ БЕЗ НЕГО [7].
Было включено 2473 пациента с локализованным раком простаты, у которых был:
- неблагоприятный промежуточный риск (например, несколько факторов риска: скоротечение ПСА 10–20 иг/мл, стадия Т2b, Glesson 7);
- благоприятный высокий риск (например, ПСА <50 иг/мл, стадия Т1–T2b, Glesson 7–10);
- по расчетной формуле Rosely у них был риск поражения тазовых лимфоузлов >15%;
- статус по ECOO <1 б.
У этой группы пациентов вероятность наличия микрометастики в лимфоузлах достаточно высока, но при этом опухоль еще локализована.
Все больные получали гормональную терапию + высокодозное облучение простаты (IMRT до 79,2 Гр или буст методом брахитерапии). Далее шла рандомизация на 1) облучение только простаты или 2) облучение простаты + профилактическое облучение малого таз.
Результаты через 10 лет:
- Общая выживаемость одинаковая (68% в обеих группах)
- Выживаемость, связанная с раком простаты, одинаковая (98%) в обеих группах
- Биохимические рецидивы (по ПСА): немного ниже при облучении малого таза (13% против 17%).
- Частота отдаленных метастазов: различный не выявлено
- Токсичность осложнения 3+ степени встречались резко, но кишечная дисфункция 1–2 степени чаще наблюдалась в группе расширенного облучения.
Главный вывод:
- Даже у пациентов с повышенным риском поражения лимфоузлов профилактическое облучение таза не улучшает выживаемость по сравнению с облучением тонкого простаты.
- На сегодняшний день комбинация гормональной терапии и облучения простаты остается надежным стандартом для этой группы.
- Возможно, в будущем биомаркеры помогут выделить подгруппы, которым дополнительное облучение таза действительно будет необходимо.
РАНДОЛИЗИРОВАНИЕ О ИССЛЕДОВАНИЕ 2 ФАЗЫ LUNAR: 17 ГЦ – РSNA ПЕРЕД СТЕРЕОТАКСИЧЕСКОЙ ЛУЧЕВОЙ ТЕРАПИЕЙ ПРИ ОЛИГОРЕЦИДНЕЕ РАКА ПРОСТАТЫ [8]
У пациентов с опилометастатическим гормонометрантенным раком простаты стандартным подходом считается метастаз-направления стереотаксического лучевая терапия (SRBT). Но сможет ли добавление радиолизца, вой терапии на основе "7Ln-FSMA усилить эффект?
В исследование включили 92 пациентов с рецидивом и 1–5 опилометастатическим октавил по данным FSMA ПЭ7ИХТ. Сравнение было по 2 группы больших получавших его стереотаксическую лучевую терапию на очаги или 2 цикла "7Ln-FSMA (неодноквантно) + стереотаксическую лучевую терапию. Первичная конечная точка – выживаемость без прогрессирования (PFS).
Результаты (медиана наблюдения 20 мес):
- Медиана PFS: 18 мес. в группе 17 Гц – PSMA+SRBT против 7 мес. в группе SRBT (p<0,0001).
- Рекс прогрессирования снизился более чем в раза (HR 0,32; 95% CI 0,18–0,55).
- Покончность ≥3 степени: только лимфоидения 77%, серьезных осложнений не выявлено
- Дополнительное выявление интересные иммунологические сигналы – больше продуктивных перестроек TCR и прогностические SNP в теле TGFBI.
Главный вывод авторов: добавление 177Lu-PSMA к стереотаксической лучевой терапии более чем удвоило время до прогрессирования у пациентов с олигорецидивом рака простаты, без увеличения частоты клинически значимой токсичности. Это открывает перспективу для интеграции радиолигандной терапии в более ранние схемы лечения, а не только у пациентов в кастрационнорезистентном статусе.
РКМ BART (ФАЗА III): АДЬЮ-ВАНТНАЯ ЛТ ПОСЛЕ ЦИ-СТАКТОМИИ ПРИ МЕСТНО-РАСПРОСТРАНЕННОМ РАКЕ МОЧЕВОГО ПУЗЫРЯ [9]
В исследовании BART впервые в рандомизированном формате оценили роль адъювантной лучевой терапии (6x4). Рука фрамида на хаос удаленного пузыря и тазовые узлы после радикальной цистэктомии и химиотерапии у пациентов с местнораспространенным мышечно-инвазивным раком мочевого пузыря.
Всего было включено 153 пациента (T3-T4 – 62%, pN+ – 41%), которым проведена химиотерапия: неоадъювантная – у 71%, адъювантная – у 20%. Пациенты рандомизированы на наблюдение или адъювантную ЛТ.
Результаты (медиана наблюдения 23 мес):
- Люкоретиональные рецидивные функции (7ГГ) против 25% (наблюдение), p=0,006.
- 2-летний люкоретиоверный контроль: 91% (7ГГ) против 76% (наблюдение), HR 0,22; p=0,004.
- 2-летний ВВП: 1,6% против 1–28%, HR 0,62 (95% CI 0,36–1,05); p=0,07; врача в полку ЛТ.
- 2-летняя RGS (раково-светодифическая выживаемость): 69,5% против 65%, HR 0,59 (95% CI 0,31–1,10); p=0,09.
- 2-летняя OR: 70,4% против 57,4%, HR 0,29 (95% CI 0,49–1,26); p=0,11.
- Паттерны прогрессирования: ложе удаленного пузыря – 13% (шабл) против 24 (7ГГ), регионарные узлы – 21% против 8%.
- Отдаленные метастазы: =30% в обеих группах.
- Покончность ≥3 степени (поздняя): сопоставимая (5,8% против 10,5%).
Выводы:
Адъювантная ЛТ после цистэктомии достоверно снижает риск люкоретиональных рецидивов и улучшает локальный контроль. Есть терты к улучшению DFS и рак-специфической выживаемости, но различия не достигли статистической значимости. Общая выживаемость выше не отличается. Эффект наиболее выражен у пациентов с Т3–T4 стадией и pN+.
Исследование BART подтверждает ту пациентов высокого риска адъювантная ЛТ должна обеспечить в мультидисциплинарной команде как реальный способ улучшить локальный контроль без роста выраженной токсичности.
МЕТIS TRAL (ФАЗА III): ТИМОН ТЕРАПИЯ FIELDS ПО-CHE СТЕРЕОТАКСИЧЕСКОЙ РАДИОМЕРУНИИ (SRS) ПРИ МЕТАСТАЗАХ ИННУ В МОЗГ [10]
Одно из самых ожидаемых исследований ASTRO 2035 – METIS V пациентов с метастазами юнеклонского центра роза легкого (1–10 очагов) стандартом остается стереотаксическая радиомортурия (SRS), но риск новых очагов высок, а облучение всего объема головного мозга улучшает когнитивные функции (MET, исследовано, может ли добавление TTF отсрочить прогрессирование, сохраняя качество жизни.
Было включено 298 пациентов, рандомизация в группе SRS + TFTields (n=149) против SRS только (n=149). Первичная конечная точка – время внутрирецептов прогрессирования, вторичные – отдаленное прогрессирование, выживаемость когнитивные функции, качество жизни.
Результаты:
- TFTields достоверно отсрочили внутрирецептов прогрессирования HR 0,72; p=0,039, снизив риск на 28%.
- Абсолютное снижение риска прогрессиве за 2 мес. – с 22% до 14% (–1%), за 6 мес. – с 46% до 34% (–13%), за 12 мес. – с 59% до 74% (–13%), за 24 мес. – с 65% до 54% (–12%).
- Качество жизни не ухудшилось: добавление TFTields даже ассоциировалось с меньшей утомляющейся и лучшей физической функцией (HR -0,7).
- Нежелательные явления – в основном команды (1–1 ст.).
- Общая выживаемость – без различий между группами.
Вывод: добавление TTF к SRS достоверно отсрочивает внутрирецептов прогрессирования у пациентов с HMPU и метастазами в мозг. При этом метод хорошо переносится, без негативного влияния на когнитивные функции и качество жизни.
Потенциально METIS может изменить стандарт: SRS + TTFields как новый подход к контролю метастазов в мозге при НМРЛ.
Источник:
- Kong L. Hu J. Huang Q. et al. Protom vs. Photom for Nasopharyngeal Carcinoma: Toxicity and Survival in a Phase 2 Randomized Study.
- Mehta MR Pagh S. Mahajan A. et al. Signal-Seeking P2R Trial of Proton or IMRT Dose Intensification in GBM: NRG-BN001.
- MacDonald SM, Pugh S, Paulus R, et al. Phase III Randomized Trial of Proton vs. Photon Therapy for Patients with Non-Metastatic Breast Cancer Receiving Comprehensive Nodal Radiation: A Radiotherapy Comparative Effectiveness (RadComp) Consortium Trial: HealthRelated Quality Of Life Outcomes.
- Thomson D, Price J, Tyler M, et al. Primary Results for the Phase III Trial of Toxicity Reduction using Proton Beam Therapy for Oropharyngeal Cancer (TORPEdO; CRUK/18/010).
- Iyer P, Krishnamurthy A, Velusamy S, et al. Neoadjuvant Chemotherapy with Trastuzumab with or without Concurrent Radiotherapy in HER2- Positive Inoperable Locally Advanced Breast Cancer: A Phase 2 Randomized Trial (NEOTRAC).
- Khan AJ, Gu X, Tang G, et al. Utilization of a lumpectomy bed boost after whole breast radiotherapy does not improve ipsilateral breast tumor recurrence risk in patients with ductal carcinoma in-situ treated on three NSABP trials.
- Roach III M, Karrison TG, Chung HT, et al. Androgen Deprivation Therapy (ADT) and High Dose Definitive Radiotherapy (RT) ± Whole Pelvic RT in Patients with Unfavorable Intermediate or Favorable High-Risk Prostate Cancer: Early Results of a Phase III Randomized Controlled Trial.
- Kishan AU, Valle L, Wilhalme H, et al. Lutetium-PSMA Neoadjuvant to Ablative Radiotherapy for Oligorecurrent Prostate Cancer; Primary Endpoint Analysis of the Phase II LUNAR Randomized Trial.
- Murthy V, Maitre P, Pal M, et al. Bladder Adjuvant Radiotherapy (BART): Clinical Outcomes from a Phase III Multicenter Randomized Controlled Trial.
- Gondi V, Ahluwalia M, Roberge D, et al. Tumor Treating Fields (TTFields) After Stereotactic Radiosurgery (SRS) for Brain Metastases from Non-Small Cell Lung Cancer (NSCLC BM): Final Results of The Phase 3 METIS Trial.
Материал подготовил А. Черчик
ЗНАКОМЬТЕСЬ: СВЕРДЛОВСКОЕ РЕГИОНАЛЬНОЕ ОТДЕЛЕНИЕ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ (RUSSCO)

Свердловская область образована 17 января 1934 года. Регион находится в 2000 километрах к востоку от Москвы, на границе Европы и Азии, охватывает территорию Среднего и Северного Урала, а также часть Западно-Сибирской равнины. В Свердловской области расположены 94 муниципальных образования, среди них 15 городских округов, 53 муниципальных округа, 5 муниципальных районов, 5 городских поселений, 16 сельских поселений. На 1 января 2025 года численность постоянного населения региона составляла 4 218 204 человека. Свердловская область — один из наиболее перспективных субъектов Российской Федерации: по большинству основных социально-экономических показателей развития регион входит в первую десятку.
В 2024 году в Свердловской области было выявлено 23 635 новых случаев злокачественных новообразований (далее — ЗНО). Интенсивный показатель заболеваемости ЗНО на 100 000 населения составил 359,7 человека, что на 42,5% выше уровня 2015 года. В структуре заболеваемости населения Свердловской области первое место занимают ЗНО предстепенной железы, второе место – ЗНО кожи, третье место – ЗНО молочной железы. Неблагополучная экологическая обстановка, обусловленная высокой концентрацией промышленных предприятий в Свердловской области, дискрет необходимость разработки эффективных мер первичной и вторичной профилактики онкологических заболеваний и комплексного развития онкологической службы Свердловской области.
Центром онкологической службы Cвердловской области является ГАУЗ СО «Свердловский областной онкологический диспансер» в г. Екатеринбург с филиалами в городах Нижний Тагил и КаменскУральский. Диагностика и лечение осуществляются с использованием современного оборудования и методик, высококвалифицированная мультидисциплинарная команда медиков обладает богатым опытом и глубокими знаниями, обеспечивая индивидуальный подход к каждому пациенту. Ежегодно в СООД выполняют 22,5 тысячи операций, 30 тысяч курсов лекарственной и 9,5 тысяч курсов лучевой терапии. С 2019 года начался этап обновления материально-технической базы учреждения здравоохранения благодаря реализации национального проекта «Здравоохранение». Новейшая аппаратура поступила на вооружение специалистов службы лучевой и эндоскопической диагностики, современными линейными ускорителями оснащена радиотерапевтическая служба, открыты важнейшие для региона Референсные центры лучевой и морфологической диагностики, позволившие объединить усилия всех диагностов-онкологов в борьбе с одним из самых тяжелых недугов.
На фото: главный врач ГАУЗ СО «Свердловский онкологический диспансер» Киселев Евгений Александрович и
профессор Берзин Сергей Александрович, руководивший кафедрой онкологии с 1992 по 2009 гг.

Свердловская область вышла на совершенно новый уровень оказания злонамерена этической помощи, напишите проклятия терапию в областном онкосилере, в многопрофильных медиатеграх, а также в Центрах амбулаторной онкологической помощи, которые открыты по всему региону. Значительно усовершенствована работа амбулаторно-поликлинического звена Свердловского оплодисание:рекомендованные приемы теперь проводятся в две смены, организован колл-центр и служба поддержки маломобильных пациентов.
На фото: слева направо: Шевченко Светлана Анатольевна (к.м.н., врач отделения диагностики СООД), профессор Демидов Сергей Михайлович (заведующий кафедрой онкологии и лучевой диагностики УГМУ), Киселев
Евгений Александрович (главный врач СООД, к.м.н.), Магдалянова Маргарита Ивановна (заведующая отделением онкомаммологии СООД), Дорофеев Александр Владимирович (заместитель главного врача СООД по
лечебной работе, д.м.н.).

Коечный фонд диспансера составляет 1100 коек. Развернуто 25 клинических отделений. Ежедневно в 23 операционных залах выполняются около 70 хирургических вмешательств. Ежегодно в отделениях стационара специализированную медицинскую помощь получают более 42 тысяч больных.
В учреждении работают 8 докторов медицинских наук (из них 2 профессора), 31 кандидат медицинских наук, трем медикам присвоено почетное звание «Эксплуатация врач Российской Федерации», одному медику – почетное звание «Эксплуатация работник здравоохранения Российской Федерации», третьи медикам вручен патрульный знак «Отличник здравоохранения». Благодарностью Министра здравоохранения РФ отмечает 21 сотрудник Медики являются ежегодными лауреатами такой премии, как Всероссийская премия «Будем жить» за особый вклад в борьбу против онкологических заболеваний в различных номинациях, лауреатами премии Губернатора Свердловской области в сфере здравоохранения в номинации «Технология года» (2022 год), лауреатами премии профессионального признания Свердловской области «Медицинский опыт» 2023- в номинации «Технология года» и др.
В 2025 году Онкологической службе Свердловской области исполнилось 95 лет. Итоги работы подвели на ежегодной межрегиональной научно-практической конференции «ФорумУралОнко 2025». Мероприятие, инициированное Свердловским областным онкологическим диспансером, организовано при поддержке министерства здравоохранения Свердловской области, привлекает свыше 400 специалистов различных направлений: онкоррологов, олимпианекологов, онкомамовологов, абдоминальных и нейрохирургов, радиологов и радиотерапевтов, химиотерапевтов, рейкрилологов, специалистов в области IT-технологий в медицине и других. Эксперты представляют новейшие исследования и достижения в области онкологии, обсуждают клинические аспекты и организационные вопросы, касающиеся работы профильных учреждений.
На фото: главный врач ГАУЗ СО «Свердловский онкологический диспансер» Кислова Евгений Александрович и профессор Берлин Сергей Александрович, руководивший кафедрой онкологии с 1992 по 2009 гг.

Региональное отделение Российского общества клинической онкологии (RUSSCO) Свердловской области организовано в 2011 г. и в настоящее время насчитывает 66 членов, среди которых онкологи, химиотерапевты, радиотерапевты, хирурги. Активное участие принимают сотрудники кафедры онкологии. Уральского государственного медицинского университета. С 2011 по 2022 г. председателем регионального отделения был Дмитрий Евгеньевич Емельянов, работавший начмедом областного онкологического диспансера более 30 лет и стоматный у истоков формирования химиотерапевтической службы области. С 2022 г. по настоящее время председателем является Петьку Вадимова Владимирович, заместитель главного врача по лекарственной терапии ГАУЗ СО «Свердловский областной онкологический диспансер», доцент кафедры онкологии ФГБОУ ВО «Уральский государственный медицинский университет», кандидат медицинских наук (Екатеринбург).
Члены регионального отделения активно участвуют в качестве слушателей и спикеров в мероприятиях Российского общества клинической онкологии (RUSSCO) – вебинарах, очных конференциях, Российском онкологическом конгрессе. В рамках ежегодных конгрессов RUSSCO постерные доклады свердловских Начало на стр. 5 врачей неоднократно выбирались в качестве лучших (Киселева К.Е. – «Злокачественные новообразования, ассоциированные с беременностью: популяционное исследование», Ваганова И.Ю. – «Опыт терапии распространенного гепатоцеллюлярного рака мультикиназными ингибиторами у пациентов со сниженным функциональным статусом (ECOG 2)»). Члены регионального отделения публикуются в журнале общества «Злокачественные опухоли» (Демидов С.М., Шевченко С.А., Петкау В.В., Киселева Е.А. и др.), участвуют в разработке Практических рекомендаций (Петкау В.В.).
Ежегодно в Свердловской области проводится 2-3 образовательных мероприятия при поддержке
RUSSCO, направленных не только
на врачей, но и на средний медицинский персонал. Для семинаров
RUSSCO сотрудниками диспансера
подготовлены доклады по тромбопрофилактике, централизованному
разведению противоопухолевой
лекарственной терапии, работе с
противоопухолевыми препаратами. Непрерывное повышение квалификации, образовательные мероприятия, поддержка в вопросах
экспертизы со стороны Российского
общества клинической онкологии
позволяют врачам онкологам Свердловской области повышать качество
оказываемой медицинской помощи
онкологическим пациентам.
ТЕРАПЕВТИЧЕСКИЕ ВАКЦИНЫ ДЛЯ ВПЧ-АССОЦИИРОВАННОГО РАКА ШЕЙКИ МАТКИ: НАДЕЖДА ИЛИ РАЗОЧАРОВАНИЕ?
Автор: Румянцев Алексей Александрович
Заведующий отделением лекарственных методов лечения злокачественных опухолей №4
НИИ клинической онкологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, к.м.н.,
Москва
В последнее время в России наблюдается рост интереса к противоопухолевым вакцинам, во многом подогреваемый средствами массовой информации. Уверен, каждый онколог не раз желал вечно спешащим журналистам добра и здоровья. Проблема эта сложна и многогранна, и на примере одного злокачественного новообразования – рака шейки матки (РШМ) – попробуем оценить успехи и неудачи данного направления. В отличие от профилактических, терапевтические вакцины нацелены на «элиминацию» уже существующих опухолевых клеток.
При РШМ разработка терапевтических вакцин имеет длительную и поучительную историю. Как известно, в подавляющем большинстве случаев развитие РШМ связано с инфекцией – вирусом папилломы человека (ВПЧ). Многие штаммы этого вируса относятся к онкогенным, но наибольшее значение имеют 16 и 18 типы ВПЧ, которые кодируют синтез белков E6 и E7, способные инактивировать опухолевые супрессоры p53 и RB. При прогрессии инфекции и интеграции ДНК вируса в геном клетки именно экспрессия белков E6 и E7 считается ключевым фактором поддержания трансформированного фенотипа и инициирования злокачественного процесса [1]. Именно эти протеины являются мишенью для большинства противоопухолевых вакцин.
Еще в 2002 году Li и соавт. в доклиническом исследовании продемонстрировали, что иммунизация мышей антигеном E7-mFc (онкопротеин E7, конъюгированный с Fc-областью мышиного иммуноглобулина) способна предотвращать или значительно замедлять рост опухолевых клеток в модели TC-1 по сравнению с непрерывным ростом опухоли в контрольных группах. TC-1 – модель «бессмертных» эпителиальных клеток мышей, трансформированных E6 и E7, используется как «суррогат» РШМ у человека [2]. На той же модели Peng и соавт. показали потенциальный синергизм между введением терапевтической вакцины и воздействием анти-PD-1 препарата [3]. Ряд других авторов также представили многообещающие доклинические данные по применению различных типов противоопухолевых терапевтических вакцин для ВПЧ-ассоциированных опухолей [4,5]. С такой убедительной базой – есть вирус как первоисточник «проблемы», есть белок, который «виновен» в опухолевой трансформации, есть способ на него воздействовать – что могло пойти не так? Тем не менее, за долгие годы активной разработки по ряду причин по настоящее время ни один препарат данного класса не нашел своего места в клинической практике, несмотря на многочисленные усилия в этой области.
Начнем с одной из «перспективных» молекул: противоопухолевая ДНК-вакцина VGX-3100, кодирующая синтез генов E6 и E7 ВПЧ 16 и 18 подтипов разрабатывалась компанией INOVIO. Первоначальные данные по препарату были весьма многообещающими. В рандомизированном плацебо-контролируемом исследовании II фазы, опубликованном в журнале Lancet в 2015 году, вакцина VGX-3100 продемонстрировала значимую эффективность у женщин с предопухолевым поражением шейки матки (CIN2/3), ассоциированным с наличием инфекции ВПЧ 16 или 18 типов. Всего в исследование, точнее в его per-protocol популяцию, было включено 167 пациенток. По результатам у 53 (49,5%) пациенток в группе VGX-3100 и 11 (30,6%) пациенток в группе плацебо была отмечена гистопатологическая регрессия дисплазии [6]. Долгосрочные результаты этого исследования были представлены в 2020 году – у подавляющего большинства (91%) женщин, получавших VGX-3100, у которых произошла регрессия цервикальной HSIL, отсутствовали признаки инфекции ВПЧ через 18 месяцев после завершения лечения, что подчеркивает долговременное сохранение терапевтического эффекта [7]. Несмотря на первоначальные успехи, при дальнейшем изучении VGX-3100 возникли некоторые (значительные) сложности. Результаты исследования III фазы REVEAL-1, впервые представленные в 2021 году, показали отсутствие значимых различий в частоте ответа на терапию между группой исследуемого препарата и плацебо в общей популяции исследования (22,5% против 11,1%, p=0,029 при заявленном пороговом уровне статистической достоверности p<0,025) [8,9].
Второе исследование III фазы по оценке эффективности VGX-3100, REVEAL 2, «споткнулось» в том числе благодаря своему разработчику: в ходе проведения исследования было принято решение об изменении первичной конечной точки исследования и оценки эффективности препаратa в биомаркерной популяции, отобранной с использованием проприетарного теста от QIAGEN, направленного на подтверждение наличия инфекции ВПЧ 16/18 путем NGS. Однако оказалось, что размеры этой биомаркерной популяции были меньше, чем ожидалось – 21 пациентка в группе исследуемого препарата по сравнению с 4 пациентками в группе плацебо. Ответ на терапию был у 28,6% и 0% пациенток в этой популяции в группе плацебо (p=0,115). Отметим, что в то же время в общей популяции исследования первичная конечная точка была достигнута у 27,6% и 8,7% пациенток (p=0,001), однако FDA этими данными впечатлить не удалось. С клинической точки зрения показатели эффективности также представляются достаточно низкими. В настоящее время программа дальнейшего изучения VGX-3100 фактически свернута компанией-разработчиком.
ADXS11-001, живая аттенуированная вакцина Listeria monocytogenes, модифицированная для секреции слитого белка HPV16 E7-LLO, была изучена в рандомизированном исследовании II фазы, куда было включено 109 пациенток с прогрессированием РШМ после химиотерапии и/или лучевой терапии. Рандомизация – между группой ADXS11 в монотерапии или в комбинации с цисплатином. Медиана общей выживаемости была сопоставима между группами лечения – 8,3 мес. в группе комбинации и 8,8 мес. в группе с цисплатином. Частота объективного ответа (ЧОО) составила 17,1% против 14,7% [10]. На основании этих данных было инициировано исследование III фазы AIM2CERV по оценке эффективности препарата после химиолучевой терапии при местнораспространенном РШМ, однако исследование было преждевременно завершено по требованию FDA [11].
Рекомбинантная векторная вакцина VTP-200 в многоцентровом рандомизированном исследовании Ib/II фазы не показала статистически значимого преимущества перед плацебо по частоте элиминации ВПЧ. Хорошие показатели эффективности (до 60% клиренса ВПЧ через 12 месяцев) были зафиксированы в группе с максимальной дозой ChAdOx, однако различия не достигли значимости, возможно, по причине малого размера выборки [12]. Другая ДНК вакцина, GX-188E, кодирующая синтез белков E6 и E7, была изучена Choi и соавт. в рандомизированном многоцентровом открытом исследовании II фазы (n=73). Включались пациентки с CIN3, положительные по ВПЧ16/18. Работа продемонстрировала, что 52% пациенток через 20 недель после первой инъекции GX-188E достигли регрессии предопухолевых изменений. К сожалению, несмотря на рандомизированный характер, в исследовании не было контрольной группы – рандомизация осуществлялась только между двумя дозовыми уровнями препарата [13]. Информации о продолжении изучения этого препарата при CIN найти не удалось, зато есть подвижки в лечении метастатической болезни, где в целом при РШМ отмечаются большие перспективы изучения терапевтических вакцин (см.таблицу).
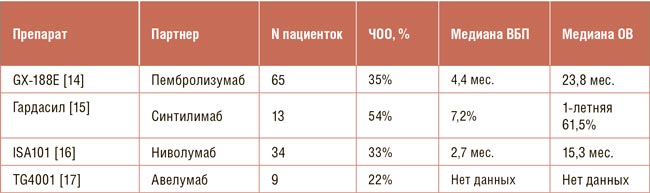
Препарат GX-188E в комбинации с пембролизумабом был изучен Lim et al. в открытом одноцентровом исследовании II фазы с участием 65 пациенток с распространенным раком шейки матки, ассоциированным с инфекцией ВПЧ16/18. При медиане наблюдения 14,7 мес. у 35% пациенток был достигнут и подтвержден объективный ответ на противоопухолевую терапию, в том числе у 5 (8,3%) пациенток был достигнут полный ответ на терапию. Медиана длительности ответа у всех пациенток составила 12,3 мес. Что особенно интересно, противоопухолевая активность отмечалась и в PD-L1-негативной популяции пациенток – традиционно наиболее трудной для иммунотерапии категории больных. Полученные результаты превосходят исторические данные по применению антагонистов PD-1 пембролизумаба или цемиплимаба в данной популяции пациенток – например, в рандомизированном исследовании EMPOWER-Cervical 1 в группе монотерапии цемиплимабом ответ на терапию был достигнут у 16% пациенток с медианой ВБП 2,8 мес. [14,18]. В KEYNOTE-158 при использовании пембролизумаба ЧОО составила 12%, причем ответы отмечались только в PD-L1-позитивной популяции пациенток [19].
В небольшом одногрупповом исследовании 2 фазы (n=13) применение синтилимаба в комбинации с четырехвалентной HPV-вакциной при рецидивирующем РШМ продемонстрировало ЧОО, равную 54%, при медиане ВБП 7,2 мес., а 1-летняя ОВ составила 61,5%. Интересно, что авторы не использовали какую-либо специально разработанную терапевтическую вакцину – вместе с ниволумабом вводилась профилактическая вакцина «Гардасил» [15]. Терапевтическая вакцина ISA101, которая представляет собой синтетические пептиды E6 и E7 ВПЧ16, в комбинации с ниволумабом в исследовании II фазы (n=34) показала ЧОО 33%, медиана общей выживаемости составила 15,3 мес. [16]. Рекомбинантная векторная вакцина TG4001, кодирующая синтез E6, E7 и IL-2, в комбинации с анти-PD-L1 препаратом авелумабом продемонстрировала не столь впечатляющие результаты в лечении ВПЧ-ассоциированных опухолей: в открытом исследовании II фазы (n=43, 21% – РШМ) ЧОО составила 22%, а медиана ВБП всего 2,8 мес. При этом в немногочисленной когорте РШМ показатель ответ был у 33% пациенток [17].
Парадокс. С одной стороны, существует четкое биологическое обоснование применения терапевтических вакцин – опухолевые клетки экспрессируют чужеродные вирусные белки, которые являются хорошими «мишенями» для иммунной системы. Вакцины должны работать! С другой стороны, десятилетия исследований показывают, что неудач в этом направлении гораздо больше, чем успехов. Подход с использованием терапевтических вакцин в комбинациях с «традиционными» агентами пока выглядит наиболее перспективным, но требует дальнейшего изучения в крупных рандомизированных исследованиях – всё, что есть на данный момент, это небольшие работы 2 фазы, результаты которых еще только должны быть подтверждены (или опровергнуты – что тоже часто бывает).
Таким образом, создание работающей терапевтической вакцины для одной конкретной нозологии, такой как ВПЧ-ассоциированный рак, остается сложнейшей и никем не решенной на данный момент задачей. Очевидно, нужны новые идеи и подходы для преодоления печальных тенденций в этой области.
Источники:
- Markowitz LE, Unger ER. Human Papillomavirus Vaccination. Solomon CG, ed. N Engl J Med. 2023; 388 (19): 1790-1798. doi:10.1056/NEJMcp2108502.
- Li J, Sun Y, Garen A. Immunization and immunotherapy for cancers involving infection by a human papillomavirus in a mouse model. Proc Natl Acad Sci. 2002; 99 (25): 16232-16236. doi:10.1073/pnas.192581299.
- Peng S, Tan M, Li YD, et al. PD-1 blockade synergizes with intratumoral vaccination of a therapeutic HPV protein vaccine and elicits regression of tumor in a preclinical model. Cancer Immunol Immunother. 2021; 70 (4): 1049-1062. doi:10.1007/s00262-020-02754-x.
- Kruse S, Büchler M, Uhl P, et al. Therapeutic vaccination using minimal HPV16 epitopes in a novel MHC-humanized murine HPV tumor model. OncoImmunology. 2019; 8 (1): e1524694. doi:10.1080/2162402X.2018.1524694.
- Li YL, Ma ZL, Zhao Y, Zhang J. Immunization with mutant HPV16 E7 protein inhibits the growth of TC-1 cells in tumor-bearing mice. Oncol Lett. 2015; 9 (4): 1851-1856. doi:10.3892/ol.2015.2911.
- Trimble CL, Morrow MP, Kraynyak KA, et al. Safety, efficacy, and immunogenicity of VGX-3100, a therapeutic synthetic DNA vaccine targeting human papillomavirus 16 and 18 E6 and E7 proteins for cervical intraepithelial neoplasia 2/3: a randomised, double-blind, placebo-controlled phase 2b trial. The Lancet. 2015; 386 (10008): 2078-2088. doi:10.1016/S0140-6736(15)00239-1.
- Bhuyan PK, Dallas M, Kraynyak K, et al. Durability of response to VGX-3100 treatment of HPV16/18 positive cervical HSIL. Hum Vaccines Immunother. 2021; 17 (5): 1288-1293. doi:10.1080/21645515.2020.1823778.
- INOVIO Announces Positive Results from REVEAL 1, a Phase 3 Pivotal Trial Evaluating VGX-3100, its DNA-based HPV Immunotherapy for the Treatment of High-grade Precancerous Cervical Dysplasia Caused by HPV-16 and/or HPV-18. Inovio.com. March 1, 2021.
- ClinicalTrials.gov. REVEAL 1 (Evaluation of VGX-3100 and Electroporation for the Treatment of Cervical HSIL) (REVEAL 1).
- Basu P, Mehta A, Jain M, et al. A Randomized Phase 2 Study of ADXS11-001 Listeria monocy’togenes-Listeriolysin O Immunotherapy With or Without Cisplatin in Treatment of Advanced Cervical Cancer. Int J Gynecol Cancer. 2018; 28 (4): 764-772. doi:10.1097/IGC.0000000000001235.
- ClinicalTrials.gov. Study of ADXS11-001 in Participants With High Risk Locally Advanced Cervical Cancer (AIM2CERV). March 14, 2023. Accessed October 2, 2025.
- Barinthus Bio Announces Topline Data from Phase 1b/2 APOLLO Trial of VTP-200 in Persistent High-Risk Human Papillomavirus (HPV) Infections. April 18, 2024. Accessed October 3, 2025.
- Choi YJ, Hur SY, Kim TJ, et al. A Phase II, Prospective, Randomized, Multicenter, Open-Label Study of GX-188E, an HPV DNA Vaccine, in Patients with Cervical Intraepithelial Neoplasia 3. Clin Cancer Res. 2020; 26 (7): 1616-1623. doi:10.1158/1078-0432.CCR-19-1513.
- Lim MC, Choi YJ, Hur SY, et al. GX-188E DNA vaccine plus pembrolizumab in HPV 16- and/or 18-positive recurrent or advance cervical cancer: a phase 2 trial. eClinicalMedicine. 2024; 74: 102716. doi:10.1016/j.eclinm.2024.102716.
- Wang B, Liang Y, Wu Y, et al. Sintilimab plus HPV vaccine for recurrent or metastatic cervical cancer. J Immunother Cancer. 2024; 12 (11): e009898. doi:10.1136/jitc-2024-009898.
- Sousa LGD, Rajapakshe K, Rodriguez Canales J, et al. ISA101 and nivolumab for HPV-16+ cancer: updated clinical efficacy and immune correlates of response. J Immunother Cancer. 2022; 10 (2): e004232. doi:10.1136/jitc-2021-004232.
- Borcoman E, Lalanne A, Delord JP, et al. Phase Ib/II trial of tipapkinogene sovacivec, a therapeutic human papillomavirus16-vaccine, in combination with avelumab in patients with advanced human papillomavirus16-positive cancers. Eur J Cancer. 2023; 191: 112981. doi:10.1016/j.ejca.2023.112981.
- Tewari KS, Monk BJ, Vergote I, et al. Survival with Cemiplimab in Recurrent Cervical Cancer. N Engl J Med. 2022; 386 (6): 544-555. doi:10.1056/NEJMoa2112187.
- Chung HC, Ros W, Delord JP, et al. Efficacy and Safety of Pembrolizumab in Previously Treated Advanced Cervical Cancer: Results From the Phase II KEYNOTE-158 Study. J Clin Oncol. 2019; 37 (17): 1470-1478. doi:10.1200/JCO.18.01265.
ОКОНЧАТЕЛЬНЫЕ РЕЗУЛЬТАТЫ PACIFIC-2: АНАЛИЗ НЕУДАЧИ В ЦИФРАХ
13 октября в журнале JCO опубликованы наконец результаты исследования PACIFIC-2 [1], которые уже были представлены ранее на крупных онкологических мероприятиях, а пресс-релиз по данным этой работы появился еще в ноябре 2023 года.
Напомним: в этом проспективном исследовании 3 фазы пациенты были рандомизированы в соотношении 2:1 для приема фиксированной дозы дурвалумаба (Имфинзи) в дозе 1500 мг или плацебо каждые четыре недели, с начала радикального курса ХЛТ по поводу местнораспространенного нерезектабельного немелкоклеточного рака легкого. Пациенты продолжали получать дурвалумаб или плацебо в качестве консолидирующей терапии после ХЛТ до прогрессирования заболевания. PACIFIC-2 проводилось в 88 центрах более чем 20 стран с участием 328 пациентов. Первичной конечной точкой была ВБП, а ключевыми вторичными конечными точками – общая выживаемость, частота объективного ответа и продолжительность ответа, а также безопасность.
Увы, исследователям не удалось продемонстрировать преимуществ добавления иммунотерапии к стандартной ХЛТ: достоверной разницы не было ни в ВБП (HR 0,85 [95% CI 0,65-1,12]; P=0,247), ни в OВ (HR 1,03 [95% CI 0,78-1,39]; P=0,823); при этом медиана ОВ в группе Д в PACIFIC-2 оказалась ниже, чем в PACIFIC (36,4 против 47,5 мес.), тогда как группа плацебо показала схожие результаты (29,5 против 29,1 мес.). OВ за 24 месяца составила 58,4% в группе дурвалумаба против 59,5% в группе плацебо. Частота объективных ответов – 60,7% против 60,6% (95% CI 215,2-16,3%; P=0,976).
Классическая схема PACIFIC – радикальная одновременная ХЛТ с последующей консолидацией дурвалумабом – остается стандартом лечения этой категории пациентов [2].
Основной вопрос, который на протяжении вот уже двух лет задают онкологи во всем мире – почему так? Мнений было немало.
Первое, что бросается в глаза – токсичность. Несмотря на то, что первоначальный анализ безопасности и переносимости дурвалумаба и ХЛТ в этой популяции пациентов показал, что профили в целом соответствовали таковым для этих методов лечения, в экспериментальной группе наблюдался повышенный уровень инфекционных осложнений в течение ХЛТ, но исследование было продолжено. Побочные эффекты любой степени выраженности в итоге наблюдались практически у всех пациентов в обеих группах (98,6% и 100%).
Рисунок 1.
Показатели ВБП и ОВ в группах
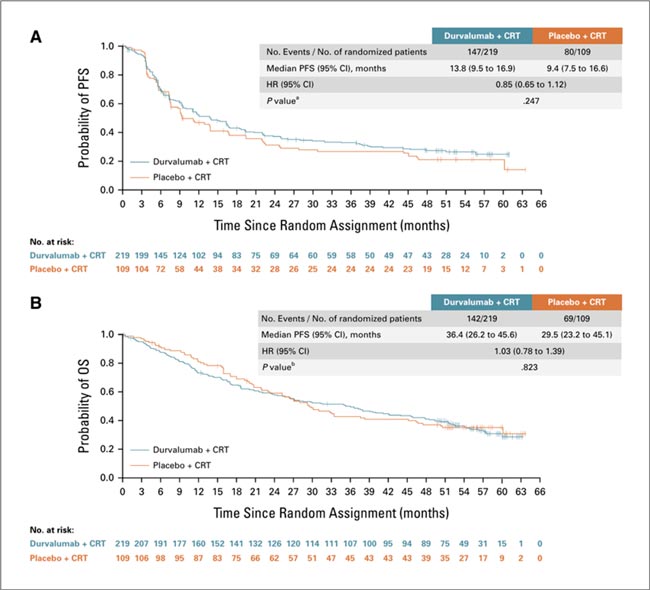
Окончательный анализ продемонстрировал:
- осложнения, приведшие к прекращению лечения, в два раза чаще отмечены в группе иммунотерапии: 25,6% против 12,0%; безусловно, это повлияло на отбор пациентов, получавших консолидирующую терапию, которые утратили шанс получать это столь важное и необходимое им лечение;
- частота фатальных кровотечений – 6 в группе Д против 2 в группе П, большинство из них зафиксировано в первые 4 месяца после проведенного лечения;
- частота фатальных инфекционных осложнений (пневмония, сепсис, септический шок) – 6,8% против 1,9%, также в течение ближайших 4 месяцев и также не в пользу Д.
Второй важный момент (о котором говорили радиобиологи и который подтверждают некоторые рандомизированные исследования, в том числе и по НМРЛ, в частности, CheckMate-73L [3]) – минимизация эффекта иммунотерапии на фоне одновременной ХЛТ. Большинство ученых приходят к мысли, что лучевая терапия, проводимая на область первичной опухоли и регионарных лимфоузлов, где, как показывают многие доклинические исследования, происходит выработка специфических Т-лимфоцитов, участвующих в иммунном противоопухолевом ответе, негативно сказывается на их выработке, что сводит на нет возможности иммунотерапии, применяемой одномоментно. Более того, Т-лимфоциты известны своей высоченной радиочувствительностью, и ежедневное облучение немалого объема тканей и сосудов, по которым циркулируют эти клетки, приводит к быстрому падению их уровня и, опять-таки, сведению к минимуму эффекта иммунотерапии.
Анализ причин, безусловно, будет продолжен и, будем надеяться, в итоге приведет к выработке наиболее эффективной стратегии.
Источники:
- Jeffrey D. Bradley, et al. Simultaneous Durvalumab and Platinum-Based Chemoradiotherapy in Unresectable Stage III Non-Small Cell Lung Cancer: The Phase III PACIFIC-2 Study. J Clin Oncol. 2025 October 13; 00: 1-12.
- Antonia SJ, et al.; PACIFIC Investigators. Durvalumab after Chemoradiotherapy in Stage III Non-Small-Cell Lung Cancer. N Engl J Med. 2017 Nov 16; 377 (20): 1919-1929. doi: 10.1056/NEJMoa1709937. Epub 2017 Sep 8. PMID: 28885881.
- Peters S, Tan DSW, Gerber DE, et al. CheckMate 73L: Phase III study comparing nivolumab (N) 1 concurrent chemoradiotherapy (CCRT) followed by N 6 ipilimumab (I) v CCRT followed by durvalumab (D) for previously untreated, locally advanced stage (stg) III NSCLC. Immuno-Oncol Technol. 2024; 24: 100808 (65O).
Материал подготовила Н.В. Деньгина
КСЕВИНАПАНТ С ХЛТ ПРИ ОГШ: ПРИЧИНЫ ГРОМКОЙ НЕУДАЧИ И РАЗБОР ПОЛЕТОВ
Пять лет назад на ESMO 2020 французскими авторами группы GORTEC были представлены весьма позитивные данные по применению комбинации ксевинапанта с химиолучевой терапией у больных с местнораспространенным плоскоклеточным раком головы и шеи и плохим прогнозом (ВПЧ-негативные, курильщики), мы писали об этом в новостях ESMO 2020 на сайте и в газете (https://www.rosoncoweb.ru/news/oncology/2020/09/25/, [1)]. Прошло 5 лет – и ситуация реально развернулась на 180 градусов: как демонстрируют результаты исследования уже III фазы TrilynX [2], комбинация оказалась провальной.
История с ксевинапантом (X) поистине завораживает. Этот пероральный препарат, по сути, блокирует белки IAP, ингибиторы апоптоза, тем самым усиливая апоптоз в раковых клетках. Ксевинапант действует как миметик SMAC — это эндогенный белок, ингибирующий IAP. Поскольку лучевая терапия обычно НЕ работает через апоптоз, комбинация этого препарата и лучевой терапии выглядела несколько странной (отсутствие явного синергизма) - но публикация результатов невероятно успешного рандомизированного контролируемого исследования II фазы с X и ХЛТ при ВПЧ-негативном плоскоклеточном раке головы и шеи стала настоящей сенсацией.
Кривые разошлись рано и широко, и впечатленность научного мира этими данными привела не только к инициированию двух исследований III фазы, проводимых экспертами мирового уровня под руководством фармакологов, но и к разработке дизайна исследования III фазы в рамках кооперативной группы. Что же могло пойти не так? Оказалось - всё. В сентябре 2025 года были опубликованы окончательные результаты исследования III фазы TrilynX, сравнивающие результаты X+ХЛT с только ХЛT при ВПЧ-негативном раке головы и шеи. Результаты не только оказались отрицательными, но и свидетельствовали о худшей токсичности и худших показателях контроля заболевания при применении ксевинапанта. Что же произошло?!
Во-первых, начнем с первого исследования II фазы, в котором участвовало всего 96 пациентов [3]. Главным результатом было улучшение локорегионального контроля, определяемое через 18 месяцев как процент пациентов, выживших и с сохраняющимся локорегиональным контролем, от общего числа больных. Ксевинапант оказался победителем: 54% против всего лишь 33%. Кривые ВБП и ОВ с учетом цензурирования тоже выглядели потрясающе!
Рисунок 1
Локорегиональный контроль в группах ХЛТ и Х+ХЛТ

Рисунок 2
Кривые Каплана-Майера по ВБП и ОВ в группах

Посмотрим, что было с TrilynX, где все пошло наперекосяк.
Исследование фазы III с участием 730 пациентов, аналогичное фазе II, но со значительным изменением: еще 3 цикла ксевинапанта после химиолучевой терапии. Почему? Хороший вопрос. Очевидно, были некоторые лабораторные данные, предполагающие дополнительную пользу консолидации после окончания лучевой терапии. Была ли цель компании просто продать больше препарата? В любом случае отклонение от весьма успешной парадигмы фазы II БЕЗ клинических данных является рискованным и тревожным предложением. Исследование не только оказалось негативным в плане эффективности - препарат привел к большей токсичности, что также сказалось на худшей переносимости лучевой терапии и цисплатина и прерыванию лечения у части пациентов. В исследовании TrilynX все тенденции контроля заболевания благоприятствовали стандартной ХЛТ, а 2-летняя ВБП в стандартной группе составила около 75% против 55% в фазе II.
Рисунок 3
Бессобытийная выживаемость в группах

Рисунок 4
Общая выживаемость в группах

Популяции пациентов в двух исследованиях также различались. В исследовании III фазы было больше больных с раком гортаноглотки (27% против 17%), а также гораздо больше больных раком гортани (31% против 10%). В зависимости от стадии заболевания, у первых, как правило, результаты хуже, чем у пациентов с раком ротоглотки ВПЧ-, а у больных раком гортани немного лучше, поэтому, возможно, разница в ВБП в группе стандартного лечения могла быть обусловлена не связанными с ними смертями. Самое главное: преимущество ксевинапанта в локорегиональном контроле ИСЧЕЗЛО.
Хуже того, в группе ксевинапанта было зафиксировано БОЛЬШЕ отдаленных метастазов! Поскольку сопутствующий цисплатин не обладает системной активностью, можно предположить, что происходит что-то неблагоприятное с биологической точки зрения, что на самом деле очень интересно.
Профессор David Sher из UT Southwestern Medical Center, Техас, заведующий отделом ЛТ ОГШ, в одной из соцсетей представил свои размышления по поводу столь громкой неудачи ксевинапанта. Давайте разберём некоторые детали первого исследования. Во-первых, и это важно, в отчете с пролонгированным наблюдением число смертей, не связанных с раком, в стандартной группе (ХЛТ) было вдвое больше (14 против 7). При таком небольшом количестве пациентов в группе (48) эта случайность абсолютно убийственна. Что важно, локорегиональный контроль определялся как процент живых с локорегиональным контролем от общего количества пациентов, поэтому если пациенты случайно умерли, они фактически считались спрогрессировавшими. В комментариях авторов высказывалось предположение, что некоторые из этих смертей были действительно вызваны прогрессированием заболевания, но это не было чётко установлено. Более того, также наблюдался дисбаланс среди пациентов с Т4 в пользу ксевинапанта (37% в когорте Х против 50% в стандартной). Даже если бы разница в локорегиональном контроле была реальной, очень сложно добиться локального контроля у пациентов с ВПЧ-отрицательной стадией T4, и эта разница имеет значение.
В исследовании TrilynX дополнительное введение ксевинапанта также могло быть проблематичным. На самом деле впечатляет, что локорегиональный контроль был сопоставимым в обеих группах, несмотря на меньшую дозу лучевой терапии и химиотерапии в группе X, что, возможно, указывает на некоторую локальную активность препарата. При этом несмотря на то, что есть доказательства того, что миметики SMAC могут способствовать иммунному ответу, некоторые недавние данные свидетельствуют об обратном после лучевой терапии, то есть, по сути, добавление X могло аннулировать иммунный ответ (как количество, так и активность инфильтрирующих Т-клеток). Результаты исследования могут содержать важную информацию в этом плане, и, надеемся, мы сможем извлечь из этого урок [4]. Наконец, в группе ксевинапанта было больше пневмоний 3 степени, включая 6 летальных исходов. Возможно, X привел к увеличению количества дисфункциональных миелоидных клеток, что способствовало развитию инфекции и помешало полноценному лечению. Добавление ещё 3 циклов X явно не способствовало улучшению ситуации. Превосходная сопутствующая статья, в которой обсуждаются другие возможные причины результатов исследования, также дает пищу для размышлений [5].
Понятно, что отрасль отчаянно стремится улучшить результаты лечения пациентов с ВПЧ-негативным плоскоклеточным раком головы и шеи, подверженных высокому риску рецидива. Однако нам также следует проявлять осторожность при интерпретации исследований II фазы. Это исследование с участием менее 100 пациентов потребовало поистине огромного объёма дополнительной работы (и затрат), которая в конечном итоге ни к чему не привела. Иногда такое случается, несмотря на самые лучшие намерения (как в данном случае).
Рисунок 5
Локорегиональный контроль в группах

Рисунок 6
Кумулятивная частота отдаленных метастазов в группах

Несколько заключительных мыслей от профессора David Sher (надеемся, они пригодятся всем молодым исследователям):
- Выбирайте конечные точки с умом и сделайте их значимыми для клинического заключения и последующего исследования. Использование живых пациентов с локорегиональным контролем (с критерием хи-квадрат) в качестве первичной конечной точки нетипично, особенно для системного препарата с целым рядом других эффектов (положительных или отрицательных).
- Подкрепите исследование достаточным количеством данных, чтобы задать релевантный вопрос. Исследование было довольно небольшим, с исходным дисбалансом критически важных клинических характеристик и с досадными случайными летальными исходами, ещё больше затрудняющими интерпретацию. Исследования меньшего размера дешевле и быстрее (и стремление к эффективности понятно), но они могут привести именно к такому сценарию.
- При переходе от фазы II к фазе III не меняйте экспериментальную группу, если для этого нет реальной необходимости. Сомневаюсь, что добавление трёх дополнительных циклов что-либо дало – исследование неизбежно должно было продемонстрировать отрицательный результат, и пациенты могли пострадать, если это увеличило бы метастатический потенциал опухоли.
- Обеспечьте наличие «защитных барьеров». Промежуточный анализ проводился после 65% от общего числа событий. Во многих исследованиях используется 50%, и это сэкономило бы время (и, возможно, число пациентов). Учитывая небольшое исследование фазы II, рабочей группе следовало бы оценить результаты раньше, до включения более чем 700 пациентов.
- Я глубоко разделяю нетерпение, связанное с желанием улучшить результаты, но при интерпретации результатов фазы II необходима большая осторожность, особенно при наличии внутренних ограничений самого исследования.
- Крайне важно применять более креативные подходы к дизайну фаз II (и фазы III) для более быстрого и точного выявления новых успешных методов лечения.
Источники:
- Bourhis J. et al. 3-years follow-up of double-blind randomized phase II comparing concurrent high-dose cisplatin chemo-radiation plus xevinapant or placebo in high-risk patients with locally advanced squamous cell carcinoma of the head and neck. Annals of Oncology (2020) 31 (suppl_4): S1142-S1215.
- Jean Bourhis, et al. Xevinapant or Placebo Plus Platinum-Based Chemoradiotherapy in Unresected Locally Advanced Squamous Cell Carcinoma of the Head and Neck (TrilynX): A Randomized, Phase III Study. Journal of Clinical Oncology Volume 43, Number 29 https://doi.org/10.1200/JCO-25-00272
- Sun XS, Tao Y, Le Tourneau C, et al. Debio 1143 and high-dose cisplatin chemoradiotherapy in high-risk locoregionally advanced squamous cell carcinoma of the head and neck: a double-blind, multicentre, randomised, phase 2 study. Lancet Oncol. 2020 Sep;21(9):1173-1187. doi: 10.1016/S1470-2045(20)30327-2. Epub 2020 Aug 3. PMID: 32758455.
- Charleen Chan Wah. Hak et al. Xevinapant plus chemoradiotherapy negatively sculpts the tumour immune microenvironment in head and neck cancer. Cancer Research Communications, Research Article| October 22 2025
- Michael Dougan, Stephanie K. Dougan. Second Mitochondrial Activator of Caspases Mimetics Accelerate Progression of Locally Advanced Head and Neck Cancer. Journal of Clinical Oncology, Sep 3, 2025.
Автор: Материал подготовила Н.В. Деньгина