Дорогие коллеги, дорогие друзья!
Декабрь – традиционно архи-загруженный месяц для онколога. Тем не менее, разгребая дела накануне январских праздников, наряжая елку и обдумывая меню новогоднего стола, невольно...

Рене Магритт. Большая семья.
1963, холст, масло.
Юрий Левитанский.
Диалог у новогодней елки. 1970 г.

13 НОЯБРЯ СОСТОЯЛОСЬ ЗАСЕДАНИЕ ПРАВЛЕНИЯ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ (RUSSCO), НА КОТОРОМ В ХОДЕ ТАЙНОГО ГОЛОСОВАНИЯ НОВЫМ ПРЕДСЕДАТЕЛЕМ RUSSCO БЫЛ ИЗБРАН Д.А. НОСОВ
Разрешите поблагодарить всех членов Общества и членов Правления за оказанное мне высокое доверие возглавить ведущую отечественную профессиональную организацию, объединяющую...

ИТОГИ XXVII РОССИЙСКОГО ОНКОЛОГИЧЕСКОГО КОНГРЕССА
За три дня работы в нем приняли очное участие 4152 специалистаонколога и врача смежных специальностей из 162 городов и 82 регионов России (от Калининграда до Владивостока, от

ЗНАКОМЬТЕСЬ: РЕГИОНАЛЬНОЕ ОТДЕЛЕНИЕ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ ПРИМОРСКОГО КРАЯ
Приморский край входит в состав Дальневосточного федерального округа. Расстояние от Москвы до регионального центра – 9598 км по железной дороге. Площадь территории края – 164,7 км2...

НОВОСТИ ESMO 2023 / ESMO 2023: РАК МОЛОЧНОЙ ЖЕЛЕЗЫ
В первый день на конгрессе представлены работы, отражающие перспективы терапии раннего рака молочной железы (РМЖ).
НОВОСТИ ESMO 2023 / TДАТОПОТАМАБ ДЕРУКСТЕКАН (DATO-DXD) В КОМБИНАЦИИ С ДУРВАЛУМАБОМ В ПЕРВОЙ ЛИНИИ ТЕРАПИИ МЕСТНОРАСПРОСТРАНЕННОГО ИЛИ ДИССЕМИНИРОВАННОГО ТНРМЖ
Датопотамаб дерукстекан (DatoDxd) представляет собой конъюгат, состоящий из моноклонального антитела (IgG1) к рецептору Trop-2 и ингибитора топоизомеразы I. Исследование BEGONIA – мультикогортное исследование, посвященное изучению различных режимов терапии в комбинации с дурвалумабом в первой линии лечения...
НОВОСТИ ESMO 2023 / TROPINION-BREAST01 TRIAL. ЭФФЕКТИВНОСТЬ ДАТОПОТАМАБА ДЕРУКСТЕКАНА (DATO-DXD) В ПОЗДНИХ ЛИНИЯХ ТЕРАПИИ ГОРМОНОЗАВИСИМОГО HER2-НЕГАТИВНОГО ДИССЕМИНИРОВАННОГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ
Датопотамаб дерукстекан (Dato-Dxd) – конъюгат, состоящий из моноклонального антитела (IgG1) к рецептору Trop-2 и ингибитора топоизомеразы I. TROPINION-Breast01 trial – исследование 3 фазы, посвященное изучению эффективности Dato-Dxd в сравнении с химиотерапией по выбору исследователя (эрибулин, винорельбин, гемцитабин...

НОВОСТИ ESMO 2023 / КОЛОРЕКТАЛЬНЫЙ РАК. ШТРИХИ К ПОРТРЕТУ
Отсутствие прорывных результатов исследований, как, к примеру, в онкоурологии или немелкоклеточном раке легкого (НМРЛ), не ограничивает результативность конференции ESMO в вопросе...

НОВОСТИ ESMO 2023 / ОБЗОР СОБЫТИЙ В МИРЕ ОНКОГИНЕКОЛОГИИ
В октябре 2023 года прошел очередной ежегодный конгресс ESMO, который оказался очень «урожайным» в части представления новых данных по лечению различных злокачественных...

НОВОСТИ ESMO 2023 / НЕСТОЙКАЯ СТАБИЛИЗАЦИЯ В ТЕРАПИИ РАКА ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Начало лечения неметастатического рака поджелудочной железы строится вокруг рентгенологической классификации резектабельности. Неоадъювантная терапия погранично резектабельного...

НОВОСТИ ESMO 2023 / ЛОКАЛИЗОВАННЫЙ И МЕСТНОРАСПРОСТРАНЕННЫЙ НМРЛ – САМОЕ ИНТЕРЕСНОЕ НА КОНГРЕССЕ ESMO 2023
Конференцию ESMO 2023 года можно смело считать посвященной опухолям легкого – настолько значимые результаты были представлены в этом году....
ВОЛНЫ И ТУРБУЛЕНТНОСТИ ПАСИФИКа
14 ноября научный онкологический мир вчитывался в содержание пресс-релиза компании AstraZeneca, посвященного первым – и столь долгожданным – результатам исследования PACIFIC-2 [1]. В этом исследовании пациенты были рандомизированы в соотношении 2:1 для приема фиксированной дозы дурвалумаба (Имфинзи) в дозе 1500 мг или плацебо каждые четыре недели, с...

РОССИЙСКОЕ ОБЩЕСТВО КЛИНИЧЕСКОЙ ОНКОЛОГИИ ОТКРЫВАЕТ НОВЫЙ РАЗДЕЛ НА САЙТЕ RosOncoWeb.ru – ПОДКАСТЫ
Несмотря на развитие визуального искусства, подкасты продолжают набирать популярность и привлекать все большую аудиторию. Вам не нужно откладывать свои дела ради онлайн-трансляции
TTF ПРИ РАКЕ ЛЕГКОГО IV СТАДИИ: НОВЫЙ СТАНДАРТ ЛЕЧЕНИЯ?
Совсем недавно на сайте мы публиковали данные метаанализа 9 исследований по применению TTF (Tumor Treating Fields) при глиобластоме с комментарием Н.В. Жукова. И снова аббревиатура прозвучала громко, да еще в журнале Lancet Oncology, где в конце сентября 2023 года были представлены результаты крупного проспективного рандомизированного исследования 3 фазы...
ЭФФЕКТИВНОСТЬ ТАРЛАТАМАБА В ПОЗДНИХ ЛИНИЯХ ТЕРАПИИ МЕЛКОКЛЕТОЧНОГО РАКА ЛЕГКОГО. ПЕРВЫЕ РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ DELLPHI-301
Лекарственная терапия мелкоклеточного рака легкого (МРЛ) позволяет увеличить медиану общей выживаемости, контролировать симптомы болезни и сохранить качество жизни пациента, однако опции лечения ограничены. Разработка новых опций терапии является актуальной задачей. Тарлатамаб (AMG 757) – биспецифическое антитело, связывающее между собой

УГОЛОК РАДИОТЕРАПЕВТА / ШАГ ЗА ШАГОМ: ПРОТОНЫ В ЛЕЧЕНИИ БОЛЬНЫХ МЕСТНОРАСПРОСТРАНЕННЫМ РАКОМ ЛЕГКОГО
Интерес онкологического сообщества к проблеме применения протонного излучения в терапии больных с опухолями различных локализаций велик. Теоретически метод имеет преимущества...
КОПИЛКА ПОЗИТИВНЫХ ИССЛЕДОВАНИЙ ПО ЛОКАЛЬНОМУ ЛЕЧЕНИЮ ОЛИГОМЕТАСТАТИЧЕСКОГО РАКА ПОПОЛНИЛАСЬ: ESO-SHANGHAI 13
И действительно, количество исследований по применению локальных методов в лечении больных с олигометастатическим раком возрастает, появляются даже метаанализы. При этом проспективные рандомизированные исследования пока на вес золота, тем более что в отношении эффективности и целесообразности воздействия на олигометастазы рака пищевода не было...

«А ВОТ БЫЛ У МЕНЯ СЛУЧАЙ…» ИЛИ ОХОТНИЧЬИ ЗАПИСКИ ОНКОЛОГОВ / МАЛЕНЬКИЕ ДЕТАЛИ ИНТЕРПРЕТАЦИИ ЛАБОРАТОРНЫХ ПОКАЗАТЕЛЕЙ, ИЛИ ЧИТАЯ ТИЦА…
Во времена моей онкологической молодости доступ к информации был достаточно сильно ограничен в силу отсутствия интернета как такового, поэтому я благодарен судьбе за книжки, которые смог найти на полке отделения...
FDA ОДОБРИЛО ПЕМБРОЛИЗУМАБ В КОМБИНАЦИИ С ТРАСТУЗУМАБОМ И ХИМИОТЕРАПИЕЙ НА ОСНОВЕ ПРЕПАРАТОВ ПЛАТИНЫ В ПЕРВОЙ ЛИНИИ ТЕРАПИИ ДИССЕМИНИРОВАННОГО HER2-ПОЗИТИВНОГО РАКА ЖЕЛУДКА ПРИ CPS≥1
7 ноября 2023 г. Food and Drug Administration (FDA) на основании результатов исследования KEYNOTE-811 (NCT03615326) одобрило комбинацию пембролизумаба с трастузумабом и химиотерапией на основе платины в первой линии лекарственного лечения диссеминированного HER2+ рака желудка при CPS≥1.
ФГБНУ «МГНЦ» ПРОВЕЛО ПЕРВЫЙ ЦИКЛ ЗАНЯТИЙ ПО ПОВЫШЕНИЮ КВАЛИФИКАЦИИ ДЛЯ СОТРУДНИКОВ РЕГИОНАЛЬНЫХ ЛАБОРАТОРИЙ (ОБУЧЕНИЕ МЕТОДИКЕ NGS) RUSSCO ВЫСТУПИЛО ОРГАНИЗАТОРОМ И СПОНСОРОМ ЭТОГО ПРОЕКТА
По инициативе и при финансовой поддержке Российского общества клинической онкологии (RUSSCO) в Москве с 09 по 21 октября был проведен первый цикл занятий по повышению квалификации для сотрудников региональных лабораторий. Лаборатории выбирались с перспективой проведения молекулярно-генетических исследований методом NGS при различных нозологиях. Программа обучения по теме «Методы работы с мультигенными панелями в...
ОТ ТИХОГО ОКЕАНА ДО БАЛТИЙСКОГО МОРЯ: ОНЛАЙН-ДИСКУССИЯ RUSSCO
Этот новый формат вебинаров запустил целый цикл встреч, посвященных обсуждению вопросов организации онкологической помощи и спорных вопросов из клинической практики, которые будут регулярно проходить по субботам на сайте RosOncoWeb.ru...
СТАТЬЯ ПО РЕЗУЛЬТАТАМ ИССЛЕДОВАНИЯ RUSSCO CLOVER ВОШЛА В ТОП-100 САМЫХ ЧИТАЕМЫХ
В 2019-2020 годах Российское общество клинической онкологии провело крупнейшее исследование по оценке сопоставимости различных тестов иммуногистохимии и ПЦР для оценки статуса PD-L1 у пациентов с метастатическим немелкоклеточным раком легкого. Главной целью был ответ на вопрос, являются ли тесты, оценивающие экспрессию PD-L1, взаимозаменяемыми и какой...
ЭКЗАМЕН ПО КЛИНИЧЕСКОЙ ОНКОЛОГИИ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ, 2023
В первый день XXVII Российского онкологического конгресса, а именно, 14 ноября 2023 г. Российское общество клинической онкологии, во второй раз провело экзамен по клинической онкологии среди врачей онкологов Российской Федерации. В этом году, сорок один доктор, решился принять участие в экзамене и проверить свои знания.
Анонс
-

19 января 2024
МЕЛАНОМА И ДРУГИЕ ОПУХОЛИ КОЖИ
VIII КОНФЕРЕНЦИЯ RUSSCO
-

28 - 29 марта 2024
РАК МОЛОЧНОЙ ЖЕЛЕЗЫ
XI КОНФЕРЕНЦИЯ RUSSCO
-

12 - 13 апреля 2024
РАК ЛЕГКОГО И ДРУГИЕ ОПУХОЛИ ГРУДНОЙ КЛЕТКИ
X КОНФЕРЕНЦИЯ RUSSCO
Дорогие коллеги, дорогие друзья!
Декабрь – традиционно архи-загруженный месяц для онколога. Тем не менее, разгребая дела накануне январских праздников, наряжая елку и обдумывая меню новогоднего стола, невольно окидываешь взором вновь
так стремительно, птицей пролетевшие месяцы 2023-го - январь, февраль…май…август…ноябрь… Воспоминания о приятных событиях, что они принесли с собой, будут еще долго подпитывать нас, а мысли о мрачном
хочется спрятать подальше вглубь памяти. Анализируя события научного онкологического мира, понимаешь, что в нем нет ничего однозначного, и требуется опыт для осознания этой многогранности. Новости
осеннего конгресса ESMO, представленные нашими экспертами на страницах номера, также, как и данные
публикаций крупных журналов и очередные «Охотничьи записки онкологов» еще раз демонстрируют это.
Картина Рене Магритта с обложки нашей декабрьской газеты носит название «La Grande Famille» - «Большая
семья». На первый взгляд сразу возникает сомнение в уместности названия, поскольку в нем нет ни образа семьи, ни человека. Однако Магритт, как известно, получал огромное
удовольствие, сбивая с толку своих зрителей. Унылое небо (то ли на
грани грозы, то ли в ее окончании?), зловещие облака вместе с волнующимся морем вызывают смутные чувства, возможно, символизируя испытания и невзгоды, которые семьи часто переживают вместе. С другой
стороны, огромная, похожая на окно, птица раскрывает в своем силуэте
спокойное голубое небо с белыми пушистыми облаками, приносящими ощущение тепла и спокойствия. Птица - словно символ единства и
любви внутри семьи. Изображая гармонию и раздор, Магритт умело
изобразил концепцию семьи в картине посредством символического
сюрреализма.
Мы надеемся, что, просматривая декабрьский номер газеты, вы оживите в памяти самое значительное событие уходящего года в нашей
большой онкологической семье RUSSCO – Российский онкологический
конгресс - и вновь окунетесь в приятные эмоции общения и познания
нового. А вспомнив, пожелаете нам всем новых встреч в 2024 году - и
они обязательно будут! Пусть в новом году семья RUSSCO станет еще
больше, и пусть ощущение безмятежного голубого неба пребудет в
душе у каждого из нас!
Доброго нового года, дорогие друзья, вам и вашим семьям!
Ваша команда RUSSCO
Рене Магритт. Большая семья.
1963, холст, масло.

Юрий Левитанский.
Диалог у новогодней елки. 1970 г
***
— Что происходит на свете? — А просто зима.
— Просто зима, полагаете вы? — Полагаю.
Я ведь и сам, как умею, следы пролагаю
в ваши уснувшие ранней порою дома.
— Что же за всем этим будет? — А будет январь.
— Будет январь, вы считаете? — Да, я считаю.
Я ведь давно эту белую книгу читаю,
этот, с картинками вьюги, старинный букварь.
— Чем же все это окончится? — Будет апрель.
— Будет апрель, вы уверены? — Да, я уверен.
Я уже слышал, и слух этот мною проверен,
будто бы в роще сегодня звенела свирель.
— Что же из этого следует? — Следует жить,
шить сарафаны и легкие платья из ситца.
— Вы полагаете, все это будет носиться?
— Я полагаю, что все это следует шить.
— Следует шить, ибо сколько вьюге ни кружить,
недолговечны ее кабала и опала.
— Так разрешите же в честь новогоднего бала
руку на танец, сударыня, вам предложить!
— Месяц — серебряный шар со свечою внутри,
и карнавальные маски — по кругу, по кругу!
— Вальс начинается. Дайте ж, сударыня, руку,
и — раз-два-три,
раз-два-три,
раз-два-три,
раз-два-три!..
13 НОЯБРЯ СОСТОЯЛОСЬ ЗАСЕДАНИЕ ПРАВЛЕНИЯ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ (RUSSCO), НА КОТОРОМ В ХОДЕ ТАЙНОГО ГОЛОСОВАНИЯ НОВЫМ ПРЕДСЕДАТЕЛЕМ RUSSCO БЫЛ ИЗБРАН Д.А. НОСОВ

Уважаемые коллеги,
дорогие друзья!
Разрешите поблагодарить всех членов Общества и членов Правления
за оказанное мне высокое доверие возглавить ведущую отечественную
профессиональную организацию, объединяющую практически всех
онкологов нашей огромной страны.
С момента своего создания Обществом пройден большой путь, и оно
превратилось в эффективную организацию, насчитывающую на сегодня более 6 тысяч онкологов и имеющую 61 региональное отделение.
От имени всех членов Общества я хотел бы поблагодарить Сергея Алексеевича Тюляндина, который стоял у истоков создания нашего Общества, заложил его традиции и сделал невероятно много для его развития.
Уверен, что Российское общество клинической онкологии всегда будет
оставаться той платформой, которая позволяет консолидировать усилия представителей всех онкологических специальностей, направленные на развитие онкологической науки и улучшение онкологической
помощи нашим пациентам. Залогом поступательного развития Общества является совместная работа всех его членов по реализации научных и образовательных программ, различных инициатив и проектов,
позволяющих своевременно реагировать на все вызовы, стоящие перед
профессиональным сообществом.
Только общими усилиями мы сможем не только сохранить, но и преумножить все то, что было сделано нами за эти годы.
С уважением,
Д.А. Носов
Председатель Российского общества клинической онкологии (RUSSCO)
Дмитрий Александрович Носов: Заведующий отделением противоопухолевой лекарственной терапии ФГБУ «Центральная Клиническая Больница с Поликлиникой» Управления делами Президента РФ, главный внештатный онколог ГМУ УД Президента РФ, доктор медицинских наук, профессор РАН.
После окончания лечебного факультета Московского медицинского стоматологического института им. Н.Н. Семашко (1992 г.) и клинической ординатуры на кафедре внутренних болезней № 2 (терапия) ГКБ № 59 (1995 г.) Д.А. Носов работал ведущим научным сотрудником отделения клинической фармакологии и химиотерапии, НИИ клинической онкологии ФГБУ «РОНЦ им. Н.Н. Блохина» МЗ РФ (1995–2016 гг.). В 1998 г. стажировался в Онкологическом центре г. Лиона (Франция), а в 2000 г. защитил диссертацию на соискание ученой степени кандидата медицинских наук. С 2002 по 2010 гг. являлся Национальным представителем России в ESMO (Европейское Общество Медицинской Онкологии). В 2011 г. вошел в состав Правления Российского общества клинической онкологии (RUSSCO).
В 2012 г. Д.А. Носов защитил диссертацию на соискание ученой степени доктора медицинских наук: «Метастатический рак почки: новые лекарственные возможности и рациональные лечебные подходы».
2012–2020 гг. – председатель научного и сопредседатель организационного комитета XVI–XXIV Российского онкологического конгресса, одновременно с 2013 по 2017 гг. – член экспертного совета ВАК при Министерства образования и науки РФ (медицинские науки). С 2019 г. является главным редактором журнала «Злокачественные опухоли». С 2016 г. Дмитрий Александрович руководит отделением противоопухолевой лекарственной терапии в ФГБУ «Центральная Клиническая Больница с Поликлиникой» Управления делами Президента РФ и является главным внештатным онкологом ГМУ УД Президента РФ.
Д.А. Носов является автором более 100 публикаций в ведущих отечественных и зарубежных журналах; соавтор глав в руководствах для врачей-онкологов, в том числе: «Практическая онкология. Сборник лекций», «Фармакотерапия злокачественных новообразований» и др.; имеет Международный индекс цитируемости Хирша (H-индекс) 18.
ИТОГИ XXVII РОССИЙСКОГО ОНКОЛОГИЧЕСКОГО КОНГРЕССА

С 14 по 16 ноября 2023 г. в Москве
с успехом прошел уже XXVII Российский онкологический конгресс.
За три дня работы в нем приняли
очное участие 4152 специалистаонколога и врача смежных специальностей из 162 городов и 82 регионов России (от Калининграда
до Владивостока, от Мурманска до
Махачкалы), а также из 14 стран
(Армения, Беларусь, Казахстан,
Эквадор, Израиль и др.). В ходе онлайн-трансляции было зарегистрировано еще 3874 участника.
В Научный (Программный) комитет Конгресса вошли: в 1-й
день – 99 спикеров, во 2-й – 109
спикеров, в 3-й – 138 спикеров, а
всего Конгресс собрал более 500
лекторов и модераторов.
Открывая торжественную церемонию, член Правления
RUSSCO, директор ГБУЗ «СПб
КНпЦСВМП(о) им. Н.П. Напалкова», член-корреспондент РАН,
профессор, д.м.н. Владимир Михайлович Моисеенко сообщил,
что Сергей Алексеевич Тюляндин
сложил с себя полномочия председателя Российского общества
клинической онкологии и новым
председателем был избран член
Правления RUSSCO, руководитель онкологического отделения
противоопухолевой терапии
ФГБУ «Центральная клиническая
больница» Управления делами
Президента РФ, профессор, д.м.н.
Дмитрий Александрович Носов.
Д.А. Носов поблагодарил коллег
за доверие, кратко рассказал о
себе и заверил участников Конгресса, что Российское общество
клинической онкологии продолжит развивать направления, заложенные С.А. Тюляндиным, а он
лично приложит все усилия для
достижения новых свершений.
С видеообращением к участникам выступил министр здравоохранения Михаил Альбертович
Мурашко, отметивший, что Российский онкологический конгресс – это одно из важнейших
онкологических мероприятий в
стране. Именно подобные форумы вносят огромный вклад в дело
консолидации усилий, направленных на борьбу с онкологическими заболеваниями.
Также М.А. Мурашко сообщил:
«На сегодня в стране функционируют 89 онкодиспансеров, 4 специализированных больницы и 8
федеральных онкоцентров. Большое внимание в последнее время
уделяется и проблемам детской
онкологии: на сегодня в стране
работают 4 крупных специализированных лечебных учреждения
для детей, а еще 7 будут открыты
в ближайшее время».
Затем участников по видеосвязи приветствовал главный внештатный онколог России, президент АОР, академик РАН Андрей Дмитриевич Каприн, который поблагодарил Российское общество клинической онкологии и лично С.А. Тюляндина за плодотворную работу Общества в течение многих лет, отметил эффективное взаимодействие АОР и RUSSCO, отметил, что Российский онко - логический конгресс по своему уровню не уступает европейским форумам.
В своем видеообращении профес - сор С.А. Тюляндин объяснил ре - шение уйти с поста председателя желанием уступить место более молодым коллегам, поблагодарил участников Конгресса за много - летнюю поддержку деятельности RUSSCO и участие во всех меро - приятиях Общества и пожелал Российскому обществу клиниче - ской онкологии и дальше оста - ваться флагманом отечественной онкологии. Сам Сергей Алексее - вич остается в составе Правления RUSSCO.

Игорь Евгеньевич Хатьков, ака - демик РАН, главный внештатный специалист-онколог Москвы, лич - но поздравил Д.А. Носова с избра - нием председателем RUSSCO и вы - разил уверенность в дальнейшем развитии проектов Общества, как в сфере образования, так и в практи - ческой сфере.
В завершение церемонии состоя - лись традиционные награждения российских онкологов за вклад в развитие отечественной онколо - гии (А.В. Бойко, Л.В. Манзюк, М.Б. Стенина и В.И. Владимиров), а так - же троих победителей ежегодного конкурса молодых онкологов из Москвы и Челябинска (всего было подано несколько десятков науч - ных работ).
В первый день работы Конгресса для представителей СМИ был про - веден брифинг «Перспективы ис - кусственного интеллекта в онколо - гии». В его работе приняли участие замминистра здравоохранения РФ Павел Сергеевич Пугачев и зам. директора по реализации феде - ральных проектов ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России Тигран Гагико - вич Геворкян.

П.С. Пугачев кратко рассказал журналистам о внедрении ИИ в медицинской сфере и отметил, что уже реализованного оказалось до - статочно, чтобы на 30% разгрузить врачей в части документального ве - дения пациентов и, как следствие, своевременно выявлять онколо - гические заболевания на ранних стадиях, то есть ИИ позволил ис - ключить «человеческий фактор», иногда приводящий к ошибкам диагностирования.
По словам замминистра, «главное – правильно доносить до врачей на местах, что искусственный ин - теллект – это не замена живому специалисту, а важнейшая помощь. Поэтому важна просветительская работа всех заинтересованных ве - домств и сообществ».
А Т.Г. Геворкян доложил о результа - тах опроса, проведенного RUSSCO в регионах, в частности, сообщив, что 78% респондентов не опаса - ются внедрения ИИ в их работу, поскольку не считают его заменой себе, а более 95% респондентов уве - рены, что внедрение ИИ в онколо - гии возможно только при участии медицинских специалистов. По - этому в НМИЦ онкологии им. Н.Н. Блохина уже создана специальная служба, которая вплотную сотруд - ничает с виднейшими технически - ми вузами страны. Именно в подоб - ной совместной работе видят залог успеха и в Минздраве России.
Кроме 77 научных сессий, мастерклассов, лекций, дискуссий и 38 сателлитных симпозиумов, в дни работы Конгресса проводились совместные сессии RUSSCO с Мо - сковским онкологическим обще - ством, РакФондом и другими он - кологическими сообществами, а также состоялись другие знаковые мероприятия:
Постерная сессия, во время ко - торой эксперты RUSSCO, члены Правления Ф.В. Моисеенко, И.А. Покатаев и А.А. Румянцев отме - тили те работы, которые вызвали у них наибольшую заинтересован - ность. В частности, были названы исследования, касающиеся эффек - тивности второй линии терапии после прогрессирования на инги - биторах CDK4/6 в реальной клини - ческой практике (Москва), клини - ко-морфологических особенностей рака желудка, ассоциированного с дефицитом белков репарации неспаренных (Санкт-Петербург), сразу несколько работ из различ - ных регионов по онкоурологии и лечению колоректального рака. Безусловным выводом стала общая оценка участников, что многие раз - работки заслуживают внимания и могут быть рекомендованы для по - всеместного внедрения.
Совещание RUSSCO по молекуляр
-
ной диагностике, во время которо
-
го был представлен отчет по резуль
-
татам Национальной Программы
RUSSCO «Совершенствование мо
-
лекулярно-генетической диагно
-
стики в Российской Федерации с
целью повышения эффективности
противоопухолевого лечения» за
1-е полугодие 2023 г. (охвачено 83
региона России, задействовано 28
лабораторий, проведено более 7,3
тыс. тестов для почти 7 тыс. паци
-
ентов) и рассмотрены практиче
-
ские аспекты проекта АНО НООП
«Таргетное секвенирование ткани
опухоли больных немелкоклеточ
-
ным неплоскоклеточным раком
легкого в Российской Федерации».
Представители 35 лабораторий из
различных регионов страны собра
-
лись в зале и подключились дис
-
танционно. Многолетняя практика
проведения подобных рабочих со
-
вещаний подтвердила их важность
не только с точки зрения обмена
информацией и опытом, но и для
расширения возможностей моле
-
кулярно-генетического тестирова
-
ния с одновременным улучшением
качества проводимых тестов.

Экзамен по клинической онколо
-
гии RUSSCO, участие в котором
позволило специалистам (экзаме
-
новались более 40 чел.) использо
-
вать уникальную возможность по
-
пробовать свои силы в отношении
знаний клинической онкологии.
Экзамен состоял из 100 вопросов,
посвященных диагностике, меха
-
низмам действия лекарственных
препаратов, тактике ведения паци
-
ентов, лекарственной терапии опухолей. В их составлении участвовали ведущие эксперты RUSSCO:
Л.Ю. Владимирова, М.И. Волкова,
О.А. Гладков, А.А. Маркович, Ф.В.
Моисеенко, Д.Р. Насхлеташвили,
А.В. Новик, М.П. Никулин, И.С.
Романов, А.А. Румянцев, А.И. Се
-
менова, С.А. Тюляндин, А.С. Тю
-
ляндина, А.А. Трякин, И.А. Утяшев,
М.Ю. Федянин.
Успешно экзамен сдали 22 челове
-
ка, которые получили дипломы.
А четверо из них набрали наи
-
большее количество баллов: М.
Глузман из Санкт-Петербурга
стал первым, москвичи А. Ахме
-
тьянова и В. Евдокимов поделили
второе место, третьим оказался Д
Шеметов из Челябинска. Им, по
-
мимо дипломов, были вручены
гранты на организацию поездки
на одну из конференций RUSSCO
в 2024 г.
ЗНАКОМЬТЕСЬ: РЕГИОНАЛЬНОЕ ОТДЕЛЕНИЕ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ ПРИМОРСКОГО КРАЯ

Приморский край входит в состав
Дальневосточного федерального
округа. Расстояние от Москвы
до регионального центра – 9598
км по железной дороге. Площадь
территории края – 164,7 км2
(0,97% от территории России),
плотность населения – 11,68 чел.
на 1 кв.м. Максимальная протяженность края около 900 км, наибольшая ширина – 280 км. Общая
протяженность границ – 3000 км,
из них морские – около 1500 км.
Приморское отделение Российского общества клинической онкологии было организовано 12
октября 2012 года в присутствии
учредителей:
• Гурина Людмила Ивановна,
д.м.н., врач-онколог, заместитель главного врача по медицинской части;
• Евтушенко Елена Владимировна, врач-онколог, заместитель
главного врача по клиникоэкспертной работе;
• Грицай Жанна Викторовна,
врач-онколог отделения
противоопухолевой лекарственной терапии;
• Парасочко Екатерина Сергеевна, врач-радиотерапевт, заведующая отделением радиотерапии;
• Ершова Светлана Иосифовна,
врач-онколог, заведующая
отделением онкогинекологии;
• Богословская Елена
Владимировна, заведующая
организационно-методическим
отделом;
• Иванкова Марина Игоревна,
врач-онколог;
• Апанасевич Владимир
Иосифович, д.м.н., профессор
кафедры онкологии
Тихоокеанского государственного медицинского университета.
Сегодня в Приморском отделении общества зарегистрировано
35 членов. Из них хирургов – 3,
радиотерапевтов – 2, радиологов
– 1, терапевтов – 1, организаторов
здравоохранения – 2, медицинская сестра – 1.
Действующим председателем общества является Гурина Людмила Ивановна, секретарем – Евтушенко Елена Владимировна.

Ежегодно в Приморском крае при
поддержке и участии RUSSCO
проводятся образовательные мероприятия. Только в 2021-2022
годах проведено 8 мероприятий
по различным проблемам и актуальным вопросам противоопухолевой лекарственной терапии, в
том числе при активном участии
в качестве докладчика врача-онколога Фатеевой Анастасии Валерьевны, занимавшей должность
заместителя главного врача ГБУЗ
«ПКОД» по медицинской части с
2019 года по октябрь 2023 года.
Совместно с RUSSCO организована и проведена 5-7 октября 2023
года Первая Дальневосточная
онкологическая конференция –
«Территория инноваций 2023»,
посвященная 75-летию онкологической службы Пиморского края,
в которой приняли участие более
150 человек.

Совместно с RUSSCO, под руководством Тимофеева И.В.
проведены клинические исследования и опубликованы материалы: «Everolimus in patients
with metastatic renal cell carcinoma
previously treated with bevacizumab:
a prospective multicenter study
CRAD001LRU02T» (Timofeev I.,
Snegovoy A., Varlamov S., Manzuk
L. Gurina L. J. Target Oncology. 2015;
Vol.10, №3, P.423-427).
Совместно с Тюляндиным С.А., Карасевой В.В. проведены клинические
исследования по протоколу «Терапия больных немелкоклеточным
раком легкого в Российской Федерации: исследование EPICLIN-Lung» и
опубликована статья в журнале «Современная онкология» (2016; том 18,
№6) в соавторстве (Тюляндин С.А.,
Имянитов Е.Н., Моисеенко В.М., Пономаренко Д.М., Королева И.А., Карасева В.В., Гурина Л.И.).
Под эгидой Приморского отделения RUSSCO организована на постоянной основе образовательная
и просветительская деятельность
с врачами онкологами, патоморфологами, специалистами диагностических профилей и другими
врачами-специалистами, в том
числе в 10 Центрах амбулаторной
онкологической помощи, с проведением ежеквартальных региональных научно-практических
конференций, семинаров, школ
по актуальным вопросам онкологической помощи населению Приморского края.
Приморье занимает самую крайнюю часть юго-востока России,
на севере граничит с Хабаровским краем, на западе с Китаем, на
юго-западе с Северной Кореей. С
юго-востока омывается Японским
морем и граничит с Сахалинской
областью. Некоторые районы
Приморья приравнены к районам
Крайнего Севера. В самом холодном месяце – январе – температура в среднем составляет от –12°C
до –20°C. Зима сухая, ясная и ветреная. Самые теплые месяцы –
июль и август. В этот период средняя температура составляет от
+18°C до +20°C. На летние месяцы
приходится максимум количества
осадков, нередки тайфуны. Численность населения Приморского
края на 01.01.2022 г. составила 1
863 011 человек, из них мужчин
– 892 759, женщин – 970 252; трудоспособное население – 1 096 260
человек (58,8%).
Административно край делится
на 12 городских округов с численностью 1 444 057 жителей.
Города Приморья: Владивосток,
Арсеньев, Артем, Большой Камень – ЗАТО, Дальнереченск,
Дальнегорск, Лесозаводск, Находка, Партизанск, Спасск-Дальний
Уссурийск, Фокино – ЗАТО. Владивостокский городской округ:
численность населения составила
629 001 человек, из них мужчин
– 297 390, женщин – 331 611. В ноябре 2019 года Владивосток официально получил статус столицы
Дальнего Востока. Это крупнейший город и порт на Дальнем Востоке России, расположен на полуострове Муравьёва-Амурского и
островах в заливе Петра Великого Японского моря. Главная база
Тихоокеанского флота России. В
городе развиты рыбодобывающая,
судоремонтная, деревообрабатывающая, строительная, химическая, энергетическая, пищевая,
полиграфическая и медицинская
промышленности.
На протяжении последнего десятилетия заболеваемость злокачественными новообразованиями
(ЗНО) населения Приморского
края имела тенденцию к увеличению. Однако в 2020 году с начала
пандемии инфекции COVID-19
впервые в крае зарегистрировано снижение до 381,4 интенсивного
показателя (ИП) заболеваемости
ЗНО с небольшим подъемом до
413,0 в 2021 году и последующим
снижением до 385,7 на 100 тыс.
населения в 2022 году. Подобные
изменения произошли в стандартизованном показателе (СП) заболеваемости. В 2022 году СП заболеваемости ЗНО составил 236,3 на
100 тыс. населения, превысив уровень 2021 года (235,8) и 2020 года
(221,2), но не достигнув величины
показателя 2019 года (276,3 на 100
тыс. населения).
В 2022 году в структуре интенсивного показателя заболеваемости
ЗНО обоих полов на первом месте
расположились ЗНО кожи (12,5%),
на втором – молочной железы
(12,2%), на третьем – трахеи, бронхов, легкого (11,2%), на четвертом
– предстательной железы (10,1%),
на пятом – тела матки (7,1%), на
шестом ободочной кишки (6,8%),
на седьмом – желудка (6,0%), на
восьмом – шейки матки (5,7%), на
девятом – поджелудочной железы
(4,6%), на десятом – ректо-сигмоидного отдела, прямой кишки.

С 2013 года доля пациентов, выявленных на I-II стадиях злокачественного новообразования, имела тенденцию к росту с 44,0%
в 2013 году до 59,7% в 2022 году. В
2022 году в Приморском крае под
наблюдением находилось 47024
пациента, из них 26710 пациентов состоят на диспансерном наблюдении 5 лет и более с момента
установления диагноза.
Благодаря национальной программе «Борьба с онкологическими заболеваниями» в Приморском
крае увеличилась доступность и
качество онкологической помощи населению: организовано 10
ЦАОП с дневными стационарами
общей мощностью 100 пациентомест (17000 госпитализаций в год) для проведения противоопухолевой лекарственной терапии.
Переоснащена современным медицинским оборудованием служба специализированной медицинской помощи края, развернутая
преимущество на базе ГБУЗ «Приморский краевой онкологический
диспансер» с 283 койками круглосуточного, 50 койками дневного
стационара с собственной диагностической службой и поликлиникой на 100 посещений в две смены.
В ГБУЗ «ПКОД» развита современная служба радиотерапии с
современными линейными ускорителями, служба радионуклидной диагностики с кабинетами ОФЭК-КТ и ПЭТ-КТ и радионуклидной терапии, в том числе с
3-мя койками для лечения рака
щитовидной железы. Кроме современных хирургических, радиотерапевтических отделений в
ГБУЗ «ПКОД» развернуты 2 отделения противоопухолевой лекарственной терапии с 35 койками
круглосуточного и 10-ю койками
дневного пребывания каждое и
возможностью выполнения государственного задания в объеме
1296 госпитализаций в круглосуточный стационар, 900 госпитализаций для выполнения ВМП и
2000 госпитализаций в дневной
стационар для проведения противоопухолевой лекарственной
терапии и химиолучевой терапии.
Организована доступность амбулаторно-поликлинической помощи в ГБУЗ «ПКОД» благодаря
внедрению удаленной записи на
прием к врачу, записи на инструментальное обследование чрез Регистрационный портал (КТ, МРТ,
ОФЭКТ, эндоскопия). Внедрены
проекты «Бережливое производство», «Индивидуальный помощник пациента», «Скрининг
рака полости рта» и другие, что
улучшило качество медицинской
помощи населению Приморского
края.

НОВОСТИ ESMO 2023 / ESMO 2023: РАК МОЛОЧНОЙ ЖЕЛЕЗЫ
Автор: Титова Татьяна Александровна,
Врач-онколог в отделении химиотерапии
НМИЦ онкологии им Н.Н. Блохина, Москва

В первый день на конгрессе представлены работы, отражающие
перспективы терапии раннего
рака молочной железы (РМЖ).
Nicholas Turner
На церемонии открытия ESMO
Award for Translational Research 2023
вручена профессору Nicholas Turner
(он возглавляет Центр Ральфа Лорена по исследованиям в области рака
молочной железы и также является
лидером группы молекулярной онкологии Центра современных исследований рака молочной железы
при Институте Исследования Рака,
Великобритания) за изучение роли
циркулирующих опухолевых ДНК в
качестве предиктора рецидива при
раннем раке молочной железы; также отмечена роль профессора Turner
в исследовании динамики цДНК, как
метода оценки эффективности терапии при диссеминированном РМЖ.
Научная программа 1 дня включала несколько исследований, посвященных периоперационной
иммунотерапии в комбинации с
химиотерапией при раннем раке
молочной железы, прежде всего, это
KEYNOTE-522 (тройной негативный
РМЖ) и CheckMate 7FL (ГР+ РМЖ)
и KEYNOTE-522 (ГР+ РМЖ). Нужно
отметить, что интерес к иммунотерапии при РМЖ сейчас крайне высок.
KEYNOTE-522
Представлены обновленные результаты известного и широко обсуждаемого исследования 3 фазы
KEYNOTE-522, в котором изучалась целесообразность добавления пембролизумаба к химиотерапии при
раннем трижды негативном РМЖ. В
некоторых странах результаты данного исследования послужили причиной одобрения пембролизумаба в
периоперационной терапии в рутинной клинической практике.
В работу были включены пациенты (n=1174) с ТНРМЖ с T1c N1-2
или T2-4 N0-2 и ECOG статусом 0-1,
рандомизированные в две лечебные
группы. Дизайн исследования представлен на рисунке 1.
Рисунок 1.
Дизайн исследования KEYNOTE-522.
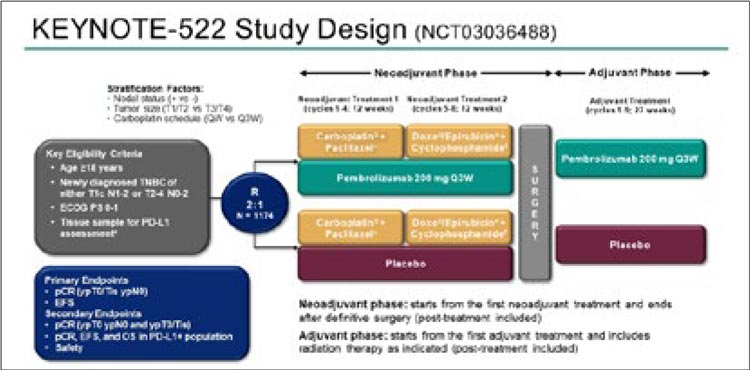
Рисунок 2.
Результаты исследования KEYNOTE-522.
У большинства пациентов в исследовании PD-L1 статус был оценен как
позитивный (83,7% и 81,3%), первичная опухоль – T1/T2 (74,0% и 74,4%) и
лимфатические узлы как N+ (51,7% и
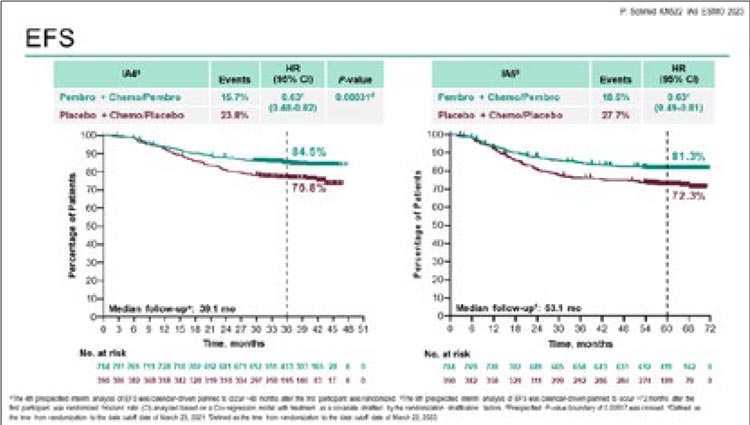
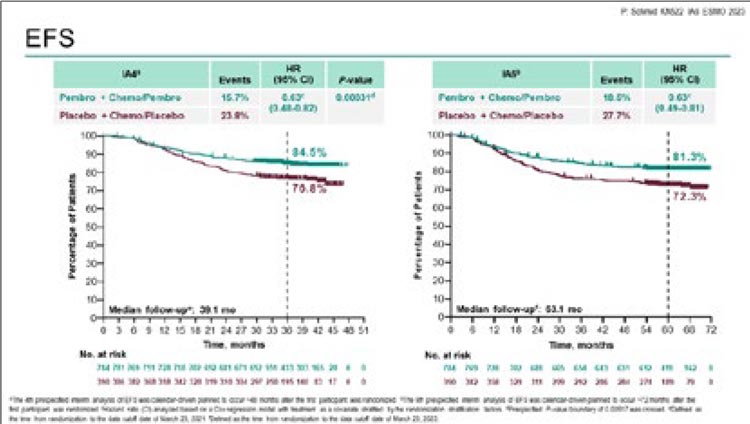
51,7%). При медиане времени наблюдения в 63,1 мес. добавление пембролизумаба к химиотерапии позволило
увеличить 60-месячную бессобытийную выживаемость (БСВ) с 72,3% до
81,3% (ОР 0,63; 95% ДИ 0,49-0,81) и
снизить риск прогрессирования на
27% (рис.2).
Интересен анализ результатов в зависимости от полного патоморфологического ответа (pCR). Так, в группе с
pCR добавление пембролизумаба увеличивало 60-месячную БСВ только
на 3% – с 88,2% до 92,2%, но если pCR
не был достигнут, то в этой крайне
неблагоприятной когорте пациентов
комбинация химиотерапии с иммунотерапией позволяла увеличить этот
показатель уже на 10% – с 52,3% до
62,6%.
Новое направление в периоперационной иммунотерапии РМЖ – иммунотерапия при раннем гормонозависимом РМЖ. Напомним, что частота
достижения pCR при раннем рецептор-позитивном РМЖ, по данным
разных авторов, варьирует от 0% до
18%.
KEYNOTE-756 – первые результаты
KEYNOTE-756 – исследование 3
фазы, основной задачей которого
была оценка целесообразности добавления пембролизумаба к НАПХТ
на основе антрациклинов и таксаном.
В исследование были включены
больные РМЖ grade 3, начиная со
стадии T1c-T2 (≥2 см) сN1-2 или T3-
T4 cN0-2. Пациенты были рандомизированы в две лечебные группы 1:1:
группа 1 (n=635) – 12 введений паклитаксела 80 мг/м2 1 раз в 7 дней +
пембролизумаб 200 мг 1 раз в 4 недели, далее AC/EC 1 раз в 2/3 недели
+ пембролизумаб 200 мг 1 раз в 4 недели. После хирургического лечения
больные еще 6 месяцев получали терапию пембролизумабом и эндокринотерапию до 10 лет;
группа 2 (n=643) – 12 введений паклитаксела 80 мг/м2 1 раз в 7 дней,
далее AC/EC 1 раз в 2/3 недели. После
хирургического лечения больные получали эндокринотерапию до 10 лет.
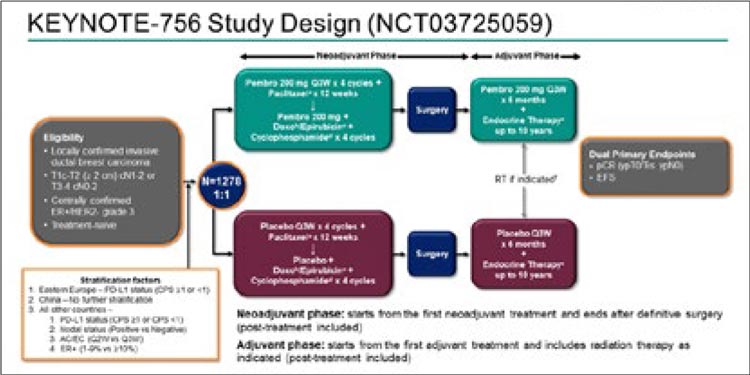
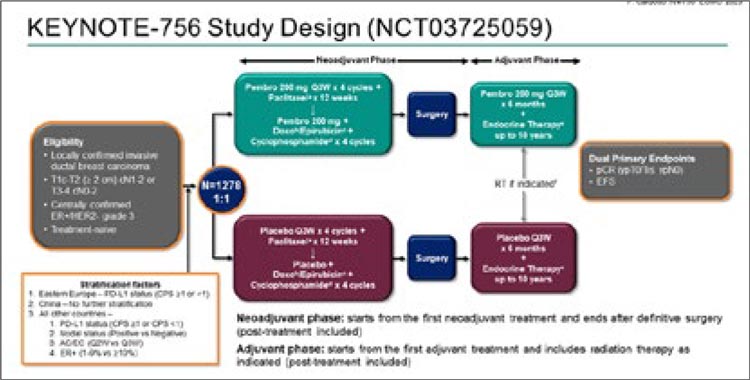
Дизайн исследования представлен на
рисунке 3.
Рисунок 3.
Дизайн исследования KEYNOTE-756.
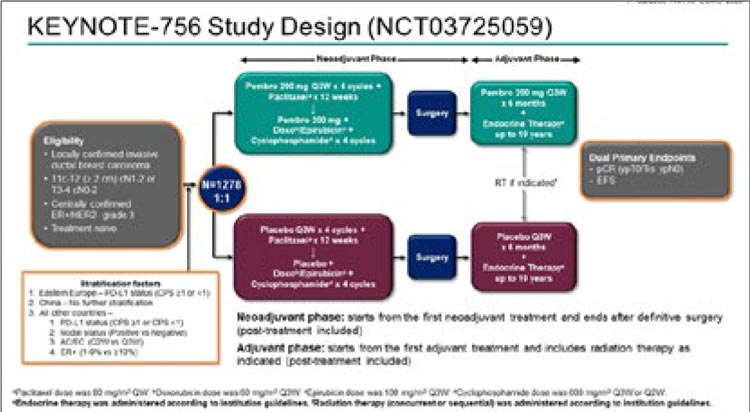
Рисунок 4.
Эффективность ниволумаба в комбинации
с химиотерапией при раннем ГР+ РМЖ.
Первичными конечными точками
исследования были частота достижения pCR и БСВ.
У большинства пациентов, включенных в работу, зарегистрирован
CPS≥1 (75,9% и 76,0%), первичная
опухоль T3/T4 (36,7% и 35,8%), и
лимфатические узлы оценены как
метастатические в 89,8% и 90,5% случаев в 2 группах соответственно.
Добавление пембролизумаба к химиотерапии позволило увеличить
частоту достижения ypT0/Tis ypN0
на 8,5% – c 15,6% до 24,3%. Fatima
Cardoso особенно подчеркнула, что
максимальный выигрыш от добавления иммунотерапии отмечен
у больных с уровнем ЭР <10%. Нежелательные явления (НЯ) любой
степени отмечены у 98,4% и 98,6%
больных в лечебных группах и были
преимущественно представлены
алопецией (60,4% и 60,9%), тошнотой (48,3% и 50,0%), анемией (32,3%
и 25,5%), слабостью (30,0% и 28,0%),
диарей (27,1% и 20,2%), повышением
уровней АСТ (24,9% и 22,9%) и АЛТ
(21,% и 16,7%), нейтропенией (23,0%
и 24,6%), астенией (21,1% и 18,1%),
рвотой (20,0% и 16,8%) и полинейропатией (17,5% и 20,2%). НЯ 3 степени
и выше зарегистрированы у 52,5% и
46,4% соответственно.
В группе с иммунотерапией иммуноопосредованные НЯ любой степени
были преимущественно. представлены гипотиреозом (17,5%), гипертиреозом (9,0%), пневмонитом (2,8%),
надпочечниковой недостаточностью
(2,5%).
CheckMate 7FL
Представлены первые результаты
рандомизированного исследования
3 фазы CheckMate 7FL, посвященного целесообразности добавления
ниволумаба к химиотерапии (P+AC/
ddAC) при раннем гормонозависимом РМЖ при T1c-T2 cN1-N2 или
T3-T4 cN0-cN2.
В две лечебные группы был рандомизирован 521 больной, представлен
анализ эффективности у 510 пациентов. Первичной конечной точкой
исследования была частота достижения pCR в лечебных группах, вторичными – pCR при PD-L1+, а также
частота достижения RCB 0/1/2/3 в зависимости от статуса PD-L1. У большинства пациентов, включенных в
исследование, имелись метастазы в
подмышечные лимфоузлы (80% и
79%), PD-L1+ ≥34%, а степень злокачественности опухоли оценена как
grade 3 (98% и 99%).Добавление ниволумаба к химиотерапии позволило
увеличить частоту достижения pCR
в ITT популяции с 13,8% до 24,5%
(p=0,0021), при PD-L1≥1% комбинации с иммунотерапией привела к росту pCR с 20,2% до 44,3% (рис.4).
Комбинация ХТ с иммунотерапией
также привела к росту RCB 0-1 при
PD-L1≥1% с 26,2% до 54,5% (ОР 3,49;
95% ДИ 1,82-6,69).
НЯ любой степени были зарегистрированы у 98% пациентов как в группе
с ниволумабом, так и без него, причем НЯ, потребовавшие прекращения терапии, отмечены у 10% больных в группе с иммунотерапией и у
3% при назначении только химиотерапии. Зарегистрировано 2 случая
смерти связанными с иммуноопосредованными НЯ.
Иммунотерапия – крайне интересная и наиболее вероятно перспективная опция при раннем РМЖ, однако эксперты осторожно относятся
к представленным данным и ждут
отдаленных результатов этих и будущих работ.
Источники:
- Schmid P, et al. Pembrolizumab or placebo plus chemotherapy followed by pembrolizumab or placebo for early-stage TNBC: Updated EFS results from the phase 3 KEYNOTE-522 study. ESMO Congress 2023, LBA18.
- Loi S, et al. A randomized, doubleblind trial of nivolumab (NIVO) vs placebo (PBO) with neoadjuvant chemotherapy (NACT) followed by adjuvant endocrine therapy (ET) ± NIVO in patients (pts) with high-risk, ER+ HER2− primary breast cancer (BC). ESMO Congress 2023, LBA20.
- Cardoso F, et al. KEYNOTE-756: Phase 3 study of neoadjuvant pembrolizumab (pembro) or placebo (pbo) + chemotherapy (chemo), followed by adjuvant pembro or pbo + endocrine therapy (ET) for early-stage high-risk ER+/HER2– breast cancer. ESMO Congress 2023, LBA21.
Различные конъюгаты моноклональных антител с цитостатиками
активно внедряются в рутинную
клиническую практику в мире.
Множество новых молекул появляется на фарма-цевтическом
рынке ежегодно, что позволяет
расширять опции лекарственной
терапии боль-ным со злокачественными новообразованиями.
NCT05263479
Интересное исследование 1b фазы NCT05263479 из Китая, посвященное изучению эф-фективности нового коньюгата АТ с цитостатиком HS-20089. В работу были включены больные раком молочной железы, яичников и тела матки, ранее получавшие терапию.
HS-20089 представляет собой конъюгат, состоящий из моноклонального антитела (IgG1) к рецептору B7-H4 и ингибитора топоизомеразы I. Основной целью исследования NCT05263479 являлось определение профиля ток-сичности и дозы исследуемого препарата. Опубликованы результаты терапии 28 больных диссеминированным тройным негативным РМЖ. При медиане времени наблюдения в 5,7 мес. и уровне дозы в 4,8 мг/кг (n=12) ЧОО достигла 33,3% при КРО в 66,7%, а при дозе 5,8 мг/кг (n=11) – 27,3% и 81,8% соответственно (рис. 1). Эффективность лечения не зави-села от терапии PARPi и иммунотерапии в анамнезе.
Рис 1.
Эффективность HS-20089 при ТНРМЖ.
Исследование NCT05263479
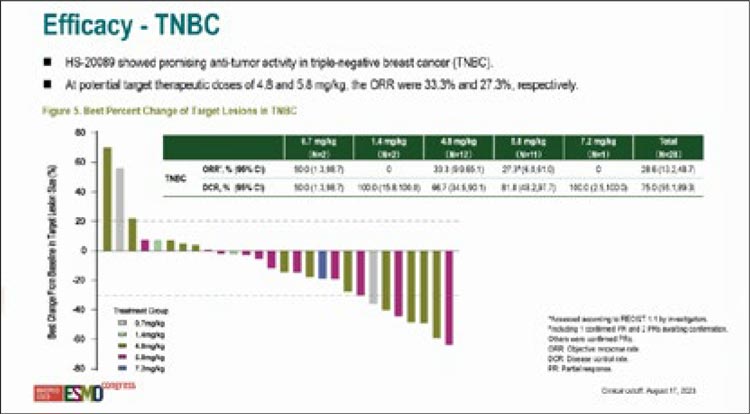
НЯ 3 степени и выше были преимущественно представлены гематологической и гастроинтестинальной токсичностью, ни одного случая пневмонита зарегистрировано не было.
Обновленные результаты
DESTINY-Breast 04
DESTINY-Breast 04 – исследование
3 фазы отражающие эффективность трастузумаба де-рукстекана
(T-DXd) в сравнении с химиотерапией у пациентов HER2-low (HER2
1+ или HER2 2+/FISH отрицательный) диссеминированным РМЖ в
поздних линиях лечения.
557 пациентов были рандомизированы в 2 лечебные группы (2:1):
1 группа (n=373) – T-DXd 5,4 мг/кг 1
раз в 3 недели;
2 группа (n=184) – химиотерапия по
выбору исследователя: капецитабин
(20,1%), эрибулин (51,5%), гемцитабин (10,3%), паклитаксел (8,2%), nabпаклитаксел (10,3%).
При медиане времени наблюдения
в 32,0 мес. медиана ВБП в группе
T-DXd достигла 8,8 мес. против
4,2 мес. в группе химиотерапии
(ОР=0,36; 95% ДИ 0,29-0,45), что
позволило снизить риск прогрессирования на 64%. В когорте пациентов с гормонозависимым РМЖ медиана ВБП в группе
T-DXd составила 9,6 мес. против
4,2 мес. в группе химиотерапии
(ОР =0,37; 95% ДИ 0,30-0,46).
Медиана ОВ в группе T-DXd достигла 22,9 мес. и 16,8 мес. в группе химиотерапии (ОР=0,69; 95% ДИ 0,55-
0,86), при 36 мес. ОВ в 26,2% и 16,3%
в когортах соответственно.
У пациентов с гормонозависимым
РМЖ медиана ОВ в группе T-DXd
достигла 23,9 мес. против 17,6 мес. в
группе химиотерапии (ОР=0,69; 95%
ДИ 0,55-0,87), при 36 мес. ОВ в 26,5%
и 16,9% в лечебных группах соответственно (рис. 2).
Рис 2.
Обновленные результаты DESTINY-Breast 04
Объединенный анализ DESTINY-Breast 01, 02, 03.
В ретроспективное исследование
включено 1350 больных с метастатическим поражением ЦНС,
851 пациент получали T-DXd и
465 пациентов – другую терапию
(трастузумаб+ капецитабин, лапатиниб + капецитабин, T-DM1).
В работе показано, что назначение T-DXd позволяет достигнуть
ЧОО в 45,2% (17,3% – полный ответ, 28,8% – частичный ответ)
при бессимптомных метастазах
в головном мозге и 45,5% (15,9% –
полный ответ, 29,5% – частичный
ответ) при клинически явном пораже-нии ЦНС. Эти результаты
значимо выше, чем в группе сравнения, где КРО даже у паци-ентов
с неактивными метастазами составил 27,6% (рис. 3).
Рис 3.
Объеденный анализ DESTINY-Breast 01, 02, 03.
Эффективность T-DXd при метастазах в ЦНС.
Назначение T-DXd в этой крайне
неблагоприятной группе пациентов также позволило увеличить
и мВБП, как в группе с бессимптомными метастазами в ЦНС с
8,7 мес. до 12,2 мес. (ОР=0,59; 95%
ДИ 0,4-0,9), так и при клинически
значимом поражении с 4,0 мес. до
18,5 мес. (ОР=0,20; 95% ДИ 0,11-
0,35).
На основании представленных
данных исследователи делают
вывод о высокой активно-сти
T-DXd при метастатическим поражении головного мозга у больных HER2 позитив-ным РМЖ.
Источники:
- Аbstract 3810. First-in-human/ phase I trial of HS-20089, a B7-H4 ADC, in pаtients with advanced solid tumors/ Annals of Oncology Vol. 34. Supple-ment S336 Published in issue: October, 2023
- Abstract 376O. Trastuzumab deruxtecan (T-DXd) versus treatment of physician’s choice (TPC) in patients (pts) with HER2- low unresectable and/or metastatic breast cancer (mBC): Updated survival results of the randomized, phase III DESTINY-Breast04 study. Annals of OncologyVol. 34 Supple-ment S334–S335. Published in issue: October, 2023
- Abstract 377O. A pooled analysis of trastuzumab deruxtecan (T-DXd) in patients (pts) with HER2-positive (HER2+) metastatic breast cancer (mBC) with brain metastases (BMs) from DESTINYBreast (DB) -01, -02, and -03. Annals of Oncology Vol. 34 Supplement S334–S335 Published in issue: October, 2023
НОВОСТИ ESMO 2023 / TДАТОПОТАМАБ ДЕРУКСТЕКАН (DATO-DXD) В КОМБИНАЦИИ С ДУРВАЛУМАБОМ В ПЕРВОЙ ЛИНИИ ТЕРАПИИ МЕСТНОРАСПРОСТРАНЕННОГО ИЛИ ДИССЕМИНИРОВАННОГО ТНРМЖ
Датопотамаб дерукстекан (DatoDxd) представляет собой конъюгат, состоящий из моноклонального антитела (IgG1) к рецептору
Trop-2 и ингибитора топоизомеразы I.
Исследование BEGONIA – мультикогортное исследование, посвященное изучению различных
режимов терапии в комбинации
с дурвалумабом в первой линии
лечения местнораспространенного или диссеминированного
ТНРМЖ. На конгрессе представлены результаты терапии в
7 когорте, где пациенты (n=62) в
первой линии терапии получали
датопотамаб дерукстекан 6 мг/кг
с дурвалумабом 1120 мг/кг 1 раз в
3 недели до прогрессирования или
неприемлемой токсичности.
Первичной конечной точкой исследования была оценка переносимости терапии, вторичными –
частота достижения объективных
ответов (ЧОО), длительность достигнутого ответа, медианы ВБП
и ОВ. Большинство пациентов,
включенных в исследование, ранее получали терапию по поводу
раннего РМЖ (58%), и у 60% больных были подтверждены висцеральные метастазы
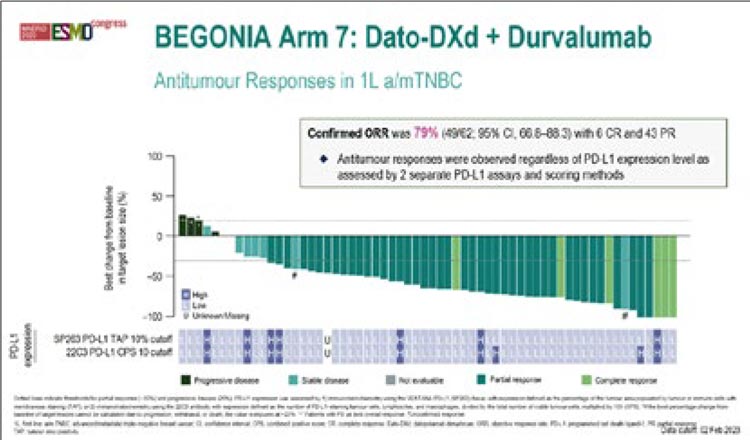
При медиане времени наблюдения
в 11,7 мес. ЧОО составила 79% (6
полных ответов, 43 частичных) при
медиане длительности ответа в 15,5
мес. (рис.1).
Рисунок 1.
Результаты исследования BEGONIA, 7 когорта
Медиана ВБП достигла 13,8 мес. (95% ДИ 11,0-НД). НЯ любой степени зарегистрированы у 100% пациентов, включенных в исследование, при этом осложнения 3-4 степени отмечены у 57% больных и преимущественно представлены стоматитом (11%), запорами (2%), тошнотой (2%), подъемом амилазы (18%) и снижением аппетита (2%). Пневмонит отмечен у 3 больных: 2 степени – у 2 пациентов, 1 степени – у 1.
Редукция дозы Dato-Dxd потребовалась 18 больным, в 11 случаях в связи со стоматитом.
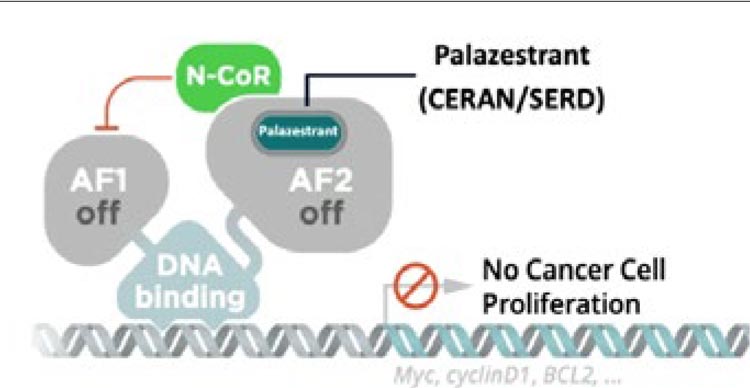
Палазестрант (ОР-1250, CERAN+
SERD) – полный антагонист эстрогеновых рецепторов. Механизм
действия связан с подавлением активности и деградацией эстроген-рецепторов, в том числе при мутации в
гене ESR1 (рис.2).
Рисунок 2.
Механизм действия палазестранта
В исследование были включены больные диссеминированным гормонозависимым HER2-
отрицательным РМЖ, ранее
получившие от 1 до 4 линии эндокринотерапии, также включались
пациенты с 1 линией химиотерапии
в анамнезе. Представлены данные
об эффективности терапии палазестраентом у 86 пациентов в дозе 120
мг в день.
Медиана возраста пациентов, включенных в исследование, составила
61 год, у 71% имелись висцеральные метастазы, у 44% проведено 3
и более линии терапии в анамнезе,
97% ранее получали ингибиторы
CDK4/6 и 29% – ингибиторы mTOR.
У 41% больного выявлена клинически значимая мутация в гене ESR1.
НЯ любой степени были преимущественно представлены тошнотой (65%), рвотой (30%), слабостью
(27%), нейтропенией (25%), головной болью (20%), запорами (18%)
и повышением уровня АСТ (16%);
6% пациентов завершили терапию в
связи с токсичностью.
Контроль роста опухоли (КРО) отмечен у 40% больных. Среди пациентов с мутацией в гене ESR1 КРО
зарегистрирован в 52% случаях
(рис.3).
Рисунок 3.
Эффективность терапии палазестрантом
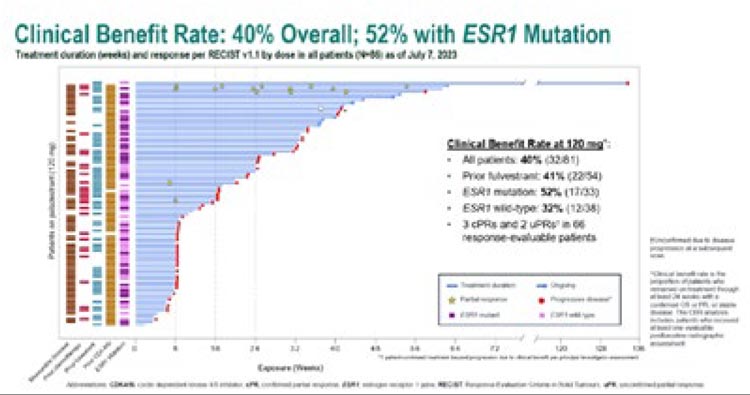
Медина ВБП в общей группе достигла 4,6 мес., при 12-месячной
ВБП в 38%. В когорте больных с
мутацией в гене ESR1 медиана ВБП
составила 5,6 мес., при 12-месячной
ВБП в 46%.
Исследователи делают вывод о высокой эффективности и хорошей
переносимости палазестранта у пациентов с диссеминированным гормонозависимым HER2-негативным
РМЖ в поздних линиях терапии.
Исследование
EMBER. Эффективность
имлунестранта
в монотерапии или в
комбинации с эверолимусом
или алпелисибом в поздних
линиях лечения
Имлунестрант – селективный пероральный деградатор эстрогеновых
рецепторов, проникающий через гематоэнцефалический барьер и проявляющий эффект при мутациях в
гене ESR1.
В исследование были включены пациенты с метастатическим гормонозависимым HER2-негативным РМЖ,
ранее получившие не более 3 линий
лекарственного лечения по поводу
диссеминированного РМЖ. Пациенты были распределены в 3 лечебные
группы:
• 1 группа (n=114) – имлунестрант;
• 2 группа (n=42) – имлунестрант в
комбинации с эверолимусом;
• 3 группа (n=21) – имлунестрант в
комбинации с алпелисибом.
У большинства пациентов в исследовании были висцеральные метастазы
и у половины – мутация в гене ESR1.
НЯ любой степени в группе имлунестранта отмечены у 93% пациентов, 3
степени и выше – у 21% и были преимущественно представлены тошнотой (1%), слабостью (2%) и диареей
(2%). НЯ любой степени в когорте
имлунестранта в комбинации с эверолимусом отмечены у 100% больных, 3 степени и выше – у 43%, в
большинстве случаев регистрировались тошнота (2%), рвота (2%), повышение АСТ (10%) и диарея (2%).
НЯ любой степени в группе имлунестранта c алпелисибом выявлены у
100% пациентов, 3 степени и выше
– у 81% и были преимущественно
представлены тошнотой (5%), слабостью (5%), диареей (10%), снижением аппетита (5%), сыпью (48%) и
гипергликемией (10%).
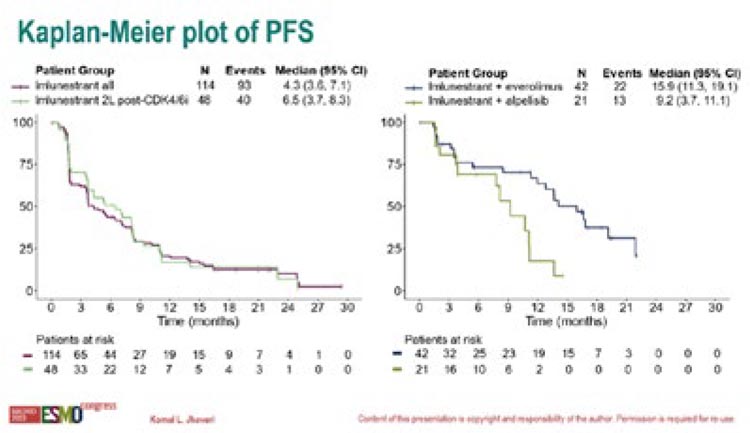
Медина ВБП в группе монотерапии
имлунестрантом достигла 4,3 мес.
при КРО в 42% (ЧОО составила
8%), в когорте имлунестранта и эверолимуса – 15,9 мес. при КРО в 62%
(ЧОО составила 21%) и в группе
имлунестранта и алпелисиба – 9,2
мес. при КРО в 62% (ЧОО составила 58%) (рис.4).
Рисунок 4.
Результаты исследования EMBER.
Финальный анализ
исследования FALCON.
Анастрозол в сравнении
с фулвестрантом
в первой линии терапии
у женщин в постменопаузе
при гормонозависимом
HER2-негативном
диссеминированным РМЖ.
462 пациента были рандомизированы в две лечебные группы (1:1):
анастрозол – 1 мг 1 раз в день, ежедневно, лечение до прогрессирования или неприемлемой токсичности; фулвестрант – 500 мг в/м в 1, 14 и 28 дни и далее 1 раз в 28 дней, лечение до прогрессирования или неприемлемой токсичности.
Первичной конечной точкой исследования была медиана ВБП, вторичной – медиана ОВ.
В группе с фулвестрантом медиана ВБП достигла 16,8 мес. против 13,8 мес. в группе анастрозола (ОР=0,8; 95% ДИ 0,64-1,00; p=0,049). При подгрупповом анализе у пациентов без висцеральных метастазов назначение фулвестранта в сравнении с анастрозолом позволило увеличить медиану ВБП с 13,8 до 22,3 мес. (ОР=0,59; 95% ДИ 0,42-0,84) (рис.5).
Рисунок 5.
Результаты исследования FALCON
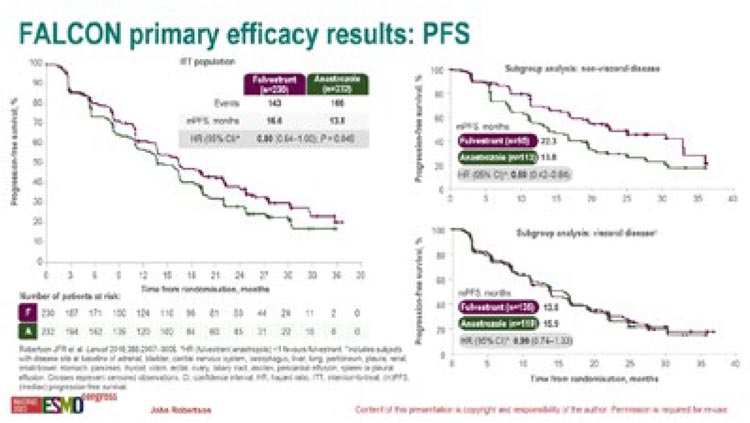
Однако увеличение медианы ВБП на фоне терапии фулвестрантом в сравнении с анастрозолом не привело к значимым различиям в медианах в исследуемых группах; так, медиана ОВ составила 44,8 мес. в когорте фулвестранта и 42,7 мес. в когорте анастрозола (ОР=0,97; 95% ДИ 0,77-1,21; p=0,76).
При поданализе не было выявлено значимого преимущества ни в одной из исследуемых групп.
Источники:
- Abstract 379MO. Datopotamab deruxtecan (Dato-DXd) + durvalumab (D) as first-line (1L) treatment for unresectable locally advanced/metastatic triple-negative breast cancer (a/mTNBC): Updated results from BEGONIA, a phase Ib/II study. Annals of Oncology. Vol.34, Supplement S337. Published in issue: October, 2023.
- Аbstract 382MO. Updated results from the phase I/II study of OP-1250, an oral complete estrogen receptor (ER) antagonist (CERAN) and selective ER degrader (SERD) in patients (pts) with advanced or metastatic ER-positive, HER2-negative breast cancer. Annals of Oncology. Vol.34, Supplement S338. Published in issue: October, 2023.
- Abstract 383MO. Imlunestrant with or without everolimus or alpelisib, in ER+, HER2- advanced breast cancer (aBC): Results from the phase Ia/b EMBER study. Annals of Oncology. Vol.34, Supplement S338-339. Published in issue: October, 2023.
- Abstract 384MO. Final overall survival analysis for fulvestrant vs anastrozole in endocrine therapy (ET)-naïve, hormone receptor-positive (HR+) advanced breast cancer (FALCON). Annals of Oncology. Vol.34, Supplement S339-340. Published in issue: October, 2023.
НОВОСТИ ESMO 2023 / TROPINION-BREAST01 TRIAL. ЭФФЕКТИВНОСТЬ ДАТОПОТАМАБА ДЕРУКСТЕКАНА (DATO-DXD) В ПОЗДНИХ ЛИНИЯХ ТЕРАПИИ ГОРМОНОЗАВИСИМОГО HER2-НЕГАТИВНОГО ДИССЕМИНИРОВАННОГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ
Датопотамаб дерукстекан (Dato-Dxd)
– конъюгат, состоящий из моноклонального антитела (IgG1) к рецептору Trop-2 и ингибитора топоизомеразы I.
TROPINION-Breast01 trial – исследование 3 фазы, посвященное изучению эффективности Dato-Dxd в
сравнении с химиотерапией по выбору исследователя (эрибулин, винорельбин, гемцитабин, капецитабин)
в поздних линиях лечения диссеминированного гормонозависимого
HER2-отрицательного рака молочной железы.
Пациенты были рандомизированы в
две лечебные группы:
• группа 1 (n=365) – Dato-Dxd 6 мг/кг
1 раз в 3 недели;
• группа 2 (n=367) – химиотерапия
по выбору исследователя (эрибулин n=220, винорельбин n=38,
капецитабин n=76, гемцитабин
n=33).
Терапия продолжалась до прогрессирования или неприемлемой токсичности. Большинство пациентов, включенных в исследование, ранее получали CDK4/6i (82% и 78%) и химиотерапию на основе антрациклинов и таксанов (90% и 92%). При медиане времени наблюдения в 10,8 мес. медиана ВБП в группе DatoDxd достигла 6,9 мес. против 4,9 мес. в группе химиотерапии (ОР=0,63; 95% ДИ 0,52-0,75; p<0,0001), при 6-месячной ВБП в 53,3% и 38,5% и 12-месячной ВБП в 25,5% и 14,6% соответственно (рис.1).
Рисунок 1.
Результаты исследования TROPINION-Breast01 trial
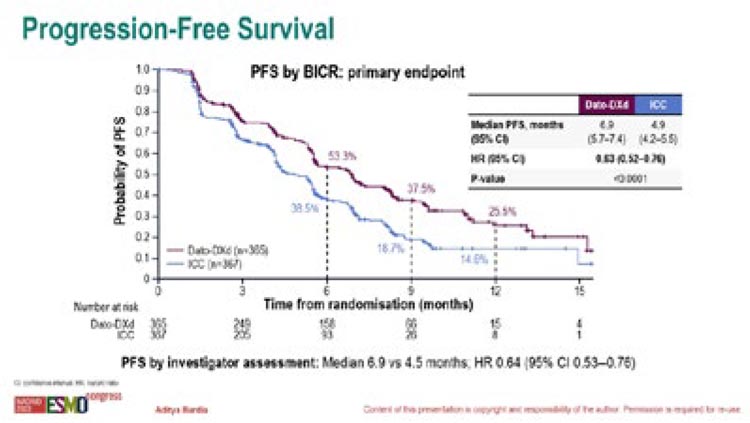
Частота ОО в группе с Dato-Dxd составила 36,4% и 22,9% в группе химиотерапии. Медиана ОВ не достигнута.
Нежелательные явления (НЯ) любой
степени отмечены у 94% пациентов в
группе Dato-Dxd и у 86% больных в
группе химиотерапии, частота регистрации НЯ 3 степени и выше в группах составила 21% и 45%, редукция
доз потребовалась в 21% и 30% случаях соответственно.
НЯ ≥3 степени в когортах Dato-Dxd
и химиотерапии были представлены
анемией (1% и 2%), нейтропенией
(1% и 31%), сухостью глаз (1% и 0),
тошнотой (1% и 1%), стоматитом (6%
и 3%), рвотой (1% и 1%) и слабостью
(2% и 2%).
Исследование крайне интересное,
первые результаты многообещающие, но главный вопрос – увеличит ли Dato-Dxd медиану ОВ – попрежнему открыт.
Продолжаются активные обсуждения результатов исследований
MonarchE и NATALEE. Назначение
CDK4/6i (абемациклиб и рибоциклиб) в адъювантной терапии пациентам ранним гормонозависимым
HER-негативным раком молочной
железы является актуальной стратегией лечения, однако крайне затратной.
Nadia Harbeck представила 5-летние
результаты исследования 3 фазы
MonarchE, в котором изучалось добавление ингибитора CDK4/6 абемациклиба к стандартной адъювантной
гормонотерапии у пациентов с люминальным HER2-негативным ранним раком молочной железы с поражением лимфатических узлов (N+) и
высоким риском рецидива.
Первичной конечной точкой исследования была выживаемость без
инвазивного заболевания (iDFS),
вторичными – выживаемость без отдаленных метастазов (DRFS), общая
выживаемость (OS) и безопасность.
В исследование рандомизировано
5637 пациентов (1:1):
• 1 группа – абемациклиб в комбинации с эндокринотерапией
(ингибиторами ароматазы или
тамоксифен);
• 2 группа – только гормонотерапия
(ИА или тамоксифен).
Исходно пациенты подразделялись
на 2 когорты в зависимости от клинико-морфологических характеристик и уровня ki-67:
• когорта 1: ≥4 л/у или 1-3 л/у при
наличии одного из факторов: grade
3 или T ≥5 см;
• когорта 2: 1-3 л/у и ki67 ≥20% и
grade 1-2 и T <5см.
Медиана наблюдения на момент промежуточного анализа общей выживаемости (3 июля 2023 года) составила 54 месяца. В результате:
• добавление абемациклиба к
адъювантной ГТ в ITT популяции
увеличивает 5-летнюю iDFS с 76,0%
до 83,6% (+7,6%) и снижает риск
рецидива на 32,0% (p<0,0001);
• добавление абемациклиба к
адъювантной ГТ в ITT популяции увеличило 5-летнюю DRFS с
79,2% до 86,0% (+6,7%) и снизило
риск прогрессирования на 32,5%
(p<0,0001).
При эксплоративном анализе отдаленные результаты терапии у пациентов с ЭР+/ПР– были значимо хуже
чем при ЭР+/ПР+ РМЖ; так, 36-месячная IDFS у больных ЭР+/ПР+, получавших абемациклиб в комбинации с эндокринотерапией, составила
89,9% против 83,2% для пациентов с
ЭР+/ПР–. В когорте больных, получавших только эндокринотерапию,
36-месячная IDFS достигла 85,9% и
72,8% для опухолей ЭР+/ПР+ и ER+/
PR– соответственно.
Также на конгрессе O’Shaughnessy J.
представил данные об отсутствии
снижения эффективности абемациклиба при обоснованной редукции
его дозы.
Aditya Bardia представил эксплоративный подгрупповой анализ
результатов исследования III фазы
NATALEE, посвященного оценке
эффективности рибоциклиба в адъювантном режиме в комбинации с
эндокринотерапией при гормонозависимом HER2-отрицательном
РМЖ II и III стадий. В работу были
включены пациенты без метастазов
в лимфатических узлах (28% от всех
включенных в исследование пациентов имели статус лимфоузлов N0),
что принципиально отличает данную
работу от исследования MonarchE.
При медиане времени наблюдения
в 27,7 мес. было показано преимущество в IDFS при добавлении рибоциклиба к эндокринотерапии у
больных моложе 65 лет (ОР=0,723;
95% ДИ 0,460-1,137), при III стадии
(ОР=0,740; 95% ДИ 0,592-0,925), N1-3
(ОР=0,771; 95% ДИ 0,630-0,944), ki67
>20% (ОР=0,756; 95% ДИ 0,559-0,996)
и независимо от статуса менопаузы.
Нужно отметить, результаты исследования пока не зрелые.
Источники:
- Bardia A, et al. Datopotamab deruxtecan (Dato-DXd) vs chemotherapy in previously-treated inoperable or metastatic hormone receptor-positive, HER2-negative (HR+/HER2–) breast cancer (BC): Primary results from the randomised phase III TROPION-Breast01 trial. ESMO Congress 2023, Abstract LBA11.
- Harbeck N, et al. Adjuvant abemaciclib plus endocrine therapy for HR+, HER2-, high-risk early breast cancer: results from a preplanned monarchE overall survival interim analysis, including 5-year efficacy outcomes. ESMO Congress 2023, Abstract LBA17.
- Goetz MP, et al. Prognostic and predictive impact of estrogen/ progesterone receptor (ER/PR), and Ki-67 expression: an exploratory analysis from the monarchE trial in patients with high-risk, HR+, HER2- , early breast cancer (EBC). ESMO Congress 2023, Abstract 240MO. Impact of dose reductions on efficacy of adjuvant abemaciclib for patients with high risk early breast cancer (EBC): Analyses from the monarchE study. ESMO Congress 2023, Abstract 274P.
- Bardia A, et al. Invasive disease-free survival (iDFS) across key subgroups from the Phase III NATALEE study of ribociclib (RIB) + a nonsteroidal aromatase inhibitor (NSAI) in patients (pts) with HR+/HER2− early breast cancer (EBC). ESMO Congress 2023, Abstract LBA23.
НОВОСТИ ESMO 2023 / КОЛОРЕКТАЛЬНЫЙ РАК. ШТРИХИ К ПОРТРЕТУ
Автор: Федянин Михаил Юрьевич
старший научный сотрудник
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина»
Минздрава России, доктор медицинских наук, Москва
Отсутствие прорывных результатов
исследований, как, к примеру, в онкоурологии или немелкоклеточном
раке легкого (НМРЛ), не ограничивает результативность конференции
ESMO в вопросе улучшения результатов лечения пациентов с колоректальным раком. Все представленные
работы позволяют внести дополнительные штрихи к терапевтическим
возможностям в отношении данной
патологии, как Леонардо да Винчи вносил штрихи в портрет Моны
Лизы, что сами мазки становились
невидимыми, а картина стремилась к
идеалу. Именно в этом аспекте разберем вместе с вами результаты работ с
конгресса.
При резектабельном раке толстой
кишки никогда не прекратит быть
актуальным поиск маркеров неблагоприятного прогноза. В объединенном анализе индивидуальных
данных из 7 рандомизированных
исследований ACENT/IDEA, в которых изучалась роль адъювантной
химиотерапии при операбельных
стадиях рака толстой кишки, удалось показать, что наличие мутации
в генах RAS и, в большей степени, в
гене BRAF значимо компрометирует
показатели выживаемости без признаков болезни, но только в группе
пациентов без микросателлитной
нестабильности (MSS). В группе же
пациентов с опухолями, ассоциированными с микросателлитно нестабильным фенотипом (MSI), выживаемость без признаков болезни не
различалась в зависимости от генетического портрета опухоли. Только
в случае прогрессирования последующая выживаемость уже зависела от
наличия мутаций. С практической
точки зрения озвученные результаты
ничего не меняют, с другой стороны,
при планировании последующих исследований в рамках адъювантной
терапии, по-видимому, данный параметр необходимо учитывать как
фактор стратификации, особенно у
пациентов с MSS фенотипом.
Продолжается накопление проспективных данных по изучению прогностических и предикторных свойств
циркулирующей опухолевой ДНК
(цоДНК) как маркера резидуальной
опухолевой болезни после хирургического лечения I-III стадии рака
толстой кишки. Ранее в рамках исследования DYNAMIC удалось доказать, что при отсутствии цоДНК
после операции можно обойтись без
адъювантной химиотерапии, однако
ЧТО дает адъювантная химиотерапия при наличии цоДНК – информация в этом вопросе была ограничена.
Обновлены результаты исследования
GALAXY: показано, что проведение
адъювантной химиотерапии улучшает выживаемость без признаков
болезни в случае наличия цоДНК
при II-III стадии болезни (ОР 3,29;
95% ДИ 2,13-5,07). А в исследовании
PEGASUS показано, что в случае отсутствия конверсии цоДНК после 3
месяцев терапии с включением оксалиплатина и фторпиримидинов с
позитивного на негативный статус
переход на режим FOLFIRI позволяет перевести в группу негативной
цоДНК порядка половины пациентов. Правда, эти данные получены
у 13 из 24 пациентов, исследование пока продолжается. Но то, что
цоДНК в будущем будет определять
алгоритм введения пациентов после
хирургии не только в плане назначения адъювантной химиотерапии, но
и в процессе послеоперационного лечения – несомненно.
Как еще можно снизить риск прогрессирования после хирургического
лечения? Ранее публиковались работы по профилактическому действию
аспирина на риск прогрессирования
колоректального рака после операций, но в большинстве своем они
были наблюдательными или ретроспективными. В рандомизированном
исследовании ASCOLT после хирургического лечения резектабельных
стадий давали аспирин по 200 мг в
сутки или наблюдали. Различий ни в
выживаемости без признаков болезни, ни в общей выживаемости получено не было. Группы даже значимо
не различались и по смертности от
неонкологических причин. Таким
образом, если в каких-либо наблюдательных, популяционных исследованиях, даже с включением 100 тыс.
пациентов, показывают, что прием
витаминов, метформина, орехов или,
к примеру, аспирина увеличивает выживаемость после радикального лечения, всегда ждите проспективных
рандомизированный исследований.
Большое число негативных исследований, которые посвящены неоадъювантному лечению пациентов
с III стадией рака ободочной кишки,
не останавливают исследователей. В
этот раз вернулись к теме комбинации анти-EGFR антител с химиотерапией до операции. Напомню, что в 2
проспективных рандомизированных
исследованиях данные группы были
закрыты в связи с неэффективностью, но набор в них шел лишь по
мутационному статусу гена KRAS,
и то в рамках анализа только 2 экзона. Из базы данных исследования
FOXTROT решили отобрать пациентов с диким типом генов RAS и BRAF
и повторить сравнение 6 курсов неоадъювантного режима FOLFOX с и
без панитумумаба. Авторы получили
значимое улучшение безрецидивной
выживаемости (ОР 0,51; р=0,09). Однако небольшое число пациентов в
поданализе, отсутствие каких-либо
различий в частоте патоморфозов и
патоморфологических стадий не позволяют однозначно интерпретировать полученные результаты, и назначать анти-EGFR антитела в данной
ситуации не стоит.
В копилке исследований, которые
посвящены возможностям неназначения предоперационной лучевой
терапии при местнораспространенном раке прямой кишки, пополнение. В этом году на ASCO результаты
исследования PROSPECT наделало
немало шума: авторы продемонстрировали, что можно провести 6 курсов
химиотерапии по схеме FOLFOX и в
случае, если опухоль уменьшается на
≥20%, отказаться от лучевой терапии
и сразу выполнить операцию. Это
не менее эффективно стандартному
подходу – химиолучевой терапии с
последующей хирургией. Только 9,5%
пациентам в исследуемой группе потребовалось проведение химиолучевой терапии. Основная критика работы связана с критериями включения
пациентов – T2N+, T3N-, T3N+, кандидаты на сфинктеросохраняющую
резекцию на момент рандомизации,
то есть практически отсутствовали
пациенты с низкорасположенными
опухолями (3%), так как у части таких
пациентов возможно на первом этапе просто провести хирургическое
лечение, и им даже не понадобится
проводить и адъювантную химиотерапию. Также такой отбор пациентов
объясняет и высокий уровень полных патоморфологических ответов
в обеих группах – на уровне 20%. На
конференции ESMO представили
результаты исследования из Китая
CONVERT: пациентам с местнораспространенным раком прямой кишки без вовлечения мезоректальной
фасции проводили 4 курса терапии
по схеме XELOX до и после операции
или проводили предоперационную
химиолучевую терапию. Прелесть
работы в том, что в какой-то момент времени исследователи начали
включать и пациентов с нижнеампулярными опухолями. И хотя авторы
статистически не доказали неменьшую эффективность химиотерапии в
сравнении с химиолучевой терапией
в отношении 3-летней выживаемости без локальных рецидивов, частота рецидивов была всего 3,7% и 2,6%
соответственно, а ВБПБ и ОВ не различались между группами. Оба проведенных исследования позволяют в
случае невозможности проведения
предоперационной лучевой терапии
в отсутствии факторов риска рассматривать проведение 12 недель химиотерапии.
Другое направление, активно изучаемое в лечении пациентов с локализацией опухоли в прямой кишке,
основано на мнении, что проведение
лучевой терапии меняет микроокружение опухоли, приводит к выбросу
неоантигенов, улучшает результаты
хирургии. Все это в совокупности
дарит надежу на то, что иммунотерапия сработает здесь и в отсутствии
MSI. До этого по результатам исследования NRG-CI002 было известно,
что добавление анти-PD1 антитела в
процессе лучевого воздействия при
раке прямой кишки не увеличивает
частоту полных патоморфологических эффектов, и исследователи
пришли к выводу, что лучше изучать
внедрение иммунотерапии на этапе
консолидации, то есть между окончанием лучевой терапии и до операции. Представлены предварительные
результаты рандомизированного исследования III фазы (UNION) по применению 2 курсов консолидирующей
химиотерапии по схеме XELOX с камрелизумабом (анти-PD1 антитело)
после короткого курса ЛТ против 2
курсов химиотерапии после пролонгированной ХЛТ. Удалось увеличить
частоту полных патоморфозов в 2,5
раза. Правда, данных по выживаемости еще не представлено, но известно,
что при раке прямой кишки частота
достижения полных патоморфологических реакций не всегда коррелирует с выживаемостью. Смущает и
количество курсов до операции: если
проводить более 4 – результаты по
pCR выше, кроме этого, не исключались пациенты с MSI (а их было 5%),
да и исследование из Китая.
По-прежнему идут баталии вокруг
места тройных химиотерапевтических комбинаций в первой линии лечения метастатического рака толстой
кишки, а более просто – кому нужно
назначать режим FOLFOXIRI? По
результатам метаанализа 5 рандомизированных исследований было показано, что применение комбинации
FOLFOXIRI с бевацизумабом увеличивает частоту объективных ответов,
частоту R0/1 резекций печени, выживаемость без прогрессирования и
общую выживаемость в сравнении с
дуплетами и бевацизумабом. Однако
это оказалось справедливым при правосторонней локализации первичной опухоли и при мутациях в генах
RAS. Что же касается комбинации FOLFOXIRI с анти-EGFR антителами,
то исследование TRPLETE из Италии показало отсутствие улучшения
какого-либо параметра эффективности, включая глубину ответов, при
применении FOLFOXIRI с панитумумабом при диком типе генов RAS и
BRAF и неоперабельных метастазах
в сравнении с FOLFIRI с панитумумабом. Однако следует отметить, что
дозовая интенсивность иринотекана и фторурацила получилась даже
ниже в группе «интенсивного» режима.
Любители комбинации FOLFOXIRI
не расстроились и вспомнили, что
анти-EGFR антитела лучше работают
при более тщательном отборе пациентов по молекулярно-генетическим
характеристикам, например, ориентируясь на циркулирующую в крови
ДНК, так как она позволяет выявить
еще 14% пациентов, потенциально не отвечающих на данный класс
препаратов. На конференции представили результаты исследования
PANIRINOX – сравнивали FOLFOX
с панитумумабом и FOLFOXIRI с панитумумабом, но пациентов отбирали с диким типом генов RAS и BRAF
по цоДНК. Представили пока группу
с нерезектабельными метастазами
разной локализации. Интенсивный
режим улучшил наступление ответа
и общую выживаемость, но не частоту объективных ответов, глубину
ответа и выживаемость без прогрессирования.
Исследователи не расстроились и
подумали, что нужно отбирать больных с изолированным поражением
печени на интенсивный режим, так
как возможно получить более высокий шанс успешной операции при
применении FOLFOXIRI. И в исследовании TRICE при диком типе генов RAS и BRAF и неоперабельном
метастатическом поражении раком
толстой кишки печени (хотя в характеристике пациентов 20% имели
резектабельные очаги) пациентов
рандомизировали между FOLFOXIRI
или FOLFOX с цетуксимабом. Удалось улучшить глубину ответов с
55% до 59,6% (р=0,039), но получена
тенденция к ухудшению выживаемости без прогрессирования. При этом
частота резекций печени была крайне высокая для таких исследований
и составляла 51,4% в обеих группах.
Сразу вспоминается исследование
newEPOCH, когда добавление цетуксимаба ухудшило выживаемость при
резектабельных метастазах рака толстой кишки в печени.
Тогда вспомнили, что анти-EGFR антитела лучше работают при левосторонней локализации. На это можем
привести результаты исследования
CAIRO5, которые обновили на данном конгрессе. Исследование примечательно тем, что имело 4 рукава: при
правосторонней локализации и/или
мутациях в генах KRAS или BRAF
пациентов рандомизировали между
режимом FOLFOXIRI или дуплетом
с бевацизумабом, а при левосторонней локализации и диком типе генов
– между режимом с цетуксимабом
или дуплетом с бевацизумабом. Все
пациенты имели изолированное поражение печени неоперабельными
метастазами. Неоперабельность подтверждалась мнением трех хирургов
на консилиуме. При первом сравнении отмечено улучшение частоты
объективных ответов, R0/1 резекций
печени и выживаемости без прогрессирования, хотя улучшить общую
выживаемость не получилось (ОР
0,92; 95% ДИ 0,7-1,2; р=0,52). При
втором – различий между группами
ни по одному из параметров получено не было, в том числе по общей
выживаемости (ОР 1,02; 95% ДИ
0,72-1,46; р=0,89). И если для сравнения режимов с бевацизумабом, повидимому, не хватило пациентов, так
у нас есть данные вышеупомянутого
метаанализа 5 рандомизированных
исследований, в котором только после совокупного включения 1697 пациентов удалось достичь значимого
улучшения общей выживаемости.
Для второго сравнения с анти-EGFR
антителами и бевацизумаба с химиотерапией при диком типе генов,
вероятно, большое число пациентов,
которым выполнено хирургическое
вмешательство, нивелировало влияние цетуксимаба с режимом FOLFOX
на общую выживаемость. Тем более,
что у нас есть и результаты исследования DEEPER, которые также обновили к ESMO 2023. В исследовании
рандомизировали пациентов с неоперабельным метастатическим поражением, диким типом генов RAS и BRAF
между комбинацией FOLFOXIRI +
цетуксимаб и FOLFOXIRI + бевацизумаб. При левосторонней локализации опухоли получено значимое
улучшение глубины ответов при применении цетуксимаба – 59,2% против
47,5% (р=0,0017), а также улучшилась выживаемость без прогрессирования (ОР 0,71; р=0,032), в первую
очередь у пациентов с метастазами
вне печени (ОР 0,65; р=0,015). После R0/1 метастазэктомий выживаемость без прогрессирования не различалась. Другой поданализ данной
работы, опубликованный в этом
году на ASCO GI, показал, что если
к перечисленным признакам еще добавить и изолированное поражение
метастазами печени, то частота R0/1
резекций печени увеличится с 14,8%
до 25% при применении анти-EGFR
антител с режимом FOLFOXIRI.
Из всего выше сказанного вырисовывается следующая картина: при
правосторонней локализации и/или
мутациях в генах RAS выбор за режимом FOLFOXIRI с бевацизумабом.
При левосторонней локализации и
диком типе генов и неоперабельных
метастазах можно ограничиться дуплетами с анти-EGFR антителами.
Вероятно, последнее место, которое
можно рассматривать для комбинации FOLFOXIRI с цетуксимабом
или панитумумабом, – при данном
фенотипе еще и поражение печени
потенциально-операбельными метастазами, так как именно в этой группе пациентов, как показано, правда, в
небольшом, но проспективном исследовании VOLFI, применение режима
FOLFOXIRI с анти-EGFR приводило
к большей частоте R0/1 резекций
печени в сравнении с FOLFOXIRI
без таргетной терапии с группой неоперабельного изолированного поражения органа. Хотя это требует
проведения проспективного рандомизированного исследования.
Вопросы тактики ведения пациентов
с метастатическим раком толстой
кишки при достижении контроля
болезни волнуют умы многих онкологов: можно ли прекращать лечение,
продолжать эффективную терапию
до прогрессирования, переходить
на поддерживающую терапию? А
если переходить, то после скольких
курсов – 12, 9, 8 или 6? А влияет ли
на выбор тактики таргетный препарат, который получает пациент? А
если это не первая, а вторая линия? В
общем, перечисленные задачи удовлетворяют критериям практической
значимости диссертационной работы, как говорится, на соискание ученой степени… На ESMO 2023 у нас
появились новые данные: в исследовании AFEMA при достижении контроля болезни после 6 курсов режима
FOLFIRI с афлиберцептом во второй
линии лечения пациентов рандомизировали на продолжение терапии
до прогрессирования или непереносимой токсичности или переход на
поддерживающую терапию по схеме
de Gramont с афлиберцептом. Исследователям удалось значимо с 21,6% до
4,4% уменьшить частоту астений 3-4
степени, при этом отмечена тенденция к улучшению выживаемости без
прогрессирования (медианы составили 6,1 и 5,5 месяца), выросла частота объективных ответов (20% и 9,4%)
и доказана не меньшая эффективность лечения до прогрессирования.
Таким образом, появились данные,
что и во второй линии лечения можно спокойно пользоваться тактикой
перехода на поддерживающую терапию, которая эффективна не только
в отношении применения анти-EGFR
антител, но и антиангиогенной терапии, в частности, наиболее токсичного из данного класса препаратов,
которые применяются при раке толстой кишки, – афлиберцепта. Причем
становится актуальным и понимание
возможности перехода на поддерживающую терапию при развитии
токсических нежелательных явлений
даже после 6 курса. Такой подход,
с одной стороны, позволяет сохранить пациенту приемлемое качество
жизни, а с другой – сохранят потенциальную чувствительность опухоли
к отмененному препарату, в данном
случае – иринотекану
Рассматривая третью и последующие
линии лечения в выборе схемы, врачи ориентируются на функциональный статус пациента, длительность
лечения и ответ на предыдущие
линии системной терапии, токсичность, реже на генетический портрет
опухоли. Последнее связано с тем,
что препараты, зарегистрированные
для данной клинической ситуации,
проходили валидацию для всех пациентов независимо от мутационного статуса и локализации первичной
опухоли. Речь идет о регорафенибе
и трифлуридине/типирациле, причем комбинация последнего с бевацизумабом в настоящее время по
результатам исследования SUNLIGT
показывает наилучшие результаты;
на втором месте регорафениб в виде
постепенной эскалации стартовой
дозы. И так как медиана продолжительности жизни у пациентов в третьей линии составляет на наилучшей
поддерживающей терапии порядка
6 месяцев, то в регистрационных исследованиях для обоих препаратов
основным критерием эффективности являлась общая выживаемость.
Один момент, который смущал при
выборе терапии между регорафенибом и трифлуридином/типирацилом,
– это данные поданализа исследования RECOURSE, в котором показано
отсутствие улучшения общей выживаемости у пациентов с mKRAS G12,
хотя выживаемость без прогрессирования и была увеличена. На конференции в Мадриде представлен аналогичный поданализ исследования
SUNLIGHT, в котором при применении комбинации данного препарата с
бевацизумабом отмечено улучшение
общей выживаемости независимо
от наличия или отсутствия данной
альтерации. Таким образом, по совокупности данных можно сказать, что
мутация в гене KRAS G12 является
неблагоприятным прогностическим
фактором, но не негативным предиктором эффективности трифлуридина/типирацила.
Развитие генетики и фармакологии
позволило создать ингибиторы, которые блокируют белок, образующийся
при мутации в гене KRAS G12C. Данная альтерация при метастатическом
раке толстой кишки встречается приблизительно у 3% пациентов, хотя
при НМРЛ – у 15%. Тем не менее,
уже на этапе предклинических экспериментов стало понятно, что к таким ингибиторам при раке толстой
кишки имеется первичная резистентность, обусловленная гиперэкспрессией рецептора к эпидермальному
фактору роста. В связи с этим в клинических исследованиях стали применять комбинацию данных молекул
(соторасиба или адаграсиба) с антителами к EGFR (панитумумабом и
цетуксимабом). Данные режимы в
рамках II фаз демонстрировали частоту объективных ответов на уровне
30%. Правда, смущали относительно
невысокие значения медианы выживаемости без прогрессирования. И
все же, учитывая ограниченное количество терапевтических опций за
пределами двух линий, были запущены исследования III фаз.
Первый звоночек того, что данный
класс препаратов не является революционным решением проблемы
лечения пациентов с мутацией в гене
KRAS, был получен на ASCO 2023
года и связан, скажем прямо, с провальным, хоть и статистически значимым улучшением выживаемости
без прогрессирования в сравнении
с доцетакселом в лечении больных
НМРЛ. На ESMO 2023 были представлены результаты III фазы по
сравнению эффективности комбинации соторасиба и панитумумаба против терапии на выбор исследователя
(регорафениб или трифлуридин/типирацил) в 3 линии лечения пациентов с метастатическим раком толстой
кишки и mKRAS G12C. Применение
комбинации позволило значимо
улучшить частоту объективных ответов с 0% до 6% и 26% при применении
дозы соторасиба в 240 мг или 960 мг
в сутки, а также медиану выживаемости без прогрессирования с 2,2 до 3,9
и 5,6 мес. соответственно. К сожалению, в стремлении провести исследование на меньшем числе пациентов и
получению более ранних результатов
исследователи в качестве основного
критерия эффективности взяли выживаемость без прогрессирования.
Это привело к тому, что на небольшом числе пациентов не удалось
показать выигрыш в общей выживаемости. Коме того, оптимальным
лечением в контрольной группе все
же являлась бы комбинация трифлуридина/типирацила с бевацизумабом, которая демонстрирует медиану
общей выживаемости в 10,8 месяца.
Таким образом, возможно, комбинацию соторасиба с панитумумабом и
зарегистрируют, но, скорее всего, она
останется для терапии в рамках 4 и
последующих линии, когда пациент
уже успел получить все зарегистрированные опции лечения. А лучше
всего дождаться результатов исследования по комбинации соторасиба,
панитумумаба и режима FOLFIRI, которая в рамках I фазы продемонстрировала частоту объективных ответов
58,1%. Перспективы комбинации
конкурента (адаграсиба и цетуксимаба), возможно, видятся несколько позитивнее, так как в рамках II фазы показывают медиану выживаемости без
прогрессирования при mKRAS G12C
6,9 месяца, а комбинации еще одного
ингибитора гарсорасиба с цетуксимабом – 7,6 месяца.
Но расстраиваться не стоит: на горизонте вырисовываются новые ингибиторы KRAS, которые уже менее
селективны и могут потенциально
помочь большем числу пациентов с
мутацией в гене KRAS. Приведу только одно исследование I фазы по применению ингибитора KRAS G12, то
есть способного ингибировать переход в активное состояние измененного белка KRAS с любыми заменами
в кодоне G12, не только С, но и A, D
и др. Последний вариант мутаций, к
примеру, наиболее часто встречается
при mKRAS НМРЛ и рака поджелудочной железы. Именно эти нозологии включались в работу. Авторы
сообщили о 85% частоте контроля
болезни, 38% частоте объективных
ответов при НМРЛ и 20% при раке
поджелудочной железы. Вероятно,
препарат будет активен и при раке
толстой кишки. Тем не менее, сразу
настораживает, что медиана длительности лечения составила всего 3,1-3,3
месяца. Поэтому в будущих исследованиях уже будут изучаться комбинации данной молекулы с другими
препаратами.
Продолжая тему персонализированного подхода, напомню, что при метастатической меланоме наиболее значимое увеличение общей выживаемости достигнуто при применении комбинации анти-CTLA4 и анти-PD1 антител. Другой иммунотерапевтической опцией является комбинация анти-PD1 антитела и анти-Lag3 антитела, которая демонстрирует улучшение выживаемости без прогрессирования, но не общей выживаемости, и позиционируется как замена более токсичной комбинации ипилимумаба и ниволумаба. При метастатическом раке толстой кишки иммунотерапия пока входит в стандарты лечения только опухолей, ассоциированных с нарушением в системе репарации неспаренных оснований или микросателлитнонестабильным фенотипом (MSI). И также как и при меланоме, наиболее эффективным оказалось применение комбинации ипилимумамба и ниволумаба, как во второй, так и в первой линии лечения. А эффективность при неоадъювантном назначении данной комбинации при III стадии в рамках исследования NICHE-2 составляет 67% полных патоморфозов. Исследователи решили оценить эффективность комбинации ниволумаба и антитела к Lag3 релатлимаба в течение 4 недель до операции по поводу II-III стадии рака ободочной кишки. Режим в рамках II фазы однорукавного исследования на 19 пациентах продемонстрировал частоту полных патоморфозов в 79%, что можно объяснить включением пациентов и со II стадией заболевания. И если при меланоме понятно стремление врачей к применению менее токсичного режима, так как доза ипилимумаба составляет 3 мг/кг, то при опухолях, ассоциированных с MSI, доза ипилимумаба в комбинации составляет 1 мг/кг, а в первой линии вообще вводится 1 раз в 6 недель. Таким образом, и применения релатлимаба кажутся несколько туманны по данному показанию, но дождемся более крупных исследований.
Также чтобы закрыть тему с иммунотерапией при раке толстой кишки, представим 5-летние результаты наблюдения за пациентами в исследовании KEYNOTE-177. Применение монотерапии пембролизумабом при метастатическом раке толстой кишки в первой линии показывает стойкое улучшение ВБП (медиана 16,5 против 8,2 мес.), а также улучшение общей выживаемости: через 5 лет живыми остаются 54,8% пациентов, при этом в группе химиотаргетной терапии – 44,2%, что можно объяснить частым (более 60%) назначением иммунотерапии во второй линии лечения. Также как и авторы исследования и рецензент работы, подчеркнем необходимость рассмотрения назначения иммунотерапии в первой линии лечения при метастатическом колоректальном раке с MSI. Возможности применения не только монотерапии анти-PD1 антител, но их комбинации вместе с химиотерапией или анти-CTLA4 антителами позволяют минимизировать случаи отсутствия эффекта и ранние смерти на данный класс препаратов.
Нельзя не упомянуть и о единственном исследовании, доложенном с трибуны ESMO в этом году, которое касалось лечения пациентов с метастатическим раком анального канала. Так, в рамках исследования PEVOsq в когорте данных пациентов оценили эффективность комбинации пембролизумаба и HDAC ингибитора вориностата, который, как верится, модулируя эпигенетически геном опухолевых клеток и изменяя микроокружение, делает опухоль более чувствительной к иммунотерапии. Последняя, к сожалению, при плоскоклеточном раке анального канала показывает низкую эффективность. Авторы исследования хотели достичь 40% объективных ответов. Включив с этой целью 27 пациентов, сообщили о 31% ответов, причем все они были зарегистрированы у пациентов с экспрессией PD-L1 ≥1. Это больше, чем в исследованиях с монотерапией пембролизумабом (11-17%), но приблизительно соответствует эффективности монотерапии ниволумабом (24%) при данной нозологии. В связи с этим ждем более крупных и рандомизированных исследований.
Таким образом, портрет лечения
пациента с колоректальным раком
постепенно вырисовывается от
фона до черт лица, однако далек до
шедевров великого итальянца. В то
же время нет сомнений, что с каждым годом мы будем приближаться
к идеалу, и в какой-то момент искусство терапии остановит данное
заболевание.
НОВОСТИ ESMO 2023 / ОБЗОР СОБЫТИЙ В МИРЕ ОНКОГИНЕКОЛОГИИ
Автор: Румянцев Алексей Александрович
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России,
кандидат медицинских наук, Москва
В октябре 2023 года прошел очередной ежегодный конгресс ESMO, который оказался очень «урожайным»
в части представления новых данных
по лечению различных злокачественных новообразований. Естественно,
не обошел конгресс вниманием и
онкогинекологическую патологию.
В этом материале – наиболее примечательные работы в этой области,
расставленные, в соответствии с
субъективным взглядом автора, от
наиболее важных. Have fun.
Индукционная
химиотерапия перед
химиолучевой терапией
улучшает отдаленные
результаты лечения
рака шейки матки –
рандомизированное
исследование
III фазы INTERLACE
Пожалуй, самым значимым для нашей практики исследованием среди
работ, представленных на конгрессе
ESMO 2023, стали результаты рандомизированного клинического исследования III фазы INTERLACE,
включившего 500 пациенток с местнораспространенным раком шейки матки (РШМ). Основной целью исследования было продемонстрировать, что
проведение индукционной химиотерапии паклитакселом 80 мг/м2 и карбоплатином AUC2 (6 еженедельных
введений) перед химиолучевой терапией позволит улучшить отдаленные
результаты лечения пациенток. Рандомизация между данной группой и
группой стандартной химиолучевой
терапии осуществлялась в соотношении 1:1. Стратификация производилась в соответствии со стадией, статусом лимфатических узлов, методикой
дистанционной (3D-конформная или
IMRT) лучевой терапии, вариантом
брахитерапии (2D или 3D), размером
первичной опухоли, ее гистотипом, а
также исследовательским центром. В
качестве основного анализируемого
показателя исследования выбрана
композитная конечная точка, включившая выживаемость без прогрессирования (ВБП) и общую выживаемость (ОВ) пациенток. Целевое время
начала химиолучевой терапии после
завершения индукционной химиотерапии составляло ≤7 дней. Дизайн исследования представлен на рисунке 1.
Сформированные группы были сбалансированы по основным демографическим характеристикам, у 70%
пациенток в обеих группах была IIB
(FIGO 2008) стадия РШМ, у 42% отмечалось метастатическое поражение
регионарных лимфатических узлов,
плоскоклеточный вариант РШМ был
у 82% пациенток. Набор в исследование шел с 2012 года, 76% пациенток
было включено в UK, 20% – в Мексике, остальные – Италия, Индия, Бразилия. Индукционная химиотерапия
в полном объеме была завершена у
84% пациенток. Медиана времени до
начала этапа химиолучевого лечения
в экспериментальной группе исследования составила 7 дней (5-53 дня).
Рисунок 1.
Дизайн исследования INTERLACE.
Таблица 1.
Данные о проведении лучевой терапии в исследовании INTERLACE.
По результатам исследования, при
медиане наблюдения 64 мес. медиана
ВБП не была достигнута ни в одной
из групп исследования, показатели
3-летней и 5-летней ВБП в группе индукционной химиотерапии с последующим проведением ХЛТ – 75% и
73% по сравнению с 72% и 64% в контрольной группе (HR 0,65; p=0,013).
Медиана ОВ не была достигнута ни
в одной из групп исследования, показатели 3-летней и 5-летней ОВ в
группе индукционной химиотерапии
составили 86% и 80%, в контрольной
группе – 80% и 72% соответственно
(HR 0,61; p=0,04). Кривые КапланаМайера представлены на рисунке 2.
Ожидаемо снижение частоты прогрессирования опухолевого процесса произошло за счет улучшения системного контроля заболевания. При
этом профиль безопасность терапии
был приемлемым – некоторое повышение частоты нежелательных явлений G3-4 (59% vs 48%), но только за
счет гематологической токсичности
(30% vs 13%), что ожидаемо.
Основной вывод из этого исследования – индукционная химиотерапия паклитакселом/карбоплатином в еженедельном режиме
дозирования позволяет достоверно
увеличить медиану ВБП и ОВ пациенток при приемлемом профиле
безопасности. Что очень важно, это
опция терапии может быть легко
внедрена в рутинную практику онкологических учреждений. Самое
значимое достижение в лечении
местнораспространенного РШМ за
последние 10 лет? Данный вариант
лечения должен стать новым стандартом терапии.
Рисунок 2.
Кривые Каплана-Майера по ВБП и ОВ пациенток
в исследовании INTERLACE.
LBA8 – A randomised phase III trial
of induction chemotherapy followed
by chemoradiation compared with
chemoradiation alone in locally
advanced cervical cancer: The GCIG
INTERLACE trial.
Поддерживающая терапия
дурвалумабом/олапарибом
при метастатическом раке
эндометрия улучшает
результаты лечения –
исследование DUO-E
Рандомизированное плацебо-контролируемое исследование III фазы DUO-E/ENGOT-EN10 было посвящено оценке эффективности добавления моноклонального антитела к PD-L1 дурвалумаба или комбинации олапариба/дурвалумаба к стандартной первой линии химиотерапии метастатического рака эндометрия.
Рандомизация – в три рукава:
- химиотерапия паклитакселом 175 мг/м2 и карбоплатином AUC5 каждые 21 день с плацебо дурвалумаба в процессе химиотерапии и последующей поддерживающей терапией плацебо дурвалумаба и олапариба;
- группа химиотерапии паклитакселом/карбоплатином в сочетании с дурвалумабом 1120 мг каждые 21 день с поддерживающей терапией дурвалумабом 1500 мг каждые 4 недели и плацебо олапариба;
- группа химиотерапии с дурвалумабом с поддерживающей терапией
дурвалумабом и олапарибом 300
мг 2 раза в сутки.
Этап поддерживающей терапии проводился до прогрессирования или
непереносимой токсичности. В качестве факторов стратификации были
выбраны статус MMR (dMMR vs
pMMR), стадия опухолевого процесса (de novo метастатическая болезнь
или прогрессия после ранее проведенного лечения) и регион происхождения пациента (рис.3).
Рисунок 3.
Дизайн исследования DUO-E
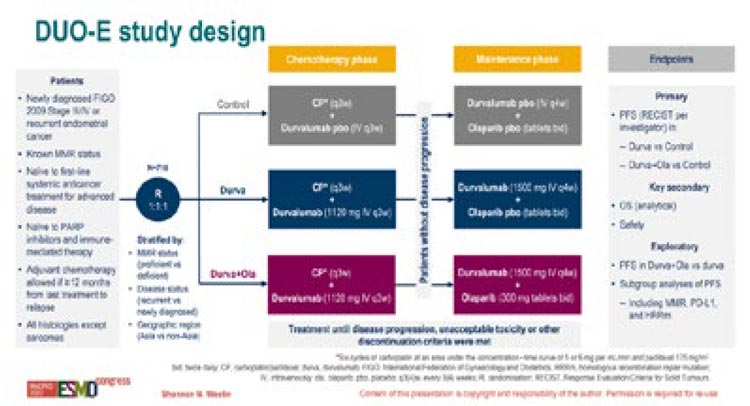
В качестве первичной конечной
точки исследования была выбрана
ВБП пациенток, дизайн исследования предусматривал иерархическое
тестирование гипотез и сравнение
эффективности двух экспериментальных рукавов исследования с контрольной группой. Всего в исследование было включено 718 пациенток,
dMMR статус был выявлен у 20% из
них, у 41% пациенток определялись
отдаленные метастазы на момент постановки диагноза.
По результатам исследования в общей популяции пациенток в группе
только химиотерапии, группе дурвалумаба и группе дурвалумаба с
олапарибом медиана ВБП составила
9,6 мес., 10,2 мес. (HR 0,71; p=0,003)
и 15,1 мес. соответственно (HR 0,55;
p<0,0001). Таким образом, в сравнении с группой химиотерапии оба
рукава исследования продемонстрировали достоверное увеличение ВБП
пациенток. При оценке данных по
ОВ пациенток медиана ОВ составила 25,9 мес. в группе химиотерапии,
не была достигнута в группе дурвалумаба (HR 0,77; p=0,120) и в группе
дурвалумаба/олапариба (HR 0,59;
p=0,003). Отметим, что данные были
«незрелыми» на момент проведения
анализа (27,7%). Кривые КапланаМайера по ВБП и ОВ пациенток
представлены на рисунке 4.
Рисунок 4.
Кривые Каплана-Майера по ВБП и ОВ пациенток
в исследовании DUO-E.
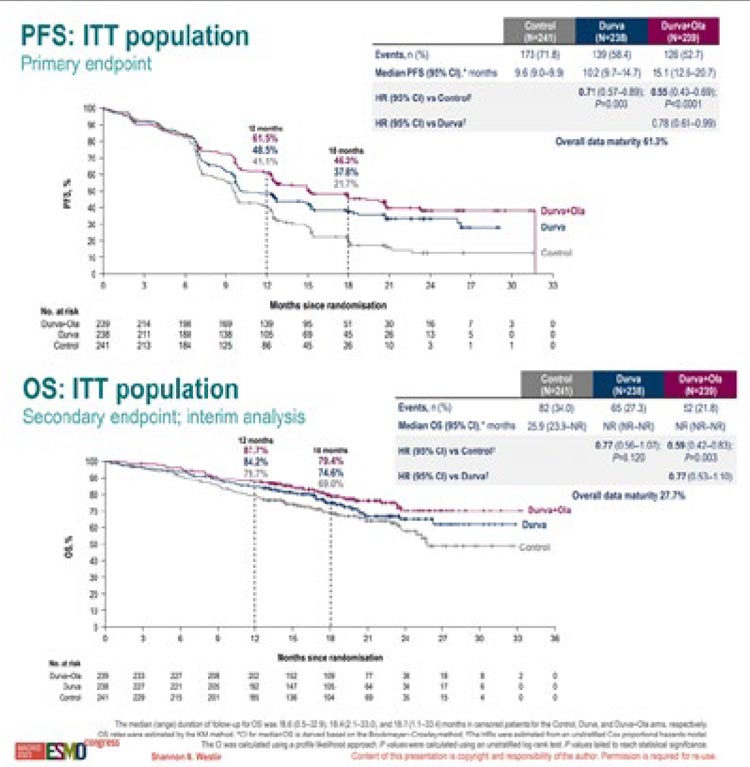
Естественно, наиболее важным
представляется раздельная оценка
эффективности комбинации препаратов в зависимости от MMR статуса
опухоли, так как данный биомаркер
является признанным предиктором
эффективности терапии анти-PD-1/
PD-L1 агентов при раке эндометрия.
В популяции с dMMR медиана ВБП
в группе только химиотерапии составила 7 мес. и не была достигнута
группе дурвалумаба (HR 0,42; 95%
ДИ 0,22-0,80) и комбинации дурвалумаба/олапариба (HR 0,41; 95% ДИ
0,21-0,75). В популяции с pMMR соответствующие показатели составили 9,7 мес., 9,9 мес. (HR 0,77; 95% ДИ
0,60-0,97) и 15,0 мес. (HR 0,57; 95%
ДИ 0,44-0,73) (рис.5).
Рисунок 5.
Кривые Каплана-Майера по ВБП пациенток в ис- следовании DUO-E в зависимости от MMR-статуса опухоли.
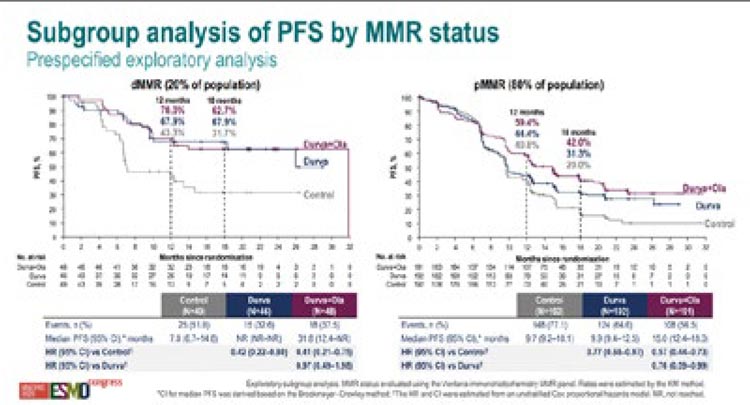
Таким образом, результаты исследования DUO-E демонстрируют значимое улучшение ВБП пациенток с распространенным раком эндометрия
и создают предпосылки для дифференцированного выбора варианта
терапии в зависимости от MMR статуса опухоли.
LBA41 – Durvalumab (durva) plus
carboplatin/paclitaxel (CP) followed
by maintenance (mtx) durva ± olaparib (ola) as a first-line (1L) treatment
for newly diagnosed advanced or
recurrent endometrial cancer (EC): Results from the phase III DUO-E/
GOG-3041/ENGOT-EN10 trial.
Иммунотерапия
пембролизумабом улучшает
результаты лечения у
пациенток, получающих
химиолучевую терапию при
местнораспространенном
РШМ, – исследование KEYNOTE-A18
В рандомизированное плацебо-контролируемое исследование III фазы
включались пациентки с IB2-IIB с
N+ (FIGO 2014) или III-IVA стадиями РШМ, рандомизация 1:1 в группу
пембролизумаба 200 мг каждые 21
день на период химиолучевой терапии или соответствующего ему плацебо, далее проводилась поддерживающая терапия пембролизумабом/
плацебо 400 мг каждые 6 недель до
15 введений препарата. Химиолучевая терапия проводилась с радиомодификацией цисплатином 40 мг/
м2 еженедельно №5. Стратификация
осуществлялась в соответствии со
стадией процесса (IB2-IIB vs III-IVA),
планируемым вариантом дистанционной лучевой терапии (IMRT/
VMAR vs другие) и запланированной
общей дозой лучевой терапии (<70
Гр или >70 Гр). Дизайн исследования
представлен на рисунке 6. В качестве
основных оцениваемых показателей
исследования были выбраны ВБП и
ОВ пациенток.
Рисунок 6.
Дизайн исследования KEYNOTE-A18.
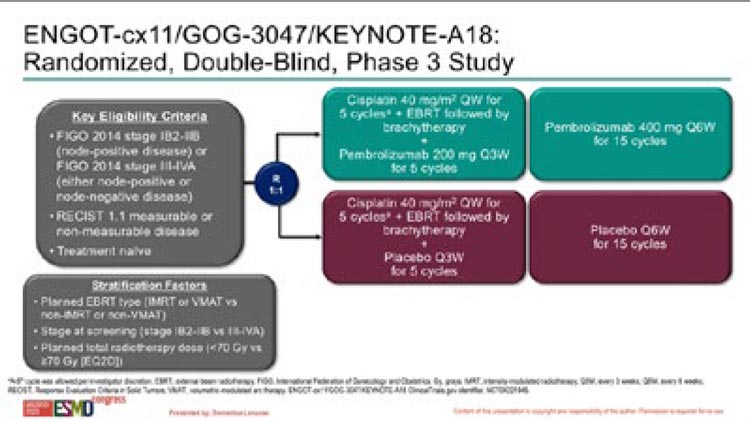
Всего в исследование было включено
1060 пациенток, однако скрининг для
участия в исследовании прошли 1562
пациентки – 32% неудачи скрининга; на что стоит обратить внимание
– причины не уточнены. У 56% пациенток была III-IVA стадии опухолевого процесса. Медиана длительности лучевой терапии составила
52 дня (12-139 дней), 75% пациенток
завершили данный этап лечения в
течение 56 дней.
На ESMO 2023 представлены результаты первого запланированного
анализа данных из исследования.
При медиане наблюдения 17,9 мес.
по результатам исследования на момент анализа медиана ВБП не была
достигнута ни в одной из групп исследования, 2-летняя ВБП составила 67,8% в группе пембролизумаба
и 57,3% в группе плацебо (HR 0,70;
95% ДИ 0,55-0,89; p=0,002), различия
были достоверными в соответствии
с планом статистического анализа
данных. Результаты подгруппового
анализа продемонстрировали наибольшую эффективность лечения
при III-IVA стадиях опухолевого процесса (HR 0,58; 95% ДИ 0,42-0,80);
в то время как при IB2-IIB (N+!) стадиях различия не были так очевидны
(HR 0,91; 95% ДИ 0,61-1,31). Показатель 2-летней ОВ составил 87,2%
в группе пембролизумаба и 80,8%
в группе плацебо (HR 0,73; 95% ДИ
0,49-1,07) (рис.7).
Рисунок 7.
Кривые Каплана-Майера по ВБП и ОВ пациенток
в исследовании KEYNOTE-A18.
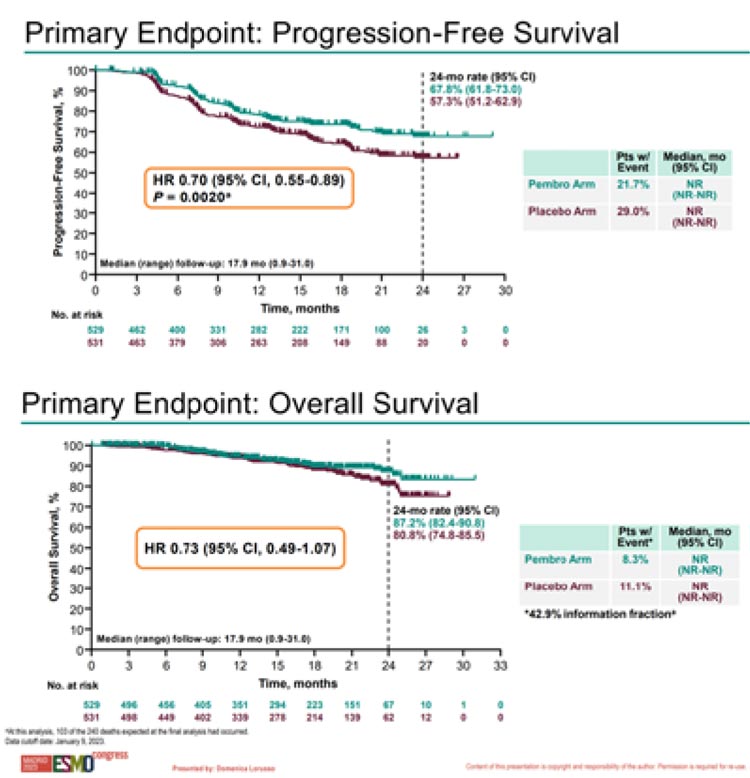
LBA38 – Pembrolizumab plus
chemoradiotherapy for high-risk
locally advanced cervical cancer: A
randomized, double-blind, phase III
ENGOT-cx11/GOG-3047/KEYNOTEA18 study
Эффективность PARPингибитора сенапариба
в поддерживающей
терапии при раке яичников
– рандомизированное
исследование III фазы
В плацебо-контролируемом исследовании FLAMES изучалась эффективность нового PARP-ингибитора из
Китая в первой линии терапии распространенного (III-IV стадии) серозного
или эндометриоидного рака яичников
высокой степени злокачественности.
Включались пациентки с полным или
частичным ответов на первую линию
платиносодержащей химиотерапии.
Рандомизация – 1:1 в группу сенапариба 100 мг 1 раз в сутки или группу
плацебо, стратификация – в соответствии с ответом на первую линию терапии (полный vs частичный ответ) и
статусом генов BRCA1/2. Первичной
конечной точкой исследования была
выбрана ВБП пациенток. Дизайн исследования – на рисунке 8.
Рисунок 8.
Дизайн исследования FLAMES.
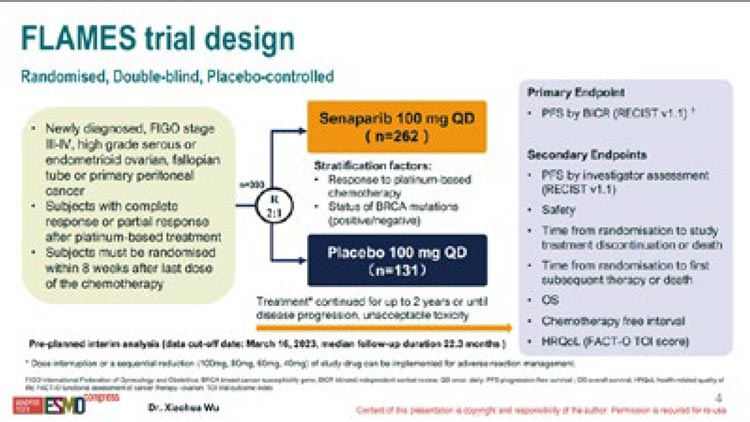
Всего в исследование были включены
393 пациентки, первичные циторедукции были выполнены у 50% пациенток,
наличие резидуальной опухоли после
хирургического лечения отмечалось у
20% пациенток; патогенные мутации в
генах BRCA1/2 были выявлены у 65%
пациенток. По результатам исследования при медиане наблюдения 22,3
мес. медиана ВБП не была достигнута
в группе сенапариба и составила 13,6
мес. в группе плацебо (HR 0,43; 95%
ДИ 0,32-0,58; p<0,0001). Пожалуй, самая интересная часть исследования
– отсутствие достоверных различий в
эффективности терапии между группой BRCA-мутированных пациенток
и в группе пациенток с «диким» типом
этих генов. Кривые Каплана-Майера
представлены на рисунке 9.
Рисунок 9.
Кривые Каплана-Майера по ВБП
пациенток в исследовании FLAMES.
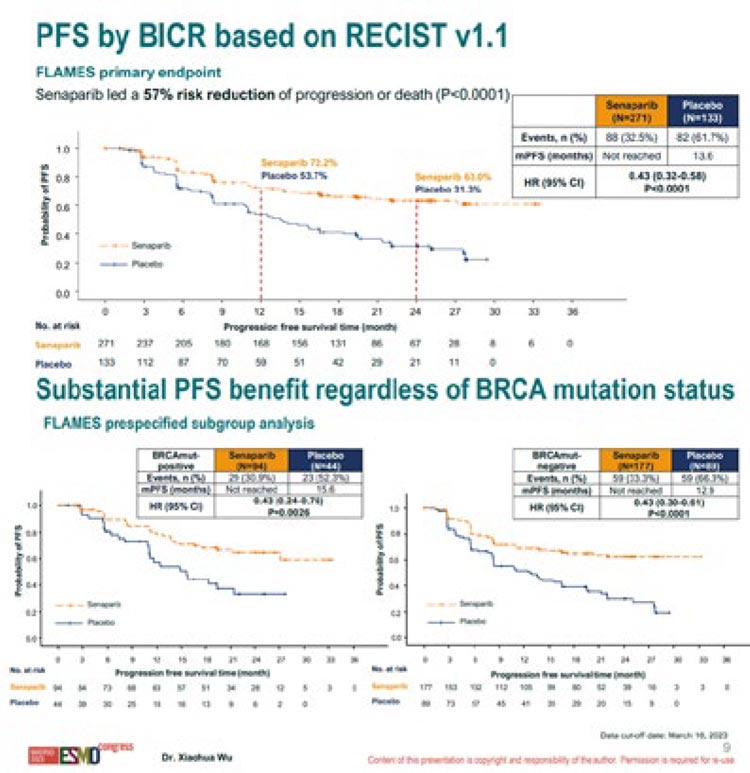
В то же время некоторые вопросы
вызывает профиль безопасности
препарата: сенапариб выглядит более токсичным в сравнении с другими ингибиторами PARP, например,
олапарибом (рис.10).
Рисунок 10.
Профиль безопасности сенапариба.
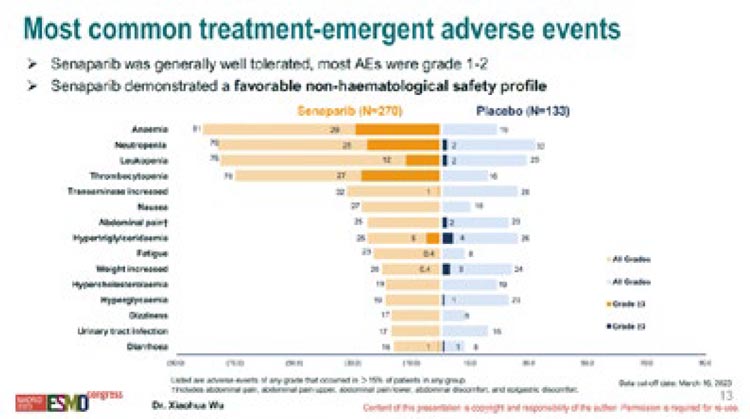
LBA36 – Efficacy and safety of
senaparib as maintenance treatment
in patients with newly diagnosed
advanced ovarian cancer (FLAMES
study): A randomized, double-blind,
placebo-controlled, phase III trial.
Персонализированная
(или не очень) терапия при
«редких» злокачественных
опухолях яичников – первые
результаты исследования
BOUQUET
В рамках этого многорукавного
нерандомизированного исследования изучаются различные варианты молекулярно-направленной терапии при редких разновидностях
злокачественных новообразований
яичников. Включаются пациентки
с low-grade опухолями яичников,
светлоклеточным раком, муцинозными опухолями, карциносаркомами и другими подтипами рака
яичников, ранее получившие 1-4
линии системной терапии. Всем пациенткам выполняется тест F1CDx,
после чего они распределяются по
когортам (n=20 для каждой с возможностью расширения когорты
до 50 пациенток). Всего здесь есть 11 когорт пациенток в зависимости
от найденных мишеней для терапии – дизайн исследования представлен на рисунке 11. Сейчас нам
показали результаты лечения в 2
из них: когорта кобиметиниба для
пациенток с активирующими мутациями BRAF/KRAS/NRAS или мутациями NF1, а также когорта
атезолизумаба/бевацизумаба – для
тех пациенток, кто не вошел в другие когорты.
Рисунок 11.
Дизайн исследования BOUQUET
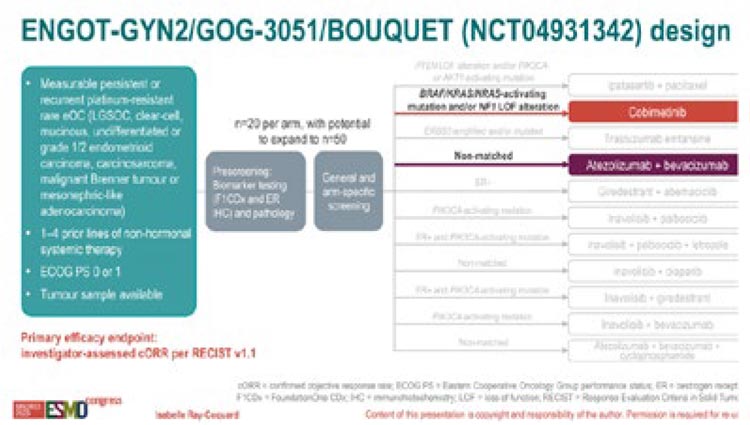
Полученные результаты выглядят следующим образом. Когорта кобиметиниба (n=20) – медиана наблюдения 6,9 мес., 65% пациенток ранее получили >3 линий терапии, у 8 пациенток были low-grade опухоли. По результатам – объективный ответ у 3 пациенток (19%), при этом наибольшая эффективность отмечена при low-grade опухолях (рис.12).
Рисунок 12.
Частота объективного ответа в когорте кобиметиниба в исследовании BOUQUET
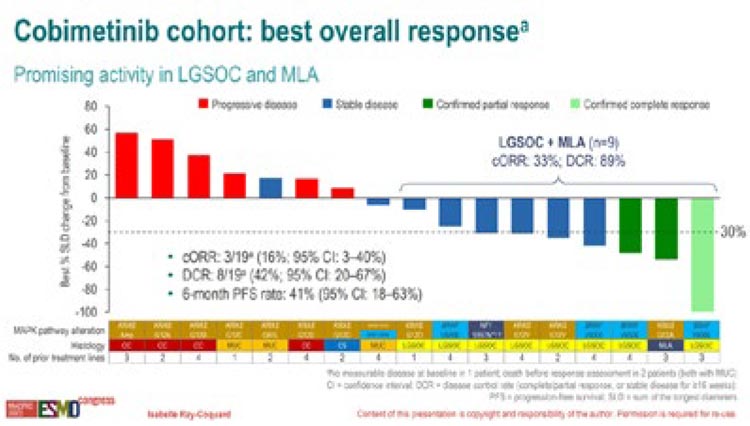
В когорте атезолизумаба/бевацизумаба (n=21) 48% пациенток ранее получили >3 линий терапии. Здесь объективный ответ на терапию отмечен у 3 (14%) пациенток, в том числе у 1 пациентки со светлоклеточным раком, у 2 пациенток с lowgrade опухолями.
747MO – First results from the
ENGOT-GYN2/GOG-3051/BOUQUET
phase II biomarker-directed platform
study: Cobimetinib (cobi) or atezolizumab (atezo) + bevacizumab (bev)
for persistent/recurrent rare epithelial
ovarian cancer (eOC).
Повторюсь, конгресс был очень
продуктивным на представление
новых работ – был представлен и
ряд других интересных исследований в области лечения онкогинекологических заболеваний.
НОВОСТИ ESMO 2023 / НЕСТОЙКАЯ СТАБИЛИЗАЦИЯ В ТЕРАПИИ РАКА ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Автор: Покатаев Илья Анатольевич
ГБУЗ «Городская клиническая онкологическая больница №1» ДЗ Москвы,
доктор медицинских наук, Москва
Неоадъювантная терапия
Начало лечения неметастатического рака поджелудочной железы
строится вокруг рентгенологической классификации резектабельности. Неоадъювантная терапия
погранично резектабельного рака
поджелудочной железы давно является стандартом [6]. Неоадъювантная стратегия исходно резектабельного рака поджелудочной
железы до этого года развивалась
в исследованиях II фазы, достаточно уверенно и прямолинейно демонстрируя свои успехи по
сравнению с традиционным стартом лечения с хирургического
этапа. Проведенные исследования
PREOPANC1, PACT-15, NEONAX
и Prep-02/JSAP-05 указывали на
высокие перспективы этого направления [7-10]. Действительно,
высокая частота R1 резекций, pN+
статуса и редкая 5-летняя выживаемость этих пациентов за счет
отдаленного метастазирования
в сочетании с невозможностью
провести FOLFIRINOX большинству больных в адъюванте даже
в сниженных дозах, указывают
на необходимость максимальных
усилий для достижения системного контроля роста опухоли на
дооперационном этапе.
Однако сначала на ASCO 2023 исследование II фазы NORPACT-1
[11], а затем на ESMO 2023 исследование PREOPANC-2 [12] заставили усомниться, что неоадъювант при исходно резектабельном
раке работает так, как это необходимо. Исследование NORPACT-1
предусматривало рандомизацию
пациентов с исходно резектабельным РПЖ либо на 4 курса неоадъювантного FOLFIRINOX, либо на
операцию на первом этапе, еще
до разгрузки желтухи и морфологической верификации опухоли,
которые, справедливости ради,
необязательны при начале лечения с хирургического этапа. В
итоге 17% выбыли из группы неоадъюванта по причине неудачи
этих процедур. Несмотря на более
высокую частоту R0-резекций,
группа неоадъювантного лечения несколько проиграла в общей
выживаемости группе исходно
хирургического лечения: медианы составили 25 и 38 месяцев
соответственно (HR=1,5; p=0,10).
Много вопросов и дискуссий в
зале на конгрессе ASCO вызвала
реализация исследования: почему только 52% пациентов завершили 4 запланированных курса
неоадъювантной химиотерапии
FOLFIRINOX, почему при заявленном в дизайне продолжении
лечении mFOLFIRINOX в адъюванте в обеих группах в реальности пациенты в 73% случаев
получали гемцитабин-содержащие режимы, а mFOLFIRINOX
получили только 25% в группе с
неоадъювантом и 40% в группе
хирургии? В итоге все решили дождаться хорошо спланированных
исследований III фазы.
И дождались на ESMO 2023 исследования III фазы PREOPANC-2.
Исследователи из Нидерландов
признались, что PREOPANC-1
настолько убедил их в необходимости неоадъюванта, что группы
с хирургическим началом лечения даже не было запланировано. Напомню, что исследование
II фазы PREOPANC-1 доказало
преимущество неоадъювантной
химиолучевой терапии (ХЛТ) по
сравнению с операцией на первом
этапе только в когорте погранично резектабельного рака, тогда
как в когорте исходно резектабельных карцином был отмечен
только тренд к положительному
влиянию неоадъювантной терапии [13]. В итоге в исследование
PREOPANC-2 отбирались пациенты с исходно резектабельным и
погранично резектабельным РПЖ
при условии охвата опухолью
вены <270° и артерии <90°. Пациенты рандомизированы на группу
восьми курсов неоадъювантного
лечения FOLFIRINOX или группу
контроля, получавшую неоадъювантную терапию гемцитабином в сочетании с ХЛТ (рис.1).
Рисунок 1.
Дизайн исследования PREOPANC-2
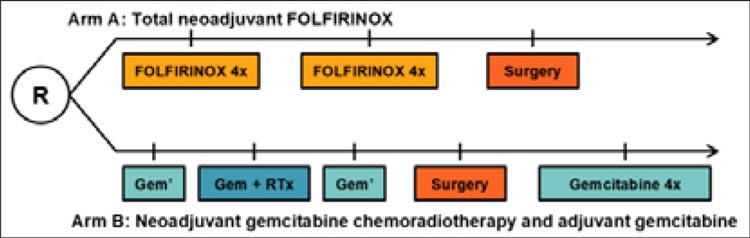
Авторы не забыли отметить, что в
отличие от своих скандинавских
коллег, они провели более 4 курсов FOLFIRINOX в 81% случаев.
Но сравнительная эффективность
двух групп многих специалистов
поставила в тупик. Медианы продолжительности жизни для групп
FOLFIRINOX и ХЛТ составили
22 и 21 месяц, без статистически
значимых различий (рис.2). Стоит
напомнить, что в историческом
исследовании PREOPANC-1 медианы продолжительности жизни в
группе хирургического лечения и
неоадъювантной ХЛТ составили
14,3 и 15,7 месяца соответственно
[13]. Критерии включения и режим ХЛТ в экспериментальной
группе PREOPANC-1 были такими
же, как и в контрольной группе
PREOPANC-2.
Рисунок 2.
Общая выживаемость в исследуемых группах
(PREOPANC-2).
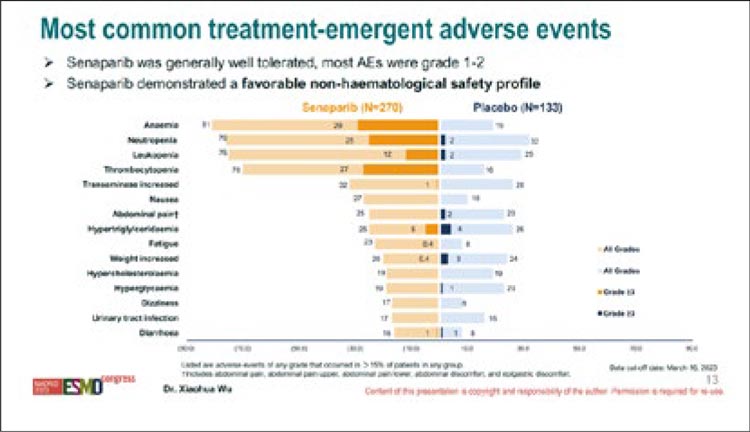
Казалось бы, проведенные исследования A021501, ESPAC-5F и
CONKO-007 показали, что комбинированная химиотерапия существенно более эффективна, чем
химиолучевая терапия при погранично резектабельном процессе, а
консолидирующая ХЛТ после нескольких курсов химиотерапии не
увеличивает отдаленные результаты лечения и не увеличивает шанс
на перевод в резектабельный статус [14-16]. Поэтому отсутствие
различия между группами в продолжительности жизни было неожиданным. В дискуссии критики
исследования не получили ответа
на некоторые свои вопросы:
Почему в исследовании не запланирован рукав с исходным началом
лечения с хирургического этапа?
Почему при доле пациентов с R1-
резекцией 39% и рN2-статусом
20% в группе FOLFIRINOX (рис.3)
авторы не пытались проводить
адъювантную терапию, тогда как
8 недель адъювантной терапии до
суммарной продолжительности
лекарственного лечения 6 месяцев
являются стандартом в настоящее
время?
Почему не собирались данные по
безрецидивной выживаемости?
Рисунок 3.
Сравнение вторичных конечных точек в исследовании PREOPANC-2.
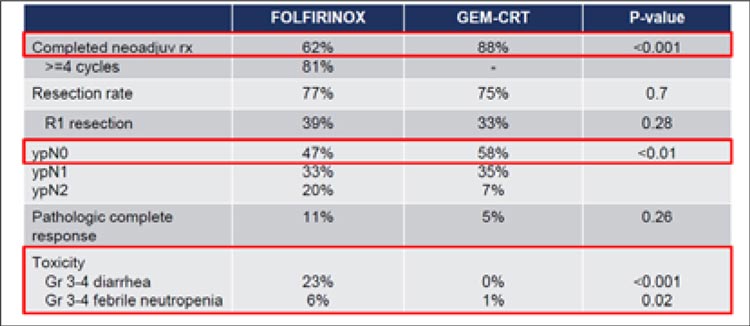
Пока мы ждем поданализа по статусу резектабельности, уже анонсировано исследование III фазы
PREOPANC-3, где сравнят неоадъювантную терапию FOLFIRINOX
(8 курсов) и операцию на первом
этапе при исходно резектабельном
процессе.
Мы следим за развитием событий,
а пока неоадъювантную терапию
исходно резектабельного РПЖ следует считать исследовательской методикой, не подходящей для рутинной клинической практики.
Наиболее эффективная
терапия первой линии
Представленные на ESMO 2023
данные поставили много вопросов. Равнозначны ли две наиболее эффективные комбинации
– FOLFIRINOX и гемцитабин +
nab-паклитаксел в первой линии
лечения рака поджелудочной железы (РПЖ)? В отношении модифицированного FOLFIRINOX со
сниженными дозами иринотекана и фторурацила была определенность, что это так, основанная
на двух рандомизированных исследованиях: на основании исследования II фазы SWOG S1505
неоадъювантная терапия двумя
схемами показала сопоставимые
результаты по доле патоморфозов и времени без прогрессирования [1], в японском исследовании
JCOG1407 при местнораспространенном раке эти две комбинации
показали сопоставимые данные
по отдаленным результатам лечения [2]. Кроме того, многочисленные ретроспективные анализы
показывали то же самое при метастатическом раке.
Сомнения появились после публикации исследования NAPOLI
3 на конференциях в начале 2023
года. Режим NALIRIFOX с заменой иринотекана на липосомальный иринотекан оказался более
эффективным, чем гемцитабин
с nab-паклитакселом [3]. При
этом сам инновационный режим
NALIRIFOX продемонстрировал
такие же результаты, как 12 лет
назад режим FOLFIRINOX с обычным иринотеканом в регистрационном исследовании PRODIGE4/
ACCORD11 [4]. Учитывая отсутствие сравнительных исследований липосомального иринотекана
и обычного при любой опухоли,
а также историю сравнения липосомального доксорубицина
и обычного [5], многие эксперты поспешили поставить режим
FOLFIRINOX как приоритетный
для метастатического рака поджелудочной железы, передвинув
гемцитабин + nab-паклитаксел на
вторую линию.
Рисунок 4.
Дизайн исследования JCOG1611.
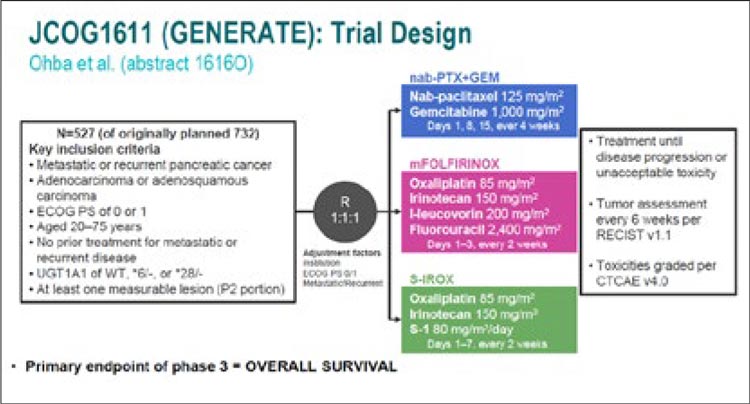
Однако на ESMO 2023 представили первые результаты рандомизированного японского исследования JCOG1611, где сравнили
модифицированный FOLFIRINOX
с гемцитабином в комбинации
с nab-паклитакселом. Получены
одинаковые данные по времени
без прогрессирования и несколько более высокая (статистически
не значимо) общая выживаемость
на гемцитабин-содержащей комбинации. Третий рукав с комбинацией иринотекана, оксалиплатина
и S1 для России неактуален (рис.4).
Полученные данные указывают
на равнозначную эффективность
при старте лечения с модифицированного FOLFIRINOX или
гемцитабин+nab-па к лита ксел
(рис. 5-6). Будет ли полнодозовый FOLFIRINOX более эффективен, чем гемцитабин +nabпаклитаксел, остается вопросом.
Рисунок 5.
Общая выживаемость в исследуемых группах
(JCOG1407).
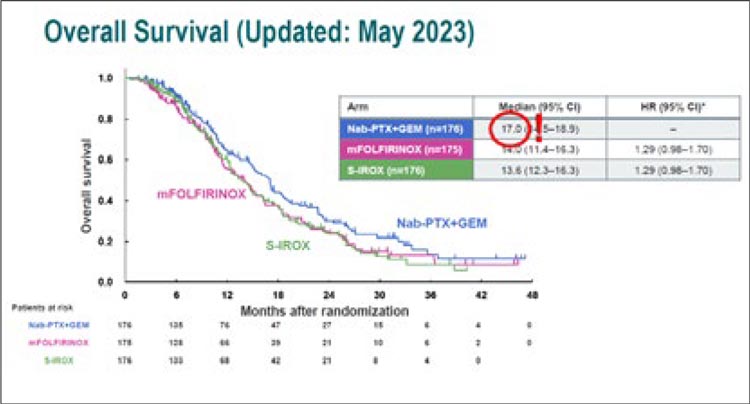
Рисунок 6.
Выживаемость без прогрессирования в исследуемых группах (JCOG1407).
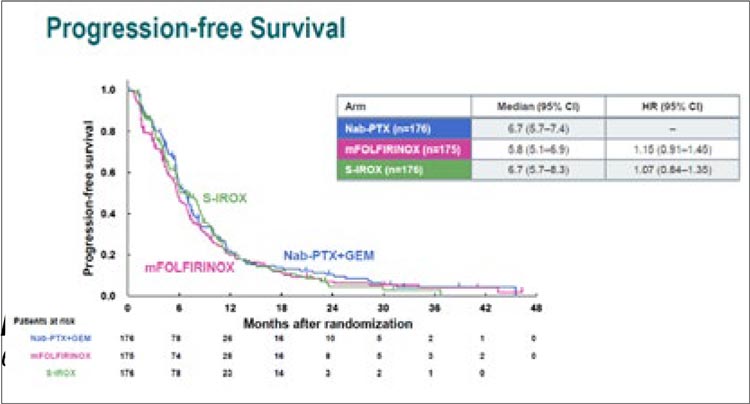
Персонализированная терапия
Ну а любителям редкого, но меткого лечения была предложена постерная сессия. В исследовании II фазы препарата zenocutuzumab (биспецифическое антитело к HER2 и HER3) при ранее предлеченном метастатическом РПЖ с NRG1-фьюженами частота объективных эффектов составила 42%, а медиана длительности эффекта – 9 месяцев [17]. NRG1-фьюжены и мутация KRAS не являются взаимоисключающими событиями, и пациенты, содержащие мутации KRAS и NRG1-fusion, не включались в данное исследование. Это очень оптимистичные данные, но ситуацию омрачает редкость данной альтерации (1% случаев при wtKRAS) и отсутствие препарата в РФ. Для наших пациентов с данной находкой можно отметить опубликованные клинические случаи эффективности афатиниба или комбинации эрлотиниба и пертузумаба [18-20].
В поданализе мультикогортного исследования RAGNAR у пациентов с метастатическим предлеченным РПЖ и FGFR1- 4-альтерациями исследовался FGFR-ингибитор эрдафитиниб (в РФ зарегистрирован, но пока нет коммерческой доступности). В анализ включено 18 пациентов, все из которых имели FGFRфьюжены, ни одного пациента с мутациями FGFR. Все эти пациенты также не имели мутации KRAS. Частота объективных эффектов составила 56%, медиана времени без прогрессирования – 7 месяцев, медиана продолжительности жизни – 20 месяцев [21]. И снова оптимизм результатов разбивается о редкость выявления данных альтераций – около 1% случаев [22].
Наконец, в крупном исследовании, направленном на изучение ларотректиниба при NTRKальтерациях вне зависимости от нозологии (агностический подход), нашлось 7 пациентов с метастатическим РПЖ. Когорта РПЖ была самой малочисленной, поскольку всего 0,7% пациентов имеют NTRK-фьюжены на практике [23]. Как видно на графиках, объективный эффект был примерно у половины из них (рис.7), однако длительность лечения в когорте РПЖ была наименьшей (после меланомы) среди всех злокачественных опухолей (рис.8) [24].
Рисунок 7.
Глубина эффектов ларотректиниба при NTRKальтерациях.

Рисунок 8.
Длительность лечения ларотректинибом при
NTRK-альтерациях.
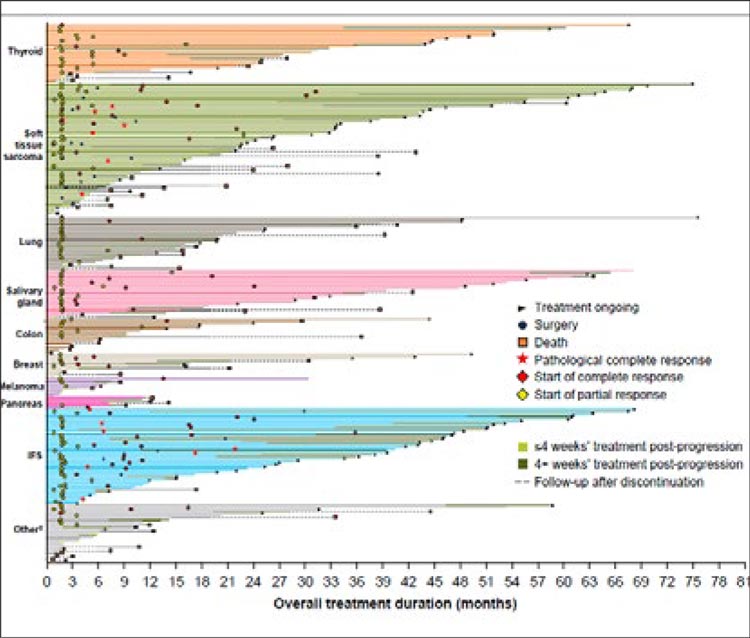
B заключение следует отметить постерный доклад из Франции, в котором из 24 пациентов с wtKRAS РПЖ четверть карцином имели различные альтерации, для которых разработаны методы персонализированной медицины, доступные в том числе в нашей стране [25].
Источники:
- Sohal D, et al. SWOG S1505: Results of perioperative chemotherapy (peri-op CTx) with mfolfirinox versus gemcitabine/nab-paclitaxel (Gem/ nabP) for resectable pancreatic ductal adenocarcinoma (PDA). JCO. 2020; 38: 4504-4504.
- Ozaka M, et al. A randomised phase II study of modified FOLFIRINOX versus gemcitabine plus nab-paclitaxel for locally advanced pancreatic cancer (JCOG1407). European Journal of Cancer. 2023; 181: 135-144.
- Wainberg ZA, et al. NALIRIFOX versus nab-paclitaxel and gemcitabine in treatment-naive patients with metastatic pancreatic ductal adenocarcinoma (NAPOLI 3): a randomised, open-label, phase 3 trial. The Lancet. 2023; 402: 1272-1281.
- Conroy T, et al. FOLFIRINOX versus Gemcitabine for Metastatic Pancreatic Cancer. N Engl J Med. 2011; 364: 1817- 1825.
- O’Brien MER, et al. Reduced cardiotoxicity and comparable efficacy in a phase IIItrial of pegylated liposomal doxorubicin HCl (CAELYXTM/Doxil®) versus conventional doxorubicin forfirst-line treatment of metastatic breast cancer. Annals of Oncology. 2004; 15: 440-449.
- Покатаев И.А., Гладков О.А., Загайлов В.Е. Практические рекомендации по лекарственному лечению рака поджелудочной железы. Злокачественные опухоли: Практические рекомендации RUSSCO. 2022; 12: 530-544.
- Uhl W, et al. NEONAX trial: Neoadjuvant plus adjuvant or only adjuvant nab-paclitaxel plus gemcitabine for resectable pancreatic cancer, a phase II study of the AIO pancreatic cancer group (AIOPAK-0313) – Safety interim analysis. JCO. 2019; 37: 4128-4128.
- Unno M, et al. Randomized phase II/ III trial of neoadjuvant chemotherapy with gemcitabine and S-1 versus upfront surgery for resectable pancreatic cancer (Prep-02/JSAP-05). JCO. 2019; 37: 189- 189.
- Van Tienhoven G, et al. Preoperative chemoradiotherapy versus immediate surgery for resectable and borderline resectable pancreatic cancer (PREOPANC-1): A randomized, controlled, multicenter phase III trial. JCO. 2018; 36: LBA4002-LBA4002.
- Reni M, et al. Safety and efficacy of preoperative or postoperative chemotherapy for resectable pancreatic adenocarcinoma (PACT-15): a randomised, open-label, phase 2-3 trial. The Lancet Gastroenterology & Hepatology. 2018; 3: 413-423.
- Labori KJ, et al. Short-course neoadjuvant FOLFIRINOX versus upfront surgery for resectable pancreatic head cancer: A multicenter randomized phase-II trial (NORPACT-1). JCO. 2023; 41: LBA4005-LBA4005.
- Groot Koerkamp B, et al. LBA83 Neoadjuvant chemotherapy with FOLFIRINOX versus neoadjuvant gemcitabine-based chemoradiotherapy for borderline resectable and resectable pancreatic cancer (PREOPANC-2): A multicenter randomized controlled trial. Annals of Oncology. 2023; 34: S1323.
- Versteijne E, et al. Neoadjuvant Chemoradiotherapy Versus Upfront Surgery for Resectable and Borderline Resectable Pancreatic Cancer: LongTerm Results of the Dutch Randomized PREOPANC Trial. JCO. 2022; 40: 1220- 1230.
- Fietkau R, et al. Randomized phase III trial of induction chemotherapy followed by chemoradiotherapy or chemotherapy alone for nonresectable locally advanced pancreatic cancer: First results of the CONKO-007 trial. JCO. 2022; 40: 4008-4008.
- Ghaneh P, et al. ESPAC-5F: Four-arm, prospective, multicenter, international randomized phase II trial of immediate surgery compared with neoadjuvant gemcitabine plus capecitabine (GEMCAP) or FOLFIRINOX or chemoradiotherapy (CRT) in patients with borderline resectable pancreatic cancer. JCO. 2020; 38: 4505-4505.
- Katz MHG, et al. Alliance A021501: Preoperative mFOLFIRINOX or mFOLFIRINOX plus hypofractionated radiation therapy (RT) for borderline resectable (BR) adenocarcinoma of the pancreas. JCO. 2021; 39: 377-377.
- Schram A, et al. 1618P Durable efficacy of zenocutuzumab, a HER2 x HER3 bispecific antibody, in advanced NRG1 fusion positive (NRG1+) pancreatic ductal adenocarcinoma (PDAC). Annals of Oncology. 2023; 34: S895-S896.
- Aguirre AJ. Oncogenic NRG1 Fusions: A New Hope for Targeted Therapy in Pancreatic Cancer. Clinical Cancer Research. 2019; 25: 4589-4591.
- Laskin J, et al. NRG1 fusion-driven tumors: biology, detection, and the therapeutic role of afatinib and other ErbB-targeting agents. Annals of Oncology. 2020; 31: 1693-1703.
- Liu SV, Minasi LAE, Herpers M, Frohn C. Efficacy of afatinib in patients with advanced/metastatic solid tumors harboring NRG1 gene fusions: A novel, prospective real-world outcomes study based on single-patient protocol data. JCO. 2022; 40: TPS3180-TPS3180.
- Pant S, et al. 1621P Efficacy and safety of erdafitinib in adults with pancreatic cancer and prespecified fibroblast growth factor receptor alterations (FGFRalt) in the phase II open-label: Single-arm RAGNAR trial. Annals of Oncology. 2023; 34: S898.
- Hyung S, et al. Incidence of FGFR2 Amplification and FGFR2 Fusion in Patients with Metastatic Cancer Using Clinical Sequencing. Journal of Oncology. 2022; 9714570.
- Demols A, et al. A Two-Step Diagnostic Approach for NTRK Gene Fusion Detection in Biliary Tract and Pancreatic Adenocarcinomas. The Oncologist. 2023; 28: e520-e525.
- Drilon A, et al. 668P Efficacy and safety of larotrectinib in a pooled analysis of patients (Pts) with tropomyosin receptor kinase (TRK) fusion cancer. Annals of Oncology. 2023; 34: S470.
- Lena J, et al. 1634P Extensive molecular profiling of KRAS wild-type versus KRAS mutant pancreatic ductal adenocarcinoma on 233 patients. Annals of Oncology. 2023; 34: S904.
НОВОСТИ ESMO 2023 / ЛОКАЛИЗОВАННЫЙ И МЕСТНОРАСПРОСТРАНЕННЫЙ НМРЛ – САМОЕ ИНТЕРЕСНОЕ НА КОНГРЕССЕ ESMO 2023
Авторы: Моисеенко Федор Владимирович
ГБУЗ «СПб КНпЦСВМП(о) им. Н.П. Напалкова»,
доктор медицинских наук, Санкт-Петербург
Понасенко Ольга Игоревна
Ординатор НМИЦ онкологии им. Н.Н. Петрова, Санкт-Петербург
Конференцию ESMO 2023 года можно смело считать посвященной опухолям легкого – настолько значимые
результаты были представлены в
этом году.
На настоящий момент мы убедились
в способности таргетных ингибиторов, использованных после радикального хирургического лечения,
после или вместо цитостатической
адъювантной терапии, влиять на
выживаемость больных с ранними
и местнораспространенными стадиями болезни. Само по себе данное
открытие имеет далеко идущие последствия, оценить которые в полной
мере мы еще не можем. Так, сходный
результат в отношении безрецидивной выживаемости, не вызвавший
особенного удивления, был представлен для больных НМРЛ с транслокацией ALK, получавших в течение
двух лет алектиниб, в рамках исследования ALINA [1]. Как мы знаем на
примере исследования ADAURA [2],
получение окончательных данных в
отношении общей продолжительности жизни, увеличение которой является основной целью любого лечения,
может растянуться на многие годы. В
связи с этим специалистам предстоит
решить, есть ли возможность экстраполировать сходные данные по БРВ
между ADAURA и ALINA на увеличение ОВ, которое пока не показано
для алектиниба, и, соответственно,
неизвестно, будет ли обоснованным
назначение адъювантной анти-ALK
терапии уже сейчас
Другим направлением, развивающимся с поразительной скоростью,
является периоперационное применение иммунотерапии у больных с локализованным и местнораспространенным НМРЛ. Целая
серия периоперационных исследований в настоящий момент находится на этапе представления основных
результатов. Первой из работ, достигших достаточной зрелости для
представления общей продолжительности жизни больных, которым
проводились различные варианты
периоперационного лечения, стало
исследование с пембролизумабом –
KEYNOTE-671 [3]. Напомним, что
особенностью конкретно этой работы было использование цисплатина
в качестве платиновой основы для
цитостатического режима, а также
возможность включения пациентов без тестирования на наличие
распространенных активирующих
мутаций. В этой работе после четырех лет наблюдения доля живых
пациентов составила 67,1% против
51,5% в группах с иммунотерапией
и без соответственно. К сожалению,
в рамках этого подхода мы не получаем ответа на вопрос о роли послеоперационного лечения.
Как уже упоминалось ранее, первой попыткой оценки эффективности периоперационной иммунотерапии при НМРЛ было применение ниволумаба в исследовании CHECKMATE-816 [4,5]. Принципиальной особенностью данной работы, позволившей представить результаты ранее, чем они были получены для других работ, является отсутствие адъювантного компонента. В этом году были представлены результаты уже трехлетнего наблюдения [4]. Первое, на что стоит обратить внимание, – доля больных без рецидива после трех циклов предоперационной иммунохимиотерапии в течение 3 лет достигает 57%. Для сравнения, аналогичный показатель для периоперационной цитостатической терапии составляет 43%. К сожалению, пока не удается преодолеть предиктивное значение экспрессии PD-L1 как маркера, предсказывающего эффективность применения ингибиторов контрольных точек. Доля больных, достигших полного патоморфологического регресса, и доля больных без рецидива в течение трех лет были выше в группе с наличием экспрессии маркера чувствительности (32,1% против 16,7% и 71% против 42% соответственно). Второй представленный в этом году анализ для исследования CM816 включал результаты для рукава с двойной иммунотерапией и без цитостатического компонента [5]. Результаты достижения полного патоморфологического регресса и трехлетней выживаемости без прогрессирования для всех пациентов, независимо от экспрессии PD-L1, оказались не хуже, чем для терапии ниволумаб + ХТ (20% и 56% соответственно). Однако при этом нельзя не обратить внимание на перекрест кривых в течение первого года лечения, связанный с ранним прогрессированием на фоне иммунотерапии. Во втором исследовании, включавшем комбинацию ниволумаба и цитостатической терапии, CM77T [6], также были получены убедительные доказательства эффективности предоперационной иммунотерапии, а также, в рамках поданализа пациентов, получавших и не получавших адъювантный этап после предоперационного лечения, проведена попытка разобраться в значимости послеоперационного лечения. Было продемонстрировано преимущество неоадъювантного этапа с включением иммунотерапии. Тем не менее, принципиальные различия в выживаемости больных в зависимости от послеоперационного этапа (8,8 мес. без адъюванта и не достигнуто в группе с лечением) надо рассматривать с учетом того, что среди больных без второго этапа значительная доля имела прогрессирование заболевания до операции.
Вторым любопытным наблюдением в этой работе является попытка выявления клинических факторов, связанных с большей длительностью БРВ или pCR. Среди характеристик пациентов с меньшей длительностью БРВ и PCR были, например, негативный уровень экспрессии PD-L1 и курение в анамнезе.
Роль этиологии опухоли в чувствительности к иммунотерапии получила подтверждение в другой работе по неоадъювантному применению тислелизумаба. Так, включенная в исследование группа была представлена курильщиками на 85%, что могло являться одним из факторов, повлиявших на более высокую, чем в исследованиях с другими препаратами, частоту pCR [7].
Кроме изучения новых комбинаций препаратов, в 2023 году были также представлены данные одной из первых систематизированных попыток выявления биомаркера для предсказания полного патоморфологического лечения, которое является одним из важнейших критериев эффективности предоперационного лечения. Так, в исследовании AEGEN с комбинацией дурвалумаба и цитостатических препаратов среди больных с pCR у большинства цоДНК к четвертому циклу лечения исчезала [8]. Таким образом, постепенно формулируется оптимальный подход в лечении больных с локализованным и резектабельным НМРЛ, который включает предоперационную иммунотерапию. Также формируются предпосылки к пониманию характеристик наиболее чувствительной к этому варианту лечения группы больных.
Кроме предоперационного подхода, значимое место среди представленных результатов занимали исследования возможностей лечения пациентов с нерезектабельным местнораспространенным НМРЛ. Во многих странах, включая страны Западной Европы, доля больных с III стадией, которым было проведено адекватное по эффективности лечение, колеблется от 20% до 30%, а конкурентной химиолучевой терапии – от 33% в Германии до 55% в Нидерландах. Объяснением недостаточной агрессивности является неоптимальное состояние большинства пациентов с выявленным заболеванием и высокая вероятность нежелательных явлений на фоне применения агрессивного подхода. На этом фоне среди представленных работ выделяется PACIFIC-6 [9], в которой поддерживающий этап терапии дурвалумабом применялся после несколько более легкой для пациентов последовательной ХЛТ. На фоне отсутствия неожиданной токсичности исследуемого режима двухлетнее время без прогрессирования было сравнимо с результатами PACIFIC [10] (35% против 45%), а также в последовательном рукаве наблюдательного исследования в реальной практике PACIFIC-R [11].
Возможность проведения лучевой терапии с последующей поддерживающей терапией дурвалумабом у больных с противопоказаниями для цитостатического компонента была изучена в исследовании DUART, также представленном на ESMO 2023 [12]. Несмотря на ожидаемое снижение доли больных без прогрессирования в течение первого года (непрямое сравнение исследований: конкурентная в PACIFIC – 60%; последовательная в PACIFIC-6 – 50,6% против 35% в DUART), данный подход можно считать обоснованным в категории ослабленных или возрастных пациентов.
Таким образом, представленные на конгрессе результаты подчеркивают значимость применения иммунотерапии на разных этапах лечения больных с локализованным и местнораспространенным НМРЛ, позволяя существенно повысить долю потенциально излеченных от опухолевого процесса пациентов оставляют на настоящий момент открытым вопрос об оптимальной длительности терапии, применении или неприменении лечения после достижения полного патоморфологического регресса, а также стадий, при которых периоперационное лечение позволяет достичь значимых улучшений выживаемости.
Источники:
- Solomon BJ, et al. ALINA: efficacy and safety of adjuvant alectinib versus chemotherapy in patients with early-stage ALK+ NSCLC. ESMO Congress 2023, Report #LBA2.
- Herbst RS, et al. Adjuvant Osimertinib for Resected EGFR-Mutated Stage IB-IIIA NonSmall-Cell Lung Cancer: Updated Results From the Phase III Randomized ADAURA Trial. Journal of clinical oncology. 2023 Jan 31.
- Spicer JD, et al. Overall survival in the KEYNOTE-671 study of perioperative pembrolizumab for early-stage non-small-cell lung cancer (NSCLC). ESMO Congress 2023, Report #LBA56.
- Provencio Pulla M, et al. Neoadjuvant nivolumab (N) + chemotherapy (C) in the phase III CheckMate 816 study: 3-y results by tumor PD-L1 expression. ESMO Congress 2023, Report #LBA57.
- Awad MM, et al. Neoadjuvant nivolumab (N) + ipilimumab (I) vs chemotherapy (C) in the phase III CheckMate 816 trial. ESMO Congress 2023, Report #1261O.
- Cascone T, et al. CheckMate 77T: Phase III study comparing neoadjuvant nivolumab (NIVO) plus chemotherapy (chemo) vs neoadjuvant placebo plus chemo followed by surgery and adjuvant NIVO or placebo for previously untreated, resectable stage IIIIIb NSCLC. ESMO Congress 2023, Report #LBA1.
- Yue D, et al. Pathological response to neoadjuvant tislelizumab (TIS) plus platinum-doublet (PtDb) chemotherapy (CT) in resectable stage II-IIIA NSCLC patients (pts) in the phase III (Ph3) RATIONALE-315 trial. ESMO Congress 2023, Report #LBA58.
- Reck M, et al. Associations of ctDNA clearance and pathological response with neoadjuvant treatment in patients with resectable NSCLC from the phase III AEGEAN trial. ESMO Congress 2023, Report #LBA59.
- Garassino MC, et al. Durvalumab (durva) after sequential chemoradiotherapy (CRT) in patients (pts) with unresectable stage III NSCLC: Final analysis from PACIFIC-6. ESMO Congress 2023, Report #LBA61.
- Spigel DR, et al. Five-Year Survival Outcomes From the PACIFIC Trial: Durvalumab After Chemoradiotherapy in Stage III Non-Small-Cell Lung Cancer. Journal of clinical oncology. 2022 Apr 20.
- Girard N, et al. Treatment Characteristics and Real-World Progression-Free Survival in Patients With Unresectable Stage III NSCLC Who Received Durvalumab After Chemoradiotherapy: Findings From the PACIFIC-R Study. Journal of thoracic oncology. 2023 Feb.
- Filippi ARR, et al. Durvalumab after radiotherapy (RT) in patients with unresectable stage III NSCLC ineligible for chemotherapy (CT): Primary results from the DUART study. ESMO Congress 2023, Report #LBA62.
ВОЛНЫ И ТУРБУЛЕНТНОСТИ ПАСИФИКа
14 ноября научный онкологический мир вчитывался в содержание
пресс-релиза компании AstraZeneca,
посвященного первым – и столь
долгожданным – результатам исследования PACIFIC-2 [1]. В этом
исследовании пациенты были рандомизированы в соотношении 2:1
для приема фиксированной дозы
дурвалумаба (Имфинзи) в дозе 1500
мг или плацебо каждые четыре недели, с начала радикального курса
ХЛТ. Пациенты продолжали получать дурвалумаб или плацебо в качестве консолидирующей терапии
после ХЛТ до прогрессирования заболевания. PACIFIC-2 проводилось
в 88 центрах более чем 20 стран с
участием 328 пациентов. Первичной
конечной точкой была ВБП, а ключевыми вторичными конечными
точками – общая выживаемость,
частота объективного ответа и продолжительность ответа.
Увы, в этом проспективном исследовании III фазы, где дурвалумаб
назначался одновременно с химиолучевой терапией (ХЛТ), авторам
не удалось достичь статистической значимости для первичной
конечной точки – выживаемости
без прогрессирования (ВБП) – по
сравнению с только ХЛТ в лечении
пациентов с неоперабельным нерезектабельным НМРЛ III стадии.
Дурвалумаб, назначаемый в консолидирующем режиме после радикального курса ХЛТ на основе
препаратов платины, является установленным глобальным стандартом
лечения неоперабельного НМРЛ III
стадии, основанным на результатах
исследования PACIFIC [2]. Исследование PACIFIC-2 было начато для
оценки одновременного применения Имфинзи с ХЛТ с целью охвата
той категории пациентов, которые
прогрессируют или прекращают
лечение во время ХЛТ и, следовательно, в дальнейшем не подходят
для режима PACIFIC. Первоначальный анализ безопасности и переносимости дурвалумаба и ХЛТ в этой
популяции пациентов показал, что
профили в целом соответствовали
таковым для этих методов лечения,
хотя в экспериментальной группе
наблюдался повышенный уровень
инфекционных осложнений в течение ХЛТ.
Хотя цифры до сих пор неизвестны,
известнейшие онкологи мира активно обсуждают в чатах возможные
причины неуспеха столь ожидаемого исследования, вспоминая о подобных негативных исследованиях
по применению комбинации ЛТ и
иммунотерапии, в частности, при
плоскоклеточном раке головы и
шеи.
Stephen V Liu, MD, Lombardi
Comprehensive Cancer Center,
Georgetown, US: «PACIFIC-2 не достиг ожидаемой ВБП. Токсичность?
Негативное взаимодействие? Или
причина тому – изначальная разница в популяции больных, ведь, как
известно, в PACIFIC набирали только тех пациентов, кто благополучно
закончил ХЛТ?»
Drew Moghanaki, UCLA Health
Johnsson Cancer Center, LA, US: «Это
сильно. Потенциально это даже
большая неудача, чем RTOG 0617.
Значение этих результатов невозможно переоценить. Нам следовало
бы больше прислушиваться к трансляционным онкологам, которые
предсказывали такой исход».
Ralph Weichselbaum, University of
Chicago, US: «Что ж, исследование
негативно. Но PACIFIC-1 работает,
и перед нами до сих пор огромное
поле деятельности, чтоб продолжать
делать науку в этом направлении».
С этом согласен Jeffrey D. Bradley, заместитель председателя Отдела протонной терапии и развития технологий Penn Medicine, Филадельфия, и
главный исследователь PACIFIC-2:
«Хотя результаты исследования
PACIFIC-2 не показали того, на что
мы надеялись, режим PACIFIC остается стандартом лечения пациентов
с неоперабельным немелкоклеточным раком легкого III стадии. Мы
воспользуемся этими результатами
для продвижения будущих исследований».
Большинство ученых приходят к
мысли, что лучевая терапия, проводимая на область первичной
опухоли и регионарных лимфоузлов, где, как показывают многие
доклинические исследования, происходит выработка специфических
Т-лимфоцитов, участвующих в
иммунном противоопухолевом ответе, негативно сказывается на их
выработке, что сводит на нет возможности иммунотерапии, применяемой одномоментно. Более
того, Т-лимфоциты известны своей
высоченной радиочувствительностью, и ежедневное облучение немалого объема тканей и сосудов, по
которым циркулируют эти клетки,
приводит к быстрому падению их
уровня и, опять-таки, сведению к
минимуму эффекта иммунотерапии. Будем с нетерпением ждать
публикаций по результатам исследования, чтоб получить возможность судить о них с большей долей
вероятности.
Меж тем, еще одна недавняя публикация в журнале Practical Radiation
Oncology от начала ноября 2023
года, в которой упоминается последовательная комбинация ХЛТ и
иммунотерапии при местнораспространенном НМРЛ, внушает больше
оптимизма. В ней были представлены результаты проспективного
мультицентрического исследования
2 фазы по применению интересного
подхода: стереотаксической лучевой терапии на первичную опухоль
(50-54 Гр за 3 фракции), затем химиолучевая терапия в стандартном
режиме (60 Гр на фоне ХТ на основе
препаратов платины) на область вовлеченных лимфоузлов средостения
с последующей консолидацией дурвалумабом до 12 месяцев. В исследование был включен 61 пациент с нерезектабельным НМРЛ II-III стадии
в период с 2017 по 2022 годы. Одними из условий включения были размеры опухоли в пределах 7 см и ее
расположение на расстоянии ≥2 см
от вовлеченных лимфоузлов средостения (рис.1). Первичной конечной
точкой была выбрана ВБП за 12 мес.,
вторичные точки – сердечная и легочная токсичность, ОВ, типы рецидивов.
Рисунок 1.
Дозиметрический план комбинированного облучения: SBRT на первичную опухоль и ХЛТ на средостение
(данные, представленные на ASTRO 2023).
Токсичность оказалась вполне приемлемой и абсолютно сравнимой с
таковой из исследования PACIFIC:
пневмониты 2+ степени – у 23%
больных (PACIFIC – 34%), пневмониты 3+ степени – у 4,9% (PACIFIC –
3,4%), эзофагиты 3 степени – у 1,6%
(PACIFIC – 7%). Основные результаты не разочаровали: ВБП за 12 мес.
составила 62,8%, за 24 мес. – 50,0%.
Медиана ВБП – 25,9 мес. (14,6-40,2).
Четырнадцать пациентов по разным
причинам не получали дурвалумаб,
и авторы смогли произвести предварительное сравнение результатов
(рис.2). Оказалось, что медиана ВБП
в группах Д+ и Д- почти в 3 раза
выше – 26,3 мес. против 9,7 мес.,
хотя, без сомнения, число пациентов для адекватного сравнения пока
слишком мало. Но отраден тот факт,
что исследование явилось руководством по методам планирования и
ориентиром на профиль токсичности для последующего исследования
3 фазы, NRG Oncology LU-008.
Рисунок 2.
ВБП во всей популяции и в подгруппах с консолидирующей иммунотерапией и без нее (данные, представленные на ASTRO 2023).
Источники:
- www.astrazeneca.com/mediacentre/press-releases/2023/update-onpacific-2-phase-iii-trial-for-imfinzi. html.
- Antonia SJ, et al; PACIFIC Investigators. Durvalumab after Chemoradiotherapy in Stage III NonSmall-Cell Lung Cancer. N Engl J Med. 2017 Nov 16; 377(20): 1919-1929. doi: 10.1056/NEJMoa1709937. Epub 2017 Sep 8. PMID: 28885881.
- Heinzerling JH, et al. Full Dose SBRT in Combination With Mediastinal Chemoradiation for Locally Advanced, Non-Small Cell Lung Cancer: A Practical Guide for Planning, Dosimetric Results From a Phase 2 Study, and a Treatment Planning Guide for the Phase 3 NRG Oncology LU-008 Trial. Pract Radiat Oncol. 2023 Nov-Dec; 13(6): 531-539. doi: 10.1016/j.prro.2023.04.014. Epub 2023 Jul 3. PMID: 37406774.
РОССИЙСКОЕ ОБЩЕСТВО КЛИНИЧЕСКОЙ ОНКОЛОГИИ ОТКРЫВАЕТ НОВЫЙ РАЗДЕЛ НА САЙТЕ RosOncoWeb.ru – ПОДКАСТЫ
Несмотря на развитие визуального искусства, подкасты продолжают
набирать популярность и привлекать все большую аудиторию.
Вам не нужно откладывать свои дела ради онлайн-трансляции
интересного вебинара. Вы можете включить запись, когда
и где вам будет удобно. Экономия времени и возможность делать
что-то параллельно, прослушивая выпуски, – пожалуй, одна
из главных причин популярности подкастов

TTF ПРИ РАКЕ ЛЕГКОГО IV СТАДИИ: НОВЫЙ СТАНДАРТ ЛЕЧЕНИЯ?
Совсем недавно на сайте мы публиковали данные метаанализа 9 исследований по применению TTF (Tumor
Treating Fields) при глиобластоме с
комментарием Н.В. Жукова. И снова
аббревиатура прозвучала громко, да
еще в журнале Lancet Oncology, где в
конце сентября 2023 года были представлены результаты крупного проспективного рандомизированного
исследования 3 фазы LUNAR, охватившего 130 центров из 19 стран [1].
До сих пор клиническое применение
TTF при раке легкого оставалось
своеобразной tabula rasa: авторы отмечают, что поиск в PubMed по запросу «TTFields AND non-small cell
lung cancer» с 1 января 2003 г. по 30
апреля 2023 г. без языковых ограничений выявил всего лишь одно (!)
пилотное исследование фазы 1/2 (EF15; NCT00749346) по применению
переменных электрических полей,
создаваемых портативным медицинским устройством (NovoTTF-100L,
Novocure, Хайфа, Израиль), в сочетании с пеметрекседом [2]. Пациенты,
включенные в швейцарское исследование в 2008 и 2009 годах, имели
НМРЛ, прогрессирующий на фоне
предыдущей терапии; 90% больных
получали лечение на основе платины. Исследование показало, что добавление Tumor Treating Fields (TTF)
к пеметрекседу (рекомендованной
терапии второй линии при включении пациентов) продемонстрировало предварительные данные по
эффективности, включая медиану
выживаемости без прогрессирования (ВБП) 22 недели, медиану общей
выживаемости (ОВ) 13,8 месяца и
1-летнюю выживаемость 57%. Воспалительные изменения кожи были
единственным частым нежелательным явлением, связанным с устройством, от легкой (24% пациентов) до
умеренной (2%) степени дерматита
под пластинами, который в целом
купировался при применении местных стероидов; при этом серьезных
нежелательных явлений, связанных
с терапией TTF, отмечено не было.
Доклинические исследования также
показали эффективность TTF при
НМРЛ; лечение снижало жизнеспособность клеточных линий немелкоклеточного рака легких с максимальным эффектом при частоте 150 кГц, и
этот эффект суммировался при применении различных системных агентов. Кроме того, клеточная гибель,
индуцированная TTF, стимулировала противоопухолевый иммунный
ответ и увеличивала эффективность
ингибиторов контрольных точек у
мышей. Исследование LUNAR является первым и пока единственным
рандомизированным исследованием
3 фазы по применению у больных
НМРЛ.
Напомним: TTF – это переменные
электрические поля, которые при
воздействии на опухоль нарушают
множество внутриклеточных процессов, имеющих решающее значение для выживания и пролиферации
опухолевых клеток. Терапия TTF
сугубо локорегиональна и неинвазивна, проводится с помощью портативного медицинского устройства,
в котором используются две пары
аппликаторов, помещаемых на кожу
грудной клетки пациента, и связанных с основным генератором полей
(рис.1). Ряд исследователей отмечают, что ношение устройства более
75% единицы времени (сутки) достоверно улучшает результаты, чем если
это делать реже.
Рисунок 1.
Расположение пластин-аппликаторов на грудной
клетке пациента; генератор магнитных полей.
Рисунок 2.
Общая выживаемость пациентов 2 групп, пролеченных по протоколу.
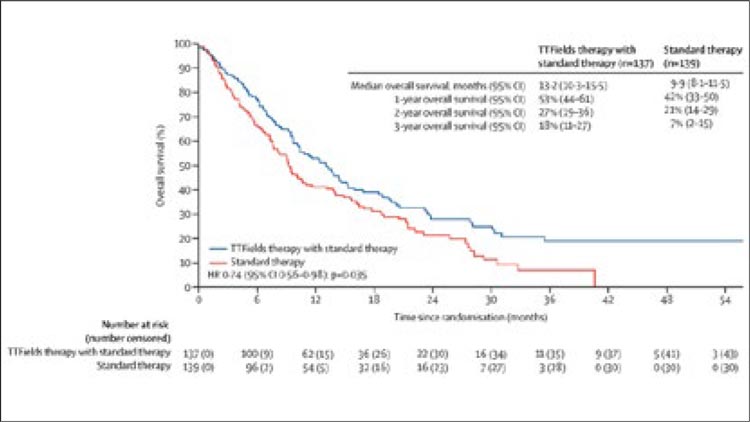
Рисунок 3.
Общая выживаемость в группе TTF+ ИКТ (А) и TTF
и доцетаксела (В).
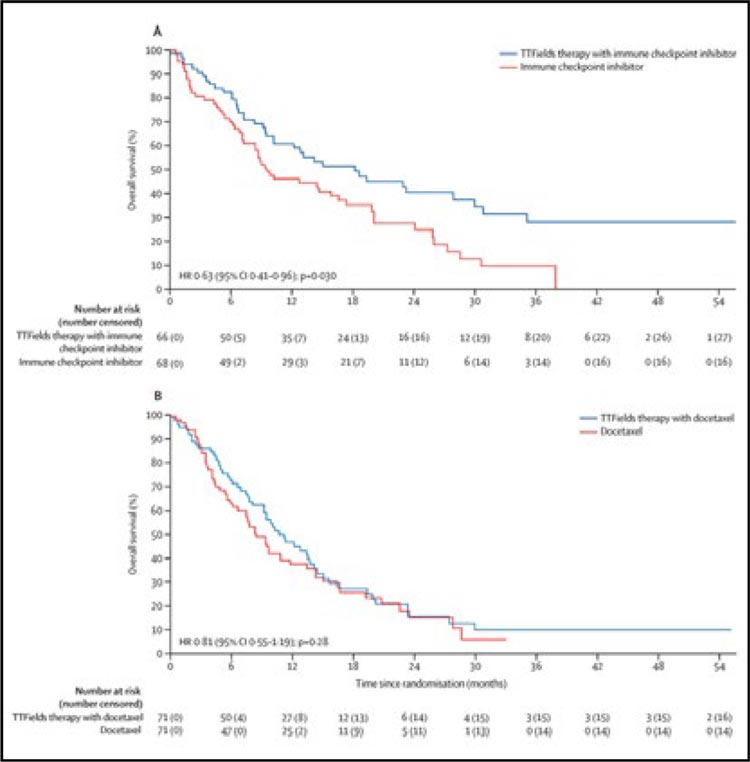
Пациенты, включенные в исследование, были в возрасте 22 лет и старше, с
метастатическим немелкоклеточным
раком легких, прогрессирующим во
время или после терапии на основе
платины, с плоскоклеточным или неплоскоклеточным раком и статусом
по ECOG 2 или меньше. Предыдущая терапия препаратами платины
была одним из условий, но не было
ограничений на количество или тип
предыдущих линий системной терапии. Участники были случайным
образом распределены (1:1) на терапию TTF и стандартную системную
терапию (ингибиторы иммунных
контрольных точек (ниволумаб, пембролизумаб или атезолизумаб) или
доцетаксел по выбору исследователя)
или только стандартную терапию.
Рандомизация проводилась централизованно и была стратифицирована по гистологии опухоли, лечению
и локализации. Системную терапию
проводили в соответствии с местными практическими рекомендациями. Терапия TTF (частотой 150 кГц)
проводилась непрерывно на область
грудной клетки (ориентировочно на
опухоль и вовлеченные зоны) с рекомендацией достичь применения
устройства в среднем не менее 18
часов в день. Первичной конечной
точкой была общая выживаемость. В
группу оценки безопасности вошли
все пациенты, получавшие какуюлибо терапию и прошедшие анализ в
соответствии с фактически полученным лечением.
В итоге в период с 13 февраля 2017 г.
по 19 ноября 2021 г. было зарегистрировано 276 пациентов, которые случайным образом были распределены
на лечение TTF в сочетании со стандартной терапией (n=137) или только стандартной терапией (n=139).
Средний возраст составил 64 года
(59-70), 178 (64%) мужчин и 98 (36%)
женщин, 156 (57%) имели неплоскоклеточный немелкоклеточный рак
легкого и 87 (32%) ранее получали
ингибиторы иммунных контрольных точек. Медиана периода наблюдения составила 10,6 мес. (6,1-33,7)
для пациентов, получавших терапию
TTF в сочетании со стандартной терапией, и 9,5 мес. (0,1-32,1) для пациентов, получавших стандартную
терапию. Осмотры проводились
каждые 6 недель.
Общая выживаемость оказалась значительно выше при комбинации TTF
и стандартной терапии, чем только
при стандартной терапии (медиана
13,2 мес. [95% ДИ 10,3-15,5] против
9,9 мес. [8,1-11,5]; отношение рисков
[ОР] 0,74 [95% ДИ 0,56-0,98]; p=0,035)
(рис.2). Общая одногодичная выживаемость составила 53% (95% ДИ
44-61) с TTF и стандартной терапией
и 42% (33-50) в группе только стандартной терапии.
В подгруппе, получавшей ингибиторы иммунных контрольных точек, отмечено 38 случаев смерти из
66 пациентов, получавших терапию
TTFields, и 52 случая смерти из 68
пациентов, получавших только ингибиторы иммунных контрольных
точек. Добавление терапии TTF значительно улучшило общую выживаемость по сравнению с применением
только ингибиторов иммунных контрольных точек, с медианой общей
выживаемости 18,5 мес. (95% ДИ
10,6-30,3) и 10,8 мес. (8,2-18). соответственно и ОР 0,63 (95% ДИ 0,41-0,96;
р=0,030) (рис.3А). Общая выживаемость в течение 1 года составила 60%
(95% ДИ 47-71) с TTF и ингибитором
иммунных контрольных точек и 46%
(33-57) при использовании только
ингибиторов иммунных контрольных точек.
В подгруппе, получавшей доцетаксел, медиана общей выживаемости
составила 11,1 мес. (95% ДИ 8,2-
14,1) с TTF и доцетакселом и 8,7 мес.
(6,3-11,3) при использовании только доцетаксела, с ОР 0,81 (95% ДИ
0,55-1,19; p=0,28) (рис.3B). Общая
одногодичная выживаемость составила 46% (95% ДИ 33-57) с TTF и
доцетакселом и 38% (27-49) при использовании только доцетаксела.
Многофакторный анализ с использованием модели регрессии пропорциональных рисков Кокса выявил значительные преимущества терапии
TTF со стандартным лечением по
сравнению со стандартной терапией,
а также для ингибиторов иммунных
контрольных точек по сравнению с
доцетакселом в качестве стандартной
терапии, тогда как другие факторы,
включая возраст, пол, статус ECOG,
PD-L1 статус, история курения и гистология, существенно не повлияли
на общую выживаемость.
В группе оценки безопасности лечения (n=267) любые серьезные нежелательные явления были зарегистрированы у 70 (53%) из 133 пациентов,
получавших TTF в сочетании со
стандартной терапией, и у 51 (38%)
из 134 пациентов, получавших только стандартную терапию. Наиболее
частыми нежелательными явлениями 3-4 степени были лейкопения (37
[14%] из 267), пневмония (28 [10%])
и анемия (21 [8%]). Нежелательные
явления, связанные с TTF, были зарегистрированы у 95 (71%) из 133
пациентов; в основном это были (81
[85%)] осложнения со стороны кожи
и подкожной клетчатки 1-2 степени.
Было зарегистрировано три случая
смерти, связанных со стандартной
терапией (два из-за инфекций и один
из-за легочного кровотечения), и ни
одного случая смерти, связанного с
терапией TTF.
Рандомизированное базовое исследование 3 фазы LUNAR явило собой
доказательство 1-го уровня о том,
что терапия TTF, инновационный
локорегиональный метод лечения,
применяемый одновременно со
стандартной системной терапией,
значительно улучшает общую выживаемость у пациентов с метастатическим немелкоклеточным раком
легких после прогрессирования на
терапии платиной или после нее по
сравнению со стандартной системной терапией. Общий выигрыш в
выживаемости при терапии TTF отмечен без усугубления токсичности,
связанной с системной терапией; его
профиль токсичности в основном
ограничивался минимальными дерматологическими осложнениями.
Возможно, в будущем подобная комбинация будет рассматриваться как
стандартное лечение для этой категории пациентов.
Источники:
- Leal T, Kotecha R, Ramlau R, Zhang L, Milanowski J, Cobo M, Roubec J, Petruzelka L, Havel L, Kalmadi S, Ward J, Andric Z, Berghmans T, Gerber DE, Kloecker G, Panikkar R, Aerts J, Delmonte A, Pless M, Greil R, Rolfo C, Akerley W, Eaton M, Iqbal M, Langer C; LUNAR Study Investigators. Tumor Treating Fields therapy with standard systemic therapy versus standard systemic therapy alone in metastatic non-small-cell lung cancer following progression on or after platinumbased therapy (LUNAR): a randomised, open-label, pivotal phase 3 study. Lancet Oncol. 2023 Sep; 24(9): 1002-1017. doi: 10.1016/S1470-2045(23)00344-3. PMID: 37657460.
- Pless M, Droege C, von Moos R, Salzberg M, Betticher D. A phase I/II trial of Tumor Treating Fields (TTFields) therapy in combination with pemetrexed for advanced non-small cell lung cancer. Lung Cancer. 2013 Sep; 81(3): 445-450. doi: 10.1016/j.lungcan.2013.06.025. Epub 2013 Jul 23. PMID: 23891283.
ЭФФЕКТИВНОСТЬ ТАРЛАТАМАБА В ПОЗДНИХ ЛИНИЯХ ТЕРАПИИ МЕЛКОКЛЕТОЧНОГО РАКА ЛЕГКОГО. ПЕРВЫЕ РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ DELLPHI-301
Лекарственная терапия мелкоклеточного рака легкого (МРЛ) позволяет увеличить медиану общей
выживаемости, контролировать
симптомы болезни и сохранить качество жизни пациента, однако опции
лечения ограничены. Разработка новых опций терапии является актуальной задачей.
Тарлатамаб (AMG 757) – биспецифическое антитело, связывающее
между собой дельта-подобный лиганд 3 (DLL3), экспрессирующийся
на клетках МРЛ, и рецептор CD3,
представленный на T-лимфоцитах.
Взаимодействие опухолевых клеток
с Т-лимфоцитами приводит к активации T-клеточного иммунного ответа (рис.1).
Рисунок 1.
Механизм действия тарлатамаба.
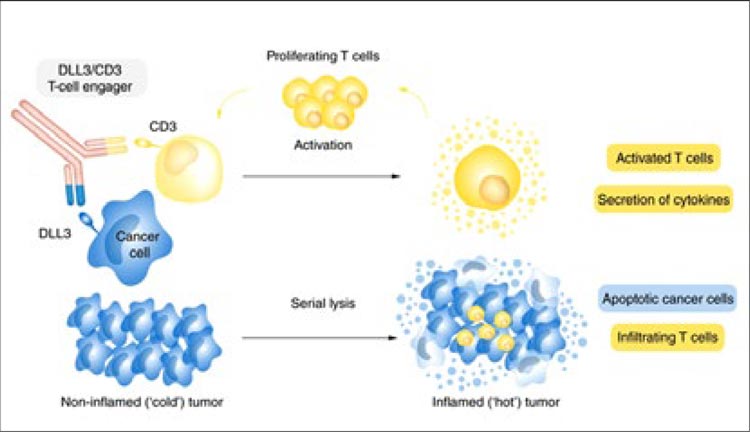
Рисунок 2.
Дизайн исследования DeLLphi-301.
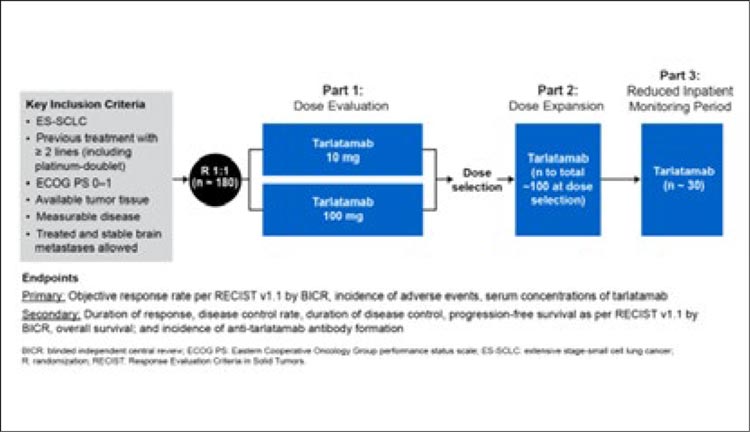
Уровень экспрессии DLL3 оценивался ретроспективно методом ИГХ
с использованием антитела SP347.
Первичной конечной точкой была
частота достижения объективного ответа (ОО), вторичными
– длительность достигнутого ОО,
контроль роста опухоли (КРО),
длительность КРО, медианы выживаемости без прогрессирования
(ВБП) и общей выживаемости (ОВ)
и токсичность терапии.
С декабря 2021 г. по май 2023 г. в исследование включено 222 пациента,
в 1 часть – 176 больных, которых
рандомизировали в две лечебные
группы (1:1):
• n=88 – тарлатамаб 10 мг;
• n=88 – тарлатамаб 100 мг.
После проведения промежуточного
анализа (оценка токсичности и эффективности) была выбрана доза в
10 мг. На всех трех этапах исследования пациенты получали тарлатамаб в дозе 1 мг в 1-й день 1-го цикла,
далее – целевую дозу 10 мг или 100
мг в 8-й и 15-й день 1-го цикла и далее каждые 2 недели.
Во вторую и третью части работы
было включено еще 12 и 34 больных
соответственно.
Большинство пациентов в исследовании были ранее курившими мужчинами без метастазов в головном мозге,
с ECOG статусом 1, ранее получавшие
анти-PD-L1 или PD-1 терапию и с 2 и
более линиями лечения в анамнезе.
В анализ эффективности включены
результаты терапии 176 больных. Медиана времени наблюдения составила
10,6 мес. в группе с дозовым режимом
10 мг и 10,3 мес. в группе с дозовым
режимом 100 мг.
Объективный ответ достигнут у 40%
пациентов в группе, принимавшей
тарлатамаб в дозе 10 мг, и у 32% в
группе 100 мг. Подробно результаты
терапии представлены в таблице.
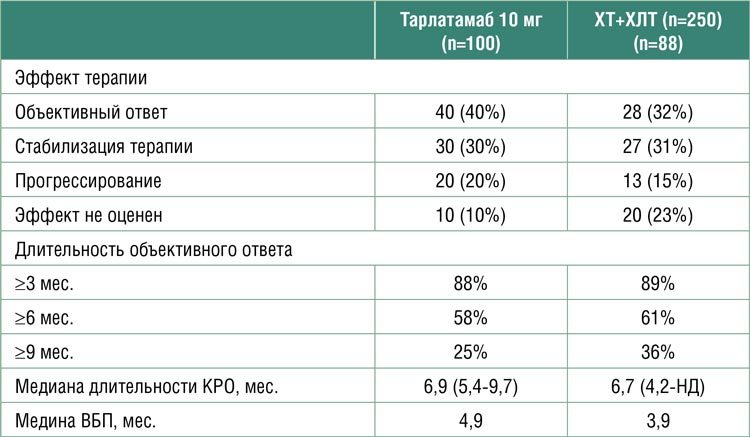
Медиана ВБП в группе с тарлатамабом в 10 мг составила 4,9 мес. и 3,9 мес.
в когорте 100 мг, при 6-месячной ВБП
в 40% и 34% и 9-месячной ВБП в 28%
и 27% в группах соответственно.
Представлены образцы опухолевой
ткани 157 пациентов (84%), из них
83 пациента (83%) в группе 10 мг и
74 пациента (84%) в группе 100 мг,
в 151 (96%) случае подтвержден положительный статус DLL3. Частота регистрации ОО не зависела от
статуса DLL3.
Нежелательные явления 3 степени и
выше зарегистрированы у 58% больных в группе 10 мг и у 64% в группе
100 мг и были преимущественно
представлены синдром выброса цитокинов (3% и 6%), нейротоксичностью (0% и 5%) и нейтропенией (6%
и 10%).
Источники:
- Ahn M-J, Chul Cho B, Felip E, et al. for the DeLLphi-301 Investigators. Tarlatamab for Patients with Previously Treated Small-Cell Lung Cancer. NEJM. Published online: 20 October 2023. DOI: 10.1056/ NEJMoa2307980.
- LBA92 – Paz-Ares L, Ahn M-J, Felip E, et al. Tarlatamab for patients (pts) with previously treated small cell lung cancer (SCLC): Primary analysis of the phase II DeLLphi-301 study. Ann Onc. 2023; 34(Suppl 2): S1333-S1334. DOI: https://doi. org/10.1016/j.annonc.2023.10.094.
УГОЛОК РАДИОТЕРАПЕВТА / ШАГ ЗА ШАГОМ: ПРОТОНЫ В ЛЕЧЕНИИ БОЛЬНЫХ МЕСТНОРАСПРОСТРАНЕННЫМ РАКОМ ЛЕГКОГО
Автор: Деньгина Наталья Владимировна
ГУЗ «Областной клинический онкологический диспансер»,
к.м.н, Ульяновск
Интерес онкологического сообщества к проблеме применения протонного излучения в терапии больных с
опухолями различных локализаций
велик. Теоретически метод имеет
преимущества перед традиционным фотонным излучением в плане
снижения нагрузки на критических
здоровых тканях с концентрацией
максимума дозы на вовлеченных в
опухолевый процесс зонах, это обусловлено физическими особенностями протонного излучения – и пока это
основное предназначение протонов.
Однако пока подтверждений тому,
что это имеет клинический выигрыш
в сравнении с фотонами, практически
нет. Сравнительных исследований 3
фазы очень мало, опираться на имеющиеся данные в основном небольших
работ довольно сложно. Несмотря на
постепенное увеличение числа центров протонной терапии в мире, говорить о широком применении метода
у онкологических больных, которым
требуется лучевая терапия, пока рано,
не только в силу чрезвычайно высокой стоимости протонной терапии,
но и ввиду недоказанности клинических преимуществ.
Немалый интерес вызвала недавняя
публикация голландских и итальянских авторов в «Зеленом журнале» –
Radiotherapy & Oncology – датируемая
уже 2024 годом [1] и касающаяся лечения больных местнораспространенным немелкоклеточным раком легкого III стадии. Стандартом лечения для
большинства подобных пациентов
является одновременная химиолучевая терапия (ХЛТ) с последующей
консолидацией дурвалумабом. При
наличии массивного опухолевого
процесса ХЛТ, несмотря на эффективность, чревата развитием острых и
отсроченных токсических эффектов,
которые могут негативно повлиять
на дальнейшую судьбу пациентов, в
том числе из-за невозможности проведения консолидирующей иммунотерапии по причине развития лучевых пневмонитов, эзофагитов и т.д.
Кроме того, лучевая/химиолучевая
терапия не только угнетает функцию
костного мозга, но и непосредственно
разрушает высокорадиочувствительные циркулирующие лимфоциты,
участвующие в иммунном ответе,
причем подобные последствия лечения весьма долговременны. Предохранение функции костного мозга
и сохранение максимального числа
иммунокомпетентных клеток – это,
возможно, залог большей эффективности консолидирующей иммунотерапии. По версии авторов исследования, протонная терапия позволит
значительно уменьшить малые дозы
на критических органах и в меньшей
степени воздействовать на циркулирующие лимфоциты.
С июня 2016 года по декабрь 2022 года
в 4 центрах Нидерландов и Италии
проспективно отслежены результаты лечения 271 пациента с НМРЛ III стадии, которые получали стандартную
ХЛТ на основе препаратов платины;
более трети имели плоскоклеточный
рак (36%). Из них 200 больных получали облучение фотонной терапией
методикой IMRT, а 71 – протонами
(IMPT). Лимфопения ≥3 степени в
процессе проведения ХЛТ была отмечена значительно чаще в группе больных, получавших фотонную терапию,
в сравнении с протонной: 67% против
47% (отношение рисков 2,2; 95% ДИ
1,0-4,9; P=0,032), при этом выбор режима ХТ (еженедельное введение или
1 раз в 3 недели) не влиял на частоту и
выраженность лимфопении. Анемия
3 степени и выше также наблюдалась
чаще в группе фотонов (отношение
рисков 3,8; 95% ДИ 1,6-9,3; P=0,003)
(рис.1А), причем наиболее часто это
осложнение встречалось при выборе
режима ХТ с введением 1 раз в 3 недели и было достоверно ассоциировано с худшей общей выживаемостью.
Протонная терапия в два раза реже
приводила к ухудшению общего состояния пациента (статусу по ECOG
≥2) на отрезке 21 день после начала
ХЛТ (13% против 26%; OR=0,44; 95%
ДИ 0,2-0,96; P=0,04) и через 42 дня
(24% против 39%, OR=0,49; 95% ДИ
0,26-0,91; P=0,024) (рис.1В).
Рисунок 1.
Рисунок 1. А – частота анемии и лимфопении ≥3
степени в процессе ХЛТ при применении IMRT и IMPT; В –
объективный статус пациентов до начала лечения, через 21
и 42 дня после начала ХЛТ при использовании IMRT и IMPT.
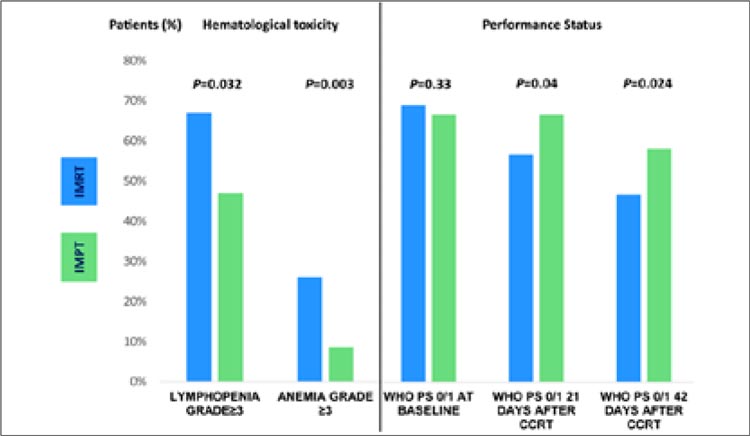
Применение протонной терапии позволило уменьшить облучаемые объемы и сократить дозы на критических
органах – костном мозге (для определения которого оконтуривались
костные структуры, в которых преимущественно содержатся очаги кроветворения – грудина, ребра, лопатки,
ключицы и тела позвонков Th1-12),
легких, сердце (рис.2).
Рисунок 2.
Дизайн исследования DeLLphi-301.
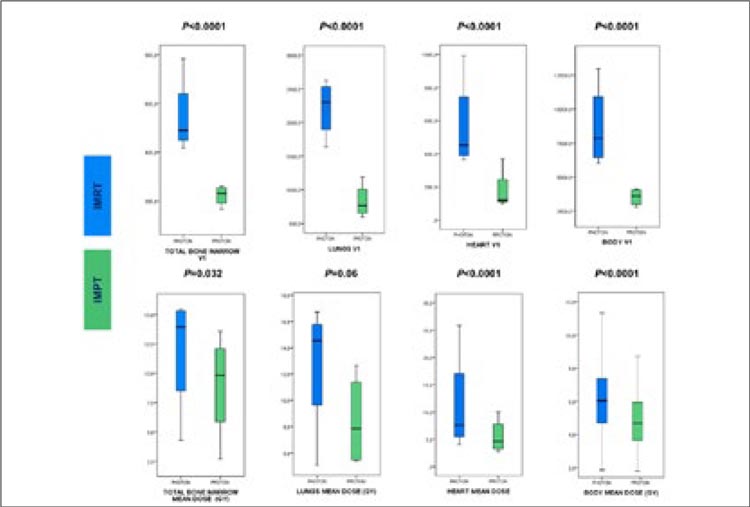
В итоге в процентном соотношении
большее количество пациентов в
группе IMPT начали получать консолидирующую терапию дурвалумабом
(74% против 52%), причем в более
ранние сроки (в пределах 42 дней после окончания ХЛТ), чем в группе
IMRT (72% против 51%).
Дальнейшее отслеживание результатов лечения этих пациентов продемонстрирует, будут ли эти различия
транслироваться в лучшие показатели выживаемости без прогрессирования или общей выживаемости,
пока авторы не сообщают о подобных планах. Однако эти результаты
можно рассматривать как уверенный шаг в сторону подтверждения
возможных преимуществ протонной терапии, в частности, снижения токсичности стандартного
химиолучевого лечения больных с
местнораспространенным раком
легкого.
Источник:
Francesco Cortiula, et
al. Proton and photon radiotherapy
in stage III NSCLC: Effects on
hematological toxicity and adjuvant
immune therapy. Radiotherapy and
Oncology. 2024; 190: 110019.
КОПИЛКА ПОЗИТИВНЫХ ИССЛЕДОВАНИЙ ПО ЛОКАЛЬНОМУ ЛЕЧЕНИЮ ОЛИГОМЕТАСТАТИЧЕСКОГО РАКА ПОПОЛНИЛАСЬ: ESO-SHANGHAI 13
И действительно, количество исследований по применению локальных
методов в лечении больных с олигометастатическим раком возрастает,
появляются даже метаанализы. При
этом проспективные рандомизированные исследования пока на вес
золота, тем более что в отношении
эффективности и целесообразности
воздействия на олигометастазы рака
пищевода не было известно ровным счетом ничего. Картина начала
вырисовываться: в журнале Lancet
Oncology опубликованы результаты
исследования ESO-Shanghai 13 – рандомизированного открытого многоцентрового исследования 2 фазы.
Пациенты в возрасте ≥18 лет были
набраны из шести больниц Китая с
гистологическим подтверждением
олигометастатического плоскоклеточного рака пищевода с контролируемой первичной опухолью и от
одного до четырех метастатических
очагов. Подходящие пациенты были
рандомизированы по составленному
компьютером графику в соотношении 1:1 для получения либо только
системной терапии, либо комбинации системной и местной терапии.
Схемы системной терапии в обеих
группах определялись по усмотрению исследователя и включали только химиотерапию, только антитела
против PD-1 или химиотерапию в
сочетании с анти-PD-1 препаратами.
Локальное лечение – лучевая терапия, хирургическое вмешательство
или термическая абляция – проводилось на всех метастатических очагах
у пациентов в группе комбинации
системной и местной терапии, причем лучевая терапия применялась у
подавляющего большинства пациентов (89%). Рандомизация была динамически сбалансирована по трем
факторам: количеству очагов поражения, линиям системной терапии
и локализации метастазов. Первичной конечной точкой была выживаемость без прогрессирования (ВБП),
определяемая как время от рандомизации до прогрессирования или
смерти от любой причины в популяции, получавшей лечение по протоколу. Исследование продолжается,
хотя набор пациентов прекращен.
В итоге было включено 116 больных
в период с 5 марта 2019 г. по 16 сентября 2021 г., и 104 пациента, которые
соответствовали критериям отбора,
были случайным образом распределены в группу системной и местной
терапии (n=53) или группу только
системной терапии (n=51). Двадцать
(38%) пациентов в группе комбинации и 23 (45%) пациента в группе
только системной терапии получали лечение препаратами на основе
антител против PD-1; три пациента в
группе комбинации системную терапию не получали.
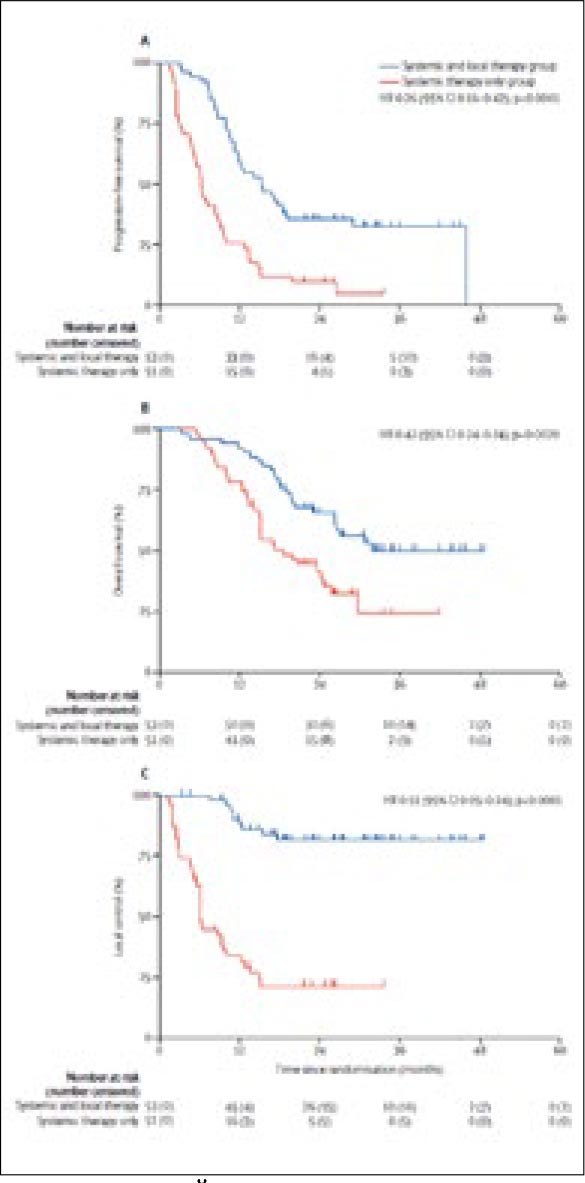
Токсичность была ожидаемой:
острый эзофагит 1-2 степени чаще
встречался в группе системной и
местной терапии, чем в группе только системной терапии (10 [19%] против одного [2%] пациента; p=0,036).
Число пациентов, у которых наблюдались нежелательные явления,
связанные с лечением, 3-й степени
и выше, было одинаковым в обеих
группах (25 [47%] против 21 [41%];
p=0,538), при этом наиболее частыми
нежелательными явлениями были
лейкопения (17 [32%] против 18
[35%]) и нейтропения (19 [36%] против 20 [39%]). Смертельные исходы,
связанные с лечением, произошли у
двух пациентов в группе системной и
местной терапии и у одного пациента
в группе только системной терапии.
Результаты впечатлили мировое онкологическое сообщество. При медиане наблюдения 30,5 мес. (24,7-37,8)
медиана выживаемости без прогрессирования составила 15,3 мес. (95%
ДИ 10,1-20,5) в группе комбинации
по сравнению с 6,4 мес. (5,2-7,6) в
группе только системной терапии
(стратифицированный HR 0,26 [95%
ДИ 0,16-0,42]; p<0,0001) (рис.1). Показатели общей выживаемости и
особенно локального контроля в
группе комбинированного лечения
также значительно и достоверно
превосходили таковые в группе системной терапии.
Авторы сделали вывод, что добавление локального лечения метастазов может значительно улучшить ВБП среди пациентов с олигометастатическим плоскоклеточным раком пищевода, получающих системную терапию. Результаты исследования показывают, что сочетание местной и системной терапии может быть вариантом лечения пациентов с олигометастатическим плоскоклеточным раком пищевода, но требуется дальнейшее изучение в исследованиях 3 фазы.
Источник:
Qi Liu, et al. Systemic
therapy with or without local
intervention for oligometastatic
oesophageal squamous cell carcinoma
(ESO-Shanghai 13): an open-label,
randomised, phase 2 trial. Lancet
Oncol. Published online: November 16,
2023. DOI: https://doi.org/10.1016/
S2468-1253(23)00316-3.
«А ВОТ БЫЛ У МЕНЯ СЛУЧАЙ…» ИЛИ ОХОТНИЧЬИ ЗАПИСКИ ОНКОЛОГОВ / МАЛЕНЬКИЕ ДЕТАЛИ ИНТЕРПРЕТАЦИИ ЛАБОРАТОРНЫХ ПОКАЗАТЕЛЕЙ, ИЛИ ЧИТАЯ ТИЦА…
Автор: Жуков Николай Владимирович
Руководитель отдела междисциплинарной онкологии ФГБУ «НМИЦ Детской гематологии,
онкологии и иммунологии им. Д. Рогачева», доцент кафедры онкологии, гематологии и лучевой терапии
РНИМУ им. Н.И. Пирогова, член правления RUSSCO, доктор медицинских наук, профессор, Москва
Во времена моей онкологической
молодости доступ к информации
был достаточно сильно ограничен в силу отсутствия интернета
как такового, поэтому я благодарен судьбе за книжки, которые
смог найти на полке отделения
комбинированных методов лечения РОНЦ им. Н.Н. Блохина,
где я проходил ординатуру. Были
среди них чисто «онкологические буквари», которые я до сих
пор искренне рекомендую всем
молодым и не очень молодым онкологам, желающим получить
системное образование в данной
области – DeVita, Hellman, and
Rosenberg's Cancer: Principles and
Practice of Oncology и Holland-Frei
Cancer Medicine, так как эти книги стали моими проводниками в
увлекательный мир онкологии.
Но была и такая книжка (вроде
бы прямого отношения к онкологии не имевшая) – «Клиническая
оценка лабораторных тестов» под
редакцией Тица Н.У. (правда это
был перевод Tietz Clinical Guide
to Laboratory Tests, а не оригинал).
Но как любая книжка по делу,
прочитанная в «детстве», она надолго закрепилась в моей памяти
– ибо открыла мне, как будущему врачу-клиницисту, то, что он
должен был бы знать благодаря
обучению на ранних курсах института. Должен был бы – но не
знал. То, что даже привычные, а
не только «мудрёные онкологические» лабораторные тесты могут
быть ложноположительными и
ложноотрицательными. Что, оказывается, есть такое понятие, как
«интерференция» – когда какое-то
вещество может ложно распознаваться тестом как позитивный
результат. И иногда эти знания
оказываются очень даже нелишними, когда ты пытаешься понять,
что же произошло с пациентом и
почему вдруг лабораторные показатели ведут себя неожиданно… А
лабораторные тесты могут влиять
на судьбу больных не меньше, чем
лечение – ведь оно-то как раз на
этих тестах и основывается.
Относительно недавно проблема настигла целую группу пациентов. Точнее, пациенток. Речь идет о больных, получающих терапию с использованием абемациклиба по поводу распространенного рака молочной железы. Мы все знаем, что данная терапия у пременопаузальных больных требует выключения функции яичников, и если она проводится медикаментозным путем (агонисты ЛГРГ), то необходим контроль уровня эстрадиола для подтверждения достижения менопаузального статуса. Но вдруг оказалось, что по какой-то причине в этой группе больных стало часто отмечаться неудовлетворительное снижение уровня эстрадиола (по сравнению с тем, что мы видели раньше, при лекарственном выключении функции). Это влияло на тактику лечения, и пациенткам проводили хирургическое удаление яичников. Но… Вот сюрприз, оказывалось, что и после этого у некоторых из них продолжал сохраняться пременопаузальный уровень эстрогенов. Что же делать в такой ситуации? Вопрос долго оставался без ответа… Потому что правильный ответ – поискать причину за пределами привычного спектра решений. А именно в особенностях лабораторных тестов, той самой интерференции. В общем, спасибо за эти тайные знания профессору Тицу и его книге! Литературный поиск с ключевыми словами «абемациклиб» и «эстрадиол» привел меня к статье, в которой было дано простое и логичное объяснение происходящего – абемациклиб может «обманывать» некоторые варианты определения уровня эстрогенов в крови [1]. То есть речь шла не об истинном повышении уровня эстрогенов, а об ошибке метода. Системной ошибке. К счастью, при метастатической болезни это не транслировалось в действия клинически значимые – да, пациентке проводилась овариэктомия, но на фоне очевидного клинического эффекта никто не отменял эффективную терапию, несмотря на сохраняющийся повышенный уровень эстрадиола. Тем более, честно признаюсь, при распространенном заболевании, с моей точки зрения, хирургическое выключение функции яичников даже более предпочтительный метод по многим причинам. Однако при адъювантном использовании, которое уже не «за горами», последствия могли бы быть гораздо более серьезными – мы ведь не видим проявлений болезни, а значит сохраняющийся повышенный уровень эстрадиола может привести к отмене терапии и замене абемациклиба и ингибиторов ароматазы на тамоксифен, как единственный препарат, который может быть назначен при сохраненной функции яичников. Хотя, очевидно, и гораздо менее эффективный. И такая замена из-за «интерференции» лабораторного теста, увы, может дорого стоить пациентке в отношении шанса на излечение. Данная заметка, разумеется, не является призывом не контролировать уровень эстрадиола у пременопаузальных пациенток, получающих эндокринотерапию и абемациклиб, и тем более не является призывом игнорировать сохраняющийся высокий уровень эстрадиола. Это призыв искать альтернативные причины, если поведение лабораторного показателя входит в конфликт с ожидаемым. Ну, и кому интересно: книга, которая дала мне посыл для поиска «интерференции», в 2006 году претерпела новое переиздание [2], и из нее можно узнать очень много интересного по поводу многих других лабораторных тестов, которые тоже могут вести себя неожиданно по разным причинам. Хотя и переводное русскоязычное издание ранней версии тоже вряд ли будет бесполезным в силу того, что большинство лабораторных методов, описанных в нем, используются до сих пор [3].
Источники:
- Kessler AJ, Patel R, Gallagher EJ, Shao T, Fasano J. Discrepancies in estradiol levels in a premenopausal woman receiving abemaciclib despite ovarian function suppression and bilateral salpingo-oophorectomy. Curr Probl Cancer Case Rep. 2023 Mar; 9: 100224. doi: 10.1016/j. cpccr.2023.100224. Epub 2023 Feb 16. PMID: 37124155; PMCID: PMC10137258.
- Tietz Clinical Guide to Laboratory Tests – Elsevier eBook on VitalSource, 4th Edition by Alan H. B. Wu, PhD, DABCC, FACB. ISBN: 9781455757190. Publication Date: 06-08-2006. Page Count: 1856. Imprint: Saunders.
- Энциклопедия клинических лабораторных тестов. Под редакцией Н. Тица. Перевод с англ. под редакцией В.В. Меньшикова. М.: Издательство «Лабинформ». 1997. 960 с. ISBN 5-89429-004-Х.
FDA ОДОБРИЛО ПЕМБРОЛИЗУМАБ В КОМБИНАЦИИ С ТРАСТУЗУМАБОМ И ХИМИОТЕРАПИЕЙ НА ОСНОВЕ ПРЕПАРАТОВ ПЛАТИНЫ В ПЕРВОЙ ЛИНИИ ТЕРАПИИ ДИССЕМИНИРОВАННОГО HER2-ПОЗИТИВНОГО РАКА ЖЕЛУДКА ПРИ CPS≥1
7 ноября 2023 г. Food and Drug Administration (FDA) на основании результатов исследования KEYNOTE-811 (NCT03615326) одобрило комбинацию пембролизумаба с трастузумабом и химиотерапией на основе
платины в первой линии лекарственного лечения диссеминированного
HER2+ рака желудка при CPS≥1.
KEYNOTE-811 – рандомизированное мультицентровое исследование 3
фазы, посвященное изучению эффективности пембролизумаба в комбинации с трастузумабом и стандартной химиотерапией на основе препаратов платины в первой линии лечения больных метастатическим
HER2-позитивным раком желудка (РЖ).
Всего 698 больных было рандомизировано (1:1) в две лечебные группы:
• n=350: пембролизумаб 200 мг + трастузумаб 8 мг/кг в день 1, далее
6 мг/кг в комбинации с цисплатином 80 мг/м2 или оксалиплатином
130 мг/м2 и капецитабином 2000 мг/м2 с 1 по 14 дни или 5-ФУ 800
мг/м2 с 1 по 5 дни, курс 3 недели;
• n=346: плацебо + трастузумаб 8 мг/кг в день 1, далее 6 мг/кг в комбинации с цисплатином 80 мг/м2 или оксалиплатином 130 мг/м2 и
капецитабином 2000 мг/м2 с 1 по 14 дни или 5-ФУ 800 мг/м2 с 1 по 5
дни, курс 3 недели.
Лечение проводилось до прогрессирования заболевания или неприемлемой токсичности, максимальная длительность терапии составила 24
месяца. Большинство пациентов в исследовании (85%) получали в качестве химиотерапии комбинацию оксалиплатина и капецитабина.
Добавление иммунотерапии позволило увеличить ЧОО с 59,8% до
72,6%, при медиане длительности ответа в 9,5 и 11,3 мес. в группах с и без
анти-PD-1 терапии соответственно.
Медина ВБП в группе с пембролизумабом достигла 10,0 мес. против 8,0
мес. в группе плацебо (ОР=0,72; 95% ДИ 0,60-0,87; p=0,0002) при 24-месячной ВБП в 25,1% и 14,2% соответственно.
При подгрупповом анализе при CPS>1 добавление пембролизумаба к
лечению позволило увеличить ВБП с 7,3 до 10,9 мес. (ОР=0,71; 95% ДИ
0,59-0,86).
Медина ОВ составила 20,0 мес. в группе пембролизумаба и 16,8 мес. в
группе плацебо (ОР=0,84; 95% ДИ 0,70-1,01), при CPS>1 комбинация с
пембролизумабом позволила увеличить ОВ с 15,7 до 20,0 мес. (ОР=0,81;
95% ДИ 0,67-0,98) (рис.1).
Рисунок 1.
Кривые ОВ при CPS>1
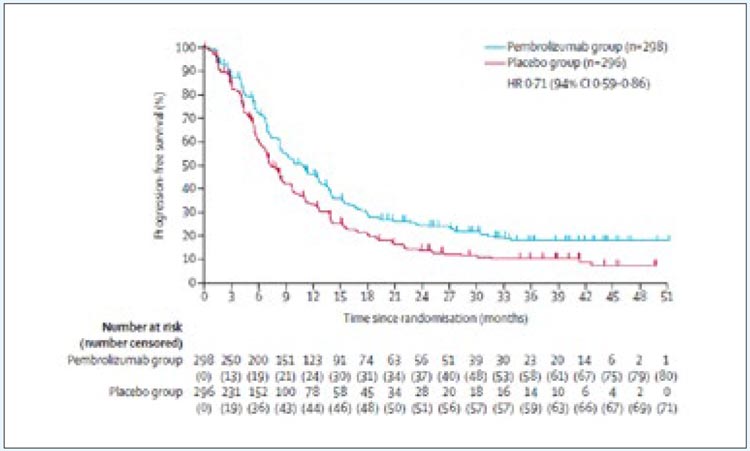
НЯ любой степени были зарегистрированы у 99% больных в группе с
пембролизумабом и у 100% в группе контроля. НЯ 3 степени и выше
были преимущественно представлены диареей (9% и 8%), тошнотой (4%
и 4%), анемией (6% и 6%), нейтропенией (8% и 9%), тромбоцитопенией
(6% и 7%), периферической сенсорной полинейропатией (4% и 2%).
Инфузионные реакции были отмечены у 16% в группе иммунотерапии и
у 13% в группе плацебо, 3 степени и более – у 3% и 1% больных. Иммуноопосредованные НЯ любой степени в когортах были преимущественно
представлены гипотиреозом (11% и 4%), пневмонитом (6% и 1%), колитом (5% и 3%) и гипертиреозом (4% и 3%).
Источники:
- www.fda.gov/drugs/resources-information-approved-drugs/fda-amendspembrolizumabs-gastric-cancer-indication.
- Yelena Y Janjigian, Akihito Kawazoe, Yuxian Bai, et al. Pembrolizumab plus trastuzumab and chemotherapy for HER2-positive gastric or gastro-oesophageal junction adenocarcinoma: interim analyses from the phase 3 KEYNOTE-811 randomised placebo-controlled trial. Lancet Oncology. October 20, 2023. https:// doi.org/10.1016/S0140-6736(23)02033-0.
ФГБНУ «МГНЦ» ПРОВЕЛО ПЕРВЫЙ ЦИКЛ ЗАНЯТИЙ ПО ПОВЫШЕНИЮ КВАЛИФИКАЦИИ ДЛЯ СОТРУДНИКОВ РЕГИОНАЛЬНЫХ ЛАБОРАТОРИЙ (ОБУЧЕНИЕ МЕТОДИКЕ NGS) RUSSCO ВЫСТУПИЛО ОРГАНИЗАТОРОМ И СПОНСОРОМ ЭТОГО ПРОЕКТА
По инициативе и при финансовой
поддержке Российского общества
клинической онкологии (RUSSCO) в
Москве с 09 по 21 октября был проведен первый цикл занятий по повышению квалификации для сотрудников
региональных лабораторий. Лаборатории выбирались с перспективой
проведения молекулярно-генетических исследований методом NGS при
различных нозологиях. Программа
обучения по теме «Методы работы с
мультигенными панелями в практической онкогенетике» готовилась совместно RUSSCO и ФГБНУ «МГНЦ».
Цикл состоял из двух этапов:
Online – теоретическая часть, которая
длилась 5 дней, когда обучающиеся
могли без отрыва от работы прослушать теоретический курс по теории
выполнения тестирований методом
NGS. По окончанию теоретической
части состоялась итоговая аттестация.

В теоретической части были разобраны следующие темы:
• Возможен ли полный переход тестирования в онкологии на метод
NGS;
• Опыт NGS-диагностики в программах RUSSCO;
• Разбор основных этапов подготовки библиотек для NGS-диагностики
рака легкого и выявления мутаций в
генах HRR и так далее.
В целях обеспечения практического
обучения, которое проходило в лаборатории МГНЦ ежедневно с 09:00
до 18:00, иногородним специалистам
(Ольге Александровне Тихоновой
– БУЗ ВО «ВОКОД» из Воронежа и
Эльвире Александровне Вартанянц –
ГБУЗ НИИ ККБ № 1 из Краснодара)
были организованы приезд и проживание в Москве. Это был шестидневный практический курс с последующим экзаменом.
В практической части были пройдены все этапы тестирования методом
NGS:
• Выделение ДНК;
• Получение библиотек для NGS;
• Запуск секвенирования мультигенных панелей;
• Снятие результатов секвенирования мультигенных панелей;
• Обсуждение полученных результатов.
Практическое обучение позволило
генетикам из региональных лабораторий овладеть всеми этапами определения соматических мутаций – от
парафиновых блоков и стекол с материалом опухоли до определения терапевтической значимости выявленных
с помощью NGS соматических генетических вариантов мутаций. Причем, некоторые опухоли содержали
мутации, на примере которых в режиме реального времени обучающиеся
освоили алгоритмы интерпретации
данных «проблемных» образцов, увидели ограничения панелей различных
производителей, научились оперировать современными международными консенсусами и критериями
патогенности (онкогенности) в практической онкогенетике.
В итоге О.А. Тихонова и Э.А. Вартанянц успешно сдали экзаменационные работы и получили сертификат о повышении квалификации. В ближайшее время RUSSCO планирует проведение еще двух циклов: 2-й состоится 27.11 – 01.12.2023, 3-й – в 1 квартале 2024 г.
Благодарим Дмитрия Сергеевича
Михайленко за подготовку этого
цикла повышения квалификации и
плодотворное сотрудничество в подготовке квалифицированных специалистов-генетиков.
ОТ ТИХОГО ОКЕАНА ДО БАЛТИЙСКОГО МОРЯ: ОНЛАЙН-ДИСКУССИЯ RUSSCO
Российское общество клинической онкологии (RUSSCO) 2 декабря провело на своей онлайнплощадке заседание дискуссионного клуба «ТОЧКА ЗРЕНИЯ»: «Клинические рекомендации,
практические рекомендации и офф-лейбл. Что мы об этом знаем?» с участием специалистов
из Южно-Сахалинска, Владивостока, Красноярска, Перми, Санкт-Петербурга и Москвы.
Этот новый формат вебинаров
запустил целый цикл встреч, посвященных обсуждению вопросов организации онкологической
помощи и спорных вопросов из
клинической практики, которые будут регулярно проходить по
субботам на сайте RosOncoWeb.ru.
Во время дискуссии эксперты
рассмотрели практические аспекты внедрения клинических рекомендаций и их место в нынешней
системе правого регулирования,
в том числе судебную практику и правовые разночтения; помогли слушателям разобраться
в вопросе, можно ли рассматривать рекомендации как помощь
в принятии клинических решений, например, если решения не
покрываются стоимостью КСГ.
Рассказали об эффективных инструментах взаимодействия с
ТФОМС.
Отдельно обсудили вопрос, как
правильно выстроить работу в
региональном диспансере и снизить риски для медицинской
организации, исходя из особенностей регионов при внедрении
КР: техническая база, кадровая
укомплектованность, исполнение сроков ПГГ.
По итогам заседания онлайн-дискуссионного клуба предполагается опубликовать ответы на заданные вопросы с проработкой
простых и понятных инструментов по правовым и практическим
аспектам обсужденной темы.
Также в ближайшее время можно
будет ознакомиться и с записью
мероприятия.
Второе заседание, запланированное на 27 января, будет посвящено
вопросам телемедицины при взаимодействии регионов с НМИЦ.
СТАТЬЯ ПО РЕЗУЛЬТАТАМ ИССЛЕДОВАНИЯ RUSSCO CLOVER ВОШЛА В ТОП-100 САМЫХ ЧИТАЕМЫХ

В 2019-2020 годах Российское общество клинической онкологии провело крупнейшее исследование по оценке сопоставимости различных тестов иммуногистохимии и ПЦР для оценки статуса PD-L1 у пациентов с метастатическим немелкоклеточным раком легкого. Главной целью был ответ на вопрос, являются ли тесты, оценивающие экспрессию PD-L1, взаимозаменяемыми и какой из них нужно использовать в практике. У 500 пациентов было проведено 1419 исследований. Результаты CLOVER были опубликованы в журнале Scientific Reports группы Nature.
В настоящее время статья вошла в ТОП-100 статей в онкологии этого журнала, занимая 36 позицию и имея более 17 000 прочтений. Всего в журнале было опубликовано более 20 000 статей в разделе «Онкология».
Источник: www.nature.com
ЭКЗАМЕН ПО КЛИНИЧЕСКОЙ ОНКОЛОГИИ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ, 2023
Карасева В.В., Егорова Ю.О., Калаева А.П
В первый день XXVII Российского
онкологического конгресса, а именно, 14 ноября 2023 г. Российское общество клинической онкологии, во
второй раз провело экзамен по клинической онкологии среди врачей
онкологов Российской Федерации.
В этом году, сорок один доктор, решился принять участие в экзамене и
проверить свои знания.
Участие приняли врачи из разных
уголков страны, а именно: Москва, Санкт-Петербург, Челябинск,
Южно – Сахалинск, Архангельск,
Калужская область (г. Малоярославец), Пенза, Ижевск, Тула, Ставропольский край (станица Курская),
Тамбов, Саратов, респ. Карелия (г.
Сортавала). Возраст участников составил от 23 до 45 лет, средний возраст в этом году составил 25 лет.
Экзамен состоял из 100 вопросов,
посвященных диагностике, механизмам действия лекарственных
препаратов, тактике ведения пациентов, лекарственной терапии
опухолей. Вопросы подготовили
ведущие эксперт Общества: д.м.н.,
профессор Владимирова Л.Ю.,
д.м.н. Волкова М.И., д.м.н., профессор Гладков О.А., к.м.н. Маркович
А.А., д.м.н. Моисеенко Ф.В., к.м.н.
Насхлеташвили Д.Р., д.м.н. Новик
А.В., к.м.н. Никулин М.П., д.м.н.
Романов И.С., к.м.н. Румянцев А.А.,
к.м.н. Семенова А.И., д.м.н., профессор Тюляндин С.А., д.м.н. Тюляндина А.С., д.м.н. Трякин А.А.,
к.м.н. Утяшев И.А., д.м.н. Федянин
М.Ю.

В таблице представлены число вопросов по разделам и процент правильных ответов в 2023 году, а также
процент правильных ответов по аналогичным разделам в прошлом году.
Обращает на себя внимание снижение числа правильных ответов в
разделах сопроводительная терапия,
онкогинекология (рак яичников, рак
шейки матки), рак прямой и ободочной кишки. А вот ответы на вопросы
по темам рак легкого, рак молочной
железы, саркомы костей и мягких
тканей чаще были правильными в
этом году по сравнению с прошлым
годом.
При подведении итогов экзамена, в
этом году было принято решение о
проходном балле в 50 правильных
ответов из 100.
Итак, результат экзамена - из сорока одного доктора, достаточное
количество баллов набрали двадцать два, что составило 53,66 %.
16 ноября, в последний день Российского онкологического конгресса, всем участникам, успешно
прошедшим экзамен, Председателем Российского общества клинической онкологии профессором
Дмитрием Александровичем Носовым, были вручены дипломы.
Наибольшее количество баллов в
этом году составило 77 (I место)
и такого результата добился заведующий отделением СП-б ГБУЗ
«Городского клинического онкологического диспансера» Глузман Марк Игоревич. Следующий
результат, с одинаковым количеством баллов 73, добились два
участника экзамена и разделили
II место: врач – онколог «Клиники доктора Ласкова» Евдокимов
Владимир Игоревич и аспирант
ФГБУ НМИЦ онкологии им. Н.Н.
Блохина Ахметьянова Ангелина
Евгеньевна (победительница, набравшая наибольшее количество
баллов на экзамене RUSSCO в 2022
г.) и результат в 67 баллов (III место) был достигнут заведующим
отделением ГАУЗ Челябинского
областного клинического центра
онкологии и ядерной медицины
Шеметовым Дмитрием Юрьевичем. Поздравляем!

В качестве поощрения, участники
получают грант на организацию
поездки на одну из конференций
Общества.
Подведя итоги, сообщаем, что
те, кто не смог принять участие в
этом году, может проверить свои
знания в следующем, а кто хочет
продолжать принимать участие и
проверять свои знания, мы всегда
ждем на экзамене.
Проведение экзамена в следующем году, планируется на 12 ноября 2024 г. на XXVIII Российском
онкологическом конгрессе. Более
подробная информации об экзамене, будет доступна в новостях
Общества и известна летом следующего года. Следите за новостями.