
Tony Allain (шотландский художник, род. 1949 г.)
Солнечный свет и тени. Пастель на шлифованной бумаге.
НОВОСТИ ОБЩЕСТВА / РОССИЙСКОЕ ОБЩЕСТВО КЛИНИЧЕСКОЙ ОНКОЛОГИИ (RUSSCO) ПРИНЯЛО УЧАСТИЕ В XIII СЪЕЗДЕ ОНКОЛОГОВ РОССИИ С МЕЖДУНАРОДНЫМ УЧАСТИЕМ, ПОСВЯЩЕННОМ ПАМЯТИ МИХАИЛА ИВАНОВИЧА ДАВЫДОВА
Одной из ключевых задач современной системы здравоохранения остается борьба с онкологическими заболеваниями. В последние годы этому направлению уделяется особое внимание – реализуется федеральный проект, объединяющий
НОВОСТИ ОБЩЕСТВА / АО «ЭКСПОЦЕНТР» И РОССИЙСКОЕ ОБЩЕСТВО КЛИНИЧЕСКОЙ ОНКОЛОГИИ (RUSSCO) ЗАКЛЮЧИЛИ СОГЛАШЕНИЕ О СОТРУДНИЧЕСТВЕ
22 мая 2025 года на заседания Организационного комитета по подготовке Международного научно-практического форума «Российская неделя здравоохранения-2025», прошедшего в Торгово-промышленной палате Российской Федерации...
НОВОСТИ ОБЩЕСТВА / RUSSCO ЗАПУСКАЕТ НОВЫЙ ОБРАЗОВАТЕЛЬНЫЙ КУРС ВЕБИНАРОВ ДЛЯ ОНКОЛОГОВ И СТОМАТОЛОГОВ
Российское общество клинической онкологии продолжает традицию образовательных инициатив и объявляет о запуске нового курса вебинаров, посвященных актуальным вопросам стоматологических осложнений у пациентов, проходящих
УГОЛОК РАДИОТЕРАПЕВТА / КОГДА ЛУЧЕВАЯ ТЕРАПИЯ ИГРАЕТ НА СТОРОНЕ ОПУХОЛИ
14 мая 2025 года в журнале Nature появилась интересная публикация. Новые данные показывают, что лучевая терапия, несмотря на эффективность воздействия на первичную опухоль при ее облучении вплоть до полного уничтожения, может...
УГОЛОК РАДИОТЕРАПЕВТА / БУСТ ПОСЛЕ ОПЕРАЦИИ ПРИ РАКЕ МОЛОЧНОЙ ЖЕЛЕЗЫ: ВСЕМ ЛИ ОН НУЖЕН?
4 мая 2025 года в журнале Radiotherapy&Oncology (онлайн) появились новые данные датского исследования DBCG IMN2, посвященного изучению частоты возникновения рецидивов в молочной железе после органосохраняющей операции и...

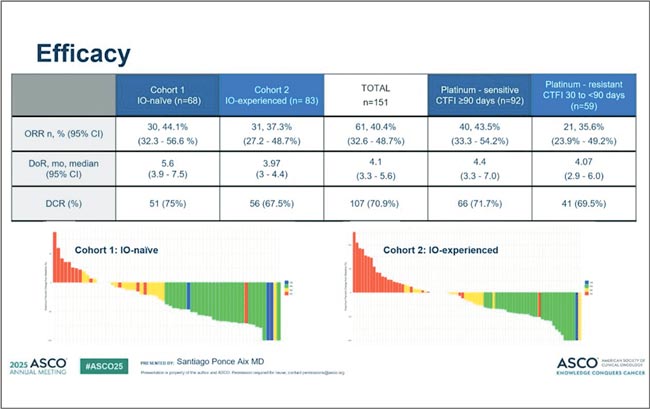
НОВОСТИ ASCO 2025 / ASCO 2025: ОПЕРАБЕЛЬНЫЙ РАК МОЛОЧНОЙ ЖЕЛЕЗЫ
Сессия, посвященная операбельному раку молочной железы (РМЖ), в этом году состояла из трех частей. В первой рассматривали вопрос модификации неоадъювантной терапии у больных HER2-позитивным (HER2+) фенотипом, в третьей оценивали...

НОВОСТИ ASCO 2025 / НОВОСТИ ASCO 2025: РАК КОЖИ
Все уже привыкли к тому, что в качестве терапии первой линии у пациентов этой группы (когда невозможно хирургическое лечение или радикальная лучевая терапия) целесообразно использование иммунотерапии анти-PD1. На конгрессе было...

НОВОСТИ ASCO 2025 / МЕТАСТАТИЧЕСКИЙ РАК МОЛОЧНОЙ ЖЕЛЕЗЫ
В этом году ASCO было богатым на исследования, изучающие новые противоопухолевые препараты и комбинации для лечения метастатического рака молочной железы (РМЖ). Несколько исследований было посвящено поиску новых лекарств при...

НОВОСТИ ASCO 2025 / РАК ЛЕГКОГО
(МРЛ) традиционно характеризуется ограниченными терапевтическими возможностями и, как следствие, зачастую бывает обделен вниманием в обзорах новостей. Тем не менее, на конференции ASCO 2025 были представлены несколько

НОВОСТИ ASCO 2025 / НОВОСТИ В ЛЕЧЕНИИ ОГШ
На состоявшемся конгрессе ASCO2025 доклады, посвященные лечению опухолей, локализующихся в органах головы и шеи, имели довольно разнообразную тематику. Конечно, большинство работ были посвящены плоскоклеточному раку слизистых...

НОВОСТИ ASCO 2025 / РАК ПОЧКИ
Изучение новых подходов в диагностике и терапии почечноклеточного рака (ПКР) продолжается, а наши знания об этой опухоли становятся все более обширными. Такой вывод можно сделать по результатам представленных докладов на конгрессе

НОВОСТИ ASCO 2025 / РАК ТОЛСТОЙ КИШКИ
С каждым годом появляются результаты новых исследований, которые дополняют картину лечения пациентов с колоректальным раком, и конгресс ASCO 2025 не стал исключением. Рассмотрим ключевые работы...

НОВОСТИ ASCO 2025 / УРОТЕЛИАЛЬНЫЙ РАК
Увы, в этом году обошлось без эффектных прорывов. Представленные данные укрепляют наши позиции в текущих подходах и открывают новые окна возможностей. Посмотрим, что нового на всех фронтах – от ранних стадий до системной терапии...

ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / PRODIGE 29-UCGI 26 (NEOPAN) TRIAL: FOLFIRINOX VS ГЕМЦИТАБИН ПРИ МЕСТНОРАСПРОСТРАНЕННОМ РАКЕ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
FOLFIRINOX приводит к более длительной ВБП по сравнению с гемцитабином. Соответствующие выводы по результатам исследования III фазы опубликованы в JCO. Ранее исследование было представлено на конгрессе ESMO. Фактически...
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / FDA ОДОБРИЛО РЕТИФАНЛИМАБ С КАРБОПЛАТИНОМ И ПАКЛИТАКСЕЛОМ ДЛЯ ПАЦИЕНТОВ С ПЛОСКОКЛЕТОЧНЫМ РАКОМ АНАЛЬНОГО КАНАЛА
15 мая 2025 года комбинация химиотерапии и нового чек-поинт ингибитора одобрена в качестве первой линии терапии для пациентов с неоперабельным местнорецидивирующим или метастатическим плоскоклеточным раком анального канала...
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / ЛАРОТРЕКТИНИБ ЭФФЕКТИВЕН В ПЕРВОЙ ЛИНИИ ТЕРАПИИ У ПАЦИЕНТОВ СО СЛИЯНИЕМ TRK
В ESMO Оpen опубликован анализ трех клинических исследований по ларотректинибу, которые проводились среди и взрослых, и детей с целью объединить данные для понимания эффективности TRK ингибитора при различных опухолях.

ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / КОМПЛЕКСНЫЙ ПОДХОД К ЛЕЧЕНИЮ ОЛИГОМЕТАСТАТИЧЕСКОГО НЕМЕЛКОКЛЕТОЧНОГО РАКА ЛЕГКОГО
Согласно концепции олигометастатической болезни, при ограниченном числе метастазов возможно достижение долгосрочной выживаемости без прогрессирования или даже излечения при условии точного стадирования, эффективной системной...

ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / ALEK-B: ЭФФЕКТИВНО ЛИ СОЧЕТАНИЕ АЛЕКТИНИБА И БЕВАЦИЗУМАБА?
Мутация в гене ALK при немелкоклеточном раке легкого встречается у 3-9% пациентов, ассоциируется с высокой частотой метастатического поражения головного мозга и является одной из наиболее таргетируемых. За последнее время...

ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / ЭФФЕКТИВЕН ЛИ ДАТОПОТАМАБ ДЕРУКСТЕКАН ПОСЛЕ ОСИМЕРТИНИБА ПРИ EGFR-МУТАНТНОМ НМРЛ?
Датопотамаб дерукстекан (DatoDXd, DS-1062) является относительно новым конъюгатом, стремящимся занять прочные позиции во многих областях клинической онкологии и, особенно, в лечении немелкоклеточного рака легкого (НМРЛ). Высокая...
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / ЭФФЕКТИВНОСТЬ АДЪЮВАНТНОЙ ХТ ПРИ ГЕРМИНОГЕННЫХ ОПУХОЛЯХ ЯИЧКА (ГОЯ) I СТАДИИ – ДАННЫЕ ИТАЛЬЯНСКОЙ БАЗЫ ДАННЫХ
Принимая во внимание редкую встречаемость ГОЯ, зачастую коллегам тяжело разобраться в вопросах проведения адъювантной терапии в той или иной клинической ситуации при I стадии заболевания. Кратко напомним, что показанием к...
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / ПРОГНОСТИЧЕСКАЯ ЗНАЧИМОСТЬ ПСА >0,2 ПОСЛЕ 6-12 МЕС. ТЕРАПИИ ПО ПОВОДУ МГЧРПЖ – ДАННЫЕ РЕГИСТРА IRONMAN
Достижение ультранизких значений ПСА (<0,2 нг/мл) в процессе первой линии терапии мГЧРПЖ продемонстрировало свою прогностическую значимость в клинических исследованиях. Однако работает ли это правило в реальной клинической...

РАЗМЫШЛЕНИЯ В ОТРЫВЕ ОТ РУТИНЫ / ПЕРВОЕ РАНДОМИЗИРОВАННОЕ ИССЛЕДОВАНИЕ ДОКАЗАЛО ПРЕИМУЩЕСТВО ИНИЦИАЛЬНОЙ ЦИТОРЕДУКЦИИ (ПО СРАВНЕНИЮ С ИНТЕРВАЛЬНОЙ) ПРИ РАКЕ ЯИЧНИКОВ. НО ПОЧЕМУ НЕ ХОЧЕТСЯ КРИЧАТЬ «УРА»?
Рак яичников до настоящего времени остается одним из основных «убийц» женского населения, что в значительной части связано с его бессимптомным течением и выраженной распространенностью опухолевого процесса на момент...
ПРОФИЛАКТИКА И КУПИРОВАНИЕ НЕЖЕЛАТЕЛЬНЫХ ЯВЛЕНИЙ / КАРДИОПРОТЕКЦИЯ: ДАННЫЕ РАНДОМИЗИРОВАННОГО ИССЛЕДОВАНИЯ SAFE
Список кардиотоксичных химиопрепаратов обширен, но антрациклины занимают одно их первых мест по частоте развития как кратковременной, так и длительной кардиоваскулярной токсичности, являясь при этом краеугольным камнем в лечении...
ПРОФИЛАКТИКА И КУПИРОВАНИЕ НЕЖЕЛАТЕЛЬНЫХ ЯВЛЕНИЙ / ПЕРИФЕРИЧЕСКАЯ НЕЙРОПАТИЯ ПОСЛЕ ХИМИОТЕРАПИИ: ПОИСКИ ЭФФЕКТИВНЫХ МЕТОДОВ КУПИРОВАНИЯ
Недавно мы представляли данные исследования по предотвращению развития периферической нейропатии, вызвавшие немалый интерес онкологического сообщества. Но когда нейропатия уже в наличии, купировать ее проявления крайне сложно, и...

Дорогие коллеги, дорогие друзья!
В Национальной галерее Шотландии в Эдинбурге хранится картина современного художника Кена Карри (Ken Currie), датируемая 2002 годом. Она носит название «Три онколога», и изображены на ней три профессора из отделения хирургии и...
Анонс
-

18 ОКТЯБРЯ 2025
ЭКЗАМЕН ESMO
МОСКВА
-

11 ДЕКАБРЯ 2025
ЭКЗАМЕН ПО КЛИНИЧЕСКОЙ ОНКОЛОГИИ RUSSCO
МОСКВА
-

11-13 ДЕКАБРЯ 2О25
XXIX РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС 2025
МОСКВА
Tony Allain (шотландский художник, род. 1949 г.)
Солнечный свет и тени. Пастель на шлифованной бумаге.

НОВОСТИ ОБЩЕСТВА / РОССИЙСКОЕ ОБЩЕСТВО КЛИНИЧЕСКОЙ ОНКОЛОГИИ (RUSSCO) ПРИНЯЛО УЧАСТИЕ В XIII СЪЕЗДЕ ОНКОЛОГОВ РОССИИ С МЕЖДУНАРОДНЫМ УЧАСТИЕМ, ПОСВЯЩЕННОМ ПАМЯТИ МИХАИЛА ИВАНОВИЧА ДАВЫДОВА
Одной из ключевых задач современной системы здравоохранения остается борьба с онкологическими заболеваниями. В последние годы этому направлению уделяется особое внимание – реализуется федеральный проект, объединяющий профилактические, диагностические и лечебные мероприятия, направленные на снижение смертности и заболеваемости от злокачественных новообразований.
Ярким примером эффективного взаимодействия медицинского сообщества стал XIII Съезд онкологов России с международным участием, который проходил 19-21 мая 2025 года на площадке Конгресс-холла «ТОРАТАУ» в г. Уфа. В этом году мероприятие посвящено памяти выдающегося ученого, хирурга-онколога, академика РАМН и РАН, доктора медицинских наук, профессора Михаила Ивановича Давыдова – человека, внесшего неоценимый вклад в развитие отечественной онкологии.
Участие RUSSCO в XIII Съезде онкологов России стало важным шагом на пути консолидации профессионального сообщества и внедрения передовых мировых практик в отечественную клиническую онкологию. Подобные мероприятия способствуют не только повышению квалификации специалистов, но и формированию единого научно-практического пространства для совместной работы по снижению онкологической заболеваемости и смертности в России.
НОВОСТИ ОБЩЕСТВА / АО «ЭКСПОЦЕНТР» И РОССИЙСКОЕ ОБЩЕСТВО КЛИНИЧЕСКОЙ ОНКОЛОГИИ (RUSSCO) ЗАКЛЮЧИЛИ СОГЛАШЕНИЕ О СОТРУДНИЧЕСТВЕ

22 мая 2025 года на заседания Организационного комитета по подготовке Международного научно-практического форума «Российская неделя здравоохранения-2025», прошедшего в Торгово-промышленной палате Российской Федерации, состоялось торжественное подписание соглашения о сотрудничестве между АО «ЭКСПОЦЕНТР» и Российским обществом клинической онкологии (RUSSCO).
Документ был подписан генеральным директором АО «ЭКСПОЦЕНТР» Максимом Фатеевым и председателем Российского общества клинической онкологии (RUSSCO), руководителем онкологического отделения противоопухолевой терапии ФГБУ «Центральная клиническая больница» Управления делами Президента РФ, главным внештатным специалистом-онкологом Главного медицинского управления делами Президента РФ Дмитрием Носовым.
Основной целью соглашения стало содействие внедрению новейших научных достижений в клиническую практику, развитие медицинской науки, а также расширение выставочно-конгрессной деятельности в области здравоохранения. Сотрудничество направлено на создание эффективной платформы для диалога профессионального сообщества, обмена опытом и продвижения инновационных решений в сфере онкологии.

Соглашение предусматривает повышение статуса и укрепление авторитета профильных мероприятий в профессиональном медицинском сообществе, а также развитие новых форматов взаимодействия между участниками рынка здравоохранения.
Подписание соглашения между АО «ЭКСПОЦЕНТР» и Российским обществом клинической онкологии открывает новые возможности для развития отечественной онкологической службы, внедрения современных клинических практик и повышения качества медицинской помощи пациентам.
Следующий Российский онкологический конгресс состоится с 11 по 13 декабря 2025 года на площадке МВЦ «Крокус Экспо». Организаторы приглашают всех заинтересованных специалистов принять активное участие в предстоящем мероприятии.
НОВОСТИ ОБЩЕСТВА / RUSSCO ЗАПУСКАЕТ НОВЫЙ ОБРАЗОВАТЕЛЬНЫЙ КУРС ВЕБИНАРОВ ДЛЯ ОНКОЛОГОВ И СТОМАТОЛОГОВ
Российское общество клинической онкологии продолжает традицию образовательных инициатив и объявляет о запуске нового курса вебинаров, посвященных актуальным вопросам стоматологических осложнений у пациентов, проходящих химиолучевую и иммунотерапию. Курс рассчитан на врачей-онкологов, стоматологов, нутрициологов и всех специалистов, участвующих в мультидисциплинарном ведении онкологических пациентов. Документация по учебному мероприятию будет представлена в Комиссию по оценке учебных мероприятий и материалов для НМО.
Старт курса – 17 июня 2025 года.
В рамках курса ведущие эксперты подробно рассмотрят этиопатогенез, клинику, диагностику, лечение, профилактику и нутритивное сопровождение стоматологических осложнений при онкологических заболеваниях. Особое внимание будет уделено разбору реальных клинических случаев и междисциплинарному взаимодействию. Участие бесплатное.
Подробная информация о лекторах и программах: www.rosoncoweb.ru/ Присоединяйтесь к курсу – совершенствуйте профессиональные знания вместе с ведущими экспертами страны!

УГОЛОК РАДИОТЕРАПЕВТА / КОГДА ЛУЧЕВАЯ ТЕРАПИЯ ИГРАЕТ НА СТОРОНЕ ОПУХОЛИ
14 мая 2025 года в журнале Nature появилась интересная публикация. Новые данные показывают, что лучевая терапия, несмотря на эффективность воздействия на первичную опухоль при ее облучении вплоть до полного уничтожения, может непреднамеренно способствовать росту отдаленных метастазов. Ключевую роль в этом процессе играет белок амфирегулин (Amphiregulin, AREG).
После лучевой терапии опухолевые клетки начинают вырабатывать больше амфирегулина – белка, который способен воздействовать на иммунные клетки в легких, перепрограммируя их, снижая их способность уничтожать опухоль, тем самым помогая опухоли избегать иммунного контроля, заставляя ее производить защитный сигнал – белок CD47.
CD47 – это своеобразный «не ешь меня» сигнал, который останавливает процесс фагоцитоза. Это позволяет опухоли выживать и расти, даже находясь под наблюдением иммунной системы.
Ученые выяснили следующее: амфирегулин активируется через сигнальный путь, связанный с интерфероном первого типа; это, в свою очередь, запускает 4 мая 2025 года в журнале Radiotherapy&Oncology (онлайн) появились новые данные датского исследования DBCG IMN2, посвященного изучению частоты возникновения рецидивов в молочной железе после органосохраняющей операции и лучевой терапии – с дополнительным «бустом» (дополнительной дозой на ложе удаленной опухоли) и без него. Напомним, DBCG IMN2 – это проспективное датское общенациональное когортное исследование, изучавшее эффект облучения внутренних грудных узлов (IMNI) у 4541 пациента с раком молочной железы с положительными лимфатическими узлами, лечившихся в 2007-2014 годах. Пациенты с правосторонними опухолями были распределены в IMNI в соответствии с национальными рекомендациями, тогда как пациенты с левосторонними опухолями – нет. Новый анализ носил характер постхок: исследователи берут уже завершенное исследование и пересматривают данные с новым вопросом: а можно ли в каких-то случаях обойтись без буста? Основные выводы анализа: В целом рецидив случается редко – у 1,7% пациенток через 5 лет и у 3,6% через 10 лет. У женщин старше 50 лет, которые не получали буст, риск оставался низким почти у всех – кроме тех, у кого опухоль была более агрессивной (ER-/HER2-). У них риск рецидива белок STAT3, который стимулирует выработку CD47. Всё это создает иммуносупрессивную и благоприятную для опухоли среду в легких. В экспериментах на мышах было показано, что блокирование амфирегулина, а также блокада белков STAT3 и CD47 уменьшает размер и количество метастазов, восстанавливает работу иммунных клеток, повышает эффективность лучевой терапии.
Эти данные открывают новые возможности, например, реализацию комбинированного подхода – лучевой терапии вместе с блокадой амфирегулина или CD47 – что потенциально может дать лучший результат при лечении метастатического рака. Но, по крайней мере, сегодня мы уже знаем: амфирегулин может быть маркером неблагоприятного ответа на облучение, его повышение после терапии – сигнал, который нельзя игнорировать.
В будущем возможна индивидуализация лечения с учетом активности амфирегулина, STAT3 и CD47.
Источник:
Piffkó A, Yang K, Panda A, et al. Radiation-induced amphiregulin drives tumour metastasis. Nature. 2025 May 14. https://doi.org/10.1038/s41586-025- 08994-0.
УГОЛОК РАДИОТЕРАПЕВТА / БУСТ ПОСЛЕ ОПЕРАЦИИ ПРИ РАКЕ МОЛОЧНОЙ ЖЕЛЕЗЫ: ВСЕМ ЛИ ОН НУЖЕН?
4 мая 2025 года в журнале Radiotherapy&Oncology (онлайн) появились новые данные датского исследования DBCG IMN2, посвященного изучению частоты возникновения рецидивов в молочной железе после органосохраняющей операции и лучевой терапии – с дополнительным «бустом» (дополнительной дозой на ложе удаленной опухоли) и без него. Напомним, DBCG IMN2 – это проспективное датское общенациональное когортное исследование, изучавшее эффект облучения внутренних грудных узлов (IMNI) у 4541 пациента с раком молочной железы с положительными лимфатическими узлами, лечившихся в 2007-2014 годах. Пациенты с правосторонними опухолями были распределены в IMNI в соответствии с национальными рекомендациями, тогда как пациенты с левосторонними опухолями – нет.
Новый анализ носил характер постхок: исследователи берут уже завершенное исследование и пересматривают данные с новым вопросом: а можно ли в каких-то случаях обойтись без буста?
Основные выводы анализа: В целом рецидив случается редко – у 1,7% пациенток через 5 лет и у 3,6% через 10 лет.
У женщин старше 50 лет, которые не получали буст, риск оставался низким почти у всех – кроме тех, у кого опухоль была более агрессивной (ER-/HER2-). У них риск рецидива белок STAT3, который стимулирует выработку CD47. Всё это создает иммуносупрессивную и благоприятную для опухоли среду в легких. В экспериментах на мышах было показано, что блокирование амфирегулина, а также блокада белков STAT3 и CD47 уменьшает размер и количество метастазов, восстанавливает работу иммунных клеток, повышает эффективность лучевой терапии. Эти данные открывают новые возможности, например, реализацию комбинированного подхода – лучевой терапии вместе с блокадой амфирегулина или CD47 – что потенциально может дать лучший результат при лечении метастатического рака. Но, по крайней мере, сегодня мы уже знаем: амфирегулин может быть маркером неблагоприятного ответа на облучение, его повышение после терапии – сигнал, который нельзя игнорировать. В будущем возможна индивидуализация лечения с учетом активности амфирегулина, STAT3 и CD47. Источник: Piffkó A, Yang K, Panda A, et al. Radiation-induced amphiregulin drives tumour metastasis. Nature. 2025 May 14. https://doi.org/10.1038/s41586-025- 08994-0. БУСТ ПОСЛЕ ОПЕРАЦИИ ПРИ РАКЕ МОЛОЧНОЙ ЖЕЛЕЗЫ: ВСЕМ ЛИ ОН НУЖЕН? составил более 8% через 10 лет.
У женщин младше 50 лет, которые получали буст, самые низкие риски были среди тех, кто был в возрасте от 41 до 49 лет и имел гормонозависимую опухоль (ER+/HER2-) – у них риск рецидива оказался ниже 2%.
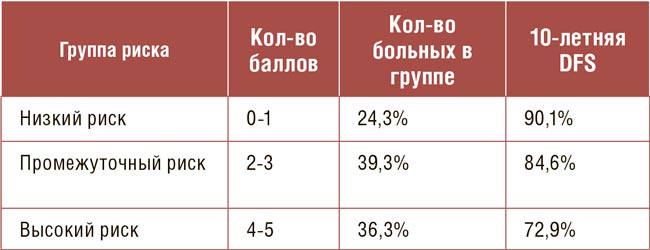
Рисунок.
Частота локальных рецидивов в группах больных
в возрасте 50 лет и старше в зависимости от подтипа РМЖ
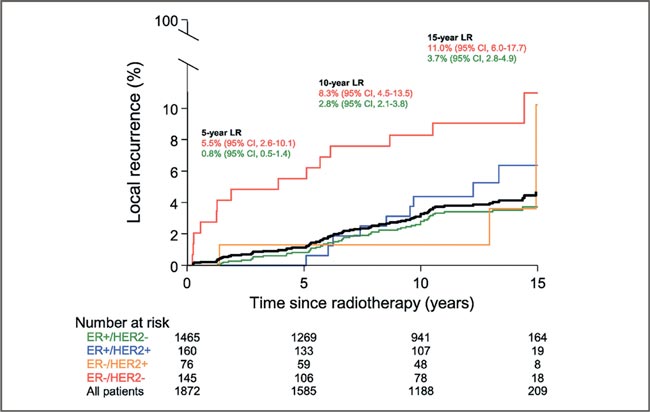
Что это значит для нашей практической деятельности:
- Буст действительно нужен, если опухоль – агрессивная (ER-/ HER2-), независимо от возраста.
- Если пациентке 41-49 лет и у нее гормонозависимая опухоль, без буста, вероятно, можно обойтись, поскольку риск рецидива и без него очень низкий.
По сути, это шаг к более индивидуальному подходу. Не всем нужны одинаковые дозы. Кому-то буст снижает риск рецидива, а кому-то может быть лишней нагрузкой, повышающей риск осложнений.
Датская группа по лечению рака молочной железы (DBCG) уже обновила рекомендации – теперь всем с агрессивными опухолями (ER-/ HER2-) назначается буст в дозе 16 Гр, 8 фракций.
Источник:
Nielsen, Anders W. Mølby, et al. Local recurrence with and without a tumour-bed boost: A post-hoc analysis of the DBCG IMN2 study. Radiotherapy and Oncology. 2025; Vol.207, 110905.
Материал подготовил А. Черчик
НОВОСТИ ASCO 2025 / ASCO 2025: ОПЕРАБЕЛЬНЫЙ РАК МОЛОЧНОЙ ЖЕЛЕЗЫ
Автор: Тюляндин Сергей Алексеевич
Заслуженный деятель науки РФ, главный научный сотрудник
отделения противоопухолевой лекарственной терапии
№2 ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России,
член правления RUSSCO, профессор, доктор медицинских наук,
Москва
Сессия, посвященная операбельному раку молочной железы (РМЖ), в этом году состояла из трех частей. В первой рассматривали вопрос модификации неоадъювантной терапии у больных HER2-позитивным (HER2+) фенотипом, в третьей оценивали опыт выключения функции яичников как компонента адъювантной гормональной терапии у пременопаузальных больных люминальным РМЖ, и рассмотрению итогов этих обсуждений будет посвящен данный обзор. Во второй части были представлены доклады, предсказывающие эффект предоперационной терапии с помощью геномных сигнатур, недоступных на нашем рынке, и потому исключенных из обсуждения.
Деэскалация неоадъювантной химиотерапии у больных операбельным HER2+ РМЖ
Abstracts LBA 500
Корейские коллеги представили результаты рандомизированного исследования neoCARHP по сравнению эффективности и безопасности комбинации одного из таксанов по выбору врача (паклитаксел, набпаклитаксел, доцетаксел), трастузумаба и пертузумаба, вводимых с карбоплатином AUC x 5 (TCbHP) или без карбоплатина (THP). Все препараты использовались в стандартных дозах и вводились 1 раз каждые 3 недели, всего проводилось 6 курсов лечения. В исследование включались пациенты в возрасте 18 лет и старше с нелеченым инвазивным HER2+ РМЖ II-III стадии, которые были стратифицированы в зависимости от статуса аксиллярных лимфоузлов (N0 vs N+) и гормональных рецепторов (ER-/PR- vs ER+ или PR+). Первичной конечной точкой был показатель полного патологического ответа (pCR), вторичными точками были безрецидивная (DFS), общая (OS) выживаемость и токсичность. Статистическая теория предполагала, что комбинация ТHP не хуже (non-inferior) TCbHP по частоте pCR, если нижняя граница 95% интервала разницы между двумя показателями на превысит 10%. В исследование было включено 766 больных с медианой возраста 52 года, Т1-2 опухолями у 80%, N+ у 64%, ER-/PR- у 37% больных. В группе THP частота pCR составила 64,1% в сравнении с 65,9% в группе TCbHP (абсолютная разница -1,8%, 95% ДИ -8,5 до 5,0), что соответствует статистической гипотезе о non-inferiority (нижнее значение 95% ДИ -8,5%, что менее заданного 10%). При подгрупповом анализе не отмечено выигрыша от добавления карбоплатина ни в одной из анализируемых подгрупп. Наиболее частыми нежелательными явлениями 3-4 степени при THP в сравнении с TCbHP были нейтропения (6,8% против 16,4%) и диарея (2,6% против 4,2%), а осложнениями 1-2- степени - нейропатия (43,5% против 48,4;) и тошнота (26,7% против 43,2%). Авторы сделали вывод, что THP обеспечивала не худшие показатели pCR и улучшенную переносимость по сравнению с TCbHP. Исключение карбоплатина может быть эффективной стратегий деэскалации неоадъювантной химиотерапии при наличии двойной блокады HER2 у пациентов с HER2+ ранним раком молочной железы.
Abstract 502
Результаты корейского исследования совпадают с данными немецкой кооперированной группы West Germany Study Group, которая представила результаты 4 протоколов IIIII фазы неоадъювантной терапии больных HER2+ РМЖ и пыталась на основании геномных сигнатур предсказать отдаленные результаты лечения. Но нам интересны результаты лечения, в частности комбинации THP, где еженедельное введение паклитаксела использовали с двойной анти-HER2 блокадой в течение 12 недель. Частота pCR зависела от гормоночувствительности опухоли и составила 91% при гормоноотрицательных (42 больные) и 56% при гормоноположительных (101 больная) опухолях, а 5-летняя инвазивная DFS - 98% и 96% соответственно. Показатель 5-летней OS для всех 142 больных, получивших THP, составил 97,8%. Столь высокие результаты были получены преимущественно у больных I-II стадиями 97,3%, c N0 - у 68%, grade 3 - у 70,4% пациенток. У части больных с pCR после операции проводили адъювантную терапию и заметили, что она, неожиданно для всех, повышает риск прогрессирования в сравнении с больными, ее не получавшими. Дискутант этих двух абстрактов профессор Sara Hurvitz напомнила, что целесообразность включения производных платины при лечении HER2+ РМЖ были обоснованы их синергизмом с трастузумабом в эксперименте и затем в клинике при назначении адъювантно (исследование BCIRG006) и неоадъювантно (исследование BCIRG101). Исследования KRISTINE, TRYPHAENA и TRAIN-2 продемонстрировали эффективность включения карбоплатина в тройную комбинацию с добавлением таксанов, трастузумаба и пертузумаба. Однако терапия карбоплатином увеличивает риск токсичности, включая миелосупрессию и желудочно-кишечные расстройства. Озвученные результаты исследований свидетельствуют, что комбинации химиотерапии таксанами и двойной анти-HER2 блокадой без карбоплатина демонстрируют высокую эффективность и могут представлять собой потенциально новый подход в лечении больных операбельным HER2+ РМЖ, который поможет избежать избыточного лечения и токсичности. Однако сегодня этот подход может быть рекомендован только больным I-II стадиями заболевания, которые составляли большинство в анализируемых исследованиях. Вопрос целесообразности проведения адъювантной терапии больным с pCR должен быть решен результатами проводимых в настоящее время рандомизированных исследований.
Выбор оптимальной адъювантной гормонотерапии у больных молодого возраста
Целая серия презентаций была посвящена выбору оптимальной адъювантной гормональной терапии у больных молодого возраста с сохраненной менструальной функцией. Были доложены результаты 15-летнего наблюдения двух самых крупных исследований в этой популяции TEXT и SOFT, а также обновленные данные корейского исследования ASTRRA и ретроспективного анализа адъювантной гормонотерапии молодых больных с герминальной мутаций BRCA1/2.
Abstracts 505
В исследовании SOFT (3047 больных) пытались оценить эффективность овариальной супрессии (OC) в течение 5 лет при ее добавлении к тамоксифену или ингибиторам ароматазы в сравнении с тамоксифеном у больных в пременопаузе. Авторы доказывают, что добавление ОС к тамоксифену или ингибитору ароматазы экземестану снижает риск прогрессирования и достоверно увеличивает 15-летнюю безрецидивную выживаемость (DFS) с 72,1% в группе тамоксифена до 75,7% в группе тамоксифена и ОС и 78,6% в группе экземестана и ОС. Влияние ОС на общую выживаемость зависело от проведенной ранее адъювантной химиотерапии (ХТ), которая, как правило, назначалась больным более молодого возраста, с большим распространением опухоли, высокой степенью злокачественностью и более низкой экспрессией стероидных гормонов. У больных без проведенной ранее ХТ (медиана возраста 46 лет, подавляющее большинство имело стадию pТ1N0 и grade 1-2) добавление OC к тамоксифену или экземестану оказало минимальное влияние на 15-летнюю общую выживаемость (OS) по сравнению с тамоксифеном. Напротив, в группе получивших адъювантную ХТ (медиана возраста 40 лет) отмечено достоверное увеличение 15-летней общей выживаемости при назначении экземестана и ОС в сравнении с тамоксифеном с 76,8% до 81,0% (таблица 1). Но есть группа больных, которая без сомнений выигрывает от добавления ОС независимо от проведенной ранее ХТ.
Таблица 1.
Показатели 15-летней DFS и OS исследований
TEXT и SOFT у пременопаузальных ER+/PR+ HER2- больных
РМЖ

Это молодые пациентки, чей возраст не превышает 35 лет. Исследование TEXT изучало вопрос, могут ли ингибиторы ароматазы, в частности, экземестан, уменьшать риск прогрессирования у пременопаузальных в комбинации с ОС в сравнении с добавлением ОС к тамоксифену. С учетом того, что в обеих исследованиях SOFT и TEXT были больные, получавшие ОС с тамоксифеном и экземестаном, было решено объединить эти данные для получения достоверных результатов. Добавление ОС к экземестану увеличило безрецидивную выживаемость в сравнении с комбинацией тамоксифена и ОС с 61% до 73,1%, что соответствует достоверному снижению риска прогрессирования на 25%. Однако, уменьшив риск прогрессирования, комбинация экземестана и ОС достоверно не улучшила общую выживаемость в общей анализируемой популяции. Достоверный выигрыш от комбинации экзeместана и ОС был получен лишь у больных grade 3. В своих выводах авторы говорят, что добавление ОС к тамоксифену или экземестану улучшает отдаленные результаты пременопаузальных больных РМЖ по сравнению с тамоксифеном. Этот выигрыш нарастает по мере роста риска прогрессирования и, особенно очевиден у больных не старше 35 лет и при наличии опухоли высокой степени злокачественности. Одновременно было показано, что для больных с I стадией, grade 1-2 назначение тамоксифена остается стандартной опцией проведения адъювантной гормонтерапии. Тем не менее, при рассмотрении назначения адъювантной химиотерапии и гормонотерапии конкретной пациентке мы учитываем многочисленные прогностические факторы (возраст, размеры первичной опухоли и число метастазов в регионарных лимфоузлах, степень дифференцировки, величина экспрессии РЭ и РП, экспрессия Ki-67) что затрудняет объективный выбор. Для объективизации индивидуального риска на основании всех вышеперечисленных факторов авторы исследования разработали индекс риска прогрессирования CRIB (Composite Risk Index Breast Cancer). Было показано, что этот индекс играет прогностическую роль, и с увеличением его значения повышается и риск прогрессирования. Но оказалось, что этот индекс имеет и предсказывающее значение у больных, которые не получали ХТ. Для определения CRIB существует удобный и простой в использовании калькулятор (https://crib-calculator. com) (доступен на сайте RUSSCO). На слайде профессора Michael Gnant (рис. 1), который был рецензентом исследований TEXT и SOFT, представлена кривая 8-летней DFS в зависимости от величины индекса CRIB (нижняя шкала). При величине индекса менее 1,5 значения 8-летней DFS выше 90%, и для больных с эти индексом показано назначение тамоксифена. При величине индекса от 1,5 до 1,99 отмечается снижение кривой ниже 90%, и этим больным целесообразно добавление ОС к тамоксифену или ингибиторам ароматазы. Для больных с индексом 2 и более кривая резко идет вниз и сигнализирует о плохом прогнозе. Для этих больных показана адъювантная химиотерапия и назначение ингибиторов ароматазы с ОС. Таким образом, CRIB представляет собой относительно объективный показатель прогноза пациентки, сбалансированный по основным факторам риска, что позволяет уменьшить степень субъективизма при выборе адъювантной терапии пременопаузальным больным гормоночувствительным HER2- РМЖ.
Abstract 506
Корейские коллеги представили свой композитный индекс для определения показания добавления ОС к тамоксифену на основании данных исследования ASTRRA. В это исследование были включены 1282 женщины в пременопаузе не старше 45 лет I-III стадией гормоночувствительного HER2- РМЖ, у которых после проведения операции и адъювантной химиотерапии сохранилась функция яичников или восстановилась в течение 2 лет. Они были рандомизированы для лечения в течение 5 лет только тамоксифеном (TAM) (только TAM), либо 5 лет TAM с ОС в течение 2 лет (TAM + OС). Первичной конечной точкой была DFS, а вторичной конечной точкой OS. Добавление ОС к тамоксифену по сравнению с тамоксифеном увеличило показатель 10-летней DFS с 75,4% до 82,8%, что соответствует достоверному снижению относительного риска прогрессирования на 32% (HR=0,68 p=0.003). Авторы провели однофакторный анализ влияние различных прогностических факторов на показатель 10-летней OS и обнаружили, что наибольшее влияние оказывают размеры первичной опухоли (<2 см vs 2 см и более), состояние подмышечных лимфоузлов (N0 vs N+), степень дифференцировки опухоли (grade 1 vs 2 vs 3). После чего они присвоили баллы и разделили все больных в группы низкого, промежуточного и высокого риска прогрессирования (табл.2,3). При анализе результатов исследования исходя из распределения по группам риска, оказалось, что достоверный выигрыш от добавления ОС имели только больные высокого риска. Таким образом, нам предлагается еще один метод оценки риска прогрессирования, на основании которого мы можем принимать решение о добавлении ОС больным с сохраненной менструальной функцией после завершения адъювантной химиотерапии. Больным с низким и промежуточным рисками следует назначить тамоксифен, при высоком риске следует добавить к тамоксифену или ингибиторам ароматазы ОС. Исследование ASTRRA также поднимает вопрос о продолжительности ОС. В этом исследовании продолжительность ОС была 2 года, в то время как в SOFT и TEXT - 5 лет, что оказывало негативное влияние на качество жизни пациенток.
Рисунок 1.
Кривая 8-летней DFS в зависимости от
величины индекса CRIB у пременопаузальных больных
гормоночувствительным РМЖ
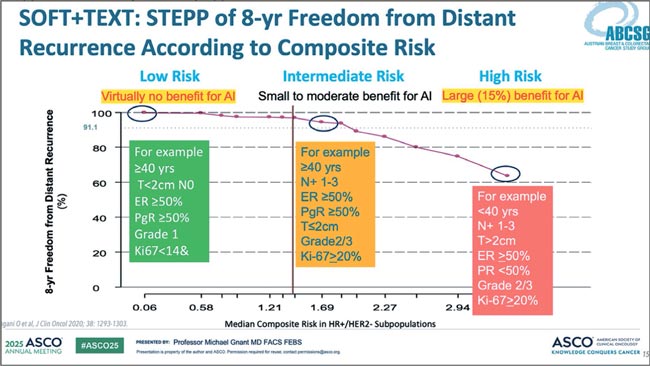
Рисунок 2.
Возможные опции адъювантной терапии
пременопаузальных больных люминальным РМЖ I-III стадий

Abstract 507
Авторы большого многоцентрового ретроспективного исследования попытались оценить влияние адъювантной гормонотерапии с добавлением ОС на результаты лечения больных с герминальными мутациями BRCA1/2. В исследование включались больные моложе 40 лет с диагностированным в период с 2000 по 2020 год с инвазивным РМЖ I-III стадии. Анализ включал пациенток с гормоночувствительным РМЖ, получавших гормональную адъювантную терапию, в том числе с включением ОС с помощью агонистов LHRH и/или двусторонней овариоэктомией. Анализ результатов включал DFS и OS. В исследовании принимали 109 центров, которые включили 1865 пациентов с гормоночувствительным РМЖ, из которых 1071 (57%) получали комбинацию ОС и гормонотерапии (35% - ингибиторы ароматазы, 65% - тамоксифен) и 794 (43%) получали только тамоксифен. Большее число пациенток, получавших ОС в сравнении с тамоксифеном только, имели метастазы в регионарные лимфоузлы (56% против 47%), получали лечение в последние годы (36% против 17%), подвергались мастэктомии (70% против 57%) и проходили тестирование на gBRCA при постановке диагноза (46% против 30%). При медиане наблюдения в 7,8 лет показатель 8-летней DFS составил 68% в группе гормонотерапии и ОС и 61% в группе только тамоксифена, что соответствует достоверному снижению относительного риска прогрессирования на 21% (HR=0,79 p=0,009). Этот же показатель в зависимости от вида гормонотерапии составил для тамоксифена 73%, для тамоксифена и ОС - 75%, для ингибиторов ароматазы и ОС - 76%. Добавление ОС к гормонотерапии увеличило показатель 8-летней OS с 85% до 89%, что соответствует достоверному снижению относительного риска смерти на 34% (HR=0,66 p=0.005). Не было выявлено значимой связи между эффективностью ОС и наличием конкретной мутации BRCA или статусом HER2. Авторы делают вывод, что в этой когорте молодых носителей герминальной мутации BRCA1/2 ОС в сочетании с гормонотерапией обеспечено улучшение показателей 8-летней DFS и OS по сравнению с тамоксифеном только. Эти результаты подтверждают важность ОС как ключевого компонента адъювантной терапии в этой популяции. Обсуждая результаты приведенных двух исследований, профессор Michael Gnant подчеркнул, что выбор адъювантного лечения пременопаузальных больных люминальным РМЖ I-III стадий должен быть индивидуальным и основанным на оценке риска прогрессирования (рис. 2). Больным с высоким риском прогрессирования (молодой возраст, grade 3, мутация BRCA1/2) назначение комбинации ингибиторов ароматы и ОС достоверно улучшает отдаленные результаты лечения.
Таблица 2.
Определение композитного риска
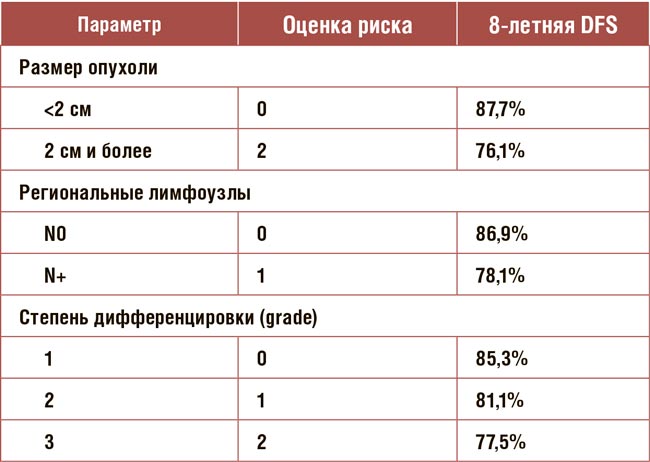
Таблица 3.
Группы риска в исследовании ASTRRA
НОВОСТИ ASCO 2025 / НОВОСТИ ASCO 2025: РАК КОЖИ
Автор: Орлова Кристина Вячеславовна
к.м.н., старший научный сотрудник отделения опухолей кожи
НМИЦ онкологии им. Н.Н. Блохина, Москва
Местнораспространенный и/или метастатический плоскоклеточный рак кожи
Все уже привыкли к тому, что в качестве терапии первой линии у пациентов этой группы (когда невозможно хирургическое лечение или радикальная лучевая терапия) целесообразно использование иммунотерапии анти-PD1. На конгрессе было представлено исследование II фазы, дизайн superiority, группа иммунотерапии анти-PDL1 авелумабом (до 24 мес. терапии) по сравнению с группой иммунотерапии антиPDL1 авелумабом в сочетании с анти-EGFR (цетуксимаб до 12 циклов). Планировалось улучшение медианы ВБП с 12 до 21 мес. Вторично – оценить ЧОО, ОВ, ВБП2. Пациенты в группе авелумаба при прогрессировании и удовлетворительном общем самочувствии могли переключаться на терапию авелумаб + цетуксимаб. Всего включено 57 пациентов: 28 в группе авелумаба в монорежиме и 29 в группе авелумаб + цетуксимаб.
Медиана ВБП в группе авелумаб + цетуксимаб – 11,1 мес. (7,6 – не достигнуто) с 24-мес. ВБП 39,7%, в группе только авелумаба – 3 мес. (2,7-13,6) с 24-мес. ВБП 23,5% (11,2- 49,2%), ОР 0,48 [0,23-0,97], р=0,018. Значимых различий при подгрупповом анализе не получено. Наилучшая ЧОО в группе авелумаба составила 28,6% (n=8), подтвержденная ЧОО (подтверждение ответа при последующем исследовании) – 21,4% (n=6; ПО-3, ЧО-3). Наилучшая ЧОО в группе авелумаб + цетуксимаб составила 37,9% (n=11), подтвержденная ЧОО (подтверждение ответа при последующем исследовании) – 27,6% (n=8; ПО-5, ЧО-3). Медиана ВБП 2 у пациентов при переходе с авелумаба на вторую линию авелумаба + цетуксимаба составила 11,3 мес. (5,8-НД). Медиана ОВ в группе авелумаба – 35,8 мес. (18,6-НД) по сравнению с не достигнутой (25,2-НД) в группе авелумаб + цетуксимаб, ОР=0,78 [0,34-1,8], р=0,279.
Переносимость:
- отмена терапии по причине НЯ – 14,3% в группе авелумаба и 31% в группе авелумаб + цетуксимаб;
- НЯ >3 ст., связанные с лечением, – 21,5% по сравнению с 48,3%.
C-POST, семиплимаб по сравнению с плацебо у пациентов с плоскоклеточным раком кожи высокого риска рецидива (экстракапсулярное распространение с самым большим узлом ≥2 см или ≥3 вовлеченных лимфатических узлов и/или наличие транзитных метастазов, Т4, PNI или рецидивная опухоль с ≥1 дополнительным критерием риска) после операции и послеоперационной лучевой терапии (≥50 Гр в течение 2-10 недель до рандомизации). Включено 415 пациентов (209/206 семиплимаб/плацебо), медиана возраста 71 год (33-95). Медиана наблюдения составила 24 мес. Основной целью была БРВ (36 мес. по гипотезе). 36-месячная БРВ в группе семиплимаба составила 83,1% по сравнению с плацебо 60,4% (ОР=0,32; 95% ДИ 0,2-0,51; р<0,0001). Преимущество было показано вне зависимости от экспрессии PD-L1, однако более выраженные различия были у пациентов с PDL1 TPS≥1 (ОР=0,28 [0,15-0,52]), при TPS<1 – ОР=0,32 [0,12-0,86]. Семиплимаб улучшил как выживаемость без локорегионарного рецидива (ОР 0,2; 95% ДИ 0,09-0,40), так и выживаемость без отдаленного прогрессирования (ОР 0,35; 95% ДИ 0,17-0,72). Общая выживаемость (data cutoff 7 апреля 2025, 33 события): значимых отличий не продемонстрировано – ОР=0,78 (95% ДИ 0,39-1,56) по сравнению с плацебо.
KEYNOTE-630, пембролизумаб по сравнению с плацебо у пациентов с ПКРК высокого риска: 1) экстракапсулярное распространение с самым большим узлом ≥2 см или ≥2 вовлеченных лимфатических узлов или 2) опухоль с двумя и более следующими признаками: ≥4 см с глубиной более 6 мм или прорастание за пределы подкожно-жировой клетчатки/PNI/низкодифференцированная или саркоматоидная морфология/рецидив/наличие сателлитов или транзитных метастазов или 3) инвазия в кортикальный слой кости после операции и послеоперационной лучевой терапии (≥45 Гр в течении 4-16 недель до рандомизации). Включено 450 пациентов (250 в группу пембролизумаба 400 мг 1 раз в 6 недель и 250 пациентов в группу плацебо). Медиана наблюдения – 28 мес. 36-месячная БРВ составила 69,4% в группе пембролизумаба по сравнению с 63,2% в группе плацебо (ОР=0,76 [0,53-1,10]; p=0,07). И интересный результат по общей выживаемости: 36-месячная ОВ в группе пембролизумаба 81,6% по сравнению с плацебо 87,1% (ОР=1,47 [0,87- 2,48]). Пища для размышлений.
НОВОСТИ ASCO 2025 / МЕТАСТАТИЧЕСКИЙ РАК МОЛОЧНОЙ ЖЕЛЕЗЫ
Автор: Тюляндин Сергей Алексеевич
Заслуженный деятель науки РФ, главный научный сотрудник
отделения противоопухолевой лекарственной терапии
№2 ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России,
член правления RUSSCO, профессор, доктор медицинских наук,
Москва
В этом году ASCO было богатым на исследования, изучающие новые противоопухолевые препараты и комбинации для лечения метастатического рака молочной железы (РМЖ). Несколько исследований было посвящено поиску новых лекарств при развитии резистентности после лечения ингибиторами ароматазы отдельно или в комбинации с ингибиторами циклинзависимых киназ 4/6 (CDK4/6).
Исследование VERITAC-2 (abstract LBA1000)
Примерно у 40–50% больных резистентность к эндокринной терапии обусловлена приобретенными активирующими мутациями гена ESR1. В результате этого происходит независимая от наличия эстрогенов активация рецептора и его сигнального пути, который стимулирует пролиферацию опухолевых клеток. Считается, что в этом случае преодолеть возникшую резистентность можно путем разрушения рецептора эстрогенов с помощью SERD (селективные дегрейдеры рецептора эстрогенов). К ним относится эласцентрант и доступный в наших клиниках фулвестрант, которые обладают скромной эффективностью у мутированных пациенток с прогрессированием заболевания с медианой продолжительности жизни до прогрессирования (PFS) около 4 мес., что подчеркивает потребность в поиске новых боле эффективных препаратов. Вепдегестрант по механизму действия относится к SERD, и в рамках рандомизированного исследования 3 фазы VERITAC-2 были предварительно оценены его эффективность и токсичность в сравнении с фулвестрантом у больных с гормоночувствительным РМЖ с прогрессированием после приема CDK4/6 ингибиторов в сочетании ингибиторами ароматазы. В исследование включались больные метастатическим гормоночувствительным (ER+/HER2-) РМЖ, ранее получившие не более 2 линий гормонотерапии с обязательным включением ингибиторов ароматазы и CDK4/6, пациенты с предшествующей химиотерапией для лечения метастатической болезни были исключены. Рандомизация проводилась в группу вепдегестранта 200 мг перорально один раз в день непрерывно или фулвестранта 500 мг внутримышечно (дни 1 и 15 цикла 1; день 1 последующих циклов), лечение проводили до признаков прогрессирования или непереносимой токсичности. Пациенты были стратифицированы по статусу мутации ESR1 и наличию висцерального заболевания. Первичной конечной точкой была выживаемость без прогрессирования (PFS) у пациентов с мутациями ESR1 (mESR1) и всех включенных пациентов. Общая выживаемость (OS) и токсичность были вторичными конечными точками. В исследование было включено 624 больных с медианой возраста 60 лет, у 43% в опухоли определялся mESR1 и у 63% диагностированы метастазы в висцеральные органы. В группе больных с mESR1 вепдегестрант увеличил медиану времени до прогрессирования с 2,1 мес. в группе фулвестранта до 5 мес. (HR=0.57, P= .0001), и частоту объективного противоопухолевого ответа с 4% до 19%. В группе больных без мутации не отмечено разницы в результатах лечения между вепдегестрантом и фулвестрантом: PFS 3,7 мес. и 3,6 мес. соответственно. Вепдегестрант обладает хорошей переносимостью, основными побочными эффектами препарата были слабость, повышение печеночных ферментов и тошнота. Лечение вепдегестрантом по причине токсичности было отменено у 2,9% больных. Короткое время наблюдения пока не позволяет оценить общую продолжительность жизни. Авторы делают вывод, что вепдегестрант является потенциальным вариантом перорального лечения для ранее леченных пациентов с наличием мутации ESR1 ER+/ HER2- метастатического РМЖ.
Исследование INAVO (abstract 1003)
Еще одним механизмом резистентности гормоночувствительного РМЖ, встречаемый с частотой примерно 30%, является мутация гена PIK3CA, который кодирует белок передатчик PI3K одноименного сигнального пути, контролирующий пролиферацию и инвазию опухолевых клеток. Алпелисиб – первый селективный ингибитор PI3K зарегистрированный для лечения больных с мутацией PIK3CA. Основной проблемой использования алпелисиба в клинике является гипергликемия, обусловленная нарушением метаболизма глюкозы, который также регулируется сигнальным путем PI3K/ AKT/mTOR. На конгрессе были представлены окончательные результаты рандомизированного исследования INAVO-120, которое изучало эффективность и токсичность нового ингибитора PI3K инаволесиба в комбинации с палбоциклибом и фулвестрантом в сравнении палбоциклибом и фулвестрантом у больных ER+/ HER2- метастатическим РМЖ с мутацией PIK3CA. Пациенты в рамках 4-х недельного цикла получали инаволисиб 9 мг перорально ежедневно, палбоциклиб 125 мг 3 недели, одна неделя перерыв, фулвестрант 500 мг в/м цикл 1, дни 1 и 15, затем каждые 4 недели. Лечение проводили до прогрессирования или непереносимой токсичности. В этом сообщении приводится окончательный анализ PFS и общей выживаемости (OS), а также данные об эффективности и безопасности. В исследование было включено 325 больных, медиана наблюдения которых составила 32 мес. Обновленная медиана PFS составила 17,2 мес. в группе инаволесиба и 7,3 мес. в группе палбоциклиб + фулвестрант, что соответствует уменьшению относительного риска прогрессирования на 58% (НR=0,42). Медиана OS составила 34,0 мес. и 27,0 мес., что соответствует достоверному снижению относительного риска смерти на 35% (HR=0,67; 0,48–0,94; p = 0,0190) в группе инаволисиба. Выигрыш от назначения инаволисиба наблюдался во всех анализируемых подгруппах. Частота объективного противоопухолевого эффекта составила 62,7% в группе инаволисиба и 28,0% в группе палбоциклиба и фулвестранта (p<0,0001). Медиана время до химиотерапии составила 35,6 мес. и 12,6 мес. соответственно. У 90,7% пациентов в группе инаволисиба и у 84,7% пациентов в группе палбоциклиба и фулвестранта наблюдались нежелательные явления 3-4 степени. Лечение комбинацией с включением инаволисиба сопровождалось развитием нейтропении, стоматита, диареи, кожной сыпи и сухостью роговицы. Основной токсичностью инаволисиба, как и другого представителя этой группы алпелисиба, является гипергликемия, которая наблюдалась у 63% больных и явилась поводом назначения антидиабетических препаратов. Из них у 6,8% пациенток зарегистрирована гипергликемия 3-4 степени, что потребовало отмены препарата. Авторы делают вывод, что инаволисиб в комбинации с палбоциклибом и фулвестрантом продемонстрировали статистически и клинически значимое преимущество PFS и OS по сравнению с комбинацией палбоциклибом и фулвестрантом. При более длительном наблюдении не было отмечено новых изменений в профиле безопасности препарата, получено подтверждение его относительно хорошей переносимости и управляемой токсичности, о чем свидетельствует единичные больные, прекратившие лечение инаволисибом в связи с токсичностью.
Исследование АКТ ингибитора ипатосертиба (abstract LBA1005)
Еще одним способом прервать пролиферативную и прометастатическую активность сигнального пути PI3K/AKT/mTOR может быть ингибирование киназы АКТ с помощью селективных ингибиторов, таких как капивасертиб или ипатасертиб. На ASCO было представлено рандомизированное исследование III фазы комбинации фулвестранта и ипатасертиба в сравнении с фулвестрантом в качестве лечения 250 больных метастатическим ER+/ HER2- РМЖ после прогрессирования на первой линии комбинацией ингибиторов ароматазы и CDK4/6. При медиане наблюдения 15,2 мес. добавление ипатасертиба к фулвестранту в сравнении с фулвестрантом увеличило медиану PFS c 1,9 мес. до 5,3 мес., что соответствует достоверному снижению относительного риска прогрессирования на 39% (HR=0,61; p= 0,0007). У больных с наличием активации сигнального пути PI3K/ AKT/mTOR вследствие мутаций в генах PIK3CA или AKT или делеции гена PTEN (44% включенных в исследование больных) медиана PFS составила 1,9 мес. и 5,4 мес., что соответствует снижению относительного риска прогрессирования на 53% (HR=0,47; p=0.005). Эффективность ипатасертиба не зависела от наличия или отсутствия мутации в гене ESR1. Частота побочных эффектов 3-4 степени в группе комбинации ипатасертиба и фулвестранта в сравнении с фулвестрантом составила 37,1 % против 27,4% соответственно, в том числе диарея 16% против 0%, утомляемость 3% против 0%, рвота 2% против 0%, сыпь 2% против 0%. Прекращение терапии в связи с побочными эффектами потребовалось 6,5% больных в группе ипатасертиба и 0,8% в группе фулвестранта. Авторы делают вывод, что комбинация ипатасертиба и фулвестранта значительно продлевает PFS по сравнению с фулвестрантом у пациентов с ER+/ HER2- РМЖ после прогрессирования на 1-й линии гормонотерапии.
Исследование SERENA-6 (LBA4)
На главной Пленарной сессии ASCO был представлен доклад, посвященный новому препарату из группы SERD камизестранту больным метастатическим гормоночувствительным раком молочной железы (РМЖ) в первой линии гормонотерапии. Обычно в этой линии лечения больные с этим фенотипом опухоли получают ингибиторы ароматазы в комбинации с ингибиторами CDK4/6. Доказано, что примерно у 40 пациентов прогрессирование процесса обусловлено приобретенными мутациями гена ESR1. В исследовании SERENA-6 исследователи пытались определить может ли раннее переключение на камизестрант при обнаружении мутации ESR1 без клинических признаков прогрессирования увеличить продолжительность первой линии гормонотерапии. Для этого при лечении 3256 больных метастатическим ER+/HER2- РМЖ, которые получали первую линию гормонотерапии комбинацией ингибиторов ароматазы и CDK4/6, после 6 месяцев лечения каждые 2-3 месяца определяли наличие циркулирующей опухолевой ДНК с мутацией в гене ESR1. Больные с появившейся мутацией ESR1 в циркулирующей опухолевой ДНК рандомизировались в группу продолжения гормонотерапии (контроль) или переключались на прием камизестранта в комбинации с CDK4/6 ингибитором. Всего было рандомизировано 315 больных, медиана времени до прогрессирования от момента рандомизации составила 16 мес. в группе камизестранта и 9,2 мес. в контроле, что соответствует снижению относительного риска прогрессирования на 56% (HR=0,44 p<0.0001). Ранний переход на камизестрант сопровождался также увеличением медианы времени до клинического ухудшения с 6,4 мес. до 23 мес. Лечение камизестрантом в сочетании с СDK4/6 ингибиторами хорошо переносилось, и отмена вследствие токсичности потребовалась только 2 (1,3%) пациенткам. Авторы делают вывод, что раннее переключение на камизестрант в случае появления мутации ESR1 в опухолевых клетках увеличивает продолжительность времени до прогрессирования первой линии гормонотерапии в сравнении с продолжением лечения ингибиторами ароматазы. Они представляют данное исследование как модель для последующих исследований, где появление мутации резистентности будет поводом для раннего изменения терапии с выбором препарата эффективного при данном механизме резистентности. Не отрицая перспективность данного подхода, следует отметить неадекватный задачам дизайн исследования, в частности выбор в качестве основной конечной точки PFS. Более правильным было бы сравнение PFS2, так как в экспериментальной группе больные формально получили 2 линии гормонотерапии, в то время как в контроле только одну. Кроме того, PFS2 в большей степени чем PFS1 коррелирует с OS. При этом больные контрольной группы в случае клинического прогрессирования на комбинации ингибиторов ароматазы и CDK4/6 должны были бы получать в качестве второй линии комбинацию камизестранта с ингибиторами CDK4/6, но настоящим протоколом кроссовер не предусмотрен. Авторы обязались представить сведения о второй линии терапии, которую получали больные в контроле при прогрессировании. Возможно, большая часть из них будет получать SERD, что позволит хоть как-нибудь сравнить PFS2. Следует так же отметить, что в контроле клиническое прогрессирование болезни наблюдали в среднем через 9 мес. после обнаружения мутации ESR1. Это существенный интервал, который может уравнять PFS2 в контроле и PFS2 в группе раннего перехода на камизестрант. Будем следить за дальнейшим ходом исследования, в котором авторы обещают представить данные о PFS2 и общей выживаемости. DESTINY Breast09 (LBA1008) Для больных HER2-позитивным метастатическим РМЖ важнейшим событием было представление предварительных результатов исследования трастузумаб дерукстекана (T-DXd) в первой линии терапии. После исследования CLEOPATRA этим больным в первой линии назначаются таксаны (доцетаксел или паклитаксел) в комбинации с двойной анти-HER2 блокадой трастузумабом и пертузумабом (THP). Эта комбинация обеспечивала медиану PFS 18 месяцев. Рандомизированное исследование III фазы DESTINY-Breast09 оценивало эффективность и безопасность T-DXd в монотерапии, T-DXd в комбинации с пертузумабом в сравнении с THP у 1157 пациентов с HER2+ метастатическим РМЖ. В исследование включались больные de novo метастатическим РМЖ или с прогрессированием через 6 и более месяцев после окончания адъювантной анти-HER2 терапии операбельной опухоли. Стратификационными факторами при рандомизации были de-novo против рецидивирующего заболевания, HR+ vs HR- и наличие или отсутствие мутации PIK3CA. Доза T-DXd составляла 5,4 мг/кг каждые 3 нед., в комбинации THP использовали паклитаксел 80 мг/м2 еженедельно или доцетаксел 75 мг/м2 каждые 3 нед. Анти-HER2 препараты назначали в стандартных дозах. Лечение проводили каждые 3 недели до признаков прогрессирования или непереносимой токсичности. Основным критерием эффективности была PFS, вторичными OS и токсичность. В представленном докладе анализировались данные PFS для комбинации T-DXd и пертузумаба в сравнении с THP. В эти две группы больных было включено 770 больных с медианой возраста 54 года, de-novo РМЖ был у 52%, гормоночувствительный РМЖ определялся у 54%, а мутация PIK3CA - у 31% больных. Висцеральные метастазы и метастазы в головной мозг диагностированы у 71% и 6% пациенток соответственно. При медиане наблюдения 29 мес. медиана PFS составила 40,7 мес. в группе T-DXd-пертузумаб и 20,7 мес. в группе THP, что соответствует достоверному снижению относительного риска прогрессирования на 51% (HR=0,49 p<0.00001). Выигрыш в увеличении PFS наблюдали во всех анализируемых подгруппах больных, в том числе и в зависимости от стратификационных факторов. Частота объективных эффектов в группе T-DXd-пертузумаб составила 85,1%, из них 15% полные, и 79%, из них 8,5% полные, в группе THP. Медиана продолжительности ответа составила 39 мес. и 26 мес. соответственно. Нежелательные явления 3-4 степени, обусловленные проводимой терапией, наблюдались у 54,9% и 52,4% больных в группах T-DXd-пертузумаб и THP соответственно. Основными проявлениями токсичности любой степени были тошнота (71% T-DXdпертузумаб vs 29% THP), диарея (56% vs 54%), нейтропения (49%а vs 46%), слабость (46% vs 35%), рвота (42% vs 13%). Основным опасным для жизни осложнением T-DXd является развитие интерстициальной пневмонии, которая диагностирована в этом исследовании у 46 (12,1%) больных, из них у 2 (0,5%) пациенток стало причиной летального исхода. Отмена препарата в связи с токсичностью, прерывание лечения, редукция дозы были необходимы у 21% vs 25%, 69% vs 49%, 46% vs 20% больных в группе T-DXdпертузумаб и THP соответственно. Авторы делают вывод, что предварительные данные свидетельствуют о статистически достоверном и значимом увеличении медианы PFS по сравнению с THP во всей популяции включенных в исследование больных. Комбинация T-DXd и пертузумаба может считаться новым стандартом первой линии терапии при метастатическом HER2+ РМЖ.
Исследование 3 ASCENT-04/ KEYNOTE-D19 (LBA109)
У 40% больных метастатическим тройным негативным фенотипом РМЖ на этапе метастазирования выявляется экспрессия PD-L1 в опухоли. Для этих пациентов показано назначение комбинации пембролизумаба и химиотерапии, которая способна обеспечить PFS в диапазоне 7,5-9,7 мес. Практически все больные прогрессируют после прекращения этой терапии и только 50% из них получают вторую линии лечения. Все это обуславливает актуальность поиска более эффективной первой линии терапии. Ранее конъюгат моноклонального антитела к рецептору Trop-2, экспрессируемому на мембране клеток тройного негативного РМЖ, и ингибитора топоизомеразы говитекана - сацитузумаб говитекан (SG) продемонстрировал свою эффективность у больных с опухолью этого фенотипа, прогрессирующих после ранее проведенной химиотерапии. В данном рандомизированном исследовании III фазы проводится сравнение эффективности и токсичности комбинации SG (SG 10 мг/кг 1, 8 дни каждые 3 недели) и пембролизумаба (200 мг каждые 3 недели) в сравнении с комбинацией химиотерапии по выбору врача (паклитаксел или наб-паклитаксел, гемцитабин+карбоплатин) и пембролизумаба а качестве первой линии терапии у больных с PD-L1+ (CPS >10) тройным негативным РМЖ de novo или с рецидивом, возникшим через 6 мес. и более 6 мес. после окончания неоадъювантной химиотерапии по поводу операбельного процесса. Основным критерием эффективности была PFS. В исследование было включено 443 пациентки, de novo РМЖ был диагностирован у 34% из них. В контрольной группе 52% больных получали таксаны и 48% комбинацию гемцитабина и карбоплатина. При медиане наблюдения 14 мес. медиана PFS составила 11,2 мес. в группе SG-пембролизумаб и 7,8 мес. в группе химиотерапия-пембролизумаб, что соответствует достоверному уменьшению относительного риска прогрессирования на 35% (HR=0,65, p<0,001). Одногодичная PFS составила 48% и 36% соответственно. Выигрыш от использования комбинации SG-пембролизумаб наблюдался во всех анализируемых подгруппах. Частота объективного противоопухолевого ответа составила 60% (из них полный у 13%) в группе SG-пембролизумаб против 53% (из них у 8 % полный) в группе химиотерапия-пембролизумаб. Наиболее частыми (более 10% пациентов) нежелательными явлениями 3-4 степени, возникшими во время лечения SG-пембролизумабом, были нейтропения (43%) и диарея (10%), а при химиотерапии -пембролизумаб нейтропения (45%), анемия (16%) и тромбоцитопения (14%). Отмена терапии по причине токсичности произведена у 12% и 31% больных соответственно. Авторы сделали вывод, что комбинация SG-пембролизумаб, продемонстрировав лучшую переносимость лечения, обеспечила статистически и клинически значимое увеличение PFS по сравнению с химиотерапией-пембролизумаб у пациентов с PD-L1–положительным тройным негативным РМЖ в качестве первой линии терапии метастатического процесса.
НОВОСТИ ASCO 2025 / РАК ЛЕГКОГО
Автор: Гречухина Катерина Сергеевна
Заведующая химиотерапевтическим отделением
ГБУЗ «Московский клинический научный центр им. А.С. Логинова»,
кандидат медицинских наук, Москва
Мелкоклеточный рак легкого
(МРЛ) традиционно характеризуется ограниченными терапевтическими возможностями и, как следствие, зачастую бывает обделен вниманием в обзорах новостей. Тем не менее, на конференции ASCO 2025 были представлены несколько перспективных подходов, направленных на оптимизацию лечения МРЛ на различных стадиях заболевания.
Начнем с местнораспространенных форм МРЛ. Известны результаты исследования ADRIATIC, когда проведение консолидирующей иммунотерапии дурвалумабом после ХЛТ позволило добиться успеха у пациентов с местнораспространенным МРЛ. Учитывая успех атезолизумаба в первой линии лечения, было любопытно оценить его роль именно в качестве консолидирующей терапии. Были представлены результаты исследования 2 фазы, которое было посвящено именно этому [1]. Пациенты, у которых не было отмечено признаков прогрессирования после ХЛТ, рандомизировались либо в группу атезолизумаба, либо в группу наблюдения. ЧОО была сопоставима в обеих группах (атезо – 95%, наблюдение – 94%). При медиане наблюдения 45,1 мес. (95% ДИ 40,7-47,3) мОВ составила 43,3 мес. (95% ДИ 25,1-51,2) в группе атезолизумаба и 38,8 мес. (95% ДИ 25,8-NR) в группе наблюдения (HR 1,14; 95% ДИ 0,76-1,72; p=0,5). Медиана ВБП была 21,1 мес. (95% ДИ 9,5-43,4) и 15,9 мес. (95% ДИ 10,6- 23,2) соответственно (HR 0,88; 95% ДИ 0,60-1,28, p=0,5). К сожалению, консолидирующая терапия атезолизумабом после ХЛТ не улучшила ни общую выживаемость, ни выживаемость без прогрессирования у пациентов с ограниченной стадией МРЛ.
Рассмотрим далее распространенные формы МРЛ и опции его лечения. DeLLphi-304: тарлатамаб против химиотерапии во второй линии лечения МРЛ. На ASCO 2025 были представлены результаты исследования DeLLphi-304, в котором сравнивали тарлатамаб и стандартную химиотерапию во второй линии терапии у пациентов с МРЛ, прогрессировавших после платиносодержащего режима [2]. Напомним, что тарлатамаб – биспецифическое антитело, направленное на DLL3, экспрессируемый опухолевыми клетками, и CD3 на Т-лимфоцитах, тем самым активирующее клеточный иммунный ответ. В контрольной группе использовалась химиотерапия по выбору врача – топотекан, антрациклины или лурбинектидин. Результаты обнадеживающие: тарлатамаб обеспечил прирост общей выживаемости – 13,6 мес. против 8,3 мес. на химиотерапии (рис.1), при этом преимущество наблюдалось в большинстве подгрупп. Статистика говорит «да», хотя выживаемость без прогрессирования выглядит скромнее: 4,2 против 3,2 мес. (рис.2).
Рисунок 1.
Медиана ОВ в исследовании DeLLphi-304
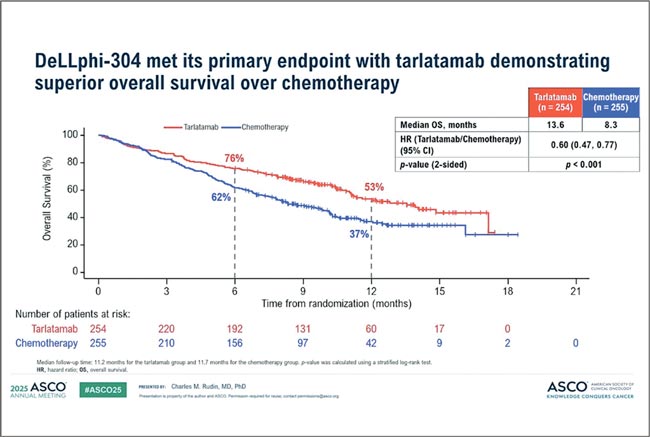
Рисунок 2.
Медиана ВБП в исследовании DeLLphi-304
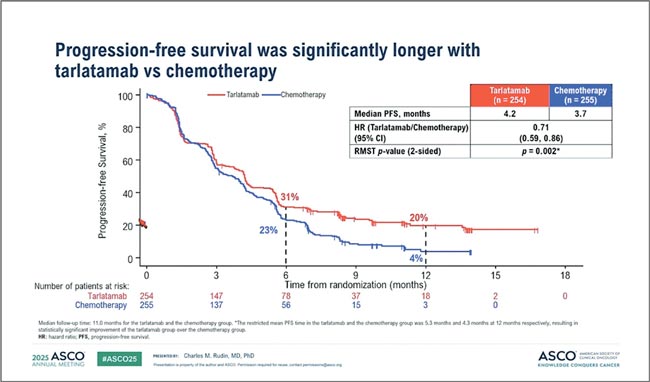
Тем не менее, для второй линии при МРЛ – уже событие. Отдельного внимания заслуживает профиль безопасности тарлатамаба: синдром высвобождения цитокинов отмечался чаще, чем обычно ожидается в терапии МРЛ. Так, реакция 1 степени наблюдалась у 42% пациентов, 2 степени – у 13%, а тяжелые проявления (3 степень) – у 1%. IMforte: комбинированная поддерживающая терапия при мелкоклеточном раке легкого (МРЛ) – лубринектидин и атезолизумаб [3]. В этом исследовании пациенты с мелкоклеточным раком легкого, не продемонстрировавшие прогрессирования после четырех циклов химиотерапии по схеме ЕС в комбинации с атезолизумабом, были рандомизированы на поддерживающую терапию: атезолизумаб в монотерапии или в сочетании с лубринектидином. При медиане наблюдения 15 месяцев комбинированный подход продемонстрировал убедительное преимущество по выживаемости без прогрессирования: медиана ВБП была достоверно выше, а отношение рисков составило 0,49 (p<0,0001) (рис.3).
Рисунок 3.
Медиана ВБП в исследовании IMforte

Рисунок 4.
Медиана ОВ в исследовании IMforte
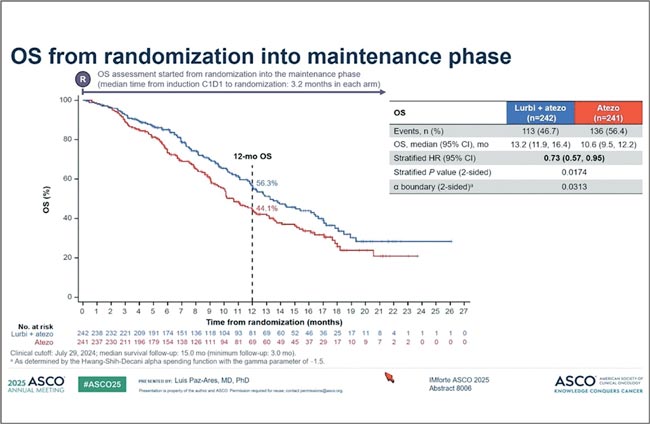
Что особенно приятно – эффект проявился и в общей выживаемости: HR 0,73, p=0,0174 (рис.4). Не рекорд, но вполне убедительно. Однако возникает закономерный вопрос: а насколько атезолизумаб вообще критичен в такой стратегии, если мы говорим о пациентах без признаков прогрессирования?
Еще одно исследование, которое оценивало комбинацию лурбинектидина и атезолизумаба, но в рамках 2-й линии при МРЛ – 2SMALL [4]. Есть ли смысл добавлять иммунотерапию ко второй линии? При этом дизайн исследования предлагал добавление иммунотерапии и тем пациентам, которые получили ее в рамках первой линии (две когорты: наивная к иммунотерапии и предлеченная). Характеристики пациентов представлены на рисунке 5. Частота объективного ответа составила 40% и при этом не зависела от применения ингибиторов иммунных контрольных точек в анамнезе (рис.6), а мВБП составила привычные для 2 линии МРЛ 4 месяца. Нежелательные явления отмечены у 91% пациентов. Таким образом, на ASCO 2025 было представлено несколько любопытных исследований, которые пытаются найти разнообразные подходы к комбинации или перемещению существующих опций, но и также изучают новые препараты, в том числе новейшие биспецифики. Увы, вновь без вау-эффекта, но тем не менее…
Рисунок 5.
Характеристики пациентов в исследовании 2SMALL
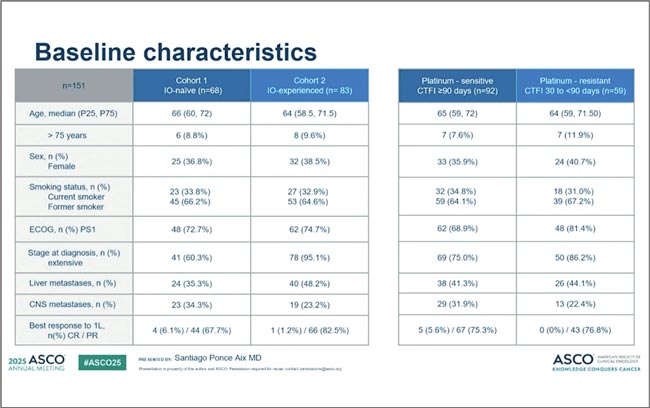
Рисунок 6.
ЧОО в исследовании 2SMALL
Источники:
- Bjorn Henning Gronberg, et al. Randomized phase II trial investigating whether atezolizumab after chemoradiotherapy (CRT) prolongs survival in limited stage (LS) small cell lung cancer (SCLC). JCO. 2025; 43: LBA8005.
- Charles M. Rudin, et al. Tarlatamab versus chemotherapy (CTx) as secondline (2L) treatment for small cell lung cancer (SCLC): Primary analysis of Ph3 DeLLphi-304. JCO. 2025; 43: LBA8008.
- Luis G. Paz-Ares, et al. Lurbinectedin (lurbi) + atezolizumab (atezo) as firstline (1L) maintenance treatment (tx) in patients (pts) with extensive-stage small cell lung cancer (ES-SCLC): Primary results of the phase 3 IMforte trial. JCO. 2025; 43: 8006.
- Santiago Ponce Aix, et al. Safety and efficacy of lurbinectedin plus atezolizumab as second-line treatment for advanced small-cell lung cancer: Results of the 2SMALL phase 1/2 study (NCT04253145). JCO. 2025; 43: 8013.
Немелкоклеточный рак легкого
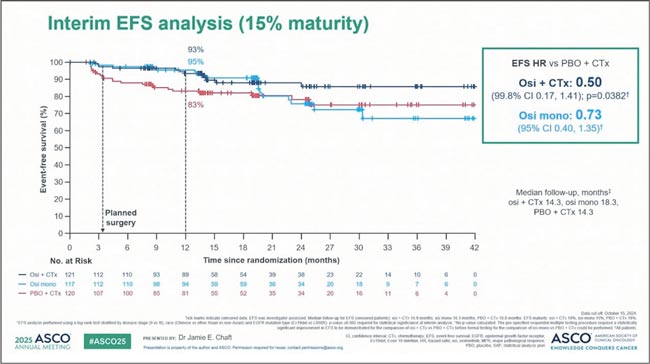
Традиционно конгресс ASCO характеризируется большим количеством новостей в лечении немелкоклеточного рака легкого. Попробуем разобраться в наиболее значимых опциях: от неоадъюванта до новых конъюгатов в метастатических формах. NeoADAURA: как насчет неоадъювантного осимертиниба [1]? В этом исследовании 3 фазы изучали неоадъювантное применение осимертиниба (Оси) ± химиотерапии у пациентов с резектабельным EGFR-мутированным НМРЛ II–IIIB стадий. В качестве первичной конечной точки использовали выраженный патоморфоз (MPR). Хирургическое лечение удалось выполнить чаще в группах, получавших таргетную терапию: на 8% выше в группе монотерапии осимертинибом и на 5% выше в группе Оси+ХТ по сравнению с группой только химиотерапии. Частота MPR составила 26% в группе Оси, 25% в Оси+ХТ и крошечные 2% при применении одной ХТ — результат, наводящий на грустные размышления (в том числе и об этичности использования только химиотерапии при малой чувствительности этой формы EGFR-mut НМРЛ к ней), что показано на рисунке 1. При первом промежуточном анализе (15% событий) бессобытийная выживаемость (EFS) не демонстрировала статистически значимых различий (рис. 2), и, вероятнее всего, не продемонстрирует — 80% пациентов в любом случае получали осимертиниб в адъюванте. Хороший вопрос: нужен ли всем неоадъювантный Оси, или можно ограничиться адъювантным применением? Ответа NeoADAURA не даст. Но коечто становится очевидным: химиотерапия при EGFR+ опухолях, даже в комбинации, даже при IIIB стадии, не выглядит необходимой. Двигаемся дальше по волнам неоадъювантной таргетной терапии. Представлена результаты исследования II фазы ALNEO - очередной шаг в сторону персонализированной неоадъвантной терапии. Пациенты с потенциально резектабельным ALK+ НМРЛ III стадии получали 2 курса алектиниба (8 недель) до операции, а затем — адъювантный курс длиной почти два года (96 недель) [2].
Рисунок 1.
Частота MPR в исследовании NeoADAURA
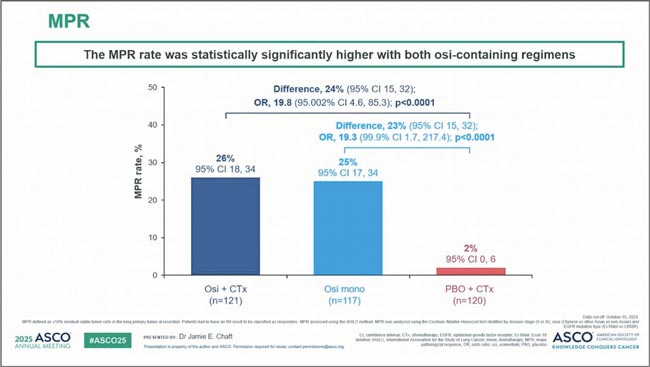
Рисунок 2.
Бессобытийная выживаемость в исследовании
NeoADAURA
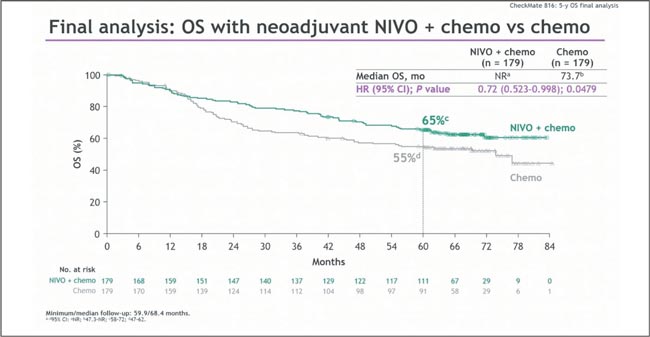
Всего в исследование включено 33 пациента (64% — стадия IIIA, 36% — IIIB). Неоадъювантную терапию прошли все. Радикальное удаление опухоли (R0) удалось выполнить у 86%, MPR достигнут в 46% случаев, pCR — в 12%. Что важно — 94% пациентов живы при медиане наблюдения 15,2 месяца, прогрессирование зарегистрировано у 18% (рис. 3). Впечатляет и оставляет надежду. Еще одно «неоадъювантно-периоперационное» исследование CheckMate 816 - комбинация ниволумаба с 3 курсами химиотерапии в качестве предоперационного этапа лечения резектабельного НМРЛ IB (≥4 см)–IIIA стадии значимо улучшило бессобытийную выживаемость. Но насколько это транслируется в увеличение медианы общей выживаемости? При медиане наблюдения 68 месяцев химиоиммунотерапия продемонстрировала значимое преимущество — мОВ не достигнута против 73,7 месяцев (HR 0,72, p=0,0479), а 5-летняя выживаемость выросла на 10%, рис. 4 [3].
Рисунок 3.
ЧОО и выживаемость в исследовании ALNEO
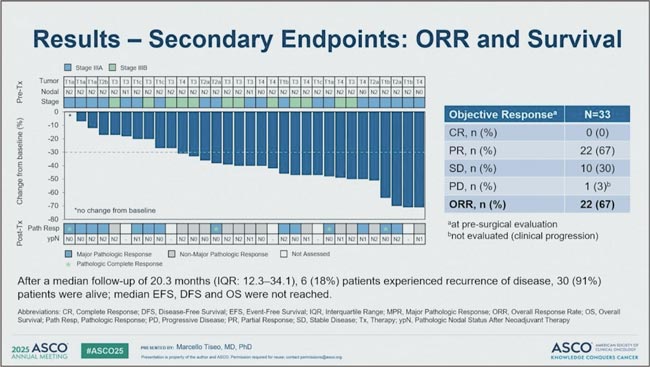
Рисунок 4.
Медиана ОВ в результате исследования CheckMate
816
NeoADAURA
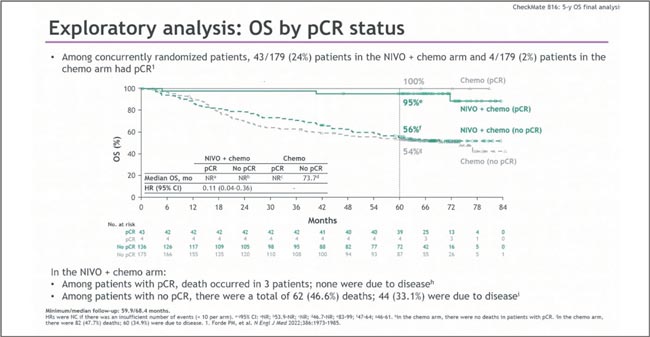
У пациентов с полным морфологическим ответом выживаемость впечатляющая. При этом в PD-L1- негативной когорте эффект был скромнее (HR 0,89, рис.8), особенно с цисплатин-содержащей ХТ — тут, видимо, работает не магия, а механизмы устойчивости. У пациентов с полным морфологическим ответом выживаемость впечатляющая: 95% в группе химиоиммунотерапии на пятилетнем срезе, в то время как у недостигших pCR – 56% (рис. 6).
Рисунок 5.
Медиана ОВ в зависимости от уровня экспрессии
PD-L1 в исследовании CheckMate 816
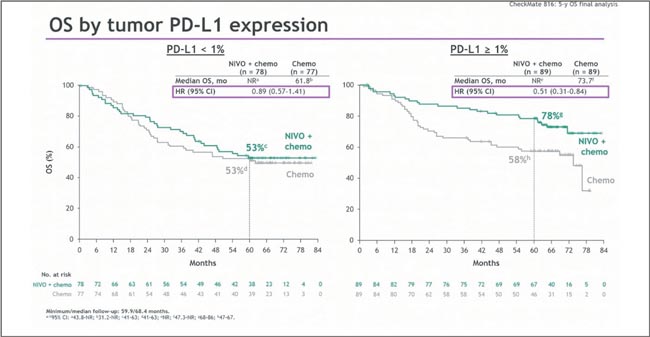
Рисунок 6.
Медиана ОВ в зависимости от достижения pCR в
исследовании CheckMate 816
816
NeoADAURA
Ну и как сейчас модно и актуально — оценили цоДНК и показали, что клиренс чаще наблюдался в группе ниволумаба. Еще одно иммунотерапевтическое исследование в периоперационной терапии: CheckMate 77T - периоперационное применение ниволумаба (нео + адъювант) против плацебо у пациентов с резектабельным НМРЛ [4]. При медиане наблюдения 41 месяц EFS оставалась выше в группе ниволумаба (HR 0,61): 30-месячная ВБП — 61% против 43% (при этом разница в основном обеспечивалась пациентами с PD-L1 TPS >50%). Показатель цоДНК опять оказался полезным — его клиренс чаще встречался в группе ниволумаба. А вот по мОВ значимых различий пока нет (HR 0,85). Перейдем к исследованиям с включением радиотерапии. Часть пациентов, которым невозможно проведение хирургического лечения, проходит лучевое лечение, как вариант – SBRT. Можем ли мы как-то эскалировать ее эффект? В исследовании SWOG/NRG S1914 пытались усилить эффект SBRT у пациентов с ранним НМРЛ, добавляя атезолизумаб [5]. Пациенты (T1–T3N0M0, ≤7 см + фактор риска) были рандомизированы на SBRT с или без атезолизумаба. Но увы — исследование завершили досрочно: ни по мОВ (HR=1,15), ни по БРВ (HR=1,35) добавление атезолизумаба преимущество не дало (рис. 8).
Рисунок 7.
Бессобытийная выживаемость в исследовании
CheckMate 77T
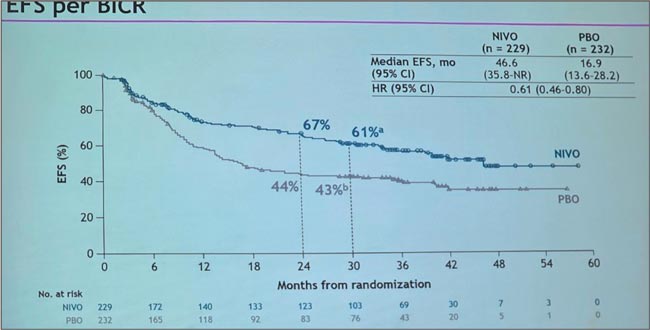
Рисунок 8.
Результаты исследования SWOG/NRG S1914
816
NeoADAURA
Когда хирургия невозможна, а лучевая терапия откладывается из-за слишком большого масштаба бедствия, на помощь может прийти индукционная химиоиммунотерапия. В исследовании InTRist изучали эффективность либо химиоиммунотерапии (торипалимаб + ХТ, далее консолидирующий торипалимаб, т.е. по аналогии с уже валидированной опцией дурвалумаба) в сравнении только с ХТ перед ХЛТ у пациентов с III стадией НМРЛ (без EGFR/ALK мутаций, с опухолью ≥5 см или лимфоузлами ≥2 см) [6]. Получили значимое улучшением мВБП (HR 0,25, p=0,034, рис. 9), частота объективных ответов — 77,8% против 40%. Двигаемся дальше, к метастатическим опциям. Один из золотых надежных стандартов терапии плоскоклеточного рака – комбинация иммунотерапии с платиносодержащими цитостатиками. Антиангиогенные препараты, вопервых, демонстрировали крайне ограниченную эффективность, а во-вторых, приводили к более значимой частоте фатальных нежелательных явлений. В исследовании R-ALPS/TQB2450-III-12 китайские коллеги сравнили две комбинации у 565 пациентов с плоскоклеточным НМРЛ 1 линии: бенмелстобарт (очень непривычное название анти-PD-1 препарата) + химиотерапия + анлотиниб (тирозинкиназный антиангиогенный препарат) против тислелизумаба + ХТ [7]. В плане мВБП победа за тройной комбинацией: 10,12 против 7,79 месяцев (HR 0,64, p = 0,0038, рис. 10), частота объективного ответа — 71% против 65%. Однако данных по мОВ пока нет, будем ждать с нетерпением. Одним из важных биомаркеров при лечении распространенного мНМРЛ является определение мутаций в гене KRAS. Уже изучено применение соторасиба или адаграсиба у пациентов с мутацией G12C, сегодня исследуются и следующие поколения ингибиторов KRAS G12C.
Рисунок 9.
Медиана ВБП в исследовании InTRist
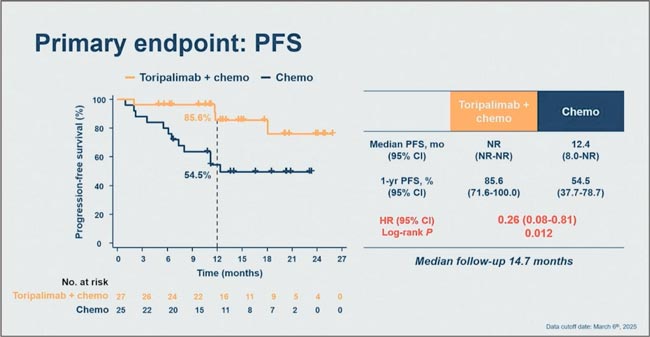
Рисунок 10.
Медиана ВБП в исследовании R-ALPS/TQB2450-
III-12
Ранее были представлены обнадеживающие результаты исследования 2 фазы KRYSTAL-7, которое изучало эффективность комбинации адаграсиба с пембролизумабом у пациентов с уровнем экспрессии PD-L1 не менее 50% [8]. На ASCO 2025 представили обновленные данные выживаемости пациентов. При медиане наблюдения в 22,8 месяцев мВБП составила 11,0 мес (95% CI: 5,8–14,0), мОВ — 18,3 мес (95% CI: 14,3– НД), а 18-месячная ОВ достигла 51,8%. ЧОО составила 44.3% (95% CI: 36,2–52,7) при медиане длительности ответа в 26,3 месяцев. Очень многообещающе! В исследовании 2 фазы новый KRAS G12C ингибитор сосимерасиб продемонстрировал частоту ответа 52,4% [9]. Медиана ВБП — 7,2 мес, медиана наблюдения — 6,8 мес. Частота нежелательных явлений тоже немаленькая: 3–4 степень наблюдалась у 40%. И хотя это только вторая фаза, направление многообещающее, особенно в комбинации с иммунотерапией. Конечно же, не обошлось без конъюгатов! -TROPION-Lung02: датопотомаб-дерукстекан (Dato-DXd) + пембролизумаб ± платиносодержащая химиотерапия в первой линии при НМРЛ (как аденокарцинома, то и плоскоклеточный) [10]. Пока исследование в процессе, представлены только ультра-первичные данные, в котором проанализировали 42 пациента, получивших «дуплет» и 54 – «триплет». На сегодняшний день ЧОО составила 55% в группе без химиотерапии и 56% - с ее добавлением. Медиана длительности лечения — 9,7 и 5,8 мес, соответственно. Токсичность в целом соответствовала известным профилям препаратов: стоматит G1-2 (57% в дуплете, 33% в триплете) и тошнота (42% и 48%). - HERTHENA-Lung02: патритумаб-дерукстекан (антитело к HER3 + «старый добрый дерукстекан», HER3-DXd) у пациентов с EGFR-мутированным НМРЛ после прогрессирования на ТКИ 3-го поколения [11]. Конъюгат сравнивали с платиносодержащей химиотерапией, и HER3-DXd продемонстрировал преимущество по мВБП: 5,8 мес против 5,4 мес (HR 0,77; p=0,011); 6-месячная ВБП составила 50% против 38%; а 12-месячная — 18% против 5%. Достигнута ЧОО в 35,2% в сравнении с 25,3%. С нетерпением ждем данных по мОВ! Основные НЯ, кажется, уже привычны для такого класса препарата и интуитивно ожидаемы: частота интерстициальной болезни легких составила 5% (в т.ч. 2 случая G5). - OptiTROP-Lung03: сацитузумаб тирумотекан (sac-TMT) против доцетаксела у пациентов с EGFR-мутированным НМРЛ [12]. Продемонстрировано значимое увеличение ЧОО (с 15,6 до 45,1%), мВБП составила 6,9 мес против 2,8 мес (HR 0.30). Интерпретация данных по ОВ несколько затруднительна ввиду того, что дизайном был предусмотрен кроссовер, который произошел у 36 из пациентов (изначально включены 91 пациент в группу конъюгата и 46 – доцетаксела), тем не менее, было показано, что мОВ не была достигнута. После статистической поправки с учетом кроссовера мОВ для доцетаксела составила 9,3 месяцев, а для sac-TMT не была достигнута вовсе. Профиль токсичности весьма приличный: среди G3-4 чаще всего нейтропения (42,9%) и стоматит (16,5%). Очень, очень любопытная опция! Ждем обновленных данных. Конгресс ASCO 2025 вновь задал высокую планку в обсуждении НМРЛ: от новых горизонтов неоадъювантной терапии до обнадеживающих данных по конъюгатам в метастатическом процессе. Та самая персонализированная терапия всё настойчивее вытесняют химиотерапию, конъюгаты уже наступают на пятки — и, похоже, это уже не тренд, а новая норма.
Рисунок 11.
Эффективность сосимерасиба
Источники:
- Jianxing He et al. Neoadjuvant Osimertinib for Resectable EGFRMutated Non-Small-Cell Lung Cancer. JCO 0, 10.1200/JCO-25-00883
- Alessandro Leonetti et al. Alectinib as neoadjuvant treatment in potentially resectable stage III ALK-positive NSCLC: Final analysis of ALNEO phase II trial (GOIRC01-2020-ML42316). JCO 43, 8015- 8015(2025).
- Patrick M. Forde et al. Overall survival with neoadjuvant nivolumab (NIVO) + chemotherapy (chemo) in patients with resectable NSCLC in CheckMate 816. JCO 43, LBA8000- LBA8000(2025).
- Tina Cascone et al. Perioperative nivolumab (NIVO) vs placebo (PBO) in patients (pts) with resectable NSCLC: Updated survival and biomarker analyses from CheckMate 77T. JCO 43, LBA8010-LBA8010(2025).
- Charles B. Simone et al. SWOG/ NRG S1914: Randomized phase III trial of induction/consolidation atezolizumab + SBRT versus SBRT alone in high risk, early-stage NSCLC. JCO 43, 8003-8003(2025).
- Yu Wang et al. The preliminary results of a randomized phase II trial evaluating induction toripalimab plus chemotherapy followed by concurrent chemoradiotherapy and consolidation toripalimab in bulky unresectable stage III non-small-cell lung cancer (InTRist). JCO 43, 8012- 8012(2025).
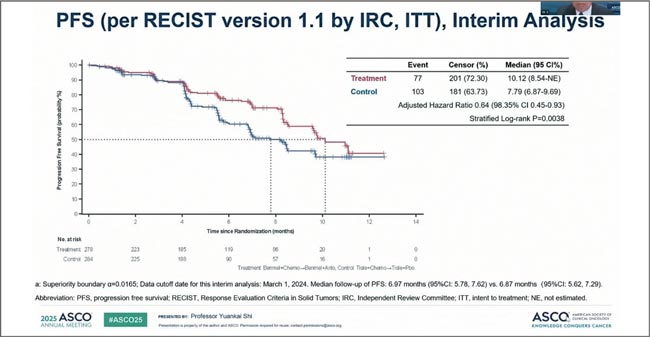
- Ming Chen et al. R-ALPS: A randomized, double-blind, placebocontrolled, multicenter phase III clinical trial of TQB2450 with or without anlotinib as maintenance treatment in patients with locally advanced and unresectable (stage III) NSCLC without progression following concurrent or sequential chemoradiotherapy. JCO 43, LBA8004-LBA8004(2025).
- Pasi A. Jänne et al. Firstline adagrasib (ADA) with pembrolizumab (PEMBRO) in patients (pts) with advanced/ metastatic KRASG12C-mutated non-small cell lung cancer (NSCLC) from the phase 2 portion of the KRYSTAL-7 study. JCO 43, 8500- 8500(2025).
- Jia Zhong et al. Sosimerasib monotherapy in patients with previously treated KRAS G12C– mutated non-small cell lung cancer: Primary results of a phase 2 study. JCO 43, 8520-8520(2025).
- Benjamin Philip Levy et al. TROPION-Lung02: Datopotamab deruxtecan (Dato-DXd) plus pembrolizumab (pembro) with or without platinum chemotherapy (Pt-CT) as first-line (1L) therapy for advanced non-small cell lung cancer (aNSCLC). JCO 43, 8501-8501(2025).
- Tony S. K. Mok et al. Patritumab deruxtecan (HER3-DXd) in resistant EGFR -mutated (EGFR m) advanced non-small cell lung cancer (NSCLC) after a third-generation EGFR TKI: The phase 3 HERTHENA-Lung02 study. JCO 43, 8506-8506(2025).
- Li Zhang et al. Sacituzumab tirumotecan (sac-TMT) in patients (pts) with previously treated advanced EGFR-mutated non-small cell lung cancer (NSCLC): Results from the randomized OptiTROP-Lung03 study. JCO 43, 8507-8507(2025).
НОВОСТИ ASCO 2025 / НОВОСТИ В ЛЕЧЕНИИ ОГШ
Авторы: Болотина Лариса Владимировна
д.м.н., доцент РАН, заведующая отделением химиотерапии
МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИЦ радиологии»
Минздрава России
Рубан Максим Сергеевич
Аспирант отделения химиотерапии
МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИЦ радиологии»
Минздрава России, Москва
На состоявшемся конгрессе ASCO2025 доклады, посвященные лечению опухолей, локализующихся в органах головы и шеи, имели довольно разнообразную тематику. Конечно, большинство работ были посвящены плоскоклеточному раку слизистых оболочек, однако наряду с этим были представлены исследования, изучавшие режимы лекарственной терапии при плоскоклеточном раке кожи, раке слюнных желез, анапластическим раке щитовидной железы. Среди исследований, потенциально меняющих клиническую практику, особый интерес представляют результаты 3 фазы KEYNOTE-689, в котором авторы изучали неоадъювантное (НА, 2 введения) и адъювантное (А) применение пембролизумаба в дополнение к стандартной терапии при резектабельном местнораспространенном ПРГШ (гортани, гортаноглотки, полости рта, ротоглотки) [1]. Вторым этапом в экспериментальной группе и первым в группе контроля выполнялась операция. На этапе адъювантной фазы пациентам исследовательской группы в зависимости от факторов прогноза проводилась ХЛТ (цисплатин 100 мг/м2 1 раз в 3 недели, 3 цикла) или ЛТ + 3 введения пембролизумаба, с последующим продолжением 12 циклов иммунотерапии. Первичной конечной точкой была бессобытийная выживаемость (БСВ). Исследование достигло поставленной цели: медианы БСВ в исследовательской и контрольной группах составили 51,8 мес. и 30,4 мес. (HR 0,73; р=0,0041). К 3 годам БСВ в группах оказались 57,6% vs 46,4%. Преимущество от добавления пембролизумаба отмечено независимо от уровня экспрессии PD-L1: 3-летняя БСВ при CPS ≥10 – 59,8% vs 45,9% (HR 0,66; р=0,0022), мБСВ 59,7 мес. vs 26,9 мес. В популяции CPS ≥1 3-летняя БСВ – 58,2% vs 44,9% (HR 0,70, р=0,0014), мБСВ 59,7 мес. vs 29,6 мес., рис.1. Лучший контроль в экспериментальной группе отмечен и в отношении отдаленных метастазов: медианы выживаемости без отдаленных метастазов составили 51,8 мес. vs 35,7 мес. (HR 0,71). Полный ПО (вторичная конечная точка) составил 4,3% (CPS ≥10), 3,1% (CPS ≥1) и 3% в общей популяции. Большой ПО отмечен в 13,7%, 9,8% и 9,3% соответственно. Данные по ОВ пока незрелые. В популяции CPS ≥10 медиана ОВ в экспериментальной группе не достигнута, в контрольной составила 61,8 мес. (HR 0,72, р= 0,02). Переносимость лечения была хорошей, иоНЯ 3-4 ст. отмечены у 10% пациентов, получавших пембролизумаб.
Рисунок 1.
БСВ в подгруппах CPS ≥10 и CPS ≥1.
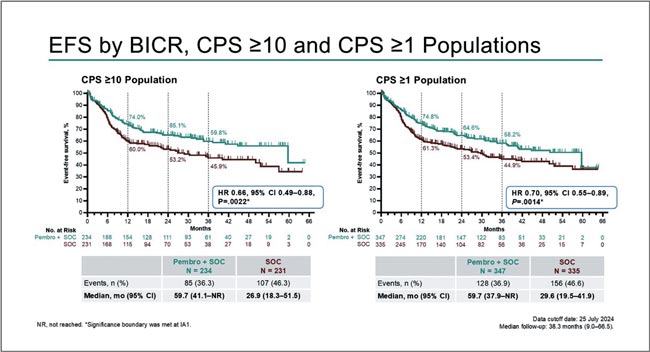
Другой подход был изучен группой исследователей под руководством J. Bourhis (NIVOPOSTOP), которые добавляли ниволумаб на этапе послеоперационной (п/о) ХЛТ пациентам с резектабельным ПРГШ (полости рта – 58%, гортаноглотки 13%-12%, гортани-12%, ротоглотки 17%-18%) с признаками высокого риска рецидива (экстракапсулярное распространение, R1 или операционный край ≤1 мм, поражение ≥4 лимфоузлов без экстракапсулярного распространения, периневральная инвазия) [2]. Группа стандартного лечения получала п/о ХЛТ (IMRT 66 Гр + цисплатин 100 мг/м2 1 раз в 3 недели), а экспериментальная группа дополнительно ниволумаб (одно введение 240 мг до начала ХЛТ, а далее ХЛТ IMRT 66 Гр + цисплатин 100 мг/м2 + ниволумаб 360 мг 1 раз в 3 недели). После завершения ХИЛТ проводились 6 введений ниволумаба в дозе 480 мг. Первичной конечной точкой (ПКТ) являлась безрецидивная выживаемость. При медиане наблюдения 30,3 месяца 3-летняя ВБП составила 63,1% vs 52,5% в экспериментальной и контрольной группах соответственно (HR 0,67; р=0,034). В исследовательской группе реже отмечены случаи как локо-регионарного прогрессирования (HR 0,63), так и появления отдаленных метастазов, рис.2.
Рисунок 2.
Беспрогрессивная выживаемость и характер
прогрессирования в исследовании NIVOPOSTOP.
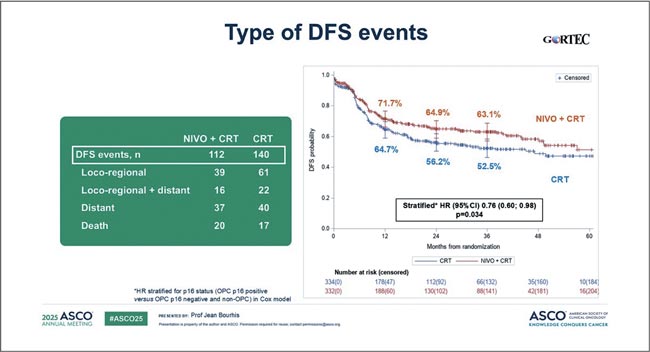
Польза от добавления ниволумаба была отмечена независимо от уровня экспрессии PD-L1 (более 80% больных имели CPS от 1 до ≥20). Показатель ОВ (вторичная конечная точка, ВКТ) составил 74,2% vs 67,8%, но данные пока незрелые. Токсичность лечения увеличилась незначительно. Авторы делают вывод о том, что данный лечебный подход, возможно, станет новым стандартом лечения этой категории пациентов. Однако, следует упомянуть анализ этого исследования, который был представлен в разделе обсуждения отобранных для дискуссии абстрактов. С учетом двух разных подходов, представленных в исследованиях KEYNOTE-689 и NIVOPOSTOP, было сделано заключение, что для выбора той или иной стратегии для конкретного пациента необходима работа и обсуждение мультидисциплинарной командой и учет персональных особенностей каждого случая с целью определения наиболее подходящего места внедрения в лечебный процесс иммунотерапевтического агента, рис.3.
Рисунок 3.
Возможные лечебные алгоритмы при
местнораспространенном резектабельном ПРГШ.
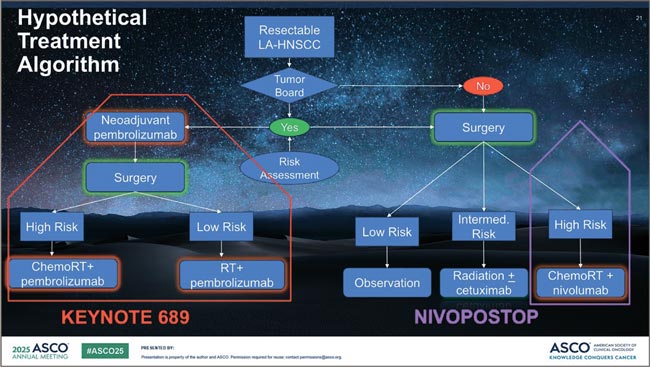
Отдельно был сделан акцент на том, что НА + А применение пембролизумаба позволило обеспечить равный со стандартным подходом локо-регионарный контроль, но лучше контролировать появление отдаленных метастазов. Группа китайских авторов изучала НА ХИТ (наб-паклитаксел + цисплатин + торипалимаб, 3 цикла) в сравнении с ХТ (наб-паклитаксел + цисплатин, 3 цикла) у больных резектабельным ПРГШ (гортаноглотка, гортань, полость рта, ротоглотка, околоносовые пазухи) [3]. Первичной конечной точкой была частота полных ПО. Полный ПО составил 57,8% vs 34,9% (р=0,03), а ПО + большой ПО 82,2% vs 53,5% (р<0,01) в экспериментальной и контрольной группах соответственно. НЯ с одинаковой частотой наблюдались в обеих группах. НЯ 3-4 степени зарегистрированы в 13,1% и 9,8% соответственно. Статус CPS оценен как CPS ≥1 - 92%, CPS ≥20 – 46% в общей популяции участников и не различался между группами. Различия в БРВ и ОВ оказались статистически незначимыми, однако авторы отмечают тенденцию к улучшению показателей в группе НА ХИТ.
Следующая интересная работа от группы американских исследователей была посвящена изучению комбинации коньюгата брентуксимаба ведотина (МАТ к CD30, преимущественно экспрессируемых Treg, + монометилауристатин) с пембролизумабом в качестве 1 линии терапии пациентов метастатическим ПРГШ с CPS ≥1 (мПРГШ, ротоглотка, полость рта, гортань, носоглотка, гортаноглотка, когорта 6 (n=38)) [4]. Первичной конечной точкой являлась ЧОО, вторичными - длительность ответа, ВБП и безопасность. CPS 1-19 – 21%, CPS ≥20 – 79%. ЧОО составила 37%, из них 5% - ПО. При медиане наблюдения 13,4 месяца медиана длительности ответа не достигнута. Частота контроля заболевания достигла 71%. Ответ на лечение отмечался независимо от уровня экспрессии PD-L1 (CPS 1-19 – 25%, CPS ≥20 – 40%) (рис.4).
Рисунок 4.
а и б. ЧОО (а) и длительность ответа (б)

Медиана ВБП составила 6,1 мес. НЯ 3-4 ст. отмечены у 76% пациентов, наиболее частыми среди которых были лимфоцитопения (11%), увеличение уровня АСТ (5%), слабость (5%), нейтропения (5%). Иммуноопосредованные НЯ были представлены гипотиреозом (13%), кожным зудом (11%), пневмонитом (5%). Досрочно прекратить лечение из-за НЯ пришлось 16% участников. На фоне лечения авторы отметили в периферической крови значимое снижение уровня Treg и увеличение уровня пролиферации CD8 Т-лимфоцитов. В заключении авторы делают вывод о многообещающей эффективности изученного режима у пациентов мПРГШ с CPS ≥1. Продолжаются усиления по созданию и внедрению в клиническую практику адъювантного применения персонализированных вакцин на основе вирусов. Международной группой исследователей представлены результаты исследования I фазы, в котором пациентам ВПЧнегативным ПРГШ (полость рта, ротоглотка, гортань, гортаноглотка) III-IV ст. после радикального удаления опухоли и завершения адъювантной терапии в случае отсутствия прогрессирования в течение 3 месяцев вводились 6 еженедельных, а далее 14 доз 1 раз в 3 недели индивидуально изготовленной вакцины [5]. Вакцина TG4050 представляет собой продукт, произведенный на основе специфических соматических мутаций, обнаруживаемых при помощи секвенирования опухоли пациента (до 30 специфических антигенных эпитопов). Первичной конечной точкой была безопасность терапии, среди вторичных оценивались осуществимость исследования, безрецидивная выживаемость (БРВ). Всего 33 пациента были разделены на 2 группы, одна из которых (А, n=17) получала TG4050 в адъювантном режиме, а вторая (В, n=16) – только при регистрации рецидива. В анализ БРВ из группы А включались только пациенты, которые получили как минимум первые 6 еженедельных введений вакцины, а из группы В – наблюдавшиеся не менее 6 недель. Дисбаланс между группами наблюдался в отношении ряда характеристик: локализация опухоли в полости рта – 82% vs 63%; экстракапсулярное распространение опухоли при поражении лимфоузлов: 29% vs 50%; позитивный хирургический край: 24% vs 19%; периневральная инфильтрация 77% vs 44%; наличие 1 фактора риска 29% vs 56%; наличие 2+ факторов риска 53% vs 31%. При оценке ПКТ отмечено, что дозолимитирующая токсичность, серьезные НЯ, НЯ 3-5 ст. зафиксированы не были. Отмечалась реакция 1-2 ст. в месте подкожного введения вакцины (группа А, (n=17) 94% и группа В (n=3) 33%. Дополнительно в группе адъювантного применения вакцины по 12% приходилось на сыпь, слабость, гриппоподобный синдром и диарею. У 6% участников данной группы зафиксирована головная боль. Группа В (назначения вакцины при реализации рецидива) адекватна оценена быть не может, так как включает всего 3 пациентов. Медиана наблюдения составила 30 месяцев. Показатель 2-летней БРВ в группе А составил 100%, а в группе В снизился до 81% (рис. 5).
Рисунок 5.
Двухлетняя БРВ в группах А и В
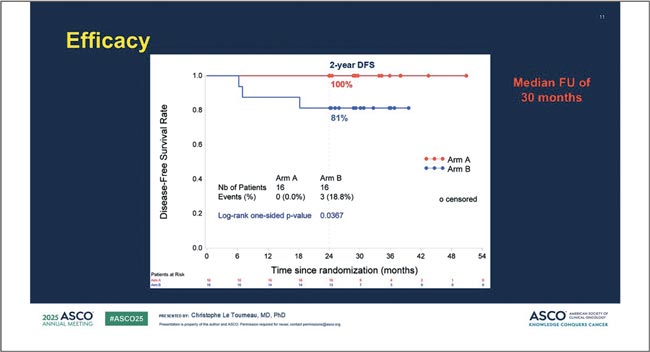
Авторы делают вывод о том, что персонализированная вакцина TG4050 при использовании в адъювантном режиме обеспечивает долгосрочный контроль над заболеванием за счет длительно сохраняющегося иммунного ответа, что явилось поводом к проведению исследования II фазы (планируется в 4 квартале 2025 года). Для лечения назофарингеального рака (НФР) помимо очередных исследований комбинаций платиносодержащей химиотерапии с различными анти-PD1 агентами, разработанными в Китае, была представлена работа по сравнению коньюгата с ХТ у предлеченных пациентов – исследование MRG003 [6]. В протокол включались пациенты рецидивным/ метастатическим раком носоглотки, прогрессирующим как минимум после 2 линий ХТ и иммунотерапии. В равной пропорции участники разделялись на 2 группы, одна из которых получала коньюгат бекотатуг ведотин, а группа контроля капецитабин или доцетаксел. Первичными конечными точками являлись ЧОО и ВБП. При прогрессировании разрешался кроссовер из группы контроля на терапию бекотатугом ведотином (он составил 37,9%). Метастазы в печени отмечены у 47%, в легких – у 57%/46%, в костях – у 51% больных. ЧОО составила 30,2% vs 11,5% в группах коньюгата и ХТ соответственно. Контроль над заболеванием достигнут у 77,9% и 56,3% пациентов в экспериментальной и контрольной группах. Отмечено более чем двукратное увеличение мВБП в исследовательской группе, 5,82 мес. vs 2,83 мес. (рис.6).
Рисунок 6.
ВБП в группах бекотатуга ведотина и ХТ
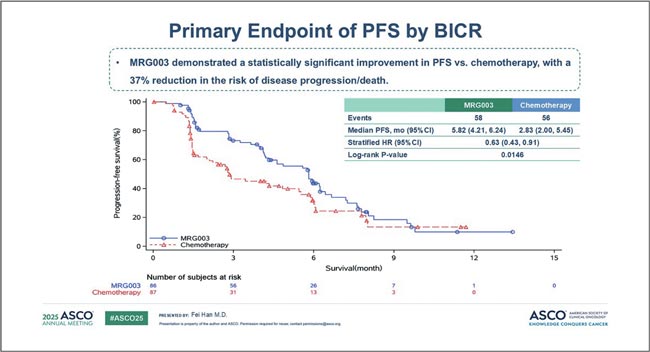
Данные по ОВ пока незрелые, однако отмечено раннее расхождение кривых и тенденция к увеличению медианы (HR 0,73, с учетом кроссовера HR 0,59). Переносимость коньюгата оказалась хорошей, токсические реакции 3-4 ст. наблюдались реже в экспериментальной группе.
Авторы полагают, что бекотатуг ведотин может рассматриваться как новая лечебная опция для пациентов раком носоглотки, прогрессирующих на фоне ХТ и иммунотерапии.
Но, пожалуй, наиболее интересное исследование при назофарингеальном раке (DIAMOND), которое способно поменять клиническую практику, было представлено также коллективом китайских авторов. При местнораспространенном НФР после индукционной ХИТ изучалась возможность на этапе ХЛТ заменить цисплатин на ИТ торипалимабом [7].
ПКТ были выбраны выживаемость до неудачи лечения (ВНЛ) и частота рвоты всех степеней (CTCAE v.5), которые были успешно достигнуты (рис. 7).
Рисунок 7.
Выживаемость до неудачи лечения и частота рвоты
всех степеней
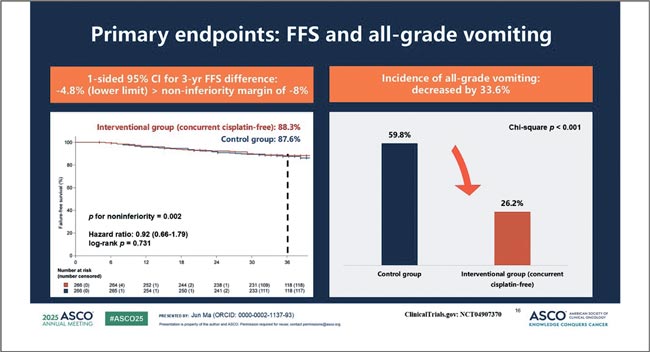
ВНЛ не различалась между группами: к 3 годам без признаков неблагоприятного события оставались 87,6% больных группы стандартного лечебного подхода и 88,3% бесплатиновой группы ЛТ. При этом случаи рвоты при исключении цисплатина на этапе ЛТ снизились на 33,6%. Вторичные точки были представлены 3-летними показателями ОВ, локо-регионарного контроля и выживаемостью без отдаленных метастазов (ВБОМ). Показатели не различались между группами: к 3 годам ОВ 96,1% vs 96,5%, локо-регионарный контроль 92,9% vs 93,6%, ВБОМ 93,2% vs 91,6% в исследовательской и контрольной группах (рис. 8).
Рисунок 8.
Показатели 3-летней ОВ, локального контроля, ВБОМ
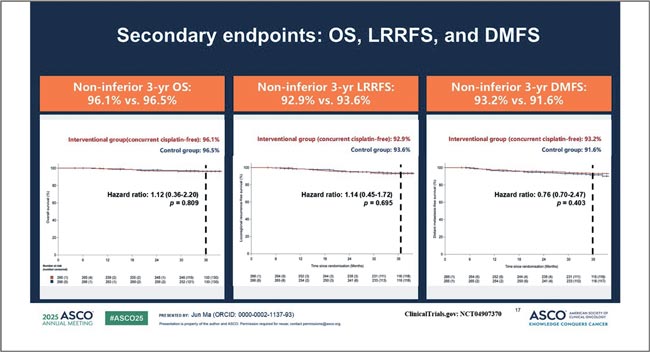
Таким образом, авторы делают вывод о том, что замена цисплатина на торипалимаб на этапе ЛТ после индукционной ХИТ у пациентов местно-распространенным НФР группы высокого риска является рациональной многообещающей стратегией. Следующее исследование, представляющее интерес, посвящено использованию иммуно-таргетной терапии (ИТТ) на этапе неоадъювантного лечения анапластического рака щитовидной железы (АРЩЖ) с мутацией BRAF V600E [8]. АРЩЖ является крайне редким ЗНО (1-2 случая на 1 млн), имеющим агрессивное течение, часто нерезектабельный процесс на момент установления диагноза с медианой ОВ 3-4 месяца. Мутация BRAF V600E обнаруживается приблизительно у 40% больных. Применение комбинации дабрафениб + траметиниб (ДТ) обеспечивает мОВ около 14,5 месяцев. Zaferio M. с соавторами представили результаты исследования 2 фазы по изучению эффективности комбинации ДТ с пембролизумабом в неоадъювантном режиме (n=39). После 2-7 циклов НА ИТТ выполнялась операция, после которой опционально было предусмотрено проведение адъювантной ЛТ на фоне продолжения ИТ пембролизумабом, с последующим продолжением ИТТ. До включения в протокол пациенты могли не более 42 дней получать терапию ДТ. В результате проведенной НА ХТТ ЧОО составила 72%, стабилизация – 15%, прогрессирование отмечено у 13%. Средний суммарный размер редукции очагов в популяции составил -48%. Операцию в объеме R0/R1 удалось выполнить 72% участников (59%/15%). Показатели годичной и 2-летней ВБП и ОВ составили 59% и 33% и 71% и 44% соответственно. Медианы ВБП и ОВ достигли 13,9 мес. и 18 мес., что оказалось выше в сравнении с комбинацией ДТ (6,7 мес. и 14,5 мес., ROAR trial). В случае достижения полного ответа мОВ достигнута не была, 2-летняя ОВ составила 69%. У 5% (n=2) отмечены НЯ 5 ст. (сепсис, перфорация 12-перстной кишки). Исходя из полученных результатов, авторы делают вывод о том, что комбинацию ДТ + пембролизумаб следует рассматривать в качестве нового стандарта 1 линии IVB и IVC стадии АРЩЖ с мутацией BRAF V600E и внести данную комбинацию в клинические рекомендации. Японскими авторами были представлены ожидаемые результаты исследования 2 фазы DISCOVARY по использованию комбинированной гормонотерапии у пациентов андроген-позитивным раком слюнных желез (РСЖ) [9]. Сегодня не существует стандартов лечения рецидивного/метастатического и нерезектабельного местнораспространенного РСЖ. Монотерапия даролутамидом сопровождалась объективным ответом у 20,8% пациентов (ASCO 2023). В настоящем исследовании изучена эффективность комбинации даролутамида с гозерелином. ПКТ являлась ЧОО, среди ВКТ изучались частота контроля заболевания (ЧКЗ), длительность ответа, ВБП, ОВ, безопасность терапии и др. Уровень экспрессии рецепторов андрогенов (РА) >70% наблюдался у 29/33, менее 70% у 4/33 больных. У большинства метастазы локализовались в легких (25/33). Ранее операция была выполнена у 21/33, проводилась ЛТ 21/33 и ХТ 15/33 участников. ЧОО составила 45,2%, у 1 пациента удалось добиться ПО; ЧКЗ достигла 64,5%. При медиане наблюдения 13,7 мес. мВБП оказалась 13,1 мес., а мОВ достигнута не была (рис.9).
Рисунок 9.
ВБП и ОВ в исследовании DISCOVARY
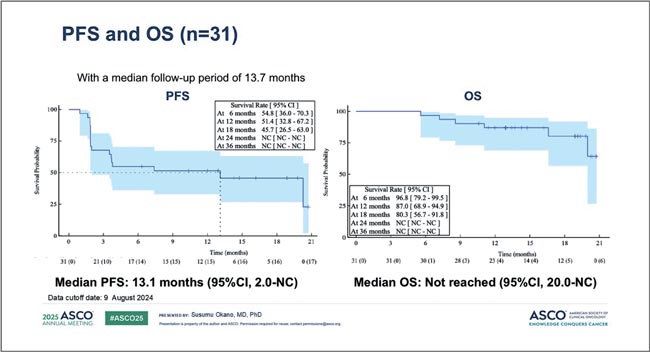
К 18 месяцам оставались живы 80,3% больных. Токсические реакции в основном имели 1-2 ст. (увеличение АСТ, АЛТ), только у 18,2% наблюдались НЯ 3-4 ст. (нейтропения, гиперкальциемия, сыпь). Авторы исследования полагают, что комбинация даролутамида с гозерелином может быть предпочтительной лечебной опцией до назначения ХТ. Резюмируя представленные работы, можно сделать некоторые выводы:
1. Продолжают расширяться показания к использованию ИТ на различных этапах лечения ОГШ:
- В адъювантной терапии местнораспространенного ПРГШ высокого риска добавление ниволумаба к ХЛТ (NIVOPOSTOP) значимо улучшает БРВ (HR 0,76; 3-летняя БРВ: 63,1% vs 52,5%, ХЛТ+ниво vs ХЛТ). Периоперационное использование пембролизумаба значимо улучшает БСВ (HR 0,73, мБСВ 51,8 мес. и 30,4 мес. – О + ХЛТ +пембро vs О + ХЛТ).
- При местнораспространенном раке носоглотки включение торипалимаба в схему индукционной химиотерапии и лучевой терапии позволяет обеспечить деэскалацию лечения (отказ от конкурентного цисплатина) без ущерба для эффективности (3-летняя выживаемость без неудач лечения: 88,3% в группе без цисплатина vs 87,6% в стандартной группе; разница 0,7%, p non-inferiority = 0.002), но со значительным улучшением переносимости и качества жизни (DIAMOND).
2. Таргетная терапия демонстрирует высокую эффективность при наличии соответствующих молекулярных мишеней, особенно при редких и агрессивных опухолях:
- При BRAF V600E-мутированном анапластическом раке щитовидной железы комбинация пембролизумаба с дабрафенибом и траметинибом (ПДТ) на предоперационном этапе увеличивает частоту R0/R1 резекций (97%), полных патоморфологических ответов (67%) и приводит к улучшению общей выживаемости (мОВ: 20 месяцев; 1- и 2-летняя ОВ: 71% и 48% соответственно).
- При андроген-рецептор позитивных раках слюнных желез комбинация даролутамида с гозерелином демонстрирует высокую частоту объективного ответа (ЧОО: 45,2%), хороший контроль над заболеванием (мВБП: 13,1 месяцев; 12-месячная OВ: 87%), предлагая новую терапевтическую опцию (DISCOVARY).
3. Изучаются новые классы препаратов с высокой эффективностью для сильно предлеченных пациентов ПРГШ:
- Новый конъюгат антитело-лекарственное средство бекотатуг ведотин, нацеленный на EGFR, превосходит стандартную химиотерапию по частоте ответа (ЧОО: 30,2% vs 11,5%) и ВБП (HR 0,63; мВБП: 5,8 месяцев vs 2,8 месяцев) у пациентов с рецидивирующим/метастатическим раком носоглотки, ранее получивших несколько линий терапии (исследование MRG003).
4. Разрабатываются персонализированные вакцины для улучшения онкологических показателей радикально прооперированных больных.
Источники:
- D. Adkins et al. “Neoadjuvant and adjuvant pembrolizumab plus standard of care (SOC) in resectable locally advanced head and neck squamous cell carcinoma (LA HNSCC): Exploratory efficacy analyses of the phase 3 KEYNOTE-689”.
- J. Bourhis at al. NIVOPOSTOP ”A phase III randomized trial of adjuvant nivolumab added to radio-chemotherapy in patients with resected head and neck squamous cell carcinoma at high risk of relapse”.
- H. Wang et al. Neoadjuvant PD-1 inhibitor combined with Nab-paclitaxel and cisplatin in resectable locally advanced head and neck squamous cell carcinoma: a randomized controlled open label phase II clinical trial.
- C. Rodrigues et al. Phase II openlabel study of brentuximab vedotin + pembrolizumab in patients with treatment-naïve metastatic head and neck squamous cell carcinoma.
- Le Tourneau et al. Randomized phase I trial of adjuvant personalized cancer vaccine TG4050 in resected, locally advanced HNSCC patients.
- Han F. et al. Becotatug vedotin vs chemotherapy in pre-heavily treated advanced nasopharyngeal carcinoma: a randomized-controlled , multicenter, open-label study.
- Ma J. et al. PD-1 blockade with toripalimab incorporated into induction chemotherapy and radiotherapy with or without cisplatin in locoregionally advanced nasopharyngeal carcinoma (DIAMOND): a multicenter, noninferiority, phase 3, randomized controlled trial.
- Zaferio M. et al. Neoadjuvant pembrolizumab in combination with dabrafenib and trametinib (DTP) for BRAF V600E mutated anaplastic thyroid cancer (BRAFm ATC): a multicenter phase 2 trial.
- Okano S. et al. Darolutamide plus goserelin for androgen receptorpositive salivary gland cancers: results of phase II study (DISCOVARY).
НОВОСТИ ASCO 2025 / РАК ПОЧКИ
Автор: Тимофеев Илья Валерьевич
Директор Бюро по изучению рака (Россия), член научного комитета
Колледжа Европейской Школы Онкологии (ESCO)
Изучение новых подходов в диагностике и терапии почечноклеточного рака (ПКР) продолжается, а наши знания об этой опухоли становятся все более обширными. Такой вывод можно сделать по результатам представленных докладов на конгрессе ASCO 2025 в Чикаго.
Диагностика рака почки: те, кто еще использовал ПЭТ-КТ с фторированной глюкозой, забудьте о нем!
В сравнительном исследовании 2 фазы (Zhu et al.) изучалась эффективность нового радиоизотопа для ПЭТ-КТ метастатического светлоклеточного ПКР – 68GaNY104. Молекула связывается с карбоангидразой IX на клетках ПКР и «подсвечивает» их радиоактивным галлием. Авторы использовали тот же принцип, что в исследовании Zircon (Zrгирентуксимаб). Результат получился впечатляющим, дающим надежду на использование ПЭТКТ с данным радиоизотопом в диагностике ПКР. Чувствительность и специфичность метода по разному уровню оценки превысили 95% и приблизились к 100%. Дальнейшее изучение продолжится в крупном исследовании 3 фазы. Группой сравнения была стандартная ПЭТ-КТ с фторированной глюкозой, которая в очередной раз продемонстрировала свою несостоятельность. Специфичность метода не удивила и находилась в пределах 5,5-11,4%, чувствительность – 77,8-82%. Авторы сочли ПЭТ-КТ с глюкозой неэффективным подходом, показатели которого значимо уступают новым видам радиоизотопов. Попытки неоадъювантной терапии ПКР: полных патоморфологических ответов не наблюдается, но треть пациентов имеет сокращение объема опухолевой массы В проспективном исследовании PELUR авторы (Zhu et al.) оценили эффективность и безопасность комбинации ленватиниба и пембролизумаба, назначаемых в виде трех циклов до нефрэктомии, у пациентов с резектабельным ПКР высокого риска, в том числе с опухолевым тромбом. Сокращение объема опухоли/тромба было отмечено у всех пациентов (n=23), в том числе зафиксирован ответ у 47,8% (но только частичный). Через 22 месяца только 5 пациентов прогрессировали. Качество жизни и частота нежелательных явлений (НЯ) были приемлемыми. Авторы сделали вывод о потенциальном эффективном и безопасном неоадъювантном подходе с применением ленватиниба и пембролизумаба, но требуется большее исследование с оценкой частоты полных патоморфологических ответов. Другая комбинация – авелумаб и акситиниб – назначалась в неоадъювантном режиме в течение 12 недель до операции в проспективном исследовании 2 фазы NEOAVAX (Bex et al.). 30% пациентов имели частичный ответ (ЧО) на терапию и 7,5% – глубокий патологический ответ (major pathological response, MPR). Патологический ответ MPR не был связан с рентгенологическими признаками ЧО. Через 36 месяцев наблюдения рецидив был выявлен у 1 из 3 пациентов (33%) с MPR, через 12 месяцев 7 из 12 (56%) с ЧО имели прогрессирование и через 3 месяца 14 из 25 (56%) без какого-либо ответа также прогрессировали. При иммуногистохимическом исследовании наличие внутри опухоли после терапии клеток с профилем CD8+CD39+ достоверно ассоциировалось с рецидивом (P<0,0001). Наличие опухоль-инфильтрирующих макрофагов, Т-клеток памяти и B-лимфоцитов приводило к лучшему ответу на лечение. Авторы также отметили внутриопухолевую гетерогенность в молекулярном профиле. Режим подлежит дальнейшему изучению с оглядкой на молекулярно-биологические особенности опухоли. В двух исследованиях 2 фазы 40 пациентов получили неоадъювантно комбинацию ингибитора PD-1 торипалимаба и акситиниба с целью уменьшения объема опухолевой массы, в том числе опухолевого тромба (Peng et al.). Частота объективных ответов (ЧОО) составила 37,5%. Медиана сокращения размера опухолевого тромба была 1,9 см, при этом 45% больных имели уменьшение протяженности тромба, что делает подход интересным.
Рисунок 1.
Показатели общей выживаемости в исследовании
KEYNOTE-564
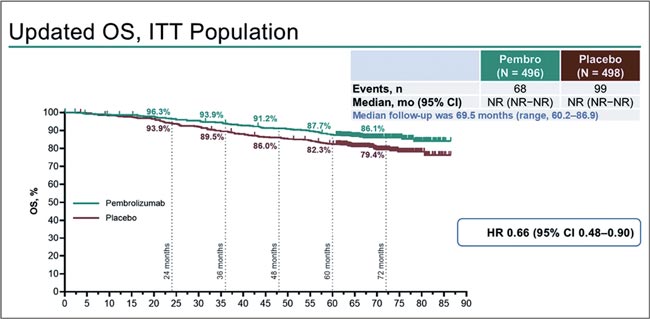
Рисунок 2.
Показатели эффективности терапии в группе
промежуточного/неблагоприятного риска

Адъювантная терапия пембролизумабом: что с пациентами спустя 5 лет?
В рандомизированном исследовании 3 фазы KEYNOTE-564 сравнивалась эффективность одного года терапии пембролизумабом с плацебо в когорте пациентов высокого риска возобновления ПКР после хирургического лечения. Результаты 5-летнего наблюдения были представлены Haas с соавт. Через 5 лет 87,7% пациентов в группе иммунотерапии и 82,3% в группе плацебо были живы (медиана не достигнута). Различия остаются достоверными в пользу пембролизумаба (HR=0,66). Также сохраняются преимущества пембролизумаба по показателю безрецидивной выживаемости, медиана которой не была достигнута, в отличие от группы плацебо – 68,3 мес. (HR=0,71). Через 5 лет в соответствующих группах 58,5% и 48,7% больных остаются без признаков рецидива. По-прежнему в группе плацебо менее половины пациентов при прогрессировании болезни получили последующую иммунотерапию (48,2%), при этом частота таргетной терапии при прогрессировании в обеих группах была одинаковой, что не может не вызывать критику в отношении возможного негативного влияния на общую выживаемость (ОВ) в группе плацебо и дисбаланса по этому показателю. Спустя длительное время частота НЯ 3-5 степени оказалась ниже в группе плацебо – 17,7% против 32% в группе пембролизумаба, равно как и частота иммуноопосредованной токсичности – 7,3% против 36,7%, но в целом адъювантная терапия переносилась хорошо. Могут ли биомаркеры предсказать эффективность адъювантной иммунотерапии? Исследование KEYNOTE-564 пока не отвечает на этот вопрос, тем не менее, интересные данные получены в исследовании IMmotion010, оценивающем эффективность и безопасность адъювантного атезолизумаба (Pal et al.). Несмотря на отрицательный результат в общей популяции, была выявлена когорта, которая выигрывала от назначения анти-PD-L1 антитела – пациенты с высоким уровнем KIM-1, и особенно в сочетании с выраженной сигнатурой Т-эффекторов. Возможно, в будущем для участия в исследованиях адъювантной иммунотерапии стоит отбирать таких пациентов.
Метастатический светлоклеточный ПКР: «старая добрая» иммунотерапия укрепляет позиции, новые подходы догоняют
Прошло 9 лет с момента старта рандомизированного исследования 3 фазы CheckMate-214, сравнивающего эффективность и безопасность ниволумаба/ ипилимумаба с сунитинибом у пациентов с преимущественно промежуточным/плохим прогнозом (Motzer et al.). 30% пациентов, получивших двойную иммунотерапию, остаются живы, а риск смерти снижен на 31% (HR=0,69). Также 21% больных не имеют прогрессирования болезни (HR=0,73), ответ – в половине случаев – продолжается на протяжении 9 лет (HR=0,48). Интересно, что даже в группе благоприятного прогноза, на что постоянно указывал проф. Motzer, исходы со временем стали лучше. Так, HR для ОВ составило 0,8; ответчики на ниволумаб/ипилимумаб значимо выиграли по сравнению с сунитинибом (HR=0,74). Более того, важно подчеркнуть, что на момент последней оценки 99% пациентов прекратили терапию ниволумабом и ипилимумабом и только 49% по причине прогрессирования, что снова свидетельствует о возможных длительных периодах контроля над болезнью после прекращения двойной иммунотерапии. Иммуноопосредованная токсичность во времени не нарастала – после двух лет НЯ, связанные с ИО, имели единичные пациенты. Таким образом, авторы делают вывод о продолжающейся эффективности двойной иммунотерапии спустя 9 лет наблюдения, особенно у ответчиков. Представленные новые подходы к терапии светлоклеточного метастатического ПКР основаны на разработке препаратов следующих классов, клеточной терапии, а также влияющих на микробиом и микроокружение. Что касается последнего, Kashima с соавт. оценили роль опухольассоциированных макрофагов (tumor-associated macrophages, TAM) в развитии резистентности к иммунотерапии. Они показали, что у пациентов, не ответивших на лечение, количество клеток с типичным фенотипом TAM, а также несущих рецепторы SIGLEC10, значимо выше, чем у ответчиков. Следовательно, моделирование микроокружения через влияние на TAM может увеличить эффективность иммунотерапии. О том, как это можно сделать, сообщалось на конференции RUSSCO «Иммуноонкология – 2025» (видео доклада будет доступно в архиве). Например, занзалитиниб – ингибитор TAM – уже изучается в клиническом исследовании (табл.1).
Таблица 1.
Новые подходы, представленные на ASCO 2025, в лечении метастатического светлоклеточного ПКР
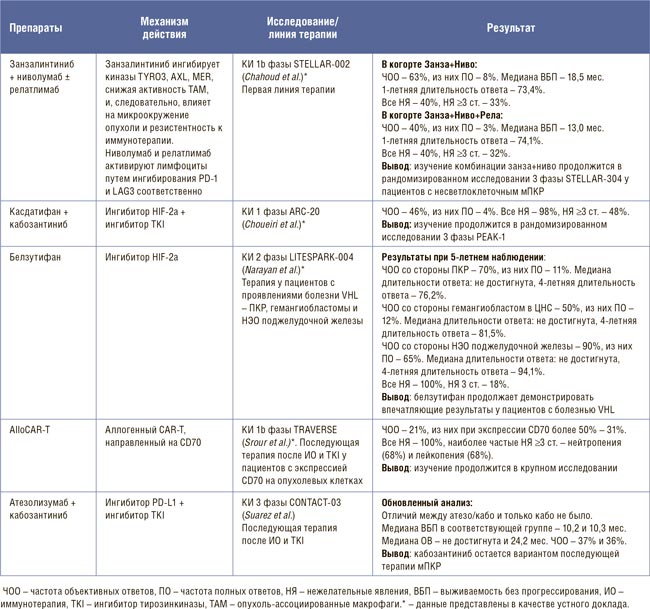
Метастатический несветлоклеточный ПКР: анализ эффективности иммунотерапии, комбинации для редких подтипов
Ранее считавшийся редким, а ныне, с внедрением оценки в рамках новой классификации рака почки ВОЗ (2022 г.), выявляющийся в 1-5% случаев ПКР с транслокациями – вариант TFE – представляется важным для дальнейшего изучения. В частности, стандартных подходов терапии метастатической формы до сих пор не существует. В рандомизированном исследовании 2 фазы AREN1721 сравнивалась эффективность комбинации акситиниба и ниволумаба с монотерапией ниволумабом или монотерапией акситинибом у пациентов с метастатическим ПКР с амплификациями или слияниями в гене TFE (Geller et al.). В исследование было включено 15 пациентов, после чего оно было остановлено из-за сложностей включения и скорости набора. ЧОО в группах монотерапии ниволумаба и акситиниба составила 0%. В группе комбинации ниволумаба-акситиниба 33% пациентов ответили на лечение. Медиана ВБП также, почти в 10 раз, была лучше для нивоакси и составила 10,5 мес. Авторы сделали вывод, что в исследовании получен сигнал эффективности иммунотаргетной терапии и дальнейшие исследования новых комбинаций должны быть продолжены. В настоящее время Бюро по изучению рака (РФ) проводит проспективное наблюдательное исследование по оценке эффективности комбинаций ниволумаба-ипилимумаба и ниволумаба-кабозантиниба у пациентов с транслокациями в гене TFE. В рандомизированном исследовании 2 фазы SUNNIEFORECAST сравнивалась эффективность двойной иммунотерапии с терапией на выбор врача у пациентов с метастатическим несветлоклеточным раком, ранее не получавших лечение (ESMO 2024). Результаты последнего анализа были представлены в качестве постерного доклада на ASCO 2025. Первичная конечная точка – 12-месячная ОВ – была достигнута: 78,3% в группе иммунотерапии и 68,3% в группе стандартного лечения (p=0,026). Лучшие показатели 12-месячной ОВ были получены в случае экспрессии PDL1 (CPS ≥1) – 83,5% против 57,6% (HR=0,56). В подгруппе без экспрессии PD-L1 разницы в ОВ не наблюдалась (HR=1,33). Также, на удивление, пациенты без нефрэктомии в анамнезе имели больший выигрыш от ниволумаба-ипилимумаба. Несмотря на новые данные поданализа, вряд ли на практике нужно тестировать PDL1 и включать только пациентов без нефрэктомии, так как исследование было сланировано статистически без учета этих факторов при включении пациентов. Еще один режим ингибитора TKI + ингибитор mTOR – анлотиниба с эверолимусом – изучался у пациентов с метастатическим несветлоклеточным ПКР, почти половина из которых имели папиллярный подтип. Клиническое исследование 2 фазы UC-001 (Xu et al.) включало китайских пациентов, ранее не получавших лечение. ЧОО была 54,5%, прогрессирования болезни не выявлено ни в одном случае. Медиана ВБП составила 20,8 мес. Авторы сделали вывод о необходимости проведения рандомизированного исследования для двойной таргетной терапии. Попытка комбинировать ингибитор TKI анлотиниб с ингибитором PD-1 синтилимабом оказалась успешной: 56,8% пациентов ответили на лечение, медиана ВБП превысила один год (13,6 мес.). Режим продолжит изучаться в крупном исследовании (Dong et al.).
НОВОСТИ ASCO 2025 / РАК ТОЛСТОЙ КИШКИ
Автор: Федянин Михаил Юрьевич
ГБУЗ «ММКЦ «Коммунарка» ДЗМ», ФГБУ «НМИЦ онкологии им. Н.Н. Блохина»
Минздрава России, ФГБУ «НМХЦ им. Н.И. Пирогова»
Министерства здравоохранения РФ, д.м.н., Москва
С каждым годом появляются результаты новых исследований, которые дополняют картину лечения пациентов с колоректальным раком, и конгресс ASCO 2025 не стал исключением. Рассмотрим ключевые работы.
РАННИЕ СТАДИИ
Лечение пациентов с MSI/dMMR
Наличие микросателлитной нестабильности при ранних стадиях рака толстой кишки ассоциировано с благоприятным прогнозом. Однако нужно понимать, что все зависит от клинической ситуации. Так, если имеется сочетание данного фенотипа с T4N0M0, то прогноз пациентов с MSI и MSS уже не различается. Аналогичные данные имеются и в отношении III стадии – в случае низкого риска прогрессирования (T1-3N1M0) пациенты с MSI имеют наилучший прогноз, но в случае T4N1M0 или TлюбоеN2M0 – прогноз становится наихудшим, даже в сравнении с MSS фенотипом. При этом проведение адъювантной химиотерапии с включением оксалиплатина в описанных ситуациях улучшает выживаемость по результатам ретроспективных исследований.
Высокая чувствительность метастатического рака толстой кишки с MSI фенотипом к иммунотерапии обусловила инициацию исследований с адъювантным назначением ингибиторов иммунных контрольных точек. На ASCO 2025 представлены результаты рандомизированного исследования III фазы ATOMIC, в котором пациенты с III стадией рака толстой кишки с MSI/dMMR были рандомизированы на проведение адъювантной химиотерапии в течение 6 мес. по схеме FOLFOX с или без атезолизумаба. При чем в экспериментальной группе терапию атезолизумабом продолжали до 12 месяцев. Авторы работы показали значимое улучшение 3-летней выживаемости без признаков болезни (ВБПБ) в группе химиоиммунотерапии – 86,4% против 76,6% (ОР 0,5; р<0,0001) практически во всех подгруппах. Данные по общей выживаемости (ОВ) еще не зрелые. Однако есть высокие риски того, что улучшение ОВ не наступит, так как при прогрессировании в первой линии пациентам из контрольной группы, с большой долей вероятности, будут назначать ингибиторы иммунных контрольных точек. Вопросы, конечно, есть и к токсичности – терапия комбинацией атезолизумаба с FOLFOX была ассоциирована с большей частотой нежелательных явлений 3-4 степени (83,8% против 69,1%). Нельзя забывать и об осложнениях, связанных с химиотерапией, в частности, нейропатии, и финансовой токсичности терапии атезолизумабом до года. Всех этих проблем можно избежать при неоадъювантном назначении иммунотерапии при местнораспространенном раке толстой кишки.
Так, в исследовании NICHE-2 1 введение по схеме ипилимумаба с ниволумабом и 1 курс ниволумаба в монорежиме перед операцией при MSI-ассоциированном раке толстой кишки позволяет достичь частоты полных патоморфозоз (pCR) у 69% и показателей 3-летней ВБПБ в 100%. Более того, у большинства пациентов при проведении неоадъювантной иммунотерапии при раке прямой кишки с MSI возможно отказаться от выполнения хирургии. На конференции ACCR 2025 представлены обновленные данные исследования по проведению 27 недель терапии анти-PD1 антителом достарлимабом при местнораспространенном раке прямой кишки с MSI/dMMR фенотипом – полные клинические ответы достигнуты у 100% пациентов. Более того, аналогичное исследование авторы провели и у пациентов с локализацией опухоли вне прямой кишки. Среди пациентов с опухолью в ободочной кишке 27 недель терапии достарлимабом привели к достижению полного клинического ответа у 82% пациентов, и этих больных оставили под наблюдением, то есть не выполняли хирургию. В процессе наблюдения пока ни у кого не развилось в данной подгруппе прогрессирования болезни.
Таким образом, если пришел пациент с 3 стадией рака толстой кишки, у которого выявили MSI/dMMR, то можно рассматривать адъювантную терапию по схеме FOLFOX с атезолизумабом. Но лучше, если еще перед решением вопроса о хирургии всем пациентам со II-III стадией рака толстой кишки проводилось бы определение MSI/dMMR. И в случае ее выявления рассмотреть на консилиуме проведение короткого (до 27 недель) курса индукционной иммунотерапии с последующим наблюдением в случае достижения полного клинического ответа.
К вопросу о циркулирующей опухолевой ДНК
Ранее в исследовании DYNAMIC впервые в мире было показано, что для назначения адъювантной химиотерапии при раке толстой кишки II стадии достаточно ориентироваться на риск прогрессирования лишь по наличию одного биомаркера – циркулирующей опухолевой ДНК (цоДНК) после операции, при ее отсутствии можно адъювант не назначать. Соответственно встал вопрос: а если она определяется после операции, нужно ли эскалировать лечение, например, до режима FOLFOXIRI? И чтобы ответить на этот вопрос, провели исследование 2/3 фазы у пациентов с III стадией заболевания (DYNAMIC 3): при положительном тесте цоДНК после операции пациентов рандомизировали на группу стандартной адъювантной терапии или эскалировали лечение со фторпиримидинов в монорежиме до комбинации их с оксалиплатином или если нужно было проводить 3 месяца комбинации FOLFOX/XELOX – увеличивали длительность терапии до 6 месяцев или до режима FOLFOXIRI (по выбору исследователя) или если нужно было проводить 6 месяцев адъюванта FOLFOX/XELOX, то вместо дуплета проводили лечение по схеме FOLFOXIRI. И хотя, как обычно, наличие цоДНК было ассоциировано с неблагоприятным прогнозом, по сути, исследование негативное – в общей выборке эскалация не улучшила показатели выживаемости без признаков болезни.
Возможно, не нужно было вводить различные варианты эскалации, а можно было подходить унифицированно, или нужно было разделять пациентов на группы прогноза с учетом и цоДНК, и клинических факторов и в группе неблагоприятного прогноза проводить 6 месяцев лечения, а в группе благоприятного – 3 месяца терапии; а может быть нужно применить другую стратегию – начинать XELOX и при отсутствии клиренса цоДНК эскалировать до режима FOLFOXIRI? Но, тем не менее, для 3 стадии пока цоДНК осталась прогностическим, но не предикторным маркером.
Еще одно исследование, посвященное цоДНК при резектабельных стадиях толстой кишки, заслужило устного доклада на ASCO 2025 тем, что оно проливает свет на биологию заболевания. В работе авторы определяли цоДНК по наличию мутаций, свойственных опухоли, в плазме крови после операции по поводу рака толстой кишки III стадии. Всем пациентам проводили адъювантную химиотерапию по схеме FOLFOX с или без цетуксимаба. Дополнительно среди пациентов с цоДНК+ оценивали ее клиренс (то есть переход в цоДНК-) в процессе адъюванта и параллельно также оценивали наличие эпигенетической фракции опухоли (наличие в плазме крови эпигенетических маркеров цоДНК). Исследователи обнаружили, что среди пациентов, у которых цоДНК перестала определяться мутационным анализом на фоне адъювантной терапии, и в дальнейшем развивалось прогрессирование в течение 3 лет, в плазме практически в 2 раза чаще сохранялись эпигенетические маркеры цоДНК. То есть при III стадии нужно оценивать цоДНК двумя методами для изучения эскалационных подходов к адъювантной терапии?
РАСПРОСТРАНЕННЫЕ СТАДИИ РАКА ТОЛСТОЙ КИШКИ
К вопросу об удалении метастазов по брюшине и HIPEC
Сколько было забито гвоздей в крышку HIPEC при раке толстой кишки, но хирурги так и не сдаются и продолжают разводить и нагревать. Говорят, что просто неправильно все делали, нужно HIPEC сочетать с периоперационной химиотерапией. Представлены результаты исследования III фазы CAIRO6, в котором пациентов с изолированным перитонеальным поражением раком толстой кишки рандомизировали или в группу циторедуктивной операции с HIPEC или в группу периоперационной химиотерапии (XELOX, FOLFOX или FOLFIRI и с бевацизумабом неоадъювантно) с циторедуктивной операцией и HIPEC. Исследование формально негативное: добавление химиотерапии статистически значимо не улучшало 3-летнюю ОВ – именно такая была конечная точка. В группе правосторонней локализации и при синхронном метастазировании в группе периоперационной химиотерапии отмечено улучшение ОВ (ОР 0,44).
Почему не было группы с химиотерапией и циторедуктивной операцией без HIPEC, авторы не объяснили, по-видимому, побоялись, что она победит. Тем более что в этом исследовании в группе химиотерапии медиана ОВ была на 10 мес. больше, а медиана ВБП улучшилась с 7 до 13,5 мес. Но если веришь в свой метод, то могут ли тебя остановить какието цифры и статистика? С другой стороны, результаты данной работы тоже можно имплементировать в клиническую практику: в случае синхронного метастазирования и правосторонней локализации первичной опухоли, если планируете оптимальную циторедукцию, то лечение предпочтительнее начинать с системной терапии.
К вопросу о комбинации FOLFOXIRI и анти-EGFR антител
В рекомендациях различных обществ в выборе схем первой линии лечения в течение последних нескольких лет пришли к консенсусу: при правосторонней локализации или при наличии мутаций в генах RAS оптимальным режимом лечения является FOLFOXIRI с бевацизумабом, а при левосторонней локализации и wtRAS/wtBRAF предпочтение отдается применению двойных схем – FOLFOX или FOLFIRI с анти-EGFR антителами. В основе последнего постулата лежали результаты ряда исследований: рандомизированного исследования III фазы TRIPLETE, в котором не получено различий ни в частоте объективных ответов, ни в глубине ответов, ни в выживаемости без прогрессирования между режимами FOLFOXIRI с панитумумабом и комбинацией FOLFOX с панитумумабом; рандомизированного исследования PANIRINOX – сравнение FOLFOX с панитумумабом и FOLFOXIRI с панитумумабом, только пациентов отбирали с диким типом генов RAS и BRAF по цоДНК – в группе с нерезектабельными метастазами разной локализации интенсивный режим улучшил ранее наступление ответа и ОВ, но не ЧОО, глубину ответа и ВБП. Исследователи не расстроились и подумали, что нужно отбирать больных с изолированным поражением печени на интенсивный режим. Так, в исследовании TRICE провели сравнение FOLFOXIRI с цетуксимабом и FOLFOX с цетуксимабом при wtRAS и изолированным поражением, как было сказано, неоперабельными метастазами. Хотя в характеристике пациентов 20% имели резектабельные очаги, авторы значимо увеличили глубину ответа, но получена тенденция к ухудшению ВБП.
Однако на ASCO 2025 представили обновленные результаты исследования TRIPLETE: показано улучшение ОВ в группе интенсивного режима – медиана ОВ в группе FOLFOXIRI с панитумумабом составила 41,4 мес. против 33,3 мес. в группе дуплета (ОР 0,79; р=0,049). При этом преимущество в основном у пациентов без изолированного поражения метастазами печени. Аналогичные результаты были получены и в поданализе исследования DEEPER – сравнение FOLFOXIRI с цетуксимабом и FOLFOXIRI с бевацизумабом при неоперабельных метастазах КРР с wtBRAF, wtRAS и левосторонней локализацией; подтверждено значимое улучшение глубины уменьшения проявлений болезни и ВБП при применении интенсивного режима с цетуксимабом, особенно в отсутствии изолированного поражения метастазами печени. Отсутствие эффекта в группе изолированного поражения печени связано, вероятно, с высоким процентом R0/1 резекций метастазов и трудностями в диагностике именно неоперабельного поражения печени. Таким образом, авторы исследования TRIPLETE говорят о ренессансе применения FOLFOXIRI с анти-EGFR. Следует вспомнить, что в клинических рекомендациях RUSSCO была и останется возможность применения данного режима именно при неоперабельном метастатическом раке толстой кишки. Главное, следите за токсичностью.
Если говорить о дуплетах с антиEGFR антителами, то ряд рандомизированных исследований показали, что сочетание цетуксимаба с пероральными фторпиримидинами или струйным введением фторурацила не приводило не только к улучшению ВБП и ОВ, но даже не увеличивало ЧОО. И во всех рекомендациях указана возможность сочетания анти-EGFR только с инфузионными режимами введения фторурацила. На ASCO 2025 представлены результаты рандомизированного исследования II фазы CAPCET, в котором китайские исследователи сравнили режимы FOLFOX с цетуксимабом и XELOX с цетуксимабом. Правда пришлось изменить режим его применения – оксалиплатин 85 мг/м2 1 день и капецитабин 2000 мг/м2 в 2 приема в сутки 1-7 дни 1 раз в 2 недели. Коллеги не отметили различий в ВБП, ЧОО и ОВ между сравниваемыми режимами. Осталось дождаться результатов III фазы и в европейской популяции пациентов.
К вопросу о комбинациях к тирозинкиназными ингибиторами
Попытки комбинации тирозинкиназных ингибиторов с химиотерапией при метастатическом раке толстой кишки ранее проваливались. Однако речь в таких работах шла обычно о мультитаргетных препаратах, что значимо усиливало токсичность новых режимов. Но существуют препараты с узким спектром блокируемых рецепторов, например, только семейства VEGFR – анлотиниб. В рамках рандомизированного исследования III фазы в первой линии лечения больных с метастатическим колоректальным раком и wtRAS/wtBRAF доказана неменьшая эффективность сочетания режима XELOX и анлотиниба режиму XELOX с бевацизумабом – абсолютно одинаковые медианы ВБП в 11 мес.
Трудно понять, зачем именно такое место для режима было выбрано китайскими коллегами, почему было не посмотреть эффективность данного тирозинкиназного ингибитора при прогрессировании на бевацизумабе или в популяции с правосторонним раком или mRAS. Принимая во внимание цену нового препарата, вряд ли что-то изменит данное исследование в реальной практике мира, но есть и польза от данной работы – пациентов переводили на поддерживающую терапию в случае достижения контроля болезни после 4-8 курсов, и было бы интересно посмотреть, достаточно ли 4 курсов XELOX с бевацизумабом для индукции.
Мутация в гене BRAF
Лечение пациентов с метастатическим раком толстой кишки и мутацией в гене BRAF является нетривиальной задачей, учитывая агрессивность течения болезни, низкую чувствительность к химиотерапии и зачастую низкий функциональный статус пациентов. С другой стороны, наличие ключевой причины в канцерогенезе заболевания позволяло надеяться на эффективность таргетной терапии анти-BRAF направленности, как мы это видели при меланоме с аналогичной альтерацией. Однако, как оказалось, монотерапия BRAF ингибиторами при раке толстой кишки не только не приводила к уменьшению проявлений болезни в клинических исследованиях (частота ответов от 0% до 5%), но в предклинических экспериментах показывала ускорение пролиферации опухолевых клеток за счет гиперэкспрессии EGFR и формирования обходного пути активации нижележащих BRAF молекул сигнального пути MAPK. Чтобы избежать данных проблем, исследователи комбинировали BRAF ингибиторы с анти-EGFR антителами с или без добавления МЕК ингибиторов, что позволило в рамках исследования 3 фазы BEACON во второй линии добиться частоты объективных ответов на уровне 34%, медианы ВБП 4,4 мес. и ОВ 9,9 мес. Эти скромные результаты были выше, чем стандартная терапия. Такие низкие результаты применения двойных и тройных таргетных подходов были связаны, вероятно, с тем, что уже ко 2-3 линии лечения опухоль кроме мутации в гене BRAF имела и другие мутации в генах пути MAPK, о чем свидетельствуют наблюдения, что при прогрессировании на BRAF-анти-EGFR воздействии практически у половины пациентов определялись в циркулирующей опухолевой ДНК мутации в генах данного сигнального пути, при чем в большинстве своем с поражением не менее 2 генов. Чтобы преодолеть явления первичной и вторичной резистентности, пришла мысль скомбинировать двойную таргетную блокаду с химиотерапией и желательно в первой линии, пока опухоль еще наивна и не успела развить механизмы резистентности к любой противоопухолевой системной терапии.
Не останавливаясь на результатах ретроспективных работ, приведем сразу итоги исследования III фазы BREAKWATER. В данной работе сравнили результаты комбинации режима FOLFOX с энкорафенибом и цетуксимабом (в полных дозах) со стандартным лечением (FOLFOX/ XELO/FOLFOXIRI ± бевацизумаб – на выбор врача) и просто таргетной терапий по схеме энкорафениб с цетуксимабом в первой линии терапии пациентов с метастатическим раком толстой киши с mBRAF и MSS фенотипом. На ASCO 2025 представляли результаты по выживаемости без прогрессирования (ВБП) и общей выживаемости (ОВ); как и ожидалось, применение химиотаргетной терапии с BRAF ингибитором на голову разбило стандартные подходы: ОР=0,53 (р<0,0001); медианы ВБП 12,8 против 7,1 мес., медианы ОВ 30,3 и 15,1 мес. (ОР 0,49; р<0,0001). Таргетная терапия без химиотерапии показывает скромную медиану ВБП в 6,5 мес., хотя медиана ОВ выше, чем в группе химиотерапии, – 19 мес. Частота объективных ответов составила 65,7%, 37,4% и 45,6% в группах FOLFOX с энкорафенибом и цетуксимабом, стандартного лечения и только таргетной терапии. Токсичность 3-4 степени была выше в исследуемой группе в первую очередь за счет анемии и кожной токсичности.
Эти результаты действительно меняют клиническую практику. Озвученные 30 месяцев медианы ОВ – это выше, чем у пациентов с mRAS! Очень напоминает историю с анти-Her-2 блокадой при Her2+ РМЖ – когда пациентки с самым неблагоприятным подтипом за счет новых опций в правильном назначении становятся долгожителями. Остается ряд вопросов, в первую очередь – длительность химиотерапевтического этапа. В исследование была заложена необходимость проведения лечения до прогрессирования и непереносимой токсичности. Этот момент тем более актуален, так как 20,7% пациентов в исследуемой группе полностью прекращали химиотерапию по токсичности, а редукция доз химиопрепаратов потребовалась 59,9%. Поэтому, вероятно, как в клинической практике придется ограничиваться 8 курсами комбинации, а потом переводить пациента на поддерживающую терапию BRAF ингибитором и антиEGFR антителом. Второй вопрос – что делать в отсутствии доступа к энкорафенибу? Ответ – не отчаиваться, в новой версии клинических рекомендаций RUSSCO и клинических рекомендаций МЗ будет возможность применения и других ингибиторов BRAF с химиотерапией, и если пациент не может перенести химиотерапии по тем или иным причинам, то результаты когорты только таргетной терапии показывают возможность части таких пациентам помочь и в дальнейшем перевести на комбинацию с химиотерапией. Если пациент не может перенести именно оксалиплатин из схемы, также можно комбинировать таргетную терапию и с режимом FOLFIRI – имеют данные I фазы исследования BREAKWATER по потенциальной переносимости и эффективности данной схемы.
Микросателлитная нестабильность
При мутации в гене BRAF до 10-15% пациентов имеют признаки микросателлитно-нестабильного фенотипа (MSI). Однако эффективность таргетного воздействия в случае сочетания обеих альтераций ниже, чем в отсутствии MSI. В то же время при данном фенотипе рака толстой кишки, за счет высокой мутационной нагрузки и формирования большого числа неоантигенов, опухоли чувствительны к иммунотерапии. В частности, ингибиторы белка programmed cell death-1 (PD-1) показали выдающуюся эффективность при опухолях с дефектами репарации ДНК – так называемых опухолях с дефицитом MMR (dMMR) или MSI. Это привело к первому в истории онкологии одобрению препарата вне зависимости от локализации опухоли (агностическое показание). В настоящем сообщении представлены данные долгосрочного наблюдения исследования KEYNOTE-016 – первого, изучавшего противоопухолевую активность ингибитора PD-1 пембролизумаба у пациентов с dMMR/MSI солидными опухолями. Показатели 10-летней выживаемости без прогрессирования составили 48,3%, то есть удалось вылечить половину пациентов. То есть можно заключить, что если есть MSI, то иммунотерапия является вариантом выбора первой линии.
Улучшение эффективности применения анти-PD1 антител можно достигнуть добавлением анти-CTLA4 антитела при метастатическом раке толстой кишки с dMMR/MSI. На ASCO 2025 представили обновленные результаты исследования CheckMate 8HW (сравнение IPINIVO против ниволумаба в монорежиме и химиотаргетной терапии), правда снова без данных по ОВ. Дополнили данные ВБП показателями ВБП2 – от начала 1 линии до прогрессирования на 2 линии – данные показатель был значимо выше в группе комбинированной иммунотерапии по сравнению с ниволумабом, различия в отдаленных показателях выживаемости достигали ≈10%. Интересно, что исследование показало, что частота ошибочной трактовки MSS опухолей как имеющих MSI фенотип составило 14-19%, и это в отобранных для исследования центрах! Также очень хочется дождаться результатов не только ОВ, но и данных подгруппы ниволумаба, в которой при прогрессировании назначался режим IPINIVO, а таких пациентов было порядка 11%. В этом контексте интересны результаты французского исследования INFLATE – повторное назначение ингибиторов иммунных контрольных точек при прогрессировании на них в анамнезе у пациентов с опухолями ЖКТ, ассоциированными с dMMR/MSI. В случае отмены иммунотерапии по токсичности, при дальнейшем прогрессировании в 86% назначали монотерапию анти-PD1 антителами: частота объективных ответов составила 30%, а медиана ВБП – 14,2 мес. В случае отмены иммунотерапии по поводу прогрессирования повторное ее назначение было в 71% наблюдений в виде комбинированных схем (например, IPINIVO). К сожалению, объективные ответы были зарегистрированы лишь у 11% пациентов, а медиана ВБП составила всего 5,0 мес.
Вопросы реинтродукции
Раз мы начали рассматривать исследования с повторным назначением ранее эффективных препаратов, следует отметить, что на ASCO 2025 были представлены результаты сразу нескольких проспективных работ по реинтродукции анти-EGFR антител при метастатическом раке толстой кишки. Представлены результаты рандомизированного исследования FIRE-4, в котором пациентам в третьей линии проводили или повторное назначение антиEGFR антител с иринотекан-содержащими режимами химиотерапии или назначали лечение по выбору исследователя – в большинстве своем это были также режимы с иринотеканом и анти-VEGF антителами. После рандомизации 87 пациентов исследователи не обнаружили различий в ни в медиане ВБП (ОР 0,87), ни в медиане ОВ (ОР 0,86). Можно сделать вывод, что повторенное назначение анти-EGFR работает, как и повторное назначение любых других антител и химиопрепаратов при метастатическом раке толстой кишки, показывая медиану ВБП в 4-5 мес. В исследовании не было отбора в зависимости от локализации первичной опухоли и не было отбора по циркулирующей опухолевой ДНК.
В рамках последнего уточнения в исследовании REMARRY пациентов у пациентов с wtRAS/BRAF с ответом на анти-EGFR терапию в первой линии, длительностью второй линии, которая не должна была включать анти-EGFR антитела, более 4 мес. проводился мониторинг цоДНК. В случае прогрессирования и отсутствия в цоДНК мутаций в генах RAS/BRAF пациентов переводили в исследование PURSUIT – повторное назначение анти-EGFR антител. Из 185 пациентов только 50 больным выполнена реинтродукция антитела. Частота ответов составила скромные 14%, а медиана ВБП – 3,6 мес. Несколько улучшить данные показатели стало возможным, если отбирать на повторное назначение цетуксимаба или панитумумаба по цоДНК, не ограничиваясь диким типом генов RAS/BRAF генами, принимая во внимание мутации в других генах, ассоциированных с резистентностью к антиEGFR воздействию: частота ответов – 27,8%, медиана ВБП ≈4,5 мес.
То есть мы видим, что даже при отборе по цоДНК все равно достигаются те же 4-5 мес. медианы ВБП. Тем не менее, динамика цоДНК в процессе 1-2 линии перед началом 3 линии также может подсказать, как действовать. Если цоДНК была позитивная по мутациям в генах резистентности и она остается позитивной перед началом третьей линии или она была негативной и стала позитивной, то смысла в повторном назначении анти-EGFR нет. Если она была позитивна и стала негативной, то также ответ на повторное назначение антител будет маловероятным. Оптимальным молекулярным профилем будет вариант, когда цоДНК была негативной и осталась негативной к началу третьей линии.
Если же применить подход отбора пациентов на повторное назначение, к примеру, панитумумаба на основании цоДНК и сравнить данный лечебный подход с назначением регорафениба с последующим кроссовером при прогрессировании, как это было сделано в исследовании PARERE, то мы увидим, что медиана ВБП что при назначении панитумумаба перед или после регорафениба приблизительно одинаковая – 4,1 и 3,7 мес., не различалась и частота объективных ответов – 16% и 17,4%. Также не менялась и медиана ВБП на регорафенибе в зависимости от предшествующего назначения анти-EGFR антитела – 2,4 и 3,7 мес. соответственно. К сожалению, данных по ОВ не представлено, так как ранее в исследовании REVERCE было показано, что назначение сначала регорафениба, а потом цетуксимаба было ассоциировано с большей ОВ, чем обратная последовательность.
Интересно, что применение другого анти-EGFR антитела (JMT101), с большей аффинностью к рецептору эпидермального фактора роста, чем у известных панитумумаба и, тем более, цетуксимаба, в комбинации с иринотеканом в аналогичных условиях применения, как в предыдущих работах – применение антиEGFR в первой линии, длительный период без анти-EGFR (4 и более мес.) и отсутствие в цоДНК мутаций, ассоциированных с резистентностью, – показало большую частоту объективных ответов 34,3% и медиану ВБП 7,4 мес. Если добавить к данному антителу и иринотекану еще и анти-PD1 антитело (SG001), то частота объективных ответов хоть и увеличивается до 44,1%, однако медиана ВБП уменьшается до 5,7 мес. Результаты этого рандомизированного исследования отвергают гипотезу, которая изучалась в исследовании CAVE (комбинация цетуксимаба и авелумаба), что анти-PD(L)1 антитела увеличивают эффективность анти-EGFR антител при MSS ассоциированном раке толстой кишки.
В завершение: рамки газетного сообщения не позволяют в полной мере представить, как новые данные должны восприниматься в контексте уже проведенных клинических исследований и практических рекомендаций по лечению рака толстой кишки. Многое, например, новая TNM классификация рака толстой кишки, новые молекулы, воздействующие на mKRAS G12C и mBRAF, а также постерные и тезисные работы, осталось за рамками данного формата. Более подробно исследования будут разбираться на многочисленных конференциях RUSSCO. Тем не менее, работы, представленные на ASCO 2025 и отраженные в статье, хоть и не открывают новую эру в лечении колоректального рака, «демонстрируя, как персонализированный подход и интеграция инновационных терапевтических стратегий способны кардинально изменить прогноз пациентов» (эту фразу предложил AI), однако, как писал выше, позволяют добавить новые паззлы в концепцию лечения наших пациентов.
Источники:
- Frank Sinicrope, et al. Randomized trial of standard chemotherapy alone or combined with atezolizumab as adjuvant therapy for patients with stage III deficient DNA mismatch repair (dMMR) colon cancer (Alliance A021502; ATOMIC). 2025 ASCO Annual Meeting.
- Myriam Chalabi, et al. Neoadjuvant Immunotherapy in Locally Advanced Mismatch Repair-Deficient Colon Cancer. N Engl J Med. 2024; 390: 1949- 1958.
- Andrea Cercek, et al. Nonoperative Management of Mismatch Repair– Deficient Tumors. N Engl J Med. Published: April 27, 2025.
- Jeanne Tie, et al. ctDNA-guided adjuvant chemotherapy escalation in stage III colon cancer: Primary analysis of the ctDNA-positive cohort from the randomized AGITG dynamic-III trial (intergroup study of AGITG and CCTG). 2025 ASCO Annual Meeting.
- Elena Elez, et al. First-line encorafenib + cetuximab + mFOLFOX6 in BRAF V600E-mutant metastatic colorectal cancer (BREAKWATER): Progressionfree survival and updated overall survival analyses. 2025 ASCO Annual Meeting.
- Heinz-Josef Lenz, et al. Nivolumab (NIVO) plus ipilimumab (IPI) vs chemotherapy (chemo) or NIVO monotherapy for microsatellite instabilityhigh/mismatch repair-deficient (MSI-H/ dMMR) metastatic colorectal cancer (mCRC): Expanded analyses from CheckMate 8HW. 2025 ASCO Annual Meeting.
- Ke-Feng Ding, et al. Anlotinib versus bevacizumab added to standard first-line chemotherapy among patients with RAS/ BRAF wild-type, unresectable metastatic colorectal cancer: A multicenter, prospective, randomised, phase 3 clinical trial (ANCHOR trial). 2025 ASCO Annual Meeting.
- Frank A. Sinicrope, et al. Tissue-free circulating tumor DNA assay and patient outcome in a phase III trial of FOLFOXbased adjuvant chemotherapy (Alliance N0147). 2025 ASCO Annual Meeting.
- Ignace De Hingh, et al. Perioperative systemic therapy for resectable colorectal peritoneal metastases: A multicenter randomized phase 3 trial (CAIRO6). 2025 ASCO Annual Meeting.
- Veronica Conca, et al. Upfront modified FOLFOXIRI plus panitumumab (pan) versus FOLFOX/ pan for unresectable RAS and BRAF wild-type (wt) metastatic colorectal cancer (mCRC) patients: Overall survival (OS) results from the phase III TRIPLETE study by GONO. 2025 ASCO Annual Meeting.
- Lena Weiss, et al. FIRE-4 (AIO KRK0114): Randomized study evaluating the efficacy of cetuximab re-challenge in patients with metastatic RAS wild-type colorectal cancer responding to first-line treatment with FOLFIRI plus cetuximab. 2025 ASCO Annual Meeting.
- Yoshinori Kagawa, et al. Longitudinal ctDNA monitoring and prediction of anti-EGFR rechallenge outcomes in RAS/ BRAF wild-type metastatic colorectal cancer (mCRC): The REMARRY & PURSUIT trials. 2025 ASCO Annual Meeting.
- Chiara Cremolini, et al. Panitumumab retreatment followed by regorafenib versus the reverse sequence in chemorefractory metastatic colorectal cancer patients with RAS and BRAF wild-type circulating tumor DNA (ctDNA): Results of the phase II randomized PARERE trial by GONO. 2025 ASCO Annual Meeting.
- Jianmin Xu, et al. JMT101 in combination with irinotecan and SG001 versus regorafenib in patients with metastatic colorectal adenocarcinoma (mCRC): Results of a randomized, controlled, open-label, phase II study. 2025 ASCO Annual Meeting.
НОВОСТИ ASCO 2025 / УРОТЕЛИАЛЬНЫЙ РАК
Автор: Гречухина Катерина Сергеевна
Заведующая химиотерапевтическим отделением
ГБУЗ «Московский клинический научный центр им. А.С. Логинова»,
кандидат медицинских наук, Москва
Увы, в этом году обошлось без эффектных прорывов. Представленные данные укрепляют наши позиции в текущих подходах и открывают новые окна возможностей. Посмотрим, что нового на всех фронтах – от ранних стадий до системной терапии. Начнем с более ранних стадий. Рассмотрим результаты исследования 3 фазы ANZUP 1301, в котором оценивалось добавление старого доброго митомицина к БЦЖ у пациентов высокого риска с папиллярным уротелиальным раком pTa/pT1 (± CIS) [1]. Двухлетняя безрецидивная выживаемость составила 75% против 71% в контрольной группе, однако различие не достигло статистической значимости (p=0,3) (рис.1).
Рисунок 1.
Безрецидивная выживаемость в исследовании
ANZUP 1301
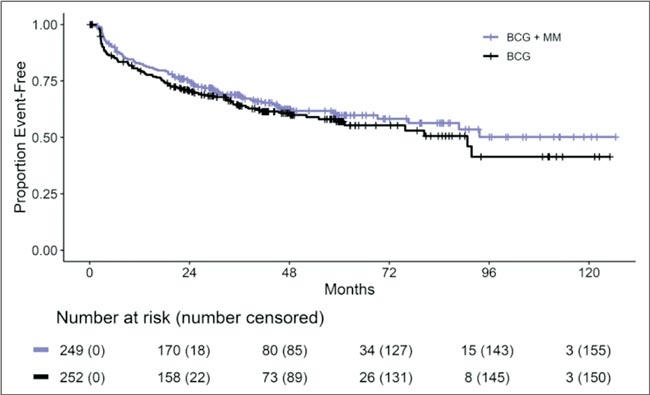
Не было получено и различий в частоте объективного ответа, ни в ОВ, но намечается маленький тренд в группе Т1 (рис.2).
Рисунок 2.
Эффективность комбинации БЦЭ и митомицина
в исследования ANZUP 1301
ANZUP 1301
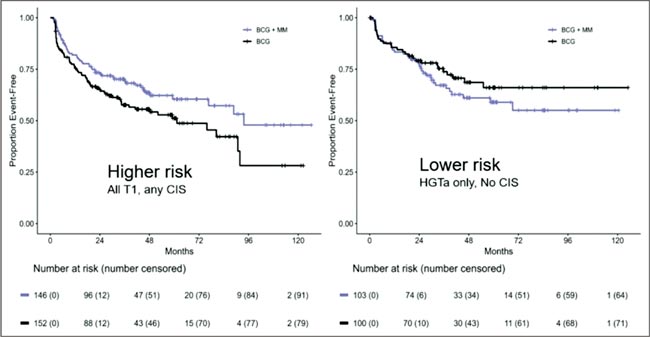
Перейдем к неоадъюванту/периоперационной терапии. Результаты исследования NIAGARA: насколько же влияет pCR, полученный в результате комбинированного подхода «химиотерапия и дурвалумаб» в неоадъювантной, а точнее, периоперационной опции. Полный ответ (pCR) часто критикуется как слишком значимая суррогатная точка к ОВ, на которую мы обращаем слишком много внимания. Что же получилось? В NIAGARA оценили влияние того самого pCR на долгосрочную выживаемость, и оказалось, что достижение pCR является крайне важным благоприятным прогностическим маркером. Добавление дурвалумаба привело к увеличению частоты полного патологического ответа (pCR) до 37% против 27% в контрольной группе [2]. Также наблюдался тренд к увеличению мОВ у пациентов, которые достигли pCR (HR 0,72; 95% CI 0,37-1,43) в сравнении с теми, кто не достиг (HR 0,84; 95% CI 0,66- 1,07), что отражено на рисунке 3.
Рисунок 3.
Графики общей выживаемости в исследовании
NIAGARA в зависимости от достижения pCR
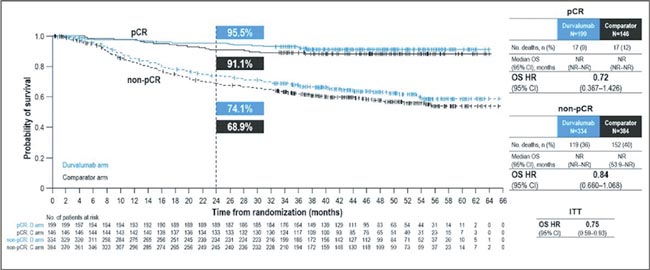
Также в рамках NIAGARA оценивалась частота выявления циркулирующей опухолевой ДНК (цоДНК) с использованием теста Signatera до и после хирургического вмешательства [3]. Частота клиренса цоДНК в группе химиоиммунотерапии составила 39% против 29% в контрольной группе, что нашло отражение и в эффективности увеличения безрецидивной выживаемости (HR 0,32; 95% CI 0,22-0,47) (рис.4).
Рисунок 4.
Результаты оценки клиренса цоДНК
в исследовании NIAGARA
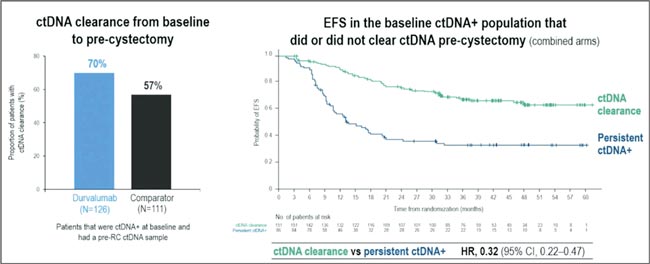
У пациентов с клиренсом цоДНК pCR достигался примерно в половине случаев. Совершенно справедливый вопрос задал М.Ю. Федянин: если клиренс цоДНК полный, можем ли мы вообще не продолжать дурвалумаб после операции? Что еще из обновленного? Немало работ было посвящено EV-302: энфортумаб ведотин + пембролизумаб в 1 линии местнораспространенного/нерезектабельного/метастатического РМП продолжает демонстрировать уверенное лидерство [4]. При медиане наблюдения в 29,1 мес. 12% пациентов все еще продолжают терапию в режиме EV+P при том, что ни один пациент не продолжает химиотерапию. Представлен обновленный анализ мВБП (рис.5) и мОВ (рис.6), который показывает, что комбинация продемонстрировала устойчивую эффективность и приемлемый профиль безопасности.
Рисунок 5.
Медиана ВБП исследования EV-302 при медиане
наблюдения 29,1 мес
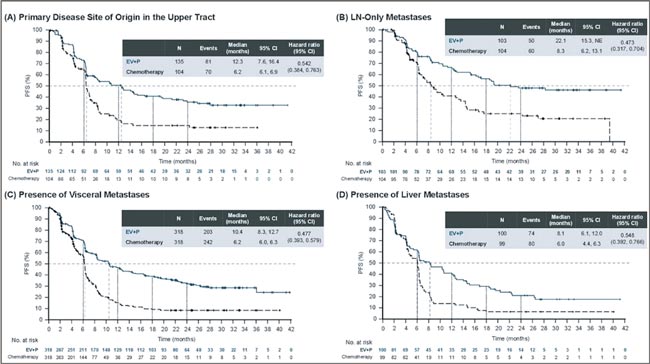
Рисунок 6.
Медиана ОВ исследования EV-302 при медиане
наблюдения 29,1 мес
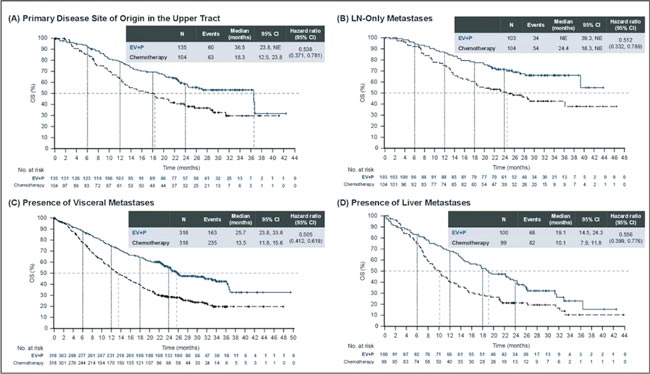
Крайне важно, что дополнительно был представлен подгруппой анализ в зависимости от локализации опухоли. Было показано, что полные ответы были достигнуты у 28,6% пациентов с локализацией опухоли в верхних мочевыводящих путях и у 31,0% с «нижней» локализацией. Среди пациентов с метастазами, ограниченными лимфатическими узлами, частота полного ответа составила 50%, тогда как у больных с висцеральными метастазами этот показатель достиг 23,5%. У пациентов с метастазами в печени отмечен более скромный, но клинически значимый эффект, при частоте полного ответа на уровне 20%. Дополнительно был проведен эксплораторный анализ пациентов, ответивших на терапию EV + пембролизумаб, который также был представлен на ASCO 2025 [5]. Как уже было отмечено ранее, достижение полного ответа (в данном случае клинического) часто критикуется как суррогат ОВ, которому мы придаем слишком много значения. Дополнительный анализ EV-302 демонстрирует, что комбинированная EV+P терапия, во-первых, позволяет удвоить достижение cCR с 14,5% до 30,4% (рис.7), а во-вторых, действительно, коррелирует с увеличением мОВ (HR 0,37; 95% CI 0,17-0,80), при этом 95,4% «полных ответчиков» в группе EV+P живы на двухлетней отметке (рис.8).
Рисунок 7.
ЧОО в исследовании EV-302

Рисунок 8.
Медиана ОВ среди «полных ответчиков»
в исследовании EV-302
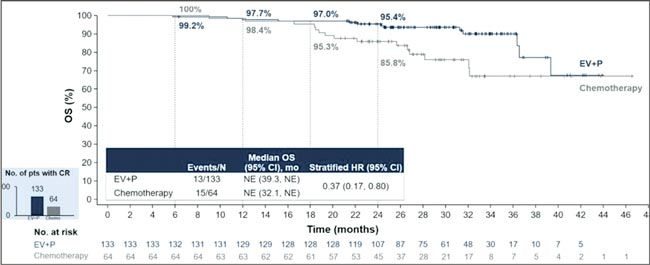
И еще один дополнительный анализ тоже касался комбинации EV + пембро в первой линии и изучал влияние редукции дозы препаратов на исходы пациентов [6]. Скорректированный регрессионный анализ продемонстрировал статистически значимое улучшение показателей выживаемости без прогрессирования и общей выживаемости у пациентов, получавших EV в редуцированной дозе. В частности, в модели с учетом временных переменных применение сниженной дозы EV ассоциировалось с уменьшением риска прогрессирования заболевания (HR 0,48; p=0,019) и смерти (HR 0,53; p=0,038), что отражено на рисунке 9.
Рисунок 9.
Результаты дополнительного анализы EV-302
в зависимости от редукции дозы
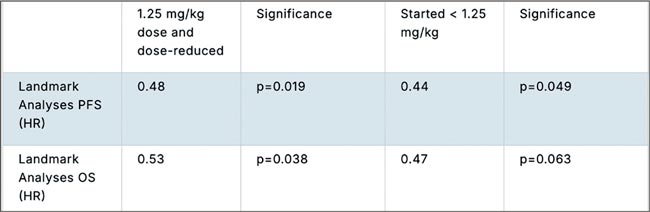
Удивительно, мы видим не только результаты «не хуже», но и даже лучше. Таким образом, комбинация EV+P продолжает утверждаться как новый стандарт первой линии терапии. Радует, что с течением времени начинают появляться исследования реальной клинической практики, которые могут дать ответ на некоторые волнующие нас вопросы. Например, были приведены результаты исследования КП, которые оценивали риски токсичности на фоне терапии комбинацией EV+Р и ее влияние на выживаемость [7]. Кожные реакции любой степени наблюдались у 60% пациентов, нейропатия – у 47%, офтальмологические нарушения – у 28%, гипергликемия – у 14% и пневмонит – у 2% больных. Прекращение лечения было зафиксировано у 20% пациентов с нейропатией, у 5% – при кожных реакциях, у 3% – при офтальмологических осложнениях и не отмечалось ни в одном случае гипергликемии или пневмонита. Среди 109 пациентов с продолжительностью наблюдения не менее трех месяцев (причём 68% получали энфортумаб ведотин в монотерапии) наличие кожной токсичности ассоциировалось со статистически значимым улучшением общей выживаемости (HR 0,401; 95% CI 0,212-0,758), что отражено на рисунке 10.
Рисунок 10.
Влияние развития кожной токсичности на общую
выживаемость пациентов на фоне терапии EV+P
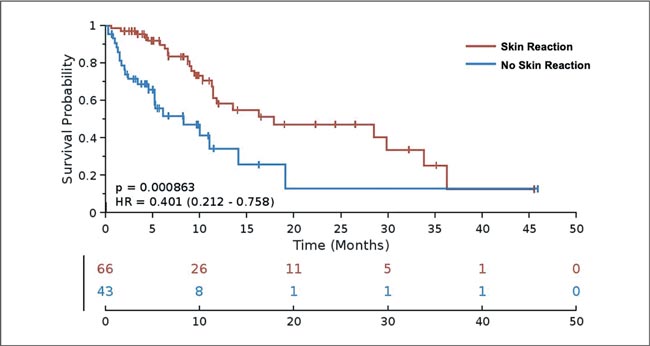
В условиях реальной клинической практики до 31% пациентов прекращали терапию EV+P из-за токсичности, что подчеркивает необходимость мониторинга и дозовой адаптации, особенно у пожилых и хрупких пациентов. Дополнительно возникает вопрос, чем же лечить пациентов после прогрессирования на этой комбинации, работает ли старый добрый режим GemCis или иная комбинация после прогрессирования на режиме EV-302. Проанализирована эффективность цитотоксической терапии у 62 пациентов, спрогрессировавших после завершения терапии EV+P в рамках реальной клинической практики (рис.11) [8].
Рисунок 11.
Распределение последующей терапии у пациентов,
спрогрессировавших после терапии в режиме EV+P
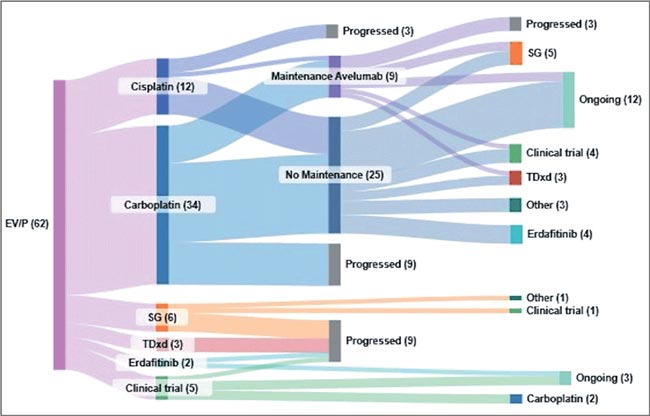
Как видно из иллюстрации, 46 пациентов получали платиносодержащий режим терапии, и общий уровень объективного ответа составил 49%. Частота ответа составила 47% в группе, получавшей карбоплатин, и 55% в группе с цисплатином. Однако полные ответы наблюдались редко: 0% в группе цисплатина и 5,9% в группе карбоплатина. Между режимами на основе цис- и карбоплатина не выявлено статистически значимых различий ни по ЧОО (p=0,7), ни по мВБП (p=0,7), но по мОВ (p=0,8). Медиана ВБП составила 4,6 мес. (95% CI 3,6-5,7), а мОВ достигла 11 мес. (95% CI 9,7-17,0), что отражено на рисунке 12.
Рисунок 12.
Эффективность платиносодержащих режимов
после прогрессирования на EV+P

Также были представлены результаты крайне любопытного исследования CheckMate 901, это исследование 3 фазы, которое сравнивало терапию в комбинации ниволумаб + ипилимумаб против гемцитабина + карбоплатина у пациентов, которые по тем или иным причинам не подходят для терапии цисплатином [9]. Дизайн исследования представлен на рисунке 13.
Рисунок 13.
Дизайн исследования CheckMate 901
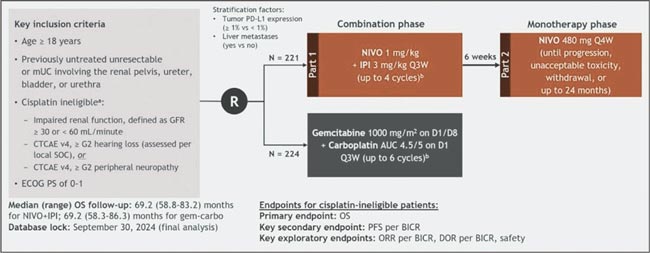
Медиана ОВ составила 19,1 мес. в группе ниво/ипи и 13,2 мес. в группе GemCarbo (HR 0,79; p=0,0245) (рис.14).
Рисунок 14.
Медиана ОВ в исследовании CheckMate 901
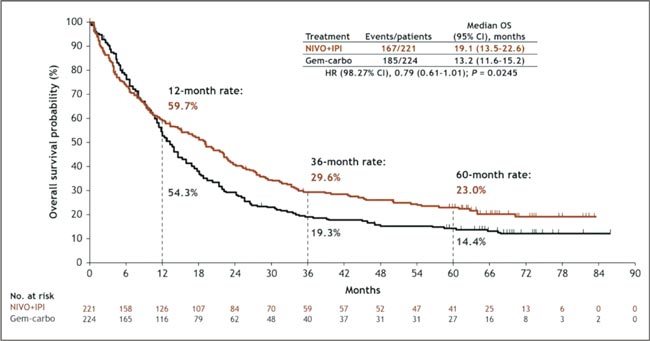
К сожалению, различия в мОВ не достигли первичной конечной точки исследования, равно как и различия в мВБП, поскольку эти показатели оказались сопоставимы (рис.15).
Рисунок 15.
Медиана ВБП в исследовании CheckMate 901
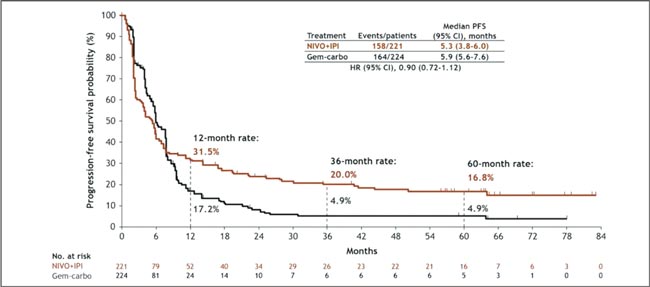
Таким образом, ASCO 2025 не преподнес нам сюрпризов, однако позволил крепче стоять на ногах в отношении опций, который уже ранее перевернули с ног на голову веху терапии распространенного уротелиального рака.
Источники:
- Dickon Hayne, et al. Mitomycin plus BCG as adjuvant intravesical therapy for high-risk, non–muscle-invasive bladder cancer: A randomized phase 3 trial (ANZUP 1301). JCO. 2025; 43: LBA4504.
- Matthew D. Galsky, et al. Additional efficacy and safety outcomes and an exploratory analysis of the impact of pathological complete response (pCR) on long-term outcomes from NIAGARA. JCO. 2025; 43: 659.
- Thomas Powles, et al. Circulating tumor DNA (ctDNA) in patients with muscle-invasive bladder cancer (MIBC) who received perioperative durvalumab (D) in NIAGARA. JCO. 2025; 43: 4503.
- Thomas Powles, et al. EV-302: Updated analysis from the phase 3 global study of enfortumab vedotin in combination with pembrolizumab (EV+P) vs chemotherapy (chemo) in previously untreated locally advanced or metastatic urothelial carcinoma (la/ mUC). JCO. 2025; 43: 664
- Shilpa Gupta, et al. Exploratory analysis of responders from the phase 3 EV-302 trial of enfortumab vedotin plus pembrolizumab (EV+P) vs chemotherapy (chemo) in previously untreated locally advanced or metastatic urothelial carcinoma (la/ mUC). JCO. 2025; 43: 4502.
- Hal Difede Rives, et al. Assessing treatment outcomes of enfortumab vedotin dose reduction in metastatic bladder cancer. JCO. 2025; 43: 4576.
- Martin Kurian, et al. Real-world enfortumab vedotin ± pembrolizumab (EV±P)–based treatment toxicity, treatment discontinuation, and associations with survival in advanced urothelial carcinoma (aUC). JCO. 2025; 43: 4562.
- Michal Sternschuss, et al. Treatment patterns and clinical outcomes with platinum-based chemotherapy after enfortumab vedotin and pembrolizumab in patients with metastatic urothelial carcinoma. JCO. 2025; 43: 4573.
- Michiel Simon Van Der Heijden, et al. Nivolumab plus ipilimumab (NIVO+IPI) vs gemcitabinecarboplatin (gem-carbo) chemotherapy for previously untreated unresectable or metastatic urothelial carcinoma (mUC): Final results for cisplatinineligible patients from the CheckMate 901 trial. JCO. 2025; 43: 4500.
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / PRODIGE 29-UCGI 26 (NEOPAN) TRIAL: FOLFIRINOX VS ГЕМЦИТАБИН ПРИ МЕСТНОРАСПРОСТРАНЕННОМ РАКЕ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Автор: Фатеева Анастасия Валерьевна
Заместитель главного врача по медицинской части
ГБУЗ «Приморский краевой онкологический диспансер»,
член общества RUSSCO, член ESMO, секретарь регионального общества RUSSCO,
Владивосток
FOLFIRINOX приводит к более длительной ВБП по сравнению с гемцитабином. Соответствующие выводы по результатам исследования III фазы опубликованы в JCO. Ранее исследование было представлено на конгрессе ESMO. Фактически обновленные данные не сильно отличаются от 2022 года.
Всего в исследование включили 171 пациента с местнораспространенным неоперабельным РПЖ, ECOG 0-1. Рандомизация 1:1 на группы FOLFIRINOX 12 курсов против 6 курсов гемцитабина.
У 48% пациентов была сосудистая инвазия верхней брыжеечной артерии, у 50% – чревного ствола, у 25% – воротной вены, у 40% – брыжеечной вены. Первичная конечная точка – ВБП, вторичные – ОВ, ЧОО.
Результаты:
- При медиане наблюдения 59,6 мес. медиана ВБП составила 9,7 мес. в группе FOLFIRINOX vs 7,7 мес. в группе гемцитабина (HR 0,7).
- Отмечено отсутствие разницы в общей выживаемости между группами: 15,7 vs 15,4 мес. (р=0,95).
Режим FOLFIRINOX достаточно хорошо себя показал при метастатическом РПЖ. Это же исследование является, наверное, первым, продемонстрировавшим бенефит FOLFIRINOX и в местнораспространенном РПЖ. Хотя и возникает вопрос, почему же все-таки при ECOG 0-1 сравнили FOLFIRINOX с монотерапией гемцитабином, а не с комбинацией наб-паклитаксела и гемцитабина?..
Рисунок.
Показатели ВБП и ОВ в группах
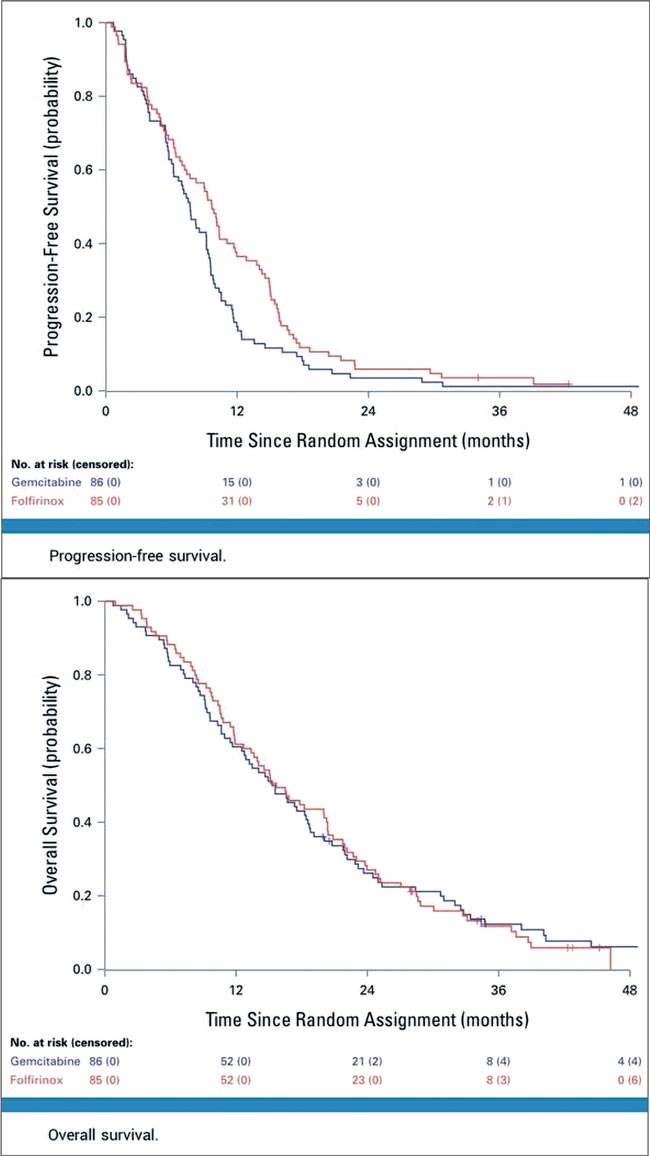
Источник:
M. Ducreux, et al. PRODIGE 29-UCGI 26 (NEOPAN): A Phase III Randomized Trial Comparing Chemotherapy With FOLFIRINOX or Gemcitabine in Locally Advanced Pancreatic Carcinoma. J Clin Oncol. May 16, 2025. doi: 10.1200/JCO-24-02210.
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / FDA ОДОБРИЛО РЕТИФАНЛИМАБ С КАРБОПЛАТИНОМ И ПАКЛИТАКСЕЛОМ ДЛЯ ПАЦИЕНТОВ С ПЛОСКОКЛЕТОЧНЫМ РАКОМ АНАЛЬНОГО КАНАЛА
Автор: Фатеева Анастасия Валерьевна
Заместитель главного врача по медицинской части
ГБУЗ «Приморский краевой онкологический диспансер»,
член общества RUSSCO, член ESMO, секретарь регионального общества RUSSCO,
Владивосток
15 мая 2025 года комбинация химиотерапии и нового чек-поинт ингибитора одобрена в качестве первой линии терапии для пациентов с неоперабельным местнорецидивирующим или метастатическим плоскоклеточным раком анального канала. Также ранее ретифанлимаб получил статус орфанного препарата для лечения рака анального канала, и эта заявка получила ускоренное назначение и приоритетное рассмотрение.
Одобрение комбинации основано на результатах исследования III фазы POD1UM-303 (InterAACT 2), представленного на конгрессе ESMO 2024, которое достигло своей первичной конечной точки, продемонстрировав значительно большую медиану ВБП по сравнению с одной химиотерапией: 9,3 против 7,4 мес. (отношение рисков 0,6395%, р=0,0006)
В исследование было включено 308 пациентов с неоперабельным рецидивным/метастатическим раком анального канала, которые были рандомизированы 1:1 на 6 циклов стандартной химиотерапии C-P плюс плацебо (группа 154 пациента) или ретифанлимаба 500 мг каждые 4 недели (также 154) в течение 1 года с возможностью кроссовера. Данные по ОВ пока незрелые, но на момент отсечения данных также отмечена тенденция к улучшению ОВ: 29,2 против 23,0 мес. (HR 0,70; 95% ДИ 0,49-1,01; p=0,0273).
Рисунок.
Выживаемость без прогрессирования в группах
ретифанлимаба и плацебо
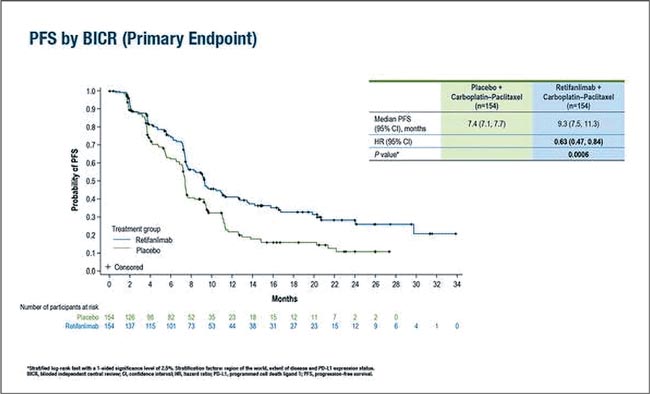
Источник:
Rao S, et al. LBA2 POD1UM-303/InterAACT 2: Phase III study of retifanlimab with carboplatin-paclitaxel (c-p) in patients (Pts) with inoperable locally recurrent or metastatic squamous cell carcinoma of the anal canal (SCAC) not previously treated with systemic chemotherapy (Chemo). Annals of Oncology. Vol.35, S1217.
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / ЛАРОТРЕКТИНИБ ЭФФЕКТИВЕН В ПЕРВОЙ ЛИНИИ ТЕРАПИИ У ПАЦИЕНТОВ СО СЛИЯНИЕМ TRK
Автор: Фатеева Анастасия Валерьевна
Заместитель главного врача по медицинской части
ГБУЗ «Приморский краевой онкологический диспансер»,
член общества RUSSCO, член ESMO, секретарь регионального общества RUSSCO,
Владивосток
В ESMO Оpen опубликован анализ трех клинических исследований по ларотректинибу, которые проводились среди и взрослых, и детей с целью объединить данные для понимания эффективности TRK ингибитора при различных опухолях.
В анализ включили 101 пациента (среди них 59 взрослых и 41 ребенок) с 14 различными типами опухолей, в том числе 30% сарком мягких тканей, по 18% – инфантильные фибросаркомы (IFS) и карциномы слюнных желез, 17% – карциномы щитовидной железы, по 4% – карциномы молочной железы и толстой кишки, по 2% – карциномы шейки матки и врожденная мезобластная нефрома и по 1% – саркомы костей, холангиокарциномы, рак наружного слухового прохода, рак желудка, липофиброматоз и карцинома легких.
Наиболее частые выявленные слияния NTRK: NTRK3 (n=58; 57%), NTRK1 (n=38; 38%) и NTRK2 (n=5; 5%).
Первичной конечной точкой выбрана общая частота объективных ответов (ЧОО, или ORR). Вторичные – DOR, ВБП и OВ.
Результаты:
- ORR для всех пациентов составила 77%.
- У 47% пациентов был полный ответ (включая 10 pCR), у 30% был частичный ответ, у 11% – стабилизация, у 9% – прогрессирование.
- ORR составила 68% (95% ДИ 54-79%) у взрослых, 90% (95% ДИ 77-97%) у детей.
- ORR у пациентов с саркомами мягких тканей (n=30), IFS (n=18), карциномой слюнных желез (n=18) и карциномой щитовидной железы (n=17) составила 77%, 100%, 89% и 53% соответственно.
- Среднее время до достижения ответа составило 1,8 месяца.
- Медиана ВБП для всех пациентов составила 61 месяц, причем для взрослых 61 месяц и 46 месяцев – для детей.
- Медиана ВБП у пациентов с мягкотканными саркомами, IFS, карциномой слюнных желез и щитовидной железы составила 32 месяца (95% ДИ 10 мес. – NE), 40 месяцев (95% ДИ 25 мес. – NE), 61 месяц (95% ДИ 31 мес. – NE) и не достигнута (95% ДИ 2 мес. – NE) соответственно.
- Медиана OВ не достигнута у всех пациентов. Пятилетняя OВ составила 76% у всех пациентов. Частота 60-месячной ОВ – 88% у детей против 67% у взрослых.
На сегодняшний день не существует рандомизированных исследований по ларотректинибу. Несмотря на это, данный анализ подчеркивает его эффективность среди пациентов со слияниями TRK.
Рисунок.
Показатели ВБП и ОВ в группах
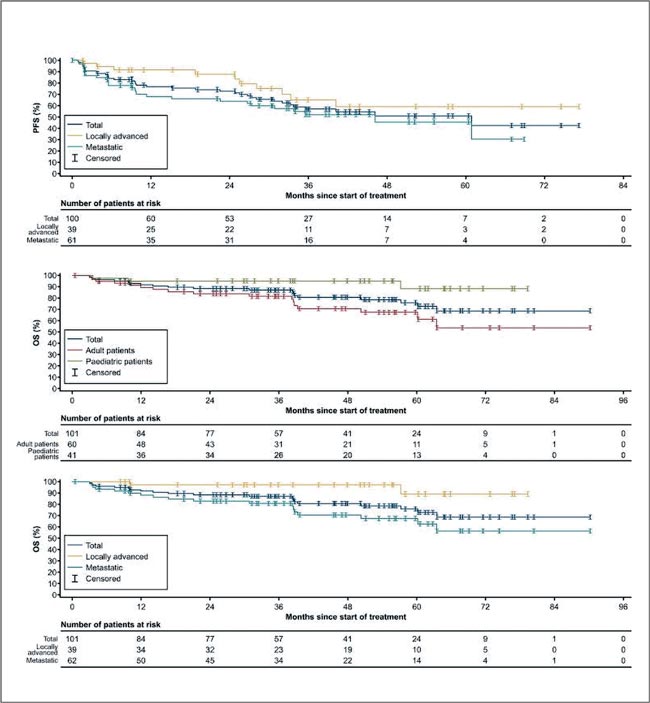
Источник:
Hong DS, et al. Efficacy and safety of larotrectinib as firstline treatment for patients with TRK fusion cancer. ESMO Open. 2025; Vol.10, Issue 6, 105110.
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / КОМПЛЕКСНЫЙ ПОДХОД К ЛЕЧЕНИЮ ОЛИГОМЕТАСТАТИЧЕСКОГО НЕМЕЛКОКЛЕТОЧНОГО РАКА ЛЕГКОГО
Автор: Черчик Алексей
Врач, радиационный онколог,
Paul Scherrer Institute,
Швейцария
Согласно концепции олигометастатической болезни, при ограниченном числе метастазов возможно достижение долгосрочной выживаемости без прогрессирования или даже излечения при условии точного стадирования, эффективной системной терапии и полного локального контроля над всеми видимыми очагами.
В международном проспективном исследовании второй фазы ETOP CHESS исследователи оценили эффективность мультимодального подхода в лечении пациентов с синхронным олигометастатическим немелкоклеточным раком легкого без активирующих драйверных мутаций. Протокол включал индукционную химиотерапию (карбоплатин с паклитакселом), иммунотерапию (дурвалумаб) и стереотаксическую лучевую терапию метастазов с последующим локальным лечением первичной опухоли (оперативное вмешательство или лучевая терапия), а после – поддерживающая терапия дурвалумабом сроком до одного года.
В исследование были включены 49 пациентов из четырех европейских стран, средний возраст составил 65 лет. Положительный статус PD-L1 отмечен у 41%.
Местнораспространенная первичная опухоль была у большинства пациентов (T3-T4 – у 67% больных, N2-N3 – у 63%).
Цель исследования – достичь однолетней выживаемости без прогрессирования у не менее 17 из 42 пациентов. В реальности только 14 пациентов (33%) достигли этого показателя, следовательно, основная цель не была достигнута.
Основные результаты:
- Медианная выживаемость без прогрессирования: 9,4 месяца.
- Однолетняя выживаемость без прогрессирования: 45%.
- Однолетняя общая выживаемость: 74,9%.
- Общий ответ на лечение: 51%.
- Нежелательные явления третьей степени и выше: у 34%.
- Пневмонит третьей степени: у 11%.
- Фатальных осложнений не зафиксировано.
Почему исследователям не удалось достичь цели?
Основная причина – раннее системное прогрессирование заболевания более чем у четверти пациентов, особенно в индукционной фазе, связанное, вероятно, с изначальной большой локальной распространенностью первичных опухолей у участников (высокие стадии по параметрам T и N).
Перспективы дальнейших исследований
Начат набор во вторую когорту исследования CHESS, где в схему добавлена двойная иммунотерапия: дурвалумаб в сочетании с тремелимумабом (ингибитором CTLA-4). Цель – усилить контроль над микроскопическими очагами уже на начальных этапах лечения.
Основные выводы исследователей:
- Комбинация химиоиммунотерапии и стереотаксической лучевой терапией безопасна.
- Отсутствие достижения первичной цели компенсируется многообещающей общей выживаемостью.
- ! Высокая частота раннего прогрессирования требует усиления индукционной терапии.
В итоге исследование CHESS можно рассматривать как еще один важный этап на пути к персонализированному комплексному лечению пациентов с синхронным олигометастатическим немелкоклеточным раком легкого. Несмотря на то, что главная цель исследования не была достигнута, обнадеживающие данные по общей выживаемости подтверждают необходимость продолжения работы в этом направлении.
Источник:
Matthias Guckenberger, et al. Multimodality treatment in synchronous oligometastatic NSCLC: Analysis of the ETOP CHESS trial. Lung Cancer. June 2025; Vol.204, 108553.
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / ALEK-B: ЭФФЕКТИВНО ЛИ СОЧЕТАНИЕ АЛЕКТИНИБА И БЕВАЦИЗУМАБА?
Авторы: Боровков Иван Максимович
Врач-онколог, аспирант отделения торакальной онкологии
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина»
Минздрава России, медицинский переводчик в сфере
профессиональной коммуникации, Москва
Хагажеева Мадина Назировна
Врач-онколог отделения противоопухолевой лекарственной терапии №3
отдела лекарственного лечения ФГБУ «НМИЦ онкологии им. Н.Н. Блохина»
Минздрава России, кандидат медицинских наук, Москва
Мутация в гене ALK при немелкоклеточном раке легкого встречается у 3-9% пациентов, ассоциируется с высокой частотой метастатического поражения головного мозга и является одной из наиболее таргетируемых. За последнее время возможности лечения пациентов с немелкоклеточным раком легкого с активными мутациями заметно расширились, поскольку доступно несколько ингибиторов третьего поколения с различными профилями эффективности и переносимости, тем не менее, глобальные показатели 5-летней выживаемости остаются ниже 20%, что подчеркивает необходимость изучить терапевтические комбинации, которые могут привести к увеличению долгосрочной выживаемости для этой подгруппы пациентов. Хотя имеются обнадеживающие данные о добавлении бевацизумаба к ИТК EGFR, эта схема не исследовалась для большой популяции пациентов с ALK-реаранжированным НМРЛ и кандидатов на ингибиторы ALK.
Одним из первых таргетных препаратов, применявшихся при распространенном ALK-мутантном НМРЛ, стал кризотиниб, который еще в 2013 году показал большую эффективность по сравнению со стандартной химиотерапией в первой линии, увеличив медиану выживаемости без прогрессирования (ВБП) с 3,0 до 7,7 мес. (ОР 0,49; p<0,001) [1]. Статистически значимых различий по показателю общей выживаемости (ОВ) в исследовании получено не было, что может быть объяснено допустимостью кроссовера между группами. Следующим эволюционным этапом стало появления мультикиназного ингибитора второго поколения алектиниба, сумевшего еще больше отдалить прогрессирование болезни, достигнув медиану ВБП в 34,8 мес. (по сравнению с 10,9 мес. в группе кризотиниба), улучшив ОВ у пациентов с метастазами в головном мозге на старте лечения (ОР 0,58; p=0,047) и продемонстрировав явную тенденцию к улучшению ОВ в общей группе больных (ОР 0,70; p=0,061) (рис.1.) [2].
Рисунок 1.
Общая выживаемость в исследовании ALEX
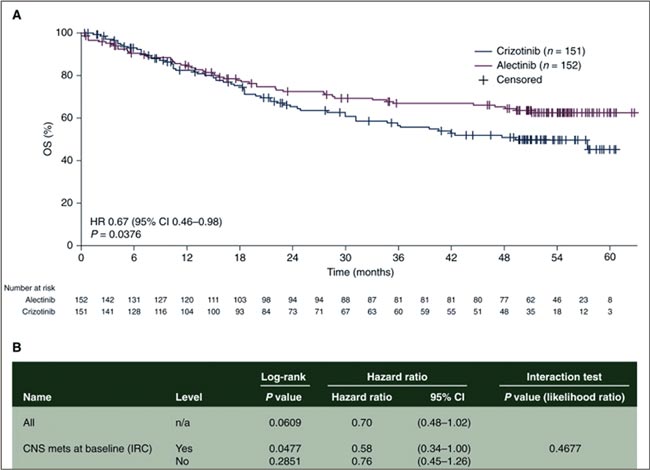
Новой вершиной стала публикация в июне 2024 года результатов исследования CROWN, поставившего временно точку в споре о том, какой же препарат обладает наибольшей эффективностью. Так, при медиане наблюдения в 60,2 мес. медиана выживаемости без прогрессирования при назначении лорлатиниба достигнута не была, в группе кризотиниба составила 9,1 мес. (ОР 0,19), а показатель 5-летней выживаемости без прогрессирования в двух группах составил 60% и 8% соответственно (рис.2). Аналогичные данные были представлены и в отношении выживаемости без прогрессирования по ЦНС. Подобные результаты позволили FDA и EMA незамедлительно зарегистрировать данный протокол в качестве нового стандарта 1 линии лечения диссеминированного ALK-мутированного НМРЛ [3].
Рисунок 2.
Выживаемость без прогрессирования
в исследовании CROWN
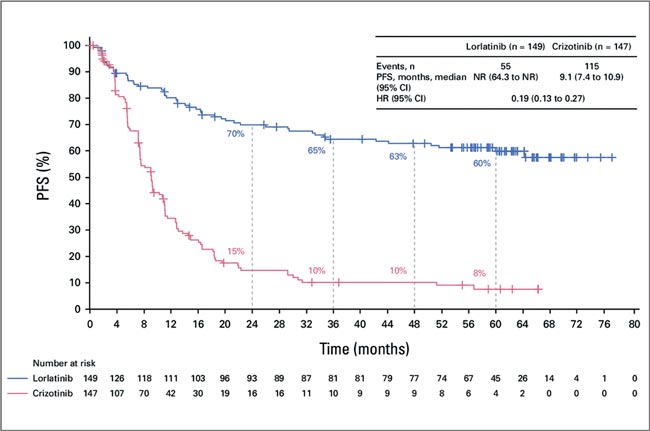
Несмотря на свою эффективность, доступность лорлатиниба в широкой популяции заметно ограничена, что диктует необходимость поиска альтернативных подходов. Одним из таких вариантов может служить исследование II фазы ALEK-B, авторы которого в мае 2025 года представили результаты анализа эффективности комбинации алектиниба и бевацизумаба у нелеченых пациентов с ALK-мутированным диссеминированным НМРЛ [4]. Возможной причиной появления подобной комбинации могли служить результаты исследования BRAIN, показавшего эффективность бевацизумаба при наличии метастазов в головном мозге, риск появления которых заметно повышен у пациентов с мутацией ALK. Работа включила 41 пациента, среди которых преобладал статус ECOG 0-1 (80,4%), наиболее распространенной зоной метастазирования являлись отдаленные лимфоузлы (63,4%), контралатеральное легкое (61%) и кости (56,1%), а метастазы в головном мозге определялись у 17%.
При медиане наблюдения в 34,5 мес. показатель 12- и 36-месячной выживаемости без прогрессирования составил 97,1% и 64,2%, соответственно (рис.3). Значимых различий по данному показателю в зависимости от варианта альтерации получено не было – 100% и 55,6% для EML4-ALK 3 и 100% и 59,8% для прочих типов EML4-ALK. Аналогичные показатели общей выживаемости составили 100% и 87,9%, а объективный ответ был зарегистрирован у 100% пациентов – частичный ответ у 87,8% и полный ответ у 12,2%. Как и в предыдущих работах, лечение обеспечивало прекрасный интракраниальный контроль с достижением 3-летней ВБП в ЦНС у 87,8% пациентов.
Рисунок 3.
ВБП и ОВ в ALEK-B

В то же время внимание на себя обращает профиль безопасности терапии. Нежелательные явления ≥3 степени были выявлены у 46,3% пациентов, наиболее распространенными из которых были протеинурия (22,0%), увеличение концентрации ферментов АЛТ (17,1%) и АСТ (9,8%). При этом у 43,9% пациентов из-за токсичности потребовалась полная отмена бевацизумаба с продолжением монотерапии алектинибом, а ведущей причиной служила тяжелая протеинурия (88%). Отмена препарата ассоциировалась с эффективным разрешением протеинурии у абсолютного большинства больных, и лишь у 1 пациента через 12 недель после прекращения бевацизумаба отмечались признаки протеинурии 2 степени.
Таким образом, исследование вызывает смешанные впечатления. С одной стороны, мы видим значительное снижение риска прогрессирования в первые 12 месяцев терапии при непрямом сравнении с протоколами по монотерапии алектинибом и лорлатинибом. С другой же, комбинация в настоящем исследовании почти не отличается по отдаленным результатам от алектиниба. Так, данные реальной клинической практики описывают при монотерапии аналогичные 3-летние общую и безрецидивную выживаемость в 85,7% и 69,3% [5] соответственно, что вместе с необходимостью отмены бевацизумаба у 44% ставит под вопрос изолированное влияние бевацизумаба на данные показатели.
Авторы сообщают, что медиана длительности применения бевацизумаба составила 22,7 мес., а лечение проводилось с использованием максимально допустимой дозировки (15 мг/кг), что, возможно, могло послужить причиной столь высокой частоты тяжелой протеинурии с необходимостью отмены препарата. В то же время подобная схема действительно позволила предотвратить раннее прогрессирование у большинства больных и заметно превысить даже результаты 12-месячной ВБП в исследовании CROWN (97,1% против 78%). Конечно, крайне сложно делать выводы на основании небольшого исследования 2 фазы, но можно предположить, что добавления бевацизумаба обеспечивает дополнительный контроль заболевания на ранних этапах лечения. Будет ли сохраняться подобный эффект при комбинировании бевацизумаба с лорлатинибом? Можно ли уменьшить риск протеинурии за счет снижения дозы препарата до 7,5 мг/ кг без потери эффективности? Является ли терапия бевацизумабом до прогрессирования или токсичности необходимой или она может быть ограничена 12 месяцами? На все эти вопросы ответа в настоящий момент нет, но они открывают поле возможностей для дальнейших исследований, которые, возможно, смогут уточнить показания для применения бевацизумаба в сочетании с киназными ингибиторами при ALK-мут. НМРЛ. Однако до тех пор, пока ситуация не будет уточнена в новых работах, добавление бевацизумаба (особенно в рамках указанного протокола) к алектинибу представляется мало оправданным, а наиболее значимыми вопросами являются необходимость уточнения кратности и дозировки введения бевацизумаба, выработка персонализированных критериев эффективности комбинированной терапии (возможно, локализация метастазов?) и анализ финансовой стороны терапии с учетом коррекции возникающих нежелательных явлений.
Источники:
- Shaw AT, Kim DW, Nakagawa K, et al. Crizotinib versus chemotherapy in advanced ALK-positive lung cancer. N Engl J Med. 2013 Jun 20; 368(25): 2385- 94. doi: 10.1056/NEJMoa1214886. Epub 2013 Jun 1. Erratum in: N Engl J Med. 2015 Oct 15; 373(16): 1582. doi: 10.1056/NEJMx150036. PMID: 23724913.
- Mok T, Camidge DR, Gadgeel SM, et al. Updated overall survival and final progression-free survival data for patients with treatment-naive advanced ALK-positive non-small-cell lung cancer in the ALEX study. Ann Oncol. 2020 Aug; 31(8): 1056-1064. doi: 10.1016/j.annonc.2020.04.478. Epub 2020 May 11. PMID: 32418886.
- Solomon BJ, Liu G, Felip E, et al. Lorlatinib Versus Crizotinib in Patients With Advanced ALKPositive Non-Small Cell Lung Cancer: 5-Year Outcomes From the Phase III CROWN Study. J Clin Oncol. 2024 Oct 10; 42(29): 3400-3409. doi: 10.1200/JCO.24.00581. Epub 2024 May 31. PMID: 38819031; PMCID: PMC11458101.
- Arrieta O, Lara-Mejía L, Rios-Garcia E, et al. Alectinib in combination with bevacizumab as first-line treatment in ALK-rearranged non-small cell lung cancer (ALEK-B): a single-arm, phase 2 trial. Nat Commun. 2025; 16: 4553. https://doi.org/10.1038/s41467-025- 59744-9.
- Singh A, Noronha V, Patil V, et al. Safety and Efficacy of Alectinib in the First Line for ALK-Mutated Lung Cancer: A Real-World Data from India. South Asian J Cancer. 2025; 00(00): 00-00. doi: 10.1055/s-0045- 1806811.
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / ЭФФЕКТИВЕН ЛИ ДАТОПОТАМАБ ДЕРУКСТЕКАН ПОСЛЕ ОСИМЕРТИНИБА ПРИ EGFR-МУТАНТНОМ НМРЛ?
Авторы: Боровков Иван Максимович
Врач-онколог, аспирант отделения торакальной онкологии
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина»
Минздрава России, медицинский переводчик в сфере
профессиональной коммуникации, Москва
Датопотамаб дерукстекан (DatoDXd, DS-1062) является относительно новым конъюгатом, стремящимся занять прочные позиции во многих областях клинической онкологии и, особенно, в лечении немелкоклеточного рака легкого (НМРЛ). Высокая ожидаемая эффективность препарата объяснялась активной экспрессией в опухолях легкого TROP2 – трансмембранного гликопротеина-мишени, участвующего в регуляции процессов клеточного роста, опосредующего опухолевую инвазию и определяющегося у абсолютного большинства пациентов как с плоскоклеточным раком, так и с аденокарциномой. Однако подобные ожидания не были полностью подтверждены в клинических испытаниях. Так, в исследовании TROPION-Lung01 назначение датопотамаба дерукстекана во 2 линии терапии диссеминированного НМРЛ ассоциировалось с достоверным, но клинически неоднозначным увеличением медианы выживаемости без прогрессирования до 4,4 мес. (ОР 0,75; 95% ДИ 0,62-0,91; p=0,004) по сравнению с 3,7 мес. в группе доцетаксела [1]. Более того, высокая эффективность не подтвердилась и в схожем по дизайну исследовании EVOKE-01, в котором назначение сацитузумаба говитекана (СГ) во второй линии после ингибиторов контрольных точек и/или таргетных препаратов вовсе не приводило к увеличению ни общей (11,1 мес. против 9,8 мес. в группе доцетаксела, p=0,0534), ни безрецидивной выживаемости (4,1 мес. против 3,9 мес. в группе доцетаксела). Полученные результаты несколько остудили интерес к препарату, сулив ему в лучшем случае роль малотоксичной альтернативы привычному доцетакселу, поскольку профиль безопасности датопотамаба действительно отличался от последнего значительно меньшим числом нежелательных явлений >3 ст. – 24,6% против 41,4%. Казалось бы, препарату не суждено войти в широкую практику даже при условии его регистрации, однако иные данные были получены в ряде узконаправленных исследований. Так, в TROPION-Lung02 (фаза 1b) изучение комбинации Dato-DXd с другими препаратами у пациентов с предлеченным EGFR+ НМРЛ показало умеренную противоопухолевую активность конъюгата, особенно при высоком уровне экспрессии TROP2. Другой важной работой стало исследование II фазы TropionLung05 [3]. Ключевой особенностью и ведущим критерием включения в данную работу служило обязательное наличие активирующих мутаций и ранее проводимой соответствующей таргетной терапии. Среди 137 пациентов у 56,9% определялась мутация EGFR (ex19 – 29,9%, ex20 T790M – 19%, ex21 L858R – 18,2%), у 24,8% – ALK, а у 21,8% – альтерации RET, MET ex14, BRAF или амплификация MET. При медиане количества предшествующих линий терапии, равной 3, назначение датопотамаба дерукстекана позволило добиться объективного ответа у 35,8% (в том числе полного ответа у 2,9% и частичного ответа у 32,8%), а медиана длительности сохранения ответа составила 7 месяцев. Хотя исследование и не предполагало сравнение отдаленных результатов лечения, анализ данных показателей продемонстрировал достижение медиан ВБП в 5,4 мес. и ОВ в 13,6 мес. (рис.1).
Рисунок 1.
ВБП и ОВ в исследовании Tropion-Lung05
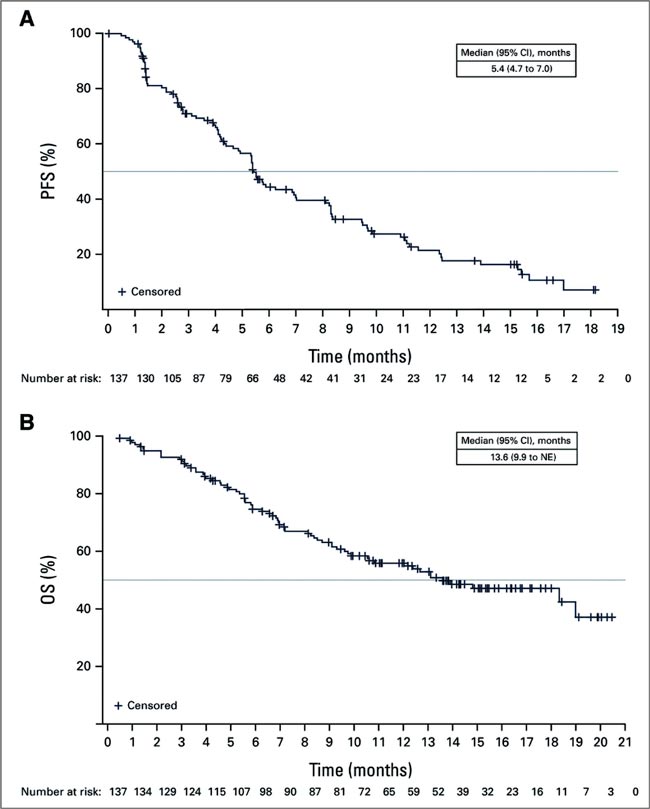
Другой работой, нацеленной на изучение эффективности датопотамаба дерукстекана при прогрессировании на фоне осимертиниба, является продолжающееся исследование ORCHARD, обновленные данные которого были представлены на ELCC2025 [4]. Авторы показали, что назначение комбинации осимертиниба и датопотамаба дерукстекана при прогрессировании позволило добиться стойкого объективного ответа у 43% (при дозировке дато 4 мг) и 36% (дато 6 мг) пациентов. При этом конкретная дозировка коррелировала с длительностью ответа: в группе 4 мг спустя 9 месяцев наблюдения ответ сохранялся у 15%, а в группе 6 мг – у 64%. Медиана выживаемости без прогрессирования в двух подгруппах составила 9,5 и 11,7 мес. соответственно. Увеличение дозы препарата также характеризовалось ростом токсичности – частота нежелательных явлений ≥3 ст. составила 34% и 56%, а редукция дозы из-за токсичности потребовалась у 23% и 59% соответственно. Несмотря на это, сами авторы приходят к выводу, что дозовый режим с применением 6 мг препарата ассоциируется с наибольшим клиническим эффектом и заслуживает дальнейшего изучения.
Сегодня мы опять сталкиваемся с неоднозначными данными. С одной стороны, Dato-DXd продемонстрировал приемлемый профиль безопасности с преимущественно управляемыми побочными эффектами, а представленные результаты демонстрируют шансы на достижение длительного стойкого ответа при назначении датопотамаба после прогрессирования на ИТК даже у тяжело предлеченных пациентов. С другой же – отдаленные результаты лечения мало отличаются от описанных в том же TropionLung01, не сильно превосходят доцетаксел и значительно уступают комбинации ABCP, показавшей возможность достижения 41,9% 3-летней ОВ. Помимо этого, все большее число данных говорит о возможности реинтродукции осимертиниба, демонстрирующего в «реальной клинической практике» схожие 4,4 месяца безрецидивной выживаемости [5]. Также не стоит забывать и про прочие альтернативы в виде платиносодержащих схем ± бевацизумаб и амивантанаб + лазертиниб (одобрен FDA, но пока не дошел до РФ). Таким образом, пока все еще сложно назвать датопотамаб дерукстекан препаратом, оправданно претендующим на звание «нового стандарта» в какойлибо подгруппе или линии лечения больных. Однако его важными преимуществами являются невысокая токсичность, позволяющая рекомендовать его даже пациентам с отягощенным соматическим статусом или исчерпанными функциональными/гематологическими резервами, а также принципиально иной механизм действия, допускающий применение препарата при исчерпании более привычных вариантов противоопухолевой терапии.
Литература:
- Ahmed Y, Berenguer-Pina JJ, Mahgoub T. The Rise of the TROP2- Targeting Agents in NSCLC: New Options on the Horizon. Oncology. 2021; 99(10): 673-680. doi: 10.1159/000517438. Epub 2021 Jul 19. PMID: 34280931.
- Paz-Ares LG, Juan-Vidal O, Mountzios GS, et al. Sacituzumab Govitecan Versus Docetaxel for Previously Treated Advanced or Metastatic Non-Small Cell Lung Cancer: The Randomized, OpenLabel Phase III EVOKE-01 Study. JCO. Published 31 May 2024. https:// doi.org/10.1200/JCO.24.00733.
- Sands J, Ahn MJ, Lisberg A, et al. Datopotamab Deruxtecan in Advanced or Metastatic Non-Small Cell Lung Cancer With Actionable Genomic Alterations: Results From the Phase II TROPION-Lung05 Study. J Clin Oncol. 2025 Apr; 43(10): 1254-1265. doi: 10.1200/JCO-24- 01349. Epub 2025 Jan 6. PMID: 39761483; PMCID: PMC11949215.
- Le X, et al. Osimertinib (osi) + datopotamab deruxtecan (DatoDXd) in patients (pts) with EGFRmutated (EGFRm) advanced NSCLC (aNSCLC) whose disease progressed on first-line (1L) osi: ORCHARD. Journal of Thoracic Oncology. Vol.20, Issue 3, S2-S4.
- Hayashi H, Nishio M, Takahashi M, Tsuchiya H, Kasahara-Kiritani M. Real-World Data About Treatment Outcomes for Patients with EGFRMutated NSCLC Resistance to Osimertinib and Platinum-Based Chemotherapy. Adv Ther. 2023 Oct; 40(10): 4545-4560. doi: 10.1007/ s12325-023-02616-9. Epub 2023 Aug 12. PMID: 37572265; PMCID: PMC10499725.
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / ЭФФЕКТИВНОСТЬ АДЪЮВАНТНОЙ ХТ ПРИ ГЕРМИНОГЕННЫХ ОПУХОЛЯХ ЯИЧКА (ГОЯ) I СТАДИИ – ДАННЫЕ ИТАЛЬЯНСКОЙ БАЗЫ ДАННЫХ
Принимая во внимание редкую встречаемость ГОЯ, зачастую коллегам тяжело разобраться в вопросах проведения адъювантной терапии в той или иной клинической ситуации при I стадии заболевания. Кратко напомним, что показанием к проведению аХТ при несеминомных ГО (НГО) является наличие лимфоваскулярной инвазии (LVI), а для пациентов с семиномами (СГО) разработана специальная шкала, оценивающая размер первичной опухоли, LVI и инвазию в rete testis, и стратифицирующая больных в 3 группы риска (подробнее https://rosoncoweb.ru/standarts/ RUSSCO/2023/2023-34.pdf).
Итальянские коллеги оценили как решение врача о тактике адъювантного лечения влияло на безрецидивную выживаемость (БРВ).
В анализ включено 184 пациента (129 с СГО и 54 с НГО). Адъювантная терапия проведена 58,1% пациентов с СГО и 57,4% - с НГО. Стоит обратить внимание на четкий тренд в сторону отказа от проведения адъювантной ЛТ в пользу ХТ (с 66,7% (до 2014 года) до 0% (начиная с 2018 года).
Рисунок 1.
Частота применения адъювантных методов с 2000
по 2023 гг.

Рисунок 2.
Показатели БРВ при СГО и НГО в группах
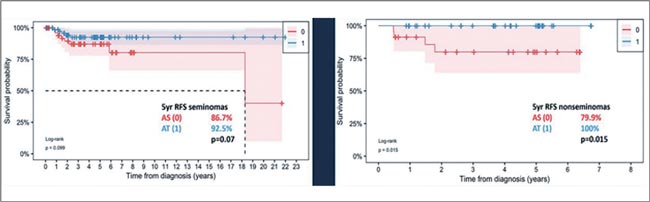
При медиане наблюдения 56,9 мес.:
- Пятилетняя БРВ во всей изучаемой когорте составила 94,6% и 84,7% (р=0,005) для групп адъювантной терапии и активного наблюдения соответственно;
- Пятилетняя БРВ при СГО – 92,5% и 86,7% (р=0,07) в вышеупомянутых группах соответственно;
- ! Пятилетняя БРВ при НГО – 100% и 79,9% в группах адъювантного лечения и активного наблюдения соответственно (р=0,015).
Результаты данной работы демонстрируют важность четкого соблюдения рекомендаций по лечению ГО. Проведение всего одного курса ХТ (карбоплатин AUC7 для СГО и ВЕР для НГО) позволяет свести к минимуму риск дальнейшего прогрессирования заболевания и излечить большинство больных. В случае если в Вашей клинической практике будет пациент с ГО, и у Вас возникнут сомнения относительно тактики лечения, направьте телемедицинскую заявку в один из НМИЦ онкологии РФ – это возможность проконсультироваться с коллегами, обладающими большим опытом в данной нозологии, и минимизировать риск ошибки.
Источник:
Isabella Caraglia et al Therapeutic decisions and outcome of patients with stage I testicular germ cell tumor: single center experience. Abstract 5020
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / ПРОГНОСТИЧЕСКАЯ ЗНАЧИМОСТЬ ПСА >0,2 ПОСЛЕ 6-12 МЕС. ТЕРАПИИ ПО ПОВОДУ МГЧРПЖ – ДАННЫЕ РЕГИСТРА IRONMAN
Достижение ультранизких значений ПСА (<0,2 нг/мл) в процессе первой линии терапии мГЧРПЖ продемонстрировало свою прогностическую значимость в клинических исследованиях. Однако работает ли это правило в реальной клинической практике?
В многонациональный регистр IRONMAN включено 1219 пациентов, получивших терапию первой линии АДТ + ИАС ± доцетаксел. В зависимости от достигнутого уровня ПСА в конкрентную временную точку пациенты разделены на 3 группы: ПСА <0,1, ПСА 0,10-0,19, ПСА ≥0,2. Первичная конечная точка – однолетняя ОВ.
Большинство пациентов представлены de novo мГЧРПЖ, у трети пациентов в анамнезе РПЭ или ДЛТ, дуплет с ИАС проводился 88% больным, остальным – тройная комбинация.
- К 6-месяцам терапии неопределяемый уровень ПСА отмечен у 35% пациентов, у 48% - ПСА ≥0.2. К 12 месяцам лечения число больных, достигших ПСА <0,1 возросло до 50%, а количество пациентов с ПСА ≥0.2 снизилось до 32%;
- Медиана ОВ в группе пациентов с уровнями ПСА <0,1 и 0,1-0,19 не достигнута, а при ПСА ≥0,2 составила 29 мес.;
- 3-летняя ОВ равнялась 84%, 79%, 45% (р <0,001) в вышеупомянутых группах соответственно;
- Медиана ВБП также не достигнута в группах ПСА <0,2, а среди пациентов с ПСА ≥0,2 составила 23 мес.;
- 3-летняя ВБП равнялась 80%, 62%, и 41% (р <0,001) соответственно;
- Прогностическая значимость достигнутого ПСА продемонстрирована вне зависимости от класса ИАС (абиратерона ацетат vs «-амиды»), двойной или тройной комбинации.
Рисунок 1.
Показатели 3-летней ОВ в группах
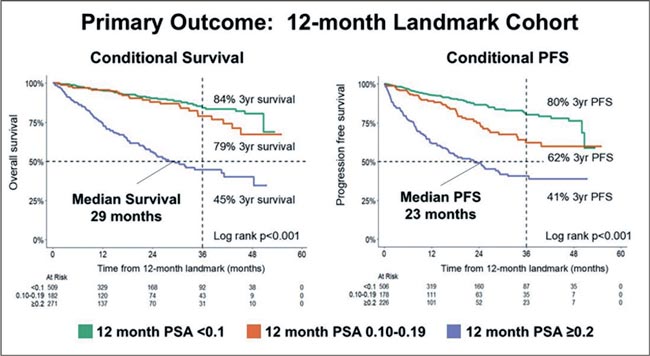
В крупном ретроспективном анализе показана важность достижения минимального уровня ПСА в процессе терапии первой линии, возможно, пациенты с уровнем ПСА ≥0,2 являются кандидатами для эскалации терапии, но верность этой мысли докажут лишь дальнейшие исследования.
Источник:
Michal Ong et al. Prognostic significance of PSA>0.2 after 6-12 months treatment for metastatic hormone-sensitive prostate cancer (mHSPC) intensified by androgenreceptor pathway inhibitors (ARPI): A multinational real-world analysis of the IRONMAN registry. ASCO 2025 Abstract 5002
РАЗМЫШЛЕНИЯ В ОТРЫВЕ ОТ РУТИНЫ / ПЕРВОЕ РАНДОМИЗИРОВАННОЕ ИССЛЕДОВАНИЕ ДОКАЗАЛО ПРЕИМУЩЕСТВО ИНИЦИАЛЬНОЙ ЦИТОРЕДУКЦИИ (ПО СРАВНЕНИЮ С ИНТЕРВАЛЬНОЙ) ПРИ РАКЕ ЯИЧНИКОВ. НО ПОЧЕМУ НЕ ХОЧЕТСЯ КРИЧАТЬ «УРА»?
Автор: Жуков Николай Владимирович
Руководитель отдела междисциплинарной онкологии
ФГБУ «НМИЦ Детской гематологии, онкологии и иммунологии им. Д. Рогачева»,
доцент кафедры онкологии, гематологии и лучевой терапии
РНИМУ им. Н.И. Пирогова, член правления RUSSCO,
доктор медицинских наук, профессор, Москва
Рак яичников до настоящего времени остается одним из основных «убийц» женского населения, что в значительной части связано с его бессимптомным течением и выраженной распространенностью опухолевого процесса на момент первоначального диагноза у многих пациенток. И именно в этой категории больных (III-IV стадия) на протяжении длительного времени существовала терапевтическая дилемма, касающаяся оптимального времени выполнения хирургического вмешательства. Всеми признавалось, что целью операции является полная или хотя бы оптимальная циторедукция, но существовало два возможных подхода её достижения – проведение циторедуктивной операции до начала химиотерапии (up-front) или в ее процессе, после нескольких курсов «неоадъювантной» химиотерапии (интервальная циторедукция). Изначально казалось, что эти два подхода могут существовать параллельно и «подстраиваться» под клиническую ситуацию – инициальная циторедукция для тех, кто заведомо может быть оперирован без проблем и рисков тяжелых последствий (стома, множественные резекции и анастомозы и т.д.), для остальных же – интервальная циторедукция, т.е. проведение операции в гораздо лучших условиях, обусловленных сокращением объема опухолевого поражения за счет проведения предоперационной химиотерапии. Однако нарастающий объем непрямых доказательств (полученных в рамках ретроспективного анализа данных), свидетельствующих о том, что при проведении инициальной циторедукции в экспертных клиниках с высокой хирургической активностью удается добиться значимо лучших (разница в медиане выживаемости достигала нескольких лет) результатов, привел к формированию групп экспертов-энтузиастов такого подхода, весьма убедительно отстаивающих преимущество инициальной циторедукции. Проведенные рандомизированные исследования, не показавшие преимуществ инициальной циторедукции подвергались справедливой критике за дефекты дизайна (в число участников исследований включались клиники с малым хирургическим опытом, не было четких критериев оценки реального объема циторедукции и т.д.) и крайне плохие отдаленные результаты в обеих сравниваемых группах (как в группе инициальной, так и в группе интервальной циторедукции) [1]. Сомнения же в возможности влияния селекции пациентов в нерандомизированных исследованиях, показавших выигрыш инициальной циторедукции, «гасились» гигантской разницей в выживаемости и весьма логичными аргументами по связи между результатами и экспертным хирургическим уровнем клиник. В результате, несмотря на то что в клинических рекомендациях (отечественных и зарубежных) сохранялись оба подхода (и инициальная, и интервальная циторедукция), практически общепринятым явилось то, что инициальная циторедукция должна выполняться практически на грани физической переносимости операции, несмотря ни на какие на «потери» пациентки, а место для интервальной циторедукции – лишь ситуации, когда инициальная циторедукция в оптимальном объеме «не совместима с жизнью».
И вот, наконец, на ASCO 2025 были доложены результаты исследования, впервые доказавшего преимущество инициальной циторедукции, и при этом, лишенного ключевых недостатков, за которые критиковались предыдущие рандомизированные исследования.
ИсследованиеTRUST [2] ставило своей целью определить оптимальное время для проведения циторедуктивной хирургии у пациенток с резектабельным по данным предоперационных обследований распространенным раком яичников, находящихся в состоянии, потенциально позволяющем перенести хирургическое вмешательство подобного объема. Крайне важным являлось то, что по условиям исследования пациентки должны были получать лечение в центрах, рутинно использующих надлежащий контроль за качеством проведенного хирургического вмешательства. Критерии оценки качества выполненного вмешательства основывались на руководстве European Training Centre in Gynaecological Oncology certification и включали оценку процесса и результатов циторедуктивной хирургии в операционной, а также оценку качества подготовки хирургического персонала и инфраструктуры клиники. Кроме того, все участвующие центры имели высокую частоту выполнения полных ИНИЦИАЛЬНЫХ циторедукций (как минимум 50% полных циторедукций при FIGO IIIBIVB) и высокую хирургическую активность при раке яичников (как минимум 36 циторедуктивных операций в год).
В рамках исследования 688 пациенток были рандомизированы на получение инициальной циторедукции с последующим проведением 6 циклов стандартной внутривенной химиотерапии или на инициальное проведение 3 циклов химиотерапии с последующим выполнением интервальной циторедукции и еще 3 циклов послеоперационной химиотерапии. Большинство пациенток, включенных в исследование, имели IIIc стадию заболевания по FIGO. Следует отметить высокую мотивированность хирургов на выполнение полной циторедукции в обеих группах – медиана времени хирургического вмешательства составили 5,5 часов в группе первичной циторедукции, и 4,5 часа в группе интервальной циторедукции. Об этом же свидетельствует и высокая частота выполнения полных циторедукций, составившая 70% при инициальной операции и 85% в группе, подвергнутой циторедуктивной хирургии после 3 циклов химиотерапии.
На момент анализа в группе инициальной циторедукции произошло 219 (64%) неблагоприятных событий (прогрессия заболевания или смерть) для выживаемости без прогрессирования (ВБП), в то время как в группе интервальной циторедукции неблагоприятные события были отмечены у 253 (74%) пациенток. Медиана ВБП в группе инициальной циторедукции составила 22,1 месяц по сравнению с 19,7 месяцами в группе интервальной циторедукции (hazard ratio [HR], 0,80; P = 0,018). Таким образом впервые в рамках рандомизированного исследования было доказано статистически значимое преимущество первичной циторедукции над интервальной. Дополнительно, было показано, что спустя 5 лет после рандомизации, в 2 раза больше больных, получивших инициальную хирургию, оставались без признаков возврата заболевания – 23 против 11% в группе интервальной циторедукции. В числовом выражении общая выживаемость (ОВ) так же была выше в группе, получавшей инициальную хирургию – медиана ОВ 54,3 месяца против 48,3 месяцев в группе интервальной циторедукции, однако различия не достигли статистической значимости (HR, 0,89; P = 0,24). Примечательно, что в обеих группах пациентки, у которых удалось добиться полной циторедукции, имели лучшую выживаемость, но с сохранением к тенденции к лучшим результатам в группе инициальной операции – медиана ВБП 27,9 против 21,8 месяцев в группе интервальной циторедукции (HR, 0,69; P = 0,0009), медиана ОВ 67,0 против 55,0 месяцев, соответственно (HR, 0,80; P = 0,0521). Дополнительно, при проведении субанализа было показано, что выигрыш от первичной циторедукции наблюдался лишь в группе пациенток с III стадией заболевания – медиана ВБП 26,3 месяца против 21.4 месяца в группе интервальной хирургии (HR, 0,73; P = 0,005), медиана ОВ 63,7 vs 53.2 месяцев, соответственно (HR, 0,84; P = 0,14). При IV стадии заболевания время проведения хирургического вмешательства не влияло ни на ВБП (HR, 1,01; 95% CI, 0,74- 1,38), ни на ОВ (HR, 0,97; 95% CI, 0,71-1,33).
Несмотря на то, что инициальная хирургия ожидаемо имела свою «цену» - частота осложнений при выполнении операции up-front составила 18% против 12% в группе интервальной циторедукции, 30-дневная постоперационная летальность составила мене 1% в обеих группах. Сопоставимым в обеих группах оказалось и качество жизни пациенток, хотя, как было отмечено во время обсуждения доклада, частота наложения кишечных стом была в 2 раза больше в группе инициальной хирургии.
Итак, наконец окончательная победа инициальной хирургии? Формально – да: показано статистически значимое преимущество, хоть и только в отношении ВБП. Плюс – гораздо больше больных в длительной полной неподдерживаемой ремиссии. Плюс – вроде бы не такая высокая «цена» для пациенток – малая частота фатальных осложнений, одинаковое качество жизни (хотя для значимо большего числа больных с инициальной циторедукцией – жизни со стомой). Ура? Увы, почему-то исследование всё же вызывает смешанные чувства… Очевидно, что пусть и статистически значимый, но равный 2,4 месяцам выигрыш в ВБП, мягко говоря, несколько ниже ожиданий. И выигрыш этот был получен в клиниках, реально способных обеспечить адекватную хирургию без тяжелых последствий. А вот достаточен ли он для того, чтобы по прежнему «принуждать» к попытке инициальной хирургии даже «на грани фола» для большинства больных с III – IV стадией болезни в обычных региональных клиниках… Не уверен. Особенно, если наложить на это исследование (точнее, на его результаты) шкалу оценки клинической пользы RUSSO. Да, эта шкала разработана для лекарственного лечения, но по здравой логике это шкала оценки магнитуды выигрыша от метода лечения – без разницы, хирургического, лучевого или лекарственного.
Источники:
- Kehoe S, Hook J, Nankivell M, Jayson GC, Kitchener H, Lopes T, Luesley D, Perren T, Bannoo S, Mascarenhas M, Dobbs S, Essapen S, Twigg J, Herod J, McCluggage G, Parmar M, Swart AM. Primary chemotherapy versus primary surgery for newly diagnosed advanced ovarian cancer (CHORUS): an openlabel, randomised, controlled, noninferiority trial. Lancet. 2015 Jul 18;386(9990):249-57. doi: 10.1016/ S0140-6736(14)62223-6. Epub 2015 May 19. PMID: 26002111.
- Sven Mahner et al. TRUST: Trial of radical upfront surgical therapy in advanced ovarian cancer (ENGOT ov33/AGO‐OVAR OP7).. JCO 43, LBA5500-LBA5500(2025). DOI:10.1200/JCO.2025.43.17_suppl. LBA5500
ПРОФИЛАКТИКА И КУПИРОВАНИЕ НЕЖЕЛАТЕЛЬНЫХ ЯВЛЕНИЙ / КАРДИОПРОТЕКЦИЯ: ДАННЫЕ РАНДОМИЗИРОВАННОГО ИССЛЕДОВАНИЯ SAFE
Список кардиотоксичных химиопрепаратов обширен, но антрациклины занимают одно их первых мест по частоте развития как кратковременной, так и длительной кардиоваскулярной токсичности, являясь при этом краеугольным камнем в лечении больных раком молочной железы и пациентов с другими опухолями. Ранее было показано, что применение ингибиторов АПФ и бета-блокаторов позволяет предотвращать и сдерживать развитие кардиотоксичности на фоне применения антрациклинов, но серьезных проспективных исследований по этой проблеме не было.
Итальянские авторы инициировали проспективное, рандомизированное, плацебо-контролируемое, двойное заслепленное исследование под названием SAFE по оценке эффективности бисопролола, рамиприла и их комбинации в сравнении с плацебо в отношении развития субклинических повреждений сердца, фиксируемых по данным эхокардиографии
Между июлем 2015 г. и июнем 2020 г. в исследование были включены 262 пациентки с инвазивным неметастатическим РМЖ, запланированных на ХТ антрациклинами и по показаниям таксаны (97,7%), трастузумаб (35,9%), адъювантную гормонотерапию (70,2%) и лучевую терапию (58,8%); все распределены на 4 группы: принимающих рамиприл, бисопролол, их комбинацию или плацебо. Терапия начиналась за 2 недели до старта ХТ и продолжалась в течение года или до окончания лечения трастузумабом. Доза препаратов повышалась 1 раз в неделю до 5 мг рамиприла и 5 мг бисопролола либо до максимально переносимой дозы. Оценка сердечной функции проводилась до начала лечения и на отрезках 3, 6, 12 и 24 месяца.
Контроль на 12 и 24 месяцах выявил существенные изменения в эхокардиографических и гемодинамических параметрах между группами: так, на 24 мес. отмечено снижение фракции выброса на 2,1% в группе рамиприла (P<0,001), на 2,2% в группе бисопролола (P<0,001), на 3,4% в группе комбинации препаратов (P<0,001) и в целом на 2,7% в этих лечебных группах в сравнении с 10,6% группы плацебо (рис.1). Такие же достоверные изменения зафиксированы в группах при определении глобальной продольной деформации сердца (GLS).
Рисунок 1.
Изменения функциональных показателей сердца
по данным эхокардиографии в группах
При этом комбинация препаратов не приводила к каким-либо дополнительным преимуществам в сравнении с монотерапией, вероятно, по причине ряда факторов: схожий механизм действия, возможность развития гипотензии и др. Однако полученные данные демонстрируют реальный кардиопротективный эффект рамиприла и бисопролола, что необходимо учитывать с целью снижения кардиотоксичности у пациентов, получающих антрациклины и иные препараты с подобным профилем токсичности.
Источник:
Meattini I, et al. Cardioprotection in patients with anthracycline-treated breast cancer: final analysis from the 2х2 randomized, placebo-controlled, double-blind SAFE trial. ESMO Open. May 2025. https://doi. org/10.1016/j.esmoop.2025.105116.
ПРОФИЛАКТИКА И КУПИРОВАНИЕ НЕЖЕЛАТЕЛЬНЫХ ЯВЛЕНИЙ / ПЕРИФЕРИЧЕСКАЯ НЕЙРОПАТИЯ ПОСЛЕ ХИМИОТЕРАПИИ: ПОИСКИ ЭФФЕКТИВНЫХ МЕТОДОВ КУПИРОВАНИЯ
Недавно мы представляли данные исследования по предотвращению развития периферической нейропатии, вызвавшие немалый интерес онкологического сообщества. Но когда нейропатия уже в наличии, купировать ее проявления крайне сложно, и основным доктором для пациента становится не онколог, не невролог – а время. Но поиск эффективных методов уменьшения клинических проявлений продолжается.
Американские авторы в своей публикации в майском номере журнала Journal of Clinical Oncology представили данные исследования по применению низкоинтенсивной вибрации (НИВ) для уменьшения проявлений ПХТ-индуцированной периферической нейропатии (ПН). В пилотное рандомизированное исследование было включено 38 больных с развившейся симптомной ПН спустя 18 месяцев после ХТ в среднем (6-39 мес.), преимущественно женщины (89%). Двадцать участников были распределены в группу НИВ, остальные – стандартной терапии. В исследуемой группе пациенты получали сеансы НИВ дважды в день по 10 минут на протяжении 12 недель. Авторы оценивали переносимость, приверженность лечению, частоту побочных эффектов; предварительная эффективность оценивалась на основании опросников, заполняемых пациентами, касавшихся выраженности симптомов ПН, болевого синдрома, слабости и функциональной активности конечностей. Помимо этого, функциональная способность и мобильность оценивалась и объективно с помощью ряда дополнительных тестов. В итоге 97% больных получали лечение на протяжении всего периода, приверженность составила в среднем 77±18%. Серьезных побочных эффектов не было. В сравнении с группой контроля пациенты из группы НИВ отметили более значительные улучшения в течение периода наблюдения в отношении симптомов сенсорной НП (НИВ: +1,4±3,3 пункта; стандартное лечение +0,2±2,8 пункта) и нарушения функции конечностей (+5,3±8,5 пункта против –0,7±9,2 пункта). Авторы сделали вывод, что метод НИВ безопасен и эффективен для купирования проявлений ПХТиндуцированной ПН.
Источник:
Stephanie M. Krasnow, et al. Low-Intensity Vibration to Reduce Symptoms and Improve Physical Functioning in Cancer Survivors With ChemotherapyInduced Peripheral Neuropathy: A Pilot Randomized Trial. JCO Oncology Practice. May 15, 2025. https://doi.org/10.1200/OP-24-00961.
Дорогие коллеги, дорогие друзья!
В Национальной галерее Шотландии в Эдинбурге хранится картина современного художника Кена Карри (Ken Currie), датируемая 2002 годом. Она носит название «Три онколога», и изображены на ней три профессора из отделения хирургии и молекулярной онкологии больницы Ninewells города Данди (Dundee) – Robert J. Steele, Sir Alfred Cuschieri, Sir David P. Lane. Многие посетители галереи выделяют именно эту картину – немного странную, мистических темно-белых тонов с минимумом оттенков (поэтому мы поместили ее не на первую, а на последнюю страницу номера, но отнюдь не потому, что имена этих людей, ныне живущих, известны в медицинском мире.
Эта картина, по мнению многих - словно иконография тайны и ритуала, которые разделяют фигуры, делая их почти священниками; они светятся на фоне непостижимого пространства, на фоне занавеса, разделяющего бытие на обычный мир – и мир внутри медицинского учреждения, доступный немногим. Их знания отличают их от обычных людей, и во взглядах профессоров – тот опыт, который неведом большинству из живущих на земле, увы, сталкивающихся с онкологией напрямую или косвенно. И зритель продолжает встречаться глазами с онкологами, продолжает задавать вопросы – наверняка те же самые, которые так же часто задают (и будут задавать) и нам, сколько бы столетий ни кануло в лету.
Стремление быть в поиске, постоянно ставить перед собой задачи, большие и малые, решать их, сомневаться, задавать вопросы более опытным коллегам, быть на «ты» с первоисточниками, проверять тысячу раз и идти вперед – и многое, многое другое. Эти качества - золотой набор врача-исследователя, присущий далеко не каждому. Лишь пройдя по этому долгому пути, ты чувствуешь себя способным ответить на большинство вопросов, что ставит перед тобой пациент. Путь этот никогда не бывает легким и безоблачным – но сейчас, в июне, в наш профессиональный праздник, так хочется ощущения просто летнего тепла, ярких красок, солнечных бликов до слепоты и чувства уверенности в завтрашнем дне. С нашим Днем, дорогие коллеги! Добрых надежд и сбывшихся мечтаний, смелости в каждом шаге, юности в душе и профессиональной зрелости нам всем!
Кен Карри, «Три онколога». Национальные галереи Шотландии, Эдинбург.
