Дорогие коллеги, дорогие друзья!
Наши календари – настенные, перекидные, отрывные, электронные в часах или телефонах – отсчитывают завершающие дни этого чертовски трудного 2022 года. Каждый из нас, наверное, как никогда, старался максимально посвятить свое время любимой работе и любимым людям – близким, друзьям. Этот 2022-й наиболее ярко продемонстрировал самые главные человеческие ценности...

Питер Мессер. Маленький снеговик. 12,7х12,7 см.
Частная коллекция
Иосиф Бродский.
Рождественский романс (отрывок), 28 декабря 1961 года.
ЭКЗАМЕН ПО КЛИНИЧЕСКОЙ ОНКОЛОГИИ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ
В этом году в дни XXVI Российского Онкологического Конгресса, а именно 15 ноября, впервые был проведен экзамен по клинической онкологии среди врачей онкологов Российской Федерации. Двадцать восемь докторов набрались смелости пройти этот экзамен впервые в России. География участников включала города: Москва, Пермь, Королев, Санкт-Петербург, Южно-Сахалинск...
ЖУРНАЛ RUSSCO «ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ» СРЕДИ ЛИДЕРОВ СПИСКА ВАК ПО ИНДЕКСУ ЦИТИРОВАНИЯ
В начале этого года Высшая аттестационная комиссия (ВАК) утвердила перечень изданий для публикаций научных работ соискателей ученых степеней. Ученым предлагают печататься не только в отечественных изданиях, но и в зарубежных, однако теперь публикации за рубежом не будут считаться обязательными.

ОТКАЗ ОТ ВЫПОЛНЕНИЯ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ У БОЛЬНЫХ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ С ПРОТИВООПУХОЛЕВЫМ ОТВЕТОМ НА НЕОАДЪЮВАНТНУЮ СИСТЕМНУЮ ТЕРАПИЮ
ИССЛЕДОВАНИЕ POLO ПОДТВЕРЖДАЕТ ЭФФЕКТИВНОСТЬ ПОДДЕРЖИВАЮЩЕЙ ТЕРАПИИ ОЛАПАРИБОМ У БОЛЬНЫХ МЕТАСТАТИЧЕСКИМ РАКОМ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ С НАЛИЧИЕМ ГЕРМИНАЛЬНОЙ МУТАЦИИ В ГЕНЕ BRCA1/2
Метастатический рак поджелудочной железы остается смертельным заболеванием, при котором медиана продолжительности больных лишь недавно достигла 10-12 месяцев при использовании комбинации FOLFORINOX, а 5-летняя общая выживаемость не превышает 3%. Известно, что наряду с раком молочной железы, яичников, простаты, риск возникновения рака поджелудочной железы...

ЗНАКОМЬТЕСЬ, РЕГИОНАЛЬНОЕ ОТДЕЛЕНИЕ RUSSCO РЕСПУБЛИКИ ТАТАРСТАН
Республика Татарстан расположена в центре Европейской части России на Восточно-Европейской равнине, в месте слияния двух рек – Волги и Камы. Входит в Приволжский федеральный округ.

РАСПРОСТРАНЕННЫЙ РАК ЯИЧНИКОВ, ПРАВИЛЬНОЕ ВРЕМЯ ДЛЯ НАЗНАЧЕНИЯ PARP-ИНГИБИТОРА
Включение PARP-ингибиторов в клиническую практику привело к изменению концепции лечения рака яичников во всем мире, в том числе даже позволило задуматься о потенциальном излечении

PARP-ИНГИБИТОРЫ ПРИ РАКЕ ЯИЧНИКОВ. ВРЕМЯ НАЗНАЧЕНИЯ ИМЕЕТ ЗНАЧЕНИЕ. НО ТОЛЬКО ЛИ ВО ВРЕМЕНИ ДЕЛО?
— РАЗМЫШЛЕНИЯ В ОТРЫВЕ ОТ РУТИНЫ
PADA-1: ПЕРВАЯ ЛИНИИ ТЕРАПИИ ПРИ ГОРМОНОЗАВИСИМОМ РАКЕ МОЛОЧНОЙ ЖЕЛЕЗЫ С МУТАЦИЕЙ В ГЕНЕ ESR1 (ЭР-α)
Резистентность к эндокринотерапии при гормонозависимом HER2- негативном раке молочной железы (РМЖ) является ключевым моментом в прогнозе, течении заболевания и определении тактики лечения. Необходимо обсудить некоторые термины и механизмы, чтобы понять причину гормонорезистентности при мутации в гене ESR1. Эстрогеновые рецепторы (ЭР) кодируются генами...
ТРАСТУЗУМАБ ДЕРУКСТЕКАН КАК ТЕРАПЕВТИЧЕСКАЯ ОПЦИЯ ПРИ HER2- LOW АДЕНОКАРЦИНОМЕ ЖЕЛУДКА И КАРДИОЭЗОФАГЕАЛЬНОГО ПЕРЕХОДА
По данным литературы, HER2- положительный рак желудка (РЖ) и кардиоэзофагеального перехода (КЭП) встречается в ≈20% случаев, с одинаковой частотой как в Европе, так и в Азии. В российской популяции 11-19% аденокарцином желудка и КЭП обладают положительным HER2 статусом [1]. Уровень экспрессии и амплификации HER2 при РЖ в пределах одного опухолевого образца...

НОВОСТИ ASTRO 2022
Одним из наиболее значимых событий уходящего года в радиотерапии традиционно стала конференция Американского общества радиационной онкологии ASTRO 2022, проходившая в Сан-Антонио...

ПРОФИЛАКТИЧЕСКОЕ ОБЛУЧЕНИЕ КОСТНЫХ ОЧАГОВ У ПАЦИЕНТОВ С ДИССЕМИНИРОВАННЫМИ МЕТАСТАТИЧЕСКИМИ ОПУХОЛЯМИ – НОВАЯ ВЕХА В ИСТОРИИ ЛЕЧЕНИЯ МЕТАСТАТИЧЕСКОГО ЗАБОЛЕВАНИЯ?
Одним из самых интересных исследований на ежегодном конгрессе ASTRO в США, который проходил в Сан-Антонио с 23 по 26 октября 2022 года, стало небольшое проспективное рандомизированное исследование 2-й фазы из Memorial Sloan Kettering Cancer Center...

КОММЕНТАРИЙ ЭКСПЕРТА
К сожалению, я вынужден буду осветить не только выигрышные стороны исследования, что уже прекрасно сделал Сергей Владимирович (хотя и он тоже обозначил определенные вопросы и...
ПРОФИЛАКТИКА ФЕБРИЛЬНОЙ НЕЙТРОПЕНИИ: ПРИНЦИПЫ LEGE ARTIS
Одним из базовых методов лечения онкологических пациентов является химиотерапия (ХТ). Зависимость непосредственных (частоты и глубины ответа), а также отдаленных результатов эффективности лечения (безрецидивной/беспрогрессивной и общей выживаемости) от соблюдения режимов и доз специфической противоопухолевой терапии была подтверждена целым рядом международных

Наталья Калагина
«В этой жизни больше всего ценю именно её – саму жизнь. В людях – созвучность с моим мировосприятием, что встреча - ется нечасто, доброту, умение и желание помогать людям и животным...

ВСТАНЬ И ИДИ!
Дело было в конце января 2022 года, когда я получил из благотворительного фонда «Подари жизнь» электронное письмо следующего содержания...
Анонс
-

20 января 2023
МЕЛАНОМА И ДРУГИЕ ОПУХОЛИ КОЖИ
VII КОНФЕРЕНЦИЯ RUSSCO
-

3-4 февраля 2023
ОПУХОЛИ ЖЕЛУДОЧНО - КИШЕЧНОГО ТРАКТА
IX КОНФЕРЕНЦИЯ RUSSCO
Дорогие коллеги, дорогие друзья!
Наши календари – настенные, перекидные, отрывные, электронные в часах или телефонах – отсчитывают завершающие
дни этого чертовски трудного 2022 года. Каждый из нас, наверное, как никогда, старался максимально посвятить свое
время любимой работе и любимым людям – близким, друзьям.
Этот 2022-й наиболее ярко продемонстрировал самые главные
человеческие ценности, перечислять которые не имеет смысла
– они в сердцах и мыслях каждого.
Российское общество клинической онкологии постаралось выполнить план мероприятий, намеченный на 2022 год, объединяя нас, представителей разных онкологических специальностей, для обсуждения наиболее актуальных тем в онкологии. Тематические конференции RUSSCO, семинары и вебинары, а также XXVI Российский онкологический конгресс состоялись в обозначенные даты, пополняя и число новых членов общества. На сайте и в газете RUSSCO в этом году мы начали знакомить вас с региональными отделениями, их деятельностью, и в будущем году, без сомнения, мы тоже увидим новые лица онкологов из разных регионов страны. У нас появились новые рубрики – «Дискуссионная сцена», «Размышления в отрыве от рутины», «Подмечено человеком» и другие, надеемся, они смогли заинтересовать многих. В финальном номере 2022 года мы открываем новую страницу, наполнять которую может любой из вас, практикующих онкологов, поскольку рубрика «А вот был у меня случай…» будет включать любые яркие клинические случаи, позволяющие добавить что-то в копилку собственного опыта. Не бойтесь писать, дорогие коллеги, страницы газеты и журнал «Злокачественные опухоли» ждут своих новых авторов!
Предновогодние дни, возможно, у всех проходят по-разному,
но наверняка мы сходимся в одном: искреннем желании оставить груз душевных и физических проблем в старом году, перелистнуть его страницу – и вступить в 1 января, вдохнув порцию свежего морозного воздуха, хрустнув снегом за порогом
дома и слепив своего первого новогоднего снеговика.
Доброго, плодотворного и мирного Нового года вам,
дорогие друзья!
Ваша команда RUSSCO
Питер Мессер. Маленький снеговик. 12,7х12,7 см.
Частная коллекция

Иосиф Бродский.
Рождественский романс (отрывок),
28 декабря 1961 года.
…Твой Новый год по темно-синей
волне средь моря городского
плывет в тоске необъяснимой,
как-будто жизнь начнется снова,
как-будто будут свет и слава,
удачный день и вдоволь хлеба,
как-будто жизнь качнется вправо,
качнувшись влево.
ЭКЗАМЕН ПО КЛИНИЧЕСКОЙ ОНКОЛОГИИ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ
Автор: Карасева В.В., Егорова Ю.Е., Калаева А.П.
В этом году в дни XXVI Российского Онкологического Конгресса, а именно 15 ноября, впервые был проведен экзамен по клинической онкологии среди врачей онкологов Российской Федерации. Двадцать восемь докторов набрались смелости пройти этот экзамен впервые в России. География участников включала города: Москва, Пермь, Королев, Санкт-Петербург, Южно-Сахалинск, Красногорск, Архангельск, Кемерово, Новосибирск, Нальчик, Красноярск, Пущино, Екатеринбург, Уфа. Возраст участников составил от 25 до 57 лет, средний возраст - 41 год.
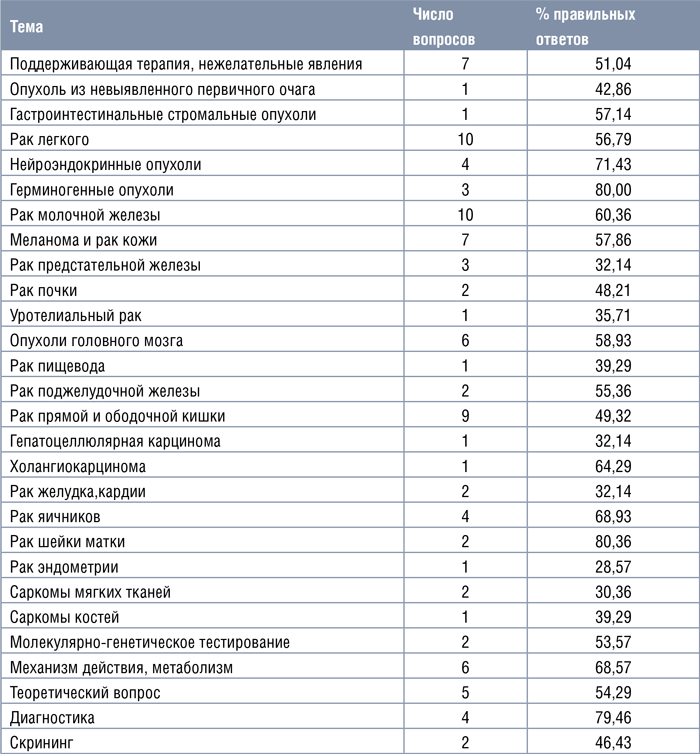
Экзамен состоял из 100 вопросов, подготовленных ведущими экспертами Общества. На каждый вопрос нужно было выбрать один наиболее подходящий ответ. Вопросы были из различных областей клинической онкологии. В таблице представлены эти разделы и число вопросов по каждой теме. В каждом разделе был посчитан процент правильных ответов. Можно заметить, что лучшие знания были продемонстрированы в разделах: рак молочной железы, рак легкого, рак яичников, рак шейки матки, рак поджелудочной железы и холангиокарцинома, опухоли головного мозга, герминогенные, нейроэндокринные, гастроинтестинальные стромальные опухоли. Из вопросов, не относящихся к конкретным нозологиям, – механизм действия, метаболизм противоопухолевых средств, диагностика опухолевых заболеваний. Наибольшие затруднения вызывали вопросы из разделов: рак предстательной железы, уротелиальный рак, рак пищевода, желудка и кардии, рак прямой и ободочной кишки, рак эндометрия, саркомы мягких тканей и костей, гепатоцеллюлярная карцинома, опухоль из невыявленного первичного очага. Интересен тот факт, что часть докторов обратили внимание на несколько вопросов, считая, что нет однозначного ответа среди представленных в задании. Эти вопросы будут внимательно рассмотрены экспертами на мероприятиях Общества. Кроме того, те разделы, которые вызвали особые затруднения, будут предметом разбора на мероприятиях Общества.

При подведении итогов экзамена
был выбран проходной балл – 55
правильных ответов из 100. Для
примера, Европейское общество
клинической онкологии в этом
году поставило проходной балл
53%, а в прошлом году он был 55%.
Итак, результаты экзамена. Из
28 докторов экзамен прошли 18,
что составило 64,3%. Всем врачам, успешно прошедшим экзамен, были вручены дипломы, а
троим участникам, набравшим
наибольшее количество баллов,
дипломы были вручены Председателем Российского общества
клинической онкологии профессором С.А.Тюляндиным на итоговой сессии Общества 17 ноября.
Наибольшее количество баллов
составило 71 и такого результата
достигли Ахметьянова Ангелина Евгеньевна, НМИЦ онкологии им. Н.Н.Блохина, и Дахтлер
Татьяна Евгеньевна, Ильинская
больница. Следующий результат
в 69 баллов был достигнут Кутаковым Никитой Михайловичем,
Клинический Госпиталь «Лапино». В качестве поощрения этих трех участников Российское общество клинической онкологии
берет на себя поддержку поездки
каждого доктора на любое мероприятие Общества. Очень приятно было отметить, что среди
участников была Председатель
Регионального отделения нашего
Общества из Южно-Сахалинска
Парсаданова Эльвира Левоновна,
которая также успешно прошла
экзамен.

В заключение сообщаем, что тот,
кто не смог принять участие в
экзамене в этом году, может проверить свои знания в следующем.
Проведение экзамена планируется на 14 ноября 2023 года на XXVII
Российском Онкологическом
Конгрессе. Следите за новостями
общества. Подробности проведения экзамена будут сообщены
летом следующего года.

ЖУРНАЛ RUSSCO «ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ» СРЕДИ ЛИДЕРОВ СПИСКА ВАК ПО ИНДЕКСУ ЦИТИРОВАНИЯ
В начале этого года Высшая аттестационная комиссия (ВАК) утвердила перечень изданий для публикаций научных работ соискателей ученых степеней. Ученым предлагают печататься не только в отечественных изданиях, но и в зарубежных, однако теперь публикации за рубежом не будут считаться обязательными.
В новый реестр ВАК вошли 2592 российских научных издания из «Перечня ВАК», а также издания из международных баз данных и Russian Science Citation Index (RSCI).
В настоящее время «Перечень ВАК» поделен на три категории по востребованности (индексу цитирования) журнала научным сообществом. Так, к самому высокому квартилю (К1) с самым высоким индексом цитирования ВАК отнесла 661 журнал, к К2 (средний индекс цитирования) — почти 1,3 тыс. изданий, оставшиеся удостоились третьего квартиля.
Официальное печатное издание Общероссийской общественной организации «Российское общество клинической онкологии» (RUSSCO) - журнал "Злокачественные опухоли", был отнесен к первому квартилю с самым высоким коэффициентом – 0,600. Журнал в перечне находится на 9 месте в соответствии с алфавитным порядком среди других журналов по всем специальностям.
Так же хочется отметить, что в России в 2021 году был пересмотрен перечень научных специальностей, он стал намного короче и актуальнее — общее число научных специальностей сократилось на 18%: было 430, стало 351, а во многих случаях две смежные специальности объединили в одну — под более общим названием.
До введения нового перечня научных специальностей журнал «Злокачественные опухоли» входил в перечень журналов, рецензируемых ВАК, по специальностям хирургия с 28.12.2018 г., по специальности онкология с 09.12.2020 г. После приказа Минобрнауки России от 24 февраля 2021 года № 118, журналу присвоили дополнительную специальность по лучевой терапии. На данный момент журнал входит в перечень, по следующим специальностям: 3.1.6. Онкология, Лучевая терапия и 3.1.9. Хирургия в отрасли медицинские науки.
Главный редактор, проф., д.м.н. Д.А.Носов
Технический редактор А.А.Плыкина
ОТКАЗ ОТ ВЫПОЛНЕНИЯ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ У БОЛЬНЫХ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ С ПРОТИВООПУХОЛЕВЫМ ОТВЕТОМ НА НЕОАДЪЮВАНТНУЮ СИСТЕМНУЮ ТЕРАПИЮ
Автор: С.А.Тюляндин
Председатель Российского общества клинической онкологии,
профессор, доктор медицинских наук, Москва
Начиная с Бернарда Фишера и его
теории о системности рака молочной железы, мы являемся свидетелями деэскалации оперативного
подхода в лечении этого заболевания, который проделал путь от расширенных операций Холстеда до
органосохраняющих операций и
отказа от выполнения подмышечной лимфаденэктомии при отсутствии метастазов в сентинальных
лимфоузлах. И вот крайняя точка
– отказ от хирургического этапа
лечения. Вопрос о возможности
отказа от операции стал актуальным в связи с постоянно возрастающим использованием предоперационной химиотерапии, которая
позволяет у больных тройным негативным и HER2-позитивным раком достигать полной морфологической регрессии опухоли у 50-65%
больных. Нужна ли была операция
у больных, достигших полной морфологической регрессии опухоли,
и можно ли отказаться от ее выполнения, если удастся доказать
полный морфологический эффект
после окончания неоадъювантной
терапии? Изучению этого вопроса было посвящено исследование
II фазы, инициированное исследователями из MD Anderson Cancer
Center и проведенное в семи клиниках США.
В исследование включались больные старше 40 лет с тройным негативным или HER2-позитивным раком молочной железы T1-2 N+ (не
более 4 клинически определяемых
л/у), которым проведена неоадъювантная системная терапия (AC-T
для тройного негативного и TC
c двойной блокадой для HER2+),
желающие сохранить молочную
железу. До начала терапии проводится клипирование первичной
опухоли, при подозрении на метастазы в подмышечные лимфоузлы
выполняется их цитологическая
верификация и при обнаружении
метастазов – клипирование. После окончания неоадъювантной
системной терапии выполняется
маммография и сонография для
определения наличия остаточной
опухоли. После этого под контролем УЗИ выполняется вакуум-ассистированная кор-биопсия
(VACB) иглой 9G в зоне расположения клипсы или в расположении резидуальной опухоли, если
таковая была обнаружена при обследовании, с целью получения не
менее 12 биопсий. При отсутствии
в полученных биопсиях опухолевых клеток операция не выполняется, больным с морфологическим
подтверждением резидуальной
опухоли выполняется оперативное
лечение. Больным с наличием cN+
выполнялась прицельная диссекция клипированных л/у и в случае
отсутствия признаков наличия резидуальной опухоли в молочной
железе и лимфоузлах операция на
молочной железе не проводилась.
Все больные получали лучевую
терапию на молочную железу (40
Гр за 15 фракций или 50 Гр за 25)
и дополнительный буст 14 Гр за 7
фракций. Больные наблюдались
каждые 6 месяцев с выполнением
маммографии в течение 5 лет. При
подозрении на рецидив заболевания выполнялась сонография и/
или МРТ и при показаниях биопсия. Больные заполняли опросники качества жизни, и производился забор крови для определения
циркулирующей опухолевой ДНК
(данные разделы работы будут опубликованы позднее). Основным
критерием эффективности была
частота развития ипсилатерального рецидива у больных без оперативного лечения. В данной работе
С.А.Тюляндин
Председатель Российского
общества клинической
онкологии, профессор,
доктор медицинских наук,
Москва
сообщаются результаты 2-летнего
промежуточного анализа.
В исследование было включено 50
больных c медианой возраста 62
года, 29 (58%) из них были HER2+,
а у 9 (18%) определялись метастазы
в подмышечные лимфоузлы. Средний размер опухоли до лечения
составил 2,3 см, после проведения
неоадъювантной терапии – 0,9 см.
Полный радиологический эффект
был зарегистрирован у 17 (34%)
больных. Среднее число VACB составило 15, что позволило определить полный морфологический
ответ у 31 (62%) и резидуальную
опухоль у 19 (38%) больных, которым была выполнена операция.
Из 19 больных с выполненной
операций у 7 из них не обнаружено резидуальной опухоли при
морфологическом исследовании
удаленного материала, у 12 больных морфологически была подтверждена резидуальная опухоль.
Наличие метастатического поражения подмышечных лимфоузлов
не было обнаружено ни у одной
больной после их удаления. При
медиане наблюдения 24 мес. не
отмечено развития ипсилатерального рецидива в группе больных
без выполненной операции. При
дальнейшем наблюдении у 9 из 31
(29%) больных потребовалось выполнение повторных биопсий в
связи с подозрением на возможное
локальное прогрессирование.
Авторы делают предварительный
вывод, что в тщательно отобранной группе больных с агрессивными фенотипами опухоли с ответом
на проведенную неоадъювантную
системную терапию возможен отказ от выполнения операции на
молочной железе при отсутствии
резидуальной опухоли по данным
вакуум-ассистированной корбиопсии. Следует помнить, что
срок наблюдения в этом исследовании составляет 2 года, что может
быть недостаточным для окончательной оценки частоты рецидива.
Сложность этой методики будет
объективным барьером для ее внедрения в клиническую практику и
получения согласия на ее выполнение от больной. Поэтому очень
важным представляется оценка
качества жизни пациенток в ходе
этого исследования. Планируемый
анализ динамики циркулирующей
опухолевой ДНК даст важную информации о корреляции между
отсутствием опухолевой ДНК и
подтверждением полного морфологического ответа по данным
кор-биопсий. Возможно, жидкая
биопсия позволит заменить технически сложную для исполнения
и травматическую для пациентки
процедуру взятия многочисленных биопсий. Авторы данной работы показали принципиальную
возможность отказа от операции,
но предстоит еще много сделать,
чтобы доказать клиническую безопасность данной методики и ее
позитивное восприятие больными
раком молочной железы.
Источник:
Kuerer HM, Smith BD,
Krishnamurthy S, et al. Eliminating
surgery for invasive breast cancer in
exceptional responders to neoadjuvant
systemic therapy: a multicentre, singlearm, phase 2 trial. Lancet Oncol.
2022, 23: 1517-24.
ИССЛЕДОВАНИЕ POLO ПОДТВЕРЖДАЕТ ЭФФЕКТИВНОСТЬ ПОДДЕРЖИВАЮЩЕЙ ТЕРАПИИ ОЛАПАРИБОМ У БОЛЬНЫХ МЕТАСТАТИЧЕСКИМ РАКОМ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ С НАЛИЧИЕМ ГЕРМИНАЛЬНОЙ МУТАЦИИ В ГЕНЕ BRCA1/2
Метастатический рак поджелудочной железы остается смертельным
заболеванием, при котором медиана продолжительности больных
лишь недавно достигла 10-12 месяцев при использовании комбинации FOLFORINOX, а 5-летняя общая выживаемость не превышает
3%. Известно, что наряду с раком
молочной железы, яичников, простаты, риск возникновения рака
поджелудочной железы увеличивается при наличии герминальной
мутации генов BRCA1/2, обуславливающей дефицит гомологичной
рекомбинации ДНК. Опухоли при
наличии этих мутаций демонстрируют большую чувствительность
к лечению платиновыми производными и ингибиторами PARP. Частота обнаружения герминальных
мутаций генов BRCA1/2 у больных
раком поджелудочной железы составляет 4-8%. Исследование POLO
ставило своей целью оценить эффективность поддерживающей
терапии олапарибом у больных
метастатическим раком поджелудочной железы с наличием герминальной мутации генов BRCA1/2
c отсутствием прогрессирования
после проведения первой линии
химиотерапии с включением препаратов платины.
В рандомизированное исследование III фазы включались больные
метастатическим раком простаты
с наличием герминальной мутации BRCA1/2, которые получили
как минимум 16 недель химиотерапии первой линии с включением
препаратов платины, с отсутствием прогрессирования по данным
обследования по ее окончанию.
Больные рандомизировались в
соотношении 3:2 для получения
олапариба (300 мг внутрь 2 раза в
день ежедневно) или плацебо до
признаков прогрессирования или
появления непереносимой токсичности. Основным критерием эффективности была выживаемость
без прогрессирования (PFS), вторичными точками были общая выживаемость (OS), время до второго
прогрессирования заболевания
(PFS2) и токсичность.
Скрининг на наличие герминальной мутации BRCA1/2 был проведен у 3315 больных метастатическим раком предстательной
железы, по результатам которого
154 больных были включены в исследование (90 больных для получения олапариба и 61 для плацебо).
Медиана возраста составила 57 лет,
у 70% больных обнаружена мутация в гене BRCA2, 86% получили в
качестве первой линии химиотерапии комбинацию FOLFORINOX c
достижением полного и частичного ответа у 49% пациентов. Данные
по времени до прогрессирования
были представлены ранее при медиане наблюдения 19 мес. и составили 7,4 мес. в группе олапариба и
3,8 мес. в группе плацебо, что соответствует достоверному снижению
относительного риска прогрессирования на 47% (HR=0,53; p=0,004).
Показатель 3-летней PFS составил
23% и 5% соответственно. При медиане наблюдения 31 мес. медиана
OS была одинаковой и составила
19 мес. Однако при сроке наблюдения 24 месяца кривые стали расходиться в пользу олапариба, и 3-летняя OS составила 34% в группе
олапариба и 18% в группе плацебо,
что соответствует недостоверному
снижению относительного риска
смерти на 17% (HR=0,83; p=0,35).
Медиана времени до второго прогрессирования PFS2 составила 16,9
мес. и 9,3 мес. соответственно.
Медиана продолжительности
приема олапариба была 7,5 мес.
Осложнения 3-4 степени зарегистрированы у 31% и 16% больных
в группе олапариба и плацебо, что
привело к прекращению лечения у
9% и 2% больных соответственно.
Наиболее частыми осложнениями
3-4 степени при приеме олапариба
были анемия (12%), слабость (6%)
и боли в брюшной полости (3%).
За время наблюдения не отмечено
развития миелодиспластического
синдрома/миелоидного лейкоза
или вторичной злокачественной
опухоли.
Несмотря на отсутствие достоверного выигрыша в общей выживаемости, поддерживающая терапия
олапарибом демонстрирует достоверное увеличение PFS и PFS2,
двукратное увеличение числа
долгожителей в группе олапариба
(33%) при умеренной токсичности,
что дало солидное основание для
регистрации препарата для проведения поддерживающей терапии
после успешной первой линии платиносодержащей химиотерапии
у носителей герминальной мутации генов BRCA1/2. Это показание
было основанием для включения в
основные клинические рекомендации, в том числе и в практические
рекомендации RUSSCO. Сложной задачей является диагностика
наличия мутации в генах BRCA.
При раке поджелудочной железы
чаще выявляются мутации в гене
BRCA2. Существующий и широко используемый тест ПЦР для
диагностики распространенных
в славянской популяции мутаций
генов BRCA1/2 не подходит для выявления герминальных мутаций в
этих генах у больных раком поджелудочной железы. Необходим
метод секвенирования следующего
поколения (NGS). Альтернативой
ему может служить диагностическая ПЦР-панель «Герда-Биочип»,
созданная сотрудниками НМИЦ
онкологии им. Н.Н. Блохина и Института молекулярной биологии
им. В.А. Энгельгардта. С помощью
этой панели можно опередить 23
наиболее часто встречаемые герминальные мутации у больных раком поджелудочной железы в генах
BRCA1 (10 мутаций), BRCA2 (16) и
PALB2 (7).
Источник:
Kindler HL, Hammel P,
Reni M, et al. Overall survival results
from the POLO trial: a phase III
study of active maintenance olaparib
versus placebo for germline BRCAmutated metastatic pancreatic
cancer. J.Clin. Oncol. 2022; 40: 3929-
3939.
ЗНАКОМЬТЕСЬ, РЕГИОНАЛЬНОЕ ОТДЕЛЕНИЕ RUSSCO РЕСПУБЛИКИ ТАТАРСТАН
Республика Татарстан расположена в центре Европейской части
России на Восточно-Европейской
равнине, в месте слияния двух
рек – Волги и Камы. Входит в Приволжский федеральный округ. Численность населения республики по
данным Росстата составляет 3 886
395 человек (на 2022 год). Республика занимает восьмое место в
России по численности населения
после городов Москва и СанктПетербург, Краснодарского края,
Республики Башкортостан, Московской, Свердловской и Ростовской областей, второе место в Приволжском федеральном округе.
Заболеваемость населения республики злокачественными новообразованиями в 2020 году составила
14528 случаев на 100 тыс. населения, в том числе наибольшее количество по локализациям: молочная
железа – 1707, кожа (кроме меланомы) – 1501 [1].
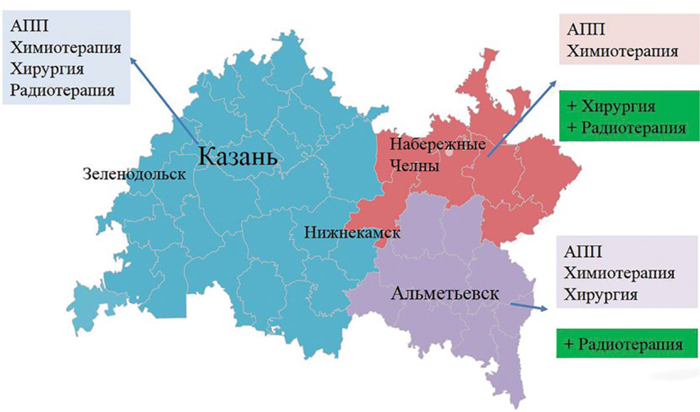
Региональное отделение Российского общества клинической онкологии (RUSSCO) Республики Татарстан в настоящее время насчитывает 99 членов, среди которых онкологи, химиотерапевты, радиотерапевты, хирурги. Председателем регионального отделения является врач-онколог поликлинического отделения ГАУЗ РКОД, к.м.н. Алина Зульфатовна Исянгулова. Центром онкологической службы является ГАУЗ «Республиканский клинический онкологический диспансер Минздрава Республики Татарстан имени профессора М.З. Сигала» (ГАУЗ «РКОД») в г. Казань с филиалами в городах Альметьевск и Набережные Челны. Диагностические и лечебные возможности филиалов в этих городах значительно расширены, благодаря чему специализированная медицинская помощь максимально приближена для жителей, воплощен замкнутый цикл диагностики и лечения больных. Также онкологические отделения имеются в шести центральных районных больницах, где проводится как хирургическое, так и лекарственное лечение онкологическим пациентам. С 2010 года создана единая информационная система, начиная с первичных онкологических кабинетов до головного учреждения – республиканского онкодиспансера, позволяющая оперативно получать информацию, записать пациента с отдаленных районов к ведущим специалистам республики и т.д.

История становления онкологической службы Республики Татарстан начинается с 1946 года, когда
для лечения пациентов со злокачественными образованиями было
предусмотрено 25 коек. Сегодня
ГАУЗ «РКОД» – это одно из крупнейших медицинских учреждений
России, которое является ведущим специализированным лечебно-профилактическим учреждением, осуществляет руководство
деятельностью онкологической
службы всей республики и курирует методическую, организационную, профилактическую, диагностическую и лечебную работу
служб здравоохранения в целях
совершенствования онкологической помощи населению. ГАУЗ
«РКОД» является также окружным
диспансером для Приволжского
федерального округа, население
которого составляет более 28 млн.
человек. На его базе располагаются
9 кафедр Казанской государственной медицинской академии–филиала ФГБОУ ДПО РМАНПО
Минздрава России и Казанского государственного медицинского
университета, Приволжский филиал ФГБУ «НМИЦ онкологии
им. Н.Н. Блохина» Минздрава
России, Ассоциация онкологических учреждений Приволжского
федерального округа. Диспансер
является членом Европейской ассоциации онкологических учреждений (OECI), которая объединила более 70 ведущих Европейских
противораковых Институтов.

Коечный фонд диспансера составляет 1123 койки. Развернуто 23 клинических отделения. На 24
операционных столах операционного блока ежедневно проводится
до 70 операций больным с опухолевой патологией. Ежегодно в
стационаре специализированную
медицинскую помощь получают
более 30000 больных. Кроме того,
в диспансере есть лаборатории,
оснащенные медицинским оборудованием высочайшего уровня.
Функционируют три поликлиники
(более 360 тыс. посещений в год),
служба неотложной паллиативной
помощи онкологическим больным,
четыре референс-центра – на базе
иммуногистохимической лаборатории, молекулярно-генетической лаборатории для лечебных
учреждений Приволжского федерального округа и для Республики
Татарстан. В 2022 году в рамках
программы «Совершенствование
молекулярно-генетической диагностики в Российской Федерации
с целью повышения эффективности противоопухолевого лечения» Российского общества клинической онкологии лаборатория
ГАУЗ «РКОД» успешно прошла
внешний контроль качества BRAFтестирования методом ПЦР. Диспансер располагает собственными
разработками в области эпидемиологии, профилактики, диагностики, лечения злокачественных новообразований, реабилитации и
паллиативной терапии онкологических больных.
В учреждении работают 17 докторов медицинских наук (из них 16
профессоров), 79 кандидатов медицинских наук, 5 лауреатов премии Правительства Российской
Федерации, 11 лауреатов Государственной Премии Республики Татарстан.
Региональное отделение проводит
международные, всероссийские,
межрегиональные конференции
и образовательные семинары, где
врачи принимают активное участие не только как слушатели, но и
являются активными участниками,
выступая с докладами и разборами
клинических случаев. Важно отметить вклад команды специалистов республики в подготовку серьезных научных событий, таких
как V съезд онкологов России, VIII
и XI съезды онкологов и радиологов стран СНГ и Евразии (АДИОР), приуроченный к 100-летию
Республики Татарстан, 100-летию
Казанской государственной медицинской академии (Казанский
ГИДУВ) и 100-летию со дня рождения великого хирурга-онколога,
профессора М.З. Сигала. В 2019
году в г. Казань впервые прошел
Международный онкологический
саммит Европейского общества
медицинской онкологии (Саммит
ESMO-RUSSCO), организаторами
которого выступили Европейское
общество медицинской онкологии
(ESMO), ГАУЗ «РКОД» и Российское общество клинической онкологии.
В 2021 году в ознаменование 75-летия онкологической службы Республики Татарстан прошла российская конференция с международным участием «Онкология 21 века. Инновации медицинской науки в практическом здравоохранении». Основной повесткой конференции стали дискуссия об актуальных вопросах, стоящих перед онкологической службой всей страны, поиск оптимальных решений для повышения эффективности функционирования онкологической службы на различных уровнях, обсуждение проблем и поиск единых подходов в области диагностики, лечения и снижения смертности от злокачественных новообразований. Совместно с RUSSCO ежегодно организуются конференции и вебинары с участием не только врачей-онкологов, но и врачей смежных специальностей – терапевтов, кардиологов, нейрохирургов, неврологов и других. В 2022 году были проведены три конференции: онлайн-конференция «Опухоли головного мозга. Современные подходы к диагностике и лечению», вебинар «Лекарственная терапия опухолей головы и шеи», а также сессия RUSSCO в рамках конференции «Опухоли малого таза. Вчера. Сегодня. Завтра». Врачи онкологического диспансера ежегодно публикуют свои научные труды с описанием и разбором клинических случаев, разработками в российских и европейских специализированных журналах, выступают с докладами в европейских и международных конференциях, организованных ESMO, ASCO, ENETS, ESO.

Врачи регионального отделения
приняли активное участие в создании регистра Российского общества клинической онкологии
RUSSCO «Изучение тактики ведения онкологических пациентов, зараженных коронавирусом»
Значимым событием стало участие сотрудников диспансера в
конкурсе на получение Премии
имени академика А.И. Савицкого,
учрежденной в 2021 году Общероссийским национальным союзом
«Ассоциация онкологов России»
(АОР) совместно с Общероссийской общественной организацией
RUSSCO в знак признания выдающихся заслуг специалистов, занимающихся диагностикой и лечением онкологических заболеваний.
Специалисты диспансера в 2021
году стали лауреатами Премии
сразу в нескольких номинациях
– «Лучший химиотерапевт», «Лучший молодой онколог», а также
диспансер в номинации «Лучший
социальный проект». Высшим критерием признания успехов в профессиональной деятельности явилась победа в номинации «Лучший
молодой онколог» председателя
регионального отделения RUSSCO,
врача-онколога высшей категории, кандидата медицинских наук
Исянгуловой Алины Зульфатовны.

В 2022 году проект диспансера
«Комплексная программа информирования и подготовки
ближайшего окружения паллиативного пациента с применением
цифровой платформы», выполненный совместно с Казанским
государственным медицинским
университетом и отмеченный
жюри в конкурсе, помогает осуществлять сопровождение онкологического пациента на всех этапах его лечения и реабилитации,
улучшая качество жизни. С помощью данной платформы любой
желающий может получить самые
необходимые практические и теоретические знания в области паллиативной помощи.
Для успешной адаптации молодых специалистов организована программа наставничества, в
рамках которой ежеквартально
сотрудниками диспансера проводятся обучающие семинары. Врачи диспансера ведут ежедневные
консультации/телеконсультации
с районными онкологическими
отделениями и с центрами амбулаторной онкологической помощи
с целью подбора оптимальной тактики ведения пациентов из отдаленных муниципальных районов.

С целью своевременного выявления
онкозаболевания организуются выездные профилактические акции
специалистов в районные больницы
и поликлиники для обследования
групп населения, а также регулярные
выезды мобильного маммографического комплекса с целью ранней диагностики рака молочной железы.
Благодаря содействию RUSSCO в 2022 году врачи районных отделений были обеспечены экземплярами текущих клинических рекомендаций по лечению злокачественных опухолей.

За прошедшие годы в Республике
Татарстан создана эффективная
система оказания онкологической
помощи, которая сегодня продолжает развиваться на основе кластерного подхода и современных
технологий. Реализация научного
и практического потенциала наших специалистов позволила Республиканскому клиническому
онкологическому диспансеру занять достойное место среди ведущих специализированных центров
страны. Казанская школа онкологов пользуется заслуженным авторитетом среди ведущих отечественных и зарубежных ученых. В
рамках Федерального проекта по
борьбе с онкологическими заболеваниями с 2019 года проводится
масштабная работа над формированием современной комплексной
системы профилактики, диагностики и лечения онкологических
заболеваний, а также уделяется
приоритетное внимание модернизации клиник, внедрению передовых технологий.
Нам важен каждый пациент!
Ссылки:
Злокачественные новообразования в
России в 2020 году (заболеваемость и
смертность). Под ред. А.Д. Каприна,
В.В. Старинского, А.О. Шахзадовой.
М.: МНИОИ им. П.А. Герцена − филиал ФГБУ «НМИЦ радиологии»
Минздрава России, 2021. илл. 252 с.
РАСПРОСТРАНЕННЫЙ РАК ЯИЧНИКОВ, ПРАВИЛЬНОЕ ВРЕМЯ ДЛЯ НАЗНАЧЕНИЯ PARP-ИНГИБИТОРА
Автор: Тюляндина Александра Сергеевна
Заведующая отделением лекарственных методов лечения злокачественных опухолей №4
НИИ клинической онкологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России,
доктор медицинских наук, Москва
Включение PARP-ингибиторов в
клиническую практику привело к
изменению концепции лечения рака
яичников во всем мире, в том числе
даже позволило задуматься о потенциальном излечении отдельной категории пациенток с этим заболеванием. Современные подходы к лечению
позволили улучшить молекулярную
диагностику наследственного рака
яичников, позволив секвенированию
последнего поколения (NGS) стать
рутинным методом, сделав его обязательным для первичных больных распространенным раком яичников.
На ESMO 2022 были представлены
данные по продолжительности жизни двух крупных регистрационных
исследований III фазы по включению PARP-ингибиторов в рутинную
практику лечения распространенного рака яичников. Всем известно, что
значительным рывком за последние
20 лет в терапии рака яичников была
публикация данных исследования
SOLO1 в 2018 году. Напомню, что в
исследование включена 321 больная
с наличием мутации в генах BRCA1/2,
которые получили первую линию
на основе платиносодержащих схем
лечения с достижением полного или
частичного ответа. После рандомизации пациенты получали поддерживающую терапию олапарибом 600
мг в сутки внутрь в течении 2 лет,
в контрольной группе – плацебо в
течении аналогичного периода времени [1]. Публикация прослеженности безрецидивной выживаемости в
течении 5 лет продемонстрировала
фантастические результаты. Медиана времени без прогрессирования
(ВБП) в группе олапариба составила
56 мес., в группе плацебо – 13,6 мес.,
риск прогрессирования снижается на
70%. При этом расхождение кривых
сохраняется после окончания приема PARP-ингибитора. Полученные
данные позволяют предполагать, что
по прошествии 5 лет у 48% больных
не наблюдается прогрессирование заболевания, что может потенциально
приводить к полному выздоровлению этой группы больных (рис.1) [2].
Поэтому все медицинское сообщество ожидало анализа продолжительности жизни в данном исследовании,
как транслируются полученные результаты на продолжительность жизни больных.
Рисунок 1.
Исследование SOLO1
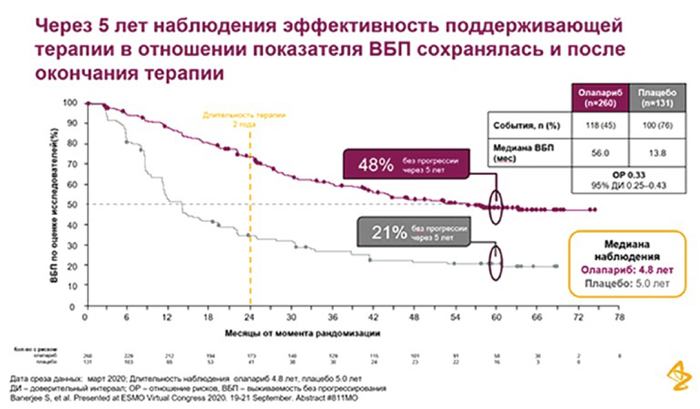
Рисунок 2.
Увеличение продолжительности жизни в исследовании
SOLO1
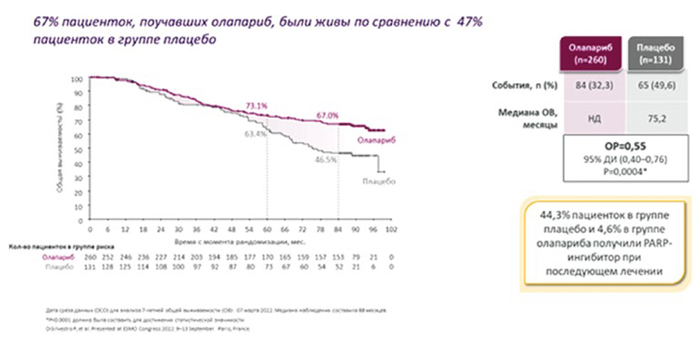
Анализ 7-летнего наблюдения за пациентками, показанный на конференции ESMO 2022, продемонстрировал
продолжительность жизни больных
с расхождением кривых в пользу
олапариба, медиана ПЖ была не достигнута, 7-летняя ОВ составила 67%,
в группе плацебо медиана – 75,2 мес.,
7-летняя ОВ – 46,5% (HR 0,55; 95%
СI 0,40-0,76; р=0,004, для подтверждения достоверности статистических
различий требовалось достижение
р<0,0001) (рис.2) [3]. Полученные результаты стоит рассмотреть внимательно. Исследователи оценили, как
много больных в группе контроля
получали PARP-ингибиторы в последующем. Оказалось, что практически
половина больных (44%) получали
данный класс препаратов при последующем лечении. Поэтому интересно было бы посмотреть сравнение
группы олапариба с группой пациенток, никогда не получавших PARPингибитор. Аналогичный анализ производился в исследовании SOLO2, в
которое включались пациентки с наличием патогенной мутации в генах
BRCA1/2, платиночувствительным
рецидивом при регистрации ответа
на препараты платины. При анализе продолжительности жизни также не было получено достоверных
различий в медиане ПЖ. Исключив
пациентов с кроссовером и проанализировав выживаемость больных,
получавших поддерживающую терапию олапарибом, с пациентками в
группе плацебо, но которые никогда
не получали PARP-ингибиторы, было
получено достоверное увеличение медианы ПЖ на 16,3 мес. в группе олапариба, со снижением риска смерти
на 44% [4]. Таким образом, вывод, что
назначение PARP в процессе лечения
больной играет важную роль, влияющую на ее отдаленные результаты,
является обоснованным, поэтому
можно предположить, что при сравнении подгрупп поддерживающей
терапии олапарибом в первой линии
с группой контроля без кроссовера в
исследовании SOLO1 будет получено
достоверное увеличение продолжительности жизни в первой когорте.
Еще одним важным пунктом является время назначения олапариба – то
есть является ли критичным неназначение олапариба после первой
линии лечения у больных BRCAассоциированным распространенным раком яичников. На наш взгляд,
следует ответить утвердительно:
во-первых, пациентка при раннем
назначении препарата может потенциально быть излечена или иметь
длительную ремиссию, позволившую
ей не быть привязанной к внутривенной системной терапии. Во-вторых, в
случае развития платинорезистентного рецидива больная может лишиться возможности получить PARPингибитор в последующем. В-третьих,
при сравнении медиан ВБП в обоих
исследованиях неоспоримая польза
отмечается от назначения олапариба максимально рано: медиана ВБП в
SOLO1 – 56 мес., в SOLO2 – 19,1 мес.
Поэтому важной задачей хирургов
онкогинекологов и медицинских онкологов является как можно раньше
узнать BRCA-статус больной распространенным раком яичников для
того, чтобы определиться с наилучшей тактикой во время первой линии
терапии.
Помимо отдаленных результатов
SOLO1, на конференции ESMO
2022 показали финальные результаты по продолжительности жизни в
PAOLA-1. В исследовании пациентки с распространенным раком яичников вне зависимости от статуса
BRCA1/2, а также факторов прогноза
для назначения олапариба получали
после окончания ХТ первой линии
с эффектом комбинацию олапариб
и бевацизумаб (введения бевацизумаба инициировались во время ХТ)
или плацебо и бевацизумаба. На
ESMO 2019 показано достоверное
увеличение ВБП в группе комбинации по сравнению с группой олапариба [5]. Исследователи провели незапланированный анализ, разделив
больных в зависимости от статуса
нарушений в системе гомологичной
рекомбинации (HRD). При наличии
мутации BRCA1/2 результаты были
сопоставимы с данными SOLO1, поэтому многие эксперты пришли к
мнению, что в данной популяции
больных комбинация олапариба и
бевацизумаба также эффективна, как
и монотерапия PARP-ингибитором,
достаточно использование одного
олапариба. В группе больных с наличием нарушений в системе репарации
(HRD+/BRCA1/2–) также отмечался
достоверный, но меньший выигрыш
в медиане ВБП от добавления олапариба к бевацизумабу по сравнению
с одним бевацизумабом. В группе
HRD-негативных больных добавление олапариба не давало никакого
преимущества. На ESMO 2020 были
показаны данные по оценке времени
до второго прогрессирования (ВБП2),
то есть от момента рандомизации
до развития второго последующего
прогрессирования заболевания. Сохраняется полученная тенденция в
зависимости от статуса HRD: при наличии мутации BRCA1/2 выигрыш
от добавления олапариба составляет
14,7 мес. (HR 0,56), в группе HRD+ без
мутации BRCA1/2 равнялся 20,2 мес.
(HR 0,60), в группе HRD негативных
больных различия не были получены
(HR 0,98). На основании этого исследования в мире регистрируется показание по включению комбинации
олапариба и бевацизумаба у больных
с HRD-позитивным статусом. Безусловно, на первых порах данное исследование было воспринято с долей
скепсиса, поскольку не все коллеги
уверены в необходимости назначения
бевацизумаба всем больным распространенным раком яичников в первой линии. Вторым моментом являлась доступность HRD-тестирования
в рутинной практике. В то же время
положительным моментом данной
регистрации является мотивация ученых и генетиков на острую необходимость разработки собственного теста
для выявления нарушений в системе
гомологичной репарации (HRD), что
видно на примере нашей страны, где
активно внедряется тест AmoyDx после его изучения и валидация на российской популяции. Напомним, что
совсем недавно полное геномное секвенирование для выявления мутаций
в генах BRCA1/2 было труднодоступным. Сейчас же, благодаря данным
исследований SOLO1, SOLO2, NGS
для определения патогенных мутаций
в генах BRCA1/2 является рутинным
тестированием во многих регионах
нашей страны.
Рисунок 3.
Исследование PAOLA-1
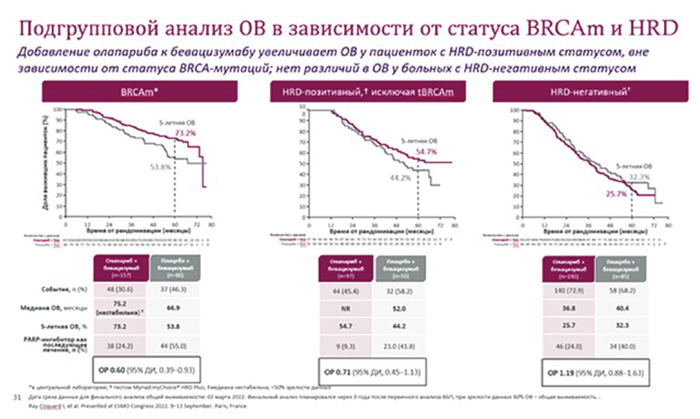
Итак, на конференции ESMO 2022
были показан анализ продолжительности жизни больных в исследовании PAOLA-1. Медиана продолжительности жизни была сопоставима
в обеих группах: 56,5 мес. в группе
олапариба и бевацизумаба и 51,6 мес.
в группе бевацизумаба (HR 0,92; 95%
CI 0,76-1,12) [6]. Отсутствие различий
исследователи связывают с высоким
числом кроссовера в контрольной
группе – 45,7% больных в последующем получали PARP-ингибиторы.
Отмечалось достоверное увеличение медианы ПЖ в группе HRDпозитивных больных, 65,5 мес. в
когорте получавших комбинацию и
48,4 мес. в когорте бевацизумаба (HR
0,62; 95% CI 0,45-0,85). Любопытно,
что полученная статистическая значимость достигалась за счет больных
с мутациями в генах BRCA1/2. У этих
пациенток, в отличие от исследования SOLO1, отмечалось достоверное
увеличение медианы ПЖ на 8,3 мес.
в группе комбинированной поддерживающей терапии: 75,2 мес. в группе
олапариб + бевацизумаб, 53,8 мес. в
группе бевацизумаба (HR 0,60; 95% СI
0,39-0,93). Полученные различия могут объясняться большим эффектом
от использования комбинированного
лечения или недостаточно зрелыми
данными, в группе олапариба и бевацизумаба состоялось всего 30,6% событий. Подгруппа HRD-позитивных
больных без мутаций в генах BRCA1/2
выигрывала от назначения олапариба
+ бевацизумаба (медиана не достигнута), 5-летняя общая выживаемость
в этой группе составила 54,7%, в подгруппе больных на поддерживающей
терапии бевацизумабом – 44,2%,
однако различия не имели статистической значимости (HR 0,71; 95% CI
0,45-1,13). В третьей группе HRDнегативных пациенток отмечалась
ранее намеченная тенденция – отсутствие выигрыша от добавления олапариба к бевацизумабу (рис.3). Скептики могут неоднозначно трактовать
полученные результаты при анализе
больных с HRD+/BRCA1/2– статусом.
С другой стороны, затруднительно
делать выводы на основании незапланированого анализа, поскольку в
этой популяции больных могло просто не хватить статистической мощности, чтобы показать достоверное
различие в пользу комбинированного
лечения (N=76). Также могла сыграть
немаловажная роль перекрестного получения PARP-ингибиторов
в последующем в группе больных,
получавших один бевацизумаб. Напомню, что результаты анализа ПЖ
исследований другого препарата данного класса, где в исследовании был
запланирован анализ в зависимости
от HRD-статуса, ожидаются, а пациентки достоверно выигрывали в медиане ВБП от добавления поддерживающей терапии PARP-ингибитором
именно в когорте больных с HRD +
статусом при отсутствии патогенных
мутаций BRCA1/2. Поэтому нам остается ждать полноценной публикации
финальных данных исследования
PAOLA-1 для продолжения данной
дискуссии. Сегодня с учетом достоверного увеличения ВБП для больных
с HRD-позитивным статусом во всех ведущих странах комбинация олапариба и бевацизумаба остается одной
из ведущих опций терапии первой
линии, требующей проведения раннего тестирования для регистрации нарушений в системе репарации ДНК.
В заключение хотелось бы обратить
особое внимание на необходимость
назначать эффективный препарат
в период, когда он будет приносить
максимальную пользу. Хорошим
примером могут служить данные исследования SOLO3. Это исследование
III фазы, в которое включались пациентки с платиночувствительным
рецидивом рака яичников (N=266).
После рандомизации они попадали в
когорту терапии олапарибом в качестве лечебной опции или назначения
неплатиновой монохимиотерапии
по выбору врача. К такому подходу
можно относиться неоднозначно,
поскольку оба рукава являются экспериментальными, стандартом терапии такого вида рецидива остается
комбинация на основе платинового
агента. Первичной конечной точкой в исследовании был объективный ответ, который оказался выше
в группе олапариба, чем в группе
химиотерапии (72,2% против 51,4%
соответственно) [7]. Также были
показаны статистически значимые
различия в медиане времени без
прогрессирования в пользу олапариба. Полученные данные стали
основанием для регистрации FDA
этого показания в США. Напомню,
что в Европе и России такой опции
не существовало. В 2022 году на конференции SGO были опубликованы
финальные данные по продолжительности жизни больных в этом
исследовании. Для больных, получивших 2 и более линии терапии,
медиана ПЖ была одинакова в обеих
группах: 34,9 мес. в группе олапариба
и 32,9 мес. в группе химиотерапии,
различия не имели статистической
значимости, что формально позволяет назначить олапариб пациентам
с платиночувствительным рецидивом в качестве линии лечения, если
им не показана комбинация на основе платины. Однако летом этого
года сама компания производитель
отзывает данное показание в США,
поскольку в группе больных, получивших 3 и более линии терапии
олапариба, он стал проигрывать химиотерапии, медиана ПЖ в группе
PARP-ингибитора оказалась на 10
мес. ниже, чем в группе химиотерапии: 29,9 и 39,4 мес. соответственно,
различия статистически не значимы.
Это еще раз показывает два важных
момента. Во-первых, хотя общая выживаемость и являлась вторичной
конечной точкой в исследовании,
данный показатель играет одну из
ключевых ролей в определении показаний к современной терапии.
Во-вторых, эффективный препарат должен быть назначен там, где
он будет приносить максимальную
пользу, т.е. в первой линии лечения
или, в крайнем случае, при платиночувствительном рецидиве. Поэтому
будьте внимательны, если столкнетесь со статьей, где будет написано
об отзыве показания олапариба для
платиночувствительных рецидивов.
Это касается только его показания
для США в качестве альтернативы
системной цитостатической терапии. Назначение олапариба в качестве поддерживающей терапии при
платиночувствительном рецидиве и ответе на комбинацию с платиной,
а тем более при наличии мутации
BRCA1/2 остается одним из важных
показаний для продления жизни пациенток с распространенным раком
яичников.
Источники:
1. Moore K, et al. Maintenance Olaparib in Patients with Newly Diagnosed Advanced Ovarian CancerN Engl J Med. 2018; 379: 2495-2505.
2. Banerjee S, et al. Maintenance olaparib for patients with newly diagnosed advanced ovarian cancer and a BRCA mutation (SOLO1/GOG 3004): 5-year follow-up of a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2021; 22: 1721- 1731.
3. DiSilvestro P, Banerjee S, Colombo N, et al. Overall survival with maintenance olaparib at a 7-year follow-up in patients with newly diagnosed advanced ovarian cancer and a BRCA mutation: The SOLO1/GOG 3004 trial. J Clin Oncol. Published online: September 9, 2022. doi:10.1200/JCO.22.01549.
4. Poveda A, et al. Olaparib tablets as maintenance therapy in patients with platinum-sensitive relapsed ovarian cancer and a BRCA1/2 mutation (SOLO2/ENGOT-Ov21): a final analysis of a double-blind, randomised, placebo-controlled, phase 3 trial. Lancet Oncol. 2021 May; 22 (5): 620-631.
5. Ray-Coquard I, Pautier P, Pignata S, et al. Olaparib plus bevacizumab as first-line maintenance in ovarian cancer. PAOLA-1 Protocol. N Engl J Med. 2019; 381 (25): 2416-2428.
6. Ray-Coquard I, et al. Final overall survival (OS) results from the Phase III PAOLA-1/ENGOT-ov25 trial evaluating maintenance olaparib (ola) plus bevacizumab (bev) in patients (pts) with newly diagnosed advanced ovarian cancer (AOC).ESMO Congress 2022, LBA 29.
7. Penson R, et al. Olaparib Versus Nonplatinum Chemotherapy in Patients With Platinum-Sensitive Relapsed Ovarian Cancer and a Germline BRCA1/2 Mutation (SOLO3): A Randomized Phase III Trial. J Clin Oncol. 2020; 10; 38 (11): 1164-1174.
8. Lawrence L. Olaparib Did Not Improve PFS2, OS in SOLO3 Trial. CancerTherapyAdvisor. Published online: March 19, 2022.
9. www.lynparzahcp.com/content/
dam/physician-services/us/590-
lynparza-hcp-branded/hcp-global/pdf/
solo3-dhcp-final-signed.pdf
PARP-ИНГИБИТОРЫ ПРИ РАКЕ ЯИЧНИКОВ. ВРЕМЯ НАЗНАЧЕНИЯ ИМЕЕТ ЗНАЧЕНИЕ. НО ТОЛЬКО ЛИ ВО ВРЕМЕНИ ДЕЛО?
Автор: Жуков Николай Владимирович
ФГБУ «НМИЦ Детской гематологии, онкологии и иммунологии им. Д. Рогачева»,
доктор медицинских наук, профессор, Москва
Путь противоопухолевых
препаратов в клинику обычно
весьма схож. Сначала эффективность новых лекарств исследуется в популяции «предлеченных» (или даже очень
сильно предлеченных) больных (поздние линии лечения).
Затем препараты, показавшие
свою эффективность в этой
популяции пациентов, продвигаются к «началу болезни» – в более ранние линии
лечения метастатического заболевания, а иногда и в адъювантную/неоадъювантную
терапию. При наличии альтернативных вариантов лечения первые исследования,
проводимые на сильно предлеченной популяции больных, редко бывают регистрационными – чаще речь идет
лишь об исследованиях I-II
фазы, задачей которых является не получение официально одобренного показания,
а лишь необходимость удостовериться в переносимости лечения и факте наличия
активности препарата при
данном типе опухоли. И если
предварительные исследования оказываются позитивным, то
в последующем уже инициируются большие и дорогостоящие
исследования III фазы у менее
предлеченных больных с целью
регистрации препарата именно в
этой популяции.
Но в случае, если в поздних линиях лечения у нового препарата нет
(или очень мало) альтернатив с доказанной эффективностью, то исследования в предлеченной популяции тоже проводятся в формате
«регистрационных», т.е. по их результатам в инструкции появляется показание «для лечения во 2 (3,
4, 5 или более) линиях терапии».
Но затем, по получении результатов дополнительных исследований, появляются показания для
применения этих же препаратов
в более ранних линиях лечения.
Таким образом, у врача появляется выбор – когда же использовать
подобный препарат. В ранних линиях терапии или «отложить его
на потом», когда другие, менее
современные (но и менее дорогостоящие) опции терапии будут исчерпаны. И в условиях дефицита
ресурсов, когда инновационных
препаратов на всех не хватает, а
также с учетом консервативности
врачей, часто идущих привычным путем, нередко (точнее, даже
чаще) на первых порах побеждает
второй подход – сначала стандартная терапия «прошлых лет», потом, когда ее возможности будут
исчерпаны, – новые препараты.
И, собственно, такой подход не
противоречит ни инструкциям,
ни клиническим рекомендациям.
Хотя, конечно, если посмотреть
с медицинской и научной точек
зрения, чаще всего, проблемы в
нем все же есть. Ведь несмотря на
формальное равенство показаний,
можно заметить, что регистрация в поздних линиях зачастую
основывается на исследованиях,
использующих лишь суррогатные маркеры эффективности – в
условиях отсутствия альтернатив
для регистрации достаточным
оказывается показать даже факт
возможности достижения ремиссии (частота объективного ответа)
или, в лучшем случае, оценить ее
длительность или выживаемость
без прогрессирования. Ну и второй нюанс – даже если в качестве
критериев эффективности заявляется общая выживаемость, абсолютный выигрыш от применения
препаратов на поздних линиях
часто гораздо меньше. Таким образом, хотя назначение «в конце
пути» и позволяет «экономить»
препарат, назначая его меньшему
количеству больных (далеко не
все «доходят» до поздних линий
лечения) и на более короткий срок
(среднее время применения препарата в поздних линиях гораздо
короче), обратной стороной этих
же фактов является то, что часть
больных не доживает до возможности получить препарат (и пользу
от него), а те, кто все же получают,
имеют от него гораздо меньший
выигрыш, чем получают больные,
получающие тот же препарат на
более ранних этапах лечения.
Но, как оказалось, время применения препарата может быть и гораздо большей проблемой – не просто уменьшая размер выигрыша,
но и полностью меняя «вектор»
влияния препарата на общую выживаемость. Причем, похоже, для
целого класса лекарств – PARPингибиторов (во всяком случае,
при раке яичников).
Отчасти это уже прекрасно изложила А.С. Тюляндина в своем
сообщении, рассказав об исследовании SOLO-3, которое, несмотря на предварительные данные
о значимом увеличении частоты
объективных ответов и выживаемости без прогрессирования,
при финальном анализе показало
снижение общей выживаемости у
пациенток, получавших терапию
олапарибом в 4+ линиях лечения
распространенного рака яичников. Несмотря на то, что различия в общей выживаемости
были статистически незначимы, в цифровом выражении
они выглядят более чем впечатляюще: по сравнению с химиотерапией использование
олапариба приводило к повышению относительного риска
смерти на 33% и снижению медианы общей выживаемости
с 39 до 29 месяцев (и это при
том, что в качестве контроля
использовалась нестандартная для этой ситуации монохимиотерапия неплатиновым
агентом). И, несмотря на отсутствие статистической значимости различий в общей
выживаемости, это исследование послужило поводом для
отзыва регистрации олапариба
по данному показанию (лечение рака яичников в 4+ линии
терапии) в США. Но, увы, это
лишь часть истории. Проблема
в том, что практически аналогичные негативные результаты по общей выживаемости,
несмотря на ранее показанное
преимущество в выживаемости без прогрессирования,
были получены в близком по
дизайну и популяции больных
исследовании и для другого
PARP-ингбитора – рукапариба
[1]. В группе рукапариба медиана общей выживаемости
составила 19,4 месяца против
25,4 месяца в контрольной
группе, получавшей химиотерапию, режим которой определялся чувствительностью
опухоли к ранее проводившейся химиотерапии. Таким образом, получилось, что и в этом
исследовании применение
PARP-ингибитора в поздних
линиях лечения увеличивало
относительный риск смерти на
31%. Это привело к добровольному отзыву показания для поздних линий лечения и для этого препарата. Производитель
еще одного PARP-ингибитора – нирапариба – не стал «искушать
судьбу» и тоже добровольно отозвал регистрацию по этому показанию, «основываясь на данных, полученных в двух рандомизированных исследованиях препаратов других компаний». Безусловно, все компании после отзыва регистрации препаратов в
поздних линиях сконцентрировались на «позитивной» для себя
стороне этого события – на констатации, что препараты должны
назначаться раньше, не вдаваясь в поиск причин наблюдаемого
негативного влияния на общую выживаемость. Очевидно, что
«потеря» 4+ линии хотя и неприятна для компании, но далеко
не «смертельна», так как сохраняется возможность применения
препаратов в боле ранних линиях, более того, отчасти даже стимулирует это делать.
Беда в том, что ситуация имеет дальнейшее развитие. Как стало известно, FDA поставила перед компаниями вопрос об ужесточении показаний к назначению PARP-ингибиторов уже во второй линии терапии. Так, 11 ноября производитель нирапариба получил предписание FDA о необходимости дальнейшего сужения показаний к поддерживающей терапии препаратом, но теперь это уже касалось больных с первым рецидивов заболевания. Согласно предписанию FDA, рекомендовалось ограничить показания только пациентками с герминальными патогенными или вероятно патогенными мутациями BRCA [2]. Запрос был основан на финальных результатах исследования NOVA, показавшего тенденцию к увеличению риска смерти больных без герминальных мутаций, получавших нирапариб в качестве поддерживающей терапии после лечения 1 рецидива заболевания. Для производителя еще одного PARP-ингибитора – рукапариба – финальные данные исследования ARIEL3, показавшие, что по всем анализируемым подгруппам соотношение рисков (HR) смерти оказалось выше 1, могут оказаться последними, так как они поставили компанию на грань банкротства [3]. Другими словами, во всех подгруппах, получавших рукапариб в качестве поддерживающей терапии после второй линии химиотерапии, отмечалась тенденция к увеличению риска смерти по сравнению с химиотерапией. А в первой линии терапии данный препарат не зарегистрирован.
Казалось бы, ну, да бог бы с ней, с компанией-производителем рукапариба. Да и с последующими линиями терапии, как таковыми, так как у нас есть возможность использовать PARPингибитор (олапариб) в качестве поддержки после первой линии терапии – и с очень хорошими результатами по выживаемости без прогрессирования и хорошей тенденцией в отношении общей выживаемости [4]. Главное – назначить препарат вовремя (то есть после первой линии химиотерапии).
Это безусловно – да! Но с учетом «кучности» негативных результатов возникает ощущение, что снижение общей выживаемости в последующих линиях не является случайным и ассоциировано именно с применением PARP-ингибиторов, а не обусловлено какими-либо другими причинами. И в отсутствии однозначного объяснения наблюдаемого феномена (почему же так произошло) сохраняются опасения в отношении того, что при раке яичников действительно есть популяция, которая проигрывает от назначения этого класса препаратов. Просто «в дебюте» этих больных меньше, чем больных выигрывающих. А вот в последующих линиях эта популяция начинает преобладать. Хотя, конечно, это лишь предположение, и результаты существующих исследований по использованию олапариба в качестве поддерживающей терапии после инициального лечения позволяют нам его беспрепятственно применять. Более того, пока эти данные говорят нам о том, что применять препарат надо именно в первой линии, как и написала в своей заметке Александра Сергеевна.
Источники:
1. Oza AM, et al. Overall survival results from ARIEL4: A phase III study assessing rucaparib vs chemotherapy in patients with advanced, relapsed ovarian carcinoma and a deleterious BRCA1/2 mutation. Annals of Oncology. 2022; 33 (suppl_7): S235-S282. 10.1016/annonc/ annonc1054.
2. www.gsk.com/en-gb/media/press-releases/gsk-provides-an-updateon-zejula-niraparib-us-prescribing-information/.
3. d18rn0p25nwr6d.cloudfront.net/CIK-0001466301/8d6f0174-be19- 4166-8f15-b9b0f26649ff.pdf.
4. DiSilvestro P, Banerjee S, Colombo N, Scambia G, Kim BG, Oaknin
A, Friedlander M, Lisyanskaya A, Floquet A, Leary A, Sonke GS,
Gourley C, Oza A, González-Martín A, Aghajanian C, Bradley W,
Mathews C, Liu J, McNamara J, Lowe ES, Ah-See ML, Moore KN;
SOLO1 Investigators. Overall Survival With Maintenance Olaparib
at a 7-Year Follow-Up in Patients With Newly Diagnosed Advanced
Ovarian Cancer and a BRCA Mutation: The SOLO1/GOG 3004 Trial.
J Clin Oncol. 2022 Sep 9; JCO2201549. doi: 10.1200/JCO.22.01549.
Epub ahead of print. PMID: 36082969.
PADA-1: ПЕРВАЯ ЛИНИИ ТЕРАПИИ ПРИ ГОРМОНОЗАВИСИМОМ РАКЕ МОЛОЧНОЙ ЖЕЛЕЗЫ С МУТАЦИЕЙ В ГЕНЕ ESR1 (ЭР-α)
Резистентность к эндокринотерапии при гормонозависимом HER2-
негативном раке молочной железы
(РМЖ) является ключевым моментом в прогнозе, течении заболевания
и определении тактики лечения. Необходимо обсудить некоторые термины и механизмы, чтобы понять
причину гормонорезистентности
при мутации в гене ESR1.
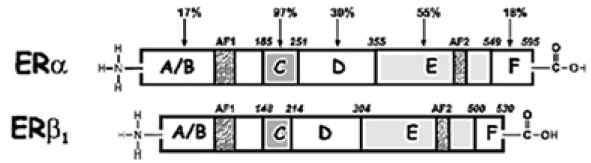
Эстрогеновые рецепторы (ЭР) кодируются генами (ESR1 – ЭР-α и
ESR2 – ЭР-β), локализующимися в
6 и 14 хромосомах, и являются стероидными ядерными рецепторами.
ЭР состоят из нескольких доменов
и кодируют множество различных
транскриптомов, образующихся
путем альтернативного сплайсинга
(рис.1).
Рисунок 1. Строение
эстрогеновых рецепторов.
Эстрогены реализуют свои эффекты
двумя путями: геномным и негеномным. Геномный делится на классический и неклассический пути активации. В большинстве случаев путь
передачи сигнала состоит из следующих этапов (геномный путь): гормон
проникает в клетку, контактирует с
ЭР, далее комплекс «гормон-рецептор» проникает в ядро, где происходит его связывание с промотерным
участком ДНК (ERE). Данная последовательность приводит к синтезу
специфических гормонозависимых
белков и соответствующим эффектам.
В дополнение к классическому пути
ЭР могут влиять на генетические
транскрипционные процессы с помощью механизма, который не требует
прямого связывания комплекса Э-РЭ
с ERE. РЭ могут взаимодействовать
с другими факторами транскрипции
(Sp1, Jun, Fos, NF-κB), связанными с
альтернативными транскрипционными факторами ДНК. Ключевым и
наиболее распространенным звеном
неклассического пути является активация транскрипционного фактора
AP1, который, также как и ERE, расположен в промоторной области различных генов.
Большинство мутаций гена
ESR1(ЭР-α), ассоциированных с гормонорезистентностью, расположены
в лиганд-связывающем домене, и их
можно разделить на несколько функционально различных групп:
• мутации, приводящие к гормононезависимой активации рецептора (Y537S, D538G);
• мутации, ассоциированные с гиперчувствительность к эстрогенам, а следовательно, к гиперактивности комплекса «Э-ЭР» (K303R, E380Q) при малой концентрации эстрогенов;
• нейтральные (S432L, V534E).
В доклинических исследованиях [1,2]
показано, что мутации в лиганд-связывающем домене гена ESR1 появлялись в условиях низкого уровня
эстрогенов в плазме крови, это обуславливает их возникновение на фоне
терапии ингибиторами ароматазы
(ИА). В других работах показано, что
различные мутации в лиганд-связывающем домене гена ESR1 приводят
к различному уровню ответа на гормонотерапию. Так, в исследовании
Jeselsohn et al. [3] in vitro отмечена резистентность к тамоксифену и фулвестранту при мутации Y537S в лигандсвязывающем домене и сохранение их
активности при мутации D538G в той
же области.
PADA-1 – рандомизированное исследование 3 фазы, посвященное определению целесообразности перехода на
гормонотерапию второй линии (фулвестрант ± ингибиторы CDK4/6) при
выявлении мутации в гене ESR1 во
время терапии ИА и ингибиторами
CDK4/6 [4].
Рисунок 2.
Дизайн исследования PADA-1
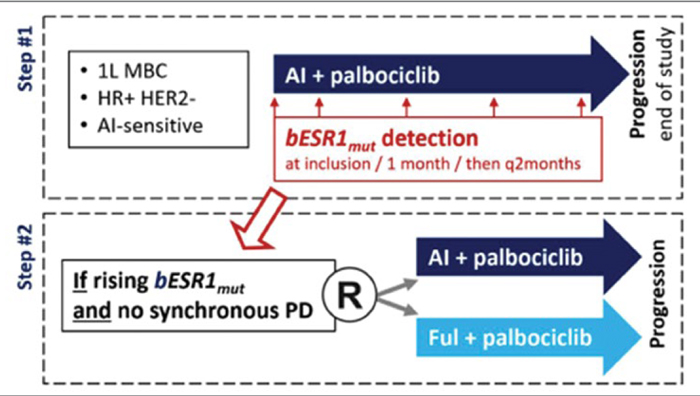
В исследование скринировано 1017
пациентов, получавших ИА с палбоциклибом в 1 линии терапии, у 279
больных во время лечения выявлена
мутация в гене ESR1 (рис.2). В 172
случаях не было выявлено прогрессирования заболевания в момент идентификации мутации, эти пациенты и
были рандомизированы в 2 лечебные
группы (1:1):
• n=84: продолжение терапии ИА в комбинации с палбоциклибом;
• n=88: фулвестрант в комбинации с
палбоциклибом.
Забор образцов крови для определения мутации в гене ESR1 (цДНК)
проводился каждые 2 месяца лечения
(каждый нечетный цикл).
Первичными конечными точками
исследования были медианы ВБП
в группах пациентов с выявленной
мутацией в гене ESR1 и частота регистрации гематологических НЯ ≥3
степени во всей группе больных. Вторичными – медиана ВБП2, время до
начала химиотерапии, токсичность
лечения и качество жизни
Рисунок 3.
График выживаемости без прогрессирования
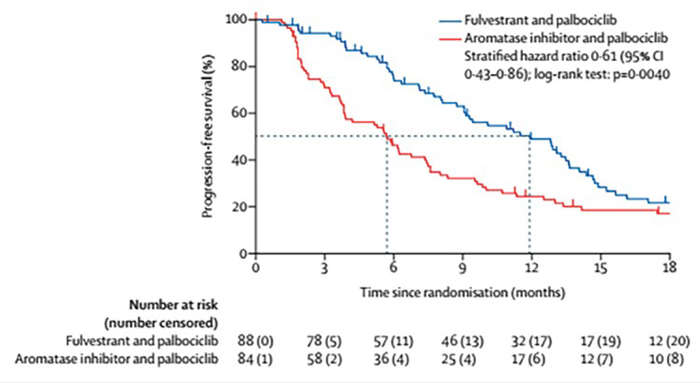
При медиане времени наблюдения
после рандомизации в 26 мес. медиана ВБП в группе фулвестранта и палбоциклиба достигла 11,9 мес. против
5,7 мес. в группе ИА и палбоциклиба
(ОР=0,61; 95% ДИ 0,43-0,86; р=0,0040;
рис.3). Гематологическая токсичность
3 степени и выше была представлена
нейтропенией (70,3%), тромбоцитопенией (2,0%) и лимфопенией (6,5%).
Время до назначения химиотерапии
достигло 14,6 мес. в группе фулвестранта и палбоциклиба и 13,1 мес. в
группе ИА и палбоциклиба (ОР=0,91;
95% ДИ 0,62-1,33; р=0,6).
Выполнена оценка медианы ВБП в
группе пациентов, у которых выявление мутации в гене ESR1 совпало с
регистрацией прогрессирования и в
качестве второй линии лекарственного лечения получавших комбинацию
фулвестранта и палбоциклиба. В этой
когорте больных медиана ВБП составила лишь 3,5 мес.
При подгрупповом анализе показано, что максимальный выигрыш от
смены лечебной тактики отмечен у
пациентов моложе 60 лет (ОР=0,45
[0,28-0,73]), с ECOG 0 (ОР=0,55 [0,35-
0,87]), висцеральными метастазами
(ОР=0,50 [0,30-0, 82]) и ранее не получавших ИА в адъювантном режиме
(ОР=0,53 [0,35-0,81]).
Нежелательные явления 3 степени и
выше были преимущественно представлены нейтропенией (35% и 39%)
и лимфопенией (3,6% и 4,5%). Новых
клинически значимых НЯ отмечено
не было.
Источники:
1. Carausu M, Bidard F-C, Callens C, et al. ESR1 mutations: a new biomarker in breast cancer. Expert Rev Mol Diagn. 2019; 19: 599-611.
2. Brett JO, Spring LM, Bardia A, Wander SA. ESR1 mutation as anemerging clinical biomarker in metastatic hormone receptorpositive breast cancer. Breast Cancer Res. 2021; 23: 85.
3. Jeselsohn R, Bergholz JS, Pun M, et al. Allele-specifc chromatin recruitment and therapeutic vulnerabilities of ESR1 activating mutations. Cancer Cell. 2018; 33: 173-186.e5.
4. François-Clément Bidard, et al. Switch
to fulvestrant and palbociclib versus no
switch in advanced breast cancer with
rising ESR1 mutation during aromatase
inhibitor and palbociclib therapy
(PADA-1): a randomised, open-label,
multicentre, phase 3 trial. Lancet Oncol.
2022. Published online: September 29,
2022. https://doi.org/10.1016/S1470-
2045(22)00555-1.
ТРАСТУЗУМАБ ДЕРУКСТЕКАН КАК ТЕРАПЕВТИЧЕСКАЯ ОПЦИЯ ПРИ HER2- LOW АДЕНОКАРЦИНОМЕ ЖЕЛУДКА И КАРДИОЭЗОФАГЕАЛЬНОГО ПЕРЕХОДА
По данным литературы, HER2-
положительный рак желудка (РЖ)
и кардиоэзофагеального перехода
(КЭП) встречается в ≈20% случаев,
с одинаковой частотой как в Европе, так и в Азии. В российской популяции 11-19% аденокарцином
желудка и КЭП обладают положительным HER2 статусом [1]. Уровень
экспрессии и амплификации HER2
при РЖ в пределах одного опухолевого образца демонстрирует выраженную гетерогенность, что во
многом объясняет феномен первичной резистентности к трастузумабу при HER2-положительном РЖ
и неэффективность продолжения
анти-HER2 терапии при прогрессировании. Единственным препаратом, продемонстрировавшим свою
эффективность в поздних линиях
терапии HER2-положительного РЖ
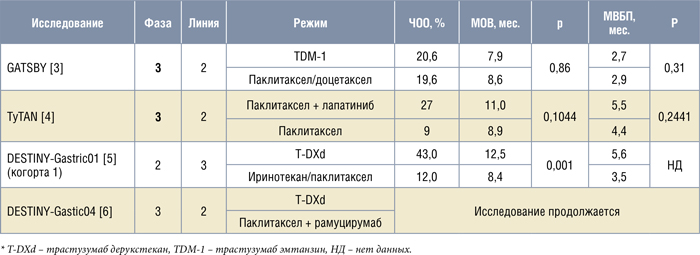
и КЭП при подтвержденном прогрессировании на фоне терапии трастузумабом, является трастузумаб дерукстекан (T-DXd) (табл.1).
Таблица 1.
Результаты рандомизированных исследований по изучению роли анти-HER2 терапии во второй и последующих
линиях лечения больных HER2 позитивным РЖ и КЭП.
HER2-low рак желудка:
• HER2+/FISH отрицательный: слабое/умеренное полное, базолатеральное или латеральное мембранное окрашивание ≥10% опухолевых клеток в операционном материале или слабое/ умеренное полное, базолатеральное или латеральное мембранное окрашивание кластера опухолевых клеток (5 клеток – кластер) в материале биопсии;
• HER2 1+: слабое/едва заметное частичное мембранное окрашивание
>10% опухолевых клеток в операционном материале или слабое/едва
заметное частичное мембранное
окрашивание кластера опухолевых
клеток (5 клеток – кластер) в материале биопсии [7].
Эффект убийства свидетеля
(bystander killing effect)
Одна из важных характеристик злокачественной опухоли – неоднородность
ее клеточного состава, или внутриопухолевая гетерогенность – генетическая, эпигенетическая и фенотипическая. Фенотипическая гетерогенность
проявляется не только в разнородности клеток по форме, размеру, но и по
экспрессионному профилю, а следовательно, и рецепторному статусу.
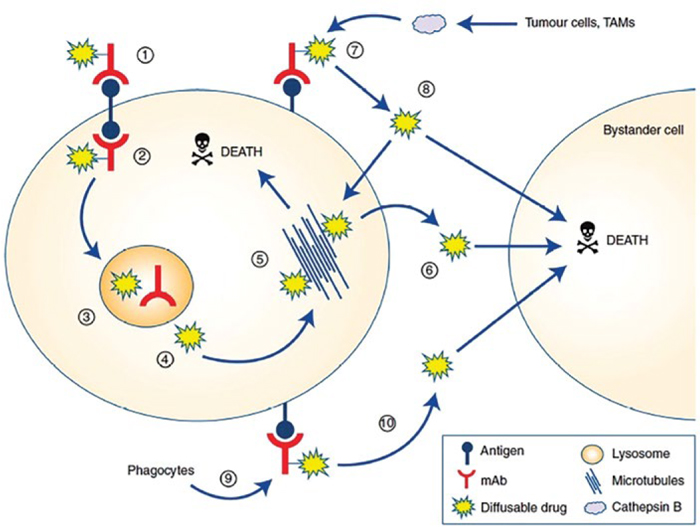
Механизм «эффекта убийства свидетеля» состоит в следующем. Конъюгат
антитело-цитостатик связывается с
рецептором (1) на поверхности опухолевой клетки, далее посредством рецепторо-опосредованного эндоцитоза
осуществляется интернализация комплекса (2) с формированием лизосомы
(3), в которой происходит деградация
линкера, связывающего цитостатик с
антителом (4,5). Низкомолекулярный
низкополярный гидрофобный цитостатик диффундирует через клеточную мембрану (6) в межклеточный
матрикс и в клетки без экспрессии
таргетного рецептора. Кроме того,
ферментативно расщепляемые линкеры, связывающие антитело с цитостатиком, могут разрушаться в межклеточном матриксе при определенной
pH или различными катепсинами (7,8)
(рис.1).
Рисунок 1.
Bystander killing effect
Наличие у современных конъюгатов
антитело-цитостатик «эффекта убийства свидетеля» позволяет надеяться
на их активность при низком уровне
экспрессии таргетных рецепторов на
поверхности опухолевых клеток.
В третью и вторую когорты исследования DESTINY-Gastric01 было включено 45 пациентов c верифицированным
HER2-low РЖ и КЭП, ранее получивших как минимум 2 линии терапии
с включением препаратов платины и
фторпиримидинов.
Пациентам назначалась терапия
T-DXd в дозе 6,4 мг/кг в/в кап. 1 раз в 21
день до прогрессирования или неприемлемой токсичности.
Первичной конечной точкой исследования была частота достижения объективного ответа (ОО), вторичными
– медианы выживаемости без прогрессирования (ВБП) и общей выживаемости (ОВ), частота контроля роста
опухоли (КРО) и длительность ответа
на терапию.
Участники были стратифицированы в две лечебные группы в зависимости от уровня экспрессии HER2:
• когорта 1 (HER2 ИГХ2+/FISH-), n=21;
• когорта 2 (HER2 ИГХ 1+), n=24.
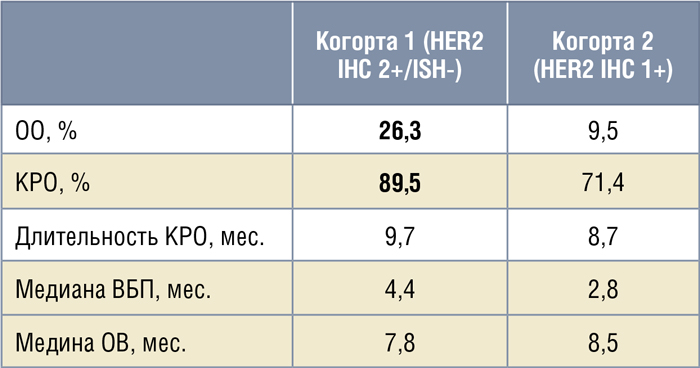
Частота ОО составила 26,3% (5/19) в
первой когорте и 9,5% (2/21) во второй,
при КРО в 89,5% (17/19) и 74,1% (15/21)
соответственно (рис.2). Медиана ВБП
в 1 группе достигла 4,4 мес. и 2,8 мес.
– во второй, при медиане ОВ в 7,8 мес.
и 8,5 мес. соответственно (рис.3). Подробно результаты исследования представлены в таблице 2.
Рисунок 2.
Непосредственная эффективность терапии в 1 и 2
когорте.
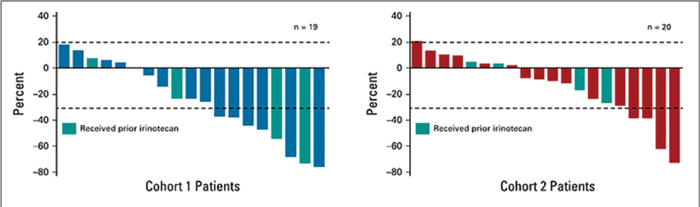
Рисунок 3.
Графики выживаемости без прогрессирования и общей
выживаемости.
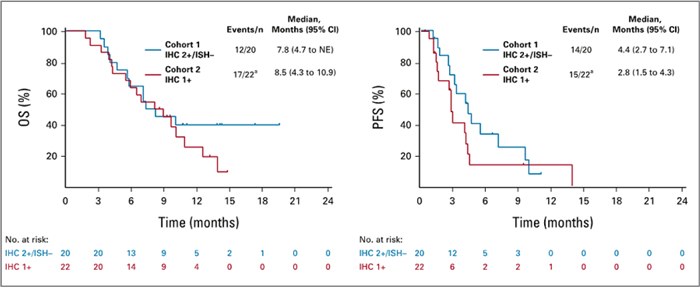
Таблица 2.
Результаты исследования DESTINY-Gastric01
НЯ 3 степени и выше зарегистрированы у 70,0% пациентов в первой группе
и у 79,2% во второй и преимущественно были представлены анемией (30,0%
и 29,2%), нейтропенией (25,0% и 29,2%)
и снижением аппетита (20,0% и 20,8%).
НЯ привели к прекращению терапии
у 2 (10,0%) больных в первой группе и
у 1 (4,2%) во второй, перерыву в лечении – у 8 (40,0%) и 10 (41,7%), редукция
дозы T-DXd потребовалась 6 (30,0%)
и 8 (33,3%) пациентам соответственно. Пульмонит, ассоциированный с
терапией T-DXd, зарегистрирован у 2
больных [8].
Если забыть о цене T-DXd, то это однозначно не самые разочаровывающие
результаты. В 2022 году вариантами
выбора во второй и последующих линиях лечения остаются монотерапия
иринотеканом, доцетакселом, паклитакселом, рамуцирумабом, пембролизумабом, ниволумабом, апатинибом,
TAS-102. При ECOG 0-1 возможно рассмотреть вопрос о комбинированной
химиотерапии (FOLFIRI, XELIRI) или
комбинации классической цитостатической терапии с таргетными препаратами (паклитаксел + рамуцирумаб,
FOLFIRI + рамуцирумаб, иринотекан
+рамуцирумаб). Выбор схемы лечения
обусловлен общим состоянием пациента, токсичностью предшествующей
химиотерапии и возможностями онкодиспансера. По данным различных
авторов, упомянутые схемы позволяют добиться МВБП от 2,1 до 4,4 мес., и
МОВ от 5,2 до 9,6 мес. [9].
Источники:
1. Cancer Genome Atlas Research Network, Analysis Working Group: Asan University, BC Cancer Agency, et al. Integrated genomic characterization of oesophageal carcinoma. Nature. 2017; 541 (7636): 169-175.
2. Van Cutsem E, Bang YJ, Feng-Yi F, et al: HER2 screening data from ToGA: Targeting HER2 in gastric and gastroesophageal junction cancer. Gastric Cancer. 2015; 18: 476-484.
3. Thuss-Patience PC, Shah MA, Ohtsu A, et al. Trastuzumab emtansine versus taxane use for previously treated HER2-positive locally advanced or metastatic gastric or gastro-oesophageal junction adenocarcinoma (GATSBY): an international randomised, open-label, adaptive, phase 2/3 study. Lancet Oncol. 2017; Vol.18, P.640-653.
4. Satoh T, Xu RH, Chung HC, et al. Lapatinib plus paclitaxel versus paclitaxel alone in the secondline treatment of HER2-amplified advanced gastric cancer in Asian populations: TyTAN – a randomized, phase III study. J. Clin. Oncol. 2014; Vol.32, P.2039-2049.
5. Shitara K, Bang YJ, Iwasa S, et al. Trastuzumab deruxtecan in previ- ously treated HER2-positive gastric cancer. N Engl J Med. 2020; 382 (25): 2419- 2430.
6. clinicaltrials.gov/ct2/show/NCT04704934.
7. Bartley AN, Washington MK, Ventura CB, et al. HER2 testing and clinical decision making in gastroesophageal adenocarcinoma: guideline from the College of American Pathologists, American Society for Clinical Pathology, and American Society of Clinical Oncology. Arch Pathol Lab Med. 2016; 140 (12): 1345-1363.
8. Kensei Yamaguch, et al.Trastuzumab Deruxtecan in Anti-Human Epidermal Growth Factor Receptor 2 Treatment Naive Patients With Human Epidermal Growth Factor Receptor 2-Low Gastric or Gastroesophageal Junction Adenocarcinoma: Exploratory Cohort Results in a Phase II Trial. J. Clin. Oncol. Published online: November 15, 2022. https://doi.org/10.1200/ JCO.22.00575.
9. Andrew Hsu, et al. Treatment for
metastatic adenocarcinoma of the stomach and
gastroesophageal junction: 2020. Ann Transl Med.
2020 Sep; 8 (17): 1109. doi: 10.21037/atm-20-
1159.
НОВОСТИ ASTRO 2022
Автор: Воробьев Николай Андреевич
Заведующий отделением протонной лучевой терапии, врач-онколог, радиолог,
Медицинский институт им. Березина Сергея, Санкт-Петербург
Одним из наиболее значимых событий уходящего года в радиотерапии
традиционно стала конференция
Американского общества радиационной онкологии ASTRO 2022, проходившая в Сан-Антонио с 22 по 26
октября. Это событие объединяет
радиотерапевтов со всего мира и дает
возможность познакомиться с результатами наиболее значимых исследований, а также лично пообщаться с
авторами и задать самые интересные
и иногда даже неудобные вопросы.
В этом году в рамках конференции
была проведена отдельная сессия,
посвященная клиническим исследованиям, потенциально способным
изменить подходы к лечению, внести
существенный вклад в повышение
эффективности терапии и улучшение
качества жизни пациентов.
Радиационные онкологи из MD
Anderson Cancer Center представили
методику применения ответ-адаптивной ультранизкодозной лучевой
терапии у пациентов с индолентной
B-клеточной лимфомой орбиты [1].
В лечении этого заболевания применяются дозы 24-30 Гр, которые способны вызывать отдаленные лучевые
повреждения органа зрения. С учетом
благоприятного прогноза при таком
заболевании крайне актуальным является проведение исследований,
направленных на снижение лучевой
нагрузки. Pinnix и соавт. предлагают
начинать облучение с подведения
дозы в 4 Гр за две фракции, с последующим наблюдением и оценкой ответа
через 3 месяца. При сохранении опухолевых изменений проводится дополнительное облучение в суммарной
дозе 20 Гр. В ходе наблюдения у 90%
пациентов был отмечен полный ответ на проведенное лечение, причем в
88% случаев облучение ограничилось
ультранизкой дозой 4 Гр.
«Учитывая, что некоторые специалисты предпочитают наблюдать пациентов с индолентной B-клеточной
лимфомой орбиты из-за опасений,
связанных с облучением глазного
яблока и последующим снижением
зрения, мы рады представить новую
парадигму лечения, которая продемонстрировала эффективность при
потенциальном снижении токсичности», – говорит один из авторов исследования доктор Chelsea Pinnix.
Также были представлены данные,
собранные более чем за 7 лет наблюдения за пациентами с опухолью
предстательной железы из группы
высокого риска, получавшими лучевую терапию в режиме умеренного
гипофракционирования [2]. В исследовании III фазы проводилась сравнительная оценка эффективности
и токсичности стандартного курса
облучения предстательной железы
(СОД 76 Гр, РОД 2 Гр на простату и 46
Гр на тазовые лимфоузлы) и гипофракционирования (СОД 68 Гр, РОД
2,72 Гр на простату, СОД 45 Гр, РОД 1,8
Гр на лимфоузлы). Облучение проводилось конкурентно с гормонотерапией. При столь длительном наблюдении не было выявлено достоверных
различий в показателях общей и
раковоспецифичной выживаемости,
частоте биохимических рецидивов
или отдаленного метастазирования.
Токсичность в обеих группах оказалась сравнимой. Это первое крупное
исследование, подтвердившее эффективность и безопасность режима
умеренного гипофракционирования,
применение которого в клинической
практике позволяет сократить продолжительность курса лучевой терапии на 3 недели.
Одной из наиболее быстро развивающихся методик в современной
лучевой терапии является FLASHтерапия. Облучение выполняется с
применением сверхвысокой мощности дозы (≥40 Гр/сек). На конгрессе были представлены результаты
первого клинического проспективного исследования FAST-01 по применению протонной FLASH-терапии
у пациентов с костными метастазами
[3]. В исследование было включено 10
пациентов с ожидаемой продолжительностью жизни более 2 месяцев
и наличием 1-3 метастазов в костях
конечностей, сопровождающихся
болевым синдромом. Полный или
частичный обезболивающий эффект
был отмечен у 7 из 10 пациентов после
облучения при отсутствии значимой
токсичности. Полученные результаты подтверждают возможность применения методики FLASH-терапии в
клинической практике. Исследование
FAST-01 является первым шагом в
изучении клинического применения
FLASH-терапии, цель которого –
оценка воздействия излучения с высокой мощностью дозы на костную,
мышечную и нервную ткань. В сентябре 2022 года был начат набор пациентов с вторичным поражением костей
грудной клетки в клиническое исследование FAST-02, основной целью которого является оценка токсичности
со стороны органов средостения.
Отдельно хочется выделить несколько работ, призванных расширить показания и сферу применения лучевой
терапии.
В первую очередь стоит отметить
рандомизированное исследование II
фазы, посвященное сравнительной
оценке профилактического облучения и стандартной терапии/наблюдения у пациентов с бессимптомным
метастатическим поражением скелета
[4]. В исследование было включено 78
пациентов при условии, что как минимум один из костных метастазов
удовлетворяет критериям высокого
риска развития нежелательных явлений со стороны скелета: большой
объем очага (≥2 см в наибольшем
измерении); поражение бедренных,
плечевых костей или крестцово-подвздошного сочленения; поражение
длинных трубчатых костей с вовлечением 1/3-2/3 кортикального слоя;
поражение задних отделов позвонков.
Доза и режим облучения выбирались на усмотрение радиотерапевта.
Спустя год после лечения частота
нежелательных явлений со стороны
скелета составила 1,6% и 29% в группах профилактического облучения и
стандартной терапии/наблюдения соответственно (p<0,001). При медиане
наблюдения в 2,4 года общая выживаемость оказалась существенно выше
в группе лучевой терапии (p=0,02),
также удалось добиться значимого
снижения выраженности болевого
синдрома (p<0,05).
«Возможно, в ближайшее время мы
сможем говорить о новом показании к проведению лучевой терапии.
Это первое рандомизированное исследование по профилактическому
облучению бессимптомных костных
метастазов, в котором было продемонстрировано снижение частоты
развития нежелательных явлений со
стороны скелета с 30% до 2% в первый
год после лечения при сравнении с
группой стандартной терапии/наблюдения, а также снижение частоты развития болевого синдрома и необходимости в госпитализации», – отметила
руководитель исследования д-р Erin
Gillespie.
Второе из представленных исследований, существенно расширяющих
область применения лучевой терапии, посвящено возможностям стереотаксического облучения в режиме гипофракционирования (СтЛТ)
у пациентов с резистентной формой
желудочковой тахикардии (ЖТ) [5].
Считается, что вызванное применением СтЛТ фиброзное повреждение
миокарда является основным механизмом нарушения сердечной проводимости, что позволяет уменьшить
количество эпизодов ЖТ, снизить
частоту разрядов имплантируемого кардиовертера-дефибриллятора,
улучшить качество жизни и снизить
риск смерти, связанной с ЖТ. В исследование были включены пациенты с
ЖТ, рефрактерной к стандартной терапии, включающей абляцию и антиаритмические препараты. Облучение
проводилось за один сеанс в дозе 25
Гр. У 4 из 6 пациентов, включенных
в исследование, было отмечено существенное снижение частоты эпизодов ЖТ в первые 6 месяцев после
облучения. Вполне возможно, что после дополнительного изучения СтЛТ
будет более широко применяться у
пациентов с ЖТ в тех случаях, когда
возможности традиционных методик
исчерпаны.
На одной из секций XXVI Российского онкологического конгресса вызвал
активное обсуждение вопрос одного
из участников о целесообразности
применения столь дорогостоящей
методики как протонная терапия у
пациентов с метастатическим процессом. Следует отметить, что эта тема
активно обсуждается не только в России, но и за рубежом.
На Конгрессе ASTRO 2022 были
представлены результаты рандомизированного исследования II фазы
по сравнению протонного краниоспинального облучения (пКСО) и локальной фотонной лучевой терапии
(лФЛТ) на очаги метастатического
поражения при лептоменингеальном
распространении солидных опухолей
[6]. Предписанная доза облучения составила 30 Гр за 10 фракций в обеих
группах. В исследование были включены пациенты с лептоменингеальным поражением при НМРЛ и РМЖ.
Целью исследования была оценка
времени до прогрессирования по
структурам ЦНС, общей выживаемости и токсичности. В группу пКСО и
лФЛТ были включены 42 и 21 пациент
соответственно. При промежуточном
анализе было отмечено существенное увеличение показателей времени
до прогрессирования по структурам
ЦНС в группе пКСО (медиана 7,5
мес.) по сравнению с лФЛТ (медиана 2
мес.), p<0,001. Показатели общей выживаемости составили 8,2 и 4,9 мес.
соответственно (p=0,04). Учитывая
полученные результаты, Комитет по
мониторингу данных и безопасности
США рекомендовал досрочно прекратить исследование. Токсичность в
обеих группах существенно не различалась. Подобные результаты заставляют задуматься о том, что любая,
даже дорогостоящая методика, при
ее разумном использовании, может
применяться и с паллиативной целью.
Планируется проведение рандомизированного исследования III фазы для
подтверждения полученных результатов.
Российские радиотерапевты на конгрессе ASTRO в этом году были представлены делегацией Центра протонной терапии Медицинского института Березина Сергея (МИБС) с двумя докладами в рамках постерных сессий с устными презентациями. В первом докладе были продемонстрированы предварительные результаты применения протонной терапии в режиме ультрагипофракционирования при адъювантном облучении по поводу локализованных форм рака молочной железы (РМЖ) [7]. В рамках исследования проводилась оценка ранней токсичности и возможностей снижения лучевой нагрузки на органы риска. Облучение проводилось до суммарной дозы 26 Гр за 5 фракций с добавлением одной фракции буста в дозе 5,2 Гр при необходимости. При анализе результатов лечения 63 пациентов и медиане наблюдения 9 месяцев дерматит I и II степени был отмечен у 71% и 6% пациентов соответственно. Средняя доза на левую переднюю нисходящую коронарную артерию (ЛПНКА) составила 1,28 Гр (0,12-8,2 Гр) при левостороннем РМЖ. Средняя доза на ипсилатеральное легкое составила 2,66 Гр. По сравнению с облучением на свободном дыхании, применение методики облучения на глубоком вдохе при левостороннем РМЖ позволило снизить среднюю дозу на сердце с 0,4 до 0,1 Гр (p=0,03), на ЛПНКА – с 2,5 до 1,2 Гр (p=0,03). На сегодняшний день это первая публикация, посвященная опыту применения протонной терапии в режиме ультрагипофракционирования при РМЖ. Полученные данные о приемлемой кожной токсичности и низкой лучевой нагрузке на органы риска станут основой для проведения крупного проспективного исследования на базе Центра протонной терапии МИБС, старт которого запланирован на 2023 год.
Вторая работа посвящена повторному краниоспинальному облучению
(КСО) у детей с рецидивом медуллобластомы [8]. Традиционно радиотерапевты с большим опасением и
нежеланием обсуждают возможность
проведения повторного облучения,
так как это связано с непредсказуемой
токсичностью, тем более когда речь
идет об облучении мишеней столь
больших объемов, как головной и
спинной мозг. Всем пациентам с медуллобластомой при первичном лечении проводится КСО. При рецидивах
заболевания и метастазировании по
структурам ЦНС химиотерапия далеко не всегда оказывается эффективной, что делает повторное облучение
единственной возможной лечебной
опцией. Основной причиной прерывания курса КСО является тяжелая
гематологическая токсичность, в первую очередь, проявляющаяся тромбоцитопенией. В представленном
исследовании авторам удалось продемонстрировать низкие показатели
гематологической и гастроинтестинальной токсичности при применении протонной терапии с целью повторного КСО. Из 18 пациентов лишь
у одного курс лечения был прерван
по причине заболевания COVID-19.
Переливание компонентов крови на
фоне облучения потребовалось одному пациенту. Полученные результаты
свидетельствуют о необходимости пересмотреть отношение к повторному
облучению, особенно в тех случаях,
когда есть возможность проведения
протонной лучевой терапии.
В заключении хочется отметить, что
ежегодная конференция ASTRO попрежнему является ведущим и наиболее масштабным событием в мире
радиационной онкологии. Мы призываем российских коллег принимать
в ней более активное участие, и не
только в качестве слушателей, но и в
качестве докладчиков, представляя
результаты собственных клинических исследований.
Источники:
1. Pinnix CC, et al. Response Adapted Ultra Low Dose Radiation Therapy for the Definitive Management of Orbital Indolent B-Cell Lymphoma. IJROBP. 2022; 114 (3): S2-S3.
2. Niazi TM, et al. Conventional vs. Hypofractionated, Radiotherapy for HighRisk Prostate Cancer: 7-Year Outcomes of the Randomized, Non-Inferiority, Phase 3 PCS5 Trial. IJROBP. 2022; 114 (3): S3.
3. Daugherty EC, et al. FAST-01: Results of the First-in-Human Study of Proton FLASH Radiotherapy. IJROBP. 2022; 114 (3): S4.
4. Gillespie EF, et al. Prophylactic Radiation Therapy vs. Standard-of-Care for Patients with High-Risk, Asymptomatic Bone Metastases: A Multicenter, Randomized Phase II Trial. IJROBP. 2022; 114 (3): P1059.
5. Gerard IJ, et al. Single Institution Experience with Stereotactic Arrhythmia Radioablation for Ventricular Tachycardia. IJROBP. 2022; 114 (3): E417.
6. Yang JT, et al. Phase II Randomized Trial Comparing Proton Craniospinal Irradiation with Photon Involved-Field Radiotherapy for Patients with Solid Tumor Leptomeningeal Metastasis. IJROBP. 2022; 114 (3): S7-S8.
7. Vorobyov N, et al. Ultrahypofractionated Adjuvant Proton Therapy for Localized Stage Breast Cancer: Early Toxicity Report. IJROBP. 2022; 114 (3): E36-E37.
8. Martynova N, et al. Craniospinal
Reirradiation Using Proton Beam
Radiotherapy in the Treatment of Pediatric
Recurrent Medulloblastoma. IJROBP.
2022; 114 (3): E482.
ПРОФИЛАКТИЧЕСКОЕ ОБЛУЧЕНИЕ КОСТНЫХ ОЧАГОВ У ПАЦИЕНТОВ С ДИССЕМИНИРОВАННЫМИ МЕТАСТАТИЧЕСКИМИ ОПУХОЛЯМИ – НОВАЯ ВЕХА В ИСТОРИИ ЛЕЧЕНИЯ МЕТАСТАТИЧЕСКОГО ЗАБОЛЕВАНИЯ?
Автор: Усычкин Сергей Владимирович
Заведующий отделением лучевой терапии
Hadassah Medical Moscow, Москва
Одним из самых интересных исследований на ежегодном конгрессе ASTRO в США, который
проходил в Сан-Антонио с 23 по
26 октября 2022 года, стало небольшое проспективное рандомизированное исследование 2-й
фазы из Memorial Sloan Kettering
Cancer Center.
На секции, посвященной клиническим исследованиям, Erin Gillespie
представила результаты своего
клинического исследования о
профилактическом применении
лучевой терапии бессимптомных
костных очагов с высоким риском
потенциальных костных осложнений (skeletal-related events – SRE) в
будущем: патологических переломов, компрессии спинного мозга,
нестабильности, требующей хирургического вмешательства, болевого синдрома, требующего облучения с целью обезболивания.
По статистике, которую привела
Erin Gillespie, метастатические
очаги с высоким риском таких
осложнений диагностируются по
данным рентгенологических исследований в среднем за 4 месяца
до развития SRE у 60% пациентов,
которым в последующем требуется проведение паллиативной лучевой терапии на эти очаги с целью обезболивания.
Основной целью исследования
[1] было подтверждение гипотезы о том, что проведение профилактического облучения бессимптомных (или минимально
симптомных, не требующих наркотических анальгетиков) костных очагов с высоким риском SRE
(очаги диаметром >2 см, очаги в
области бедренной кости и тазобедренного сустава, головки плечевой кости и плечевого сустава,
крестцово-подвздошных сочленений, очаги в длинных трубчатых
костях, охватывающие от 1/3 до
2/3 кортикального слоя, очаги в
области «стыковки» отделов позвоночного столба (C7-T1, Th12-L1,
L5-S1)) у пациентов с полиметастатическим поражением (>5 метастатических очагов в организме,
включая костные очаги) позволит
достоверно снизить вероятность
костных осложнений в будущем.
Эффективность лучевой терапии
в отношении профилактики костных осложнений ранее уже была
продемонстрирована в ретроспективных исследованиях [2].
Пациенты были рандомизированы на 2 группы в соотношении
1:1. В группе контроля пациенты
получали только стандартное системное лечение для полиметастатического заболевания либо динамическое наблюдение. В группе
исследования пациенты в дополнение к стандартному лечению
или динамическому наблюдению
получали профилактическое облучение на бессимптомные костные очаги высокого риска (максимум до 5 таких костных очагов)
согласно стандартным схемам для
паллиативного облучения, например, 8 Гр за 1 фракцию, 20 Гр за
5 фракций, 30 Гр за 10 фракций,
либо более высокодозные режимы
стереотаксической гипофракционной (например, 30 Гр за 5 фракций, 27 Гр за 3 фракции) лучевой
терапии и даже стереотаксическую радиохирургию однократной высокой дозой 24 Гр.
В исследование [3] было включено 78 пациентов (по 39 пациентов в каждую группу) с множественными (>5) метастатическими очагами опухолей разных гистологических типов (27% – рак легкого, 24% – рак молочной железы, 22% – рак предстательной железы и другие гистологические типы), 90% всех пациентов в обеих группах получили стандартное системное лечение. Большая часть пациентов на момент включения в исследование имела высокие показатели функционального статуса (97,4% – ECOG 0-1) и у них не было симптомов, связанных с метастатическими очагами. Для 31% метастатических очагов в исследуемой группе применялась схема стереотаксической аблативной лучевой терапии (27 Гр за 3 фракции), для остальных 69% очагов применялись схемы стандартного паллиативного облучения (20 Гр за 5 фракций, 30 Гр за 10 фракций и 1 фракция 8 Гр).
Рисунок 1.
Частота костных осложнений в группах
Рисунок 2.
Общая выживаемость
Рисунок 3.
Частота госпитализаций и динамика болевого синдрома у пациентов в группах.
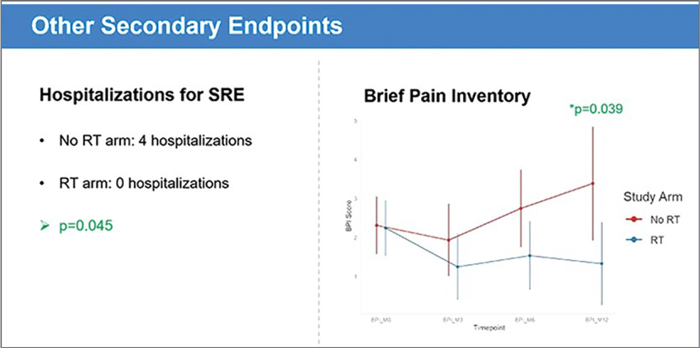
В течение 1 года наблюдения было
отмечено значительное и статистически достоверное снижение
частоты костных осложнений
(SRE) в группе, которая получала
профилактическое паллиативное
облучение бессимптомных очагов высокого риска в дополнение
к стандартному системному лечению: 1,6% против 29% (p<0,001)
(рис.1). Дополнительно было проведено сравнение по частоте SRE
с исключением паллиативного облучения с целью обезболивания
– оно также показало статистически достоверное снижение таких
костных осложнений, как патологические переломы, компрессия
спинного мозга и нестабильность,
требующая хирургического вмешательства, в группе, которой
была проведена профилактическая лучевая терапия на костных
очаги высокого риска: 0% против 12,5% (p<0,008).
Однако самым удивительным
фактом, обнаруженным в этом
исследовании, стало значительное и статистически достоверное
увеличение общей выживаемости
в группе, где была проведена профилактическая лучевая терапия
(рис.2). При медиане наблюдения
2,4 года в группе профилактической лучевой терапии примерно
50% пациентов оставались живы
(медиана общей выживаемости
1,67 года), при этом в контрольной
группе в живых оставалось около
25% пациентов (медиана общей
выживаемости 0,99 года): HR 0,49
(95% ДИ 0,27-0,89), p=0,018. При
многофакторном анализе (стратификация по SRE, KPS, гистологическому типу первичной опухоли,
возрасту, количеству облученных
профилактически очагов) проведение профилактической лучевой
терапии оставалось статистически значимым фактором, положительно повлиявшим на выживаемость пациентов: HR 0,45 (95% ДИ
0,24-0,84), p=0,011.
Также значимым результатом
оказалось достоверное снижение развития болевого синдрома,
связанного с костными очагами, у пациентов, которым было
проведено профилактическое
облучение костных метастазов
(p=0,039) (рис.3), а также снижение количества госпитализаций
по поводу костных осложнений: 0
госпитализаций в группе профилактического облучения против 4
госпитализаций в группе контроля (p=0,045).
Проведение профилактического
облучения костных очагов не привело к значительному увеличению
частоты осложнений, связанных с
облучением: не было отмечено ни
одного НЯ 3 степени и выше, частота НЯ 2 степени была только на
10% выше в группе профилактического облучения – 13% против 3%
в группе контроля.
Какие выводы можно сделать из
этого небольшого, хорошо спланированного и качественно проведенного клинического исследования?
Во-первых, фактически мы впервые получили подтверждение эффективности профилактического
облучения бессимптомных костных очагов, имеющих высокий
риск развития тяжелых, порой инвалидизирующих пациента костных осложнений. Теперь в наших
руках есть достаточно четко обозначенные критерии для отбора
костных очагов, имеющих потенциально высокий риск осложнений: крупные костные очаги более
2 см в диаметре, расположенные
возле крупных суставов с большой функциональной нагрузкой
(плечевой сустав, тазобедренный
сустав) либо в длинных трубчатых костях, вовлекающие более
1/3 толщины кортикального слоя,
либо в местах позвоночного столба с высоким риском патологического перелома.
Во-вторых, исследование показывает, что такие очаги должны
быть идентифицированы и облучены на как можно более раннем
этапе развития метастатического
заболевания до развития прогрессирования, до ухудшения общего
состояния пациента, что ранее не
было распространенной практикой, так как считалось, что для
бессимптомных очагов важнее
проведение системного лечения
либо динамическое наблюдение,
и лучевая терапия на эти очаги
рассматривалась только как паллиативное лечение, направленное
на купирование уже развившихся
осложнений: болевого синдрома,
нестабильности и других симптомов. Задержка в назначении
лучевой терапии означает, что пациенту в последующем могут понадобиться уже более серьезные
вмешательства, например, хирургическая стабилизация, которые
не всегда возможны у пациентов
с диссеминированным метастатическим заболеванием.
В-третьих, в исследовании было
обнаружено не совсем ожидаемое
увеличение выживаемости у пациентов, которые не соответствуют принятым в настоящее время
критериям олигометастатической
фазы заболевания (до 5 метастатических очагов), то есть у пациентов
с изначально диссеминированным
опухолевым процессом (полиметастатическое заболевание).
Возможным объяснением этого
факта является то, что половина
пациентов, включенных в исследование (51,3%), имела метастатические очаги немелкоклеточного
рака легкого и рака предстательной железы. Именно для этих двух
гистологических типов опухолей
на сегодняшний день доказана
эффективность добавления стереотаксической лучевой терапии
к стандартной системной терапии
при ограниченном количестве
очагов (не более 3-5 очагов), например, в исследованиях SABRCOMET, Gomez et al, Iyengar et al,
SINDAS, ORIOLE и других исследованиях [4-8].
Также можно предположить, что
увеличение выживаемости было
связано с низким суммарным объемом опухолевых очагов у некоторых пациентов, включенных в исследование Gillespie et al. В других
исследованиях стереотаксической
лучевой терапии олигометастатического заболевания [9] было показано, что удвоение суммарного
объема опухолевой массы всех
олигометастатических очагов связано с увеличением риска появления новых очагов и полиметастатического прогрессирования на
26% и увеличением риска летального исхода на 45% в течение первых 6 месяцев после проведения
облучения. У пациентов с низким
суммарным опухолевым объемом
метастатических очагов, несмотря
на общее количество выявленных
очагов (более 5 очагов), прогноз
и выживаемость могут оказаться лучше по сравнению с другими
группами пациентов.
Источники:
1. Rosen DB, Benjamin CD, Yang JC, et al. Early palliative radiation versus observation for highrisk asymptomatic or minimally symptomatic bone metastases: study protocol for a randomized controlled trial. BMC Cancer. 2020; 20 (1): 1115. Published 2020 Nov 17. doi:10.1186/ s12885-020-07591-w.
2. Shulman RM, Meyer JE, Li T, Howell KJ. External beam radiation therapy (EBRT) for asymptomatic bone metastases in patients with solid tumors reduces the risk of skeletal-related events (SREs). Ann Palliat Med. 2019; 8 (2): 159-167. doi:10.21037/apm.2018.10.04.
3. Gillespie EF, Mathis NJ, Marine C, et al. Prophylactic radiation therapy vs. standard-of-care for patients with high-risk, asymptomatic bone metastases: A multicenter, Randomized Phase II trial. Int J Radiat Oncol Biol Phys. 2022; 114 (5): 1059. doi:10.1016/j.ijrobp.2022.09.005.
4. Gomez DR, Tang C, Zhang J, et al. Local Consolidative Therapy Vs. Maintenance Therapy or Observation for Patients With Oligometastatic Non-Small-Cell Lung Cancer: LongTerm Results of a Multi-Institutional, Phase II, Randomized Study. J Clin Oncol. 2019; 37 (18): 1558-1565. doi:10.1200/JCO.19.00201.
5. Phillips R, Shi WY, Deek M, et al. Outcomes of Observation vs Stereotactic Ablative Radiation for Oligometastatic Prostate Cancer: The ORIOLE Phase 2 Randomized Clinical Trial. JAMA Oncol. 2020; 6 (5): 650-659. doi:10.1001/ jamaoncol.2020.0147.
6. Harrow S, Palma DA, Olson R, et al. Stereotactic Radiation for the Comprehensive Treatment of Oligometastases (SABR-COMET): Extended Long-Term Outcomes. Int J Radiat Oncol Biol Phys. 2022; 114 (4): 611-616. doi:10.1016/j. ijrobp.2022.05.004.
7. Wang XS, Bai YF, Verma V, et al. Randomized Trial of FirstLine Tyrosine Kinase Inhibitor With or Without Radiotherapy for Synchronous Oligometastatic EGFR-Mutated NSCLC [published online ahead of print, 2022 Jan 30]. J Natl Cancer Inst. 2022; djac015. doi:10.1093/jnci/djac015.
8. Iyengar P, Wardak Z, Gerber DE, et al. Consolidative Radiotherapy for Limited Metastatic Non-Small-Cell Lung Cancer: A Phase 2 Randomized Clinical Trial. JAMA Oncol. 2018; 4 (1): e173501. doi:10.1001/ jamaoncol.2017.3501.
9. Cao Y, Chen H, Sahgal A, et al.
Volumetric burden of metastatic
lesions drives outcomes in patients
with extracranial oligometastatic
disease. Cancer Med. 2021; 10 (22):
8091-8099. doi:10.1002/cam4.4332.
КОММЕНТАРИЙ ЭКСПЕРТА
Автор: Жуков Николай Владимирович
ФГБУ «НМИЦ Детской гематологии, онкологии и иммунологии им. Д. Рогачева»,
доктор медицинских наук, профессор, Москва
К сожалению, я вынужден буду осветить не только выигрышные
стороны исследования, что уже
прекрасно сделал Сергей Владимирович (хотя и он тоже обозначил определенные вопросы и сомнения). В большей степени я буду
говорить все же о том, что меня
настораживает при интерпретации его результатов.
Но начнем с приятного и обнадеживающего. Графики и цифры,
озвученные авторами исследования, выглядят действительно впечатляюще: значимое и очевидное
снижение частоты костных осложнений (SRE), увеличение медианы общей выживаемости (ОВ)
более чем в 1,5 раза. Магнитуда
снижения частоты SRE оставляет
далеко позади выигрыш от использования бисфосфонатов и деносумаба (и это при том, что половина
больных в исследовании и получала
остеомодифицирующие препараты
в качестве «базовой» терапии). Магнитуда увеличения ОВ также впечатляет – большинство лекарственных препаратов, применяемых для
паллиативного лечения наиболее
частых нозологий, включенных в
исследование (рак молочной железы, рак легкого, рак предстательной
железы), дают значимо меньший выигрыш.
Но вот с объяснением результатов
исследования (т.е. почему получены
именно такие результаты) у меня
возникают определенные проблемы.
На первый взгляд, объяснение большой (по сравнению с остеомодифицирующими агентами) магнитуды
снижения риска SRE мне кажется
вполне логичным. В исследования
по остеомодифицирующим агентам
включался широкий круг пациентов. Так, в исследовании, явившемся регистрационным для золедроновой кислоты при раке молочной
железы и множественной миеломе,
достаточно было иметь лишь один
костный литический метастаз любой локализации – хоть в ребре,
хоть в костях черепа [1]. При этом
очевидно, что при ряде локализаций метастазы крайне редко приводят к развитию SRE, и такие пациенты, скорее всего, от назначения
остеомодифицирующих агентов не
сильно выигрывают. Цитируемое
же исследование по лучевой терапии включило «таргетную» для
снижения риска SRE популяцию
больных (только пациентов с высоким риском их развития), в связи с
чем при весьма незначительном числе включенных больных и показало
статистически и клинически значимое снижение частоты костных осложнений. Хотя при детальном рассмотрении и здесь не обошлось без
«ложки дегтя». Меня несколько смущало, что при достаточно большой
медиане наблюдения в экспериментальной группе, получившей по условиям протокола лучевую терапию
«с профилактической целью» на 5
или менее таргетных очагов, SRE
практически не возникали (сообщается лишь об одном случае потребности в дополнительном облучении
в связи с болевым синдромом). Создавалось впечатление, что лучевая
терапия, проведенная на исходно
существующие бессимптомные очаги, предотвращает появление новых
(и очагов, и SRE). Однако при более
детальном изучении представленных результатов все встало на места.
Оказалось, что в исследовании SRE
учитывались не «на больного» (как
было в исследованиях по остеомодифицирующим агентам), а только на
опухолевые очаги, существовавшие
на момент включения больного в исследования. Т.е. в случае, если костное осложнение возникало в очаге,
появившемся уже после включения
в исследование, оно не учитывалось.
Также не совсем понятно, почему
при заявленной медиане наблюдения за больными в 2,4 года график
по SRE обрывается на 12 месяцах наблюдения. Но, как мне кажется, даже
с этими «особенностями» выигрыш
в отношении профилактики SRE выглядит объяснимым и ожидаемым.
Основные сомнения, увы, вызывают
самые желанные цифры – цифры общей выживаемости. Соотношение
«трудозатрат» и выигрыша действительно впечатляет – к стандартной
терапии добавлено лишь облучение
(причем у 70% рутинное паллиативное облучение) 5 или менее асимптоматичных костных метастазов,
в результате чего медиана ОБЩЕЙ
выживаемости увеличивается более чем в 1,5 раза (или более чем на
полгода – с 1 до 1,67 лет). К 2 годам
различие в кривых выживаемости,
определяемое «на глаз», составляет
процентов 20. Можно ли это объяснить с позиций здравого медицинского смысла? Можно, и это блестяще делает доктор Усычкин в своей
заметке. Более того, отчасти некоторые объяснения очень близки и мне
– например, о том, что в «рутинной»
системе здравоохранения даже одно
костное событие (в виде перелома
позвонков или несущих трубчатых
костей) может поставить крест на
возможности продолжать противоопухолевое лечение просто из-за
того, что пациенту будет трудно
добраться до места его проведения
(из-за одного такого события ECOG
с нуля может сразу стать 4). При желании можно найти и биологические
объяснения происходящего – сокращение агрессивных опухолевых клонов, вызывающих более «активные»
костные метастазы и т.д. Может ли
это быть реальной причиной наблюдаемых в исследовании различий
в ОВ (т.е. они обусловлены именно
проведением лучевой терапии)? Безусловно, может.
Но, увы, может быть и другая причина. Это в исследованиях «фармы»
обычно включают сотни и тысячи
больных с действительно однотипной (хотя далеко не всегда «таргетной», как было сказано выше) популяцией. И новые дорогие лекарства в
исследованиях часто берут «количеством», когда, благодаря большому
числу включенных больных, большинство дополнительных факторов
прогноза относительно равномерно
распределяется между группами,
что позволяет выявить даже небольшое истинное различие в эффективности. Но уж если выигрыша
от нового лекарства на самом деле
нет, то шанс увидеть различие из-за
случайного распределения больных
в группах в больших исследования
минимален. Увы, цитируемое исследование – «академическое» и, скорее
всего, ограниченное в финансировании, поэтому при формировании
критериев отбора исследователи
ориентировались на «реалии». И
поэтому исследование оказалось не
просто небольшое, но при этом еще
и имеющее значимо большее количество «степеней свободы» в отношении факторов, которые нельзя
учесть и сопоставить. Да, больные в
группах были сопоставимы по нозологиям (примерно равные доли рака
молочной железы, легкого, простаты и т.д.). Но, увы, например в отношении «фазы» болезни в пределах
одного и того же диагноза они могли
быть совсем не сопоставимы (кто-то
«в дебюте» и получает первую линию лечения, кто-то «на излете» и
получает лишь симптоматику). И с
учетом небольшого числа включенных больных этот дисбаланс мог
оказаться критичным, как для любого исследования со «смешанным»
контингентом больных. Косвенно
это иллюстрирует и следующий
факт: в рамках одних и тех же критериев включения с оговоренным числом очагов с высоким риском SRE
от 1 до 5 на 39 больных из группы
лучевой терапии пришлось 62 очага,
а на 39 больных из группы без лучевой – 48.
Резюме: в целом исследование все
равно вызывает позитивную реакцию, как минимум, за счет того,
что снижение риска SRE выглядит
и клинически значимым, и вполне объяснимым. В отношении же
влияния на ОВ, как мне кажется,
необходимо проведение рандомизированного исследования с ограничением критериев включения
одной нозологией и линией (линиями) терапии. С учетом простоты
вмешательства – паллиативное облучение 5 или менее костных очагов – как мне кажется, подобное
исследование вполне можно было
бы выполнить и у нас на Родине. Видимо, роль паллиативной лучевой
терапии в РФ в ближайшие годы будет только нарастать. Тем более что
– как ни странно – «исторический»
и гораздо более ранний, чем это исследование по лучевой терапии при
системном заболевании, опыт у нас
в стране есть. Помнится, я как раз
только пришел в ординатуру в отделение комбинированных методов
лечения РОНЦ им. Н.Н. Блохина,
когда там завершалась большая работа Г.В. Вышинской, посвященная
тотальному поэтапному облучению
костных метастазов у больных раком молочной железы. Может быть,
настало время перечитать…
Источник:
Rosen LS, Gordon D,
Kaminski M, Howell A, Belch A,
Mackey J, Apffelstaedt J, Hussein MA,
Coleman RE, Reitsma DJ, Chen BL,
Seaman JJ. Long-term efficacy and
safety of zoledronic acid compared
with pamidronate disodium in the
treatment of skeletal complications
in patients with advanced multiple
myeloma or breast carcinoma:
a randomized, double-blind,
multicenter, comparative trial.
Cancer. 2003 Oct 15; 98 (8): 1735-
44. doi: 10.1002/cncr.11701. PMID:
14534891.
ПРОФИЛАКТИКА ФЕБРИЛЬНОЙ НЕЙТРОПЕНИИ: ПРИНЦИПЫ LEGE ARTIS
Одним из базовых методов лечения
онкологических пациентов является химиотерапия (ХТ). Зависимость
непосредственных (частоты и глубины ответа), а также отдаленных
результатов эффективности лечения
(безрецидивной/беспрогрессивной
и общей выживаемости) от соблюдения режимов и доз специфической противоопухолевой терапии
была подтверждена целым рядом
международных клинических исследований [1-3]. В то же время токсическое воздействие цитостатиков
на костный мозг является одним из
самых распространенных дозолимитирующих нежелательных явлений, которое приводит к снижению
дозы и/или удлинению интервалов
между курсами ХТ или отмене оптимальной схемы терапии. Таким
образом, развитие нейтропении значимо ухудшает результаты лечения
(сокращает выживаемость больных)
и дальнейший прогноз заболевания
[4].
Фебрильная нейтропения (ФН) –
жизнеугрожающее состояние, требующее оказания неотложной медицинской помощи. К последствиям
ФН относятся дополнительные
экономические затраты на госпитализацию и проведение антибактериальной терапии (более 90% и
100% пациентов, соответственно),
отсрочка очередного курса лечения
(100% пациентов), необходимость
снижения оптимальной дозы химиотерапевтических препаратов (100%
пациентов), а также риск развития
тяжелой инфекционной патологии
и смерти: 30% и 15%, соответственно [5-8]. Такие пациенты нуждаются
в немедленной госпитализации и
проведении эмпирической терапии
антибиотиками широкого спектра
действия [9]. Затраты, связанные
с госпитализацией по поводу ФН,
увеличивают общую стоимость лечения онкологических больных [10].
Доказано, что снижение относительной интенсивности дозы ниже 85%
достоверно ухудшает результаты
лечения на годы для ряда нозологий
[11].
Использование препаратов на основе гранулоцитарных колониестимулирующих факторов (Г-КСФ) при
проведении ХТ для профилактики и
лечения постхимиотерапевтической
нейтропении позволяет достоверно сократить сроки восстановления
гемопоэза, снизить частоту инфекционных осложнений и сохранить
дозоинтенсивность (полноту дозы
в мг и интервал между курсами ХТ,
[12,13]). Г-КСФ пролонгированного
действия (пегилированные формы,
например, эмпэгфилграстим) характеризуются значительно большей продолжительностью периода
воздействия и достоверно большей
эффективностью [14] по сравнению
с короткими Г-КСФ (непегилированными, например, филграстим),
что позволяет сократить кратность
введения препарата, минимизировать время пребывания пациента в
онкологическом учреждении и достигнуть оптимальных результатов
лечения.
Согласно результатам исследования,
проведенным Американским Обществом Клинической Онкологии
(ASCO) препараты класса Г-КСФ
считаются одним из пяти ключевых факторов, благоприятствующих
улучшению показателей эффективности терапии и снижению затрат
[15].
О возможностях
отечественных разработок
пролонгированных форм
Г-КСФ
Экстимия® (эмпэгфилграстим) –
оригинальный российский препарат полного цикла разработки
класса пролонгированных Г-КСФ,
доказавший свою преобладающую
эффективность и безопасность в
регистрационном рандомизированном клиническом исследовании
фазы III с участием 135 пациентов
рака молочной железы, получающих
химиотерапию по схеме доцетаксел
75 мг/м2
+ доксорубицин 50 мг/м2
на
фоне первичной профилактики препаратом Экстимия® по сравнению с
филграстимом [16,17]. Дизайн проведенного исследования (популяция
больных, схема лечения, количество
пациентов) сопоставим с дизайном
исследования первого пролонгированного Г-КСФ – пэгфилграстима.
1. По результатам исследования Экстимия® доказала свою
преимущество в эффективности над филграстимом [16,17]:
• На 44% снижает частоту развития нейтропении тяжелых степеней тяжести (3-4 степеней тяжести); • В 2 раза сокращает продолжительность нейтропении любой степени тяжести;
• На 35% сокращает риск развития нейтропении, начиная со 2 курса химиотерапии;
• В 2 раза быстрее восстанавливает
абсолютное число нейтрофилов
(далее, АЧН) по сравнению с
филграстимом.
Эмпэгфилграстим связывается с
рецептором Г-КСФ, регулирует образование и высвобождение нейтрофилов из костного мозга, значимо
увеличивая количество нейтрофилов с нормальной или повышенной
функциональной активностью в
периферической крови в течение 24
часов. Одним из достоинств эмпэгфилграстима является нейтрофилопосредованный клиренс, т.е. по
достижении оптимальной концентрации нейтрофилов в периферической крови, они сами уничтожают препарат по механизму фагоцитоза.
Данная особенность характеризуют
более сбалансированный контроль
АЧН и минимизирует риски развития гиперлейкоцитоза [18].
Препарат Экстимия® показан для
снижения продолжительности нейтропении, частоты возникновения
фебрильной нейтропении (ФН)
и инфекций, проявляющихся фебрильной нейтропенией, при цитостатической терапии по поводу
злокачественных новообразований
[18].
Эмпэгфилграстим, на основании решения Комиссии по формированию
перечней лекарственных препаратов
Минздрава России, включен в перечень ЖНВЛП [19].
С 2020 года препарат Экстимия® включен в клинические рекомендации МЗ РФ по раку молочной железы (РМЖ) для первичной профилактики нейтропении при следующих режимах [20]:
• адъювантная терапия HER2 отрицательного РМЖ: АС (дозоуплотненный), АС×4 (дозоуплотненный)→P×4 (дозоуплотненный), AC×4 (дозоуплотненный)→P×12 (± карбоплатин), DC×4;
• адъювантная терапия HER2 положительного РМЖ: (DC + трастузумаб)×4, AC×4 (дозоуплотненный)→(Р + трастузумаб)×12, АС×4 (дозоуплотненный)→(Р + трастузумаб)×4, АС×4→(таксаны + трастузумаб + пертузумаб)×4, (DCН + пертузумаб**)×6;
• неоадъювантная терапия РМЖ:
АС×4 (дозоуплотненный)→P×4
(дозоуплотненный), AC×4
(дозоуплотненный)→P×12,
AC×4→(Р + карбо)×12, DCН×6,
AC×4 (дозоуплотненный)→
(Р + трастузумаб)×12, АС×4
(дозоуплотненный)→(D + трастузумаб + пертузумаб)×4, DCН
+пертузумаб×6.
С 2021 года эмпэгфилграстим
включен в клинические рекомендации МЗ РФ по нозологии
“Опухоли невыявленной первичной локализации” в качестве
первичной профилактики нейтропении при режимах ХТ, сопровождающихся риском развития ФН
более 20%: FOLFIRINOX, GD [21].
С 2022 года расширяется список
нозологий с включением эмпэгфилграстима в КР МЗ РФ: препарат Экстимия® включен в обновленные клинические рекомендации МЗ
РФ: "Саркомы костей" [22], "Саркомы мягких тканей" [23], "Рак прямой кишки" [24]. Соответствующие
клинические рекомендации находятся в открытом доступе на сайтах
АОР и МЗ РФ.
Режимы терапии с показанием
к профилактике фебрильной нейтропении препаратом Экстимия®:
• Саркомы костей: AP; HD-I; GemTax; HD-VAI [22];
• Саркомы мягких тканей: HD-AI; ADIC; HD VAI; Доксорубицин 20 мг/м2 + дакарбазин 150 мг/ м2 (цикл 28 дней); Доксорубицин 20 мг/м2 + дакарбазин 300 мг/м2 (цикл 21 день) [23];
• Рак прямой кишки: FOLFOXIRI
[24].
Отечественные разработки
в мире на примере
эмпэгфилграстима
(Экстимия®)
В 2019 году был опубликован метаанализ по оценке эффективности и безопасности применения всех существующих препаратов класса Г-КСФ [25]. В финальный анализ было включено 73 рандомизированных клинических исследования (РКИ) с участием 15124 пациентов. Отобранные исследования оценивались по ключевым характеристикам, в том числе: дизайну проведённого РКИ, характеристикам набранных пациентов, режимам ХТ с дозами и протоколом лечения, исходам терапии. Препараты оценивались по следующим параметрам эффективности: частота развития ФН, частота развития тяжелой нейтропении (3-4 степени тяжести) и частота развития болей в костях была выбрана в качестве оценки параметра безопасности, как класс-эффект всех препаратов Г-КСФ.
На момент публикации данного мета-анализа эмпэгфилграстим был изучен в рамках клинической разработки; и уже полученные результаты регистрационного исследования фазы III позволили выделить его в тройку лучших препаратов по профилактике тяжелой нейтропении, что явилось началом пути к международному признанию (рис. 1, [25]). Рисунок 1. Ранжирование препаратов класса Г-КСФ по эффективности и безопасности. Международный мета-анализ 73 РКИ. Адаптировано на основании Wang, Y., Chen, L., Liu, F. et al. Efficacy and tolerability of granulocyte colony-stimulating factors in cancer patients after chemotherapy: A systematic review and Bayesian network meta-analysis. Sci Rep 9, 15374 (2019). https://doi.org/10.1038/s41598-019- 51982-4. Эмпэгфилграстим успешно продолжает доказывать свою эффективность и безопасность не только в рамках РКИ фазы III у пациентов раннего РМЖ, но и на расширенных и сложных популяциях пациентов в наблюдательном проспективном пострегистрационном исследовании DEFENDOR (NCT04811443) [26], инициативном проспективном исследовании DEFENDOR Special (NCT04905329) [27]. Промежуточные срезы данных были опубликованы в рамках ведущего онкологического конгресса ASCO2022 [26] и будут представлены в рамках постерного доклада на ключевом ежегодном конгрессе по диагностике и лечению рака молочной железы SABCS2022 [27].
Рисунок 1.
Ранжирование препаратов класса Г-КСФ по эффективности и безопасности. Международный мета-анализ 73 РКИ. Адаптировано на основании Wang, Y., Chen, L., Liu, F. et al. Efficacy and
tolerability of granulocyte colony-stimulating factors in cancer patients after chemotherapy: A systematic
review and Bayesian network meta-analysis. Sci Rep 9, 15374 (2019). https://doi.org/10.1038/s41598-019-
51982-4.
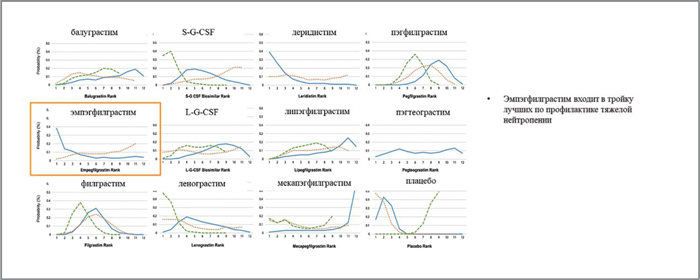
DEFENDOR (NCT04811443)[26] Многоцентровое проспективное наблюдательное пострегистрационное исследование эффективности и безопасности применения препарата Экстимия® у пациентов с солидными опухолями, получающих цитотоксическую терапию: DEFENDOR (NCT04811443). Исследование DEFENDOR проводится с целью оценки относительной дозоинтенсивности (ОДИ) проведенных курсов химиотерапии у пациентов с солидными опухолями на фоне первичной профилактики ФН эмпэгфилграстимом. В рамках данной работы впервые в РФ проводится анализ влияния первичной профилактики ФН пролонгированным Г-КСФ (эмпэгфилграстим) на сохранение дозоинтенсивности лекарственной терапии. В исследование включаются пациенты с высоким и промежуточным риском развития ФН, которые получают первичную профилактику ФН эмпэгфилграстимом в рамках рутинной клинической практики. На момент среза данных - март 2022 года - в исследование были включены 1074 пациента, из них 526 участников полностью завершили запланированные курсы цитотоксической терапии. Относительная дозоинтенсивности (далее, ОДИ) ≥85% была достигнута у 492 (93,5%) пациентов-участников. У 118 (22,4%) пациентов были зарегистрированы удлинения интервалов между циклами, либо редукции доз цитостатических агентов. Основными причинами снижения ОДИ были: личные обстоятельства - 69 (13,1%) пациентов, COVID-19 - 26 (4,9%) пациентов, выходные и праздничные дни - 9 (1,7%) пациентов и другие. Нейтропения, как причина снижения ОДИ, была зарегистрирована у 6 (1,1%) пациентов. У 12 (2,3%) пациентов развились нежелательные реакции 1-2 степеней тяжести (боли в спине, оссалгии, миалгии), связанные с исследуемым препаратом [9]. На основании промежуточного анализа авторы сделали вывод, что первичная профилактика ФН пролонгированным Г-КСФ, эмпэгфилграстимом, позволяет эффективно поддерживать ОДИ у пациентов с различными солидными опухолями и терапевтическими режимами в реальной клинической практике [26].
DEFENDOR SPECIAL
(NCT04905329) [27]
DEFENDOR Special: Мультицентровое проспективное наблюдательное пострегистрационное исследование эффективности и безопасности применения комбинированной химиотерапии в сочетании с профилактикой нейтропении эмпэгфилграстимом у пациентов с диагнозами рака молочной железы, опухолями системы ЖКТ и онкогинекологическими опухолями групп высокого риска рецидива и «серой зоны» (NCT04905329). Исследование DEFENDOR Special проводится с целью оценки влияния первичной профилактики нейтропении на исходы терапии у заявленной популяции больных. На момент среза данных – апрель 2022 года - была проанализирована когорта пациентов с диагнозом рак молочной железы (РМЖ); 111 пациентов со стадиями II-III (согласно TNM версии 8.0) высокого риска рецидива получили неоадъювантную терапию последовательными дозоуплотненными режимами (включая платина-содержащие) для HER2 негативных опухолей и THCP – для HER2 положительных опухолей на фоне первичной профилактики нейтропении эмпэгфилграстимом в составе неотъемлемого компонента лечения. Первичной конечной точкой является относительная дозоинтенсивность курса проведенной терапии, ключевой вторичной точкой – частота достижения тотального патоморфологического ответа (tpCR: ypT0/is, ypN0).
Терапия раннего РМЖ является терапией с критичной важностью соблюдения запланированной относительной дозоинтенсивности лечения, так как ее сохранение значимо коррелирует с непосредственными (частота достижения tpCR) и отдаленными (безрецидивная выживаемость, общая выживаемость) результатами эффективности лечения данной группы пациентов [28].
Таблица1.
Частота достижения tpCR у пациентов, после проведения неоадъюватной терапии на фоне первичной профилактики эмпэгфилграстимом (Defendor Special) по сравнению с историческим контролем.
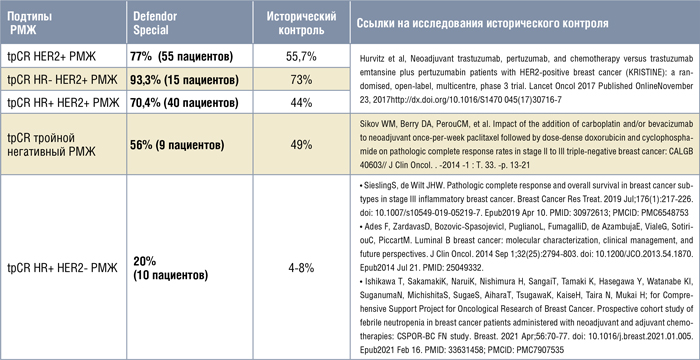
Достижение tpCR (ypT0/is, ypN0) по
данным оперативного вмешательства
определяет дальнейший благоприятный прогноз больных по сравнению с
группой, не достигших tpCR [29].
В промежуточный анализ (апрель
2022) включены 111 пациентов
(HER2+ РМЖ (n=56); HR+ HER2-
РМЖ (n=17); тройной негативный
РМЖ (ТНРМЖ) (n=38), которые
получили от 1 и более циклов терапии в рамках запланированного лечения и вошли в анализ популяции
безопасности. Весь запланированный курс терапии был завершен у 75
(68%) пациентов, которые вошли в
анализ популяции эффективности.
ОДИ≥85% была достигнута у 56 (75%)
участников. ОДИ 93% была зарегистрирована для дозоуплотненного
режима ACх4+эмпэгфилграстим→d
dPх4+эмпэгфилграстим; 90,3% - для
TCHPх6+эмпэгфилграстим; 94,1% для
4ddACх4+эмпэгфилграстим→12(P+к
арбоплатин). Предварительные данные по оценке частоты достижения
tpCR регистрируют более высокую
частоту tpCR по сравнению с историческим контролем у пациентов с
ранним РМЖ группы высокого риска
рецидива (табл. 1). Для HER2+ РМЖ
данные результаты были зарегистрированы несмотря на популяцию, обогащенную пациентами неблагоприятного прогноза по сравнению с РКИ
KRISTINE: стадии IIIB-IIIC – 32% пациентов (по сравнению с 17%, [30]),
стадии IIA-IIIA – 68% пациентов (по
сравнению с 83%, [30]), большинство
включенных пациентов имели повышенный индекс массы тела.
Нейтропения, как причина снижения
ОДИ, была зарегистрирована у одного (0,9%) пациента [27]. На основании
данных промежуточного анализа авторы предварительно делают выводы
о том, что первичная профилактика
ФН с помощью эмпэгфилграстима у
пациентов с РМЖ с высоким риском
рецидива позволяет эффективно сохранить ОДИ, демонстрируя благоприятный профиль безопасности.
Высокая частота достижения tpCR на
фоне применения эмпэгфилграстима
у пациентов с HER+ РМЖ будет далее изучаться в рамках продолжения
набора пациентов-участников и расширения выборки, а также требует
трансляционных исследований.
Резюмируя, можно заключить, что на
настоящий день, препараты класса
Г-КСФ являются неотъемлемым компонентом лечения для целого ряда
нозологий, позволяя достигать оптимальных результатов лечения. Применение пролонгированных форм на
примере нашего отечественного препарата эмпэгфилграстим позволяет
не только обеспечить безопасность
и удобство пациента к лечению, но и
достигать высоких результатов эффективности терапии.
Источники:
1. By W. Hryniuk and M.N. Levine Analysis of Dose Intensity for Adjuvant Chemotherapy Trials in Stage II Breast Cancer. Journal of Clinical Oncology, Vol 4, No 8 (August), 1986: pp 1162-1170
2. Lyman G. H. Impact of chemotherapy dose intensity on cancer patient outcomes //Journal of the National Comprehensive Cancer Network. – 2009. – Т. 7. – №. 1. – С. 99-108.
3. Gray R. et al. Increasing the dose intensity of chemotherapy by more frequent administration or sequential scheduling: a patient-level meta-analysis of 37 298 women with early breast cancer in 26 randomised trials //The lancet. – 2019. – Т. 393. – №. 10179. – С. 1440-1452.
4. Kuderer, N. M., Dale, D. C., Crawford, J., & Lyman, G. H. (2007). Impact of primary prophylaxis with granulocyte colony-stimulating factor on febrile neutropenia and mortality in adult cancer patients receiving chemotherapy: a systematic review. In Database of Abstracts of Reviews of Effects (DARE): Qualityassessed Reviews [Internet]. Centre for Reviews and Dissemination (UK).
5. Сакаева Д. Д. и др. Практические рекомендации по лечению инфекционных осложнений фебрильной нейтропении и назначению колониестимулирующих факторов у онкологических больных //Практические рекомендации RUSSCO, версия. – 2018.
6. Weycker D. et al. Abstract P2-08-24: Risk of chemotherapy-induced febrile neutropenia (FN) in patients with metastatic cancer of the breast or other sites not receiving colony-stimulating factor prophylaxis (CSF) in US clinical practice. – 2020.
7. Punnapuzha, S., Edemobi, P. K., & Elmoheen, A. (2019). Febrile Neutropenia. In StatPearls [Internet]. StatPearls Publishing.
8. Lyman, G. H., Michels, S. L., Reynolds, M. W., Barron, R., Tomic, K. S., & Yu, J. (2010). Risk of mortality in patients with cancer who experience febrile neutropenia. Cancer, 116(23), 5555-5563.
9. Снеговой А.В., Кагония Л.М., Кононенко И.Б. и др. Практические рекомендации по назначению колониестимулирующих факторов с целью профилактики развития фебрильной нейтропении у онкологических больных. Злокачественные опухоли. 2015; 4: 342–9. DOI: 10.18027/2224-5057- 2016-4s2-394-401
10.Dale D. Colony-stimulating Factors for the Management of Neutropenia in Cancer Pati- ents. Drugs 2002; 62 (1): 1–15. DOI: 10.2165/00003495-200262001-00001
11.Lyman G.H. Impact of chemotherapy dose intensity on cancer patient outcomes. J Natl Compr Canc Netw. 2009;7(1):99– 108.
12.M.S. Aapro. 2010 update of EORTC guidelines for the use of granulocytecolony stimulating factor to reduce the incidence of chemotherapy-induced febrile neutropenia in adult patients with lymphoproliferative disorders and solid tumours
13.Welte К., Reiter A., Mempel К. et al. A randomized phase-III study of the efficacy of granulocyte-colony stimulating factor in children with high-risk acute lymphoblastic leukemia. Blood 1996;87(8):3143—50
14.Lyman G. H. et al. The effect of filgrastim or pegfilgrastim on survival outcomes of patients with cancer receiving myelosuppressive chemotherapy //Annals of Oncology. – 2015. – Т. 26. – №. 7. – С. 1452-1458.
15.Schnipper L.E., Smith T.J., Raghavan D., et al. American Society of Clinical Oncology identifies five key opportunities to improve care and reduce costs: the top five list for oncology. J Clin Oncol. 2012 May 10;30(14):1715-24. doi: 10.1200/ JCO.2012.42.8375. Epub 2012 Apr 3. PMID: 22493340.
16.Криворотько П.В., Бурдаева О.Н., Ничаева М.Н. и др. Эффективность и безопасность препарата Экстимия® (эмпэгфилграстим) у пациентов с диагнозом «рак молочной железы», получающих миелосупрессивную химиотерапию: результаты двойного слепого сравнительного клинического исследования III фазы. Современная онкология. 2015; 17 (2): 45–52.
17.Итоговый отчет о результатах клинического исследования:Международное многоцентровое двойное слепое рандомизированное исследование эффективности и безопасности однократного применения препарата BCD-017 по сравнению с ежедневным введением филграстима с целью профилактики нейтропении у больных раком молочной железы, получающих миелосупрессивную химиотерапию
18.Инструкция по медицинскому применению лекарственного препарата эмпэгфилграстим. ЛП-003566-170920.
19.Электронный ресурс, Государственный реестр лекарственных средств URL: https://grls.rosminzdrav.ru/Grls_ View_v2.aspx?routingGuid=5756420e021b-46ab-891b-9a562a07e778
20.Электронный ресурс, Рубрикатор клинических рекомендаций. Рак молочной железы. https://cr.minzdrav.gov. ru/recomend/379_4
21.Электронный ресурс, Рубрикатор клинических рекомендаций. Опухоли невыявленной первичной локализации https://cr.minzdrav.gov.ru/ recomend/504_2
22.Электронный ресурс, Рубрикатор клинических рекомендаций. Саркомы костей. URL: Рубрикатор КР (minzdrav.gov.ru)
23.Электронный ресурс, Рубрикатор клинических рекомендаций. Саркомы мягких тканей. URL: Рубрикатор КР (minzdrav.gov.ru)
24.Электронный ресурс, Рубрикатор клинических рекомендаций. Рак прямой кишки. URL: Рубрикатор КР (minzdrav.gov.ru)
25.Wang Y, et al. Efficacy and tolerability of granulocyte colony-stimulating factors in cancer patients after chemotherapy: A systematic review and Bayesian network meta-analysis. Sci Rep. 2019;9:15374.
26.A. Snegovoy et al. Defendor: Realworld evidence of primary prolonged G-CSF prophylaxis by empegfilgrastim for relative dose intensity compliance in patients with solid tumors—The primary analysis. E18788. DOI: 10.1200/ JCO.2022.40.16_suppl.e18788 Journal of Clinical Oncology 40, no. 16_suppl (June 01, 2022) e18788-e18788. ASCO 2022.
27.Zhukova L et al., DEFENDOR SPECIAL: primary empegfilgrastim prophylaxis (prolonged G-CSF) for optimal treatment outcomes in high risk early breast cancer cohort. The interim analysis, P3-07-23, SABCS 2022, 6-10 Dec, in print
28.Nielson CM, Bylsma LC, Fryzek JP, Saad HA, Crawford J. Relative Dose Intensity of Chemotherapy and Survival in Patients with Advanced Stage Solid Tumor Cancer: A Systematic Review and Meta-Analysis. Oncologist. 2021 Sep;26(9):e1609-e1618. doi: 10.1002/ onco.13822. Epub 2021 Jun 9. PMID: 33973301; PMCID: PMC8417866.
29.Cortazar P, Zhang L, Untch M, Mehta K, Costantino JP, Wolmark N, Bonnefoi H, Cameron D, Gianni L, Valagussa P, Swain SM, Prowell T, Loibl S, Wickerham DL, Bogaerts J, Baselga J, Perou C, Blumenthal G, Blohmer J, Mamounas EP, Bergh J, Semiglazov V, Justice R, Eidtmann H, Paik S, Piccart M, Sridhara R, Fasching PA, Slaets L, Tang S, Gerber B, Geyer CE Jr, Pazdur R, Ditsch N, Rastogi P, Eiermann W, von Minckwitz G. Pathological complete response and longterm clinical benefit in breast cancer: the CTNeoBC pooled analysis. Lancet. 2014 Jul 12;384(9938):164-72. doi: 10.1016/ S0140-6736(13)62422-8. Epub 2014 Feb 14. Erratum in: Lancet. 2019 Mar 9;393(10175):986. PMID: 24529560.
30.Hurvitz et al, Neoadjuvant
trastuzumab, pertuzumab, and
chemotherapy versus trastuzumab
emtansine plus pertuzumabin patients
with HER2-positive breast cancer
(KRISTINE): a randomised, open-label,
multicentre, phase 3 trial. Lancet Oncol
2017 Published OnlineNovember 23,
2017http://dx.doi.org/10.1016/S1470
045(17)30716-7
Наталья Калагина
Наталья Калагина – врач-кардиолог, поэт, фотограф. Роди
-
лась в 1972 году в Ульяновске. В 1997 году закончила меди
-
цинский факультет филиала МГУ им.М.В.Ломоносова, с 1998
года работала врачом-кардиологом Ульяновского областного
кардиологического диспансера, а с 2019 года заведует отделе
-
нием соматической реабилитации. Пишет стихи с юных лет.
С 2016 года занимается фотографией, является членом Союза
фотографов дикой природы.

«В этой жизни больше всего ценю именно её – саму жизнь. В
людях – созвучность с моим мировосприятием, что встреча
-
ется нечасто, доброту, умение и желание помогать людям и
животным, чуткость и тактичность. А фотография дает воз
-
можность делиться с людьми красотой природы (хоть она,
природа, совсем рядом!), ее маленькими и большими чудеса
-
ми».

Просто жить
Было тихо и безлунно.
Было поздно.
Человек
И не старый, и не юный
Шёл, топча ногами снег.
И не страшно, и не скучно
В час полночный одному,
Что-то напевал беззвучно,
Было радостно ему.
Строй деревьев величавых
В зимней сказочной красе -
Раньше он не замечал их,
Лишь вперёд бежал, как все.
Вот по льду он прокатился
Словно в детстве, а потом
На ходу остановился
И ловил снежинки ртом.
Смог сегодня отрешиться
От того, что не решить,
Никуда не торопиться.
Наслаждаться. Просто жить!
Так внезапно окрылённым
Шёл куда-то человек.
Светофор горел зелёным.
Было поздно.
Падал снег.
04.02.22

Предновогоднее
Год уходит. Не спеша
запрягает колесницу.
На календарях шуршат
предпоследние страницы
Стрелок острые ножи
Режут время в циферблатах.
Завтра в полночь закружит
Праздник, красками богатый.
Кто бы что ни говорил,
Взгляд свой пряча торопливо,
Но для многих всё же был
В чём-то этот год счастливым
Хочется не помнить зла,
Ум заняв мечтой крылатой.
Жизнь всегда такой была
Чёрно-бело-полосатой.
Не трудитесь собирать
Ворох предсказаний лживых,
Больше делайте добра.
Будьте здравы. Будьте живы.
Пусть приходят в каждый дом
Только радостные вести.
Свято помните о том:
Мы сильны, пока мы вместе.
Пусть за тучами мелькнет
Долгожданный солнца лучик,
И придёт, ко всем придёт
Добрый гость -
счастливый случай.

ВСТАНЬ И ИДИ!
Автор: Жуков Николай Владимирович
Руководитель отдела междисциплинарной онкологии ФГБУ «НМИЦ Детской гематологии, онкологии и иммунологии им. Д. Рогачева»,
доцент кафедры онкологии, гематологии и лучевой терапии РНИМУ им. Н.И. Пирогова, член правления RUSSCO,
доктор медицинских наук, профессор, Москва
Дорогие коллеги! Поддерживая
стиль, заданный названием раздела, начну так: а вот был у меня
случай…
Дело было в конце января 2022 года,
когда я получил из благотворительного фонда «Подари жизнь» электронное письмо следующего содержания:
«Уважаемый Николай Владимирович, добрый день. Просим Вас рассмотреть документы пациента Н.
Центр Х (один из флагманских федеральных Московских центров – прим.
автора) не согласовывает операцию,
доктор А. (один из докторов экспертного уровня, занимающихся спинальной хирургией – прим. автора)
тоже считает, что операция маловероятна, но он еще думает. Опухоль
продолжает расти, возможны ли
терапевтические опции? Или лучи?
Сформулируйте, пожалуйста, экспертное заключение».
Если кто вдруг не знает, расскажу,
что уже достаточно давно являюсь
консультантом благотворительного
фонда «Подари жизнь». Учитывая,
что Фонд в основном занимается
помощью детям с онкологическими заболеваниями, не могу сказать,
что, будучи взрослым онкологом,
консультирую активно, но когда попадаются случаи взрослых или непонятных солидных опухолей у детей,
подростков или молодых взрослых,
Фонд часто обращается за помощью
ко мне. Основной вопрос (и, мне кажется, это абсолютно правильный
подход), который стоит передо мной,
– оправдано ли с медицинской точки
зрения использование средств Фонда на лечение (диагностику и т.д.) в
конкретной клинической ситуации.
Разумеется, на этот вопрос я отвечаю всегда. Но по дотошности своей
всегда смотрю на ситуацию и с другой
стороны – а можно ли порекомендовать что-то другое, отличное от того,
что «просят» обратившиеся в Фонд,
для лечения больного, что с моей точки зрения было бы более эффективно.
Бывают, правда, обращения, которые
звучат «А можно ли вообще сделать
хоть что-нибудь, если в этом поможет
Фонд?» Ситуация, о которой я хочу
рассказать, была именно такой.
Изучение предлагавшейся медицинской документации особого оптимизма не вызвало. Речь шла о 19-летнем
пациенте с остеобластомой. Опухолью доброкачественной, но в силу
расположения в первом грудном позвонке и распространенности в спинномозговом канале неоперабельной.
Симптомы в виде нарастающего болевого синдрома и слабости в нижних
конечностях у пациента появились в
2019 году, к 2020 году отмечалась уже
плегия нижних конечностей и нарушение функции тазовых органов, по
поводу чего он в июне 2020 года был
прооперирован по месту жительства
в объеме декомпрессивной ламинэктомии Th1 позвонка, удаления новообразования позвоночного канала.
При морфологическом исследовании
– остеобластома. Затем пациент обратился в тот самый федеральный
онкологический центр Х, где в сентябре 2020 года было выполнено паллиативное хирургическое лечение в
объеме декомпрессивная ламинэктомия С7-Th1 позвонка с транспедикулярной фиксацией, без клинически
значимых улучшений – сохранялась
картина нижней параплегии с нарушением функций тазовых органов.
Собственно, всю эту информацию
я почерпнул из справки о дистанционной медицинской консультации в
этом же центре от января 2022 года,
где дополнительно содержались данные о дальнейшем прогрессировании
заболевания и рекомендации такого
рода: учитывая анамнез, клиническую картину, стойкие неврологические нарушения и их длительность,
морфологическую картину, хирургическое лечение не показано.
Рекомендовано:
1. наблюдение по месту жительства;
2. адекватная анальгетическая терапия;
3. паллиативная помощь и уход;
4. консультация лучевого терапевта,
химиотерапевта на предмет возможных опций лечения.
Учитывая, что я прекрасно знаю высокий уровень онкологов-хирургов,
давших это заключение, сомнений в
неоперабельности опухоли у меня не
было, так что я даже не стал запрашивать снимки, чтобы в этом убедиться.
Тем более что неоперабельность опухоли подтверждалась и заключением
второго независимого специалиста
в приведенном выше обращении от
Фонда. Ну а формулировка, с которой
пациента отпустили из федерального
центра – наблюдение по м/ж и консультация лучевого терапевта, химиотерапевта (судя по всему, там же, по
м/ж) вкупе с тем, что с 2020 года ни
то, ни другое центром предложено не
было, не оставляла сомнений – пациент отправляется на симптоматическое лечение. Но родственники не сдавались, обращались за консультацией
в центры протонной терапии, но и
там получили отказ. Так что ситуация
выглядела безнадежно – опухоль без
каких-либо стандартных вариантов
лекарственной терапии, неоперабельная, не подлежащая лучевой терапии,
приведшая к длительной и глубокой
компрессии спинного мозга (по заключению ПЭТ/КТ сужение позвоночного канала до 2 мм) с развитием
плегии и нарушением функции тазовых органов. Но у меня есть принцип
– если речь идет об отказе в лечении
(особенно если речь идет о редкой
опухоли, знания в области которой
мною не обновляются на постоянной
основе), всегда проверять, а не появилось ли что-то новое. Так я, собственно, и сделал. Да, кое-что появилось,
например, данные об эффективности
применения высокоинтенсивного направленного ультразвука HIFU при
остеобластомах и других опухолях
костей с целью уменьшения размеров
и достижения симптоматического
эффекта. А также я обратил внимание на описание одного клинического
случая, которое было опубликовано
еще в 2019 году (т.е. как раз в год, когда
наш пациент заболел, и за год до того,
как он попал на лечение в федеральный центр Х). И случай этот описывал хороший клинический эффект от
применения деносумаба при лечении
неоперабельной остеобластомы пястья [1]. А при более детальном поиске обнаружилась и статья 2018 года об
использовании деносумаба в качестве
«неоадъюванта» при остеобластоме
крестцовых позвонков [2]. Не будучи
узким специалистом в области лечения данной патологии, я несколько
удивился, почему это лечение не было
предложено ранее в подразделении
федерального центре, специализирующемся на костных опухолях, где
пациент проходил лечение. И вообще
– не было рекомендовано никем из
докторов и клиник, которые наш пациент прошел с 2019 года.
Увы, сейчас назначение терапии выглядело совсем не многообещающим.
Признаюсь, я не ожидал чудес от деносумаба в силу того, что не рассчитывал на регресс неврологической
симптоматики при плегии, которая,
согласно имеющейся медицинской
документации, существовала около
2 лет. Но и не порекомендовать этот
подход я тоже не мог. В своем заключении для Фонда я честно написал,
что не рассчитываю на регресс неврологической симптоматики, даже если
деносумаб окажется эффективен у
данного пациента. Максимумом моих
ожиданий было уменьшение болевого синдрома и сдерживание опухоли.
В общем, порекомендовал – и забыл.
Каково же было мое удивление, когда
я в ноябре получил письмо из Фонда,
которое (убрав только части, в которых представитель Фонда хвалит лично меня, называя разными хорошими
словами) я приведу полностью для
осознания драматизма произошедшего.
«Дорогой Николай Владимирович, добрый день!
В январе мы обращались к вам за консультацией (ваш ответ внизу) по поводу пациента Н. (остеобластома).
Мне кажется важным сообщить вам,
что происходит с этим пациентом в
настоящее время.
После однократного введения деносумаба, который порекомендовали Вы,
через неделю пациент начал чувствовать нижние конечности. Еще через
несколько дней встал и начал ходить.
Я много и долго консультировалась с
радиологами и нейрохирургами, опасаясь навредить. В результате вчера
Н. был прооперирован доктором А.,
который рассказал мне сегодня, что
опухоль уплотнилась за счет введения
деносумаба очень существенно, и если
бы этого введения не было, то пациент скорее всего уже был бы окончательно парализован. После операции
Н. уже ходит, причем уверенно. Спасибо огромное!»
Вот, собственно, почти вся история.
Разве что можно добавить, что под
воздействием деносумаба опухоль
действительно претерпела существенные изменения – удаленная ткань по
структуре была представлена костной
мозолью (согласно гистологическому
заключению, которое мне любезно
предоставили родственники пациента, одновременно с его и их разрешением на публикацию этого случая).
Чему же я научился и какие же выводы я хочу сделать из этого случая? Их несколько:
1. Фонд «Подари жизнь» – одна из самых эффективных благотворительных организаций, с которыми я встречался. Они не только помогают решить проблемы с обеспеченностью пациентов, но и «сводят правильных врачей и пациентов», снимая и с тех, и с других многие проблемы, мешающие в назначении и получении лечения. И касается это не только пациентов детского возраста, но и молодых взрослых.
2. Не только гигантоклеточные опухоли костей, но и остеболастома высокочувствительны к деносумабу (причем, возможно, последняя даже более чувствительна).
3. Даже в случае очень длительного
(годы) и глубокого (плегия) существования неврологического
дефицита можно рассчитывать на
восстановления функции хотя бы
у некоторых больных, что оправдывает попытки лечения.
И еще один вывод. Наша специальность развивается очень быстро, появляются все новые и новые знания
и опции. Перед тем как отказать, убедитесь, что они не появились за день,
месяц или год до того, как вы принимаете решение, а вы об этом просто не
знаете.
Источники:
Kooner P, Ferguson P. The Use of
Denosumab in Osteoblastoma of
the Metacarpal. J Hand Surg Am.
2019 Nov; 44 (11): 994.e1-994.e6. doi:
10.1016/j.jhsa.2019.02.001. Epub 2019
Mar 22. PMID: 30910238.
Reynolds JJ, Rothenfluh DA,
Athanasou N, Wilson S, Kieser DC.
Neoadjuvant denosumab for the
treatment of a sacral osteoblastoma.
Eur Spine J. 2018 Jul; 27 (Suppl 3):
446-452. doi: 10.1007/s00586-018-
5461-z. Epub 2018 Jan 22. PMID:
29356985.