
Дорогие коллеги, дорогие друзья!
…Вспомните, не в том ли дальнем ящике старого письменного стола завалялась детская коллекция открыток 1980х годов? Да-да, тех самых, от Четверикова и Зарубина, поздравительных на все случаи жизни, с умилительными зайцами, галантными котами, разлапистыми медведями, россыпями весенних цветов или колючих снежинок?...

ШКОЛА КЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ ДЛЯ МОЛОДЫХ ОНКОЛОГОВ

ОТЧЕТ О РАБОТЕ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ В 2021
Подходит к концу 2021 год, десятый год деятельности Российского общества клинической онкологии. Этот год также ознаменовался проведением XXV юбилейного Российского...

ОСЯЗАЕМАЯ УГРОЗА ГЛОБАЛЬНОГО ПОТЕПЛЕНИЯ
К сожалению, наша планета разлюбила человечество. Мы так испортили нашу Землю, что дальше терпеть это безобразие, судя по всему, стало невозможным. Природа...
СОВЕРШЕНСТВОВАНИЕ МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКОЙ ДИАГНОСТИКИ В РОССИЙСКОЙ ФЕДЕРАЦИИ

ВОЗМОЖНО, САМОЕ ВАЖНОЕ ИССЛЕДОВАНИЕ 2021 ГОДА (КАК МИНИМУМ, САМОЕ ОЖИДАЕМОЕ И ИНТЕРЕСНОЕ)
2021 год был богат на ожидаемые (и не очень) результаты клинических исследований и события в онкологическом мире, и именно поэтому выбрать из них что-то наиболее...

НАИБОЛЕЕ ЗНАЧИМЫЕ ИССЛЕДОВАНИЯ ПО ЛЕЧЕНИЮ ОПУХОЛЕЙ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА В 2021 ГОДУ
Каждый год результаты сотен исследований транслируются с трибун, а сейчас с электронных площадок мировых онкологических конгрессов. И все большее их число...

ВРЕМЯ ПОДВОДИТЬ ИТОГИ 2021. КАКИЕ 3 СОБЫТИЯ В ТЕРАПИИ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ Я СЧИТАЮ НАИБОЛЕЕ ВАЖНЫМИ В УХОДЯЩЕМ ГОДУ
Прошедший год стал первым шагом к возвращению к «допандемийной» жизни, и большинство конгрессов, несмотря на заочный формат, порадовали нас новостями...

КОНФЕРЕНЦИЯ RUSSCO РАК МОЛОЧНОЙ ЖЕЛЕЗЫ

РАК ЛЕГКОГО ПО ДАННЫМ ИССЛЕДОВАНИЙ, ПРЕДСТАВЛЕННЫХ НА ESMO 2021 И WLCC 2021: КОРОТКО О САМОМ ВАЖНОМ
На протяжении многих лет локализованные опухоли легкого лечили хирургическим методом, который, к сожалению, не приводил к излечению более чем в половине случаев...

НАИБОЛЕЕ ЗНАЧИМЫЕ ИССЛЕДОВАНИЯ С ЛУЧЕВОЙ ТЕРАПИЕЙ В 2021 ГОДУ
У российских радиотерапевтов есть общий чат с большим числом участников – шесть сотен без малого. Чувствовать виртуальную связь с коллегами вне огромного пространства...

ОНКОГИНЕКОЛОГИЯ: НАИБОЛЕЕ ЗНАЧИМЫЕ СОБЫТИЯ 2021 ГОДА
Уходящий 2021 год ознаменовался для нас не только уникальной возможностью изучить греческий алфавит вследствие продолжающейся пандемии COVID-2019, но и многими...

КОНФЕРЕНЦИЯ RUSSCO ОНКОГИНЕКОЛОГИЯ

ЗНАЧИМЫЕ СОБЫТИЯ УХОДЯЩЕГО 2021 ГОДА В ЛЕКАРСТВЕННОМ ЛЕЧЕНИИ САРКОМ
В этом году на главных международных онкологических площадках было представлено несколько действительно важных исследований, демонстрирующих не только...

НАИБОЛЕЕ ЗНАЧИМЫЕ ИССЛЕДОВАНИЯ ПО МЕЛАНОМЕ В 2021 ГОДУ
Несмотря на пандемию, вызванную COVID-19, онкологическое научное сообщество продолжает активный поиск новых противоопухолевых препаратов. В 2021 году были

НАИБОЛЕЕ ЗНАЧИМЫЕ ДОСТИЖЕНИЯ В ЛЕЧЕНИИ ОНКОУРОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ В 2021 ГОДУ
По мнению ведущих специалистов американского общества клинической онкологии (ASCO), в области лекарственной терапии онкоурологических заболеваний за последний...
ХАЛАВЕН 10 ЛЕТ СПУСТЯ: МЕСТО В ТЕРАПИИ МЕТАСТАТИЧЕСКОГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ
04.10.2021 состоялся онлайн симпозиум с международным участием компании Эйсай «Халавен 10 лет спустя. Место эрибулина в современном алгоритме лечения метастатического рака молочной железы». В мероприятии участвовали: профессор, онколог, заместитель директора онкологического отделения госпиталя Vall d’Hebron Хавьер Кортес (Барселона, Испания), д.м.н., профессор кафедры онкологии и паллиативной медицины РМАНПО Ирина Владимировна Колядина, д.м.н., заместитель директора МКНЦ...

КОНФЕРЕНЦИЯ RUSSCO МЕЛАНОМА

СОВРЕМЕННЫЙ КЛАССИФИКАТОР РИСКА ПОМОЖЕТ РАНЬШЕ ПРЕДСКАЗАТЬ РЕЦИДИВ РАКА ЩИТОВИДНОЙ ЖЕЛЕЗЫ
В бюллетене ASCO Cancer in the News от 23 ноября 2021 года была представлена заметка, посвященная возможностям прогнозирования развития рецидива рака щитовидной...
ВПЕРВЫЕ ЗА 10 ЛЕТ: РОССИЙСКОЕ ОБЩЕСТВО КЛИНИЧЕСКОЙ ОНКОЛОГИИ ОБЕСПЕЧИЛО ЛАБОРАТОРИЯМ ВОЗМОЖНОСТЬ ПРОЙТИ МЕЖДУНАРОДНЫЙ КОНТРОЛЬ КАЧЕСТВА ОТ EUROPEAN MOLECULAR GENETICS QUALITY NETWORK
Лаборатории, работающие в Программе молекулярно-генетической диагностики в Российской Федерации с целью повышения эффективности противоопухолевого лечения, проводимой RUSSCO, признают необходимость выполнения не только входящего контроля качества, но и периодического внешнего контроля качества молекулярно-генетических исследований. Внешний контроль качества (ВКК) - это система объективной оценки результатов исследований в лаборатории, осуществленная внешней...
АКТУАЛЬНЫЕ ВОПРОСЫ ЛЕКАРСТВЕННОЙ ТЕРАПИИ РАКА ТЕЛА МАТКИ
18 ноября 2021 года в онлайнформате прошел экспертный форум «Актуальные вопросы лекарственной терапии рака тела матки». Главной задачей форума было обсуждение опыта работы с иммуно-таргетной терапией, как новой опцией лечения рака эндометрия, которую онкологическое сообщество по праву именует революционной. Не секрет, что более 20 лет ничего нового в лечении распространенного рака эндометрия не было представлено, в отличие от других индикаций, поэтому тематика вызвала большой...
ESMO 2021: CHECKMATE 214. САМЫЙ ДЛИТЕЛЬНЫЙ ПЕРИОД НАБЛЮДЕНИЯ СРЕДИ ВСЕХ ИММУНООНКОЛОГИЧЕСКИХ АГЕНТОВ В ЛЕЧЕНИИ ПАЦИЕНТОВ С МЕТАСТАТИЧЕСКИМ ПОЧЕЧНО-КЛЕТОЧНЫМ РАКОМ (МПКР) В ПЕРВОЙ ЛИНИИ ТЕРАПИИ – 5 ЛЕТ
В исследовании СheckМate 214 оценивалась эффективность и безопасность двойной иммуно- онкологической комбинации – ниволумаба и ипилимумаба (Опдиво®+ Ервой®). Исследование подтвердило, что определение группы прогноза имеет не только важное прогностическое значение, но и необходимо для разработки оптимальной тактики...

ОПДИВО + ЕВРОЙ
Анонс
-

15 - 16 января
Онлайн-конференция WEB-RUSSCO «Исследования, изменившие клиническую практику в 2020 году»
-

21 ЯНВАРЯ 2022
КОНФЕРЕНЦИЯ RUSSCO МЕЛАНОМА
-

22 января Дата проведения изменена 11:00-12:45 (время московское)
Вебинар «Рак поджелудочной железы и печени» При участии специалистов ГБУЗ «Краснодарский онкологический диспансер №1» МЗ КК
-

27 - 28 ЯНВАРЯ 2022
КОНФЕРЕНЦИЯ RUSSCO РАК МОЛОЧНОЙ ЖЕЛЕЗЫ
-

28 января Дата проведения изменена 12:00-13:35 (время московское)
Вебинар «Рак поджелудочной железы и печени» При участии специалистов ГБУЗ ТО «Тверской областной клинический онкологический диспансер»
-

28 - 30 января
Большая конференция RUSSCO «Рак молочной железы» в онлайн-формате
-

25 - 26 МАРТА2022
КОНФЕРЕНЦИЯ RUSSCO ОНКОГИНЕКОЛОГИЯ
Дорогие коллеги, дорогие друзья!

…Вспомните, не в том ли дальнем ящике старого письменного стола завалялась детская
коллекция открыток 1980х годов? Да-да, тех
самых, от Четверикова и Зарубина, поздравительных на все случаи жизни, с умилительными зайцами, галантными котами, разлапистыми
медведями, россыпями весенних цветов или колючих снежинок?..
…Пора достать те, что припорошены искрящимся снегом, созданным добрыми Художниками,
пора выбрать самые любимые, разложить – реально или мысленно – на елочных ветвях и настроиться на новогодний лад! И теперь пусть каждое предновогоднее мгновение отсылает нас в детство
или юность, даря тепло и запах дома,
маминой шали, мандариновой шкурки, сосновой смолы, вареных овощей
для салата «оливье»… Пусть дом
наполняется веселыми звуками
позвякивающей праздничной
посуды, шуршанием мишуры,
досадными стекольными брызгами
от внезапно разбившегося елочного шара
или многоцветного снеговика, не удержавшегося
на расправляющихся сосновых иголках…
Пусть новогодние свечи выстраиваются в ряды, чтоб в сумраке подпевать пламенем в такт «Happy New Year!» или
«В лесу родилась ёлочка»…
Пусть последние мгновения уходящего года несут благодарность, что он, 2021-й, состоялся и добавил нам многое: радость,
грусть, опыт, встречи, мудрости толику, глупостей горсть,
приобретения и утраты – всё то, чем так щедра Жизнь.
Пусть уверенность в том, что наступающий 2022-й несет
с собой добро, тепло, любовь, душевный уют, радость
и удачу, крепнет с каждой минутой, приближающей нас
к нему! И пусть ощущение нашего единства и причастности
любимому общему делу не меркнет, сколь много бы этих лет
ни промчалось!
Доброго Нового 2022 года,
дорогие коллеги и друзья!
Мысленно с вами,
Наталья Деньгина,
главный редактор газеты RUSSCO


ОТЧЕТ О РАБОТЕ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ В 2021
Автор: Карасева В.
д.м.н., проф. каф. онкологии Факультета постдипломного образования ФГАОУ ВО РНИМУ
им. Н.И. Пирогова Минздрава России Исполнительный директор Российского общества клинической онкологии
Подходит к концу 2021 год, десятый год деятельности Российского общества клинической онкологии. Этот год также ознаменовался проведением XXV юбилейного Российского Онкологического Конгресса, который собрал в ноябре более 5 000 докторов в залах Крокус Сити, а также более 5 000 докторов присоединились к участию дистанционно. В рамках Конгресса прошли не только традиционные совместные сессии Российского общества клинической онкологии и ASCO, ESMO, ASTRO, ESO, но и сессии Московского общества онкологов, Санкт-Петербургской школы практических онкологов, Российского общества специалистов по лечению колоректального рака. Совместная сессия RUSSCO и Отечественной школы онкологов была посвящена памяти А.М. Гарина. Высокую оценку участников получили мастер-классы, лекции ведущих экспертов и, конечно же, церемония открытия, в рамках которой прозвучали приветствия главных внештатных специалистов-онкологов А.Д. Каприна и И.С. Стилиди, отчет председателя Российского общества клинической онкологии С.А. Тюляндина о десятилетней работе общества и традиционная лекция памяти академика Н.Н. Блохина, в которой член правления общества Н.В. Жуков с присущим ему талантом осветил проблемные точки онкологии. За год проведено 127 региональных мероприятий, собравших более 15 000 слушателей, а также 11 больших конференций, участниками которых были более 4,5 тысяч докторов. Немного статистики о статусе общества. Число членов общества составляет 5 500+. Пятьдесят три региональных отделения принимают активное участие в подготовке мероприятий, проведении наблюдательных исследований, опросников и других активностях общества. Расширяются связи с международными клиническими сообществами. Теперь с ASCO и ASTRO проводятся не только совместные сессии, но и на сайте RosOncoWeb публикуются отчеты о результатах работы конференции ASCO, включающие видео мировых лидеров в онкологии, а совместные сессии ASTRO-RUSSCO уже третий год подряд дублируются на конгрессах ASTRO в Соединенных Штатах с выступлением российских лекторов. Третий год в России проходит саммит ESMORUSSCO, программа которого формируется членом правления RUSSCO А.А. Трякиным; в этом году достигнута договорённость с руководством ESMO о проведении экзамена этого сообщества в Москве, и 48 докторов приняли участие в сдаче экзамена. На данный момент мы имеем подтверждение соглашения о проведении его в Москве в 2022.
Ассоциация онкологов России пригласила RUSSCO к партнерству в проекте подведения итогов года и проведения беспрецедентного мероприятия - премии им. академика А.И. Савицкого. В партнерстве с Московским обществом онкологов RUSSCO провело телемост, посвященный Всемирному дню борьбы с онкологическими заболеваниями, в котором приняли участие ведущие онкологи из Владивостока, Красноярска, Челябинска, Нижнего Новгорода, Краснодара, Ленинградской области и Москвы и поделились инновационными проектами в этих регионах. В целях помощи практикующим врачам и начинающим ученым в написании статей RUSSCO в партнерстве с CRO Алмедис провело цикл из 5 образовательных вебинаров. В этом году опубликованы результаты двух регистров реальной клинической практики, проведенных членами Российского общества клинической онкологии. Один из них в виде постерного доклада на Advanced Breast Cancer Six International Consensus Conference в ноябре 2021, посвященный изучению особенностей назначения палбоциклиба в комбинации с эндокринной терапией в реальной клинической практике у больных люминальным HER2- раком молочной железы. И первых абстракт, посвященный характеристике пациентов, вошедших в исследование по изучению последовательностей линий терапии распространенного гормонозависимого HER2-негативного рака молочной железы в реальной клинической практике, был опубликован в материалах XXV Конгресса. Продолжает свое развитие программа молекулярно-генетический диагностики в Российской Федерации с целью повышения эффективности противоопухолевого лечения. Помимо традиционной поддержки тестирования осуществляется маршрутизация образцов в рамках ОМС. Эта возможность появилась благодаря включению в проект молекулярно-генетических лабораторий референсных центров. Продолжается внедрение NGS технологий в практику МГД, чему способствует партнерство RUSSCO с производителями панелей NGS. Из значимых новостей – дополнительно к входящему контролю качества тестирования лабораторий добавлен плановый, успешно проведенный в 35 лабораториях страны. Статистический отчет о программе Вы можете увидеть на сайте cancergenome.ru. В этом году стартовал благотворительный проект «Книготерапия RUSSCO», в рамках которого общество организовало встречи виднейших российских писателей с пациентами, как взрослыми, так и детьми, в двух своих региональных отделениях – Самаре и Ярославле. Лечебным учреждениям этих городов были безвозмездно переданы книги С. Лукьяненко, Г. Куликовой, А. Гончаровой и других авторов. В этом году обновлен дизайн сайта RosOncoWeb, но не все еще завершено. В ближайшее время будет оптимизирован поиск материалов на сайте, ведь на нем накопилось более 4 500 записей выступлений ведущих специалистов, сделанных на мероприятиях RUSSCO. В этом году создан электронный вариант ежемесячной газеты RUSSCO, и, пользуясь возможностью, напоминаю, что журнал общества «Злокачественные опухоли» входит в перечень журналов, рецензируемых ВАК, по двум специальностям – «Онкология» и «Хирургия».

Практические рекомендации Российского общества клинической
онкологии изданы традиционно
тиражом 5 000 экземпляров, но
при этом в случае появления в
практике новых клинических решений, они редактируются в течение года в электронной версии,
размещенной на сайте общества.
В заключение отчета – слова благодарности сотрудникам офиса
RUSSCO, которые стремятся внедрить в жизнь все профессиональные идеи, выдвигаемые членами
Правления общества, представителями региональных отделений и
рядовыми членами общества.
Желаю Вам прекрасного Нового
Года, профессиональных успехов
в 2022 и главное - здоровья.
ОСЯЗАЕМАЯ УГРОЗА ГЛОБАЛЬНОГО ПОТЕПЛЕНИЯ
Автор: С.А.Тюляндин
Председатель Российского общества клинической онкологии
К сожалению, наша планета разлюбила человечество. Мы так
испортили нашу Землю, что
дальше терпеть это безобразие,
судя по всему, стало невозможным. Природа посылает нам все
новые испытания в надежде заставить беспечное человечество
задуматься о том, что мы творим сейчас и что ждет наших
детей в будущем. Глобальное
потепление, вызванное парниковым эффектом двуокиси углерода вследствие хозяйственной
деятельности человека, вызывает
таяние снегов в горах и льдов на
полюсах, обуславливая подъем
мирового океана и затопление
огромных территорий проживания человека. Мы пока не в полной мере осознаем последствия
таяния вечной мерзлоты в Заполярье. Засуха и наступление
пустынь лишают целые народы
источников пропитания. Другим
последствием засухи являются
лесные пожары, которые наряду
с промышленной вырубкой проводят к исчезновению миллионов
гектаров лесов ежегодно, увеличивая концентрацию двуокиси
углерода в атмосфере, одновременно загрязняя последнюю продуктами горения, обладающими
канцерогенными свойствами.
Многочисленные свалки, сбросы
ядовитых промышленных отходов и содержимого канализации
привели к ухудшению качества
воды и ее дефициту, усиливающемуся на фоне засухи. Загрязнение
опасными отходами и засорение
пластиком вод мирового океана
приводит к гибели его обитателей и разрушению сложившихся
экосистем. Мы пока плохо понимаем, как изменение ареола обитания различных представителей
флоры и фауны, например, тех же
летучих мышей, может изменить
эпидемиологическую обстановку
на новых территориях в связи с
сопутствующим распространением вирусов и других инфекций,
характерных для их популяций.
Очевидным последствием этого
является чередование экстремальных ситуаций в природе,
когда экстремально холодные
зимы сменяются не менее экстремальной жарой, засуха с неурожаем и лесными пожарами – проливными ливнями и обширными
наводнениями. Разрушительные
ураганы стали повторяться с нарастающей частотой, захватывая
территории, где о них прежде и не
слышали. И, похоже, это только
начало, сигнал предупреждения.
Дальше будет хуже.
Потепление затронет каждый
аспект нашей жизнедеятельности. И мы, онкологи, также почувствуем это в нашей профессиональной работе. Мы можем
ожидать увеличения заболеваемости злокачественными новообразованиями в связи с плохим
и недостаточным питанием продуктами низкого качества, потреблением загрязненной воды,
ухудшением качества воздуха вообще и, в частности, вследствие
лесных пожаров. Ожидается увеличение заболеваемости раком
легкого повсеместно вследствие
постоянно возрастающего загрязнения воздуха и меланомой
вследствие усиливающего воздействия ультрафиолета. Например, согласно прогнозам, заболеваемость меланомой США в
2040 году увеличится более чем в
2 раза и выйдет на первое место
среди всех злокачественных опухолей. Трудно оценить влияние
климатических изменений качества и количества продуктов питания на заболеваемость раком,
но прогнозируется, что примерно
534 тысячи человек будут умирать ежегодно по этой причине от
различных заболеваний, включая
злокачественные опухоли.
Глобальное потепление и обусловленные им катаклизмы будут
серьезно влиять на функционирование онкологической службы. Вспомним ураган Катрина,
который на целый год нарушил
жизнедеятельность целого города
Нью-Орлеан. В результате разрушений система здравоохранения
могла оказывать только экстренную помощь, вся остальная помощь, включая онкологическую,
была недоступна в городе. Наш
собственный опыт работы в экстремальных ситуациях, в данном случае в условиях пандемии
COVID-19, демонстрирует, как
страдает плановая онкологическая помощь и еще в большей
мере наши программы по ранней
диагностике и диспансеризации.
Все это приводит к увеличению
числа больных с поздними стадиями заболевания, задержкам
и перерывам в лечении и, в конечном итоге, к худшим результатам лечения. Все организации
системы здравоохранения стоят
перед фактом разработки мер по
защите инфраструктуры от воздействия окружающей среды и
работе в условиях различных
природных катаклизмов.
Это одна сторона медали. Другая
– это как система здравоохранения и все, кто в ней работает,
влияют на климатические изменения. Оказалось, что мы среди
самых отпетых загрязнителей
нашей планеты. Оценено, что система здравоохранения, включая
фармацевтическую промышленность и производство расходных
материалов для нее, занимает
второе место после сельского хозяйства по объемам выбросов
углекислого газа в атмосферу. Не
берусь комментировать аспекты
фарминдустрии, но рациональное и рачительное использование
электричества и расходных материалов в нашей работе – важный
резерв снижения нагрузки на
природу. Наши новые диагностические технологии, операционные, новые, большего размера
больничные корпуса потребляют все больше электроэнергии.
Но всегда ли мы рационально
используем еe? Не думаю, часто
видя светящиеся больничные
корпуса в ночное время. Как мы
утилизируем наши расходные
материалы? Какое их количество
идет в повторную переработку?
Есть ли план и его реализация
при реконструкции и ремонте
рабочих помещений по использованию энергосберегающих технологий и материалов? Есть ли
возможность использования возобновляемой энергии для работы
учреждения, особенно в южных
регионах страны? А как на бытовом уровне мы и наши дети пытаемся помочь планете, уменьшив
ее загрязнение?
Правительства многих стран начали осознавать серьезность
угрозы. Но политики зажаты
между необходимостью решения
сиюминутных задач по развитию
экономики и поддержанию уровня жизни населения и принятием
мер, направленных на предотвращение дальнейшего ухудшения
климата. Поэтому их решения
всегда половинчаты и часто отложены на будущее. В этих условиях не менее важно, чтобы опасность глобального потепления и
загрязнения окружающей среды
осознали мы, рядовые жители
этой планеты. И каждый из нас
мог бы внести свой вклад в эту
борьбу на рабочем месте и дома,
который, будучи умноженным на
численность населения планеты,
стал бы заметным подспорьем в
общем деле. Уверен, что уже завтра каждый из нас может уменьшить свои потребности на 10% в
расходовании энергии, вовремя
выключив горящую без надобности лампочку, в различного
рода материалах в процессе своей
работы, в продуктах питания и
одежде, не отказавшись от них, а
лишь рационально и бережно их
используя. Организация раздельного сбора и утилизации мусора
должна быть нормой жизни для
каждой семьи. Все эти меры, в отличие от действий правительств,
могут дать осязаемый результат в
ближайшей перспективе. Теперь
это и наша борьба: чем раньше
мы начнем ее, тем меньший шанс
проиграть получим. А пока –
проигрываем…

ВОЗМОЖНО, САМОЕ ВАЖНОЕ ИССЛЕДОВАНИЕ 2021 ГОДА (КАК МИНИМУМ, САМОЕ ОЖИДАЕМОЕ И ИНТЕРЕСНОЕ)
Авторы: Жуков Николай Владимирович
ФГБУ «НМИЦ Детской гематологии, онкологии и иммунологии им. Д. Рогачева», Москва
Жукова Людмила Григорьевна
«Московский клинический научный центр им. А.С. Логинова ДЗМ», Москва
2021 год был богат на ожидаемые (и не очень) результаты клинических исследований и события в онкологическом мире, и именно поэтому выбрать из них что-то наиболее важное было очень непросто. Но, как нам кажется, результаты исследования DREAMseq, посвященного, казалось бы, чисто практическому вопросу (выбору оптимальной последовательности лечебных опций у больных BRAF-мутированной меланомой), делают это исследование одним из самых важных событий уходящего 2021 года. Все дело в том, что это не просто исследование о последовательности терапии – это прямое сопоставление двух «революционных» платформ лечения – иммунотерапии и таргетной терапии. Ведь несмотря на то, что уже достаточно долго постулируется принципиальное различие таргетной терапии (ТТ) и иммуноонкологических препаратов (ИО), заключающееся в паллиативном действии первых и, возможно, излечивающем (хотя бы для части пациентов) действии вторых, прямого подтверждения этому не было. А в связи с этим не было и единого мнения о том, какой из вариантов лечения является предпочтительным, так как при непрямом сравнении результаты обоих подходов выглядели «достойно» и вполне сопоставимо. В исследование было включено 265 пациентов, имеющих распространенную меланому с мутацией BRAF V600E, ранее не получавших системного лечения (за исключением адъювантной терапии интерфероном). Большинство пациентов (около 90%) имели стадию M1, у 40% включенных больных был повышен уровень ЛДГ, при этом стадию M1c имели около 60%, у 30% статус по ECOG был равен 1. Больные рандомизировались 1:1 на получение в качестве первичного лечения комбинации ипилимумаб (3 мг/кг)/ниволумаб (1 мг/кг) 4 введения за 12 недель, с последующей поддерживающей терапией ниволумабом (3 мг/кг) каждые 2 недели (максимально 72 недели) или терапию дабрафениб/траметиниб в стандартном режиме до прогрессирования или непереносимой токсичности. В случае прогрессирования предусматривался «перекрест» – пациенты переходили на вариант терапии, предусмотренный для другой группы. Инициальная терапия сопровождалась практически одинаковой частотой достижения ремиссий – 46% в группе, получавшей ИО препараты, и 43% в группе, начавшей ТТ. Однако во второй линии, после перекреста, частота достижения объективного ответа на ИО препараты была ниже – 30% против 48% для ТТ. Это оказалось единственным показателем эффективности, где ИО «проиграла» ТТ. Более того, отчасти это также подтверждало «суммарный» вывод исследования – начинать у этих пациентов следует с ИО препаратов (т.к. непосредственная эффективность их во 2 линии оказывается ниже, чем у ТТ, а в первой линии она сопоставима). При этом, несмотря на одинаковую частоту достижения ремиссий в первой линии терапии, длительность ответа на лечение была значимо выше у больных, получающих ИО препараты (медиана не достигнута против 12,7 месяца в группе ТТ, р<0,001; рис.1).
Рисунок 1.
Продолжительность ответа на терапию (1 линия).
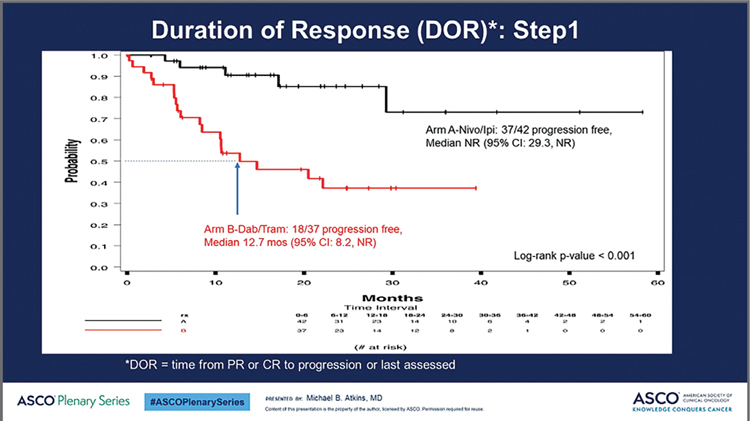
Несмотря на относительно небольшое число больных в группах, достигших объективного эффекта (42 в группе ИО и 37 в группе ТТ), это первое прямое сравнение, свидетельствующее о явном преимуществе ИО препаратов в отношении длительности эффекта при лечении диссеминированной меланомы, а длительное сохранение «плато» свидетельствует о том, что для части пациентов, скорее всего, речь действительно может идти о пожизненном эффекте (а в лучшем случае – об излечении). Выживаемость без прогрессирования также оказалась (хотя и не статистически значимо, р=0,054) выше в группе ИО препаратов. За счет более «позднего» расхождения кривых медианы выживаемости различались не очень впечатляюще – 8,8 месяца для ТТ против 12,8 месяца для ИО, однако двухлетняя ВБП различалась вдвое, составив 19% против 42% соответственно. Но основным результатом исследования, безусловно, является значимое различие в общей выживаемости. Абсолютное преимущество в 2-летней общей выживаемости группы, начавшей терапию с ИО препаратов, составило 20%: 72% против 52% при старте с ТТ (р=0,0094; рис.2).
Рисунок 2.
Показатели общей выживаемости при использовании ТТ и ИО на старте.
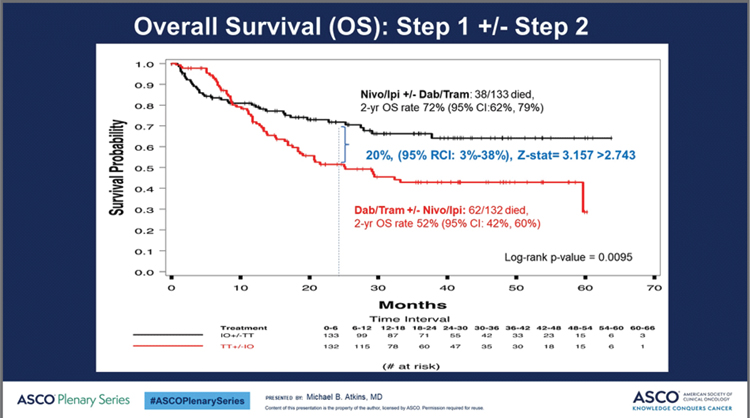
Авторы особо обратили внимание на наличие «перекреста» кривых общей выживаемости, когда в первые 10 месяцев кривая ТТ находилась выше, чем ИО кривая. Отчасти это ожидаемая ситуация, связанная со скоростью (а не вероятностью) развития эффекта от ИО и ТТ, что и подтвердилось при анализе данных – большинство пациентов, погибших в первые 10 месяцев терапии ИО препаратами, имели быстро прогрессирующие опухоли, т.к. ни один не успел получить 2 линию лечения. Второй причиной являлась ранняя и, хотя и не смертельная, но препятствующая продолжению любого лечения токсичность ИО препаратов (хорошо известная для комбинации, предусматривающей введение ипилимумаба в дозе 3 мг/кг). Медиана длительности терапии 24 больных, погибших в первые 10 месяцев от начала лечения в группе ИО препаратов, составила менее 6 недель (т.е. пациенты успели получить лишь 1-2 введения препаратов). К сожалению, выделить подгруппу пациентов, имеющих высокий риск ранней смерти на фоне ИО препаратов, не удалось – для риска ранней тяжелой токсичности это вряд ли вообще возможно, в отношении раннего прогрессирования суммарные результаты лечения оказались выше в группе ИО препаратов вне зависимости от пола, возраста, распространенности заболевания, уровня ЛДГ, статуса по ECOG. Однако даже принимая во внимание этот риск ранней неудачи, суммарный эффект оказался впечатляющим: старт с ИО позволял дополнительно каждому 5-му пациенту пережить 2-летний рубеж, а формирование «плато» кривой ОВ группы, получавшей ИО препараты, свидетельствует о том, что этот выигрыш сохранится и при увеличении срока наблюдения. Подобный выигрыш с нашей точки зрения полностью оправдывает начало лечения этих пациентов именно с комбинированной ИО терапии, хотя и требует дополнительных усилий по выявлению популяции пациентов, для которых, возможно, необходимо временное назначение ТТ с последующим переходом на ИО препараты до прогрессирования или использование комбинации ИО + ТТ. А что же по поводу теоретического вопроса о принципиальном различии действия ИО и ТТ (в отношении излечения)? С нашей точки зрения, кривые длительности эффекта дают обоснованную надежду на то, что так оно и есть. Однако, безусловно, для однозначного суждения необходим больший срок наблюдения. В отношении же общей выживаемости – скорее всего, имеет место суммация различных причин. Здесь речь идет не только о том, что для части больных ИО оказались эффективней при использовании в качестве инициального лечения, но и о том, что при прогрессии ситуация меняется с точностью до наоборот – ТТ за счет более быстрого противоопухолевого эффекта в состоянии «подхватить» пациента, дав ему пусть и паллиативный, но длительный эффект, в то время как ИО препараты при использовании у пациентов, уже получивших ТТ, гораздо менее эффективны. Что дает это исследование для клинициста? В первую очередь, уверенность в выборе в пользу начала терапии с комбинированной ИО у пациентов с BRAFмутированной меланомой за исключением ситуации, требующей быстрого противоопухолевого эффекта (аналог «висцерального криза», описанного для рака молочной железы). Но и в случае начала с ТТ переключение на ИО не по факту прогрессирования болезни (медиана времени до прогрессирования 8-9 месяцев), а намного раньше, после купирования признаков «висцерального» криза. Дополнительно возникает вопрос о выборе варианта инициальной терапии у пациентов, ранее получавших ТТ в адъювантном режиме, а также сроке безрецидивного промежутка, позволяющего ожидать ответ на ТТ, назначаемую уже при распространенной болезни. Нам еще только предстоит ответить на этот и многие другие вопросы. Результаты исследования DREAMseq (NCT02224781) – это первый, пусть пока еще и очень маленький, но серьезный шаг к формированию новых принципов терапии пациентов с BRAFмутированной меланомой, позволяющий изменить судьбу пусть пока и части, но уже значимой, больных с абсолютно фатальным ранее заболеванием.
Источник:
Michael B. Atkins, Sandra J.
Lee, Bartosz Chmielowski, et al.
DREAMseq (Doublet, Randomized
Evaluation in Advanced Melanoma
Sequencing): A phase III trial –
ECOG-ACRIN EA6134. J Clin Oncol.
2021; 39 (suppl 36; abstr 356154)
НАИБОЛЕЕ ЗНАЧИМЫЕ ИССЛЕДОВАНИЯ ПО ЛЕЧЕНИЮ ОПУХОЛЕЙ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА В 2021 ГОДУ
Автор: Федянин Михаил Юрьевич
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
Каждый год результаты сотен исследований транслируются с трибун, а сейчас с электронных площадок мировых онкологических конгрессов. И все большее их число рекомендуют применять новые технологии, в первую очередь иммунотерапевтической направленности, у всех пациентов без привязки к биомаркерам, а иногда и без учета клинической ситуации. Однако при опухолях желудочного кишечного тракта всегда была своя специфика в отношении эффективности иммунотерапии – либо она вообще не работала, либо работала в определенных подгруппах. И если мы делаем акцент на опухолях желудочно-кишечного тракта, то в 2021 году наиболее значимые работы касались только 3 нозологий: рак пищевода, рак желудка и гепатоцеллюлярный рак. Давайте посмотрим, что приведет к изменению рекомендаций к 2022 году по результатам исследований 2021 года и какова специфика назначения иммунотерапии при данных заболеваниях.
Рак пищевода
К 2021 году устоявшимися стандартом ведения больных II/III стадий плоскоклеточного рака пищевода явилось проведение химиолучевого лечения с последующим хирургическим пособием, что по результатам исследования CROSS определяет показатели одногодичной выживаемости без прогрессирования на уровне 55%, а показатели 10-летней общей выживаемости – 38%; в группе аденокарцином значимых различий в общей выживаемости не достигнуто в сравнении только с хирургией [1]. Проведение же адъювантной терапии не улучшает результатов выживаемости после комбинированного лечения [2]. Ситуация поменялась после публикации в 2021 году результатов исследования CheckMate 577, в котором 794 пациента с II/III стадией рака пищевода после завершения предоперационного химиолучевого лечения и хирургии, при R0 резекции и с наличием резидуальной опухоли в гистологическом заключении, в течение 4-16 недель после операции были рандомизированы в группу года терапии ниволумабом или плацебо. Авторам удалось улучшить первичный критерий эффективности – медиану выживаемости без признаков болезни в группе ниволумаба, которая составила 22,4 месяца против 11 месяцев в группе плацебо (ОР 0,69; 95% ДИ 0,56-0,86; р=0,0003). При этом улучшение выживаемости наблюдалось независимо от экспрессии PDL на опухолевых клетках и гистотипа опухоли. Следует отметить, что плоскоклеточный рак был только у 29% пациентов в исследовании [3]. И если для плоскоклеточного рака полученные результаты действительно поменяют клиническую практику даже еще до публикации данных по общей выживаемости, то для аденокарциномы пищевода данный подход скорее спорен, так как выше уже отмечено, что проведение предоперационной химиолучевой терапии не улучшает показатели общей выживаемости в данной группе пациентов, и это, принимая во внимание результаты исследования NEO-AEGIS, разрешает нам вести таких пациентов также, как и больных с аденокарциномой желудка. В работе NEO-AEGIS исследователи хотели доказать, что периоперационная химиотерапия по схеме EOX или FLOT при аденокарциномах пищевода и желудочно-пищеводного перехода позволяет достичь равных трехлетних показателей общей выживаемости в сравнении с комбинированным подходом (химиолучевая терапия с последующей хирургией). Рандомизировав 377 пациентов, исследователи показали лучший непосредственный эффект предоперационной химиолучевой терапии в отношении частоты R0 резекций, большей частоты показателя ypN0 и снижения патоморфологической стадии заболевания, но показатели 3-летней общей выживаемости оказались сопоставимы и составили 57% в группе периоперационной химиотерапии и 56% в группе предоперационного химиолучевого лечения (ОР 1,02). В связи с этим исследование было досрочно прекращено [4]. При метастатическом раке пищевода в копилке исследований по эффективности добавления к химиотерапии анти-PD1 антител за 2021 год добавилось еще 4 работы. Ранее было показано, что добавление пембролизумаба к комбинации цисплатина и фторурацила значимо увеличивает выживаемость без прогрессирования (ОР 0,51; 95% ДИ 0,41-0,65; p<0,0001) и общую выживаемость (ОР 0,57; 95% ДИ 0,43-0,75; р<0,0001) в группе с PDL экспрессией CPS≥10 [5]. Результаты еще 4 исследований представлены в таблице.
Таблица.
Результаты рандомизированных исследований III фазы по изучению комбинации
анти-PD1 антител и химиотерапии при раке пищевода..
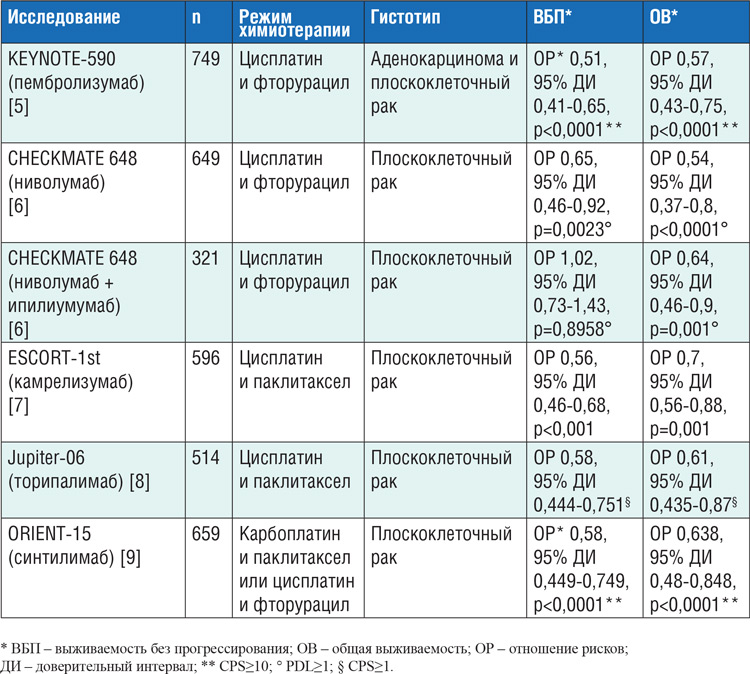
Основные выводы из данных исследований, которые мы может сделать: добавление иммунотерапии к химиотерапии при раке пищевода значимо улучшает выживаемость без прогрессирования и общую выживаемость, преимущественно при плоскоклеточном гистотипе и высокой экспрессии PDL в опухоли (CPS≥10) и, видимо, независимо от химиотерапевтического компонента – будь то цисплатин с фторурацилом, паклитаксел с цисплатином или паклитаксел с карбоплатином; самостоятельная комбинации ипилимумаба и ниволумаба противоречива – не увеличивается выживаемость без прогрессирования, но улучшается общая выживаемость. В 2021 году появились дополнительные данные по выбору химиотерапии во второй и последующих линиях плоскоклеточного рака пищевода. В частности, если пациенту не проводилась ранее терапия таксанами, то при сравнении в рамках II рандомизированной фазы исследования (OGSG1201) доцетаксела с режимом введения 1 раз в 3 недели и еженедельного режима введения паклитаксела последний улучшил медианы выживаемости прогрессирования (2,1 против 4,4 месяца, ОР 0,49; 95% ДИ 0,3-0,78; р=0,002) и общей выживаемости (7,3 против 8,8 месяца, ОР 0,62; 95% ДИ 0,38-0,99; р=0,047) [10]. Таким образом, вариант введения паклитаксела 100 мг/м2 в/в капельно в 1, 8, 15, 21, 36 дни 1 раз в 49 дней можно рассматривать как вариант выбора терапии 2 линии после проведения или невозможности назначения иммунотерапии.
Рак желудка
При распространенном раке желудка наиболее ожидаемыми, особенно в хирургических кругах, были результаты рандомизированного исследования по применению внтурибрюшинной гипертермической химиоперфузии вместе с системной химиотерапией при синхронном изолированном поражении метастазами брюшины – GASTRIPEC-1. Всем пациентам проводилась периоперационная химиотерапия по схеме EOX (эпирубицин, оксалиплатин и капецитабин) в объеме 6 курсов, после 3 курсов выполнялась циторедуктивная операция, но в одной из групп проводился HIPEC с цисплатином и митомицином. И хотя исследование было досрочно прекращено по причине медленного набора после рандомизации 105 пациентов, авторам не удалось улучшить общую выживаемость при добавлении HIPEC, которая являлась основным критерием эффективности (медианы в сравниваемых группах составили 14,9 месяца, р=0,1647). Однако выживаемость без прогрессирования была значимо выше в группе HIPEC и составила 7,1 против 3,5 месяца без HIPEC (p=0,0472) [11]. Вероятно, такие низкие показатели выживаемости без прогрессирования связаны с давностью инициации исследования, так как современная системная терапия при метастатическом раке желудка определяет медиану данного параметра на уровне 6 месяцев, а при добавлении иммунотерапии – 7,7 месяца. Последнее замечание особенно актуально, так как с конца 2020 года стандарты выбора первой линии диссеминированного рака желудка изменились. Так, по результатам исследования CheckMate 649, добавление ниволумаба к химиотерапии по схеме XELOX или FOLFOX в первой линии значимо улучшило и выживаемость без прогрессирования и общую выживаемость [12]. Исследователи не остановились и уже в 2021 году представили поданализ эффективности комбинации в зависимости от уровня экспрессии PDL. Улучшение и выживаемости без прогрессирования, и общей выживаемости наблюдалось только в группе пациентов с экспрессией PDL в опухоли CPS≥5. При экспрессии менее 5 показали выживаемости не различались: медиана выживаемости без прогрессирования в группе иммунотерапии составила 12,4 месяца против 12,3 месяца в группе только химиотерапии (ОР 0,94), медиана общей выживаемости – 7,5 месяца против 8,2 месяца только химиотерапии соответственно (ОР 0,93) [13]. На конференции ESMO 2021 были доложены результаты эффективности 3 рукава данного исследования – по применению комбинации ипилимумаба и ниволумаба в самостоятельном варианте лечения в первой линии терапии. К сожалению, комбинированная иммунотерапия ухудшала выживаемость без прогрессирования даже в когорте с экспрессией PDL CPS≥5 (медиана в группе иммунотерапии составила 2,8 месяца против 6,3 месяца в группе химиотерапии [ОР 1,42; 95% ДИ 1,14-1,71]), без влияния на показатели общей выживаемости (11,2 против 11,6 месяца соответственно [ОР 0,89; 95% ДИ 0,71-1,1; р=0,2302]) [14]. Эффективность сочетания антиPD1 антител с режимами XELOX подтвердилось и в рандомизированном исследовании III фазы ORIENT-16, в котором применялся препарат синтилимаб. В группе пациентов с экспрессией PDL CPS≥5 авторы работы показали увеличение медианы выживаемости без прогрессирования в группе иммунохимиотерапии до 7,7 месяца против 5,8 месяца в группе только химиотерапии (ОР 0,628; 95% ДИ 0,489-0,805; р=0,0002) и общей выживаемости до 18,4 месяца против 12,9 месяца соответственно (ОР 0,66; 95% ДИ 0,505-0,864; р=0,0023). И хотя авторы улучшили эти показатели эффективности и во всей группе пациентов, без привязки с экспрессии PDL, они не представили показатели выживаемости при низкой экспрессии данного биомаркера [15]. Перечисленные исследования при раке желудка касались популяции больных с отсутствием гиперэкспрессии HER2/neu в опухоли. И роль иммунотерапии в данной подгруппе пациентов до настоящего времени не была изучена. Лишь в 2021 году были представлены предварительные данные по эффективности комбинации пембролизумаба, трастузумаба и химиотерапии (цисплатин со фторурацилом или оксалиплатин со фторпиримидинами – на выбор исследователя) в сравнении с химиотерапией и трастузумабом в первой линии терапии HER2- позитивного диссеминированного рака желудка в рамках рандомизированного исследования III фазы KEYNOTE-811. Авторы работы показали, что добавление пембролизумаба к стандартному режиму системного лечения значимо увеличивает частоту объективных эффектов до 74,4% против 51,9% в группе контроля (р=0,00006). При этом медианы длительности эффекта терапии не различались в сравниваемых группах и составили 10,6 и 9,5 месяца соответственно [16]. Несмотря на отсутствие данных по выживаемости, полученные значения были достаточны, чтобы Управление по контролю качества пищевых продуктов и лекарственных средств США (FDA) зарегистрировало в отношении пембролизумаба данное показание [17]. Таким образом, для рака желудка можно считать стандартным подходом применение иммунотерапии вместе с оксалиплатин-содержащей химиотерапией в первой линии лечения при высокой экспрессии PDL в опухоли и, вероятно, независимо от экспрессии HER2/neu в опухоли.
Гепатоцеллюлярный рак
В 2019 году стандарты терапии первой линии распространенного гепатоцеллюлярного рака изменились. В исследовании IMbrave 150 комбинация атезолизумаба и бевацизумаба значимо увеличила частоту объективных эффектов, выживаемость без прогрессирования и общую выживаемость в сравнении с сорафенибом [18]. При этом медиана общей выживаемости в группе иммунотаргетного лечения в первой линии составляет в настоящее время 19,2 месяца [20]. Однако большие надежды были в отношении комбинации ингибиторов иммунных контрольных точек и мультитирозинкиназных ингибиторов, которые в отличие от бевацизумаба должны кроме антиангиогенного оказывать и прямое противоопухолевое действие. В 2021 году на конгрессе ESMO-ASIA были представлены результаты рандомизированного исследования III фазы по сравнению комбинации кабозантиниба и атезолизумаба против сорафениба в первой линии распространенного гепатоцеллюлярного рака (COSMIC-312). Рандомизировав 649 пациентов в отношении 2 к 1 соответственно, исследователям удалось улучшить медиану выживаемости без прогрессирования до 6,8 месяца в группе комбинации против 4,2 месяца в группе сорафениба (ОР 0,63; 95% ДИ 0,44-0,91; р=0,0012). Однако медианы общей выживаемости значимо не различались между группами: 15,4 против 15,5 месяца соответственно (ОР 0,9; 95% ДИ 0,69-1,18; р=0,438). Может это было связано с тем, что длительность наблюдения за пациентами еще небольшая и представлены данные промежуточного анализа, а может быть, что более вероятно, в группе сорафениба вторую и последующую эффективные линии терапии, включая и иммунотерапию, получало большее число пациентов, о чем свидетельствует беспрецедентно высокая медиана общей выживаемости в группе контроля. А так как в данном исследовании было два первичных критерия эффективности (выживаемость без прогрессирования и общая выживаемость), и при неэффективности одного из них исследование считается негативным, то атезолизумаб с бевацизумабом остался стандартом первой линии. В исследовании был еще один рукав, в котором проводилась монотерапия кабозантинибом в первой линии (n=188). В сравнении с сорафенибом применение кабозантиниба привело к незначимому увеличению медианы выживаемости без прогрессирования с 4,3 до 5,8 месяца (ОР 0,71; 95% ДИ 0,51-1,01; р=0,0107, при этом было запланировано для промежуточного анализа 0,00451); частота объективных эффектов была сопоставима в сравниваемых группах (11,2% в группе комбинации, 6,4% в группе кабозантиниба и 3,7% в группе сорафениба) [20]. Еще одним направлением в терапии распространенного гепатоцеллюлярного рака является комбинирование анти-PD(L)1 и анти-CTLA4 антител. Напомним, что в прошлом году FDA уже зарегистрировало комбинацию ниволумаба и ипилимумамба во второй линии терапии гепатоцеллюлярного рака по результатам II фазы исследования [21]. В октябре же 2021 года были сообщено о положительных результатах рандомизированного исследования III фазы HIMALAYA, в котором среди пациентов с распространенных гепатоцеллюлярным раком без возможности проведения локального лечения в первой линии терапии проводилось сравнение общей выживаемости в четырех рукавах: сорафениб, дурвалумаб (анти-PDL1 антитела), комбинация тремелимумаба (анти-CTLA4 антитела) и дурвалумаба и аналогичная комбинация только с 1 дозой тремелимумаба, авторы назвали последний режим – STRIDE (Single Tremelimumab Regular Interval Durvalumab). Именно последний режим и определил выигрыш в общей выживаемости при приемлемой переносимости; а монотерапия дурвалумабом оказалась не менее эффективна в сравнении с сорафенибом. Однако никаких цифровых значений в сообщении не приводится [22]. Следовательно, после публикации результатов лечения, вероятно, уже в 2022 году, у нас может появиться еще один вариант первой линии терапии. Таким образом, в перечисленных трех нозологиях действительно наметился прорыв, и в первую очередь он обусловлен включением иммунотерапии в первую линию лечения. Пример плоскоклеточного рака пищевода является отражением того, что иммунотерапия пойдет дальше в неоадъювантное и адъювантное назначение при резектабельных стадиях опухолей желудочного кишечного тракта – но это уже история для 2022 года.
Список литературы:
1. Eyck BM, van Lanschot JJB, Hulshof MCCM, et al. Ten-year outcome of neoadjuvant chemoradiotherapy plus surgery for esophageal cancer: The randomized controlled CROSS trial. J Clin Oncol. 2021 Jun 20; 39(18): 1995- 2004. doi: 10.1200/JCO.20.03614.
2. Xiao X, Hong HG, Zeng X, et al. The efficacy of neoadjuvant versus adjuvant therapy for resectable esophageal cancer patients: A systematic review and meta-analysis. World J Surg. 2020 Dec; 44(12): 4161-4174. doi: 10.1007/s00268-020- 05721-w.
3. Kelly RJ, Ajani JA, Kuzdzal J, Zander T, Van Cutsem E, Piessen G, et al. Adjuvant nivolumab (NIVO) in resected esophageal or gastroesophageal junction cancer (EC/GEJC) following neoadjuvant chemoradiotherapy (CRT): expanded efficacy and safety analyses from Check-Mate 577. J Clin Oncol. 2021; 39 (suppl 15): 4003.
4. Reynolds JV, Preston SR, O’Neill B, et al. Neo-AEGIS (neoadjuvant trial in adenocarcinoma of the esophagus and esophago-gastric junction international study): preliminary results of phase IIIRCT of CROSS versus perioperative chemotherapy (modified MAGIC or FLOT protocol). (NCT01726452). J Clin Oncol. 2021; 39 (suppl 15): 4004.
5. Sun J-M, Shen L, Shah MA, et al. Pembrolizumab plus chemotherapy versus chemotherapy alone for first-line treatment of advanced oesophageal cancer (KEYNOTE-590): a randomised, placebo-controlled, phase 3 study. Lancet. 2021 Aug 28; 398(10302): 759-771. doi: 10.1016/ S0140-6736(21)01234-4.
6. Chau I, Doki Y, Ajani JA, et al. Nivolumab (NIVO) plus ipilimumab (IPI) or NIVO plus chemotherapy (chemo) versus chemo as first-line (1L) treatment for advanced esophageal squamous cell carcinoma (ESCC): First results of the CheckMate 648 study. J Clin Oncol. 2021; 39 (suppl 15); abstr. LBA4001. doi: 10.1200/ JCO.2021.39.15_suppl.LBA4001.
7. Luo H, Lu J, Ba Y, et al. Effect of camrelizumab vs placebo added to chemotherapy on survival and progression-free survival in patients with advanced or metastatic esophageal squamous cell carcinoma: The ESCORT-1st randomized clinical trial. JAMA. 2021 Sep 14; 326(10): 916- 925. doi: 10.1001/jama.2021.12836.
8. Xu R, Wang F, Cu C, et al. JUPITER-06: A randomized, doubleblind, phase III study of toripalimab versus placebo in combination with first-line chemotherapy for treatment naive advanced or metastatic esophageal squamous cell carcinoma (ESCC). Annals of Oncology. 2021; 32 (suppl_5): S1040-S1075. 10.1016/ annonc/annonc708.
9. Shen L, Lu Z, Wang J, et al. Sintilimab plus chemotherapy versus chemotherapy as first-line therapy in patients with advanced or metastatic esophageal squamous cell cancer: First results of the phase III ORIENT-15 study. Annals of Oncology. 2021; 32 (suppl_5): S1283-S1346. 10.1016/ annonc/annonc741.
10.Hara H, Yamamoto S, Kii T, et al. Randomized phase II study comparing docetaxel vs paclitaxel in patients with esophageal squamous cell carcinoma who are refractory to fluoropyrimidine and platinumbased chemotherapy: OGSG1201. Annals of Oncology. 2021; 32 (suppl_5): S1040-S1075. 10.1016/ annonc/annonc708.
11.Rau B, Lang H, Königsrainer A, et al. The effect of hyperthermic intraperitoneal chemotherapy (HIPEC) upon cytoreductive surgery (CRS) in gastric cancer (GC) with synchronous peritoneal metastasis (PM): A randomized multicentre phase III trial (GASTRIPEC-Itrial). Annals of Oncology. 2021; 32 (suppl_5): S1040-S1075. 10.1016/ annonc/annonc708.
12.Janjigian YY, Shitara K, Moehler M, et al. First-line nivolumab plus chemotherapy versus chemotherapy alone for advanced gastric, gastro-oesophageal junction, and oesophageal adenocarcinoma (CheckMate 649): a randomised, open-label, phase 3 trial. Lancet. 2021 Jul 3; 398 (10294): 27-40. doi: 10.1016/S0140-6736(21)00797-2.
13.Moehler MH, Shitara K, Garrido M, et al. First-line (1L) nivolumab (NIVO) plus chemotherapy (chemo) versus chemo in advanced gastric cancer/gastroesophageal junction cancer/esophageal adenocarcinoma (GC/GEJC/EAC): Expanded efficacy and safety data from CheckMate 649. J Clin Oncol. 2021; 39 (suppl 15); abstr. 4002. doi: 10.1200/JCO.2021.39.15_ suppl.4002.
14.Janjigian YY, Ajani JA, Moehler M, et al. Nivolumab (NIVO) plus chemotherapy (Chemo) or ipilimumab (IPI) vs chemo as first-line (1L) treatment for advanced gastric cancer/gastroesophageal junction cancer/esophageal adenocarcinoma (GC/GEJC/EAC): CheckMate 649 study. Annals of Oncology. 2021; 32 (suppl_5): S1283-S1346. 10.1016/ annonc/annonc741.
15.Xu J, Jiang H, Pan Y, et al. Sintilimab plus chemotherapy (chemo) versus chemo as first-line treatment for advanced gastric or gastroesophageal junction (G/GEJ) adenocarcinoma (ORIENT-16): First results of a randomized, double-blind, phase III study. Annals of Oncology. 2021; 32 (suppl_5): S1283-S1346. 10.1016/annonc/annonc741.
16.Janjigian YY, Kawazoe A, Yanez PE, et al. Pembrolizumab plus trastuzumab and chemotherapy for HER2+ metastatic gastric or gastroesophageal junction (G/GEJ) cancer: Initial findings of the global phase 3 KEYNOTE-811 study. J Clin Oncol. 2021; 39 (suppl 15); abstr. 4013. doi: 10.1200/JCO.2021.39.15_ suppl.4013.
17.www.accessdata.fda. gov/drugsatfda_docs/ label/2021/125514s121s122lbl.
18.Finn RS, Qin S, Ikeda M, et al. Atezolizumab plus Bevacizumab in Unresectable Hepatocellular Carcinoma. N Engl J Med. 2020 May 14; 382(20): 1894-1905. doi: 10.1056/ NEJMoa1915745.
19.Finn RS, Qin S, Ikeda M, et al. IMbrave150: Updated overall survival (OS) data from a global, randomized, open-label phase III study of atezolizumab (atezo) + bevacizumab (bev) versus sorafenib (sor) in patients (pts) with unresectable hepatocellular carcinoma (HCC). Journal of oncology. 2021 January 20; 39, no.3_ suppl: 267-267.
20.Kelley RK, Yau T, Cheng A-L, et al. Cabozantinib (C) plus atezolizumab (A) versus sorafenib (S) as first-line systemic treatment for advanced hepatocellular carcinoma (aHCC): Results from the randomized phase III COSMIC-312 trial. ABSTRACT VP10-2021.
21.Yau T, Kang Y-K, Kim T-Y, et al. Efficacy and safety of nivolumab plus ipilimumab in patients with advanced hepatocellular carcinoma previously treated with sorafenib: The CheckMate 040 randomized clinical trial. JAMA Oncol. 2020 Nov 1; 6(11): e204564. doi: 10.1001/ jamaoncol.2020.4564.
22.Imfinzi plus tremelimumab
significantly improved overall
survival in HIMALAYA Phase III
trial in 1st-line unresectable liver
cancer (astrazeneca.com).
ВРЕМЯ ПОДВОДИТЬ ИТОГИ 2021. КАКИЕ 3 СОБЫТИЯ В ТЕРАПИИ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ Я СЧИТАЮ НАИБОЛЕЕ ВАЖНЫМИ В УХОДЯЩЕМ ГОДУ
Автор: Глазкова Елена Владимировна
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, кандидат медицинских наук, Москва
Прошедший год стал первым шагом к возвращению к «допандемийной» жизни, и большинство конгрессов, несмотря на заочный формат, порадовали нас новостями, способными изменить нашу практику уже в ближайшем 2022 году.
Отдаленные результаты исследования BrighTNess
Вклад добавления велипариба к комбинации паклитаксела и карбоплатина в неоадъювантной терапии тройного негативного рака молочной железы (РМЖ) хорошо известен нам с 2018 года [1]. В этом исследовании рандомизация пациенток осуществлялась на группы монотерапии паклитакселом, комбинации паклитаксела и карбоплатина, а также комбинации паклитаксела, карбоплатина и велипариба. Всем пациенткам была проведена терапия по схеме АС в стандартном или дозоуплотненном режиме. Первичной конечной точкой исследования являлась частота достижения полной патоморфологической регрессии (пПР). Частота достижения пПР в группе терапии паклитакселом составила 31%, при применении комбинации паклитаксела и карбоплатина – 53%, а в группе комбинации с велипарибом – 58%. Дизайн исследования не предполагал прямого сравнения в частоте достижения пПР между группами терапии паклитакселом и паклитаксела с карбоплатином, в связи с чем, несмотря на очевидность полученных различий, сделать аргументированный вывод о важности препаратов платины в режимах неоадъювантной терапии тройного негативного рака молочной железы мы не могли. На конгрессе ESMO 2021 были представлены результаты 4-летнего наблюдения за данными пациентками (рис.1) [2].
Рисунок 1.
Бессобытийная выживаемость в исследовании
BrighTNess [2].
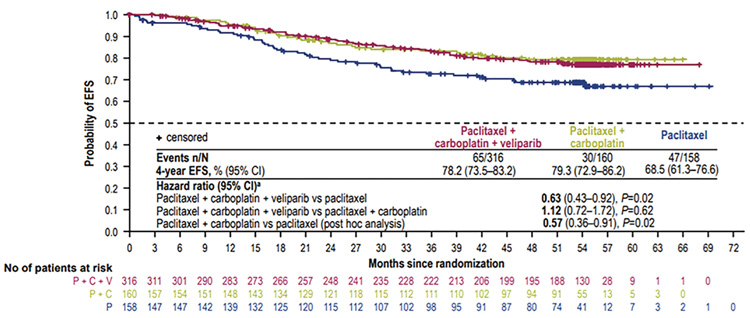
Четырехлетняя бессобытийная выживаемость в группе пациенток, получивших терапию комбинацией паклитаксела, карбоплатина и велипариба, составила 78,2%, а в группе больных, получивших карбоплатин и паклитаксел, – 79,3%, в группе монотерапии паклитакселом – 68,5% (р=0,02). Достоверных различий в общей выживаемости получено не было, что связано с недостаточным сроком наблюдения.
В конце 2021 года мы можем уверенно говорить, что добавление препаратов платины не только увеличивает шанс на достижение пПР при тройном негативном раке молочной железы, но и оказывает значимое влияние на отдаленные результаты лечения данной группы больных. Хочется верить, что в новом году препараты платины займут более уверенное место в неоадъювантной терапии тройного негативного РМЖ.
Исследование OlympiA
Продолжая тему терапии раннего РМЖ нельзя не вспомнить о результатах исследования OlympiA, представленного на конгрессе ASCO 2021 [3]. В данном исследовании была изучена эффективность адъювантной терапии олапарибом у пациенток с BRCAассоциированным РМЖ (тройным негативным и РЭ+ HER2-). В исследовании приняли участие 1836 пациенток, которые после завершения запланированного объема неоадъювантной или адъювантной химиотерапии были рандомизированы на группы терапии олапарибом 300 мг 2 р/сут. или плацебо. Исследуемая терапия проводилась в течение 2 лет. В данном исследовании было показано, что проведение адъювантной терапии олапарибом позволяет при 3-летнем наблюдении достоверно снизить риск отдаленного метастазирования на 7,1% (3-летняя выживаемость без отдаленных метастазов в группе олапариба 87,1% против 80,5% в группе плацебо, р<0,001). Кроме того, к 3 годам наблюдения были получены достоверные различия в общей выживаемости (3-летняя ОВ в группе олапариба составила 92,0% против 88,3% в группе плацебо, р=0,02). Однако при подгрупповом анализе было показано, что для пациенток, получивших платиносодержащий режим неоадъювантной терапии, достоверных преимуществ в бессобытийной выживаемости при назначении олапариба не получено. В свете обновленных результатов исследования BrighTNess, несомненно, важность адъювантного назначения олапариба несколько меркнет, но данная опция терапии уже входит в клинические рекомендации, и в 2022-м мы сможем применять ее в своей практике.
Исследование Destiny-Breast03
Исследование Destiny-Breast03 [4], представленное на конгрессе ESMO 2021, имеет шансы изменить стандарт 2 линии терапии HER2-позитивного рака молочной железы. Трастузумаб дерукстекан является новым конъюгатом цитостатик-антитело и ранее показал свою эффективность в терапии HER2-позитивного РМЖ после исчерпания стандартных опций анти-HER2 терапии. В исследовании Destiny-Breast03 приняли участие 524 пациентки с диссеминированным HER2- позитивным РМЖ после прогрессирования на стандартной терапии 1-2 линии. Пациентки были рандомизированы на группы терапии трастузумабом эмтанзином (T-DM1) 3,6 мг/кг 1 раз в 21 день и трастузумабом дерукстеканом (T-DXd) 5,4 мг/кг 1 раз в 21 день в соотношении 1:1. Первичной конечной точкой исследования являлась БРВ при независимом центральном пересмотре. К 12 месяцам БРВ в группе терапии T-DXd составила 75,8% против 34,1% в группе терапии T-DM1 (рис.2).
Рисунок 2.
Исследование Destiny-Breast03 БРВ при независимом пересмотре [4].
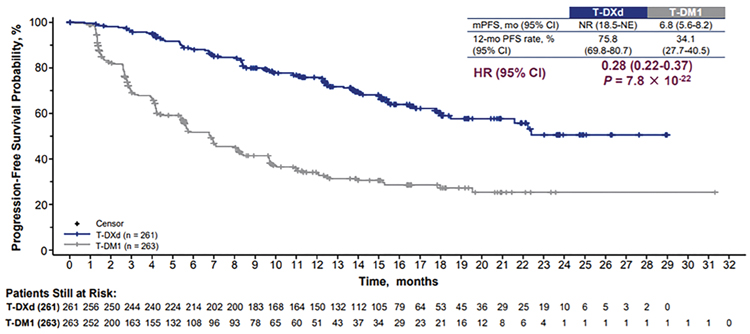
Данные по ОВ незрелые ввиду малого числа событий. Применение трастузумаба дерукстекана оказалось значительно более токсичным, чем трастузумаб эмтанзин: частота тошноты достигла 72,8% против 27,6%, диареи – 23,7% против 3,8%, алопеции – 36,2% против 2,3%. Частота развития пульмонита на фоне применения T-DXd достигла 10,5% (в 0,8% – 3 степени).
Источники:
1. Loibl S, et al. Addition of the PARPinhibitor veliparib plus carboplatin or carboplatine alone to standard neoadjuvant chemotherapy in triplenegative breast cancer (BrighTNess): a randomized, phase 3 trial. Lancet. 2018; Vol.19; P.497-509.
2. Loibl S, et al. Event-free survival (EFS), overall survival (OS), and safety of adding veliparib (V) plus carboplatin (Cb) or carboplatin alone to neoadjuvant chemotherapy in triple-negative breast cancer (TNBC) after ≥4 years of follow-up: BrighTNess, a randomized Phase 3 trial. ESMO Congress 2021, Abstract 119O.
3. Andrew Tutt, Judy Ellen Garber, Bella Kaufman, et al. OlympiA: A phase III, multicenter, randomized, placebocontrolled trial of adjuvant olaparib after (neo)adjuvant chemotherapy in patients with germline BRCA1/2 mutations and high-risk HER2-negative early breast cancer. J Clin Oncol. 2021; 39 (suppl_15); abstr LBA1.
4. Cortés J, Kim S, Chung W, et al.
Trastuzumab deruxtecan (T-DXd) vs
trastuzumab emtansine (T-DM1) in
patients (Pts) with HER2+ metastatic
breast cancer (mBC): Results of the
randomized phase III DESTINY-Breast03
study. Annals of Oncology. 2021; 32
(suppl_5): S1283-S1346.

РАК ЛЕГКОГО ПО ДАННЫМ ИССЛЕДОВАНИЙ, ПРЕДСТАВЛЕННЫХ НА ESMO 2021 И WLCC 2021: КОРОТКО О САМОМ ВАЖНОМ
Автор: Моисеенко Федор Владимирович
Санкт-Петербургский клинический научнопрактический центр
специализированных видов медицинской помощи, Санкт-Петербург
История вопроса
На протяжении многих лет локализованные опухоли легкого лечили хирургическим методом, который, к сожалению, не приводил к излечению более чем в половине случаев для всех операбельных стадий. В связи с тем, что четыре из пяти рецидивов заболевания сопровождались появлением отдаленных метастазов, основную роль в снижении вероятности рецидива должна была играть системная терапия [1]. До недавнего времени главным методом системного лечения для больных без активирующих мутаций являлась цитотоксическая терапия, которая в силу своей невысокой противоопухолевой активности при НМРЛ позволяла снизить риск рецидива лишь на 7-10% [2]. Интеграция иммунотерапии в алгоритмы паллиативного лечения диссеминированных пациентов и поддерживающей терапии после химиолучевой терапии при местнораспространенном заболевании позволила у части больных достичь существенных показателей выживаемости без прогрессирования, зачастую равносильных излечению от опухолевого процесса [3].
Терапия ингибиторами контрольных точек на раннем этапе
Безусловно, большие надежды возлагаются на терапию ингибиторами контрольных точек на раннем этапе. Первым достижением в этом поле стали результаты исследования IMPower 010, представленные на ASCO 2021 [4]. Впервые была показана возможность улучшения результатов хирургического лечения применением терапии атезолизумабом. На настоящий момент достоверные различия в показателях выживаемости достигнуты для первых двух конечных точек – безрецидивной выживаемости (БРВ) в группе PDL1 позитивных пациентов с II-IIIA стадией и для всех больных со II-IIIA стадиями [5]. В ожидании окончательных результатов исследования и соотношения показателей общей продолжительности жизни между группами, несмотря на однозначную достоверность представленных результатов, сохраняется вопрос о прогностической роли экспрессии PD-L1, продемонстрировавшей существенное влияние на БРВ при внутригрупповом анализе.
Риски рецидива после хирургического лечения
Наряду с исследованием новых возможностей адъювантного лечения существенному переосмыслению подвергается и оценка риска для больных после хирургического лечения. Несмотря на неудовлетворенность результатами только операции, радикальное удаление опухоли все-таки может полностью излечить около 30-40% пациентов, для которых дополнительные системные воздействия, например, цитотоксическая или иммунотерапия, представляют риск непосредственной и отсроченной токсичности [6]. В этому году сразу несколькими группами были представлены данные о прогностическом значении сохранения циркулирующих опухолевых ДНК (цоДНК) на различных – от одной недели до трех месяцев – периодах после операции [7,8]. Так, выживаемость пациентов с определяемой цоДНК была достоверно хуже, независимо от примененного послеоперационного лечения, чем у больных без цоДНК. Вполне возможно, что имплементация этого подхода, впервые апробированного при опухолях толстой кишки, позволит в будущем части больных избежать ненужного периоперационного лечения.
Ингибиторы контрольных точек в предоперационном периоде
С некоторым отставанием развивается альтернативный подход, заключающийся в предоперационном применении ингибиторов контрольных точек. В этом году представлены результаты работы CHECKMATE 816, в которой исследовалась роль 3 циклов химиоиммунотерапии до операции в достижении полного патоморфологического ответа и бессобытийной выживаемости [9]. Представленные результаты патоморфологических регрессов (24,0% против 2,2% в контрольной группе цитостатических препаратов) позволяют крайне позитивно оценивать перспективы этого подхода. Тем не менее, даже невиданный ранее pCR на фоне иммунохимиотерапии далек от 100%, что, по крайней мере, на ближайшее время, определяет целесообразность поиска дополнительных маркеров, которые позволили бы предсказать достижение оптимального эффекта. Как это ни удивительно, но исчезновение цоДНК после окончания системного этапа позволяло предсказать достижение полного патоморфологического ответа [8]. Изменение прогноза для местнораспространенных опухолей Применение иммунотерапии существенно изменило также прогноз для пациентов с местнораспространенными опухолями. Первым в своем классе ингибитором контрольных точек, зарегистрированным для применения в поддерживающем режиме после окончания ХЛТ, стал дурвалумаб. Мы продолжаем получать результаты длительного наблюдения за больными в исследовании PACIFIС [10]. До 4-х лет без прогрессирования заболевания доживают 35% пациентов, а до 5-ти – 33,1% – вполне достаточно, чтобы надеяться на достижение на этом уровне фазы плато. Это подтверждают представленные в 2021 году результаты расширенного доступа к дурвалумабу – PACIFIC-R, также как и работы с аналогичными по механизму действия препаратами, например, сугемалимабом в работе GEMSTONE-301 [11,12]. Результаты расширенного доступа подтверждают выявленные ранее закономерности о меньшей эффективности последовательной химиолучевой терапии, а также о существенном влиянии экспрессии PD-L1 на результаты поддерживающей терапии анти-PD-1/ L1. Не менее значимым представляется и подтверждение меньшей эффективности анти-PD-L1 у больных с активирующими мутациями [13]. Кроме подтверждения выявленных ранее закономерностей, в этом году были представлены также и результаты применения новых препаратов в поддерживающем режиме. Например, комбинации с антиCD73 олеклумабом и антиNK монализумабом с дурвалумабом позволили существенно увеличить время без прогрессирования болезни (исследование COAST [13]).
Новое в иммунотерапии распространенного рака легкого
Переходя к новым данным о системной терапии распространенного заболевания, представленным на ESMO и WCLC, заметим, что основное внимание – как всегда в последние годы – было направлено на применение иммунотерапии. Так, были представлены данные еще одного ингибитора PD-1 – целиплимаба – в группе с высоким уровнем экспрессии PD-L1 (≥50%), который в сравнении с платиносодержащей ХТ показал значительное преимущество как в ВДП, так и в ОВ [14]. Любопытно, что сразу в нескольких работах были представлены результаты тщательного анализа реальной клинической практики [15,16]. Отдельный интерес был сконцентрирован также на группе с высокой экспрессией, поскольку именно она может являться «площадкой» для сравнения моноиммунотерапии и иммунохимиотерапии. В работе, представленной S. Peters [15], из более чем 24 тысяч пациентов было отобрано 520 больных с неплоскоклеточным НМРЛ и высокой экспрессией PD-L1. После проведения процедуры псевдорандомизации, направленной на получение равных по основным прогностическим показателям групп, влияние на ВДП и ОВ иммуно- и иммунохимиотерапии было идентичным. Но подгрупповой анализ выявил существенное преимущество комбинированного режима у больных, никогда не злоупотреблявших табакокурением, что подтверждает концепцию меньшей роли текущего поколения ингибиторов контрольных точек в лечении больных с активирующими мутациями, а также позволяет получить значимые основания для выбора оптимального подхода. На фоне практически полного отсутствия инициированных исследователями оригинальных работ второй фазы значительно выросло число исследований, основанных на ретроспективном анализе реальной клинической практики. Так, многие работы ставили задачу выделения групп с различной чувствительностью к терапии ингибиторами контрольных точек. Среди изученных факторов, позволяющих провести соответствующую стратификацию по уровню чувствительности, можно отметить соотношение нейтрофилов к лимфоцитам и моноцитов к лимфоцитам, уровень глюкозы и поверхность тела на момент введения препарата с иммуноопосредованным механизмом действия, наконец, целый ряд рентгенологических особенностей опухоли [17-19]. Все эти закономерности не позволяют сомневаться в том, что будущие алгоритмы будут включать значительно больше групп пациентов в зависимости от их чувствительности к ингибиторам контрольных точек.
Таргетная терапия немелкоклеточного рака легкого
Переходя к таргетной терапии НМРЛ с активирующими мутациями, обращу внимание на некоторую подмену понятий, проявившуюся в этой области в последнее время. На протяжении многих последних лет мы рассматривали таргетную терапию, в первую очередь, как лечение, направленное на блокирование конкретного механизма, определяющего патогенез конкретной опухоли и связанного с наличием конкретного нарушения [20]. Тенденции же последнего времени предполагают применение таргетных препаратов на основе моноклональных антител как средств для доставки высокотоксичных цитостатических препаратов, высвобождающихся для реализации противоопухолевого эффекта лишь после связывания антитела носителя с мишенью на поверхности клетки и проникновения в нее. Надо сказать, что успех таких препаратов, как дерукстикан в лечении HER2-позитивных опухолей, предварительные результаты патритумаба-дерукстикана (дерукстикан + антиHER3 антитело) при резистентных к ИТК EGFR-ассоциированных опухолях, успех биспецифичного препарата амивантамаб (антиEGFR + антиМЕТ) позволяют безусловно предполагать смену вектора таргетного воздействия [21,22]. На этом фоне накопление данных об особенностях редких молекулярных нарушений требует для некоторых из них разработки альтернативных лечебных подходов. В качестве примера подобной эволюции можно привести мутации EGFR в 20-м экзоне, продемонстрировавшие ранее отсутствие чувствительности к зарегистрированным низкомолекулярным ингибиторам этого рецептора. В этом году сразу несколько лекарственных препаратов были изучены в данной группе пациентов – два низкомолекулярных ингибитора позиотиниб и мобицертиниб, а также упоминавшийся ранее амивантамаб [22-24]. По ранним результатам, представленным в этом году, наиболее обнадеживающие результаты получены для мобоцертиниба – 17,5 месяца длительности ответа и 24 месяца общей продолжительности жизни. Подведем итоги. По результатам работ, представленных на конференциях ESMO и WCLC, текущий этап развития лекарственной терапии при опухолях легкого рассматривается как переходный к более раннему применению ингибиторов контрольных точек и новым поколениям ингибиторов при распространенном заболевании. Для опухолей с драйверными мутациями текущие результаты позволяют предположить смену парадигмы в ближайшее время.
Источники:
1. Jessamy A Boyd, et al. Timing of local and distant failure in resected lung cancer: implications for reported rates of local failure. J Thorac Oncol. 2010 Feb; 5(2).
2. Mitsudomi T, et al. Surgery for NSCLC in the era of personalized medicine. Nat Rev Clin Onco. 2013 Apr; 10(4): 235-44.
3. Grant MJ, et al. Selecting the optimal immunotherapy regimen in drivernegative metastatic NSCLC. Nat Rev Clin Oncol. 2021 Oct; 18(10): 625-644.
4. Heather A. Wakelee, et al. IMpower010: Primary results of a phase III global study of atezolizumab versus best supportive care after adjuvant chemotherapy in resected stage IB-IIIA non-small cell lung cancer (NSCLC). J of Clin Oncol. 2021; 39 (15_suppl): 8500- 8500.
5. Felip E, et al. IMpower010: Sites of Relapse and Subsequent Therapy From a Phase 3 Study of Atezolizumab vs Best Supportive Care After Adjuvant Chemotherapy in Resected Stage IBIIIA NSCLC. ESMO 2021, Abstract #LBA9.
6. Lee JM, et al. Real-World Adjuvant Treatment Patterns and Survival Outcomes Among Early NSCLC US Patients. ESMO 2021, Abstract #160.
7. Wang S, et al. Circulating tumor DA analysis integrating tumor clonality detects minimal residual disease in resectable non-small-cell lung cancer. ESMO 2021, Abstract #1154H.
8. Dongsheng Yue, et al. Whole course management of surgical NSCLC patients based on ctDNA detection: neo adjuvant treatment efficacy prediction and postoperative recurrence monitoring. ESMO 2021, Abstract #1164H.
9. Jonathan Spicer, et al. Surgical outcomes from the phase 3 CheckMate 816 trial: Nivolumab (NIVO) + platinum-doublet chemotherapy (chemo) vs chemo alone as neoadjuvant treatment for patients with resectable non-small cell lung cancer (NSCLC). Journal of Clinical Oncology. 2021; 39 (15_suppl): 8503-8503.
10.Corinne Faivre-Finn, et al. FourYear Survival With Durvalumab After Chemoradiotherapy in Stage III NSCLC – an Update From the PACIFIC Trial. J Thorac Oncol. 2021.
11.Girard N, et al. PACIFIC R Real World Study: Treatment Duration and Interim Analysis of Progression Free Survival in Unresectable Stage III NSCLC Patients Treated with Durvalumab After Chemoradiotherapy. ESMO 2021, Abstract #1171MO.
12.Yi-Long Wu, et al. GEMSTONE-301: A Randomized, Double blind, Placebo controlled, Phase 3 Study of Sugemalimab in Patients With Unresectable Stage III Non Small Cell Lung Cancer Without Progression After Concurrent or Sequential Chemoradiotherapy. ESMO 2021, Abstract #LBA43.
13.Riudavets M, et al. Durvalumab consolidation in patients with stage III non resecable NSCLC with driver genomic alterations. ESMO 2021, Abstract #LBA42.
14.Miranda Gogishvili, et al. EMPOWERLung 3: Cemiplimab in combination with platinum doublet chemotherapy for firstline (1L) treatment of advanced nonsmall cell lung cancer (NSCLC). ESMO 2021, Abstract #LBA51.
15.Peters S, et al. Real world effectiveness of PD-(L)1 inhibitors alone or in combination with chemotherapy in first-line PDL1-high non-squamous lung cancer. ESMO 2021, Plenary.
16.Goto Y, et al. Real-world evaluation of first-line (1L) pembrolizumab (pembro) monotherapy for PD-L1- positive (TPS≥50%), advanced NSCLC in Japan. ESMO 2021, Abstract #1307H.
17. Sally CM Lau, et al. PD-1 inhibitors combined with chemotherapy may preferentially improve survival in metastatic NSCLC with myeloidmediated primary resistance to immunotherapy. ESMO 2021, Abstract #1298P.
18.Emma Zattarina, et al. The role of inflammatory biomarkers in advanced Non-Small Cell Lung Cancer patients treated with chemo-immunotherapy. ESMO 2021, Abstract #1311P.
19.Mazzaschi G, et al. A highly predictive blood radiomics classifier in advanced NSCLC treated with immunotherapy. ESMO 2021, Abstract #3456.
20.Hafeez U, et al Antibody-Drug Conjugates for Cancer Therapy. Molecules. 2020.
21.Bob Li, et al. Primary data from DESTINY-Lung01: A phase II trial of trastuzumab deruxtecan (T-DXd) in patients (Pts) with HER2-mutated (HER2m) metastatic non-small cell lung cancer (NSCLC). ESMO 2021, Abstract #LBA45.
22.Catherine A. Shu, et al. Amivantamab Plus Lazertinib in Post osimertinib, Post platinum Chemotherapy EGFR mutant Non small Cell Lung Cancer (NSCLC): Preliminary Results from CHRYSALIS. ESMO 2021, Abstract #1193MO.
23.Cornelissen R, et al. Efficacy and Safety of Poziotinib in Treatment naïve NSCLC Harboring HER2 exon 20 Mutations: A Multinational Phase 2 Study (ZENITH20 4). ESMO 2021, Abstract #LBA46.
24.Chih-Hsin Yang, et al.
Characterization and Management of
Mobocertinib (TAK-788) –Induced Skin
Toxicity in Patients With EGFR Exon 20
Insertion+ (ex20ins+) Non-Small Cell
Lung Cancer (NSCLC) Who Previously
Received Platinum Chemotherapy.
ESMO 2021, Abstract #1231P
НАИБОЛЕЕ ЗНАЧИМЫЕ ИССЛЕДОВАНИЯ С ЛУЧЕВОЙ ТЕРАПИЕЙ В 2021 ГОДУ
Автор: Деньгина Наталья Владимировна
ГУЗ «Областной клинический онкологический диспансер», Ульяновск
У российских радиотерапевтов есть
общий чат с большим числом участников – шесть сотен без малого. Чувствовать виртуальную связь с коллегами вне огромного пространства
страны очень приятно и, более того,
удобно и полезно. Можно не просто спросить совета в отношении
подходов в сложных клинических
ситуациях, получить ссылку на нужную статью или книгу, но и устроить
блиц-опрос. В ответ на просьбу назвать наиболее весомые исследования уходящего 2021 года с включением лучевой терапии коллегами были
упомянуты следующие.
1. Обновленные 5-летние данные исследования PACIFIC, представленные в июне 2021 года на конгрессе ASCO [1]. Переоценить их сложно, ибо ранее получить подобные результаты радикального лечения больных нерезектабельным немелкоклеточным раком легкого III стадии не удавалось: показатель 5-летней общей выживаемости в группе пациентов, получивших стандартное химиолучевое лечение и консолидирующую иммунотерапию дурвалумабом, составил невиданные до этого 43% (в сравнении с 33% в группе плацебо), при этом треть больных не имели признаков прогрессирования (выживаемость без прогрессирования в группе плацебо – 19% за 5 лет). Эти данные демонстрируют не только преимущество добавления иммунотерапии на этапе консолидации, но и более высокую эффективность самой химиолучевой терапии, нежели было показано в более ранних исследованиях. Облучение первичной опухоли и вовлеченных зон одновременно с ХТ, с применением современных технологий ЛТ, со строгим соблюдением ограничений для снижения токсичности, с максимально более ранним контролем для исключения прогрессирования и последующим переводом на поддерживающую иммунотерапию дурвалумабом – теперь это общепринятый стандарт лечения этой сложной категории пациентов.
2. Данные немецкого исследования CAO/ARO/AIO-12 по применению подхода TNT (тотальной неоадъювантной терапии) у больных с местнораспространенным раком прямой кишки [2], когда и химиотерапия, и одновременная химиолучевая терапия полностью переносятся на предоперационный этап. Стратегия TNT имеет вариации, например, применение коротких курсов облучения с последующей интенсивной химиотерапией, или стандартное химиолучевое лечение с дальнейшим оперативным лечением, или, как в данном исследовании, различная последовательность химиотерапии и химиолучевой терапии на предоперационном этапе. Триста шесть больных раком прямой кишки II-III стадии были рандомизированы либо в группу А (индукционная ХТ с последующим химиолучевым лечением), либо в группу В (наоборот, ХЛТ с консолидирующей ХТ); в дальнейшем пациенты шли на оперативное лечение через 123 дня после начала TNT, только, следовательно, в разные сроки после окончания облучения: в среднем через 45 дней для группы А и 90 дней для группы В. Схема химиолучевой терапии была следующей: 50,4 Гр за 28 фракций на фоне инфузии 5-фторурацила 250 мг/м2 в 1-14 и 22-35 дни плюс оксалиплатин 50 мг/м2 в 1, 8, 22 и 29 дни. Индукционная и консолидирующая ХТ проводились по схеме FOLFOX трижды. Первые результаты, касаю1 2 3 4 щиеся ранней токсичности и представленные пару лет назад, показали преимущество комбинации В: практически все пациенты смогли закончить полностью химиолучевое лечение и получить полнодозные режимы ХТ, тогда как в группе индукционной ХТ их процент был достоверно ниже, да и токсичность III-IV степени оказалась чаще встречаемой (37% против 27%). При этом более длительный интервал от окончания облучения до операции (на фоне проводимой химиотерапии) значительно повысил частоту полных патоморфологических регрессов (25% против 17%) без увеличения послеоперационных осложнений. Таким образом, схема ХЛТ – консолидирующая ХТ – операция полностью удовлетворила предварительную статистическую гипотезу авторов в отношении увеличения частоты pCR. При этом более длительное наблюдение за пролеченными пациентами (данные 2021 года) не показало какой-либо разницы ни в показателях ВБП за 3 года (73% против 73%), ни в частоте локорегиональных рецидивов (6% против 5%) или отдаленных метастазов (18% против 16%), ни в общей 3-летней выживаемости (92% против 92%). Частота поздних осложнений 3-4 степени тоже была схожей (15,4% против 17,4%). Дежавю: похожая ситуация наблюдалась с результатами рандомизированного проспективного исследования польских авторов (K.Bujko et al. [3]), когда первоначально в 2016 году было продемонстрировано явное достоверное преимущество в 3-летней ОВ (71,6% против 63,0%, p=0,046) в пользу режима 5×5 Гр с последующими 6 курсами CAPOX или 9 курсами FOLFOX4 по сравнению с традиционным химиолучевым лечением и адъювантной химиотерапией), но более зрелые 8-летние данные [4] практически нивелировали разницу в результатах, как в отношении общей выживаемости (48,8% против 48,6%, p=0,35), так и безрецидивной выживаемости (42,6% против 41,0%, p=0,64) и риска локальных рецидивов и отдаленных метастазов. Авторы признают адекватность двух подходов в лечении больных местнораспространенным раком прямой кишки, тем не менее, делая акцент на преимуществе 2 варианта стратегии TNT (ХЛТ с последующей ХТ и операцией) по причине лучших показателей полных патоморфологических ответов. В целом интенсификация неоадъювантного этапа лечения приобретает все большую популярность, обещая вскоре стать стандартом лечения. Позволю себе добавить в список еще пару исследований.
3. Проспективное рандомизированное исследование китайских авторов PORT-C [5], на мой взгляд, в очередной раз поставило многоточие на проблеме послеоперационного облучения больных с резектабельным НМРЛ III стадии с поражением лимфоузлов средостения (N2). Более подробная информация об исследовании – на сайте и в августовском номере газеты RUSSCO. С одной стороны, китайские исследователи, как и их коллеги из исследования Lung ART, не показали преимуществ добавления адъювантного облучения средостения при N2: 3-летняя общая выживаемость была 78,3% в группе PORT против 82,8% в контроле, без значимых различий. Но при этом нельзя назвать исследование полностью негативным: слишком явно расходятся кривые ВБП в пользу PORT, хоть и без статистической достоверности. Авторами показано, что PORT, как локальный метод воздействия, достигает своей цели: вносит вклад в локальный контроль, улучшает ВБП и выживаемость без локального прогрессирования (66,5% против 59,7% за 3 года), снижает риск локальных рецидивов за 3 года (9,5% в группе PORT против 18,3% при наблюдении), хоть это, увы, и не отражается на общей выживаемости. Но НМРЛ IIIA pN2 стадии – это особая ситуация, где рассчитывать только на качественное локальное лечение не приходится, необходима адекватная и, скорее всего, более эффективная системная терапия. В любом случае, результаты исследования китайских авторов снова заставляют нас скрупулезно взвешивать все за и против при назначении PORT нашим пациентам и ожидать более четких рекомендаций от профессиональных сообществ в отношении того, кто же в первую очередь будет выигрывать от проведения послеоперационного облучения.
4. Наконец, исследование, способное сломать существующие подходы и потому – номер 1 для меня в уходящем 2021 году. Немного предыстории. В 2000 году FDA одобрила применение стереотаксической лучевой терапии (SBRT, SABR) у больных ранним раком легкого, и это коренным образом изменило судьбу особо хрупкой категории больных раком легкого – пожилых пациентов в возрасте старше 75 лет, которым зачастую, ввиду сопутствующей патологии, отказывали в проведении любого лечения (рис.1) [6].
Рисунок 1.
Распределение больных раком легкого I стадии
в возрасте >75 лет по типу лечения в 1999-2007 годах [6].
По мере накопления опыта проведения SBRT пропорция возрастных пациентов с ранним раком легкого, получивших лучевую терапию, начала возрастать и даже потеснила группу оперированных пациентов.
По данным Национальной раковой базы данных США – крупнейшего хранилища информации по лечению больных раком легкого в мире, частота отказов от операции в пользу SBRT за период 2004-2016 гг. постепенно возрастала – но не достигла и 2%. Поэтому адекватно сравнить результаты лечения – хирургического и лучевого – на основании ретроспективных анализов было невозможно: слишком несопоставимы были группы больных по количеству. Крайне необходимы были проспективные сравнительные исследования, но три инициированных подобных исследования – STARS, ROSEL и RTOG 1021 – «захлебнулись» по причине плохого набора больных в группу лучевой терапии. Маловероятно, что тогда, в начале 2000-х, да и 2010-х, альтернатива в виде SBRT была адекватно описана пациентам, тем более что отбор производили хирурги. Авторитет хирурга в лечении раннего рака легкого всегда был непререкаем. Однако результаты лечения пациентов из 2 исследований (STARS и ROSEL) все же были проанализированы в совокупности и опубликованы в 2015 году [7] – и вызвали немало шума и волнений, иронии и споров со стороны разных представителей мирового онкологического сообщества. Практически по всем показателям SBRT выигрывала у операции: 3-летняя выживаемость без прогрессирования составила 86% против 80%, выживаемость без отдаленных метастазов за 3 года – 97% против 91%, не говоря уже о значительно более низкой токсичности. Да, частота как локальных, так и региональных рецидивов была выше в группе облучения (4% против 0% и 10% против 4% соответственно) – но это никак не сказалось на результатах общей выживаемости (86% против 80% за 3 года). Последовали многочисленные аргументы от приверженцев хирургического метода, однако единственно весомыми, на которые они могли опираться, были лишь результаты ретроспективных сравнительных анализов, в лучшем случае – с сопоставлением данных по каким-либо параметрам. Подобных анализов в доступной литературе можно обнаружить массу. Что интересно: когда четкие доказательства превосходства того или иного метода (проспективные данные) отсутствуют, большую роль начинает играть способность автора интерпретировать имеющиеся данные и маневрировать меж ними так, как ему, автору, удобно, поэтому и выводы этих многочисленных анализов здорово различаются. Одни демонстрируют явное преимущество хирургического метода, другие показывают отсутствие различий в эффективности. Но самое главное – это то, что ретроспективный анализ, сколь много бы их ни было, никогда не сможет конкурировать по уровню доказательности с проспективными данными по причине «отобранности» больных, идущих на более агрессивное лечение, да и, повторюсь, число пациентов, пролеченных SBRT, несопоставимо с количеством прооперированных. Можно привести не менее дюжины аргументов в пользу метода SBRT, развитие которого не стояло на месте эти годы, это тема для отдельного сообщения. Но главный аргумент появился в июне 2021 года в виде доклада профессора J. Chang на конгрессе ASCO 2021. Дело в том, что авторы исследования STARS после публикации совокупных результатов в 2015 году не бросили работу, а продолжили набор пациентов в группы SBRT и операции по прежнему протоколу! На момент доклада исследование включало уже свыше 300 больных, прослеженных более 5 лет. И тенденция полностью сохранилась: 5-летняя общая выживаемость оказалась достоверно лучше в группе лучевой терапии – 87% против 84%, p=0,012, HR 0,411 (95% CI 0,193-0,875; p=0,021). При этом отсутствовали различия между группами в БРВ, раково-специфической выживаемости, кумулятивной частоте рецидивов (рис.2).
Рисунок 2.
Общая выживаемость (А), выживаемость
без прогрессирования (В) и раково-специфическая
выживаемость (С) больных с НМРЛ I стадии после SABR
или видеоассистированной лобэктомии с медиастинальной
лимфодиссекцией [8].
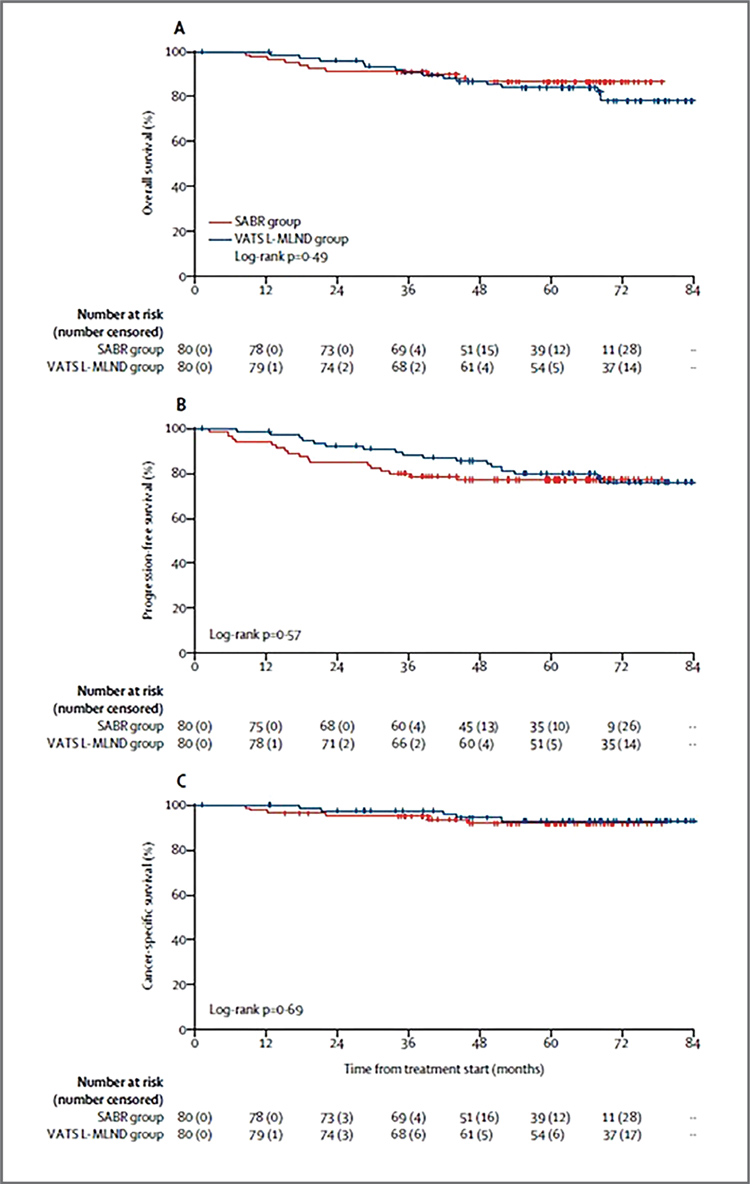
Результаты исследования были немедленно опубликованы в журнале
Lancet Oncology [8].
Данные демонстрируют, что SBRT при раннем раке как минимум не хуже, чем операция. Есть большая уверенность, что в недалеком будущем консервативный метод лечения – SBRT – станет абсолютно адекватной альтернативой операции не только для тех пациентов, которые не способны ее перенести, но и у сохранных больных ранним НМРЛ без явной сопутствующей патологии, и выбор будет исключительно за пациентом.
Источники:
1. David R. Spigel, Corinne Faivre-Finn, Jhanelle Elaine Gray, et al. Five-year survival outcomes with durvalumab after chemoradiotherapy in unresectable stage III NSCLC: An update from the PACIFIC trial. Journal of Clinical Oncology. 2021; 39 (15_suppl): 8511- 8511.
2. Fokas E, Schlenska-Lange A, Polat B, et al; German Rectal Cancer Study Group. Chemoradiotherapy Plus Induction or Consolidation Chemotherapy as Total Neoadjuvant Therapy for Patients With Locally Advanced Rectal Cancer: Long-term Results of the CAO/ARO/ AIO-12 Randomized Clinical Trial. JAMA Oncol. 2021 Nov; 18:e215445. doi: 10.1001/jamaoncol.2021.5445. Epub ahead of print. PMID: 34792531; PMCID: PMC8603234.
3. Bujko K, et al. Long-course oxaliplatin-based preoperative chemoradiation versus 5 × 5 Gy and consolidation chemotherapy for cT4 or fixed cT3 rectal cancer: results of a randomized phase III study. Annals of Oncology. 2016 May; Vol.27; Issue 5; p.834-842.
4. Bujko K, et al. 5x5 Gy and consolidation chemotherapy vs chemoradation for rectal cancer: a phase III study. ESTRO 38 Abstract book. OC0274.
5. Hui Z, Men Y, Hu C, et al. Effect of Postoperative Radiotherapy for Patients With pIIIA-N2 Non–Small Cell Lung Cancer After Complete Resection and Adjuvant Chemotherapy: The Phase 3 PORT-C Randomized Clinical Trial. JAMA Oncol. Published online June 24, 2021. doi:10.1001/ jamaoncol.2021.1910.
6. Palma, et al. Impact of Introducing Stereotactic Lung Radiotherapy for Elderly Patients With Stage I Non-SmallCell Lung Cancer: A Population-Based Time-Trend Analysis. J Clin Oncol. 2010 Dec 10; 28 (35): 5153-9.
7. Chang JY, Senan S, Paul MA, et al. Stereotactic ablative radiotherapy versus lobectomy for operable stage I nonsmall-cell lung cancer: a pooled analysis of two randomised trials [published correction appears in Lancet Oncol. 2015 Sep; 16(9):e427]. Lancet Oncol. 2015; 16(6): 630-637. doi:10.1016/ S1470-2045(15)70168-3.
8. Chang JY, Mehran RJ, Feng L, et
al; STARS Lung Cancer Trials Group.
Stereotactic ablative radiotherapy for
operable stage I non-small-cell lung
cancer (revised STARS): long-term
results of a single-arm, prospective
trial with prespecified comparison
to surgery. Lancet Oncol. 2021 Oct;
22 (10): 1448-1457. doi: 10.1016/
S1470-2045(21)00401-0. Epub 2021
Sep 13. PMID: 34529930; PMCID:
PMC8521627.
ОНКОГИНЕКОЛОГИЯ: НАИБОЛЕЕ ЗНАЧИМЫЕ СОБЫТИЯ 2021 ГОДА
Автор: Румянцев Алексей Александрович
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
Уходящий 2021 год ознаменовался для нас не только уникальной возможностью изучить греческий алфавит вследствие продолжающейся пандемии COVID-2019, но и многими событиями, которые сумели изменить к лучшему возможности лечения пациенток с онкогинекологическими заболеваниями. Рассмотрим некоторые из них.
Вторичные циторедукции при раке яичников: DESKTOP III – публикация результатов
2 декабря 2021 года в New England
Journal of Medicine были опубликованы результаты рандомизированного исследования III фазы
DESKTOP III (n=407), которое
было посвящено изучению роли
вторичных циторедуктивных операций при рецидивах рака яичников (РЯ). Включались пациентки
с платиночувствительными рецидивами РЯ, соответствующие
критериям AGO Score (ECOG 0,
асцит ≤500 мл, ранее выполненная
первичная полная циторедукция).
Рандомизация осуществлялась в
группу выполнения вторичной циторедукции с последующей химиотерапией или в группу только химиотерапии. Первичной конечной
точкой исследования была общая
выживаемость пациенток (ОВ) [1].
Полная циторедукция была достигнута у 75% пациенток в группе хирургического лечения. Медиана наблюдения составила 69,9
мес. По результатам исследования
медиана ОВ составила 53,7 мес. в группе вторичных циторедукций
по сравнению с 46,0 мес. в группе
только химиотерапии (ОР 0,75;
95% ДИ 0,59-0,96; p=0,02), а медиана выживаемости без прогрессирования (ВБП) – 14,8 мес. и 14,0 мес.
соответственно (ОР 0,66; 95% ДИ
0,54-0,82; p<0,05). При проведении
дополнительного анализа было выявлено, что медиана ОВ составила
61,9 мес. среди пациенток после
полной вторичной циторедукции
по сравнению с 27,7 мес. после неполной циторедукции (рис.1).
Рисунок 1.
Общая выживаемость пациенток после полной
вторичной циторедукции, без хирургического лечения
и после неполной вторичной циторедукции.
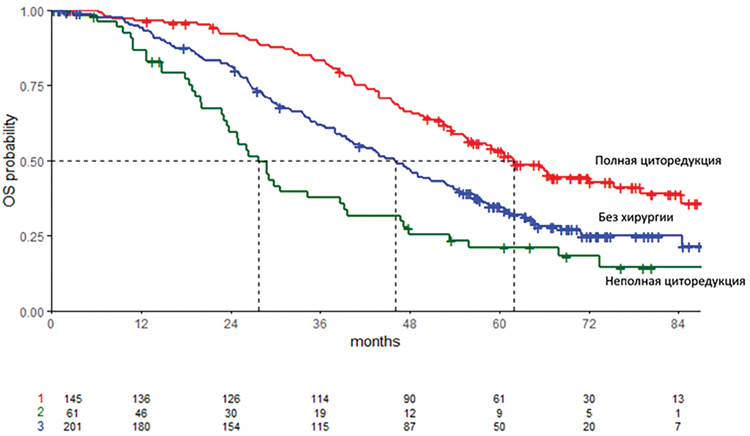
Почему это интересно: в крупном проспективном и хорошо спланированном исследовании DESKTOP III было доказано, что выполнение вторичных циторедуктивных операций позволяет достигать лучших результатов лечения пациенток с рецидивами рака яичников – но с некоторыми оговорками. Только выполнение полной вторичной циторедукции улучшает результаты лечения пациенток. В то же время, неполное удаление рецидивной опухоли не только не улучшает выживаемость, но напротив – может приводить к ухудшению ОВ пациенток. Почему так? В настоящее время невозможно однозначно ответить на этот вопрос. В качестве одной из причин можно предположить более агрессивные биологические особенности опухолевого роста в тех ситуациях, когда выполнение полной циторедукции было невозможно. Тем не менее, нельзя исключить и прямой негативный эффект на выживаемость вследствие нерадикального хирургического вмешательства. Соответственно, представленные результаты указывают на необходимость тщательного отбора пациенток для хирургического лечения при рецидивах рака яичников.
Исследование III фазы KEYNOTE-826: пембролизумаб входит в стандарты I линии метастатического рака шейки матки
В исследование KEYNOTE-826, чьи результаты были представлены на ESMO 2021, включались пациентки с метастатическим или рецидивирующим РШМ, ранее не получавшие системной противоопухолевой терапии. Рандомизация осуществлялась в соотношении 1:1 в группу пембролизумаба 200 мг в/в капельно каждые 21 день или плацебо; пациентки в обеих группах получали до 6 курсов стандартной химиотерапии по схеме паклитаксел + карбоплатин (или цисплатин) ± бевацизумаб 15 мг/кг каждые 21 день. Терапия пембролизумабом/плацебо и бевацизумабом проводилась до прогрессирования заболевания или непереносимой токсичности. Стратификация осуществлялась в соответствии с PD-L1 статусом, применением бевацизумаба и наличием отдаленных метастазов на момент постановки диагноза. Первичной конечной точкой исследования были ВБП и ОВ пациенток среди PD-L1+ пациенток [2]. В исследование было включено 617 пациенток, у 88% из них была выявлена позитивная экспрессия PD-L1 (CPS≥1). По результатам исследования медиана ВБП среди PD-L1+ пациенток составила 10,4 мес. в группе пембролизумаба по сравнению с 8,2 мес. в группе химиотерапии (ОР 0,62; 95% ДИ 0,50- 0,77; p<0,001), в общей популяции исследования данные показатели составили 10,4 и 8,2 мес. соответственно. Медиана ОВ не была достигнута в группе исследуемого препарат среди PD-L1+ пациенток и составила 16,3 мес. в группе плацебо (ОР 0,64; 95% ДИ 0,50-0,81; p<0,001), в общей популяции исследования – 24,4 мес. и 16,5 мес. соответственно (ОР 0,676; 95% ДИ 0,54-0,84% p<0,001).
Почему это интересно: первое
рандомизированное исследование
III фазы, продемонстрировавшее
эффективность иммунотерапии
в 1 линии лечения метастатического рака шейки матки – причем
не только с точки зрения ВБП, но
и ОВ пациенток. Оглядываясь назад, мы можем отметить, что развитие возможностей современной
противоопухолевой терапии позволило удвоить выживаемость пациенток с метастатическим и рецидивирующим РШМ за последние 7
лет, а в историческом аспекте наблюдается постоянное улучшение
отдаленных результатов лечения
рака шейки матки (рис.2).
Рисунок 2.
Общая выживаемость в пациенток с метастатическим/рецидивирующим раком шейки матки – первая линия
терапии (в месяцах).
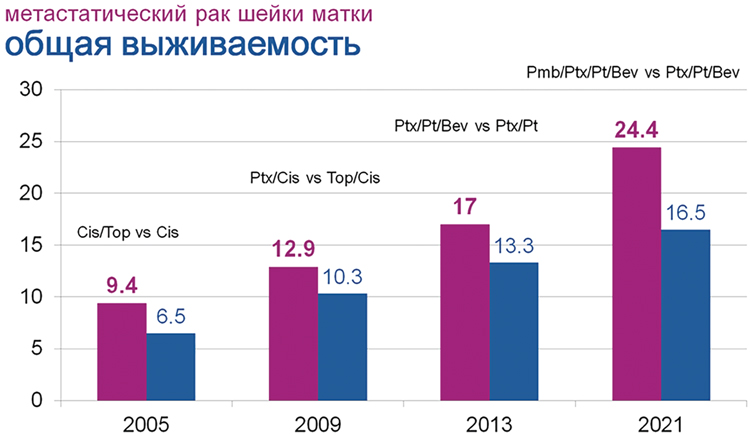
Вакцинация против ВПЧ и снижение риска развития рака шейки матки
В декабре 2021 года в журнале Lancet были опубликованы результаты крупного регистрового исследования, посвященного влиянию иммунизации против вируса папилломы человека (ВПЧ) на риски развития рака шейки матки и цервикальной in situ аденокарциномы (CIN3). В исследование включались пациентки, проходившие вакцинацию двухвалентной вакциной против ВПЧ 16 и 18 типов (Церварикс) в рамках программы рутинной иммунизации против ВПЧ в Англии. Авторами исследования было проведено сравнение заболеваемости раком шейки матки и CIN3 среди вакцинированных и невакцинированных женщин [3]. По результатам исследования расчетный показатель снижения риска развития рака шейки матки составил 34% (95% ДИ 25-41%) для пациенток, прошедших вакцинацию в возрасте 16-18 лет, 62% (95% ДИ 52-71%) – в возрасте 14- 16 лет и 87% (95% ДИ 72-94%) – в возрасте 12-13 лет по сравнению с невацинированными женщинами. Соответствующие показатели снижения риска для CIN3 оставили 39% (95% ДИ 36-41%), 75% (95% ДИ 72-77%) и 97% (95% ДИ 96-98%) соответственно. В соответствии с расчетами авторов исследования, программа вакцинации позволила предотвратить 448 случаев рака шейки матки и 17235 случаев CIN3. Почему это важно: в России на долю рака шейки матки приходится около 5% всех опухолей, возникающих у женщин; ежегодно эта опухоль диагностируется более чем у 17 тыс. пациенток, более 6 тыс. пациенток умирают. Каждый год. Эти цифры особенно трагичны с учетом того факта, что подавляющее большинство этих смертей может быть предотвращено. Результаты опубликованного исследования показывают, что вакцинация против ВПЧ позволяет резко снизить заболеваемость и, весьма вероятно, смертность от рака шейки матки. С радостью отметим, что в России уже наметились серьезные позитивные сдвиги в этом направлении: в соответствии с распоряжением Правительства Российской Федерации от 29 марта 2021 года с 2024 года вакцинация против ВПЧ должна быть внесена в Национальный календарь прививок [4]. Это событие само по себе можно отнести к одним из наиболее важных событий года в онкогинекологии. Персонально для нашей страны.
KEYNOTE-775/Study 309: эффективность комбинации ленватиниба и пембролизумаба при метастатическом раке эндометрия в зависимости от гистотипа опухоли
На ESMO 2021 были представлены новые данные из рандомизированного исследования III фазы Study 309, в рамках которого сравнивалась комбинация пембролизумаба и ленватиниба по сравнению со стандартной химиотерапией в лечении рецидивов рака эндометрия. Обновленные данные относятся к анализу эффективности терапии в зависимости от гистотипа опухоли. У пациенток с микросателлитно стабильными (MSS) опухолями данные показатели оказались следующими (рис.3) [5]:
Рисунок 3.
Медиана общей выживаемости пациенток с рецидивами рака эндометрия на фоне стандартной химиотерапии и комбинации пембролизумаба и ленватиниба
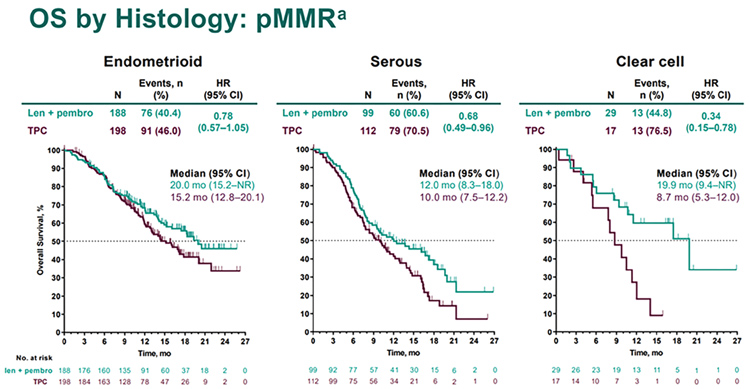
• светлоклеточный рак: медиана ВБП в группе комбинации ленватиниба и пембролизумаба составила 3,9 мес. по сравнению с 2,0 мес. в группе стандартной химиотерапии (ОР 0,49; 95% ДИ 0,25-0,97), а медиана ОВ – 19,9 и 8,7 мес. соответственно (ОР 0,34; 95% ДИ 0,15-0,78);
• серозный рак: медиана ВБП в группе комбинации ленватиниба и пембролизумаба составила 5,7 мес. по сравнению с 3,6 мес. в группе стандартной химеотерапии (ОР 0,54; 95% ДИ 0,39-0,75), а медиана ОВ – 12,0 и 10,0 мес. соответственно (ОР 0,68; 95% ДИ 0,49-0,96);
• эндометриоидный рак: медиана ВБП в группе комбинации ленватиниба и пембролизумаба составила 7,6 мес. по сравнению с 5,0 мес. в группе стандартной химиотерапии (ОР 0,59; 95% ДИ 0,46-0,76), а медиана ОВ – 20,0 и 15,2 мес. соответственно (ОР 0,78; 95% ДИ 0,57-1,05).
Почему это интересно: представленные на ESMO 2021 данные продемонстрировали крайне высокую
эффективность данной терапевтической опции при «редких» гистотипах заболевания – серозном и,
в особенности, светлоклеточном
раке, при котором было отмечено относительное снижение риска
смерти на 66%, что особенно важно
в контексте низкой чувствительности данного гистотипа к «традиционным» вариантам противоопухолевой терапии.
Источники:
1. Harter P, Sehouli J, Vergote I, et al. Randomized Trial of Cytoreductive Surgery for Relapsed Ovarian Cancer. N Engl J Med. 2021; 385 (23): 2123- 2131. doi:10.1056/NEJMoa2103294.
2. Colombo N, Dubot C, Lorusso D, et al. Pembrolizumab plus Chemotherapy versus Placebo plus Chemotherapy for Persistent, Recurrent, or Metastatic Cervical Cancer: Randomized, DoubleBlind, Phase 3 KEYNOTE-826 Study. ESMO 2021.
3. Falcaro M, Castañon A, Ndlela B, et al. The effects of the national HPV vaccination programme in England, UK, on cervical cancer and grade 3 cervical intraepithelial neoplasia incidence: a register-based observational study. The Lancet. 2021; 398 (10316): 2084-2092. doi:10.1016/ S0140-6736(21)02178-4.
4. Распоряжение Правительства Российской Федерации №774-р от 29 марта 2021 года об утверждении плана мероприятий по реализации стратегии развития иммунопрофилактики инфекционных болезней на период до 2035 года. Последний доступ: 10 декабря 2021 года. Доступно по адресу: http://static. government.ru/media/files/1AqqD3UX GsApOYZ8F5KxaUwnlNTyVRNB.pdf.
5. Colombo N, Lorusso D, Herráez
AC, et al. Outcomes by Histology
and Prior Therapy With Lenvatinib
Plus Pembrolizumab vs Treatment of
Physician’s Choice in Patients With
Advanced Endometrial Cancer (Study
309/KEYNOTE-775). ESMO 2021.

ЗНАЧИМЫЕ СОБЫТИЯ УХОДЯЩЕГО 2021 ГОДА В ЛЕКАРСТВЕННОМ ЛЕЧЕНИИ САРКОМ
Авторы: Феденко Александр Александрович
МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России, Москва
Тарарыкова Анастасия Алексеевна
НИИ клинической онкологии им. акад. РАН и РАМН Н.Н. Трапезникова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
В этом году на главных международных онкологических площадках
было представлено несколько действительно важных исследований,
демонстрирующих не только эффективность новых препаратов при
терапии сарком, но и, главным образом, важность эпигенетического
подхода в лечении орфанных заболеваний.
Результаты исследования II фазы
SPEARHEAD-1 по оценке эффективности афамицела (афамитресген
аутолейцел, ADP-A2M4) у пациентов с распространенной синовиальной саркомой или миксоидной/
круглоклеточной липосаркомой
были представлены на ASCO 2021
[1]. MAGE-A4 представляет собой
антиген рака яичка, экспрессирующийся при множестве типов солидных опухолей и, по данным
исследований, высоко экспрессируемый при синовиальной саркоме и
миксоидной/круглоклеточной липосаркоме. Т-клетки SPEAR были
разработаны для нацеливания на
HLA-рестриктированный опухолевый антиген MAGE-A4. Рецепторы
Т-клеток обладают способностью
распознавать внутриклеточные
опухолевые антигены, в отличие от
Т-клеток CAR, которые могут распознавать только антигены на поверхности клеток. Однако встречающиеся
в природе Т-клеточные рецепторы
имеют низкую аффинность к большинству этих опухолевых антигенов. Таким образом, Т-клетки SPEAR
имеют модифицированные рецепторы, которые обладают более высоким
сродством к опухолевому антигену.
В исследовании SPEARHEAD-1 пациенты должны были быть HLA-A2
положительными, опухолевая
ткань должна была экспрессировать
адекватное количество антигена
MAGE-A4 (≥30%), а также требовалось наличие в анамнезе предшествующего системного лечения антрациклинами и/или ифосфамидом.
Авторы исследования изучили данные 330 пациентов, из них выявили
176 пациентов с соответствующим
типом HLA. В итоге в исследование
было включено 59 больных, которым
был проведен лейкоферез, 37 из этих
пациентов на данный момент получили лечение Т-клетками. С точки
зрения безопасности одним из нежелательных явлений, представляющих
особый интерес, является синдром
высвобождения цитокинов, что было
зафиксировано у 59% пациентов,
хотя 3 степень токсичности составила не более 3%. Другими наиболее
частыми нежелательными явлениями были цитопении (нейтропения,
тромбоцитопения, анемия), частота
3 степени токсичности для каждой
не превышала 8% (анемия). Частота объективных ответов составила
39,4%, а частота контроля над заболеванием – 85% (рис.1).
Рисунок 1.
Sandra P. D'Angelo et al. SPEARHEAD-1
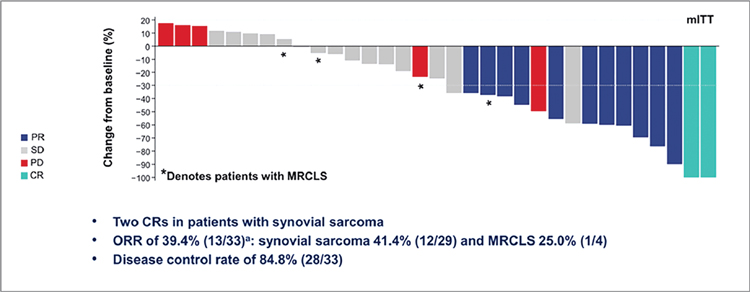
Было оценено 29 пациентов с синовиальной саркомой и 4 пациента с миксоидной/круглоклеточной липосаркомой. У одного из пациентов с миксоидной/круглоклеточной липосаркомой и у 12 больных с синовиальной саркомой зафиксированы объективные ответы. При этом у 2 пациентов с синовиальной саркомой достигнут полный ответ. Средняя продолжительность ответа не достигнута, и наблюдение за этими пациентами продолжается. Таким образом, данное исследование показывает ранние, но обнадеживающие результаты с точки зрения эффективности и безопасности. Исследование продолжается, как и активный набор пациентов (NCT04044768). Результаты работы могут представлять собой многообещающую терапевтическую опцию для пациентов с соответствующим типом HLA и экспрессией антигена, что говорит о важности подбора соответствующей когорты больных. Открытым остается вопрос эффективности терапии при других гистологических подтипах сарком, не стоит забывать, что в данное исследование были включены те типы сарком, которые отличаются своей высокой чувствительностью к лекарственному лечению. Проведение соответствующего лечения требует развитой инфраструктуры и мощности клинического центра, что в очередной раз подтверждает: пациенты с саркомами должны получать лечение в референсных центрах. Другое исследование II фазы по оценке эффективности олапариба и темозоломида при распространенной лейомиосаркоме матки основано на том, что лейомиосаркома матки связана с относительно высокой частотой дефицита гомологичной рекомбинации [2]. Примерно 20% лейомиосарком матки попадают в эту категорию, что выше, чем при других типах сарком в целом (9,3%) [3]. При дефиците гомологичной рекомбинации ингибиторы PARP являются эффективными или оказывают свое действие, блокируя репарацию PARP однонитевых разрывов ДНК. Эти разрывы ДНК могут происходить по разным причинам, включая лечение химиотерапевтическими препаратами, повреждающими ДНК, такими как темозоломид. Невосстановленные, однонитевые разрывы ДНК могут привести к двухнитевым разрывам или остановке репликативных вилок. Это дефекты, которые обычно устраняются путем гомологичной рекомбинации. Но в опухолях с дефицитом гомологичной рекомбинации эти повреждения ДНК могут привести к геномной нестабильности и гибели опухолевых клеток. Пациенты в данном исследовании должны были получить по крайней мере одну линию системной терапии по поводу диссеминированного заболевания. Первичной конечной точкой исследования была частота объективных ответов в течение шести месяцев. Лечение включало комбинацию перорального приема препаратов темозоломида (75 мг/м2) и олапариба (200 мг 2 раза в сутки), с 1-го по 7-й дни и интервалом в 21 день. Двадцать четыре пациента были включены в исследование в течение 6 месяцев в нескольких центрах. Средний возраст больных составил 55 лет; 59% пациентов прошли по крайней мере три предшествующих линии системного лечения. В исследовании токсичность чаще всего представляла собой цитопению (77%), с которой можно было справиться уменьшением дозы препаратов, она не являлась большой клинической проблемой. Исследование достигло своей основной конечной точки: у пяти (23%) пациентов наблюдался объективный ответ в течение первых шести месяцев лечения. У шести пациентов (27%) достигнут частичный ответ, у девяти пациентов (41%) – стабилизация. Медиана ВБП составила 6,9 месяца. Средняя продолжительность ответа составила 12 месяцев. Анализ биомаркеров продолжается. Следующее исследование касается определения молекулярных предикторов ответа на селинексор при диссеминированной неоперабельной дедифференцированной липосаркоме [4]. Ингибиторы CDK4/6 не одобрены FDA для использования при этом заболевании. Но по данным некоторых исследований была выявлена активность данной группы препаратов при лечении недифференцированной липосаркомы (абемациклиб – медиана ВБП 30 недели, 3-месячная ВБП 76%; палбоциклиб – мВБП 17,9 недель, 3-месячная ВБП 57,2%, [5,6]). Exportin 1 или XPO1 – это ядерный экспортный белок, который жестко регулирует транспорт белков из ядра клетки. Exportin 1 гиперэкспрессируется при ряде злокачественных заболеваний. Гиперэкспрессия связана с нерегулируемым ядерным экспортом белков-супрессоров опухоли и белков регуляции клеточного цикла. Эта чрезмерная экспрессия связана с резистентностью к лечению и плохим прогнозом. Селинексор – селективный ингибитор ядерного экспорта, который подавляет XPO1. Это ингибирование приводит к накоплению в ядре супрессоров опухолевого роста, что приводит к остановке клеточного цикла и апоптозу. Эта активность была отмечена для ряда типов опухолей, а препарат одобрен FDA для лечения множественной миеломы и диффузной В-клеточной лимфомы. В исследовании I фазы с включением нескольких типов сарком было отмечено, что у 1/3 (33%) пациентов стабилизация заболевания продолжалась более 4 месяцев [7]. Были выделены пациенты с дедифференцированной липосаркомой: у 47% пациентов стабилизация заболевания длилась 4 месяца или более, у 40% пациентов отмечалось уменьшение размеров опухоли. Эти предварительные результаты явились предпосылкой к исследованию SEAL, которое представляет собой рандомизированное исследование II/III фазы с включением пациентов с распространенной дедифференцированной липосаркомой, у которых было не менее двух предшествующих линий системной терапии (NCT02606461). Пациенты были рандомизированы на две группы: селинексор или плацебо. Исследование достигло своей первичной конечной точки – выживаемости без прогрессирования заболевания. Но общие впечатления от улучшения выживаемости без прогрессирования заболевания, хоть и статистически значимые (p=0,0114), клинически были довольно скромными. ВБП в группе с селинексором составила 2,8 месяца, тогда как в группе плацебо – 2 (HR 0,70). Однако авторы исследования продолжили анализ уже внутри набранных пациентов с целью поиска биомаркера, идентифицирующего пациентов, у которых наиболее вероятно будет наблюдаться значимый клинический эффект при лечении селинексором. Были выделены группы пациентов, у которых при лечении селинексором опухоль явно увеличивалась или явно уменьшалась в размерах, и выполнен анализ на экспрессию генов. Ген CALB1, или кальбиндин, наиболее существенно экспрессировался у пациентов с резистентной опухолью. В то же время у пациентов с опухолями, чувствительными к селинексору, не выявлена экспрессия кальбиндина. Экспрессия кальбиндина коррелировала с мВБП у пациентов, получавших селинексор: для кальбиндин-отрицательных пациентов мВБП составила 6,9 месяца, для кальбиндин-экспрессируюших – 1,68 месяца (HR 0,45; p=0,033). В настоящее время продолжаются и другие исследования по оценке эффективности селинексора, однако определение экспрессии CALB1 выглядит потенциально ценным биомаркером, который может позволить нам увеличить терапевтическую пользу для пациентов от данной терапии. И заключительная работа, на которой хочется остановить свое внимание, – это исследование III фазы APROMISS (AL3818) по оценке эффективности анлотиниба/катеквентиниба в монотерапии по сравнению с дакарбазином при диссеминированной синовиальной саркоме [8]. Катеквентиниб/анлотиниб (AL3818) представляет собой множественный ингибитор тирозинкиназы (ТКI) для перорального применения, нацеленный на VEGFR1-3, FGFR1-3, PDGFR-β и cKIT. Критерием включения, помимо гистологического типа, было предшествующее системное лечение, включающее антрациклины. Важным нюансом была возможность включать пациентов, которые ранее получали пазопаниб (также относящимся к мультиингибиторам тирозинкиназ). Катеквентиниб 12 мг/сут. принимался ежедневно в течение двух недель, далее неделя перерыва; таким образом, цикл составлял 21 день. Дакарбазин в дозе 1000 мг/ м2 вводился в/в 1 раз в 21 день. В результате в группе катеквентиниба наблюдалась более длительная мВБП, чем в группе дакарбазина: 2,89 и 1,64 месяца соответственно (HR 0,449; p=0,0015). Токсичность, наблюдаемая в исследовании, характерна для класса препаратов VEGF-TKI в целом: диарея, гипертензия. Данное рандомизированное исследование является первым, сравнивающим VEGF-TKI при саркомах мягких тканей с активным препаратом. В этом исследовании VEGF-TKI оказался лучше дакарбазина с точки зрения ВБП. Улучшение выживаемости без прогрессирования было умеренным, но статистически значимым. Что действительно интересно, так это сравнение эффективности других ингибиторов тирозинкиназы с пазопанибом, одобренным для пациентов с диссеминированными саркомами мягких тканей. Исследования, сравнивающие эти препараты, не проводились. В настоящее время не существует надежного биомаркера для выявления пациентов, которым эти препараты с наибольшей вероятностью принесут пользу. Возможно исследования, сочетающие ингибиторы тирозинкиназ с такими методами лечения, как ингибирование иммунных контрольных точек, покажут дальнейшие успехи в этой области.
Ссылки опубликованы на сайте:
https://rosoncoweb.ru/news/
oncology/2021/12/09/
НАИБОЛЕЕ ЗНАЧИМЫЕ ИССЛЕДОВАНИЯ ПО МЕЛАНОМЕ В 2021 ГОДУ
Автор: Утяшев Игорь Аглямович
Институт онкологии Хадасса Москва, Москва
Несмотря на пандемию, вызванную COVID-19, онкологическое научное сообщество продолжает активный поиск новых противоопухолевых препаратов. В 2021 году были опубликованы результаты клинических исследований, которые повлияют на тактику лечения пациентов с меланомой в ближайшее время. KEYNOTE-716 – пембролизумаб в адъювантном режиме при II стадии меланомы кожи. Пожалуй, наиболее значимым событием 2021 года в адъювантной терапии меланомы кожи стали результаты многоцентрового рандомизированного клинического исследования III фазы KEYNOTE-716, в котором изучали эффективность пембролизумаба в адъювантном режиме у взрослых и детей старше 12 лет после удаления меланомы кожи высокого риска – IIB и IIC стадии (AJCC 8 ред.) [1]. При медиане наблюдения в 14,4 месяца применение пембролизумаба в течение 12 месяцев снижает риск рецидива меланомы кожи на 35% (P=0,00658) по сравнению с плацебо. Отношение риска (ОР) прогрессирования заболевания составило 0,65 (95% доверительный интервал (ДИ) = 0,46-0,92; P=0,0132) в пользу пембролизумаба. В группе пациентов, получавших пембролизумаб, частота отдаленных метастазов также была достоверно ниже, чем в группе плацебо (4,7% против 7,8% соответственно). Однолетняя безрецидивная выживаемость (БРВ) в группе пембролизумаба составила 90,5%, а в группе плацебо – 83,1%. При этом переносимость адъювантного применения пембролизумаба при II стадии меланомы кожи можно считать удовлетворительной. Нежелательные явления (НЯ) 3-4 степени, обусловленные проводимой терапией, в группе пембро наблюдали у 16,1% пациентов, а в группе плацебо – у 17,1% пациентов. Частота прекращения терапии из-за НЯ в группе пембролизумаба составила 15,3%, а в группе плацебо – 2,5%. Результаты исследования KEYNOTE-716 привели к одобрению применения пембролизумаба в адъювантном режиме при IIB и IIC стадии меланомы кожи со стороны FDA в США. Последующий анализ результатов исследования KEYNOTE-716 позволит оценить влияние адъювантного применения пембролизумаба и на общую выживаемость пациентов при IIB/ IIC стадии меланомы. Ожидая данные по общей выживаемости (ОВ), следует учитывать, что высокая эффективность последующих режимов системной терапии, направленной на лечение уже метастатических форм меланомы кожи, способна выравнивать ОВ в обеих группах. Одним из вопросов, возникающих в связи с результатами исследования KEYNOTE-716, является роль биопсии сторожевого лимфоузла (БСЛУ) в стадировании меланомы кожи. Сегодня общепризнанной ситуацией, при которой назначают адъювантную терапию анти-PD-1 моноклональными антителами (мАТ) или ингибиторами BRAF+MEK (BRAFi+MEKi), является III стадия заболевания. Именно для выявления пациентов с III стадией заболевания всем пациентам с толщиной первичной опухоли более 0,8 мм по Бреслоу рекомендовано выполнение БСЛУ. Возможно, в ближайшее время эти рекомендации будут пересмотрены в сторону уменьшения группы пациентов, которым может быть показана БСЛУ. Например, кандидатами для БСЛУ могут быть пациенты с толщиной первичной меланомы по Бреслоу от 0,8 до 4 мм (до T3a подстадии, 2-4 мм без изъязвления), то есть только до IIA стадии (AJCC 8 ред.). Остальным пациентам, с толщиной первичной опухоли по Бреслоу более 2 мм и наличием изъязвления (IIB/ IIC стадии по AJCC 8 ред.) уже сейчас можно рекомендовать проведение адъювантной иммунотерапии пембролизумабом и не выполнять БСЛУ.
Тактика первой линии терапии метастатической меланомы кожи с BRAF-мутацией
Если для пациентов без активирующей мутации в гене BRAF выбор первой линии системной терапии метастатической меланомы кожи происходит между назначением анти-PD-1 мАТ в монорежиме или их комбинации с анти-CTLA-4 мАТ, то для BRAF-положительных пациентов системная терапия помимо иммунотерапии анти-PD1 мАТ ± анти-CTLA-4 мАТ сегодня может включать BRAFi/MEKi и тройную комбинацию BRAFi/MEKi + антиPD1/PD-L1 мАТ. До недавнего времени убедительных данных о преимуществах таргетной терапии над иммунотерапией в первой линии терапии BRAF-положительной меланомы кожи не существовало. Результаты метаанализов были скорее противоречивы.
Исследование DREAMSeq (ипилимумаб с ниволумабом против дабрафениба с траметинибом в первой линии терапии метастатической BRAF-положительной меланомы кожи) стало первым рандомизированным исследованием, убедительно доказывающим преимущество одного вида системной терапии над другим [2]. Более подробно об исследовании уже было сказано в предыдущей статье номера. Значимое различие в ОВ между двумя схемами терапии привело к досрочной остановке набора новых пациентов в исследование. При этом пациентам, рандомизированным в группу дабра+траме, в качестве первой линию терапии было предложено изменение схемы лечения на комбинацию ипилимумаба с ниволумабом не дожидаясь прогрессирования, что может стать свидетельством изменения подходов к лечению данной категории больных.
Исследование SECOMBIT [3]: ипилимумаб + ниволумаб против энкорафениба с бинимитинибом в первой и второй линиях BRAFположительной метастатической меланомы кожи. Вместо или вместе? Еще одним исследованием, позволяющим определить оптимальную последовательность применения таргетной и иммунотерапии в лечении BRAF-положительной метастатической меланомы кожи, стало рандомизированное исследование II фазы SECOMBIT, первые результаты которого появились на ESMO 2020. В этом году на ESMO 2021 были представлены обновленные данные по ОВ, свидетельствующие о преимуществе одного вида терапии над другим. В исследовании принимали участие пациенты с BRAFположительной метастатической меланомой кожи, не получавшие ранее лечения по поводу метастатической формы заболевания. Пациентов случайным образом распределяли в три группы. Пациенты в группе А получали в первую линию таргетную терапию комбинацией BRAFi/MEKi энкорафениба и бинимитиниба, а в случае прогрессирования на этой схеме пациентам проводили вторую линию иммунотерапии по схеме ипи+ниво. В группе B пациентам в первую линию проводили иммунотерапию по схеме ипи+ниво и при прогрессировании начинали таргетную терапию энко+бини. В третьей группе (группа C) применяли так называемую «сэндвич»-схему, при которой в течение первых 8 недель пациенты получали энко+бини, а затем, не дожидаясь прогрессирования, пациентам проводили иммунотерапию по схеме ипи+ниво до прогрессирования. Если пациенты в группе С прогрессировали на иммунотерапии по схеме ипи+ниво, им снова начинали таргетную терапию по схеме энко+бини. Основной целью исследования был анализ ОВ. Медиана наблюдения составила 32,2 месяца. Медиана общей продолжительности жизни не была достигнута ни для одной из групп. Трехлетняя ОВ в группе А (энко+бини, затем ипи+ниво) составила 54%, в группе В (ипи+ниво, затем энко+ниво) – 62%, в группе С (8 недель энко+бини, затем ипи+ниво, затем энко+бини) – 60%. ОР смерти между группами B и A составило 0,73 (95% ДИ 0,42-1,26) в пользу группы B (ипи+ниво, затем энко+ниво). ОР смерти между группами C и А составило 0,81 (95% ДИ 0,48-1,37) в пользу группы С (8 недель энко+бини, затем ипи+ниво, затем энко+бини). Поскольку ДИ вышел за пределы 1, ОР смерти оказались статистически недостоверными, но тенденция в пользу начала терапии с комбинации ипи+ниво хорошо заметна. Частота объективных ответов (ЧОО) при назначении ипи+ниво в первую линию составила 45%, а во второй линии – только 25%. ЧОО на таргетную терапию энко+бини в первой линии составила 87%, а во второй линии – только 61%. НЯ 3 и 4 степени чаще наблюдали в группе B (ипи+ниво, затем энко+ниво), при этом число НЯ, приведших к отмене лечения, было одинаково во всех трех группах. Результаты исследований SECOMBIT и DREAMseq свидетельствуют об увеличении ОВ у пациентов с BRAF-мутированной меланомой, получающих в первую линию комбинацию ипи+ниво. Тем не менее, результаты исследования SECOMBIT для больных, получивших первую линию терапии по схеме сэндвич (подгруппа С), позволяют предположить, что у отдельных пациентов такой подход может быть оправдан. Например, это могут быть больные, у которых необходимо достичь быстрого ответа на лечение из-за быстрого прогрессирования заболевания или большого объема опухолевого поражения. Особый интерес к пациентам, которым необходим быстрый ответ на лечение, вызывает внедрение в практику тройных комбинаций BRAFi + MEKi + анти-PD1/PD-L1 мАТ. Проведение рандомизированных исследований, направленных на сравнение эффективности первой линии системной терапии пациентов с метастатической BRAF-мутированной меланомой тройными комбинациями BRAFi + MEKi + анти-PD1/PD-L1 мАТ или комбинациями анти-PD-1 + анти-CTLA-4 мАТ или терапией по схеме сэндвич (начало лечения с таргетной терапией и переключение на комбинированную иммунотерапию не дожидаясь прогрессирования) у пациентов с плохим прогнозом в будущем позволит определить оптимальную тактику.
CHECKMATE 067: беспрецедентно
высокая общая выживаемость при
метастатической меланоме кожи.
Jedd D. Wolchok и соавт. [4] представили обновленные результаты
исследования CheckMate 067. Напомню, это легендарное рандомизированное плацебо-контролируемое исследование 3 фазы,
продемонстрировавшее стойкое
увеличение ОВ и ВБП у ранее не
леченных пациентов с неоперабельной меланомой, получавших
комбинацию ипилимумаба + ниволумаба (ипи+ниво) в сравнении с монотерапией ниволумабом
(ниво) и монотерапией ипилимумабом (ипи). При анализе 6,5-летних результатов наблюдения за
пациентами медиана ОВ в группе
ипи+ниво составила 72,1 мес., в
группе ниво – 36,9 мес., а в группе
ипи – 19,9 мес. Медиана меланома-специфичной выживаемости в
группе ипи+ниво до сих пор не достигнута, в группе ниво составила
58,7 мес., в группе ипи – 21,9 мес.
6,5-летняя ОВ у пациентов с BRAFмутированной меланомой составила 57% в группе ипи+ниво, 43% в
группе ниво и 25% в группе ипи. У
пациентов без активирующих мутаций в гене BRAF 6,5-летняя ОВ
составила 46% в группе ипи+ниво,
42% в группе ниво и 22% в группе
ипи. Медиана БРВ по оценке исследователей в группе ипи+ниво
составила 11,5 мес. (95% ДИ 8,7-
19,3), в группе ниво – 6,9 мес. (95%
ДИ 5,1-10,2), в группе ипи – 2,9 мес.
(95% ДИ 2,8-3,2). При этом 6,5-летняя БРВ в группе ипи+ниво составила 34%, в группе ниво – 29%, а в
группе ипи – 7%. Медиана времени
от рандомизации в исследование
CheckMate 067 до начала последующей системной терапии в группе
ипи+ниво не достигнута (95% ДИ
59,6-НД), в группе ниво – 25,2 мес.
(95% ДИ 16,0-43,2), а в группе ипи –
8,0 мес. (95% ДИ 6,5-8,7). Последующую системную терапию в группе
ипи+ниво получили 36% пациентов, в группе ниво – 49%, а в группе
ипи – 66% пациентов. Нежелательные явления (НЯ) 3-4 степени, связанные с проводимым лечением, в
группе ипи+ниво наблюдали у 59%
пациентов, в группе ниво – у 24%,
а в группе ипи – у 28%. Новых видов НЯ и новых случаев смерти,
связанных с НЯ, не зафиксировано. Представленные результаты
6,5-летнего наблюдения за участниками исследования CheckMate
067 на сегодняшний день являются
самыми длительными среди всех
опубликованных исследований III
фазы по терапии метастатической
меланомы с использованием комбинированной иммунотерапии
ингибиторами контрольных точек
или таргетной терапии.
RELATIVITY-047: комбинация релатлимаба с ниволумабом
– малотоксичная альтернатива
ипи+ниво?
На ASCO 2021 Evan J. Lipson и соавт.
представили первые результаты
международного регистрационного рандомизированного двойного
слепого клинического исследования II/III фазы RELATIVITY-047
(CA224-047), в котором изучали
эффективность комбинации релатлимаба (рела) с ниволумабом
(ниво) с фиксированной дозой обоих препаратов в сравнении с монотерапией ниволумабом в первой
линии терапии метастатической
меланомы [5].
Релатлимаб – это человеческое IgG4 LAG-3-блокирующее мАТ. В исследовании RELATIVITY-047 пациенты были рандомизированы в соотношении 1:1 в две группы. В экспериментальной группе (n=355) пациенты получали каждые 4 недели комбинацию с фиксированной дозой, состоящую из релатлимаба в дозе 160 мг и ниволумаба в дозе 480 мг. В контрольной группе (n=359) пациенты получали каждые 4 недели монотерапию ниволумабом в дозе 480 мг. Первичной целью исследования был анализ выживаемости без прогрессии (ВБП) по RECIST v.1.1, который проводила заслепленная независимая центральная комиссия. Вторичными целями исследования были анализ общей выживаемости (ОВ) и частоты объективного ответа (ЧОО). Медиана наблюдения за пациентами составила 13,2 мес. Медиана продолжительности жизни без прогрессии в группе рела+ниво составила 10,1 мес. (95% ДИ 6,4-15,7), в группе ниво – 4,6 мес. (95% ДИ, 3,4-5,6). ОР прогрессирования составило 0,75 (95% ДИ 0,6-0,9; P=0,0055) в пользу комбинации рела+ниво. Однолетняя ВБП в группе рела+ниво составила 47,7% (95% ДИ 41,8-53,2), а в группе ниво – 36,0% (95% ДИ 30,5-41,6). У пациентов, получивших комбинацию рела+ниво, ВБП во всех заранее определенных подгруппах была выше. Таким образом, применение комбинации рела+ниво в первой линии терапии диссеминированной меланомы имеет статистически значимое преимущество в ВБП над монотерапией ниволумабом. Частота нежелательных явлений 3-4 степени была выше в группе комбинированной терапии рела+ниво и составила 18,9%, а в группе ниво – 9,7%. В группе рела+ниво было зафиксировано 3 случая летальных исходов, связанных с лечением, а в группе ниво – 2 случая. Частота прекращения лечения из-за связанных с терапией нежелательных явлений любой степени в группе рела+ниво составила 14,6%, а в группе ниво – 6,7%. Исследование RELATIVITY-047 является первым клиническим исследованием III фазы, продемонстрировавшим клинически значимое преимущество двойной блокады LAG-3 и PD-1 сигнальных путей. Комбинация рела+ниво хорошо переносится пациентами и имеет управляемый профиль токсичности, непредвиденных побочных эффектов у пациентов, получивших рела+ниво, не выявлено. Поскольку первичная цель исследования была достигнута, мы с нетерпением ожидаем результатов анализа ОВ и ЧОО.
LEAP-004: пембролизумаб с ленватинибом (пембро+ленва) – новый стандарт лечения пациентов с диссеминированной меланомой, резистентной к анти-PD-1/анти-PD-L1 ингибиторам в монорежиме или в комбинации с анти-CTLA4 мАТ? На ASCO 2021 Ana Maria Arance и соавт. [6] представили обновленные результаты исследования LEAP-004. В этом открытом одногрупповом исследовании II фазы принимали участие пациенты с диссеминированной меланомой после подтвержденной по iRECIST прогрессии на терапии анти-PD-1/анти-PD-L1 ингибиторами в монорежиме или в комбинации с анти-CTLA4 мАТ. Пациенты получали ленватиниб (ленва) в дозе 20 мг внутрь ежедневно + пембролизумаб (пембро) 200 мг в/в каждые 3 недели. Всего было запланировано не более 35 введений пембро. Лечение проводили до прогрессирования или непереносимой токсичности. ЧОО (первичная цель) составила 21,4% при медиане длительности ответа 6,3 мес. ЧОО у пациентов, спрогрессировавших на предшествующей комбинированной терапии анти-PD-1 + анти-CTLA-4, составила 31%. На ASCO 2021 были представлены обновленные результаты анализа ЧОО для отдельных подгрупп пациентов. При медиане наблюдения 15,3 месяца (в диапазоне 12,1-19,0 мес.) на момент анализа результатов 17,5% пациентов продолжают получать исследуемую терапию. ЧОО по оценке заслепленной независимой центральной комиссией осталась на уровне 21,4% (95% ДИ 13,9-30,5), при этом частота полных ответов возросла с 2 до 3. Частота контроля над заболеванием достигла 66%. ЧОО у пациентов, прогрессирующих на ранее проведенной комбинированной иммунотерапии анти-PD-1 + анти-CTLA-4 (n=30), составила 33,3%. ЧОО у пациентов, получавших анти-PD-1/анти-PD-L1 мАТ только в адъювантном режиме (n=11), составила 18,2%. ЧОО у пациентов с первичной резистентностью (т.е. имевших наилучший ответ на лечение в виде стабилизации или прогрессирования заболевания на фоне иммунотерапии анти-PD-1/анти-PD-L1 мАТ по поводу диссеминированной формы заболевания) (n=62) составила 22,6%. ЧОО у пациентов с вторичной резистентностью (т.е. когда после полного или частичного ответа на предшествующую иммунотерапию анти-PD-1/анти-PD-L1 мАТ по поводу диссеминированной формы заболевания у пациента было зафиксировано прогрессирование заболевания) (n=22) составила 22,7%. В общей популяции пациентов медиана ВБП составила 4,2 мес. (95% ДИ 3,8-7,1 мес.), а медиана ОВ – 14,0 мес. (95% ДИ 10,8-НД). Однолетняя ВБП – 17,8%, 1-летняя ОВ – 54,5% соответственно. У 96,1% пациентов наблюдали НЯ любой степени, связанные с лечением, из них у 45,6% пациентов наблюдали НЯ 3-4 степени, у 1% пациентов – 5 степени (тромбоцитопения). Комбинация ленва+пембро обладает клинически значимой эффективностью и способна вызывать стойкие ответы у пациентов с диссеминированной меланомой, спрогрессировавших на предшествующей терапии анти-PD-1/анти-PD-L1 мАТ, а также на комбинации анти-PD-1 + антиCTLA-4 мАТ, независимо от первичной или приобретенной резистентности к иммунотерапии анти-PD-1/ анти-PD-L1 мАТ. Опубликованные в этом году обновленные результаты исследования II фазы LEAP-004 привели к включению этой схемы в практические рекомендации по лекарственному лечению меланомы кожи Российского общества клинической онкологии [7].
C-144-01: лифилюцел – новое направление клеточной терапии в лечении метастатической меланомы, рефрактерной к иммунотерапии. На ASCO 2021 James M. Larkin и соавт. представили результаты открытого многоцентрового исследование II фазы C-144-01 [8], в котором оценивали эффективность и безопасность клеточного препарата лифилюцел у пациентов с метастатической меланомой, спрогрессировавших на иммунотерапии анти-PD-1 мАТ и таргетной терапии (ТТ) BRAFi ± MEKi (в случае BRAF V600 позитивной меланомы). Lifileucel – это клеточный препарат из аутологичных криоконсервированных лимфоцитов, инфильтрирующих опухоль (TIL). На ASCO 2021 были представлены обновленные результаты 28-месячного наблюдения за пациентами в когорте 2 (n=66), а также анализ эффективности адоптивной TIL-терапии лифилюцелом в зависимости от ответа и продолжительности ранее проводимой иммунотерапии анти-PD-1 мАТ. Среднее количество предшествующих линий терапии у пациентов, принимавших участие в исследовании, составило 3,3. Перед включением в исследование 100% пациентов получали анти-PD-1 мАТ, 80% – антиCTLA-4 мАТ, 23% – BRAFi/MEKi. Пациенты исходно имели большой объем опухолевого поражения: в среднем суммарный размер таргетных очагов составлял 106 мм. У 42% пациентов было выявлено метастатическое поражение печени и головного мозга. 40,9% пациентов имели повышенный уровень ЛДГ. ЧОО по оценке исследователя составила 36,4% (3 ПО, еще один ПО был зафиксирован на 24 месяце наблюдения, 21 ЧО). Средняя продолжительность ответа не была достигнута при медиане периода наблюдения 28 месяцев (диапазон 2,2-35,2 месяца). Результаты исследования свидетельствуют о значимом увеличении продолжительности ответа на TIL-терапию у пациентов с первичной резистентностью к предшествующей иммунотерапии антиPD-1 мАТ и более короткой продолжительностью предшествующей иммунотерапии анти-PD-1 мАТ. При более длительном наблюдении за участниками исследования C-144-01 новых видов нежелательных явлений не выявлено. Представленные данные подтверждают высокую эффективность лифилюцела у сильно предлеченных пациентов, нечувствительных к иммунотерапии анти-PD-1 мАТ. Всего лишь однократное введение этого препарата вызывает развитие объективных ответов у 36,4% пациентов, при этом медиана длительности ответа до сих пор не достигнута (при 28-месячном наблюдении). При более длительном наблюдении увеличивается и количество полных ответов. Интересно, что длительность ответа на адаптивную TIL-иммунотерапию лифилюцелом положительно коррелирует с первичной резистентностью к иммунотерапии анти-PD-1 мАТ и более короткой кумулятивной продолжительностью иммунотерапии анти-PD-1 мАТ. Объяснение этому феномену находится в механизме действия лифилюцела, который нам еще предстоит изучить. Но уже сейчас становится понятно, что появился новый (или хорошо забытый старый) метод лечения пациентов с метастатической меланомой, нечувствительной к иммунотерапии антиPD-1 мАТ. Причем применять этот метод следует как можно раньше, уже при первых признаках резистентности к иммунотерапии.
IMCgp100-202: тебентафасп – прорыв в лечении метастатической увеальной меланомы. В сентябрьском номере одного из самых престижных медицинских журналов The New England Journal of Medicine опубликован промежуточный анализ результатов международного открытого клинического исследования III фазы IMCgp100-202, в котором оценивали эффективность тебентафаспа в сравнении с терапией по выбору исследователя [9]. Тебентафасп – это первый препарат из нового класса иммуноонкологических препаратов с двойной специфичностью, состоящий из растворимого Т-клеточного рецептора, соединенного с анти-CD3 иммуноэффекторным доменом. Синтезированный Т-клеточный рецептор направлен к гликопротеину 100 (gp100, PMEL) – меланома-ассоциированному антигену, экспрессирующемуся в меланоцитах и клетках меланомы. Таким образом, тебентафасп соединяет опухолевую клетку с Т-лимфоцитом, перенаправляя лимфоциты к опухоли. Это приводит к активации Т-лимфоцита, распознаванию Т-лимфоцитом опухолевой клетки и ее уничтожению. В исследовании принимали участие пациенты с метастатической увеальной меланомой с HLA фенотипом HLAA*02:01 (n=378). Пациентов случайным образом распределяли в соотношении 2:1 в одну из двух групп: в группу тебентафаспа (n=252) или в группу терапии по выбору исследователя – пембро (n=103), ипи (n=16) или дакарбазина (n=7). Стратификацию проводили по уровню ЛДГ. Основной целью исследования был анализ ОВ. Ожидаемая 1-летняя ОВ в группе пациентов, получавших тебентафасп, составила 73% (95% ДИ 66-79%) против 59% (95% ДИ 48-67%) в группе контроля. Ожидаемая медиана ОВ в группе пациентов, получавших тебентафасп, составила 21,7 месяца (95% ДИ 18,6-28,6 мес.) против 16,0 мес. (95% ДИ 9,7-18,4 мес.) в группе контроля. Стратифицированное ОР смерти составило 0,51 (95% ДИ 0,37-0,71; P<0,001) в пользу тебентафаспа. Ожидаемая 6-месячная БРВ в группе тебентафаспа составила 31%, а в группе контроля – 19%. Медиана продолжительности жизни без прогрессирования в группе тебентафаспа составила 3,3 мес. (95% ДИ 3,0-5,0 мес.), а в группе контроля – 2,9 мес. (95% ДИ 2,8-3,0 мес.). ЧОО в группе тебентафаспа составила 9% (медиана длительности ответа 9,9 мес.), а в группе контроля – 5% (медиана длительности ответа 9,7 мес.). Частота контроля над заболеванием в группе тебентафаспа составила 46%, а в группе контроля – 27%. Самыми частыми в группе тебентафаспа были НЯ, обусловленные высвобождением цитокинов (пирексия [76%], озноб [47%], гипотония [38%]), и кожная токсичность (сыпь [83%], зуд [69%], эритема [23%]). НЯ 3-4 степени наблюдали у 44% пациентов в группе тебентафаспа и у 17% в контрольной группе. Среди них в группе тебентафаспа самыми частыми были сыпь (18%), гипертермия (4%), зуд (4%), повышение уровня АСТ (4%), повышение уровня липазы (4%) и гипертензия (4%). Самыми частыми НЯ 3-4 степени в контрольной группе были повышение уровня липазы (5%) и диарея (3%). О смертельных случаях, связанных с лечением, не сообщалось. В настоящее время тебентафасп проходит ускоренную регистрацию в FDA. Ранее препарат получил статус орфанного препарата в США и Великобритании, что ускоряет получение разрешения на его применение в этих странах. И вновь, как это было 10 лет назад с иммуноонкологическими препаратами из группы анти-CTLA-4 и anti-PD-1 моноклональных антител, именно меланома стала опухолью, открывшей в клинической онкологии дорогу абсолютно новому классу противоопухолевых иммуноонкологических препаратов.
Источники:
1. Luke JJ, Rutkowski P, Queirolo P, et al. Pembrolizumab versus placebo after complete resection of high-risk stage II melanoma: Efficacy and safety results from the KEYNOTE-716 double-blind phase III trial. ESMO Congress 2021. Abstract LBA3_PR. Presented September 18, 2021.
2. Atkins MB, Lee SJ, Chmielowski B, et al. DREAMseq: A phase III trial – ECOG-ACRIN EA6134. ASCO Plenary Series. Abstract 356154. Presented November 16, 2021.
3. Ascierto PA, Mandala M, Ferrucci PF, et al. SECOMBIT: The best sequential approach with combo immunotherapy (ipilimumab/nivolumab) and combo target therapy (encorafenib/binimetinib) in patients with BRAF mutated metastatic melanoma: A phase II randomized study. ESMO Congress 2021. Abstract LBA40. Presented September 20, 2021.
4. Wolchok JD, Chiarion-Sileni V, Gonzalez R, et al. Long-Term Outcomes With Nivolumab Plus Ipilimumab or Nivolumab Alone Versus Ipilimumab in Patients With Advanced Melanoma. J Clin Oncol. 2021 Nov 24; JCO2102229. doi: 10.1200/JCO.21.02229. Epub ahead of print. PMID: 34818112.
5. Lipson EJ, Tawbi HAH, Schadendorf K, et al. Relatlimab plus nivolumab versus nivolumab in first-line advanced melanoma: Primary phase III results from RELATIVITY-047 (CA224-047). 2021 ASCO Annual Meeting. Abstract 9503. Presented June 6, 2021.
6. Journal of Clinical Oncology. 2021 May 20; 39 (15_suppl): 9504- 9504. doi:10.1200/JCO.2021.39.15_ suppl.9504.
7. Строяковский Д.Л., Абрамов М.Е., Демидов Л.В. и соавт. Практические рекомендации по лекарственному лечению меланомы кожи. Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2021 (том 11). 16.
8. Larkin J, Sarnaik A, Chesney JA, et al. Lifileucel (LN-144), a cryopreserved autologous tumor infiltrating lymphocyte therapy in patients with advanced melanoma: Evaluation of impact of prior anti–PD-1 therapy. 2021 ASCO Annual Meeting. Abstract 9505. Presented June 4, 2021.
9. Nathan P, Hassel JC, Rutkowski
P, et al. Overall Survival Benefit with
Tebentafusp in Metastatic Uveal
Melanoma. N Engl J Med. 2021;
385 (13): 1196-1206. doi:10.1056/
NEJMoa2103485.
НАИБОЛЕЕ ЗНАЧИМЫЕ ДОСТИЖЕНИЯ В ЛЕЧЕНИИ ОНКОУРОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ В 2021 ГОДУ
Автор: Гафанов Рустем Айратович
ФГБУ «Российский научный центр рентгенорадиологии», Москва
Достижения в лечении метастатического почечноклеточного рака
По мнению ведущих специалистов американского общества клинической онкологии (ASCO), в области лекарственной терапии онкоурологических заболеваний за последний год были достигнуты впечатляющие успехи. Для начала стоит обратить внимание на два исследования III фазы, целью которых было изучение возможности комбинирования таргетной и иммунотерапии при метастатическом почечноклеточном раке (ПКР) у пациентов, ранее не получавших противоопухолевое лечение по данному заболеванию. Открытое клиническое исследование CheckMate 9ER сравнило комбинацию кабозантиниба с ниволумабом против сунитиниба и выявило увеличение общей и беспрогрессивной выживаемости, а также частоты объективных ответов у пациентов с метастатическим почечноклеточным раком в группе иммунотаргетной терапии [1]. Осложнения 3 степени и выше отмечены у 75,3% больных, получавших комбинацию препаратов (против 70,6% в группе сунитиниба), но при этом пациенты отмечали лучшее качество жизни при применении комбинации. Другое, более позднее исследование CLEAR оценивало комбинации ленватиниба и пембролизумаба, ленватиниба и эверолимуса против сунитиниба [2]. Прослеживалось улучшение показателей ВБП при сравнении комбинации ленватиниба с пембролизумабом и ленватиниба и эверолимуса против сунитиниба. Однако применение второй комбинации не отразилось на улучшении ОВ в сравнении с сунитинибом (HR 1,15; 95% CI 0,88-1,50; P=0,30), при этом осложнения 3 степени встречались чаще при использовании обеих комбинаций. Улучшение показателей качества жизни (согласно данным опросников пациентов) при использовании комбинации кабозантиниба с ниволумабом по данным клинического исследования CheckMate 9ER, представленного на конференции, посвященной урогенитальному раку в 2021 году, дают режиму дополнительные преимущества [3]. Значительный прогресс достигнут в лечении несветлоклеточного метастатического почечноклеточного рака. За прошедшие годы получено мало данных из рандомизированных исследований. Немногочисленные проведенные исследования объединяют разнородные данные по неодинаковым гистологическим подтипам опухоли, что не позволяет правильно интерпретировать результаты. В рандомизированном исследовании II фазы SWOG 1500 сравнивались сунитиниб, кабозантиниб, саволитиниб и кризотиниб. Результатом этого исследования было статистически значимое увеличение выживаемости без прогрессирования в группе кабозантиниба в сравнении с сунитинибом и признание кабозантиниба стандартом лечения при данном заболевании [4]. Рассматриваемые в аналогичном исследовании ингибиторы тирозинкиназы MET (саволитиниб и кризотиниб) никак не повлияли на выживаемость без прогрессирования в сравнении с сунитинибом, хотя и соответствовали биологии опухоли. Учитывая отсутствие положительного эффекта на выживаемость, клинические исследования с использованием саволитиниба и кризотиниба были приостановлены.
Адъювантная терапия при почечноклеточном раке одобрена регулирующими органами США
по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило пембролизумаб для адъювантного лечения пациентов с почечноклеточным раком с умеренно-высоким или высоким риском рецидива после нефрэктомии или после нефрэктомии и резекции метастазов. Эффективность оценивалась в многоцентровом рандомизированном (1:1) двойном слепом плацебоконтролируемом исследовании KEYNOTE-564 с участием 994 пациентов со средним или высоким риском рецидива ПКР или M1 без признаков заболевания. Пациенты были рандомизированы для введения пембролизумаба 200 мг внутривенно каждые 3 недели или плацебо на срок до 1 года до рецидива заболевания или неприемлемой токсичности. Основным показателем эффективности лечения была оценка исследователя безрецидивной выживаемости (БРВ), определяемая как время до рецидива, метастазирования или смерти. Дополнительным критерием оценки результатов была общая выживаемость. Статистически значимое улучшение БРВ было продемонстрировано в предварительно заданном промежуточном анализе: 109 (22%) событий в группе пембролизумаба и 151 (30%) событие в группе плацебо. Медиана БРВ не была достигнута ни в одной из групп. На момент анализа БРВ данные об общей выживаемости не были зрелыми, с 5% смертей в общей популяции. Наиболее частыми побочными реакциями (≥20%), возникшими у пациентов в этом исследовании, были скелетно-мышечная боль, усталость, сыпь, диарея, зуд и гипотиреоз [5]. Рекомендуемая доза пембролизумаба составляет 200 мг каждые 3 недели или 400 мг каждые 6 недель до рецидива заболевания, неприемлемой токсичности или до 12 месяцев.
Достижения в лечении метастатического уротелиального рака
В терапии метастатического уротелиального рака (УР) также наблюдаются положительные изменения по результатам прошедшего года. Вероятно, наиболее впечатляющие данные были получены в международном рандомизированном клиническом исследовании EV-301, в котором определяли эффективность применения энфортумаба ведотина (конъюгат моноклонального антитела к белку Нектин-4) по сравнению со стандартной химиотерапией при лечении платино-рефрактерного метастатическ3го УР. На основании полученных результатов был выявлен положительный эффект, выражающийся в увеличении общей и безпрогрессивной выживаемости с высокой частотой объективных ответов. Несмотря на наличие нежелательных явлений при применении энфортумаба ведотина (сыпь, периферическая нейропатия, и т.д.), лечение данным препаратом было полностью оправданно и переносилось пациентами лучше, чем химиотерапия [6]. По данным некоторых исследований, возможна комбинация энфортумаба ведотина с ингибиторами иммунных контрольных точек, об эффективности которой будет больше известно в ближайшем будущем.
Открытый вопрос – адъювантная терапия при уротелиальном раке
Вероятнее всего, адъювантная терапия – самый противоречивый аспект в лечении уротелиального рака. Результаты III фазы рандомизированного исследования CheckMate 274 были представлены на симпозиуме ASCO GU 2021. Целью этого рандомизированного исследования было сравнить результаты лечения пациентов, получающих ниволумаб, с результатами пациентов из группы плацебо при локализованном раке мочевого пузыря из группы высокого риска после хирургического лечения. Прослеживалось улучшение показателей безрецидивной выживаемости на фоне отсутствия данных по общей выживаемости [7]. Результаты этого исследования значительно отличались от ранее опубликованных из исследования IMvigor010, в котором были группы пациентов, получающих атезолизумаб, и контроля. Согласно полученным данным, не было выявлено различий ни в общей, ни в безрецидивной выживаемости [8]. Что же тогда может считаться стандартом в терапии уротелиального рака? Нескольким ключевым исследованиям может быть адресован этот вопрос. Рандомизированное исследование III фазы AMBASSADOR (NCT03244384) до сих пор продолжается, оно посвящено сравнению результатов лечения больных, получающих пембролизумаб, против контрольной группы. Это третье в своем роде исследование, и оно может быть рассмотрено как «разграничитель» между исследованиями CheckMate 274 и IMvigor 010. Немаловажным в выборе тактики касательно адъювантного лечения остается определение биомаркеров. В данный момент идут два рандомизированных исследования, направленных на поиск наиболее предпочтительной терапии в зависимости от наличия или отсутствия соответствующих биомаркеров. Исследование IMvigor 011 (NCT04660344) призвано оценить эффективность адъювантной терапии атезолизумабом у пациентов с высоким уровнем циркулирующей опухолевой ДНК по результатам высокочувствительных тестов. В рандомизированном клиническом исследовании PROOF302 (NCT04197986) авторы сравнивают группу пациентов, получающих инфигратиниб (селективный ингибитор тирозинкиназы FGFR 3), с группой плацебо при выявленной FGFR3 мутации. Последнее исследование имеет особое значение, так как по данным CheckMate 274 адъювантная терапия ниволумабом оказалась менее эффективной у пациентов с опухолями верхних мочевыводящих путей – областью с более часто встречающейся FGFR3 мутацией.
Радионуклидная терапия в лечении метастатического кастрационно-резистентного рака предстательной железы (мКРРПЖ)
Снижение риска смерти на 40% наблюдалось при добавлении 177Lu-PSMA-617A к стандартной терапии пациентов с PSMAположительным метастатическим кастрационно-резистентным раком простаты. Статистически значимое улучшение общей выживаемости (ОВ) было зарегистрировано в исследовании III фазы VISION с добавлением целевой радиолигандной терапии 177 Lu-PSMA-617 (LuPSMA) к стандарту лечения (SOC) у пациентов с прогрессирующим PSMA-положительным мКРРПЖ. Результаты, представленные во время ежегодного конгресса ASCO 2021, показали, что при среднем периоде наблюдения 20,9 месяца добавление LuPSMA к стандартному лечению привело к достоверному и значительному улучшению медианы выживаемости без прогрессирования на 5,3 месяца, что привело к снижению риска прогрессирования или смерти на 60% (HR 0,40). По другому важному первичному показателю, которым являлась ОВ, также отмечено достоверное улучшение: медиана ОВ составила 15,3 месяца против 11,3 месяца при поддерживающем лечении (HR 0,62). Также наблюдалось статистически значимое преимущество в пользу группы LuPSMA для ключевых вторичных конечных точек, таких как частота объективного ответа (ЧОО), частота контроля над болезнью (ЧКБ) и время до первого симптоматического скелетного события (ССС). ЧОО и ЧКБ составили 29,8% против 1,7% и 89,0% против 66,7% соответственно. Среднее время до первого ССС составляло 11,5 месяца в группе LuPSMA по сравнению с 6,8 месяца в контрольной группе [9]. Это исследование демонстрирует альтернативу традиционным методам лечения с использованием системной лучевой терапии, направленной на антиген PSMA. Использование радиолигандной терапии ПСМА, если она получит одобрение регулирующих органов, действительно может стать важным вариантом лечения для этих пациентов с рефрактерным заболеванием. В заключение можно сказать, что 2021 год был продуктивным в исследованиях по лекарственной терапии при онкоурологических заболеваниях. Данные, полученные из последних клинических исследований, в комплексе с мнениями ведущих экспертов должны помочь усовершенствовать подход к лечению этих пациентов, особенно на поздних стадиях.
Литература:
1. Choueiri TK, Powles T, Burotto M, et al. 696O_PR: Nivolumab + cabozantinib vs sunitinib in first-line treatment for advanced renal cell carcinoma: First results from the randomized phase III CheckMate 9ER trial. Ann Oncol. 2020; 31 (suppl 4): S1159.
2. Motzer R, Alekseev B, Rha S-Y, et al. Lenvatinib plus pembrolizumab or everolimus for advanced renal cell carcinoma. N Engl J Med. February 13, 2021 (early release online).
3. Cella D, Choueiri TK, Blum SI, et al. Patient-reported outcomes of patients with advanced renal cell carcinoma treated with first-line nivolumab plus cabozantinib versus sunitinib: The CheckMate 9ER trial. 2021 Genitourinary Cancers Symposium. Abstract 285. Presented February 13, 2021.
4. Pal SK, Tangen C, Thompson IM, et al. Sunitinib versus cabozantinib, crizotinib, or savolitinib in metastatic papillary renal cell carcinoma: Results from the randomized phase II SWOG 1500 study. 2021 Genitourinary Cancers Symposium. Abstract 270. Presented February 13, 2021.
5. Choueiri TK, Tomczak P, Park SH, et al. Pembrolizumab versus placebo as post-nephrectomy adjuvant therapy for patients with renal cell carcinoma: Randomized, double-blind, phase III KEYNOTE-564 study. 2021 ASCO Annual Meeting. Abstract LBA5. Presented June 6, 2021.
6. Powles T, Rosenberg JE, Sonpavde G, et al. Primary results of EV-301: A phase III trial of enfortumab vedotin versus chemotherapy in patients with previously treated locally advanced or metastatic urothelial carcinoma. 2021 Genitourinary Cancers Symposium. Abstract 393. Presented February 12, 2021.
7. Bajorin DF, Witjes JA, Gschwend J, et al. First results from the phase 3 CheckMate 274 trial of adjuvant nivolumab vs placebo in patients who underwent radical surgery for high-risk muscle-invasive urothelial carcinoma (MIUC). 2021 Genitourinary Cancers Symposium. Abstract 391. Presented February 12, 2021.
8. Hussain MHA, Powles T, Albers P, et al. IMvigor010: Primary analysis from a phase III randomized study of adjuvant atezolizumab versus observation in high-risk muscle-invasive urothelial carcinoma. ASCO20 Virtual Scientific Program. Abstract 5000.
9. Morris MJ, De Bono JS, Chi KN,
et al. Phase 3 study of lutetium-177-
PSMA-617 in patients with metastatic
castration-resistant prostate cancer
(VISION). J Clin Oncol. 2021; 39 (suppl
15): LBA4.
ХАЛАВЕН 10 ЛЕТ СПУСТЯ: МЕСТО В ТЕРАПИИ МЕТАСТАТИЧЕСКОГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ
04.10.2021 состоялся онлайн симпозиум с международным участием компании Эйсай «Халавен 10 лет спустя. Место эрибулина в современном алгоритме лечения метастатического рака молочной железы». В мероприятии участвовали: профессор, онколог, заместитель директора онкологического отделения госпиталя Vall d’Hebron Хавьер Кортес (Барселона, Испания), д.м.н., профессор кафедры онкологии и паллиативной медицины РМАНПО Ирина Владимировна Колядина, д.м.н., заместитель директора МКНЦ им. А.С. Логинова по химиотерапии Людмила Григорьевна Жукова. Модератором встречи была д.м.н., заведующая химиотерапевтическим отделением ФГБУ "НМИЦ радиологии" МНИОИ им. П.А. Герцена Лариса Владимировна Болотина. Эксперты выступили с докладами, отразившими накопленный опыт применения эрибулина, а также провели дискуссии по множеству спорных и значимых вопросов лечения пациентов с HER2-негативным метастатическим раком молочной железы.
ЧТО НАЗНАЧИТЬ «ПОСЛЕ» АНТРАЦИКЛИНОВ И ТАКСАНОВ?
Алгоритм принятия решения назначения цитостатиков в последующей линии терапии после курса антрациклинов и таксанов остается актуальной и не до конца разрешенной задачей для химиотерапевтов, ведь существуют разные опции использования препаратов и необходимо сделать наиболее подходящий в конкретной клинической ситуации выбор. Ключевые аспекты и существующие варианты «терапевтического сценария» представил в своем докладе испанский коллега, профессор Хавьер Кортес. Специалист подчеркнул, что за последние 10 лет увеличилась общая выживаемость (ОВ) пациентов с метастатическим раком молочной железы (мРМЖ) вследствие расширения диагностических возможностей и спектра применяемых противоопухолевых препаратов. Однако, в когорте пациенток с HER2-негативным РМЖ всего 60% достигнет второй линии терапии, и только 40% доживет до третьей и четвертой. Это говорит о необходимости как можно более раннего назначения наилучшей опции лечения. За последние годы было несколько попыток поиска эффективных опций, которые не увенчались успехом. Единственным препаратом, увеличивающим ОВ после антрациклинов и таксанов, оказался эрибулин. В регистрационном исследовании EMBRACE он сравнивался с терапией по выбору врача, и преимущество в медиане по ОВ составило 2,7 месяцев [1]. Профессор Кортес подытожил, что по представленным данным считает эрибулин лучшей терапевтической опцией для второй линии и далее у пациентов с HER2- негативным мРМЖ за последние 10 лет.
ВИСЦЕРАЛЬНОЕ МЕТАСТАЗИРОВАНИЕ И ХИМИОТЕРАПИЯ
Тему висцерального метастазирования в контексте РМЖ и химиотерапии раскрыла И.В. Колядина. Эксперт отметила, что доминирующей локализацией метастазирования РМЖ являются кости (50%), легкие (30-35%), печень (20%), головной мозг (около 6%) и др. Крайне важно акцентировать внимание на висцеральных метастазах, потому что их появление драматически меняет судьбу пациенток, демонстрируя худшие показатели по выживаемости в сравнении с костными и мягкотканными метастазами. Возникает вопрос, что делать с пациентками, предлеченными антрациклинами и таксанами, с висцеральным метастатическим поражением. Ирина Владимировна аналогично склоняется к предпочтению эрибулина, представляя данные различных исследований. Японские коллеги изучали характер метастазирования 66 больных до терапии эрибулином и прогрессирование после нее, возникшее на фоне лечения [2]. Полученные данные фактически подтвердили теорию реверсии эпителиально-мезенхимального перехода как механизма противоопухолевой активности эрибулина. Оказалось, что половина пациентов до применения эрибулина имела прогрессирование в виде метастазов de novo, а пациентки, прогрессировавшие уже в процессе терапии препаратом, имели другой характер «прогрессии» – подрастание уже имеющихся очагов (лишь четверть из них имела новые очаги). Таким образом, Халавен, благодаря антимитотическому тубулин-опосредованному эффекту, меняет биологию опухолевого процесса, снижает агрессивность, лишая возможности колонизировать другие органы и ткани. Данные реальной клинической практики: анализ когорты из 443 пациенток онкологических центров Америки с подтвержденным мРМЖ с поражением легких или печени продемонстрировал выигрыш эрибулина в отношении одно- и двухлетней выживаемости в сравнении с гемцитабином и капецитабином в качестве третьей линии химиотерапии после антрациклинов и таксанов [3].
ВЫБОР ЦИТОСТАТИКА ПОСЛЕ ПРОГРЕССИРОВАНИЯ НА ТЕРАПИИ ИНГИБИТОРАМИ CDK 4/6 У АНТРАЦИКЛИН- И ТАКСАНПРЕДЛЕЧЕННЫХ БОЛЬНЫХ
Собственный российский опыт лечения 54 пациенток с люминальным HER2-негативным мРМЖ эрибулином после CDK4/6-ингибиторов, показал, что Халавен высокоэффективен как при рецидивирущем, так и при de novo мРМЖ, независимо от линии (2-я или 3-я), наличия висцеральных метастазов и их локализации. Это имеет сходство с результатами исследования EMPOWER, где медиана ВБП достигла 10 мес., а частота объективного ответа составила 31% [4]. Все эксперты отметили, что чрезвычайно чувствительными к эрибулину являются метастазы в легкие, также высокий ответ демонстрируют печеночные метастазы. Л.В. Болотина добавила комментарий, что эрибулин является очень хорошим препаратом в плане безопасности, его использование не усугубляет выраженность токсичности на фоне раннего применения таксанов.
ЭРИБУЛИН: КОГДА И КОМУ?
Когда назначить эрибулин и пациентам какого профиля, чтобы получить максимально эффективный ответ? На данную тему выступила Л.Г.Жукова, приведя доказательную базу на основании и исследований, и результатов реальной клинической практики и сделала вывод, что наиболее благоприятным профилем для назначения эрибулина обладают пациентки с гормонпозитивными HER2-негативными опухолями не позднее 2-й линии химиотерапии после CDK4/6-ингибиторов. При тройном негативном раке эрибулин – вариант выбора сразу после прогрессирования на опции таксаны + иммунотерапия/бевацизумаб/платиновые производные. Также эрибулин должен применяться во всех ситуациях, когда проведение иной химиотерапии сопряжено с непереносимой токсичностью. Л.В.Болотина и профессор Кортес отметили, что лучше использовать Халавен в более ранних линиях терапии вследствие не только большей эффективности, но и меньшей токсичности (преимущественно 2-я линия). Дискуссия завершилась консенсусом экспертов: эрибулин занял прочную позицию в качестве оптимальной опции лечения у пациентов, прогрессирующих на антрациклинах и таксанах при мРМЖ, причем раннее его назначение (2-я линия химиотерапии) обеспечивает более благоприятный прогноз. Халавен имеет еще не изученные молекулярно-генетические механизмы, способные менять биологию опухоли и препятствовать ее прогрессии, что дарит надежду и оставляет обширное поле для дальнейших исследований.
Литература:
1. Cortes J. et al. Eribulin monotherapy versus treatment of physician's choice in patients with metastatic breast cancer (EMBRACE): a phase 3 open-label randomised study //The Lancet. – 2011. – Т. 377. – №. 9769. – С. 914-923.
2. Fujii T, Tokuda S, Nakazawa Y, et al. Eribulin Suppresses New Metastases in Patients With Metastatic Breast Cancer. In Vivo. 2020;34(2):917-921.
3. Kazmi S, Chatterjee D, Raju D, Hauser R, Kaufman PA. Overall survival analysis in patients with metastatic breast cancer and liver or lung metastases treated with eribulin, gemcitabine, or capecitabine Breast Cancer Res Treat. 2020;184(2):559-565.
4. Mougalian S. et al. Utilization and
outcomes of Eribulin Mesylate POst a
cyclin-dependent kinase 4/6 inhibitor
(CDK 4/6i): An observational realWorld study in UnitEd States community
oncology pRactices (EMPOWER) //
Annals of Oncology. – 2019. – Т. 30. –
С. iii54.

СОВРЕМЕННЫЙ КЛАССИФИКАТОР РИСКА ПОМОЖЕТ РАНЬШЕ ПРЕДСКАЗАТЬ РЕЦИДИВ РАКА ЩИТОВИДНОЙ ЖЕЛЕЗЫ
Автор: Болотина Лариса Владимировна
МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России, Москва
В бюллетене ASCO Cancer in the News от 23 ноября 2021 года была представлена заметка, посвященная возможностям прогнозирования развития рецидива рака щитовидной железы (РЩЖ) после хирургического вмешательства. Материал составлен на основе публикации Nieto HR et al. в The Journal of Clinical Endocrinology & Metabolism [1] о 836 результатах исследования по выявлению факторов раннего рецидива после радикального лечения РЩЖ. Авторами работы разработана модель, позволяющая оценить совместно роль информационной РНК и микроРНК как прогностических маркеров рецидива опухоли. Авторы рассчитывают на то, что, применяя предлагаемую модель, клиницисты смогут увеличить выживаемость пациентов путем разработки индивидуальной программы наблюдения с учетом биологических особенностей опухолевых клеток.
В настоящее время онкологи используют клинические факторы в оценке риска возникновения рецидива заболевания, которые формируются на основании данных, полученных после проведения первичного лечения. Данная стратегия наблюдения за пациентами и определение объема гормоносупрессивной терапии может быть выработана только в послеоперационном периоде. Онколог не имеет четкого понимания о риске рецидива, пока лечение не завершено.
Nieto с соавторами проанализировали данные из The Cancer Genome Atlas (TCGA) для определения экспрессии генов (mRNA/ microRNA) у 46 пациентов с рецидивом РЩЖ и 455 пациентов без рецидива опухоли. Авторы изучали соматические мутации, функциональные гены исследовали с использованием клеточных линий РЩЖ. Прогностическую роль генов оценивали с использованием данных TCGA. Nieto с коллегами вычленили 128 новых потенциальных биомаркеров, ассоциированных с риском рецидива, включая 40 информационных РНК (mRNAs), 39 микро РНК (microRNAs) и 59 генетических вариантов. Оказалось, что различия в экспрессии генов у этих двух групп больных (с/без рецидива опухоли) проявлялись в модуляции фибронектина 1(FN1), интегрина альфа-3 (ITGalpha3) и MET протоонкогена рецептора тирозинкиназы (MET), что приводило к значимому влиянию на способность клеток РЩЖ к миграции. Помимо этого, авторами отмечено выключение miR-486 и miR-1179, также увеличивающих миграционные свойства TPC-1 и SW1736 клеток.
Далее исследователи оценили выделенные гены с точки зрения их функциональной роли и предложили шкалу-классификатор рисков по 5 генам. Результат, полученный при ее использовании, может рассматриваться как независимый предиктор рецидива РЩЖ. После контроля таких характеристик, как возраст, пол, стадия процесса, размер опухоли и статус лимфоузлов, мультивариантный анализ показал, что шкала-классификатор риска по 5 генам являлась инструментом, позволяющим распределить пациентов по группам соответственно прогнозу течения заболевания.
«С учетом ограниченного числа доступных лечебных опций раннее предсказание риска рецидива РЩЖ может оказать благотворное влияние на отдаленные результаты путем изменения характера послеоперационного наблюдения за пациентами с учетом индивидуальных рисков. Наши данные предполагают, что изучение таких генов, как FN1, ITGalpha3, MET, miR-486 и miR-1179, может быть полезным инструментом в будущем для персонализированного определения риска рецидива папиллярного РЩЖ», – заключили авторы.
Источник:
Nieto HR, et al. Next-generation
sequencing revealed more than 100
new biomarkers linked to thyroid
cancer recurrence. J Clin Endocrinol
Metab. 2021. doi:10.1210/clinem/dgab.
ВПЕРВЫЕ ЗА 10 ЛЕТ: РОССИЙСКОЕ ОБЩЕСТВО КЛИНИЧЕСКОЙ ОНКОЛОГИИ ОБЕСПЕЧИЛО ЛАБОРАТОРИЯМ ВОЗМОЖНОСТЬ ПРОЙТИ МЕЖДУНАРОДНЫЙ КОНТРОЛЬ КАЧЕСТВА ОТ EUROPEAN MOLECULAR GENETICS QUALITY NETWORK
Лаборатории, работающие в Программе молекулярно-генетической
диагностики в Российской Федерации с целью повышения эффективности противоопухолевого
лечения, проводимой RUSSCO, признают необходимость выполнения
не только входящего контроля качества, но и периодического внешнего
контроля качества молекулярно-генетических исследований.
Внешний контроль качества (ВКК)
- это система объективной оценки
результатов исследований в лаборатории, осуществленная внешней
организацией с целью обеспечения
сравнимости результатов, получаемых в разных лабораториях. В
отличие от внутреннего контроля,
который организует и проводит
ежедневно сама лаборатория, который выявляет в основном случайную ошибку, внешний контроль
проводится периодически сторонней организацией и направлен на
выявление ошибки систематической. Правильно используемые
результаты исследований по внешнему контролю качества не только
стимулируют повышение качества
лабораторных исследований, но и
совершенствуют организацию внутреннего контроля качества в лабораториях.
ВКК является общепринятым в России и мире подходом к обеспечению
качества лабораторных исследований. В частности, п. 1.5.1 «Положения об организации управления
качеством клинических лабораторных исследований в учреждениях
здравоохранения», утвержденного
Приказом Министерства Здравоохранения Российской Федерации
«О системе мер по повышению качества клинических лабораторных
исследований в учреждениях здравоохранения Российской Федерации» допускает «участие лабораторий в других программах внешней
оценки качества (международных,
коммерческих и региональных), в
частности для показателей, отсутствующих в ФСВОК». Согласно п.
1.6 Положения, «Главные специалисты по клинической лабораторной
диагностике органов управления
здравоохранением на всех уровнях
должны […] организовывать образовательные мероприятия, направленные на […] регулярное участие
во внешней оценке качества».
Российское общество клинической
онкологии ведёт активную работу
по становлению внешнего контроля качества онкогенетических тестов. Но до 2021 года в России отсутствовали провайдеры схем ВКК
для молекулярно-генетических
исследований в онкологии (http://
cancergenome.ru/quality_control/
protocols/).
В 2021 году при поддержке компании АстраЗенека удалось обеспечить схемами ВКК 28 лабораторий
из 21 региона. Провайдером выступила EMQN (https://www.emqn.
org/) – некоммерческая организация, с 1998 года занимающаяся
внешним контролем качества генетических исследований; обладатель сертификата ISO 17043 (Поставщик схем внешнего контроля
качества).
Некоторые лаборатории прошли
контроль по нескольким схемам
одновременно. Лаборатории участвовали в следующих схемах:
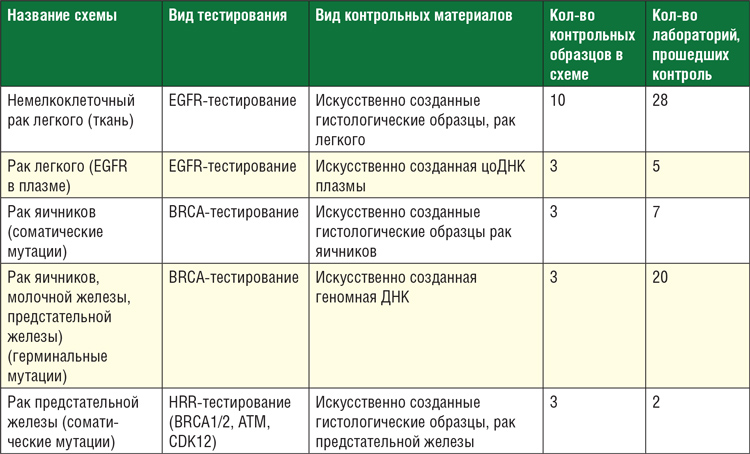
Благодаря исследованию не только стандартных образцов ДНК, но и образцов искусственной плазмы и гистологических блоков, лаборатории смогли проверить качество такого важного этапа как экстракция ДНК. Наибольшее число лабораторий приняли участие в ВКК для наиболее широко применяемых тестов: EGFRтестировании (http://cancergenome. ru/mutations/EGFR/) гистологических образцов и тестировании на наличие герминальных мутаций в генах BRCA (http://cancergenome.ru/mutations/ BRCA1_2/). Меньшее количество лабораторий смогли принять участие в схемах ВКК для исследований, направленных на выявление соматических мутаций в генах репарации ДНК, так как технологические ограничения пока не позволяют выполнить данное тестирование в большинстве молекулярно-генетических лабораторий онкологического профиля. Семь лабораторий смогли принять участие в ВКК по EGFR-тестированию свободно циркулирующей опухолевой ДНК плазмы, что важно для выполнения такого исследования, как анализ на мутацию Т790М гена EGFR (http:// cancergenome.ru/mutations/EGFR/ T790M/). Все лаборатории, подавшие заявки на участие в ВКК, проанализировали доставленные к ним стандартные образцы и подали результаты для оценки международными экспертами. По результатам оценки лаборатории получат сертификаты, признаваемые мировым сообществом. Результаты ВКК конфиденциальны и доступны только лабораториям-участницам. Российское общество клинической онкологии надеется, что в 2022 году большее число молекулярно-генетических лабораторий смогут присоединиться к ВКК и тем самым внесет свой вклад в улучшение медицинской помощи пациентам с онкологическими заболеваниями. Российское
Общество Клинической Онкологии выражает благодарность компании АстраЗенека за поддержку проекта.
Менеджер молекулярно-генетического проекта Российского общества клинической онкологии
Соколова О.В.
АКТУАЛЬНЫЕ ВОПРОСЫ ЛЕКАРСТВЕННОЙ ТЕРАПИИ РАКА ТЕЛА МАТКИ
18 ноября 2021 года в онлайнформате прошел экспертный форум «Актуальные вопросы лекарственной терапии рака тела матки». Главной задачей форума было обсуждение опыта работы с иммуно-таргетной терапией, как новой опцией лечения рака эндометрия, которую онкологическое сообщество по праву именует революционной. Не секрет, что более 20 лет ничего нового в лечении распространенного рака эндометрия не было представлено, в отличие от других индикаций, поэтому тематика вызвала большой интерес у слушателей, врачи активно участвовали в голосовании по ходу форума. Доклады, дискуссия и результаты опросов помогли понять реальную ситуацию и выработать тактику работы с иммуно-таргетной терапией на будущее.
Эксперты дискуссии:
• Жукова Людмила Григорьевна д.м.н., профессор, заместитель директора по онкологии, ГБУЗ Московского клинического научного центра имени А.С. Логинова ДЗМ, Москва
• Кедрова Анна Генриховна д.м.н., главный онколог ФМБА РФ, профессор, заведующая кафедрой акушерства и гинекологии Академии последипломного образования ФМБА России, заведующая отделением онкологии ФГБУ ФНКЦ ФМБА России, Москва
• Корниецкая Анна Леонидовна к.м.н., старший научный сотрудник отделения химиотерапии, отдела лекарственного лечения опухолей МНИОИ им. П. А. Герцена, Москва
• Нечушкина Валентина Михайловна д.м.н., председатель Евразийской рабочей группы по онкогинекологии, профессор кафедры онкологии, лучевой терапии и лучевой диагностики ФГБОУ ВО ПИМУ Минздрава России, заместитель директора Научно-образовательного центра «Евразийская онкологическая программа «EAFO», Председатель экспертного совета «Health Direct», Москва
• Тюляндина Александра Сергеевна д.м.н., профессор, заведующая химиотерапевтическим отделением ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» МЗ, Москва
• Хохлова Светлана Викторовна д.м.н., заведующая онкологическим отделением противоопухолевой лекарственной терапии, ФБГУ «НМИЦ центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» МЗ, Москва Иммуно-таргетная терапия – новый шанс для пациенток с РЭ
Открывал научную программу доклад С.В. Хохловой «Год после регистрации иммуно-таргетной терапии: что изменилось в ведении пациенток с мРТМ, какие сложности, какие достижения?» Благодаря пониманию биологии рака эндометрия (РЭ), в арсенале клиницистов появились высокоэффективные схемы лечения, сочетающие преимущества таргетной и иммунотерапии и уже нашедшие отражение в современных рекомендациях как европейских, так и российских. С 2020 года определение статуса MSI (микросателлитной нестабильности) и MMR-статуса (дефектов системы репарации ДНК) рассматривается как часть оптимальной стратегии по подбору 2 режима линии РЭ. При отсутствии MSI/ MMR в опухоли (а таких пациенток, по данным исследований, более 70%) оптимальным является выбор в пользу иммуно-таргетного режима. С 2022 года схема будет включена в стандарт лечения клинико-статистической группы (КСГ), что будет способствовать ещё более широкому применению комбинации ленватиниба и пембролизумаба в клинической практике. Эксперт обозначила и трудности связанные с возможной токсичностью комбинации, что требует обучения специалистов, относительно небольшая частота определения статуса MSI/MMR в некоторых регионах. При голосовании на вопрос, смещён ли фокус на другие индикации, есть ли инертность лечения (назначают то, к чему привыкли) 55% слушателей ответили положительно. Спикеры связали это с опасениями относительно доступности новых видов терапии и предложили несколько схем лечения, которые можно использовать уже сейчас. Из достижений в лечении РЭ, которые произошли за этот год в реальной клинической практике, 82% слушателей отметили расширение охватом тестированием для определения MSI/MMR статуса, 91% – ведение пациентки с РЭ мультидисциплинарной командой. Собственным опытом назначения комбинации пембролизумаба и ленватиниба обладают 58% аудитории. Обсуждая первый доклад, спикеры перечислили вызовы на ближайшее будущее при назначении имунно-таргетной лекарственной терапии РЭ. По мнению Л.Г. Жуковой и С.В. Хохловой, во-первых, это появление и внедрение новых методов лечения. А.С. Тюляндина и А.Г. Кедрова добавили к этому необходимость накопления практического опыта работы с комбинацией пембролизумаба и ленватиниба в России. А.Л. Корниецкая добавила повышение доступности новых препаратов в регионах нашей страны.
Анна Леонидовна Корниецкая в своем сообщении сфокусировала внимание аудитории на вопросах тестирования MMR/MSI при раке эндометрия. Более доступным и широко применяемым методом является иммуногистохимическое исследование (ИГХ). При получении неоднозначных результатов ИГХ применяется эталонный метод – полимеразная цепная реакция (ПЦР) с различными наборами маркеров. Если данные ИГХ и ПЦР расходятся, применяется ещё более точный метод — секвенирование нового поколения (NGS). Однако в исследованиях были продемонстрированы высокие специфичность и чувствительность ИГХ метода. При проведении ИГХ крайне важна качественная подготовка биологического материала для исследования. На вопрос, на каких этапах заболевания следует проводить тестирование для выявления микросателлитной нестабильности, 98% слушателей ответили (75 подключений), что материал для тестирования нужно направлять уже после первой операции. А.Л. Корниецкая и Л.Г. Жукова прокомментировали, что иметь данные тестирования MSI/MMR особенно важно для пациенток с высоким риском, чтобы не терять драгоценное время при последующем прогрессировании. С.В. Хохлова отметила, что знание статуса MMR/MSI значимо для последующего лечения. А.С. Тюляндина заметила, что в рекомендациях строго не прописаны сроки тестирования пациенток, но есть тенденция к определению MMR/ MSI операционного материала на первом этапе согласно клинической практике. Эксперты сошлись во мнении, что если есть материал для тестирования на выбор, то целесообразно определять MMR/ MSI в метастатической опухоли.
Эффективность и длительный контроль заболевания
Александра Сергеевна Тюляндина представила сообщение на тему «Место новой комбинации в лечении распространенного рака тела матки. Первый анализ российского опыта использования комбинации Ленвимы и Китруды». Эксперт напомнила, что основанием для одобрения комбинации ленватиниба и пембролизумаба (в том числе в России) стали результаты исследования 111/KEYNOTE 146, которое показало частоту объективных ответов 38% на комбинации после рецидива/прогрессирования на системной терапии у больных РЭ в группе пациенток без нарушений микросателлитной нестабильности и системы репарации ДНК. Исследование III фазы 309/KEYNOTE 775 показало достоверное увеличение общей выживаемости (ОВ) и выживаемости без прогрессирования (ВБП) с увеличением продолжительности жизни на 32% при применении комбинации ленватиниба и пембролизумаба в сравнении с терапией по выбору врача, вне зависимости от гистотипа опухоли и предшествующей лучевой терапии. Наибольшее преимущество получали пациентки с наименьшим числом предшествующих курсов химиотерапии (ХТ). Докладчик представила российский опыт применения комбинации по данным 34 пациенток со стабильным микросателлитным статусом. У 4,3% пациенток достигнут полный ответ, у 21,7% – частичный ответ, у 69,6% – стабилизация. Эксперт объяснила результаты небольшим сроком наблюдения с момента начала применения новой опции терапии. У пациенток, перешедших рубеж 6 месяцев, удается достичь контроля заболевания. Профиль безопасности терапии соответствовал профилю безопасности, описанному в регистрационном исследовании. Опрос показал, что появление комбинации изменило практику назначений у 69% аудитории. Первый анализ результатов реальной клинической практики оказался очень важным для слушателей и экспертов, у 60% врачей накопился пул пациентов, которые могут получить значимую клиническую пользу в ближайшие 3 месяца. Эксперты отметили, что на фоне пандемии некоторые пациентки вынуждены прерывать терапию комбинацией ленватиниба и пембролизумаба. И даже при отсутствии лечения в течение нескольких недель отмечается отсутствие признаков прогрессирования РЭ. После купирования инфекционного заболевания рекомендуется возобновить терапию комбинацией. Л.Г. Жукова ведет отсчет опыта применения комбинации с конца 2019 года при хороших результатах выживаемости пациенток. Спикеры заключили, что комбинация будет иметь максимальную эффективность у пациенток без микросателлитной нестабильности с рецидивом после 1 линии ХТ, не нуждающихся в лучевой терапии и хирургическом лечении.
Комбинация и этапность лечения: роль платинорезистентности
Место комбинации в зависимости от резистентности к препаратам платины определила Анна Генриховна Кедрова в своем сообщении «Платиночувствительные и платинорезистентные пациенты: разница в клиническом течении заболевания и особенности ведения пациентов данных подгрупп». Эксперт отметила, что эффективность схем с включением препаратов платины во 2 линии терапии значительно ниже, чем в 1 линии (порядка 40% и 25%, соответственно), особенно у пациенток с бесплатиновым промежутком до 6 месяцев. Поиск эффективной терапии 2 линии занял значительное время, эффективность ХТ даже в комбинаторных режимах была крайне низкой. Таргетная и иммунотерапия в монорежиме при отсутствии микросателлитной нестабильности также оказались недостаточно эффективными, однако их комбинация показала эффективность в исследовании 309/KEYNOTE 775. Комбинация пембролизумаба и ленватиниба показала преимущество по таким показателям эффективности как ВБП и ОВ у пациенток с бесплатиновым промежутком до одного года. Дополнительным аргументом является ожидаемая длительная стабилизация процесса при получении ответа на комбинацию. Сегодня комбинация пембролизумаба и ленватиниба включена в клинические рекомендации, и при её назначении во 2 линии терапии её эффективность отмечается даже у пациенток с плохим прогнозом (при отсутствии микросателлитной нестабильности). После системной терапии, применение комбинации обеспечивает тем большее преимущество, чем раньше она будет назначена. С.В. Хохлова заметила, что у пациенток с высокодифференцированной опухолью и гормонпозитивностью опухоли целесообразно в 1 линии назначать не ХТ, а гормонотерапию. У пациенток с низкодифференцированной опухолью вне зависимости от гормонального статуса рационально выбирать комбинацию пембролизумаба и ленватиниба. После прогрессирования на 1 линии сложно предполагать ответ на гормонотерапию, поэтому целесообразно в максимально ранние сроки назначать имунно-таргетную комбинацию. Эффективность комбинации против платинасодержащей комбинации у пациенток с бесплатиновым промежутком более 12 месяцев остается предметом изучения ввиду небольшой выборки данной группы в исследовании 309/ KEYNOTE 775. Однако Л.Г. Жукова, опираясь на наличие в когортах применения иммуносодержащих схем «выигрывающих от терапии долгожителей», предположила преимущества комбинации и в этой группе. У пациенток с быстрым прогрессированием РЭ в адъювантном режиме оправдано назначение комбинации пембролизумаба и ленватиниба в 1 линии терапии.
Маршрутизация пациентов
О маршрутизации пациентов с РЭ говорила Валентина Михайловна Нечушкина в докладе об актуальности мультидисциплинарного подхода и роли специалистов разных направлений в лечении больных раком эндометрия. В реалиях отечественной онкологии пациенток с первично диссеминированным РЭ зачастую направляют к химиотерапевтам, стараясь отложить операцию или вовсе её избежать. Как показали исследования, более целесообразен этап хирургического лечения с полной циторедукцией, именно в когорте таких пациенток отмечается значимое повышение медианы ОВ. Недостаточная преемственность лечения и позднее выявление прогрессирования РЭ могут ухудшать прогнозы. Эффективное использование комбинации пембролизумаба и ленватиниба на практике возможно при наличии препаратов и их доступности, учете сопутствующих заболеваний и подготовленности врачей в управлении нежелательными явлениями (НЯ). Эксперт назвала важным шагом внедрение комбинированной схемы назначения пембролизумаба и ленватиниба в КСГ с 1 января 2022 года. Первоочередным и самым реальным, по мнению экспертов, является совершенствование знаний и опыта специалистов всех направлений онкологии и ликвидация формализации при проведении консилиумов. Москва в плане возможностей онкологической помощи является пионером, на которого ориентируются регионы. Московские врачи имеют больший опыт назначения комбинации пембролизумаба и ленватиниба. Для обмена клиническим опытом спикеры предложили активнее использовать современные телемедицинские технологии.
Управление нежелательными явлениями
Сообщение Людмилы Григорьевны Жуковой «Профилактика и коррекция нежелательных явлений пациентов: что важно оценить до начала терапии и контролировать в процессе лечения?» предварял ещё один опрос аудитории, в ходе которого выяснилось, что 50% врачей видят барьер на пути назначения комбинации в виде НЯ. Менее половины слушателей не видят корреляции между проявлениями НЯ и эффективностью терапии на комбинации. Проводить коррекцию артериального давления (АД) считают нужным подавляющее большинство врачей. А.С. Тюляндина поделилась положительным опытом назначения комбинации уже через 3 дня после нормализации АД. Л.Г. Жукова уточнила, что комбинация пембролизумаба и ленватиниба при РЭ, при несомненной эффективности, обладает спектром специфических НЯ. Самыми частыми для пембролизумаба являются сыпь, утомляемость, диарея, тошнота, гипотиреоз, но серьезные нежелательные явления встречаются редко. Ленватиниб чаще всего вызывает такие нежелательные явления как повышение АД, утомляемость, диарея, снижение аппетита, тошнота. В исследовании 2 фазы серьёзные нежелательные явления стали причиной прекращения приема ленватиниба у 30,8% пациентов. Комбинация предусматривает применение ленватиниба в дозе 20 мг per os 1 раз в сутки и пембролизумаба в дозе 200 мг внутривенно 1 раз каждые 3 недели. В исследовании 111/ KEYNOTE 775 у пациенток без признаков микросателлитной нестабильности РЭ профиль безопасности комбинации был предсказуемым, самыми распространенными нежелательные явления были повышение АД, диарея, слабость, снижение аппетита, гипотиреоз, тошнота, стоматит, рвота. Эксперт отметила, что участники исследования, как правило, испытывали единичные эпизоды нежелательных явлений (например, однократное повышение АД). Токсичность комбинированного режима складывается из спектров токсичности ингибитора тирозинкиназ и иммуноонкологического препарата, и большинство нежелательных явлений все-таки обусловлены применением ленватиниба. Сегодня разработаны рекомендации пошаговой редукции дозы ленватиниба, однако наибольшая частота объективных ответов достигается на полной дозе препарата, с большим отрывом даже от минимально редуцированной дозы. Основываясь на данных исследований 211 и 218, эксперт назвала более целесообразной тактику начала терапии с полной дозы ленватиниба 20 мг, чем тактику старта с редуцированной дозы с последующей эскалацией. Накопление опыта позволяет прогнозировать НЯ и корректировать их согласно рекомендациям. Завершая форум, эксперты пришли к выводу, что для успешной работы с нежелательными явлениями необходимо подробно информировать пациента, стабилизировать сопутствующие заболевания, обеспечить телефонный контакт с администратором для непрерывного мониторинга и быстрого реагирования на нежелательные явления. Спикеры единодушно сошлись во мнении, что появление комбинации ленватиниба и пембролизумаба при РЭ можно назвать «прорывом года» в онкогинекологии.
Источники:
1. Makker V, Taylor MH, Aghajanian C, et al. Lenvatinib Plus Pembrolizumab in Patients With Advanced Endometrial Cancer. J Clin Oncol. 2020;38(26):2981-2992.
2. Makker V, et al. A multicenter, open-label, randomized, phase III study to compare the efficacy and safety of lenvatinib in combination with pembrolizumab versus treatment of physician's choice in patients with advanced endometrial cancer - ScienceDirect https://www. sciencedirect.com/science/article/abs/ pii/S0090825821006570
3. Инструкция по медицинскому применению препарата ЛЕНВИМА®: РУ ЛП 003398 от 29.12.2015, c изменениями от 30.12.2020
4. Инструкция по медицинскому применению препарата КИТРУДА®: РУ ЛП-003972, c изменениями от 05.2021. ISI-2691
5. Soldan et al. Characterization and Management of Adverse Reactions in Patients With Endometrial Carcinoma Receiving Lenvatinib Plus Pembrolizumab (Study 111/ KEYNOTE-146):Nurse Roles in Patient Education and AdverseReaction Management, 11th Annual Navigation & Survivorship Conference (Academy of Oncology Nurse & Patient Navigators); virtual meeting, November 4–8, 2020. P011; The Oncologist 2021;26:e1599–e1608
6. Dr Pal, ClinicalTrials.gov identifier: NCT03173560 Poster presented at the: International Kidney Cancer Symposium,Virtual Meeting November 6–7, 2020
7. Marcia Brose, ClinicalTrials. gov identifier: NCT02702388 Poster presented at the: European Society for Medical Oncology Asia; Virtual Format, November 20–22, 2020
Обзор подготовила
Екатерина Демьяновская,
к.м.н., врач невролог.
ESMO 2021: CHECKMATE 214. САМЫЙ ДЛИТЕЛЬНЫЙ ПЕРИОД НАБЛЮДЕНИЯ СРЕДИ ВСЕХ ИММУНООНКОЛОГИЧЕСКИХ АГЕНТОВ В ЛЕЧЕНИИ ПАЦИЕНТОВ С МЕТАСТАТИЧЕСКИМ ПОЧЕЧНО-КЛЕТОЧНЫМ РАКОМ (МПКР) В ПЕРВОЙ ЛИНИИ ТЕРАПИИ – 5 ЛЕТ
В исследовании СheckМate 214 оценивалась эффективность и безопасность двойной иммуно- онкологической комбинации – ниволумаба и ипилимумаба (Опдиво®+ Ервой®). Исследование подтвердило, что определение группы прогноза имеет не только важное прогностическое значение, но и необходимо для разработки оптимальной тактики лечения. Согласно современным клиническим рекомендациям, в настоящее время большинство пациентов с мПКР должны получать комбинированные опции лечения – двойную иммунную комбинацию или иммуно-таргетные схемы. Комбинация ниволумаба с ипилимумабом (ниво+ипи) в первой линии терапии впервые продемонстрировала преимущество в эффективности по сравнению с недавним стандартом терапии сунитинибом у больных мПКР с промежуточным и неблагоприятным прогнозом по шкале IMDC (Metastatic Renal Cell Carcinoma Database Consortium). В настоящий момент наиболее прослеженными данными среди всех доступных опций терапии с включением иммунонокологиеских препаратов обладает комбинация ниволумаба и ипилимумаба. На конгрессе ESMO 2021 были представлены результаты 5–летнего наблюдения по применению двойной иммунотерапии у пациентов с раком почки. В исследовании 3 фазы CheckMate 214 при минимальном периоде наблюдения 60,0 месяцев общая выживаемость (ОВ) у больных групп промежуточного и плохого прогноза была достоверно выше в группе ниво+ипи. Пятилетняя продолжительность жизни у таких пациентов составила 43%, с медианой ОВ 47,0 мес. (HR 0,68; p<0,0001). Впервые за всю историю изучения рака почки получены такие цифры. Ниво+ипи также показали преимущество в отношении выживаемости без прогрессирования (ВБП): 5-летний показатель составил 31% в группе плохого и промежуточного прогноза, с медианой ВБП 11,6 мес. (HR 0,73, p = 0,0004). При этом с 24 месяца начинает формироваться плато кривой выживаемости без прогрессирования в группе ниво+ипи и продолжается до 5 лет. Частота подтвержденных объективных ответов (ЧОО) была существенно выше у пациентов, получавших ниво+ипи (42% против 27%; p<0,001) согласно оценке независимого комитета (IRRC). Важно, что медиана длительности ответа на терапии ниво+ипи при максимальном периоде прослеженности данных 5 лет не достигнута, такого показателя не продемонстрировало ни одно исследование по применению иммунотерапии в 1 линии лечения мПКР. Частота полных ответов (ПО) в группе промежуточного и плохого прогноза составила 11% (против 2% в группе сунитиниба). Пациенты группы ниво + ипи чаще достигали ПО и в последующем не прогрессировали в сравнении с сунитинибом (9,6 % против 2,4%). В рамках 5-летней оценки эффективности в рамках исследования CheckMate 214 впервые был выполнен анализ долгосрочной выживаемости и введен в обиход термин conditional survival («условная выживаемость», «прогнозируемая выживаемость», «обусловленная выживаемость»). Термин conditional survival оценивает вероятность ненаступления события (для пациента это означает оставаться в живых, без прогрессии, сохраняя ответ на лечение) после достижения конечной точки в исследовании. Результаты conditional survival определялись как вероятность того, что пациент останется жив, не будет прогрессировать или достигнет ответа в течение дополнительных 2 лет после годичной отсечки контрольных точек времени, и были проанализированы ретроспективно в общей популяции, а также популяциях промежуточного, плохого и благоприятного прогноза. Данный вид анализа является новым, клинически значимым методом оценки выживаемости и ответа у пациентов, достигших или переживших годовой показатель, что позволяет врачам и пациентам оценивать прогноз заболевания и принимать решения в отношение дальнейшей терапии. Вероятность не умереть от любой причины у пациентов групп промежуточного и плохого прогноза, которые были живы 3 года, в течение 2 последующих лет составляет 79% в группе ниво+ипи (против сунитиниба 72%). У пациентов без прогрессирования заболевания через 3 года после начала лечения комбинацией двух иммунотерапевтических препаратов вероятность отсутствия прогрессирования в течение еще 2 лет составит в группе промежуточного и плохого прогноза 90% в сравнении с 62% на сунитинибе. Был также проведен анализ conditional survival в зависимости от исходных характеристик пациентов и было показано, что вероятность остаться в живых еще 2 года была одинакова у всех больных вне зависимости от PD-L1 экспрессии, наличия нежелательных явлений (НЯ), связанных с терапией (степень ≥3) или ИМТ. При этом к 3-му году терапии данный показатель во всех группах увеличивался. Вероятность остаться в живых еще 2 года в некоторой степени варьировала в разных возрастных группах пациентов (особенно в нулевой точке), однако показатели стабильно улучшались к третьему году. В рамках более длительного периода наблюдения были прослежены показатели частоты развития НЯ, а также оценено качество жизни на терапии ниволумабом и ипилимумабом в сравнении с сунитинибом. Количество связанных с лечением НЯ 3–4 степени тяжести реже встречались у пациентов, получающих ниво+ипи (48%) по сравнению с сунитинибом (64%). Частота возникновения связанных с терапией НЯ любой степени и высокой степени (иммуноопосредованных) в группе НИВО+ИПИ не отличалась от ранее доложенных результатов. Комбинация ниволумаба и ипилимумаба продемонстрировала преимущество в качестве жизни над сунитинибом и в долгосрочной перспективе. Наибольшее преимущество в качестве жизни было отмечено у пациентов групп промежуточного и плохого прогноза, а также в популяции в целом.
Robert J Motzer at al. Presented at the ESMO Virtual Congress 2021: September 16–21. Poster Number 661P.
На правах рекламы.

