
Дорогие коллеги!
Российское общество клинической онкологии (RUSSCO) приветствует всех участников XXIX Российского онкологического конгресса!

Антон-Рафаэль Менгс. Автопортрет в красной мантии. 1744-1745 гг.
Пастель, бумага. Галерея старых мастеров, Дрезден.
Дорогие коллеги, дорогие друзья!
Традиционно самый объемный номер нашей газеты выходит в преддверии главного онкологического события года – ежегодного Российского онкологического конгресса, который мы всегда негласно называли «ноябрьским конгрессом». Именно ....
Интрига раскрыта: назван победитель интенсива RUSSCO по опухолям ЖКТ!
Это были три невероятно насыщенных дня! 16 ноября завершил свою работу онлайн-интенсив RUSSCO, посвященный актуальным вопросам лекарственной терапии опухолей ЖКТ. Настоящий мозговой штурм объединил...
ОЦЕНКА ПОТЕНЦИАЛЬНОЙ ВОСТРЕБОВАННОСТИ УДАЛЕННЫХ ФОРМАТОВ ОНКОЛОГИЧЕСКОЙ ПОМОЩИ, НЕОБХОДИМЫХ ТРЕБОВАНИЙ, РИСКОВ, БАРЬЕРОВ И ПОТЕНЦИАЛЬНЫХ ПРЕИМУЩЕСТВ ИХ ВНЕДРЕНИЯ
В последние годы одним из перспективных направлений развития системы здравоохранения в онкологии является внедрение стационарзамещающих технологий с медицинской помощью на дому...
Практика BRAF-тестирования у клиницистов: результаты опроса Российского общества клинической онкологии (RUSSCO)
Целью исследования было оценить текущие подходы к диагностике мутаций в гене BRAF в клинической практике онкологов России. Проведен опрос 50 специалистов из различных регионов и типов учреждений. Среди респондентов больше всего

НОВОСТИ ESMO 2025 / ТРАСТУЗУМАБ ДЕРУКСТЕКАН В КАЧЕСТВЕ НЕОАДЪЮВАНТА/ АДЪЮВАНТА УЛУЧШАЕТРЕЗУЛЬТАТЫ ЛЕЧЕНИЯ ОПЕРАБЕЛЬНОГО HER2-ПОЗИТИВНОГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ
Отшумело и пронеслось ESMO 2025 с его урожайными результатами исследований, посвященных лечению больных раком молочной железы (РМЖ). После первого вау-эффекта пришло время в спокойной обстановке оценить полученные данные...
НОВОСТИ ESMO 2025 / CDK4/6 КАК ДОБАВЛЕНИЕ К АДЪЮВАНТНОЙ ГОРМОНОТЕРАПИИ ГОРМОНОЧУВСТВИТЕЛЬНОГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ
На конгрессе ESMO были обновлены отдаленные результаты лечения больных гормоночувствительным раком молочной железы (РМЖ) комбинацией ингибиторов ароматазы и ингибиторов CDK4/6 в рамках исследований monarchE и NATALEE...
НОВОСТИ ESMO 2025 / КОНЪЮГАТЫ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ И ЦИТОСТАТИКОВ В ПЕРВОЙ ЛИНИИ ТЕРАПИИ МЕТАСТАТИЧЕСКОГО ТРОЙНОГО НЕГАТИВНОГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ
От первых успешных результатах конъюгатов моноклональных антител и цитостатиков (ADC) в раннем раке переходим к их наступлению в лечении метастатического рака молочной железы (РМЖ).

НОВОСТИ ESMO 2025 / POST-ESMO2025: КАК МЫ БУДЕМ ЛЕЧИТЬ РАСПРОСТРАНЕННЫЙ РАК ЯИЧНИКОВ?
Юбилейный 50-й конгресс ESMO 2025 собрал более 37 000 участников из 174 стран, в ходе мероприятия были представлены результаты множества работ, имеющих не только научную, но и непосредственную практическую значимость. Рак...

НОВОСТИ ESMO 2025 / ПРОРЫВЫ В ТЕРАПИИ РАКА МОЧЕВОГО ПУЗЫРЯ
На конгрессе ESMO 2025 представлено множество значимых результатов, демонстрирующих прогресс в лечении рака мочевого пузыря. Итоги крупных клинических исследований, включая материалы Президентского симпозиума, обозначили новые...

НОВОСТИ ESMO 2025 / ОПУХОЛИ ГОЛОВЫ И ШЕИ
Состоявшийся в октябре 2025 года ежегодный конгресс ESMO хоть и не был богат на представление исследований, меняющих клиническую практику в разделе опухолей головы и шеи, тем не менее продемонстрировал сохраняющуюся тенденцию...

НОВОСТИ ESMO 2025 / РАК ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
С 17 по 21 октября в Берлине прошла юбилейная 50 конференция ESMO. Со многими новостями вы скорее всего уже ознакомлены, настало время разобрать результаты исследований в области лечения рака предстательной железы. Here we go!...
ЗНАКОМЬТЕСЬ: РЕГИОНАЛЬНОЕ ОТДЕЛЕНИЕ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ (RUSSCO) В САНКТ-ПЕТЕРБУРГЕ
Российское общество клинической онкологии (RUSSCO) активно развивает региональное присутствие в Санкт-Петербурге, консолидируя профессиональное медицинское сообщество и продвигая передовые стандарты онкологической помощи...
НОВОСТИ ОНКОЛОГИИ / ХЛТ С ОДНОВРЕМЕННОЙ ИММУНОТЕРАПИЕЙ: КОГДА БОЛЬШЕ НЕ ЗНАЧИТ ЛУЧШЕ
Очередная попытка улучшить отдаленные результаты лечения больных местнораспространенным НМРЛ с добавлением иммунотерапии дурвалумабом одновременно с ХЛТ потерпела неудачу вслед за PACIFIC-2 (об этом мы подробно писали в...

УГОЛОК РАДИОТЕРАПЕВТА / SUPREMO: ДАЕТ ЛИ ЛТ ПРЕВОСХОДСТВО ПОСЛЕ РМЭ?
Воистину загадочная опухоль – рак молочной железы – ежегодно подкидывает нам новые головоломки, меняя представления об уже устоявшихся подходах к его лечению...

УГОЛОК РАДИОТЕРАПЕВТА / АНАЛИТИЧЕСКИЙ ОБЗОР: ПРЕДОПЕРАЦИОННАЯ ЛУЧЕВАЯ ТЕРАПИЯ ПРИ РАКЕ МОЛОЧНОЙ ЖЕЛЕЗЫ – ПЕРСПЕКТИВЫ, ОГРАНИЧЕНИЯ И ПОЗИЦИЯ ESTRO
Европейское общество радиотерапии и онкологии (ESTRO) представило консенсус-документ, обобщающий результаты 27 проспективных исследований I-II фаз, посвященных предоперационной лучевой терапии (ЛТ) при раке молочной железы...
СТЕРЕОТАКСИЧЕСКАЯ ЛУЧЕВАЯ ТЕРАПИЯ БОЛЬШИМИ ДОЗАМИ ПРИ РАННЕМ РАКЕ МОЛОЧНОЙ ЖЕЛЕЗЫ
В недавно опубликованном исследовании фазы I изучалась безопасность и противоопухолевая эффективность предоперационной однофракционной парциальной стереотаксической лучевой терапии (ПСЛТ) у пациенток с люминальным...

А ВОТ БЫЛ У МЕНЯ ОДИН СЛУЧАЙ , ИЛИ «ОХОТНИЧЬИ ЗАПИСКИ» ОНКОЛОГОВ... / ПРОЛГОЛИМАБ В ЛЕЧЕНИИ МЕТАСТАТИЧЕСКОЙ BRAF-ОТРИЦАТЕЛЬНОЙ МЕЛАНОМЫ КОЖИ: ЧЕРЕЗ ПСЕВДОПРОГРЕССИЮ К ПОЛНОМУ ОТВЕТУ
Пролголимаб – рекомбинантное моноклональное антитело, специфически связывающее рецептор программируемой клеточной смерти PD-1 и блокирующее его взаимодействие с лигандами PD-L1 и PD-L2. Пролголимаб одобрен в России для...

В связи с развитием молекулярногенетической диагностики при злокачественных новообразованиях наблюдается устойчивая тенденция к выбору персонализированного подхода в лечении. За последние 10 лет в таргетной терапии (ТТ)...
Анонс
-

19 - 20 ФЕВРАЛЯ 2026
ОПУХОЛИ ЖЕЛУДОЧНО - КИШЕЧНОГО ТРАКТА
XII КОНФЕРЕНЦИЯ RUSSCO
Дорогие коллеги!
Д.А.Носов,
Заведующий отделением противоопухолевой лекарственной терапии
ФГБУ «Центральная Клиническая Больница с Поликлиникой» Управления делами Президента РФ,
главный внештатный онколог ГМУ УД Президента РФ, доктор медицинских наук, профессор РАН
Российское общество клинической онкологии (RUSSCO) приветствует всех участников XXIX Российского онкологического конгресса!
Многие говорят, что к моменту начала очередного РОКа к нам приходит настоящая зима. Видимо, мы оттянули ее приход, перенеся наше крупнейшее онкологическое мероприятие на середину декабря. Тем не менее, природу не обманешь, и зима вступает в свои права. Несмотря на постепенный уход «в минус» за окнами, уверен, что в «Крокусе» - традиционном месте проведения РОКа – будет царить теплая, дружеская, радостная атмосфера. Встречи с друзьями, коллегами, волнение перед выступлением, сосредоточенность при обсуждении важных вопросов, поиск решений, дискуссии и даже смех – это все то, чего мы ждем целый год, готовя наш Конгресс и стараясь сделать его максимально полезным и интересным для каждого участника. Надеюсь, мы все в этом преуспели.
Пусть XXIX Российский онкологический конгресс оправдает все ваши ожидания и запомнится как наиболее яркое и насыщенное событие в вашей профессиональной жизни
Успешной работы на конгрессе!
Антон-Рафаэль Менгс. Автопортрет в красной мантии. 1744-1745 гг.
Пастель, бумага. Галерея старых мастеров, Дрезден.

Дорогие коллеги, дорогие друзья!
Традиционно самый объемный номер нашей газеты выходит в преддверии главного онкологического события года – ежегодного Российского онкологического конгресса, который мы всегда негласно называли «ноябрьским конгрессом». Именно поэтому и номер попрежнему значится ноябрьским, несмотря на то что на календаре уже декабрь. Обширные обзоры с недавно прошедшего конгресса ESMO 2025 от наших экспертов не смогли полностью войти в этот номер, поэтому перед самыми праздниками нас ждет декабрьский онлайн выпуск, где мы опубликуем не только оставшиеся материалы ESMO и свежие новости онкологического мира, но и обзоры с нашего XXIX РОКа.
На картине с обложки на нас с невероятной уверенностью смотрит молодой художник – Антон Рафаэль Менгс, впоследствии – непревзойденный мастер немецкой школы позднего Барокко, преуспевший в пастельной живописи. На этом автопортрете ему всего 17 лет – но его виртуозность, его мастерство заметны в каждом штрихе и подкрепляются решительностью работать дальше и самообладанием. На наш взгляд, это отличный посыл каждому молодому онкологу, ученому и врачу. Будьте уверены в своих силах и знаниях, шлифуйте их в постоянном самосовершенствовании, творите, идите вперед, и пусть все онкологическое сообщество страны знает вас в лицо!
С началом Конгресса вас, дорогие друзья!
Ваша команда RUSSCO
Интрига раскрыта: назван победитель интенсива RUSSCO по опухолям ЖКТ!
Это были три невероятно насыщенных дня! 16 ноября завершил свою работу онлайн-интенсив RUSSCO, посвященный актуальным вопросам лекарственной терапии опухолей ЖКТ. Настоящий мозговой штурм объединил специалистов из Самары, Салехарда, Санкт-Петербурга, Уфы, Москвы, Нижнего Новгорода и Томска.
Как это было?
Максимум концентрации: члены комитета RUSSCO junior представили участникам новейшие достижения в области исследований и клинической практики по раку поджелудочной железы, колоректальному и холангиоцеллюлярному раку.

Практика с мэтрами: два дня были полностью посвящены разбору клинических случаев. Молодые коллеги получили бесценные советы и рекомендации от «первой линии» российской онкологии, участвуя в жарких дискуссиях и интерактивных консилиумах. Своим опытом и видением делились ведущие онкологи страны: Трякин Алексей Александрович, д.м.н., (НМИЦ онкологии им. Н.Н. Блохина, ESMO, RUSSCO), Федянин Михаил Юрьевич, д.м.н., (ММКЦ «Коммунарка», НМИЦ онкологии им. Н.Н. Блохина, RUSSCO), Покатаев Илья Анатольевич, д.м.н., (ГКБ им. С.С.Юдина, RUSSCO). Кроме того, этот мощный интенсив стал возможен благодаря энергии и высокому профессионализму кураторов курса — членов комитета RUSSCO junior: Гречухиной Катерины Сергеевны, к.м.н., (МКНЦ им. А.С. Логинова), Хачатурян Элины Артуровны, (ГКБ им. С.С. Юдина), Фатеевой Анастасии Валерьевны (ХКБ).

Все дни интенсива шла напряженная борьба: участники зарабатывали баллы, а эксперты внимательно оценивали их работу. На кону была поездка на XXIX Российский онкологический конгресс в Москве!
Мы рады объявить, что победителем интенсива RUSSCO стал Окулевич Никита Борисович, врач – онколог, хирург абдоминального отделения №1, "Самарского областного клинического онкологического диспансера"! Второе место по количеству набранных баллов досталось двум докторам из Санкт-Петербурга: Мурских Алексею Дмитриевичу и Рахимовой Гузель Азатовне. А третье – Юлдашевой Наталье Олеговне, г. Уфа.
Благодарим всех участников, экспертов и организаторов за эту невероятную неделю науки и практики!
ОЦЕНКА ПОТЕНЦИАЛЬНОЙ ВОСТРЕБОВАННОСТИ УДАЛЕННЫХ ФОРМАТОВ ОНКОЛОГИЧЕСКОЙ ПОМОЩИ, НЕОБХОДИМЫХ ТРЕБОВАНИЙ, РИСКОВ, БАРЬЕРОВ И ПОТЕНЦИАЛЬНЫХ ПРЕИМУЩЕСТВ ИХ ВНЕДРЕНИЯ
В последние годы одним из перспективных направлений развития системы здравоохранения в онкологии является внедрение стационарзамещающих технологий с медицинской помощью на дому.
Развитию этого направления способствовало появление цифровых технологий для удаленного мониторинга, которые позволяют врачам-онкологам обеспечивать наблюдение за состоянием пациентов и контролировать развитие нежелательных реакций. Повышение качества мониторинга приводит к улучшению результатов лечения [1,2]. Стационарозамещающие технологии становятся актуальными еще и благодаря появлению новых лекарственных форм химиотерапевтических препаратов (таблетированные, для подкожного или внутримышечного введения), которые не требуют обязательного присутствия пациента в стационаре. Все это позволяет значительно приблизить качественную высококвалифицированную медицинскую помощь к месту жительства пациента.
В 2025 году в Программу государственных гарантий бесплатного оказания гражданам медицинской помощи впервые была включена возможность организации медицинской помощи в формате стационара на дому для жителей отдаленных, малонаселенных и труднодоступных населенных пунктов. В то же время на текущий момент нет понимания, у каких групп пациентов (заболевание, функциональное состояние) и в каких регионах будет наиболее востребован такой формат медицинской помощи. Остается открытым вопрос, какие есть преимущества, риски, и какой уровень готовности медицинских учреждений для организации такого формата медицинской помощи.
В связи с этим RUSSCO в сентябре 2025 года провело анкетирование врачей-онкологов с целью оценки потенциальной востребованности удаленного формата онкологической помощи, в том числе стационара на дому, а также необходимых требований, рисков, барьеров и потенциальных преимуществ от его внедрения.
Данный опрос проведен среди членов Российского общества клинической онкологии. В опросе приняли участие 210 респондентов из 53 регионов из следующих медицинских учреждений: онкологических диспансеров – 51%, ЦАОП – 20%, Федеральных центров – 11%. Были представлены респонденты из всех федеральных округов, наибольшее число – из Сибирского (32%), Центрального (24%), Северо-западного (14%) и Приволжского (10%).
Оценка востребованности удаленного формата онкологической медицинской помощи рассматривалась с двух сторон: со стороны пациентов, проживающих в удаленных населенных пунктах, и маломобильных пациентов и со стороны медицинского сообщества.
На вопрос, насколько будет востребована возможность проведения курсов химиотерапии, не требующих длительного введения (до 10 минут), в процедурных кабинетах медицинских организаций по месту жительства (поликлиниках, ФАП) при наличии дистанционного наблюдения за пациентом с использованием телемедицинских технологий со стороны врача-онколога и контроля с помощью цифровых систем выполнения всех этапов оказания медицинской помощи, 68% врачей-онкологов ответили, что востребована (из них – 35% значительно востребована). При этом в разрезе федеральных округов востребованность химиотерапии в процедурных кабинетах медицинских организаций по месту жительства составила 60% в СКФО, 88% в СФО и ЦФО, 90% в ПФО.
Востребованность проведения курсов химиотерапии с временем введения химиотерапевтических препаратов менее 10 минут среди маломобильных пациентов средним медицинским персоналом на дому у пациента при наличии дистанционного наблюдения за пациентом врача-онколога и контроля всех этапов оказания медицинской помощи позитивно оценили 58% респондентов. При этом в разрезе федеральных округов востребованность проведения химиотерапии на дому у пациента составила 60% в СКФО, 84% в СФО и ЦФО, 95% в ПФО. Участники опроса посчитали, что нет необходимости (78%) ежедневного удаленного мониторинга состояния пациентов, получающих таблетированные формы препаратов, и состояния пациентов, получающих терапию химиотерапевтическими препаратами для подкожного или внутримышечного введения (73%).
Важным вопросом в осуществлении удаленного формата онкологической медицинской помощи является достаточность квалификации среднего медперсонала.
На вопрос, достаточна ли квалификация медсестры поликлиники/
При ответе на вопрос о достаточности квалификации процедурной медсестры поликлиники/
Другой вопрос, который рассматривался в анкете, касался категории больных, для которых наиболее востребовано проведение химиотерапии в процедурных кабинетах медицинских организаций по месту жительства (поликлиниках, ФАП). На этот вопрос респонденты ответили, что основные группы, нуждающиеся в удаленном формате, следующие: ограниченная мобильность пациентов – 86%, значительная (более 50/100 км) удаленность места проживания пациента от ЦАОП/
Проведенная оценка возможных клинических рисков при осуществлении удаленного формата онкологической медицинской помощи показала, что основными рисками со стороны пациента при удаленном формате по оценке врачей-онкологов являются следующие: осложнения химиотерапии, проявляющиеся как во время введения препаратов (86%), так и в более поздние сроки – в течение нескольких часов после введения (77%), в течение дней-недель после введения (62%). Также врачей-онкологов беспокоит невыявление или позднее выявление прогрессирования заболевания, несмотря на проводимую терапию, – 60%. Риски, связанные с применением иммунотерапии, респонденты оценивали ниже, чем осложнения химиотерапии, проявляющиеся в течение нескольких часов после введения, – 50%, осложнения в течение дней-недель после введения – 45%.
Риски со стороны действий среднего медперсонала, по мнению респондентов, при оказании онкологической медицинской помощи в удаленном формата распределились следующим образом: ошибки дозирования/разведения препарата – 83%, ошибки при оценке состояния пациента по перечню критериев – 76%, пропуск/
Среди наиболее важных организационных рисков удаленного формата респонденты выделяют: отсутствие (подходящего) среднего медперсонала в медицинской организации по месту жительства пациента – 80%, сложности в организации удаленного контроля со стороны врача-онколога онкологического диспансера или ЦАОП – 78%, сложности/
Таким образом, врачи-онкологи считают потенциально востребованной и позитивно относятся к возможности работы в удаленном формате при возможности решения логистических задач и проведения обучения среднего медицинского персонала. Такой формат, по мнению респондентов, позволит увеличить рост обеспеченности лечением пациентов онкологического профиля и повысит удовлетворенность населения онкологической медицинской помощью в регионе (80%), будет способствовать развитию и интеграции среднего медицинского персонала в отдаленных регионах в систему онкологической помощи (80%), поможет снизить пропуски введения химиопрепаратов (65%) и, как следствие, увеличить эффективность терапии (65%), снизить нагрузки на врачей онкологов (61%) и средний медицинский персонал (67%) онкодиспансера, позволит увеличить койко-оборот в дневном стационаре (56%) и снизить уровень стресса у персонала онкодиспансера, ЦАОПа и у пациентов (58%). Кроме того, работа в удаленном формате будет способствовать уменьшению количества дней нетрудоспособности у онкологических больных, связанных с необходимостью проведения терапии в онкодиспансере (60%), а также снизить распространение инфекционных и вирусных сезонных заболеваний у онкологических пациентов в осенне-зимний период (71%).
Выполнение программы организации медицинской помощи пациентам с онкологическими заболеваниями в формате стационара на дому для жителей отдаленных, малонаселенных и труднодоступных населенных пунктов позволит сделать специализированную онкологическую помощь более доступной и эффективной.
Источники:
- Шинкарев С.А., Каргальская И.Г., Зингерман Б.В., Нозик А.В. Использование цифрового сервиса ОНКОНЕТ для дистанционного мониторинга онкологических пациентов на иммунной и таргетной терапии в условиях пандемии. Журнал телемедицины и электронного здравоохранения. 2021; 7: 14-24.
- Зингерман Б.В., Нозик А.В., Боровова И.В., Каргальская И.Г., Фистул И.А. ОНКОНЕТ. Телемедицинская платформа для дистанционного мониторинга онкологических больных в процессе длительного лечения.
Инициативная группа RUSSCO
Практика BRAF-тестирования у клиницистов: результаты опроса Российского общества клинической онкологии (RUSSCO)
Целью исследования было оценить текущие подходы к диагностике мутаций в гене BRAF в клинической практике онкологов России. Проведен опрос 50 специалистов из различных регионов и типов учреждений. Среди респондентов больше всего было онкологов (92%), работающих преимущественно в онкодиспансерах (70%).
Опрос показал, что BRAF-тестирование чаще всего назначается при меланоме и колоректальном раке (70% и 60% врачей соответственно, направляют более 80% пациентов). Основной метод молекулярно-генетической диагностики – ПЦР (полимеразная цепная реакция), его используют примерно в половине случаев (до 52%) выполнения BRAF-тестирования, несколько реже используется метод ИГХ (иммуногистохимический) и NGS (next generation sequencing – секвенирование следующего поколения). Сроки выполнения теста преимущественно составляют 8-14 дней. Финансирование осуществляется главным образом в рамках ОМС (72%), но сохраняются барьеры: 16% врачей указали на ограничения финансирования и 12% – на невозможность назначения препаратов при выявлении мутации.
Результаты демонстрируют необходимость стандартизации подходов к диагностике и расширения доступа к современным методам тестирования (NGS) и терапии.
Введение
Белок BRAF – один из ключевых участников сигнального пути MAPK/ERK. Через этот путь регулируется рост, дифференцировка, пролиферация, апоптоз и миграционные функции клеток. Мутации белка BRAF обладают значительным онкогенным потенциалом и могут быть причиной аномальной активации пути MAPK/ERK, что приводит к неконтролируемой пролиферации клеток [1].
Частота встречаемости мутаций BRAF
Мутации в гене BRAF встречаются в опухолях различных локализаций, среди которых [2-6]:
- меланома кожи (частота выявления мутации BRAF в популяции пациентов до 67%);
- рак толстой кишки (до 17%);
- папиллярный рак щитовидной железы (до 69%);
- анапластический рак щитовидной железы (до 70%);
- глиомы низкой степени злокачественности (до 10-15%, в том числе плеоморфные ксантоастроцитомы – до 60-80%, ганглиоглиомы – до 20-70%);
- другие, более редкие локализации опухолей.
Выявление у пациента мутации BRAF позволяет расширить арсенал потенциальных лекарственных методов лечения и использовать таргетную терапию, действие которой направлено на мутантный белок [1,7].
Эффективность таргетной терапии при BRAF-положительных опухолях
Таргетная терапия ингибиторами BRAF и МЕК давно стала стандартном терапии BRAF-положительных меланомы и немелкоклеточного рака легкого (НМРЛ) [8-11]. Эффективность таргетной терапии также показана у пациентов с колоректальным раком и другими локализациями опухолей с мутацией BRAF [7,12,13].
Данный опрос не касался терапевтических опций в лечении указанных нозологий, но, как пример актуальности определения молекулярного профиля опухоли, можно привести данные о применении комбинации ингибиторов BRAF и МЕК при распространенных формах заболеваний. Так, у больных метастатической меланомой с мутацией в гене BRAF на фоне терапии комбинацией дабрафениба и траметиниба медиана выживаемости без прогрессирования (мВБП) составила 11,1 мес., частота объективного ответа (ЧОО) – 68%, а 5-летние показатели ВБП и общей выживаемости (ОВ) – 34% и 19% соответственно [10]. У больных НМРЛ с мутацией в гене BRAF терапия этой же комбинацией позволяет достичь мВБП 10,2-10,8 мес. при ЧОО 64-68% и 5-летней ОВ 19-22% [11].
Ингибиторы BRAF и МЕК также демонстрируют высокую эффективность при использовании в адъювантной терапии меланомы [14].
Диагностика BRAF-мутаций
Клинические рекомендации Минздрава указывают на важность выполнения тестирования на наличие мутации BRAF у широкой группы пациентов, в том числе с меланомой [8], НМРЛ [9], раком ободочной кишки и ректосигмоидного перехода [1], раком прямой кишки [16], дифференцированным раком щитовидной железы [17]. На сегодняшний день определение мутаций в гене BRAF типа V600 входит в Программу государственных гарантий бесплатного оказания медицинской помощи и тарифные соглашения ОМС большинства регионов РФ [18].
Основными методами молекулярно-генетической диагностики для поиска мутаций в гене BRAF являются ПЦР (полимеразная цепная реакция), ИГХ (иммуногистохимический метод) и NGS (next generation sequencing – секвенирование следующего поколения). Согласно клиническим рекомендациям Минздрава, NGS обладает большей чувствительностью в определении мутаций: определение мутаций в генах KRAS, NRAS, BRAF этим методом позволяет дополнительно выявить альтерации у 14-17% пациентов по сравнению с данными, полученными с помощью ПЦР [15,16]. Ограничениями для широкого распространения NGS являются высокая стоимость теста и увеличенное время для выполнения тестирования в некоторых лабораториях, которое может достигать 20-30 дней [18].
Несмотря на наличие клинических рекомендаций, практика тестирования в России остается неоднородной.
Цель исследования – анализ текущей практики и барьеров диагностики мутаций в гене BRAF.
Материалы и методы
Дизайн исследования: онлайн-опрос членов профессионального сообщества RUSSCO.
Выборка: 50 респондентов из 8 федеральных округов РФ.
Структура анкеты: блоки по характеристикам респондентов, частоте направления, методам тестирования, срокам, финансированию и барьерам.
Анализ: описательная статистика, расчет долей и сравнений между нозологиями.
Результаты
1. Характеристика респондентов
Участниками опроса в 92% случаев стали врачи онкологи, в 6% – организаторы здравоохранения, в опросе также приняли участие и представители специальности генетика (2%).
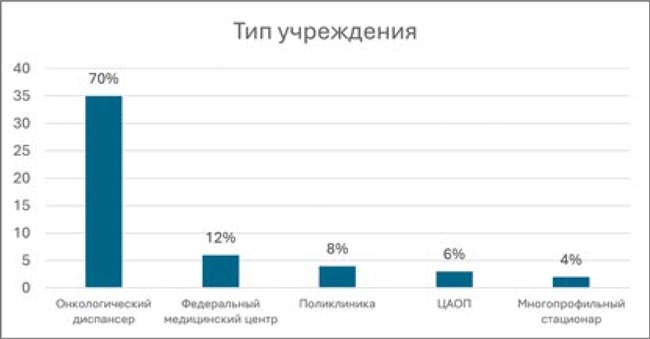
Большинство респондентов являлись сотрудниками региональных онкологических диспансеров – 70%, сотрудники федеральных научных центров вошли в 12% участников опроса, также мы отмечаем, что были включены и представители других типов учреждений.
Рисунок 1.
Распределение респондентов по типу учреждений, в которых они работают.
Исследование охватило широкую географию и включило представителей из более чем тридцати регионов нашей страны. В подавляющем большинстве участники опроса являлись представителями Центрального федерального округа – 30%, Приволжский федеральный округ был представлен 18% респондентов, Сибирский – 16%, Южный – 10%. Ознакомиться с детальным распределением респондентов можно на диаграмме (рис.2).
Рисунок 2.
Географическое распределение респондентов.

2. Практика направления на BRAF-тестирование
Чаще всего на BRAF-тестирование направляются пациенты с меланомой кожи и КРР. Тем не менее, несмотря на наличие рекомендаций по BRAF-диагностике, частота направления на тестирование при злокачественных опухолях этих локализаций не достигает 100%, хотя и приближается к этой цели, составляя более 80%.
Рисунок 3.
Частота направления на BRAF-тестирование в зависимости от локализации опухоли. По оси Y указано абсолютное количество респондентов, по оси Х – доля пациентов, которым врач назначает BRAF-тестирование.
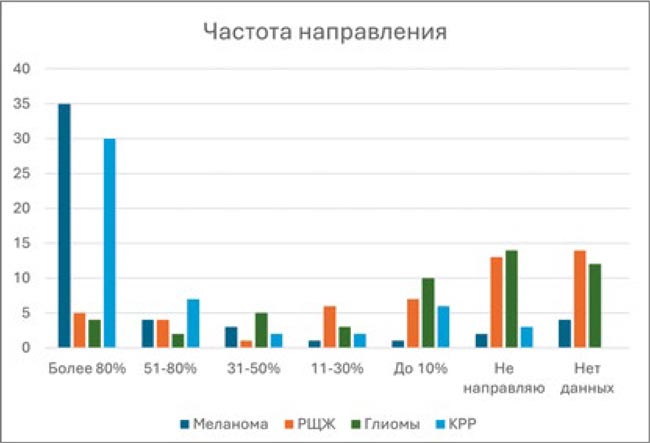
Иначе обстоит дело с направлением на BRAF-тестирование пациентов с РЩЖ и глиомами, где частота молекулярно-генетической диагностики не превышает 10%. Около 60% врачей, принявших участие в опросе, не имеют практики направлять больных РЩЖ и глиомами на BRAF-тестирование.
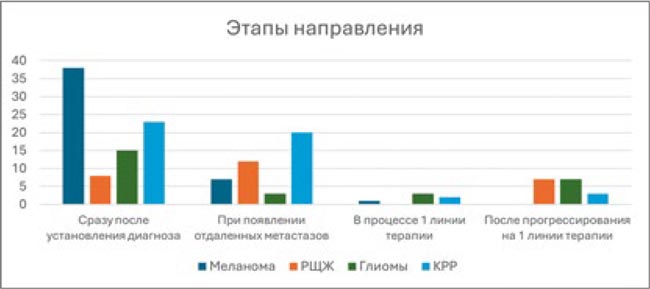
Достойным внимания представляется анализ того, на каком этапе лечения пациента направляют на BRAF-диагностику. На рисунке 4 показано, что подавляющее большинство респондентов (76%) направляют пациентов с меланомой на BRAF-тестирование сразу после установки диагноза меланома, почти половина респондентов (46%) поступают так же в отношении больных КРР. Почти треть участников опроса (30%) направляют пациентов с глиомой на BRAF-диагностику сразу после установки диагноза.
Четверть респондентов – 24% – при появлении у пациента с РЩЖ отдаленных метастазов решают направить его на BRAF-тестирование, и 40% врачей принимают такое же решение в отношении пациентов с КРР.
Рисунок 4.
Частота направления на BRAF-тестирование в зависимости от этапа диагностики или лечения пациентов с различными локализациями опухоли. По оси Y указано абсолютное количество респондентов.
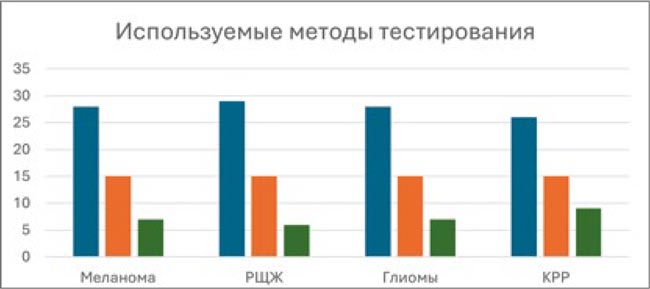
3. Методы тестирования
Вне зависимости от локализации опухоли наиболее популярным методом BRAF-диагностики в лабораториях страны является классический метод полимеразной цепной реакции – ПЦР. Около 50% респондентов указали данный метод. Несмотря на более низкую стоимость, метод иммуногистохимического выявления аномального белка BRAF несколько менее популярен, что вполне объяснимо недостаточно высокой чувствительностью и специфичностью. Самым редким из используемых методов диагностики оказался современный метод секвенирования нового поколения – NGS. Отсутствие его в клинических рекомендациях, низкая распространенность методики в регионах и высокая стоимость теста являются ограничивающими факторами для его широкого применения.
Рисунок 5.
Частота использования различных лабораторных методов BRAF-тестирования пациентов с различными локализациями опухоли. По оси Y указано абсолютное количество респондентов.
4. Сроки выполнения
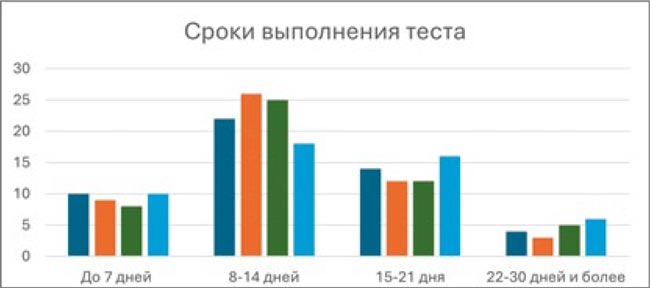
Важным представляется вопрос длительности проведения BRAF-диагностики. Анализ показал, что сроки выполнения тестов мало зависят от локализации опухоли. Большинство респондентов ответили, что результат анализа они получают в течение 8-14 дней, что позволяет им не допускать отсрочки в принятии решения о терапевтической стратегии. Особенно это касается пациентов с глиомами и агрессивно текущим РЩЖ: половина врачей указали, что получают результат в течение 8-14 дней. Лишь для 10% респондентов сроки получения ответа из лаборатории могут составлять 22 и даже 30 дней.
Рисунок 6.
Сроки выполнения BRAF-тестирования в зависимости от локализации опухоли. По оси Y указано абсолютное количество респондентов.
5. Финансирование
Стоит отметить, что BRAF-тестирование методом ИГХ и ПЦР включено в программу возмещения по ОМС. Данный факт находит отражение в нашем опросе. Более 70% респондентов указали, что тестирование BRAF производится за средства ОМС.
Рисунок 7.
Возможности финансирования BRAF-тестирования в России. По оси Y указано абсолютное количество респондентов.

Обращает на себя внимание, что почти в четверти случаев для того, чтобы выполнить тестирование, необходимо обратиться в лабораторию учреждения, отличного от того, где пациент наблюдается и получает лечение. В этой ситуации (24% случаев) логистическая поддержка по передаче биологических образцов в выбранную лабораторию осуществляется в рамках программы при поддержке профессионального сообщества RUSSCO. Лишь 4% участников исследования отметили, что пациенты выполняют тестирование за свой счет в коммерческих лабораториях.
6. Барьеры
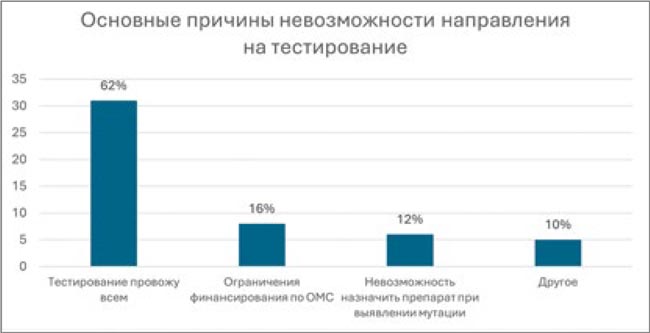
Опрос показал, что 62% респондентов не встречают каких-либо барьеров на пути к проведению пациенту BRAF-тестирования. Вместе с тем невозможно игнорировать тот факт, что 16% опрошенных врачей видят ограничение финансирования в регионе как причину невыполнения BRAF-диагностики и 12% врачей ограничивающим фактором отмечают невозможность назначить впоследствии соответствующую выявленной мутации таргетную терапию.
Рисунок 8.
Основные причины невозможности направления на тестирование BRAF в России.
- Неоднородность практики: BRAF-тестирование активно применяется при меланоме и КРР, но крайне редко при РЩЖ и глиомах, что требует усиления образовательных программ и обновления алгоритмов диагностики.
- Методологические ограничения: преобладание ПЦР отражает доступность, но ограничивает полноту анализа. Масштабирование NGS должно стать приоритетом для повышения качества молекулярной диагностики.
- Сроки и логистика: средняя длительность тестирования (8-14 дней) приемлема, но требует сокращения для агрессивных опухолей. Необходима оптимизация логистики и развитие региональных лабораторий.
- Финансирование и доступ к терапии: несмотря на включение BRAF-тестирования и BRAF и МЕК ингибиторов в ОМС, сохраняются региональные барьеры и случаи невозможности назначения таргетной терапии, что снижает клиническую значимость тестирования.
- Рекомендации:
- стандартизировать подходы к тестированию во всех нозологиях;
- включить NGS в клинические рекомендации и обеспечить его доступность;
- сократить сроки выполнения тестов за счет развития инфраструктуры;
- обеспечить равный доступ к таргетной терапии для всех пациентов с выявленной мутацией.
Источники:
- Santarpia L, Lippman SM, El-Naggar AK. Targeting the MAPK-RAS-RAF signaling pathway in cancer therapy. Expert Opin Ther Targets. 2012; 16(1): 103-119. https://doi.org/10.1517/
14728222.2011.645805 . - Pratilas CA, Xing F, Solit DB. Targeting oncogenic BRAF in human cancer. Curr Top Microbiol Immunol. 2012; 355: 83-98. https://doi.org/
10.1007/ .82_2011_162 - Wen PY, Stein A, van den Bent M, et al. Dabrafenib plus trametinib in patients with BRAFV600E-mutant low-grade and high-grade glioma (ROAR): a multicentre, open-label, single-arm, phase 2, basket trial. Lancet Oncol. 2022; 23 (1): 53-64. https://doi.org/
10.1016/ .S1470-2045(21)00578-7 - Nobre L, Zapotocky M, Ramaswamy V, et al. Outcomes of BRAF V600E pediatric gliomas treated with targeted BRAF inhibition. JCO Precis Oncol. 2020; 4: PO.19.00298. https://doi.org/
10.1200/ .PO.19.00298 - Ragazzi M, Ciarrocchi A, Sancisi V, et al. Update on anaplastic thyroid carcinoma: morphological, molecular, and genetic features of the most aggressive thyroid cancer. Int J Endocrinol. 2014; 2014: 790834. https://doi.org/
10.1155/ .2014/ 790834 - Никифорович П.А., Поляков А.П., Слепцов И.В., и др. Таргетная терапия анапластического рака щитовидной железы. Опухоли головы и шеи. 2022; 12 (4): 33-38.
- Subbiah V, Kreitman RJ, Wainberg ZA, et al. Dabrafenib plus trametinib in BRAFV600E-mutated rare cancers: the phase 2 ROAR trial. Nat Med. 2023; 29 (5): 1103-1112. https://doi.org/
10.1038/ .s41591-023-02321-8 - Клинические рекомендации Министерства здравоохранения РФ «Меланома кожи и слизистых оболочек». 2023 год. Дата обращения: 26.11.2025.
- Клинические рекомендации Министерства здравоохранения РФ «Злокачественное образование бронхов и легкого». 2022 год. Дата обращения: 26.11.2025.
- Robert C, Grob JJ, Stroyakovskiy D, et al. Five-year outcomes with dabrafenib plus trametinib in metastatic melanoma. N Engl J Med. 2019; 381 (7): 626-636. https://doi.org/
10.1056/ .NEJMoa1904059 - Planchard D, Besse B, Groen HJM, et al. Phase 2 study of dabrafenib plus trametinib in patients with BRAF V600E-mutant metastatic NSCLC: updated 5-year survival rates and genomic analysis. J Thorac Oncol. 2022; 17 (1): 103-115. https://doi.org/
10.1016/ .j.jtho.2021.08.011 - Shahjehan F, Kamatham S, Chandrasekharan C, Kasi PM. Binimetinib, encorafenib and cetuximab (BEACON Trial) combination therapy for patients with BRAF V600E-mutant metastatic colorectal cancer. Drugs Today (Barc). 2019; 55 (11): 683-693. https://doi.org/
10.1358/ .dot.2019.55.11.3035584 - Gallois C, Bergen ES, Auclin É, et al. Efficacy and safety of the combination of encorafenib/cetuximab with or without binimetinib in patients with BRAF V600E-mutated metastatic colorectal cancer: an AGEO real-world multicenter study. ESMO Open. 2024; 9 (9): 103696. https://doi.org/
10.1016/ .j.esmoop.2024.10369 - Long GV, Hauschild A, Santinami M, et al. Final results for adjuvant dabrafenib plus trametinib in stage III melanoma. N Engl J Med. 2024; 391 (18): 1709-1720. https://doi.org/
10.1056/ .NEJMoa2404139 - Клинические рекомендации Министерства здравоохранения РФ «Рак ободочной кишки и ректосигмоидного перехода». 2025 год. Дата обращения: 26.11.2025.
- Клинические рекомендации Министерства здравоохранения РФ «Рак прямой кишки». 2025 год. Дата обращения: 26.11.2025.
- Клинические рекомендации Министерства здравоохранения РФ «Дифференцированный рак щитовидной железы». 2024 год. Дата обращения: 26.11.2025.
- Болотина Л.В. Современные принципы и перспективы лекарственной терапии метастатического колоректального рака с мутацией BRAF (обзор литературы). РМЖ. Медицинское обозрение. 2025; 9 (7): 403-412. https://doi.org/
10.32364/ .2587-6821-2025-9-7-5
Материал подготовлен инициативной группой RUSSCO
НОВОСТИ ESMO 2025 / ТРАСТУЗУМАБ ДЕРУКСТЕКАН В КАЧЕСТВЕ НЕОАДЪЮВАНТА/ АДЪЮВАНТА УЛУЧШАЕТРЕЗУЛЬТАТЫ ЛЕЧЕНИЯ ОПЕРАБЕЛЬНОГО HER2-ПОЗИТИВНОГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ
Автор: Тюляндин Сергей Алексеевич
Заслуженный деятель науки РФ, главный научный сотрудник отделения противоопухолевой лекарственной терапии №2
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, председатель рабочей группы по разработке
Клинических рекомендаций RUSSCO, член правления RUSSCO, профессор, доктор медицинских наук, Москва
Отшумело и пронеслось ESMO 2025 с его урожайными результатами исследований, посвященных лечению больных раком молочной железы (РМЖ). После первого вау-эффекта пришло время в спокойной обстановке оценить полученные данные. Ибо не за горами очередной цикл обновления Практических рекомендаций RUSSCO, и надо понять, что целесообразно и возможно включить в новую редакцию с тем, чтобы новые опции терапии стали доступны нашим онкологам и пациентам. Я остановлюсь только на препаратах, зарегистрированных в России и, теоретически, доступных для клинического использования.
Продолжается экспансия конъюгатов моноклональных антител и цитостатиков при лечении всех фенотипов РМЖ. Начнем с HER2-позитивного, где трастузумаб дерукстекан (Т-DXd, Энхерту), после убедительного выигрыша в комбинации с пертузумабом перед стандартной комбинацией ТНР в первой линии терапии метастатической болезни, изучался у операбельных больных.
В исследовании DESTINY-Breast05 у 1635 пациентов с HER2-положительным РМЖ и остаточной опухолью после проведения неоадъювантного лечения с использованием химиотерапии на основе таксанов и анти-HER2 терапии введение T-DXd в сравнении с трастузумабом эмтанзином (Т-DM1), который вводили в течение года (14 введений), достоверно улучшил 3-летнюю инвазивную безрецидивную выживаемость с 83,7% до 92,4%, что соответствует снижению относительного риска прогрессирования на 53% (HR 0,47; p<0,0001). Назначения T-DXd привело к снижению относительного риска прогрессирования за счет поражения ЦНС на 36%. Этот успех сочетался с равной частотой развития побочных эффектов 3-4 степени (50,6% для T-DXd и 51,9% для T-DM1). Интерстициальный фиброз легких остается жизнеугрожающим осложнением для T-DXd с частотой 9,6% и смертью 2 пациенток.
Исследование DESTINY-Breast11 представило предварительные результаты неоадъювантного использования T-DXd (4 курса) в комбинации с THP (4 курса) в сравнении с дозоуплотненным режимом АС (4 курса) и ТНР (4 курса) у 641 больной HER2-позитивным РМЖ с высоким риском прогрессирования (cT3N0-3 или cT1-4N1-3). Частота pCR составила 67,3% и 56,3% соответственно (ΔpCR 11,2%; p=0,003). Выигрыш в достижении pCR отмечался как у больных с положительной экспрессией гормональных рецепторов (61,4% против 52,3% соответственно, Δ9,1%), так и при отрицательных (83,1% против 67,1% соответственно, Δ16,0%). При медиане наблюдения 24 месяца отмечена тенденция к улучшению безрецидивной выживаемости T-DXd-THP, о чем свидетельствует недостоверное снижение относительного риска прогрессирования на 44%. Частота побочных эффектов 3-4 степени была зарегистрирована у 37,5% пациентов в группе T-DXd-THP по сравнению с 55,8% в группе ddAC-THP, с более низкой частотой дисфункции левого желудочка любой степени при T-DXd-THP (1,3% по сравнению с 6,1%).
Первый вопрос, который возникает при рассмотрении этих позитивных для Т-DXd исследований, на каком этапе лечения его выгоднее использовать. В отсутствии биомаркеров, предсказывающих достижение pCR при использовании Т-DXD в качестве неоадъюванта, мы будем вынуждены назначать препарат всем больным IIb-III стадиями. Подгрупповой анализ исследования достижения pCR демонстрирует больший выигрыш у больных с N+ и отсутствием гормональных рецепторов, но следует признать, что количество больных с этими характеристиками составляло меньшинство, что заставляет относиться к этим результатам с осторожностью. Также короткий период наблюдения не позволяет оценить достоверное влияние использования T-DXd в неоадъюванте на отдаленные результаты. Следует отметить, что назначение только 4 введений T-DXd существенно снизило частоту развития интерстициального фиброза, который был отмечен у 14 (4,4%) больных, из них 3-5 степени у 3. Также остается неясным, что делать в случае наличия резидуальной опухоли после T-DXd.
Использование T-DXd у больных с резидуальной опухолью после предоперационной химиотерапии с двойной HER2-блокадой имеет, с моей точки зрения, больше оснований. В условиях высокой стоимости препарата его назначение только в случае обнаружения резидуальной опухоли уменьшает популяцию больных как минимум в 2 раза. Каждая третья пациентка с резидуальной опухолью прогрессирует в течение 5-7 лет при проведении адъювантной терапии трастузумабом. Назначение Т-DM1 достоверно уменьшило шанс прогрессирования до 20% по данным исследования KATHERINE, но при этом не влияло на частоту развития наиболее опасного для жизни поражения ЦНС по сравнению с тамоксифеном. Первые результаты исследования DESTINY-Breast05 демонстрируют достоверное снижение относительного риска прогрессирования более чем в 2 раза при использовании T-DXd в сравнении с T-DM1. При подгрупповом анализе безрецидивной выживаемости назначение T-DXd существенно выигрывало у больных c отсутствием гормональных рецепторов в опухоли (HR 0,37), наличием неоперабельной опухоли (N4N0M0 или Т1-3N2-3M0) перед началом лечения (HR 0,41) и резидуальной опухоли в лимфоузлах после неоадъюванта (HR 0,44). Важным достоинством назначения T-DXD является снижение частоты метастатического поражения ЦНС, а серьезным недостатком развитие жизнеугрожающего осложнения – интерстициального фиброза легких, которое явилось причиной смерти 2 пациенток.
В своем дискуссионном анализе исследования DESTINY-Breast05 Sara Tolaney предложила использовать T-DXd у больных с резидуальной болезнью после неоадъювантной терапии комбинацией таксанов с двойной анти-HER2 блокадой при условии наличия неоперабельной опухоли на момент начала неоадъюванта и резидуальной опухоли в лимфоузлах при его окончании. При этом был поставлен вопрос, нужно ли нам 14 введений Т-DXd в течение года для достижения желаемого эффекта, что сочетается не только с высокой стоимостью лечения, но и высоким риском развития интерстициального фиброза легких.
Этот же дискутант предлагает в качестве неоадъювантной терапии HER2-позитивных больных использовать 12-недельную комбинацию таксанов и двойной анти-HER2 блокады и добавлять 4 введения T-DXd только в случае отсутствия клинического эффекта. При достижении pCR после 12 недель неоадъюванта назначается двойная анти-HER2 блокада адъювантно, при наличии резидуальной опухоли адъювантно назначается T-DXd. Если после подключения T-DXd достигнута pCR, то в качестве адъюванта назначается двойная анти-HER2. И остается неясным, что делать в случае резидуальной опухоли после T-DXd: химиотерапия с двойной анти-HER2 терапией, T-DM1 или что то другое?
Высокая стоимость препарата заставляет даже американских коллег корректировать возможные показания к его назначению в ранних стадиях. Будем следить, какая судьба ждет Энхерту в качестве адъювантной и неоадъювантной терапии рака молочной железы в нашей стране.
Продолжение следует….
Источники:
- Geyer C, et al. Trastuzumab deruxtecan (T-DXd) vs trastuzumab emtansine (T-DM1) in patients (pts) with high-risk human epidermal growth factor receptor 2-positive (HER2+) primary breast cancer (BC) with residual invasive disease after neoadjuvant therapy (tx): Interim analysis of DESTINY-Breast05. ESMO Congress 2025, LBA1.
- Harbeck N, et al. DESTINY-Breast11: neoadjuvant trastuzumab deruxtecan alone (T-DXd) or followed by paclitaxel + trastuzumab + pertuzumab (T-DXd-THP) vs SOC for high-risk HER2+ early breast cancer (eBC). ESMO Congress 2025, Abstract 291O.
- Tolaney SM. Reshaping destiny: transforming outcomes in high-risk her2+ breast cancer. Discussion on DESTINY-Breast05 clinical trial. ESMO Congress 2025.
НОВОСТИ ESMO 2025 / CDK4/6 КАК ДОБАВЛЕНИЕ К АДЪЮВАНТНОЙ ГОРМОНОТЕРАПИИ ГОРМОНОЧУВСТВИТЕЛЬНОГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ
На конгрессе ESMO были обновлены отдаленные результаты лечения больных гормоночувствительным раком молочной железы (РМЖ) комбинацией ингибиторов ароматазы и ингибиторов CDK4/6 в рамках исследований monarchE и NATALEE.
В рандомизированное исследование III фазы monarchE было включено 5637 больных, которые получали стандартную адъювантную гормонотерапию (тамоксифен или ингибиторы ароматазы) в течение 5 лет или комбинацию гормонотерапии в течение 5 лет с ингибитором CDK4/6 абемациклибом в дозе 150 мг 2 раза в день ежедневно в течение 2 лет. Критериями включения были больные с наличием рN2-3 или рN1 c признаками высокого риска (grade 3 или Т3). Также существовала немногочисленная когорта, куда включались больные рT1-2N1 grade1-2 и Ki-67≥20% в качестве дополнительного фактора высокого риска. Первичной конечной точкой эффективности была инвазивная безрецидивная выживаемость (IDFS), вторичными конечными точками эффективности были выживаемость без отдаленных метастазов (DRFS) и общая выживаемость (OS), а также токсичность.
При медиане наблюдения 76,2 месяца 7-летняя ОS составила 86,8% в группе абемациклиба и 85% в группе контроля (Δ1,8%), что соответствует достоверному снижению относительного риска смерти на 15,8% (HR 0,842; р=0,027). При подгрупповом анализе наибольший выигрыш от добавления абемациклиба был получен у пременопаузальных больных (HR 0,71), моложе 65 лет (HR 0,82), при наличии pN3 (HR 0,72) и добавлении абемоциклиба к тамоксифену (HR 0,73). К результатам абемациклиба у пременопаузальных больных надо относиться с осторожностью, так как большинство из них получали гормонотерапию тамоксифеном без овариальной супрессии, несмотря на высокий риск прогрессирования. Добавление абемациклиба привело к достоверному снижению риска прогрессирования: 7-летняя IDFS составила 77,4% в сравнении с 70,9% в группе контроля ( 6,5%, HR 0,73), а 7-летняя DRFS – 80,0% и 74,9% соответственно (Δ5,1%, HR 0,74). Данные по безопасности в долгосрочной перспективе не подтвердили каких-либо опасений относительно отсроченной токсичности. Наиболее частыми нежелательными явлениями (НЯ), приведшими к смерти, были инфекции (16 [0,6%] против 10 [0,4%]), второе злокачественное новообразование (13 [0,5%] против 8 [0,3%]) и сердечные нарушения (11 [0,4%] против 9 [0,3%]).
Авторы делают вывод, что, добавление абемациклиба к адъювантной эндокринной терапии в течение 2 лет привело к статистически и клинически значимому улучшению общей выживаемости по сравнению с применением только эндокринной терапии у пациентов с раком молочной железы высокого риска (HR+, HER2-, с поражением лимфатических узлов). Через 7 лет абемациклиб в комбинации с эндокринной терапией продолжал демонстрировать устойчивое преимущество в отношении IDFS и DRFS. Положительное влияние на выживаемость, наряду с существенным снижением риска метастатического поражения, перевешивает серьезную краткосрочную токсичность, зарегистрированную на фоне двухлетней терапии абемациклибом.
На основании промежуточного анализа IDFS в Практические рекомендации RUSSCO была внесена опция добавления абемациклиба к адъювантной гормонотерапии в следующей редакции: больным в пременопаузе с люминальным HER2-негативным РМЖ III стадии (pN2-3) или с ypN2-3 после неоадъювантной ХТ к ГТ тамоксифеном или ингибиторами ароматазы может быть добавлен абемациклиб 150 мг внутрь 2 раза ежедневно в течение 2 лет. Эта выделенная группа больных демонстрирует плохой прогноз и, без сомнения, нуждается в эскалации адъювантной гормонотерапии. Молодой возраст пациенток позволяет с меньшим риском переносить возникающие на фоне приема абемациклиба осложнения. Вопрос о расширении показаний к добавлению абемациклиба будет предметом жарких дискуссий группы, отвечающей за написание раздела «Рак молочной железы» в Практических рекомендациях RUSSCO.
На конгрессе ESMO были представлены обновленные результаты другого рандомизированного исследования III фазы NATALEE, которое изучало целесообразность добавления ингибитора CDK4/6 рибоциклиба к адъювантной терапии летрозолом или аримидексом в качестве адъювантной терапии у пациентов РМЖ IIА-IIIВ стадии HR-позитивного/HER2-негативного рака молочной железы. В случае IIA стадии с pN0 для включения требовалась наличие grade 2 с Ki67>20 или высоким геномным риском или grade 3. Рибоциклиб в дозе 400 мг/сутки (3 недели приема/
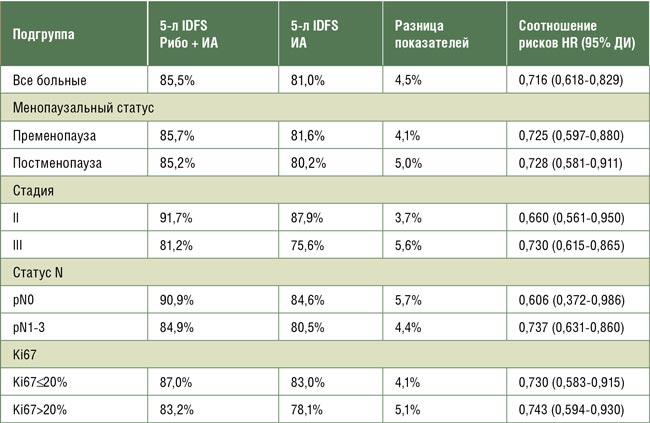
При медиане наблюдения 55,4 месяца все больные в группе комбинации закончили 3-летний прием рибоциклиба, 36,5% закончили 5-летнюю адъювантную терапию и 13,4% были потеряны для наблюдения. В группе ингибиторов ароматазы закончили 5-летний курс лечения 34,4% и были потеряны 17,3% пациентов. По данным 5-летнего наблюдения добавление рибоциклиба продолжает демонстрировать улучшение показателей 5-летней IDFS с 81,0% до 85,4% (Δ4,5%) что соответствует достоверному снижению относительного риска прогрессирования на 28,4% (HR 0,716; p<0,0001). Абсолютное преимущество в показателях IDFS при применении рибоциклиба имеет тенденцию к увеличению, о чем свидетельствует выигрыш в 2,7% при 3-летнем наблюдении и 4,5% при 5-летнем. При подгрупповом анализе отмечено преимущество добавления рибоциклиба во всех анализируемых подгруппах, в том числе и у больных с pN0 (см. табл.1). Комбинация с рибоциклибом продемонстрировала достоверное снижение относительного риска развития отдаленных метастазов (DRFS) на 29%.
Таблица 1.
Подгрупповой анализ по безрецидивной выживаемости в исследовании NATALEE.
Данные по общей выживаемости остаются незрелыми, показатели 5-летней OS в группе комбинации с рибоциклибом составляют 94,1% и в группе ингибиторов ароматазы – 92,5% (Δ1,6%). На момент окончания сбора данных умерло 300 пациентов: 137 (5,4%) в группе рибоциклиба + ИА и 163 (6,7%) в группе, принимавшей только ИА. Смерть от РМЖ наступила у 101 пациента (4,0%) в группе рибоциклиба + ИА и у 133 (5,4%) в группе, принимавшей только ИА. В ходе данного 5-летнего анализа не было выявлено новых сигналов безопасности (вторичные первичные злокачественные новообразования, другие причины смерти). Доля пациентов, у которых развились вторичные первичные злокачественные новообразования, была схожей в обеих группах: рибоциклиб + АИ – 67 (2,7%) пациентов; только АИ – 74 (3,0%).
Авторы делают вывод, что результаты 5-летнего наблюдения за больными II/III стадии HR-позитивного/
Два обсуждаемых исследования свидетельствуют, что добавление ингибиторов CDK4/6 абемациклиба или рибоциклиба к адъювантной гормонотерапии больных HR-позитивным/
Широкие критерии включения и зафиксированный умеренный позитивный эффект от добавления рибоциклиба во всех анализированных подгруппах затрудняют выделение пациентов с максимальной пользой от комбинации. Можно внести в Практические рекомендации показания, взятые из официального описания рибоциклиба (торговое название Рисарг), которые звучат в следующей редакции: препарат Рисарг в комбинации с ингибитором ароматазы показан к применению для адъювантной терапии взрослых пациентов с положительным по гормональным рецепторам (HR+) и отрицательным по рецептору HER2 ранним раком молочной железы III стадии или II стадии с высоким риском рецидива. Но в этом случае речь идет о десятках тысяч больных, возможных кандидатов, к чему не готова онкологическая служба организационно и финансово. А это значит, что это будет формальная рекомендации, которая будет исполняться у единичных пациентов.
Продолжение следует...
Источники:
- Johnston SRD, et al. monarchE: Primary overall survival (OS) results of adjuvant abemaciclib + endocrine therapy (ET) for HR+, HER2-, high-risk early breast cancer (EBC). ESMO Congress 2025, LBA13.
- Crown JP, et al. Adjuvant ribociclib (RIB) plus nonsteroidal aromatase inhibitor (NSAI) in patients (pts) with HR+/HER2− early breast cancer (EBC): NATALEE 5-year outcomes. ESMO Congress 2025, LBA14.
НОВОСТИ ESMO 2025 / КОНЪЮГАТЫ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ И ЦИТОСТАТИКОВ В ПЕРВОЙ ЛИНИИ ТЕРАПИИ МЕТАСТАТИЧЕСКОГО ТРОЙНОГО НЕГАТИВНОГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ
От первых успешных результатах конъюгатов моноклональных антител и цитостатиков (ADC) в раннем раке переходим к их наступлению в лечении метастатического рака молочной железы (РМЖ).
ТROP2 (опухолево-ассоциированный трансдуктор кальциевого сигнала 2) – белок, который передает внутриклеточный кальциевый сигнал и действует как рецептор на мембране клетки. TROP2 играет роль в прогрессировании опухолей, активно взаимодействуя с несколькими ключевыми молекулярными сигнальными путями, традиционно связанными с развитием и прогрессированием рака. Аномальная гиперэкспрессия TROP2 была описана при нескольких солидных опухолях, таких как колоректальный рак, рак почек, легких и молочной железы. Все это послужило основанием для создания ADC к TROР2 с мощными цитостатиками и их изучения при опухолях с экспрессией этого белка. Примером такого ADC является датопотамаб дерукстекан (Дато) и сацитузумаб говитекан (SG).
Дато был изучен в исследовании TROPION-Breast02 у больных метастатическим тройным негативным РМЖ с отсутствием экспрессии PD-L1, что исключает назначение иммунотерапии в первой линии этим пациенткам. В исследовании было включено 644 больных, не получавших ранее лекарственную терапию по поводу метастатической болезни и не являющихся кандидатами для иммунотерапии. Разрешалась ранее проведенная неоадъювантная или адъювантная химиоиммунотерапия по поводу операбельного РМЖ. Больные рандомизировались в группу Дато 6 мг/кг каждые 3 недели или химиотерапию по выбору врача, лечение проводили до признаков прогрессирования. Основным критерием эффективности была медиана времени до прогрессирования (ВБП), вторичными конечными точками – общая выживаемость (ОВ), частота и продолжительность объективного ответа и токсичность.
Медиана возраста больных составила 56 лет, у 34% наличие метастатического процесса было обнаружено при постановке диагноза РМЖ, 66% ранее получали системную терапию по поводу операбельного РМЖ, у 78% имелись висцеральные метастазы, включая метастазы в печени (30%) и головном мозге (10%). В группе химиотерапии больные наиболее часто получали лечение таксанами (82%) и эрибулином (12%). При медиане наблюдения 27,4 мес. медиана ВБП составила 10,8 мес. в группе Дато и 5,6 мес. в группе химиотерапии, что соответствует достоверному снижению относительного риска прогрессирования на 43% (HR 0,57; p<0,001). На отметке 18 мес. живы без прогрессирования 32,7% и 16,8% пациенток соответственно. При подгрупповом анализе все анализируемые подгруппы выигрывали от назначения Дато. Частота объективного эффекта и его продолжительность в группе Дато составила 62,5% и 12,3 мес., в группе химиотерапии – 29,3% и 7,1 мес. Медиана ОВ зарегистрирована на отметке 23,7 мес. в группе Дато и 18,7 мес. в группе химиотерапии, что соответствует достоверному снижению относительного риска смерти на 21% (HR 0,79; p=0,029). При подгрупповом анализе не отмечено выигрыша от назначения Дато у больных из Европы, Канады и США и у больных, получавших системную терапию ранее, если интервал от ее окончания до момента прогрессирования составил менее 12 мес. Во всех остальных подгруппах назначение Дато ассоциировалось с увеличением продолжительности жизни. При продолжительности лечения в группе Дато и химиотерапии 8,5 и 4,1 мес. соответственно частота побочных эффектов 3-4 степени составила 33% и 29%. Наиболее частыми осложнениями в группе Дато были сухость глаз, стоматиты, тошнота и слабость. Интерстициальный фиброз легких зарегистрирован у 9 больных, только у одной из них он был 3 степени. Не отмечено летальных исходов в ходе проведения данного исследования.
Авторы исследования делают вывод, что Дато в сравнении с химиотерапией демонстрирует статистически и клинически значимый выигрыш в частоте объективных эффектов и их продолжительности, в увеличении продолжительности БВП и ОВ при умеренной токсичности. Все это указывает, что Дато может рассматриваться как новая опция системной терапии первой линии больных метастатическим тройным негативным РМЖ.
Следует упомянуть еще об одном кандидате на роль первой линии терапии метастатического тройного негативного РМЖ. Это ADC моноклонального антитела к TROP2 и ингибитора топоизомеразы/
SG также претендует на первую линию лечения у больных тройным негативным РМЖ с экспрессией PD-L1. Предварительные результаты исследования ASCENT-04/KEYNOTE-D19, в которое были включены 443 пациентки с экспрессий PD-L1 CPS>10, свидетельствует, что комбинация SG и пембпролизумаба выигрывает перед комбинацией химиотерапии и пембролизумаба: медиана ВБП составила 11,2 и 7,8 мес. соответственно с достоверным снижением относительного риска прогрессирования на 35% (HR 0,65; p=0,0009). Частота объективного эффекта составила 59,7% и 53,2% при медиане его продолжительности 16,5 и 9,2 мес. Наиболее частыми побочными осложнениями ≥3 степени тяжести при применении SG и пембролизумаба были нейтропения (43%) и диарея (10%), а при применении химиотерапии и пембролизумаба – нейтропения (45%), анемия (16%) и тромбоцитопения (14%).
Следует помнить, что есть еще один ADC, который может назначаться больным метастатическим тройным негативным РМЖ, правда, во второй-третьей линиях. Это трастузумаб дерукстекан (T-DXd), который в исследовании Destiny-Breast004 был изучен у 557 больных метастатическим РМЖ с низкой экспрессией HER2 и прогрессированием после 1-2 линий химиотерапии. В исследовании, в которое преимущественно включали пациенток с наличием позитивных гормональных рецепторов, была когорта из 58 больных тройным негативным фенотипом. Лечение T-DXd в сравнении с химиотерапией по выбору врача достоверно уменьшило относительный риск прогрессирования и смерти в 2 раза у всех включенных в исследование. У больных с тройным негативным фенотипом медиана ВБП составила 8,3 и 18,2 мес. у получавших T-DXd и химиотерапию соответственно, со снижением относительного риска прогрессирования на 52%. Полученные данные на небольшом количестве пациентов, тем не менее, свидетельствуют о большом потенциале T-DXd при этом фенотипе РМЖ и перспективах его использования в том числе и на более ранних этапах лечения.
Изученные ADC будут постепенно вытеснять классические цитостатики на вторые роли противоопухолевой системной терапии. Скорость этого вытеснения будет зависеть от многих факторов. Среди них построение рациональных последовательностей использования различных ADC, направленных на различные мишени и несущие различные по механизму действия цитостатики, с учетом возникающей резистентности и потенциальной токсичности при их назначении. Определение предиктивных биомаркеров к назначению различных по механизму действия ADC могло бы быть важным подспорьем в определении как наилучших кандидатов для лечения, так и в выстраивании последовательности их применения с достижением наибольшего противоопухолевого эффекта при контролируемой токсичности. Сегодня основным барьером на пути широкого применения ADC остается их высокая стоимость, которая делает их недоступными для онкологической службы и наших пациентов.
Источники:
- Dent R, et al. First-line (1L) datopotamab deruxtecan (Dato-DXd) vs chemotherapy in patients with locally recurrent inoperable or metastatic triple-negative breast cancer (mTNBC) for whom immunotherapy was not an option: Primary results from the randomised, phase 3 TROPION-Breast02 trial. ESMO Congress 2025, LBA21.
- Cortes JC, et al. Primary results from ASCENT-03: a randomized phase 3 study of sacituzumab govitecan (SG) vs chemotherapy (chemo) in patients (pts) with previously untreated metastatic triple-negative breast cancer (mTNBC) who are not candidates for PD-(L)1 inhibitors. ESMO Congress 2025, LBA20.
- Tolaney SM, et al. Sacituzumab govitecan (SG) + pembrolizumab (pembro) vs chemotherapy (chemo) + pembro in previously untreated PD-L1–positive advanced triple-negative breast cancer (TNBC): Primary results from the randomized phase 3 ASCENT-04/KEYNOTE-D19 study. ASCO 2025, LBA109.
- Modi M, et al. Trastuzumab deruxtecan in previously treated HER2-low advanced breast cancer. N. Engl. J. Med. 2022; 387: 9-20.
НОВОСТИ ESMO 2025 / POST-ESMO2025: КАК МЫ БУДЕМ ЛЕЧИТЬ РАСПРОСТРАНЕННЫЙ РАК ЯИЧНИКОВ?
Автор: Румянцев Алексей Александрович
Заведующий отделением лекарственных методов лечения злокачественных опухолей №4
НИИ клинической онкологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, к.м.н.,
Москва
Юбилейный 50-й конгресс ESMO 2025 собрал более 37 000 участников из 174 стран, в ходе мероприятия были представлены результаты множества работ, имеющих не только научную, но и непосредственную практическую значимость. Рак яичников стал одним из тех заболеваний, лечение которых активно обсуждалось в ходе ESMO 2025. В данной заметке – попытки осмысления наиболее важных и перспективных исследований по лечению распространенного рака яичников и их влияния на нашу практику уже сегодня (или завтра/
Первоначальное лечение
Дозоинтенсивная химиотерапия с бевацизумабом при распространенном раке яичников: окончательные результаты исследования ICON8B
Вопрос об эффективности дозоинтенсифицированных режимов химиотерапии при этом заболевании обсуждается уже второе десятилетие, многочисленные работы демонстрируют противоречивые результаты. На ESMO 2025 – финальные результаты рандомизированного исследования III фазы ICON8B (n=579), при раке яичников высокого риска, под котором понималась проведенная неоадъювантная химиотерапия или резидуальная опухоль >10 мм при III стадии опухолевого процесса или IV стадия (Clamp et al., 2025).
Исследование проводилось в период с 2015 по 2020 гг., рандомизация в три рукава: группа стандартного лечения получала химиотерапию в режиме карбоплатин AUC5 + паклитаксел 175 мг/м2 + бевацизумаб 7,5 мг/кг каждые 3 недели, экспериментальная группа получала карбоплатин и бевацизумаб в аналогичных дозах в сочетании с паклитакселом 80 мг/м2 еженедельно (dose-dense режим). Медиана выживаемости без прогрессирования (ВБП) составила 16,7 и 22,2 мес. соответственно (ОР 0,75; 95% ДИ 0,62-0,90; p=0,002). Исходный дизайн исследования предполагал также наличие еще одной группы пациенток, получавших оба химиотерапевтических агента в еженедельном режиме, однако эта группа была закрыта.
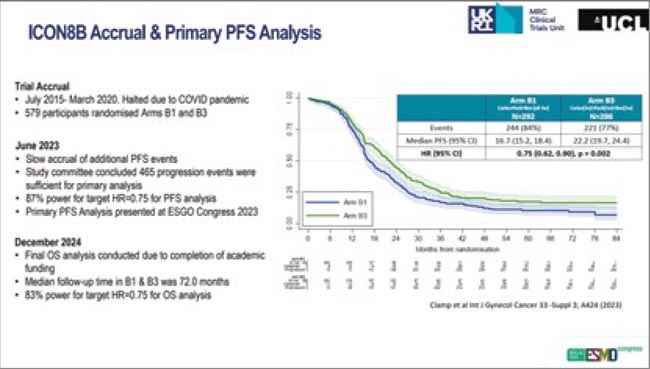
При медиане наблюдения 72,0 мес. медиана общей выживаемости составила 39,6 мес. в группе стандартного лечения по сравнению с 49,8 мес. в группе дозоинтенсивной химиотерапии (ОР 0,79; 95% ДИ 0,65-0,95; p=0,010). В подгрупповом анализе преимущества dose-dense режима отмечены при интервальных циторедукциях (ОР 0,78; 95% ДИ 0,64-0,96; p=0,015), но не при первичных циторедукциях (ОР 0,81; 95% ДИ 0,43-1,54; p=0,36) – возможно, в силу небольшой численности данной подгруппы (n=79).
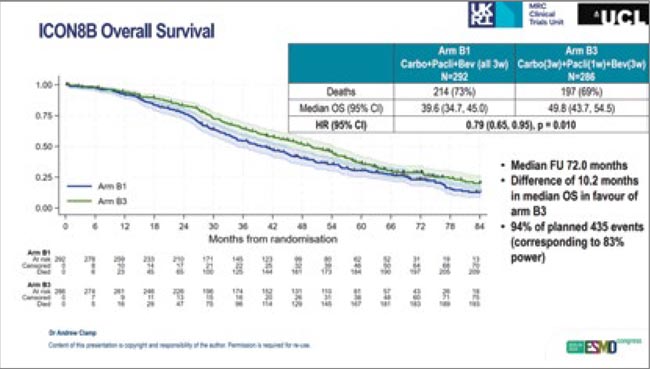
ICON8B стало первым исследованием, продемонстрировавшим статистически значимое улучшение общей выживаемости от еженедельного режима в комбинации с бевацизумабом в европейской популяции пациенток с распространенным раком яичников. Есть, впрочем, несколько нюансов, которые представляются крайне важными для понимания роли этой работы в современном ландшафте лечения рака яичников:
- Несоответствие результатам других исследований в европейской популяции пациенток – в частности, основному исследованию ICON8, результаты которого по оценке эффективности dose-dense режима в широкой популяции больных не показали пользы от интенсификации терапии – как в общей популяции исследования, так и в подгруппах больных с IV стадией опухолевого процесса, после неоадъюванта (Clamp et al., 2022); возможно, дело в более тщательном отборе пациенток или в синергетических эффектах еженедельного режима дозирования паклитаксела и бевацизумаба – хотя GOG-262, напротив, показал выигрыш от еженедельного применения паклитаксела только среди больных, которые не получали этот препарат (Chan et al., 2016). Загадка, одним словом.
- Очень малое количество пациенток в группе первичной циторедукции – всего 79 (13,6%), не очень понятно, как в целом можно экстраполировать полученные данные на эту популяцию пациенток.
- Токсичность терапии при еженедельном введении паклитаксела очевидно, выше, чем при использовании стандартного режима дозирования данного препарата, а таксан-индуцированная полинейропатия может персистировать длительное время после завершения химиотерапии (Blagden et al., 2020).
- Несвоевременность полученных результатов – судьба исследования оказалась сложной, набор был начат в 2015 году, продолжался до марта 2020 года, после чего был досрочно приостановлен по причине пандемии COVID, планы по необходимому количеству пациенток пересматривались дважды в ходе исследования. Подходы к лечению распространенного рака яичников существенно поменялись – в нашу речь вошли такие слова как «мутации BRCA», «статус HRD», которые во многом определяют возможности терапии (Lorusso et al., 2024). Прогноз для HRD+/BRCA-мутированных пациенток изменился в лучшую сторону, что может добавить интенсифицированное введение паклитаксела – не очень понятно. Опция для HRD-негативных больных?
Таким образом, результаты ICON8b оставляют смешанные чувства. Эта опция терапии явно не нужна всем пациенткам с распространенным РЯ. Кто-то может от нее выиграть, но кто – еще только предстоит узнать. Рутинные подходы к первоначальному лечению распространенного рака яичников пока, очевидно, не изменятся.
Рак яичников: фузулопариб ± апатиниб в первой линии поддерживающей терапии – финальные результаты исследования FZOCUS-1
Были представлены финальные результаты трехрукавного китайского рандомизированного исследования III фазы FZOCUS-1 (n=674) – оценка эффективности нового ингибитора PARP фузулопариба в монотерапии или в комбинации с апатинибом (тирозинкиназный ингибитор VEGFR-2) по сравнению с плацебо в поддерживающей терапии пациенток с распространенным раком яичников после первоначального лечения. Рандомизация осуществлялась в группу фузулопариба в монотерапии, фузулопариба с апатинибом или в группу плацебо в соотношении 2:2:1 (Li, 2025).
По результатам исследования при медиане наблюдения ≈40 месяцев были выявлены следующие различия в эффективности терапии между анализируемыми группами:
- Пациентки с патогенными герминальными мутациями BRCA1/2: медиана ВБП составила 47,8 мес. в группе монотерапии фузолопарибом, 45,1 мес. в группе фузулопариба и апатиниба против 16,6 мес. (плацебо); ОР 0,51 (95% ДИ 0,30-0,86) и 0,50 (95% ДИ 0,30-0,84) соответственно.
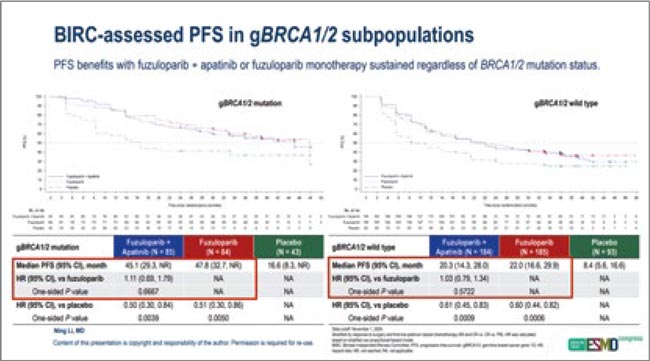
- HRD+ популяция пациенток (включая пациенток с патогенных мутациями BRCA1/2): медиана ВБП – 35,8 мес. в группе фузулопариба, 34,1 мес. в группе фузулопариба и апатиниба против 16,6 мес. в группе плацебо; ОР 0,67 (95% ДИ 0,48-0,93) и 0,57 (95% ДИ 0,44-0,75) – без значимых различий между монотерапией и комбинацией.

- Популяция пациенток без HRD (HRP популяция): здесь медиана ВБП составила 11,0 мес. в группе монотерапии фузулопарибом, 16,6 мес. в группе фузулопариба и апатиниба против 5,5 мес. в группе плацебо; ОР 0,68 (0,40-1,15) и 0,51 (95% ДИ 0,30-0,86) – пожалуй, наиболее интересная часть. Складывается впечатление, что именно среди пациенток с «профицитом» гомологичной рекомбинации (HRD-негативная популяция) использование комбинации фулузопариба и апатиниба дает клиническое преимущество.
Данные по ОВ «дозревают» и будут представлены когда-то позже. Медиана ОВ не достигнута ни в одной из сравниваемых групп пациенток, на 3 годах различий в эффективности не наблюдается.
Финальные результаты общей выживаемости из исследования III фазы DUO-O: дурвалумаб и олапариб при раке яичников
Рандомизированное исследование III фазы по оценке эффективности применения комбинации дурвалумаба и олапариба в первоначальном лечении распространенного рака яичников у пациенток с «диким» типом генов BRCA1/2. Дизайн исследования (n=1130) предусматривал рандомизацию пациенток в три группы – поддерживающей терапии дурвалумабом и олапарибом, только дурвалумабом, только плацебо. Все включенные пациентки получали стандартную химиотерапию паклитакселом, карбоплатином и бевацизумабом (Aghajanian et al., 2025).
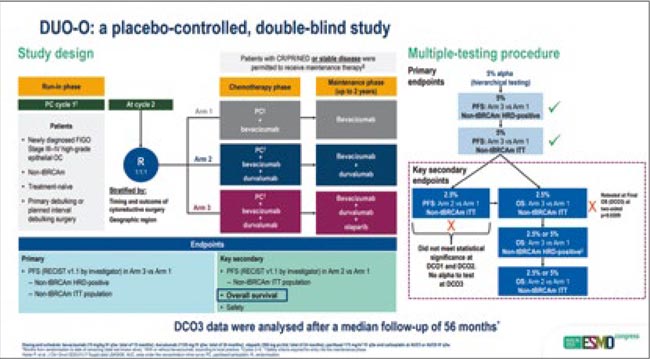
Результаты DUO-O с точки зрения первичной конечной точки исследования, беспрогрессивной выживаемости пациенток, докладывались ранее – продемонстрировано небольшое, но статистически достоверное увеличение ВБП пациенток при добавлении дурвалумаба и олапариба к стандартной химиотерапии. При текущем анализе данных в общей популяции исследования медиана ВБП составила 19,3 мес. в контрольной группе, где пациентки получали химиотерапию с бевацизумабом, 20,5 мес. в группе дурвалумаба (ОР 0,84; 95% ДИ0,71-0,99), 25,1 мес. в группе дурвалумаба с олапарибом (ОР 0,62; 95% ДИ 0,52-0,73). Соответствующие показатели для ОВ составили 49,6 мес., 48,5 мес. (ОР 0,97; 95% ДИ 0,80-01,18; p=0,785) и 50,5 мес. соответственно (ОР 0,92; 95% ДИ 0,75-1,11; p=0,378). Анализ, проведенный в популяции HRD-позитивных или HRD-негативных пациенток, также не позволил выявить «бенефициаров» такого варианта лечения.
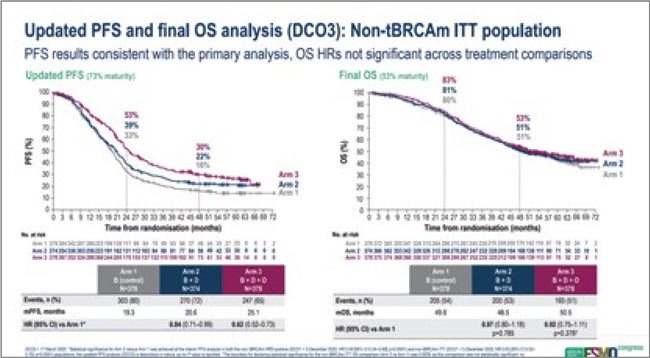
Таким образом, наши стандартные подходы к первоначальному лечению распространенного рака яичников в целом не поменяются после ESMO 2025. Стандартом лечения для BRCA-позитивного или HRD-позитивного рака яичников останется обычная трехнедельная химиотерапия с поддерживающей терапией ингибиторами PARP, без иммунотерапии. Может быть, мы со временем переосмыслим наши подходу к роли дозоинтенсивной химиотерапии, и она найдет свое место у HRD-негативных больных? Время покажет.
Лечение рецидивов рака яичников
Не обошли своим вниманием исследователи и непростую задачу по лечению рецидивов рака яичников. В первую очередь – много работ по «резистентным» рецидивам заболевания.
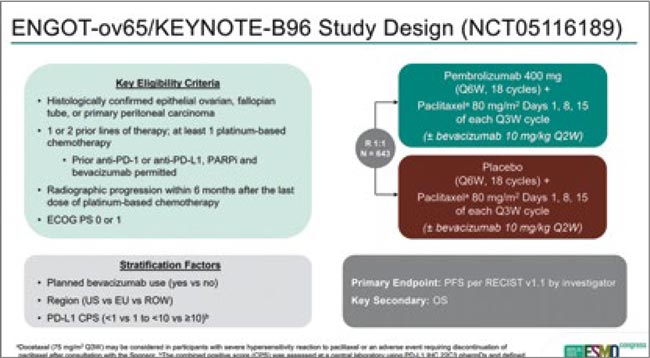
Рак яичников: пембролизумаб + еженедельный паклитаксел при «резистентных» рецидивах – результаты ENGOT-ov65/KEYNOTE-B96
На первой президентской сессии ESMO 2025 были представлены результаты крупного рандомизированного плацебо-контролируемого исследования III фазы ENGOT-ov65/KEYNOTE-B96 (n=643) – оценка эффективности применения пембролизумаба в комбинации с еженедельным паклитакселом ± бевацизумаб (назначался по выбору врача, 73% пациенток по факту получали этот препарат) при «резистентных» рецидивах рака яичников. Рандомизация между группой пембролизумаба и плацебо в соотношении 1:1, стратификация – назначение бевацизумаба, географический регион, статус экспрессии PD-L1 (Colombo et al., 2025).
У половины включенных больных бесплатиновый интервал составил <3 мес., а 60% пациенток ранее получили 2 линии противоопухолевой терапии, 35% ранее получали ингибиторы PARP. По результатам исследования при медиане наблюдения 22,6 мес. медиана ВБП в общей популяции исследования составила 8,3 мес. в группе пембролизумаба против 6,4 мес. в группе плацебо (ОР 0,70; 95% ДИ 0,58-0,84; p<0,0001), медиана ОВ в общей популяции составила 17,7 мес. против 14,0 мес. соответственно (ОР 0,81; 95% ДИ 0,68-0,97; p=0,0114). Результаты оценки эффективности терапии в PD-L1+ популяции в целом были аналогичны общей популяции исследования.
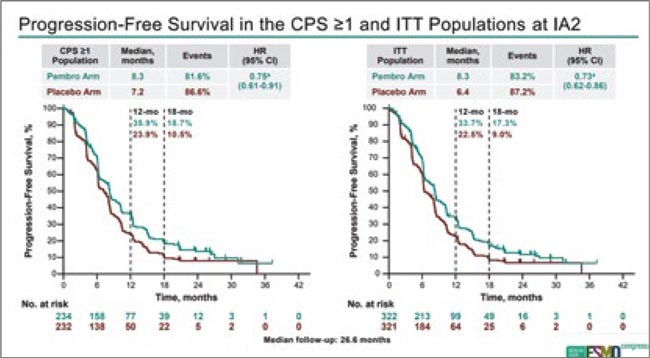
Таким образом, в многострадальной истории изучения эффективности иммунотерапии при распространенном раке яичников исследование KEYNOTE-B96 стало первым, продемонстрировавшим эффективность добавления анти-PD-1 агента к стандартной противоопухолевой терапии. Значимость определения экспрессии PD-L1 для эффективности терапии не подтвердилась. Режим паклитаксел + бевацизумаб и так был приоритетным вариантом лечения для пациенток, которым не была показана платиносодержащая химиотерапия, а теперь его еще можно усилить пембролизумабом.
Платиносодержащая против неплатиновой химиотерапии при «резистентных» рецидивах рака яичников – рандомизированное исследование
На ESMO 2025 были представлены результаты рандомизированного исследования II фазы (n=78) из НМИЦ онкологии им. Н.Н. Блохина по лечению «резистентных» рецидивов рака яичников – прямое сравнение эффективности повторного назначения платиносодержащей химиотерапии по сравнению с назначением стандартной неплатиновой химиотерапии. Включали пациенток с high-grade подтипами рака яичников с бесплатиновым интервалом ≤6 мес. после последней линии платиносодержащей химиотерапии. Особенность этой работы – включали только пациенток с ответом на последний платиносодержащий режим лечения, пациентки с платинорефрактерными рецидивами, которые определялись отсутствие ответа после на платиносодержащую химиотерапию или бесплатиновый интервал <3 мес., исключались из исследования (Rumyantsev et al., 2025).
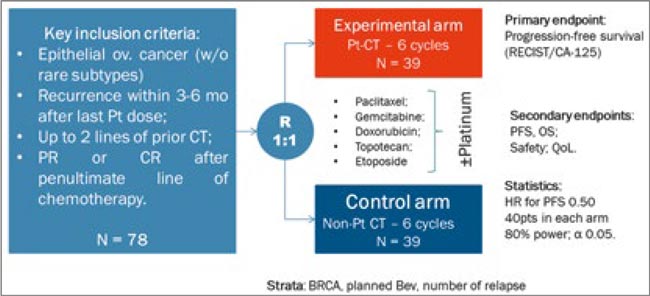
По результатам исследования медиана ВБП составила 8,0 мес. в группе платиносодержащей химиотерапии по сравнению с 4,1 мес. в контрольной группе (ОР 0,44; 95% ДИ 0,26-0,70; p<0,001). Отмечена тенденция к улучшению ОВ в группе платиносодержащей химиотерапии – медиана ОВ составила 23,8 мес. против 17,8 мес. (ОР 0,63; p=0,121). Частота объективного ответа по критериям GCIG также была значимо выше в группе и составила 55% vs. 18% (p=0,005). Подгрупповой анализ не выявил значимой гетерогенности эффективности терапии в различных популяциях пациенток.
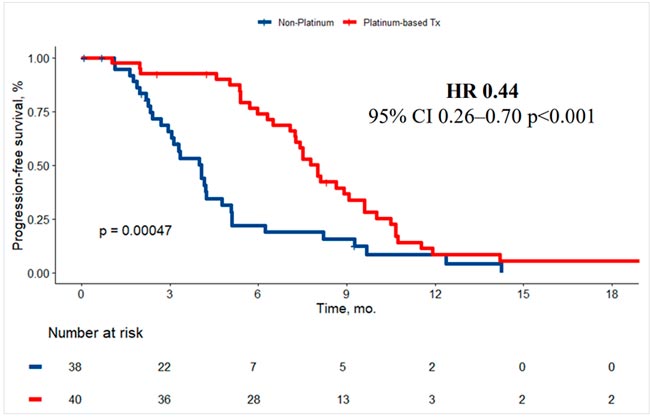
Результаты исследования подтверждают превосходство платиносодержащей химиотерапии в данной популяции пациенток и пополняют доказательную базу о малой значимости «традиционного» разделения рецидивов на «чувствительные» и «резистентные» по использованию 6-месячного порогового значения.
Добавление релакориланта к стандартной терапии улучшает результаты лечения пациенток после ингибиторов PARP – дополнительный анализ ROSELLA
Представлены результаты запланированного подгруппового анализа исследования III фазы ROSELLA (n=381) по оценке эффективности релакориланта, селективного антагониста глюкокортикоидных рецепторов, в комбинации с наб-паклитакселом у пациенток с «платинорезистентными» рецидивами рака яичников, ранее получавших ингибиторы PARP (Lorusso et al., 2025).
Дизайн исследования предусматривал рандомизацию 1:1 в группу релакориланта c наб-паклитакселом или наб-паклитаксела в монорежиме. Среди включенных пациенток 234 (61%) ранее получали ингибиторы PARP на каком-либо этапе терапии, из них у 78% было прогрессирование во время терапии ингибитором PARP. Характеристики подгруппы с предшествующей терапией ингибиторами PARP были сопоставимы с общей популяцией исследования. По результатам проведенного анализа в этой подгруппе пациенток медиана ВБП составила 7,4 мес. в группе релакориланта по сравнению с 4,6 мес. в группе наб-паклитаксела (ОР 0,60; 95% ДИ 0,42-0,85; p=0,0035), медиана ОВ – 15,6 мес. и 12,6 мес. соответственно.
Результаты демонстрируют сопоставимую пользу от добавления релакорилант к наб-паклитакселу в подгруппе с предшествующей терапией ингибиторами PARP по сравнению с общей популяцией исследования ROSELLA, а еще хорошо дополняют результаты KEYNOTE-B96, представленные выше, – видимо, пембролизумаб при рецидивах не менее эффективен, чем другие инновационные препараты.
Ралудотатуг деруктекан и другие новые «конъюгаты» при рецидивах рака яичников – одногрупповые исследования
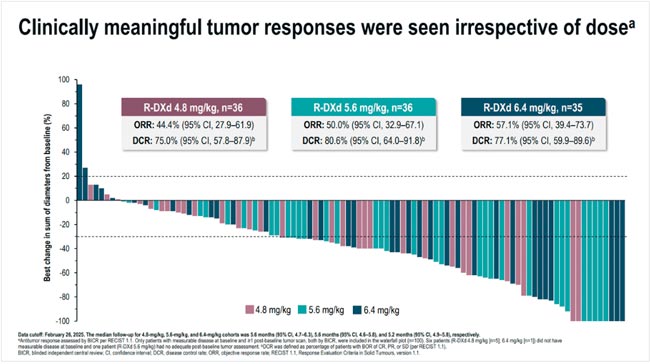
Сразу три исследования по оценке эффективности различных инновационных препаратов класса ADC при «резистентных» рецидивах рака яичников. Наиболее продвинутый в плане фазы исследований – ралудотатуг дерукстекан, первый в своем классе ADC, направленный на CDH6 – мишень, экспрессия которой обнаруживается у большинства (65-85%) больных раком яичников. Представлены результаты части II фазы по REJOICE-Ovarian01 (n=107) – ралудотатуг дерукстекан (R-DXd) в различных режимах дозирования, от 4,8 до 6,4 мг/кг при резистентных рецидивах рака яичников. Включались достаточно тяжело предлеченные пациентки – медиана количества предшествующих линий противоопухолевой терапии составила 3 линии; 70% пациенток ранее получали ингибиторы PARP. Как можно заметить, исследование было спланировано таким образом, чтобы при удаче II фазы сразу перейти к III фазе и оценить эффективность препарата в сравнении со стандартной химиотерапией.

По результатам исследования объективный ответ на терапию отмечен у 50% пациенток, в том числе – несколько полных ответов. Клинически значимые ответы наблюдались в широком диапазоне экспрессии CDH6 в опухоли. При этом препарат достаточно хорошо переносился: несмотря на 53% тяжелых нежелательных явлений, снижение дозы исследуемого препарата было произведено только у 18,7%, а необходимость в отмене терапии возникла у 5,6% пациенток (Ray-Coquard et al., 2025).
Другой перспективный ADC, TUB-040, нацеленный на NaPi2b, в исследовании I фазы (n=67) позволил достичь объективного ответа на терапию у 33% тяжело предлеченных пациенток, а показатель частоты контроля заболевания составил 91% (Gonzalez-Martin et al., 2025). Новый ADC к рецепторам FR-альфа, препарат AZD5335, в исследовании I фазы FONTANA (n=187) показал активность при резистентном раке яичников – в диапазоне доз от 1,6 до 2,4 мг/кг. Показатель частоты объективного ответа составил 61% при высокой экспрессии рецепторов фолатов (как для мирветуксимаба – ≥75% опухолевых клеток с окрашиванием ≥2+ интенсивности), 48% – при низкой экспрессии мишени (≥25% опухолевых клеток с окрашиванием ≥1+ интенсивности) (Oaknin et al., 2025). Несомненно, в будущем мы увидим продолжение исследований этих препаратов при распространенном раке яичников.
Возможность прекращения поддерживающей терапии PARP-ингибиторами при длительной ремиссии заболевания при рецидивах рака яичников
И единственное в этом материале исследование по платиночувствительным рецидивам рака яичников посвящено возможности завершения поддерживающей терапии ингибиторами PARP у пациенток, достигших длительного контроля опухолевого процесса (Haggstrom et al., 2025). Сложившаяся по результатам регистрационных исследований практика применения ингибиторов PARP при рецидивах рака яичников – проводить поддерживающую терапию неопределенно длительно, то есть до прогрессирования или непереносимости. При этом длительность терапии была определена эмпирически, а доказательная база, поддерживающая такой подход – или возможность отмены терапии в какой-либо момент времени, отсутствовала. Когда можно безопасно отменить терапию?
Практика онкологов в мире по этому вопросу существенно варьирует, отдельные специалисты высказываются в пользу завершения терапии после 5-летнего срока, но опять-таки без обоснования (Haggstrom et al., 2024). Долговременные результаты рандомизированного исследования Study 19 показали, что около 10% пациенток получают терапию олапарибом в течение ≥6 лет (Friedlander et al., 2018).
На ESMO 2025 представили результаты многоцентрового ретроспективного исследования, включившего 297 пациенток с платиночувствительными рецидивами РЯ, которые получали терапию ингибиторами PARP (75% – олапариб) в течение ≥5 лет. Из них 95 (32%) прекратили прием PARP-ингибиторов по причинам, не связанным с прогрессированием заболевания. При медиане наблюдения 6,8 лет у прекративших терапию не по причине прогрессирования показатель ВБП составил 97% через 7,5 лет и 93% – через 10 лет. У тех, кто продолжал терапию, указанные показатели были даже чуть меньше – 87% и 75% (p=0,08).

Несмотря на ретроспективный характер исследования, его результаты могут быть значимыми с практической точки зрения – отмена терапии при рецидивах РЯ может быть безопасной после ≈5-летнего периода лечения.
Список литературы:
- Aghajanian Carol, Fabian Trillsch, Shin Nishio, et al. Durvalumab + Paclitaxel/Carboplatin + Bevacizumab Followed by Durvalumab, Bevacizumab + Olaparib Maintenance in Patients with Newly Diagnosed Non-tBRCA-Mutated Advanced Ovarian Cancer: Final Overall Survival from DUO-O/ENGOT-Ov46/GOG-3025. Presented at ESMO 2025, Berlin. October 19.
- Blagden Sarah, Laura Murphy, Domenico Radice, I McNeish, and Rosmary Lord. n.d. ICON8B: GCIG Phase III Randomised Trial Comparing First-Line Weekly Dose-Dense Chemotherapy + Bevacizumab to Three-Weekly Chemotherapy + Bevacizumab in High-Risk Stage III-IV Epithelial Ovarian Cancer (EOC): Quality-of-Life Outcomes. Paper presented at ESMO2025, Berlin.
- Blagden Sarah P, Adrian D Cook, Christopher Poole, et al. Weekly Platinum-Based Chemotherapy versus 3-Weekly Platinum-Based Chemotherapy for Newly Diagnosed Ovarian Cancer (ICON8): Quality-of-Life Results of a Phase 3, Randomised, Controlled Trial. The Lancet Oncology. 2020; 21 (7): 969-77. https://doi.org/10.1016/S1470-2045(20)30218-7.
- Chan John K., Mark F. Brady, Richard T. Penson, et al. Weekly vs. Every-3-Week Paclitaxel and Carboplatin for Ovarian Cancer. New England Journal of Medicine. 2016; 374 (8): 738-48. https://doi.org/10.1056/NEJMoa1505067.
- Clamp Andrew, I McNeish, Domenico Radice, Rosemary Lord, Agnieszka Michael, and Cook, Audrey. ICON8B: GCIG Phase III Randomised Trial Comparing First-Line Weekly Dose-Dense Chemotherapy + Bevacizumab to Three-Weekly Chemotherapy + Bevacizumab in High-Risk Stage III-IV Epithelial Ovarian Cancer (EOC): Final Overall Survival (OS) Analysis. Paper presented at ESMO2025, Berlin. October 19.
- Clamp Andrew R, Elizabeth C James, Iain A McNeish, et al. Weekly Dose-Dense Chemotherapy in First-Line Epithelial Ovarian, Fallopian Tube, or Primary Peritoneal Cancer Treatment (ICON8): Overall Survival Results from an Open-Label, Randomised, Controlled, Phase 3 Trial. The Lancet Oncology. 2022; 23 (7): 919-30. https://doi.org/10.1016/S1470-2045(22)00283-2.
- Colombo Nicoletta, Emese Zsiros, Alexandra Sebastianelli, et al. Pembrolizumab vs Placebo Plus Weekly Paclitaxel With or Without Bevacizumab for Platinum-Resistant Recurrent Ovarian Cancer: Results from the Randomized, Double-Blind Phase 3 ENGOT-Ov65/KEYNOTE-B96 Study. Presented at ESMO 2025, Berlin. October 19.
- Friedlander Michael, Ursula Matulonis, Charlie Gourley, et al. Long-Term Efficacy, Tolerability and Overall Survival in Patients with Platinum-Sensitive, Recurrent High-Grade Serous Ovarian Cancer Treated with Maintenance Olaparib Capsules Following Response to Chemotherapy. British Journal of Cancer. 2018; 119 (9): 1075-85. https://doi.org/10.1038/s41416-018-0271-y.
- Gonzalez-Martin Antonio, Jalid Sehouli, Elena Braicu, Shiraj Sen, and Valentina Boni. NAPISTAR 1-01: A Phase 1 Dose Escalation Study of TUB-040, a Novel NaPi2b-Targeting Exatecan Antibody-Drug Conjugate (ADC) in Patients with Platinum-Resistant Ovarian (PROC) High Grade Serous Carcinoma (HGSC). Presented at ESMO 2025, Berlin. October 19.
- Haggstrom Lucy, Yeh Chen Lee, Maria Pilar Barretina Ginesta, et al. 2025. ‘How Long Is Long Enough? A Gynecologic Cancer InterGroup Collaboration Investigating Long Term Outcomes in Exceptional Responders with Platinum Sensitive Recurrent Ovarian Cancer Treated with PARP Inhibitors’. Presented at ESMO 2025, Berlin. October 18.
- Haggstrom Lucy, Yeh Chen Lee, Clare Scott, et al. How Long Is Long Enough? An International Survey Exploring Practice Variations on the Recommended Duration of Maintenance Therapy with PARP Inhibitors in Patients with Platinum Sensitive Recurrent Ovarian Cancer and Long-Term Outcomes. International Journal of Gynecological Cancer. 2024; 34 (12): 1932-39. https://doi.org/10.1136/ijgc-2024-005976.
- Li Ning. Fuzuloparib Monotherapy or in Combination with Apatinib as First-Line Maintenance Therapy in Advanced Ovarian Cancer. Presented at ESMO 2025, Berlin. October 19.
- Lorusso Domenica, Marie-Ange Mouret-Reynier, Philipp Harter, et al. Updated Progression-Free Survival and Final Overall Survival with Maintenance Olaparib plus Bevacizumab According to Clinical Risk in Patients with Newly Diagnosed Advanced Ovarian Cancer in the Phase III PAOLA-1/ENGOT-Ov25 Trial. International Journal of Gynecological Cancer. 2024; 34 (4): 550-58. https://doi.org/10.1136/ijgc-2023-004995.
- Lorusso Domenica, Stanislas Quesada, John K Chan, et al. ROSELLA (GOG3073, ENGOTov72, APGOT-OV10): Relacorilant + Nab-Paclitaxel in the Subgroup of Patients With Platinum-Resistant Ovarian Cancer (PROC) Previously Exposed to a PARP Inhibitor. Presented at ESMO 2025, Berlin. October 19.
- Oaknin Ana, Ruth Perets, Ronnie Shapira-Frommer, et al. First-in-Human Study of AZD5335, a Folate Receptor α (FRα)-Targeted Antibody-Drug Conjugate, in Patients with Platinum-Resistant Ovarian Cancer. Presented at ESMO 2025, Berlin. October 19.
- Ray-Coquard I, Kosei Hasegawa, Nicoletta Colombo, Jung-Yun Lee, and David Cibula. Raludotatug Deruxtecan (R-DXd) in Patients with Platinumresistant Ovarian Cancer: Primary Analysis of the Phase 2, Dose-Optimization Part of the REJOICE-Ovarian01 Study. Presented at ESMO 2025, Berlin. October 19.
- Rumyantsev A, Pokataev I, Tikhomirova T, et al. 1083P: Platinum-Based vs Non-Platinum Chemotherapy in Platinumresistant Relapsed Ovarian Cancer (PROC): A Randomized Phase II Trial. Presented at ESMO 2025, Berlin. October 18.
НОВОСТИ ESMO 2025 / ПРОРЫВЫ В ТЕРАПИИ РАКА МОЧЕВОГО ПУЗЫРЯ
Автор: Тимофеев Илья Валерьевич
Директор Бюро по изучению рака (Россия), член научного комитета
Колледжа Европейской Школы Онкологии (ESCO)
На конгрессе ESMO 2025 представлено множество значимых результатов, демонстрирующих прогресс в лечении рака мочевого пузыря. Итоги крупных клинических исследований, включая материалы Президентского симпозиума, обозначили новые стандарты терапии в разных клинических ситуациях.
Немышечно-инвазивный рак
Рандомизированное исследование 3 фазы POTOMAC: дурвалумаб + БЦЖ
В исследовании POTOMAC оценивали эффективность добавления дурвалумаба к стандартной терапии БЦЖ на индукционном и поддерживающем этапах лечения пациентов с БЦЖ-наивным немышечно-инвазивным раком мочевого пузыря и высоким риском.
Комбинированный подход достоверно улучшил безрецидивную выживаемость (БРВ): риск прогрессирования снизился на 32%, а 2-летняя БРВ выросла на 4,9% по сравнению с монотерапией БЦЖ. Эти данные подтверждают потенциал дурвалумаба как нового компонента комбинированного лечения в индукционной и поддерживающей фазе.
Рандомизированное исследование 3 фазы ALBAN: атезолизумаб + БЦЖ
В отличие от POTOMAC, исследование ALBAN не показало преимуществ при добавлении атезолизумаба к БЦЖ у пациентов с БЦЖ-наивным немышечно-инвазивным раком.
Комбинация не привела к улучшению бессобытийной выживаемости (EFS) и не продемонстрировала преимуществ ни в одной из подгрупп, включая пациентов с CIS. Следовательно, использование атезолизумаба совместно с БЦЖ не рекомендуется для дальнейшего клинического внедрения.
Неоадъювантная и адъювантная терапия мышечно-инвазивного рака высокого риска
Рандомизированное исследование 3 фазы KEYNOTE-905/EV-303: энфортумаб ведотин + пембролизумаб (EVP)
Комбинация энфортумаба ведотина с пембролизумабом показала убедительное преимущество в периоперационном лечении пациентов, не подходящих для лечения цисплатином. Результаты представлены на Президентском симпозиуме.
Применение режима EVP до и после радикальной цистэктомии обеспечило снижение риска прогрессирования на 60% и риска смерти на 50% по сравнению с хирургическим лечением без системной терапии. Частота полного патоморфологического ответа увеличилась более чем в шесть раз (57% против 9%), что делает комбинацию новым стандартом периоперационной терапии.
Рисунок 1.
Бессобытийная выживаемость.
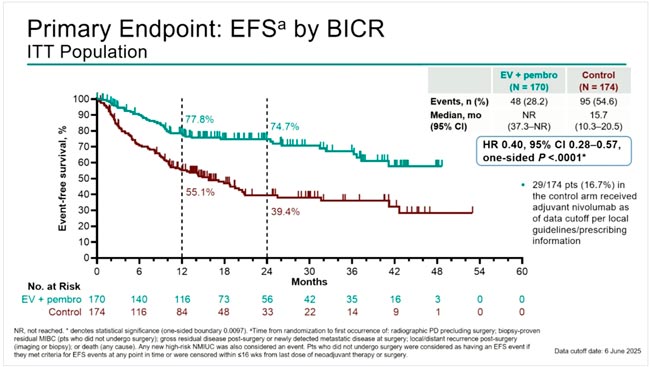
Рисунок 3.
Общая выживаемость.
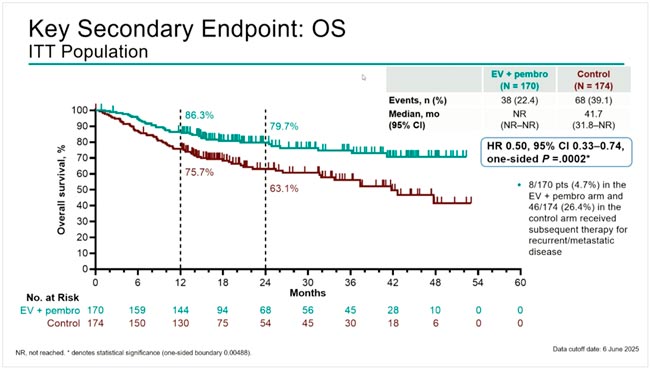
Рисунок 3.
Зависимость бессобытийной выживаемости от глубины патоморфологического ответа.
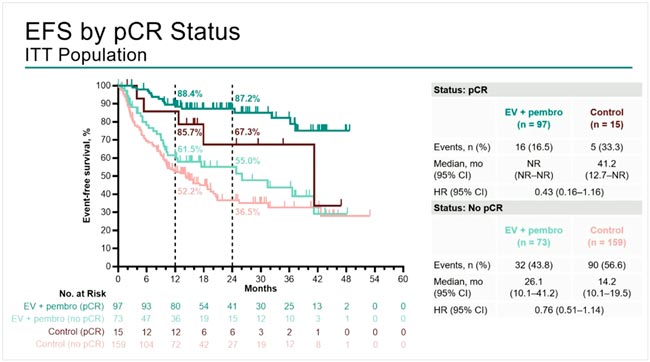
Результаты длительного наблюдения в рандомизированном исследовании 3 фазы CheckMate 274: адъювантный ниволумаб
Продолжительное наблюдение за участниками исследования CheckMate 274 подтвердило устойчивость эффекта адъювантного ниволумаба у пациентов с высоким риском мышечно-инвазивного уротелиального рака.
Через пять лет наблюдения риск прогрессирования снизился на 26% в общей популяции и на 42% при PD-L1 ≥1%, при этом медиана безрецидивной выживаемости увеличилась на 10,9 и 47,1 месяца соответственно. Кроме того, у PD-L1-положительных пациентов риск смерти уменьшился на 43%.
Анализ ctDNA показал особенно выраженное преимущество терапии у ctDNA-положительных больных (снижение риска прогрессирования на 65%), что подчеркивает значимость минимальной остаточной болезни как прогностического маркера.
Рисунок 4.
Безрецидивная выживаемость.
Рисунок 5.
Общая выживаемость.
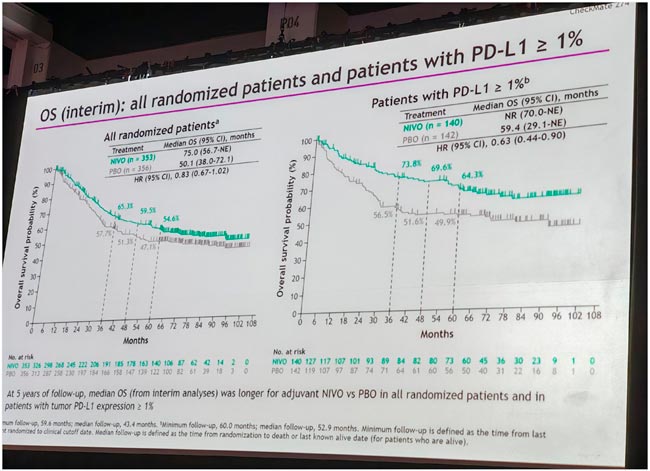
Рандомизированное исследование 3 фазы IMvigor011: адъювантный атезолизумаб в группе пациентов с циркулирующей опухолевой ДНК
Использование атезолизумаба в адъювантной терапии, основанной на мониторинге циркулирующей ДНК (ctDNA), показало эффективность у пациентов после радикальной цистэктомии. Результаты представлены на Президентском симпозиуме.
Больные с выявленной ctDNA были рандомизированы на атезолизумаб или плацебо, тогда как ctDNA-отрицательные пациенты находились под наблюдением.
Применение атезолизумаба позволило снизить риск рецидива на 36% и увеличить медиану безрецидивной выживаемости примерно на 5 месяцев, а медиану общей выживаемости – на 11 месяцев.
Для ctDNA-отрицательной когорты частота двухлетней безрецидивной выживаемости составила 88%, то есть низкую вероятность прогрессирования, – что подтверждает возможный потенциал ctDNA-мониторинга для индивидуализации адъювантного подхода.
Рисунок 6.
Безрецидивная выживаемость в основной группе ctDNA+.
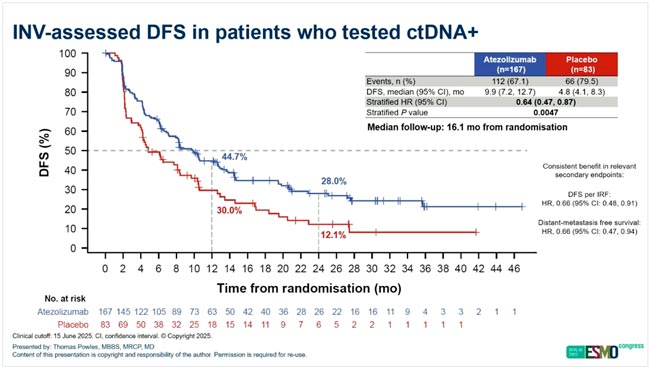
Рисунок 7.
Общая выживаемость в основной группе ctDNA+.
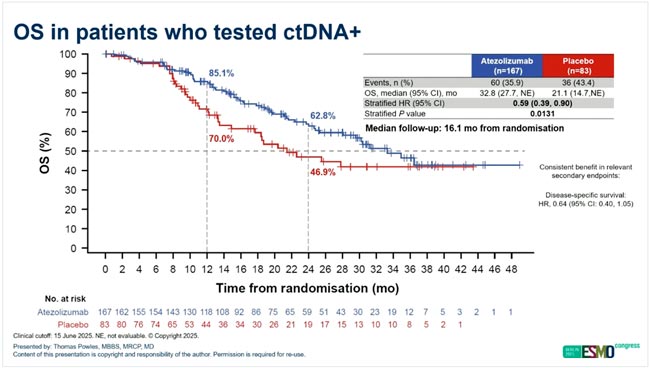
Рисунок 8.
Исходы при динамическом наблюдении в ctDNA-отрицательной когорте.
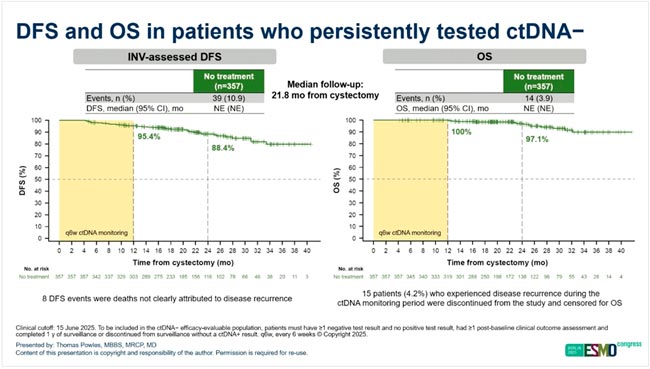
Первая линия терапии метастатического рака
Рандомизированное исследование 2 фазы DISCUS: 3 или 6 циклов платиносодержащей химиотерапии перед авелумабом?
Проведение трех циклов химиотерапии на основе препаратов платины может быть достаточным для начала поддерживающей терапии авелумабом.
В исследовании сравнивали 3 против 6 циклов платиновой химиотерапии, после которых пациенты с распространенным уротелиальным раком получали поддерживающую терапию авелумабом. Основной целью было оценить качество жизни и общую выживаемость. Три цикла обеспечили значительно лучшее качество жизни при сопоставимых показателях выживаемости (общей и без прогрессирования) по сравнению с шестью циклами. Таким образом, сокращенная химиотерапия до 3 циклов сохраняет эффективность и улучшает переносимость, предлагая более щадящий режим лечения.
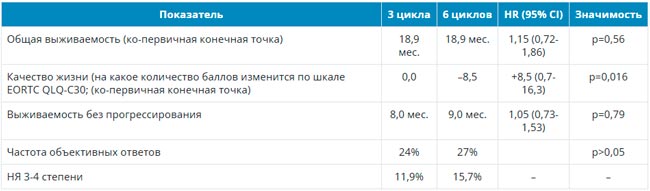
Рандомизированное исследование 3 фазы RC48-C016: дизитамаб ведотин + торипалимаб в терапии HER2-положительного уротелиального рака
У пациентов с HER2-положительным метастатическим уротелиальным раком комбинация дизитамаба ведотина (HER2-ADC антитело) и торипалимаба (анти-PD-1 антитело) показала значительное преимущество перед стандартной платиновой химиотерапией.
Комбинация продемонстрировала снижение риска прогрессирования на 64% и увеличение медианы общей выживаемости почти на 15 месяцев.
Частота объективных ответов составила 76% против 50% в группе контроля, а частота серьезных нежелательных явлений была существенно ниже (55% против 87%).
Эти данные подтверждают, что HER2-ориентированные ADC-комбинации могут стать новой терапевтической стратегией в первой линии лечения метастатического заболевания. Результаты представлены на Президентском симпозиуме.
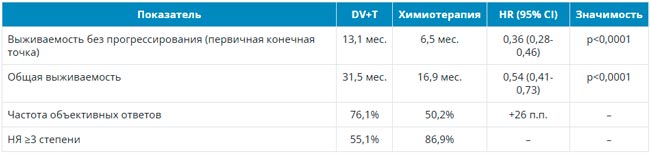
Другие опции в разных показаниях
В небольших исследованиях были продемонстрированы обещающие результаты для датопотамаба дерукстекана (TROP2-ADC) в комбинации с рилвегостомигом (анти-PD-1 и TIGIT антитело), нового FGFR3 ингибитора (LY3866288), дизитамаба ведотина в комбинации с тислелизумабом, ниволумаба в комбинации с висугромабом (GDF-15 нейтрализующее антитело).
НОВОСТИ ESMO 2025 / ОПУХОЛИ ГОЛОВЫ И ШЕИ
Авторы: Болотина Лариса Владимировна
Заведующая отделением химиотерапии МНИОИ им. П.А. Герцена
– филиала ФГБУ «НМИЦ радиологии» Минздрава России,
председатель рабочей группы по разработке Клинических рекомендаций RUSSCO,
член правления RUSSCO, доктор медицинских наук, профессор РАН,
Москва
Рубан Максим Сергеевич
Аспирант отделения химиотерапии МНИОИ им. П.А. Герцена
– филиала ФГБУ «НМИЦ радиологии» Минздрава России,
Москва
Состоявшийся в октябре 2025 года ежегодный конгресс ESMO хоть и не был богат на представление исследований, меняющих клиническую практику в разделе опухолей головы и шеи, тем не менее продемонстрировал сохраняющуюся тенденцию к представлению большого числа работ из Китая. Следует отметить, что довольно много доложенных исследований оказались негативными, особенно в разделе, посвященном местнораспространенным процессам.
Так, немецкие авторы в протоколе ADRISK (NCT03480672) изучали целесообразность добавления пембролизумаба к стандартной адъювантной химиолучевой терапии (ХЛТ) у пациентов с местнораспространенным плоскоклеточным раком полости рта, ротоглотки, гортаноглотки и гортани III, IVA/B стадий (7 издание TNM) при наличии умеренного и высокого риска прогрессирования (R0<5 мм, R1, поражение 2 и более лимфоузлов, экстракапсулярное распространение). Исследование стартовало в 2018 году, последний пациент был включен 30.11.2023 г. (n=204). Одна группа получала стандартную ХЛТ с цисплатином, вторая – ХЛТ с цисплатином + пембролизумаб в течение года [1]. Первичная конечная точка (ПКТ) – бессобытийная выживаемость (БСВ). Вторичные конечные точки (ВКТ) – ОВ и безопасность.
Исследование не достигло ПКТ: к 3-годам показатели БСВ составили 64,8% и 69,4% в группе стандартного лечения и экспериментальной группе (HR=0,812; 95% CI 0,487-1,353; p=0,423 (strata-adj. Cox model)) (рис.1). Не было различий как в отношении частоты локального рецидива, так и развития отдаленных метастазов.
Рисунок 1.
Бессобытийная выживаемость в группах адъювантной ХЛТ и ХЛТ + пембролизумаб.
Но, пожалуй, самое важно то, что не было отмечено выигрыша в отношении ОВ (рис.2). К 3 годам оставались живы 76,1% пациентов группы стандартной ХЛТ и 80,8% участников группы ХЛТ + пембролизумаб (HR=0,832; 95% CI 0,453-1,529; p=0,554 (strata-adjusted Cox model)).
Рисунок 2.
Общая выживаемость в группах адъювантной ХЛИ и ХЛТ + пембролизумаб.
Попытка сравнить результаты, полученные немецкими авторами, с позитивным исследованием NIVOPOSTOP позволило выявить ключевые различия в дизайне исследований. Так, существенная разница касалась популяций пациентов. В частности, протокол ADRISK включал пациентов со «средним или высоким риском». Это более гетерогенная группа, в которой было много пациентов с p16+ (HPV-ассоциированным) раком ротоглотки. Именно эта категория имеет хороший прогноз, и их включение могло «размыть» положительный эффект всей экспериментальной группы (NIVOPOSTOP включало пациентов только высокого риска). В этих двух работах использовалась принципиально разная схема применения иммунотерапии: ADRISK – пембролизумаб назначался одновременно с ХЛТ; NIVOPOSTOP – использовали «сэндвич»-подход: индукционная доза ниволумаба до ХЛТ, затем конкурентная фаза и консолидирующая (поддерживающая) терапия в течение почти года после ХЛТ. Дискутант предположил, что индукционная доза активирует иммунную систему, активность которой подавляется на фоне применения ХЛТ, а длительная поддерживающая терапия могла уничтожить оставшиеся микрометастазы. По мнению дискутанта, именно такая схема выглядит биологически более обоснованной. Кроме того, ADRISK является исследованием IIB фазы с участием ≈200 пациентов. Оно не было рассчитано на то, чтобы доказать преимущество, а лишь чтобы сгенерировать гипотезу. В результате оно могло просто не иметь достаточной статистической мощности, чтобы уловить умеренный, но реальный эффект от добавления пембролизумаба (HR 0,81 очень близок к HR 0,76 в NIVOPOSTOP). NIVOPOSTOP является крупным исследованием III фазы (n=680), специально спланированным и имеющим достаточную мощность, чтобы зафиксировать разницу лечебных подходов. Некоторый позитивный акцент в оценке дискутанта состоял в том, что исследование ADRISK предоставило важный, хоть и отрицательный, результат, показав, что добавление ИО агентов к ХЛТ «для всех» не работает и что нужно фокусироваться на HPV-негативных пациентах – группе, действительно имеющей негативный прогноз.
Аналогичное фиаско потерпела еще одна концепция добавления анти-EGFR агента (нимотузумаба) к адъювантной ХЛТ при местнораспространенном ПРГШ [2]. В протокол IHN01 (двойное слепое, рандомизированное, плацебо-контролируемое, многоцентровое рандомизированное исследование III фазы, в 26 центрах в 12 странах) включались пациенты с резектабельным ПРГШ III/IV стадий при наличии факторов неблагоприятного прогноза (ФНП), которым выполнено радикальное хирургическое вмешательство. Послеоперационная ХЛТ включала лучевую терапию с цисплатином 100 мг/м2 каждые 3 недели ×3 или 30 мг/м2 еженедельно ×7. Пациенты были рандомизированы в группы нимотузумаба 200 мг еженедельно в дополнение к ХЛТ (экспериментальная группа) или плацебо в течение 8 недель (группа стандартного лечения). Со-первичные конечные точки: безрецидивная выживаемость (БРВ), общая выживаемость (ОВ) и безопасность. За 9 лет были включены 422 пациента, медиана наблюдения за которыми составила 61 месяц. В результате отличий между группами не было зарегистрировано в отношении всех контрольных точек: прогрессирование заболевания отмечено у 44% (группа нимотузумаба) vs 45% (плацебо); HR 0,94 (95% CI 0,70-1,25) (рис.3а); показатель смертности на данном сроке наблюдения составил 30% vs 35% в группах соответственно, HR 0,84 (95% CI 0,60-1,18) (рис.3б).
Рисунок 3.
Выживаемость без прогрессирования (а) и общая выживаемость (б) в группах ХЛТ + нимотузумаб и ХЛТ.
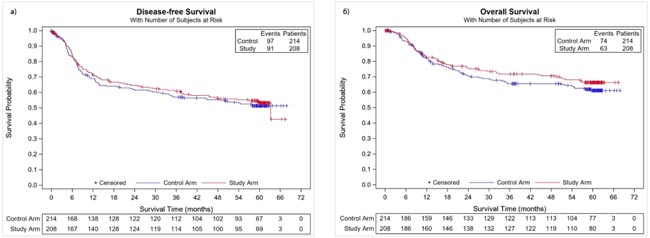
Частота нежелательных явлений (НЯ) Grade ≥3 в целом достигла 59%, 27% из которых исследователи связали с используемыми лекарственными препаратами. Более важным выводом исследователей было заключение о том, что еженедельное введение цисплатина ассоциировалось с меньшей частотой НЯ Grade ≥3, чем введение 1 раз в 3 недели без различий в ВБП и ОВ между двумя режимами. В дискуссии был сделан акцент на том, что уже многими годами ранее исследование RTOG 0522 (с цетуксимабом), а теперь протокол IHN01 (с нивотузумабом) убедительно доказывают, что стратегия замены цисплатина на таргетный препарат или добавление таргетного препарата в рамках адъювантной терапии не работает. Вероятно, это связано с тем, что цисплатин является настолько мощным радиосенсибилизатором, что добавление второго агента не дает дополнительных преимуществ, но увеличивает токсичность.
Пожалуй, наибольший интерес вызывает работа китайских исследователей CAMORAL, в которой в рамках мультицентрового рандомизированного исследования II фазы изучалась эффективность периоперационной ХИТ у пациентов с распространенным плоскоклеточным раком полости рта III-IVB ст., ротоглотки (HPV-) III-IVB ст. или (HPV+) III ст. (n=125). На этапе НА лечения экспериментальная группа получала 2 цикла ХИТ (наб-паклитаксел + карбоплатин + камрелизумаб 1 раз в 3 недели). На 2 этапе выполнялось хирургическое вмешательство с проведением послеоперационной ЛТ/ХЛТ и продолжением АТ камрелизумабом (дополнительно 15 циклов). Контрольной группе проводилась операция upfront с последующей ЛТ/ХЛТ. ПКТ являлась 2-летняя бессобытийная ВЖ. ВКТ: 2-летняя ОВ, большой патологический ответ (БПО), полный патологический ответ (пПО), 2-летняя ВЖ без отдаленных метастазов (ВБОМ), 2-летний локорегионарный контроль, безопасность. Медиана наблюдения составила 24,6 месяца. После 2 курсов ХИТ были получены следующие результаты: пПО – 25,4%, БПО – 47,6%, 2-летняя БСВ – 77,8% vs 46,1% и 2-летняя ОВ – 91,98% vs 69,08% в экспериментальной и контрольной группах соответственно (рис.4а и 4б).
Рисунок 4.
Бессобытийная выживаемость (а) и общая выживаемость (б) в группах ХИТ и контрольной группах.
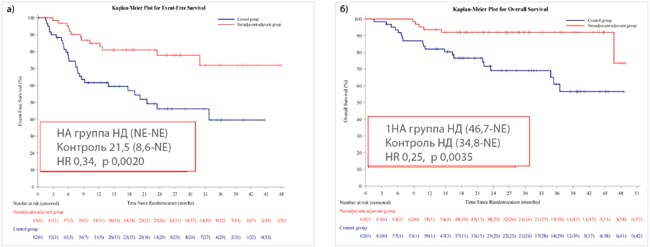
В дискуссии было отмечено, что синергия химио- и иммунотерапии представляет собой более предпочтительную стратегию, чем НА иммунотерапия только пембролизумабом (KEYNOTE-689), в связи с формированием более мощного ответа на лечение. При этом дискутант отметил, что в исследовании CAMORAL частота тяжелых НЯ была значительно выше в группе химиоиммунотерапии (58,7% vs 21,0%) из-за добавления цитостатиков на НА этапе.
Также негативные результаты были получены при добавлении иммунотерапии к ХЛТ при местнораспространенном ПРГШ. Профессором Hisham Mehanna были представлены предварительные данные исследования 3 фазы CompARE, в котором сравнивалась стандартная ХЛТ и ХЛТ с добавлением дурвалумаба и продолжением иммунотерапии в течение года у пациентов с промежуточным и высоким риском при орофарингеальном раке [4].
Рисунок 5.
Общая ВЖ (а) и ВЖ без прогрессирования (б) в группах ХЛТ и ХЛТ + дурвалумаб.
Авторами не было получено никакой разницы между группами ни в отношении выживаемости без прогрессирования, ни в отношении общей выживаемости. В дискуссии было отмечено, что одновременное или последовательное применение иммунотерапии с ХЛТ является малоэффективным для всей популяции пациентов. Представленный протокол оказался уже третьим в череде негативных исследований (Javelin-100 и KeyNote-412). В работе была обнаружен тревожный сигнал о возможном вреде дурвалумаба в группе промежуточного риска (HR=1,24). Объяснением полученных данных стала гипотеза о том, что HPV-ассоциированные опухоли «врожденно» иммуногенны. В связи с этим, возможно, стандартная ХЛТ уже вызывает настолько мощный иммунный ответ в этой группе, что дополнительная стимуляция PD-1 блокаторами приводит к избыточной, неконтролируемой реакции, которая может оказаться контрпродуктивной. Или же полученные результаты просто отражают тот факт, что в группе с 90% выживаемостью улучшить что-либо крайне сложно. В то же время для HPV-негативных опухолей была отмечена тенденция к улучшению результатов в группе высокого риска. Эти опухоли следует рассматривать как «классические» опухоли курильщиков, где PD-1/PD-L1 путь ингибирования является ключевым. Таким образом, дискутант отметил, что будущие исследования должны фокусироваться исключительно на этой популяции пациентов.
Практический интерес представляет работа, представленная T. Kodaira от коллектива японских исследователей, которые изучали возможность уменьшения дозы ДЛТ на зоны профилактического облучения у больных местнораспространенным р16-негативным ПР ротоглотки, гортаноглотки и гортани III/IVA-B стадий [5]. Исследование было запланировано с дизайном non-inferiority (n=400). Группа стандартного лечения получала ХЛТ с цисплатином 100 мг/м2 ×3. К зоне опухолевых проявлений подводилась ЛТ СОД 70 Гр за 35 фракций, а к зоне профилактического облучения – СОД 56 Гр за 35 фракций. В экспериментальной группе объем ХЛТ на зону опухоли был аналогичным, а на профилактические зоны доза ЛТ составляла 40 Гр за 20 фракций. Исследование не достигло ПТК (время до неудачи лечения, которое включало такие события как смерть, прогрессирование заболевания, наличие резидуальной опухоли после ХЛТ, прекращение лечения). Время до неудачи лечения оказалось достоверно выше в группе стандартного подхода (рис.6).
Рисунок 6.
Время до неудачи лечения (ITT-популяция).
Показатель 2-летней БСВ составил 70,6% vs 58,2% в группах стандартной ХЛТ и экспериментального режима. В отношении ОВ (HR 1,55; 95% CI 0,75-3,22), БРВ (HR 1,65; 95% CI 1,02-2,67) и локорегионарного контроля (HR 1,37; 95% CI 0,80-2,34) не удалось продемонстрировать нехудшие результаты при использовании редуцированной дозы ЛТ.
И вновь дискутант сделал акцент на том, что авторами была отобрана неправильная популяция пациентов для деэскалации. Исследователи пытались применить стратегию деэскалации к самой неблагоприятной группе пациентов с HPV-негативными опухолями, которые являются биологически более агрессивными с высоким риском регионарного метастазирования. Именно для них адекватное профилактическое облучение шеи критически важно. Стратегии деэскалации (в том числе снижение дозы ЛТ) сейчас активно и успешно изучаются, но в совершенно другой популяции – у пациентов с HPV-ассоциированным раком ротоглотки с благоприятным прогнозом. JCOG1912 четко показывает, что эти подходы нельзя экстраполировать на пациентов высокого риска. Однако самый печальный итог представленной работы – экспериментальный режим привел к худшим онкологическим результатам, не продемонстрировав снижения токсичности. Следует отметить, что исследование было досрочно прекращено.
Еще один блок дискуссий по представленным абстрактам был посвящен результатам новых иммуноонкологических комбинаций за рамками PD1/PD-L1 блокады в 1 линии при рецидивном, нерезектабельном или метастатическом ПРГШ. Две близкие работы 2 фазы были посвящены изучению эворпасепта (высокоаффинный иммуноглобулин – блокатор CD47 с неактивным Fc-фрагментом) в сочетании с пембролизумабом (ASPEN-03) [6] и пембролизумабом и ХТ (ASPEN-04) [7]. При медиане наблюдения около полугода было продемонстрировано увеличение ЧОО с 18,3% до 26,4%, однако с равной частотой ПО (13,3% vs 15,7%) и меньшей медианой длительности достигнутого ответа в экспериментальной группе (31,2 мес. vs не достигнута). Добавление эворпасепта к пембролизумабу не привело к увеличению ни ВБП, ни ОВ (рис.7).
Рисунок 7.
ВБП (а) и ОВ (б) в группах Эво + Пембро и Пембро.
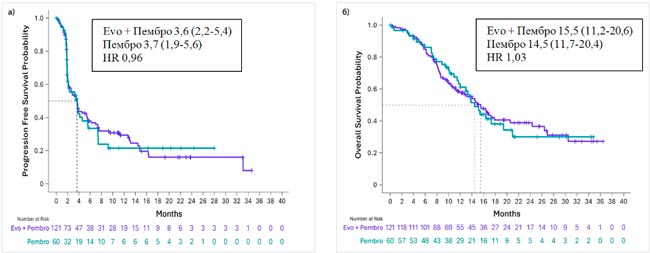
Комбинация эворпасепта с пембролизумабом и ХТ по схеме PF в сравнении с комбинацией пембролизумаб + ХТ по схеме PF также не продемонстрировала преимущество изученного режима. Добавление ХТ ожидаемо увеличило ЧОО до 37,3% в группе тройной комбинации, однако данный показатель оказался ниже, чем в группе пембролизумаб + ХТ (45,5%). Пожалуй, стоит отметить, что в экспериментальной группе отмечалась большая частота ПО – 16,4% vs 9,1%. Также при медиане наблюдения 2 года длительность достигнутого ответа более длительное время сохранялась при добавлении к лечению эворпасепта 7,7 vs 3,9 мес. К сожалению, увеличение ЧОО не транслировалось в улучшение показателей ВБП и ОВ (рис.8).
Рисунок 8.
ВБП (а) и ОВ (б) в группах Эво + Пембро + ХТ и Пембро + ХТ.
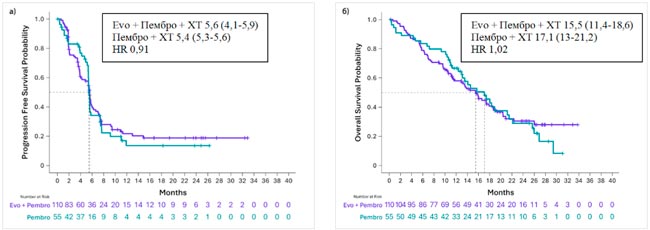
Дискуссия по данным исследованиям оказалась максимально критической. Дискутант отметил, что это не первая неудача для ингибиторов CD47. Другие препараты этого класса (например, магролимаб) демонстрировали значительную токсичность (в частности, с гемолитической анемией) при сомнительных результатах эффективности при солидных опухолях. Эворпацепт был специально разработан с неактивным Fc-фрагментом, чтобы избежать этой токсичности, и разработчикам это удалось (препарат имеет хороший профиль безопасности). Однако возникает вопрос: не была ли эта безопасность достигнута ценой снижения эффективности? Возможно, для мощного противоопухолевого эффекта необходимы и другие механизмы, которые были «отключены» в этой молекуле. В исследовании ASPEN-04 были получены еще более удручающие результаты со снижением ЧОО при добавлении к ХТ и ИТ эворпацепта. Можно предположить, что препарат может оказывать антагонистический эффект и мешать работе стандартной химиоиммунотерапии. (пембро + PF).
Аналогично безуспешными оказались попытки использования комбинаций анти-PD1 МАТ с анти-LAG3 и анти-TIM3 МАТ в 1 линии у пациентов PD-L1+ ПРГШ. В международном РКИ 2 фазы авторам удалось продемонстрировать лишь увеличение ЧОО с 20% до 30% при двойной или тройной комбинации (анти-PD1 vs анти-PD-1 + анти-LAG3 vs анти-PD-1 + анти-LAG3 + анти-TIM3) без различий в ВБП. В дискуссии было отмечено, что достигаемый непосредственный эффект оказывается нестойким, опухоль быстро находит альтернативные пути для возобновления роста. В связи с этим важен не столько сам факт ответа, сколько его глубина и продолжительность, которые и отражаются в показателе ВБП. Провал стратегии сочетания анти-PD-1 и анти-LAG-3 (ниволумаб + релатлимаб) аналогично меланоме при ПРГШ подчеркивает важность понимания, что биология опухолей имеет решающее значение. Вероятно, в микроокружении опухолей головы и шеи LAG-3 и TIM-3 не играют такой же ключевой роли в «истощении» Т-клеток, как при меланоме. Основным механизмом ускользания от иммунного ответа остается путь PD-1/PD-L1, и дополнительные блокады не приносят пользы. Стратегия «больше чекпойнтов – лучше» не работает (по крайней мере, для всех ЗНО). Будущее, очевидно, за более тонкими и продуманными комбинациями, основанными на биологии конкретной опухоли (CAMORAL, где синергия была достигнута с химиотерапией), а не за «ковровыми бомбардировками» иммунной системы.
Подтверждением справедливости данного положения являются негативные результаты еще одного протокола SKYSCRAPER-09, в котором исследовалась целесообразность сочетания анти-PD-L1 агента с анти-TIGIT [9]. Авторы продемонстрировали увеличение ЧОО в PD-L1+ (TAP≥5%) популяции при использовании двойной комбинации в сравнении с одним атезолизумабом (21,3% vs 15,4%), более выраженное преимущество в PD-L1-high (TAP≥20%) популяции (29,3% vs 13,6%). А вот в отношении ВБП и ОВ существенное улучшение было зарегистрировано только в PD-L1-high подгруппе: мВБП – 5,8 vs 4,0 мес., ОВ – 22,7 vs 10,0 мес. (тираголумаб + атезолизумаб vs плацебо + атезолизумаб). Показатель 1-летней ОВ в группах лечения в этой популяции составил 74,1% vs 43,6%. Дискутант отметил, что по своим первичным конечным точкам (ЧОО и ВБП) для всей популяции PD-L1+ пациентов исследование провалилось, встав в один ряд с ASPEN и исследованием LAG-3/TIM-3 и подтвердив, что улучшить результаты стандартной PD-1/L1 блокады для всех подряд крайне сложно. Простое добавление ингибитора TIGIT не привело к прорыву. Однако улучшение ОВ в подгруппе PD-L1-high заставляет исследователей продолжать работу и рассматривать протокол как гипотезо-генерирующий. SKYSCRAPER-09 следует рассматривать в качестве дополнительного аргумента в отношении того, что анти-TIGIT МАТ могут быть эффективными, но только у очень специфической, биомаркер-отобранной группы пациентов (например, с ко-экспрессией PD-L1 и TIGIT).
Довольно неоднозначными выглядят результаты РКИ Keynote-717 (n=130), в котором изучался абскопальный эффект [10]. Были доложены результаты по ПКТ – ОВ у больных рецидивным/метастатическим ПРГШ, которым проводилась ЛТ в режиме гипофракционирования на один из метастатических очагов в сочетании с ИТ пембролизумабом в сравнении только с одной ИТ. Группа А получала ЛТ СОД 36 Гр (12 фракций по 3 Гр за 3 недели) + пембролизумаб 1 раз в 3 недели, а группа В – только ИТ пембролизумабом в аналогичном режиме. В обеих группах ИТ проводилась максимум до 12 месяцев. В популяции Per Protocol (запланированная доза ЛТ (только группа A) и как минимум 2 цикла пембролизумаба) ЧОО в группах А и В составила 43% vs 24% (p=0,033), ПО – 13% vs 6%. Однако достоверных различий в ВБП и ОВ зарегистрировано не было: мВБП – 10,4 vs 8,3 мес. (р=0,59); мОВ – 11,4 vs 11,3 мес. (р=0,84). В дискуссии отмечено, что Keynote-717 является классическим примером научного успеха и клинического провала. Абскопальный эффект – это реальность. Впервые в рамках крупного РКИ было убедительно доказано, что добавление локальной ЛТ к ИТ действительно увеличивает системный противоопухолевый ответ. Это больше не серия отдельных клинических случаев, а доказанный факт. С научной точки зрения это прорыв, который подтверждает десятилетия доклинических исследований. Однако возникает вопрос о том, почему же этот реальный и статистически значимый биологический эффект не транслируется в увеличение продолжительности жизни. Возможными объяснениями дискутантом предложены непродолжительность ответа (комбинация «запускает» ответ у большего числа пациентов, но она не способна его поддерживать, так как опухоль быстро адаптируется и вновь ускользает от иммунной системы); эффективность последующих линий терапии, что выравнивает кривые выживаемости; неоптимальный режим ЛТ для иммунной стимуляции (накапливаются данные о большей эффективности коротких курсов СТЛТ, например, 24 Гр за 3 фракции, как более «иммуногенных»).
Примером успешного исследования является работа, представленная Paul L. Swiecick, в отношении эффективности энфортумаба ведотина в сочетании с пембролизумабом в 1 линии терапии у пациентов с рецидивным/
Таблица 1.
ЧОО в исследовании EV-202 (энфортумаб ведотин + пембролизумаб).
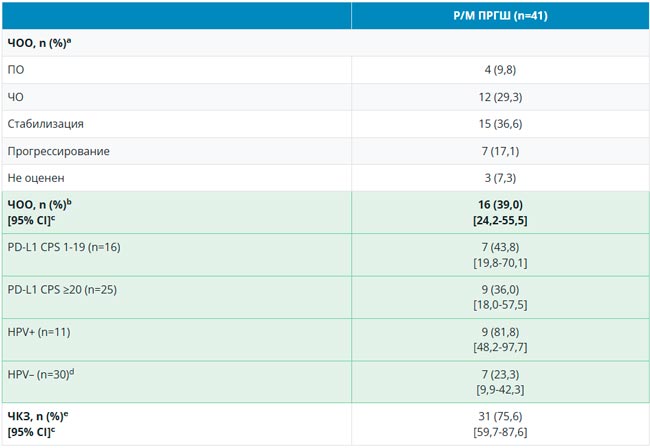
Дискутант отметил, что результаты когорты ПРГШ исследования EV-202 можно рассматривать как потенциально переломный момент 1 линии при Р/M ПРГШ, так как определяет смену парадигмы. После череды неудач с комбинациями IO+IO (LAG-3, TIM-3, TIGIT) и IO+CD47 это исследование показывает, что самый перспективный путь – комбинация иммунотерапии с принципиально иным классом препаратов, таким как иммуноконъюгаты (ИК). Это открывает совершенно новое направление для исследований. Несмотря на формально сопоставимую ЧОО в EV-202 с химиоиммунотерапией, при комбинации ИТ с ИК была отмечена невероятно высокая продолжительность ответа, что и отличает по-настоящему эффективную терапию. Именно длительные ответы в итоге приводят к значительному увеличению общей выживаемости. Однако высокая частота серьезных НЯ, которая наблюдалась авторами, означает, что эта комбинация не для всех. В финале дискутант заключил, что результаты этого исследования требуют проведения крупного РКИ III фазы с прямым сравнением EV + пембролизумаб с современным стандартом химиотерапия + пембролизумаб. Возможно, такая комбинация позволит повторить успех РКИ EV-302 при уротелиальном раке и предложить новый стандарт, полностью вытеснив химиотерапию и при ПРГШ.
К сожалению, обнаружить эффективный режим 2 линии терапии пока не удается. Негативные результаты РКИ 3 фазы BURAN ставят финальную точку в гипотезе эффективности пан-PI3K ингибирования при ПРГШ [12]. Токсичность препаратов этого класса, вероятно, нивелирует любую потенциальную пользу, мешая проводить полноценную химиотерапию. Комбинация паклитаксела с бупарлисибом в сравнении с паклитакселом не продемонстрировала увеличения ОВ (ПКТ): мОВ – 9,6 vs 9,7 мес. (HR 1,02; р=0,85). Также абсолютно сопоставимыми оказались результаты и по ВКТ – ВБП (мВБП 4,1 vs 4,1 мес.; HR 0,97; р=0,77). НЯ Grade ≥3 составили 87,5% (60,1% среди которых исследователи связали с буперлесибом) и 59,4% в экспериментальной и контрольной группах. Прием бупарлесиба в связи с НЯ пришлось прекратить 37% пациентов. Авторы справедливо отмечают, что контрольная группа (паклитаксел) продемонстрировала очень высокий показатель мОВ в 9,7 мес. Это свидетельствует о том, что даже после неудачи ИТ стандартная химиотерапия остается важной и достаточно эффективной опцией 2+ линий при ПРГШ, и любой новый препарат должен будет доказать свое преимущество перед этим высоким стандартом.
Результаты исследования ранней фазы с амивантамабом при прогрессировании после ИТ и ХТ продемонстрировали потенциальную пользу от использования ИК [3]. Имеются основания предложить, что высокоточное биспецифическое воздействие на ключевые драйверы EGFR и MET одним препаратом приводит к существенному успеху. Это подчеркивает важность выбора правильной мишени и правильного лекарственного агента. Амивантамаб обеспечил высокий уровень ЧОО – 41% без химиотерапии, что может рассматриваться как обоснованная заявка на новый стандарт лечения для 3 линии при ПРГШ. Конечно, требуется подтверждение этих данных в более крупном РКИ, но такой мощный сигнал редко оказывается ложным. В целом же было отмечено, что вырисовывается четкая тенденция того, что будущее за биспецификами и ИК, о чем свидетельствуют результаты OrigAMI-4 (биспецифик) и EV-202 (ИК).
Таким образом, обсуждение всех представленных исследований позволило отметить, что Конгресс ESMO 2025 ознаменовал собой смену парадигмы в лечении опухолей головы и шеи. Он четко обозначил стагнацию одних терапевтических направлений и одновременно выявил новые, обладающие высоким клиническим потенциалом. Это формирует более ясное, хотя и более комплексное, понимание текущих и будущих стратегий в лечении ПРГШ.
Источники:
- Dietz A, et al. ADRISK; ESMO 2025. Postoperative aRCH With Cisplatin Versus aRCH With Cisplatin and Pembrolizumab in Locally Advanced Head and Neck Squamous Cell Carcinoma.
- Gopal Iyer (On behalf of IHN01 investigators). Phase III Trial of Adjuvant Nimotuzumab Plus Cisplatin-Based Chemoradiotherapy in Resected Stage III/IV Head and Neck Squamous Cell Carcinoma.
- Yue He. Perioperative camrelizumab plus chemotherapy in locally advanced squamous cell carcinoma of the head and neck, a multicenter, open-label, randomized, phase II Study (CAMORAL).
- Hisham Mehanna (On behalf of the CompARE trial group). Results from CompARE phase III RCT: neoadjuvant durvalumab plus chemoradiotherapy (CRT) followed by adjuvant durvalumab immunotherapy (IO) vs CRT alone in intermediate and high-risk oropharyngeal cancer (OPC). Preliminary Results.
- Takeshi Kodaira, et al. A phase III randomized trial of prophylactic radiation with 2-step40 versus SIB56 IMRT techniques for locally advanced squamous cell carcinoma of the head and neck (JCOG1912, NEW BRIDGE).
- Keam B, et al. ASPEN-03: A Randomized Phase 2 Study of Evorpacept in Combination with Pembrolizumab in Patients with Recurrent, Unresectable or Metastatic (R/M) PD-L1 Positive Head and Neck Squamous Cell Carcinoma (HNSCC).
- Harrington K, et al. ASPEN-04: A Randomized Phase 2 Study of Evorpacept in Combination with Pembrolizumab and Chemotherapy in Patients with Recurrent, Unresectable or Metastatic (R/M) Head and Neck Squamous Cell Carcinoma (HNSCC).
- Haddad R, et al. Retifanlimab (Anti–PD-1 mAb) Alone Or In Combination With Anti-LAG3 ± Anti-TIM3 mAbs In Previously Untreated, Recurrent And/Or Metastatic PD-L1+ HNSCC: A Double-Blind Randomised Controlled Phase 2 Trial.
- Psyrri A, et al. SKYSCRAPER-09: Phase 2, non-comparative, randomised study of tiragolumab + atezolizumab and placebo + atezolizumab as first-line treatment in patients with recurrent/metastatic PD-L1+ squamous cell carcinoma of the head and neck.
- Schubert P, et al. Hypofractionated radiotherapy of single tumor lesion increases systemic response rate to pembrolizumab in recurrent or metastatic head-and-neck cancer (R/M-HNSCC): Primary endpoint of the randomized Keynote-717 trial.
- Paul L. Swiecick. et al. Enfortumab vedotin plus pembrolizumab as first-line treatment in recurrent or metastatic head and neck squamous cell carcinoma: results from a cohort of the EV-202 trial.
- Soulières D, et al. Phase 3 BURAN Study of Buparlisib + Paclitaxel vs. Paclitaxel Alone in Recurrent/Metastatic head and neck squamous cell carcinoma.
- Kevin J. Harrington, et al. Amivantamab in recurrent/metastatic head & neck squamous cell cancer after disease progression on checkpoint inhibition and chemotherapy. Results from the phase 1b/2 OrigAMI-4 study.
НОВОСТИ ESMO 2025 / РАК ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
Автор: Исраелян Эдгар Рудикович
Врач-онколог онкологического отделения лекарственных методов лечения (химиотерапевтическое) №4
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
С 17 по 21 октября в Берлине прошла юбилейная 50 конференция ESMO. Со многими новостями вы скорее всего уже ознакомлены, настало время разобрать результаты исследований в области лечения рака предстательной железы. Here we go!
ENZARAD (ANZUP 1303): рандомизированное исследование III фазы по оценке эффективности добавления энзалутамида к АДТ и ЛТ при локализованном РПЖ высокого риска и местнораспространенном процессе
Стандартной опцией лечения локализованного РПЖ высокого риска (сТ3-Т4, ПСА >20 нг/мл, группа градации ISUP 4-5) и РПЖ с пораженными тазовыми л/у (N1M0) является проведение лучевой терапии (ЛТ) и андроген-депривационной терапии (АДТ) в течение 12-36 мес. либо ЛТ + АДТ 24 мес. + абиратерона ацетат [1]. Последний подход изучен в исследовании STAMPEDE, где добавление абиратерона ацетата к ЛТ и АДТ (SoC) в сравнении с плацебо + SoC привело к улучшению выживаемости без метастазов (ВБМ) (6-летняя ВБМ 82% vs 69%; ОР 0,53; 95% ДИ 0,44-0,64; р<0,0001) и общей выживаемости (ОВ) (6-летняя ОВ 86% vs 77%; ОР 0,6; 95% ДИ 0,48-0,73; р<0,0001) [2].
На конгрессе представлены результаты работы ENZARAD, в которой изучалось добавление энзалутамида к SoC в сравнении с плацебо + SoC (рис.1). Первичная конечная точка – выживаемость без метастазов. Стоит оговориться, что авторами инициально выбрана ОВ, однако малое число событий в исследованиях схожего плана привело к замене первичной конечной точки на ВБМ, что является адекватным суррогатом ОВ [3].
Рисунок 1.
Дизайн исследования ENZARAD.

При медиане наблюдения 8 лет не продемонстрировано улучшения ВБМ в группе энзалутамида – 74% vs 72% (ОР 0,88; 95% ДИ 0,67-1,15; р=0,34) (рис.2), а также ПСА-ВБП (ОР 0,78; 95% ДИ 0,61-0,99; р=0,044) (рис.3) и ОВ (ОР 0,87; р=0,4) (рис.4).
Рисунок 2.
Выживаемость без метастазов в исследовании ENZARAD.

Рисунок 3.
Время до ПСА прогрессирования в исследовании ENZARAD.
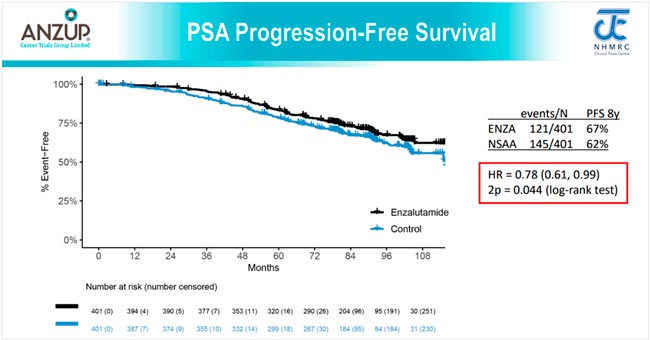
Рисунок 4.
Общая выживаемость в исследовании ENZARAD.

В подгрупповом анализе ВБМ наибольшее преимущество от эскалации терапии отмечено при N1 статусе и проведенной ЛТ на таз (рис.5).
Рисунок 5.
Дизайн исследования ENZARAD.
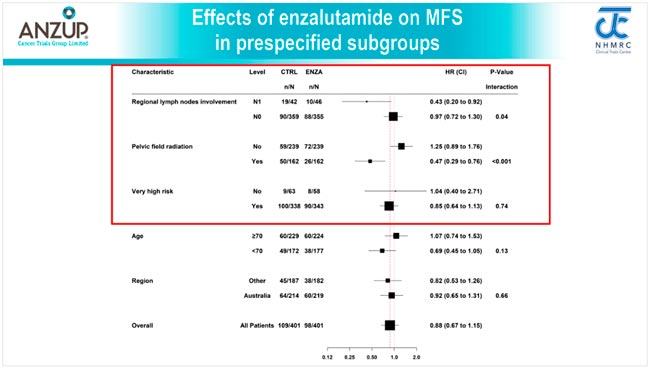
Возникает вопрос: а почему у энзалутамида не получилось? Авторы провели корреляцию с исследованием STAMPEDE, оказалось, что в работу с энзалутамидом включена более благоприятная когорта пациентов: меньшее число с N1M0 (39% vs 11%), cT3-T4 (92% и 47%) и с более низкой медианой ПСА (35 нг/мл vs 14 нг/мл). Подобные различия обусловлены несколько разными критериями включения (табл.1), например, в STAMPEDE пограничный уровень ПСА для высокого риска ≥40 нг/мл, а в ENZARAD ≥20 нг/мл, допускалось включение пациентов с б/х рецидивом и факторами высокого риска после локального лечения.
Таблица 1.
Критерии включения в исследования STAMPEDE (абиратерона ацетат + SoC) и ENZARAD (энзалутамид + SoC).
Согласно текущим рекомендациям NCCN [6] и EAU [7], добавление абиратерона к SoC необходимо только пациентам сверхвысокого риска (сТ3-Т4, группа градации ISUP 4-5, ПСА ≥40 нг/мл = критерии STAMPEDE), в практических рекомендациях RUSSCO – при высоком и очень высоком рисках.
Согласно статистической гипотезе исследование ENZARAD является негативным, тем не менее преимущество от эскалации терапии энзалутамидом отмечено среди пациентов с N1. Окончательные выводы о роли ингибиторов андрогенного сигнала (ИАС) в данной популяции пациентов делать преждевременно, ожидаются результаты еще 3 рандомизированных исследований (ATLAS – апалутамид, DASL-HiCAP – даролутамид, NRG GU 009 – абиратерона ацетат/
Финальные результаты исследования III фазы PRESTO: комбинированная андрогенная блокада у пациентов с биохимическим рецидивом (БХР) РПЖ высокого риска
Пациенты с БХР после локальных методов лечения делятся на группы высокого и низкого рисков в зависимости от времени удвоения ПСА (ВУПСА). Пациенты низкого риска могут быть оставлены под динамическим наблюдением, а высокого – кандидаты к началу АДТ.
В исследование PRESTO включались пациенты с б/х рецидивом РПЖ высокого риска после радикальной простатэктомии (РПЭ) (ВУПСА ≤9 мес. при минимальном уровне ПСА 0,5 нг/мл), которые были рандомизированы в 3 группы – монотерапия АДТ, дуплет – АДТ + апалутамид – и триплет – АДТ + апалутамид + абиратерон. Длительность терапии – до одного года, прогрессирования заболевания либо неприемлемой токсичности. Первичная конечная точка – ПСА-ВБП.
В прошлом году опубликованы результаты по первичной конечной точке: дуплет (ОР 0,52; р=0,00047) и триплет (ОР 0,48; р=0,00008) оказались эффективнее моноАДТ в отношении ПСА-ВБП, при этом триплет оказался токсичнее дуплета при равной эффективности.
На конгрессе представили данные по ключевым вторичным конечным точкам: ВБМ, время до кастрат-резистентности, ПСА-ВБП среди пациентов с восстановленным уровнем тестостерона.
В связи с равноэффективностью дуплета и триплета при меньшей токсичности первого далее уделим внимание именно этой группе пациентов. ОР методом Кокса для ВБМ между дуплетом и монотерапией АДТ составило 0,80 (95% ДИ 0,56-1,13). Разница в ограниченном среднем времени выживания (restricted mean survival time) к 48 мес. составила 2,92 мес. (рис.6).
Рисунок 6.
Выживаемость без метастазов среди пациентов, получивших лечение дуплетом и монотерапией АДТ.
ОР для времени до кастрат-резистентности составило 0,55 при номинальном p-value 0,0176 (рис.7).
Рисунок 7.
Время до кастрат-резистентности среди пациентов, получивших лечение дуплетом и монотерапией АДТ.
Медиана времени до нормализации концентрации тестостерона (Т >150 нг/мл) составила 6,4 мес. в группе дуплета и 6,1 мес. в группе монотерапии. ОР ПСА-ВБП среди пациентов с Т >150 нг/мл 0,67 (95% ДИ 0,50-0,90) при номинальном p-value 0,0075. Время до последующей терапии 47,6 мес. в группе АДТ + апалутамид и 35,7 мес. при монотерапии АДТ (ОР 0,75; 95% ДИ 0,56-1,0; р=0,0075).
Несмотря на достижение первичной конечной точки – улучшение ПСА-ВБП – неоднозначные результаты по запланированным вторичным конечным точкам «смазывают» общие впечатления о данной работе. К тому же ПСА-ВБП не является суррогатом ОВ при локализованном РПЖ [8].
Финальные результаты EMBARK: энзалутамид при БХР РПЖ
Энзалутамид также изучался при БХР РПЖ высокого риска в исследовании EMBARK, но, в отличие от PRESTO, в данную работу допускалось включение пациентов как после РПЭ (ВУПСА ≤9 мес. и рост ПСА на 2 нг/мл от надира), так и после ДЛТ (ВУПСА ≤9 мес. и рост ПСА на 1 нг/мл от надира). Пациенты рандомизированы в соотношении 1:1:1 в следующие группы: лейпролид + энзалутамид, монотерапия энзалутамидом, лейпролид + плацебо. В случае если к 36 нед. ПСА достигал 0,2 нг/мл и ниже, то лечение прерывалось с 37 недели, реиндукция терапии при росте ПСА; в случае если ПСА ≥0,2 нг/мл – продолжение лечения. Первичная конечная точка – ВБМ.
В NEJM 2 года назад представлены данные по ВБМ: лейпролид + энзалутамид (ОР 0,42; р<0,0001) и монотерапия энзалутамидом (ОР 0,63; р=0,005) оказались эффективнее лейпролида + плацебо (5-летняя ВБП 87,3%, 80% и 71,4% соответственно) [9].
На ESMO 2025 представлены вторичные конечные точки. Овациями были встречены результаты ОВ! Комбинация лейпролида и энзалутамида статистически значимо превосходит монотерапию лейпролидом по этому показателю (8-летняя ОВ 78,9% vs 69,5%; ОР 0,6; р=0,0006) (рис.8)! А вот монотерапия энзалутамидом демонстрирует лишь клинически значимое превосходство над лейпролидом (8-летняя ОВ 73,1% vs 69,5%; ОР 0,83; р=0,18).
Рисунок 8.
Общая выживаемость в группах лейпролид + энзалутамид и монотерапия лейпролидом.
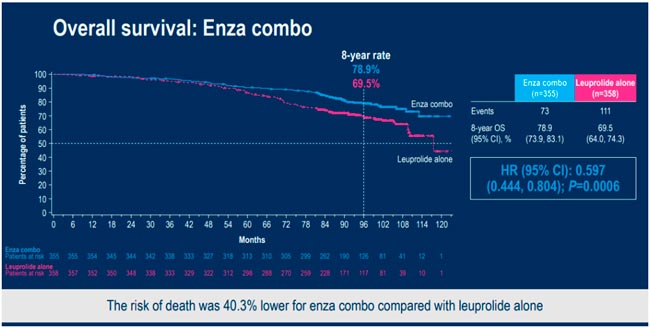
В подгрупповом анализе ОВ наибольшее преимущество отмечено среди пациентов с ВУПСА 3-6 мес., возраст ≥65 лет, ПСА на старте >10 нг/мл (рис.9).
Рисунок 9.
Подгрупповой анализ общей выживаемости (лейпролид + энзалутамид).
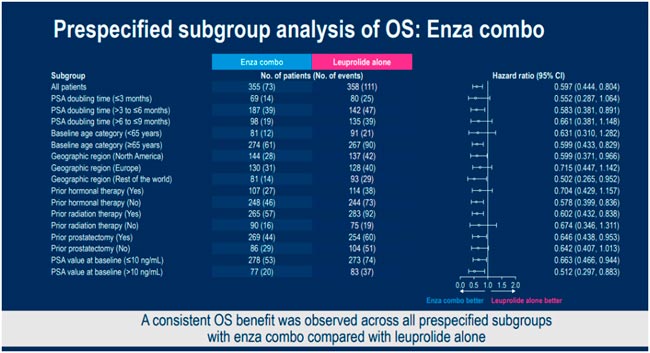
Время до терапии следующей линии (ОР 0,37; р<0,0001), первого скелетного события (ОР 0,39; р=0,0015) дольше в группе комбинации, чем моноАДТ. ВБП2 (время от момента терапии следующей линии до прогрессирования/смерти) также выше в группе комбинации (ОР 0,56; р<0,0001) (рис.10).
Рисунок 10.
Выживаемость без прогрессирования 2.
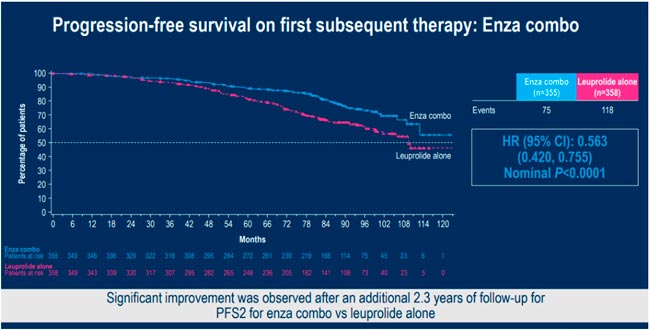
Безусловно, энзалутамид + лейпролид – это новый стандарт терапии при БХР высокого риска РПЖ. Но возникает вопрос: а почему у апалутамида в исследовании со схожим дизайном не получилось? Причины кроются в деталях, довольных важных деталях, а именно:
- критерии включения: в EMBARK включались пациенты с БХР как после РПЭ, так и ДЛТ, в PRESTO – только после РПЭ;
- в EMBARK предусмотрены лекарственные каникулы при достижении ПСА-ответа к 36 неделе, в PRESTO – фиксированная терапия в течение 52 нед.;
- первичная конечная точка в EMBARK – ВБМ – коррелирует с ОВ, а вот ПСА-ВБП в PRESTO – нет;
- ограничением обеих работ является стадирование по КТ/МРТ, а не ПЭТ/КТ с ПСМА, что позволило бы выявить источник персистенции маркера и провести локальный контроль с возможной отсрочкой системной терапии [10].
Метаанализ STOPCAP: влияние ЛТ на предстательную железу на отдаленные результаты при синхронном мГЧРПЖ
О роли лучевой терапии на первичную опухоль при мГЧРПЖ сломано немало копий. Данному вопросу посвящен ряд исследований: в одних из них демонстрируется эффективность этого подхода при опухолях с низкой метастатической нагрузкой [11, 12], но не подтверждается в других [13].
В метаанализ STOPCAP включены индивидуальные данные пациентов трех рандомизированных исследований: HORRAD, STAMPEDE и PEACE-1. Целью исследования явилась оценка эффекта от добавления ЛТ к SoC (рис.11). Первичная точка – ОВ.
Рисунок 11.
Исследования, включенные в метаанализ STOPCAP.
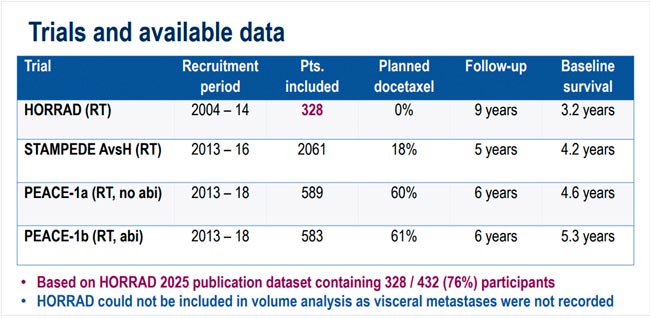
ОР для ОВ при проведении ЛТ составило 0,92 (95% ДИ 0,84-1,0; р=0,058) (рис.12). Отмечена лишь тенденция к улучшению ОВ, но без статистической значимости. Существенной гетерогенности между исследованиями не отмечено (р=0,664).
Рисунок 12.
Оценка влияния ЛТ на предстательную железу на общую выживаемость.
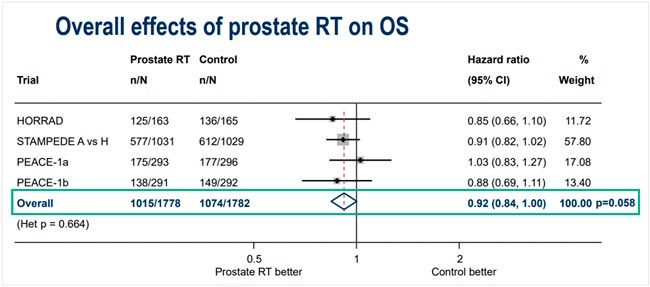
Продемонстрировано позитивное влияние на ВБП среди пациентов, получивших ЛТ (ОР 0,88; 95% ДИ 0,81-0,95; р=0,002).
При подгрупповом анализе в зависимости от количества очагов в костях отмечен явный выигрыш в ВБП для пациентов с <5 очагами (ОР 0,79; р<0,01), для больных с ≥5 очагами – нет (ОР 0,97). Аналогичные результаты показаны при разделении пациентов на группы риска по CHAARTED – преимущество ЛТ лишь при низком риске (ОР 0,76; р=0,002) (рис.13).
Рисунок 13. Подгрупповой анализ по оценке эффективности ЛТ в зависимости от объема метастатического поражения.

Авторы предупредили, что демонстрируемый анализ неокончательный, вскоре они добавят обновленные данные исследования HORRAD, PEACE-1, а также оценят влияние ЛТ на частоту развития симптомных местных осложнений.
Метаанализ продемонстрировал отсутствие влияния ЛТ на ОВ при синхронном мГЧРПЖ, при этом показано преимущество в ВБП для пациентов низкого риска от добавления ЛТ к SoC! Каждый пациент низкого риска должен обсуждаться на мультидисциплинарном консилиуме для решения вопроса о проведении ЛТ на первичную опухоль.
ARASAFE: 3-недельный доцетаксел (75 мг/м2) vs 2-недельный (50 мг/м2) в комбинации с даролутамидом и АДТ при мГЧРПЖ
Триплет (АДТ + доцетаксел + абиратерона ацетат/
В исследование ARASAFE включались пациенты с мГЧРПЖ, являющиеся кандидатами для триплета с даролутамидом. Больных рандомизировали в 2 группы: АДТ + даролутамид + доцетаксел 75 мг/м2 (3-нед. курс) (Д75), всего до 6 курсов, и АДТ + даролутамид + доцетаксел 50 мг/м2 (2-нед. курс) (Д50), всего до 12 курсов. Первичные конечные точки – частота развития НЯ 3-5 степени, нейтропении 3-4 степени или смерть от любой причины.
Группы сопоставимы по основным клинико-морфологическим характеристикам: возрасту, ECOG статус, объему метастатического поражения (большой объем в 83% и 86% в группах Д75 и Д50 соответственно), исходному уровню ПСА. Необходимо отметить, что количество курсов терапии (10,7 vs 5,6), кумулятивная доза доцетаксела за линию (1073,5 мг vs 842,8 мг) больше в группе Д50.
Частота НЯ 3-5 степени (61,2% vs 78,9%; р=0,0024), как и нейтропения 3-4 степени (64,1% vs 24%; р<0,00001), статистически значимо ниже в группе Д50! ФН отмечена у 5,5% пациентов в группе Д75 и у 1,7% в группе Д50.
В качестве оценки онкологических результатов авторы решили оценить ПСА-ответ к 26 нед. Медиана уровня ПСА нумерически несколько выше в группе Д50, в подгруппах по ПСА-ответу различий нет (рис.14).
Рисунок 14.
ПСА-ответ к 26 неделе терапии..
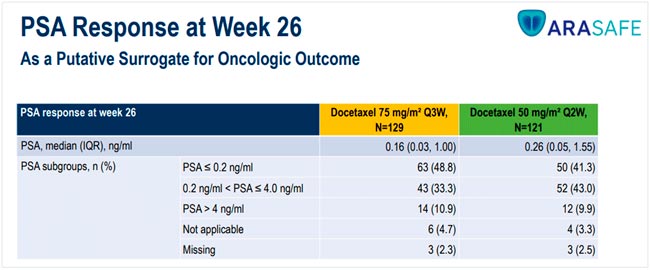
Исследование ARASAFE является первым проспективным исследованием в гормоночувствительной фазе РПЖ, продемонстрировавшим меньшее число НЯ/нейтропений при 2-недельном режиме дозирования доцетаксела. Тем не менее, стоит обратить внимание на большую кумулятивную дозу доцетаксела в группе Д50, отсутствие информации о частоте использования Г-КСФ, а также адекватных суррогатов отдаленной выживаемости при первом срезе данных (рВБП, время до развития кастрат-резистентности, ОВ).
Автором заметки проведен самостоятельный анализ по оценке частоты возникновения нейтропении ≥3 степени в исследованиях при мРПЖ с упором на дозовый вариант доцетаксела (табл.2).
Таблица 2.
Сравнение исследований, оценивающих токсичность различных дозовых режимов доцетаксела.
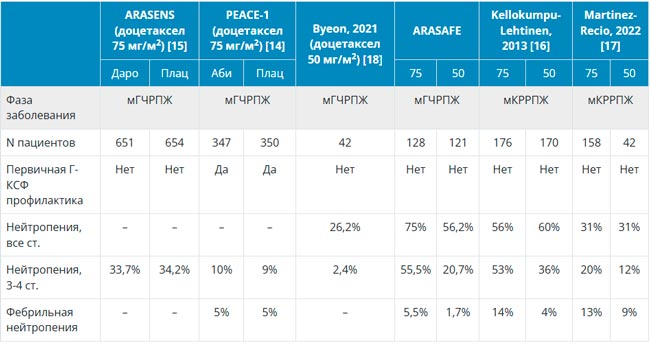
Авторы ARASAFE взяли за основу результаты исследования ARASENS (триплет [АДТ + доцетаксел + даролутамид] vs дуплет [АДТ + доцетаксел] в первой линии мГЧРПЖ), в котором частота нейтропении 3-4 ст. составила 33-34% в обеих группах, основанных на доцетакселе [15]. В аналогичной по дизайну работе PEACE-1 нейтропения 3-4 ст. отмечена у ≈10% пациентов в каждой группе (АДТ + доцетаксел + абиратерона ацетат vs АДТ + доцетаксел) [14]! Подобные различия в нейтропении связаны с тем, что в протоколе PEACE-1 проводилась первичная Г-КСФ профилактика, а в ARASENS и ARASAFE нет.
Еще одним интересным фактом протокола ARASAFE служит доза доцетаксела. В группе Д75 запланировано проведение 6 курсов – 6×75 мг/м2 = 450 мг/м2 за линию, в группе Д50 – 6×100 мг/м2 = 600 мг/м2. Известно, что увеличение числа курсов терапии доцетакселом в 1 линии не улучшает отдаленные результаты [19]. Возможно, стоило бы перерасчитать дозу доцетаксела в группе Д50 по Д75: 450/50 = 9 курсов 1 раз в 2 недели.
Безусловно, опция 2-недельного дозирования доцетаксела должна быть внедрена в практику и рассматриваться, в первую очередь, для коморбидных и ослабленных пациентов. Первичная Г-КСФ профилактика значительно снижает число нейтропений 3-4 степени и также может рассматриваться у пациентов большого объема метастатического поражения.
CAPItello-281: капивасертиб + абиратерона ацетат у пациентов с дефицитом PTEN при de novo мГЧРПЖ
У пациентов с мГЧРПЖ и профицитом PTEN основным драйвером пролиферации опухолевых клеток является андроген-зависимый путь. При дефиците PTEN активируются иные механизмы, приводящие к нарушению каскада PI3KT/AKT и обеспечивающие выживаемость опухолевых клеток [20].
Капивасертиб является мощным селективным ингибитором всех трех изоформ AKT (AKT 1/2/3). Ранее показал свою эффективность в комбинации с абиратероном при мКРРПЖ и дефиците PTEN [20, 21].
В рандомизированное исследование CAPItello-281 включены пациенты с дефицитом PTEN (определяемым как отсутствие специфической цитоплазматической экспрессии на ≥90% клеток) и de novo мГЧРПЖ. Объем метастатического поражения по CHAARTED явился фактором стратификации. Среди 6200 пациентов, проходивших скрининг, лишь у 25% выявлен дефицит PTEN. Пациенты рандомизированы в 2 группы: капивасертиб + абиратерон + АДТ и плацебо + абиратерон + АДТ. Первичная конечная точка – рВБП.
Медиана рВБП в группах капивасертиб/
Рисунок 15.
Первичная конечная точка исследования – радиологическая выживаемость без прогрессирования.
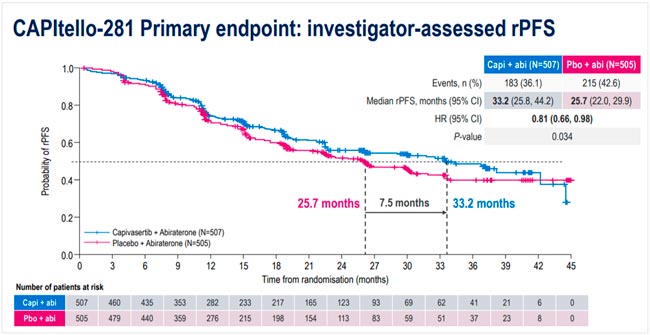
При подгрупповом анализе рВБП не отмечено популяции пациентов, получившей наибольшее преимущество от комбинации.
Медиана ОВ не достигнута ни в одной из групп (ОР 0,90; р=0,401) в связи с малым сроком наблюдения.
Авторы предположили, что эффективность AKT-ингибитора растет по мере увеличения числа клеток с дефицитом PTEN, однако подобные выводы делать преждевременно (рис.16).
Рисунок 16.
Радиологическая выживаемость без прогрессирования в зависимости от степени дефицита PTEN.
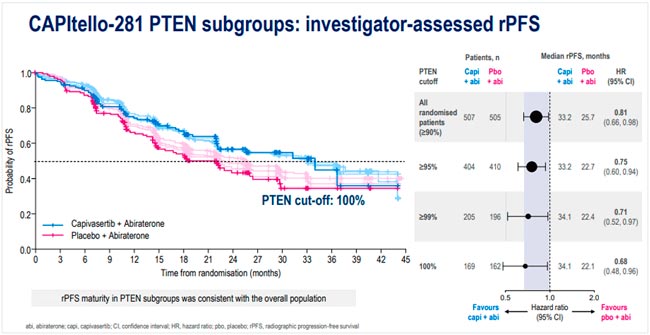
Частота НЯ ≥3 степени выше в группе капивасертиба (67% vs 40,4%). Частота диареи (51,9% vs 8%), гипергликемии (38% vs 13%), сыпи (35,4% vs 7%) и анемии (24% vs 12%) также выше в группе AKT-ингибитора (рис.17). Девяноста два (18,3%) пациента завершили лечение капевасертибом/
Рисунок 17.
Нежелательные явления, отмеченные более чем у 10% пациентов..
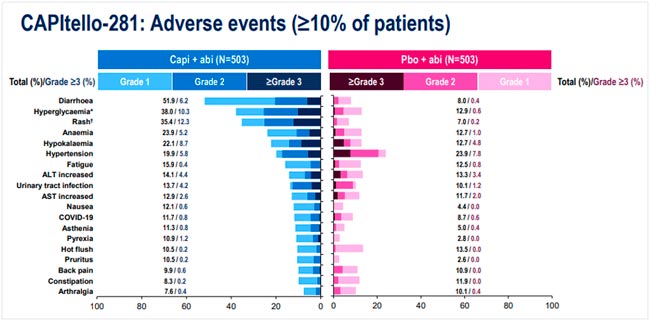
Скорость появления новых терапевтических возможностей в лечении мГЧРПЖ поражает! Буквально два года назад мы только начали внедрять триплеты в реальную клиническую практику для пациентов большого объема метастатического поражения, как уже нам необходимо обращать внимание и на генетический профиль заболевания: HRR-позитивный статус → добавление PARP-ингибитора [22], дефицит PTEN → добавление AKT-ингибитора.
Молекулярно-направленный подход только набирает обороты, но не за горами его включение в алгоритмы лечения мГЧРПЖ.
Рандомизированное исследование III фазы PSMAddition: Lu-PSMA + АДТ + ИАС при ПСМА-позитивном мГЧРПЖ
Не только молекулярно-направленный подход ищет дорогу в мГЧРПЖ, но и радиолигандный (РЛТ) [23].
В исследование PSMAddition включены пациенты с мГЧРПЖ и PSMA-позитивными очагами (на ПЭТ/КТ с 68-Ga) и рандомизированы в 2 группы: 6 курсов Lu-PSMA + АДТ + ИАС (РЛТ) vs АДТ + ИАС (SoC). Протоколом разрешена терапия лютецием при прогрессировании пациентов в группе SoC. Первичная конечная точка – рВБП. На конгрессе представили первый срез данных – промежуточные результаты рВБП и ОВ.
В каждую из групп рандомизировано по 572 пациента. Половина пациентов в ITT представлена de novo опухолевым процессом, 68% в каждой группе отнесена к большому объему метастатического поражения. Радиологическое прогрессирование отмечено у 19,6% группе РЛТ и 26,6% – в SoC (59,9% получили Lu-PSMA при прогрессировании). Радиологическая ВБП оказалась выше в группе РЛТ (ОР 0,72; 95% ДИ 0,58-0,90; р=0,002), медианы рВБП не достигнуты (рис.18).
Рисунок 18. Радиологическая выживаемость без прогрессирования в исследовании PSMAddition.
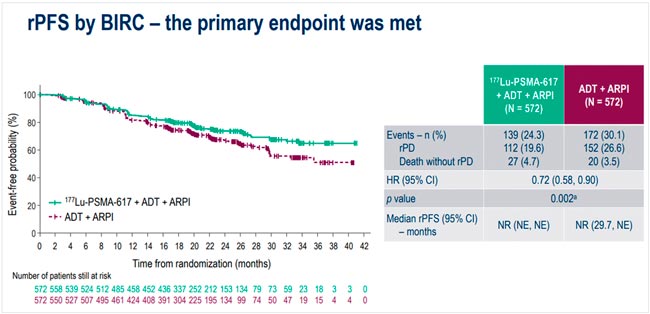
В подгрупповом анализе рВБП наибольшее преимущество от РЛТ отмечено среди пациентов моложе 70 лет, без локального лечения на первичную опухоль, суммой баллов по Глисону <8 лет, ЛДГ <260 Ед/л, выоским ПСА и ECOG статусом 1-2.
Малый срок наблюдения (медиана 23,6 мес.) пока что не позволяет адекватно оценить ОВ (медианы не достигнуты, р-value 0,125) (рис.19).
Рисунок 19. Промежуточные данные по ОВ в исследовании PSMAddition.
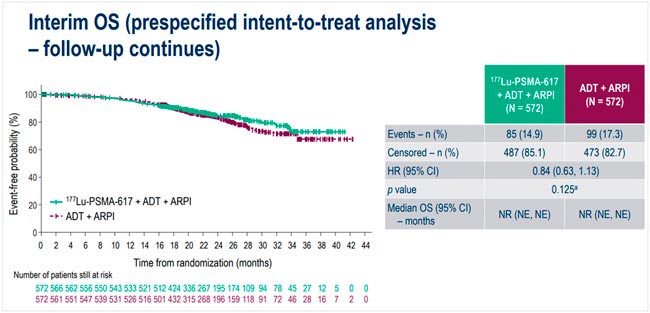
При оценке вторичных конечных точек (ЧОО, время до ПСА-прогрессирования, время до симптомного скелетного события, время до кастрат-резистентности) нумерическое преимущество достигнуто в группе РЛТ.
Многие эксперты восприняли результаты данного исследования воодушевляюще, называя добавление РЛТ к АДТ и ИАС «скорым новым стандартом», что не нашло отклика в сердце автора заметки. Безусловно, мы будем ждать финального анализа, но следует уточнить, что 68% пациентов в группе SoC не получили адекватного лечения, а именно триплета. С другой стороны, подобная РЛТ-содержащая комбинация может стать альтернативой доцетаксел-содержащему триплету для пациентов, не являющихся кандидатами для данного препарата. Сможет ли Lu-PSMA занять свою нишу в первой линии? Скоро узнаем!
Источники:
- EAU Guidelines on Prostate Cancer. Accessed: Oct. 27, 2025. [Online]. Available: https://uroweb.org/
guidelines/ .prostate-cancer - Attard G, et al. Abiraterone acetate and prednisolone with or without enzalutamide for high-risk non-metastatic prostate cancer: a meta-analysis of primary results from two randomised controlled phase 3 trials of the STAMPEDE platform protocol. The Lancet. Jan. 2022; Vol.399, no.10323, pp.447-460. doi: 10.1016/S0140-6736(21)02437-5.
- Xie W, et al. Validation of metastasis-free survival as a surrogate endpoint for overall survival in localized prostate cancer in the era of docetaxel for castration-resistant prostate cancer. Annals of Oncology. Mar. 2024; Vol.35, no.3, pp.285-292. doi: 10.1016/J.ANNONC.2023.11.017.
- ESMO Congress 2021. Accessed: Oct. 28, 2025. [Online]. Available: https://oncologypro.esmo.org/
congress-resources/ .esmo-congress-2021? presentation= abiraterone_acetate_ plus_prednisolone__ aap__with_o_312cd34 - Study Details. NCT02446444. Enzalutamide in Androgen Deprivation Therapy With Radiation Therapy for High Risk, Clinically Localised, Prostate Cancer. ClinicalTrials.gov. Accessed: Oct. 28, 2025. [Online]. Available: https://www.clinicaltrials.gov/
study/NCT02446444 . - Prostate Cancer – Guidelines Detail. Accessed: Oct. 28, 2025. [Online]. Available: https://www.nccn.org/
guidelines/ .guidelines-detail? category=1&id=1459 - EAU Guidelines on Prostate Cancer. Accessed: Oct. 28, 2025. [Online]. Available: https://uroweb.org/
guidelines/ .prostate-cancer - Gharzai LA, et al. Intermediate clinical endpoints for surrogacy in localised prostate cancer: an aggregate meta-analysis. Lancet Oncol. Mar. 2021; Vol.22, no.3, p.402. doi: 10.1016/S1470-2045(20)30730-0.
- Freedland SJ, et al. Improved Outcomes with Enzalutamide in Biochemically Recurrent Prostate Cancer. New England Journal of Medicine. Oct. 2023; Vol.389, no.16, pp.1453-1465, doi: 10.1056/NEJMOA2303974.
- Falkenbach F, et al. Prostate-specific Membrane Antigen–radioguided Surgery in an EMBARK-like Cohort of Patients with Oligorecurrent Hormone-sensitive Prostate Cancer: Delay in Systemic Treatment. Eur Urol Focus. 2025; Vol.0, no.0. doi: 10.1016/j.euf.2025.01.006.
- Bossi A, et al. Efficacy and safety of prostate radiotherapy in de novo metastatic castration-sensitive prostate cancer (PEACE-1): a multicentre, open-label, randomised, phase 3 study with a 2×2 factorial design. The Lancet. Nov. 2024; Vol.404, no.10467, pp.2065-2076. doi: 10.1016/S0140-6736(24)01865-8.
- Lancia A, et al. Management of de Novo Metastatic Hormone-Sensitive Prostate Cancer (mHSPC) and the Role of Radiation Therapy: A Consensus by the Italian Association of Radiotherapy and Clinical Oncology (AIRO). Pract Radiat Oncol. May 2025; Vol.15, no.3, pp.e286-e294. doi: 10.1016/j.prro.2024.10.007.
- Roessler N, et al. Prostate radiotherapy in patients with metastatic hormone-sensitive prostate cancer: A systematic review and meta-analysis of randomised controlled trials. Clin Transl Radiat Oncol. Sep. 2025; Vol.54, p.101009. doi: 10.1016/J.CTRO.2025.101009.
- Fizazi K, et al. Abiraterone plus prednisone added to androgen deprivation therapy and docetaxel in de novo metastatic castration-sensitive prostate cancer (PEACE-1): a multicentre, open-label, randomised, phase 3 study with a 2×2 factorial design. The Lancet. Apr. 2022; Vol.399, no.10336, pp.1695-1707. doi: 10.1016/S0140-6736(22)00367-1.
- Hussain M, et al. Darolutamide Plus Androgen-Deprivation Therapy and Docetaxel in Metastatic Hormone-Sensitive Prostate Cancer by Disease Volume and Risk Subgroups in the Phase III ARASENS Trial. Journal of Clinical Oncology. Jul. 2023; Vol.41, no.20, pp.3595-3607. doi: 10.1200/JCO.23.00041.
- Kellokumpu-Lehtinen PL, et al. 2-weekly versus 3-weekly docetaxel to treat castration-resistant advanced prostate cancer: A randomised, Phase 3 trial. Lancet Oncol. Feb. 2013; Vol.14, no.2, pp.117-124. doi: 10.1016/S1470-2045(12)70537-5.
- Martinez-Recio S, et al. Comparison of 2-Weekly and 3-Weekly Dosing of Docetaxel in Metastatic Prostate Cancer. Clin Genitourin Cancer. Aug. 2022; Vol.20, no.4, pp.363-370. doi: 10.1016/J.CLGC.2022.02.009.
- Byeon S, et al. A prospective phase-II trial of biweekly docetaxel plus androgen deprivation therapy in patients with previously-untreated metastatic castration-naïve prostate cancer. BMC Cancer. 1-7 Nov. 2021; Vol.21, no.1. doi: 10.1186/S12885-021-09018-6.
- Gravis G, et al. Androgen-deprivation therapy alone or with docetaxel in non-castrate metastatic prostate cancer (GETUG-AFU 15): A randomised, Open-label, Phase 3 trial. Lancet Oncol. Feb. 2013; Vol.14, no.2, pp.149-158. doi: 10.1016/S1470-2045(12)70560-0.
- De Bono JS, et al. Clinical Trials: Targeted Therapy Randomized Phase II Study Evaluating Akt Blockade with Ipatasertib, in Combination with Abiraterone, in Patients with Metastatic Prostate Cancer with and without PTEN Loss. doi: 10.1158/1078-0432.CCR-18-0981.
- Sweeney C, et al. Ipatasertib plus abiraterone and prednisolone in metastatic castration-resistant prostate cancer (IPATential150): a multicentre, randomised, double-blind, phase 3 trial. The Lancet. Jul. 2021; Vol.398, no.10295, pp.131-142. doi: 10.1016/S0140-6736(21)00580-8.
- Attard G, et al. Niraparib and abiraterone acetate plus prednisone for HRR-deficient metastatic castration-sensitive prostate cancer: a randomized phase 3 trial. Nature Medicine. Oct. 2025; pp.1-10, doi: 10.1038/s41591-025-03961-8.
- Azad AA, et al. Sequential [177Lu]Lu-PSMA-617 and docetaxel versus docetaxel in patients with metastatic hormone-sensitive prostate cancer (UpFrontPSMA): a multicentre, open-label, randomised, phase 2 study. Lancet Oncol. Oct. 2024; Vol.25, no.10, pp.1267-1276. doi: 10.1016/S1470-2045(24)00440-6.
ЗНАКОМЬТЕСЬ: РЕГИОНАЛЬНОЕ ОТДЕЛЕНИЕ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ (RUSSCO) В САНКТ-ПЕТЕРБУРГЕ
Российское общество клинической онкологии (RUSSCO) активно развивает региональное присутствие в Санкт-Петербурге, консолидируя профессиональное медицинское сообщество и продвигая передовые стандарты онкологической помощи.
Об отделении
Санкт-Петербургское региональное отделение RUSSCO объединяет ведущих специалистов в области клинической онкологии, химиотерапии, радиологии и смежных дисциплин с 2010 года. В настоящее время в региональном отделении Санкт-Петербурга насчитывается 544 члена. На протяжении всего времени существования отделения его бессменный председатель – Владимир Михайлович Моисеенко, профессор, доктор медицинских наук, Заслуженный врач Российской Федерации, член-корреспондент РАН, президент Геронтологического общества при РАН, директор СПб ГБУЗ «Санкт-Петербургский клинический научно-практический центр специализированных видов медицинской помощи (онкологический) имени Н.П. Напалкова». Также Владимир Михайлович является главным редактором Практических рекомендаций RUSSCO – уникального отечественного проекта, не имеющего аналогов в российской медицинской практике. В этом году свет увидит уже 14 издание Практических рекомендаций, которые давно стали «настольной книгой» для опытных онкологов, надежным наставником для молодых специалистов, а также мостом между теорией и практикой, соединяющим последние научные достижения с реальными потребностями клинической работы.
Деятельность Санкт-Петербургского отделения RUSSCO направлена на повышение квалификации онкологов региона, внедрение современных клинических рекомендаций и протоколов лечения, развитие междисциплинарного взаимодействия, поддержку научных исследований и клинических испытаний, а также информирование медицинского сообщества о новейших достижениях онкологии.
Ключевые направления работы:
- Образовательная деятельность:
- регулярные научно-практические семинары и мастер-классы;
- школы для молодых специалистов по актуальным вопросам онкотерапии;
- онлайн-интенсивы и вебинары с участием федеральных экспертов.
- Научно-практическая работа:
- разработка локальных протоколов на основе федеральных рекомендаций RUSSCO;
- участие в многоцентровых клинических исследованиях;
- публикация клинических наблюдений и научных статей.
- Конференционная деятельность:
- организация региональных конференций по направлениям: поддерживающая терапия, онкоурология, опухоли ЖКТ, рак молочной железы и др.;
- проведение симпозиумов в рамках крупных международных и всероссийских форумов.
- Информационная поддержка:
- распространение практических рекомендаций RUSSCO среди врачей региона;
- обновление базы клинических кейсов;
- консультирование по сложным клиническим ситуациям.
Партнерские организации
Отделение взаимодействует с ключевыми онкологическими учреждениями города, такими как СПб ГБУЗ «Санкт-Петербургский клинический научно-практический центр специализированных видов медицинской помощи (онкологический) имени Н.П. Напалкова», Национальный медицинский исследовательский центр онкологии имени Н.Н. Петрова, СПб ГБУЗ «Городской клинический онкологический диспансер», а также с рядом медицинских факультетов вузов Санкт-Петербурга.
Возглавляемый Председателем регионального отделения Российского общества клинической онкологии (RUSSCO) Онкологический центр имени Н.П. Напалкова – ведущий в Северо-западном регионе современный центр, обладающий всеми возможностями для оказания специализированной медицинской помощи онкологическим больным. На сегодняшний день это учреждение мощностью 648 коек, в том числе 36 коек детского онкологического отделения.

Онкологический центр имени Н.П. Напалкова оснащен первоклассным оборудованием, отвечающим мировым стандартам, кроме того, в учреждении внедрены 138 высоких технологий в диагностике и лечении злокачественных опухолей, из них 24 уникальных.
Под руководством Моисеенко В.М. Онкологический центр имени Н.П. Напалкова стабильно наращивает показатели работы, предоставляя хирургическое, радиологическое и лекарственное лечение жителям Санкт-Петербурга, в том числе детям. Ежегодно в поликлиническом отделении регистрируется более 150 000 посещений, а стационарное лечение получают более 55 500 человек. В течение 10 лет достигнут рост оперативной активности в 2,5 раза: в 2024 году проведено 19 191 операций, выполняются мини- и микроинвазивные вмешательства (доля – до 95%), что позволяет сократить время восстановления пациента и сохранить качество жизни.
В Онкологическом центре имени Н.П. Напалкова внедрены 198 высоких технологий в диагностике и лечении ЗНО, 24 – уникальные и запатентованные.
Под руководством профессора Моисеенко В.М. полностью реализована третья очередь строительства учреждения: в марте 2024 года открыт новый поликлинический корпус с увеличенной пропускной способностью до 1200 посещений в смену.

Кроме полной диагностической базы, развернуты два дневных стационара: хирургический (с двумя операционными) и противоопухолевой лекарственной терапии. Открыт центр амбулаторной онкологической помощи, в задачи которого в т.ч. входит диспансерное наблюдение пролеченных пациентов, что позволяет обеспечить полный цикл ведения онкологических больных от постановки диагноза до динамического наблюдения после проведенного специализированного лечения.
Создано и успешно работает отделение централизованного разведения цитостатических лекарственных препаратов, которое позволяет не только производить более точное разведение препаратов, но и существенно экономить денежные средства: за 8 лет было сэкономлено более 1 млрд. рублей.
С целью обеспечения комплексного процесса диагностики, лечения и восстановления после специализированной терапии открыто отделение реабилитации, которое позволяет подготовить пациентов к сложному лечению, существенно улучшить качество жизни после завершения терапии, а также ускорить процесс восстановления и возвращения к социальной и трудовой жизни.

ГБУЗ «СПб КНпЦСВМП(о) имени Н.П. Напалкова» – это высокие стандарты оказания медицинских услуг, комплексный подход к лечению и профилактике заболеваний, высококвалифицированные и опытные специалисты, самое передовое, современное медицинское оборудование, новейшие и уникальные медицинские технологии, комфорт и высокий уровень сервиса, отвечающий европейским стандартам качества.
Российское общество клинической онкологии (RUSSCO) активно работает в Санкт-Петербурге, организуя международные, всероссийские, межрегиональные конференции и образовательные семинары, где врачи принимают активное участие не только как слушатели, но и являются активными участниками, выступая с докладами и разборами клинических случаев.
Врачи отделения занимаются информационно-просветительской деятельностью, в том числе снимаются образовательные видеоролики с врачами, рассказывающих об онкологических заболеваниях, их профилактике, диагностике и лечении, а также о личных пациентских историях борьбы с раком. Разрабатываются просветительские материалы о различных аспектах онкологических заболеваний: на сегодняшний день под редакцией профессора В.М. Моисеенко выпускается более 20 видов методических рекомендаций, буклетов и листовок о диагностике, лечении и побочных эффектах терапии, которые выпускаются в печатном виде и доступны на официальном сайте Онкологического центра имени Н.П. Напалкова. Несколько раз в год проводятся Школы для пациентов, где эксперты доступным языком рассказывают о терапии рака: с 2021 года школы посетило более 1850 человек.
С учетом важности ранней диагностики и профилактики онкологических заболеваний организуются акции: «День борьбы с меланомой», «Экспресс-диагностика здоровья молочной железы», «Мужское здоровье» и другие, в которых принимают участие и пациенты и их здоровые родственники: с 2019 года акции посетило более 2500 человек.
Совместно с RUSSCO ежегодно организуются конференции и вебинары с участием не только врачей-онкологов, но и врачей смежных специальностей – терапевтов, кардиологов, нейрохирургов, неврологов и других. В 2025 году было проведено более 26 онлайн-мероприятий – симпозиумов, вебинаров, докладов, разборов клинических случаев, сессий, в том числе в рамках Академии RUSSCO. Врачи Онкологического центра имени Н.П. Напалкова ежегодно публикуют свои научные труды с описанием и разбором клинических случаев, разработками в российских и европейских специализированных журналах, выступают с докладами в европейских и международных конференциях.
Ежегодно специалисты Онкологического центра имени Н.П. Напалкова организовывают и проводят собственную сессию в рамках VIII Международного Форума онкологии и радиотерапии «Ради жизни | For Life». Кроме того, в 2025 году двое ведущих специалистов Онкологического центра имени Н.П. Напалкова стали лауреатами конкурса на присуждение премии имени академика А.И. Савицкого. Заместитель директора по химиотерапевтическому и радиотерапевтическому лечению Никита Михайлович Волков стал победителем в номинации «Лучший химиотерапевт года» за инновационный проект «Оценка эффективности неоадъювантного назначения ингибиторов иммунных контрольных точек при раке толстой кишки».

В номинации «Лучший проект года» социальный проект «Предреабилитация пациентов пожилого и старческого возраста» команды специалистов отделения медицинской реабилитации пациентов с соматическими заболеваниями нашего центра под руководством заведующего Ильи Андреевича Важенина занял второе место, уступив в голосах всего 0,29% победителю – Нижегородскому областному онкологическому диспансеру с его проектом «Отраслевой онкоинцидент «Повышение качества онкоскрининга в рамках диспансеризации и профосмотров».
Ежегодно врачи регионального отделения RUSSCO принимают участие в ключевых конференциях Российского общества клинической онкологии, в том числе в Российском онкологическом конгрессе.
Вот некоторые ключевые события и аспекты деятельности RUSSCO в городе:
Х Конференция RUSSCO «Поддерживающая терапия» прошла 17-18 мая 2024 года в Санкт-Петербурге. Мероприятие собрало ведущих специалистов в области онкологии для обсуждения современных методов лечения, включая сопроводительную терапию при опухолях легких, ЖКТ, раке молочной железы и других заболеваниях.
В 2024 году RUSSCO провело сессию на IX Петербургском международном онкологическом форуме «Белые ночи 2024». Тема сессии – «Новые разделы рекомендаций по поддерживающей терапии: нерешенные вопросы». Эксперты обсудили инфузионные реакции, хронические вирусные гепатиты, гормоноопосредованные побочные явления и неврологические осложнения.
В рамках форума «Белые ночи 2024» представители RUSSCO были награждены почетными медалями им. М.Л. Гершановича за вклад в развитие химиотерапии. Среди награжденных – директор СПб ГБУЗ «Санкт-Петербургский клинический научно-практический центр специализированных видов медицинской помощи (онкологический) имени Н.П. Напалкова» Владимир Михайлович Моисеенко и другие специалисты.
XI Конференция RUSSCO «Поддерживающая терапия» состоялась 27-28 мая 2025 года в Санкт-Петербурге. Место проведения – СПб ГБУЗ «Городской клинический онкологический диспансер» (просп. Ветеранов, 56). Конференция прошла в гибридном формате с онлайн-трансляцией.
НОВОСТИ ОНКОЛОГИИ / ХЛТ С ОДНОВРЕМЕННОЙ ИММУНОТЕРАПИЕЙ: КОГДА БОЛЬШЕ НЕ ЗНАЧИТ ЛУЧШЕ
Очередная попытка улучшить отдаленные результаты лечения больных местнораспространенным НМРЛ с добавлением иммунотерапии дурвалумабом одновременно с ХЛТ потерпела неудачу вслед за PACIFIC-2 (об этом мы подробно писали в недавней публикации) и другими работами. Согласно исследованию, представленному на WCLC 2025 – Всемирной конференции по раку легких 2025 года Международной ассоциации по изучению рака легких (IASLC), лечение пациентов с НМРЛ III стадии дурвалумабом одновременно с химиолучевой терапией (ХЛТ) и продолжение иммунотерапии в качестве консолидации не улучшило общую выживаемость по сравнению с применением только дурвалумаба в качестве консолидирующей терапии. Публикация результатов исследования появилась в октябрьском номере Journal of Clinical Oncology.
Консолидация с применением дурвалумаба улучшает выживаемость пациентов с неоперабельным НМРЛ III стадии после радикальной ХЛТ. Однако оптимальные сроки начала ингибирования иммунных контрольных точек неизвестны. В исследовании 3 фазы EA5181 проверялась гипотеза о том, что начало терапии дурвалумабом одновременно с ХЛТ и последующее продолжение иммунотерапии улучшит общую выживаемость (ОВ) по сравнению с применением дурвалумаба только на этапе консолидации.
В исследование были включены 662 пациента с ранее не леченным, неоперабельным НМРЛ IIIA-C стадии или с рецидивом в лимфатических узлах средостения после перенесенной операции; у 49% больных была аденокарцинома и около 82% получили ХТ в комбинации карбоплатин/паклитаксел. Пациенты были рандомизированы в группы, которым проводилась либо комбинация дурвалумаба с химиотерапией и лучевой терапией (группа A), либо только химиолучевая терапия (группа B). Пациентам в обеих группах, завершившим химиолучевую терапию без прогрессирования или значительной токсичности, была назначена консолидация дурвалумабом в течение года.
Результаты показали, что медиана общей выживаемости (ОВ) составила 41,5 мес. в группе A против 39,4 мес. в группе B (p=0,83; HR=1,03). Медиана выживаемости без прогрессирования (ВБП) составила 15,5 против 16,8 мес. (p=0,65; HR=1,05). В ходе предварительного анализа результатов по подгруппам не было выявлено значимых различий в частоте объективных ответов, характере рецидивов или токсичности, за исключением одной подгруппы: у больных, получавших цисплатин-пеметрексед, результаты были хуже при добавлении дурвалумаба, однако число пациентов было небольшим.
Рисунок 1.
Показатели ОВ и ВБП в группах.
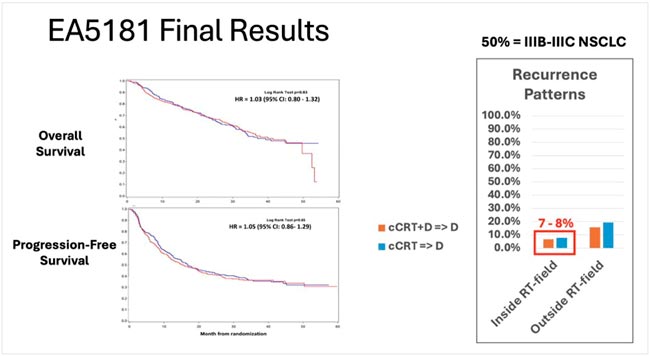
«Наше исследование показало, что добавление дурвалумаба одновременно с химиолучевой терапией не улучшило общую выживаемость по сравнению с применением дурвалумаба только в качестве консолидационной терапии, – прокомментировал Джон Варлотто, доктор медицинских наук из Университета Маршалла в Хантингтоне, Западная Вирджиния. – Эти результаты свидетельствуют о том, что текущий стандарт назначения дурвалумаба после химиолучевой лучевой терапии по-прежнему остается актуальным при нерезектабельном НМРЛ III стадии».
В целом, отсутствие пользы от сопутствующей иммунотерапии, выявленное в исследовании EA5181 и других исследованиях рака легких как при немелкоклеточном раке легкого, так и при мелкоклеточном раке легкого ограниченной стадии, свидетельствует о том, что иммунной системе требуется «правильное окно», и EA5181 дает практически окончательное подтверждение отсутствия преимуществ от сопутствующей иммунотерапии дурвалумабом, при этом режим PACIFIC остается стандартной схемой лечения.
Источник: Varlotto JM, et al. PL03.06: EA5181: Phase 3 Trial of Concurrent and Consolidative Durvalumab vs Consolidation Durva Alone for Unresectable Stage 3 NSCLC. Journal of Thoracic Oncology. Vol.20, Issue 10, S4-S5.
УГОЛОК РАДИОТЕРАПЕВТА / SUPREMO: ДАЕТ ЛИ ЛТ ПРЕВОСХОДСТВО ПОСЛЕ РМЭ?
Автор: Деньгина Наталья Владимировна
Заведующая радиологическим отделением
ГУЗ «Областной клинический онкологический диспансер»,
директор Центра лучевой терапии «R-Spei», к.м.н., Ульяновск
Воистину загадочная опухоль – рак молочной железы – ежегодно подкидывает нам новые головоломки, меняя представления об уже устоявшихся подходах к его лечению.
Казалось бы, недавно мы все сошлись во мнении (и это было подкреплено в клинических рекомендациях), что вовлечение подмышечных лимфоузлов (N+) – это показание к послеоперационной лучевой терапии у подавляющего большинства больных даже после радикальной мастэктомии – на основании данных крупного анализа EBCTCG 2014 года [1]. И вот 5 ноября 2025 года в NEJM опубликованы результаты проспективного рандомизированного исследования 3 фазы SUPREMO, в котором авторы продемонстрировали: даже при наличии поражения подмышечных лимфоузлов категории N1, а также в ряде других ситуаций, расцененных как промежуточный риск (pT1N1, pT2N1, pT3N0 или pT2N0 grade 3 ± ЛВИ (размеры опухоли: T1, ≤2 см; T2, >2 см до 5 см; T3, >5 см)), добавление адъювантной ЛТ после РМЭ не дает преимуществ в общей выживаемости [2].
В это международное исследование было включено 1607 пациенток после РМЭ по поводу РАМ промежуточного риска, получивших системную терапию и рандомизированных на группы послеоперационной ЛТ (n=808) в дозе 40-50 Гр на грудную стенку и без облучения (n=799); период наблюдения составил 9,6 лет. Первичная конечная точка – ОВ, в качестве вторичных оценивались рецидивы в области грудной стенки, регионарные рецидивы, безрецидивная выживаемость, выживаемость без отдаленных метастазов, причины смерти и побочные эффекты, связанные с облучением.
Общая выживаемость составила 81,4% в группе ЛТ и 81,9% без облучения (коэффициент риска смерти 1,04; 95% доверительный интервал [ДИ] 0,82-1,30; p=0,80).
Рисунок 1.
Общая выживаемость в группах (ITT популяция).
Рецидив в области грудной стенки наблюдался у 29 пациентов: у 9 (1,1%) в группе облучения и у 20 (2,5%) в группе без облучения (коэффициент риска 0,45; 95% ДИ 0,20-0,99). ВБП составила 76,2% в группе ЛТ и 75,5% без нее (коэффициент риска рецидива или смерти 0,97; 95% ДИ 0,79-1,18), а выживаемость без отдаленных метастазов – 78,2% и 79,2% соответственно (коэффициент риска отдаленных метастазов или смерти 1,06; 95% ДИ 0,86-1,31).
Рисунок 2.
Результаты исследования: А – частота рецидивов в области грудной стенки, В – локорегиональные рецидивы, С – выживаемость без отдаленных метастазов, D – выживаемость без прогрессирования.

Подгрупповой анализ продемонстрировал интересный факт: у пациенток с трижды негативным РМЖ добавление лучевой терапии не только не улучшало, а даже ухудшило ОВ (HR 1,9), при том, что мы привыкли считать ТН РМЖ одним из факторов высокого риска и, следовательно, весомым аргументом для назначения ЛТ.
Рисунок 3.
Подгрупповой анализ в исследовании.
Исследование демонстрирует, что современная системная терапия способна эффективно снизить риск рецидива без добавления лучевой терапии, тем самым позволяя избежать риска возможных дополнительных осложнений и сохраняя облучения как резерв при возможных рецидивах.
Результаты исследования активно обсуждаются в профессиональных кругах, многие сходятся во мнении, что пришла пора пересмотреть показания к адъювантной ЛТ после РМЭ.
Источники:
- EBCTCG (Early Breast Cancer Trialists' Collaborative Group); McGale P, Taylor C, Correa C, Cutter D, Duane F, Ewertz M, Gray R, Mannu G, Peto R, Whelan T, Wang Y, Wang Z, Darby S. Effect of radiotherapy after mastectomy and axillary surgery on 10-year recurrence and 20-year breast cancer mortality: meta-analysis of individual patient data for 8135 women in 22 randomised trials. Lancet. 2014 Jun 21; 383 (9935): 2127-35. doi: 10.1016/S0140-6736(14)60488-8. Epub 2014 Mar 19. Erratum in: Lancet. 2014 Nov 22; 384 (9957): 1848. PMID: 24656685; PMCID: PMC5015598.
- Kunkler IH, et al. Ten-Year Survival after Postmastectomy Chest-Wall Irradiation in Breast Cancer. N Engl J Med. 2025; 393: 1771-1783. DOI: 10.1056/NEJMoa2412225.
УГОЛОК РАДИОТЕРАПЕВТА / АНАЛИТИЧЕСКИЙ ОБЗОР: ПРЕДОПЕРАЦИОННАЯ ЛУЧЕВАЯ ТЕРАПИЯ ПРИ РАКЕ МОЛОЧНОЙ ЖЕЛЕЗЫ – ПЕРСПЕКТИВЫ, ОГРАНИЧЕНИЯ И ПОЗИЦИЯ ESTRO
Автор: Черчик Алексей
Врач, радиационный онколог, Paul Scherrer Institute,
Швейцария
Европейское общество радиотерапии и онкологии (ESTRO) представило консенсус-документ, обобщающий результаты 27 проспективных исследований I-II фаз, посвященных предоперационной лучевой терапии (ЛТ) при раке молочной железы (РМЖ). Этот подход пока остается экспериментальным, но вызывает растущий интерес как потенциальный инструмент оптимизации последовательности и индивидуализации лечения.
Рациональность подхода
Традиционная стратегия лечения РМЖ предполагает хирургическое вмешательство с последующей ЛТ. Однако развитие современных технологий планирования и доставки дозы (IMRT, VMAT, IGRT, гипофракционирование) делает возможным пересмотр этой парадигмы.
Потенциальные преимущества предоперационной ЛТ включают:
- Более точное определение мишени – облучение неповрежденной ткани позволяет минимизировать неопределенность контурирования и снизить объем облучения
- Уменьшение стадии заболевания (downstaging) – повышение вероятности выполнения органосохраняющих операций (ОСО)
- Рост частоты полного патоморфологического ответа (pCR), особенно при трижды негативном и HER2-положительном подтипах
- Улучшение косметических и реконструктивных исходов при выполнении мастэктомии с одномоментной реконструкцией
- Потенциальные синергии с системной терапией, включая иммунотерапию, за счет модуляции опухолевого микроокружения
Ключевые результаты систематического анализа
В анализ включены данные с 2000 по 2024 год, охватывающие более 1000 пациенток. При раннем РМЖ с низким риском (ER+, ≤3 см, cN0) предоперационное частичное облучение (PBI) приводило к pCR до 42%, особенно при увеличении интервала между ЛТ и операцией. При местнораспространенном РМЖ медианная частота pCR составила около 30%, достигая 71% у пациенток с тройным негативным подтипом. При планируемой мастэктомии с реконструкцией pCR достигала 46,7%, а частота осложнений (некроз лоскута, инфекция) оставалась в пределах 3-17%, что указывает на техническую осуществимость метода.
Основные ограничения
- Высокая гетерогенность дизайна исследований, популяций и режимов облучения
- Отсутствие стандартизации доз и фракционирования, а также единого подхода к определению интервала между ЛТ и хирургией
- Недостаточная валидация pCR как прогностического и предиктивного показателя после ЛТ
- Ограниченные данные по качеству жизни, экономической эффективности и техническим аспектам выполнения
- Недостаточная стратификация по молекулярным подтипам, что снижает возможность точной интерпретации результатов
Рекомендации ESTRO для будущих исследований
Предоперационная ЛТ должна рассматриваться исключительно в рамках клинических испытаний или проспективных регистров. Исследования должны включать сбор PROMs, фармакоэкономическую оценку, трансляционные биомаркеры и данные по реконструктивным исходам.
Для низкого риска – возможна оценка предоперационного PBI по критериям ASTRO/ESTRO, с обязательным включением биопсийного канала в объем.
Для высокого риска – изучение комбинированных режимов с химио- и иммунотерапией, а также предоперационного буста.
Для мастэктомии с реконструкцией – требуется уточнение оптимального интервала между ЛТ и хирургическим вмешательством.
Заключение
Предоперационная лучевая терапия при РМЖ – это инновационная, но пока не стандартизированная стратегия, способная улучшить результаты лечения отдельных категорий пациенток и повысить персонализацию терапии. На данный момент ее применение должно ограничиваться контролируемыми клиническими исследованиями. Для интеграции в стандартную практику необходимы рандомизированные испытания III фазы, определяющие оптимальные дозовые режимы, комбинации с системной терапией и долгосрочные клинические исходы.
Документ ESTRO задает исследовательский вектор, который может сформировать новую парадигму в лечении рака молочной железы – от «операции с последующим облучением» к биологически обоснованной предоперационной радиомодификации опухоли.
Источник: Zamagni A, Luis AM, Mjaaland I, Chirila ME, Ciervide R, Machiels M, Ratosa I, Van Den Bongard DHJ, Aznar M, Boersma LJ, Coles CE, Corradini S, Caluwe AD, Gabrys D, Kaidar-Person O, Kirby AM, Krug D, Maraldo MV, Meattini I, Rivera S, Somaiah N, Strnad V, Zeidan Y, Poortmans P. ESTRO recommendations on preoperative radiation therapy in breast cancer: current and future perspectives. Radiotherapy and Oncology. 2025. https://doi.org/
СТЕРЕОТАКСИЧЕСКАЯ ЛУЧЕВАЯ ТЕРАПИЯ БОЛЬШИМИ ДОЗАМИ ПРИ РАННЕМ РАКЕ МОЛОЧНОЙ ЖЕЛЕЗЫ
Автор: Тюляндин Сергей Алексеевич
Заслуженный деятель науки РФ, главный научный сотрудник отделения противоопухолевой лекарственной терапии №2
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России,
председатель рабочей группы по разработке Клинических рекомендаций RUSSCO,
член правления RUSSCO, профессор, доктор медицинских наук, Москва
В недавно опубликованном исследовании фазы I изучалась безопасность и противоопухолевая эффективность предоперационной однофракционной парциальной стереотаксической лучевой терапии (ПСЛТ) у пациенток с люминальным (HR+/HER2-) раком молочной железы (РМЖ) в стадии cT1-2N0. Ранее той же группой авторов была продемонстрирована безопасность ПСЛТ в дозе 30 Гр за одну фракцию. В настоящем исследовании основной целью являлось определение максимально переносимой дозы (МПД) и оценка частоты полного патологического ответа (pCR) по критериям Residual Cancer Burden (RCB).
Это нерандомизированное исследование фазы I с эскалацией дозы предоперационной однофракционной ПСЛТ у пациентов с люминальным раком молочной железы cT1-2N0 для определения максимально переносимой дозы (МПД) и оценки безопасности нового метода лечения. Пациенты проходили лечение в 3 когортах доз – 30 Гр, 34 Гр или 38 Гр за одну фракцию в группах по 7-15 человек, затем получали эндокринную терапию через 2 недели после окончания ПСЛТ. Эскалация дозы прекращается, если в течение 90 дней наблюдения частота побочных эффектов 3 степени составит 33% и выше. Дозолимитирующей токсичностью (ДЛТ) считалось локальное лучевое повреждение кожи, ребер (перелом), легких (лучевой пневмонит), лучевые периферические невриты или любые другие осложнения 4-5 степени, связанные с лечением. МПД считалась доза на один уровень ниже от дозы, на которой зафиксирована ДЛТ. Первая фаза данного исследования считалась завершенной при наступлении одного из следующих событий: 1) достижение МПД для когорты или 2) достижение и переносимость дозы 38 Гр, которую исследователи определили как вероятно эффективную для контроля заболевания. Безопасность и токсические эффекты оценивались в соответствии с критериями токсичности CTCAE, версия 5. Облучение проводилось на одном из трех аппаратов: MR-linac, CyberKnife или кобальтовый стереотаксический аппарат GammaPod. Объем мишени (GTV) определялся по КТ, МРТ и клипсам, установленным при биопсии. Планируемый объем (PTV) равнялся GTV плюс 5 мм, но не ближе 5 мм к коже и грудной стенке. Дозы были оптимизированы для защиты кожи.
Одновременно проводилась оценка противоопухолевого эффекта различных доз облучения, критерием которой являлся морфологический ответ, в частности, частота рСR (RCB0) после выполнения оперативного вмешательства. Для реализации противоопухолевого эффекта лучевой терапии выполнение органосохранной операции откладывалось, и она выполнялась в сроки не позднее 12 месяцев после окончания ПСЛТ, в течение которых больные принимали гормональные препараты. Также оценивалась взаимосвязь времeни выполнения операции и частоты pCR, локальный контроль и безрецидивная выживаемость, косметический результат по Гарвардской шкале через 36 месяцев.
В исследование были включены 44 больных люминальным раком (HR+/HER2-) молочной железы стадии cT1N0 (41 больная) и T2N0 (3 больных), которым не требовалась химиотерапия. Все пациенты были набраны в одном академическом центре с декабря 2019 года по апрель 2024 года. Все больные получили однофракционную ПСЛТ в дозе 30 Гр (14 пациентов), 34 Гр (15 пациентов) или 38 Гр (15 пациентов). Медиана времени наблюдения составила 52, 40 и 20 месяцев для групп 30, 34 и 38 Гр соответственно. Медианы объемов GTV и PTV составили 2,4 (0,73-13,94) и 16,7 (0,68-51,7) см3. Медиана возраста включенных в исследование составила 64,5 года. Все пациенты начали эндокринную терапию после ЧСЛТ. У двух из 44 пациентов (4,5%) наблюдался pCR первичной опухоли, но в ходе операции выявлено поражение лимфатических узлов. Им было проведено облучение всей молочной железы и регионарных лимфатических узлов до 45 Гр за 25 фракций, а также химиотерапия.
Дозы ПСЛТ вплоть до 38 Гр в одной фракции оказались безопасными, MTD не была достигнута. Острая токсичность в течение 90 дней в основном была 1-й степени: дерматит, боль, слабость. Было зарегистрировано только 3 случая токсичности 2-й степени (умеренный дерматит) в когорте 30 Гр. Поздняя токсичность включала один случай сохраняющейся боли в зоне облучения 2-й степени и один случай расхождения раны 3-й степени у пациента с неконтролируемым диабетом (оба в когорте 30 Гр).
Частота pCR росла с увеличением дозы и составила 35,7% при дозе 30 Гр, при дозе 34 Гр – 46,7% и при дозе 38 Гр – 66,7%. Когда объединили RCB0 и RCB1, частота выраженного морфологического ответа составила 64,3%, 93,3% и 93,3% соответственно. Статистический анализ выявил, что более длительный интервал между облучением и операцией был значимо связан с достижением pCR. Каждый дополнительный день увеличивал шансы достижения pCR примерно на 1,7%. Оптимальным интервалом для выполнения оперативного лечения для получения максимального pCR составил 277 дней после выполнения ПСЛТ (около 9 месяцев). Среди пациентов, перенесших операцию в сроки более 9 месяцев после облучения, частота pCR составила 72% (18 из 25), а частота RCB0 + RCB1 – 92% (23 из 25).
Локальный контроль и безрецидивная выживаемость составили 100% во всех когортах на момент анализа. Проведенный многофакторный анализ показал, что время до операции было достоверно ассоциировано с более высокой вероятностью pCR в отличие от размера первичной опухоли и дозы проведенной ПСЛТ. Косметический эффект, оцененный врачами до начала лечения и через 36 месяцев после его окончания, не показал значимых изменений ни в одной из когорт.
Авторы делают вывод, что однократная предоперационная парциальная лучевая терапия в дозах до 38 Гр является безопасной и хорошо переносимой больными ранним HR+ РМЖ и обладает высокой противоопухолевой активностью. Отсрочка операции более чем на 9 месяцев в сочетании с эндокринной терапией оказалась более важным фактором для достижения pCR, чем сама доза облучения свыше 30 Гр. Это говорит о том, что для полной гибели опухолевых клеток под действием радиации и эндокринной терапии требуется длительное время. Полученные данные закладывают основу для будущих исследований, в которых можно будет тестировать отказ от хирургического вмешательства у тщательно отобранных пациентов с ранним HR+ РМЖ, достигших полного ответа после неоадъювантной ЧСЛТ радиотерапии.
Все это напоминает успешный опыт применения стереотаксической лучевой терапии у больных I стадией немелкоклеточного рака легкого. Этот лечебный подход, вошедший в клинические рекомендации многих стран, позволил отказаться от выполнения операции у отдельных категорий пациентов без негативного влияния на прогноз. Трудной задачей на пути использования стереотаксического облучения как возможной замены операции при лечении любой злокачественной опухоли является стадирование с исключением регионарного и отдаленного метастазирования. Для РМЖ эта проблема решается проведением ПЭТ-КТ, прицельной пункционной биопсии подозрительных на наличие метастазов регионарных лимфоузлов. Другой нерешенной задачей является подтверждение pCR после проведенного облучения. Визуальные методы исследования (маммография, МРТ, КТ) не отличаются точностью в определении полной эрадикации опухоли на фоне остаточных изменений ткани молочной железы после проведенной лучевой терапии. Возможно, потребуется выполнение вакуум-ассистируемой биопсии ложа опухоли для большей уверенности в достижении pCR. Важным этапом на пути внедрения однофракционной ПСЛТ большими дозами в клинику будет проведение рандомизированного исследования сравнения эффективности и переносимости с хирургическим лечением, в ходе которого должны быть решены и вопросы стадирования и оценки противоопухолевого ответа.
Источник: Rahimi А, et al. Ablative preoperative single-fraction radiation dose escalation among patients with breast cancer: A phase I nonrandomized clinical trial. JAMA Network Open. 2025; 8(11): e2543689.
А ВОТ БЫЛ У МЕНЯ ОДИН СЛУЧАЙ , ИЛИ «ОХОТНИЧЬИ ЗАПИСКИ» ОНКОЛОГОВ... / ПРОЛГОЛИМАБ В ЛЕЧЕНИИ МЕТАСТАТИЧЕСКОЙ BRAF-ОТРИЦАТЕЛЬНОЙ МЕЛАНОМЫ КОЖИ: ЧЕРЕЗ ПСЕВДОПРОГРЕССИЮ К ПОЛНОМУ ОТВЕТУ
Авторы: Данилова Ирина Вячеславовна
Онколог, заведующая химиотерапевтическим отделением (отделение противоопухолевой лекарственной терапии)
ГБУЗ ВО «Областной клинический онкологический диспансер», Владимир
Шейко Андрей Владимирович
Онколог, радиотерапевт, заведующий радиотерапевтическим отделением №2
ГБУЗ ВО «Областной клинический онкологический диспансер», Владимир
Румянцева Елена Арнольдовна
Онколог, заместитель главного врача по медицинской части
ГБУЗ ВО «Областной клинический онкологический диспансер», Владимир
Пролголимаб – рекомбинантное моноклональное антитело, специфически связывающее рецептор программируемой клеточной смерти PD-1 и блокирующее его взаимодействие с лигандами PD-L1 и PD-L2. Пролголимаб одобрен в России для применения в первой линии терапии неоперабельной или метастатической меланомы кожи. Его роль аналогична роли других анти-PD-1 препаратов, таких как ниволумаб и пембролизумаб, которые являются признанными препаратами первой линии терапии метастатической меланомы в США и Европе [1-4].
Данные клинических исследований (MIRACULUM) показывают, что пролголимаб обеспечивает объективный ответ примерно в 28-38% при ранее не леченной распространенной меланоме, с двухлетней общей выживаемостью в 46-57% и контролируемым профилем безопасности. Оба режима дозирования препарата, основанные на весе (1 мг/кг каждые 2 недели или 3 мг/кг каждые 3 недели), и режим с фиксированной дозой (250 мг каждые 3 недели) продемонстрировали сопоставимую эффективность и переносимость [1-2]. Исследование III фазы FLAT подтвердило не меньшую эффективность фиксированных доз по сравнению с дозировкой, основанной на весе, что подтверждает их применение в клинической практике [2]. Исследование применения пролголимаба в реальной клинической практике в России (FORA) также продемонстрировало ту же частоту объективного ответа и схожие показатели годичной выживаемости без прогрессирования, что и исследование MIRACULUM [5].
Доклинические данные свидетельствуют о том, что пролголимаб может обладать более высокой степенью связывания с рецепторами PD-1 и более высокой активацией Т-клеток по сравнению с ингибиторами PD-1 на основе IgG4. При этом ингибирование роста опухоли in vivo составило 16% для пембролизумаба и 56% для пролголимаба [4]. Также имеются ограниченные данные о том, что переключение между анти-PD-1 препаратами, включая пролголимаб, безопасно и не снижает эффективность у отдельных пациентов [6].
Клинический случай
20.06.2011 пациентке 68 лет, жительнице Владимирской области, в одной из городских больниц г. Москвы было выполнено иссечение пигментного образования на коже межлопаточной области. Послеоперационное патогистологическое заключение: меланома кожи межлопаточной области, поверхностно распространяющаяся форма, с изъязвлением, 3 уровень по Кларку, толщина опухоли по Бреслоу 0,9 мм, край резекции R0. Послеоперационный диагноз: меланома кожи межлопаточной области рT1bN0M0, стадия Ib. Далее в онкологический диспансер г. Владимир пациентка не обращалась, находилась под наблюдением по месту жительства. В мае 2023 года самостоятельно обнаружила увеличенный аксиллярный лимфоузел справа. По месту жительства 04.05.2023 выполнено УЗИ периферических лимфоузлов: в правой аксиллярной области выявлен спаренный лимфоузел неправильной формы размерами 24×28 мм с неровными четкими контурами, неоднородно гипоэхогенный, без четкого подразделения слоев. Больная направлена в онкологический диспансер г. Владимир для морфологической верификации и решения вопроса о дальнейшей тактике. 30.05.2023 выполнена тонкоигольная аспирационная биопсия (ТАБ) подмышечного лимфоузла справа. Цитологически – меланома. 27.06.2023 при ПЭТ-КТ выявлена вторичная правосторонняя аксиллярная аденопатия с гиперметаболизмом ФДГ (конгломерат 33×41 мм с SUVmax 14,22); гиперметаболические метастатические очаги в легких (в S10 левого легкого, до 11 мм в диаметре, SUVmax 4,04), печени (в S5 сегменте, до 13 мм, SUVmax 6,39), селезенке (до 15 мм, в паренхиме, субкапсульно, SUVmax 4,97), в клетчатке правой большой половой губы (до 9 мм, SUVmax 3,68), в правой подвздошной мышце (до 19×9 мм, SUVmax 8,68) (рис.1).
Рисунок 1.
Результаты ПЭТ-КТ пациентки от 27.06.2023: А – метастазы в подмышечных лимфоузлах справа, B – метастазы в легких, С – метастаз в печени, D – метастаз в правой большой половой губе, Е – метастаз в правой подвздошной мышце.
05.07.2023 при МРТ головного мозга данных за наличие метастазов не выявлено. 13.07.2023 выполнена повторная ТАБ подмышечного лимфоузла справа. Цитологически – метастаз меланомы в лимфатический узел. При молекулярно-генетическом исследовании мутаций в 15 экзоне гена BRAF не обнаружено.
С 19.07.2023 пациентке начата терапия пролголимабом в режиме 1 мг/кг в/в капельно, 60 минут, 1 раз в 2 недели. Исходный уровень S100 от 19.07.2023 – 197 нг/мл (при норме до 90 нг/мл). При ПЭТ-контроле от 02.10.2023 (после шести введений пролголимаба) в сравнении с ПЭТ-КТ исследованием от 27.06.2023 выявлено прогрессирование заболевания: увеличение размеров, активности ФДГ метастатического конгломерата аксиллярных лимфоузлов справа (47×63 мм (ранее 33×41 мм); SUVmax 19,77 (ранее 14,22)); увеличение размеров, активности ФДГ метастазов обоих легких, контроль в S10 слева (14 мм (ранее 11 мм); SUVmax 7,11 (ранее 4,04)); увеличение размеров, активности ФДГ метастазов печени, контроль S4 (23 мм (ранее 13 мм); SUVmax 13,89 (ранее 6,39)); увеличение размеров, активности ФДГ метастаза селезенки (28 мм (ранее 15 мм); SUVmax 7,38 (ранее 4,97)); увеличение размеров, активности ФДГ метастаза в клетчатке правой большой половой губы (12 мм (ранее 9 мм); SUVmax 7,96 (ранее 3,68)); в правой запирательной мышце сохранился метастаз 12×34 мм (ранее 19×9 мм), с гиперфиксацией ФДГ, SUVmax 9,89 (ранее 8,68)). ПЭТ-динамика расценена как псевдопрогрессия (рис.2).
Рисунок 2.
Псевдопрогрессия в динамике ПЭТ-КТ от 27.06.2023 [слева] и ПЭТ-КТ от 02.10.2023 [справа]: А-В – метастазы в подмышечных лимфоузлах справа, С-D – метастазы в печени, Е-F – метастаз в правой подвздошной мышце.
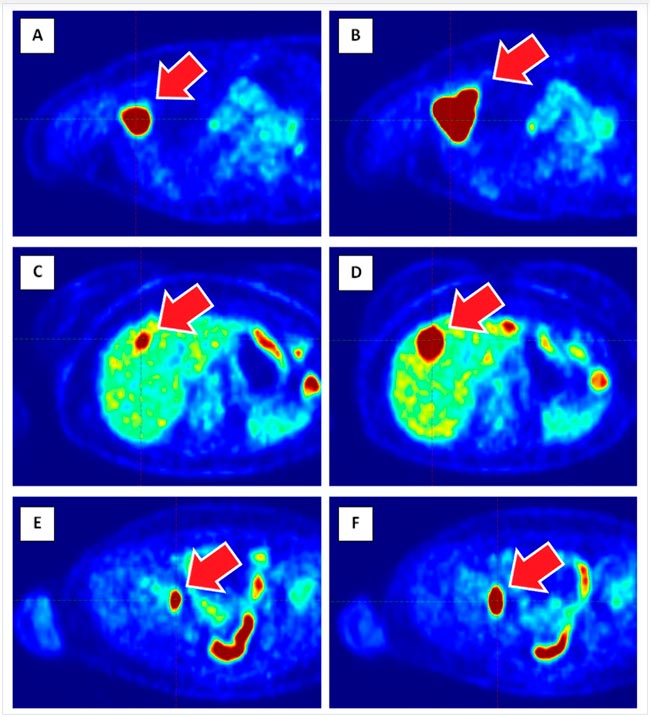
Пациентке продолжена иммунотерапия в прежнем режиме: выполнено еще 5 введений 1 раз в 14 дней. При ПЭТ-контроле 21.12.2023 в сравнении с ПЭТ-КТ от 02.10.2023 отмечен частичный метаболический ответ: уменьшение размеров, активности ФДГ метастатического конгломерата аксиллярных лимфоузлов справа, метастазов легких, печени, селезенки. В дальнейшем пациентке продолжена иммунотерапия пролголимабом. К апрелю 2025 года (42 цикла иммунотерапии) достигнут полный метаболический ответ по данным ПЭТ-КТ. После июня 2025 года по собственному желанию пациентка находится без лечения. В ходе динамического обследования на сегодняшний день сохраняется полный метаболический ответ (последний ПЭТ-КТ от 06.11.2025) (рис.3).
Рисунок 3.
Полный метаболический ответ в динамике ПЭТ-КТ от 27.06.2023 [слева] и ПЭТ-КТ от 06.11.2025 [справа]: А-В – метастазы в подмышечных лимфоузлах справа, С-D – метастазы в печени, Е-F – метастаз в правой подвздошной мышце, G-H – метастаз в правой большой половой губе.
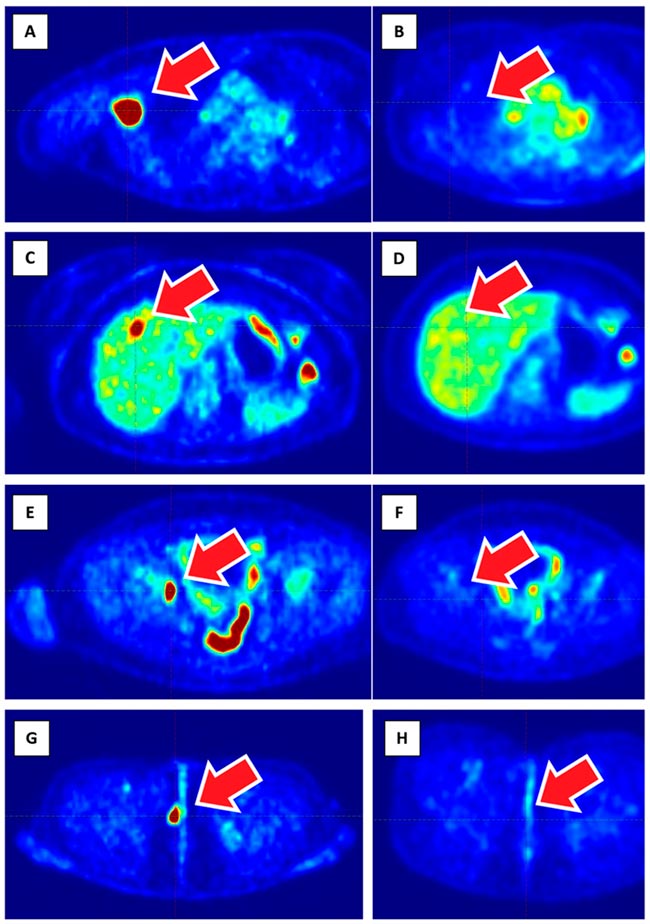
Динамика маркера S100 за период лечения и наблюдения представлена на рис.4. Итого длительность терапии пролголимабом составила 24 месяца (50 курсов), длительность наблюдения со старта лечения составила 27 месяцев. Из нежелательных явлений наблюдался лишь гипотиреоз, послуживший причиной для назначения заместительной терапии левотироксином натрия.
Рисунок 4.
Динамика онкомаркера S100 (нг/мл) на фоне проводимой терапии.
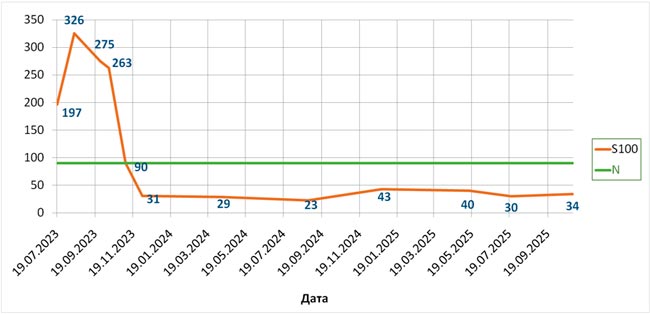
Заключение
- Иммунотерапия пролголимабом – эффективная опция первой линии терапии при BRAF-негативной метастатической меланоме кожи.
- Даже при псевдопрогрессии возможно достижение полного метаболического ответа.
- Приведенное клиническое наблюдение продемонстрировало стойкий полный ответ на иммунотерапию пролголимабом.
- Отмечен минимум нежелательных явлений, не приведших к остановке лечения.
Литература:
- Tjulandin S, Demidov L, Moiseyenko V, et al. Novel PD-1 inhibitor prolgolimab: expanding non-resectable/metastatic melanoma therapy choice. Eur J Cancer. 2021; 149: 222-232. doi: 10.1016/j.ejca.2021.02.030.
- Demidov L, Kharkevich G, Petenko N, et al. A phase III study to access the safety and efficacy of prolgolimab 250 mg fixed dose administered every 3 weeks versus prolgolimab 1 mg/kg every 2 weeks in patients with metastatic melanoma (FLAT). Front Oncol. 2024; 14: 1385685. Published: 2024 Sep 4. doi: 10.3389/fonc.2024.1385685.
- Long GV, Swetter SM, Menzies AM, Gershenwald JE, Scolyer RA. Cutaneous melanoma. Lancet. 2023; 402 (10400): 485-502. doi: 10.1016/S0140-6736(23)00821-8.
- Gordeev A, Vaal A, Puchkova M, et al. Preclinical comparison of prolgolimab, pembrolizumab and nivolumab. Sci Rep. 2024; 14 (1): 23136. Published: 2024 Oct 4. doi: 10.1038/s41598-024-72118-3.
- Орлова К.В., Федянин М.Ю., Симаненков К.Э. и соавт. Финальные данные по эффективности исследования FORA «FOrteca Real practice Assessment»: многоцентровое проспективное наблюдательное исследование эффективности терапии пролголимабом у больных с метастатической меланомой в реальной клинической практике в России. Современная онкология. 2024; 26 (1): 20-34. doi: 10.26442/18151434.2024.1.202617.
- Andabekov T, et al. Replacement of anti-PD-1 drugs with prolgolimab during treatment, safety and efficacy. J Clin Oncol. 2023; 41: e14701-e14701. doi: 10.1200/JCO.2023.41.16_suppl.e14701.
В связи с развитием молекулярногенетической диагностики при злокачественных новообразованиях наблюдается устойчивая тенденция к выбору персонализированного подхода в лечении. За последние 10 лет в таргетной терапии (ТТ) метастатической меланомы с мутацией BRAF достигнуты значительные успехи благодаря появлению на рынке такого класса противоопухолевых препаратов, как BRAF/MEK ингибиторы. Об успехах последних лет в борьбе с меланомой с мутацией BRAF рассказывает врач-онколог, кандидат медицинских наук, Самойленко Игорь Вячеславович, старший научный сотрудник, заведующий отделением опухолей кожи ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
В октябре 2025 года прошел очередной международный онкологический конгресс ESMO в Берлине. Расскажите, пожалуйста, о Ваших впечатлениях о конгрессе. Какие новости по лечению меланомы сейчас обсуждаются больше всего в международном сообществе?
Всегда интересно принимать участие в мероприятиях такого уровня, пусть даже и онлайн (это в значительной степени даже удобнее, чем очно). Уровень международных конгрессов продолжает расти, и это отражает живой интерес профессионального сообщества к обмену опытом и получению данных «из первых рук». Если говорить о лечении опухолей кожи, то на ESMO 2025 прозвучало сразу несколько значимых новостей.
Прежде всего, это дальнейшее развитие клеточных технологий. На конгрессе обсуждали новые подходы к применению инженерных Т-клеток в солидных опухолях, включая меланому; особенно это важно для увеальной меланомы, где терапевтических опций попрежнему крайне мало.
Вторая важная тема — результаты исследования PKC-ингибитора даровасертиба при увеальной меланоме, представленные впервые. Для такой редкой и биологически агрессивной опухоли появление новых таргетных стратегий имеет принципиальное значение.
Третий блок новостей связан с противоопухолевыми вакцинами. Если ещё несколько лет назад mRNAвакцины обсуждались преимущественно как адъювантный подход у пациентов с полностью резектабельными опухолями, то на этом конгрессе были представлены ранние данные об их применении уже на метастатической стадии заболевания, что значительно расширяет горизонты этой технологии.
Отдельно стоит отметить и возобновившийся интерес к онколитическим вирусам. Вирусные платформы, такие как RP1 и другие современные аналоги, вновь обсуждались как перспективный способ локальной иммунной активации с возможностью усиления ответа на иммунные чекпоинт-ингибиторы. Технология по-прежнему находится в стадии активных клинических исследований, но сам факт устойчивого интереса международного сообщества подчеркивает ее потенциал в лечении как кожной, так и акральной меланомы.
Наконец, значимое внимание на ESMO было уделено неоадъювантной иммунотерапии при резектабельной меланоме. Представленные обновленные результаты убедительно показали, что раннее включение иммунной терапии (до хирургического вмешательства) позволяет улучшить долгосрочные исходы, увеличить глубину патоморфологического ответа и сформировать более стойкий противоопухолевый иммунитет и, вероятно, приводит к хорошим отдаленным результатам (их пока ждем). В этой связи роль самостоятельной адъювантной терапии (в том числе при ранних стадиях) для меня остается весьма ограниченной.
По известным причинам российские пациенты сейчас не всегда попадают в международные клинические исследования. Как Вы думаете, можно ли результаты исследований, полученных за рубежом, экстраполировать на популяцию российских пациентов?
Если говорить о крайне редких, орфанных заболеваниях (таких как увеальная меланома), то, действительно, международные данные обычно хорошо экстраполируются на российских пациентов, поскольку биология опухоли достаточно однородна, и крупных различий между популяциями не выявляется. Однако ситуация меняется, когда речь идёт о частых опухолях, например, о кожной меланоме. Здесь, на мой взгляд, необходимость собственных данных значительно выше. Мы знаем, что результаты крупных исследований, таких как CheckMate 067, воспроизводятся неодинаково в разных регионах: показатели общей выживаемости, частоты объективного ответа и длительности ответа в европейских и американских когортах заметно различаются. Данные по азиатской популяции, например, в LEAP003, также существенно отличаются от «западной». Это отражено и в реальной клинической практике, и в регистрах.
Поэтому для таких заболеваний нам важно проводить собственные наблюдательные исследования и строить национальные регистры, которые позволят точно оценить, насколько международные результаты соответствуют данным российской практики. Это критично для понимания эффективности и безопасности терапии, а также для рационального планирования маршрутизации пациентов и выбора оптимальных стратегий лечения.
Была ли на конгрессе ESMO представлена новая информация, посвященная лечению меланомы кожи с мутацией BRAF?
Как известно, во всем мире в лечении меланомы кожи с мутацией BRAF сейчас широко применяются BRAF/MEK-ингибиторы. Данный класс лекарственных препаратов в своё время произвёл революцию в лекарственной терапии метастатической меланомы с мутацией BRAF. С тех пор каждый год на международных конгрессах мы узнаем чтото новое как в отношении BRAF/ MEK-ингибиторов, так и новых лекарственных препаратов.
Сейчас в арсенале онкологов имеются три комбинации BRAF/MEKингибиторов. Чем они отличаются между собой?
Все три комбинации BRAF/MEKингибиторов действуют быстро, и они оказывают клинический эффект у большинства пациентов. Самое главное, что ответ на терапию наблюдается уже в короткие сроки – через 1-2 неделю с момента начала лечения. Можно сказать, что все три комбинации BRAF/ MEK-ингибиторов сопоставимы по своей эффективности. И как раз на ESMO 2025 были представлены результаты ретроспективного анализа данных национального регистра пациентов с метастатической меланомой из Дании. В исследование был включен 751 пациент, все получали комбинации дабрафениба и траметиниба или энкорафениба и биниметиниба. Обе комбинации показали приблизительно одинаковую клиническую эффективность у пациентов с метастатической меланомой с мутацией BRAF. Таким образом, комбинации BRAF/MEKингибиторов отличаются друг от друга по переносимости и профилю безопасности. Например, комбинация энкорафениб и биниметиниб характеризуемся наименьшей частотой кожной токсичности, пирексии и нежелательных явлений со стороны сердечно-сосудистой системы. Поэтому при выборе той или иной комбинации BRAF/MEKингибитора следует обязательно учитывать сопутствующие заболевания у пациента. Например, при наличии сердечно-сосудистых заболеваний у пациента, предпочтение следует отдавать наименее токсичной комбинации – энкорафенибу и биниметинибу.
К сожалению, при применении BRAF/MEK-ингибиторов полного ответа удается достичь не очень большому числу пациентов, и у большинства больных в сроки от 6 до 15 месяцев развивается резистентность к BRAF/ MEK-ингибиторам. На конгрессе ESMO 2025 ряд докладов были посвящены преодолению резистентности к BRAF/MEK-ингибиторам, а также ряду новых методов лечения. Стратегиями преодоления резистентности являются, прежде всего, комбинирование BRAF-ингибитора с другими молекулами (МЕКингибиторами, иммунотерапией), смена комбинации BRAF/MEKингибиторов через какое-то время (речеллендж) и другие опции.
Сейчас проводится несколько клинических исследований по применению комбинаций BRAF/ MEK-ингибиторов с ингибиторами контрольных точек иммунного ответа, в том числе в так называемом режиме «сэндвич», когда на 8-12 недель назначается комбинация BRAF/MEK-ингибиторов, а затем идет переключение на иммунотерапию. Применение режима «сэндвич» показало обнадеживающие результаты, поэтому этот режим был включен в Практические рекомендации ESMO по лечению метастатической меланомы с мутацией BRAF еще в 2024 г. Почему режим «сэндвич» не был включен в Клинические рекомендации МЗ РФ по лечению меланомы?
Я полагаю, что действующие клинические рекомендации уже имеют все необходимые режимы и возможности для последовательного назначения режимов таргетной и иммунотерапии. Клинические рекомендации сегодня – это набор определенных стандартных путей лечения, которые следует применять в лечении пациентов. При этом встречаются разные обстоятельства, и решение о длительности применения той или иной терапии принимает врач (или врачебный консилиум) на основании общего состояния пациента, динамики его заболевания, сопутствующих заболеваний и других факторов. Если Вы считаете, что достигли максимальной клинической пользы от применения той или иной комбинации, Вы вполне можете поменять терапию и назначить другой вариант лечения.
В таком случае, где, по Вашему мнению, находится точка приложения тройной иммунотаргетной комбинации, кто эти пациенты, которые могут получить максимальную клиническую пользу от применения такой комбинации?
На мой взгляд, точка приложения тройной иммунотаргетной комбинации несколько отличается от той, что была показана в клинических исследованиях. В исследованиях продемонстрировано, что наибольшую пользу от такой терапии получают пациенты с хорошим функциональным статусом и сравнительно благоприятным общим прогнозом (мы говорим, в первую очередь, об IMSpire 150 и COMBI-I).
Однако в реальной клинической практике мы сталкиваемся с иной ситуацией. Я считаю, что место тройной комбинации именно там, где вероятность получить вторую линию терапии крайне низка. Речь идёт о пациентах с высокой опухолевой нагрузкой, с быстро прогрессирующим заболеванием, с симптомными метастазами в головном мозге, то есть о тех, для кого временной ресурс критичен и чрезвычайно сжат.
Как правило, таким пациентам мы начинаем лечение с таргетной терапии, но при ее отмене на фоне прогрессирования (или придерживаясь идеологии «сэндвича») далеко не всегда удаётся своевременно перейти на иммунотерапию из-за быстрого прогрессирования. Именно здесь тройная комбинация может дать максимальный клинический выигрыш: она позволяет одновременно контролировать опухолевый рост за счет таргетного компонента, и будет надежда сформировать устойчивый иммунный ответ, что в конечном счете повышает вероятность длительной стабилизации заболевания.
Вы упомянули, что появились еще и другие стратегии лечения меланомы с мутацией BRAF.
Да, действительно, на ESMO 2025 обсуждались новые стратегии лечения меланомы с мутацией BRAF, и здесь стоит отметить важный сдвиг в парадигме. Помимо таргетных малых молекул, которые мы используем уже более десяти лет, на конгрессе были представлены данные о развитии клеточных иммунных технологий, прежде всего TCR-T-терапии. Впервые были показаны результаты применения TCR-T-продукта, нацеленного на антиген PRAME у пациентов с метастатической увеальной меланомой, и это продемонстрировало, что технология может эффективно работать и в солидных опухолях. Именно этот пример стал основой для дискуссий о том, что в будущем подобные платформы могут быть адаптированы и для других молекулярных драйверов, включая BRAF-мутацию в кожной меланоме. То есть сегодня речь идёт не о готовой терапии против мутантного BRAF, а о том, что на ESMO обсуждалась концепция: вместо разработки всё новых таргетных ингибиторов мы потенциально сможем использовать клеточные продукты, направленные на строго специфический опухолевый антиген — фактически обучая иммунную систему пациента избирательно уничтожать клетки с соответствующей мутацией.
Как Вы думаете, сколько лет нам понадобится, чтобы внедрить у нас в стране и поставить на поток такую инновационную клеточную терапию против мутированного белка BRAF?
Пока сказать трудно, но в настоящее время у нас в НМИЦ им. Н.Н. Блохина уже запущен процесс по созданию инфраструктуры клеточной индустрии. Буквально месяц назад была получена лицензия на производство биологических клеточных продуктов для индивидуального применения, и мы можем теперь по клиническому исключению проводить CAR-T-терапию, у нас появилось для этого специальное оборудование. Конечно же, существуют пока некоторые ограничения в виде отсутствия тарифа по данному виду лечения, поэтому государство пока не может определить объем оказания медицинской помощи и его полную стоимость. Также пока не ясно, сколько ресурсов нужно будет потратить на данный вид лечения и какую популяцию пациентов можно будет переориентировать на эту терапию.
Правильно ли я понимаю, что мы идём по пути дальнейшей персонализации в терапии меланомы, когда в будущем лечение для каждого пациента будет подобрано индивидуально?
Да, я бы даже сказал, что мы действительно идем по пути персонализации и индивидуализации терапии для каждого пациента. И не только в отношении CAR-T-терапии. Например, те же мРНК вакцины для профилактических и лечебных режимов вообще производятся строго индивидуально. Но индивидуализация, с другой стороны, замедляет процесс производства и понижает доступность этого вида лечения для населения, потому что производство одной вакцины для одного человека и серии одной и той же вакцины для большого количества людей – это разные вещи. Интересно, что на ESMO уже активно начал подниматься этот вопрос. В частности, были доклады, посвященные созданию так называемых “on shelf” заготовок для ускорения процесса производства индивидуальной клеточной терапии, то есть в будущем мы сможем быстрее создавать подходящий вариант терапии для каждого пациента, используя заранее заготовленные «наборы».
Сейчас много говорят про применение искусственного интеллекта (ИИ) в медицине. Скажите, пожалуйста, можем ли мы рассчитывать на активное использование ИИ в диагностике и лечении меланомы?
Полагаю, что вполне возможно использование ИИ, но пока, в большей степени, в диагностике. Процесс обучения нейросетей визуальной оценке и классификации новообразований кожи можно сравнить с процессом обучения человека. Я даже знаю, что в нашей стране выдано регистрационное удостоверение на компьютерную программу, работающую на основе ИИ, которая без специальной подготовки изображения, т.е. при использовании фотографии, сделанной на камеру мобильного телефона, может классифицировать новообразования кожи как доброкачественные или злокачественные с достаточно высокой степенью достоверности. Данная программа была создана нашими коллегами из Нижнего Новгорода и проходила клинические испытания на базе нашего центра. Сейчас идет активное внедрение этой программы ранней диагностики опухолей кожи в медицинские организации нашей страны, которые не обладают большой возможностью обучать кадры.
Что касается применения искусственного интеллекта в разработке лекарственных средств, то сегодня он используется прежде всего для структурного проектирования молекул — от малых химических соединений до пептидов, антител и неоантигенных вакцин. ИИ позволяет прогнозировать сродство к мишени, иммуногенность, устойчивость пептидов, оптимизировать их структуру, а также ускорять виртуальный скрининг и выявлять потенциальные off-target-эффекты задолго до проведения лабораторных экспериментов. Что касается применения искусственного интеллекта для выбора терапии, то работа в этом направлении ведётся уже много лет, однако на сегодняшний день клиническое мышление врача остаётся решающим. Хорошо известен пример системы Watson for Oncology компании IBM, с которой в начале 2010-х годов связывали большие ожидания. На практике алгоритм формировал рекомендации, которые либо полностью повторяли стандартные клинические руководства, либо не обладали достаточной клинической обоснованностью и не могли конкурировать с реальным врачебным опытом. В результате IBM изменила стратегию и перенесла фокус с «автоматизированного выбора лечения» на разработку инструментов, поддерживающих научные исследования, анализ данных и поиск гипотез.
Подводя итоги, можно выделить три ключевых вектора развития в терапии злокачественных заболеваний кожи:
- Персонализация лечения — от мРНК‑вакцин до клеточной терапии: всё больше подходов строятся на индивидуальной генетической и иммунологической картине пациента;
- Преодоление резистентности — поиск комбинаций (в т. ч. режим «сэндвич») и новых мишеней для BRAF‑мутированной меланомы, чтобы продлить ответ на терапию;
- Цифровизация и ускорение процессов — внедрение ИИ в диагностику и разработку лекарств. Несмотря на очевидный прогресс, остаются важные вызовы:
- Доступность инновационных методов для широкой популяции;
- Интеграция ИИ в рутинную клиническую практику с гарантией безопасности;
- Адаптация международных протоколов к реальным условиям российской онкологической службы.
В целом, конгресс ESMO 2025, как обычно, показал значительные достижения в области мировой онкологии и подчеркнул важность международного сотрудничества и обмена знаниями для улучшения лечения пациентов. Современная онкология кожи движется в сторону персонализированной, точно подобранной, динамичной терапии, где решение принимает врач, опираясь на молекулярные данные, клинические алгоритмы и новые технологические возможности.
Материал подготовлен при поддержке ООО «Пьер Фабр». За информацией обращайтесь по адресу: ООО «Пьер Фабр», 119048, Москва, ул. Усачева, д. 2, стр. 1. Тел.: +7 (495) 789-95-33. Е-mail: info. pfrussia@pierre-fabre.com Информация для медицинских работников. 10-PFM -Nov-2025