
Дорогие коллеги, дорогие друзья!
Российскому онкологическому конгрессу – четверть века! Для крупного научного мероприятия это отличный показатель стабильности и качества. Начиная с онкологической...

Огюст Ренуар. «Танец в Буживале» 1883
Музей изящных искусств, Бостон

Глубокоуважаемые коллеги, дорогие друзья!
В этом году Российское Общество Клинических Онкологов проводит юбилейный XXV Российский Онкологический Конгресс. За 25 лет мы вместе прошли большой, насыщенный и...
РОССИЙСКОМУ ОНКОЛОГИЧЕСКОМУ КОНГРЕССУ 25 ЛЕТ
Главный редактор нашего сайта и газеты Наталья Деньгина попросила поделиться воспоминаниями об организации и первых шагах Российского онкологического конгресса, которому в этом году исполняется 25 лет. Этот проект был инициирован небольшой группой сотрудников тогда еще Российского онкологического научного центра. Назову их...
НАЦИОНАЛЬНАЯ ПРОГРАММА РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ

RUSSCO. 10 ЛЕТ ПОЗАДИ
Стояло жаркое лето 2010 года. Утомленные гости отеля «Мариотт» возвращались с прогулки по Тверской. На 2 этаже гостиницы проходил небольшой экспертный совет, на...

RUSSCO. ВЗГЛЯД ИЗ-ЗА ОКЕАНА
Позвольте рассказать вам, как завязалось мое сотрудничество с RUSSCO около 7 лет назад. История относится к 2014 году, когда я начал работать в отделении радиационной...
ASTRO 2021
Очередной конгресс ASTRO 2021 состоялся в Чикаго в смешанном формате. Похоже, второй год пандемии продемонстрировал нам всем, что совершенно необязательно проделывать огромный путь, чтобы активно принимать участие в мероприятии и даже выступать с лекциями, практически не отрываясь от текущих дел. Конечно, живое общение не заменишь – но есть риск поддаться малоподвижному образу жизни....

И СНОВА О ПАРАСТЕРНАЛЬНЫХ ЛИМФОУЗЛАХ
...Играют ли они какую-либо роль в развитии локальных рецидивов или метастазировании? Нужно ли воздействовать (оперировать, облучать) на парастернальную зону при...

ВСПОМИНАЯ ПРОФЕССОРА ГАРИНА
14 ноября 2021 года Августу Михайловичу Гарину исполнилось бы 90 лет. Сухие строки его автобиографии, свидетельствующие о его огромном вкладе в развитие...

ШКОЛА КЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ

ИЗМЕНЕНИЕ ПАРАДИГМЫ В ЛЕЧЕНИИ МЕСТНОРАСПРОСТРАНЕННОГО НЕМЕЛКОКЛЕТОЧНОГО РАКА ЛЕГКОГО
Рак легкого по-прежнему занимает первое место по заболеваемости и смертности среди онкологических заболеваний и у женщин, и у мужчин в мире. Немелкоклеточный рак...

КАЖДЫЙ ДЕНЬ - НОВЫЙ ШАГ К ПОБЕДЕ

ПО ИТОГАМ МАСТЕР-КЛАССА ESTRO FALCON 2021 ПО СТЕРЕОТАКСИЧЕСКОЙ ЛУЧЕВОЙ ТЕРАПИИ РАКА ЛЕГКОГО
28 сентября и 5 октября 2021 года в онлайн формате состоялся мастеркласс ESTRO FALCON по стереотаксической лучевой терапии рака легкого. Целями мастер-класса, в...

ОБРАЗОВАТЕЛЬНЫЕ ВОЗМОЖНОСТИ ДЛЯ МОЛОДЫХ ХИРУРГОВ-ОНКОЛОГОВ В ОБЛАСТИ ОПУХОЛЕЙ ГОЛОВЫ И ШЕИ
Основными признаками профессионализма врача являются, прежде всего, база медицинских знаний и умение учиться, чтобы поддерживать ее на актуальном уровне, навыки...

ОБНОВЛЕННЫЕ РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ MONARCHE: АДЪЮВАНТНАЯ ТЕРАПИЯ АБЕМАЦИКЛИБОМ В КОМБИНАЦИИ С ГОРМОНОТЕРАПИЕЙ ПРИ РАННЕМ РАКЕ МОЛОЧНОЙ ЖЕЛЕЗЫ ВЫСОКОГО РИСКА РЕЦИДИВА
В ходе пленарного заседания ESMO, которое состоялось 14-15 октября, экспертами клинической онкологии были обсуждены обновленные результаты рандомизированного...
НОВОСТИ КОНГРЕССА ESMO21: ФИНАЛЬНЫЕ РЕЗУЛЬТАТЫ ОБЩЕЙ ВЫЖИВАЕМОСТИ В ИССЛЕДОВАНИИ ARCHES У БОЛЬНЫХ мГЧРПЖ
В течение последнего десятилетия возможности терапии больных метастатическим раком предстательной железы значительно расширились, а онкологические результаты лечения существенно улучшились. Стандартом терапии больных с первично выявленным метастатическим гормоно-чувствительным раком предстательной железы (мГЧРПЖ) или больных, у которых метастазы развились после лечения локализованного...

НЕТ ПРИЧИНЫ ЖДАТЬ. НАЧНИТЕ ЛЕЧЕНИЕ ПРЕПАРАТОМ КСАНДИН
ВЫХОДЯ ЗА ГОРИЗОНТ СОБЫТИЙ: ПРОГРЕСС В ЛЕКАРСТВЕННОЙ ТЕРАПИИ НЕМЕТАСТАТИЧЕСКОГО НМРЛ
Основная цель терапии пациентов с неметастатическим НМРЛ – излечение. Несмотря на многочисленные исследования в течение последних 60 лет, разработка системных методов лечения неметастического НМРЛ была затруднена гетерогенностью этой группы пациентов. Мультидисциплинарное обсуждение стратегии лечения таких пациентов необходимо для того, чтобы определить, какое радикальное лечение можно провести

КОМПАНИЯ "МИРАМЕДИКС" РАЗРАБАТЫВАЕТ ЦИФРОВЫЕ РЕШЕНИЯ ДЛЯ СТАНДАРТИЗАЦИИ ПОРЯДКА ДИАГНОСТИКИ И ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ

КИТРУДА меняет представления о выживаемости

ТЕЦЕНТРИК создан преображать

ОПДИВО + ЕВРОЙ чтобы жить дольше
Анонс
-

9 - 11 НОЯБРЯ 2021
XXV (юбилейный) РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС
Дорогие коллеги, дорогие друзья!
Автор: Н.В.Деньгина,
главный редактор газеты и сайта RUSSCO
Российскому онкологическому конгрессу – четверть века! Для крупного научного мероприятия это отличный показатель стабильности и качества. Начиная с онкологической конференции небольшого формата (120 участников), с поиска новых интересных тем для обсуждения на сессиях, новых лекторов, новых площадок для проведения, преодолевая множество проблем и препятствий, энтузиасты-организаторы конгресса – Сергей Алексеевич Тюляндин, Наталья Юзефовна Сидорова, Марина Борисовна Стенина, Август Михайлович Гарин – с помощью коллег вели конгресс вперед, растили и пестовали, словно любимого ребенка. На следующем развороте этого номера газеты вас ждет более подробный рассказ об этом. Не могу похвастаться тем, что посетила все 25 конгрессов: когда состоялись первые конференции, я лишь делала свои первые шаги в качестве клинического ординатора. В отсутствие интернета в широком доступе новости о планируемых научных мероприятиях доходили не сразу. Но, как говорится, слухами земля полнится, и к началу 2000-х мы все – врачионкологи со стажем и молодняк, преподаватели кафедры онкологии, представители фармкомпаний – стали мечтать о том, чтоб попасть на ежегодную онкологическую конференцию, о которой так много начали говорить! Помню почти благоговейный трепет при вхождении в залы заседаний, красную обивку и деревянные, отполированные сотнями рук, ручки кресел в аудиториях Академии на Юго-Западе. Казалось, в ее переходах можно было заплутаться – таким все казалось масштабным!
Помню, как более опытные коллеги просвещали торжественным шепотом на ухо: вон профессор Гарин пошел!.. а вот профессор Гершанович… Михаил Лазаревич, разрешите с Вами сфотографироваться!.. а во-о-он там – главный организатор, профессор Тюляндин!.. Помню, что лекторская трибуна воспринималась, как Олимп, а каждый всходящий на неё был небожителем! О, скольких известных онкологов приняли гостеприимные трибуны конгресса! Как блистательно эти лекторы умели подавать материал, говорить просто о сложном! Снимков, увы, почти не осталось – но память хранит, словно оттиски и обрывки записей, выступления академика Семиглазова, профессора Имянитова, профессора Давыдова, профессора Моисеенко, столпов российской радиотерапии (тогда еще радиологии) – профессора Голдобенко, профессора Ткачева, профессора Бойко и многих-многих других. И тогда даже в мечтах не было оказаться на этой трибуне самой! Конгресс познакомил нас со многими известнейшими зарубежными онкологами с мировыми именами. Позже, когда конференция уже стала Российским онкологическим конгрессом, когда усилиями организаторов увеличилась его численность и вырос его статус до главного научного онкологического мероприятия года, когда окрепли профессиональные связи - тогда сложились мосты между RUSSCO, основанным в 2011 году, и европейскими и американскими профессиональными онкологическими сообществами – ESMO, ASCO, ESGO, ESO, ESTRO, ASTRO и другими. А главной площадкой для совместных сессий стал опять-таки он – Российский онкологический конгресс. Огромное спасибо первым и последующим организаторам конгресса за саму идею, за упорство и несгибаемость в пути, за высоченный профессионализм в выборе тем и составлении сессий, за то, что для российских онкологов ноябрь теперь всегда ассоциируется с РОК. Спасибо лекторам конгресса за ценнейший материал, который все мы впитывали, запоминали, записывали, сидя в залах – и мечтали когда-то оказаться на трибунах. Спасибо всем прошлым и нынешним участникам конгресса за интерес и приверженность делу, за стремление к профессиональному росту. А всем молодым специалистам – онкологам, хирургам, радиотерапевтам, диагностам, патоморфологам, онкопсихологам и другим – хочется сказать: трибуны Российского онкологического конгресса ждут вас, сегодня, завтра и, надеюсь, всегда!
С юбилеем, РОК!
Н.В.Деньгина, главный редактор
газеты и сайта RUSSCO
Огюст Ренуар. «Танец в Буживале» 1883
Музей изящных искусств, Бостон

Глубокоуважаемые коллеги, дорогие друзья!
В этом году Российское Общество Клинических Онкологов проводит юбилейный XXV Российский Онкологический Конгресс. За 25 лет мы вместе прошли большой, насыщенный и интересный путь от небольшой онкологической конференции до крупного международного форума с участием более 6000 специалистов из различных регионов и стран. Именно благодаря вашим идеям и вашему непосредственному участию в данном мероприятии нам удается сделать его ярким, интересным и запоминающимся событием в жизни профессионального онкологического сообщества. Позвольте поблагодарить каждого из вас за тот неоценимый вклад, который вы вносите в развитие нашей специальности во благо нашим пациентам!
С уважением
и признательностью,
Д.А.Носов, председатель программного комитета Российского Онкологического Конгресса с
2011 по 2020 г.
РОССИЙСКОМУ ОНКОЛОГИЧЕСКОМУ КОНГРЕССУ 25 ЛЕТ
Как это начиналось. Вспоминают С.А.Тюляндин и М.Б.Стенина
Главный редактор нашего сайта и
газеты Наталья Деньгина попросила поделиться воспоминаниями об
организации и первых шагах Российского онкологического конгресса,
которому в этом году исполняется 25
лет.
Этот проект был инициирован небольшой группой сотрудников тогда
еще Российского онкологического научного центра. Назову их имена: недавно ушедший из жизни профессор
Август Михайлович Гарин, Марина
Борисовна Стенина, Наталья Юзефовна Сидорова и ваш покорный
слуга Серей Алексеевич Тюляндин.
Для того чтобы этот проект смог реализоваться требовалось сочетание
нескольких факторов.
После распада СССР и социалистического блока и создания независимых
государств, которых ранее не было
на карте Европы, встала задача их
интеграции в существующие европейские механизмы взаимодействия.
Применительно к онкологической
службе на тот момент имелось явное
отставание в организации оказания
онкологической помощи в ВосточноЕвропейских странах, обусловленное
недостаточной профессиональной
подготовкой кадров, слабым развитием инфраструктуры, минимальным финансированием в связи тяжелым экономическим и финансовым
положением молодых государств.
Европейское общество медицинской
онкологии (ESMO) в те годы возглавлял профессор Хайне Хансон (Копенгаген, Дания), который понимал
необходимость помощи восточно-европейским онкологам в преодолении
этого разрыва и делал для этого все
возможное.
В 1986 году усилиями ESMO по инициативе профессора Хансона был
создан комитет стран Восточной Европы, в который меня пригласили
работать в качестве представителя от
России. Основными задачами Комитета были: создание национальных
онкологических обществ при поддержке ESMO, там где их еще не было,
инициация образовательных программ для практикующих онкологов, организация просветительской
работы с населением, лоббирование
интересов развития онкологической
службы страны. На тот момент Онкологического сообщества в стране
не было. Была Ассоциация онкологов России, объединявшая онкологические учреждения страны, но не
предусматривавшая персонального
членства. Наряду с ощущением необходимости объединения онкологов
страны в единое сообщество было
четкое понимание того, что попытка
создания такого общества по инициативе специалистов, не обладающих бюрократическим весом в онкологической иерархии, может натолкнуться на активное сопротивление власть
предержащих. Поэтому было решено
организовать Российскую группу
членов ESMO, которых к тому времени насчитывалось около 10 человек.
Для работы нам нужна была трибуна.
Так появилась первая предпосылка.
Первые организаторы РОК: Н.Ю.Сидорова (первая слева),
А.М.Гарин (в центре), М.Б.Стенина (вторая справа)

Первые организаторы РОК: С.А.Тюляндин и Н.Ю.Сидорова

Стоит напомнить читателям, что на
тот момент в России не было ни одного онкологического мероприятия,
проводившегося на регулярной основе. Съезды Ассоциации онкологов
России проводились раз в 4-5 лет и
являлись, скорее, событием социальным, нежели научным, и в большей
степени фокусировались на организационных вопросах, чем на проблемах информирования и образования
онкологов. Потребность в ежегодных
мероприятиях объяснялась также начавшимся стремительным развитием
экспериментальной и клинической
онкологии, что требовало интеграции новых знаний в повседневную
клиническую практику, а также формирования мультидисциплинарных
подходов к лечению злокачественных
опухолей. Так возникла вторая предпосылка.
Все это послужило своеобразным
катализатором принятия решения о
проведении конференции на ежегодной основе. Для организации и проведения конференции была создана
автономная некоммерческая организация «Онкоавангард», в которой Наталья Юзефовна Сидорова отвечала
за организационные вопросы, в то
время как три других комиссионера – за научную составляющую программы. Поскольку ESMO объединяло специалистов по лекарственному
лечению злокачественных опухолей,
и в российской группе также были в
основном химиотерапевты (за исключением одного странным образом
попавшего в наши ряды гирудотерапевта), первая конференция была
посвящена исключительно вопросам
лекарственного лечения и называлась
«Современные тенденции развития
лекарственной терапии опухолей».
Она с успехом прошла 9-10 декабря
1997 года в Онкологическом научном
центре при участии примерно 130 специалистов-онкологов.
Оргкомитет конференции
за работой



Конференция
была поддержана фармацевтической
индустрией, научная программа и техническая организация получили высокую оценку. В конференции принял
участие Хайне Хансон, который также
участвовал в официальном собрании
российских членов ESMO и выборе
первого национального представителя России в комитете национальных
представителей ESMO. Работу конференции предварило создание и открытие для публичного пользования
вебпортала RosOncoWeb, который и
по настоящее время остается важным
источником информации, посвященной разнообразным проблемам диагностики и лечения злокачественных
опухолей, а также организационной
платформой проведения Конгресса и
рупором Российского общества клинической онкологии.
Первый позитивный опыт прибавил
нашей маленькой группе энтузиазма,
который оказался отнюдь не лишним
при проведении второй по счету конференции, проходившей в год экономического коллапса в стране. Опыт
предыдущей конференции показал
огромный интерес специалистов различных онкологических дисциплин
к мероприятиям подобного рода.
Именно в связи с развитием мультидисциплинарности наша конференция, первоначально сконцентрированная на вопросах исключительно
лекарственного лечения, уже на следующий год стала рассматривать современные комплексные подходы к
диагностике и лечению онкологических заболеваний.
РОК 1998 (слева направо): проф.М.Л.Гершанович,
проф.С.А.Тюляндин, проф.А.М.Гарин, проф.М.И.Давыдов

На 4-ом году существования конференции количество ее участников
перевалило за 1000, а в 2002 году превысило 2000, в связи с чем Михаил
Иванович Давыдов предложил изменить статус мероприятия и отныне
именовать его Российским онкологическим конгрессом.
Первоначальным местом проведения был Онкологический научный
центр, в котором прошли две первые конференции, однако, по мере
роста количества участников, мы
были вынуждены переместиться на
площадки, способные принять возрастающее количество участников:
сначала это была Академия Государственной службы при Президенте
РФ, затем Центр международной
торговли и, наконец, Выставочный
концертный комплекс Крокус. Единственный раз, на 3-ем году существования, конференция была успешно
проведена за пределами Москвы – в
Санкт-Петербурге, за что выражаем
огромную благодарность Владимиру Михайловичу Моисеенко и его
сотрудникам. С 2011 года права на
организацию и проведение Конгресса перешли от «Онкоавангарда» к
RUSSCO.
Сегодня Российский онкологический
конгресс является одним из наиболее
важных событий в жизни онкологического профессионального сообщества нашей страны и постсоветского
пространства. Ежегодно, до возникновения пандемии, он собирал
на своих заседаниях более 5 тысяч
онкологов и врачей других специальностей. Эта площадка стала местом
получения новой информации, обсуждения мультидисциплинарных
подходов, которые в последующем
оформляются в виде практических
рекомендаций RUSSCO, обмена опытом, встреч с ведущими международными экспертами. В организации
и проведении Российского онкологического конгресса, помимо членов
RUSSCO, принимают участие специалисты ведущих международных и
отечественных профессиональных
онкологических организаций, работающие в федеральных и региональных онкологических учреждениях
нашей страны. Важнейшей задачей
Конгресса является открытие новых
имен, поэтому ежегодно в программе
появляются десятки фамилий молодых онкологов, для которых трибуна
Конгресса является важным этапом
построения профессиональной карьеры: большинство сегодняшних
ведущих специалистов и экспертов
в области онкологии прошли школу
участия в Российском онкологическом конгрессе.
Материалы первых конгрессов

Организаторы и участники конгресса 2000 года

Проведение Конгресса является важным событием и для представителей
фарминдустрии, благодаря которым
в рамках работы Конгресса проводятся сателлитные симпозиумы и
выставка продукции фармацевтических компаний и производителей
медицинского оборудования.
Успех конгресса был бы невозможен без активной поддержки всего
онкологического сообщества нашей
страны. У многих коллег ноябрь в
календаре отмечен как время поездки в Москву для участия в Конгрессе. Хотелось бы поблагодарить вас за
то, что все эти годы вы были вместе
с нами! Успех Конгресса обеспечивается интересной и полезной программой, в подготовке и реализации
которой ежегодно участвует большое
количество специалистов различных
направлений в онкологии. Спасибо
вам за ваше участие и поддержку!
Мы надеемся на продолжение совместной работы!
Лекторы конгресса 2004 года (слева направо): проф.А.М.Гарин,
проф.Парис Космидис (экс-президент ESMO), проф.И.В.Поддубная, проф.Б.К.Поддубный,
аспирант О.Кармановская, проф.Корнелис Пунт (Нидерланды), проф.С.А.Тюляндин.

В организации Конгресса нет мелочей, ибо создание
комфортной и удобной, а сейчас и
безопасной для участников атмосферы является залогом успеха мероприятия. За это огромное спасибо
организаторам – Наталье Юзефовне
Сидоровой, которая на протяжении
первых 15 лет существования Конгресса выполняла эту работу практически в одиночку, и офису RUSSCO,
который организует работу Конгресса на протяжении последних 10 лет!
Надеюсь, что юбилейный 25 Российский онкологический конгресс не
разочарует его участников - очных и
виртуальных!

RUSSCO. 10 ЛЕТ ПОЗАДИ
Автор: Тимофеев Илья Валерьевич,
директор Бюро по изучению рака, Москва
Стояло жаркое лето 2010 года. Утомленные гости отеля «Мариотт» возвращались с прогулки по Тверской. На 2 этаже гостиницы проходил небольшой экспертный совет, на котором обсуждали вопросы тогда еще только появляющейся таргетной терапии, рекомендаций, сообществ. Всё шло обычно и монотонно. Неожиданно слово взял Сергей Алексеевич Тюляндин. Он заявил, что в России нет ни одного профессионального объединения онкологов, занимающихся лекарственной терапией, наподобие ASCO и ESMO. «Такое профессиональное общество крайне необходимо», - сказал Сергей Алексеевич. Этот момент стал отправной точкой создания профессиональной организации, которую теперь мы называем RUSSCO. На Российском онкологическом конгрессе 2010 года прошло установочное заседание, на котором онкологам-химиотерапевтам было предложено создать Межрегиональную общественную организацию «Общество онкологов-химиотерапевтов» (см.фото).

Идея была одобрена большинством голосов; началась юридическая регистрация, формирование совета Правления, офиса. Первая команда офиса состояла из двух человек – меня и Юлии Егоровой – офис-менеджера, а теперь заместителя директора – на хрупкие плечи которой легло всё: от обустройства офиса, взаимодействия с первыми создаваемыми региональными отделениями до раскладывания газет в конверты и организации мероприятий. За это время RUSSCO трижды сменило здания офисов, найдя, наконец, постоянное гнездо на Трубной улице и расширив состав офиса. Сотрудники, которые прошли весь путь вместе с RUSSCO, - Елена Филатова, Анна Плыкина, Наталья Байкова, Анастасия Калаева, - работают в обществе и по сей день. Но не расширение офиса было задачей Общества онкологов-химиотерапевтов. Главной задачей было развитие подходов лекарственной терапии в России. Так, впервые были созданы рабочие группы экспертов и появились ежегодно обновляемые Практические рекомендации RUSSCO – теперь настольная книга онкологов и базис для рекомендаций АОР. Впервые RUSSCO повлияло на формирование списка ЖНВЛП, в который попали такие необходимые препараты, как гефитиниб, цетуксимаб, сунитиниб, сорафениб, пеметрексед, в значении которых сегодня уже не сомневается никто.
Первый офис RUSSCO

Заседание рабочей группы в первом офисе RUSSCO

В то время образовательные мероприятия проводились крайне
редко, и RUSSCO стало первым
обществом, активно проводящим
работу в регионах (до 80 мероприятий в год), инициировавшим
большие профильные конференции с участием 1000 человек и более – по раку молочной железы и
другим опухолям. Для онкологов,
не имеющих возможности выехать на все значимые международные конгрессы, были созданы
конференции «Восток» и «Запад»,
обобщающие результаты главных
событий. RUSSCO задолго до развития онлайн-образования в России первым начало транслировать
свои мероприятия онлайн в виде
вебинаров и записывать видео-лекции, создав, тем самым, крупнейший сегодня архив видео на канале
YouTube c 3.800.422 просмотров!
Особое направление выделилось у
радиотерапевтов – группа INDIGO,
активированная Натальей Деньгиной, Мариной Черных и Тимуром
Митиным. На их школы по оконтуриванию и планированию лучевой терапии порой было нельзя
попасть.
Понимая необходимость расширения знаний, RUSSCO начало тесное
взаимодействие с ASCO и ESMO
– крупнейшими в мире профессиональными сообществами онкологов. И ASCO, и ESMO поддержали
концепцию создания в России национального общества. С тех пор было
реализовано множество инициатив
с международными организациями:
ASCO, ESMO, ESO, ASTRO, Kidney
Cancer Association, MASCC, ESGO,
что сделало RUSSCO узнаваемым не
только в России. Иностранные организации пригласили российское
общество и на свою территорию,
разрешая бесплатно участвовать в
выставках на крупнейших конгрессах и представлять RUSSCO, проводить симпозиумы, входить в состав
журналов.

Тем временем, RUSSCO росло в
количестве членов, региональных
отделений, специальностей, выходя за пределы общества онкологов-химиотерапевтов. В 2014
году произошла трансформация
межрегиональной организации в
Общероссийскую общественную
организацию «Российское общество клинической онкологии», и
RUSSCO действительно стало соответствовать своей аббревиатуре.
Одним из достижений общества
стала программа молекулярногенетического тестирования. В
рамках программы удалось кардинально изменить подходы к
молекулярной диагностике и предоставить доступ к бесплатному тестированию онкологам во всех
регионах. Теперь это воспринимается, как само собой разумеющееся в рамках ОМС, но тогда
пришлось разрушать стандарты,
обучать лаборатории, внедрять
методы тестирования, отрабатывать подходы и логистику. Россия
стала передовой страной в мире,
внедрившей такую программу национального масштаба. В рамках
программы проходили исследования по изучению российских
особенностей – частота мутаций в
российской популяции, охват в условиях такой большой территории
и т.п. Все это научным комитетом
превращалось в отчеты и статьи,
представленные на международных форумах и опубликованные в
значимых журналах. С внедрением
иммунотерапии в нашу практику,
RUSSCO организовало программу
тестирования экспрессии PD-L1,
а также провело исследование по
идентичности клонов - CLOVER
(Клевер) для рака легкого (>6000
прочтений статьи в журнале группы Nature) и исследование для рака
мочевого пузыря, результаты которого были опубликованы в журнале патологов со столетней историей - Virchow Archives.
И, наконец, Российское общество
клинической онкологии сплотило
онкологов в профессиональном
плане, поддерживая как молодых,
так и уже зрелых специалистов.
10 лет – это только начало. Дальнейший путь будет еще ярче.

RUSSCO. ВЗГЛЯД ИЗ-ЗА ОКЕАНА
Автор: Митин Тимур
Университет Здоровья и Науки Орегона, Портленд, США
Позвольте рассказать вам, как завязалось мое сотрудничество с
RUSSCO около 7 лет назад.
История относится к 2014 году, когда я начал работать в отделении радиационной медицины Орегонского университета здоровья и науки.
После прилежной работы в течение
многих месяцев я наконец попросил неделю отпуска, чтобы навестить
родителей в Москве. Мой шеф, само
собой, эту неделю дал, но при этом
попросил узнать, не получится ли
у меня выступить с каким-либо докладом там, в Москве, в течение этой
самой недели. Несколько дней я старательно сдерживал ярость. Выступить в Москве?! Выставить постер
посреди Красной площади и рассказывать проходящим людям о рандомизированных клинических исследованиях, продемонстрировавших
преимущества локального контроля
при добавлении лучевой терапии?!
Отличная идея!! Середина зимы, холод, темень – стопроцентное попадание в каталажку за подозрительную
деятельность!
Но затем я погуглил и обнаружил
существование RUSSCO – Российского общества клинической онкологии. В тот момент я ничего не знал
о нем, лишь позже осознав, что это
крупнейшее профессиональное онкологическое сообщество в России,
созданное преимущественно для
медицинских онкологов, но включающее и хирургов, и радиационных
онкологов, как и ASCO! Сообщество
с хорошей образовательной программой, своим веб-сайтом и своим
журналом, ежегодно обновляемыми
клиническими рекомендациями и,
в чем я смог вскоре убедиться, с невероятно вдумчивым и талантливым
руководством, глубоко уважаемым
не только в России, но и за её пределами, искренне заинтересованным в
улучшении онкологической помощи
в России.
Я отправил письмо по электронному адресу, указанному на вебсайте
RUSSCO, в котором представился
и предложил несколько вариантов
лекций для грядущей конференции
по раку молочной железы как раз в
период моей поездки. Поначалу ответа не было – и я это ожидал. Если
б кто-то вдруг написал в ASCO или
ASTRO, предлагая устную презентацию за месяц до мероприятия, никто
б не принял это всерьез.
Как оказалось, мое послание было
обсуждено, звезды сошлись – и незадолго до отъезда я получил позитивный ответ. В феврале 2015 года
я прочитал свой первый доклад на
RUSSCO об отказе от лучевой терапии у пожилых пациенток с ранним
раком молочной железы. Это было
всего лишь короткое сообщение в
самом конце второго дня конференции, но я был польщен тем, что
до сих пор были посетители. Кроме
того, я сидел в зале во время других
докладов и был приятно удивлен качеством презентаций, уровнем понимания клинических нюансов; я
несколько раз подходил к микрофону после докладов – и осознавал, что
нахожусь здесь не только для того,
чтоб поделиться собственными знаниями, но и пополнить свои!
Мой короткий доклад (а может,
и мои вопросы из зала?), должно
быть, понравился, поскольку организаторы пригласили меня вновь
на ежегодный конгресс в ноябре
2015 года. Именно тогда, на Российском онкологическом конгрессе, мы
впервые обсудили идею подготовки
мастерклассов по оконтуриванию
и планированию лучевой терапии
при опухолях разных локализаций
для российских радиотерапевтов. В
феврале 2016 года состоялся первый
мастеркласс по раку молочной железы, он был невероятно позитивно
воспринят, длился несколько часов –
и мы сразу поняли, что должны продолжать эту работу.
Я невероятно горд и счастлив, что на
эти мастерклассы нам удалось привезти лидирующих экспертов в лучевой терапии из Штатов в Москву.
Этого бы не случилось без моральной
и финансовой поддержки RUSSCO.
Лично я очень многое подчерпнул
для себя из этих мастерклассов и рад,
что российским радиотерапевтам
выпал отличный шанс увидеть, услышать и пообщаться с известнейшими
клиницистами и учеными.
При поддержке RUSSCO мы провели 20 мастерклассов с начала 2016
года, кроме них – еще 3 совместно с
другими организациями, в том числе 2 мастеркласса этого года на базе
одной из клиник в режиме реального времени и на реальном пациенте,
начиная с КТ симуляции и оконтуривания, с планированием и подведением первой фракции облучения
в конце этого же дня.

На нынешнем
Российском онкологическом конгрессе Маша Рейнгольд и я проведем
еще два мультидисциплинарных мастеркласса с участием европейских
лидеров - Piet Ost (Бельгия) по раку
простаты и профессором JJB van
Lanschot (Нидерланды) по раку пищевода.
Готовя мастерклассы, мы также создаем небольшие брошюры – клинические и методические рекомендации – для участников мастерклассов
и их коллег дома. Поскольку конкретных клинических руководств
по практической радиационной онкологии с основами оконтуривания
и планирования в России не было,
они всегда пользовались большой
популярностью, доезжая до клиник в
самых дальних регионах России.
На юбилейном XXV Российском онкологическом конгрессе мы, таким
образом, проведем юбилейный 25
мастеркласс! Мы успели обсудить
основы лучевой терапии практически для всех локализаций опухолей.
Чтобы узнать, насколько эффективны наши мероприятия, мы не раз использовали опросники. Так, в апреле
2017 года при подготовке к мастерклассу по гепатоцеллюлярному раку
мы создали два опросника – один до
и один после мероприятия, - основной целью которых было понять, какие технические возможности имеют
Российские центры для этого метода
лечения, а также оценить влияние
мастерклассов на уровень знаний
участников [1]. Так, участники узнали, что биопсия для постановки
диагноза ГЦР необязательна, вплотную познакомились с практическим
применением для лучевой терапии
шкалы Чайлд-Пью и выяснили, как
нужно планировать облучение с учетом толерантности ткани печени.
В 2018 году подобный опросник
был создан по мышечно-инвазивному раку мочевого пузыря. Я был
удивлен большому количеству российских радиационных онкологов,
которые проводят лучевую терапию
как пациентам-кандидатам на радикальное хирургическое лечение, так
и неоперабельным больным. Мы показали, как лучше проводить отбор
на одновременное химиолучевое лечение. Более важно то, что мы смогли изменить восприятие российских
радиотерапевтов в отношении отдаленных последствий ХЛТ и качества
жизни пациентов, перенесших его,
таких как эректильная функция или
функция самого мочевого пузыря
[2].
В 2016 году на мастерклассе по раку
пищевода мы впервые представили российской аудитории бесплатную интернет-платформу по
оконтуриванию eContour.org. Годом
позже опросник показал, насколько использование этой программы
изменило клиническую практику
врачей-радиотерапевтов: 90% из них
отметили изменения в своих подходах по оконтуриванию, в том числе
органов риска, GTVs и CTVs. Доклад
об этом даже был представлен в устной сессии на конгрессе ASCO 2018
года [3,4]. Доказать, что это лучшим
образом сказалось на качестве лечения российских пациентов, мы не
можем – но мы знаем, что наверняка
так и есть!
При подготовке к конференции
RUSSCO по раку легкого мы создали опросник по лечению больных
НМРЛ III стадии. Это позволило понять, как эти пациенты лечатся в России, и оказалось, что лишь 40% ответивших назначают одновременную
химиолучевую терапию больным с
нерезектабельным НМРЛ III стадии,
а треть респондентов не проводят
ХЛТ вообще, ссылаясь на высокую
токсичность, ослабленное состояние
пациентов и другие причины [5]. Это
отчасти объясняет, почему дурвалумаб в России назначают как после
одновременной, так и после последовательной ХЛТ.
Мы смогли пригласить в Россию на
конференции RUSSCO многих американских и европейских экспертов
– благодаря безоговорочной поддержке руководства сообщества. Как
Познер и Донахью в 1990х годах строили телемосты, так и у нас получилось выстроить мост между ASTRO
и RUSSCO в формате объединённых
сессий, которые стали регулярными с
2018 года. Эти сессии первоначально
были представлены на РОК в Москве,
а затем – на следующий год – транслированы на ежегодных конгрессах
ASTRO в США. Первая совместная
сессия ASTRO-RUSSCO была посвящена паллиативной лучевой терапии
(в Москве её открывала всем известная Нюта Федермессер), вторая – лечению больных с ОГШ в странах со
сниженными ресурсами, ну а третья
состоялась недавно - 25 октября 2021
года - на только что прошедшем в Чикаго ASTRO 2021 и была посвящена
эмоциональным и ментальным нарушениям у онкологических больных
в процессе лечения. Приятно, что нынешний президент ASCO Lorie Pierce
(по специальности – радиационный
онколог) безоговорочно согласилась
участвовать в этой сессии, как в Москве в формате онлайн, так и очно в
Чикаго.
В 2015 году я не мог себе представить,
что моя поездка в Москву к родителям настолько изменит мою жизнь,
познакомит меня с великолепными
врачами, коллегами, которые вскоре
станут моими друзьями. Я выражаю
глубочайшее признание каждому, кто
участвовал во всех наших проектах
на протяжении этих 7 лет – руководству RUSSCO, российским и американским спикерам, членам сообщества и участникам нашей аудитории,
которые проделывали огромный
путь даже из отдаленных регионов
России, организаторам конференций
и пациентам, доверившимся нам на
мастерклассах в реальном формате.
RUSSCO – это самый настоящий маяк
знаний для российских онкологов, и я
невероятно горд и счастлив быть малой частью этой великой миссии.

Источники:
1. Mitin T., Nabavizadeh N., Thomas C.R., Dengina N., Chernich M., Usychkin S., Pankratov A., Likhacheva A., Degnin C., Chen Y., Shirvani S., Gillespie E., Hoffe S., Latifi K., Kharitonova E., Egorova Y., Tsimafeyeu I., Tjulandin S. Radiotherapy for hepatocellular carcinoma in russia: a survey-based analysis of current practice and the impact of an educational workshop on clinical expertise. Journal of Cancer Education. 2020. Т. 35. № 1. С. 105- 111.
2. Mitin T, Dengina N, Chernykh M, Usychkin S, Gladkov O, Degnin C, Chen Y, Nosov D, Tsimafeyeu I, Thomas CR Jr, Tjulandin S. Management of Muscle Invasive Bladder Cancer with Bladder Preservation in Russia: a Survey-Based Analysis of Current Practice and the Impact of an Educational Workshop on Clinical Expertise. J Cancer Educ. 2020 Mar 4.
3. N.Dengina, S.McClelland, M.Chernich, E.F.Gillespie, A.Likhacheva, S.Usychkin, A.Pankratov, E.Kharitonova, Y.Egorova, I.Tsimafeyeu, S.Tjulandin, C.R.Thomas, T.Mitin. Bridging the gap in global advanced radiation oncology training: Impact of a web-based open-access interactive three-dimensional contouring atlas on radiation oncology practice in Russia. Journal of Clinical Oncology 36, no. 15_suppl (May 2018) 11001-11001.
4. McClelland S 3rd, Chernich M, Dengina N, Gillespie EF, Likhacheva A, Usychkin S, Pankratov A, Kharitonova E, Egorova Y, Tsimafeyeu I, Tjulandin S, Thomas CR Jr, Mitin T. Bridging the Gap in Global Advanced Radiation Oncology Training: Impact of a Web-Based Open-Access Interactive Three-Dimensional Contouring Atlas on Radiation Oncologist Practice in Russia. Journal of Cancer Education: the Official Journal of the American Association for Cancer Education. 2019 Oct;34(5):871-873. DOI: 10.1007/s13187-018-1388-7. PMID: 29938298
5. Dengina N, Chernykh M, Degnin
C, Chen Y, Tsimafeyeu I, Karaseva VV,
Tjulandin S, Laktionov K, Thomas CR
Jr, Mitin T. Patterns of Care and Barriers
to Utilization of Definitive Concurrent
Chemoradiation Therapy for Stage III
Non-Small Cell Lung Cancer in Russia.
J Cancer Educ. 2021 Feb 2. doi: 10.1007/
s13187-021-01966-8. Epub ahead of
print. PMID: 33533013.
ASTRO 2021
Очередной конгресс ASTRO 2021 состоялся в Чикаго в смешанном формате. Похоже, второй год пандемии продемонстрировал нам всем, что совершенно необязательно проделывать огромный путь, чтобы активно принимать участие в мероприятии и даже выступать с лекциями, практически не отрываясь от текущих дел. Конечно, живое общение не заменишь – но есть риск поддаться малоподвижному образу жизни.
Несколько новостей от ASTRO 2021
Неоадъювантная химиотерапия стала неотъемлемой частью лечебного плана для большинства больных раком молочной железы. У многих пациенток удается добиться выраженного – вплоть до полного – регресса опухоли. Но вместе с тем подобный сценарий ставит немало вопросов перед радиотерапевтами, один из них: нужно ли облучать пациенток с ранее клинически позитивными лимфоузлами, у которых впоследствии зарегистрирован полный патоморфологический ответ на НАХТ? Экстраполируя результаты более ранних исследований, демонстрировавших преимущества добавления ЛТ на регионарные зоны, многие радиотерапевты предпочитают облучать их при любом поражении независимо от ответа на химиотерапию. Однако ряд ретроспективных исследований также показывает, что риск рецидива при полном ответе даже без облучения невысок. Облучение же, как известно, повышает частоту локальных осложнений – лимфостаз, фиброз, пневмониты. С нетерпением ожидаемое проспективное исследование NSABP B-51 (RTOG 1304), призванное оценить эффект ЛТ у пациенток с полным патоморфологическим регрессом после НАХТ, будет завершено ориентировочно в июле 2023 года. Пока же на конгрессе были представлены предварительные результаты за средний период наблюдения в 24 месяца [1]. Набрана 231 пациентка с клинически позитивными лимфоузлами, у всех после НАХТ и операции диагностирован полный ответ по лимфоузлам. Одной группе пациенток проводилась ЛТ на регионарные зоны (112 больных), другой – нет (119). Рецидивов в области лимфоузлов в обеих группах отмечено не было. Выживаемость без локального прогрессирования была сопоставима: 98,2% в группе ЛТ и 100% в группе наблюдения (р=0,28); выживаемость без отдаленных метастазов – 93,6% против 97,4% (р=0,93) соответственно. Общая выживаемость также не отличалась между группами: 96,3% против 99,1% (р=0,75), причем только возраст моложе 35 лет оказался фактором, ассоциированным с худшей выживаемостью (р=0,03). Данные демонстрируют, что отказ от облучения регионарных зон у пациенток с cN+ и ypN0 после НАХТ не ухудшает отдаленные результаты лечения. Ждем окончательных долговременных данных. В лечении больных рецидивным раком молочной железы – после резекции или мастэктомии – крайне необходим строго индивидуальный подход. Помимо системного лечения в большинстве случаев заходит речь об облучении, но при этом многие пациенты ранее уже получали лучевую терапию при первичном лечении, и возможности повторного облучения, увы, уже ограничены. При этом ряд исследований демонстрирует, что повторная сальважная лучевая терапия возможна как после органосохраняющего лечения (вариант парциального облучения), так и после мастэктомии. В подобных ситуациях оптимальным вариантом выбора являются протоны. На ASTRO 2021 представлены результаты по сальважной протонной ЛТ при рецидиве РМЖ, и пока это самая многочисленная серия данных по этой проблеме. Исследователи из Memorial Sloan Kettering Cancer Center, New York Proton Center (MSKCC/NYPC) и ProCure Proton Therapy Center, Нью Джерси, проводили протонную ЛТ 46 пациенткам с рецидивом РМЖ, причем у 17,4% облучалась молочная железа, у 28,3% – грудная стенка без реконструкции, а у 43,5% – грудная стенка после реконструкции; у 11% облучались только рецидивы в области регионарных лимфоузлов. Средняя доза ЛТ при повторном облучении составила 50,4 Гр, а кумулятивная доза достигала 109 Гр (в перерасчете на 2 Гр). За средний период наблюдения 21 месяц после сальважной ЛТ не было зафиксировано ни локальных, ни регионарных рецидивов. Не обошлось без осложнений: ранняя токсичность 3 степени была представлена только дерматитом у 30% больных. Из поздних осложнений 3 степени отмечены капсулярная контрактура у 3 пациенток и боль у одной. Эти предварительные данные демонстрируют логику применения протонного облучения у пациенток с рецидивами с хорошей толерантностью и отличным локальным эффектом [2]. Определение оптимальной последовательности для иммунотерапии при местнораспространенном неоперабельном немелкоклеточном раке легкого (НМРЛ) остается открытым вопросом. Обновленные данные исследования PACIFIC сообщали о беспрецедентной пятилетней общей выживаемости 33,1% при НМРЛ 3 стадии при консолидации дурвалумабом после химиолучевой терапии. Однако в реальных условиях частота прекращения приема дурвалумаба из-за побочных эффектов составляет 16,7% [3]. Кроме того, недавний многоцентровой голландский анализ из реальной практики показал, что только 57% пациентов получали адъювант дурвалумаб при НМРЛ 3 стадии [4]. Задача по увеличению пропорции пациентов, получающих иммунотерапию, продолжает быть актуальной. Именно в этом контексте исследователи из H. Lee Moffitt Cancer Center изучали комбинацию ипилимумаб (anti-CTLA-4) в сочетании с химиолучевой терапией с последующей консолидацией ниволумабом (анти-PD-1) [5]. По данным, полученным на доклинической модели на мышах, комбинация была приемлемой, при этом 3% мышей умерли от одновременной ЛТ на грудную клетку и анти-PD-1 терапии. В этом исследовании, представленном на ASTRO 2021, пациенты с НМРЛ 3 стадии получали химиотерапевтический дублет на основе платины с одновременной лучевой терапией до 60 Гр за 30 фракций в течение шести недель и двумя дозами IPI (1 мг/кг) в 1 и 4 недели с последующим поддерживающим лечением – 12 циклов ниволумаба каждые четыре недели (480 мг). Основными конечными точками были безопасность и переносимость режима (фаза I) и ВБП за 12 месяцев (фаза II). Исследование было прекращено досрочно, так как у 19 из запланированных 55 пациентов была превышена граница токсичности. Частота пневмонитов 2+ степени через 6 и 12 месяцев составила 57% (ДИ 30-84) и 74% (ДИ 49-99) соответственно. Пять пациентов (26%, ДИ 6-46) имели токсичность 5 степени, вероятнее всего, связанную с лечением, включая трех пациентов с легочной токсичностью 5 степени (16%, ДИ 0-32). Какой-либо связи средней дозы на легких или показателя V20 с повышенной токсичностью отмечено не было, что позволяет предположить, что столь негативные события были вызваны в первую очередь иммунотерапией. Ранее в исследовании ETOP-NICOLAS сообщалось о девяти пациентах (11,7%) с пневмонитом 3+ степени и семи (6%) случаях токсичности 5 степени, связанных с лечением при химиолучевой терапии с одновременным и адъювантным ниволумабом у больных НМРЛ 3 стадии [6]. Таким образом, применение комбинации ипилимумаба и ниволумаба может оказаться слишком опасным в сочетании с химиолучевой терапией. Основной вывод исследования: следует тщательно изучить альтернативные стратегии или последовательности для интеграции иммунотерапии с цитотоксической химиотерапией и лучевой терапией для пациентов с неоперабельным НМРЛ 3 стадии. И, похоже, придется проделать большую работу для оптимизации результатов у этих больных в эпоху иммунотерапии. Зато появились неплохие новости в отношении лучевой терапии олигометастатического НМРЛ. Ранее исследование SABR-COMET продемонстрировало преимущество общей выживаемости при консолидированной стереотаксической абляционной лучевой терапии тела по сравнению со стандартной паллиативной лучевой терапией у пациентов с олигометастатическим заболеванием и контролируемым первичным процессом. В SABRCOMET 3 из 66 участников (4,5%) в группе SABR погибли по причине проводимого лечения (токсичность 5 степени), что, по мнению многих, было неожиданно высокой токсичностью для абляционной лучевой терапии. Таким образом, исследование SABR-5 было разработано с основной целью – установить более точные критерии токсичности при подготовке к возможной фазе III рандомизированных исследований. SABR-5 – это популяционное однорукавное исследование II фазы по проведению стереотаксической аблативной лучевой терапии на все очаги у пациентов с пятью олигометастатическими или олигопрогрессивными поражениями и контролируемой первичной опухолью [7]. Было включено 399 пациентов (что превышает первоначальную цель набора – 200 участников). Первичной конечной точкой была токсичность с априорным определением, что SABR клинически безопасна, если риск токсичности 3 степени не превышает 25%, риск токсичности 4 степени – до 10% и риск токсичности 5 степени – до 5%. Основными критериями включения были контролируемая первичная опухоль, ECOG 0-2 с ожидаемой продолжительностью жизни более шести месяцев и наличие отдаленных метастазов (включая головной мозг) в количестве 5 и менее, которые были расценены как безопасные для облучения. В зависимости от анатомического расположения использовались стандартные режимы абляционных доз. Ограничения по дозам для органов риска (OAR) имели приоритет над охватом PTV. Средний срок наблюдения составил 28 месяцев. Девятнадцать пациентов не получили SABR после включения в исследование (окончательное число включенных для анализа больных – 380). Наиболее частыми локализациями опухолей были рак простаты (32%), колоректальный рак (14%), рак молочной железы (11%), рак легких (9%) и рак почек (9%). Количество очагов, подвергнутых SABR, составляло один (69%), два (22%) и три или более (9%). Наиболее частыми мишенями для SABR были очаги в легких (33%), костях вне позвоночника (28%), позвоночнике (14%), лимфатических узлах (13%), печени (5%) и надпочечниках (3%). На ASTRO 2021 были представлены обновленные данные о токсичности. Частота осложнений составила: 2 степени – 14,2% (n=54), 3 степени – 4,2% (n=16), 4 степени зафиксировано не было и 1 пациент погиб (0,3%) по причинам, связанным с лечением. Токсичность 3 степени и более чаще всего включала: 1,3% – боли, 1,1% – переломы позвоночника, 0,3% – диарея и другие проявления, включая тошноту/ рвоту, стеноз желчных протоков, желтуху, утомляемость, асцит и гидронефроз. Переломов ребер 3+ степени, невропатий, желудочно-кишечных свищей, перфораций, кровоизлияний или пневмонитов не было. Единственное осложнение 5 степени среди 380 больных возникло у пациента, облучавшегося по поводу двух метастазов колоректального рака в печень, который получал 54 Гр за 3 фракции. Один из очагов был в воротах печени. Через пятнадцать месяцев после SABR пациенту потребовалось вмешательство по поводу стеноза желчных протоков, что могло быть связано с прогрессированием заболевания или токсичностью SABR. Смерть пациента произошла непосредственно из-за рецидивирующих инфекций, вызванных холангитом, и была оценена комитетом по токсичности как «возможно связанная» с SABR. Независимая внешняя экспертиза, проведенная специалистами по инфекционным заболеваниям, свидетельствует в пользу смерти, связанной с инфекциями, связанными с оттоком наружных желчевыводящих путей. В целом SABR-5 демонстрирует отличные результаты для пациентов с олигометастатическим заболеванием, подтверждая меняющийся ландшафт лечения рака благодаря достижениям во всех областях радиационной онкологии. ОВ после SABR на олигометастазы составила 93% за 1 год, за 2 года – 84%, за 3 года – 76% и 70% общей выживаемости за 4 года. Авторы приходят к выводу, что тщательно спланированная SABR на олигометастазы относительно безопасна, с весьма умеренной токсичностью. Это поддерживает дальнейшее проведение рандомизированных исследований фазы III, таких как SABR-COMET-3 и SABR-COMET-10. Однако токсичность SABR для метастазов в печени и надпочечниках требует осторожности и дальнейшего изучения. В будущих исследованиях следует продолжить изучение токсичности, учитывая относительно длительную общую выживаемость этой популяции больных. SABR-5 – действительно знаковое исследование, которое подчеркивает первостепенную роль лучевой терапии в лечении пациентов с метастатическим заболеванием и пополняет список литературы, в которой предпочтение отдается использованию SABR по сравнению с традиционными сугубо паллиативными подходами. Конгресс ASTRO 2021 примечателен еще и тем, что продемонстрировал: совместная сессия двух профессиональных сообществ – ASTRO и RUSSCO – становится регулярной и традиционной. В 2019 году, еще до пандемии, состоялась первая подобная сессия на крупнейшем конгрессе по радиационной онкологии в мире, она была посвящена различным аспектам паллиативной лучевой терапии. В 2020 году конгресс проходил в онлайн-формате, и наша вторая совместная сессия была посвящена лечению больных с опухолями головы и шеи в условиях стран со сниженными ресурсами. Наконец, третья сессия состоялась 25 октября в смешанном формате. Часть докладчиков, включая нынешнего президента ASCO Lorie Pierce, профессора Alphonse Taghian из Медицинской школы Гарварда и председателя сессии Тимура Митина, находились в зале центра McCormick в Чикаго, остальные присутствовали онлайн – William Pirl, онкопсихолог из Онкологического центра Dana Farber, Dan Spratt из Seidman Cancer Center Case Western Reserve University, со стороны RUSSCO – Наталья Деньгина в качестве докладчика и Марина Черных как модератор. На первый взгляд, тема сессии не имела непосредственного отношения к лучевой терапии, поскольку была посвящена вопросам эмоциональных и ментальных нарушений у онкологических больных в процессе лечения. Но лекторы продемонстрировали, что этой проблеме в мире уделяется немалое внимание, многочисленные крупные популяционные исследования демонстрируют: у пациентов с нарушением психоэмоционального состояния без необходимой коррекции хуже результаты лечения, более высок риск прогрессирования. Особенно это касается пациентов с опухолями простаты и молочной железы. Онкопсихологи должны быть в штате каждого онкологического центра, и, увы, в России эта проблема остается без внимания и, соответственно, без решения. Помощь онкопсихологов (или обычных психологов) оказывается спорадически, ограниченно и географически неравномерно. Если в Санкт-Петербурге есть своя школа, то во многих других, даже крупных городах онкопсихологи отсутствуют вообще. К этой теме стоит вернуться отдельно. В любом случае, можно с уверенностью сказать: к юбилею RUSSCO и Российского онкологического конгресса связи между двумя профессиональными сообществами окрепли, и сотрудничество выглядит многообещающим. На юбилейном XXV конгрессе состоится уже четвертая совместная сессия ASTRO-RUSSCO, посвященная проблеме применения лучевой терапии у больных НМРЛ с метастазами в головной мозг в эпоху таргетной и иммунотерапии.
Источники указаны на сайте:
https://www.rosoncoweb.ru/news/
oncology/2021/10/28/
И СНОВА О ПАРАСТЕРНАЛЬНЫХ ЛИМФОУЗЛАХ
Автор: Деньгина Наталья Владимировна
ГУЗ «Областной клинический онкологический диспансер», Ульяновск
...Играют ли они какую-либо роль
в развитии локальных рецидивов
или метастазировании? Нужно ли
воздействовать (оперировать, облучать) на парастернальную зону
при инвазивном раке молочной
железы? Эти вопросы стоят перед
научным онкологическим сообществом и практикующими врачами
уже не одно десятилетие.
Согласно данным лимфосцинтиграфии, основной отток лимфы от
всех квадрантов молочной железы
идет в подмышечные лимфоузлы
(около 85%), на парастернальные
приходится около 15%, а надключичные лимфоузлы принимают
лимфу из всех зон. Считается, что
при внутренней или центральной
локализации опухолей идет прямое дренирование непосредственно в парастернальные лимфоколлекторы в 44% случаев [1]. Но даже
при позитивных сигнальных подмышечных лимфоузлах далеко не
всегда эта зона оказывается вовлеченной, лишь в 8-27% [2]. Однако
по данным, полученным в целой
серии исследований (более 5000 пациентов), в том числе проспективных, по проведению расширенной
мастэктомии с парастернальной
лимфодиссекцией, частота поражения парастернальных лимфоузлов
строго ассоциирована с поражением подмышечных лимфоузлов
и может достигать чуть ли не 52%
при позитивных лимфоузлах подмышечной зоны с преимущественным поражением коллекторов первых 2 межреберий [3] – но имеет ли
такая высокая частота вовлечения
какое-либо клиническое значение?
Данные 3 рандомизированных
исследований по сравнению результатов радикальной мастэктомии по Холстеду с расширенной
мастэктомией (с удалением парастернальных лимфоузлов), опубликованные в 1980-90-х годах, не
выявили каких-либо преимуществ
расширенной операции, после чего
подобный подход был практически
полностью забыт [2]. В настоящее
время нет никаких рекомендаций
в отношении того, что мы должны
совершать диагностический поиск
для выявления парастернальных
лимфоузлов (проводить КТ грудной клетки, прицельную биопсию,
ПЭТ, лимфосцинтиграфию парастернальной зоны и т.д.). Отношение к профилактическому воздействию (облучению) на внутренние
грудные лимфоузлы также долгое
Продолжение на стр.8
И СНОВА О ПАРАСТЕРНАЛЬНЫХ ЛИМФОУЗЛАХ
время оставалось прохладным.
Одно дело, если имеются веские
данные о метастатическом поражении этой зоны, полученные каким-либо методом визуализации
или подтвержденные биопсией:
тогда это реальная опухоль, теоретически и потенциально способная к росту и метастазированию. Другое дело, если облучать с
профилактической целью, держа
в голове возможность наличия
микрометастазов в парастернальных лимфоузлах, то есть некое
опасение, что эти лимфоузлы без
какого-либо локального воздействия станут причиной большой
катастрофы. Основные выводы
многих исследований 1980-2000-х
годов по облучению парастернальной зоны сводились к следующему:
эффект воздействия сомнителен,
а вот грань между возможным
выигрышем и риском осложнений слишком тонка. И лишь преимущественное применение более
старых технологий не позволяет
причислить подобные работы к
числу весомых, учитывающих все
нынешние реалии (биологические
подтипы опухоли, лекарственная
терапия и т.д.). Тем не менее, в рекомендациях крупных онкологических сообществ на рубеже веков
конкретной информации о том,
как действовать в отношении парастернальных лимфоузлов, не было.
Эксперты предлагали практикующим врачам решать самостоятельно, возможно, ориентируясь на
собственный опыт или традиции
центра.
Традиции оказались разнообразны,
как следует из результатов опроса
Taghian et al. 2004 года [4]. Практикующим специалистам – радиационным онкологам – из Европы (435
респондентов) и Северной Америки (702) было предложено ответить
на вопросы о показаниях к облучению парастернальной зоны при
разных клинических сценариях –
после мастэктомии или резекции,
с 1-3 пораженными лимфоузлами
или 4 и более, с наличием экстракапсулярной инвазии или без нее.
Оказалось, что подходы значительно различались даже в пределах Европы: так, если во Франции
и Бельгии парастернальная зона
включалась в объем облучения
практически во всех ситуациях, то
в Великобритании – почти никогда.
Ориентироваться, кто из них более
прав, было невозможно. На курсах
по доказательной радиационной
онкологии от ESTRO в качестве
очевидных представляли следующие факты:
проспективные рандомизированные исследования не выявили преимуществ в выживаемости при парастернальной лимфодиссекции;
• при проведении адъювантной
химиотерапии риск рецидива,
особенного изолированного,
во внутригрудных лимфоузлах
низок;
• облучение ассоциировано с повышенным риском пневмонитов
и поздней кардиоваскулярной
смертности;
• облучение парастернальных
лимфоузлов показано при подтверждении наличия метастазов
в них после биопсии, а также,
возможно, пациентам с медиальной и центральной локализацией
опухоли и поражением подмышечных лимфоузлов (NCCN).
Решение на протяжении десятилетий было отдано на откуп радиотерапевту, призванному тщательно
взвешивать все за и против, все
риски и преимущества – однако,
согласитесь, имея столь зыбкие
основания из доказательной базы,
сложно иметь четкие ориентиры.
Вот поэтому так сильно ожидались
исследования, способные оценить
вклад облучения парастернальной
зоны в отдаленные результаты лечения больных с инвазивным раком молочной железы.
Они появились практически одновременно, в начале прошлого десятилетия, вот только публикации
несколько припозднились. Дизайн
канадского исследования МА20 и
европейского EORTC 22922/10925
[6,7] был схож: пациентки после
органосохраняющей операции
или мастэктомии и адъювантного
лекарственного лечения рандомизировались в группу расширенного облучения (молочная железа/
грудная стенка + надподключичные и парастернальные лимфоузлы) или лучевой терапии только
на молочную железу или грудную
стенку. Авторы французского исследования [7] отнеслись более
избирательно к проблеме выбора
предмета рандомизации: сравнение
проводилось между группами, где
в поле облучения включались либо
грудная стенка и надключичные
лимфоузлы, либо добавлялось еще
и парастернальное поле. Вскоре после публикации результатов этих
исследований появился и их метаанализ – настолько долгожданны
они были [8].
В итоге канадское и европейское
исследования продемонстрировали
схожие результаты – преимущество
добавления облучения зон лимфоузлов: плюс 3-5% к выживаемости
без прогрессирования, плюс 3-4% к
выживаемости без отдаленных метастазов и тенденция (без достижения достоверности) к улучшению
общей выживаемости (+1-1,6%).
Французское исследование какихлибо преимуществ избирательного
добавления парастернального поля
не выявило. Тем не менее, метаанализ трех исследований торжественно присудил победу расширенному
облучению региональных зон: ВБП
HR 0,85, выживаемость без отдаленных метастазов HR 0,82, OВ HR
0,88. Однако, когда отзвучали аплодисменты, появились вопросы и сомнения, да немало.
Самое главное: разница в результатах была действительно невелика
(3-5%). В любых иных ситуациях
даже большая разница могла бы
быть расценена как «отсутствие
различий». Влияние на ОВ не доказано (+1-1,6% без достижения
достоверности). По данным исследований МА20 и EORTC было
невозможно оценить, за счет чего
случился выигрыш, какая зона облучения внесла наибольший вклад
в улучшение показателей – именно
парастернальная или все же надключичная, или обе вкупе. В канадском исследовании МА20 среди
всех больных с развившимся регионарным рецидивом 63% рецидивов
зарегистрированы в подмышке и
27% – в надключичной зоне. Ни одного рецидива в парастернальной
зоне не было отмечено, несмотря на
то, что подавляющее большинство
пациентов имели N+ (90%). В исследовании EORTC 22922 частота
рецидивов в парастернальных лимфоузлах как была низкой без облучения (0,8%), так и осталась таковой после лучевой терапии (0,2%).
Если предположить, что расширение объемов облучения имело бы
выигрыш у больных с большим
размером первичной опухоли и
более массивным поражением лимфоузлов (а следовательно, и более
высоким риском метастазов в парастернальной зоне), то результаты
EORTC не поддерживают данную
мысль. Чем больше была первичная
опухоль, чем массивнее поражение
лимфоузлов, тем меньше отмечено
пользы от облучения регионарных
зон; очевидно, отнюдь не лучевая
терапия играет первую скрипку в
подобных ситуациях, а лекарственное лечение. Наконец, отсутствие
преимуществ добавления парастернального поля во французском
исследовании оставляет осадок неудовлетворенности. Тем не менее,
в рекомендациях NCCN 2016 года
появилась обтекаемая фраза «если
есть показания к облучению, то рекомендовано рассмотреть необходимость добавления парастернального поля». При этом большинство
экспертов St.Gallen 2015 года попрежнему не рекомендовали облучение парастернальной зоны.
Пока продолжалось бурное обсуждение результатов трех исследований, по отдельности и совокупно,
сомнения в отношении вклада парастернальной зоны в общее дело
улучшения результатов оставалось
у многих. Итальянские авторы
Dellapasqua et al. в своем ретроспективном анализе сопоставили
результаты лечения 107 больных с
верифицированными метастазами
в надключичных (n=42) либо парастернальных (n=65) лимфоузлах с
основной целью: оценить прогностическое значение данных клинических ситуаций в схожих когортах
пациентов, но без подтвержденного
поражения этих зон лимфоузлов
[9]. Больные были хорошо распределены в группы по возрасту, TNM,
стадии процесса, даже по биологическим подтипам (большинство
имели люминальные раки), все они
получали стандартное лечение, в
том числе и лучевую терапию на
региональные зоны (она была проведена у подавляющего большинства пациенток).
Даже будучи ретроспективными,
данные оказались весьма показательными. Пятилетняя ВБП составила 84% в группе с метастазами в
парастернальных лимфоузлах против 38,8% у пациентов с вовлечением надключичной зоны (P<0,0001),
а 5-летняя общая выживаемость
оказалась почти вдвое лучше –
96,9% против 57,1% (P<0,0001).
При этом никакой разницы в отдаленных результатах между пациентами с верифицированными
метастазами в парастернальных
лимфоузлах и без оных не отмечено (5-летняя ОВ 96,9% против
93,5%, P=0,897; 5-летняя ВБП 84%
против 76,5%, P=0,729; локорегиональные рецидивы за 5 лет – 6,2%
против 5,1%, P=0,801; частота отдаленных метастазов за 5 лет 6,7%
против 12,8%, P=0,423), тогда как в
случае с надключичной зоной эта
разница была значительна и часто
достоверна (5-летняя ВБП 38,8%
против 58,9%, P=0,041; ЛРР за 5 лет
22,6% против 8,6%, P=0,048), тренд
в сторону различий в 5-летней ОВ
(57,1% против 78%, P=0,068) и кумулятивной частоте отдаленного
метастазирования за 5 лет (32,9%
против 24,9%, P=0,511). Основной
вывод, сделанный авторами, –
именно вовлечение надключичных
лимфоузлов коррелирует с худшим
прогнозом в отличие от поражения
парастернальной зоны.
Но в 2016 году явились датчане
со своим новым видением того,
быть или не быть облучению внутренних грудных лимфоузлов, и
со своим элегантным дизайном
проспективного популяционного исследования: пациенткам с
правосторонней локализацией
опухоли проводилось облучение
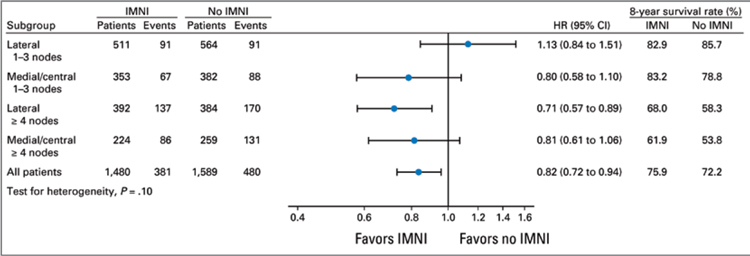
парастернальной зоны, а с левосторонней – нет [10]. Основными конечными точками были общая выживаемость, раково-специфичная
смертность и частота отдаленных
метастазов. В отличие от исследования EORTC, где почти половина
больных имели N0, все пациенты
из датского DBCG-IMN (n=3086)
имели N+, а медиальные или центральные локализации опухоли отмечены более чем у 1/3 пациенток.
И датчанам впервые удалось достичь статистически достоверного
улучшения ОВ за 5 лет при облучении парастернальной зоны (75,9%
против 72,2%) и снижения раковоспецифической смертности (20,9%
против 23,4%). При этом подгрупповой анализ показал, что наибольшее значение облучение имеет
в случае медиальной/центральной
локализации опухоли в сочетании с N+, а также при латеральной
локализации при поражении 4 и
более лимфоузлов. Для наиболее
частой клинической ситуации –
латеральная опухоль, N1 – добавление парастернального поля не
давало преимуществ (рис.1).
Рисунок 1.
Подгрупповой анализ исследования DBCG-IMN.
Несмотря на столь небольшую разницу в результатах (приблизительно в 3%), мнение экспертов NCCN и St.Gallen к 2017 году изменилось. St. Gallen 2017: было рекомендовано рассмотреть отказ от облучения регионарных зон при N1 и отсутствии отягощающих факторов риска – и облучать при их наличии (возраст 40 лет и менее, низкая экспрессия ЭР и ПР либо рецептор-негативные опухоли, G3, обширная лимфоваскулярная инвазия) и >3 позитивных л/узлов. NCCN 2.2017: показано облучение региональных зон при 4 и более позитивных лимфоузлах (включать парастернальную зону!), рассмотреть необходимость их облучения при 1-3 лимфоузлах (включая парастернальную зону) и при N0 – рассмотреть необходимость региональных зон при медиальной/ центральной локализации опухоли. Однако сомнения оставались. К примеру, если пристально рассмотреть технические аспекты лучевой терапии всех 4 исследований, то можно отметить: все они имеют технические различия в отношении объемов мишени (в частности, в МА20 облучали 1-3 межреберные промежутки, тогда как во французском – с 1 по 5), методик планирования и облучения (только 2D в EORTC и французском и 3D в МА20; в датском допускалось и то, и другое) и т.д. Ни в одном из исследований не применялась 3D конформная лучевая терапия. Анатомия парастернальных лимфоузлов вариабельна, поэтому 2D планирование считается неэффективным. Нет гарантии, что все парастернальные лимфоузлы полностью покрывались предписанной дозой. Практически во всех исследованиях допускалось подведение 80-85% от предписанной дозы вместо классических 95%. Учитывая вариации в дозах (от 45 Гр за 18 фракций 4 дня в неделю из французского исследования до более стандартных 50 Гр за 25 фракций из EORTC и МА20), можно предположить, что доза на парастернальной зоне могла быть гораздо ниже представляемой, тем более что ее покрытие могло быть весьма вариабельно при разной толщине грудной стенки, особенно в условиях несовершенного 2D планирования. Так, исследование 2004 года по лимфосцинтиграфии парастернальных лимфоузлов с изучением степени их покрытия при облучении тангенциальными полями показало, что при толщине престернальной клетчатки ≤10 мм они как минимум частично покрыты в 100% случаев, тогда как при толщине >10 мм частичное покрытие отмечено лишь в 60% случаев [11]. Если предположить, что выигрыш в отдаленных показателях был достигнут даже при подведении неполных доз на парастернальные лимфоузлы, возможно, им и не надо много? Каждый радиотерапевт и медицинский физик представляет себе, что и обычные тангенты на грудную клетку или молочную железу частично покрывают парастернальную зону. Бразильские авторы в 2016 году провели оценку средних «случайных» доз на внутренних грудных лимфоузлах при 2D и 3D планировании облучения после мастэктомии без добавления отдельного парастернального поля и выяснили, что при 2D планировании случайная доза составляет 7,93 Гр, а при 3D – 20,64 Гр [12]. Многие практикующие специалисты называли и большие дозы в этой зоне, вплоть до 30-36 Гр, хотя до сих пор неизвестно, играет ли величина дозы какуюлибо роль для парастернальных лимфоузлов. Возможно, есть чтото, что мы пока не знаем о них. Возможно, их природа, их биология отличаются от биологии лимфоузлов других зон совершенно иной, более индолентной способностью – не накапливать и взращивать метастазы и отправлять их в свободное плавание, но кумулировать метастатические клетки и оставлять их при себе. В любом случае, по данным исследования EORTC 22922 риск рецидива в парастернальной зоне был крайне низок – 0,8% даже без облучения, а по данным крупного исследования Chen et al. 2010 года с включением почти 9 тысяч пациенток, рецидивы с поражением внутренних грудных лимфоузлов отмечены в 1,5% случаев, а рецидивы в них в качестве 1 очага были почти казуистичны – 0,5%, и прогноз у этой группы больных при отсутствии других очагов метастазирования был хорошим [13]. Упорные попытки подвести стандартные послеоперационные дозы к парастернальной зоне могут быть более проблемными в случае нестандартной анатомии грудной клетки или при ее изменении после одномоментной реконструкции с постановкой имплантатов или экспандера, а частота подобных операций значительно возросла в настоящее время. Изменение геометрии грудной клетки чревато неадекватностью покрытия отдельных участков грудной стенки при применении стандартных методик (и, следовательно, повышению риска локального рецидива) либо увеличением доз на критических органах (легких, сердце при левосторонней локализации) [14]. Не стоит полагать, что в нынешний век продвинутых технологий эта проблема полностью ушла. В России, где по-прежнему остро стоит необходимость глубокого теоретического и практического обучения радиотерапевтов и медицинских физиков, а также проблема отсутствия качественного обучения работе на современном оборудовании, частота неадекватности планов лучевой терапии может быть высокой – просто эта тема у нас не изучалась. Авторы исследования EORTC 22922 до сих пор продолжают анализировать полученные результаты, уже спустя 15 лет после завершения набора больных. В 2020 году в журнале Lancet Oncology были опубликованы данные по отдаленным непосредственным результатам за 15 лет [15], а буквально недавно – в конце июля 2021 года – в Journal of Natural Cancer Institute были проанализированы данные, касающихся поздних лучевых осложнений [16]. В отношении общей выживаемости за 15 лет тенденция была полностью сохранена: разница составила всего 2,2%, не достигнув статистической достоверности (73,1% при облучении лимфоузлов против 70,9% без него, р=0,36). Весомых различий в ВБП и выживаемости без отдаленных метастазов также не отмечено. Расширение объемов облучения позитивно сказалось лишь на снижении риска локорегиональных рецидивов (24,5% против 27,1%, р=0,024) и смертности от рака молочной железы (16,0% против 19,8%, р=0,005), хотя, опять-таки, разница была невелика. Но если преимущество облучения парастернальной зоны все же сомнительно, то потенциальный риск осложнений от этого вполне реален. Кумулятивная частота легочных фиброзов за 15 лет оказалась достоверно вдвое выше при добавлении полей на лимфоузлы: 5,7% против 2,9% (P<0,001), кардиальный фиброз также регистрировался чаще (1,9% против 1,1%, P=0,07), так же как и любая сердечная патология (11,1% против 9,4%, P=0,04), хотя в целом радует, что общая частота подобных осложнений была невелика, даже при проведении преимущественно конвенционального облучения (рис.2). Но, скорее всего, учитывая все вышеизложенные факты, включение парастернальной зоны в объем облучения не требуется абсолютно всем пациентам – оно должно быть избирательным.
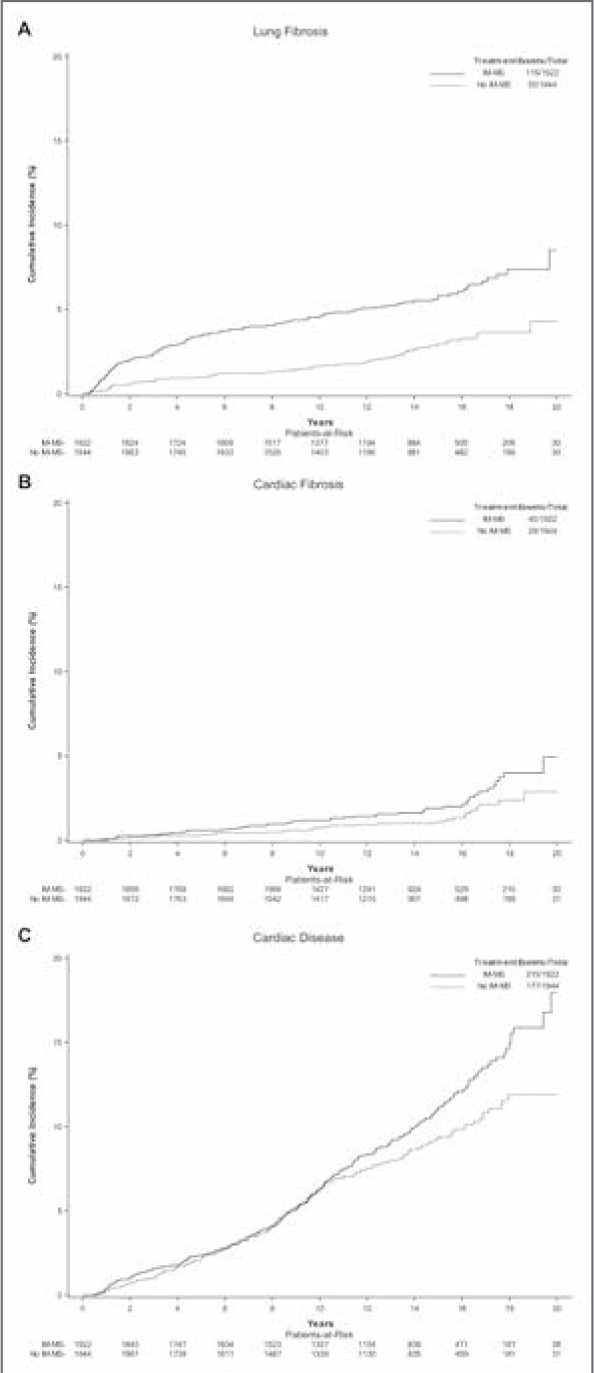
Рисунок 2.
Частота легочных
(А) и кардиальных (В)
фиброзов и сердечной
патологии (С) за 15 лет
после облучения региональных зон или без него
(данные EORTC 22922 [16]).
Кому стоит отдать предпочтение в плане облучения парастернальных лимфоузлов? Вероятнее всего, не нужно брать за основу только размеры первичной опухоли и массивность поражения лимфоузлов, скорее, наоборот. Первый главный момент – локализация опухоли. Есть уже давнее мнение, что опухоли латеральных и медиальных локализаций ведут себя по-разному. В исследовании из Института Густава Русси, включающем почти 1200 больных, лечебные манипуляции в парастернальной зоне (лучевая терапия и/ или операция) достоверно снижали риск отдаленного метастазирования в 1,6 раза ТОЛЬКО у больных с медиальной локализацией опухоли в сочетании с N+ [17]. И исследование EORTC 22922, и датское DBCG-IMN тоже продемонстрировали выигрыш парастернального облучения при медиальных локализациях в сравнении с латеральными в отношении снижения риска смерти (EORTC: HR 0,84 против 0,93) и улучшении ОВ (DBCGIMN: HR 0,80 при медиальной/центральной опухоли в сочетании с N+ против HR 1,13 при латеральной локализации с 1-3 вовлеченными лимфоузлами). Во французском исследовании наибольшая разница в результатах 10-летней общей выживаемости (преимущество в 7-7,5%) была достигнута при облучении парастернальной зоны больным с медиальной/ центральной локализацией опухоли и пораженными подмышечными лимфоузлами, независимо от того, получали они ХТ или нет, хотя статистическая достоверность достигнута не была. Предпочтение стоит отдать пациенткам с рецептор-негативными опухолями и особенно с трижды негативным раком молочной железы с учетом колоссального риска рецидива именно в области региональных зон (по данным Voduc KD et al. 2010 [18] этот риск практически в 4 раза выше для трижды негативного подтипа в сравнении с люминальным А подтипом, а по данным канадского МА20 достоверное улучшение ОВ было отмечено именно для группы пациенток ЭР/ ПР-). Размышлять на эту тему можно долго – но снять основную массу вопросов могли бы лишь проспективные исследования с унифицированной методикой планирования и облучения парастернальной зоны и с применением современных технологий.
Источники:
1. Uren RF, Howman-Giles RB, Thompson JF, Malouf D, Ramsey-Stewart G, Niesche FW, Renwick SB. Mammary lymphoscintigraphy in breast cancer. J Nucl Med. 1995 Oct; 36(10): 1775-80. PMID: 7562041.
2. Chen RC, Lin NU, Golshan M, Harris JR, Bellon JR. Internal mammary nodes in breast cancer: diagnosis and implications for patient management – a systematic review. J Clin Oncol. 2008 Oct 20; 26(30): 4981-9. doi: 10.1200/JCO.2008.17.4862. Epub 2008 Aug 18. PMID: 18711171.
3. Freedman GM, Fowble BL, Nicolaou N, Sigurdson ER, Torosian MH, Boraas MC, Hoffman JP. Should internal mammary lymph nodes in breast cancer be a target for the radiation oncologist? Int J Radiat Oncol Biol Phys. 2000 Mar 1; 46(4): 805-14. doi: 10.1016/s0360- 3016(99)00481-2. PMID: 10705000.
4. Taghian A, Jagsi R, Makris A, Goldberg S, Ceilley E, Grignon L, Powell S. Results of a survey regarding irradiation of internal mammary chain in patients with breast cancer: practice is culture driven rather than evidence based. Int J Radiat Oncol Biol Phys. 2004 Nov 1; 60(3): 706- 14. doi: 10.1016/j.ijrobp.2004.04.027. PMID: 15465186.
5. Whelan TJ, et al. Regional Nodal Irradiation in Early-Stage Breast Cancer. N Engl J Med. 2015; 373: 307-316 DOI: 10.1056/NEJMoa1415340.
6. Poortmans PM, et al. Internal Mammary and Medial Supraclavicular Irradiation in Breast Cancer. N Engl J Med. 2015; 373: 317-327 DOI: 10.1056/ NEJMoa1415369.
7. Hennequin C, Bossard N, ServagiVernat S, et al. Ten-year survival results of a randomized trial of irradiation of internal mammary nodes after mastectomy. Int J Radiat Oncol Biol Phys. 2013 Aug 1; 86(5): 860-6. doi: 10.1016/j.ijrobp.2013.03.021. Epub 2013 May 9. Erratum in: Int J Radiat Oncol Biol Phys. 2014 Aug 1; 89(5): 1145. PMID: 23664327.
8. Budach W, Kammers K, Boelke E, Matuschek C. Adjuvant radiotherapy of regional lymph nodes in breast cancer – a meta-analysis of randomized trials. Radiat Oncol. 2013 Nov 14; 8: 267. doi: 10.1186/1748-717X-8-267. PMID: 24225206; PMCID: PMC3842771.
9. Dellapasqua S, Bagnardi V, Balduzzi A, et al. Outcomes of patients with breast cancer who present with ipsilateral supraclavicular or internal mammary lymph node metastases. Clin Breast Cancer. 2014 Feb; 14(1): 53-60. doi: 10.1016/j.clbc.2013.09.008. Epub 2013 Sep 27. PMID: 24183613.
10.Thorsen LB, Offersen BV, Danø H, et al. DBCG-IMN: A Population-Based Cohort Study on the Effect of Internal Mammary Node Irradiation in Early Node-Positive Breast Cancer. J Clin Oncol. 2016 Feb 1; 34(4): 314-20. doi: 10.1200/JCO.2015.63.6456. Epub 2015 Nov 23. PMID: 26598752.
11.Hare GB, Proulx GM, Lamonica DM, Stomper PC. Internal mammary lymph node (IMN) coverage by standard radiation tangent fields in patients showing IMN drainage on lymphoscintigraphy: therapeutic implications. Am J Clin Oncol. 2004 Jun; 27(3): 274-8. doi: 10.1097/01.coc.0000092596.03967.80. PMID: 15170147.
12.Leite ET, Ugino RT, Santana MA, et al. Incidental irradiation of internal mammary lymph nodes in breast cancer: conventional two-dimensional radiotherapy versus conformal threedimensional radiotherapy. Radiol Bras. 2016; 49(3): 170-175. doi:10.1590/0100- 3984.2015.0003.
13.Chen L, Gu Y, Leaw S, et al. Internal mammary lymph node recurrence: rare but characteristic metastasis site in breast cancer. BMC Cancer. 2010; 10: 479. doi. org/10.1186/1471-2407-10-479.
14.Buchholz TA, Strom EA, Perkins GH, McNeese MD. Controversies regarding the use of radiation after mastectomy in breast cancer. Oncologist. 2002; 7(6): 539- 46. doi: 10.1634/theoncologist.7-6-539. PMID: 12490741.
15.Poortmans PM, Weltens C, Fortpied C, et al.; European Organisation for Research and Treatment of Cancer Radiation Oncology and Breast Cancer Groups. Internal mammary and medial supraclavicular lymph node chain irradiation in stage I-III breast cancer (EORTC 22922/10925): 15-year results of a randomised, phase 3 trial. Lancet Oncol. 2020 Dec; 21(12): 1602-1610. doi: 10.1016/S1470-2045(20)30472-1. Epub 2020 Nov 2. Erratum in: Lancet Oncol. 2021 Jan; 22(1): e5. PMID: 33152277.
16.Poortmans PM, Struikmans H, De Brouwer P, et al.; EORTC Radiation Oncology and Breast Cancer Groups. Side Effects 15 Years After Lymph Node Irradiation in Breast Cancer: Randomized EORTC Trial 22922/10925. J Natl Cancer Inst. 2021 Oct 1; 113(10): 1360-1368. doi: 10.1093/jnci/djab113. PMID: 34320651.
17. Lê MG, Arriagada R, de Vathaire F, Dewar J, Fontaine F, Lacour J, Contesso G, Tubiana M. Can internal mammary chain treatment decrease the risk of death for patients with medial breast cancers and positive axillary lymph nodes? Cancer. 1990 Dec 1; 66(11): 2313-8. doi:10.1002/1097- 0142(19901201)66:11<2313::aidcncr2820661110>3.0.co;2-m. PMID: 2245386.
18.Voduc KD, Cheang MC, Tyldesley S, Gelmon K, Nielsen TO, Kennecke H. Breast cancer subtypes and the risk of local and regional relapse. J Clin Oncol. 2010 Apr 1; 28(10): 1684-91. doi: 10.1200/ JCO.2009.24.9284. Epub 2010 Mar 1. PMID: 20194857.
ВСПОМИНАЯ ПРОФЕССОРА ГАРИНА
Автор: С.А.Тюляндин
Председатель Российского общества клинической онкологии
14 ноября 2021 года Августу Михайловичу Гарину исполнилось бы
90 лет. Сухие строки его автобиографии, свидетельствующие о его
огромном вкладе в развитие отечественной онкологической науки
и практики, тем не менее, не дают
полного представления о нем, как
человеке, и его трудном пути к профессиональному признанию. Гарин
Август Михайлович родился 14 ноября 1931 года. Его папа, Михаил
Давидович, член ВКПБ с 2017 года,
был журналистом, работал заведующим отделом партийной жизни газеты ЦК ВКП(б) «Правда» в
Москве и редактором белорусской
республиканской газеты «Звезда»,
был членом ЦК ВКП(б), участником 17 съезда партии - «съезда
победителей» или, как оказалось,
«съезда расстрелянных». Его мама,
Александра Захаровна, была директором Института философии в
Киеве. Оба родителя были многократно репрессированы: сначала в
1937 году, затем в 1940 и 1948 годах.
Семья смогла объединиться только
в начале 50-х годов в Казахстане,
где ссылку отбывал Михаил Давидович. Оба родителя были реабилитированы после смерти Сталина
в 1955 году. Поэтому Август после
окончания средней школы поступил на лечебный факультет Казахского Государственного медицинского института в г. Алма-Ата,
который и закончил в 1955 году.
После окончания института два
года работал на целине заведующим райздравотделом Бурлинского района Западно-Казахстанской
области и был награжден за эту работу медалью «За освоение целинных земель». В 1957 году приехал
в Москву, поступил в аспирантуру Института экспериментальной
и клинической онкологии АМН
СССР и окончил ее в 1960 году, а
в 1961 уже защитил кандидатскую
диссертацию; его научным руководителем был член-корреспондент
АМН СССР профессор Юрий Михайлович Васильев. С 1960 г. работал в Онкологическом научном
центре, пройдя путь от младшего
научного сотрудника до ученого секретаря Института. В 1970 г. Август
Михайлович защитил докторскую
диссертацию по под руководством
академика Николая Николаевича
Блохина. В 1970 г. Августу Михайловичу Гарину было присвоено
звание профессора. Он был одним
из любимейших учеников Николая
Николаевича и его верным соратником. Он создал Отдел кооперированных исследований и успешно руководил им. В рамках этого
отдела и силами онкологических
учреждений страны были успешно
проведены несколько кооперированных исследований, в том числе и рандомизированных, по изучению новых противоопухолевых
препаратов и их комбинаций, в том
числе и совместно с Национальным институтом рака США.
В 1974 году Август Михайлович Гарин уехал в Женеву, где возглавил
работу Отдела рака ВОЗ.

По его
рассказам, основной задачей отдела была оценка распространенности онкологических заболеваний в
различных странах и континентах,
в первую очередь, развивающихся, помощь в организации онкологической службы и разработке
планов противораковой борьбы. В
рамках этой работы он посетил десятки стран, встречался с лидерами
онкологической науки и практики,
обладая абсолютным международным авторитетом. По прошествии
многих лет, когда в 1990-х годах мы
стали выезжать для участия в международных онкологических форумах, я лично был свидетелем, как к
Августу Михайловичу подходили
коллеги, с которыми он встречался
в бытность его работы в ВОЗ и благодарили за помощь.
В 1978 году Август Михайлович
возвращается в Москву и назначается на должность заместителя
директора по научной работе Всесоюзного онкологического научного центра. Это время открытия
новых корпусов онкоцентра на Каширском шоссе. В новом клиническом корпусе Август Михайлович
организует отделение клинической
фармакологии, состоящее из клинического отделения и экспериментальной лаборатории. Задачей
отделения была оценка противоопухолевых и фармакологических
свойств новых противоопухолевых
препаратов и их комбинаций. Под
руководством Гарина проведено
изучение десятков химиотерапевтических, эндокринных, таргетных
препаратов, а также комбинированных режимов лекарственной
терапии, многие из которых вошли
в практику лечения диссеминированных опухолей. С 1986 года
Август Михайлович Гарин был
куратором и участником многих
международных клинических исследований. В 2001 году ему было
присвоено звание Лауреата Государственной Премии Российской
Федерации в области науки и техники за клиническую разработку
и внедрение в медицинскую практику новых эффективных методов
лекарственной терапии злокачественных опухолей.
Всю свою жизнь Август Михайлович занимался педагогической
работой, создавая свою школу -
школу Гарина. Он был замечательным учителем. Основной педагогический принцип, который он
исповедовал – делай как я. А это
означало необходимость постоянной работы, получения и анализа
новой информации. Именно так
работал сам Август Михайлович
всю свою жизнь. Он не опекал мелочно своего ученика, но давал ему
полную свободу самостоятельной
работы, всегда был доступен для
советов и консультаций. Он очень
любил своих учеников, гордился
и радовался их успехам и никогда
не завидовал их победам. Поэтому
выходцев школы Гарина отличает,
кроме высокого профессионализма, особая креативность и желание
постоянно работать. Под руководством Августа Михайловича Гарина защищены 15 докторских и 32
кандидатские диссертации, Указом
Президента Российской Федерации в 2001 г. Гарину Августу Михайловичу было присвоено звание
Заслуженного Деятеля Науки Российской Федерации.
Август Михайлович был замечательным доктором, грамотным,
добрым, отзывчивым, желающим
помочь своим пациентам. В отделении всегда царила комфортная
атмосфера доброжелательности и
взаимопомощи между научными
сотрудниками, врачами, средним
и младшим медицинским персоналом. Август Михайлович был примерным семьянином. Его отношения с супругой Анной Петровной
могли бы быть наглядным примером любви, уважения и поддержки
друг друга на протяжении многих
лет.
Августа Михайловича всегда можно было встретить на Российском
онкологическом конгрессе. Он был
одним из основателей этого мероприятия, его организатором и
активным участником. Последнее
время Август Михайлович был ответственен за сессию, посвященную лекарственной терапии злокачественных опухолей. С этого года
эта сессия станет традиционной и
будет называться мемориальной
сессией профессора Гарина. В юбилейном для конгресса 2021 году эта
сессия организована профессором
В.М. Моисеенко и состоится 10 ноября, во 2 день конгресса.
Уход из жизни Августа Михайловича Гарина стал невосполнимой
потерей для всего коллектива Онкологического научного центра,
его семьи и друзей. Память о нем
навсегда останется в наших сердцах, и для всех нас – тех, кто его
знал лично, и тех, кому мы будем
рассказывать об Учителе – он всегда будет ориентиром в нашей профессиональной жизни.


ИЗМЕНЕНИЕ ПАРАДИГМЫ В ЛЕЧЕНИИ МЕСТНОРАСПРОСТРАНЕННОГО НЕМЕЛКОКЛЕТОЧНОГО РАКА ЛЕГКОГО
Автор: Данилова Анастасия Сергеевна
Московская городская онкологическая больница №62, Москва
Рак легкого по-прежнему занимает первое место по заболеваемости и смертности среди онкологических заболеваний и у женщин, и у мужчин в мире. Немелкоклеточный рак легкого (НМРЛ) составляет приблизительно 84% [1] среди всех злокачественных опухолей легкого. Несмотря на успехи диагностики и внедрение скрининговых программ, практически половина всех случае рака легкого приходится на IV cтадию [2]. С внедрением молекулярно-генетических методов диагностики, появлением таргетной терапии, появлением иммунотерапии лекарственное лечение метастатического НМРЛ драматически изменилось [3]. В настоящее время мы выделяем множество биологически совершенно разных опухолей, которые объединены исключительно локализацией, и подходы к лечению принципиально отличаются: плоскоклеточные раки (ассоциированные с курением, с большой мутационной нагрузкой и высоким потенциалом ответа на иммунотерапию или комбинацию химиоиммунотерапии), аденокарциномы с драйверными мутациями, где есть высоко эффективные опции таргетной терапии, аденокарциномы различного строения и другие формы НМРЛ лечатся по-разному. При этом до сих пор в лечении местнораспространенного неоперабельного рака легкого используется «one size fits all» подход, где вне зависимости от гистологической и молекулярно-биологической структуры стандартном лечения является химиолучевая терапия.
Рисунок 1.
Соотношение различных морфологических
вариантов рака легкого [1].
Большим прорывом в лечении немелкоклеточного местнораспространенного рака легкого стало исследование PACIFIC, которое оценивало эффективность применения ингибитора PD-L1 дурвалумаба в качестве поддерживающей терапии у пациентов с местнораспространенным неоперабельным НМРЛ после проведенной химиолучевой терапии. По данным финального анализа исследования [4], медиана безрецидивной выживаемости увеличилась в три раза с 5,6 до 16,9 мес. Другой, не менее важный показатель эффективности терапии, особенно в контексте иммунотерапии, – это выживаемость на определенной временной точке. Безрецидивная выживаемость (БРВ) на отметке 60 месяцев составила 19,0% в группе плацебо против 33,1% в экспериментальной группе. Это значит, что каждый третий пациент не прогрессировал в течение 5 лет, получая дурвалумаб. Общая выживаемость (ОВ) к 5 годам была 33,4% в группе плацебо против 42,9% в экспериментальной группе. При этом медиана (ОВ) была 47,5 мес. в группе дурвалумаба против 29,1 мес. в группе плацебо. На основании этого исследования стандартом лечения местнораспространенного рака легкого стала химиолучевая терапия с последующей поддерживающей терапией дурвалумабом в течение 1 года.
Рисунок 2.
Соотношение всех впервые выявленных
случаев рака легкого по стадиям [2].
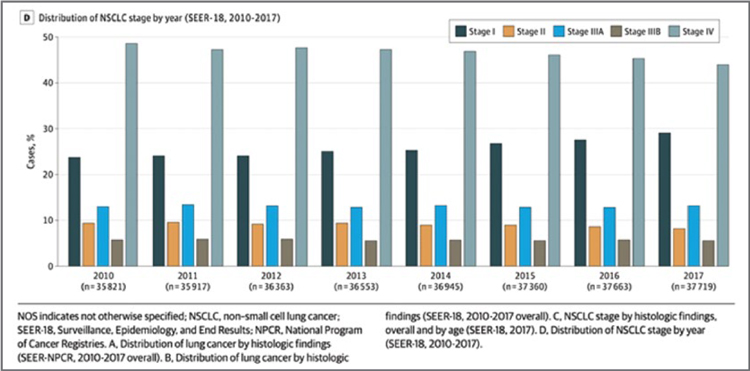
При этом, как и в других исследованиях с иммунотерапией, не все группы пациентов одинаково выигрывали от проводимой поддерживающей иммунотерапии. Наибольшее преимущество отмечено у пациентов с экспрессией PD-L1 >25% (HR 0,41) и пациентов без драйверной мутации EGFR (HR 0,47). Также стоит отметить, что только 8% в исследовании не курили, что говорит о том, что в исследование были включены пациенты с большим потенциалом чувствительности к иммунотерапии [5]. Данные исследования PACIFIC были подтверждены и исследованием реальной клинической практики. На конгрессе ESMO 2021 года были доложены результаты исследования PACIFIC-R, где дурвалумаб использовался уже не в рамках клинического исследования, а в программе раннего доступа для того, чтобы оценить эффективность поддерживающей терапии у более неоднородной группы пациентов. В финальный анализ исследования было включено 1399 пациентов из нескольких центров Европы [6]. Медиана БРВ в этом исследовании была даже больше, чем в исследовании PACIFIC, – 21,7 против 16,9 мес., 12-месячная и 24-месячная БРВ составили 62,4% и 48,2% соответственно. Несмотря на очень убедительные данные этих исследований, назначение дурвалумаба в качестве поддерживающей терапии остается недооцененным. По данным анализа страховых выплат Medicare и Medicaid в США, несмотря на то, что дурвалумаб был одобрен с 2018 года, лишь 23% и 36% пациентов получали поддерживающую терапию этим препаратом [7]. С чем это связано, остается не до конца ясным. Дурвалумаб одобрен в качестве поддерживающей терапии в Российской Федерации как после одновременного химиолучевого лечения, так и после последовательного, однако поддерживающая иммунотерапия на территории РФ применяется нечасто. Большой проблемой остается невысокая частота химиолучевой терапии у этой группы пациентов. В исследовании PACIFIC чуть меньше половины пациентов (44,5%) имели IIIB стадию НМРЛ легкого, а у 52,9% отмечена IIIA стадия. Хирургическое лечение не рассматривается у пациентов с IIIB и IIIC cтадиями, и основой лечения становится сочетание химио- и лучевой терапии. При этом IIIA стадия – это одна из самых разнородных и сложных для лечения групп пациентов.
Рисунок 3.
ВБП при применении осимертиниба у больных с
НМРЛ с мутацией EGFR по данным исследования ADAURA [9].
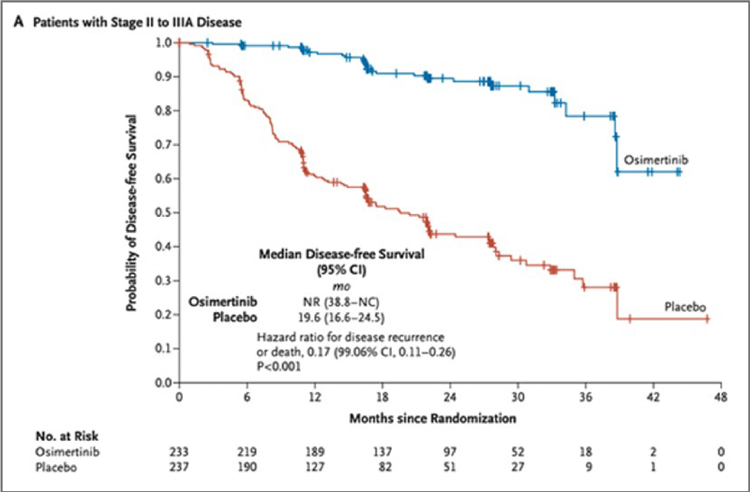
Именно поэтому мультидисциплинарное обсуждение, в котором равноценно участвуют торакальные хирурги, химиотерапевты, морфологи, радиотерапевты и специалисты по лучевой диагностике – неотъемлемая часть эффективного лечения. Одна крайность IIIA стадии – это bulky disease, или массивное поражение лимфоузлов средостения, когда изначально опухоль неоперабельна. У этих пациентов, скорее всего, решение будет принято в пользу химиолучевого лечения. Другая категория пациентов с IIIA стадией – это случаи патоморфологи ческой «находки», когда клиническая стадия была ниже, но по результатам планового морфологического исследования было выявлено N2 поражение лимфатических узлов. Это та группа больных НМРЛ, которые чаще всего идут по пути хирургического лечения, а затем адьювантной химиотерапии. В адъювантной терапии НМРЛ длительное время была стагнация. Адъювантная химиотерапия на основе цисплатина добавляет 5-10% общей выживаемости, но, к сожалению, ее могут перенести далеко не все пациенты [8].
Рисунок 4.
ВБП у больных с II-IIIA стадией НМРЛ и PD-L1 экспрессией ≥1%, всех рандомизированных пациентов с II-IIIA
стадией и всей популяции больных, пролеченных по схеме
(данные исследования IMpower 010).
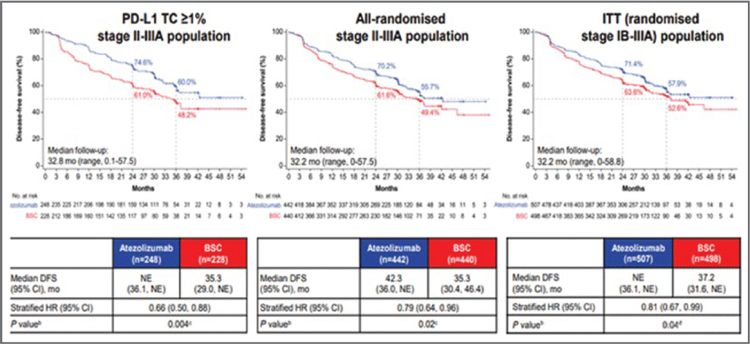
Колоссальным прорывом стало применение осимертиниба в качестве адъювантной таргетной терапии у пациентов IB-IIIA стадии EGFR мутированного НМРЛ после хирургического лечения (± адъювантная химиотерапия). Исследование было настолько очевидно позитивным, что по решению независимого комитета оно было завершено раньше запланированного анализа. На конгрессе ASCO 2021 были доложены феноменальные результаты исследования ADAURA [9]. К отметке 24 месяца 90% пациентов, получавших осимертиниб, не имели прогрессирования, в то время как в группе плацебо без признаков прогрессирования были лишь 44% больных. Фантастическими были не только цифры БРВ, но и такой важный показатель, как прогрессирование в головной мозг. Метастатическое поражение ЦНС – это один из самых сложных сайтов прогрессирования, который зачастую определяет прогноз заболевания. К 24 месяцам 98% пациентов были живы и без метастазов в ЦНС, в то время как в группе плацебо без метастазов в головной мозг к 2 годам было только 85% пациентов. Подгрупповой анализ показал эффективность осимертиниба вне зависимости от стадии заболевания, в том числе и при IB стадии, вне зависимости от вида мутации (del19ex vs L858R) и вне зависимости от того, получали ли пациенты адъювантную химиотерапию. Следующим большим прорывом адъювантной терапии НМРЛ стало исследование IMpower 010, которое оценивало эффективность адъювантной терапии атезолизумабом после радикального хирургического лечения у пациентов с IB-IIIA стадией рака легкого [10]. В это исследование также включались пациенты с драйверными мутациями. Иерархический дизайн исследования сначала предусматривал оценку первичных конечных точек у пациентов с положительной PD-L1 экспрессией с II-IIIA стадией, а в случае достижения этой первичной конечной точки статический анализ расширялся сначала на общую популяцию пациентов с II-IIIA стадией, а затем и до целой популяции в исследовании (ITT). Исследование оказалось позитивным: безрецидивная выживаемость увеличилась на 11,8% (с 48,2% до 60%) в точке 36 месяцев у PD-L1 позитивных пациентов с II-IIIA стадией (p=0,04). Увеличение БРВ было отмечено и в общей популяции пациентов (в том числе и PD-L1 негативных), однако в подгрупповом анализе видно, что для этой группы больных HR составляет 0,92, что говорит, вероятно, об отсутствии преимуществ у этих пациентов. Два метода расчета подгруппового анализа (включая и исключая пациентов с драйверными мутациями) позволяют нам сделать вывод, что наличие мутации EGFR или ALK «сдвигает» HR в пользу плацебо.
На основании данных этого исследования FDA зарегистрировало атезолизумаб в качестве адъювантной терапии у пациентов с позитивной PD-L1 экспрессией, перенесших хирургическое лечение и платиносодержащую адъювантную химиотерапию [11]. Но есть и промежуточная группа больных, достаточно большая, где объем операции на первом этапе представляется слишком травматичным или вовсе невозможным, но при этом есть потенциал для хирургического вмешательства в случае ответа опухоли на лечение, которое может улучшить результаты этого лечения. Для этих пациентов достижение глубокого ответа на лечение позволит уменьшить объем операции (с пневмонэктомии до лобэктомии), для них проведение неоадъювантной химиотерапии – это реальный шанс на излечение. Эта группа пациентов в течение длительного времени оставалась недооцененной, потому что эффективных опций для неоадъювантной химиотерапии НМРЛ было мало. В метаанализе 15 исследований по неоадъювантной терапии для II-IIIA стадии немелкоклеточного рака легкого разница в ОВ в группах составила 5%, что сопоставимо с исследованиями адъювантной химиотерапии, которые проводились в это же время [12]. В 2014 году было предложено использовать суррогатную конечную точку MPR (major pathological response, или наибольший патоморфологический ответ) в качестве оценки эффективности неоадъювантной химиотерапии. Этот показатель, как и pСR, коррелирует с БРВ и ОВ [13]. Учитывая феноменальную эффективность как моноиммунотерапии (у пациентов с высокой PD-L1 экспрессией), так и комбинированной химиоиммунотерапии [14] у пациентов с метастатическим НМРЛ, следующим шагом была попытка использования этих режимов у пациентов в качестве неоадъювантной терапии. Исследование СheckMate 816 оценивало эффективность добавления ниволумаба к 3 циклам химиотерапии до хирургического лечения. В исследовании не включались пациенты с драйверными мутациями. Первичными конечными точками в этом исследовании стали pCR и БРВ. Добавление ниволумаба к химиотерапии увеличило частоту pСR с 2,2% до 24,0%. Частота MPR (наибольший патоморфологический регресс, при котором остается менее 10% жизнеспособной опухолевой ткани) увеличилась с 8,9% до 36,9% [15]. Несмотря на интенсификацию лечения в экспериментальной группе, частота побочных явлений не увеличилась, более того, среднее время хирургического вмешательства было меньше в группе с ниволумабом: 169-186 минут против 210-218 минут в группе плацебо. Частота послеоперационных осложнений, длительность госпитализации были одинаковы в обеих группах. Добавление ниволумаба также позволило снизить частоту пневмонэктомий у пациентов с IIIA стадией. Пневмонэктомия была у 30% пациентов в группе плацебо против 17% в группе ниволумаба. Результаты БРВ будут доложены в скором времени. На наших глазах большой клубок проблем, касающихся опухолей легкого, начинает распутываться. И мы видим, что это десятки абсолютно разных, не похожих друг на друга нитей. Сегодня мы не можем лечить рак легкого в отрыве от его биологии и клинического контекста.
Рисунок 5.
Частота полных (pCR) и наибольших (MPR) патоморфологических регрессов
опухоли по данным исследования СheckMate 816 [15].
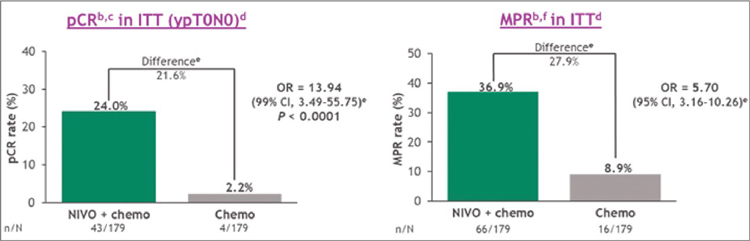
В настоящее время идут исследования NEOADAURA (NCT04351555) по неоадъювантной терапии осимертинибом, LAURA (NCT03521154) по таргетной терапии после лучевой терапии для EGFR мутированного местнораспространенного НМРЛ. Группа исследований ALCHEMIST использует концепцию корзиночных исследований таргетных препаратов для пациентов, у которых есть драйверные мутации [16]. Параллельно продолжаются исследования с неоадъювантной и адъювантной химиоиммунотерапией. На мой взгляд, наиболее эффективные опции лечения должны использоваться на более ранних этапах. Наша задача, в первую очередь, помочь как можно большему числу пациентов. Очевидно, что для больных с драйверными мутациями будущее за неоадъювантной и/или адъювантной таргетной терапией. Для курящих пациентов с ранним НМРЛ, где хирургическое лечение нетравматично, опцией могут быть разные варианты адъювантной химиоиммунотерапии. А для пациентов с местнораспространенным раком легкого, где хирургическое лечение на первом этапе неоправданно, безусловно, свое место займет неоадъювантная химиоиммунотерапия. Единый подход в лечении местнораспространенного рака легкого постепенно сменяется подходом «biology driven», когда имея высокоэффективные опции лечения для разных биологических формы опухоли, мы можем их применять на разных этапах лечения, помогая большему числу пациентов.
Источники:
1. Ganti AK, Klein AB, Cotarla I, Seal B, Chou E. Update of Incidence, Prevalence, Survival, and Initial Treatment in Patients With NonSmall Cell Lung Cancer in the US. JAMA Oncol. Published online October 21, 2021. doi:10.1001/ jamaoncol.2021.49321.
2. JAMA Oncol. doi:10.1001/ jamaoncol.2021.4932 Published online October 21, 2021.
3. Joan H. Schiller. A New Standard of Care for Advanced Lung Cancer. N Engl J Med 2018; 378: 2135-2137 DOI: 10.1056/NEJMe1804364
4. Spigel DR, et al. Five-year survival outcomes with durvalumab after chemoradiotherapy in unresectable stage III NSCLC: An update from the PACIFIC trial. Journal of Clinical Oncology. 2021 May 20; 39 (15_suppl): 8511-8511.
5. Scott J. Antonia N Durvalumab after Chemoradiotherapy in Stage III Non-Small-Cell Lung Cancer. Engl J Med. 2017; 377: 1919-29.
6. Taugner J, et al. Real-world analysis of treatment patterns and efficacy of durvalumab maintenance after chemoradiotherapy in NSCLC patients. Journal of Thoracic Oncology. 2021; 16 (suppl_4): S737-S747.
7. MA06.05 – Patterns of Care in Maintenance Therapy in U.S. Patients Undergoing Definitive Chemoradiation for Stage 3 Non-Small Cell Lung Cancer (NCSLC).
8. Pignon J-P, Tribodet H, Scagliotti GV, et al; LACE Collaborative Group. Lung adjuvant cisplatin evaluation: a pooled analysis by the LACE Collaborative Group. J Clin Oncol. 2008; 26 (21).
9. Wu YL, et al.; ADAURA Investigators. Osimertinib in Resected EGFR-Mutated Non-Small-Cell Lung Cancer. N Engl J Med. 2020 Oct 29; 383 (18): 1711-1723. doi: 10.1056/ NEJMoa2027071. Epub 2020 Sep 19. PMID: 32955177.
10.Felip E, et al. Adjuvant atezolizumab after adjuvant chemotherapy in resected stage IB-IIIA non-small-cell lung cancer (IMpower010): a randomised, multicentre, open-label, phase 3 trial. Lancet. 2021; 398: 1344-57 Published Online: September 20, 2021. https://doi. org/10.1016/ S0140-6736(21)02098-5.
11.www.fda.gov/drugs/resourcesinformation-approved-drugs/fdaapproves-atezolizumab-adjuvanttreatment-non-small-cell-lung-cancer.
12.NSCLC Meta-analysis Collaborative Group. Preoperative chemotherapy for non-small-cell lung cancer: a systematic review and meta-analysis of individual participant data. Lancet. 2014 May 3; 383 (9928): 1561-71. doi: 10.1016/ S0140-6736(13)62159-5. Epub 2014 Feb 25. PMID: 24576776; PMCID: PMC4022989.
13.Hellmann MD, et al; University of Texas MD Anderson Lung Cancer Collaborative Group. Pathological response after neoadjuvant chemotherapy in resectable non-smallcell lung cancers: proposal for the use of major pathological response as a surrogate endpoint. Lancet Oncol. 2014 Jan; 15(1): e42-50. doi: 10.1016/S1470- 2045(13)70334-6. PMID: 24384493; PMCID: PMC4734624.
14.Gandhi L, et al. Pembrolizumab plus Chemotherapy in Metastatic NonSmall-Cell Lung Cancer. N Engl J Med. 2018; 378: 2078-2092.
15.Spicer J, et al. Surgical outcomes from the phase 3 CheckMate 816 trial: Nivolumab (NIVO) + platinumdoublet chemotherapy (chemo) vs chemo alone as neoadjuvant treatment for patients with resectable non-small cell lung cancer (NSCLC). Journal of Clinical Oncology. 2021 May 20; 39 (15_suppl): 8503-8503.
16.Govindan R, et al. ALCHEMIST
Trials: A Golden Opportunity to
Transform Outcomes in Early-Stage
Non-Small Cell Lung Cancer. Clin
Cancer Res. 2015 Dec 15; 21 (24): 5439-
44. doi: 10.1158/1078-0432.CCR15-0354. PMID

ПО ИТОГАМ МАСТЕР-КЛАССА ESTRO FALCON 2021 ПО СТЕРЕОТАКСИЧЕСКОЙ ЛУЧЕВОЙ ТЕРАПИИ РАКА ЛЕГКОГО
Автор: Шейко Андрей Владимирович,
ОКОД, Владимир
28 сентября и 5 октября 2021 года в онлайн формате состоялся мастеркласс ESTRO FALCON по стереотаксической лучевой терапии рака легкого. Целями мастер-класса, в котором приняли участие более 40 радиотерапевтов и радиационных онкологов из разных стран мира, были обозначены улучшение навыков контуринга таргетных и критических структур при стереотаксической радиотерапии (SBRT) рака легкого, а также анализ и сравнение контуров участников с гайдлайнами ESTRO и контурами экспертов. В ходе мастер-класса и последующей дискуссии были определены основные показания к SBRT (на этот раз с поправками на условия пандемии COVID-19), клинические сценарии при планировании SBRT рака легкого и обсуждены основные проблемы, возникающие при прецизионном оконтуривании. Эксперт Ahmed Salem из онкологического центра The Christie NHS Foundation Trust (Манчестер, Великобритания) предлагает следующие критерии для отбора пациентов на SBRT рака легкого: • наличие медицинских противопоказаний к оперативному лечению; • отказ пациента от операции; • высокий и крайне высокий риск послеоперационных осложнений (должен быть обсужден на мультидисциплинарном консилиуме); • немелкоклеточный рак легкого размером ≤5 см, однако в условиях пандемии COVID-19 больница Christie повысила лимит размера опухоли до ≤6 см, фактически рекомендуя к SBRT опухоли T3 (ранее UK SABR Consortium 2019 версии 6.1 рекомендовал для SBRT только группу опухолей Т3, инвазирующих грудную стенку, но размерами до 5 см) [1]; • негативный по регионарным лимфатическим узлам статус; • состояние пациента по шкале ECOG 0-2 (Christie также не исключают лечение больных в статусе ECOG 3 после обсуждения на мультидисциплинарном консилиуме); • периферические опухоли, локализованные не ближе 1 см от структур центральной зоны (SBRT пациентам с опухолями ультрацентральной зоны вне клинических исследований не рекомендуется ввиду высокой токсичности). При выполнении вышеописанных критериев отбора был предложен следующий сценарий окончательного принятия решения о проведении SBRT рака легкого (мнение онкологического центра The Christie): • SBRT должна быть рассмотрена в случае локализации планируемого таргетного объема (PTV) не менее чем в 1 см от спинномозгового канала и в 0,5 см от плечевого сплетения, пищевода, трахеи и проксимального отдела бронхиального дерева; в случае локализации в «no fly zone» (трахея и проксимальный отдел бронхиального дерева + 1 см) при условии нахождения IGTV в зоне проксимального отдела бронхиального дерева + 1 см следует рассмотреть режим фракционированной лучевой терапии 60 Гр за 15 фракций, при более удаленном расположении IGTV – 60 Гр за 8 фракций; • при локализации IGTV в пределах 1,5-2 см от органов средостения (сердце и крупные сосуды) возможно проведение SBRT в режиме 60 Гр за 5 фракций; при дистанции 1-1,5 см в условиях необходимости соблюсти дозные ограничения на сердце, пищевод и проксимальный отдел бронхиального дерева рекомендован возврат к режиму 60 Гр за 8 фракций; • при дистанции от IGTV до средостения более 2 см и приемлемой удаленности от диафрагмы и грудной стенки рекомендуется режим SBRT 54 Гр за 3 фракции; • при дистанции от IGTV до средостения более 2 см, но при «перекрытии» грудной стенки (но не диафрагмы!) рекомендуется режим SBRT 48 Гр за 3 фракции (в эпоху до пандемии COVID-19 данный режим предусматривал 55-60 Гр за 5 фракций); • при дистанции от IGTV до средостения более 2 см, но при «перекрытии» диафрагмы (± грудной стенки) возможно проведение SBRT в режиме 60 Гр за 5 фракций. Смена режимов и суммарных очаговых доз (СОД) также возможна на усмотрение лечащего врача в зависимости от коморбидного фона или статуса общего состояния пациента (например, отказ от рекомендуемой трехфракционной схемы в пользу пятифракционной или восьмифракционной). Однако туморицидный эффект может быть реализован только при условии достижения биологической эффективной дозы на первичную опухоль (BED10) ≥100 Гр (рис.1).
Рисунок 1.
Оптимальные туморицидные СОД и BED10
при гипофракционированной лучевой терапии и SBRT рака легкого.
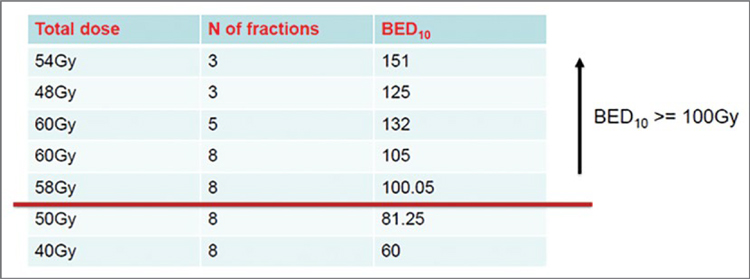
В настоящее время методика SBRT находится в условиях дефицита убедительных руководств и гайдлайнов по оконтуриванию таргетных и критических структур: всего 6% (8 из 142) гайдлайнов по состоянию на 2020 год посвящены определению объемов облучения при лучевой терапии рака легкого и опухолей грудной клетки, из них всего 2 руководства посвящены оконтуриванию как первичной опухоли, так и органов риска, и только 1 руководство посвящено SBRT [2]. Эксперт Jose Lopez из университетской клиники Virgen del Rocio (Севилья, Испания) с опорой на атлас Kong et al. [3] рекомендует к оконтуриванию при SBRT рака легкого следующие критические структуры: сердце, пищевод, легкие, спинной мозг, проксимальный отдел бронхиального дерева, плечевое сплетение, грудную стенку, крупные сосуды, печень и желудок, кардиостимулятор. Единых стандартов к оконтуриванию сердца на данный момент не существует, что связано с большим количеством разночтений и проблем при определении необходимого объема оконтуривания: невозможность достаточно точно графически определить объемы миокарда, клапанов сердца, коронарных артерий и прочих из-за погрешностей при дыхательных движениях, отсутствия данных о дозных ограничениях на сердечные подструктуры, разночтений в принципиальных подходах к оконтуриванию (включение или исключение из объема сердца перикарда и крупных сосудов). Позитивный вклад в выживаемость пациентов без острого коронарного синдрома при ограничении доз на левый желудочек, левое предсердие, переднюю нисходящую ветвь левой коронарной артерии достаточно изучен и сомнений не вызывает (чему был посвящен целый раздел номера 152 журнала Radiotherapy & Oncology за ноябрь 2020 года [4]). Однако данных о дозных ограничениях на вышеуказанные структуры при SBRT на сегодняшний момент все еще не существует. Рекомендации NCCN 2021 года по дозным ограничениям при SBRT предписывают лимиты доз только на сердце/перикард и крупные сосуды [5]. Важно отметить, что дозные ограничения на критические структуры, регламентированные Американской ассоциацией медицинских физиков (доклад TG101 от 2010 года), более не используются. В случае SBRT рака легкого и наличия у пациента кардиостимулятора рекомендованы обязательный осмотр кардиолога, тщательный расчет дозы на кардиостимулятор, дислокация поля облучения в случае прохождения через кардиостимулятор, наличие протокола мероприятий в случае ургентной кардиологической ситуации во время лучевой терапии. Необходимость оконтуривания грудной стенки при SBRT, по мнению Jose Lopez, также остается спорным моментом ввиду недостаточности данных крупных исследований [6], однако UK SABR Consortium 2019 версии 6.1 в исчерпывающем объеме описывает технологию оконтуривания и дозные ограничения для данной критической структуры. Оконтуривание ребер в качестве критических структур имеет большое значение при опухолях, располагающихся в непосредственной близости от грудной стенки или инвазирующих последнюю в случае T3. Риск перелома ребра в случае покрытия его объема 2 см3 в дозе 16 Гр за 3 фракции возрастает до 50% [7]. Мастер-класс FALCON продемонстрировал значительные различия в оконтуривании участниками как первичного опухолевого объема (учитывая даже дополнительные данные ПЭТ), так и практически всех заявленных критических структур. Разница в определении объемов пищевода и трахеи была минимальной. Наибольшие трудности вызвал контуринг проксимального отдела бронхиального дерева, сердца и плечевого сплетения (даже при использовании метода Тиммермана с контурингом пространства между ключицей и первым ребром [8]). Различия в оконтуривании представлены на рисунках 2-4.
Рисунок 2.
Отличия в оконтуривании GTV участниками мастеркласса (синие контуры)
и объема эксперта (розовый).
Рисунок 3.
Различия в оконтуривании проксимального
отдела бронхиального дерева
участниками мастер-класса
(красные контуры).
Рисунок 4.
Различия в оконтуривании левого плечевого
сплетения участниками мастеркласса (фиолетовые и коричневые контуры).
SBRT немелкоклеточного рака легкого в настоящий момент – метод выбора радикального лечения пациентов ранних стадий, не подлежащих хирургическому лечению. В России тренд на внедрение и активное использование SBRT в последние годы особенно заметен, что связано с появлением весомой доказательной базы эффективности методики и существенным апгрейдом радиотерапевтической аппаратуры в рамках Федерального проекта не только в крупных исследовательских институтах, но и в региональных онкологических службах. Заслуживает пристального внимания обеспечение качества проводимой подготовки к SBRT на этапах оконтуривания целевых и критических структур, подбора режима фракционирования и оценки дозной нагрузки с прогнозированием возможных осложнений. Появление отечественных гайдлайнов и протоколов, регламентирующих выполнение вышеозначенных этапов, должно привести к более взвешенной и качественной имплементации метода SBRT в рутинную радиотерапевтическую практику.
Источники:
1. UK SABR Consortium, Version 6.1. January 2019.
2. Lin D, Lapen K, Sherer MV, et al. A Systematic Review of Contouring Guidelines in Radiation Oncology: Analysis of Frequency, Methodology, and Delivery of Consensus Recommendations. Int J Radiat Oncol Biol Phys. 2020 Jul 15; 107(4): 827-835. doi: 10.1016/j. ijrobp.2020.04.011.
3. Kong FM, Ritter T, Quint DJ, et al. Consideration of dose limits for organs at risk of thoracic radiotherapy: atlas for lung, proximal bronchial tree, esophagus, spinal cord, ribs, and brachial plexus. Int J Radiat Oncol Biol Phys. 2011 Dec 1; 81(5): 1442- 57. doi: 10.1016/j.ijrobp.2010.07.1977.
4. Radiotherapy & Oncology. 2020 Nov; Vol.152.
5. NCCN Clinical Practice Guidelines Non-Small Cell Lung Cancer, Version 6.2021. September 30, 2021. P.69.
6. Mir R, Kelly SM, Xiao Y, et al. Organ at risk delineation for radiation therapy clinical trials: Global Harmonization Group consensus guidelines. Radiother Oncol. 2020 Sep; 150: 30-39. doi: 10.1016/j.radonc.2020.05.038.
7. Pettersson N, Nyman J, Johansson KA. Radiation-induced rib fractures after hypofractionated stereotactic body radiation therapy of non-small cell lung cancer: a dose- and volumeresponse analysis. Radiother Oncol. 2009 Jun; 91(3): 360-8. doi: 10.1016/j. radonc.2009.03.022.
8. Kong FM, Quint L, Machtay M.
RTOG Atlases for Organs at Risk (OARs)
in Thoracic Radiation Therapy. P.20-21.
ОБРАЗОВАТЕЛЬНЫЕ ВОЗМОЖНОСТИ ДЛЯ МОЛОДЫХ ХИРУРГОВ-ОНКОЛОГОВ В ОБЛАСТИ ОПУХОЛЕЙ ГОЛОВЫ И ШЕИ
Автор: Котов Максим Андреевич,
НМИЦ онкологии им.Н.Н.Петрова, Санкт-Петербург
Основными признаками профессионализма врача являются, прежде
всего, база медицинских знаний и
умение учиться, чтобы поддерживать
ее на актуальном уровне, навыки принятия решений в медицине, включая
проведение и интерпретацию данных
научных медицинских исследований,
а также навыки коммуникации с пациентами. Для хирургов-онкологов
помимо этих навыков необходимо
развивать мануальные навыки и осваивать современные хирургические
технологии.
В этой статье приведен обзор образовательных возможностей для хирургов-онкологов по специальности
опухоли головы и шеи.
Международная федерация онкологических обществ специалистов по опухолям головы и шеи
(International Federation of Head and
Neck Oncologic Societies, IFHNOS)
Данная профессиональная организация предоставляет два вида образовательных программ. Первая
- Global Online Fellowship, двухгодичная международная образовательная
программа, проходящая в онлайнформате. В течение двух лет студенты
самостоятельно осваивают теоретические аспекты диагностики, лечения,
профилактики опухолей головы и
шеи, а также вопросы эпидемиологии,
хирургической анатомии, молекулярной биологии и генетики, а также
принципы реабилитации и нутритивной поддержки. Обучение разбито на
семестры - по 4 на год, после каждого
из них предусмотрен экзамен в виде
компьютерного тестирования. Также в рамках данной образовательной
программы предусмотрена месячная
стажировка в клинике из числа аккредитованных центров. В России
таким центром является клиника
Первого Московского Государственного Медицинского Университета
имени И.М.Сеченова. В конце обучения студент сдает экзамен, состоящий
из решения клинических ситуаций
перед экзаменационным комитетом,
в который входят лидеры хирургии и
онкологии головы и шеи, например,
доктор Jatin Shah из отдела хирургии
головы и шеи Memorial Sloan Kettering
Cancer Center. После успешного прохождения экзамена студент получает
сертификат о соответствии его знаний в области хирургии и онкологии
головы и шеи мировым стандартам.
Вторая образовательная программа
— международные клинические стажировки. В рамках данной программы предоставляется возможность
посетить ведущие клиники мира,
например Memorial Sloan Kettering
Cancer Center (Нью-Йорк, США) или
MD Anderson Cancer Center на срок от
двух недель до двух месяцев. Во время прохождения стажировок, предоставляются следующие образовательные возможности:
- Наблюдение за ходом и техникой
хирургических операций;
- Участие в утреннем обходе пациентов госпитальной клиники;
- Участие в консультативном приеме в амбулаторной клинике;
- Образовательные мероприятия
для резидентов: лекции, семинары,
журнальные клубы, хирургические
мастер-классы;
- Разбор клинических случаев мультидисциплинарной комиссией.
Также это прекрасная возможность
познакомиться с ведущими мировыми лидерами мнений и исследователями в области опухолей головы и
шеи.
Для того чтобы получить возможность пройти стажировку в департаменте хирургии головы и шеи
Memorial Sloan Kettering Cancer Center
необходимо отправить свое резюме и
мотивационное письмо ассистенту -
Marsha Kaplan на электронную почту
KaplanM@mskcc.org
Для того чтобы получить возможность пройти стажировку в департаменте хирургии головы и шеи MD
Anderson Cancer Center необходимо
отправить свое резюме и мотивационное письмо ассистенту - Lisa Sriver
на электронную почту LMSriver@
mdanderson.org
Американское общество головы
и шеи - American Head and Neck
Society.
Данное профессиональное общество
предоставляет несколько образовательных возможностей для хирургов
и онкологов.
Журнальный клуб. Ежемесячно специалисты данного профессионального сообщества публикуют критический разбор научных статей по
определенной клинической проблеме
или заболеванию.
Каждый разбор содержит краткое
резюме статьи, включающее методологию, полученные результаты и
клиническую применимость, а также
сильные и слабые стороны, включающее систематические ошибки и погрешности в методологии проведения
исследования.
Виртуальная мультидисциплинарная комиссия. Ежемесячное
образовательное мероприятие,
представляющее заседание мультидисциплинарной комиссии по разбору конкретных клинических ситуаций. Каждое заседание направлено на
рассмотрение конкретной клинической проблемы или ситуации. Например, последняя серия семинаров была
посвящена лечению рака ротоглотки
с использованием роботической хирургии, где обсуждались вопросы отбора пациентов, критериев качества
хирургического лечения и показания
к адъювантной терапии.
Европейское общество клинической онкологии (ESMO).
Профессиональное общество медицинских онкологов предоставляет
образовательные возможности на
портале oncologyPRO. Также для
молодых специалистов существуют
образовательные семинары - ESMO
Preceptorship, некоторые посвящены
опухолям головы и шеи. Они представляют собой серию докладов ведущих европейских специалистов с
дальнейшем обсуждением клинических случаев. В связи с пандемией
COVID-19 данные образовательные
программы проводятся в режиме онлайн. Для принятия участия в данных
образовательных курсах необходимо
быть членом ESMO, а также подать заявку с резюме и клиническим случаем.
В случае отбора, вам предоставляется
возможность обсудить клинический
случай с ведущими европейскими
экспертами.
Открытый медицинский институт
(Open Medical Institute).
Представляет собой международную
образовательную инициативу для
медицинских работников, которая
существует с 1993 года. Основной образовательной программой данный
инициативы являются семинары по
определенным разделам медицины,
продолжительность которых составляет два дня. В том числе проводятся
семинары по онкологическим направлениям.
В связи с пандемией COVID-19 данные образовательные программы
проводятся в основном в дистанционном формате. Для подачи заявки
на участие необходимо отправить
резюме. Представление клинического
случая не требуется.
Помимо данных образовательных
возможностей существуют профильные медицинские издания и
образовательные мероприятия, организованные национальными профессиональными сообществами - Российского общества специалистов по
опухолям головы и шеи и российского общества клинической онкологии.
ОБНОВЛЕННЫЕ РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ MONARCHE: АДЪЮВАНТНАЯ ТЕРАПИЯ АБЕМАЦИКЛИБОМ В КОМБИНАЦИИ С ГОРМОНОТЕРАПИЕЙ ПРИ РАННЕМ РАКЕ МОЛОЧНОЙ ЖЕЛЕЗЫ ВЫСОКОГО РИСКА РЕЦИДИВА
Автор: Семиглазова Татьяна Юрьевна,
Шарашенидзе Софико Мамуковна ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России
В ходе пленарного заседания ESMO, которое состоялось 14-15 октября, экспертами клинической онкологии были обсуждены обновленные результаты рандомизированного исследования III фазы MonarchE. Ранее уже были доложены сведения о клинически значимом увеличении выживаемости без инвазивного заболевания и выживаемости без отдаленного рецидива у больных гормонопозитивным HER2-негативным ранним раком молочной железы (HR+HER2-рРМЖ) высокого риска [1]. Двенадцатого октября 2021 года FDA одобрило применение абемациклиба в комбинации с гормонотерапией (тамоксифеном или ингибитором ароматазы) в адъювантной терапии данной группы больных с высоким индексом ki-67≥20% [2]. Известно, что больные HR+HER2- рРМЖ с метастазами в регионарных лимфатических узлах (ЛУ+) имеют высокий риск рецидива заболевания при проведении стандартной гормонотерапии (ГТ). Ингибиторы CDK 4/6 показали высокую эффективность при HR+HER2- метастатическом РМЖ. Возникает вопрос, возможно ли применение CDK 4/6 ингибиторов в адъювантном режиме с целью снижения риска рецидива в группе больных высокого риска. В исследовании были проанализированы сведения о 5637 пациентах, которые были рандомизированы в соотношении 1:1 и получали адъювантную гормонотерапию как минимум в течение 5 лет ± абемациклиб 2 года. В первую когорту включались пациенты с ≥4 подмышечными лимфатическими узлами (ЛУ+) или 1-3 ЛУ+ при условии наличия хотя бы одного из следующих факторов: степень дифференцировки G3, размер опухоли ≥ 5 см. Во вторую когорту включались пациенты с 1-3 ЛУ+ и высоким индексом ki-67 (≥20%). Первичной конечной точкой была выживаемость без инвазивного заболевания в популяции ITT (intention to treat), которая включала 1 и 2 когорты пациентов. Вторичные конечные точки: выживаемость без инвазивного заболевания у больных с высоким индексом ki-67, выживаемость без отдаленного рецидива, общая выживаемость и безопасность. При медиане наблюдения 19 мес, при назначении абемациклиба + ГТ, было выявлено снижение риска инвазивного заболевания [ОР – 0.71 95% ДИ 0.58-0.87, р=0.0009]. При дополнительном анализе, медиана наблюдения достигала 27 месяцев, 90% пациентов завершили лечение, было отмечено преимущество выживаемости без инвазивного заболевания (ОР – 0.70 [95% ДИ 0.59-0.82], р<=0.0001) (рис. 1) и выживаемости без отдаленного рецидива у больных (ОР – 0.69 [95% ДИ 0.57-0.83], р<0.0001) [3].
Рисунок 1.
Выживаемость без инвазивного заболевания
в ITT популяции
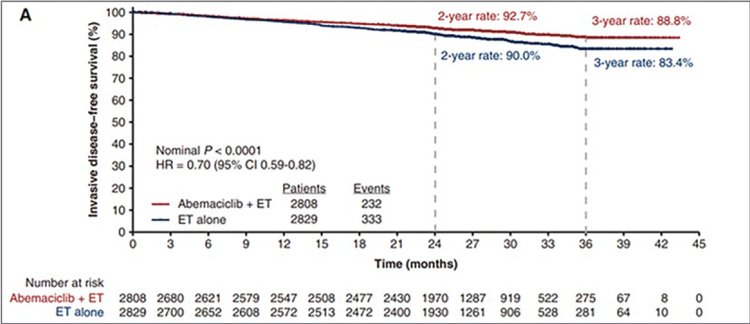
Абсолютное увеличение в 3-годичной выживаемости составило 5,4 и 4,2%, соответственно. Индекс ki-67 имел прогностическое значение, однако преимущество от назначения абемациклиба наблюдалось вне зависимости от уровня ki-67. При анализе безопасности удалось выявить, что нежелательные явления ≥3 степени тяжести и серьезные НЯ чаще возникали в лечебной группе абемациклиба в комбинации с ГТ по сравнению с только ГТ (50% против 16% и 15% против 9%, соответственно). Наиболее частыми НЯ являлись диарея, нейтропения и усталость в группе пациентов получавших абемациклиб. В итоге 181 пациент (6,5%) в группе абемациклиба и 30 пациентов (1,1%) в группе контроля завершили участие в исследовании до окончания по причине развития НЯ. Преимущество должно быть сбалансировано с риском, в особенности с риском развития диареи, ВТЭО и пневмонита. Кроме того, необходимо более длительное наблюдение, так как рецидив заболевания может возникать спустя 3 года. Также большое значение приобретает поддержание приверженности лечению больных при адъювантной терапии. Таким образом, для пациентов HR+HER2- рРМЖ железы высокого риска, адъювантная терапия абемациклибом с ГТ продемонстрировала клинически значимое преимущество в 3-летней выживаемости без инвазивного заболевания, особенно в когорте больных с высоким уровнем ki67.
Источники:
1. Johnston S.R.D., Harbeck N., Hegg R., et al. Abemaciclib Combined with Endocrine Therapy for the Adjuvant Treatment of HR+, HER2-, NodePositive, High-Risk, Early Breast Cancer (monarchE). J Clin Oncol. 2020 ;38(34):3987-3998.
2. FDA approves abemaciclib with endocrine therapy for early breast cancer | FDA
3. N. Harbeck, P. Rastogi, M. Martin et
al. Adjuvant abemaciclib combined with
endocrine therapy for high-risk early
breast cancer: updated efficacy and Ki67 analysis from the monarchE study.
Annals of Oncology. 2021.
НОВОСТИ КОНГРЕССА ESMO21: ФИНАЛЬНЫЕ РЕЗУЛЬТАТЫ ОБЩЕЙ ВЫЖИВАЕМОСТИ В ИССЛЕДОВАНИИ ARCHES У БОЛЬНЫХ мГЧРПЖ
В течение последнего десятилетия
возможности терапии больных метастатическим раком предстательной
железы значительно расширились, а
онкологические результаты лечения
существенно улучшились. Стандартом терапии больных с первично
выявленным метастатическим гормоно-чувствительным раком предстательной железы (мГЧРПЖ) или
больных, у которых метастазы развились после лечения локализованного
или местно-распространенного процесса, несколько десятилетий являлась андроген-депривационная терапия (АДТ) в варианте хирургической
или медикаментозной кастрации
(кастрационная терапия). Несмотря
на то, что АДТ у больных мГЧРПЖ
может приводить к купированию
симптомов заболевания, регрессии
опухолевых очагов, снижению уровня простато-специфического антигена (ПСА), в крупных исследованиях
не было получено данных о достоверном увеличении выживаемости
пациентов при проведении немедленной кастрационной терапии. Попытки улучшить результаты лечения
путем добавления к АДТ стероидных
и нестероидных антиандрогенов 1
поколения (флутамид, бикалутамид,
ципротерон) не привели к успеху:
рандомизированные исследования
со схожим дизайном демонстрировали различные результаты в отношении выживаемости больных, а метаанализ 27 протоколов показал, что
комбинированная или максимальная
андрогенная блокада приводит к увеличению 5-летней выживаемости
всего на 1,8%, но при этом значительно увеличивает частоту побочных
реакций.
Первым вариантом комбинированного подхода к лечению больных
мГЧРПЖ, который показал достоверное и значительное увеличение
выживаемости, явилась комбинация
АДТ и химиотерапии с доцетакселом. В исследовании CHAARTED добавление доцетаксела к стандартной
кастрационной терапии привело к
увеличению медианы общей выживаемости (ОВ) на 16,8 мес. (ОР=0,63;
95% ДИ 0,50-0,79; P<0,001) в группе
больных с высокой метастатической
нагрузкой. В то же время комбинированная химиогормональная терапия
приводила к увеличению частоты
нежелательных явлений (НЯ), прежде всего гематологических: частота
развития фебрильной нейтропении
составила 6% и 15% в исследованиях
CHAARTED и STAMPEDE, соответственно.
Энзалутамид является антиандрогеном 2 поколения, воздействующим
на все пути передачи сигнала андрогенных рецепторов и блокирующим
репликацию опухолевых клеток.
Препарат был впервые одобрен в
РФ в 2016 году для лечения больных
метастатическим кастрационно-резистентным раком предстательной
железы (КРРПЖ) до и после химиотерапии доцетакселом на основании
данных исследований PREVAIL и
AFFIRM. В 2019 году препарат был
одобрен для лечения больных неметастатическим КРРПЖ на основании
данных исследования PROSPER. Также в 2019 году были получены первые
результаты двух крупных многоцентровых рандомизированных исследований (ARCHES и ENZAMET), в
которых изучали эффективность и
токсичность комбинации энзалутамида (160 мг в сутки) и АДТ у больных мГЧРПЖ в сравнении с АДТ. Результаты этих исследований привели
к регистрации в 2020 году нового показания для препарата энзалутамид в
лечении больных мГЧРПЖ.
В рандомизированном исследовании
3 фазы ENZAMET сравнивалась терапия энзалутамидом в комбинации
с АДТ с антиандрогеном 1 поколения
в комбинации с АДТ у 1125 больных
мГЧРПЖ. При первом промежуточном анализе с медианой наблюдения
34 месяца была достигнута первичная цель исследования ENZAMET
в виде увеличения общей выживаемости больных мГЧРПЖ в группе
раннего назначения энзалутамида
в комбинации с АДТ со снижением
риска смерти на 33% (ОР=0,67; 95%
ДИ: 0,52 – 0,86; р=0,002). Все дополнительные цели, такие как выживаемость без прогрессии с оценкой
по уровню ПСА и клиническому
прогрессированию, имели положительное значение с преимуществом
в группе комбинированной терапии
с энзалутамидом. Таким образом,
комбинация энзалутамида с АДТ по
данным исследования ENZAMET
привела к достоверному увеличению
ОВ, выживаемости без клинического
и биохимического прогрессирования
по сравнению со стандартной терапией (комбинация АДТ с нестероидными антиандрогенами первого поколения). Добавление энзалутамида
к АДТ был ассоциировано с некоторым увеличением частоты НЯ, в частности утомляемости и судорог.
В рандомизированное исследование
3 фазы ARCHES включили 1150 больных мГЧРПЖ вне зависимости от
факторов прогноза течения заболевания. Больных рандомизировали в соотношении 1:1 в группу комбинации
АДТ и энзалутамида и в группу АДТ
+ плацебо. Стратификация выполнялась по степени распространенности
онкологического процесса (высокая и низкая распространенность) и
предшествующей химиотерапии доцетакселом (терапия не проводилась,
от 1-5 или 6 курсов). Высокая распространенность онкологического
процесса оценивалась по критериям
CHAARTED: 4 и более костных метастазов, один из которых находится
вне осевого скелета (позвоночник и
кости таза) или наличие висцеральных метастазов. У пациентов, включенных в исследование, высокая распространенность метастатического
процесса отмечена у 61,7 % в группе
энзалутамида и у 64,8 % в группе
плацебо соответственно. Первичной конечной точкой в данном исследовании являлась выживаемость
без прогрессирования по данным
радиологического обследования
(рВБП). Основными вторичными
конечными точками явились: общая выживаемость, время до ПСАпрогрессирования, время до инициации новой противоопухолевой
терапии, частота встречаемости не
поддающегося обнаружению уровня
ПСА, частота развития объективного
ответа. При медиане наблюдения 14,4
месяца была достигнута первичная
цель исследования ARCHES в виде
увеличения радиологической выживаемости без прогрессирования
у больных мГЧРПЖ в группе назначения энзалутамида в комбинации
с АДТ со снижением риска прогрессирования или смерти на 61% (ОР
= 0,39; 95 % ДИ: 0,30 – 0,50; р<0,001).
Профиль безопасности энзалутамида соответствовал полученным ранее
данным в исследованиях с участием
больных кастрационно-резистентным РПЖ. Нежелательные явления,
связанные с приемом энзалутамида
в данных исследованиях, включали
усталость, судороги и гипертензию.
Таким образом, первичный анализ
результатов исследования ARCHES
показал высокую эффективность
энзалутамида в комбинации с АДТ
у больных с мГЧРПЖ в отношении
увеличения времени до прогрессирования заболевания. При этом данные
по общей выживаемости на момент
первичного анализа данных еще
были незрелые.
18 сентября 2021 года на конгрессе
ESMO21 были представлены финальные результаты исследования
ARCHES по оценке общей выживаемости и времени до последующей
противоопухолевой терапии. На момент окончания сбора данных в мае
2021 года медиана наблюдения составила 44,6 месяца. Средняя продолжительность лечения составила 40,2
месяца для энзалутамида + АДТ, 13,8
месяца для плацебо + АДТ и 23,9 месяца для пациентов группы плацебо,
перешедших на терапию энзалутамидом после расслепления исследования
в 2019 году. Комбинация энзалутамида + АДТ достоверно увеличивала общую выживаемость больных
мГЧРПЖ по сравнению с плацебо +
АДТ со снижением риска смерти на
34% (ОР 0,66; 95 % ДИ 0,53-0,81; р <
0,0001). Важно отметить, что увеличение выживаемости наблюдалось
независимо от ранее проведенной терапии доцетакселом, объема метастатического поражения, индекса Глисона и локализации метастазов. Кроме
того, при назначении энзалутамида в
сочетании с АДТ увеличивалось время до последующей противоопухолевой терапии по сравнению с плацебо
+ АДТ. При анализе этих данных
надо принимать во внимание то, что
с учетом кроссовера (n=180), 42% пациентов, исходно получавших АДТ +
плацебо, получили терапию энзалутамидом и 70% пациентов, исходно получавших АДТ + плацебо, получили в
последующем терапию, приводящую
к наилучшим отдаленным результатам лечения. Более зрелые результаты
исследования ARCHES демонстрируют достоверное увеличение общей
выживаемости с разницей в 4% через
2 года, 9% через 3 года и 14% через 4
года. Разница в общей выживаемости
становится более значимой при длительном наблюдении. Таким образом,
результаты исследования ARCHES
показали, что энзалутамид в сочетании с АДТ, на сегодняшний день, является стандартом лечения большинства подгрупп пациентов мГЧРПЖ.
На основании данных этих исследований энзалутамид в комбинации с
АДТ следует рассматривать в качестве стандарта терапии первой линии
у больных метастатическим гормоночувствительным РПЖ. Возможность
применения энзалутамида у больных
мГЧРПЖ включена в клинические
рекомендации МЗ РФ 2021 по лечению больных РПЖ, а также в стандарт медицинской помощи взрослым
при раке предстательной железы (утвержден приказом МЗ РФ №1244н от
24.11.2020).

ВЫХОДЯ ЗА ГОРИЗОНТ СОБЫТИЙ: ПРОГРЕСС В ЛЕКАРСТВЕННОЙ ТЕРАПИИ НЕМЕТАСТАТИЧЕСКОГО НМРЛ
Введение
Основная цель терапии пациентов с неметастатическим НМРЛ – излечение. Несмотря на многочисленные исследования в течение последних 60 лет, разработка системных методов лечения неметастического НМРЛ была затруднена гетерогенностью этой группы пациентов. Мультидисциплинарное обсуждение стратегии лечения таких пациентов необходимо для того, чтобы определить, какое радикальное лечение можно провести пациенту, и подобрать последующее системное лечение для повышения шансов на излечение [1].
Адъювантная терапия для операбельного НМРЛ
В течение последних 15 лет единственной опцией адъювантной лекарственной терапии была химиотерапия (ХТ) на основе препаратов платины [2]. Применение адъювантной ХТ позволило снизить риск развития рецидива или смерти не более чем на 24% [3-6]. Однако в связи с высокой токсичностью от трети до половины пациентов в рутинной клинической практике не получают полное число циклов [7,8]. И лишь около 40% пациентов в принципе получают адъювантную химиотерапию [8,9]. Все это приводит к тому, что почти у половины пациентов со стадией IB и более чем у 75% пациентов со стадией IIIА развивается рецидив заболевания [3]. Для пациентов с EGFR мутацией ситуация усугубляется тем, что уже при первом рецидиве в 97% случаев обнаруживаются отдаленные метастазы [10]. Неудивительно, что поиск новых возможностей лечения был начат с этой группы пациентов, что и привело к регистрации осимертиниба, ИТК EGFR 3-го поколения, в качестве адъювантной терапии EGFRm НМРЛ IB-IIIA стадии. Регистрация нового показания препарата была основана на результатах исследования ADAURA [11].
Дизайн и ключевые результаты исследования ADAURA.
В данное исследование было включено 682 пациента с НМРЛ IB-IIIA стадии после полной резекции с мутацией в гене EGFR (делеция в 19 экзоне или мутация L858R в 21 экзоне). Проведение пред- или послеоперационной лучевой терапии не допускалось, но пациенты могли получать адъювантную химиотерапию на основе препарата платины по решению врача и пациента. После завершения стандартного лечения пациенты получали осимертиниб или плацебо в течение 3х лет, до рецидива или выполнения других критериев отмены лечения, в зависимости от того, что наступит раньше. Первичной конечной точкой исследования была безрецидивная выживаемость (БРВ) у пациентов с НМРЛ II-IIIA стадии. Запланированное отношение рисков для подтверждения преимущества осимертиниба (ОР) согласно протоколу исследования было равно 0,70, а согласно результатам исследования ОР составило 0,17 (99,06% ДИ 0,11-0,26; P<0,001), что соответствует снижению риска рецидива или смерти на 83% при применении адъювантной терапии осимертинибом в сравнении с плацебо в группе пациентов с НМРЛ II-IIIA стадии. Обращает на себя внимание высокий риск рецидива в группе сравнения: медиана безрецидивной выживаемости у пациентов с НМРЛ II-IIIA стадии составила всего 19,6 месяцев, а 2-летняя безрецидивная выживаемость – 44%, т.е. более чему у половины пациентов с мутацией в гене EGFR, несмотря на радикальную операцию и адъювантную химиотерапию, через 2 года развился рецидив. Результат для всей популяции пациентов - НМРЛ IB-IIIA стадии был сопоставимым: ОР 0,20 (99.12% ДИ 0,14-0,30; P <0,001), что соответствует снижению риска на 80%. Немаловажно отметить, что осимертиниб продемонстрировал преимущество по БРВ во всех заранее определенных подгруппах (независимо от типа мутации, анамнеза курения, возраста пациента, стадии и факта проведения предшествующей адъювантной химиотерапии). Характеристика первого рецидива На момент окончания сбора данных для промежуточного анализа рецидив заболевания зарегистрирован у 11% пациентов, получавших осимертиниб, и 46% пациентов, получавших плацебо. При этом большинство рецидивов в группе осимертиниба носили локальный характер (7 из 11%). Только у 1% пациентов выявлено метастатическое поражение ЦНС. В то же время в группе плацебо более половины рецидивов сопровождались развитием отдаленных метастазов (28 из 46%), у 10% пациентов отмечались метастазы в ЦНС. При применении осимертиниба в адъювантном режиме достигнуто снижение риска развития метастазов в ЦНС или смерти на 82% (ОР 0,18; 95% ДИ 0,10–0,33; p<0,0001). Общая выживаемость Данные по общей выживаемости на момент промежуточного анализа были незрелыми (зрелость данных в группе пациентов с НМРЛ II-IIIA стадии составила 5%). Важно отметить, что несмотря на публикацию результатов, исследование попрежнему заслеплено для врачей и пациентов (как завершивших, так и продолжающих лечение в рамках исследования). Это позволит в будущем получить результаты по общей выживаемости. Однако на ESMO 2021 уже была опубликована модель прогнозирования отдаленных результатов применения осимертиниба в адъювантном режиме. Ожидаемый прирост 5-летней общей выживаемости в абсолютном значении составляет 14,3% [12]:
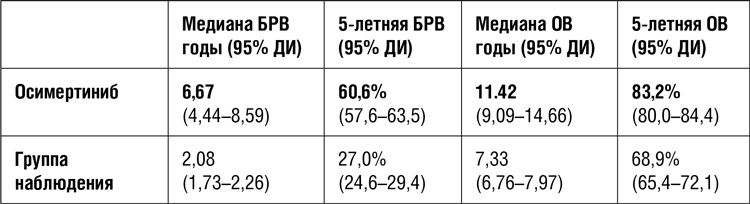
Можно также провести параллели с другими нозологиями, при которых изучали ИТК в качестве адъювантной терапии. Так, в исследовании COMBI-AD у пациентов с резектабельной меланомой III стадии с мутацией в гене BRAF комбинация ингибиторов BRAF и МЕК дабрафениба и траметиниба применялась в течение года в адъювантном режиме. Преимущество в отношении БРВ сохранялось в течение всего пятилетнего периода наблюдения (пятилетняя БРВ в группе комбинированной терапии составила 52%, в группе плацебо – 36%). Медиана БРВ в группе таргетной терапии не достигнута, а в группе плацебо составила 16,6 месяца (ОР 0,51; 95% ДИ 0,42–0,61). Выживаемость без отдаленных метастазов через пять лет в группе дабрафениб + траметиниб достигла 65%, в группе плацебо этот показатель составил 54% (ОР 0,55; 95% ДИ 0,44–0,70). Таким образом, применение таргетной терапии может приводить к долгосрочному увеличению БРВ спустя продолжительное время после окончания адъювантной терапии [13]. Осимертиниб рекомендован в адъювантном режиме пациентам с НМРЛ IB–IIIA стадии с мутацией в гене EGFR после полной резекции опухоли ведущими российскими и международными онкологическими обществами [15,20-22].
Поддерживающая иммунотерапия у пациентов с нерезектабельным НМРЛ III стадии, не имеющих признаков прогрессирования заболевания после ХЛТ
В 2020 году в России каждый четвертый пациент с НМРЛ выявлялся с III стадией заболевания [9]. На сегодняшний день принято, что целью терапии НМРЛ III стадии является попытка излечения пациента [20]. При этом пациенты с IIIA стадией считаются условно операбельными, а пациенты с исходной IIIB/ IIIC считаются неоперабельными [15]. В случае, если пациент исходно не операбелен, на первом этапе лечения рекомендуется проведение химиолучевой терапии (ХЛТ). В зависимости от функционального состояния может быть выбрано как одновременное (ECOG 0-1), так и последовательное применение двух методов лечения (ECOG 2). Предпочтительным будет одновременное применение двух методов. В 2017 году были впервые представлены данные рандомизированного двойного слепого плацебоконтролируемого исследования III фазы PACIFIC – применение дурвалумаба (моноклонального антитела к PD-L1) у пациентов с нерезектабельным НМРЛ III стадии, не имеющих признаков прогрессирования после проведенной ХЛТ [16]. Дизайн и ключевые результаты исследования PACIFIC [16]. В исследование включались пациенты с местно-распространенным нерезектабельным НМРЛ III стадии, не имеющие признаков прогрессирования заболевания после радикальной одновременной ХЛТ (СОД 60 Гр +/- 10%; ≥2 курсов химиотерапии одновременно с лучевой терапией), с функциональным статусом ECOG 0-1, независимо от статуса экспрессии PD-L1 и наличия активирующих мутаций EGFR/ ALK. Всего было включено 713 пациентов, которые были рандомизированы в течение 1–42 дней после окончания химиолучевой терапии в соотношении 2:1 в две группы сравнения. Первая группа получала дурвалумаб 10 мг/кг каждые две недели до 12 месяцев (n=476), вторая получала плацебо каждые две недели до 12 месяцев (n=237). Первичными конечными точками являлись ОВ и ВБП. В рамках первичного анализа 1-летняя ВБП в группе получавших дурвалумаб составила 56% против 35% в группе плацебо. Медиана ВБП в группе получавших дурвалумаб составила 16,8 месяца против 5,6 месяцев в группе плацебо. Медиана ОВ в группе получавших Имфинзи не была достигнута в рамках 2-летнего наблюдения, составив в группе плацебо 28,7 месяца. 2-летняя ОВ составила 66% в группе получавших дурвалумаб против 55% в группе плацебо [19]. В июне этого года, в рамках конгресса ASCO, были представлены данные 5-летнего наблюдения за пациентами в исследовании PACIFIC [17]. Анализ данных ВБП показал, что применение дурвалумаба у пациентов без признаков прогрессирования после проведенной ХЛТ, снижает риск прогрессирования заболевания на 45% по сравнению с применением плацебо (отношение рисков (ОР) = 0,55; 95% ДИ, 0,45–0,68)). Треть пациентов в группе дурвалумаба не имели признаков прогрессирования заболевания спустя 5 лет, а медиана ВБП составила 16,9 месяца, по сравнению с 5,6 месяцев в группе получавших плацебо. Анализ данных ОВ показал, что применение дурвалумаба у пациентов без признаков прогрессирования после проведенной ХЛТ, снижает риск смерти на 28% по сравнению с применением плацебо (отношение рисков (ОР) = 0,72; 95% ДИ, 0,59–0,89)), при этом 42,9% пациентов в группе получавших дурвалумаб оставались живы спустя 5 лет после начала иммунотерапии, а медиана ОВ составила 47,5 месяца, по сравнению с 29,1 месяца в группе получавших плацебо.

Важно, что преимущество терапии дурвалумабом над плацебо по ОВ наблюдалось независимо от глубины ответа на предшествующую ХЛТ и времени начала поддерживающей терапии, хотя наибольшую выгоду получали пациенты, начинавшие иммунотерапию дурвалумабом в течение 2 недель после завершение ХЛТ [18]. Таким образом, назначение дурвалумаба у пациентов с нерезектабельным НМРЛ III стадии, не имеющих признаков прогрессирования заболевания после ХЛТ, позволяет статистически и клинически значимо увеличить как ВБП, так и ОВ по сравнению с плацебо. Немаловажно, что данные по безопасности указывают на статистически сопоставимые показатели в группе получавших дурвалумаб и группе плацебо [19]. На основании результатов исследования PACIFIC дурвалумаб включен в клинические рекомендации как стандарт терапии нерезектабельного НМРЛ III стадии у пациентов, получивших ХЛТ и не имеющих признаков прогрессирования заболевания после завершения ХЛТ [20].
Заключение
Дурвалумаб после ХЛТ был первым шагом, который изменил рутинную практику и позволил улучшить прогноз у пациентов с местно-распространенным НМРЛ. А сегодня мы уже внедряем молекулярно-генетическое тестирование с целью поиска мутации в гене EGFR и возможности последующего применения осимертиниба в адъювантном режиме. Эти новые решения дают новые возможности для врачей и перспективы для пациентов.
Список литературы:
1. Chaft et al, Nature Reviews Clinical Oncology volume 18, pages 547–557 (2021)
2. Parsons S, et al. JAMA Network Open. Parsons S, et al. JAMA Network Open.
3. Pignon J-P, et al. J Clin Oncol. 2008;26(21):3552-3559;
4. Douillard JY, et al. Lancet Oncol 2006; 7:719–727;
5. IALT Collaborative Group. N Engl J Med 2004; 50:351–360;
6. Arriagada R, et al. J Clin Oncol. 2010 Jan 1;28(1):35-42;
7. Alam N et al. Lung Cancer. 2005;47:385-394
8. Chouaid C et al. Lung Cancer.2018;124:310-316;
9. Состояние онкологической помощи населению России в 2020 году, под редакцией А.Д. Каприна, В.В. Старинского, А.О Шахзадовой. М:МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России. – 2021. – 239с.
10.Galvez C, et al. Oncotarget. 2020;11(21):1953-1960
11.Wu YL,et al. Osimertinib in Resected EGFR-Mutated Non-SmallCell Lung Cancer. N Engl J Med. 2020;383(18):1711-1723;
12.Cheema et al, Poster 1165P, ESMO 2021
13.Dummer R., Hauschild A., Santinami M. et al. Five-year analysis of adjuvant dabrafenib plus trametinib in stage III melanoma //N. Engl. J. Med. 2020. Vol. 383. № 12. P. 1139–1148.
14.Donington J, Ferguson M, Mazzone P, et al. American College of Chest Physicians and Society of Thoracic Surgeons consensus statement for evaluation and management for highrisk patients with stage I non-small cell lung cancer. Chest. 2012;142(6):1620- 1635. doi:10.1378/chest.12-0790.
15.Клинические рекомендации: Рак лёгкого. Профессиональные ассоциации: Ассоциация онкологов России, Российское общество клинической онкологии. [электронный ресурс] Дата доступа: 01.02.2021 URL: http://cr.rosminzdrav.ru/ recomend/30_1
16.Antonia SJ, Villegas A, Daniel D, et al. Durvalumab after chemoradiotherapy in stage III non-small-cell lung cancer. N Engl J Med 2017;377:1919-29. 10.1056/ NEJMoa1709937
17.D.R. Spigel, C. Faivre-Finn, J.E. Gray et al. Five-year survival outcomes with durvalumab after chemoradiotherapy in unresectable stage III NSCLC: An update from the PACIFIC trial. Journal of Clinical Oncology 2021 39:15_suppl, 8511-8511. https://ascopubs.org/ doi/abs/10.1200/JCO.2021.39.15_ suppl.8511
18.Gray JE, Villegas A, Daniel D, et al. Three-Year Overall Survival with Durvalumab after Chemoradiotherapy in Stage III NSCLC-Update from PACIFIC. J Thorac Oncol. 2020;15(2):288-293. doi:10.1016/j. jtho.2019.10.002
19.Paz-Arez A et al. Poster presented at: ESMO Annual Meeting, September 8-12, 2017; Madrid, Spain.
20.Лактионов К. К., Артамонова Е. В., Бредер В. В., Горбунова В. А., Моисеенко Ф. В., Реутова Е. В. и соавт. Практические рекомендации по лекарственному лечению немелкоклеточного рака легкого. Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2020 (том 10).02
21. NCCN Clinical Practice Guidelines in Oncology. Non-small cell lung cancer. Version 6.2021. https:// www.nccn.org/store/ login/login. aspx?RetumURL=https://www.nccn. org/professionals/physician_gls/ pdf/nscl.pdf. (дата обращения 24.10.2021).
22.J. Remon, J.-C. Soria, S. Peters et al. Ann of Oncol 2021 https://www. annalsofoncology.org/action/showPd f?pii=S0923-7534%2821%2904279-4 Дата обращения: 18.10.21
Информация подготовлена и предоставлена компанией АстраЗенека
Контактная информация: ООО «АстраЗенека Фармасьютикалз», 123100, город Москва, 1-й Красногвардейский проезд, дом 21, строение 1, этаж 30. Тел.: +7 (495) 799-56-98, www.astrazeneca.ru;
номер одобрения TAG- RU-11714
дата одобрения 29.10.21
дата истечения 29.10.23





