Дорогие коллеги, дорогие друзья!
Октябрь, еще пара месяцев до финала очередного года. Бабье лето позади, и осень теряет свои краски, солнечные лиственно-пряные дни сменились сероватыми и дождливыми. Все становится более...

Пьер Огюст Ренуар.
Зонтики. 1881. Холст, масло, 180х115 см. Национальная галерея, Лондон
Лев Ошанин.
*** Я совсем отвык от дождя – Ослепительным было лето. И теперь дождь стучит за это, Душу каплями холодя...

К ЮБИЛЕЮ НАТАЛЬИ ИННОКЕНТЬЕВНЫ ПЕРЕВОДЧИКОВОЙ
10 октября исполнилось бы 100 лет человеку, чье имя известно не только онкологам со стажем, но и молодым врачам, делающим первые шаги в нашей специальности, – одному из основоположников отечественной клинической...
НОВОСТИ ОБЩЕСТВА / ТУЛА ВСТРЕТИЛА БЛАГОТВОРИТЕЛЬНУЮ АКЦИЮ «КНИГОТЕРАПИЯ RUSSCO»
4 октября в Туле прошла благотворительная просветительская акция «Книготерапия RUSSCO», которая организована и проводится Российским обществом клинической онкологии...
НОВОСТИ ОБЩЕСТВА / ПРЕМИЮ ИМЕНИ АКАДЕМИКА А.И. САВИЦКОГО ЛУЧШЕМУ ХИМИОТЕРАПЕВТУ ВРУЧИЛ ПРОФЕССОР С.А. ТЮЛЯНДИН
18 сентября состоялась торжественная церемония вручения ежегодной Премии имени академика А.И. Савицкого, учрежденной Общероссийским национальным союзом «Ассоциация онкологов России»...
НОВОСТИ ОБЩЕСТВА / В НИЖНЕМ НОВГОРОДЕ ПРОШЕЛ ЭКЗАМЕН RUSSCO ПО КЛИНИЧЕСКОЙ ОНКОЛОГИИ
10 октября Российское общество клинической онкологии (RUSSCO) в рамках работы научно-практической онкологической конференции «ВОЛЖСКИЕ ОГНИ VII» провело экзамен по клинической онкологии....
ЭКЗАМЕН ПО КЛИНИЧЕСКОЙ ОНКОЛОГИИ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ (RUSSCO)
12 ноября 2024 г. с 15:00-17:30 в Москве в рамках работы XXVIII Российского онкологического конгресса состоится очередной экзамен Российского общества клинической онкологии (RUSSCO).
НОВОСТИ ОБЩЕСТВА / РЕЗОЛЮЦИЯ ПО РЕЗУЛЬТАТАМ СЕССИИ RUSSCO «ЗАКЛЮЧЕНИЕ NGS, КОНСЕНСУС МЕЖДУ ГЕНЕТИКОМ И КЛИНИЦИСТОМ»
Сессия состоялась 30 июля 2024 года в г. Горно-Алтайске, в рамках Всероссийской конференции «Опухолевые маркеры - фундаментальные и клинические аспекты», которая проходила с ...

НОВОСТИ ESMO 2024 / ОПУХОЛИ ЖКТ
В сентябре классически проходит одно из главных событий для каждого онколога – ежегодный конгресс ESMO. Мы только успели обдумать и обсудить все новости, которые пришли в лечение рака...
НОВОСТИ ESMO 2024 / ЗАВЕРШЕНА РАЗРАБОТКА КРИТЕРИЕВ ОЦЕНКИ КЛИНИЧЕСКОЙ ЗНАЧИМОСТИ ПРИМЕНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ТЕРАПИИ
Российское общество клинической онкологии (RUSSCO) совместно с экспертами ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России и другими ведущими онкологическими учреждениями...
НОВОСТИ ESMO 2024 / АНТАГОНИСТ ПРОТЕИНА EWS::FLI1 ПРИ САРКОМЕ ЮИНГА: ИССЛЕДОВАНИЕ I/II ФАЗЫ
Слияние белков EWS и FLI1 имеет важнейшее патогенетическое и диагностическое значение для саркомы Юинга, но таргетно воздействовать на новообразованный онкопротеин (EWS::FLI1) долгое...

НОВОСТИ ESMO 2024 / ОПУХОЛИ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ И ГЕПАТОБИЛИАРНОЙ ЗОНЫ
Первый день конгресса ESMO начался с секции по опухолям верхних отделов ЖКТ, и вот что нам удалось узнать...

НОВОСТИ ESMO 2024 / ОНКОУРОЛОГИЯ
Завершившийся конгресс ESMO 2024 оказался богат на различные исследования в онкоурологии. Все больше и больше лекарственных препаратов и комбинаций изучается как при локализованных...

НОВОСТИ ESMO 2024 / ПОСВЯЩЕННЫЕ ЛЕЧЕНИЮ НМРЛ
Исследования последнего времени показали, что применение ингибиторов контрольных точек может позволить иммунной системе реализовывать выраженный противоопухолевый эффект. При этом...

НОВОСТИ ESMO 2024 / МЕСТНОРАСПРОСТРАНЕННАЯ МЕЛАНОМА КОЖИ
Прошедший недавно конгресс ESMO 2024 не был богат на новые данные в лечении меланомы, но мы выбрали кое-что интересное. Захотим ли и сможем ли мы воспользоваться полученными...

НОВОСТИ ESMO 2024 / РАК МОЛОЧНОЙ ЖЕЛЕЗЫ
Современные конъюгаты антител с цитостатиком активно изучаются при раке молочной железы (РМЖ), а некоторые, такие как трастузумаб дерукстекан (T-DXd), уже внедрены и в рутинную...

ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / МЫШЕЧНО-ИНВАЗИВНЫЙ РАК МОЧЕВОГО ПУЗЫРЯ (МИРМП): ОТДАЛЕННЫЕ РЕЗУЛЬТАТЫ В ЗАВИСИМОСТИ ОТ ЧИСЛА КУРСОВ ХТ
Неоадъювантная химиотерапия с последующей радикальной цистэктомией – стандартный подход ведения пациентов с МИРМП. На практике значительной части пациентов удается провести...
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / COMBINAIR 3 TRIAL: РОЛЬ ПЭТ-КТ С 18ФДГ У ПАЦИЕНТОВ С НАЧАЛЬНОЙ СТАДИЕЙ САРКОМЫ ЮИНГА
Во французском проспективном исследовании II фазы, в которое было включено 43 пациента с саркомой Юинга без метастазов в легкие, но с биопсией костного мозга, подтверждающей его...
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / МЕТААНАЛИЗ ЭФФЕКТИВНОСТИ РАЗЛИЧНЫХ ВАРИАНТОВ ПЕРВОЙ ЛИНИИ ТЕРАПИИ У ПАЦИЕНТОВ С EGFR МУТАЦИЯМИ НМРЛ С МЕТАСТАЗАМИ В ГОЛОВНОЙ МОЗГ
Наверное, это первый метаанализ, в который включены только пациенты с метастазами в головной мозг. На основании данных 24 рандомизированных клинических исследований в анализ были...

УГОЛОК РАДИОТЕРАПЕВТА... / ХЛТ ПРИ РАКЕ ТОЛСТОЙ КИШКИ? СЕРЬЕЗНО?!..
...Да-да, не вы один поймали себя на этой мысли! Мы давно привыкли к постулатам, что лучевая/химиолучевая терапия при местнораспространенных опухолях толстого кишечника – тех, что выше...
УГОЛОК РАДИОТЕРАПЕВТА... / ОЛИГОМЕТАСТАЗЫ КОЛОРЕКТАЛЬНОГО РАКА В ЛЕГКИЕ: ОПЕРИРОВАТЬ ИЛИ ОБЛУЧАТЬ?
Немало копий было сломано в дискуссиях в отношении оптимального подхода к лечению больных колоректальным раком (КРР) с метастазами в легкие. К слову сказать, этот подход, особенно этап...
ШКОЛА РАКФОНДА. ИТОГИ
В Москве с успехом прошла «Школа научных исследований для молодых онкологов». 29 специалистов из Калининграда, Санкт-Петербурга, Донецка, Читы и Москвы под руководством...

Глубокоуважаемые коллеги!
Приглашаем вас принять участие в XXVIII РОССИЙСКОМ ОНКОЛОГИЧЕСКОМ КОНГРЕССЕ, который пройдет 12-14 ноября 2024 г. в Москве.
Анонс
-

12-14 НОЯБРЯ 2024
XVIII РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС 2024
Москва
-

12 ноября 2024
ЭКЗАМЕН ПО КЛИНИЧЕСКОЙ ОНКОЛОГИИ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ (RUSSCO)
Москва
Дорогие коллеги, дорогие друзья!
Октябрь, еще пара месяцев до финала очередного года. Бабье
лето позади, и осень теряет свои краски, солнечные лиственно-пряные дни сменились сероватыми и дождливыми. Все
становится более медленным – восход солнца, мухи на окне,
мысли… Ренуар растянул написание дождливо-осенней картины «Зонтики» (одной из наиболее известных своих работ) на
несколько лет: изучение фасонов одежды экспертами показало,
что платья на женщинах, изображенных в правой части картины, соответствуют моде 1881 года, а платье на женщине слева
- моде 1886 года, и даже в манере письма художника произошли явные перемены. Этот звук – постукивание капель дождя
по куполу зонта, по крыше дома или лобовому стеклу машины
– на ближайшее время теперь с нами, настраивая кого-то на
философский, а кого-то на деловой лад.
Активность нашего сообщества в октябре однозначно не снизится. Мы готовимся к главному научному мероприятию года
– Российскому онкологическому конгрессу, и ждем вас 12-14
ноября 2024 года в Москве, в залах «Крокуса». Еженедельно в
различных регионах проходят тематические вебинары, к которым вы также можете подключиться, дабы освежить свои знания, а программу найти на сайте rosoncoweb.ru. На страницах
октябрьского и ноябрьского выпусков газеты мы напомним о
наиболее интересных данных прошедших осенью конгрессов
ESMO и ASTRO, а также познакомим вас с новостями крупных
журналов. Жизнь продолжается, и осенние дожди не препятствуют ей, а лишь придают свой особый сезонный колорит.
До встречи в ноябре, off-line, на XXVIII Российском онкологическом конгрессе!
Ваша команда RUSSCO.
Пьер Огюст Ренуар.
Зонтики. 1881. Холст, масло, 180х115 см.
Национальная галерея, Лондон

Лев Ошанин.
***
Я совсем отвык от дождя –
Ослепительным было лето.
И теперь дождь стучит за это,
Душу каплями холодя.
Непроглядное небо мутно...
Что ты сердишься, идиот!
Просто Осень, и дождь идет –
Это, в сущности, так уютно…
К ЮБИЛЕЮ НАТАЛЬИ ИННОКЕНТЬЕВНЫ ПЕРЕВОДЧИКОВОЙ

10 октября исполнилось бы 100
лет человеку, чье имя известно не
только онкологам со стажем, но и
молодым врачам, делающим первые шаги в нашей специальности,
– одному из основоположников
отечественной клинической онкологии, известной ученой, учителю,
профессору и просто красивой
женщине Наталье Иннокентьевне
Переводчиковой.
Наталья Иннокентьевна родилась
10 октября 1924 года в городе Иркутск, в семье заслуженного деятеля науки РСФСР, доктора медицинских наук, профессора Иннокентия
Николаевича Переводчикова
(1886-1961). «Мой папа в 1913 году
окончил медицинский факультет
Императорского Томского университета и в Первую мировую ушёл
на фронт военным врачом, – вспоминала в одном из интервью сама
Наталья Иннокентьевна. – Был
эпизод, когда во время тяжёлых
боёв из строя вышли все кадровые
офицеры, и папа вынужден был заменить командира. За подвиги против неприятеля он был пожалован
орденом Святого Владимира 4 степени с мечами и бантом, дающим
право на потомственное дворянство. Но правом этим воспользоваться не успел. Мама тоже ушла
на войну после окончания Харьковского Императорского университета. На фронте мои родители и
поженились. В мирное время папа
продолжал работать в госпиталях
– Омском и Иркутском, Иркутском мединституте. В Иркутске я
и родилась».
Позже семья перебралась в Астрахань, где с 1943 по 1948 год Н.И. Переводчикова обучалась в Астраханском государственном медицинском институте. По окончании ВУЗа попала в клиническую ординатуру по терапии, затем работала в том же институте в качестве ассистента кафедры госпитальной терапии.
«В онкологию я попала совершенно случайно, мне просто повезло. Я подготовила кандидатскую диссертацию по кардиологии, по электрокардиографии и поехала на защиту в г. Горький (Нижний Новгород). В то время Астраханский мединститут не имел права на проведение диссертационной защиты. На учёном совете случайно оказался Н.Н. Блохин, он уже работал в Москве и был приглашён оппонентом на защиту докторской диссертации по хирургии. Ему понравилось, как я выступила. Мой шеф, профессор терапии Шестаков Сергей Вячеславович, собирался переезжать из Астрахани в Куйбышев, куда его пригласили заведовать кафедрой, и он рекомендовал меня Николаю Николаевичу как терапевта». (Из воспоминаний Н.И. Переводчиковой.)
С 1955 году по приглашению академика Н.Н. Блохина была приглашена на научно-исследовательскую работу в Институт экспериментальной патологии и терапии рака АМН СССР (с 1988 года – Всесоюзный онкологический научный центр АМН СССР, ныне – Национальный медицинский исследовательский центр онкологии имени Н.Н. Блохина) и поначалу действительно занималась только терапией. Но в те годы как раз начинались первые исследования по химиотерапии, в которые Наталья Иннокентьевна с энтузиазмом внедрилась – и погрузилась на всю жизнь. Сначала в качестве научного и старшего научного сотрудника, с 1969 по 1989 год – как руководитель отделения химиотерапии, с 1989 по 2020 год – как ведущий научный сотрудник этого отделения, занималась клиническим изучением и внедрением в практику новейших групп цитостатиков – противоопухолевых антибиотиков, антиметаболитов.
В 1955 году защитила кандидатскую диссертацию по теме: «Об изменениях электрокардиограммы при грудной жабе (стенокардии) и о клинике и диагностике микроинфаркта миокарда», в 1964 году – докторскую диссертацию на соискание ученой степени доктора медицинских наук по теме: «Применение препаратов группы хлорэтиламинов в онкологической клинике». В 1973 году ВАК СССР присвоил ей ученое звание – профессор. Н.И. Переводчикова являлась автором более трехсот пятидесяти научных трудов, монографий и первого в Советском Союзе справочника по химиотерапии опухолевых заболеваний, изданного в 1984 году
С 1973 года Н.И. Переводчикова на основе сотрудничества Советского Союза и США в медицинской области, совместно с американскими учеными-онкологами из Национального института онкологии и других НИИ Национальных институтов здравоохранения США, занималась изучением цитостатиков и изучением режима комбинированной химиотерапии, в том числе при лечении мелкоклеточного рака легкого.
Н.И. Переводчикова являлась одним из авторов открытия синтеза и секреции в кровь α-фетопротеина (опухолевого маркера). В 1962 году являлась генеральным секретарем VIII Международного противоракового конгресса, проходившего в Москве. Н.И. Переводчикова являлась членом ESMO и RUSSCO.

Выдающийся вклад Н.И. Переводчиковой и ее коллектива в отечественную онкологию отмечен в 2001 году Государственной премией в области науки и техники «За разработку и внедрение в клиническую практику новых эффективных методов лекарственной терапии злокачественных опухолей».
В феврале 2020 года Н.И. Переводчикова стала победителем премии «Будем жить!» в номинации «Легенды онкологии», учрежденной Ассоциацией онкологических пациентов «Здравствуй!». «Получить знак признания от пациентов очень и очень приятно. У меня много государственных наград. Но эту награду я считаю главной. Потому что смысл моей работы и всей моей жизни – помогать людям, моим пациентам», – комментировала победу в номинации Наталья Иннокентьевна.
Октябрь подарил стране эту прекрасную женщину – октябрь и унес ее в возрасте 97 лет (25 октября 2021 года). Великолепная, долгая, яркая жизнь – словно факел для многих из нас. Ее образ – в элегантном костюме в первом ряду конференц-зала, где бы это ни было, с макияжем, приветливой улыбкой человека, интересующегося каждой минутой происходящего в этой жизни, – надолго останется в памяти.
НОВОСТИ ОБЩЕСТВА / ТУЛА ВСТРЕТИЛА БЛАГОТВОРИТЕЛЬНУЮ АКЦИЮ «КНИГОТЕРАПИЯ RUSSCO»
4 октября в Туле прошла благотворительная просветительская акция «Книготерапия
RUSSCO», которая организована
и проводится Российским обществом клинической онкологии
(RUSSCO). Тула стала девятым
областным центром, принимающим акцию. Ранее книги от
RUSSCO были переданы в дар
ЛПУ Самары, Ярославля, Ульяновска, Казани, Астрахани,
Оренбурга, Уфы и Твери.

В гости к пациентам и врачам
Тульского областного клинического онкологического диспансера приехали популярная детская
поэтесса и писатель Анна Гончарова, Александр Набоков, известный российский журналист,
главный редактор интернет-портала «Книжное обозрение», и
Сергей Сидоров, пресс-секретарь
RUSSCO, организатора акции и
писатель.
писатель.
Вел встречу А. Набоков, отметивший, что девиз акции «Читайте
на здоровье!» как нельзя лучше
отражает ее направленность, ведь
терапевтическое воздействие книг
на процесс выздоровления больных неоспорим.
С видеоприветствием к участникам акции обратился председатель
RUSSCO, профессор Дмитрий
Носов, который сказал: «Чтение
хороших книг помогает создать
позитивный настрой и оказать
дополнительное благоприятное
воздействие на лечебный процесс.
Именно пациенты, заряженные на
положительный результат, имеют
больше шансов на излечение. Кроме того, чтение помогает и врачам
в свободное время отвлечься от
ежедневных рутинных процедур».
А поэт-юморист Владимир Вишневский в своем видеоприветствии назвал «Книготерапию
RUSSCO» «безусловно важнейшим, необходимым и полезным
делом».
От онкодиспансера с приветствием выступил врио главного врача Дмитрий Истомин. «У нас уже пациенты стационарных отделений обеспечены планшетами, с помощью которых они не только получают информацию о лечении, но и могут читать литературу в электронном виде. Теперь они смогут взять в руки и настоящие книги», – сообщил главврач.
От лица пациентов перед присутствующими выступил председатель Тульского отделения Союза писателей России Николай Жуков. Поблагодарив организаторов акции, гостей из Москвы и врачей онкодиспансера, которые устроили настоящий праздник для больных людей, он прочитал свое стихотворение, специально написанное для «Книготерапии RUSSCO».
Затем московская делегация переместилась в Тульскую детскую областную клиническую больницу, где состоялась встреча с маленькими пациентами. Перед ее началом главный врач больницы Дмитрий Харитонов заметил, что если врачи, несомненно, оказывают всю необходимую медицинскую помощь детям, то книги лечат духовно, лечат душу

В интерактивном режиме Анна Гончарова пообщалась с детьми, рассказала им о популярной серии сказок про енотиков Еню и Елю, а затем подписала маленьким пациентам свои книги. Вот как Анна Сергеевна оценила встречу: «Рада, что во время нашего общения дети окунулись в волшебный мир сказок и зарядились позитивом. Ведь чтение художественной литературы – один из видов поддерживающей терапии. Безусловно, что данная акция носит не только просветительский, но и целительный характер».
В рамках акции «Книготерапия
RUSSCO» лечебные учреждения
Тулы получили в дар более 300
книг известных российских писателей: Анны Гончаровой, Сергея
Лукьяненко, Галины Куликовой,
Владимира Вишневского, в том
числе с автографами авторов. Книги предоставлены центральными российскими издательствами:
АСТ, «Вече», ТД «Белый город»,
продюсерским центром «Динамо»
и другими.
НОВОСТИ ОБЩЕСТВА / ПРЕМИЮ ИМЕНИ АКАДЕМИКА А.И. САВИЦКОГО ЛУЧШЕМУ ХИМИОТЕРАПЕВТУ ВРУЧИЛ ПРОФЕССОР С.А. ТЮЛЯНДИН
18 сентября состоялась торжественная церемония вручения
ежегодной Премии имени академика А.И. Савицкого, учрежденной Общероссийским
национальным союзом «Ассоциация онкологов России» и
Общероссийской общественной организацией «Российское общество клинической
онкологии». Данная Премия – знак глубокого уважения к самоотверженному труду профессионалов онкологической отрасли
на благо здоровья пациентов.

В номинации «Химиотерапевт
года» Премию из рук члена
Правления RUSSCO, профессора
Сергея Алексеевича Тюляндина получила Эльвира Левоновна
Парсаданова, представляющая
Сахалинский областной клинический онкологический диспансер.

Следует отметить, что на конкурс было прислано 75 работ
от специалистов со всей России, а также из-за рубежа, в
том числе из Казахстана, Узбекистана и Таджикистана.
Поздравляем коллегу с высокой и заслуженной наградой.
НОВОСТИ ОБЩЕСТВА / В НИЖНЕМ НОВГОРОДЕ ПРОШЕЛ ЭКЗАМЕН RUSSCO ПО КЛИНИЧЕСКОЙ ОНКОЛОГИИ
10 октября Российское общество клинической онкологии
(RUSSCO) в рамках работы научно-практической онкологической конференции «ВОЛЖСКИЕ ОГНИ VII» провело
экзамен по клинической онкологии.

С приветственным словом перед
участниками выступил главный
врач ГАУЗ НО НИИКО «Нижегородский областной клинический
онкологический диспансер»,
д.м.н. Сергей Викторович Гамаюнов.

Экзамен состоял из 100 вопросов,
посвященных диагностике, механизмам действия лекарственных
препаратов, тактике ведения пациентов, лекарственной терапии
опухолей.
В составлении вопросов участвовали ведущие эксперты, в том
числе члены Правления RUSSCO:
Л.Ю. Владимирова, О.А. Гладков, Ф.В. Моисеенко, А.А. Румянцев, А.А. Трякин, С.А. Тюляндин и М.Ю. Федянин.

В экзамене приняли участие 34
специалиста из Нижнего Новгорода.
11 октября уже были подведены
итоги экзамена. Успешно ответили на 100 вопросов 19 участников
из 34. На церемонии награждения им были вручены дипломы,
а троим (набравшим наибольшие
баллы): Владиславу Александровичу Гришину, Юлии Александровне Петряковой и Екатерине
Евгеньевне Тоненковой – гранты на поездку на одну из конференций RUSSCO.
Поздравляем победителей!

Одновременно напоминаем, что
следующий экзамен RUSSCO по
клинической онкологии состоится 12 ноября уже в рамках работы
XXVIII Российского онкологического конгресса.
ЭКЗАМЕН ПО КЛИНИЧЕСКОЙ ОНКОЛОГИИ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ (RUSSCO)

НОВОСТИ ОБЩЕСТВА / РЕЗОЛЮЦИЯ ПО РЕЗУЛЬТАТАМ СЕССИИ RUSSCO «ЗАКЛЮЧЕНИЕ NGS, КОНСЕНСУС МЕЖДУ ГЕНЕТИКОМ И КЛИНИЦИСТОМ»
Сессия состоялась 30 июля 2024 года в г. Горно-Алтайске, в рамках Всероссийской
конференции «Опухолевые маркеры - фундаментальные и клинические аспекты»,
которая проходила с 29 июля по 1 августа 2024 года. На ней обсуждались проблемы
осведомленности пациентов о молекулярно-генетических исследованиях (МГИ), были
затронуты актуальные вопросы формирования заключения по результатам NGS.
Ключевые темы:
1. Информированность пациентов о МГИ.
Проведенный опрос среди 221 онкологического пациента, показал, что 32% считают МГИ недоступным, 70% уверены в его полезности для подбора наиболее эффективного лечения, у половины пациентов остаются вопросы и опасения по поводу проведения МГИ (начиная с того, какую лабораторию выбрать для проведения МГИ, заканчивая доступностью необходимого лекарственного лечения). И только 13% пациентов получили достаточную информацию о МГИ от врачей. Все это указывает на необходимость улучшения коммуникации между пациентом и врачом, повышения осведомленности пациентов о МГИ.
Предложены пути решения: проведение образовательных мероприятий (школ для пациентов), разработка информационных брошюр и онлайн ресурсов, подготовка врачебного сообщества по вопросам МГИ.
2. Формирование
заключения по результатам
МГИ, проведенного методом
NGS.
Свою точку зрения высказали
259 врачей-онкологов и 36 врачей
лабораторных-генетиков/врачей
КЛД.
Большинство врачей-онкологов
высказались о необходимости
выносить в заключение информацию о качестве исследуемого
материала, типе мутации (герминальная/соматическая) и класса
патогенности/клинической значимости обнаруженной мутации.
Технические характеристики запуска было предложено выносить
отдельно от текста заключения,
например, в примечание. Что же
касается терапевтических опций,
то подавляющее большинство
врачей-онкологов ответило, что
хотели бы видеть информацию об
этом в заключении. Однако если
найдены мутации в генах, которые не являются мишенями для
таргетной терапии, такую информацию следует выносить в примечание.
Вопрос, касающийся терапевтических опций, выносимых в заключение, встает особенно остро
и вызывает сомнения со стороны
врачей лабораторных-генетиков/
врачей КЛД и некоторых врачейонкологов.

Пути решения:
- Создание единого стандарта заключений по результатам МГИ, понятного врачам-онкологам и включающего пункты, необходимые врачам лабораторий для правильной трактовки результатов исследования;
- Создание централизованной российской базы данных, в
которой была бы информация
от выявленного варианта до терапевтических опций, а также
информация о доступных клинических исследованиях и рекомендаций по лечению.
Поставленные задачи по результатам обсуждений:
- Провести исследование и опрос среди пациентов для повышения информированности о молекулярно-генетических исследованиях, срок - до конца 2024 г., исполнитель - Ольга Владимировна Вострикова.
- Разработать информационные брошюры и материалы для
пациентов о молекулярно-генетических исследованиях, срок
- до первого квартала 2025 г., исполнитель: Российское общество
клинической онкологии.
- Создать образовательные программы для врачей о молекулярно-генетических исследованиях,
срок - в течение 2025 г. провести
4 образовательных мероприятия,
исполнитель - Российское общество клинической онкологии).
- Разработать стандарты для заключений по результатам молекулярно-генетических исследований, срок - до конца 2025 г., исполнитель - Российское общество клинической онкологии в партнерстве с Обществом Молекулярных генетиков.
- Создать централизованную российскую базу данных о клинически значимых мутациях, клинических исследованиях и терапевтических опциях, срок запуска - до конца 2024 г., работа на постоянной основе, исполнитель: Российское общество клинической онкологии в партнерстве с Обществом Молекулярных Генетиков.
- Возможность включения информации о терапевтических
опциях в заключения по результатам молекулярно-генетических
исследований остается для дальнейшего обсуждения и принятия
решения в медицинском сообществе.
НОВОСТИ ESMO 2024 / ОПУХОЛИ ЖКТ
Автор: Евсеев Владислав Николаевич
Врач онколог, химиотерапевт,
заведующий отделением химиотерапии Клиники МЕДСИ,
эксперт фонда «Не напрасно», Санкт-Петербург
В сентябре классически проходит одно из главных событий для
каждого онколога – ежегодный
конгресс ESMO. Мы только успели обдумать и обсудить все новости, которые пришли в лечение
рака желудка после конференций
ASCO и ESMO GI, но уже надо
вновь думать о том, как может измениться наша практика. Секции
по лечению опухолей верхних
отделов желудочно-кишечного
тракта на ESMO в этом году были
достаточно насыщенные, и в этой
статье предлагаю обсудить основные исследования по лечению
рака желудка.
Очередное подтверждение
отсутствия пользы предоперационной химиолучевой
терапии при раке желудка
и пищеводно-желудочного
перехода – исследование
TOPGEAR
Пациенты с аденокарциномами
желудка или пищеводно-желудочного перехода IB-IIIC стадии
рандомизировались в две групп:
в первой пациенты получали 3
цикла ECF или 4 цикла FLOT, а во
второй – на 1 цикл химиотерапии
меньше, но проходили химиолучевую терапию с 5-фторурацилом.
После операции проводилась адъювантная терапия по предоперационной схеме. В качестве первичной конечной точки была выбрана
общая выживаемость.
Рисунок 1.
Схема исследования TOPGEAR.
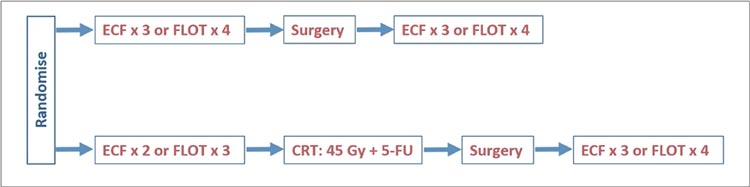
Рисунок 2.
Непосредственные результаты исследования
TOPGEAR.
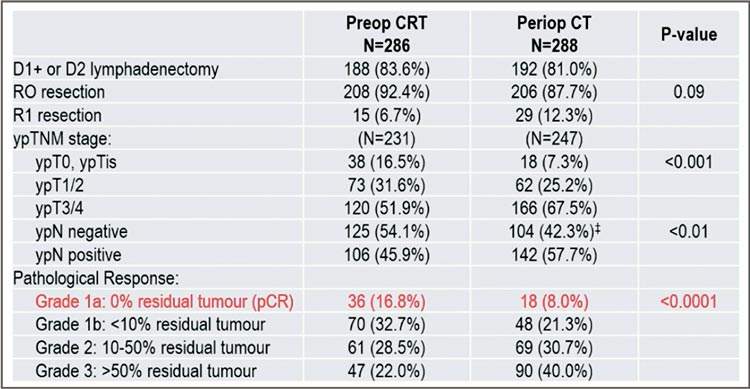
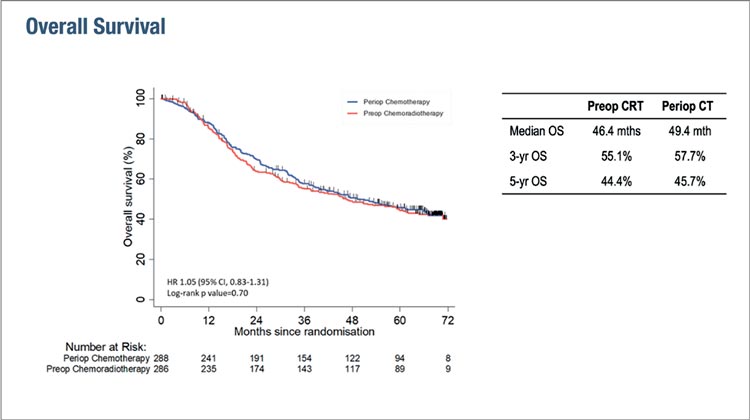
Рисунок 3.
Общая выживаемость по данным исследования
TOPGEAR.
Проведение химиолучевой терапии
привело к увеличению вероятности
достижения полного патоморфологического регресса в 2 раза – с 8,0%
в группе химиотерапии до 16,8%
в группе химиолучевой терапии.
При этом частота R0-резекций статистически значимо не отличалась
– 87,7% в группе химиотерапии и
92,4% в группе химиолучевой терапии.
К сожалению, эти результаты не
транслировались в увеличение общей выживаемости – первичная
конечная точка оказалась негативной. Не отличались ни показатели
медианы общей выживаемости
(49,4 мес. в группе только химиотерапии и 46,4 мес. в группе химиолучевой терапии), ни показатели
5-летней выживаемости – 45,7% в
группе только ХТ против 44,4% в
группе ХЛТ.
При подгрупповом анализе не было
выявлено ни одной подгруппы, у
которой проведение химиолучевой
терапии все же привело бы к улучшению результатов лечения. Был
определенный тренд к улучшению
результатов у пациентов с опухолями гастроэзофагеального перехода,
но он не достиг статистической значимости. У пациентов с опухолями
нижней трети проведение ХЛТ наоборот приводило даже к ухудшению
показателя общей выживаемости.
Хорошая новость – проведение
предоперационной химиолучевой терапии не повлияло на
частоту послеоперационных осложнений 3 и выше степени. Послеоперационная летальность
(как 30-, так и 90-дневная) также
не отличалась между группами.
Роль послеоперационной
химиотерапии по схеме
FLOT в зависимости от
патоморфологического
ответа на лечение –
когортное исследование
SPACE-FLOT
Одна из нерешенных, но частых
проблем в практике лечения локализованного рака желудка
– понимание, кому нужна адъювантная терапия после предоперационной химиотерапии по
схеме FLOT. С одной стороны, «по
протоколу» мы ее должны проводить всем, с другой – понимаем,
что, наверное, не все пациенты
действительно получают от нее
пользу. И вот на ESMO были представлены результаты многоцентрового когортного исследования
SPACE-FLOT, в котором авторы
попытались приблизить нас к ответу, а кому действительно нужна
адъювантная химиотерапия.
Рисунок 4.
Показатели ОВ при подгрупповом анализе.
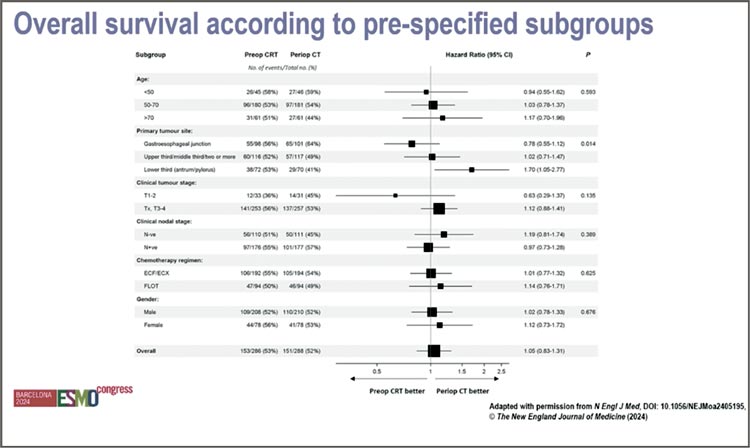
Рисунок 5.
Показатели ОВ в подгруппе с частичным ответом
на лечение.
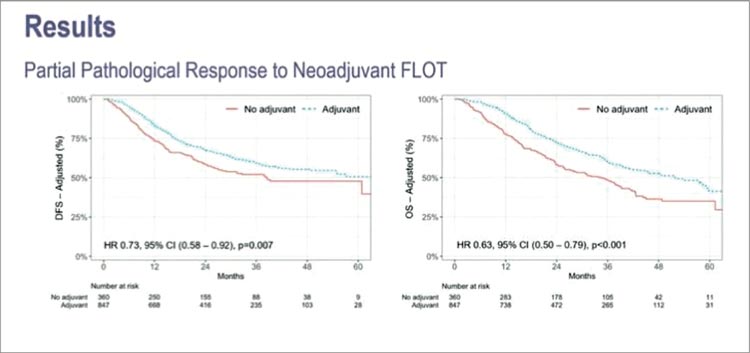
Рисунок 6.
Дизайн исследования KEYNOTE-811.
Исследователи разделили всех пациентов на 3 группы – те, кто достиг
полного регресса на фоне предоперационной терапии, пациенты с
частичным морфологическим ответом и пациенты без ответа на лечение. Оказалось, что выигрывали
от назначения послеоперационной
терапии только пациенты с частичным регрессом на фоне лечения. Те,
у кого ответа на терапию не было
или ответ был полный, от продолжения адъювантной терапии ничего не получали.
Надо понимать, что это исследование по сути носило ретроспективный характер, и опираться только
на него в принятии решений нельзя, но это очередной шажок к тому,
чтобы стратифицировать больных
на лечение в зависимости от того,
какой эффект был достигнут на
предоперационном этапе.
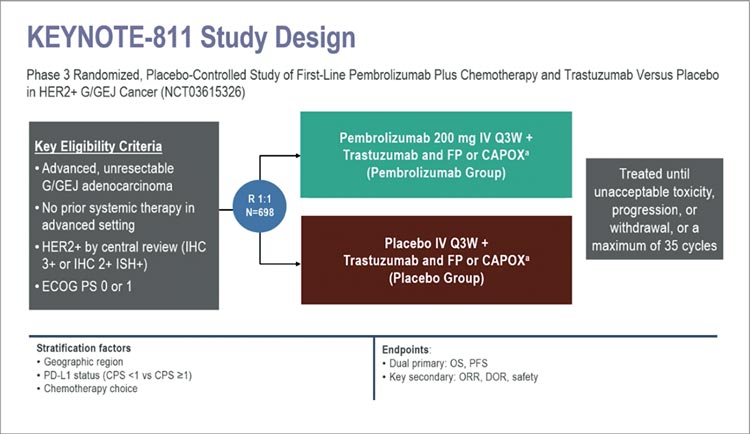
Финальные результаты
исследования KEYNOTE-811
Еще в 2020 году FDA провело ускоренное одобрение схемы трастузумаб + пембролизумаб + химиотерапия при HER2-позитивном
метастатическом раке желудка
по результатам исследования
KEYNOTE-811. Схема получила
зеленый свет на основании значимого увеличения частоты объективных ответов при добавлении
пембролизумаба по сравнению с
терапией только по схеме химиотерапия + трастузумаб. С 2020
года было представлено несколько
обновлений этого исследования, и вот на конгрессе ESMO 2024 представлены финальные результаты
по общей выживаемости.
Рисунок 7.
Показатели ОВ в группах в исследовании KEYNOTE-811.
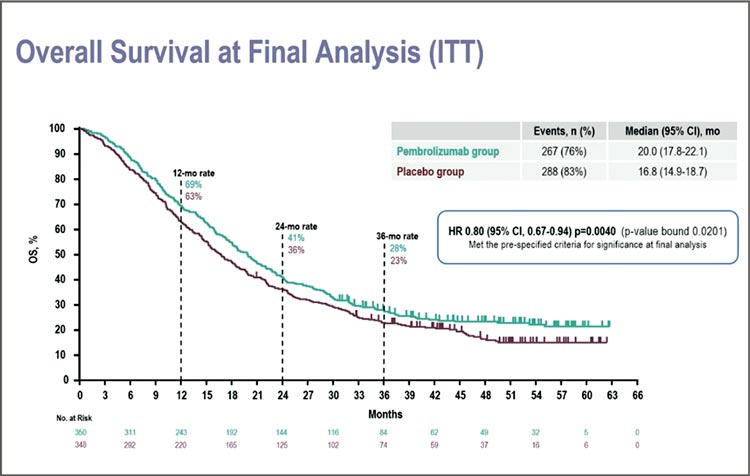
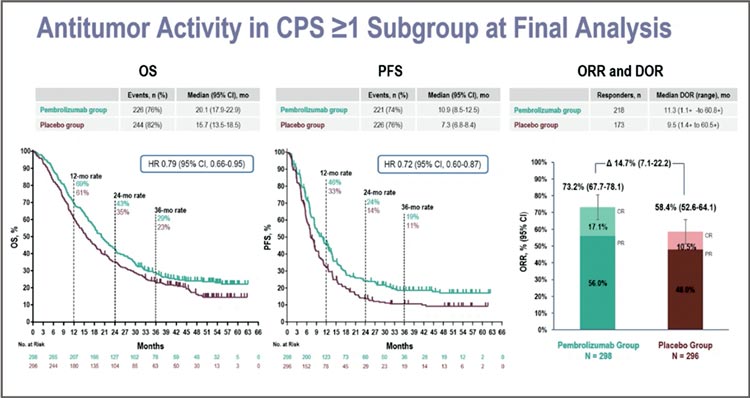
Анализ в общей группе пациентов
показал, что добавление пембролизумаба к химиотерапии и трастузумабу у HER2-позитивных
пациентов с распространенным
раком желудка приводит к увеличению показателей общей выживаемости примерно на 3 месяца – с 16,8 месяца в контрольной
группе до 20 месяцев в группе иммунотерапии.
При подгрупповом анализе оказалось, что у пациентов с негативным
PD-L1 статусом (то есть уровнем
CPS <1) разницы в общей выживаемости между группами отмечено не
было. Авторы исследования указывают, что нельзя делать четкие выводы об этой группе пациентов изза того, что таких пациентов было
мало – около 85% людей в исследовании имели PD-L1 позитивный
статус. Но для меня это подтверждение того, что иммунотерапия при
раке желудка должна применяться
только у отобранных по CPS пациентов.
Отдельно хочется отметить, что не
было представлено анализа по другим значениям CPS. Как мы знаем из
предыдущих исследований, граница
в 1% может быть слишком низкой,
возможно, разница действительно
присутствует только у пациентов с
уровнем выше 5% или 10%, но такие подгруппы проанализированы
в рамках представленного доклада
не были.
DESTINY-Gastric03
Трастузумаб дерукстекан быстро
проникает в лечение различных
HER2-позитивных опухолей. При
распространенном раке желудка
исследования DESTINY-Gastric01
и DESTINY-Gastric02 уже показали
эффективность этого препарата во
второй и последующих линиях лечения, и в клинических рекомендациях ряда стран Энхерту уже фигурирует как достаточно стандартная
опция.
Рисунок 8.
Показатели ВБП в исследовании KEYNOTE-811.
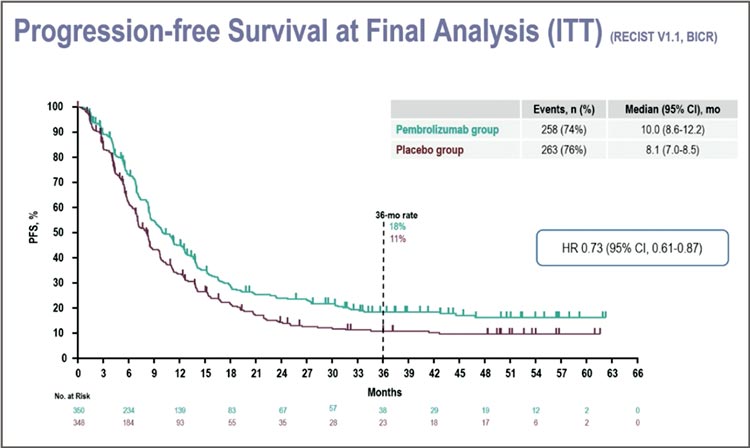
Рисунок 9.
Данные ВБП в подгруппах в зависимости от статуса PD-L1.
На конгрессе ESMO были представлены результаты исследования
DESTINY-Gastric03, в котором пытались назначать трастузумаб дерукстекан в самостоятельном режиме или в сочетании с различными
схемами лечения в 1-й линии терапии. Групп набралось целых 6:
- трастузумаб дерукстекан в дозе 6,4 мг/кг;
- трастузумаб дерукстекан 6,4 мг/кг + 5-фторурацил/капецитабин;
- трастузумаб дерукстекан 6,4 мг/ кг + 5-фторурацил/капецитабин и пембролизумаб;
- трастузумаб дерукстекан 6,4 мг/кг + пембролизумаб;
- трастузумаб дерукстекан 5,4 мг/ кг + 5-фторурацил/капецитабин и пембролизумаб;
- трастузумаб + капецитабин/5- фторурацил + цисплатин/оксалиплатин.
Рисунок 10.
Показатели ВБП в исследовании KEYNOTE-811.
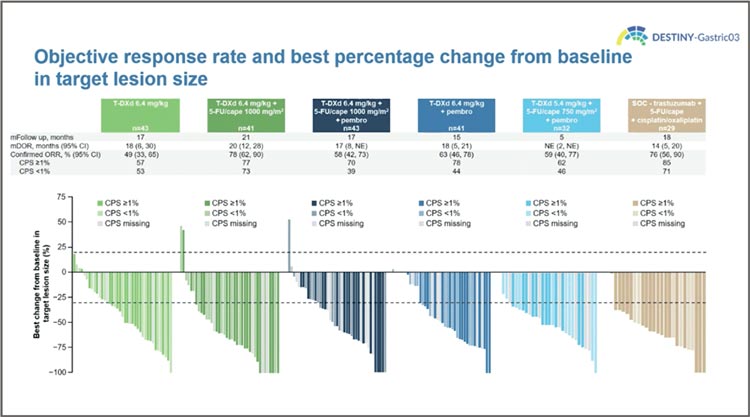
Рисунок 11.
Результаты лечения в подгруппе больных с CPS.
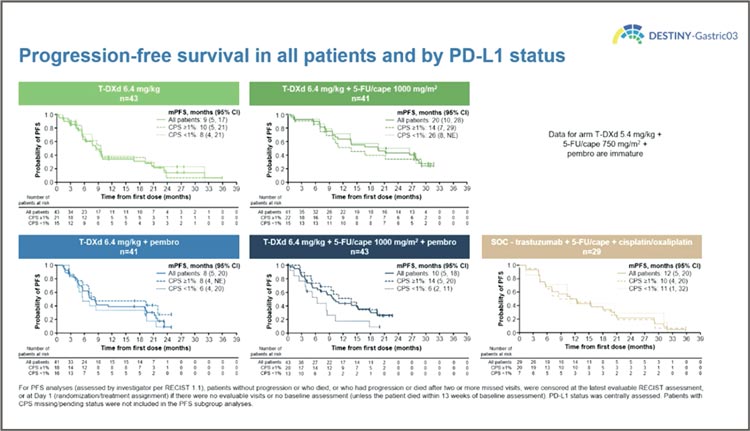
Напрямую все эти варианты лечения между собой не сравнивались, но можно было оценить потенциальную необходимость изучения этих режимов в дальнейших исследованиях. Самой перспективной оказалась комбинация фторпиримидинов с трастузумабом дерукстеканом, эта комбинация продемонстрировала впечатляющие 78% частоты объективных ответов и длительность ответа 20 (!) месяцев.
Интересно, что добавление к этой комбинации пембролизумаба по какой-то причине не только не улучшило результаты, но даже немного ухудшило, в таком триплете частота ответов составила 58%, а длительность ответа – 17 месяцев. Причем даже в подгруппе PD-L1 позитивных пациентов (CPS ≥1) эффективность была несколько ниже.
Еще одно исследование
иммунотерапии в 1-й линии
лечения распространенного
рака желудка –
биспецифическое антитело
SHR-1701
К назначению химиоиммунотерапии при PD-L1 позитивном распространенном раке желудка мы
уже привыкли, при этом спектр
возможных препаратов и сочетаний
постепенно расширяется. В этот раз
представлено рандомизированное
исследование, в котором использовался не просто анти-PD1 препарат,
а биспецифическое антитело, направленное против PD-L1 и TGFбета.
Пациенты с HER2-негативным распространенным раком желудка или
пищеводно-желудочного перехода
вне зависимости от уровня PD-L1
рандомизировались в одну из двух
групп: в 1-й группе пациенты получали до 6 циклов химиотерапии по
схеме XELOX, во 2-й – тот же самый
XELOX, но в сочетании с биспецифическим антителом SHR-1701. В
качестве первичной конечной точки
авторы выбрали общую выживаемость среди пациентов с уровнем
CPS ≥5.
В подгруппе пациентов с CPS ≥5 комбинация с новым препаратом оказалась лучше по всем пунктам – более
чем на 20% выше частота объективных ответов (32,7% против 56,5%),
длительность ответа выше ровно в
2 раза (5,1 против 10,2 мес.), закономерно увеличились общая (10,4 против 16,8 мес.) и безпрогрессивная выживаемость (5,5 против 7,6 мес.).
Рисунок 12.
Результаты исследования в подгруппах.
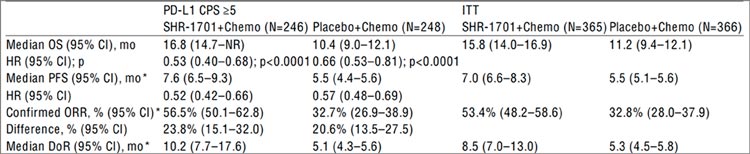
Один из главных минусов исследования – не было сравнения с привычными иммунотерапевтическими
препаратами, такими как ниволумаб,
поэтому нельзя сказать, насколько
новый препарат лучше уже привычных для нас.
НОВОСТИ ESMO 2024 / ЗАВЕРШЕНА РАЗРАБОТКА КРИТЕРИЕВ ОЦЕНКИ КЛИНИЧЕСКОЙ ЗНАЧИМОСТИ ПРИМЕНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ТЕРАПИИ
Российское общество клинической
онкологии (RUSSCO) совместно с экспертами ФГБУ «НМИЦ
онкологии им. Н.Н. Блохина»
Минздрава России и другими ведущими онкологическими учреждениями, поддерживав инициативу Министерства здравоохранения
РФ о разработке методологии анализа эффективности лекарственных противоопухолевых препаратов для объективной оценки вклада
инновационных высокозатратных
и дорогостоящих лекарственных
препаратов в снижение смертности
от онкологических заболеваний в
нашей стране, разработали критерии оценки клинической значимости применения противоопухолевой терапии.
Эти критерии легли с основу шкалы, которая, по мнению разработчиков, является наиболее объективной и независимой от точки
зрения фармацевтических компаний-производителей при проведении оценки вклада современных
режимов противоопухолевой терапии в улучшение результатов лечения пациентов. Следует отметить,
что шкала, предлагаемая RUSSCO,
обладает рядом практически значимых преимуществ перед шкалой
ESMO и имеет более строгие критерии оценки клинической значимости терапии. В соответствии с ней
все подходы противоопухолевой
терапии условно разделены на четыре категории: https://rosoncoweb.
ru/standarts/criteria_evaluating_
clinical_significance_therapy/.
Российское общество клинической
онкологии (RUSSCO) и ведущие
эксперты профессионального сообщества уверены, что имплементация вышеуказанных изменений
позволит добиться обеспечения
права пациентов на доступ к инновационным и высокоэффективным лекарственным препаратам
при одновременном сокращении
затрат на лекарственное обеспечение.
НОВОСТИ ESMO 2024 / АНТАГОНИСТ ПРОТЕИНА EWS::FLI1 ПРИ САРКОМЕ ЮИНГА: ИССЛЕДОВАНИЕ I/II ФАЗЫ
Слияние белков EWS и FLI1 имеет важнейшее патогенетическое
и диагностическое значение для
саркомы Юинга, но таргетно воздействовать на новообразованный онкопротеин (EWS::FLI1)
долгое время не удавалось. Токалас (ТК)216 – первый в своем роде
препарат, направленный на связывание EWS::FLI1, разрыв межбелковых связей и ингибирование
транскрипции.
В исследование I/II фазы включены
пациенты с рефрактерной/рецидивной саркомой Юинга (медиана
линий – 3), которым проводилась
инфузия ТК216 + винкристин в
день 1. Цель исследования – оценка токсичности, определения дозы
для инициации II фазы.
Получены следующие результаты:
- максимальная толерантная доза (МТД) – 200 мг/м2 в течение суток – 14 дней, 1 раз в 28 дней;
- дозолимитирующая токсичность – нейтропения (44,4%), анемия (29,4%), ФН (15,3%), тромбоцитопения (11,8%);
- ЧОО (в когорте 9 с МТД, n=48) – 6,3%, стабилизация заболевания – 29,2%;
- медиана длительности ответа – 25,5 мес., медиана длительности стабилизации – 2,3 мес.;
- мВБП – 1,8 мес., 6-месячная ВБП – 11,9%.
Революции не произошло, cаркома
Юинга все еще остается малотаргетируемой агрессивной опухолью. Последние успехи в лечении
данного заболевания связаны с
дозоинтенсивной ХТ (ddVAC/IE)
в неоадъювантном подходе. Тем
не менее, дверь в молекулярно-направленную терапию открыта, будем ждать новых исследований.
НОВОСТИ ESMO 2024 / ОПУХОЛИ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ И ГЕПАТОБИЛИАРНОЙ ЗОНЫ
Автор: Хачатурян Элина Артуровна
Врач онколог дневного стационара
противоопухолевой и лекарственной терапии,
Онкологический центр им. С.С. Юдина ДЗМ,
Москва
Первый день конгресса ESMO начался с секции по опухолям верхних отделов ЖКТ, и вот что нам удалось узнать.
Рисунок 1.
Результаты исследования PRODIGE 44.
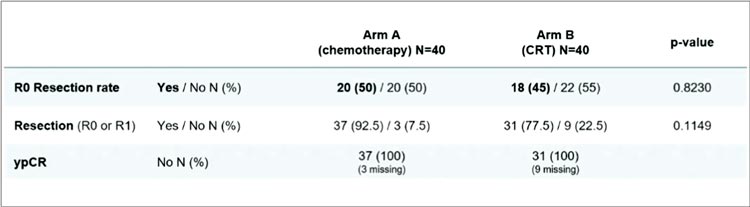
Исследование PRODIGE 44/
PANDAS, в котором изучался модифицированный FOLFIRINOX с или без химиолучевой терапии в
сеттинге неоадъюванта погранично резектабельного рака поджелудочной железы.
Рисунок 2.
Результаты исследования PRODIGY 44.
В исследование было включено
130 пациентов с погранично резектабельным раком поджелудочной железы, которых рандомизировали на 2 рукава – 6 курсов
mFOLFIRINOX с последующим
оперативным вмешательством и 6
курсов mFOLFIRINOX с ДЛТ+ капецитабин с последующим оперативным вмешательством.
Рисунок 3.
Безрецидивная выживаемость.
Первичной конечной точкой была
частота R0 резекций, вторичными
конечными точками были выбраны общая выживаемость и выживаемость без прогрессирования.
Частота R0 резекций была равнозначна в обеих группах, нумерически незначительно выше в группе
только химиотерапии.
Результаты вторичных конечных
точек также статистически между
группами не различались, медиана
ОВ в группе только химиотерапии
составила 32,8 мес., в группе химиотерапии с ХЛТ медиана ОВ 30 мес.
(p=0,9875).
Результаты данной работы позволяют поставить точки над i в месте
ХЛТ при резектабельном раке поджелудочной железы, а точнее над
его отсутствием.
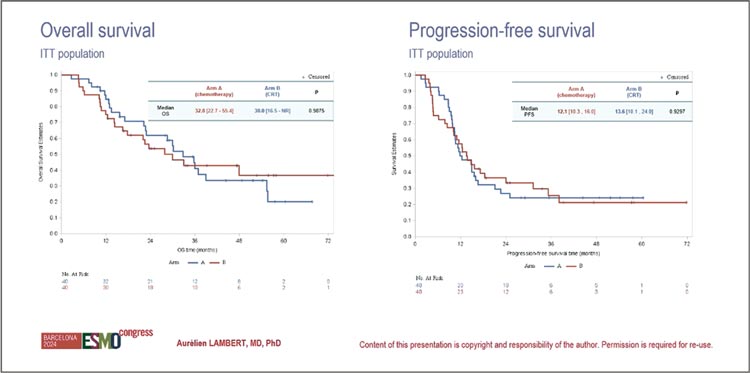
Также коллеги представили целую
серию исследований по поводу
гепатоцеллюлярного рака, одним
из значимых было представление
обновленных результатов исследования Imbrave 050: адъювантная
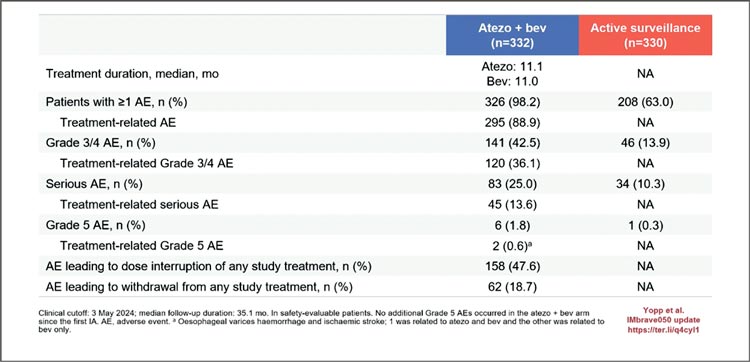
терапия атезолизумаб + бевацизумаб при гепатоцелюллярной карциноме.
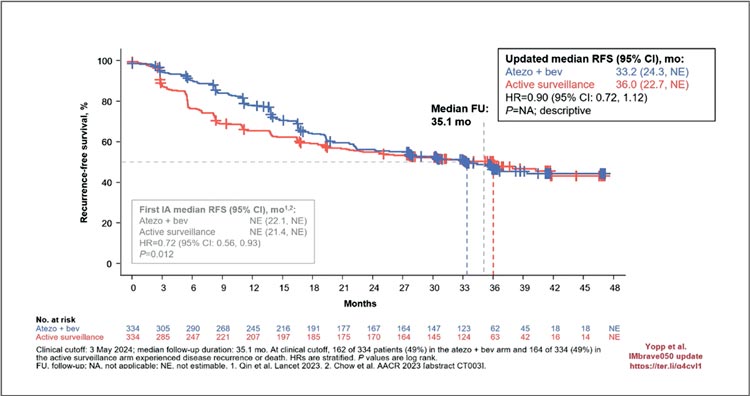
Рисунок 4.
Общая выживаемость.
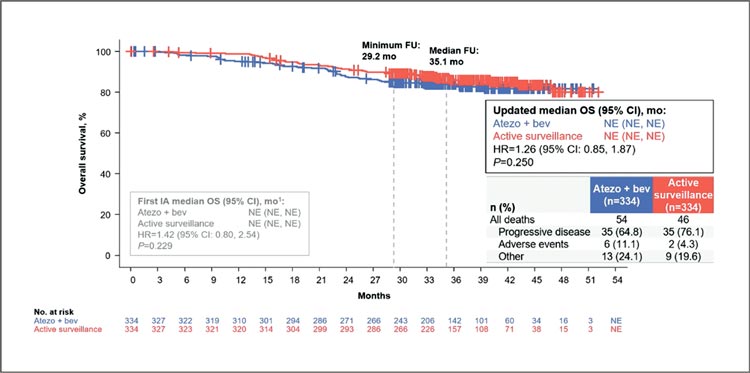
Комбинация атезолизумаба с бевацизумабом в сеттинге адъювантной терапии ГЦР высокого риска
с прошлого года числится в рекомендациях RUSSCO. Однако исследование продолжает вызывать
споры, потому что в чем же смысл
адъюванта, как не увеличить общую выживаемость, чего в данном исследовании не произошло,
и даже количество смертей было
больше в группе адъюванта.
Ранее исследователи делали ставку
на RFS, но с продолжением длительности наблюдения и эти показатели начали проседать – в группе
адъюванта 33,2 мес. против 36 мес.
в группе активного наблюдения.
Со слов доктора Adam Yopp, данные по общей выживаемости незрелые, потому что 80% все еще
живы на отметке наблюдения в 2
года. Однако дискутант, как и я,
скептически отнеслась к данным
результатам. И имея сегодняшние
данные по токсичности и HR для
ОВ 1,26, вопрос обоснованности
проведения адъювантной терапии
ГЦР высокого риска висит в воздухе.
Рисунок 5. .
Также коллегами из Поднебесной
было представлено исследование
III фазы APOLLO: анлотиниб плюс
пенпулимаб vs сорафениб в 1 линии распространенного гепатоцеллюлярного рака
Рисунок 6. .
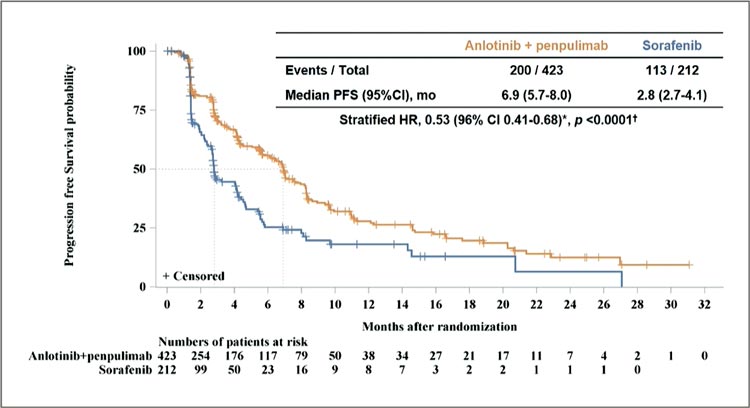
649 пациентов были включены в
исследование, 433 – в группу комбинации. Первичными конечными
точками были выбраны ВБП и ОВ.
Медиана ВБП была значительно
лучше при применении анлотиниба + пенпулимаба по сравнению с
сорафенибом: 6,9 мес. (95% ДИ 5,8-
8,0) против 2,8 мес. (HR 0,53; 95%
ДИ 0,41-0,68; р<0,0001).
Промежуточный срез по ОВ: 16,5
мес. (95% ДИ 14,7-19,7) против
13,2 мес. (95% ДИ 9,7-16,9); HR 0,69
(95% ДИ 0,52-0,92); р=0,0013.
Профиль нежелательных явлений не отличался от стандартно известных в группе сорафениба, а частота нежелательных явлений была ниже в группе комбинации.
Новая опция в терапии метастатического гепатоцеллюлярного рака?
И будет ли она работать на европейской популяции?
НОВОСТИ ESMO 2024 / ОНКОУРОЛОГИЯ
Автор: Исраелян Эдгар Рудикович
Врач-онколог ФГБУ «Национальный медицинский исследовательский
центр онкологии им. Н.Н. Блохина» Минздрава России, Москва
Завершившийся конгресс ESMO
2024 оказался богат на различные
исследования в онкоурологии. Все
больше и больше лекарственных
препаратов и комбинаций изучается как при локализованных стадиях, так и при метастатическом
процессе. А готовы ли мы внедрять новые опции в клиническую
практику, и самое главное – нужно ли? Постараемся рассмотреть в
данном обзоре.
Исследование TiNivo-2:
тивозаниб + ниволумаб
vs тивозаниб при
метастатическом почечноклеточном раке (мПКР)
после прогрессирования
на иммунотерапии
Иммунотаргетные комбинации
(ИТК) в 1 линии мПКР – стандарт
терапии для пациентов независимо
от прогноза по IMDС [1,2], хотя роль
ИТК при благоприятном прогнозе
все еще остается спорной [3]. Но
сейчас не об этом. Опции 2 и последующей линий при прогрессировании на ИТК проспективно не определены, тем не менее на практике
чаще всего используется кабозантиниб [4]. Роль реиндукции ИТ изучалась в исследовании CONTACT-03,
добавление атезолизумаба к кабозантинибу не продемонстрировало
улучшение отдаленных результатов
лечения [5]. А получится ли у комбинации тивозаниба и ниволумаба?
В исследование TiNivo-2 включены
пациенты с мПКР и прогрессированием на фоне ИТ и рандомизированы в 2 группы – тивозаниб/ниволумаб или тивозаниб в монорежиме
(рис.1). Первичная конечная точка
– выживаемость без прогрессирования (ВБП).
Рисунок 1.
Дизайн исследования TiNivo-2.
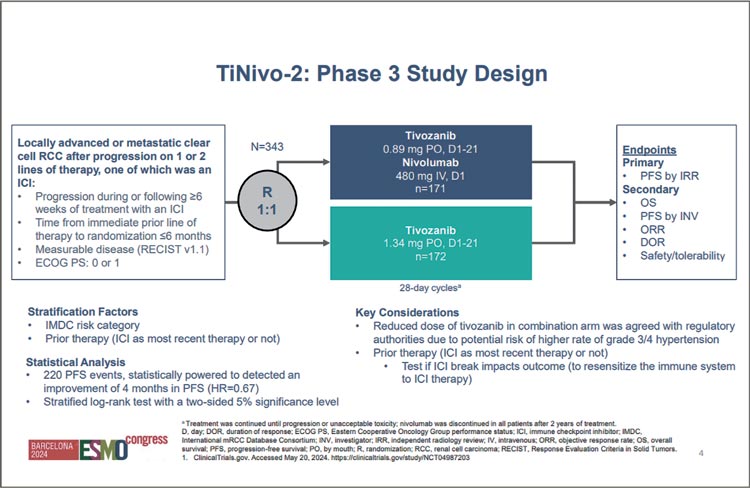
Преимуществ в мВБП при добавлении ниволумаба к тирозинкиназному ингибитору (ТКИ) не отмечено:
5,7 мес. в группе тивозаниб/ниволумаб vs 7,4 мес. в группе тивозаниба (HR 1,1; 95% CI 0,84-1,43; p=0,49),
эффект не зависел от количества
ранее проведенных линий терапии
(рис.2).
Рисунок 2.
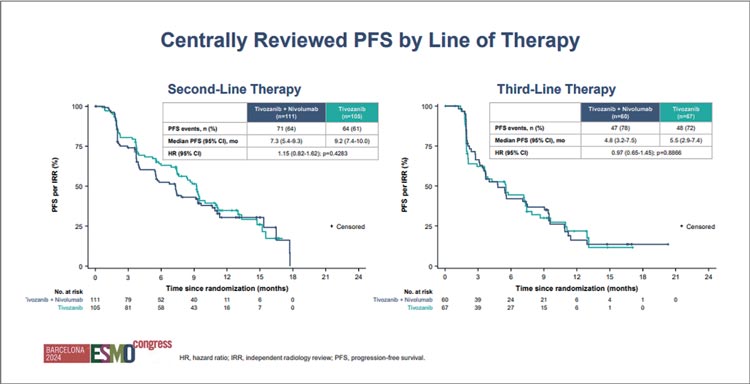
В подгрупповом анализе ВБП преимуществ от ИТК также не отмечено.
При анализе общей выживаемости
(ОВ) тивозаниб нумерически оказался лучше ИТК (p=0,98). Неустанно исследователи пытаются найти
тирозинкиназного партнера для ИТ
с целью преодолеть резистентность
к ней. Но и с тивозанибом не вышло. Вывод напрашивается сам собой – не занимайтесь реиндукцией
ИТ при мПКР.
LITESPARK-005: белзутифан
vs эверолимус в поздних
линиях мПКР
Мутация гена VHL и активация HIF
– одни из ключевых звеньев в онкогенезе ПКР. Белзутифан – первый в
своем классе препарат, направленный на ингибирование HIF-2a. Ранее
представлены результаты исследования LITESPARK-005 по оценке
ВБП и частоты объективных ответов (ЧОО), в которых белзутифан
оказался лучше эверолимуса [6]. На
ESMO 2024 представлены данные по
ОВ.
Напомним, что в исследование
включались пациенты с мПКР, у которых отмечено прогрессирование
как на ИТ, так и на ТКИ. В работе две
первичные точки – ВБП и ОВ. Подробнее дизайн исследования представлен ниже (рис.3).
Рисунок 3.
Дизайн исследования LITESPARK-005.

При настоящем анализе мВБП между группами не различалась и составила 5,6 мес. Однолетняя ВБП в
группах белзутифана и эверолимуса
равнялась 33,7% и 17,6% соответственно (рис.4).
Рисунок 4.
Обновленные данные ВБП.
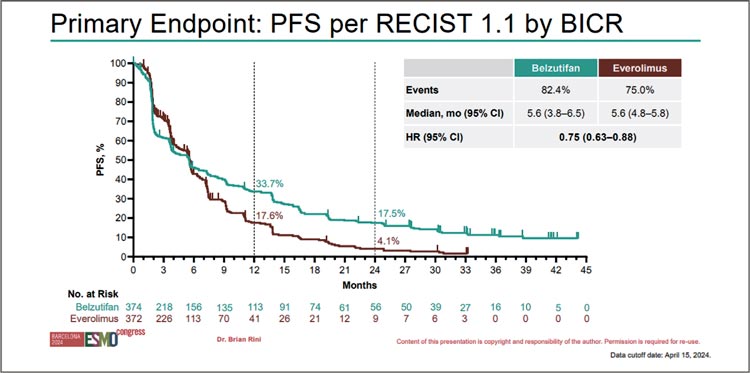
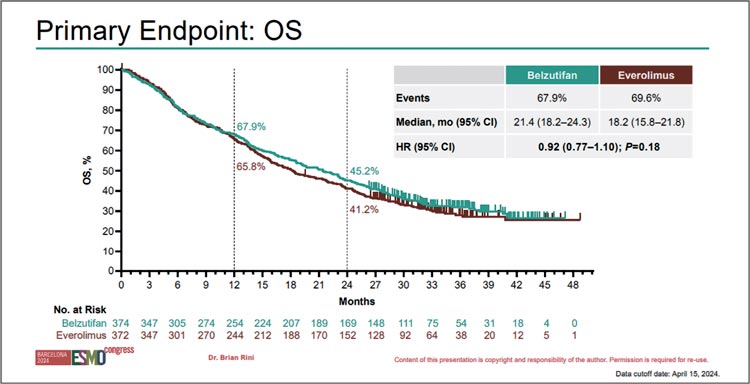
Медиана ОВ составила 21,4 мес. в
группе HIF-2a ингибитора vs 18,2
мес. в группе mTOR-ингибитора (HR
0,92; 95% CI 0,77-1,10; p=0,18) (рис.5).
В подгрупповом анализе ОВ явных
преимуществ от белзутифана не
отмечено. Белзутифан при финальном анализе не смог улучшить ОВ, в
мВБП также различий не отмечено.
Данный препарат не зарегистрирован на территории РФ, а по этому
показанию, видимо, и не стоит.
Рисунок 5.
Данные по ОВ.
JCOG1019: оценка
эффективности
стратегии наблюдения
vs внутрипузырной БЦЖ
терапии среди пациентов
с рТ1 HG раком мочевого
пузыря и рТ0 после 2-го ТУР
Рак мочевого пузыря (РМП) Т1
характеризуется инвазией субэпителиальной соединительной
ткани и составляет примерно 20%
от немышечно-инвазивного РМП
(НМИРМП), а также, обладая
агрессивными биологическими характеристиками, часто приводит к
рецидиву заболевания. Стандартной практикой является выполнение ТУР МП с последующей ТУР
second-look и адъювантной БЦЖ терапией [7]. Но эффективен ли такой
алгоритм для пациентов с рТ0 после
второй ТУР?
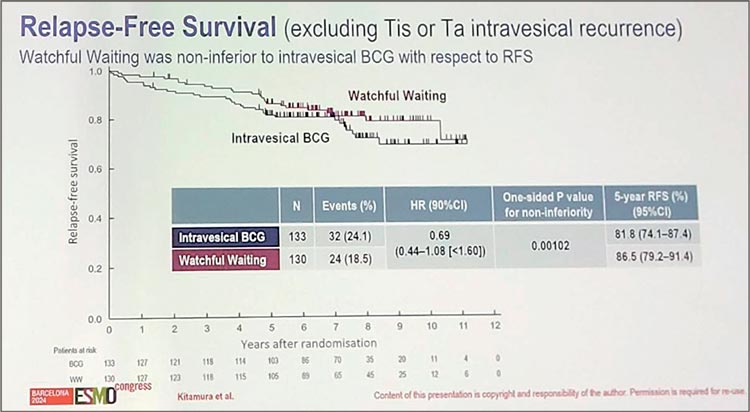
В открытое рандомизированное
исследование III фазы JCOG1019
включены пациенты с рТ0 после второй ТУР по поводу Т1 HG НМИРМП. Пациенты рандомизированы в группы наблюдения и
внутрипузырной БЦЖ-терапии.
Первичная конечная точка – безрецидивная выживаемость (БРВ)
(за исключением Tis и Та). Согласно
статистическому дизайну, не меньшая эффективность опции наблюдения должна быть продемонстрирована при значении HR<1,6.
Исследование является позитивным, опция наблюдения демонстрирует схожие показатели 5-летней
БРВ в сравнении с БЦЖ-терапией –
81,8% vs 86,5% (HR 0,69; 95% CI 0,44-
1,08; р=0,00102) (рис.6).
Рисунок 6.
Данные по БРВ.
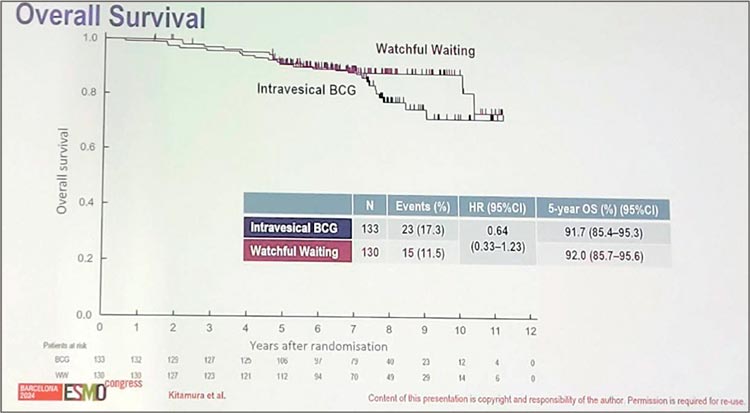
В подгрупповом анализе БРВ наибольшее преимущество в группе наблюдения отмечено среди мужчин
≥65 лет, с папиллярными солитарными опухолями размером ≥3 см.
Пятилетняя ОВ в обеих группах составила ≈92% (рис.7).
Рисунок 7.
Данные по ОВ.
Стратегия наблюдения продемонстрировала не меньшую эффективность в сравнении с БЦЖ-терапией,
что очень отрадно, учитывая токсичность вакцинотерапии, периодически возникающий дефицит
препарата. Интересно, внесут ли
данную опцию в клинические рекомендации? Скоро узнаем!
Ниволумаб + ХЛТ среди
пациентов с МИРМП,
не являющихся
кандидатами к радикальной
цистэктомии (РЦЭ)
Иммунотерапия все активнее внедряется в уротелиальный рак и в
мышечно-инвазивную стадию в
частности. Не всем пациентам удается провести НАХТ с последующей РЦЭ ввиду различных причин и альтернативной служит ХЛТ.
Добавление ИТ к ХЛТ уже некий
тренд (вспомним исследование
KEYNOTE-A18 при РШМ [8]), греческие коллеги не остались в стороне и инициировали исследование II
фазы.
В данную работу включены пациенты с МИРМП, сТ2-Т4аN0M0 и
СКФ ≥40 мл/мин. Пациенты рандомизированы в 2 группы – ХЛТ на
основе цисплатина + ниволумаб vs
ХЛТ. Первичная конечная точка – местная БРВ (МБРВ) в течение 2 лет.
Двулетняя МБРВ составила 42,7% в
группе ХЛТ и 68,6% в группе ХЛТ
и ниволумаба (р=0,021). Данные по
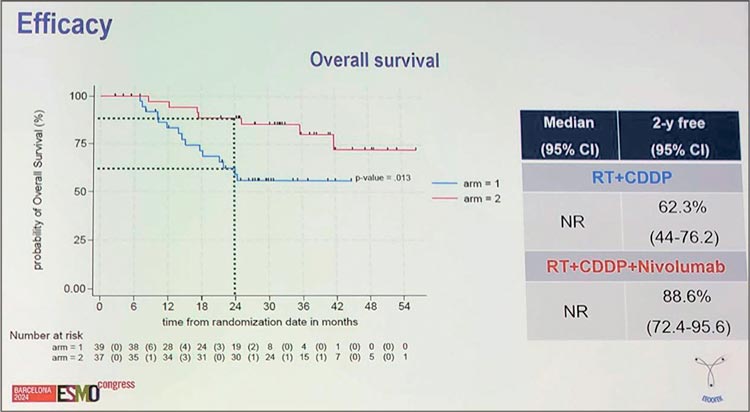
ОВ еще незрелые, но 2-летняя выживаемость составила 62,3% в группе ХЛТ vs 88,6% в экспериментальной группе (р=0,13) (рис.8).
Рисунок 8.
Данные по ОВ.
Крайне интересное и практически
значимое исследование. Эффективных опций лечения для пациентов,
не являющихся кандидатами для
РЦЭ, не так много. Стоит отметить,
что радиомодификатором в данной
работе являлся цисплатин, который
показал себя наилучшим партнером
для ИТ среди платиновых агентов
[9]. Очень хочется увидеть результаты III фазы, потенциально это
новый стандарт лечения при невозможности/отказе выполнения РЦЭ.
NIAGARA trial: дурвалумаб
+ GC vs GC в неоадъюванте
при мышечно-инвазивном
РМП
Идея химиоиммунотерапии (ХИТ)
в неоадъюванте РМП не нова. На
ASCO 2024 представлены данные
исследования AURA – добавление
авелумаба к ddMVAC и GС. Однако первичная конечная точка – частота pCR – не позволила сравнить
режимы между собой, к тому же отсутствовала группа контроля в виде
стандартной ХТ [10]. Комбинация
ниволумаб + GC изучалась в однорукавном исследовании и в качестве
органосохраняющей стратегии [11].
А вот исследование NIAGARA эти
недочеты попыталось исправить:
рандомизированная III фаза, первичные конечные точки – бессобытийная выживаемость (БСВ) и рCR.
Пациенты рандомизированы в 2
группы – 4 курса дурвалумаб + GC,
далее – дурвалумаб в поддержке до
8 курсов vs GC. Отрадно, что допускалось включение больных с промежуточным значением СКФ (≥40
– <60 мл/мин.) на GC split-dose.
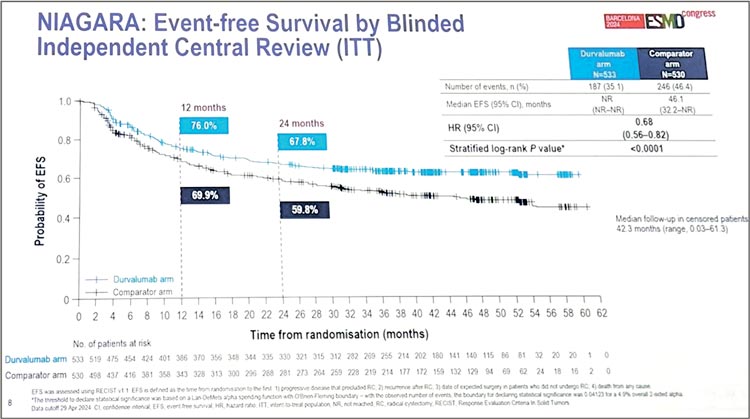
Медиана БСВ не достигнута в группе ХИТ и составила 46,1 мес. в группе ХТ (HR 0,68; 95% CI 0,56-0,82;
p<0,0001) (рис.9).
Рисунок 9.
Данные по БСВ.
Частота достижения полного патоморфоза составила 37,3% в группе
дурвалумаба + GC vs 27,5% в группе GC (OR 1,6; 95% CI 1,23-2,08;
p=0,0005). Интересный факт, что
впервые анализ pCR проведен в 2022
году, и статистически значимых различий в частоте полного ответа не
получено, однако 59 образцов были
неправильно оценены патоморфологами. В этом году коллеги исправились, все честно пересмотрели, и
уже различия продемонстрировали
достоверные преимущества группы
дурвалумаба. Медиана ОВ не достигнута, одно- и двулетняя выживаемость в группах ХИТ и ХТ составила
89,5% vs 86,5% и 82,2% vs 75,2% (HR
0,75; 95% CI 0,59-0,93; p=0,0106) соответственно.
Несмотря на вышеописанные преимущества дизайна исследования
NIAGARA, таки есть и некоторые замечания. Во-первых, стандарт НАХТ
смещается в сторону ddMVAC, и в
исследовании VESPER данная комбинация продемонстрировала частоту pCR в 42% vs 36% в группе GC
[12], что оказалось статистически
значимым. При непрямом сравнении рCR режим дурвалумаб + GC
оказался не лучше группы GC из
VESPER (37,3% и 36%). Во-вторых,
отсутствие адъювантной ИТ ниволумабом в группе контроля для пациентов, у которых не отмечено полного патоморфоза. В любом случае
исследование NIAGARA открывает
дверь в мир ХИТ при МИРМП, но
какой режим все-таки использовать
– большой вопрос.
UpFrontPSMA:
эффективность 177LuPSMA-617 в комбинации
с доцетакселом при
гормоночувствительном
раке предстательной
железы (ГЧРПЖ)
Терапия лютецием демонстрирует свою высокую эффективность
при кастрационно-резистентном
РПЖ (КРРПЖ) как в самостоятельном виде [13], так и в комбинации с
антиандрогенами [14]. Пациенты с
большим объемом распространения
согласно критериям CHAARTED выиграли от интенсификации терапии
до тройной комбинации (АДТ + доцетаксел + даролутамид/абиратерона ацетат) [15,16]. Может добавление
ПСМА-таргетной терапии позволит
улучшить результаты для этой группы больных?
В исследование включались пациенты с первичным метастатическим
ГЧРПЖ большого объема поражения и очагами, накапливающими
SUVmax >15 по данным ПЭТ/КТ с
ПСМА. Больные рандомизированы
в группу экспериментального подхода – 2 курса 177Lu-PSMA-617 7.5 ГБк
+ 6 курсов доцетаксела – и стандартной терапии – 6 курсов доцетаксела.
Первичная конечная точка – частота
полных ПСА ответов к 48 неделе терапии (≤0,2 нг/мл).
Все пациенты в экспериментальной
группе получили запланированные
курсы радиолигандной терапии
(РЛТ). В группе комбинации 6 курсов доцетаксела получили 79% пациентов, в группе стандартного лечения – 84%. Редукция доз требовалась
33% пациентов в группе Lu-PSMA и
лютеция и 17% в группе доцетаксела в монорежиме. Неопределяемый уровень ПСА к 48 неделе в группе
комбинации составил 41%, в группе
контроля – 16% (ОR 3,88; 95% CI 1,61-
9,38; p=0,002).
Рисунок 10.
Биохимическая ВБП, время до развития кастрационнорезистентной фазы.
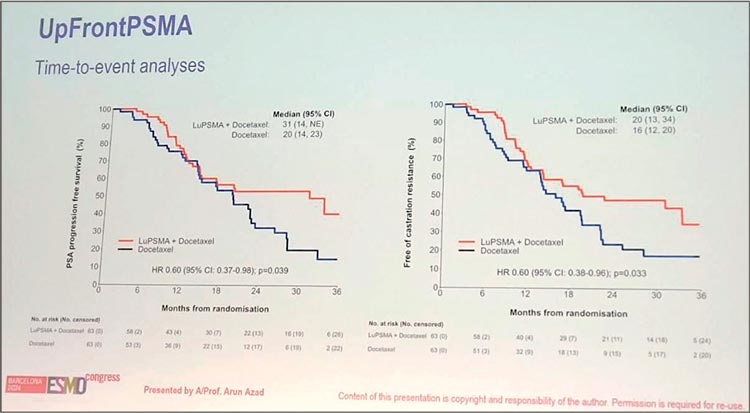
Отмечено преимущество экспериментального подхода как в биохимической ВБП (медиана: 31 мес. vs
20 мес.; HR 0,6; p=0,033) (рис.10), так
и радиологической (медиана: не достигнута vs 22 мес.; HR 0,58; p=0,067).
В ОВ значимых различий не получено (HR 0,6; 95% CI 0,38-0,96; p=0,033).
Несмотря на позитивные данные по
первичной конечной точке, интенсификация терапии для пациентов
с большой распространенностью
в виде двух курсов РЛТ не кажется адекватной. К тому же текущим
стандартом является проведение
тройной терапии с включением
антиандрогенов, что доступнее для
большего числа пациентов. На настоящий момент продолжается
исследование PSMAddition [17] –
вторая попытка интеграции РЛТ в
ГЧРПЖ. А пока что терапию 177LuPSMA-617 следует проводить только пациентам с мКРРПЖ.
PEACE-3: Ra-223
+ энзалутамид
у асимптомных/
малосимптомных пациентов
с преимущественно
костным метастатическим
поражением при КРРПЖ
Ранее исследование ERA-223 [18], в
котором изучалась комбинация абиратерона ацетата и Ra-223, оказалось
негативным в связи с недостижением
первичной конечной точки, к тому
же в экспериментальной группе продемонстрировано увеличение костных переломов. Многие думали, что
на комбинацию антиандрогена и Ra223 наложено вето, но, оказывается,
есть еще смельчаки.
В исследование PEACE-3 включены
пациенты с преимущественно костными метастазами и асимптомным
либо малосимптомным течением.
Пациенты рандомизированы в 2
группы: экспериментальная – Ra-223
55 кБк/кг каждые 4 недели, 6 курсов
+ энзалутамид 160 мг внутрь в сутки,
контрольная – энзалутамид 160 мг
внутрь в сутки. Первичная конечная
точка – рВБП. Важным преимуществом данного исследования стало
добавление остеомодифицирующих
агентов (ОМА). Факторами стратификации явились: страна, болевой
синдром, терапия доцетакселом, использование ОМА, терапия абиратероном. Стоит отметить, что треть
пациентов в каждой группе получила
ранее терапию доцетакселом и 2-3%
пациентов – абиратерон.
Рисунок 11.
Радиологическая выживаемость без прогрессирования.
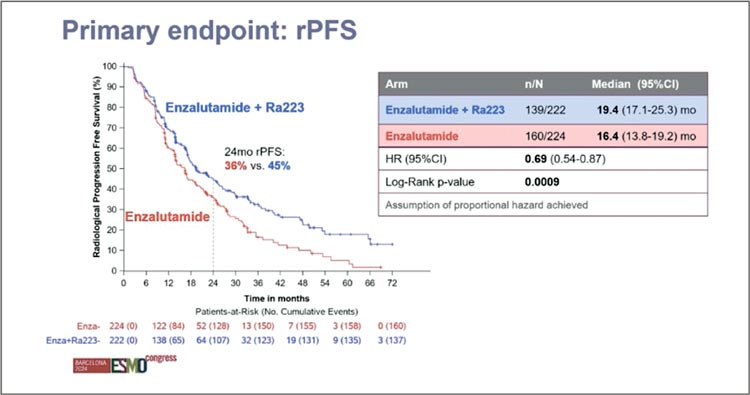
Добавление энзалутамида к Ra-223
позволило достоверно и статистически значимо улучшить рВБП (медиана: 19,4 мес. vs 16,4 мес.; HR 0,69; 95% CI 0,54-0,87; p=0,0009) (рис.11).
Наибольшее преимущество от комбинации отмечено у пациентов, не
получавших доцетаксел в анамнезе,
моложе 75 лет, с удовлетворительным соматическим статусом. Медиана ОВ составила 42,3 мес. в экспериментальной группе и 35 мес. в
контрольной (HR 0,69; 95% CI 0,52-
0,90; p=0,0031). Однако на границе 18
мес. отмечено пересечение кривых,
что заставляет задуматься над достоверностью результатов (рис.12).
Рисунок 12.
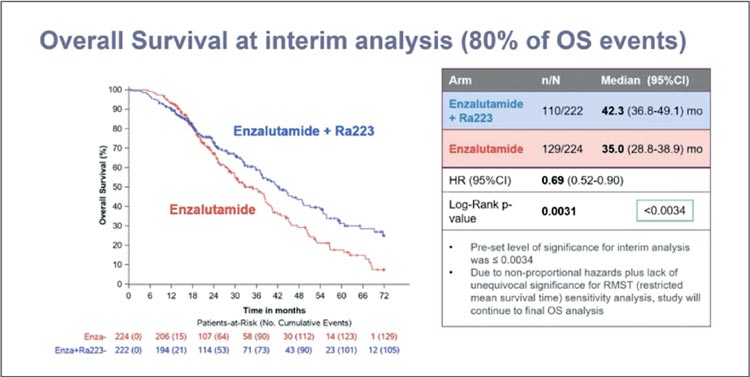
Не отмечено статистически значимых различий по симптомным скелетным событиям (отмечено у 18%
пациентов в каждой из групп).
Позитивные результаты данного
исследования заставляют пересмотреть наши взгляды на комбинацию
антиандрогена с Ra-223 для довольно очерченной категории больных
(только метастатическое поражение
костей, а- или малосимптомное течение, не получавшие ранее доцетаксел). Окончательному внедрению
в практику энзалутамида и радионуклидной терапии препятствует
неоднозначный результат по ОВ. С
нетерпением ждем финальных результатов данного исследования.
RAPSON trial: оценка
последовательности
Ra-223 > доцетаксел
или доцетаксел > Ra-223
при мКРРПЖ
В какой последовательности следует
проводить терапию при мКРРПЖ
– вопрос крайне дискутабельный.
Ранее в ретроспективном исследовании RALU продемонстрировано,
что нет значимых различий в отдаленных результатах при последовательной терапии доцетаксел → радий
→ лютеций ИЛИ радий → доцетаксел
→ лютеций [19].
В рандомизированное многоцентровое исследование II фазы RAPSON
включены пациенты с симптомными преимущественно костными
очагами, у которых отмечено прогрессирование на АДТ ± абиратерона ацетате или энзалутамиде. Пациенты рандомизированы в 2 рукава:
1) терапия Ra-223, далее при прогрессировании заболевания – доцетаксел; 2) доцетаксел, далее при прогрессировании заболевания терапия
Ra-223. Первичная конечная точка –
изменение качества жизни согласно
опроснику FACT-P к 12 неделе. При
медиане наблюдения 13 мес. ухудшение суммы баллов FACT-P отмечено
в 33% и 55% случаев среди групп Ra223 → доцетаксел и доцетаксел → Ra223 соответственно (рис.13).
Рисунок 13.
Разница в количестве баллов по опроснику FACT-P
среди различных ее составляющих
В группе Ra-223 → доцетаксел также
отмечено меньшее число редукций
доз (1 vs 9), отмен терапии в связи с
токсичностью (2 vs 7). Статистически значимых различий в мВБП не
обнаружено (р=0,074), мОВ не достигнута в группе Ra-223 → доцетаксел vs 17,4 мес. в группе доцетаксел →
Ra-223 (р=0,964).
Ставя во главу угла эффективность
какой-либо терапии, мы часто мало
обращаем внимание на качество
жизни в процессе лечения. Исследование RAPSON оказалось практически важным. С учетом роста
лекарственных опций при мКРРПЖ
определение правильной последовательности терапии – новая цель
клинических исследований. С чего
бы не начал свой путь в кастрационно-резистентной фазе пациент с
преимущественно костным поражением – Ra-223 → доцетаксел или доцетаксел → Ra-223 – выживаемость
не пострадает, а вот качество жизни
лучше в группе РНТ.
SPLASH: эффективность
177Lu-PNT2002 при PSMAпозитивном мКРРПЖ
после прогрессирования на
антиандрогенах
177Lu-PNT2002 ([Lu 177]-PSMAI&T) – радиолиганд небольшой
молекулы, нацеленный на ПСМА
и связанный с простатическим
DOTAGA.
В многоцентровое рандомизированное исследование III фазы
SPLASH включались пациенты с
мКРРПЖ и PSMA-позитивными
очагами, у которых отмечено прогрессирование на антиандрогене.
Допускалось включение пациентов, получивших доцетаксел на
гормоночувствительной фазе,
если терапия завершена более 1
года назад. Пациенты рандомизированы в 2 группы: экспериментальная – 177Lu-PNT2002 6.8
ГБк, всего 4 курса, и контрольная
– смена антиандрогена. Первичная конечная точка – рВБП. Исследованием разрешен кроссовер
в группу РЛТ в случае прогрессирования в контрольной группе, и
такой благой опцией воспользовались 84,6% пациентов.
Около 17% пациентов в каждой группе получили доцетаксел в гормоночувствительную фазу. При медиане
наблюдения 12 месяцев исследование
достигло первичной конечной точки в виде увеличения рВБП в группе
РЛТ (медиана: 9,5 vs 6 мес.; HR 0,71;
95% CI 0,55-0,92; p=0,0088) (рис.14).
Рисунок 14.
Данные по рВБП.
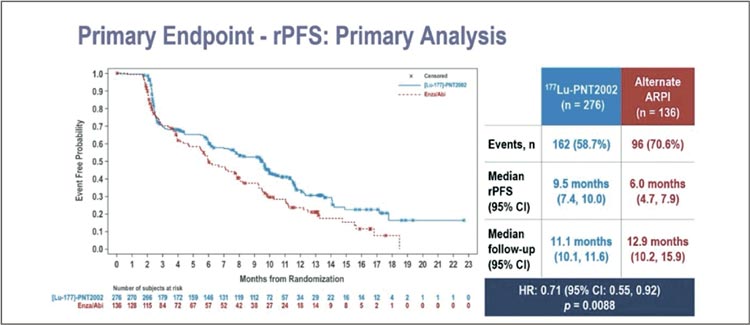
При подгрупповом анализе практически все группы получили выигрыш от РЛТ. Частота объективных
ответов (38,1% vs 12%; р=0,0021), снижение ПСА на 50% (35,7% vs 14,6%) и
качество жизни согласно опроснику
FACT-P (р=0,0005) выше в экспериментальной группе. При первом промежуточном анализе не получено
различий в ОВ (медиана: 20,8 мес. vs
не достигнуто; р=0,62).
Исследование SPLASH крайне напоминает исследование PSMAfore [20]
и по дизайну, и по своей сути: в оба
исследования включались преимущественно пациенты без таксанов
в анамнезе, допускался кроссовер,
группа контроля представлена откровенно слабой сменой антиандрогенов. Как внедрить данные этого
исследования в практику, пока что
сложно сказать. Вероятно, что целевой группой будут пациенты, у
которых есть противопоказания к
таксанам. Ждем более зрелые данные
по ОВ.
Источники:
- Powles T, et al. Renal cell carcinoma: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up 5 behalf of the ESMO Guidelines Committee. Annals of Oncology. 2024; Vol.35, P.692- 706. doi: 10.1016/j.annonc.2024.05.537.
- Renal Cell Carcinoma. EAU Guidelines. 2024.
- Bolek H, Yekedüz, E, Ürün Y. Combination therapies in patients with favorable risk metastatic renal cell Carcinoma: A Systematic Review and Meta-Analysis. Cancer Treat Rev. Jan. 2024; Vol.122, P.102667. doi: 10.1016/J. CTRV.2023.102667.
- Navani V, et al. CABOSEQ: The Effectiveness of Cabozantinib in Patients With Treatment Refractory Advanced Renal Cell Carcinoma: Results From the International Metastatic Renal Cell Carcinoma Database Consortium (IMDC). Clin Genitourin Cancer. Feb. 2023; Vol.21, no.1, P.106.e1-106.e8. doi: 10.1016/J.CLGC.2022.07.008.
- Pal SK, et al. Atezolizumab plus cabozantinib versus cabozantinib monotherapy for patients with renal cell carcinoma after progression with previous immune checkpoint inhibitor treatment (CONTACT-03): a multicentre, randomised, open-label, phase 3 trial. The Lancet. Jul. 2023; Vol.402, no.10397, P.185- 195. doi: 10.1016/S0140-6736(23)00922-4.
- Choueiri T.K, et al. Belzutifan versus Everolimus for Advanced Renal-Cell Carcinoma. New England Journal of Medicine. Aug. 2024; Vol.391, no.8, P.710- 721. doi: 10.1056/NEJMOA2313906/ SUPPL_FILE/NEJMOA2313906_DATASHARING.PDF.
- Gontero P, et al. Non-muscle-invasive Bladder Cancer (TaT1 and CIS) EAU Guidelines. 2024.
- Lorusso D, et al. Pembrolizumab or placebo with chemoradiotherapy followed by pembrolizumab or placebo for newly diagnosed, high-risk, locally advanced cervical cancer (ENGOT-cx11/GOG3047/KEYNOTE-A18): a randomised, double-blind, phase 3 clinical trial. The Lancet. Apr. 2024; Vol.403, no.10434, P.1341-1350. doi: 10.1016/S0140- 6736(24)00317-9.
- van der Heijden MS, et al. Nivolumab plus Gemcitabine-Cisplatin in Advanced Urothelial Carcinoma. New England Journal of Medicine. Nov. 2023; Vol.389, no.19, P.1778-1789. doi: 10.1056/ NEJMOA2309863/SUPPL_FILE/ NEJMOA2309863_DATA-SHARING. PDF.
- Blanc J, et al. Avelumab (A) as neoadjuvant therapy in patients (pts) with muscle-invasive urothelial carcinoma (MIUC): Survival data of AURA trial, Oncodistinct 004. Journal of Clinical Oncology. Jun. 2024; Vol.42, no.16_suppl, P.4516-4516. doi: 10.1200/ JCO.2024.42.16_SUPPL.4516.
- Galsky MD, et al. Gemcitabine and cisplatin plus nivolumab as organ-sparing treatment for muscle-invasive bladder cancer: a phase 2 trial. Nature Medicine. Oct. 2023; Vol.29, no.11, P.2825-2834. doi: 10.1038/s41591-023-02568-1.
- Pfister C, et al. Dose-Dense Methotrexate, Vinblastine, Doxorubicin, and Cisplatin or Gemcitabine and Cisplatin as Perioperative Chemotherapy for Patients With Nonmetastatic MuscleInvasive Bladder Cancer: Results of the GETUG-AFU V05 VESPER Trial. Journal of Clinical Oncology. Jun. 2022; Vol.40, no.18, P.2013-2022. doi: 10.1200/JCO.21.02051/SUPPL_FILE/ PROTOCOL_JCO.21.02051.PDF.
- Sartor O, et al, Lutetium-177–PSMA617 for Metastatic Castration-Resistant Prostate Cancer. New England Journal of Medicine. Sep. 2021; Vol.385, no.12, P.1091- 1103. doi: 10.1056/NEJMOA2107322/ SUPPL_FILE/NEJMOA2107322_DATASHARING.PDF.
- Emmett L, et al. [177Lu]LuPSMA-617 plus enzalutamide in patients with metastatic castration-resistant prostate cancer (ENZA-p): an openlabel, multicentre, randomised, phase 2 trial. Lancet Oncol. May 2024; Vol.25, no.5, P.563-571. doi: 10.1016/S1470- 2045(24)00135-9.
- Smith MR, et al. Darolutamide and Survival in Metastatic, Hormone-Sensitive Prostate Cancer. New England Journal of Medicine. Mar. 2022; Vol.386, no.12, P.1132-1142. doi: 10.1056/ NEJMOA2119115/SUPPL_FILE/ NEJMOA2119115_DATA-SHARING. PDF.
- Fizazi K, et al. Abiraterone plus prednisone added to androgen deprivation therapy and docetaxel in de novo metastatic castrationsensitive prostate cancer (PEACE-1): a multicentre, open-label, randomised, phase 3 study with a 2×2 factorial design. The Lancet. Apr. 2022; Vol.399, no.10336, P.1695-1707. doi: 10.1016/ S0140-6736(22)00367-1.
- Tagawa ST, et al. PSMAddition: A phase 3 trial to compare treatment with 177Lu-PSMA-617 plus standard of care (SoC) and SoC alone in patients with metastatic hormone-sensitive prostate cancer. Journal of Clinical Oncology. Jun. 2023; Vol.41, no.16_suppl, P.TPS5116-TPS5116. doi: 10.1200/ JCO.2023.41.16_SUPPL.TPS5116.
- Smith M, et al. Addition of radium-223 to abiraterone acetate and prednisone or prednisolone in patients with castration-resistant prostate cancer and bone metastases (ERA 223): a randomised, double-blind, placebocontrolled, phase 3 trial. Lancet Oncol. Mar. 2019; Vol.20, no.3, P.408-419. doi: 10.1016/S1470-2045(18)30860-X.
- Rahbar K, et al. Safety and Survival Outcomes of 177 Lu-Prostate-Specific Membrane Antigen Therapy in Patients with Metastatic Castration-Resistant Prostate Cancer with Prior 223 Ra treatment: The RALU Study. doi: 10.2967/jnumed.122.264456.
- Morris MJ, et al. 177Lu-PSMA-617 versus a change of androgen receptor pathway inhibitor therapy for taxanenaive patients with progressive metastatic castration-resistant prostate cancer (PSMAfore): a phase 3, randomised, controlled trial. The Lancet. Sep. 2024; Vol.404, no.10459, P.1227-1239. doi: 10.1016/S0140- 6736(24)01653-2.
НОВОСТИ ESMO 2024 / ПОСВЯЩЕННЫЕ ЛЕЧЕНИЮ НМРЛ
Автор: Моисеенко Федор Владимирович
ГБУЗ «СПб КНпЦСВМП(о) им. Н.П. Напалкова»,
ФГБОУ ВО «СЗГМУ им. И.И. Мечникова»
Минздрава России, доктор медицинских наук,
Санкт-Петербург
Исследования последнего времени
показали, что применение ингибиторов контрольных точек может
позволить иммунной системе реализовывать выраженный противоопухолевый эффект. При этом в зависимости от стадии болезни, на которой
применяются данные препараты,
эффект может заключаться в уменьшении или исчезновении очагов на
длительное время при метастатической стадии, длительном отсутствии
роста очагов после химиолучевой
терапии при поддерживающем режиме, отсутствии рецидива болезни
при послеоперационной применении и достижении различной степени патоморфологического регресса
при предоперационном курсе.
Сейчас мы находимся на этапе изучения иммунотерапии у больных с
локализованными опухолями. В то
время как во многих работах по периоперационному использованию
ингибиторов контрольных точек
уже было показано существенное
увеличение времени без рецидива
заболевания, а также практически
десятикратное увеличение вероятности достижения полного патоморфологического регресса, влияние на
общую продолжительность жизни
и вероятность излечения пока проявляется не так ярко. На этом фоне
пока окончательных данных по
общей выживаемости в исследованиях еще не получено, на конгрессе
ESMO было представлено несколько
любопытных клинических работ, в
которых проводится связь между
суррогатными маркерами пользы и
классическими отдаленными показателями выживаемости.
В подгрупповом анализе исследования KEYNOTE 671 было указано,
что большинство пациентов, достигших pCR на неоадъювантном этапе, продолжают наблюдаться после
окончания адьювантной терапии без
прогрессирования заболевания [1].
Любопытно, что 3 из 7 зарегистрированных рецидива зафиксированы
более чем через 3 года после начала
лечения.
С учетом прогностической значимости pCR продолжаются активные
попытки неинвазивного, предоперационного предсказания данного
варианта ответа. В поданализе крупного исследования CHECKMATE
77T было сказано, что достижение
pCR выделяет группу со значительно меньшей вероятностью рецидива
заболевания (HR 0,59 [0,12–2,91]) [2].
Кроме того, достижение pCR, оценить который на настоящий момент
возможно только во время хирургической операции, было ассоциировано с исчезновением и цоДНК.
Любопытно, что в работе IMPower
010, включившей адъювантное применение атезолизумаба, улучшение
общей выживаемости больных наблюдалось в цоДНК позитивной
группе, но не в негативной [3]. Среди
других факторов, ограничивавших
группу с максимальным преимуществом, получаемым от адъювантной
иммунотерапии, – наличие экспрессии PD-L1 и большая стадия заболевания.
Несмотря на большой объем уже
полученных результатов наши представления о механизмах активации
иммунной системы, в частности,
против опухолевых клеток с помощью ингибиторов контрольных точек, остаются крайне поверхностными. В этом году сразу несколькими
группами подтверждено сделанное
ранее наблюдение о меньшей эффективности иммунотерапии при
ее введении в первые три месяца
лечения в послеполуденное время.
В качестве примера можно привести работу из Испании, в которой
на основании данных 418 пациентов авторы показали, что среди
больных, получивших введение после 16:30, была ниже частота объективных ответов (37,7% vs 22,6%),
время до прогрессирования (3,1 vs
4,8 мес.; p<0,05), а также общая выживаемость (5,6 vs 14,8 мес.; p<0,05)
[4]. Таким образом, на настоящий
момент объем доказательств целесообразности утреннего введения
иммунотерапевтических препаратов
не вызывает сомнений, применение
же этих результатов в клинической
практике связано с решением в каждом конкретном центре, так как пока
не регулируется регуляторной базой.
Другим вопросом, имеющим первостепенное значение как для системы
здравоохранения, так и для предотвращения нежелательных явлений у
пациентов, является доза используемых ингибиторов контрольных
точек. Ранее в исследованиях 1-й
фазы было показано, что насыщение рецептора при введении многих
ингибиторов PD-1 достигается при
значительно более низких уровнях
дозирования, чем те, которые были
зарегистрированы. В этом году были
представлены результаты проспективного сравнения стандартных
(400 мг каждые 6 недель, 200 мг каждые 3 недели) и редуцированных
(300 мг каждые 6 недель и 100 мг
каждые 2 недели) доз пембролизумаба (DEDICATION-1 trial) [5]. Статистическая non-inferiority гипотеза
для редуцированных доз в виде подтверждения отсутствия различий в
одногодичной выживаемости была
доказана, что в очередной раз подтверждает возможности для альтернативного подхода к использованию
имеющихся ресурсов.
В области таргетной терапии
НМРЛ большое число успешных попыток направленного блокирования
опухолей, ассоциированных с мутациями KRAS, ознаменовало собой
концептуально значимое движение
вперед. Так, клиническое изучение
диварасиба – более нового, в сравнении с соторасибом и адаграсибом,
ингибитора G12C – показало его потенциальную эффективность даже
в монорежиме: 13,8 мес. медианы
ВДП и 55,6% ЧОО вселяют надежду
на скорое практическое применение
данного препарата [6]. При отсутствии принципиальных отличий от
более новых таргетных ингибиторов
KRAS диварасиб в 10-50 раз более
селективен к мишени и обладает в
5-25 раз большим сродством, что и
обеспечивает подобное улучшение
результатов.
Стратегически новый подход в блокировании опухолей, ассоциированных с драйверным молекулярным
изменением, был продемонстрирован в раннем исследовании первого
в своем классе «protein degrader» у
больных с KRAS G12D – ASP3082 [7].
Механизм действия препарата основан на связи KRAS с мутацией G12D
с E3 лигазой, что усиливает убиквитинизацию и протеосомальную
деградацию KRAS. Говорить о выраженной клинической пользе пока
преждевременно, однако в подгруппе больных с НМРЛ объективные
ответы наблюдались у 3/13 пациентов, а у 11/13 заболевание контролировалось.
Источники:
- Garassino MC, et al. Neoadjuvant Pembrolizumab or Placebo Plus Chemotherapy Followed by Adjuvant Pembrolizumab or Placebo for EarlyStage Non-Small-Cell Lung. #1210P.
- Mariano Provencio Pulla, et al. Perioperative nivolumab vs placebo in patients with resectable NSCLC: clinical update from the phase 3 CheckMate 77T study. #LBA50.
- Heather Wakelee, et al. IMpower010: ctDNA Status and 5-Y Disease-Free Survival Follow-Up in Patients With Resected NSCLC Who Received Adjuvant Chemotherapy Followed by Atezolizumab or Best Supportive Care. #1211P.
- Víctor Albarrán, et al. Association of infusion timing with immunotherapy outcomes: real-world evidence from a multi-tumor cohort. #1063P.
- Michel M van den Heuvel, et al. Lowdose versus standard dose pembrolizumab for treatment of advanced-stage nonsmall cell lung carcinoma (NSCLC).
- Elena Garralda, et al. Long-term follow-up of single-agent divarasib in patients with KRAS G12C-positive solid tumors.
- Wungki Park, et al. Preliminary safety and clinical activity of ASP3082, a first-in-class, KRAS G12D selective protein degrader in adults with advanced pancreatic, colorectal, and non-small cell lung cancer.
НОВОСТИ ESMO 2024 / МЕСТНОРАСПРОСТРАНЕННАЯ МЕЛАНОМА КОЖИ
Автор: Жукова Наталья Владимировна
Заведующая отделением противоопухолевой лекарственной терапии
клиники высоких технологий «Белоостров» (ГК ММЦ),
доцент кафедры онкологии СПбГУ, кандидат медицинских наук, Санкт-Петербург
Королева Екатерина Игоревна
Врач-онколог отделения противоопухолевой лекарственной терапии
клиники высоких технологий «Белоостров» (ГК ММЦ), Санкт-Петербург
Прошедший недавно конгресс
ESMO 2024 не был богат на новые
данные в лечении меланомы, но
мы выбрали кое-что интересное.
Захотим ли и сможем ли мы воспользоваться полученными данными в реальной практике – покажет время.
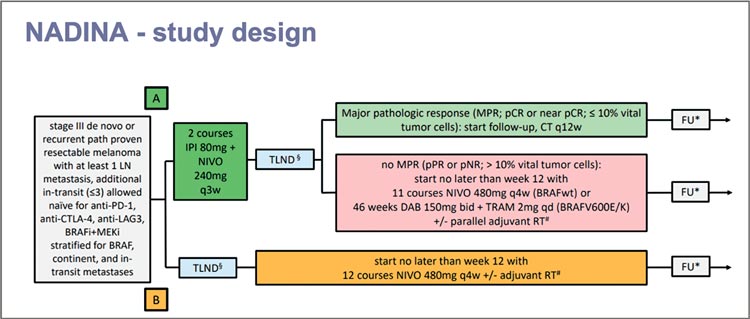
Многие результаты, представленные на ESMO 2024, касались лечения местнораспространенной меланомы кожи, а именно лечения в неоадъювантном режиме. Так, Minke W. Lucas были доложены обновленные данные исследования NADINA, широко обсуждавшегося ранее на ASCO в этом году.
NADINA – исследование 3 фазы, в которое было включено 423 пациента с резектабельной меланомой III стадии в период с 2021 по 2023 год. Исследование состояло из 2 рукавов: в первой группе 212 пациентов получали 2 цикла комбинированной иммунотерапии (кИТ) по схеме ниволумаб 240 мг + ипилимумаб 80 мг 1 раз в 21 день перед операцией, затем пациенты переводились в наблюдение при достижении полного или почти полного патоморфологического ответа, при частичном патоморфологическом ответе или отсутствии ответа пациентам назначались BRAF+MEK ингибиторы для BRAFV600Е/К или ниволумаб в адъювантном режиме для BRAFwt; во второй группе 211 пациент получал 12 циклов адъювантной иммунотерапии (ИТ) ниволумабом (рис.1).
Рисунок 1.
Дизайн исследования NADINA.
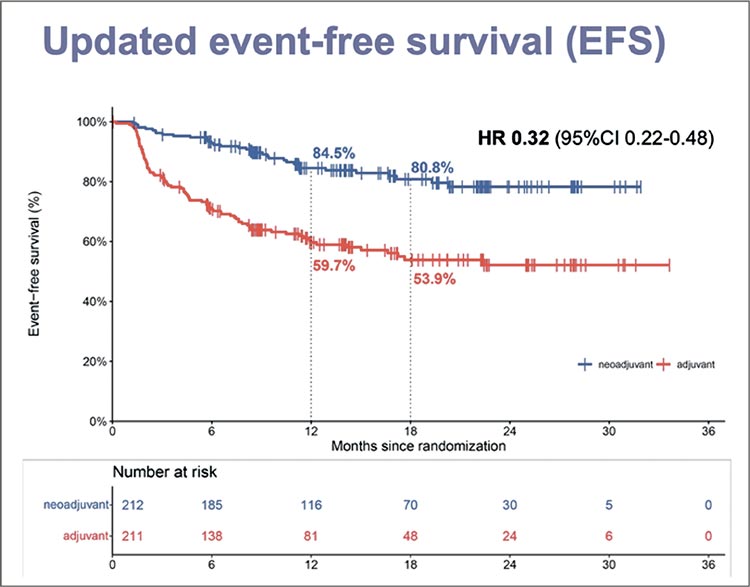
Обновленные данные, представленные на ESMO 2024, подтверждают отмеченную ранее тенденцию преимущества в бессобытийной выживаемости (EFS) в группе неоадъювантной терапии: 18-месячная EFS составила 80,8% в группе кИТ ниволумаб + ипилимумаб и 53,9% в группе ИТ ниволумаб (p<0,001) (рис.2). Разница в выживаемости без отдаленных метастазов после 18 месяцев наблюдения также была статистически значимой: 85,7% в неоадъювантной группе кИТ ипилимумаб + ниволумаб и 62,4% в группе адъювантной ИТ ниволумаба.
Рисунок 2.
Обновленные данные по бессобытийной
выживаемости, NADINA trial.
Частота развития большого патоморфологического ответа (major pathological response, MPR) составила 60,8%, полный патоморфологический ответ (pathological complete response, pCR) зафиксирован в 49,1% случаев. Выживаемость без отдаленных метастазов в зависимости от глубины патоморфологического ответа представлена на рисунке 3.
Рисунок 3.
Выживаемость без отдаленных метастазов в
зависимости от глубины патоморфологического ответа,
NADINA trial.
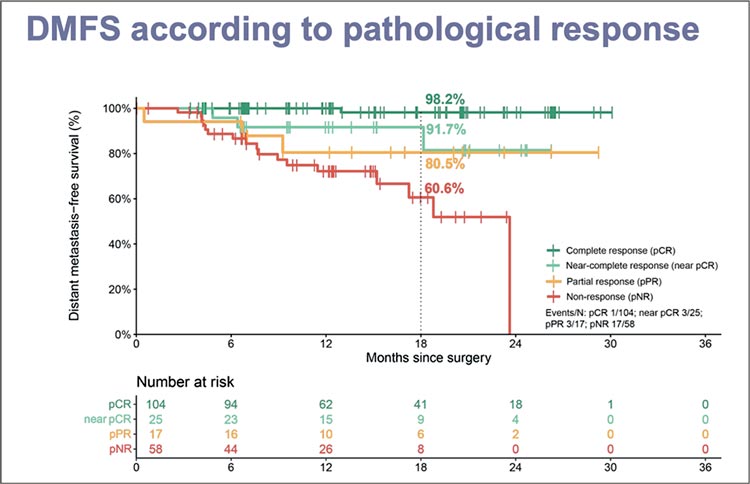
Важность проведения неоадъювантного лечения меланомы демонстрирует и обновленный анализ, представленный Georgina V. Long, International Neoadjuvant Melanoma Consortium. В нем также отмечается увеличение безрецидивной выживаемости у пациентов с резектабельной меланомой ≥IIIB стадии, получавших иммунотерапию в неоадъювантном режиме. Первоначально в 2021 году в журнале Nature были опубликованы данные 192 пациентов. На конгрессе ESMO 2024 были представлены обновленные данные 818 пациентов с медианой наблюдения 3 года (от 0,05 до 11 лет): 75% пациентов получали неоадъювантную терапию ингибиторами контрольных точек иммунного ответа (ИКТИО) (из них 11% – монотерапию антиPD1, 43% – комбинацию анти-PD1 + СTLA4, 6,7% – комбинацию PD1+LAG3, 3,8% – комбинацию анти-PD1 + другой ИКТИО, 0,5% – монотерапию CTLA4); 11% получали неоадъювантную терапию BRAF+MEK ингибиторами; 15% – комбинацию ингибиторов контрольных точек и таргетной терапии.
У пациентов, получавших неоадъювантную терапию ингибиторами контрольных точек, частота полных и частичных патологических ответов (рис.4) составила 70% (из них полный и почти полный патоморфологический ответ – у 58%), BRAF + MEK ингибиторы – 73% (полный и почти полный патоморфологический ответ – у 51%), ингибиторы контрольных точек + таргетную терапию – 64% (полный и почти полный патоморфологический ответ – у 46%).
Рисунок 4.
Влияние вариантов неоадъювантной тера
пии на патоморфологический ответ.
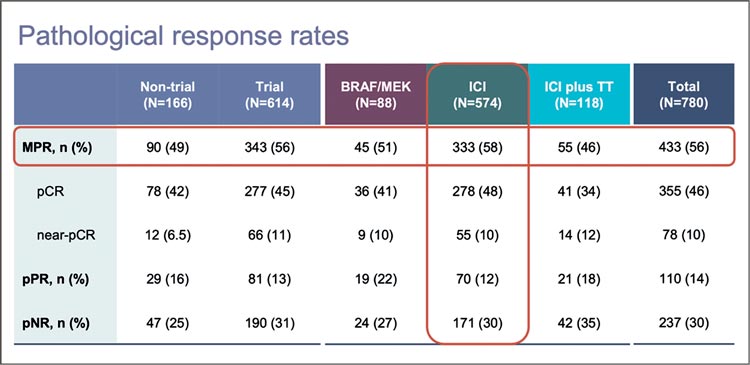
Рисунок 5.
Влияние вариантов неоадъювантной терапии на выживаемость.
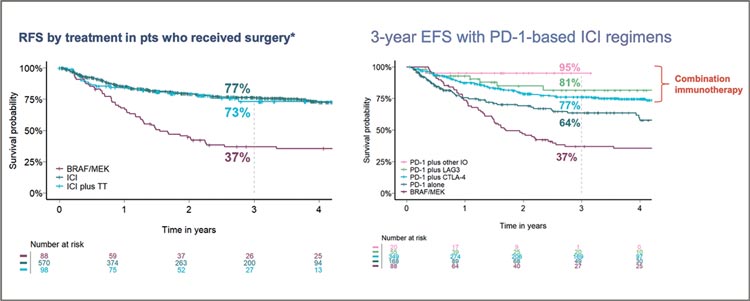
Данные, полученные по безрецидивной выживаемости (БРВ) у пациентов, которым было проведено хирургическое лечение, показывают преимущество ИКТИО в неоадъювантном режиме: у таких пациентов 3-летняя БРВ составила 77%; у пациентов, получавших BRAF+MEK ингибиторы, – 37%, ИКТИО + таргетную терапию – 73%. Среди ИКТИО лидирующие позиции по показателю БРВ занимает комбинация иммунотерапии (например, 3-летняя БРВ на комбинации анти-PD1 + другого ИКТИО – 95%, на комбинации анти-PD1+LAG3 – 81%, на комбинации анти-PD1 + СTLA4 – 77%, на монотерапии анти-PD1 – 64%).
Наилучшая 3-летняя безрецидивная выживаемость отмечалась у пациентов, у которых был достигнут полный или почти полный патоморфологический ответ на фоне ингибиторов контрольных точек – 89% (рис.6).
Рисунок 6.
Безрецидивная выживаемость в зависимости
от глубины патоморфологического ответа, INMC trial.
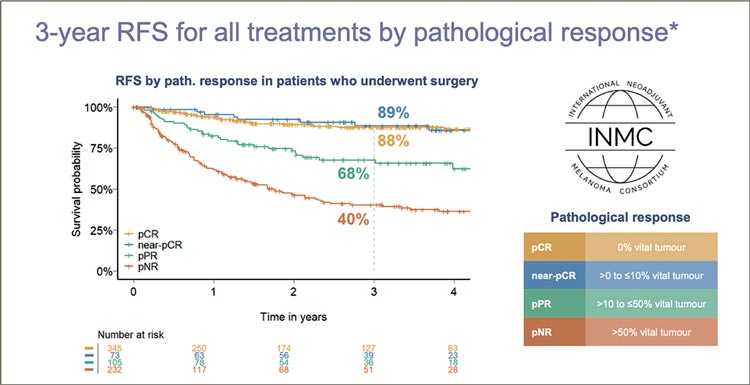
Рисунок 7.
Включение адъювантной терапии в стандарты
лечения меланомы III стадии в Швеции в 2018 году не дало
улучшения в меланома-специфичной и общей выживаемости.
Получая такие обнадеживающие данные об эффективности иммунотерапии в неоадъювантном режиме, начинаешь задумываться, а как они соотносятся с данными по адъювантной терапии пациентов с местнораспространенной меланомой кожи после хирургического лечения?
Обратим внимание на обновленные данные EORTC 1325-MG/ KEYNOTE-054, доложенные на ESMO 2024. По результатам 7-летнего наблюдения в рамках исследования сохранялось преимущество в БРВ (50% против 36%; HR=0,63) и выживаемости без отдаленных метастазов (54% против 42%; HR=0,64) у пациентов с меланомой III стадии и высоким риском рецидива, получавших пембролизумаб, по сравнению с пациентами, получавшими плацебо. Преимущество сохранялось вне зависимости от наличия BRAF мутации и уровня экспрессии PD-L1. Данные по общей выживаемости в настоящий момент не представлены.
В целом, наличие или отсутствие преимущества со стороны общей выживаемости от проведения адъювантной иммунотерапии у данной когорты пациентов в настоящий момент активно обсуждается. Так, на конгрессе ESMO 2024 Hildur Helgadottir представила результаты проведенного в Швеции исследования, включавшего 1376 пациентов с III стадией меланомы и положительным результатом биопсии сигнальных лимфатических узлов. Пациенты были разделены на 2 когорты в зависимости от даты постановки диагноза относительно внедрения адъювантной терапии в Швеции в 2018 году: у первой когорты (пре-когорта) диагноз был установлен с 2016 по август 2018 года и адъювантная терапия не назначалась, у второй когорты (посткогорта) диагноз был установлен с сентября 2018 года по декабрь 2020 года, когда в стандарт лечения вошла адъювантная терапия. По результатам 3-летнего наблюдения статистически значимых различий в общей выживаемости или меланома-специфичной выживаемости не отмечалось.
Выводы:
- Все больше полученных нами данных, включая доложенные на ESMO 2024, показывают необходимость пересмотра стандартов лечения местнораспространенной меланомы кожи. Многие исследователи приходят к выводу, что неоадъювантная терапия на основе антиPD1 превосходит адъювантную и вскоре должна стать новым стандартом терапии.
- Конечно, у нас остаются актуальными вопросы, какие есть варианты терапии для не ответивших на лечение пациентов. Можем ли мы предсказать, кому нужна комбинация препаратов, обращая внимание на выраженность иммуноопосредованных осложнений и формирование хронической токсичности? Ответы на них даст время.
НОВОСТИ ESMO 2024 / РАК МОЛОЧНОЙ ЖЕЛЕЗЫ
Автор: Титова Татьяна Александровна
Врач-онколог отделения противоопухолевой лекарственной терапии №1
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России,
кандидат медицинских наук, Москва
Современные конъюгаты антител
с цитостатиком активно изучаются при раке молочной железы
(РМЖ), а некоторые, такие как
трастузумаб дерукстекан (T-DXd),
уже внедрены и в рутинную клиническую практику.
На конгрессе представлены первые результаты исследования
DESTINYBreast-12, посвященного, в том числе, оценке эффективности T-DXd у пациентов с
HER2-позитивным диссеминированным РМЖ с метастазами в
головном мозге (ГМ). Напомним,
что приблизительно у 30-55%
пациентов с HER2-позитивным
дРМЖ диагностируются интракраниальные метастазы.
В исследование DESTINY
Breast-12 было включено 504 пациента с ECOG 0-1, ранее получивших не менее 2 линий терапии,
у 263 больных диагностировано
метастатическое поражение головного мозга (ГМ). Более трети
больных ранее получали трастузумаб эмтанзин.
Все пациенты получали T-DXd в
дозе 5,4 мг/кг 1 раз в 3 недели. В
когорте пациентов с метастазами
в ГМ 12-месячная ВБП достигла
61,6%, при медиане ВБП в 17,3 мес.;
12-месячная ВБП при стабильных
метастазах в ГМ составила 62,9%,
что практически сопоставимо с
12-мес. ВБП при «активных» метастазах в ГМ – 59,6% (рис.1).
Рисунок 1.
Первые результаты исследования DESTINYBreast-12.
12-месячная ОВ у пациентов с интракраниальными метастазами составила 90,3% и 90,6% – у пациентов без них.
Непосредственная эффективность терапии по очагам в головном мозге оценена у 119 больных.
В общей группе пациентов частота достижения объективного ответа составила 51,7%.
Нежелательные явления (НЯ)
3 степени и выше зарегистрированы у 51,0% и были преимущественно представлены нейтропенией (16%), анемией (7%) и
слабостью (9%).
Что нам дают результаты данной
работы? Эксперты отметили, что
появление такого эффективного
препарата при метастазах в ГМ,
как T-DXd, позволяет в некоторых ситуациях отказаться от облучения всего объема головного
мозга. Однако Fatima Cardoso напомнила, что только интракраниальное прогрессирование не является показанием к смене линии
терапии, а добавление этапа локального контроля, который обеспечивает стереотаксическая ЛТ,
позволяет продолжить системное
лечение в прежнем режиме.
На Конгрессе исследователи из
Франции представали результаты исследования II фазы ICARUSBREAST01, в котором изучалась
активность патритумаба дерукстекана у пациентов с гормонопозитивным HER2-отрицательным
неоперабельным местнораспространенным/метастатическим
РМЖ, ранее получавших ингибиторы CDK-4/6 в комбинации
с эндокринной терапией и одну
линию химиотерапии.
Патритумаб дерукстекан – конъюгат IgG1 к рецептору HER3 и ингибитора топоизомеразы I типа.
В ранее представленных работах
показано, что экспрессия HER3
ассоциирована с агрессивным течением РМЖ и резистентностью
к эндокринотерапии.
Крайне интересная работа, с учетом того, что все мы знаем о низкой эффективности гормонотерапии у пациентов ГР+ HER2- отрицательным РМЖ, ранее получавших ингибиторы CDK-4/6. В работу включено 99 больных, получавших патритумаб дерукстекан в дозе 5,6 мг/кг в/в капельно каждые 3 недели. В исследовании могли принимать участие пациенты с любым уровнем экспрессии HER3. У 49,4% пациентов уровень мембранного окрашивания опухолевых клеток РМЖ оценен как HER3-high (мембранное окрашивание ≥75% опухолевых клеток), а у 16,2% – ниже 25%. Частота объективного ответа достигла 53,5% при медиане длительности ответа в 8,7 мес., а контроль роста опухоли составил 62,6%. Медиана ВБП – 9,4 мес. (рис.2).
Рисунок 2.
Результаты исследования ICARUS-BREAST01.
У 50,1% пациентов зарегистрированы НЯ ≥3 степени и выше,
которые преимущественно были
представлены усталостью (10,1%),
тошнотой (14,1%) и диареей
(10,1%).
При поданализе было показано, что наличие мутации в гене
PIK3CA не влияло на эффективность терапии патритумаб дерукстеканом.
Таким образом, патритумаб дерукстекан демонстрирует эффективность в поздних линиях терапии ГР+ HER2-отрицательного
РМЖ.
Были представлены результаты исследования CAPItello-290, оценивающего целесообразность добавление капивасертиба к паклитакселу
в первой линии терапии диссеминированного ТНРМЖ.
Капивасертиб – селективный ингибитор всех 3 изоформ АКТ (AKT1,
AKT2 и AKT3), что приводит к нарушению передачи сигнала по пути
PIK3CA-AKT-mTOR.
В исследование CAPItello-290 было
рандомизировано 812 больных (1:1),
ранее не получавших терапию по поводу диссеминированного ТНРМЖ.
К сожалению, добавление капивасертиба к паклитакселу в общей популяции не привело к увеличению
мОВ – 17,7 и 18,0 мес. соответственно (p=0,3239). При подгрупповом
анализе у пациентов с альтерациями
в генах PIK3CA, AKT, PTEN также
не показано улучшения отдаленных
результатов терапии при добавлении капивасертиба (рис.3).
Рисунок 3.
Результаты исследования CAPItello-290.
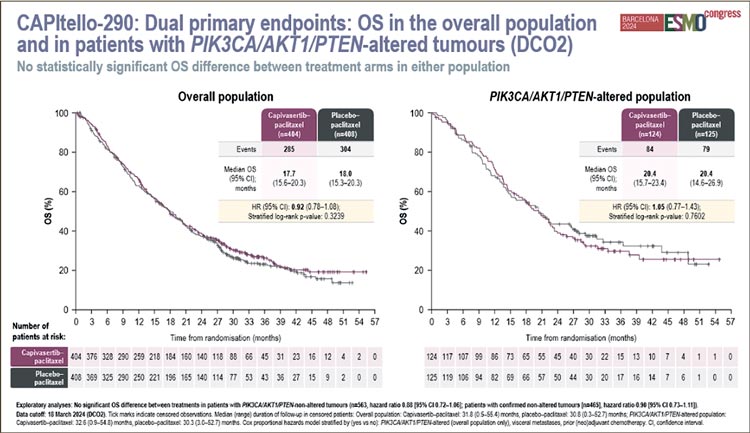
НЯ 3 степени и выше отмечены у 58,8% больных в группе с капивасертибом и у 38,8% в группе с плацебо и были преимущественно представлены диарей (12,7% против 0,7%), нейтропенией (7,2% против 6,6%), анемией (4,0% против 4,9%) и сыпью (5,5% против 0,2%).
В этом исследовании в очередной раз продемонстрировано, насколько различны драйверные механизмы при развитии гормонозависимого и ТНРМЖ.
Источники:
- Lin N, et al. Trastuzumab deruxtecan (T-DXd) in patients (pts) with HER2+ advanced/metastatic breast cancer (mBC) with or without brain metastases (BM): DESTINYBreast-12 primary results. ESMO Congress 2024, LBA18 Proffered Paper Session – Breast cancer, metastatic.
- Pistilli B, et al. Efficacy, safety and biomarker analysis of ICARUSBREAST01: A phase 2 study of patritumab deruxtecan (HER3-DXd) in patients (pts) with HR+/HER2- advanced breast cancer (ABC). ESMO Congress 2024, Abstract 340O.
- Heather McArthur Capivasertib (C) + paclitaxel (P) as first-line treatment of metastatic triple-negative breast cancer (mTNBC): The CAPItello-290 phase III trial. LBA19 Proffered Paper Session – Breast cancer, metastatic.
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / МЫШЕЧНО-ИНВАЗИВНЫЙ РАК МОЧЕВОГО ПУЗЫРЯ (МИРМП): ОТДАЛЕННЫЕ РЕЗУЛЬТАТЫ В ЗАВИСИМОСТИ ОТ ЧИСЛА КУРСОВ ХТ
Автор: Фатеева Анастасия Валерьевна
Заведующая отделом телемедицинских технологий, онколог,
химиотерапевт, ГБУЗ «Приморский краевой онкологический диспансер»,
Владивосток
Исраелян Эдгар Рудикович
Врач-онколог отделения противоопухолевой лекарственной терапии
ФГБУ «Национальный медицинский исследовательский центр онкологии
им. Н.Н. Блохина» Минздрава России, Москва
Неоадъювантная химиотерапия с последующей радикальной цистэктомией – стандартный подход ведения пациентов
с МИРМП. На практике значительной части пациентов удается
провести ≥3 курсов НАХТ (что не
ухудшает результаты лечения по
сравнению с 4 курсами). А какова участь пациентов, получивших
<3 курсов ХТ?
В ретроспективный анализ, представленный в сентябрьском номере журнала Clinical Genitourinary
Cancer, было включено 256 пациентов, которым проведено ≥1
курса НАХТ (GC, ddMVAC).
Пациенты, получившие <3 курсов НАХТ (n=39), оказались:
- старше, чем пациенты из группы ≥3 курсов НАХТ (медиана возраста 75 лет vs 66 лет, р<0,001);
- в худшем соматическом статусе (ECOG0 61,5% vs 76,5%, p=0,015);
- с меньшей стартовой СКФ (медиана СКФ 71 мл/мин. vs 90 мл/ мин.).
Рисунок 1.
Кривые безрецидивной выживаемости при
проведении менее 3 курсов НАХТ (А) и 3 и более курсов (В).
Причины, приведшие к завершению терапии:
- развитие НЯ – ухудшение почечной функции (43%), астения (18%), диарея, гипотензия и гематологическая токсичность (по 13%);
- отказ от продолжения ХТ (8%). Результаты лечения:
- рCR между группами <3 и ≥3 курсов НАХТ составил 9,4% против 27% (p=0,008);
- медиана бессобытийной выживаемости – 11,6 против 79,5 мес. (р<0,001);
- 5-летняя ОВ составила 13,3% против 53,3% (р=0,002).
Эффективность предоперационной лекарственной терапии
напрямую зависит от дозы введенного цисплатина (поданализ
исследования VESPER). В то же
время частота pCR при цистэктомии на первом этапе составляет
5-15%, что равнозначно аналогичному показателю при проведении
<3 курсов НАХТ. Результаты данного исследования трактуют необходимость в более четком определении кандидатов для НАХТ
при МИРМП.
Источник:
Chakraborty Anumita,
et al. Survival outcomes in patients
with muscle-invasive bladder cancer
receiving neoadjuvant chemotherapy
stratified by number of cycles.
Clinical Genitourinary Cancer. 2024
September 11; Vol.0, Issue 0, 102218.
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / COMBINAIR 3 TRIAL: РОЛЬ ПЭТ-КТ С 18ФДГ У ПАЦИЕНТОВ С НАЧАЛЬНОЙ СТАДИЕЙ САРКОМЫ ЮИНГА
Во французском проспективном исследовании II фазы, в которое
было включено 43 пациента с саркомой Юинга без метастазов в легкие, но с биопсией костного мозга, подтверждающей его поражение,
авторы оценили эффективность ПЭТ/КТ для возможного выявления
большего количества пациентов с поражением костного мозга и костей. Как известно, поражение костей и костного мозга при саркоме
Юинга значительно ухудшает прогноз в этой когорте пациентов.
Все включенные в исследование пациенты прошли ПЭТ/КТ и получили стандартное лечение. В результате:
- до ПЭТ/КТ только у 11 пациентов было подтверждено поражение
костного мозга по данным биопсии или цитологически;
- ПЭТ/КТ выявила поражение костей или костного мозга у 35 пациентов (81%), в т.ч. у 24 с отрицательной биопсией.
Это свидетельствует о том, что ПЭТ/КТ обладает 100% специфичностью и 83,3% чувствительностью при выявлении начального поражения КМ. Таким образом, в диагностике саркомы Юинга ПЭТ/КТ
потенциально может заменить инвазивные вмешательства для выявления поражения костей и костного мозга.
Источник:
Jehanno N, Corradini N, Gaspar N, Brahmi M, Valentin T, Revon Rivière
G, Lervat C, Probert J, Entz-Werle N, Mansuy L, Plantaz D, Rios M, Saumet
L, Verité C, Castex MP, Thebaud E, Cassou-Mounat T, Plissonnier AS,
Mosseri V, Cordero C, Laurence V. Role of 18F-FDG-PET/CT in the initial
staging of very high-risk Ewing Sarcoma in a prospective multicentric
Phase II Study: Is there still a place for bone marrow sampling? Br J Cancer.
2024 Oct 8. doi: 10.1038/s41416-024-02864-8. Epub ahead of print. PMID:
39379569
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / МЕТААНАЛИЗ ЭФФЕКТИВНОСТИ РАЗЛИЧНЫХ ВАРИАНТОВ ПЕРВОЙ ЛИНИИ ТЕРАПИИ У ПАЦИЕНТОВ С EGFR МУТАЦИЯМИ НМРЛ С МЕТАСТАЗАМИ В ГОЛОВНОЙ МОЗГ
Наверное, это первый метаанализ, в который включены только
пациенты с метастазами в головной мозг. На основании данных
24 рандомизированных клинических исследований в анализ были
включены 2682 пациента с НМРЛ
EGFR+ и метастазами в головной
мозг. Среди них только 197 пациентов (7,3%) получали лучевую
терапию.
Основное сравнение лекарственРисунок. Основные результаты метаанализа
ной терапии проводилось между
ингибиторами тирозинкиназы
(ИТК) 1 и 3-го поколений и их
комбинаций с химиотерапией и/
или бевацизумабом.
Рисунок.
Основные результаты метаанализа.
Результаты оказались весьма интересными:
- ИТК первого поколения + бевацизумаб снижали риск смерти на 29,6% по сравнению только с ИТК 1-го поколения;
- аналогично риск смерти снижался на 31,8% при использовании комбинации ИТК 1-го поколения + ХТ;
- ИТК 3-го поколения не показали преимуществ в ОВ перед ИТК 1-го поколения (интересно, почему?), HR 0,855. При этом комбинация ИТК 3-го поколения + ХТ продемонстрировала самую лучшую ОВ по сравнению с моноИТК 1-го или 3-го поколения, но не комбинации ИТК 1-го + ХТ;
- в части улучшения ВБП ИТК 3-го поколения превзошли ИТК 1-го, но комбинация ИТК 3-го с бевацизумабом не улучшила ВБП по сравнению с моно-ИТК 3-го поколения.
В целом этот метаанализ демонстрирует эффективность именно
комбинированного подхода к лечению пациентов с метастазами
в головной мозг по сравнению с
монотерапией.
Источник:
Ma J, Pang X, Zhang S,
et al. First-line treatment of EGFRmutated non-small cell lung cancer
with brain metastases: a systematic
review and meta-analysis. Sci
Rep. 2024; 14: 22901. https://doi.
org/10.1038/s41598-024-74496-0.
УГОЛОК РАДИОТЕРАПЕВТА... / ХЛТ ПРИ РАКЕ ТОЛСТОЙ КИШКИ? СЕРЬЕЗНО?!..
Автор: Деньгина Наталья Владимировна
Заведующая радиологическим отделением
ГУЗ «Областной клинический онкологический диспансер»,
директор Центра лучевой терапии «R-Spei»,
член правления RUSSCO,
главный редактор Газеты RUSSCO и сайта RosOncoWeb,
кандидат медицинских наук,
Ульяновск
...Да-да, не вы один поймали себя на
этой мысли! Мы давно привыкли
к постулатам, что лучевая/химиолучевая терапия при местнораспространенных опухолях толстого
кишечника – тех, что выше среднеампулярного отдела прямой кишки,
– не применяется, поскольку не дает
ощутимых преимуществ в отдаленных результатах, потому что на опухоли, расположенные выше ампулы
прямой кишки, сложно «нацелиться» по причине вариабельности положения, плюс множество других
причин. При этом около четверти
всех первичных больных с опухолями толстой кишки имеют местнораспространенный рак, а около
5% – изначально нерезектабельные
опухоли. Неоадъювантная химиотерапия, как показывают немногие
исследования, позволяет «держать
под контролем» резектабельный
местнораспространенный рак толстой кишки (мрРТК), способствуя
регрессии опухолей с приемлемой
токсичностью по сравнению с послеоперационной лекарственной терапией. Однако лишь немногие авторы
исследовали подходы, способные
превратить неоперабельный мрРТК
во вполне курабельный процесс. Неоадъювантная химиолучевая терапия (НАХЛТ) является стандартным
подходом в лечении местнораспространенного рака прямой кишки и
пищевода, с учетом ее способности
повышать радикальность резекции,
показатели общей выживаемости
и качество жизни. Однако сложно
сказать, имеет ли неоадъювантная
ХЛТ какие-либо преимущества при
мрРТК, и только несколько небольших ретроспективных исследований
демонстрируют спорные результаты.
И вот в октябрьском номере Lancet
Oncology появилась публикация
первого в своем роде проспективного рандомизированного исследования III фазы по оценке результатов
НАХЛТ при мрРТК в сравнении
с НАХТ [1]. В исследование были
включены 45 пациентов с нерезектабельным мрРТК (опухоли выше 15 см
от анального кольца, у половины они
располагались в сигмовидной кишке,
у остальных – в более высоких отделах толстого кишечника) в период с
11 мая 2019 года по 30 мая 2022 года
и распределены в группу НАХТ (20
больных получали 4 курса по схеме
XELOX) и НАХЛТ (25 больных, получавших в добавление к такой же
ХТ облучение в дозе 45-50 Гр за 25
фракций). При этом 40 пациентов
(89%) имели клиническую стадию заболевания T4b (причем большее число – в группе НАХЛТ, 22 против 18),
43 (96%) – стадию IIIС; мочевой пузырь и тонкая кишка наиболее часто
вовлекались в опухолевый процесс.
Если спустя 6-12 месяцев после окончания неоадъювантного лечения
пациенты были расценены резектабельными, они были оперированы
и в адъюванте получали ХТ по схеме
XELOX. Первичной конечной точкой
была выбрана общая выживаемость
за 5 лет, вторичными – частота R0 резекций и 3-летняя выживаемость без
прогрессирования.
В итоге набор пациентов был преждевременно прекращен в июле 2021
года из-за значительных различий
в конверсии опухоли и частоте резекции R0 между двумя группами.
На основании рентгенологических и
эндоскопических клинических данных у 21 пациента в группе НАХЛТ
наблюдался полный или частичный
ответ, по сравнению с 4 пациентами
в группе НАХТ. Конверсия опухоли
в резектабельный статус была значительно выше в группе НАХЛТ (n=21,
84%), чем в группе НАХТ (n=4, 20%)
(P<0,001).
Все пациенты, перенесшие операцию, достигли резекции R0 с негативными краями, подтвержденными патоморфологическим исследованием,
за исключением 1 пациента в группе
НАХЛТ, у которого была обнаружена опухолевая инфильтрация правого мочеточника. Частота резекции
R0 на первом этапе была значительно
лучше в группе НАХЛТ (20/25, 80%),
по сравнению с группой НАХТ (4/20,
20%) (P<0,001). Кроме того, группа
НАХЛТ также превосходила НАХТ
с точки зрения частоты понижения
стадии (понижение индекса T: 72%
против 10%; понижение индекса N:
80% против 20%; оба P<0,001) и сохранения органов. В группе НАХЛТ
опухоли успешно перешли в резектабельный статус у 6/8 пациентов с
инвазией мочевого пузыря, и у всех
удалось сохранить мочевой пузырь
в ходе операции, причем 4 из них
перенесли частичную цистэктомию.
Напротив, в группе НАХТ только
1/6 пациентов с инвазией мочевого
пузыря перенесли операцию и сохранили мочевой пузырь.
Рисунок 1.
Общая выживаемость в группах.
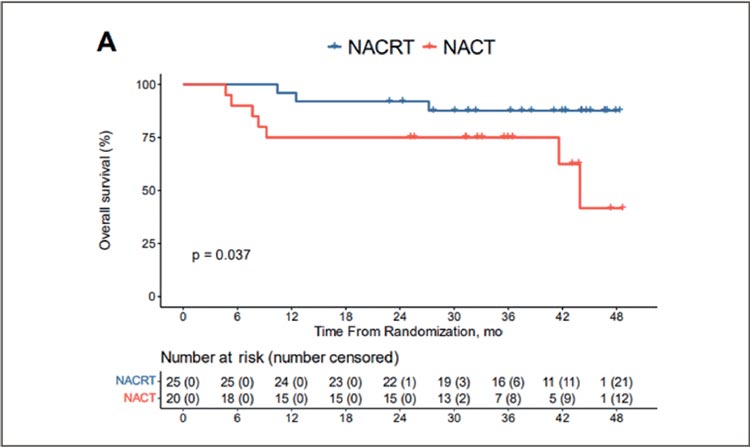
Средний срок наблюдения составил
42,3 и 36,0 мес. для групп НАХЛТ и
НАХТ соответственно. Трехлетние
показатели общей выживаемости составили 87,6% и 75,0% соответственно (P=0,037) (рис.1), тогда как 3-летние показатели ВБП – 76,0% и 45,0%
в группах НАХЛТ и НАХТ (P=0,049)
(рис.2).
Рисунок 2.
Выживаемость
без прогрессирования в группах.
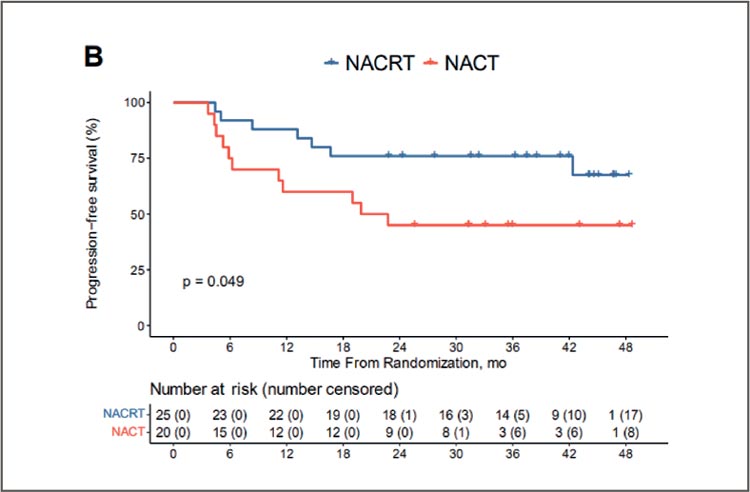
В группе НАХЛТ не наблюдалось ни
местного, ни регионального рецидива у пациентов, перенесших операцию в период наблюдения, и все
отдаленные события были связаны
с отдаленными метастазами. Напротив, у двух пациентов в группе
НАХТ наблюдался локорегиональный рецидив после операции; 3-летние показатели ЛК составили 96,0%
в группе НАХЛТ по сравнению с
60,0% в группе НАХТ соответственно (P=0,002) (рис.3).
Рисунок 3.
Локальный контроль в группах.
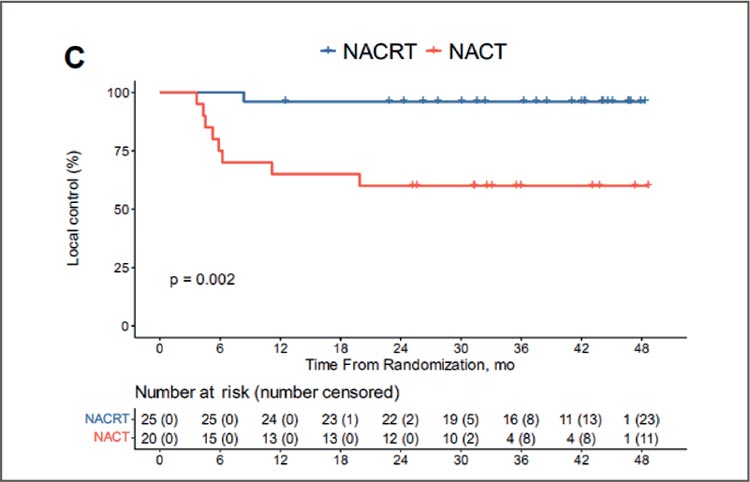
И НАХТ, и НАХЛТ были вполне безопасны и хорошо толерантны, без
существенных различий в частоте
нежелательных явлений, зарегистрированных во время и после лечения.
Наиболее часто наблюдаемым НЯ
3-4 степени была миелосупрессия
(39% для НАХЛТ и 47% для НАХТ;
P=0,609). НЯ 5 степени не было. Ни
один пациент не был признан неподходящим для хирургического вмешательства из-за острых НЯ. Никаких
серьезных послеоперационных осложнений, таких как несостоятельность анастомоза или кишечная непроходимость, не наблюдалось.
В настоящее время невозможно представить себе радикальное лечение
рака толстой кишки без операции и
лекарственной терапии. Данное исследование демонстрирует явные
преимущества добавления и лучевой
терапии у больных с местнораспространенными и изначально нерезектабельными опухолями не только
в плане повышения частоты R0 резекций, но и улучшения отдаленных
результатов – ВБП и потенциально
– ОВ, что, несомненно, делает такой
подход (НАХЛТ) привлекательным
для будущих проспективных исследований. Опасения в глазах радиотерапевтов (неужели поток больных
в отделение радиотерапии вырастет
и за счет этой локализации??) пока
преждевременны – но представленные данные стоит взять на заметку,
не правда ли?
Источник:
Zi-Tong Zhang, et al.
Neoadjuvant chemoradiotherapy versus
neoadjuvant chemotherapy for initially
unresectable locally advanced colon
cancer: short-term outcomes of an
open-label, single-centre, randomised,
controlled, phase 3 trial. Lancet Oncol.
2024; Vol.76. https://doi.org/10.1016/j.
eclinm.2024.102836.
УГОЛОК РАДИОТЕРАПЕВТА... / ОЛИГОМЕТАСТАЗЫ КОЛОРЕКТАЛЬНОГО РАКА В ЛЕГКИЕ: ОПЕРИРОВАТЬ ИЛИ ОБЛУЧАТЬ?
Немало копий было сломано в дискуссиях в отношении оптимального
подхода к лечению больных колоректальным раком (КРР) с метастазами
в легкие. К слову сказать, этот подход,
особенно этап локального лечения,
до сих пор не ясен, хотя лекарственная терапия является безусловно
определяющим методом.
Китайские авторы решили внести
свою лепту, проведя ретроспективный анализ с псевдорандомизацией
по результатам лечения 355 пациентов с олигометастазами КРР в легкие,
которые получали SBRT или были
оперированы в качестве первого метода, включив 251 из них. Больные
были распределены по группам: хирургического лечения (173 пациента,
им производилась краевая резекция,
сегментэктомия или лобэктомия) и
SBRT (78 больных, средняя доза на
очаг – 50 Гр, БЭД – 105 Гр в среднем).
Основными показателями для анализа были выбраны выживаемость
без интраторакального прогрессирования (ВБИП), выживаемость без
прогрессирования (ВБП) и общая
выживаемость (OВ).
Медиана наблюдения составила 61,6
мес. для пациентов после оперативного лечения и 54,4 мес. для SBRT.
Авторами были выявлены значительные различия как в ВБИП, так
и в ВБП между группами операции
и SBRT (ВБИП: отношение рисков
[HR] = 0,50, 95% доверительный интервал [CI], 0,31–0,79; ВБП: HR = 0,56,
95% CI, 0,36–0,87). Показатели ВБИП
через 3 и 5 лет составили 58,6% и
54,8% соответственно после операции и 34,6% и 31,3% соответственно
после SBRT (P = .006). Показатели
ВБП через 3 и 5 лет составили 49,4%
и 45,2% соответственно после операции и 28,8% и 26,1% - после SBRT
(P = .010). Однако OВ не была существенно зависима от выбранного лечебного подхода (HR = 0,93, 95% CI,
0,49-1,76); 3- и 5-летние показатели
OВ составили 85,9% и 73,1% соответственно после операции и 78,9% и
68,7% - после SBRT (P = .849).
Рисунок 1.
Показатели ВБИП, ВБП и ОВ в результате
сопоставления между группами.
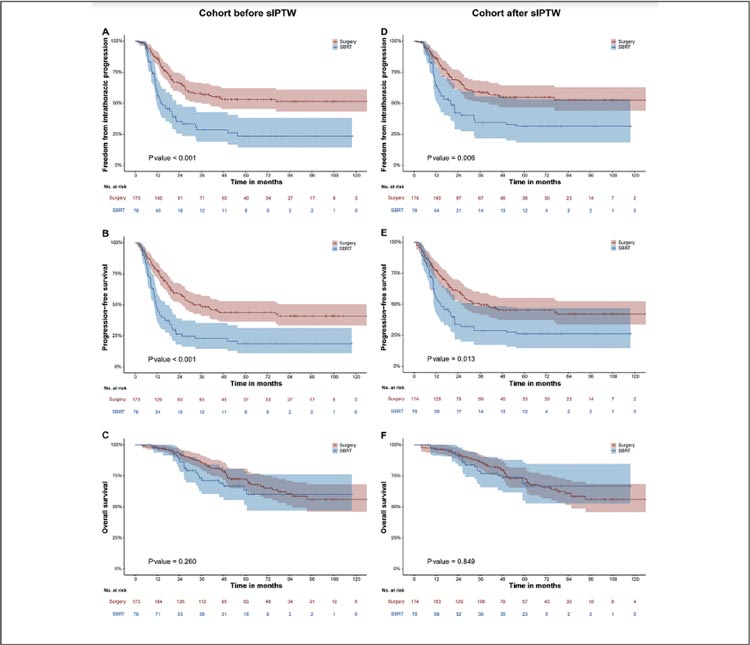
Оба варианта локального лечения
были хорошо толерантны, с осложнениями, соответствующими профилю воздействия.
Несмотря на то, что существующие
литературные данные в отношении
оптимального локального воздействия на олигометастазы КРК противоречивы, большинство авторов
сходятся во мнении, что на общую
выживаемость выбор не оказывает
влияния. SBRT несомненно может
стать предпочтительным методом для
пациентов с противопоказаниями к
операции, хотя проспективное исследование однозначно не помешало бы.
Источник:
Wang, Yaqi et al. Comparison of the Longterm Survival Outcome of Surgery versus
Stereotactic Body Radiation Therapy as
Initial Local Treatment for Pulmonary
Oligometastases from Colorectal Cancer:
A Propensity Score Analysis. International
Journal of Radiation Oncology, Biology,
Physics, September 2024, in press.
ШКОЛА РАКФОНДА. ИТОГИ
В Москве с успехом прошла
«Школа научных исследований для молодых онкологов».
29 специалистов из Калининграда, Санкт-Петербурга, Донецка, Читы и Москвы под руководством лучших онкологов
страны изучали, как готовить,
запускать, собирать и анализировать данные клинических исследований, важных драйверов
современной науки.
«Школа научных исследований
для молодых онкологов» - это бесплатный образовательный курс
для улучшения теоретической
базы, практической подготовки и реализации исследований
российскими учеными, который
проводится с 2022 года в Москве.
В ходе лекций и индивидуальных
консультаций лучшие российские специалисты в онкологии,
медицинской статистике и клинических исследованиях делятся
знаниями по организации и проведению самих исследований от
дизайна и построения гипотезы
до обработки данных и публикации результатов.
В этом году на участие было подано 105 заявок от молодых специалистов в области онкологии
- втрое больше, чем получила
предыдущая «Школа». Научный
комитет и совет РакФонда, по
чьей инициативе проводится
«Школа», пригласил в Москву
на очный этап 29 талантов. Бесплатный интенсив прошел с 11
по 14 сентября в отеле Holiday
Inn Sokolniki. Участники высоко
оценили «Школу» в целом, то, насколько грамотно, эффективно и
заботливо была выстроена логистика работы и жизни в эти дни.
Все особенно выделяли качество
практической работы в группах
с менторами, за что организаторы благодарны бессменному и
надежному партнеру - Российскому обществу клинической онкологии (RUSSCO) и Фонду президентских грантов.
«Эффективность работы «Школы» мы оцениваем по многим
параметрам, один из главных -
вероятность инициации в дальнейшем собственных исследований, - объясняет Юлия Игоревна
Атаманюк, директор РакФонда,
руководитель проекта. – Большая
часть участников «Школы» (более
80% опрошенных) указали в выходных анкетах, что теперь, доработав протоколы своих исследований, наверняка их реализуют. И
это, безусловно, важно, поскольку
основная задача «Школы» - стимулировать развитие исследовательской деятельности в России и
улучшить качество проводимых в
онкологии исследований».

По итогам работы «Школы» возможность получения финансирования своего проекта «Номограмма для прогнозирования
патоморфологического ответа и
выживаемости у больных ранним трижды негативным раком
молочной железы (ТНРМЖ)»
получила Шейда Абдуллаева,
врач-онколог Национального медицинского исследовательского
центра онкологии имени Н.Н.
Петрова (Санкт-Петербург). Вот,
что она сама говорит о достижении: «Иммунотерапия активно
внедряется в лечение ТНРМЖ.
Однако, на сегодняшний день отсутствуют эффективные биомаркеры, позволяющие определить
группу пациентов, нуждающихся в интенсификации терапии.
Определение групп риска на основе клинико-морфологических
показателей поможет выделить
высоких ответчиков на неоадъювантную химиотерапию с благоприятным прогнозом. В исследование я планирую включить 250
пациентов c ТНРМЖ I-III стадии.
Будут оценены клинико-морфологические показатели, включая
уровень опухоль инфильтрирующих лимфоцитов (TILs) до начала неоадъювантной терапии в
биопсийных образцах. На основе
анализа этих данных будет создана номограмма, предсказывающая достижение полного патоморфологического ответа (pCR)
и риск рецидива. Номограмма
позволит выделить группу пациентов с ТНРМЖ благоприятного
прогноза с высокой частотой pCR
и высокими показателями выживаемости. Тем самым, на основе
клинико-морфологических показателей, мы сможем потенциально избежать применение иммунотерапии у больных с отличным
прогнозом только на неоадъювантную химиотерапию».

Члены Экспертного совета о
«Школе научных исследований
для молодых онкологов»
Татьяна Юрьевна Семиглазова, Заведующая научным отделом инновационных методов
терапевтической онкологии и
реабилитации ФГБУ «НМИЦ
онкологии им. Н.Н. Петрова»
Минздрава России, профессор
кафедры ФГБОУ ВО «СЗГМУ
им. И.И. Мечникова» Минздрава России, член правления
RUSSCO, профессор, доктор
медицинских наук, г. СанктПетербург:
«У молодых специалистов есть несколько острых профессиональных запросов и потребностей, которые играют ключевую роль в их становлении и развитии. Прежде всего для молодого специалиста крайне важна поддержка более опытных коллег, которую в том числе можно получить в «Школе научных исследований для молодых онкологов». Регулярное обсуждение последних новостей ведущих медицинских сообществ позволяет не только быть в курсе последних тенденций, но и грамотно интерпретировать полученную информацию и применять полученные знания на практике. Разбор сложных клинических случаев с наставником способствует развитию ключевых профессиональных навыков, таких как клиническое мышление, грамотная коммуникация с пациентами и коллегами, Эти навыки играют важную роль в повседневной практике врача и напрямую влияют на качество медицинской помощи».
Михаил Александрович Масчан, заместитель генерального
директора по науке, директор
Института молекулярной и экспериментальной медицины
ФГБУ «НМИЦ ДГОИ им. Д. Рогачева», доктор медицинских
наук, г. Москва:
«Нетворкинг для людей, которые
начинают карьеру в медицине и
в медицинских исследованиях, -
это важная вещь, потому что во
всем мире профессионалы давно
поняли, что гораздо лучше будет,
если они объединят результаты и
решат какую-то задачу, чем будут
каждый сидеть в своем домике.
Здесь, в рамках «Школы», люди
вместе не только работают, но и
проводят время, обедают, общаются, есть большая вероятность,
что, когда они превратятся в зрелых исследователей, у них будет
дополнительная причина, почему
надо дружить и объединяться, а
не соперничать».
Олег Александрович Гладков,
Заслуженный врач РФ, член
правления RUSSCO, главный
редактор, автор и председатель
рабочей группы по разработке
Практических рекомендаций
RUSSCO, доктор медицинских
наук, г. Челябинск:
«Школа» даст возможность проводить исследования по самым
важным проблемам онкологии, познакомиться с методологией
исследований и правильности
выбора важнейших направлений
исследовательской деятельности
(высокой актуальности научных
работ). «Школа» позволяет формировать ученых – профессионалов».
Сергей Сергеевич Гордеев, доктор медицинских наук, ведущий
научный сотрудник, хирург-онколог хирургического отделения №3 НИИ клинической онкологии ФГБУ «НМИЦ онкологии
им. Н.Н. Блохина»:
«Такая «Школа» России и онкологам нашей страны действительно
необходима, потому что доля исследований сейчас не настолько
высока, как хотелось бы. Одна из
проблем - в недостатке информации о том, как правильно строить
дизайн исследования и само исследование. А без этого инноваций сложно ожидать. Мы не можем двигаться вперед, показать
разработку, если не знаем, как ее
правильно оформить, как распланировать исследование... Я рад,
что есть подвижники, которые
меняют ситуацию к лучшему. И
«Школа» РакФонда - один из ярких примеров».
Глубокоуважаемые коллеги!
Приглашаем вас принять участие
в XXVIII РОССИЙСКОМ ОНКОЛОГИЧЕСКОМ КОНГРЕССЕ,
который пройдет 12-14 ноября 2024 г. в Москве.
Российский онкологический конгресс – крупнейшее
национальное онкологическое мероприятие в России.
Конгресс проводится Российским обществом клинической
онкологии (RUSSCO) совместно с НМИЦ онкологии
им. Н.Н. Блохина и Ассоциацией онкологов России.
В прошлом году XXVII Конгресс проходил в очно-заочном
формате. В нем приняли участие онкологи и врачи смежных
специальностей из всех регионов Российской Федерации
и многих зарубежных стран.
В дни работы XXVIII Российского онкологического
конгресса планируется провести пленарные сессии,
лекции, мастер-классы, а также сателлитные симпозиумы.
Традиционно состоятся совместные сессии с
профессиональными и научными обществами.
Планируется постерная сессия, на которой будут доложены
результаты новейших разработок отечественных ученых.
В программе будут представлены выступления
ведущих отечественных и зарубежных онкологов,
освещающие основные достижения в диагностике
и лечении злокачественных опухолей за последний год.
Планируется проведение выставки крупнейших
фармацевтических компаний, представленных на
российском рынке, а также книжных и журнальных новинок.
По всем вопросам, связанным
с участием в конгрессе, обращаться:
Российское общество клинической онкологии
Тел./факс: (499) 685-02-37, код России 107
E-mail: congress@russco.org
