
Первый Российский онкологический конгресс 1997
Первый Российский онкологический конгресс 1997 года носил более скромное название, но по сути уже был конгрессом. Все участники уместились в актовом зале Российского онкологического научного центра им. Н.Н.Блохина. Было очень радостно («Вот куда добрались!») и немного страшно («Столько всего нового!»). Для меня и многих моих коллег...

Илья Галкин (Россия, 1860-1915), «За чтением», 1890.
Холст, масло. Омский областной музей изобразительных искусств имени М.А. Врубеля.

ESMO 2021: ИЗБРАННЫЕ ИССЛЕДОВАНИЯ ПО ЛЕЧЕНИЮ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ
На прошедшем юбилейном конгрессе ESMO было представлено несколько интересных исследований по лечению рака молочной железы. Начну с наиболее интересного и даже сенсационного, озвученного на Президентском симпозиуме. Речь идет о предварительных результатах исследования Destiny-Breast03, целью которого было оценить...

ESMO 2021: САРКОМЫ. НОВЫЙ СТАНДАРТ ПЕРВОЙ ЛИНИИ И ЭФФЕКТИВНОСТЬ ТАКТИКИ STAY-AND-LOOK
В сентябре прошел ежегодный конгресс ESMO, который в этом году, как и в прошлом, ввиду эпидемиологической ситуации в мире проходит в формате онлайн. Несмотря на то, что живое общение, знакомства, обсуждение и дискуссии невозможно заменить цифровыми платформами, подобный формат конференций становится очень популярным...

ESMO 2021: ИЗМЕНЕНИЕ АЛГОРИТМОВ ЛЕЧЕНИЯ НЕМЕТАСТАТИЧЕСКОГО РАКА ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ, РАКА ЖЕЛЧНЫХ ПРОТОКОВ И ГЕПАТОЦЕЛЛЮЛЯРНОГО РАКА
На ESMO 2021 были представлены обновленные данные результатов многоцентрового рандомизированного исследования 3 фазы PRODIGE 24/CCTG PA6, сравнившего эффективность и безопасность адъювантных режимов mFOLFIRINOX и гемцитабина после хирургического лечения пациентов с протоковой аденокарциномой поджелудочной...


ESMO 2021: ИНТЕРЕСНОЕ И НОВОЕ В МИРЕ ОНКОГИНЕКОЛОГИИ
В сентябре 2021 года в онлайн-формате прошел очередной ежегодный конгресс ESMO. В ходе прошедшего мероприятия были представлены результаты множества исследований в области лечения онкогинекологических заболеваний. Коротко рассмотрим результаты наиболее интересных из них.

ESMO 2021: МЕЛАНОМА КОЖИ
Современная иммунотерапия, безусловно, совершила революцию в лечении пациентов с меланомой кожи. Достигнуты высокие результаты выживаемости пациентов с распространенными стадиями заболевания. В настоящее время мы становимся свидетелями возможного применения ингибиторов контрольных точек...

ESMO 2021 И WCLC 2021: РАК ЛЕГКОГО
Последние несколько лет были очень богаты на события в терапии опухолей легкого, однако 2021 год не был столь же насыщенным. Среди особо интересных результатов, представленных на ESMO2021 и WCLC 2021, хотелось бы выделить несколько сообщений. Комбинация ниволумаба и ипилимумаба с двумя циклами химиотерапии увеличивает...
RUSSCO ПРОВЕЛО ЭКЗАМЕН ESMO В МОСКВЕ
Знаменательное событие в сфере онкологии состоялось 18 сентября 2021 г. в Москве: впервые одной из площадок проведения для российских врачей Экзамена Европейского общества медицинской онкологии (ESMO) стала наша столица. Кроме Москвы экзамен проводился одновременно в Париже, Мадриде, Багдаде, Каире и других городах мира...

УГОЛОК РАДИОТЕРАПЕВТА
Продолжительность жизни больных с распространенным раком пищевода очень невелика – 6-8 месяцев, и у подавляющего большинства пациентов имеется дисфагия вплоть до полной непроходимости пищи. Постановка саморасправляющегося стента – типичное паллиативное вмешательство для таких больных, однако дальнейший рост опухоли...
ESMO 2021: ОПУХОЛИ ЖКТ
С 16 по 21 сентября 2021 г. состоялся конгресс Европейского общества медицинской онкологии (European Society of Medical Oncology, ESMO) в онлайн-режиме. На ежегодном конгрессе ESMO были представлены более 1200 докладов, из которых более 380 посвящены лечению опухолей желудочно-кишечного тракта. В данном обзоре приведены...

РЕЗОЛЮЦИЯ ПРОВЕДЕННОГО ОНКОФОРУМА «ВОЗМОЖНОСТИ ПОДДЕРЖИВАЮЩЕЙ ТЕРАПИИ В СОЛИДНОЙ ОНКОЛОГИИ: ВЗГЛЯД НА НЕЙТРОПЕНИЮ»
Нейтропения, индуцированная химиотерапией, относится к наиболее частому нежелательному явлению и в ряде случаев может быть причиной фебрильной нейтропении (ФН). Примерно у 80% больных ФН является причиной тяжелой инфекции. По данным Национального ракового регистра США, частота ФН составляет 19,4 случаев на 1000 пациентов в год в онкологии солидных опухолей и 43,3 случаев на 1000 пациентов в год - в онкогематологии. Данные рандомизированных клинических исследований (РКИ) и клинической практики свидетельствуют о более высокой частоте развития ФН - до 117 случаев на 1000 пациентов [1,2]....

Анонс
-

9 - 11 НОЯБРЯ 2021
РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС
Первый Российский онкологический конгресс 1997
Автор: Ирина Альбертовна Королева,
д.м.н, профессор кафедры клинической медицины последипломного образования
Медицинского университета «Реавиз», г.Самара – участница всех 25 онкологических конгрессов.
Первый Российский онкологический конгресс 1997 года носил более скромное название, но по сути уже был конгрессом.
Все участники уместились в актовом зале Российского онкологического научного центра им. Н.Н.Блохина. Было очень радостно
(«Вот куда добрались!») и немного страшно («Столько всего нового!»). Для меня и многих моих коллег появление Российского
конгресса стало знаком перемен в нашей специальности. До этого момента онкологи проходили усовершенствование один раз
в 5 лет, и целых 5 лет можно было «подглядывать» в заветную
тетрадку с лекциями Ирины Владимировны Поддубной, каждый
раз находя там ответы на возникающие вопросы. Книг по химиотерапии было так мало, что синий Справочник по химиотерапии
под редакцией Натальи Иннокентьевны Переводчиковой воспринимался как свод законов.
Именно на Первом конгрессе мы поняли, что онкология стала
развиваться настолько динамично, что нам не хватает источников информации. Сергей Алексеевич Тюляндин со своими сотрудниками реально менял наше представление о химиотерапии
от конгресса к конгрессу. Доклады о механизме действия новых
противоопухолевых препаратов, вызывали желание немедленно начать лечить больных именно по новым схемам. С первых
дней Российский онкологический конгресс отличался высокими
требованиями к докладчикам и тщательно подготовленной программой. Число участников росло так быстро, что конгресс скоро стал одним из самых крупных и значимых онкологических мероприятий Российской федерации. Российский онкологический
конгресс стал первой регулярной образовательной и научной
площадкой такого масштаба.
Именно на конгрессе Август Михайлович Гарин сказал: «За
химиотерапией будущее. Хирурги без работы тоже не останутся,
ведь должен кто-нибудь выполнить биопсию…» Мы тогда смеялись, но вот прошло 25 лет, и без определения драйверных мутации, статуса рецепторов мы не назначаем противоопухолевую
терапию. На III Конгрессе на вопрос «Кто проводит химиотерапию при немелкоклеточном раке легкого?» подняли руку только
треть присутствующих, а сегодня все больные НМРЛ получают
лекарственную терапию. На ХIII Конгрессе доклад об антиэметической профилактике в разных диспансерах страны вызвал не
только живую дискуссию, но и внедрение новых средств профилактики тошноты и рвоты в реальную клиническую практику.
Много лет подряд за месяц до открытия конгресса мои коллеги
начинали решать, кто из отделения поедет, а кто останется, потому что ехать хотели все. Клинические ординаторы возвращались
окрыленными, с огромным желанием учиться и работать. Именно на конгрессе было задумано создание Российского общества
клинической онкологии, объединяющее нас.
Дорогие друзья и коллеги, соратники по борьбе с злокачественными опухолями, я буду рада приветствовать вас на юбилейном
XXV Российском онкологическом конгрессе!
Илья Галкин (Россия, 1860-1915), «За чтением», 1890.
Холст, масло. Омский областной музей изобразительных искусств имени М.А. Врубеля.

ESMO 2021: ИЗБРАННЫЕ ИССЛЕДОВАНИЯ ПО ЛЕЧЕНИЮ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ
Автор: С.А.Тюляндин
Председатель Российского общества клинической онкологии
На прошедшем юбилейном конгрессе ESMO было представлено несколько интересных исследований по лечению рака молочной железы. Начну с наиболее интересного и даже сенсационного, озвученного на Президентском симпозиуме. Речь идет о предварительных результатах исследования Destiny-Breast03, целью которого было оценить эффективность и токсичность трастузумаба эмтанзина (T-DM1) и трастузумаба дерукстекана (T-DXd) в качестве второй линии системной терапии у больных HER2- позитивным метастатическим раком молочной железы [1]. Оба препарата относятся к новому классу противоопухолевых средств – иммуноконъюгатам. В данном случае к моноклональному антителу, задача которого доставить цитостатик к опухолевой клетке с наличием HER2 рецептора, присоединяется антитрубочковый препарат эмтанзин или ингибитор топоизомеразы дерукстекан. T-DM1 является стандартной рекомендованной терапией для больных с прогрессировавшем после трастузумаба и пертузумаба, продемонстрировав медиану времени до прогрессировали (PFS) 9,6 мес. в исследовании Emilia [2]. При использовании T-DXd в исследовании Destiny-Breast01 в качестве третьей линии на фоне резистентности к T-DM1 PFS составил беспрецедентные 19,4 мес. [3]. Кроме того, существуют фармакологические предпосылки для предположения, что T-DXd обладает большей противоопухолевой активностью по сравнению с T-DM1. Дерукстекан более сильный цитостатик по сравнению с эмтанзином. В T-DXd к молекуле трастузумаба удалось присоединить 8 молекул дерукстекана, в то время как в T-DM1 только 3-4. В T-DXd дерукстекан присоединен к трастузумабу с помощью пептидных мостиков, которые легко разрушаются пептидазами, высвобождая цитостатик для реализации противоопухолевого эффекта. Все это послужило основанием для сравнения двух препаратов в качестве второй линии системной терапии у больных с прогрессированием метастатического процесса после ранее проведенной химиотерапии таксанами с добавлением трастузумаба и пертузумаба. Рандомизация с учетом стратификационных факторов проводилась в соотношении 1:1 в группу T-DXd в дозе 5,4 мг/кг в/в каждые 3 недели или в группу T-DM1 в дозе 3,6 мг/кг в/в каждые 3 недели; лечение продолжалось до признаков прогрессирования или непереносимой токсичности. Основным критерием эффективности была ВБП. В исследование было включено 524 больных, 100% которых ранее получили трастузумаб, 60% – пертузумаб и 16% – тирозинкиназные ингибиторы. При медиане наблюдения 15 мес. медиана ВБП в группе T-DM1 составила 6,8 мес. и не была достигнута в группе T-DXd, что соответствует достоверному снижению относительного риска прогрессирования на 72% (HR=0,28; p<0,0001). Одногодичная выживаемость составила 34,1% и 75,8% соответственно. Выигрыш T-DXd отмечен во всех анализированных подгруппах, включая рецепторный статус, предшествующее лечение пертузумабом, наличие висцеральных метастазов (ВБП 5,7 и 22,4 мес.) и метастазов в ЦНС (5,7 и 15,0 мес.), число проведенных линий терапии. Первый промежуточный анализ общей выживаемости демонстрирует уверенный тренд к увеличению продолжительности жизни в группе T-DXd со снижением относительного риска смерти на 44% (HR=0,56) при одногодичной выживаемости 94,1% и 85,9% в группе T-DXd и T-DM1 соответственно. Частота объективного эффекта составила 79,7% и 34,2%, из них полных – 16,1% и 8,7% соответственно. Частота серьезных побочных эффектов 3-4 степени составила 45,1% и 39,8% в группах T-DXd и T-DM1, лечение было прекращено по причине токсичности у 12,8% и 5,0% больных соответственно. Основным потенциально опасным осложнением T-DXd является развитие интерстициальной болезни легких, которое наблюдалось у 13,6% больных в исследовании Destiny-Breast01. В данном исследовании частота пневмонитов составила 10,5%, в основном 1-2 степени, что свидетельствует об эффективности рекомендаций по ранней диагностике и лечению осложнения, своевременной редукции дозы T-DXd. Ни один пациент, включенный в исследование, не умер от побочных эффектов лечения. Предварительные данные оставляют открытыми ряд вопросов: в какой степени достигнутый существенный выигрыш в ВБП сможет транслироваться в увеличение общей выживаемости, какое лечение получали больные с прогрессией в группе T-DXd и что работает в этом случае, сколько больных в группе T-DM1 при прогрессии получали T-DXd и какова их продолжительность жизни? Если T-DM1 уходит из второй линии, то будет ли он эффективен у больных с прогрессированием на T-DXd? Возможно, на часть из этих вопросов мы получим ответ при дальнейшем анализе исследования, для оставшихся потребуется проведение дополнительных исследований. На основании уже предварительных данных получены убедительные свидетельства о преимуществе назначения T-DXd перед T-DM1 в качестве системной терапии второй линии у больных HER2-позитивным метастатическим раком молочной железы с резистентностью к трастузумабу. Этот вывод базируется на достоверном снижении относительного риска прогрессирования, высокой частоте объективных эффектов, включая полные, выигрыш во всех анализируемых подгруппах пациентов, в том числе и с наличием метастатического поражения ЦНС, приемлемой общей токсичности и снижении частоты пневмонитов. Исходя из представления о предпочтительности использования более эффективной терапии на более ранних этапах лечения, T-DXd следует считать новым стандартом проведения второй линии терапии в случае резистентности к трастузумабу, независимо от предшествующего назначения пертузумаба. Были подведены итоги важного исследования KEYNOTE-355, изучавшего возможность совместного использования пембролизумаба с химиотерапией в сравнении с химиотерапией только у больных метастатическим тройным негативным раком молочной железы (ТН-РМЖ) с экспрессией PD-L1 (CPS ≥1) в качестве первой линии системной терапии [4]. Ранее было сообщено, что комбинация в сравнении с химиотерапией только достоверно увеличивала ВБП с 6,7 до 8,8 мес., снизив относительный риск прогрессирования на 39% [5]. Наибольший выигрыш в увеличении PFS отмечен в группе больных с высокой экспрессией PD-L1 (CPS ≥10): c 5,6 до 17,3 мес. [5]. На данном конгрессе были представлены показатели общей выживаемости. Комбинация достоверно увеличила продолжительность жизни с 16,1 до 23,0 мес. в группе c высокой экспрессией, уменьшив относительный риск смерти на 27% (HR=0,73; p=0,093). При этом в общей группе больных (CPS ≥1) не было отмечено достоверного выигрыша от добавления пембролизумаба. Это важная информация для одной трети больных с впервые выявленным метастатическим ТН-РМЖ и высокой экспрессией PD-L1, результаты лечения которого остаются неудовлетворительными. Добавление пембролизумаба позволяет увеличить медиану продолжительности жизни почти до 2 лет. Для больных с развитием прогрессирования после ранее проведенного лечения операбельного ТН-РМЖ использование пембролизумаба на этапе метастатической болезни будет лимитировано характером ранее проведенной системной терапии. Сегодня у таких больных все чаще проводится предоперационная химиотерапия, которая предполагает добавление пембролизумаба независимо от экспрессии PD-L1. Это, по данным исследования KEYNOTE-522, приводит к увеличению частоты полных морфологических ответов и снижает относительный риск прогрессирования на 37% [6]. Неизвестно, какой эффективностью будет обладать пембролизумаб в случае, если больная получала его ранее на этапе лечения операбельного ТН-РМЖ. Возможно, мы увидим зависимость от продолжительности безрецидивного периода или величины экспрессии PD-L1 на этапе метастазирования. Но в любом случае, потребуется проведение дополнительных исследований, чтобы ответить на этот вопрос. Были доложены результаты общей выживаемости больных в исследовании MONALEESA-7, которое оценивало целесообразность назначения комбинации CDK 4/6 ингибитора рибоциклиба и летрозола в сравнении с летрозолом только в качестве первой линии гормонотерапии у постменопаузальных больных метастатическим раком молочной железы с наличием рецепторов стероидных гормонов [7]. Ранее было показано, что медиана времени до прогрессирования составила 25,3 и 16,0 мес. соответственно, достоверно уменьшив развития рецидива заболевания на 44% при использовании комбинации. Подобные результаты увеличения продолжительности безрецидивного периода были получены и при использовании других ингибиторов CDK 4/6 – пальбоциклиба и абемациклиба, но MONALEESA-7 впервые представляет результаты общей выживаемости. Медиана общей выживаемости в группе летрозола и рибоциклиба составила 63,9 мес. в сравнении с 51,4 мес. в группе летрозола, что соответствует снижению относительного риска смерти на 24% (HR=0,76; p=0,004). Увеличение более чем на год медианы общей выживаемости является солидным основанием для использования этой комбинации в рутинной практике. Для больных операбельным раком молочной железы стоит упомянуть метаанализ результатов стандартной годичной адъювантной терапии трастузумабом в сравнении с более коротким (6 месяцев и 9 недель) назначением [8]. Особенностью этого метаанализа, в отличие от многочисленных ранее опубликованных, является использование индивидуальных данных пациентов и статистический дизайн non-inferiority (не хуже). За основной критерий была выбрана 5-летняя инвазивная безрецидивная выживаемость (IDFS), результат считался не хуже, если абсолютная разница этого показателя при годичном и 6-месячном курсе не превышала 2%. При оценке 12 и 6 мес. назначения трастузумаба у 7961 пациентки 5-летняя IFDS составила 89,3% и 88,6% при годичном и 6-месячном курсах. Абсолютная разница составила 0,7%, что достоверно подтверждает вывод «не хуже» (HR=1,07; p=0,02). В случае сравнения годичного и 9 недельного назначения трастузумаба абсолютная разница 5-летней IDFS составила 2,2%, что не позволяет сделать вывод, что короткий курс не хуже годичного. Таким образом, после 15 лет использования годичного адъювантного курса трастузумаба было доказана возможность использования короткого 6-месячного курса. С экономической тоски зрения сокращение продолжительности дорогостоящего лечения в 2 раза выглядит заманчиво. Но с клинической точки зрения возникает вопрос, как сегодня мы можем интегрировать 6-месячный курс в нашу клиническую практику, кто может быть кандидатом для его назначения. В исследовании PHARE, включенном в данный метаанализ, ранее была проанализирована 3-летняя безрецидивная выживаемость больных, получавших годичный и 6-месячный курс адъювантного трастузумаба в зависимости от распространенности процесса. Только в группе больных Т1N0 отмечена равная эффективность, с увеличением стадии отмечается проигрыш короткого курса в отдаленных результатах, который достиг 4,6% в группе Т2-3N2. Т.е. теоретически мы можем деэскалировать еще в большей степени комбинацию 12-недельного введения паклитаксела и трастузумаба, сократив введение последнего до 6 мес. У больных с большим распространением мы наоборот эскалируем HER-2 терапию, назначая ее предоперационно и используя двойную блокаду. Это позволяет нам, оценив морфологический эффект проведенной терапии, разделить больных на группу хорошего прогноза (т.е. тех, кто достиг полной морфологической регрессии) и группу плохого прогноза (наличие резидуальной опухоли). Возможно, у больных с полным морфологическим эффектом, получивших на предоперационном этапе 6-месячный курс химиотерапии с трастузумабом или его комбинации с пертузумабом, мы можем отказаться от дальнейшего продолжения трастузумаба до одного года. Предвижу, что без проведения соответствующих исследований найдется немного желающих действовать таким образом. И следует выразить сожаление, что результаты подобного метаанализа не появились хотя бы на 5 лет раньше.
Литература:
1. Cortés J, et al. Trastuzumab deruxtecan (T-DXd) vs trastuzumab emtansine (TDM1) in patients (Pts) with HER2+ metastatic breast cancer (mBC): Results of the randomized phase III DESTINYBreast03 study. ESMO 2021, Abstract LBA1.
2. Dieras V, et al. Trastuzumab emtansine versus capecitabine plus lapatinib in patients with previously treated HER2-positive advanced breast cancer (EMILIA): a descriptive analysis of final overall survival results from a randomised label, phase 3 trial. Lancet Oncol. 2017; 18: 732-742.
3. Modi S, et al. Trastuzumab Deruxtecan in Previously Treated HER2-Positive Breast Cancer. N Engl J Med. 2020; 382: 610-621.
4. Rugo HS, et al. KEYNOTE-355: Final results from a randomized, double-blind phase III study of first-line pembrolizumab + chemotherapy vs placebo + chemotherapy for metastatic TNBC. ESMO 2021, LBA16.
5. Cortes J, et al. Pembrolizumab plus chemotherapy versus placebo plus chemotherapy for previously untreated locally recurrent inoperable or metastatic triple-negative breast cancer (KEYNOTE-355): a randomised, placebocontrolled, double-blind, phase 3 clinical trial. Lancet. 2020; 396: 1817-28.
6. Schmid P, et al. Pembrolizumab for Early Triple-Negative Breast Cancer N Engl J Med. 2020; 382: 810-821.
7. Hortobagy GN, et al. Overall survival (OS) results from the phase III MONALEESA-2 (ML-2) trial of postmenopausal patients (pts) with hormone receptor positive/human epidermal growth factor receptor 2 negative (HR+/HER2−) advanced breast cancer (ABC) treated with endocrine therapy (ET) ± ribociclib (RIB). ESMO 2021, LBA17.
8. Earl H, et al. Individual patient data
meta-analysis of 5 non-inferiority RCTs
of reduced duration single agent adjuvant
trastuzumab in the treatment of HER2
positive early breast cancer ESMO 2021,
LBA11.
ESMO 2021: САРКОМЫ. НОВЫЙ СТАНДАРТ ПЕРВОЙ ЛИНИИ И ЭФФЕКТИВНОСТЬ ТАКТИКИ STAY-AND-LOOK
Автор: Тарарыкова Анастасия Алексеевна
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрав
В сентябре прошел ежегодный конгресс ESMO, который в этом году, как и в прошлом, ввиду эпидемиологической ситуации в мире проходит в формате онлайн. Несмотря на то, что живое общение, знакомства, обсуждение и дискуссии невозможно заменить цифровыми платформами, подобный формат конференций становится очень популярным. Тема сарком на ESMO 2021 обсуждалась в виде коротких устных докладов и отдельной сессии, посвященной исследованиям II и III фазы. Остановимся на самых значимых. Представлены данные крупного исследования об отсутствии влияния гормональной контрацепции и беременности на риск прогрессирования или развития рецидива десмоидного фиброматоза [1]. В исследование были набраны 242 пациентки, которым было выполнено хирургическое лечение (48/242) или выбрана тактика активного наблюдения (194/242). В 36% случаях беременность наступила в течение 2 лет до постановки диагноза, в 5% – на момент постановки и в 9,9% – после постановки диагноза. В 44,2% случаях применялись гормональные контрацептивы в течение 2 лет до постановки диагноза, в 33,9% – на момент постановки и в 38,8% – после постановки диагноза. Среднее время наблюдения составило 23,9 месяца (от 0,4 до 59,7). Двухлетняя выживаемость без прогрессирования (ВБП) составила 74,5% (95% ДИ 67,5-80,3%). Связи между беременностью, наступившей в течение 2 лет, и ВБП не выявлено (HR 1,32: 0,77-2,28; p=0,31), так же как и связи между применением гормональной контрацепции в течение 2 лет и ВБП (HR 0,84: 0,48-1,46; p=0,53). При анализе подгрупп не выявлено зависимости от таких факторов, как локализация первичного очага, возраст пациентки, размер опухоли или выбор тактики активного наблюдения (p>0,15). Полученные результаты действительно важны для женщин детородного возраста, поскольку тактика активного наблюдения для пациентов с десмоидным фиброматозом находит все больше подтверждений. Ранее на ASCO 2018 были опубликованы данные плацебо-контролируемого исследования III фазы по оценке эффективности сорафениба при десмоидном фиброматозе, где 2-летняя ВБП в группе плацебо составила 36% [2]. Это первое масштабное исследование, предполагающее возможный выбор активного наблюдения (тактика stay-and-look). Однако критерием включения в исследование были рецидив или прогрессирование заболевания. Целью проспективного наблюдательного исследования французской саркомной группы (French Sarcoma Group, FSG) была оценка эффективности активного наблюдения среди пациентов с впервые диагностированным десмоидным фиброматозом [3]. Оценка по МРТ проводилась через 1, 3 и далее каждые 6 месяцев согласно критериям RECIST. Оценка боли проводилась по шкале CTAV4. В период с 2012 г. по 2015 г. в исследование было набрано 100 пациентов, которые подписали информированное согласие о тактике наблюдения. Медиана наблюдения составила 46,6 месяца (IQR 36,8-61,1). Двухлетняя и трехлетняя ВБП составили 59,1% (49,2-68,4) и 53,4% (43,5-63,1) соответственно. Полный ответ (ПО) зафиксирован у 8,9%, частичный ответ (ЧО) – у 22,2%, стабилизация заболевания (СЗ) – у 66,7% и прогрессирование заболевания (ПЗ) – у 2,2% больных. Среднее время до спонтанного ответа составило 38,6 месяца (29,8-NA). Медиана ВДП составила 6,74 месяца (5,65-10,65). В среднем через 9 месяцев отмечалось уменьшение размера опухоли по отношению к исходному. Средний балл по шкале оценки боли через 3 месяца составил 0 баллов (0-0,75). Как и в предыдущем исследовании, такие факторы, как возраст, локализация и размер опухоли, не влияли на ВБП. При прогрессировании заболевания из 48 случаев 25 продолжили активное наблюдение. В данном исследовании активное наблюдение первично диагностированных пациентов с десмоидным фиброматозом послужило эффективным методом для более точного выбора показаний к лечению и, самое главное, избавило от лечения, когда в нем нет необходимости. В другом исследовании FSG были представлены очень интересные результаты ретроспективного анализа лечения CIC-DUX4 – второй по распространенности подгруппы круглоклеточных сарком высокой степени злокачественности после сарком Юинга [4]. В исследовании были проанализированы результаты лечения данного заболевания в двух группах: первая группа получала лечение согласно рекомендациям для саркомы Юинга (38/64), вторая – для сарком мягких тканей высокой степени злокачественности (26/64). Это исследование интересно тем, что является одним из самых крупных для такого орфанного заболевания и демонстрирует важность объединения клиник для создания единой базы. В исследовании представлены данные французской базы NETSARC+. Среди 64 пациентов с подтвержденным диагнозом CIC-DUX4 средний возраст на момент постановки диагноза составлял 25 лет (от 11 до 87). При среднем сроке наблюдения 37 месяцев (от 3 до 252) 32 пациента (50%) умерли от заболевания. Медиана общей выживаемости с момента постановки диагноза составила 4 года без существенной разницы между двумя группами. Тем не менее, если сосредоточить внимание на пациентах с метастатическим заболеванием на момент постановки диагноза (18/64), то все шесть пациентов из второй группы умерли из-за прогрессирующего заболевания, тогда как 7 пациентов из первой группа живы и находятся в полной ремиссии, что привело к значительно лучшей общей выживаемости (p<0,05). После внесения изменений в классификацию сарком Всемирной организацией здравоохранения в 2020 году, в том числе на основе молекулярно-генетических характеристик опухоли, часть исследований в настоящее время сконцентрировались на анализе тех результатов, где ранее заметно выделялась часть пациентов, отличающихся от классического течения заболевания. Например, у CIC-DUX4 саркомы прогноз предположительно хуже, чем при саркоме Юинга. Упомянутое исследование подтверждает агрессивность заболевания, а с учетом полученных результатов авторы делают вывод, что в настоящее время при выборе тактики лечении CIC-DUX4 сарком предпочтение следует отдавать рекомендациям по лечению саркомы Юинга. В рандомизированном плацебо-контролируемом исследовании II фазы проведен анализ эффективности и безопасности регорафениба у пациентов с рецидивом распространенной или метастатической хордомы (FSG и Unicancer) [5]. Ранее были опубликованы результаты эффективности регорафениба при остеосаркоме (медиана выживаемости без прогрессирования (ВБП) 16,4 и 4,1 недель в пользу регорафениба), хондросаркоме (медиана ВБП 19,4 и 8 недель в пользу регорафениба) и саркоме Юинга (медиана ВБП 11,4 и 3,9 недель в пользу регорафениба) [6-8]. К сожалению, результаты нового исследования отрицательные. С 2016 г. по 2020 г. было набрано 27 пациентов с рецидивом распространенной или метастатической хордомы. Из них оценке подлежало 23 случая. В группу плацебо было рандомизировано 7 случаев, из них 1 – с метастазами заболевания. В группу регорафениба рандомизировано 16 случаев, из них 6 – с метастазами заболевания. Согласно дизайну исследования, пациенты из группы плацебо могли перейти в группу с регорафенибом при прогрессировании заболевания. Стабилизация заболевания (СЗ) в 6 месяцев составила 37,5% и 33,3% для группы регорафениба и плацебо соответственно. Медиана ВБП составила 8,2 (95% ДИ 4,5-12,9) и 10,1 (95% ДИ 0,8-NE) месяца для группы регорафениба и плацебо соответственно. Медиана ОВ составила 28,3 месяца в группе регорафениба, но не достигнута в группе плацебо. Четыре из 7 пациентов перешли в группу регорафениба после подтверждения прогрессирования заболевания в группе плацебо. Несмотря на то, что исследование показало отрицательные результаты, оно, несомненно, представляет собой большую ценность. Исходя из полученных результатов, можем ли мы выбирать тактику активного наблюдения при хордомах, как, например, при десмоидном фиброматозе? В группе регорафениба было большее соотношение пациентов с метастазами хордомы, что потенциально говорило о более агрессивном течении заболевания, что, однако, по данным настоящего исследования не подтвердилось. Повлияла ли предшествующая терапия иматинибом на результаты исследования? Соотношение пациентов с предшествующей терапией иматинибом было примерно одинаковым в двух группах и составило примерно одну треть. На ESMO 2021 также были представлены результаты рандомизированного исследования III фазы (LMS-04), которые, возможно, изменят стандарт лечения первой линии терапии диссеминированных лейомиосарком (ЛМС) [9]. Ранее авторами (FSG) были опубликованы данные II фазы исследования (LMS02) об эффективности доксорубицина в сочетании с трабектином в качестве лечения первой линии при метастатической или местнораспространенной ЛМС матки или ЛМС мягких тканей [10]. При среднем периоде наблюдения 7,2 года медиана ВБП в общей группе составила 10,1 месяца, а медиана ОВ – 34,4 месяца. В рандомизированное исследование LMS-04 с 2017 г. по 2019 г. было набрано 150 пациентов с ЛМС (ЛМС матки – 67/150, ЛМС мягких тканей – 83/150). Большинство (90%) пациентов имели метастазы опухоли. Среднее время наблюдения составило 37 месяцев. Все больные были рандомизированы на две группы: группа контроля – доксорубицин 75 мг/м2 каждые 3 недели до 6 циклов суммарно, вторая группа – доксорубицин 60 мг/м2 + трабектедин 1,1 мг/ м2 каждые 3 недели до 6 циклов, далее поддерживающая терапия трабектедином до 17 циклов. Согласно дизайну исследования, после 6 циклов для каждой группы возможно было хирургическое удаление резидуальной опухоли. Стратификация выполнялась на основе данных о локализации опухоли (ЛМС матки или мягких тканей). Из второй группы 74% пациентов получили по крайней мере 1 цикл трабектедина в качестве поддерживающей терапии. По результатам исследования отмечалось значительное улучшение медианы ВБП: 13,5 месяца во второй группе (95% ДИ 11,3-16,7) и 7,3 месяца в группе контроля (95% ДИ 6,2- 8,3), скорректированный HR: 0,384 (0,27; 0,55) и p<0,0001. Общая частота ответов составила 13% в группе контроля и 38% во второй группе. Общий контроль над заболеванием (ПО + ЧО + СЗ) в группе контроля составил 79% и 92% во второй группе. После завершения 6 циклов лечения 8% из группы контроля и 19% из второй группы были выполнено хирургическое лечение. Медиана ОВ составила 24,1 месяца для группы контроля и 30,5 месяца для второй группы (HR 0,74; 95% ДИ 0,49-1,12). Частота нежелательных явлений (НЯ) ≥3 степени была больше во второй группе (81%), чем в первой (46%). НЯ в основном представлены гематологической токсичностью и тошнотой/рвотой. Таким образом, результаты подтвердили значительную эффективность комбинации доксорубицина и трабектедина в терапии первой линии распространенной ЛМС по сравнению с монотерапией доксорубицином. Такие результаты несомненно отразятся в клинических рекомендациях. Однако стоит обратить внимание на то, что стандартом терапии первой линии распространенных сарком в принципе является проведение двухкомпонентного режима при отсутствии противопоказаний. Покажет ли комбинация доксорубицина и трабектедина свою эффективность по сравнению с другими двухкомпонентными режимами химиотерапии – пока это остается вопросом для будущих исследований. В настоящее время ожидается официальная публикация полных данных для оценки результатов в подгруппах по локализациям заболевания. И в последнем, но не менее важном, исследовании японских авторов изучена эффективность миладеметана (ингибитора MDM2) при крайне редкой интимальной саркоме [11]. Амплификация MDM2 (murine double minute 2) обнаруживается более чем в 70% случаев интимальных сарком. Предположительно, ингибирование MDM2 может показать клиническую эффективность в этой популяции пациентов. Это исследование было проведено в рамках общенационального большого реестра редких видов рака в Японии (проект MASTERKEY). С 2018 г. по 2021 г. в исследование II фазы набрано 11 случаев интимальной саркомы с амплификацией MDM2 и диким типом TP53. Пациенты получали 260 мг миладеметана внутрь три раза в день каждые 14 дней дважды в течение 28-дневного цикла до прогрессирования заболевания или неприемлемой токсичности. Медиана наблюдения составила 8,2 месяца (IQR 4,4-18,6). Частота объективного ответа и частота контроля над заболеванием составили 20% (95% ДИ 2,5-55,6) и 50% (95% ДИ 18,7-81,3) соответственно. Стоит отметить агрессивность заболевания: медиана ВБП для интимальной саркомы при неэффективности химиотерапии, включающей антрациклины, стремительно падает с 7,7 до 3,2 месяца, а частота объективных ответов – с 38% до 8% [12]. Представленное исследование показывает, что ингибитор MDM2 может стать потенциальным вариантом лекарственного лечения для пациентов с интимальной саркомой. Однако до получения окончательных результатов исследования говорить об этом еще рано.
Список источников указан на сайте https://www.rosoncoweb.ru/news/
oncology/2021/09/23/

ESMO 2021: ИЗМЕНЕНИЕ АЛГОРИТМОВ ЛЕЧЕНИЯ НЕМЕТАСТАТИЧЕСКОГО РАКА ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ, РАКА ЖЕЛЧНЫХ ПРОТОКОВ И ГЕПАТОЦЕЛЛЮЛЯРНОГО РАКА
Авторы: Стативко Олеся Алексеевна
Врач-онколог дневного стационара ГБ
Покатаев Илья Анатольевич
Руководитель службы химиотерапевтического лечения ГБУЗ
«Городская клиническая онкологическая больница №1»
ДЗ Москвы, доктор медицинских наук, Москва
На ESMO 2021 были представлены обновленные данные результатов многоцентрового рандомизированного исследования 3 фазы PRODIGE 24/CCTG PA6, сравнившего эффективность и безопасность адъювантных режимов mFOLFIRINOX и гемцитабина после хирургического лечения пациентов с протоковой аденокарциномой поджелудочной железы. В исследование включались пациенты после резекции поджелудочной железы в объеме R0 и R1 и с уровнем СА19-9 ниже 180 ед/мл. Пациенты были рандомизированы в группу mFOLFIRINOX или монотерапии гемцитабином в течение 6 месяцев. Несмотря на то, что 40% и 45% пациентов соответственно в обеих группах были оперированы в объеме R1, основным событием при прогрессировании являлось отдаленное метастазирование (54,3% в группе mFOLFIRINOX и 46,9% в группе гемцитабина). Подтвердились ранее доложенные результаты эффективности режима mFOLFIRINOX. Медиана времени, свободного от рецидива, составила 21,4 месяца в группе mFOLFIRINOX против 12,8 месяца при использовании гемцитабина. Впервые получены впечатляющие данные 5-летней общей выживаемости – 43,2% в группе mFOLFIRINOX и 31,4% в группе гемцитабина (HR=0,68; 95% CI 0,54-0,85; p=0,0009). В проведенных ранее исследованиях адъювантных режимов при раке поджелудочной железы 5-летняя общая выживаемость составляла 20,7% в группе гемцитабина против 10,4% в группе динамического наблюдения (CONKO-001) и 28,8% в группе комбинации гемцитабина с капецитабином против 16,3% при монотерапии гемцитабином (ESPAC-4). Более четверти пациентов, получивших mFOLFIRINOX, не имели прогрессирования после 5 лет наблюдения. Поскольку кривая Каплана-Майера выходит на плато при данных сроках наблюдения, эти данные указывают на реальный шанс выздоровления от рака поджелудочной железы. Таким образом, режим mFOLFIRINOX является наиболее предпочтительным в качестве адъювантной терапии рака поджелудочной железы. Отметим также значительную разницу между безрецидивной и общей выживаемостью в обеих группах – более 2 лет, указывающую на определенные успехи в лечении рецидивов заболевания. Целью интервенционного проспективного рандомизированного исследования II фазы NEONAX было улучшение выживаемости без прогрессирования при использовании режима гемцитабин + nab-паклитаксел периоперационно (проведение 2 курсов до операции и 4 курсов после) либо только адъювантно. Формально дизайн исследования предусматривал не сравнение двух рукавов, а соотношение полученных результатов с историческим контролем. Включено по 59 пациентов в каждую группу. Исследование интересно описательной статистикой: несмотря на то, что включались только пациенты с рентгенологически резектабельными карциномами, в группе адъювантного лечения только в 78% случаев удалось выполнить резекцию. R0-резекция произведена только в 53% случаев (31/59 пациентов). Более того, лишь 42% пациентов смогли начать адъювантную терапию, а завершить – 27% пациентов. В группе периоперационной терапии общая частота резекций была ниже, чем в случае операции на первом этапе, – 69,5%. Однако большее число пациентов прооперированы в объеме R0-резекции – 61% (36/59). В группе периоперационной терапии только у 6,7% пациентов отмечено прогрессирование на фоне химиотерапии, что было ниже ожидаемого. Медиана времени без прогрессирования составила 11,4 месяца в группе периоперационного лечения против 5,9 месяца среди пациентов, прооперированных на первом этапе. Несмотря на то, что ни в одной из двух групп не была достигнута первичная конечная точка (18-месячная выживаемость без прогрессирования – 55%), можно сделать выводы об удовлетворительной частоте общего ответа (29%) при проведении всего двух циклов гемцитабина и nabпаклитаксела, высокой доле R0 резекций, что позволяет большему количеству пациентов получить выигрыш от периоперационной химиотерапии. Это уже четвертое рандомизированное исследование (ранее опубликованы PREOPANC, PACT-15 и Prep-02/Jsap-05), продемонстрировавшее выигрыш от предоперационной терапии при исходно резектабельном раке поджелудочной железы. Паллиативная терапия билиарного рака долгое время остается неизменной, не предоставляя большого выбора опций. Поэтому заслуживают внимания результаты рандомизированного многоцентрового исследования 2 фазы NIFE, изучавшего эффективность комбинации липосомального иринотекана, лейковорина и фторурацила по сравнению со стандартом – гемцитабин с цисплатином в первой линии распространенного билиарного рака. Суммарно 93 пациента стратифицированы в зависимости от расположения опухоли на группы с внутри- и внепеченочными холангиокарциномами. Достигнута первичная конечная точка исследования – 4-месячная выживаемость без прогрессирования, составившая 51%, отмечено двукратное увеличение частоты объективного ответа – 24,5% в экспериментальной группе. При подгрупповом анализе оказалось, что медиана времени без прогрессирования при внутрипеченочной холангиокарциноме – 3,45 месяца в группе с липосомальным иринотеканом против 7,72 месяца при стандартной химиотерапии, в то время как при внепеченочной локализации первичной опухоли медиана времени без прогрессирования составила 9,59 месяца в экспериментальной группе против 1,76 месяца в группе GemCis, что отразилось и на увеличении медианы продолжительности жизни этих пациентов до 18,23 месяца (в сравнении с 6,34 месяца в группе контроля). Эти данные позволяют рассматривать режим FOLFIRI с липосомальным иринотеканом в качестве опции первой линии лечения внепеченочных холангиокарцином. В лечении гепатоцеллюлярного рака (ГЦР) подтверждена высокая эффективность комбинации атезолизумаба и бевацизумаба, теперь и у пациентов со стадиями BCLC B и BCLC С. Обновленные данные исследования IMbrave 150 продемонстрировали относительно высокую частоту объективного ответа: в группе BCLC B – 43% по RECIST 1.1 (48% mRECIST), в группе BCLC C – 15% по RECIST 1.1 (35% mRECIST), а также наибольшую медиану продолжительности жизни среди исследований 3 фазы первой линии терапии распространенного ГЦР– 25,8 месяца при BCLC B и 24,6 месяца при BCLC С. Актуальным вопросом является поиск опций терапии для пациентов с промежуточной стадией ГЦР, чья общая выживаемость не превышает 20 месяцев. В исследовании II фазы IMMUTACE изучалось добавление ниволумаба к стандартному лечению промежуточной стадии – трансартериальной химиоэмболизации (ТАХЭ). Частота объективного ответа составила 71,4% (8% полных ответов), медиана времени без прогрессирования – 6,14 месяца, что поддерживает перспективность дальнейшего изучения комбинации иммунотерапии и ТАХЭ в рандомизированном исследовании.
Литература:
1. Conroy T, et al. LBA57 Unicancer PRODIGE 24/CCTG PA6 trial: Updated results of a multicenter international randomized phase III trial of adjuvant mFOLFIRINOX (mFFX) versus gemcitabine (gem) in patients (pts) with resected pancreatic ductal adenocarcinomas (PDAC). Annals of Oncology. Volume 32, S1334.
2. Seufferlein T, et al. Perioperative or only adjuvant nab-paclitaxel plus gemcitabine for resectable pancreatic cancer: Results of the NEONAX trial, a randomized phase II AIO study. Annals of Oncology. Volume 32, S1333.
3. Kudo M, et al. IMbrave150: Exploratory efficacy and safety results in patients with hepatocellular carcinoma without macrovascular invasion (MVI) or extrahepatic spread (EHS) treated with atezolizumab (atezo) + bevacizumab (bev) or sorafenib (sor). Annals of Oncology. Volume 32, S818.
4. Vogel A, et al. IMMUTACE: A biomarker-orientated, multi center phase II AIO study of transarterial chemoembolization (TACE) in combination with nivolumab performed for intermediate stage hepatocellular carcinoma (HCC). Annals of Oncology. Volume 32, S1312.
5. Perkhofer L, et al. Nal-IRI with
5-fluorouracil (5-FU) and leucovorin or
gemcitabine plus cisplatin in advanced
biliary tract cancer: Final results of the
NIFE-trial (AIO-YMO HEP-0315), a
randomized phase II study of the AIO
biliary tract cancer group. Annals of
Oncology. Volume 32, S1282.

ESMO 2021: ИНТЕРЕСНОЕ И НОВОЕ В МИРЕ ОНКОГИНЕКОЛОГИИ
Автор: Румянцев Алексей Александрович
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
В сентябре 2021 года в онлайн-формате прошел очередной ежегодный конгресс ESMO. В ходе прошедшего мероприятия были представлены результаты множества исследований в области лечения онкогинекологических заболеваний. Коротко рассмотрим результаты наиболее интересных из них.
Повторное применение поддерживающей терапии олапарибом при рецидивах рака яичников (РЯ)
На ESMO 2021 были представлены результаты рандомизированного исследования II фазы, посвященного изучению эффективности применения олапариба в лечении пациенток с рецидивами РЯ после ранее проводившейся терапии ингибиторами PARP (PARPi). Включались пациентки с наличием патогенных мутаций в генах BRCA1/2 (BRCAm когорта) или без них (BRCAwt когорта) с рецидивами немуцинозного РЯ, которым была проведена платиносодержащая химиотерапия с частичным или полным ответом (или без проявлений заболевания – если перед началом химиотерапии была выполнена полная циторедукция), ранее получавшие PARPi в поддерживающем режиме после завершения химиотерапии [1]. Рандомизация осуществлялась в соотношении 2:1 в группу олапариба 300 мг 2 раза в сутки или в группу плацебо, дизайном исследования было предусмотрено раздельное включение пациенток в BRCAm (n=112) или BRCAwt (n=108) когорты. Терапия проводилась до прогрессирования опухолевого процесса или до непереносимой токсичности. Первичная конечная точка – выживаемость без прогрессирования (ВБП). По результатам исследования медиана ВБП в BRCAm когорте составила 4,3 мес. в группе олапариба по сравнению с 2,8 мес. в группе плацебо (отношение рисков [ОР] 0,57; 95% ДИ 0,37-0,87; p=0,022), в BRCAwt когорте – 5,3 мес. и 2,8 мес. соответственно (ОР 0,43; 95% ДИ 0,26-0,71; p=0,0023). Первичная конечная точка исследования была достигнута. При проведении подгруппового анализа преимущества применения олапариба были выявлены вне зависимости от HRD-статуса пациенток. Профиль безопасности олапариба соответствовал ранее описанному.
Почему это интересно: лечение пациенток с рецидивами РЯ после терапии PARPi – новый вызов для всех специалистов, занимающихся лечением данной патологии. Современные концепции лечения рецидивов рака яичников формировались до появления препаратов этого класса, что затрудняет выбор наиболее эффективных опций лекарственной терапии. Результаты исследований продемонстрировали снижение эффективности противоопухолевого лечения после применения ингибиторов PARP [2]. Результаты исследования OReO дали нам ответ на актуальный вопрос: есть ли смысл в повторном применении PARPi у пациенток, которые до этого уже получали такое лечение? Ответ представляется неоднозначным. С одной стороны, применение олапариба позволило достоверно увеличить ВБП пациенток – достигнуто снижение относительного риска прогрессирования на 43% по сравнению с плацебо. С другой стороны, в когорте BRCAm в абсолютных цифрах различия в медиане ВБП составили ровно 1,5 мес., в BRCAwt – 2,5 мес. Пациенты, ранее получавшие терапию олапарибом в течение длительного срока, получали несколько большее преимущество от терапии. Отсутствие влияния HRD на результаты применения олапариба также представляется весьма примечательным: обусловлено ли это изменением генетического ландшафта опухоли на фоне лечения или низкой диагностической ценностью теста в целом? Таким образом, исследование OReO оказалось позитивным, но в целом достигнутые результаты выглядят достаточно пессимистично. Необходима целенаправленная разработка подходов к терапии пациенток с прогрессированием заболевания после PARPi.
Олапариб vs монохимиотерапия паклитакселом при «платинорезистентных» рецидивах рака яичников
Nicum S. и соавт. представили результаты рандомизированного исследования II фазы OCTOVA, посвященного сравнению эффективности олапариба (± цедираниб) и монохимиотерапии еженедельным паклитакселом в лечении платинорезистентных резистентных рецидивов РЯ. Отметим, что под последним термином понималось прогрессирование опухолевого процесса в течение ≤12 мес. с момента завершения платиносодержащей химиотерапии, хотя всего у 10% пациенток бесплатиновый интервал был >6 мес. Всего в исследование было включено 139 пациенток [3]. По результатам исследования медиана ВБП составила 3,9 мес. в группе паклитаксела и 3,7 мес. в олапариба (ОР 0,93; 95% ДИ 0,76-1,15; p=0,61). В группе олапариба в комбинации с цедиранибом медиана ВБП составила 5,4 мес. Проведение подгруппового анализа не позволило выявить категорию пациентов, получающих достоверное преимущество от применения олапариба, при этом среди пациенток с мутациями в генах BRCA1/2 было отмечено незначимое повышение эффективности терапии на фоне применения олапариба (ОР 1,97; 95% ДИ 0,57-6,83). Была выявлена тенденция к снижению эффективности терапии олапарибом у пациенток, ранее получавших PARPi, однако малое количество пациенток не позволяет сделать окончательные выводы (ОР 0,67). Добавление к олапарибу цедираниба также не позволило улучшить результаты лечения по сравнению с монотерапией паклитакселом.
Почему это интересно: представленное исследование по платинорезистентным рецидивам РЯ не смогло показать превосходство олапариба перед монотерапией паклитакселом в неотобранной популяции больных. При этом заслуживает внимания тенденция к повышению эффективности среди пациенток с BRCAассоциированным РЯ.
Оценка HRD статуса опухоли: вопрос взаимозаменяемости тестсистем различных производителей
Weichert W. и соавт. представили результаты сравнительного исследования, посвященного изучению конкордантности между различными тест-системами для определения дефицита гомологичной рекомбинации (HRD) при РЯ высокой степени злокачественности [4]. Проводилось сравнение результатов тестирования при использовании тест-системы Myriad MyChoice (валидированная тест-система для диагностики HRD) и тестов других производителей – OncoScan (44 образца опухоли), CytoSNP (38 образцов) и AmoyDx HRD (47 образцов). В качестве порогового уровня HRD-позитивности был выбран уровень в 42 балла. По результатам проведенного исследования был продемонстрирован высокий уровень конкордантности между различными диагностическими тестами (r>0,8 для всех сравнений). Авторы отмечают, что случаи дискордантности, как правило, были связаны с низким качеством материала, и планируют продолжить проводимые исследования и увеличить суммарное количество образцов для каждого теста до 100, а также провести сопоставление с клиническими результатами лечения пациенток.
Почему это интересно: результаты рандомизированного исследования III фазы PAOLA (n=806) продемонстрировали высокую эффективность терапии комбинацией олапариба и бевацизумаба в качестве поддерживающей терапии для пациенток с BRCA-ассоциированным или HRDпозитивным РЯ [5]. При этом выраженность эффекта была примерно сопоставима у пациенток с мутациями в генах BRCA1/2 (n=233; HR 0,31) и у пациенток с «диким» типом указанных генов, но наличием HRD (n=152; HR 0,43). HRD-негативные пациентки не имели значимого преимущества от проведения терапии (n=277; HR 1). Таким образом, проведение HRD тестирования позволяет дополнительно выявить около 18% пациенток, которые могут получить значимое преимущество от применения олапариба в первой линии терапии РЯ. В то же время отсутствие в нашей стране валидированной тест-системы для определения HRD-статуса затрудняет клиническое применение данной комбинации. Результаты представленного сравнительного исследования могут помочь в решении этой проблемы.
Обновленные данные KEYNOTE775/ Study 309: эффективность комбинации ленватиниба и пембролизумаба при метастатическом раке эндометрия в зависимости от гистотипа опухоли
Ранее представленные результаты рандомизированного исследования III фазы Study 309, посвященного сравнению эффективности комбинации пембролизумаба и ленватиниба в лечении рецидивов рака эндометрия (РЭ) по сравнению со стандартной химиотерапией, продемонстрировали выраженное улучшение ОВ (ОР 0,68; 95% ДИ 0,56-0,84) и ВБП (ОР 0,60; 95% ДИ 0,50-0,72) у пациенток с метастатическим РЭ. На ESMO 2021 были представлены обновленные результаты данного исследования с анализом результатов лечения в зависимости от гистотипа опухоли [6]. У пациенток с микросателлитно стабильными (MSS) опухолями данные показатели составили:
• светлоклеточный рак: медиана ВБП в группе комбинации ленватиниба и пембролизумаба составила 3,9 мес. по сравнению с 2,0 мес. в группе стандартной химиотерапии (ОР 0,49; 95% ДИ 0,25-0,97), а медиана ОВ – 19,9 мес. и 8,7 мес. соответственно (ОР 0,34; 95% ДИ 0,15-0,78);
• серозный рак: медиана ВБП в группе комбинации ленватиниба и пембролизумаба составила 5,7 мес. по сравнению с 3,6 мес. в группе стандартной химеотерапии (ОР 0,54; 95% ДИ 0,39-0,75), а медиана ОВ – 12,0 мес. и 10,0 мес. соответственно (ОР 0,68; 95% ДИ 0,49-0,96);
• эндометриоидный рак: медиана ВБП в группе комбинации ленватиниба и пембролизумаба составила 7,6 мес. по сравнению с 5,0 мес. в группе стандартной химиотерапии (ОР 0,59; 95% ДИ 0,46-0,76), а медиана ОВ – 20,0 мес. и 15,2 мес. соответственно (ОР 0,78; 95% ДИ 0,57-1,05).
Почему это интересно: ранее представленные результаты исследования Study 309/KEYNOTE-775 сделали комбинацию ленватиниба и пембролизумаба стандартной второй линией терапии метастатического РЭ. Представленные на ESMO 2021 данные продемонстрировали крайне высокую эффективность данной терапевтической опции при «редких» гистотипах заболевания – серозном и, в особенности, светлоклеточном раке, при котором было отмечено относительное снижение риска смерти на 66%.
Трастузумаб дерукстекан в лечении HER2-позитивных карциносарком тела матки: исследование 2 фазы STATICE
В рандомизированное исследование II фазы включались пациентки с прогрессированием заболевания после стандартной химиотерапии, у которых при проведении иммуногистохимического тестирования была выявлена экспрессия HER2-neu (1+ или более выраженная экспрессия). Всем пациенткам проводилась терапия трастузумабом дерукстеканом в дозе 6,4 мг/кг каждые 3 недели. В исследование было включено 34 пациентки. По результатам исследования объективный ответ на терапию был отмечен у 12 (55%) пациенток с экспрессией HER2-neu 2/3+ и у 7 (70%) пациенток с экспрессией 1+. Ни у одной пациентки в обеих группах исследования не было зарегистрировано прогрессирования заболевания на фоне проводимой терапии. Медиана ВБП составила 6,7 мес., медиана ОВ – 15,8 мес. [7].
Почему это интересно: карциносаркомы тела матки – редкий и агрессивный вид новообразований эндометрия. Трастузумаб дерукстекан продемонстрировал крайне многообещающую противоопухолевую активность при наличии даже минимального уровня экспрессии HER2.
Рандомизированное исследование III фазы KEYNOTE-826: эффективность добавления пембролизумаба к стандартной терапии 1 линии в лечении метастатического рака шейки матки
И последнее в списке, но не по значимости, исследование – наверное, одно из наиболее обсуждаемых исследований, представленных в ходе Конгресса. Напомню, что в это исследование включались пациентки с метастатическим или рецидивирующим РШМ, ранее не получавшие системной терапии. Рандомизация в соотношении 1:1 в группу пембролизумаба 200 мг в/в капельно каждые 21 день или плацебо; пациентки в обеих группах получали до 6 курсов стандартной терапии паклитакселом и карбоплатином/ цисплатином ± бевацизумаб 15 мг/ кг – каждые 21 день. Терапия пембролизумабом/плацебо и бевацизумабом проводилась до прогрессирования заболевания или непереносимой токсичности. Стратификация осуществлялась в соответствии с PD-L1 статусом, применением бевацизумаба и наличием отдаленных метастазов на момент постановки диагноза. Первичной конечной точкой исследования были ВБП и ОВ пациенток среди PD-L1+ пациенток [8]. Суммарно в исследование было включено 617 пациенток, у 88% из них уровень экспрессии PD-L1 (CPS) был ≥1. По результатам исследования медиана ВБП среди PDL1+ пациенток составила 10,4 мес. в группе пембролизумаба по сравнению с 8,2 мес. в группе химиотерапии (ОР 0,62; 95% ДИ 0,50-0,77; p<0,001), в общей популяции исследования данные показатели составили 10,4 и 8,2 мес. соответственно. Медиана ОВ не была достигнута в группе исследуемого препарата среди PD-L1+ пациенток и составила 16,3 мес. в группе плацебо (ОР 0,64; 95% ДИ 0,50-0,81; p<0,001), в общей популяции исследования – 24,4 мес. и 16,5 мес. соответственно (ОР 0,676; 95% ДИ 0,54-0,84% p<0,001).
Почему это интересно: первое рандомизированное исследование III фазы, продемонстрировавшее эффективность иммунотерапии в 1 линии лечения метастатического рака шейки матки. Продемонстрировано не только увеличение ВБП, но и ОВ пациенток. Последним исследованием, продемонстрировавшем увеличение ОВ пациенток в первой линии терапии рака шейки матки, стало исследование GOG240, в котором было отмечено увеличение медианы ОВ с 13,3 до 16,8 мес. на фоне добавления бевацизумаба к стандартной химиотерапии (ОР 0,77; 95% ДИ 0,62-0,95; p=0,0068) [9]. Таким образом, можно говорить об удвоении общей выживаемости пациенток с данным заболеванием за последние 7 лет. В то же время, неясной остается эффективность иммунотерапии у PD-L1 негативных пациенток. Кроме того, безусловный интерес будут представлять результаты дальнейшего наблюдения за пациентками: будет ли достигнуто «плато» кривой выживаемости в группе пембролизумаба?
Литература:
1. Pujade-Lauraine E, Selle F, Scambia G, Asselain B, Marmé F, Lindemann K, et al. Maintenance olaparib rechallenge in patients with ovarian carcinoma previously treated with a PARP inhibitor: Phase IIIb OReO/ENGOT Ov38 trial. ESMO 2021 Annual Meeting.
2. Frenel J-S, Kim J-W, Berton D, Asher R, Vidal L, Pautier P, et al. Patterns of progression and subsequent management of patients with BRCA1/2 mutated platinum-sensitive recurrent epithelial ovarian cancer (EOC) progressing on olaparib versus placebo: the SOLO2/ ENGOT Ov-21 trial (NCT01874353). J Clin Oncol. 20 May 2020; 38 (15_suppl): 6070-6070.
3. Nicum DS, Holmes J, McGregor N, Dunn R, Collins L, Kaye S. Randomised Phase II Trial of olaparib, chemotherapy or olaparib and cediranib in patients with platinum-resistant ovarian cancer. ESMO 2021 Annual Meeting.
4. Weichert W, Bartels S, Barreton G, Braicu E, Demes MC, Endris V, et al. Concordance between multiple HRD assays is substantial in high grade ovarian cancer. ESMO 2021 Annual Meeting.
5. Ray-Coquard I, Pautier P, Pignata S, Perol D, Gonzalez-Martin A, Sevelda P, et al. Phase III PAOLA-1/ENGOT-ov25: maintenance olaparib with bevacizumab in patients with newly diagnosed, advanced ovarian cancer treated with platinum-based chemotherapy and bevacizumab as standard of care. ESMO 2019 Annual Meeting.
6. Colombo N, Lorusso D, Herráez AC, Santin AD, Colomba E, Miller DS, et al. Outcomes by Histology and Prior Therapy With Lenvatinib Plus Pembrolizumab vs Treatment of Physician’s Choice in Patients With Advanced Endometrial Cancer (Study 309/KEYNOTE-775). ESMO 2021 Annual Meeting.
7. Hasegawa K, Nishikawa T, Hirakawa A, Kawasaki M, Tomatsuri S, Nagasaka Y, et al. Efficacy and safety of trastuzumab deruxtecan in HER2-expressing uterine carcinosarcoma (STATICE trial, NCCH1615): A multicenter, phase II clinical trial. ESMO 2021 Annual Meeting.
8. Colombo N, Dubot C, Lorusso D, Caceres V, Hasegawa K, ShapiraFrommer R, et al. Pembrolizumab plus Chemotherapy versus Placebo plus Chemotherapy for Persistent, Recurrent, or Metastatic Cervical Cancer: Randomized, Double-Blind, Phase 3 KEYNOTE-826 Study. ESMO 2021 Annual Meeting.
9. Tewari KS, Sill MW, Penson RT, Huang
H, Ramondetta LM, Landrum LM, et
al. Final Overall Survival of the Phase III
Randomised Trial of Chemotherapy with
and without Bevacizumab for Advanced
Cervical Cancer: An NRG Oncology/
Gynecologic Oncology Group Study. 2018.
ESMO 2021: МЕЛАНОМА КОЖИ
Автор: Проценко Светлана Анатольевна
ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, Санкт-Петербург
Современная иммунотерапия, безусловно, совершила революцию в лечении пациентов с меланомой кожи.
Достигнуты высокие результаты
выживаемости пациентов с распространенными стадиями заболевания.
В настоящее время мы становимся
свидетелями возможного применения ингибиторов контрольных точек
иммунного ответа на более ранних
стадиях, в адъювантном, а также неоадъювантном режимах.
Одним из значимых событий
Конгресса ESMO 2021 года стало выступление Jason Luke на Президентском симпозиуме с результатами
первого промежуточного анализа
исследования KEYNOTE-716, свидетельствующими, что назначение пембролизумаба в адъювантном режиме
увеличивает безрецидивную выживаемость при меланоме кожи II стадии
высокого риска [1].
Современным стандартом ведения
пациентов с меланомой кожи II стадии
Рисунок 1.
Докладчики на Президентском симпозиуме 1.
Дискуссионная сессия: Меланома и другие опухоли кожи
(Конгресс ESMO 2021).
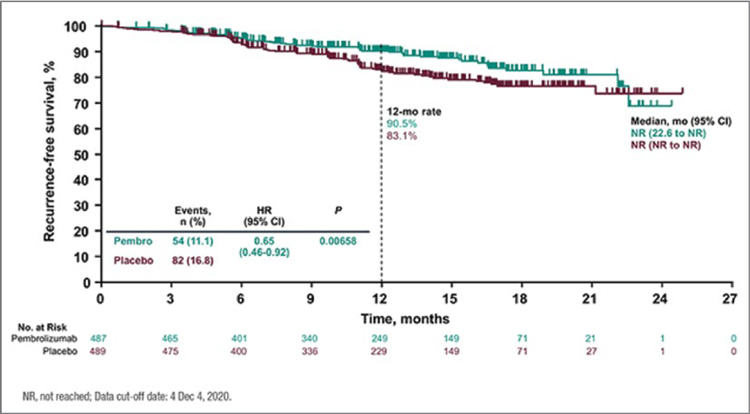
Рисунок 2.
Риск безрецидивной выживаемости по оценке
исследователей значительно ниже в группе адъювантного
пембролизумаба по сравнению с группой плацебо (LBA3,
ESMO 2021).
после радикального удаления
является наблюдение. Адъювантная
таргетная или анти-PD1 терапия назначается начиная с IIIA стадии. Пациенты с меланомой IIB и IIC стадии
имеют глубокую или изъязвленную
первичную опухоль (T3b, T4a, T4b)
и имеют такой же риск рецидива заболевания и смерти, как и пациенты
с меланомой стадии IIIA и IIIB. Представленные промежуточные результаты исследования KEYNOTE-716 могут
изменить текущий подход, поскольку
показывают, что адъювантная иммунотерапия должна быть новым стандартом лечения меланомы II стадии
высокого риска.
В рандомизированное двойное
слепое исследование III фазы включено 976 пациентов старше 12 лет со II
стадией меланомы кожи и высоким
риском прогрессирования заболевания (IIb и IIc стадии) после радикального удаления первичной опухоли.
Пациенты рандомизированы либо в
группу пембролизумаба 200 мг (2 мг/
кг для детей) в/в капельно 1 раз в 3 недели (всего 17 циклов), либо в группу
плацебо. Длительность лечения – до 1
года.
Стратификация у взрослых пациентов проведена по категории T (3b,
4a, 4b) и по отдельной страте для педиатрических пациентов. Большинство
пациентов (64%) имели IIB стадию заболевания, почти в два раза реже наблюдалась IIC стадия (34,8%).
Первичная конечная точка исследования – безрецидивная выживаемость по оценке исследователей.
Первый промежуточный анализ показал, что применение пембролизумаба в адъювантном режиме снижает
риск рецидива заболевания на 35% по
сравнению с плацебо (отношение риска 0,65; 95% доверительный интервал
0,46-0,92; p=0,00658) при медиане наблюдения 14,4 месяца. Медиана продолжительности жизни без прогрессирования не достигнута ни в одной
группе. Применение пембролизумаба
привело к снижению частоты рецидивов по сравнению с плацебо (11,1%
против 16,8%) и уменьшению почти
в два раза частоты появления отдаленных метастазов (28 против 38).
Безрецидивная выживаемость за 12
месяцев составила 90,5% в группе иммунотерапии и 83,1% в группе плацебо (рис.2).
Частота любых нежелательных явлений ≥3 степени была выше при применении пембролизумаба по
сравнению с плацебо (25,9% против
17,1%), а частота нежелательных явлений ≥3 степени, связанных с лекарственными препаратами, была выше в
группе пембролизумаба по сравнению
с плацебо (16,1% против 4,3%). Ввиду
нежелательных явлений лечение прекращено у 15,3% пациентов в группе
пембролизумаба по сравнению с 2,5%
пациентов с плацебо.
В группе пембролизумаба не
было случаев смерти, а в группе плацебо четыре пациента умерли ввиду нежелательных явлений. Иммуноопосредованные нежелательные
явления зарегистрированы у 36,2%
пациентов, получавших пембролизумаб, и у 8,4% пациентов, получавших
плацебо. Наиболее частыми иммуноопосредованными нежелательными
явлениями были гипотиреоз (15,7% в
группе пембролизумаба против 3,5% в
группе плацебо) и гипертиреоз (10,4%
в группе пембролизумаба против 0,6%
в группе плацебо); большинство иммуноопосредованных нежелательных
явлений были 1-2 степени тяжести.
Таким образом, пациенты, радикально прооперированные по поводу меланомы кожи IIB и IIC стадии,
имеют высокий риск рецидива. Исследование KEYNOTE-716 является первым рандомизированным, двойным
слепым исследованием III фазы, которое показало, что анти-PD-1- терапия
пембролизумабом в адъювантном режиме значительно снижает риск рецидива по сравнению с плацебо при меланоме кожи II стадии высокого риска.
Reinhard Dummer представил 5-летние результаты рандомизированного исследования III фазы
COLUMBUS по сравнению эффективности комбинации энкорафениб + биниметиниб против энкорафениба или
вемурафениба у пациентов с метастатической BRAF V600-мутированной
меланомой [2]. Энкорафениб и биниметиниб не зарегистрированы в
России. В первую часть исследования
включено 577 пациентов, не получавших ранее лечения или с прогрессированием опухоли после иммунотерапии первой линии. Рандомизация
проводилась в соотношении 1:1:1:
энкорафениб 450 мг один раз в день +
биниметиниб 45 мг два раза в день; энкорафениб 300 мг один раз в день или
вемурафениб 960 мг два раза в день.
Обновленный анализ проведен
после минимального наблюдения за
пациентами в течение 65 месяцев. В
группе энкорафениб + биниметиниб
показатели 5-летней ОВ (95% ДИ) у
всех пациентов (n=192), с уровнем
лактатдегидрогеназы (ЛДГ) ≤ верхней
границы нормы на исходном уровне
(n=137) и низкой опухолевой нагрузкой (n=88) составила 35% (28-42), 45%
(36-53) и 48% (37-58) соответственно.
Результаты исследования представлены в таблице 1.
Таблица 1.
5-летние результаты исследования III фазы COLUMBUS по сравнению эффективности: энкорафениб + биниметиниб против энкорафениба или вемурафениба
у пациентов с метастатической меланомой при наличии мутации в гене BRAF V600

Данные по безопасности соответствовали известному профилю
переносимости комбинации энкорафениб + биниметиниб. Побочными
явлениями, встречающимися у ≥20%
пациентов на комбинированной
терапии энкорафениб + биниметиниб, были тошнота, диарея, рвота,
артралгия, усталость, повышение
креатинфосфокиназы крови (КФК),
головные боли, запоры, астения и
пирексия. Токсичность 3/4 степени
наблюдалась у ≥2,5% пациентов, это
были гипертония, пирексия, боли в
животе, диарея и рвота. Изменения
лабораторных показателей 3/4 степени отмечены у ≥2,5% пациентов,
включали повышенный уровень
гамма-глутамилтрансферазы, КФК,
аланин-трансаминазы и гипергликемию. Виду побочных эффектов в
каждой рандомизированной группе
прекратили лечение 12-14% пациентов. Наиболее часто назначаемыми
противоопухолевыми препаратами
после таргетной терапии были ингибиторы контрольных точек иммунного ответа.
Обновленные результаты исследования подтвердили длительно
сохраняющуюся эффективность
комбинированной терапии энкорафениб + биниметиниб у пациентов
с метастатической меланомой BRAF
V600.
Ввиду недостаточно высокой эффективности современной иммунотерапии постоянно идет поиск новых путей противодействия опухолевой экспансии, и в дополнение к уже известным ингибиторам контрольных точек иммунного ответа выявляются новые перспективные мишени воздействия, в частности, ингибиторы LAG-3. LAG3 – это рецептор иммунного чек-пойнта, обладающий многочисленными биологическими эффектами на функции T-лимфоцитов, включая связывание молекул главного комплекса гистосовместимости со значительным подавлением активности иммунной системы. В клиническом исследовании RELATIVITY-047 оценивалась эффективность комбинации релатлимаб (RELA), LAG-3 антитела + ниволумаб (NIVO) в сравнении с монотерапией ниволумабом у не леченых ранее пациентов с метастатической меланомой. Результаты терапии указанной комбинацией продемонстрировали высокие показатели выживаемости без прогрессирования (ВБП), хорошую переносимость и безопасность [3]. Семьсот четырнадцать пациентов были рандомизированы в группы RELA + NIVO (n=355) или NIVO (n=359). Доза ниволумаба была фиксированной: 480 мг в/в каждые 4 недели. Лечение продолжалось до прогрессирования, неприемлемой токсичности или отзыва согласия. ВБП оценивалась по подгруппам. ВБП 2 определялась как время от рандомизации до прогрессирования процесса при последующей терапии или смерти. Также оценивалось свободное от лечения время: от последней исследуемой дозы до последующей терапии. Терапия комбинацией RELA + NIVO увеличила ВБП в определенных подгруппах, включая BRAF, M стадию по AJCC v.8 и ЛДГ. Медиана продолжительности лечения составила 5,6 месяца для RELA + NIVO и 4,9 месяца для NIVO. Лечение было прекращено, в основном из-за прогрессирования заболевания, в 36,3% и 46,0% случаях соответственно. Пациенты, получавшие последующую системную терапию в группе RELA + NIVO и группе NIVO, составили 27,9% и 29,8% соответственно, включая ингибиторы PD-1 или CTLA-4 (9,0% против 12,8%) и терапию BRAF/MEK (11,5% против 13,9%). Медиана ВБП 2 в группе RELA + NIVO не достигнута (95% ДИ 21,8-NA), в группе NIVO составила 20,0 месяцев (95% ДИ 15,4-25,1), отношение рисков [HR] 0,77 (95% ДИ 0,61–0,97) (рис.3). Медиана времени без лечения от последней дозы исследования до последующей терапии составила 3,98 месяца (95% ДИ 2,10- 7,43) для RELA + NIVO против 1,45 месяца (95% ДИ 1,25-1,71) для NIVO (ОР 0,63; 95% ДИ 0,48-0,83).
Рисунок 3.
Исследование RELATIVITY-047: преимущество
ВБП при комбинации Relatlimab + Nivolumab против
монотерапии Nivolumab

Рисунок 4.
Исследование RELATIVITY-047:
преимущество ВБП 2 при комбинации Relatlimab + Nivolumab
против монотерапии Nivolumab.
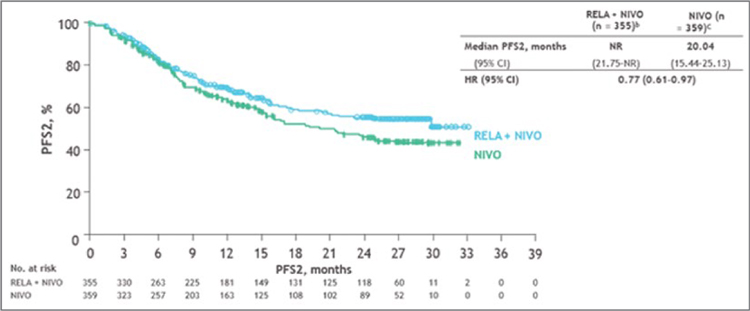
Выводы:Применение комбинации RELA + NIVO у пациентов с метастатической меланомой в первой линии терапии продемонстрировало длительную ВБП, а также преимущество после первого прогрессирования, включая более длительное время до начала последующего лечения по сравнению с монотерапией NIVO. Paolo Ascierto представил данные рандомизированного исследования II фазы SECOMBIT по выбору наилучшей последовательности в первой линии терапии у пациентов с метастатической меланомой с наличием мутации в гене BRAF: комбинированная иммунотерапия ипилимумабом (IPI) и ниволумабом (NIVO) или комбинированная таргетная терапия энкорафенибом (E) и биниметинибом (B) [4]. Лечение таргетной терапией (ингибиторы BRAF и MEK) и ингибиторами иммунных контрольных точек (анти-CTLA4, анти-PD-1) улучшило результаты лечения пациентов с метастатической меланомой BRAF-V600 в первой линии. Таргетная терапия продемонстрировала более высокие показатели ответа, но длительность ответа была ограничена, в то время как комбинация иммунотерапии IPI + NIVO характеризуется более низкой частотой ответа, но более продолжительным ответом. Вопрос о наилучшей последовательности остается открытым. Кроме того, короткий курс таргетной терапии, переключенный на иммунотерапию IPI + NIVO, поддерживается доклиническими исследованиями и может быть клинически целесообразен. С целью изучения наилучшей последовательной стратегии начато исследование SECOMBIT – рандомизированное исследование II фазы с тремя рукавами (NCT02631447). С ноября 2016 года по май 2019 года в 37 центрах из 9 стран в исследование были включены пациенты (n=251) с не леченой ранее метастатической меланомой и наличием мутации в гене BRAF V600. Пациенты были рандомизированы в одну из трех групп: в группу A (E+ B до прогрессирования, затем IPI + NIVO до прогрессирования), в группу B (IPI + NIVO до прогрессирования, затем E+ B до прогрессирования) или в группу C (E+ B в течение 8 недель, затем IPI + NIVO до прогрессирования, затем E+ B до прогрессирования). Схемы лечения были следующими: таргетная терапия – E 450 мг в день + B 45 мг в день; иммунотерапия – IPI 3 мг/кг + NIVO 1 мг/кг каждые 3 недели, 4 цикла, затем N 3 мг/кг каждые 2 недели. ОВ является основной конечной точкой исследования. Вторичные конечные точки включали общую ВБП, 2- и 3-летнюю выживаемость, общую частоту ответов, продолжительность ответа, оценку уровня биомаркеров. Медиана наблюдения составила 32,2 месяца (диапазон 27,9-41,6 мес.). Медиана ОВ не достигнута ни в одной из групп лечения. Показатели 2-летней и 3-летней ОВ составили 65% и 54% в группе А, 73% и 62% в группе В, 69% и 60% в группе С соответственно. ВБП через 2 и 3 года равнялась 46% и 41% в группе A, 65% и 53% в группе B, 57% и 54% в группе C соответственно (рис.5.).
Рисунок 5.
Тенденция к более благоприятной выживаемости
в течение 2 и 3 лет для групп B и C по сравнению с группой A
(Abstract LBA40, ESMO 2021).
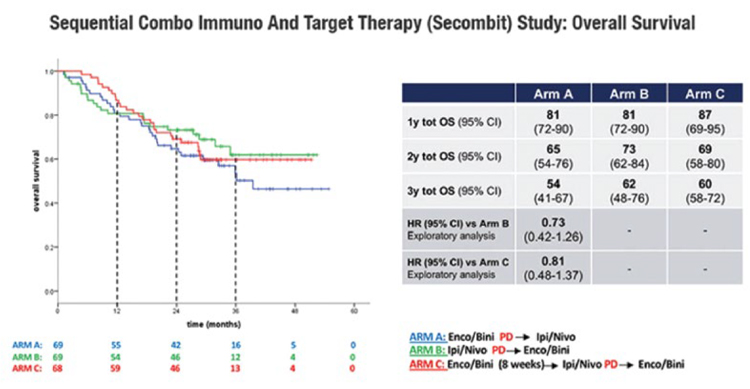
Таблица 2.
Эффективность лечения пациентов с метастазами меланомы в головной мозг комбинацией ниволумаба (NIVO) и ипилимумаба (IPI) (исследование II фазы
CheckMate 204).
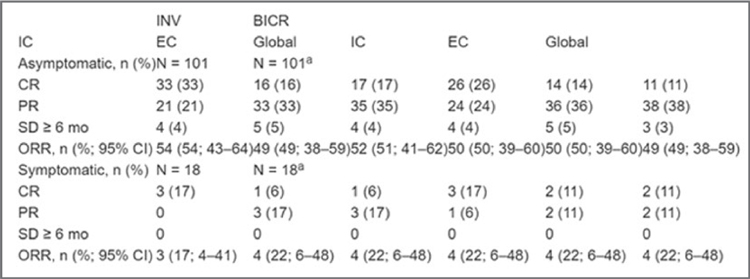
Таким образом, показатели OВ и
ВБП через 2 и 3 года продемонстрировали лучшую тенденцию в
группах B и C. Продолжается сбор
данных для предоставления дополнительной информации о долгосрочной пользе трех комбинаций
лечения. Анализ биомаркеров продолжается.
Заслуживают внимание представленные JS Weber результаты исследования II фазы по эффективности комбинации ипилимумаба, ниволумаба и тоцилизумаба для неоперабельной метастатической меланомы [5]. Комбинированная иммунотерапия ипилимумаба с ниволумабом имеет частоту ответов 45-55%, при этом 50% пациентов имеют побочные эффекты 3-5 степени. Высокий уровень сывороточного IL-6 коррелирует с низкой эффективностью ингибиторов контрольных точек иммунного ответа и короткой выживаемостью при многих злокачественных опухолях. Тоцилизумаб – это гуманизированное антитело, блокирующее рецептор IL-6, одобренное для лечения ревматоидных артритов и синдрома высвобождения цитокинов. Являясь иммунодепрессантом, тоцилизумаб купирует иммуноопосредованные нежелательные явления, в том числе резистентные к стероидам. Исследование было проведено для оценки, может ли тоцилизумаб снизить токсичность и/или повысить эффективность ингибиторов контрольных точек иммунного ответа. Пациентам с метастатической меланомой проводилась иммунотерапия: ипилимумаб в дозе 1 мг/кг и ниволумаб в дозе 3 мг/кг вводили внутривенно каждые 3 недели, 4 раза во время индукции, затем поддержка ниволумабом в течение 2 лет. Тоцилизумаб вводили по 4 мг/кг каждые 6 недель внутривенно в течение первых 24 недель. В исследование включено 28 пациентов, 14 мужчин и 14 женщин, средний возраст составил 67 лет, ECOG статус пациентов был 0-1. Большинство (24) больных имели IV стадию заболевания и только четверо – IIIC/D стадию. Наблюдалось 5 случаев иммуноопосредованных нежелательных явлений 3-4 степени (энтерит, колит, нефрит, два случая повышения уровня трасаминаз). Медиана наблюдения составила 6 месяцев. Частота объективных ответов равнялась 70% (14 из 20), у двух пациентов сохранялась стабилизация процесса в течение 18 недель. Четыре пациента имели прогрессирование и двое умерли. Высокий уровень TNF-альфа коррелировал с 3-4 степенью токсичности, а повышенный уровень IL-6/ IL-8 – с прогрессированием опухолевого процесса. Таким образом, измененный режим комбинированной терапии IPI/NIVO (ипилимумаб 1 мг/кг и ниволумаб 3 мг/кг) с тоцилизумабом обладает многообещающей противоопухолевой активностью с благоприятным профилем токсичности. В дальнейшем будут представлены результаты корреляционных исследований. На ESMO 2021 продемонстрированы 3-летние результаты лечения пациентов с метастазами меланомы в головной мозг комбинацией ниволумаба (NIVO) и ипилимумаба (IPI) (исследование II фазы CheckMate 204 [6]). В исследовании показано, что наилучшие результаты лечения меланомы с метастатическим поражением головного мозга комбинацией NIVO + IPI наблюдались у бессимптомных пациентов (когорта А) по сравнению с теми пациентами, которые имели симптомы поражения ЦНС (когорта В). Оценка данных проводилась как исследователями (INV), так и с помощью слепой независимой центральной экспертизы (BICR). В многоцентровом исследовании пациенты с метастатической меланомой в головной мозг получали комбинацию NIVO 1 мг/кг + IPI 3 мг/ кг каждые 3 недели ×4, затем NIVO 3 мг/кг каждые 2 недели до прогрессирования или неприемлемой токсичности. Первичной конечной точкой был показатель клинической эффективности IC, определяемый как доля пациентов с полным ответом (CR), частичным ответом (PR) или стабильным заболеванием (SD) ≥6 месяцев (RECIST 1.1). При медиане наблюдения 34 месяца в когорте А и 7,5 месяца в когорте В оценен 101 пациент с бессимптомным течением и 18 пациентов с наличием симптомов поражения ЦНС. Показатели INV- и BICR-ответов были согласованными (табл.2), при этом коэффициент соответствия между оцениваемыми показателями составлял 85% для когорты A и 94% для когорты B. Общий ответ на лечение был значительно выше в когорте пациентов без симптомов поражения ЦНС. ВБП на период 36 месяцев для когорты A составила 54% (95% ДИ 43- 64) по INV и 52% (41-62) по BICR, а показатель ОВ составил 72% (62-80). Для когорты В 36-месячный показатель ВБП равнялся 19% (95% ДИ 5-40) по INV и 28% (10-50) по BICR, а ОВ – 37% (14-60). Никаких новых нежелательных явлений или смертей, связанных с лечением, не наблюдалось. В рамках сессии «Меланома и другие опухоли кожи» Helen Gogas с коллегами обсудили результаты исследования фазы III MASTERKEY-265 по иммунотерапии Talimogene laherparepvec (T-VEC) в сочетании с пембролизумабом у пациентов с прогрессирующей меланомой. T-VEC – аттенуированный вирус простого герпеса человека 1 типа (не зарегистрирован в России). Комбинированная терапия не позволила достичь первичной конечной точки выживаемости без прогрессирования (ВБП), несмотря на более ранние многообещающие результаты фазы Ib [7].
В исследование MASTERKEY265 были включены 692 пациента с неоперабельной/метастатической (стадия IIIB-IVM1C) меланомой. Пациенты не получали анти-PD-1 терапию. При медиане наблюдения 31,0 месяц отношение рисков (HR) для ВБП – первичной конечной точки наряду с общей выживаемостью (ОВ) – составило 0,86 (95% доверительный интервал [ДИ] 0,71-1,04; р=0,13), при этом медиана ВБП составила 14,3 месяца для T-VEC + пембролизумаб и 8,5 месяца для плацебо + пембролизумаб (рис.6).
Рисунок 6.
Исследование MASTERKEY-265: первичная
конечная точка – ВБП не соответствует статистической
значимости при медиане наблюдения 31 месяц.
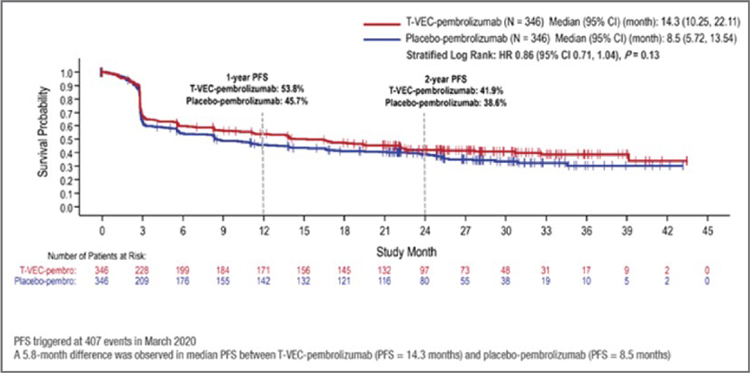
Данные по ОВ не являются зрелыми, в промежуточном анализе не сообщалось о преимуществе выживаемости (медиана еще не достигнута при T-VEC + пембролизумаб по сравнению с 49,2 месяца с плацебо + пембролизумаб; ОР 0,96; 95% ДИ 0,76-1,22; р=0,74). Существенных улучшений показателей при первичном анализе не ожидается. По мнению доктора Marco Donia, которое он высказал в дискуссии, разочаровал тот факт, что обнадеживающие результаты ранних клинических исследований не привели к улучшению выживаемости в более крупном исследовании III фазы. Аналогичная история наблюдалась с комбинацией эпакадостат + пембролизумаб в исследовании ECHO-301 / KEYNOTE-252 (Lancet Oncol. 2019; 20 (8): 1083-1097), при этом не было показано преимуществ выживания по сравнению с плацебо + пембролизумаб. Возможно, будущий анализ или исследование, сосредоточенные на подгруппах пациентов с конкретными биомаркерами, могут оказаться более информативными в выявлении пациентов, которые с большей вероятностью выиграют от комбинации. Несмотря на отрицательные результаты в комбинации с пембролизумабом, T-VEC продолжает играть важную роль в лечении пациентов с меланомой, и новые исследовательские подходы к иммунотерапии с помощью T-VEC продемонстрировали обнадеживающие ранние результаты. Например, было представлено клиническое испытание I фазы внутриопухолевой инъекции аутологичных CD1c (BDCA-1)+/CD141 (BDCA3) + миелоидных дендритных клеток (MYDC) в сочетании с T-VEC у пациентов с прогрессирующей меланомой (резюме 962MO). Хотя в исследование было включено только 13 пациентов, сообщалось о противоопухолевой активности – у 2 пациентов была достигнута патологическая полная ремиссия, у 1 пациента был частичный ответ, а у 2 пациентов был смешанный ответ – с регрессией, происходящей как в местах инъекции, так и в других очагах. Marco Donia отметил, что многие потенциальные агенты находятся в разработке, и на данный момент лидером, по-видимому, является онколитическая вирусная терапия, такая как T-VEC, но необходимо определить любые клинические различия между этими методами лечения. В заключении следует отметить, что, несмотря на достигнутые результаты, изменившие стандарты лечения пациентов с меланомой кожи, и непростую эпидемиологическую обстановку, клинические исследования продолжаются. Нерешенных вопросов достаточно. Множество работ посвящены поиску предикторов ответа на противоопухолевую терапию, изучению новых комбинаций, преодолению резистентности, анализу нежелательных явлений. Обсуждение новых данных, применение их в практической онкологии, позволяет повысить эффективность лечения и продлить жизнь нашим пациентам.
Источники:
1. Luke JJ, et al. Pembrolizumab versus placebo after complete resection of highrisk stage II melanoma: Efficacy and safety results from the KEYNOTE-716 double-blind phase III trial. ESMO Congress 2021, Abstract LBA3.
2. Dummer R, et al. 5-year update on COLUMBUS: A randomized phase III trial of encorafenib (enco) + binimetinib (bini) versus enco or vemurafenib (vem) in patients (pts) with BRAF V600-mutant melanoma. Annals of Oncology. 2021; 32 (suppl_5): S867-S905.
3. Hodi FS, et al. Tawbi H.A., E.J. Lipson, D. Schadendorf, P.A. Ascierto, L. Matamala, E.C. Gutiérrez, P. Rutkowski, H.J. Gogas, C.D. Lao, J.J. De Menezes, S. Dalle, A. Arance, J.J. Grob, L. Toms, K. Jonczak, A.M. Sobiesk, G.V. Long. Relatlimab (RELA) + nivolumab (NIVO) vs. NIVO in previously untreated metastatic or unresectable melanoma: Additional efficacy in RELATIVITY-047. Annals of Oncology. 2021; 32 (suppl_5): S867-S905.
4. Ascierto PA, et al. SECOMBIT: the best sequential approach with combo immunotherapy [ipilimumab (I) /nivolumab (N)] and combo target therapy [encorafenib (E)/binimetinib (B)] in patients with BRAF mutated metastatic melanoma. A phase II randomized study. ESMO Congress 2021, LBA40. Annals of Oncology. 2021; 32 (suppl_5): S1283-S1346.
5. Weber JS, et al. Phase II trial of ipilimumab, nivolumab and tocilizumab for unresectable metastatic melanoma. Annals of Oncology. 2021; 32 (suppl_5): S867-S905.
6. Margolin KA, et al. CheckMate 204: 3-year outcomes of treatment with combination nivolumab (NIVO) plus ipilimumab (IPI) for patients (pts) with active melanoma brain metastases (MBM). Annals of Oncology. 2021; 32 (suppl_5): S867-S905.
7. Ribas A, et al. MASTERKEY-265:
A phase 3, randomized, placebo
(PBO)-controlled study of talimogene
laherparepvec (T) plus pembrolizumab
(P) for unresectable stage IIIB-IVM1C
melanoma (MEL). ESMO Congress
2021, Abstract 1037O.
ESMO 2021 И WCLC 2021: РАК ЛЕГКОГО
Автор: Сакаева Дина Дамировна
ФГБОУ «Башкирский государственный медицинский университет», Уфа
Последние несколько лет были очень богаты на события в терапии опухолей легкого, однако 2021 год не был столь же насыщенным. Среди особо интересных результатов, представленных на ESMO2021 и WCLC 2021, хотелось бы выделить несколько сообщений. Комбинация ниволумаба и ипилимумаба с двумя циклами химиотерапии увеличивает ОВ у пациентов с НМРЛ с метастатическим поражением головного мозга – об этом свидетельствуют данные исследования CheckMate 9LA, которые были представлены на конференции WCLC 2021 (Carbone D, et al. WCLC Sept. 8-14, 2021, Abstract OA09.01). Практически в три раза больше пациентов, получавших двойную иммунотерапию, были живы 2 года и более. Медиана ОВ среди пациентов с метастазами в головной мозг составила 19,3 мес. в группе комбинации ниволумаба и ипилимумаба с двумя циклами химиотерапии и только 6,8 мес. в контрольной группе пациентов, получавших стандартную терапию платиновым дуплетом (HR 0,43, 95% CI 0,27-0,67). Однолетняя ОВ составила 67% и 26%, а двухлетняя – 35% и 12% в соответствующих группах. Преимущество было отмечено также и в показателях выживаемости без прогрессирования. Медиана ВБП составила 10,6 мес. против 4,1 мес. (HR 0,40; 95% CI 025-0,64) среди пациентов с метастазами в головной мозг в группах с двойной иммунотерапий и только химиотерапией соответственно. Не отмечалось прогрессирования через 1 год у 36% пациентов с метастазами в головной мозг, получавших двойную иммунотерапию с добавлением химиотерапии, через 2 года – у 19% пациентов, аналогичные показатели в группе химиотерапии составили 8% и 6%. Добавление к химиотерапии комбинации ниволумаба и ипилимумаба также увеличило частоту объективных ответов для пациентов с метастазами в головной мозг – 43% против 24%, среди пациентов без метастазов в головной мозг эти показатели были соответственно 37% и 26%. Что касается безопасности – новых сигналов выявлено не было. Частота неврологических осложнений любой степени у пациентов с метастазами в головной мозг в группе с двойной иммунотерапией составила 22%, в группе химиотерапии – 10%. Большинство осложнений были 1-2 степени тяжести. Иммунотерапия, направленная на сигнальный путь PD-1/ PD-L1, применяемая самостоятельно и в комбинации с ХТ, изменила подходы к лечению метастатического НМРЛ. Комбинация терапии антителами к PD-L1 с ХТ может обеспечить контроль заболевания на ранней стадии. Появляется все больше доказательств того, что совместное применение антител к CTLA-4 с антителами к PD-L1 в комбинации с ХТ или без нее может сопровождаться дополнительными клиническими преимуществами, также как и преимуществами в отношении долгосрочной выживаемости в отдельных популяциях пациентов. В исследовании POSEIDON проводилась оценка применения дурвалумаба (антитело к PD-L1) с тремелимумабом (антитело к CTLA-4) или без него в комбинации с выбранными исследователями схемами ХТ в качестве терапии первой линии плоскоклеточного или неплоскоклеточного метастатического НМРЛ. В исследовании POSEIDON у пациентов с мНМРЛ отмечено значимое улучшение показателей ВБП при применении дурвалумаба в сочетании с ХТ в качестве терапии первой линии по сравнению с ХТ, с положительной динамикой, но без достижения статистической достоверности со стороны ОВ:
• ОР для ВБП – 0,74 (95% ДИ 0,62- 0,89; р=0,00093);
• ОР для ОВ – 0,86 (95% ДИ 0,72-
1,02; р=0,07581).
Рисунок 1.
Медиана периода наблюдения за цензурированными пациентами на дату среза данных: 10,3
месяца (диапазон 0-23,1).
Рисунок 2.
Медиана периода наблюдения за цензурированными пациентами на дату среза данных: 10,3
месяца (диапазон 0-23,1).
Дурвалумаб + тремелимумаб + ХТ по сравнению с ХТ в качестве терапии первой линии у пациентов с мНМРЛ продемонстрировали статистически достоверные и клинически значимые улучшения ВБП и ОВ:
• ОР для ВБП – 0,72 (95% ДИ 0,60- 0,86; р=0,00031);
• ОР для ОВ – 0,77 (95% ДИ 0,65- 0,92; р=0,00304).
Наиболее заметный положительный эффект на ОВ и ВБП регистрировался среди пациентов с неплоскоклеточным (по сравнению с плоскоклеточным) раком. В целом во всех трех группах терапии не было выявлено различий в профиле токсичности, также не было зарегистрировано новых сигналов по осложнениям. Добавление тремелимумаба к комбинации дурвалумаб + ХТ не сопровождалось значимым увеличением числа случаев прекращения терапии. Частота прекращения терапии в связи с развитием нежелательных явлений составила 15,5% и 14,1% в группе Д+T+ХT и в группе Д+ХT соответственно. Таким образом, комбинация дурвалумаб + тремелимумаб + ХТ представляет собой перспективный новый вариант терапии первой линии мНМРЛ. 1171MO – практическое исследование PACIFIC-R, представленное на ESMO 2021: продолжительность лечения и промежуточный анализ выживаемости без прогрессирования у пациентов с нерезектабельным НМРЛ стадии III, получавших дурвалумаб после химиолучевой терапии. В исследовании 3 фазы PACIFIC дурвалумаб приводил к значимому улучшению первичных конечных точек ОВ и ВБП у пациентов с нерезектабельным НМРЛ стадии III и отсутствием прогрессирования заболевания после ХЛТ; обновленные результаты примерно за 5 лет наблюдения показали устойчивое преимущество режима PACIFIC, который стал стандартом лечения у этой популяции пациентов, в отношении ОВ и ВБП.
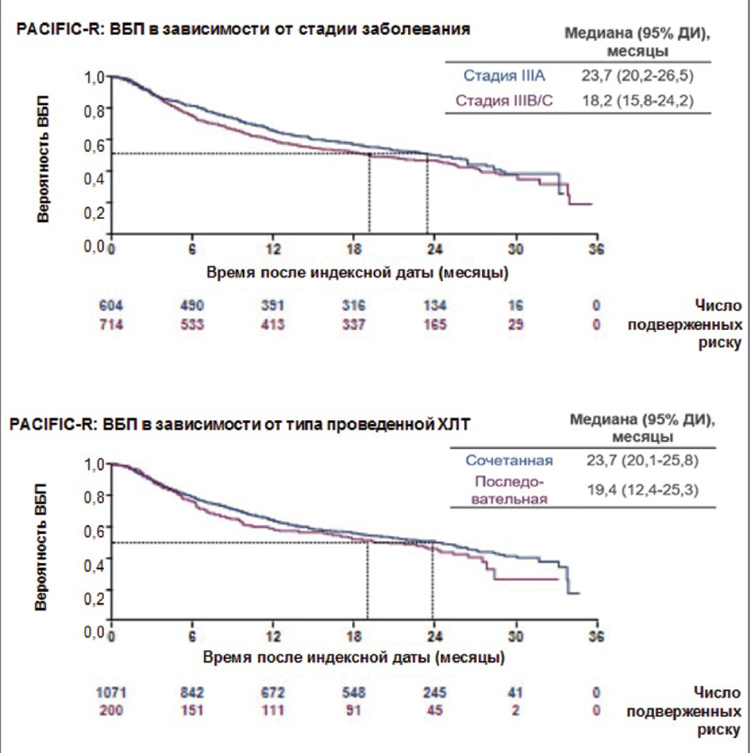
• Медиана ВБП в клинической практике (21,7 месяца) была выше, чем описанная медиана ВБП для группы дурвалумаба в исследовании PACIFIC (16,9 месяца).
• Эффективность дурвалумаба послеХЛТ в изучаемых подгруппах в целом соответствовала результатам предыдущих анализов исследования PACIFIC, включая подгруппы по экспрессии PD-L1.
Рисунок 3.
Медиана периода наблюдения за цензурированными пациентами на дату среза данных: 34,9
месяца (диапазон 0-44,5).
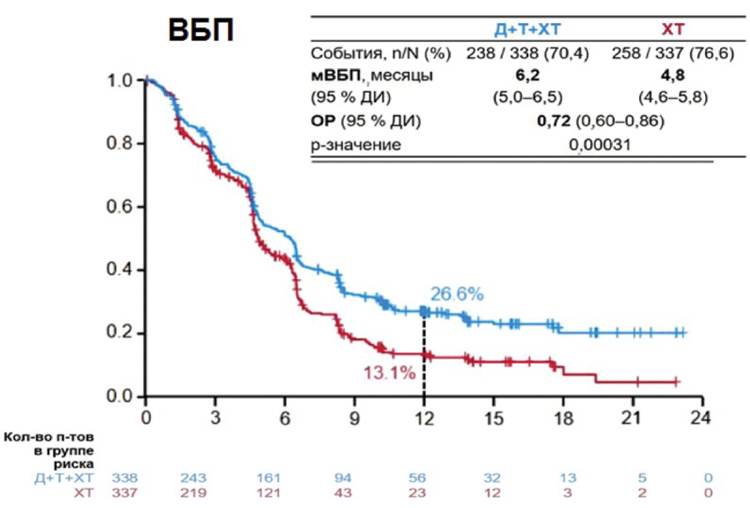
Показатели частоты отмены терапии дурвалумабом вследствие НЯ (16,7%) и прогрессирования заболевания (26,9%) соответствовали таковым в исследовании PACIFIC (15,4% и 31,3% соответственно). События типа пневмонита/ИБЛ были контролируемыми и в основном имели среднюю степень тяжести, что согласуется с исследованием PACIFIC. На конгрессе ЕSМО 2021 также были представлены результаты 3-летнего наблюдения в исследовании CASPIAN по лечению мелкоклеточного рака легкого. Согласно ранее опубликованным результатам, применение дурвалумаба в сочетании с ХТ в первой линии лечения распространенного МРЛ привело к достоверному увеличению ОВ, по сравнению с только ХТ (ОР=0,75; 95% ДИ 0,62-0,91; номинальное значение р=0,0032), при медиане наблюдения более двух лет преимущество в ОВ в группе дурвалумаб + EP сохранялось, в группе дурвалумаб + тремелимумаб + EP первичная конечная точка (ОВ) не была достигнута. Впервые опубликованы результаты 3-летнего наблюдения за популяцией пациентов, получающих ИТ+ХТ в первой линии лечения рМРЛ. При медиане наблюдения более 3 лет комбинация дурвалумаба с ХТ продолжает демонстрировать убедительное преимущество над стандартной схемой ХТ в первой линии рМРЛ: • достоверное снижение риска смерти на 29%, ОР=0,71 (95% ДИ 0,60-0,86), номинальное значение p=0,0003; • в 3 раза больше пациентов были живы в группе дурвалумаб + EP по сравнению с EP (17,6% и 5,8%); • преимущество комбинации дурвалумаба с ХТ в отношении ОВ по-прежнему отмечалось у всех пациентов с рМРЛ независимо от исходных демографических характеристик, распространенности опухолевого процесса и применяемого препарата платины; • не отмечено существенных различий между группами дурвалумаб + EP и EP по частоте серьезных НЯ (32,5% и 36,5% соответственно), частоте НЯ (с любой причинно-следственной связью), приведших к смерти (5,3% и 6,0% соответственно), а также частоте НЯ (связанных с терапией), приведших к смерти (2,3% и 0,8% соответственно).
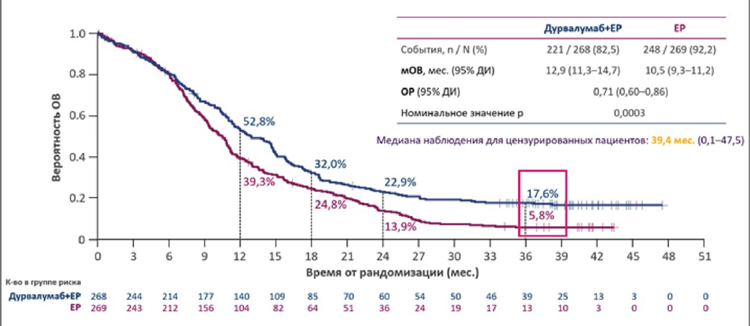
В рамках эксплоративного, не запланированного протоколом анализа оценили взаимосвязь между HLA I/II генотипом и ответом на терапию в исследовании CASPIAN.
В CASPIAN часть пациентов
предоставила образцы крови, полученные до введения первой дозы
терапии, для генетических исследований. Образцы использованы
для проведения HLA типирования.
Проанализированы 6 аллелей HLA I
класса и 6 аллелей HLA II класса.
Наличие аллеля HLADQB1*03:01 было ассоциировано с
увеличением ОВ в группе Д+Т+EP,
но не в других группах. HLADQB1*03:01-позитивные (n=58)
в сравнении с HLA-DQB1*03:01-
негативными (n=84): ОР 0,59 (95%
ДИ 0,39-0,88). Вероятно, это связано
с ролью HLA-DQB1*03:01 в иммунном ответе, ведь HLA II класса презентируют опухолевые неоантигены
CD4+ Т-лимфоцитам, активность
которых, в свою очередь, подавляется при гиперэкспрессии CTLA-4. Ингибирование CTLA-4 может усиливать противоопухолевый иммунный ответ на фоне блокады PD-L1.
Без сомнения, требуется дальнейшее
изучение DQB1*03:01 и его роли в
опухолевом микроокружении.
RUSSCO ПРОВЕЛО ЭКЗАМЕН ESMO В МОСКВЕ
Знаменательное событие в сфере онкологии состоялось 18 сентября 2021 г. в Москве: впервые одной из площадок проведения для российских врачей Экзамена Европейского общества медицинской онкологии (ESMO)
стала наша столица. Кроме Москвы экзамен проводился одновременно в Париже, Мадриде, Багдаде, Каире и
других городах мира – всего в 15 странах.
Данное мероприятие – результат плодотворного сотрудничества ESMO с Российским обществом клинической онкологии (RUSSCO), которому и было поручено принимать экзамены у молодых специалистов – членов
ESMO, которых собралось около 50 человек. География оказалась весьма обширной: буквально от Владивостока до Стамбула, поскольку экзаменуемые представляли не только различные города нашей страны, но и
зарубежные государства.
Следует отметить, что в некоторых странах, например, в Словении и Швейцарии, такой экзамен уже стал
обязательной письменной частью для получения сертификата медицинского онколога. В остальных странах
Экзамен ESMO подтверждает отличные знания в области медицинской онкологии по критериям Европейского общества медицинской онкологии.

Сам экзамен представлял собой 100 тестовых заданий на английском языке, на которые необходимо было
ответить в течение 150 минут. Вопросы касались в основном диагностики и лекарственного лечения злокачественных новообразований, а около 10% из них были посвящены онкогематологии.
Немаловажно и то, что для части молодых иногородних онкологов была предусмотрена возможность получения гранта, который позволил покрыть затраты, связанные с поездкой и проживанием в Москве. Это стало
возможным благодаря спонсорской поддержке российской фармацевтической компании «Биокад».
Экзамен ESMO позволил молодым специалистам использовать уникальную возможность попробовать свои
силы в отношении знаний медицинской онкологии.
Итоговый экзаменационный анализ будет проводится на базе Бернского университета (Швейцария). Все
участники, успешно сдавшие экзамен, будут аттестованы и получат соответствующий сертификат на пятилетний период своей деятельности.
УГОЛОК РАДИОТЕРАПЕВТА
Автор: Деньгина Наталья Владимировна
К.м.н., заведующая радиологическим отделением ГУЗ ОКОД, директор Центра лучевой терапии «ЭрСпей», Ульяновск
Паллиативная лучевая терапия после стентирования у больных распространенным раком пищевода
Продолжительность жизни больных с распространенным раком пищевода очень невелика – 6-8 месяцев, и у подавляющего большинства пациентов имеется дисфагия вплоть до полной непроходимости пищи. Постановка саморасправляющегося стента – типичное паллиативное вмешательство для таких больных, однако дальнейший рост опухоли продолжает ухудшать проявления дисфагии. Исследователи из нескольких центров Великобритании постарались определить, насколько эффективно паллиативное облучение в плане сдерживания нарастающей дисфагии у больных с установленным стентом [1]. В проспективное рандомизированное исследование 3 фазы было включено 220 некурабельных больных раком пищевода со стентом, для ITT анализа – 199 из них (102 – в группе наблюдения после постановки стента, 97 – в группе ЛТ). Облучение проводилось в 2 режимах: 20 Гр за 5 фракций или 30 Гр за 10 фракций. Первичной конечной точкой было выбрано усугубление дисфагии более чем на 11 пунктов по опроснику QLQ-OG25 или смертность за 12 недель. Увы, паллиативная лучевая терапия не повлияла на дальнейшее усугубление дисфагии: оно отмечено у 36 (49%) пациентов группы поддерживающего лечения и у 34 (45%) из группы ЛТ (OR 0,82; 95% CI 0,40- 1,68; p=0,59). Не было разницы и в показателях выживаемости: медиана ОВ составила 19,7 недель в группе поддерживающего лечения против 18,9 недель в группе облучения (р=0,70). Однако средний промежуток времени до кровотечения или госпитализации в связи с кровотечением оказался больше у облученных пациентов: 65,9 недель против 49,0 недель (р=0,038). Наиболее частым осложнением 3-4 степени оказалась слабость, встречавшаяся чаще после облучения (23% против 19%). В целом авторы сделали вывод, что проведение лучевой терапии в этой сложной категории больных с инкурабельным раком пищевода после стентирования нецелесообразно, за исключением, возможно, только тех, у кого имеется повышенный риск кровотечения из опухоли.
Дурвалумаб в комбинации с SBRT в качестве неоадъюванта при раннем НМРЛ
Ряд исследований 2 фазы по применению анти-PD-1 и антиPD-L1 иммунопрепаратов в качестве монотерапии в неоадъюванте при раннем НМРЛ продемонстрировали частоту близких к полным патоморфологических ответов в диапазоне 15-45%. Американские исследователи из одного из центров Нью-Йорка предположили, что добавление SBRT позволит увеличить частоту ответов за счет активации противоопухолевого иммунного ответа [2]. В исследование 2 фазы было включено 60 пациентов с ранним НМРЛ I-IIIA стадий, которые на неоадъювантном этапе получали либо только дурвалумаб в монорежиме (30 больных), либо комбинацию дурвалумаба с SBRT на первичную опухоль (30 больных). Препарат вводился дважды 1 раз в 3 недели, в группе ЛТ – сразу после облучения в дозе 24 Гр за 3 фракции. Пациенты без системного прогрессирования шли на оперативное лечение. Первичной конечной точкой являлся патоморфологический ответ в первичной опухоли, близкий к полному. В каждой группе по 26 (87%) больных было прооперировано. При этом почти полный ответ был достигнут у 2 больных из группы монотерапии (6,7%) и у 16 (53,3%) – из группы комбинации, из них у половины – полный патоморфологический регресс. При этом толерантность лечения была вполне удовлетворительной, обошлось без токсичности 5 степени, хотя избежать клинически выраженных осложнений не удалось (частота их была примерно одинакова – 17% в группе монотерапии и 20% в группе комбинации). Авторы пришли к мнению, что подобный неоадъювантный подход имеет право на существование, необходимо продолжать исследование. Тем не менее, сомнения в его целесообразности остаются. Учитывая появление новых данных о высокой эффективности SBRT у больных ранним НМРЛ в сравнении с хирургическим лечением (Chang JY et al, Lancet Oncol 2021), не рациональнее ли глубже изучить эффективность консервативного подхода (SBRT с иммунотерапией), чем вновь возвращаться к проблеме трехмодального лечения раннего НМРЛ с весьма сомнительными преимуществами?
НМРЛ: ХЛТ и дурвалумаб у пациентов с мутацией KEAP1-NFE2L2
Консолидирующая иммунотерапия после радикального химиолучевого лечения нерезектабельного НМРЛ III стадии стала стандартом, позволив значительно улучшить показатели ВБП и ОВ, это продемонстрировали результаты исследования PACIFIC в 2017 году, и на протяжении 5 лет тенденция сохраняется. Дополнительные анализы исследования показали, что от иммунотерапии дурвалумабом выигрывали различные подгруппы пациентов, в том числе и те, кто изначально имел низкую экспрессию PD-L1 (менее 1%) – это одно из проявлений синергизма лучевой/химиолучевой терапии и иммунотерапии. Еще одно достижение подобной комбинации продемонстрировали американские исследователи из Memorial Sloan Kettering Cancer Center [3]. Известно, что примерно четверть больных НМРЛ имеют мутации генов KEAP1-NFE2L2, и ранее было показано, что они являются причиной высокой радиорезистентности опухолей и ранних локорегионарных рецидивов более чем у половины пациентов, прошедших ХЛТ. Shaverdian et al. в ретроспективном исследовании поставили задачу оценить, насколько эффективен дурвалумаб в этой когорте больных и способен ли он нивелировать различия в частоте локорегионарных рецидивов. Сто двадцать больных местнораспространенным НМРЛ III стадии были распределены в группы только одновременной ХЛТ (54 пациента) и ХЛТ с последующей иммунотерапией (66 больных). Частота локорегионарных рецидивов за 12 месяцев оказалась более чем в 2 раза ниже с дурвалумабом (18% против 39%, p=0,002), как и ожидалось (рис.1).
Рисунок 1.
. Частота ЛРР после ХЛТ и ХЛТ + дурвалумаб.
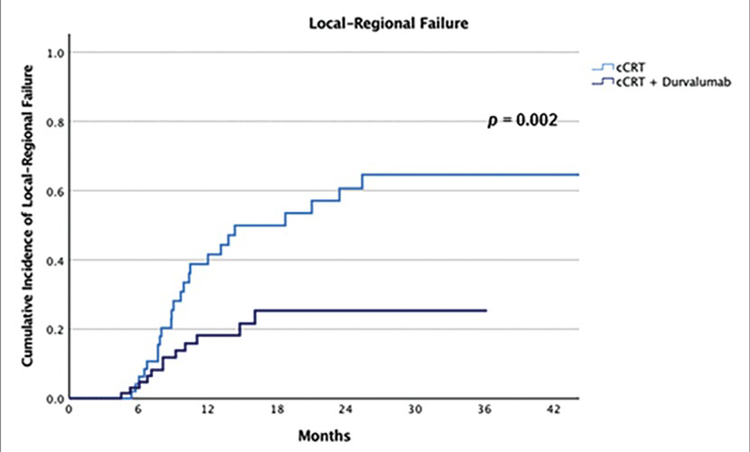
KEAP1- NFE2L2-мутация явилась предиктором ЛРР (HR 3,9; 95% CI 1,6-9,8; p=0,003), но при этом добавление дурвалумаба действительно ликвидировало различия в частоте ЛРР между мутантными и немутантными опухолями (p=0,541), и мутация KEAP1-NFE2L2 переставала быть предиктивным фактором для этой сложной категории больных (рис.2,3).
Рисунок 2.
Частота ЛРР после ХЛТ у пациентов с KEAP1-
NFE2L2 мутацией.
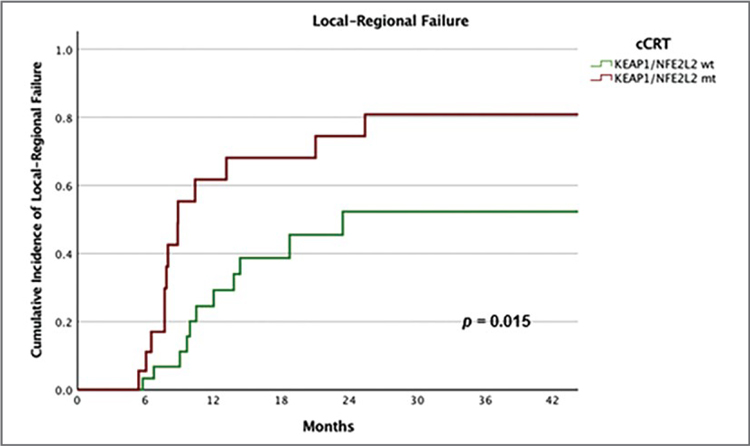
Рисунок 3.
Частота ЛРР после ХЛТ+дурвалумаб у пациентов
с KEAP1-NFE2L2 мутацией.
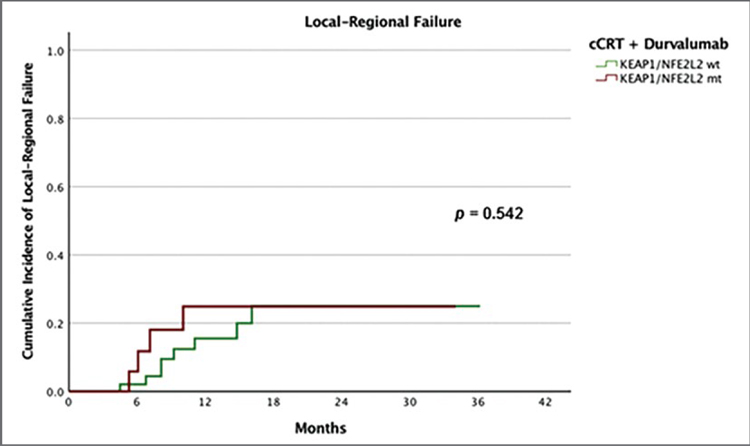
При этом у больных с выявленной мутацией дурвалумаб значительно снижал частоту ЛРР по сравнению с группой больных, получивших только ХЛТ: 25% рецидивов за 12 месяцев против 60% (p=0,021). Без сомнения, это еще одна победа в копилке консолидирующей иммунотерапии.
Неоадъювантная ХТ+ХЛТ при местнораспространенном раке прямой кишки
Подход TNT – тотального неоадъювантного лечения – при местнораспространенном раке прямой кишки набирает обороты. Результаты недавнего французского исследования UNICANCER-PRODIGE 23 [4] еще раз подтверждают это. Мультицентрическое рандомизированное исследование 3 фазы проводилось с 2012 по 2017 годы в 35 центрах Франции, общее число пациентов – 461 с cT3 или cT4 M0, рандомизированных на две группы: группа TNT (FOLFIRINOX до 6 курсов, затем ХЛТ (50 Гр на фоне капецитабина), операция и 3 курса адъювантной ХТ по схеме FOLFOX6) и группа стандартного лечения (ХЛТ, операция + 6 месяцев адъювантной ХТ). Первичная конечная точка – выживаемость без прогрессирования за 3 года, оцененная в популяции ITT. Средний период наблюдения составил 46,7 месяца, и показатели ВБП оказались достоверно лучше в группе TNT: 76% против 69% (HR 0,69; 95% CI 0,49- 0,97; p=0,034). На неоадъювантном этапе частота и выраженность осложнений практически не различались. Осложнения 3-4 степени в адъюванте встречались в 2-2,5 раза чаще у пациентов группы стандартного лечения. Трое пациентов погибло в процессе лечения: 1 – в экспериментальной группе и 2 – в стандартной. Результаты исследования подтверждают, что подобный подход (тотальное неоадъювантное лечение) в ближайшее время изменит стандартную практику лечения местнораспространенного рака прямой кишки по причине более высокой эффективности и лучшей переносимости.
Литература:
1. Adamson D, Byrne A, Porter C, et al. Palliative radiotherapy after oesophageal cancer stenting (ROCS): a multicentre, open-label, phase III randomized controlled trial. Lancet Gastroenterol Hepatol. 2021 Apr; 6(4): 292-303.
2. Altorki NK, McGraw TE, Borczuk AC, et al. Neoadjuvant durvalumab with or without stereotactic body radiotherapy in patients with earlystage non-small-cell lung cancer: a single-centre, randomised phase 2 trial. Lancet Oncol. 2021 Jun; 22(6): 824-835.
3. Shaverdian N, Offin M, Shepherd AM, et al. The Impact of Durvalumab on Local-Regional Control in Stage III NSCLCs Treated with Chemoradiation and on KEAP1-NFE2L2-Mutant Tumors. Journal of Thoracic Oncology. 2021; 16(8): 1392-1402.
4. Conroy T, Bosset JF, Etienne PL,
et al. Neoadjuvant chemotherapy
with FOLFIRINOX and preoperative
chemoradiotherapy for patients
with locally advanced rectal cancer
(UNICANCER-PRODIGE 23): a
multicentre, randomised, open-label,
phase III trial. Lancet Oncol. 2021 May;
22(5): 702-715.
ESMO 2021: ОПУХОЛИ ЖКТ
Авторы: Семиглазова Татьяна Юрьевна
ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России,
ГБОУ ВО «СЗГМУ им. И.И. Мечникова» Минздрава России, Санкт-Петербург Шарашенидзе Софико Мамуковна
ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, Санкт-Петербург
С 16 по 21 сентября 2021 г. состоялся конгресс Европейского общества
медицинской онкологии (European
Society of Medical Oncology, ESMO) в
онлайн-режиме. На ежегодном конгрессе ESMO были представлены
более 1200 докладов, из которых более 380 посвящены лечению опухолей желудочно-кишечного тракта. В
данном обзоре приведены наиболее
значимые результаты исследований,
доложенных на заседаниях конгресса,
которые касались вопросов противоопухолевой лекарственной терапии
злокачественных новообразований
желудочно-кишечного тракта.
Рак пищевода и пищеводножелудочного перехода,
рак желудка
Janjigian Y.Y. и соавт. представили
обновленные результаты рандомизированного исследования III фазы
CheckMate-649 по изучению эффективности лекарственной терапии на
основе ниволумаба у больных распространенным раком желудка и
пищеводно-желудочного перехода,
аденокарциномой пищевода в 1-й
линии терапии [1]. Согласно ранее
полученным данным исследования
(апрель 2021 г.), комбинация ниволумаб + ХТ при метастатическом раке
желудка и пищеводно-желудочного
перехода и аденокарциноме пищевода была одобрена FDA. В исследовании были проанализированы сведения о ранее не леченных больных с
распространенным раком желудка и
пищеводно-желудочного перехода и
аденокарциномой пищевода без экспрессии HER2. Пациенты (n=2031)
были рандомизированы в соотношении 1:1:1 на 3 группы:
• группа ниволумаба (360 мг каждые
3 недели или 240 мг каждые 2 недели) в комбинации с химиотерапией (XELOX каждые 3 недели или
FOLFOX каждые 2 недели);
• группа ниволумаб 1 мг/кг + ипилимумаб 3 мг/кг (4 введения, далее
ниволумаб 240 мг каждые 2 недели);
• группа химиотерапии.
К первичным конечным оценочным
точкам относились общая выживаемость (ОВ) и выживаемость без
прогрессирования (ВБП) для группы
ниволумаб + ХТ против ХТ у пациентов с PD-L1 CPS ≥5. Вторичными
конечными точками являлись ОВ в
группе больных, получавших ниволумаб + ХТ против ХТ (вначале при
PD-L1 CPS ≥1, далее в общей группе
больных) и ОВ в группе ниволумаб +
ипилимумаб против ХТ (вначале при
PD-L1 CP ≥5, далее в общей группе
больных).
Клинически значимое преимущество
ОВ было отмечено только у больных
с PD-L1 CPS ≥5 в группе ниволумаба
+ХТ: медиана ОВ составила 14,4 мес
(13,1-16,2 мес.) против 11,1 мес. (10,0-
12,1 мес.) в группе ХТ; ОР=0,70 (95%
ДИ 0,61-0,81). В группе пациентов с
PD-L1 CPS ≥5 добавление ниволумаба
к химиотерапии снизило риск смерти
на 30% и увеличило 2-годичную ОВ
на 12%, тогда как в общей группе снизило риск смерти на 21%, увеличив
2-годичную ОВ на 9% (рис.1).
Преимущество ВБП также сохранялось при применении комбинации
Рисунок 1.
Исследование CheckMate-649: ниволумаб + ХТ
в 1-й линии терапии больных распространенным раком
желудка, пищеводно-желудочного перехода
и аденокарциномой пищевода [1].
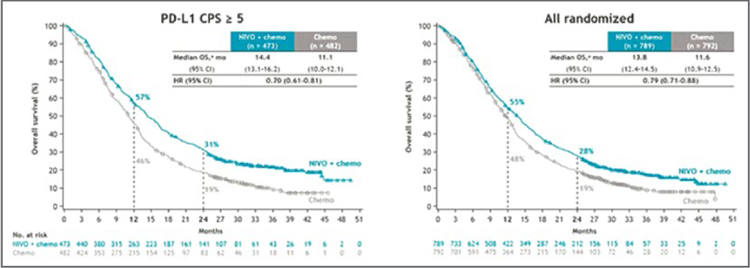
ниволумаб + ХТ против ХТ, как в группе больных с PD-L1 CPS ≥5, так и в общей группе больных. Сообщалось о 5 новых случаях полного регресса опухоли у пациентов с PD-L1 CPS≥5 на фоне терапии ниволумабом + ХТ. При применении комбинации ниволумаба и ипилимумаба в группе больных с PD-L1 CPS ≥5 вторичная конечная точка (ОВ) не была достигнута: медиана ОВ составила 11,2 мес. (9,2- 13,4 мес.) в группе ниволумаб + ипилимумаб против 11,6 мес. (10,1-12,7 мес.) в группе ХТ; ОР=0,89 (96,5% ДИ 0,71-1,10), р=0,2302. Проведение исследования в группе комбинированной иммунотерапии было приостановлено по причине частого развития серьезных нежелательных явлений и случаев летальных исходов. Также не было отмечено преимущества в ВБП. Однако при анализе базы данных увеличение медианы ОВ и частоты объективных ответов на фоне комбинированной иммунотерапии наблюдалось в подгруппе больных с микросателлитной нестабильностью (n=21). В схожем исследовании CheckMate648, которое было представлено ранее в ходе конгресса ASCO 2021, было отмечено значительное увеличение ОВ при применении комбинации ниволумаб + ипилимумаб у больных только плоскоклеточным раком пищевода с PD-L1 ≥1%. Вероятно, существует несколько причин различий результатов этих двух исследований:
• во 2-й линии исследования CheckMate-649 по причине «crossover-эффекта» в группе ниволумаб + ипилимумаб 47% пациентов получали ХТ и только 9-12% пациентов в группе ХТ получали иммунотерапию;
• другой важной причиной различий могло стать применение разных реагентов для тестирования PD-L1 статуса: в исследовании CheckMate-649 оценка PD-L1 выполнялось при помощи теста 28-8 pharmDx c более высокой чувствительностью и, как следствие, большей вероятностью получения ложноположительных результатов;
• в-третьих, использование различных режимов ниволумаба и ипилимумаба в исследованиях могло повлиять на значительно более высокую частоту развития серьезных нежелательных явлений и летальных исходов в группе ниволумаб + ипилимумаб исследования CheckMate-649 (исследование в этой подгруппе группе было приостановлено).
В целом, данные исследования CheckMate-649 еще раз доказывают эффективность комбинации ниволумаб + ХТ в первой линии терапии распространенного рака желудка, пищеводно-желудочного перехода и аденокарциномы пищевода при PD-L1 CPS ≥5. Не вызывает сомнений и различная биология плоскоклеточного рака и аденокарциномы пищевода. Давно назрела необходимость проведения отдельных клинических исследований этих двух заболеваний по причине их разной чувствительности к системной терапии, включая и иммунотерапию.
Колоректальный рак
В ходе конгресса ESMO 2021 были доложены результаты двух исследований II фазы по изучению эффективности иммунотерапии у пациентов с профицитом белков системы репарации ДНК/микросателлитной стабильностью. Доказано, что ингибиторы иммунных контрольных точек обладают выраженным эффектом при микросателлитной нестабильности/ дефиците белков репарации (dMMR), однако остается неизученной роль иммунотерапии при микросателлитной стабильности и профиците белков системы репарации ДНК. Обсуждались несколько гипотез перевода «холодных» опухолей в «горячие», т.е. чувствительные к иммунотерапии. Так, в многоцентровом однорукавном исследовании MAYA (n=135) были проанализированы сведения о ранее предлеченных больных метастатическим колоректальным раком с микросателлитной стабильностью и инактивированным геном MGMT [2]. Метилгуанин-ДНК метилтрансфераза (MGMT) отвечает за репарацию повреждений ДНК при применении различных алкилирующих агентов. При инактивации гена MGMT (вследствие метилирования) опухоль становится более чувствительной к алкилирующим агентам. Исследователями предполагалось, что применение такого алкилирующего агента как темозоломид позволит превратить «холодную опухоль» (с микросателлитной стабильностью и инактивированным геном MGMT) в «горячую». Все вышеизложенное определило актуальность данного исследования, целью которого являлась оценка безопасности и эффективности 2 циклов монохимиотерапии темозоломидом, а также последующих 4 циклов комбинированной иммунотерапии по схеме ипилимумаб в дозе 1 мг/кг каждые 8 недель + ниволумаб в дозе 480 мг каждые 4 недели. Первичной конечной точкой являлась ВБП в течение 8 месяцев. Вторичными конечными точками были ОВ, частота объективных ответов и безопасность. Первичная конечная точка была достигнута. В исследовании были проанализированы сведения о 135 пациентах, из которых только 33 пациента приступили ко второму «иммунотерапевтическому» этапу лечения. Выживаемость без прогрессирования в течение 8 месяцев составила 32%, медиана ВБП – 7,1 мес. [95% ДИ 5,6- 8,4], медиана ОВ – 18,5 мес. [95% ДИ 14 – не достигнута] и частота объективного ответа – 39%. В другом проспективном исследовании ATEZOTRIBE были проанализированы сведения о больных метастатическим колоректальным раком вне зависимости от MMR статуса [3]. В роли «спички» в данном исследовании II фазы выступала комбинация цитостатиков FOLFOXIRI и бевацизумаба, которая должна была «зажечь» чувствительность к иммунотерапии, увеличив экспозицию неоантигенов и иммунную инфильтрацию микроокружения опухоли. Пациенты были рандомизированы в соотношении 1:2 на две группы: FOLFOXIRI + бевацизумаб (группа А) против FOLFOXIRI + бевацизумаб + атезолизумаб (группа В) с дальнейшим проведением до прогрессирования соответственно поддерживающей терапии 5-ФУ + лейковорин + бевацизумаб против 5-ФУ + лейковорин + бевацизумаб + атезолизумаб. Первичной конечной точкой являлась ВБП. Основными характеристиками пациентов были (группа А/В): правосторонняя локализация опухоли (44%/44%), синхронные метастазы (89%/86%), метастатическое поражение только печени (22%/22%), наличие мутации в гене RAS (71%/73%), наличие мутации в гене BRAF (14%/8%) и дефицит репарации dMMR (7%/6%).
Рисунок 2.
Исследование MAYA: темозоломид + ниволумаб
+ ипилимумаб у больных предлеченным метастатическим
колоректальным раком с микросателлитной стабильностью
и инактивированным геном MGMT [2]..
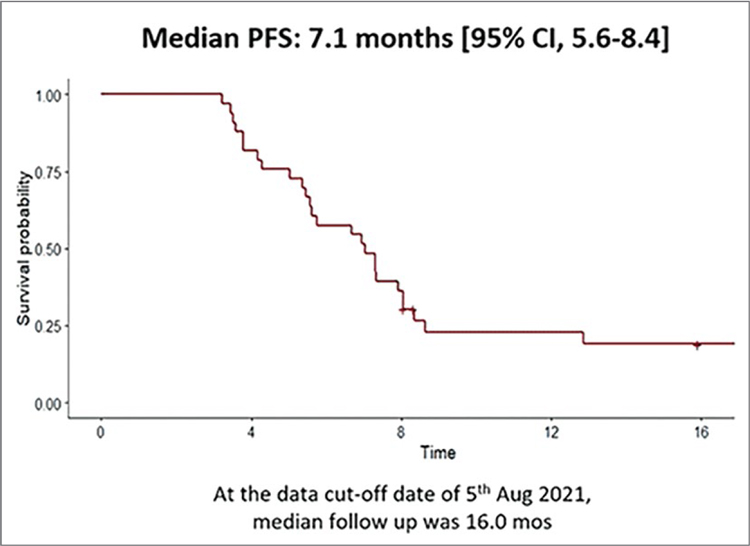
Рисунок 3.
Исследование ATEZOTRIBE (II фаза): FOLFOXIRI +
бевацизумаб против FOLFOXIRI + бевацизумаб + атезолизумаб у больных метастатическим колоректальным раком вне
зависимости от MMR статуса [3].
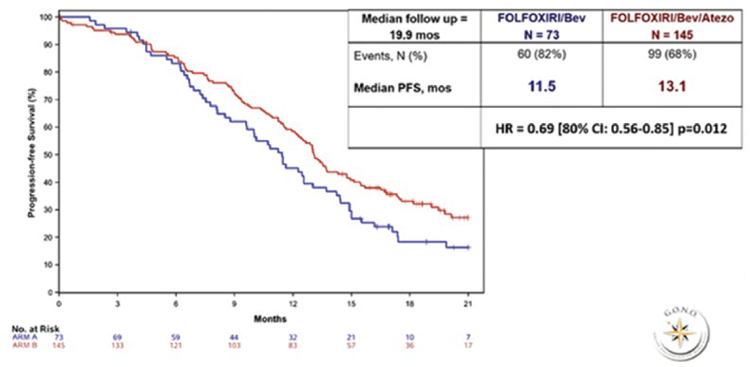
При медиане наблюдения 19,9 мес. (рис.3) было отмечено значимое увеличение ВБП при добавлении атезолизумаба – 13,1 мес. против 11,5 мес. (ОР=0,69; 80% ДИ 0,56-0,85; р=0,012), однако отсутствовал выигрыш в частоте объективных ответов (59% против 64%, p=0.412). Численное преимущество ВБП при назначении атезолизумаба было отмечено в группе больных с профицитом белков репарации ДНК (pMMR) – 12,9 мес. против 11,4 мес. (ОР=0,78; 80% ДИ 0,62- 0,97; р=0,071).
Гепатоцеллюлярный рак
Vogel A. и соавт. представили результаты исследования II фазы IMMUTACE по изучению эффективности комбинированного метода лечения больных гепатоцеллюлярным раком промежуточной стадии, включающего проведение трансартериальной химиоэмболизации (ТАХЭ) и иммунотерапии ниволумабом [4]. Пациентам выполнялась ТАХЭ, далее проводилась терапия ниволумабом в дозе 240 мг 1 раз в 2 недели до прогрессирования заболевания (максимальная длительность терапии составляла 2 года). Первичной конечной точкой являлась частота объективных ответов, вторичными конечными точками – ВБП, ОВ, время до отмены лечения и безопасность. Частота объективных ответов составила 71% (рис.4), медиана ВБП – 6,14 мес., медиана ОВ – 28,3 мес. (предварительные данные). Побочные эффекты ≥3 степени наблюдались у 34,7% пациентов. Таким образом, исследование достигло первичных конечных точек, доказав эффективность комбинированного метода лечения, включающего ТАХЭ и иммунотерапию ниволумабом, у больных гепатоцеллюлярным раком промежуточной стадии.
Рисунок 4.
Исследование IMMUTACE: комбинация трансартериальной химиоэмболизации и иммунотерапии ниволумабом в дозе 240 мг 1 раз в 2 недели до прогрессирования
заболевания (максимальная длительность терапии составила 2 года) у больных гепатоцеллюлярным раком промежуточной стадии [4].
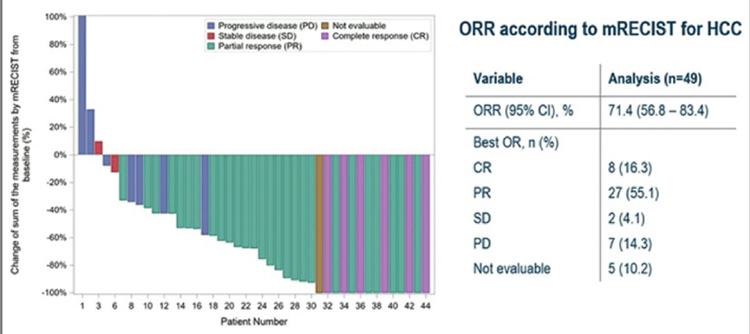
Рисунок 5.
Исследование PRODIGE: mFOLFIRINOX против
гемцитабина в адъювантном режиме у больных раком поджелудочной железы [5].
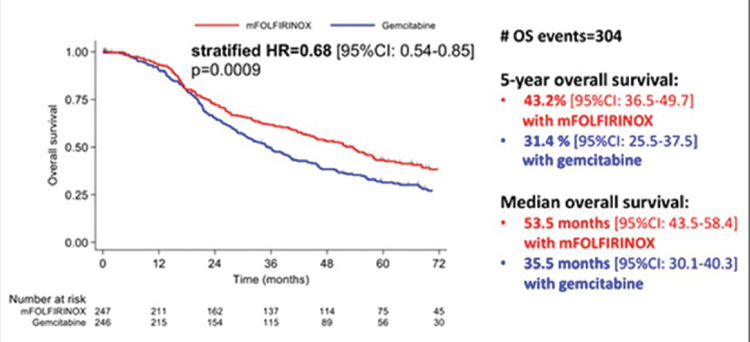
Рак поджелудочной железы
Conroy T. с соавторами [5] представили 5-летние результаты исследования PRODIGE, оценивающего эффективность адъювантных режимов mFOLFIRINOX против гемцитабина у больных операбельным раком поджелудочной железы (n=493). При медиане наблюдения 69,7 мес. 5-летняя БРВ в группе mFOLFIRINOX составила 26,1% (95% ДИ 20,5-32,1) против 19,0% (95% ДИ 14,3-24,3) в группе гемцитабина; ОР=0,66 (95% ДИ 0,54-0,82), p=0,0001. Медиана ОВ (рис.5) составила 53,5 мес. (95% ДИ 43,5-58,4) против 35,5 мес. (95% ДИ 30,1-40,3) соответственно; ОР=0,68 (95% ДИ 0,54-0,85), p=0,0009. Пятилетняя ОВ составила 43,2% (95% ДИ 36,5-49,7) в группе mFOLFIRINOX против 31,4% (95% ДИ 25,5-37,5) в группе гемцитабина. Важно, что существенными прогностическими факторами, влияющими на ОВ, помимо режима адъювантной терапии, являлись частота выполняемых операций по поводу рака поджелудочной железы в клиническом центре, степень дифференцировки опухоли и стадия заболевания. Таким образом, 5-летние результаты исследования PRODIGE безапелляционно подтвердили преимущество назначения адъювантного режима mFOLFIRINOX по сравнению с гемцитабином у больных операбельным раком поджелудочной железы.
Источники:
1. Janjigian Y, et al. LBA7 Nivolumab (NIVO) plus chemotherapy (Chemo) or ipilimumab (IPI) vs chemo as firstline (1L) treatment for advanced gastric cancer/gastroesophageal junction cancer/ esophageal adenocarcinoma (GC/ GEJC/EAC): CheckMate 649 study. Annals of Oncology. 2021; 32 (suppl_5): S1283-S1346.
2. Pietrantonio F, et al. 383O MAYA trial: Temozolomide (TMZ) priming followed by combination with low-dose ipilimumab and nivolumab in patients with microsatellite stable (MSS), MGMT silenced metastatic colorectal cancer (mCRC).
3. Cremolini C, et al. LBA20 FOLFOXIRI plus bevacizumab (bev) plus atezolizumab (atezo) versus FOLFOXIRI plus bev as firstline treatment of unresectable metastatic colorectal cancer (mCRC) patients: Results of the phase II randomized AtezoTRIBE study by GONO.
4. Vogel A, et al. LBA37 IMMUTACE: A biomarker-orientated, multi center phase II AIO study of transarterial chemoembolization (TACE) in combination with nivolumab performed for intermediate stage hepatocellular carcinoma (HCC).
5. Conroy T, et al. LBA57 Unicancer
PRODIGE 24/CCTG PA6 trial:
Updated results of a multicenter
international randomized phase III trial
of adjuvant mFOLFIRINOX (mFFX)
versus gemcitabine (gem) in patients
(pts) with resected pancreatic ductal
adenocarcinomas (PDAC).

РЕЗОЛЮЦИЯ ПРОВЕДЕННОГО ОНКОФОРУМА «ВОЗМОЖНОСТИ ПОДДЕРЖИВАЮЩЕЙ ТЕРАПИИ В СОЛИДНОЙ ОНКОЛОГИИ: ВЗГЛЯД НА НЕЙТРОПЕНИЮ»
19-23 ФЕВРАЛЯ 2021 г
Кононенко И.Б., Авраменко И.В., Бабина К.Г., Гармарник Т.В., Лазаревич О.В., Леонов О.В.,
Мищенко А.А., Новикова О.Ю., Рыков И.В., Строкова М.А., Файрушина А.Н.
Нейтропения, индуцированная химиотерапией, относится к наиболее частому нежелательному явлению и в ряде случаев может быть причиной фебрильной нейтропении (ФН). Примерно у 80% больных ФН является причиной тяжелой инфекции. По данным Национального ракового регистра США, частота ФН составляет 19,4 случаев на 1000 пациентов в год в онкологии солидных опухолей и 43,3 случаев на 1000 пациентов в год - в онкогематологии. Данные рандомизированных клинических исследований (РКИ) и клинической практики свидетельствуют о более высокой частоте развития ФН - до 117 случаев на 1000 пациентов [1,2]. Ключевая проблема состоит в том, что оценить актуальную статистику ФН в реальной клинической практике крайне трудно. Онкологи не всегда могут идентифицировать это нежелательное событие. По мнению участников форума, это осложнение часто случается на дому, особенно в случаях, когда пациент проживает в отдаленном от онкологической службы районе, и возникает, по некоторым данным, у 15-20% пациентов. Это именно те случаи, когда удается зафиксировать нежелательное явление. Но если учитывать, что к концу 2019 года на диспансерном учете в РФ состояло 3 928 338 пациентов, а частота ФН составила 15 - 20%, то в пересчете на абсолютные цифры - это 589 251–785 668 человек [3]. Онкологи отметили, что чаще всего, они узнают уже о факте госпитализации по причине развития ФН и, к сожалению, участковые терапевты не всегда имеют возможность и достаточный опыт оказания незамедлительной помощи. В таких случаях задержка с госпитализацией и назначением адекватной антибактериальной терапии может привести к летальному исходу (10-30% пациентов, по оценкам участников форума). Международные и российские клинические рекомендации предусматривают применение рекомбинантного человеческого гранулоцитарного колониестимулирующего гранулоцитов (рчГ-КСФ) с целью профилактики ФН.
Участники форума отметили, что необходимо соблюдать приверженность клиническим рекомендациям и назначать первичную профилактику ФН при проведении:
• химиотерапии с риском ФН >20% или с риском ФН 10-20% или менее 10%, но с наличиеминдивидуальных факторов риска;
• дозоуплотненных режимов неоадъювантной или адъювантной химиотерапии [4,5].
Известно, что нейтропения 3-4 степени тяжести является причиной удлинения интервала между циклами химиотерапии и в ряде случаев приводит к редукции дозы цитостатиков [6]. В ретроспективном анализе данных 2015 года с участием 16233 пациентов, получавших 20 различных режимов неоадъювантной и/или адъювантной химиотерапии по 6 нозологическим группам, была проведена оценка зарегистрированных случаев удлинения интервалов между циклами, редукции доз препаратов и снижения относительной дозоинтенсивности (ОДИ) лечения. Частота случаев составила более 15%, а ОДИ лечения <85% наблюдалась у 19-45%, 67%, 79-82% пациентов с РМЖ, раком яичников (РЯ) и немелкоклеточным раком легкого (НМРЛ), соответственно. Снижение ОДИ чаще регистрировали у пожилых пациентов, с повышенным индексом массы тела и у больных с ограниченной повседневной активностью [7]. Принимая во внимание то, что нейтропения 3-4 степени тяжести является дополнительным фактором иммуносупрессии (и может увеличить риск вторичной инфекции), причиной снижения дозоинтенсивности режимов химиотерапии, направленных на излечение или достижение прогнозируемого хорошего эффекта, а также может негативно повлиять на непосредственные и отдаленные результаты лечения, участники форума обсудили группы пациентов и клинические ситуации, когда целесообразно рассматривать первичную профилактику препаратами рчГ-КСФ:
• нео-/адъювантная химиотерапия раннего рака молочной железы;
• адъювантная химиотерапия рака яичников;
• химиотерапия ВПЧассоциированного рака шейки матки, при котором исходно существует высокий риск миелосупрессии по причине репликации вируса в миелоидных клетках-предшественниках, нарушения костномозгового микроокружения, гипоксии костного мозга и снижении активности колониестимулирующих факторов [8,9];
• химиотерапия мелкоклеточного рака легкого и сарком по причине высокой гематологической токсичности применяемых режимов и ограниченности лекарственных опций;
• химиотерапия у пожилых пациентов, особенно с наличием сопутствующей патологии;
• состояние после химиолучевой или лучевой терапии из-за сниженного ресурса костного мозга, что часто сопровождается не только тяжелой нейтропенией, но и панцитопенией;
• паллиативная химиотерапия, проводимая с целью достижения быстрого симптоматического и/или клинического эффекта (герминогенные опухоли, саркомы, лимфопролиферативные заболевания, висцеральный «криз», потенциально резектабельные метастазы при опухолях желудочно-кишечного тракта и другие) [10-12].
В ходе форума были обсуждены причины низкой приверженности клиническим рекомендациям по профилактике ФН. Отсутствие препарата и/или условий для ежедневного введения Г-КСФ – наиболее частые причины. Оптимальным решением является применение пролонгированных форм Г-КСФ (однократно на цикл), которые демонстрируют более высокую эффективность и комфортную форму введения. Такой режим введения препаратов Г-КСФ надежно защищает пациента от развития неблагоприятных события, связанных с ФН при 2-х или 3-х недельных режимах химиотерапии. Практически все участники форума отметили, что при возможности выбора препаратов для профилактики нейтропении, особенно в случаях прогнозируемого эффекта или продолжительного противоопухолевого лечения, они бы предпочли пролонгированную форму введения, т.е. применение пегилированных Г-КСФ. Дополнительным решающим фактором является отсутствие необходимости контроля общего анализа крови в интервале между циклами. По мнению онкологов, в рутинной клинической практике по-прежнему остается высокая потребность в расширении доступности к этой форме препаратов.
Подводя итоги форума, доктора высказали пожелания:
1. Строгое соблюдение клинических рекомендаций по первичной профилактике ФН;
2. Индивидуализировать первичную профилактику у пациентов с риском нейтропении 3-4 ст. с учетом прогноза заболевания;
3. Повысить доступность и показания к применению пролонгированной формы препаратов класса Г-КСФ в рутинной клинической практике;
4. Предоставлять пациентам четкие рекомендации и алгоритм действий в интервалах между циклами химиотерапии.
Литература:
1.Aapro M, Boccia R, Leonard R,
Camps C, Campone M, Choquet
S, Danova M, Glaspy J, Hus I,
Link H, Sliwa T, Tesch H, Valero V.
Refining the role of pegfilgrastim (a
long-acting G-CSF) for prevention
of chemotherapy-induced febrile
neutropenia: consensus guidance
recommendations. Support Care
Cancer. 2017 Nov;25(11):3295-3304.
doi: 10.1007/s00520-017-3842-1.
Epub 2017 Aug 25. PMID: 28842778;
PMCID: PMC5610660
2.Schelenz S, Giles D, Abdallah
S. Epidemiology, management
and economic impact of febrile
neutropenia in oncology patients
receiving routine care at a regional
UK cancer centre. Ann Oncol. 2012
Jul;23(7):1889-93. doi: 10.1093/
annonc/mdr520. Epub 2011 Nov 2.
PMID: 22048152.
3. Каприн А. Д., Старинский В. В.,
Петрова Г. В. Состояние онкологической помощи населению России в 2019 году. – 2020.
4.Aapro MS, Bohlius J, Cameron DA,
Dal Lago L, Donnelly JP, Kearney
N, Lyman GH, Pettengell R, TjanHeijnen VC, Walewski J, Weber DC,
Zielinski C; European Organisation
for Research and Treatment of
Cancer. 2010 update of EORTC
guidelines for the use of granulocytecolony stimulating factor to reduce
the incidence of chemotherapyinduced febrile neutropenia in adult
patients with lymphoproliferative
disorders and solid tumours. Eur
J Cancer. 2011 Jan;47(1):8-32. doi:
10.1016/j.ejca.2010.10.013. Epub 2010
Nov 20. PMID: 21095116.
5.Wang L, Baser O, Kutikova L, Page
JH, Barron R. The impact of primary
prophylaxis with granulocyte
colony-stimulating factors on febrile
neutropenia during chemotherapy:
a systematic review and metaanalysis of randomized controlled
trials. Support Care Cancer. 2015
Nov;23(11):3131-40. doi: 10.1007/
s00520-015-2686-9. Epub 2015
Mar 29. PMID: 25821144; PMCID:
PMC4584106
6. Kuderer NM, Dale DC, Crawford
J, Cosler LE, Lyman GH. Mortality,
morbidity, and cost associated
with febrile neutropenia in adult
cancer patients. Cancer. 2006 May
15;106(10):2258-66. doi: 10.1002/
cncr.21847. PMID: 16575919.
7.Denduluri N, Patt DA, Wang Y,
Bhor M, Li X, Favret AM, Morrow
PK, Barron RL, Asmar L, Saravanan
S, Li Y, Garcia J, Lyman GH. Dose
Delays, Dose Reductions, and
Relative Dose Intensity in Patients
With Cancer Who Received Adjuvant
or Neoadjuvant Chemotherapy in
Community Oncology Practices.
J Natl Compr Canc Netw. 2015
Nov;13(11):1383-93. doi: 10.6004/
jnccn.2015.0166. PMID: 26553767.
8.Murphy M, Metcalfe P, Waters A,
et al. Incidence and mechanism of
neutropenia and thrombocytopenia
in patients with human
immunodeficiency virus infection. Br
J Haematol 1987;66:337–40.
9.Shi X, Sims MD, Hanna MM, et al.
Neutropenia during HIV infection:
adverse consequences and remedies.
Int Rev Immunol 2014;33: 511–36
10.Miyanaga N, Akaza H, Hattori
K, Takeshima H, Koiso K. The
importance of dose intensity in
chemotherapy of advanced testicular
cancer. Urol Int. 1995;54(4):220-5. doi:
10.1159/000282728. PMID: 7541924.
11.Bronchud MH, Howell A,
Crowther D, Hopwood P, Souza L,
Dexter TM. The use of granulocyte
colony-stimulating factor to
increase the intensity of treatment
with doxorubicin in patients with
advanced breast and ovarian cancer.
Br J Cancer. 1989;60(1):121-125.
doi:10.1038/bjc.1989.234
12. Kasymjanova G, Kreisman H,
Correa JA, Dajczman E, Small D.
Does granulocyte colony-stimulating
factor affect survival in patients with
advanced non-small cell lung cancer?
J Thorac Oncol. 2006 Jul;1(6):564-70.
doi: 10.1016/s1556-0864(15)30360-9.
PMID: 17409918.
