Дорогие коллеги, дорогие друзья!
В суете будней дни летят почти незаметно, и вот очередная осень перевалила за половину. Кто-то отсчитывает годы по дням рождения, ктото – по снова надвигающимся новогодним праздникам, а многие онкологи – мы почти уверены в этом! – по ноябрьским конгрессам...

Василий ПОЛЕНОВ. Женщина, идущая по лесной тропинке (Прогулка в лесу),
1883 год. Холст, масло. Частная коллекция
Борис Рыжий
*** Я осенью люблю гулять один. Тут у меня одна подруга - осень. Душа моя полна, как сквер мой полон, Её промокших карточек визитных. И я, мой друг, меняюсь, как природа, Как дождь, рыдаю и роняю листья...
РОССИЙСКОЕ ОБЩЕСТВО КЛИНИЧЕСКОЙ ОНКОЛОГИИ ПРОВЕЛО В МОСКВЕ ЭКЗАМЕН ESMO
21 октября 2023 г. RUSSCO провело ежегодный экзамен Европейского общества медицинской онкологии (ESMO) для молодых врачей – членов ESMO...
В ОРЕНБУРГЕ ПРОВЕЛИ «КНИГОТЕРАПИЮ RUSSCO»
В Оренбурге провели «Книготерапию RUSSCO» В Оренбурге провели «Книготерапию RUSSCO» Российское общество клинической онкологии (RUSSCO) 3 октября провело в Оренбурге уже...

КАК ПРОШЕЛ ЭКЗАМЕН ESMO? ВПЕЧАТЛЕНИЯ УЧАСТНИКА
Итак, 21.10.2023 состоялось значимое событие в жизни молодых онкологов страны – экзамен сообщества ESMO. Как участник этого события, я спешу поделиться с вами своими мыслями о том, как все прошло, и об экзамене в целом.

Глубокоуважаемые коллеги!
На протяжении ближайших 6 месяцев научный комитет в составе коллектива ведущих специалистов, занимающихся изучением, диагностикой и лечением больных злокачественными...
ИССЛЕДОВАНИЕ SOUND РАЗРЕШАЕТ ОТКАЗАТЬСЯ ОТ БИОПСИИ СТОРОЖЕВЫХ ЛИМФОУЗЛОВ У БОЛЬНЫХ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ С CT1N0
С момента предложенной более 50 лет назад Бернардом Фишером теории системного развития рака молочной железы и проведенных последующих клинических исследований отмечается...

ЗНАКОМЬТЕСЬ: РЕГИОНАЛЬНОЕ ОТДЕЛЕНИЕ RUSSCO БЕЛГОРОДСКОЙ ОБЛАСТИ
Белгородская область находится в центре Европейской территории России, входит в состав Центрально-Черноземного экономического района и Центрального федерального округа Российской Федерации...

НОВОСТИ WCLC 2023 (WORLD CONFERENCE ON LUNG CANCER)
9-12 сентября 2023 года в Сингапуре состоялась очередная Всемирная конференция по раку легкого (World Conference on Lung Cancer), где были представлены результаты наиболее актуальных исследований, посвященных терапии рака легкого.

ЛУЧШЕЕ ПО МАТЕРИАЛАМ ВСЕМИРНОЙ КОНФЕРЕНЦИИ ПО РАКУ ЛЕГКОГО WCLC 2023
World Conference on Lung Cancer – одно из крупнейших и наиболее насыщенных мировых мероприятий, посвященных лечению опухолей внутригрудной локализации. В рамках конференции в 2023 году были представлены данные...
РАННИЙ РАК МОЛОЧНОЙ ЖЕЛЕЗЫ: РИСК РЕЦИДИВОВ
Рак молочной железы (РМЖ) является наиболее часто встречающимся онкологическим заболеванием у женщин во всем мире, и Россия не является исключением [1,2]. В подавляющем большинстве...
СОВРЕМЕННЫЕ ПОДХОДЫ К ДИАГНОСТИКЕ И ЛЕЧЕНИЮ МЕЗОТЕЛИОМЫ. ОБЗОР МАТЕРИАЛОВ КОНФЕРЕНЦИИ IMIG-2023
В период с 26 по 28 июля 2023 года в г. Лилль состоялась 16-я Международная конференция международной группы по изучению мезотелиом (International Mesothelioma Interest Group – iMig)...

УГОЛОК РАДИОТЕРАПЕВТА / КОМБИНАЦИЯ ИНГИБИТОРОВ ТИРОЗИНКИНАЗЫ И ЛУЧЕВОЙ ТЕРАПИИ: ВМЕСТЕ НЕВЕСЕЛО ШАГАТЬ…
На подобную комбинацию – таргетной терапии, в частности, ингибиторов тирозинкиназы (ТКИ), и лучевой терапии – уже давно возлагались немалые надежды исследователей, практикующих врачей и самих пациентов, практически с тех пор...

УГОЛОК РАДИОТЕРАПЕВТА / НОВЫЕ РЕКОМЕНДАЦИИ ПО SBRT ОЛИГОМЕТАСТАЗОВ В ЛЕГКИЕ: КОММЕНТАРИИ ЭКСПЕРТА
В июньском онлайн-номере журнала Lung Cancer были опубликованы практические рекомендации Международного общества стереотаксической радиохирургии (ISRS) по проведению...
БОЛЬШЕ – НЕ ЗНАЧИТ ЛУЧШЕ? ДАННЫЕ ИССЛЕДОВАНИЯ NEO-AEGIS
В сентябрьском номере журнала The Lancet Gastroenterology and Hepatology были опубликованы отдаленные результаты уже многим известного крупного мультицентрического (24 европейских...
ASTRO 2023: ОБЗОР LATE-BREAKING ABSTRACTS
LBA 02. Randomized Controlled Trial of Hypofractionated vs. Normo-fractionated Accelerated Radiation Therapy with or without Cisplatin for Locally Advanced Head and Neck Squamous Cell Carcinoma (HYPNO). S.M. Bentzen, et al...
СТОИТ ЛИ ОПЕРИРОВАТЬ МЕСТНОРАСПРОСТРАНЕННЫЙ РАК ШЕЙКИ МАТКИ?
Этот вопрос вновь и вновь задают себе исследователи на протяжении многих лет, несмотря на то, что уже давно стандартом лечения местнораспространенного рака шейки матки (РШМ) стала...

ПРОБЛЕМЫ КОММУНИКАЦИИ: ВЗГЛЯД ПАЦИЕНТА
Обсуждая совершенствование онкологической помощи, мы часто затрагиваем вопросы финансирования. Однако есть и другая проблема. Это критический дефицит времени на приеме...
ДИСКУССИОННЫЙ КЛУБ «ТОЧКА ЗРЕНИЯ»
В сумасшедшем темпе открытий и развития онкологии как науки как никогда важно выстраивать качественный диалог с ведущими специалистами в области онкологии и молодыми онкологами...
Анонс
-

19 января 2024
МЕЛАНОМА И ДРУГИЕ ОПУХОЛИ КОЖИ
VIII КОНФЕРЕНЦИЯ RUSSCO
Дорогие коллеги, дорогие друзья!
В суете будней дни летят почти незаметно, и вот очередная осень перевалила за половину. Кто-то отсчитывает годы по дням рождения, ктото – по снова надвигающимся новогодним праздникам, а многие онкологи – мы почти уверены в этом! – по ноябрьским конгрессам.
Мы надеемся, что Вы сейчас читаете этот номер, держа в руках его печатный вариант и находясь в одном из залов КРОКУС ЭКСПО в качестве участника уже XXVII Российского онкологического конгресса. Как всегда, программа продумана и обсуждена до мелочей оргкомитетом, насыщенна и способна удовлетворить интересы представителей всех онкологических специальностей и не только. Каждый из нас наверняка отметил в программе интересующие сессии, и этих пометок немало. Мы ждем данных новых исследований, зарубежных и отечественных, всестороннего рассмотрения уже известных подходов, блестящих выступлений признанных ораторов – и открытия новых имен молодых онкологов. Каждый раз участие в конгрессе – это некий refreshment, обновление, встряхивание багажа знаний, ведущие к более вдумчивому и, следовательно, более качественному лечению наших пациентов.
До начала конгресса члены RUSSCO узнают имя своего нового председателя – выборы состоятся на собрании членов правления накануне мероприятия. С момента основания общества его неизменным рулевым оставался профессор Сергей Алексеевич Тюляндин. Мы, команда RUSSCO, были и всегда будем счастливы работать с Сергеем Алексеевичем. Мы благодарны нашему руководителю за мудрость, дальновидность, дипломатичность и яркость – этим качествам мы восхищаемся и учимся у него. Верим, что новый председатель как минимум обладает этим «джентльменским набором».
На страницах газеты вас ждут новости крупных научных мероприятий осени: обзор и философское осмысление данных WCLC 2023 – Всемирной конференции по раку легкого, прошедшей в Сингапуре, результаты исследований, попавших в раздел Late Breaking Abstracts конгресса ASTRO 2023, а также новости крупных журналов. Представители Комитета молодых онкологов RUSSCO поделятся впечатлениями о прошедшем недавно экзамене ESMO, а также результатах опроса в отношении коммуникации с пациентами. Также в этом номере вы познакомитесь с представителями Белгородского регионального отделения нашего общества и их работой, а радиотерапевты найдут ряд интересных данных в своем персональном уголке газеты.
Наша страна так велика, что пока жители одних регионов носят легкие
куртки и ловят мягкие лучи осеннего солнца, кто-то удерживает зонт,
шагая по мокрым кленовым листьям аллеи, а где-то уже белая зима полностью стерла осеннее разноцветье. Неизменно одно: вслед за ноябрем
придет декабрь, который завершится вхождением в новый год, а дальше
– «…Будет апрель, вы уверены? – Да, я уверен!»… А пока – насыщенной
и удачной осени вам, дорогие коллеги, в Москве ли в дни конгресса –
или в любой точке мира, где, тем не менее, каждый из нас продолжает
оставаться врачом и онкологом.
До встречи в декабре!
Ваша,
Команда RUSSCO
Василий ПОЛЕНОВ. Женщина, идущая по лесной тропинке (Прогулка в лесу),
1883 год. Холст, масло. Частная коллекция

Борис Рыжий
***
Я осенью люблю гулять один.
Тут у меня одна подруга - осень.
Душа моя полна, как сквер мой полон,
Её промокших карточек визитных.
И я, мой друг, меняюсь, как природа,
Как дождь, рыдаю и роняю листья,
Покачиваясь на ветру холодном,
Всё забывая начисто, что было.
И стиль, в котором сочинял и мыслил
До рококо больного листопада.
До безымянной готики ветвей.
РОССИЙСКОЕ ОБЩЕСТВО КЛИНИЧЕСКОЙ ОНКОЛОГИИ ПРОВЕЛО В МОСКВЕ ЭКЗАМЕН ESMO

21 октября 2023 г. RUSSCO провело ежегодный экзамен
Европейского общества медицинской онкологии (ESMO)
для молодых врачей – членов ESMO.
Сорок три онколога, пожелавшие проверить свои знания, съехались в столицу не только из различных уголков России (Москва, Санкт-Петербург,
Казань, Пермь, Томск, Челябинск, Нижний Новгород, Калуга, Саранск,
Ярославль), но и из Азербайджана, Армении, Белоруссии, Казахстана, Кыргызстана и Узбекистана.
Как всегда, экзамен ESMO, состоявший из тестовых заданий на английском
языке, стал для молодых специалистов реальной возможностью попробовать свои силы в отношении знаний медицинской онкологии.
Все участники, успешно сдавшие экзамен, будут аттестованы и получат соответствующий сертификат на пятилетний период своей деятельности.
В ОРЕНБУРГЕ ПРОВЕЛИ «КНИГОТЕРАПИЮ RUSSCO»
В Оренбурге провели «Книготерапию RUSSCO» В Оренбурге провели «Книготерапию RUSSCO» Российское общество клинической онкологии (RUSSCO) 3 октября провело в Оренбурге уже шестую благотворительную акцию «Книготерапия RUSSCO» при участии известных российских писателей и с передачей книг в Оренбургский областной клинический онкологический диспансер.

Во время пресс-подхода к местным
журналистам гости дали исчерпывающие ответы как на вопросы,
касающиеся творчества писателей,
так и о перспективах акции, которая
будет продолжена и в следующем
году. На очереди – Уфа, Тверь, Тула
и другие российские города.
Началась акция в конференц-зале
диспансера, где гости встретились
с взрослыми пациентами и врачами. Вел встречу главный редактор
портала «Книжное обозрение»,
журналист Александр Михайлович
Набоков. Он рассказал об идее акции
«Книготерапия RUSSCO», которая в
течение трех лет прошла уже в пяти
российских городах, а также о книгах, привезенных специально для
Оренбургского диспансера
С приветствиями выступили и.о.
главного врача Инга Яковлевна Панова, главный онколог Оренбургской
области, зам. главного врача Константин Владимирович Щетинин,
а пресс-секретарь RUSSCO Сергей
Людвигович Сидоров зачитал приветствие от имени исполнительного
директора Общества Веры Витальевны Карасевой.
С видеоприветствием к участникам
акции обратилась писатель Галина
Михайловна Куликова, отметившая,
что без сомнения чтение книг оказывает благотворный терапевтический
эффект на человека, ведь от состояния духа зависит и его физическое
состояние. А хорошие книги как раз
и способствует душевному подъему,
заодно позволяя отвлечься от любых
невзгод.
О благотворном влиянии книг, прочитанных в период лечения, также
сказала известный детский писатель
и поэт Анна Сергеевна Гончарова,
подчеркнувшая, что особенно радует
в подобных встречах – это неподдельная взаимная заинтересованность их
участников в общении. Представляя
свои детские произведения, она пояснила, что по сути – это книги для
семейного чтения.
Перед тем, как передать 300 экземпляров книг, в том числе с автографами Анны Гончаровой, Галины
Куликовой, Сергея Лукьяненко и Владимира Вишневского, а также другие
книги издательств «Белый город»,
«АСТ», «Вече», продюсерского центра «Динамо» в дар диспансеру, Сергей Сидоров торжественно вручил А.
Гончаровой и А. Набокову Почетные
грамоты Российского общества клинической онкологии за поддержку
и активное личное участие в акции
«Книготерапия RUSSCO».
Затем гости посетили детское онкологическое отделение диспансера,
где с маленькими пациентами и их
родителями пообщалась Анна Гончарова. Как обычно, непосредственное личное общение и вовлечение
детей в игровой процесс смогли
отвлечь ребят от ежедневных процедур и придали дополнительную
позитивную энергию, которая, безусловно, поможет им преодолеть
свои болезни. А книги Анны Сергеевны (многие из них она подписала)
и других авторов, переданные в дар
отделению, добавили положительных эмоций не только детям, но и их
родителям.
КАК ПРОШЕЛ ЭКЗАМЕН ESMO? ВПЕЧАТЛЕНИЯ УЧАСТНИКА
Автор: Евдокимов Владимир Игоревич
Врач-онколог, заведующий онкологическим отделением №1
в ЦАОП ММКЦ «Коммунарка», Москва
Итак, 21.10.2023 состоялось значимое событие в жизни молодых онкологов страны – экзамен сообщества
ESMO. Как участник этого события,
я спешу поделиться с вами своими
мыслями о том, как все прошло, и
об экзамене в целом.
Общие мысли
об экзамене в Москве
В Москве экзамен ESMO проходит всего лишь в третий раз. К
результатам наших коллег можно
относиться по-разному. Можно
сказать, что все плохо, а можно
сказать, что мы уверенно продвигаемся вперед. В любом случае, отрицательного роста в результатах
не отмечено: процент сдавших экзамен на «проходной» балл возрос
с 22,9% до 47,8%. Правда при внимательном изучении отчетов за
2021 и 2022 годы видим: средний
балл и стандартное отклонение
балла сдающих сильно «цепляет»
проходную точку. Получается, от
успеха многих отделяли считанные баллы! Количество желающих
сдать растет, в этот раз было около
50 человек, в прошлом году – почти в полтора раза меньше.
Как все проходило?
21 октября 2023 г. в 18:00 открылась регистрация на экзамен. Однако еще практически за час до ее
начала порог отеля переступили
первые экзаменующиеся (место
встречи неизменно – отель «Арткорт»). Кто-то уже уверенно шел
протоптанной в прошлый год
тропой, а кто-то робко уточнял у
окружающих, правильно ли его
привели Яндекс.Карты.
Коллег уже ждали гостеприимные
организаторы, «шведский стол»
и горячий кофе. Время за обсуждением предстоящего события и
поглощением ужина пролетело
незаметно, и вот уже за стойкой
регистрации каждый экзаменующийся идентифицирует свою личность, ставит подпись в списке,
получает долгожданный конверт с
вопросами и направляется в просторный экзаменационный зал.
Начинается экзамен… с совместной фотографии, которая никогда
бы не получилась без Веры Витальевны Карасевой, исполнительного директора RUSSCO и одного
из главных организаторов экзамена в Москве. А затем все, убрав
телефоны и наточив карандаши,
вскрыли выданные ранее конверты.
Конверт содержал буклет с заданиями и бланк, в который необходимо внести правильные ответы. Мне лично показалось, что
самой сложной частью экзамена
было правильно отметить ответы
в этом бланке, так как размер его
небольшой, а поставить вертикальную черту в прямоугольнике
размером с кончик карандаша –
задача, мягко говоря, непростая.
О заданиях
Распределение по темам было
вполне логичным. Да, попадалась
гематология, да, были странные
«веселые» картинки, но в целом
вопросы касались преимущественно солидных опухолей.
Обратило внимание то, что они
часто сопровождались уточнением «согласно клиническим рекомендациям ESMO», что облегчало выбор правильного ответа.
Запомнились вопросы о новой
классификации рака эндометрия
в соответствии с исследованием
ProMisE. Я также понял, что не
помню, как из организма выводится добрая половина химиопрепаратов – слишком привык
«гуглить» это на UpToDate. Вопросы по голове и шее и вовсе
оказались «ахиллесовой пятой».
Но следует признать: неоднозначных вопросов было мало, в целом
экзамен был на знания и осведомленность об онкологии. К сожалению, он не подразумевает долгие
размышления, а лишь проверяет
набор усвоенных знаний и умение следовать букве рекомендаций. Тем не менее, это, безусловно, полезная разминка, которая
позволяет поддерживать в тонусе
память.
Более всего напрягали вопросы, требующие якобы правильного ответа согласно рекомендациям, но на которые любой онколог имеет право ответить иначе в условиях реальной клинической практики. Самый большой негатив же вызвало следующее: в экзамен вошло много вопросов по ряду спорных исследований, о результатах и месте которых до сих пор продолжаются дискуссии в научном сообществе. Однозначно «правильных» ответов здесь нет и на сегодняшний день не может быть, но ESMO, очевидно, хочет, чтобы он был, и мы их запомнили (невидимая рука большого бизнеса?). Позвольте привести примеры. Так, адъювантный осимертиниб в Ib-III стадии NSCLC (исследование ADAURA) – о хитросплетениях дизайна этого исследования, наверное, слышали уже все (и недостадированные пациенты, поскольку не было базовой MРТ, и слабый контрольный рукав, не получивший осимертиниб после прогрессирования). Однако это не остановило составителей вопросов. Или: химиолучевая терапия при раке легкого и дурвалумаб (PACIFIC) – исследование требует не менее осторожной интерпретации, чем ADAURA, но экзамен требует жертв. Еще: циркулирующая опухолевая ДНК (исследование DYNAMIC) – складывается ощущение, что из тебя как будто клещами тянут подтверждение предиктивности этого биомаркера. Ну и «вишенка» – атезолизумаб + наб-паклитаксел при тройном негативном раке молочной железы. Здесь стоит только упомянуть про отзыв FDA этого показания, но в самом вопросе составители прямо намекают на якобы правильный ответ с упоминанием того препарата.
Тем не менее, экзамен прошел отлично, все экзаменованные еще целый час после окончания обсуждали вопросы и с чувством огромного удовлетворения покинули отель и отправились навстречу новым знаниям. И вам, уважаемые коллеги, также желаем новых знаний, эмоций и новых встреч!
Постскриптум: никакими словами не передать благодарность
коллег за возможность сдавать
экзамен в Москве и спасибо сообществу RUSSCO за эту предоставленную возможность и
потрясающую организацию процесса!
Глубокоуважаемые коллеги!
На протяжении ближайших 6 месяцев научный комитет в составе коллектива ведущих специалистов, занимающихся изучением, диагностикой и лечением больных злокачественными новообразованиями, активно работал над программой Российского онкологического конгресса с целью сделать ее интересной, насыщенной современной научной информацией и, самое главное, актуальной для практикующего врача онколога. Экспериментальная и клиническая онкология развивается стремительно, что требует от нас постоянного совершенствования наших знаний и практических навыков для оказания помощи онкологическим больным на современном уровне. Уверен, что программа конгресса позволит узнать новое и освежить уже известное в различных областях, направлениях и специализациях онкологической помощи, включая важные вопросы ее организации и финансирования. Обсуждения и дискуссии во время сессий послужат основой будущих изменений клинических рекомендаций Российского общества клинической онкологии, которые являются путеводителем и настольной книгой онкологов во все увеличивающемся списке современных медицинских подходов. Сегодня новые технологии позволяют более точно определить биологические свойства опухоли, спрогнозировать характер течения заболевания и предсказать эффект различных лечебных методик. Все это необходимо для выбора эффективной терапии конкретного пациента.
Кроме скорейшего внедрения в клиническую практику достижений онкологической науки, другой важнейшей задачей конгресса является обмен опытом между онкологическими учреждениями, научными школами различных регионов и профессиональными сообществами. Только во взаимном продуктивном диалоге могут быть найдены оптимальные решения сложных задач, стоящих перед онкологической службой. Российское общество клинической онкологии всегда предоставляет трибуну конгресса молодым коллегам, тем самым открывая новые имена талантливых онкологов, которые уже завтра займут лидирующие позиции в нашей дисциплине. На этом конгрессе Российское общество клинической онкологии подведёт итоги проведённой отчетно-выборной компании по избранию новых членов проявления и председателя на последующие четыре года.
Желаю Вам плодотворной работы на конгрессе и приятного
времяпрепровождения в Москве!
ИССЛЕДОВАНИЕ SOUND РАЗРЕШАЕТ ОТКАЗАТЬСЯ ОТ БИОПСИИ СТОРОЖЕВЫХ ЛИМФОУЗЛОВ У БОЛЬНЫХ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ С CT1N0
С момента предложенной более 50 лет
назад Бернардом Фишером теории
системного развития рака молочной
железы и проведенных последующих
клинических исследований отмечается неуклонное уменьшение объема
хирургического лечения с отказом от
мастэктомии и преимущественного
выполнения органосохраняющих
операций [1]. На фоне постоянного
повышения эффективности системной адъювантной терапии стало очевидным, что подмышечная лимфаденэктомия в большей степени имеет
важное диагностическое значение
для выбора характера адъювантной
терапии. Выполнение подмышечной
лимфаденэктомии ассоциируется с
частым развитием лимфостаза, что
определило поиск менее травматичного метода оценки состояния лимфоузлов подмышечной впадины.
На смену подмышечной лимфаденэктомии пришла биопсия сторожевых лимфатических узлов (БСЛУ) у
больных с отсутствием клинических
признаков вовлечения лимфоузлов
аксиллярной зоны. Больным без наличия метастазов в сторожевых лимфоузлах рекомендовано отказаться
от подмышечной лимфодиссекции и
ограничиться проведением лучевой
терапии. В исследовании Z0011 было
продемонстрировано, что даже при
обнаружении метастазов в сторожевых лимфоузлах лимфатические
узлы подмышечной области могут
быть оставлены нетронутыми без
ухудшения исходов рака молочной
железы при условии эффективной
системной терапии и дополнительной лучевой терапии на эту область
[2]. Недавняя публикация 10-летних
результатов европейского исследования указывает на эквивалентные результаты лечения у женщин с метастазами в сторожевых лимфоузлах,
получивших подмышечную лимфодиссекцию или подмышечную лучевую терапию с уменьшением частоты
развития лимфостаза верхней конечности [3].
Таблица1.
Частота рецидивов, прогрессирования заболевания
и смертельных исходов) исследования SOUND
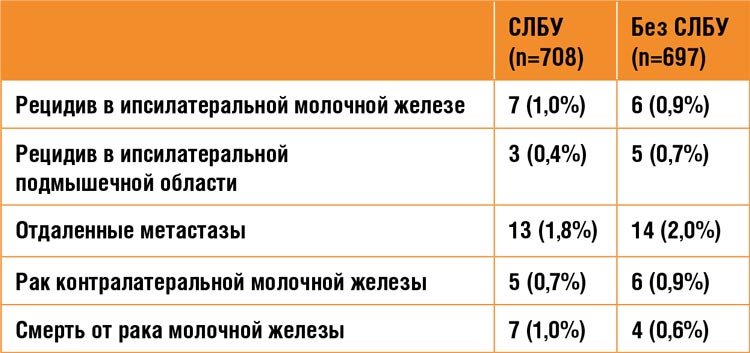
Параллельно с процессом деэскалации локальной терапии развитие
эффективного скрининга привело
к существенному увеличению числа
больных с клиническими ранними
формами (cT1-2N0) рака молочной
железы. С учетом низкого риска
вовлечения лимфоузлов подмышечной области было признано нецелесообразным выполнение БСЛУ
у больных старше 70 лет. Но возможен ли отказ от выполнения БСЛУ у
более молодых пациенток? Не приведет ли это к неправильному стадированию и, соответственно, неадекватной адъювантной терапии,
что ухудшит отдаленные результаты
лечения?
Рандомизированное клиническое
исследование SOUND ставило цель
оценить ультразвуковую визуализацию подмышечной впадины
в качестве альтернативы биопсии
сторожевого узла для определения
состояния подмышечных лимфоузлов у больных раком молочной
железы сT1N0 моложе 70 лет [4].
Если подмышечная ультрасонография демонстрировала подозрение
на поражение изолированного лимфатического узла, требовалось проведение тонкоигольной биопсии для
цитологической оценки. Пациенты с
ультразвуковым или цитологически
подтвержденным отсутствием метастазов в аксиллярных лимфоузлах
были рандомизированы в соотношении 1:1 для биопсии сторожевого
узла или отказа от нее. Если положительный результат сигнального узла
был задокументирован, назначенное лечение включало подмышечную лимфаденэктомию. Основной
конечной точкой исследования, указанной в протоколе, была выживаемость без отдаленных метастазов
(DDFS) через 5 лет (включая смертность от всех причин). Вторичные
конечные точки включали ряд специфических для рака молочной железы событий, общую выживаемость
и рекомендации по адъювантному
лечению. Статистическая гипотеза предполагала не худшие (noninferior) показатели выживаемости
без отдаленных метастазов при
отказе от БСЛУ. Предполагалось,
что абсолютная разница в 5-летней
DDFS между двумя подходами не
превысит 2,5% с верхним пределом
доверительного интервала 1,74.
В исследовании SOUND приняли
участие 1463 женщины с медианой
возраста 60 лет, медианой наибольшего размера первичной опухоли
1,1 (0,8-1,5) см; люминальный фенотип (HR+, HER2-) зарегистрирован почти у 90% пациенток. Всем
больным выполнялась органосохраняющая операция с последующей
адъювантной лучевой терапией. Все
пациентки с люминальным раком
получали адъювантную гормонотерапию, 20% больных в группе биопсии и 17,5% в группе без биопсии
получали адъювантную химиотерапию, включая трастузумаб в случае
HER2+ рака. В группе биопсии сторожевого узла у 13,7% женщин были
обнаружены патологически вовлеченные сторожевые и подмышечные лимфатические узлы, но только
у 0,6% было 4 или более лимфоузлов,
пораженных метастазами. При средней продолжительности наблюдения
от 5,8 года DDFS составила 97,7% в
группе БСЛУ и 98,0% в группе без
БСЛУ. Разница между 5-летними
DDFS была менее 2,5%, верхняя граница 90% доверительного интервала
равнялась 1,54, что ниже заданного
предела 1,74, и это подтверждало не
худшую эффективность лечения при
отказе от выполнения БСЛУ. В связи
с малым количеством событий для
оценки вторичных точек необходима
большая продолжительность наблюдения. Результаты наблюдения в двух
группах представлены в таблице.
Исследование SOUND демонстрирует, что мы безопасно можем отказаться от выполнения биопсии
сторожевого лимфоузла и точного
стадирования регионарных лимфоузлов у больных с сT1N0. Более
сложным остается вопрос, может ли
этот вывод распространяться на все
фенотипы рака молочной железы и
возрастные группы. В исследовании
SOUND подавляющее большинство
больных имело люминальный фенотип, HER2-позитивный и тройной негативный фенотипы определялись у
6% и 5% больных соответственно. Как
правило, этим пациентам назначалась
химиотерапия, в том числе и только
по результатам иммуногистохимического анализа первичной опухоли.
Хотя не получено свидетельств об
ухудшении локального контроля этих
больных, число таких наблюдений
явно недостаточно, чтобы безопасно
рекомендовать отказ от выполнения
биопсии сторожевых лимфоузлов
при агрессивных фенотипах.
В исследовании SOUND только 19%
больных были моложе 50 лет и 20%
сохраняли менструальную функцию,
что не позволяет рекомендовать отказ от биопсии сторожевых лимфоузлов молодым пациенткам, у которых
риск регионального метастазирования гораздо выше. Точное стадирование на основе БСЛУ позволит
провести адекватную адъювантную
системную терапию, соответствующую стадии, включая химиотерапию.
Больные в менопаузе старше 50 лет
являются кандидатами для отказа от
выполнения биопсии сторожевых
лимфоузлов. Возможно дальнейшее
наблюдение и анализ результатов
исследования SOUND в различных
возрастных группах смогут уточнить
данную рекомендацию.
Еще одним важным для практической деятельности аспектом исследования является рутинное использование подмышечной ультрасонографии
для селекции больных, которым можно отказаться от БСЛУ. В литературе
имеются противоречивые результаты
о прогностической ценности данного
исследования для определения состояния подмышечных лимфоузлов. В
исследовании SOUND частота ложноотрицательных результатов составила 13,7%, что, однако, не повлияло
на отдаленные результаты лечения.
Это не отменяет относительно субъективный характер ультразвукового
исследования, во многом зависящий
от опыта специалиста.
Исследование SOUND показало, что
наличие метастазов в сторожевых
лимфатических узлах не является
критическим показанием к выполнению подмышечной лимфаденэктомии у больных раком молочной
железы I стадии. Полученные сегодня
данные свидетельствуют, что мы можем отказаться от выполнения СБЛУ
без потери эффективности у больных
старше 50 лет сT1N0 люминальным
раком молочной железы в постменопаузе.
Источники:
- Fisher B, Montague E, Redmond C, et al. Findings from NSABP protocol No. B-04 – comparison of radical mastectomy with alternative treatments for primary breast cancer. Cancer. 1980; 46(1): 1-13.
- Giuliano AE, Ballman KV, McCall L, et al. Effect of axillary dissection vs no axillary dissection on 10-year overall survival among women with invasive breast cancer and sentinel node metastases: the ACOSOG Z0010 randomized clinical trial. JAMA. 2017; 318: 918-926.
- Bartels SAL, Donker M, Poncet C, et al. Radiotherapy or surgery of the axilla after a positive sentinel node in breast cancer: 10-year results of the randomized controlled EORTC 10981- 22023 AMAROS trial. J Clin Oncol. 2023; 41(12): 2159-2165.
- Gentilini OD, Botteri E, Sangalli C, et al. Sentinel lymph node biopsy vs no axillary surgery in patients with small breast cancer and negative results on ultrasonography of axillary lymph nodes: the SOUND randomized clinical trial. JAMA Oncol. Published online: September 21, 2023.
ЗНАКОМЬТЕСЬ: РЕГИОНАЛЬНОЕ ОТДЕЛЕНИЕ RUSSCO БЕЛГОРОДСКОЙ ОБЛАСТИ
Белгородская область находится в центре Европейской
территории России, входит в
состав Центрально-Черноземного экономического района
и Центрального федерального
округа Российской Федерации.
Площадь области составляет
27,1 тыс. кв. км, протяженность
с севера на юг – около 190 км, с
запада на восток – около 270 км.
По данным Белгородстата численность населения Белгородской
области на 1 января 2023 года составила 1514,5 тыс. человек.
В Белгородской области на онкологическом учете состоит более
45 тысяч пациентов, ежегодно
регистрируется около 7100 новых
случаев. По заболеваемости ЗНО
Белгородская область находится на втором месте в ЦФО, что
свидетельствует о высокой выявляемости онкологических заболеваний в регионе. Из общего
числа впервые зарегистрированных 46,8% составляют мужчины,
53,2% – женщины. За десятилетний период с 2013 по 2022 год в
Белгородской области отмечается
тенденция роста заболеваемости
злокачественными новообразованиями, увеличение численности контингента онкологических
больных, снижение смертности
от новообразований и, как следствие, увеличение доли лиц, проживших пять лет и более. Ведущими локализациями (оба пола) в
общей структуре заболеваемости
ЗНО населения Белгородской области в 2022 году являлись: кожа
(без меланомы) – 20,0% (2021 год
БО – 18,3%; РФ – 11,8%); молочная железа – 11,6% (2021 год БО –
11,4%; РФ – 12,1%); трахея, бронхи,
легкие – 8,4% (2021 год: БО – 8,8%;
РФ – 9,7%).
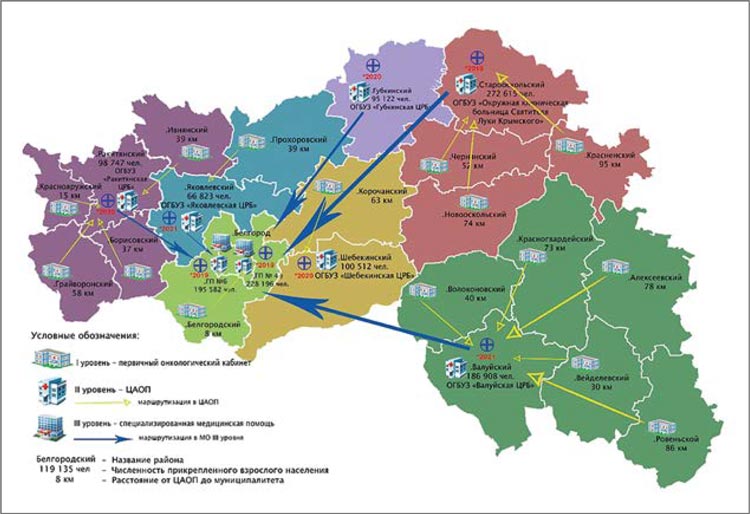
Белгородский областной онкологический диспансер
Региональное отделение Российского общества клинической онкологии (RUSSCO) Белгородской
области создано в 2012 году и в
настоящее время насчитывает 31
члена, среди которых онкологи,
химиотерапевты, радиотерапевты, хирурги. Председателем регионального отделения является
главный внештатный специалист
онколог Министерства здравоохранения Белгородской области, главный врач ОГБУЗ «Белгородский областной онкологический
диспансер», к.м.н. Шаманов Андрей Валерьевич. Центром онкологической службы является
ОГБУЗ «Белгородский областной
онкологический диспансер» (ОГБУЗ «БООД») в г. Белгород. Областное государственное бюджетное учреждение здравоохранение
«Белгородский областной онкологический диспансер» образовано в 1967 году. В структуру учреждения вошли: поликлиника
на 180 посещений в смену и 200
коек круглосуточного стационара.
Одним из важных этапов развития учреждения стало открытие в
1995 году нового хирургического
корпуса на 220 коек, после чего
общий коечный фонд учреждения составил 370 коек.

Сегодня коечная мощность онкологического диспансера представлена 405 койками круглосуточного пребывания ОГБУЗ
«Белгородский областной онкологический диспансер», из них
онкологические – 305 коек (том
числе 9 реанимационных и 35
паллиативных), радиологические
– 100 и 45 коек дневного стационара. В диспансере проводятся
все виды лечения онкологических
заболеваний: хирургический,
радиотерапевтический, противоопухолевая лекарственная терапия, а также комбинированное и
комплексное противоопухолевое
лечение.
Онкологический диспансер в
своем составе имеет шесть отделений хирургического профиля, ежедневно выполняется до
30 операций; четыре отделения
радиотерапевтического профиля; четыре отделения для проведения противоопухолевой
лекарственной терапии. Ежегодно в условиях круглосуточного
стационара проводится лечение
более чем 16 тысячам пациентов,
в условиях дневного стационара –
более 12 тысячам. В поликлинике
осуществляется более 110 тысяч
амбулаторных посещений.
Лечебно-диагностическая база
учреждения, обеспечивает проведение максимального объема
обследований и включает лабораторные, рентгеновские, радионуклидные, эндоскопические,
ультразвуковые исследования, а
также функциональную диагностику. Непрерывная техническая
и программная модернизация
приобретаемого диагностического оборудования обусловила
улучшение качества медицинской
помощи онкологическим больным.
Белгородский онкологический
диспансер является одним из ведущих участников реализации
регионального проекта «Борьба
с онкологическими заболеваниями», являющего частью национального проекта «Здравоохранение». С начала реализации
проведено полное переоснащение
медицинским оборудованием
Белгородского онкологического
диспансера. Полностью обновлен
парк тяжелого оборудования для
диагностики злокачественных
новообразований и лучевой терапии. Три современных линейных
ускорителя позволяют применять
методики, которые ранее были
доступны только в федеральных
центрах, в том числе конформная
дистанционная лучевая терапия
с функцией стереотаксиса. Широко применяется брахитерапия
в качестве альтернативы хирургическому лечению рака предстательной железы и опухолей других локализаций.
Значительно увеличились диагностические возможности онкологической службы благодаря введению в эксплуатацию
однофотонного эмиссионного
компьютерного томографа, аппарата МРТ, трех компьютерных
томографов.
Качественно изменились возможности хирургического лечения злокачественных опухолей
в регионе за счет переоснащения
современным оборудованием, в
частности, для выполнения малоинвазивных видеоэндоскопических операций. Увеличилось
число реконструктивно-пластических операций, в том числе при
раке молочной железы, в области
проведено уже более 120 подобных операций.
Полностью обновлен парк оборудования для операционного блока и отделения анестезиологии и
реанимации, приобретен рентгеновский аппарат типа С-дуга,
позволяющий выполнять хирургические вмешательства под
рентгеновским контролем.
Обеспечение лекарственными препаратами – это один из
важнейших приоритетов онкологической службы. Бюджет
Белгородского онкологического
диспансера позволяет использовать в лечении современные
таргетные и иммунологические
противоопухолевые лекарственные препараты.
Белгородский онкологический
диспансер является методическим и консультативным центром
по профилю онкология для медицинских организаций области.
Под методическим руководством специалистов онкологического
диспансера в регионе была реали
-
зована одна из важнейших задач
регионального проекта «Борьба
с онкологическими заболевани
-
ями» – создание сети Центров
амбулаторной онкологической
помощи.
В регионе функционируют восемь
Центров амбулаторной онкологи
-
ческой помощи (ЦАОП) – два в
городе Белгород, городе Старый
Оскол, г. Губкин, Ракитянском,
Шебекинском, Валуйском и Яков
-
левском районах. Во всех ЦАОП
проводится противоопухолевая
лекарственная терапия на койках
дневного стационара. В 2022 году
было проведено более 3500 кур
-
сов лечения. Пациенты высоко
оценили возможность получать
специализированное лечение не
-
далеко от дома. Врачи-онкологи
ЦАОП работают в тесном контак
-
те со специалистами онкологиче
-
ского диспансера, с применением
телемедицинских консультаций,
с возможностью пересмотра циф
-
ровых изображений в референсцентре Белгородского онкологического диспансера. В области в
рамках регионального проекта
«Цифровой контур» реализована
возможность передачи данных
в Центральный архив медицин
-
ских изображений (ЦАМИ).
Региональное отделение прово
-
дит межрегиональные конферен
-
ции и образовательные семина
-
ры, где врачи принимают участие
не только как слушатели, но и яв
-
ляются активными участниками,
выступая с докладами и разбора
-
ми клинических случаев. Важно
отметить вклад команды специ
-
алистов региона в подготовку се
-
рьезных научных событий, таких
как ежегодные съезды онколо
-
гов России, съезды онкологов и
радиологов стран СНГ и Евразии
(АДИОР).
Ежегодно в Белгородской обла
-
сти при поддержке Российского
общества клинической онкологии
(RUSSCO) проводятся научные ме
-
роприятия в формате вебинаров по
различным вопросам онкологии. В
мероприятиях принимают участие
федеральные спикеры, а также у
наших коллег имеется возмож
-
ность представить клинические
случаи из собственной практики.
Наиболее широкий отклик у вра
-
чей-онкологов имеют такие темы
к обсуждению, как современные
подходы к противоопухолевой те
-
рапии рака легкого, рака молочной
железы, колоректального рака, во
-
просы сопроводительной терапии.
Врачи-онкологи регионального от
-
деления принимают активное уча
-
стие в Национальной Программе
RUSSCO «Совершенствование мо
-
лекулярно-генетической диагно
-
стики в Российской Федерации с
целью повышения эффективности
противоопухолевого лечения» и
направляют пациентов на молеку
-
лярно-генетическую диагностику.
Благодаря содействию RUSSCO
в 2023 году врачи районных от
-
делений были обеспечены экзем
-
плярами текущих клинических
рекомендаций по лечению злокаче
-
ственных опухолей.
Помимо лечебной и научной дея
-
тельности врачи регионального от
-
деления принимают активное уча
-
стие в благотворительных акциях
и мероприятиях, приуроченных к
Всемирному дню борьбы с онкоза
-
болеваниями. Ежегодно Белгород
-
ский онкологический диспансер
проводит просветительские акции,
направленные на профилактику
и выявление онкологических за
-
болеваний у населения области. В
2023 году проведено 4 масштабных
акции: «Мужское и женское здо
-
ровье», «День диагностики рака
кожи», «Профилактика и ранняя
диагностика онкологических за
-
болеваний», «День диагностики
рака молочной железы». Акции
достаточно популярны среди на
-
селения, проводятся на различ
-
ных площадках в крупных тор
-
говых центрах и в медицинских
организациях региона. По итогам
проведения акций выявляются в
среднем 5 случаев онкологических
заболеваний.
За прошедшие годы в Белгород
-
ской области создана эффектив
-
ная система оказания онкологи
-
ческой помощи, которая сегодня
продолжает развиваться на основе
кластерного подхода и современ
-
ных технологий. Реализация науч
-
ного и практического потенциала
наших специалистов позволила
Белгородском онкологическому
диспансеру занять достойное ме
-
сто среди специализированных
центров страны. В рамках Феде
-
рального проекта по борьбе с он
-
кологическими заболеваниями с
2019 года проводится масштабная
работа над формированием со
-
временной комплексной системы
профилактики, диагностики и
лечения онкологических заболе
-
ваний, а также уделяется приори
-
тетное внимание модернизации
медицинских организаций, вне
-
дрению передовых технологий.
НОВОСТИ WCLC 2023 (WORLD CONFERENCE ON LUNG CANCER)
Автор: Титова Татьяна Александровна
Врач-онколог химиотерапевтического отделения №1
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России,
кандидат медицинских наук, Москва
9-12 сентября 2023 года в Сингапуре состоялась очередная Всемирная конференция по раку легкого (World Conference on Lung Cancer), где были представлены результаты наиболее актуальных исследований, посвященных терапии рака легкого.
Опубликован проект обновления TNM при раке легкого (РЛ) для 9-го издания Классификации злокачественных опухолей
Корректировки к 9 изданию сделаны с целью улучшения прогностической ценности стадирования. Итак, новое:
1. Изменения в 9-м издании классификации не коснутся первичной
опухоли (T).
2. Предполагается разделить N2 на
две подкатегории: N2a и N2b.
3. Разделение категории N2 на N2a и
N2b приведет к тому, что T1N1
перейдет из IIB (8-е издание) в IIA
(9-е издание). В 8-м издании Т1N2
классифицировалось как IIIA, в новом издании T1N2a будет классифицироваться как IIB, а T1N2b –
как IIIA. При T2N2a стадия будет
определяться как IIIA, при T2N2b
– как IIIB.
4. Предполагается разделить M1
также на две категории – M1c1 и
M1c2:
5. M1c1 определяется как множественные внегрудные метастазы
в одном органе;
6. M1c2 определяется как множественные внегрудные метастазы
в нескольких органах.
7. Это изменение было обусловлено
оценками 5-летней выживаемости при РЛ в 27% с M1c1 по сравнению в 19% при M1c2. Разделение
M1c на M1c1 и M1c2 не повлияет
на стадию заболевания – во всех
случаях это будет IVB.
FLAURA2
FLAURA2 – рандомизированное исследование III фазы, направленное на изучение эффективности осимертиниба в комбинации с химиотерапией (пеметрексед с цисплатином/карбоплатином) в первой линии лечения местнораспространенного (стадии IIIB-IIIC) или метастатического (стадия IV) немелкоклеточного рака легкого (НМРЛ) с мутацией гена EGFR. 557 пациентов были рандомизированы в две лечебные группы (1:1):
• N=279 – осимертиниб в комбинации с пеметрекседом и карбоплатином/цисплатином, с последующей поддерживающим терапией
осимертинибом и пеметрекседом;
• N=278 – только осимертиниб.
Лечение продолжалось до прогрессирования или неприемлемой токсичности.
Первичной конечной точкой исследования была медиана ВБП, оцененная центральной командой, вторичными – медиана ОВ, частота достижения контроля роста опухоли (КРО), длительность достигнутого ответа и токсичность терапии. Средний возраст пациентов составил 61 год. Большинство больных, включенных в работу, были некурящими (67% и 65%), женщинами (61% и 62%) с ECOG статусом 1 (62% и 63%) и делецией в 19 экзоне (Del19) (61% и 60%) или заменой L858R (38% и 38%) в 21 экзоне в гене EGFR. У 42% и 40% пациентов в лечебных группах были метастазы в центральную нервную систему.
При медиане времени наблюдения в 16,5 мес. в группе осимертиниба и 19,5 мес. в группе комбинированной терапии медиана ВБП составила 19,9 и 29,4 мес. (ОР=0,62; 95% ДИ 0,48-0,80; p=0,002) соответственно, Добавление химиотерапии к осимертинибу позволило увеличить 12-месячную ВБП с 67% до 80%, 24-месячную – с 47% до 62% и статистически значимо снизить риск прогрессирования на 38%.
Добавление химиотерапии к осимертинибу позволило достигнуть частоты ОО в 83,2% против 75,5% в группе монотерапии и увеличить длительность ответа с 15,3 до 24 мес. Максимальный эффект от комбинированной терапии отмечен у пациентов с метастазами в ЦНС, добавление химиотерапии к осимертинибу увеличило медиану ВБП с 13,8 до 24,9 мес. (ОР=0,47; 95% ДИ 0,33-0,66) и статистически значимо снизило риск прогрессирования на 53%. Эффективность терапии не зависела от типа активирующей мутации гена EGFR (Ex19del vs L858R). НЯ 3 степени и более были значимо выше в группе комбинированного лечения в сравнении с монотерапией осимертинибом: 64% и 27%, что ожидаемо.
HERTHENA-Lung01
Исследование HERTHENA-Lung01 посвящено эффективности патритумаба дерукстекана (HER3-DXd) при НМРЛ с мутацией в гене EGFR.
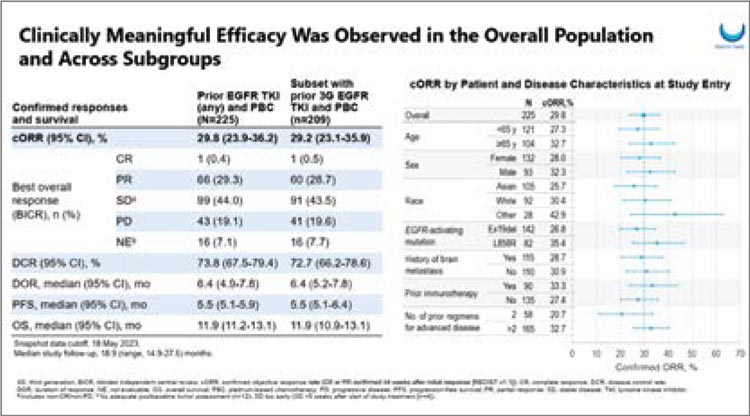
Патритумаб дерукстекан (HER3- DXd) представляет собой конъюгат, состоящий из моноклонального антитела (IgG1) к рецептору HER3 и ингибитора топоизомеразы I. В исследование 2 фазы HERTHENALung01 были включены больные НМРЛ с мутацией в гене EGFR, ранее получавшие ИТК и химиотерапию на основе платины. В работу также были включены пациенты с бессимптомными метастазами в головном мозге. Первоначально пациенты были рандомизированы (1:1) в две лечебные группы: первая – с фиксированной дозой HER3-DxD – 5,6 мг/кг 1 раз в 3 недели и группа с повышением дозы с 3,2 мг/кг до 4,8 мг/кг и 6,4 мг/кг в течение трех первых циклов. Однако набор во вторую группу был завершен досрочно на основании «оценки соотношения пользы и риска». Текущие результаты отражают эффективность терапии у 225 пациентов, получавших HER3-DxD в фиксированной дозе 5,6 мг/кг 1 раз в 3 недели. Более чем у половины пациентов, включенных в исследование, были метастазы в центральную нервную систему (51%), и в среднем больные ранее получили три линии терапии (92,9% – ТКИ третьего поколения, около 40% – иммунотерапию и всем пациентам была проведена химиотерапия на основе препаратов платины).
При медиане времени наблюдения в 18,9 мес. в общей группе пациентов медиана ВБП достигла 5,5 мес. при медиане ОВ в 11,9 мес. Частота достижения объективного ответа (ОО) составила 29,8%, при КРО в 73,8% и медиане длительности ответа в 6,4 мес. При подгрупповом анализе ЧОО не зависела от возраста, пола, мутации в гене EGFR, наличия метастазов в головном мозге и иммунотерапии в анамнезе. Эффективность терапии также не зависела от уровня экспрессии HER3 (рис.1).
Рисунок 1.
Результаты исследования HERTHENA-Lung01
(клинически значимая эффективность во всей популяции и в подгруппах).
Среди 30 пациентов с измеримыми
метастазами в головной мозг у 33,3%
был подтвержден ОО. В этой группе
больных КРО составил 76,7%, при
длительности ответа в 8,4 мес.
НЯ любой степени были зарегистрированы у 99,6% пациентов, но только в
7,1% случаев привели к прекращению терапии. НЯ 3 степени и выше, связанные с лечением, отмечены у 45,3%
больных и были преимущественно
представлены тромбоцитопенией
(21%), нейтропенией (19%), анемией
(14%), лейкопенией (10%), слабостью
(6%). Пульмонит развился у 5,3% пациентов, 1 пациент погиб от интерстициальной болезни легких.
TROPION-Lung04
На конгрессе представлены первые результаты мультикогортного исследования TROPION-Lung04, посвященного изучению датопотамаба дерукстекана (Dato-DXd) в комбинации с дурвалумабом ± карбоплатин у пациентов с местнораспространенным или диссеминированным НМРЛ без активирующих мутаций с ECOG статусом 0-1. Первичная конечная точка исследования – токсичность терапии, вторичные – частота достижения ОО и КРО.
Датопотамаб дерукстекан (Dato-Dxd) представляет собой конъюгат, состоящий из моноклонального антитела (IgG1) к рецептору Trop-2 и ингибитора топоизомеразы I.
Дизайн исследования представлен на рисунке 2.
Рисунок 2.
Дизайн исследования TROPION-Lung04.
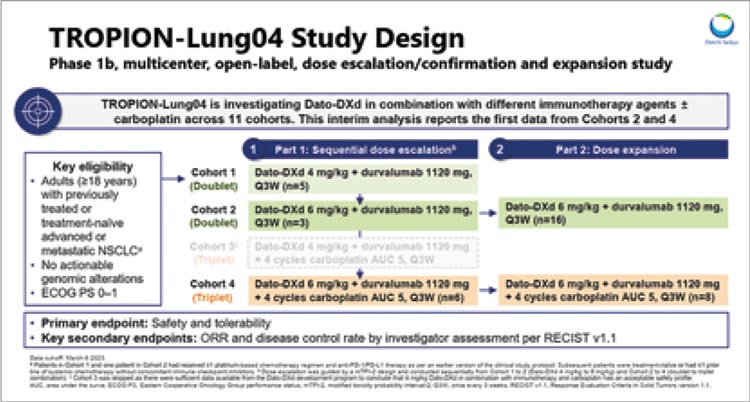
Представлены промежуточные результаты второй (n=19) и четвертой (n=14) когорт:
• 2 когорта – датопотамаб дерукстекан 6 мг/кг в комбинации с
дурвалумабом 1120 мг, курс 1 раз в
3 недели;
• 4 когорта – датопотамаб дерукстекан 6 мг/кг в комбинации с дурвалумабом 1120 мг и карбоплатином
AUC 5, курс 1 раз в 3 недели.
Большинство пациентов, включенных в исследование, были мужчинами (73,7% и 64,3%) с неплоскоклеточным РЛ (73,4% и 71,4%), получавшими терапию в качестве первой линии лечения (73,7% и 92,9%). Частота ОО во 2 когорте достигла 47,4% и 71,4% – в 4 когорте.
НЯ 3 степени в первой когорте и выше были преимущественно представлены стоматитом (11%), слабостью (5%), анемией (5%), нейтропенией (5%), тошнотой (5%) и пневмонией (11%), во второй – анемией (36%), тромбоцитопенией (21%), диареей (14%), нейтропенией (14%), лейкопенией (7%) и пневмонией (7%). Гематологическая токсичность была ожидаемо значимо выше в когорте больных на химиотерапии.
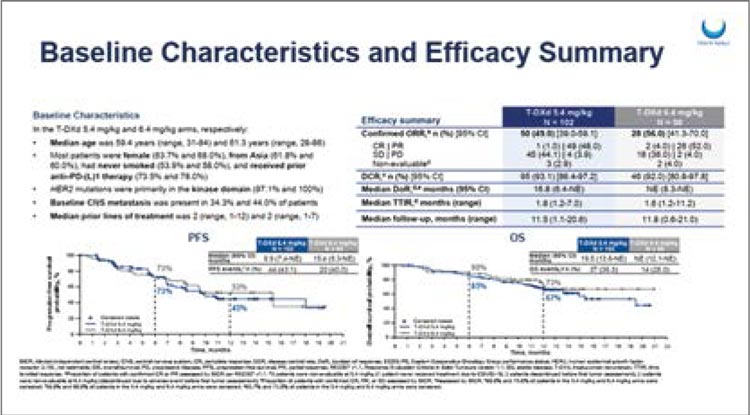
DESTINY-Lung02
Представлены первые результаты
исследования DESTINY-Lung02, отражающие эффективность трастузумаба дерукстекана (T-DXd) при
диссеминированном неплоскоклеточном РЛ с мутацией в гене HER2.
152 больных, ранее получившие не
менее 1 линии терапии, с ECOG статусом 0-1, были рандомизированы в
2 лечебные группы (2:1):
• N=102 – T-DXd 5,4 мг/кг 1 раз в 3недели;
• N=50 – T-DXd 6,4 мг/кг 1 раз в 3
недели.
Первичной конечной точкой исследования стала ЧОО, вторичными – длительность ответа на терапию, медианы ВБП и ОВ и токсичность терапии.
Большинство пациентов, включенных в работу, были некурящими (53,9% и 58,0%), женщинами (63,7% и 68,0%), ранее получавшими antiPD-(L)1 терапию (73,5% и 78,0%). Метастазы в ЦНС были у 34,4% и 44,0% больных в лечебных группах. При медиане времени наблюдения в 11,5 и 11,8 мес. ЧОО в группе T-DXd 5,4 мг/кг составила 50% и 56% при дозе 6,4 мг/кг, при медиане длительности ответа в 16,8 мес. и НД. Шестимесячная ВБП в лечебных группах составила 73% при 12-месячной ВБП в 53% и 45%, а 6-месячная и 12-месячная достигли 90% и 85% и 73% и 67% соответственно. Подробно результаты представлены на рисунке 3.
Рисунок 2.
Результаты исследования DESTINY-Lung02
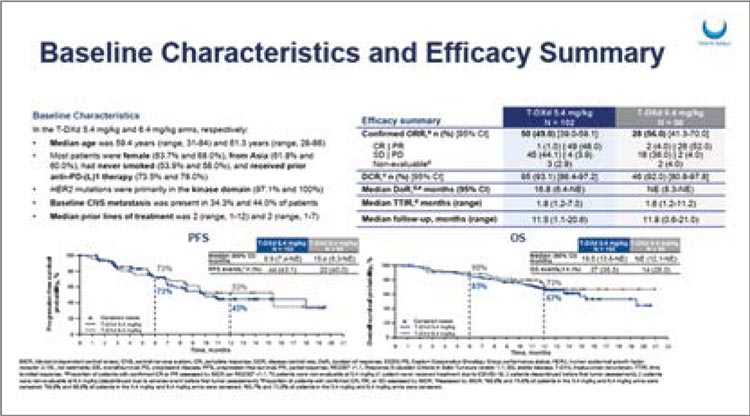
При медиане длительности лечения в 7,7 мес. в группе T-DXd 5,4 мг/ кг и 8,3 мес. в группе T-DXd 6,4 мг/ кг НЯ любо степени были преимущественно представлены тошнотой (67,3% и 82,0%), нейтропенией (42,6% и 56,0%) и слабостью (44,6% и 50,0%). Пульмонит любой степени зафиксирован у 12,9% пациентов при дозовом режиме 5,4 мг/кг и у 28,0% больных при 6,4 мг/кг.
Исследование DS-7300 1/2 фазы, данные подгруппового анализа
Ифинатамаб дерукстекан (I-DXd) представляет собой конъюгат, состоящий из моноклонального антитела (IgG1) к рецептору B7-H3 и ингибитора топоизомеразы I.
B7-H3 – это трансмембранный гликопротеин I типа. Физиологическая роль B7-H3 остается дискуссионной и связана как с ко-стимулирующими, так и с коингибирующими функциями в регуляции Т-клеточного ответа. Описывается различный уровень экспрессии B7-H3 при таких злокачественных новообразованиях, как плоскоклеточный рак слизистой оболочки полости рта (91,8%), остеосаркомы (93-100%), рак молочной железы (80,5-90,6%) и рак легкого (37,1-69,5%).
Представлены первые результаты терапии 22 пациентов с дозовым уровнем ифинатамаба дерукстекана от 3,2 мг/кг до 16,0 мг/кг.
Медиана возраста пациентов, включенных в исследование, составила 61 год. Преимущественно это были мужчины (63,6%) с ECOG статусом 1 (68,2%), ранее получавшие химиотерапию на основе платины (100%) и иммунотерапию (81,8%).
При медиане времени наблюдения в 11,7 мес. в группе пациентов, получавших I-DXd ≥6,4 мг/кг, ЧОО достигла 52,4%, при медиане времени до регистрации ОО в 1,2 мес. и медиане длительности в 5,9 мес. (рис.4).
Рисунок 4.
Первые результаты исследования DS-7300 1/2 фазы
Медиана ВБП (I-DXd≥6,4) составила 5,6 мес. (95% ДИ 3,9-8,1) при медиане ОВ в 12,2 мес. (95% ДИ 6,4- НД).
НЯ любой степени зарегистрированы у 22 больных (100%), 3 степени и выше – у 8 пациентов (36,4%) и привели к прекращению терапии в 5 случаях (22,7%). НЯ были преимущественно представлены тошнотой (59,1%), слабостью (50,0%), анемией (27,3%), рвотой (27,3%), снижением аппетита (22,7%), гипертермией (18,2%), запорами (18,2%) и диареей (13,6%).
Рисунок 5.

Источники:
- IASLC 2023 World Conference on Lung Cancer: Abstract PL04.03. Presented September 11, 2023. J Clin Oncol. Published online: September 11, 2023.
- IASLC 2023 World Conference on Lung Cancer: Abstract PL03.13. Presented September 11, 2023.
- IASLC 2023 World Conference on Lung Cancer. Abstract OA05.03. Presented September 10, 2023.
- Papadopoulos KP, Bruno DS, Kitazono S, et al. Datopotamab deruxtecan (Dato-DXd) + durvalumab ± carboplatin in advanced/mNSCLC: Initial results from phase 1b TROPIONLung04. Presented at: 2023 World Conference on Lung Cancer; September 10-12, 2023; Singapore. Abstract OA05.06.
- Goto, K, Goto Y, Kubo T, et al. Trastuzumab Deruxtecan in Patients With HER2-Mutant Metastatic Non– Small-Cell Lung Cancer: Primary Results From the Randomized, Phase 2 DESTINY-Lung02 Trial. J Clin Oncol. Published online: September 11, 2023.
- Johnson M, Awad M, Koyama T, et al. Ifinatamab deruxtecan (I-DXd; DS7300) in patients with refractory SCLC: a subgroup analysis of a phase 1/2 study. Presented at: World Conference on Lung Cancer; September 9-12, 2023; Singapore. Oral abstract OA05.05.
ЛУЧШЕЕ ПО МАТЕРИАЛАМ ВСЕМИРНОЙ КОНФЕРЕНЦИИ ПО РАКУ ЛЕГКОГО WCLC 2023
Авторы: Моисеенко Федор Владимирович
Федор Владимирович ГБУЗ «СПб КНпЦСВМП(о) им. Н.П. Напалкова»,
доктор медицинских наук, Санкт-Петербург >
Белышева Яна Вадимовна
ФГБОУ ВО «СанктПетербургский государственный педиатрический медицинский университет»
Минздрава России, Санкт-Петербург
World Conference on Lung Cancer – одно из крупнейших и наиболее насыщенных мировых мероприятий, посвященных лечению опухолей внутригрудной локализации. В рамках конференции в 2023 году были представлены данные, касающиеся всех этапов лечения. В этом материале – коротко о самых важных мировых новостях в области терапии рака легкого.
Иммунотерапия у пациентов с локализованными и местнораспространными опухолями
Несколько последних лет ознаменовались получением феноменальных для НМРЛ результатов при применении иммунотерапии у пациентов с местнораспространенными или даже локализованными опухолями. Довольно узкий и относительно малоэффективный ранее алгоритм применения лекарственной терапии до операции в настоящий момент имеет тенденцию превратиться в основной подход для лечения больных с IIA-IIIA стадиями. Это стало возможным благодаря существенному увеличению частоты полных и больших патоморфологических регрессов после 3-4 циклов химиоиммунотерапии по результатам нескольких клинических работ – AEGEAN, CheckMate 816, CheckMate 77T, KEYNOTE 671, IMpower 030 [1- 3]. Ранее значимость такого ответа была показана для многих опухолей, равно как и для рака легкого. Возможность выявлять pCR (полный патоморфологический ответ) или MPR (наибольший патоморфологический ответ) после окончания неоадъювантного этапа могла бы существенно изменить наши тактические подходы.
В рамках WCLC 2023 была представлена одна из таких успешных попыток. Изучив последовательные ПЭТ-КТ до начала неоадъювантной терапии и перед операцией, авторы предположили, что изменение SUV и гликолитический активности на фоне терапии может быть использовано как маркер для обогащения группы, достигшей pCR [4]. Проводя аналогию с меланомой, для которой в рамках исследования OpACIN-neo была предположена возможность избежать калечащих оперативных вмешательств в случае достижения полного патоморфологического регресса, выявление подобной глубины ответа без выполнения хирургического этапа – крайне соблазнительный результат [5].
Новые системы предсказания прогноза для локализованного рака
Другим направлением, которое, стремительно развиваясь, уже в ближайшем будущем может повлиять на определение минимальных изменений в опухоли, является радиомика. Лимфоваскулярная инвазия – один из негативных предиктивных факторов для IB стадии НМРЛ – может иметь неожиданно большую роль при предоперационном лечении локализованного НМРЛ. Одним из примеров того, как постепенно появляются возможности для применения искусственной оценки изображений и предсказания эффекта лечения, стала корейская работа, в которой на основании алгоритма анализа была показана возможность определения лимфоваскулярной инвазии на предоперационных КТ изображениях [6,7].
ИКТ для метастатического заболевания
Продолжается активное определение оптимального места ИКТ и для метастатического заболевания. После неожиданной демонстрации отсутствия выигрыша в общей выживаемости у больных с PD-L1 негативным плоскоклеточным раком легкого в рамках исследования KEYNOTE-407 в воздухе повис вопрос о целесообразности применения подобных дорогостоящих препаратов у малочувствительных пациентов [8]. Но, как показал подгрупповой анализ, проведенный для PD-L1 негативного рукава исследования CheckMate 227, комбинация ниволумаба и ипилимумаба позволяет достичь достоверного увеличения общей продолжительности жизни с медианой 17,4 мес. против 12,2 мес. для терапии цитостатиками. Что особенно любопытно, время до прогрессирования у больных с ответом на терапию было значительно выше и составило 19,4 мес. Это наблюдалось и при использовании другой комбинации – тремелимумаб и дурвалумаб [9,10].
Предполагаем, что на настоящий момент для пациентов с негативной экспрессией фактора чувствительности тот или иной вариант двойной иммунотерапии PD-1/PD-L1 и CTLA-4 ингибиторами может являться оптимальным.
Гериатрические системы оценки
Все больше данных появляется о необходимости интеграции в клиническую медицину гериатрических систем оценки перед проведением любого из вариантов терапии. Так, коллеги показали, что больные с нормальным уровнем ECOG-0-1, но малым «запасом прочности», к сожалению, значительно чаще преждевременно прекращают терапию по поводу местнораспространенного НМРЛ, а результаты ее проведения, несмотря на поддерживающую терапию дурвалумабом, оказываются значительно хуже [11].
Редкие вопросы лечения: есть прогресс?
Расширение использования информационных технологий существенно облегчает изучение редких вопросов. Один из тех вопросов, ответ на которые не будет получен в рандомизированных исследованиях в ближайшее время, – это оптимальная тактика лечения больных с местнораспространенными, ассоциированными с драйверными мутациями опухолями легкого. Так, сравнение стандартного и таргетного подходов у больных с мутациями EGFR проводится в настоящее время в рамках исследования LAURA, тем не менее, скорость набора в эту работу не позволяет надеяться на скорое завершение. В прошлом году были представлены данные, полученные коллегами из Китая, которые провели сетевой метаанализ и показали, что проведение ХЛТ с последующей поддерживающей терапией таргетным препаратом может быть лучше всех остальных методов для этой группы. В этом году другие исследователи проанализировали медицинские записи 58000 пациентов, среди которых было 169 больных с местнораспространенным ALK-ассоциированным НМРЛ. Сравнение применяемых для лечения подходов выявило преимущество таргетной терапии (медиана 17,8 мес.) относительно ХЛТ (14,8 мес.) [12].
Сразу в нескольких работах было проведено сравнение эффективности различных подходов в реальной клинической практике и в рамках метаанализов [13].
Новые системы предсказания эффекта иммунотерапии
Есть впечатление, что развитие индивидуализации будет происходить не за счет выявления отдельных предиктивных факторов, а за счет объединения уже известных и легкодоступных для определения характеристик в одну систему и выделения подгрупп с комбинациями признаков. Несомненно, оптимальным способом выявления подобных закономерностей для сложных, комбинированных характеристик является формирование тренированных нейронных сетей.
Например, на сегодняшний день не заполнена ниша, связанная с определением чувствительной к иммунотерапии популяции пациентов среди тех, кто рассматривается для проведения первой линии терапии. Попытки выявления этих подгрупп ведутся в нескольких направлениях. Одним из них является оценка влияния на выживаемость иммунотерапии в зависимости от различных сочетаний клинических факторов. Так, коллеги из Австралии поставили вопрос, есть ли связь локализации и объема метастатического поражения и эффективности иммунотерапии. В итоге анализа относительно небольшого числа пациентов (n=199) было показано, что к наиболее негативной группе относятся пациенты с поражением костей, у которых наблюдались самые низкие показатели ВДП и ОВ [14]. В другом исследовании фактором, предсказывающим благоприятную выживаемость на фоне ИТ, был избыточный вес, а косвенным признаком метаболического синдрома – изменения липидограммы [15].
Преодоление резистентности к иммунотерапии
В отсутствии принципиально новых подходов для преодоления резистентности к иммунотерапии несколькими группами изучался вопрос о применении более активных режимов с двумя ингибиторами у больных с прогрессированием заболевания после одной или нескольких линий. В небольшой работе применение ипилимумаба и ниволумаба у пациентов, резистентных к монотерапии ИКТ, позволило достичь ЧОО 17%, а у 48% – контроля заболевания. Медиана времени до прогрессирования, к сожалению, была невысока – 2,8 мес., однако из положительных моментов необходимо отметить более низкую частоту нежелательных явлений [16].
Новые молекулы для лечения НМРЛ
Лечение НМРЛ с активирующими мутациями также находится на этапе получения клинических результатов для целой серии новых молекул. С учетом доминирующего положения осимертиниба и отсутствия клинически значимых преимуществ в общей популяции интеграция новых препаратов требует выделения отдельных ниш для их клинического использования. Так, были представлены результаты применения аумолертиниба – нового ингибитора EGFR третьего поколения – в комбинации с анлотинибом (ингибитор ангиогенеза) у больных с частыми мутациями EGFR и метастатическим поражением головного мозга. Данный подход позволил достичь интракраниального ответа у 74,4% пациентов, а контроля очагов в головном мозге – у всех включенных пациентов. Любопытно, что в прогностически негативной группе с ко-мутациями ТР53 частота ответов не была ниже и составила 77,8%, однако преодолеть более низкую чувствительность у пациентов с L858R пока не удалось (61,9% против 88,9% для пациентов с делецией в экзоне 19) [17].
Другой актуальной нишей для совершенствования таргетного подхода является относительно нечувствительная к обычным ингибиторам EGFR группа с инсерциями в 18 экзоне. Для этих пациентов в рамках исследования 1b фазы применение фурмонертиниба позволило достичь ответа у 78,6% из пациентов, не получавших терапию, и у 38,5% – 46,2% из предлеченных больных [18].
Нетаргетный подход: ожидания оправдываются
Несмотря на значимость развития методов противоопухолевого воздействия с направленным на конкретные мишени механизмом, основные ожидания на настоящий момент оправдываются, в первую очередь, для «нетаргетного» подхода. Много лет назад было продемонстрировано, что комбинирование таргетных ингибиторов EGFR с цитотоксической терапией в первой линии терапии позволяет улучшить не только длительность ее эффекта, но и показатели отдаленной выживаемости. Тем не менее, до настоящего времени данный подход не был интегрирован в парадигму лечения НМРЛ. Одним из наиболее значимых событий конференции в этом году было представление ранних результатов исследования FLAURA2. Здесь проводилось сравнение монотерапии осимертинибом и химиотаргетной терапии у носителей мутации EGFR [19]. Комбинация осимертиниба в стандартной дозе 80 мг и платинового дуплета пеметрексед + карбоплатин/цисплатин позволила увеличить показатель ВДП с 16,7 до 25,5 месяца – и это существенное достижение! Крайне любопытно, что улучшение показателя относилось в равной мере и к пациентам с мутациями в 18 экзоне, и к менее чувствительным к таргетной терапии больным с точковой заменой в экзоне 21. Будет ли подобный подход принят как стандартный для больных с негативным прогнозом и мутацией L858R, метастатическим поражением головного мозга или наличием ко-активирующей мутации ТР53 – покажет время.
Другим «нетаргетным» подходом, который в течение последних нескольких лет развивается существенно быстрее остальных, является доставка высокотоксичных препаратов с помощью антител – конъюгаты. При НМРЛ этот подход очевидно ожидает большой успех. В рамках WLCC 2023 были представлены результаты применения сразу нескольких препаратов в совершенно разных областях. Так, патритумаб дерукстекан – конъюгат с анти-HER3 моноклональным антителом – в рамках исследования HERTHENA-Lung01 позволил достичь объективного ответа у 29,7% пациентов, а контроля заболевания – у 73,8% больных с EGFR-ассоциированным НМРЛ и резистентностью к стандартной таргетной терапии [20]. Другая комбинация анти-TROP моноклонального антитела сацитузумаба говитекана, уже нашедшего свое место при трипл-негативном раке молочной железы, и пембролизумаба позволила достичь ответа у 44% больных с умеренным уровнем экспрессии PD-L1 и у 69% пациентов с высоким уровнем [21]. Таким образом, в настоящее время мы находимся на пороге нового этапа развития лекарственной терапии НМРЛ.
Источники:
- Heymach JV, et al. Abstract CT005: AEGEAN: A phase 3 trial of neoadjuvant durvalumab + chemotherapy followed by adjuvant durvalumab in patients with resectable NSCLC. Cancer Research [Internet]. 2023 May 29.
- Wakelee H, et al. Perioperative Pembrolizumab for Early-Stage NonSmall-Cell Lung Cancer. The New England Journal of Medicine. 2023 Jun 3.
- Shun Lü, et al. Perioperative toripalimab + platinum-doublet chemotherapy vs chemotherapy in resectable stage II/III non-small cell lung cancer (NSCLC): Interim event-free survival (EFS) analysis of the phase III NEOTORCH study. Journal of Clinical Oncology. 2023 Jun 1; 41(16_suppl): 8501-1.
- Eun Seong Lee, et al. Parameters of FDG PET/CT predicting pathological response to neoadjuvant immunotherapy in stage II/III non-small cell lung cancer patients. WCLC 2023, Poster EP08.02- 01.
- Versluis JM, et al. Survival update of neoadjuvant ipilimumab plus nivolumab in macroscopic stage III melanoma in the OpACIN and OpACIN-neo trials. Annals of Oncology: Official Journal of the European Society for Medical Oncology. 2023 Apr 1.
- Misuk Lee Lymphovascular Invasion (LVI) Prediction with CT Images in Patients with Non-Small Cell Lung Cancer (NSCLC). WCLC 2023, Poster EP08.02-08.
- Takafumi Kabuto, et al. Prognostic Impacts of Lymphovascular Invasion of Resected Lung Adenocarcinoma after Induction Chemoradiotherapy. WCLC 2023, Poster EP08.02-35.
- Novello S, et al. Pembrolizumab Plus Chemotherapy in Squamous NonSmall-Cell Lung Cancer: 5-Year Update of the Phase III KEYNOTE-407 Study. Journal of Clinical Oncology. 2023 Feb 3.
- Brahmer JR, et al. Five-Year Survival Outcomes With Nivolumab Plus Ipilimumab Versus Chemotherapy as First-Line Treatment for Metastatic NonSmall-Cell Lung Cancer in CheckMate 227. Journal of Clinical Oncology. 2023 Feb 20; 41(6): 1200-12.
- Johnson ML, et al. Durvalumab With or Without Tremelimumab in Combination With Chemotherapy as First-Line Therapy for Metastatic Non-Small-Cell Lung Cancer: The Phase III POSEIDON Study. Journal of Clinical Oncology: Official Journal of the American Society of Clinical Oncology. 2022 Nov 3.
- James A Fletcher, et al. Real world chemoradiotherapy outcomes for frail older adults with unresectable stage III non-small cell lung cancer (NSCLC).
- Lu S, et al. Management of Inoperable Locally Advanced Stage III ALK fusion Positive NSCLC: A Retrospective Multi-institutional Analysis. WCLC 2023, Poster EP08.02- 40.
- Shunichi Kataoka, et al. EP11.03-04 Multi-institutional retrospective study for the efficacy of immune checkpoint inhibitor (ICI) plus platinum-based chemotherapy for epidermal growth factor receptor (EGFR) mutated non-small cell lung cancer (NSCLC). WCLC 2023, Poster EP11.03-04.
- Lauren Julia Brown, et al. Site-specific response patterns in patients with advanced NSCLC treated with first-line systemic therapy. WCLC 2023, Poster EP11.03-11.
- Sun Y, et al. Prognostic Value of Body Mass Index and Serum Lipid for First-line Immunotherapy in Patients with Advanced NSCLC: A Retrospective Study. WCLC 2023, Poster EP11.03-33.
- Takuma Imakita, et al. Reimmunotherapy with nivolumab plus ipilimumab in advanced non-small cell lung cancer patients previously treated with anti-programmed death-1 and/ or anti-programmed death ligand-1 antibodies. Discover Oncology. 2023 Aug 31; 14(1).
- Jing Chen, et al. Aumolertinib Plus Anlotinib in Advanced EGFRm+ NSCLC with Brain Metastasis: A Singlearm, Phase II Study. WCLC 2023, Report OA03.03.
- Baohui Han, et al. A Phase 1b Study Of Furmonertinib, an Oral, Brain Penetrant, Selective EGFR Inhibitor, in Patients with Advanced NSCLC with EGFR Exon 20 Insertions WCLC 2023, Report OA3.04.
- Pasi Janne, et al. Osimertinib With/Without Platinum-Based Chemotherapy as First-Line Treatment in Patients with EGFRm Advanced NSCLC (FLAURA2). WCLC 2023, Plenary PL03.13.
- Helena Yu, et al. Patritumab Deruxtecan (HER3 DXd) in mEGFR NSCLC Following EGFR TKI and Platinum Based Chemo: HERTHENA Lung01. WCLC 2023, Report OA5.03.
- Byoung Chul Cho, et al. Sacituzumab Govitecan (TROP 2 ADC) + Pembrolizumab in 1L Metastatic NSCLC. WCLC 2023, Report OA5.04.
РАННИЙ РАК МОЛОЧНОЙ ЖЕЛЕЗЫ: РИСК РЕЦИДИВОВ
Рак молочной железы (РМЖ) является наиболее часто встречающимся онкологическим заболеванием у женщин во всем мире, и Россия не является исключением [1,2]. В подавляющем большинстве случаев РМЖ диагностируется на ранних стадиях (I–III). К раннему РМЖ относят заболевание, ограниченное молочной железой и регионарными лимфатическими узлами, но не имеющее отдаленных метастазов в другие органы. В России доля раннего РМЖ среди впервые выявленных случаев постоянно растёт (рис. 1) и в 2022 г. составила 91,7% [2]. Таким образом, выбор наиболее эффективных опций адъювантной терапии с каждым годом становится всё более актуальным.
Эндокринная терапия (ЭТ) является основой адъювантного лечения гормонозависимого HER2- отрицательного (ГР+/HER2–) РМЖ [3], наиболее распространённого подтипа этого заболевания [4]. На ранних стадиях ГР+/HER2–РМЖ после хирургического лечения большинству пациентов рекомендуется назначать длительную (≥5 лет) адъювантную ЭТ согласно рекомендациям Европейского общества медицинской онкологии (ESMO) и Национальной всеобщей онкологической сети (NCCN) [1,5]. Для пациентов с повышенным риском рецидива рекомендована продленная адъювантная ЭТ [1,6- 8]. В дополнение к ЭТ может быть назначено лечение адъювантной химиотерапией (ХТ) с учётом степени риска рецидива и вероятной пользы от ХТ.
Назначение 5-летней адъювантной ЭТ существенно снижает
частоту рецидивов во время и
после лечения у женщин на ранних стадиях ГР+/HER2–РМЖ. При анализе выборки из более
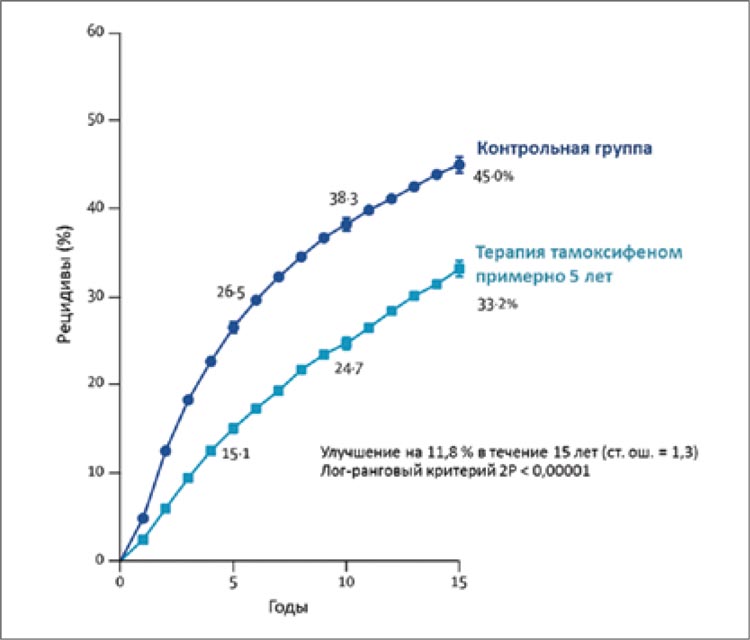
10 тыс. случаев ГР+ РМЖ (включая 20% случаев ЭР-неизвестного
РМЖ) было показано, что приём тамоксифена в течение 5 лет после постановки диагноза снижает 15-летнюю вероятность рецидивов на 11,8% по сравнению с
пациентами, не принимавшими
тамоксифен (рис. 2) [9].
Мета-анализ, объединивший 88
исследований и почти 63 тыс.
пациенток, показал, что каждая
третья (27-37%) женщина со II
стадией и каждая вторая (46-
57%) женщина с III стадией ГР+/
HER2– РМЖ рано или поздно
столкнется с рецидивом заболевания (рис.3) [10]. Было доказано,
что рецидивы могут возникать на
протяжении 15 лет наблюдений
уже после завершения 5-летней
адъювантной ЭТ, то есть в течение 20 лет после постановки диагноза. Таким образом, результаты
данного мета-анализа указывают
на субоптимальную эффективность 5-летней адъювантной ЭТ
у пациентов с ранними стадиями
РМЖ.
Рисунок 1.
Изменение доли больных с впервые установленным диагнозом РМЖ
на разных стадиях в России за 10 лет
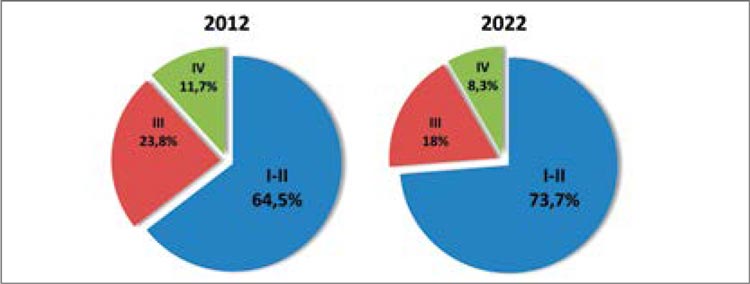
Рисунок 2.
Оценка вероятности рецидива при ГР+ (или ЭР-неизвестном) РМЖ у
пациенток, принимавших терапию тамоксифеном в течение 5 лет по сравнению с контрольной группой, не принимавшей тамоксифен. Оценка основана
на данных 10 386 женщин: 20% случаев ЭР-неизвестного РМЖ, 30% случаев
с метастазами в лимфатические узлы. Планки погрешности составляют ±1
ст.ош. [9]
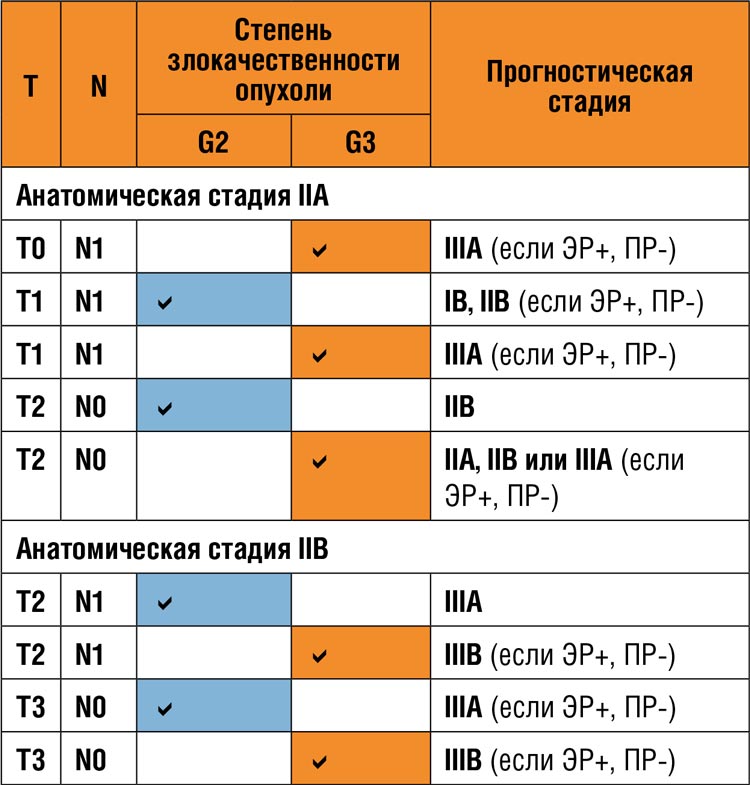
Анатомическая стадия опухоли, выявленная при постановке диагноза, является важным прогностическим фактором. Было показано, что вероятность возникновения отдаленных рецидивов связана с исходным статусом TN (рис. 3), а пациенты с более продвинутой стадией имеют худший прогноз относительно выживаемости без признаков заболевания (ВБИЗ) по сравнению c пациентами на начальных стадиях [11,12]. Выделяют низкий, промежуточный и высокий риски развития рецидива, которые соответствуют анатомическим стадиям РМЖ 0-I, II и III согласно критериям AJCC (рис. 4) [11]. При этом некоторые пациенты с одинаковыми анатомическими стадиями могут быть отнесены к более высокой прогностической стадии, если по результатам оценки морфологических особенностей их опухоль имеет более высокую степень злокачественности (G) (табл. 1) [11].
Рисунок 3.
Частота возникновения отдаленных рецидивов в зависимости от стадии раннего ГР+ РМЖ (планки погрешностей соответствуют 95% доверительному интервалу (ДИ)) [10]. ЭТ – эндокринная терапия, TN – классификация
опухоли, где T – оценка распространения рака груди, N – оценка поражения
регионарных лимфоузлов.
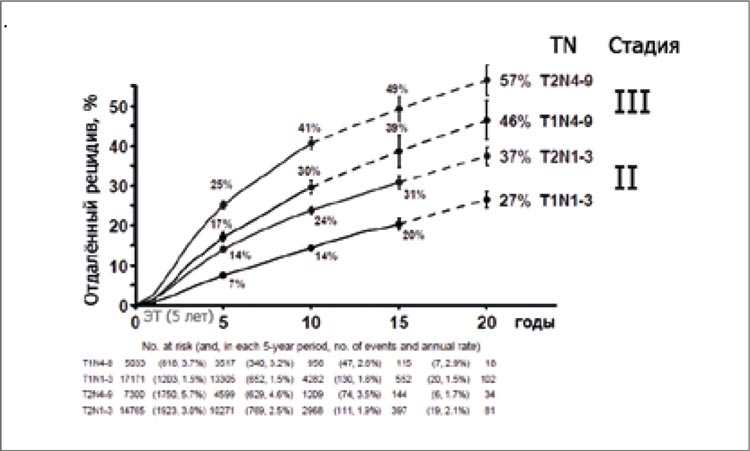
Рисунок 4.
Соответствие уровня риска развития рецидива и прогностической
стадии РМЖ. Классификация риска в зависимости от анатомической стадии
согласно клиническим рекомендациям AJCC [11]]
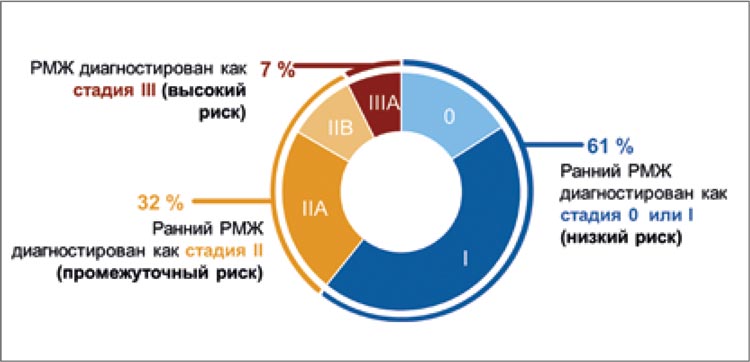
Таблица 1.
Взаимосвязь анатомической и прогностической стадий в зависимости от степени злокачественности опухоли [11].
В некоторых случаях при ГР+/ HER2– раннем РМЖ прогностическое значение может иметь оценка уровня экспрессии Ki-67. Уровни экспрессии делят на низкий (<10%), умеренный (10-19%) и высокий (≥20%) [13]. Но прогностическая ценность Ki-67 для пациентов с опухолями разной степени тяжести различна. Так, для пациентов с I стадией, и пациентов со II стадией и низким или средним уровнями экспрессии Ki-67 прогностическая роль этого критерия несущественна. Но для пациентов со II стадией заболевания уровень экспрессии Ki-67 ≥20% является фактором неблагоприятного прогноза, который переводит пациентов с промежуточным риском в прогностическую группу с высоким риском рецидива [13].
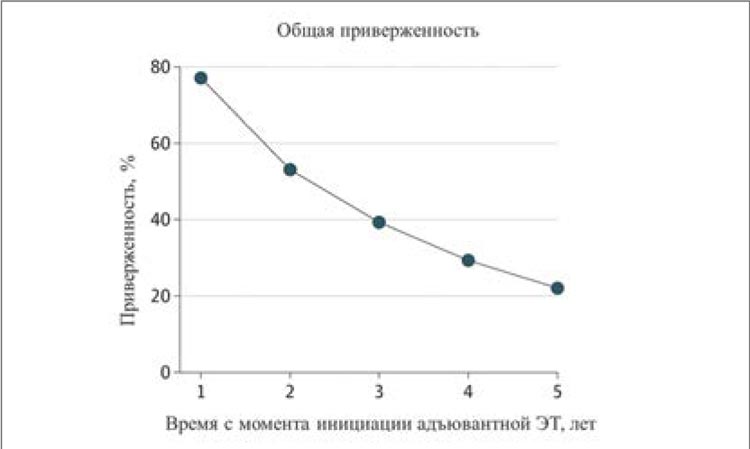
Дополнительной проблемой, влияющей на эффективность адъювантной терапии при раннем РМЖ, является приверженность пациентов лечению. Как показало недавнее исследование, проведённое в США и включившее более 1700 женщин, соблюдение режима адъювантной ЭТ существенно снижается с течением времени: от 77% пациенток, соблюдавших режим лечения в течение первого года, всего до 22% пациенток, соблюдавших режим лечения в течение полных 5 лет (рис. 5) [14].
Рисунок 5.
Изменение приверженности адъювантной ЭТ у женщин
с ГР+/HER2– ранним РМЖ в течение 5 лет [14].
Таким образом, при раннем РМЖ вероятность рецидива может сохраняться многие годы (более 20 лет от постановки диагноза). Основными критериями, отражающими степень риска развития рецидива, являются анатомическая стадия заболевания, выявленная при постановке диагноза, и степень злокачественности опухоли. Два этих критерия в совокупности определяют прогностическую группу пациента. В то же время для пациентов с промежуточным риском имеет значение уровень экспрессии Ki-67, который позволяет уточнить прогностическую группу. Сильное снижение приверженности пациентов лечению в ходе 5-летнего курса адъювантной ЭТ также может приводить к снижению её эффективности. Поскольку лечение пациентов с ранним РМЖ проводится с целью достижения полного выздоровления, риск появления локорегионарных и/или отдаленных рецидивов всё ещё остаётся серьезной проблемой.
Литература:
- Cardoso F, Kyriakides S, Ohno S, et al. Early breast cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2019;30(8):1194-1220. doi:10.1093/ annonc/mdz173
- Состояние онкологической помощи населению России в 2022 году. Под редакцией А.Д. Каприна, В.В. Старинского, А.О. Шахзадовой – М.: МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии». Минздрава России, 2023. – 249 с. Электронный ресурc: https://oncology-association. ru/sostoyanie-onkologicheskojpomoshhi-naseleniyu-rossii-v-2022- godu (Дата последнего обращения – 21 сентября 2023 г.)
- Pistilli B, Lohrisch C, Sheade J, et al. Personalizing adjuvant endocrine therapy for early-stage hormone receptor-positive breast cancer. Am Soc Clin Oncol Educ Book. 2022; 42: 1–13.
- Howlader N, Altekruse SF, Li CI, et al. US incidence of breast cancer subtypes defined by joint hormone receptor and HER2 status. J Natl Cancer Inst 2014; 106: dju055.
- National Comprehensive Cancer Network. Breast Cancer, http://www. nccn.org/professionals/physician_gls/ pdf/breast.pdf (Дата последнего обращения – 21 сентября 2023 г.)
- Davies C, Gray R, Pan H, et al. Tamoxifen therapy for patients with breast cancer – authors’ reply. Lancet 2013; 381: 2078–2079.
- Jakesz R, Greil R, Gnant M, et al. Extended adjuvant therapy with anastrozole among postmenopausal breast cancer patients: results from the randomized Austrian Breast and Colorectal Cancer Study Group Trial 6a. J Natl Cancer Inst 2007; 99: 1845– 1853.
- Howell A. Adjuvant aromatase inhibitors for breast cancer. Lancet 2005; 366: 431–433.
- Early Breast Cancer Trialists' Collaborative Group (EBCTCG). Effects of chemotherapy and hormonal therapy for early breast cancer on recurrence and 15- year survival: an overview of the randomised trials. Lancet. 2005 May 14-20;365(9472):1687-717. https://doi. org/10.1016/S0140-6736(05)66544-0
- Pan H, Gray R, Braybrooke J, et al. 20-Year Risks of BreastCancer Recurrence after Stopping Endocrine Therapy at 5 Years. N Engl J Med. 2017 Nov 9;377(19):1836- 1846 (+ supplementary). https://doi. org/10.1056/NEJMoa1701830
- Amin MB, et al. AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer International Publishing; 2017.
- Park Y.H. et al. Clinical relevance of TNM staging system according to breast cancer subtypes. Ann Oncol. 2011;22(7):1554-1560. doi: 10.1093/annonc/mdq617
- Fasching PA, et al. Prognostic effect of Ki-67 in common clinical subgroups of patients with HER2- negative, hormone receptor-positive early breast cancer. Breast Cancer Res Treat. 2019;175(3):617-625. doi: 10.1007/s10549-019-05198-9
- Sood N, et al. Association of Endocrine Therapy Initiation Timeliness With Adherence and Continuation in Low-Income Women With Breast Cancer. JAMA network open 2022;5(8):e2225345. https://doi.org/10.1001/ jamanetworkopen.2022.25345
«При поддержке
ООО Новартис Фарма»
740438/onco/art/11 23/1
СОВРЕМЕННЫЕ ПОДХОДЫ К ДИАГНОСТИКЕ И ЛЕЧЕНИЮ МЕЗОТЕЛИОМЫ. ОБЗОР МАТЕРИАЛОВ КОНФЕРЕНЦИИ IMIG-2023
Автор: Барболина Татьяна Дмитриевна
Врач-онколог, ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России,
ассистент кафедры онкологии ФДПО МГМСУ им. А.И. Евдокимова,
кандидат медицинских наук, Москва
Часть 1: мезотелиома плевры
В период с 26 по 28 июля 2023 года в
г. Лилль состоялась 16-я Международная конференция международной группы по изучению мезотелиом
(International Mesothelioma Interest
Group – iMig) совместно с Французской объединенной торакальной
группой (French Cooperative Thoracic
Intergroup – IFCT). Эта междисциплинарная конференция собрала
делегатов со всего мира, чтобы представить современные представления по различным интересующим
вопросам в отношении мезотелиом
различных локализаций. Впервые
Россия принимала участие в этой
конференции.
Международная группа по изучению
мезотелиомы (iMig) представляет
собой сообщество врачей, фундаментальных исследователей, ученых,
включая сестринские, пациентские
фармацевтические, общественные и
юридические сообщества. Это единственная общественная организация, посвященная исключительно
изучению мезотелиомы, занимающаяся вопросами генетики, иммунных и молекулярных механизмов
и эпидемиологических факторов,
лежащих в основе развития мезотелиомы, с целью установления наилучших возможностей диагностики
и лечения этого заболевания.
Основываясь на опыте и успехе предыдущих конференций с момента
основания iMig в Париже в 1991 году
(далее каждые 2 года конференция
проходила в Бостоне, Кейптауне,
Бирмингеме, Оттаве, не говоря уже
об успешной виртуальной конференции iMig, проведенной в 2021 году
австралийскими коллегами), 16-я
конференция, благодаря семинарам,
пленарным заседаниям, устным и
стендовым докладам, предоставила
множество возможностей для общения с ведущими учеными и исследователями, а также с пациентами и их
ассоциациями, в первую очередь, для
налаживания международного сотрудничества.
Мы представляем материалы по наиболее интересным и спорным вопросам в отношении злокачественной
мезотелиомы.
Эпидемиология
К сожалению, истинная распространенность мезотелиомы неизвестна,
поскольку есть страны, которые
не репортируют о случаях выявления мезотелиомы. Заболеваемость
очень сильно вариабельна от 0 до 10
случаев на миллион населения каждый год. Статистические данные по
распространенности мезотелиомы
хорошо представлены из Австралии, Великобритании, Нидерландов,
Италии, Голландии и США. К сожалению, мало подобной информации
из Индии, Африки и России. Попрежнему основной причиной развития мезотелиомы считается асбест,
причем все его волокна, особенно
амфиболовые варианты, а также вермикулит, цеолит, ставший причиной
массовой семейной наследственной
мезотелиомы в Турции, как и флюорит на Сицилии. Однако тип, размер
и синергизм асбестовых волокон, а
также длительность контакта с ними
остаются предметом изучения. Не
стихают противоречивые данные о
вреде хризотил-асбеста и его роли
в развитии мезотелиомы. Другими
причинами возникновения мезотелиомы считаются радиация, хроническое воспаление, генетическая
предрасположенность. Несмотря на
все имеющиеся знания, в нашей
практике появляется новый термин «идиопатическая» мезотелиома, причины возникновения которой неясны.
По мнению Vahan Kepenekian,
(Франция) заболеваемость мезотелиомой в различных странах приняла масштабы эпидемии. Тенденция
эпидемии остается неопределенной.
Отсутствие данных по подавляющему большинству стран мира не позволяет достичь осознания рисков,
связанных с воздействием асбеста.
На рисунке 1 представлены стандартизованные по возрасту (мировые)
показатели заболеваемости на 100
000 населения среди мужчин [1].
Рисунок 1.
Мезотелиома в некоторых странах. Стандартизированные по возрасту (мировые) показатели заболеваемости на 100 000 населения, мужчины.
Молекулярно-генетические
основы развития мезотелиом.
Плевральная и перитонеальная мезотелиома –
родственники, но не сестры
О том, что мезотелиома плевры и
мезотелиома брюшины являются
абсолютно самостоятельными нозологиями, становится все очевиднее.
Геномный ландшафт мезотелиом в
основном характеризуется потерей
генов-супрессоров опухолей и мутациями в генах репарации ДНК. В
настоящее время данные молекулярно-генетического анализа методом
секвенирования нового поколения
(NGS) мезотелиомы ограничены малым числом наблюдений. Согласно
результатам обследования 198 пациентов, у 23 (12%) пациентов с мезотелиомой плевры, брюшины и вагинальной оболочки яичка выявлено
24 герминальные (зародышевые)
мутаций в 13 генах (рис.2). Мутации
BAP1 встречались чаще (n=6; 25%).
Плевральная локализация, воздействие асбеста и пожилой возраст
связаны с низкой вероятностью наличия зародышевой мутации [2].
Герминальные мутации встречаются
в 25% случаев при перитоненальной
мезотелиоме и лишь в 7% случаев при
плевральной локализации (p<0,01).
Рисунок 2.
А) Гены предрасположенности к развитию мезотелиомы.
В) Клиническая характеристика пациентов с герминальной мутацией
Hiltbrunner S., ссылаясь на работы
Raphael Bueno (2016 г.) и Hmeljak
J. (2018 г.), лидеров по морфологической диагностике мезотелиом,
представил данные о распространенности геномных нарушений при
мезотелиоме плевры (n-1113) и мезотелиоме брюшины (n-355) [3]. Анализ выявил изменения в 19 генах с общей распространенностью не менее
2%. BAP1, CDKN2A, CDKN2B, NF2,
MTAP, TP53 и SETD2 встречались с
распространенностью не менее 10%.
Изменения CDKN2A, CDKN2B и
MTAP представляли собой преимущественно делеции числа копий. Мезотелиома брюшины, по сравнению
с мезотелиомой плевры, характеризовалась меньшей распространенностью мутаций CDKN2A, CDKN2B
и MTAP. Более того, авторы смогли
определить четыре отдельные подгруппы в соответствии с наличием
BAP1 и CDKN2A/B (рис.3). Группа 1
характеризуется изменениями BAP1,
CDKN2A и CDKN2B. Для группы
2 характерны только CDKN2A и
CDKN2B. Группа 3 характеризуется
мутацией BAP1, а группа 4 не имеет
генетических поломок вовсе.
Подгруппы только с нарушением
CDKN2A и подгруппы с изменением
CDKN2A/BAP1 имеют наихудшую
выживаемость. Интересно, что подгруппа без изменений CDKN2A или
BAP1 имеет наиболее благоприятный
прогноз (рис.4).
Рисунок 3.
. Геномные изменения в опухолях мезотелиомы плевры
(слева) и при мезотелиоме брюшины (справа)
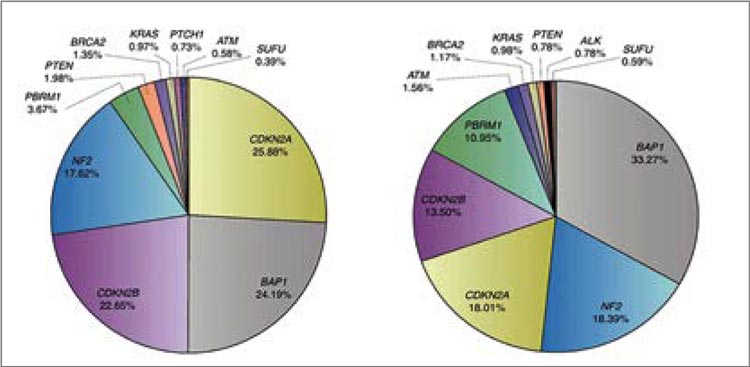
Рисунок 4.
Общая выживаемость пациентов с различными вариантами
генетических нарушений.
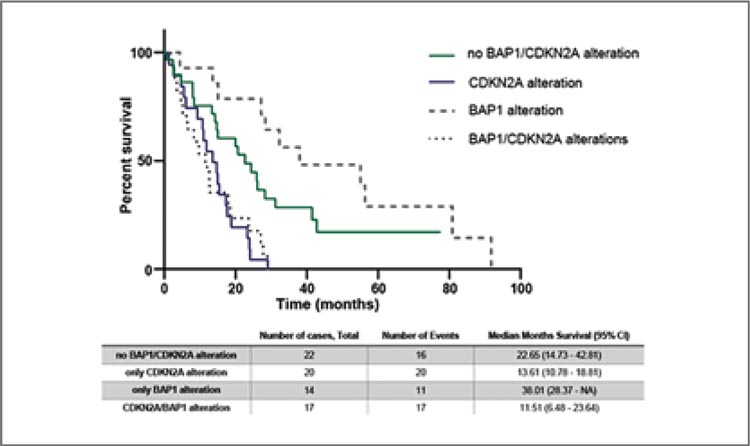
Мезотелиомы содержат меньше соматических мутаций по сравнению с
Рисунок 1. Мезотелиома в некоторых странах. Стандартизированные по возрасту (мировые) показатели заболеваемости на 100 000 населения, мужчины.
другими опухолями, при этом менее
5% опухолей мезотелиомы имеют высокий показатель мутационной нагрузки (TMB) (определяемой как ≥10
мутаций/Mb): в среднем 1,7 мутации
на Мб [4]. Авторы не обнаружили
различий в TMB между плевральным
и перитонеальным поражением. Так,
встречаемость высокой TMB была у
15 (1,35%) пациентов с мезотелиомой
плевры и у 5 (1,41%) пациентов с мезотелиомой брюшины.
Морфологическая
классификация
В международной гистологической
классификации ВОЗ 2021 года (5-е
издание) появились новые термины и подходы к морфологической
диагностике мезотелиом. В первую
очередь, принципиальным отличием от классификации 2015 года стало понимание, что все мезотелиомы
злокачественные. Плевральная мезотелиома и мезотелиома перикарда
были объединены в одну главу, тогда
как в классификации ВОЗ за 2015 г.
мезотелиома перикарда была классифицирована как опухоли сердца.
Во-вторых, абсолютным открытием
стала неинвазивная мезотелиома in
situ (MIS), характеризуемая как преинвазивные одиночно расположенные участки пролиферации неопластических мезотелиальных клеток с
потерей BAP1 и/или CDKN2A/MTAP.
BAP1, CDKN2A, MTAP и р16 стали
практически обязательными диагностическими маркерами. Однако потеря BAP1 по данным ИГХ не является
эквивалентом герминальной мутации, а р16 не определяет степень злокачественности. MTAP методом ИГХ
будет суррогатом потери CDKN2A.
Клиническая картина MIS включает
в себя отсутствие опухолевых масс по
плевре как по данным рентгенологических методов обследования, так и
при торакоскопической визуализации. Рецидивирующий плеврит, семейный анамнез, длительный контакт
с асбестом или воздействие радиации
дают основание заподозрить эту формы мезотелиомы. В этом случае очевидной становится необходимость
множественной биопсии плевры,
перикарда, брюшины, исследование
смывов с плевральных поверхностей
и внесения диагностических изменений в существующие клинические рекомендации. Основные изменения в
новой классификации представлены
в таблице 1.
Таблица 1.
Сравнительная характеристика международной
гистологической классификации мезотелиом (WHO) 2015-2021 гг.
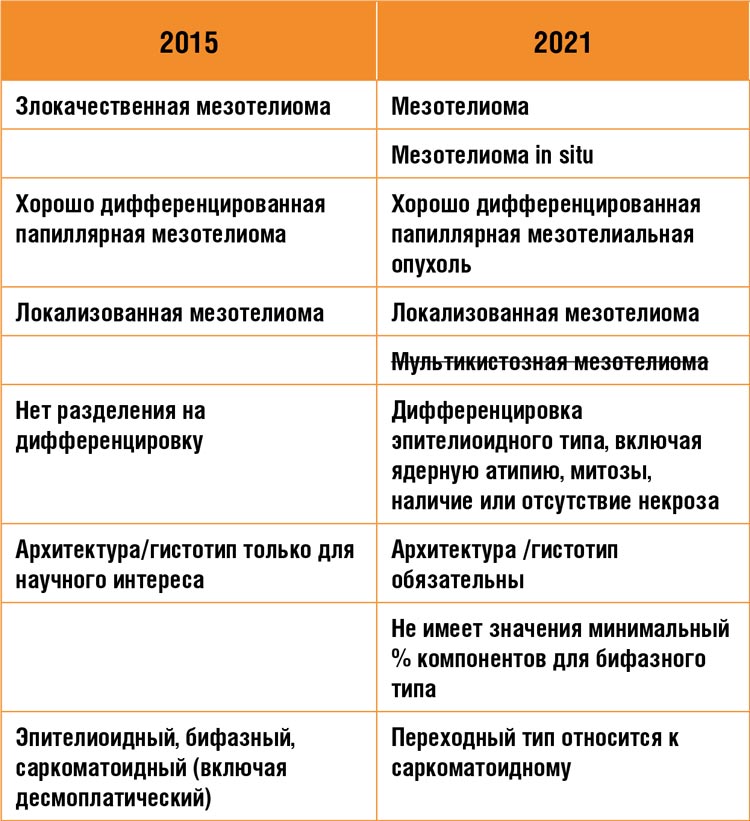
Таким образом, выделение MIS диктует необходимость пересмотра TNM
классификации и внесения изменений в диагностические и лечебные
подходы, а хорошо дифференцированная папиллярная мезотелиальная
опухоль (WDPMT) рассматривается
как предрак (рис.5).
Рисунок 5.
Алгоритм морфологической диагностики хорошо
дифференцированной папиллярной мезотелиальной опухоли
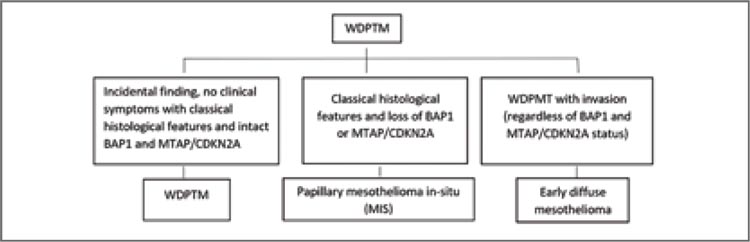
Для эпителиоидной диффузной мезотелиомы становится обязательным
определение степени дифференцировки (high или low grade) и других
цитологических и/или стромальных
особенностей (рис.6).
Рисунок 6.
Примеры диффузной мезотелиомы плевры с ядерной атипией: А)
легкая, 1; Б) умеренная, 2; и C) тяжелая, 3.
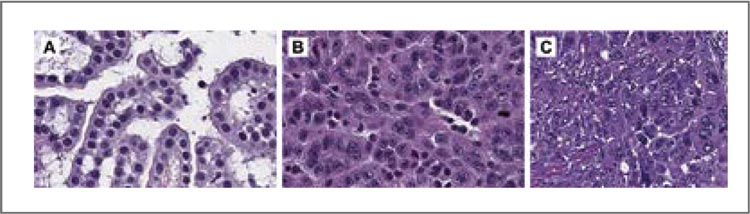
Таким образом, обобщив данные о
молекулярном ландшафте мезотелиомы за последние 6 лет, была создана
молекулярная классификация мезотелиомы (рис.7).
Рисунок 7.
Дизайн молекулярной классификации мезотелиом в современном
представлении.
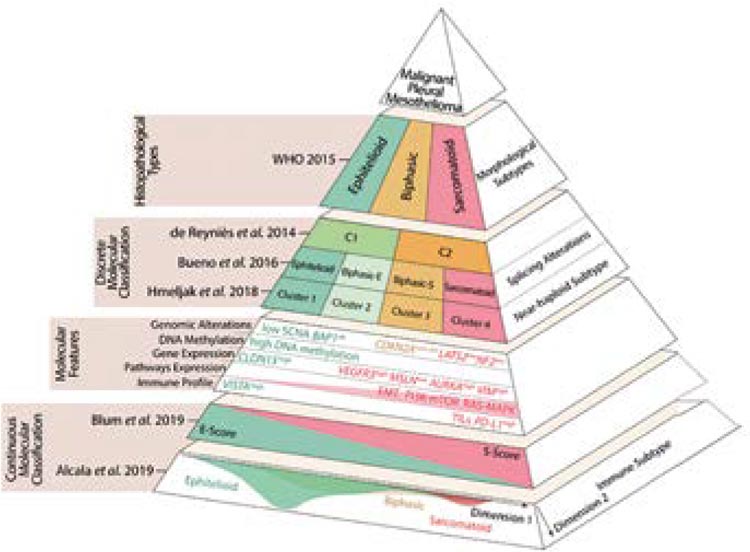
Новая терминология
в хирургии
Существующая в настоящий момент
терминология в описании объемов
хирургического лечения мезотелиомы
плевры не позволяет сформировать
единый стандартизованный хирургический подход. Японские коллеги
настаивают на необходимости единых правил описания операционного
протокола, что позволит объединять
международный опыт, учитывая
редкость заболевания и резектабельных форм особенно. Как известно,
в настоящее время используется два
вида операции: плевропульмонэктомия (ЕРР) и плеврэктомия (или декортикация легкого) (PD). Какая из
вышеперечисленных хирургических
процедур предпочтительнее, до сих
пор не установлено, поскольку нет
рандомизированных клинических исследований, сравнивающих обе процедуры, и решение о том, какую хирургическую процедуру выполнить,
больше зависит от предпочтений и
опыта хирурга. Нерандомизированные сравнения и объединенные данные из крупных регистров позволяют
предположить, что PD может быть
более осуществимой процедурой изза более низкой периоперационной
смертности и лучшего качества жизни, в том числе у пожилых пациентов,
из-за его щадящей техники.
Действующая терминология не позволяет описать все проведенные хирургические манипуляции, а полнота
редукции и эксплоративная торакотомия вовсе не учитываются.
Для более стандартизованного подхода для применения в ежедневной
клинической практике предлагается
более удобная и понятная хирургическая номенклатура, которая поможет
хирургу описать все детали:
1) Название операции:
• ЕРР или PD без резекции диафрагмы/перикарда
• Расширенные (extEPP, extPD) с
резекцией диафрагмы/перикарда
• ET – эксплоративная торакотомия
2) Радикальность операции:
Термин макроскопически полная резекция (MCR) должен включать удаление всех визуально и пальпаторно
определяемых очагов опухоли. В зависимости от объема (%) остаточной
резидуальной опухоли выделены 4
типа макроскопически определяемой
полноты редукции:
• 0% – MCR=R1
• <10% – R2
• 10-90% – частичная (partial) PD
• >90% – эксплоративная операция
(ET)
3) Объем резекции:
Декортикация – PD, часть легкого – L:
• PD – без резекции легкого
• PD-L1 – с клиновидной резекцией
части легкого
• PD-L2 – с сегментэкомией
• PD-L3 – с лобэктомией
При расширенной плеврэкомии к вышеуказанным аббревиатурам добавляется приставка «ext».
• CW (Chest wall) – резекция грудной
стенки
• CW-0 – резекция не проводилась
• CW-1 – резекция мягких тканей
• CW-2 – резекция ребер
Таким образом, объем проведенной
операции может быть указан как
extPD-L2 CW-0 R2, что будет означать,
что проведена расширенная плеврэктомия с резекцией диафрагмы, перикарда, сегментэктомией легкого, без
резекции грудной клетки, с остаточной опухолью менее 10%.
Будут ли внесены изменения в действующую терминологию, пока неизвестно, но то, что существующая не
удовлетворяет потребностей хирургов, занимающихся лечением мезотелиом, очевидно.
Неоадъювантная терапия и
комплексный подход
Подходы к лечению мезотелиом различных локализаций различаются,
однако при любом типе оптимальным
является комплексный подход. Роль
хирургического метода лечения за
последние годы возросла в большей
степени при мезотелиоме брюшины
(рис.8), а использование системной
химиотерапии увеличилось с 2003
года для мезотелиомы плевры (с 9,3%
до 39,4% на основании анализа 12168
пациентов из Голландского ракового
регистра) [6].
Несмотря на то, что число пациентов,
получивших лечение, увеличивается с
2003 года, большинство пациентов по
данным на 2018 год не получают никакой противоопухолевой терапии.
Надо отметить, что хирургический
метод по-прежнему является основным в лечении мезотелиомы как
плевры, так и брюшины. Выживаемость несколько улучшилась за последние годы, однако прогноз этого
заболевания по-прежнему остается
неблагоприятным (рис.9).
Рисунок 9.
Кривые общей выживаемости пациентов (1993-2018 гг.) с мезотелиомой плевры (слева) и брюшины (справа) в зависимости от проводимого
лечения
Поскольку ни EPP, ни PD не гарантируют радикального удаления опухоли
при мезотелиоме плевры, в настоящее
время весьма актуальным является
комплексный подход с включением
неоадъювантной или адъювантной
химиотерапии, послеоперационной
лучевой терапии (PORT) или других
вмешательств, таких как фотодинамическая терапия (ФДТ) или гипертермическая интраоперационная
внутриплевральная химиотерапия
(HITOX), или их комбинации.
Мультимодальный подход в лечении
мезотелиомы плевры является наиболее эффективным, при котором мОВ
достигла 17-25 мес., но последовательность хирургического, лучевого и лекарственных методов все еще обсуждается. В ретроспективном анализе
Sharkey et al. разницы в ОВ между адъювантной и неоадъювантной химиотерапией не получено [7], а по данным Cao et al. мОВ составила 23,1 мес.
в группе адъювантной химиотерапии
по сравнению с 27,8 мес. в группе неоадъювантной химиотерапии [8].
Следует также понимать, что сроки
и схемы адъювантной химиотерапии
различаются между исследованиями,
и несмотря на то, что неоадъювантный этап удается провести большинству пациентов, хирургическое лечение с последующей лучевой терапией
получают не более 52-65% пациентов
по данным различных авторов
Окончательным, по-видимому, ответом в этом вопросе станут результаты
рандомизированного исследования
II фазы EORTC1205, предварительно показавшие отсутствие различий
между группами с индукционной химиотерапией и хирургией up-front. В
исследование включались пациенты
с cT1-3N0-2M0 (7-я классификация), ранее не получавшие противоопухолевого лечения (химический плевродез тальком допускался).
Группа А получала хирургическое лечение и адъювантную ХТ (3-6 циклов
пеметрексед/цис- или карбоплатин).
Группа В начинала лечение с неоХТ с
последующей операцией не позднее 4
недель после завершения лекарственной терапии. Запланированный объем операции – PD или extPD.
Включено 64 пациента, по 32 в каждую группу. Характеристика пациентов представлена в таблице 2.
Официальные результаты исследования еще не опубликованы. Предварительные данные представлены в
таблице 3, согласно которым авторы
видят некоторое преимущество в
адъювантном лечении в показателях
выживаемости без прогрессирования.
Таблица 2.
Характеристика пациентов, включенных в исследование
EORTC1205
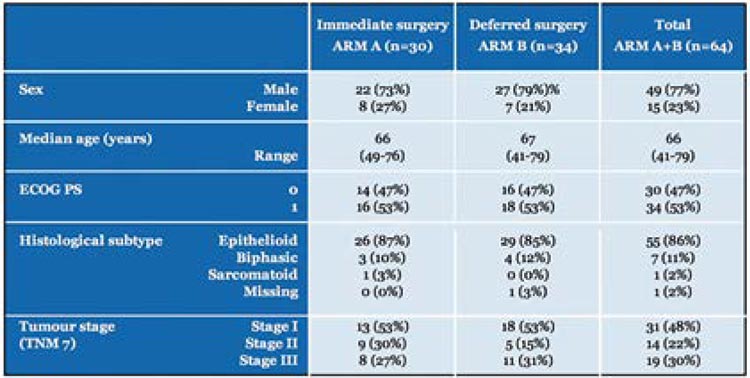
Таблица 3.
Предварительные результаты эффективности и токсичности неоадъювантной и адъювантной химиотерапии в исследовании EORTC1205
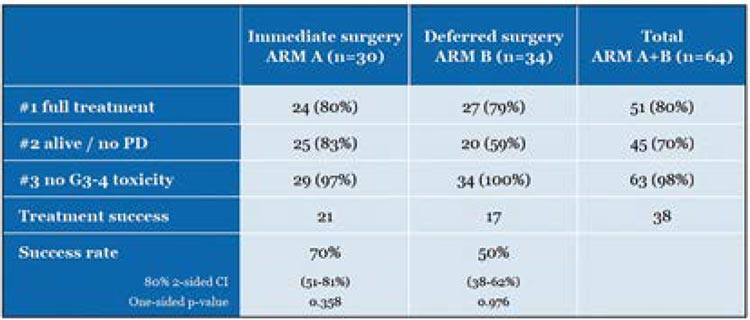
В ходе дискуссии на конференции
iMig2023 ведущими экспертами было
подтверждено, что определяющую
роль в выборе последовательности
операции и химиотерапии играет
Таблица 1. Сравнительная характеристика международной
гистологической классификации мезотелиом (WHO) 2015-2021 гг.
2015 2021
Злокачественная мезотелиома Мезотелиома
Мезотелиома in situ
Хорошо дифференцированная
папиллярная мезотелиома
Хорошо дифференцированная
папиллярная мезотелиальная
опухоль
Локализованная мезотелиома Локализованная мезотелиома
Мультикистозная мезотелиома
Нет разделения на
дифференцировку
Дифференцировка
эпителиоидного типа, включая
ядерную атипию, митозы,
наличие или отсутствие некроза
Архитектура/гистотип только для
научного интереса
Архитектура /гистотип
обязательны
Не имеет значения минимальный
% компонентов для бифазного
типа
Эпителиоидный, бифазный,
саркоматоидный (включая
десмоплатический)
Переходный тип относится к
саркоматоидному
опыт хирурга. Поскольку неоадъювантная химиотерапия не приводит
к увеличению резектабельности и
уменьшению объема операции, а отдаленные результаты доказательно не
улучшены, то хирургическое лечение
при условии абсолютной резектабельности опухоли должно быть в приоритете, и именно с этого лечения
нужно начитать, добавляя системную
ХТ в адъювантном режиме.
Иммунотерапия
Иммунотерапия все больше проникает в сферу лечения злокачественных
новообразований. Представлены результаты небольшого мультицентрового исследования I фазы S1619 по
изучению неоадъювантной терапии
атезолизумабом в сочетании с пеметрекседом и цисплатином с поддерживающей адъювантной терапией
атезолизумабом при резектабельной
I-III ст. мезотелиоме плевры. В исследование включены 28 пациентов.
Неоадъювантная терапия включала
четыре цикла цисплатина (75 мг/м2),
пеметрекседа (500 мг/м2) и атезолизумаба (1200 мг в/в) каждые 3 недели.
При отсутствии прогрессирования
болезни был проведен хирургический
этап. Далее проводилась адъювантная
иммунотерапия атезолизумабом 1200
мг внутривенно каждые 3 недели в
течение 1 года. Объем операции выбирался на усмотрение хирурга: ЕРР
или PD. Пациенты, перенесшие пневмонэктомию, также получили послеоперационную лучевую терапию.
В итоге 25 пациентов получили как
минимум 2 курса неоадъювантной
терапии, и 21 пациент получил весь
запланированный объем неоадъювантного лечения, однако только 18
из них были прооперированы (1 –
EPP, 17 – PD), а 15 получили поддерживающую терапию атезолизумабом.
К сожалению, 7 пациентов не завершили первый этап лечения: несмотря на раннюю стадию болезни, у 4
пациентов при нео-терапии отмечено
прогрессирование, у 2 пациентов развилась непереносимая токсичность, 1
пациент скончался из-за сепсиса, не
связанного с проводимым лечением.
Через 20 месяцев наблюдения медиана общей выживаемости не была достигнута, а медиана выживаемости
без прогрессирования составила 18,6
мес. (рис.10).
Рисунок 10.
Кривые общей и безрецидивной выживаемости при неоадъювантной химиоиммунотерапии в исследовании S1619.
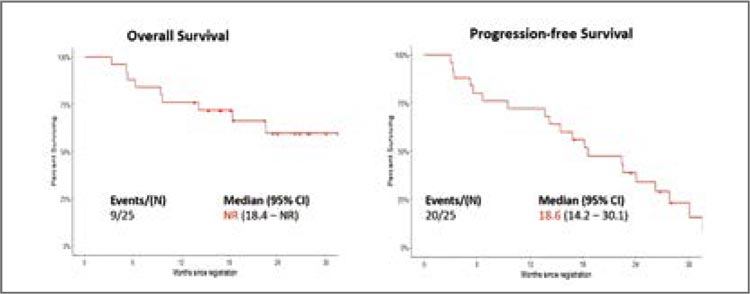
Предвзятость отбора была проблемой для этого исследования. Пока не
будет проведен окончательный анализ, авторы хотели бы воздержаться
от рассуждений о пользе добавления
атезолизумаба в схему неоадъювантного лечения.
Иммунотерапия
неоперабельной
мезотелиомы плевры
Иммунотерапия активно включается в схемы лечения мезотелиомы плевры. Мы уже знаем о прорывных результатах исследования
CheckMate-743, где комбинация двух
иммунных препаратов ниволумаба
и ипилимумаба позволила улучшить
общую выживаемость при всех гистологических подтипах по сравнению со стандартной химиотерапией
пеметрекседом с цисплатином (18,1
против 14,1 мес. соответственно).
Более того, число пациентов, удерживающих ответ через 4 года, составило
16% при иммунотерапии в сравнении
с 0% при ХТ.
Безусловным фаворитом на конференции стали результаты исследования Канадской группы по изучению
рака (CCTG) IND.227 при использовании комбинации химиотерапии с
пембролизумабом в 1 линии лечения
(рис.11).
Рисунок 11.
Дизайн исследования IND.227
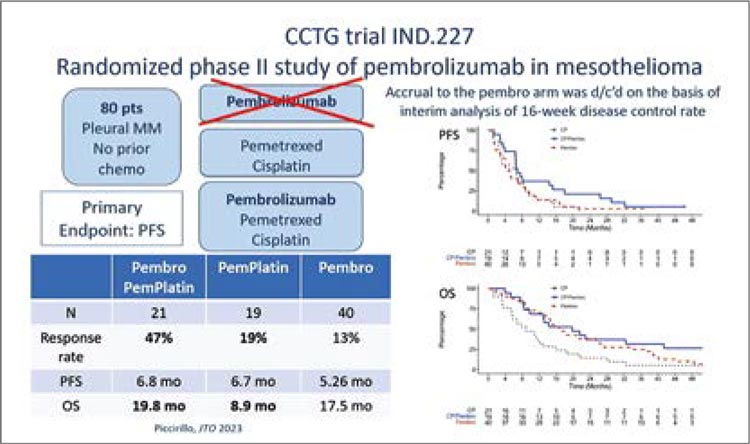
В исследование рандомизировано
440 пациентов с МП; 218 пациентов
в группу химиотерапии пеметрексед/
цисплатин и 222 пациента в группу с
ХТ теми же препаратами и пембролизумабом. Медиана общей выживаемости составила 17,3 мес. против 16,1
мес. для группы ХТ-пембро против
группы с ХТ (HR 0,79; 95% CI 0,64-
0,98; p=0,0324), мВБП составила 7,13
мес. против 7,16 мес. соответственно
(HR 0,80; 95% CI 0,65-0,99, р=0,0372).
Частота объективного ответа была
значительно выше для ХТ-пембро
(63% против 40%, p<0,0001). Нежелательные явления (НЯ) 3-й степени
или выше, связанные с пембролизумабом, наблюдались у 19% пациентов
(наиболее часто отмечались утомляемость (5%) и диарея; пульмониты
(2%); 16% пациентов прекратили лечение полностью из-за развития иммуноопосредованных НЯ). Авторы
однозначно сделали выводы, что со
статистически значимым улучшением мОВ и приемлемой переносимостью комбинация пеметрекседа, цисплатина и пембролизумаба является
вариантом лечения нерезектабельной
МП в 1 линии лечения.
Не менее интересными были результаты исследования PEMMELA,
одноцентровое рандомизированное
исследование без группы сравнения
по изучению эффективности пембролизумаба с ленватинибом во второй
и третьей линии у пациентов со злокачественной мезотелиомой плевры.
Ленватиниб – это ингибитор рецепторов тирозинкиназ, избирательно
подавляющий киназную активность
рецепторов фактора роста эндотелия
сосудов (VEGF) – VEGFR1 (FLT1),
VEGFR2 (KDR) и VEGFR3 (FLT4).
Также ленватиниб воздействует на
другие рецепторы тирозинкиназ, задействованных в проангиогенных и
онкогенных механизмах, включая рецепторы фактора роста фибробластов
1-го, 2-го, 3-го и 4-го типов (FGFR1, 2,
3 и 4), альфа-рецептор тромбоцитарного фактора роста (PDGFRa), а также рецепторы тирозинкиназ KIT и
RET. Именно синергизм ингибиторов
иммунных контрольных точек с антиангиогенными препаратами послужил началом данного исследования.
Дизайн исследования представлен на
рисунке 12.
Рисунок 12.
Дизайн исследования PEMMELA
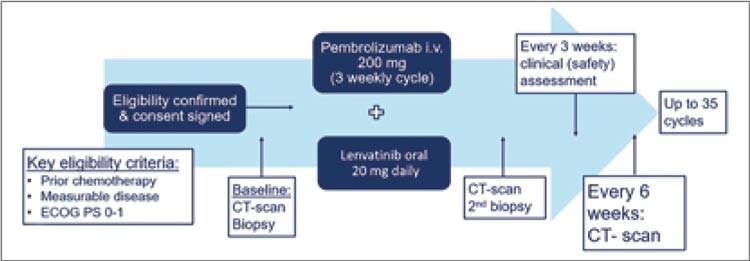
В исследование включено 38 пациентов. Из 38 пациентов 33 (86,8%)
были мужчинами, 19 (50%) имели
статус ECOG 0 и средний возраст составил 70,5 лет (диапазон 36-83). У
большинства пациентов (89,5%) была
выявлена эпителиоидная МП, у 5,3%
— неэпителиоидная мезотелиома, а у
остальных 5,3% — смешанная форма.
У 18 пациентов (47,4%) выявлена экспрессия PD-L1, 17 (44,7%) были PDL1-отрицательными и 3 (7,9%) имели
неопределенный статус. Несмотря
на то, что полных регрессий не было
отмечено, что вполне ожидаемо, учитывая 2 и 3 линию лечения, объективный эффект удалось подтвердить
в 40% случаев (39,5%; 95% CI 24-57%;
р=0,07). Результаты представлены на
рисунке 13.
Рисунок 13.
Эффективность применения комбинации пембролизумаба
и ленватиниба во 2 и 3 линиях лечения в исследовании PEMMELA
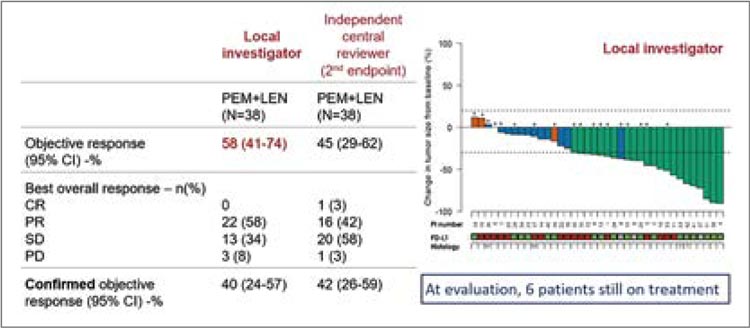
Токсичность изучаемого режима
оказалась относительно приемлемой
(рис.14). Основными жалобами стали
слабость и дисфония 1-2 ст., диарея
1-2 степени, а тяжелые нежелательные
явления 3-4 степени в виде повышения артериального давления и анорексии отмечены у 8 (21%) и 4 (10,5%)
пациентов соответственно.
Снижение дозы или окончательное
прекращение лечения ленватинибом
потребовались у 76% пациентов из-за
токсичности, что вполне закономерно, учитывая начальную дозу 20 мг/
сут. Пембролизумаб полностью отменен в 3 (8%) случаях из 38 из-за НЯ.
Кроме того, было 2 пациента с миозитом 3-4 степени и 10 пациентов с 16
серьезными нежелательными явлениями, связанными с лечением.
Медиана ВБП составила 5,6 мес., а
медиана ОВ – 12,8 мес., что наглядно
представлено на рисунке 15.
Таким образом, дальнейшие исследования иммуно- и таргетных препаратов представляются перспективными.
Необходимость продолжения исследований по лекарственному лечению
мезотелиом очевидна. Повышенный
интерес к злокачественной мезотелиоме, несмотря на редкость данной патологии, в виде тематической международной конференции дает надежду
на новые научные изыскания, которые, возможно, улучшат перспективы
лечения этих больных.
Рисунок 14.
Характеристика нежелательных явлений при применении комбинации пембролизумаба и ленватиниба во 2 и 3 линиях лечения в исследовании PEMMELA
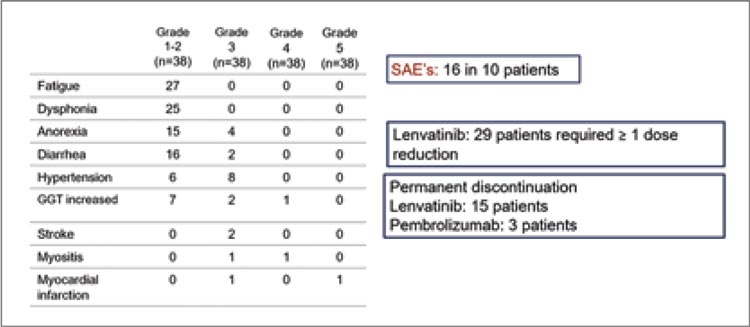
Рисунок 15.
Кривые общей выживаемости и выживаемости без прогрессирования в исследовании PEMMELA
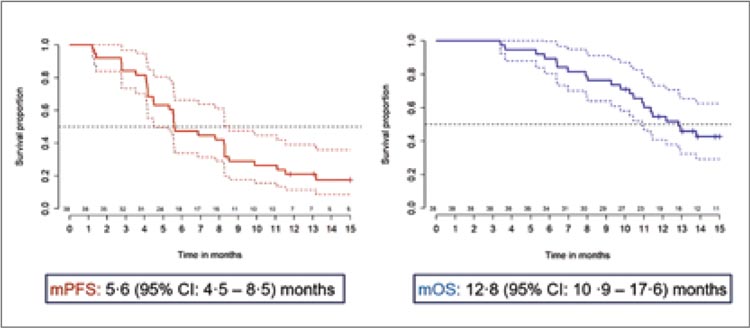
Источники:
- Bianchi C, Bianchi T. Global mesothelioma epidemic: Trend and features. Indian J Occup Environ Med. 2014; 18(2): 82-88.
- Panou V, Gadiraju M, Wolin A, Weipert C, Skarda E, et al. Frequency of Germline Mutations in Cancer Susceptibility Genes in Malignant Mesothelioma. J Clin Oncol. 2018; 36(28): 2863-2871.
- Hiltbrunner S, Fleischmann Z, Sokol E, Zoche M, Felley-Bosco E, et al. Genomic landscape of pleural and peritoneal mesothelioma tumours. Br J Cancer. 2022; 127(11): 1997-2005.
- Sauter J, Dacic S, Galateau-Salle F, Attanoos R, et al. The 2021 WHO Classification of Tumors of the Pleura: Advances Since the 2015 Classification. J. of Thoracic Oncol. 2022; 17(5): 608-622.
- Fernandez-Cuesta L, Mangiante L, Alcala N, Foll M. Challenges in lung and thoracic pathology: molecular advances in the classification of pleural mesotheliomas. Virchows Arch. 2021; 478(1): 73-80.
- van Kooten JP, Belderbos К, von der Thüsen J, Aarts M, Verhoef C, et al. Incidence, treatment and survival of malignant pleural and peritoneal mesothelioma: a populationbased study. Thorax. 2022; 77: 1260-1267.
- Sharkey AJ, O'Byrne KJ, Nakas A, et al. How does the timing of chemotherapy affect outcome following radical surgery for malignant pleural mesothelioma? Lung Cancer. 2016; 100: 5-13.
- Cao C, Tian D, Manganas C, et al. Systematic review of trimodality therapy for patients with malignant pleural mesothelioma. Ann Cardiothorac Surg. 2012; 1: 428-37.
УГОЛОК РАДИОТЕРАПЕВТА / КОМБИНАЦИЯ ИНГИБИТОРОВ ТИРОЗИНКИНАЗЫ И ЛУЧЕВОЙ ТЕРАПИИ: ВМЕСТЕ НЕВЕСЕЛО ШАГАТЬ…
Автор: Деньгина Наталья Владимировна
заведующая отделением радиотерапии ГУЗ «Областной клинический онкологический диспансер»,
главный врач Центра лучевой терапии «R-Spei», к.м.н, Ульяновск
На подобную комбинацию – таргетной терапии, в частности, ингибиторов тирозинкиназы (ТКИ), и
лучевой терапии – уже давно возлагались немалые надежды исследователей, практикующих врачей
и самих пациентов, практически
с тех пор, как таргетная терапия
получила широкое распространение в лечении опухолей различных локализаций. До тех пор, да
и поныне, одновременная химиолучевая терапия на протяжении
многих лет была и остается краеугольным камнем лечения злокачественных опухолей многих локализаций, поскольку сочетание
химиотерапии и дистанционной
лучевой терапии отличается хорошим синергизмом. Однако преимущества химиолучевой терапии в плане выживаемости чаще
всего идут рука об руку с повышенной токсичностью, ведь ХЛТ
не обладает селективностью в отношении только опухолевых клеток. По этой причине комбинация
лучевой терапии с ингибиторами
тирозинкиназы опухолеспецифических рецепторов (например,
с лапатинибом, эрлотинибом,
цетуксимабом, бевацизумабом,
панитумумабом) казалась многообещающей альтернативой ХЛТ,
подразумевая более «сфокусированный» противоопухолевый эффект и, таким образом, уменьшая
токсичность.
Ответ на комбинированную терапию может быть усилен при сочетании ионизирующего излучения
с ТКИ по ряду причин: поскольку
ионизирующее излучение способствует активности тирозинкиназ,
радиационно-индуцированные
противоопухолевые эффекты
ТКИ в сочетании с облучением
могут быть более выражены; репарация ДНК, которой способствуют тирозинкиназы, будет
ингибироваться TKИ, тем самым
еще более препятствуя восстановлению повреждений, вызванных
ионизирующим излучением, и т.д.;
по этим причинам на комбинацию
ТКИ и ЛТ действительно возлагались немалые надежды.
Сотни работ – ретро-анализов,
клинических наблюдений, исследований 1, 2 и, наконец, 3 фазы
– были посвящены этой проблеме. Авторы метаанализа ROCKIT
2021 года [1] из общего количества
работ выбирали только проспективные рандомизированные исследования с четкими критериями, и их набралось 13 с общим
числом пациентов 5678. Исследования включали пациентов со
злокачественными опухолями
головы и шеи (6 исследований,
3295 пациентов), пищевода (3 исследования, 762 пациента), легких
(2 исследования, 550 пациентов) и
головного мозга (2 исследования,
1542 пациента). Препараты, примененные в исследованиях, – лапатиниб, эрлотиниб, бевацизумаб, цетуксимаб, панитумумаб. В
трех исследованиях оценивалась
комбинация малых молекул и лучевой терапии (949 больных), а в
10 исследованиях – антитела и ЛТ
(4729 больных).
Увы, никаких преимуществ в общей выживаемости в целом по
данным анализа не наблюдалось
(HR=1,02; 95% CI 0,90-1,15; P=0,76)
(рис.1).
Рисунок 1.
Метаанализ проспективных исследований по комбинации любых ТКИ и ХЛТ/ЛТ: общая выживаемость в
сравнении с только ХЛТ/ЛТ
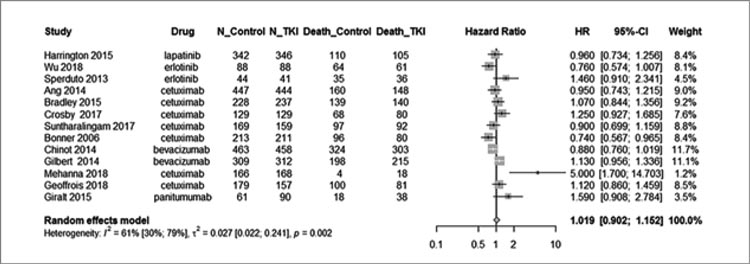
Авторы метаанализа сделали вывод, что подобная комбинация
не приводит к улучшению общей
выживаемости, но чревата более
высокой частотой грозной токсичности 3+ степени, а следовательно – не рекомендована к рутинному применению.
Тем не менее, идея по-прежнему
казалась привлекательной, и исследования продолжались. В
июле и сентябре 2023 года опубликованы результаты еще 2 проспективных исследований 2 фазы.
В июле 2023 года в Красном
журнале ASTRO представлены
данные мультицентрического проспективного рандомизированного исследования 2 фазы
NRG Oncology-KROG/RTOG
1119 по применению лапатиниба в комбинации с облучением
всего объема головного мозга
или стереотаксической радиохирургией (СРХ) у больных HER2-
позитивным раком молочной
железы с метастазами в головной
мозг [2]. Коллектив авторов из
Южной Кореи, США и Канады
сравнил результаты комбинации с только лучевой терапией в
плане частоты развития полного
клинического интракраниального ответа на 12 неделях, включив
в исследование 143 пациента, из
которых 116 оказались доступны
для анализа. Все больные получали лучевую терапию (37,5 Гр
за 3 недели на весь объем мозга
либо СРХ в соответствии с размером очагов) с одновременным
добавлением лапатиниба (1000 мг
ежедневно на протяжении 6 недель) либо без него. Вторичные
конечные точки включали общую
частоту объективных ответов
(ЧОО), частоту ответов в зависимости от характеристик очагов,
выживаемость без прогрессирования по ЦНС и общую выживаемость.
Рисунок 2.
Риск развития осложнений 3+ степени при комбинации ХЛТ+ТКИ в
сравнении с только ХЛТ
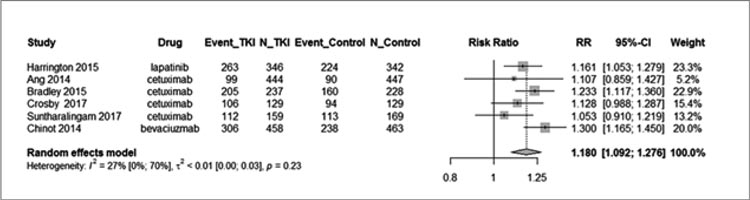
И вновь разочарование: комбинация не улучшила ни частоту полных клинических ответов (0% против 6% для только ЛТ, P=0,97), ни частоту общих ответов за 12 недель, хотя на отрезке 4 недель ЧОО оказалась выше в группе комбинации (55% против 42%), то есть кратковременный эффект был отмечен – но ценой клинически выраженных осложнений 3 и 4 степени, которые встречались значительно чаще в случае комбинированного лечения: 8% и 0% только для ЛТ, 28% и 6% для комбинации соответственно. Исследование оказалось вновь негативным – но не единственным. В сентябрьском номере журнала JAMA Oncology опубликованы результаты рандомизированного исследования 2 фазы по применению ХЛТ с цисплатином с добавлением лапатиниба или без него у больных местнораспространенным ВПЧнегативным раком головы и шеи, проведенного в 20 американских центрах [3]. Выживаемость без прогрессирования (ВБП) явилась первичной конечной точкой, общая выживаемость (ОВ) – вторичной. Сто сорок два пациента с III-IV стадией были включены в исследование с 2012 по 2017 годы. Средний период наблюдения составил 4,1 года. Рандомизация – 1:1 в группы ХЛТ (70 Гр за 6 недель + 2 введения цисплатина 1 раз в 3 недели) в комбинации с лапатинибом 1500 мг ежедневно на фоне всего лечения или плацебо. Результаты были оценены у 127 больных (63 в группе ХЛТ+Л и 64 – ХЛТ+П). В итоге не было отмечено улучшений ни в ВБП (HR 0,91; 95% CI 0,56-1,46; P=0,34), ни в ОВ (HR 1,06; 95% CI 0,61-1,86; P=0,58) при добавлении лапатиниба (рис.3). Клинически выраженная токсичность 3 и 4 степени встречалась у подавляющего большинства больных, хотя значимой разницы между группами не отмечено ни в отношении ранней (83,3% [95% CI 73,9-92,8%] при ХЛТ+Л против 79,7% [95% CI 69,4- 89,9%] при ХЛТ+П; P=0,64), ни поздней токсичности (44,4% [95% CI 30,2- 57,8%] ХЛТ+Л против 40,8% [95% CI 27,1-54,6%] ХЛТ+П; P=0,84). В очередной раз продемонстрировано, что стандартная ХЛТ с цисплатином на данный момент является адекватным методом лечения. Имеющиеся объективные данные по применению комбинации ТКИ и ЛТ (результаты проспективных рандомизированных исследований), также как и публикации отдельных (порой пугающих) клинических случаев и их совокупных анализов пока не позволяют нам широко использовать комбинацию ТКИ и лучевой терапии. Однако теоретические возможности ее применения и возможные преимущества при соблюдении ряда условий (дозы ЛТ, дозы препаратов, режимы и т.д.) стимулируют научное сообщество к продолжению подобных исследований. Поживем – увидим.
Рисунок 3.
Выживаемость без прогрессирования как первичная конечная
точка исследования.
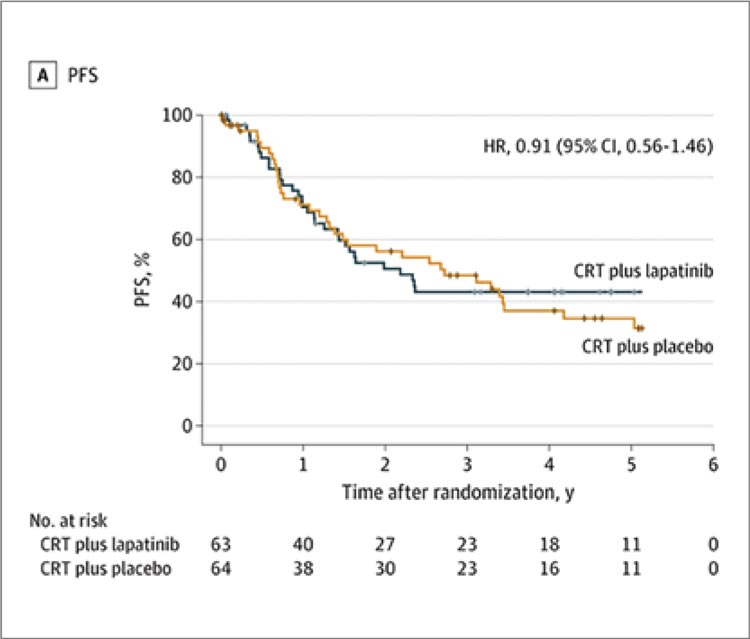
Источники:
- Leila T. Tchelebi, et al. Radiotherapy and Receptor Tyrosine Kinase Inhibition for Solid Cancers (ROCKIT): A MetaAnalysis of 13 Studies. JNCI Cancer Spectrum. 2021; 5(4): pkab050.
- Kim IA, Winter KA, Sperduto PW, et al. Concurrent Lapatinib With Brain Radiation Therapy in Patients With HER2+ Breast Cancer With Brain Metastases: NRG Oncology-KROG/ RTOG 1119 Phase 2 Randomized Trial. Int J Radiat Oncol Biol Phys. 2023 Jul 26; S0360-3016(23)07681-2. doi: 10.1016/j. ijrobp.2023.07.019. Epub ahead of print. PMID: 37506981.
- Wong SJ, Torres-Saavedra PA, Saba NF, et al. Radiotherapy Plus Cisplatin With or Without Lapatinib for NonHuman Papillomavirus Head and Neck Carcinoma: A Phase 2 Randomized Clinical Trial. JAMA Oncol. 2023 Sep 28; e233809. doi: 10.1001/jamaoncol.2023.3809. Epub ahead of print. PMID: 37768670; PMCID: PMC10540060.
УГОЛОК РАДИОТЕРАПЕВТА / НОВЫЕ РЕКОМЕНДАЦИИ ПО SBRT ОЛИГОМЕТАСТАЗОВ В ЛЕГКИЕ: КОММЕНТАРИИ ЭКСПЕРТА
Автор: Петухов Евгений Алексеевич
Заведующий отделением лучевой терапии
ФГБУ «Главный военный клинический госпиталь
им. акад. Н.Н. Бурденко» МО РФ, Москва
В июньском онлайн-номере журнала Lung Cancer были опубликованы
практические рекомендации Международного общества стереотаксической радиохирургии (ISRS) по проведению стереотаксического облучения
олигометастазов в легкие [1]. Стереотаксическая лучевая терапия (SBRT)
представляет собой эффективный
метод самостоятельного лечения, сочетающий высокие показатели локального контроля и низкий риск лучевой токсичности, – к такому выводу
пришли эксперты, проведя систематический обзор стереотаксической
лучевой терапии при легочных олигометастазах, который и послужил
основой для разработки этих практических рекомендаций. Рассмотрим
позиции экспертов и определим, что
же является наиболее очевидным по
этой проблеме в настоящее время.
Олигометастатический процесс в настоящее время трактуется как ограниченное число (<5) метастазов, при
котором аблативное воздействие на
выявленные очаги может привести
к долгосрочному контролю и увеличению выживаемости в дополнение
к стандартной системной терапии.
В ряде исследований было показано, что добавление лучевой терапии
на метастатические очаги в легких
к системной терапии приводило к
увеличению выживаемости без прогрессирования и общей выживаемости. Цель систематического обзора
заключалась в описании характеристик и результатов стереотаксической
лучевой терапии, а также в оценке
лучевой токсичности у больных с
олигометастазами в легких. На основе
систематического обзора были сформулированы рекомендации по отбору
пациентов, тактике проведения SBRT
и наблюдению для формирования
практических рекомендаций группой
экспертов ISRS. Уровни доказательности и сила рекомендаций были
основаны на рекомендациях Американского общества радиационной
онкологии (ASTRO). Шесть экспертов
(по одному от каждого центра) проголосовали за сформулированные
рекомендации по 5-балльной шкале
Лайкерта (1 – полностью согласен, 2
– согласен, 3 – не уверен, 4 – не согласен и 5 – категорически не согласен).
Уровень согласия определялся как совокупный процент голосов за «полностью согласен» и «согласен».
После всестороннего обзора опубликованной литературы 35 отдельных
исследований соответствовали критериям включения и исключения, из
них 5 были рандомизированными,
3 – проспективными и 27 – ретроспективными. Всего было зарегистрировано 3643 пациента и 4672 облученных метастаза, при этом в трех
исследованиях не указано количество
пациентов с метастазами в легких и в
еще трех не указано количество облученных метастатических очагов.
Среднее число пациентов составило 62 (диапазон [мин–макс] 20-206)
в одноцентровых и 105 (диапазон
6-1378) в многоцентровых исследованиях. Число метастазов на одного пациента колебалось от одного до семи.
Медиана максимального диаметра
метастаза и объема GTV составляли
1,7 см (диапазон 1,4-3,1 см) и 7,2 см3
(диапазон 1,5-60 см3) соответственно.
В тринадцати исследованиях оценивалось расположение метастазов: 621
очаг располагался центрально, а 936
– периферически. Первичная опухоль
была диагностирована как немелкоклеточный рак легкого (НМРЛ) в 3
исследованиях (336 пациентов), колоректальный рак (КРР) в 7 исследованиях (363 пациента) и саркома в 3
исследованиях (111 пациентов). Дозы
SBRT варьировали от 18 до 75 Гр за
1-15 фракций. Медиана биологически
эквивалентной дозы (BED) составляла 100 Гр и колебалась от 48 до 180
Гр. Дозы для периферически расположенных метастазов варьировали
по BED 96-180 Гр (в среднем 116 Гр),
тогда как центрально расположенные
метастазы получали BED 75-115,5 Гр
(в среднем 100 Гр). В шести исследованиях сообщалось о ежедневном лечении, в 4 – через день.
Если лечение проводилось с использованием линейного ускорителя, для
топометрии во всех исследованиях использовался 4D-КТ-сканер. Техника
абдоминальной компрессии применялась у отдельных пациентов в 4 исследованиях. В шести исследованиях
сообщалось о лечении с использованием Кибер-ножа, в 4 исследованиях
производилась имплантация маркеров (fiducials). В 20 исследованиях использовалась концепция формирования ITV для компенсации смещения
мишени в зависимости от дыхательных движений. В 26 исследованиях не
сообщалось о формировании CTV на
основе GTV. В четырех исследованиях
описано использование дополнительного отступа от GTV/ITV к CTV в
размере 1-10 мм. PTV создавался путем расширения GTV/ITV или CTV
на 2-10 мм. Трехмерная конформная
лучевая терапия (3D-CRT) применялась в 3 исследованиях. В тринадцати
исследованиях проводилось лечение
методом IMRT или VМАТ. В шестнадцати исследованиях не сообщалось о
методе облучения.
Медиана локального контроля (на
основе анализа 29 исследований;
85%) составила 90% (диапазон 57-
100%) через 1 год и 79% (диапазон
70-96%) через 5 лет. Сообщалось, что
2- или 3-летние показатели локального контроля составляют в среднем
54% для КРР, 80% для НМРЛ, 91%
для саркомы и 85% для остальных
нозологий с BED 105, 103, 97 и 100 Гр
соответственно. Суммарный 2- или
3-летний локальный контроль с использованием модели случайных
эффектов составил 79% (95% ДИ 75-
84%). Результаты ВБП сообщались в
20 исследованиях (61%) со средним
значением 56% (диапазон 24-66%)
через 1 год и 21% (диапазон 0-26%)
через 5 лет.
Лучевая токсичность ≥3 степени по
отношению к числу пролеченных
пациентов оценивалась в 22 статьях
и включала острый пневмонит 3
степени (n=14), бронхостеноз (n=3)
, одышка (n=4), бронхоплевральный
свищ (n=1), поздний фиброз легких
(n=14), перелом ребра (n=2), кровохарканье (n=1), эзофагит (n=1) и
боль в груди (n=1). Сообщалось об
ателектазе 4 степени (n=1), позднем
фиброзе легких (n=1), бронхиальной
стриктуре (n=1), а также о токсичности 5 степени (n=7). В двенадцати
исследованиях (34%) не наблюдалась
токсичность ≥3 степени. Медиана
частоты возникновения острой токсичности ≥3 степени составила 0,5%
пролеченных пациентов, поздней
токсичности ≥3 степени – 1,8%.
В двадцати трех (66%) анализах сообщалось о прогностических факторах,
влияющих на локальный контроль,
общую выживаемость, выживаемость без прогрессирования, опухоль специфичную выживаемость и/
или токсичность. К ним относятся:
количество облученных метастазов,
размер очагов, центральное или периферическое расположение, морфология первичной опухоли, BED,
режим фракционирования, объем
метастатического поражения на момент проведения SBRT и системной
терапии.
Результаты систематического обзора
послужили основой для разработки
консенсусных рекомендаций по отбору пациентов, стадированию, планированию и проведению лучевой
терапии, а также наблюдению после
SBRT по поводу легочных олигометастазов. Всего выработана 21 практическая рекомендация с уровнем согласия 100% по всем рекомендациям,
кроме рекомендации 13 (83%).
Стадирование и отбор
пациентов
Рекомендация 1: У пациентов с
олигометастатическим процессом и
подозрением на метастазы в легкие
полное обследование органов и систем (в т.ч. ПЭТ-КТ с 18ФДГ) должно дополняться КТ органов грудной
клетки с высоким разрешением,
включая применение внутривенного
контрастирования для оценки ворот
и структур средостения (уровень доказательности: средний; сила рекомендации: сильная; согласованность
100%).
Комментарий радиотерапевта: КТ
органов грудной клетки с внутривенным контрастированием можно
провести во время топометрической
подготовки в том положении, в котором будет проводиться лечение, в
том числе при использовании методов контроля дыхания либо использовать фьюжн диагностических изображений с КТ-топометрическими.
Шаг сканирования при топометрии
2,5-3 мм.
Рекомендация 2: Пациентам с олигометастатическим процессом и
подозрением на метастазы в легкие
рекомендуется выполнение биопсии
для подтверждения злокачественного новообразования в ситуации солидного метастаза в легкие, если это
выполнимо (уровень доказательности: умеренный; сила рекомендации:
сильная; согласованность 100%).
Комментарий радиотерапевта: В
ситуациях, когда олигометастатический процесс обусловлен солидным
метастазом в легких либо характер и/
или время возникновения метастазов в легкие не укладываются в клиническую картину основного онкологического заболевания, требуется
проведение морфологической верификации при технической возможности и отсутствии существенных
рисков манипуляции для пациента.
В случаях невыполнимости биопсии
или высокого риска осложнений,
при наличии достаточных рентгенологических и клинических данных за
метастатический процесс в легких,
от проведения морфологической верификации возможно воздержаться.
Рекомендация 3: У пациентов с
морфологически подтвержденным
олигометастатическим процессом
при постановке клинического диагноза метастазов в легкие следует
учитывать рентгенологические критерии злокачественности, такие как
появление новых легочных очагов,
рост ранее выявленных очагов в
сравнении с предыдущими обследованиями и изменение метаболической активности по данным ПЭТ-КТ
(уровень доказательности: высокий;
сила рекомендации: сильная; согласованность 100%).
Комментарий радиотерапевта: Следует принимать во внимание рентгенологические критерии, характерные для злокачественного процесса и
метастатического поражения легких
во всех случаях, особенно когда невозможно провести морфологическую верификацию очагов либо в
отсутствии возможности выполнить
ПЭТ-КТ.
Рекомендация 4: У пациентов с
олигометастатическим процессом
легкие часто становятся мишенью,
и, согласно существующим проспективным данным, таким пациентам
показана аблативная локальная терапия на выявленные очаги в легких
(уровень доказательности: высокий;
сила рекомендации: сильная; согласованность 100%).
Рекомендация 5: Пациентам с олигометастатическим поражением легких, которым показано проведение
аблативной локальной терапии после обсуждения на мультидисциплинарном онкологическом консилиуме,
стереотаксическая лучевая терапия
(SBRT) и хирургическое удаление
метастазов могут быть рекомендованы в качестве методов локального
лечения на основании данных проспективных рандомизированных
исследований (уровень доказательности: высокий; сила рекомендации:
сильная; согласованность 100%). В
рандомизированных исследованиях
сообщалось, что локальная консолидирующая лучевая терапия (в виде
SBRT) улучшает общую выживаемость (ОВ) и выживаемость без прогрессирования (ВБП).
Комментарий радиотерапевта:
SBRT и хирургическое удаление метастазов представляют собой научно обоснованные методы локального лечения, оба метода лечения
являются допустимыми опциями.
В ретроспективном исследовании
[2], сравнивающем SBRT и метастазэктомию, не выявлено различий в
локальном контроле, совокупный
2- или 3-летний локальный контроль
составил 79%, при этом ВБП снизилась с 56% через 1 год до 21% через 5
лет. Авторы исследования обращают
внимание на тот факт, что лечение
метастатических проявлений прежде
всего направлено на улучшение качества жизни пациента. Лучевая терапия переносима пациентами в большинстве клинических ситуаций, в то
время как хирургическое вмешательство следует предлагать отобранным
пациентам в хорошей физической
форме и с определенным физиологическим резервом. С другой стороны,
множественные поражения, локализуемые, например, в одной доле,
легче лечить с помощью лобэктомии,
чем пытаться воздействовать на все
очаги лучевой терапией.
Рекомендация 6: У пациентов с олигометастатическим поражением легких, которым показано проведение
аблативной локальной терапии, оптимальный персонализированный
подход в виде проведения аблативной лучевой терапии (SBRT) либо
проведении хирургического удаления метастазов должен обсуждаться
на мультидисциплинарном онкологическом консилиуме с участием торакального хирурга и радиотерапевта и должен учитывать предпочтения
пациента (уровень доказательности:
умеренный; сила рекомендации:
сильная; согласованность 100%).
Выбор конкретного метода лечения
должен осуществляться с учетом
рекомендаций мультидисциплинарного онкологического консилиума
и предпочтений пациента. В целом,
при отборе пациентов следует учитывать количество метастазов, их
расположение и размер поражения.
Рекомендация 7: Пациентам с олигометастатическим поражением легких, которым показано проведение аблативной локальной терапии, SBRT на солидный периферический метастаз в легком максимальным диаметром до 5 см может быть рекомендована в качестве одного из стандартных вариантов лечения, основанного на благоприятном профиле безопасности и эффективности (уровень доказательности: умеренный; сила рекомендации: сильная; согласованность 100%). Анализ локализации метастатического очага (центральный или периферический) в одном из исследований [3] показал, что SBRT на центрально расположенные метастатические очаги связана со снижением локального контроля. Причиной этого вывода может быть более высокая сложность определения целевого объема, уменьшение суммарной дозы лучевой терапии или уменьшение целевого объема для соблюдения ограничений по дозовой нагрузке на органы риска. К этому выводу следует относиться с осторожностью, поскольку в соответствующем исследовании доза варьировалась в зависимости от локализации опухоли, а авторы также сообщали о худшем локальном контроле при применении более низких доз. Ряд исследований продемонстрировали, что размер метастатического очага, на который проводилась SBRT, является предиктивным фактор прогноза для локального контроля, общей выживаемости и выживаемости без прогрессирования.
Рекомендация 8: У пациентов с количеством легочных метастазов от 2 до 5 и наличием показаний к аблативной локальной терапии должна рассматриваться одновременная SBRT на все очаги, если возможно соблюсти дозовые ограничения на органы риска (уровень доказательности: умеренный; сила рекомендации: сильная; согласованность 100%). Количество метастазов у одного пациента является значимым фактором прогноза эффективности лечения. При центральных и ультрацентральных локализациях увеличивался риск развития токсичности ≥3 степени при одновременном лечении всех метастатических очагов [4]. В этом исследовании лечение метастазов в лимфатических узлах также было связано с более высоким риском возникновения токсичности. Большее количество метастатических очагов связано с уменьшением общей выживаемости и выживаемости без прогрессирования. У пациентов с единичным метастазом по сравнению с пациентами с более чем одним метастазом риск возникновения регионарных метастазов снижался, в то время как опухолево-специфическая выживаемость и выживаемость без прогрессирования увеличивались.
Рекомендация 9: Пациентам с олигометастатическим поражением легких, которым показано проведение аблативной локальной терапии, SBRT на легочные очаги с центральным расположением или диаметром >5 см следует применять рискадаптированную суммарную дозу и выбирать режим фракционирования для достижения разумного баланса между эффективностью и безопасностью (уровень доказательности: умеренный; сила рекомендации: сильная; согласованность 100%). В исследовании фазы I [5] по оценке эскалации дозы отмечалось увеличение частоты случаев токсичности ≥3 степени у пациентов с диаметром метастатического очага >5 см. Суммарная острая токсичность ≥3 степени выявлялась только у 0,5% после проведения SBRT, а суммарная поздняя токсичность – у 1,8% пациентов.
Рекомендация 10: Пациентам с олигометастатическим поражением легких, которым показано проведение аблативной локальной терапии, SBRT на легочные очаги с ультрацентральным расположением потенциально связана с повышенным риском тяжелой токсичности, и выбор SBRT в качестве аблативной лучевой терапии должен быть тщательно оценен (уровень доказательности: умеренный; сила рекомендации: сильная; согласованность 100%). У пациентов с легочными метастазами ультрацентральной локализации SBRT следует тщательно оценивать из-за повышенного риска тяжелой токсичности.
Комментарий радиотерапевта: В исследованиях, на которые приводят ссылки авторы систематического обзора, не выявлялась зависимость увеличения риска развития тяжелой токсичности (≥3 степени) от локализации метастатических очагов, не приводились убедительные данные о тяжелой токсичности при облучении метастатических очагов ультрацентральной локализации. Основными факторами прогноза развития лучевой токсичности ≥3 степени при однофакторном анализе были одновременное облучение регионарных зон и нескольких метастатических очагов, при многофакторном анализе – только облучение зон лимфоузлов [4]. Поскольку биология опухоли и радиорезистентность различных первичных опухолей различаются, локальный контроль, общая выживаемость и выживаемость без прогрессирования зависят от морфологического варианта первичной опухоли. По сравнению с морфологическими типами опухолей головы и шеи, пищевода, шейки матки, молочной железы или легких, колоректальный рак (КРР) считается отрицательным прогностическим фактором в отношении локального контроля и выживаемости без прогрессирования. Метастатический статус на момент проведения SBRT представлял собой еще один прогностический фактор для синхронных заболеваний, приводящий к снижению локального контроля и общей выживаемости. С другой стороны, контролируемая первичная опухоль рассматривалась как положительный прогностический фактор [1].
Лечение
Рекомендация 11: Пациентам с олигометастатическим поражением легких, которым показано проведение аблативной лучевой терапии, минимальная доза, подведенная с помощью SBRT, должна быть не ниже BED 100 Гр при соблюдении должной безопасности (уровень доказательности: умеренный; сила рекомендации: сильная; согласованность 100%). В нескольких исследованиях сообщалось о более высоком локальном контроле при лечении BED ≥100 Гр. О положительной корреляции между дозой и локальным контролем сообщалось в исследовании [6,7]: суммарная доза BED 150-170 Гр по сравнению с BED 100-150 Гр являлась независимым положительным прогностическим фактором для локальной выживаемости без прогрессирования у всех пациентов. Как следствие, некоторые пациенты могут даже получить пользу от лечения более высокими дозами, например, при КРР. В указанных исследованиях метастазы центрального расположения лечили редуцированной BED.
Рекомендация 12: Пациентам с олигометастатическим поражением легких, которым показано проведение аблативной лучевой терапии, рекомендуется деэскалация дозы SBRT до BED ≥75 Гр при ультрацентральном расположении метастатических очагов (уровень доказательности: заключение эксперта; сила рекомендации: условная; согласованность 100%). При ультрацентральном расположении метастазы, примыкающие к проксимальному бронхиальному дереву, даже при риск-адаптированном фракционировании связаны с дифференциальным риском развития токсичности и смерти при проведении SBRT.
Комментарий радиотерапевта: Как уже было отмечено, в исследовании, на которое дается ссылка [4], не было выявлено существенных различий при сравнении центральных и ультрацентральных метастатических очагов в отношении локального контроля, общей выживаемости или развития лучевой токсичности ≥3степени.
Рекомендация 13: Пациентам с олигометастатическим заболеванием, которым показано проведение аблативной лучевой терапии легочных метастазов, следует рассмотреть возможность снижения суммарно дозы при SBRT с BED <100 Гр, особенно если SBRT сочетается с системной противоопухолевой терапией (уровень доказательности: умеренный; сила рекомендации: сильная; согласованность 83%). Могут быть выделены категории пациентов, которым показаны более низкие дозы SBRT (BED <100 Гр), например, пациенты с олигопрогрессией, которым до или после SBRT проводится системная противоопухолевая терапия.
Комментарий радиотерапевта: В данной ситуации может идти речь о повышении токсичности лечения за счет суммации побочных эффектов системной терапии и стереотаксической лучевой терапии и целесообразности снижения суммарной дозы для снижения риска развития тяжелой лучевой токсичности. Вклад каждого из методов лечения как в отношении эффективности, так и в отношении токсичности при их комбинации в разрезе лечения олигометастатического заболевания оценивать крайне сложно.
Рекомендация 14: Пациентам с олигометастатическим заболеванием, которым показано проведение аблативной лучевой терапии легочных метастазов, следует рассмотреть возможность проведения SBRT за одну фракцию, если очаги в легких малого размера, расположены по периферии на удалении от критических органов риска и без широкого контакта с грудной стенкой (уровень доказательности: высокий; сила рекомендации: сильная; согласованность 100%). Рандомизированное клиническое исследование, включавшее пациентов с олигометастазами в легких, не показало разницы между подведением одной фракции в дозе 28 Гр или 4 фракции в суммарной дозе 48 Гр [8,9]. Тем не менее, в ряде публикаций сообщалось о снижении локального контроля при проведении лучевой терапии за одну фракцию по сравнению с мультифракционным режимом, даже при периферических опухолях [10,11].
Комментарий радиотерапевта: Имея в распоряжении линейный ускоритель, оснащенный лечебным столом с шестью степенями свободы, HD120 коллиматором, центральные лепестки которого имеют толщину 2,5 мм и обеспечивают максимально конформное облучение с высоким градиентом дозы, может рассматриваться режим фракционирования 28 Гр за одну фракцию. Принимая во внимание, что наиболее доступными для проведения стереотаксической лучевой терапии являются линейные ускорители, не имеющие специальных технических надстроек для проведения только стереотаксической лучевой терапии, подведение однократной дозы в размере 28 Гр не оправдано. Рекомендуемыми режимами фракционирования могут быть: для периферических очагов – 3 фракции по 15-20 Гр, 4 фракции по 12 Гр; для центрально расположенных очагов – 8 фракций по 7,5 Гр, 5 фракций по 10 Гр, также допустимо использовать режим 4 фракции по 12 Гр.
Рекомендация 15: Пациентам с олигометастатическим заболеванием, которым показано проведение аблативной лучевой терапии легочных метастазов, проводится индивидуальная оценка движения GTV, вызванного дыханием, с использованием синхронизированной с дыханием 4D-КТ и использованием стратегии компенсации движения (например, respiratory gaiting – синхронизация облучения с фазой дыхания; tumor tracking – слежение пучка излучения за движением мишени; формирование ITV, deep-inspiration breath-hold – облучение на глубоком вдохе, абдоминальная компрессия) (уровень доказательности: умеренный; сила рекомендации: сильная; согласованность 100%). Поскольку сообщается о значительной разнице между фактическим и запланированным положением опухолевого очага, КТтопометрию следует дополнять 4DКТ, как это было реализовано во всех исследованиях, в которых описывалась техника лечения на линейном ускорителе. Уменьшение любых погрешностей во время лечения гарантирует возможность доставки высококонформной дозы.
Комментарий радиотерапевта: Во всех случаях, когда пациент может контролировать дыхание и способен задержать дыхание на глубоком вдохе длительностью 30-40 секунд, целесообразно проведение лечения с задержкой дыхания на вдохе. При невозможности длительно задерживать дыхание, при смещении мишени >1 см по КТ на вдохе, выдохе и свободном дыхании, во всех случаях должна применятся 4D-КТ для оценки движения GTV и формирования на основе движения ITV. Лечение на свободном дыхании допустимо только после оценки степени смещаемости очага и формирования ITV.
Рекомендация 16: Для пациентов с олигометастатическим заболеванием, которым показано проведение аблативной лучевой терапии метастазов в легких, расчет дозы следует производить с использованием алгоритма расчета дозы type B или Монте-Карло (уровень доказательности: умеренный; сила рекомендации: сильная; согласованность 100%).
Рекомендация 17: Для пациентов с олигометастатическим заболеванием, которым показано проведение аблативной лучевой терапии метастазов в легких, следует проводить высококонформное планирование лучевой терапии (уровень доказательности: умеренный; сила рекомендации: сильная; согласованность 100%).
Рекомендация 18: У пациентов с олигометастатическим заболеванием, которым показано проведение аблативной лучевой терапии метастазов в легких, не следует использовать SBRT с одним изоцентром для нескольких мишеней за исключением случаев, когда ожидается, что вариабельность положения очагов будет небольшой (уровень доказательности: экспертное мнение; сила рекомендации: условная; согласованность 100%).
Комментарий радиотерапевта: При одновременном облучении множественных метастатических очагов выбор методики облучения, способа доставки дозы и количества изоцентров в лечебном плане является многофакторной задачей, которая должна решаться в зависимости от степени оснащенности, квалификации персонала и возможностей отделения. Подобный комплексный подход с учетом всех перечисленных аспектов и технических особенностей может и должен реализовать медицинский физик как высококвалифицированный специалист в данных вопросах.
Рекомендация 19: Пациентам с диагнозом олигометастатического заболевания и показанием к аблативной лучевой терапии легочных метастазов SBRT следует проводить под ежедневным визуальным контролем с прямой визуализацией мишени или имплантированных маркеров (уровень доказательности: умеренный; сила рекомендации: сильная; согласованность 100%).
Комментарий радиотерапевта: Визуализация должна позволять четко дифференцировать мишень относительно основных анатомических структур грудной клетки, предпочтительным является контроль по компьютерной томографии в коническом пучке (CBCT). В ряде случаев, при облучении из нескольких изоцентров, CBCT должна выполнятся перед каждым планом.
Рекомендация 20: Пациентам с диагнозом олигометастатического заболевания и показанием к аблативной лучевой терапии легочных метастазов SBRT может проводиться ежедневно или через день (уровень доказательности: умеренный; сила рекомендации: сильная; согласованность 100%).
Комментарий радиотерапевта: В рамках проанализированных в систематическом обзоре исследований не оценивалась корреляции режима фракционирования с эффективностью и безопасностью лучевой терапии, только в одном рандомизированном пилотном исследовании сообщалось об увеличении частоты возникновения одышки у пациентов, которые лечились на протяжении 4 дней подряд в сравнении с пациентами, которые лечились в течение 11 дней [12]. Для более детального изучения влияния режима лечения на токсичность необходимы более масштабные исследования.
Наблюдение
Рекомендация 21: Пациентам с олигометастатическим заболеванием после проведенной аблативной лучевой
терапии на метастатические очаги в
легких рекомендуется динамическое
наблюдение с выполнением КТ. Разумным является график наблюдения
каждые 3 месяца в течение первых
двух лет, каждые 6 месяцев в течение
периода до 3 лет и ежегодно в течение
периода до 5 лет, а затем каждые 2
года; изменение сроков контрольных
обследований может быть рассмотрено при наступлении клинических
событий (уровень доказательности:
высокий; сила рекомендации: сильная; согласованность 100%). Пациентов также следует координировать с
периодическими обследованиями в
зависимости от статуса основного заболевания и необходимости оценки
ответа на системную терапию. В случае неблагоприятных клинических
событий рассмотреть более раннее и
более частое дообследование.
Вместо заключения: предложенные практические рекомендации
с некоторыми неохваченными дополнениями, такими как выбор метода фиксации (вакуумный матрас,
ArmShuttle, термопластические маски), методика оконтуривания и
определение органов риска, технология определения локализации очага
относительно бронхиального дерева
(периферический, центральный, ультрацентральный), ограничениями по
дозовым нагрузкам на органы риска,
могут стать основой для разработки
локальных стандартов учреждения
(отделения лучевой терапии) по проведению стереотаксической лучевой
терапии метастазов в легких.
Источники:
- Mayinger M, Kotecha R, Sahgal A, et al. Stereotactic Body Radiotherapy for Lung Oligo-metastases: Systematic Review and International Stereotactic Radiosurgery Society Practice Guidelines. Lung Cancer. 2023; 182: 107284. doi:10.1016/j.lungcan.2023.107284.
- Qiu H, Katz AW, Milano MT. Stereotactic body radiation therapy versus metastasectomy for oligometastases. J Thorac Dis. 2019; 11(4): 1082-1084. doi:10.21037/jtd.2019.02.80.
- Helou J, Thibault I, Poon I, et al. Stereotactic Ablative Radiation Therapy for Pulmonary Metastases: Histology, Dose, and Indication Matter. Int J Radiat Oncol Biol Phys. 2017; 98(2): 419-427. doi:10.1016/j.ijrobp.2017.02.093.
- Chang JH, Poon I, Erler D, Zhang L, Cheung P. The safety and effectiveness of stereotactic body radiotherapy for central versus ultracentral lung tumors. Radiother Oncol. 2018; 129(2): 277-283. doi:10.1016/j.radonc.2018.07.001.
- McGarry RC, Papiez L, Williams M, Whitford T, Timmerman RD. Stereotactic body radiation therapy of early-stage non-small-cell lung carcinoma: phase I study. Int J Radiat Oncol Biol Phys. 2005; 63(4): 1010-1015. doi:10.1016/j. ijrobp.2005.03.073.
- Moher D, Liberati A, Tetzlaff J, Altman DG; PRISMA Group. Preferred reporting items for systematic reviews and metaanalyses: the PRISMA Statement. Open Med. 2009; 3(3): e123-e130.
- Burkon P, Kazda T, Pospisil P, et al. Ablative dose stereotactic body radiation therapy for oligometastatic disease: a prospective single institution study. Neoplasma. 2019; 66(2): 315-325. doi:10.4149/neo_2018_180731N558.
- Siva S, Bressel M, Mai T, et al. SingleFraction vs Multifraction Stereotactic Ablative Body Radiotherapy for Pulmonary Oligometastases (SAFRON II): The Trans Tasman Radiation Oncology Group 13.01 Phase 2 Randomized Clinical Trial. JAMA Oncol. 2021; 7(10): 1476-1485. doi:10.1001/ jamaoncol.2021.2939.
- Siva S, Sakyanun P, Mai T, et al. Long-Term Outcomes of TROG 13.01 SAFRON II Randomized Trial of SingleVersus Multifraction Stereotactic Ablative Body Radiotherapy for Pulmonary Oligometastases. J Clin Oncol. 2023; 41(19): 3493-3498. doi:10.1200/ JCO.23.00150.
- Kalinauskaite GG, Tinhofer II, Kufeld MM, et al. Radiosurgery and fractionated stereotactic body radiotherapy for patients with lung oligometastases. BMC Cancer. 2020; 20(1): 404. Published 2020 May
- doi:10.1186/s12885-020-06892-4. 11. Sharma A, Duijm M, Oomen-de Hoop E, et al. Factors affecting local control of pulmonary oligometastases treated with stereotactic body radiotherapy. Acta Oncol. 2018; 57(8): 1031-1037. doi:10.1080/028418 6X.2018.1445285. 12. Jain S, Poon I, Soliman H, et al. Lung stereotactic body radiation therapy (SBRT) delivered over 4 or 11 days: a comparison of acute toxicity and quality of life. Radiother Oncol. 2013; 108(2): 320- 325. doi:10.1016/j.radonc.2013.06.045.
БОЛЬШЕ – НЕ ЗНАЧИТ ЛУЧШЕ? ДАННЫЕ ИССЛЕДОВАНИЯ NEO-AEGIS
В сентябрьском номере журнала The Lancet Gastroenterology and
Hepatology были опубликованы
отдаленные результаты уже многим известного крупного мультицентрического (24 европейских
страны-участницы) рандомизированного исследования 3 фазы NeoAEGIS. Оно напрямую касалось
одной из давних нерешенных проблем торакальной онкологии – неоадъювантного лечения местнораспространенных аденокарцином
пищевода и эзофаго-гастрального
перехода (ЭГП). Оптимальный подход в лечении этой категории пациентов пока не определен, в большинстве рекомендаций показано
проведение неоадъювантного химиолучевого лечения с последующей
радикальной операцией. Без сомнения, пройти весь сложный тримодальный путь, чреватый немалым
процентом осложнений, вплоть до
летальных, под силу далеко не всем
пациентам. Но нужен ли столь токсичный подход всем пациентам с
аденокарциномой этой локализации?
Исследование Neo-AEGIS (также известное как CTRIAL-IE 10-14) было
разработано после публикации
исследования CROSS с основной
целью напрямую сравнить результаты лечения по тримодальному
протоколу CROSS (лучевая терапия
на фоне ПХТ с карбоплатином/паклитакселом) с модифицированной схемой исследования MAGIC
(эпирубицин, цисплатин или оксалиплатин плюс фторурацил или
капецитабин). Подтекст заключался в том, чтобы понять, релевантен
ли для аденокарцином пищевода и
ЭГП режим, включающий лучевую
терапию с доказанным локальнорегионарным эффектом, в эпоху
растущей тенденции к радикальной
хирургии en-block и лимфаденэктомии, и имеет ли периоперационная
химиотерапия преимущества за
счет снижения частоты системных
рецидивов.
В период с 24 января 2013 г. по 23 декабря 2020 г. было рандомизировано
377 пациентов, из которых 362 были
включены в intention-to-treat анализ
(327 [90%] мужчин и 360 [99%] белых):
• 184 пациента – в группу периоперационной химиотерапии по схеме: три предоперационных и три
послеоперационных 3-недельных
цикла внутривенного введения 50
мг/м2 эпирубицина в 1 день плюс
внутривенное введение 60 мг/м2
цисплатина или внутривенное
введение 130 мг/м2 оксалиплатина в 1 день плюс непрерывная
инфузия фторурацила в дозе 200
мг/м2 ежедневно или перорально
625 мг/м2 капецитабина два раза
в день до 2018 года, или четыре
предоперационных и четыре послеоперационных двухнедельных
курсов 2600 мг/м2 фторурацила,
85 мг/м2 оксалиплатина, 200 мг/м2
лейковорина и 50 мг/м2 доцетаксела (FLOT) внутривенно в первый
день после 2018 года, когда схема
вошла в стандарты;
• 178 пациентов – в группу стандартной тримодальной терапии (лучевая терапия 41,4 Гр за 23 фракции
на фоне еженедельного введения
карбоплатина AUC2 и паклитаксела 50 мг/м2).
Исследование завершилось преждевременно в декабре 2020 года
после второго промежуточного
анализа (после фиксирования 143
смертей) с учетом схожих показателей выживаемости и воздействия
пандемии COVID-19. Все пациенты
имели первичные аденокарциномы
пищевода T2-3N0-3 и ЭГП I, II и III
типов по Siewert, стадированные по
ПЭТ-КТ и методом эндоскопического ультразвукового исследования.
Первичной конечной точкой была
общая выживаемость, оцениваемая
у всех случайно выбранных пациентов, получивших хотя бы одну
дозу исследуемого препарата, независимо от того, какой исследуемый
препарат они получали по протоколу. Вторичными конечными точками были безрецидивная выживаемость, локализация рецидива,
послеоперационные осложнения,
токсичность, патологический ответ
(полный [ypT0N0] и большой [степень регрессии опухоли 1 и 2]), частота резекции R0 и качество жизни.
При медиане наблюдения 38,8 мес.
(16,3-55,1) медиана общей выживаемости составила 48,0 мес. (95% ДИ
33,6-64,8) в группе периоперационной химиотерапии и 49,2 мес.
(34,8-74,4) в группе тримодальной
терапии (3-летняя общая выживаемость 55% [95% ДИ 47-62] против
57% [49-64]; отношение рисков 1,03
[95% ДИ 0,77-1,38]). Медиана безрецидивной выживаемости составила 32,4 мес. (95% ДИ 22,8-64,8)
в группе периоперационной химиотерапии и 24,0 мес. (18,0-40,8)
в группе тримодальной терапии
(отношение рисков 0,89 [95% ДИ
0,68-1,17]) (рис.1). Характер рецидивов, локорегиональный или системный, достоверно не отличался
(отношение рисков 1,35 [95% ДИ
0,63-2,91], p=0,44). Патологический
полный ответ (4% в группе ХТ и
12% в группе ХЛТ, отношение шансов 0,33 [95% ДИ 0,14-0,81], p=0,012),
наибольший патологический ответ (0,21 [0,12-0,38], p<0,0001) и показатели R0 резекций (0,21 [0,08-
0,53], p=0,0003) все же оказались в
пользу тримодальной терапии.
Наиболее частым нежелательным
явлением 3-4 степени была нейтропения (49 [27%] из 183 пациентов
в группе периоперационной химиотерапии против 11 [6%] из 178
пациентов в группе тримодальной
терапии), за которой следовали диарея (20 [11%]) против 0%) и легочная эмболия (по 5%). Один (1%) пациент в группе периоперационной
химиотерапии и три (2%) пациента
в группе тримодальной терапии
умерли от серьезных нежелательных явлений, у двоих (по одному
в каждой группе) причины, возможно, были связаны с лечением.
Никаких различий не наблюдалось
в операционной смертности (пять
[3%] смертей в группе периоперационной химиотерапии против
четырех [2%] в группе тримодальной терапии) или общем состоянии
здоровья через 1 и 3 года.
Рисунок 1.
Кривые общей
и безрецидивной выживаемости
в группах
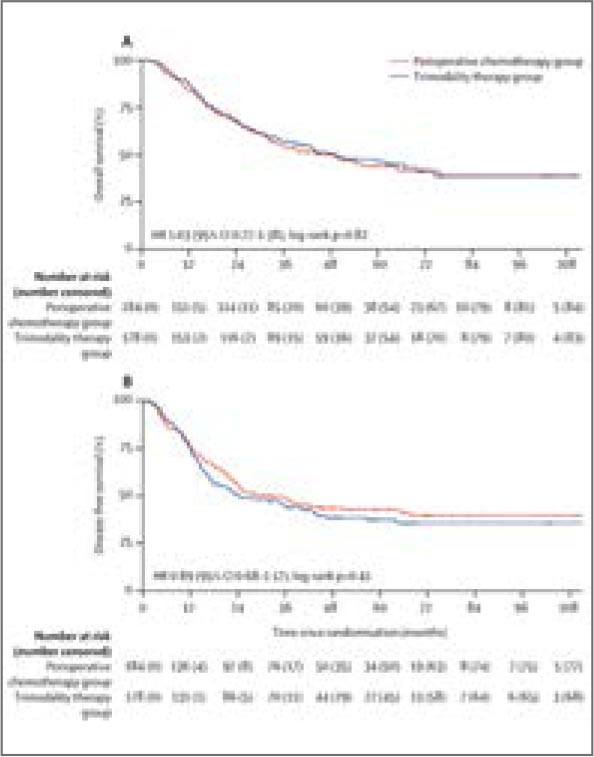
Подгрупповой анализ показал, что,
пожалуй, более возрастные и ослабленные пациенты без явных признаков поражения регионарных
лимфоузлов больше подходят для
тримодального лечения, тогда как
остальным показана более интенсивная системная терапия с целью
улучшения показателей выживаемости (рис.2).
Рисунок 2.
Подгрупповой анализ общей выживаемости по данным
исследования
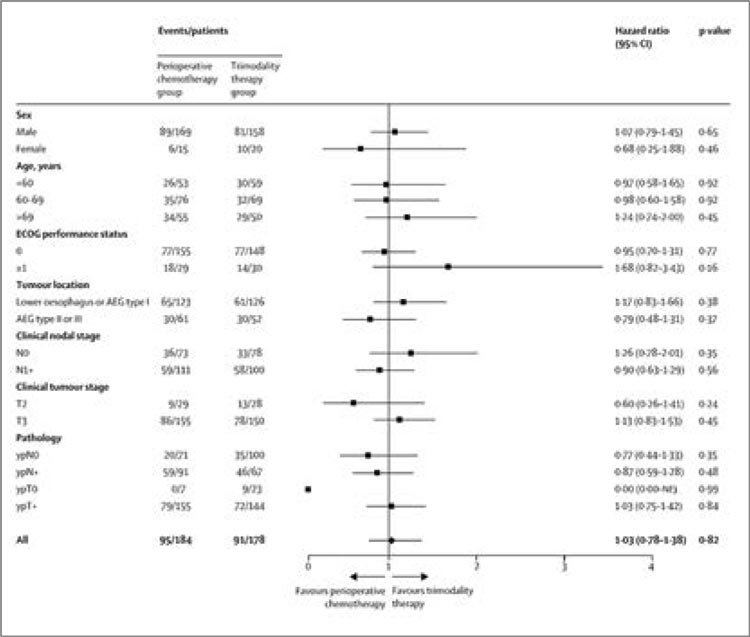
Несмотря на недостаточную полноту данных, Neo-AEGIS предоставляет собой, пожалуй, крупнейшее
рандомизированное исследование
по аденокарциноме пищевода и
пищеводно-желудочного перехода,
получавших периоперационную
химиотерапию (преимущественно модифицированный режим
MAGIC) и тримодальную терапию
CROSS, демонстрируя схожую
3-летнюю выживаемость и отсутствие принципиальных различий
в последствиях оперативного этапа
и общем качестве жизни. Авторы
предполагают, что эти данные подтверждают сохранение клинического равновесия при использовании двух упомянутых подходов.
Источник:
Reynolds JV, Preston SR,
O'Neill B, Lowery MA, Baeksgaard
L, Crosby T, Cunningham M, Cuffe
S, Griffiths GO, Parker I, Risumlund
SL, Roy R, Falk S, Hanna GB, Bartlett
FR, Alvarez-Iglesias A, Achiam
MP, Nilsson M, Piessen G, Ravi N,
O'Toole D, Johnston C, McDermott
RS, Turkington RC, Wahed S, Sothi
S, Ford H, Wadley MS, Power D;
Neo-AEGIS Investigators and Trial
Group. Trimodality therapy versus
perioperative chemotherapy in the
management of locally advanced
adenocarcinoma of the oesophagus
and oesophagogastric junction (NeoAEGIS): an open-label, randomised,
phase 3 trial. Lancet Gastroenterol
Hepatol. 2023 Sep 18; S2468-
1253(23)00243-1. doi: 10.1016/S2468-
1253(23)00243-1. Epub ahead of print.
PMID: 37734399.
ASTRO 2023: ОБЗОР LATE-BREAKING ABSTRACTS
LBA 02. Randomized Controlled
Trial of Hypofractionated vs.
Normo-fractionated Accelerated
Radiation Therapy with or without
Cisplatin for Locally Advanced
Head and Neck Squamous Cell
Carcinoma (HYPNO). S.M.
Bentzen, et al.
Гипофракционированные режимы лучевой терапии прочно
обосновались в лечебных схемах
опухолей разных локализаций.
Однако укороченные курсы облучения, да еще на фоне химиотерапии при опухолях головы и шеи,
как правило, чреваты более выраженной токсичностью, ранней
и поздней, поэтому применялись
они чаще всего в паллиативных
целях. HYPNO, многоцентровое, двухрукавное, неслепое исследование фазы III, оценивало
эффективность и безопасность
гипофракционированной (ГипоФ) ускоренной ЛТ в сравнении с традиционной (НормоФ)
с добавлением цисплатина или
без него при местнораспространенном плоскоклеточном раке
головы и шеи. HYPNO проводилось в 12 центрах в 10 странах с
низким и средним уровнем дохода. Авторы предположили, что
гипофракционирование (55 Гр, 20
фракций по 5 фракций в неделю
в течение 4 недель) не уступает
нормофракционированию (66 Гр,
33 фракций, по 6 фракций в неделю в течение 5,5 недель) на фоне
еженедельного приема цисплатина или без него по своей эффективности. Согласно гипотезе,
ожидалась абсолютная разница в
10% через 3 года наблюдения для
первичных конечных точек – локорегионального контроля (LRC)
и поздних нежелательных явлений 3+ степени.
792 пациента были централизованно рандомизированы с марта
2014 г. по февраль 2020 г.: 395 в
группу гипофракционирования,
397 – в группу традиционных
фракций. Химиотерапия подразумевала внутривенное введение
цисплатина 35 мг/м2 еженедельно во время лучевой терапии, 4
цикла в группе ГипоФ, 5 в группе
НормоФ. Стратификация была
по статусу ECOG 0-1 против 2
(3,7%), химиотерапии либо ее отсутствию (75,8%), локализации
первичной опухоли (полость рта
(8,5%), ротоглотка (50,5%), нижняя часть глотки (13,5%), гортань
(24,5%), другие (3,0%)) и учреждениям. Среди включенных в
исследование пациентов было
86,9% мужчин, 38,1% нынешние
и 39,3% – бывшие курильщики;
с опухолями Т3-4 – 72,7% больных; N2-3 (49,1%). Исследователи
HYPNO позволили учреждениям
использовать стандартную клиническую технику лучевой терапии: 2D (22,5%) против 3D (7,1%)
против IMRT (70,2%). В результате исследование HYPNO продемонстрировало: гипофракционированная ускоренная ЛТ не
уступает схеме с 6 фракциями в
неделю как в отношении локально-регионарного контроля опухоли, так и в отношении ранних и
поздних нежелательных явлений
3+ степени. Трехлетние результаты были удивительно схожими с
абсолютной разницей <1,5% между двумя группами (см. табл.1).
Это исследование уже расценено как потенциально меняющее
стандартную практику, хотя для
перехода на гипофракционирование при ОГШ, тем более на
фоне ХТ, требует достаточного
опыта и определенной смелости
команды. Более короткий курс в
20 фракций вместо 33 экономит
ресурсы и более удобен для пациентов. Насколько нам известно,
HYPNO является крупнейшим
рандомизированным контролируемым исследованием такого
уровня сложности, проводимым
в странах с низким и средним
уровнем дохода.
Таблица 1.
Трехлетние результаты исследования HYPNO.
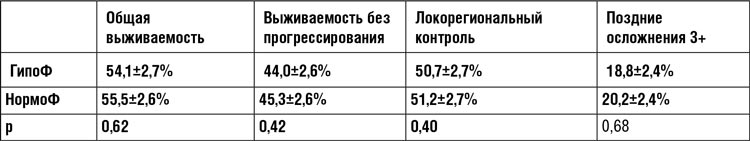
LBA 05. Patient-Reported and
Toxicity Results from the FABREC
Study: A Multicenter Randomized
Trial of Hypofractionated vs.
C onvent iona l ly-Fr ac t ionate d
Postmastectomy Radiation
Therapy after Implant-Based
Reconstruction. J.S. Wong, et al.
И снова гипофракционирование –
и снова риск, и снова он оправдан.
В исследовании FABREC авторы
смело взялись за ускоренное облучение святая святых – грудной
стенки после одномоментной реконструкции. Сам факт проведения лучевой терапии на имплантате или экспандере до сих пор
являет собой проблему, и многие
исследователи сходятся во мнении, что предсказать риск осложнений практически невозможно,
это сродни некоей лотерее. Но
укорочение курса ЛТ теоретически может увеличить частоту
осложнений и сказаться на эффективности лечения и качестве
жизни. Посмотрим же на результаты этой работы.
Это рандомизированное исследование по ЛТ после реконструкции молочной железы (FABREC)
имело целью сравнить качество
жизни и клинические результаты
гипофракционированной (HF) и
традиционной (CF) радиотерапии после мастэктомии (ПМРТ)
и одномоментной реконструкции.
В период с марта 2018 г. по ноябрь
2021 г. в 18 центрах 400 больных
раком молочной железы стадии
0-III после мастэктомии и одномоментной установки тканевого
экспандера или имплантата были
рандомизированы в соотношении
1:1 на фотонную лучевую терапию
в режимах HF или CF. Соответствующие дозы в обеих группах
составляли 42,56 Гр/16 фракций
на грудную стенку с захватом
подмышечных/надключичных
лимфатических узлов или без них
(39,9 Гр/15 фракций) и 50 Гр за 25
фракций на грудную стенку (46-50
Гр на подмышечные ЛУ). Эскалация дозы не разрешалась; болюс
использовался по усмотрению
врача. Токсичность ЛТ определялась как любое нежелательное
явление ≥3 степени (CTCAE) после начала ПМРТ. Пациенты были
цензурированы при выходе из исследования или при диагностике
отдаленного рецидива. Участники заполняли опросники контроля качества жизни (FACT-B,
BREAST-Q, Lymph-ICF) исходно,
через 6, 12 и 18 месяцев от начала
ПМРТ. Первичной конечной точкой исследования было улучшение физического благополучия по
опроснику FACT-B через 6 месяцев с заранее заданной стратификацией по возрасту (моложе 45 лет
против 45 лет и старше). Показатели качества жизни сравнивались с
использованием t-критерия Стьюдента.
Медиана наблюдения за 385 проанализированными пациентами
составила 31,8 месяца (диапазон
6,9-54,4); средний возраст составил 47,0 лет (диапазон 23-79).
Предоперационная химиотерапия применялась в 67,8%, а
предоперационная эндокринная
терапия – в 21,5% случаев. Было
16 отдаленных (по 8 в каждой
группе) и 2 местных регионарных
(по 1 в каждой группе) рецидива.
Токсичность со стороны тканей
грудной стенки наблюдалась у 35
пациентов (19 после гипофракционирования, 16 – после традиционных фракций, p=0,58) в среднем
через 3,4 и 4,8 месяца после начала лучевой терапии в группах
HF и CF соответственно (p=0,82).
Послеоперационные инфекционные осложнения перед лучевой
терапией (HR=3,31; p=0,03), облучение экспандера vs импланта
(HR=7,74; p=0,046), проведение
предоперационной эндокринной
терапии (HR=3,45; p=0,0007) и количество удаленных ЛУ (HR=1,06/
узел; p=0,02) были значимыми для
развития токсичности со стороны
грудной стенки при многофакторном анализе, тогда как сам вариант фракционирования – нет (HF
HR=1,19; p=0,63). Не было значительной разницы в общем изменении показателей физического благополучия через 6 месяцев между
двумя группами (p=0,71) или отдельно в более молодых (p=0,15) и
старших когортах (p=0,27). Однако пациентов моложе 45 лет после
укороченных курсов меньше беспокоили побочные эффекты лечения (р=0,045) и тошнота (р=0,02)
по сравнению с пациентами моложе 45 лет после традиционного
облучения.
Основной вывод авторов: физическое благополучие и общий
профиль токсичности ПМРТ
были сопоставимы при проведении гипо- и нормофракционированного облучения после одномоментной реконструкции. При
этом гипофракционирование
было связано с лучшим качеством
жизни в течение 6 месяцев среди
более молодых пациентов в ряде
аспектов. Эти ранние результаты
подтверждают возможность и целесообразность более широкого
применения укороченных курсов
ЛТ после реконструкции с постановкой временных экспандеров
или имплантатов.
LBA 09. Stereotactic Ablative
Body Radiotherapy (SABR) for
Oligoprogressive ER-Positive
Breast Cancer (AVATAR): A Phase
II Prospective Multicenter Trial.
S.P. David et al.
Одна из важных целей стереотаксической лучевой терапии (SABR)
при олигопрогрессировании –
максимально отсрочить начало
системной терапии либо момент
перехода на следующую линию.
Основной задачей авторов проспективного мультицентрического исследования 2 фазы AVATAR
было оценить, может ли SABR
при олигопрогрессирующем люминальном (ER-положительном,
Her2-отрицательном) олигометастатическом раке молочной
железы отсрочить переход с комбинации ингибитора CDK 4/6 и
ингибитора ароматазы (CDK 4/6 +
AI) более чем на 6 месяцев у более
25% пациентов.
В исследование AVATAR (ACTRN
12620001212943) были включены
пациенты с распространенным
люминальным РМЖ, которые
получали системное лечение в
первой или второй линии комбинацией CDK 4/6 + AI в течение ≥6
месяцев, будучи в статусе ECOG
0-2 и с 1-5 экстракраниальными
очагами олигопрогрессии, подходящими для SABR. Пациенты, получавшие химиотерапию по поводу метастатического заболевания,
имеющие лептоменингеальные
метастазы или предшествующую
лучевую терапию на очаги олигопрогрессии, планируемые для
SABR, были исключены. При последующем прогрессировании
разрешалось проведение SABR
для отсрочки изменения системной терапии. Первичной конечной точкой была бессобытийная
выживаемость (БСВ), определяемая как время изменения системной терапии после SABR, любого
прогрессирования в течение 6
месяцев или в более чем 3 очагах.
Вторичными конечными точками были выживаемость без прогрессирования (ВБП), общая выживаемость (ОВ), токсичность,
связанная с лечением, и модифицированная выживаемость без
прогрессирования (мВБП), определяемая как прогрессирование,
не поддающееся дальнейшему
SABR в любой момент времени.
С августа 2020 г. по ноябрь 2022 г.
было набрано 32 пациента, средний срок наблюдения составил
15,8 месяца. Число пациентов с
1, 2, 3 или 4 очагами олигопрогрессии исходно было 13 (41%), 10
(31%), 7 (22) и 2 (6%) соответственно. Наиболее частыми участками олигопрогрессии были кости
(44, 71%) и лимфоузлы (11, 18%).
Как правило, SABR проводилась
однократно в дозе 20 Гр или в
СОД 24 Гр за 2 фракции. В итоге
у 47% (95% ДИ 29-65) пациентов
не возникло событий в течение
≥6 месяцев. Медиана мВБП составила 10,4 месяца (95% ДИ 4,1 – не
достигнута), при этом 46% больных (95% ДИ 27-63) оставались
на прежней системной терапии в
течение 12 месяцев. Медиана ВБП
составила 5,2 месяца (95% ДИ 3,1-
6,8), при этом 10/30 (33%) случаев
прогрессирования подходили для
проведения второго курса SABR
из-за олигопрогрессии с целью
дальнейшего отсрочивания изменений в системной терапии. У 17
(53%) пациентов не отмечено какой-либо токсичности, связанной
с лечением. У 13 (40%) и 2 (13%)
пациентов наблюдалась токсичность 1 или 2 степени, при этом о
токсичности 3 степени или выше
не сообщалось.
Авторы отмечают, что AVATAR –
это первое проспективное исследование, в котором подтверждена
роль SABR в качестве стратегии
продолжения применения комбинации CDK 4/6 + AI у пациентов с
олигопрогрессивным люминальным РМЖ и отсрочивания момента перехода на следующую линию.
Подобное лечение высоко толерантно, с более высоким, чем ожидалось, средним промежутком
времени до изменения системной
терапии, составившим 10,4 месяца, и 46% пациентов продолжали
получать CDK 4/6 + AI в течение
12 месяцев. Эти результаты позволяют предположить, что пациентам с олигопрогрессирующим
люминальным РМЖ настоятельно следует рассматривать возможность назначения SABR вместо изменения системной терапии.
LBA 11. Early Results of a Phase
I Pre-Operative Single Fraction
Ablative Trial for Early Stage Breast
Cancer. A.S. Rahimi et al.
Как говорится, новое – хорошо забытое старое. Российские радиотерапевты со стажем хорошо помнят времена, когда при раннем
раке молочной железы широко
применялось предоперационное
гипофракционированное облучение молочной железы и подмышечной зоны в дозах 24-25 Гр
за 5-6 фракций с последующей
немедленной операцией. Строгая
ориентированность на стандарты лечения исключила подобную
схему из рутинной практики, и
долгое время мы о ней не вспоминали. Однако идея предоперационного облучения опухоли
большой дозой в последние годы
изучается многими исследователями.
Американские авторы представили первые результаты когортного
исследования 1 фазы с эскалацией
дозы ЛТ с целью изучить влияние
предоперационного однофракционного стереотаксического
аблативного парциального облучения молочной железы (SPBI в
дозе 30, 34 или 38 Гр за фракцию)
на токсичность и ответ опухоли
при раннем гормонопозитивном
(HR+) РМЖ (NCT04040569).
В исследование включались пациентки с инвазивными карциномами молочной железы размером <3
см, HR+, Her2-, cN0, не требующие
химиотерапии. Больные получали лучевую терапию на ускорителях MR LINAC, аппаратах
роботизированной радиохирургии или кобальтовых аппаратах с
функцией стереотаксического наведения. Эндокринную терапию
начинали спустя две недели после
облучения, а операция проводилась через 2-12 месяцев после ЛТ.
Основная цель работы состояла в
подборе дозы одиночной фракции
SPBI до максимально абляционной без превышения максимально переносимой дозы (MTD). Вторичные конечные точки включали
полный патоморфологический
ответ (pCR), локальный контроль,
токсичность, косметический эффект и отдаленную безрецидивную выживаемость (БРВ). Дозолимитирующая токсичность (DLT)
определялась токсичностью ≥3
степени или любой токсичностью
степени 4/5, связанной с SPBI. В
каждую дозовую группу набирали 7-15 пациентов. Повышение
дозы разрешалось, если у 0/7, 2/9,
≤3/12 или ≤4/15 пациентов наблюдалась ДЛТ в течение 90 дней
после облучения. MTD считалась
превышенной, если в какой-либо
когорте встречалось больше событий DLT.
С декабря 2019 г. по июнь 2023 г.
11 и 15 пациентов получили дозу
ЛТ 30 Гр и 34 Гр соответственно.
Частота полных и почти полных
патоморфологических ответов
(pCR/nCR) составила 37,5% для 30
Гр против 92,8% для 34 Гр (p=0,01).
При дозе 30 Гр 8 из 11 пациентов
(73%) были прооперированы с медианным интервалом 4,3 (диапазон 2,8-5,9) месяца от ЛТ до операции: у 0/8 (0%) был pCR, а у 3/8
(37,5%) – nCR. При уровне дозы 34
Гр 14 из 15 пациентов (93%) перенесли операцию с медианным интервалом 7,3 (диапазон 5,9-12) месяца от ЛТ до операции: у 6 из 14
(42,8%) был рCR, а у 7 из 14 (50%)
был nCR. Из 8 пациентов с nCR у
50% имелась только 1-3 мм остаточная опухоль. Среднее значение
ki67 для всей группы составило 12,0±6,9% при постановке диагноза и снизилось до 1,4±2,3% при
обследовании после операции. У
13 из 14 (92,8%) пациентов с остаточной опухолью ki67 составил
<3% после проведенного лечения.
Было зафиксировано 33 случая
ранней токсичности 1 степени,
2 – 2-й степени (боль в грудной
клетке и дерматит) и 10 поздних
осложнений 1-й степени (плюс
1 – 2-й степени (боль в груди) и 1
– 3-й степени (медленно заживающая рана) при неконтролируемом
диабете).
Эти крайне интересные результаты небольшого исследования
дают пищу для раздумий. Авторы
отмечают, что это первое исследование, продемонстрировавшее
безопасность и эффективность
предоперационного SPBI в дозе
34 Гр за одну фракцию для больных с ранней стадией HR+ РМЖ.
Эскалация дозы привела к резкому увеличению частоты pCR/nCR
(92,8%), а также снижению индекса пролиферации, что позволяет
предположить, что это интересный подход не только для снижения злокачественного потенциала
опухоли, но и потенциального ее
полного устранения с помощью
только лучевой/эндокринной терапии на ранних стадиях РМЖ,
что упорно прокладывает путь к
нехирургическому консервативному лечению в отобранной когорте больных.
СТОИТ ЛИ ОПЕРИРОВАТЬ МЕСТНОРАСПРОСТРАНЕННЫЙ РАК ШЕЙКИ МАТКИ?
Этот вопрос вновь и вновь задают
себе исследователи на протяжении
многих лет, несмотря на то, что уже
давно стандартом лечения местнораспространенного рака шейки матки
(РШМ) стала радикальная химиолучевая терапия, позволяющая достичь
отличных отдаленных результатов,
в том числе и общей выживаемости, превышающей 90% за 5 лет при
начальных стадиях. Возможно ли
улучшить эти результаты, если всетаки прибегнуть к операции – но
после проведенного неоадъювантного системного лечения? В недавнем
номере журнала Journal of Clinical
Oncology опубликованы результаты
крупного исследования с подобным
дизайном – которые в очередной раз
продемонстрировали уже известные
факты.
EORTC-55994 — международное
проспективное рандомизированное
исследование 3 фазы, в которое были
включены именно больные местнораспространенным РШМ IB2-IIB
стадий, ранее не получавшие лучевую или химиотерапию. На момент
начала исследования (2002 год) стандартом лечения местнораспространенного РШМ уже была одновременная химиолучевая терапия, однако
результаты 2 исследования 2 фазы,
проведенных вскоре, показали, что
комбинация неоадъювантной химиотерапии с последующим хирургическим вмешательством может быть
предпочтительной благодаря уменьшению размера опухоли и улучшению условий для ее хирургического
удаления. На основании этих данных
авторы исследования поменяли его
формат на superiority trial.
Пациентки были рандомизированы
в группу неоадъювантной химиотерапии (314 больных) с последующим
радикальным хирургическим вмешательством или группу стандартной
одновременной химиолучевой терапии (312 больных). Неоадъювантная
химиотерапия была платиносодержащей (это минимальное требование
исследователей), но некоторые центры добавили к платине паклитаксел.
Хирургическое вмешательство было
запланировано в течение 6 недель после завершения неоадъювантной химиотерапии. Набор вели 25 центров
из 10 стран. При медиане наблюдения 8,7 лет большинство пациентов в
группах неоадъювантной химиотерапии/хирургии (71%) и химиолучевой
терапии (82%) завершили лечение,
определенное протоколом. Первичной конечной точкой была 5-летняя
общая выживаемость (ОВ). Вторичными конечными точками были выживаемость без прогрессирования
заболевания, ОВ, токсичность и качество жизни, связанное со здоровьем
(HRQOL).
В итоге исследование, которое
продолжалось целых 15 лет, продемонстрировало весьма схожие
результаты. Пятилетняя общая выживаемость (ОВ) составила 72% в
группе комбинации по сравнению с
76% в группе химиолучевой терапии.
Никаких различий в зависимости от
стадии FIGO не наблюдалось; однако
отмечена тенденция к улучшению ОВ
после химиолучевой терапии у больных старше 50 лет (78% против 69%
через 5 лет, ОР 0,66; 95% ДИ 0,42–1,03)
и у пациенток с ИМТ 25 или менее
(81% против 71% через 5 лет, ОР 0,59;
95% ДИ 0,37–0,96).
Пятилетняя выживаемость без прогрессирования (ВБП) составила 57%
в группе неоадъювантной химиотерапии/хирургии по сравнению с
66% в группе химиолучевой терапии
(ОР 0,73; 95% ДИ 0,57–0,93; P=0,011).
Однако исследователи отметили, что
первая визуальная оценка эффекта,
как правило, проводилась раньше в
группе неоадъюванта, поэтому дополнительный анализ интервального цензурирования показал схожие
результаты ВБП между группами.
Кроме того, ВБП была одинаковой
в группах пациентов, пролеченных
строго по протоколу.
Соблюдение требований скрининга
качества жизни во время исследования было неважным: процент завершения составил 69% на исходном
уровне и только 27% в конце второго
года. Несмотря на это, не было обнаружено существенных различий в качестве жизни между двумя группами.
Но при этом имелись весомые различия в профилях побочных эффектов
между группами. В неоадъювантной
группе ранние побочные эффекты
были более выражены и встречались
чаще, но это, по мнению авторов, в
основном было вызвано химиотерапией. В группе ХЛТ более распространены более поздние побочные
эффекты. Так, нежелательные явления 3/4 степени во время лечения
чаще возникали при применении
неоадъювантной химиотерапии в
сочетании с хирургическим вмешательством по сравнению с группой
ХЛТ (41% против 23%); в основном
это были осложнения со стороны
желудочно-кишечного тракта и гематологические. За весь период наблюдения осложнения 3-й степени и
выше были отмечены у 15% пациентов, получавших неоадъювантную
химиотерапию, по сравнению с 21%
после ХЛТ.
Таким образом, исследование
EORTC-55994 не выявило различий
в общей выживаемости у пациенток
с распространенным раком шейки
матки, получавших неоадъювантную химиотерапию с последующей
радикальной хирургией или стандартной одновременной химиолучевой терапией. Хотя исследование
было задумано как superiority, а не
non-inferiority, его результаты попрежнему важны, как полагают авторы. Комбинированное лечение
может иметь значение в ряде стран
с низким уровнем дохода, не имеющих возможность позволить себе
хорошую лучевую терапию. «Лучшее» вновь оказалось врагом «хорошего», и «доброе старое» химиолучевое лечение рака шейки матки
продолжает занимать основательные позиции во всех клинических
рекомендациях.
Источник:
Kenter G, Greggi S,
Vergote I, et al. Randomized Phase
III study comparing neoadjuvant
chemotherapy followed by surgery
vs chemoradiation in stage IB2-IIB
cervical cancer: EORTC-55994. J Clin
Oncol. 2023;JCO.22.02852.
ПРОБЛЕМЫ КОММУНИКАЦИИ: ВЗГЛЯД ПАЦИЕНТА
Автор: Гордеева Ольга Олеговна
Врач-онколог, химиотерапевт, заведующая дневным стационаром
ФГБУ ФНКЦ ФХМ им. Ю.М. Лопухина ФМБА России, кандидат медицинских наук, Москва
Обсуждая совершенствование
онкологической помощи, мы
часто затрагиваем вопросы финансирования. Однако есть и
другая проблема. Это критический дефицит времени на приеме, который лишает возможности больных задать вопросы
о своем состоянии. В результате
пациенты зачастую абсолютно не
ориентируются в своем диагнозе
и лечении. Мы знаем об этой проблеме, но как на это смотрят они
сами?
Чтобы ответить на этот вопрос,
мы инициировали опрос онкологических пациентов в социальных сетях, прежде всего, через
телеграм-канал. Поделиться своими переживаниями на этот счет
сочли возможным 944 пациента.
Почти половина (44%) пациентов
получали лечение в Москве или
Санкт-Петербурге, 27,2% – в региональных центрах, остальные
– в других учреждениях разных
городов России. Большая часть
пациентов (93%) лечились за счет
ОМС, 5,7% – за свой счет, 1,3%
воспользовались полисом ДМС.
Результаты продемонстрировали, что пациентов беспокоит как
отсутствие времени на приеме
(43,6%), так и отсутствие внимания и заинтересованности со стороны доктора (53%). Это и не удивительно, учитывая, что 59,9%
пациентов отметили, что на прием было отведено менее 10 минут.
Среди волнующих вопросов, на
которые пациенты так и не смогли получить ответы, – вопросы по самой сути заболевания
(54,2%), возможных опциях терапии (52,2%), нежелательных явлениях (57,6%), образе жизни во
время лечения (49,6%), вопросы
психологического сопровождения (43%).
Один из возможных путей решения этой проблемы – это экономия времени приема. Например,
выдача пациентам, которые ждут
своей очереди за дверью кабинета, опросника с базовыми вопросами о самочувствии, жалобах,
сопутствующих заболеваниях и
терапии. Тем не менее, даже этот
способ не позволит выкроить
достаточно времени для беседы
с пациентом. Это ставит перед
нами задачу доставки информации вне основного приема. Для
большинства пациентов (78,1%)
наиболее удобным является текстовый формат.
Прежде всего, мы можем предоставлять ссылки на надежные
ресурсы, где интересующиеся
могут получить ответы на многие
свои вопросы. Например, рекомендации NCCN для пациентов,
часть из которых переведена на
русский язык. Кроме того, важно
сообщать о наличии пациентских
сообществ в социальных сетях,
которые осуществляют не только
информационную, но и психологическую поддержку.
Также в рамках отделений можно
сформировать памятки или иной
раздаточный материал для пациентов с базовой информацией об
образе жизни, питании, развенчании основных предрассудков о
лечении и так далее – словом, ответить на самые частые вопросы
пациентов, которые мы слышим
на приеме изо дня в день. Это не
только обеспечивает лучшую информированность, но и ограждает пациентов от поиска ответов
на свои вопросы во вредоносных
источниках.
Еще одна проблема – это получение информации уже от самих
пациентов о переносимости лечения и общем состоянии в промежутке между курсами. Чуть
больше трети пациентов (34,7%)
имели возможность задать вопрос своему доктору в интервале
между циклами, что, безусловно,
подчеркивает альтруизм некоторых наших докторов. Но, как
выясняется, такая связь – это не
роскошь, а необходимость. Дело
в том, что 42,9% пациентов признались: в отсутствии связи с
доктором они хотя бы единожды
чувствовали, что те побочные
эффекты, которые они испытывают на фоне лечения, угрожают
их жизни.
Что же делали пациенты в момент, когда им нужно было получить помощь? К сожалению,
более половины (53,1%) пользовались ссылками, найденными в
интернете (что это были за ресурсы и насколько безопасна та информация, которая там была размещена, остается только гадать);
16,3% воспользовались советами
знакомых, а 27% пытались самостоятельно читать профессиональную литературу, делая свои
выводы. Радует, что 42,6% пациентов все же нашли возможность
обратиться к другому доктору.
Тут нужно вспомнить исследование Denis et al. [1], которое продемонстрировало увеличение ОВ
у пациентов с метастатическим
НМРЛ, имевших возможность
написать своему лечащему врачу,
по сравнению с теми, кто такой
возможности не имел. На данный
момент идет разработка программ, отслеживающих нежелательные явления и информирующих о критических отклонениях
от нормы у пациентов докторам,
однако пока ни одна из них не
имеет широкого использования.
Безусловно, наши возможности
поддерживать связь с пациентами между курсами невелики. Это
связано прежде всего с загруженностью врачей на основном
приеме. Тем не менее, создание
дополнительных каналов связи
(например, централизованная
почта, куда пациенты могли бы
присылать свои вопросы) необходимо для осуществления качественной помощи.
Сложности работы онколога зачастую заставляют нас концентрироваться исключительно на
назначении адекватной терапии,
способной продлить жизнь пациента. Однако сами пациенты
хотят понимать, что с ними происходит, и ищут информацию.
Работая над дополнительными
способами просвещения больных, мы можем направить этот
интерес в правильное русло и
уберечь их от ненадежных (а иногда и вредоносных) источников
информации. Такой подход может позволить улучшить результаты лечения конкретных больных. Ведь, в конечном счете, ради
этого мы и работаем.
Источник:
Denis F, Basch E,
Septans A, et al. Two-Year Survival
Comparing Web-Based Symptom
Monitoring vs Routine Surveillance
Following Treatment for Lung
Cancer. JAMA. 2019; 321(3): 306-
307. doi:10.1001/jama.2018.18085.
ДИСКУССИОННЫЙ КЛУБ «ТОЧКА ЗРЕНИЯ»
В сумасшедшем темпе открытий и развития онкологии как науки как никогда важно выстраивать качественный диалог с ведущими специалистами в области онкологии и молодыми онкологами. Особенно важным это является для молодых онкологов
из регионов. Возможность посещать топовые конференции и
напрямую общаться с экспертами в целях обмена опытом и знаниями доступна далеко не каждому начинающему специалисту.
Аналогичные возможности ограничены и у уже опытных врачей, работающих в отдаленных регионах. А зачастую прямой
диалог и обмен мнениями, озвучивание текущей проблематики
в регионе для молодого онколога позволяет не просто повысить
компетентность, но и сформировать собственное мнение, основанное на принципах доказательной медицины, найти опытного
наставника, вдохновляющего к достижению высоких профессиональных результатов, да и просто высказаться, что для молодежи, пожалуй, наиболее важно.
Наш дискуссионный клуб является не просто еще одним проектом, где много говорят и читают лекции. Нет, это некий форум
по обмену мнениями между молодыми онкологами и экспертами
или онлайн-площадка, в рамках которой создаются ситуации диалога и обсуждения общественно значимых медицинских проблем
по актуальным и спорным вопросам профилактики, диагностики
и лечения онкопатологии, сложным клиническим случаям в формате врачебного консилиума, организации медицинской помощи
в регионах и даже социальных вопросов. Здесь возможно как проведение дебатов в формате «за» и «против», так и обычных бесед с
клиницистами, представителями власти, медицинских сообществ
и так далее.
Хочется обсудить насущные вопросы? Накопилось достаточно
вопросов? Сомневаешься в принятом решении? Может быть, тебя
беспокоят глобальные вопросы организации медицинской помощи внутри твоего региона?
Тогда наш дискуссионный клуб для тебя. А мы, представители комитета RUSSCO Junior и Школы химиотерапевтов, поможем тебе
разобраться и выстроить дорожку из «желтого кирпича».
Чтобы обсудить конкретную тему переходи по qr-коду и формируй проблематику и вопросы. Лучшие и горячие темы будут выбраны для обсуждения с ведущими экспертами своей области.
Уже 2 декабря в 11:00 по Москве мы приглашаем тебя на
наш первый дискуссионный
клуб по теме «Клинические
или практические рекомендации. Что, где, когда?». Задать вопросы экспертам также
можно, перейдя по qr-коду.
Следите за анонсами на сайте
RosOncoWeb.ru.