Дорогие коллеги, дорогие друзья!
Перед вами – осенний номер, подготовленный к открытию XXVI Российского онкологи- ческого конгресса, а это значит,

Peter Messer.
Flight (Полет).
Человеку надо мало: чтоб искал и находил. Чтоб имелись для начала Друг один и враг – один... Человеку надо мало: чтоб тропинка вдаль вела. Чтоб жила на свете мама.

ИССЛЕДОВАНИЕ GEPARNUEVO МЕНЯЕТ ВЗГЛЯД НА ВОЗМОЖНОСТИ ПРЕДОПЕРАЦИОННОЙ ХИМИОИММУНОТЕРАПИИ У БОЛЬНЫХ ТРОЙНЫМ НЕГАТИВНЫМ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ
Иммунотерапия с применением ингибиторов контрольных точек иммунного ответа стала неотъемлемой частью лечения больных тройным негативным раком молочной железы (ТНРМЖ) после

Зкзамен
ПО КЛИНИЧЕСКОЙ ОНКОЛОГИИ 15.11.2022 с 17:00 до 19:30

АЛПЕЛИСИБ: НОВЫЕ ЗНАНИЯ И НОВЫЕ ВОЗМОЖНОСТИ
В августе 2022 г. комиссия МЗ РФ рекомендовала включить таргетный препарат алпелисиб в перечень ЖНВЛП [1,2]. И это очень хорошая новость для врачей и пациентов с метастатическим раком

СКАЗКА О ПОТЕРЯННОМ ВРЕМЕНИ, ИЛИ НЕЗАМЕТНАЯ «ПЛАТА» ЗА ЛЕЧЕНИЕ…
Относительно недавно мы с доктором Митиным вступили в заочную дискуссию на тему «Когда финал близок: лечиться, чтобы жить – или жить, чтобы лечиться?». Отстаивая позицию о том, что есть

ESMO 2022: ЛЕКАРСТВЕННАЯ ТЕРАПИЯ РАННЕГО РАКА ПОЧКИ В 2022 ГОДУ - НАДЕЖДЫ И РАЗОЧАРОВАНИЯ
Известно, что около 30% больных «ранним» светлоклеточным почечноклеточным раком будут иметь прогрессирование болезни после стандартного хирургического лечения [1]. Риск появления

ESMO 2022: ЛЕЧЕНИЕ НМРЛ
На протяжении многих лет лечение и диагностика опухолей легкого немелкоклеточной природы занимают существенное место среди представленных на ежегодном конгрессе Европейского

ESMO 2022: РАК МОЛОЧНОЙ ЖЕЛЕЗЫ
В этом году в Париже прошел юбилейный 50-й конгресс ESMO, и мы вновь стали свидетелями, с какой скоростью онкологическая наука движется вперед. Расскажу про самые интересные, на мой...

ESMO 2022: НАИБОЛЕЕ ВАЖНЫЕ НОВОСТИ ESMO 2022 В ЛЕЧЕНИИ ОПУХОЛЕЙ ЖКТ
Прошедшая конференция ESMO в этом году принесла несколько интересных исследований в области лечения опухолей ЖКТ, результатами которых я и поделюсь. При этом, на мой взгляд, в лечении

ESMO 2022: НОВОСТИ ИЗ МИРА ОНКОГИНЕКОЛОГИИ
Традиционно в сентябре 2022 года прошел очередной ежегодный конгресс Европейского общества медицинской онкологии (ESMO). Вашему вниманию – краткий обзор важных обновлений.

ESMO 2022: МЕЛАНОМА И ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ КОЖИ
На прошедшем с 9 по 13 сентября 2022 года в Париже ежегодном онкологическом конгрессе ESMO 2022 были представлены результаты ключевых клинических исследований по меланоме и...

Ксанди
Энзалутамид

ESMO 2022: ПЕРСПЕКТИВНЫЕ И НОВЫЕ НАПРАВЛЕНИЯ В ТЕРАПИИ САРКОМ
Саркомы – редкие, орфанные заболевания. Каждое клиническое исследование, посвященное этой нозологии, заслуживает пристального внимания, так как сопряжено с трудностями набора пациентов

ЗНАКОМЬТЕСЬ: РЕГИОНАЛЬНОЕ ОТДЕЛЕНИЕ RUSSCO УЛЬЯНОВСКОЙ ОБЛАСТИ
Региональное отделение RUSSCO, как и большинство подобных отделений, было организовано в 2011 году под руководством заведующей тогда еще единственного отделения химиотерапии к.м.н.
БУДУЩИЕ ВОЗМОЖНОСТИ ТЕРАПИИ ПАЦИЕНТОВ С МЕСТНО-РАСПРОСТРАНЕННЫМ И МЕТАСТАТИЧЕСКИМ УРОТЕЛИАЛЬНЫМ РАКОМ
Рак мочевого пузыря характеризуется высокой злокачественностью, его метастатическая форма – плохим прогнозом. В 2020 году в РФ было зарегистрировано 15 292 новых больных раком мочевого пузыря (РМП), а всего под наблюдением находились 118 624 пациента с этим заболеванием [1]. Большинство новых случаев РМП выявляется на ранних стадиях, однако более 70% пациентов прогрессируют после хирургического лечения...
АУМОЛЕРТИНИБ – НОВАЯ ОПЦИЯ В ТЕРАПИИ НЕМЕЛКОКЛЕТОЧНОГО РАКА ЛЕГКОГО C ДЕЛЕЦИЕЙ В 19 ЭКЗОНЕ (DEL19) ИЛИ ЗАМЕНЕ L858R В 21 ЭКЗОНЕ ГЕНА EGFR
Аумолертиниб – необратимый ингибитор третьего поколения тирозинкиназного домена рецептора эпидермального фактора роста (EGFR). Аумолертиниб ранее уже продемонстрировал свою...

МУТАЦИЯ РIЗКЗСА
При раке молочной железы

ПОДМЕЧЕНО ЧЕЛОВЕКОМ
«Прости, тороплюсь на открытие выставки картин моего друга!» - так однажды мне оставили интригу, ссылку на веб-сайт того самого друга-художника и несколько фото из альбомов, что заставили...

Экстимия
Терапия полностью и в срок

ТЕХНОЛОГИИ РАБОТЫ ОНКОПСИХОЛОГА
Итак, сегодня мы обсудим технологии, которые целесообразно использовать в работе онкопсихолога. Мы уже размышляли о психологической помощи в российской онкологии, рассматривали

Эрлеада
ПОЗВОЛЯЕТ ПАЦИЕНТАМ ЖИТЬ ДОЛЬШЕ...
Анонс
-

15 ноября 2022 c 18:00 до 20:30
Экзамен ПО КЛИНИЧЕСКОЙ ОНКОЛОГИИ
Дорогие коллеги, дорогие друзья!
Перед вами – осенний номер,
подготовленный к открытию
XXVI Российского онкологи-
ческого конгресса, а это значит,
что по окончании мероприятия
еще пахнущие краской печатные
экземпляры газеты разлетятся
в разные уголки страны, увозя
с собой воспоминания об оче-
редном состоявшемся конгрессе,
радость от встречи с коллегами,
новую информацию и даже, воз-
можно, заметки на полях. Кто-то
уедет с сертификатом участника
экзамена по клинической он-
кологии и «чувством глубокого
удовлетворения» от этого уча-
стия, но даже если чувство будет
недостаточно полным – это хо-
роший стимул для дальнейшей
работы и углубления знаний.
Большая часть номера посвяще-
на новостям конгресса ESMO,
состоявшегося в сентябре в Па-
риже, - так узнаем же мнение
ведущих российских онкологов
о том, какие из представленных
данных, на их взгляд, оказались
наиболее интересными и пер-
спективными. На страницах
номера вы также познакомитесь
с результатами ряда новых ис-
следований и информацией по
новым и уже зарекомендовав-
шим себя фармацевтическим
препаратам. Можно продолжить
размышлять в отрыве от рутины
с профессором Жуковым на одну
из самых философских тем в он-
кологии – безвозвратности вре-
мени, потраченного на лечение
с сомнительной эффективно-
стью, а можно помедитировать,
рассматривая мистические
осенние пейзажи маленького ан-
глийского городка...
Но для начала нам всем надо
встретиться – и мы ждем это-
го с нетерпением! Не так много
радужных эмоций принесли
нам последние три года, но как
минимум возврат к очному фор-
мату мероприятий не может
не радовать. Даже будучи без-
мерно сложным, каждый наш
день – это еще один ровно иль
коряво уложенный камень в мо-
стовую под названием «жизнь».
До встречи на зимних страницах
газеты!
Команда RUSSCO
Peter Messer.
Flight (Полет).

***
Человеку надо мало:
чтоб искал
и находил.
Чтоб имелись для начала
Друг
один
и враг –
один...
Человеку надо мало:
чтоб тропинка вдаль вела.
Чтоб жила на свете
мама.
Сколько нужно ей –
жила...
Человеку надо мало:
после грома –
тишину.
Голубой клочок тумана.
Жизнь –
одну.
И смерть –
одну.
Утром свежую газету –
с Человечеством родство.
И всего одну планету:
Землю!
Только и всего.
И –
межзвездную дорогу
да мечту о скоростях.
Это, в сущности,
немного.
Это, в общем-то, – пустяк.
Невеликая награда.
Невысокий пьедестал.
Человеку
мало
надо.
Лишь бы дома кто-то
ждал.
ИССЛЕДОВАНИЕ GEPARNUEVO МЕНЯЕТ ВЗГЛЯД НА ВОЗМОЖНОСТИ ПРЕДОПЕРАЦИОННОЙ ХИМИОИММУНОТЕРАПИИ У БОЛЬНЫХ ТРОЙНЫМ НЕГАТИВНЫМ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ
Автор: С.А.Тюляндин
Председатель Российского общества клинической онкологии,
профессор, доктор медицинских наук, Москва
Иммунотерапия с применением ингибиторов контрольных точек иммунного ответа стала неотъемлемой
частью лечения больных тройным
негативным раком молочной железы
(ТНРМЖ) после публикации результатов исследования KEYNOTE 522. В
этом рандомизированном исследовании добавление пембролизумаба
к предоперационной химиотерапии
карбоплатином и паклитакселом у
больных ТНРМЖ II-III стадиями независимо от экспрессии PD-L1 привело к увеличению частоты полных
морфологических регрессий (pCR)
на 7,4% и 3-летней безрецидивной
выживаемости (PFS) с 76,2% в группе химиотерапии до 84,3% в группе
пембролизумаба, что соответствует
статистически значимому снижению
риска прогрессирования на 37% [1].
После оперативного лечения пембролизумаб назначали адъювантно
в течение года, что не повлияло на
3-летнюю PFS больных с pCR, но достоверно улучшило ее у больных, не
достигших ее, с 56,8% в группе химиотерапии до 67,4% в группе химиоиммунотерапии. А всего по результатам
3-летнего наблюдения PFS составила
84,3% в группе пембролизумаба и
76,2% в группе плацебо, что соответствует статистически значимому
снижению риска прогрессирования
на 37% [1]. Обсуждая результаты исследования KEYNOTE 522, многие
ставили под сомнение целесообразность назначения пембролизумаба
адъювантно для больных с pCR, не
сомневаясь при этом в его пользе у
больных с неполной морфологической регрессией опухоли после предоперационного этапа.
Однако ставшие доступными отдаленные результаты исследования
GeparNuevo заставляют взглянуть
на целесообразность адъювантного
продолжения иммунотерапии подругому. В этом рандомизированном исследовании II фазы изучали
эффективность добавления PD-L1
ингибитора дурвалумаба к неоадъювантной химиотерапии ТНРМЖ [2].
В это исследование включались больные с T2-4N0-1, которым проводили
предоперационную химиотерапию
с включением наб-паклитаксела 125
мг/м2 еженедельно 12 недель с последующим назначением эпирубицина
в дозе 90 мг/м2 и циклофосфана 600
мг/м2 каждые 2 недели 4 введения.
В экспериментальной группе к проводимой химиотерапии добавляли
введение дурвалумаба в дозе 1,5 г в/в
каждые 4 недели 4 введения. После
выполнения операции дурвалумаб
адъювантно не назначался. Основным критерием эффективности была
частота рСR, которая должна была
увеличиться с 44% в группе химиотерапии до 66% в группе химиоиммунотерапии.
В исследование было включено 174
больных, из которых 86 получали
дурвалумаб. Исследование было
признано негативным, так как добавление дурвалумаба увеличило частоту pСR всего на 9% (с 44% до 53%).
Однако при дальнейшем наблюдении
было обнаружено, что 3-летняя БРВ
составила 85,5% в группе дурвалумаба и 77,2% в группе химиотерапии,
что соответствует снижению относительного риска прогрессирования на
52% (HR=0,48; p=0,036). Трехлетняя
общая выживаемость демонстрирует
ту же тенденцию и составляет 94,2%
и 83,5% соответственно, что соответствует снижению относительного риска смерти на 76% (HR=0,24;
p=0,006). Важным представляется то,
что добавление дурвалумаба только
на предоперационном этапе улучшало прогноз больных независимо
от полноты достижения морфологического эффекта, увеличив в когорте пациентов с pCR 3-летнюю PFS
c 86,1% до 95,5% (снижение относительного риска прогрессирования на
78%), а в когорте с неполным ответом
– c 69,7% до 76,3% (снижение относительного риска прогрессирования на
33%).
Таблица.
Отдаленные результаты исследований KEYNOTE 522 и GeparNuevo [1,2].
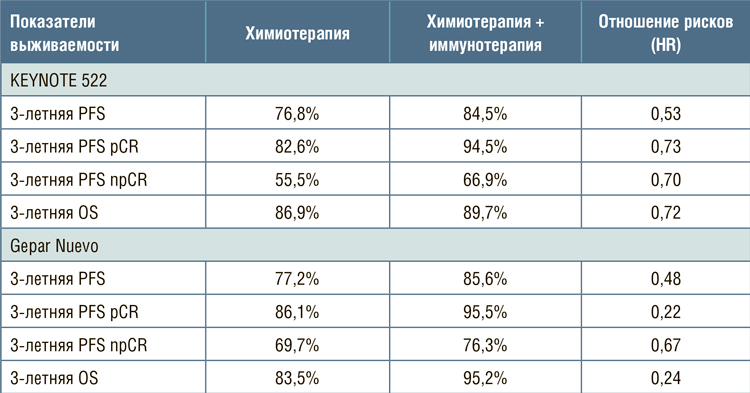
В обоих исследованиях использование неоадъювантной химиоиммунотерапии лишь незначительно
увеличивало частоту pCR, что, однако, сопровождалось существенным
улучшением отдаленных результатов. В отличие от неоадъювантной
химиотерапии, где достижение pCR
является суррогатным маркером
улучшения отдаленных результатов,
при назначении неоадъювантной
химиоиммунотерапии этот показатель становится не столь важным и
не может быть первичной конечной
точкой проводимых исследований.
Дизайн KEYNOTE 522 не позволяет
оценить вклад предоперационного
и адъювантного этапов химиоиммунотерапии в отдельности. Результаты GeparNuevo свидетельствуют,
что добавление иммунотерапии на
предоперационном этапе достаточно
активирует иммунную систему для
дальней реализации противоопухолевого иммунного ответа на послеоперационном этапе. Потенциально
это может привести к отказу от эмпирически выбранного адъювантного
назначения иммунотерапии в течение года, что существенно уменьшит
стоимость лечения и частоту иммуноопосредованных побочных эффектов. Все это делает актуальным
проведение рандомизированного
исследования III фазы с целью определения роли постнеоадъювантной
иммунотерапии у больных не только
с pCR, но и с резидуальной опухолью.
У больных ТНРМЖ с резидуальной
опухолью после неоадъювантной химиоиммунотерапии важной задачей
остается определение значения существующей адъювантной терапии.
Способно ли добавление капецитабина и/или олапариба при наличии мутации BRCA1/2 адъювантно уменьшить риск прогрессирования
при наличии резидуальной болезни
после предоперационной химиоиммунотерапии? Однако наличие множества потенциально эффективных
опций для изучения все равно лучше,
чем их отсутствие.
Источники:
1. Schmid P, Cortes J, Pusztai L, McArthur H, Kümmel S, Bergh J, Denkert C, Park Y-H, Hui R, Harbeck N, Takahashi M, Foukakis T, Fasching PA, Cardoso F, Untch M, Jia L, Karantza V, Zhao J, Aktan G, Dent R, O'Shaughnessy J, KEYNOTE-522 Investigators. Pembrolizumab for early triplenegative breast cancer. N. Engl. J. Med. 2020; 382: 810-821.
2. Loibl S, Schneeweiss A, Huober
J, et al. Neoadjuvant durvalumab
improves survival in early triplenegative breast cancer independently
of pathological complete response.
Ann. Oncol. Available online:
October 12, 2022.
Зкзамен
<p>ПО КЛИНИЧЕСКОЙ ОНКОЛОГИИ 15 ноября 2022 с 17:00 до 19:30</p>
<p style="text-align: center"><img class="img-fluid rounded" src="http://gazeta.russco.org/media/10_2022/exam.jpg" width="650"></p>
АЛПЕЛИСИБ: НОВЫЕ ЗНАНИЯ И НОВЫЕ ВОЗМОЖНОСТИ
Автор: Артамонова Елена Владимировна
д.м.н., профессор, заведующая химиотерапевтическим отделением №1
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России
В августе 2022 г. комиссия МЗ РФ рекомендовала включить таргетный препарат алпелисиб в перечень ЖНВЛП [1,2]. И это очень хорошая новость для врачей и пациентов с метастатическим раком молочной железы (мРМЖ), поскольку алпелисиб станет более доступным, появится возможность назначать эффективное патогенетическое лечение большему количеству пациентов с гормонопозитивным (HR+) HER2- негативным (HER2–) мРМЖ с мутациями в гене PIK3CA.

Мутации в гене PIK3CA:
где сделать тестирование?
Мутации в гене PIK3CA вызывают гиперактивацию белка PI3K
(фосфатидилинозитол-3-киназы),
что приводит к злокачественной
трансформации клеток, прогрессированию рака и появлению
резистентности к ЭТ [3]. Кроме
того, опухоли с мутациями в гене
PIK3CA демонстрируют меньшую
чувствительность к химиотерапии (ХТ), а пациенты с такими
мутациями – более короткую общую выживаемость (ОВ) [4]. То
есть мутации гена PIK3CA являются фактором неблагоприятного прогноза, и поэтому так важно
знать об их наличии у пациента.
Эта информация позволяет прогнозировать течение заболевания
и планировать последовательность терапии с применением алпелисиба – специфического ингибитора киназы PI3K [5].
Активирующие мутации в гене
PIK3CA в России встречаются примерно у 32-37,2% пациентов с HR+
HER2– мРМЖ, что сопоставимо с
общемировым уровнем (40,5%) [6,
7]. Поэтому тестирование на наличие этих мутаций необходимо
проводить всем пациентам с HR+
HER2– мРМЖ при прогрессировании на фоне адъювантной ЭТ или
после ее завершения, во время терапии метастатической стадии, а
также пациентам с РМЖ, впервые
выявленным на стадии IV. Эта рекомендация закреплена в международных и отечественных клинических руководствах [8-12] для
решения вопроса о возможности
назначения алпелисиба.
Тестирование на наличие мутаций
гена PIK3CA для онкологических
пациентов в РФ доступно на бесплатной основе при поддержке
ООО «Новартис Фарма». Провести
тестирование можно в рамках Национальной Программы RUSSCO
«Совершенствование молекулярно-генетической диагностики в
Российской Федерации с целью повышения эффективности противоопухолевого лечения» [13], Программы поддержки диагностики
заболеваний РМЖ, меланома Aston
Health [14], а также по программе
«Активный пациент» на базе ООО
«Лаборатория "Гемотест"» [15] и
АНО «Развитие научных исследований в медицине» [16].




BYLieve: эффективность алпелисиба после ингибиторов CDK4/6 и фулвестранта
Алпелисиб в комбинации с фулвестрантом одобрен для лечения женщин в постменопаузе и мужчин с HR+ HER2– распространенным или метастатическим РМЖ с мутацией гена PIK3CA с прогрессированием заболевания во время или после проведения режимов ЭТ [1].
Согласно российским и в международным клиническим рекомендациям алпелисиб можно применять как в 1-ой, так и в последующих линиях терапии [8-12]. В клинической практике предпочтительной опцией 1-ой линии в настоящее время являются ингибиторы CDK4/6 (иCDK4/6), поэтому алпелисиб часто назначают уже после них. Исследование II фазы BYLieve было направлено на изучение эффективности алпелисиба у пациентов с HR+ HER2– мРМЖ с мутацией гена PIK3CA после прогрессирования на фоне терапии иCDK4/6 в комбинации с ингибиторами ароматазы (ИА) [17]. В этом исследовании была выделена когорта А, в которой пациенты получали алпелисиб с фулвестрантом после прогрессирования на иCDK4/6 с летрозолом. Медиана выживаемости без прогрессирования (мВБП) в этой когорте составила 7,3 мес. (95% ДИ 5,6-8,3) [17], что в два раза превышает мВБП (3,6 мес.; 95% ДИ 3,1-6,1), полученную по данным базы Flatiron Health (США) для других вариантов терапии (ХТ/ЭТ/эверолимус) у пациентов с мутацией PIK3CA, получавших ранее ингибитор CDK4/6 [18]. Медиана ОВ в когорте А исследования BYLieve составила 26,4 мес. (95%ДИ, 21,0-30,5), а уменьшение размера опухоли наблюдалось у 71,3% пациентов [19].
Результаты исследования BYLieve
доказывают, что эффективность
алпелисиба не зависит от длительности предшествующего лечения иCDK4/6 [20, 21]. Пациенты
с HR+ HER2– мРМЖ и мутациями в гене PIK3CA могут получить
клиническую пользу от лечения
алпелисибом в том числе в случае
быстрого (≤ 6 мес.) прогрессирования на фоне приема иCDK4/6
[21], что особенно важно, поскольку таких пациентов обычно переводят на ХТ. Примечательно,
что у пациентов с коротким (≤ 6
мес.) ответом на иCDK4/6 медиана ВБП на терапии алпелисибом с
фулвестрантом была больше, чем
у пациентов с длительным (> 6
мес.) ответом: 12,0 мес. vs. 6,2 мес.
(ОР 0,51; 95% ДИ: 0,29-0,89) [21].
Причины этого могут заключаться в величине общей мутационной нагрузки опухоли. При HR+
HER2– мРМЖ мутациям подвергается множество генов помимо
гена PIK3CA. Дополнительные
мутации могут быть связаны с
появлением резистентности к ЭТ
или к терапии иCDK4/6 и ингибиторами PI3K. Оказалось, что
в исследования BYLieve пациенты с предшествующей терапией
иCDK4/6 ≤ 6 мес. имели меньше
мутаций по сравнению с пациентами, получавшими иCDK4/6 > 6
мес. [22]. То есть у пациентов из
первой группы основным драйвером роста опухоли являлась
мутация PIK3CA, а другие мутации еще не успели накопиться,
что вероятно и привело к более
значимому эффекту от приёма алпелисиба в исследовании BYLieve.
Анализ данных исследования
SOLAR-1 подтвердил, что алпелисиб эффективен при всех уровнях мутационной нагрузки, но
лучший эффект демонстрирует
у пациентов с меньшим количеством дополнительных мутаций
[23]. Таким образом, своевременное назначение алпелисиба сразу
после иCDK4/6 может привести к
большей эффективности лечения
и позволит длительно контролировать заболевание.
Многие пациенты на момент выявления у них мутации гена PIK3CA
уже успевают пройти лечение фулвестрантом, и в таком случае встает
вопрос о возможности повторного
назначения фулвестранта в комбинации с алпелисибом. Данные клинических исследований подтверждают эффективность применения
такой последовательности. Так, в
исследовании 1b фазы по подбору
дозы алпелисиба 45% пациентов
ранее получали фулвестрант, и у
большинства из них впоследствии
наблюдалось уменьшение размеров опухоли на терапии алпелисибом с фулвестрантом [24]. В
когорте С исследования BYLieve
пациенты получали алпелисиб с
фулвестрантом после прогрессирования на ХТ или ЭТ. Среди них
32,5% ранее получали фулвестрант
в любой комбинации (23% – в комбинации с иCDK4/6). В подгруппе
пациентов, получавших ранее фулвестрант, мВБП на фоне лечения
алпелисибом с фулвестрантом составила 5,4 мес. (95% ДИ 2,8-8,2),
что оказалось сопоставимо с мВБП
в общей когорте С (5,6 мес.; 95% ДИ
5,4-8,1) [25]. Эти данные подтверждают эффективность комбинации
алпелисиба с фулвестрантом у пациентов, ранее уже принимавших
фулвестрант. Повторное применение фулвестранта в комбинации с
алпелисибом не запрещается инструкцией по медицинскому применению препарата Пикрэй [1],
а также разрешено российскими
клиническими рекомендациями
[11, 12].
Нежелательные явления:
профилактика и коррекция
Помимо активности в опухолевых клетках киназа PI3K участвует в передаче сигнала от
рецептора инсулина, регулируя
поступление глюкозы в клетки,
а также участвует в регуляции
дифференцировки клеток эпидермиса [26, 27]. Нарушение этих
функций киназы PI3K на фоне
терапии алпелисибом может привести в первом случае к развитию
гипергликемии, а во втором – к
появлению сыпи. Эти нежелательные явления (НЯ) чаще других приводят к отмене алпелисиба или редукции дозы. Чтобы
лечение принесло максимальную
пользу, необходимо профилактировать и корректировать эти НЯ.
К счастью, способы справиться с
этой задачей к настоящему времени уже отработаны и проверены
как в ходе клинических исследований, так и в рутинной клинической практике.

Повышение сахара крови на фоне
приеме алпелисиба – это физиологическая реакция, а не сахарный
диабет, поэтому данное НЯ разрешается после отмены лечения
[27]. Гипергликемия чаще всего
отмечается в первые две недели
терапии алпелисибом, а её уровень
коррелирует с исходным метаболическим статусом. Поэтому перед
началом лечения нужно оценить
индекс массы тела (ИМТ), уровень
глюкозы плазмы натощак (ГПН)
и гликированного гемоглобина
(HbA1c), а также семейный анамнез по сахарному диабету. На основании этих данных пациента относят к одной из трёх групп риска
развития гипергликемии: низкого,
умеренного и высокого. В рутинной практике группу риска удобно определять, воспользовавшись
он-лайн калькулятором на сайте
АОР [28]. Решение о назначении
алпелисиба и сопутствующей профилактики гипергликемии должно приниматься в зависимости от
того, в какую группу риска попадёт
пациент.
На основании накопленного опыта
экспертами Российской ассоциации эндокринологов и Российского
общества клинической онкологии
был сформулирован консенсус по
профилактике и коррекции гипергликемии у пациентов, получающих терапию препаратом алпелисиб [29].

Согласно Консенсусу отнесение пациента к группе умеренного и высокого риска является показанием к профилактическому назначению метформина (до 2000 мг). При необходимости получить консультацию и официальные рекомендации эндокринологов, знакомых с особенностями возникновения и коррекции гипергликемии на фоне терапии алпелисибом, можно обращаться на горячую линию «НМИЦ онкологии им. Н.Н. Петрова» (8-921-976-80-30). Важно также убедить пациента в необходимости модификации образа жизни – поддержании физической активности и соблюдении диеты [27]. В этом может помочь информационная программа поддержки пациентов, получающих алпелисиб, «Не опускайте руки» [30].

Развитие сыпи происходит, как
правило, в течение первых 2 недель
от начала приема, но профилактический прием антигистаминных
препаратов позволяет снизить частоту возникновения этого клинически значимых проявлений этого
НЯ, что позволяет успешно его
контролировать и пролонгировать
терапию алпелисибом.

Коллектив онкологов и дерматовенерологов из ведущих клинических
и научно-исследовательских медицинских центров России обобщил накопленный опыт лечения пациентов алпелисибом и сформулировал практические рекомендации
(консенсус) по профилактике и коррекции сыпи [31]. Кроме того, подробный алгоритм по профилактике
и коррекции сыпи доступен он-лайн
на сайте АОР [32].

Итак...
• Алпелисиб дает возможность пациентам с мутацией гена PIK3CA получить дополнительную линию таргетной терапии.
• Алпелисиб рекомендуется назначать пациентам с HR+ HER2– рРМЖ с мутацией гена PIK3CA, резистентным к ЭТ: o при прогрессировании на фоне проведения адъювантной ЭТ или в течение 1 года после ее завершения – в 1 линии; o при прогрессировании на фоне лечения мРМЖ (моноЭТ или комбинация с иCDK4/6) – во 2 линии.
• Алпелисиб в комбинации с фулвестрантом демонстрирует эффективность как в ранних, так и в поздних линиях терапии, в том числе у пациентов, получавших ранее ХТ, фулвестрант и иCDK4/6.
• Профилактика гипергликемии и
сыпи у пациентов с факторами риска снижает частоту и степень тяжести этих НЯ.
Литература:
1. Общая характеристика лекарственного препарата Пикрэй (алпелисиб) ЛП-№(000328)-(РГ-RU)-290721;
2. см. QR-код;
3. Ciruelos Gil EM. Cancer Treat Rev. 2014;40(7): 862-871;
4. Mosele F, et al. Ann Oncol. 2020;31(3): 377-386;
5. Fritsch C, et al. Cancer Res. 2018;78(13_ Supplement): 3934;
6. Rajadurai P, et al. P5-13-25. Presented at SABCS 2021;
7. Соколова ТН и др. Современная Онкология. 2021;23(1):61-67; 8. Gennari A, et al. Ann Oncol. 2021; 32(12): 1475-1495;
9. Burstein HJ, et al. J Clin Oncol. 2021;39(35): 3959- 3977;
10. NCCN Clinical Practice Guidelines in Oncology. Breast Cancer. Version 8 – September 13, 2021;
11. Тюляндин СА и др. Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2021 (том 11).09;
12. Клинические рекомендации. Рак молочной железы. 2021;
13-16. см. QR-коды;
17. Rugo H. et al. J Clin Oncol. 2020;38(15_suppl): abstr 1006;
18. Turner S. et al. Ann Oncol. 2020;31(suppl_4): S348-S395;
19. Ciruelos E. et al. Poster P5- 13-03. Presented at SABCS 2021;
20. Chia S.K.L. et al. J Clin Oncol. 2021. 39(suppl 15): abstr 1060;
21. Chia S. et al. Poster P1-18-08. Presented at SABCS 2021;
22. Juric D. et al. J Clin Oncol 40, 2022 (suppl 16; abstr 1038);
23. Juric D. et al. J Clin Oncol 40, 2022 (suppl 16; abstr 1006);
24. Juric D. et al. JAMA Oncol. 2019;5(2):e184475;
25. Rugo H. et al. Poster PD13-05. Presented at SABCS 2021;
26. Rugo HS, et al. Breast. 2022;61:156-167;
27. Коваленко И.М. Медицинский алфавит. 2022;13:44–47;
28-32. см. QR -коды.
СКАЗКА О ПОТЕРЯННОМ ВРЕМЕНИ, ИЛИ НЕЗАМЕТНАЯ «ПЛАТА» ЗА ЛЕЧЕНИЕ…
— РАЗМЫШЛЕНИЯ В ОТРЫВЕ ОТ РУТИНЫ
Автор: Жуков Николай Владимирович
ФГБУ «НМИЦ Детской гематологии, онкологии и иммунологии им. Д. Рогачева»,
доктор медицинских наук, профессор, Москва
Относительно недавно мы с доктором Митиным вступили в заочную дискуссию на тему «Когда финал близок: лечиться, чтобы
жить – или жить, чтобы лечиться?». Отстаивая позицию о том, что
есть определенная точка, в которой надо бы остановиться, даже
если пациент физически может перенести новую попытку лечения, спор я проиграл с разгромным счетом 24% против 76%. Так
«легли» ответы аудитории на вопрос «Чья позиция вам ближе?».
Ну, проиграл и проиграл. Собственно, я не планировал возвращаться к этой теме в ближайшее время, так как сказал, что хотел,
аргументируя свою позицию тогда. Но неожиданно все же решил
вернуться. Не для того, чтобы привести дополнительные аргументы, а чтобы немножко «похвалить себя» за предвидение. Относясь серьезно к поставленной цели доказать свою правоту (а я
всегда отношусь к этому серьезно), я старался найти все возможные аргументы, подтверждающие мою точку зрения. И среди этих
аргументов чисто интуитивно (и достаточно эмоционально) я затронул вопрос времени, которое пациент тратит на лечение: «Да и
сам «процесс» назначения и введения терапии… Где бы хотелось
провести короткий остаток жизни? В очереди на «капельницу»,
перед кабинетом онколога в ожидании результатов анализов и в
непростой дороге до диспансера и обратно (страдая по дороге от
тех самых «незначимых» осложнений в виде слабости, диспепсии
и диареи)? Или дома с родными и любимым котом?». Собственно,
оказалось, что этот вопрос интересует не только меня.
Временная токсичность… Да, именно с таким ударением – время, которое пациенту прямо или косвенно приходится тратить на осуществление терапии. Термин непривычный, новый. Но, как мне кажется, совсем не лишний. Ведь, если задуматься, в чем мы измеряем основной успех нашей терапии?
Во времени! В дополнительном времени жизни. Поэтому то, где пациент проводит это время и что
это время «крадет», – вопрос не праздный.
Итак, зарубежная онкологическая общественность размышляет над тем, что «цена» лечения рака —
это не только «медицинская» токсичность, финансовые расходы, но и время, которое тратит на лечение пациент. Тратит не только на сам процесс получения терапии (если речь идет о парентеральном
введении), но и на дорогу до клиники и обратно, ожидание приема доктора, анализов, на борьбу с
побочными эффектами и на другие процессы, прямо или косвенно связанные с лечением. Все большее число зарубежных онкологов приходит к заключению, что это также тема, которая должна обсуждаться с пациентами, когда решается вопрос о проведении лечения. Так, по мнению Arjun Gupta,
MD, онколога, специализирующегося на лечении гастроинтестинальных опухолей в Университете
Миннесоты (США), пациенты, получающие «последние» линии паллиативного лечения, могут проводить каждый 4 день своей жизни в «активностях», связанных с обеспечением терапии [1]. С учетом
того, что средний выигрыш во времени жизни от подобной терапии обычно составляет 2-3 месяца,
может оказаться, что как раз это время пациент и тратит на получение лечения.
Как оказалось, информация о том, как пациент «проводит свое время» в процессе лечения, очень хорошо изучена, например, в кардиологии и некоторых других специальностях, однако в области онкологии подобные исследования практически отсутствовали. И это при том, что соотношение времени,
выигранного за счет терапии, и времени, затраченного на получение терапии, даже на интуитивном
уровне далеко не в пользу онкологии.
Доктор Arjun Gupta анонсировал публикацию в одном из ближайших номеров Journal of Clinical
Oncology, которая будет посвящена исследованию «временной токсичности» по результатам завершенных клинических исследований. Более того, оказалось, что вопрос временной токсичности начал
изучаться не только в отношении паллиативного лечения поздних линий, но и в отношении потенциально куративных опций с не очень большим выигрышем. Так, в исследовании, посвященном потенциально куративному лечению местнораспространенного рака поджелудочной железы, оказалось,
что в среднем около 11% из 17,5 мес. выживаемости, достигнутых за счет проведения мультимодального лечения, пациент проводил в процессе этого самого лечения [2].
Безусловно, эти данные не должны быть поводом для отказа пациентам в проведении подобного
лечения, если по мнению врача это принесет им пользу. Но задуматься об этом, принимая решение
лечить или не лечить, все же нужно. Хотя важно это и в связи с другой причиной, которую мы тоже
отчасти излагали ранее – возможно, далеко не все визиты в клинику для пациента являются обязательными и целесообразными. И, может быть, их можно легко заменить различными цифровыми сер
Источники:
1. M. Alexander Otto, PA, MMS. Time Toxicity: A "Very Hidden" Cost of Cancer Care. Medscape. Sep 15, 2022.
2. Lim SA, Hao SB, Boyd BA, Mitsakos A, Irish W, Burke AM, Parikh AA, Snyder RA. Opportunity Costs of Surgical Resection and Perioperative Chemotherapy for Locoregional Pancreatic Adenocarcinoma. JCO Oncol Pract. 2022 Apr; 18(4):302-309. doi: 10.1200/OP.21.00311. Epub 2021 Oct 28. PMID: 34709961.
3. Bange EM, Coughlin K, Li W, Moriarty E, Brown TJ, Shulman LN, Mamtani R. Accuracy of a Text Intervention to Minimize the Burden of Cancer Care Among Patients Treated With Immune Checkpoint Inhibitors. JAMA Netw Open. 2022 Aug 1; 5(8):e2228452. doi: 10.1001/jamanetworkopen.2022.28452. PMID: 36036938; PMCID: PMC9425147.
ESMO 2022: ЛЕКАРСТВЕННАЯ ТЕРАПИЯ РАННЕГО РАКА ПОЧКИ В 2022 ГОДУ - НАДЕЖДЫ И РАЗОЧАРОВАНИЯ
Автор: Тимофеев Илья Валерьевич
Директор Бюро по изучению рака (Россия), член Международного комитета ASCO (США),
член научного комитета Колледжа Европейской Школы Онкологии (ESCO)
Известно, что около 30% больных
«ранним» светлоклеточным почечноклеточным раком будут
иметь прогрессирование болезни после стандартного хирургического лечения [1]. Риск появления отдаленных метастазов
существенно увеличивается у
пациентов с высокой степенью
анаплазии (G3-4) вне зависимости от стадии или при стадиях T3
и выше, саркоматоидной дифференцировке опухоли, метастазах
в лимфатические узлы, а также
в случае олигометастатического
рака [2]. Пятилетняя безрецидивная выживаемость составляет
51-78%, а 5-летняя общая выживаемость – 44-72% в зависимости
от риска, и это, безусловно, неудовлетворительные показатели
[3-5]. Следовательно, изучение терапевтических подходов, направленных на снижение вероятности
прогрессирования болезни в этой
популяции, представляется крайне необходимым.
Попытки разработки адъювантных режимов ведутся со времен
цитокинотерапии, которая была
признана неуспешной [6-8]. Медианы безрецидивной и общей
выживаемости пациентов, получавших интерферон, находились
в пределах 2,2 и 5,1 года соответственно [6], 5-летние показатели
– 42% и 58% [7].
Казалось, таргетная терапия ингибиторами рецептора фактора
роста эндотелия сосудов может
исправить ситуацию. Однако
исследование за исследованием
терпели неудачу: сорафениб, пазопаниб, акситиниб не снизили
риск прогрессирования болезни
по сравнению с плацебо у пациентов с местнораспространенным раком после нефрэктомии
(табл.1) [9-12]. Сорафениб и пазопаниб также не оказались эффективными опциями у пациентов с олигометастатическим
раком после локального лечения
[13,14]. Единственным исследованием, продемонстрировавшим
статистическую пользу адъювантной терапии, был протокол
S-TRAC [15]. В нем сунитиниб,
назначаемый в течение 12 месяцев, достоверно улучшил безрецидивную выживаемость по
сравнению с плацебо, особенно
в группе крайне высокого риска,
различия в которой составили 2,2
года в пользу таргетного агента.
Достижение первичной конечной
точки в исследовании сделало
сунитиниб опцией адъювантной
терапии в рекомендациях NCCN,
но отсутствие различий в общей
выживаемости (HR=0,92) ограничило энтузиазм онкологов в практическом его применении [16].
Таблица 1.
Ранняя и поздняя токсичность комбинации таргетных агентов или иммунопрепаратов с SBRT [11].
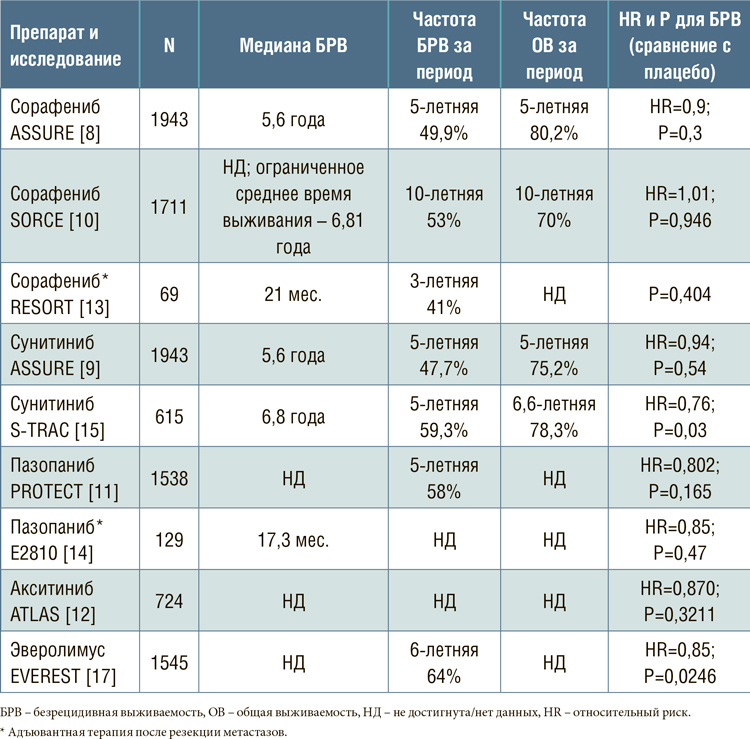
Новые надежды адъювантной
таргетной терапии были связаны
с ингибированием белка mTOR в
исследовании EVEREST с участием 1545 пациентов, рандомизированных в группу эверолимуса,
назначаемого в дозе 10 мг ежедневно на протяжении 54 недель,
или в группу плацебо [17]. К сожалению, в докладе на конгрессе
ASCO 2022 сообщалось, что «Эверест» не был покорен – значимых
отличий между группами ни в
безрецидивной выживаемости
(HR=0,85; P=0,0246), ни в продолжительности жизни (HR=0,90;
P=0,178) достигнуто не было. Так,
6-летняя безрецидивная выживаемость составила 64% в группе
эверолимуса и 61% в группе плацебо. Лучшие результаты были
получены в когорте пациентов с
очень высоким риском (HR=0,79;
P=0,011), но это, учитывая планирование мощности в общей популяции, не позволит сделать mTOR
ингибитор стандартом адъювантной терапии. Таким образом, последняя надежда на таргетную терапию также не оправдалась. Иммунотерапия совершила революцию в лечении метастатического почечноклеточного рака,
повлияв на все важные параметры эффективности – общую выживаемость, выживаемость без
прогрессирования и частоту объективных ответов [18]. Разумеется, логично было предположить
переход иммунотерапии из опции лечения распространенного
рака в адъювантный режим.
На Президентском симпозиуме ESMO 2022 были представлены результаты исследования
CheckMate 914 [19], в которое
было включено 816 пациентов после нефрэктомии с высоким риском (T2, G3, G4 или саркоматоидная дифференцировка; T3 или
выше; N+). Рандомизация происходила в группу комбинации
ипилимумаба 1 мг/кг, каждые 6 недель, 4 дозы, с ниволумабом
240 мг, каждые 2 недели, 12 доз,
или в группу плацебо. Первичной
конечной точкой была безрецидивная выживаемость согласно
слепой независимой центральной
оценке, в то время как общая выживаемость и безопасность были
важными вторичными конечными точками.
Медиана продолжительности
лечения в группах составила 5,1
и 5,1 мес. соответственно. При
медиане наблюдения 37,0 мес.
первичная конечная точка провалилась (HR=0,92; P=0,5347), и исследование было признано негативным. Медиана безрецидивной
выживаемости не была достигнута среди пациентов, получавших ниволумаб и ипилимумаб,
и составила 50,7 мес. среди получавших плацебо. Двухлетняя
безрецидивная выживаемость
также не отличалась – 76,4% и
74,0%. Аналогичные результаты
были получены при оценке безрецидивной выживаемости самими
исследователями (HR=0,92).
Подгрупповой анализ не выявил различий. Тем не менее, д-р
Motzer обратил особое внимание
на потенциальные различия в
зависимости от стадии заболевания и наличия саркоматоидной
дифференцировки. К сожалению,
назначение комбинации сопровождалось большей токсичностью.
Так, связанные с лечением нежелательные явления (НЯ) любой
степени тяжести были зарегистрированы у 88,9% пациентов,
получавших ниволумаб-ипилимумаб, по сравнению с 56,8%
получавших плацебо. Серьезные
НЯ, связанные с лечением (3 степени и выше), были зарегистрированы у 28,5% и 2,0% пациентов соответственно. Связанные
с лечением НЯ привели к прекращению приема ниволумаба и
ипилимумаба у 29,0% пациентов,
а плацебо – у 1,0% пациентов.
Авторы сделали вывод, что комбинация ниволумаба и ипилимумаба не продемонстрировала
эффективности в адъювантном
режиме.
Второе крупное рандомизированное исследование 3 фазы PROSPER
(ECOG-ACRIN EA8143), представленное на ESMO 2022, оценивало
роль периоперационного ниволумаба [20]. Отличие от предыдущего исследования заключалось
в использовании монотерапии
ниволумабом в качестве одной
дозы 480 мг в неоадъювантном
режиме с переходом в адъювант
после операции – 480 мг ежемесячно, до 9 доз. 819 пациентов
были рандомизированы в группу
иммунотерапии или в группу наблюдения, следовательно, исследование было незаслепленным.
Критерии включения в исследование PROSPER были очень похожи на исследование CheckMate
914. Дополнительно разрешалось
включать пациентов с олигометастатическим раком, если после
локального лечения признаки
болезни отсутствовали в течение
12 недель, а также пациентов с
несветлоклеточными гистологическими подтипами. И снова
первичной конечной точкой была
безрецидивная выживаемость
независимо от гистологии. Вторичные конечные точки включали безрецидивную выживаемость
в группе светлоклеточного рака
(83% от всей популяции), общую
выживаемость и показатели качества жизни.
Более 60% больных были с опухолями pT3/T4, >60% с опухолями высокой степени злокачественности, около 5% после резекции почки, 3% после нерадикального хирургического вмешательства. При медиане наблюдения 16 мес. безрецидивная выживаемость оказалась одинаковой между группами (HR=0,97; P=0,43), и ее медиана не была достигнута. Общая выживаемость также не была зрелой на момент анализа, но статистически не отличалась между исследуемыми группами (HR=1,48; P=0,93). Частота отмены ниволумаба составила примерно 12% в группе ниволумаба. В целом, у 20% пациентов, получавших ниволумаб, наблюдалось по крайней мере одно НЯ 3-4 степени по сравнению с 6% в контрольной группе. Наиболее частыми НЯ 3-4 степени, связанными с лечением, были повреждение почек (1% против 2%), сыпь (2% против 0%) и повышение уровня липазы (4% против <1%). Частота смертей между группами не отличалась – 4%. Д-р Allaf заключил, что периоперационная монотерапия ниволумабом не снижает риск возобновления болезни после операции. Дальнейший подгрупповой анализ в рамках этого уникального исследования должен помочь в планировании будущих протоколов.
Хотелось бы предположить, что использование ингибитора против другой иммунной контрольной точки – PD-L1 – может оказаться эффективным в адъювантном режиме. В рандомизированном исследовании 3 фазы IMmotion 010 сравнивалась эффективность атезолизумаба c плацебо, назначаемых в течение года, 778 пациентам после нефрэктомии и с высоким риском (T2 и степень анаплазии 4, T3а и степень анаплазии 3/4, T3b или выше, саркоматоидная дифференцировка, N+, M1 после резекции) [21]. Д-р Bex представил его результаты на ESMO 2022. Первичной конечной точкой была безрецидивная выживаемость. Вторичные конечные точки включали общую выживаемость и безрецидивную выживаемость по оценке независимого исследовательского центра в популяции ITT, а также безрецидивную выживаемость у пациентов с экспрессией иммунных клеток PD-L1 ≥1% (Ventana SP142).
Медиана периода наблюдения составила 44,7 мес., и пациентов, получающих терапию, не осталось. Медиана безрецидивной выживаемости по оценке исследователей была 57,2 мес. (95% ДИ 44,6-НД) для атезолизумаба и 49,5 мес. (95% ДИ 47,4-НД) для плацебо (HR=0,93; P=0,5). Соответственно, еще в одном иммуноонкологическом исследовании не была достигнута первичная конечная точка. 2-летняя безрецидивная выживаемость также не отличалась между группами, составив 67% и 65% соответственно. Безрецидивный период был дольше в подгруппе пациентов с экспрессией PD-L1 >5%, и в этой подгруппе кривые достоверно разошлись (HR=0,57). К сожалению, различий по общей выживаемости в общей популяции зафиксировано не было (HR=0,97). Наиболее частыми НЯ 3-4 степени были артериальная гипертензия (2% в группе атезолизумаба против 4% в группе плацебо), гипергликемия (3% против 2%) и диарея (1% против 2%). У 69 (18%) пациентов, получавших атезолизумаб, и у 46 (12%) пациентов, получавших плацебо, были отмечены серьезные НЯ, тем не менее, летальные исходы, связанные с лечением, не встречались. Исследователи подытожили, что, несмотря на неплохую переносимость, адъювантный атезолизумаб не привел к желаемым результатам эффективности.
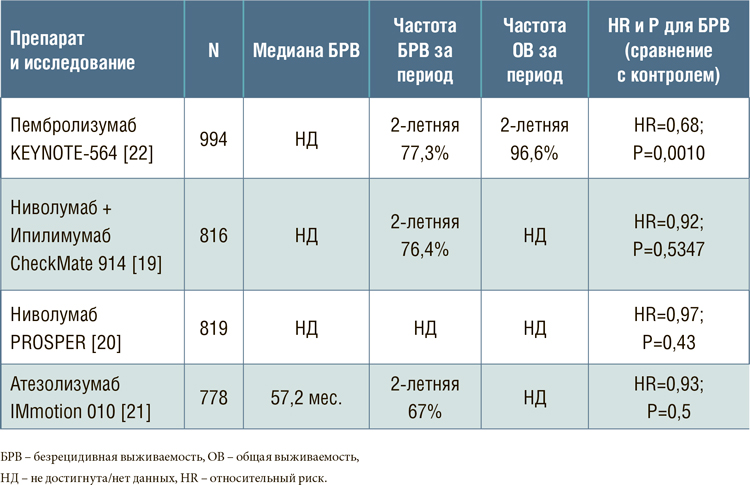
Что же остается, учитывая провал трех исследований адъювантной иммунотерапии, представленных на ESMO 2022? Надежда еще есть – это пембролизумаб. В регистрационном рандомизированном исследовании 3 фазы KEYNOTE-564 994 пациента с описанным выше риском, включая олигометастатическую болезнь, были рандомизированы в группу пембролизумаба 200 мг каждые 3 недели в течение года или в группу плацебо. Первый срез данных, представленный год назад на ASCO 2021 [22], показал преимущества пембролизумаба – безрецидивная выживаемость, как первичная конечная точка, статистически отличалась (HR=0,68; P=0,0010). Двухлетняя безрецидивная выживаемость составила 77,3% для пембролизумаба и 68,1% для плацебо. Различия только на 9,2% во времени контроля и отсутствие существенных различий в общей выживаемости (2-летние показатели в группах были 96,6% и 93,5%) вызвали дискуссию о необходимости более длительного наблюдения за пациентами, чтобы сделать окончательный вывод. Группа NCCN включила пембролизумаб в рекомендации 2022 года, однако присвоила 2 уровень доказательности – такой же уровень имеет опция наблюдения [23]. В сентябре 2022 года журнал Lancet Oncology опубликовал результаты исследования, спустя 30 месяцев наблюдения [24]. Мы видим скорее сохранение тренда, нежели колоссальное улучшение 30-месячной безрецидивной выживаемости в группе пембролизумаба в сравнении с плацебо – 75,2% против 65,5%, то есть разница стала 9,7%, что означает плюс 0,5% в пользу иммунотерапии по сравнению с предыдущим периодом наблюдения (HR=0,63). Однако данных по общей выживаемости все еще нет. Хорошей новостью является отсутствие роста токсичности во времени. Частота НЯ 3 степени и выше ни для пембролизумаба, ни для плацебо кардинально не изменилась – 32% и 18%. Следовательно, продолжаем наблюдать за пациентами и результатами терапии в будущем. Основные параметры исследований иммунотерапии в адъювантном режиме представлены в таблице 2.
Таблица 2.
Адъювантная иммунотерапия почечноклеточного рака.
В заключение нужно признать, что на данном этапе достичь превосходных успехов адъювантной терапии почечноклеточного рака, у пациентов, имеющих риск прогрессирования болезни после хирургического лечения, не удалось. Надежды, связанные с цитокинотерапией, таргетной терапией и иммунотерапией, потерпели крах. Последние результаты, представленные в этом году, скорее разочаровали – цифры весьма похожи на те, которые мы видели в более ранних неудачных исследованиях. Механизм ускользания оставшихся опухолевых клеток от активированной иммунной системы трудно объяснить – имеющиеся доводы представляют собой лишь размышления без практического результата.
Литература:
1. Tsimafeyeu I, Zolotareva T, Varlamov S, Zukov R, et al. Fiveyear Survival of Patients With Metastatic Renal Cell Carcinoma in the Russian Federation: Results From the RENSUR5 Registry. Clin Genitourin Cancer. 2017 Dec; 15(6): e1069-e1072.
2. Agrawal S, Haas NB, Bagheri M, Lane BR, et al. Eligibility and Radiologic Assessment for Adjuvant Clinical Trials in Kidney Cancer. JAMA Oncol. 2020 Jan 1; 6(1): 133- 141.
3. Tsimafeyeu I, Shatkovskaya O, Krasny S, Nurgaliev N, et al. Overall survival in patients with metastatic renal cell carcinoma in Russia, Kazakhstan, and Belarus: a report from the RENSUR3 registry. Cancer Rep (Hoboken). 2021 Jun; 4(3): e1331.
4. Patard JJ, Leray E, Rioux-Leclercq N, Cindolo L, et al. Prognostic value of histologic subtypes in renal cell carcinoma: a multicenter experience. J Clin Oncol. 2005 Apr 20; 23(12): 2763-71.
5. SEER 17, 2012-2018 database, https://seer.cancer.gov/statfacts/html/ kidrp.html [Sept. 24, 2022].
6. Messing EM, Manola J, Wilding G, Propert K, et al. Phase III study of interferon alfa-NL as adjuvant treatment for resectable renal cell carcinoma: an Eastern Cooperative Oncology Group/Intergroup trial. J Clin Oncol. 2003 Apr 1; 21(7): 1214- 22.
7. Atzpodien J, Kirchner H, Illiger HJ, Metzner B, et al. IL-2 in combination with IFN- alpha and 5-FU versus tamoxifen in metastatic renal cell carcinoma: long-term results of a controlled randomized clinical trial. Br J Cancer. 2001 Oct 19; 85(8): 1130- 6.
8. Tsimafeyeu I, Demidov L, Kharkevich G, Petenko N, et al. Granulocyte-Macrophage ColonyStimulating Factor, Interferon Alpha and Interleukin-2 as Adjuvant Treatment for High-Risk Renal Cell Carcinoma. J Cancer Sci Ther. 2010; 2: 157-159.
9. Haas NB, Manola J, Dutcher JP, Flaherty KT, et al. Adjuvant Treatment for High-Risk Clear Cell Renal Cancer: Updated Results of a High-Risk Subset of the ASSURE Randomized Trial. JAMA Oncol. 2017; 3: 1249.
10.Eisen TQ, Frangou E, Smith B, Ritchie A, et al. Primary efficacy analysis results from the SORCE trial (RE05): Adjuvant sorafenib for renal cell carcinoma at intermediate or high risk of relapse: An international, randomised double-blind phase III trial led by the MRC CTU at UCL. Ann Oncol. 2019; 30: 891-2.
11.Motzer RJ, Haas NB, Donskov F, Gross-Goupil M, et al. Randomized Phase III Trial of Adjuvant Pazopanib Versus Placebo After Nephrectomy in Patients With Localized or Locally Advanced Renal Cell Carcinoma. J Clin Oncol Off J Am Soc Clin Oncol. 2017; 35: 3916-23.
12.Gross-Goupil M, Kwon TG, Eto M, Ye D, et al. Axitinib versus placebo as an adjuvant treatment of renal cell carcinoma: results from the phase III, randomized ATLAS trial. Ann Oncol. 2018; 29: 2371-8.
13.Procopio G, Apollonio G, Cognetti F, Miceli R, et al. Sorafenib Versus Observation Following Radical Metastasectomy for Clear-cell Renal Cell Carcinoma: Results from the Phase 2 Randomized Open-label RESORT Study. Eur Urol Oncol. 2019; 2: 699-707.
14.Appleman LJ, Puligandla M, Pal SK, Harris W, et al. Randomized, double-blind phase III study of pazopanib versus placebo in patients with metastatic renal cell carcinoma who have no evidence of disease following metastasectomy: A trial of the ECOG-ACRIN cancer research group (E2810). J Clin Oncol. 2019; 37: 4502-4502.
15.Ravaud A, Motzer RJ, Pandha HS, George DJ, et al. Adjuvant Sunitinib in High-Risk Renal-Cell Carcinoma after Nephrectomy. N Engl J Med. 2016; 375: 2246-54.
16.Motzer RJ, Ravaud A, Patard JJ, Pandha HS, et al. Adjuvant Sunitinib for High-risk Renal Cell Carcinoma After Nephrectomy: Subgroup Analyses and Updated Overall Survival Results. Eur Urol. 2018 Jan; 73(1): 62-68.
17.Ryan CW, Tangen C, Heath EI, Stein MN, et al. EVEREST: Everolimus for renal cancer ensuing surgical therapy – A phase III study (SWOG S0931, NCT01120249). J Clin Oncol. 2022; 40: 17_suppl, LBA4500-LBA4500.
18.Тимофеев И.В. Ниволумаб: 5 лет со дня международной регистрации иммунотерапии метастатического рака почки. Злокачественные опухоли. 2020; 10(4): 21-29.
19.Motzer RJ, Russo P, Gruenwald V, Tomita Y, et al. LBA4 – Adjuvant nivolumab plus ipilimumab (NIVO+IPI) vs placebo (PBO) for localized renal cell carcinoma (RCC) at high risk of relapse after nephrectomy: Results from the randomized, phase III CheckMate 914 trial. Ann Oncol. 2022; 33 (suppl_7): S808-S869. 10.1016/annonc/annonc1089.
20.Allaf M, Kim SE, Harshman LC, McDermott D, et al. LBA67 – Phase III randomized study comparing perioperative nivolumab (nivo) versus observation in patients (Pts) with renal cell carcinoma (RCC) undergoing nephrectomy (PROSPER, ECOG-ACRIN EA8143), a National Clinical Trials Network trial. Ann Oncol. 2022; 33 (suppl_7): S808-S869. 10.1016/annonc/annonc1089.
21.Pal SK, Uzzo R, Karam JA, Master VA, et al. Adjuvant atezolizumab versus placebo for patients with renal cell carcinoma at increased risk of recurrence following resection (IMmotion010): a multicentre, randomised, double-blind, phase 3 trial. Lancet. 2022 Sep 9: S0140- 6736(22)01658-0.
22.Choueiri TK, Tomczak P, Park SH, Venugopal B, et al. Pembrolizumab versus placebo as post-nephrectomy adjuvant therapy for patients with renal cell carcinoma: Randomized, double-blind, phase III KEYNOTE-564 study. J Clin Oncol. 2021; 39(suppl 15; abstr LBA5).
23.NCCN Guidelines Kidney Cancer, Version 3.2023.
24.Powles T, Tomczak P, Park SH,
Venugopal B, et al. Pembrolizumab
versus placebo as post-nephrectomy
adjuvant therapy for clear cell renal
cell carcinoma (KEYNOTE-564):
30-month follow-up analysis of a
multicentre, randomised, doubleblind, placebo-controlled, phase 3
trial. Lancet Oncol. 2022 Sep; 23(9):
1133-1144.
ESMO 2022: ЛЕЧЕНИЕ НМРЛ
Автор: Моисеенко Федор Владимирович
Санкт-Петербургский клинический научнопрактический центр специализированных видов медицинской помощи (онкологический),
СевероЗападный государственный медицинский университет им. И.И. Мечникова, д.м.н., Санкт-Петербург
На протяжении многих лет лечение и диагностика опухолей легкого немелкоклеточной природы
занимают существенное место
среди представленных на ежегодном конгрессе Европейского
общества клинической онкологии (ESMO). С точки зрения общих тенденций можно выделить
постепенное накопление данных
о применении ингибиторов контрольных точек для ранних опухолей с существенным увеличением числа излеченных пациентов,
накопление клинических данных
о лечении опухолей, ассоциированных с редкими мутациями, а
также существенное увеличение
роли исследований в реальной
клинической практике.
Кроме все более расширяющейся
роли NGS в диагностике НМРЛ, в
этом году был представлен крайне
любопытный подход к выявлению
одного из наиболее частых видов
мутаций при НМРЛ – KRAS G12C
[I. Soubeyran и соавт., №1084]. Авторы использовали гистологические препараты, окрашенные
гематоксилином и эозином, для
тестирования разработанного
ранее алгоритма с использованием искусственного интеллекта с
целью выявления этих мутаций.
Искусственный интеллект смог
предсказать наличие мутации
KRAS у 403 пациентов с чувствительностью 66%. Данные результаты нельзя считать достаточными для клинического применения
метода, тем не менее, развитие
этого направления можно считать
крайне перспективным, с учетом
существенной экономии как опухолевой ткани, так и аналитических ресурсов.
Кроме данных уже широко используемых и при НМРЛ, и при
опухолях других локализаций
препаратов ниволумаба и пембролизумаба, проводится изучение
результатов предоперационного применения и новых лекарственных средств. Ториплимаб в
комбинации с цитостатический
дуплетом был изучен у пациентов с местнораспространенным
резектабельным НМРЛ IIIA и IIIB
(cT3-4N2). В рамках этой работы 1- и 2-летняя безрецидивная
выживаемость после 3 циклов
предоперационного лечения и хирургического удаления – 87,8% и
67,9% соответственно. У половины
пациентов был зарегистрирован
полный патоморфологический
регресс, а аналогичные показатели безрецидивной выживаемости для этой группы составили
95% и 76,9%. В то же время при
использовании кармелизумаба в
комбинации с наб-паклитакселом
и препаратами платины частота больших регрессов составила
38,5%, а полных патоморфологических регрессов – 19,2% [Y
Liu&YS Zhang и соавт., №942Р]. Параллельно с этим нельзя не обратить внимание на представленные
впервые результаты исследования
INCREASE, в котором больным
с погранично резектабельными
опухолями cТ3-4 проводилась
стандартная химиолучевая терапия, дополненная ипилимумабом
и ниволумабом. Подобный агрессивных подход позволил достичь
полного патоморфологического
регресса у 63%, а большого патоморфологического регресса – у
79% больных.
В ожидании окончательных данных по общей выживаемости
больных локализованным НМРЛ
с мутациями EGFR было представлено обновление результатов
оценки безрецидивной выживаемости, медиана которой при применении осимертиниба составила
65,8 мес. против 21,9 мес. для группы плацебо [M. Tsuboi и соавт.,
ADAURA upd]. Таким образом, основным открытым вопросом для
адъювантного применения ИТК
остается то, будет ли наблюдаться увеличение числа излеченных
с помощью таргетного блокирования EGFR пациентов, в то время
как эффективность этого препарата в отношении блокирования
и минимальной резидуальной болезни можно считать доказанной.
Несмотря на высокую вероятность позитивных результатов исследования, проблемы со скорым
клиническим применением полученных данных существуют во
многих регионах мира. Так, в Китае проводится описательное исследование тактики лечения больных с ранними опухолями легкого
[Wenhua Liang и соавт., №1118Р]. С
2020 года в исследование включены 914 пациентов с различными
мутациями EGFR, из которых 184
получали терапию осимертинибом. Любопытно, что существенная часть этих больных получала
в адъювантном режиме ингибиторы EGFR 1-го и 2-го поколений,
регистрации которых в других
странах по этому показанию нет.
Несколько лет подряд основной
областью, в которой мы ожидаем
нововведений, является применение иммунотерапевтических
препаратов. Общая концепция на
настоящий момент заключается в
применении монотерапии ингибиторами контрольных точек у больных с высоким уровнем экспрессии PD-L1, анамнезом курения и
небольшим объемом опухолевой
массы. В этом году были представлены данные трехлетнего наблюдения за больными, получавшими
лечение цемиплимабом (один из
последних ингибиторов PD-1) в
рамках исследования EMPOWER
Lung-1 [Mustafa Özgüroğlu и соавт., EMPOWER-Lung01]. Медиана
общей выживаемости в рамках исследования составила 23,4 против
13,7 мес. в группе платиносодержащей химиотерапии, а время до
прогрессирования – 8,1 против 5,3
мес. соответственно. Кроме стандартных целей, в этой работе был
поднят и крайне актуальный вопрос об оптимальной тактике лечения после прогрессирования на
монотерапии цемиплимабом. Так,
продолжение цемиплимаба с дополнением четырьмя циклами терапии позволило достичь объективного ответа у 31,3% пациентов.
Также были оценены и отдаленные показатели выживаемости:
медиана времени до прогрессирования составила 6,6 мес., медиана
общей продолжительности жизни
после прогрессирования на первой линии – 15,1 мес. Вне всякого
сомнения, данные наблюдения, по
аналогии с антиангиогенной терапией, позволяют поднять вопрос
о целесообразности продолжения
иммунотерапии после прогрессирования заболевания. Более широкие возможности для применения монотерапии ингибиторами
контрольных точек независимо
от гистологической формы опухоли и уровня экспрессии PD-L1
были изучены в рамках исследования IPSOS у больных, проведение комбинаций с препаратами
платины которым невозможно в
связи с плохим общим состоянием
[Siow Ming Lee и соавт., IPSOS]. В
этом исследовании в стандартной
группе проводилась терапия винорельбином или гемцитабином
по выбору исследователя, а в экспериментальной – атезолизумабом в 3-недельном режиме (1200
мг). Основная цель работы была
достигнута – общая продолжительность жизни в группе атезолизумаба была достоверно выше,
чем в группе монохимиотерапии
(10,3 против 9,2 мес.). Крайне любопытно, что частота объективных ответов на фоне монотерапии
анти-PD-L1 – 16,9% против 7,9%,
равно как и длительность этих ответов – 14,0 против 7,8 мес., – были
примерно в два раза выше.
Кроме курильщиков с небольшим
объемом опухолевой массы и высоким уровнем PD-L1, всем остальным пациентам в качестве первой
линии терапии целесообразно
комбинировать иммунотерапию
со стандартной платиносодержащей химиотерапией. Данный
подход, вне всякого сомнения,
дает существенные преимущества
относительно режимов без иммунотерапии, что было продемонстрировано несколько лет назад
для пембролизумаб-содержащих
режимов, как для аденокарциномы, так и для плоскоклеточного
рака в исследованиях KEYNOTE
189 и 407 [M.C. Garassino и соавт.,
KEYNOTE 189; S. Novello и соавт.,
KEYNOTE 407]. Сходное преимущество было показано независимо
от уровня PD-L1 и для комбинации ниволумаба, ипилимумаба и
двух циклов химиотерапии в исследовании CHECKMATE 9LA.
В этом году были представлены
результаты длительного наблюдения за пациентами в этих, вне сомнения, значимых исследованиях.
Так, при применении комбинации
пембролизумаба, пеметрекседа
и карбоплатина в первой линии
пятилетняя выживаемость составила 19,4% против 11,3% для больных, начавших лечение в группе
химиотерапии. Сходные различия наблюдались и при прогрессировании заболевания, которое
отсутствовало у 10,2% пациентов
через 4 года и у 7,5% через 5 лет
после начала терапии пембролизумабом. Крайне важно обратить
внимание на то, что различия в
доле пациентов без прогрессирования наблюдались в зависимости
от экспрессии PD-L1. Сходные результаты получены и у пациентов
с плоскоклеточными опухолями
– чуть менее 1/5 пациентов прожили 5 лет после начала лечения,
а у 1 из 10 через 60 месяцев не было
прогрессирования заболевания.
В одном из представленных исследований (IFCT-1701 DICIPLE),
которое представляется авторам
необычным, изучался вопрос влияния сокращения длительности
проведения комбинации ипилимумамба и ниволумаба до 6 месяцев
с последующей реинтродукцией
этого режима при прогрессировании [G. Zalcman и соавт., №9720Р].
Концепция «stop-go» позволила
продемонстрировать как минимум
не худшие результаты в сравнении
с продолжением лечения до прогрессирования (медиана ВДП – 35,2
против 20,8 мес., медиана ОВ не
достигнута ни в одной из групп,
но 18-месячная ОВ – 93,7% против
79,3% в пользу экспериментального
режима).
Существенный интерес вызывают исследования возможностей
преодоления резистентности у
больных, получавших ингибиторы
контрольных точек. Наиболее изученным на сегодняшний день подходом является дополнение к предшествовавшей терапии того или
иного ингибитора ангиогенеза. В
одной из таких работ сравнивалась
стандартная терапия и продолжение пембролизумаба с дополнением рамуцирумабом. Комбинация
ингибитора контрольных точек
и анти-VEGFR позволила увеличить общую продолжительность
жизни пациентов, а максимальное
преимущество получили больные
с коротким (<6 месяцев) и, наоборот, длинным (>12 месяцев) сроком на фоне первичной терапии
[K.L. Reckamp и соавт., Lung-MAP
S1800A]. Похожая по дизайну работа показала эффективность антиPD-1/PD-L1 и анлотиниба [V. Bhat и
соавт., №1086Р].
Довольно большое число представленных работ можно отнести
к ретроспективному анализу различных характеристик, ассоциированных с ответом или, наоборот, первичной резистентностью
к используемым в клинике ингибиторам контрольных точек. Во
многих исследованиях основным
фактором, определявшим эффект
от ингибиторов, было наличие той
или иной формы системного воспаления на момент начала терапии.
Тем не менее, пока однозначные
выводы из выявленных закономерностей сделать крайне затруднительно. Крайне любопытными
представляются результаты работы, показавшие изменение динамики роста опухоли у больных с длительным эффектом монотерапии
пембролизумабом [I. Poumir и соавт., №1150Р]. Так, в 76,2% случаев
прогрессирование после длительного ответа заключалось либо в
появлении одного или нескольких
очагов (олигопрогрессирование),
либо в увеличении предсуществовавших очагов. Среди пациентов с
олигопрогрессированием у подавляющего большинства следующее
обследование не выявляло появления дополнительных сайтов прогрессирования. Подобный профиль
прогрессирования предполагает по
аналогии с ингибиторами тирозинкиназ более активное применение
локальных методов с целью блокирования резистентных клонов. Безопасность и клиническая целесообразность подобного подхода были,
например, продемонстрированы для
комбинации ипилимумаба и ниволумаба в исследовании RECLAIM [I.
Bahce и соавт., №1020], а также атезолизумаба и лучевой терапии.
Как и в предыдущие годы, большое
число работ было посвящено лечению и клиническим особенностям
группы больных с активирующими мутациями. Из многочисленных исследований реальной клинической практики, проведенных
в разных странах, можно сделать
вывод о постепенной, но небыстрой интеграции NGS в обследование пациентов до начала лечения [I. Tian и соавт., №1125Р; A.
Cortot и соавт., №1699Р]. Все более
широкое внедрение этого метода
генетического анализа, позволяющего в том числе выявлять более
редкие мутации, способствует накоплению данных о клиническом
течении опухолей, ассоциированных с такими нарушениями, как
инсерции в экзоне 20 EGFR [K.
Li и соавт., №1110; V. Lee и соавт.,
№1111] или G12C KRAS [M. Awad
и соавт., №989]. Среди важных
клинических новинок можно отметить представленные данные о
крайне высокой интракраниальной эффективности лорлатиниба у больных с транслокациями
ALK: метастатическое поражение
появилось на фоне терапии ИТК
3-го поколения только у 1 из 112
пациентов, а прогрессирование
метастазов в головном мозге произошло только у 8 из 37 больных в
течение 3 лет наблюдения [A. Bearz
и соавт., №979].
Таким образом, можно ожидать в
ближайшие годы расширения числа используемых в клинической
практике молекулярно-генетических нарушений для определения
тактики лечения, а также оптимизации для этих групп применения
уже зарегистрированных независимо от мутаций видов терапии.
ESMO 2022: РАК МОЛОЧНОЙ ЖЕЛЕЗЫ
Автор: Данилова Анастасия Сергеевна
Врач-химиотерапевт отделения химиотерапии ГБУЗ «Московская городская онкологическая больница №62 ДЗМ», Москва
В этом году в Париже прошел юбилейный 50-й конгресс ESMO, и мы вновь стали свидетелями, с какой скоростью онкологическая наука движется вперед. Расскажу про самые интересные, на мой взгляд, исследования по раку молочной железы.
Проспективное
рандомизированное
исследование III фазы DATA
[1]: улучшает ли отдаленные
результаты лечения
продленная (6 против 3
лет) терапия ингибиторами
ароматазы после 2-3 лет
терапии тамоксифеном
(последовательно)?
Нумерически было достигнуто
увеличение безрецидивной выживаемости на 3,1% в точке 10 лет,
но оно оказалось статистически
не достоверно. При этом основные преимущества мы видим в
подгруппе пациентов с более распространенными стадиями. Так, в
группе больных с pN2 разница на
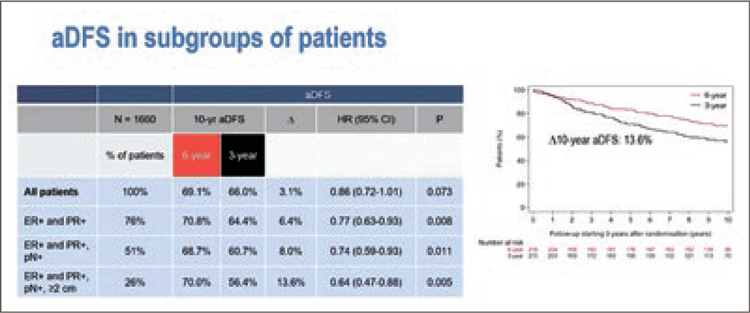
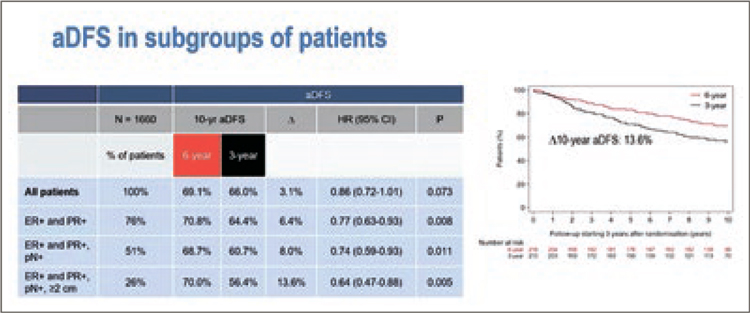
10 годах составила 13,6% (рис.1-3).
Рисунок 1. Характеристики пациентов из исследования DATA [1].
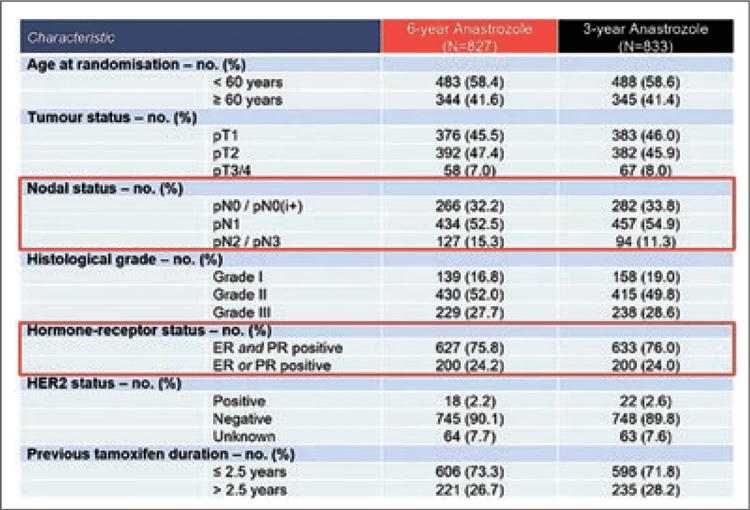
Рисунок 2. Выживаемость без прогрессирования по данным DATA [1].
Это еще одно исследование, которое показывает, что продленная
гормонотерапия – опция для пациентов высокого риска, и предлагать мы ее можем в том числе
и больным, которые вначале проходили адъювантную терапию тамоксифеном.
Исследование TROPICS-2:
обновленные данные
общей выживаемости
по применению
сацитузумаба говитекана
у сильно предлеченных
(3-4 линии) пациенток с
HR+ Her2- раком молочной
железы [2]
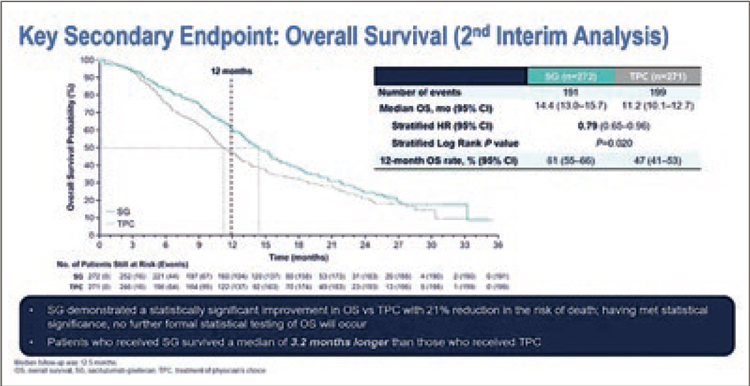
Исследование показало увеличение и частоты объективных ответов практически в 2 раза (21% против 14%), и статистически достоверное увеличение медианы общей выживаемости (14,4 против 11,2 мес., рис.4). Исследование позитивное, но рождающее много вопросов. Как соотносятся эти данные с таковыми из исследования с трастузумабом дерукстеканом? Есть ли место для последовательного использования конъюгатов? Какова оптимальная последовательность терапии?
Рисунок 3. Общая выживаемость по данным исследования DATA [1].
Исследование MONARCH
Все очень ждали второго промежуточного анализа исследования
MONARCH [3]. В нашем распоряжении есть 3 ингибитора CDK4/6,
которые показали практически
одинаковые результаты по увеличению выживаемости без прогрессирования в 1 и 2 линиях терапии
метастатического гормонопозитивного Her2-негативного рака молочной железы, при этом они показали
разные результаты в отношении
увеличения ОВ. И поэтому все ждали результатов этого исследования
как ответа на вопрос, сможем ли
мы понять, за счет чего в исследовании с рибоциклибом было достигнуто статистически значимое
увеличение ОВ, а в исследовании с
палбоциклибом – нет.
Рисунок 4. Общая выживаемость по данным исследования
TROPICS-2 [2].
Второй промежуточный анализ исследования MONARCH показал
численно значимое увеличение ОВ
– 67,1 против 54,5 мес. (HR=0,754
(0,584-0,974), p=0,03; рис.5), причем
численно значимое увеличение ОВ
мы видим даже в группе пациентов
с висцеральными метастазами – 65,1
против 48,8 мес. (рис.6)
Рисунок 5. . Общая выживаемость по данным 2 промежуточного
анализа исследования MONARCH [3].
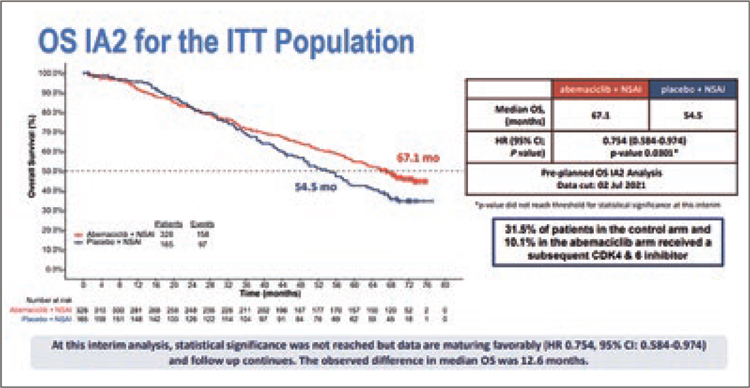
Рисунок 6. Общая выживаемость у пациентов с висцеральными
метастазами по данным 2 промежуточного анализа исследования
MONARCH [3].
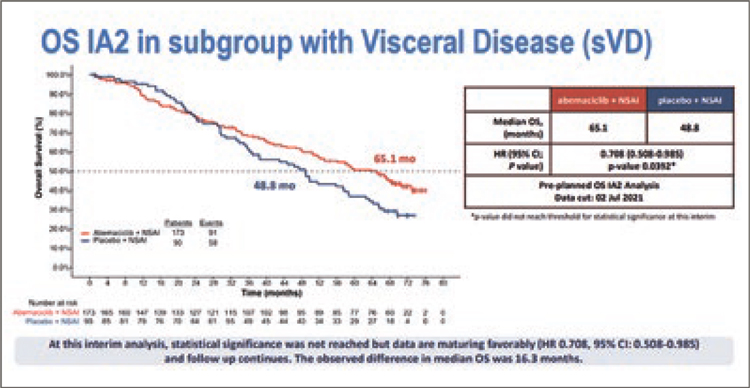
Но эти, казалось бы, очень хорошие
цифры по запланированному анализу
пока не достигли статистической значимости. Так что ждем следующего
анализа, который ожидается в 2023
году.
Вышли окончательные результаты
очень важного исследования итальянской группы GIM, которое оценивало
роль добавления 5-фторурацила к антрациклинам и роль dose dense режима антрациклинов у пациентов, получающих адъювантную химиотерапию
при раке молочной железы.
Это исследование, на мой взгляд,
ставит окончательную точку в использовании режима FEC – он никак
не улучшает результаты лечения по
сравнению EC с и не должен применяться у пациентов, которые получают адъювантную терапию (рис.7).
При этом есть значимое увеличение
PFS и OS у пациентов, которые получали антрациклины в режиме dd
(рис.8).
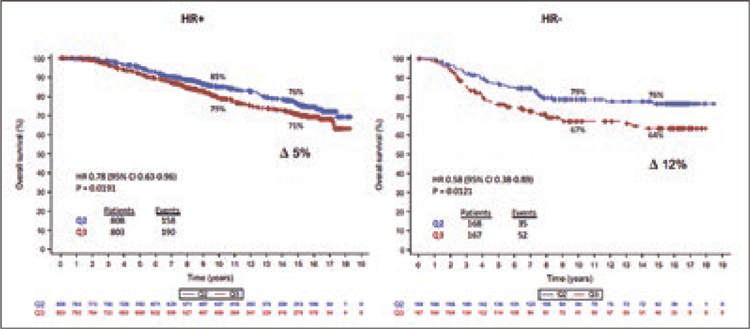
При этом разница была наиболее значима у пациентов с гормононегативными опухолями: так, дельта составила 12% при медиане наблюдения 15,2
года (рис.9).
Рисунок 7. Выживаемость без прогрессирования и общая выживаемость при проведении аПХТ в 2 режимах [4].
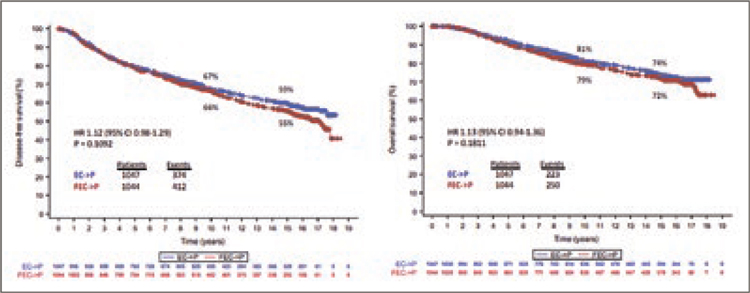
Рисунок 8.
Р. ВБП и ОВ при проведении аПХТ в 2 режимах [4].
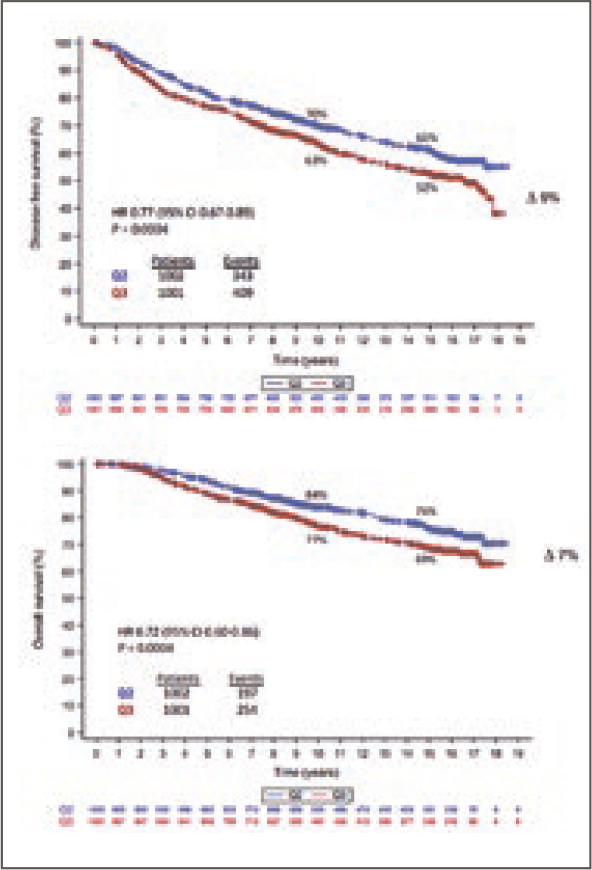
Рисунок 9. . ОВ при проведении аПХТ в 2 режимах у больных
с гормонопозитивными и гормононегативными опухолями [4].
Еще одно важное исследование из тех,
что были доложены на конгрессе, –
так называемое исследование с patient
reported outcomes, то есть результаты
лечения, которые оценивались пациентами в исследовании DESTINYBreast04, где эффективность трастузумаба дерукстекана исследовалась у больных раком молочной железы
с низкой экспрессией Her2 по сравнению с химиотерапией по выбору
врача.
Напомню, что это исследование вызвало овации на конгрессе ASCO и
стало одним из главных событий в лечении рака молочной железы в этом
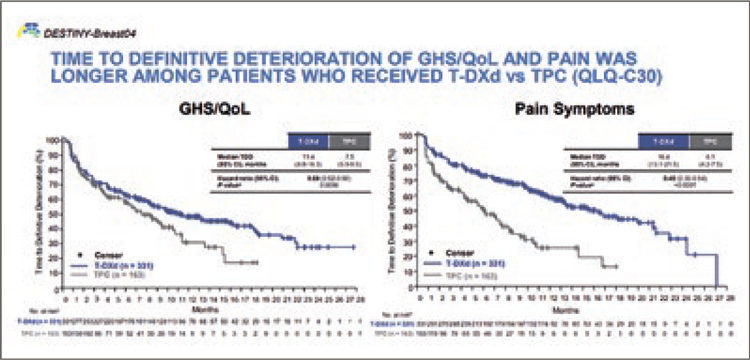
году. Результаты исследования показали увеличение медианы общей выживаемости с 17,5 до 23,9 мес. в группе T-Dxd. Сейчас же были доложены
результаты оценки качества жизни
(рис.10) [5].
Мы видим, что терапия трастузумабом дерукстеканом увеличивает
время до снижения качества жизни
у пациентов (11,4 против 7,5 мес.) и
увеличивает время до появления
болевого синдрома (16,4 против 6,1мес., HR=0,40)
Рисунок 10. Оценка качества жизни пациентами по данными
исследования DESTINY-Breast04 [5].
Клинические онкологи, во всяком
случае раньше, при интерпретации
результатов клинических исследований ориентировались на первичные и вторичные конечные точки,
которые касались продолжительности жизни или времени до прогрессирования. При этом достаточного
внимания оценке качества жизни
со стороны пациентов не уделялось.
Мы считали, что увеличение продолжительности жизни на несколько месяцев – это победа. При этом
при опросах самих пациентов оказывалось, что им не менее важно
качество жизни этих месяцев терапии. Именное поэтому оценка качества жизни пациентами постепенно
становится одной из важнейших
оценок эффективности того или
иного лечения.
Источники:
1. Tjan-Heijnen VCG, at al. Extended adjuvant aromatase inhibition after sequential endocrine therapy: Final results of the phase III DATA trial. Annals of Oncology. 2022; 33 (suppl_7): S55-S84.
2. Rugo HS, Bardia A, Marmé F, et al. Sacituzumab Govitecan in Hormone Receptor–Positive/Human Epidermal Growth Factor Receptor 2–Negative Metastatic Breast Cancer. JCO; Published online: 26 August 2022. DOI: 10.1200/ JCO.22.01002.
3. Goetz MP, et al. MONARCH 3: Interim overall survival (OS) results of abemaciclib plus a nonsteroidal aromatase inhibitor (NSAI) in patients (pts) with HR+, HER2- advanced breast cancer (ABC). Annals of Oncology. 2022; 33 (suppl_7): S808-S869.
4. Del Mastro L, et al. Dose-dense adjuvant chemotherapy in early-stage breast cancer patients: End-of-study results from a randomised, phase III trial of the Gruppo Italiano Mammella (GIM) Annals of Oncology. 2022; 33 (suppl_7): S55-S84.
5. Ueno NT, et al. Patient-reported
outcomes (PROs) from DESTINYBreast04, a randomized phase III study
of trastuzumab deruxtecan (T-DXd) vs
treatment of physician's choice (TPC) in
patients (pts) with HER2-low metastatic
breast cancer (MBC). Annals of Oncology.
2022; 33 (suppl_7): S88-S121.
ESMO 2022: НАИБОЛЕЕ ВАЖНЫЕ НОВОСТИ ESMO 2022 В ЛЕЧЕНИИ ОПУХОЛЕЙ ЖКТ
Автор: Трякин Алексей Александрович
НИИ клинической онкологии им. акад. РАН и РАМН Н.Н. Трапезникова
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, доктор медицинских наук, Москва
Прошедшая конференция ESMO в
этом году принесла несколько интересных исследований в области лечения опухолей ЖКТ, результатами
которых я и поделюсь. При этом, на
мой взгляд, в лечении рака пищевода и желудка ничего особенно интересного доложено не было, поэтому
ограничимся нижележащими отделами ЖКТ.
Гепатоцеллюлярный рак
После выхода в 2020 году результатов
исследования IMBRAVE 150 комбинация атезолизумаба с бевацизумабом стала стандартом первой линии
терапии ГЦР. На ESMO 2022 были
представлены давно ожидаемые результаты исследования LEAP-002, в
котором полюбившаяся по другим
нозологиям комбинация пембролизумаба с ленватинибом сравнивалась с монотерапией ленватинибом.
Медиана общей выживаемости (ОВ)
в комбинации оказалась несколько
лучше (21,1 против 19,0 мес.), но различия не достигли статистической
достоверности [1].
В то же время концепция комбинации ингибиторов тирозинкиназ
(TKI) и иммунотерапии оказалась
успешной в другом исследовании
III фазы, где с сорафенибом сравнивалась комбинация камрелизумаба
(анти-PD1 антитело) и ривоцераниба
(мультикиназного TKI) [2]. Комбинация значимо превзошла сорафениб
по всем показателям эффективности,
включая ОВ (медиана 22,1 против
15,2 мес., HR 0,62) (рис.1).
Одной из причин различных исходов в этих двух исследованиях может
быть слишком хорошая контрольная
группа в LEAP-002 – ленватиниб. Последний и в монотерапии является
достаточно эффективной опцией
лечения ГЦР, особенно у пациентов
без вирусного гепатита, где его эффективность, по-видимому, даже
превосходит комбинацию атезолизумаба с бевацизумабом [3].
Желчные протоки
Первая линия терапии рака желчных
протоков долгие годы была прочно
занята комбинацией цисплатина с
гемцитабином. В январе 2021 года
было показано, что добавление к
комбинации дурвалумаба увеличивает показатели ОВ, что быстро приведет в ближайшие время к пересмотру
клинических рекомендаций. Возможности второй линии продолжают
оставаться ограниченными: возможно применение режимов FOLFOX,
FOLFIRI, фторпиримидинов, монотерапии иринотекана, однако реальная эффективность их остается
невысокой. В рандомизированном
исследовании II фазы NALIRICC исследователи из Германии сравнили
комбинацию липосомального иринотекана с фторурацилом (режим ранее
показал эффективность во 2+ линиях
терапии метастатического рака поджелудочной железы) с одними фторпиримидинами. К сожалению, не удалось продемонстрировать улучшения
показателей ни выживаемости без
прогрессирования (ВБП), ни ОВ [4].
Наибольшие перспективы терапии
химиорефрактерного рака желчных
протоков видятся в применении таргетной терапии у пациентов с перестройками FGFR2, мутациями IDH1,
мутациями BRAF. Для терапии пациентов с перестройками FGFR2 уже
применяются TKI инфигратиниб,
пемигатиниб, футибатиниб, позволяющие достичь объективного ответа у 23-42% больных. На ESMO 2022
были представлены первые результаты применения высокоселективного
ингибитора FGFR2 RLY-4008, который показал потрясающие 88% ЧОО,
большинство из которых были длительными [5].
Рисунок 1. 1. ОВ больных ГЦР в исследовании камрелизумаб +
ривоцераниб vs сорафениб

Рак поджелудочной железы
(РПЖ)
Комбинации FOLFIRINOX и гемцитабин – наб-паклитаксел как
в лечении локализованного, так
и метастатического РПЖ продемонстрировали превосходство
над гемцитабином у пациентов с
IV стадией, однако так ли это при
местнораспространенном процессе – остается неизвестным. В рандомизированном исследовании
PRODIGE 29-UCGI 26(NEOPAN)
171 пациент с местнораспространенным РПЖ рандомизировались
на гемцитабин или FOLFIRINOX
[6]. В группе последнего была достигнута лучшая ВБП (медиана 9,7
мес. против 7,5 мес., p=0,03), однако
ОВ не различалась. Частота резекций в обеих группах была низка
(3,5%). Изменит ли данное исследование наши подходы в лечении
местнораспространенного РПЖ?
Вряд ли. У пациентов в удовлетворительном состоянии комбинации
FOLFIRINOX и гемцитабин – набпаклитаксел остаются равноэффективными вариантами выбора
первой линии [7].
Колоректальный рак (КРР)
Роль хирургии и ранние стадии
На ESMO 2022 японские хирурги представили результаты сразу
двух рандомизированных исследований III фазы. В первом из них
производилось сравнение лапароскопической и открытой резекции
при симптомном (кровотечение
или стенозирующая опухоль, но
без острой кишечной непроходимости) метастатическом раке ободочной кишки. Показатели БРВ и
ОВ в обеих группах были идентичны при несколько меньшем числе
осложнений в группе лапароскопии, что позволяет рассматривать
последнюю в качестве стандартного подхода [8].
В другом исследовании изучался
вопрос необходимости применения
no-touch isolation техники (обработка на первом этапе опухолевых
сосудов), которая, как предполагалось, должна привести к уменьшению поступления опухолевых
клеток в кровоток. 863 пациента со
II-III стадями были рандомизированы в группу обычной и no-touch
isolation техники, применялась
только лапаротомия. Показатели
ОВ в обеих группах, к сожалению,
оказались одинаковы [9].
Как нужно наблюдать пациентов с
локализованным КРР после радикального лечения? На этот вопрос
попыталось ответить французское
исследование PRODIGE 13. В нем
2009 пациентов рандомизировались
в группы обычного (УЗИ и рентгенография ОГК) и интенсифицированного (КТ) наблюдения с или без
контроля уровня РЭА (рандомизация 2×2, рис.2). Ни в одной из групп
не удалось показать преимущество
в отношении ОВ. Таким образом,
для наблюдения за пациентами со
II-III стадиями вполне достаточно
выполнения УЗИ органов брюшной
полости каждые 3 месяца в течение
первых 3 лет и каждые 6 месяцев в
последующие два года, а также рентгенографию органов грудной клетки
каждые полгода в течение 5 лет.
Рисунок 2.
Дизайн исследования PRODIGE 13

Внутрибрюшинная гипертермическая химиотерапия (HIPEC) продолжает терять свои позиции. Ранее
было показано, что она бесполезна
у пациентов с карциноматозом КРР.
На ESMO 2022 были доложены результаты испанского исследования
III фазы, в котором половине больных с сT4N0-2M0 раком ободочной
кишки дополнительно к хирургии
проводилась HIPEC митомицином.
В последней группе удалось увеличить частоту локорегионарного
контроля (время до появления метастазов по брюшине или смерти
от любой причины) с 87% до 97%
(3 года, р=0,025), но не ВБП или
ОВ [10]. При поданализе наибольший выигрыш в локальном контроле отмечен при pT4 опухолях.
Несмотря на позитивные выводы
авторов исследования, сомневаюсь, что адъювантный HIPEC войдет в нашу практику.
Иммунотерапия КРР с высоким уровнем микросателлитной нестабильности (MSI-high) уже прочно вошла
в лечение IV стадии заболевания и
начала проникновение в лечение более ранних стадий. 2021-2022 годы
ознаменовались серией небольших
работ с потрясающей активностью
этого подхода: достарлимаб при раке прямой кишки, пембролизумаб при
КРР, комбинации ниволумаба с ипилимумабом (NICHE-1 trial). На ESMO
2022 были представлены результаты
исследования NICHE-2, в котором 112
пациентов с II-III стадией рака ободочной кишки получили одно введение
ипилимумаба 1 мг/кг и два введения
ниволумаба 3 мг/кг с последующей хирургией через 6 недель. Все пациенты
были прооперированы, у 67% зафиксирован полный лечебный патоморфоз, а у 95% – большой патоморфоз
(<10% злокачественных клеток) [11].
При медиане наблюдения 13,1 мес. ни
у одного пациента не зафиксировано
прогрессирования заболевания, несмотря на то, что у 87% исходно была
III стадия заболевания, а адъювантная
химиотерапия была проведена лишь
у 3 пациентов! Неоадъювантная иммунотерапия при MSI-high КРР уже
сейчас включена в обновленные клинические рекомендации Минздрава
(пока еще не приняты).
Метастатический КРР
До недавнего времени было не так
много проспективных рандомизированных исследований, посвященных роли дуплетов и триплетов, а
также разных таргетных препаратов
в первой линии терапии больных с
потенциально резектабельными и нерезектабельными метастазами КРР в
печень. В исследовании CAIRO-5 тестировались две гипотезы (рис.3):
1. Лучше ли FOLFOXIRI чем дуплеты в комбинации с бевацизумабом при мутациях KRAS, NRAS, BRAF или правосторонней локализации (доложено на ASCO 2022, FOLFOXIRI + бевацизумаб – лучше ВБП и частота резекций печени)?
2. Какое антитело лучше добавить
к дуплетам у пациентов с левосторонней локализацией опухоли и
диким типом генов RAS, BRAF (результаты представлены на ESMO
2022)?
Рисунок 3.
Дизайн исследования CAIRO-5

Оказалось, что у пациентов вне зависимости от применения панитумумаба или беацизумаба ВБП (медиана
около 10,5 мес.) и частота резекций
печени (57%) не отличалась. Данные
по ОВ еще не зрелые.
Какие выводы можно сделать из данных CAIRO-5 для пациентов с левосторонней локализацией опухоли и
диким типом генов RAS, BRAF в отношении выбора моноклонального
антитела? Лично я считаю, что наши
подходы остаются прежними: применение анти-EGFR антител. Во-первых,
использование анти-EGFR антител
ассоциируется с большей ЧОО, глубиной ответа, что по данным метаанализов приводит к большей частоте и
резекций печени. Во-вторых, следует
помнить, что, несмотря на успехи таргетной терапии, не менее половины
больных с исходными потенциально
резектабельными/нерезектабельными метастазами так и не будут прооперированы. А применение у них
бевацизумаба вместо анти-EGFR
антител в среднем «крадет» у пациента около 3,5-6 месяцев продолжительности жизни (исследования FIRE
3, CALGB/SWOG 80405, PARADIGM,
STRATEGIC-1).
Много копий сломано в обсуждении
оптимальной продолжительности терапии анти-EGFR антителами в первой линии лечения. Причиной этому
является невысокая доказательная
база небольших рандомизированных исследований II фаз (COIN-B,
MACRO-2, VALENTINO, PANAMA).
2022 году внес дополнительную путаницу в данный вопрос. На ASCO
2022 были представлены результаты
исследования IMPROVE, в котором
полные перерывы в терапии оказались лучше продолжения терапии до
прогрессирования в отношении искусственно выбранного странного
показателя «выживаемости на лечении» [12]. Данное исследование было
сразу же подхвачено в СМИ как обоснование полных перерывов терапии
после 8 курсов с последующей реинтродукцией при прогрессировании
заболевания.
ESMO 2022 порадовало результатами
сразу двух исследований по данному вопросу. В первом из них – исследовании ERMES – 606 пациентов
были рандомизированы на 8 курсов
FOLFIRI + цетуксимаб с последующей поддерживающей терапией
цетуксимабом или на FOLFIRI + цетуксимаб до прогрессирования заболевания [13]. Задачей было показать
не меньшую ВБП в первой группе.
Не вдаваясь в путанности end-points
исследования, можно кратко суммировать, что: а) ВБП у пациентов с левосторонней локализацией была недостоверно лучше в группе FOLFIRI
+ цетуксимаб (медианы 10,4 мес.
против 12,3 мес., HR 1,16 (0,88-1,52));
б) ОВ была недостоверно лучше в
группе с поддерживающей терапией цетуксимабом (медианы 25,4 мес.
против 31,1 мес., HR 0,81 (0,60-1,09)).
Таким образом, поддержка монотерапией цетуксимабом несколько
проигрывает непрерывной терапии
по ВБП, но несколько выигрывает в
ОВ (рис.4). Во втором исследовании
– TIME-PRODIGE 28 UNICANCER –
131 пациент после 8 курсов FOLFIRI
+ цетуксимаб были рандомизированы на наблюдение или поддерживающую терапию цетуксимабом [14].
В случае прогрессирования в обеих
группах предполагалось повторное
назначение FOLFIRI + цетуксимаба.
Полный перерыв приводил не только к достоверно меньшей ВБП (2,0
против 5,3 мес., что неудивительно),
но и к тенденции ухудшения ОВ (19,7
против 25,6 мес., рис.5).
Рисунок 4.
ВБП и ОВ пациентов в исследовании ERMES
Рисунок 5.
ВБП и ОВ
в исследовании TIME-PRODIGE
28 UNICANCER
Так как же лучше поступать с антиEGFR антителами в первой линии после индукционного этапа (12-16
недель терапии)? Однозначного ответа так и нет, выскажу мой подход. Наиболее предпочтительным
вариантом пока выглядит продолжение поддерживающей терапии
анти-EGFR антителом с режимом de
Gramont. Если терапия фторпиримидинами сопровождается значимыми
побочными явлениями, то возможно применение одних анти-EGFR
антител. Полный перерыв в лечении
– возможная опция у пациентов с
незначительной опухолевой массой
(в случае прогрессирования пациент
успеет получить реиндукцию первой
линии), «уставшего» от терапии или
в случае нехватки анти-EGFR антител на всех пациентов.
КРР с мутацией BRAF V600E является прогностически крайне неблагоприятным. Ранее была показана высокая эффективность совместного
применения TKI BRAF, анти-EGFR
моноклонального антитела у пациентов во 2+ линиях терапии. В настоящее время инициировано исследование III фазы BREAKWATER, в
котором в качестве первой линии
сравниваются группы энкорафениб + цетуксимаб, энкорафениб +
цетуксимаб + FOLFOX и FOLFOX/
FOLFOXIRI ± бевацизумаб. На ESMO
были представлены результаты первой части этого исследования, в котором изучалась безопасность и эффективность комбинации энкорафениб +
цетуксимаб + FOLFOX или + FOLFIRI
(n=57) [15]. Токсичность режимов
признана приемлемой (несмотря на
18% больных, полностью прекративших терапию из-за нее), достигнута
высокая ЧОО (67%) и ВБП (медиана
9,9 мес.). Будем с нетерпением дожидаться результатов III фазы исследования.
Сегодня не существует стандартов
терапии КРР в 3+ линиях. За исключением «особых» вариантов КРР
(MSI-high, mutBRAF, mutKRAS G12C,
HER2neu+ или NTRK+) возможными
универсальными вариантами лечения являются повторное применение
ранее эффективных режимов терапии, регорафениб, трифлуридин типирацил. На ESMO 2022 были представлены результаты исследования
FRESCO-2, сравнивавшего фруквитиниб (мультикиназный TKI) с симптоматической терапией у 687 предлеченных пациентов [16]. Удалось
достоверно увеличить показатели ОВ
(медиана 4,8 против 7,4 мес., HR 0,66;
95% ДИ 0,55-0,80) и ВБП (медиана 1,8
мес. против 3,7 мес., HR 0,32, 95% ДИ
0,27-0,39; рис.6). К сожалению, в исследовании практически не было пациентов после регорафениба, для того
чтобы высказаться об эффективности
фруквитиниба в этой подгруппе. При
непрямом сравнении результатов
данного исследования с эффективностью регорафениба (исследование
CORRECT) создается впечатление о
преимуществе фруквитиниба.
Рисунок 6.
ОВ в исследовании FRESCO-2.
Литература:
1. Finn RS, Kudo M, Merle P, et al. LBA34 – Primary results from the phase III LEAP002 study: Lenvatinib plus pembrolizumab versus lenvatinib as first-line (1L) therapy for advanced hepatocellular carcinoma (aHCC). Annals of Oncology. 2022; 33 (suppl_7): S808-S869. 10.1016/annonc/annonc1089.
2. Qin S, Chan LS, Gu S, et al. LBA35 – Camrelizumab (C) plus rivoceranib (R) vs. sorafenib (S) as first-line therapy for unresectable hepatocellular carcinoma (uHCC): A randomized, phase III trial. Annals of Oncology. 2022; 33 (suppl_7): S808-S869. 10.1016/annonc/annonc1089.
3. Casadei-Gardini A, Rimini M, Rimassa L, et al. Atezolizumab plus bevacizumab versus lenvatinib or sorafenib in non-viral unresectable hepatocellular carcinoma: An international study. Journal of Clinical Oncology. June 01, 2022. 40, no.16_suppl, 4069-4069.
4. Vogel A, Wenzel P, Folprecht G, et al. 53MO – Nal-IRI and 5-FU/LV compared to 5-FU/LV in patients with cholangio- and gallbladder carcinoma previously treated with gemcitabine-based therapies (NALIRICC – AIO-HEP-0116). Annals of Oncology. 2022; 33 (suppl_7): S19-S26. 10.1016/annonc/ annonc1036. 5. Hollebecque A, Borad M, Goyal L, et al. LBA12 – Efficacy of RLY-4008, a highly selective FGFR2 inhibitor in patients (pts) with an FGFR2-fusion or rearrangement (f/r), FGFR inhibitor (FGFRi)-naïve cholangiocarcinoma (CCA): ReFocus trial. Annals of Oncology. 2022; 33 (suppl_7): S808-S869. 10.1016/annonc/annonc1089.
6. Ducreux MP, Desgrippes R, Rinaldi Y, et al. 1296MO – PRODIGE 29-UCGI 26(NEOPAN): A phase III randomised trial comparing chemotherapy with folfirinox or gemcitabine in locally advanced pancreatic carcinoma (LAPC). Annals of Oncology. 2022; 33 (suppl_7): S592-S598. 10.1016/ annonc/annonc1067.
7. Ozaka M, Ueno M, Ishii H, et al. Randomized phase II study of modified FOLFIRINOX versus gemcitabine plus nabpaclitaxel combination therapy for locally advanced pancreatic cancer (JCOG1407). Journal of Clinical Oncology. May 20, 2021. 39, no.15_suppl, 4017-4017.
8. Akagi T, Inomata M, Kanzaka R, et al. 416P – A randomized controlled trial to compare laparoscopic surgery with open surgery for symptomatic, non-curable stage IV colorectal cancer (CRC): First efficacy results from Japan clinical oncology group study JCOG1107. Annals of Oncology. 2022; 33 (suppl_7): S136-S196. 10.1016/annonc/ annonc1048.
9. Takii Y, Mizusawa J, Kanemitsu Y, et al. 414P – Long-term follow-up of the randomized trial of the conventional technique versus the no-touch isolation technique for primary tumor resection in patients with colon cancer ( JCOG1006). Annals of Oncology. 2022; 33 (suppl_7): S136-S196. 10.1016/annonc/annonc1048.
10.Arjona-Sanchez A, Cano-Osuna MT, Gutierrez A, et al. 314O – Adjuvant hyperthermic intraperitoneal chemotherapy in locally advanced colon cancer (HIPECT4): A randomized phase III study. Annals of Oncology. 2022; 33 (suppl_7): S136-S196.
11.Chalabi M, Verschoor YL, van den Berg J, et al. LBA7 – Neoadjuvant immune checkpoint inhibition in locally advanced MMR-deficient colon cancer: The NICHE-2 study. Annals of Oncology. 2022; 33 (suppl_7): S808-S869.
12.Avallone A, Giuliani F, Nasti G, et al. Randomized intermittent or continuous panitumumab plus FOLFIRI (FOLFIRI/ PANI) for first-line treatment of patients (pts) with RAS/BRAF wild-type (wt) metastatic colorectal cancer (mCRC): The IMPROVE study. J Clin Oncol. 2022; 40 (suppl_16), abstr 3503.
13.Pinto C, Orlandi A, Normanno N, et al. LBA22 – Phase III study with FOLFIRI/ cetuximab versus FOLFIRI/cetuximab followed by cetuximab (Cet) alone in first-line therapy of RAS and BRAF wild-type (wt) metastatic colorectal cancer (mCRC) patients: The ERMES study. Annals of Oncology. 2022; 33 (suppl_7): S808-S869.
14.Boige V, Francois E, Blons H, et al. 387P – Maintenance treatment with cetuximab versus observation in RAS wild-type metastatic colorectal cancer: Final results of the randomized phase II TIME-PRODIGE 28 UNICANCER study. Annals of Oncology. 2022; 33 (suppl_7): S136-S196.
15.Tabernero J, Yoshino T, Kim TW, et al. LBA26 – BREAKWATER safety lead-in (SLI): Encorafenib (E) + cetuximab (C) + chemotherapy (chemo) for BRAFV600E metastatic colorectal cancer (mCRC). Annals of Oncology. 2022; 33 (suppl_7): S808-S869.
16.Dasari NA, Lonardi S, GarciaCarbonero R, et al. LBA25 – FRESCO-2: A global phase III multiregional clinical trial (MRCT) evaluating the efficacy and safety of fruquintinib in patients with refractory metastatic colorectal cancer. Annals of Oncology. 2022; 33 (suppl_7): S808-S869.
ESMO 2022: НОВОСТИ ИЗ МИРА ОНКОГИНЕКОЛОГИИ
Автор: Румянцев Алексей Александрович
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России,
кандидат медицинских наук, Москва
Традиционно в сентябре 2022 года
прошел очередной ежегодный конгресс Европейского общества медицинской онкологии (ESMO). Вашему
вниманию – краткий обзор важных
обновлений.
Ингибиторы PARP (в лице
олапариба) улучшают
общую выживаемость
в первой линии терапии
BRCAm рака яичников
Вниманию широкой публики были
представлены результаты сразу
двух исследований по изучению
поддерживающей терапии олапарибом в первой линии лечения рака
яичников – SOLO1 (монотерапия
олапарибом) и PAOLA-1 (олапариб
+ бевацизумаб). Оба исследования
продемонстрировали клинически
значимое увеличение общей выживаемости (ОВ) пациентов.
В исследование SOLO1 включались
пациентки с III-IV стадиями BRCAассоциированного рака яичников.
После завершения платиносодержащей химиотерапии пациентки
рандомизировались в группу поддерживающей терапии олапарибом
300 мг 2 раза в сутки или в группу
Утяшев Игорь Аглямович
кандидат медицинских наук,
Институт онкологии Хадасса
Москва, директор отдела
клинических исследований
группы компаний «Медскан»,
Москва
плацебо. По результатам 7-летнего
наблюдения за пациентками было
отмечено увеличение ОВ в группе
олапариба – медиана ОВ не была достигнута в группе исследуемого препарата и составила 75,2 мес. в группе
плацебо (ОР 0,55; 95% ДИ 0,40-0,76;
p=0,0004). При этом необходимо отметить, что для текущего анализа
пороговым уровнем статистической
значимости было p<0,0001 [1].
В исследование PAOLA-1 включались пациентки с III-IV стадиями
рака яичников вне зависимости
от BRCA-статуса пациенток, получивших ≥2 курсов химиотерапии
с бевацизумабом [2]. Пациентки
рандомизировались в группу олапариба 300 мг 2 раза в сутки в сочетании с бевацизумабом или в
группу монотерапии бевацизумабом. Ранее в данном исследовании
было продемонстрировано значимое увеличение выживаемости без
прогрессирования (ВБП) на фоне
применения олапариба (ОР 0,59;
95% ДИ 0,49-0,72), в первую очередь
– за счет BRCA/HRD+ пациенток
(ОР 0,33; 95% 0,25-0,45). В соответствии с финальными результатами
анализа общей выживаемости в
ITT-популяции исследования медиана ОВ была сопоставимой (ОР 0,92;
p=0,4118), однако в группе пациенток с HRD-позитивными опухолями показатель 5-летней ОВ составил
65,5% в группе олапариба и бевацизумаба по сравнению с 48,4% в группе монотерапии бевацизумабом (ОР
0,62; 95% ДИ 0,45-0,85). При дальнейшем анализе было выявлено, что
в основном преимущество от применения олапариба получают пациентки с мутациями в генах BRCA1/2
(ОР 0,60; 95% ДИ 0,39-0,93).
Несмотря на то, что в соответствии
со статистическим дизайном исследования SOLO1 формальная граница статистической достоверности
для ОВ пациенток не была пересечена и требуется дальнейшее наблюдение за пациентками, по совокупности результатов вышеуказанных
исследований можно сделать вывод
о высокой клинической эффективности олапариба в первой линии
терапии рака яичников.
Пембролизумаб:
иммунотерапия эффективна
при светлоклеточных
новообразованиях женской
репродуктивной системы –
исследование PEACOCC
В данное исследование (n=48) включались пациентки с различными метастатическими светлоклеточными
опухолями женской репродуктивной
системы (рак яичников/брюшины/
маточной трубы, эндометрия, шейки матки, влагалища или вульвы), с
прогрессированием опухолевого процесса после ≥1 линии терапии. Включенным больным проводилась монотерапия пембролизумабом в дозе 200
мг в/в капельно каждый 21 день. Первичной конечной точкой исследования была 12-недельная ВБП [3].
По результатам исследования показатель 12-недельной ВБП составил
43,8%, а медианы ВБП и ОВ достигли 12,2 и 71,0 недель соответственно.
Объективный ответ на терапию был
отмечен у 12 (25%) пациенток, в т.ч.
зарегистрирован 1 случай полного ответа. Отметим, что такие результаты
были получены в категории «предлеченных» пациенток – медиана количества линий ранее проведенной
терапии составила 2 линии (от 1 до 6).
Полученные результаты, безусловно,
свидетельствует о перспективности
дальнейшего изучения иммунотерапии при светлоклеточных новообразованиях женской репродуктивной
системы – тем более, что все опухоли
этой группы характеризуются схожим «молекулярным портретом [4].
Добавление атезолизумаба
к стандартной
платиносодержащей
химиотерапии не улучшает
результаты лечения при
рецидивах рака яичников
Очередная неудача иммунотерапии
при раке яичников. Рандомизированное плацебо-контролируемое исследование III фазы ATALANTE (n=614)
было посвящено изучению эффективности применения атезолизумаба
в комбинации с химиотерапией на
основе карбоплатина и бевацизумаба.
Включались пациентки с «платиночувствительными» рецидивами (бесплатиновый интервал ≥6 мес. после
последней линии терапии) немуцинозных гистотипов заболевания, ранее получившие 1-2 линии системной
терапии. Первичной конечной точкой
исследования была ВБП, заданный
уровень статистической значимости
соответствовал p<0,025. По результатам исследования медиана ВБП составила 13,5 мес. в группе атезолизумаба
и 11,3 мес. в группе плацебо (ОР 0,83;
95% ДИ 0,69-0,99), что не соответствует критерию значимости. В популяции PD-L1-позитивных пациентов
также не было выявлено достоверных
различий [5].
Как лечить пациенток
с BRCA-ассоциированным
раком яичников после
прогрессирования на
олапарибе? Результаты
ретроспективного
исследования
Наконец, последнее исследование, о
котором хотелось бы рассказать, –
это ретроспективное исследование,
проведенное на базе НМИЦ онкологии им. Н.Н. Блохина. Результаты
исследования были представлены
на постерной сессии прошедшего
конгресса. В рамках данной работы
(n=61) была оценена эффективность
химиотерапии у пациенток с прогрессированием BRCA-ассоциированного
рака яичников после поддерживающей терапии олапарибом. По результатам исследования были сделаны
следующие выводы [6]:
• применение препаратов платины не оказывает достоверного влияния на ВБП (ОР 1,28; 95% ДИ 0,56-2,91) или ОВ (ОР 0,75; 95% ДИ 0,24-2,31) пациентов;
• применение таксанов ассоциировано с достоверным увеличением ВБП (ОР 0,47; 95% ДИ 0,25-0,86) и ОВ (ОР 0,26; 95% ДИ 0,07-0,89);
• применение бевацизумаба ассоциировано с достоверным увеличением ВБП (ОР 0,54; 95% ДИ 0,29-0,98), но не ОВ (ОР 0,46; 95% ДИ 0,17-1,20);
• назначение антрациклинов напротив приводило к ухудшению ВБП
(ОР 5,7; 95% ДИ 2,48-13,12)
и ОВ (ОР 2,57; 95% ДИ 1,02-6,51).
Естественно, данное исследование обладает всеми ограничениями, характерными для ретроспективных работ,
и к его результатам следует относиться как к гипотезо-генерирующим, однако это может предоставить ценные
сведения для лечения этой категории
пациенток.
Литература:
1. Di Silvestro P, Banerjee S, Colombo N, Scambia G, Kim BG, Oaknin A, et al. Overall survival at 7-year follow-up in patients with newly diagnosed advanced ovarian cancer and a BRCA mutation who received maintenance olaparib in the SOLO1/GOG 3004 trial. ESMO Annual Meeting 2022.
2. Ray-Coquard I, Leary A, Pignata S, Cropet C, González-Martín A, Bogner G, et al. Final overall survival results from the Phase III PAOLA-1/ENGOT-ov25 trial evaluating maintenance olaparib plus bevacizumab in patients with newly diagnosed advanced ovarian cancer. ESMO Annual Meeting 2022.
3. Kristeleit R, Clamp A, Gourley C, Roux R, Devlin MJ, Nirsimloo R, et al. Efficacy of Pembrolizumab Monotherapy for Advanced Clear Cell Gynaecological Cancer: Phase II PEACOCC Trial. ESMO Annual Meeting 2022.
4. Haribhakti N, Elliott A, Walker P, Marks EI, El-Deiry WS, Kurzrock R, et al. Genomic analysis of clear cell carcinoma. J Clin Oncol. 2022; 40 (16_suppl): 5548- 5548.
5. Kurtz JE, Pujade-Lauraine E, Oaknin A, Belin L, Rodrigues M, de Gregorio N, et al. A randomized, double-blinded, phase III study of atezolizumab versus placebo in patients with late relapse of epithelial ovarian, fallopian tube, or peritoneal cancer treated by platinumbased chemotherapy and bevacizumab. GINECO-OV236b/ENGOT-ov29. ESMO Annual Meeting 2022.
6. Rumyantsev A, Tyulyandina A,
Glazkova E, Pokataev I, Tjulandin S.
Efficacy of various anticancer agents
after failure of maintenance olaparib: A
retrospective study. Annals of Oncology.
2022; 33 (suppl_7): S235-82.
ESMO 2022: МЕЛАНОМА И ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ КОЖИ
Автор: Утяшев Игорь Аглямович
кандидат медицинских наук, Институт онкологии Хадасса Москва,
директор отдела клинических исследований группы компаний «Медскан», Москва
На прошедшем с 9 по 13 сентября
2022 года в Париже ежегодном онкологическом конгрессе ESMO 2022
были представлены результаты ключевых клинических исследований
по меланоме и злокачественным
опухолям кожи. Среди них следует
особо выделить те, которые смогут
изменить текущую практику ведения пациентов со злокачественными
опухолями кожи.
Неоадъювантное
применение
пембролизумаба (пембро)
при III и IV стадии меланомы
кожи (МК) значительно
улучшает безрецидивную
выживаемость (БРВ)
Sapna P. Patel из MD Anderson Cancer
Center, США, представила результаты рандомизированного клинического исследования (КИ) II фазы
SWOG S1801 [1]. В исследование
были включены 313 пациентов с
операбельной МК III или IV стадии,
которых случайным образом распределяли в две группы. Пациентам
в первой группе сразу проводили
радикальную операцию с последующим проведением 18 циклов адъювантной терапии пембро 200 мг,
1 раз в 21 день. Во второй группе
пациентам перед удалением опухолевых очагов проводили три цикла
неоадъювантной терапии пембро по
той же схеме и еще дополнительно 15
циклов иммунотерапии пембро уже
после операции. Основной целью
исследования была бессобытийная
выживаемость (БСВ), при анализе
которой учитывали прогрессирование заболевания или нежелательные
явления, приведшие к невозможности выполнить операцию или начать адъювантную терапии в течение
12 недель после операции, а также
рецидив меланомы после операции
или смерть пациента по любой причине. При медиане наблюдения в 14,7
мес. 2-летняя ВБС в группе пациентов, получавших пембро до и после
операции, составила 72%, а в группе
получавших пембро только после
операции – 49%, отношение рисков
(ОР) 0,58, 95% ДИ 0,39-0,87, p=0,004.
Результаты по общей выживаемости пока предварительные, но из 36
смертей 14 зафиксировали в группе
неоадъювантного и адъювантного
применения пембро и 22 – в группе
только адъювантного применения
пембро. ОР смерти составило 0,63,
95% ДИ 0,32-1,24, p=0,18 в пользу
неоадъювантного применения пембро. Прогрессирование или рецидив
заболевания выявили у 20% (n=31)
пациентов в группе неоадъювантной
терапии и у 40% (n=61) в группе адъювантной терапии. Частота НЯ, связанных с лечением, была одинаковой
в обеих группах. Неоадъювантная терапия пембро не увеличивала частоту НЯ в периоперационном периоде.
По данным локальных гистологических исследований, у 21% пациентов
в группе неоадъювантной терапии
пембро был зафиксирован полный
патоморфологический ответ.
Результаты исследования исследование SWOG S1801 являются хорошей
иллюстрацией механизма противоопухолевого иммунного ответа,
индуцируемого терапией ингибиторами контрольных точек (ИКТ)
анти-PD-1/анти-PD-L1 моноклональными антителами (мАТ). Для
формирования противоопухолевого ответа на иммунотерапию ИКТ
требуется тесный контакт между
существующими противоопухолевыми Т-лимфоцитами и клетками опухоли, который происходит в ее
микроокружении. Однако при радикальной операции, вместе с удалением опухоли, en block удаляют
и все ее микроокружение, включая
те самые необходимые для формирования противоопухолевого иммунного ответа инфильтрирующие
опухоль Т-лимфоциты (TIL). Применение анти-PD-1 мАТ перед операцией стимулирует формирование
более эффективного противоопухолевого иммунного ответа за счет
большой популяции Т-лимфоцитов
в микроокружении опухоли. Таким
образом, после удаления опухоли в
организме пациента остается большее количество противоопухолевых
Т-лимфоцитов, уничтожающих потенциально существующие микрометастазы.
Сама идея неоадъювантного применения ИКТ в лечении операбельной
МК и ее подтверждение результатами КИ в ближайшее время изменит тактику лечения пациентов
с операбельной меланомой III и IV
стадии, расширив показания для неоадъювантного применения ИКТ.
Неоадъювантное применение ИКТ
позволяет на ранних этапах терапии
оценивать резистентность пациента
к ИКТ путем анализа глубины патоморфологического ответа удаленной
опухоли и решать вопрос о целесообразности продолжения терапии
ИКТ уже в адъювантном режиме.
Особый интерес в неоадъювантном
применении ИКТ вызывает использование препаратов этой группы перед проведением стереотаксического
облучения солитарных МК. Хотя
лучевая терапия и вызывает уменьшение количества окружающих
опухоль Т-лимфоцитов, сроки проведения неоадъювантной иммунотерапии ИКТ и выбор оптимальных
схем может улучшить результаты
стереотаксической терапии олигометастатической меланомы кожи.
5-летнее наблюдение
подтверждает преимущество
неоадъювантного
применения онколитического
вируса T-VEC при
операбельной меланоме
III и IV стадии
Reinhard Dummer из University
Hospital Zurich, Швейцария, представил обновленные 5-летние результаты многоцентрового, рандомизированного открытого КИ II
фазы, в котором оценивали роль онколитического вирусного препарата
T-VAE (талимоген лагерпарепвек)
в качестве адъювантной терапии в
сравнении с только хирургическим
лечением операбельной меланомы
IIIB-IVM1a стадий [2].
В исследовании приняли участие 150
пациентов, которых случайным образом распределяли в одну из двух
групп в соотношении 1:1. Основными критериями включения в исследование были наличие как минимум
одного опухолевого очага, расположенного на коже, внутрикожно или
в лимфоузле и подходящего для внутриопухолевого введения препарата,
удовлетворительное общее состояние пациента (ECOG≤1), уровень
ЛДГ для пациентов с IIIB/C, не превышающий 1,5 нормы, у пациентов
с IVM1a стадией – не выше верхней
границы нормы. Стратификацию
проводили по стадии заболевания
и наличию показаний к проведению
адъювантной терапии.
Пациентам в первой группе перед
операцией выполняли 6 внутриопухолевых инъекций T-VEC, пациентам
во второй группе выполняли только
хирургическое вмешательство. В исследование были включены особые
популяции пациентов с МК: IIIB стадия с транзиторными метастазами,
IIIC стадия только с метастазами в
лимфоузлы и IIIC стадия с транзиторными метастазами в сочетании с
метастазами в лимфоузлы. Большинство пациентов как в группе T-VEC,
так и в контрольной группе ранее уже
оперировали (93,4% и 89,2% соответственно), часть пациентов до включения в исследование получали лучевую
терапию (5,3% и 6,8%) или системную
терапию (5,3% и 4,1%).
Основной целью исследования был
анализ БРВ, определяемой как время от рандомизации до наступления
одного из следующих событий: появление первого местного рецидива, появление первого регионарного
или отдаленного метастаза, смерть
пациента, выход из исследования до
операции и R1/R2 резекция опухоли.
Пятилетняя БРВ составила 22,3% у
пациентов, получавших T-VEC плюс
хирургическое вмешательство, по
сравнению с 15,2% в контрольной
группы (только операция), при этом
ОР рецидива составило 0,76, 80% ДИ
0,60-0,97 в пользу неоадъювантной терапии препаратом T-VEC.
Пятилетняя бессобытийная выживаемость также была значительно выше
в группе пациентов, получавших
T-VEC: 43,7% по сравнению с 27,4% в
группе только хирургического лечения (ОР 0,57; 80% ДИ 0,43-0,76). Пятилетняя ОВ в группе T-VEC составила
77,3%, а в группе только хирургического лечения – 62,7% (ОР 0,54; 80%
ДИ 0,36-0,81).
Пациенты, участвующие в исследовании, в последующем получали противоопухолевую терапию,
включавшую адъювантную иммунотерапию, иммунотерапию метастатических форм заболевания, химиотерапию или таргетную терапию
с лучевой терапией или без нее или
только лучевую терапию. В группе
T-VEC + операция любую последующую противоопухолевую терапию
получали 54,8% больных, а в группе
только хирургического лечения таких было 78,3%. Эти данные могут
свидетельствовать о том, что преимущество в общей выживаемости
при использовании T-VEC в неоадъювантном режиме было достигнуто
не последующей системной терапией, а именно препаратом T-VEC.
Результаты исследования подтверждают эффективность применения
T-VEC в неоадъювантном режиме
у пациентов с определенными подтипами операбельной меланомой
кожи IIIB-IVM1a стадий, имеющих
опухолевые очаги, подходящие для
внутриопухолевого введения препарата. При этом в сравнении с другими методами неоадъювантной
терапии операбельной меланомы
кожи T-VEC обладает, пожалуй, самой минимальной токсичностью. И
вновь неоадъювантное применение
противоопухолевой иммунотерапии
свидетельствует о высокой эффективности этого подхода в терапии
операбельной меланомы IIIB-IVM1a
стадии, что в ближайшее время изменит парадигму лечения операбельных форм этой опухоли.
Циркулирующая опухолевая
ДНК – новый предиктор
прогрессирования меланомы
Georgina V. Long из Melanoma
Institute Australia представила результаты анализа циркулирующей
опухолевой ДНК (цоДНК), полученной перед проводимой адъювантной иммунотерапией ниволумабом (ниво) или комбинацией
ниволумаба (ниво) и ипилимумаба
(ипи) у пациентов с МК IIIB-D/IV
стадий, и ее связи с риском рецидива заболевания [3]. Анализ цоДНК
до лечения проводили в совокупности с другими клиническими
и молекулярно-биологическими
факторами прогноза. Этот анализ
был выполнен в рамках двойногослепого международного многоцентрового рандомизированного
КИ III фазы CheckMate 915, в котором принимали участие пациенты
с операбельной IIIB-D/IV стадией
МК. 1833 пациента случайным образом распределяли в одну из двух
групп. Пациенты первой группы
после операции получали ниво в
дозе 240 мг каждые 2 недели в комбинации с ипи в дозе 1 мг/кг каждые 6 недель. Пациенты во второй
группе после операции получали
ниво в дозе 480 мг каждые 4 недели. Адъювантную терапию в обеих
группах проводили до года. Основной целью был анализ БРВ у всех
пациентов, включенных в исследование. Дополнительной целью был
анализ БРВ у пациентов с уровнем
экспрессии PD-L1 в опухоли менее
1%. Непосредственные результаты этого исследования оказались
негативными – комбинированная
иммунотерапия ипи с ниво не продемонстрировала преимуществ
перед иммунотерапией ниво в монорежиме в улучшении БРВ ни в
общей популяции, ни в популяции
пациентов с уровнем экспрессии
PD-L1 менее 1%, что, вероятно, обусловлено малоэффективным режимом применения ипилимумаба
(1 мг/кг каждые 6 недель) [4]. Однако в процессе его проведения от пациентов получали образцы плазмы
крови и опухолевую ткань перед
операцией. После хирургического
лечения у пациентов получали образцы плазмы на 13-й и 19-й неделях адъювантной иммунотерапии.
В анализ цоДНК вошли образцы
плазмы и опухоли 1127 пациентов
(61% от всех больных, включенных
в исследование CheckMate 915), получивших адъювантную терапию.
Анализ индивидуальных мутаций
в образцах опухолевой ткани каждого конкретного пациента с помощью полногеномного секвенирования позволил разработать панели
пациент-специфических генетических тестов. Эти индивидуальные
генетические профили использовали для выявления в плазме крови пациента цоДНК, специфичную
именно для его опухоли. ЦоДНК
выявили у 16% больных (95% ДИ
14-18%). Основные характеристики 1127 пациентов, у которых
проводили анализ цоДНК, были
идентичны характеристикам всех
1833 пациентов, включенных в исследование. Частота выявления
цоДНК была немного выше при более высокой подстадии III стадии
(при IIIB стадии – 11% [35/333],
при IIIC стадии – 18% [110/596],
при IIID стадии – 41% [13/32]), а
также у пациентов с более высоким статусом по ECOG. При этом
корреляции между частотой выявления цоДНК с другими характеристиками опухоли, включая суммарную мутационную опухолевую
нагрузку (TMB), PD-L1 или BRAF
статус опухоли, не выявлено. БРВ
и выживаемость пациентов без
отдаленных метастазов в случае
выявления в плазме крови цоДНК
была значительно ниже. ОР прогрессирования составило 1,87 (95%
ДИ 1,48-2,36). ОР отдаленных метастазов составило 2,86 (95% ДИ
1,90-4,30).
Выявление цоДНК в плазме крови
коррелировало с ранним прогрессированием заболевания, особенно
в первые 3 месяца после операции.
При выявлении цоДНК 13-недельная БРВ составила 72,3% (95% ДИ
65-78,3) против 91,7% (95% ДИ
89,7-93,3) у пациентов без цоДНК.
12-месячная БРВ составила 58,4%
(95% ДИ 50,7-65,3) против 75,1%
(95% ДИ 72,1-77,8), а 24-месячная
БРВ – 45,5% (95% ДИ 37,9-52,8)
против 65,4% (95% ДИ 62,1-68,4)
соответственно.
Поскольку основная цель исследования CheckMate 915 не была достигнута, авторы не увидели различий в прогностическом значении
цоДНК между обеими терапевтическими группами (ипи+ниво
против ниво). Авторы также провели анализ предиктивной роли
цоДНК в совокупности с другими
опухолевыми биомаркерами: мутационной опухолевой нагрузкой
(TMB статус) и экспрессией ИФНгамма. Прогностическое значение
этих трех факторов вместе (наличие в плазме циркулирующей опухолевой ДНК, TMB и экспрессия
ИФН-гамма) оказалось намного
выше. Многофакторный анализ
комбинации этих биомаркеров позволил выделить 8 подгрупп, позволяющих точнее предсказывать
прогрессирование заболевания.
Наилучший прогноз с минимальным риском прогрессирования
меланомы был у пациентов с высоким уровнем экспрессии ИФНгамма в опухоли, высоким уровнем
мутационной нагрузки в опухоли и
отсутствием цоДНК перед операцией.
На сегодняшний день это исследование цоДНК в плазме крови
с помощью NGS секвенирования
опухолевого образца после радикальной резекции является крупнейшим по оценке прогностического значения этого биомаркера
при адъювантной терапии меланомы кожи.
Комбинация ипи+ниво
в адъювантном режиме
увеличивает общую
и безрецидивную
выживаемость при
радикально пролеченной
меланоме IV стадии [5]
Несмотря на то, что основная цель
исследования III фазы CheckMate 915
так и не была достигнута и комбинированная адъювантная иммунотерапия по схеме ниво 240 мг 1 раз в 2 недели + ипи 1 мг/м2 1 раз в 6 недель не
показала преимуществ в отношении
БРВ и выживаемости без отдаленных
метастазов по сравнению с моноиммунотерапией ниво в дозе 480 мг каждые 4 недели у пациентов с резецированной меланомой кожи IIIB-D/IV
стадий [6], интерес к адъювантному
применению комбинации ипи+ниво
сохраняется.
Dirk Schadendorf из University Hospital
Essen, Германия, представил финальные результаты двойного-слепого, плацебо-контролируемого
клинического исследования II фазы
IMMUNED, одновременно с публикацией этих данных в журнале The
Lancet [7]. Эти данные свидетельствуют о значительном улучшении БРВ и
ОВ при назначении комбинированной иммунотерапии уже по другой
схеме ипи 3 мг/кг + ниво 1 мг/кг, 1 раз
в 21 день в адъювантном режиме у пациентов с высоким риском рецидива
после радикального удаления метастазов с помощью операции или стереотаксической радиохирургии при
IV стадии меланомы по сравнению
моноиммунотерапией по схеме ниво
3 мг/кг, 1 раз в 14 дней или с плацебо.
Первичной целью исследования был
анализ БРВ.
При медиане наблюдение в 49,2 мес.
БРВ была выше у пациентов, получавших в адъювантном режиме комбинированную иммунотерапию по схеме
ипи+ниво или моноиммунотерапию
ниволумабом по сравнению с плацебо. Медиана БРВ в группе ипи+ниво
не была достигнута, в группе ниво составила 12,3 мес., а в группе плацебо
достигла 6,3 мес. соответственно. ОР
рецидива для комбинации ипи+ниво
против плацебо составило 0,25 (95%
ДИ 0,13-0,48), для моноиммунотерапии ниво против плацебо – 0,60 (95%
ДИ 0,36-1,00). Четырехлетняя БРВ
составила 64,2% в группе ипи+ниво,
31,4% в группе ниво и 15,0% в группе плацебо соответственно. Преимущество от назначения комбинированной иммунотерапии по схеме
ипи+ниво в улучшении БРВ в сравнении с плацебо сохранялось для всех
подгрупп пациентов, вне зависимости
от возраста, пола, подстадии IV стадии, экспрессии PD-L1, BRAF и NRAS
статуса опухоли или наличия предшествующей радиотерапии. БРВ в группе ипи+ниво значительно превосходила БРВ в группе монотерапии ниво.
ОР рецидива составило 0,41 (95% ДИ
0,22-0,78) в пользу ипи+ниво. Эта разница сохранялась для всех проанализированных подгрупп пациентов.
Медиана ОВ не была достигнута ни
в одной из трех групп: 4-летняя ОВ в
группе ипи+ниво составила 83,8%, в
группе ниво – 72,6%, а в группе плацебо – 63,1% соответственно. ОР смерти
было достоверным только для группы ипи+ниво против плацебо – 0,41
(95% ДИ 0,17-0,99). Преимущество от
проведения адъювантной иммунотерапии комбинацией ипи+ниво по
сравнению с плацебо в виде увеличения ОВ наблюдали во всех анализируемых подгруппах пациентов.
Нежелательные явления (НЯ) 3-4
степени наблюдали у 71% пациентов
в группе ипи+ниво и у 29% в группе
ниво. Прерывание терапии из-за НЯ
потребовалось у 53% пациентов в
группе ипи+ниво, у 9% в группе ниво
и всего у 2% в группе плацебо.
Результаты исследования IMMUNED
уже нашли свое отражение в практических рекомендациях по лечению
меланомы кожи от NCCN и RUSSCO
2021, где пациентам после радикальной операции или стереотаксической
лучевой терапии при IV стадии меланомы кожи рекомендовано проведение комбинированной иммунотерапии по схеме ипи+ниво. Тем не
менее, в будущем нам еще предстоит
определить оптимальный режим применения этой комбинации с учетом
высокой частоты НЯ 3-4 степени CTC
AE. При этом не следует забывать
негативные результаты рандомизированного исследования III фазы
Check Mate 915, в котором одной из
основных причин негативных результатов стала низкая доза ипи (1 мг/
кг) и уменьшенная частота (1 раз в 6
недель) его применения. Отдельный
интерес заслуживает самая прогностически неблагоприятная подгруппа
пациентов с радикально пролеченным олигометастатическим поражением головного мозга.
TIL-терапия –
высокоэффективный
метод лечения пациентов с
метастатической меланомой
кожи, спрогрессировавших
на иммунотерапии антиPD-1 моноклональными
антителами [8]
John B.A.G. Haanen из The Netherlands Cancer Institute представил результаты рандомизированного клинического исследования III фазы, в котором сравнивали эффективность TILтерапии с терапией ипилимумабом у пациентов с метастатической МК, спрогрессировавших на иммунотерапии анти PD-1 мАТ. TIL-терапия (от англ. tumorinfiltrating lymphocytes) – это метод клеточной терапии, суть которого состоит в том, чтобы после биопсии опухолевого очага выделить из него субпопуляцию инфильтрирующих опухоль лимфоцитов (TIL-клеток), простимулировать их размножение с помощью цитокинов in vitro и затем, после немиелоаблятивной лимфодеплеции, ввести внутривенно обратно пациенту, с последующим внутривенным введением высоких доз ИЛ-2. Введенные пациенту обратно TIL-клетки распознают опухоль и уничтожают ее. В исследование было включено 168 пациентов с неоперабельной IIICIV стадиями МК, получивших не более одной линии предшествующей терапии анти PD-1 мАТ и спрогрессировавших на ней. Пациентов случайным образом распределяли 1:1 в одну из двух групп: TIL-терапия 5×109 – 2×1011 или ипи 3 мг/кг, 1 раз в 21 день, всего 4 введения. Основной целью исследования был анализ выживаемости без прогрессирования (ВБП) по оценке исследователя. Медиана времени без прогрессирования у пациентов, получавших TIL-терапию, составила 7,2 мес. (95% ДИ 4,2-13,1), против 3,1 мес. (95% ДИ 3,0-4,3) в группе пациентов, получавших ипи. В группе пациентов, получавших TIL, ЧОО составила 48,8%, а частота полных ответов 20,2%. При этом ЧОО в группе ипи составила только 21,4%, с частотой полных ответов в 7,1%. Анализ ОВ также показал преимущество TIL терапии, хотя исследование не было спланировано таким образом, чтобы продемонстрировать разницу в ОВ (не хватило мощности, поэтому данные статистически недостоверны). Медиана ОВ в группе TIL составила 25,8 мес. (95% ДИ 18,2-НД), а в группе ипи – 18,9 мес. (95% ДИ 13,8-32,6). Результаты исследования свидетельствуют о снижении риска прогрессирования заболевания или смерти на 50% у больных, получивших TIL-терапию. НЯ 3 и 4 степени наблюдали у всех пациентов (100%), получавших TIL-терапию. В группе ипи НЯ 3 и 4 степени встречались у 57,3% пациентов. Причиной большинства НЯ в группе TIL стали обязательные компоненты этого метода лечения – лимфодеплеция, вызванная циклофосфамидом и флударабином, или введение высоких доз интерлейкина-2 после введения TIL пациенту. Эти НЯ полностью заканчивались к моменту выписки пациента из стационара и после этого уже не повторялись. Качество жизни пациентов, получавших TIL, было выше, чем у пациентов, получавших ипи, эта тенденция сохранялась даже спустя год после проводимого лечения. Это первое рандомизированное контролируемое КИ по применению клеточной терапии при солидном раке, наглядно показавшее ее преимущество по БРВ и ОВ перед стандартной терапией. Клеточная терапия в будущем может стать новым стандартом лечения пациентов с метастатической меланомой. Особенно интересно оценить возможности комбинированного применения TIL в сочетании с ингибиторами контрольных точек, причем не только при меланоме, но и при других солидных опухолях. Это исследование служит еще одной иллюстрацией механизма противоопухолевого иммунного ответа на терапию ИКТ. Одним из объяснений эффективности TIL у пациентов, которые ранее не ответили на терапию анти-PD-1 мАТ, является то, что развитие резистентности к ИКТ происходит не за счет самой опухоли, а за счет ее микроокружения. Именно поэтому реактивация противоопухолевых лимфоцитов путем их извлечения из естественного опухолевого микроокружения и последующая модификация TIL in vitro способны вызывать столь впечатляющий противоопухолевый ответ. Следует отдельно подчеркнуть, что исследование выполнялось без какой бы то ни было поддержки фармацевтических компаний и было исключительно академическим. Все нидерландские центры, которые принимали в нем участие, производили TIL на базе своих собственных лабораторий. Этот факт говорит о высокой воспроизводимости этого метода клеточной противоопухолевой иммунотерапии.
Неоадъювантная
иммунотерапия
семиплимабом вызывает
полный ответ у половины
пациентов с операбельным
плоскоклеточным раком
кожи II-IV стадии [9]
Neil Gross из MD Anderson Cancer
Center, США, представил результаты нерандомизированного
исследования II фазы, в котором пациентам с операбельным
плоскоклеточным раком кожи
(ПКРК) II-IV стадии проводили
неоадъювантную иммунотерапию
анти-PD-1 мАТ семиплимабом. В
это одногрупповое исследование
включили 79 пациентов из США,
Австралии и Европы. Пациенты в
течение 12 недель перед операцией получали четыре дозы неоадъювантного семиплимаба в дозе 350
мг каждые 3 недели с последующей
радикальной операцией. Основной целью исследования был анализ патоморфологического ответа
в послеоперационном опухолевом
материале. Все 4 запланированные
дозы семиплимаба получили 62
пациента (78,5%). Часть пациентов
дополнительно получала адъювантную лучевую терапию. 84,8%
пациентов были мужчинами,
средний возраст пациентов составил 73 года, 87,3% пациентов были
белыми, у 91,9% пациентов первичной локализацией ПКРК была
голова и шея. Стадии ПКРК были
распределены следующим образом: II стадия – 6,3%, III стадия –
48,1%, IV стадия без отдаленных
метастазов – 45,6%. 70 пациентам
удалось выполнить операцию. Из
9 пациентов, которым операцию
не выполнили, 3 пациента от нее
отказались, поскольку опухоль
перестала определяться клинически и методами лучевой диагностики. 2 пациента досрочно выбыли из исследования, поскольку не
соблюдали процедуры исследования, у 2 пациентов было выявлено
прогрессирование заболевания,
еще у 2 возникли НЯ.
С помощью клинического осмотра
и инструментальной визуализации у 6,3% пациентов перед операцией установили полный ответ,
а общая частота объективных ответов составила 68,4%. Еще у 20%
пациентов перед операцией была
диагностирована стабилизация
заболевания. Таким образом, по
данным клинических и инструментальных методов визуализации контроль над заболеванием
был достигнут у 89% пациентов.
При этом независимый пересмотр
послеоперационного гистологического материала выявил, что у
50,6% пациентов был достигнут
полный патоморфологический
ответ. Еще у 12,7% пациентов по
данным независимого патоморфологического пересмотра операционного материала наблюдался выраженный патоморфологический
ответ – выявлено менее 10% жизнеспособных опухолевых клеток.
Частота патоморфологических
ответов (полных и выраженных)
таким образом составила 63,3%.
Таким образом, оценка ответа на
лечение с помощью методов клинической и инструментальной
визуализации не коррелировала с
патоморфологическим ответом.
Анализ биомаркеров выявил у
56 пациентов корреляцию между
экспрессией PD-L1 в опухоли и
частотой полных патоморфологических ответов. При экспрессии
PD-L1≥1 частота полного патоморфологического ответа составляла
54%, а ЧОО 76%, при уровне экспрессии PD-L1<1 частота полного
патоморфологического ответа составляла всего 20%, а ЧОО 47%. У
50 пациентов удалось определить
мутационную нагрузку опухоли
(TMB). При TMB >58,5 мутаций/
мегабазу частота полного патоморфологического ответа составляла 56%, а ЧОО 80%, при TMB
<58,5 мутаций/мегабазу частота
полного патоморфологического
ответа составляла уже 20%, а ЧОО
лишь 56%.
НЯ, связанные с лечением, любой
степени тяжести наблюдали у 72%
пациентов, среди них чаще всего
была утомляемость (28%), макулопапулезная сыпь (14%) и диарея
(11%). Иммуноопосредованные
НЯ возникали в 15% случаев, в
том числе иоНЯ 3 степени – в 4%.
В целом НЯ 3-4 степени тяжести
наблюдали у 14 пациентов (17,7%).
На сегодняшний день результаты
этого исследования демонстрируют самую высокую частоту патоморфологических ответов среди
всех солидных опухолей после
неоадъювантной иммунотерапии
анти-PD-1 мАТ в монорежиме.
Эти данные позволят в ближайшее время изменить подход не
только к терапии распространенных форм ПКРК, но и к выбору
методов клинической и инструментальной оценки эффективности иммунотерапии этой опухоли.
Применение ИКТ в предоперационном периоде позволит избежать
калечащих операций и проведения лучевой терапии, нередко
приводящих к существенным косметическим и функциональным
дефектам при распространенных
формах ПКРК. Поиск эффективных биомаркеров, предсказывающих ответ на иммунотерапию
ПКРК, также улучшит результаты
лечения.
100% контроль над
заболеванием при
назначении комбинации
ипи+ниво в первой линии
системной терапии
диссеминированной
карциномы Меркеля [10]
Карцинома Меркеля – редчайшая
опухоль кожи, с крайне высоким
метастатическим потенциалом.
Текущим стандартом лечения пациентов с диссеминированной
карциномой Меркеля является
терапия анти-PD-1/PD-L1 мАТ,
однако лишь половина пациентов
отвечает на это лечение. Sungjune
Kim из H Lee Moffitt Cancer, США,
представил результаты исследования II фазы по применению
комбинации ипилимумаба и ниволумаба у пациентов с диссеминированной карциномой Меркеля.
В исследование включили 50 пациентов с неоперабельной диссеминированной карциномой
Меркеля. Пациентов случайным
образом распределяли в соотношении 1:1 в одну из двух групп.
В первой группе пациенты получали комбинированную иммунотерапию по схеме: ниво 240 мг в/в
капельно каждые 2 недели + ипи
1 мг/кг в/в капельно 1 раз в 6 недель. Пациенты во второй группы
получали комбинацию ипи+ниво
по той же схеме, но в сочетании со
стереотаксической лучевой терапией (СЛТ) в общей дозе 24 Гр за
3 фракции на 2-й неделе терапии.
В каждой группе были как ранее
получавшие анти-PD-1/PD-L1 ингибиторы, так и ранее нелеченые
пациенты. 52% пациентов ранее
получали ИКТ – пембролизумаб
или авелумаб. Лечение проводили
до прогрессирования или непереносимой токсичности. Основной
целью исследования был анализ
ЧОО.
Медиана наблюдения за пациентами составила 14,6 мес. Медиана
продолжительности жизни без
прогрессирования не была достигнута в группе пациентов, ранее не
получавших ИКТ, независимо от
проведения СЛТ. У пациентов с
предшествующей терапией ИКТ
медиана продолжительности
жизни без прогрессирования составила 4,2 мес. для группы получивших только комбинацию
ипи+ниво и 2,7 мес. у пациентов,
у которых комбинированная иммунотерапия ипи+ниво была дополнена СЛТ. У всех 100% (n=22)
пациентов, не получавших ранее
анти-PD-1/PD-L1 ингибиторы, вне
зависимости от лечебной группы
был зафиксирован ответ на лечение комбинацией ипи+ниво, из
них у 41% был зафиксирован полный ответ. Из 26 пациентов, ранее
уже получавших терапию антиPD-1/PD-L1 ингибиторами, у 8
пациентов (31%) отмечен был объективный ответ на лечение, из них
у 4 пациентов (15%) зафиксирован
полный ответ. Медиана продолжительности ответа у пациентов, ранее не получавших ИКТ,
не была достигнута, у пациентов,
уже получавших ИКТ, она составила 10,8 мес. Медиана общей продолжительности жизни в группе
пациентов, не получавших ранее
ИКТ (вне зависимости от СЛТ),
не была достигнута. При этом в
группе пациентов, которые ранее
получали ИКТ, медиана общей
продолжительности жизни составила 14,9 мес. в группе только комбинированной иммунотерапии
ипи+ниво и 9,7 мес. в группе комбинированной иммунотерапии
ипи+ниво в сочетании со СЛТ. Частота НЯ, связанных с лечением,
3-й или 4-й степени была сопоставима в обеих группах пациентов: в
группе ипи+ниво – 40%, в группе
ипи+ниво+СЛТ – 32% соответственно. НЯ были обусловлены
главным образом комбинированной иммунотерапией ипи+ниво,
поскольку специфические НЯ
СЛТ наблюдали крайне редко.
Применение комбинации
ипи+ниво в первой линии диссеминированной карциномы Меркеля IIIB-IV стадии вызывает высокую частоту объективных ответов.
Эта комбинация может стать новой опцией терапии у пациентов,
не ответивших на стандартное
лечение, особенно у пациентов, не
получавших ранее иммунотерапию ИКТ. Комбинация ипи+ниво
может стать новым стандартом и
в первой линии терапии при распространенной карциноме Меркеля. Однако для рутинного применения комбинации ипи+ниво
необходимы дополнительные
клинические исследования с
большей выборкой пациентов и
большей медианой наблюдения,
хотя, учитывая орфанный характер этого заболевания, набрать в
рандомизированное клиническое
исследование большее количество
пациентов будет очень непросто.
Большое количество сопутствующих заболеваний у пациентов пожилого возраста, которые являются основными носителями этого
заболевания в популяции, также
осложнят проведение КИ III фазы.
Источники указаны на сайте:
https://www.rosoncoweb.ru/news/
oncology/2022/10/24/
Ксанди
Энзалутамид

ESMO 2022: ПЕРСПЕКТИВНЫЕ И НОВЫЕ НАПРАВЛЕНИЯ В ТЕРАПИИ САРКОМ
Автор: Титова Татьяна Александровна
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России,
кандидат медицинских наук, Москва
Саркомы – редкие, орфанные заболевания. Каждое клиническое
исследование, посвященное этой
нозологии, заслуживает пристального внимания, так как сопряжено с трудностями набора
пациентов и требует экспертного
уровня работы команды исследователей. Поиск новых мишеней
терапии, схем лечения, внедрение их в рутинную клиническую
практику является важной задачей особенно для этой группы
больных.
Рассказывая о конгрессе ESMO
2022 года, в частности, о саркомах
мягких тканей (СМТ), ловишь
себя на ощущении, что в этом
году трабектидин является самым
изучаемым препаратом для этой
нозологии. Два исследования,
представленные на конгрессе в
2022 году, посвящены изучению
эффективности этого препарата
при СМТ и одно было опубликовано в Lancet Oncology в августе
2022 года.
Эффективность трабектдина в
монотерапии в условиях реальной клинической практики оценена в исследовании YON-SAR
[1]. В работу включено 128 пациентов с различными гистологическими подтипами СМТ (лейомиосаркома – 35,2%, липосаркома
– 18,0%, недифференцированная
плеоморфная саркома – 15,6% и
другие). Важным аспектом исследования является включение в работу не только СМТ конечностей
(31,3%), но и забрюшинной локализации (24,2%), что встречается достаточно редко. В большинстве
случаев трабектидин был назначен во вторую (51,6%) и третью
(19,5%) линию терапии. Частота
объективного ответа составила
11,7% при контроле роста опухоли
в 45,3%. Терапия трабектидином
позволила достигнуть медианы
ВБП в 5,2 мес. при медиане ОВ в
15,2 мес. (рис.1).
Рисунок 1.
Результаты исследования YON-SAR [1]
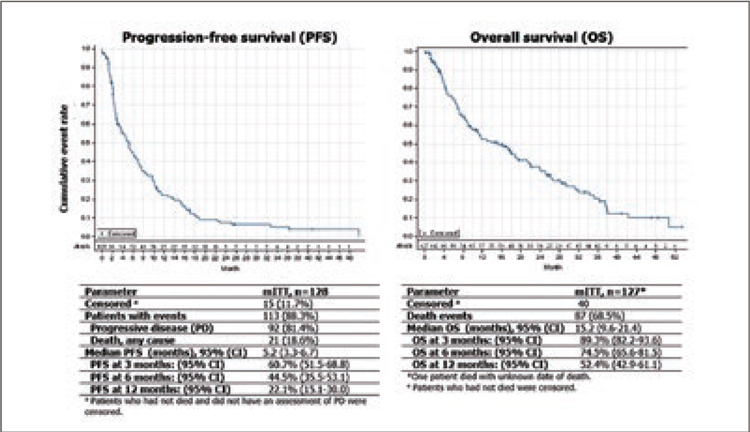
В исследовании 1/2 фазы SAINT [2]
изучалась комбинации ипилимумаба, ниволумаба и трабектидина
в первой линии терапии лейомиосарком. В работу было включено
26 пациентов, анализ эффективности терапии был проведен у 19
больных. При медиане времени
наблюдения в 17,0 мес. частота регистрации объективного ответа
составила 31,6% (2 полных ответа,
4 частичных), при контроле роста
опухоли в 89,5%. Медианы ВБП и
ОВ достигли 7,4 мес. и 36,1 мес. соответственно (рис.2). Токсичность
лечения была оценена у 26 пациентов, нежелательные явления 3-4
степени преимущественно были
представлены слабостью (7,7%),
анемией (7,7%), тромбоцитопенией (3,8%), нейтропенией (3,8%), нарушением функции щитовидной
(3,8%) железы повышением уровней АЛТ (19%), АСТ (7,7%) и ЩФ
(3,8%).
Рисунок 2.
Результаты исследования SAINT [2]
В августе 2022 года в Lancet Oncology опубликованы результаты важного и интересного исследования 3 фазы LMS-04 [3], посвященного изучению эффективности доксорубицина в комбинации с трабектидином в сравнении с монотерапией доксорубицином в первой линии лекарственного лечения лейомиосарком. Ранее результаты были представлены на конгрессе ESMО 2021 г. В исследование было рандомизировано 150 пациентов (1:1). При медиане времени наблюдения 36,9 и 38,8 мес. добавление трабектидина к доксорубицину позволило увеличить медиану ВБП с 6,2 мес. до 12,2 мес. (ОР 0,41; 95% ДИ 0,29-0,58; p<0,0001, рис.3). Нежелательные явления 3 степени и выше в группах доксорубицина и доксорубицина с трабектидином зарегистрированы у 71 (96%) и 39 (52%) пациентов и были преимущественно представлены нейтропенией (13% и 80%), анемией (5% и 31%), тромбоцитопенией (0 и 47%) и фебрильной нейтропенией (9% и 28%).
Рисунок 3.
. График
выживаемости без
прогрессирования [3]
Добавление авелумаба (анти-PD-L1) к регорафенибу не привело к значимым успехам в лечении
СМТ в поздних линиях терапии.
В исследование 2 фазы [4] было
включено 49 пациентов, ранее которым проведено 2 и более линии
лекарственной терапии (63,3%),
в том числе с включением антрациклинов (93,9%). В большинстве
случаев опухоли были представлены лейомиосаркомами (44,9%).
Добавление авелумаба к регорафенибу позволило достигнуть медианы ВБП в 2,1 мес. при медиане
ОВ в 15,1 мес. (рис.4). Скромные
результаты и фактические сопоставимые с монотерапией регорафенибом.
Рисунок 4.
Результаты терапии авелумабом и регорафенибом
при СМТ
В исследовании SAKK 57/16 [5],
результаты которого кажутся на
первый взгляд крайне скромными, изучалась эффективность
наб-паклитаксела в комбинации с гемцитабином при СМТ.
Но исследование достигло своей первичной конечной точки, а
именно 3-месячная ВБП – более
40%. В работу было включено 39
больных, в большинстве случаев
гистологические подтипы СМТ
были представлены лейомиосаркомами (35,9%), липосаркомами
(25,6%) и недифференцированными плеоморфными саркомами
(17,9%). Частота объективного ответа составила 10,1%. Пре медиане
времени наблюдения в 26,4 мес.
3-месячная ВБП достигла 56,4%
(рис.5). Нежелательные явления 3
степени и выше преимущественно
были представлены нейтропенией
(15,4%).
Рисунок 5.
Результаты исследования SAKK 57/16 [5]
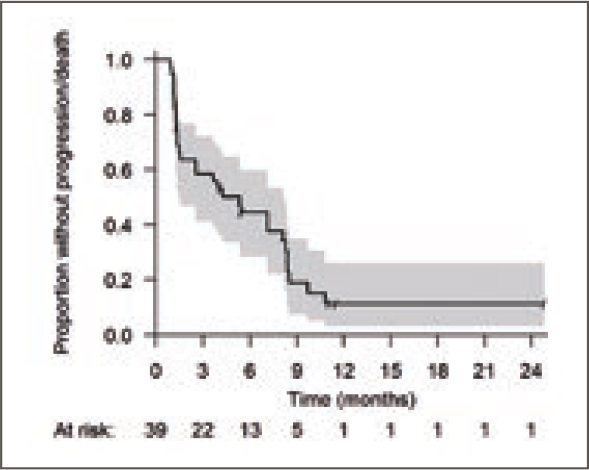
Десмоидные фибромы (ДФ) – редкая патология соединительной ткани. Спектр лекарственных
препаратов эффективных при ДФ
ограничен, а эффективность низкая.
Нирогацестат – селективный низкомолекулярный ингибитор гамма-секретазы. На конгрессе ESMO 2022 представлены результаты исследования 3 фазы [6], демонстрирующие высокую эффективность нирогацестата при ДФ. В исследование было включено 142 пациента с ДФ, которые были рандомизированы (1:1) в две лечебные группы – нирогацестат и плацебо (n=72). Терапия нирогацестатом позволила увеличить медиану ВБП (ОР 0,29; 95% ДИ 0,15-0,55; p<0,001). Эффективность нирогацеcтата не зависела от пола, наличия мутации в генах APC и CTNNB1, локализации опухоли и предшествующей терапии (рис.6).
Рисунок 6.
Выживаемость без прогрессирования в группах нирогацестата и плацебо при десмоидных фибромах [6]
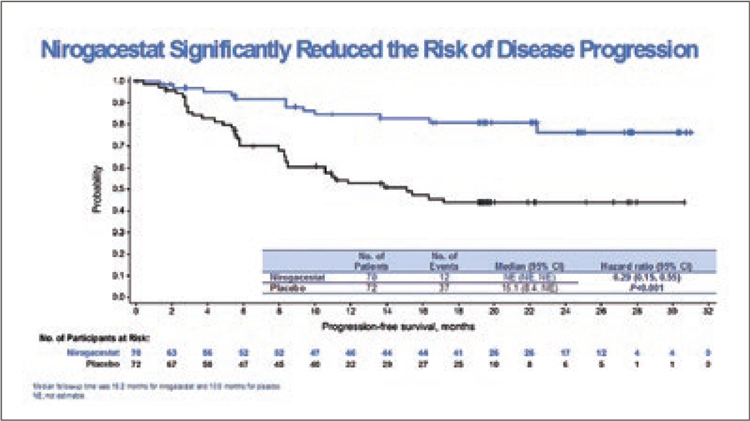
В исследовании было показано,
что нирогацестат позволяет достигнуть ОО у 41% пациентов
против 8% в группе плацебо. Нежелательные явления любой степени были зарегистрированы у
100% пациентов в группе нирогацестата и у 96% в группе плацебо,
а НЯ 3 степени и выше – у 57% и
17% соответственно. НЯ ≥3 степени в группах были представлены
диарей (16% и 1%), тошнотой (1% и
0%), слабостью (3% и 0%), гипофосфатемией (3% и 0%), сыпью (6% и
0%) и стоматитом (4% и 0%).
Источники:
1. Viktor Gruenwald, et al. 1496P – Trabectedin for patients with advanced soft tissue sarcoma: A noninterventional, prospective, multicenter study. Annals of Oncology. 2022; 33 (suppl_7): S681-S700. 10.1016/ annonc/annonc1073.
2. Erlinda Gordon, et al. 1483O – Results of a phase I/II combination regimen with ipilimumab (I), nivolumab (N) and trabectedin (T) as first line therapy for advanced leiomyosarcoma. Annals of Oncology. 2022; 33 (suppl_7): S681-S700. 10.1016/annonc/annonc1073.
3. Patricia Pautier, et al. Doxorubicin alone versus doxorubicin with trabectedin followed by trabectedin alone as first-line therapy for metastatic or unresectable leiomyosarcoma (LMS-04): a randomised, multicentre, open-label phase 3 trial. The Lancet Oncology. August 2022. Vol.23, Issue 8, P.1044-1054.
4. Sophie Cousin, et al. 1494P – Regomune – a phase II study of regorafenib + avelumab in solid tumors: Results of the soft tissue sarcoma (STS) cohort. Annals of Oncology. 2022; 33 (suppl_7): S681-S700. 10.1016/ annonc/annonc1073.
5. Antonia Digklia, et al. SAKK 57/16 nab-paclitaxel and gemcitabine in soft tissue sarcoma (NAPAGE): Final results from the phase Ib/II trial with >2y median follow up Annals of Oncology. 2022; 33 (suppl_7): S681-S700. 10.1016/annonc/annonc1073.
6. Bernd Kasper, et al. LBA2 – DeFi:
A phase III, randomized controlled
trial of nirogacestat versus placebo
for progressing desmoid tumors
(DT). Annals of Oncology. 2022;
33 (suppl_7): S808-S869. 10.1016/
annonc/annonc1089.
ЗНАКОМЬТЕСЬ: РЕГИОНАЛЬНОЕ ОТДЕЛЕНИЕ RUSSCO УЛЬЯНОВСКОЙ ОБЛАСТИ
Региональное отделение RUSSCO,
как и большинство подобных отделений, было организовано в
2011 году под руководством заведующей тогда еще единственного
отделения химиотерапии к.м.н.
Людмилы Алексеевны Даниловой. На тот момент состав был
представлен только несколькими
врачами-химиотерапевтами, а
также единичными представителями других специальностей.
В настоящее время региональное
отделение насчитывает 42 члена
общества, в ГУЗ областной клинический онкологический диспансер г.Ульяновска и ФГБУ ФНКЦ
МРиО в г.Димитровграде, и это
22 онколога-химиотерапевта, 7
радиотерапевтов, 10 хирургов, 3
организатора здравоохранения, из
них 1 доктор медицинских наук,
профессор И.И.Антонеева, 9 кандидатов наук, 1 заслуженный врач
РФ. Большинство представителей
регионального отделения – молодые онкологи в возрасте до 40 лет.
В настоящее время председателем
регионального отделения является Наталья Владимировна Деньгина, врач-радиотерапевт, к.м.н.,
член Правления RUSSCO с 2014
года.
Онкологическая служба
Ульяновской области: от
ранней диагностики до
высоких технологий
Онкологическая служба Ульяновской области была организована в 1945 году, когда впервые было открыто онкологическое отделение на базе существующей областной больницы, а также выделены койки в шести центральных районных больницах. На момент открытия диспансера стационарная база учреждения составляла 30 коек хирургического и радиологического отделений. Амбулаторный приём вёлся по пяти врачебным специальностям. В настоящее время государственное учреждение здравоохранения Областной клинический онкологический диспансер – современное лечебное учреждение для оказания специализированной, в том числе высокотехнологичной медицинской помощи пациентам со злокачественными новообразованиями. Он является центром организации всей онкологической службы в регионе.
Члены регионального отделения RUSSCO, г.Ульяновск

Учреждение располагает стационаром круглосуточного пребывания на 360 коек, состоящим из 6
хирургических отделений (абдоминальная, торакальная хирургия,
маммологическое, гинекологическое, урологическое и отделение
хирургии ОГШ), 3 отделений лекарственной противоопухолевой
терапии, дневного стационара на
185 коек, радиологического отделения, отделения анестезиологии-реанимации, пяти диагностических
подразделений (рентгеновского,
патолого-анатомического, отделения радионуклидной диагностики,
цитологической и клинико-диагностической лабораторий). На базе
радиологического отделения с 2020
года функционирует Центр Томотерапии «R-Spei», один из первых
проектов государственно-частного партнерства, реализованных на
территории Ульяновской области.
Амбулаторно-поликлиническая
база представлена консультативной поликлиникой на 180 посещений в день и Центром здоровья
женщин на 105 посещений в день.
Ежегодно в Ульяновском онкологическом диспансере обслуживается
более 110 тысяч пациентов. На диспансерном учёте онкологической
службы Ульяновской области состоит более 34 тысяч человек.
Учреждение имеет стабильный
кадровый состав высококвалифицированных специалистов.
В диспансере работает 116 врачей,
из них 1 доктор медицинских наук,
профессор, 17 кандидатов медицинских наук. Численность врачей за 10 лет увеличилась на 30%,
диспансер регулярно пополняется
молодыми кадрами. Высшую квалификационную категорию имеют более 30% врачей и более 70%
медицинских сестер. За последнее
время врачами диспансера освоены самые современные методики
лечения, за год более 1200 пациентов получают высокотехнологическую медицинскую помощь.
С 1994 года диспансер является
клинической базой кафедры онкологии и лучевой диагностики
Ульяновского государственного
университета, она была основана
профессором Модниковым О.П.
Ежегодно более 600 студентов проходят обучение на базе кафедры.
Первичная доврачебная помощь в
регионе осуществляется в 83 смотровых кабинетах. Первичную специализированную медицинскую
помощь пациенты получают в 31
первичном онкологическом кабинете. В регионе работают 2 Центра
амбулаторной онкологической помощи, планируется открытие ещё 6
ЦАОПов до 2024 года.
Паллиативная медицинская помощь онкологическим пациентам
оказывается в ГУЗ Ульяновский
областной Хоспис, который имеет
в своём составе стационар на 35
коек, и в учреждениях первично
медико-санитарной помощи, имеющих койки сестринского ухода
(270 коек).
«Школа ранней диагностики,
лечения и реабилитации»
С 2014 года ГУЗ Областной клинический онкологический диспансер
реализует проект «Школа ранней
диагностики новообразований и
предопухолевых заболеваний для
медицинских работников». Данный
проект включает в себя стажировку
медицинских работников первичной сети на рабочем месте в онкологическом диспансере (специалисты
первичных онкологических кабинетов, гинекологи, участковые терапевты, оториноларингологи, стоматологи, медицинские работники со
средним специальным образованием и др.), не менее 50 специалистов
ежегодно; теоретические семинары по онкологии для медицинских
работников первичного звена,
организационно-методические мероприятия с освещением нормативных документов и подведением итогов работы на днях онколога. Для
первичной лечебной сети были разработаны методические рекомендации по профилактике и раннему
выявлению злокачественных новообразований, в том числе по онкологическому компоненту при диспансеризации взрослого населения.
В настоящее время образовательный проект для врачей первичного
звена носит название «Школа ранней диагностики, лечения и реабилитации», к реализации проекта
подключены специалисты Института медицины, экологии и физической культуры Ульяновского государственного университета.
Заседание Школы пациентов

«Школа пациентов»
С 2009 года специалисты ГУЗ Областной клинический диспансер
вместе с активистами общественных пациентских организаций
проводят «Школы пациентов».
За эти годы «Школа пациентов»
стала регулярно действующим и
востребованным проектом среди онкологических пациентов, их
близких и врачей. Школы проводятся 1 раз в месяц. На них выступают врачи – специалисты
областного диспансера, юристы,
представители социальных служб,
психологи. Участники «Школ пациентов» получают возможность
узнать от практикующих врачей,
специалистов об особенностях
злокачественных опухолей и познакомиться с передовыми методами лечения. Юристы во время
занятий помогают разобраться
пациентам в правах на гарантированное оказание медицинской
помощи. Не менее важным блоком «Школы пациентов» является
участие медицинского психолога, который подсказывает больным
и их близким, как не сломаться,
выстоять и бороться с заболеванием. Пациенты, их родственники
и близкие могут задать вопросы
специалистам и получить компетентные ответы.
Вместе с участниками «Школ пациентов» и активистами общественных пациентских организаций региона специалисты ГУЗ
Областной клинический онкологический диспансер реализуют программы по реабилитации
пациентов с онкологическими
заболеваниями. Пациентам, перенесшим лечение, доступно бесплатное посещение бассейнов,
ЛФК, театров, выставок.
«Модниковские Чтения»
С 2004 г. в Ульяновской области
проводится научно-практическая
конференция «Модниковские
Чтения» в память выдающегося учёного и врача, основателя
кафедры онкологии и лучевой
диагностики Ульяновского государственного университета, профессора, доктора медицинских
наук, заслуженного деятеля науки
Российской Федерации, академика РАЕН, профессора Олега Павловича Модникова.
Организаторами конференции
традиционно выступают Ульяновский государственный университет и Областной клинический
онкологический диспансер. В
партнёрах конференции - Министерство здравоохранения Ульяновской области, Ассоциация
содействия развитию здравоохранения «Медицинская Палата
Ульяновской области», Ассоциация онкологов России; Казанская
государственная медицинская
академия - филиал ФГБОУДПО
«Российская медицинская академия непрерывного профессионального образования» Министерства здравоохранения РФ,
Профессор С.А.Тюляндин
на семинаре по лекарственному
лечению НМРЛ,
январь 2016 года, Ульяновск

ФГБУ ФНКЦ МРиО ФМБА России, Ассоциация онкологических
учреждений Приволжского федерального округа, Российская ассоциация паллиативной медицины.
В октябре 2022 года проведена уже
XVII научно-практическая конференция «Модниковские Чтения»
в смешанном формате. В работе
конференции приняло участие
более 200 человек: врачи, преподаватели, клинические ординаторы,
студенты. В программе конференции были представлены доклады о
современных подходах к скринингу и диагностике злокачественных
новообразований, возможностях
противоопухолевого лечения и
реабилитации пациентов, цифровизации в онкологии.
Акция «Книготерапия», Ульяновск, 2 ноября 2022 года

Конференция «Модниковские чтения» 2022 г.

Региональное отделение регулярно взаимодействует с RUSSCO в
различных направлениях. Практически ежегодно проводятся
тематические семинары и вебинары RUSSCO на базе ГУЗ ОКОД
г.Ульяновска с участием ведущих
онкологов России. Так, 24 мая
2013 года был проведен семинар
Отечественной Школы Онкологов и RUSSCO «Таргетная терапия злокачественных опухолей»,
22 января 2016 года – семинар
«Лекарственная терапия немелкоклеточного рака легкого» с
участием председателя общества
С.А.Тюляндина и профессора
К.К.Лактионова, 14 мая 2018 года
– семинар «Опухоли ЖКТ», 20
мая 2019 года – семинар «Лекарственное лечение рака молочной
железы», 10 сентября 2020 года (в
период ковида) – вебинар «Опухоли головы и шеи» в режиме онлайн
совместно со специалистами ГБУЗ
ТО «Тверской областной клинический онкологический диспансер»,
22 апреля 2022 года - «Первичные
и метастатические мягкотканные
саркомы: современные представления о диагностике и лечении».
Врачи диспансера, в том числе и
члены регионального отделения
общества, принимали активное
участие не только как слушатели,
но и были активными участниками - представляли доклады и клинические примеры, кроме того,
доктора и медицинские сестры регулярно участвуют в конференциях RUSSCO и Российском онкологическом конгрессе, как в очном,
так и онлайн формате, в том числе
и с докладами.
Семинар «Опухоли ЖКТ» с участием д.м.н. А.А.Трякина,
д.м.н. М.Ю.Федянина, май 2018 года, Ульяновск



2 ноября в Ульяновске состоялась
очередная благотворительная акция RUSSCO с участием российских писателей. С утра детский
писатель Анна Гончарова и главный редактор портала «Книжное
обозрение» Александр Набоков
посетили областную детскую
больницу, где пообщались с детьми, проходящими там лечение в
онкологическом отделении. Писатель провела интерактивную
встречу с ребятами и их родителями и вместе с представителями
RUSSCO передала комплекты своих книг в дар лечебному учреждению. Позже общение продолжилось в областном онкологическом
диспансере. Авторы выразили надежду, что подобные мероприятия
найдут свое продолжение и в других городах России, где у RUSSCO
есть отделения.
Семинар по мягкотканным саркомам, апрель 2022 г.

Трудно переоценить значение
организационно-методической
помощи Общества для врачей
диспансера. С 2012 года Клинические рекомендации RUSSCO,
которые стали настольной книгой
всех врачей диспансера и, обновляемые ежегодно, по-прежнему
пользуются огромной популярностью. Председатель регионального
общества Н.В.Деньгина входит в
состав авторов ряда клинических
рекомендаций, а также с 2021 года
является главным редактором
официальной газеты RUSSCO и
сайта rosoncoweb.ru.
Реалии ковидной эры: вебинар RUSSCO «Опухоли головы и шеи»
с д.м.н. И.С.Романовым

На протяжении нескольких лет
ГУЗ ОКОД участвовал в Программе молекулярно-генетического
тестирования RUSSCO, и это была
хорошая возможность сделать исследование на мутации бесплатно
и получить ценнейшую информацию, благодаря которой пациенты
со злокачественными новообразованиями легкого, молочной и
предстательной желез, яичников,
колоректальным раком, меланомой могли целенаправленно получить самую современную и наиболее эффективную лекарственную
терапию.

БУДУЩИЕ ВОЗМОЖНОСТИ ТЕРАПИИ ПАЦИЕНТОВ С МЕСТНО-РАСПРОСТРАНЕННЫМ И МЕТАСТАТИЧЕСКИМ УРОТЕЛИАЛЬНЫМ РАКОМ
Рак мочевого пузыря характеризуется высокой злокачественностью,
его метастатическая форма – плохим прогнозом. В 2020 году в РФ
было зарегистрировано 15 292 новых больных раком мочевого пузыря (РМП), а всего под наблюдением находились 118 624 пациента
с этим заболеванием [1]. Большинство новых случаев РМП выявляется на ранних стадиях, однако
более 70% пациентов прогрессируют после хирургического лечения.
Выживаемость без прогрессирования у больных метастатической
формой заболевания после проведенной химиотерапии 1 линии составляет менее 1 год. Только около
5% пациентов имеют срок жизни
более 5 лет после возникновения
метастазов. Ежегодно в РФ от РМП
умирают более 6 000 пациентов [1].
Схемы лечения метастатического
и нерезектабельного РМП основаны на платиносодержащих схемах,
новых препаратов не появлялось
несколько десятилетий. Согласно
эпидемиологическим данным, в
мире только около 50% пациентов
могут перенести режим на основании цисплатина. Проблемой применения цисплатинсодержащей
химиотерапии является химиорезистентность опухоли. Отсутствие
эффекта от использования препаратов платины может достигать
50%. Даже достигаемые в 50–60%
объективные ответы при использовании платиносодержащих схем
химиотерапии скоротечны, в первый год прогрессирование происходит у 70% больных. Во 2-й линии
терапии после прогрессирования
на препаратах платины могут быть
использованы ингибиторы контрольных точек (пембролизумаб и
др.), но и они позволяют получить
объективный ответ лишь у 25% пациентов, а общая выживаемость
(ОВ) пациентов не превышает 1
года [2]. В 3-й линии терапии для
пациентов с РМП на сегодняшний
момент в РФ не существует одобренных схем терапии [3].
В декабре 2019 года FDA предоставило ускоренное одобрение препарату энфортумаб ведотин для
пациентов с РМП, которые ранее
получили ингибитор PD-1 или PDL1 и платиносодержащую химиотерапию. 9 июля 2021 года Управление по контролю за продуктами
и лекарствами (FDA) одобрило энфортумаб ведотин (Padcev, Astellas
Pharma, США, Inc.), конъюгат
антитела, направленного на Нектин-4, и ингибитора микротрубочек для взрослых пациентов с
местно-распространенным или
метастатическим раком мочевого
пузыря, которые:
• ранее получали ингибитор рецептора запрограммированной смерти-1 (PD-1) или лиганда запрограммированной смерти (PDL1) и химиотерапию, содержащую платину, или
• имели противопоказания к химиотерапии, содержащей цисплатин, и ранее получали одну или
несколько предшествующих линий
терапии [4].
Исследование EV-301 (NCT03474107)
было открытым рандомизированным многоцентровым исследованием, необходимым для подтверждения
клинической пользы ускоренного
одобрения препарата 2019 года. В
этом исследовании приняли участие
608 пациентов с местно-распространенным или метастатическим раком
мочевого пузыря, которые ранее получали ингибитор PD-1 или PD-L1 и
химиотерапию на основе платины.
Пациенты были рандомизированы
(1:1) для получения либо энфортумаба ведотин (EV) 1,25 мг/кг в 1, 8
и 15-й дни каждого 28-дневного
цикла или химиотерапии одним из
препаратов по выбору исследователя (доцетаксел, паклитаксел или
винфлунин).
Первичной конечной точкой эффективности была общая выживаемость (ОВ), ключевыми вторичными конечными точками
эффективности были выживаемость без прогрессирования (ВБП)
и частота объективного ответа
(ЧОО), оцененными исследователем с использованием критериев
RECIST 1.1. При первичном промежуточном анализе данных по
достижении 65% запланированных
событий было отмечено достоверное увеличение ОВ: медиана ОВ составила 12,9 месяцев (95% ДИ: 10,6,
15,2) для пациентов в группе энфортумаба (n=301) по сравнению
с 9,0 месяцами для пациентов, получающих химиотерапию (n=307)
(95% ДИ: 8,1, 10,7) (ОР 0,70; 95%
ДИ: 0,56, 0,89; р=0,0014). Медиана
ВБП составила 5,6 месяца (95% ДИ:
5,3, 5,8) по сравнению с 3,7 месяцами (95% ДИ: 3,5, 3,9) соответственно (ОР 0,62; 95% ДИ: 0,51, 0,75;
р<0,001). Частота объективного ответа составила 40,6% (95% ДИ: 34,9,
46,5) против 17.9% (95% ДИ: 13,7,
22,8), соответственно (р<0,001) [5].
Эффективность энфортумаба у
пациентов, имеющих противопоказания к химиотерапии, содержащей цисплатин, была оценена
в когорте 2 исследования EV-201
(NCT03219333), одногруппового,
многокогортного международного исследования у 89 пациентов
с местно-распространенным или
метастатическим раком мочевого
пузыря, которые ранее получали
ингибитор PD-1 или PD-L1 и имели
противопоказания к химиотерапии, содержащей цисплатин. Первичной конечной точкой эффективности была подтвержденная ЧОО,
оцененная независимой комиссией
в слепом режиме, а ключевой вторичной конечной точкой эффективности была продолжительность
ответа. Подтвержденная ЧОО составила 51% (95% ДИ: 39,8, 61,3), в
том числе 22% с полными ответами,
а средняя продолжительность ответа составила 13,8 месяца (95% ДИ:
6,4, не поддается оценке). Результаты анализа эффективности в других
когортах данного исследования будут представлены позднее [6].
Наиболее распространенными побочными реакциями, включая лабораторные нарушения (≥20%),
были сыпь, повышение аспартатаминотрансферазы, повышение глюкозы, повышение креатинина, усталость, периферическая нейропатия,
снижение лимфоцитов, алопеция,
снижение аппетита, снижение гемоглобина, диарея, снижение натрия,
тошнота, зуд, снижение фосфата,
дисгевзия, повышение аланинаминотрансферазы, анемия, снижение
альбумина, снижение нейтрофилов,
повышение урата, повышение липазы, снижение тромбоцитов, снижение веса и сухость кожи [5,6].
В USPI было добавлено предупреждение о серьезных кожных
реакциях, включая синдром Стивенса-Джонсона и токсический
эпидермальный некролиз, а также
предупреждение о пневмоните [7].
В настоящее время препарат энфортумаб ведотин проходит процедуру
регистрации в Российской Федерации и его одобрение ожидается в
2023 году.
Литература:
1.Каприн А.Д. и соавт. Злокачественные новообразования в России в 2020 году(заболеваемость и смертность) – М.: МНИОИ им. П.А. Герцена − филиал ФГБУ «НМИЦрадиологии» Минздрава России, − 2021
2.European Association of Urology. EAU guidelines on muscle-invasive bladder cancer. Доступныпо ссылке https://uroweb.org/guidelines/muscleinvasive-and-metastatic-bladder-cancer
3.Клинические рекомендации МЗ РФ по лечению рака мочевого пузыря. Доступны поссылке https:// cr.minzdrav.gov.ru/schema/11_2
4.Сайт FDA. https://www.fda.gov/ drugs/resources-information-approveddrugs/fda-grants-regular-approvalenfortumab-vedotin-ejfv-locallyadvanced-or-metastatic-urothelialcancer
5. Powles T et al. Enfortumab Vedotin in Previously Treated Advanced Urothelial Carcinoma. N Engl J Med. 2021 Mar 25;384(12):1125-1135
6. Evan Y et al. Enfortumab vedotin after
PD-1 or PD-L1 inhibitors in cisplatinineligible patients with advanced
urothelial carcinoma (EV-201): a
multicentre, single-arm, phase 2 trial.
Lancet Oncol. 2021 Jun;22(6):872-882
7. Сайт FDA.https://www.
accessdata.fda.gov/drugsatfda_docs/
label/2021/761137s006s008lbl.pdf
АУМОЛЕРТИНИБ – НОВАЯ ОПЦИЯ В ТЕРАПИИ НЕМЕЛКОКЛЕТОЧНОГО РАКА ЛЕГКОГО C ДЕЛЕЦИЕЙ В 19 ЭКЗОНЕ (DEL19) ИЛИ ЗАМЕНЕ L858R В 21 ЭКЗОНЕ ГЕНА EGFR
Аумолертиниб – необратимый
ингибитор третьего поколения
тирозинкиназного домена рецептора эпидермального фактора
роста (EGFR). Аумолертиниб ранее уже продемонстрировал свою
эффективность у больных НМРЛ
с реаранжировками в 19 и 21 экзонах гена EGFR, в тои числе с мутацией T790M, в поздних линиях
терапии.
AENEAS – рандомизированное
исследование 3 фазы, направленное на изучение эффективности
аумолертиниба в сравнении с гефитинибом в первой линии терапии НМРЛ с делецией в 19 экзоне
или заменой L858R в 21 экзоне
гена EGFR.
Пациенты были рандомизированы в соотношении 1:1 в две лечебные группы:
• n=214 – аумолертиниб по 110 мг 1 раз в день внутрь;
• n=215 – гефитиниб по 250 мг 1
раз в день внутрь; все пациенты
получали терапию до прогрессирования заболевания или неприемлемой токсичности.
Больные были стратифицированы
в две лечебные группы в зависимости от типа мутации (делеция
в 19 экзоне vs замена L858R в 21
экзоне) и наличия метастазов в головном мозге.
Первичной конечной точкой исследования была медиана ВБП,
вторичными – медиана ОВ, частота достижения ОО и КРО, длительность ответа и токсичность
терапии.
При медиане времени наблюдения
в группе аумолертиниба в 20,5 мес.
и гефитиниба в 20,7 мес. медианы
ВБП в группах составили 19,3 и 9,9
мес. (p<0,0001), что привело к статистически значимому снижению
риска прогрессирования на 54%
(рис.1).
Рисунок 1.
Выживаемость без прогрессирования
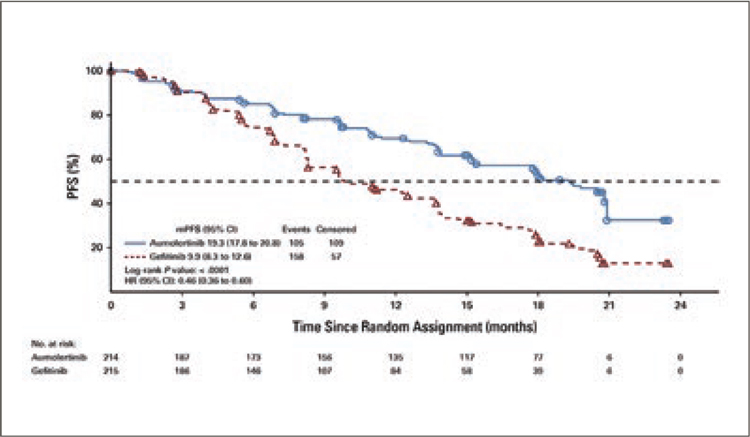
Назначения аумолертиниба в
сравнении с гефитинибом позволило увеличить 1-летнюю ВБП с
46,3% до 69,5%, а 2-летнюю ВБП – с
12,9% до 32,5%.
Высокая эффективность аумолерРисунок 1. Выживаемость без прогрессирования
тиниба в сравнении с гефитинибом не зависела от типа мутаций,
наличия метастазов в головном
мозге, пола, возраста, курения в
анамнезе и статуса ECOG (рис.2).
Рисунок 2.
Подгрупповой анализ исследования AENEAS

Таблица 1.
Подгрупповой анализ исследования AENEAS
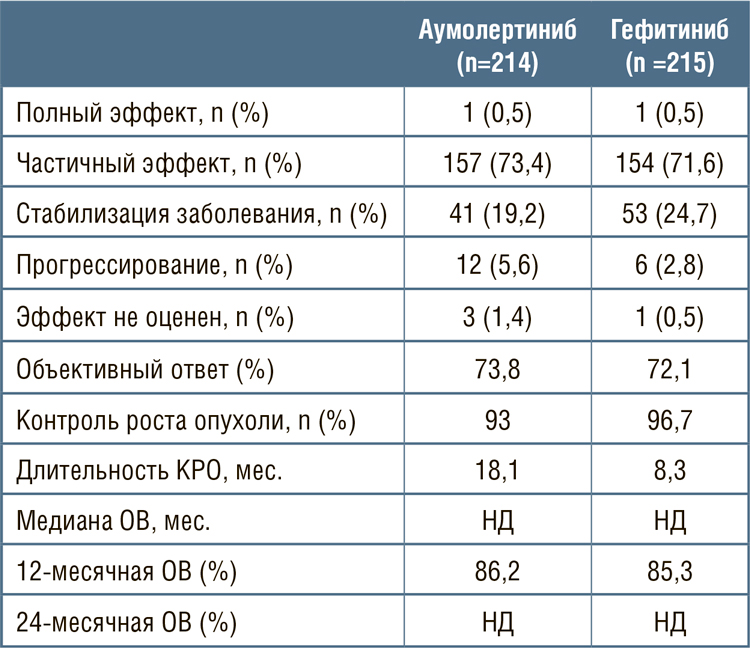
■ У пациентов с делецией в 19 экзоне гена EGFR медианы ВБП в группах аумолертиниба и гефитиниба составили 20,8 и 12,3 мес. соответственно (ОР=0,39; p<0,0001).
■ У пациентов с заменой L858R в 21 экзоне гена EGFR медианы ВБП в группах аумолертиниба и гефитиниба достигли 13,4 мес. против 8,3 мес. (ОР=0,60; p=0,0102).
■ У больных с метастазами в
головной мозг назначение
аумолертиниба позволило
увеличить медиану ВБП с 8,2
до 15,3 мес. и снизить риск прогрессирования на 62% (ОР=0,38;
p<0,0001).
НЯ любой степени зарегистрированы у 98,6% пациентов в группе
аумолертиниба и у 99,1% в группе гефитиниба, преимущественно
были представлены повышением
КФК (35,5% и 9,3%), ростом АСТ
(29,9% и 54,0%) и АЛТ (29,4% и
55,8%), сыпью (23,4% и 41,4%) и
диарей (16,4% и 35,8%) соответственно.
Восемь пациентов – пять в группе аумолертиниба и трое в группе гефитиниба – погибли на фоне
терапии не от прогрессирования
заболевания. Причинами смерти
пяти больных, получавших аумолертиниб, были остановка сердца (n=2), инсульт, кардиогенный
отек легких, и у 1 пациента точная
причина гибели не установлена.
Больные, получавшие гефитиниб,
погибли от инфекционной пневмонии (n=2), и 1 пациент совершил
самоубийство.
МУТАЦИЯ РIЗКЗСА
При раке молочной железы

ПОДМЕЧЕНО ЧЕЛОВЕКОМ
Автор: Н.В. Деньгина
главный редактор газеты RUSSCO
«Прости, тороплюсь на открытие выставки картин моего друга!» - так однажды мне оставили интригу, ссылку на веб-сайт того самого друга-художника и несколько фото из альбомов, что заставили меня желать увидеть их, картины, в реальности.
The Old House Dreams It Is Still There
(Старому дому снится, что он еще там)

Для начала - Льюис. Городок на юге Англии,
в нескольких километрах от побережья ЛаМанш, безупречно уютный, древний и до слез
умиления красивый… Думаю, за пару-тройку
часов его можно было б обежать целиком - но
не получилось бы минимум по двум причинам: наличию жемчужин вроде крепости XI
века, и дома, принадлежавшего одной из жён
Генриха VIII (того самого, про чьи женатые
похождения британцы в школе заучивают
поговорку: divorced-beheaded-died-divorcedbeheaded-survived), а также других манких местечек типа местных пабов с сопутствующим
колоритом. Анна Клевская (Anne of Cleves),
четвертая жена Генриха, немка, счастливо сохранила с ним дружеские отношения после
развода и около 13 лет прожила в Льюисе в
двухэтажном типичном английском домике
с английским садиком, где удивляет и аскетизм, и - одномоментно - уют и тишина. Представляется ныряющая в перину под одеяло с
грелкой экс-королева в более чем прохладной
спальне осеннего деревянного дома на узкой
улице старого Льюиса, пока прислуга намывает чугунки и посудины из дубленой кожи на
нижнем этаже…

Домики по соседству с королевским умиляют
ветвистым плющом и цветущими плетистыми
розами, увивающими окна и стены до самых
крыш, ухоженными английскими садиками и
тишиной, несмотря на соседство с проезжей
частью дороги.
Dead Girl Singing
(Поющая мертвая девочка)

Если углубиться от дома Анны Клевской вбок и начать нырять по льюисским холмам внизвверх - то вскоре выйдешь к прелестному
парку Grange gardens, с разбросанными там и
тут деревянными лавочками под деревьямикустами, стриженными газонами, цветами,
фонтанчиками и скульптурами. Провести половину выходного дня здесь - более чем разумная идея, и, судя по всему, многие жители
Льюиса согласны с этим. Меж тем, все дороги,
выводящие тебя из садов, продолжают нырять
вверх-вниз, демонстрировать названия домов
вместо традиционных номеров (Mead house,
Tyne house..), истёртые, но прочные камни мостовой - и живописное небо, логичное дополнение прелестнейших пейзажей.
A Lane to the Land of the Dead
(Дорога в Страну мертвых)

Мастерская художника оказалась неожиданно
маленькой и открытой для посещения любому желающему войти в неё. Две бумажки - на
полу и под потолком - со стрелками и надписью «Peter Messer» не позволят ошибиться.
Питер - центр своей маленькой вселенной -
восседает в живописном фартуке у мольберта,
но всегда рад поговорить с каждым входящим.
За 20 минут моего пребывания там посетителей было немало. В основном они перебрасываются парой слов, оглядываются и уходят,
дабы не мешать. Ухватила взором картины,
что по-прежнему в каталоге, отметила то, что
особо «торкает» и пожалела, что финансовые
возможности российского врача не позволяют
купить ни одну из них, зафиксировала взор на
книгах и черепах неведомых животных..
Итак - Peter Messer, Lewes, England

Его изюмина номер 1: Льюис, городок, улочки,
замок, потайные местечки, россыпи желтых
листьев, заснеженные (иногда) газоны, невидимые, но дописанные художником, персонажи,
которые доступны взору лишь немногих из нас
– прозрачные одежды привидений, звуки поющих ушедших, марионетки, живущие своей
жизнью, уставший ангел, присевший перекусить сэндвичем – и снова улицы Льюиса, главного места в жизни художника..
Rain God
(Бог Дождя)

«На протяжении многих лет я чувствовал легкий дискомфорт в отношении термина «местный художник». Определить художника как
«местного» все равно что назвать сыр плавленым – и только. Сейчас я пришел к пониманию
того, что «местный» отнюдь не означает «ограниченный местными рамками». Постепенно,
медленно, моя деятельность концентрировалась вокруг той короткой тропинки меж моим
домом и студией в центре Льюиса, и я осознал,
что когда одно и то же место видят множество
глаз – это круче, чем лицезреть его лишь одной
парой глаз. И я не уверен, обусловлено ли это
лишь некоей особенной магией Льюиса, или,
как многие другие художники, я дорисовываю
эту магию сам. …Этот город полон окон, через
которые я привычно пытался увидеть комнаты,
в которых мне не было места, да мне и не нужно
было быть там. Я вхожу в новые дома и смотрю в окна, которые когда-то просто миновал
бездумно. Я вижу тени, странные светящиеся
пятна, необычные камни в стенах и жестикулирующие деревья, которые могут снова стать
знакомыми при смене освещения или ветра…
Мне нравится удивляться каждодневной прелести бытия, оттенкам света, эмоций и воспоминаний. Великая удача – изумляться моменту
жизни в правильном месте».
The Lewes Fairies
(Феи Льюиса)

Изюмина номер 2: краски. Egg tempera - метод окраски пигментами, диспергированными в эмульсии, смешиваемой с водой,
обычно это яичный желток, содержащий натуральные масла. Этот метод использовался
в Европе для тонкой росписи, в основном на
деревянных панелях или тонкой коже, с 12
или начала 13 века до 15 века, когда он начал уступать место масляным краскам. Возможно, поэтому живопись Питера выглядит
столь тонко, мистически прозрачно и в то же
время насыщенно и сочно. «Краску можно
наносить пунктиром или мазками, разбрызгивать, глазировать, надрезать, соскребать,
наращивать, тонко промывать или тщательно обрабатывать. Картина закончена, когда к
ней по существу больше нечего добавить».
The Steps
(Ступени)

Shadow and Symbols in Castle Lane
(Тень и символы на на Касл Лейн)

October Evening, Castle Lane
(Октябрьский вечер на Касл Лейн)

Экстимия
Терапия полностью и в срок

ТЕХНОЛОГИИ РАБОТЫ ОНКОПСИХОЛОГА
Автор: Вагайцева Маргарита Валерьевна
Кандидат психологических наук,
ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» МЗ РФ, Санкт-Петербург
Итак, сегодня мы обсудим технологии, которые целесообразно использовать в работе онкопсихолога. Мы
уже размышляли о психологической
помощи в российской онкологии,
рассматривали клинические и поведенческие симптомы у пациента,
сообщающие о необходимости консультации психолога, и знакомились
с методами работы психолога в онкологии.
Как известно, эффективность метода зависит от набора технологий,
то есть конкретных вмешательств,
позволяющих решить врачебную
задачу относительно жалобы пациента. То, что во врачебной практике
представлено как объективированная жалоба пациента, в психологии
называют запросом. Анализ запроса в той или области применения
практической психологии позволяет
сформулировать общую программу психологической интервенции,
в рамках которой будут сформированы индивидуальные программы
психологической коррекции, реабилитации или психологического
сопровождения онкологических пациентов.
Например, при первом посещении
пациент описывает врачу субъективные жалобы. Врач в ходе исследования субъективных жалоб
формирует объективное представление о симптоме. Также человек
на приеме психолога предъявляет
первичный (субъективный) запрос,
а психолог в беседе-исследовании
объективирует картину переживания и помогает сформировать вторичный (подлинный) запрос, исходя
из рабочей гипотезы об эмоциональном состоянии пациента. В обычной
психологической практике формирование и перепроверка запроса являются задачами нескольких первых
сессий.
В зависимости от направления психологической помощи стандартной
психологической практики условно
здоровых людей в дальнейшем могут проводиться исследования особенностей обратившегося. Для этого
на установочном (диагностическом)
этапе могут применяться функциональные пробы, различные тесты,
анализируя которые психолог строит программу плановой коррекции.
Затем следует самый длительный
этап психотерапевтической интервенции – коррекционный. На этом
этапе технологии коррекции зависят от метода, в котором проводится
интервенция. Завершает плановое
взаимодействие этап закрепления
результатов и подведения итогов,
его называют оценочным. Все этапы
предполагают от нескольких до нескольких десятков встреч.
Исследования показывают, что психотерапия (в самом общем ее смысле) в ситуации онкологического заболевания имеет свои выраженные
особенности. В первую очередь здесь
востребованы технологии короткого
и сверхкороткого подходов. В прошлый раз мы уже говорили о цели
и задачах в работе онкопсихолога.
Как же онкопсихологи решают поставленные задачи за одну, три или
пять консультаций? Рассмотрим соотношение этапов и применяемых
технологий в условиях единственной
встречи.
Первое знакомство в нашей работе
совпадает с установочным и коррекционным этапами. Элементы
интервенции распределяются в зависимости от остроты реактивного
эмоционального состояния пациента, его личностных особенностей
и гипотетического срока встреч.
Например, пациент на радиологическом лечении может планировать
более длительное посещение психолога, тогда как пациент, получающий
хирургическое лечение, часто ограничен во времени.
Консультация онкопсихолога всегда начинается с проведения клинико-психологической беседы (КПБ).
В ходе КПБ методом наблюдения
специалист составляет себе представление о личности пациента,
восприятии пациентом ситуации
заболевания, которая удобнее всего
укладывается в описание «отношение к болезни».
Термин «отношение к болезни» был
сформулирован советским психиатром, профессором, доктором
медицинских наук Андреем Евгеньевичем Личко. В свою очередь,
исходя из концепции основателя ленинградской школы психотерапии
Владимира Николаевич Мясищева,
советского психиатра и медицинского психолога, исследователя проблем
человеческих способностей и отношений, член-корреспондента АПН
СССР, отношение к болезни есть
часть отношений, формирующих
личность индивида.
Задачей этапа первой, а иногда и
каждой встречи пациента с онкопсихологом становится диагностика эмоционального, когнитивного
и мотивационно-поведенческого
компонентов отношения к болезни
у пациента. Выявленная в ходе клинико-психологической беседы направленность отношения к болезни
обуславливает потенциальную длительность психокоррекционных мероприятий. На данном этапе следует
помнить, что предикторами эмоционального неблагополучия у онкологических пациентов являются более
молодой возраст, а также негативное
субъективное восприятие изменений, обусловленных болезнью.
Наблюдения показывают, что онкологические пациенты в условиях
острой и переходящей в хроническую психотравмирующей ситуации
носящего непредсказуемый характер заболевания (дистресс) крайне
восприимчивы к воздействию и не
всегда нуждаются в продолжительной психокоррекционной работе.
При выявлении в первичной диагностической беседе дезадаптивных
тенденций отношения к болезни целесообразно оговаривать с пациентом программу троекратных встреч
в рамках краткосрочного подхода.
В онкопсихологии чаще всего проводятся индивидуальные психологические консультации. В случае
групповой работы предполагается
проведение открытой группы психологической помощи. Открытой
называют группы с произвольным
наполнением участников – пациентов любой онкологической нозологии, находящихся на любом этапе
заболевания. Наполнение открытой
группы в онкопсихологии не должно
превышать 10 человек. Оптимальное
наполнение – 6 человек. Время ведения группы обычно не превышает 90
минут. Опыт проведения трехчасовой открытой группы предполагает
внестационарные встречи. Как правило, встречи вне стационара проводятся вне лечебного учреждения.
Рассмотрим психокоррекционные
технологии индивидуальной консультации. Это опрос (КПБ), в результате которого специалист принимает
решение о применении кризисной
интервенции либо психологического
сопровождения. Кризисная интервенция применяется в случае выявления сильного и сверхсильного
реактивного эмоционального напряжения пациента. Реактивным называется состояние обратимое и не нарушающее способность пациента к
критичной коммуникации. В случае
выявления острых или подострых
психотических проявлений целесообразно назначать медикаментозную
коррекцию. Медицинские психологи
не выписывают рецепты. Для назначения медикаментозной поддержки
пациенту необходимо обратиться
к врачу-психотерапевту. Задача онкопсихолога – корректно информировать пациента о важности такого
обращения.
К технологиям кризисной интервенции относят: терапевтическое
активное слушание, вербализацию
эмоционального состояния, называние и нормализацию чувств, утилизацию негативных переживаний,
формулирование проблемы; информирование; представление техник
саморегуляции. Перечисленные технологии требуют профессиональной
подготовки специалиста именно в
направлении оказания экстренной
психологической помощи. Основной
трудностью взаимодействия с пациентом в состоянии сверхсильного
эмоционального напряжения становится потенциальное индуцирование (заражение) специалиста, что
может приводить к вторичной травматизации самого психолога.
Еще одной фрустрирующей особенностью психологического сопровождения онкологических пациентов
является непредсказуемость временной перспективы встреч. В связи с
этим экспресс-оценка эффективности воздействия является завершением каждой сессии, а не отдельным
этапом коррекционной работы. К
психокоррекционным технологиям
этого этапа относят: формирование
конструктивного убеждения относительно нормативности реагирования
на происходящее; обсуждение сессии; обсуждение актуального чувства пациента; формирование плана
встреч; обсуждение ближайших планов лечения пациента с оцениванием
в позитивном ключе «все настолько
хорошо, насколько это возможно в
данных условиях».
Таким образом, онкопсихолог должен уметь в ходе единственной
встречи оказать психологическую
помощь. Чаще всего в рамках сверхкороткого подхода встреча так и
остается единственной. О том, чем
обусловлена такая краткость, мы
подробнее поговорим в следующей
статье.
В случае, если пациент настроен и
имеет возможность перейти к краткосрочной плановой работе (до
5 встреч), мы переходим к установочному этапу психокорреционной
программы. На данном этапе с пациентом оговаривается план посещений от 3 до 5 раз с возможным обоснованным продлением количества
встреч. Более детально формируется
запрос пациента, который, как правило, носит смешанный характер
и состоит из формирования навыков саморегуляции психического и
физического состояния в условиях
заболевания и осознавания себя в
условиях тяжелого хронического заболевания и изменений, связанных
с ним. Психокоррекционные технологии установочного этапа: релаксация; направленное воображение
(визуализация); внутренний диалог;
дифференциация чувств и переживаний; осознание функциональности
базовой тревоги; освоение способов
утилизации негативных переживаний (телесный, нарративный); оценка эффективности воздействия.
Следует помнить, что применение
кризисной интервенции может быть
востребовано при каждой встрече.
Выбор технологий осуществляет
специалист в зависимости от наблюдаемого эмоционального состояния
пациента.
При выявлении расширенного запроса пациента предусматривается
расширенный коррекционный этап
психокоррекционной программы.
На данном этапе с пациентом формируется план дополнительных 5
дальнейших посещений. Пересматривается запрос пациента, который
чаще смещается из области формирования навыков саморегуляции
психического и физического состояния в условиях заболевания в область экзистенциальных вопросов.
На этом этапе программы для пациентов и членов их семей становится
актуальным улучшение навыков
коммуникативной компетентности.
При работе с пациентами на разных
стадиях паллиативного этапа характерным запросом родственников
пациентов становится эффективная
коммуникация с неизлечимо больным пациентом, чувство «вины выжившего», обсуждение различного
спектра эмоциональных реакций в
связи с неизлечимостью пациента.
На данном этапе предусмотрены
формы индивидуальной, групповой
работы и работа с семейной парой.
Это самый богатый и разнообразный
по применению психокоррекционных технологий этап. По-прежнему
может оказаться актуальной кризисная интервенция, но также: исследование специфики и приоритетов
жизни пациента; техника фокусирования на смысле с фиксацией ощущений тела; поощрение инсайта;
парадоксальная интенция; выработка навыков самоосознавания, минимального анализа; дерефлексия;
юмор; «Сократовский диалог»; освоение навыков коммуникативной
компетентности, навыков принятия
решения в ситуации неопределенности; работа с иррациональными
установками, освоение навыков минимального планирования; оценка
эффективности воздействия. Этот
этап в работе онкопсихолога запрашивается реже всего.
По времени работы индивидуальная
консультация проводится один раз в
неделю, в отдельных, острых случаях
– несколько раз в неделю. Длительность работы определяется в зависимости от соматического состояния
пациента – от 20 до 50 минут.
Основным результатом (ожидаемым и наблюдаемым) психологической коррекции у онкологических
пациентов становится безусловное
признание пациентом собственной
личности, само существование которой есть ценность независимо от
изменений в связи с заболеванием
и гарантий срока существования.
Зачастую этот эффект достигается
от единственной встречи со специалистом.
Надеюсь, что в вашей команде онкопсихолог есть.
С уважением,
Вагайцева Маргарита Валерьевна
Эрлеада
Ранний старт с ЭРЛЕАДЫ улучшает результаты лечения РПЖ, не ухудшая качества жизни*, и позволяет пациентам жить дольше: с мГЧРПЖ > 4,5 лет **1,2 с нмКРРПЖ > 6 лет ***3,4
