Дорогие коллеги, дорогие друзья!
За окнами вновь сентябрь – щедрый, теплый, златовласый, немного меланхоличный месяц, столь любимый поэтами и художниками. В сентябре когда-то заканчивались основные работы по уборке...

Джон Эверетт Милле. Подружка невесты («The Bridesmaid»). 1851.
Холст, масло. Музей Fitzwilliam, Кембридж, Англия.
Иван Бунин. Вечер. 1909 г.
О счастье мы всегда лишь вспоминаем. А счастье всюду. Может быть, оно — Вот этот сад осенний за сараем И чистый воздух, льющийся в окно. ...
RUSSCO НА ФОРУМЕ «ИННОВАЦИОННАЯ ОНКОЛОГИЯ»
7 сентября в рамках Международного форума «Инновационная онкология», проходившего в Москве, состоялась сессия Российского общества клинической онкологии (RUSSCO)...
РОССИЙСКОЕ ОБЩЕСТВО КЛИНИЧЕСКОЙ ОНКОЛОГИИ (RUSSCO) ПРИНЯТО В СОСТАВ НАЦИОНАЛЬНОЙ МЕДИЦИНСКОЙ ПАЛАТЫ
4 сентября 2024 г. в Москве прошло заседание Совета Союза медицинских сообществ «Национальная Медицинская Палата», на котором в ее состав было принято Российское общество...
RUSSCO ПРОВЕЛО ЭКЗАМЕН ESMO В МОСКВЕ
Российское общество клинической онкологии (RUSSCO) проводит 14 сентября в Москве ежегодный экзамен Европейского общества медицинской онкологии (ESMO) для молодых врачей – членов...
ДИСКУССИОННЫЙ КЛУБ «ТОЧКА ЗРЕНИЯ». КЛЮЧЕВЫЕ ИЗМЕНЕНИЯ В КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЯХ ПО АНЕМИИ
В субботу, 24 августа, на онлайнплощадке RUSSCO состоялось очередное заседание дискуссионного клуба «Точка зрения». Центральной темой обсуждения стало обновление клинических...
К 100-ЛЕТИЮ ПРОФЕССОРА ГЕРШАНОВИЧА М.Л.
Сто лет назад, 18 сентября 1924 года, родился Михаил Лазаревич Гершанович, доктор медицинских наук, профессор, лауреат Государственной премии Российской Федерации, заслуженный деятель...
ВОЗМОЖНА ЛИ БОРЬБА С КАХЕКСИЕЙ
Кахексия является частым осложнением злокачественного процесса, особенно на финальных стадиях, и связана с повышенным риском смерти. Рядом авторов было отмечено, что при раковой...

НУЖНО ЛИ КОНТРОЛИРОВАТЬ УРОВНИ ЭСТРОГЕНОВ В КРОВИ БОЛЬНЫХ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ ПРИ ПРОВЕДЕНИИ АДЪЮВАНТНОЙ ГОРМОНОТЕРАПИИ ИНГИБИТОРАМИ АРОМАТАЗЫ?
В Journal of Clinical Cancer Research опубликована интересная работа, имеющая потенциально важное практическое значение для применения ингибиторов ароматазы у больных раком молочной...
КАК ЧАСТОТА И ИНТЕНСИВНОСТЬ ФИЗИЧЕСКОЙ НАГРУЗКИ ВЛИЯЮТ НА ОТДАЛЕННЫЕ РЕЗУЛЬТАТЫ ЛЕЧЕНИЯ БОЛЬНЫХ ОПЕРАБЕЛЬНЫМ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ
Благодаря современным методам диагностики и лечения больные раком молочной железы как с локальным, так и с метастатическим процессом стали жить дольше, у них реже отмечается прогрессия...

ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / ЦИСПЛАТИН В РЕЖИМЕ SPLIT-DOSE ПРИ МЕСТНОРАСПРОСТРАНЕННОМ НЕОПЕРАБЕЛЬНОМ/МЕТАСТАТИЧЕСКОМ УРОТЕЛИАЛЬНОМ РАКЕ (МУР): СИСТЕМАТИЧЕСКИЙ ОБЗОР И СЕТЕВОЙ МЕТААНАЛИЗ (СМА)
Ввиду низкой доступности комбинации энфортумаба ведотина и пембролизумаба [1] в реальной клинической практике стандартом 1 линии терапии УР остается режим гемцитабин/цисплатин (GC) с...
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / CABASTY TRIAL: ВЛИЯНИЕ КАБАЗИТАКСЕЛА В ДВУХ- И ТРЕХНЕДЕЛЬНОМ РЕЖИМАХ НА БОЛЕВОЙ СИНДРОМ И КАЧЕСТВО ЖИЗНИ У ПОЖИЛЫХ ПАЦИЕНТОВ ПРИ МКРРПЖ
Сложно представить современное лечение метастатического кастрационно-резистентного рака предстательной железы (мКРРПЖ) без кабазитаксела. Однако, учитывая профиль токсичности...
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / ДОЛГОСРОЧНЫЕ РЕЗУЛЬТАТЫ НАБЛЮДЕНИЯ В ИССЛЕДОВАНИЯХ IMPOWER133 И IMBRELLA A
В журнале Lung cancer опубликованы результаты 5-летнего наблюдения за пациентами из группы атезолизумаба, перешедших после завершения исследования IMpower133 в исследование IMbrella А....

ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / ЕЩЁ ОДНО ПОДТВЕРЖДЕНИЕ НЕЭФФЕКТИВНОСТИ МОНОИММУНОТЕРАПИИ У ПАЦИЕНТОВ С EGFR MUT+ НМРЛ
В журнале Lancet Oncology опубликован метаанализ по оценке различных вариантов лечения с применением чек-поинт ингибиторов среди пациентов с EGFR+ НМРЛ, у которых наступило
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / ДОКСОРУБИЦИН В КОМБИНАЦИИ С ТРАБЕКТИДИНОМ С ПОСЛЕДУЮЩЕЙ ПОДДЕРЖИВАЮЩЕЙ ТЕРАПИЕЙ ТРАБЕКТИДИНОМ СПОСОБСТВУЕТ ПОВЫШЕНИЮ ВЫЖИВАЕМОСТИ ПАЦИЕНТОВ С ЛЕЙОМИОСАРКОМОЙ
Обновленные результаты III фазы исследования LMS04, направленного на оценку эффективности комбинации доксорубицина с трабектидином по сравнению с монотерапией доксорубицином...
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / TAPIR TRIAL: ТОЦИЛИЗУМАБ ЭФФЕКТИВЕН ПРИ ЛЕЧЕНИИ ИММУНООПОСРЕДОВАННОГО АРТРИТА
Артрит, связанный с применением ингибиторов иммунных контрольных точек, может быть стойким и существенно влияет на качество жизни пациентов, требуя прекращения ИТ и длительного...

ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / ETER701: ПРИМЕНЕНИЕ КОМБИНАЦИИ БЕНМЕЛСТОБАРТА, АНЛОТИНИБА И ХИМИОТЕРАПИИ В ЛЕЧЕНИИ РАСПРОСТРАНЕННОГО МЕЛКОКЛЕТОЧНОГО РАКА ЛЕГКОГО
На долю мелкоклеточного рака приходится до 15% от всех злокачественных опухолей легких, при этом у превалирующего числа пациентов заболевание впервые выявляется уже на этапе...
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / СОВРЕМЕННОЕ ЗНАЧЕНИЕ TROP2-НАПРАВЛЕННОЙ ТЕРАПИИ У ПАЦИЕНТОВ С РАСПРОСТРАНЕННЫМ НЕМЕЛКОКЛЕТОЧНЫМ РАКОМ ЛЕГКОГО
Появление принципиально нового класса препаратов и новых возможных молекул-мишеней является значимым событием в любой области клинической онкологии. Так, применение...
ТРИМОДАЛЬНАЯ ТЕРАПИЯ (ТМТ) ПРИ Т1 HIGH-GRADE РАКА МОЧЕВОГО ПУЗЫРЯ (РМП): ИССЛЕДОВАНИЕ 2 ФАЗЫ RTOG 0926
Сохранение мочевого пузыря при рецидиве немышечно-инвазивного РМП (НМИРМП) после БЦЖ терапии является главной задачей последующих опций лечения. Известно, что при...

УГОЛОК РАДИОТЕРАПЕВТА... / И СНОВА О ГИПОФРАКЦИОНИРОВАНИИ: РАК ЛЕГКОГО
Стандартная схема лечения неоперабельного немелкоклеточного рака легких (НМРЛ) III стадии – одновременная химиолучевая терапия (в дозе 60 Гр за 30 фракций + 2-3 курса ХТ), хотя умеренно...
УГОЛОК РАДИОТЕРАПЕВТА... / СНИЖАЕТ ЛИ ДВУСТОРОННЯЯ МАСТЭКТОМИЯ СМЕРТНОСТЬ ОТ РМЖ?..
Согласно исследованию, опубликованному в журнале JAMA Oncology [1], многие больные раком молочной железы, включая протоковую карциному in situ (DCIS), выбирают двустороннюю...
УГОЛОК РАДИОТЕРАПЕВТА... / ВОЛШЕБНАЯ ФРАКЦИЯ ДЛЯ ПЕЧЕНИ
Недавняя публикация в журнале Lancet Oncology – это весьма оптимистичные новости для специалистов, занимающихся патологией печени, и важная информация для радиотерапевтов, которым

«А ВОТ БЫЛ У МЕНЯ СЛУЧАЙ…» ИЛИ «ОХОТНИЧЬИ» ЗАПИСКИ ОНКОЛОГОВ / РЕДКОЕ ОСЛОЖНЕНИЕ, АССОЦИИРОВАННОЕ C ИСПОЛЬЗОВАНИЕМ СОВРЕМЕННЫХ ИММУНООНКОЛОГИЧЕСКИХ ПРЕПАРАТОВ, — ПОРАЖЕНИЕ ПОЧЕК
По мере увеличения заболеваемости и распространенности злокачественных новообразований разрабатываются и внедряются в клиническую практику новые противоопухолевые препараты...
РЕЗОЛЮЦИЯ ПО РЕЗУЛЬТАТАМ СЕССИИ RUSSCO «ЗАКЛЮЧЕНИЕ NGS, КОНСЕНСУС МЕЖДУ ГЕНЕТИКОМ И КЛИНИЦИСТОМ»
Сессия состоялась 30 июля 2024 года в г. Горно-Алтайске, в рамках Всероссийской конференции «Опухолевые маркеры - фундаментальные и клинические аспекты», которая проходила с 29 июля по 1 августа 2024 года...
Анонс
-

12 ноября 2024
ЭКЗАМЕН ПО КЛИНИЧЕСКОЙ ОНКОЛОГИИ
российского общества клинической онкологии
-

12-14 НОЯБРЯ 2024
XVIII РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС 2024
Москва
Дорогие коллеги, дорогие друзья!
За окнами вновь сентябрь – щедрый, теплый, златовласый, немного
меланхоличный месяц, столь любимый поэтами и художниками. В
сентябре когда-то заканчивались основные работы по уборке урожая
и начиналась пора свадеб – пора магическая и радостно-печальная,
словно бесповоротный переход от юности ко взрослой жизни. Старая английская поговорка гласит: «Выходи замуж в блеске сентября,
и твоя гостиная будет всегда богатой и счастливой». Девушка с полотна прерафаэлита Джона Эверетта Милле, будучи подружкой невесты, пытается увидеть лицо суженого, совершая викторианский
свадебный обряд: пропускает кусочек свадебного торта через обручальное кольцо девять раз. Множество символов на картине (копна
рыжих волос как символ юности и фертильности, букетик флердоранжа, нетронутый апельсин как атрибуты невинности, желтое платье как символ разлуки и другие) говорят: у девушки уже есть возлюбленный, но в этот момент они не вместе, и цель гадания – узнать,
станет ли её мужем он или кто-то другой. Ее взгляд, устремленный в
себя, меж тем говорит о покорности принять свою судьбу в качестве
будущей жены.
Мы же с вами, напротив, в сентябре, отдохнув, с новыми силами и,
надеемся, с желанием вступаем в новый рабочий год, чтоб делать то,
что мы умеем лучше всего – лечить людей, помогать им преодолеть
сложный период и продлевать жизни, насколько это возможно. Без
постоянной подпитки знаниями делать это невозможно, и врач перманентно учится и даже сдает экзамены. В сентябре в Москве прошел
очередной экзамен ESMO (отчет о нем появится в новостях сайта и
на страницах газеты), а в ноябре, в дни Российского онкологического
конгресса, желающих ждет экзамен RUSSCO, как максимально приближенная к реалиям возможность проверить свои знания. XXVIII
РОК – завершающее крупнейшее онкологическое событие года, подготовка к которому вступает в свою финальную фазу. Нас ждет немало интересных сессий и мастерклассов, обновленные «Практические
рекомендации» RUSSCO уже ждут своей очереди в печати, а предвкушение от встречи с коллегами – одно из самых чудесных ощущений осени, не правда ли?
Плодотворного Сентября Вам, дорогие коллеги!
Ваша команда RUSSCO
Джон Эверетт Милле. Подружка невесты («The Bridesmaid»). 1851.
Холст, масло. Музей Fitzwilliam, Кембридж, Англия.

Иван Бунин. Вечер. 1909 г.
***
О счастье мы всегда лишь вспоминаем.
А счастье всюду. Может быть, оно —
Вот этот сад осенний за сараем
И чистый воздух, льющийся в окно.
В бездонном небе легким белым краем
Встает, сияет облако. Давно
Слежу за ним… Мы мало видим, знаем,
А счастье только знающим дано.
Окно открыто. Пискнула и села
На подоконник птичка. И от книг
Усталый взгляд я отвожу на миг.
День вечереет, небо опустело.
Гул молотилки слышен на гумне…
Я вижу, слышу, счастлив. Все во мне.
RUSSCO НА ФОРУМЕ «ИННОВАЦИОННАЯ ОНКОЛОГИЯ»

7 сентября в рамках Международного форума «Инновационная онкология», проходившего
в Москве, состоялась сессия Российского общества клинической
онкологии (RUSSCO) «Иммунотерапия злокачественных опухолей. Как достичь большего?».
Среди обсуждаемых на ней вопросов были такие:
Готовы ли мы к практическому
применению предикторов ответа
за пределами экспрессии PD-L1 и
MSI?
В какой последовательности и каком сочетании с другими методами лечения применять иммунотерапию?
Как оценить эффективность иммунотерапии (сложности в дифференциальной диагностике псевдо и гиперпрогрессирования)?

Весомую лепту в работу сессии
внесли члены Правления RUSSCO
– модератор сессии Алексей Александрович Трякин, зам. директора
по научной работе НИИ клинической онкологии им. акад. РАН и
РАМН Н.Н. Трапезникова ФГБУ
«НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, зав. отделением противоопухолевой лекарственной терапии №2, д.м.н.,
Федор Владимирович Моисеенко,
зав. онкологического химиотерапевтического (противоопухолевой лекарственной терапии) отделения биотерапии ГБУЗ «СПб
КНпЦСВМП(о) им. Н.П. Напалкова», д.м.н. (Санкт-Петербург),
поделившийся со слушателями
возможными методами оптимизации применения иммунотерапии
в условиях ограничения финансирования на примере рака легкого, и Илья Анатольевич Покатаев,
руководитель службы химиотерапевтического лечения, Онкологический центр №1 ГКБ им. С.С.
Юдина ДЗМ, д.м.н. (Москва), который рассказал о важнейшем для
практики вопросе – оптимальной
продолжительности иммунотерапии, в том числе о стоящей перед
врачом дилемме – отменять ее
планово или лечить до прогрессирования, когда специалист должен
сделать прогноз эффективности
управления токсичностью, принять решение о сроках остановки
и возможности возврата к иммунотерапии.
Все сообщения вызвали неподдельный интерес у участников сессии, что отразилось в большом количестве вопросов из аудитории и
последующих живых дискуссиях.
РОССИЙСКОЕ ОБЩЕСТВО КЛИНИЧЕСКОЙ ОНКОЛОГИИ (RUSSCO) ПРИНЯТО В СОСТАВ НАЦИОНАЛЬНОЙ МЕДИЦИНСКОЙ ПАЛАТЫ

4 сентября 2024 г. в Москве прошло
заседание Совета Союза медицинских сообществ «Национальная
Медицинская Палата», на котором
в ее состав было принято Российское общество клинической онкологии (RUSSCO). Сертификат,
удостоверяющий членство, за подписью президента «Союза НМП»,
академика Л.М. Рошаля получил из рук академика А.Г. Румянцева
председатель RUSSCO, профессор
Д.А. Носов.

Следует отметить, что в состав
Национальной Медицинской
Палаты входит уже почти 180
региональных общероссийских
профессиональных медицинских
объединений, включая объединения врачей общей практики.
Уверены, что Российское общество клинической онкологии
(RUSSCO) будет принимать активное и действенное участие в
реализации основной цели НМП
– совершенствовании системы
охраны здоровья населения России путем объединения всего
профессионального медицинского сообщества России на принципах саморегулирования.
RUSSCO ПРОВЕЛО ЭКЗАМЕН ESMO В МОСКВЕ
Российское общество клинической онкологии (RUSSCO) проводит 14 сентября
в Москве ежегодный экзамен Европейского общества медицинской онкологии
(ESMO) для молодых врачей – членов ESMO.
Экзамен, состоящий из тестовых заданий на английском языке, стартовал
в одно и тоже время одновременно в России и еще в 12 странах: Германии,
Греции, Египте, Индии, Ираке, Испании, Италии, Непале, Словении, Турции,
Франции и Швейцарии.
Сорок онкологов, изъявивших желание принять участие в этом престижном
экзамене и попробовать свои силы в отношении знаний медицинской
онкологии, съехались в Москву из разных городов нашей необъятной страны.
Все участники, успешно сдавшие экзамен, будут аттестованы и получат
соответствующий сертификат на пятилетний период своей деятельности.

ДИСКУССИОННЫЙ КЛУБ «ТОЧКА ЗРЕНИЯ». КЛЮЧЕВЫЕ ИЗМЕНЕНИЯ В КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЯХ ПО АНЕМИИ
В субботу, 24 августа, на онлайнплощадке RUSSCO состоялось
очередное заседание дискуссионного клуба «Точка зрения».
Центральной темой обсуждения
стало обновление клинических
рекомендаций по анемии при
злокачественных новообразованиях. Традиционно участниками
заседания стали члены комитета
молодых онкологов совместно с
экспертами RUSSCO.
В первой части дискуссионного
клуба Владислав Евсеев представил разбор изменений новой версии клинических рекомендаций.
Основные изменения коснулись
следующих моментов.
1. Нижняя граница нормы гемоглобина. Теперь действуют границы, к которым мы привыкли из
ежедневной практики: «Основным
диагностическим критерием анемии является стойкое снижение
концентрации гемоглобина менее
120 г/л у женщин и менее 130 г/л у
мужчин». Ранее диагностическим
критерием было снижение гемоглобина менее 110 г/л.
2. С учетом изменения границ нормальных значений уровня гемоглобина, изменились и критерии
степеней тяжести анемии. Степени тяжести теперь соотносятся с
CTCAE.
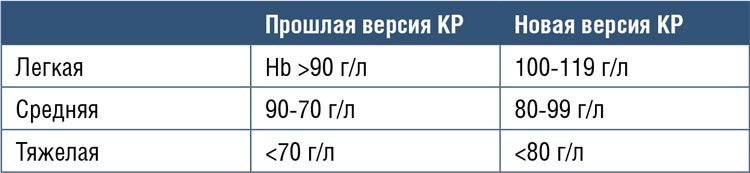
3. Изменился минимальный обязательный уровень лабораторных
обследований. По сравнению с
прошлой редакцией добавилось
определение в клиническом анализе крови MCV, MCH, MCHC, а
в биохимическом – трансферрина
сыворотки, железосвязывающая
способность сыворотки, уровня
С-реактивного белка.
Теперь перечень выглядит так:
Клинический анализ крови:
• + ретикулоциты
• + эритроциты
• + гематокрит
• + MCV
• + MCH
• + MCHC
Биохимический анализ крови:
• Ферритин
• Железо сыворотки
• Насыщение трансферрина железом
• Трансферрин сыворотки
• Железосвязывающая способность сыворотки
• Уровень С-реактивного белка
4. Кроме того, появился список
обследований, которые необходимы при подозрении на ту или
иную причину анемии. Например, при наличии признаков B12-
дефицитной анемии, необходимо
определение уровня витамина B12 и фолиевой кислоты. В текущую
версию КР внесены уточняющие
признаки В12-дефицитной анемии:
макроцитоз, гиперхромия эритроцитов, нормальное/сниженное
количество ретикулоцитов, мегалобластный эритропоэз в костном
мозге, тромбоцитопения, лейкопения (до глубокой панцитопении),
гиперсегментация ядер нейтрофилов, лабораторные признаки гемолиза.
5. Добавлен еще один возможный
дифференциальный диагноз –
миелодиспластический синдром:
«Пациентам, у которых по клиническим и лабораторным проявлениям можно заподозрить миелодиспластический синдром или
нарушение выработки эритропоэтина почками, рекомендуется исследование уровня эритропоэтина
крови».
Подозревать миелодиспластический синдром необходимо в следующих ситуациях:
• Рефрактерная анемия при исключении другой этиологии
• Сочетание с тромбоцитопенией
и/или лейкопенией
• Нормо (иногда макро) цитоз
• Нормальное/сниженное количество ретикулоцитов
• Повышение концентрации ферритина >300 нг/мл
• Повышение НТЖ >45%
• Снижение концентрации сывороточного трансферрина
• Снижение показателя ОЖСС
6. В случае выявления железодефицитной анемии на фоне злокачественного новообразования
необходимо проведение гастро- и
колоноскопии. При этом возможно проведение большого списка дополнительных обследований с
целью поиска источника кровотечения.
7. Также в новых клинических рекомендациях появился пункт о необходимости определения группы
крови и резус фактора у всех пациентов с анемией злокачественных
новообразований.
8. Проведение гемотрансфузий
теперь не так строго привязано к
уровню гемоглобина 70 г/л. В новой редакции допускается проведение гемотрансфузий и при более
высоких цифрах в случае симптомов анемической гипоксии.
9. Добавлен перечень противопоказаний к терапии ЭСП:
• Известная гиперчувствительность к эритропоэтин-содержащим препаратам
• Неконтролируемая артериальная
гипертензия
• Высокий риск тромбоэмболических осложнений (тромбоз в
анамнезе, обширное хирургическое вмешательство, длительная
иммобилизация или ограничение
активности, лечение леналидомидом в сочетании с доксорубицином и глюкокортикоидами)
10. Появился критерий остановки
терапии ЭСП. При этом при терапии этой группой препаратов теперь
не обязательно назначение препаратов железа, необходим мониторинг
показателей метаболизма железа и
проведение терапии при возникновении абсолютного дефицита:
• В случае отсутствия эффекта
(увеличение Hb менее чем на 10
г/л при исходном уровне Hb <100
г/л) лечение ЭСП должно быть
прекращено через 8 недель
11. У пациентов с доказанным
абсолютным дефицитом железа
рекомендуется назначение лекарственных препаратов железа, в соответствие с разработанным алгоритмом:
• При анемии легкой/средней степени тяжести, отсутствии признаков
кровотечения и нормального
уровня С-реактивного белка возможно применять пероральные
препараты железа
• При анемии тяжелой степени,
продолжающемся кровотечении
и высокого уровня С-реактивного
белка (>5 нг/мл) необходима
терапия внутривенными формами
железа
12. Также появилось упоминание
о пациентах с аутоимунной гемолитической анемией: «Пациентам
с развитием аутоиммунной гемолитической анемии на фоне ЗН рекомендуется проведение терапии в
соответствии с протоколами лечения аутоиммунных гемолитических
анемий». В данных клинических
рекомендациях протоколы лечения
этого состояния не указаны, но есть
отдельный документ, одобренный
МЗ РФ.
После обзора ключевых изменений
в клинических рекомендациях эксперты обсудили сложные и неоднозначные вопросы реальной клинической практики. Одним из самых
насущных вопросов было обсуждение на тему, должны ли мы откладывать начало противоопухолевой лекарственной терапии из-за анемии.
Все участники заседания сошлись
во мнении, что сама по себе анемия
не является противопоказанием
для начала лекарственной терапии.
Противоопухолевое лечение должно начинаться независимо от уровня гемоглобина (за исключением
ряда ситуаций, например, лечения
PARP-ингибиторами), при этом перед началом лечения лечащий врач
должен установить причину анемии
и провести соответствующее лечение.
Отдельно обсудили вопрос сочетания терапии препаратами железа с
химиопрепаратами. Олег Александрович Гладков прокомментировал этот вопрос и предложил ориентироваться на фармакокинетику химиопрепаратов (насколько быстро
они выводятся из организма), стараясь разделять введение препаратов
железа и химиопрепаратов на разные дни.
Были заданы вопросы и про нюансы терапии эритропоэтинами.
Например, является ли отсутствие
эффективности терапии этой группы препаратов на протяжении 6-8
недель показанием для проведения
биопсии костного мозга? Участники обсуждения сошлись на том, что
неэффективность терапии ЭСП не
является признаком развития миелодиспластического синдрома и
проведение биопсии не требуется.
Важным вопросом была стандартизация измерения степени тяжести
клинических проявлений анемии,
но на данный момент валидированной проверенной шкалы не представлено.
В конце участники дискуссионного
клуба ответили на блиц-опрос, который представлен ниже:
• Если у пациента во время химиотерапии не подтверждается
ЖДА, значит она индуцирована
химиотерапией?
• На первом этапе для подтверждения анемии в клиническом
анализе крови должны быть
исследованы общий гемоглобин,
эритроциты и ретикулоциты,
гематокрит, MCV, MCH, MCHC
• У пациента с клиническими симптомами и уровнем гемоглобина
85 я буду проводить гемотрансфузию
• Если у пациента анемия, это повод
прерывать химиотерапию до восстановления нормального уровня
гемоглобина
Попробуйте тоже ответить на эти
вопросы. А как ответили на эти вопросы эксперты, можно будет посмотреть в полной записи эфира на
сайте RosOncoWeb.ru.
К 100-ЛЕТИЮ ПРОФЕССОРА ГЕРШАНОВИЧА М.Л.
Сто лет назад, 18 сентября 1924
года, родился Михаил Лазаревич
Гершанович, доктор медицинских
наук, профессор, лауреат Государственной премии Российской Федерации, заслуженный деятель
науки РФ, академик Российской
академии естественных наук, основоположник Ленинградской –
Санкт-Петербургской школы химиотерапии, внесший весомый вклад
в развитие противоопухолевой лекарственной терапии в России. Подполковник в отставке, Михаил Лазаревич до последнего дня, 16 декабря
2013 года, оставался руководителем
отдела терапевтической онкологии
Научно-исследовательского института онкологии им. Н.Н. Петрова и
членом редколлегии журнала «Вопросы онкологии» авторитетного онкологического издания нашей страны. В 2024 году решением Ученого
совета ФГБУ «НМИЦ онкологии им.
Н.Н. Петрова» Минздрава России
Памятная медаль «К 100-летию со
дня рождения МИХАИЛА ЛАЗАРЕВИЧА ГЕРШАНОВИЧА», которой
награждаются специалисты и коллективы, внесшие вклад в развитие
отечественного противоопухолевого
лекарственного лечения.

Михаил Лазаревич родился в городе Прилуки Полтавской губернии, в 1928 году его семья переехала в Ленинград. Окончил 102 школу Володарского района Ленинграда (сейчас — 155 гимназия Центрального района Санкт-Петербурга). После окончания десятого класса был призван в Военно-Морской Флот в качестве курсанта Военно-морской медицинской академии, которую закончит с отличием в 1947 году.
В рядах ВМФ Михаил Лазаревич прослужит до февраля 1961 года, и всегда будет гордиться своим воинским званием подполковника запаса. С 1948 году в Главном госпитале Балтийского флота (город Таллин) подполковник медицинской службы М.Л. Гершанович без отрыва от основной службы выполняет экспериментально-клиническую работу «Материалы о жаропонижающем и антиаллергическом действии сульфаниламидов», которую защитит в качестве кандидатской диссертации в 1954 году.
В НИИ онкологии им. Н.Н. Петрова Михаил Лазаревич Гершанович начал работать в должности младшего научного сотрудника с 1961 года, и уже в 1965 году возглавил отделение лекарственной терапии. В 1980 году М.Л. Гершанович защитил докторскую диссертацию на тему «Лекарственное лечение местных лучевых повреждений у онкологических больных». И всю свою научную и практическую деятельность Михаил Лазаревич посвятил поискам новых методов лекарственного лечения злокачественных опухолей, прежде всего лимфом. Результаты данной работы он обобщил в монографиях «Лекарственная терапия опухолей» и «Осложнения при химио- и гормонотерапии». О коррекции патологических синдромов, сопровождающих распространенный опухолевый процесс, Михаил Лазаревич блестяще изложил в монографии «Симптоматическое лечения при злокачественных образованиях».
Гершанович Михаил Лазаревич — автор более 600 научных трудов, многие из которых опубликованы в зарубежных изданиях, и 11 монографий. Изучены более 130 противоопухолевых и 25 вспомогательных препаратов, большинство из которых прочно вошли в онкологическую практику и были включены в Государственный реестр лекарственных препаратов. Михаил Лазаревич - руководитель 20 кандидатских и консультант 4 докторских диссертаций. Профессором Гершановичем создана научная школа, ориентированная на постоянный поиск новых методов лекарственного и комбинированного лечения злокачественных новообразований.

Для меня Михаил Лазаревич - проводник и маяк по жизни на протяжении вот уже на тридцати лет, начиная с лета 1994 года. Будучи студенткой IV курса 1-го Медицинского института им. акад. И.П. Павлова я посмела постучаться в дверь профессора. По-доброму строго прозвучали тогда слова профессора: «Приходите через 3 года, там посмотрим, а для начала поработайте у нас, познакомьтесь с работой хирургических отделений». Работа в Институте одновременно с учебой в 1 Меде еще больше укрепила меня в решении стать онкологом химиотерапевтом. Вернулась к Михайлу Лазаревичем уже клиническим ординатором, так и стал для меня НМИЦ онкологии им. Н.Н. Петрова вторым домом, если не первым.

Под руководством профессора состоялись защиты моих кандидатской и докторской диссертаций. Один день Михаил Лазаревич не дожил защиты нашей докторской диссертации. Это заседание диссертационного совета 17 декабря 2013 года фактически было посвящено памяти моего Учителя. Профессор Наталия Иннокентьевна Переводчикова, которой в этом году также исполнилось бы 100 лет, друг и соратник Михаила Лазаревича, пример для меня настоящей Женщины-Ученого, в тот день виртуозно оппонировала в стенах нашего Института и очень поддержала в тот непростой для всех нас день.

Михаил Лазаревич – врач, ученый, исследователь, педагог, дипломат, эрудит, интеллектуал с феноменальной памятью, с высоким чувством ответственности за любимое дело и тонким, пронзительным юмором, уважаемый и признанный эксперт и у пациентов, и у коллег, основоположник Ленинградской школы химиотерапевтов (все ведущие химиотерапевты Санкт-Петербурга прошли школу Профессора), сотрудник НаучноИсследовательского института им. Н.Н. Петрова более полувека! Живет и будет жить в нашей памяти и наших сердцах!
Профессор
Татьяна Юрьевна Семиглазова
Профессор
Вера Андреевна Горбунова
Насколько я помню, нас познакомила и представила друг другу Наталья Иннокентьевна Переводчикова.
С тех пор мы постоянно общались,
встречаясь на конференциях, митингах по обсуждению протоколов международных исследований новых противоопухолевых препаратов. Что
меня поражало всегда в Михаиле Лазаревиче, так это его вдумчивость,
скрупулезность и дотошность при
обсуждении, с акцентом на всех мелочах, чтобы не дай бог пропустить
какой-нибудь возможный побочный
нежелательный эффект, чтобы
не нанести вред больному человеку.
Михаил Лазаревич - врач от Бога,
изумительно интеллектуальный и
внимательный. Вот такому подходу я всегда стремилась следовать и
учиться у него. Еще вспоминается
один момент, когда мы с ним летели
в США видимо на ASCO. Тогда уже
был везде запрет на курение. И я стояла вместо ширмы, предоставляя
ему возможность покурить. Всегда в
моей душе будет храниться память
об этом замечательном человеке.
Профессор
Рашида Вахидовна Орлова
Мне повезло, что в начале моего
профессионального пути первым
моим учителем стал Михаил Лазаревич! Этот человек научил меня
«чувствовать» больных и сочувствовать им! Он научил меня мастерству общения с больными! Он
научил меня клиническому мышлению и индивидуальному подходу к
больным! Только сейчас мы говорим
об индивидуализации! А он еще в
90-е говорил, что все больные разные, и мы должны к ним подходить
индивидуально! Я не встречала в
жизни человека, который так аналитически мыслил в медицине, человека с таким широким кругозором
и потрясающем чувством юмора!
Такие люди, как Михаил Лазаревич,
рождаются один раз в столетие! И
нам всем посчастливилось учиться
у него и работать с ним!
Профессор
Эдуард Кузьмич Возный
При воспоминании о Михаиле Лазаревиче Гершановиче в моей душе
становится тепло и охватывает чувство радости. Я благодарен
судьбе за то, что мы встретились
в ним по жизни. Мы познакомились в 1970х годах на симпозиуме в
Ленинграде. В перерыве между заседаниями в зал быстрой походкой
вошел человек с красивым интеллигентным лицом и выразительными глазами. Он говорил очень
быстро, эмоционально, убедительно и всегда по существу. Михаил
Лазаревич был оппонентом на защите моей докторской диссертации. С тех пор он стал для меня
коллегой, соратником по профессии и другом по жизни.

Профессор
Константинова
Мария Михайловна
Моя встреча с Михаилом Лазаревичем произошла по воле судьбы
после окончания 1 медицинского института имени акад. И.П.
Павлова. В моих планах была
терапия, а именно лечение пациентов с почечной недостаточностью (на диализе работала в
СНО с 3 курса), но судьба решила
иначе: в год выпуска отцам и матерям, работающим в институте, запретили оставлять детей
там же, где работают родители.
И именно это обстоятельство
оказалось для меня счастливым
билетом в мою любимую, восхитительную специальность «онкология», которая сочетает в себе
все специальности и в которой
на протяжении нашей трудовой
жизни произошли блистательные
открытия и прорывы. С нашего
курса 5 человек поступили в ординатуру по онкологии в Институт онкологи им. Петрова.
Перед подачей документов меня
пригласил на встречу Михаил
Лазаревич. Сказать, что я волновалась - не сказать ничего, но
с первой минуты знакомства все
страхи ушли, несколько вопросов,
взаимных шуток, улыбки, смех
и вердикт Михаила Лазаревича:
«Вы наша, я вас беру, поступайте к нам»! И вот уже вместе несемся в дирекцию уточнить, что
и когда. А дальше - учеба, прежде
всего человеческим взаимоотношениям, мудрости, вниманию к
пациентам, сотрудникам, отношению к делу: как смотреть
пациента, как оформлять историю болезни, как писать статьи,
потом - диссертации. Как обсуждать пациента и вести грамотно научные споры, исследовать
новые лекарственные препараты
(первая инспекция FDA в РФ прошла у нас)…
И еще одна удивительная способность Михаила Лазаревича
- умение создавать вокруг семейную атмосферу, где все сотрудники работают на общее дело,
где, если необходимо, тебя поддержат или пожурят, а если потребуется помощь членам твоей
семьи - окажут на самом высоком
уровне, где забота о благосостоянии сотрудников - первая задача
руководителя, где все постоянно
учатся и делятся знаниями и умениями, где молодым сотрудникам
предоставлены все условия роста,
главное - хотеть. Для меня Михаил Лазаревич – Учитель, образец
руководителя и ученого на протяжении всей моей профессиональной, да и не только, жизни.

ВОЗМОЖНА ЛИ БОРЬБА С КАХЕКСИЕЙ
Кахексия является частым осложнением злокачественного процесса, особенно на финальных стадиях, и связана с повышенным
риском смерти. Рядом авторов было отмечено, что при раковой
кахексии повышается уровень фактора дифференцировки роста
15 (GDF-15), циркулирующего цитокина. В недавнем небольшом
открытом исследовании фазы 1b с участием пациентов с раковой кахексией применение препарата понсегромаб (гуманизированное моноклональное антитело, ингибирующее GDF-15) было
связано с увеличением веса, аппетита и физической активности,
а также с подавлением уровня GDF-15 в сыворотке [1].
В рандомизированном двойном слепом 12-недельном исследовании фазы 2, опубликованном в сентябрьском номере NEJM [2],
авторы распределили пациентов с раковой кахексией и повышенным уровнем GDF-15 в сыворотке (≥1500 пг/мл) в соотношении 1:1:1:1 для приема понсегромаба в дозе 100 мг, 200 мг или 400
мг или плацебо, подкожно каждые 4 недели в количестве трех
доз. Первичной конечной точкой было изменение массы тела
по сравнению с исходным уровнем через 12 недель. Ключевыми
вторичными конечными точками были признаки проявления
аппетита и кахексии, цифровые показатели физической активности и безопасность.
Всего было рандомизировано 187 пациентов, у 40% из них был
немелкоклеточный рак легких, у 32% — рак поджелудочной железы и у 29% — колоректальный рак. Через 12 недель пациенты в группах, принимавших понсегромаб, имели значительно
большую прибавку веса, чем в группе, принимавшей плацебо, со
средней разницей между группами 1,22 кг (95% ДИ 0,37 до 2,25)
в группе, принимавшей 100 мг, 1,92 кг (95% ДИ 0,92 до 2,97) в
группе 200 мг и 2,81 кг (ДИ 1,55 до 4,08) в группе 400 мг. Улучшения наблюдались по улучшению аппетита и снижению симптомов кахексии, а также по физической активности в группе,
принимавшей 400 мг понсегромаба, по сравнению с плацебо.
Нежелательные явления по любой причине были зарегистрированы у 70% пациентов в группе понсегромаба и у 80% пациентов
в группе плацебо.
Авторы сделали вывод, что у пациентов с раковой кахексией и
повышенными уровнями GDF-15 ингибирование GDF-15 понсегромабом приводило к увеличению веса и общего уровня активности, а также к уменьшению симптомов кахексии, что подтвердило роль GDF-15 как лидирующей движущей силы в развитии
кахексии.
Источники:
- Crawford J, Calle RA, Collins SM, Weng Y, Lubaczewski SL, Buckeridge C, Wang EQ, Harrington MA, Tarachandani A, Rossulek MI, Revkin JH. A Phase Ib First-In-Patient Study Assessing the Safety, Tolerability, Pharmacokinetics, and Pharmacodynamics of Ponsegromab in Participants with Cancer and Cachexia. Clin Cancer Res. 2024 Feb 1;30(3):489-497. doi: 10.1158/1078-0432.CCR-23-1631. PMID: 37982848; PMCID: PMC10831332.
- Groarke JD et Al. Ponsegromab for the Treatment of Cancer Cachexia. New Eng J Med, published online September 14, 2024
НУЖНО ЛИ КОНТРОЛИРОВАТЬ УРОВНИ ЭСТРОГЕНОВ В КРОВИ БОЛЬНЫХ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ ПРИ ПРОВЕДЕНИИ АДЪЮВАНТНОЙ ГОРМОНОТЕРАПИИ ИНГИБИТОРАМИ АРОМАТАЗЫ?
Автор: Тюляндин Сергей Алексеевич
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России,
профессор, доктор медицинских наук, Москва
В Journal of Clinical Cancer Research
опубликована интересная работа,
имеющая потенциально важное практическое значение для применения
ингибиторов ароматазы у больных
раком молочной железы.
Ингибиторы ароматазы третьего поколения (ИА) анастрозол, экземестан и летрозол играют важную роль
в адъювантной терапии женщин в
постменопаузе с раком молочной
железы ранней стадии, положительным по рецептору эстрогена α (ER+).
Механизмы, с помощью которых все
три ИА ингибируют рост опухоли,
заключаются в ингибировании ароматазы, фермента, кодируемого геном
CYP19A1, и снижении продукции
эстрона (E1) и эстрадиола (E2) из андрогенных предшественников. Хотя
все три ИА эффективны с точки зрения ингибирования ароматизации
in vivo, летрозол среди них обладает
наибольшей ингибирующей способностью. Однако крупные клинические
испытания адъювантной терапии
фазы III не указывают на какую-либо
разницу в клинической эффективности между тремя ИА. В частности,
исследование MA.27 не выявило существенной разницы между анастрозолом и экземестаном с точки зрения
безрецидивной выживаемости, а исследование FACE не выявило разницы
между анастрозолом и летрозолом с
точки зрения как безрецидивной, так
и общей выживаемости. Однако в
этих исследованиях было обнаружено,
что у женщин в постменопаузе с недостаточным подавлением продукции
эстрогенов (определяемым как E1 ≥1,3
пг/мл и E2 ≥0,5 пг/мл) на фоне приема
анастрозола отмечено повышение риска прогрессирования рака молочной
железы в три раза. Такая зависимость
не была обнаружена при назначении
экземестана или летрозола.
Авторы провели проспективное фармакодинамическое исследование для
оценки влияния стандартной дозы
анастрозола (1 мг/день) в течение 8-10
недель на уровни E1 и E2. Больным с
неадекватным подавлением продукции эстрогенов (E1 ≥1,3 пг/мл и E2
≥0,5 пг/мл) назначали высокую дозу
анастрозола (10 мг/день) в течение
8-10 недель, чтобы оценить безопасность и степень супрессии продукции
эстрогенов. Высокая доза анастрозола
была выбрана на основании предыдущих исследований, которые показали
равную эффективность стандартной и
высокой дозы анастрозола в подавлении эстрадиола и сопоставимы с точки зрения клинических результатов
и переносимости. Основной целью
было оценить долю женщин, у которых наблюдается неадекватное подавление E1 и/или E2 после 8-10 недель
адъювантной терапии анастрозолом и
оценить эффективность его высокой
дозы для достижения постменопаузальных значений эстрогенов в случае
их неадекватного подавления. После
окончания приема высокой дозы анастрозола все больные, независимо от
эффекта высокой дозы, переводились
на лечение стандартной дозой летрозола с оценкой уровня эстрогенов после 8-10 недель приема.
В это исследование были включены
156 больных раком молочной железы
I-III стадий в постменопаузе, которым
была показана адъювантная гормонотерапия ингибиторами ароматазы.
У 30% женщин, получавших стандартную дозу анастрозола (1 мг/день),
было обнаружено недостаточное
подавление продукции эстрогенов.
Среди них 76% достигли желаемых
уровней E1 и E2 после приема высокой дозы анастрозола (10 мг/день) в
течение 8-10 недель, и эта доза хорошо
переносилась. Кроме того, адекватное
подавление эстрогена сохранялось
или достигалось у 91,3% участников
при переходе с высокой дозы анастрозола на стандартную дозу летрозола
(2,5 мг/день).
Это исследование оспаривает представление о том, что стандартная доза
анастрозола подходит для всех пациентов. Адаптация уровней дозы ИА
(и, возможно, не только для анастрозола) с целью достижения адекватного подавления продукции эстрогенов
может быть необходима для оптимизации их терапевтического эффекта.
Это исследование поднимает вопрос
о том, не следует ли регулярно или
хотя бы на начальном этапе лечения
оценивать уровни E1 и E2 у пациентов, получающих ИА адъювантно, и
утверждает необходимость внедрения
более чувствительных методов их количественной оценки в клиническую
практику. Если будет проведена проспективная валидация предлагаемого
порога для подавления E1 и E2, эти
уровни могут служить биомаркерами прогноза и эффективности ИА у
женщин в постменопаузе с ранним
ER-положительным раком молочной
железы.
А сегодня у больных с недостаточной
супрессией продукции эстрогенов на
фоне лечения стандартной дозой анастрозола существуют два возможных
варианта действия: увеличение дозы
анастрозола до 10 мг в течение 8-10
недель с последующим возвращением к стандартной либо немедленный
переход на прием стандартной дозы
летрозола. Будет ли такая тактика
лечения обеспечивать эффективную
супрессию эстрогенов и приводить к
подавлению пролиферации опухоли
и снижению рецидива рака молочной
железы, предстоит оценить в будущих
исследованиях.
Источник:
Haddad ТC, Suman
VJ, Giridhar RV, et al. Anastrozole
dose escalation for optimal estrogen
suppression in postmenopausal earlystage breast cаncer: a prospective trial.
Clin. Cancer Res. 2024; 30: 3147-56.
КАК ЧАСТОТА И ИНТЕНСИВНОСТЬ ФИЗИЧЕСКОЙ НАГРУЗКИ ВЛИЯЮТ НА ОТДАЛЕННЫЕ РЕЗУЛЬТАТЫ ЛЕЧЕНИЯ БОЛЬНЫХ ОПЕРАБЕЛЬНЫМ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ
Благодаря современным методам диагностики и лечения больные раком
молочной железы как с локальным,
так и с метастатическим процессом
стали жить дольше, у них реже отмечается прогрессия заболевания. В
связи с этим приобрел актуальность
вопрос, какой образ жизни пациенток
может позитивно влиять на течение
заболевания. Уже сегодня существуют многочисленные свидетельства,
основанные в основном на ретроспективных опросах пациенток, что
следование здоровому образу жизни
сочетается с благоприятным прогнозом. Таким образом, модификация
образа жизни, которая сопровождается минимальной токсичностью,
лучше контролирует симптомы заболевания и улучшает качество жизни,
могла бы быть важным дополнением
к проводимому противоопухолевому
лечению.
Существенным компонентом здорового образа жизни является физическая активность. Занятия физическими упражнениями во время
постановки диагноза, лечения или последующего наблюдения, в частности,
занятия йогой, могут оказывать позитивное влияние на результаты лечения. Метаанализы проведенных исследований демонстрируют снижение
риска смертности как от всех причин,
так и от рака молочной железы среди
тех, кто сообщает о более высоком
уровне физической активности как
до, так и после постановки диагноза.
Однако конкретные рекомендации,
какая физическая нагрузка, ее объем
и интенсивность дают наибольший
выигрыш, отсутствуют. Исследование
Soldato et al, опубликованное в Journal
of Clinical Oncology, было направлено
на заполнение этого пробела путем
оценки связи между объемом физической нагрузки после постановки
диагноза и выживаемостью без отдаленных метастазов (DRFI) у пациентов с первичным раком молочной
железы. Не менее важным вопросом
является, какие пациентки в наибольшей степени выигрывают от занятий
физкультурой.
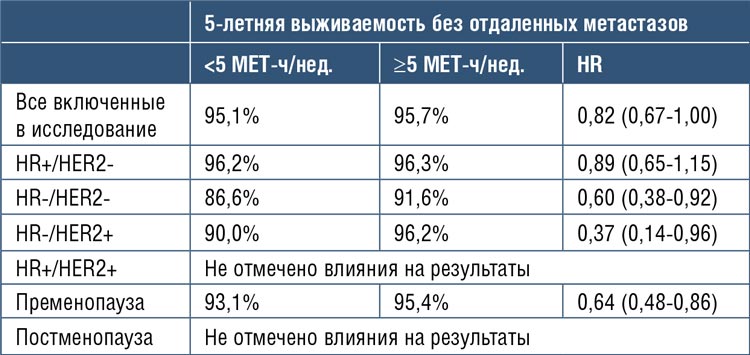
Таблица 1.
Показатели 5-летней выживаемости без отдаленных
метастазов в зависимости от объема физической нагрузки.
Для этого при проведении проспективного исследования канцерогенной
токсичности противоопухолевого лечения (CANTO) у 10359 больных раком молочной железы I-III стадий на
фоне противоопухолевого лечения и
в процессе дальнейшего наблюдения
изучался характер и объем физической нагрузки с помощью Глобального опросника по физической активности (GPAQ-16). Объем физической
нагрузки рассчитывалась путем умножения частоты сеансов активности
в неделю на среднюю продолжительность сеанса и его интенсивность,
определяемую по стандартизированному значению метаболических затрат (MET), чтобы получить общее
количество часов MET в неделю
(MET-ч/нед.). Первичной конечной
точкой была 5-летняя выживаемость
без отдаленных метастазов (DRFI).
Результаты показали нелинейную
связь между физической активностью и DRFI (табл.1). Позитивное
влияние физической нагрузки было
отмечено при достижении уровня 5
MET-ч/нед. (HR 0,82; 95% CI 0,61-1,00
для ≥5 MET-ч/нед. против <5 MET-ч/
нед.). Уровень 5 MET-ч/нед. эквивалентен примерно 90 минутам умеренных упражнений в неделю: ходьба,
лечебная физкультура, йога. При увеличении нагрузки от 5 до 25 MET-ч/
нед. (эквивалентно 5 часам умеренных занятий в неделю) зафиксировано достоверное снижение относительного риска прогрессирования на
35% (HR=0,65). Дальнейшее повышение нагрузки более 25 МЕТ-ч/нед. не
дает дополнительных преимуществ.
Выигрыш от физических нагрузок в
указанных пределах был особенно
заметен у больных с отрицательным
гормональным рецептором (HR−),
в частности, достоверное снижение риска прогрессирования на 41%
было отмечено в популяции больных
тройным негативным РМЖ (HR−/
HER2) и на 63% у больных с HER2-
позитивным раком при наличии
отрицательных рецепторов (HR−/
HER2+), а также у женщин в пременопаузе (HR 0,64; 95% ДИ 0,48-0,86), у
которых объем физической нагрузки
составлял ≥5 MET-ч/нед.
Результаты данного исследования
подчеркивают потенциальную терапевтическую роль умеренных
упражнений в снижении рецидива
рака молочной железы. Уже необременительные ежедневные занятия
физкультурой в течение 20-30 минут
оказывают положительное влияние
на прогноз заболевания. Особенно существенное снижение риска
прогрессирования при физической
активности отмечено у молодых
(пременопаузальных) пациенток с
агрессивными фенотипами заболевания. Это не означает, что не следует
рекомендовать умеренные занятия
физкультурой больным в постменопаузе или с наличием гормональных
рецепторов в опухоли, которые не
ухудшают прогноз, но будут оказывать позитивное влияние на общее
физическое и психоэмоциональное
состояние. Возможно, что короткий
период наблюдения (5 лет) в этом исследовании не позволил обнаружить
влияние физической активности на
прогноз этих больных, у которых мы
часто наблюдаем прогрессирование
после 5 лет с момента окончания локальной терапии. При планировании
занятий физкультурой следует рекомендовать ее проведение на регулярной основе в течение длительного
времени и ограничить нагрузку не
более 45-60 минут в день или 5 часов
в неделю.
В целом данное исследование сообщает ценную информацию о связи между
интенсивностью физических упражнений и рецидивом рака молочной
железы. Демонстрируя, что умеренная
физическая нагрузка может снизить
риск отдаленного метастазирования,
особенно у определенных подтипов
и женщин в пременопаузе, это исследование подчеркивает важность ее
интеграции в программу здорового
образа жизни для больных после постановки диагноза первичного рака
молочной железы. Мне кажется, что
данная рекомендация может быть распространена на всех больных злокачественными опухолями различных
локализаций в определенном данным
исследованием диапазоне нагрузок.
Даже если занятия физкультурой не
улучшат результаты противоопухолевого лечения у определенных больных, они окажут позитивное влияние
на его психоэмоциональное состояние, работоспособность, переносимость проводимого лечения. Больным
с распространенным процессом и тем,
кому проводится противоопухолевое
лечение, можно рекомендовать ежедневные умеренные физические нагрузки длительностью 15-30 минут,
больным без признаков заболевания
после проведенного лечения объем
физической нагрузки будет определяться возрастом, общим состоянием
и наличием сопутствующих заболеваний, но для большинства будет достаточно ежедневных упражнений и
ходьбы в течение 45-60 минут. Наша
задача – донести эту информацию до
пациента и его близких и мотивировать его активно включиться в борьбу
за свое собственное благополучие.
Источник:
Soldato D, Michiels S, Havas J,
et al. Dose/exposure relationship of exercise
and distant recurrence in primary breast
cancer. J. Clin. Oncol. 2024. Published
online: June 5, 2024.
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / ЦИСПЛАТИН В РЕЖИМЕ SPLIT-DOSE ПРИ МЕСТНОРАСПРОСТРАНЕННОМ НЕОПЕРАБЕЛЬНОМ/МЕТАСТАТИЧЕСКОМ УРОТЕЛИАЛЬНОМ РАКЕ (МУР): СИСТЕМАТИЧЕСКИЙ ОБЗОР И СЕТЕВОЙ МЕТААНАЛИЗ (СМА)
Ввиду низкой доступности комбинации энфортумаба ведотина и пембролизумаба [1] в реальной клинической практике
стандартом 1 линии терапии УР
остается режим гемцитабин/цисплатин (GC) с совместным или
последовательным проведением
иммунотерапии (ИТ) [2,3]. Примерно у половины пациентов с
мУР имеются противопоказания
к цисплатину (Критерии Гальского – сердечная/почечная дисфункция, нейропатия, оценка слуха,
ECOG PS [4]), в подобной ситуации альтернативными подходами
являются карбоплатин-содержащие режимы ХТ и ИТ [5]. В то же
время есть определенная когорта
пациентов с промежуточным значением СКФ 40-60 мл/мин/1,73 м2
и ECOG PS 0-1, которая может выиграть от проведения цисплатинсодержащей ХТ [6]. Часто именно
для этой подгруппы применяется дробное введение цисплатина
(режим split-dose) – по 35 мг/м2
в
день 1 и 8 вместо 70 мг/м2
в день
1 как при классическом режиме.
А стоит ли биться за цисплатин,
учитывая токсический профиль
препарата?
В крупный метаанализ [7] включено 16 исследований, посвященных оценке эффективности
дробного введения цисплатина
(в 10 публикациях – режим GC, 1
линия терапии, в половине – введение в день 1 и 8).
Результаты:
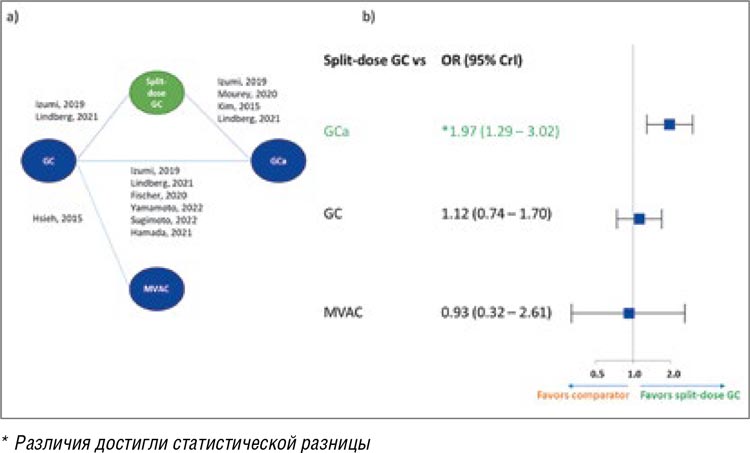
• Частота объективных ответов (ЧОО) колеблется от 39% до 80%; при проведении сетевого метаанализа (4 исследования: в 2 группах сравнения – GC и гемцитабин/карбоплатин (GCa); в 2 – только GCa) показатель ЧОО значимо выше в группе пациентов, получивших GC split-dose, нежели гемцитабин/карбоплатин (ОШ 1,97; 95% ДИ 1,29-3,02), и сопоставим с режимом GC (рис.1).
Рисунок 1.
Сетевой метаанализ (а) и результаты (b) по ЧОО.
GC – гемцитабин/цисплатин; GCa – гемцитабин/карбоплатин;
MVAC – метотрексат/винбластин/доксорубицин/цисплатин;
split-dose GC – разделенная доза цисплатина в комбинации
с гемцитабином; OR – отношение шансов
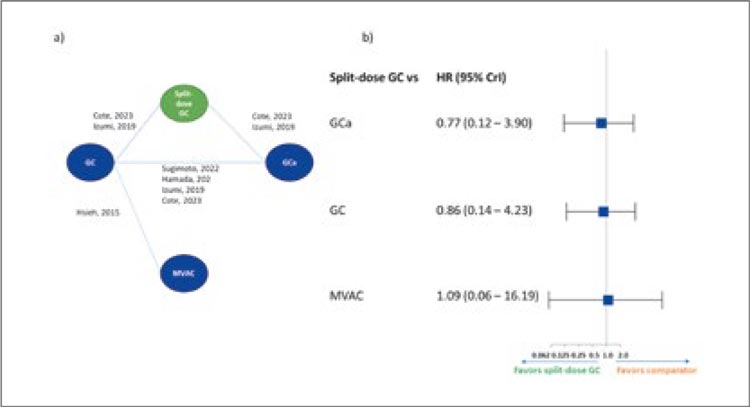
• мВБП составила от 3,5 до 9,9 мес.; при проведении СМА (5 исследований) мВБП не отличается при сравнении с режимами GCa, GC, MVAC. Тем не менее, отношение рисков (ОР) указывает на возможную несколько большую эффективность режима GC split dose против GCa (ОР 0,77; 95% ДИ 0,12-3,90) и vs GC (ОР 0,86; 95% ДИ 0,14-4,23). ОР мВБП GC split-dose и MVAC составило 1,09 (95% ДИ 0,06-16,19) (рис.2).
Рисунок 2.
Сетевой метаанализ (а) и результаты (b) по мВБП.
GC – гемцитабин/цисплатин; GCa – гемцитабин/карбоплатин;
MVAC – метотрексат/винбластин/доксорубицин/цисплатин;
split-dose GC – разделенная доза цисплатина в комбинации с
гемцитабином; НR – отношение рисков
• мОВ составила от 8,5 до 18,1 мес.; при проведении СМА (n=11) ОР мОВ режима GC split-dose против GCa, GC, MVAC составили 0,78 (95% ДИ 0,48-1,27), 0,91 (95% ДИ 0,57-1,48) и 0,87 (95% ДИ 0,53-1,43) соответственно.
• Безопасность подхода: частота отмены терапии в режиме splitdose в связи с развитием НЯ составила от 5% до 38%; в 3 публикациях данный показатель колебался от 21% до 38%, в 3 других – от 5% до 8%. Среди режимов сравнения частота преждевременного завершения ХТ составила: GCa – от 17% до 25% (2 исследования), GC – от 18% до 19% (3 исследования).
• Почечная токсичность как причина завершения ХТ колебалась от 0% (2 исследования) до 36,8% (1 исследование). В 2 исследованиях не продемонстрировано различий в почечной токсичности среди комбинаций GC split-dose против GCa и GC split-dose против GC.
Рисунок 3.
Клинические факторы, обуславливающие выбор
различных лекарственных опций 1 линии терапии в реальной
клинической практике
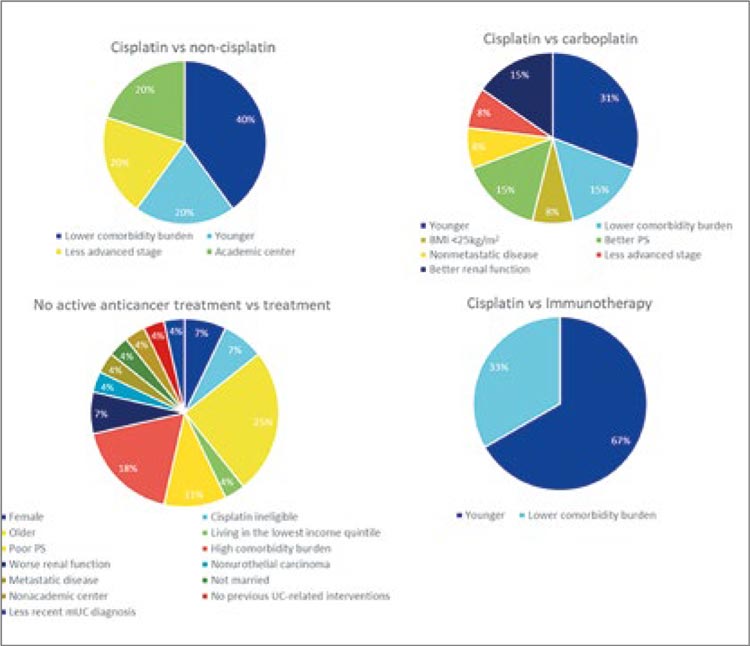
• Наиболее частыми причинами
проведения ХТ в режиме GC splitdose явились почечная недостаточность, неудовлетворительный
соматический статус, пожилой
возраст, наличие сопутствующих
заболеваний в 89%, 44%, 33% и
33% соответственно. На рисунке 3 представлены клинические
данные, обуславливающие выбор
лекарственной опции 1 линии в
реальной клинической практике.
Предпочтение в проведении цисплатин-содержащей ХТ отдается
молодым пациентам с малым числом сопутствующих заболеваний.
Платиносодержащая химиоиммунотерапия – наиболее доступная и эффективная опция лечения пациентов с мУР. Ввиду отсутствия крупных рандомизированных исследований по сравнению эффективности цис- и карбоплатин-содержащих режимов в 1 линии мУР необходимо проведение ХТ, основанной на карбоплатине, тогда, когда это не удовлетворяет критериям Гальского (СКФ >50- 60 мл/мин/1,73 м2, нейропатия ≤2степени, снижение слуха ≤2 степени, ECOG PS ≤1, СН ФК <III по NYHA). Тем не менее, есть группа пациентов с «пограничным значением СКФ» (в диапазоне от 40 до 60 мл/мин/1,73 м2), которая может выиграть от проведения цисплатин-содержащей ХТ как в ЧОО, так и в мВБП, мОВ. В подгрупповом анализе исследования JAVELIN Bladder 100 дельта мОВ между группами пациентов, получивших GC и GCa, составила 5,2 мес. (31 против 25,8 мес.) [8]. Стоит ли биться за цисплатин в «пограничной зоне»? Личное мнение автора – да, особенно для молодых пациентов без выраженной сопутствующей патологии с целью достижения большей ЧОО и, возможно, мВБП и мОВ.
Источники:
- Van Der Heijden MS, Gupta S, Bedke J, et al. Enfortumab vedotin (EV) with pembrolizumab (P) versus chemotherapy (chemo) in previously untreated locally advanced or metastatic urothelial carcinoma (la/ mUC): Analysis of the cisplatin (cis)- ineligible population from EV-302/ KEYNOTE-A39. Journal of Clinical Oncology. 2024; 42 (16_suppl): 4563- 4563. doi:10.1200/JCO.2024.42.16_ suppl.4563.
- Powles T, Park SH, Voog E, et al. Avelumab Maintenance Therapy for Advanced or Metastatic Urothelial Carcinoma. New England Journal of Medicine. 2020; 383(13): 1218- 1230. doi:10.1056/NEJMOA2002788/ SUPPL_FILE/NEJMOA2002788_ DATA-SHARING.PDF.
- Van der Heijden MS, Sonpavde G, Powles T, et al. Nivolumab plus Gemcitabine–Cisplatin in Advanced Urothelial Carcinoma. New England Journal of Medicine. 2023; 389(19): 1778-1789. doi:10.1056/ NEJMOA2309863/SUPPL_FILE/ NEJMOA2309863_DATA-SHARING. PDF.
- Bamias A, Tzannis K, Harshman LC, et al. Impact of contemporary patterns of chemotherapy utilization on survival in patients with advanced cancer of the urinary tract: A Retrospective International Study of Invasive/ Advanced Cancer of the Urothelium (RISC). Annals of Oncology. 2018; 29(2): 361-369. doi:10.1093/annonc/ mdx692.
- Moschini M, Gandaglia G, Dehò
F, Salonia A, Briganti A, Montorsi F.
Bladder cancer: ESMO Clinical Practice
Guideline for diagnosis, treatment
and follow-up. Annals of Oncology.
2022; 33(5): 561. doi:10.1016/j.
annonc.2022.01.075.
- Bladder Cancer – Guidelines Detail.
https://www.nccn.org/guidelines/
guidelines-detail?category=1&id=1417.
Accessed July 29, 2024.
- O’Dwyer R, Musat M, Gulas I, et
al. Split-dose cisplatin in patients with
locally advanced or metastatic urothelial
carcinoma: a systematic literature
review and network meta-analysis. Clin
Genitourin Cancer. 2024; 0(0): 102176.
doi:10.1016/J.CLGC.2024.102176
- Grivas P, Grande E, Davis ID, et
al. Avelumab first-line maintenance
treatment for advanced urothelial
carcinoma: review of evidence to guide
clinical practice. ESMO Open. 2023; 8(6).
doi:10.1016/J.ESMOOP.2023.102050/
ATTACHMENT/37068FAD-1806-
4F4E-9680-A2397DBCE071/MMC1.
DOCX.
Материал подготовил
Э.Р. Исраелян
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / CABASTY TRIAL: ВЛИЯНИЕ КАБАЗИТАКСЕЛА В ДВУХ- И ТРЕХНЕДЕЛЬНОМ РЕЖИМАХ НА БОЛЕВОЙ СИНДРОМ И КАЧЕСТВО ЖИЗНИ У ПОЖИЛЫХ ПАЦИЕНТОВ ПРИ МКРРПЖ
Сложно представить современное
лечение метастатического кастрационно-резистентного рака предстательной железы (мКРРПЖ) без
кабазитаксела. Однако, учитывая
профиль токсичности препарата
(высокая частота нейтропений, фебрильных нейтропений (ФН)), не
все пациенты, особенно старшей
возрастной группы (≥65 лет), являются кандидатами для терапии
данным препаратом в стандартном режиме. Ранее в исследовании
III фазы CABASTY кабазитаксел
в дозе 16 мг/м2 1 раз в 2 недели +
Г-КСФ в день 3-7 продемонстрировал меньшую частоту развития
нейтропении 3 степени и/или ФН
в сравнении с 25 мг/м2 1 раз в 3
недели + Г-КСФ в день 3-7 (5,1%
против 62,5%, р<0,001), при схожей
эффективности (медиана рВБП
7,82 против 10,25 мес., р=0,89 соответственно).
В журнале European Urology
Oncology представлены данные
по вторичным конечным точкам:
болевой синдром (NPRS score), потребность в анальгетиках и качество жизни (FACT-p score).
Получены следующие
результаты:
• Прогрессирование болевого синдрома отмечено у 31,6% и 36,9%
(р=0,9) пациентов в группах двухи трехнедельного режимов соответственно.
• Медиана времени до прогрессирования болевого синдрома не достигнута (stratified HR = 1,7; 95% CI
0,7-4,2; p=0,3) (рис.1).
Рисунок 1.
Время до прогрессирования болевого синдрома и
до первого применения опиатов в группах 2- и 3-недельного
режимов.
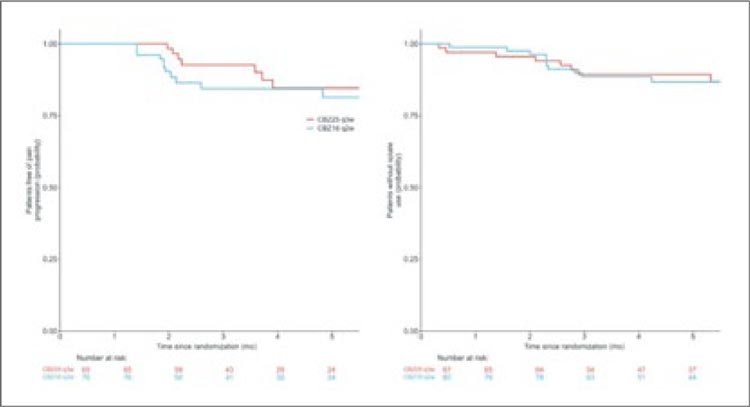
• Медиана времени до старта терапии опиатами не достигнута (HR 1,05; 95% CI 0,4-2,6; p=0,9).
• Показатель по шкале FACT-p total score не различался между группами ни до старта, ни во время терапии, за исключением оценки функционального статуса (HR 1,9; 95% CI 1,1-3,2; p=0,020).
• В группе двухнедельного подхода несколько позже отмечается развитие таких НЯ, как диарея (р=0,05), тошнота и рвота (р=0,013), нарушение аппетита (р=0,019).
Результаты данного исследования
расширяют когорту пациентов, являющихся кандидатами для терапии
кабазитакселом в двухнедельном режиме без ущерба как для онкологических результатов, так и для качества
жизни, при меньшей токсичности
лечения. При этом стоит отметить,
что около 50% включенных пациентов старше 75 лет, что делает данные
результаты важными для ежедневной клинической практики.
Источник:
Stephane Oudard, et al. Pain and Health-related Quality of Life with Biweekly Versus Triweekly Cabazitaxel Schedule in Older Men with Metastatic Castration-resistant Prostate Cancer in the Multicenter, Randomized CABASTY Trial. European Urology Oncology. Available online: 13 August 2024 (In Press). https://doi.org/10.1016/j. euo.2024.07.011
Материал подготовил
Э.Р. Исраелян
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / ДОЛГОСРОЧНЫЕ РЕЗУЛЬТАТЫ НАБЛЮДЕНИЯ В ИССЛЕДОВАНИЯХ IMPOWER133 И IMBRELLA A
В журнале Lung cancer опубликованы результаты 5-летнего
наблюдения за пациентами из
группы атезолизумаба, перешедших после завершения исследования IMpower133 в исследование IMbrella А. Напомним, что
IMpower133 – это исследование
III фазы, оценивавшее эффективность атезолизумаба с этопозидом и карбоплатином у пациентов
с метастатическим МРЛ в первой
линии терапии.
На момент закрытия исследования IMpower133 пациенты, получавшие атезолизумаб (то есть
только больные из экспериментальной группы), имели право
участвовать в расширенном исследовании III фазы IMbrella A,
где они продолжали получать
атезолизумаб в дозе 1200 мг 1 раз
в 3 недели. Первичной конечной
точки не было. Для пациентов из
IMpower133 вторичной конечной
точкой была общая выживаемость.
На момент завершения IMpower133 медиана наблюдения составила 35,7 мес. для группы атезолизумаб + ХТ и 26,4 мес. для группы плацебо + ХТ. Медиана наблюдения за группой атезолизумаба в объединенном анализе IMpower133 и IMbrella А составила 59,4 мес. В итоге 18 пациентов перешли в IMbrella А.
Результаты:
• В группе атезолизумаба 1-, 2-, 3-,
4-, и 5-летняя ОВ составила 52%,
22%, 16%, 13% и 12% соответственно
(рис.1).
Рисунок 1.
Результаты ХИТ НМРЛ в зависимости
от применения антибиотикотерапии.
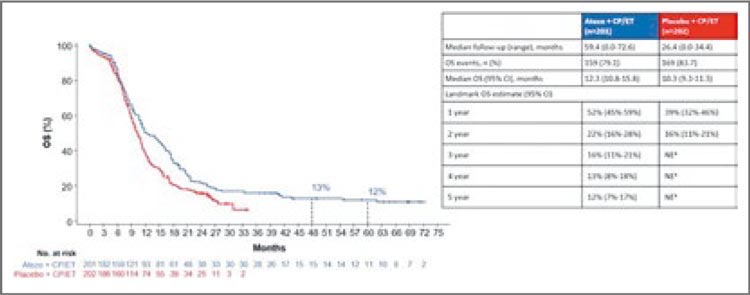
• В группе плацебо + ХТ известны результаты только 1- и 2-летней ОВ: 39% (32-46%) и 16% (11-21%) соответственно.
• 11 пациентов в группе атезолизумаба были живы на момент среза 5-летнего наблюдения (5-летняя ОВ 12% против 2% исторического контроля).
Этот долгосрочный анализ пациентов из IMbrella A, ранее включенных
в IMpower133, представляет собой
первый отчет о 5-летних результатах
общей выживаемости у пациентов с
мелкоклеточным раком легкого распространенной стадии, получавших
лечение с помощью иммунотерапии
и химиотерапии первой линии. Несмотря на ограничения из-за небольшого числа пациентов и отсутствия
долгосрочных данных для контрольной группы IMpower133, данные по
общей выживаемости у пациентов
из группы атезолизумаба оказались
выгодно сопоставимы с историческими данными по использованию
только химиотерапии.
Источник:
Reck M. et al. Five-year survival in patients with extensivestage small cell lung cancer treated with atezolizumab in the Phase III IMpower133 study and the Phase III IMbrella a extension study. Lung Cancer. 2024, August 10. https://doi. org/10.1016/j.lungcan.2024.107924.
Материал подготовил
Э.Р. Исраелян
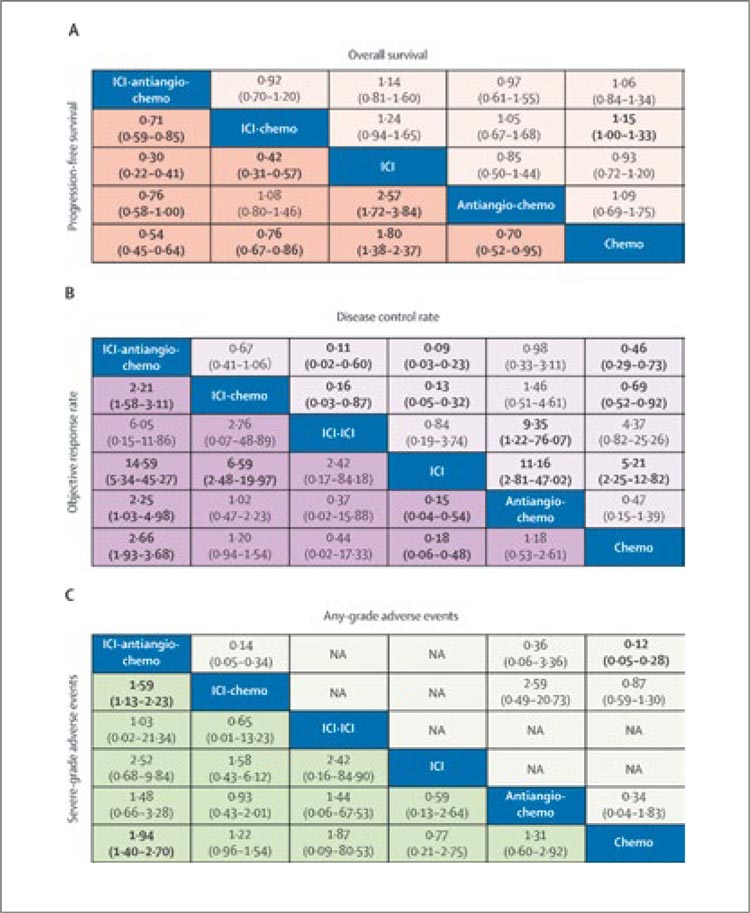
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / ЕЩЁ ОДНО ПОДТВЕРЖДЕНИЕ НЕЭФФЕКТИВНОСТИ МОНОИММУНОТЕРАПИИ У ПАЦИЕНТОВ С EGFR MUT+ НМРЛ
В журнале Lancet Oncology опубликован метаанализ по оценке
различных вариантов лечения
с применением чек-поинт ингибиторов среди пациентов с
EGFR+ НМРЛ, у которых наступило прогрессирование на ИТК.
Многочисленные клинические
исследования показали, что иммунотерапия (ИТ) в первой и
второй линии не улучшает выживаемость пациентов с мутациями
EGFR, даже среди пациентов с
экспрессией PD-L1 >50%. Вопрос:
является ли мутация EGFR негативным фактором эффективности иммунотерапии?
В исследовании ATLANTIC (дурвалумаб в 3 или последующих
линиях) было показано, что у
пациентов с мутациями EGFR
или ALK ОВ была, по крайней
мере, не ниже, чем у пациентов
без мутаций EGFR или ALK. Что
касается комбинированной терапии, то в исследовании III фазы
IMpower150 в подгруппе пациентов с мутациями EGFR, которые
ранее лечились ИТК, добавление
атезолизумаба с бевацизумабом
улучшило ОВ.
В РКИ III фазы ORIENT-31 было
продемонстрировано, что комбинация химиотерапия + синтилимаб (ингибитор PD-1) и IBI305
(биоаналог бевацизумаба) улучшила ВБП у пациентов с прогрессированием на EGFR-ИТК.
Между тем, в CheckMate-722 добавление ниволумаба привело
лишь к небольшому улучшению
ВБП, которое не достигло статистической значимости по сравнению только с химиотерапией.
Таким образом, добавление ИТ
остается спорным при НМРЛ с
мутациями EGFR, особенно у
пациентов с прогрессированием на EGFR-ИТК, у которых возможности лечения ограничены.
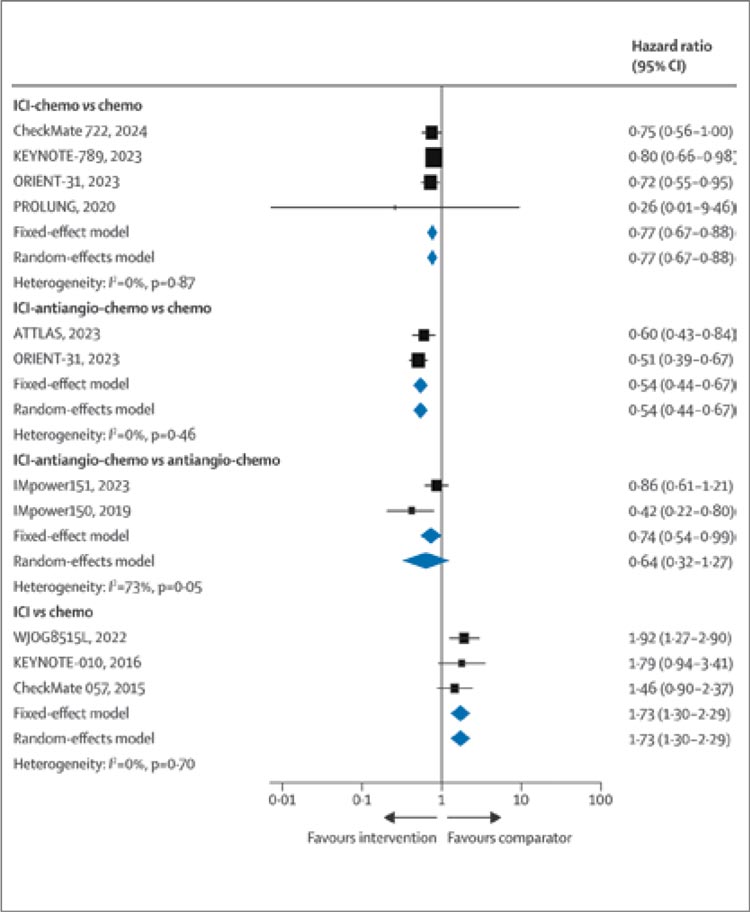
Результаты данного метаанализа подтверждают тот факт, что
моно-ИТ в последующих линиях
после прогрессирования на ИТК
не улучшает ВБП (рис.1). По сравнению с химиотерапией монотерапия ИТ приводила к более
короткой ВБП: HR=1,73 (95% ДИ
1,30-2,29). При этом комбинированная ИТ + ХТ + антиангиогенная терапия (HR=0,54 [0,44-0,67])
и ИТ+ХТ (HR=0,77 [0,67-0,88])
обеспечивают более длительную
ВБП. ИТ + ХТ + антиангиогенная
терапия обеспечивает наилучшие
результаты ВБП по сравнению с
ИТ+ХТ (HR=0,71 [95% ДИ 0,59-
0,85]), монотерапией ИТ (HR=0,30
[0,22-0,41]), только антиангиогенной терапией + ХТ (HR=0,76 [0,58-
1,00]) и только ХТ (HR=0,54 [0,45-
0,64]). Однако «квартет» связан
с более высокой частотой НЯ 3
степени.
Рисунок 1.
Совокупный анализ показателя ВБП в парном
сравнении.
Авторы сделали вывод, что
для лиц с прогрессирующим
EGFR-мутированным НМРЛ, у которых наблюдалось прогрессирование на EGFR-TKI, ICIантиангиохимиотерапия была
определена как оптимальный вариант лечения. Токсичность этого лечения была приемлемой, но
требовала тщательного внимания.
ICI-химиотерапия показала значительно большую эффективность,
чем стандартная химиотерапия
(рис.2). Эти результаты прояснили
роль различных стратегий на основе ICI в этой трудно поддающейся
лечению рефрактерной популяции,
потенциально дополняя недавние
рекомендации.
Рисунок 2.
Совокупный анализ ОВ, контроля над болезнью
и НЯ по данным метаанализа.
Источник:
Y Zhao, Y He, W Wang, Q Cai, F Ge, et al. Efficacy and safety of immune checkpoint inhibitors for individuals with advanced EGFRmutated non-small-cell lung cancer who progressed on EGFR tyrosinekinase inhibitors: a systematic review, meta-analysis, and network meta-analysis. The Lancet Oncology. 2024. ISSN 1470-2045. https://doi. org/10.1016/S1470-2045(24)00379-6.
Материал подготовила
А.В. Фатеева
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / ДОКСОРУБИЦИН В КОМБИНАЦИИ С ТРАБЕКТИДИНОМ С ПОСЛЕДУЮЩЕЙ ПОДДЕРЖИВАЮЩЕЙ ТЕРАПИЕЙ ТРАБЕКТИДИНОМ СПОСОБСТВУЕТ ПОВЫШЕНИЮ ВЫЖИВАЕМОСТИ ПАЦИЕНТОВ С ЛЕЙОМИОСАРКОМОЙ
Обновленные результаты III фазы
исследования LMS04, направленного на оценку эффективности комбинации доксорубицина с трабектидином по сравнению с монотерапией
доксорубицином, продолжают подтверждать улучшение безрецидивной и общей выживаемости у пациентов с лейомиосаркомой (ЛМС)
матки и мягких тканей.
В прошлом году результаты этого
исследования были представлены
на конгрессе ESMO, однако преимущества по выживаемости все еще
не привели к утверждению данной
комбинации в качестве стандарта
первой линии лечения ЛМС. Надеемся, что скоро ситуация изменится.
Обновленные данные:
• Медиана безрецидивной выживаемости (мВБП) составила
12 месяцев против 6 месяцев в
Рисунок 1. Выживаемость без прогрессирования в группах
Рисунок 2. Общая выживаемость в группах
группе только с доксорубицином,
HR=0,37 (рис.1).
Рисунок 1.
Выживаемость без прогрессирования в группах.
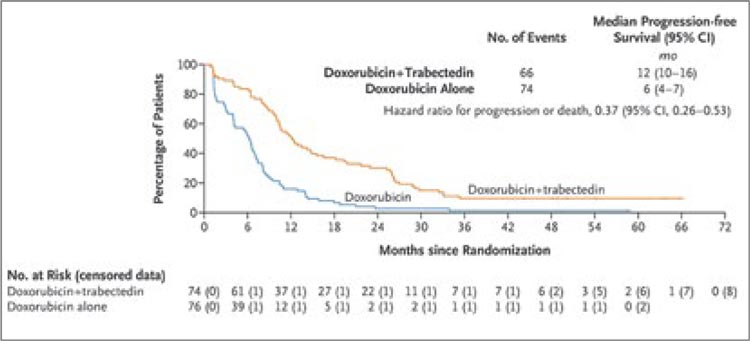
• Процент безрецидивной выживаемости через 2 года – 30% против 3% соответственно.
• Медиана общей выживаемости (мОВ) составила 33 месяца против 24 месяцев, HR=0,65 (рис.2).
Рисунок 2.
Общая выживаемость в группахх.
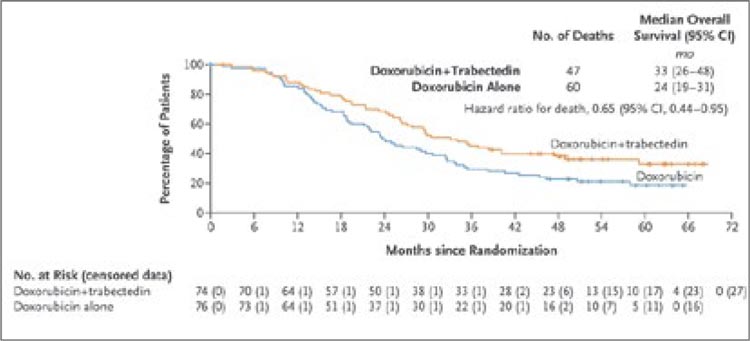
• Общая выживаемость через 2 года – 68% против 49%.
• Частота объективного ответа (ЧОО) – 36% против 13%. На протяжении десятилетий стандартом первой линии терапии ЛМС является доксорубицин, и изменить этот стандарт не так просто.
Комбинация доксорубицина и трабектидина демонстрирует выдающуюся общую выживаемость в 33
месяца, но при этом возрастает частота токсичности, что требует более
тщательного отбора пациентов для
такого лечения.
Тем не менее, результаты исследования LMS04 подтверждают обоснованность использования комбинации препаратов для лечения
метастатических лейомиосарком в
первой линии, вызывая надежду на
улучшение результатов среди этой
сложной группы пациентов.
Источник:
Patricia Pautier, et al. Doxorubicin-Trabectedin with Trabectedin Maintenance in Leiomyosarcoma. N Engl J Med. 2024; 391: 789-799. DOI: 10.1056/ NEJMoa2403394.
Материал подготовила
А.В. Фатеева
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / TAPIR TRIAL: ТОЦИЛИЗУМАБ ЭФФЕКТИВЕН ПРИ ЛЕЧЕНИИ ИММУНООПОСРЕДОВАННОГО АРТРИТА
Артрит, связанный с применением
ингибиторов иммунных контрольных точек, может быть стойким и
существенно влияет на качество
жизни пациентов, требуя прекращения ИТ и длительного применения ГКС. Хотя в клинических исследованиях сообщается о частоте
артритов в диапазоне от 5% до 11%,
мнение экспертов предполагает,
что данные о иНЯ могут быть занижены. Наиболее распространенные ревматические иНЯ включают воспалительный полиартрит и
синдромы, подобные ревматической полимиалгии (PMR).
В отличие от классических результатов, наблюдаемых у пациентов с
ревматоидным артритом, у пациентов с ICI-AR редко выявляется
положительный результат на ревматоидный фактор или антитела
к цитруллинированному белку
(ACPA).
Ретроспективное исследование
TAPIR (n=26) продемонстрировало
высокую эффективность тоцилизумаба (ингибитора рецептора интерлейкина-6) в сочетании с преднизолоном уже через 10 недель от
начала лечения иНЯ; 81% этих пациентов также достигли ремиссии
без стероидов после 24 недель лечения тоцилизумабом (рис.1).
Рисунок 1.
Непосредственные результаты применения
тоцилизумаба по данным исследования TAPIR.
Несмотря на ретроспективный характер исследования, комбинация
тоцилизумаба с преднизолоном является жизнеспособной как для лечения иммуноопосредованного артрита, так и для его профилактики.
Источник:
Petit P-F, et al. Tocilizumab provides dual benefits in treating immune checkpoint inhibitorassociated arthritis and preventing relapse during ICI rechallenge: the TAPIR study. Annals of Oncology. Vol.0, Issue 0.
Материал подготовила А.В. Фатеева
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / ETER701: ПРИМЕНЕНИЕ КОМБИНАЦИИ БЕНМЕЛСТОБАРТА, АНЛОТИНИБА И ХИМИОТЕРАПИИ В ЛЕЧЕНИИ РАСПРОСТРАНЕННОГО МЕЛКОКЛЕТОЧНОГО РАКА ЛЕГКОГО
На долю мелкоклеточного рака
приходится до 15% от всех злокачественных опухолей легких,
при этом у превалирующего числа
пациентов заболевание впервые
выявляется уже на этапе распространенного процесса. Несмотря
на активное использование иммунотерапии, возможности которой
были впервые продемонстрированы в IMpower133, отдаленный
прогноз при мелкоклеточном раке
легкого (МРЛ) остается неудовлетворительным, а медиана общей
выживаемости (ОВ) и 5-летняя ОВ
не превышают, соответственно, 11-
15% и 1-5%. В свою очередь, интенсификация лечения за счет проведения двойной иммунологической
блокады (CASPER) не обеспечила
должного улучшения отдаленных
результатов лечения, показав отсутствие положительного влияния
комбинации дурвалумаб + тремелимумаб + ХТ на ОВ при PDL1<1% и небольшое увеличение
медианы ОВ при PD-L1>1% до 15,5
мес. в группе дурвалумаб + тремелимумаб + ХТ по сравнению с 14,6
мес. и 12,2 мес. в группах дурвалумаб + ХТ и ХТ соответственно [1].
Попытки модификации терапии
не прекращались. В августе 2024
года были представлены результаты рандомизированного исследования III фазы ETER701,
исследовавшего возможности сочетания китайских препаратов:
иммунотерапевтического агента
бенмелстобарта и мультикиназного ингибитора анлотиниба [2].
Рациональность подобного подхода авторы аргументируют имеющимися данными об усилении
инфильтрации иммунными клетками опухоли и окружающих тканей при нормализации сосудистой
архитектоники, наблюдающейся
при применении анти-VEGF препаратов [3,4]. Авторы включили
1005 пациентов и рандомизировали их в группы бенмелстобарт +
анлотиниб + ХТ (группа А, n=246),
анлотиниб + ХТ (группа B, n=245)
и плацебо + ХТ (группа контроля,
n=247). Группы были хорошо сбалансированы, а выборка включала пациентов преимущественно
с IV стадией заболевания (89,4%,
n=660). Первичными конечными
точками служили медиана общей
выживаемости и выживаемости
без прогрессирования, а вторичные конечные точки включали
оценку глубину и длительности сохранения объективного ответа по
данным RECIST1.1.
Рисунок 1.
Общая выживаемость в ETER701.
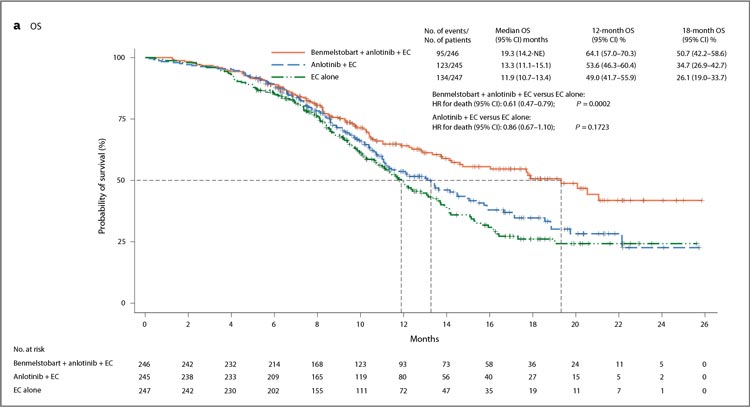
Авторами были получены положительные результаты. При медиане
наблюдения в 14,0 мес. (Intentionto-treat) медиана ОВ в группе А
была улучшена до 19,3 мес. по
сравнению с 11,9 мес. в группе контроля (ОР 0,61; 95% ДИ 0,47-0,79;
p=0,0002). В свою очередь, в группе
B (анлотиниб + ХТ) достоверного улучшения ОВ по сравнению с
только химиотерапией выявлено
не было – 13,3 против 11,9 мес. (ОР
0,86; 95% ДИ 0,67-1,10, p=0,1723).
Показатели 18-месячной ОВ в 3
группах составили 50,7%, 34,7% и
26,1% соответственно (рис.1). При
оценке выживаемости без прогрессирования (ВБП) определялось
аналогичное увеличение показателя медианы в группах А и B до
6,9 мес. (ОР 0,32; 95% ДИ 0,26-0,41,
p<0,0001) и 5,6 мес. (ОР 0,44; 95%
ДИ 0,36-0,55, p<0,0001) соответственно по сравнению с 4,2 мес.
в группе контроля, а показатель
12-месячной ВБП в экспериментальных и контрольной группах
составил 27,9%, 12,6% и 2,3% соответственно.
Рисунок 2.
Подгрупповой анализ по показателю ОВ в ETER701.
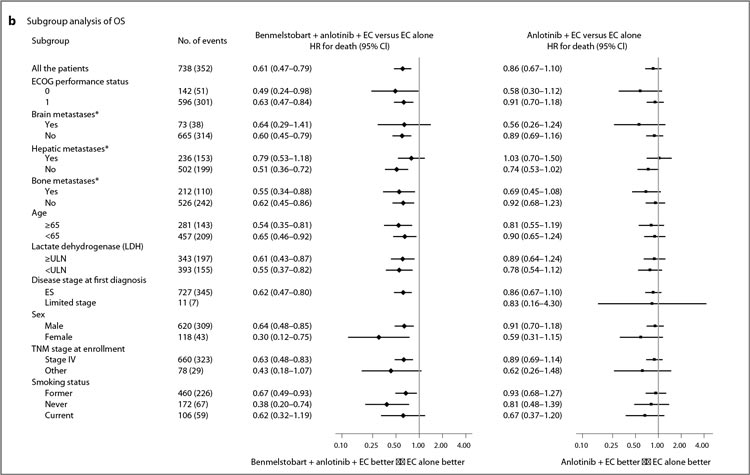
Проведенный подгрупповой анализ подтвердил высокую эффективность комбинированной иммунохимиотаргетной терапии у превалирующего числа включенных пациентов, однако также подчеркнул отсутствие достоверных различий по эффективности комбинированной и конвенциональной химиотерапии у пациентов с метастазами в печени, что согласуется с результатами ранее опубликованных исследований (рис.2) [5]. Авторы объясняют полученные данные вероятным влиянием врожденного иммуннотолерантного статуса печени и ее микроокружения, которые не только обеспечивают профилактику аутоиммунных реакций в здоровом организме, но и подавляют реакции иммунного ответа на метастатические опухолевые клетки [6]. Аналогичные данные были продемонстрированы и для пациентов с метастазами в головном мозге, однако малый размер выборки (10,2%, n=25) не позволяет делать однозначные выводы.
В то же время эффективность химиотаргетной терапии и химиотерапии во всех подгруппах достоверно не различалась (рис.2). Подобные результаты могут быть объяснены как исключительным синергизмом между иммунологическим и таргетным препаратами с отсутствием прямого независимого влияния анлотиниба на опухолевые клетки, так и различающейся в данном исследовании тактикой последующего лечения. Согласно приведенным данным, терапия второй и последующих линий проводилась у 71,3% пациентов в группе контроля, 58,4% пациентов в группе анлотиниб + ХТ и 42,7% пациентов в группе бенмелстобарт + анлотиниб + ХТ.
Терапия характеризовалась высокой частотой нежелательных явлений (НЯ) во всех группах, при этом НЯ 3 ст. определялись у 94,3% пациентов в группе A, у 95,9% в группе B и у 89% в группе контроля. Среди нежелательных явлений преобладала гематологическая токсичность и артериальная гипертензия, ассоциированная с применением анлотиниба. Гибель пациента на фоне терапии отмечалась в 4,5%, 2,5% и 1,6% случаев в 3 группах соответственно, а непосредственными причинами смерти служили пневмонит, кровохаркание, острая дыхательная недостаточность и сепсис. Редукция дозы бенмелстобарта/плацебо или пропуск очередного курса выполнялись у 50,4%, 46,3% и 33,3% пациентов в экспериментальных и контрольной группах, а медиана времени до первого пропуска курса составила 1,45 мес., 1,12 мес. и 1,35 мес. соответственно. В отношении анлотиниба/плацебо были получены аналогичные результаты: частота редукции дозы или пропуска курса составила 61,4%, 61,1% и 37,0%, а медиана времени до первого пропуска – 1,38 мес., 1,25 мес. и 1,51 мес. Важно отметить, что нарушение дозовой интенсивности бенмелстобарта и анлотиниба не приводило к достоверному ухудшению отдаленных результатов лечения в группах А (ОР 1,05; p=0,9997) и B (ОР 1,16; p=0,4726).
Таким образом, ETER701 является первой крупной рандомизированной работой, продемонстрировавшей на большой популяции возможность улучшения отдаленных результатов лечения распространенного мелкоклеточного рака легкого при сочетании химиотерапии по схеме EC с иммунологическими и мультикиназными анти-VEGF агентами. Однако крайне высокая частота нежелательных явлений и отсутствие однозначных данных по эффективности максимальной комбинации у пациентов с метастатическим поражением головного мозга и печени требуют дальнейшего анализа для уточнения конкретных претендентов на данный вид токсичного и дорогостоящего лечения.
Источники:
- Paz-Ares L, et al. Durvalumab plus platinum-etoposide versus platinumetoposide in first-line treatment of extensive-stage small-cell lung cancer (CASPIAN): a randomised, controlled, open-label, phase 3 trial. Lancet. 2019; 394: 1929-1939.
- Cheng Y, Chen J, Zhang W, et al. Benmelstobart, anlotinib and chemotherapy in extensive-stage small-cell lung cancer: a randomized phase 3 trial. Nature Medicine. Published online: 11 July 2024. https:// doi.org/10.1038/s41591-024-03132-1.
- Li T, Qiao T. Unraveling tumor microenvironment of smallcell lung cancer: implications for immunotherapy. Semin. Cancer Biol. 2022; 86: 117-125.
- Augustin HG, Koh GY. Antiangiogenesis: vessel regression, vessel normalization, or both? Cancer Res. 2022; 82: 15-17.
- Wang J, et al. Adebrelimab or placebo plus carboplatin and etoposide as first-line treatment for extensive-stage small-cell lung cancer (CAPSTONE-1): a multicentre, randomised, doubleblind, placebo-controlled, phase 3 trial. Lancet Oncol. 2022; 23: 739-747.
- Yu J, et al. Liver metastasis restrains immunotherapy efficacy via macrophage-mediated T cell elimination. Nat. Med. 2021; 27: 152- 164.
Материал подготовил И.М. Боровков
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / СОВРЕМЕННОЕ ЗНАЧЕНИЕ TROP2-НАПРАВЛЕННОЙ ТЕРАПИИ У ПАЦИЕНТОВ С РАСПРОСТРАНЕННЫМ НЕМЕЛКОКЛЕТОЧНЫМ РАКОМ ЛЕГКОГО
Появление принципиально нового класса препаратов и новых
возможных молекул-мишеней
является значимым событием
в любой области клинической
онкологии. Так, применение иммунологических анти-PD-L1
агентов и таргетных EGFR- и
ALK-ингибиторов заняло прочные позиции в терапии пациентов с немелкоклеточным раком
легкого (НМРЛ), демонстрируя
крайне высокую эффективность.
Однако не все новые препараты
показывают похожие результаты.
Одним из наиболее обсуждаемых «новичков» в 2024 году стало семейство различных конъюгатов моноклональных антител
к TROP2 – трансмембранному
гликопротеину, участвующему в регуляции процессов клеточного роста, опосредующему
опухолевую инвазию и активно
экспрессирующемуся на поверхности опухолевых клеток при
ряде высокоагрессивных злокачественных новообразований. При
НМРЛ его экспрессия определяется у абсолютного большинства
пациентов с плоскоклеточным
раком и у 64% с аденокарциномой
[1]. Несмотря на высокую распространенность и перспективность
данной мишени, эффективность
конъюгатов оказалась крайне неоднозначной. Так, в обсужденном
ранее исследовании TROPIONLung01 применение датопотамаба дерукстекана обеспечило
статистически значимое увеличение медианы выживаемость
без прогрессирования (ВБП) до
4,4 мес. (ОР 0,75; 95% ДИ 0,62-
0,91; p=0,004) в общей популяции
предлеченных пациентов и до 5,6
мес. (ОР 0,63; 95% ДИ 0,51-0,78) в
популяции пациентов с неплоскоклеточным НМРЛ по сравнению с 3,7 мес. в группе монотерапии доцетакселом (рис.1).
В мае 2024 года представители
AstraZeneca сообщили о некотором нумерическом улучшении
показателя общей выживаемости
(ОВ) в экспериментальной группе, однако различия не достигли
статистической достоверности
и точные показатели пока представлены не были.
Рисунок 1.
Выживаемость без прогрессирования
в TROPION-Lung01.
Другим схожим исследованием
стало EVOKE-01, изучившее эффективность анти-TROP2 конъюгата сацитузумаба говитекана (СГ)
у пациентов с распространенным
НМРЛ, ранее получавших терапию ингибиторами контрольных
точек и/или таргетными препаратами [2]. Работа включила 603
пациента, которые были рандомизированы в экспериментальную
группу СГ (n=299) и контрольную
группу доцетаксела (n=288). При
медиане наблюдения в 12,7 мес.
медиана длительности терапии СГ
и доцетакселом составила 3,45 мес.
и 2,33 мес. соответственно, а первичной конечной точкой являлось
увеличение общей выживаемости.
новых прогностических и предиктивных маркеров. Тем не менее, почти неизученными остаются возможности применения
данных препаратов в сочетании
с ИКТ в первой линии терапии
(EVOKE-02, EVOKE-03) или в составе пред- и периоперационных
противоопухолевых режимов
(NeoCOAST-2). Возможно, подобные варианты лечения позволят
в большей мере реализовать перспективность нового семейство
противоопухолевых агентов.
Источники:
1. Ahmed Y, Berenguer-Pina JJ,
Mahgoub T. The Rise of the TROP2-
Targeting Agents in NSCLC: New
Options on the Horizon. Oncology.
2021; 99(10): 673-680. doi:
10.1159/000517438. Epub 2021 Jul 19.
PMID: 34280931.
2. Paz-Ares LG, Juan-Vidal O,
Mountzios GS, et al. Sacituzumab
Govitecan Versus Docetaxel for
Previously Treated Advanced or
Metastatic Non-Small Cell Lung
Cancer: The Randomized, OpenLabel Phase III EVOKE-01 Study.
JCO. Published: 31 May 2024. https://
doi.org/10.1200/JCO.24.00733.
3. Pérol M. TROP2-Directed AntibodyDrug Conjugates in Advanced NonSmall Cell Lung Cancer: A Fading
Hope?! JCO. Published online: 10
July 2024. https://doi.org/10.1200/
JCO.24.01043.
4. Garon EB, Ciuleanu TE, Arrieta
O, et al. Ramucirumab plus docetaxel
versus placebo plus docetaxel for
second-line treatment of stage IV nonsmall-cell lung cancer after disease
progression on platinum-based
therapy (REVEL): A multicentre,
double-blind, randomised phase 3
trial. Lancet. 2014; 384: 665-673.
5.www.rosoncoweb.ru/news/
oncology/2024/09/10-1/.
Материал подготовил
И.М. Боровков
Исследованию не удалось достичь заданной конечной точки.
Авторы показали, что применение сацитузумаба говитекана ассоциировалось с нумерическим
увеличением медианы ОВ с 9,8
мес. в группе доцетаксела до 11,1
мес. в группе СГ (ОР 0,84; 95% ДИ
0,68-1,04, p=0,0534), а 12-месячная ОВ в экспериментальной и
контрольной группах составила
46,59% и 36,72% (рис.2). Подобные результаты сохранялись как
у пациентов с плоскоклеточным
гистологическим вариантом (ОР
0,83; 95% ДИ 0,56-1,22), так и с неплоскоклеточным НМРЛ (ОР 0,87;
95% ДИ 0,68-1,11), а наибольшая
эффективность СГ определялась у
пациентов с низким ответом (стабилизация/прогрессирование) на
предшествующую иммунную или
химиоиммунную терапию. Медиана выживаемости без прогрессирования между группами значимо
не различалась – 4,1 мес. в экспериментальной группе и 3,9 мес. в
группе контроля (ОР 0,92%; 95%
ДИ 0,77-1,11). Показатель 6-месячной ВБП составил в двух группах
33,71% и 31,39%.
Рисунок 2.
Общая выживаемость в популяции
Intention-to-Treat, EVOKE-01.
Профиль безопасности нового
препарата, как и в исследовании
с датопотамабом дерукстеканом,
являлся более благоприятным по
сравнению с доцетакселом. Так,
нежелательные явления (НЯ)
≥3 развивались у 66,6% в экспериментальной группе и 75,7% в
группе контроля. При этом среди
НЯ в группе СГ преобладали диарея, алопеция, тошнота, рвота и
анемия, а терапия доцетакселом
характеризовалась более частым
развитием нейтропении, стоматита, лейкопении и периферической
полинейропатии.
Несмотря на отсутствие достоверных различий и недостижение
первичной конечной точки, авторы обращают внимание на расхождение кривых Каплана-Майера, начинающееся после 4 месяцев
и сохраняющееся на протяжении всего периода наблюдения.
Так, показатель 12-месячной ОВ
в группе СГ был на 10% выше такового при применении доцетаксела, в связи с чем авторы делают
предположении о вероятном влиянии недостаточной мощности
исследования. Однако, как было
дополнительно подчеркнуто в недавней статье Pérol M. [3], все приведенные работы не применяют в
качестве сравнения комбинацию
доцетаксела и рамуцирумаба, показавшую в исследовании REVEL
достоверное увеличение медианы
ОВ до 10,5 мес. по сравнению с 9,1
мес. в группе доцетаксела (ОР 0,86;
95% ДИ 0,75-0,98; p=0,023) у пациентов, получавших ранее химиотерапию первой линии [4]. Другим
предметом для обсуждения является причина большей эффективности СГ у пациентов с низким ответом на терапию ингибиторами
контрольных точек (ИКТ). Pérol
M. отмечает, что значимая часть
пациентов в первой линии получала комбинацию ингибиторов
контрольных точек и платиносодержащей химиотерапии, в связи с
чем прогрессирование или отсутствие объективного ответа на проводимое лечение может означать
не только ИКТ-рефрактерность, но
и ХТ-рефрактерность, способную
частично объяснить большую эффективность TROP2-конъюгатов в
данной подгруппе пациентов.
Другим возможным вариантом
применения TROP2-ингибиторов
является их интеграция в схемы
неоадъювантной/периоперационной противоопухолевой терапии.
Так, согласно представленным
на WCLC2024 результатам исследования NeoCOAST-2, предоперационное лечение пациентов с
IIA-IIIB ст. НМРЛ по схеме дурвалумаб + датопотамаб дерукстекан
+ ХТ обеспечило достоверное увеличение частоты полных патоморфологических ответов до 34,1% по
сравнению с 20% и 26,7% в группах
комбинаций дурвалумаба с ХТ и
олеклумабом или монализумабом
соответственно [5]. При этом комбинация с ингибитором TROP2
демонстрировала наименьшую
частоту НЯ 3 ст. – 18,5% против
31,1% и 29,6%. Данные по влиянию
подобных схем на отдаленные результаты лечения пока представлены не были.
Таким образом, роль TROP2-ингибиторов в настоящий момент
остается сомнительной, а для ее
уточнения требуется разработка новых прогностических и предиктивных маркеров. Тем не менее, почти неизученными остаются возможности применения
данных препаратов в сочетании
с ИКТ в первой линии терапии
(EVOKE-02, EVOKE-03) или в составе пред- и периоперационных
противоопухолевых режимов
(NeoCOAST-2). Возможно, подобные варианты лечения позволят
в большей мере реализовать перспективность нового семейство
противоопухолевых агентов.
Источники:
- Ahmed Y, Berenguer-Pina JJ, Mahgoub T. The Rise of the TROP2- Targeting Agents in NSCLC: New Options on the Horizon. Oncology. 2021; 99(10): 673-680. doi: 10.1159/000517438. Epub 2021 Jul 19. PMID: 34280931.
- Paz-Ares LG, Juan-Vidal O, Mountzios GS, et al. Sacituzumab Govitecan Versus Docetaxel for Previously Treated Advanced or Metastatic Non-Small Cell Lung Cancer: The Randomized, OpenLabel Phase III EVOKE-01 Study. JCO. Published: 31 May 2024. https:// doi.org/10.1200/JCO.24.00733.
- Pérol M. TROP2-Directed AntibodyDrug Conjugates in Advanced NonSmall Cell Lung Cancer: A Fading Hope?! JCO. Published online: 10 July 2024. https://doi.org/10.1200/ JCO.24.01043.
- Garon EB, Ciuleanu TE, Arrieta O, et al. Ramucirumab plus docetaxel versus placebo plus docetaxel for second-line treatment of stage IV nonsmall-cell lung cancer after disease progression on platinum-based therapy (REVEL): A multicentre, double-blind, randomised phase 3 trial. Lancet. 2014; 384: 665-673. 5.www.rosoncoweb.ru/news/ oncology/2024/09/10-1/.
Материал подготовил
И.М. Боровков
ТРИМОДАЛЬНАЯ ТЕРАПИЯ (ТМТ) ПРИ Т1 HIGH-GRADE РАКА МОЧЕВОГО ПУЗЫРЯ (РМП): ИССЛЕДОВАНИЕ 2 ФАЗЫ RTOG 0926
Сохранение мочевого пузыря при рецидиве немышечно-инвазивного
РМП (НМИРМП) после БЦЖ терапии является главной задачей последующих опций лечения. Известно, что при мышечно-инвазивном РМП
альтернативой радикальной цистэктомии (РЦЭ) служит тримодальная
терапия (ТМТ): максимальная трансуретральная резекция (ТУР) с последующей ХЛТ. Уверен, что у большинства врачей-онкологов хоть раз
да возникала мысль: может, и при НМИРМП тримодальный подход
также сработает?
В проспективное исследование II фазы включено 37 пациентов с
БЦЖ-рефрактерным течением заболевания, которым проводилась
ТМТ (лучевая терапия в СОД 61,2 Гр за 34 фракции, в качестве радиомодификатора допускалось использование 5-ФУ, цисплатина, митомицина). Первичная конечная точка – сохранение мочевого пузыря
в течение 3 лет
При медиане наблюдения >5 лет отмечено:
- частота выполнения РЦЭ в первые 3 года – 12,4%;
- 3-летняя и 5-летняя ОВ составила 69,5% и 56,4% соответственно;
- отдаленное метастазирование в течение 3 и 5 лет отмечено у 12,2%
и 18,7% соответственно;
- 10 пациентов погибли до 3 лет наблюдения, из них пятеро - в связи
с прогрессированием заболевания.
Несмотря на достижение первичной конечной точки, малое количество включенных пациентов, большое число ранних смертей заставляют задуматься о целесообразности такого подхода на практике.
Ранее ногапендикин альфа инбакицепт продемонстрировал высокую частоту полных ответов в популяции предлеченных пациентов
с НМИРМП. А если применить комбинацию с пембролизумабом (по
аналогии с раком легкого) – может, станет еще лучше?
УГОЛОК РАДИОТЕРАПЕВТА... / И СНОВА О ГИПОФРАКЦИОНИРОВАНИИ: РАК ЛЕГКОГО
Автор: Деньгина Наталья Владимировна
Заведующая радиологическим отделением ГУЗ «Областной клинический онкологический диспансер»,
директор Центра лучевой терапии «R-Spei», член правления RUSSCO,
главный редактор Газеты RUSSCO и сайта RosOncoWeb,
кандидат медицинских наук, Ульяновск
Стандартная схема лечения неоперабельного немелкоклеточного рака легких (НМРЛ) III стадии – одновременная химиолучевая терапия (в дозе 60 Гр за 30 фракций + 2-3 курса ХТ), хотя умеренно гипофракционированная лучевая терапия (Hypo-RT) также всегда рассматривалась в качестве альтернативной стратегии. Укорочение курса облучения теоретически обосновано: ряд авторов показывают, что клетки НМРЛ обладают быстрым ростом и ускоренной пролиферацией, причем к концу 3-4 недели ЛТ темпы размножения клеток возрастают [1,2]. Одно из радиобиологических исследований показало, что более высокая интенсивность дозы облучения связана с улучшением локорегионального контроля; при каждом увеличении BED (биологически эквивалентной дозы) на 1 Гр относительный риск локорегионального рецидива снижается примерно на 3% [3], что говорит об одном: нам нельзя недооценивать важность эффективного воздействия на первичный очаг. Несмотря на теоретические преимущества интенсификации облучения, явного выигрыша гипофракционирования ранее продемонстрировано не было, а токсичность лечения (по данным ретроспективных работ и исследований 1 фазы) была слишком велика. Целью данного исследования китайских авторов было сравнение эффективности и токсичности умеренно гипофракционированной лучевой терапии и обычной фракционированной лучевой терапии (Con-RT) у пациентов с неоперабельным НМРЛ III стадии, получающих сопутствующую химиотерапию [4]. При этом авторы сделали упор на применение аппарата томотерапии для проведения ускоренных курсов. Томотерапия (или спиральная томотерапия) – это система с визуальным контролем, которая позволяет проводить лучевую терапию с модуляцией интенсивности (IMRT) путем объединения непрерывно вращающегося веерного пучка с синхронным движением лечебного стола. Благодаря значительному преимуществу вращения на 360° в дополнение к уникальному бинарному пневматическому многолепестковому коллиматору и 51 углу поля пучка метод позволяет улучшить однородность дозы, одновременно снижая дозу на органах риска по сравнению с обычным линейным Рисунок 1. Показатели ОВ, ВБП и ЛРК в группах Hypo-RT и Con-RT ускорителем, что способствует более благоприятному профилю токсичности для лечения местнораспространенного НМРЛ.
В этом рандомизированном, многоцентровом клиническом исследовании 3 фазы пациенты были
рандомизированы в соотношении 1:1 либо в группу Hypo-RT (60
Гр за 20 фракций), либо в группу
Con-RT (60 Гр за 30 фракций).
Все пациенты получили 2 цикла
одновременной химиотерапии
на основе платины плюс 2 цикла
консолидирующей терапии. Первичной конечной точкой была
3-летняя общая выживаемость
(OВ) в популяции intention-to-treat.
Вторичными конечными точками
были выживаемость без прогрессирования и нежелательные явления, связанные с лечением.
Рисунок 1.
Показатели ОВ, ВБП и ЛРК в группах Hypo-RT и Con-RT.

Всего в исследование было включено 146 пациентов с 27 июля 2018
г. по 1 ноября 2021 г., медиана наблюдения – 46 месяцев. Показатели общей выживаемости за 3
года в группах Hypo-RT и Con-RT
составили 58,4% и 38,4% соответственно (P=0,02). Медиана общей
выживаемости после рандомизации составила 41 месяц в группе
Hypo-RT и 30 месяцев в группе Con-RT (коэффициент риска
0,61; 95% ДИ 0,40-0,94; P=0,02). Не
было никакой существенной разницы в частоте и выраженности
нежелательных явлений ≥2 степени, связанных с лечением, между
двумя группами.
Частота локорегиональных рецидивов оказалась ниже в группе Hypo-RT (31,5% против 49,3%,
р=0,04); частота отдаленных рецидивов также была ниже, но
разница не достигла статистической достоверности (37,0% против 46,6%, р=0,31).
Насколько нам известно, это первое многоцентровое РКИ фазы 3
с достаточно большой когортой
пациентов и длительным наблюдением по сравнению результатов выживаемости и токсичности
между Hypo-RT и Con-RT. Исследование показывает улучшение
результатов выживаемости при
Hypo-RT по сравнению с Con-RT
без повышения токсичности. Это
указывает на то, что умеренная
Hypo-RT (3 Гр за фракцию) с максимально точной доставкой дозы
является безопасным и эффективным подходом. В этой работе
пациенты на консолидирующем
этапе получали только химиотерапию, возможно, применение
консолидирующей иммунотерапии в соответствии с нынешними
стандартами продемонстрировало бы даже лучшие результаты.
Дальнейшее исследование эффективности Hypo-RT в сочетании с
иммунотерапией/таргетной терапией является оправданным.
Кроме всего, Hypo-RT имеет явные практические преимущества
перед классическим фракционированием. Во-первых, весь план
лечения может быть завершен за
более короткое время, что обеспечивает большее удобство для пациента и финансовую выгоду для
системы здравоохранения. Вовторых, он снижает нагрузку на
отделения ЛT и экономит время
врачей и медицинские ресурсы.
Источники:
- Partridge M, Ramos M, Sardaro A, Brada M. Dose escalation for nonsmall cell lung cancer: Analysis and modelling of published literature. Radiother Oncol. 2011; 99: 6-11.
- McMillan MT, Ojerholm E, Verma V, et al. Radiation treatment time and overall survival in locally advanced non-small cell lung cancer. Int J Radiat Oncol Biol Phys. 2017; 98: 1142-1152.
- Machtay M, Bae K, Movsas B, et al. Higher biologically effective dose of radiotherapy is associated with improved outcomes for locally advanced non-small cell lung carcinoma treated with chemoradiation: An analysis of the Radiation Therapy Oncology Group. Int J Radiat Oncol Biol Phys. 2012; 82: 425-434.
- Zhang Qi, et al. Efficacy and Toxicity of Moderately Hypofractionated Radiation Therapy with Helical TomoTherapy Versus Conventional Radiation Therapy in Patients with Unresectable Stage III Non-Small Cell Lung Cancer Receiving Concurrent Chemotherapy: A Multicenter, Randomized Phase 3 Trial. Int Jour Radiat Oncol Biol Phys. 1 October 2024. Vol.120, Issue 2, P.422-431.
УГОЛОК РАДИОТЕРАПЕВТА... / СНИЖАЕТ ЛИ ДВУСТОРОННЯЯ МАСТЭКТОМИЯ СМЕРТНОСТЬ ОТ РМЖ?..
Согласно исследованию, опубликованному в журнале JAMA
Oncology [1], многие больные раком молочной железы, включая
протоковую карциному in situ
(DCIS), выбирают двустороннюю
мастэктомию в качестве первичного лечения, даже если опухоль
локализована в одной молочной
железе. Двусторонняя мастэктомия более «привлекательна» для
ряда пациентов, поскольку, как известно, она снижает риск возникновения второй опухоли и дает
надежду на снижение риска смертности. Как говорится, нет органа –
нет проблемы. Однако насколько
верен подобный подход?..
Причины роста частоты двусторонних мастэктомий являются
комплексными. Среди них – более
тщательное обследование пациенток, выявление большего количества двусторонних опухолей,
обнаруженных с помощью МРТ,
увеличение частоты тестирования
на BRCA, а также усовершенствование моделей риска, боязнь негативного косметического эффекта
при одностороннем оперативном
вмешательстве, прогресс в реконструктивной хирургии, влияние
мнения хирургов и СМИ (в том
числе примеры подобного опыта от известных личностей), да и
просто элементарный страх перед
вероятностью погибнуть от РМЖ
[2]. Но при этом двусторонняя
мастэктомия – это серьезная, обширная операция, которая часто
приводит к более длительному
пребыванию в больнице, увеличению частоты гемотрансфузий
и более высокой вероятности повторных операций: и односторонняя реконструкция несет свои
собственные риски, а уж после
двусторонней реконструкции эти
проблемы могут усугубляться.
Последние данные показывают,
что риск контралатерального
рака молочной железы составляет приблизительно 0,4% в год
в течение 20 лет после постановки первичного диагноза. Преимущество контралатеральной
мастэктомии после диагностики
первичного РМЖ зависит от индивидуальной вероятности развития рака в другой молочной
железе. Этот риск, как правило,
выше для молодых женщин. Для
поддержки принятия обоснованных решений крайне важно
предоставить пациентам индивидуальную информацию об их
конкретных факторах риска при
рассмотрении варианта контралатеральной профилактической
мастэктомии.
В большом когортном исследовании из Women’s College Hospital
(Канада) использовалась база
данных реестра SEER; для анализа отбирались больные унилатеральным РМЖ, диагностированным в период с 2000 по 2019
год. Пациенты были прослежены
в течение 20 лет в отношении частоты развития контралатерального рака и раково-специфичной
смертности. Анализ подразумевал сравнение 20-летнего кумулятивного риска смертности от
РМЖ после лампэктомий, односторонних мастэктомий и двусторонних мастэктомий и проводился в период с октября 2023
года по февраль 2024 года.
Исследование включало 661 270 пациенток, средний возраст – 58,7 лет.
Зарегистрировано 564 062 случая
инвазивного рака (85,3%) и 97 208
случаев DCIS (14,7%). Большинству
пациенток была проведена органосохраняющая операция (70,6%),
односторонняя мастэктомия выполнена у 23,4%, двусторонняя
мастэктомия – у 6%.
После отбора пациенток, прошедших двустороннюю мастэктомию, и формирования 3 хирургических групп для сопоставления,
в каждой из них оказалось по 36
028 женщин. В течение 20-летнего периода наблюдения у 766
пациентов (2,1%) в группе лампэктомии и у 728 пациентов (2%)
в группе односторонней мастэктомии был диагностирован контралатеральный инвазивный рак,
тогда как в группе двусторонней
мастэктомии ЗНО второй молочной железы было обнаружено только у 97 пациенток (0,3%)
(рис.1).
Рисунок 1.
Двадцатилетние показатели А) выживаемости
без контралатерального инвазивного рака, В) раковоспецифической выживаемости в зависимости от развития
или отсутствия контралатерального рака, С) раковоспецифической выживаемости в 3 группах за 20 лет.
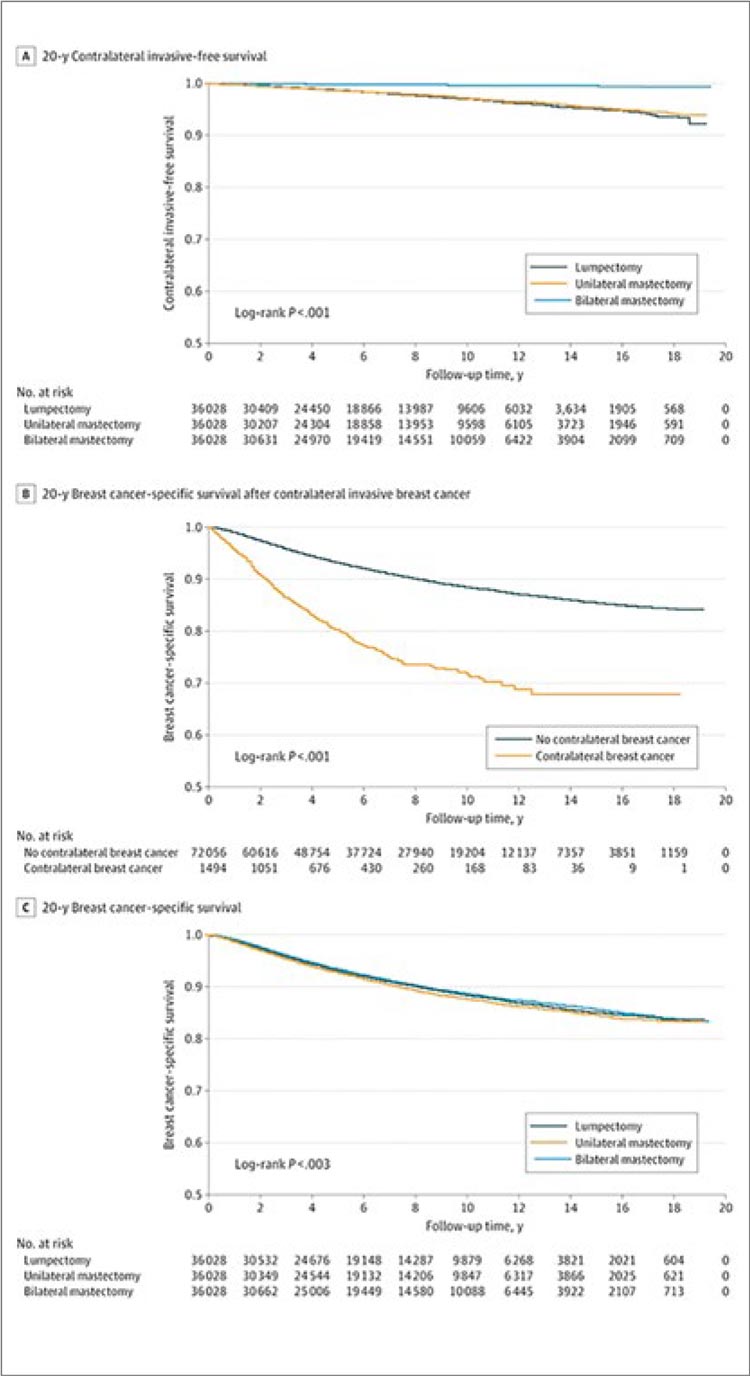
20-летняя кумулятивная частота
контралатерального инвазивного
рака молочной железы составила
6,9% (95% ДИ 6,1-7,9%) в группах
лампэктомии и односторонней
мастэктомии. Также в этих группах кумулятивная смертность от
рака молочной железы за 15 лет
составила 32,1% для тех, у кого
развился контралатеральный рак,
и 14,5% для тех, у кого его не было
(HR 4,0; 95% ДИ 3,52-4,54). При
этом HR был выше для пациенток
с DCIS (HR 10,3; 95% ДИ 5,17-20,49)
по сравнению с женщинами, лечившимися от инвазивного рака
(HR 4,04; 95% ДИ 3,54-4,6). От рака
молочной железы погибли 3077
(8,54%) пациенток в группе лампэктомии, 3269 (9,07%) – в группе
односторонней мастэктомии и
3062 (8,5%) – в группе двусторонней мастэктомии, что в итоге демонстрирует отсутствие разницы
в раково-специфической выживаемости за 20 лет (рис.1).
Безусловно, исследование имеет
свои ограничения, поскольку в
нем отсутствуют данные о факторах, имеющих большое значение в
плане риска развития контралатерального рака молочной железы,
таких как применение эндокринной терапии у пациентов с положительным статусом рецептора
эстрогена, семейный анамнез и
мутации гена BRCA, проведенная
химиотерапия и др. В исследование были включены только пациентки с определенными гистологическими типами (дольковый,
протоковый или смешанный).
Поэтому результаты применимы
только к этим конкретным группам и не могут быть автоматически распространены на всю популяцию рака молочной железы.
На основании этого исследования
можно сделать вывод, что двусторонняя мастэктомия значительно
снижает риск возникновения второго рака, но не влияет на смертность. Риск контралатерального
РМЖ является существенным и
остается относительно постоянным на протяжении всей жизни
пациентки. Данные позволяют
предположить, что у 69 из 1000
женщин с РМЖ в течение 20 лет
после постановки диагноза разовьется контралатеральный рак.
Пациентки, перенесшие двустороннюю мастэктомию по поводу
одностороннего РМЖ, продемонстрировали такие же показатели
смертности, как и те, кто прошел
через одностороннюю операцию.
Источники:
- Giannakeas V, Lim DW, Narod SA. Bilateral mastectomy and breast cancer mortality. JAMA Oncol. Published online: July 25, 2024. doi:10.1001/jamaoncol.2024.2212.
- Lim DW, Metcalfe KA, Narod SA. Bilateral mastectomy in women with unilateral breast cancer: A review. JAMA Surg. 2021; 156(6): 569-576. doi:10.1001/jamasurg.2020.6664.
Материал подготовила
Н.В. Деньгина
УГОЛОК РАДИОТЕРАПЕВТА... / ВОЛШЕБНАЯ ФРАКЦИЯ ДЛЯ ПЕЧЕНИ
Недавняя публикация в журнале Lancet Oncology – это весьма
оптимистичные новости для
специалистов, занимающихся
патологией печени, и важная информация для радиотерапевтов,
которым пока не слишком часто
доводилось заниматься облучением этого органа. Меж тем, нам
есть о чем задуматься.
Гепатоцеллюлярная карцинома,
наиболее распространенный первичный рак печени, обычно диагностируется на поздней стадии.
Печень также является излюбленным местом метастазирования различных злокачественных
новообразований (например,
колоректального рака, рака поджелудочной железы, легких и др.).
При этом ежегодно около 1 миллиона пациентов во всем мире имеют болевой синдром в печени
из-за первичного или метастатического рака, и боль эта может
быть весьма интенсивной, однако
исследований по эффективному
купированию такой боли крайне
мало. Задача может быть усложнена наличием у таких пациентов
фонового цирроза или дисфункции печени. Необходимы стратегии для более эффективного
уменьшения печеночной боли и
улучшения качества жизни таких
больных.
Авторы канадского рандомизированного исследования 3 фазы
CCTG HE1 задались целью определить роль лучевой терапии в
паллиативном лечении пациентов с болевым синдромом в печени. Девять центров Канады
включили в исследование пациентов в возрасте 18 лет и старше с
гепатоцеллюлярной карциномой
или метастазами в печень, которые были рефрактерны к стандартному лечению, имели статус
по ECOG от 0 до 3, ожидаемую
продолжительность жизни более 3 месяцев и максимальную
интенсивность боли или дискомфорта за последние 24 часа по
Краткому опроснику боли (BPI)
не менее 4 из 10, которая сохранялась стабильной в течение 7
дней до рандомизации. Пациенты были рандомизированы (1:1)
с помощью метода минимизации
после стратификации по центру
и типу опухолевого поражения
(гепатоцеллюлярная карцинома
против метастазов в печени) для
проведения лучевой терапии ( 1
фракция 8 Гр) на всю печень с 8 мг
ондансетрона (или эквивалента)
перорально и 4 мг дексаметазона
перорально за 1–2 часа до лучевой терапии с последующей поддерживающей терапией (включая
неопиоидную или опиоидную терапию, или дексаметазон, или их
комбинацию) в сравнении с только поддерживающей терапией.
Первичной конечной точкой было уменьшение боли или дискомфорта, о которых сообщал сам пациент, минимум на 2 балла по шкале BPI в наибольшей интенсивности боли через 1 месяц после рандомизации. Безопасность также оценивалась у всех пациентов.
В итоге в период с 25 июля 2015
г. по 2 июня 2022 г. 66 пациентов
были случайным образом распределены на лучевую терапию
(плюс поддержка, n=33) или только поддерживающую терапию
(n=33). Средний возраст составил 65 лет (57–72), 37 (56%) из 66 пациентов были мужчинами, 29
(44%) - женщинами, 43 (65%) имели метастазы в печени и 23 (35%)
– первичную гепатоцеллюлярную
карциному. На момент окончания
сбора данных (8 сентября 2022 г.)
медиана наблюдения составляла
3,2 месяца (95% ДИ 3,0–3,4), при
этом 24 (73%) в группе ЛТ и 18
(55%) в группе только поддерживающей терапии завершили базовую и 1-месячную оценку эффективности.
Уменьшение боли в печени минимум на 2 балла по шкале BPI через
1 месяц наблюдалось у 16 (67%) из
24 пациентов в группе ЛТ против
четырех (22%) из 18 пациентов в
группе наилучшей поддерживающей терапии (p=0,0042). Наиболее распространенными нежелательными явлениями 3–4 степени
в течение 1 месяца после рандомизации были боли в животе (9%
из группы ЛТ против 3% из группы наилучшей поддерживающей
терапии) и асцит (6% против 3%).
Серьезных нежелательных явлений или смертей, связанных с лечением, не наблюдалось.
Что особо примечательно, локальная терапия (напомним –
всего одна фракция облучения в
дозе 8 Гр!) отразилась на общей
выживаемости пациентов, дав
определенные преимущества: HR
0.56, 95% CI 0.30-1.05), правда, без
статистической достоверности
(р=0.068), возможно, по причине
малого числа больных (рис.1).
Рисунок 1.
Показатели общей выживаемости в группах.
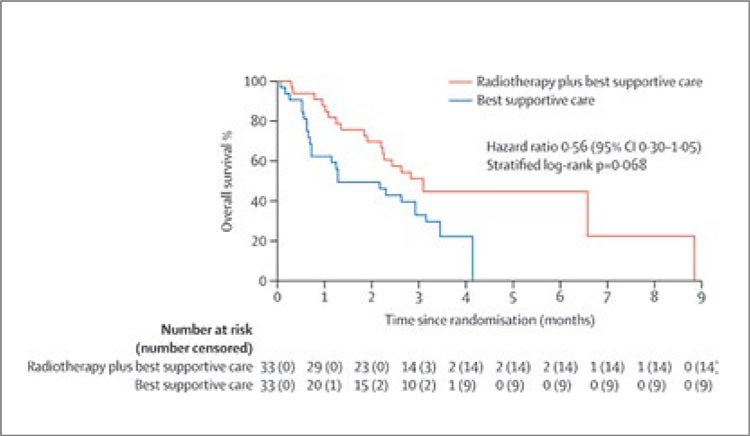
В любом случае, тот факт, что
облучение в сочетании с поддерживающей терапией более эффективно для уменьшения боли
в печени по сравнению с только
наилучшей поддерживающей терапией, позволяет надеяться на
более широкое применение ЛТ и,
возможно, включение в рекомендации в качестве стандартного
паллиативного лечения больных
с первичным или метастатическим поражением печени.
Источник:
Dawson, Laura A et al. Palliative
radiotherapy versus best supportive
care in patients with painful hepatic
cancer (CCTG HE1): a multicentre,
open-label, randomised, controlled,
phase 3 study. The Lancet Oncology,
September 05, 2024.
«А ВОТ БЫЛ У МЕНЯ СЛУЧАЙ…» ИЛИ «ОХОТНИЧЬИ» ЗАПИСКИ ОНКОЛОГОВ / РЕДКОЕ ОСЛОЖНЕНИЕ, АССОЦИИРОВАННОЕ C ИСПОЛЬЗОВАНИЕМ СОВРЕМЕННЫХ ИММУНООНКОЛОГИЧЕСКИХ ПРЕПАРАТОВ, — ПОРАЖЕНИЕ ПОЧЕК
Автор: Орлова Рашида Вахидовна
Заведующая кафедрой онкологии медицинского института
ФГБОУВО «Санкт-Петербургский государственный университет»,
главный специалист по клинической онкологии СПб ГБУЗ «Городской клинический онкологический диспансер»,
член правления RUSSCO, доктор медицинских наук, профессор, Санкт-Петербург
Беляк Наталья Петровна
Заведующая отделением противоопухолевой лекарственной терапии (химиотерапевтическое) №10
СПб ГБУЗ «Городской клинический онкологический диспансер», клинический онколог,
доцент кафедры онкологии медицинского факультета СПбГУ,
кандидат медицинских наук, Санкт-Петербург
Мгарь Екатерина Андреевна
Врач-онколог отделения противоопухолевой лекарственной терапии №10
СПб ГБУЗ «Городской клинический онкологический диспансер», Санкт-Петербург
Введение
По мере увеличения заболеваемости и распространенности злокачественных новообразований
разрабатываются и внедряются
в клиническую практику новые
противоопухолевые препараты,
которые более специфично воздействуют на злокачественные
клетки и более эффективны по
сравнению с препаратами прошлых поколений. Установление роли иммунных контрольных точек (ИКТ) в регуляции
противоопухолевой активности
Т-лимфоцитов и создание моноклональных антител, селективно
блокирующих ИКТ, обусловили
новый подход к иммунотерапии
опухолей, благодаря которому
значительно улучшился прогноз
для многих онкологических пациентов [1]. Однако уникальный
механизм действия этих препаратов предполагает и особый профиль нежелательных явлений
(НЯ), таких как иммуноопосредованные НЯ (иоНЯ), которые
возникают в результате аутоиммунного поражения различных
тканей и органов и часто ограничивают дальнейшие возможности
терапии. В данном клиническом
случае представлено редкое, но не
менее грозное иоНЯ со стороны
почек, ассоциированное с терапией ингибиторами ИКТ.
Механизм развития иоНЯ
со стороны почек
Механизмы нарушения структуры и функции почек в результате
применения ингибиторов ИКТ
изучены недостаточно. Предполагается, что ингибирование
CTLA-4 и PD-1 приводит к «перепрограммированию» иммунной
системы и потере толерантности
с образованием аутоантител к
эндогенным антигенам [17-20].
К настоящему времени наиболее изучен патогенез ОТИН, обусловленного ингибиторами
PD-1/PD-L. Показано, что клетки
эпителия почечных канальцев
постоянно экспрессируют молекулы MHC класса II и способны
презентировать пепдидные антигены CD4+ T-лимфоцитам [20] и
таким образом активировать их.
Сигналы PD1/PD-L1 способствуют поддержанию периферической иммунной толерантности
Т-лимфоцитов [21], в частности,
клетки почечных канальцев экспрессируют PD-L1, который защищает их от иммуноопосредованного повреждения [23].
Следовательно, блокада PD-1/
CTLA-4 приводит к потере периферической толерантности аутореактивных Т-лимфоцитов [22],
миграции и активации эффекторных Т-лимфоцитов в ткани
почек с последующим привлечением других иммунных клеток,
высвобождением провоспалительных цитокинов и выработкой
аутоантител, непосредственно
повреждающих почки [23, 24].
Рисунок 1.
Патогенез ОТИН, обусловленный применением
ингибиторов PD-1/PD-L1.
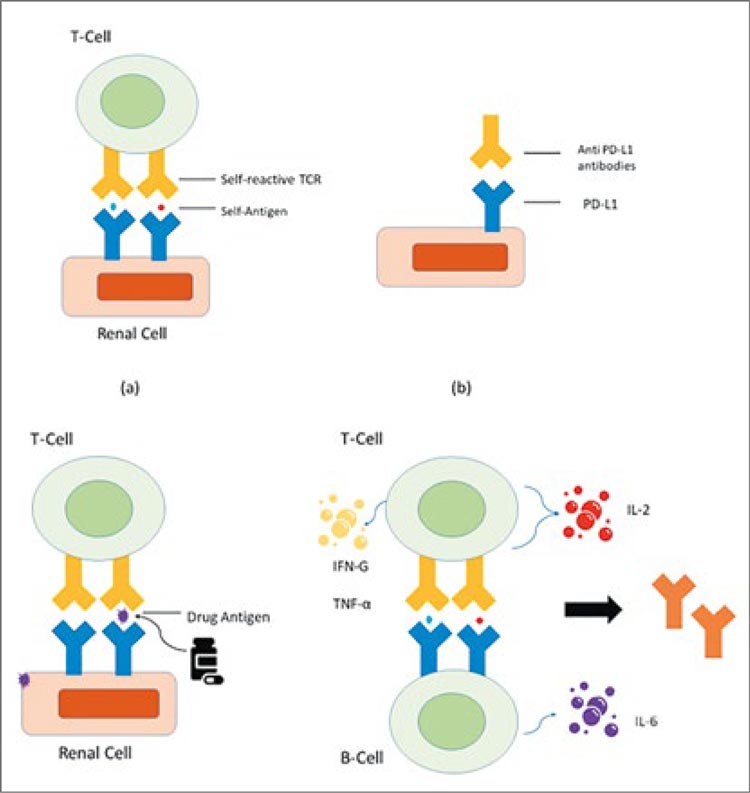
Иммуноопосредованное поражение почек на фоне применения
ингибиторов ИКТ.
Частота развития иоНЯ у пациентов, получающих лечение ингибиторами ИКТ, варьирует от 15%
до 90% и зависит от типа препарата [2, 3]. Потенциально могут поражаться любые органы и ткани,
однако чаще всего наблюдаются
иоНЯ со стороны кожи, желудочно-кишечного тракта и эндокринной системы [2]. Со стороны
почек побочные эффекты ингибиторов ИКТ встречаются относительно редко [2, 4-9], но именно
они, будучи серьезными и/или
жизнеугрожающими, могут определять ближайший прогноз пациента. Спектр поражения почек,
ассоциированный с применением
ингибиторов ИКТ, достаточно
широк, но наиболее частым иоНЯ
со стороны почек является острое
повреждение почек (ОПП) [5, 8-9,
10-12].
В 2012 году Международной организацией по улучшению глобальных результатов лечения заболевания почек (KDIGO) было
предложено единое определение
ОПП, включающее присутствие
любого из следующих признаков:
• увеличение креатинина сыворотки крови >0,3 мг/дл (26,5
мкмоль/л) в течение 48 часов;
• увеличение креатинина сыворотки крови > чем в 1,5 раза от
известного или предполагаемого,
в течение последних 7 дней исходного значения;
• диурез <0,5 мл/кг/час в течение
6 часов.
В таблице 1 представлены критерии оценки степени тяжести
ОПП.
Таблица 1.
Степень тяжести ОПП.
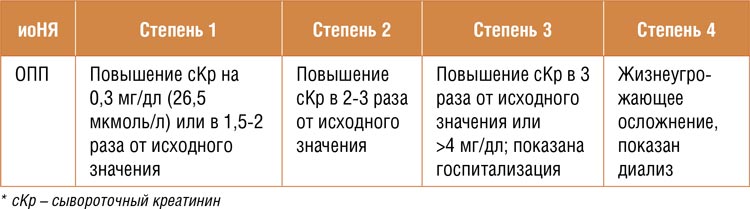
Факторы риска развития иоНЯ со стороны почек
На сегодняшний день хорошо
изучена нефротоксичность, обусловленная применением традиционных противоопухолевых
средств (соединений платины,
алкилирующих препаратов,
антиметаболитов, ингибиторов
микротрубочек, противоопухолевых антибиотиков, таргетных
препаратов и т.д.) [14, 15]. Как
правило, она зависит от дозировки, пути введения и длительности применения препарата.
Дополнительный вклад также
вносят факторы как со стороны
пациента (в том числе пожилой
возраст, сопутствующие заболевания и сопутствующая терапия),
так и со стороны опухоли (например, обструкция мочевыводящих
путей за счет опухолевого роста
или увеличения лимфатических
узлов).
Однако надежные предикторы
развития иоНЯ со стороны почек
на фоне терапии ингибиторами
ИКТ до сих пор не установлены.
Тем не менее многие исследователи обращали внимание на то, что
пациенты, у которых развилось
иоНЯ, чаще принимали препараты с потенциально нефротоксическим действием (НПВП, ИПП,
антибиотики и т.д.), кроме того,
у них чаще использовались комбинированные режимы иммунотерапии, а также снижена исходная функция почек [5, 10-12, 16]. В
качестве других потенциальных
факторов, предрасполагающих
к развитию иоНЯ, можно рассматривать наличие в анамнезе
аутоиммунных заболеваний (таких как ревматоидный артрит,
псориаз, системная склеродермия, аутоиммунный тиреоидит,
миастения гравис, узелковый полиартериит, системная красная
волчанка, саркоидоз, сахарным
диабетом 1-го типа и т.д.) [13].
Таким образом, несмотря на отсутствие в настоящее время четких критериев, позволяющих прогнозировать сроки развития, тип и степень тяжести иоНЯ, накапливаются данные, которые позволяют выделить особые группы пациентов, требующих как более тщательного обследования перед назначением ингибиторов ИКТ, так и более пристального контроля в период терапии.
Клинический случай
Пациентка – женщина, 1965 года
рождения. В конце мая 2022 года
начала отмечать появление сукровичных выделений из влагалища, в связи с чем обратилась в
женскую консультацию при поликлинике по месту жительства.
При осмотре у гинеколога выявлена опухоль шейки матки, пациентка направлена на консультацию врача-онколога в СПБ ГБУЗ
«Городской клинический онкологический диспансер» (ГКОД)
за консультативной помощью,
обследованием и дальнейшим лечением. По результатам инструментальных и лабораторных методов обследования (КТ органов
грудной клетки, органов брюшной полости с в/в контрастированием и МРТ органов малого
таза с в/в контрастированием и
гистологического и ммуногистохимического исследования) установлен диагноз: рак шейки матки
сT2сN1M1/IV ( lymh, pulm). ИГХ:
без признаков dMMR/MSI-H, PDL1 (22C3): CPS=100.
Учитывая распространенность
основного заболевания, гистологический тип опухоли, решением консилиума, пациентке в
условиях дневного стационара
СПБ ГБУЗ ГКОД начата терапия
1 линией ПХТ по схеме ТС + бевацизумаб. В процессе лечения у
пациентки прекратились сукровичные выделения из влагалища.
По завершению 6 циклов ПХТ по
результатам контрольного обследования отмечался хороший эффект системной лекарственной
терапии в виде частичного регресса всех наблюдаемых очагов,
в связи с чем было принято решение о продолжении таргетной
терапии в монорежиме препаратом бевацизумаб. Данное лечение пациентка получала до июня
2023 года. При очередном плановом контрольном обследовании
было выявлено прогрессирование заболевания в виде продолженного роста очагов в легких и
забрюшинных л/у (наблюдались
с самого начала лекарственной
терапии). Учитывая удовлетворительное общее состояние пациентки, выявленное прогрессирование основного заболевания,
гистологический тип опухоли,
консилиумом СПБ ГБУЗ ГКОД
принято решение о проведении
2 линии иммунотерапии пембролизумабом. С конца октября 2023
года по март 2024 года пациентка
получила 10 введений пембролизумаба. В марте 2024 года в межцикловом периоде пациентка с
признаками ОРВИ была госпитализирована в инфекционное
отделение дежурного стационара
города Санкт-Петербург. Пациентка обследована, по результатам лабораторных методов исследования в общем анализе крови
(ОАК) выявлен незначительный
лейкоцитоз (11,9×109/л), анемия
1 степени (Hb=98 г/л); в биохимическом анализе крови: уровень
креатинина 1017 мкмоль/л, К, Na,
ТТГ – в норме; по данным общего анализа мочи (ОАМ): протеинурия (>0,91 – положительный),
лейкоцитурия (571 сплошь), бактериурия (626 сплошь). Также
проведены инструментальные
исследования с целью установления причины, повлекшей за
собой изменения в лабораторных показателях. По результатам
ЭКГ и ЭХО-КГ не было получено
данных за острую сердечно-сосудистую патологию (показатели
в пределах нормы); УЗИ органов
брюшной полости и забрюшинного пространства – без убедительных данных за механическое
воздействие на чашечно-лоханочную систему; КТ органов грудной
клетки – сохраняются множественные очаги в легких до 15 мм
в диаметре, без увеличения в размерах и количестве; КТ органов
брюшной полости и забрюшинного пространства – увеличение
размеров обеих почек, полостные
системы почек не расширены;
в левой почке сохраняется конкремент до 5 мм, паренхима левой почки однородная; в правой
почке единичная киста 3 мм, забрюшинная лимфаденопатия до
19 мм максимально по короткой
оси, размеры и количество прежние. В результате обследования
проведен дифференциальный
диагноз между различными причинами развития ОПП, а именно исключены данные за острую
сердечно-сосудистую недостаточность (ИМ, кардиогенный
шок, миокардиодистрофия), обезвоживание, обструкцию мочевыводящих путей вследствие
сдавление конгломератами лимфоузлов, также исключен прием
препаратов, обладающих нефротоксическим действием (НПВП
и ИПП). Пациентка осмотрена
нефрологом в условиях стационара и, учитывая исключающие
вышеперечисленные причины,
принимая во внимание анамнез
заболевания, выставлен диагноз
исключения – острый канальцевый некроз токсического генеза (на фоне ТТ/ИТ?). Пациентке
своевременно назначена терапия
в соответствии со стандартами
лечения иоНЯ в виде глюкокортикостероидов (ГКС) в дозах 2
мг/кг (по преднизолону) с постепенным снижением доз ГКС с последующей их полной отменой. В
таблице 2 представлена динамика снижения уровня креатинина
крови и повышения уровня СКФ
в зависимости от доз ГКС.
Таблица 2.
Степень тяжести ОПП.
Терапию ГКС пациентка начала в
условиях инфекционного отделения под наблюдением нефролога,
в последующем, с выявленным
снижением уровня креатинина и отсутствием клинических
проявлений иоНЯ, в удовлетворительном общем состоянии выписана под наблюдение терапевта и онколога. Далее коррекция
терапии ГКС и контроль лабораторных показателей проводился в условиях СПБ ГБУЗ ГКОД.
Однако, несмотря на терапию
ГКС, достичь нормальных значений уровня креатинина крови не
удалось, но учитывая отсутствие
ухудшения общего состояния,
отсутствие клинической симптоматики, купирование иоНЯ до 1
степени, терапия ГКС прекращена. Пациентка в начале мая 2024
года выполнила контрольное обследование в СПБ ГБУЗ ГКОД, по
результатам которого сохраняется стабилизация опухолевого
процесса. Решением консилиума
было рекомендовано завершить
терапию ИКТ, а именно пембролизумабом, учитывая развившееся иоНЯ 3 степени тяжести, и
продолжить динамическое наблюдение.
Вывод
Клинический случай показывает, что, несмотря на активное
внедрение в современную клиническую практику ингибиторов
ИКТ, доказавших свою эффективность при лечении злокачественных новообразований, их
уникальный механизм действия
может обусловливать изменение
профиля НЯ с развитием иммуноопосредованного повреждения различных органов и тканей,
в том числе и стороны почек.
Наиболее часто встречается ОПП
в результате ОТИН и/или острого повреждения канальцев, однако возможно развитие целого
спектра нарушений, что следует
учитывать при проведении дифференциальной диагностики.
Подход к терапии иоНЯ определяется их степенью тяжести и в
случаях значимого нарушения
функции почек заключается в
отмене ингибитора ИКТ и назначении иммуносупрессивной терапии (в первую очередь
ГКС). Необходимы дальнейшие
исследования по установлению
факторов риска, расшифровке механизмов развития иоНЯ
со стороны почек, поиску биомаркеров раннего повреждения.
Важное практическое значение
будет иметь разработка единых
рекомендаций (с привлечением
онкологов и нефрологов) по ведению пациентов с иоНЯ со стороны почек, развившихся на фоне
терапии ингибиторами ИКТ.
Список литературы:
- Hodi FS, O'Day SJ, McDermott DF, et al. Improved survival with ipilimumab in patients with metastatic melanoma. N Engl J Med. 2010; 363(8): 711-23. DOI:10.1056/ NEJMoa1003466.
- Postow MA, Sidlow R, Hellmann MD. Immune-Related Adverse Events Associated with Immune Checkpoint Blockade. N Engl J Med. 2018; 378(2): 158-68. DOI:10.1056/ NEJMra1703481.
- Champiat S, Lambotte O, Barreau E, et al. Management of immune checkpoint blockade dysimmune toxicities: a collaborative position paper. Ann Oncol. 2016; 27(4): 559- 74. DOI:10.1093/annonc/mdv623.
- Voskens CJ, Goldinger SM, Loquai C, et al. The price of tumor control: an analysis of rare side effects of anti-CTLA-4 therapy in metastatic melanoma from the ipilimumab network. PLoS One. 2013; 8(1): e53745. DOI:10.1371/journal. pone.0053745.
- Cortazar FB, Marrone KA, Troxell ML, et al. Clinicopathological features of acute kidney injury associated with immune checkpoint inhibitors. Kidney Int. 2016; 90(3): 638-47. DOI:10.1016/j. kint.2016.04.008.
- Hofmann L, Forschner A, Loquai C, et al. Cutaneous, gastrointestinal, hepatic, endocrine, and renal side-effects of anti-PD-1 therapy. Eur J Cancer. 2016; 60: 190-209. DOI:10.1016/j.ejca.2016.02.025.
- Perazella MA, Shirali AC. Nephrotoxicity of Cancer Immunotherapies: Past, Present and Future. J Am Soc Nephrol. 2018; 29(8): 2039-52. DOI:10.1681/ ASN.2018050488.
- Mamlouk O, Selamet U, Machado S, et al. Nephrotoxicity of immune checkpoint inhibitors beyond tubulointerstitial nephritis: singlecenter experience. J Immunother Cancer. 2019; 7(1): 2. DOI:10.1186/ s40425-018-0478-8.
- Patel V, Elias R, Formella J, et al. Acute interstitial nephritis, a potential predictor of response to immune checkpoint inhibitors in renal cell carcinoma. J Immunother Cancer. 2020; 8(2): e001198. DOI:10.1136/jitc-2020-001198.
- Seethapathy H, Zhao S, Chute DF, et al. The Incidence, Causes, and Risk Factors of Acute Kidney Injury in Patients Receiving Immune Checkpoint Inhibitors. Clin J Am Soc Nephrol. 2019; 14(12): 1692-700. DOI:10.2215/CJN.00990119.
- Manohar S, Kompotiatis P, Thongprayoon C, et al. Programmed cell death protein 1 inhibitor treatment is associated with acute kidney injury and hypocalcemia: meta-analysis. Nephrol Dial Transplant. 2019; 34(1): 108-17. DOI:10.1093/ndt/gfy105.
- Cortazar FB, Kibbelaar ZA, Glezerman IG, et al. Clinical Features and Outcomes of Immune Checkpoint Inhibitor-Associated AKI: A Multicenter Study. J Am Soc Nephrol. 2020; 31(2): 435-46. DOI:10.1681/ASN.2019070676.
- Belliere J, Meyer N, Mazieres J, et al. Acute interstitial nephritis related to immune checkpoint inhibitors. Br J Cancer. 2016; 115(12): 1457-61. DOI:10.1038/bjc.2016.358.
- Kidney Disease: Improving global outcomes (KDIGO) acute kidney injury work group. KDIGO clinical practice guideline for acute kidney injury. Kidney Int Suppl. 2012; 2: 1-138. DOI:10.1038/kisup.2012.
- Захарова Е.В., Остроумова О.Д. Онконефрология: поражения почек при использовании противоопухолевых препаратов. Нефрология и диализ. 2020; 22(3): 383-95 [Zakharova EV, Ostroumova OD. Onco- nephrology: Anticancer Druginduced Kidney Damage. Nephrology and Dialysis. 2020; 22(3): 383-95 (in Russian)].DOI:10.28996/2618-9801- 2020-3-383-95.
- Shirali AC, Perazella MA, Gettinger S. Association of Acute Interstitial Nephritis With Programmed Cell Death 1 Inhibitor Therapy in Lung Cancer Patients. Am J Kidney Dis. 2016; 68(2): 287-91. DOI:10.1053/j.ajkd.2016.02.057.
- Izzedine H, Mateus C, Boutros C, et al. Renal effects of immune checkpoint inhibitors. Nephrol Dial Transplant. 2017; 32(6): 936-42. DOI:10.1093/ndt/gfw382.
- Hu R, Chen M, Xu Y, et al. Renal immune-related adverse events of immune checkpoint inhibitor. Asia Pac J Clin Oncol. 2020; 16(6): 305-11. DOI:10.1111/ajco.13387.
- Spanou Z, Keller M, Britschgi M, et al. Involvement of drugspecific T cells in acute druginduced interstitial nephritis. J Am Soc Nephrol. 2006; 17(10): 291927. DOI:10.1681/ASN.2006050418.
- Wuthrich RP, Glimcher LH, Yui MA, et al. MHC class II, antigen presentation and tumor necrosis factor in renal tubular epithelial cells. Kidney Int. 1990; 37(2): 783-92. DOI:10.1038/ki.1990.46.
- Francisco LM, Sage PT, Sharpe AH. The PD-1 pathway in tolerance and autoimmunity. Immunol Rev. 2010; 236: 219-42. DOI:10.1111/ j.1600-065X.2010.00923.
- Schoop R, Wahl P, Le Hir M, et al. Suppressed T-cell activation by IFN- gamma-induced expression of PD-L1 on renal tubular epithelial cells. Nephrol Dial Transplant. 2004; 19(11): 2713-20. DOI:10.1093/ndt/ gfh423 24.
- Murakami N, Motwani S, Riella LV. Renal complications of immune checkpoint blockade. Curr Probl Cancer. 2017; 41(2): 100-10. DOI:10.1016/j. currproblcancer.2016.12.004. 24. Marco T, Anna P, Annalisa T, et al. The mechanisms of acute interstitial nephritis in the era of immune checkpoint inhibitors in melanoma. Ther Adv Med Oncol. 2019; 11: 1758835919875549. DOI:10.1177/1758835919875549.
РЕЗОЛЮЦИЯ ПО РЕЗУЛЬТАТАМ СЕССИИ RUSSCO «ЗАКЛЮЧЕНИЕ NGS, КОНСЕНСУС МЕЖДУ ГЕНЕТИКОМ И КЛИНИЦИСТОМ»
Сессия состоялась 30 июля 2024 года в г. Горно-Алтайске, в рамках Всероссийской
конференции «Опухолевые маркеры - фундаментальные и клинические аспекты»,
которая проходила с 29 июля по 1 августа 2024 года. На ней обсуждались проблемы
осведомленности пациентов о молекулярно-генетических исследованиях (МГИ), были
затронуты актуальные вопросы формирования заключения по результатам NGS.
Ключевые темы:
1. Информированность
пациентов о МГИ.
Проведенный опрос среди 221 онкологического пациента, показал, что 32% считают МГИ недоступным, 70% уверены в его полезности для подбора наиболее эффективного лечения, у половины пациентов остаются вопросы и опасения по поводу проведения МГИ (начиная с того, какую лабораторию выбрать для проведения МГИ, заканчивая доступностью необходимого лекарственного лечения). И только 13% пациентов получили достаточную информацию о МГИ от врачей. Все это указывает на необходимость улучшения коммуникации между пациентом и врачом, повышения осведомленности пациентов о МГИ.
Предложены пути решения: проведение образовательных мероприятий (школ для пациентов), разработка информационных брошюр и онлайн ресурсов, подготовка врачебного сообщества по вопросам МГИ.
2. Формирование заключения по результатам МГИ, проведенного методом NGS.
Свою точку зрения высказали
259 врачей-онкологов и 36 врачей
лабораторных-генетиков/врачей
КЛД.
Большинство врачей-онкологов высказались о необходимости выносить в заключение информацию о качестве исследуемого материала, типе мутации (герминальная/соматическая) и класса патогенности/клинической значимости обнаруженной мутации. Технические характеристики запуска было предложено выносить отдельно от текста заключения, например, в примечание. Что же касается терапевтических опций, то подавляющее большинство врачей-онкологов ответило, что хотели бы видеть информацию об этом в заключении. Однако если найдены мутации в генах, которые не являются мишенями для таргетной терапии, такую информацию следует выносить в примечание.
Вопрос, касающийся терапевтических опций, выносимых в заключение, встает особенно остро и вызывает сомнения со стороны врачей лабораторных-генетиков/ врачей КЛД и некоторых врачейонкологов.
Пути решения:
1) Создание единого стандарта заключений по результатам МГИ, понятного врачам-онкологам и включающего пункты, необходимые врачам лабораторий для правильной трактовки результатов исследования;
2) Создание централизованной российской базы данных, в
которой была бы информация
от выявленного варианта до терапевтических опций, а также
информация о доступных клинических исследованиях и рекомендаций по лечению.
Поставленные задачи по результатам обсуждений:
А) Провести исследование и
опрос среди пациентов для повышения информированности о
молекулярно-генетических исследованиях, срок - до конца 2024
г., исполнитель - Ольга Владимировна Вострикова.
Б) Разработать информационные брошюры и материалы для пациентов о молекулярно-генетических исследованиях, срок - до первого квартала 2025 г., исполнитель: Российское общество клинической онкологии.
В) Создать образовательные программы для врачей о молекулярно-генетических исследованиях, срок - в течение 2025 г. провести 4 образовательных мероприятия, исполнитель - Российское общество клинической онкологии).
Г) Разработать стандарты для заключений по результатам молекулярно-генетических исследований, срок - до конца 2025 г., исполнитель - Российское общество клинической онкологии в партнерстве с Обществом Молекулярных генетиков.
Д) Создать централизованную
российскую базу данных о клинически значимых мутациях,
клинических исследованиях и
терапевтических опциях, срок запуска - до конца 2024 г., работа на
постоянной основе, исполнитель:
Российское общество клинической онкологии в партнерстве с
Обществом Молекулярных Генетиков.
Е) Возможность включения информации о терапевтических опциях в заключения по результатам
молекулярно-генетических исследований остается для дальнейшего обсуждения и принятия решения в медицинском сообществе.
