Дорогие коллеги, дорогие друзья!
Закончилось наше «каникулярное» лето, мы уже близки к середине осени. Потекли рутинные будни, загруженные работой, поездками, контактами, учебой…

Фредерик Хендрик Кеммерер. Укрываясь от бури. 1880-1890.
Холст, масло, 86,5х63 см. Частная коллекция
Белла Ахмадуллина. 1968
Я говорю вам: научитесь ждать! Еще не все! Всему дано продлиться! Безмерных продолжений благодать не зря вам обещает бред провидца: возобновит движение рука, затеявшая добрый жест привета, и мысль, невнятно тлевшая века, все ж вычислит простую суть предмета...
НОВОСТИ RUSSCO / RUSSCO НА VI МЕЖДУНАРОДНОМ ФОРУМЕ ОНКОЛОГИИ И РАДИОТЕРАПИИ «РАДИ ЖИЗНИ»
Эксперты Российского общества клинической онкологии (RUSSCO) приняли активнейшее участие в работе VI Международного форума онкологии и радиотерапии «Ради жизни» (Москва, 12-14 сентября 2023 г.).
НОВОСТИ RUSSCO / RUSSCO НА МЕЖДУНАРОДНОМ ФОРУМЕ «ИННОВАЦИОННАЯ ОНКОЛОГИЯ»
Российское общество клинической онкологии (RUSSCO) принимает участие в работе IV Международного форума «Инновационная онкология», который проводит в Москве с 6 по 9 сентября 2023 г. НМИЦ онкологии им. Н.Н. Блохина.


НОВОСТИ RUSSCO / ПРЕДСЕДАТЕЛЬ RUSSCO ВРУЧИЛ ПРЕМИЮ ХИМИОТЕРАПЕВТУ ГОДА
В Москве 12 сентября состоялась ежегодная церемония вручения Премии академика А.И. Савицкого лучшим специалистам-онкологам страны.

СОВРЕМЕННЫЕ ПОДХОДЫ К ДИАГНОСТИКЕ И ЛЕЧЕНИЮ МЕЗОТЕЛИОМЫ. ОБЗОР МАТЕРИАЛОВ КОНФЕРЕНЦИИ iMig-2023
В период с 26 по 28 июля 2023 года в г. Лилль состоялась 16-я Международная конференция международной группы по изучению мезотелиом (International Mesothelioma Interest Group – iMig)...

ЗНАКОМЬТЕСЬ: РЕГИОНАЛЬНОЕ ОТДЕЛЕНИЕ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ БРЯНСКОЙ ОБЛАСТИ
Брянская область входит в состав Центрального федерального округа, расположена к юго-западу от Москвы. Областной центр – город Брянск..

Экзамен ПО КЛИНИЧЕСКОЙ ОНКООРГИИ
14 ноября 2023 с 16:30 до 19:30

МНЕНИЕ: НУЖНО ЛИ ПРОВОДИТЬ ОНКОЛОГИЧЕСКИЙ КОНСИЛИУМ ДЛЯ ВСЕХ ПАЦИЕНТОВ? ДА, НУЖНО
Онкологический консилиум или мультидисциплинарная команда – объединение специалистов разного профиля для выбора наиболее оптимальной тактики лечения конкретного пациента...

TTF (TUMOR TREATING FIELDS) ТЕРАПИЯ В ЛЕЧЕНИИ БОЛЬНЫХ С ГЛИОБЛАСТОМОЙ: ДАННЫЕ МЕТААНАЛИЗА 9 ИССЛЕДОВАНИЙ
Далеко не всем онкологам в России известен метод TTF-терапии, несмотря на то, что в мире он применяется весьма успешно на протяжении нескольких лет, а в 2015 году был одобрен FDA для пациентов с впервые выявленной глиобластомой (ГБМ)...

SBRT + ИММУНОТЕРАПИЯ = ПОБЕДА?
То, о чем многие онкологи говорили на протяжении нескольких лет, начинает получать подтверждение...

УГОЛОК РАДИОТЕРАПЕВТА / ЛУЧЕВЫЕ ДЕРМАТИТЫ: ПОЧЕМУ ВСЕ МЕЧТАЮТ КОЛОНИЗИРОВАТЬ МАРС, А РАДИОТЕРАПЕВТЫ – ДЕКОЛОНИЗИРОВАТЬ ПОЛОСТЬ НОСА?
Острый лучевой дерматит остается частым нежелательным явлением при проведении лучевой терапии, особенно у пациентов со злокачественными новообразованиями (ЗНО) молочной железы или головы и шеи...
УГОЛОК РАДИОТЕРАПЕВТА / ИССЛЕДОВАНИЕ PAINPANC: О ВОЗМОЖНОЙ НЕДООЦЕНКЕ РОЛИ ЛОКАЛЬНЫХ МЕТОДОВ ДЛЯ КУПИРОВАНИЯ БОЛИ ПРИ РАСПРОСТРАНЕННОМ РАКЕ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
В самом конце августа в Красном журнале ASTRO (International Journal of Radiation Oncology, Biology & Physics) появилась статья, причем в открытом доступе, хоть и не в окончательном варианте, принятая к публикации буквально недавно с рекомендацией дополнить ряд данных, поэтому на страницах стоит штамп «Journal Pre-proof». Чем же так интересна эта работа?
Анонс
-

30 сентября 2023 13:00 - 13:50
Цикл вебинаров ДЛЯ ПОДГОТОВКИ К ЭКЗАМЕНУ ESMO. ОПУХОЛИ ЖКТ
Цикл вебинаров ДЛЯ ПОДГОТОВКИ К ЭКЗАМЕНУ ESMO. ОПУХОЛИ ЖКТ
-

14 - 16 НОЯБРЯ 2023 МОСКВА
XXVII РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС 2023
XXVII РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС 2023
-

14 ноября 2023
КОНКУРС МОЛОДЫХ УЧЕНЫХ
В РАМКАХ XVII РОССИЙСКОГО ОНКОЛОГИЧЕСКОГО КОНГРЕССА
Дорогие коллеги, дорогие друзья!
Закончилось наше «каникулярное» лето, мы уже близки к середине осени. Потекли рутинные будни, загруженные работой, поездками, контактами, учебой…
Мы приближаемся к главному научному событию года – XXVII Российскому онкологическому конгрессу. Программа составлена, вы можете увидеть ее на сайте rosoncoweb.ru и отметить наиболее интересные для вас сессии. Абстракты присланы, и комитет отбирает наиболее актуальные из них. Ждем вас в середине ноября, чтобы обсудить самые важные аспекты нашей работы, узнать новые факты по результатам недавних исследований – и просто встретиться с любимыми коллегами, погулять по Москве, напитаться положительными эмоциями.
Сентябрьский номер газеты, возможно, в большей степени заинтересует радиотерапевтов, поскольку немало новостей именно в этой специальности появилось в крупных журналах конца лета – начала осени (и продолжение следует). Очень важная информация по лечению мезотелиом будет интересна всем специалистам – мы не так много знаем о наиболее эффективных подходах к лечению этой сложной патологии. Вышел «с каникул» комитет молодых онкологов RUSSCO, предлагая вашему вниманию ряд доводов в отношении необходимости проведения мультидисциплинарных консилиумов – и мы ждем, найдутся ли оппоненты, скажущие «Нет, это совершенно не обязательно!»
Наконец, региональное отделение Брянcка знакомит нас со своей работой и являет миру свои лица – запомним наших коллег! Также напомним, что газета RUSSCO ждет новых авторов, новых клинических случаев для публикации и тем для общего обсуждения. Не стесняйтесь стать чуточку известнее в нашем онкологическом мире!
Летят наши дни, в работе и рутине… Но мы очень надеемся, что в череде обыденных будней вы не забываете о себе, своем здоровье, душевном балансе и маленьких и больших радостях жизни – хотя бы о хорошей книге с чашечкой кофе и кусочком шоколада, хорошем фильме по ноутбуку или походе в театр на любимый спектакль.
Душевной и теплой осени нам, дорогие друзья!
Ваша команда RUSSCO
Фредерик Хендрик Кеммерер. Укрываясь от бури. 1880-1890.
Холст, масло, 86,5х63 см. Частная коллекция

Белла Ахмадуллина. 1968
***
Я говорю вам: научитесь ждать!
Еще не все! Всему дано продлиться!
Безмерных продолжений благодать
не зря вам обещает бред провидца:
возобновит движение рука,
затеявшая добрый жест привета,
и мысль, невнятно тлевшая века,
все ж вычислит простую суть предмета,
смех округлит улыбку слабых уст,
отчаянье взлелеет тень надежды,
и бесполезной выгоды искусств
возжаждет одичалый ум невежды…
Лишь истина окажется права,
в сердцах людей взойдет ее свеченье,
и обретут воскресшие слова
поступков драгоценное значенье.
Белла Ахмадуллина. Продолжение следует. 1968
НОВОСТИ RUSSCO / RUSSCO НА VI МЕЖДУНАРОДНОМ ФОРУМЕ ОНКОЛОГИИ И РАДИОТЕРАПИИ «РАДИ ЖИЗНИ»

Эксперты Российского общества клинической онкологии
(RUSSCO) приняли активнейшее участие в работе
VI Международного форума онкологии и радиотерапии
«Ради жизни» (Москва, 12-14 сентября 2023 г.).
Среди ключевых тем, обсуждавшихся на Форуме:
• Организация онкологической помощи в РФ
• Организационные вопросы онкореабилитации:
от образовательных программ до клиники
• Актуальные проблемы радиационной онкологии
• Эндоскопия против рака
• Инновации в онкологии
В фойе участники Форума получили печатные издания
и другие раздаточные материалы RUSSCO, в том числе газету
RUSSCO и журнал «Злокачественные опухоли».

НОВОСТИ RUSSCO / RUSSCO НА МЕЖДУНАРОДНОМ ФОРУМЕ «ИННОВАЦИОННАЯ ОНКОЛОГИЯ»

Российское общество клинической онкологии (RUSSCO)
принимает участие в работе IV
Международного форума «Инновационная онкология», который проводит в Москве с 6 по 9
сентября 2023 г. НМИЦ онкологии им. Н.Н. Блохина.
В одной из интереснейших сессий «Практические рекомендации RUSSCO: что новое войдет в нашу практику в 2024 году?» приняли участие виднейшие российские эксперты, в том числе члены Правления Общества проф., д.м.н. О.А. Гладков (Челябинск) – новое в поддерживающей терапии, д.м.н. М.Ю. Федянин – новое в лечении колоректального рака, д.м.н. А.С. Тюляндина – инновации в онкогинекологии. Вел сессию председатель RUSSCO, проф., д.м.н. С.А. Тюляндин.
Отметим и еще одну сессию –
«Онкология завтра: несбыточная
мечта или достижимая цель?»,
подготовленную Советом молодых ученых НМИЦ онкологии
им. Н.Н. Блохина и Комитетом
молодых онкологов RUSSCOjr.
В фойе Форума его участники
смогли ознакомиться и получить
печатные издания и другие раздаточные материалы RUSSCO.

НОВОСТИ RUSSCO / ПРЕДСЕДАТЕЛЬ RUSSCO ВРУЧИЛ ПРЕМИЮ ХИМИОТЕРАПЕВТУ ГОДА
В Москве 12 сентября состоялась
ежегодная церемония вручения
Премии академика А.И. Савицкого
лучшим специалистам-онкологам
страны.
В номинации «Химиотерапевт года»
премию вручал председатель Российского общества клинической
онкологии (RUSSCO), заслуженный
деятель науки РФ, главный научный
сотрудник НМИЦ онкологии им.
Н.Н. Блохина Минздрава России,
профессор, доктор медицинских
наук Сергей Алексеевич Тюляндин.
Лауреатом стала врач-онколог ОГБУЗ Онкологический диспансер г. Биробиджан Юлия Мурзина (проект – «Работа врача-химиотерапевта в условиях небольшого учреждения»).
Присоединяемся к поздравлениям
коллег с заслуженными наградами и
желаем им дальнейших успехов в их
нелегком и благородном деле.

СОВРЕМЕННЫЕ ПОДХОДЫ К ДИАГНОСТИКЕ И ЛЕЧЕНИЮ МЕЗОТЕЛИОМЫ. ОБЗОР МАТЕРИАЛОВ КОНФЕРЕНЦИИ iMig-2023
Автор: Барболина Татьяна Дмитриевна
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России,
кандидат медицинских наук, Москва
ЧАСТЬ 1:
МЕЗОТЕЛИОМА ПЛЕВРЫ
В период с 26 по 28 июля 2023
года в г. Лилль состоялась 16-я
Международная конференция
международной группы по изучению мезотелиом (International
Mesothelioma Interest Group –
iMig) совместно с Французской
объединенной торакальной группой (French Cooperative Thoracic
Intergroup – IFCT). Эта междисциплинарная конференция собрала
делегатов со всего мира, чтобы
представить современные представления по различным интересующим вопросам в отношении
мезотелиом различных локализаций. Впервые Россия принимала
участие в этой конференции.
Международная группа по изучению мезотелиомы (iMig)
представляет собой сообщество
врачей, фундаментальных исследователей, ученых, включая
сестринские, пациентские фармацевтические, общественные
и юридические сообщества. Это
единственная общественная организация, посвященная исключительно изучению мезотелиомы,
занимающаяся вопросами генетики, иммунных и молекулярных
механизмов и эпидемиологических факторов, лежащих в основе
развития мезотелиомы, с целью
установления наилучших возможностей диагностики и лечения этого заболевания.
Основываясь на опыте и успехе
предыдущих конференций с момента основания iMig в Париже
в 1991 году (далее каждые 2 года
конференция проходила в Бостоне, Кейптауне, Бирмингеме, Оттаве, не говоря уже об успешной
виртуальной конференции iMig,
проведенной в 2021 году австралийскими коллегами), 16-я конференция, благодаря семинарам,
пленарным заседаниям, устным и
стендовым докладам, предоставила множество возможностей для
общения с ведущими учеными и
исследователями, а также с пациентами и их ассоциациями, в первую очередь, для налаживания
международного сотрудничества.
Мы представляем материалы по
наиболее интересным и спорным
вопросам в отношении злокачественной мезотелиомы.
Эпидемиология
К сожалению, истинная распространенность мезотелиомы неизвестна, поскольку есть страны,
которые не репортируют о случаях выявления мезотелиомы.
Заболеваемость очень сильно вариабельна от 0 до 10 случаев на
миллион населения каждый год.
Статистические данные по распространенности мезотелиомы
хорошо представлены из Австралии, Великобритании, Нидерландов, Италии, Голландии и США.
К сожалению, мало подобной информации из Индии, Африки и
России. По-прежнему основной
причиной развития мезотелиомы
считается асбест, причем все его
волокна, особенно амфиболовые
варианты, а также вермикулит, цеолит, ставший причиной массовой
семейной наследственной мезотелиомы в Турции, как и флюорит
на Сицилии. Однако тип, размер
и синергизм асбестовых волокон,
а также длительность контакта с
ними остаются предметом изучения. Не стихают противоречивые
данные о вреде хризотил-асбеста
и его роли в развитии мезотелиомы. Другими причинами возникновения мезотелиомы считаются
радиация, хроническое воспаление, генетическая предрасположенность. Несмотря на все имеющиеся знания, в нашей практике
появляется новый термин «идиопатическая» мезотелиома, причины возникновения которой
неясны.
По мнению Vahan Kepenekian,
(Франция) заболеваемость мезотелиомой в различных странах
приняла масштабы эпидемии.
Тенденция эпидемии остается неопределенной. Отсутствие
данных по подавляющему большинству стран мира не позволяет достичь осознания рисков,
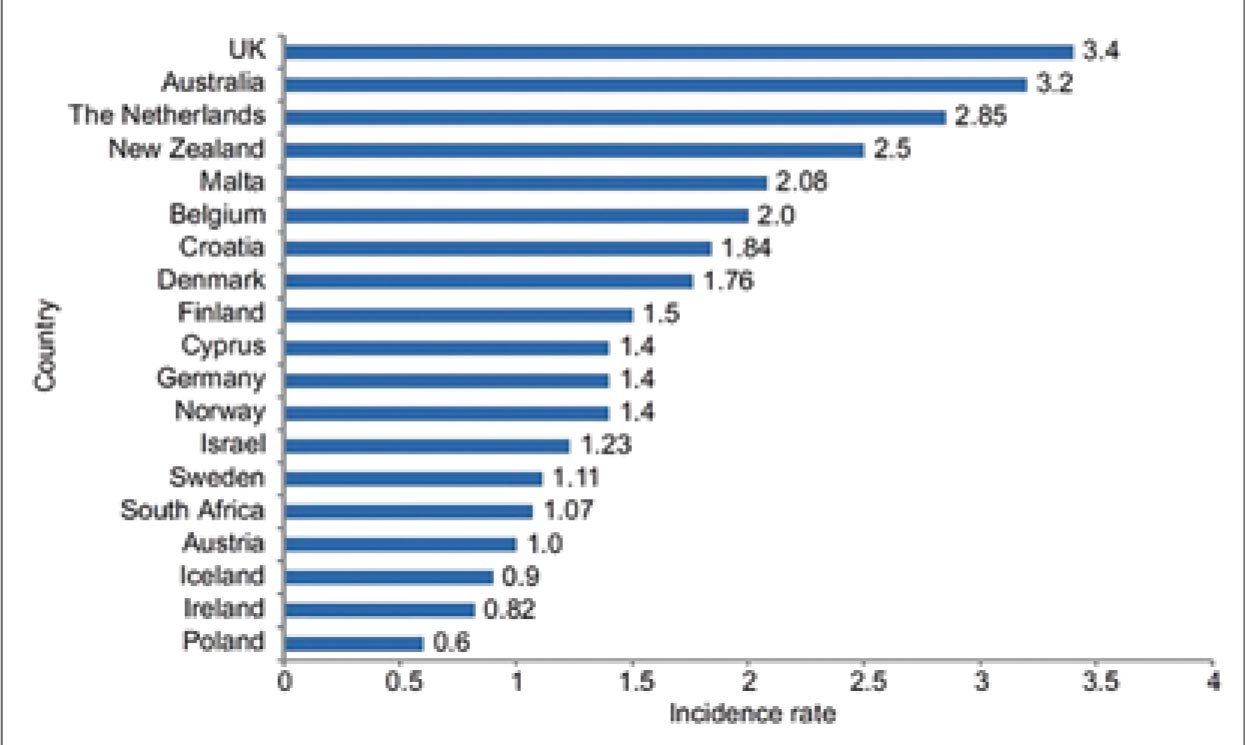
связанных с воздействием асбеста. На рисунке 1 представлены
стандартизованные по возрасту
(мировые) показатели заболеваемости на 100 000 населения среди
мужчин [1].
Рисунок 1.
Мезотелиома в некоторых странах. Стандартизированные по возрасту (мировые) показатели заболеваемости на 100 000 населения, мужчины.
Молекулярно-генетические
основы развития
мезотелиом. Плевральная
и перитонеальная
мезотелиома –
родственники, но не сестры
О том, что мезотелиома плевры и
мезотелиома брюшины являются
абсолютно самостоятельными нозологиями, становится все очевиднее.
Геномный ландшафт мезотелиом в
основном характеризуется потерей
генов-супрессоров опухолей и мутациями в генах репарации ДНК. В настоящее время данные молекулярно-генетического анализа методом
секвенирования нового поколения
(NGS) мезотелиомы ограничены малым числом наблюдений. Согласно
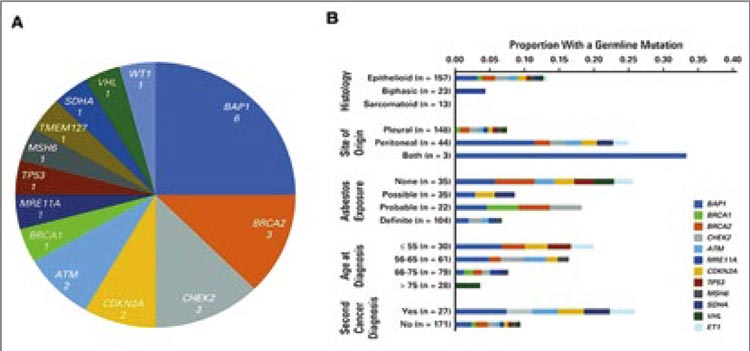
результатам обследования 198 пациентов, у 23 (12%) пациентов с мезотелиомой плевры, брюшины и вагинальной оболочки яичка выявлено
24 герминальные (зародышевые)
мутаций в 13 генах (рис.2). Мутации
BAP1 встречались чаще (n=6; 25%).
Плевральная локализация, воздействие асбеста и пожилой возраст
связаны с низкой вероятностью наличия зародышевой мутации [2].
Герминальные мутации встречаются в 25% случаев при перитоненальной мезотелиоме и лишь в 7% случаев при плевральной локализации
(p<0,01).
Рисунок 2.
А) Гены предрасположенности к развитию мезотелиомы.
В) Клиническая характеристика пациентов с герминальной мутацией.
Hiltbrunner S., ссылаясь на работы
Raphael Bueno (2016 г.) и Hmeljak
J. (2018 г.), лидеров по морфологической диагностике мезотелиом,
представил данные о распространенности геномных нарушений
при мезотелиоме плевры (n-1113)
и мезотелиоме брюшины (n-355)
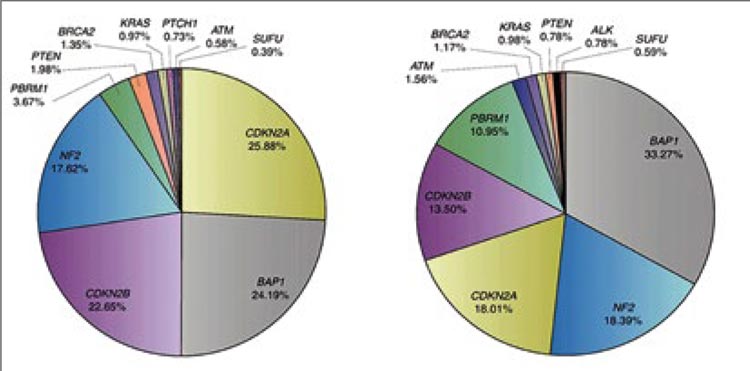
[3]. Анализ выявил изменения в 19
генах с общей распространенностью не менее 2%. BAP1, CDKN2A,
CDKN2B, NF2, MTAP, TP53 и SETD2
встречались с распространенностью не менее 10%. Изменения
CDKN2A, CDKN2B и MTAP представляли собой преимущественно
делеции числа копий. Мезотелиома
брюшины, по сравнению с мезотелиомой плевры, характеризовалась
меньшей распространенностью мутаций CDKN2A, CDKN2B и MTAP.
Более того, авторы смогли определить четыре отдельные подгруппы
в соответствии с наличием BAP1
и CDKN2A/B (рис.3). Группа 1 характеризуется изменениями BAP1,
CDKN2A и CDKN2B. Для группы
2 характерны только CDKN2A и
CDKN2B. Группа 3 характеризуется
мутацией BAP1, а группа 4 не имеет
генетических поломок вовсе.
Рисунок 3.
Геномные изменения в опухолях мезотелиомы плевры (слева)
и при мезотелиоме брюшины (справа).
Подгруппы только с нарушением
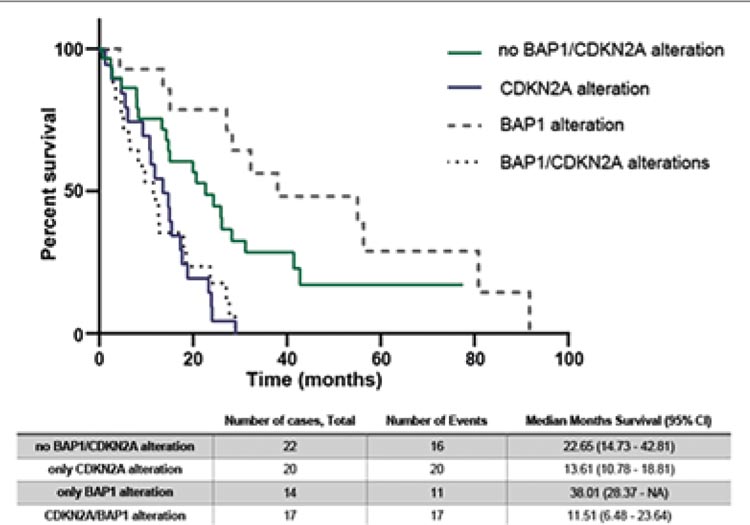
CDKN2A и подгруппы с изменением CDKN2A/BAP1 имеют наихудшую выживаемость. Интересно, что
подгруппа без изменений CDKN2A
или BAP1 имеет наиболее благоприятный прогноз (рис.4).
Рисунок 4.
Общая выживаемость пациентов с различными вариантами
генетических нарушений.
Мезотелиомы содержат меньше
соматических мутаций по сравнению с другими опухолями, при
этом менее 5% опухолей мезотелиомы имеют высокий показатель
мутационной нагрузки (TMB)
(определяемой как ≥10 мутаций/
Mb): в среднем 1,7 мутации на Мб
[4]. Авторы не обнаружили различий в TMB между плевральным
и перитонеальным поражением.
Так, встречаемость высокой TMB
была у 15 (1,35%) пациентов с мезотелиомой плевры и у 5 (1,41%)
пациентов с мезотелиомой брюшины.
Морфологическая
классификация
В международной гистологической
классификации ВОЗ 2021 года (5-е
издание) появились новые термины и подходы к морфологической
диагностике мезотелиом. В первую
очередь, принципиальным отличием от классификации 2015 года стало понимание, что все мезотелиомы злокачественные. Плевральная
мезотелиома и мезотелиома перикарда были объединены в одну главу, тогда как в классификации ВОЗ
за 2015 г. мезотелиома перикарда
была классифицирована как опухоли сердца. Во-вторых, абсолютным
открытием стала неинвазивная
мезотелиома in situ (MIS), характеризуемая как преинвазивные
одиночно расположенные участки
пролиферации неопластических
мезотелиальных клеток с потерей
BAP1 и/или CDKN2A/MTAP.
BAP1, CDKN2A, MTAP и р16 стали
практически обязательными диагностическими маркерами. Однако потеря BAP1 по данным ИГХ не
является эквивалентом герминальной мутации, а р16 не определяет
степень злокачественности. MTAP
методом ИГХ будет суррогатом потери CDKN2A.
Клиническая картина MIS включает в себя отсутствие опухолевых масс по плевре как по данным рентгенологических методов
обследования, так и при торакоскопической визуализации. Рецидивирующий плеврит, семейный
анамнез, длительный контакт с асбестом или воздействие радиации
дают основание заподозрить эту
формы мезотелиомы. В этом случае очевидной становится необходимость множественной биопсии
плевры, перикарда, брюшины, исследование смывов с плевральных
поверхностей и внесения диагностических изменений в существующие клинические рекомендации.
Основные изменения в новой классификации представлены в таблице 1.
Таблица 1.
Сравнительная характеристика международной
гистологической классификации мезотелиом (WHO)
2015-2021 г

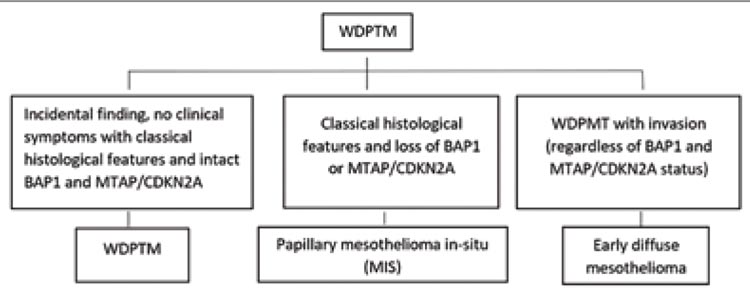
Таким образом, выделение MIS
диктует необходимость пересмотра TNM классификации и внесения изменений в диагностические
и лечебные подходы, а хорошо
дифференцированная папиллярная мезотелиальная опухоль
(WDPMT) рассматривается как
предрак (рис.5).
Рисунок 5.
Общая выживаемость пациентов с различными вариантами
генетических нарушений.
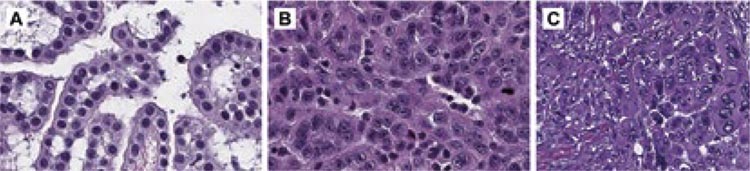
Для эпителиоидной диффузной
мезотелиомы становится обязательным определение степени дифференцировки (high или low grade)
и других цитологических и/или
стромальных особенностей (рис.6).
Рисунок 6.
Примеры диффузной мезотелиомы плевры с ядерной атипией: А)
легкая, 1; Б) умеренная, 2; и C) тяжелая, 3
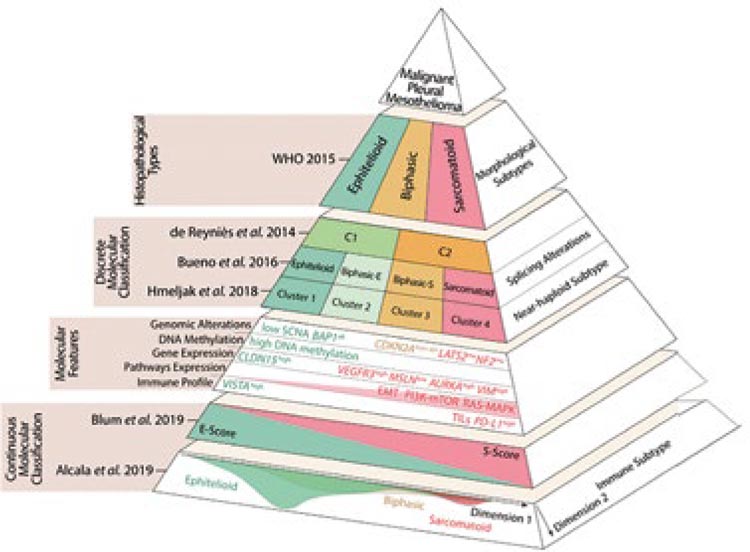
Таким образом, обобщив данные
о молекулярном ландшафте мезотелиомы за последние 6 лет, была
создана молекулярная классификация мезотелиомы (рис.7).
Рисунок 7.
Дизайн молекулярной классификации мезотелиом в современном
представлении
Новая терминология
в хирургии
Существующая в настоящий момент
терминология в описании объемов
хирургического лечения мезотелиомы плевры не позволяет сформировать единый стандартизованный
хирургический подход. Японские
коллеги настаивают на необходимости единых правил описания операционного протокола, что позволит
объединять международный опыт,
учитывая редкость заболевания и
резектабельных форм особенно.
Как известно, в настоящее время используется два вида операции: плевропульмонэктомия (ЕРР) и плеврэктомия (или декортикация легкого)
(PD). Какая из вышеперечисленных
хирургических процедур предпочтительнее, до сих пор не установлено, поскольку нет рандомизированных клинических исследований,
сравнивающих обе процедуры, и
решение о том, какую хирургическую процедуру выполнить, больше
зависит от предпочтений и опыта
хирурга. Нерандомизированные
сравнения и объединенные данные
из крупных регистров позволяют
предположить, что PD может быть
более осуществимой процедурой
из-за более низкой периоперационной смертности и лучшего качества
жизни, в том числе у пожилых пациентов, из-за его щадящей техники.
Действующая терминология не
позволяет описать все проведенные хирургические манипуляции, а полнота редукции и эксплоративная торакотомия вовсе
не учитываются.
Для более стандартизованного
подхода для применения в ежедневной клинической практике
предлагается более удобная и понятная хирургическая номенклатура, которая поможет хирургу
описать все детали:
1) Название операции:
• ЕРР или PD без резекции диафрагмы/перикарда
• Расширенные (extEPP, extPD)
с резекцией диафрагмы/перикарда
• ET – эксплоративная торакотомия
2) Радикальность операции:
Термин макроскопически полная резекция (MCR) должен включать удаление всех визуально и пальпаторно определяемых очагов опухоли. В зависимости от объема (%) остаточной резидуальной опухоли выделены 4 типа макроскопически определяемой полноты редукции:
• 0% – MCR=R1
• <10% – R2
• 10-90% – частичная (partial) PD
• >90% – эксплоративная операция
(ET)
3) Объем резекции:
Декортикация – PD, часть легкого – L:
• PD – без резекции легкого
• PD-L1 – с клиновидной резекцией части легкого
• PD-L2 – с сегментэкомией
• PD-L3 – с лобэктомией
При расширенной плеврэкомии к
вышеуказанным аббревиатурам
добавляется приставка «ext».
• CW (Chest wall) – резекция грудной стенки
• CW-0 – резекция не проводилась
• CW-1 – резекция мягких тканей
• CW-2 – резекция ребер
Таким образом, объем проведенной
операции может быть указан как
extPD-L2 CW-0 R2, что будет означать, что проведена расширенная
плеврэктомия с резекцией диафрагмы, перикарда, сегментэктомией
легкого, без резекции грудной клетки, с остаточной опухолью менее
10%.
Будут ли внесены изменения в действующую терминологию, пока неизвестно, но то, что существующая
не удовлетворяет потребностей
хирургов, занимающихся лечением
мезотелиом, очевидно.
Неоадъювантная терапия
и комплексный подход
Подходы к лечению мезотелиом различных локализаций различаются, однако при любом типе оптимальным является комплексный подход. Роль хирургического метода лечения за последние годы возросла в большей степени при мезотелиоме брюшины (рис.8), а использование системной химиотерапии увеличилось с 2003 года для мезотелиомы плевры (с 9,3% до 39,4% на основании анализа 12168 пациентов из Голландского ракового регистра) [6].
Рисунок 8.
Роль различных методов лечения мезотелиомы с 1993 по 2018
год: А) мезотелиома плевры, В) мезотелиома брюшины. Суммированные
области не составляют в сумме 100% из-за пациентов, получающих мультимодальное лечение, или пациентов, получающих другое лечение. MPM –
злокачественная мезотелиома плевры. MPeM – злокачественная мезотелиома
брюшины. BSC – лучшая поддерживающая терапия.
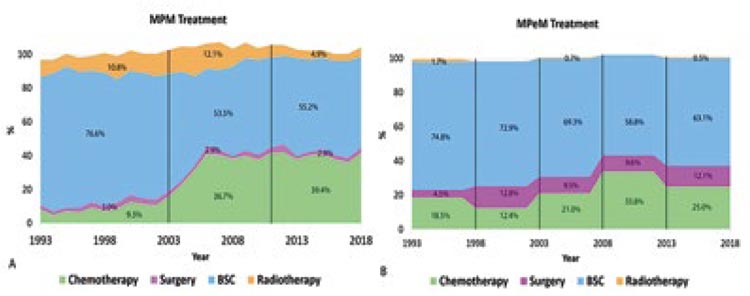
Несмотря на то, что число пациентов, получивших лечение, увеличивается с 2003 года, большинство пациентов по данным на 2018 год не получают никакой противоопухолевой терапии.
Надо отметить, что хирургический метод по-прежнему является основным в лечении мезотелиомы как плевры, так и брюшины. Выживаемость несколько улучшилась за последние годы, однако прогноз этого заболевания по-прежнему остается неблагоприятным (рис.9).
Рисунок 9.
Кривые общей выживаемости пациентов (1993-2018 гг.) с мезотелиомой плевры (слева) и брюшины (справа) в зависимости от проводимого
лечения
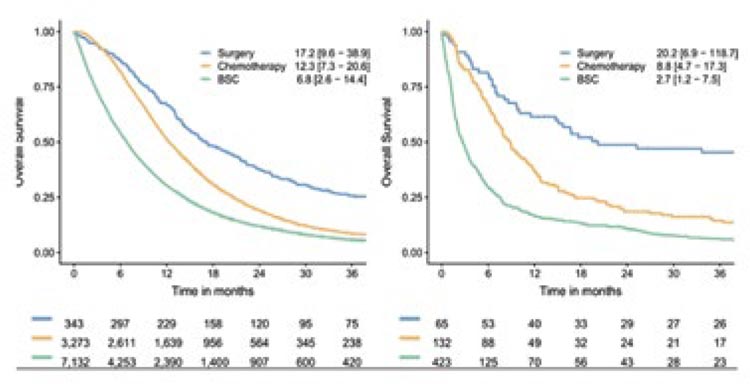
Поскольку ни EPP, ни PD не гарантируют радикального удаления опухоли при мезотелиоме плевры, в настоящее время весьма актуальным является комплексный подход с включением неоадъювантной или адъювантной химиотерапии, послеоперационной лучевой терапии (PORT) или других вмешательств, таких как фотодинамическая терапия (ФДТ) или гипертермическая интраоперационная внутриплевральная химиотерапия (HITOX), или их комбинации.
Мультимодальный подход в лечении мезотелиомы плевры является наиболее эффективным, при котором мОВ достигла 17-25 мес., но последовательность хирургического, лучевого и лекарственных методов все еще обсуждается. В ретроспективном анализе Sharkey et al. разницы в ОВ между адъювантной и неоадъювантной химиотерапией не получено [7], а по данным Cao et al. мОВ составила 23,1 мес. в группе адъювантной химиотерапии по сравнению с 27,8 мес. в группе неоадъювантной химиотерапии [8]. Следует также понимать, что сроки и схемы адъювантной химиотерапии различаются между исследованиями, и несмотря на то, что неоадъювантный этап удается провести большинству пациентов, хирургическое лечение с последующей лучевой терапией получают не более 52-65% пациентов по данным различных авторов.
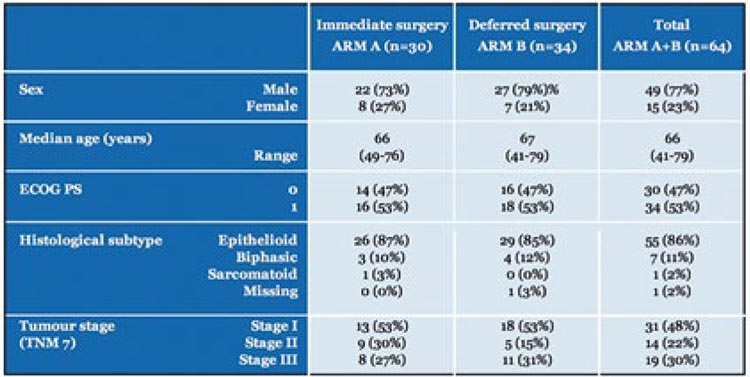
Окончательным, по-видимому, ответом в этом вопросе станут результаты рандомизированного исследования II фазы EORTC1205, предварительно показавшие отсутствие различий между группами с индукционной химиотерапией и хирургией up-front. В исследование включались пациенты с cT1-3N0-2M0 (7-я классификация), ранее не получавшие противоопухолевого лечения (химический плевродез тальком допускался).
Группа А получала хирургическое лечение и адъювантную ХТ (3-6 циклов пеметрексед/цис- или карбоплатин). Группа В начинала лечение с неоХТ с последующей операцией не позднее 4 недель после завершения лекарственной терапии. Запланированный объем операции – PD или extPD.
Включено 64 пациента, по 32 в каждую группу. Характеристика пациентов представлена в таблице 2.
Таблица 2.
Характеристика пациентов, включенных
в исследование EORTC1205
Официальные результаты исследования еще не опубликованы. Предварительные данные представлены в таблице 3, согласно которым авторы видят некоторое преимущество в адъювантном лечении в показателях выживаемости без прогрессирования.
Таблица 3.
Предварительные результаты эффективности
и токсичности неоадъювантной и адъювантной химиотерапии в исследовании EORTC1205
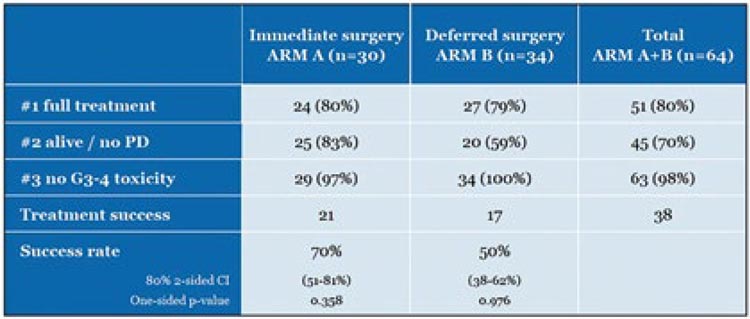
В ходе дискуссии на конференции iMig2023 ведущими экспертами было подтверждено, что определяющую роль в выборе последовательности операции и химиотерапии играет опыт хирурга. Поскольку неоадъювантная химиотерапия не приводит к увеличению резектабельности и уменьшению объема операции, а отдаленные результаты доказательно не улучшены, то хирургическое лечение при условии абсолютной резектабельности опухоли должно быть в приоритете, и именно с этого лечения нужно начитать, добавляя системную ХТ в адъювантном режиме.
Иммунотерапия
Иммунотерапия все больше проникает в сферу лечения злокачественных новообразований. Представлены результаты небольшого мультицентрового исследования I фазы S1619 по изучению неоадъювантной терапии атезолизумабом в сочетании с пеметрекседом и цисплатином с поддерживающей адъювантной терапией атезолизумабом при резектабельной I-III ст. мезотелиоме плевры. В исследование включены 28 пациентов. Неоадъювантная терапия включала четыре цикла цисплатина (75 мг/м2), пеметрекседа (500 мг/м2) и атезолизумаба (1200 мг в/в) каждые 3 недели. При отсутствии прогрессирования болезни был проведен хирургический этап. Далее проводилась адъювантная иммунотерапия атезолизумабом 1200 мг внутривенно каждые 3 недели в течение 1 года. Объем операции выбирался на усмотрение хирурга: ЕРР или PD. Пациенты, перенесшие пневмонэктомию, также получили послеоперационную лучевую терапию.
В итоге 25 пациентов получили как минимум 2 курса неоадъювантной терапии, и 21 пациент получил весь запланированный объем неоадъювантного лечения, однако только 18 из них были прооперированы (1 – EPP, 17 – PD), а 15 получили поддерживающую терапию атезолизумабом. К сожалению, 7 пациентов не завершили первый этап лечения: несмотря на раннюю стадию болезни, у 4 пациентов при нео-терапии отмечено прогрессирование, у 2 пациентов развилась непереносимая токсичность, 1 пациент скончался из-за сепсиса, не связанного с проводимым лечением. Через 20 месяцев наблюдения медиана общей выживаемости не была достигнута, а медиана выживаемости без прогрессирования составила 18,6 мес. (рис.10).
Рисунок 10.
Кривые общей и безрецидивной выживаемости
при неоадъювантной химиоиммунотерапии в исследовании S1619.
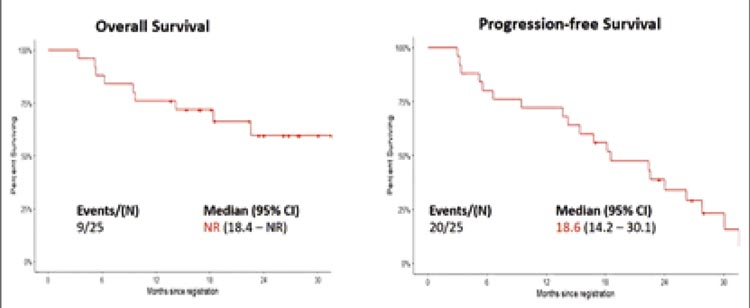
Предвзятость отбора была проблемой для этого исследования. Пока не будет проведен окончательный анализ, авторы хотели бы воздержаться от рассуждений о пользе добавления атезолизумаба в схему неоадъювантного лечения.
Иммунотерапия неоперабельной мезотелиомы плевры
Иммунотерапия активно включается в схемы лечения мезотелиомы плевры. Мы уже знаем о прорывных результатах исследования CheckMate-743, где комбинация двух иммунных препаратов ниволумаба и ипилимумаба позволила улучшить общую выживаемость при всех гистологических подтипах по сравнению со стандартной химиотерапией пеметрекседом с цисплатином (18,1 против 14,1 мес. соответственно). Более того, число пациентов, удерживающих ответ через 4 года, составило 16% при иммунотерапии в сравнении с 0% при ХТ.
Безусловным фаворитом на конференции стали результаты исследования Канадской группы по изучению рака (CCTG) IND.227 при использовании комбинации химиотерапии с пембролизумабом в 1 линии лечения (рис.11).
Рисунок 11.
Дизайн исследования IND.227.
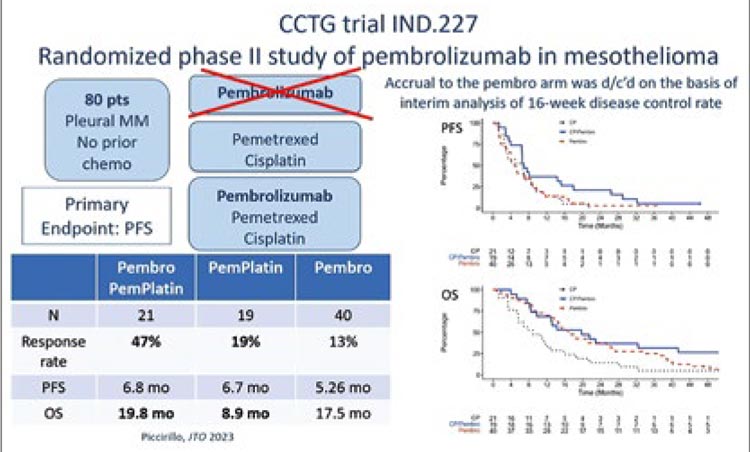
В исследование рандомизировано 440 пациентов с МП; 218 пациентов в группу химиотерапии пеметрексед/цисплатин и 222 пациента в группу с ХТ теми же препаратами и пембролизумабом. Медиана общей выживаемости составила 17,3 мес. против 16,1 мес. для группы ХТ-пембро против группы с ХТ (HR 0,79; 95% CI 0,64-0,98; p=0,0324), мВБП составила 7,13 мес. против 7,16 мес. соответственно (HR 0,80; 95% CI 0,65-0,99, р=0,0372). Частота объективного ответа была значительно выше для ХТ-пембро (63% против 40%, p<0,0001). Нежелательные явления (НЯ) 3-й степени или выше, связанные с пембролизумабом, наблюдались у 19% пациентов (наиболее часто отмечались утомляемость (5%) и диарея; пульмониты (2%); 16% пациентов прекратили лечение полностью из-за развития иммуноопосредованных НЯ). Авторы однозначно сделали выводы, что со статистически значимым улучшением мОВ и приемлемой переносимостью комбинация пеметрекседа, цисплатина и пембролизумаба является вариантом лечения нерезектабельной МП в 1 линии лечения.
Не менее интересными были результаты исследования PEMMELA, одноцентровое рандомизированное исследование без группы сравнения по изучению эффективности пембролизумаба с ленватинибом во второй и третьей линии у пациентов со злокачественной мезотелиомой плевры. Ленватиниб – это ингибитор рецепторов тирозинкиназ, избирательно подавляющий киназную активность рецепторов фактора роста эндотелия сосудов (VEGF) – VEGFR1 (FLT1), VEGFR2 (KDR) и VEGFR3 (FLT4). Также ленватиниб воздействует на другие рецепторы тирозинкиназ, задействованных в проангиогенных и онкогенных механизмах, включая рецепторы фактора роста фибробластов 1-го, 2-го, 3-го и 4-го типов (FGFR1, 2, 3 и 4), альфа-рецептор тромбоцитарного фактора роста (PDGFRa), а также рецепторы тирозинкиназ KIT и RET. Именно синергизм ингибиторов иммунных контрольных точек с антиангиогенными препаратами послужил началом данного исследования. Дизайн исследования представлен на рисунке 12.
Рисунок 12.
Дизайн исследования PEMMELA.
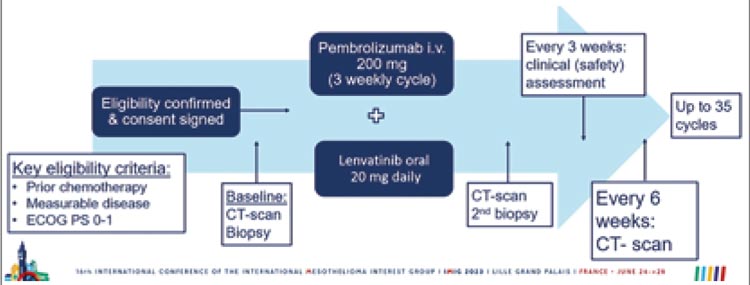
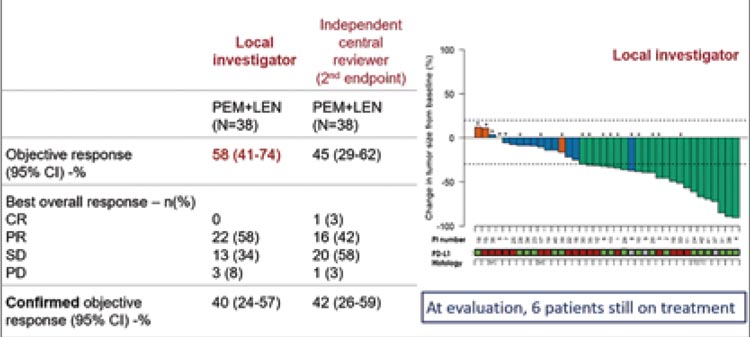
В исследование включено 38 пациентов. Из 38 пациентов 33 (86,8%) были мужчинами, 19 (50%) имели статус ECOG 0 и средний возраст составил 70,5 лет (диапазон 36-83). У большинства пациентов (89,5%) была выявлена эпителиоидная МП, у 5,3% — неэпителиоидная мезотелиома, а у остальных 5,3% — смешанная форма. У 18 пациентов (47,4%) выявлена экспрессия PD-L1, 17 (44,7%) были PD-L1-отрицательными и 3 (7,9%) имели неопределенный статус. Несмотря на то, что полных регрессий не было отмечено, что вполне ожидаемо, учитывая 2 и 3 линию лечения, объективный эффект удалось подтвердить в 40% случаев (39,5%; 95% CI 24-57%; р=0,07). Результаты представлены на рисунке 13.
Рисунок 13.
Эффективность применения комбинации пембролизумаба
и ленватиниба во 2 и 3 линиях лечения в исследовании PEMMELA.
Токсичность изучаемого режима оказалась относительно приемлемой (рис.14). Основными жалобами стали слабость и дисфония 1-2 ст., диарея 1-2 степени, а тяжелые нежелательные явления 3-4 степени в виде повышения артериального давления и анорексии отмечены у 8 (21%) и 4 (10,5%) пациентов соответственно.
Рисунок 14.
Характеристика нежелательных явлений при применении комбинации пембролизумаба и ленватиниба во 2 и 3 линиях лечения в исследовании PEMMELA.
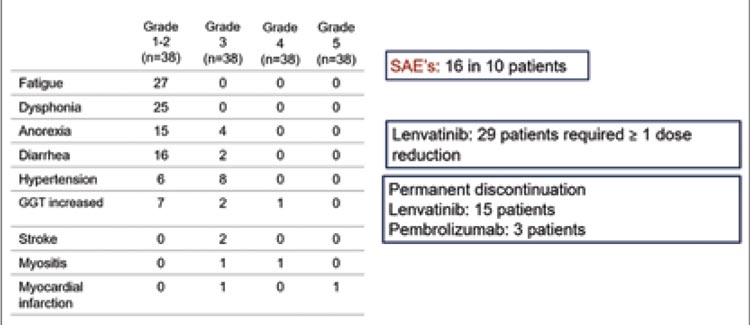
Снижение дозы или окончательное прекращение лечения ленватинибом потребовались у 76% пациентов из-за токсичности, что вполне закономерно, учитывая начальную дозу 20 мг/сут. Пембролизумаб полностью отменен в 3 (8%) случаях из 38 из-за НЯ. Кроме того, было 2 пациента с миозитом 3-4 степени и 10 пациентов с 16 серьезными нежелательными явлениями, связанными с лечением.
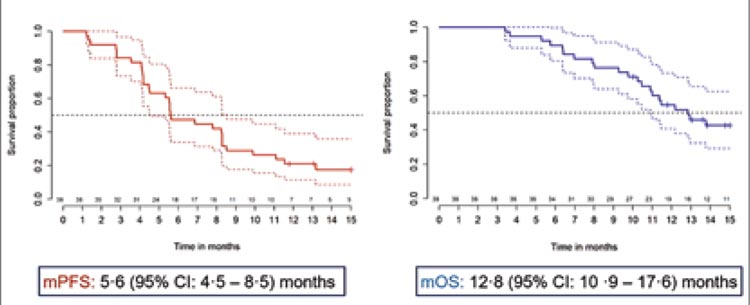
Медиана ВБП составила 5,6 мес., а медиана ОВ – 12,8 мес., что наглядно представлено на рисунке 15.
Рисунок 15.
Кривые общей выживаемости и выживаемости без прогрессирования в исследовании PEMMELA.
Таким образом, дальнейшие исследования иммуно- и таргетных препаратов представляются перспективными.
Необходимость продолжения исследований по лекарственному лечению мезотелиом очевидна. Повышенный интерес к злокачественной мезотелиоме, несмотря на редкость данной патологии, в виде тематической международной конференции дает надежду на новые научные изыскания, которые, возможно, улучшат перспективы лечения этих больных.
Источники:
- Bianchi C, Bianchi T. Global mesothelioma epidemic: Trend and features. Indian J Occup Environ Med. 2014; 18(2): 82-88.
- Panou V, Gadiraju M, Wolin A, Weipert C, Skarda E, et al. Frequency of Germline Mutations in Cancer Susceptibility Genes in Malignant Mesothelioma. J Clin Oncol. 2018; 36(28): 2863-2871.
- Hiltbrunner S, Fleischmann Z, Sokol E, Zoche M, Felley-Bosco E, et al. Genomic landscape of pleural and peritoneal mesothelioma tumours. Br J Cancer. 2022; 127(11): 1997-2005.
- Sauter J, Dacic S, Galateau-Salle F, Attanoos R, et al. The 2021 WHO Classification of Tumors of the Pleura: Advances Since the 2015 Classification. J. of Thoracic Oncol. 2022; 17(5): 608-622.
- Fernandez-Cuesta L, Mangiante L, Alcala N, Foll M. Challenges in lung and thoracic pathology: molecular advances in the classification of pleural mesotheliomas. Virchows Arch. 2021; 478(1): 73-80.
- van Kooten JP, Belderbos К, von der Thüsen J, Aarts M, Verhoef C, et al. Incidence, treatment and survival of malignant pleural and peritoneal mesothelioma: a populationbased study. Thorax. 2022; 77: 1260-1267.
- Sharkey AJ, O'Byrne KJ, Nakas A, et al. How does the timing of chemotherapy affect outcome following radical surgery for malignant pleural mesothelioma? Lung Cancer. 2016; 100: 5-13.
- Cao C, Tian D, Manganas C, et al. Systematic review of trimodality therapy for patients with malignant pleural mesothelioma. Ann Cardiothorac Surg. 2012; 1: 428-37.
ЗНАКОМЬТЕСЬ: РЕГИОНАЛЬНОЕ ОТДЕЛЕНИЕ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ БРЯНСКОЙ ОБЛАСТИ
Брянская область входит в состав Центрального федерального
округа, расположена к юго-западу
от Москвы. Областной центр – город Брянск. Численность населения области по данным Росстата
составляет 1 152 505 чел. (2023 г.).
Городское население – 70,25%.
Брянская область лежит в западной части Восточно-Европейской
равнины, занимая среднюю часть
бассейна Десны и лесистый водораздел между ней и Окой.
Центром онкологической службы
региона является ГАУЗ «Брянский областной онкологический
диспансер» в г. Брянск.
Еще шла Великая Отечественная война, когда 5 июля 1944 года
Указом Президиума Верховного
Совета СССР была образована
Брянская область. Началось формирование новой административно-территориальной структуры,
и уже в декабре 1945 года вышли
первые документы об организации онкологического диспансера.
В первой половине 1946 года на
территории Брянской области появилось новое лечебно-профилактическое учреждение – областной
онкологический диспансер. Этот
год и стал официальной точкой
отсчета становления онкологической службы на Брянщине. Вновь
организованный диспансер имел
в своем составе всего лишь один
кабинет при консультативной поликлинике Брянской областной
больницы №1 и 10 коек в хирургическом отделении этой же больницы. Фактически же самостоятельным учреждением диспансер стал
только в январе 1947 года, когда
был переведен в отдельное здание
и ему было выделено 30 коек для
диагностики и лечения онкологических больных, а штат сотрудников насчитывал 3 врача и 5 медицинских сестер.
В результате аварии на Чернобыльской АЭС 26 апреля 1986
года часть территории Брянской
области была загрязнена долгоживущими радионуклидами
(главным образом Злынковский,
Климовский, Клинцовский, Новозыбковский, Красногорский и
Гордеевский районы). Загрязнению подверглось более 200 тысяч
кв. км. Загрязнение было очень
неравномерным, оно зависело от
направления ветра в первые дни
после аварии. Наиболее сильно
пострадали области, находящиеся
в непосредственной близости от
ЧАЭС: северные районы Киевской
и Житомирской областей Украины, Гомельская область Белоруссии и Брянская область России.
Большая часть стронция и плутония выпала в пределах 100 км от
станции, так как они содержались
в основном в более крупных частицах. Йод и цезий распространились на более широкую территорию. Произошедшее не могло не
отразиться на дальнейшей работе
специалистов Брянского ООД.

На сегодняшний день в структуру ГАУЗ БООД входят следующие
подразделения: консультативная
поликлиника на 200 посещений в
смену; стационар на 315 коек круглосуточного пребывания, в том
числе 174 койки хирургического
профиля, 85 коек радиологического и 47 коек химиотерапевтического профиля; центр амбулаторно-поликлинической хирургии с
2 койками дневного стационара;
дневной стационар на 31 пациенто-место, 9 коек реанимации, операционный блок. В учреждении
работают 5 кандидатов медицинских наук, 2 Заслуженных врача РФ.
Труд сотрудников онкодиспансера
отмечен и на федеральном уровне:
в 2021 году заместитель главного
врача по организационно-методической работе Галина Тимофеевна
Почтенная была награждена медалью имени П.А. Герцена «За вклад
в развитие онкологии»; благодаря
ее напряжённой работе и четкому
руководству на территории региона
появился и стал функционировать
один из первых в стране региональных онкорегистров, который в наши
дни интегрирован в федеральную
сеть.
Первичная медико-санитарная помощь по профилю «Онкология»
организована в 31 медицинской
организации области, в регионе
функционирует 5 ЦАОПов (на базе
Брянской городской больницы №2,
Клинцовской ЦГБ, Навлинской
ЦРБ, Почепской ЦРБ, Жуковской
МБ), 1 первичное онкологическое
отделение, 28 первичных онкологических кабинетов. Специализированную онкохирургическую
помощь, помимо онкодиспансера,
также оказывают ГАУЗ «Брянская
областная больница №1» и ГАУЗ
«Брянская городская больница №1».
На диспансерном учете по поводу
злокачественных новообразований
состоит 38 200 жителей Брянской
области. За год на прием к врачам
поликлиники диспансера приходит
более 86 000 человек, и это число
непрерывно растет. В стационаре
онкологического диспансера ежегодно проходят лечение более 17 000
пациентов.
Региональное отделение Российского общества клинической онкологии (RUSSCO) Брянской области появилось в 2022 году и насчитывает 15 членов, среди которых не только онкологи-химиотерапевты, но и радиотерапевты и хирурги. Председателем регионального отделения является заведующий отделением онкологии №3 (абдоминальной хирургии) ГАУЗ БООД, к.м.н. Лопатин Дмитрий Владимирович. Несмотря на незначительный срок с момента образования регионального подразделения, у онкологической службы Брянской области имеется позитивный опыт проведения ежегодных совместных с RUSSCO конференций, научно-практических школ на базе ГАУЗ БООД, которые проходят также при поддержке Ассоциации онкологов Брянской области. Специалисты Брянского онкодиспансера регулярно принимают участие в Российском онкологическом конгрессе и других мероприятиях по эгидой RUSSCO. Специалисты Брянского онкодиспансера активно участвуют в Национальной Программе Российского общества клинической онкологии «Совершенствование молекулярно-генетической диагностики в Российской Федерации с целью повышения эффективности противоопухолевого лечения».
Сегодня с уверенностью можно
сказать, что региональное отделение Российского общества клинической онкологии Брянской
области будет использовать все
имеющиеся возможности для расширения взаимодействия онкологической службы Брянской области и RUSSCO для повышения
эффективности и уровня качества
оказания онкологической помощи
жителям региона, так как главным
критерием успеха для всех нас является качество и продолжительность жизни наших пациентов.
Экзамен ПО КЛИНИЧЕСКОЙ ОНКООРГИИ

МНЕНИЕ: НУЖНО ЛИ ПРОВОДИТЬ ОНКОЛОГИЧЕСКИЙ КОНСИЛИУМ ДЛЯ ВСЕХ ПАЦИЕНТОВ? ДА, НУЖНО
Автор: Евсеев Владислав Николаевич
Врач-онколог, химиотерапевт Клиника МЕДСИ, Санкт-Петербург
Онкологический консилиум или
мультидисциплинарная команда – объединение специалистов
разного профиля для выбора
наиболее оптимальной тактики
лечения конкретного пациента.
Многие профессиональные организации рекомендуют выбирать лечение пациентов именно
в рамках онкологического консилиума, особенно – при редких
опухолях [1-3]. Проведение онкологических консилиумов выступает и как один из критериев
качества помощи; например, национальная группа по качеству
онкологической помощи Шотландии считает, что даже при
мышечно-неинвазивном раке мочевого пузыря необходимо стремиться к обсуждению на онкологическом консилиуме не менее
95% всех случаев.
В таких странах, как Франция
[4] и Англия, была принята программа, целью которой стало
проведение консилиумов у 100%
онкологических пациентов. Не
так давно и в нашей стране проведение консилиума у всех онкологических пациентов стало обязательным.
Но действительно ли это надо?
Какие есть преимущества при
обсуждении пациентов на онкологическом консилиуме?
Проведение онкологического
консилиума может изменить
процесс лечения пациента на
каждом из этапов. Уже на этапе
определения стадии заболевания консилиум в 4-45% случаев
может изменить решение одного
лечащего врача [5]. Совместное
обсуждение достаточно часто
приводит к смене тактики лечения примерно у 20-25% пациентов при гинекологических опухолях, раке поджелудочной железы,
раке молочной железы, колоректальном раке [6-9] и других онкологических заболеваниях. При
этом лечение в рамках рекомендаций мультидисциплинарной
команды больше соответствует
критериям качественного оказания помощи [10]. Консилиумы
также помогают большему числу
пациентов быть включенными в
клинические исследования [11].
Уже есть данные о том, что проведение онкологического консилиума не только приводит к
изменению тактики лечения, но
и ассоциировано с лучшей выживаемостью. Так, в одном из исследований проведение консилиума
было связано со значительным
увеличением общей выживаемости больных раком желудка
[12]. Систематические обзоры и
метаанализы проведенных исследований также подтверждают эти результаты. Например,
систематический обзор показал,
что выживаемость пациенток с
раком молочной железы, лечение
которых обсуждалось на онкологическом консилиуме, оказалась
выше, чем у тех, кому консилиум
не проводился [13].
Кроме того, консилиум не только
позволяет лучше выбирать тактику лечения, но и несет образовательную роль [14]. Во время
консилиума специалисты могут
узнать друг от друга результаты
актуальных исследований, а для
ординаторов это дополнительный способ обучения.
Пожалуй, главной проблемой
проведения консилиума для всех
пациентов является нехватка
времени и перегруженность врачей работой. С учетом растущего
количества пациентов это приводит к тому, что большинство
случаев обсуждается 2-3 минуты,
при этом в половине случаев обсуждение длится менее 2 минут
[15].
Одним из вариантов решения
проблемы нехватки времени является разделение всех случаев на
сложные случаи, требующие подробного обсуждения, и простые
случаи, по поводу которых может
быть принято «стандартное» решение, не требующее глубокого
обсуждения. Такой подход уже
практикуется в Великобритании
[16]. Важно, что вынесение случаев без последующего обсуждения
все равно требует подготовки:
необходимо заполнить базовый
«чек-лист» с информацией о случае и, таким образом, перепроверить самого себя на предмет того,
выполнены ли все необходимые
обследования, анализы и проведена ли достаточная подготовка к
лечению. Кроме того, эти случаи
в последующем могут быть подвергнуты аудиту, а само «стандартное» лечение должно быть
проведено в клинике.
При этом разграничение всех
пациентов на «сложных» и «простых» важно не только с точки
зрения экономии времени. Надо
понимать, что подробный разбор
большого количества случаев, а
также слишком затянувшиеся
консилиумы приводят к менее
обоснованным решениям. Например, в одном из исследований
было показано, что решения начинают становиться все менее
научно обоснованными после 20
пациента [17].
На мой взгляд, основная проблема лежит не в бесполезности
консилиумов, а в сложности организации работы таким образом, чтобы они не тратили весь
рабочий день и длились разумное количество времени. Тем не
менее, уже есть пути, помогающие повысить эффективность
работы консилиума и потратить
достаточное количество времени
для обсуждения сложных случаев и только быстро подтверждать
лечение «согласно стандартному
плану» в обычных, простых ситуациях. Ни один пациент в таком
случае не уходит от внимания
всей онкологической команды, а
необходимость заполнения чеклистов позволяет исключить человеческий фактор.
Источники:
- Jon D. Vogel, et al. The American Society of Colon and Rectal Surgeons Clinical Practice Guidelines for the Management of Colon Cancer. DISEASES OF THE COLON & RECTUM. 2022; Vol.65:
- Postmus PE, et al. Early and locally advanced non-small-cell lung cancer (NSCLC): ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2013; 24 (Suppl. 6): vi89–vi98.
- www.nccn.org/professionals/ physician_gls/pdf/sarcoma.pdf.
- www.e-cancer.fr/Institutnational-du-cancer/Strategiede-lutte-contre-les-cancersen-France/Les-Plans-cancer/ Le-Plan-cancer-2003-2007.
- Pillay B, Wootten AC, Crowe H, Corcoran N, Tran B, Bowden P, Crowe J, Costello AJ. The impact of multidisciplinary team meetings on patient assessment, management and outcomes in oncology settings: A systematic review of the literature. Cancer Treat Rev. 2016 Jan; 42: 56- 72. doi: 10.1016/j.ctrv.2015.11.007. Epub 2015 Nov 24. PMID: 26643552.
- Greer HO, Frederick PJ, Falls NM, Tapley EB, Samples KL, Kimball KJ, Kendrick JE, Conner MG, Novak L, Straughn JM Jr. Impact of a weekly multidisciplinary tumor board conference on the management of women with gynecologic malignancies. Int J Gynecol Cancer. 2010 Nov; 20(8): 1321-5. doi: 10.1111/ IGC.0b013e3181f5871e. PMID: 21051971.
- Quero G, et al. The impact of the multidisciplinary tumor board (MDTB) on the management of pancreatic diseases in a tertiary referral center. ESMO Open. February 2021; Vol.6, Issue 1, 100010.
- Chang JH, Vines E, Bertsch H, Fraker DL, Czerniecki BJ, Rosato EF, Lawton T, Conant EF, Orel SG, Schuchter L, Fox KR, Zieber N, Glick JH, Solin LJ. The impact of a multidisciplinary breast cancer center on recommendations for patient management: the University of Pennsylvania experience. Cancer. 2001 Apr 1; 91(7): 1231-7. doi: 10.1002/1097-0142(20010401)91 : 7<1231::aid-cncr1123>3.0.co;2-k. PMID: 11283921
- Osterlund P, et al. Repeated centralized multidisciplinary team assessment of resectability, clinical behavior, and outcomes in 1086 Finnish metastatic colorectal cancer patients (RAXO): A nationwide prospective intervention study. The Lancet. April 2021; Vol.3, 100049.
- Kelly SL, Jackson JE, Hickey BE, Szallasi FG, Bond CA. Multidisciplinary clinic care improves adherence to best practice in head and neck cancer. Am J Otolaryngol. 2013 Jan-Feb; 34(1): 57-60. doi: 10.1016/j.amjoto.2012.08.010. PMID: 23218113.
- Hendrik Dapper, et al. Relevance of tumor boards for the inclusion of patients in oncological clinical trials. Journal of Cancer Research and Clinical Oncology. 2023; 149: 7601– 7608.
- Xiang YY, Deng CC, Liu HY, Kuo ZC, Zhang CH, He YL. The Prognostic Effect of Multidisciplinary Team Intervention in Patients with Advanced Gastric Cancer. Curr Oncol. 2022 Feb 17; 29(2): 1201-1212. doi: 10.3390/curroncol29020102. PMID: 35200601; PMCID: PMC8871247.
- Pangarsa EA, Rizky D, Tandarto K, Setiawan B, Santosa D, Hadiyanto JN, Kyana S, Suharti C. The effect of multidisciplinary team on survival rates of women with breast cancer: a systematic review and meta-analysis. Ann Med Surg (Lond). 2023 May 25; 85(6): 2940-2948. doi: 10.1097/ MS9.0000000000000914. PMID: 37363480; PMCID: PMC10289736.
- Walraven JEW, van der Meulen R, van der Hoeven JJM, et al. Preparing tomorrow’s medical specialists for participating in oncological multidisciplinary team meetings: perceived barriers, facilitators and training needs. BMC Med Educ. 2022; 22: 502. https://doi.org/10.1186/ s12909-022-03570-w.
- www.cancerresearchuk.org/sites/ default/files/full_report_meeting_ patients_needs_improving_the_ effectiveness_of_multidisciplinary_ team_meetings.pdf.
- www.england.nhs.uk/wp-content/ uploads/2020/01/multi-disciplinaryteam-streamlining-guidance.pdf.
- Soukup T, Lamb BW, Morbi A, Shah NJ, Bali A, Asher V, Gandamihardja T, Giordano P, Darzi A, Sa Green J, Sevdalis N. A multicentre cross-sectional observational study of cancer multidisciplinary teams: Analysis of team decision making. Cancer Med. 2020 Oct; 9(19): 7083-7099. doi: 10.1002/cam4.3366. Epub 2020 Aug 13. PMID: 32794351; PMCID: PMC7541152.
TTF (TUMOR TREATING FIELDS) ТЕРАПИЯ В ЛЕЧЕНИИ БОЛЬНЫХ С ГЛИОБЛАСТОМОЙ: ДАННЫЕ МЕТААНАЛИЗА 9 ИССЛЕДОВАНИЙ
Далеко не всем онкологам в России
известен метод TTF-терапии, несмотря на то, что в мире он применяется
весьма успешно на протяжении нескольких лет, а в 2015 году был одобрен FDA для пациентов с впервые
выявленной глиобластомой (ГБМ)
на основании данных рандомизированного контролируемого исследования EF-14 [1]. Действительно,
несмотря на пристальное внимание,
огромный интерес исследователей к
этой проблеме в течение последних
двух десятилетий и прогресс в нашем понимании болезни, большинство больных с глиобластомой попрежнему имеют плохой прогноз,
исторически всего лишь с 5% пятилетней выживаемости. В конечном
итоге у всех пациентов наблюдается
рецидив опухоли после первоначального лечения, даже проведенного в полном объеме – операция,
адъювантная химиолучевая терапия
и темозоломид в поддерживающем
режиме.
TTF (Tumor Treating Fields) — это
переменные электрические поля, которые воздействуют на опухолевые
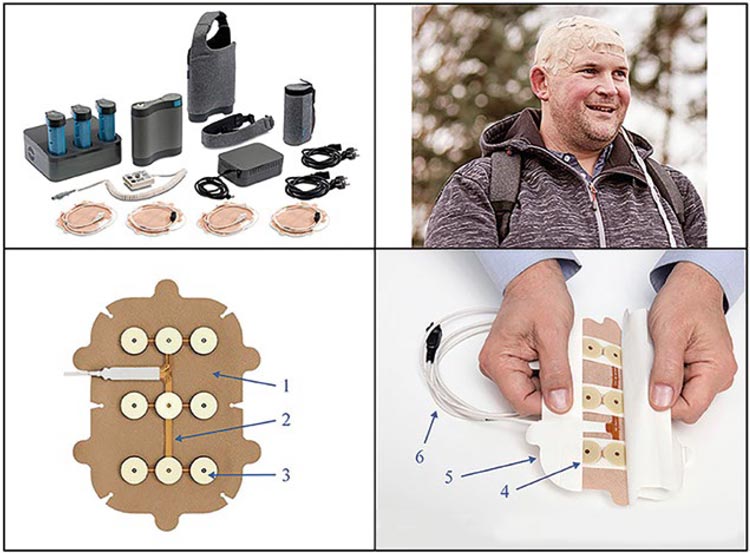
клетки, вызывая нарушение митотического цикла. Устройство имеет 4
пластины, которые связаны с основным генератором и размещаются на
коже головы. Они изготавливаются
и размещаются индивидуально на
основе данных МРТ пациента.
ТTF-терапию начинают через 4 недели после окончания комбинированной химиолучевой терапии.
Обычно ее проводят в сочетании с
приемом темозоломида в поддерживающем режиме. Таким образом,
метод неинвазивный, оказывающий
локорегиональное избирательное
цитотоксическое воздействие, хотя
ряд авторов отмечает не только синергизм с другими специфическими
методами, но и возможное существование иммуностимулирующих
эффектов ТТФ. По данным EF-14 [1],
у пациентов с впервые диагностированной ГБМ добавление терапии
TTF привело к увеличению средней
продолжительности жизни до 20,9
месяца по сравнению с 16 месяцами
только для темозоломида в поддержке, а также снижение риска смерти
более чем на 30%, причем независимо от возраста, объема резекции или
статуса метилирования MGMT. Ряд
исследователей отмечают, что ношение устройства более 75% единицы
времени (сутки, месяц) достоверно
улучшает результаты, чем если это
делать реже. Следует еще добавить,
что переносимость метода очень
хорошая, с единственным осложнением в виде кожной реакции 1-2
степени под аппликаторами у части
пациентов.
Метод получил наиболее широкое
распространение в США, Израиле,
Германии, Чехии, Японии, Китае,
число исследований постепенно
увеличивалось – наступила пора
подведения первых итогов в виде
систематических обзоров и метаанализов исследований, что и было сделано группой авторов из различных
центров вышеупомянутых стран.
Публикация появилась в конце июля
в журнале Journal of Neuro-Oncology
[2]. Основной вопрос, который поставили перед собой авторы: увеличивает ли метод TTF показатели
выживаемости у больных с впервые
выявленной глиобластомой при использовании в реальной клинической практике?
В результате проведенного тщательного отбора в метаанализ попали 9
исследований по сравнению стандартного лечения ГБМ (операция,
ХЛТ) и стандартного с добавлением
TTF; общее количество пациентов в
исследовании – 1430. По возрасту пациенты были аккуратно распределены между группами, число больных
с IDH1 мутацией составило менее
10% в обеих группах. Такой показатель, как GTR (gross tumor resection),
или полнота резекции опухоли, превалировал в группе стандартного
лечения.
В итоге метаанализ продемонстрировал статистически достоверные
преимущества добавления ТТФ к
стандартному лечению в плане общей выживаемости: HR 0,63; 95% ДИ
Рисунок 1. Кривые общей выживаемости при использовании стандартного
лечения глиобластом и с добавлением TTF терапии.
0,53-0,75; p<0,001 (рис.1).
Рисунок 1.
Кривые общей выживаемости при использовании стандартного
лечения глиобластом и с добавлением TTF терапии.
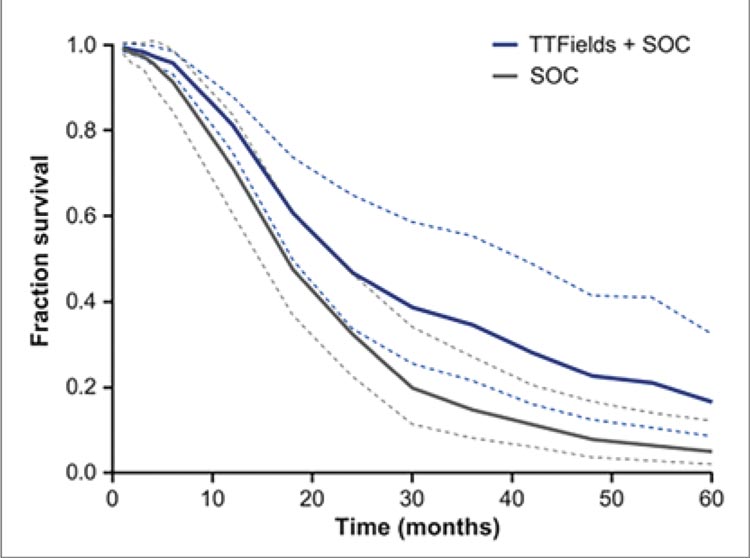
При этом медиана ОВ составила 22,6
мес. (95% ДИ 17,6-41,2) для больных из группы TTF и 17,4 мес. (95%
ДИ 14,4-21,6) для пациентов группы
стандартного лечения. Двухлетний
показатель ОВ составил 46,8% (95%
ДИ 33,8-64,8) и 32,3% (95% ДИ 22,5-
46,5) для групп TTF и не-TTF соответственно. Четырехлетняя выживаемость составила 22,7% (95% ДИ
12,5-41,4) и 8,0% (95% ДИ 3,8-16,6)
соответственно.
Помимо исследований, указанных в метаанализе, дополнительные работы выявили преимущества использования терапии TTF в подгруппах пациентов с высокой опухолевой нагрузкой и в сочетании с другими терапевтическими методами. Небольшая когорта пациентов из Великобритании со статусом неметилированного MGMT показала увеличение медианы ОВ на 3,3 месяца с добавлением TTF к стандартной терапии [3], хотя размер выборки был небольшим, без достижения статистической значимости. Авторы делают выводы, что объем исследований, оценивающих эффективность терапии TTF при ГБМ, растет и приносит новые данные о необходимости сосредоточения внимания на добавлении TTF к стандартному лечению. Проводятся исследования по применению метода при метастатическом поражении головного мозга, при опухолевом поражении плевры (мезотелиомы) и брюшины и др. Увы, в России этот метод недоступен, поэтому российским онкологам не представляется возможность составить собственное мнение по этому вопросу – надеемся, что только пока.
Источники:
- Stupp R, Taillibert S, Kanner A, et al. Effect of Tumor-Treating Fields Plus maintenance temozolomide vs maintenance temozolomide alone on survival in patients with glioblastoma: a randomized clinical trial. JAMA. 2017; 318: 2306-2316. https://doi.org/10.1001/ jama.2017.18718.
- Ballo MT, Conlon P, Lavy-Shahaf G, et al. Association of Tumor Treating Fields (TTFields) therapy with survival in newly diagnosed glioblastoma: a systematic review and meta-analysis. J Neurooncol. 2023. https://doi. org/10.1007/s11060-023-04348-w.
- Olubajo F, Thorpe A, Davis C, et al. Tumour treating fields in glioblastoma: is the treatment tolerable, effective, and practical in UK patients? Br J Neurosurg. 2022; 36: 770-776. https://doi.org/10.108 0/02688697.2022.2028722.
КОММЕНТАРИЙ ЭКСПЕРТА
Автор: Жуков Николай Владимирович
ФГБУ «НМИЦ Детской гематологии, онкологии и иммунологии им. Д. Рогачева»,
доктор медицинских наук, профессор, Москва
Лучше поздно, чем никогда... Медицинский мир консервативен. Онкологический – консервативен в квадрате. К сожалению, это часто мешает заметить действительно интересные и
важные вещи. Такие, как, например, появление принципиально новых подходов к лечению, не основанных на классических
представлениях о том, как должна работать противоопухолевая терапия.
«Лечение рака электричеством»1
– когда я впервые писал об
этом в 2016 году, это вызывало улыбку, в лучшем случае. И
даже через 3 года подтверждающая публикация2
не вызвала особого резонанса. Ну что же, теперь это новость с ASCO.
Так почему бы не устроить небольшой flashback, как это теперь
принято в JCO. И может быть задуматься о возможности применения 4 методики лечения рака (четвертой, дополнительно к
хирургии, лучевой и лекарственной терапии) и у нас в стране?
SBRT + ИММУНОТЕРАПИЯ = ПОБЕДА?
Автор: Деньгина Наталья Владимировна
Заведующая радиологическим отделением
ГУЗ «Областной клинический онкологический диспансер»,
главный врач Центра лучевой терапии «RSpei», к.м.н, Ульяновск
То, о чем многие онкологи говорили на протяжении нескольких
лет, начинает получать подтверждение.
Для начала вспомним глубочайший скепсис в отношении роли SBRT (стереотаксической лучевой терапии) в лечении больных ранним раком легкого: какое неимоверное количество ретроспективных (!) анализов демонстрировало «бесперспективность» метода для тех больных, которые могли быть прооперированы, но отказывались от операции в пользу консервативного метода лечения. Вспомним, как медленно шел набор в исследования, пытавшиеся подтвердить адекватность метода SBRT. Как профессору из MDACC Joe Chang это удалось на основании данных пролонгированного исследования STARS по сравнению результатов SBRT и радикальной лобэктомии при раннем раке легкого [1]. Статистически достоверный, явный, пусть и упорно не признаваемый многими успех не может кануть в небытие. Новый этап в лечении больных ранним раком легкого – комбинация SBRT и иммунотерапии, изучаемая в настоящее время многими исследователями, – начинает давать плоды.
Июльский номер журнала The Lancet Oncology включил публикацию профессора Chang, которая собрала немало комплиментов и персональных поздравлений известных онкологов в социальных сетях и, вне всякого сомнения, будет не раз цитирована в статьях и презентациях [2].
Итак, в настоящее время SBRT, или SABR, является предпочтительным вариантом лечения для тех, кто признан неоперабельным по медицинским показаниям, или для отказавшихся от операции, а также для пациентов с изолированным паренхиматозным поражением легкого. Регулярно появляющиеся данные указывают на то, что лучевая терапия и иммунотерапия могут иметь синергический эффект, особенно если биологически эффективные дозы лучевой терапии достаточно высоки (≥100 Гр). Аблативная лучевая терапия способна превратить так называемые «холодные» опухоли в радиочувствительные за счет эффекта «вакцина in situ» – за счет увеличения высвобождаемых опухолеассоциированных антигенов, повышающих экспрессию PD-L1, активацию Т-лимфоцитов, направленных на опухолевые очаги, не только явные, но и латентные (микрометастазы). Преимущества иммунотерапии как самостоятельного метода в лечении НМРЛ, так и в качестве неоадъювантной терапии были продемонстрированы рядом исследований. Идея комбинации SBRT как эффективного метода локального воздействия, синергичного с лекарственной терапией и иммунотерапией, лежала на поверхности, и в настоящее время не менее десятка проспективных рандомизированных исследований занимается изучением этой проблемы. В целях уменьшения риска рецидивов и улучшения результатов после SABR для больных, ранее не получавших лечения на ранней стадии НМРЛ, первичного или в виде изолированного паренхиматозного рецидива, а также подтверждения теоретического преимущества сочетания SABR с иммунотерапией (I-SABR), авторы из MDACC провели рандомизированное исследование 2 фазы по сравнению только SABR и I-SABR у данной категории больных.
Пациенты в возрасте 18 лет и старше, в статусе ECOG 0-2 балла и способные получать ниволумаб, с патоморфологически подтвержденным НМРЛ ранних стадий, которые не могли или не хотели оперироваться, включались в исследование. Ранняя стадия заболевания была определена как стадия IA-IB (размер опухоли ≤4 см, N0M0), стадия IIA (размер опухоли ≤5 см, N0M0) или стадия IIB (размер опухоли >5 см и ≤7 см, N0M0) в соответствии с последней классификацией.
Первая доза ниволумаба для группы I-SABR (480 мг внутривенной инфузии) совпадала с первой фракцией SABR или в течение 36 часов после первой фракции и повторялась каждые 4 недели (±1 неделя), в общей сложности – четыре запланированных цикла. Режим SABR составлял 50 Гр на планируемый объем с одновременным интегрированным бустом на опухоль до 60 Гр в случае периферических или центральных очагов, если ограничения доза-объем для критических органов позволяли это. При всех других центральных поражениях подводились десять фракций в общей дозе 70 Гр, при возможности – с одновременным бустом до 80 Гр, если ограничения доза-объем были соблюдены.
Первичной конечной точкой была 4-летняя бессобытийная выживаемость для пациентов, получавших лечение по протоколу.
В итоге с 30 июня 2017 г. по 22 марта 2022 г. 156 больных были случайным образом распределены в одну из двух групп, и 141 пациент из 19 стран получили лечение по протоколу (n=75 в группе SABR, n=66 в группе I-SABR) в трех разных больницах штата Техас, США. Достоверных различий по возрасту, полу, состоянию, работоспособности, гистологии опухоли, размеру опухоли, статусу курения или наличию рецидива/первичной опухоли между двумя группами не было. Средний период от первоначального диагноза до рецидива составил 46,4 мес. (диапазон 15,6- 111,1 мес.). Следует отметить, что 32 участника были потенциальными кандидатами на хирургическое вмешательство, но они отказались от операции и были включены в исследование (16 – в группе I-SABR и 16 – в группе SABR). Медиана наблюдения составила 33 месяца.
В итоге комбинация I-SABR значительно улучшила 4-летнюю бессобытийную выживаемость с 53% (95% ДИ 42-67%) при использовании SABR до 77% (66-91%; популяция по протоколу, отношение рисков [ОР] 0,38; 95% ДИ 0,19-0,75; р=0,0056 (рис.1); для популяции ITT – HR 0,42; 95% ДИ 0,22-0,80; р=0,0080). Не было отмечено при этом нежелательных явлений 3 степени и выше, связанных с SABR. В группе I-SABR у десяти участников (15%) наблюдались иммунологические неблагоприятные явления 3 степени, связанные с ниволумабом, но ни у кого не было отмечено пневмонита 3-й степени или токсичности 4-й степени или выше.
Мультивариантный анализ с учетом ряда факторов (ECOG статус, размер опухоли, длительность истории рака легких и гистология) показал, что преимущество в бессобытийной выживаемости в группе I-SABR все еще было значительным (HR 0,36; 95% ДИ 0,18-0,74; р=0,0054).
Рисунок 1.
Бессобытийная выживаемость пациентов, пролеченных
по протоколу, в 2 группах за 4 года

Результаты показали значительное преимущество в бессобытийной выживаемости у участников с размером опухоли 2 см или меньше (ОР 0,35; 95% ДИ 0,14-0,86; p=0,0230). Однако для пациентов с опухолью размером более 2 см незначительная тенденция к улучшению была отмечена, но без достоверности (0,40 [0,14-1,20]; р=0,10). Не было никакого влияния объема опухоли на бессобытийную выживаемость (0,99 [0,98-1,02]; р=0,90). Кроме того, отмечено значительное улучшение показателя бессобытийной выживаемости для больных с заболеванием на ранней стадии, не получавших лечения (0,32 [0,14-0,74]; р=0,0077); однако у тех, у кого зарегистрирован изолированный паренхиматозный рецидивный НМРЛ, различий не выявлено, возможно, из-за малого числа больных (n=28; 0,52 [0,15- 1,85]; p=0,31).
Рецидивы любого типа отмечены у 36% участников (27/75) в группе SABR по сравнению с 12% участников (8/66) в группе I-SABR. Местные рецидивы наблюдались у 13% (10/75) в группе SABR по сравнению с отсутствием таковых в группе I-SABR. Региональные рецидивы наблюдались у 11% (8/75) в группе SABR и 6% (4/66) в группе I-SABR, отдаленные рецидивы – в 16% (12/75) в группе SABR и в 3% (2/66) в группе I-SABR. При использовании SABR 11% (8/75) имели более одного типа рецидива (например, местный, региональный и отдаленный) по сравнению с отсутствием такой закономерности в группе I-SABR. Второй первичный рак легких наблюдался у 8% (6/75) в группе SABR и 3% (2/66) в группе I-SABR. 13 участников умерли: девять [12%] в SABR и четыре [6%] в I-SABR.
Рисунок 2.
Подгрупповой анализ бессобытийной выживаемости в 2 группах

Данные о статусе экспрессии PDL1 были доступны для 92 больных (65%) и данные о статусе мутации EGFR – у 51 участников (36%). При анализе преимущество бессобытийной выживаемости для больных группы I-SABR было более выражено у участников с PD-L1- положительными опухолями, ни у одного из этих участников не развился рецидив (0/15 I-SABR против 5/16 SABR). Однако выигрыш в бессобытийной выживаемости при I-SABR также был статистически значимым и у PD-L1-отрицательных пациентов (n=61; ОР 0,27; 95% ДИ 0,09-0,81; p=0,012).
Таким образом, это рандомизированное исследование фазы 2 показало, что для пациентов с впервые диагностированной ранней стадией НМРЛ или изолированным паренхиматозным рецидивом НМРЛ I-SABR значительно улучшает бессобытийную выживаемость и может стать вариантом лечения для таких пациентов. Результаты нескольких продолжающихся исследований фазы 3 подтвердят выводы, представленные профессором Chang и соавторами. А пока они собирают комплименты от коллегонкологов со всего мира, мы ждем 3 фазу исследования и отдаленные результаты, прежде всего – общей выживаемости.
Источники:
- Chang JY, Mehran RJ, Feng L, et al. Stereotactic ablative radiotherapy for operable stage I non-small-cell lung cancer (revised STARS): long-term results of a single-arm, prospective trial with prespecified comparison to surgery. Lancet Oncol. 2021; 22: 1448-57.
- Chang JY, Lin SH, Dong W, et al. Stereotactic ablative radiotherapy with or without immunotherapy for early-stage or isolated lung parenchymal recurrent nodenegative non-small-cell lung cancer: an open-label, randomised, phase 2 trial. Lancet. 2023 Jul 18; S0140- 6736(23)01384-3. doi: 10.1016/S0140- 6736(23)01384-3. Epub ahead of print. PMID: 37478883.
УГОЛОК РАДИОТЕРАПЕВТА / ЛУЧЕВЫЕ ДЕРМАТИТЫ: ПОЧЕМУ ВСЕ МЕЧТАЮТ КОЛОНИЗИРОВАТЬ МАРС, А РАДИОТЕРАПЕВТЫ – ДЕКОЛОНИЗИРОВАТЬ ПОЛОСТЬ НОСА?
Автор: Шейко Андрей Владимирович
ГБУЗ ВО «Областной клинический онкологический диспансер», Владимир
Острый лучевой дерматит остается
частым нежелательным явлением
при проведении лучевой терапии,
особенно у пациентов со злокачественными новообразованиями
(ЗНО) молочной железы или головы
и шеи. Даже не смотря на интенсивное развитие высокопрецизионных
методик облучения, отношение
радиотерапевтов к коже в зоне облучения, как к критическому органу, требующему соблюдения строго
определенных дозных ограничений,
частота лучевых дерматитов остается высокой, достигая 100% в случае
ЗНО головы и шеи. Патогенез лучевого дерматита при этом остается
до конца неизвестным, что препятствует разработке надежных стратегий его профилактики. За последние
несколько десятилетий было опубликовано множество данных по
профилактике и лечению острого
лучевого дерматита. Тем не менее,
подходы к лечению продолжают существенно различаться в разных лечебных учреждениях и часто зависят
от личного опыта и мнения лечащих
врачей. В Российской Федерации основные принципы сопроводительной, в том числе ранозаживляющей,
терапии лучевого дерматита изложены в Учебно-методическом пособии
по диагностике и лечению осложнений лучевой терапии, опубликованном в 2021 году [1].
Международная ассоциация специалистов в области симптоматической
терапии злокачественных новообразований (MASCC), как один из крупнейших генераторов методических
пособий по симптоматической терапии, также обновил свои практические рекомендации, касающиеся
лучевого дерматита [2,3]. Опубликованный в апреле 2023 года новый
гайдлайн пришел на смену рекомендациям, не менявшимся с 2013 года.
В ходе четырехэтапного консенсусного процесса в рамках метода Дельфи были собраны мнения 42 международных экспертов, опирающихся
на данные из существующей литературы (235 статей с 1946 по 2023 гг.).
Подходы к профилактике и лечению
лучевого дерматита, которые достигли консенсуса ≥75%, были рекомендованы для клинического использования. Полученные результаты по
профилактике и лечению лучевого дерматита от MASCC представлены
в Таблице 1.
Таблица 1.
Рекомендации MASCC 2023 по профилактике и лечению лучевого дерматита
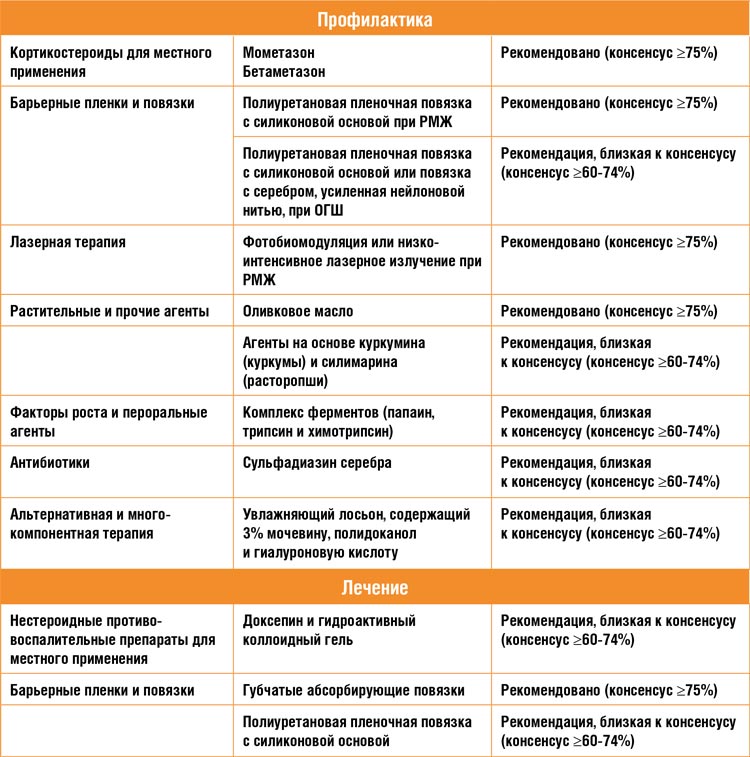
Представленные в таблице 1 рекомендации совсем не многочисленны.
Панель экспертов не пришла к консенсусу по многим вопросам, особенно касающихся непосредственного лечения лучевых дерматитов.
Одобрение в ≥60% голосов получили
лишь повязки и коллоидные гели в
дуэте с антидепрессантами. В отношении антибактериальной профилактики практически достиг консенсуса только сульфадиазин серебра,
антибиотик для местного применения. Безопасность его использования
у онкологических больных вызывает
некоторые вопросы, учитывая наличие среди побочных эффектов лейкои нейтропении (с частотой от ≥1/1000
до <1/100), жжения и местного болевого синдрома (с неизвестной частотой), а также необходимость постоянного лабораторного мониторинга
у пациентов с нарушением функции
почек и/или печени [4].
Интерес к антибактериальной профилактике лучевых дерматитов с новой силой вспыхнул в мае 2023 года в
связи с публикацией в журнале JAMA
Oncology сразу двух статей, посвященных изучению колонизации золотистым стафилококком (S.aureus),
как предиктора высокого риска дерматита >2 степени у больных раком
молочной железы и органов головы
и шеи.
В проспективном когортном исследовании Kost et al. оценивалась
связь колонизации S.aureus с тяжестью острого лучевого дерматита
[5]. Авторы предположили, что наличие колонизации S.aureus полости
носа (назального носительства) до
проведения лучевой терапии будет
причиной более тяжелого течения
лучевого дерматита по сравнению с
отсутствием колонизации. Причиной
постановки подобной гипотезы стало
доказанное участие S.aureus в патогенезе прочих воспалительных дерматозов, таких как атопический дерматит. Было высказано предположение,
что S.aureus может способствовать
активному воспалению и предотвращению реэпителизации кератиноцитов, подвергшихся лучевой терапии.
Из 76 пациентов, набранных в исследование, 53,9% составили пациенты
с раком молочной железы и 46,1% - с
опухолями головы и шеи. Средняя
суммарная очаговая доза составила
58,5 Гр. Бактериологическое исследование мазков из полости носа, с кожи
в области поля облучения и с кожи
контралатеральной стороны выполнялись дважды: до начала лучевой
терапии и в течение последней недели лечения. Выраженность лучевого
дерматита оценивалась еженедельно
лечащим врачом, ослепленным относительно статуса колонизации
пациента, с использованием шкалы
CTCAE версии 4.03. В результате
21,1% пациентов имели исходный положительный результат назального
посева на S.aureus. При этом частота назального носительства S.aureus
была статистически значимо выше
среди пациентов с развившимся дерматитом ≥2 степени по сравнению
с теми, у кого развился дерматит не
выше 1 степени (34,5% против 12,8%;
р=0,02). По завершении лучевой терапии уровень колонизации S.aureus
на каждом тестируемом участке
(носовые ходы, облученная кожа и
контралатеральная необлученная
сторона) был значительно выше среди пациентов, у которых развился
дерматит ≥2 степени. Регрессионный анализ также выявил достоверную зависимость частоты развития
лучевого дерматита ≥2 степени от
наличия исходной назальной колонизации S.aureus (OR = 4,24; 95% ДИ
= 1,24–14,51; р=0,02). Полученные
результаты были также соотнесены с
позитивными результатами междисциплинарного клинического опыта
в профилактической бактериальной
деколонизации в области ортопедии,
интенсивной терапии и кардиохирургии.
Та же команда исследователей Kost
et al. в своей следующей статье опубликовала результаты рандомизированного исследования фазы 2/3,
сравнившего результаты бактериальной деколонизации S.aureus и
стандартной терапии дерматита
(группы пациентов в соотношении
1:1) [6]. Пациенты из группы деколонизирующей профилактики получали интраназальное введение 2%
мази мупироцина два раза в день и
местные обработки 4% хлоргексидина глюконатом один раз в день в
течение 5 дней подряд до старта лучевой терапии и повторно в течение
5 дней каждые 2 недели в течение
курса лучевой терапии. Пациенты в
группе стандартного ухода использовали обычные средства гигиены
и смягчающие средства. Исходная
колонизация носа S. аureus при этом
была выявлена лишь у 13% пациентов. Среди больных раком молочной
железы и ОГШ (n=77) ни у одного
из 39 пациентов, получавших деколонизирующее лечение, не развился лучевой дерматит ≥2 степени
по сравнению с 9 из 38 пациентов
(23,7%), получавших стандартное
лечение (р=0,001). Бактериальная
деколонизация также привела к
снижению степени выраженности
лучевого дерматита (р=0,004) даже
при поправке на известные факторы риска дерматита (индекс массы
тела, доза облучения, возраст). Более
того, частота колонизации полости
носа S.aureus в группе деколонизирующей терапии снизилась от исходного уровня 10,8% до 5,4% после лечения, тогда как показатели в
группе стандартного ухода увеличились (с 16,2% до 24,3% по окончании
лучевой терапии) (р=0,02). Однако
следует отметить, что в данном исследовании большинство пациентов
были женщинами (n=75 [97,4%]),
что связано с тем, что исследуемая
популяция состояла в основном из
больных раком молочной железы (75
пациентов [97,4%]). В чем заключалась сложность в наборе пациентов с
опухолями головы и шеи, авторы не
уточняют. Всего 5 пациентов (6,5%)
получали одновременную химиолучевую терапию. Таким образом,
гипотетически наиболее обширная
подверженная острым лучевым дерматитам ≥2 степени когорта пациентов, получающих одновременное
химиолучевое лечение до высоких
доз более 60 Гр, просто не попала в
исследование. При этом большинство исследуемых пациентов были
чернокожими (33,7% [n=26]) или латиноамериканцами (32,5% [n=25]).
Необходимо отметить, что темный
цвет кожи – предиктор развития
менее тяжелых лучевых дерматитов,
но более выраженной поздней гиперпигментации [7,8]. Можно предположить, что по этой же причине
в приведенном выше исследовании
в принципе весьма немного случаев
с установленным лучевым дерматитом степени 3 (всего 9,2% в обеих
группах). В то же время, в опубликованном в июне 2023 года проспективном когортном исследовании Xie
et al [9] частота развития дерматита 3-4 степени у пациенток с раком
молочной железы составила 17,8%.
При этом значимыми независимыми предикторами развития тяжелого лучевого дерматита послужили
высокий индекс массы тела, диабет,
курение, высокий уровень ферритина и С-реактивного белка крови, высокий уровень CD3+T-лимфоцитов.
Результаты применения деколонизации S.aureus у подобной наиболее
тяжелой группы пациенток могли бы
представлять особый интерес.
В любом случае исследования Kost
et al. выглядят более чем перспективными и многообещающими.
Деколонизация S.aureus интраназальным мупироцином – довольно
простой метод, который может привести к существенному снижению
степени выраженности лучевого
дерматита как у пациентов с раком
молочной железы, так и, в перспективе, у пациентов с опухолями головы и шеи. Стоит также отметить,
что в июне 2023 года начался набор
пациентов в китайское исследование NCT05893810, целью которого
является оценить вклад деколонизации полости носа мупироциновой
мазью в предотвращение тяжелых
радиоиндуцированных мукозитов
у пациентов с опухолями головы и
шеи. Таким образом, деколонизация
S.aureus имеет определенные шансы
стать официальной рекомендацией
в профилактике и лечении не только
лучевых дерматитов, но и мукозитов.
Источники:
- Диагностика и лечение осложнений лучевой терапии: учебно-методическое пособие. Обнинск: ФГБУ «НМИЦ радиологии» Минздрава России, 2021. 88 с. (Серия «Библиотека врача-онколога»).
- Behroozian T, Goldshtein D, Ryan Wolf J, van den Hurk C, Finkelstein S, Lam H, Patel P, Kanee L, Lee SF, Chan AW, Wong HCY, Caini S, Mahal S, Kennedy S, Chow E, Bonomo P, on behalf of the Multinational Association of Supportive Care in Cancer (MASCC) Oncodermatology Study Group Radiation Dermatitis Guidelines Working Group. MASCC clinical practice guidelines for the prevention and management of acute radiation dermatitis: part 1) systematic review. eClinicalMedicine, 2023 Mar 7. doi: 10.1016/j.eclinm.2023.101886.
- Behroozian T, Bonomo P, Patel P, Kanee L, Finkelstein S, van den Hurk C, Chow E, Ryan Wolf J, on behalf of the Multinational Association of Supportive Care in Cancer (MASCC) Oncodermatology Study Group Radiation Dermatitis Guidelines Working Group. Multinational Association of Supportive Care in Cancer (MASCC) clinical practice guidelines for the prevention and management of acute radiation dermatitis: international Delphi consensus-based recommendations. Lancet Oncol. 2023 Apr; 24(4): E172-E185. doi: 10.1016/S1470-2045(23)00067-0.
- Государственный реестр лекарственных средств.
- Kost Y, Rzepecki AK, Deutsch A, et al. Association of Staphylococcus aureus Colonization With Severity of Acute Radiation Dermatitis in Patients With Breast or Head and Neck Cancer. JAMA Oncol. 2023;9(7):962-965. doi:10.1001/ jamaoncol.2023.0454.
- Kost Y, Deutsch A, Mieczkowska K, et al. Bacterial Decolonization for Prevention of Radiation Dermatitis: A Randomized Clinical Trial. JAMA Oncol. 2023;9(7):940-945. doi:10.1001/ jamaoncol.2023.0444.
- Purswani JM, Nwankwo C, Adotama P, et al. Radiation-induced skin changes after breast or chest wall irradiation in patients with breast cancer and skin of color: a systematic review. Clin Breast Cancer. 2023;23(1):1-14. doi:10.1016/j. clbc.2022.10.002.
- Purswani JM, Bigham Z, Adotama P, et al. Risk of Radiation Dermatitis in Patients With Skin of Color Who Undergo Radiation to the Breast or Chest Wall With and Without Regional Nodal Irradiation [published online ahead of print, 2023 Apr 14]. Int J Radiat Oncol Biol Phys. 2023;S0360-3016(23)00365-6. doi:10.1016/j.ijrobp.2023.04.006.
- Xie Y, Hu T, Chen R, Chang H, Wang Q, Cheng J. Predicting acute radiation dermatitis in breast cancer: a prospective cohort study. BMC Cancer. 2023;23(1):537. Published 2023 Jun 12. doi:10.1186/s12885-023-10821-6.
УГОЛОК РАДИОТЕРАПЕВТА / ИССЛЕДОВАНИЕ PAINPANC: О ВОЗМОЖНОЙ НЕДООЦЕНКЕ РОЛИ ЛОКАЛЬНЫХ МЕТОДОВ ДЛЯ КУПИРОВАНИЯ БОЛИ ПРИ РАСПРОСТРАНЕННОМ РАКЕ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
В самом конце августа в Красном журнале ASTRO (International
Journal of Radiation Oncology, Biology
& Physics) появилась статья, причем в открытом доступе, хоть и не в
окончательном варианте, принятая к
публикации буквально недавно с рекомендацией дополнить ряд данных,
поэтому на страницах стоит штамп
«Journal Pre-proof». Чем же так интересна эта работа?
Это исследование 2 фазы от голландских авторов с интригующим
названием PAINPANC, посвященное противоболевой роли локальных методов, прежде всего лучевой
терапии, при раке поджелудочной
железы (РПЖ). Не стоит говорить
об известном коварстве этой опухоли и ее крайней неподатливости
существующим методам лечения.
Мы также прекрасно знаем о разнообразии негативной симптоматики
местнораспространенного и метастатического рака поджелудочной
железы, с которой сложно бороться.
Большинство (70-80%) пациентов
жалуются на боль из-за опухолевой
инфильтрации чревного сплетения,
обструкции или растяжения протоков и воспаления в окружающих
тканях; эта крайне неприятная боль
обычно локализуется в эпигастральной области и/или иррадиирует в
спину. Интенсивность боли зачастую
варьирует от умеренной до сильной,
и ее довольно сложно регулировать.
В целом, наряду с другими симптомами запущенного заболевания, это
приводит к крайне плохому общему
качеству жизни (QoL).
Несколько лечебных подходов были
призваны бороться с подобной болью: применение обезболивающих
фармакологических препаратов, химиотерапия и/или лучевая терапия и
блокада чревного сплетения. Опиаты
применяются как правило для купирования умеренной и тяжелой рефрактерной боли, однако использование сильных опиатов часто вызывает
побочные эффекты, которые могут
привести к тяжелым последствиям
и дальнейшему снижению качества
жизни. Лучевая терапия способна
уменьшить боль, связанную с опухолью, и даже снизить дозу наркотических анальгетиков, однако роль
метода явно недооценена на протяжении десятилетий.
По данным крупного ретроспективного анализа канадских авторов [1],
основанного на результатах лечения
2623 больных раком поджелудочной
железы, из которых у большинства
(62%) был отмечен сильный болевой
синдром, основная роль в купировании боли принадлежит именно опиатам (75,6% таких пациентов получали
только обезболивающие препараты),
тогда как значение локальных методов (ЛТ и нервная блокада) остается
недооцененным (лишь 13,5% получали ЛТ и 1,2% – хирургическую блокаду). Авторы продемонстрировали,
что значимое уменьшение болевого
синдрома было отмечено у 62% больных, получавших только опиаты, у
73% получивших противоболевую
ЛТ и у всех пациентов после хирургической нервной блокады, при этом
удачное купирование болевого синдрома даже позитивно отразилось на
результатах выживаемости (рис.1).
Рисунок 1.
Показатели выживаемости
некурабельных больных РПЖ
в зависимости от выраженности
(и степени купирования) болевого
синдрома (p<0,001) [1].
На рисунке 2 представлена шкала
изменений болевого синдрома в зависимости от выбранного метода его
купирования – применения наркотических анальгетиков или ЛТ.
Без сомнения, эти данные должны
привлечь внимание к выбору альтернативных методов эффективного купирования болевого синдрома у этой
сложной категории больных, нежели
простого назначения сильных обезболивающих препаратов со всеми
вытекающими из этого последствиями. Поэтому голландские авторы
сконцентрировались на оценке эффективности паллиативного короткого курса ЛТ у некурабельных пациентов с местнораспространенным
и распространенным РПЖ с болевым синдромом.
Рисунок 2.
Динамика болевого
синдрома после применения
опиатов и ЛТ.
Ряд более ранних ретроспективных
и проспективных наблюдательных
исследований продемонстрировали,
что короткие курсы радиотерапии
способны уменьшить болевой синдром при РПЖ, однако качественная
оценка, на основании валидированных опросников, не проводилась.
Целью этого проспективного нерандомизированного исследования II
фазы было оценить изменение интенсивности боли (как первичный
результат) и общее качество жизни
(вторичная конечная точка), причем
многократно, через определенные
промежутки времени, во время короткого курса паллиативной лучевой
терапии и последующего наблюдения, с использованием валидированных пациенто-ориентированных
оценочных шкал у больных РПЖ с
болевым синдромом, связанным с
опухолью и рефрактерным к обезболивающим препаратам. Кроме
того, острая токсичность и общая
выживаемость также были оценены
авторами.
В проспективном нерандомизированном исследовании 2 фазы PAINPANC 29 больных РПЖ с болевым синдромом получали короткий курс ЛТ (24 Гр за 3 фракции, 1 фракция в неделю) в период с 2015 по 2018 гг. Подавляющее большинство пациентов имели статус ECOG-ВОЗ ≥1 (n=27, 90%), 56,7% (n=17) имели отдаленные метастазы, а у 63,3% (n=19) опухоль располагалась в головке поджелудочной железы. Восемь пациентов (26,7%) не получили общую дозу ЛТ в 24 Гр из-за клинического ухудшения или прогрессирования опухоли. Болевой синдром у всех пациентов был рефрактерен к обезболивающим препаратам. Первичная конечная точка определялась как клинически значимое среднее снижение интенсивности боли на ≥2 балла по сравнению с исходным уровнем, в течение семи недель после начала лечения. Вторичной конечной точкой была оценка глобального качества жизни с клинически значимым увеличением на 5-10 баллов (по шкале 0-100). Уменьшение боли и изменение качества жизни оценивались девять раз с использованием Краткого опросника боли и опросника EORTC-QoL-C15-PAL.
Из всех пациентов, получавших лучевую терапию, снижение приема
обезболивающих препаратов оказалось возможно у 16 больных (55,2%)
во время лечения и дальнейшего
наблюдения. У шести пациентов
(20,7%) объем обезболивания оставался неизменным, а пяти пациентам
(17,2%) потребовалось увеличение
назначения опиоидных препаратов
на ≥25%, из которых три пациента
сообщили об уменьшении приема
обезболивающих препаратов в течение периода наблюдения. Коррекция обезболивающих препаратов
неизвестна у двух пациентов (6,9%),
оба получали только одну фракцию
лучевой терапии. Исходно средняя
эквивалентная суточная доза перорального морфина составила 129,5
мг (диапазон 20,0-540,0 мг), после облучения она снизилась до 75,0 мг (диапазон 15,0-360,0 мг), P=0,021. Боль
уменьшилась в среднем на 3,15 балла
от исходного уровня к седьмой неделе (P=0,045). Пациенты сообщили
о клинически значимом снижении
средней интенсивности боли с 5,9 до
3,8 балла (P=0,011) в течение первых
трех недель, которое далее снижалось до 3,2 до 11-й недели и в итоге
заканчивалось на 3,4 балла (P=0,006)
на 21-й неделе после первой фракции
лучевой терапии. Глобальное качество жизни значимо улучшилось с
50,5 до 60,8 за период наблюдения,
P=0,001 (рис.3). Острая токсичность
3 степени наблюдалась у трех пациентов (преимущественно слабость
и тошнота/рвота), токсичности 4-5
степени не наблюдалось. Медиана
ОВ составила 11,8 недель, а одногодичная выживаемость – 13,3%.
Рисунок 3.
Прогнозируемые средние баллы по А) интенсивности
боли и Б) общему качеству жизни с
течением времени. Заштрихованная
область представляет 95% доверительные интервалы. Временные
точки оценки: исходно (0 = до начала лучевой терапии) и в течение
периода наблюдения (до второй и
третьей фракций лучевой терапии,
через 4, 5, 7, 11, 19 и 31 неделю после первой лучевой терапии).
В заключение авторы сделали вывод,
что, возможно, роль лучевой терапии при распространенном РПЖ
незаслуженно недооценена, поскольку это пусть и небольшое проспективное нерандомизированное
исследование II фазы продемонстрировало возможность быстрого
и клинически значимого снижения
интенсивности болевого синдрома у большинства пациентов после
короткого курса ЛТ и повышение
общего качества жизни, продолжающееся практически до финала
жизни ценой преимущественно
умеренной и преходящей острой
токсичности. Положительный результат исследования и воспроизводимость лечения могут и должны
быть использованы для возмещения расходов на паллиативное облучение для подобной группы
больных. Для подтверждения этих
данных, без сомнения, необходимо
проведение более крупных исследований.
Источники:
- Tung S, Coburn NG, Davis LE, Mahar AL, Myrehaug S, Zhao H, Earle CC, Nathens A, Hallet J. Population-based study of the prevalence and management of self-reported high pain scores in patients with non-resected pancreatic adenocarcinoma. Br J Surg. 2019 Nov; 106(12): 1666-1675. doi: 10.1002/ bjs.11330. PMID: 31639208; PMCID: PMC7938812.
- C. Paola Tello Valverde, et al. Impact of short-course palliative radiotherapy on pancreatic cancerrelated pain: Prospective phase II non-randomized PAINPANC trial. Int J Radiat Oncol Biol Phys 2023. August 28, 2023. https://doi. org/10.1016/j.ijrobp.2023.08.055.