Дорогие коллеги, дорогие друзья!
Промелькнуло очередное лето, и под ногами вновь зашуршала желтая листва. Сентябрь милостиво позволяет насладиться последним теплом года, неуклонно приближающегося к завершению, и войти в рабочий режим до следующего отпускного периода. Школьники, студенты, аспиранты погрузились в учебу...

Витторио Коркос, итальянский художник-портретист.
Мечты. 1896 (Sogni). Холст, масло. 160 × 135 см. Галерея современного искусства, Рим
Опять сентябрь, как тьму времен назад, и к вечеру мужает юный холод. Я в таинствах подозреваю сад: все кажется — там кто-то есть и ходит...

RUSSCO ПРОВЕЛО ОЧЕРЕДНОЙ ЭКЗАМЕН ESMO В МОСКВЕ
10 сентября 2022 г. в Москве состоялся очередной ежегодный экзамен Европейского общества медицинской онкологии (ESMO) для молодых российских врачей – членов ESMO, который...

Зкзамен
ПО КЛИНИЧЕСКОЙ ОНКОЛОГИИ 15.11.2022 с 17:00 до 19:30

ДАННЫЕ 5-ЛЕТНЕЙ ВЫЖИВАЕМОСТИ АДЪЮВАНТНОЙ ТЕРАПИИ FOLFIRINOX В СРАВНЕНИИ С ГЕМЦИТАБИНОМ У БОЛЬНЫХ РАКОМ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Опубликованы 5-летние показатели общей выживаемости больных операбельным раком...
ИССЛЕДОВАНИЕ TRIPLET ДЕМОНСТРИРУЕТ ОТСУТСТВИЕ ВЫИГРЫША ОТ НАЗНАЧЕНИЯ КОМБИНАЦИИ FOLFOXIRI В СРАВНЕНИИ C FOLFOX У БОЛЬНЫХ МЕТАСТАТИЧЕСКИМ КОЛОРЕКТАЛЬНЫМ РАКОМ
Как часто при виде больного, особенно молодого, нам хочется именно в этом случае достичь максимального противоопухолевого эффекта, а то и излечения, несмотря на наличие диссеминированного процесса! Что мы делаем чаще всего? Интенсифицируем планируемый режим химиотерапии, дополняя его при возможности еще и таргетной или иммунотерапией. Но, судя по...
ТРАСТУЗУМАБ-ДЕРУКСТЕКАН ПРИ НЕПЛОСКОКЛЕТОЧНОМ ДИССЕМИНИРОВАННОМ РАКЕ ЛЕГКОГО С МУТАЦИЕЙ В ГЕНЕ HER2. НОВАЯ ОПЦИЯ ТЕРАПИИ
11 августа 2022 г. FDA одобрила Трастузумаб дерукстекан в качестве лечебной опции для больных неплоскоклеточным раком легкого (РЛ) с мутацией в гене HER2. Так же были одобрены тесты Oncomine™ Dx и Guardant360® CDx для диагностики мутаций в гене HER2 при неплоскоклеточном РЛ. Частота мутаций в гене HER2 при неплоскоклеточном РЛ достигает 2-4%, эта небольшая группа...
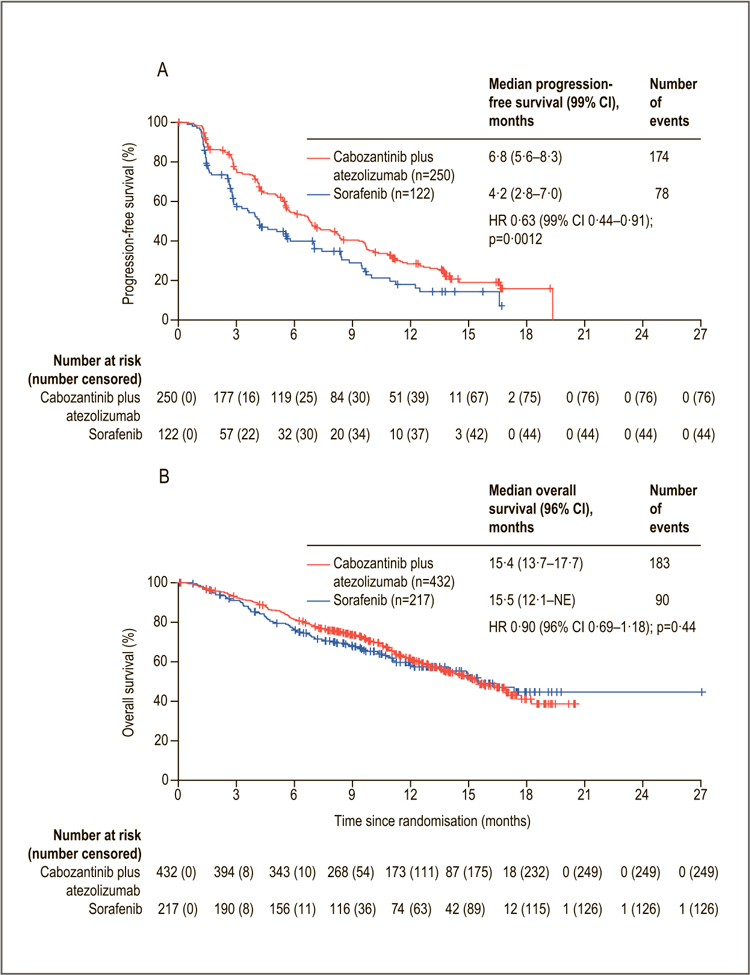
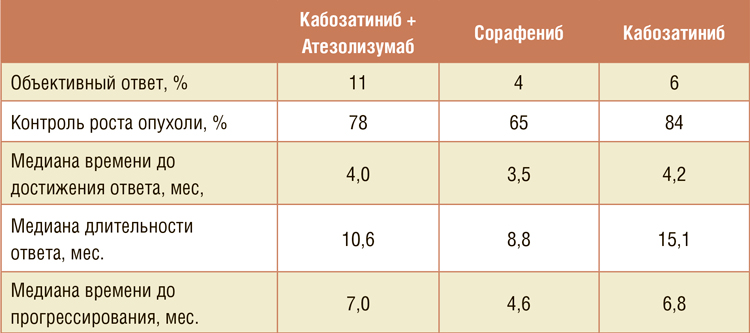
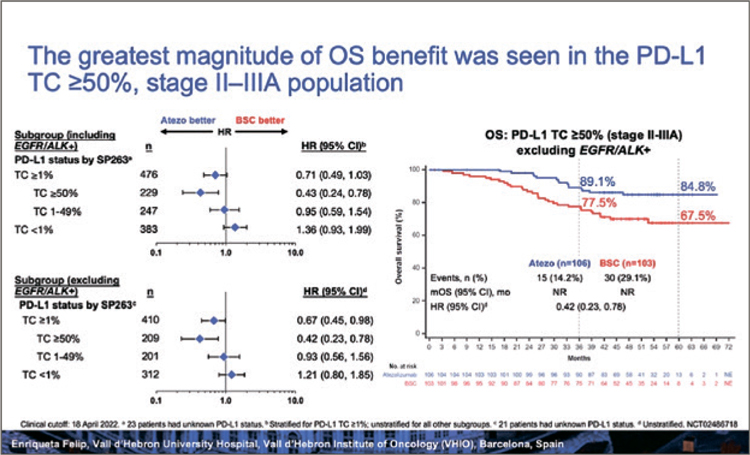
COSMIC-312. КАБОЗАТИНИБ В КОМБИНАЦИИ С АТЕЗОЛИЗУМАБОМ В СРАВНЕНИИ С СОРАФЕНИБОМ ПРИ ГЕПАТОЦЕЛЛЮЛЯРНОМ РАКЕ
Гепатоцеллюлярный рак (ГЦР, гепатоцеллюлярная карцинома, печеночно-клеточный рак) – наиболее частая (до 90%) первичная злокачественная опухоль печени. На основа¬нии результатов исследования 3 фазы SHARP мультикиназный ингибитор сорафениб был одобрен в 1 линии терапии гепатоцеллюлярного рака...
НОВОСТИ WORLD CONFERENCE ON LUNG CANCER 2022
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ CALGB104503/ALLIANCE
НОВОСТИ WORLD CONFERENCE ON LUNG CANCER 2022
ИССЛЕДОВАНИЯ С «ВЫСОКИМ РЕЙТИНГОМ»
НОВОСТИ WORLD CONFERENCE ON LUNG CANCER 2022
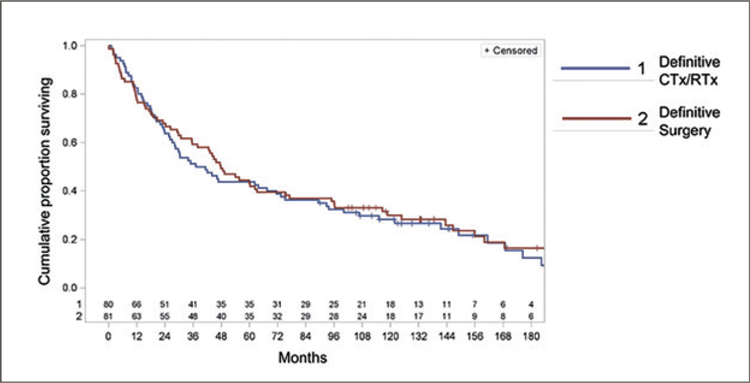
ОТДАЛЕННЫЕ РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ ESPATUE
НОВОСТИ WORLD CONFERENCE ON LUNG CANCER 2022
ИССЛЕДОВАНИЕ DOLPHIN: РАДИКАЛЬНАЯ ЛТ ПЛЮС ДУРВАЛУМАБ У НЕРЕЗЕКТАБЕЛЬНЫХ БОЛЬНЫХ НМРЛ
НОВОСТИ КРУПНЫХ НАУЧНЫХ ЖУРНАЛОВ
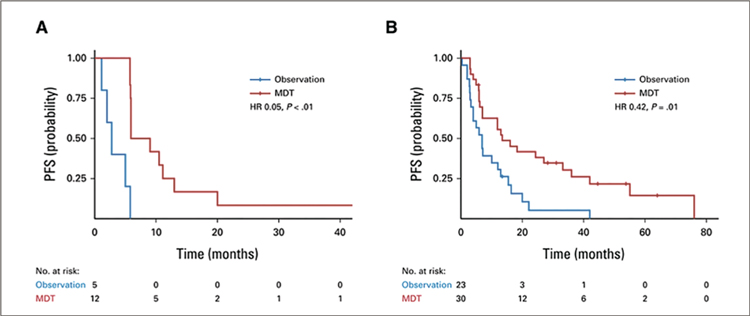
ЛОКАЛЬНАЯ ТЕРАПИЯ НА МЕТАСТАЗЫ ПРИ ОЛИГОМЕТАСТАТИЧЕСКОМ РАКЕ ПРОСТАТЫ: РОЛЬ БИОМАРКЕРОВ В ОТБОРЕ БОЛЬНЫХ
НОВОСТИ КРУПНЫХ НАУЧНЫХ ЖУРНАЛОВ
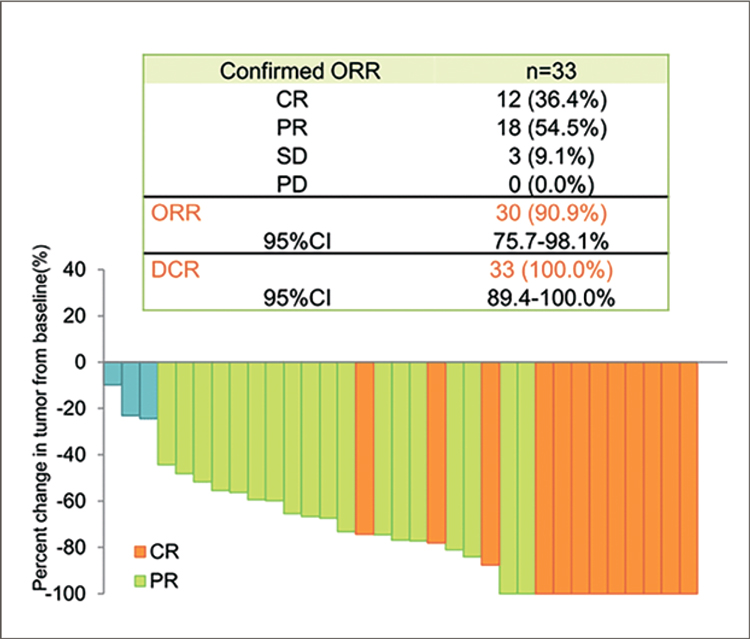
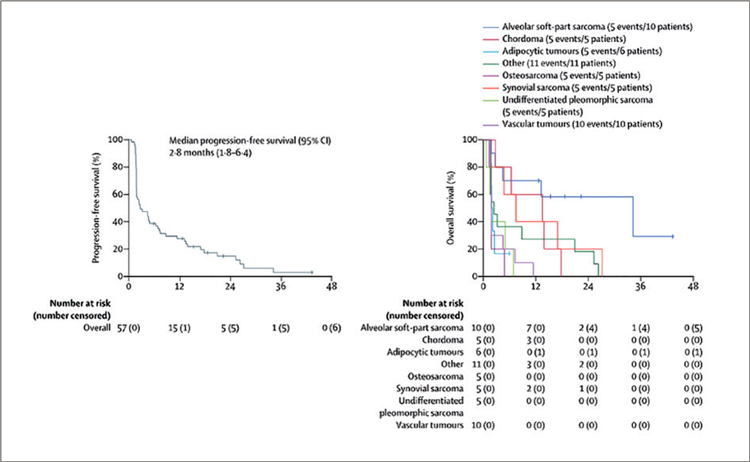
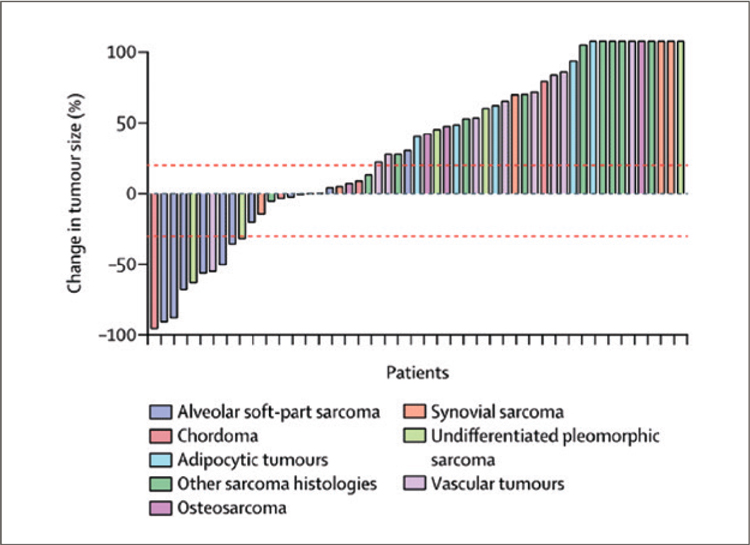
ДУРВАЛУМАБ В КОМБИНАЦИИ С ТРЕМЕЛИМУМАБОМ ПРИ ДИССЕМИНИРОВАННЫХ САРКОМАХ МЯГКИХ ТКАНЕЙ И ОСТЕОГЕННЫХ САРКОМАХ. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ 2 ФАЗЫ. НОВАЯ ОПЦИЯ В ТЕРАПИИ ПРИ АЛЬВЕОЛЯРНОЙ МЯГКОТКАННОЙ САРКОМЕ
10 Лет Национальной программе Российского онкологического общества клинической онкологии
СОВЕРШЕНСТВОВАНИЕ МОЛЕКУЛЯРНОЙ-ГЕНЕТИЧЕСКОЙ ДИАГНОСТИКИ В РОССИЙСКОЙ ФЕДЕРАЦИИ

РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС - 2022
Российский онкологический конгресс - крупнейшее национальное онкологическое мероприятие в Европе с международным участием.
Анонс
-

15 -17 ноября 2022
РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС - 2022
-

15 ноября 2022 c 18:00 до 20:30
Экзамен ПО КЛИНИЧЕСКОЙ ОНКОЛОГИИ