
«Профессия врача – подвиг. Она требует самоотвержения, чистоты души и чистоты помыслов» Блохин Н.Н.
В этом году состоится юбилейный XXV Российский онкологический конгресс! Так же, как нелегко сейчас себе представить, что мы застали время, когда не было мобильных телефонов...
ЛЕНВАТИНИБ + ПЕМБРОЛИЗУМАБ: ЭФФЕКТИВНАЯ КОМБИНАЦИЯ ДЛЯ ЛЕЧЕНИЯ РАСПРОСТРАНЕННОГО РАКА ЭНДОМЕТРИЯ
Симпозиум компании Eisai, состоявшийся в рамках II международной веб-конференции «Онкогинекология: от клинических исследований к практике», был посвящен комбинации ленватиниба ...

ESTRO 2021: НОВОСТИ КОНГРЕССА
Очередной конгресс ESTRO 2021 проходил в Мадриде в комбинированном (очно и онлайн) формате: около 3 тысяч участников приехали в столицу Испании...

ESTRO 2021: ЧУТЬ БОЛЬШЕ, ЧЕМ ПРОСТО ЛУЧЕВАЯ ТЕРАПИЯ
Абскопальный эффект и анализ факторов, оказывающих влияние на его развитие, вызывает все больший интерес у исследователей...

ESTRO 2021: РАК МОЛОЧНОЙ ЖЕЛЕЗЫ
В рамках докладов по поводу лечения рака молочной железы на конгрессе ESTRO 2021 красной нитью проходила идея о повышении уровня качества жизни пациентов...

ESTRO 2021: ЛУЧЕВАЯ ТЕРАПИЯ РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
В этом году на ESTRO 2021, который проходил в Мадриде, было представлено большое количество докладов по лучевой терапии рака предстательной железы...

НИВОЛУМАБ В ПЕРВОЙ ЛИНИИ ТЕРАПИИ МЕТАСТАТИЧЕСКОГО РАКА ЖЕЛУДКА: РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ НАЧИНАЮТ РЕАЛИЗОВЫВАТЬСЯ НА ПРАКТИКЕ
Рак желудка занимает 6 место по заболеваемости и второе место по уровню смертности во всем мире, при этом лекарственная терапия рака желудка...

ЗАМЕНИТ ЛИ СТЕРЕОТАКСИЧЕСКАЯ АБЛАТИВНАЯ ЛУЧЕВАЯ ТЕРАПИЯ (SABR) БРАХИТЕРАПИЮ В ЛЕЧЕНИИ РАКА ПРОСТАТЫ?
Ответ – да, причем этот вариант будет одобрен многими системами здравоохранения. Одни изменения в клинических парадигмах требуют проведения...
ПОИСК НОВЫХ ПОДХОДОВ К ЛЕЧЕНИЮ РАКА ПИЩЕВОДА
Рак пищевода и гастроэзофагеального соединения – одна из наиболее коварных злокачественных опухолей, требующая мультимодального подхода для большинства пациентов, подлежащих радикальному лечению. Неоадъювантная химиолучевая терапия с последующей радикальной операцией является стандартом...
МЕСТНОРАСПРОСТРАНЕННЫЙ РАК ПРЯМОЙ КИШКИ
Подход ТНТ (тотальная неоадъювантная терапия) в лечении местнораспространенного рака прямой кишки привлекает все больший интерес онкологов мира. Максимальная интенсификация лечения на предоперационном этапе, включающая не только химиолучевое лечение, но и интенсивные режимы химиотерапии...
РЕЗОЛЮЦИЯ ПО ИТОГАМ КОНСУЛЬТАЦИОННОГО СОВЕТА «ОПТИМИЗАЦИЯ АЛГОРИТМА NTRK ДИАГНОСТИКИ»
Обсудить результаты обновленного анализа эффективности и безопасности энтректиниба ...

К 80-ЛЕТИЮ ЧЛЕНА-КОРРЕСПОНДЕНТА РАМН, ЧЛЕНА-КОРРЕСПОНДЕНТА РАН, ПРОФЕССОРА ВЛАДИМИРА ФЕДОРОВИЧА СЕМИГЛАЗОВА
Все годы своей профессиональной жизни Владимир Федорович трудится во благо отечественной медицины...

МЕТФОРМИН В ЛЕЧЕНИИ БОЛЬНЫХ НЕМЕЛКОКЛЕТОЧНЫМ РАКОМ ЛЕГКОГО
Метформин, препарат из группы бигуанидов, общедоступный, хорошо переносимый и недорогой, широко применяется в лечении сахарного диабета 2 типа. При этом многие исследователи изучали и его противоопухолевые свойства, и подобные работы проводились еще с конца 1970-х годов. Эпидемиологические исследования показали, что заболеваемость и смертность от злокачественных опухолей...

Мнение эксперта. Наше будущее написано вчера…
Ларионов Леонид Федорович, основоположник отечественной химиотерапии, еще в 1937 году защитил докторскую диссертацию на тему «Эндокринные железы и рак», показав, что рак – это болезнь всего организма, причиной развития которой может быть нарушение функций эндокринной системы...
АНОНСЫ ВЕБИНАРОВ NCCN
Глубокоуважаемые коллеги! Эксперты NCCN (National Comprehensive Cancer Network) организуют целый ряд образовательных онлайн мероприятий, циклов и вебинаров для онкологов разных специальностей, зарегистрироваться на которые можно совершенно бесплатно по указанным ссылкам...

Анонс
-

9 - 11 НОЯБРЯ 2021
РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС
«Профессия врача – подвиг. Она требует самоотвержения, чистоты души и чистоты помыслов» Блохин Н.Н.
Автор: Жуков Николай Владимирович
ФГБУ «НМИЦ Детской гематологии, онкологии и иммунологии им. Д.Рогачева», Москва
Дорогие коллеги, друзья!
В этом году состоится юбилейный XXV Российский онкологический конгресс! Так же, как нелегко сейчас себе представить,
что мы застали время, когда не было мобильных телефонов, а
все зарубежные машины назывались «иномарка», так мне уже
трудно представить, что я пришел в специальность, когда еще
не было этого ежегодного события в жизни российских онкологов.
Начавшись со скромных онкологических конференций, конгресс превратился в знаковое и, не побоюсь этих слов, самое
важное событие для всех отечественных онкологов. Постепенно трансформируясь, улучшаясь и расширяясь, незаметно конгресс стал долгожданным событием для большинства наших
коллег. Причем как для слушателей, так и для спикеров – для
меня возможность выступить на конгрессе до сих пор это событие, отличающееся от выступлений на других мероприятиях.
Возможно, именно из-за этого, что бы не происходило, но наши
онкологи измеряют «профессиональное» время от конгресса к
конгрессу. И ждут его каждый год. А организаторы конгресса
каждый год идут как на экзамен, чтобы эти ожидания оправдать. Именно поэтому, как мне кажется, все удается. Заранее
обсуждая, споря, иногда даже ругаясь, правление RUSSCO и
председатели научных сессий выстраивают программу, персонал Общества готовит технические вопросы, логистику. И все
это для того, чтобы вам было интересно и комфортно. И чтобы
в очередной раз вы вышли из залов конгресса богаче знаниями,
общением, эмоциями, чем когда зашли в них. Этому не смог помешать даже COVID, более того, если вы посмотрите на сетку
программы, то увидите, что отчасти он даже помог – количество
зарубежных спикеров, за счет новой «online-нормальности» на
этом конгрессе как никогда велико. Разумеется, это не только
COVID, в первую очередь это усилия организаторов и (опять
же, не побоюсь этого слова) признание, однозначное признание
площадки одной из ведущих, в том числе и со стороны зарубежных спикеров и онкологических сообществ. При этом, безусловно, расширяется площадка конгресса и для отечественных врачей и ученых. Много новых имен, много новых тем, не
только из Москвы и Питера, но и из-за их пределов. Уверен, все
участники найдут что-то интересное для себя.
Не скрою, для меня этот конгресс особенный. Мне предстоит
прочесть лекцию памяти Николая Николаевича Блохина. На
юбилейном Конгрессе. Первому из тех, кто, к сожалению, не застал самого Николая Николаевича. Видя в президиуме, в зале
людей, которые с ним общались, тех, кто гораздо дольше в специальности и в науке. Так что я готовлюсь. Приходите, подключайтесь и пусть начнется очередной Конгресс!
В 2021 году НМИЦ онкологии им.
Н.Н. Блохина исполняется 70 лет.
Семьдесят лет со дня основания
уникального медицинского учреждения, крупнейшей школы
современной онкологии, обладающей колоссальным научнопрактическим опытом.
22 октября 1951 года постановлением Совета Министров СССР
учреждён Институт экспериментальной патологии и терапии
рака Академии медицинских
наук СССР. Новый институт располагался в корпусе Московского
областного клинического института (МОНИКИ), где была развернута клиника на 60 коек.
НМИЦ онкологии им. Н.Н. Блохина
– это масштабная организация,
в его состав входят 2 клинических
и 3 научных института:
• НИИ клинической онкологии им.
Н. Н. Трапезникова – 900 коек;
• НИИ детской онкологии
и гематологии – 150 коек;
• НИИ канцерогенеза, включающий
в себя 16 лабораторий;
• НИИ экспериментальной диагностики и терапии опухолей включающий в себя 15 лабораторий;
• НИИ клинической и экспериментальной радиологии – 50 коек.
В НМИЦ изучаются новые направления комбинированного
лечения, совершенствуются методы лучевой терапии, разрабатываются современные подходы
хирургической помощи.
Первым и.о. директора института
в декабре 1951 года стал Михаил
Михайлович Маевский.
Михаил Михайлович Маевский


В 1952 году директором института стал Николай Николаевич
Блохин.
Постановление Совета Министров
СССР от 22 октября 1951 г.

Николай Николаевич Блохин был не
только выдающимся хирургом нашей страны, талантливым организатором здравоохранения, известным
общественным деятелем, осно-вателем хирургической школы и блестящим клиницистом, но и человеком
с исключительными личными
качествами: глубоким, тонким ценителем искусства, обладателем великолепной коллекции картин русских художников.
Хирургическую деятельность Н.Н.
Блохин начал в Горьковской области. Н.Н. Блохин так рассказывал
о начале трудового пути: «Работа
в сельской больнице не дала мне
много времени на раскачку, на робкое ученичество, пришлось скоро
браться и за сложные операции…
Я мог считать себя подготовленным – оперировал ещё на тре-тьем
курсе, но то были несложные случаи, да и рядом стояли опытнейшие специалисты. В моей первой
больнице оглядываться было не на
кого. А ведь любая операция – шаг в
неведомое… Терялся, опускал руки
– было всё! Но я благодарен годам,
они стави-ли меня пред ситуациями, требовавшими полнейшей
собранности, мобилизации духа и
знаний. В те годы я полюбил хирургию навсегда!».
Коллектив института экспериментальной и клинической
онкологии АМН СССР

В годы Великой Отечественной
войны проявился хирургический и организаторский талант
Н.Н. Блохина, он работал ведущим
хирургом эвакогоспиталя, а затем
возглавил госпиталь восстановительной хирургии.
В период Великой Отечественной
войны Н.Н.Блохин опубликовал ряд
работ по хирургическому лечению
огнестрельных ранениях костей и
суставов, по методам пласти-ческих
операций после ранений и ожогов.Н.Н. Блохин разработал технику
кожной пластики при гранулирующих ранах, предложил ряд методов
и модификаций пластических операций при рубцах, обезображивающих лицо после ожогов. Итогом
исследований ста-ла докторская
диссертация «Кожная пластика в
хирургии военных повреждений»,
защи-щенная в 1946.
В 1952 г. начался новый этап в жизни
учёного: он переехал в Москву, возглавив Институт экспериментальной и клинической онкологии АМН
СССР. Н.Н. Блохин развивал институт как уникальный научный, производственный и лечебный центр.
Николаю Николаевичу удалось
собрать выдающихся врачей, хирургов, ученых. В стенах института
оперировали и занимались научной
деятельностью А.Д.Тимофеевский,
Л.М.Шабад, Л.Ф.Ларионов,
М.М.Маевский, Л.А.Зильбер,
Л.А.Новиков, Б.Е.Петерсон,
А.В.Чаклин, Н.А.Краевский,
Н.И.Переводчикова, В.И.Астрахан.
Это был коллектив молодых,
энер-гичных, увлеченных врачей,
способных заниматься и практикой и научной работой.
Коллектив института экспериментальной и клинической онкологии АМН СССР

Здесь внедрялись и продвигались
самые современные высокотехнологичные методики функциональной диагностики, проводились уникальные операции.
Н.Н.Блохин был человеком с необычайной широтой взглядов и
редкой интуицией. Он понимал,
что онкологическое заболевание
− это системная болезнь, и пациенты нуж-даются не только в
оперативном, но и лекарственном лечении. Проблема химиотерапии была включена в программу
межгосударственного сотрудничества СССР-США в области медицинской науки (1972-1991 гг.).
Американская делегация: профессора Вассерман, Берченал, Зуброд,
Селари, Картер и коллектив НМИЦ онкологии им Н.Н.Блохина
обсуждают перспективы сотрудниче-ства.

Начиная с 1955 года, исследования по противоопухолевой лекарственной терапии в нашей стране
сосредоточились в Институте
экспериментальной патологии и
терапии рака Академии медицинских наук СССР. Клинические испытания первых отечественных
цитостатиков – сарколизина и
допана − стартовали под личным
руководством Н.Н.Блохина. Одним из первых больных, получивших сарколизин, оказался пациент с огромными метастазами
семиномы яичка. На фоне проведенного лечения была достигнута
полная и стойкая ремиссия, это
был первый в истории медицины
случай излечения химиотерапией больного с солидной злокачественной опухолью − счастливый
случай, за которым стоит колоссальный труд.
Н.Н.Блохин с первых дней работы
в онкологии, а затем уже будучи директором ОНЦ и Президентом
АМН, всегда боролся с псевдоучеными. Н.Н.Блохин добился постановления ЦК, в котором утверждалось, что «…судить о средствах и
методах лечения больных должны
только врачи, и никакие другие инстанции, в том числе и прави-тельственные, не должны иметь преимущество в оценки этого». Он был
одним из первых, кто активно занимался доказательной медициной.
Результаты терапии сарколизином пациента с семиномой яичка.

С 1988 года директором ВОНЦ
АМН СССР становится академик РАМН, профессор Николай
Николаевич Трапезников. У
Н.Н. Трапезникова было потрясающее научное и организационное чутье, он относился к категории людей, которые всегда
принимают правильные решения, точно оценивают события,
видят перспективы в, казалось
бы, не-значительных научных
достижениях. Будучи очень
энергичным человеком, он всегда мог чётко и быстро оценить
ситуацию и не позволял сиюминутным обстоятельствам влиять на принятие решений.
Николай Николаевич Трапезников

«В отношениях со всеми без исключения людьми Николай Николаевич был простым и доступным человеком. Если бы вы
не знали, что это академик двух
академий, учёный с мировым именем, вы бы никогда не догадались,
с кем имеете дело, настолько он
был доступен и прост» (Михаил
Иванович Давыдов)
Почти 50 лет своей научной и врачебной деятельности
Н.Н.Трапезников провел в стенах
Онкологического Центра, пройдя
путь от ординатора до директора.
Академики Н.Н. Блохин,
Н.Н. Трапезников, Е.И. Чазов

Н.Н.Трапезников создал научную
школу онкоортопедии. Под его руководством и при непосредственном участии были разработаны
принципы проведения сохранных
операций при новообразованиях
костей, методика регионарной внутриартериальной химиотерапии при
саркомах конечностей, убедительно
показан эффект химиотерапии при
остеогенной саркомах. Н.Н. Трапезников совместно с С.Т.Зацепиным,
А.А.Коржом, Я.Г.Дубровым,
А.С.Имамалиевым, С.С.Ткаченко,
П.П.Коваленко, В.Д.Чаклиным внедрил в клиническую практику оригинальные отечественные титановые
эндопротезы коленного, плечевого и
тазобедренного суставов, позволяющие полностью восстанавливать
функцию конечности, а также методику аллогенных костных трансплантатов.
Будучи онкологом, изучая канцерогенез, Н.Н.Трапезников одним из
первых оценил иммунотерапию, как
перспективный метод лечения злокачественных новообразова-ний. Под
его руководством разработана иммунотерапия злокачественных опухолей активированными лимфоцитами больного, изучена специфическая
и неспецифическая иммунотерапия
злокачественных новообразований,
иммунохимиотерапия и профилактика метастазирования при меланоме кожи.
Зная свой коллектив, будучи уверенным в нем, видя уровень подготовки
сотрудников, объективно оценивая
их достижения, Н.Н. Трапезников
активно занимался попу-ляризацией
отечественной медицины на международном уровне.
Профессора В. де Вита и Н.Н.Трапезников подписывают
протокол по сотруд-ничеству.

Н.Н.Трапезников с коллегами во время визита в Мадрид в 1968 г.

Один из ведущих мировых специалистов онкоортопедов, профессор
Коц, говорил пациентам из России: «Уезжайте домой, лечитесь у
Трапезникова, лучше, чем он, мы
всё равно вам не поможем». Так, в
конце 60-х годов у племянника Дж.
Кеннеди выявили остеосаркому, и
Кеннеди попросил консультацию
Трапезникова для определения тактики лечения, в том числе выбора
химиотерапии и целесообразного
объёма операции.
С 2001 года по 2017 год ФГБУ
НМИЦ онкологии им. Н.Н. Блохина Минздрава России возглавил
выдающийся российский хирургонколог, академик РАН, профессор
Михаил Иванович Давыдов.
Михаил Иванович Давыдов

Михаил Иванович Давыдов − блистательный торако-абдоминальный
хирург, известный в России и за
рубежом как крупный ученый, посвятивший свою научную и практическую деятельность разработке
новых и совершенствованию существующих методов хирургического
лечения рака легкого, пищевода,
желудка, опухолей средостения.
Михаил Иванович с юности отличался стойкостью и лидерскими
качествами. Будучи подростком и
во время службы в ВДВ, он стал мастером спорта СССР по боксу.
Под руководством Михаила
Ивановича разработаны методики
комбинированных оперативных
вмешательств с использованием
аортокоронарного шунтирования
и магистральной сосудистой пластики при облитерирующих опухолевых тромбозах нижней по-лой
вены и правого предсердия, апробированы и внедрены в клиническую практику но-вые методики
внутриплевральных желудочно-пищеводных и пищеводно-кишечных
анастомозов, характеризующиеся
безопасностью и высокой физиологичностью.
Впервые М.И. Давыдовым выполнены операции с одномоментной абдомино-медиастинальной и шейнонадключичной лимфодиссекцией,
что позволило повысить радикальность хирургического и комбинированного метода лечения злокачественных опухолей пищевода.
В 2001 г. М.И. Давыдов первым выполнил тотальную аллогенную трансплантацию трахеи двум больным аденокистозным раком трахеи – первую в
мире пересадку трахеи при опухолевом поражении.
Под руководством М.И.Давыдова
защищено 57 докторских и 50 кандидатских диссертации. Он является автором и соавтором более
900 научных работ, включая 34 монографии и 9 научно-методических
фильмов, 20 изобретений и рационализаторских предложений.
Заслуги М.И. Давыдова перед страной высоко оценены в России: за
большой вклад в развитие здравоохранения, медицинской науки
и многолетнюю добросовестную
работу он награжден орденом «За
заслуги перед Отечеством» IV степени.
С ноября 2017 года директором
ФГБУ «НМИЦ онкологии им. Н.Н.
Блохина» Минздрава России назначен академик РАН, профессор Иван
Сократович Стилиди.
Иван Сократович Стилиди

В сферу научных интересов ученика
М.И.Давыдова, опытного клинициста-онколога и универсального хирурга, в совершенстве владеющего
всеми типами опера-ций, входят
хирургическое лечение опухолей
внутригрудного отдела пищевода,
желудка, тонкой и толстой кишки, забрюшинных опухолей, хирургическое лечение опухолей
Директор института экспериментальной патологии и терапии рака
Академии меди-цинских наук СССР Блохин Н.Н. на открытии Международного противоракового конгресса

магистральных сосудов, хирургическое лечение опухолей почек и
надпочечников, в том числе случаи, осложненные протяженным
опухолевым тромбозом. Иваном
Сократовичем усовершенствована
методика операции типа Льюис с
расширенной лимфодиссекцией,
обоснован оптимальный хирургический доступ при различных
уровнях опухолевого по-ражения
внутригрудного отдела пищевода.
Все эти методики на внедрены в
клиниче-скую практику и активно используются его учениками во
всех регионах России. В сферу научных интересов И.С. Стилиди входят
сложнейшие, уникальные оперативные вмеша-тельства с резекцией
и протезированием аорты и нижней
полой вены у больных с внеорганными забрюшинными саркомами
и опухолями надпочечников, которые он виртуозно выполняет.
Автор более четырех сотен научных работ, получивших широкую
известность в России и в мире, в
их числе пяти монографий, Иван
Сократович активно занимается
педагогической деятельностью:
он не только возглавляет кафедру
онкологии и лучевой терапии лечебного факультета Российского
национального исследовательского
медицинского университета им.
Международный противораковый
конгресс 1962 года

Н. И. Пирогова, но и лично обучает
молодых хирургов мастер-ству.
За вклад в развитие онкологической
помощи в нашей стране, активное
внедрение совре-менных технологий в клиническую практику и
ежедневное служение пациентам
И.С.Стилиди был награжден орденом Почета.
Сегодня НМИЦ онкологии им
Н.Н.Блохина – одна из ведущих онкологических клиник в мире,
крупнейший научный, лечебно-диагностический, учебный и
производ-ственный комплекс в
России, где изучают этиологию
и патогенез онкологических забо-леваний, разрабатывают и
внедряют современные виды диагностики и лечения, проводят современные операции
В 1962 году под руководством и
активном участии Н.Н.Блохина
в Москве был проведен Международный противораковый конгресс. Фактически это был первый
и единственный международный
конгресс, проведенный в СССР.
Можно себе представить все трудности того времени, чтобы в той
политической и экономической
ситуации про-вести мероприятие
с участием 5000 делегатов из США,
Англии, Франции и других стран
(более 60 стран).
А в дни празднования юбилея центра – 9-11 сентября 2021
года – в НМИЦ онколо-гии им
Н.Н.Блохина прошел форум «Инновационная онкология», в котором приняли участие ведущие
эксперты России, США, Испании,
Италии, Франции и Швейцарии. Под своей эгидой форум объединил онкологов, врачей смежных
специальностей, известных ученых, организаторов здравоохранения, общественных деятелей,
представителей медицинского бизнеса и средств массовой информации. Форум явился площадкой, где
были продемонстрированы современные возможности онкологии,
представлены актуальные научные
исследования и перспективные направления.
Форум открыл И.С.Стилиди, директор ФГБУ «НМИЦ онкологии
им. Н.Н. Блохина, д.м.н., профессор, академик РАН, с докладом
«Что такое онкохирургия сегодня?». Далее выступил Тюляндин
Сергей Алексеевич, г.н.с. ФГБУ
«НМИЦ онкологии им. Н.Н. Блохина», д.м.н., профессор, который в докладе «Вдохновляющая
эволюция лекарственной терапии
злокачественных опухолей» продемонстрировал успехи современной
лекарственной терапии и перспективы ее развития.
Форум «Инновационная онкология» стал поистине масштабным
событием, а представленные доклады вызвали живой интерес аудитории. В форуме приняли участие более 4300 участников из 269
городов. Онкологи из 23 стран объединились для обсуждения острых
вопросов современной терапии.
Широкая география участников из
Украины, Латвии, Молдовы, стран
средней Азии, США, Перу и Мексики позволила поделиться бесценным опытом лечения пациентов в ведущих мировых клиниках
в условиях пандемии. В рамках
Форума выступили 216 (из них 10
иностранных) спикеров, состоялся
22 доклад и 15 сателлитных симпозиумов.
Были проведены прекурсы «Живая хирургия», где на высочайшем уровне выполнены сложные
хирургические вмешательства с
использованием современных малоинвазивных технологий, в том
числе роботического комплекса
DaVinci.
Живой интерес вызвал прекурс
по эндоскопии, на котором доктор
Seiichiro Abe представил доклад
«Эндоскопическая диагностика
рака желудка». В рамках курса
прове-дено несколько операций:
д.м.н. Малихова О.А. и д.м.н. Кашин С.В. виртуозно исполнили
комплексную эндоскопическую
диагностику и эндоскопическую
резекцию с диссекцией в подслизистом слое у больного ранним
раком желудка, а Шишкин К.В.
выполнил туннельное эндоскопическое удаление неэпителиальной
опухоли пищевода. Впервые в Российской Федерации
в рамках форума «Инновационная онкология» проведен прекурс,
посвященный стереотаксической
лучевой терапии локализованного
рака предстательной железы, проведенный доктором Тимуром Митиным из Университета Здоровья
и Медицины, Орегон, США. Были
продемонстрированы все этапы
терапии, начиная с предлучевой
топометрии, дозиметрического
планирования и вплоть до самого
сеанса лечения.
Большой интерес участников вызвали доклады, посвященные раку
молочной железы, желудка, легкого,
колоректального рака, онкогинекологии и лечению редких опухолей.
Запоминающимся аспектом стали
сессии по онкогематологии, онкоортопедии, лучевой терапии и фундаментальной онкологии.
Форум «Инновационная онкология»
позволил осветить современные технологии в их развитии и во взаимосвязи фундаментальной науки и клинической практики.




ЛЕНВАТИНИБ + ПЕМБРОЛИЗУМАБ: ЭФФЕКТИВНАЯ КОМБИНАЦИЯ ДЛЯ ЛЕЧЕНИЯ РАСПРОСТРАНЕННОГО РАКА ЭНДОМЕТРИЯ
Симпозиум компании Eisai, состоявшийся в рамках II международной
веб-конференции «Онкогинекология: от клинических исследований к
практике», был посвящен комбинации ленватиниба и пембролизумаба. Эксперты представили данные
новейших исследований и подробно
обсудили первые результаты применения комбинации в России.
Спикеры дискуссии:
– Светлана Викторовна Хохлова, д.м.н., заведующая онкологическим отделением противоопухолевой лекарственной терапии ФГБУ «Научный центр акушерства, гинекологии и перинатологии им. В. И. Кулакова»; – Михаил Викторович Волконский, заведующий дневным стационаром отделения химиотерапии ПО МГОБ 62; – Елена Курбановна Шаварова, к.м.н., доцент кафедры внутренних болезней, кардиологии и клинической фармакологии РУДН; – Александра Сергеевна Тюляндина, д.м.н., заведующая отделением химиотерапии №4 ФГБУ «НМИЦ онкологии им. Н.Н. Блохина».
Приоритетный режим терапии во второй линии с длительным ответом
В первом докладе С.В. Хохлова обратила внимание слушателей на незначительное количество исследований лекарственной терапии диссеминированного рака эндометрия и то, что в большинстве из них результаты терапии достаточно низкие. Медиана выживаемости без прогрессирования в 1-ой линии терапии – около 14 месяцев, медиана общей выживаемости – от 15 до 30 месяцев, а 5-летняя выживаемость при III и IV стадиях – 16,8% [1-8]. Но появляются новые исследования, а вместе с ними – новые опции лечения. В прошлом году на основании исследования второй фазы KEYNOTE-146 / Исследование 111 была зарегистрирована комбинация ленватиниба и пембролизумаба. Исследование включило анализ результатов лечения 124 пациенток, при этом подгруппа pMMR/MSS (без микросателлитной нестабильности) насчитывала 94 больных. Именно на основании показателей этой подгруппы комбинация зарегистрирована в РФ. Представлены все гистологические подтипы, значимый процент приходился на самые агрессивные серозные светлоклеточные аденокарциномы. Более чем у половины пациенток PD-L статус был положительным, и почти все они до начала лечения комбинацией ленватиниба с пембролизумабом получали химиотерапию на основе платины [9]. Комментируя результаты исследования, С. В. Хохлова отметила, что частота объективного ответа при оценке на сроке 24 недели составила 38% вне зависимости от PD-L статуса и гистологического подтипа. Медиана выживаемости без прогрессирования составила 7,4 месяца, а медиана общей выживаемости – 16,4 месяца. Согласно обновленным данным, у тех пациенток, у которых отмечался объективный ответ на лечение, он был длительным и сохранялся на протяжении трех лет [9]. В финале выступления С. В. Хохлова еще раз подчеркнула, что комбинация ленватиниба с пембролизумабом показывает более высокую эффективность, чем любая химиотерапия во 2-й линии при распространенном раке эндометрия. Затем М. В. Волконский представил клинический случай 76-летней больной раком тела матки T1bN0M0. На первых этапах лечения пациентке было проведено хирургическое лечение (тотальная гистерэктомия с придатками) и лучевая терапия. При прогрессировании заболевания (появлении метастазов в легких) через два года проведен курс химиотерапии (паклитаксел + карбоплатин), затем курс гормонотерапии (ингибиторы ароматазы). После прогрессирования назначена иммунотаргетная терапия в стандартных дозах: ленватиниб 20 мг ежедневно и пембролизумаб 200 мг внутривенно каждые 3 недели. При контрольном обследовании через 3 месяца отмечено уменьшение очагов в культе влагалища и уменьшение других очагов, в том числе контрольного в легком. М. В. Волконский отметил, что комбинация ленватиниба и пембролизумаба – высокоэффективная опция терапии распространенного рака эндометрия и подчеркнул, что на сегодняшний день у специалистов 62 городской онкологической больницы накоплен значительный опыт ее применения. При правильном управлении нежелательными явлениями (своевременная редукция дозы) пациенты продолжают достаточно долго получать инновационную терапию. Третий докладчик симпозиума - кардиолог Е. К. Шаварова подняла тему контроля артериального давления у пациентов на иммуно-таргетной терапии, т.к. лечение ингибиторами тирозинкиназы (к числу которых относится ленватиниб) снижает синтез вазодилататоров и повышает продукцию вазоконстрикторов, что увеличивает общее сосудистое сопротивление. До начала лечения ленватинибом Е. К. Шаварова рекомендует провести ряд стандартных обследований: сбор анамнеза, измерение офисного артериального давления и ЧСС, клинический и биохимический анализы крови. Для полной оценки сердечнососудистых факторов риска следует проанализировать уровень креатинина, липидный спектр и глюкозу. Если артериальное давление превышает 140/90, то антигипертензивную терапию следует подобрать еще до начала лечения ленватинибом, но как только прием препарата прекращается (или его доза снижается), снижается и артериальное давление. Чтобы сохранить пациента на максимально необходимой эффективной дозе таргетного препарата, необходимо параллельно с назначением ленватиниба и выявлением артериальной гипертонии очень быстро титровать дозы гипертензивных препаратов. В рутинной практике речь идет об 1 разе в 2 недели, а в случае с таргетной терапией - уже каждые 1, 2 или 3 дня. Доктор обозначила целевой уровень давления, к которому нужно стремиться: не более 130/80 для пациентов старше 65 лет. Е. К. Шаварова посоветовала онкологам обязательно консультироваться с кардиологами до того, как всерьез думать о редукции дозы ленватиниба, если побочная реакция проявилась, и указала, что артериальная гипертония – в подавляющем большинстве случаев корректируемая побочная реакция.
Первый анализ применения комбинации ленватиниба и пембролизумаба в России при раке эндометрия
Клинические исследования – основа для начала использования новых опций терапии, но также крайне важен опыт из реальной клинической практики. В завершении симпозиума А. С. Тюляндина представила анализ первых результатов применения комбинации ленватиниба с пембролизумабом в России у 34 пациентов. У всех больных, включенных в анализ, отсутствовала микросателлитная нестабильность, 10% имели статус ECOG 2 и более. В большинстве случаев встречалась эндометриоидная аденокарцинома, у каждой пятой пациентки - серозная аденокарцинома. Препараты платины и таксаны получали почти все (94% пациенток), в дальнейшем другие комбинации с цитостатиком получали 70% больных. Большинство больных были предлечены: половина получила одну или две линии химиотерапии, другая половина – три и более. Частота объективного ответа составила 26%, у каждой четвертой пациентки наблюдался частичный ответ. Стабилизация опухолевого процесса была высокая – практически 70%, то есть болезнь можно контролировать в подавляющем большинстве случаев. Основной вид токсичности – артериальная гипертензия – проявилась в 47% случаев. Общая слабость (II степени) наблюдалась больше, чем у половины больных. Остальные виды токсичности составили не более 10% - это диарея, гипотериоз, стоматит, миалгия, артралгия. На сегодняшний день длительность приема препарата не столь велика, медиана составляет 2,5 месяца, но некоторые пациентки получают комбинацию в течении 13 месяцев. Редукция дозы отмечается у каждой третьей больной: 70% получают терапию в полноценных дозах, у 30% потребовалась редукция дозы ленватиниба. У тех пациенток, которые продолжают терапию 6 и более месяцев, медиана длительности ответа составилат 6-7 месяцев. Стоит отметить, что в исследование включены больные, которые перешли за отметки в 10 и 12 месяцев. У четырех пациенток лечение было прекращено в связи с прогрессированием заболевания. Подводя итоги симпозиума, А. С. Тюляндина сказала, что в России появилась новая опция терапии рака эндометрия, и врачи уже начали ее активно использовать. Комбинация ленватиниба и пембролизумаба – это хороший шанс для больных и эффективная схема лечения. Отмечается статистически и клинически значимое улучшение показателей частоты объективного ответа, в том числе по сравнению с химиотерапией. Во всех проанализированных подгруппах наблюдаются преимущества в отношении времени без прогрессирования и продолжительности жизни. При этом комбинация характеризуется управляемым уровнем токсичности, который в целом соответствует профилю безопасности комбинации ленватиниба + пембролизумаба. По мнению А. С. Тюляндиной, нет сомнения в эффективности назначения комбинации ленватиниба и пембролизумаба, поэтому важной задачей специалистов, занимающихся лечением рака эндометрия, – это правильно управлять токсичностью, чтобы пациентки как можно дольше получали эффективную терапию.
Источники:
1. Bradford LS. et al. Am J Clin Oncol. 2015;38(2):206-12.
2. Morice P, et al. Lancet. 2016:387(10023):1094-108.
3. Bestvina CM, et al. Oncologist. 2016;21(10):1250-9.
4. Gynecologic Oncology Group. GOG Publication Search Engine. http://www. gog.org/pubsearch/pubtop.asp. Accessed February 13. 2019
5. Miller D, et al. Presented at SGO Annual Meeting 2012. Late-Breaking Abstract 1.
6. Thigpen JT. et al. J Clin Onol. 2004:22(19):3902-8.
7. Fleming GF, et al. J Clin Oncol. 2004:22(11): 2159-66. 8. ©2019, American Cancer Society, Inc., Surveillance Research https://seer.cancer. gov/statfacts/html/corp.html 9. Makker V et al. J Clin Oncol. 2020;38
При поддержке компании Eisai.
Публикуется в редакции авторов.

ESTRO 2021: НОВОСТИ КОНГРЕССА
Автор: Деньгина Наталья Владимировна
К.м.н., заведующая радиологическим отделением ГУЗ ОКОД, директор Центра лучевой терапии «ЭрСпей», Ульяновск
Очередной конгресс ESTRO 2021 проходил в Мадриде в комбинированном (очно и онлайн) формате: около 3 тысяч участников приехали в столицу Испании и примерно столько же участников подключались дистанционно. Эра ковида примирила нас с временной невозможностью посещать массовые научные мероприятия – но и продемонстрировала одно несомненное преимущество онлайн участия: в любое время, без спешки, без перебежек из зала в зал можно спокойно пролистать все интересующие сессии и сделать пометки для практической деятельности. При просмотре сессий в записи не создалось впечатления, что конгресс оказался богат на научные прорывы, но некоторые данные могли показаться интересными.
Роль элективного облучения лимфоузлов в 2021 году
В рамках этой сессии докладчики рассмотрели основные доводы в пользу расширенного облучения либо против него при опухолях ряда локализаций. Для рака легкого стало уже практически очевидным отсутствие необходимости (и целесообразности) облучать все средостение при проведении радикального лучевого или химиолучевого лечения: метаанализ Li et al. 2016 года [1] продемонстрировал отсутствие преимуществ такого подхода в сравнении с селективным облучением только вовлеченных зон лимфоузлов. Отличия в частоте рецидивов в средостении были минимальны, как по данным рандомизированных исследований (6,9% после селективного облучения против 5,0% после широкопольного), так и по данным когортных исследований (4,4% против 3,0%). Основной проблемой остается правильное определение вовлеченных зон. Когда есть возможность использовать ПЭТ/КТ для предлучевой подготовки и оконтуривания, ситуация упрощается. В иных случаях определение именно вовлеченных лимфоузлов (прежде всего, по размеру – 1 см и более в наименьшем изменении) несет определенный процент погрешностей. ESTRO-ACROP рекомендации 2018 года [2] предлагали ориентироваться прежде всего на данные ПЭТ/КТ и морфологическое подтверждение вовлеченности лимфоузлов при биопсии и включать в поле облучения и зоны тех лимфоузлов, которые могли полностью уйти после индукционной химиотерапии. Считалось разумным облучать а) лимфоузлы корня со стороны поражения, б) зону между двумя вовлеченными группами лимфоузлов (хотя это опционально). Обновленные рекомендации 2020 года, основанные на результатах исследования PET-PLAN [3], предлагают полностью отойти от элективного облучения и ориентироваться только на вовлеченные зоны, определяемые по ПЭТ. Оказалось, что риск локорегионального прогрессирования при облучении только вовлеченных зон был не выше, а фактически даже ниже в сравнении с таковым при традиционном элективном облучении [4]. Более того, в эпоху иммунотерапии в консолидирующем лечении рака легкого отказ от широкопольного облучения всех зон лимфоузлов может стать принципиально важным моментом, стимулируя более выраженный иммунный ответ, индуцированный радиотерапией, со стороны необлученных зон лимфоузлов, где вырабатываются иммунокомпетентные лимфоциты [5]. Селективное облучение стало стандартом и для мелкоклеточного рака легкого, хотя рекомендации ESTROACROP 2020 года [6] предлагают включать в поле облучения не только явно увеличенные (более 10 мм) лимфоузлы, но и более мелкие, визуализируемые и располагающиеся рядом – с учетом более высокой агрессивности МРЛ. Недавнее рандомизированное исследование китайских коллег, в котором сравнивались 2 подхода – с облучением вовлеченных зон по данным визуализации ДО химиотерапии и ПОСЛЕ, не показало достоверной разницы в отдаленных результатах [7], но такой подход все же пока выглядит новаторским. Для пациентов с опухолями головы и шеи пока элективное облучение групп лимфоузлов остается стандартом, хотя в настоящее время, по мнению профессора Vincent Gregoir, мы имеем гораздо больше информации в отношении предиктивного паттерна распространения опухолевых клеток по лимфоузлам шеи из первичного очага и, следовательно, в ближайшем будущем речь однозначно будет идти о селективном воздействии на зоны шейных лимфоузлов (хирургическом или лучевом). В ряде случаев и сегодня при хорошо латерализованных опухолях можно говорить об унилатеральном облучении зон региональных лимфоузлов или, как вариант, о снижении дозы лучевой терапии на зоны низкого риска до 40 Гр, что по данным ряда исследований не отражается на увеличении риска рецидивов, но способствует снижению токсичности [8], но эти данные должны быть валидированы в дальнейших исследованиях. При раке предстательной железы подход к облучению тазовых лимфоузлов должен быть строго индивидуальным и основанным на конкретных характеристиках опухоли. Крупные исследования разных лет по сравнению облучения только простаты или с включением лимфоузлов таза продемонстрировали различные результаты, но недавние работы (Murthy, 2021 [9], предварительные данные NRG/RTOG 0534) являются доказательством первого уровня, что при раке простаты высокого риска расширение объемов облучения обосновано, в том числе и на послеоперационном этапе при уровне ПСА ≥0,35 нг/мл. По мнению профессора Allan Pollack из университета Майами, в первую очередь кандидатами на радикальное облучение простаты и регионарных лимфоузлов являются пациенты с высоким и очень высоким риском рецидива, причем верхняя граница тазового поля должна располагаться минимум на уровне L4/5, а дозы на простату должны составлять минимум 78 Гр и выше в перерасчете на традиционное фракционирование.
Исследования из категории Proffered Papers
Датские авторы [10] представили данные по анализу уровня и скорости элиминации опухолевой ДНК в качестве предиктора рецидивов у больных с первичным раком анального канала. В исследование были включены 45 больных с ВПЧ-позитивным плоскоклеточным раком анального канала, которые получали радикальное химиолучевое (более 70%) или лучевое лечение. До начала лечения, в середине курса, по его окончании, а также спустя 1-3 года после его окончания в плазме крови определяли опухолевую ДНК, и по скорости ее элиминации из плазмы распределили больных в 3 группы – группу быстрой элиминации (когда уже к середине курса ДНК не определялась), медленной элиминации (ДНК переставала регистрироваться к концу курса) и группу персистенции, когда ДНК продолжала определяться на протяжении всего периода наблюдения. Средний период наблюдения составил 29 месяцев, за это время у 4 больных (8%) возникли локальные рецидивы, у 4 (8%) – отдаленные метастазы. При этом в 1 группе (12 пациентов) признаков прогрессирования не отмечено вообще, во 2 группе (медленной элиминации – 20 больных) отмечены 4 случая локальных рецидивов, а в 3 группе (13 больных) – все 4 случая отдаленного метастазирования, что свидетельствует о персистенции опухолевой ДНК после лечения как о факторе негативного прогноза. Соответственно, тактика ведения таких пациентов может различаться: группу быстрой элиминации целесообразно просто наблюдать, при медленной элиминации ДНК стоит рассмотреть возможность локального буста для улучшения локального контроля, а в группе персистенции – необходимость проведения дополнительного более агрессивного системного лечения. Интересные данные в отношении комбинации стереотаксической лучевой терапии (SBRT) и таргетной терапии представили авторы из Швейцарии [11]. Исследование TOasTT – пока единственное проспективное мультицентрическое (27 центров Европы и Австралии) исследование, поставившее целью определить токсичность комбинации различных групп таргетных и иммунных препаратов и концентрированной лучевой терапии у больных с отдаленными метастазами. До сих пор информация была крайне противоречивой, с упоминанием немалого количества выраженных осложнений, поэтому тема однозначно актуальна. Было включено 438 больных, из них большинство – с полиметастатическим процессом (58%), которые получали различные варианты таргетной терапии и SBRT как на интракраниальные, так и на экстракраниальные очаги. Большинство пациентов имели НМРЛ и меланому (37% и 36%), меньшее количество – рак почки (8%), рак молочной железы (6%) и опухоли других локализаций (13%). Наиболее часто проводилось облучение интракраниальных метастазов, из препаратов чаще всего пациенты получали иммунотерапевтические агенты (50% случаев). Как правило, лекарственное лечение было начато до облучения и продолжено на его фоне; в ряде случаев в период облучения оно было прервано и редко – начато после лучевой терапии. Перерыв в лечении никак не сказался на частоте и выраженности осложнений, и в подавляющем большинстве случаев клинически значимая токсичность (3 степени), как ранняя, так и поздняя, не превышала 10% – уровень, который считается допустимым. Только комбинация SBRT с BRAF/MEK ингибиторами показала превышение частоты выраженных осложнений свыше 10% (см. рисунок).
Рисунок 1.
Ранняя и поздняя токсичность комбинации таргетных агентов или иммунопрепаратов с SBRT [11].
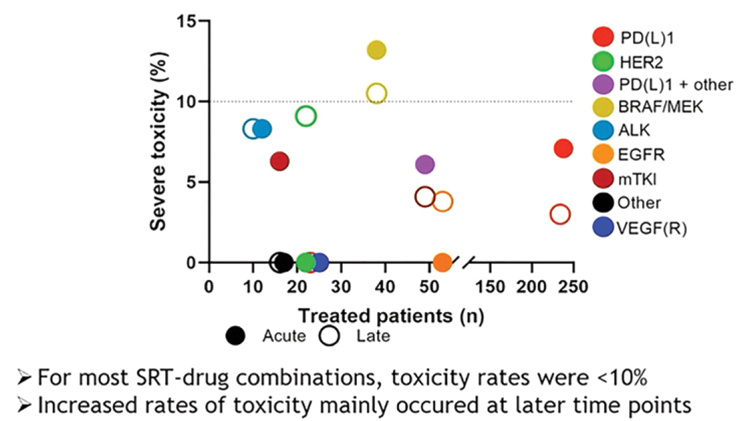
Преобладала внутримозговая токсичность, ранняя и поздняя, это касалось нескольких групп препаратов (BRAF/MEK, ALKi, PD-L1i, EGFRi, HER2i). Экстракраниальная SBRT чаще сопровождалась осложнениями со стороны грудной клетки (EGFRi, mTKIi) и брюшной полости (PD-L1i). Исследователи из парижского института Марии Склодовской-Кюри представили одногодичные данные [12] по токсичности комбинации олапариба и лучевой терапии у больных с трижды негативным раком молочной железы (проспективное исследование RADIOPARP 1 фазы с эскалацией дозы олапариба с 50 мг дважды в сутки до 200 мг на фоне стандартной лучевой терапии 50 Гр ± буст). Олапариб уже продемонстрировал эффективность в лечении этой сложной группы пациентов, снижая риск прогрессирования на 57% (по данным исследования OlympiAD) и увеличивая выживаемость без прогрессирования у пациенток с BRCA мутацией. Но безопасность комбинации препарата с лучевой терапией пока не оценена. В исследование были включены больные с неполным патоморфологическим регрессом после неоадъювантной ХТ, с нерезектабельным процессом после ХТ и с контролируемым метастатическим процессом, которым было принято решение проводить местное лечение – всего 24 пациентки. Ранняя токсичность была вполне умеренная: у 2 больных – кожная токсичность 3 степени, у 1 – болевой синдром в молочной железе 3 ст. У 46% (11 больных) отмечена купируемая лейкопения 3-4 степени. Спустя 1 год осложнений 3 степени и выше не зарегистрировано. В итоге олапариб в дозе 200 мг BID был рекомендован для изучения эффективности в комбинации с лучевой терапией в дальнейших исследованиях 2 фазы. Американские исследователи из Пенсильвании решили оценить эффективность адъювантного лечения у больных низкодифференцированным раком эндометрия и светлоклеточными карциномами с глубокой инвазией [13]. Для анализа использовались результаты лечения 7680 пациенток за период 2004-2016 гг., взятые из Национальной раковой базы данных США. Треть из них не получали никакого адъювантного лечения, у остальных варианты терапии включали дистанционное облучение малого таза (26,5%), вагинальную брахитерапию (16,3%), комбинацию ДЛТ и ХТ (7,3%), вагинальную ЛТ и ХТ (9,7%) и только ХТ (7,2%). При этом предпочтение варианту вагинального облучения отдавалось у более пожилых пациенток с более высоким индексом коморбидности, проживающим преимущественно в отдалении от городов, после лапароскопических оперативных вмешательств, лимфаденэктомий и в тех случаях, когда пациенткам изначально предполагалось проведение ХТ. Наилучшие показатели 5-летней общей выживаемости оказались в группах больных, у которых один из вариантов лучевой терапии сочетался с ХТ (кривые практически совпали, ОВ за 5 лет составила 75,0% и 74,8% после ДЛТ+ХТ и ВПЛТ+ХТ соответственно). Чуть хуже результаты оказались в группе изолированного адъювантного лучевого лечения (72,3% после ДЛТ и 71,0% после ВПЛТ) и худшие результаты – после ХТ в качестве единственной адъювантной терапевтической опции (67,9%). В России в подобных клинических ситуациях более распространен вариант сочетанной лучевой терапии на адъювантном этапе, но данные этого исследования демонстрируют целесообразность сочетания локального облучения и лекарственной терапии для улучшения отдаленных результатов.
Источники указаны на сайте:
https://www.rosoncoweb.ru/news/
oncology/2021/09/06-1/
ESTRO 2021: ЧУТЬ БОЛЬШЕ, ЧЕМ ПРОСТО ЛУЧЕВАЯ ТЕРАПИЯ
Автор: Гордон Константин Борисович
ФГБУ «НМИЦ радиологии» Минздрава России, Обнинск
Абскопальный эффект. Как заставить иммунитет работать против опухоли?
Абскопальный эффект и анализ факторов, оказывающих влияние на его развитие, вызывает все больший интерес у исследователей, что отражается в количестве посвященных этому работ. На ESTRO 2021 данной проблематике была посвящена целая секция. Американские ученые рассказали о роли каспаз в механизме абскопального эффекта. Было показано, что эти белки не оказывают влияния на саму клеточную смерть, а ускоряют непосредственный распад клеток. Быстрая дегенерация погибающих клеток не позволяет им продуцировать интерферон-1 на протяжении большего количества времени, что угнетает Т-клеточный иммунитет и, как следствие, снижает частоту развития абскопального эффекта [1]. В другой работе были проанализированы режимы облучения и дозы, которые позволяли максимально потенцировать развитие эффекта. Схема в 3 фракции по 8 Гр в сочетании с иммунотерапией ингибиторами контрольных точек показала наилучшие результаты в сравнении с комбинацией такой же терапии и единовременными большими дозами облучения, и стандартными режимами фракционирования. Крупные разовые дозы подавляют выработку интерферонов и антител к двухцепочечной ДНК, что влияет на иммунный ответ и чувствительность к радиотерапии. Применение колониестимулирующих факторов увеличивает шанс развития абскопального эффекта. Также было отмечено, что при опухолях молочной и предстательной желез эффект от комбинации иммуно- и радиотерапии минимален из-за низкого уровня Т-лимфоцитов и большого количества миелоцитарных клеток [2]. Уменьшение количества миелоидных клеток за счет их прямого угнетения или перепрограммирования их работы позволят побороть радиорезистентность опухолей за счет иммунного ответа, как полагают ученые из Университета Манчестера [3]. Сочетание иммунотерапии и радиотерапии у пациентов с генерализованными формами заболеваний может позволить потенцировать абскопальный эффект, что позволит улучшить выживаемость. Следующими направлениями в изучении абскопального эффекта станут объемы облучения и необходимость максимального исключения путей лимфооттока из полей облучения.
Персонализированные подходы к лечению злокачественных опухолей (категория Proffered papers)
Вопросы прогнозирования радиочувствительности опухолей за счет поиска определенных биомаркеров обсуждались в одной из секций, озвученных на ESTRO 2021. Голландскими авторами из университета Radboud UMC было показано, что присутствие в ДНК клеток рака молочной железы гена АРОВЕС3В (A3B) потенцирует ДНК поврежденных клеток к гомологичной рекомбинации, что улучшает их способность к репарации и, как следствие, повышает радиорезистентность при высокой экспрессии данного гена. В опухолях, где гомологичная рекомбинация дефективна (BRCA1/2), A3B ген усиливает радиочувствительность опухолей [4]. Высокое содержание цируллина, орнитина, фенилаланина и ряда карнитинов связано с более частым развитием полного ответа на предоперационное лечение рака прямой кишки [5]. Низкое содержание гена miR-200a/b/-429 в клетках рака шейки матки увеличивало риск развития центрального рецидива, а его гиперэкспрессия наоборот повышала радиочувствительность опухолевых клеток, как выяснили норвежские авторы [6]. Такие же результаты были отмечены при изучении ряда генетических мутаций в клетках злокачественных глиом. Было показано, что наличие гена XRCC3 rs1799794 значительно увеличивало как общую, так и безрецидивную выживаемость [7]. Все эти и многие другие подобные исследования направлены на развитие персонализированного подхода к каждому пациенту и определению индивидуальных показаний к тем или иным видам лечения.
FLASH-терапия – следующий этап в лучевой терапии онкологических пациентов
Применение больших доз облучения за очень маленький промежуток времени вызывает большие дискуссии в научном мире, без сессии, посвященной этой теме, не обходится ни одно научное мероприятие. Для сравнения: технология FLASH-терапии позволяет подвести дозу в 40 Гр за секунду, тогда как при конвенциональном облучении ткани получают 0,03 Гр в секунду. Данные первых доклинических и клинических испытаний по FLASH-терапии (Швейцария) показывают хорошую переносимость лечения и обнадеживающие результаты, однако не стоит ожидать очень быстрого клинического распространения данной методики. Основные препятствия на пути внедрения метода в практику – это потребность в крайне точных дозиметрах, отсутствие протоколов приема и работы с настолько сложным оборудованием, особенно в плане безопасности для пациента. На настоящий момент все работы, опубликованные по FLASHтерапии, выполнялись с помощью пучка электронов, что ограничивает возможности ее применения [8], но определенные надежды возлагаются на протоны. Разработка данного метода может стать переломным моментом в радиотерапии, но это потребует определенного количества времени, сил и денег, чтобы довести до ума не только техническую часть, но и разработать абсолютно новые стандарты лечения для такой многообещающей методики.
Ссылки:
1. Galluzzi L, et al. Apoptotic caspases – Key regulators of the interaction between radiotherapy and anticancer immunity. ESTRO 2021 Abstract Book, SP-0130.
2. Rodriguez-Ruiz M, et al. Molecular triggers of the abscopal effect by radiotherapy, ESTRO Abstract Book, SP-0131.
3. Illidge T, et al. Manipulating the immune contexture to improve radiotherapy responses. ESTRO 2021 Abstract Book.
4. Span P, et al. Co-occurrence of APOBEC3B and Homologous Recombination Deficiency is Rare in Breast Cancer. ESTRO 2021 Abstract Book.
5. Rosa C, et al. Metabolomics as predictor of treatment response in neoadjuvant chemoradiation for rectal cancer. ESTRO 2021 Abstract Book.
6. Nilsen A, et al. MiR-200 family members as predictive biomarkers for radioresistance in cervical cancer. ESTRO 2021 Abstract Book.
7. Gonneli A. Role of single nucleotide polymorphisms (SNPs) in high-grade gliomas treated with concomitant RTCT. ESTRO 2021 Abstract Book.
8. Moeckli R, et al. FLASH
radiotherapy. ESTRO 2021 Abstract
Book, SP-0719.
ESTRO 2021: РАК МОЛОЧНОЙ ЖЕЛЕЗЫ
Автор: Иванов Валерий Анатольевич
Онкорадиологический центр «ПЭТ-Технолоджи Подольск», Подольск
В рамках докладов по поводу лечения рака молочной железы на конгрессе ESTRO 2021 красной нитью проходила идея о повышении уровня качества жизни пациентов. Учитывая современные успехи в лечении данной нозологии, пациенты могут рассчитывать на 10-летнюю выживаемость в 70% случаев, что не позволяет игнорировать необходимость снижения частоты побочных явлений применяемых методов лечения. Экспертами единогласно высказывалось мнение о необходимости использования опросников о качестве жизни для самоанкетирования пациентов как в рамках клинических исследований, так и в повседневной клинической практики для индивидуализации лечения. Отсутствие доказанного влияния лучевой терапии на общую выживаемость обоснованно вызывает вопросы о возможности сокращения показаний к применению данного метода или к применению ультрагипофракционированных режимов лучевой терапии. В частности, в рамках дискуссии прошло обсуждение о необходимости сокращения количества фракций лучевой терапии до 5 после органосохраняющих операций. Поводом для данного вопроса явились результаты исследования FAST-Forward [1], в котором сравнивалась эффективность применения гипофракционированных режимов облучения длительностью в 3 или 1 неделю. На основании исследования клинических случаев 4096 рандомизированных пациентов не было получено достоверной разницы в показателях безрецидивной выживаемости между группами, равно как и по показателям переносимости лечения. Отдельным веским аргументом за переход на однонедельный режим облучения явилась потенциальная выгода для экономики Великобритании в возможности сохранить до 40 млн. фунтов в год при переходе на данный режим. Brigitte Offersen, высказывавшая мнение против данного подхода, аргументировала это тем, что на основании одного многоцентрового рандомизированного исследования не должны меняться рекомендации по лечению онкологического заболевания. У экспертов также были разные мнения насчет радиобиологического эффекта ультрагипофракционирования. Суммируя дискуссию совместно с экспертами и результаты голосования, большинство пришло к выводу, что переход на ультрагипофракционирование – это будущее в радиотерапии, а результаты исследования FAST-Forward являются первой ступенью на этом пути. Отдельно была обсуждена тема индивидуализации подхода к подмышечным лимфатическим узлам после системной терапии. Учитывая возросшую (по данным научной литературы) частоту полных морфологических ответов (ypN0) до 70%, возникла необходимость обдумать деэскалацию подходов воздействия на подмышечные лимфатические узлы, а именно оценить возможность отказа от лимфодиссекции и проведения лучевой терапии на данную область. На основании трех рандомизированных исследований Anna Kirby из Royal Marsden Hospital приходит к выводу, что при соблюдении адекватных методов диагностики вовлеченности лимфатических узлов (при исследовании 2-3 сторожевых лимфатических узлов) и отсутствии данных о первоначальном вовлечении (cN0) тактика отказа от подмышечной лимфодиссекции выглядит рациональной. На основании данных исследования RAPCHEM [2] голландские авторы предполагают сохранение низкого уровня риска местного рецидива при отказе от выполнения лучевой терапии на область подмышечных лимфатических узлов у пациенток после неоадъювантной ПХТ и операции на основании ypN статуса. В исследование было включено 848 пациенток с изначальной клинической стадией cT1-2N1M0, распределенных на 3 группы: низкого риска (ypN0), промежуточного риска (ypN1) и высокого риска (ypN2). Рецидивы возникли у 5,1% больных, при этом в группах низкого и промежуточного риска изменение объемов облучения в большую или меньшую стороны от протокола не приводило к изменению риска рецидивов. Только в группе высокого риска сокращение объемов облучения ассоциировано с более высоким риском рецидива. Тем не менее, сообщение завершается выводом о необходимости проведения рандомизированных исследований и ожидания результатов заявленных научных изысканий (NSABP B-51 [3], ANTEC study). Развивая тему сокращения сроков лечения, в одном из сообщений были доложены 5-летние результаты британского исследования IMPORT HIGH [4], заключавшегося в сравнении эффективности и безопасности проведения последовательного и двух вариантов симультантных интегрированных бустов (40 Гр + 16 Гр и 40,05 Гр с симультанными бустами до 48 и 53 Гр соответственно). Оценены результаты лечения 2617 пациенток с высоким риском рецидива после органосохраняющих операций (pT1- 3N0-3aM0) за средний период наблюдения 74 месяца. Авторам удалось подтвердить нон-инфериорити гипотезу, согласно которой проведение симультантного интегрированного буста не увеличивает частоту нежелательных явлений по сравнению с проведением последовательного буста. Учитывая отсутствие достоверной разницы в показателях частоты местных рецидивов, исследователи пришли к выводу, что использование симультантного интегрированного буста является безопасной и эффективной альтернативой последовательному, а дальнейшее повышение дозы интегрированного буста является нецелесообразным. Косметический эффект после комплексного лечения – это немаловажный фактор качества жизни пациенток. Исторически проведение лучевого лечения после реконструктивных операций было ассоциировано с неудовлетворительными косметическими результатами (дополнительные пластические хирургические вмешательства требовались до 50% пациенток для достижения приемлемого косметического эффекта), что и по сей день приводит к негативному отношению к сочетанию реконструктивных этапов хирургических вмешательств с лучевой терапией. Однако в связи с развитием как хирургических методик реконструктивных этапов операций, так и методологии проведения лучевой терапии данная парадигма значительно изменилась. По словам экспертов, основная задача лучевого терапевта, преследующего цель сохранить приемлемые косметические результаты лечения с адекватно проведенной адъювантной лучевой терапией, – всесторонняя оценка клинического случая перед началом лечения: необходимо проводить оценку риска осложнений лучевой терапии после реконструктивных этапов хирургических вмешательств по поводу рака молочной железы перед операцией и модернизировать возможные риски (к примеру, исключить курение пациентов, достоверно вызывающее снижение косметических результатов лечения). Рассматривая вопрос очередности проведения лучевой терапии и реконструктивных этапов, Orit Kaidar-Person из Израиля на основании данных многих исследований, в частности, Momoh и соавт. [5], делает вывод о том, что частота осложнений идентична при применении любой из последовательностей. Немаловажной темой, затронутой на конгрессе, была возможность отказа от гормонотерапии у пациентов старшего возраста и/или с выраженными сопутствующими заболеваниями. Учитывая высокий риск побочных явлений гормонотерапии у упомянутой группы больных, в рамках доклада Elzbieta Nowicka из польского института Марии Склодовской-Кюри рассматривался потенциальный отказ от данного метода лечения. На основании результатов исследования BASO II trial [6] было установлено, что снижение риска местного рецидива после хирургического лечения достигало 0,37 (ДИ 0,22-0,61; p<0,001) в группе пациенток, которым проводилась лучевая терапия, и 0,33 (ДИ 0,15- 0,7; p<0,004) в группе пациенток, получавших гормонотерапию в монорежиме. На основании актуариального анализа ежегодный риск развития местного рецидива после хирургического лечения составлял 1,9% против 0,7% при применении радиотерапии и 0,8% при использовании адъювантной гормонотерапии тамоксифеном. Учитывая равнозначные низкие показатели риска при применении отдельно радиотерапии и гормонотерапии, докладчик приходит к выводу, что отказ от гормонотерапии у ограниченной группы пациенток будет более выгодным клиническим решением, учитывая потенциальные побочные действия от применения Начало на стр.7 тамоксифена. Данный подход косвенно подтвердился в исследовании Matthew C Ward и соавт. [7], в рамках которого было проведено микромоделирование рисков прогрессирования заболевания у пациенток старше 70 лет с низким риском заболевания, которым (в рамках модели) проводили адъювантную терапию ингибиторами ароматазы или лучевую терапию. Не выявив достоверной разницы в показателях общей и безрецидивной выживаемости, авторы работы делают аналогичный докладчику вывод: у популяции женщин старшего возраста отказ от гормонотерапии не компрометирует онкологические результаты лечения. Таким образом, обобщая доклады конгресса, можно отметить тренд на сокращение объемов комплексного лечения и отдельных его этапов. Несмотря на отсутствие метаанализов, многие учреждения уже применяют данный подход в ежедневной практике, и, судя по всему, изменение клинических рекомендаций – это лишь дело времени, а именно публикации результатов проводимых в настоящее время рандомизированных исследований.
Ссылки:
1. Murray Brunt A, Haviland JS, Wheatley DA, et al. Hypofractionated breast radiotherapy for 1 week versus 3 weeks (FAST-Forward): 5-year efficacy and late normal tissue effects results from a multicentre, noninferiority, randomised, phase 3 trial. Lancet. 2020; 395(10237): 1613-1626.
2. de Wild S, et al. De-escalation of radiation therapy after primary chemotherapy ib cT1-2N1 breast cancer. ESTRO 2021 Abstract Book, OC-0067.
3. Mamounas EP, Bandos H, White JR, et al. NRG Oncology/NSABP B-51/RTOG 1304: Phase III trial to determine if chest wall and regional nodal radiotherapy (CWRNRT) post mastectomy (Mx) or the addition of RNRT to whole breast RT post breastconserving surgery (BCS) reduces invasive breast cancer recurrence-free interval (IBCR-FI) in patients (pts) with pathologically positive axillary (PPAx) nodes who are ypN0 after neoadjuvant chemotherapy (NC). Journal of Clinical Oncology. 2019; 37(15_suppl): TPS600-TPS600.
4. Coles C, et al. IMPORT HIGH trial: Dose escalated simultaneous integrated boost radiotherapy in early breast cancer. ESTRO 2021 Abstract Book, OC-0291.
5. Momoh AO, Ahmed R, Kelley BP, et al. A systematic review of complications of implant-based breast reconstruction with prereconstruction and postreconstruction radiotherapy. Ann Surg Oncol. 2014; 21(1): 118-124.
6. Blamey RW, Bates T, Chetty U, et al. Radiotherapy or tamoxifen after conserving surgery for breast cancers of excellent prognosis: British Association of Surgical Oncology (BASO) II trial. Eur J Cancer. 2013; 49(10): 2294-2302.
7. Ward MC, Vicini F, Chadha M,
et al. Radiation Therapy Without
Hormone Therapy for Women Age 70
or Above with Low-Risk Early Breast
Cancer: A Microsimulation. Int J
Radiat Oncol Biol Phys. 2019; 105(2):
296-306.
ESTRO 2021: ЛУЧЕВАЯ ТЕРАПИЯ РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
Автор: Усычкин Сергей Владимирович
Hadassah Medical Moscow, Москва
В этом году на ESTRO 2021, который проходил в Мадриде, было представлено большое количество докладов по лучевой терапии рака предстательной железы, в том числе результаты нескольких давно ожидаемых клинических исследований. Alan Pollack продемонстрировал окончательные результаты исследования RTOG 0534/SPORRT по сальважной лучевой терапии при раке простаты. Было проведено сравнение результатов лечения с применением 3 схем: облучение только ложа предстательной железы до 64,8-70,2 Гр (PBRT), облучение ложа вместе с АДТ в течение 4-6 мес. (PBRT + STAD) и облучение ложа вместе с АДТ и облучением регионарных лимфоузлов таза до 45 Гр (PBRT + STAD + PLNRT). При сравнении 3 групп обнаружено, что в 3 группе комбинация всех 3 модальностей по сравнению с облучением только ложа предстательной железы приводит к статистически достоверному улучшению выживаемости без прогрессирования (87% против 71%, p<0,001, см. рисунок),
Рисунок
Выживаемость без прогрессирования для всех
пациентов (n=1792) в зависимости от схемы лечения.
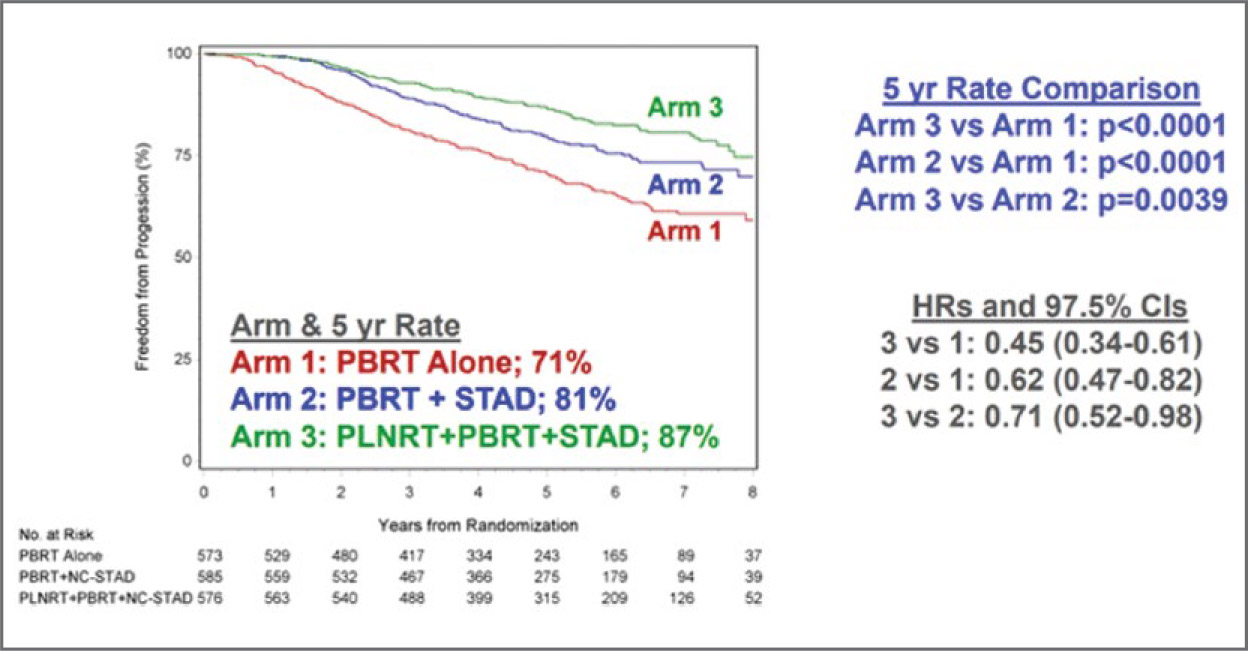
при этом наилучшие показатели
зафиксированы в группе с ПСА
>0,35 нг/мл до ЛТ. Также в группе PBRT + STAD + PLNRT гораздо
реже у пациентов требовалась повторная сальважная АДТ (8% против 23%). Развитие отдаленных метастазов также реже отмечалось в
группе PBRT + STAD + PLNRT по
сравнению с PBRT: 4,6% против
8,7% (p<0,001). Количество летальных исходов, связанных с раком
предстательной железы, также
было ниже в группе PBRT + STAD +
PLNRT по сравнению с PBRT: 0,7%
против 3,0% (p<0,012), при этом не
выявлено статистически достоверных различий в общей выживаемости пациентов. Таким образом, при
сальважной лучевой терапии рака
предстательной железы есть показания к облучению не только ложа
предстательной железы, но и регионарных лимфоузлов, в первую
очередь у пациентов с ПСА >0,35
нг/мл до начала лучевой терапии.
Также были представлены данные
исследования SPORT (Stereotactic
PrOstate RadioTherapy) у 30 пациентов с неблагоприятным промежуточным и высоким риском локализованного рака предстательной
железы, которые были рандомизированы в группу, где проводилась стереотаксическая аблативная
радиотерапия только на предстательную железу с основанием семенных пузырьков (СОД 36,25 Гр
с синхронным интегрированным
бустом на CTV до 40 Гр и до 45-50
Гр на определяемые по МРТ опухолевые очаги в предстательной
железе), и в группу, где пациенты
помимо стереотаксического облучения предстательной железы
также получали профилактическое
облучение регионарных лимфоузлов до 25 Гр за 5 сеансов. У всех
пациентов перед разметкой были
имплантированы спейсеры и золотые маркеры. Сравнение в этих
группах неожиданно показало, что
профилактическое облучение регионарных лимфоузлов таза достоверно увеличивало частоту острых
и поздних осложнений Grade 2 и
выше со стороны мочеполовой системы, но не со стороны кишечника [2].
Представлены данные рандомизированных исследований FLAME/
hypoFLAME [3]. В этих проспективных исследованиях II фазы был
изучен синхронно-интегрированный буст на «доминантный интрапростатический очаг» (DIL, GTV)
до СОД 90 Гр в режиме классического фракционирования (FLAME
trial) или в режиме экстремального
гипофракционирования до СОД 50
Гр за 5 сеансов (hypoFLAME trial). В
обоих случаях СИБ сравнивался со
стандартным «гомогенным» облучением всей предстательной железы. Лечение переносилось довольно неплохо: острые осложнения
со стороны мочеполовой системы
Grade 2 отмечались примерно у
30% пациентов (при этом ни одного случая токсичности Grade 3) и
очень редко – со стороны прямой
кишки (5% Grade 2, GI toxicity). В
исследовании FLAME добавление
синхронно-интегрированного буста на GTV привело к улучшению
5-летних показателей биохимического контроля заболевания: 92%
против 85%. При этом в исследовании FLAME не было выявлено
различий в острой и поздней токсичности между сравниваемыми
группами. Также было продемонстрировано, что между дозой на
уретру и мочевой пузырь и частотой острых и поздних осложнений
есть зависимость, что подтверждает необходимость контролировать дозу на интрапростатическую
часть уретры при планировании
СИБ на опухоль внутри предстательной железы.
В лекции Michael Zelefsky, посвященной поиску оптимальной
аблативной дозы при стереотаксической радиотерапии локализованного рака предстательной железы
промежуточной неблагоприятной
группы риска, были представлены
результаты проспективного исследования ступенчатой эскалации
дозы от 32,5 Гр за 5 сеансов до 40
Гр за 5 сеансов, где было продемонстрировано, что увеличение суммарной дозы ведет к достоверному
снижению процента обнаруживаемых жизнеспособных опухолевых
клеток через 2 года при повторной
биопсии (% of positive 2-year biopsy)
с 38% до 11%. Снижение частоты
«позитивных» биопсий коррелировало со снижением вероятности
биохимического рецидива (57%
против 7%). При этом именно суммарная доза (<40 Гр против 40+ Гр
за 5 сеансов) была наиболее значимым предиктивным фактором в
отношении вероятности «позитивной биопсии» через 2 года после
SBRT (OR 2,76; p<0,008).
Данные этих исследований и немалое количество других работ по
лучевой терапии рака простаты,
представленных на ESTRO 2021,
еще раз демонстрируют, что требования к качеству проведения
облучения при увеличении интенсивности курса (с применением
гипофракционирования, ультрагипофракционирования, SBRT)
значительно возросли, а подходы
к лечению пациентов с раком простаты требуют тщательного рассмотрения в мультидисциплинарной команде.
Ссылки:
1. Pollack A, et al. Short Term
Androgen Deprivation Therapy
Without or With Pelvic Lymph Node
Treatment Added to Prostate Bed
Only Salvage Radiation Therapy: The
NRG Oncology/RTOG 0534 SPPORT
Trial. ESTRO 2021.
2. Fairmichael C, et al. SABR ±
pelvic nodal irradiation for higher
risk prostate cancer. A randomized
feasibility study. ESTRO 2021 Abstract
Book, OC-0510.
3. Van der Heide U. Focal boosting
in prostate cancer: the FLAME/
hypoFLAME experience. ESTRO 2021
Abstract Book, SP-0714.
НИВОЛУМАБ В ПЕРВОЙ ЛИНИИ ТЕРАПИИ МЕТАСТАТИЧЕСКОГО РАКА ЖЕЛУДКА: РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ НАЧИНАЮТ РЕАЛИЗОВЫВАТЬСЯ НА ПРАКТИКЕ
Авторы: Казанцева Мария Александровна
Hadassah Medical Moscow, Сколково
Вилков Сергей Анатольевич
Hadassah Medical Moscow, Сколково
Тимофеев Илья Валерьевич
Hadassah Medical Moscow, Сколково
Рак желудка занимает 6 место по заболеваемости и второе место по уровню
смертности во всем мире, при этом
лекарственная терапия рака желудка
является актуальной проблемой современной онкологии [1]. До недавнего времени химиотерапия являлась
основным методом системной терапии больных метастатическим раком
желудка, медиана общей выживаемости (ОВ) составляла менее 1 года
[2]. За последние несколько лет был
достигнут значимый успех применения иммунотерапии в лечении солидных опухолей, включая рак желудка.
Проведенные к настоящему времени
рандомизированные исследования
и исследования в реальной практике
показали целесообразность назначения иммунотерапии ниволумабом
в поздних линиях лечения распространенного рака желудка [3,4], что
послужило основанием для изучения
ингибиторов контрольных точек иммунного ответа в качестве первой линии терапии.
Так, в многоцентровом рандомизированном клиническом исследовании 3 фазы CHECKMATE-649
(NCT02872116) была оценена эффективность и переносимость ниволумаба в комбинации со стандартной химиотерапией в качестве первой линии
терапии распространенного рака желудка [5]. В исследование был включен
1581 пациент, ранее не получавший
терапию по поводу распространенного или метастатического рака желудка, желудочно-пищеводного перехода
или аденокарциномы пищевода.
Пациенты случайным образом были
рандомизированы в соотношении 1:1
в группу ниволумаба в комбинации
с химиотерапией (ниволумаб в дозе
360 мг с CapeOX каждые 3 недели или
ниволумаб в дозе 240 мг с FOLFOX
каждые 2 недели, n=789) или в группу только химиотерапии (режимы
CapeOX или FOLFOX, n=792).
Первичными конечными точками
исследования были общая выживаемость (ОВ) и выживаемость без прогрессирования (ВБП) у пациентов
с PD-L1 CPS ≥5, в то время как вторичной конечной точкой была ОВ у
всех рандомизированных пациентов.
Шестьдесят процентов больных имели PD-L1 CPS ≥5.
Медиана ОВ в группе пациентов, получавших ниволумаб в комбинации
с химиотерапией, составляла 14,4
месяца у пациентов с PD-L1 CPS ≥5
в сравнении с 11,1 месяца в группе,
получавшей только химиотерапию
(отношение рисков (ОР) 0,71; 95% ДИ
0,61-0,83; P<0,0001). Кроме того, статистически значимое улучшение ОВ
было также продемонстрировано для
всех рандомизированных пациентов
(n=1581) независимо от уровня CPS.
Так, медиана общей выживаемости в
группе пациентов, получавших иммунотерапию в комбинации с химиотерапией, по сравнению с группой
только химиотерапии составила 13,8
месяца (95% ДИ 12,6-14,6) и 11,6 месяца (95% ДИ 10,9-12,5) соответственно
(ОР=0,80; 95% ДИ 0,71-0,9; P=0,0002).
Медиана ВБП составила 7,7 месяца
(95% ДИ 7,0-9,2) в группе ниволумаба
и химиотерапии по сравнению с 6,0
месяца (95% ДИ 5,6-6,9) в группе только химиотерапии (ОР=0,68; 95% ДИ
0,58-0,79; p<0,0001).
Таким образом, назначение ниволумаба в комбинации с химиотерапией
у пациентов с ранее нелеченым распространенным или метастатическим
раком желудка, раком желудочно-пищеводного перехода или аденокарциномой пищевода в первой линии позволило снизить риск смерти на 29% у
пациентов с экспрессией PD-L1 (CPS)
≥5 . Более того, ниволумаб в комбинации с химиотерапией также приводил
к снижению риска прогрессирования
заболевания или смерти на 32% по
сравнению с одной химиотерапией
(HR 0,68; 95% ДИ 0,56-0,81; P<0,0001).
Наиболее частыми нежелательными
явлениями (частота ≥20%), наблюдаемыми у пациентов, получавших
ниволумаб в сочетании с фторпиримидин- и платиносодержащей химиотерапией, были периферическая
нейропатия, тошнота, усталость, диарея, рвота, снижение аппетита, боли
в животе, запоры и боли в опорнодвигательном аппарате. Терапия ниволумабом также может сопровождаться иммуноопосредованными
нежелательными явлениями, такими
как пневмонит, колит и гепатит, а также эндокринопатии и нефрит.
Основываясь на результатах исследования CHECKMATE-649, в апреле
2021 года FDA одобрило ниволумаб в
комбинации с фторпиримидин- и платиносодержащей химиотерапией в качестве первой линии терапии распространенного или метастатического
рака желудка, рака желудочно-пищеводного перехода и аденокарциномы
пищевода [4].
Рекомендуемые режимы лечения и
дозы ниволумаба: 360 мг каждые 3 недели в сочетании с химиотерапией, содержащей фторпиримидин и платину,
каждые 3 недели; 240 мг каждые 2 недели в сочетании с химиотерапией, содержащей фторпиримидин и платину,
каждые 2 недели.
Результаты исследования суммированы в таблице.
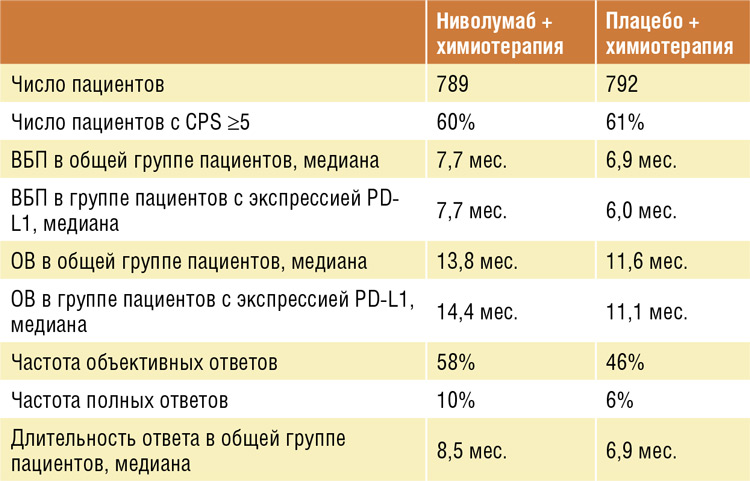
На основании этих результатов в Институте онкологии Хадасса Москва было принято решение об использовании в первой линии терапии метастатического HER2-негативного рака желудка иммунотерапии в комбинации с химиотерапией.
Клинический случай
Пациентка Б, 31 год. С апреля 2020 года больную периодически беспокоили спастические боли в животе, вздутие. Пациентке проводилась симптоматическая терапия без эффекта. В связи с карантином по поводу COVID-19 дополнительное обследование выполнено не было. В марте 2021 г. отмечено появление тошноты, рвоты съеденной пищей, по поводу чего больная госпитализирована в стационар с клиникой кишечной непроходимости. При дообследовании было выявлено образование в антральном отделе желудка с инвазией в печеночный изгиб ободочной кишки, анемия II ст. (HB 88 г/л). 13 марта 2021 было выполнено экстренное хирургическое лечение в объеме субтотальная дистальная резекция желудка, правосторонняя мезоколэктомия, лимфаденэктомия D3.
Рисунок
КТ исследование до начала лечения ниволумабом
и химиотерапией и через 4 месяца.
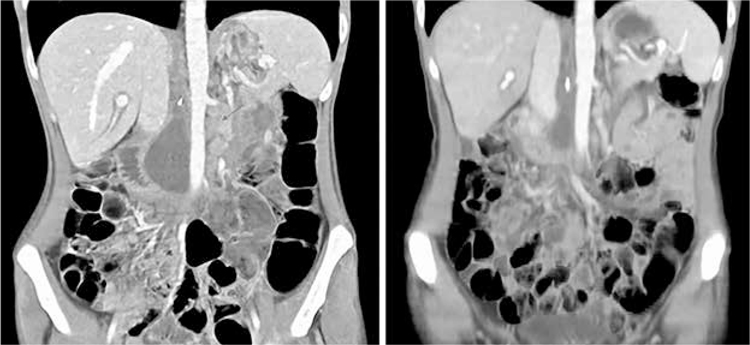
Гистологическое заключение: низкодифференцированная аденокарцинома привратника желудка, с диффузным характером роста, изъязвлением, отрицательный. Таким образом, по результатам дообследования больной был установлен диагноз – рак желудка pT4bpN3bM1 с множественными метастазами в региональные и отдаленные лимфатические узлы. По данным КТ органов грудной клетки, брюшной полости, малого таза (до начала химиотерапии): на уровне всей брюшины аорты парааортально, прекавально, аортокавально – конгломерат увеличенных лимфатических узлов. Прекавально – аваскулярное жидкостное образование, размерами до 40×28 мм. Аналогичное образование размерами до 25×25 мм выявлено в области серповидной связки печени. На уровне почечной артерий справа – шовный материал, сама почечная артерия не визуализируется. При контрастировании в правой почке множественные гиподенсивные аваскулярные участки плотностью вплоть до жидкостной. На уровне и кпереди верхней 1/3 левого мочеточника прослеживается поперечно направленная ветвь маточной вены с признаками супрастенотического расширения ЧЛС (чашечки – 9-10 мм, лоханка – 23 мм). Петли кишечника диффузно с горизонтальным уровнем содержимого – признаки пареза. В полости малого таза, межпетельно – минимальный выпот. Размеры печени увеличены до 207×100×134 мм. Селезенка увеличена до 100×53×73 мм. Матка смещена влево, при контрастировании определяются извитые сосуды маточного сплетения. С апреля 2021 года начата химиотерапия в режиме FOLFOX (оксалиплатин 85 мг/м2 в/в + кальций фолианата 400 мг/м2 в/в + 5 – ФУ 400 мг/м2 в/в стр. + 2400 мг/м2 в/в 46-48 ч, цикл 14 дней). Принимая во внимание результаты рандомизированного клинического исследования 3 фазы CHECKMATE-649, возраст и состояние пациентки, начата иммунотерапия ниволумабом 240 мг внутривенно капельно каждые 14 дней в комбинации с химиотерапией в режиме FOLFOX. Нежелательные явления включали гиперкоагуляцию, анемию 1 ст. (по СТСАЕ v.5), лейкопению 1 ст., нейтропению 1-2 ст., тошноту 2 ст. По данным контрольного обследования ПЭТ-КТ в августе 2021 года (после 7 циклов химиотерапии и иммунотерапии) – ПЭТ/КТ данных о наличии очагов/ткани с патологическим метаболизмом 18F-ФДГ, характерной для опухолевого процесса, не получено. При оценке безопасности совместного применения иммунотерапии и химиотерапии увеличения степени ранее выявленных и появления новых нежелательных явлений отмечено не было. Таким образом, назначение ниволумаба в комбинации с химиотерапией у пациентов с ранее нелеченым распространенным или метастатическим раком желудка в первой линии терапии открывает новые возможности лечения, позволяет добиться ответа на терапию, снизить риск смерти и прогрессирования заболевания по сравнению с только химиотерапией, которая была стандартом на протяжении десятилетий. Конфликт интересов Авторы не имеют конфликта интересов, не получали вознаграждений за подготовку данной статьи. Назначение ниволумаба по незарегистрированному показанию проводилось в рамках федерального закона №160.
Источники:
1. Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021 May; 71(3): 209-249.
2. Ilson DH. Advances in the treatment of gastric cancer: 2020-2021. Curr Opin Gastroenterol. 2021 Aug 26. doi: 10.1097/ MOG.0000000000000776. Epub ahead of print. PMID: 34456227.
3. Boku N, Satoh T, Ryu MH, et al. Nivolumab in previously treated advanced gastric cancer (ATTRACTION-2): 3-year update and outcome of treatment beyond progression with nivolumab. Gastric Cancer. 2021 Jul; 24(4): 946-958. doi: 10.1007/s10120-021-01173-w. 4. Takahashi Y, Sunakawa Y, Inoue E, et al. Real-world effectiveness of nivolumab in advanced gastric cancer: the DELIVER trial (JACCRO GC-08). Gastric Cancer. 2021 Aug 24.
5. Janjigian YY, Shitara K, Moehler M, et
al. First-line nivolumab plus chemotherapy
versus chemotherapy alone for advanced
gastric, gastro-oesophageal junction, and
oesophageal adenocarcinoma (CheckMate
649): a randomised, open-label, phase 3
trial. Lancet. 2021 Jul 3; 398(10294): 27-40.
ЗАМЕНИТ ЛИ СТЕРЕОТАКСИЧЕСКАЯ АБЛАТИВНАЯ ЛУЧЕВАЯ ТЕРАПИЯ (SABR) БРАХИТЕРАПИЮ В ЛЕЧЕНИИ РАКА ПРОСТАТЫ?
Автор: Митин Тимур
Университет Здоровья и Науки Орегона, Портленд, США
Ответ – да, причем этот вариант будет одобрен многими системами здравоохранения. Одни изменения в клинических парадигмах требуют проведения крупных рандомизированных исследований, другие продвигаются благодаря цене и удобству. Если какое-то лечение более ценозатратно и/или менее удобно, то необходимо надежное обоснование его клинических преимуществ для продолжения его применения. Брахитерапия была весьма популярным методом лечения больных с локализованным раком простаты, которые не соглашались на радикальную простатэктомию – популярным особенно по той причине, что альтернативный метод в виде традиционно фракционированной дистанционной лучевой терапии требовал не менее 8-9 недель для лечения. Брахитерапия простаты, кроме того, значительно дешевле курса дистанционного облучения, и это также позволяло представить метод оптимальной опцией в рамках систем здравоохранения, стремящихся пролечить большее число больных за меньшие деньги. За последние 20 лет дистанционная лучевая терапия в лечении рака простаты вышла на лидирующие позиции. В 2012 году Arcangeli et al. впервые поставили перед научным сообществом вопрос «Заменит ли SBRT конвенциональное облучение в терапии больных раком простаты низкого и промежуточного риска?» и начали постепенно и осторожно продвигать метод, осознавая все возможные ограничения новой лечебной модальности [1]. В 2019 году в журнале The Lancet были опубликованы 5-летние результаты исследования 3 фазы HYPO-RT-PC, в котором 1200 больных раком простаты промежуточного (90%) и высокого (10%) риска из 12 центров Швеции и Дании были рандомизированы в группу конвенциональной дистанционной лучевой терапии в дозе 78 Гр за 39 фракций или группу гипофракционированного облучения – 42,7 Гр за 7 фракций через день [2]. Облучению подвергалась только предстательная железа, около 80% больных получали 3D-конформную лучевую терапию. Безрецидивная выживаемость за 5 лет составила 84% в обеих группах, продемонстрировав, таким образом, что короткий ультрагипофракционированный курс не хуже по отдаленным результатам. Ранние побочные эффекты (со стороны ЖКТ и мочеполовых органов) регистрировались чаще в группе 7 фракций ближе к концу курса, тогда как поздняя токсичность оказалась сопоставимой. Если наше определение SBRT основано больше на физических и радиобиологических аспектах, нежели на произвольной номенклатуре, тогда мы можем сделать вывод, что 7-фракционная SBRT – даже без модуляции интенсивности и ректальных спейсеров – не хуже, чем конвенциональная дистанционная лучевая терапия, но при этом более удобная и экономически выгодная. Брахитерапия простаты требует тщательного освоения и регулярной практики, чтобы врач мог добиться оптимальных результатов. На протяжении последнего десятилетия отмечено значительное снижение частоты применения брахитерапии, в том числе в академических центрах, призванных обучать новое поколение врачей. В период между 2004 и 2012 годами число центров, практикующих в среднем 1 и более сеансов брахитерапии в неделю, снизилось как среди академических центров (с 6,7% до 1,5%), так и в неакадемических учреждениях (с 4,5% до 2,7%) [3]. Среди резидентов 4 и 5 года по радиационной онкологии в 2018 году 97% чувствовали себя уверенными для проведения SBRT/ SRS и лишь 54% – для проведения брахитерапии [4]. Субоптимальное обучение методу приводит не только к недостатку уверенности, но и – что более важно – к неоптимальному проведению процедуры. Исследование CEASAR 2017 года проанализировало 878 планов облучения из 6 национальных регистров и обнаружило, что 73% больных получали дистанционную лучевую терапию, соответствующую параметрам качества, но среди планов брахитерапии лишь 60% имели подобное соответствие [5]. Общая стоимость того или иного метода лечения – это лишь часть финансового уравнения, которое либо поддерживает, либо отвергает жизнеспособность этой терапевтичеcкой модальности. Радиационные онкологи Университета Вирджинии подсчитали, что общая стоимость курса низкодозной брахитерапии составила $2719, а умеренно гипофракционированной брахитерапии (28 фракций с IMRT) – $4173. В то же время возврат суммы за низкодозную брахитерапию составил $3123, а за IMRT – $7862. Более того, радиационному онкологу и всей рабочей группе требуется больше времени для планирования LDR брахитерапии, нежели IMRT [6]. Откровенно говоря, в США клиническая практика, основанная на подсчете RVU (Relative Value Unite – единица относительной стоимости, учитывающая затратность различных аспектов, формирующих в итоге тот или иной лечебный план), не оставила никаких финансовых оснований для того, чтоб предлагать пациентам брахитерапию простаты. Вкупе с неоптимальным обучением методике, отсутствием уверенности врача и меньшим удобством (в сравнении с SBRT) только неопровержимые доказательства клинических преимуществ брахитерапии смогут продлить жизнь этой лечебной опции. Несмотря на ряд ограничений по своей сути, недавние ретроспективные исследования (см. табл.)
Таблица.
Данные ретроспективных исследований по сравнению эффективности SBRT
и брахитерапии.
не демонстрируют преимуществ брахитерапии над SBRT ни в качестве монотерапии, ни в качестве буста, как в радикальном, так и в сальважном лечении. Частота применения SBRT при раке простаты выросла с 0,1% в 2004 до 3% в 2010 и дo >7% в 2015 году [11]. С появлением результатов исследования HYPO-RT-PC можно ожидать, что она еще увеличится. За тот же период времени в США частота проведения брахитерапии больным раком предстательной железы уменьшилась с 17% в 2002 до 8,2% в 2010 году [12]. Американское общество брахитерапии запустило инициативу «300 за 10» с целью обучения 30 компетентных брахитерапевтов в год в течение следующих 10 лет. Однако эта инициатива сама по себе вряд ли способна изменить судьбу брахитерапии рака простаты в Штатах, только если проспективное рандомизированное клиническое исследование продемонстрирует ее явное преимущество по сравнению с SBRT или финансовая модель возврата средств существенно оживит ее. Те системы здравоохранения, в которых либо сам больной раком простаты платит за лечение из своего кармана, либо клиника заинтересована в более дешевой терапии больных, более низкая стоимость брахитерапии будет поддерживать жизнеспособность метода. В других случаях SBRT однозначно продолжит вытеснять брахитерапию предстательной железы.
Ссылки:
1. Arcangeli S, Scorsetti M, Alongi F. Will SBRT replace conventional radiotherapy in patients with lowintermediate risk prostate cancer? A review. Critical reviews in oncology/ hematology. 2012; 84(1): 101-8.
2. Widmark A, Gunnlaugsson A, Beckman L, ThellenbergKarlsson C, Hoyer M, Lagerlund M, et al. Ultra-hypofractionated versus conventionally fractionated radiotherapy for prostate cancer: 5-year outcomes of the HYPO-RT-PC randomised, non-inferiority, phase 3 trial. Lancet (London, England). 2019; 394(10196): 385-95.
3. Orio PF, 3rd, Nguyen PL, Buzurovic I, Cail DW, Chen YW. Prostate Brachytherapy Case Volumes by Academic and Nonacademic Practices: Implications for Future Residency Training. International journal of radiation oncology, biology, physics. 2016; 96(3): 624-8.
4. Marcrom SR, Kahn JM, Colbert LE, Freese CM, Doke KN, Yang JC, et al. Brachytherapy Training Survey of Radiation Oncology Residents. International journal of radiation oncology, biology, physics. 2019; 103(3): 557-60.
5. Lee DJ, Barocas DA, Zhao Z, Huang LC, Koyama T, Resnick MJ, et al. Contemporary prostate cancer radiation therapy in the United States: Patterns of care and compliance with quality measures. Practical radiation oncology. 2018; 8(5): 307-16.
6. Dutta SW, Bauer-Nilsen K, Sanders JC, Trifiletti DM, Libby B, Lash DH, et al. Time-driven activitybased cost comparison of prostate cancer brachytherapy and intensitymodulated radiation therapy. Brachytherapy. 2018; 17(3): 556-63.
7. Kishan AU, Wang PC, Upadhyaya SK, Hauswald H, Demanes DJ, Nickols NG, et al. SBRT and HDR brachytherapy produce lower PSA nadirs and different PSA decay patterns than conventionally fractionated IMRT in patients with low- or intermediate-risk prostate cancer. Practical radiation oncology. 2016; 6(4): 268-75.
8. Gonzalez-Motta A, Roach M. Stereotactic body radiotherapy (SBRT) versus high dose rate (HDR) brachytherapy (BT) boost for highrisk (HR) prostate cancer. 2018; 36(6_ suppl): 12.
9. Hegde JV, Collins SP, Fuller DB, King CR, Demanes DJ, Wang PC, et al. A Pooled Analysis of Biochemical Failure in Intermediate-risk Prostate Cancer Following Definitive Stereotactic Body Radiotherapy (SBRT) or HighDose-Rate Brachytherapy (HDR-B) Monotherapy. American journal of clinical oncology. 2018; 41(5): 502-7.
10.Mbeutcha A, Chauveinc L, Bondiau PY, Chand ME, Durand M, Chevallier D, et al. Salvage prostate re-irradiation using high-dose-rate brachytherapy or focal stereotactic body radiotherapy for local recurrence after definitive radiation therapy. Radiation oncology (London, England). 2017; 12(1): 49.
11.Mahase SS, D'Angelo D, Kang J, Hu JC, Barbieri CE, Nagar H. Trends in the Use of Stereotactic Body Radiotherapy for Treatment of Prostate Cancer in the United States. JAMA network open. 2020; 3(2): e1920471.
12.Martin JM, Handorf EA, Kutikov
A, Uzzo RG, Bekelman JE, Horwitz
EM, et al. The rise and fall of prostate
brachytherapy: use of brachytherapy
for the treatment of localized prostate
cancer in the National Cancer Data
Base. Cancer. 2014; 120(14): 2114-21.
ПОИСК НОВЫХ ПОДХОДОВ К ЛЕЧЕНИЮ РАКА ПИЩЕВОДА
Рак пищевода и гастроэзофагеального соединения – одна из наиболее коварных злокачественных опухолей, требующая мультимодального подхода для большинства пациентов, подлежащих радикальному лечению. Неоадъювантная химиолучевая терапия с последующей радикальной операцией является стандартом на протяжении десятилетия и даже более, но рецидивы и отдаленное метастазирование опухолей пищевода по-прежнему остаются огромной проблемой. Поиск оптимальных схем лечения продолжается постоянно, и в недавнем выпуске Journal of Clinical Oncology были опубликованы результаты двух рандомизированных клинических исследований, авторы которых предложили два варианта оптимизации. Голландские авторы исследования ARTDECO [1] пошли по логичному, но сложному и чаще всего неблагодарному для опухолей грудной клетки пути – эскалации дозы лучевой терапии. Немалое количество работ потерпело неудачу в попытке увеличить дозу лучевой терапии при облучении опухолей внутригрудных локализаций, но прогресс в технологиях лучевой терапии заставляет возвращаться к этой идее снова и снова. В исследование было включено 260 больных с нерезектабельным раком пищевода T2-4, N0-3, M0, которые получали радикальное химиолучевое лечение: лучевую терапию на первичную опухоль и региональные лимфоузлы на фоне химиотерапии (карбоплатин AUC2 + паклитаксел 50 мг/м2 1 раз в неделю на протяжении 6 недель). Пациенты были рандомизированы в 2 группы – низкодозной лучевой терапии (скорее, стандартной дозы – 50,4 Гр за 28 фракций по 1,8 Гр) и высокодозной (с эскалацией до 61,6 Гр). Набор больных продолжался с 2012 по 2018 годы, средний период наблюдения составил 50 месяцев. Большинство пациентов имели плоскоклеточный рак (61%), остальные – аденокарциному (31%). Девяносто четыре процента больных смогли получить предписанную дозу лучевой терапии полностью, но только 85% получили хотя бы 5 курсов ХТ. Полученные отдаленные результаты ненамного различались в группах, без достижения статистической значимости: 3-летняя выживаемость без локального прогрессирования составила 70% в группе стандартной дозы лучевой терапии против 73% в высокодозной, причем для аденокарцином и плоскоклеточных опухолей различия также были минимальны (75% против 79% для плоскоклеточного рака, 61% против 61% для аденокарцином). При этом отмечена тенденция к улучшению показателей безрецидивной выживаемости за 3 года при повышении дозы облучения (53% против 59%), но, увы, разница была статистически незначимая (P=0,08). Однако токсичность 5 степени (означающая гибель пациента от осложнений проводимого лечения) была практически вдвое выше в группе эскалации дозы: 10% против 5%. Дежавю: исследование 20-летней давности RTOG 94-05 уже предпринимало попытку эскалации дозы до 64 Гр, но было остановлено раньше времени после промежуточного анализа по причине отсутствия разницы в показателях выживаемости и более высокой смертности на фоне лечения [2]. Спустя 20 лет еще одни авторы сделали вывод, что и сейчас, в эру современных технологий лучевой терапии, эскалация дозы при раке пищевода выглядит нецелесообразной. Данные рандомизированного исследования 2 фазы CALGB 80803 (Alliance) впервые были представлены на конгрессе ASCO в 2018 году; сейчас авторы публикуют уже зрелые 5-летние результаты, вызвавшие немалый интерес ввиду вероятной перспективности подхода к лечению резектабельного рака пищевода [3]. Особенностью исследования является то, что авторы поставили задачу оценить эффективность выбранной схемы химиотерапии как компонента комплексного лечения с применением метода ПЭТ/КТ. Ранее вклад лекарственного компонента оценить было невозможно, так как на неоадъювантном этапе применялось одновременное химиолучевое лечение. Исследователи Alliance/CALGB 80803 постарались оценить роль метаболического ответа, определяемого по ПЭТ, для принятия решения о смене схемы для последующей одновременной химиолучевой терапии на неоадъювантном этапе с целью повышения частоты полных патоморфологических регрессий и улучшения отдаленных результатов. Двести сорок один пациент с раком пищевода, подходящий для тримодального лечения, после первоначальной ПЭТ/КТ были рандомизированы в 2 группы индукционной химиотерапии (FOLFOX в 1, 15 и 29 дни или карбоплатин/паклитаксел еженедельно 4 введения), после чего была проведена повторная ПЭТ/ КТ для оценки ответа на лечение (на 36-42 дни после начала терапии). Те больные, кто не ответил должным образом на индукционную терапию (метаболический ответ по ПЭТ составил менее 35% SUV от первоначального показателя), переходили на альтернативную схему химиотерапии совместно с лучевой терапией. Те, у кого уменьшение SUV составило 35% и более, продолжали лечение по прежней схеме на фоне облучения. Операция проводилась через 6 недель после окончания химиолучевой терапии. Среди тех пациентов, кто минимально ответил на индукцию и перешел на альтернативную схему, полный патоморфологический регресс составил 18% после смены FOLFOX на CP и 20% после СР – FOLFOX. Полный регресс у тех, кто ответил на индукцию, оказался намного выше после применения схемы FOLFOX (40,3%), чем после СР (14,1%). За средний период наблюдения в 5,2 года медиана общей выживаемости составила 48,8 месяца для ответивших на индукцию и 27,4 месяца для тех, кому пришлось менять схему. При этом схема FOLFOX в качестве индукции выглядела более предпочтительно: медиана выживаемости для тех, кто имел хороший метаболический ответ по ПЭТ, достигнута не была, а 5-летняя общая выживаемость достигла весьма привлекательных цифр в 53%. Данная схема является примером персонализированного подхода к лечению больных с одной из наиболее коварных опухолей – раком пищевода и гастроэзофагеального перехода, с индивидуальной оценкой эффективности индукционной терапии для принятия решения о выборе схемы для следующего важного этапа – химиолучевой терапии. Это позволило увеличить процент полных патоморфологических регрессий не только у ответивших на изначальное лечение, но и у тех, кому оказалась необходима смена схемы химиотерапии. Кроме того, эти данные продемонстрировали, что более интенсивная схема FOLFOX, вероятнее всего, имеет потенциальные клинические преимущества перед классической схемой CROSS (карбоплатин/паклитаксел + лучевая терапия), и будущие исследования призваны сравнить их эффективность.
Источники:
1. Hulshof MCCM, et al. Randomized Study on Dose Escalation in Definitive Chemoradiation for Patients With Locally Advanced Esophageal Cancer (ARTDECO Study). Journal of Clinical Oncology 39, no. 25 (September 01, 2021), 2816- 2824.
2. Minsky BD, Pajak TF, Ginsberg RJ, Pisansky TM, Martenson J, Komaki R, Okawara G, Rosenthal SA, Kelsen DP. INT 0123 (Radiation Therapy Oncology Group 94-05) phase III trial of combined-modality therapy for esophageal cancer: high-dose versus standard-dose radiation therapy. J Clin Oncol. 2002 Mar 1; 20(5): 1167- 74. doi: 10.1200/JCO.2002.20.5.1167. PMID: 11870157.
3. Goodman KA, et al. Randomized
Phase II Study of PET ResponseAdapted Combined Modality
Therapy for Esophageal Cancer:
Mature Results of the CALGB 80803
(Alliance) Trial. Journal of Clinical
Oncology 39, no. 25 (September 01,
2021), 2803-2815.
МЕСТНОРАСПРОСТРАНЕННЫЙ РАК ПРЯМОЙ КИШКИ
Подход ТНТ (тотальная неоадъювантная терапия) в лечении местнораспространенного рака прямой кишки привлекает все больший интерес онкологов мира. Максимальная интенсификация лечения на предоперационном этапе, включающая не только химиолучевое лечение, но и интенсивные режимы химиотерапии (как правило, FOLFOX), возможно, позволит увеличить процент полных патоморфологических регрессий и улучшить отдаленные результаты лечения пациентов, прежде всего, снизив риск локорегиональных рецидивов. Вероятно, именно подобный подход может стать надежной основой для стратегии Watch&Wait, если интенсивное неоадъювантное лечение приведет к развитию полного клинического ответа. Однако проблема отдаленного метастазирования по-прежнему остается насущной. Исследователи из нескольких американских центров предложили свой вариант интенсификации ТНТ, добавив пембролизумаб на этапе химиолучевого лечения после уже проведенной химиотерапии по схеме FOLFOX. В рандомизированное проспективное исследование 2 фазы NRG-GI002 [1] было включено 185 больных с местнораспространенным нижнеампуллярным раком прямой кишки II/III стадии (cT3-4 ≤5 см от анального края, любая N), с массивным первичным процессом (cT4 или опухоль в пределах 3 мм от мезоректальной фасции) и высоким риском метастазирования (cN2), а также те, кто не являлся кандидатом для сфинктерсохраняющей операции. Все пациенты были стратифицированы в соответствии с размерами первичной опухоли и статусом лимфоузлов. Рандомизация (1:1) состоялась в группу неоадъювантной ХТ по схеме FOLFOX в течение 4 месяцев с последующей химиолучевой терапией (50,4 Гр лучевой терапии на фоне капецитабина) с добавлением пембролизумаба внутривенно в дозе 200 мг каждые 3 недели до 6 введений (90 пациентов) либо без него (95 пациентов в группе). Первичной конечной точкой исследования являлся NAR (Neoadjuvant Rectal score) – суррогатный композитный показатель, разработанный рядом онкологических сообществ (NSABP, RTOG и NRG) для клинических исследований, позволяющий прогнозировать общую выживаемость даже более точно, чем полный патоморфологический ответ. Он вычисляется по формуле, включающей данные по первичной опухоли (клинические и патоморфологические) и ypN. В исследовании NSABP R-04 индекс NAR был классифицирован как низкий (при NAR<8), промежуточный (NAR=8- 16) и высокий (NAR>16), при этом более низкий показатель ассоциирован с лучшей общей выживаемостью [2]. Оценить NAR оказалось возможным у 137 пациентов из обеих групп. На первый взгляд, добавление пембролизумаба привело к некоторому улучшению непосредственных показателей лечения, однако ни по одному из них не удалось достичь статистической достоверности: средний NAR индекс был 11,53 в группе пембролизумаба (95% CI 8,54-14,51) против 14,08 в контрольной группе (95% CI 10,74- 17,43) (P=0,26); частота полных патоморфологических регрессий (pCR) составила 31,9% в исследуемой группе против 29,4% в группе контроля (P=0,75). Полный клинический ответ зарегистрирован в равном проценте случаев: 13,9% против 13,6% (P=0,95), а вот процент больных, которым удалось выполнить сфинктеросохраняющую операцию, был ниже в группе пембролизумаба: 59,4% против 71,0% (P=0,15). При этом токсичность 3-4 степени была несколько выше при добавлении иммунотерапии (48,2% против 37,3%). Несмотря на вполне удовлетворительную толерантность лечения с интенсификацией неоадъювантного этапа путем добавления пембролизумаба, авторы делают вывод, что отсутствие каких-либо преимуществ данного варианта лечения делает продолжение подобного исследования нецелесообразным. Необходимы поиски иных вариантов повышения эффективности тотальной неоадъювантной терапии.
Источники:
1. Rahma OE, Yothers G, Hong TS, et al. Use of Total Neoadjuvant Therapy for Locally Advanced Rectal Cancer: Initial Results From the Pembrolizumab Arm of a Phase 2 Randomized Clinical Trial. JAMA Oncol. 2021; 7(8): 1225-1230. doi:10.1001/jamaoncol.2021.1683.
2. George Jr. TJ, Allegra CJ, Yothers
G. Neoadjuvant Rectal (NAR) Score:
a New Surrogate Endpoint in Rectal
Cancer Clinical Trials. Curr Colorectal
Cancer Rep. 2015; 11: 275-280.
РЕЗОЛЮЦИЯ ПО ИТОГАМ КОНСУЛЬТАЦИОННОГО СОВЕТА «ОПТИМИЗАЦИЯ АЛГОРИТМА NTRK ДИАГНОСТИКИ»
30 января 2021 года, Москва
ВОПРОСЫ ПОВЕСТКИ ДНЯ
1) Обсудить результаты обновленного анализа эффективности и безопасности энтректиниба у пациентов с солидными опухолями с транслокациями генов NTRK1/2/3, данные программы расширенного доступа к препарату энтректиниб в Российской Федерации.
2) Обсудить особенности работы с pan-TRK иммуногистохимическим исследованием, определить преимущества и ограничения метода, профиль пациентов для направления на тестирование, выбор подтверждающего теста, определение перечня клинических рекомендаций, в которые целесообразно включение данного вида тестирования после регистрации.
РЕКОМЕНДАЦИИ ПО ОБСУЖДАЕМЫМ ВОПРОСАМ
Тропомиозин-рецепторные киназы (TRK) – семейство белков, которые экспрессируются в нормальных клетках, преимущественно нервной ткани, и регулируют пролиферацию, дифференцировку и выживание нейронов. Существует три белка: TrkA/B/C, которые кодируются тремя генами NTRK1, NTRK2, NTRK3 соответственно. Транслокации генов NTRK являются значимым онкогенным драйвером при различных солидных опухолях у детей и взрослых [1]. Онкогенные перестройки генов NTRK сопровождаются экспрессией химерного белка TRK со спонтанной киназной активностью, который является мишенью для таргетной терапии [2].
Клиническое применение препарата энтректиниб
Энтректиниб – высокоактивный ингибитор тирозинкиназ ROS1 и TRKA/ B/C, разработанный для повышения эффективности в ЦНС [3]. В отличие от кризотиниба и ларотректиниба, энтректиниб является слабым субстратом для Р-гликопротеина, поэтому демонстрирует высокую и стабильную концентрацию в ЦНС in vitro и in vivo [4]. Это согласуется с данными клинической эффективности энтректиниба в отношении опухолей ЦНС и интракраниальных метастазов опухолей с перестройками генов ROS1 и NTRK у взрослых и педиатрических пациентов [5-7]. В обновленном анализе на большей выборке взрослых пациентов с солидными опухолями с перестройками NTRK (n=64) энтректиниб продемонстрировал клинически значимые и стойкие ответы: высокая частота непосредственных ответов – 63,5% при медиане общей выживаемости 23,9 мес., частота интракраниальных ответов 50,0%, благоприятный и управляемый профиль безопасности [2]. Обновленные данные по когорте педиатрических пациентов демонстрируют быстрые и стойкие ответы на лечение энтректинибом у детей с рецидивирующими или рефрактерными первичными опухолями ЦНС и экстракраниальными солидными опухолями с перестройками таргетных генов: частота объективных ответов составила 64% для первичных опухолей ЦНС и 100% для экстракраниальных солидных опухолей, профиль безопасности соответствует предыдущим сообщениям [7]. В Российской Федерации открыта программа расширенного доступа к препарату энтректиниб для взрослых и детей с солидными опухолями с транслокациями NTRK и ROS1- положительным немелкоклеточным раком легкого с метастазами в ЦНС. На момент проведения экспертного совета 4 пациента в Российской Федерации получали лечение препаратом энтректиниб. Включение в программу может быть рекомендовано для пациентов с опухолями с перестройками генов NTRK, для которых исчерпаны возможности стандартной терапии при необходимости лечения по жизненным показаниям.
Иммуногистохимическое исследование pan-ТRК
Иммуногистохимическое исследование экспрессии pan-ТRК (ИГХ) на платформе VENTANA с антителами клона EPR17341 (№ РЗН 2021/14900 от 27.07.2021) может использоваться в качестве скринингового метода по выявлению перестроек генов NTRK. Pan-ТRК ИГХ имеет высокую чувствительность, доступность, короткое время выполнения и требует небольшого объема опухолевого материала. Согласно рекомендациям ESMO для опухолей с низкой частотой транслокаций NTRK при недоступности секвенирования нового поколения (NGS) рекомендуется проводить первичное тестирование иммуногистохимическим методом с последующим подтверждением NGS [8]. Существуют различные антитела, которые способны выявить иммуногистохимическую экспрессию TRK в тканях, сейчас в большинстве случаев используется хорошо изученный клон EPR17341, так называемые pan-TRK антитела, которые связываются с С-концевой областью всех трех белков TRK – А, В и С и, как следствие, подходят для выявления любых химерных белков TRK, образовавшихся в результате слияния NTRK. Данный клон демонстрирует высокую чувствительность 95,2%, что представляет оптимальный результат для биологических исследований и позволяет использовать иммуногистохимическое исследование для тестирования экспрессии генов NTRK [9]. Интенсивность и локализация окрашивания (цитоплазматическое, мембранное, перинуклеарное, ядерное) могут варьировать. Локализацию экспрессии TRK в клетке, отличную от нативной цитоплазматической, обеспечивает партнер слияния, поэтому есть корреляция между локализацией окрашивания и геном-партнером [9]. В качестве внешнего контроля может быть использована ткань коры головного мозга или мозжечка, также оптимальным контролем является аппендикс, в котором достаточно хорошо окрашиваются нервы и ганглиозные клетки, как подслизистого сплетения, так и межмышечного. В качестве внутреннего позитивного контроля могут быть оценены периферические нервы, а в качестве негативного – нормальные ткани, кровеносные сосуды и кожа [10]. Ограничением иммуногистохимического метода является низкая специфичность и отсутствие стандартизованных алгоритмов оценки. Может быть получен ложноположительный результат при наличии в тканях физиологической экспрессии белков TRK [11]. Интенсивность окраски может варьировать, тест чувствителен к погрешностям на преаналитическом этапе, фиксации, декальцинации, что может снижать интенсивность окраски и привести к ложноотрицательной интерпретации результата. При нарушении правил фиксации опухоли может иметь место аутолиз в центральной зоне опухолевого фрагмента, который приводит к разрушению эпитопов и отсутствию окраски, в то время как на периферии эпитопы сохраняются, и мы можем видеть градиент окрашивания.
Физиологическая экспрессия pan-ТRК
Тропомиозин-рецепторные киназы экспрессируются в нормальных тканях, преимущественно нейрогенной дифференцировки. В таких случаях при выполнении ИГХ pan-ТRК выявляется физиологическая экспрессия, то есть экспрессия без реаранжировки генов NTRK, обусловливающей чувствительность к энтректинибу и другим ингибиторам TRK. Тем не менее, в части этих опухолей может наблюдаться и онкогенная транслокация NTRK, например, в опухолях ЦНС, но иммуногистохимический метод не позволяет разделить химерные и нативные белки TRK [1]. Также часто демонстрируют экспрессию pan-TRK, не ассоциированную с наличием перестройки генов NTRK нейробластомы, гастроинтестинальные стромальные опухоли, лейомиосаркомы, аденокистозный рак [11]. В связи с этим данные опухоли лучше исходно не скринировать иммуногистохимическим методом, а делать сразу любой доступный молекулярно-генетический тест, например, ПЦР, FISH, при доступности NGS.
При выявлении экспрессии pan-ТRК подтверждение перестройки гена NTRK должно быть выполнено доступным молекулярным методом.
Каждый из методов имеет свои преимущества и недостатки, однако при их использовании необходимо помнить об особенностях перестроек генов NTRK, заключающихся в многочисленности (по сравнению с другими онкогенными реаранжировками) типов перестроек (транслокации, парацентрические инверсии, небольшие делеции) и генов-партнеров, что может сказаться на эффективности выявления перестроек с «неканоническими» генами-партнерами или точками разрыва при использовании некоторых молекулярных методов диагностики. FISH в качестве подтверждающего метода может быть применен на гистологических и цитологических стеклах, однако ограничением является невозможность определения точек разрыва и подтверждения перестройки без сдвига рамки считывания, другими словами – будет ли эта перестройка транслироваться в активный онкогенный белок или нет. Также FISH может быть неинформативным в случае небольших делеций, когда визуально не получается наблюдать расхождение зондов, а ограничением может являться субъективность интерпретации результатов и необходимость выполнения трех гибридизационных проб для генов NTRK1/2/3 соответственно [8]. Для выявления транслокаций генов NTRK1/2/3 можно применять различные модификации метода ПЦР. Сравнительная экзонная экспрессия позволяет выявить любую транслокацию, но без идентификации партнера, а вариант-специфическая ПЦР позволяет определить конкретный вариант перестройки [12]. Методы на основе высокопроизводительного секвенирования имеют высокую чувствительность и специфичность и анализируют несколько маркеров одновременно [8]. Мультиплексность является важным преимуществом NGS в опухолях с известной или предполагаемой высокой частотой обнаружения различных мишеней для таргетной терапии, например, при раке легкого кроме NTRK могут быть обнаружены и другие транслокации – REТ, ALK и ROS1, в то время как при использовании альтернативных методов детекции для каждого из них понадобился бы дополнительный тест [13]. Это особенно актуально в связи с проблемой нехватки материала при выполнении множества отдельных молекулярно-генетических исследований, особенно когда речь идет о нозологиях, где очень часто бывает малая биопсия – это рак легкого, рак поджелудочной железы, холангиокарцинома. Опубликованные в 2020 г. рекомендации Рабочей группы прецизионной медицины Европейского общества медицинской онкологии (ESMO) для пациентов с метастатическими опухолями рекомендуют использовать мультигенные панели NGS при немелкоклеточном раке легкого, холангиокарциноме, раке предстательной железы и раке яичников, а в последних двух нозологиях – для поиска клинически значимых мутаций в генах гомологичной рекомбинации [13].
Когда выполнять тестирование NTRK?
Если в опухоли предполагается возможное наличие перестройки генов семейства NTRK, тестирование можно выполнять на том же этапе, когда проводится стандартное исследование уже известных биомаркеров, которые применяются для принятия клинических решений в рутинной практике. В случае, если мы будем откладывать тестирование NTRK на момент, когда исчерпаны все опции стандартной терапии, пациент может не успеть получить таргетную терапию.
Редкие опухоли с высокой частотой транслокаций NTRK
Для некоторых редких опухолей наличие перестроек NTRK является практически патогномоничным: это секреторные карциномы молочной железы и их аналоги, а также инфантильная фибросаркома, клеточный тип мезобластной нефромы. Для данной группы опухолей целесообразно проведение тестирования NTRK на ранних стадиях, уже на стадии IIa, и при рассмотрении вопроса о неоадъювантной терапии до резекции опухоли. Это обеспечит лечащего врача максимальным объемом информации к началу лечения, даст дополнительные терапевтические инструменты и позволит провести менее калечащие хирургические вмешательства [14]. Важно в целом выявлять пациентов с данными типами опухолей и фиксировать все эти случаи для обучения патологов диагностике редких опухолей. Уже опубликованы отечественные работы по диагностике секреторных карцином слюнных желез у детей [15] и взрослых [16], о выявлении экспрессии белков TRK и перестроек в гене NTRK3 в секреторной карциноме молочной железы [17].
При каких еще нозологиях рекомендуется выполнение тестирования NTRK?
В ряде опухолей транслокация NTRK отмечается хотя и значимо реже, чем в новообразованиях, перечисленных выше, однако частота встречаемости достаточно велика и сопоставима с встречаемостью других редких онкогенных драйверов (например, ROS-1 или BRAF при немелкоклеточном раке легкого). Подобные новообразования также должны подлежать обязательному тестированию на наличие транслокации NTRK:
• Папиллярный и низкодифференцированный рак щитовидной железы (~3% у взрослых и ~20% у детей), при рефрактерности к терапии радиоактивным йодом отдаленных метастазов или других жизнеугрожающих очагов опухоли. Возможно как выполнение pan-TRK ИГХ скрининга, так и изначальное тестирование доступным молекулярногенетическим методом.
• Немелкоклеточный рак легкого (НМРЛ), местнораспространенный и метастатический в составе панели тестов перед или во время первой линии терапии. При выполнении скрининга методом pan-TRK имеет смысл проводить предварительную селекцию пациентов, иначе стратегия поиска может быть очень экстенсивной [18]. Стоит обратить более пристальное внимание на никогда не куривших пациентов, чаще женщин, имеющих характерный для драйверной мутации КТ-профиль, особенно при исключении других более частых онкогенных мутаций ALK, ROS1, EGFR, BRAF. Как правило, транслокации NTRK являются взаимоисключающими с драйверными мутациями ALK, ROS1, EGFR, BRAF.
• Холангиокарцинома – пациенты, подлежащие паллиативному химиотерапевтическому лечению, в составе панели тестов, включающей NTRK, стратегия первичного тестирования методом высокопроизводительного секвенирования представляется наиболее перспективной в данной нозологии.
• Веретеноклеточные саркомы – рекомендуется тестирование pan-TRK с последующим подтверждением доступным молекулярным методом или тестирование методами на основе РНК-секвенирования. Веретеноклеточные саркомы со слиянием генов NTRK выделены в отдельный гистопатологический тип в классификации ВОЗ в 2020 г., и дальнейшее изучение данной группы опухолей у взрослых и детей представляется очень интересным.
• Колоректальный рак – тестирование NTRK может быть рекомендовано для пациентов с диким типом KRAS, NRAS, BRAF и микросателлитной нестабильностью dMMR/ MSI-H. Применение TRK ингибиторов в случае колоректального рака может быть рассмотрено после того, как будут исчерпаны возможности стандартной терапии.
• Рак поджелудочной железы – стратегия скрининга pan-TRK в данном типе опухолей возможна, однако представляется очень экстенсивной, и, возможно, имеет смысл отбор пациентов с нехарактерным течением заболевания и/или другими особенностями, позволяющими выделить их среди общей популяции больных.
• Тройной негативный рак молочной железы – перестройки NTRK встречаются редко и составляют ~0,5%, чаще встречаются транслокации NTRK1, в данном типе опухолей возможно проведение panTRK ИГХ скрининга параллельно с тестированием PD-L1 (клон SP142).
• Опухоли невыявленной первичной локализации – данная группа пациентов получает наибольшие преимущества от использования методов комплексного геномного профилирования, при невозможности проведения КГП имеет смысл рассмотреть выполнение pan-TRK ИГХ.
• Другие типы опухолей по усмотрению лечащего врача – например, все типы рака щитовидной железы, рак пищевода, рак желудка, гепатоцеллюлярная карцинома, рак шейки матки, рак вульвы, рак яичников, меланома могут быть направлены на pan-TRK ИГХ скрининг. Согласно консенсусу JSCO-ESMOASCO-JSMO-TOS, все пациенты с нерезектабельными или метастатическими солидными опухолями без значимых драйверных мутаций, перестроек должны быть тестированы на NTRK [14].
С нашей точки зрения онкологов не стоит ограничиваться нозологиями, которые перечислены выше, и принимать решение всегда следует индивидуально, исходя из комплекса факторов, представленных типом опухоли и вероятностью обнаружения в ней транслокации NTRK, доступности и предполагаемой эффективности альтернативной терапии, общего состояния пациента, клинических особенностей течения заболевания, технической возможности получения таргетной терапии, желания пациента и т.д. Несмотря на то, что NTRK – это редкий маркер, необходимо более широкое тестирование в популяции онкологических пациентов. Тем не менее, чтобы шире использовать pan-TRK ИГХ исследование после регистрации препаратов, ингибирующих TRK, имеет смысл рассмотреть возможность включения данного тестирования в клинические рекомендации по вышеперечисленным нозологиям.
Заключение мультидисциплинарной команды
Еще раз подчеркнем, что только NTRK тестирование позволяет выявить пациентов, которые получат преимущество от таргетной терапии ингибиторами TRK, эффективность которой оправдывает усилия, вложенные на этапе диагностики. В заключение отметим, что несомненна большая ценность участия патоморфолога и молекулярного генетика в мультидисциплинарном консилиуме при обсуждении диагностической и лечебной тактики. При необыкновенной сложности молекулярногенетических методов, появлении новых гистологически-зависимых и гистологически-независимых маркеров, тенденции к орфанизации онкологических заболеваний компетенций клинического онколога может быть недостаточно для принятия наиболее информированного клинического решения.
Авторы:
Андреева Ю.Ю.1 , Делекторская В.В.2 , Демидова И.А.3 , Ефремов Г.Д.4 , Жуков Н.В.5 , Жукова Л.Г.6 , Коновалов Д.М.5 , Ледин Е.В.7 , Литвинов Д.В.5 , Поляков А.П.8 , Румянцев П.О.9 , Савёлов Н.А.3 , Строганова А.М.2, Тертычный А.С.10, Федянин М.Ю.2
1. ФГБОУ ДПО РМАНПО кафедра патологической анатомии
2. ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России
3. ГБУЗ «МГОБ № 62 ДЗМ»
4. НИИ урологии и интервенционной радиологии им. Н.А. Лопаткина – филиал ФГБУ «НМИЦ радиологии» Минздрава России
5. ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачёва» Минздрава России
6. ГБУЗ МКНЦ им. А.С. Логинова ДЗМ
7. Клиническая больница «Медси»
8. МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России
9. ММЦ «СОГАЗ»
10. ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России
Список используемых источников:
1. Solomon, James P. NTRK fusion detection across multiple assays and 33,997 cases: diagnostic implications and pitfalls. vol.33, no.1, 2020, pp.38-46. VENTANA pan-TRK (EPR17341) Assay Package Insert. 2018.
2. Rolfo Christian D. Efficacy and safety of entrectinib in patients (pts) with NTRKfusion positive (NTRK-fp) solid tumors: An updated integrated analysis. Journal of Clinical Oncology. 2020, vol.38, no.15 supplement, pp.3605-3605.
3. Menichincheri, M. Discovery of entrectinib: a new 3-aminoindazole as a potent anaplastic lymphoma kinase (ALK), c-ros oncogene 1 kinase (ROS1), and pan-tropomyosin receptor kinases (Pan-TRKs) inhibitor. J Med Chem. 2016, vol.59, no.7, pp.3392-3408.
4. Fischer Holger. Entrectinib, a TRK/ ROS1 inhibitor with anti-CNS tumor activity: differentiation from other inhibitors in its class due to weak interaction with P-glycoprotein. NeuroOncology. 2020, vol.22, no.6, pp.819-829.
5. John Thomas. Intracranial efficacy of entrectinib in patients with NTRK fusionpositive solid tumors and baseline CNS metastases. Annals of Oncology. Vol.31, no.4 supplement, pp.396-408.
6. Dziadziuszko R. Efficacy of entrectinib in patients with NTRK or ROS1 fusionpositive NSCLC with CNS metastases at baseline. J Ann Onc. 2020, vol.31, no.4 supplement, pp.833-834.
7. Robinson G. Entrectinib in recurrent or refractory solid tumors including primary CNS tumors: updated data in children and adolescents. Neuro-Oncology. 2020, vol.22, no.3 supplement, p.344.
8. Marchio С. ESMO recommendations on the standard methods to detect NTRK fusions in daily practice and clinical research. Annals of Oncology. 2019, vol.0, pp.1-11.
9. Hechtman JF. Pan-Trk Immunohistochemistry Is an Efficient and Reliable Screen for the Detection of NTRK Fusions. Am J Surg Pathol. 2017, vol.41, no.11, pp.1547-1551.
10.VENTANA pan-TRK (EPR17341) Assay Package Insert, 2018.
11.Conde Esther. Pan-TRK Immunohistochemistry An ExampleBased Practical Approach to Efficiently Identify Patients With NTRK Fusion Cancer. Arch Pathol Lab Med, 2020.
12.Preobrazhenskaya EV. Gene rearrangements in consecutive series of pediatric inflammatory myofibroblastic tumors. Pediatr Blood Cancer. 2020, vol.67, no.5, p.28220.
13.Mosele F. Recommendations for the use of next-generation sequencing (NGS) for patients with metastatic cancers: a report from the ESMO Precision Medicine Working Group. Ann Oncol. 2020, vol.31, no.11, pp.1491-1505.
14.Yoshino T. JSCO-ESMO-ASCOJSMO-TOS: international expert consensus recommendations for tumoragnostic treatments in patients with solid tumors with microsatellite instability or NTRK fusions. Ann Oncol. 2020, vol.31, no.7, pp.861-872.
15.Sidorov LV. Secretory carcinoma of the salivary gland (mammary analogue secretory carcinoma) in children. Arkh Patol. 2020, vol.82, no.2, pp.43-51.
16.Швед Н.В. Клинико-морфологический анализ трех случаев секреторной карциномы слюнной железы, ассоциированной со слиянием ETV6- NTRK3. Архив патологии. 2020, том 82, №4, с.47-52.
17.Кузнецова О.А. Значение выявления экспрессии белков TRK и перестроек в гене NTRK3 в секреторной карциноме молочной железы. Архив патологии. 2020, том 82, №4, с. 53-57.
18.Elfving Hedvig. Evaluation of NTRK immunohistochemistry as a screening method for NTRK gene fusion detection in non-small cell lung cancer. Lung Cancer. 2021, vol.153, pp.53-59.
При поддержке компании Roche.
Публикуется в редакции авторов.
К 80-ЛЕТИЮ ЧЛЕНА-КОРРЕСПОНДЕНТА РАМН, ЧЛЕНА-КОРРЕСПОНДЕНТА РАН, ПРОФЕССОРА ВЛАДИМИРА ФЕДОРОВИЧА СЕМИГЛАЗОВА
Все годы своей профессиональной жизни Владимир Федорович трудится во благо отечественной медицины, реализуя свой научный и практический потенциал на ниве онкологии. Более пятидесяти лет он работает в Научно-исследовательском институте онкологии им. Н.Н. Петрова (Санкт-Петербург), пройдя за эти годы путь от рядового врача до генерального директора прославленного НИИ. Среди прочих достижений следует отметить, что особое значение приобрели разработанные хирургами института принципы органосохраняющих и сберегательных вмешательств. Научные достижения профессора основаны на постоянной практической работе. Им лично выполнено свыше восьми тысяч успешных операции. Он разработал и внедрил в клиническую практику вместе со своими учениками и соратниками органосохраняющее лечение опухолей молочной железы, биопсию сигнального лимфатического узла, что позволяет снизить травматичность операции и избежать инвалидности пациентам с диагнозом РМЖ. Открытие Владимиром Федоровичем биологического (патогенетического) многообразия гормонозависимых опухолей получило признание не только в нашей стране, но и за рубежом. Научные заслуги В.Ф. Семиглазова были по достоинству оценены коллегами: в 2000 году он был избран членом-корреспондентом Российской академии медицинских наук по специальности «онкохирургия», а в 2005 году избран членом-корреспондентом Российской Академии наук. Владимир Федорович создал целую школу онкологов. Под его руководством подготовлено более 80 докторов и кандидатов медицинских наук, работающих в Российской Федерации и за рубежом. Он автор более 500 научных работ, в том числе национальных рекомендаций, 20 монографий, а также учебно-методических пособий. Сегодня В.Ф. Семиглазов – председатель Научного общества онкологов Санкт-Петербурга и Ленинградской области, с 2013 года – президент Российского общества онкомаммологов, эксперт Международной панели ученых St. Gallen (Швейцария), член Правления Европейского общества хирургической онкологии (ESSO). Владимир Федорович является координатором по России исследования ATLAS международного комитета Оксфордского университета по разработке новых методов лечения рака молочной железы. В 2007 году был удостоен золотой медали Оксфордского университета «За выдающийся вклад в разработку неоадъювантного лечения опухолей». В.Ф. Семиглазов – член редколлегий журналов «Вопросы онкологии», «Клинический вестник» РАН, «Опухоли женской репродуктивной системы», «The Breast», «European Journal Of Epidemiology», «International Journal of Surgery», «Breast Cancer Management». В 2003 году профессору Семиглазову присвоено звание «Заслуженный деятель науки Российской Федерации». В 2015 году он был награжден орденом Почета. А в 2016 году за выдающийся вклад в развитие онкологии – медалью имени профессора Петрова. И это только часть достигнутого Владимиром Федоровичем за годы его славной жизни! Уверены, что клиническую онкологию еще ждут новые и новые свершения молодого поколения ученых под чутким руководством профессора Семиглазова.
Российское общество клинической
онкологии (RUSSCO) желает юбиляру неиссякаемой творческой
энергии, позволяющей делиться
своим уникальным опытом с коллегами и соратниками, крепкого
здоровья и благополучия в личной
жизни!

МЕТФОРМИН В ЛЕЧЕНИИ БОЛЬНЫХ НЕМЕЛКОКЛЕТОЧНЫМ РАКОМ ЛЕГКОГО
Метформин, препарат из группы бигуанидов, общедоступный, хорошо переносимый и недорогой, широко применяется в лечении сахарного диабета 2 типа. При этом многие исследователи изучали и его противоопухолевые свойства, и подобные работы проводились еще с конца 1970-х годов. Эпидемиологические исследования показали, что заболеваемость и смертность от злокачественных опухолей у больных сахарным диабетом, принимающих метформин, ниже, чем у тех, кто лечился другими препаратами [1]. Интерес к метформину возрос 5-7 лет назад, когда ряд исследований продемонстрировали преимущества добавления препарата в схемы лечения больных раком молочной железы. Были определены многие механизмы противоопухолевого действия метформина. Так, доказано, что центральным звеном является его способность активировать циклическую аденозин-монофосфатзависимую протеинкиназу, одного из главных ферментов регуляторов энергообеспечения и деления клеток. Это приводит к ингибированию активности M-TOR – центрального регулятора синтеза белка и клеточного роста. В связи с ингибированием M-TOR происходит снижение активности циклинзависимых киназ, bcl-2 и других белков и ферментов, вовлеченных в процесс деления опухолевых клеток. Препарат также может снижать повышенный уровень глюкозы, повышенное потребление глюкозы опухолевыми клетками и ослаблять известный эффект Варбурга, уменьшая уровень инсулина. Метформин способен подавлять активность ароматазы и уменьшать гиперэкспрессию онкопротеина HER2 [2]. Немало вопросов было и остается по применению метформина у онкологических больных. Способен ли препарат решать проблему лекарственной резистентности? Может ли он применяться при различных подтипах рака молочной железы? И главное: проявляет ли он эффективность в лечении больных со злокачественными опухолями других локализаций? В августе 2021 года в журнале JAMA были опубликованы результаты сразу двух проспективных рандомизированных исследований II фазы по добавлению метформина к химиолучевой терапии местнораспространенного немелкоклеточного рака легкого – NRG-LU001 [3] и OCOGALMERA [4]. Основной вопрос, который ставили перед собой исследователи, был следующим: способен ли метформин, назначаемый во время ХЛТ и на этапе консолидации, улучшить результаты лечения больных НМРЛ, не страдающих сахарным диабетом? Проблема оптимизации результатов ХЛТ у этой сложной категории больных уже долгое время занимает умы исследователей. В настоящее время появилась новая опция – консолидирующая иммунотерапия, которая становится стандартом терапии. Однако широкая доступность метода ограничена стоимостью лечения, поэтому поиск иных вариантов консолидирующей терапии оправдан. Исследование NRG-LU001 проводилось в 2014-2016 годах и включало 170 больных с нерезектабельной III стадией НМРЛ, получавших радикальную ХЛТ (на основе схем с таксанами, у большинства (76%) – с применением технологии IMRT) на фоне метформина 2000 мг/сутки или без него. Из них 167 было доступно для анализа: 86 в группе метформина и 81 – в контрольной группе. Средний период наблюдения составил 27,7 месяца. Выживаемость без прогрессирования (ВБП) за 1 год составила 60,4% в группе контроля против 51,3% в группе метформина (HR 1,15; 95% CI 0,77-1,73; P=0,24). Одногодичная выживаемость оказалась сопоставима и составила 80,2% в группе контроля и 80,8% у больных, получавших метформин. Не было отмечено существенных различий ни в частоте локорегиональных рецидивов, ни в частоте отдаленного метастазирования за 1 и 2 года. При этом, как и ожидалось, добавление метформина не сказалось на частоте побочных явлений. В целом данные исследования NRG-LU001 оказались просто разочаровывающими – в отличие от данных другого исследования, OCOG-ALMERA, продемонстрировавшего не схожие, а худшие результаты при добавлении метформина. Оно было остановлено по причине плохого набора больных: за период с 2014 по 2019 годы было набрано всего 54 пациента, 26 – в группе метформина (они получали препарат на фоне курса ХЛТ и в дальнейшем в течение года) и 28 – в контрольной группе. Негативные события (любые: локорегиональные рецидивы, отдаленные метастазы, смерть, отказ от продолжения запланированного лечения по разным причинам) в течение 1 года наблюдались гораздо чаще в экспериментальной группе (69,2% против 42,9%). Одногодичная ВБП составила 34,8% в группе метформина и 63,0% в контрольной (HR 2,42; 95% CI 1,14-5,10), а общая выживаемость оказалась почти вдвое хуже – 47,4% против 85,2% (HR 3,80; 95% CI 1,49- 9,73). При этом у большего числа больных из исследуемой группы зарегистрированы побочные явления 3 степени и выше. Авторы сделали вывод, что метформин не должен применяться в комбинации с ХЛТ у больных местнораспространенным НМРЛ ввиду большей токсичности и худших результатов. Попытка улучшить результаты ХЛТ у этой сложной категории больных с помощью метформина не удалась. Небольшое число пациентов в исследованиях не позволяет делать окончательные выводы – но маловероятно, что подобные исследования с метформином будут проводиться в дальнейшем у больных с этой локализацией опухоли. Эти работы оставили немало вопросов; к примеру, можно ли пациентам с НМРЛ и диабетом применять метформин на фоне проводимого химиолучевого лечения. В настоящее время немалое число исследований проводится для определения эффективности метформина в лечении первичных и метастатических опухолей разных локализаций, чаще всего – гормонально активных (рак молочной железы, рак простаты), результаты многих ожидаются в ближайшее время [5]. P.S. На недавно прошедшем конгрессе WCLC 2021 (World Conference on Lung Cancer) американскими авторами из University of Buffalo были представлены ретроспективные клинические данные и результаты исследований на животных, которые продемонстрировали, что метформин действительно способен улучшить результаты лечения больных раком легкого – но у тех, кто имеет избыточный вес или ожирение. Метформин снижал количество медиаторов иммуносупрессии в опухолевом микроокружении именно у этой категории пациентов. У мышей с индуцированными опухолями легких и при наличии избыточного веса рост опухоли был гораздо более стремительный, чем у особей с нормальным весом. Добавление метформина приводило к быстрому уменьшению опухолевого объема (у мышей без избыточного веса изменений не наблюдалось). Подобная находка может стать полезной в клинической практике, так как сопутствующее раку легких ожирение в последние годы становится большой проблемой.
Ссылки:
1. Roshan МНК, Shing YK, Pace NP. Metformin as an adjuvant in breast cancer treatment. SAGE Open Med. 2019; 7: 2050312119865114.
2. М.А. Осипов, Т.Ю. Семиглазова, П.В. Криворотько и др. Метформин в лечении рака молочной железы. Злокачественные опухоли 2017; 7(2): 76-82.
3. Skinner H, Hu C, Tsakiridis T, et al. Addition of Metformin to Concurrent Chemoradiation in Patients With Locally Advanced Non-Small Cell Lung Cancer: The NRG-LU001 Phase 2 Randomized Clinical Trial. JAMA Oncol. Published online July 29, 2021. doi:10.1001/jamaoncol.2021.2318.
4. Eze C, Belka C, Manapov F. Forging a Path for Metformin Use in Inoperable Locally Advanced Non-Small Cell Lung Cancer. JAMA Oncol. Published online July 29, 2021. doi:10.1001/ jamaoncol.2021.2316.
5. clinicaltrials.gov.
Мнение эксперта. Наше будущее написано вчера…
Автор: Семиглазова Татьяна Юрьевна
ФГБУ «НМИЦ онкологии им. Н.Н. Петрова»
Минздрава России, доктор медицинских наук, Санкт-Петербург
Ларионов Леонид Федорович, основоположник отечественной химиотерапии, еще в 1937 году защитил докторскую диссертацию на тему «Эндокринные железы и рак», показав, что рак – это болезнь всего организма, причиной развития которой может быть нарушение функций эндокринной системы. Далее, начиная с 60-70-х годов, в лаборатории НМИЦ онкологии им. Н.Н. Петрова под руководством профессора Дильмана В.М. получило развитие такое направление, как «метаболическая реабилитация». Были изучены и продолжаются изучаться различные лекарственные соединения, активно влияющие на гормонально-метаболические изменения организма, с целью не только снижения риска развития злокачественных новообразований, но и повышения эффективности лечения онкологических больных посредством устранения метаболического синдрома и ассоциированных с ним эндокринных нарушений: резистентности к инсулину, нарушенной толерантности к глюкозе, активации системы инсулиноподобных факторов роста, висцерального ожирения, включая глобальную проблему избыточного потребления углеводов и «эпидемию ожирения», и т.д. [1,2]. В.Ф. Семиглазов в 1988 году представил к защите докторскую диссертацию, обосновав закономерность образования патогенетических форм рака молочной железы в зависимости от патологических изменений организма человека – еще аргумент в копилку об учении о гормонозависимых опухолях. Сегодня широкое распространение получило такое направление, как метаболомика. Интерес же к метформину за последние годы еще больше возрос, что связано с результатами опытов in vitro и in vivo, продемонстрировавших выраженную противоопухолевую активность метформина, хотя механизм его противоопухолевого действия по-прежнему малопонятен. Предполагается, что метформин, активируя аденозин-монофосфатзависимую протеинкиназу (ключевой фермент регуляции системы энергообеспечения клеток), опосредованно ингибирует активность mTOR (центральный регулятор синтеза белка и клеточного роста) и, наконец, снижая уровень глюкозы, повышает потребление глюкозы опухолевыми клетками, что приводит к снижению уровня инсулина, значимо влияя на систему инсулиноподобного фактора роста, еще одну потенциальную мишень. Кроме того, метформин является геропротектором и входит в базу данных лекарственных препаратов Geroprotectors и DrugAge, содержащих сведения о более чем четырех сотнях низкомолекулярных соединений, испытанных почти в 2 тысячах экспериментов. Данные эпидемиологических исследований все больше подтверждают превентивное влияние метформина на снижение заболеваемости злокачественными опухолями у пациентов с сахарным диабетом (СД), принимающих данный препарат. Опубликованные результаты эпидемиологических исследований свидетельствуют о снижении на 17-20% риска заболеваемости РМЖ у больных сахарным диабетом (СД), получавших синтетический бигуанид метформин, и об увеличении показателей выживаемости при использовании метформина после радикального лечения больных РМЖ [3]. В крупном метаанализе, опубликованном в 2016 году [4], ретроспективно оценивались результаты радикального лечения пациентов (n=24178) с различными ЗНО, получавших метформин по поводу СД II типа и не получавших данный препарат. Применение метформина приводило к статистически значимому увеличению показателей БРВ (ОР 0,63; 95% ДИ 0,47-0,85) и ОВ (ОР 0,69; 95% ДИ 0,58-0,83) у пациентов с колоректальным раком. У больных ранним раком предстательной железы использование метформина также ассоциировалось с лучшими показателями как БРВ (ОР 0,83; 95% ДИ 0,69-1,00), так и ОВ (ОР 0,82; 95% ДИ 0,73-0,93). Наилучшие результаты БРВ с метформином были получены у пациентов, которые по поводу рака предстательной железы получили лучевую терапию с радикальной целью (ОР 0,45; 95% ДИ 0,29-0,70). В рамках рандомизированного клинического исследования «Влияние мелатонина и метформина на эффективность неоадъювантной гормонотерапии торемифеном больных (n=62) эстроген-рецептор-позитивным РМЖ» [ClinicalTrials.gov Identifier: NCT02506790] нами было показано, что добавление метформина (в дозе 850 мг два раза в день) к неоадъювантной гормонотерапии торемифеном на протяжении 4-х месяцев значимо подавляло пролиферативную активность опухоли – суррогатного маркера улучшения выживаемости у больных гормоночувствительным РМЖ без сахарного диабета в анамнезе. Снижение маркера Ki-67 наблюдалось в 4,2 раза чаще в группе комбинированной терапии метформина и торемифена по сравнению с только гормонотерапией торемифеном (95% ДИ 1,04- 17,1; р=0,043). Также была выявлена значимая корреляция между динамикой снижения индекса Ki-67 в опухоли и индексом массы тела выше нормы (р=0,015). Важно отметить и данные о низком профиле токсичности и отсутствии гипогликемии у пациентов без СД при приеме метформина. Несомненно, представляет интерес дальнейшее изучение в рамках рандомизированных проспективных исследований феномена «метаболической реабилитации» на фоне применения антидиабетических лекарственных соединений. Предполагается, что, влияя на клинико-метаболические обменные процессы, метформин будет индуцировать противоопухолевый ответ, по крайне мере, у части больных раком молочной железы, раком предстательной железы, колоректальным раком и ряда других онкологических больных с гормонально-метаболическими нарушениями. В перспективе – это профилактика гормонозависимых опухолей, основанная на сочетании современных комбинированных и прецизионных подходов, включая «drug-gene» взаимодействия. Не факт, что при всех локализациях опухолей метформин проявит противоопухолевые свойства, и данные два исследования по раку легкого тому свидетельство, но большее число подобных исследований однозначно предоставит нам больше ценной информации. Тот факт, что метформин участвует в проспективных исследованиях, уже является свидетельством существующего интереса к препарату.
Ссылки:
1. Анисимов В.Н., Морозов В.Г., Хавинсон В.Х., Дильман В.М. Сопоставление противоопухолевой активности экстрактов эпифиза, гипоталамуса, мелатонина и сигетина у мышей с перевитым раком молочной железы. Вопр. онкологии. 1973; 10: 99-101.
2. Berstein L. Metformin in obesity, cancer and aging: addressing controversies. Aging 2012; 4(5): 320-329.
3. Анисимов В.Н., Попович И.Г., Егормин П.А. и др. Перспективы применения антидиабетических бигуанидов для профилактики и лечения рака: результаты доклинических исследований. Вопр. онкологии. 2016; 62(2): 234-245.
4. Coyle C, Cafferty F, Vale C, Langley R. Metformin as an adjuvant treatment for cancer: a systematic review and meta-analysis. Ann. of Oncol. 2016; 27: 2184-2195.
5. Semiglazova TY, Osipov M, Krivorotko P, et al. Neoadjuvant endocrine
therapy in combination with melatonin and metformin in locally advanced
breast cancer. Ann. of Oncol. 2019; 30(5): 99-103.
АНОНСЫ ВЕБИНАРОВ NCCN
Глубокоуважаемые коллеги!
Эксперты NCCN (National Comprehensive Cancer Network) организуют целый ряд образовательных онлайн мероприятий, циклов и вебинаров для онкологов разных специальностей, зарегистрироваться на которые можно совершенно бесплатно по указанным ссылкам.
Вебинары
Вебинар «Инфекционные осложнения, связанные с таргетной и иммунотерапией у иммунокомпрометированных онкологических больных» – 4 ноября 2021 года
Почти половина из возможных вариантов таргетной терапии в настоящее время доступна исключительно в виде пероральных препаратов, а доля пероральных противоопухолевых средств, разрабатываемых сегодня, постоянно увеличивается. Хотя новые лекарственные средства с молекулярной направленностью в меньшей степени затрагивают клетки крови, чем традиционные цитотоксические препараты, инфекционные риски все же существуют. Безопасность и эффективность могут гарантировать только мультидисциплинарные команды, обладающие достаточным опытом в фармакологии пероральной противораковой терапии.
Основные цели вебинара:
• Определить основные факторы, которые предрасполагают к инфекционным заболеваниям у онкологических больных
• Выстроить парадигму профилактики инфекционных осложнений, включая использование противомикробной профилактики и превентивной терапии для онкологических пациентов, получающих лечение иммунными и таргетными агентами
• Оценить рекомендации по мониторингу, а также определять возможные негативные последствия лекарственного взаимодействия между антимикробными препаратами и иммунотаргетными агентами
Вебинар «Эволюция в поддерживающей терапии рака яичников» – 30 ноября 2021 года
Стремительная эволюция поддерживающей терапии рака яичников в сочетании с достижениями в понимании генетической и молекулярной природы привела к созданию сложной парадигмы поддерживающего лечения. Клиницистам может быть сложно оставаться в курсе быстро появляющихся данных и изменяющихся схем лечения. На этом вебинаре будут обсуждаться ключевые концепции поддерживающей терапии рака яичников, рассмотрены данные о клинической эффективности и безопасности потенциальных вариантов лечения, а также определены и рассмотрены особые аспекты мониторинга и обучения пациентов и лиц, осуществляющих уход за ними.
Цели вебинара:
• Представить данные о безопасности и эффективности PARP ингибиторов и антиангиогенных средств в качестве поддерживающей терапии для пациентов с распространенным раком яичников
• Идентификация пациентов с распространенным раком яичников, которые являются кандидатами на поддерживающую терапию, а также сравнение и сопоставление индивидуальных характеристик пациента и данных конкретного клинического случая, таких как результаты тестирования на мутацию BRCA1/2, при выборе одного из вариантов поддерживающей терапии
• Обзор параметров мониторинга и этапов консультирования пациентов, которые следует учитывать при использовании поддерживающей терапии при распространенном раке яичников
• Ежемесячные онкологические мультидисциплинарные консилиумы NCCN: мультидисциплинарный подход к индивидуализированному лечению
Достижения в лечении гастроинтестинальных стромальных опухолей желудочно-кишечного тракта (GIST) и других сарком мягких тканей – 21 сентября 2021 года
Диагностика и лечение сарком мягких тканей претерпели изменения в последние годы. Морфологическая диагностика в сочетании с дополнительным молекулярно-генетическим тестированием считаются золотым стандартом диагностики. Методы лечения включают новые системные подходы к лечению, а также современные методики лучевой терапии и абляции. Непрерывное обучение онкологов необходимо для своевременного информирования о последних достижениях в ведении пациентов с мягкотканными саркомами и улучшения результатов их лечения.
Цели курса:
• Ознакомление с новыми методами молекулярно-генетического тестирования, используемыми для диагностики GIST и других сарком мягких тканей
• Обобщение новых вариантов системной терапии
• Обсуждение особенностей междисциплинарного ведения пациентов с мягкотканными саркомами
Достижения в системном лечении почечно-клеточного рака – 20 октября 2021 года
Возрастающая доступность иммунотерапии и таргетной терапии предоставляет пациентам с метастатическим почечно-клеточным раком (ПКР) больше возможностей для лечения в первой и последующих линиях, но клиницистам не всегда легко определить, какие препараты и в каких комбинациях/режимах являются наиболее эффективными при различными вариантах гистологиями рака почки и в разных группах риска. Консилиум NCCN поможет стратифицировать наиболее эффективные схемы лечения в зависимости от гистологии и группы риска.
Цели курса:
• Обобщить информацию по появляющимся новым вариантам системной терапии, доступным для пациентов с распространенным ПКР
• Обозначить конкретные одобренные FDA схемы лечения пациентов с прогрессирующим ПКР
• Обсудить, какие схемы системной терапии первой и второй линии предпочтительны для пациентов с распространенным ПКР с учетом гистологии и группы риска
Оптимальное мультидисциплинарное лечение больных распространенным раком пищевода – 29 октября 2021 года
Принятие решений в отношении лечения запущенного или метастатического рака пищевода требует, чтобы клиницисты были знакомы с существующими и новыми системными методами лечения, таргетной терапией, а также с наиболее эффективными и хорошо переносимыми комбинированными схемами лечения. Клиницистам необходимо регулярно оценивать данные последних клинических исследований, чтобы принимать обоснованные решения по выработке наиболее подходящего плана лечения, особенно по мере того, как новые схемы таргетного лечения, а также новые показания для существующих вариантов таргетной терапии получают одобрение FDA.
Цели курса:
• Обсудить важность мультидисциплинарной помощи пациентам с раком пищевода
• Обозначить оптимальный подход к лечению пациентов с различными клиническими вариантами рака пищевода
• Оценить существующие данные по лечению распространенного рака пищевода с помощью таргетной терапии
Кроме того, NCCN предлагает поучаствовать в онлайн-мероприятиях без конкретной даты (по запросу), лекции по предложенным темам записаны и будут доступны при регистрации в течение обозначенных сроков:
• Лечение местнораспространенного колоректального рака (20 мая 2021 – 1 марта 2022 года)
• Рекомендации NCCN: немелкоклеточный рак легкого, версия 2.2021 (10 марта 2021 – 10 марта 2022 года)
• Мультидисциплинарное лечение
рака предстательной железы (14
мая 2021 – 1 марта 2022 года)
