Дорогие коллеги, дорогие друзья!
В чём же дело?.. Почему в августе так часто возникает ощущение грусти, мимолетности, недосказанности, недоделанности? Ожидание лета в течение долгих месяцев серой сырости или лютого холода много продолжительнее самого лета и радостных дней отпуска, когда огромный список запланированных на свободные от работы дни остается выполненным в лучшем случае наполовину…
Фердинанд Георг Вальдмюллер (австрийский художник).
«Натюрморт с великолепным кубком» 1839 г. 63,5х50 см. Холст, масло. Галерея Бельведер, Вена, Австрия.
Этого года неяркое лето. В маленьких елках бревенчатый дом. Август, а сердце еще не согрето. Минуло лето… Но дело не в том.
RUSSCO ВЫСТУПИЛО ОДНИМ ИЗ ОРГАНИЗАТОРОВ IV ВСЕРОССИЙСКОЙ КОНФЕРЕНЦИИ В ГОРНО-АЛТАЙСКЕ
Со 2-го по 5-е августа в Республике Алтай (г. Горно-Алтайск) проходила IV Всероссийская конференция с международным участием «Опухолевые маркёры: фундаментальные и клинические аспекты»....

ПРЕДОПЕРАЦИОННАЯ ЛУЧЕВАЯ ТЕРАПИЯ НЕ УЛУЧШАЕТ РЕЗУЛЬТАТЫ ЛЕЧЕНИЯ БОЛЬНЫХ МЕСТНОРАСПРОСТРАНЕННЫМ РАКОМ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Протоковая аденокарцинома поджелудочной железы демонстрирует стремительный рост заболеваемости и смертности в связи с поздней диагностикой и относительной резистентностью к...
10 Лет Национальной программе Российского онкологического общества клинической онкологии
СОВЕРШЕНСТВОВАНИЕ МОЛЕКУЛЯРНОЙ-ГЕНЕТИЧЕСКОЙ ДИАГНОСТИКИ В РОССИЙСКОЙ ФЕДЕРАЦИИ

САРКОМЫ НА ASCO 2022: ПЛОДЫ ГИСТОТИП-СПЕЦИФИЧЕСКОГО ПОДХОДА В ИССЛЕДОВАНИЯХ ОТ IB ДО III ФАЗЫ
Все больше и больше на конференциях, посвященных саркомам, мы видим тенденцию на изучение исследовательских препаратов (ИП) в гомогенных группах, а с учетом орфанности заболевания...

ДИСКУССИОННАЯ СЦЕНА. РАК МОЛОЧНОЙ ЖЕЛЕЗЫ IV СТАДИИ: РАДИКАЛЬНЫЙ ИЛИ ПАЛЛИАТИВНЫЙ ПОДХОД К ЛЕЧЕНИЮ
В 2021 году в России среди почти 70000 пациенток с установленным диагнозом рака молочной железы (РМЖ) 8% имели IV стадию заболевания. Стандартный подход к лечению РМЖ IV стадии...

ПОДДЕРЖИВАЮЩАЯ ТЕРАПИЯ В ОНКОЛОГИИ
В рамках VII Российской конференции «Поддерживающая терапия в онкологии» прошел сателлитный симпозиум, посвященный анемиям при злокачественных новообразованиях. Приветственное...
МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКАЯ ДИАГНОСТИКА В РОССИИ: ВНУТРЕННИЙ КОНТРОЛЬ КАЧЕСТВА
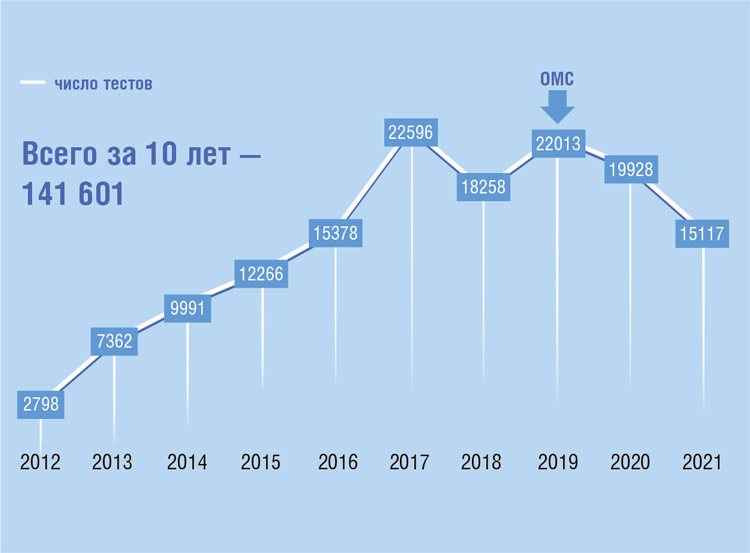
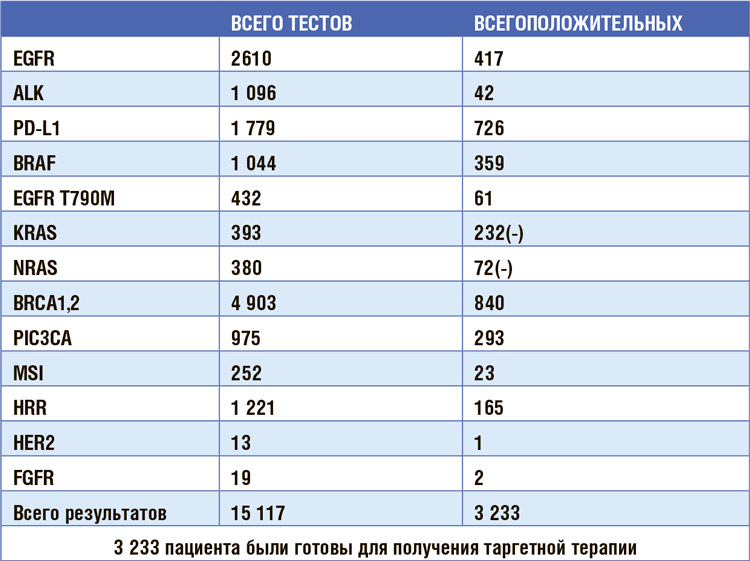
Российское общество клинической онкологии в течение 11 лет проводит программу «Совершенствование молекулярно-генетической диагностики в Российской Федерации с целью повышения эффективности противоопухолевого лечения». Более 140 000 тестов выполнено за этот период при 9 нозологических формах рака. Благодаря этому у нескольких десятков тысяч пациентов появилась...
ПОДМЕЧЕНО ЧЕЛОВЕКОМ
Меня зовут Ал-Файсаль, или просто Ал, я из Омана, хотя наполовину марокканец. Считаю себя фотографомсамоучкой, серьёзно влюбленным в фотографию уже несколько лет. Я родился в Касабланке, возможно, поэтому большинство моих работ отражают влияние двух разных арабских культур. Мне двадцать лет, изучаю юриспруденцию в университете Брайтона (Великобритания), помимо...

МЕТОДЫ РАБОТЫ ОНКОПСИХОЛОГА
В предыдущих статьях мы рассуждали о доступности психологической помощи в российской онкологии и рассматривали клинические и поведенческие симптомы у пациента, сообщающие о...

ИССЛЕДОВАНИЯ И ЛЕЧЕНИЕ РАКА ЯИЧНИКОВ: НОВЫЙ КОНСЕНСУС GYNECOLOGIC CANCER INTERGROUP (GCIG)
В октябре 2021 года состоялась VI конференция Gynecologic Cancer InterGroup (GCIG) – собрание специалистов из 33 наиболее авторитетных исследовательских групп в онкогинекологическом...

РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС - 2022
Российский онкологический конгресс - крупнейшее национальное онкологическое мероприятие в Европе с международным участием.
Анонс
-

15 -17 ноября 2022
РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС - 2022
-

15 ноября 2022
КОНКУРС МОЛОДЫХ УЧЕНЫХ В РАМКАХ XXVI РОССИЙСКОГО ОНКОЛОГИЧЕСКОГО КОНГРЕССА
Дорогие коллеги, дорогие друзья!
«Август, а сердце еще не согрето.
Минуло лето... Но дело не в том» ©
В чём же дело?.. Почему в августе так часто возникает ощущение грусти, мимолетности, недосказанности, недоделанности? Ожидание лета в течение долгих месяцев серой сырости или лютого холода много продолжительнее самого лета и радостных дней отпуска, когда огромный список запланированных на свободные от работы дни остается выполненным в лучшем случае наполовину… В научной жизни – относительное августовское затишье с минимумом мероприятий, хотя новые и интересные публикации продолжают появляться с регулярностью даже в период отпусков. О некоторых недавних публикациях вы узнаете со страниц августовского номера. Вдогонку к июльским статьям о новостях конгресса ASCO предлагаем ознакомиться с последними достижениями в лечении сарком. Дискуссионная сцена посвящена вечно спорной проблеме – целесообразности проведения условно радикального или только паллиативного лечения больным с изначально метастатическим раком молочной железы; данные по этому вопросу весьма противоречивы, и оппоненты представили их с точки зрения предпочтительности различных подходов. Надеемся, что информация о методах работы онкопсихологов заинтересует наших коллег и позволит чаще прибегать к услугам этих специалистов, рекомендуя их своим пациентам, нуждающимся в психологической поддержке.
По-прежнему продолжается прием тезисов для XXVI Российского онкологического конгресса, а наступающая осень означает, что работа по его подготовке
выходит на финишную прямую и становится максимально интенсивной. Пусть
финальные летние дни не разочаруют вас, и все же согреют и сердце, и душу,
и взор, насладят вкусом летних фруктов, яркостью красок и насыщенностью
августовских ароматов!
Увидимся осенью!
Команда RUSSCO
Фердинанд Георг Вальдмюллер (австрийский художник).
«Натюрморт с великолепным кубком» 1839 г. 63,5х50 см. Холст, масло.
Галерея Бельведер, Вена, Австрия.

* * *
Этого года неяркое лето.
В маленьких елках бревенчатый дом.
Август, а сердце еще не согрето.
Минуло лето… Но дело не в том.
Рощу знобит по осенней погоде.
Тонут макушки в тумане густом.
Третий десяток уже на исходе.
Минула юность… Но дело не в том
Старше ли на год, моложе ли на год,
дело не в том, закадычный дружок.
Вот на рябине зардевшихся ягод
первая горсточка, словно ожог.
Жаркая, терпкая, горькая ярость
в ночь овладела невзрачным кустом.
Смелая зрелость и сильная старость —
верность природе… Но дело не в том.
Сердце мое, ты давно научилось
крепко держать неприметную нить.
Все бы не страшно, да что-то случилось.
В мире чего-то нельзя изменить.
Что-то случилось и врезалось в души
всем, кому было с тобой по пути.
Не обойти, не забыть, не разрушить,
как ни старайся и как ни верти.
Спутники, нам не грозит неизвестность.
Дожили мы до желанной поры.
Круче дорога и шире окрестность.
Мы высоко, на вершине горы.
Мы в непрестанном живем озаренье,
дышим глубоко, с равниной не в лад.
На высоте обостряется зренье,
пристальней и безошибочней взгляд.
Но на родные предметы и лица,
на августовский безветренный день
неотвратимо и строго ложится
трудной горы непреклонная тень.
Что же, товарищ, пройдем и сквозь это,
тень разгоняя упрямым трудом,
песней, которая кем-то не спета,
верой в грядущее, словом привета…
Этого года неяркое лето.
В маленьких елках бревенчатый дом.
Маргарита Алигер. Август. 1945 г
RUSSCO ВЫСТУПИЛО ОДНИМ ИЗ ОРГАНИЗАТОРОВ IV ВСЕРОССИЙСКОЙ КОНФЕРЕНЦИИ В ГОРНО-АЛТАЙСКЕ


Со 2-го по 5-е августа в Республике Алтай (г. Горно-Алтайск) проходила IV Всероссийская конференция с международным участием «Опухолевые маркёры: фундаментальные и клинические аспекты». Одним из ее организаторов, наряду с Горно-Алтайским государственным университетом, НМИЦ онкологии им. Н.Н. Блохина Минздрава России, Институтом химической биологии и фундаментальной медицины СО РАН и Межрегиональной общественной организацией молекулярных генетиков в онкологии и онкогематологии (МОО ОМГО), выступило Российское общество клинической онкологии (RUSSCO).
Основными целями конференции являлись – обзор современных трендов в онкодиагностике и формирование научно-практического сотрудничества ученых, работающих в области фундаментальной онкологии и клинических врачей. В первую очередь затрагивались следующие направления: молекулярно-генетическая диагностика в онкологической практике; онкопатология; биологические маркеры в клинической диагностике онкологических заболеваний – фундаментальные и клинические аспекты; онкогематология – диагностические возможности; новые подходы для поиска и выявления биомаркеров.


В последний день работы RUSSCO провело сессию, посвященную итогам реализации Программы молекулярно-генетического тестирования и контролю качества за 10 лет.
С первым докладом выступила Исполнительный директор RUSSCO, профессор кафедры онкологии факультета усовершенствования врачей ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России, д.м.н. Вера Витальевна Карасева. Она не только довела до участников конференции результаты десятилетней работы Общества по реализации Национальной Программы RUSSCO «Совершенствование молекулярногенетической диагностики в Российской Федерации с целью повышения эффективности противоопухолевого лечения», но и сообщила о новых направлениях, проводимых в ее рамках, а также наиболее значимых образовательных мероприятиях RUSSCO для молекулярных генетиков.
За 10-летний период работы выполнено более 140 000 тестов. Только по
результатам тестирования в рамках
Программы у более 3000 пациентов
были определены предикторы ответа, что позволило назначить им инновационную терапию. К настоящему
времени тестирование выполняется
для 14 молекулярных маркеров в 9
нозологиях.
Следует отметить, что в 2021 г. в
программу включились следующие
референсные лаборатории: НМИЦ
радиологии им. П.А. Герцена Минздрава России, НМИЦ онколгии им.
Н.Н. Блохина Минздрава России,
МКНЦ им. А.С. Логинова Минздрава
России и Томский НИМЦ (НИИ онкологии), которыми было выполнено
более 2000 тестов в рамках ОМС для
регионов, в которых пока не проводятся молекулярно-генетические исследования, направленные на определение предикторов для назначения
таргетной и иимунотерапии.

Затем эксперты RUSSCO рассказали о перспективах внедрения NGS
в клиническую практику и о своем
опыте применения этой технологии. К.м.н. Ирина Анатольевна Демидова представила современные
подходы и перспективы в молекулярной диагностике при раке легкого, и особенно, что должно быть
внедрено в реальную практику в
ближайшие годы. О результатах
HRR тестирования у 650 российских пациентов, страдающих раком
предстательной железы, доложила
к.м.н. Татьяна Владимировна Кекеева. В ее выступлении был проведен детальный анализ причин, влияющих на частоту выявления HRR,
а также сопоставлены зарубежные и
отечественные данные. К.м.н. Анна
Михайловна Строганова сделала
сообщение о диагностике мутаций
в генах BRCA1/2 методом NGS при
злокачественных новообразованиях различных локализаций. Ею был
представлен не только личный опыт
в этой области молекулярной генетики, но и проблемные вопросы,
касающиеся наследственных форм
злокачественных новообразований.
В фойе Конференции на стенде Российского общества клинической
онкологии все желающие могли получить печатную продукцию Общества (газеты, журналы) и различные
информационные материалы, как о
Программе МГД, так и о RUSSCO в
целом.
ПРЕДОПЕРАЦИОННАЯ ЛУЧЕВАЯ ТЕРАПИЯ НЕ УЛУЧШАЕТ РЕЗУЛЬТАТЫ ЛЕЧЕНИЯ БОЛЬНЫХ МЕСТНОРАСПРОСТРАНЕННЫМ РАКОМ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Автор: С.А.Тюляндин
Председатель Российского общества
клинической онкологии, Москва
Протоковая аденокарцинома
поджелудочной железы демонстрирует стремительный рост
заболеваемости и смертности в
связи с поздней диагностикой и
относительной резистентностью
к лекарственной и лучевой терапии. Лекарственная терапия доказала свою эффективность для
больных этой опухолью, улучшив
результаты оперативного лечения
при ее адъювантном назначении
и увеличив продолжительность
жизни больных с метастатическим процессом. Для больных с
местнораспространенным процессом актуальной задачей является назначение химиотерапии с
целью уменьшения распространения опухоли и возможности
выполнения радикальной резекции. Предоперационная или периоперационная химиотерапия
в этом случае позволяет провести
селекцию больных, которые выиграют от выполнения хирургического удаления опухоли. Вместе с
тем, проведенные исследования
показывают, что предоперационная химиотерапия позволяет выполнить R0 резекцию лишь ограниченному числу пациентов, что
обуславливает необходимость ее
усиления. Теоретически для этой
цели может быть целесообразно
применение лучевой терапии. В
рандомизированном исследовании II фазы Alliance A021501 изучалась рациональность использования на предоперационном
этапе последовательной химиолучевой терапии в сравнении с
только химиотерапией.
В исследование включались больные с местнораспространенным
погранично операбельным раком поджелудочной железы без
отдаленных метастазов в общем
удовлетворительном состоянии.
В группе химиотерапии на предоперационном этапе проводили 8
курсов лечения mFOLFORINOX.
Больные, рандомизированные в
группу лучевой терапии, после
7 курса mFOLFORINOX прекращали химиотерапию и через 2-4
недели после ее окончания получали стереотаксическую лучевую
терапию (SABR) в суммарной
дозе 33-40 Гр за 5 фракций. После
окончания предоперационного
этапа проводилось рестадирование пациентов для определения
возможности выполнения хирургического этапа. Операция выполнялась в сроки от 4 до 8 недель
после окончания лечения. Основным критерием эффективности
была выбрана 18-месячная общая
выживаемость.
В исследование было включено
110 больных, все они получили 8
или 7 курсов химиотерапии, 40
(73%) больных из рандомизированных в группе лучевой терапии
получили SBRT. Хирургический
этап лечения был осуществлен у
58% и 51% больных в группе химиотерапии и химиолучевой терапии соответственно. Панкреатоэктомия была выполнена у 49%
и 35% пациентов соответственно,
при этом R0 резекция была достигнута у 88% и 74% больных в
группе химио- и химиолучевой
терапии. Медиана продолжительности жизни составила 42,9 и
17,1 мес., показатель 18-месячной
общей выживаемости – 66,1% и
47,4% соответственно.
Авторы делают вывод, что добавление лучевой терапии к химиотерапии на предоперационном
этапе не увеличивает частоту
выполнения R0 резекций и не
улучшает отдаленные результаты
лечения больных местнораспространенным погранично операбельным раком поджелудочной
железы. Проведение 8 циклов химиотерапии (mFOLFRINOX) предоперационно остается стандартным подходом у этой популяции
больных.
Результаты данного исследования подтверждают результаты
нескольких рандомизированных
исследований III фазы. В исследовании PREOPANC у больных
с местнораспространенным резектабельным или погранично
резектабельным раком поджелудочной железы сравнивали эффективность предоперационной
химиолучевой терапии с последующей операцией и первоначальное оперативное лечение с
проведением адъювантной химиотерапии. Проведение предоперационной химиолучевой терапии не улучшило отдаленные
результаты лечения, медиана
общей выживаемости составила
16,0 и 14,3 мес. соответственно. В
исследовании LAP07 больные с
местнораспространенным раком
поджелудочной железы с отсутствием прогрессирования после
индукционной химиотерапии
рандомизировались в группу немедленного хирургического лечения или группу проведения перед
операцией дополнительной лучевой терапии. Добавление лучевой
терапии достоверно уменьшило
частоту локального прогрессирования, но не сказалось на отдаленных результатах: медиана
продолжительности жизни составила 16,5 мес. для химиотерапии и 15,2 мес. для химиолучевого
лечения. Не получено убедительных свидетельств, что добавление
лучевой терапии на этапе проведения адъювантного лечения
улучшает результаты оперативного лечения. Использование
химиотерапии у больных с местнораспространенным процессом
привело к достоверному, хотя
и далекому от удовлетворения
увеличению продолжительности
жизни, в то время как многолетние попытки интеграции лучевой
терапии на пред- или послеоперационном этапе потерпели поражение. Хочется надеяться, что
проводящиеся в настоящее время исследования (PREOPANC2,
MASTERPLAN) смогут определить роль лучевой терапии в
мультидисциплинарном лечении
больных местнораспространенным раком поджелудочной железы.
Литература:
1. Katz MHG, Shi Q, Meyers J, et al. Efficacy of preoperative mFOLFIRINOX vs mFOLFIRINOX plus hypofractionated radiotherapy for borderline resectable adenocarcinoma of the pancreas: the A021501 phase 2 randomized clinical trial. JAMA Oncol. Published online July 14, 2022.
2. Versteijne E, Suker M, Groothuis K, et al. Dutch Pancreatic Cancer Group. Preoperative chemoradiotherapy versus immediate surgery for resectable and borderline resectable pancreatic cancer: results of the Dutch randomized phase III PREOPANC trial. J Clin Oncol. 2020; 38: 1763- 1773.
3. Hammel P, Huguet F, van Laethem
JL, et al. LAP07 Trial Group. Effect of
chemoradiotherapy vs chemotherapy
on survival in patients with locally
advanced pancreatic cancer controlled
after 4 months of gemcitabine with
or without erlotinib: the LAP07
randomized clinical trial. JAMA.
2016; 315: 1844-1853.
10 Лет Национальной программе Российского онкологического общества клинической онкологии

САРКОМЫ НА ASCO 2022: ПЛОДЫ ГИСТОТИП-СПЕЦИФИЧЕСКОГО ПОДХОДА В ИССЛЕДОВАНИЯХ ОТ IB ДО III ФАЗЫ
Автор: Тарарыкова Анастасия Алексеевна
НИИ клинической онкологии им. акад. РАН и РАМН Н.Н. Трапезникова
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
Все больше и больше на конференциях, посвященных саркомам, мы
видим тенденцию на изучение исследовательских препаратов (ИП) в
гомогенных группах, а с учетом орфанности заболевания речь идет об
анализе малых групп пациентов с
достаточно тяжелым и долгим периодом набора. Кроме того, поставлен
акцент на подборе ИП (или синергизма при их комбинации) исходя из
понимания принципа его действия
и соответствующем выборе адекватных конечных точек в исследовании. Эти критерии необходимо соотносить с гистологическим типом
саркомы, ее биологией и течением
заболевания. Несмотря на практическую сложность с набором такой
группы, как показывает прошедшая
конференция ASCO 2022, это возможно, причем не только при проведении исследований ранних фаз, но и
в рандомизированном исследовании
III фазы. Решение очень простое и
довольно понятное – это многоцентровая и международная кооперация саркомных центров, а также четкие критерии набора, учитывающие
частоту встречаемости гистологического типа и возможности (или доступности) лечения участвующих в
исследовании центров. Почему речь
идет о доступности лечения в рамках
КИ? Потому что помимо новых ИП
существует ряд открытых вопросов в
уже имеющихся схемах лечения. Это
не отменяет роль трансляционных
исследований, которые дают нам все
больше информации относительно
биологии сарком.
Пожалуй, самым значимым по своему содержанию и смыслу является
исследование III фазы по оценке эффективности топотекана/циклофосфамида и высоких доз ифосфамида у
пациентов с рецидивной или первичной рефрактерной саркомой Юинга
(rEEcur), которое является первым
в истории рандомизированным контролируемым исследованием второй
линии при саркоме Юинга (СЮ) [1].
Пятилетняя общая выживаемость
для первично-локализованной СЮ в
возрасте <20 лет составляет 70-75%.
У пациентов с рецидивом заболевания при неэффективности стандартной терапии прогноз значительно
хуже. До получения результатов исследования rEECur у нас было очень
мало данных для выбора тактики лечения таких пациентов. Из четырех
изученных схем либо проспективных исследований II фазы не было
вообще (иринотекан/темозоламид),
либо исследование было с небольшим набором пациентов, где сообщалось только о частоте объективного ответа (ЧОО).
Чтобы провести рандомизированное исследование редкого заболевания, авторы сформировали группу,
в которую вошли 13 европейских
стран, Новая Зеландия и Австралия,
а также более 15 организаций, включая исследовательские консорциумы,
научные центры, национальные и пациентские организации. Такое международное сотрудничество неминуемо связано с длительным периодом
подготовки, где для планирования,
финансирования и старта исследования требуется несколько лет, для завершения необходима максимально
возможная отдача. К решению этой
задачи авторы подошли несколькими способами.
Был выбран байесовский дизайн исследования с включением 4 групп,
что позволило изучить различные
схемы лечения. Исследование, в
общем, состояло из II и III фазы,
первичной конечной точкой для II
фазы была ЧОО, а для III фазы – бессобытийная выживаемость (БСВ).
На основе выбранной первичной
конечной точки во II фазе и методом «исключая лишнего» в итоге в
III фазе оставались всего две схемы.
Это было сделано для того, чтобы
можно было быстро перейти к III
фазе, сравнив два лучших режима. У
такого подхода есть очевидный минус – существует вероятность того,
что режим, исключенный во время
II фазы, может оказаться столь же
эффективным, как и один из окончательных режимов в III фазе: если
ЧОО не является хорошим суррогатом БСВ, то исключенный рукав
может быть лучше, чем оставшийся.
Еще одна уникальность исследования заключалась в том, что рандомизации между всеми четырьмя группами не требовалось. Пациенты и
врачи, участвующие в исследовании,
должны были согласиться только на
рандомизацию в две или более группы испытаний. Приемлемые схемы
сообщались после регистрации, но
до рандомизации. Такой подход был
использован для максимального увеличения числа пациентов с редким
заболеванием, поскольку предполагалось несколько проблем. Некоторые схемы могут быть недоступны
в определенных странах, пациент
может не соответствовать критериям включения в одну из конкретных
групп (схем) лечения или пациент
или врач могут отказаться от конкретной группы (схемы) лечения.
Так, в группу с ифосфамидом было
набрано всего 78 пациентов, хотя
набор был открыт до апреля 2022
г., а в группу с топотеканом/циклофосфамидом – 162, в то время как в
исключенных группах с гемцитабином/доцетакселом и иринотеканом/
темозоламидом было набрано 72 и
127 пациентов соответственно. Причина заключается в том, что большее количество и исследователей, и
пациентов отказывались на этапе до
рандомизации от лечения в группе
с ифосфамидом. Это связано как с
возможностью центров провести
данный режим, так и с опасениями
докторов и пациентов по поводу
возможного большего риска нежелательных явлений выбранной схемы.
Это вносит определенные опасения,
что пациенты, рандомизированные в
группу ифосфамида, могут отличаться от пациентов, рандомизированных в другие группы.
Прежде чем начать исследование, авторы провели несколько симуляций,
смоделированных с разной годовой
БСВ от 20% до 40%. Причины такого диапазона в БСВ заключаются в
том, что до настоящего исследования
данные о БСВ для этих схем проспективно не были достаточно описаны.
Первоначально авторы приняли
решение отказаться от первых двух
групп после того, как 50 пациентов
были набраны во все группы (2018
г.), и от второй группы после того, как
в них были набраны 75 пациентов
(2020 г.), основываясь на первичной
конечной точке для II фазы. Планировалось включение до 200 случаев
в два конечных рукава, но с учетом
полученных результатов комитет по
контролю данных настоял на закрытии набора и публикации данных.
Что касается общих характеристик
(время появления рецидива/прогрессирования, распространенность
заболевания) для всех 439 рандомизированных случаев, то у 85% пациентов был первый эпизод прогрессирования: 52% – менее двух лет после
завершения первичного лечения,
18% – первичная рефрактерность,
15% – рецидив через 2 и более лет.
У большинства (85%) пациентов
было метастатическое заболевание
(33% – метастазы в легкие). Каждый
рукав был сбалансирован по этим характеристикам и пропорционально
существенно не отличался от общей
когорты.
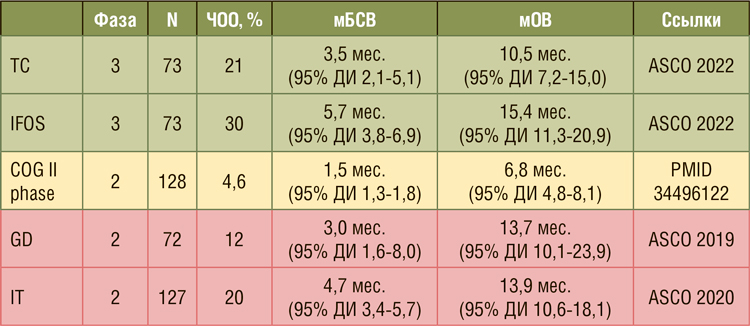
Медиана БСВ в группе топотекана/
циклофосфамида составила 3,5 месяца (95% ДИ 2,1-5,1) и 5,7 месяца (95%
ДИ 3,8-6,9) в группе ифосфамида, что
соответствует 10% разнице в 6-месячной выживаемости между группами (37% и 47% соответственно).
Вероятность того, что БСВ при ифосфамиде лучше, чем при топотекане/
циклофосфамиде, составляет 96%
(HR=0,73; 95% ДИ 0,51-1,05). Вторичная конечная точка была также
достигнута, медиана общей выживаемости (мОВ) составила 10,5 месяца
(95% ДИ 7,2-15,0) и 15,4 месяца (95%
ДИ 11,3-20,9) для топотекана/циклофосфамида и ифосфамида соответственно. Помимо пятимесячной разницы между группами в медиане ОВ,
одногодичная разница ОВ составила
10%. Вероятность того, что ОВ при
IFOS лучше, чем при TC, составляет
94% (HR=0,73; 95% ДИ 0,50-1,08).
При анализе подгрупп в соответствии с возрастом (≤14 и >14 лет)
было отмечено, что группа ифосфамида была равноэффективной в
обеих группах по сравнению с топотеканом/циклофосфамидом, но
наблюдалась очевидная разница для
детей (≤14 лет). Также у детей в группе ифосфамида отмечались более
высокие показатели качества жизни
по сравнению с топотеканом/циклофосфамидом, в отличие от подростков или взрослых.
Что касается оценки безопасности,
то для 146 пациентов, включенных
в III фазу сравнения, ифосфамид
с большей вероятностью вызывал
токсичность 3-й степени. Частота
фебрильной нейтропении была одинаковой в двух группах, но у пациентов, получающих ифосфамид, чаще
встречались инфекции 3 степени.
Характерные для высокодозного
ифосфамида нежелательные явления
(НЯ) ожидаемо встречались чаще,
чем в группе топотекана/циклофосфамида: случай энцефалопатии 3 степени (8%) или нарушение функции
почек (8%). Если посмотреть на причину выхода из КИ, то в 53% случаев
в группе топотекана/циклофосфамида – это прогрессирование, а в группе ифосфамида 22% – прогрессирование и 26% – вследствие НЯ. Но! В
группе топотекана/циклофосфамида
возможно было снижение доз и продолжение участия в КИ, тогда как в
группе с ифосфамидом – нет.
Сравнивая полученные данные с
историческим эталоном (исследование COG II фазы), где медиана БСВ
и медиана ОВ для данных пациентов
была 1,5 и 6,8 месяца соответственно,
были получены лучшие результаты
в обоих исследуемых рукавах [2].
Результаты в исключенных рукавах
были представлены на предыдущих
конференциях ASCO – 2019 и 2020 гг.
(таблица 1). И в свете полученных результатов их так же важно оценить.
В то время как ЧОО для гемцитабина/доцетаксела составляет менее
20%, как гемцитабин/доцетаксел,
так и иринотекан/темозоломид имеют лучшую медиану БСВ и ОВ, чем
исторический контроль (исследование COG II фазы). В случае иринотекана/темозоломида медиана БСВ
приближается к наблюдаемой при
высоких дозах ифосфамида. В настоящее время, ввиду особенностей
набора пациентов при рандомизации, сказать однозначно, что исключенные режимы хуже, чем высокодозный ифосфамид, невозможно.
Поэтому они остаются разумными
опциями при выборе схемы лечения
рефрактерной/рецидивной саркомы
Юинга.
Таблица 1.
Сравнение результатов rEECur II/III фаза и COG II фазы.
Чем это исследование примечательно? Это первое рандомизированное
исследование эффективности и безопасности ХТ при рефрактерной и рецидивной саркоме Юинга. Дизайн исследования помог быстро достичь его
контрольных точек. Мы увидели, что
схема с высокодозным ифосфомидом
лучше, чем комбинация топотекана/
циклофосфамида, особенно у детей.
Но у нас остались другие режимы, которые непосредственно применяются
в реальной клинической практике,
а именно комбинация иринотекана/
темозоломида во вторую линию и
гемцитабина/доцетаксела в последующую.
Следующее исследование является
продолжением или дополнительным
анализом одной из важных работ по
эффективности гистотип-специфической неоадъювантной химиотерапии
(НАПХТ) [3]. Исследование, которое
проводили четыре саркомные группы, сравнивая гистотип-специфическую НАПХТ в группе сарком мягких
тканей высокого риска со стандартной химиотерапией, – комбинация
доксорубицина и ифосфамида (AI).
Финальные результаты исследования были представлены на ASCO
2019. При окончательном анализе и
медиане наблюдения 52 месяца не
выявлено статистически значимого
улучшения (ОВ, ВБП) при гистотипспецифической НАПХТ по сравнению со стандартной AI. Хотя это преимущество было очевидным для всех
гистологических подтипов, это не
относилось к миксоидной липосаркоме, где два метода лечения казались
эквивалентными. Таким образом, это
привело к внесению поправки во время третьего промежуточного анализа, чтобы продолжить рандомизацию
в когорту миксоидной липосаркомы
(AI против трабектедина) [4].
Также был выбран байесовский дизайн исследования, а первичной конечной точкой – выживаемость без
прогрессирования (ВБП). С 2017 г.
было дополнительно включено еще
36 пациентов, в общей сложности –
101 пациент с миксоидной липосаркомой, которых авторы исследования
набрали за 10 лет в 32 саркомных
центрах из четырех стран. При медиане наблюдения 66 месяцев пятилетняя ВБП составила 86% в группе
трабектедина по сравнению с 73% в
группе стандартной химиотерапии
(HR 0,60; 95% ДИ 0,24-1,46; р=0,26).
Пятилетняя ОВ составляет 88% в
группе трабектедина и 90% в группе стандартной химиотерапии (HR
1,20; 95% ДИ 0,37-3,93; р=0,77). ЧОО в
группе трабектедина, где предоперационно было выполнено три цикла,
составила 6,5%, в то время как при
стандартной химиотерапии – 13,2%.
Однако во многих исследованиях уже
сообщалось, что трабектедин является препаратом, действие которого
относительно медленное: три или
четыре цикла – это минимальное количество введений, при которых действительно можно зарегистрировать
сокращение опухоли.
При оценке безопасности в группе
трабектедина были получены ожидаемо значительно лучшие результаты по сравнению со стандартной
НАПХТ. Только частота развития гепатотоксичности 1-2 степени в группе с трабектедином была на 23% больше, чем при стандартной НАПХТ
(р=0,025), в то время как к группе AI
наблюдалась анемия, нейтропения,
фебрильная нейтропения и тромбоцитопения 3-4 степени (р<0,001).
Был ли трабектедин лучше стандартной схемы НАПХТ при миксоидной
липосаркоме? Нет. Но трабектедин и
не уступал стандартной химиотерапии и имел лучший профиль токсичности. Эффективна ли неоадъювантная химиотерапия при миксоидной
липосаркоме в целом? Авторами был
проведен анализ прогнозируемой
и наблюдаемой 5-летней ОВ с помощью сарккулятора, и общая выживаемость пациента с миксоидной
липосаркомой была выше среднего
и выше порога, который авторы обозначили для общей исследуемой популяции (10-летняя прогнозируемая
выживаемость менее 60%). Это наводит на мысль, что, возможно, следует переоценить факторы риска при
миксоидной липосаркоме, которые, в
частности, используются в сарккуляторах.
В этом году были представлены окончательные результаты исследования
IB/II фазы по комбинации ленватиниба и эрибулина при распространенной липосаркоме и лейомиосаркоме (LEADER) [5]. Ранее на основе
результатов III фазы эрибулин был
одобрен для лечения распространенной липосаркомы во второй или более поздних стадиях лечения и с
прогрессированием после антрациклина [6]. Однако первоначально в
исследование III фазы были включены пациенты как с липо-, так и с
лейомиосаркомой. Авторы настоящего исследования предполагали,
что комбинированный режим может
добиться большей эффективности
у пациентов с L-саркомами. Авторы
выбрали ленватиниб в качестве партнера для эрибулина. В исследовании
I фазы в Японии монотерапия ленватинибом показала предварительную
эффективность при лейомиосаркоме
у шести пациентов [7]. Среди этих
шести пациентов у одного наблюдался частичный ответ, у четырех заболевание было стабильным более 24
недель.
Для фазы IB конечные точки включали ограничивающую дозу токсичность и рекомендуемую дозу II фазы.
В II фазе основной конечной точкой
была ЧОО. На основании IВ фазы
доза ленватиниба составила 14 мг/
сут., а эрибулина – 1,1 мг/м2 в 1, 8 дни.
Для II фазы был выбран двухэтапный
минимаксный план Саймона: ЧОО
на уровне от 5% (H0) до 20% (H1).
Промежуточные данные были опубликованы на ASCO 2020, когда 2/3
пациентов прошли хотя бы одну контрольную оценку эффекта. За прошедший период увеличился набор
пациентов и период наблюдения, но
сохранилось соотношение гистологических групп.
Стоит отметить, что в исследовании
11 пациентов (37%) получали данную комбинацию в качестве терапии
первой линии при распространенном
заболевании. Что касается нежелательных явлений, то наиболее распространенными отклонениями 3-4
степени были ладонно-подошвенный
синдром, нейтропения, гипертензия,
протеинурия и фебрильная нейтропения. Все эти НЯ были преодолены
либо снижением дозы, либо ее прерыванием. ЧОО составила 20% (6/30
пациентов): частичный ответ – 6/30,
стабилизация заболевания – 21/30.
Если посмотреть на пациентов, у
которых был достигнут частичный
ответ, то эти показатели совпадают с
теми, что были представлены в 2020
году. Это означает, что за последние
два года новых пациентов с частичным ответом не было. Другой вопрос
– важен ли частичный ответ, когда
мы не можем излечить, но можем
продлить жизнь? Соответственно,
правильно ли была выбрана конечная первичная точка? Не было статистически значимых различий по
ЧОО для тех, кто получает схему в
качестве первой линии лечения или
последующей. У 23 (77%) из 30 пациентов «отсутствие роста» по сути
можно расценивать как наилучший
достигнутый эффект.
При анализе ВБП и стратификации
по гистологическому типу опухоли
или линии лечения медиана ВБП
для лейомиосаркомы составила 8,56
месяца, а для липосаркомы – 11,36
(p=0,68). У тех, кто получал комбинацию в качестве терапии первой линии, медиана ВБП составила 16 месяцев, а в качестве более поздней линии
– 8,56 (p=0,41). Таким образом, эти
два показателя не отличались статистически значимо. При стратификации ОВ по гистологическому типу в
случае лейомиосаркомы наблюдалась
значительно более длительная ОВ
по сравнению с липосаркомой, при
этом медиана ОВ при лейомиосаркоме не достигнута, а медиана ОВ при
липосаркоме составила 23,6 месяца
(p=0,032). Возможно, это объясняется тем фактом, что 40% получили
комбинацию в первую линию.
При непрямом сравнении с исследованием фазы III монотерапии эрибулином ЧОО значительно отличается – 20% и 4%, как и мВБП и мОВ
(8,5 и 2,6 мес.; 27,1 и 13,5 мес.) [8]. Но,
конечно, это сравнение надо делать
очень осторожно. Помимо количества пациентов и рандомизации, в исследовании LEADER 64% пациентов
получили исследуемую комбинацию
в качестве поздней линии терапии,
тогда как в исследовании Schoffski и
соавт. в 100% случаев терапия эрибулином была в более поздние линии.
Несмотря на то, что исследование
LEADER достигло своей первичной
конечной точки, показало длительно
сохраняющейся эффект на лечение
и управляемый профиль токсичности при лечении распространенной
липо- и лейомиосаркоме, достаточно
убедительными полученные данные
не выглядят. ЧОО, судя по всему,
плохо коррелирует с выживаемостью исследуемой популяции пациентов. И мы опять же возвращаемся
к адекватности выбранной конечной
точки, ИП и гомогенности по гистологическим подтипам. Так, при
подгрупповом анализе лейомиосаркомы того же исследования III фазы
медиана ОВ составила 12,7 и 13,0 месяцев для эрибулина и дакарбазина
соответственно (HR=0,93; 95% ДИ
0,71-1,20; р=0,57), а медиана ВБП – 2,2
и 2,6 месяца (HR=1,07; 95% ДИ 0,84-
1,38; р=0,58), ЧОО – 5 и 7%. Т.е. эффективность эрибулина у пациентов
с лейомиосаркомой была сравнима
с дакарбазином, в то время как при
липосаркоме медиана ОВ составила
15,6 и 8,4 месяца (HR=0,51; 95% ДИ
0,35-0,75; p<0,001), а ВБП – 2,9 и 1,7
месяца (HR=0,52; 95% ДИ 0,35-0,78;
p=0,0015). Поэтому имеет смысл исследовать в дальнейшем эту комбинацию с разделением гистологических
подтипов и с корректировкой дизайна исследования.
И перейдем к последнему исследованию II фазы по оценке эффективности палбоциклиба при распространенной саркоме и сверхэкспрессии
CDK4, за исключением дедифференцированной липосаркомы (исследование Испанской саркомной группы)
[9]. В более чем 90% высоко(хорошо)-
дифференцированных и дедифференцированных липосаркомах наблюдается амплификация CDK4 [10].
И уже имеется несколько работ по
эффективности ингибиторов CDK4
при дедифференцированной липосаркоме: палбоциклиб (60 пациентов)
– мВБП 17,9 недель, абемациклиб (30
пациентов) – мВБП 30,4 недель [11].
Интересно было бы посмотреть эффективность ингибиторов при других гистологических подтипах, где
также выявляется сверхэкспрессия
CDK4. Таким образом, было разработано исследование II фазы для
изучения палбоциклиба при распространенной прогрессирующей саркоме, сверхэкспрессии в CDK4 и отсутствии сверхэкспрессии в CDKN2A.
Не было никаких ограничений по
подтипу саркомы, исключались
только дифференцированная липосаркома, ангиосаркома и рабдомиосаркома. В анамнезе должна быть, по
крайней мере, одна предшествующая
линия, и всем пациентам до начала
лечения обязательно выполнялась
биопсия для оценки экспрессии генов
CDK4 и CDKN2A. В период с декабря 2018 г. по ноябрь 2021 г. набрано
214 пациентов, собрано 236 образцов
опухолей (141 – архивный материал,
95 – набран во время скрининга). Исследуя весь материал, в итоге в исследование, согласно критериям отбора,
были включены 22 пациента, в основном больные с лейомиосаркомой
(23%, 5/22).
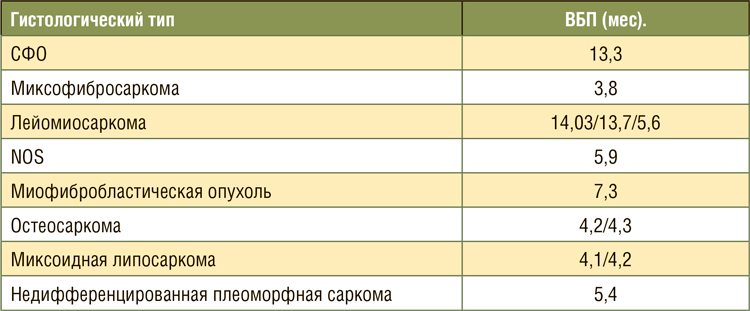
Показатель 6-месячной ВБП составил
30% (95% ДИ: 9/51). Медиана ВБП составила 4,2 месяца (0,9-7,4), а медиана общей выживаемости – почти
один год – 11,9 месяца (8,3-15,4). Что
касается ЧОО – частичных ответов
не наблюдалось, у 50% (11/22) – стабилизация заболевания. Среди всех
гистологических подтипах при лейомасаркоме и солитарной фиброзной
опухоли были самые длительные случаи ВБП (таблица 2). Выявлена корреляция между медианой ВБП и ОВ
с уровнем экспрессии CDK4: мВБП
составила 5,9 и 1,9 месяца (р=0,046),
мОВ – 15,5 и 10,6 месяца (р=0,047) в
пользу случаев со сверхэкспрессией
CDK4. Есть несколько важных моментов в обсуждении этого исследования. Во-первых, следует поблагодарить команду авторов за попытку проведения сложного и дорогостоящего по скринингу и набору исследования. Так, продемонстрирована корреляция между экспрессией CDK4 и
ВБП/ОВ при различных гистотипах
сарком. И второй вопрос: ингибирование CDK4 – и что дальше? Активный компаратор или плацебо? Ингибиторы CDK4/6 не одобрены FDA
для лечения сарком, и мы только в самом начале пути достоверной оценки
роли и места этой опции в лечении
диссеминированных сарком.
Таблица 2.
ВБП при различных гистологических подтипах сарком со сверхэкспрессией CDK4.
Источники:
1. Phase III assessment of topotecan
and cyclophosphamide and high-dose
ifosfamide in rEECur: An international
randomized controlled trial of
chemotherapy for the treatment of
recurrent and primary refractory Ewing
sarcoma (RR-ES). J Clin Oncol. 2022; 40
(suppl 17; abstr LBA2).
2. Collier AB 3rd, et al. Outcome of
patients with relapsed or progressive Ewing
sarcoma enrolled on cooperative group
phase 2 clinical trials: A report from the
Children's Oncology Group. Pediatr Blood
Cancer. 2021 Dec; 68(12): e29333.
3. Gronchi A, et al. Neoadjuvant
Chemotherapy in High-Risk Soft Tissue
Sarcomas: Final Results of a Randomized
Trial From Italian (ISG), Spanish (GEIS),
French (FSG), and Polish (PSG) Sarcoma
Groups. J Clin Oncol. 2020 Jul 1; 38(19):
2178-2186.
4. Gronchi A, et al. Neoadjuvant
chemotherapy in high-risk soft tissue
sarcomas: Results of the expanded cohort
of myxoid liposarcoma of the randomized
clinical trial from the Italian Sarcoma
Group (ISG), the Spanish Sarcoma Group
(GEIS), the French Sarcoma Group (FSG),
and the Polish Sarcoma Group (PSG).
J Clin Oncol. 2022; 40 (suppl 16; abstr
11508).
5. Tom Wei-Wu Chen, et al. A phase Ib/II
study of the combination of lenvatinib (L)
and eribulin (E) in advanced liposarcoma
(LPS) and leiomyosarcoma (LMS)
(LEADER): Efficacy updates. J Clin Oncol.
2022; 40 (suppl 16; abstr 11506).
6. Demetri GD, et al. Activity of Eribulin
in Patients With Advanced Liposarcoma
Demonstrated in a Subgroup Analysis
From a Randomized Phase III Study
of Eribulin Versus Dacarbazine. J Clin
Oncol. 2017 Oct 20; 35(30): 3433-3439.
7. Nakamichi S, et al. A phase 1 study
of lenvatinib, multiple receptor tyrosine
kinase inhibitor, in Japanese patients
with advanced solid tumors. Cancer
Chemother Pharmacol. 2015 Dec; 76(6):
1153-61.
8. Schöffski P, et al. Eribulin versus
dacarbazine in previously treated
patients with advanced liposarcoma or
leiomyosarcoma: a randomised, openlabel, multicentre, phase 3 trial. Lancet.
2016 Apr 16; 387(10028): 1629-37.
9. Phase II trial of palbociclib in advanced
sarcoma overexpressing CDK4 gene
excluding dedifferentiated liposarcoma
(DD LPS): A study from the Spanish
Group for Research on Sarcoma (GEIS).
J Clin Oncol. 2022; 40 (suppl 16; abstr
11511).
10.Dickson MA, et al. ProgressionFree Survival Among Patients With
Well-Differentiated or Dedifferentiated
Liposarcoma Treated With CDK4 Inhibitor
Palbociclib: A Phase 2 Clinical Trial. JAMA
Oncol. 2016 Jul 1; 2(7): 937-40.
11.Perez M, Muñoz-Galván S, JiménezGarcía MP, Marín JJ, Carnero A. Efficacy
of CDK4 inhibition against sarcomas
depends on their levels of CDK4 and
p16ink4 mRNA. Oncotarget. 2015 Dec 1;
6(38): 40557-74.
ДИСКУССИОННАЯ СЦЕНА. РАК МОЛОЧНОЙ ЖЕЛЕЗЫ IV СТАДИИ: РАДИКАЛЬНЫЙ ИЛИ ПАЛЛИАТИВНЫЙ ПОДХОД К ЛЕЧЕНИЮ
Автор: Шарабура Татьяна Михайловна
ГБУЗ «Санкт-Петербургский клинический научнопрактический центр специализированных
видов медицинской помощи (онкологический)», ФГБОУ ВО «СевероЗападный государственный медицинский
университет им. И.И. Мечникова», Санкт-Петербург

В 2021 году в России среди почти
70000 пациенток с установленным
диагнозом рака молочной железы
(РМЖ) 8% имели IV стадию заболевания. Стандартный подход к
лечению РМЖ IV стадии основан
на применении системной терапии,
локальным методам при этом отводится паллиативная роль. Успехи
системной терапии последних лет
способствовали улучшению выживаемости пациенток с метастатическим раком молочной железы
(мРМЖ), что определило интерес к
более агрессивному локальному лечению [1,2]. Появились сообщения о
возможности продления жизни пациентов с ограниченным метастатическим процессом за счет удаления
или высокопрецизионного высокодозного облучения (SBRT, SABR)
всех метастатических очагов. О метастаз-направленном локальном
лечении все чаще стали говорить
как о возможном новом радикальном подходе к лечению так называемой олигометастатической болезни
(ОМБ) [3,4]. Насколько обоснован
такой подход сегодня при олигометастическом РМЖ (ОмРМЖ)? Для
начала следует определить понятие
ОМБ.
В 2020 году был опубликован консенсусный документ группы экспертов ASTRO-ESTRO, определивший
критерии ОМБ, одним из основных
является наличие ограниченного
числа (до 5) метастатических очагов
(включая, возможно, и первичную
опухоль), доступных для локального
радикального лечения. По времени
появления метастазов относительно
первичной опухоли и динамики в
процессе лечения, что весьма важно
для прогноза, предложено выделять
синхронную и метахронную ОМБ,
олигопрогрессию и олигоперсистенцию. Очевидно, при существующих
вариантах ОМБ возможности локальных методов лечения в достижении радикальной или паллиативной цели различны.
У значительной части пациенток с
синхронным мРМЖ системное лечение позволяет добиться частичного
или полного ответа как со стороны
метастазов, так и первичной опухоли, что стало основанием для применения радикального локорегионального лечения (ЛРЛ), включающего
операцию и/или лучевую терапию
(ЛТ). Несколько ретроспективных
исследований показали снижение
риска смерти среди оперированных
пациенток с мРМЖ [5,6]. В 2020 году
был опубликован самый крупный
до настоящего времени метаанализ,
включавший 42 ретроспективных и
3 проспективных исследования и 216
066 пациенток с de novo мРМЖ. Среди получивших любой вариант ЛРЛ
(операция и/или ЛТ) риск смерти
оказался на 31,8% ниже в сравнении
с теми, кто получил только системное лечение (СЛ), но в трех проспективных исследованиях снижение риска смерти оказалось ниже (19,23%)
и не достигло статистической значимости [6]. В 2021 году был завершен
метаанализ 4 рандомизированных
исследовании III фазы для сравнения результатов ЛРЛ и стандартной
паллиативной терапии у 970 пациенток с мРМЖ IV стадии [7]. Несмотря на значимое улучшение времени
до локорегиональной прогрессии
(ОР 0,36; 95% ДИ 0,14-0,95; p=0,04),
ЛРЛ не оказало значимого влияния
на общую выживаемость (ОВ) (ОР
0,97; 95% ДИ 0,72-1,29; p=0,81) при
мРМЖ. Не удалось выявить и тех,
кому ЛРЛ давало бы преимущество
в выживаемости. ЛРЛ не улучшила ОВ при всех подтипах, включая
гормонопозитивный (ОР 0,96; 95%
ДИ 0,65-1,43), трижды-негативный
(ОР 1,4; 95% ДИ 0,50-3,91) и Her2-
позитивный РМЖ (ОР 0,93; 95% ДИ
0,68-1,28). Не удалось достичь улучшения ОВ и при ограниченном метастатическом процессе, как среди
пациенток с изолированными костными метастазами (ОР 0,97; 95% ДИ
0,58-1,62), так и с висцеральными
метастазами (ОР 1,02; 95% ДИ 0,77-
1,35) [7].
Справедливости ради следует признать, что отдаленные результаты
исследования MF07-01, включенного в метаанализ, показали преимущество в ОВ среди получивших ЛРЛ,
медиана ОВ достигла 46 мес. против
35 мес. в группе СЛ (р=0,003) [8]. Но
причина, вероятно, кроется в неоднородности исследуемых групп: в
группе ЛРЛ было меньше пациенток
с трижды-негативным раком и больше – с изолированными костными
метастазами и гормонопозитивными опухолями, что могло повлиять
на ОВ. Результаты же метаанализа
[7] оказались не в пользу радикального подхода при мРМЖ.
На сегодняшний день нет оснований для рутинного применения радикального локорегионального лечения при мРМЖ, хотя при определенных ситуациях, в частности, при
ОМБ, такой подход может оказаться
успешным, что требует подтверждения в соответствии с принципами
доказательной медицины [7,9]. На
практике радиотерапевту чаще приходится иметь дело с уже оперированными пациентками с мРМЖ. С
учетом вышесказанного, принимая
решение об адъювантном лечении,
специалист должен руководствоваться принципами паллиативного
подхода.
Вместе с тем, контроль над первичной опухолью существенным
образом меняет расстановку сил.
В 2020 году были опубликованы
отдаленные результаты рандомизированного исследования II фазы
SABR-COMET, показавшего значимое улучшение 5-летней ОВ (42,3%
против 17,7%; р=0,006) и 5-летней
выживаемости без прогрессирования (ВБП) (17,3% против 0%) у пациентов с ОМБ и контролируемой
первичной опухолью, получивших
SВRT на все метастатические очаги,
в сравнении со стандартной паллиативной ЛТ [10]. Результаты SABRCOMET укрепили позиции сторонников радикального локального
лечения при ОМБ. Однако пестрый
состав исследуемых групп, в которых лишь 18 из 99 пациентов имели
РМЖ, не дает оснований для изменения стандартной практики.
Следует также учесть, что радикальный подход предполагает определенный уровень требований к ЛТ:
технология – не ниже SBRT, а биологическая эффективная доза (BED10)
>100 Гр [3]. Необходимо принимать
во внимание токсичность такого высокодозного облучения. В исследовании SABR-COMET в группе SABR
лучевые повреждения grade ≥2 достигли 29% против 9% в группе СЛ
и было 3 случая смерти (4,5%), ассоциированной с SABR [10]. Впрочем,
метаанализ Viani и соавт., включавший 10 исследований и 467 пациенток с ОмРМЖ, свидетельствует о
безопасности и высоком локальном
контроле SABR. При этом 2-летняя
ОВ составила 81%, но имела значимые различия при разных подтипах:
100%, 86% и 32% при HER2+, гормонопозитивном и трижды-негативном РМЖ (p=0,001) соответственно
[11]. Влияние локальной аблативной
терапии на общую выживаемость,
вероятно, возможно при хорошем
ответе на системное лечение, при
низкой же чувствительности к СЛ, в
частности, при трижды-негативном
РМЖ, эффект и от SABR менее значим [1].
До недавнего времени большая часть
научного сообщества все же склонялась в пользу радикального подхода
к лечению при ОмРМЖ, поскольку
результаты ретроспективного и, отчасти, проспективного анализа свидетельствовали о преимуществах
последнего [12-14]. Наибольший
эффект от SBRT удалось достичь у
молодых пациенток, при контролируемой первичной опухоли, ограниченном количестве метастазов и
меньшем их объеме, при изолированных костных метастазах, хорошем ответе на системную терапию и
положительном гормональном статусе [2, 12-14]. Впрочем, достоверно
оценить вклад в улучшение ОВ собственно локального лечения на основании ретроспективного анализа
не представляется возможным.
Немногие проспективные исследования демонстрируют высокие
показатели выживаемости у пациенток с контролируемой первичной
опухолью и ограниченным (до 5)
количеством экстракраниальных
метастазов РМЖ, получивших SABR
на все метастазы, но при отсутствии
группы сравнения достигнутый результат можно смело отнести и на
счет эффективности современной
системной терапии [15,16].
Теперь понятно, с каким нетерпением все ждали результатов первого
рандомизированного исследования
II фазы NRG-BR002. В исследование
включались пациентки с мРМЖ, с
≤4 экстракраниальными метастазами и при отсутствии прогрессии
в течение ≤12 месяцев СЛ [17]. Для
пациенток с синхронными олигометастазами и первичной опухолью
требовался контроль над первичной
опухолью до рандомизации, допускалась резекция или мастэктомия
с последующей ЛТ или без. Авторы
были уверены в успехе, и по завершению II фазы исследование должно
было перейти в III фазу. В контрольной группе 65 пациенток получили
только системное лечение, в исследуемой группе системная терапия была
дополнена радикальным локальным
лечением у 60 пациенток (SBRT в
93% и операция в 2% случаев). В исследовании преобладали пациентки
с благоприятным прогнозом: 79%
имели гормонопозитивные опухоли, 13% – HER2+ и лишь у 8% был
трижды-негативный подтип. 60%
пациенток имели только 1 метастаз,
20% – синхронные метастазы и первичную опухоль. На конгрессе ASCO
в июне 2022 года были доложены результаты NRG-BR002. В группах без
и с SBRT медиана ВБП составила 23
и 19,5 мес., 36-месячная ВБП – 32,8%
и 38,1% (p=0,36), медиана ОВ не достигнута, 36-месячная ОВ составила
71,8% и 68,9% (p=0,54) соответственно. Не было токсичности Grade 5,
токсичность Grade 3 и 4 встречалась
редко. Добавление метастаз-направленной терапии к СЛ не повлияло
на ВБП и ОВ, в связи с чем авторы
отказались от проведения III фазы.
Прогрессирование в поле облучения
и в зафиксированных очагах имело
место в 6,7% и 29,2% случаев среди
получивших и не получивших SBRT
[17]. Эти цифры свидетельствуют
не только о высоком локальном
контроле SBRT, но и о локальном
эффекте системной терапии, хотя и
менее выраженном. Новые метастатические очаги преобладали над локальной прогрессией и выявлялись
в исследуемых группах с одинаковой
частотой 40%. Риск отдаленной системной прогрессии оказался, вероятно, более значимым для ОВ, чем
эффект от локального лечения, несмотря на преобладание пациенток с благоприятным прогнозом.
Но исследования продолжаются.
Идет набор в рандомизированное
исследование III фазы STEREOSEIN пациенток с de novo мРМЖ
IV ст., с положительными гормональным статусом, контролируемой первичной опухолью (операция и/или ЛТ) и ≤5 метастазами.
Основная цель – оценить эффективность радикальной SBRT при
de novo мРМЖ [18]. Возможно,
среди пациенток с индолетным течением заболевания радикальный
потенциал SBRT окажется значимым, хотя результаты NRG-BR002
оставляют мало надежды на такой
исход.
В 2019 году в Чикаго на ежегодном
конгрессе ASTRO в рамках Президентского Симпозиума состоялась
захватывающая дискуссия на тему,
может ли стереотаксическая аблативная лучевая терапия (SABR)
считаться радикальной и стать
новым стандартом лечения метастатического рака. Дебаты возглавили два профессора, всемирно известных авторитета – Robert
Timmerman и Anthony Zietman.
Первый был весьма убедителен в
призыве дать дополнительную надежду пациентам с метастазами,
второй – апеллировал исключительно к принципам доказательной медицины. В итоге участники
дискуссии высказались против
рутинного применения SABR с радикальной целью при метастатическом раке до получения надежных результатов исследований III
фазы. До начала дискуссии мнение
участников разделилось почти поровну: 53% – за и 46% – против радикальной SABR, по завершению
доля противников радикального
подхода выросла до 62% [19]. Дискуссия проводилась еще до того,
как были опубликованы результаты SABR-COMET, но для пациенток с ОмРМЖ паллиативный подход остался определяющим.
Таким образом, до настоящего времени радикальный подход к лечению олигометастатического РМЖ
не имеет убедительной доказательной базы и не должен применяться
рутинно, что не исключает проведение высокопрецизионной ЛТ с
паллиативной целью. SBRT стирает
грань между радикальной и паллиативной ЛТ, поскольку аблативный
уровень доз позволяет достичь высокого локального контроля, сопоставимого с операцией, что не противоречит паллиативным целям.
На мой взгляд, паллиативный подход к лечению олигометастатического РМЖ на сегодняшний день
более универсален в обеспечении
персонализированного выбора схемы лечения, технологии и параметров ЛТ
Список источников указан на
портале: https://www.rosoncoweb.
ru/news/oncology/2022/08/12/
Автор: Фролова Мона Александровна
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России,
доктор медицинских наук, Москва

Вопрос локального лечения при
диссеминированном раке молочной железы (РМЖ) давно обсуждается среди онкологов. Особенно
остро он стал подниматься в последние годы, когда оформился
отдельный подвид диссеминированного рака, а именно олигометастатическая болезнь. Кроме того,
успехи лекарственного лечения,
которые позволили существенно
увеличить продолжительность
жизни при определенных подтипах РМЖ, меняют локальные
подходы к лечению больных с метастатическим процессом. В зарубежной литературе в последнее
время даже оформился термин
«терапия, направленная на метастазы» (metastases directed therapy,
MDT).
Олигометастатическая болезнь
считается промежуточной стадий
между местнораспространенным
и метастатическим заболеванием и характеризуется наличием
от 1 до 5 метастатических очагов.
Есть данные, что олигометастатический рак имеет молекулярную
сигнатуру, отличную от распространенного метастатического
процесса, и, как правило, лучший
прогноз [1,2]. Таким образом,
предполагается, что при олигометастатическом раке, который
имеет меньший потенциал для
множественной диссеминации,
агрессивная локальная терапия
может быть полезна.
В последние годы опубликовано
немало данных, поддерживающих
использование локальной терапии при олигометастатической
болезни. Справедливости ради
надо отметить, что большинство
исследований носит ретроспективный характер. Так, исследование, включавшее 467 больных
метастатическим РМЖ с метастазами в легких, продемонстрировало лучшие показатели медианы
продолжительности жизни (37
против 25 мес.) и 5-летней выживаемости (38% против 18%) при
выполнении полной по сравнению
с неполной резекцией метастазов
в легких (р=0,0009) [3]. В другой
ретроспективной серии было показано преимущество в отношении общей выживаемости при выполнении резекции метастазов в
печени у больных, ответивших на
системную лекарственную терапию, по сравнению с пациентами,
у которых отмечалось прогрессирование на системной терапии
(80 против 30 мес., р<0,001) [4].
Кроме того, опубликованы исследования, продемонстрировавшие
благоприятный прогноз у больных РМЖ, которым выполнялись
резекция метастазов в головном
мозге [5,6] и костных метастазов
[7].
Кроме оперативного лечения, при
олигометастатической болезни
может использоваться лучевая
терапия. Чаще всего применяется стереотаксическая терапия и
лучевая терапия с визуальным
контролем в режиме гипофракционирования (hypofractionated
image-guided radiation therapy,
HIGRT). Ряд исследований продемонстрировал длительный
контроль метастатического процесса в легких, печени, надпочечниках и других органах при
помощи HIGRT [8-12]. Недавно
были опубликованы результаты
лечения 48 больных с олигометастатической болезнью, которые
проходили лечение в рамках двух
проспективных исследований,
изучавших HIGRT [13]. Все больные получили лучевую терапию
на все рентгенологически определяемые метастатические очаги. Пяти- и десятилетняя общая
выживаемость составила 83% и
75% соответственно у больных с
только костными метастазами, в
то время как у больных с другой
локализацией метастазов данные показатели составили 31% и
17% (р=0,002). Пациенты с только
костными метастазами имели также значимо более длительное время, свободное от множественного
метастазирования (freedom from
widespread metastases), по сравнению с пациентами с некостными
метастазами (0,018). Пятилетние
показатели составили 67% против
30% соответственно. Среди пациентов с некостными метастазами
объем метастатических очагов, их
количество, а также количество
пораженных органов были факторами, значимо коррелирующими
со временем, свободным от множественного метастазирования.
В проспективном исследовании
II фазы 54 пациента с олигометастатической болезнью получали
HIGRT (30-45 Гр за 3 фракции)
или лучевую терапию с модулированной интенсивностью (intensity
modulated radiotherapy, IMRT) (60
Гр за 25 фракций) на все известные метастатические очаги. При
медиане наблюдения 30 мес. 1- и
2-годичная БРВ составила 75% и
53%, а 2-летняя ОВ – 95% [14]. Не
было зарегистрировано побочных
явлений 3 и более степеней.
На основании этих данных было
инициировано исследование II/III
фазы (NRG BR0020), которое рандомизировало больных с олигометастатической болезнью на стандартную терапию и локальную
терапию (HIGRT или хирургию)
на все известные метастатические
очаги [15]. На ASCO 2022 были
представлены результаты этого
исследования. К сожалению, не
было продемонстрировано увеличения времени до прогрессирования и общей продолжительности
жизни больных, подвергшихся
локальному лечению. К недостаткам исследования следует отнести
небольшое количество больных
– 125 человек (60 получили локальное лечение) и крайне малый
процент больных с тройным негативным и Her2-позитивным РМЖ
(8% и 12% соответственно), что не
позволяет судить об эффективности локального лечения при данных подтипах. Важно, что исследование показало малую частоту
побочных явлений при проведении локального лечения (всего у
5% больных в группе локального
отмечались побочные явления 3
степени, явления 4 степени отсутствовали) [16].
Таким образом, накопленные в настоящий момент данные позволяют рекомендовать агрессивную локальную тактику при олигометастатической болезни, что и было оформлено в последнем консенсусе по лечению распространенного рака молочной железы (АВС5) [17]. Подавляющее большинство экспертов (91%) проголосовали за целесообразность локального лечения с целью возможного излечения у больных с высокой чувствительностью к системной терапии. Безусловно, требуются дальнейшие исследования для изучения прогностических факторов, определяющих группу больных с наибольшим выигрышем от локального лечения, а также для выбора оптимальной последовательности системного и локального лечения.
Гораздо более сложным представляется вопрос о целесообразности применения локальных методов при диссеминированном РМЖ с множественными очагами метастазирования. В частности, речь идет об удалении первичной опухоли при de novo метастатическом РМЖ, о воздействии на отдельные метастатические очаги с паллиативной целью. Так, в настоящий момент данные о потенциальном выигрыше от удаления первичной опухоли при de novo метастатическом РМЖ противоречивы.
Исследование, проведенное в Индии (Tata Memorial Hospital), включало 716 больных с de novo метастатическим РМЖ, получавших лечение с 2005 по 2013 гг. Пациенты, ответившие на начальную системную терапию, рандомизировались на проведение локального лечения (хирургия и адъювантная лучевая терапия). Медианы ОВ не различались в группе локального лечения и в группе контроля (19,2 против 20,5 мес., р=0,79) [18]. Однако это исследование критиковалось за субоптимальное системное лечение (ограниченное применение таксанов, 92% больных с Her2 позитивным раком не получали анти-Her2 терапию).
Последующее турецкое исследование (MF07-01) с 2007 по 2012 гг. рандомизировало 274 больных с IV стадией, не получавших системного лечения, на локорегионарное лечение с последующей системной терапией или на системную терапию без локального лечения [19]. При времени наблюдения 3 года показатели выживаемости были одинаковыми между двумя группами (60% и 51% соответственно, р=0,1). Однако при наблюдении 5 лет медиана выживаемости была значимо выше в группе локорегионарного лечения (46 мес. против 37 мес., HR=0,66, 95% CI 0,49-0,88; P=0,005). Незапланированный подгрупповой анализ показал преимущество локорегионарного лечения у больных с ER+ раком, Her2 негативным раком, моложе 55 лет и у больных с солитарными костными метастазами.
В проспективном исследовании TBCRC 013 были проанализированы 90 больных, которые классифицировались как ответившие на первую линию системной терапии, 39 из них в последующем подверглись удалению первичной опухоли [20]. Не было отмечено различий в 3-летней ОВ между теми, кому выполнялась операция, и теми, кому не выполнялась (77% против 76%, р=0,85). Возможно, как и в исследовании NRG BR002, небольшое количество больных в целом, а также больных с тройным негативным и Her2 позитивным подтипами не позволило выявить различия в выживаемости.
Напротив, в недавнем анализе NCDB изучались истории болезни 24 тыс. женщин с диссеминированным РМЖ, получавших лечение с 2003 по 2012 гг., 43,8% из них выполнено оперативное вмешательство. Хирургическое лечение как до, так и после системного лечения (HR=0,68, 95% CI 0,62- 0,73; HR=0,56, 95% CI 0,52-0,61; p<0,001) было независимым прогностическим фактором лучшей общей выживаемости по сравнению с только системной терапией [21]. Так, медиана ОВ у больных, получивших хирургическое лечение после системной терапии, составила 52,8 мес., 49,4 мес. – при выполнении хирургического вмешательства до системной терапии и 37,5 мес. – у больных только на системной терапии.
Исследование ECOG E2108 рандомизировало 390 больных с IV стадией без прогрессирования на инициальной системной терапии на получение хирургического лечения с последующей адъювантной лучевой терапией (в случае органосохранной операции или после маcтэктомии при наличии показаний). Предварительные данные, доложенные на ASCO 2020, продемонстрировали, что при медиане времени наблюдения 59 мес. не было значимых различий по показателю 3-летней ОВ в группе локорегионарного лечения и в группе только системной терапии (68,4% против 67,9%, HR=1,09, 90% CI 0,80-1,49) или в отношении БРВ (р=0,40). Однако 3-летняя частота локорегионарного прогрессирования была значимо выше в группе только системного лечения (25,6% против 10,2%, р=0,003) [22]. На наш взгляд, снижение только частоты местного прогрессирования является немаловажным преимуществом, так как любой возврат болезни неблагоприятно сказывается на психоэмоциональном состоянии больных, требует дополнительного лечения, как локального, так и системного (нередко токсичного), новых визитов в клинику, госпитализаций. Кроме того, локальное прогрессирование нередко имеет широкое распространение с захватом все новых областей (переход на контрлатеральную сторону, на переднюю грудную, брюшную стенки, область спины с экзофитным ростом, тенденцией к изъязвлениям, кровотечениям и т.д.). Данные проявления, как правило, плохо поддаются системной терапии, требуется ее постоянная смена в отсутствие прогрессирования со стороны других проявлений болезни (например, костных метастазов).
Таким образом, имеющиеся данные говорят о том, что локорегионарное лечение при IV стадии болезни может быть полезно у отдельных категорий больных, таких как ER+ РМЖ, Her2- позитивный РМЖ, выраженный ответ на исходную системную терапию, ограниченный характер метастатической болезни. Немаловажно, что локальное лечение обладает невысокой стоимостью и крайне низким процентом выраженных побочных явлений. Тщательный отбор больных в данной ситуации является критически важным. Кроме того, при выборе в пользу локорегионарного лечения необходимо добиваться чистых краев резекции и сопровождать хирургическое лечение адъювантной лучевой терапией по тем же показаниям, что и при раннем раке.
Список источников указан на
портале: https://www.rosoncoweb.
ru/news/oncology/2022/08/12/
Результаты голосования:
РАК МОЛОЧНОЙ ЖЕЛЕЗЫ IV СТАДИИ: РАДИКАЛЬНЫЙ
ИЛИ ПАЛЛИАТИВНЫЙ ПОДХОД К ЛЕЧЕНИЮ

*https://www.rosoncoweb.ru/news/oncology/2022/08/12/
Всего проголосовало: 19
ПОДДЕРЖИВАЮЩАЯ ТЕРАПИЯ В ОНКОЛОГИИ
В рамках VII Российской конференции «Поддерживающая терапия
в онкологии» прошел сателлитный
симпозиум, посвященный анемиям
при злокачественных новообразованиях. Приветственное слово было
предоставлено Жигулёву Антону
Николаевичу, кандидату медицинских наук, заместителю главного врача Пермского краевого онкологического диспансера.
Первый доклад про актуальность
анемии при злокачественных новообразованиях и алгоритму коррекции данного состояния был
представлен врачом – онкологом,
кандидатом медицинских наук,
доцентом ОБПО ФГБУ «НМИЦ
онкологии им. Н.Н. Петрова»,
Еленой Викторовной Ткаченко.
Анемия характерна практически
для всех пациентов с различными
злокачественными новообразованиями. Частота встречаемости
анемии у пациентов, получающих
химиотерапию, достигает 75%, лучевую терапию - 38%, сочетанную
терапию (химиолучевую) - 61,9%,
по данным исследования ECAS.
Имеется прямая связь между дозой
и длительностью химиотерапии и
развитием анемии, длительная ХТ
увеличивает риск развития анемии
средней и тяжелой степени. Елена
Викторовна отметила, что чем более продвинутая стадия заболевания по TNM, тем чаще у этих пациентов встречается анемический
синдром. Докладчик сделал акцент
на то, что анемия влияет на прогрессирование опухоли. Важную
роль в этом процессе играет транскрипция фактора, индуцируемого
при гипоксии (HIF-1). Гипоксия
стимулирует выживание клеток
опухоли, за счет этого происходит
селекция клонов клеток с высокой
скоростью мутаций. Таким образом, новый клон клеток обладает
лучшей способностью к росту и
метастазированию. Так же докладчик ссылалась на несколько
важных клинических исследований. Согласно этим исследованиям, анемия является предиктором
общей выживаемости у больных
с раком пищевода и раком молочной железы. Выявлена корреляция
между концентрацией гемоглобина и выживаемостью больных: чем
ниже концентрация гемоглобина,
тем короче общая выживаемость.
По мнению автора, важно отметить, что концентрация гемоглобина линейно связана с качеством
жизни пациентов с солидными
опухолями. Улучшение качества
жизни наблюдается при повышении концентрации гемоглобина >110 г/л. Есть несколько причин
развития анемии у онкологических
больных, связанных с самим заболеванием (инфильтрация опухоли в костный мозг, кровотечения,
гиперспленизм, гемолиз, анемия
хронических заболеваний), а также
с проводимой терапией (обширная
лучевая терапия; вторичная токсичность по отношению к костному мозгу и почкам, связанная с химиотерапией; гемолиз, вызванный
препаратами). Из всего вышесказанного можно сделать вывод, что
анемический синдром ухудшает
течение и прогноз основного заболевания за счет снижения эффективности химиотерапии и повышения риска летального исхода,
а также значимо снижает качество
жизни пациентов. Затем докладчик
перешел к принципам лечения анемии при злокачественных новообразованиях. Они заключаются в
заместительной (трансфузия эритроцитарной массы) и патогенетической терапии (стимуляторы эритропоэза, препараты железа, др.).
Показаниями для назначения эритропоэтинов (ЭПО) являются: 1)
наличие выраженных клинических
симптомов анемии; 2) уровень Нt
<30 – 33% и/или Нв <100 г/л; 3)
зависимость от гемотрансфузий.
Автор сделал акцент на том, что
стоит с осторожностью применять
ЭПО у пациентов со склонностью
к тромбозам, поскольку применение ЭПО повышает вероятность
венозных тромбоэмболических
осложнений. Однако назначение
ЭПО не требует дополнительной
антикоагулянтной профилактики.
Также, по мнению автора, важно
отметить, что в связи с возможным
взаимодействием железа и некоторых цитостатиков (антрациклины,
препараты платины), необходимо
воздерживаться от введения препаратов железа в дни введения
противоопухолевых препаратов.
Второй доклад был посвящен
аспектам финансирования поддерживающей терапии на примере
анемии в онкологическом стандарте, и представил его Антон Николаевич Жигулёв. Автор начал свой
доклад с определения каналов финансирования медицинской помощи, к которым относятся средства
ОМС, ВМП-ОМС, ВМП-бюджет,
ВЗН и другие. Постановление Правительства РФ от 28.12.2021 №2505
«О программе государственных
гарантий бесплатного оказания
гражданам медицинской помощи на 2022 год и на плановый период 2023 и 2024 гг.» определяет
норматив медицинской помощи
и финансовых затрат. По мнению
автора, важно понимать, что формирование потребности в товарах,
работах, услугах для нужды медицинской организации происходит
в августе; в октябре организовывается защита заявки и ее утверждение; в ноябре – закупочные процедуры; в декабре – публикация
базовой Программы государственных гарантий, Закон о бюджете
субъекта РФ; в январе следующего
года – публикация тарифного соглашения, размера тарифов, условий оплаты и объема медицинской помощи для медицинской организации. По договору на оказание и
оплату медицинской помощи по
ОМС медицинская организация
обязуется оказать медицинскую
помощь застрахованному лицу в
соответствии с территориальной
программой ОМС и в рамках объемов предоставления и финансового обеспечения медицинской
помощи. Докладчик сделал акцент
на том, что лечение сопутствующей патологии, возникшей на фоне
онкологического заболевания, в
разделе сопроводительная терапия
также является частью клинических рекомендаций. Есть клинические рекомендации (КР) по анемии при ЗНО от 2020 г, разработан
проект КР 2022 года, который в
скором времени появится на сайте
Министерства Здравоохранения
РФ. КР содержат лекарственные
препараты, которые могут применять медицинские организации при оказании медицинской
помощи. К эритроопоэз-стимулирующим препаратам, рекомендованным к использованию в КР,
относятся эпоэтин альфа, эпоэтин
бета, эпоэтин тета, дарбэпоэтин
альфа. Важно отметить, что в КР
для эпоэтина альфа есть несколько
вариантов начальных доз препарата - 150 МЕ/кг 3 р/нед., 12 000 МЕ
3 р/нед. и 40 000 МЕ 1 р/нед. Согласно Федеральному закону №323,
медицинская помощь оказывается
на основании КР с учетом стандарта медицинской помощи (СМП).
СМП является механизмом, который используют при расчете тарифов. В стандарт медицинской
помощи по анемиям из возможных дозировок эпоэтина альфа
входит только 40 000 МЕ 1 р/нед.,
другие дозы в СМП не включены.
На территории РФ сформирована
единая методология формирования тарифов на оплату медицинской помощи за счет средств ОМС.
Дифференцированная оплата медицинской помощи производится
с учетом нозологий, уровня медицинской организации, длительностью лечения, тяжестью заболевания и применения технологий.
Для лечения анемии при ЗНО существуют две клинико - статистические группы (круглосуточный и
дневной стационар) по профилю
«гематология», однако они могут
использоваться и у онкологических
больных. В завершении своего доклада автор предложил возможности оплаты отдельных лекарственных схем через изменение тарифов
на региональном уровне: 1) оплата
госпитализации осуществляется
по КСГ с наибольшим коэффициентом затратоёмкости; 2) создание
новых подгрупп КСГ (с установлением региональных коэффициентов затратоёмкости); 3) введение
региональных коэффициентов: коэффициента уровня медицинской
организации, коэффициента специфики для КСГ/КПГ, коэффициента сложности лечения пациента.
Третий доклад был представлен
Инной Александровной Железняковой, который позволил
слушателям понять, как осуществляется оплата сопутствующей
терапии при злокачественных
новообразованиях. Согласно указу президента РФ от 07.05.2018
№204, формирование тарифов на
оплату медицинской помощи основывается на клинических рекомендациях и протоколах лечения.
Клинические рекомендации размещаются на официальном сайте
Министерства здравоохранения
РФ. На основе КР разрабатываются стандарты медицинской помощи, один СМП покрывает все
условия оказания медицинской помощи. КСГ является инструментом
распределения фактически имеющихся средств, утверждается один
раз в год. СМП уходят из оценки
качества медицинской помощи, на
их место должны прийти критерии
оценки качества медицинской помощи. Инна Александровна подробно остановилась на основных
проблемах, связанных с включением сопутствующей терапии в
КР: 1) неопределенность решения
в части необходимости разработки
отдельных КР в разрезе состояний,
требующих проведения сопутствующей терапии при лечении онкологических заболеваний, включая
их профилактику либо включения
данной информации в КР по основному заболеванию; 2) размещенная на официальном сайте Министерства здравоохранения КР по
анемии при ЗНО, согласно официально поступающих в адрес Минздрава России, ФФОМС и ФГБУ
ЦЭККМП обращений нуждается в
серьезной переработке.
Александр Владимирович Зуев в
своем докладе рассказал о принципах оплаты симптоматической терапии в 2022 г. Методические рекомендации от 02.02.2022 Минздрава
России №11-7/И/2-1619 и ФОМС
№00-10-26-2-06/750 от 02.02.2022
«Методические рекомендации по
способам оплаты медицинской помощи за счет средств обязательного медицинского страхования»
являются нормативными документами федерального уровня. В
настоящее время оплата сопроводительной терапии онкологических заболеваний осуществляется
с применением следующих механизмов: 1) лекарственные препараты, необходимые для сопроводительной терапии, включены в ряд
схем лекарственной терапии, для
которых клиническими рекомендациями в обязательном порядке
предусмотрено наличие данного
препарата в основе схемы; 2) при
расчете стоимости КСГ заболеваний для оплаты лекарственной
терапии в стоимости койко-дня
(пациенто-дня) учтены затраты
на возможное проведение сопроводительной терапии для коррекции нежелательных явлений и для
лечения и профилактики осложнений основного заболевания (затраты учтены в стоимости койко/
пациенто-дня); 3) в модели КСГ
предусмотрены группы st36.012
и ds36.006 «Злокачественные новообразования без специального
противоопухолевого лечения» в
стационарных условиях (тариф 12
127,70 руб.) и в условиях дневного
стационара (тариф 5 566,25 руб.),
позволяющие в рамках госпитализации проводить в том числе сопроводительную терапию; 4) в модели КСГ выделена группа st19.037
«Фебрильная нейтропения, агранулоцитоз вследствие проведения лекарственной терапии ЗНО» (тариф
71 068,32 руб.), в рамках которой
оплачивается лечение осложнения,
требующего назначения наиболее
дорогостоящих лекарственных
препаратов; 5) в модели КСГ выделены группы st05.001 (тариф22
800,08) и ds05.001 (тариф 12 663,21)
для оплаты случаев лечения анемии в стационарных условиях и
в условиях дневного стационара,
классификационным критерием
отнесения к которым является
код диагноза D63.0 «Анемия при
новообразованиях (С00- D48+)».
Также докладчик добавил, что все
КСГ разделены по профилям медицинской помощи, при этом часть
диагнозов, устанавливаемых при
различных заболеваниях, хирургических операций и других медицинских технологий могут использоваться в смежных профилях, а
часть являются универсальными
для применения их в нескольких
профилях. При оплате медицинской помощи в подобных случаях
отнесение КСГ к конкретной КПГ
не учитывается. Оплата случаев
сопроводительной терапии при
оказании медицинской помощи
может осуществляться по группам,
которые попадают в профиль «гематология». В завершение своего
доклада Александр Владимирович
предложил в новые методические
рекомендации внести критерии,
в рамках которых возможно дифференцировать оплату тарифа по
двум случаям, а также прописать
возможность лечения анемии при
ЗНО на онкологической койке.
В следующем сообщении И.А.
Железнякова коротко рассказала
слушателям о возможных «радикальных» перспективах, с которыми мы можем встретиться в 2023
году. По мнению автора, важно
отметить условия, которые необходимо учесть при определении вариантов оплаты: 1) особенностью
сопутствующей терапии является
возможность ее проведения как одновременно с проведением химиотерапевтического/химиолучевого
лечения, так и самостоятельно; 2)
стоимость сопутствующей терапии существенно отличается, при
этом нецелесообразно осуществлять «целевую» оплату при незначительной стоимости затрат на ее
проведение, что требует определения понятия «значительная стоимость». К основным возможным
принципам и способам оплаты
сопутствующей терапии в системе
ОМС относятся: 1) оплата «дешевой» сопутствующей терапии в
рамках стоимости койко/пациенто–дня в случае сочетания лечения
с химиотерапевтическим лечением
или по КСГ в случае госпитализации в целях проведения симптоматической терапии; 2) выделение
отдельных групп КСГ для «дорогостоящей» сопутствующей терапии
с возможностью оплаты по двум
группам; 3) выделение КСЛП для
«дорогостоящей» сопутствующей
терапии с возможностью применения его к КСГ «Госпитализация без
специального противоопухолевого
лечения»; 4) сочетание двух механизмов: отдельные КСГ для случаев без химиотерапии и КСЛП при
сочетании сопутствующей и химиотерапии; 5) погружение «дорогостоящих» схем сопутствующей
терапии в перечень схем химиотерапии с возможностью оплаты по
двум схемам.
Информация, представленная докладчиками, вызвала много вопросов, представляющих практический
интерес:
Вопрос из чата: Возможно ли использование ЭПО при анемии, возникшей после лучевой терапии?
Е.В. Ткаченко: Да, если это результат лечения противоопухолевой
терапии, и вы исключили дефицит
железа.
Вопрос из чата: Использование
группы КСГ у пациентов с лимфоидными опухолями по профилю «гематология» на онкологической койке
понятно. А есть ли возможность
использования обозначенные вами
КСГ для пациентов с солидными
опухолями по профилю «онкология»?
А.В. Зуев: Да, это возможно, это
как раз и подразумевается в модели
КСГ. Вероятно, в методических рекомендациях стоит четко конкретизировать такую ситуацию.
Вопрос из чата: Подскажите, пожалуйста, учитывается ли в системе
КСГ влияние препаратов или схем
лечения на качество жизни пациента? Есть ли примеры?
И.А. Железнякова: Нет, поэтому
и примеров нет. Мы не учитываем
данный параметр, обсчитываем по
предельным ценам с учетом НДС все
схемы лечения, которые есть в КР
Анемия – хорошо известное осложнение злокачественного заболевания и его лечения. Возросшее внимание к проблеме
анемии злокачественного процесса объясняется как возможностью использовать эффективное
противоанемическое лечение, так
и прогностической значимостью
синдрома анемии. Однако в рамках
финансирования системы здравоохранения сохраняются вопросы
о тарифах, не всегда покрывающих
в полной мере лечение таких пациентов, о разнице региональных коэффициентов, приводящей к различию в выплатах медицинским
организациям в разных регионах.
Согласно текущей системы оплаты ОМС получить оплату по двум
группам КСГ (за лечение онкологического заболевания и анемии)
в рамках одной госпитализации
невозможно. Эксперты мероприятия призвали к дальнейшему диалогу, чтобы совместно выработать
общий подход к финансированию,
который снимет стоящие перед рядовыми практическими врачами
ограничения.
При поддержке компании Сотекс
МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКАЯ ДИАГНОСТИКА В РОССИИ: ВНУТРЕННИЙ КОНТРОЛЬ КАЧЕСТВА
Российское общество клинической
онкологии в течение 11 лет проводит программу «Совершенствование молекулярно-генетической диагностики в Российской Федерации
с целью повышения эффективности противоопухолевого лечения».
Более 140 000 тестов выполнено за
этот период при 9 нозологических
формах рака. Благодаря этому у
нескольких десятков тысяч пациентов появилась возможность получать инновационную таргетную и
иммунотерапию. В последние два
года Российское общество клинической онкологии осуществляет программу по сбору данных о частоте
встречаемости мутаций в опухолях
различных локализаций, выполняет анализ полученных данных и на
основании него проводит раунды
по контролю качества.
В июне этого года проведен уже 3
раунд внутреннего контроля качества тестирования мутации BRAF
лабораторий, которые сотрудничают с RUSSCO в рамках проекта
«Частота мутаций». В этом раунде
по контролю качества приняли участие 8 региональных лабораторий
из городов России: Казани, Владивостока, Уфы, Екатеринбурга, Хабаровска, Красноярска, Тамбова,
Перми.
Экспертами в раунде контроля качества BRAF были молекулярные
генетики из референс-центров:
МКНЦ им. Логинова г. Москва (руководитель лаборатории Бодунова
Н.А.) и РО ПАБ г. Ростов-на-Дону
(заведующая лаборатории Повилайтите П.Е.). Ими были подготовлены протоколы по прохождению
контроля, сопоставимые с европейскими требованиями к контролю
качества. В экспертных лабораториях были протестированы контрольные образцы и направлены
в лаборатории, проходящие контроль качества.
В каждую лабораторию были направлены индивидуальные сеты
из 15 образцов опухолевой ткани
в виде срезов (5 микрон) на четырех стеклах (три неокрашенных и
один окрашенный срезы, окраска
гематоксилин, эозин), содержащих
не менее 30-40% опухолевой ткани
в образце. Ни один сет не повторял
сет других лабораторий. На проведение тестирования образцов
лабораториям давался временной
промежуток 14 календарных дней.
На каждый образец участник контроля качества формировал заключение с интерпретацией результата. Экспертная группа проводила
оценку в баллах по каждому этапу
тестирования и, при необходимости, давала рекомендации.
Мы благодарим экспертную группу молекулярных генетиков за
помощь в проведении раунда контроля качества, интерпретацию результатов и оценку, а также лично
Бодунову Наталью Александровну
и Повилайтите Патрицию Едмундовну за организацию раунда контроля качества тестирования мутации в гене BRAF.
И поздравляем с успешным прохождением контроля качества лаборатории следующих медицинских учреждений:
• ГАУЗ «Республиканский клинический онкологический диспансер МЗ РТ», Казань
• ГБУЗ «ПКОД», Владивосток
• Республиканский медико-генетический центр, Уфа
• ГБУЗ СООД, Екатеринбург
• ГБУЗ ККЦО, Хабаровск
• ККОД, Красноярск
• ОКД, Тамбов
• ПКОД, Пермь
Соколова О.В., заместитель медицинского директора по программе молекулярно-генетической диагностики Российского общества клинической онкологии
Соколова Н.С., специалист по
программе молекулярно-генетической диагностики Российского
общества клинической онкологии

ПОДМЕЧЕНО ЧЕЛОВЕКОМ
Меня зовут Ал-Файсаль, или просто Ал, я из Омана,
хотя наполовину марокканец. Считаю себя фотографомсамоучкой, серьёзно влюбленным в фотографию
уже несколько лет. Я родился в Касабланке, возможно,
поэтому большинство моих работ отражают влияние
двух разных арабских культур. Мне двадцать лет,
изучаю юриспруденцию в университете Брайтона
(Великобритания), помимо фотографии люблю играть
на гитаре: вершин мастерства в игре фламенко
на испанской гитаре я, само собой, пока не достиг,
но очень стремлюсь к этому. Больше всего в этой жизни
ценю саму жизнь, семью и хорошую компанию друзей.







Дорогие коллеги, если вы пишете стихи или прозу, любите фотографию или живопись – присылайте свои работы
для публикации в газете в рубрике «Подмечено онкологом:
будем жить!» indigo.radonc@gmail.com
МЕТОДЫ РАБОТЫ ОНКОПСИХОЛОГА
Автор: Вагайцева Маргарита Валерьевна
ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» МЗ РФ
В предыдущих статьях мы рассуждали о доступности психологической помощи в российской
онкологии и рассматривали клинические и поведенческие симптомы у пациента, сообщающие
о необходимости консультации
психолога.
Наблюдения показывают, что
врачи-онкологи достаточно хорошо сориентированы в методах
психиатра или врача-психотерапевта, работающих с грубыми
или пограничными нарушениями
психики. При этом врачи не всегда полностью информированы о
сущности психологической интервенции в онкологии, но интуитивно предполагают, что разница
в подходах должна быть. Действительно, существуют различия в
методах оказания психологической помощи в рамках нозологических единиц.
Эффективность психотерапевтического консультирования онкологических пациентов, доказанная в мировой практике, получает
подтверждение в практической
деятельности российских психологов, работающих с онкологическими больными. Исследователи
полагают, что сегодня возрастает
роль медицинского психолога в
комплексном онкологическом
лечении и что основной целью
психологической интервенции
становится облегчение эмоционального дистресса, который
развивается у многих пациентов
(Володин Б.Ю., Петров С.С., Куликов Е.П., Петров Д.С., 2004).
Как упоминалось в предыдущих
публикациях, дистрессом принято называть состояние страдания,
то есть чрезвычайного эмоционального напряжения, при котором человек не может полностью
адаптироваться к стрессовым
факторам, обусловленным трудной жизненной ситуацией. Дистресс несет в себе высокий риск
дезадаптации, не доходящий до
клинически значимых повреждений психики. Принято считать,
что дистресс – это фактор, существенно влияющий на качество
жизни пациента. Исследования
показывают, что онкологические
пациенты не утрачивают свой
психоэмоциональный статус.
Именно поэтому помощь оказывается медицинским психологом,
который имеет право работать
только с психической нормой.
При выявлении устойчивых эмоциональных повреждений любого уровня медицинский психолог
обязан назначить консультацию
врача-психотерапевта, а при необходимости – психиатра.
В должностных инструкциях медицинского психолога среди прочего указано, что должность эту
может занимать лицо, имеющее
высшее психологическое образование и дополнительное образование по клинической психологии.
Хочется добавить, что ассоциация онкопсихологов убеждена
в целесообразности повышения
квалификации специалиста в
области онкопсихологии. Каждый медицинский психолог должен знать основы нейропсихологии, патопсихологии, психологию
личности, общую и дифференциальную психологию, возрастную психологию, психотерапию,
психогигиену, психодиагностику
и психопрофилактику. В онкологии, пожалуй, самыми важными
являются навыки психологического консультирования и оказания экстренной психологической
помощи.
Медицинский психолог онкологического профильного учреждения (онкопсихолог) осуществляет
работу по психопрофилактике,
психокоррекции, психологическому консультированию пациентов и их родственников. При
этом в задачи онкопсихолога не
входит расширенная психодиагностика. Мы оцениваем факторы
риска психических расстройств у
целевой группы. И основным методом в нашей работе становится
наблюдение с возможным включением методов экспресс-диагностики. В некоторых учреждениях
медицинский психолог проводит
работу по обучению медицинского персонала вопросам медицинской и социальной психологии и
деонтологии.
Оказание психологической помощи в онкологии базируется на
принципах комплексного и деятельностного подходов. Основными принципами психологической
коррекции являются личностный
и каузальный. Это обусловлено
наличием объективно психотравмирующего события – тяжелого
хронического заболевания с выраженной витальной угрозой.
Особенно актуальны в работе с
онкологическими пациентами основные направления клиент-центрированной терапии (Роджерс
К., 1977). Личностный подход,
постулирующий уважение к личной истории пациента и праву его
самоопределения, является основополагающим. Определяющим
принципом является принцип
биомедицинской этики.
При работе с онкологическими
пациентами онкопсихолог прежде всего ориентируется на соматическое состояние пациента. В
период реализации индивидуальной программы психокоррекции
обязательно корректируется план
и ход мероприятий в зависимости
от актуальной ситуации течения
болезни, так как онкологические
заболевания имеют специфические особенности, сопряженные
с высокой частотой неблагоприятной динамики, быстрой инвалидизацией а также серьезными
осложнениями, сопровождающими лечение опухолей.
Целью психологической помощи
человеку в ситуации онкологического заболевания является
стабилизация эмоционального
напряжения, обусловленного течением заболевания.
Задачами медицинского психолога в онкологии являются оценка,
профилактика и коррекция риска
дезадаптивного эмоционального
реагирования на ситуацию заболевания.
С какой бы локализацией ЗНО,
на каком бы этапе течения заболевания ни проводилась работа,
мишенью психологической коррекции становится выявленный
риск дезадаптивного эмоционального реагирования на ситуацию заболевания.
Исходя из цели стабилизации
эмоционального напряжения пациента (родственника пациента),
ведущими технологиями в работе
онкопсихолога являются установление с ним эмпатичного контакта, активное взаимодействие
с ситуацией болезни, конгруэнтность, вербализация и отражение
эмоций.
В психореррекционной практике
при работе с онкологическими пациентами выделяют стандартные
направления работы со взрослыми (Осипова А.А., 2002), такие как
психодинамическое, гуманистическое и когнитивно-поведенческое направления.
По времени применения психокоррекционные мероприятия в
онкологии относятся к сверхкоротким и коротким (1-5 занятий)
на этапе лечения и паллиативного
лечения, а также коротким и длительным (5-15 занятий) на этапе
ремиссии, а также при работе с
родственниками пациентов. Количество занятий и направление
работы определяются специалистом с учетом факторов течения
болезни и фазы динамики психического состояния пациента.
Задачи психокоррекции относятся к профилактическому виду – в
случае выявления адаптивного
отношения к болезни, и коррекционному виду – в случае выявления дезадаптивной тенденции
отношения к болезни.
Занятие строится свободно с учетом выявленных особенностей
личности, особенностей отношения к болезни и особенностей соматического состояния пациента.
Психокоррекционный комплекс
включает в себя стандартные блоки, такие как диагностический,
установочный, коррекционный и
блок оценки эффективности воздействия. Следует помнить, что
в рамках сверхкороткого подхода
беседа может носить экспрессдиагностический и одновременно
экспресс-коррекционный характер.
Чаще в практике онкопсихолога
применяется индивидуальный
формат консультирования. Иногда на консультацию приходит
пара – пациент и его родственник,
реже семейная группа. Эффективной формой также считается открытая группа психологической
поддержки. Закрытая групповая
работа проводится значимо реже.
По времени занятие варьируется
от 15 до 50 минут. Время занятия
зависит от состояния пациента.
Так, например, в реанимации и
хосписе время активной концентрации внимания пациента значительно ниже, чем у пациента на
этапе восстановления или в ремиссии. Стандартное время работы в палате стационара равно половине часа, а для амбулаторного
приема в кабинете психологической помощи – 50 минут.
Технологически различаются
приемы экстренной и плановой
помощи. Для онкопсихологии характерна вероятность оказания
экстренной помощи при заявленной плановой, так как ситуация
болезни может вносить стремительные изменения в жизнь пациента даже в период одной недели.
Выбор технологий обусловлен
уровнем актуального эмоционального напряжения. Важно
в ходе коррекционной работы
задавать локус концентрации
внимания не на проблеме пациента – течении онкологического
заболевания (эта проблема может оказаться неразрешимой), а
на непреходящей ценности «Я»
человека, в какой бы ситуации
этот человек ни оказался.
Особенностью подготовки онкопсихолога является осознанная устойчивость к индуцированию (заражению) сверхсильным
эмоциональным напряжением
онкологических пациентов и их
родственников, обусловленным
высоким риском витальной угрозы.
Различают нюансы оказания
психологической помощи в зависимости от особенностей эмоционального реагирования, фазы
динамики адаптации, особенностей этапа заболевания, локализации ЗНО и даже возраста пациентов. Также существуют различия
ведения первичного и повторного
приемов. В свою очередь, повторный прием различается по направлениям оказания помощи и
зависит от выявленного запроса
пациента.
Результатом психологической
коррекции человека в ситуации
онкологического заболевания
становится формирование адаптивного отношения к тяжелому
хроническому заболеванию, которое состоит в выработке у пациента большего самоуважения и
способности предпринимать действия в соответствии с его личным опытом и глубинными переживаниями.
Надеюсь, что в вашей команде онкопсихолог есть.
О технологиях, фазах и других нюансах работы онкопсихолога мы поговорим в следующих выпусках.
С уважением,
Вагайцева Маргарита Валерьевна
ИССЛЕДОВАНИЯ И ЛЕЧЕНИЕ РАКА ЯИЧНИКОВ: НОВЫЙ КОНСЕНСУС GYNECOLOGIC CANCER INTERGROUP (GCIG)
Автор: Румянцев Алексей Александрович
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина»
Минздрава России, Москва
В октябре 2021 года состоялась VI
конференция Gynecologic Cancer
InterGroup (GCIG) – собрание
специалистов из 33 наиболее авторитетных исследовательских
групп в онкогинекологическом
сообществе, включая EORTCGCG, AGO, MITO, ANZGOG,
GEICO, MaNGO, NCI-US, JGOG.
Конференции GCIG для обсуждения результатов последних
достижений в лечении рака яичников проходят каждые 5 лет;
итоги последней, включившие 20
основных пунктов по проведению
дальнейших исследований в области лечения рака яичников, были
опубликованы в августе 2022 года
в журнале Lancet Oncology. В этой
заметке кратко суммированы
наиболее значимые аспекты представленного документа в части
лечения и приведены некоторые
соображения по этому поводу [1].
Первичная циторедукция –
предпочтительный вариант
первоначального лечения
рака яичников
Назначение неоадъювантной химиотерапии с последующей интервальной циторедукцией после
3-4 курсов химиотерапии может
рассматриваться только в тех ситуациях, когда достижение полной циторедукции невозможно.
При гистотипах рака яичников
с низкой чувствительностью к
лекарственной терапии (муцинозная аденокарцинома, опухоли
low-grade) выполнение первичной
должно быть приоритетным вне
зависимости от вероятности достижения полной циторедукции.
Распространенность опухолевого процесса в начале хирургического вмешательства и после его
завершения должно быть полностью отражено в протоколе операции.
Комментарий: вечный спор
между сторонниками различных
подходов к лечению рака яичников – с чего начинать лечение, с
неоадъювантной химиотерапии
или выполнения первичной циторедукции? Первые ссылаются
на «удобство» первоначального проведения неоадъювантной
химиотерапии и результаты нескольких, пусть и «слегка» ущербных, но рандомизированных
исследований, вторые приводят
в защиту своей позиции несоизмеримо лучшие отдаленные
результаты лечения у пациенток
после первичной циторедукции.
Результаты рандомизированного исследования TRUST, которое
должно поставить точку в этом
споре, мы не увидим еще год или
два. Текущая позиция GCIG может показаться компромиссом – с
одной стороны, четко указано на
предпочтение первоначального
хирургического лечения, с другой отмечено, что если все-таки
нельзя удалить опухоль полностью, то так и быть – можно назначить неоадъювант. При этом
такой подход обладает рядом существенных недостатков, в первую очередь это влечет за собой
опасность широкого отказа от
первичных циторедукций при сомнительно резектабельных опухолях и уменьшение доли первичных циторедукций. Кроме того,
преимущество данного подхода
к лечению рака яичников, естественно, остается недоказанным,
а вопрос, дает ли это увеличение
доли полных циторедукций за
счет неоадъювантной химиотерапии, безусловно, требует подтверждения (или опровержения
– как пойдет).
Результаты голосования:
«за» – 32 группы,
«против» – 1 группа.
Режим лечения
паклитаксел 175 мг/м2
день 1 + карбоплатин
AUC5-6 1 день каждые
21 день – схема выбора
в качестве первой линии
терапии распространенного
рака яичников
Также допустимо включение в
состав режима лечения бевацизумаба или использование еженедельного режима введения препаратов (паклитаксел 60 мг/м2 +
карбоплатин AUC2). Использование дозоинтенсивного режима
целесообразно только в азиатской
популяции пациентов. Пациентки с BRCA-мутированным раком
яичников или с HRD-позитивным
должны получать поддерживающую терапию ингибиторами
PARP (±бевацизумаб).
Результаты голосования:
«за» – 31 группа,
против – 2 группы.
Платиносодержащая
химиотерапия –
предпочтительный вариант
лечения для пациенток
с рецидивами рака
яичников, возникшими
в срок ≥12 недель
(3 месяца), ответивших
на ранее проведенную
платиносодержащую
химиотерапию
Среди режимов платиносодержащей химиотерапии предпочтение отдается комбинации ПЛД
и карбоплатина (±бевацизумаб).
Проведение неплатиновой химиотерапии предпочтительно в тех
ситуациях, когда не приходится ожидать эффекта проведения
платиносодержащей химиотерапии (подтвержденное прогрессирование на фоне назначения
препаратов платины или в течение <12 недель или отсутствие
эффекта платиносодержащей химиотерапии). В этом контексте
предпочтительно использование
пегилированного липосомального доксорубицина, еженедельного
паклитаксела, гемцитабина или
топотекана (±бевацизумаб). При
лечении пациентов, получивших
≥4 линий противоопухолевой терапии, стоит рассматривать возможность отказа от дальнейшего
специфического лечения.
Результаты голосования: «за» – 32 группы, «против» – 1 группа.
Комментарий: пожалуй, наиболее «революционное» изменение во всем консенсусном документе. Напомню, преобладающая в настоящее время концепция лечения рецидивов рака яичников подразумевает их разделение на «платиночувствительные» и «платинорезистентные», водоразделом выступает волшебное число 6 месяцев, которое возникло на базе результатов нескольких небольших ретроспективных исследований, показавших низкую эффективность препаратов платины при рецидивах заболевания, возникших в течение ≤6 мес. после окончания химиотерапии. В последующем рядом автором было показано, что пациентки с такими «ранними» рецидивами заболевания все-таки имеют преимущество от повторного назначения платиновых агентов. Например, в работе Lindemann K. и соавт. было продемонстрировано увеличение общей выживаемости пациенток с бесплатиновым интервалом ≥3 мес. на фоне проведения платиносодержащей химиотерапии по сравнению с бесплатиновым подходом [5]. В мета-анализе исследований по лечению «платинорезистентных» рецидивов также была показана более высокая эффективность платиновой химиотерапии по сравнению с неплатиновыми вариантами лечения (самоцитирование, да) [6]. Текущее решение GCIG стало еще одним шагом на пути к изменению наших подходов к лечению рецидивов рака яичников.
Выполнение вторичной
циторедукции следует
рассматривать у всех
пациенток с рецидивами
рака яичников при
соответствии критериям
отбора для достижения
полной циторедукции
В качестве шкалы для отбора пациенток консенсусом предлагается шкала AGO-Score.
Комментарий: в целом, особо
нечего и добавить. Результаты
крупного и хорошо спланированного исследования DESKTOP III
[7], проведенного немецкой группой AGO (Arbeitsgemeinschaft
Gynäkologische Onkologie) продемонстрировали выраженное
улучшение выживаемости без
прогрессирования и, что особенно важно, общей выживаемости
пациенток с рецидивами рака
яичников – при выполнении полной циторедукции. Критериями
отбора пациенток для вторичных
циторедукций были:
• Бесплатиновый интервал ≥6 мес.;
• Отсутствие асцита >500 мл;
• Функциональный статус по шкале ECOG 0 баллов (отсутствие симптомов болезни);
• Ранее выполненная полная
циторедукция.
Пациентки соответствующие
этим критериям должны рассматриваться на предмет целесообразности выполнения повторных циторедуктивных операций.
Результаты голосования: «за» – 32 группы, «воздержалась» – 1 группа.
Литература:
1. Vergote I, Gonzalez-Martin A, Lorusso D, et al. Clinical research in ovarian cancer: consensus recommendations from the Gynecologic Cancer InterGroup. Lancet Oncol. 2022;23(8):e374-e384. doi:10.1016/S1470-2045(22)00139-5
2. Katsumata N, Yasuda M, Isonishi S, et al. Long-term results of dosedense paclitaxel and carboplatin versus conventional paclitaxel and carboplatin for treatment of advanced epithelial ovarian, fallopian tube, or primary peritoneal cancer (JGOG 3016): a randomised, controlled, open-label trial. Lancet Oncol. 2013;14(10):1020-1026. doi:10.1016/ S1470-2045(13)70363-2
3. Chan JK, Brady MF, Penson RT, et al. Weekly vs. Every-3-Week Paclitaxel and Carboplatin for Ovarian Cancer. N Engl J Med. 2016;374(8):738-748. doi:10.1056/ NEJMoa1505067
4. Clamp AR, James EC, McNeish IA, et al. Weekly dose-dense chemotherapy in first-line epithelial ovarian, fallopian tube, or primary peritoneal carcinoma treatment (ICON8): primary progression free survival analysis results from a GCIG phase 3 randomised controlled trial. The Lancet. 2019;394(10214):2084- 2095. doi:10.1016/S0140- 6736(19)32259-7
5. Lindemann K, Gao B, Mapagu C, et al. Response rates to second-line platinum-based therapy in ovarian cancer patients challenge the clinical definition of platinum resistance. Gynecol Oncol. 2018;150(2):239-246. doi:10.1016/j.ygyno.2018.05.020
6. Rumyantsev A, Tyulyandina A, Fedyanin M, Pokataev I, Glazkova E, Tjulandin S. Platinum vs Non-Platinum Chemotherapy for Platinum-Resistant Ovarian Cancer: A Systematic Review and Meta-Analysis. Oncology; 2022. doi:10.1101/2022.07.12.22277568
7. Harter P, Sehouli J, Vergote I, et al.
Randomized Trial of Cytoreductive
Surgery for Relapsed Ovarian Cancer.
N Engl J Med. 2021;385(23):2123-
2131. doi:10.1056/NEJMoa2103294
РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС - 2022
