
До открытия юбилейного XXV Российского онкологического конгресса осталось чуть больше 3 месяцев. Оргкомитет конгресса проводит большую работу по составлению программы, список предполагаемых сессий уже находится на сайте, всего их планируется 45. Кроме того, будут мастер-классы, лекции и большое число сателлитных...

Винсент Ван Гог. Подсолнухи. 1888 г.
Новая пинакотека, Мюнхен

ПЯТЬ МИНУТ С ИЗВЕСТНЫМ ОНКОЛОГОМ: ПРОФЕССОР В.Ф. СЕМИГЛАЗОВ
Абсолютно логично, что первым участником интервью стал известнейший советский и российский онколог, доктор медицинских наук, профессор, член-корреспондент РАМН, член-корреспондент РАН Владимир Федорович Семиглазов, для которого 2021 год тоже юбилейный: в наступающем сентябре он будет праздновать свое 80-летие....

ЛЕНВАТИНИБ И ПЕМБРОЛИЗУМАБ В ЛЕЧЕНИИ МЕТАСТАТИЧЕСКОГО РАКА ЭНДОМЕТРИЯ: ОДОБРЕНИЕ FDA
Рак эндометрия (РЭ) – одно из самых распространенных заболеваний женской репродуктивной системы. В течение длительного времени единственной доступной опцией для лечения диссеминированного РЭ была цитотоксическая химиотерапия, при этом результаты лечения для многих пациенток оставались крайне неудовлетворительными...

РАКФОНД ОБЪЯВЛЯЕТ НОВЫЙ КОНКУРС НАУЧНО-ИССЛЕДОВАТЕЛЬСКИХ ПРОЕКТОВ В ОБЛАСТИ ОНКОЛОГИИ
Цель программы – предоставить финансирование и дополнительную поддержку ученым и врачам, работающим в России, для стимулирования и продвижения исследований в области онкологии, поиска и разработки новых способов профилактики, диагностики и лечения онкологических заболеваний. ...

ПО СЛЕДАМ НЕДАВНИХ ПУБЛИКАЦИЙ: МНЕНИЕ СПЕЦИАЛИСТОВ
Стоит ли проводить послеоперационное облучение при IIIA pN2 НМРЛ? Это вопрос, на который уже несколько десятилетий самые авторитетные исследователи пытаются найти ответ. Еще в 1998 году Metaanalysis Trialists Group во главе с д-ром Stewart опубликовали в журнале The Lancet крупный метаанализ результатов послеоперационного облучения...

КОММЕНТАРИЙ ЭКСПЕРТА
После выхода в свет результатов исследования Lung ART на ESMO 2020 короткий опрос российских радиотерапевтов на сайте RUSSCO показал, что у части наших коллег никакие крупные проспективные исследования, никакие метаанализы не способны поколебать веру в необходимость проведения лучевой терапии после радикальной операции при...

ПЯТЬ МИНУТ С ИЗВЕСТНЫМ ОНКОЛОГОМ: ПРОФЕССОР HISHAM MEHANNA
Профессор Hisham Mehanna – широко известный в мире ОГШ хирург, заместитель проректора Университета Бирмингема (Междисциплинарные исследования), директор Института Глобальной Инновации (I.G.I.) и Института перспективных исследований (I.A.S) Университета Бирмингема. Профессор Механна неоднократно выступал с результатами собственных исследований на крупнейших международных мероприятиях, включая конгрессы ESMO...

ПО КОМ ЗВОНИТ КОЛОКОЛ: ДЕЛЬТА-ШТАММ, ВАКЦИНАЦИЯ И ОНКОПАЦИЕНТЫ
Дельта-штамм (В1.617.2) коронавирусной инфекции, впервые зарегистрированный в Индии в декабре 2020 года, уже к середине апреля 2021 года стал наиболее распространенным штаммом SARS-CoV-2 в стране, а к 19 мая 2021 года распространился и на 43 государства на шести континентах. В настоящее время доля дельта-штамма в...
Зенлистик™ – новое показание для пациентов с HR+, HER2- РМЖ
10 июня 2021 года Министерство здравоохранения Российской Федерации одобрило препарат Зенлистик™ в качестве комбинации c эндокринной терапией для адъювантного лечения положительного по гормональным рецепторам (HR+) и отрицательного по рецептору эпидермального фактора роста человека 2-го типа (HER2-) рака молочной железы на ранних стадиях с поражением региональных лимфатических узлов и высоким риском развития рецидива. Таким образом, Зенлистик™ является первым и единственным препаратом из группы ингибиторов циклин-зависимых киназ 4/6, одобренным в комбинации с адъювантной...

БЕРЕМЕННОСТЬ ПОСЛЕ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ
Большинство женщин хотели бы стать матерями. Материнство – это, в первую очередь, выбор женщины, но иногда статус «childfree» является заданной ситуацией. В современном мире многие женщины по карьерным или иным соображениям не спешат с рождением детей: так, в Российской Федерации средний возраст женщины при...

Анонс
-

9 - 11 НОЯБРЯ 2021
РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС
Автор: С.А.Тюляндин
Председатель Российского общества клинической онкологии
Глубокоуважаемые коллеги!
До открытия юбилейного XXV Российского онкологического конгресса осталось чуть больше 3 месяцев. Оргкомитет конгресса проводит большую работу по составлению
программы, список предполагаемых сессий уже находится
на сайте, всего их планируется 45. Кроме того, будут мастер-классы, лекции и большое число сателлитных симпозиумов, и я надеюсь, что программа вас не разочарует.
Конгресс будет проходить в очно-заочном формате. Очные
сессии пройдут в выставочном комплексе «Крокус», регистрация уже открыта. При регистрации вам будут предложены две опции – очного или заочного участия. Для очного участия в «Крокусе» будет создана ковид-свободная
зона на всей территории конгресса, куда участники смогут
пройти, предъявив паспорт и QR-код. Большая просьба:
учитывать это условие при регистрации и последующем
посещении комплекса, поскольку без этих документов вы
не сможете пройти на территорию конгресса и участвовать
в нем. Предварительная бесплатная регистрация для очного участия обязательна, она открыта и будет доступна до 15
сентября. После этой даты очное участие возможно после
оплаты регистрационного взноса на месте.
Если вы планируете участие онлайн, просим вас также
пройти регистрацию для получения ссылки на трансляцию
– она будет доступна за несколько дней до конгресса. Большая просьба к тем участникам, кто уже зарегистрирован
на сайте и планирует очное участие: перерегистрируйтесь,
пожалуйста, в соответствии с новыми правилами.
В связи с изменяемостью и непредсказуемостью эпидемической обстановки оргкомитет конгресса планирует
строго следовать требованиям и рекомендациям Роспотребнадзора по проведению массовых мероприятий. На
сегодняшний день при создании свободной от ковида зоны
массовые мероприятия на территории Москвы и Московской области разрешены. Благодарим вас за понимание и
надеемся на дружную регистрацию. Знание того, сколько
участников планирует быть очно и сколько онлайн, очень
важно для подготовки и организации эффективной работы конгресса.
Ждем вас на XXV Российском онкологическом конгрессе!
Винсент Ван Гог. Подсолнухи. 1888 г.
Новая пинакотека, Мюнхен

ПЯТЬ МИНУТ С ИЗВЕСТНЫМ ОНКОЛОГОМ: ПРОФЕССОР В.Ф. СЕМИГЛАЗОВ
Автор: Владимир Федорович Семиглазов,
д.м.н., профессор, член-корреспондент РАМН, член-корреспондент РАН
АВГУСТ, уходящее лето, последние дни отпуска – однозначно не повод для уныния. Это возможность не спеша оглядеться вокруг, насладиться теплом, неповторимыми красками позднего лета, ароматом фруктов, прочитать еще пару книг, ожидающих своей очереди, или посмотреть новый фильм.
Август питает нас живительной силой лета, дабы на много месяцев вперед, до нового тепла и свежей зелени нового года, хватило нам энергии жить, учиться, работать и остро ощущать эмоции каждого дня. Август, как период отпусков, не богат на научные события. В преддверии осени и грядущего юбилейного XXV Российского онкологического конгресса мы решили представить вашему вниманию серию мини-интервью с известными онкологами, как российскими, так и зарубежными, в первую очередь – теми, кого мы сможем увидеть и услышать на сессиях конгресса.
Абсолютно логично, что первым участником интервью стал известнейший советский и российский онколог, доктор медицинских наук, профессор, член-корреспондент РАМН, член-корреспондент РАН Владимир Федорович Семиглазов, для которого 2021 год тоже юбилейный: в наступающем сентябре он будет праздновать свое 80-летие. Многие из нас росли и воспитывались как онкологи на публикациях профессора Семиглазова, его выступлениях, его работах. Многим посчастливилось с ним работать или просто общаться. Заслуги академика Семиглазова можно перечислять бесконечно долго. С 1984 года он был заместителем директора по научной работе, а с 2005 по 2009 – директором НИИ онкологии им. Н.Н. Петрова, много лет возглавлял научную работу Центра Всемирной организации здравоохранения по изучению опухолей молочной железы. Хотя бы тот факт, что с 2005 года он является бессменным и единственным представителем от России, стран СНГ и Восточной Европы в составе экспертной группы СанктГаллена по разработке мировых стандартов лечения опухолей молочной железы (Швейцария), не может не восхищать. Основатель питерской плеяды онкологов, обладатель немалого количества наград, хирург-маммолог с колоссальным опытом, Владимир Федорович до сих пор в строю и регулярно оперирует, начиная новый рабочий день фразой: «Так, что у нас, ребята, в рюкзаках?» Время практически не оставило отпечатка на его внешности. На примере Владимира Федоровича сформировалась целая династия врачей, которую вскоре пополнят его внуки. Российское общество клинической онкологии, а также все российские онкологи с удовольствием ждут наступления сентября, чтобы поздравить академика Владимира Федоровича Семиглазова с юбилеем, а пока представляем вам небольшое интервью с ним.
– Где Вы родились? Каким было Ваше детство – беззаботным или непростым? Есть ли наиболее запоминающиеся эпизоды?
– Я родился в деревне Кабановщина Уржумского района Кировской области (Вятка) 16 сентября 1941 года, и мое детство проходило в суровые военные годы. Отец, Федор Прокопьевич, был на передовой (армейская разведка), а мать Нина Михайловна с тремя детьми (я – младший, старшая сестра Валентина и брат Анатолий) вынуждена была уехать к дальним родственникам в город Курган. До сих пор помню переполненные общие вагоны, кипяток в чайниках на вокзалах и самую вкусную еду – сухари. После демобилизации отца в 1948 году мы вернулись в Вятку, в город Котельнич, где в 1959 году я закончил среднюю школу.
– Когда Вы решили стать врачом?
Что сподвигло Вас на этот шаг,
был ли выбор?
В.Ф. Семиглазов, выпускник 1-го Ленинградского медицинского
института им. акад. И. П. Павлова, 1965 год (на фото в центре)

– Стать врачом решил по совету сестры, которая уже закончила тогда фельдшерское училище, мне это показалось интересным и очень нужным делом. В 1965 году закончил с отличием 1-й Ленинградский Медицинский институт (1-й ЛМИ) имени академика И.П. Павлова – сейчас это ПСПбГМУ имени академика И.П. Павлова.
– Каким Вы видели свое профессиональное будущее в период студенчества? Если бы не онкология – кем бы Вы могли быть?
В.Ф. Семиглазов, молодой заведующий отделением опухолей молочной
железы НИИ онкологии им. Н.Н. Петрова

– На первых курсах я регулярно посещал студенческое научное общество при кафедре физики, где мы изучали значение «отрицательных ионов» при заболеваниях легких. Какое-то время входил в СНО при кафедре биохимии и даже был рекомендован в аспирантуру. Так что мог бы стать биохимиком, но при распределении все же решил посвятить себя реальной клинической практике – хирургической онкологии. С 4-го курса посещал СНО в клинике академика Углова Федора Григорьевича, он был другом моего основного учителя, члена-корреспондента АМН СССР Семена Абрамовича Холдина, являвшегося «правой рукой» основателя нашего института Николая Николаевича Петрова. К нему я и был принят сначала в ординатуру в 1965 году, а затем в аспирантуру. Поначалу ассистировал на операциях, впоследствии вел и оперировал пациентов c опухолями толстой кишки, а после переформирования клиники всецело начал заниматься опухолями молочной железы.
– Какой период в Вашей карьере Вы считаете наиболее удачным?
– Наиболее удачным считаю период с 1980 по 2005 годы, когда я был избран на пост руководителя отделения опухолей молочной железы, а затем стал руководителем хирургического отдела. В эти годы нам удалось пересмотреть виды и объемы хирургического лечения рака молочной железы от расширенных (подмышечно-грудинных) и радикальных операций Холстеда до менее травматичных операций с сохранением большой грудной мышцы, а также органосохраняющих операций с биопсией сигнальных лимфатических узлов. Главное достижение, на мой взгляд, – это переход от одного местно-регионального лечения к комплексной терапии, включающей неоадъювантное и адъювантное системное лечение. Широкое сотрудничество с лабораторией эндокринологии (В.М. Дильман, Л.М. Берштейн) и патоморфологическим отделом (С.Ф. Серов, Э.Л. Нейштадт) позволило нам обосновать существование различных патогенетических типов рака молочной железы (включая подтипы А, В и C) и показать прогностическое значение инфильтрирующих опухоль лимфоцитов (TILs). Результаты этих работ были опубликованы в Германии еще в 1974 году (журнал RadioBiology, RadioTherapy). Результаты нашего рандомизированного исследования о неоадъювантной химиотерапии были опубликованы в журнале Annals of Oncology в 1991 году. О проводимых в клинике исследованиях по применению различных видов лечения докладывалось на крупных конгрессах и конференциях – в Париже, Монреале, Сан-Антонио (ASCO 2004-2005), Бордо, Афинах, Сан-Франциско, Сан-Диего, Осло... После нашей публикации в журнале The Breast о неточном определении категории N3 (метастазы в парастернальные лимфатические узлы) вместо N1 международный TNM комитет внес соответствующие изменения, определив (как мы и предлагали) категорию N3 только при одновременном метастатическом поражении парастернальных и подмышечных лимфатических узлов. По решению отдела онкологии ВОЗ мы провели рандомизированное проспективное исследование по определению значимости обучения женщин самообследованию в снижении смертности от рака молочной железы (1985-2005 гг.), когда нами была доказана низкая эффективность самообследования в снижении смертности от заболевания. Данные были представлены на конгрессе МАИР в Осло в 2005 году. Американская группа биостатистов, проведя чуть позже подобное исследование в Китае, полностью согласилась с нашими выводами. – Что Вы считаете самым приятным в своей работе, а что – наименее приятным? – Самое приятное – это встреча с коллегами и своими учениками, работающими в других центрах, городах и даже странах, на различных конференциях. Наименее приятное – рецензирование статей, диссертаций и написание громадных отчетов. – Какое исследование из всех, что приходят на ум, Вы считаете наиболее значимым, повлиявшим на изменение клинической практики в онкологии? – Наиболее значимым нашим исследованием мне кажется рандомизированное клиническое исследование по неоадъювантной эндокринотерапии против химиотерапии у постменапаузальных женщин с ER+ раком молочной железы. Это первое в мире исследование подобного рода. Результаты его были доложены на конгрессе ASCO в Сан-Антонио в 2004 году и опубликованы в журнале Cancer в 2007-м. Самое интересное, что оно цитируется до сих пор, в чем я мог убедиться, будучи участником очередной конференции в Санкт-Галлене в 2021 году; в рекомендациях ASCO 2021 ссылка на него также есть. – Что Вы считаете наиболее весомым личным вкладом в отечественную онкологию? Чем Вы более всего гордитесь? – У меня немало поводов для гордости, но главным считаю создание нашей питерской школы онкологов – сейчас в ней более 75 учеников, а теперь и соратников, работающих во всех уголках России и в других странах. Многие из них входят в Российское общество онкомаммологов (РООМ), RUSSCO, Ассоциацию онкологов России. Всеми ими и горжусь!
ЛЕНВАТИНИБ И ПЕМБРОЛИЗУМАБ В ЛЕЧЕНИИ МЕТАСТАТИЧЕСКОГО РАКА ЭНДОМЕТРИЯ: ОДОБРЕНИЕ FDA
Автор: Румянцев Алексей Александрович
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
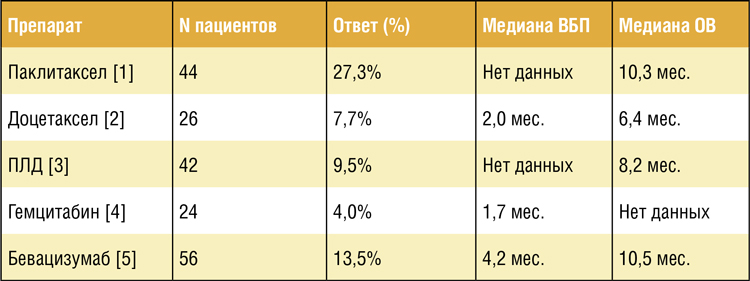
Рак эндометрия (РЭ) – одно из самых распространенных заболеваний женской репродуктивной системы. В течение длительного времени единственной доступной опцией для лечения диссеминированного РЭ была цитотоксическая химиотерапия, при этом результаты лечения для многих пациенток оставались крайне неудовлетворительными, особенно при прогрессировании заболевания после уже проведенной системной терапии. Эффективность большинства вариантом химиотерапии при рецидивах РЭ представляется неудовлетворительной (таблица 1).
Таблица 1.
Различные режимы терапии II линии для метастатического рака эндометрия
и их эффективность.
Создается впечатление, что наилучших результаты при рецидивах РЭ показывают режимы с паклитакселом, но скорее всего это связано с тем, что представленное исследование включало пациенток, не получавших паклитаксел в составе предшествующей терапии [1]. Как видно из таблицы, при любом из перечисленных вариантов лечения не удается достичь медианы общей выживаемости (ОВ) более 12 месяцев, что указывает на острую необходимость разработки более эффективных методов лечения для этой категории пациенток. Ранее, в марте 2019 года, в журнале Lancet Oncology были опубликованы результаты одногруппового исследования II фазы (n=53), продемонстрировавшие высокую противоопухолевую активности комбинации ленватиниба и пембролизумаба в лечении пациенток с рецидивами РЭ [6]. Объективный ответ был зарегистрирован у 21 (39,6%) пациентки, а медиана ВБП составила 7,4 мес. На основании этих результатов комбинация пембролизумаба и ленватиниба была одобрена для применения в ряде стран, включая Россию, а также зарегистрирована FDA по процедуре «ускоренного» одобрения. 21 июля 2021 года FDA подтвердило ранее принятое решение и одобрило применение комбинации ленвтиниба и пембролизумаба для лечения метастатического рака эндометрия у пациенток с отсутствием микросателлитной нестабильности (dMMR/MSI-h) с прогрессированием заболевания после ранее проведенной системной терапии. Решение FDA основано на результатах рандомизированного исследования III фазы Study 309/ KEYNOTE-775, посвященного сравнению эффективности комбинации пембролизумаба и ленватиниба в лечении пациенток с различными гистотипами РЭ, ранее получивших ≥1 линии системной терапии [7]. Пациентки рандомизировались в группу пембролизумаба 200 мг 1 раз в 21 день в комбинации с ленватинибом 20 мг 1 раз в сутки ежедневно непрерывно длительно или в группу химиотерапии по выбору лечащего врача (доксорубицин 60 мг/м2 каждые 21 день или паклитаксел 80 мг/м2 еженедельно). Стратификация осуществлялась в соответствии с наличием или отсутствием dMMR/MSI-h, а при позитивном статусе – в соответствии с регионом происхождения пациентки, статусом по шкале ECOG и ранее проведенной лучевой терапией на область малого таза. Первичными конечными точками исследования были показатели ВБП и ОВ. В исследование было включено 827 пациенток, медиана возраста составила 65 лет; 16% пациенток характеризовались dMMR/MSI-h. По результатам исследования медиана ВБП составила 7,2 мес. в группе пембролизумаба/ленватиниба по сравнению с 3,8 мес. в группе стандартной химиотерапии (ОР 0,56; 95% ДИ 0,47-0,66; p<0,0001), а медиана ОВ – 18,3 и 11,4 мес. соответственно (ОР 0,62; 95% ДИ 0,51- 0,75; p<0,0001). Таким образом, на фоне применения исследуемой комбинации препаратов были достигнуты обе заявленные конечные точки и зафиксировано снижение относительного риска смерти пациенток на 38% по сравнению со стандартной терапией. В подгруппе pMMR/MSS пациенток (то есть без микросателлитной нестабильности) медиана ВБП составила 6,6 мес. в группе пембролизумаба/ленватиниба по сравнению с 3,8 мес. в группе химиотерапии (ОР 0,60; 95% ДИ 0,50-0,72; p<0,0001), а медиана ОВ – 17,4 и 12,0 мес. соответственно (ОР 0,68; 95% ДИ 0,56-0,84; p=0,0001). При проведении подгруппового анализа преимущества применения комбинации были выявлены во всех изученных подгруппах. Применение комбинации ленватиниба и пембролизумаба сопровождалось повышением риска развития различных нежелательных явлений. Среди нежелательных явлений 3-4 степени в группе комбинированной терапии наиболее часто отмечалось развитие артериальной гипертензии (38% по сравнению с 2% в контрольной группе), снижение массы тела (10% vs 0%) и диарея (8% vs 2%). Это указывает на необходимость тщательного мониторинга состояния пациенток на фоне проводимой терапии ленватинибом/пембролизумабом. Таким образом, результаты исследования KEYNOTE-775 закрепляют комбинацию пембролизумаба и ленватиниба в качестве нового стандарта терапии для пациенток с метастатическим РЭ, ранее получивших системную терапию. Отдельно хотелось бы отметить следующие аспекты данного исследования: • В исследование включались пациентки, ранее получившие системную терапию по поводу РЭ в любом клиническом контексте, то есть в качестве адъювантной терапии или по поводу метастатического опухолевого процесса. Таким образом, пациентки с прогрессированием РЭ после ранее проведенной адъювантной химиотерапии могут получать комбинацию пембролизумаба и ленватиниба в качестве первой линии системной терапии. • Решение FDA одобряет применение комбинации только для пациенток без dMMR/MSI-h, хотя в исследование KEYNOTE-775 включались пациентки как с указанными биомаркерами, так и без них. Вероятно, это связано с двумя аспектами – малым количеством пациенток с dMMR/MSI-h в исследовании и с высокой эффективностью пембролизумаба при dMMR/MSI-h РЭ: по данным исследования KEYNOTE-158 частота объективного ответа в этой категории пациенток составила 57,1%, а медиана ВБП – 25,7 мес. [8]. По этой причине тестирование на предмет наличия dMMR/MSI-h должно проводиться всем пациенткам с диссеминированными формами заболевания при планировании системной терапии. Задача будущих исследований – уточнение роли комбинированной иммунотерапии в лечении данной категории пациенток.
Список литературы:
1. Lincoln S, Blessing JA, Lee RB, Rocereto TF. Activity of paclitaxel as second-line chemotherapy in endometrial carcinoma: a gynecologic oncology group study. Gynecol Oncol. 2003; 88(3): 277-281. doi:10.1016/S0090-8258(02)00068-9.
2. Garcia AA, Blessing JA, Nolte S, Mannel RS. A phase II evaluation of weekly docetaxel in the treatment of recurrent or persistent endometrial carcinoma: A study by the Gynecologic Oncology Group. Gynecol Oncol. 2008; 111(1): 22-26. doi:10.1016/j.ygyno.2008.06.013.
3. Muggia FM, Blessing JA, Sorosky J, Reid GC. Phase II Trial of the Pegylated Liposomal Doxorubicin in Previously Treated Metastatic Endometrial Cancer: A Gynecologic Oncology Group Study. J Clin Oncol. 2002; 20(9): 2360-2364. doi:10.1200/ JCO.2002.08.171.
4. Tait DL, Blessing JA, Hoffman JS, Moore KN, Spirtos NM, Lachance JA, et al. A phase II study of gemcitabine (gemzar, LY188011) in the treatment of recurrent or persistent endometrial carcinoma: A gynecologic oncology group study. Gynecol Oncol. 2011; 121(1): 118-121. doi:10.1016/j. ygyno.2010.11.027.
5. Aghajanian C, Sill MW, Darcy KM, Greer B, McMeekin DS, Rose PG, et al. Phase II Trial of Bevacizumab in Recurrent or Persistent Endometrial Cancer: A Gynecologic Oncology Group Study. J Clin Oncol. 2011;29(16):2259-2265. doi:10.1200/JCO.2010.32.6397
6. Makker V, Rasco D, Vogelzang NJ, Brose MS, Cohn AL, Mier J, et al. Lenvatinib plus pembrolizumab in patients with advanced endometrial cancer: an interim analysis of a multicentre, open-label, single-arm, phase 2 trial. Lancet Oncol. 2019; 20(5): 711-718. doi:10.1016/S1470- 2045(19)30020-8.
7. Makker V, Colombo N, Herraez AC, Santin AD, Colomba E, Miller D. A multicenter, open-label, randomized, phase 3 study to compare the efficacy and safety of lenvatinib in combination with pembrolizumab vs treatment of physician’s choice in patients with advanced endometrial cancer: Study 309/KEYNOTE-775. SGO Annual Meeting 2021.
8. Marabelle A, Le DT, Ascierto
PA, Di Giacomo AM, De JesusAcosta A, Delord J-P, et al. Efficacy
of Pembrolizumab in Patients With
Noncolorectal High Microsatellite
Instability/Mismatch RepairDeficient Cancer: Results From the
Phase II KEYNOTE-158 Study. J Clin
Oncol. 2020; 38(1): 1-10. doi:10.1200/
JCO.19.02105.

РАКФОНД ОБЪЯВЛЯЕТ НОВЫЙ КОНКУРС НАУЧНО-ИССЛЕДОВАТЕЛЬСКИХ ПРОЕКТОВ В ОБЛАСТИ ОНКОЛОГИИ
Цель программы – предоставить финансирование и дополнительную поддержку ученым и врачам, работающим в России, для стимулирования и продвижения исследований в области онкологии, поиска и разработки новых способов профилактики, диагностики и лечения онкологических заболеваний.
Принимаются заявки на проведение исследований в области онкологии по следующим направлениям:
• Клинические исследования: интервенционные, рандомизированные (предпочтительно), направленные на изучение методов и средств профилактики, диагностики, мониторинга и лечения злокачественных новообразований, реабилитации и качества жизни онкологических больных
• Трансляционные исследования: поиск и изучение биомаркеров для диагностических и прогностических целей, подбора терапии
• Фундаментальные исследования
Победитель конкурса получит
финансирование от РакФонда
в размере до 500 000 рублей на
выполнение исследовательского проекта, а также экспертную
помощь в доработке дизайна и
протокола исследования и статистической обработке данных
и доступ к онлайн-сервису для
проведения клинических исследований Энроллми.ру.
Результаты конкурса будут
объявлены 9-11 ноября 2021 года
в ходе XXV Российского онкологического конгресса. Зарегистрировать и подать заявку
можно до 10 сентября 2021 на
сайте rakfond.org

ПО СЛЕДАМ НЕДАВНИХ ПУБЛИКАЦИЙ: МНЕНИЕ СПЕЦИАЛИСТОВ
Автор: Константин Борисович Гордон
МРНЦ им. А. Цыба, Обнинск
Hui Z, Men Y, Hu C, et al. Effect of Postoperative Radiotherapy for Patients With pIIIA-N2 Non–Small
Cell Lung Cancer After Complete Resection and Adjuvant Chemotherapy: The Phase 3 PORT-C
Randomized Clinical Trial. JAMA Oncol. Published online June 24, 2021.
To PORT or not to PORT?
That is the question…
Стоит ли проводить послеоперационное облучение при IIIA pN2 НМРЛ? Это вопрос, на который уже несколько десятилетий самые авторитетные исследователи пытаются найти ответ. Еще в 1998 году Metaanalysis Trialists Group во главе с д-ром Stewart опубликовали в журнале The Lancet крупный метаанализ результатов послеоперационного облучения при НМРЛ: как при раннем раке, так и при местнораспространенных формах [1]. В этом исследовании были проанализированы результаты 9 рандомизированных исследований, включающих 2128 пациентов. Однозначно было доказано, что локализованные формы рака легкого после радикальных операций не нуждаются в адъювантном облучении. Более того, ранняя и поздняя токсичность от лучевой терапии в те времена заметно ухудшала не только качество жизни больных, но и в целом снижала общую выживаемость. Для pN2 и III стадии результаты были неоднозначные, вследствие чего авторы не рекомендовали облучение как стандарт лечения для этой категории больных. Стоит отметить, что набор пациентов велся с 1965 по 1995 гг., и применяемые техники 2D-терапии оставляли желать лучшего. Это дало повод для сомнений в результатах метаанализа и пищу для размышлений о новых проспективных исследованиях. Со временем было доказано, что химиолучевая терапия при IIIA N3 стадии НМРЛ однозначно необходима [2-4]. И было также посеяно зерно сомнения, что современные техники облучения (3D-CRT, IMRT), вероятно, позволят улучшить результаты лечения и у больных с N2. Когда мы говорим о результатах лечения рака легкого, важно понимать, что основные неудачи связаны не столько с локорегионарным контролем, сколько с отдаленным прогрессированием. Поэтому, начиная с середины 2000-х годов, в качестве адъювантного лечения было рекомендовано проведение 4 курсов системной полихимиотерапии. А в 2007 году профессором Le Pechoux из Института Gustave Roussy было инициировано новое европейское проспективное исследование LungART [5], призванное ответить на вопрос, стоит ли игра свеч в случае pN2. Учитывая изменения, произошедшие как в качестве проведения лучевой терапии, так и на фоне позитивных эффектов от химиолучевой терапии при IIIA стадии НМРЛ, вновь был поставлен вопрос, стоит ли проводить послеоперационное облучение при pN2 и 4 курсах неоадъювантной химиотерапии. Более 500 пациентов были рандомизированы в группы послеоперационной лучевой терапии (PORT) и контроля с 2007 по 2018 гг. Медиана возраста больных составила 61 год. Преобладающей морфологической формой являлась аденокарцинома (73%). Лучевая терапия была реализована в дозе 54 Гр за 27-30 фракций. Конечными точками исследования стали ВБП (выживаемость без прогрессирования заболевания), а также токсичность, локальный контроль, общая выживаемость (ОВ) и прогностические факторы. Анализ результатов был проведен после достижения медианы наблюдения в 4,8 лет. ВБП в группе PORT составила 47,1% против 43,8% в группе контроля, без статистической значимости различий. Общая выживаемость была 66,5% в группе PORT против 68,5% в контроле, и также без значимых различий. А вот кардиопульмональная токсичность была многократно выше в группе PORT: 20% против 7,7% в контрольной группе. Обращает на себя внимание различие в медиане ВБП: 30,5 мес. в группе PORT против 22,8 мес. в контроле, хотя и здесь статистической значимости не было отмечено. Таким образом, профессор Le Pechoux в своем пресс-релизе для ESMO в сентябре 2020 года отметила, что использование PORT, возможно, и имеет некоторые позитивные моменты (снижение риска рецидив в средостении на 50%) , но в настоящий момент никак не может быть рекомендовано как стандарт лечения в силу неубедительных различий в ВБП и ОВ, а главное – практически трехкратного роста кардиопульмональной токсичности. Новым весомым аргументом «против» PORT стало недавно (июнь 2021 г.) вышедшее исследование 3-й фазы от китайских коллег, опубликованное в журнале JAMA Oncology [6]. За период с 2009 по 2017 год были рандомизированы 394 пациента с IIIA pN2 стадией НМРЛ: 202 больных вошли в группу PORT, 192 человека – в группу наблюдения. Лучевое лечение осуществлялось на 6 MeV линейных ускорителях с МЛК, в дозе 50 Гр за 25 фракций. В окончательный анализ вошли 364 больных (184 в группе PORT, 180 в группе контроля). Трехлетняя ВБП в группе PORT составила 40,5% против 32,7% в контрольной группе, при этом медиана выживаемости также была выше в группе PORT – 22,6 мес. против 18,6 мес. в контроле (HR 0,84; 95% CI 0,65-1,09; P=0,20). И вновь, несмотря на номинально превосходящие результаты в группе PORT, статической значимости они не возымели. Однако когда авторы проанализировали результаты лечения 310 больных, лечение и наблюдение за которыми велось в абсолютном соответствии с протоколом исследования, значимые различия в ВБП в пользу группы PORT все же были найдены (42,8% против 30,6%; HR 0,75; 95% CI 0,57-1,00; P=0,05). Выживаемость без локальных рецидивов ожидаемо и значимо была выше в исследуемой группе (71,9% против 58,4%; HR 0,56; 95% CI 0,39-0,80) (рис.1).
Рисунок 1.
. Показатели ВБП и ОВ по данным исследования
Hui Z et al. [6].
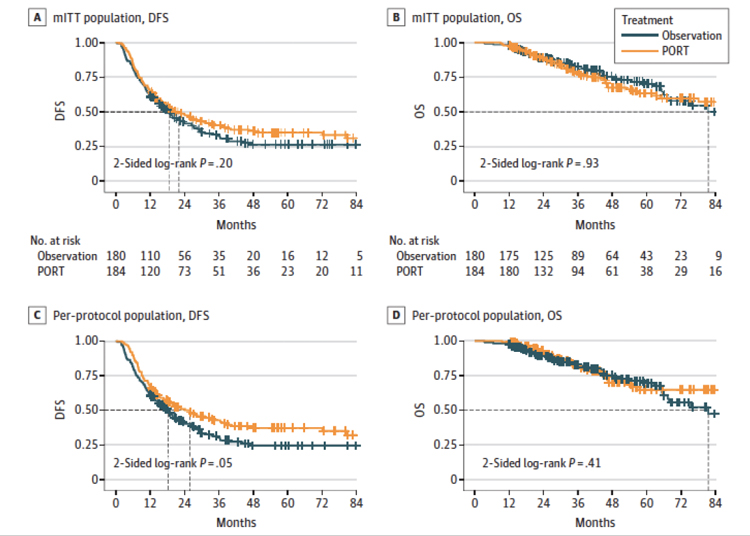
Авторы лишь поверхностно рассматривают токсичность лучевого лечения, сообщая, что осложнений 4-5 степени, к счастью, отмечено не было. Всего у одного пациента был выявлен пневмонит 3 ст. В целом же частота реакций была выше в группе PORT (55 больных против 20 человек в контроле). Особенно стоит отметить, что авторы провели фактически несколько статистических анализов, включая: 1) всю популяцию (mITT), 2) строгих приверженцев протокола (PP), 3) пролеченных «как есть» (AT). Ни один из аналитических подходов не продемонстрировал убедительного влияния PORT на общую выживаемость, хотя в группе PP было отмечено увеличение ВБП после проведения облучения (HR 0,75). Среди факторов, которые затрудняют правильную интерпретацию данных, авторы отмечают именно невысокую степень приверженности лечению. Однако это частое явление, и мы все понимаем, что «идеальных» пациентов просто не существует и всегда могут быть отклонения от запланированного курса лечения. Мы живем в реальном мире, в котором достаточно большое количество непрогнозируемых интеракций, потенциально влияющих на исходы лечения, при этом это не всегда касается именно медицинской части. Поэтому очень важен выбор метода терапии, который будет полезен вне зависимости от строгости следования протоколу. Компилируя полученные данные с результатами LungART, наши китайские коллеги во главе с д-ром Hui также делают вывод о том, что проведение послеоперационной лучевой терапии при IIIA pN2 стадии и полной резекции опухоли не улучшает результаты лечения в целом, хотя имеются и некоторые положительные моменты (например, локальный контроль, приемлемая токсичность и т.д.). Глядя на абсолютные цифры в обоих этих исследованиях, без поправки на статистическую значимость, складывается впечатление, что при определенных условиях PORT все же может быть востребована. Возможно, стоит рассмотреть и добавление конкурентной химиотерапии, так как основной причиной неудач лечения было и остается отдаленное прогрессирование. Требуется поиск прогностических факторов и выделение конкретной группы больных, которым проведение послеоперационного облучения принесет максимальную пользу.
Ссылки:
1. PORT Meta-analysis Trialists Group. Postoperative radiotherapy in non smallcell lung cancer: systematic review and meta-analysis of individual patient data from nine randomised controlled trials. Lancet. 1998; 352: 257-263.
2. Douillard JY, Rosell R, De Lena M, et al. Impact of postoperative radiation therapy on survival in patients with complete resection and stage I, II, or IIIA non-small-cell lung cancer treated with adjuvant chemotherapy: The adjuvant Navelbine International Trialist Association (ANITA) randomized trial. Int J Radiat Oncol Biol Phys. 2008; 72: 695-701.
3. Lally BE, Zelterman D, Colasanto JM, et al. Postoperative radiotherapy for stage II or III non-small-cell lung cancer using the Surveillance, Epidemiology, and End Results database. J Clin Oncol. 2006; 24: 2998-3006.
4. John L Mikell, Theresa W Gillespie, William A Hall, et al. Postoperative radiotherapy is associated with better survival in non-small cell lung cancer with involved N2 lymph nodes: results of an analysis of the National Cancer Data Base. J Thorac Oncol. 2015; 10(3): 462-71. doi: 10.1097/ JTO.0000000000000411.
5. Le Pechoux C, et al. An international randomized trial, comparing postoperative conformal radiotherapy (PORT) to no PORT, in patients with completely resected non-small cell lung cancer (NSCLC) and mediastinal N2 involvement. Primary end-point analysis of Lung ART (IFCT-0503, UK NCRI, SAKK) NCT00410683. ESMO Virtual Congress 2020, LBA3_PR Presidential Symposium II, 20.09.2020.
6. Hui Z, Men Y, Hu C, et al. Effect of
Postoperative Radiotherapy for Patients
With pIIIA-N2 Non-Small Cell Lung
Cancer After Complete Resection and
Adjuvant Chemotherapy: The Phase 3
PORT-C Randomized Clinical Trial.
JAMA Oncol. Published online June 24,
2021. doi:10.1001/jamaoncol.2021.1910.
КОММЕНТАРИЙ ЭКСПЕРТА
После выхода в свет результатов исследования Lung ART на ESMO 2020
короткий опрос российских радиотерапевтов на сайте RUSSCO показал,
что у части наших коллег никакие крупные проспективные исследования, никакие метаанализы не способны поколебать веру в необходимость проведения лучевой терапии после радикальной операции при
раке легкого, даже в тех ситуациях, когда это противоречит существующим рекомендациям (rosoncoweb.ru/news/oncology/2020/09/25/).
На самом деле утверждение «PORT показана всегда» не имеет ничего
общего с реальностью, и это надо признать. Показано ли облучение всем
пациентам с N2, как мы полагали некоторое время назад – скорее всего
нет, это демонстрирует Lung ART. Явилось ли недавнее исследование китайских авторов еще одним подтверждением в пользу отказа от PORT
– не столь очевидно, и сложно назвать исследование полностью негативным. Слишком явно расходятся кривые ВБП, хоть и без статистической
достоверности, и кто знает, как бы они выглядели при большем периоде
наблюдения и большем числе пациентов. Авторами показано, что PORT
как локальный метод воздействия достигает своей цели: вносит вклад
в локальный контроль, улучшает ВБП и выживаемость без локального
прогрессирования (66,5% против 59,7% за 3 года), хоть это, увы, и не отражается на общей выживаемости. Но НМРЛ IIIA pN2 стадии – это та
ситуация, где рассчитывать только на качественное локальное лечение
не приходится, необходима адекватная и, скорее всего, более эффективная системная терапия. В любом случае, результаты исследования китайских авторов снова заставляют нас скрупулезно взвешивать все за и
против при назначении PORT нашим пациентам и ожидать более четких
рекомендаций от профессиональных сообществ в отношении того, кому
же прежде всего показано послеоперационное облучение.
ПЯТЬ МИНУТ С ИЗВЕСТНЫМ ОНКОЛОГОМ: ПРОФЕССОР HISHAM MEHANNA
Автор: Professor Hisham Mehanna
Director of the Institute of Head and Neck Studies and Education (InHANSE), Birmingham
В преддверии юбилейного XXV Российского онкологического конгресса
Профессор Hisham Mehanna – широко известный в мире ОГШ хирург, заместитель проректора Университета Бирмингема (Междисциплинарные исследования), директор Института Глобальной Инновации (I.G.I.) и Института перспективных исследований (I.A.S) Университета Бирмингема. Профессор Механна неоднократно выступал с результатами собственных исследований на крупнейших международных мероприятиях, включая конгрессы ESMO, ASCO и ASTRO, не раз бывал с лекциями в России. Разговаривая с профессором Механной, не перестаешь удивляться не только обширным знаниям и колоссальному хирургическому, исследовательскому и административному опыту (несмотря на молодость – 1 сентября ему исполняется 52 года), но и простоте общения и великолепному чувству юмора. Выступление профессора Хишама Механны планируется в сессии INDIGO на XXV Российском онкологическом конгрессе. Регистрируйтесь и участвуйте!
– Опишите Ваше детство – было ли оно счастливым или сложным? Какой эпизод из детства Вам более всего запомнился?
– Скажу определенно: мое детство было счастливым. Я родился в Кувейте, в старом городе Ахмади. У отца была хорошая работа, мы жили относительно неплохо, мама обожала нас всех. Память хранит множество эпизодов из детства, и один факт мама всегда любит вспоминать, когда рассказывает обо мне моим детям. Когда она хотела наказать меня за какую-нибудь оплошность, она обычно говорила, что не разрешит мне идти в школу на следующий день – такова была моя любовь к учебе. После этого я сразу начинал торговаться, чтобы она наказывала меня «недопуском» в клуб, а не в школу, и в конце концов она соглашалась. Еще одним сильным воспоминанием детства я считаю вторжение Ирака в Кувейт в 1990 году, когда я был на полпути к окончанию медицинской школы в Кувейте. Мы смогли продержаться два месяца после вторжения и покинули страну накануне начала войны за освобождение. Запомнились те колоссальные трудности, через которые пришлось пройти семье – но также и тот факт, что это было первое испытание для меня, как взрослого мужчины. К счастью, я справился.
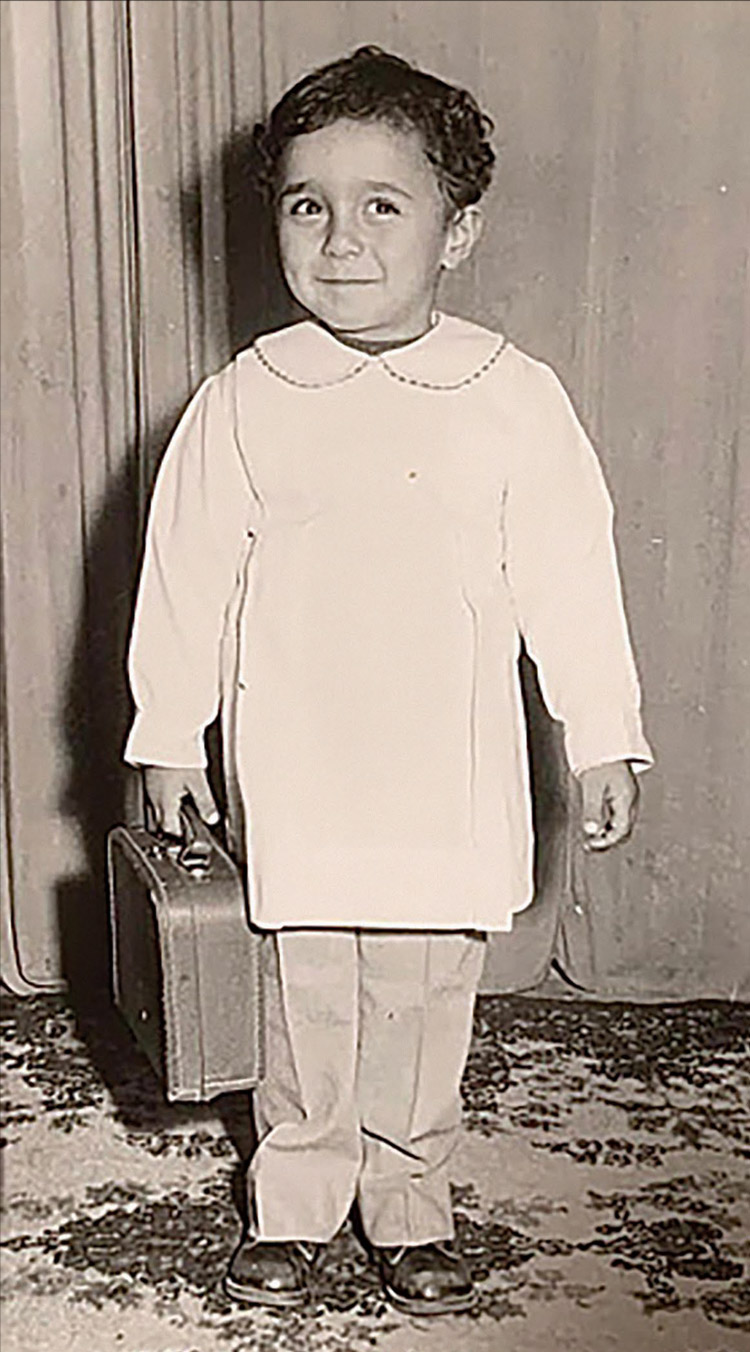
– Когда Вы поняли, что хотите заниматься медициной?
– Я всегда знал, что буду заниматься медициной, возможно, из-за клише «хочу помогать людям». У меня даже есть фотография в 4-летнем возрасте, где на мне хирургический халат! Но когда я учился в старшей школе, тот объем информации, связанный с биологией, который нужно было усвоить, меня просто добивал, поэтому в тот момент я решил вместо медицины заняться инженерией и был принят в один из университетов в США. Однако жизнь распорядилась по-другому: незадолго до моего отъезда родилась моя младшая сестра, которая оказалась инвалидом – вот тогда я и решил остаться в Кувейте, чтобы помогать. Тогда же я окончательно понял, что займусь медициной – так оно и вышло.
– Каким Вы видели свое профессиональное будущее в период студенчества, насколько осуществились Ваши планы в реальности?
– Я понятия не имел, какова будет моя карьера, и что все сложится так, как есть сейчас, и я благодарен Богу, что именно так шёл по своему профессиональному пути, стараясь не упускать те возможности, которые мне открывались. Всё, о чем я мечтал, будучи студентом-медиком, – просто сдать все экзамены и стать врачом. Впервые став консультирующим доктором, я однажды услышал от своего старшего коллеги: «Скоро ты будешь профессором». Помню, здорово удивился этому, поскольку даже не рассматривал такую возможность.
– Если бы не ЛОР хирургия – кем бы Вы могли стать?
– Если б ЛОР хирургия не случилась в моей жизни, я бы, пожалуй, все равно предпочел хирургическую специальность, например, реконструктивно-пластическую хирургию. Но если говорить откровенно, я никогда не думал о том, чтобы заниматься чем-то другим, не хирургией головы и шеи – не только потому, что это интересно и технически сложно, но и потому, что твои пациенты остаются с тобой надолго и даже становятся твоими друзьями.
– Если б кто-то из Ваших детей спросил Вашего совета, кем ему быть, посоветовали б Вы становиться ЛОР хирургом?
– На самом деле моя дочь спрашивала моего совета по поводу дальнейшей карьеры. Я ответил так: если она действительно заинтересована в медицине, значит, надо становиться врачом, но затем обязательно получить образование и диплом в сфере искусственного интеллекта. На мой взгляд, искусственный интеллект вскоре станет большой и неотъемлемой частью медицины и принесет немало колоссальных изменений в практическую деятельность к тому моменту, как моя дочь станет самостоятельным консультирующим врачом, поэтому лучше сразу занять оптимальную позицию, имея хороший багаж знаний по этой теме. В итоге она решила стать дантистом!
– Что Вы считаете самым лучшим в своей работе, а что – наименее приятным?
– Моя карьера развивалась так, что теперь у меня весьма разносторонняя работа. Я являюсь заместителем проректора Университета Бирмингема, и это значит, что я играю важную руководящую роль в университете. Я также возглавляю Институт глобальной инновации (Institute for Global Innovation, IGI), крупный межотраслевой многопрофильный институт, созданный для формирования междисциплинарных инноваций между разными специальностями, не только медицинскими – и снова эта работа охватывает весь университет. Я руковожу крупной исследовательской группой по опухолям головы и шеи, которая занимается как клиническими, так и фундаментальными исследованиями, и, наконец, занимаюсь клинической практикой. Таким образом, в течение одного дня я могу работать в операционной, обсуждать эксперименты в области молекулярной биологии с моей командой, а затем дискутировать по вопросам кооперации с международными организациями, такими, как UNESCO, или с министром из правительства Великобритании в качестве представителя IGI. Я даже не мог представить тогда, когда изучал медицину, что окажусь в настолько привилегированном положении с таким разнообразием деятельности и интересов! Наименее любимая часть моей работы – это заполнение административных бумаг. У меня это плохо получается, но это неизбежное зло.
– На Ваш взгляд, какое исследование можно назвать наиболее влиятельным в плане изменения клинической практики в Вашей сфере онкологии? Почему?
– Я думаю, таким исследованием является RTOG 91-11 – оно прочно закрепило позиции химиолучевой терапии в лечении больных с опухолями головы и шеи. Я также считаю, что исследование Kian Ang (RTOG 0129), опубликованное в NEJМ в 2010 году, было чрезвычайно важным, продемонстрировав роль вируса папилломы человека (HPV) в качестве важного прогностического фактора. Я бы назвал и два недавних исследования – RTOG 1016 и наше DeESCALaTE, поскольку они четко продемонстрировали, что старый добрый цисплатин более эффективен, чем цетуксимаб, в химиолучевом лечении больных с ВПЧ-позитивными ОГШ. Наконец, Keynote 048 показало, что иммунотерапия должна стать стандартом лечения больных с рецидивным и метастатическим раком головы и шеи, открыв дорогу иммунотерапии в качестве потенциально излечивающего метода.
– Что Вы считаете наиболее существенным вкладом в Вашу работу, которым Вы действительно гордитесь?
– Более всего горжусь двумя своими рандомизированными клиническими исследованиями. Первое – исследование PET Neck – как я полагаю, позволило установить новую парадигму лечения больных с ОГШ после радикального химиолучевого лечения в плане воздействия на зону лимфоузлов шеи с применением ПЭТ-КТ. До сих пор это исследование является единственным определяющим тактику ведения пациентов в соответствии с 1 уровнем доказательности. Наше исследование DeESCALaTE, которое я уже упоминал, также часто цитируется в научной литературе по причине значительного вклада в доказательную медицину. Также я очень горд быть основателем и – в настоящее время – лидером Международной группы по раку головы и шеи (Head and Neck Cancer International Group), представляющей собой кооперацию 20 национальных исследовательских групп со всего мира. С помощью этой организации мы гармонизируем клинические исследования и клиническую практику в целом в интересах пациентов с опухолями головы и шеи во всем мире.
– Что помогает Вам расслабиться после тяжелого дня?
– Рэп и R&B на полную громкость в машине, теплая ванна и долгая прогулка – если нет традиционного английского дождя!
Беседовала Наталья Деньгина
ПО КОМ ЗВОНИТ КОЛОКОЛ: ДЕЛЬТА-ШТАММ, ВАКЦИНАЦИЯ И ОНКОПАЦИЕНТЫ
Автор: Шейко Андрей Владимирович
Врач-радиотерапевт, заведующий радиотерапевтическим отделением №2 ОКОД, Владимир
Дельта-штамм (В1.617.2) коронавирусной инфекции, впервые зарегистрированный в Индии в декабре 2020 года, уже к середине апреля 2021 года стал наиболее распространенным штаммом SARS-CoV-2 в стране, а к 19 мая 2021 года распространился и на 43 государства на шести континентах. В настоящее время доля дельта-штамма в структуре вариантов коронавируса в мире приближается к отметке 100%, практически полностью вытеснив при этом альфа штамм (рис. 1, 2) [1].
Рисунок 1.
Процентное соотношение штаммов COVID-19
среди случаев заболевания к концу июля – началу августа
2021 года.
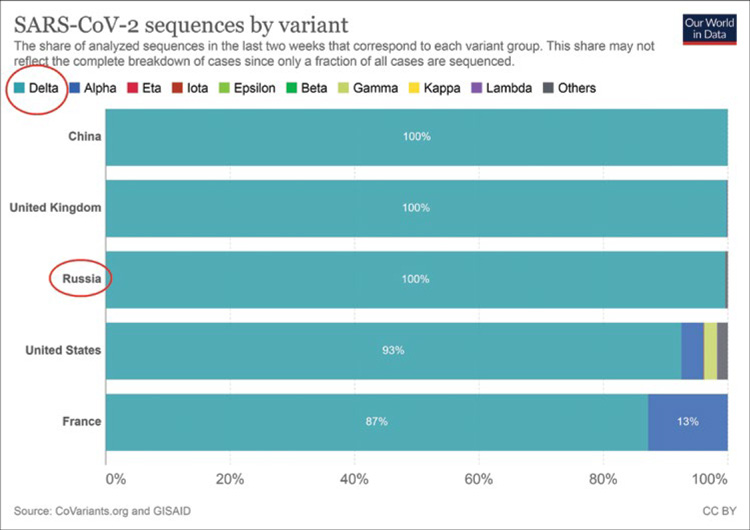
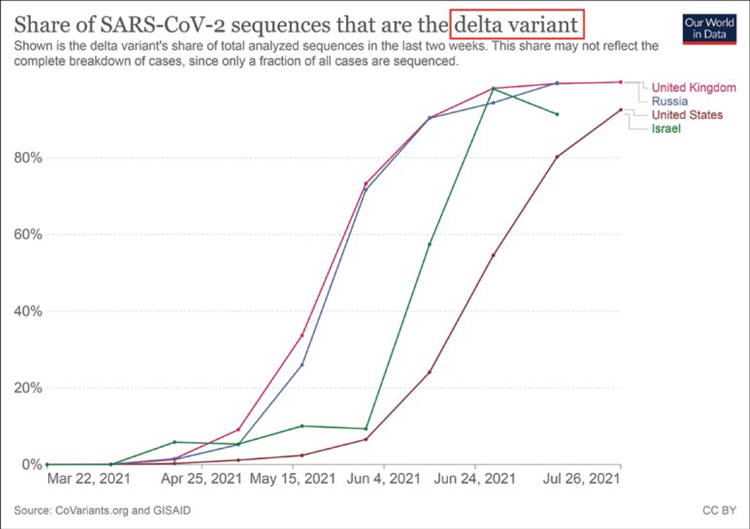
Рисунок 2.
Частота случаев заболеваемости дельта-штаммом
COVID-19 с марта по июль 2021 года.
Дельта-штамм коронавируса обладает мутациями T19R, Δ157-158, L452R, T478K, D614G, P681R и D950N в спайковом белке, что приводит к более интенсивной репликации, высокой вирусной нагрузке и высокой контагиозности возбудителя. Данных об эффективности вакцин против COVID-19, вызванной новым индийским штаммом, до сегодняшнего момента не было. В конце июля 2021 года в журнале NEJM были опубликованы результаты тест-негативного ретроспективного исследования случай-контроль, посвященного оценке эффективности вакцинации против симптомной коронавирусной инфекции, вызванной дельта- и альфа-штаммами SARS-CoV-2 в период начала циркуляции в популяции дельта-штамма [2]. В британское исследование были включены вакцинированные пациенты старше 16 лет с положительными и отрицательными (для тест-негативного анализа случайконтроль) результатами ПЦР-тестов на COVID-19, полученными не позднее десяти дней с момента манифестации симптомов заболевания в период с октября 2020 по май 2021 года. В зависимости от статуса вакцинации пациенты были разделены на три группы:
1. лица с симптомами заболевания, появившимися в течение 21 дня и более с момента введения первой дозы вакцины до кануна введения второй дозы;
2. лица с симптомами заболевания, появившимися в течение 14 дней и более с момента введения второй дозы вакцины;
3. лица с симптомами заболевания, появившимися в течение 21 дня и более с момента введения первой дозы вакцины, включая любой период после введения второй дозы.
Для определения штаммпринадлежности вируса во всех случаях было выполнено полногеномное секвенирование. Из 38 592 случаев в исследование было отобрано 19 109 вакцинированных пациентов с симптомным течением COVID-19, вызванным альфа- (14 837 случаев) и дельта- (4 272 случая) штаммами. Для оценки вероятности развития симптоматической ПЦР-подтвержденной инфекции COVID-19 среди вакцинированных лиц в сравнении с невакцинированными (группа контроля) был использован логистический регрессионный анализ. Результаты оценки эффективности представлены на рисунке 3.
Рисунок 3.
Эффективность вакцинации против альфа- и
дельта-штаммов в зависимости от дозы и типа вакцин.

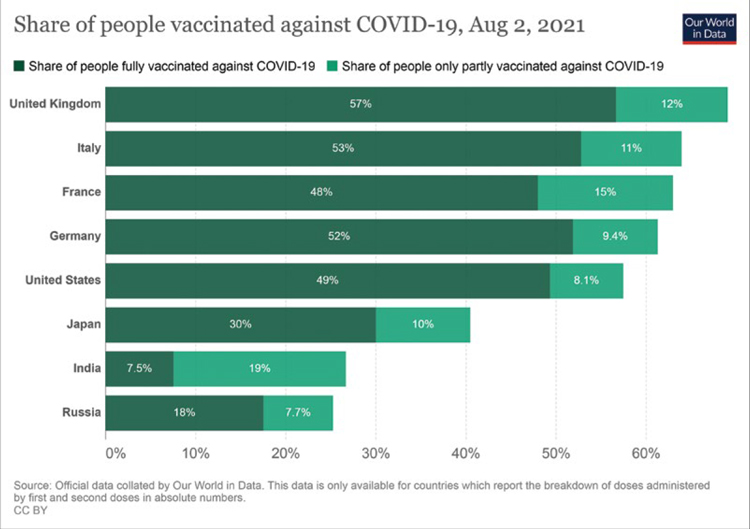
В британском исследовании, как можно заметить, выполнена оценка эффективности двух видов вакцин: BNT162b2 и ChAdOx1 nCoV-19. Но, кроме того, проведен анализ эффективности группы так называемой «any vaccine», куда были отнесены все лица, привитые прочими вакцинами, не относящимися к двум указанным выше. Данная когорта пациентов представляет особый интерес. Эффективность вакцинации в группе «any vaccine» среди инфицированных дельта-штаммом при этом оказалась заметно ниже после введения первой дозы вакцин (30,7%; 95% доверительный интервал [ДИ] 25,2-35,7), нежели у лиц с альфа-штаммом (48,7%; 95% ДИ 45,5-51,7). Однако эта разница в эффективности была почти нивелирована после введения второй дозы: 87,5% (95% ДИ 85,1-89,5) для альфаштамма и 79,6% (95% ДИ 76,7-82,1) для дельта-штамма. Таким образом, по результатам проведенного исследования любая из вакцин оказалась эффективной против дельта-штамма SARS-CoV-2, однако максимальный эффект может быть достигнут лишь при условии введения двух доз (79,6% с 95% ДИ 76,7-82,1 в группе «any vaccine»). Результат весьма обнадеживающий и вселяющий определенную долю оптимизма. Естественно, следует помнить, что исследование «случай-контроль» тест-отрицательным методом не лишено определенных недостатков (случаи неверной интерпретации ложно-отрицательных тестов, поскольку как заболевшие, так и контрольные участники имеют симптомы, сходные с COVID-19; искажение от общих прогностических факторов вакцинации и риска воздействия инфекции, таких как принадлежность к приоритетной группе по возрасту или роду занятий и т.д.). Однако в соответствии с рекомендациями ВОЗ 2021 года данный метод остается наиболее эффективным и содержащим наименьшее количество ошибок в оценке эффективности вакцинации против COVID-19 [3]. На этом позитивном фоне все более удручающей выглядит ситуация с темпами вакцинации на территории Российской Федерации (лишь 18% населения полностью привито от SARSCoV-2 по состоянию на начало августа 2021 года) (рис. 4).
Рисунок 4.
Темпы вакцинации в мире на начало августа 2021 г
Необычное и весьма интересное исследование было опубликовано в журнале Nature Medicine в июле 2021 года, посвященное оценке как популярности, так и неприятия вакцинации в странах со средним и низким уровнем дохода [4]. В исследование включены 10 стран Азии, Африки, Южной Америки, а также США и Россия. По результатам опроса 44 260 респондентов в среднем готовность вакцинироваться в исследованных странах составила 80,3% (95% ДИ 74,9-85,6). В России готовность вакцинироваться среди населения составила всего 30,4% (95% ДИ 29,1-31,7). Основными причинами неприятия вакцинации явились боязнь выраженных побочных эффектов, убежденность в отсутствии эффективности вакцинации и приверженность конспирологическим теориям (!) (рис. 5).
Рисунок 5.
Причины отказа от вакцинации в различных
странах со средним и низким уровнем дохода [4].

Еще более неоднозначная и тревожная ситуация складывается с вакцинацией онкологических больных, подверженных крайне высокому риску развития тяжелых симптомных форм COVID-19 и летальных исходов, учитывая, что данный контингент пациентов преимущественно представлен более возрастным населением с большим количеством сопутствующих заболеваний, более низким статусом работоспособности и множеством неизмеряемых искажающих факторов [5]. Однако нельзя не признать позитивного эффекта от вышедших в июле 2021 года Временных методических рекомендаций о порядке проведения вакцинации против COVID-19 МЗ РФ, на этот раз весьма убедительно регламентировавших порядок иммунизации онкологических больных [6]. Особое внимание уделено при этом вакцине Гам-КОВИД-Вак (Спутник V) как наиболее исследованной. Использование вакцины Спутник V без дополнительных ограничений теперь рекомендуется всем онкологическим больным, завершившим противоопухолевое лечение вне зависимости от стадии и формы заболевания, а также больным в процессе циклического лечения без признаков гематологической токсичности и пациентам – кандидатам на хирургическое лечение не позднее 14 дней до даты операции. Рекомендуется рассматривать вакцинацию Спутником V пациентам в процессе противоопухолевого лечения с заранее ожидаемой гематологической токсичностью в период минимального риска ее развития (не позднее двух недель до начала курсов химиотерапии, лучевой терапии, химиолучевой терапии или в перерывах между курсами или по их окончании). Вакцинации также подлежат онкогематологические пациенты до начала или в процессе лечения с достигнутым уровнем лимфоцитов более 1,0×103 кл/мкл и В-клеток более 50/мкл, а также пациенты, получающие иммунотерапию, без признаков гематологической токсичности. Убедительных данных о возможности и относительной безопасности применения вакцин «ЭпиВакКорона», «КовиВак» и «Спутник Лайт» у онкологических больных пока не представлено. Неоспоримым остается тот факт, что онкологические пациенты – группа высочайшего приоритета в графике вакцинации. Однако применение вакцин у данной категории больных должно всегда проходить с оглядкой на токсичность лечения, виды и методы химио-, иммуно-, гормоно- или биотерапии, сроки лечения, состояние пациента и прогноз его заболевания. Итак, британское исследование внесло новый весомый аргумент в неоспоримую пользу вакцинации против COVID-19, вызванную не только уже изученными штаммами SARS-CoV-2, но и бушующим в настоящее время во всех странах мира дельта-штаммом. Весьма ожидаемо, что максимальной эффективности иммунизация против дельта-варианта достигает лишь после введения второй вакцины. Вышедшие в июле 2021 года обновленные Методические рекомендации МЗ наконец-то направили вектор иммунизации и в сторону онкологических больных, вакцинация которых имеет высочайший приоритет. Очевидно, что вакцинация не лишит нас и наших пациентов опасности первичного или повторного заражения коронавирусной инфекцией, но точно избавит от тяжелого симптомного течения и высоких рисков осложнений и летального исхода. Но только лишь полноценный максимальный охват населения иммунизацией сможет пусть и не победить COVID-19, но, по крайней мере, обуздать пандемию.
Источники:
1. ourworldindata.org.
2. Lopez Bernal J, Andrews N, Gower C, et al. Effectiveness of Covid-19 Vaccines against the B.1.617.2 (Delta) Variant. N Engl J Med. 2021 Jul 21; NEJMoa2108891. doi: 10.1056/NEJMoa2108891. Epub ahead of print. PMID: 34289274. PMCID: PMC8314739.
3. Оценка эффективности вакцины против COVID-19: временное руководство ВОЗ от 17.03.2021.
4. Solís Arce JS, Warren SS, Meriggi NF, et al. COVID-19 Vaccine Acceptance and Hesitancy in Low- and Middle-income Countries. Nat Med. 2021 doi.org/10.1038/ s41591-021-01454-y.
5. Поляков А.А., Лунин В.В., Аббайсбейли Ф.М. и др. Вакцинация против SARS-COV-2 в онкологической практике. Онкогематология. 2021; 16(2): 70-80. DOI: 10.17650/1818-8346-2021- 16-2-70-80.
6. Временные методические рекомендации «Порядок проведения вакцинации взрослого населения против
COVID-19» от 24.07.2021 МЗ РФ и
ФГБУ «НМИЦ ТПМ» МЗ РФ.
Зенлистик™ – новое показание для пациентов с HR+, HER2- РМЖ
10 июня 2021 года Министерство здравоохранения Российской Федерации одобрило препарат Зенлистик™ в качестве комбинации c эндокринной терапией для адъювантного лечения положительного по гормональным рецепторам (HR+) и отрицательного по рецептору эпидермального фактора роста человека 2-го типа (HER2-) рака молочной железы на ранних стадиях с поражением региональных лимфатических узлов и высоким риском развития рецидива. Таким образом, Зенлистик™ является первым и единственным препаратом из группы ингибиторов циклин-зависимых киназ 4/6, одобренным в комбинации с адъювантной гормональной терапией за последние 20 лет в рамках данного показания и доказавший эффективность в ходе проведенного клинического исследования.
• Лечение препаратом Зенлистик™ снижало риск развития рецидива рака молочной железы на 29%, что характеризуется клинически значимым увеличением выживаемости без признаков инвазивного заболевания.
• Приблизительно у 20-30% пациентов с ГР+, HER2- РМЖ на ранних стадиях в дальнейшем развивается неизлечимое метастатическое заболевание, и регистрация препарата Зенлистик™ в качестве адъювантной терапии может быть новым методом лечения для такой группы больных.
«Это одобрение характеризует Зенлистик™ как первый и единственный препарат из группы ингибиторов циклин-зависимых киназ 4/6, который зарегистрирован для лечения ГР+, HER2- рака молочной железы на ранних стадиях с высоким риском развития рецидива и является первой успешной опцией в дополнение к адъювантной эндокринной терапии за последние двадцать лет, – заявила Ирина Запорожец, генеральный директор филиала «Лилли» в России и СНГ. – Мы понимаем, что пациенты хотят сделать все возможное, чтобы уменьшить риск возвращения рака в надежде жить полной, свободной от болезни жизнью, и мы гордимся тем, что можем предложить им такое лечение. Мы хотим поблагодарить врачей, медицинских сестер, пациентов, тех, кто ухаживает за ними, и всех, кто принимает участие в клиническом исследовании monarchE».
Это одобрение основывается на результатах исследования 3 фазы monarchE, в котором основной критерий эффективности был достигнут при втором промежуточном анализе эффективности: было показано статистически значимое увеличение выживаемости без признаков инвазивного заболевания (IDFS). При анализе результатов препарат Зенлистик™ в комбинации с эндокринной терапией снижал риск развития рецидива рака молочной железы на 29% по сравнению с применением одной стандартной адъювантной эндокринной терапии у пациентов с ГР+, HER2- раком молочной железы на ранних стадиях и высоким риском развития рецидива с поражением региональных лимфатических узлов (ОР 0,71 [95% ДИ 0,58-0,87], номинальное значение p=0,0009 (2-стороннее)). Это увеличение наблюдалось во всех заранее выбранных подгруппах, и абсолютная разница составила 3% для IDFS между группами лечения (92,3% в группе Зенлистик™ и 89,3% в контрольной группе) через два года. Добавление препарата Зенлистик™ к эндокринной терапии приводило также к увеличению выживаемости без отдаленных метастазов (DRFS), что означает, что в группе пациентов, получавших Зенлистик™ + эндокринная терапия, было меньше случаев метастатической стадии заболевания по сравнению с пациентами в группе стандартной эндокринной терапии. Комбинация Зенлистик™ + эндокринная терапия снижала риск развития метастатической стадии заболевания на 31% (ОР 0,69 [95% ДИ 0,55-0,86], номинальное значение p=0,0009 (2-стороннее)), с наибольшим снижением частоты развития метастазов в печень и кости. Показатели 2-летней выживаемости без отдаленных метастазов составили 93,8% в группе Зенлистик™ и 90,8% в контрольной группе. Препарат Зенлистик™ стабильно снижал риск развития отдаленных метастазов в популяции всех рандомизированных пациентов согласно назначенному лечению и во всех заранее определенных подгруппах [1,2]. Данные по безопасности из исследования monarchE соответствовали известному профилю безопасности препарата Зенлистик™, и новых данных по токсичности зарегистрировано не было. Наиболее частыми нежелательными явлениями (≥10%) были диарея, нейтропения, утомляемость, лейкопения, боль в животе, тошнота, анемия, артралгия, приливы, лимфопения, тромбоцитопения, рвота, запор, инфекции верхних дыхательных путей, инфекции мочевыводящих путей, снижение аппетита, головная боль, кашель и лимфостаз. 17,2% пациентов прекратили терапию вследствие нежелательных явлений в группе Зенлистик™ + эндокринная терапия по сравнению с 0,8% пациентов в группе применения одной ЭТ. Причины прекращения терапии включают диарею (5,1%), утомляемость (1,9%) и нейтропению (0,9%). Многие случаи досрочного прекращения терапии из-за нежелательных явлений произошли в первые месяцы лечения. Большинство пациентов, которым требовались временная приостановка терапии или снижение дозы после нежелательных явлений, были в состоянии продолжать исследуемое лечение [2]. Частота развития диареи 3/4 степени была низкой: у 7,6% пациентов отмечалась диарея 3 степени, и 5,1% пациентов прекратили терапию вследствие этого нежелательного явления. Большинство случаев диареи в группе препарата Зенлистик™ приходилось на ранний этап лечения и были кратковременными: медиана времени до начала (все степени тяжести) составляла восемь дней, а медиана времени до разрешения нежелательного явления (2-3 степени) составляла 5-6 дней. В большинстве случаев осуществлялось проактивное ведение диареи в соответствии с имеющимися схемами лечения. В исследование monarchE было рандомизировано 5 637 пациентов с ГР+, HER2- РМЖ на ранних стадиях и высоким риском развития рецидива более чем в 600 центрах 38 стран. Высокий риск развития рецидива определялся следующими характеристиками заболевания: либо ≥4 пораженных подмышечных лимфатических узлов, либо 1-3 пораженных подмышечных лимфатических узлов и по крайней мере один из следующих критериев: размер опухоли ≥5 см, 3 гистологическая степень злокачественности или показатель Ki-67 ≥20%. Пациенты получали лечение препаратом Зенлистик™ в течение двух лет в комбинации с эндокринной терапией (период лечения) или до момента соответствия критериям прекращения лечения. Пациенты в обеих группах будут получать эндокринную терапию в течение 5-10 лет в зависимости от клинических показаний (2 года в ходе исследования и еще 3-8 лет в ходе длительного последующего наблюдения). Одобрение препарата Зенлистик™ при ГР+, HER2- РМЖ на ранних стадиях основывается на известном профиле данного препарата, который ранее был одобрен для лечения ГР+, HER2- распространенного или метастатического рака молочной железы. Десятки тысяч пациентов во всем мире уже получили лечение препаратом Зенлистик™ при метастатической стадии заболевания. С 1 января 2021 года лекарственный препарат Зенлистик™, во всех доступных формах выпуска и дозировках, включен в перечень ЖНВЛП [3]. Абемациклиб в комбинации с ингибитором ароматазы, в комбинации с фулвестрантом и в качестве монотерапии выделен в отдельные КСГ для дневного стационара, на уровнях, покрывающих стоимость терапии [4]. «С учетом наличия препарата Зенлистик™ в списке ЖНВЛП и рубрикаторе КСГ, в настоящий момент пациенты, нуждающиеся в терапии раннего рака молочной железы с неблагоприятным прогнозом, имеют возможность получить лечение, включающее Зенлистик™, как в рамках льготного лекарственного обеспечения, так и в рамках системы ОМС», – прокомментировала директор отдела по связям с общественными и государственными организациями и доступу препаратов на рынок филиала «Лилли» в России и СНГ Наталия Парфенова.
Ссылки:
1. Johnston SRD, Harbeck N, Hegg R, et al; monarchE Committee Members and Investigators. Abemaciclib combined with endocrine therapy for the adjuvant treatment of HR+, HER2-, nodepositive, high-risk, early breast cancer (monarchE) [published online ahead of print, September 20, 2020]. J Clin Oncol. doi:10.1200/JCO.20.02514.
2. SABCS 2020 PO Presentation: O’Shaughnessy JA, Johnston S, Harbeck N, et al. Primary outcome analysis of invasive disease-free survival for monarchE: Abemaciclib combined with adjuvant endocrine therapy for high risk early breast cancer. Oral presentation at: San Antonio Breast Cancer Symposium; December, 2020: San Antonio, TX.
3. Распоряжение Правительства Российской Федерации от 23 ноября 2020 г. №3073-р.
4. Методические рекомендации по способам оплаты медицинской помощи за счет средств обязательного медицинского страхования МЗРФ и ФФОМС от 29.12.2020.
5. Государственный реестр предельных отпускных цен. Зенлистик™ – торговое наименование, зарегистрированного в России лекарственного препарата с международным непатентованным наименованием «абемациклиб».
При поддержке компании Лилли.
PP-AL-RU-0496 от 10.08.2021
БЕРЕМЕННОСТЬ ПОСЛЕ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ
Автор: Титова Татьяна Александровна
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
Большинство женщин хотели бы стать матерями. Материнство – это, в первую очередь, выбор женщины, но иногда статус «childfree» является заданной ситуацией. В современном мире многие женщины по карьерным или иным соображениям не спешат с рождением детей: так, в Российской Федерации средний возраст женщины при рождении первенца – 28,5 лет [15]. Заболеваемость раком молочной железы (РМЖ) среди женщин моложе 40 лет составляет 6-7% [1, 6], и далеко не каждая к этому возрасту является матерью и не планирует больше детей. Не только в России, но и во всем мире, беременность и РМЖ ассоциированы с такими стигмами, как:
1. высокий риск рецидива заболевания;
2. высокий риск неблагоприятных перинатальных и постнатальных исходов;
3. плохое «качество» яйцеклеток и, как следствие, высокая частота пороков развития плода.
В 2013 году был опубликованы результаты опроса, проведенного среди акушеров-гинекологов и онкогинекологов из 14 стран Европы. Оказалось, что 44% опрошенных рекомендовали прерывание беременности при выявлении онкологического заболевания, 58% – преждевременное родоразрешение с целью начала активной терапии в послеродовом периоде и 37% респондентов считали нецелесообразным проведение химио- или лучевой терапии во время беременности [9]. Хотелось бы верить, что с 2013 года мнение онкологов и онкогинекологов изменилось. По данным различных исследований, доля пациенток с хотя бы одной доношенной беременностью после постановки диагноза РМЖ составляет 3% для женщин моложе 45 лет и 8% для женщин моложе 35 лет [7]. Несомненно, каждый случай беременности женщины с анамнезом РМЖ должен тщательно наблюдаться в перинатальном центре под контролем опытных акушеров-гинекологов во взаимодействии с онкологом. Беременность у пациенток после лечения РМЖ значимо чаще ассоциирована с преждевременными родами (ОР=1,56; 95% ДИ 1,37-1,77), низким весом ребенка при рождении (ОР=1,47; 95% ДИ 1,24-1,73), экстренным родоразрешением путем кесарева сечения (ОР=1,22; 95% ДИ 1,15- 1,30) и послеродовым кровотечением (ОР=1,18; 95% ДИ 1,02-1,36) [8]. Беременность после радикального лечения РМЖ не ухудшает отдаленные результаты терапии, прогноз РМЖ определяется в первую очередь распространенностью РМЖ и его молекулярно-биологическим подтипом [2-4]. Впервые это было продемонстрировано в ретроспективном исследовании 2011 года [10], которое оценивало влияние беременности на общую выживаемость (ОВ) женщин, излеченных от рака молочной железы. В работе было показано, что беременность у пациенток с РМЖ в анамнезе позволила снизить риск смерти от РМЖ на 41% (ОР=0,59; 90% ДИ 0,50-0,70). Этот результат, вероятно, объясняется особенностью отбора, известного как «эффект здоровой матери»: только здоровые женщины, излеченные от РМЖ, смогли зачать и выносить ребенка. В 2018 году были опубликованы результаты многоцентрового исследования «случай-контроль» Lambertini и соавторов [11], основной задачей которого была оценка безрецидивной выживаемости пациенток, забеременевших после лечения РМЖ. В работу было включено 1207 пациенток с РМЖ в анамнезе, 333 женщины забеременели после завершения терапии и 874 пациенток были включены в контрольную группу. При медиане наблюдения в 9,6 лет было показано что беременность не является фактором риска рецидива РМЖ ни в группе с положительными ЭР (ОР=0,94, 95% ДИ 0,70-1,26, р=0,68), ни в группе с отрицательными ЭР (ОР=0,75, 95% ДИ 0,53-1,06, р=0,10). Беременность также не оказывала влияния на ОВ пациенток с ЭР позитивным РМЖ (HR=0,84, 95% ДИ 0,60-1,18, р=0,32), но оказывала значимое протективное действие у пациенток с ЭР негативными подтипом опухоли (HR=0,57, 95% ДИ 0,36-0,90, р=0,01) (рис.1).
Рисунок 1.
Влияние беременности на общую и безрецидивную выживаемость больных РМЖ в зависимости от рецепторного статуса [11].
А) ВБП у пациенток с ЭР+ РМЖ; В) ВБП у пациенток с ЭР- РМЖ;
С) ОВ у пациенток с ЭР+ РМЖ; D) ОВ у пациенток с ЭР+ РМЖ.
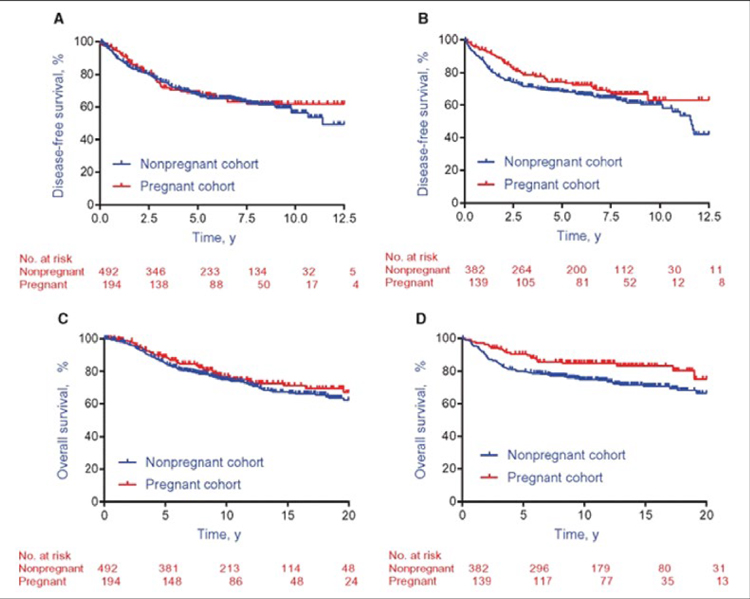
При подгрупповом анализе не было отмечено влияния на безрецидивную выживаемость таких факторов, как время до наступления беременности (ОР=1,12, 95% ДИ 0,82-1,54, р=0,47), прерывание беременности (ОР=0,80, 95% ДИ 0,56-1,13, р=0,20) и грудное скармливание (ОР=0,70, 95% ДИ 0,26-1,94, р=0,50). В представленной работе 30% женщин прервали беременность; с чем связан такой высокий процент абортов – сказать затруднительно, возможно, это решение женщины, но высока вероятность и некоторого «поощрения» аборта врачом [11]. Особое опасение женщины вызывает риск рождения ребенка с пороком развития. По данным литературы, в общей популяции доля детей с врожденными пороками развития внутренних органов составляет 5-8% от всех живорожденных детей [14]. В метаанализ 2021 года было включено 112 840 женщин с РМЖ в анамнезе, из которых 7505 забеременели после лечения. В работе показано, что риск рождения ребенка с пороками развития у женщин после терапии сопоставим с общей популяцией [15]. Остается неясным, какой интервал без лечения до наступления беременности необходимо соблюсти, чтобы минимизировать риски. Большинству женщин рекомендуется отложить беременность как минимум на 2 года после лечения, так как именно в этот период риск рецидива максимален. Есть несколько препаратов, для которых сроки от завершения терапии до беременности оговорены достаточно определенно, так как они могут оказывать негативное влияние на развитие плода.
Трастузумаб
Особую группу пациенток составляют женщины с HER2-позитивным РМЖ. Трастузумаб является гуманизированным моноклональным антителом, относящимся к IgG1, проникающим через плацентарный барьер. В настоящее время считается, что трастузумаб не оказывает прямого тератогенного воздействия на плод, но может увеличить риск внутриутробных инфекций и смерти плода за счет уменьшения количества амниотической жидкости. Малый объем амниотической жидкости в свою очередь приводит к нарушению пренатального формирования органов дыхания плода. Таким образом, женщины, получавшие трастузумаб в адъювантном режиме по поводу HER2-положительного РМЖ, должны использовать эффективную контрацепцию в течение не менее семи месяцев после последнего введения трастузумаба.
Тамоксифен
Тамоксифен является нестероидным селективным модулятором эстрогеновых рецепторов. Тамоксифен, а также некоторые его метаболиты конкурируют с эстрадиолом за сайты связывания с цитоплазматическими рецепторами эстрогена, что приводит к изменению транскрипции и трансляции. В нескольких крупных ретроспективных работах была показана высокая частота внутриутробных пороков развития при применении женщинами тамоксифена во время беременности [12,13]. В настоящий момент, с учетом периода полувыведения тамоксифена, пациенткам рекомендовано планировать беременность через 2-3 месяца после отмены препарата.
Заключение
Беременность женщины, излеченной от РМЖ, является нечастой ситуацией. Каждый такой случай должен рассматриваться индивидуально в контексте возраста пациентки, распространенности РМЖ, молекулярно-биологического подтипа опухоли, проводимой на данной момент терапии (тамоксифен, трастузумаб) и обсуждаться с пациенткой и ее семьей. Исход беременности и родов в этой группе женщин, как правило, благоприятный, а сам факт беременности не увеличивает частоту рецидивов заболевания.
Источники:
1. Partridge AH, Hughes ME, Warner ET, et al. Subtype-dependent relationship between young age at diagnosis and breast cancer survival. J Clin Oncol. 2016; 34: 3308-14.
2. Kroman N, Jensen M-B, Wohlfahrt J, et al. Danish Breast Cancer Cooperative Group. Pregnancy after treatment of breast cancer – a population-based study on behalf of Danish Breast Cancer Cooperative Group. Acta Oncol. 2008; 47(4): 545-549.
3. Mueller BA, Simon MS, Deapen D, et al. Childbearing and survival after breast carcinoma in young women. Cancer. 2003; 98(6): 1131-1140.
4. Kroman N, Jensen MB, Melbye M, et al. Should women be advised against pregnancy after breast-cancer treatment? Lancet. 1997; 350(9074): 319-322.
5. MacMahon B, Cole P, Lin TM, et al. Age at first birth and breast cancer risk. Bull. World Health Organ. 1970; 43: 209- 221.
6. Winchester DP. Breast cancer in young women. Surg Clin North Am. 1996; 76: 279-87.
7. Ives A, Saunders C, Bulsara M, et al. Pregnancy after breast cancer: population based study. BMJ. 2007; 334: 194.
8. van der Kooi A-LLF, Kelsey TW, van den Heuvel-Eibrink MM, et al. Perinatal complications in female survivors of cancer: a systematic review and metaanalysis. Eur J Cancer. 2019; 111: 126- 137.
9. Han SN, Kesic VI, et al. Cancer in pregnancy: a survey of current clinical practice. Eur. J. Obstet. Gynecol. Reprod. Biol. 2013; 167(1): 18-2.
10.Azim HA, et al. Safety of pregnancy following breast cancer diagnosis: a metaanalysis of 14 studies. Eur J cancer. 2011; 47(1): 74-83.
11.Lambertini M, Kroman N, Ameye L. Long-term Safety of Pregnancy Following Breast Cancer According to Estrogen Receptor Status. J Natl Cancer Inst. 2018 Apr; 110(4): 426-429. Published online 2017 Oct 26. doi: 10.1093/jnci/djx206.
12.Tewari K, Bonebrake RG, Asrat T, et al. Ambiguous genitalia in infant exposed to tamoxifen in utero. Lancet. 1997; 350:18.
13.Braems G, Denys H, De Wever O, Cocquyt V, Van den Broecke R. Use of tamoxifen before and during pregnancy. Oncologist. 2011; 16(11): 1547-51. doi: 10.1634/theoncologist.2011-0121. Epub 2011 Oct 21.
14.Всемирная организация здравоохранения. Пороки развития 2016 г.
15.Lambertini М, Blondeaux Е, Bruzzone M. Pregnancy After Breast Cancer: A Systematic Review and MetaAnalysis J Clin Oncol. 2021 Jul 1. doi: 10.1200/JCO.21.00535/.
16.Ежемесячный мониторинг социально-экономического положения.
2015 – ноябрь 2018 г

