Июль - сердцевина лета - далеко не всегда такой изнурительно жаркий, каким его представляет поэт, и порой он балует нас и прохладой, и дождями. Особо приятно то, что для многих из нас, дорогие коллеги, это месяц отпусков или подготовки к ним. Можно сделать передышку от ежедневной рутины, спланировать поездки или просто наметить домашние дела, на которые не хватает времени вне...

Пластов А.А. «Летом» 1954.
160 x 112,5 см. Холст масло. Русский музей, г.Санкт-Петербург
Иосиф Бродский
Что хорошего в июле? Жуткая жара. Осы жалятся как пули. Воет мошкара. Дождь упрямо избегает тротуаров, крыш. И в норе изнемогает Полевая мышь.
ВЫПУСК 07 • 2024 | НОВОСТИ ОБЩЕСТВА ГАЗЕТА РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ | 2 RUSSCO ПРОВЕЛО СЕССИЮ НА ОНКОЛОГИЧЕСКОМ ФОРУМЕ «БЕЛЫЕ НОЧИ 2024» В САНКТ-ПЕТЕРБУРГЕ
4 июля в Санкт-Петербурге в рамках X Петербургского международного онкологического форума «БЕЛЫЕ НОЧИ 2024» прошла сессия Российского общества клинической онкологии (RUSSCO) «Новые разделы рекомендаций по поддерживающей терапии: нерешенные вопросы».

ЗНАКОМЬТЕСЬ: РЕГИОНАЛЬНОЕ ОТДЕЛЕНИЕ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ В ГОРОДЕ ПЯТИГОРСК
Ставропольский край – крупнейший по площади субъект Российской Федерации в Северо-Кавказском федеральном округе. Площадь региона составляет более 66 тысяч квадратных километров...

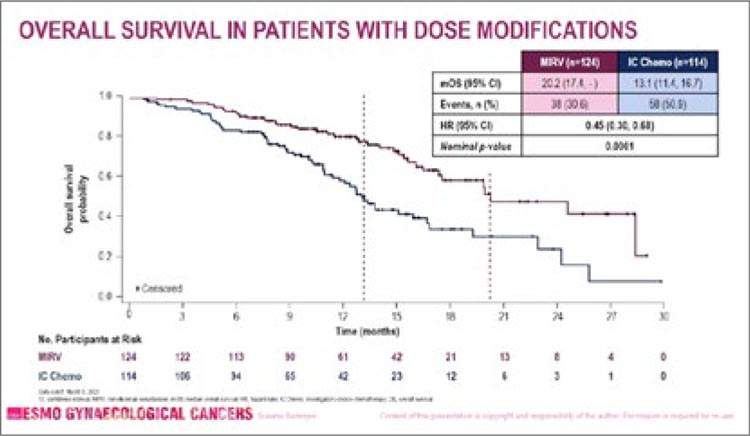
НОВОСТИ ESMO GYN 2024 / ДОБАВЛЕНИЕ АНТИ-PD-1 ИММУНОТЕРАПИИ К ХИМИОЛУЧЕВОЙ ТЕРАПИИ ПРИ МЕСТНОРАСПРОСТРАНЕННОМ РАКЕ ШЕЙКИ МАТКИ УВЕЛИЧИВАЕТ ВЫЖИВАЕМОСТЬ БЕЗ ПРОГРЕССИРОВАНИЯ
Исследование III фазы ENGOT-cx11/ GOG-3047/KEYNOTE-A18, представленное на ESMO 2023 г. в Мадриде...
НОВОСТИ ESMO GYN 2024 / ESMO GYN 2024: ГОТОВА ЛИ НОВАЯ КЛАССИФИКАЦИЯ FIGO 2023 РАКА ЭНДОМЕТРИЯ ДЛЯ ВНЕДРЕНИЯ В РЕАЛЬНУЮ КЛИНИЧЕСКУЮ ПРАКТИКУ ПРЯМО СЕЙЧАС?
Отдельная сессия на ESMO GYN 22 июня 2024 г. была посвящена новой классификации рака эндометрия – FIGO 2023. Идея FIGO 2023 – объединение биологии и патолого-анатомических параметров...
НОВОСТИ ESMO GYN 2024 / ESMO GYN 2024. КАК УЛУЧШИТЬ РЕЗУЛЬТАТЫ Начало на стр. 8 ЛЕЧЕНИЯ РАКА ШЕЙКИ МАТКИ ВО 2 ЛИНИИ: КОМБИНАЦИИ АНТИ-TIGIT + АНТИ-PD1?
Исследование KEYNOTE-826 изменило стандарт первой линии лечения метастатического и рецидивирующего CPS-позитивного рака шейки матки (РШМ), продемонстрировав для пациентов,...
НОВОСТИ ESMO GYN 2024 / ПО СЛЕДАМ ESMO GYN 2024: РАК ЯИЧНИКОВ
20-22 июня 2024 года в Италии прошел ежегодный конгресс ESMO gynaecological cancers. Не сказать, чтоб в этом году было представлено много новых данных, которые бы мы уже не обсудили в контексте прошедшего ASCO и других конференций...

НОВОСТИ ESMO GI 2024 / ПИЩЕВОД И ЖЕЛУДОК
Спустя месяц после ежегодного конгресса ASCO состоялась конференция ESMO по опухолям желудочно-кишечного тракта. Конференция уже закончилась, доклады прослушаны и пришло время...
Очередной конгресс ESMO по опухолям желудочно-кишечного тракта начался 26 июня 2024 года. В первый же день были представлены результаты нескольких важных для практики работ: 1. Метаанализ индивидуальных данных пациентов из рандомизированных исследований, посвященных применению химиотерапии при резектабельных метастазах колоректального...

В Мюнхене подошел к концу конгресс ESMO по опухолям желудочно-кишечного тракта, и несмотря на то, что значимую роль в программе занимает колоректальный рак, удалось обсудить некоторые интересные вопросы в опухолях

НОВОСТИ ESMO GI 2024 / НОВОСТИ ESMO GI 2024: КОЛОРЕКТАЛЬНЫЙ РАК
Казалось бы, только недавно отгремел ASCO 2024, как мы снова можем узнать что-то свежее, новое и интересное.

ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / ИССЛЕДОВАНИЕ 2 ФАЗЫ NEOTRIO (NCT02858921)
Попытки найти наилучший вариант неоадъювантной терапии для пациентов с III стадией меланомы кожи все еще продолжаются. Существующий стандарт неоадъювантной терапии (исследование SWOG S1801), включающий 3 введения...
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / ИССЛЕДОВАНИЕ UNION: НЕОАДЪЮВАНТНЫЙ КОРОТКИЙ КУРС ЛТ С ПОСЛЕДУЮЩЕЙ ХИМИОИММУНОТЕРАПИЕЙ УВЕЛИЧИВАЕТ ЧАСТОТУ PCR ПРИ МЕСТНОРАСПРОСТРАНЕННОМ РАКЕ ПРЯМОЙ КИШКИ
Первые результаты многоцентрового РКИ III фазы UNION, опубликованные в журнале Annals of Oncology, демонстрируют значимое преимущество неоадъювантного короткого курса ЛТ (SCRT) с...
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / ИССЛЕДОВАНИЕ ATEMPT: ДАННЫЕ 5-ЛЕТНЕГО НАБЛЮДЕНИЯ
Можно ли улучшить долгосрочные результаты адъювантного лечения пациенток с I стадией HER2+ рака молочной железы и при этом не ухудшить качество жизни? Вопрос оптимизации адъювантной терапии остается областью активного интереса...
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / АНТИБИОТИКИ УХУДШАЮТ ПОКАЗАТЕЛИ ВЫЖИВАЕМОСТИ У ПАЦИЕНТОВ С НМРЛ ДО И ВО ВРЕМЯ ХИМИО-ИММУНОТЕРАПИИ
Появляется все больше данных о том, что прием антибиотиков (АБ) до начала иммунотерапии (ИТ) нарушает состав кишечной микробиоты и негативно влияет на клинические исходы пациентов с...

«А ВОТ БЫЛ У МЕНЯ СЛУЧАЙ…» ИЛИ «ОХОТНИЧЬИ» ЗАПИСКИ ОНКОЛОГОВ / КЛИНИЧЕСКИЙ СЛУЧАЙ ПАЦИЕНТКИ С РЕДКИМ ИММУНООПОСРЕДОВАННЫМ ОСЛОЖНЕНИЕМ
Ингибиторы контрольных точек иммунитета (ИКТ) широко используются в современной онкологии и улучшают прогноз рака легких, злокачественной меланомы и других злокачественных
Анонс
-

Июль -Сентябрь 2024
Цикл вебинаров ДЛЯ ПОДГОТОВКИ К ЭКЗАМЕНУ ESMO
Экзамен 14 сентября 2024 в Москве
-

12 ноября 2024
ЭКЗАМЕН ПО КЛИНИЧЕСКОЙ ОНКОЛОГИИ
российского общества клинической онкологии
-

12-14 НОЯБРЯ 2024
XVIII РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС 2024
Москва
Июль - сердцевина лета - далеко не всегда такой изнурительно жаркий, каким его представляет поэт, и
порой он балует нас и прохладой, и дождями. Особо
приятно то, что для многих из нас, дорогие коллеги,
это месяц отпусков или подготовки к ним. Можно
сделать передышку от ежедневной рутины, спланировать поездки или просто наметить домашние дела,
на которые не хватает времени вне отпуска. А еще отдыхать, спать, читать, зависать в любимых сериалах,
просто гулять и уделять время себе самому – ведь это
чертовски нужно каждому из нас дабы хоть на шаг
отодвинуться от почти неминуемого профессионального выгорания.
Газета RUSSCO тоже берет тайм-аут на месяц; пока же в июльском номере мы собрали данные конференций ESMO по онкогинекологии и ЖКТ, прошедших недавно, новости из ряда крупных журналов и новости нашего сообщества. Напоминаем, что продолжается подготовка к экзамену ESMO, который состоится в Москве 14 сентября 2024 года – это действительно уникальная возможность испытать себя и опробовать свои силы в отношении знаний по современной онкологии, так что следите за расписанием вебинаров в июле, августе и сентябре на сайте. Мы искренне желаем каждому из вас, дорогие коллеги, набраться сил этим летом, чтоб их хватило на весь год – на новые свершения, на каждодневные врачебные подвиги, на жизнь во всех ее проявлениях! Увидимся в сентябре!
Ваша команда RUSSCO
Пластов А.А. «Летом» 1954.
160 x 112,5 см. Холст масло. Русский музей,
г.Санкт-Петербург

Иосиф Бродский
***
Что хорошего в июле?
Жуткая жара.
Осы жалятся как пули.
Воет мошкара.
Дождь упрямо избегает
тротуаров, крыш.
И в норе изнемогает
Полевая мышь.
Душно в поле для овечки,
В чаще для лося.
Весь июль купайся в речке
вместо карася
ВЫПУСК 07 • 2024 | НОВОСТИ ОБЩЕСТВА ГАЗЕТА РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ | 2 RUSSCO ПРОВЕЛО СЕССИЮ НА ОНКОЛОГИЧЕСКОМ ФОРУМЕ «БЕЛЫЕ НОЧИ 2024» В САНКТ-ПЕТЕРБУРГЕ
4 июля в Санкт-Петербурге в
рамках X Петербургского международного онкологического
форума «БЕЛЫЕ НОЧИ 2024»
прошла сессия Российского общества клинической онкологии
(RUSSCO) «Новые разделы рекомендаций по поддерживающей
терапии: нерешенные вопросы».


Ведущие эксперты RUSSCO представили новые разделы: инфузионные реакции, хронические
вирусные гепатиты, гормоноопосредованные побочные явления, неврологические осложнения. Именно ими в 2023 году
были дополнены практические
рекомендации. Затем член Правления RUSSCO, профессор, д.м.н.
Рашида Вахидовна Орлова
вместе с коллегами из СанктПетербурга и Москвы – д.м.н.
Мариной Борисовной Стениной, к.м.н. Полиной Сергеевной Феоктистовой и Дарьей
Александровной Масловой провели детальный разбор ведения
пациентов с данными нежелательными явлениями
Вторая часть сессии представляла из себя дискуссию по вопросам возмещения затрат на
сопроводительную терапию в
рамках программы госгарантий.
Вопросы со стороны практикующего врача были представлены членом правления RUSSCO,
главным врачом Красноярского
краевого клинического онкологического диспансера им. А.А. Крыжановского, профессором, д.м.н.
Русланом Александровичем
Зуковым. Сформулированы они
были на основании потребностей,
озвученных представителями региональных отделений RUSSCO.
Например, касаясь КСЛП (коэффициент сложности лечения пациента), Руслан Александрович
сказал, что он имеет ряд ограничений, тем не менее, есть двенадцать
КСГ, которые в дневном и круглосуточном стационаре позволяют
его использовать. А в программе
госгарантий для всех федеральных медицинских учреждений
такая возможность прописана начиная с первого января 2024 г.


В свою очередь, о возможных
вариантах возмещения этих затрат и будущем клинических
рекомендаций рассказала заместитель генерального директора
ФГБУ «Центр экспертизы и контроля качества медицинской помощи» Минздрава России Инна
Александровна Железнякова.
В частности, она сообщила: «Уже
сегодня клинические рекомендации
становятся основой оказания медицинской помощи. Безусловно, их
схема будет совершенствоваться
и в последующие годы. Так, сейчас
активно обсуждается тема их
цифровых двойников, когда помимо
текстового документа будет электронный формат, позволяющий
специалисту быстро ориентироваться при ведении пациентов».
НА ОНКОФОРУМЕ «БЕЛЫЕ НОЧИ 2024»
В САНКТ-ПЕТЕРБУРГЕ НАГРАДИЛИ ЧЛЕНОВ
ПРАВЛЕНИЯ RUSSCO
В дни работы X Петербургского международного онкологического форума «БЕЛЫЕ НОЧИ 2024» состоялось
награждение представителей Российского общества клинической онкологии (RUSSCO) почетными медалями им. М.Л. Гершановича, которые
вручаются специалистам-онкологам,
внесшим особый вклад в развитие
отечественной химиотерапии.


Почетных наград были удостоены:
председатель RUSSCO, заведующий отделением противоопухолевой лекарственной терапии ФГБУ
«Центральная Клиническая Больница с Поликлиникой» Управления делами Президента РФ, главный внештатный онколог ГМУ
УД Президента РФ, профессор,
д.м.н. Дмитрий Александрович
Носов и члены Правления RUSSCO
– председатель регионального отделения RUSSCO, директор ГБУЗ
«СПб КНпЦСВМП(о) им. Н.П. Напалкова», заслуженный врач РФ,
член-корреспондент РАН, профессор, д.м.н. Владимир Михайлович
Моисеенко, заведующая кафедрой
онкологии медицинского института
ФГБОУВО «Санкт-Петербургский
государственный университет»,
главный специалист по клинической онкологии СПб ГБУЗ «Городской клинический онкологический диспансер», профессор, д.м.н.
Рашида Вахидовна Орлова и заведующая научным отделом инновационных методов терапевтической
онкологии и реабилитации ФГБУ
«НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, профессор кафедры ФГБОУ ВО «СЗГМУ
им. И.И. Мечникова» Минздрава
России, профессор, д.м.н Татьяна
Юрьевна Семиглазова.

Вручала медали известная актриса,
депутат Законодательного собрания Санкт-Петербурга VII созыва
Анастасия Мельникова, которая
и сама имеет отношение к сфере онкологии, поскольку ее отец
– известнейший онколог Рюрик
Александрович Мельников.
ЗНАКОМЬТЕСЬ: РЕГИОНАЛЬНОЕ ОТДЕЛЕНИЕ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ В ГОРОДЕ ПЯТИГОРСК
Историческая справка о регионе
Ставропольский край – крупнейший по площади субъект Российской Федерации в Северо-Кавказском федеральном округе. Площадь
региона составляет более 66 тысяч
квадратных километров. В состав
Ставропольского края входят 10 городов краевого значения и 26 районов. Административный центр
региона – город Ставрополь.
По данным Управления Федеральной службы государственной статистики по Северо-Кавказскому
федеральному округу, численность
постоянного населения края на 1
января 2023 года составила 2891,2
тыс. человек.
Ставрополье – это край природных
контрастов. Здесь есть и обширные
равнины, и пустыни с высокими
ребристыми песчаными барханами, и степи. На востоке региона
расположен Пятигорский вулканический район. Но самая известная
достопримечательность – лечебные
источники и грязи. Всего на территории свыше 130 источников минеральных вод, аналогов которых нет
нигде в мире. Большая часть из них
расположена в Пятигорске, за что
город называют природным музеем минеральных вод.
Заболеваемость злокачественными
новообразованиями у населения в
2023 году в Ставропольском крае
составила 2686 на 100 тысяч населения, на первом месте рак молочной
железы, на втором – рак кожи, на
третьем – рак предстательной железы и почек.
За 2023 год смертность от злокачественных новообразований составила 150,3 случая на 100 тыс.
населения, что на 1% меньше, чем
в 2022 году (151,7 случая на 100 тыс.
населения).
За период реализации нацпроекта
«Здравоохранение» в Ставропольском крае с 2018 по 2023 год показатели онкологической службы
существенно улучшились. Ранняя
выявляемость выросла с 56,6% до
61%, рост на 7,8%. Ранее выявление
позволило значительно снизить
одногодичную летальность с 22%
до 17,7%, снижение на 19,5%. Пятилетняя выживаемость выросла с
49,2% до 57,2%, рост составил 15,2%.
Охват диспансерным наблюдением
и лечением онкологических больных в 2023 году составил 98% при
плановом значении 75%.
Показатель онкологической заболеваемости достиг доковидного
уровня, что является результатом
планомерной работы по улучшению ранней диагностики и доступности онкологической помощи.
ГБУЗ СК «Пятигорский межрайонный онкологический диспансер» в своем становлении
неразрывно связан с развитием
онкологической службы Ставропольского края.
Так, в Ставропольском крае с 1939
г. были открыты Ворошиловский
и Пятигорский онкологические
пункты. Позднее начали работать онкологические отделения:
Ворошиловское, Пятигорское,
Георгиевское. Но со 2 августа 1942
г. по 3 ноября 1943 г. в связи с оккупацией немецко-фашистскими
войсками лечебно-профилактическая помощь жителям края не
оказывалась.
Уже 4 ноября 1943 г. принял больных онкологический пункт №1, а
с 26 мая 1945 г. Начала работать
краевая онкологическая станция.
В соответствии с постановлением
Совета Народных комиссаров от
30 апреля 1945 г. на базе больницы Ставропольского медицинского института 1 октября 1945 г.
был открыт Ставропольский краевой онкодиспансер.
В эти годы диспансер не имел стационара, в нем работали 5 врачей
и 2 медицинские сестры. Прием и
лечение больных проводились амбулаторно – на базе клиники общей
хирургии. В конце 1956 г. был открыт первый стационар на 50 коек,
вследствие чего существенно увеличился объем специализированной медицинской помощи.

Возможности краевого онкодиспансера в тот период были ограничены и не могли обеспечить
потребность населения края в специализированной медицинской
помощи. Поэтому в 1948 году в городе Пятигорске был открыт городской онкодиспансер.
Сегодня Пятигорский онкодиспансер – это укомплектованный новейшим оборудованием центр, принимающий ежегодно десятки тысяч
человек и являющийся основной
медицинской организацией, оказывающей специализированную
онкологическую помощь населению Кавказских минеральных вод
и близлежащих районов Ставропольского края.
Главный врач Пятигорского межрайонного онкологического диспансера – врач-онколог, Отличник
здравоохранения Лапина Наталья
Валерьевна.
В диспансере внедрен персонализированный подход к лечению пациента. Для подбора индивидуального
плана ведения пациента в диспансере практически ежедневно проводятся консилиумы, представленные
мультидисциплинарной командой
врачей с участием хирургов-онкологов, радиотерапевтов, врачей-химиотерапевтов, специалистов по
лучевой и морфологической диагностике.
В 2022 году в структуру диспансера
введено еще одно поликлиническое
отделение (работает в две смены) и
увеличен коечный фонд дневного
стационара, в котором проводятся
все виды противоопухолевой лекарственной терапии (химиотерапия,
таргетная терапия, иммунная терапия, гормональная терапия), данные
отделения диспансера расположены
в новом помещении, доступном, в
том числе, для маломобильных пациентов.
В 2023 году открыто новое отделение
– противоопухолевой лекарственной терапии на 24 койки (круглосуточного пребывания пациентов).
В отделении пациентам проводятся
различные виды противоопухолевой лекарственной терапии, осуществляется оценка эффективности и переносимости проведенного
лечения с использованием лабораторных и инструментальных методов исследования, проведение восстановительной и коррегирующей
терапии, связанной с возникновением побочных реакций на фоне
высокотоксичного лекарственного
лечения.
При поддержке Правительства
Ставропольского края в рамках реализации регионального проекта
«Борьба с онкологическими заболеваниями», который является частью
Федерального проекта «Борьба с
онкологическими заболеваниями»
в рамках Национального проекта
«Здравоохранение», в диспансере
было приобретено и введено в работу новое медицинское оборудование, что позволило проводить
лечение пациентов на самом современном уровне, в том числе с
помощью внутриполостной гамматерапии, дистанционной лучевой
терапии, рентгенотерапии.

В рамках реализации регионального
проекта «Борьба с онкологическими заболеваниями» Пятигорский
межрайонный онкологический диспансер определен как медицинская
организация, на базе которой организованы два Центра амбулаторной
онкологической помощи. Прикрепленные территории: Предгорный
район, Минераловодский район,
Георгиевский район, Курский район, Советский район, Кировский
район, г. Ессентуки, г. Кисловодск, г.
Лермонтов, п. Иноземцево, г. Минеральные воды.
В коллективе онкологического диспансера трудятся 50 врачей и 64 представителя среднего медицинского звена.
Для успешной адаптации молодых
специалистов организована про
-
грамма наставничества, в рамках которой ежеквартально сотрудниками
диспансера проводится обучающие
семинары.
Врачи диспансера ведут ежедневные
консультации и телеконсультации с
районными онкологическими больницами.
Также принимают участие в клинических исследованиях на базе ГБУЗ
СК «ПМОД», главный исследователь Владимиров Владимир Иванович
.
Пятигорское отделение Российского
общества клинической онкологии
было организовано в апреле 2012
года. Действующим председателем
общества является врач-онколог,
доктор медицинских наук, Отличник здравоохранения Владимиров
Владимир Иванович. 16 ноября 2023
года на семнадцатом Российском
онкологическом конгрессе, прошедшем в Москве, Владимир Иванович
награжден почетным дипломом
Российского онкологического конгресса за выдающийся вклад в развитие российской онкологии.
При содействии RUSSCO был про
-
веден второй симпозиум онкологов
юга России в городе Пятигорск. В
RUSSCO Владимир Иванович занимал должности главного внештатного онколога Ставропольского края
Министерства здравоохранения
Ставропольского края и главного
внештатного онколога Северо-Кавказского федерального округа Министерства здравоохранения Российской Федерации.

Сегодня в Ставропольском отделе
-
нии общества зарегистрировано 46
членов.
Ежегодно в Ставропольском крае
при поддержке и участии RUSSCO
проводятся образовательные мероприятия, мастер классы, межрегиональные конференции, вебинары и
сессии.
При активном участии в качестве
докладчика и принятии участия в
научном комитете врача-онколога высшей категории, заведующей
дневным стационаром Пятигорского межрайонного онкологического
диспансера, члена RUSSCO, АОР
Арутюновой Алены Игоревны
проведены десятки мероприятий по
многим актуальным вопросам онкологии. Также активно участвует в
клинических исследованиях.
Заведующий поликлиническим от
-
делением №2, член RUSSCO, АОР
Хачатуров Давид Евгеньевич принимает участие в мероприятиях, вы
-
ступает с докладами.
Благодаря содействию RUSSCO в
2023 году врачи районных отделений, ЦАОПы были обеспечены экземплярами текущих клинических
рекомендаций по лечению злокачественных новообразований. С
целью своевременного выявления
ЗНО организуются выездные профилактические акции специалистов
в районные больницы и поликлиники для обследования групп на
-
селения.
НОВОСТИ ESMO GYN 2024 / ДОБАВЛЕНИЕ АНТИ-PD-1 ИММУНОТЕРАПИИ К ХИМИОЛУЧЕВОЙ ТЕРАПИИ ПРИ МЕСТНОРАСПРОСТРАНЕННОМ РАКЕ ШЕЙКИ МАТКИ УВЕЛИЧИВАЕТ ВЫЖИВАЕМОСТЬ БЕЗ ПРОГРЕССИРОВАНИЯ
Автор: Дудина Ирина Александровна,
врач-онколог, химиотерапевт,
ГБУЗ Московская городская онкологическая больница №62 ДЗМ, Москва
Исследование III фазы ENGOT-cx11/
GOG-3047/KEYNOTE-A18, представленное на ESMO 2023 г. в Мадриде, продемонстрировало преимущество в увеличении выживаемости без
прогрессирования при добавлении
пембролизумаба к химиолучевой терапии (ХЛТ) с дальнейшим продолжением поддерживающей терапии
пембролизумабом до 2 лет в лечении
местнораспространенного рака шейки матки [1]. Данная опция получила
одобрение FDA в январе 2024 г. для
пациенток с местнораспространенным раком шейки матки III-IVA стадии по FIGO 2014 г.
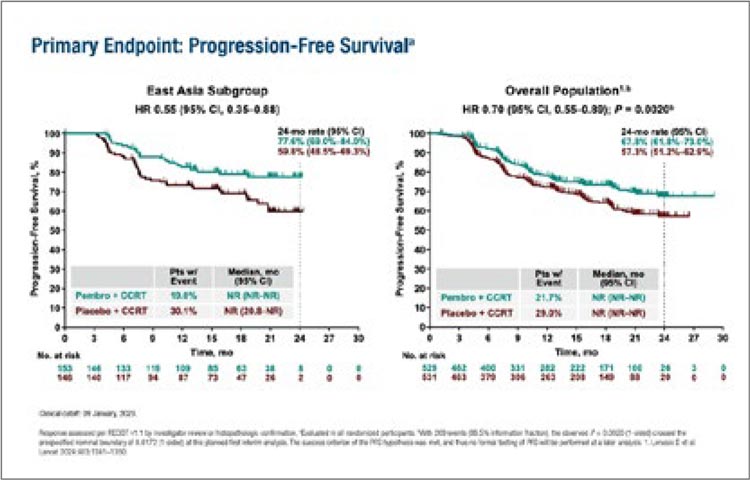
На ESMO GYN 20 июня 2024 г. представлены результаты лечения пациенток, включенных в исследование
KEYNOTE-A18 из стран Восточной
Азии (Китай, Япония, Корея, Таиланд, Тайвань) [2]. Более четверти
больных (299/1060) относились к
данному географическому региону.
При медиане наблюдения 19,3 мес.
добавление пембролизумаба к ХЛТ
снизило риск прогрессирования
или смерти на 45% (ОР 0,55; 95% ДИ
0,35-0,88) в подгруппе пациенток из
Восточной Азии. Двухлетняя выживаемость без прогрессирования
составила 77,6% в группе пембролизумаб + ХЛТ против 59,8% в группе
только ХЛТ, причем при непрямом
сравнении преимущество в двухлетней выживаемости без прогрессирования у пациенток из Восточной
Азии оказалось даже выше по сравнению с общей популяцией: 17,8%
против 10,3% (рис.2). Но стоит отметить, что в Восточной Азии большее
число больных имели стадии III-IV
(66,7% против 55,6%), где по данным
подгруппового анализа как раз и наблюдалась большая польза от добавления пембролизумаба к ХЛТ. Новых
данных о нежелательных явлениях
получено не было.
Рисунок 1.
Дизайн исследования ENGOT-cx11/GOG-3047/KEYNOTE-A18.
На ESMO GYN 20 июня 2024 г. представлены результаты лечения пациенток, включенных в исследование
KEYNOTE-A18 из стран Восточной
Азии (Китай, Япония, Корея, Таиланд, Тайвань) [2]. Более четверти
больных (299/1060) относились к
данному географическому региону.
При медиане наблюдения 19,3 мес.
добавление пембролизумаба к ХЛТ
снизило риск прогрессирования
или смерти на 45% (ОР 0,55; 95% ДИ
0,35-0,88) в подгруппе пациенток из
Восточной Азии. Двухлетняя выживаемость без прогрессирования
составила 77,6% в группе пембролизумаб + ХЛТ против 59,8% в группе
только ХЛТ, причем при непрямом
сравнении преимущество в двухлетней выживаемости без прогрессирования у пациенток из Восточной
Азии оказалось даже выше по сравнению с общей популяцией: 17,8%
против 10,3% (рис.2). Но стоит отметить, что в Восточной Азии большее
число больных имели стадии III-IV
(66,7% против 55,6%), где по данным
подгруппового анализа как раз и наблюдалась большая польза от добавления пембролизумаба к ХЛТ. Новых
данных о нежелательных явлениях
получено не было.
Рисунок 2.
Результаты исследования ENGOT-cx11/GOG-3047/
KEYNOTE-A18.
Также на постерной сессии ESMO
GYN 2024 г. во Флоренции были
представлены результаты похожего
по дизайну на KEYNOTE-A18 небольшого исследования II фазы из
Китая [3], цель которого – оценить
эффективность и безопасность антиPD-1 антитела тислелизумаба в сочетании с ХЛТ с дальнейшим продолжением тислелизумаба до 1 года
при местнораспространенном раке
шейки матки высокого риска. Всего
25 пациенток завершили ХЛТ и были
включены в анализ. Шестимесячная
частота объективного ответа (ЧОО)
составила 100% (рис.3), 1-летняя выживаемость без прогрессирования
также составила 100%. Конечно, выборка в исследовании небольшая,
необходимо подтверждение в более
крупном исследовании.
Рисунок 3.
ЧОО за 6 месяцев по данным исследования [3].
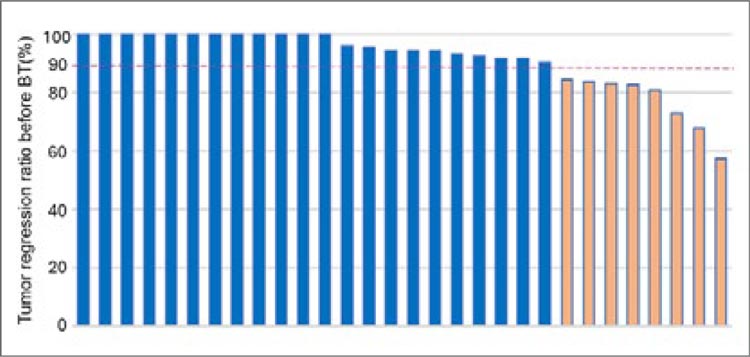
Рисунок 4.
Набор азиатского, европейского и темнокожего
населения в исследования по онкогинекологии.
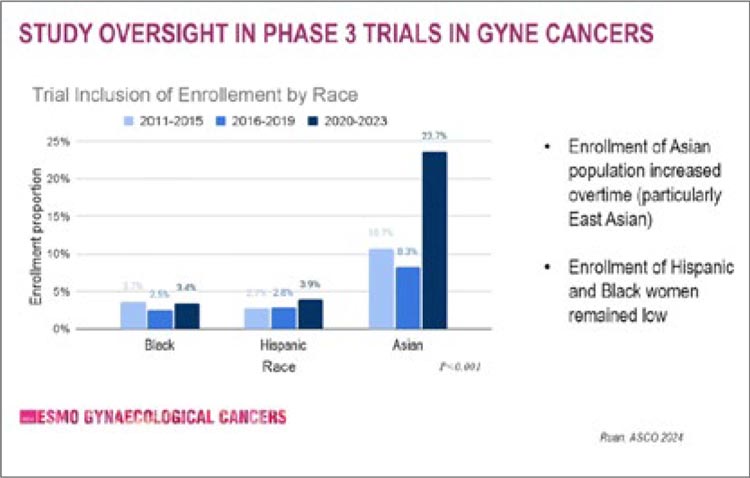
Интересно, что с каждым годом количество участников международных клинических исследований из
стран Азии увеличивается (рис.4).
Докладчики отмечают, что расовые
и этнические особенности фармакогеномики и фармакокинетики могут
влиять на результаты исследований.
Но с учетом того, что 58% смертей
от злокачественных новообразований приходится на азиатскую популяцию, необходимо их активное
включение в клинические исследования. Кроме того, самое большое
количество новых антител и молекул в онкологии создается в Китае.
Несмотря на то, что данные по добавлению анти-PD1 терапии к ХЛТ
при местнораспространенном раке
шейки матки воодушевляют, существуют явные противоречия и
ограничения, помимо высокой стоимости. Во-первых, нет официально опубликованных данных о статистически значимом увеличении
общей выживаемости. Во-вторых,
в 2023 году по результатам исследования INTERLACE короткий курс
индукционной химиотерапии перед
ХЛТ продемонстрировал преимущество как в увеличении выживаемости без прогрессирования, так и
общей выживаемости. Эффективно
ли добавление анти-PD-1 терапии к
ХЛТ для данной группы пациентов?
В-третьих, появляются первые данные и ведется большое число исследований по эффективности индукционной химиоиммунотерапии в
лечении местнораспространенного
рака шейки матки. Будет ли данная
опция более эффективна?Источники:Источники:
Источники:
- Lorusso D, et al.; ENGOTcx11/GOG-3047/K EY NOTE-A18 investigators. Pembrolizumab or placebo with chemoradiotherapy followed by pembrolizumab or placebo for newly diagnosed, high-risk, locally advanced cervical cancer (ENGOTcx11/GOG-3047/KEYNOTE-A18): a randomised, double-blind, phase 3 clinical trial. Lancet. 2024 Apr 6; 403(10434): 1341-1350. doi: 10.1016/ S0140-6736(24)00317-9. Epub 2024 Mar 20. PMID: 38521086.
- Xiang Y, et al. A randomized, phase 3, double-blind study of chemoradiotherapy with or without pembrolizumab in patients with highrisk, locally advanced, cervical cancer (KEYNOTE-A18/ENGOT-cx11/GOG3047): Results for patients enrolled in Asia. ESMO Gynaecological Cancers Congress 2024, Abstract 23O.
- Ma S, et al. Efficacy and safety of tislelizumab combined with concurrent chemoradiotherapy for high risk locally advanced cervical cancer. ESMO Gynaecological Cancers Congress 2024, Abstract 26P.
НОВОСТИ ESMO GYN 2024 / ESMO GYN 2024: ГОТОВА ЛИ НОВАЯ КЛАССИФИКАЦИЯ FIGO 2023 РАКА ЭНДОМЕТРИЯ ДЛЯ ВНЕДРЕНИЯ В РЕАЛЬНУЮ КЛИНИЧЕСКУЮ ПРАКТИКУ ПРЯМО СЕЙЧАС?
Отдельная сессия на ESMO GYN 22
июня 2024 г. была посвящена новой классификации рака эндометрия – FIGO 2023. Идея FIGO 2023
– объединение биологии и патолого-анатомических параметров, что
позволяет более точно определять
прогноз пациента и планировать
лечение. Но в реальной жизни FIGO
2023 часто подвергается критике и
с трудом входит в повсеместное использование. Данная сессия была
устроена в виде дебатов (за и против
FIGO 2023) с голосованием, участникам необходимо было ответить
на вопрос: «Готова ли новая классификация FIGO 2023 для внедрения
в реальную клиническую практику
прямо сейчас?». До выступления
рецензентов состоялся 1 этап голосования (результаты см. ниже), где
были заданы «проблемные» вопросы новой классификации.
Аргументы за FIGO 2023 приводил
известный клинический онколог и
врач-радиотерапевт Mansoor Raza
Mirza из Дании. Он подчеркнул,
что за последние 10 лет произошла
революция в понимании биологии
и лечении рака эндометрия, что потребовало изменения системы стадирования FIGO 2009 на FIGO 2023.
По его мнению, классификация
FIGO, во-первых, должна определять прогноз пациента, а во-вторых,
являться основой для планирования лечения. Ниже представлены
основные аргументы за:
1. Молекулярный подтип рака
эндометрия влияет
на прогноз (рис.1).
Рисунок 1.
Влияние молекулярной группы
рака эндометрия на прогноз
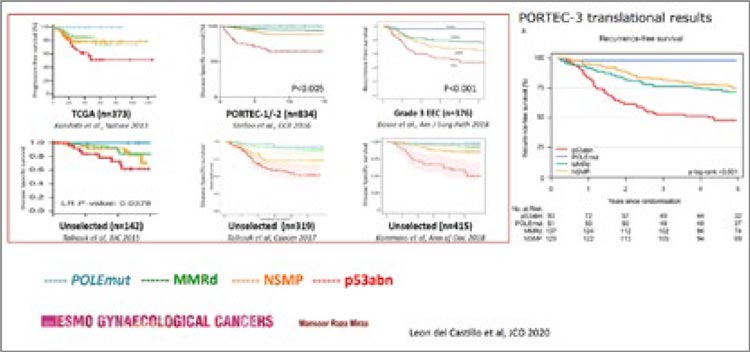
Результаты множества исследований и анализа баз данных показывают схожие результаты: благоприятный прогноз при POLE-мутации,
промежуточный прогноз при
dMMR и NSMP подтипе, неблагоприятный при p53abn. Молекулярный подтип определяет прогноз не
зависимо от стадии и гистологии,
поэтому его необходимо определять
во всех случаях рака эндометрия.
2. Молекулярный подтип рака
эндометрия определяет тактику
лечения.
Все случаи р53abn РЭ даже с минимальной инвазией в миометрий по
FIGO 2023 будут отнесены к стадии
минимум IICm и требовать назначения послеоперационной химиотерапии (ХТ) с учетом крайне неблагоприятного прогноза. Напротив, все
случаи POLE-мутированного рака
эндометрия, ограниченные маткой
или шейкой матки, отнесены к IAm
стадии. Послеоперационное лечение нецелесообразно. Если говорить
о распространенном РЭ, докладчик
приводит пример выбора тактики
лечения для ЭРЭ G3 3С2 стадии после радикального хирургического
лечения. При отсутствии данных о
молекулярном подтипе возможны
две опции: ХТ или ХТ + дистанционная лучевая терапия. При возможности определения молекулярный
подтип будет определять стратегию
послеоперационного лечения (в условиях неограниченного числа лекарственных препаратов): POLEmut
– отказ от послеоперационного лечения, dMMR – комбинация ХТ +
иммунотерапии, NSMP – ХТ с последующей терапией селинексором,
p53abn – комбинация ХТ + иммунотерапии ± PARP-ингибиторы.
3. Кроме анатомической распространенности существуют другие,
не менее важные прогностические
параметры.
На прогноз рака эндометрия и выбор тактики лечения при ранних
стадиях также влияет наличие значимой лимфоваскулярной инвазии
(LVSI), степень дифференцировки
и гистологический подтип опухоли.
При поздних – характер метастазирования в лимфоузлы (микро- или
макро-), наличие метастаза в яичник с учетом гистологии опухоли,
распространенность канцероматоза. Все эти особенности учтены в
FIGO 2023.
4. У каждого 4 пациента произойдет рестадирование при использовании FIGO 2023 по сравнению с
FIGO 2009 (рис.2).
Рисунок 2.
Изменение стадии при использовании FIGO 2023
по сравнению с FIGO 2009
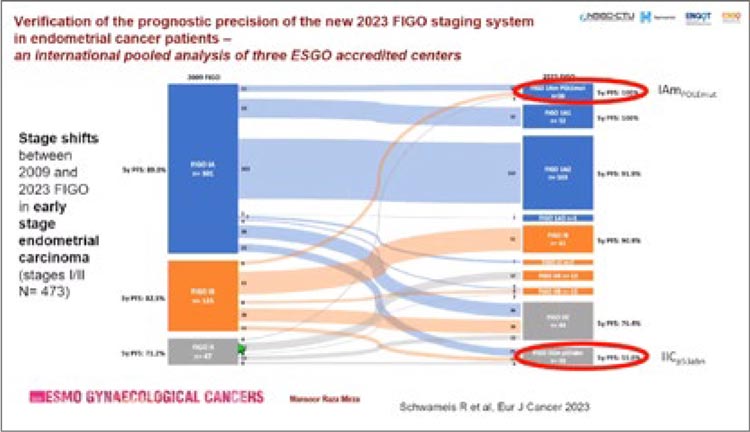
В исследовании Schwameis R. et al.
2023 года при анализе 517 пациентов
с РЭ было продемонстрировано, что
использование FIGO 2023 приводит
к повышению стадии у 23,7% и понижению стадии у 3,9% по сравнению с FIGO 2009. Рестадирование
позволило с более высокой точностью прогнозировать PFS и OS.
5. Знание молекулярного подтипа
необязательно (но желательно)
для проведения стадирования по
FIGO 2023, поэтому новая классификация может быть внедрена во
все центры.
Рецензентом против FIGO 2023
выступал врач-патологоанатом
Gianfranco Zannoni из Италии, поставив перед собой вопрос: «Есть ли
необходимость трансформировать
удобную для реальной клинической
практики систему стадирования
рака эндометрия в сложную мультипараметральную систему стратификации риска?». Вот его основные
аргументы против:
1. Система стадирования рака любой локализации должна обладать
ключевыми характеристиками.
Это валидность (наличие доказательной базы для принятия решений клиницистами), достоверность (базироваться на анатомических параметрах, отражающих размер, протяженность и опухолевую нагрузку), воспроизводимость в мировом масштабе и возможность сравнивать результаты лечения среди различных учреждений. По мнению докладчика, FIGO 2023 сложна для восприятия (включает 21 подстадию), интуитивно непонятна, не обладает достаточной доказательностью, неприменима для многих центров и требует больших временных и экономических затрат для каждого случая.
2. Возвращение к бинарной системе гистологии: неагрессивные (эндометриоидная G1 и G2) и агрессивные подтипы.
Эндометриоидный рак эндометрия
(ЭРЭ) G3 даже с минимальной инвазией в миометрий отнесен к группе
агрессивных подтипов и стадирован
как IIC и выше по FIGO 2023 наравне со светлоклеточным, серозным,
муцинозным, дедифференцированным раком, карциносаркомами.
Причем для агрессивных подтипов
не учитываются другие важные
(особенно для G3 ЭРЭ) прогностические факторы: глубина инвазии
в миометрий, наличие лимфоваскулярной стромальной инвазии
(LVSI), поражение шейки матки. В
одну группу отнесены опухоли с
различным прогнозом: 5-летняя PFS
для ЭРЭ G3 составляет 78% против
64% для серозной гистологии или 52% для карциносарком.
3. Степень злокачественности опухоли определяет стадию.
В новой классификации ЭРЭ G3 с
любой инвазией в миометрий относится минимум к IIC стадии, постановка IA-B, IIA-B стадии возможна
только при low grade ЭРЭ. Докладчик отмечает, что многочисленные
исследования демонстрируют гетерогенность в определении grade
опухоли среди различных центров.
При внедрении FIGO 2023 это неминуемо приведет к неправильному
стадированию и всему последующему лечению.
4. Отсутствие общепринятого
определения значимой лимфоваскулярной инвазии.
При анализе исследований
PORTEC I и II значимая LVSI определялась как поражение 4 и более
сосудов опухолевыми эмболами, а
в крупном исследовании Tortorella
L. et al. как 3 и более сосуда. При
этом для классификации FIGO
2023 было выбрано пороговое значение в 5 и более сосудов, предложенное ВОЗ в 2021 г. Докладчик
отмечает, что значимая LVSI влияет на безрецидивную и общую выживаемость независимо от других
факторов, но при этом существует
огромное количество технических
сложностей и неопределенностей
в оценке.
5. Сложность во внедрении и интерпретации молекулярной классификации.
В случае диагностики POLEмутации или p53abn молекулярного статуса изменяется стадия
заболевания, при этом при NSMP и dMMR (большинство случаев
РЭ) стадия остается прежней. В
большинстве центров рутинное
тестирование на POLE мутацию
недоступно, а значит достоверное
определение молекулярного подтипа невозможно. Все понимают,
что молекулярный статус определяет прогноз и влияет на принятие
решения, но целью классификации FIGO в первую очередь является адекватное стадирование для
каждого пациента, а не создание
сложной недоступной стратификационной модели. Кроме того,
определение молекулярного подтипа требует времени, что приведет к задержке послеоперационного лечения.
6. Неясность с синхронным раком эндометрия c инвазией менее половины толщины миометрия и раком яичника IA стадии
low grade.
С одной стороны, с учетом благоприятного прогноза и, вероятно,
синхронным характером заболевания данная ситуация перестадирована с IIIА стадии по FIGO 2009
на IA3 по FIGO 2023 г. Это позволяет отказаться от адъювантной
ХТ. С другой стороны, появляется еще больше вопросов: если
инвазия в миометрий 60%? или
двухсторонние опухоли яичников G1 без выхода на капсулу? как
трактовать опухолевое поражение
фаллопиевой трубы в пределах
слизистой оболочки?
В целом, профессор Gianfranco
Zannoni считает, что новая классификация рака эндометрия необходима. Однако с учетом сохраняющихся пробелов в наших
знаниях и невоспроизводимостью
в мировом масштабе предложенная FIGO 2023 – не самый оптимальный вариант. Также он не
уверен, что новая классификация
FIGO должна стать самостоятельной стратификационной моделью,
а не быть ее частью.
После выступления двух рецензентов состоялся 2 этап голосования слушателей и участников
сессии. Повторно были заданы те
же самые вопросы, но ответы на
некоторые из них после выступления докладчиков изменилось.
Ниже представлены вопросы, серым цветом обозначены ответы
слушателей до выступлений рецензентов, синим – после.
Первый вопрос: подходит ли FIGO 2023 для принятия рутинных клинических решений на междисциплинарных онкогинекологических консилиумах? Только половина участников считает, что FIGO 2023 применима в
реальной клинической практике, причем после выступления рецензентов
мнение почти не изменилось.
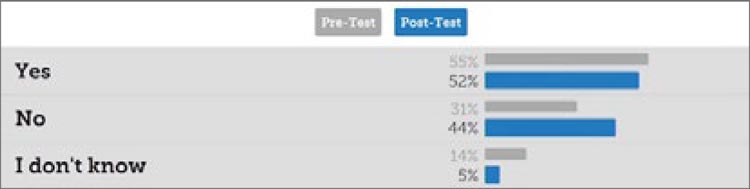
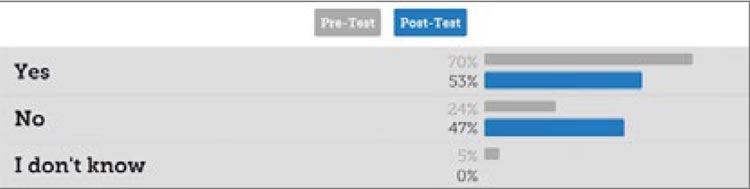
Второй вопрос: могут ли гистологические критерии быть стандартизированы для разных центров? Удивительно, но 70% участников до выступления Gianfranco Zannoni считали, что это вполне возможно, но его аргументы против уменьшили уверенность участников до 53%.
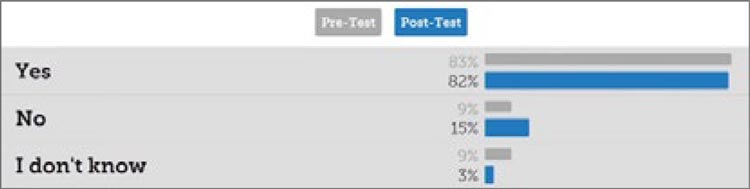
Третий вопрос: целесообразна ли интеграция молекулярной классификации для стратификации групп риска по прогнозу? Более 80% участников как до, так и после сессии считают, что это целесообразно.
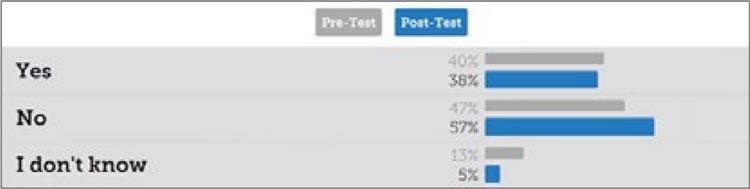
Четвертый вопрос: готова ли новая классификация FIGO 2023 для внедрения прямо сейчас? Более половины (57%) участников после дебатов
признали, что внедрение классификации FIGO 2023 преждевременно
Материал подготовила И.А. Дудина,
врач-онколог, химиотерапевт
ГБУЗ Московская городская
онкологическая больница №62 ДЗМ, Москва
НОВОСТИ ESMO GYN 2024 / ESMO GYN 2024. КАК УЛУЧШИТЬ РЕЗУЛЬТАТЫ Начало на стр. 8 ЛЕЧЕНИЯ РАКА ШЕЙКИ МАТКИ ВО 2 ЛИНИИ: КОМБИНАЦИИ АНТИ-TIGIT + АНТИ-PD1?
Исследование KEYNOTE-826 изменило стандарт первой линии
лечения метастатического и рецидивирующего CPS-позитивного
рака шейки матки (РШМ), продемонстрировав для пациентов,
получающих комбинацию пембролизумаб + ХТ ± бевацизумаб,
увеличение общей выживаемости на 12,1 мес. (28,6 против 16,5
мес.; ОР 0,69; 95% ДИ 0,49-0,74) и
выживаемости без прогрессирования на 2,3 мес. (10,5 против 8,2
мес.; ОР 0,58; 95% ДИ 0,47-0,71) по
сравнению с группой ХТ ± бевацизумаб. В реальной жизни не
все пациенты с CPS-позитивным
РШМ в 1 линии получают комбинацию с анти-PD1 иммунотерапией, для многих моноиммунотерапия остается стандартом
лечения второй и последующей
линии после прогрессирования
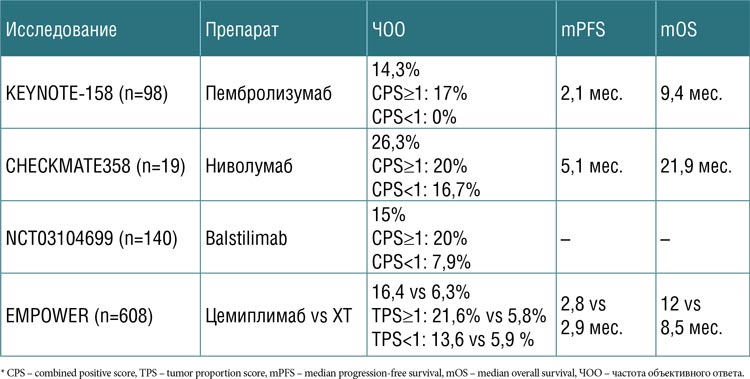
на платиносодержащей химиотерапии. Эффективность моноиммунотерапии во 2 линии невысокая (табл.1): в наиболее крупных исследованиях медиана ВБП не
превышает 3 мес., а частота объективного ответа (ЧОО) составляет около 20%.
Таблица 1.
Анти-PD-1 моноиммунотерапия
во 2 и последующих линиях лечения рака шейки матки
Для улучшения результатов лечения во второй линии активно изучаются различные комбинации с
анти-PD-1/L1 препаратами. Один
из вариантов – блокирование
TIGIT-пути. Вибостолимаб (MK7684) – гуманизированное антитело против рецептора TIGIT,
которое восстанавливает противоопухолевую активность, блокируя связывание рецептора TIGIT
с его лигандами (CD112 и CD155),
тем самым активируя противоопухолевый ответ Т-лимфоцитов.
На конгрессе ESMO GYN 20 июня
2024 г. были доложены результаты рандомизированного исследования II фазы KEYVIBE-005,
оценивающего эффективность
комбинации анти-TIGIT препарата видостолимаб с пембролизумабом по сравнению с моноиммунотерапией пембролизумабом.
Дизайн исследования представлен на рисунке 1.
Рисунок 1.
Дизайн исследования KEYVIBE-005
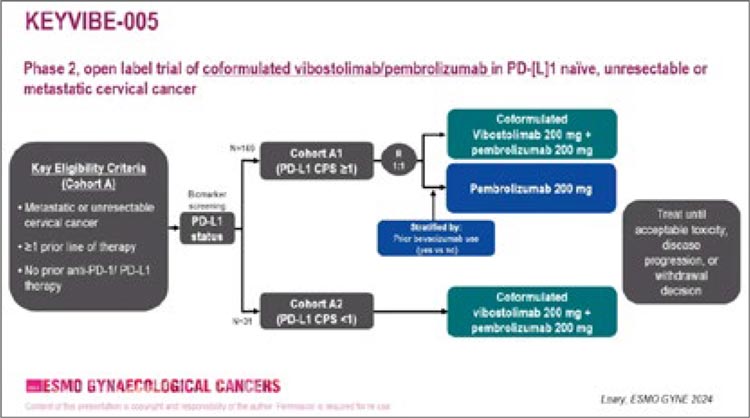
В исследовании KEYVIBE-005
пациенты, ранее не получавшие
анти-PD-1/L1 терапию и имеющие
прогрессирование заболевания
после 1 и более линии химиотерапии, были отнесены к когорте A1
(CPS≥1) или A2 (CPS<1). Пациенты
когорты A1 были рандомизированы 1:1 для комбинации вибостолимаб 200 мг (вибо) + пембролизумаб 200 мг (пембро) 1 раз в 3
недели (n=85) или пембролизумаб
200 мг 1 раз в 3 недели (n=84). Все
пациенты когорты А2 получали
комбинацию вибо+пембро (n=31).
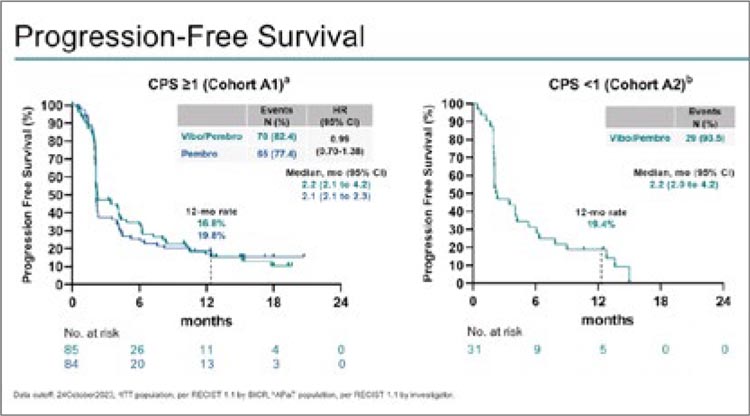
ЧОО в когорте А1 составила 20%
для группы вибо+пембро по сравнению с ЧОО 15,5% для пембро
(p=0,2215). ЧОО составила 16,1%
для когорты A2. Медиана выживаемости без прогрессирования
(mPFS) составила 2,2 мес. для
вибо+пембро против 2,1 мес. для
пембро (ОР 0,99; р=0,4787) в когорте А1. mPFS составила 2,2 мес.
для когорты A2 (рис.2). Увеличение общей выживаемости также
достигнуто не было.
Рисунок 2.
Выживаемость без прогрессирования для когорты
А1 и А2 в исследовании KEYVIBE-005
При анализе биомаркеров наблюдалось увеличение ЧОО при PDL1-позитивном, TMB-high (≥175
мутаций/экзом), высокой инфильтрации T-клетками. Ввиду отсутствия достоверных статистически
значимых различий между контрольной и исследуемой группой и
в целом негативными результатами исследования, выделить группу пациентов, получающих пользу от комбинации вибо+пембро,
авторам не удалось.
Рисунок 3.
Анализ биомаркеров в когорте 1
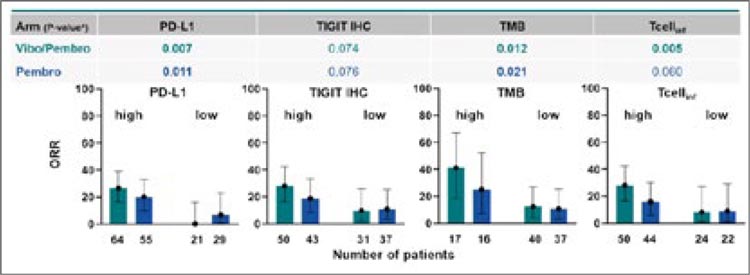
Таблица 2.
Комбинированная иммунотерапия (анти-PD-1 + анти-CTL-4)
во 2 и последующей линии лечения рака шейки матки
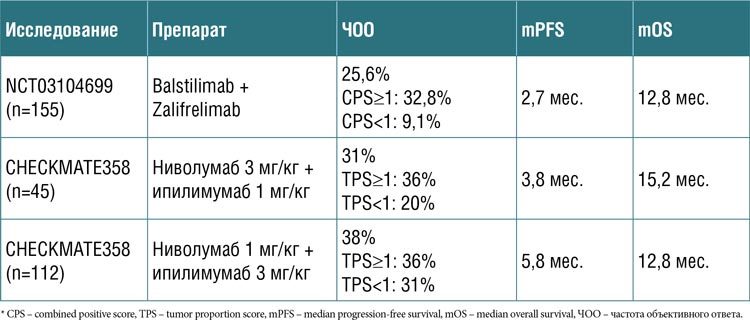
Таким образом, исследование
KEYVIBE-005 не позволило улучшить результаты лечения второй
и последующей линии терапии
метастатического и рецидивирующего РШМ у непредлеченных имммунотерапией пациентов с CPSпозитивным статусом. В данной
группе наиболее перспективной
стратегией представляется комбинация – анти-PD-1 + анти-CTL-4
(табл.2), но данная опция не зарегистрирована в связи с малым количеством данных. Поэтому очень
важно всем CPS-позитивным пациентам с метастатическим и рецидивирующим РШМ в 1 линии дать
комбинацию ХТ + пембролизумаб
+ бевацизумаб (при отсутствии
противопоказаний), т.к. все опции
2 и последующей линии обладают
низкой эффективностью.
Источник:
Leary А, et al. Coformulated vibostolimab/pembrolizumab
in advanced cervical cancer: KEYVIBE-005. Annals of Oncology. 2024;
№9 (suppl_5): 1-7. 10.1016/esmoop/
esmoop103498.
Материал подготовила
И.А. Дудина
НОВОСТИ ESMO GYN 2024 / ПО СЛЕДАМ ESMO GYN 2024: РАК ЯИЧНИКОВ
Автор: Тесленко Ксения Николаевна
клинический онколог химиотерапевтического отделения
(противоопухолевой лекарственной терапии) №13
ГБУЗ «Городской клинический онкологический диспансер», Санкт-Петербург
20-22 июня 2024 года в Италии прошел ежегодный конгресс ESMO
gynaecological cancers. Не сказать,
чтоб в этом году было представлено много новых данных, которые
бы мы уже не обсудили в контексте
прошедшего ASCO и других конференций, но все же были обновления
некоторых ключевых исследований,
продолжены жаркие дискуссии по
нерешенным вопросам в лечении
онкогинекологических заболеваний,
обсуждены дальнейшие направления
исследований. Как отметил профессор Giovanni Scambia во вступительной лекции конгресса, использовав
метафору с шедеврами мировой живописи: «Последние 10 лет мы обсуждали тематику и цвет, пора обсудить
вопросы перспективы».
Рисунок 1.
Зависимость эффекта PARP-ингибиторов
от локации мутаций.
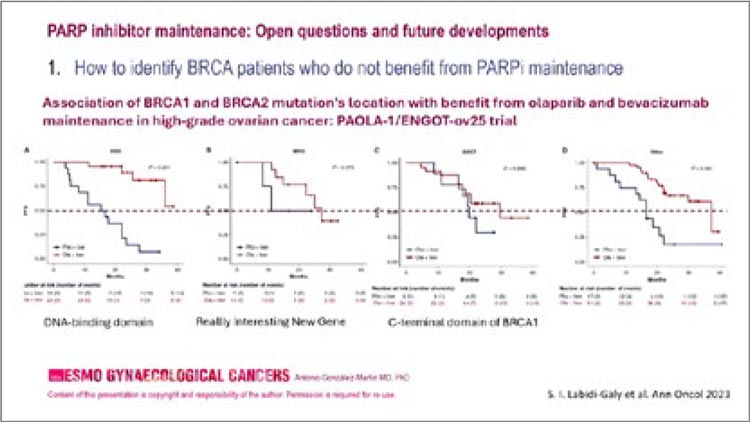
В первый день конференции на
сессии, посвященной изменениям
принципов лечения первичного
рака яичников, обсуждались такие
важные вопросы, как правильный
отбор пациентов на первичные и интервальные циторедуктивные операции. Еще раз было подчеркнуто, что
первичная полная циторедуктивная
операция является наилучшей стратегией для пациенток. Однако мы все
еще не имеем сравнительных данных
о времени циторедукции в эру новой
поддерживающей терапии бевацизумабом и PARP-ингибиторами, поэтому мы с интересом ждем результатов
рандомизированного исследования
TRUST, где сравнивается стратегия первичных и интервальных циторедуктивных операций с последующей
поддерживающей терапией бевацизумабом. При этом в дискуссии сам
автор подчеркнул, что в дизайне исследования не было запланировано
использование PARP-ингибиторов,
что может оказать значимое влияние
на ожидаемые результаты. В докладе
о стратегиях 1 линии лекарственного лечения были представлены интересные данные из исследования
PAOLA-1 о том, оказывает ли влияние тип мутации в гене BRCA на эффективность использования у таких
пациенток олапариба. Ведь несмотря
на ошеломляющие данные исследований SOLO-1 и PAOLA-1 у когорты
BRCAmut, часть пациенток не получает преимуществ от использования
PARP-ингибиторов. Возможная причина кроется в локализации мутации.
Рисунок 2.
Дизайн исследований NIRVANA/ENGOT– ov63 и AGO – OVAR 28/ENGOT – ov57.
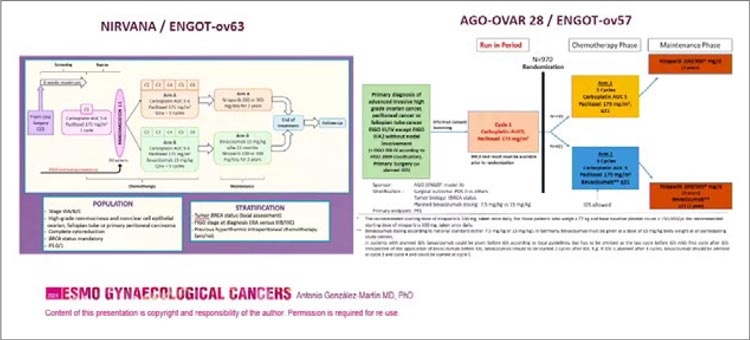
Обсуждалась и такая важная тема,
как использование комбинированной поддерживающей терапии
бевацизумабом и олапарибом для
HRD(+) BRCA(–) пациенток. Действительно ли все пациентки нуждаются в этом режиме, или пользы
от применения PARP-ингибиторов
в монорежиме хватит, чтобы улучшить прогнозы для таких пациенток?
К сожалению, дизайн исследования
PAOLA-1 не включал пациенток, которым бы проводилась поддержка
только PARP-ингибитором. Поэтому
мы ждем результаты исследований
NIRVANA/ENGOT– ov63 и AGO –
OVAR 28/ENGOT – ov57, в которых
будет изучено сравнение использования нирапариба и комбинации нирапариба с бевацизумабом для таких
пациенток.
Одним из наиболее интересных в этой
сессии был доклад Ilaria Colombo, посвященный HRD(+) и HRD(–) опухолям. Почему пациентки с HRD(+)
статусом могут не получать пользы от
PARP-ингибиторов? Для BRCA(+) пациенток одним из самых изученных
на сегодняшний день механизмов является появление реверсивных мутаций в гене BRCA, которые восстанавливают нормальную активность гена
и делают опухоль нечувствительной
к PARP-ингибированию. Для HRD(+)
пациенток, помимо молекулярных
механизмов, причина может крыться
в несовершенстве довольного сложного теста, отражающего динамическое состояние опухоли в данный
момент времени. Пространственная
(зависимость от локуса биопсии) и
временная (состояние до или после
химиотерапии) гетерогенность могут
вносить значимое влияние на результаты теста.
Почему же некоторые HRD(–) опухоли могут получать преимущества от PARP-ингибиторов, хоть и
менее выраженные, как это было
показано в исследованиях с нирапарибом и рукапарибом? Возможно, это также связано с несовершенством теста, и мы имеем дело
с HRD(+) опухолью. Другой причиной может быть сложный механизм действия PARP-ингибиторов,
который включает в себя не только
синтетическую летальность, но и
влияет на регуляцию транскрипции, клеточное деление и воспаление. Как мы можем улучшить
результаты лечения пациенток с
HRD(–)? Автор видит перспективу в дальнейших исследованиях
альтернативных мишеней, таких
как WEE-1 ингибиторы и CDK-2
ингибиторы, но данные по этим
исследования пока ограничены
первыми фазами.
В сессии, посвященной новым
исследованиям, были доложены
обновленные данные уже хорошо
известного исследования DUO-O,
где в фазе поддерживающей терапии в одном из рукавов изучалась
комбинация олаприба, бевацизумаба и дурвалумаба. По-прежнему
группа тройной поддерживающей
терапии демонстрирует наилучшие результаты mPFS – 45,1 мес. в
сравнении с контролем в 23,3 мес.
для HRD(+) BRCA(–) подгруппы.
При этом в промежуточном анализе общей выживаемости преимущества для этой когорты получено не было.
Рисунок 3, 4.
Показатели ВБП и ОВ по обновленным данным
исследования DUO-O.
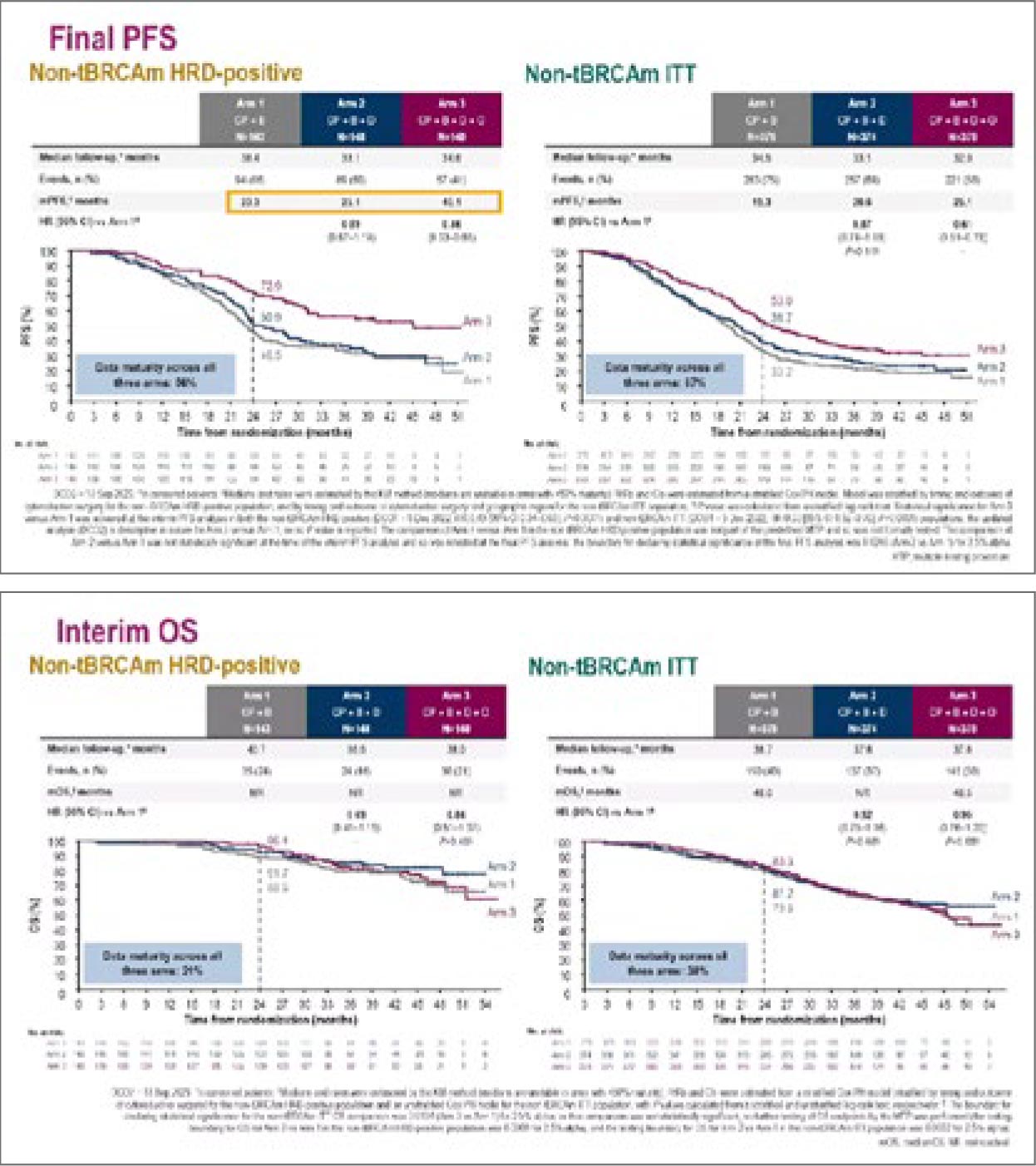
Для подгруппы HRD(–) данные
также остались прежними. Медиана ВБП для когорты тройной
терапии составила 21,1 мес. против 17,5 мес. в группе контроля
(HR=0,68). Различий в OS получено не было. Такие данные заставляют задуматься, точно ли подход
«наращивания» опций в поддерживающей терапии себя оправдывает?
Дискутант также отметил, что мы
уже давно имеем результаты исследования PAOLA-1 для HRD(+)
BRCA(–) когорты, при этом для
HRD(–) обнадеживающих результатов на сегодняшний день не получено. Нужно искать новые биомаркеры.
В этой же сессии были обсуждены
результаты post-hoc анализа, касающегося модификации дозы и
эффективности препарата, исследования 3 фазы MIRASOL (GOG
3045/ENGOT-ov55), где изучался мирветуксимаб соравтанзин
(конъюгат ингибитора миротрубочек DM4 с антителом к рецепторам фолатов FRa) в сравнении
с стандартной терапией при платинорезистентном раке яичников
(одобрен FDA как стандарт терапии платинорезистентного рака
яичников с экспрессией рецепторов фолатов в марте 2024 года).
Как оказалось, 55% пациенток в
группе мирветуксимаба и 50% пациенток в группе химиотерапии
получили редукцию дозы (а также
имели задержку введения, остановку введения) вследствие токсичности.
Рисунок 5, 6.
ЧОО и ОВ в зависимости от дозы препаратов по
данным исследования MIRASOL.
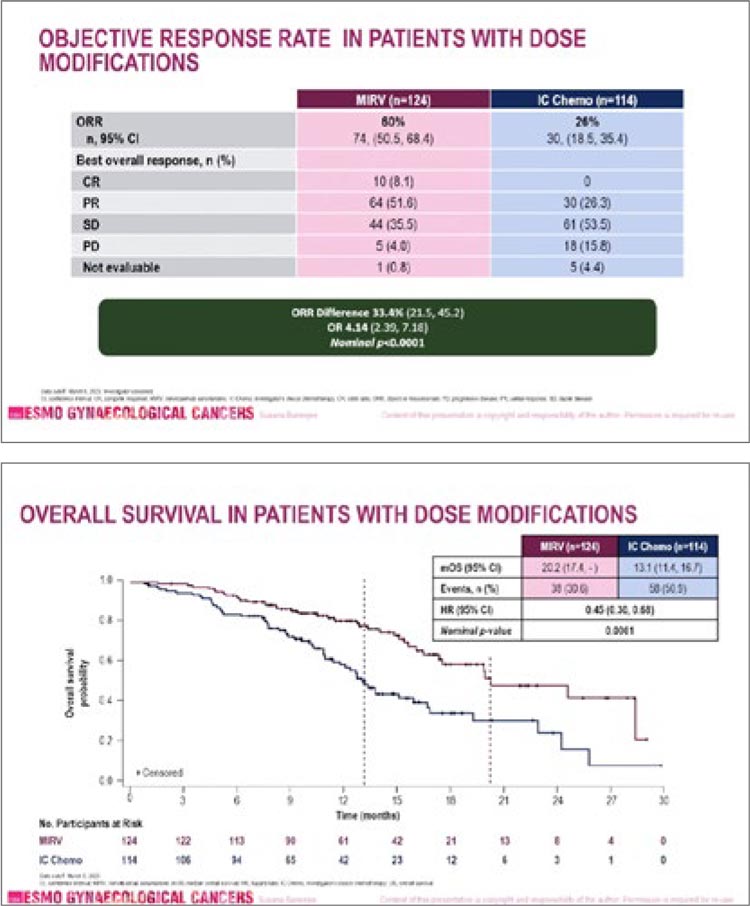
Анализ показал, что у пациентов,
которые получили модификацию
дозы мирветуксимаба, сохранялись преимущества в ВБП, ОВ и
ЧОО. Нам известно, что мирветуксимаб обладает довольно специфической токсичностью в виде
офтальмопатий, что может значительно изменять качество жизни
пациентов, поэтому продолжающийся выигрыш в группе пациентов, получивших редукцию дозы,
представляется важным заключением из этого анализа. В дискуссии к этому докладу были подняты
такие важные вопросы, как выбор
первоначальной дозы препарата в
исследовании. Панель экспертов
вспомнила, как были изменены
дозы нирапариба в исследовании
NOVA в связи с выраженной гематологической токсичностью,
как до сих пор продолжаются дискуссии о дозе ленватиниба 20 мг
в комбинации пембролизумаб + ленватиниб для лечения MSS рака
эндометрия. Действительно ли
доза, которая используется в клиническом исследовании, подобрана правильно? На такие вопросы
нам должны ответить продолжающиеся исследования.
Также в этой сессии были доложены результаты исследования
ROSCAN, в котором изучалась
эффективность нирапариба, комбинации нирапариба и достарлимаба против стандартной химиотерапии при прогрессирующей
после платиновой терапии карциносаркоме яичников и тела матки.
Первичной конечной точкой была
ЧОО через 16 недель. Исследование оказалось негативным, комбинация нирапариба и достарлимаба
не стала лучше стандартной химиотерапии. Однако продолжение
исследований в такой сложной
когорте пациентов внушает надежду.
Рисунок 7.
ЧОО в подгруппах по данным исследования
ROSCAN.
В завершение первого дня конференции была проведена сессия,
касающаяся применения хирургических методов в «особых»
клинических ситуациях, таких
как прогрессирование на фоне
применения PARP-ингибиторов,
использования HIPEC, вторичных циторедукивных операций и
хирургического лечения 4 стадии
рака яичников.
Автор доклада о хирургическом лечения на фоне PARPингибиторов отметила, что по
данным поданализа исследования PRIMA около 75% пациентов
имеют олигопрогрессирование.
Автор сделала акцент на возможной пользе для таких пациентов
хирургических методов лечения и
лучевой терапии, особенно SBRT
при изолированном поражении
лимфоузлов, что в настоящий
момент продолжает изучаться в
исследовании MITO-RT3/RAD
PHASE II TRIAL (NCT04593381).
В докладе по применению HIPEC
при раке яичников автор в очередной раз указал на сложности
планирования рандомизированных исследований с включением
хирургического лечения. В настоящий момент мы имеем некоторые данные о возможной пользе
этого подхода при проведении
интервальных циторедуктивных
операций при первичном лечении рака яичников (исследование
OVHIPEC) и при лечении рецидива заболевания, когда операция
выполняется после 6 циклов химиотерапии (исследование CHIPOR),
однако к таким работам остаются
вопросы, и применение HIPEC
требует дальнейшего изучения. В
настоящий момент продолжаются
исследования OVHIPEC-2, HORSE
и CHIPPI, в которых данный метод
будет применяться в лечении первичного рака яичников.
На сессии были вновь продемонстрированы результаты исследования SOC-1, доказавшие пользу
от проведения вторичных циторедуктивных операций в полном
объеме с последующей химиотерапией в сравнении с только химиотерапией у пациенток с платиночувствительным раком яичников
(они уже были представлены на
ASCO 2024, ОВ 58,1 против 52,1
мес.). В завершающем докладе,
посвященном хирургическому лечению 4 стадии рака яичников,
акцент был сделан на гетерогенности таких пациентов, ведь под 4
стадией мы можем подразумевать
пациентов с цитологически верифицированным плевритом (4А
стадия), множественными метастазами в паренхиматозные органы, локализованным поражением
или увеличенными лимфоузлами в
средостении (и все это 4В стадия).
Несомненно, наилучший прогноз
будет у тех пациентов, которым
на первом этапе будет выполнена
первичная полная циторедуктивная операция, когда это возможно.
Наиболее интересные суждения
были о группе пациентов, имеющих увеличение единичных экстраабдоминальных лимфоузлов;
автор проводит параллель с исследованием, показавшим отсутствие
пользы от систематической тазовой лимфодиссекции у пациентов с
перитонеальным карциноматозом,
и видит для таких пациентов все
возможности для хирургического
лечения. Автор отмечает, что наличие экстраабдоминальных лимфоузлов может быть фактором неблагоприятного прогноза и влиять на
дальнейшее планирование лечения
пациента, однако не должно быть
единственным ограничивающим
фактором при решении вопроса о
циторедуктивной операции.
Источники:
- Ray-Coquard IL, et al. ROCSAN: A multicentric randomized phase II/III evaluating dostarlimab in combination with niraparib versus niraparib alone compared to chemotherapy in the treatment of endometrial/ovarian carcinosarcoma after at least one line of platinum-based chemotherapy – Preliminary results. Abstract Book of the ESMO Gynaecological Cancers Congress, Abstract 340. https://doi. org/10.1016/j.esmoop.2024.103534.
- Trillsch F, et al. Durvalumab (D) + carboplatin/paclitaxel (CP) + bevacizumab (B) followed by D, B + olaparib (O) maintenance (mtx) for newly diagnosed advanced ovarian cancer (AOC) without a tumour BRCA1/BRCA2 mutation (nontBRCAm): Updated results from DUO-O. Abstract Book of the ESMO Gynaecological Cancers Congress, Abstract 440. https://doi.org/10.1016/j. esmoop.2024.103550.
- Banerjee S, et al. Safety and efficacy results in patients who received dose modifications in the phase III MIRASOL (GOG 3045/ ENGOT-ov55) trial of mirvetuximab soravtansine vs investigator’s choice chemotherapy (ICC) in platinumresistant ovarian cancer (PROC) with high folate receptor-alpha expression. Abstract Book of the ESMO Gynaecological Cancers Congress, Abstract 440. https://doi.org/10.1016/j. esmoop.2024.103551.
НОВОСТИ ESMO GI 2024 / ПИЩЕВОД И ЖЕЛУДОК
Автор: Евсеев Владислав Николаевич
онколог, химиотерапевт, Санкт-Петербург
Спустя месяц после ежегодного конгресса ASCO состоялась конференция ESMO по опухолям желудочно-кишечного тракта. Конференция
уже закончилась, доклады прослушаны и пришло время подвести
итоги самых основных исследований в лечении опухолей желудка и
пищевода.
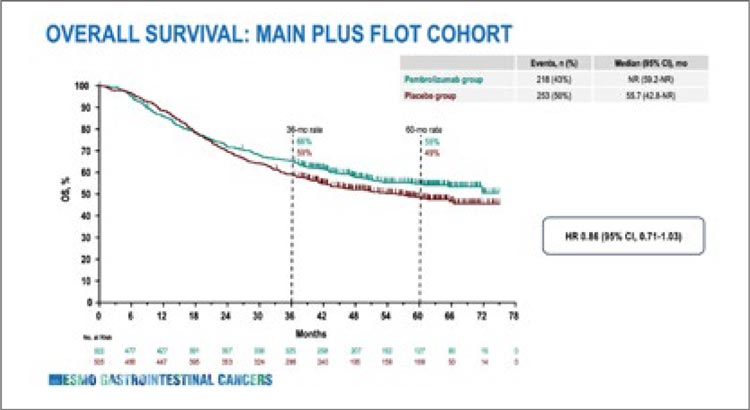
Финальный анализ общей выживаемости исследования KEYNOTE
585 показал отсутствие выигрыша
в общей выживаемости от добавления препарата пембролизумаб к
периоперационной терапии рака
желудка. Обновленные результаты
подтвердили уже известные для нас
данные – периоперационная химиоиммунотерапия увеличивает показатель частоты полных патоморфологических регрессов на 11,4% по
сравнению с только химиотерапией,
а также улучшает показатель безпрогрессивной выживаемости – при
5-летнем наблюдении она составила
48% и 38% соответственно.
Несмотря на достаточно значительную разницу, это не транслировалось в увеличение показателя общей выживаемости ни в основной
группе, ни в объединенной группе
с химиотерапией по схеме FLOT. На
5-летнем рубеже абсолютная разница в общей выживаемости составила 6% (55% против 49%), но она не
достигла статистической значимости. (рис.1).
Рисунок 1.
Показатели ОВ в группах пембролизумаба и плацебо
В подгрупповых анализах также
не получилось выделить группу со
статистически значимым преимуществом в общей выживаемости,
но польза от периоперационной терапии была несколько выше среди
пациентов с микросателлитной нестабильностью, высоким уровнем
CPS (10 и более), а также среди пациентов, получавших схему FLOT.
В подгрупповых анализах также
не получилось выделить группу со
статистически значимым преимуществом в общей выживаемости,
но польза от периоперационной терапии была несколько выше среди
пациентов с микросателлитной нестабильностью, высоким уровнем
CPS (10 и более), а также среди пациентов, получавших схему FLOT
(рис.2).
Рисунок 2.
Подгрупповой анализ ОВ

Результаты этого исследования несколько уменьшают энтузиазм от
периоперационной иммунотерапии
и пока что оставляют эту опцию
только для клинических исследований. Еще один важный вывод из
этого исследования - показатели
частоты полных патоморфологических регрессов и безпрогрессивной
выживаемости все же являются
суррогатными и далеко не всегда хорошо коррелируют с показателями
общей выживаемости.
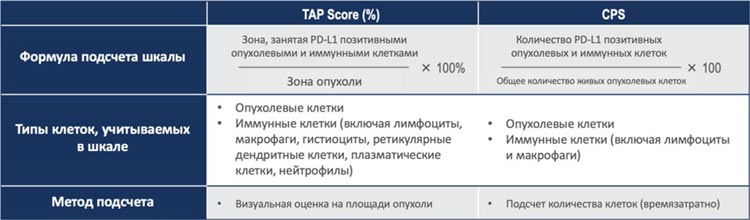
Два доклада были посвящены валидации шкалы TAP (tumor area
positivity) как метода подсчета уровня PD-L1 при лечении метастатической аденокарциномы желудка и
пищеводно-желудочного перехода и
плоскоклеточного рака пищевода в
1-й линии. Шкала TAP в отличии от
CPS использует визуальную оценку
площади опухоли и не требует подсчета количества клеток. Это делает
ее более удобной и быстрой для рутинной практики (табл.1).
Таблица 1.
Основные отличия двух методов подсчета уровня PD-L1
Для валидации авторы докладов провели анализ исследований
RATIONALE-305 и RATIONALE-306
и оценили сопоставимость определения уровня PD-L1 с помощью подсчета CPS (combined positivity score)
и TAP, а также оценили, насколько
шкала TAP предсказывает выигрыш
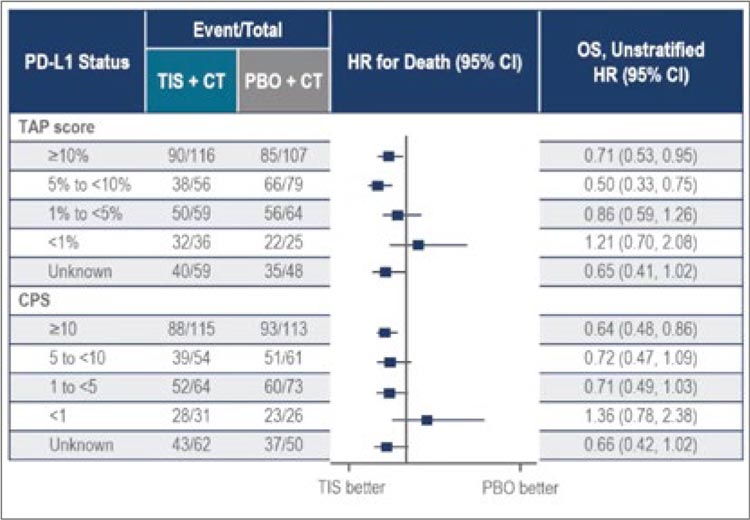
в общей и безпрогрессивной выживаемости от добавления иммунотерапии в 1-й линии лечения.
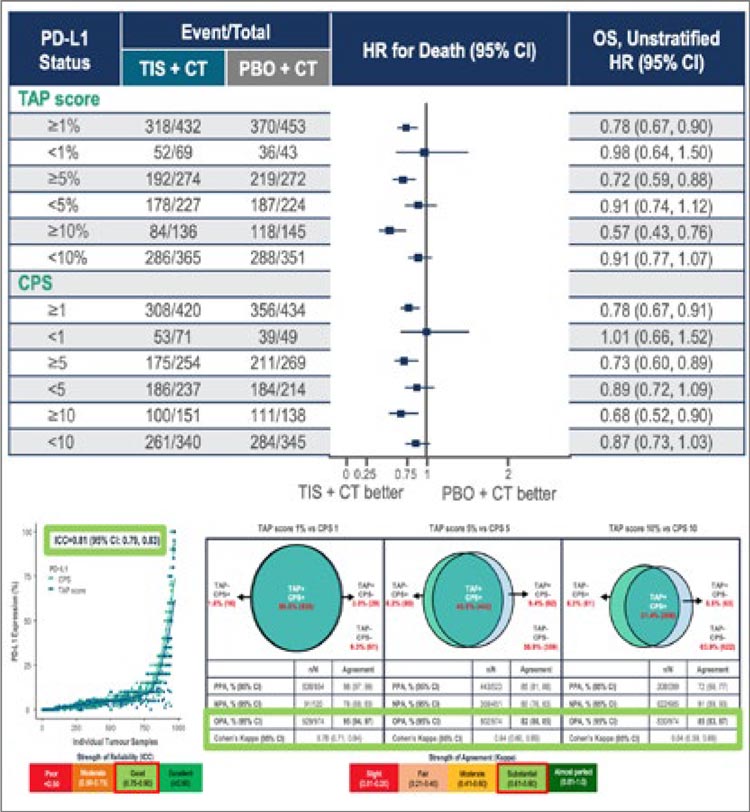
Анализ показал, что при лечении
аденокарциномы желудка уровни
PD-L1 по шкале TAP и CPS сходятся
в значительном количестве случаев
(коэффициент корреляции 0,81).
При этом для назначения иммунотерапии могут использоваться те
же уровни, что и при более классическом определении уровня PD-L1
с помощью CPS – статистически
значимый выигрыш в общей выживаемости отмечался при уровне TAP
10% и более (рис.3).
Рисунок 3.
Сравнение двух шкал TAP и CPS для назначения
иммунотерапии при аденокарциноме желудка
Для плоскоклеточного рака пищевода ситуация оказалась схожей
– уровень PD-L1 при оценке методом CPS и TAP также сходился в
значительном количестве случаев
(коэффициент корреляции – 0,85).
Но вот по определению, кому все же
назначать иммунотерапию в 1-й линии, было небольшое расхождение.
Дело в том, что при анализе уровня
PD-L1 методом CPS статистически
значимый выигрыш от добавления
тислелизумаба в 1-ю линию лечения наблюдался только у пациентов
с уровнем 10 и выше. Но если подсчет проводился по шкале TAP, то
выигрыш был и в группе пациентов
с уровнем PD-L1 от 5 до 10. Тем не
менее, оба эти исследования показывают, что потенциально такой
более быстрый и простой способ
определения может использоваться
в рутинной клинической практике,
а «отсечки» для назначения иммунотерапии могут оставаться привычными нам из других исследований.
(рис.4).
Рисунок 4.
Сравнение двух шкал TAP и CPS для назначения
иммунотерапии при плоскоклеточном раке пищевода
Всего спустя месяц от конгресса
ASCO 2024 были представлены и
обновленные данные исследования
ARMANI, в котором изучался вопрос раннего перехода на 2-ю линию лечения по схеме паклитаксел
+ рамуцирумаб в качестве поддерживающей терапии после 3 месяцев
терапии по схеме FOLFOX (рис.5).
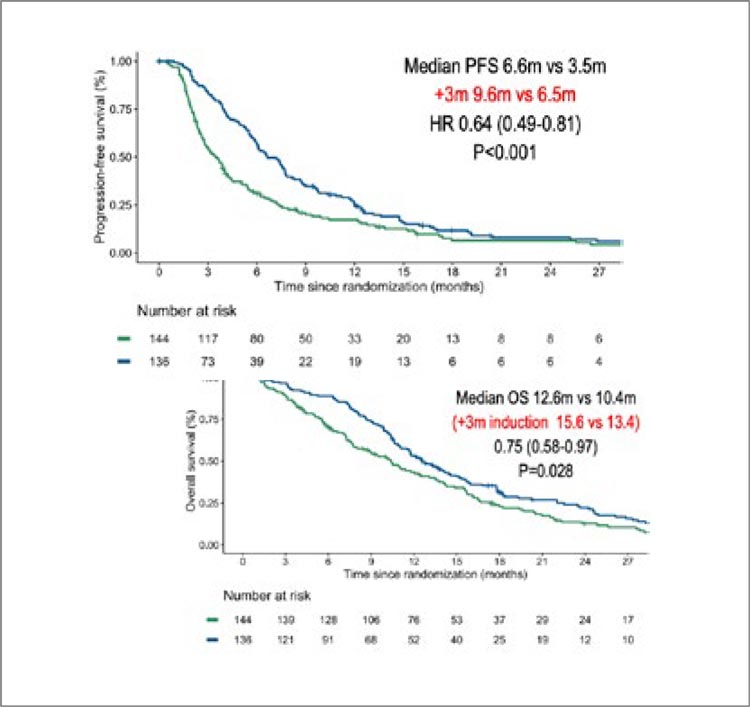
При подгрупповых анализах оказалось, что ранний переход на
поддержку паклитакселом и рамуцирумабом улучшал показатели
безпрогрессивной выживаемости
среди всех групп пациентов. Интересно, что наибольшим образом выигрывали более пожилые пациенты
(70 лет и старше). Экспрессия PD-L1
и клаудина 18.2 не влияла на эффективность такого подхода. В целом
ранний переход на схему паклитаксел + рамуцирумаб позволил увеличить медиану безпрогрессивной
выживаемости на 3,1 мес., а общей
выживаемости – на 2,2 мес. (рис.6).
Несмотря на оптимизм исследования, остался целый ряд принципиально важных для практики
вопросов: как на необходимость
раннего перехода на поддержку
паклитакселом с рамуцирумабом
влияет чувствительность к платине,
насколько отличается показатель PFS2 и общей выживаемости среди
тех пациентов, которые все же получили паклитаксел с рамуцирумабом
после прогрессирования на фоне
химиотерапии по схеме FOLFOX в
контрольной группе? Для меня без
ответов на этот вопрос данная стратегия все еще не выглядит слишком
убедительной.
Рисунок 5.
Дизайн исследования ARMANI
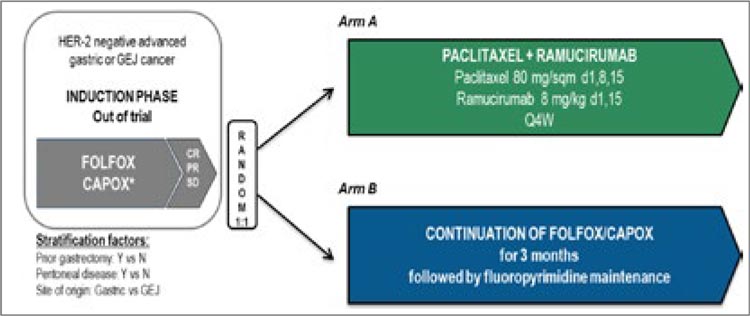
Рисунок 6.
Показатели ВБП и ОВ по данным исследования ARMANI
Как справедливо заметила Элизабет
Смит во время обсуждения этих докладов, ожидаемый выигрыш в безпрогрессивной выживаемости и достаточное скромное преимущество
в общей выживаемости во многом
может быть скомпенсировано необходимостью более частых визитов в
больницу и большей токсичностью
терапии.
Не успели мы научиться выговаривать слово золбетуксимаб, как
на конгрессе ESMO GI 2024 был
представлен еще один препарат, направленный против клаудина 18.2
(CLDN18.2). На этот раз препарат
представляет из себя конъюгат
антитело-лекарственный препарат,
при этом в качестве химиопрепарата используется экзатекан (топоизомеразный ингибитор).
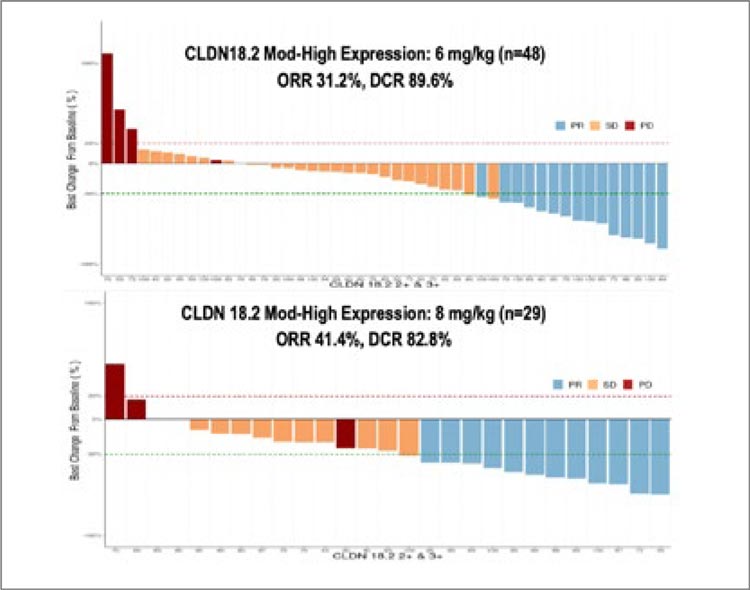
В исследовании 1 фазы он показал
достаточно хорошие показатели
эффективности – частота объективных ответов на лечение среди
пациентов с умеренной и высокой
экспрессией CLDN18.2 составила
31,2%, а частота контроля заболевания – 89,6% при использовании
дозы 6 мг/кг. При более высокой
дозе (8 мг/кг) – 41,4% и 82,8% соответственно (рис.7).
Рисунок 7.
Частота объективных ответов при применении
препарата Anti-claudin 18.2 (CLDN18.2) antibody-drug conjugate
(ADC) IBI343 у пациентов с умеренной и высокой экспрессией
CLDN18.2
Показатели безпрогрессивной выживаемости также были достаточно воодушевляющими – среди пациентов с высоким уровнем экспрессии
CLDN18.2 она составила 6,8 мес. при
дозе 6 мг/кг и 5,5 мес. при дозе 8 мг/
кг.
При этом надо понимать, что больше 70% пациентов получали его в
качестве 3 и последующих линий
лечения, то есть в ситуации, где мы
обычно рассчитываем на куда более
скромные показатели частоты объективных ответов и безпрогрессивной выживаемости.
Интересно, что в этом исследовании
не было отмечено случаев интерстициальной болезни легких на фоне
лечения. Самыми частыми осложнениями 3-4 степени оказались нейтропения, лейкопения и анемия.
Рисунок 8.
Показатели ВБП при применении анти-CLDN18.2 конъюгата IBI343
Очередной конгресс ESMO по опухолям желудочно-кишечного тракта начался 26 июня 2024 года. В
первый же день были представлены
результаты нескольких важных для
практики работ:
1. Метаанализ индивидуальных
данных пациентов из рандомизированных исследований, посвященных применению химиотерапии при резектабельных
метастазах колоректального рака
в печень.
Уже достаточно давно ведется обсуждение необходимости проведения химиотерапии у подобных
пациентов, и из предыдущих исследований мы точно знали, что такой подход приводит к увеличению
ВБП, но неизвестно, влияет ли это
на показатели общей выживаемости.
В данную работу были объединены
данные из 4 рандомизированных
исследований 3 фазы: EORTC 40983,
FFCD-ACHBTH-AURC 9002, ENG,
UMIN C000000013. Оказалось, что
проведение адьювантной или периоперационной терапии приводит к
однозначному увеличению ВБП и
тренду к увеличению общей выживаемости.
При подгрупповом анализе оказалось, что применение химиотерапии увеличивало показатели общей
выживаемости у пациентов с синхронным поражением печени, левосторонней локализацией опухоли,
отсутствием ранее проводимого
лечения. Очень интересным оказалась и то, насколько в абсолютных
цифрах химиотерапия улучшила
показатели общей выживаемости.
При проведении адьювантной химиотерапии отмечено увеличение
общей выживаемости на 6% – с 52%
до 58%, при проведении периоперационной на 5% – c 50% до 55%.
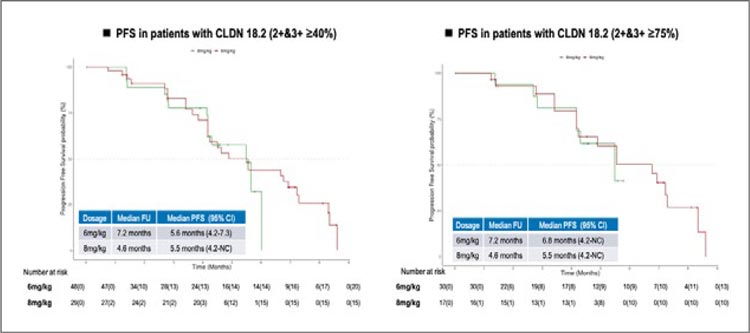
2. Подгрупповой анализ эффективности терапии [177Lu] LuDOTA-TATE у пациентов с нейроэндокринными опухолями
поджелудочной железы или тонкого кишечника в зависимости от
их степени дифференцировки и
расположения.
Ранее результаты исследования
NETTER-2 продемонстрировали
увеличение частоты объективных ответов и увеличение ВБП
при применении терапии [177Lu]
Lu-DOTA-TATE по сравнению
с высокодозным октреотидом у
пациентов нейроэндокринными
опухолями G2-G3 поджелудочной железы и тонкого кишечника.
Оставался вопрос – какие подгруппы наиболее выигрывают от такой
терапии, а у каких пациентов значимого преимущества от такой терапии нет. Чтобы ответить на этот
вопрос был проведен подгрупповой анализ в зависимости от степени дифференцировки (G2/G3) и
расположения опухоли (поджелудочная железа/тонкий кишечник).
Оказалось, что польза была получена абсолютно во всех подгруппах
(табл. 1).
Таблица 1.
Подгрупповой анализ в исследовании NETTER-2
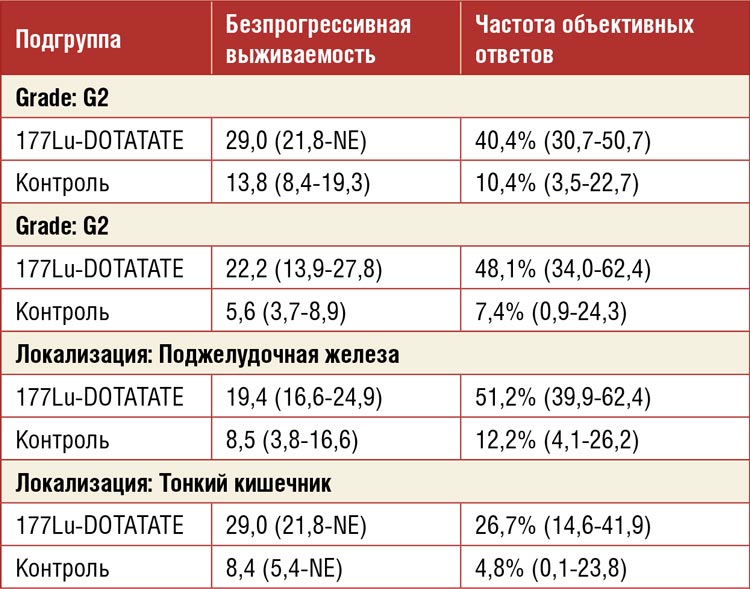
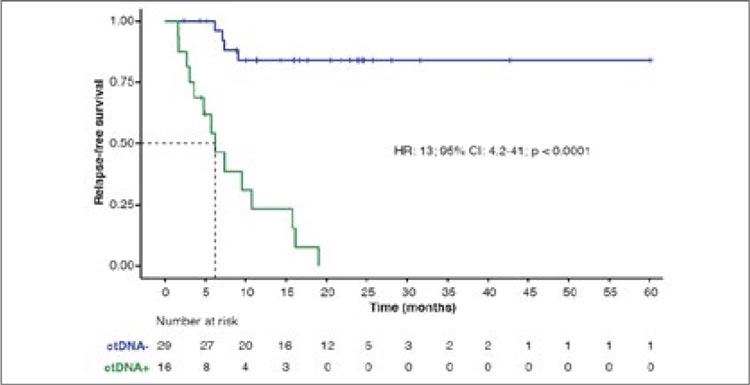
3. Предложены правки в систему стадирования колоректального рака на основании наличия циркулирующих опухолевых ДНК (ctDNA) после хирургического лечения (MRD-статус).
Исследователи оценили ctDNA
4291 пациента из исследований GALAXY, BESPOKE CRC,
а также из программы MDACC
INTERCEPT с помощью PCR-NGS
теста Signatera и сопоставили с
показателями 2-летней ВБП. Оказалось, что положительный MRD
статус, то есть выявление циркулирующих опухолевых ДНК после
операции значимо предсказывает
прогноз пациентов и позволяет
лучше их распределить в группы
риска. Большинство пациентов с
положительным MRD статусом
спрогрессировали в ближайшие
два года вне зависимости от стадии
заболевания. (табл. 2).
Таблица 2.
Показатели ВБП за 2 года в зависимости от MRD статуса
Автор: Хачатурян Элина Артуровна,
врач онколог дневного стационара
противоопухолевой и лекарственной терапии,
Онкологический центр им. С.С. Юдина ДЗМ, Москва
В Мюнхене подошел к концу конгресс ESMO по опухолям желудочно-кишечного тракта, и несмотря на то, что значимую роль в программе занимает колоректальный рак, удалось обсудить некоторые интересные вопросы в опухолях гепатобилиарной зоны и поджелудочной железы.
1. Таргетная терапия рака билиарного тракта
Несмотря на то, что сочетание
химиоиммунотерапии (TOPAZ,
KEYNOTE 966) позволило значимо увеличить общую выживаемость у пациентов с метастатическим раком билиарного тракта,
вопрос о 2 линии терапии остается открытым.
В качестве таргетной терапии 2
линии на конгрессе ESMO обсуждались FGFR2 ингибиторы.
При непрямом сравнении представленных данных, учитывая
агрессивный биологический тип
опухолей данной локализации,
FGFR2 ингибиторы являются оптимальной 2 линией терапии. Интересно, можем ли мы попытаться
экстраполировать данные результаты на «отечественный» FGFR2
ингибитор алофаниб?
2. цДНК как предиктор раннего
рецидива гепатоцеллюлярного
рака после радикального лечения
Ретроспективно были оценены 672
образца плазмы у 120 пациентов
с радикально пролеченным ГЦР.
Среди 64 пациентов, перенесших
трансплантацию печени и последующий мониторинг рецидива,
все 36 пациентов с тестированием, доступным в окне минимальной остаточной болезни (MRD) до
12 недель после операции, были
отрицательными по цДНК, а 35
оставались отрицательными при
медианном наблюдении 21,2 месяца. Из 61 пациента с визуализацией, доступной в течение 6 месяцев
после теста цДНК, наблюдалась
99,5% специфичность на уровне
образца. Среди 47 пациентов, перенесших гепатэктомию и последующий мониторинг рецидива,
цДНК была обнаружена у 7 из 31
пациента (22,5%) в окне MRD; у 4
наблюдался клинический рецидив, а у 3 было короткое наблюдение. У 42 пациентов, у которых
визуализация была доступна в
течение 6 месяцев после тестирования, положительный результат
ctDNA был прогностическим для
рецидива, с отношением рисков
для безрецидивной выживаемости 12 (p<0,0001). цДНК также
показала пользу в мониторинге
ответа на лечение у пациентов с
известным рецидивом.
3. Периоперационная химиотерапия рака билиарного тракта
Таблица 1.
Основные исследования по FGFR2
ингибиторам и их результаты
Рисунок 1.
График Каплана Майера для безрецидивной
выживаемости в когорте гемигепатэктомии
В сеттинге неоадъювантной химиотерапии обсуждалось исследование II фазы NEO-GAP: комбинация гемцитабина, цисплатина и
nab-паклитаксела при внутрипеченочной холангиокарциноме высокого риска.
22 пациента из 30 включенных в
исследование завершили 4 курса
химиотерапии и хирургический
этап терапии. Бессобытийная выживаемость составила 7,1 мес. ОВ
на этапе наблюдения 24 мес. еще не
достигнута. В качестве адъювантной терапии капецитабин остается на лидирующих позициях
согласно исследованиям BILCAP
и STAMP, однако было анонсировано ARTEMIDE-BILIARY 01: адъювантная химиоиммунотерапия
гемцитабин+ цисплатин+ рилвеголстомиг.
4. Ленватиниб в сравнении с
сорафенибом в первой линии у
пациентов с ГЦР после трансплантации печени
В Канаде проведено одноцентровое исследование, включившее
754 пациента, перенесших трансплантацию печени, у 120 развился
рецидив ГЦР. Из них 42 получили
сорафениб, 14 – ленватиниб.
Медиана общей выживаемости
после рецидива практически в 2
раза была выше в группе ленватиниба – 30,7 мес. в сравнении с
18,1 мес. (p 0,006), что доказывает эффективность ленватиниба в
качестве первой линии терапии у
пациентов после ОТП, учитывая
абсолютное противопоказание к
иммунотерапии.
5. OPTIMZE-1: анти-CD40
(митазалимаб) в комбинации
с mFOLFIRINOX (mFFX) у пациентов в первой линии метастатического рака поджелудочной
железы
Пациенты получали митазалимаб
в первый день перед началом 2-недельного режима дозирования,
начиная с mFFX на 8-й день и митазалимаба на 10-й день. На этапе
1b в качестве рекомендуемой дозы
для фазы 2 определялась 900 мкг/
кг митазалимаба. Первичной конечной точкой фазы 2 была общая
частота ответа (ЧОО). Вторичные
конечные точки включали безопасность, продолжительность
ответа, ВБП и ОВ.
Рисунок 2.
ОВ в группах ленватиниба и сорафениба
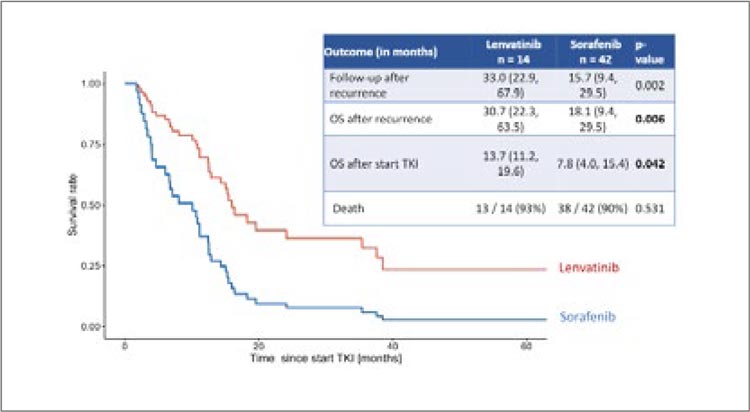
Впечатляет медиана продолжительности ответа – 12,5 мес. Медиана ВБП – 7,7 мес., медиана ОВ
– 14,3 мес. Профиль токсичности
также был значимо ниже, чем в
предыдущих попытках внедрить
моноклональные антитела в терапию рака поджелудочной железы,
только четыре (5,7%) пациента
прекратили терапию из-за нежелательных явлений. Ждем третью
фазу.
НОВОСТИ ESMO GI 2024 / НОВОСТИ ESMO GI 2024: КОЛОРЕКТАЛЬНЫЙ РАК
Автор: Гречухина Катерина Сергеевна
Заведующая химиотерапевтическим отделением
ГБУЗ «Московский клинический научный центр им. А.С. Логинова»,
кандидат медицинских наук, Москва
Казалось бы, только недавно отгремел ASCO 2024, как мы снова
можем узнать что-то свежее, новое и интересное.
Напомним, что на ASCO 2024
были представлены данные исследования TRANSMET, которое
оценивало роль трансплантации
печени у пациентов с колоректальным раком. На ESMO GI
были представлены обновленные
данные [1].
В анализе ITT (94 пациента)
5-летняя общая выживаемость
составила 57% в группе «химиотерапия + трансплантация»
против 13% в группе только химиотерапии (HR 0,37; 95% CI 0,21-
0,65; p=0,0003), а в анализе «per
protocol» эти показатели составили 73% и 9% соответственно (HR
0,16; 95% CI 0,07-0,33; p<0,0001)
(рис.1).
Рисунок 1.
Показатели общей выживаемости в обновленном
анализе исследования TRANSMET [1]
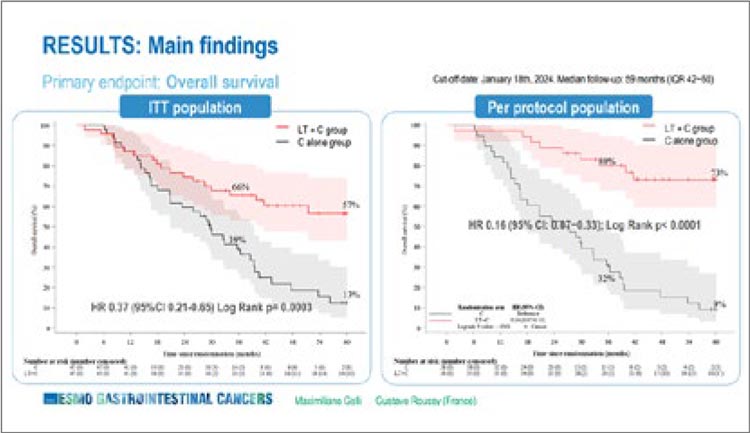
Медиана выживаемости без прогрессирования составила 17,4
мес. в группе с трансплантацией печени и 6,4 мес. с только химиотерапией (HR 0,34; 95% CI
0,20-0,58; p<0,0001). У двадцати
восьми (74%) пациентов, которым провели и химиотерапию,
и трансплантацию, произошло
прогрессирование заболевания,
из них 13 было проведено хирургическое или локорегионарное лечение. В общей сложности у 15
пациентов в группе трансплантации не наблюдалось признаков
заболевания.
Таким образом, трансплантация
позволяет добиться значимо более длительной медианы общей
выживаемости, несмотря на то
что у 74% пациентов наступил
рецидив заболевания. Это подчеркивает то, что печень является наиболее важным локусом
метастазирования и ее поражение – важный неблагоприятный прогностический фактор,
а потому радикальное удаление метастазов в печени может
обеспечить колоссальное преимущество пациентам. Данные
TRANSMET, несомненно, изменят наш взгляд на лечение определенной подгруппы пациентов
с нерезектабельными метастазами в печени. Однако стоит понимать, что это была довольно
узкая группа пациентов, которая
должна отвечать строгим критериям отбора, включая отсутствие
внепеченочного поражения. Кроме того, необходимо создание
экспертных групп или центров
компетенций, необходимых для
адекватного отбора пациентов, а
также обеспечение доступа к центрам, специализирующимся на
трансплантации печени. Также
стоит отметить, что метод трансплантации обладает существенным ограничением: донорских
органов может не хватить, стоит определить приоритетность
трансплантации печени у пациентов с другими заболеваниями
или, например, гепатоцеллюлярным раком.
Следом обсуждался довольно
большой блок исследований, посвященных роли иммунотерапии
при колоректальном раке.
Были доложены результаты крайне любопытного исследования
POCHI, посвященного исследованию эффективности комбинации пембролизумаба и бевацизумаба с химиотерапией CAPOX в первой линии терапии pMMR/
MSS распространенного колоректального рака (мКРР) с высоким уровнем лимфоцитов, инфильтрирующих опухоль (TILs)
[2]. Применение иммунотерапии
крайне ограничено (точнее, не демонстрировало эффективность)
у пациентов без «мишеней», т.е.
pMMR/MSS, однако было показано, что высокий уровень TILs является позитивным предиктором
ответа на ингибиторы контрольных точек иммунитета. С учетом
того, что приблизительно у 15%
пациентов наблюдаются высокие
показатели TILs, авторы исследования смоделировали именно
такой дизайн.
POCHI – однорукавное открытое
исследование, в которое включались пациенты с pMMR/MSS метастатическим колоректальным
раком, которые ранее не получали системной терапии по поводу
своего заболевания. Среди критериев включения также было
необходимо наличие «чистых»
краев резекции после хирургического лечения первичной опухоли, если оно проводилось. Также
было необходимо наличие высокого уровня TILs, т.е. не менее
одного «положительного» балла.
В исследование не включали пациентов с dMMR/MSI статусом,
а также пациентов, которым
требовалась антибиотикотерапия по любым причинам. Всего
было включено 28 пациентов,
получивших уже указанную терапию. Средний возраст пациентов составил 66 лет, при этом 61%
были мужчинами. Большинство
пациентов (86%) были в удовлетворительном соматическом статусе (ECOG 0), а 14% – ECOG 1.
«Правосторонняя» локализация
первичной опухоли была у 43%
пациентов, «левосторонняя» – у
46%, а рак прямой кишки диагностирован у 11% пациентов; 65%
включенных пациентов имели
мутацию в генах KRAS. У практически половины (46%) пациентов
были выявлено метастатическое
поражение печени (что само по
себе является неблагоприятным
предиктором ответа на иммунотерапию).
Первичный анализ проводился при медиане наблюдения в 19
месяцев. Одногодичная выживаемость без прогрессирования в
группе пациентов, получавших
комбинированное лечение (n=28),
составила 68%, а двухлетняя общая выживаемость – 67% (рис.2).
В группе комбинированного лечения в 21% случаев наблюдался
полный ответ, частичный ответ
– у 54%, тогда как стабилизации
достигли 21% пациентов (таким
образом, частота контроля над
заболеванием составила 96%).
Медиана продолжительности
ответа достигла 10 месяцев, при
этом на момент среза данных 46%
пациентов все еще находились в
процессе терапии (рис.3).
Рисунок 2.
Выживаемость без прогрессирования и общая
выживаемость в исследовании POCHI [2]
Рисунок 3.
Объективный ответ и продолжительность ответа
в исследовании POCHI [2]
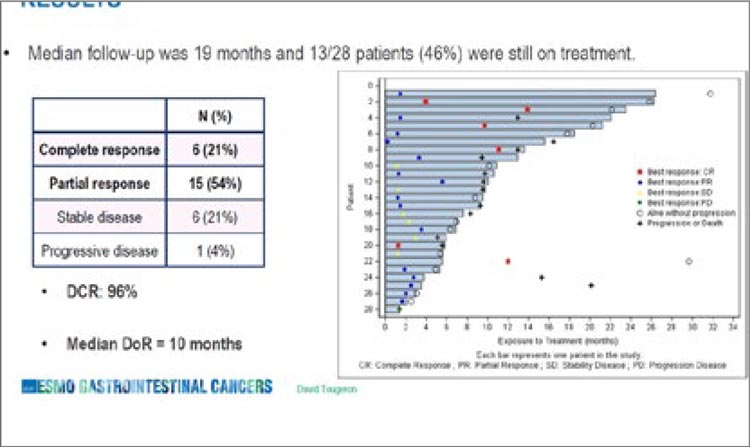
Таким образом, исследование
POCHI продемонстрировало эффективность иммунотерапии в
комбинации с бевацизумабом и
CAPOX у пациентов, которые ранее не имели шанса на иммунотерапию. Набор пациентов все еще
продолжается, поэтому будем
ждать обновленных результатов.
Тем не менее, данные уже оптимистичные.
Наконец, были обсуждены обновленные результаты маленького исследования NEST-1, в
котором изучалась роль неоадъювантной терапии резектабельного колоректального рака
комбинацией ботенсилимаба
(анти-CTLA-4) и балстилимаба
(анти-PD-1) [3]. Ранее на ASCO GI
уже были доложены оптимистичные результаты, которые продемонстрировали высокую частоту
патоморфологического ответа у
MSS пациентов (до 67%) и у 100%
пациентов с MSI-H.
Весь протокол NEST состоит из
двух частей в зависимости от режима введения. В NEST-1 однократно вводили 75 мг ботенсилимаба и далее дважды вводили
каждые 2 недели по 240 мг балстилимаба; в NEST-2 после однократного введения 75 мг ботенсилимаба лечение продолжали до
четырех введений балстилимаба.
В течение 1-6 недель проводили
хирургическое лечение.
Всего было включено 25 пациентов. Средний возраст пациентов
составил 67 лет (размах 23-79) в
обеих группах. В исследовании
NEST-1 70% пациентов были
женщинами, медиана времени от
начала терапии до операции составила 29,5 дня (размах 21-38).
Важно отметить, что 70% получили адъювантную химиотерапию.
В NEST-2 40% пациентов были
женщинами, медиана времени до
операции составила 57 дней (размах 45-81). У 20 пациентов выявлена MSS опухоль, а у 3 пациентов – MSI-H. Из 23 пациентов у 20
было проведено хирургическое
лечение на момент анализа.
В NEST-1 в подгруппе MSS частота патоморфологического ответа
с регрессией опухоли не менее
50% составила 63%, при этом у
одного пациента был отмечен
полный патоморфоз. При MSI оба
пациента достигли морфологической регрессии не менее 50%, при
этом у одного пациента был полный ответ (pCR), как отмечено на
рисунке 4.
Рисунок 4.
Частота патоморфологического ответа в
исследованиях NEST-1 и NEST-2 [3]
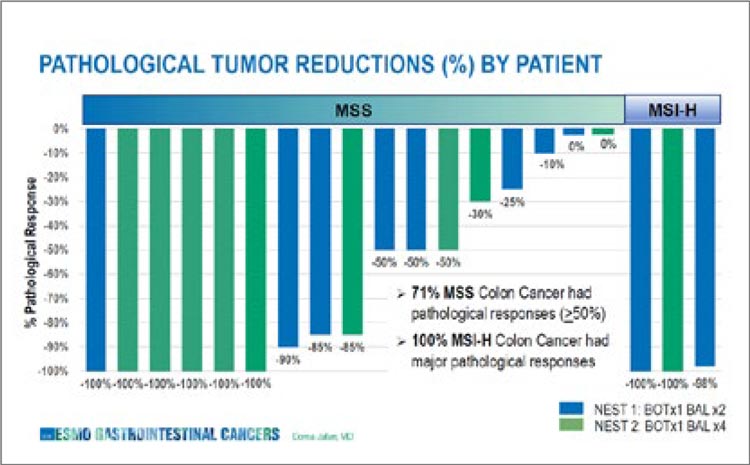
Из 9 пациентов с MSS-опухолью в
NEST-2 частота частичного рентгенологического ответа составила 78% (n=7/9), а частота полного
патоморфологического ответа 56% (n=5/9). У 1 пациента с MSI-H
в этой когорте наблюдался полный патологический ответ.
Профиль безопасности был довольно ожидаем для иммунотерапии, однако у двух пациентов
развился иммуноопосредованный колит G3, потребовавший
назначения глюкокортикостероидов и инфликсимаба.
Таким образом, NEST продолжает линейку исследований, посвященных роли иммунотерапии в неоадъювантных режимах
лечения колоректального рака
(рис.5). То ли еще будет…
Рисунок 5.
Роль иммунотерапии в неоадъювантном режиме
при лечении колоректального рака
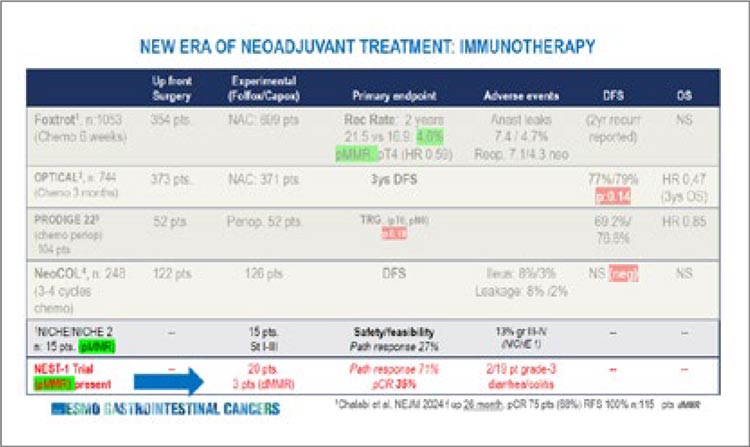
Нельзя не упомянуть постерный
доклад группы отечественных
ученых-клиницистов [4]. Были
представлены данные по эффективности пролголимаба в качестве неоадъювантной терапии
при MSI резектабельном раке
толстой кишки (II-III стадии).
Всего были включены 30 пациентов, пока при первичном анализе
(медиана наблюдения 15 месяцев)
проанализировали результаты
лечения 15 из них. На момент
первичного анализа большая
часть пациентов все еще получает терапию с эффектом (n=11).
Среди прооперированных пациентов (n=9) частота полного
патоморфологического ответа
составила 78%, что абсолютно сопоставимо с результатами других
иммунопрепаратов (например,
пембролизумаба или комбинации ипи/ниво). Частота патоморфоза TRG 2 – 22%. Суммарный
клинический и патоморфологический полный ответ отмечен у
56% (n=9) пациентов. Прогрессирования на фоне терапии отмечено не было.
Частота нежелательных явлений
G3-4, связанных с лечением, составила 3,8%: у одного пациента
был отмечен иммуноопосредованный гепатит G4. У 15,4% пациентов отмечены иммуноопосредованный тиреоидит и диарея.
Еще одно исследование ECOGACRIN EA2201 было посвящено
изучению роли предоперационной комбинированной иммунотерапии Ипи-Ниво в сочетании с лучевой терапией при
местнораспространенном MSI/dMMR раке прямой кишки [5].
Клюевыми критериями включения были подтвержденная аденокарцинома, T3/4Nx или cTxN+,
локализованная в пределах 15 см
от анального отверстия, а также
статус MSI-H/dMMR.
В это исследование были включены 14 пациентов. На первом этапе
дважды вводили ипилимумаб в
дозе 1 мг/кг и ниволумаб (480 мг)
каждые 2 недели, далее проводили короткий курс лучевой терапии (РОД 5 Гр, 5 фракций), далее
повторно проводили 2 курса иммунотерапии в прежнем режиме
с последующей оценкой эффекта
и хирургическим лечением.
Средний возраст пациентов составил 48,5 лет. Первичная опухоль стадировалась как T2 у
14,3% пациентов, T3 – у 57,1%, а
T4 – у 28,6%. N1 статус отмечался
у половины пациентов, тогда как
N2 – у 35,7%. У 14,3% пациентов
состояние лимфатических узлов
не могло быть достоверно оценено. Следует отметить, что 50%
пациентов были MSI-H, а 92,9% –
dMMR.
Частота частичного полного патоморфологического плюс клинического ответа составила 57,1% (95% CI 31,2-83,1%) (рис.6); 11 пациентов не завершили лечение, предусмотренное протоколом, по причине отказа от операции, отзыва согласия на включение в исследование и развития нежелательных явлений.
Рисунок 6.
Эффективность проводимой терапии в
исследовании ECOG-ACRIN EA2201 [5]
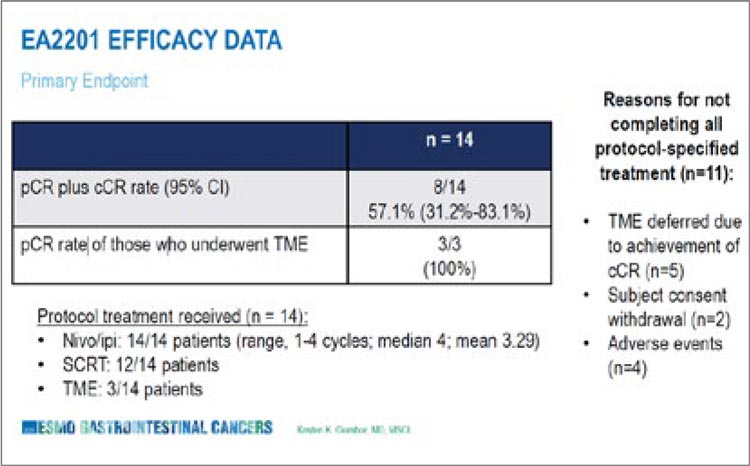
Нежелательные явления, связанные с лечением (TRAEs), любой степени наблюдались у 100% пациентов. При этом TRAEs G3-4 наблюдались у 35,7% пациентов. Наиболее распространенными TRAEs G1-2 были астения, диарея, гипотиреоз, анемия, тошнота/рвота, повышенные уровни АЛТ или АСТ, зуд и макуло-папулезная сыпь. TRAEs G3 степени включали гипокалиемию, боль в животе, ацидоз, кишечную непроходимость повышение уровня АЛТ/АСТ, утомляемость и лимфопению.
Учитывая, что добавление лучевой терапии к иммунотерапии не привело к увеличению частоты полного ответа, авторы пришли к выводу, что 2 введения терапии недостаточно, в связи с чем дизайн EA2201 претерпевает изменения и теперь все включенные пациенты будут получать все 4 курса иммунотерапии до проведения лучевой терапии (рис.7).
Рисунок 7.
. Обновленный дизайн исследования ECOG-ACRIN
EA2201 [5]
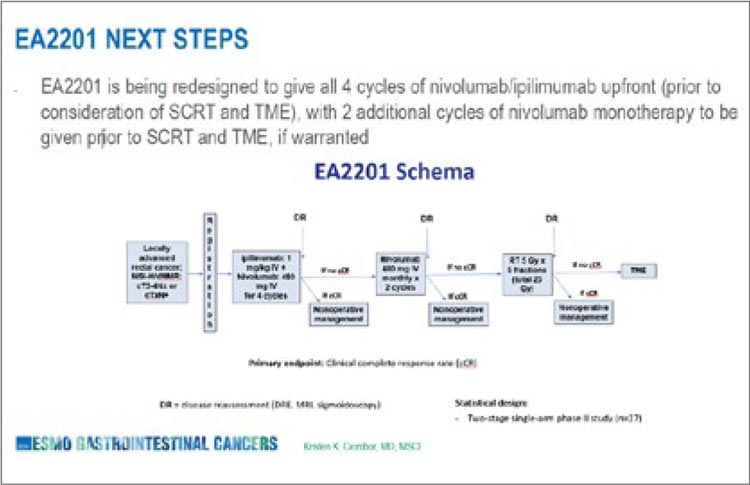
Наконец, еще одно исследование с весьма любопытным дизайном – REGINA, которое оценивало роль комбинации регорафениба, ниволумаба и короткого курса лучевой терапии у пациентов с II-III стадией рака прямой кишки [6]. В целом концепция комбинации иммунотерапии и антиангиогенных препаратов уже не нова (мы это видели и в «квадриплете» при немелкоклеточном раке легкого и в даже ранее продемонстрированном исследовании POCHI), поэтому биологическое обоснование понятно.
В это однорукавное исследование были включены 36 пациентов с подтвержденной аденокарциномой прямой кишки и cT3/T4a и любым N статусом либо cT1-2 и N+. Дистальная граница опухоли не должна вовлекать брюшину и располагаться не более чем на 15 см дальше от анального сфинктера. Статус микросателлитной нестабильности не имел значения: включались как pMMR/MSS пациенты, так и dMMR/MSI-H.
Пациентам проводили забор образцов крови, стула, а также выполняли МРТ в режиме DCE-CWI, после чего проводили индукционную терапию в следующем режиме: 2 введения ниволумаба 240 мг каждые 2 недели плюс регорафениб 80 мг внутрь ежедневно в течение двух недель. После лекарственного этапа проводили короткий курс лучевой терапии, затем переходили к консолидирующему лекарственному этапу: 3 введения ниволумаба на фоне продолжающейся терапии регорафенибом 80 мг в течение 3 недель. В течение 7-8 недель после завершения лучевой терапии пациенты либо оставались под динамическим наблюдением, либо направлялись на хирургическое лечение.
Средний возраст пациентов составил 64,5 года (размах 29-86), 50% были мужчинами. Большинство пациентов имели соматический статус ECOG 0 (89%). У подавляющего большинства пациентов (92%) распространенность первичной опухоли была cT3, а у 72% – cN1-2. У четверти процентов пациентов было подозрение на вовлечение мезоректальной фасции. У чуть менее чем половины пациентов (44%) был по крайней мере 1 признак высокого риска по критериям RAPIDO (T4, N2, LPLN+ и CRM+). У 14% пациентов опухоль имела признаки микросателлитной нестабильности dMMR/MSI-H.
Из всех включенных пациентов 27 перенесли хирургическое лечение, при этом у 8 отмечен полный клинический ответ, в связи с чем предпочли тактику динамического наблюдения. Среди подгруппы MSS/pMMR 24 пациентам было проведено хирургическое лечения и 5 пациентов достигли полного клинического ответа (рис.8).
Рисунок 8.
Эффективность режима в исследовании REGINA [6]
Всего 36 пациентов начали индукционную терапию, при этом полностью ее завершили 83%. Большинство пациентов (97%) завершили короткий курс лучевой терапии; 94% пациентов начали консолидирующую терапию, однако завершили ее только 61%. У 6% пациентов был отложен курс лучевой терапии ввиду токсичности после индукционного режима, а у 14% по той же причине было отложено хирургическое лечение.
У всех пациентов наблюдались нежелательные явления любой степени, все они были связаны с лечением. TRAEs G3 или выше наблюдались у 56% пациентов. Более половины пациентов (53%) испытывали серьезные НЯ, связанные с лечением. Послеоперационные осложнения любой степени наблюдались у 36% пациентов, и у 17% пациентов они были 3 степени или выше. Профиль токсичности подробно отражен на рисунке 9.
Рисунок 9.
Профиль токсичности в исследовании REGINA [6]
Авторы исследования отметили, что в связи с высокой частотой нежелательных явлений будут внесены поправки в протокол и доза регорафениба будет редуцирована до 60 мг.
Ну и, наконец, битва титанов: что лучше в случае предлеченного метастатического колоректального рака? Старт с регорафениба или TAS-102? На ESMO GI представили результаты исследования 2 фазы SOREGATT/ PRODIGE 68, которое попробовало ответить на этот вопрос [7]. Ответим коротко: применение TAS-102 перед регорафенибом приводит к минимальному нумерическому увеличению времени до неудачи лечения (TTF), чем обратная последовательность (рис.10). Однако значимой разницы в общей выживаемости между двумя последовательностями лечения не наблюдалось (рис.11). Стоит отметить, что исследование было досрочно завершено в результате публикации данных исследования SUNLIGHT (напомним, что оно принесло опцию TAS-102 + бевацизумаб). Вот таким выдался ESMO GI для такой локализации, как колоректальный рак. Стали ли эти результаты practice-changing? Вряд ли. Интересны ли они? Еще как! Будем ждать обновленных результатов.
Рисунок 10.
Показатели TTF в зависимости от
последовательности терапии при мКРР:
А) регорафениб → TAS-102; B) TAS-102 → регорафениб [7]
Рисунок 11.
Общая выживаемость пациентов в зависимости от
последовательности терапии при мКРР:
А) регорафениб → TAS-102; B) TAS-102 → регорафениб [7]
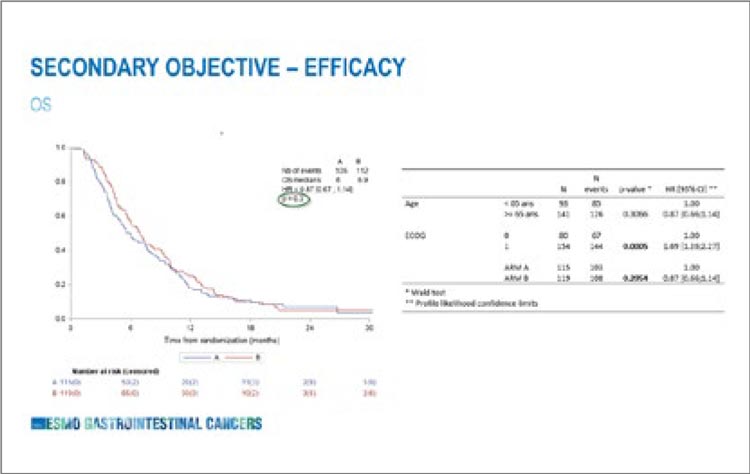
Литература:
- Adam R, Piedvache C, Chiche L, et al. Chemotherapy and liver transplantation versus chemotherapy alone in patients with definitively unresectable colorectal liver metastases: Updated results from the randomized TRANSMET trial. Annals of Oncology. 2024; 35 (suppl_1): S1-S74. 10.1016/annonc/ annonc1477.
- Tougeron D, et al. LBA1 – Pembrolizumab in combination with xelox and bevacizumab in patients with microsatellite stable (pMMR/MSS) metastatic colorectal cancer (mCRC) and a high immune infiltrate: A proof of concept study – Preliminary results of FFCD 1703 POCHI trial. Annals of Oncology. 2024; 35 (suppl_1): S212-S214. 10.1016/annonc/annonc1497.
- Kasi PM, Jafari MD, Yeo H, et al. 8MO – Neoadjuvant botensilimab (BOT) plus balstilimab (BAL) in resectable mismatch repair proficient and deficient colorectal cancer: NEST-1 clinical trial. Annals of Oncology. 2024; 35 (suppl_1): S1-S74. 10.1016/annonc/annonc1477.
- Zagidullina AA, Kuznetsova OA, Tryakin A, et al. 45P – Neoadjuvant immunotherapy with prolgolimab in locally advanced MSI/dMMR colorectal cancer: Safety and efficacy analysis. Annals of Oncology. 2024; 35 (suppl_1): S1-S74. 10.1016/annonc/ annonc1477.
- Ciombor KK, Hong S, Eng C, et al. Neoadjuvant nivolumab plus ipilimumab in microsatellite instability-high (MSI-H)/deficient mismatch repair (dMMR) rectal tumors: ECOG-ACRIN EA2201. Annals of Oncology. 2024; 35 (suppl_1): S106-S118. 10.1016/ annonc/annonc1480.
- Sclafani F. LBA2 – Interim analysis of REGINA, a phase II trial of neoadjuvant regorafenib (Rego), nivolumab (Nivo), and shortcourse radiotherapy (SCRT) in stage II-III rectal cancer (RC). Annals of Oncology. 2024; 35 (suppl_1): S212-S214. 10.1016/annonc/ annonc1497.
- Ducreux MP, Ben Abdelghani M, Tougeron D, et al. 3O – PRODIGE 68 – UCGI 38 – SOREGATT: A randomized phase II study comparing the sequences of regorafenib (reg) and trifluridine/tipiracil (t/t) after failure of standard therapies in patients (pts) with metastatic colorectal cancer (mCRC). Annals of Oncology. 2024; 35 (suppl_1): S1-S74. 10.1016/ annonc/annonc1477.
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / ИССЛЕДОВАНИЕ 2 ФАЗЫ NEOTRIO (NCT02858921)
Автор: Фатеева Анастасия Валерьевна,
ГБУЗ «ПРиморский краевой онкологический диспансер»,
Владивосток
Попытки найти наилучший вариант
неоадъювантной терапии для пациентов с III стадией меланомы кожи
все еще продолжаются. Существующий стандарт неоадъювантной терапии (исследование SWOG S1801),
включающий 3 введения пембролизумаба 200 мг для пациентов с III
стадией меланомы кожи, независимо
от мутационного статуса, продемонстрировал высокую частоту 2-летней
ВБР 72% по сравнению с только адъювантной терапией 49%.
В исследовании NeoTrio 2 фазы проведена попытка оценить эффективность комбинации пембролизумаба
с дабрафенибом и траметинибом у
пациентов с BRAF мутацией. Согласно выдвинутой гипотезе, предполагалось, что ответ на неоадъювантное
лечение анти-PD-1 улучшится за счет
короткого курса индукционной терапии BRAF и MEK ингибиторами.
В дизайне исследования 60 пациентов с IIIB-D стадией BRAF mut+ меланомы кожи были рандомизированы
на 3 равные группы:
- группа монотерапии: пембролизумаб 200 мг в 1 и 22 дни;
- группа последовательной терапии: дабрафениб 150 мг перорально 2 раза в день и траметиниб 2 мг перорально 1 раз в день в течение 7 дней, затем пембролизумаб 200 мг внутривенно в 8 и 22 дни;
- группа параллельной терапии: дабрафениб 150 мг перорально 2 раза в день и траметиниб в дозе 2 мг перорально 1 раз в день течение 6 недель + пембролизумаб 200 мг 1 и 22 дни.
После 6 недель терапии всем пациентам была проведена лимфодиссекция
с последующей адъювантной терапией пембролизумабом в количестве 16
курсов. Пациенты, у которых не был
получен патологический ответ, получали в качестве адъюванта комбинацию дабрафениба и траметиниба.
Первичная конечная точка – частота
патоморфологического ответа ≥5%.
Вторичные: ВБР, ОВ, частота рентгенологического ответа.
Рисунок.
Общая выживаемость в группах по данным
исследования NeoTrio
Результаты:
- частота PR 55% (11/20; 95% ДИ 36-83) в группе пембролизумаба в монорежиме, 50% (10/20; 95% ДИ 27-73) в группе последовательной терапии и 80% (16/20; 95% ДИ 60- 97) в параллельной группе;
- частота полных патоморфологических ответов составила 30% (6/20), 15% (3/20) и 50% (10/20) соответственно;
- наилучшие результаты были получены в группе параллельной терапии при рентгенологическом контроле и оценке метаболической активности по ПЭТ-КТ; • ВБР через 12 и 24 мес. составили 80% и 60% в группе моно пембролизумаба, 80% и 80% при последовательном лечении и 80% и 71% в группе параллельной терапии;
- ОВ через 12 и 24 мес. составили 95% и 76%, 95% и 89%, 95% и 95% соответственно.
Однако, несмотря на более высокие результаты pCR, ВБР и ОВ в группе параллельной терапии, к сожалению, частота НЯ 3-4 степени (55%), а также частота отмены терапии (40%) в связи с НЯ в этой группе были сами высокими. На сегодняшний день еще рано говорить о целесообразности применения данного похода ввиду отсутствия долгосрочных результатов наблюдения, хоть и полученные первичные данные выглядят очень привлекательно. Кроме
того, исследователи сами признаются, что не рекомендовали бы
подход тройной комбинации, как
минимум, из-за высокого профиля токсичности.
Источник:
Long GV, Carlino MS,
Au-Yeung G, Spillane AJ, Shannon
KF, Gyorki DE, Hsiao E, Kapoor
R, Thompson JR, Batula I, Howle
J, Ch'ng S, Gonzalez M, Saw RPM,
Pennington TE, Lo SN, Scolyer
RA, Menzies AM. Neoadjuvant
pembrolizumab, dabrafenib and
trametinib in BRAFV600-mutant
resectable melanoma: the randomized
phase 2 NeoTrio trial. Nat Med. 2024
Jun 21. doi: 10.1038/s41591-024-
03077-5. Epub ahead of print. PMID:
38907159.
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / ИССЛЕДОВАНИЕ UNION: НЕОАДЪЮВАНТНЫЙ КОРОТКИЙ КУРС ЛТ С ПОСЛЕДУЮЩЕЙ ХИМИОИММУНОТЕРАПИЕЙ УВЕЛИЧИВАЕТ ЧАСТОТУ PCR ПРИ МЕСТНОРАСПРОСТРАНЕННОМ РАКЕ ПРЯМОЙ КИШКИ
Первые результаты многоцентрового РКИ III фазы UNION, опубликованные в журнале Annals of
Oncology, демонстрируют значимое
преимущество неоадъювантного
короткого курса ЛТ (SCRT) с последующей химиотерапией CAPOX
и новым анти-PD-1 ингибитором
камрелизумабом по сравнению с
длительным курсом ХЛТ и последующей химиотерапией CAPOX.
В исследование были включены пациенты с местнораспространенной
аденокарциномой прямой кишки
T3-4/N+, с хорошим соматическим
статусом ECOG 0-1 (n=231), рандомизированные 1:1 в 2 группы.
Пациенты экспериментальной группы (CAM+CAPOX) получала неоадъювантную SCRT (25 Гр за 5 дней)
с последующим введением камрелизумаба (200 мг/м2 в/в капельно в
1-й день; каждые 3 недели в течение
2 циклов) в сочетании с CAPOX (оксалиплатин 130 мг/м2 в/в в течение
2 часов в 1-й день, капецитабин 1000
мг/м2 внутрь 2 раза в день с 1 по 14
день, каждые 3 недели в течение 2
циклов).
В группе контроля (CAPOX) пациенты получали неоадъювантную
LCRT (50,4 Гр в течение 28 дней с
одновременным приемом капецитабина 825 мг/м2 2 раза в день), за
которым через 2 недели следовал
CAPOX, 2 цикла.
Оперативное лечение проводилось в обеих группах в течении 10 недель после завершения ЛТ.
Адъювантная терапия: в группе CAM + CAPOX – камрелизумаб в сочетании с CAPOX в течение 6 циклов с последующим приемом только камрелизумаба (до 17 доз в течение всего исследования); в группе CAPOX получали CAPOX, 6 циклов. Первичная конечная точка – частота pCR (ypT0N0), вторичные конечные точки – 3-летняя безрецидивная выживаемость, ОВ, частота R0 резекций, хирургическая безопасность, частота тяжелых и серьезных НЯ.
Результаты:
- частота pCR (ypT0N0) выше в группе CAM + CAPOX, чем в группе CAPOX (39,8% [95% ДИ 30,7-49,5] против 15,3% [95% ДИ 9,3-23,0]; разница 24,6%, р<0,001);
- средние показатели регрессии опухоли – 98,0% в группе CAM + CAPOX и 85,0% в группе CAPOX;
- частота полного ответа (pCR + cCR): 41,6% (47/113) в группе CAM + CAPOX и 18,6% (22/118) в группе CAPOX;
- частота R0 резекций составила 96,2% (100/104) для CAM + CAPOX и 97,0% (96/99) для CAPOX;
- частота сохранения анального отверстия составила 94,2% (98/104) и 89,9% (89/99);
- частота НЯ была выше в группе CAM + CAPOX: 85,8% и у 78,9% пациентов в группе CAPOX; серьезные НЯ – 7,1% против 4,4% соответственно;
- частота хирургических осложнений в обеих группах была одинаковой, но серьезных – на 2% выше в группе CAM + CAPOX.
Исследование UNION достигло своей первичной точки и демонстрирует, наверное, пока один из лучших
показателей pCR – 39,8%, по сравнению с другими исследованиями
(RAPIDO – 28%, STELLAR – 16,6%,
AVERECTAL – 37,5%). Результаты,
конечно, многообещающие, дождемся последующих долгосрочных
наблюдений.
Источник:
Lin ZY, et al. Neoadjuvant
short-course radiotherapy followed by
camrelizumab and chemotherapy in
locally advanced rectal cancer (UNION):
early outcomes of a multicenter
randomized phase III trial. Open Access.
Published: July 2, 2024. https://doi.
org/10.1016/j.annonc.2024.06.015.
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / ИССЛЕДОВАНИЕ ATEMPT: ДАННЫЕ 5-ЛЕТНЕГО НАБЛЮДЕНИЯ
Можно ли улучшить долгосрочные
результаты адъювантного лечения
пациенток с I стадией HER2+ рака
молочной железы и при этом не ухудшить качество жизни? Вопрос оптимизации адъювантной терапии остается областью активного интереса.
Текущий стандарт лечения TH (паклитаксел + трастузумаб), продемонстрировал свою эффективность в исследовании APT, в котором 3-летняя
безинвазивная выживаемость (IDFs)
составила 98,7%, 7-летняя IDFs – 93%
и 7-летний интервал без рецидивов
(RFI) – 97,5%. На основании этих результатов экспертная группа СанктГаллена рекомендовала TH при
HER2+ РМЖ с опухолями размером
от 0,5 до 2 см и N0.
Недавно представленные результаты
многоцентрового рандомизированного исследования II фазы ATEMPT
продемонстрировали улучшение
3-летней iDFS – 97,8% (95% 96,3-99,3)
при применении в адъювантном режиме T-DM1 в течении 12 месяцев по
сравнению с 3-летней IDFs в группе
TH – 93,4% (95% ДИ 88,7-98,2). При
этом статистически значимых различий в клинически выраженной токсичности между группами не было.
Но частота отмены терапии в группе
T-DM1 была выше – 18% по сравнению с 6% в группе TH. Частота прекращения T-DM1 была значительно
выше среди женщин старше 50 лет и
составила 4%, 8% и 17%, у пожилых
пациентов на 3, 6 и 9 месяцев соответственно.
Обновленные данные после медианы
наблюдения 5,8 лет показали следующее:
- 5-летняя IDFs для T-DM1 – 97,0% (95% ДИ 95,2-98,7);
- 5-летний RFI – 98,3% (95% ДИ 97,0-99,7);
- 5-летняя ОВ – 97,8% (95% ДИ 96,3-99,3).
Странно, что в данном исследовании
не проводилось прямого сравнения
между группами и конечные точки
оценивались отдельно. При непрямом сравнении результаты для группы TH оказались чуть хуже, кроме
OВ:
- 5-летняя IDFs – 91,1% (95% ДИ 85,7-96,8);
- 5-летний RFI – 93,2% (95% ДИ 88,5-98,2);
- 5-летняя OВ – 97,9%
Интересно также и то, что 5-летняя
iDFS в группе T-DM1 среди пациентов с HER2 3+ и ≤2+ была схожая –
96,9% и 96,7% соответственно.
Когда стало понятно, что в группе
T-DM1 возникло больше эпизодов
отмены терапии из-за токсичности,
логично возник вопрос: а что будет
с этими пациентами в долгосрочной
перспективе при неполном прохождении 12-месячного лечения?
Данные 5-летнего наблюдения показали, что среди пациентов, получавших T-DM1 в течение <6 месяцев,
5-летняя IDFS составила 96,8%, а
5-летний RFI – 100%, тогда как среди
пациентов, получавших его в течение
≥6 месяцев, 5-летняя IDFS составила
97,0%, а 5-летний RFI – 98,1%.
В целом да, T-DM1 эффективен в качестве адъювантной терапии для пациенток с I стадией. Однако какой группе пациенток, или может всем, стоит назначать данный режим, не совсем ясно. Ведь стоимость лечения T-DM1 все-таки на порядок выше классического режима ТН, а различий в 5-летней OВ как бы и нет.
Источник:
Tarantino P, et al. Adjuvant
Trastuzumab Emtansine Versus
Paclitaxel Plus Trastuzumab for Stage
I Human Epidermal Growth Factor
Receptor 2-Positive Breast Cancer: 5-Year
Results and Correlative Analyses From
ATEMPT. Journal of Clinical Oncology.
2024 June 27. https://doi.org/10.1200/
JCO.23.02170.
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / АНТИБИОТИКИ УХУДШАЮТ ПОКАЗАТЕЛИ ВЫЖИВАЕМОСТИ У ПАЦИЕНТОВ С НМРЛ ДО И ВО ВРЕМЯ ХИМИО-ИММУНОТЕРАПИИ
Появляется все больше данных о
том, что прием антибиотиков (АБ)
до начала иммунотерапии (ИТ) нарушает состав кишечной микробиоты и негативно влияет на клинические исходы пациентов с НМРЛ и
другими солидными злокачественными новообразованиями.
Крупнейший на сегодняшний день
мета-анализ, изучающий воздействие антибиотиков до начала ИТ
во всех солидных опухолях у 41 663
пациентов, продемонстрировал, что
антибиотики отрицательно влияют на выживаемость пациентов. В
журнале Nature опубликованы результаты исследования, в котором
оценивается влияние моно- и комбинированной антибиотикотерапии на исходы пациентов с НМРЛ,
получающих химиоиммунотерапию
(ХИТ). В исследование было включено 2028 пациентов.
Рисунок.
Результаты ХИТ НМРЛ в зависимости от применения
антибиотикотерапии
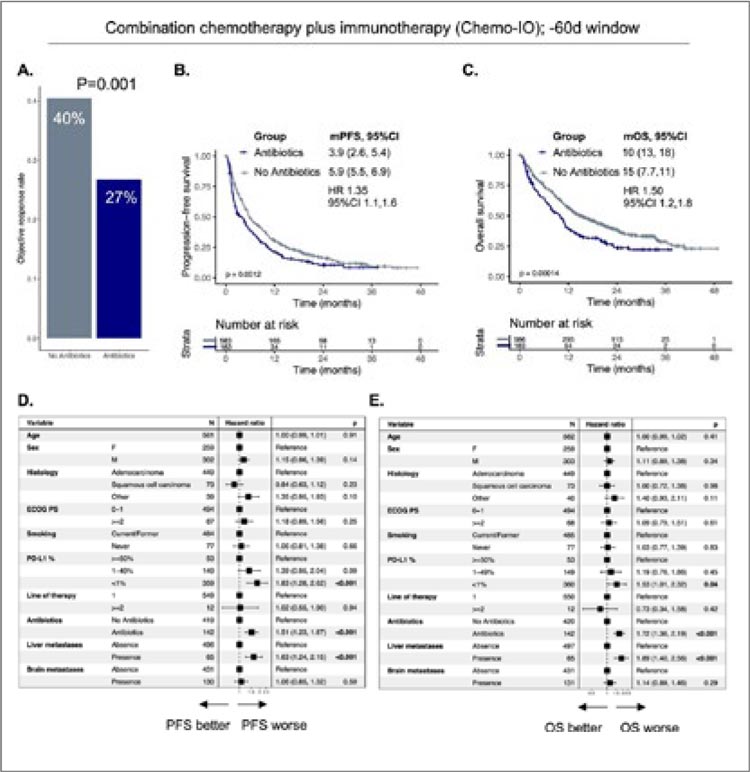
В ходе исследования оценивались
результаты лечения в группах пациентах, получавших АБ до начала
ХИТ (в течение 60 дней) и через 42
дня после ее начала. Наиболее частыми монотерапевтическими антибиотиками были цефалоспорины,
сульфаниламиды и хинолоны, комбинированными - цефалоспорины
+ сульфаниламиды и цефалоспорины + макролиды. Большинство пациентов в группе АБ до ХИТ получали противоопухолевое лечение в
первой лини.
Результаты антибиотикотерапии за
60 дней до начала ХИТ:
- У пациентов в группе АБ частота объективных ответов (ЧОО) ниже - 27% против 40%, p = 0,001;
- Медиана ВБП короче - 3,9 месяца по сравнению с 5,9 месяцами, HR 1,35, 95%1,10,1,60, p = 0,0012;
- Медиана OВ также была короче - 10 месяцев по сравнению с 15 месяцами, HR= 1,50, 95%ДИ 1,20,1,80, p = 0,00014;
- У пациентов, получавших комбинированные схемы приема АБ, была самая короткая ВБП - 1,9 месяца против 5,9 месяцев, HR = 1,87, 95% ДИ 1,38, 2,54, p < 0,001, и OВ - 6,1 месяца против 15 месяцев, HR=2,24, 95%ДИ 1,61, 3,11, p < 0,001;
- По сравнению с группой без применения АБ у пациентов, получавших пероральные АБ, была самая короткая ВБП - 2,8 месяца, HR=1,52, 95%ДИ 1,15,2, p = 0,003, при внутривенном введении АБ медиана ВБП составила 4,2 месяца, HR= 1,27, 95% ДИ 1,02, 1,58, p = 0,032;
- OВ была аналогично ниже как в группе перорального (медиана OВ - 9,9 месяцев, HR=1,58, 95%ДИ 1,16,2,16, p = 0,004), так и внутривенного (медиана OВ - 10,0 месяцев, HR=1,43, 95% ДИ 1,13, 1,82, p = 0,003) приема АБ.
Результаты АБ за 60 дней до и через 42 дня после начала ХИТ:
- Аналогично ЧОО (p < 0,001), ВБП (HR=1,35 95% ДИ 1,15, 1,59) и OВ (HR=1,58 95% ДИ 1,31, 1,90).
При этом в обоих случаях результаты, связанные с АБ, не зависели ни от одного известного прогностического фактора НМРЛ.
Таким обратном, авторы исследования пришли к выводу, что воздействие антибиотиков в течение 60 дней до начала ХИТ и в течение 42 дней после ее начала связано с ухудшением ЧОО, ВБП и OВ. И хотя антибиотики иногда неизбежны, рекомендуют минимизировать продолжительность воздействия и выбирать классы препаратов узкого спектра действия.
Источник:
Elkrief, A., MéndezSalazar, E.O., Maillou, J. et al. Antibiotics
are associated with worse outcomes
in lung cancer patients treated with
chemotherapy and immunotherapy. npj
Precis. Onc. 8, 143 (2024). https://doi.
org/10.1038/s41698-024-00630-w
«А ВОТ БЫЛ У МЕНЯ СЛУЧАЙ…» ИЛИ «ОХОТНИЧЬИ» ЗАПИСКИ ОНКОЛОГОВ / КЛИНИЧЕСКИЙ СЛУЧАЙ ПАЦИЕНТКИ С РЕДКИМ ИММУНООПОСРЕДОВАННЫМ ОСЛОЖНЕНИЕМ
Авторs: Орлова Рашида Вахидовна
Заведующая кафедрой онкологии медицинского института
ФГБОУВО «Санкт-Петербургский государственный университет»,
главный специалист по клинической онкологии СПб
ГБУЗ «Городской клинический онкологический диспансер»,
член правления RUSSCO, доктор медицинских наук, профессор, Санкт-Петербург
Беляк Наталья Петровна
Заведующая отделением противоопухолевой лекарственной терапии (химиотерапевтическое)
№10 СПб ГБУЗ «Городской клинический онкологический диспансер»,
клинический онколог, доцент кафедры онкологии медицинского факультета СПбГУ,
кандидат медицинских наук, Санкт-Петербург
Пудина Анастасия Васильевна
Врач-онколог химиотерапевтического отделения (противоопухолевой лекарственной терапии)
ГБУЗ «Городской клинический онкологический диспансер», Санкт-Петербург
Иткин Илья Михайлович
Заведующий отделением противоопухолевой лекарственной терапии (химиотерапевтическое)
№11 СПб ГБУЗ «Городской клинический онкологический диспансер», клинический онколог,
кандидат медицинских наук, Санкт-Петербург
Ингибиторы контрольных точек
иммунитета (ИКТ) широко используются в современной онкологии и улучшают прогноз рака
легких, злокачественной меланомы и других злокачественных
новообразований. В отличие от
цитотоксической химиотерапии,
такие препараты, как ипилимумаб, ниволумаб, пембролизумаб,
авелумаб и т.д., демонстрируют
противоопухолевый эффект за
счет активации иммунного ответа.
Многими авторами неоднократно
был обозначен спектр наиболее часто встречающихся иммуноопосредованных нежелательных явлений (иоНЯ), среди них подробно
описаны кожная токсичность, гастроинтестинальная токсичность,
иммуноопосредованный гепатит,
тиреоидит и др. Однако в реальной
клинической практике врач может
столкнуться с редкими иоНЯ, например, с иммуноопосредованной
гемолитической анемией (иоГА).
В базе данных ассоциации по
контролю за продуктами и лекарствами (FDA), США, выявлено 68
случаев иммуноопосредованной
гемолитической анемии, при этом
43 из них были связаны с препаратом ниволумаб, 13 – с пембролизумабом, 7 – с ипилимумабом и 5 – с
атезолизумабом. Иммуноопосредованная гемолитическая анемия
(иоГА) чаще встречается при проведении терапии анти-PD-1 или
PD-L1 ингибиторами (0,15-0,25%),
нежели ингибиторами CTLA-4
(0,06%) (рис.1). В большинстве случаев иоГА пациентам проводилась терапия глюкокортикостероидами (ГКС), однако два из них закончились смертельным исходом [1].
Клинический случай
Пациент К., 76 лет, имел первично-множественные метахронные злокачественные опухоли: 1)
Рак антрального отдела желудка
сT4N1M0, MSI-H, PDL CPS= 5%,
HER2-low. Гастроэнтероанастомоз
с межкишечным соустьем по Брауну, декабрь 2023. 1 цикл ИТ пембролизумаб – май 2024; 2) Лимфома (ДВБКЛ + фолликулярная). 6
циклов RCVP + лучевая терапия
2016 г. (ремиссия).
Рисунок 1.
Характеристика пациентов, у которых развилась
аиГА вследствие применения ингибиторов контрольных точек.
Из данных анамнеза известно, что
в декабре 2023 года в связи с жалобами на рвоту «кофейной гущей»
больной был экстренно госпитализирован в стационар скорой
помощи по месту жительства, где при дообследовании по эзофагогастродуоденоскопии было выявлено образование антрального отдела желудка. По данным
компьютерной томографии (КТ)
не было данных за вторичное поражение органов грудной клетки,
брюшной полости и малого таза.
Было выполнено хирургическое
лечение в объёме гастроэнтероанастомоз с межкишечным соустьем по Брауну. Гистологическое
заключение оперативного материала: аденокарцинома желудка высокой степени злокачественности
(high grade) с перстневидноклеточным и муцинозным компонентом. По данным иммуногистологического заключения в опухоли
обнаружены признаки микросателлитной нестабильности (изолированное выпадение белка
PMS2), негативный статус HER-2,
PDL CPS= 5%.
Важно отметить, что больной имел
сопутствующую патологию в виде
ишемической болезни сердца,
смешанной формы бронхиальной
астмы, хронического вирусного
гепатита В и перенес пневмонию,
вызванную новой коронавирусной инфекцией COVID-19 в феврале 2024 года, в связи с чем обратиться за медицинской помощью в
онкодиспансер смог только в марте 2024 года.
По данным контрольных обследований от марта 2024 определялось
циркулярное утолщение стенок
желудка пилорического отдела до
18 мм на протяжении 60 мм. Парагастральный лимфатический
узел увеличен до 11 мм, образования надпочечников (справа 18×11
мм, слева до 22×15 мм, вероятнее
всего, аденомы). Свободной жидкости нет, тяжистое уплотнение
клетчатки в проекции лапаротомного шва (рис.2).
Рисунок 2.
Визуализация циркулярного утолщения стенок желудка.
Решение консилиума: учитывая
выявленные признаки dMMR/MSI
в опухоли, местнораспространенный нерезектабельный характер
заболевания, ECOG-2, рекомендовано проведение лекарственного
лечения анти-PD-1 препаратом
пембролизумаб с оценкой КТ в
динамике для повторного обсуждения целесообразности/возможности хирургического лечения.
В конце марта 2024 года был проведен 1 цикл ИТ пембролизумабом.
При госпитализации для очередного введения иммунотерапии
пациент отметил жалобы на выраженную слабость, отечность голеней и стоп, «желтушность» склер
и кожных покровов, потемнение
мочи, возникшие за 2 дня до поступления.
В клинико-биохимических и иммуногематологических анализах
крови при поступлении обращают
на себя внимание анемия 3 ст. (гемоглобин 60 г/л), ретикулоцитоз,
положительный прямой антиглобулиновый тест (реакция Кумбса),
необходимость переливания крови по индивидуальному подбору,
повышение общего билирубина до
87 ммоль/л за счет непрямой фракции, при этом показатели ферментов печени в пределах референсных значений. В общем анализе
мочи отмечается содержание уробилиногена – 34 мкмоль/л.
По данным УЗИ органов брюшной
полости – гепатоспленомегалия,
печень без специфических изменений. Забрюшинные лимфатические узлы не визуализируются.
Асцита нет.
На момент поступления наиболее
вероятной причиной анемии 3 ст.
являлось кровотечение из опухоли
желудка. По результатам фиброгастродуоденоскопии признаков
состоявшегося/продолжающегося
кровотечения не выявлено.
Учитывая клиническую картину,
данные лабораторных анализов и
инструментальных обследований,
больному было выполнено переливание двух доз эритроцитраной
взвеси, а также проводилась терапия преднизолоном в дозировке 2
мг/кг в течение месяца с постепенным снижением дозы по варианту
медленного снижения дозы на 20%
в неделю согласно рекомендациям
RUSSCO [2].
Важно подчеркнуть, что нарастание
гемоглобина после переливания 2
доз эритроцитарной взвеси увеличило цифры гемоглобина лишь на 10
единиц, тогда как на фоне терапии
глюкокортикостероидами уровень
гемоглобина поднялся на 33 единицы гемоглобина. Также положительная динамика наблюдалась в виде
нормализации показателей общего
билирубина, отсутствия ретикулоцитоза и отсутствия уробилиногена
в моче.
Несмотря на положительную лабораторную картину, у пациента сохранялись жалобы на выраженную слабость. С целью оценки распространенности опухолевого процесса в мае 2024 года было выполнено КТ органов грудной клетки и брюшной полости (рис.3), по данным которой определяется образование желудка, признаки перитонеального канцероматоза, асцит.
Решение онкологического консилиума в мае 2024: учитывая общий соматический статус пациента ECOG 3 б., осложнение лечения после 1 цикла иммунотерапии в виде иммуноопосредованной гемолитической анемии, высокий риск развития осложнений от предлагаемого противоопухолевого лечения, рекомендовано дальнейшее проведение симптоматической поддерживающей терапии в условиях хосписной службы по месту жительства.
Рисунок 3.
Признаки перитонеального канцероматоза, асцит.
К сожалению, на фоне симптоматической терапии в июне 2024 года пациент скончался.
Выводы:
Иммунноопосредованная гемолитическая анемия является редким осложнением, чаще встречающимся на фоне терапии анти-PD-1 или PDL1 ингибиторами.
Учитывая редкую частоту встречаемости подобных иоНЯ, рекомендовано проведение тщательной
оценки клинико-лабораторных показателей, данных инструментальных исследований, клинической
картины больного с целью точной
постановки осложнения на фоне
терапии ингибиторами контрольных точек и своевременного начала
лечения.
Гемолитическая анемия, развившаяся на фоне терапии ингибиторами
контрольных точек, как на примере
клинического случая, так и по данным изученной литературы, в большинстве случаев отвечает на терапию глюкокортикостероидами.
Литература:
- Tanios GE, Doley PB, Munker R. Autoimmune hemolytic anemia associated with the use of immune checkpoint inhibitors for cancer: 68 cases from the Food and Drug Administration database and review. Eur J Haematol. 2019; 102: 157–162.
- Проценко С.А., Баллюзек М.Ф., Васильев Д.А., Жукова Н.В., Новик А.В., Носов Д.А. и соавт. Практические рекомендации по управлению иммуноопосредованными нежелательными явлениями. Практические рекомендации RUSSCO, часть 2. Злокачественные опухоли, 2023 (том 13), №3s2, стр.213–252.