Дорогие коллеги, дорогие друзья!
Июльский выпуск газеты практически полностью посвящен новостям прошедшего в июне очередного конгресса ASCO 2022, часть которых мы начали публиковать еще в июне. Многие результаты будут взяты на вооружение, многие препараты и схемы продолжат изучение своей эффективности в новых проспективных исследованиях – а что-то из актуального ныне уйдет в историю, оставшись навеки на...

Шарль Менье. «Клио, муза истории». Холст, масло, 1800
Кливлендский художественный музей, США
Видишь дом, назови его дом. Видишь дерево, дерево тоже назови, а потом... А потом назови человека прохожим. Мост мостом постарайся назвать. Помни, свет называется светом. ....

ASCО 2022: МЕТАСТАТИЧЕСКИЙ РАК МОЛОЧНОЙ ЖЕЛЕЗЫ
Самым удивительным от прошедшего ASCO для меня лично было отсутствие на сессиях по раку молочной железы (РМЖ) докладов, посвященных химиотерапии и классическим цитостатикам. Это не значит, что химиотерапия ушла из методов лечения этой опухоли. Она осталась в качестве фундамента, на котором строятся дальнейшие стратегии борьбы с этим заболеванием. Использование...

ОБЗОР КЛЮЧЕВЫХ НОВОСТЕЙ ASCO 2022 ПО ЛЕКАРСТВЕННОЙ ТЕРАПИИ РАННЕГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ
В Чикаго с 3 по 7 июня 2022 года в гибридном формате состоялся конгресс Американского общества клинической онкологии (American Society of Clinical Oncology – ASCO). Более 2900 тезисов были отобраны для устного доклада и постерной сессии, а также более 2200 – для публикации онлайн. По теме рака молочной железы было опубликовано около 500 тезисов.
10 Лет Национальной программе Российского онкологического общества клинической онкологии
СОВЕРШЕНСТВОВАНИЕ МОЛЕКУЛЯРНОЙ-ГЕНЕТИЧЕСКОЙ ДИАГНОСТИКИ В РОССИЙСКОЙ ФЕДЕРАЦИИ

НОВОСТИ КОНГРЕССА ASCO 2022. ОПУХОЛИ ГОЛОВЫ И ШЕИ, ЧАСТЬ I – ПЛОСКОКЛЕТОЧНЫЙ РАК
На прошедшем с 3 по 7 июня 2022 года ежегодном конгрессе ASCO традиционно обсуждались современные подходы в лечении опухолей, локализующихся на голове и шее. Среди представленных материалов большинство касались плоскоклеточных раков, однако помимо этого были представлены результаты исследований лечения аденокарцином, а также рака щитовидной железы....

Цикл вебинаров ДЛЯ ПОДГОТОВКИ К ЭКЗАМЕНУ ESMO
В июле-августе 2022 года мы планируем провести цикл вебинаров для подготовки к экзамену ESMO

НОВОСТИ ASCO 2022. РАК ТОЛСТОЙ КИШКИ: ПРОРЫВ ИЛИ ПЛАНОМЕРНАЯ РАБОТА?
В течение последних пяти лет в разделе лечения пациентов, в первую очередь, метастатическим колоректальным раком существенных прорывов не отмечалось, за исключением дальнейшего субтипирования пациентов на отдельные подгруппы и назначения персонализированной терапии лишь небольшой доле больных (MSI, mBRAF, гиперэкспрессия Her-2/neu). В этом году, напротив///

ОСНОВНЫЕ СОБЫТИЯ, ПРЕДСТАВЛЕННЫЕ НА КОНГРЕССЕ ASCO, В ОБЛАСТИ ЛЕЧЕНИЯ НМРЛ В 2022 ГОДУ
Принято считать наиболее современными два принципиально различных метода лечения опухолей легкого – таргетную и иммунотерапию. Именно с этими методами связаны основные достижения последних лет. Кроме оптимизации их использования, появляется все больше сообщений о роли локальных методов лечения на фоне достигнутого системного контроля заболевания...

НОВОСТИ ASCO 2022. РАК ПИЩЕВОДА И ЖЕЛУДКА
Конгресс ASCO в этом году оказался не особо богатым на интересные исследования по раку пищевода и желудка, явно отдав предпочтение колоректальному раку. Тем не менее, несколько из опубликованных работ интересны для обсуждения....

РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС - 2022
Российский онкологический конгресс - крупнейшее национальное онкологическое мероприятие в Европе с международным участием.
ТРАСТУЗУМАБ И ПЕРТУЗУМАБ В КОМБИНАЦИИ С РЕЖИМОМ FLOT ПРИ ПЕРВИЧНО ОПЕРАБЕЛЬНОМ HER2-ПОЗИТИВНОМ РАКЕ ЖЕЛУДКА И КАРДИОЭЗОФАГЕАЛЬНОГО ПЕРЕХОДА
В мае 2022 года в Journal of Clinical Oncology опубликована интересная статья, посвященная назначению трастузумаба и пертузумаба в комбинации с режимом периоперационной терапии FLOT при первично операбельном HER2- позитивном раке желудка (РЖ) и кардиоэзофагеального перехода (КЭП) [1]. Частота гиперэкспрессии и амплификации рецептора HER2 при РЖ и КЭП достигает 15-20%. В классическом исследовании FLOT4 [2] было показано, что достижение pCR позволяет значимо увеличить медиану общей выживаемости (ОВ) и безрецидивной выживаемости (БРВ) у пациентов с первично операбельным РЖ и КЭП.

НОВЫЕ МИШЕНИ ДЛЯ ТАРГЕТНОЙ ТЕРАПИИ НА ASCO 2022: ИННОВАЦИОННЫЕ ПОДХОДЫ В РАННИХ ФАЗАХ КЛИНИЧЕСКИХ ИСПЫТАНИЙ
Конгресс ASCO в этом году принес обилие новостей об испытаниях препаратов, направленно воздействующих на разнообразные новые молекулярные мишени, о некоторых из которых практикующие онкологи даже и не слышали ранее. Исследовались и низкомолекулярные препараты, и целый ряд антител и конъюгатов цитостатиков с антителами. Обращает на себя внимание, что...
РОЛЬ СТЕРЕОТАКСИЧЕСКОЙ ЛУЧЕВОЙ ТЕРАПИИ В ЛЕЧЕНИИ ПОЧЕЧНО-КЛЕТОЧНОГО РАКА
В июльском номере журнала European Urology опубликован крупный обзор [1] большого количества исследований (2 мета-анализа, включающих 54 исследования, 20 ретроспективных и 13 проспективных работ, одна из которых из России [2]) по применению SBRT в лечении больных первичным и метастатическим почечно-клеточным раком, опубликованных в период с 2000 по 2021 годы. SBRT, или SABR, является относительно новой опцией в лечении данной патологии, преимущественно по причине того, что ранее ПКР считался радиорезистентной опухолью при облучении малыми дозами (менее 3-5 Гр за фракцию). Первые исследования по облучению метастатических очагов ПКР в головном мозге методом SRS продемонстрировали великолепные результаты...
ПОДМЕЧЕНО ЧЕЛОВЕКОМ: БУДЕМ ЖИТЬ!
Zoe Cotton, 28 лет, закончила Лондонскую Королевскую Центральную Школу Речи и Драмы, курс по руководству театральной постановкой. Её дипломная работа по пьесе А.П.Чехова «Медведь» была великолепно встречена публикой. Спустя несколько лет жизни в Лондоне Зоуи круто развернула свою жизнь и уехала в глубокую провинцию. Много времени проводит на ферме с животными, любит фотографировать...
Анонс
-

июль - август 2022
Цикл вебинаров ДЛЯ ПОДГОТОВКИ К ЭКЗАМЕНУ ESMO
-

15 -17 ноября 2022
РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС - 2022
Дорогие коллеги, дорогие друзья!
Июльский выпуск газеты практически полностью посвящен
новостям прошедшего в июне очередного конгресса ASCO
2022, часть которых мы начали публиковать еще в июне. Многие результаты будут взяты на вооружение, многие препараты
и схемы продолжат изучение своей эффективности в новых
проспективных исследованиях – а что-то из актуального ныне
уйдет в историю, оставшись навеки на свитках папируса музы
Клио. Прошедший конгресс представил немало интереснейшей информации, которую мы, несомненно, будем использовать в своей практике – и ждать новых данных грядущих научных конференций и конгрессов. Все происходящее подобно
капле в бесконечном потоке Времени или мазку на холсте, что
вкупе с миллионами других мазков создают единую картину -
часть всемирной Истории.
Июль – период отпусков, и мы желаем вам максимально плодотворного отдыха, короткого или длинного, главное – в полном соответствии с вашими желаниями. До встречи в августе!
Ваша команда RUSSCO
Шарль Менье. «Клио, муза истории». Холст, масло, 1800
Кливлендский художественный музей, США

* * *
Видишь дом, назови его дом.
Видишь дерево, дерево тоже
назови, а потом... А потом
назови человека прохожим.
Мост мостом постарайся назвать.
Помни, свет называется светом.
Я прошу тебя не забывать
говорить с каждым встречным предметом.
Меня, кажется, попросту нет —
спит, читает, идет на работу
чей-то полурасслышанный бред,
некрасивое чучело чье-то.
И живу-не-живу я, пока
дорогими устами своими —
сквозь туман, сон, века, облака —
кто-нибудь не шепнет мое имя.
Говори, не давай нам забыть
наше тяжкое дело земное.
Помоги встрепенуться, ожить,
милый друг, повстречаться с собою.
Борис Рыжий. Детское стихотворение, 1995.
ASCО 2022: МЕТАСТАТИЧЕСКИЙ РАК МОЛОЧНОЙ ЖЕЛЕЗЫ
Автор: Тюляндин Сергей Алексеевич
Заслуженный деятель науки РФ, главный научный сотрудник ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России,
председатель Российского общества клинической онкологии (RUSSCO), профессор, доктор медицинских наук, Москва
Самым удивительным от прошедшего ASCO для меня лично было отсутствие на сессиях по раку молочной железы (РМЖ) докладов, посвященных химиотерапии и классическим цитостатикам. Это не значит, что химиотерапия ушла из методов лечения этой опухоли. Она осталась в качестве фундамента, на котором строятся дальнейшие стратегии борьбы с этим заболеванием. Использование цитостатиков перешло на новый уровень развития, когда препарат таргетно доставляется к опухолевой клетке. Это стало возможным за счет разработки конъюгатов антитела и цитостатика (ADC-antibody drug conjugate) – комбинации мощных цитостатиков и моноклональных антител к рецепторам на мембране опухолевых клеток. Именно разработка и исследование этих препаратов в клинике во многом определяли повестку сессии, посвященной метастатическому раку молочной железы.
ASCO 2022 abstract LBA 3:
исследование DESTINYBreast04
Результаты этого исследования
были озвучены на пленарной
сессии. Трастузумаб дерукстекан (T-DXd) является конъюгатом моноклонального антитела
трастузумаб, в задачу которого
входит доставка цитостатика к
опухолевой клетке с наличием
HER2-рецептора, и ингибитора
топоизомеразы I дерукстекана.
Ранее в исследовании DestinyBreast01 T-DXd продемонстрировал беспрецедентные 19,4 мес.
медианы времени до прогрессирования (ВДП) в качестве третьей линии терапии у больных
метастатическим HER2+ РМЖ с
резистентностью к T-DM1. Впоследствии в рандомизированном
исследовании Destiny-Breast03 он
показал бóльшую противоопухолевую эффективность по сравнению с T-DM1 в качестве терапии
второй линии, уменьшив относительный риск прогрессирования
на 72% (ВДП не достигнута при
назначении T-DXd и составила
6,8 мес. для T-DM1). Первый опыт
продемонстрировал мощнейший противоопухолевый эффект
T-DXd, что оправданно поставило вопрос о его использовании и
у больных с низкой экспрессией
рецептора HER2 на мембране. На
недавней конференции ESMO,
посвященной РМЖ, было представлено исследование DAISY, в
котором T-DXd назначался в качестве второй-третьей линии химиотерапии больным метастатическим РМЖ с экспрессией HER2
1-2+ и с отсутствием экспрессии.
В этом исследовании 38% больных с низкой экспрессией и 30%
с ее отсутствием продемонстрировали объективный ответ на
терапии с медианой времени до
прогрессирования 6,9 и 4,2 мес.
соответственно.
Все это делает актуальным проведение исследования DestinyBreast004, в котором больные
метастатическим РМЖ (мРМЖ)
с экспрессией HER2 по данным
иммуногистохимии 1+ и 2+ без
амплификации, с прогрессированием после 1-2 линий химиотерапии были рандомизированы в
соотношении 2:1 для получения
T-DXd в дозе 5,4 мг/кг каждые 3
недели или химиотерапии (капецитабин, эрибулин, гемцитабин,
наб-паклитаксел) по выбору врача. В исследование было включено 557 больных, из которых,
согласно дизайну, люминальный
и тройной негативный рак был у
499 и 58 больных соответственно.
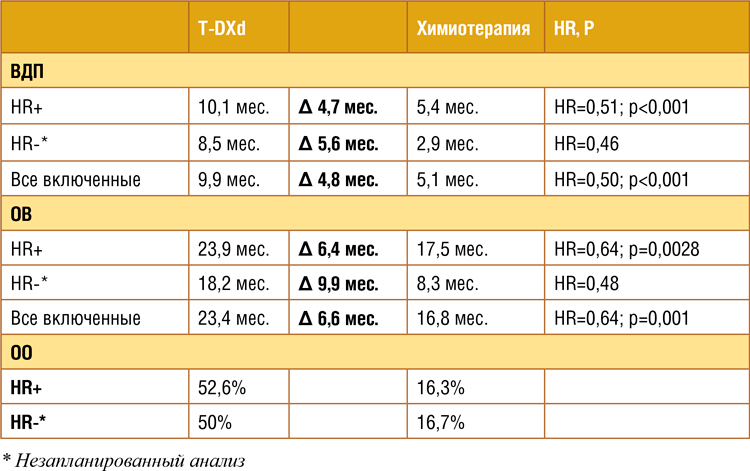
Основным критерием эффективности была медиана ВДП в группе рецепторпозитивных больных
(HR+) и в общей популяции.
Лечение T-DXd в сравнении с химиотерапией по выбору врача
достоверно уменьшило относительный риск прогрессирования
и смерти в 2 раза, как в группе
HR+ больных, так и среди всех
включенных в исследование (таблица 1). При подгрупповом анализе выигрыш T-DXd отмечен во
всех анализируемых подгруппах.
При незапланированном анализе
больных с тройным негативным
фенотипом отмечен еще больший
выигрыш от назначения T-DXd.
У всех пациентов лечение T-DXd
ассоциировалось с трехкратным
увеличением частоты объективного ответа (ОО). При анализе
токсичности лечение T-DXd сопровождалось большей частотой
тошноты и рвоты, в то время как
при проведении химиотерапии
отмечена большая частота глубоких нейтропений. Следует заметить, что при лечении T-DXd
у части больных возникает опасное для жизни осложнение – интерстициальный фиброз легких,
который мы не умеем профилактировать. Тщательное наблюдение за больными, выполнение
КТ легких позволяют выявить
это осложнение на ранних этапах, отменить T-DXd и назначить
глюкокортикоиды. У большинства больных это приводит к разрешению пульмонита. В этом
исследовании пульмонит был
диагностирован у 45 (12,1%) больных, из них 1-2 степени – у 10%, 3
степени – у 1,3%, смерть от этого
осложнения наступила у 3 (0,8%)
больных. Таким образом, фиброз
легких при использовании T-DXd
остается грозным осложнением,
лечение которого, особенно при
поздней диагностике, не всегда
успешно. Авторы делают вывод,
что назначение T-DXd является
новым стандартом лечения больных мРМЖ с низкой экспрессией
HER2.
Таблица 1.
Результаты исследования DESTINY-Breast004
ASCO 2022 abstract LBA
1001: исследование TROPICS-02
У больных с мРМЖ HR+ и HER2- проведено рандомизированное исследование сацитузумаба говитекана (СГ) в сравнении с химиотерапией по выбору врача при прогрессировании после эндокринотерапии и химиотерапии. СГ представляет собой комбинацию моноклонального антитела к рецептору Trop-2 и активного метаболита ингибитора топоизомеразы I иринотекана SN-38. Трансмембранный рецептор Trop-2 активирует кальций-зависимый сигнальный путь и экспрессирован на мембране большинства опухолевых клеток РМЖ. СГ, соединяясь с рецептором Trop-2, избирательно доставляет SN-38 в опухолевую клетку для реализации цитотоксического эффекта. Ранее в исследовании ASCENT СГ достоверно продемонстрировал большую противоопухолевую активность по сравнению с химиотерапией по выбору врача у многократно леченных больных мРМЖ с тройным негативным фенотипом.
В исследование TROPICS включались больные, которые ранее
получали эндокринотерапию с
CDK4/6 и 2-4 линии предшествующей химиотерапии. Они рандомизировались в группу СГ 10 мг/
кг в/в 1 и 8 дни каждые 3 недели
или в группу химиотерапии по выбору врача с возможностью
назначения капецитабина, винорельбина, гемцитабина или эрибулина. Основным критерием эффективности была медиана ВДП.
В исследование были включены
543 пациентки с прогрессированием после эндокринотерапии
и химиотерапии (медиана ранее
проведенных линий химиотерапии составила 3), наличием висцеральных метастазов у 95% из
них. При медиане наблюдения 10
мес. медиана ВДП в группе СГ и
химиотерапии составила 5,5 и 4,0
мес., что соответствует достоверному снижению относительного
риска прогрессирования на 34%
(HR=0,66; p=0,003), Одногодичная ВДП составила 21,3% и 7,1%
соответственно. При подгрупповом анализе выигрыш от назначения СГ наблюдали во всех анализируемых подгруппах. Частота
объективного ответа и контроля
заболевания составила 21% и 34%
для СГ и 14% и 22% для химиотерапии. Токсичность 3-4 степени
отмечалась у 74% в группе СГ и у
60% в группе химиотерапии. Отмена СГ по причине токсичности
была у 6% больных, 6 больных
умерли на фоне лечения, только одна смерть была следствием
токсичности СГ. При назначении
СГ чаще наблюдали осложнения
3-4 степени: нейтропения (31%),
диарея (9%), тогда как частота и
степень выраженности других
побочных эффектов существенно не отличались в двух группах.
Не отмечено развития интерстициального фиброза легких
при использовании СГ. Авторы
делают вывод, что у популяции
больных мРМЖ HR+ HER2- с
резистентностью к эндокрино- и
химиотерапии назначение СГ демонстрирует выигрыш в частоте
объективных эффектом и медиане ВДП по сравнению с продолжением стандартной химиотерапии.
ASCO 2022 abstract 1002: I
фаза изучения патритумаба
дерукстекана
У больных мРМЖ в рамках I фазы
был изучен новый ADC – патритумаб дерукстекан (HER3-DXd),
комбинация моноклонального
антитела к рецептору HER3 и ингибитора топоизомервзы I дерукстекана. Рецептор HER3 экспрессируют многие клетки РМЖ, и его
экспрессия сочетается с плохим
прогнозом. В рамках первой фазы
была определена безопасная доза
препарата 5,6 мг/кг и в расширенной когорте лечение получили 179
многократно леченных пациенток
с различными фенотипами опухоли, большинство из которых
имели висцеральные метастазы.
Критерием включения было наличие экспрессии HER3. Противоопухолевые эффекты наблюдали
при всех фенотипах, и частота
объективного ответа составила
28% при медиане продолжительности ответа 7 мес. Препарат обладал умеренной токсичностью,
в основном гематологической и
гастроинтестинальной, частота
отмены лечения по причине токсичности составила 10%. Развитие
интерстициального фиброза легких зарегистрировано у 12 (6,6%)
больных, одна из которых погибла
от этого осложнения. Отдаленные
результаты не были представлены, но авторы делают вывод, что
HER3-DXd демонстрирует выраженный противоопухолевый
эффект у больных мРМЖ с резистентностью к стандартной эндокринотерапии, химиотерапии и
анти-HER2 терапии, что требует
его дальнейшего изучения, также
как и прогностической и предиктивной роли экспрессии рецептора HER3.
ADC представляют собой успешный пример таргетной химиотерапии. Теоретически за счет
адресной доставки цитостатика в
опухолевую клетку ADC должны
обладать большей эффективностью и меньшей токсичностью по
сравнению с системной химиотерапией. Результаты первых исследований свидетельствуют в пользу
большей эффективности ADC по
сравнению со стандартной химиотерапией, по крайней мере в поздних линиях. Но вот убедительных свидетельств о меньшей токсичности пока получено не было. Все
ADC демонстрировали гематологическую и гастроинтестинальную (диарея, тошнота и рвота)
токсичность, частота которых
была сравнимой и даже превосходила таковую при системной химиотерапии. Более того, большинство из них индуцирует развитие
опасного для жизни осложнения,
такого как интерстициальный фиброз легких, патогенез которого
в полной мере неизвестен, и профилактические меры его развития
отсутствуют. Для успешной интеграции ADC в клинику потребуется проведение исследований с
целью определения их места в существующей последовательности
системной терапии. Предстоит
внедрение методов диагностики
различных антигенов и оценки их
экспрессии на мембране опухолевой клетки, которые могут быть
мишенями для всё возрастающего
количества ADC, и поиск предиктивных биомаркеров для выбора
правильного препарата для конкретного пациента. Важнейшей
задачей остается профилактика,
ранняя диагностика и тактика лечения интерстициального фиброза легких – осложнения, которое
будет серьезным препятствием
для использования ADC в рутинной клинической практике.
ASCO 2022 abstract
LBA 1003: исследование
PALOMA-2
Главным разочарованием для
всех, кто занимается лечением рака молочной железы, стали результаты исследования
PALOMA-2, в котором сравнивали эффективность летрозола
и комбинации летрозола и ингибитора CDK4/6 палбоциклиба в
первой линии эндокринотерапии
у больных HR+ HER2- мРМЖ.
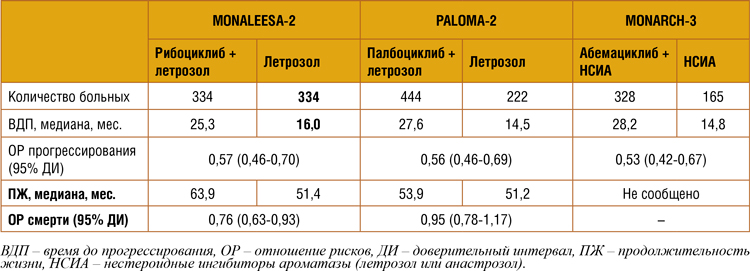
Известно, что три препарата из
этой группы, включая палбоциклиб, получили регистрацию
FDA для использования в первой
линии с ингибиторами ароматазы на основании впечатляющего
увеличения медианы времени
до прогрессирования (таблица
2). При этом формально все они
в равной степени уменьшали относительный риск прогрессирования. Первыми о влиянии на
общую выживаемость комбинации ингибитора CDK4/6 рибоциклиба и летрозола отчитались
исследователи MONALEESA-2.
Добавление рибоциклиба позволило выиграть больше года в
медиане общей выживаемости,
что соответствовало достоверному снижению относительного
риска смерти на 24%. Поэтому
с таким интересом ожидались
результаты PALOMA-2, помня о
двух негативных исследованиях
использования палбоциклиба в
адъювантной терапии (PALLAS и
PENELOPE-B).
К сожалению, следует констатировать по результатам исследования PALOMA-2, что выигрыш,
полученный в увеличении медианы ВДП, комбинация летрозола
и палбоциклиба растеряла, и разница в общей выживаемости между комбинацией и летрозолом достоверно не отличается (HR=0,95;
p=0,34). При этом контрольные
группы с приемом летрозола в
исследованиях MONALEESA-2
и PALOMA-2 демонстрируют
практически идентичную медиану продолжительности жизни,
что косвенно свидетельствует о
прогностически равноценных
популяциях больных в обеих исследованиях. Потеря выигрыша
в PFS может быть обусловлена
большей резистентностью опухоли к последующему лечению
после комбинации CDK4/6 и ИА
или снижением репаративной
способности костного мозга, что
уменьшает шанс использования
цитостатиков в полных дозах,
Можно долго теоретизировать о
возможных причинах отсутствия
выигрыша в общей выживаемости при назначении палбоциклиба, но очевидно, что результаты
PALOMA-2 будут негативно сказываться на выборе препарата
для проведения первой линии эндокринотерапии у больных HR+
HER2- мРМЖ.
Таблица 2.
Результата рандомизированных исследований по изучению ингибиторов CDK4/6 в первой линии
гормонотерапии.
ASCO 2022 abstract LBA
1004: исследование
MAINTAIN
Интересными – с точки зрения
практики – являются результаты
рандомизированного исследования II фазы MAINTAIN, в котором изучается целесообразность
продолжения приема ингибитора
CDK4/6 во второй линии эндокринотерапии при прогрессировании после использования этой
группы препаратов в первой линии. Комбинация рибоциклиба
и фулвестранта или экземестана
сравнивалась с гормонотерапией
этими препаратами у 119 больных HR+ HER2- мРМЖ с прогрессированием после первой
линии гормонотерапии ингибиторами ароматазы в комбинации
с любым ингибитором CDK4/6.
Основным критерием эффективности была медиана ВДП, которая
составила 6,29 мес. при использовании комбинации и 2,76 мес.
при использовании только эндокринотерапии, что соответствует
достоверному снижению относительного риска прогрессирования на 43% (HR=0,57; p=0,006).
Безрецидивная годичная выживаемость составила 24,6% и 7,4%
соответственно. Комбинация демонстрировала лучшую эффективность как при прогрессировании после палбоциклиба, так
и после рибоциклиба, хотя число
таких больных было немногочисленным. Данное исследование
свидетельствует о перспективности постоянного ингибирования
CDK4/6 при проведении гормонотерапии, но для использования
этого показания в рутинной клинической практике требуется подтверждение в рандомизированных
исследованиях III фазы.
ASCO 2022 abstract 1007:
исследование NRG-BR002
В этом исследовании изучалось значение контроля метастатических
очагов с помощью стереотаксической лучевой терапии у больных с
олигометастатическим РМЖ, получающих системную терапию. В
рандомизированное исследование
II фазы включались больные с контролируемыми системной терапией локальными проявлениями
болезни и наличием не более 4 метастатических опухолевых очагов.
В исследование было включено 125
больных, 80% из которых имели
HR+ HER- опухоль, 72% получали
гормонотерапию, 28% – химиотерапию ± гормонотерапию, у 60% был
солитарный метастатический очаг.
Медиана времени до прогрессирования составила 24 мес. и 18 мес. в
группе системной терапии только
и стереотаксической лучевой терапии соответственно. Авторы делают
вывод, что современная системная
терапия при наличии олигометастатической болезни способна в течение длительного времени обеспечивать контроль над заболеванием.
Добавление стереотаксической
лучевой терапии на имеющиеся
метастазы не уменьшает риск прогрессирования и может быть рекомендовано в качестве паллиативной
меры при наличии симптомов.
ОБЗОР КЛЮЧЕВЫХ НОВОСТЕЙ ASCO 2022 ПО ЛЕКАРСТВЕННОЙ ТЕРАПИИ РАННЕГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ
Авторы: Семиглазова Татьяна Юрьевна
ФГБУ «НМИЦ онкологии им. Н.Н. Петрова»
Минздрава России, Санкт-Петербург
Абдуллаева Шейда Раджабалиевна
ФГБУ «НМИЦ онкологии им. Н.Н. Петрова»
Минздрава России, Санкт-Петербург
В Чикаго с 3 по 7 июня 2022 года
в гибридном формате состоялся конгресс Американского
общества клинической онкологии (American Society of Clinical
Oncology – ASCO). Более 2900 тезисов были отобраны для устного
доклада и постерной сессии, а также более 2200 – для публикации
онлайн. По теме рака молочной
железы было опубликовано около
500 тезисов.
В данном обзоре приведены наиболее значимые результаты исследований, доложенных на заседаниях конгресса, которые касались
вопросов противоопухолевой
лекарственной терапии раннего
рака молочной железы (рРМЖ).
Роль циркулирующей
опухолевой ДНК при рРМЖ
Lipsyc-Sharf M. и соавт. представили результаты исследования CHiRP
по изучению связи между уровнем
циркулирующей опухолевой ДНК
(цДНК) и поздним рецидивом при
HR+ HER2-негативном раке молочной железы (РМЖ) высокого риска
[1].
Согласно предыдущим исследованиям, обнаружение минимальной
остаточной болезни (МОБ) с помощью цДНК связано с высоким риском рецидива РМЖ. Однако мало
что известно о прогностической
значимости цДНК в отношении
позднего рецидива после адъювантного лечения при HR+ раке молочной железы [2].
В исследование было включено 83
пациента с HR+ РМЖ высокого
риска и отсутствием признаков рецидива в течение 5 лет после постановки диагноза. Под высоким риском понимали категорию больных
рРМЖ с:
• Т3-4 и/или N2-3;
• T1N1 с поражением 3 и более лимфатических узлов (Л/У);
• T2N1 с Ki67 ≥20%, Grade 3 или RS
≥26 согласно тесту OncotypeDX
Большая часть пациентов имели
III стадию (68,7%), 90,4% получали адъювантную химиотерапию и все
100% пациенты – адъювантную эндокринную терапию.
С целью обнаружения цДНК плазмы была разработана диагностическая панель на основе первичной
опухоли. Образцы плазмы для
детекции цДНК собирали каждые
6-12 месяцев.
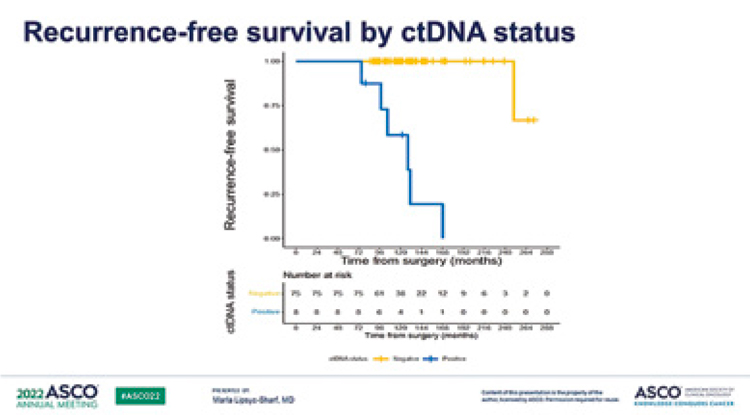
В общей сложности у 8 из 83 больных HR+ РМЖ высокого риска
была обнаружена минимальная
остаточная болезнь в виде циркулирующей опухолевой ДНК
(МОБ). Из них у 6 пациентов с
МОБ+ отдаленный рецидив развился в среднем через 37,6 мес.
(медиана 12,4 мес.), тогда как у двух
из восьми МОБ+ пациентов на момент последнего осмотра рецидива выявлено не было. Важно, что
в исследовании у одного пациента
без признаков минимальной остаточной болезни развился местный
рецидив.
Адъювантная лучевая
терапия при люминальном
А подтипе рРМЖ
Рисунок 1.
Исследование CHiRP: связь между поздним
рецидивом и уровнем цДНК при HR+ HER2-негативном раке
молочной железы высокого риска [1].
Адъювантная лучевая терапия
обычно назначается пациенткам с
РМЖ после органосохраняющей
операции для снижения рисков
местного рецидива [4]. Недавний
ретроспективный анализ Liu F.F. и
соавт. [5] исследования по изучению адъювантной ЛТ после органосохраняющей операции показал низкий риск рецидива (1,3%) у пациенток с люминальным А подтипом I
стадии. Тем не менее, на сегодняшний день, в рамках проспективных
исследований, не установлено, будет
ли определение подтипа РМЖ влиять на принятие решения о проведении адъювантной лучевой терапии.
Whelan T.J. и соавт. представили
результаты проспективного когортного исследования LUMINA по
оценке риска местного рецидива без
проведения адъювантной лучевой
терапии у больных люминальным А
подтипом рРМЖ низкого риска после органосохраняющей операции и
эндокринной терапии [3].
В исследование LUMINA III фазы
были включены 500 пациентов
старше 55 лет, с люминальным
А подтипом рРМЖ (ER ≥1%, PR
>20%, HER2-отрицательный и Ki67
≤13,25%), T1N0 стадии, Grade 1-2.
Всем пациентам была проведена
органосохраняющая операция без
проведения адъювантной лучевой
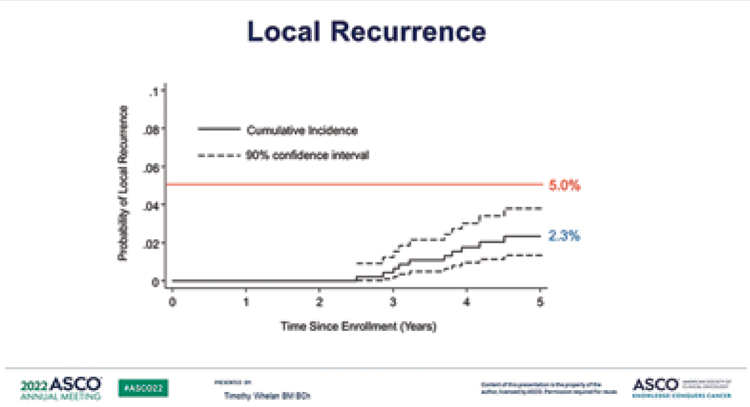
терапии. На ASCO 2022 были представлены 5-летние результаты данного исследования:
• вероятность местного рецидива составила 2,3% (90% ДИ 1,3-3,8%), что было ниже порога значимости в 5%;
• вероятность развития контралатерального РМЖ составила 1,9% (90% ДИ 1,1-3,2%);
• безрецидивная выживаемость –
97,3% (90% ДИ 95,9-98,4%);
• общая выживаемость – 97,2% (90%
ДИ 95,9-98,4%).
Данные результаты нуждаются в более длительном наблюдении, ведь риск локального рецидива продолжает увеличиваться после 5 лет, особенно в группе пациентов с люминальным А подтипом РМЖ [6].
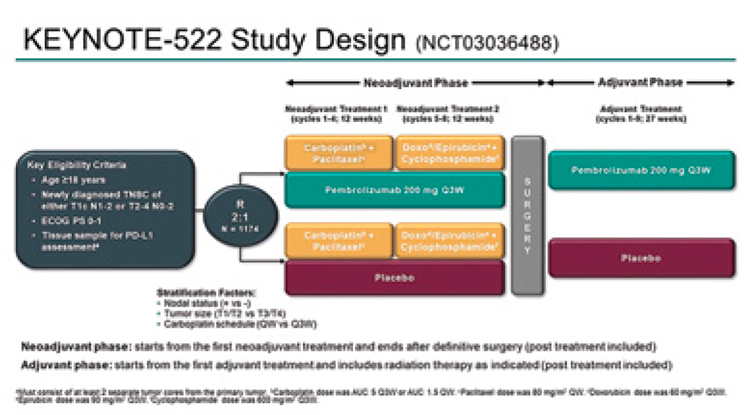
Обновленные данные
исследования KEYNOTE 522
В ходе конгресса Pusztai L. и сооавт.
были озвучены обновленные результаты проспективного рандомизированного плацебо-контролируемого
исследования 3 фазы KEYNOTE-522
по изучению иммунотерапии при
раннем трижды-негативном раке молочной железы (ТНРМЖ) [7].
Рисунок 2.
Дизайн проспективного когортного исследования
LUMINA [3].
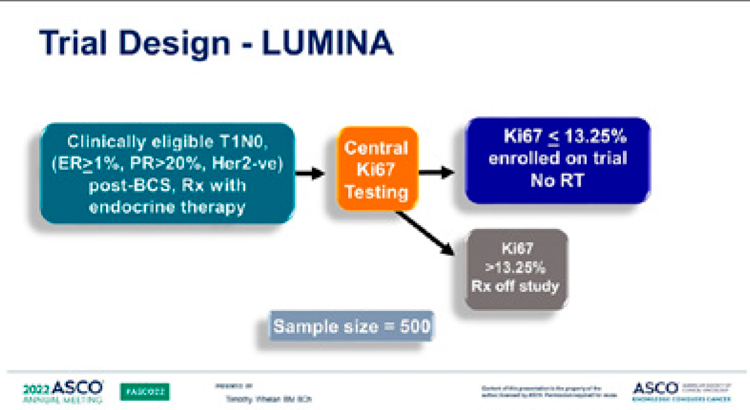
Рисунок 3.
Частота локального рецидива в исследовании
LUMINA [3]
Напомним, что в данное исследование было включено 1174 пациента с ТНРМЖ II-III стадии,
которые были рандомизированы
для получения неоадъювантной
терапии карбоплатином и паклитакселом с последующим назначением доксорубицина или
эпирубицина и циклофосфамида
в сочетании с пембролизумабом
или плацебо. После оперативного
лечения пациентам продолжали
вводить пембролизумаб или плацебо каждые 3 недели в течение 9
циклов. Первичными конечными
точками были полный патоморфологический ответ и бессобытийная выживаемость (БСВ).
При четвертом промежуточном
анализе авторы оценили связь
БСВ с патоморфологическим ответом по RCB (Residual Cancer
Burden). Через 36 месяцев БСВ в
исследовании составила 76,8% в
группе плацебо и 84,5% в группе
пембролизумаба. Статус RCB-0
был достигнут у 63,4% в группе
пембролизумаба и 56,2% пациентов в группе плацебо. Отношение
рисков для бессобытийной выживаемости с RCB-0 составило
0,70 (95% ДИ 0,38-1,31), для RCB-1
– 0,92 (95% ДИ 0,39-2,20); для RCB2 – 0,52 (95% ДИ 0,32-0,82); а для
RCB-3 – 1,24 (95% ДИ 0,69-2,23).
Данный поданализ показал, что
у пациентов из группы RCB-2 с
умеренно выраженным остаточным заболеванием наблюдалось
значительное улучшение БСВ при
добавлении пембролизумаба. Тем
ни менее, необходимо осторожно
интерпретировать эти данные,
так как количество наблюдений в
каждой группе в зависимости от
RCB было небольшим, особенно
в группе RCB-1 и RCB-3. Будущее
исследование SWOG S1418 поможет ответить на вопрос о необходимости добавления адъювантной иммунотерапии у пациентов
с остаточной опухолью.
Рисунок 4.
Дизайн проспективного рандомизированного плацебо-контролируемого исследования 3 фазы
KEYNOTE-522 [7]
Биоаналог трастузумаба TX05 при раннем раке молочной железы
Разработка первого таргетного препарата трастузумаб произвела революцию в лечении HER2+ РМЖ. Однако высокая стоимость биологически направленных таргетных препаратов может препятствовать более широкому доступу пациентов к оптимальному лечению. Внедрение биоаналогов в терапевтический арсенал потенциально может облегчить доступ к эффективным методам лечения РМЖ.
Криворотько П.В. и сооавт. представили результаты исследования 3 фазы TX05-03, в котором сравнивалась эффективность и безопасность биоаналога трастузумаба TX05 с оригинальным трастузумабом у пациентов с HER2+ ранним РМЖ [8].
Ранее на конгрессе ESMO 2021 были доложены данные по первичной конечной точке pCR, где биоаналог TX05 не уступал оригинальному трастузумабу в эффективности. Частота pCR составила 48,8% в группе биоаналога TX05 и 45,3% в группе трастузумаба (ОР 1,0783; 95% ДИ 0,92-1,27) [9].
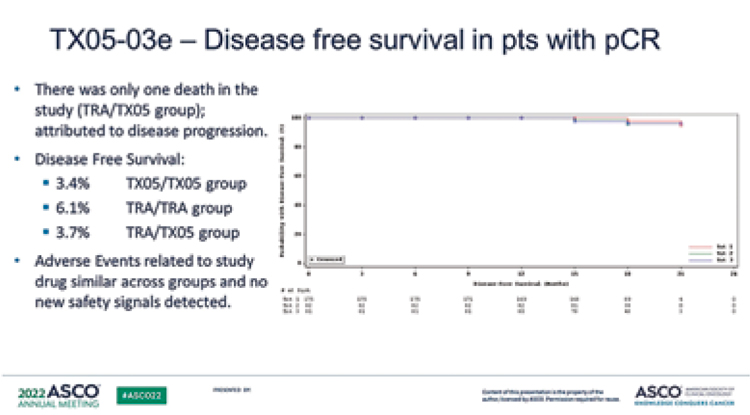
На ASCO исследователи представили теперь уже отдаленные результаты исследования. Выживаемость без прогрессирования, общая выживаемость и безопасность были сопоставимы для биоаналога и оригинального препарата.
Рисунок 5.
Результаты БСВ в зависимости от уровня RCB
в исследовании KEYNOTE-522 [7].
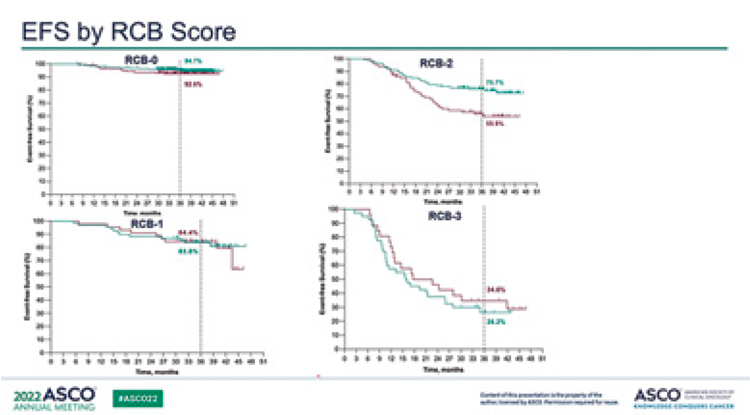
Рисунок 6.
Исследование TX05-03: биоаналог трастузумаба
TX05 против оригинального трастузумаба. Представлены
данные по ВБП [8].
Отдаленные результаты адъювантной терапии деносумабом при рРМЖ
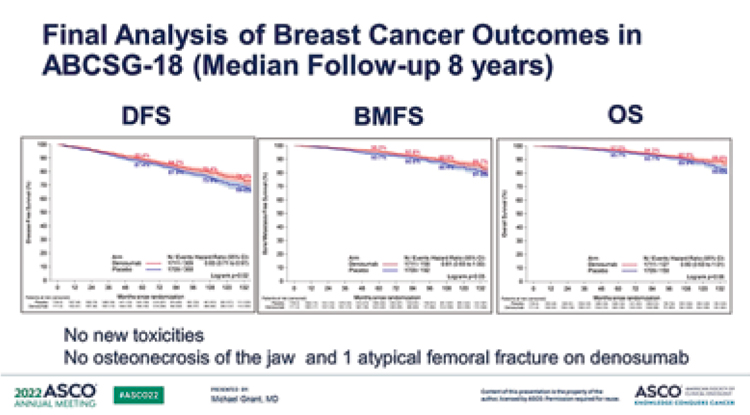
Gnant M. и сооавт. представили заключительные данные рандомизированного контролируемого исследования ABCSG-18, в котором ранее было продемонстрировано увеличение времени до первого клинического перелома у больных рРМЖ, получавших деносумаб в дозе 60 мг каждые 6 месяцев во время адъювантной терапии ингибиторами ароматазы [10].
Безрецидивная выживаемость (БРВ) составила 69,0% в группе плацебо и 74,4% в группе деносумаба (ОР 0,83; 95% ДИ 0,71-0,97; p=0,02) после медианы наблюдения 8 лет. Показатели выживаемости без костных метастазов составили 81,3% в группе плацебо и 85,7% в группе деносумаба соответственно (ОР 0,81; 95% ДИ 0,65-1,00; p=0,05). Общая выживаемость составила 83,6% в группах плацебо и 88,8% в группе деносумаба (ОР 0,80; 95% ДИ 0,63-1,01; p=0,06) [11].
Не было отмечено новых случаев токсичности, а также ни одного случая остеонекроза челюсти в течение периода исследования, что может быть связано с низкой дозой деносумаба.
Рисунок 7.
Результаты БРВ, выживаемости без костных
метастазов и ОВ в исследовании ABCSG-18 [11].
Литература:
1. Lipsyc-Sharf M, et al. Circulating Tumor DNA and Late Recurrence in High-Risk Hormone ReceptorPositive, Human Epidermal Growth Factor Receptor 2-Negative Breast Cancer. J Clin Oncol. 2022 Jun. DOI: 10.1200/JCO.22.00908.
2. Parsons HA, et al. Sensitive Detection of Minimal Residual Disease in Patients Treated for Early-Stage Breast Cancer. Clin Cancer Res. 2020 Jun 1; 26(11): 2556- 2564. doi: 10.1158/1078-0432.CCR19-3005.
3. Whelan TJ, et al. LUMINA: A prospective trial omitting radiotherapy (RT) following breast conserving surgery (BCS) in T1N0 luminal A breast cancer (BC). J Clin Oncol. 2022; 40 (suppl.17): LBA501. doi:10.1200/JCO.2022.40.17_suppl. LBA501.
4. Early Breast Cancer Trialists' Collaborative Group (EBCTCG), Darby S, et al. Effect of radiotherapy after breast-conserving surgery on 10-year recurrence and 15-year breast cancer death: meta-analysis of individual patient data for 10,801 women in 17 randomised trials. Lancet. 2011 Nov 12; 378(9804): 1707-16. doi: 10.1016/S0140- 6736(11)61629-2.
5. Liu FF, et al. Identification of a Low-Risk Luminal A Breast Cancer Cohort That May Not Benefit From Breast Radiotherapy. J Clin Oncol. 2015 Jun 20; 33(18): 2035-40. doi: 10.1200/JCO.2014.57.7999.
6. Hughes KS, Schnaper LA, Bellon JR, Cirrincione CT, Berry DA, McCormick B, Muss HB, Smith BL, Hudis CA, Winer EP, Wood WC. Lumpectomy plus tamoxifen with or without irradiation in women age 70 years or older with early breast cancer: long-term follow-up of CALGB 9343. J Clin Oncol. 2013 Jul 1; 31(19): 2382-7. doi: 10.1200/ JCO.2012.45.2615.
7. Pusztai L, et al. Event-free survival by residual cancer burden after neoadjuvant pembrolizumab + chemotherapy versus placebo + chemotherapy for early TNBC: Exploratory analysis from KEYNOTE-522. Journal of Clinical Oncology. 2022 June 1; 40, no.16_ suppl, P.503-503. DOI: 10.1200/ JCO.2022.40.16_suppl.503.
8. Krivorotko P, et al TX05-03e: Adjuvant treatment following neoadjuvant treatment and surgical resection in TX05-03, a trial comparing the safety, efficacy, and immunogenicity of trastuzumab biosimilar candidate (TX05) with originator trastuzumab in HER2+ EBC. Journal of Clinical Oncology. 2022 June 10; 40, no.17_suppl, LBA511-LBA511. DOI: 10.1200/ JCO.2022.40.17_suppl.LBA511.
9. Krivorotko P, et al. 137P Trial comparing the safety, efficacy and immunogenicity of trastuzumab biosimilar candidate (TX05) with originator trastuzumab in HER2+ early breast cancer. Annals of Oncology. 2021; Vol.32, Suppl.5, P.S419. https://doi.org/10.1016/j. annonc.2021.08.418.
10.Gnant M, et al. Adjuvant denosumab in postmenopausal patients with hormone receptorpositive breast cancer (ABCSG-18): disease-free survival results from a randomised, double-blind, placebocontrolled, phase 3 trial. Lancet Oncol. 2019 Mar; 20(3): 339-351. doi: 10.1016/S1470-2045(18)30862-3.
11.Gnant M, et al. Long-term
outcomes of adjuvant denosumab
in breast cancer: Fracture reduction
and survival results from 3,425
patients in the randomised, doubleblind, placebo-controlled ABCSG-18
trial. Journal of Clinical Oncology.
2022 June 1; 40, no.16_suppl, P.507-
507. DOI: 10.1200/JCO.2022.40.16_
suppl.507.
10 Лет Национальной программе Российского онкологического общества клинической онкологии

НОВОСТИ КОНГРЕССА ASCO 2022. ОПУХОЛИ ГОЛОВЫ И ШЕИ, ЧАСТЬ I – ПЛОСКОКЛЕТОЧНЫЙ РАК
Автор: Болотина Лариса Владимировна
Заведующая отделением химиотерапии МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИЦ радиологии»
Минздрава России, член правления RUSSCO, доктор медицинских наук, доцент РАН, Москва
На прошедшем с 3 по 7 июня 2022
года ежегодном конгрессе ASCO
традиционно обсуждались современные подходы в лечении опухолей, локализующихся на голове
и шее. Среди представленных материалов большинство касались
плоскоклеточных раков, однако
помимо этого были представлены
результаты исследований лечения
аденокарцином, а также рака щитовидной железы.
Всего было опубликовано 112 постерных докладов, которые объединили 9 постеров, изложенных
в разделе Oral Abstract Session с одним Late Breaking Abstract (LBA);
13 докладов, обсужденных в Poster
Discussion Session вновь с одним
LBA; 15 абстрактов были посвящены текущим исследованиям,
для которых пока результаты не
получены, а оставшиеся публикации были представлены в виде
печатных работ в Poster Session.
Примечательным является то,
что авторами обоих LBA являются исследователи из Индии (Tata
Memorial Centre, Mumbai, India).
Наиболее интересным с практической точки зрения является
направление деинтенсификации
терапии: лучевого/химиолучевого компонента как послеоперационного этапа, так и этапа консервативного лечения. Немецкими
исследователями были представлены результаты мультицентрового проспективного исследования 2
фазы, в котором авторы оценили
возможность деинтенсификации
послеоперационной лучевой терапии (ЛТ) в лечении пациентов
с плоскоклеточным раком головы и шеи (ПРГШ) независимо от
статуса HPV [1]. Поводом для исследования послужили данные о
том, что пациенты с ПРГШ низкого риска после комбинированного
лечения (операция + ЛТ) имеют
высокие показатели 5-летнего
локорегионарного контроля, однако у 30% пациентов наблюдаются токсические реакции (ТР) 3
степени (ксеродерма, дисфагия),
значимо снижающие качество
жизни (КЖ). Протокол объединил 150 пациентов с опухолями
полости рта, ротоглотки и гортани pT1-3N0-2b и гортаноглотки
pT1-2N1, которые были разделены
на 3 группы в зависимости от варианта лечения. Группа 1 в послеоперационном периоде получала
редуцированную дозу на зону первичной опухоли ЛТ до СОД 56 Гр,
группа 2 – меньший объем (зону)
облучения в виде избирательных
ипсилатеральных лимфоузлов, а
группе 3 совмещали оба варианта
редукции ЛТ. Первичной точкой
являлся 2-летний локорегионарный контроль. Медиана времени
наблюдения составила 36 месяцев.
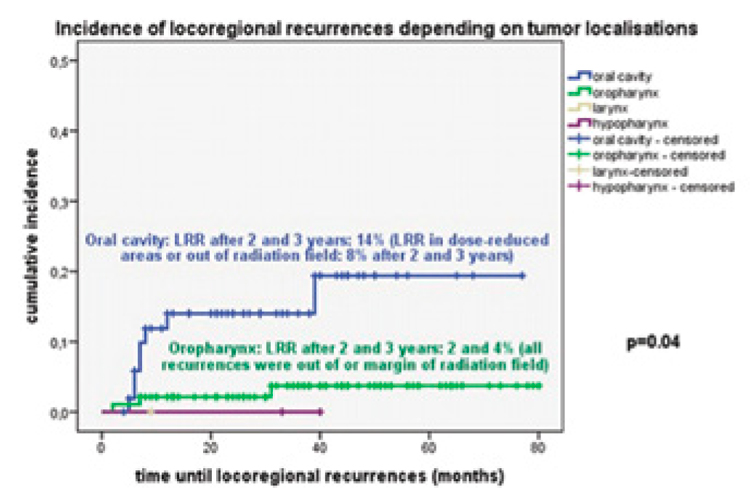
Частота локорегиогнарных рецидивов в общей популяции составила к 2 годам 6%, а к 3 годам – 7%.
Частота рецидивов в необлученных зонах или зоне редуцированной ЛТ составила 4% к 2 годам и
5% к 3 годам. Авторам удалось выявить зависимость более высокой
частоты рецидива от локализации
первичной опухоли: более часто
рецидивы наблюдались при раке
полости рта в сравнении с опухолями ротоглотки (14% против
4%, рис.1). Показатель общей выживаемости (ОВ) сохранялся на
высоком уровне после 2 и 3 лет –
94%, выживаемость до прогрессирования (ВДП) к 2 годам 90% и к
3 годам – 88%, частота появления
отдаленных метастазов к 2 и 3 годам – 4% и 5% соответственно. Отсроченная токсичность 3-4 степени составила 2,7% для дисфагии,
2,1% для стеноза пищевода и 0,7%
для ксеростомии и остеонекроза
нижней челюсти. Исследователи
сделали вывод о том, что предложенные варианты деинтенсификации послеоперационной ЛТ
являются безопасными, позволяющими существенно снизить
частоту значимых ТР; учитывая
более высокий процент рецидива
среди пациентов с опухолями ротовой полости, данная подгруппа
требует более детального анализа;
для пациентов с орофарингеальным раком деинтенсификация ЛТ
является безопасной.
Рисунок 1.
Частота локорегионарного рецидива
при деинтенсификации послеоперационной ЛТ
в зависимости от локализации первичного очага.
Японским авторским коллективом был изучен вариант альтернативной доставки цитостатика
при проведении ХЛТ у больных
местнораспространенным раком
верхнечелюстной пазухи сТ4а,
которые не подлежали операции
как «золотому» стандарту лечения
данной популяции пациентов. В
рамках исследования производилось суперселективное внутриартериальное еженедельное введение цисплатина в дозе 100 мг/м2 с
дополнительным внутривенным
применением тиосульфата натрия 20 мг/м2 для нейтрализации
цисплатина и одновременной
ЛТ в течение 7 недель до СОД 70
Гр [2]. Первичной целью была
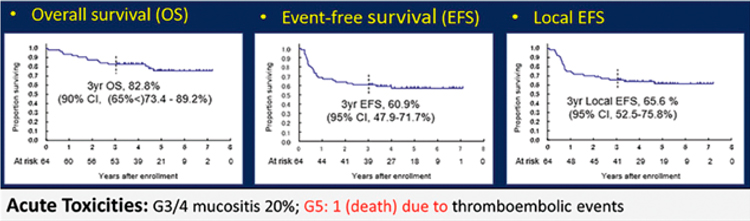
оценка 3-летней выживаемости.
Исследование предусматривало характер non-inferiority, где за
основной показатель сравнения
был взят уровень 3-летней ОВ 80%
при выполнении хирургического
вмешательства, а также 65% при
проведении стандартной ХЛТ с
внутривенным введением цисплатина. Авторам удалось достичь
поставленной цели – показатель
3-летней ОВ в исследуемой группе составил 82,8%. Уровень БРВ
оказался 60,9%, локорегионарного
контроля – 65,6%, а частота объективного ответа (ЧОО: ПО + выраженный ЧО) – 73,4% (рис.2).
Рисунок 2.
Показатели ОВ, ВБП и локорегионарного контроля при применении
внутриартериальной ХТ при раке верхнечелюстной пазухи (Т4а).
Исследователи делают вывод о
том, что ХЛТ с внутриартериальным введением цисплатина не
менее эффективна, чем операция,
но более эффективна, чем традиционная ХЛТ с внутривенным
введением цитостатика для подгруппы больных раком верхнечелюстной пазухи сТ4а, в связи с
чем должна рассматриваться как
возможный вариант стандарта
лечения наряду с хирургическим
вмешательством.
В Tata Memorial Centre, Mumbai,
India, было проведено рандомизированное исследование 3 фазы по
сравнению эффективности 2-компонентных (доцетаксел/цисплатин, DC) и 3-компонентных (доцетаксел/цисплатин/5-фторурацил,
DCF) режимов неоадъювантной
химиотерапии (НАХТ) у больных
нерезектабельным раком полости
рта [3]. Поводом к проведению
данного исследования стали данные о высоком уровне токсичности 3 и более степени при использовании стандартного режима
НАХТ – трехкомпонентной схемы DCF. Критериями нерезектабельности были распространение
опухоли в подвисочную ямку или
инфильтрация кожи, не позволяющие обеспечить негативный
хирургический край. Первичной
целью была оценка ОВ. Трехкомпонентный режим DCF позволил
обеспечить более высокий показатель 2-летней ОВ: 29,3% против
23,5% для режима DC (HR 0,81;
р=0,042) (рис.3).
Рисунок 3.
ОВ при применении режима
DCF и DC.
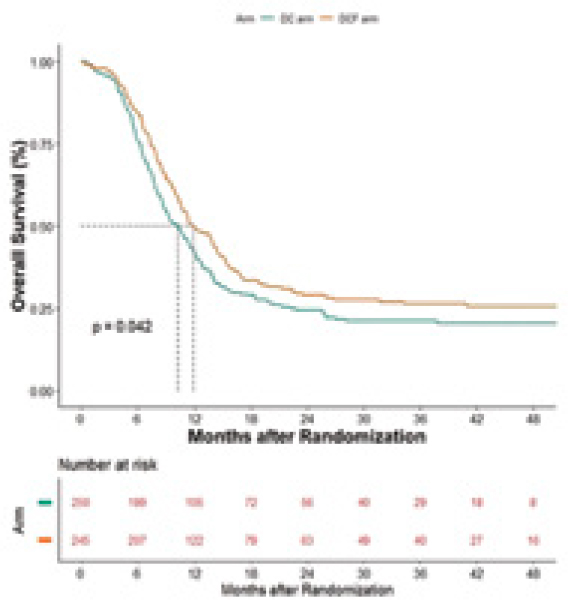
Среди вторичных целей была оценена 2-летняя ВБП, которая также
оказалась выше при применении
трехкомпонентной схемы: 26,5% vs
21,6% (HR 0,81; р=0,047). Ожидаемо в группе DCF более часто наблюдались
и ТР значимых степеней: мукозиты
– 10,6% против 1,2%; диарея – 13,6%
против 9,6%; фебрильная нейтропения – 23,2% против 2,6%; гипонатриемия – 40,8% против 20,8%; гипокалиемия – 17,9% против 1,6%. Таким
образом, авторами в очередной раз
подтверждено, что режим DCF позволяет обеспечить наиболее высокий показатель ОВ в сравнении с
двухкомпонентной схемой, но ценой
большей токсичности.
Также вопросам индукционной
химиотерапии при раке носоглотки была посвящена работа
китайских авторов, отобранная
для Poster Discussion Session [4].
Поводом к формированию протокола послужили данные о том,
что местнораспространенный рак
носоглотки имеет высокий потенциал развития отдаленных метастазов, а также наличие данных
о синергизме ингибиторов точек
иммунного контроля (ИТИК), в
частности анти-PD1 агентов, в сочетании с ХТ и антиангиогенными
препаратами при ПРГШ. Авторы в
открытом однорукавном исследовании 2 фазы изучали эффективность и безопасность анти-PD1
препарата кармелизумаба и антиангиогенного средства апатиниба
в комбинации с индукционной
химиотерапией (ИХТ) и ХЛТ при
раке носоглотки TлюбоеN3M0. На
фазе индукции пациенты (n=50)
получали 3 курса ИХТ в режиме
ТСР (наб-паклитаксел + цисплатин + капецитабин), дополнительно в 1 день каждого курса вводили
кармелизумаб и 5 дней в неделю
пациенты принимали апатиниб
(в течение 8 недель). ХЛТ этап был
представлен IMRT 68-72, 64-68,
60-64 и 54-58 Гр за 30-33 фракции для PTVnx, PTVnd, PTVhigh-risk
и PTVlow-risk соответственно в сочетании в цисплатином 100 мг/
м2 1 раз в 3 недели, вводимом
дважды. Введения кармелизумаба
продолжались максимально до 1
года. Основной целью была выбрана 1-летняя выживаемость без
отдаленных метастазов (ВБОМ).
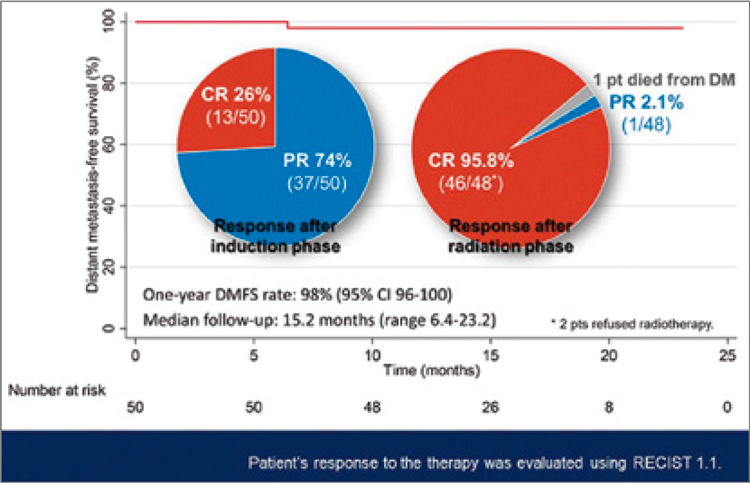
Все пациенты ответили на ИТ (ПО
26% и ЧО 74%), после завершения
ХЛТ частота ПО увеличилась до
95,8%. При медиане наблюдения
за больными 15,2 месяца 1-летняя
ВБОМ составила 98% (рис.4).
После завершения ИТ пациентам
выполнялась эндоскопическая биопсия и биопсия лимфоузлов, и
оказалось, что у 84,8% больных был
достигнут полный патоморфологический ответ со стороны первичного очага и у 50% – со стороны
лимфоузлов. У подавляющего числа больных фиксировались ТР 3-4
степеней, среди которых преобладали тошнота/рвота, нейтропения,
анемия, тромбоцитопения и сыпь.
Не было отмечено ни одного случая смерти в связи с иммунными
реакциями. Авторы исследования
делают вывод о том, что предложенный ими вариант лечения пациентов
раком носоглотки с распространенностью N3 обеспечивает высокий
показатель ВБОМ с приемлемым профилем токсичности. Однако дискутантом B.O’Sullivan было упомянуто
ранее проведенное одноцентровое исследование Shanghai, Niu et al. (2021),
в котором изучалась эффективность
комбинации ИХТ (2 цикла TPF/PF/
TP/Gp+ЛТ (IMTI) + АХТ 1-2 цикла), в
котором 1-летняя ВБОМ имела очень
схожий результат – 95%, а 5-летний
показатель составил 73%. При этом
частота ТР 3-4 степени составила 23%.
Кроме того, в дискуссии приводились
данные протокола, опубликованного
в 2019 году Fujian, о лечении больных раком носоглотки N3 (n=143)
по поддерживающей химиотерапии
пероральным фторпиримидином после ИХТ + ХЛТ. При данном подходе
3-летняя ВБОМ составила 91%, а ОВ
– 95%.
Аналогичная комбинация изучалась
не только как индукционный режим,
но и как 1 линия терапии при ранее
леченном рецидивном/метастатическом раке носоглотки [5]. Популяция
включала две когорты: 1 – платинорезистентные, но иммуно-наивные
пациенты (n=40), а 2 – иммуно-резистентные больные после как минимум 1 линии химиотерапии (n=32).
Основной целью была ЧОО. Медиана
наблюдения в 1-й когорте составила
13,1 месяца, а во 2-й когорте – 9,0 месяцев. ЧОО в 1-й когорте оказалась
65%, во 2-й когорте – 34,4%. Медиана
ВБП в 1-й когорте не достигнута, тогда как во 2-й была ограничена 6 месяцами. ТР 3 и более степеней составили
47,2% (гипертензия – 18%; повышение
трансаминаз – 13,9%; ладонно-подошвенный синдром – 12,5%). Авторы
полагают, что им удалось достичь обнадеживающих результатов, в связи с
чем планируют проведение исследования 3 фазы.
Рисунок 4.
Показатели 1-летней ВБОМ и ЧОО
при проведении ИХТ у больных раком носоглотки.
Вопросу индукционной терапии была
посвящена еще одна работа, в которой режим индукционного лечения
включал ХТ гемцитабин/цисплатин
с PD1 ингибитором тизлелизумабом
[6]. Включались пациенты (n=63) c
III-IVa стадиями (AJCC 8th) ПРГШ.
Три курса ИТ проводились в режиме
гемцитабин-цисплатин в сочетании
с тизлелизумабом 200 мг 1 раз в 3 недели с последующей ХЛТ. Первичная
цель – частота ПО после ИТ. Вторичные цели включали частоту патоморфологического ПО, 2-летнюю ВБП,
ОВ, локорегионарный контроль и
ВБОМ, а также токсичность. К февралю 2022 года медиана наблюдения
составила 7,37 месяца. К этому времени ни один из пациентов не имел
признаков прогрессирования. Частота ПО после индукционного этапа
составила 41,3%. ЧОО и патоморфологический ПО зафиксирован в 88,9%
и 75,8% соответственно. ТР и иоТР 3
и 4 степеней развились в 69,8% и 3,2%
соответственно и были представлены гепатотоксичностью или кожной
сыпью. Авторы сделали очередное
заключение о том, что изученный режим ИТ GP + тизлелизумаб позволяет достичь впечатляющего уровня ПО
и патоморфологического ПО и хорошо переносится пациентами.
Примечательным является то, что на
прошедшем конгрессе обсуждались
вопросы целесообразности проведения при раке носоглотки низкого
риска (n=338, II (75%) – III (25%) стадии T1N1M0/T2N0-1/T3N0M0 при
размере шейных лимфоузлов не более
3 см, без экстракапсулярного распространения и числа копий ДНК вируса
Эпштейн-Барра (ВЭБ) не более 4000
в мл) ХЛТ, а не самостоятельной ЛТ.
Авторы представленного абстракта [7] обосновали целесообразность
проведенного ими исследования
тем, что все предыдущие протоколы
использовали технологию D2 ЛТ, а
данных по эффективности IMRT в
настоящее время недостаточно. При
этом хорошо известно, что применение ХЛТ ведет к высокому риску
развития острой токсичности, в том
числе 5 степени. В представленном
китайском исследовании одна группа
получала ХЛТ по методике IMRT в
сочетании с 3-недельным введением
цисплатина 100 мг/м2, а экспериментальная группа только ЛТ (IMRT).
Общая доза была не менее 66 Гр (2-2,2
Гр за фракцию 5 дней в неделю). Первичной целью являлась бессобытийная выживаемость (локорегионарный рецидив/отдаленные метастазы).
Исследование вновь имело характер
non-inferiority. В группе ХЛТ 97,3%
больных удалось получить цисплатин
в дозе >200 мг/м2. Показатель 3-летней бессобытийной выживаемости
составил 90,6% против 91,9% в группе
самостоятельной ЛT и ХЛТ соответственно (HR 1,35; p=0,86). Порогом
non inferiority был заложен p<0,01.
Уровень 3-летней ОВ не отличался
между группами (98,2% и 98,6%). Не
было получено различий в локорегионарном контроле и частоте отдаленного метастазирования. ТР 3-4 степеней
ожидаемо чаще регистрировались в
группе ХЛТ: анорексия – 29% против
4,8%; мукозиты – 18,9% против 9,7%;
тошнота – 14,8% против 1,2%; лейкопения – 10,1% против 1,2%; потеря
веса – 4,7% против 0,6%. При оценке
качества жизни было показано, что в
группе самостоятельной ЛТ достоверно выше было общее состояние здоровья, социальная активность, менее
выражена общая слабость, тошнота/
рвота, болевой синдром, нарушение
сна, потеря веса, запоры. Авторы делают вывод о том, что для данной популяции больных в эру применения
методики IMRT проведение самостоятельной ЛТ в сравнении с ХЛТ является эффективным и безопасным.
Также назофарингеальному раку III
стадии низкого риска было посвящено еще одно китайское исследование
II фазы, авторы которого изучали
возможность редукции дозы ЛТ. Низкий риск определялся по исходному
уровню копий ДНК ВЭБ [8]. Стандартная доза ЛТ для рака носоглотки составляет 70 Гр, подведение которой сопряжено с высоким риском
развития значимой токсичности. В
представленной работе больным с
исходным уровнем ДНК ВЭБ менее 4000 копий в мл проводилось 2
курса индукционной химиотерапии
(ИХТ: липосомальный паклитаксел/
цисплатин/5ФУ). В случае ответа
на ИХТ (ПО/ЧО с неопределяемым
уровнем ВЭБ) 2 этапом пациентам
проводилась ХЛТ до СОД 60 Гр на
фоне введения цисплатина 100 мг/м2
в 1, 22 и 43 дни. При стабилизации
или определяемом уровне ВЭБ проводилась стандартная ХЛТ до СОД 70
Гр с аналогичным режимом введения
цисплатина. Первичной целью была
2-летняя ВБП в группе СОД 60 Гр. После ИХТ 54% больных достигли ПО/
ЧО с неопределяемым уровнем ВЭБ.
К 3 месяцам после завершения ХЛТ
все больные в обеих группах достигли
ПО. Медиана наблюдения составила
33 месяца. Показатель 2-летней БРВ
в группе 60 Гр и 70 Гр составил 95%
и 86% соответственно. К данному
сроку выживаемость без отдаленных
метастазов достигла 97% и 94%, а локорегионарный контроль – 97% и 92%
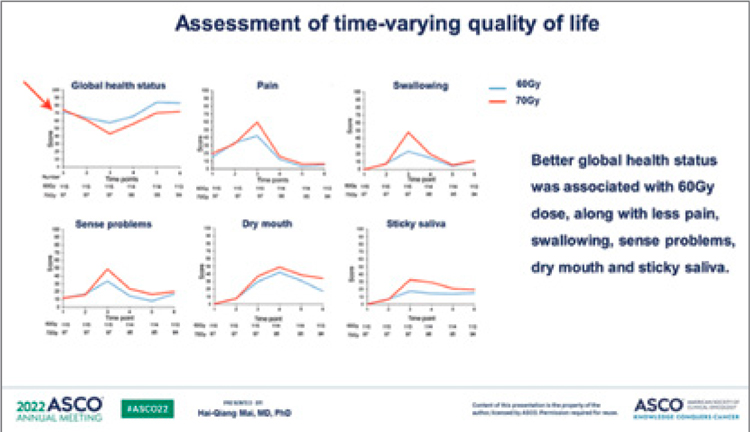
соответственно. Токсические реакции
значимых степеней реже фиксировались в группе 60 Гр (нейтропения
– 14% против 20%; мукозиты – 11%
против 21%; боль – 13% против 25%;
рвота – 4% против 15%). Проявления
поздней токсичности 3-4 степеней
регистрировались только в группе 70
Гр, среди которой наблюдались ксеростомия (4%), фиброз кожи (2%), проблемы с речью (1%), периферическая
нейропатия (1%). В целом лучшее качество жизни отмечалось в группе 60
Гр (рис.5).
Рисунок 5.
Показатели качества жизни больных раком
носоглотки при проведении ХЛТ в группах 60 Гр и 70 Гр.
Авторы делают вывод о возможности
отбора больных РН III стадии низкого
риска для проведения ХЛТ в редуцированной дозе в случае ответа на ИХТ
и снижении уровня ДНК ВЭБ до неопределяемого уровня.
Дополнительно китайские исследователи изучали эффективность бесплатинового режима 1 линии терапии
при рецидивном/метастатическом
РН [9]. Пациенты (n=41) получали
гемцитабин (1, 8 дни, максимум 6 циклов), торипалимаб (анти-PD1 агент)
и апатиниб до прогрессирования или
непереносимой токсичности. Первичной целью была безопасность. Вторичные цели включали ЧОО и ВБП.
Медиана наблюдения составила 13,4
месяца. Гематологическая, гастроинтестинальная и почечная токсичность
3-4 степени не превысила 7,3%, тогда
как частота некроза стенки носоглотки 3-4 степени составила 21,9%.
Факторами риска для данного осложнения были повторная ЛТ и начало лечения в рамках представленного
исследования менее 12 месяцев после завершения ЛТ. ЧОО составила
90,2%, медиана ВБП – 13,9 месяца, а
1-летняя ВБП – 72%. Кроме того, авторы оценили влияние генетических
характеристик опухоли на показатель
ВБП. Оказалось, что амплификация
11q13.3 и высокий уровень MRGPRF
были предикторами худшего прогноза в отношении ВБП при использовании изученного режима трехкомпонентной терапии.
Следующим направлением комбинированной лекарственной терапии
при рецидивном метастатическом
ПРГШ было изучения комбинации
иммунотерапии и таргетных препаратов. В американском исследовании
2 фазы изучалась эффективность
комбинации пембролизумаба и кабозантиниба [10]. В протокол включались пациенты, ранее не получавшие
иммунотерапию (n=34). Основной
целью была ЧОО. У 53% была установлена HPV-позитивная опухоль и
50% опухолей имели CPS≥20. ЧОО
составила 45,2%, наилучшим ответом
на терапию был ЧО. Показатель 1-летней ОВ был равен 67,7% (медиана ОВ
22,3 мес.) и 1-летней ВБП – 51,8% (медиана 14,6 мес.). При подгрупповом
анализе была отмечена зависимость
ОВ от уровня экспрессии PD-L1. Так,
при CPS≥20 мОВ составила 32,9 мес.,
тогда как при CPS<20 лишь 14,6 мес.
Режим проявил хорошую переносимость, хотя у 47% пациентов проводилась редукция дозы кабозантиниба.
Авторы делают вывод о высокой эффективности и контролируемой токсичности изученного режима, продемонстрировавшего более высокие
показатели 1-летней БРВ и ОВ в подгруппе больных CPS≥20 в сравнении
с монотерапией пембролизумабом в
исследовании KN 048 (54% и 68% против 30% и 56%).
Довольно много вопросов вызывает исследование, представленное специалистами из Tata Memorial Centre, в котором исследовалась возможность применения крайне низких доз ниволумаба у больных с предлеченным или впервые диагностированным ПРГШ [11]. Обоснованием для такого подхода авторы обозначили недоступность современных режимов лекарственной терапии для пациентов из стран с низким уровнем экономического развития. Включенные 151 пациент были рандомизированы на 2 группы: 1 группа получала метотрексат 15 мг/м2 внутрь еженедельно + целекоксиб 200 мг внутрь ежедневно + эрлотитниб 150 мг внутрь ежедневно, 2 группа – ниволумаб 20 мг в/в 1 раз в 3 недели. Основной целью являлась 1-летняя ОВ. Применение экспериментального режима привело к увеличению 1-летней ОВ с 16,3% до 43,4% (HR 0,54; р=0,035). Медиана ОВ составила 6,7 мес. против 10,1 мес. соответственно. ЧОО зафиксирована в 49,3% и 65,2% в 1 и 2 группах. Частота ТР 3-4 степеней значимо не отличалась между группами. Авторы делают вывод о возможности использования альтернативного режима введения ниволумаба при недоступности стандартных доз препарата.
Интерес представляет работа немецких исследователей, посвященная исследованию циркулирующей опухолевой ДНК после проведенного хирургического вмешательства при ПРГШ, наличие которой определяет наличие резидуальной болезни на молекулярном уровне [12]. У 58 больных с I (15,5%), II (13,8%), III (36,2%) и IV (34,5%) стадиями в пред- и послеоперационном периоде проводилось полногеномное секвенирование опухоли для определения опухолеспецифических генетических характеристик, исследовались плазма и слюна (на предоперационном этапе). Авторы определили 48 соматических вариантов генетических характеристик из собранных образцов, что позволило определить циркулирующую опухолевую ДНК (цоДНК) до операции у 94,28%. При выявлении цоДНК в послеоперационном периоде или при последующем наблюдении рецидив болезни возник в 72,7%. Время до выявления визуализируемого рецидива болезни с момента детекции цоДНК колебалось от 56 до 265 дней. Авторы полагают, что полученные результаты позволяют предположить, что в будущем исследование цоДНК будет имплементировано в клиническую практику и позволит оптимизировать лечебную стратегию.
Часть работ была посвящена вопросам неоадъювантной терапии (НАТ) при резектабельных формах ПРГШ. Так, в китайском исследовании Ib фазы изучалась эффективность комбинации химиоиммунотерапии у пациентов с ПРГШ III-IVB стадий [13]. Пациентам проводились 2 курса терапии торипалимабом (анти-PD1 агент) в сочетании с цисплатином и гемцитабином. Через 3-5 недель после завершения 2 курса выполнялась операция. Первичными целями были безопасность комбинированного лечения и соблюдение сроков выполнения хирургического этапа. Среди вторичных целей были частота патоморфологического ПО, обширного ответа, ЧОО и операции R0. Из 23 включенных пациентов 18 успешно завершили весь лечебный план. ТР 3-4 степени отмечены у 13% больных (нейтропения – 8,7%; слабость, гипергликемия, рвота и диарея – по 4,3%). Медиана времени до выполнения операции была равна 33 дням. По данным радиологического обследования ПО составил 5%, ЧО – 35%, стабилизация – 60%. Частота R0 резекций оказалась 100%. Три пациента достигли патоморфологического ПО, у 5 был получен патоморфологический обширный ответ (жизнеспособная резидуальная опухоль менее 10%) и у 5 зафиксирован патоморфологический ответ, близкий к полному (жизнеспособная резидуальная опухоль 1%). Авторы делают вывод о том, что изученная комбинация НАТ при резектабельном ПРГШ обеспечивает обширный патоморфологический ответ в 44,4%.
Интерес представляет анализ исследования Е1305, проведенный группой авторов, позволивший предложить прогностическую модель в отношении ОВ для пациентов с нерезектабельным/метастатическим ПРГШ [14]. Среди факторов, влияющих на показатель ОВ, оказались статус ECOG (1 против 0), предшествующая ЛТ, локализация первичного очага (неорофарингеальный против орофарингеального рака), метастазы в костях и печени (против другой локализации или отсутствия отдаленных метастазов). Оказалось, что пациенты с 0-2 факторами (n=249) имели медиану ОВ 15,2 мес., в то время как при наличии 2 и более факторов (n=154) медиана ОВ снижалась до 7,6 мес. (HR 2,14; p<0,0001). Авторы отмечают, что в сравнении с 5-факторной шкалой в предложенную модель включены такие характеристики, как «метастазы в печени/костях», и исключены такие факторы, как «степень дифференцировки опухоли» и «потеря веса», как не имеющие значения. Авторы заключают, что только 4 предложенных фактора следует учитывать при прогнозировании ОВ в 1 линии терапии рецидивного/метастатического ПРГШ.
Вопросам имплементации иммуноонкологических препаратов в лечение локального рецидива с повторным применением ЛТ было посвящено исследование 2 фазы группы американских авторов [15]. Основной целью исследования была оценка 1-летней ВБП, ОВ и переносимости комбинации ниволумаба с повторным назначением ЛТ при локальном рецидиве ПРГШ. Предшествующая доза ЛТ не должна была превышать СОД 40 Гр. При рецидиве повторно назначалась ЛТ до СОД 60-66 Гр (в режиме IMRT 30-33 фракции) на фоне и последующим применением ниволумаба. Из 51 включенного пациента у 31% опухоли были HPV-позитивными. При медиане наблюдения 12,5 мес. показатель 1-летней ВБП составил 57,8%, а 1-летней ОВ – 81,7%. Дополнительно у 38 пациентов измеряли уровень PD+Ki67+CD8+ T-лимфоцитов до и на фоне проведения лечения (на 0, 2 и 4 неделях). При увеличении уровня данного показателя в 1,5 раза отмечалось увеличение ОВ до 19,3 мес. (против 13,3 мес.). Среди ТР отмечались слабость (78%), дерматиты (58%), дисфагия (54%). Авторы сообщают, что исследование достигло поставленной цели.
Среди исследований I фаз представляет интерес китайское исследование, представившее первые результаты применения нового двойного иммунного ингибитора у больных раком носоглотки – анти-PD-1 IgG4 и антиCTLA4 IgG1 [16]. В процессе исследования была отобрана доза препарата 5 мг/кг 1 раз в 3 недели. В протокол было включено 110 пациентов, для которых медиана наблюдения составила 7,7 мес., 72% участников ранее получили как минимум 2 предшествующие линии лечения, причем 43,6% в том числе иммунные препараты. В общей популяции ЧОО составила 24,5%, а у больных, не получавших иммунотерапию, – 39,1%. Контроль заболевания (КЗ) был достигнут у 49,1%. Медиана продолжительности ответа оказалась близка к году – 11,7 мес. Среди пациентов со снижением уровня копий ВЭБ на 50% и более к 43 дню ЧОО была достоверно выше – 67% против 12% при снижении менее чем на 50% (р=0,0045). У 12,7% развились ТР значимых степеней (сыпь и гипотиреоидизм по 22,7%). Иммуноопосредованные ТР фиксировались у 46,4%, среди них 7,3% – 3 и более степеней. Прервать лечение из-за токсичности пришлось 9,1% пациентов. Авторы заключают, что новая молекула продемонстрировала впечатляющую активность и удовлетворительную переносимость.
Крайне востребованными для клинической практики являются результаты работы французских коллег, которые изучали эффективность комбинации таксанов ± препараты платины и цетуксимаба после прогрессирования на иммунных препаратах [17]. Из 99 пациентов 63 получили режим ТС и 36 – тройную комбинацию. У 42% опухоль имела признаки платино-рефрактерности, 13 ранее получали таксаны и 24 – цетуксимаб. ЧОО составила 62% (в группе ТС – 57% и в группе тройной комбинации – 69%), включая 5 полных ответов, а КЗ – 79%. Медиана ВБП достигла 4,4 мес., медиана ОВ – 7,5 мес. У больных, достигших ПО, длительность превысила 24 месяца. ЧОО у больных, ранее получавших цетуксимаб, составила 50% против 75% среди тех, кому ранее цетуксимаб не назначали. Для получавших/не получавших таксаны ЧОО распределилась следующим образом: 38% против 65%. Авторы делают вывод о том, что комбинация таксанов и цетуксимаба является высокоэффективной у больных, прогрессирующих на иммунотерапии.
Роль индукционной химиотерапии изучалась в китайском исследовании у больных HPV+/- орофарингеальном раке II-IVB стадий [18]. Авторы поставили цель оценить влияние ответа на ИХТ на показатель ОВ. С 2010 по 2020 годы 108 пациентам (51 больной с HPV+ и 57 больных с HPV-) проводилась ИХТ таксанами и препаратами платины с последующей ХЛТ. ЧОО в общей популяции составила 55,6%, для HPV+/- 62,7% против 49,1%. При HPV+ опухолях была отмечена более высокая ЧОО – 62,7% против 49,1% при HPV-. Ответ на ИХТ ассоциировался с более высоким показателем ОВ как в общей популяции (3-летняя ВБП 91,7% против 43,7%, P<0,001; 3-летняя ОВ 98,3% против 67,4%, P=0,002), для HPV+ подгруппы 3-летняя ВБП – 94,7% против 47,9%, P<0,001; 3-летняя ОВ – 100% против 73,5%, P=0,055, а для HPV- подгруппы 3-летняя ВБП – 88,2% против 40,9%, P=0,001; 3-летняя ОВ – 96,4% против 63,1%, P=0,026. Мультивариантный анализ показал, что ответ на ИХТ является независимым фактором прогноза в отношении 3-летней ВБП (HR 0,088; P<0,001) и 3-летней ОВ (HR 0,100; P=0,004).
Эффективность другой комбинации в качестве ИХТ, вновь китайских исследователей, была изучена в рамках исследования 2 фазы IMplus [19]. Привычная комбинация кармелизумаба и апатиниба в объеме 2 циклов применялась у 18 пациентов с не леченным ПРГШ (орофарингеальный рак – 8, рак полости рта – 9, рак гортаноглотки – 1). У 6 (33%), 3 (17%), и 9 (50%) пациентов установлены III, IVA и IVB стадии соответственно. После ИХТ 6 участников достигли ПО, 9 – ЧО, 3 – стабилизации, т.е. ЧОО составила 83%. В настоящее время в исследование запланировано дополнительное включение 14 пациентов. Двум пациентам (11%) с ЧО на 2 этапе выполнено хирургическое лечение и адъювантная ХЛТ, а 16 (89%) были подвергнуты радикальной ЛТ. При медиане наблюдения 18 месяцев был зафиксирован рецидив только у 1 больного. Среди токсических реакций наблюдалась гипертензия (56%), боль в полости рта (50%), увеличение АСТ и АЛТ (28%). И вновь авторы делают вывод о том, что кармелизумаб с апатинибом в качестве ИХТ при местнораспространенном ПРГШ демонстрирует обнадеживающую эффективность с приемлемым профилем токсичности.
Интерес к высокой чувствительности HPV+ опухолей лег в основу работы, представленной американскими авторами [20]. Они исследовали эффективность и безопасность комбинации новой молекулы PDS0101, содержащей особым образом созданные неоантигены HPV16, которые демонстрируют высокую противоопухолевую активность при совместном применении с чекпойнт ингибиторами, путем усиления активности интерферонов I типа, приводящих к активации процесса антигенпрезентации. В результате формируется высокий уровень многофункциональных HPV16-специфических CD8 и CD4 T-лимфоцитов. Протокол 2 фазы VERSATILE-002 включал комбинацию PDS0101 и пембролизумаба, которая применялась как у иммуно-наивных, так и у рефрактерных к иммунотерапии пациентов с рецидивным/метастатическим HPV16-ассоциированным ПРГШ. На конгрессе был представлен предварительный анализ безопасности и эффективности у иммуно-наивных пациентов (n=18). Пембролизумаб назначали в дозе 200 мг 1 раз в 3 недели + подкожно вводили PDS0101 в 1 день 1-4 циклов и на 12 цикле; пембролизумаб продолжали до 35 циклов, прогрессирования или непереносимой токсичности. Помимо HPV16+ опухоли имели CPS score ≥1. К моменту проведения анализа 17 (94%) участники получили 4 или более доз PDS0101 и пембролизумаба. Не было отмечено токсичности 3 и более степеней. Частота клинического эффекта (ПО + ЧО + Стабилизация) отмечены у 13 (72,2%) больных: ЧОО – у 7 (38,9%; 2 ПО, 5 ЧО); стабилизация – у 6 (33,3%), прогрессирование – у 3 (16,7%). К 9 месяцам ВБП и ОВ составили 52% и 81% соответственно; медиaны ВБП и ОВ достигнуты не были. Авторы сделали заключение о том, что комбинация PDS0101 и пембролизумаба продемонстрировала высокий уровень безопасности и предварительную эффективность у иммуно-наивных пациентов с HPV-ассоциированным ПРГШ.
Китайским коллективом была предпринята очередная попытка провести сравнительную оценку двух стратегий при местнораспространенном раке носоглотки [21]. В равных долях 266 пациентов были разделены на 2 группы: 1-я (исследовательская, n=133) получала 3 курса ИХТ в режиме TPF (доцетаксел/цисплатин/5-ФУ) с последующей ХЛТ с тремя введениями цисплатина 100 мг/м2, а 2-я (контрольная, n=133) получала на 1 этапе ХЛТ с 3 введениями цисплатина 100 мг/м2 и последующими 3 курсами АПХТ, но двойной комбинацией цисплатин/5ФУ (без доцетаксела). Медиана наблюдения составила 19 месяцев, 129 пациентов в исследовательской и 124 в контрольной группе были оценены в отношении эффективности и токсичности. Показатель 2-летней ОВ составил 91,7% и 90,5%, 2-летней ВБП – 92,4% и 90,4% соответственно, статистических отличий зафиксировано не было (p>0,05). В исследовательской группе реже наблюдались лучевые мукозиты, сухость рта и дисфагия (p<0,05), в то время как чаще отмечены лейкопения, нейтропения, снижение гемоглобина рвота (p<0,05). Заключая, авторы отмечают равные возможности использования обеих лечебных стратегий.
В целом можно отметить, что исследований, меняющих клиническую практику, на прошедшем конгрессе в разделе ПРГШ представлено не было.
Литература:
1. Haderlein M, Grun J, et al. DeIntensification of postoperative radiotherapy in head and neck cancer independent of human papillomavirus status – Results of a prospective multicentre phase II trial (DIREKHT Trial, NCT02528955). (Abstract 6009).
2. Homma A, Matsuura K, et al. Dose finding and efficacy confirmation trial of the superselective intra-arterial infusion of cisplatin and concomitant radiotherapy for locally advanced maxillary sinus cancer (JCOG1212): Results of the efficacy confirmation phase in the T4a cohort. (Abstract 6014).
3. Singh Ajaykumar, et al. Phase 3 randomized study comparing docetaxelplatinum with docetaxel-platinum-5 fluoruoracil as neoadjuvant in chemotherapy in technically unresectable oral cancer. (Abstract 60013).
4. Liang H, Wang L, et al. Efficacy and safety of carmelizumab and apatinib with induction chemotherapy and concurrent chemoradiotherapy for stage TanyN3M0 nasopharyngeal carcinoma (a phase II QUINTUPLED trial). (Abstract 6012).
5. Lin-Quan Tang, Guo-Dong Jia, xiaoFei Lv, Siyi Xie, et al. Efficacy and safety of camrelizumab combined with apatinib in previously treated recurrent or metastatic nasopharyngeal carcinoma: A phase II clinical trial. (Abstract 6042).
6. Chen Q-Y, Mai H-Q, Tang L-Q, et al. Neoadjuvant chemotherapy plus tislelizumab followed by concurrent chemoradiotherapy in patients with locoregionally advanced nasopharyngeal carcinoma: A single-arm, phase II trial. (Abstract 6068).
7. Ma J. Radiotherapy alone versus concurrent chemoradiotherapy in low-risk nasopharyngeal carcinoma: a randomized non-inferiority, open-label, multicenter phase III trial. (Abstract 6000).
8. Mai H-Q. Reduced-dose radiotherapy for pretreatment EBV DNA selected lowrisk stage III nasopharyngeal carcinoma: A single-arm, phase II trial. (Abstract 6002).
9. Chen M, Rui Y, Zou X, et al. Comprehensive immune landscape and molecular characteristics of clinical responses to chemotherapy, antiangiogenic agents, and PD-1 inhibitors in recurrent or metastatic nasopharyngeal carcinoma. (Abstract 6028).
10.Saba NF, Ekpenyong A, et al. A phase II trial of pembrolizumab and cabozantinib in patients (pts) with recurrent metastatic head and neck squamous cell carcinoma (RMHNSCC). (Abstract 6008).
11.Patil VM, Noronha V, et al. Phase 3 randomised study evaluating the addition of low-dose nivolumab to palliative chemotherapy in head and neck cancer. (LBA 6016).
12.Flach S, Howarth K, et al. Liquid Biopsy for Minimal Residual Disease Detection in Head and Neck Squamous Cell Carcinoma (LIONESS): A personalized cell-free tumor DNA analysis for patients with HNSCC. (Abstract 6017).
13.Liu Z, Huang X, et al. Neoadjuvant toripalimab combined with gemcitabine and cisplatin in resectable locally advanced head and neck squamous cell carcinoma (NeoTGP01): An open label, single-arm, phase Ib clinical trial. (Abstract 6023).
14.Argiris A, Flamand Y, Savvides P, et al. A new prognostic model in patients with recurrent or metastatic head and neck cancer treated with chemotherapy: An analysis of ECOG-ACRIN E1305. (Abstract 6026).
15.Saba NF, McDonald MW, et al. A209-9KY: Results of a phase II study of intensity modulated radiotherapy (IMRT) re-irradiation and concurrent/adjuvant nivolumab (nivo) in patients with locoregionally recurrent or second primary (RSPT) head and neck squamous cell carcinoma (HNSCC). (Abstract 6029).
16.Zhao H, Huang Y, Fang W, Ma Y, et al. Efficacy and safety of QL1706, a novel dual immune checkpoint blockade containing a mixture of anti-PD1 IgG4 and anti-CTLA4 IgG1 antibodies, for advanced nasopharyngeal carcinoma (NPC): Pooled cohort data from phase 1a/1b trials. (Abstract 6034).
17. Saleh K, Vinches M, Safta I, et al. Taxanes plus cetuximab with or without platinum chemotherapy after progression on immune checkpoint inhibitors in patients with squamous cell carcinoma of the head and neck. (Abstract 6036).
18.Zhang Q, Zhou X, Xu T, Shen C, et al. The impact of induction chemotherapy response to survival outcomes in oropharyngeal cancer. (Abstract 6040).
19.Lulu Ye, Lin Zhang, Rongrong Li, Shengjin Dou et al. Camrelizumab plus apatinib as induction therapy for locally advanced head and neck squamous cell carcinoma (IMplus): A single-arm phase II study. (Abstract 6060).
20.Weiss J, Chintakuntlawar AV, Price KAR, et al. PDS0101, a novel type I interferon and CD8 T-cell activating immunotherapy, in combination with pembrolizumab in subjects with recurrent/ metastatic HPV16-positive head and neck squamous cell carcinoma (HNSCC). (Abstract 6041).
21.Qianyong H. TPF induction
chemotherapy versus PF adjuvant
chemotherapy plus concurrent
chemoradiotherapy for locoregionally
advanced nasopharyngeal carcinoma: A
multicenter, randomized controlled, III
trial. (Abstract 6069).
Цикл вебинаров ДЛЯ ПОДГОТОВКИ К ЭКЗАМЕНУ ESMO

НОВОСТИ ASCO 2022. РАК ТОЛСТОЙ КИШКИ: ПРОРЫВ ИЛИ ПЛАНОМЕРНАЯ РАБОТА?
Автор: Федянин Михаил Юрьевич
Руководитель химиотерапевтической службы ГБУЗ «ММКЦ «Коммунарка» ДЗМ»,
научный консультант ФГБУ «Национальный медикохирургический Центр им. Н.И. Пирогова»
Министерства здравоохранения РФ, доктор медицинских наук, Москва
В течение последних пяти лет в разделе лечения пациентов, в первую
очередь, метастатическим колоректальным раком существенных прорывов не отмечалось, за исключением дальнейшего субтипирования
пациентов на отдельные подгруппы
и назначения персонализированной
терапии лишь небольшой доле больных (MSI, mBRAF, гиперэкспрессия
Her-2/neu). В этом году, напротив,
именно доклады, посвященные лечению больных раком толстой кишки,
стали украшением конгресса – были
расставлены точки во многих спорных вопросах, поставлены под сомнения принятые методы лечения,
сделаны рекомендации по изменению существующих практик.
Неоадъювантная терапия
при раке толстой кишки, или
всегда ли нужны хирурги
В лечении рака прямой кишки отмечена нарастающая тенденция к проведению полного курса неоадъювантной химиотерапии как в комбинации
с лучевой терапией, так и в самостоятельном варианте. В то же время следует понимать, что это не взаимозаменяемые подходы, а каждый из них
приемлем для определенных клинических ситуаций. В одних случаях,
особенно при низко расположенных
опухолях, где главная цель – добиться
полного клинического эффекта, повидимому, необходимо провести пролонгированный курс химиолучевого
лечения с последующим консолидирующим курсом химиотерапии в течение 16-18 недель, чтобы увеличить
вероятность достижения полного
клинического эффекта или шанса выполнения сфинктер-сохранной операции. В других случаях, когда опухоль расположена высоко или даже
в среднеампулярном отделе и нет
значимых факторов риска (cT<3b),
онкологи уверены в качественном
исполнении оперативного лечения,
неоадъювантная терапия может вообще не понадобиться. В большинстве ситуаций можно рассмотреть
проведение гипофракционированного курса лучевой терапии с последующей химиотерапией с включением
оксалиплатина и фторпиримидинов
в течение 16-18 недель. Однако хирургия по-прежнему оставалась для
большинства пациентов неотъемлемой частью лечения, тем более при
ранних стадиях [1].
В 2021 году были озвучены предварительные результаты исследований,
посвященных возможности проведения неоадъювантной химиотерапии
при ранних стадиях рака прямой
кишки с целью уменьшения объема
хирургического лечения. В исследовании NEO при раке прямой кишки
cT1-T3a/bN0 без факторов риска проводилось 12 недель химиотерапии с
включением оксалиплатина и фторпиримидинов, при прогрессировании
выполнялась тотальная мезоректумэктомия; при наличии эффекта выполнялась трансанальная эндоскопическая хирургия, при подтверждении
выраженного патоморфологического
эффекта (ypT0-1) пациентов переводили под динамическое наблюдение;
при неполном патоморфологическом
эффекте планировалось выполнение тотальной мезоректумэктомии.
И хотя авторы не выполнили запланированную статгипотезу по достижению органосохранного подхода у
не менее 65% больных (достигнуто
у 57%), если учесть пациентов, которые даже при патоморфологической
стадии > ypT1 отказались от операции, органосохранный подход был
реализован у 79% пациентов. Данных по выживаемости еще не представлено [2]. В этой связи интересны
и результаты исследования WW2, в
котором также при ранних стадиях
(cT1-3N0-1) дистально расположенных опухолей (до 6 см) проводился
пролонгированный курс лучевой
терапии на фоне приема капецитабина (СОД 62 Гр), и при достижении
полного клинического эффекта пациентов оставляли под динамическим
наблюдением. Авторы сообщили о
83,3% полных клинических эффектов.
Как и в предыдущей работе, не сообщалось об отдаленных показателях
выживаемости [3]. В этом году представлены два уже рандомизированных проспективных исследования с
попыткой ограничения необходимости выполнения тотальной мезоректумэктомии при небольших опухолях
прямой кишки. Так, в исследование II
фазы (STAR-TREC) включались пациенты с опухолью mrT1-T3b (≤5 мм
экстрамурального распространения)
N0M0, без признаков сосудистой инвазии, без вовлечения мезоректальной фасции. В контрольной группе
пациентам выполнялась тотальная
мезоректумэктомия. В исследуемой
группе на первом этапе проводилась
лучевая терапия в виде короткого
курса (5×5 Гр) или пролонгированного курса (СОД 50,4 Гр на фоне приема
капецитабина) с оценкой эффекта через 11-13 недель с момента окончания
лучевого лечения; в случае неудовлетворительного ответа выполнялась
тотальная мезоректумэктомия, а в
случае уменьшения опухоли обследование повторяли на 16-20 неделе и
при подтверждении полного клинического ответа переводили пациента под динамическое наблюдение. В
случае отсутствия полного эффекта
на 16-18 неделе выполнялось трансанальное иссечение опухоли. Всего в
исследование было включено 120 пациентов в отношении 1:2 в пользу исследуемой группы. Из 78 пациентов,
которые были включены в исследовательскую группу, недостаточный эффект на лучевом лечении отмечен у 7
пациентов (9%), полный клинический
эффект реализовался на 16-20 неделе
у 38 пациентов (49%), еще 32 пациентам (41%) выполнено локальное иссечение опухоли. Исследование было
направлено на оценку возможности
реализации данного дизайна и включения за 2 года 120 пациентов, поэтому статистического сравнения по
показателям эффективности между
группами не проводилось. Тем не менее, в группе стандартного хирургического подхода значимые осложнения
в послеоперационном периоде развились у 17,5% пациентов, а наличие
колостомы через год с момента начала
лечения отмечалось у 27,5%, показатель двухгодичной выживаемости
без признаков болезни составил 88%.
В исследуемой группе удалось избежать выполнения тотальной мезоректумэктомии в течение 2 лет у 58,8%
пациентов; частота осложнений в послеоперационном периоде составила
11,2%, наличие стомы на сроках до 2
лет зарегистрировано у 17,5% пациентов, двухгодичная выживаемость без
признаков болезни составила 80,5%.
Причем прогрессирование реализовалось в большей степени в виде
развития отдаленных метастазов, так
как двухгодичная выживаемость без
локального роста опухоли была сопоставима в сравниваемых группах
– 98,6% в рукаве органосохранного лечения и 97,2% при стандартном подходе [4]. Эти результаты позволили
инициировать III фазу исследования
с дизайном не меньшей эффективности органосохранного подхода, набор
в которое продолжается. Однако создается впечатление о более высоком
риске прогрессирования в группе без
хирургического пособия. Поэтому
тот или иной вариант хирургии все
же важен. И в этой связи интересны
результаты второго исследования,
результаты которого представлены
на ASCO 2022 в аналогичной группе
пациентов. В исследование TAUTEM
включались пациенты с опухолью
прямой кишки mrT2-3N0M0, с максимально возможной глубиной инвазии
в клетчатку не более 5 мм, диаметром
не более 4 см и локализацией не выше
10 см от анального края. Было рандомизировано 173 пациента в группы тотальной мезоректумэктомии и
органосохранного лечения, которое
заключалось в проведении лучевой
терапии по пролонгированной программе (СОД 50,4 Гр) на фоне приема
капецитабина с последующим (через
8 недель) локальным иссечением образования. Авторы работы хотели
доказать неменьшую эффективность
органносохранного подхода группе с
хирургией в отношении двухгодичного показателя частоты локального
рецидивирования (граница неменьшей эффективности составила 10%).
Пока сообщено о непосредственных
эффектах: частота полных патоморфологических ответов в группе химиолучевого лечения составила 44,3%,
также значимо уменьшилась частота
послеоперационных осложнений [5].
Если в дальнейшем докажут неменьшую эффективность такого подхода,
то, возможно, стандарты лечения раннего рака прямой кишки изменятся.
Но в некоторых подгруппах пациентов с опухолью данной локализации
стандарты меняются уже сейчас. Это
произошло, когда сообщили результаты проспективного исследования
по самостоятельной терапии антиPD1 антителом достарлимабом пациентов с местнораспространенным
раком прямой кишки, ассоциированным с наличием дефицита в системе
неспаренных оснований или микросателлитно нестабильным фенотипом еще на ASCO GI зимой 2022 года,
окончательные результаты которого
были отмечены отдельной сессией в
рамках ASCO 2022. Всего в проспективное нерандомизированное исследование было включено 14 пациентов,
так как статистическая гипотеза подразумевала достижение не менее 25%
объективных эффектов. Кроме частоты объективных эффектов, в качестве
дополнительных первичных конечных точек рассматривалась одногодичная частота полных клинических
и патоморфологических эффектов.
Исследователи перед запуском проекта планировали в случае наличия
резидуальной опухоли после завершения 9 трехнедельных курсов иммунотерапии проводить химиолучевое
и, при необходимости, хирургическое
лечение. Однако при оценке эффекта
лечения достарлимабом на 28 неделе
у всех включенных пациентов был зарегистрирован полный клинический
ответ, и все пациенты были оставлены под динамическим наблюдением.
Следует отметить, что все больные,
кроме одного, имели клиническое поражение метастазами регионарных
лимфоузлов, только у 4 пациентов
первичная опухоль имела индекс T1-
2. При медиане наблюдения в 6,8 мес.
(от 0,7 до 23,8 мес.) прогрессирование болезни не зарегистрировано ни
у одного из пациентов [6]. Несмотря
на то, что рецензент исследования говорил о необходимости проведения
рандомизированного проспективного исследования, уже сейчас возможно рассматривать данную опцию
в рамках клинической практики с
целью достижения полного клинического эффекта без применения лучевой терапии, химиотерапии и без
хирургического пособия. Пока нет
данных по выживаемости без признаков болезни, но здесь мы можем
сориентироваться по отдаленной
выживаемости среди больных резектабельными стадиями рака толстой
кишки с микросателлитно-нестабильным фенотипом после проведения неоадъювантной иммунотерапии
в исследовании NICHE. В данной работе пациентам со II-III стадией рака
ободочной кишки на первом этапе
проводилась терапия одним курсом
режима ипилимумаб (1 введение) с
ниволумабом (2 введения). Пациенты
были разделены на 2 когорты – с MSI
(n=32) и MSS (n=31) фенотипом опухоли. В группе с MSI у 41% больных
был выявлен синдром Линча. Частота
полных патоморфологических эффектов составила 69% в группе MSI
(среди пациентов с синдромом Линча
в 12 из 13 случаях; без герминальных
мутаций в генах системы MRR – 10 из
19) и 13% в группе MSS. В последней
группе только у 2 пациентов зарегистрировано прогрессирование через
10 и 12 месяцев после операции; в
группе с MSI все пациенты живы без
признаков заболевания [7].
Данные результаты обнадеживают не
только в контексте длительной выживаемости без признаков болезни у
пациентов с MSI, но и в возможности
неоадъювантной терапии при ранних
стадиях рака толстой кишки и MSS
фенотипе. Тем не менее, встает вопрос, насколько необходимо добавление неоадъювантной иммунотерапии
при операбельном раке ободочной
кишки, так как мы знаем, что наличие
нарушений в системе неспаренных
оснований определяет благоприятный прогноз при II стадии болезни
с факторами риска и зачастую не
требует даже проведения адъювантной терапии. Но в этой связи можно
вспомнить результаты совместного
анализа индивидуальных данных 12
рандомизированных исследований,
посвященных изучению адъювантной химиотерапии при раке толстой
кишки, в котором благоприятное прогностическое влияние MSI терялось
уже при индексе N2 в III стадии болезни [8]. Кроме этого, на ASCO 2022
были представлены тезисы авторов из
США, в которых были собраны 9634
пациентов со второй стадией рака
толстой кишки и MSI, клинические
факторы риска прогрессирования
выявлены у 2538 пациентов (26%),
среди них у 505 больных выявлены 2
и более факторов риска. При многофакторном анализе подтверждено
отсутствие негативного влияния на
прогноз при MSI лимфоваскулярной
инвазии и низкой степени дифференцировки. Однако периневральная
инвазия, изучение менее 12 лимфоузлов, R1 резекция и стадия T4N0M0
сохраняли независимое отрицательное влияние. Более того, 5-летняя
общая выживаемость составила при
отсутствии факторов риска 77%, при
1 факторе риска – 66%, 2 фактора риска – 54%. При этом на всей популяции пациентов химиотерапия увеличивала ОВ (HR 0,76; p<0,0001), хотя у
пациентов моложе 60 лет проведение
адъювантной химиотерапии ухудшало ОВ (HR 1,4; p=0,0156) [9]. Все это
говорит о том, что в случае T4N0M0,
периневральной инвазии, изучении
менее 12 лимфоузлов, R1 резекции
или наличия 2 и более факторов риска
следует рассматривать адъювантную
химиотерапию при II стадии болезни и микросателлитно нестабильном
фенотипе опухоли в объеме 4 курсов
режима XELOX, но, с другой стороны,
показывает ориентировочную популяцию пациентов даже при раке ободочной кишки, у которых можно изучать эффективность неоадъювантной
иммунотерапии. А вот что делать при
достижении полного клинического
эффекта, критерии которого не разработаны, при раке ободочной кишки
на фоне иммунотерапии – оставлять
под наблюдением или оперировать –
неизвестно.
Адъювантное лечение
при раке толстой кишки,
или всегда ли нужны
химиотерапевты
Одним из основных событий ASCO
2022 явилось сообщение результатов первого рандомизированного
проспективного исследования по
изменению тактики назначения
адъювантной химиотерапии при II
стадии рака толстой кишки на основании данных циркулирующей
опухолевой ДНК (цДНК) после
операции.
Источником циркулирующей в
крови цДНК являются погибшие
клетки опухоли вследствие некроза, фагоцитоза, апоптоза или активной секреции [10]. Основными
методами исследования опухолевой цДНК в крови являются определение мутаций и метилирование участков ДНК, свойственных
опухолевым клеткам рака толстой
кишки в ДНК плазмы крови. Соответственно, было выдвинуто
предположение, что если после радикальной операции при ранних
стадиях болезни в крови будет выявляться цДНК, у таких пациентов
опухолевая ткань еще представлена в организме, и она может явиться источником прогрессирования.
При проведении проспективных
исследований данная теория наиболее ярко подтвердилась именно
при II стадии заболевания. Так,
было проспективно оценено прогностическое значение мутационных изменений опухолевой цДНК,
взятой через 4-10 недель после операции у 250 больных раком толстой
кишки II стадии. У 7 из 9 (77,8%)
больных с позитивной цДНК после оперативного лечения развилось прогрессирование заболевания, тогда как в случае отсутствия
цДНК в плазме крови после хирургического вмешательства прогрессирование заболевания развилось
лишь у 7 из 103 (6,8%) больных, и
наличие опухолевой цДНК было
значимо ассоциировано с короткой
безрецидивной выживаемостью
(ОР 25,7; p<0,001). При этом в группе больных, которым проводилась
адъювантная химиотерапия, выживаемость больных позитивных
по цДНК в послеоперационном
периоде увеличилась, тогда как в
группе отрицательных по цДНК не
менялась, в сравнении с пациентами, которым адъювантная химиотерапия не проводилась. Авторы
работы сделали вывод о возможности оценки уровня опухолевой
цДНК в крови пациента в плане
предсказания риска прогрессирования болезни [11]. В дальнейшем
было большое число исследований,
подтвердивших данные закономерности и при III стадии рака толстой
кишки, и после метастзэктомий, и
при других нозологиях. Запущены
большие рандомизированные исследования по возможности деэскалации или наоборот эскалации
адъювантного лечения в зависимости от наличия или отсутствия
цДНК. И именно группе авторов
из Австралии, которые одними из
первых сообщили о возможности
клинического применения цДНК
с целью выявления минимальной
резидуальной болезни при II стадии, выпала честь первыми завершить и опубликовать в этом году
результаты рандомизированного
исследования.
В исследовании DYNAMIC 441 пациент со II стадией рака толстой
кишки был рандомизирован в отношении 1:2 в группы стандартного назначения адъювантной химиотерапии по наличию клинических
факторов негативного прогноза
и исследовательского подхода: в
случае отсутствия цДНК на 4 и 7
неделе после операции – динамическое наблюдение, в случае наличия цДНК в одном из 2 заборов
крови – проведение адъювантной
химиотерапии. Основными целями исследования были доказать,
что исследовательский подход не
менее эффективен в отношении
2-летней безрецидивной выживаемости (границы неменьшей эффективности – 8,5%), но при этом
позволит уменьшить число пациентов, которым проводится адъювантная химиотерапия (с 30% до
10%). Выбор режима адъювантной
химиотерапии был дан на откуп
врачам-исследователям. В итоге в
контрольной группе химиотерапия
была назначена 28%, из них в 90%
– фторпиримидинами в монорежиме; в исследуемой группе послеоперационное лечение назначалось
значимо реже – только 15% пациентам (p=0,0017), в большинстве
своем с комбинацией оксалиплатина и фторпиримидинов. При этом
в группе клинически низкого риска
шанс назначения адъювантной химиотерапии между группами был
одинаков (RR 1,2; 95% ДИ 0,57-2,5),
а в группе высокого риска значимо
ниже (RR 2,14; 95% ДИ 1,48-3,21).
Показатели безрецидивной выживаемости не различались, и на
сроках наблюдения 2 года неменьшая эффективность была доказана:
93,5% в группе биомаркерного выбора терапии и 92,4% в контрольной группе (95% ДИ для различий
в 1,1% от –4,1% до 6,2%). Исследователи не представили данных по
сравнению обоих подходов по выживаемости в отдельных прогностических подгруппах [12]. Тем не
менее, это первое проспективное
рандомизированное позитивное
исследование в онкологии такого
масштаба, доказывающее клиническую применимость цДНК не
только как прогностического маркера, но и как маркера выбора адъювантного лечения.
Второй вопрос, который регулярно
обсуждается, особенно на конференциях онкопроктологов, – потенциальная эффективность неоадъювантной химиотерапии при
раке ободочной кишки. И если
при местнораспространенном раке
прямой кишки проведение неоадъювантной химиотерапии с лучевым компонентом или без него в
отсутствие данных в пользу увеличения продолжительности жизни
рассматривается как метод снижения стадии болезни, снижения
риска местного рецидива и повышения шанса достижения полного
клинического эффекта с последующим отказом от операции, то эффективность неоадъювантного лечения при раке ободочной кишки
должна рассматриваться в первую
очередь в контексте увеличения
общей выживаемости. К настоящему времени стандартным подходом у пациентов с резектабельным
локализованным раком ободочной
кишки является хирургическое
лечение. Пациентам с III стадией
заболевания (поражение регионарных лимфатических узлов) обязательно проведение адъювантной
химиотерапии с включением оксалиплатина и фторпиримидинов в
течение 3 или 6 мес. Это позволяет
добиться значимого абсолютного
выигрыша в длительной выживаемости без прогрессирования и общей выживаемости, достигающего
20-23% и 15-18% соответственно
[13]. Поэтому явно всем пациентам
не требуется проведение данного
подхода в результате или неправильного стадирования вследствие
не 100% чувствительности диагностических методов, или возможности деэскалации адъювантного
лечения. Тем не менее, все ждали
результатов проспективных рандомизированных исследований.
В рандомизированном исследовании III фазы FOxTROT было 4
рукава: в группе I проводилась неоадъювантная терапия по схеме
FOLFOX или XELOX на протяжении 6 недель с последующей хирургией и 18 недель адъювантной химиотерапии по аналогичной схеме;
в группе II на предоперационном
этапе еще добавлялся панитумумаб (при «диком типе» гена KRAS);
в группе III на 1-м этапе выполнялась хирургия с последующими 24
нед. адъювантной химиотерапии
по схеме FOLFOX или XELOX; в
группе IV лечение проводилось как
в группе III, только с добавлением
панитумумаба на первых 3 курсах
(при «диком типе» гена KRAS).
Было рандомизировано 1052 пациента с клинической стадией T3 с
факторами риска и экстрамуральным распространением ≥5 мм или
Т4 по данным КТ. В связи с неэффективностью добавления панитумумаба в дальнейшем анализ проводился по совокупности 1-2-го
и 3-4-го рукавов. В итоге в группе
неоадъювантной химиотерапии
частота выполнения R0-резекций
была выше: 93,1% против 88,4% в
группе хирургии (р=0,001). Однако значимых различий в 2-летних
показателях выживаемости без
признаков болезни отмечено не
было (21% в группе неоадъювантного лечения против 27% в группе контроля, ОР 0,77; р=0,11) [14].
На ASCO 2022 были представлены
результаты еще одного исследования III фазы (OPTICAL) по оценке
эффективности более продолжительного курса неоадъювантной
химиотерапии по схеме FOLFOX
или XELOX (12 недель до операции и 12 недель после операции)
у пациентов со стадией рака ободочной кишки cT4 или сT3 с глубиной инвазии ≥5 мм по данным
компьютерной томографии. В контрольной группе на первом этапе
проводилось хирургическое лечение с последующей адъювантной
химиотерапией на протяжении
24 недель. Основным критерием
эффективности выбрана 3-летная
выживаемость без признаков болезни. Было рандомизировано 752
пациента. И снова, несмотря на
большее число полных патоморфозов (7% против 0%), большую
частоту показателей pN0 (69% против 54%) в группе неоадъювантной
химиотерапии, улучшить основной критерий эффективности не
удалось (78,4% против 76,6%; ОР
0,78; 95% ДИ 0,55-1,1; р=0,16). Наилучшие результаты выживаемости
при неоадъювантном лечении получены в группе пациентов с возрастом менее 50 лет (ОР 0,56; 95%
ДИ 0,33-0,96) и женского пола (ОР
0,54; 95% ДИ 0,31-0,93), в отличие
от исследования FOXTROT, в котором выигрывали пациенты с левосторонней локализацией опухоли.
В то же время показатели общей
выживаемости были выше в группе неоадъювантного лечения (ОР
0,43; 95% ДИ 0,22-0,83; р=0,01) [15].
По совокупности данных обоих
исследований можно сказать, что
для всех пациентов рекомендовать
проведение неоадъювантной химиотерапии при раке ободочной
кишки не следует, тем не менее в
арсенале мультидисциплинарной
команды и в клинических рекомендациях такую опцию следует
иметь, особенно в контексте опухолей с индексом Т4b.
Метастатический рак
толстой кишки – главное
не перелечивать?
Несмотря на то, что еще в 2020
году были представлены результаты рандомизированного исследования, которое показало, что удаление бессимптомной первичной
опухоли при неоперабельном метастатическом раке толстой кишки не приводит к улучшению ни
общей выживаемости (ОР 1,1; 95%
ДИ 0,76-1,59; р=0,69), ни выживаемости без прогрессирования (ОР
1,08; 95% ДИ 0,77-1,5), но при этом
было ассоциировано со значимым
увеличением частоты нежелательных явлений 3-4 степени при проведении химиотерапии, скепсис
в среде хирургов к данной работе
сохранялся [16]. Шли дискуссии о
высокой послеоперационной летальности, азиатской популяции
больных, о совершенствовании
хирургических методик, необходимости дождаться результатов
других рандомизированных исследований, которые посвящены
данному вопросу. И в этом году
были представлены результаты
еще одного рандомизированного
исследования III фазы, в которое
было включено 393 пациента с
нерезектабельными метастазами
рака толстой кишки. В отличии
от японского исследования, данная работа была проведена в Германии, разрешалось проводить
системную терапию по любой
схеме, выбранной исследователем.
Несмотря на перечисленные отличия, удаление первичной опухоли
и в этом исследовании не улучшило результатов общей выживаемости (16,7 мес. против 18,6 мес.
в группе без операции; ОР 0,946;
95% ДИ 0,74-1,209; р=0,658). В то
же время в группе хирургического
лечения отмечалась меньшая частота осложнений со стороны желудочно-кишечного тракта (4,8%
против 10,7%; р=0,031). В группе
без хирургического лечения частота развития кишечной непроходимости в процессе химиотерапии составила 8,7% [17]. Таким
образом, по совокупности данных
можем сделать очередной раз вывод, что стремиться удалять бессимптомную первичную опухоль
при неоперабельных метастазах
рака толстой кишки у каждого
больного не нужно.
В вопросе выбора системной терапии в первой линии лечения метастатического рака толстой кишки
оставался ряд вопросов, в частности, что лучше назначать – интенсивный режим химиотерапии
(FOLFOXIRI) или стандартный
режим в виде химиотерапевтических дуплетов применять в первой линии; что лучше – бевацизумаб или анти-EGFR антитела при
wtRAS, wtBRAF и левосторонней
локализации опухоли?
Начнем со второго вопроса. По
результатам метаанализа 3 рандомизированных исследований по
сравнению анти-EGFR антител и
бевацизумаба совместно с дуплетами химиотерапии (FOLFOX/
FOLFIRI) среди пациентов с
wtRAS при назначении цетуксимаба или панитумумаба увеличивается частота объективных
эффектов и общая выживаемость,
но не выживаемость без прогрессирования, особенно при левосторонней локализации опухоли.
Однако данный вывод, по сути,
основан на поданализе исследований, так как в основном в работы
включались пациенты с wtKRAS,
а потом в результате дальнейшего
молекулярного исследования исключались из анализа пациенты с
редкими мутациями в генах KRAS
и с мутациями в гене NRAS; аналогичный подход реализован и в
отношении локализации первичной опухоли. Только в этом году
на ASCO были представлены результаты проспективного исследования III фазы (PARADIGM) по
сравнению комбинации FOLFOX с
панитумумабом и FOLFOX с бевацизумабом у пациентов с метастатическим неоперабельным раком
толстой кишки при wtRAS. Было
рандомизировано 823 пациента.
Первичной целью явилась общая
выживаемость среди пациентов с
левосторонней локализацией первичной опухолью. При медиане
наблюдения 61 месяц авторы доказали, что применение комбинации
с анти-EGFR антителом значимо
увеличивает медиану общей выживаемости в сравнении с бевацизумабом: 37,9 против 34,3 мес. (ОР
0,82; 95% ДИ 0,68-0,99; р=0,031),
аналогичные данные получены в
отношении частоты объективных
эффектов (80,2% против 68,6%),
глубины уменьшения проявлений
болезни (–59,4 против –43,6) и частоты выполнения R0 резекций
метастазов (18,3% против 11,6%).
При этом выживаемость без прогрессирования между терапевтическими опциями не различалась
(13,7 мес. в группе панитумумаба
против 13,2 мес. в группе с бевацизумабом; ОР 0,98; 95% ДИ
0,82-1,17). Частота назначений последующих линий терапии была
одинакова – вплоть до 4 линии лечения. Также и спектр таргетной терапии во второй линии был
сходным: антиангиогенная терапия в группе с панитумумабом
была назначена у 53,8% и у 56,8%
в группе с бевацизумабом [18].
Возможно несколько объяснений
таких результатов. Первое – за
счет более выраженной глубины
уменьшения опухоли смертельно
значимое увеличение происходит
позже, если стартовать с панитумумаба, нежели бевацизумаба;
другое объяснение, возможно,
кроется в последовательности назначения таргетных препаратов
в первой и во второй линии лечения. Данные предположения,
по-видимому, подтверждаются
результатами другого исследования, которое было представлено
на ASCO 2022 (STRATEGIC-1), в
котором провели сравнение двух
последовательностей терапии
при метастатическом раке толстой кишки wtRAS, wtBRAF. Было
рандомизировано 424 пациента
между контрольной группой (в
первой линии назначался режим
FOLFIRI c цетуксимабом, во второй – FOLFOX с бевацизумабом;
каждая линия проводилась до
прогрессирования или непереносимой токсичности) и исследовательской группой (в первой
линии – FOLFOX с бевацизумабом
в режиме OPTIMOX, во второй –
FOLFIRI с бевацизумабом, в третьей – анти-EGFR антитела с или
без иринотекана; лечение проводилось до прогрессирования или
непереносимой токсичности).
В качестве основного критерия
эффективности был выбран показатель длительности контроля
заболевания в виде суммы выживаемости без прогрессирования
каждой из линий лечения. Статистическая гипотеза предполагала
улучшение медианы данного показателя в исследуемой группе с 16
до 24 месяцев. После исключения
пациентов с мутациями в опухоли в анализ вошло 263 пациента.
Несмотря на то, что в популяции
было порядка 15% пациентов с
правосторонней локализацией
опухоли, различий в медиане длительности контроля болезни не отмечено: 22,5 мес. в группе контроля против 23,5 мес. в исследуемой
группе (ОР 0,97; 95% ДИ 0,72-1,29;
р=0,805). При этом общая выживаемость была выше в группе
контроля – 37,8 против 34,4 мес.
(ОР 1,26; 95% ДИ 0,94-1,7; р=0,121),
также как и частота объективных
эффектов на первой линии (82,4%
против 69,7%). Интересно, что различий в выживаемости без прогрессирования при сравнении
первых линий лечения и вторых
линий лечения не выявлено [19].
Таким образом, для достижения
максимальной общей выживаемости у пациентов с диким типом
генов RAS, BRAF, при левосторонней локализации первичной опухоли на первой линии необходимо
назначение анти-EGFR антител
вместе с химиотерапией, на второй – антиангиогенной терапии с
химиотерапией.
Остается вопрос, с каким режимом химиотерапии наиболее эффективно сочетать анти-EGFR
антитела. До настоящего момента было известно, что цетуксимаб или панитумумаб можно
сочетать с режимами FOLFOX,
FOLFIRI, De Gramont, иринотеканом, FOLFOXIRI (с редукцией доз
препаратов), но не с пероральными фторпиримидинами и болюсным введением фторурацила. В
исследовании III фазы TRIPLETE
врачи из Италии попытались доказать, что режим FOLFOXIRI
с панитумумабом эффективнее
схемы FOLFOX с панитумумабом при нерезектабельном раке
толстой кишки wtRAS, wtBRAF.
Лечение предполагало проведение 12 курсов с последующим
переходом на поддерживающую
терапию по схеме de Gramont с панитумумабом до прогрессирования. Доза иринотекана в режиме
FOLFOXIRI составляла 150 мг/м2,
оксалиплатина – 85 мг/м2, 5-фторурацила – 2400 мг/м2. С целью
увеличения частоты объективных эффектов при применении
FOLFOXIRI с панитумумабом с
60% до 75% необходимо было рандомизировать 432 пациента. Среди включенных пациентов только
2-6% проводилась адъювантная
терапия в анамнезе, у 88% пациентов опухоль локализовалась в
левых отделах толстой кишки. Несмотря на данные характеристики
популяции больных, различий ни
в частоте объективных эффектов
– 76% против 73% (ОШ 0,87; 95%
ДИ 0,56-1,34; р=526), ни в глубине
уменьшения проявлений болезни
– 47% против 48% (р=0,847), ни в
частоте R0 резекций – 29% против 25% (ОШ 0,81; 95% ДИ 0,53-
1,23; р=0,317), ни в выживаемости
без прогрессирования (ОР 0,88;
95% ДИ 0,7-1,11; р=0,277) между
контрольной группой и группой
интенсивного лечения отмечено
не было, при значимо большей частоте диарей в группе FOLFOXIRI.
Даже в группе изолированного
поражения печени метастазами
различии выживаемости без прогрессирования не выявлено (ОР
0,94; 95% ДИ 0,64-1,37) [20]. Такие
результаты можно объяснить возможным снижением дозовой интенсивности режима FOLFOXIRI,
так как в классическом варианте
дозы иринотекана составляют
165 мг/м2, а фторурацила – 3200
мг/м2. Поэтому желательно дождаться результатов поданализа
непосредственной эффективности
в зависимости от интенсивности
дозового режима, а также провести аналогичное исследование у
пациентов с потенциально операбельными метастазами в печени.
В последней популяции глубина
ответа выше в сравнении с общей популяцией нерезектабельного рака толстой кишки. Тем не
менее, можем сделать вывод, что
при левосторонней локализации
и диком типе генов RAS и BRAF
стандартным подходом остаются
дуплеты химиотерапии с цетуксимабом или панитумумабом.
Более того, очередное рандомизированное исследование доказывает отсутствие необходимости
лечения пациентов дуплетами, в
частности, FOLFIRI с анти-EGFR
непрерывно до прогрессирования
(IMPROVE). Если раньше в клинической практике химиотерапевты переходили после 8 курсов
на поддерживающую терапию по
схеме De Gramont с анти-EGFR
антителами, то теперь появилась еще одна опция – можно вообще прекращать лечение после 8
курсов и при прогрессировании
возобновлять прежнюю схему
лечения. Такой подход значимо
улучшит результаты выживаемости без прогрессирования в процессе нахождения на лечении, чем
продолжение режима FOLFIRI до
прогрессирования или непереносимой токсичности (медиана в
группе химиотерапевтических каникул составила 17,1 мес., в группе
непрерывного лечения – 13,2 мес.),
особенно при левосторонней локализации. Показатели частоты
объективных эффектов не различались – 57% и 66% соответственно [21]. Тем не менее, желательно
увидеть и результаты общей выживаемости.
Другой извечный спор: что лучше – FOLFOXIRI с бевацизумабом
или дуплеты с бевацизумабом? Ранее в метаанализе индивидуальных данных пациентов пяти рандомизированных исследований на
общей когорте больных было показано преимущество интенсивного лечения как в отношении частоты объективных эффектов, так
и выживаемости. Однако поданализ показал, что это правомочно
для правосторонней локализации
опухоли как с диким типом генов
RAS, так и с мутацией [22]. Тем не
менее, хотелось дополнительных
подтверждений выявленных находок, особенно после негативных
результатов вышеописанного исследования TRIPLETE.
На ASCO 2022 были представлены
результаты исследования CAIRO5
по сравнению эффективности
FOLFOXIRI с бевацизумабом и
дуплетов с бевацизумабом у пациентов с нерезектабельными метастазами рака толстой кишки в
печени и правосторонней локализации первичной опухоли или при
мутации в генах RAS/BRAF. Среди
291 рандомизированного пациента в 82-86% случаях ситуация
рассматривалась как потенциально операбельная по метастазам в
печени, в 41-42% была правосторонняя локализация первичной
опухоли, в 86% встречалась мутация в генах RAS. Применение режима FOLFOXIRI с бевацизумабом улучшило основной критерий
эффективности в исследовании
– выживаемость без прогрессирования (ОР 0,77; 95% ДИ 0,6-0,99;
р=0,033), хотя нумерически медиана выросла лишь с 9 до 10,6 мес.
При этом наибольший выигрыш
был именно в группе правосторонней локализации дикого типа
генов (ОР 0,54; 95% ДИ 0,13-2,26).
Также увеличилась и частота R0/1
резекций печени с 37% до 51%
(р=0,02) [23]. Таким образом, в отличие от левосторонней локализации, где можно не перелечивать
пациентов, при правосторонней
локализации лучше рассматривать применение интенсивных
режимов вместе с бевацизумабом. Остается еще вопрос, какой
же все-таки режим предпочесть
при потенциально операбельных
метастазах и правосторонней локализации при диком типе генов,
когда цель лечения – перевод в
операбельное состояние метастазов в печени, – FOLFOXIRI с
бевацизумабом или FOLFOXIRI
с анти-EGFR или дуплеты с антиEGFR антителами.
В итоге, несмотря на то, что невозможно в рамках одной статьи
рассказать обо всех исследованиях, посвященных раку толстой
кишки, с ASCO 2022, результаты
озвученных работ уже говорят о
необходимости изменений клинических рекомендаций и нашей
рутинной практики.
Литература:
1. Федянин М.Ю., Трякин А.А. Неоадъювантная терапия при местнораспространенном раке прямой кишки. Тазовая хирургия и онкология. 2022; 12(2): 36-45.
2. Hagen Fritz Kennecke, Carl J Brown, Jonathan M. Loree, et al. CCTG CO.28 primary endpoint analysis: Neoadjuvant chemotherapy, excision and observation for early rectal cancer, the NEO trial. Journal of Clinical Oncology. 2021 May 20; 39 (no.15_suppl): 3508-3508.
3. Jensen LH, Poulsen LØ, Risum SN, et al. Curative chemoradiation for low rectal cancer: Early clinical outcomes from a multicentre phase II trial. Annals of Oncology. 2020; 31 (suppl_4): S409-S461. 10.1016/annonc/annonc270.
4. Bach SP, de Wilt JHW, Peters F, et al. STAR-TREC phase II: Can we save the rectum by watchful waiting or transanal surgery following (chemo)radiotherapy versus total mesorectal excision for early rectal cancer? J Clin Oncol. 2022; 40 (suppl 16; abstr 3502).
5. Serra-Aracil X, Pericay C, BadiaClosa J, et al. Noninferiority multicenter prospective randomized controlled study of rectal cancer T2-T3s (superficial) N0, M0 (T2T3sN0M0) undergoing neoadjuvant treatment and local excision (TEM) versus total mesorectal excision (TME): Preoperative, surgical, and pathological outcomes – The TAUTEMstudy. J Clin Oncol. 2022; 40 (suppl 16; abstr 3501).
6. Cercek A, Lumish MA, Sinopoli JC, et al. Single agent PD-1 blockade as curative-intent treatment in mismatch repair deficient locally advanced rectal cancer. J Clin Oncol. 2022; 40 (suppl 17; abstr LBA5).
7. Verschoor YL, van den Berg J, Beets G, et al. Neoadjuvant nivolumab, ipilimumab, and celecoxib in MMRproficient and MMR-deficient colon cancers: Final clinical analysis of the NICHE study. J Clin Oncol. 2022; 40 (suppl 16; abstr 3511).
8. Cohen R, Taieb J, Fiskum J, et al. Microsatellite instability in patients with stage III colon cancer receiving fluoropyrimidine with or without oxaliplatin: An ACCENT pooled analysis of 12 adjuvant trials. J Clin Oncol. 2021 Feb 20; 39(6): 642-651.
9. Fleming P, Chen C, Moore DF, et al. High-risk MSI-H stage II colon cancer: Treatment patterns and outcomes. J Clin Oncol. 2022; 40 (suppl 16; abstr e15587).
10.Crowley E, Di NF, Loupakis F, Bardelli A. Liquid biopsy: monitoring cancergenetics in the blood. Nat Rev Clin Oncol. 2013; 10: 472-84.
11.Tie J, Wang Y, Kinde I, et al. Circulating tumor DNA (ctDNA) in nonmetastatic colorectal cancer (CRC): Potential role as a screening tool. J Clin Oncol. 2015; 33 (s3): abstr. 518.
12.Tie Jeanne, Cohen Joshua D, Lahouel Kamel, et al. Circulating tumor DNA analysis guiding adjuvant therapy in stage II colon cancer. N Engl J Med. 2022 Jun 16; 386(24): 2261-2272. doi: 10.1056/NEJMoa2200075.
13.Федянин М.Ю., Трякин А.А. Неоадъювантная химиотерапия при раке ободочной кишки. Тазовая хирургия и онкология. 2022; 12(2): 46-54.
14.Glasbey J, Seligmann J, Morton DG, FOxTROT Collaborating Group. Risk of bowel obstruction in patients undergoing neoadjuvant chemotherapy for highrisk colon cancer: A nested case-control matched analysis of an international, multi-centre, randomised controlled trial (FOxTROT). Ann Oncol. 2021; 32 (Suppl 5): S530-S582.
15.Hu H, Huang M, Li Y, et al. Perioperative chemotherapy with mFOLFOX6 or CAPOX for patients with locally advanced colon cancer (OPTICAL): A multicenter, randomized, phase 3 trial. J Clin Oncol. 2022% 40 (suppl 16; abstr 3500).
16.Kanemitsu Y, Shitara K, Mizusawa J, et al. A randomized phase III trial comparing primary tumor resection plus chemotherapy with chemotherapy alone in incurable stage IV colorectal cancer: JCOG1007 study (iPACS). J Clin Oncol. 2020; 38 (suppl 4; abstr 7). doi: 10.1093/ jjco/hyz173.
17.Rahbari NN, Biondo S, Feißt M, et al. Randomized clinical trial on resection of the primary tumor versus no resection prior to systemic therapy in patients with colon cancer and synchronous unresectable metastases. J Clin Oncol. 2022; 40 (suppl 17; abstr LBA3507).
18.Yoshino T, Watanabe J, Shitara K, et al. Panitumumab (PAN) plus mFOLFOX6 versus bevacizumab (BEV) plus mFOLFOX6 as first-line treatment in patients with RAS wild-type (WT) metastatic colorectal cancer (mCRC): Results from the phase 3 PARADIGM trial. J Clin Oncol. 2022; 40 (suppl 17; abstr LBA1).
19.Chibaudel B, Dourthe LM, Andre T, et al. STRATEGIC-1: Multi-line therapy trial in unresectable wild-type KRAS/ NRAS/BRAF metastatic colorectal cancer – A GERCOR-PRODIGE randomized open-label phase III study. J Clin Oncol. 2022; 40 (suppl 16; abstr 3504).
20.Cremolini C, Rossini D, Lonardi S, et al. Modified FOLFOXIRI plus panitumumab (mFOLFOXIRI/PAN) versus mFOLFOX6/PAN as initial treatment of patients with unresectable RAS and BRAF wild-type metastatic colorectal cancer (mCRC): Results of the phase III randomized TRIPLETE study by GONO. J Clin Oncol. 2022; 40 (suppl 17; abstr LBA3505).
21.Avallone A, Giuliani F, Nasti G, et al. Randomized intermittent or continuous panitumumab plus FOLFIRI (FOLFIRI/PANI) for firstline treatment of patients (pts) with RAS/BRAF wild-type (wt) metastatic colorectal cancer (mCRC): The IMPROVE study. J Clin Oncol. 2022; 40 (suppl 16; abstr 3503).
22.Cremolini C, Antoniotti C, Stein A, et al. Individual patient data meta-analysis of FOLFOXIRI plus bevacizumab versus doublets plus bevacizumab as initial therapy of unresectable metastatic colorectal cancer. J Clin Oncol. 2020 Aug 20. JCO2001225.
23.Punt CJA, Bond MJG, Bolhuis K, et
al. FOLFOXIRI + bevacizumab versus
FOLFOX/FOLFIRI + bevacizumab
in patients with initially unresectable
colorectal liver metastases (CRLM) and
right-sided and/or RAS/BRAFV600Emutated primary tumor: Phase III
CAIRO5 study of the Dutch Colorectal
Cancer Group. J Clin Oncol. 2022; 40
(suppl 17; abstr LBA3506).
ОСНОВНЫЕ СОБЫТИЯ, ПРЕДСТАВЛЕННЫЕ НА КОНГРЕССЕ ASCO, В ОБЛАСТИ ЛЕЧЕНИЯ НМРЛ В 2022 ГОДУ
Автор: Моисеенко Федор Владимирович
Заведующий онкологического химиотерапевтического (противоопухолевой лекарственной терапии) отделения биотерапии
Санкт-Петербургского клинического научнопрактического центра специализированных видов медицинской помощи (онкологического),
доктор медицинских наук, Санкт-Петербург
Принято считать наиболее современными два принципиально различных метода лечения опухолей
легкого – таргетную и иммунотерапию. Именно с этими методами
связаны основные достижения последних лет. Кроме оптимизации их
использования, появляется все больше сообщений о роли локальных методов лечения на фоне достигнутого
системного контроля заболевания.
Так, основной тенденцией в области
применения терапевтических методов при НМРЛ являются попытки
применения ингибиторов контрольных точек (ИКТ) при более ранних
стадиях опухолевого процесса. В
прошлом году были представлены
результаты адъювантного применения атезолизумаба (IMPower 010),
позволившего достоверно повысить
медиану безрецидивной выживаемости для больных с II-IIIA стадиями PD-L1 позитивного и негативного НМРЛ после хирургического
лечения и адъювантной химиотерапии [1]. Принципиально сходные результаты были получены и для адъювантного пембролизумаба в рамках
исследования PEARLS [2]. Тем не
менее, результаты данных работ
выявили и существенные различия
между характеристиками наиболее
чувствительных к адъювантной иммунотерапии групп, что существенно осложняет интерпретацию этих
результатов, а главное – формирование обобщенного представления о
роли ингибиторов PD-1 после радикального удаления опухоли.
С некоторым отставанием представляются результаты работ по изучению предоперационного применения иммунотерапии. В исследовании NADIM, первой работе, систематически исследовавшей частоту морфологических ответов после применения нескольких введений ниволумаба, была выявлена невиданная ранее частота полных морфологических регрессов – 40%, что определило крайне высокий интерес именно к предоперационному применению ИКТ [3]. Инициированные по его итогам работы CHECKMATE 815 и NADIM II на настоящий момент находятся на этапе получения первых результатов. Так, первые данные в рамках третьей фазы были получены для химиоиммунотерапии: частота полных морфологических ответов (pCR) в исследовании CHECKMATE 815 составила 24,4%, а MPR (больших морфологических ответов – 10% жизнеспособных клеток) – 36,9% [4]. Аналогичные показатели эффективности в исследовании NADIM II на настоящий момент подтверждают тенденцию к крайне высокой эффективности – 36,8% pCR и 52,6% MPR позволяют говорить о подтверждении тенденции [5]. Тем не менее, связь между pCR, достигнутым при применении иммунотерапии, и длительной выживаемостью без рецидива болезни требовала подтверждения [6]. В этом году были представлены первые наблюдения, подтверждающие эту взаимосвязь. Среди больных, достигших pCR на фоне химиоиммунотерапии, медиана времени без прогрессирования не была достигнута против 27,8 мес. для больных без pCR. Любопытно, что, в отличие от вероятности достижения, роль pCR была одинаковой для больных с PD-L1 <1% и ≥1. Очевидно, что следующими шагами для оптимизации данного варианта лечения будет подтверждение излечения части пациентов с помощью предоперационной химиоиммунотерапии. Вариант лечения, исследованный в описанных выше работах, не является единственным, и уже начаты попытки его оптимизации. Так, в этом году была представлена работа, изучавшая вопрос оптимальной длительности 2 против 3 циклов ХИТ. Несмотря на отсутствие достоверных различий, тенденция как частоты pCR, так и MPR говорит в пользу 3 циклов [7].
Успехи периоперационного использования ИКТ вселяют существенный оптимизм относительно улучшения результатов лечения раннего рака легкого. Однако не стоит забывать про то, что около 50% больных излечиваются после хирургического удаления первичной опухоли и не нуждаются в дополнительных воздействиях [8]. Выявление этих пациентов могло бы быть ключевым фактором, который позволит не только сэкономить финансовые ресурсы в виде дорогостоящих препаратов, но также и избавить пациентов от потенциальной токсичности. На сегодняшний момент наиболее близким к клиническому применению маркером, позволяющим отличить пациентов с более высокой вероятностью рецидива заболевания, является исследование циркулирующей опухолевой ДНК. Последние работы, результаты которых представлены на конгрессе ASCO в этом году, подтверждают тенденцию, выявленную ранее. Группа больных с сохранением цоДНК после хирургического лечения относится к группе высокого риска развития рецидива и, по-видимому, нуждается в проведении дополнительных противоопухолевых воздействий, в то время как большинство больных без цоДНК могут считаться излеченными только после хирургического удаления [9]. Подтверждая биологическую роль исчезновения цоДНК, существенные различия как во времени без прогрессирования опухоли, так и в общей продолжительности жизни были выявлены после окончания лучевой терапии, проведенной по радикальной программе [10].
На фоне относительного затишья и небольшого числа новых молекул, влияющих на эффект иммунотерапии при НМРЛ, многие авторы сконцентрировались на выявлении пациентов, у которых возможно достижение длительного эффекта при использовании уже зарегистрированных ИКТ. Крайне важным представляется то, что поиск биомаркеров ответа на ИКТ производился как среди оцениваемых в рамках рутинной практики соотношения нейтрофилов и лимфоцитов или уровня ЛДГ, так и на основании сложного математического анализа множества радиологических, генетических характеристик опухолевых клеток, а также клеток, формирующих микроокружение [11-13]. Кроме того, в этом году были представлены данные, полученные в крупном Северо-американском онкологическом центре при исследовании пациентов с высоким уровнем PD-L1, получавших моноиммунотерапию [14]. Авторы продемонстрировали с помощью полногеномного анализа значимые различия между пациентами с ультравысоким уровнем экспрессии, превышающим 90%, и пациентов с уровнем от 50-90%. Совершенно очевидно, что успешная реализация задач этого направления, также как и синтез новых препаратов, существенно изменит подходы к лечению диссеминированного НМРЛ без активирующих мутаций.
Целая серия работ была посвящена лечению больных при прогрессировании на фоне ИКТ. В этом году акцент пришелся на исследование роли антиангиогенных препаратов. Так, кабозантиниб в комбинации с атезолизумабом или пембролизумаб в комбинации с рамуцирумабом продемонстрировали принципиальную оправданность этого подхода с точки зрения времени без прогрессирования [15,16]. Любопытно, что большая эффективность продолжения ИКР с дополнением антиангиогенным препаратом наблюдалась у больных с плоскоклеточным раком легкого, а также при последовательном применении химиотерапии и иммунотерапии. Относительно скромные результаты применения комбинации на сегодняшний момент не позволяют однозначно сказать, является ли это изменяющим практику открытием или всего лишь шагом к выявлению оптимального подхода при прогрессировании на фоне ИКР.
Рассказывая о развитии лекарственной терапии НМРЛ, нельзя оставить за кадром и работы в области таргетной терапии. В этом году исследователи из Гарварда обратили внимание на редкие нарушения тирозин-киназного домена МЕТ [17]. Авторы исследовали базы данных нескольких крупных сервисов NGS, например, Foundation Medicine, China PanCancer, Genie v10, включавших более 100 000 пациентов. Нарушения МЕТ были выявлены у 0,6% больных (662/106379). Кроме частоты нарушений в общей популяции важным наблюдением можно считать то, что практически у половины больных наблюдались конкурентные ко-активирующие мутации, что, по-видимому, значительно сужает группу для таргетного блокирования MET.
Целая серия работ продолжила изучение дополнительных воздействий для улучшения результатов таргетной терапии. Так, было представлено несколько работ о влиянии антиангиогенных препаратов на результаты первой линии лечения EGFR мутированного рака легкого. В отличие от представленных ранее исследований, сходившихся на увеличении ВДП при применении комбинации, результаты новых исследований не были настолько похожи. В одной из работ комбинация эрлотиниба и бевацизумаба показала преимущество относительно монотерапии лишь в группе больных с метастатическим поражением головного мозга [18]. В то же время комбинирование афатиниба с тем же бевацизумабом не привело к улучшению результатов лечения (ВДП 16,3 против 16,1 мес.) [19]. Несмотря на отсутствие рандомизации, о положительном влиянии на отдаленные результаты можно судить при дополнении осимертиниба цитостатическими препаратами. Так, без прогрессирования в течение первого года были 90,4%, а в течение второго – 70,0% пациентов [20].
Продолжено движение к формированию стандартного подхода в лечении редких опухолей с мутациями экзона 20 EGFR и HER2. Так, было проведено непрямое сравнение двух основных лидеров в этой области – мобицертиниба и амивантамаба, не показавшее принципиальных преимуществ одного из препаратов [21].
Таким образом, наиболее значимыми событиями, представленными на мероприятии в этом году, можно считать подтверждение эффективности адъювантного применения иммунотерапии, а также дальнейшее уточнение места и роли предоперационного применения этого вида лечения. Развитие таргетного подхода связано с дальнейшей детализацией представлений о частоте и активирующей роли конкретных молекулярных нарушений.
Источники:
1. Felip E, Altorki N, Zhou C, et al., Investigators I.M. Adjuvant atezolizumab after adjuvant chemotherapy in resected stage IB-IIIA non-small-cell lung cancer (IMpower010): a randomised, multicentre, open-label, phase 3 trial. Lancet. 2021; Vol.398, №10308, P.1344- 1357.
2. Murray J, Cruickshank C, Bird T, et al. PEARLS: A multicenter phase II/ III trial of extended field radiotherapy for androgen-sensitive prostate cancer patients with PSMA‐avid pelvic and para-aortic lymph nodes at presentation. . Journal of Clinical Oncology. 2022; 40 (6_suppl.): TPS199-TPS199.
3. Provencio M, Serna-Blasco R, Nadal E, et al. Overall Survival and Biomarker Analysis of Neoadjuvant Nivolumab Plus Chemotherapy in Operable Stage IIIA Non–Small-Cell Lung Cancer (NADIM phase II trial). Journal of Clinical Oncology. Vol.0, №0, P.JCO.21.02660.
4. Forde PM, Spicer J, Lu S, et al. Neoadjuvant Nivolumab plus Chemotherapy in Resectable Lung Cancer. New England Journal of Medicine. 2022; Vol.386, №21, P.1973- 1985.
5. Provencio-Pulla M, Nadal E, Larriba JLG, et al. Nivolumab + chemotherapy versus chemotherapy as neoadjuvant treatment for resectable stage IIIA NSCLC: Primary endpoint results of pathological complete response (pCR) from phase II NADIM II trial. Journal of Clinical Oncology. 2022; 40 (16_suppl.): 8501-8501.
6. Passaro A, Attili I, Marinis FD. Neoadjuvant Chemotherapy Plus Immunotherapy in Early-Stage Resectable Non-Small-Cell Lung Cancer. Journal of Clinical Oncology. Vol.0, №0, P.JCO.22.00873.
7. Qiu F, Fan J, Shao M, et al. Two cycles versus three cycles of neoadjuvant sintilimab plus platinum-doublet chemotherapy in patients with resectable non-small-cell lung cancer (neoSCORE): A randomized, single center, twoarm phase II trial. Journal of Clinical Oncology. 2022; 40 (16_suppl.): 8500- 8500.
8. Provencio M, Calvo V, Romero A, Spicer JD, Cruz-Bermúdez A. Treatment Sequencing in Resectable Lung Cancer: The Good and the Bad of Adjuvant Versus Neoadjuvant Therapy. American Society of Clinical Oncology Educational Book. 2022.10.1200/edbk_358995. №42, P.1-18.
9. Yin R, Wang S, Li M, et al. Utilization of cell-free DNA fragmentomics in minimal residual disease detection for non-small cell lung cancer. Journal of Clinical Oncology. 2022; 40 (16_suppl.): 3038-3038.
10.Lebow ES, Murciano-Goroff YR, Jee J, et al. Minimal residual disease (MRD) detection by ctDNA in relation to radiographic disease progression in patients with stage I-III non-small cell lung cancer (NSCLC) treated with definitive radiation therapy. Journal of Clinical Oncology. 2022; 40 (16_suppl.): 8540-8540.
11.Luo J, Vanguri RS, Aukerman AT, et al. Multimodal integration of radiology, pathology, and genomics for prediction of response to PD-1 blockade in patients with non-small cell lung cancer. Journal of Clinical Oncology. 2022; 40 (16_ suppl.): 9064-9064.
12.O'Byrne KJ, Monkman J, Kim H, Cumberbatch M, Bhagat M, Ladwa R, Adams MN, Kulasinghe A. Multi-omic and spatial dissection of immunotherapy response groups in non–small cell lung cancer (NSCLC). Journal of Clinical Oncology. 2022; 40 (16_suppl.): 8544- 8544.
13.Auclin E, Nolin-Lapalme A, Richard C, Malo J, Tonneau M, Benlaifaoui M, Ponce M, Messaoudene M, Okuma Y, Hakozaki T, Routy B. Association between lung immune prognostic index, microbiome, and immunotherapy outcomes in non-small cell lung . Journal of Clinical Oncology. 2022; 40 (16_ suppl.): 9050-9050.
14.Ricciuti B, Alessi JVM, Li YY, et al. Genomic correlates of acquired resistance to PD-(L)1 blockade in patients with advanced non-small cell lung cancer (NSCLC). Journal of Clinical Oncology. 2022; 40 (16_suppl.): 9021-9021.
15.Garon EB, Liu SV, Owen SP, et al. EVOKE-02: A phase 2 study of sacituzumab govitecan (SG) plus pembrolizumab (pembro) with or without platinum chemotherapy in first-line metastatic non–small cell lung cancer (NSCLC). Journal of Clinical Oncology. 2022; 40 (16_suppl.): TPS9146-TPS9146.
16.Reckamp KL, Redman MW, Dragnev KH, et al. Phase II Randomized Study of Ramucirumab and Pembrolizumab Versus Standard of Care in Advanced Non-Small-Cell Lung Cancer Previously Treated With Immunotherapy-LungMAP S1800A. Journal of Clinical Oncology. Vol.0, №0, P.JCO.22.00912.
17. Pecci F, Ricciuti B, Alessi JVM, et al. Activating MET kinase domain mutations define a novel molecular subtype of non-small cell lung cancer that is clinically targetable with the MET inhibitor elzovantinib (TPX-0022). Journal of Clinical Oncology. 2022; 40 (16_suppl.): 9124-9124.
18.Lee Y, Kim HR, Hong MH, Lee KH, Park KU, Lee GK, Kim HY, Lee S-H, Lim KY, Yoon SJ, Cho BC, Han J-Y. A randomized phase II study comparing erlotinib with or without bevacizumab in patients with advanced non-small cell lung cancer (NSCLC) with EGFR. Journal of Clinical Oncology. 2022; 40 (16_suppl.): 9107-9107.
19.Ishikawa N, Ninomiya T, Kozuki T, et al. Afatinib (Afa) + bevacizumab (Bev) versus afatinib alone as firstline treatment of patients with EGFRmutated advanced non-squamous NSCLC: Primary analysis of the multicenter, randomized, phase II study – AfaBev-CS. Journal of Clinical Oncology. 2022; 40 (16_suppl.): 9112- 9112.
20.Nakamura A, Saito R, Ko R, et al. A phase II study of osimertinib in combination with platinum plus pemetrexed in patients with EGFRmutated, advanced non-small cell lung cancer: The OPAL study (NEJ032C/ LOGIK1801). Journal of Clinical Oncology. 2022; 40 (16_suppl.): 9097- 9097.
21.Ou S-HI, Prawitz T, Lin HM, et al.
Matching-adjusted indirect comparison
(MAIC) of mobocertinib versus
amivantamab in patients with non-small
cell lung cancer (NSCLC) with EGFR
exon 20 insertions (ex20ins). Journal of
Clinical Oncology. 2022; 40 (16_suppl.):
9115-9115.
НОВОСТИ ASCO 2022. РАК ПИЩЕВОДА И ЖЕЛУДКА
Автор: Трякин Алексей Александрович
Заместитель директора по научной работе, заведующий онкологическим
отделением лекарственных методов лечения (химиотерапевтическое) №2 НИИ
клинической онкологии им. акад. РАН и РАМН Н.Н. Трапезникова ФГБУ «НМИЦ онкологии
им. Н.Н. Блохина» Минздрава России, доктор медицинских наук, Москва
Конгресс ASCO в этом году оказался не особо богатым на интересные
исследования по раку пищевода и
желудка, явно отдав предпочтение
колоректальному раку. Тем не менее,
несколько из опубликованных работ
интересны для обсуждения.
Рак пищевода
Самостоятельная химиолучевая
терапия (ХЛТ) занимает значимое
место в лечении локализованного
рака пищевода. В качестве компаньона ЛТ обычно выступают комбинации цисплатина с фторурацилом и паклитаксел + карбоплатин.
В исследовании III фазы из Китая
201 пациент с плоскоклеточным
раком получил ХЛТ с комбинацией паклитаксел + цисплатин ±
нимотузумаб [1]. Нимотузумаб
– моноклональное антитело, блокирующее EGFR1. В отличие от
цетуксимаба и панитумумаба, оно
характеризуется меньшей аффинностью к рецепторам, что приводит к значительно меньшей дерматологической токсичности. На
ASCO 2022 были сообщены промежуточные результаты по частоте
объективного ответа. Применение
моноклонального антитела позволило существенно увеличить
частоту полных клинических ответов с 12,2% до 32,5%. Ранее предпринимались попытки добавления
цетуксимаба к самостоятельной
ХЛТ, приведшие лишь к ухудшению общей выживаемости (ОВ) за
счет, по-видимому, большей токсичности режима [2]. В исследовании с нимотузумабом последний
не ухудшил переносимость ХЛТ,
что, возможно, и определило улучшение непосредственных результатов. Данные по ОВ ожидаются.
Основой лечения метастатического плоскоклеточного рака пищевода долгие годы являются дуплеты
на основе цисплатина с фторпиридинами или с таксанами. При этом
реальная польза этой ХТ, а также
возможность ее деэскалации (например, у ослабленных пациентов)
оставались неизвестными. Ученые
из Индии провели исследование III
фазы, в котором больные плоскоклеточным раком сравнили еженедельный паклитаксел с поддерживающей терапией (best supportive
care). ХТ позволила значимо увеличить продолжительность жизни
с 4,2 до 8,6 мес. (HR 0,52; 95% CI
0,40-0,66) [3]. Стоит только предполагать, что добавление к паклитакселу цисплатина привело бы к еще
большему выигрышу в ОВ.
Рак желудка
Периоперационная ХТ режимом
FLOT стала стандартом терапии
локализованного рака желудка на
основании единственного, хотя и
хорошо спланированного исследования. В то же время в странах
Азии для адъювантной или периоперационной терапии активно
применяются комбинации SOX
(S1 + оксалиплатин) или DOS (доцетаксел, оксалиплатин, S1). В рандомизированном исследовании II
фазы MATCH (Китай) пациенты
получали по 4 курса периоперационной ХТ этими режимами. Режим
с доцетакселом достоверно улучшил 3-летние ВБП с 35% до 52%
и ОВ с 49,2% до 57,5%, вновь подтвердив свое значение в лечении
резектабельного рака желудка [4].
Можем ли мы улучшить эффективность FLOT за счет добавления к
нему таргетных препаратов? Обновленные результаты рандомизированного исследования RAMSES
(FLOT ± рамуцирумаб) вновь не
смогли показать преимущества
экспериментального режима, за
исключением большей частоты
R0-резекций [5]. В небольшом исследовании PETRARCA (FLOT ±
пертузумаб/трастузумаб) удалось
значимо улучшить частоту pCR
при тенденции к пролонгации ВБП
и ОВ ценой существенного роста
токсичности (по моему мнению,
пертузумаб в этом исследовании
был лишним) [6]. Однако малое
число больных не смогло дать четкие рекомендации о необходимости интеграции анти-HER2 терапии в периоперационную терапию.
Перспективной опцией выглядит
попытка применения химиоиммунотерапии. В рандомизированном
исследовании II фазы DANTE 295
пациентов получали терапию FLOT
± атезолизумаб [7]. Лишь 8% больных имели MSI-high и 29% – PD-L1
CPS ≥5. Пока доступны результаты
только по частоте патоморфологических регрессий. У пациентов с
MSI-high частота pCR улучшилась
с 27% до 50%, а в группе c CPS ≥10
– c 14% до 38%. Высокая эффективность иммунотерапии у пациентов
с MSI-high раком желудка в контексте предоперационной терапии
была недавно продемонстрирована
в метаанализе исследований II фаз:
частота pCR в этой группе составила 39% [8]. Все это, на мой взгляд,
говорит о возможности интеграции иммунотерапии в режимы
периоперационной терапии уже
сегодня.
Исследование CheckMate 649 установило новый стандарт первой линии терапии метастатического рака желудка с экспрессией PD-L1 CPS ≥5 – комбинацию FOLFOX/ XELOX с ниволумабом. В самом исследовании 60% больных имели столь высокую экспрессию, что позволяло врачам надеяться на столь широкое внедрение нового подхода, а организаторам здравоохранения с печалью думать, где изыскать на нее столько средств. Неожиданной преградой к внедрению данного подхода в России является отсутствие у нас регистрации антитела 28-8, что ставит вопрос о легитимности использования по этому показанию других антител. На ASCO 2022 было представлено исследование из Сингапура, где сравнили конкордантность разных антител – Dako 28-8, Dako 22C3, Ventana SP-142 [9]. Оказалось, что применение двух последних занижает частоту экспрессии CPS ≥5 вдвое (табл.1). Основываясь на результатах данного исследования, можно пока лишь констатировать, что в отсутствие клона 28-8 пациентов кандидатов для химиоиммунотерапии мы будем встречать значительно реже, чем в пределах ранее предполагаемых 60%. Можно ли улучшить эффективность химиоиммунотерапии за счет комбинации ХТ + анти-PD1 + анти-CTLA4 антитела? К сожалению, нет. В двух небольших рандомизированных исследованиях комбинации FOLFOX + ниволумаб + ипилимумаб (I линия) и FOLFIRI + дурвалумаб + тремелимумаб (II линия) не смогли показать большую эффективность по сравнению с режимами без анти-CTLA4 антител [10,11].
Таблица 1.
Частота экспрессии PD-L1 при раке желудка
с использованием различных антител..
Источники:
1. Thomas Crosby, Christopher N Hurt, Stephen Falk, et al. Chemoradiotherapy with or without cetuximab in patients with oesophageal cancer (SCOPE1): a multicentre, phase 2/3 randomised trial. Lancet Oncol. 2013 Jun; 14(7): 627-37.
2. Xue Meng, Anping Zheng, Jun Wang, et al. Nimotuzumab plus concurrent CRT versus CRT in unresectable locally advanced esophageal squamous cell carcinoma (ESCC): Interim analysis from a prospective, randomizedcontrolled, double-blinded, multicenter, and phase III clinical trial (NXCEL1311 Study). J Clin Oncol. 2022; 40 (suppl 16; abstr. 4016).
3. Vanita Noronha, Vijay Maruti Patil, Nandini Sharrel Menon, et al. Phase III randomized controlled trial comparing chemotherapy to best supportive care in advanced esophageal and gastroesophageal junction cancer. J Clin Oncol. 2022; 40 (suppl 16; abstr. 4065).
4. Ryan Yong Kiat Tay, Joe Poh Sheng Yeong, Jeffrey Lum, et al. Choice of PD-L1 immunohistochemistry assay influences clinical eligibility for gastric cancer immunotherapy. J Clin Oncol. 2022; 40 (suppl 16; abstr. 4026).
5. Sylvie Lorenzen, Peter C. ThussPatience, Jorge Riera Knorrenschild, et al. FOLFOX versus FOLFOX plus nivolumab and ipilimumab administered in parallel or sequentially versus FLOT plus nivolumab administered in parallel in patients with previously untreated advanced or metastatic adenocarcinoma of the stomach or GEJ. J Clin Oncol. 2022; 40 (suppl 16; abstr. 4043).
6. David Tougeron, Laetitia Dahan, Farid El Hajbi, et al. The PRODIGE 59-DURIGAST trial: A randomized phase II study evaluating FOLFIRI plus durvalumab and FOLFIRI plus durvalumab plus tremelimumab in second-line treatment of patients with advanced gastric or gastro-esophageal junction adenocarcinoma. J Clin Oncol. 2022; 40 (suppl 16; abstr. 4036).
7. Wen Zhang, Chun-Xia Du, Zhichao Jiang, et al. Perioperative chemotherapy with docetaxel plus oxaliplatin and S-1 (DOS) versus oxaliplatin plus S-1 (SOX) for locally advanced gastric or gastroesophageal junction adenocarcinoma (MATCH): An open-label, randomized, phase 2 study. J Clin Oncol. 2022; 40 (suppl 16; abstr. 4031).
8. Thorsten Oliver Goetze, Ralf-Dieter Hofheinz, Harald Schmalenberg, et al. Perioperative ramucirumab in combination with FLOT versus FLOT alone for resectable esophagogastric adenocarcinoma (RAMSES/FLOT7) with high rate of signet cell component: Final results of the multicenter, randomized phase II/III trial. J Clin Oncol. 2022; 40 (suppl 16; abstr. 4042).
9. Ralf-Dieter Hofheinz, Kirsten Merx, Georg M Haag, et al. FLOT Versus FLOT/ Trastuzumab/Pertuzumab Perioperative Therapy of Human Epidermal Growth Factor Receptor 2-Positive Resectable Esophagogastric Adenocarcinoma: A Randomized Phase II Trial of the AIO EGA Study Group. J Clin Oncol. 2022 Jun 16; JCO2200380.
10.Salah-Eddin Al-Batran, Sylvie Lorenzen, Peter C. Thuss-Patience, et al. Surgical and pathological outcome, and pathological regression, in patients receiving perioperative atezolizumab in combination with FLOT chemotherapy versus FLOT alone for resectable esophagogastric adenocarcinoma: Interim results from DANTE. J Clin Oncol. 2022; 40 (suppl 16; abstr. 4003).
11.Song Li, Qian Xu, Xin Dai, et al.
Efficacy and toxicity of neoadjuvant
immune checkpoint inhibitors in
resectable gastric cancer: A meta-analysis
and systematic review. ASCO GI 2022,
abstr. 291.
РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС - 2022

ТРАСТУЗУМАБ И ПЕРТУЗУМАБ В КОМБИНАЦИИ С РЕЖИМОМ FLOT ПРИ ПЕРВИЧНО ОПЕРАБЕЛЬНОМ HER2-ПОЗИТИВНОМ РАКЕ ЖЕЛУДКА И КАРДИОЭЗОФАГЕАЛЬНОГО ПЕРЕХОДА
В мае 2022 года в Journal of Clinical
Oncology опубликована интересная статья, посвященная назначению трастузумаба и пертузумаба
в комбинации с режимом периоперационной терапии FLOT при
первично операбельном HER2-
позитивном раке желудка (РЖ) и
кардиоэзофагеального перехода
(КЭП) [1].
Частота гиперэкспрессии и амплификации рецептора HER2 при РЖ
и КЭП достигает 15-20%. В классическом исследовании FLOT4 [2]
было показано, что достижение
pCR позволяет значимо увеличить
медиану общей выживаемости
(ОВ) и безрецидивной выживаемости (БРВ) у пациентов с первично
операбельным РЖ и КЭП.
В представленное исследование
2 фазы в 2 лечебные группы (1:1)
рандомизирован 81 пациент:
• 1 группа (n=40): 4 курса терапии в режиме FLOT в комбинации с трастузумабом и пертузумабом – хирургическое лечение – 4 курса терапии в режиме FLOT в комбинации с трастузумабом и пертузумабом и далее до 9 циклов трастузумаба с пертузумабом;
• 2 группа (n=41): 4 курса терапии
в режиме FLOT – хирургическое
лечение – 4 курса терапии в режиме FLOT.
В работу были включены больные HER2-позитивным раком
РЖ и КЭП начиная со стадии
сT≥2NлюбоеM0 с ECOG 0-2, в том
числе старше 70 лет. Пациенты
были стратифицированы в лечебные группы по распространенности заболевания (по статусу T и N),
возрасту (18-69 vs >70) и локализации первичной опухоли (РЖ против КЭП).
Первичной конечной точкой исследования была частота достижения полного патоморфоза (pCR),
оцененного по Becker. Вторичными
– частота резекции R0, БРВ, ОВ и
нежелательные явления (НЯ).
В группе FLOT+TP частота достижения pCR составила 35% (n=14)
против 12% (n=5) в группе только химиотерапии в режиме FLOT
(p=0,019). Частота достижения
ypT1 и N0 была также численно
выше в группе FLOT+TP против
FLOT и достигла 68% и 39% против
43% и 27% соответственно.
При медиане времени наблюдения 21 мес. медиана БРВ в группе
только химиотерапии составила 26
мес., а в группе с трастузумабом и
пертузумабом не достигнута. Медианы ОВ не достигнуты в обеих
лечебных группах (рис.1).
Рисунок 1.
. А – общая выживаемость, В – выживаемость без прогрессирования.
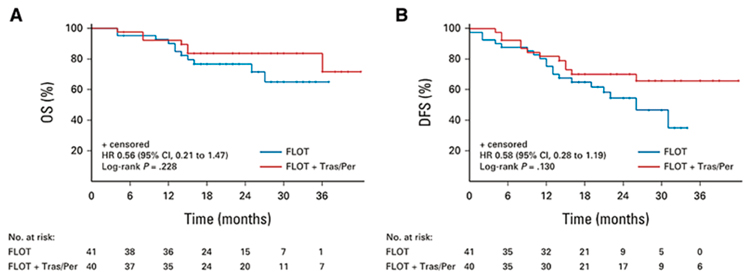
Токсичность терапии была приемлемой и управляемой. Нежелательные явления (НЯ) любой степени
в группах FLOT и FLOT+TP были
представлены тошнотой (60,0% и 59,0%), рвотой (30,0% и 36,0%),
диареей (50,0% и 92,0%), мукозитом (23,0% и 33,0%), нейтропенией
(35,0% и 36,0%), периферической
полинейропатией (46,0% и 34,0%)
и астенией (48,0% и 59,0%), а среди НЯ 3 и более степени наиболее
часто зарегистрированы нейтропения (30,0% и 28,0%) и диарея
(5,0% и 41,0%). С одной стороны,
частота диареи на фоне терапии
пертузумабом ожидаема, а с другой – уровень диареи 3-4 степени
в 41% заставляет задуматься о возможности использования данного
режима лечения в рутинной клинической практике.
Добавление пертузумаба и трастузумаба к режиму FLOT не привело
к увеличению числа послеоперационных осложнений и 30- и 60-дневной летальности.
К сожалению, в недавно опубликованном исследовании JACOB
[3] добавление пертузумаба к трастузумабу в 1 линии терапии диссеминированного РЖ не привело к
статистически значимому увеличению медианы ОВ – 14,2 мес. против
17,5 мес. (p=0,057). Результаты, полученные в исследовании JACOB,
послужили причиной отказа авторов, несмотря на достигнутые результаты, от продолжения данного
исследования в 3 фазе.
Источники:
1. Hofheinz R-D, Merx K, Haag GM, et al. FLOT Versus FLOT/Trastuzumab/ Pertuzumab Perioperative Therapy of Human Epidermal Growth Factor Receptor 2-Positive Resectable Esophagogastric Adenocarcinoma: A Randomized Phase II Trial of the AIO EGA Study Group. JCO; Published online 16 June 2022. DOI: 10.1200/ JCO.22.00380.
2. Al-Batran S-E, Homann N, Pauligk C, et al. Perioperative chemotherapy with fluorouracil plusleucovorin, oxaliplatin, and docetaxel versus fluorouracil or capecitabine plus cisplatin and epirubicin for locally advanced, resectable gastric or gastrooesophageal junction adenocarcinoma (FLOT4): A randomised, phase 2/3 trial. Lancet. 2019; 393: 1948-1957.
3. Tabernero J, Hoff PM, Shen L, et
al. Pertuzumab plus trastuzumab
and chemotherapy for HER2-
positive metastatic gastric or gastrooesophagealjunction cancer (JACOB):
Final analysis of a double-blind,
randomized, placebo-controlled phase 3
study. Lancet Oncol. 2018; 19: 1372-1384.
НОВЫЕ МИШЕНИ ДЛЯ ТАРГЕТНОЙ ТЕРАПИИ НА ASCO 2022: ИННОВАЦИОННЫЕ ПОДХОДЫ В РАННИХ ФАЗАХ КЛИНИЧЕСКИХ ИСПЫТАНИЙ
Автор: Волков Никита Михайлович
ГБУЗ «Санкт-Петербургский клинический научнопрактический центр
специализированных видов медицинской помощи (онкологический)»,
кандидат медицинских наук, Санкт-Петербург
Конгресс ASCO в этом году принес обилие новостей об испытаниях
препаратов, направленно воздействующих на разнообразные новые
молекулярные мишени, о некоторых
из которых практикующие онкологи
даже и не слышали ранее. Исследовались и низкомолекулярные препараты, и целый ряд антител и конъюгатов
цитостатиков с антителами. Обращает на себя внимание, что растет число
исследуемых препаратов, направленных на мишени, не специфичные для
отдельных локализаций опухолей, и
потенциально способных приобрести так называемые «tumor-agnostic»
показания.
Особого внимания заслуживают несколько работ, в которых впервые показана эффективность принципиально новых механизмов воздействия на
физиологию опухоли, в частности,
восстановления активности белка
р53 и изменения метаболических
процессов.
р53 является самым известным антионкогеном. Функционально белок
р53 связывается с ДНК и активируется под воздействием стрессорных
факторов при повреждениях генетического аппарата. При этом он активирует механизмы репарации, блокирует прогрессию клеточного цикла и
запускает апоптоз. Инактивирующие
мутации в гене р53 – это ключевой
момент в канцерогенезе и самое часто встречающееся молекулярное нарушение среди всех солидных опухолей, они обнаруживаются более чем в
половине случаев. Однако до сих пор
попытки использовать р53 в качестве
мишени для терапевтических воздействий не приносили успеха. На конгрессе в этом году впервые показаны
результаты успешного применения
препарата, мишенью которого является р53. Причем следует заметить,
что и механизм действия лекарства
оригинален. PC14586 является пероральным низкомолекулярным препаратом, обладающим сродством к р53 с мутацией Y220C. Связавшись с
белком, PC14586 стабилизирует его
в нормальной конформации, таким
образом восстанавливая функциональное активное состояние р53,
то есть, в отличие от большинства
известных препаратов, PC14586 не
является ингибитором молекулымишени, а, наоборот, восстанавливает ее утерянную за счет мутации
функцию. В исследование I фазы, в
котором впервые изучалось применение препарата у людей, включен
41 пациент с опухолями яичников,
поджелудочной, предстательной и
молочной желез, колоректальным
раком и некоторыми другими новообразованиями с мутацией р53
Y220C. Доза препарата 1500 мг
перорально дважды в день оказалась максимальной переносимой.
Что касается противоопухолевой
эффективности препарата, в первых трех когортах (до 600 мг 1 раз
в день) объективных ответов отмечено не было, тогда как среди
пациентов, получавших 1150 мг и
больше (31 больной), частота объективных ответов составила 32%.
Этот результат является ярким
показателем успеха нового препарата и открывает перспективы для
дальнейших исследований. Однако
нужно заметить, что PC14586 среди всего многообразия мутаций
р53 эффективен только при вполне
конкретной мутации Y220C, частота выявления которой при солидных опухолях составляет всего
около 1%. Тем не менее, перспективность не только самого нового
препарата, но и, что еще важнее,
нового механизма воздействия на
мишень не вызывает сомнений.
Еще один новый препарат, воздействующий на активность р53
опосредованно, также показал
определенные успехи. Так, были
представлены данные об эффективности низкомолекулярного ингибитора взаимодействия MDM2
и р53 BI-907828. Известно, что
MDM2 является негативным регулятором р53 и реализует этот
эффект как через блокирование
домена последнего, ответственного
за регуляцию экспрессии таргетных генов, так и за счет ускорения
деградации этого белка. Амплификация MDM2 – один из самых
частых механизмов подавления
активности р53 дикого типа при
опухолях. Чаще всего эта генетическая альтерация выявляется при
саркомах мягких тканей, особенно
при липосаркоме. В расширенную
когорту исследования Ia/Ib фазы
были включены 49 больных липосаркомой с амплификацией MDM2
(у 34 больных – дедифференцированная липосаркома, у 15 – высокодифференцированная). Среди
подлежащих оценке пациентов с
дедифференцированной липосаркомой у 4 (12,5%) отмечен частичный регресс, у 87,5% достигнута
как минимум стабилизация заболевания. Оценочная медиана выживаемости без прогрессирования
составила 8 месяцев, что является
выдающимся результатом на фоне
крайне ограниченной эффективности второй линии стандартной
химиотерапии трабектедином или
эрибулином при этой опухоли
(мВБП около 2 месяцев). В то же
время в группе больных с высокодифференцированной липосаркомой, которая считается вовсе нечувствительной к лекарственной
терапии, у 4 из 15 (26,7%) пациентов достигнут частичный ответ. У
остальных пациентов наблюдалась
стабилизация заболевания, а прогрессирование на момент анализа
отмечено только у 2 больных, что
не дает возможности оценить ВБП.
Еще один новый принцип воздействия на опухоли заключается в изменении метаболических процессов. Известно, что бета-окисление
жирных кислот имеет существенное значение как для метаболической адаптации опухолевых
клеток, так и для функционирования клеток иммуносупрессивного микроокружения и процессов
ангиогенеза. На конгрессе были
представлены результаты исследования I фазы препарата TPST-1120,
являющегося ингибитором PPARα
– транскрипционного фактора, регулирующего экспрессию ферментов метаболизма, ответственных
за процесс бета-окисления жирных
кислот. В монотерапии препарат
позволил добиться стабилизации
у 53% больных с ранее леченными
опухолями различных локализаций, с некоторым уменьшением
размеров очагов в отдельных случаях. Более многообещающие результаты показала комбинация
TPST-1120 с ингибитором PD-1
ниволумабом. Частичный ответ
отмечен у 3 из 13 пациентов. Причем среди этих ответов 2 зафиксированы у больных раком почки,
ранее уже прогрессировавших на
фоне иммунотерапии анти-PD-1,
а третий – у пациента с холангиокарциномой после 6 линий химиотерапии.
Описанные результаты открывают
широкую перспективу для развития новых эффективных подходов
к воздействию на биологические
свойства опухолей, ранее считавшихся недоступными для терапевтического вмешательства.
Источники:
1. Ecaterina Elena Dumbrava, Melissa Lynne Johnson, Anthony W. Tolcher, et al. First-in-human study of PC14586, a small molecule structural corrector of Y220C mutant p53, in patients with advanced solid tumors harboring a TP53 Y220C mutation. Abstr. 3003, Oral Abstract Session ASCO 2022.
2. Mrinal M. Gounder, Noboru Yamamoto, Manish R. Patel, et al. A phase Ia/Ib, dose-escalation/expansion study of the MDM2–p53 antagonist BI 907828 in patients with solid tumors, including advanced/metastatic liposarcoma (LPS). Abstr. 3004, Oral Abstract Session ASCO 2022.
3. Mark Yarchoan, John D. Powderly,
Bruno R. Bastos, et al. A phase 1 study
of TPST-1120 as a single agent and in
combination with nivolumab in subjects
with advanced solid tumors. Abstr. 3005,
Oral Abstract Session ASCO 2022.
РОЛЬ СТЕРЕОТАКСИЧЕСКОЙ ЛУЧЕВОЙ ТЕРАПИИ В ЛЕЧЕНИИ ПОЧЕЧНО-КЛЕТОЧНОГО РАКА
В июльском номере журнала European Urology опубликован крупный обзор [1] большого количества исследований (2 мета-анализа, включающих 54 исследования, 20 ретроспективных и 13 проспективных работ, одна из которых из России [2]) по применению SBRT в лечении больных первичным и метастатическим почечно-клеточным раком, опубликованных в период с 2000 по 2021 годы. SBRT, или SABR, является относительно новой опцией в лечении данной патологии, преимущественно по причине того, что ранее ПКР считался радиорезистентной опухолью при облучении малыми дозами (менее 3-5 Гр за фракцию). Первые исследования по облучению метастатических очагов ПКР в головном мозге методом SRS продемонстрировали великолепные результаты локального контроля, после чего количество работ по изучению эффективности SBRT при воздействии не только на интракраниальные, но и экстракраниальные очаги ПКР, изолированно или в сочетании с системной терапией, начало нарастать в геометрической прогрессии. В настоящее время SBRT внесена в рекомендации NCCN как альтернатива хирургическому лечению у больных, не операбельных по медицинским показаниям. Основные данные обзора кратко обозначены на рисунке 1. В целом SBRT при первичных опухолях почки обеспечила локальный контроль свыше 90% при минимальной клинически выраженной токсичности 0-9% у 575 пациентов, включенных в обзор. Рекомендуемые авторами дозы и режимы для подобного лечения - 25–26, 35–45 и 40–50 Гр за 1, 3 и 5 фракций, соответственно. Локальный контроль после стереотаксической радиохирургии интракраниальных метастазов ПКР среди 1225 пациентов оказался наиболее высоким – 90-97%. SABR позволила отсрочить назначение системной терапии минимум на год у 70-90% больных с олигометастазами ПКР при частоте клинически явной токсичности 3-4 степени менее 10%. Как демонстрируют первые исследования по комбинации SABR с таргетной и иммунотерапией, подобный подход является безопасным и вполне толерантным. В эру дальнейшего развития системного лечения метастатического ПКР и на фоне данных исследований CARMENA и SURTIME частота проведения циторедуктивных нефрэктомий снижается, но при этом возрастает интерес к комбинации циторедуктивной SABR и системной терапии. Грядущие исследования CYTOSHRINK (NCT04090710) и NRG-GU012 SAMURAI оценят эффективность SABR на первичную опухоль и иммунотерапии при метастатическом ПКР промежуточного и высокого риска.
Рисунок 1.
Эффективность, осложнения и показания
к проведению SBRT при ПКР [1].
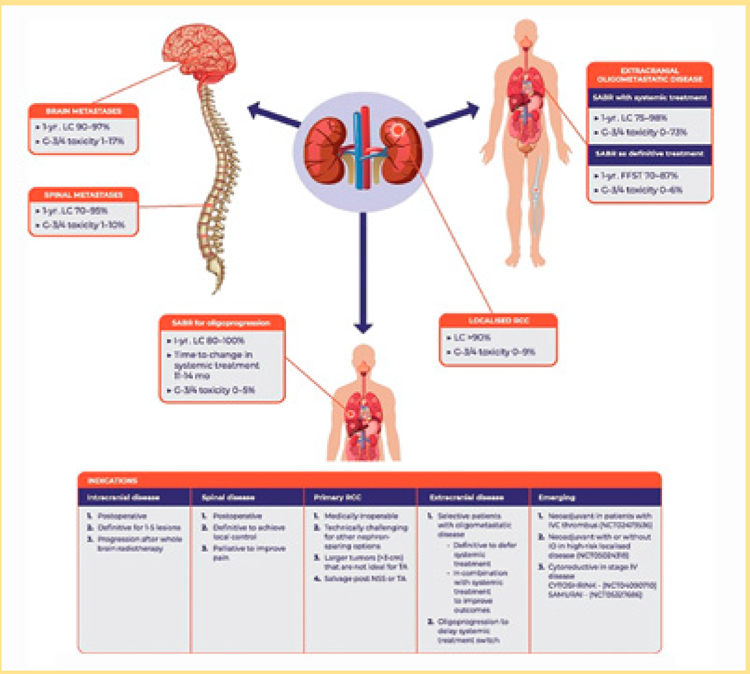
Источники:
1. Ali M, Mooi J, Lawrentschuk N, McKay RR, Hannan R, Lo SS, Hall WA, Siva S. The Role of Stereotactic Ablative Body Radiotherapy in Renal Cell Carcinoma. Eur Urol. 2022 Jul 14:S0302-2838(22)02468-X. doi: 10.1016/j.eururo.2022.06.017. Epub ahead of print. PMID: 35843777.
2. Dengina N., Mitin T., Gamayunov
S., Safina S., Kreinina Y., Tsimafeyeu
I. Stereotactic body radiation
therapy in combination with
systemic therapy for metastatic
renal cell carcinoma: a prospective
multicentre study. ESMO Open.
2019; 4: e000535
ПОДМЕЧЕНО ЧЕЛОВЕКОМ: БУДЕМ ЖИТЬ!
Zoe Cotton, 28 лет, закончила
Лондонскую Королевскую Центральную Школу Речи и Драмы,
курс по руководству театральной
постановкой. Её дипломная работа по пьесе А.П.Чехова «Медведь» была великолепно встречена публикой. Спустя несколько
лет жизни в Лондоне Зоуи круто
развернула свою жизнь и уехала
в глубокую провинцию. Много времени проводит на ферме с
животными, любит фотографировать.
Zoe Cotton:
Три года назад я приняла решение
сменить свою лихорадочную жизнь
технического менеджера сцены в
Лондоне на сельскую жизнь в Нортингтоне, крошечной деревушке в
Хэмпшире, недалеко от Винчестера. Почти десять лет до этого я работала за кулисами мюзиклов ВестЭнда, гастролировала по оперным,
танцевальным и театральным фестивалям вместе с удивительными
людьми из разных слоев общества.
Наэлектризованная атмосфера,
привкус адреналина, когда поднимается занавес и начинается шоу
- это чувство, которое я никогда не
забуду. Но как бы я ни любила его,
мне страстно хотелось отказаться
от постоянного шума и волнения
города ради успокаивающей тишины и уединения сельской местности.
Сейчас я живу и работаю на ферме,
ежедневно любуясь пышными зелеными полями и лесами – та же сцена, которая меняется в зависимости
от времени года, со вступительным
актом в виде ослепительно желтых
полей рапса на фоне ярко-голубого
неба и пушистых веточек ярового
ячменя, грациозно колышущихся
на ветру, уступающих место мясистым золотым зернам пшеницы, созревающей летом. Здесь солируют
стаи косуль и ланей, пролетающих
над полями, им радостно подпевают полевые жаворонки, огромные
рыжеватые коршуны кружат и парят над головой, их пронзительные
крики разносятся ветром, а златоглазые зайцы резвятся и танцуют,
постоянно прислушиваясь и грациозно взмахивая длинными ногами.
Финал: великолепная сипуха, низко и бесшумно охотящаяся над полями в сумерках, расправив белые
крылья, пролетает над всеми нами,
освещенная серебристым лунным
светом.
Пребывание здесь, на ферме, дает пищу и пространство для размышлений, для более спокойного дыхания и наблюдения за жизнью во всей ее красоте, с возможностью радоваться мельчайшим деталям. Я никогда не забуду свою жизнь в театре и не буду жалеть о ней. Я просто поменяла свет прожекторов на пение жаворонков.








Дорогие коллеги, если вы пишете стихи или прозу, любите фотографию или живопись – присылайте свои работы для публикации в газете в рубрике «Подмечено онкологом: будем жить!»
indigo.radonc@gmail.com