Дорогие коллеги, дорогие друзья!
Перед вами – объединенный июльско-августовский номер газеты. Он в основном посвящен новостям прошедшего в июне конгресса ASCO 2023, и в нем ведущие онкологи страны рассказали о наиболее ярких событиях этого крупнейшего онкологического мероприятия мирового уровня. Одни исследования, по мнению многих ученых, способны изменить существующую практику, другие...

Эгон Шиле. Гавань в Триесте. Картон, масло, 1907 год.
Художественный музей, Грац, Австрия.
Борис Рыжий 1997
Поехать в августе на юг на десять дней, трястись в плацкарте, играя всю дорогу в карты с прелестной парочкой подруг. Проститься, выйти на перрон качаясь, сговориться с первым о тихом домике фанерном под тенью шелестящих крон...
СОСТОЯЛИСЬ ВЫБОРЫ ПРАВЛЕНИЯ RUSSCO
Российское общество клинической онкологии (RUSSCO) 22 июня провело свою отчетно-перевыборную конференцию, результатом которой стали выборы Правления RUSSCO. Теперь в его состав входят двадцать пять ведущих специалистов-онкологов страны:
СЕССИЯ RUSSCO НА ОНКОЛОГИЧЕСКОМ ФОРУМЕ «БЕЛЫЕ НОЧИ» В САНКТ-ПЕТЕРБУРГЕ
Российское общество клинической онкологии (RUSSCO) 4 июля 2023 года провело в рамках IX Петербургского международного онкологического форума «БЕЛЫЕ НОЧИ 2023» сессию «Сопроводительная и поддерживающая терапия: что сделано, и что предстоит сделать».

Благотворительный забег «Самое время жить»
24 сентября 2023 МОСКВА
РАК МОЛОЧНОЙ ЖЕЛЕЗЫ: СНОВА ОБ ОБЛУЧЕНИИ ЛИМФОУЗЛОВ. ДАННЫЕ ВТОРИЧНОГО АНАЛИЗА ИССЛЕДОВАНИЯ SWOG S1007
Отношение к облучению регионарных лимфоколлекторов при раке молочной железы (РМЖ) менялось весьма значительно на протяжении десятилетий. Крупный анализ группы Early Breast Cancer Trialists' Collaborative Group 2014 года [1]...
«АБСКОПАЛЬНЫЙ ЭФФЕКТ»: ПОХОРОНЫ ИДЕИ – ИЛИ МЫ ЧТО-ТО ДЕЛАЕМ НЕ ТАК?..»
Именно так озаглавил свой пост в Twitter Piet Ost, главный автор проспективного рандомизированного исследования 2 фазы CHEERS, результаты которого были опубликованы в июльском номере журнала JAMA Oncology [1]. В кооперации с известными онкологами Европы, исследователи из 5 онкологических центров Бельгии постарались определить, является ли комбинация лучевой терапии в...
ОЧЕРЕДНАЯ ПОПЫТКА ЭСКАЛАЦИИ ДОЗЫ: ГЛИОБЛАСТОМА
Комплексное лечение злокачественных глиом головного мозга, подразумевающее удаление опухоли с последующей химиолучевой терапией, является в настоящее время единственным адекватным подходом к лечению этих крайне коварных опухолей. Тем не менее, результаты пока не внушают оптимизма, глиобластома рецидивирует у подавляющего большинства пациентов в течение 1,5-2 лет...
ГЛИОБЛАСТОМА: И СНОВА ПОИСКИ ИНТЕНСИФИКАЦИИ ДОЗЫ
На этот раз попытку улучшить результаты лечения предприняли индийские авторы в своем исследовании 2 фазы HART-GBM [1], опубликованном в июльском номере журнала Journal of NeuroOncology. Основываясь на том, что большинство рецидивов глиобластомы случаются в пределах поля ранее проведенного облучения, они предположили, что эскалация дозы на ложе...

НОВОСТИ ASCO 2023 / ВЗРЫВНЫЕ ИЗМЕНЕНИЯ ВО ВСЕХ ПЕРВЫХ ЛИНИЯХ ТЕРАПИИ В ОНКОГИНЕКОЛОГИИ. ASCO 2023: «ЗОЛОТОЙ СТАНДАРТ» В ОНКОГИНЕКОЛОГИИ СТАНОВИТСЯ «ПЛАТИНОВЫМ»
Этот год заставил нас задуматься над уже произошедшими, продолжающимися и грядущими изменениями в лечении больных с онкогинекологической патологией. Еще совсем недавно...

Цикл вебинаров ДЛЯ ПОДГОТОВКИ К ЭКЗАМЕНУ ESMO. ОПУХОЛИ ЖКТ
В августе-октябре 2023 года мы планируем провести цикл вебинаров для подготовки к экзамену ESMO, который состоится 21 октября 2023 года в Москве

НОВОСТИ ASCO 2023 / НЕМЕЛКОКЛЕТОЧНЫЙ РАК ЛЕГКОГО
В течение последних трех лет формат взаимодействия между специалистами как внутри страны, так и на международной арене существенно изменился. Ведущую роль в этих изменениях сыграла...

НОВОСТИ ASCO 2023 / РЕЗУЛЬТАТЫ С КОНФЕРЕНЦИИ ASCO 2023 (РАК ТОЛСТОЙ КИШКИ) – ИЛИ ЗАПИСКИ ИЗ ТЕЛЕГРАМА
В 2022 году с целью доведения информации с зарубежных конференций до ординаторов отделения Алексей Александрович Трякин создал телеграм-канал «Новости онкологии»...

НОВОСТИ ASCO 2023 / ASCO 2023: ЧТО ТАМ В МИРЕ ОНКОУРОЛОГИИ?
В июне 2023 года прошел очередной ежегодный конгресс ASCO 2023. Огромное количество новостей из мира онкоурологии. В этом небольшом материале постараемся рассказать о наиболее практически значимых из них...

НОВОСТИ ASCO 2023 / ОПУХОЛИ ГОЛОВЫ И ШЕИ
Прошедший конгресс ASCO 2023 в разделе опухолей головы и шеи не был ознаменован представлением результатов исследований, способных изменить существующую клиническую практику. Несколько работ обсуждались в рамках презентаций и в последующих дискуссиях, однако большее число исследований были представлены на постерной сессии...

НОВОСТИ ASCO 2023 / НОВЫЕ ДАННЫЕ ПО ЛЕЧЕНИЮ МЕЛАНОМЫ
Jason J. Luke представил финальные результаты выживаемости без отдаленных метастазов при применении пембролизумаба в адъювантном лечении у пациентов IIB/C стадии меланомы кожи в исследовании KEYNOTE-716. В исследовании сравнивались две группы: первая – с использованием пембролизумаба (487 пациентов) и вторая группа - плацебо (489 пациентов)...

ИССЛЕДОВАНИЕ SONIA СТАВИТ ПОД СОМНЕНИЕ НАЗНАЧЕНИЕ ИНГИБИТОРОВ CDK4/6 В ПЕРВОЙ ЛИНИИ ГОРМОНОТЕРАПИИ МЕТАСТАТИЧЕСКОГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ
Для меня самым интересным докладом на прошедшем конгрессе ASCO было представление исследования SONIA, проведенное у больных метастатическим гормоночувствительным (HR+) HER2...

КОММЕНТАРИИ ЭКСПЕРТОВ
SONIA оказалось одним из самых обсуждаемых (а иногда – на повышенных тонах) исследований, результаты которого были озвучены на последнем конгрессе ASCO. Пожалуй, его действительно...

ASCO 2023: ЧТО ПОКАЗАЛОСЬ МНЕ ИНТЕРЕСНЫМ ИЗ ПРЕДСТАВЛЕННЫХ ДАННЫХ О ТЕРАПИИ РАННЕГО РМЖ?
Данные последнего ASCO, касающиеся терапии раннего рака молочной железы (рРМЖ), не стали пока ни судьбоносными, ни меняющими нашу практику. Но кое-что было не только интересным, но и полезным для понимания правильности наших,...
МНЕНИЕ. 10 ИЗМЕНЕНИЙ, КОТОРЫЕ Я СДЕЛАЮ В СВОЕЙ ПРАКТИЧЕСКОЙ РАБОТЕ ПОСЛЕ ПОСЕЩЕНИЯ ASCO 2023
Jeffrey J. Kirshner, MD, FACP, FASCO, Central New York (HOACNY) in East Syracuse Ten Practice Changes I Will Make After Attending ASCO 2023...

ДЕПРЕССИЯ И ТРЕВОЖНЫЕ СОСТОЯНИЯ НЕ УВЕЛИЧИВАЮТ РИСК ЗАБОЛЕТЬ ЗЛОКАЧЕСТВЕННЫМИ ОПУХОЛЯМИ
Думаю, что большинство практикующих онкологов согласятся с утверждением, что у оптимистически настроенных больных злокачественными новообразованиями в отличие от депрессивных...

XXVII РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС 2023
14 - 16 НОЯБРЯ 2023 МОСКВА
Анонс
-

5 Августа 2023 10:00-11:40
Цикл вебинаров ДЛЯ ПОДГОТОВКИ К ЭКЗАМЕНУ ESMO. ОПУХОЛИ ЖКТ
Цикл вебинаров ДЛЯ ПОДГОТОВКИ К ЭКЗАМЕНУ ESMO. ОПУХОЛИ ЖКТ
-

24 cентября 2023 МОСКВА
Благотворительный забег «Самое время жить»
Благотворительный забег «Самое время жить»
-

14 - 16 НОЯБРЯ 2023 МОСКВА
XXVII РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС 2023
XXVII РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС 2023
Дорогие коллеги, дорогие друзья!
Перед вами – объединенный июльско-августовский номер газеты. Он в основном посвящен новостям прошедшего в июне
конгресса ASCO 2023, и в нем ведущие онкологи страны рассказали о наиболее ярких событиях этого крупнейшего онкологического мероприятия мирового уровня. Одни исследования,
по мнению многих ученых, способны изменить существующую
практику, другие вызвали немало дискуссий в онкологическом
сообществе - наши эксперты постарались продемонстрировать
это в своих публикациях по различным локализациям опухолей. Читайте, берите себе на заметку, обсуждайте с коллегами и
пишите свои комментарии нам на сайт rosoncoweb.ru.
Приближается XXVII Российский онкологический конгресс, основные этапы подготовки научной программы уже завершены.
Не пропустите информацию об экзамене ESMO, который будет
проходить в дни конгресса. Цикл вебинаров для подготовки к
нему уже идет, даты обозначены на заглавной странице сайта.
Наше общество в лице его представителей из региональных
отделений избрало новое правление. Приглашаем вас ознакомиться с новым расширенным списком членов правления на
страницах нашей газеты и на сайте. Новый состав действительно отражает мультидисциплинарный характер RUSSCO –
общества, объединяющего различных специалистов в области
онкологии и диагностики.
…Пролетело еще одно лето, снова – почти незаметно. Многие из нас уже вернулись на рабочие места из отпусков, и мы надеемся, что душевное равновесие, наступающее в период отдыха, пребудет с нами как можно дольше. Кожа еще хранит следы летнего загара, на улице по-прежнему тепло и светло большую часть дня – но скоро первые желтые листья напомнят об осени. Тем не менее – добрых и ярких августовских дней вам, дорогие друзья!
Ваша команда RUSSCO
Эгон Шиле. Гавань в Триесте. Картон, масло, 1907 год.
Художественный музей, Грац, Австрия.

Борис Рыжий 1997
***
Поехать в августе на юг
на десять дней, трястись в плацкарте,
играя всю дорогу в карты
с прелестной парочкой подруг.
Проститься, выйти на перрон
качаясь, сговориться с первым
о тихом домике фанерном
под тенью шелестящих крон.
Но позабыть вагонный мат,
тоску и чай за тыщу двести,
вдруг повстречавшись в том же месте,
где расставались жизнь назад.
А вечером в полупустой
шашлычной с пустотой во взоре
глядеть в окно и видеть море,
что бушевало в жизни той.
СОСТОЯЛИСЬ ВЫБОРЫ ПРАВЛЕНИЯ RUSSCO
Российское общество клинической онкологии (RUSSCO)
22 июня провело свою отчетно-перевыборную конференцию,
результатом которой стали выборы Правления RUSSCO.
Теперь в его состав входят двадцать пять ведущих
специалистов-онкологов страны:

• Болотина Лариса Владимировна, зав. отделением химиотерапии МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИЦ радиологии» Минздрава России, доцент РАН, д.м.н. (Москва);
Владимирова Любовь Юрьевна,
зав. отделением противоопухолевой лекарственной терапии ФГБУ
«НМИЦ онкологии» Минздрава
России, профессор, д.м.н., председатель регионального отделения
RUSSCO (Ростов-на-Дону);
• Гладков Олег Александрович, директор клиники «ЭВИМЕД», Заслуженный врач РФ, главный редактор, автор и председатель рабочей группы по разработке Практических рекомендаций RUSSCO, профессор, д.м.н. (Челябинск);
• Деньгина Наталья Владимировна, зав. радиологическим отделением ГУЗ «Областной клинический онкологический диспансер», директор Центра лучевой терапии «R-Spei», главный редактор Газеты RUSSCO и сайта RosOncoWeb.ru, к.м.н., председатель регионального отделения RUSSCO (Ульяновск);
• Жигулев Антон Николаевич, зам. главного врача по организационно-методической работе ГБУЗ ПК «Пермский краевой онкологический диспансер», к.м.н. (Пермь);
• Жуков Николай Владимирович, руководитель отдела междисциплинарной онкологии ФГБУ «НМИЦ Детской гематологии, онкологии и иммунологии им. Д. Рогачева», доцент кафедры онкологии, гематологии и лучевой терапии РНИМУ им. Н.И. Пирогова, профессор, д.м.н. (Москва);
• Жукова Людмила Григорьевна, зам. директора ГБУЗ «Московский клинический научный центр им. А.С. Логинова ДЗМ», член-корр. РАН, д.м.н. (Москва);
• Зуков Руслан Александрович, главный врач КГБУЗ «Красноярский краевой клинический онкологический диспансер им. А.И. Крыжановского», зав. кафедрой онкологии и лучевой терапии с курсом ПО, ГБОУ ВПО «Красноярский государственный медицинский университет им. проф. В.Ф. Войно-Ясенецкого», профессор, д.м.н. (Красноярск);
• Карабина Елена Владимировна, зав. отделением противоопухолевой лекарственной терапии ГУЗ «Тульский областной онкологический диспансер» (Тула);
• Кононец Павел Вячеславович, зам. директора по лечебной и научной работе – директор НИИ клинической онкологии им. акад. РАМ и РАМН Н.Н. Трапезникова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, к.м.н. (Москва);
• Моисеенко Владимир Михайлович, директор ГБУЗ «СанктПетербургский клинический научно-практический центр специализированных видов медицинской помощи (онкологический) им. Н.П. Напалкова», Заслуженный врач РФ, член-корреспондент РАН, профессор, д.м.н., председатель регионального отделения RUSSCO, главный редактор Практических рекомендаций RUSSCO (Санкт-Петербург);
• Моисеенко Федор Владимирович, зав. онкологического химиотерапевтического (противоопухолевой лекарственной терапии) отделения биотерапии ГБУЗ «Санкт-Петербургский клинический научно-практический центр специализированных видов медицинской помощи (онкологический) им. Н.П. Напалкова», доцент кафедры онкологии Северо-Западного государственного медицинского университета им. И.И. Мечникова, д.м.н. (СанктПетербург);
• Носов Дмитрий Александрович, руководитель онкологического отделения противоопухолевой терапии ФГБУ «Центральная клиническая больница» Управления делами Президента РФ, председатель рабочей группы по разработке Практических рекомендаций RUSSCO, профессор, д.м.н. (Москва);
• Орлова Рашида Вахидовна, зав. кафедрой онкологии медицинского факультета ФГБОУВО «СанктПетербургский государственный университет», главный специалист по клинической онкологии СПб ГБУЗ «Городской клинический онкологический диспансер», профессор, д.м.н. (Санкт-Петербург);
• Петровский Александр Валерьевич, зам. директора по образовательной деятельности ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, зав. отделением комбинированного лечения опухолей молочной железы, доцент кафедры онкологии Института клинической медицины ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России, к.м.н. (Москва);
• Покатаев Илья Анатольевич, руководитель службы химиотерапевтического лечения ГБУЗ «Городская клиническая онкологическая больница №1» ДЗ Москвы, д.м.н. (Москва);
• Проценко Светлана Анатольевна, зав. отделением химиотерапии и инновационных технологий ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, д.м.н. (Санкт-Петербург);
• Раскин Григорий Александрович, зав. отделением патологической анатомии МИБС, профессор кафедры онкологии ФГБОУВО «Санкт-Петербургский государственный университет», д.м.н. (Санкт-Петербург);
• Румянцев Алексей Александрович, ст. науч. сотрудник онкологического отделения лекарственных методов лечения (химиотерапевтическое) №4 ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, председатель комитета молодых онкологов RUSSCOjr, к.м.н. (Москва);
• Семиглазова Татьяна Юрьевна, зав. научным отделом инновационных методов терапевтической онкологии и реабилитации ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, профессор кафедры ГБОУ ВО «СЗГМУ им. И.И. Мечникова» Минздрава России, профессор, д.м.н. (СанктПетербург);
• Трякин Алексей Александрович, зам. директора по научной работе, заведующий онкологическим отделением лекарственных методов лечения (химиотерапевтическое) №2 НИИ клинической онкологии им. акад. РАН и РАМН Н.Н. Трапезникова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, национальный представитель России в ESMO, д.м.н. (Москва);
• Тюляндин Сергей Алексеевич, глав. науч. сотрудник ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Заслуженный деятель науки РФ, профессор, д.м.н. (Москва);
• Тюляндина Александра Сергеевна, зав. отделением лекарственных методов лечения злокачественных опухолей №4 НИИ клинической онкологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, профессор кафедры онкологии ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России, д.м.н. (Москва);
• Федянин Михаил Юрьевич, руководитель химиотерапевтической службы ГБУЗ «ММКЦ «Коммунарка» ДЗМ», научный консультант ФГБУ «Национальный медико-хирургический Центр им. Н.И. Пирогова» Министерства здравоохранения РФ, д.м.н. (Москва);
• Черных Марина Васильевна,
зам. директора НИИ КиЭР
ФГБУ «НМИЦ онкологии им.
Н.Н. Блохина» Минздрава
России, доцент кафедры онкологии, радиотерапии ФГАОУ ВО «Первый МГМУ им.
И.М. Сеченова» Минздрава
России, к.м.н. (Москва).
СЕССИЯ RUSSCO НА ОНКОЛОГИЧЕСКОМ ФОРУМЕ «БЕЛЫЕ НОЧИ» В САНКТ-ПЕТЕРБУРГЕ
Российское общество клинической онкологии (RUSSCO) 4 июля 2023 года провело в рамках IX Петербургского международного онкологического форума «БЕЛЫЕ НОЧИ 2023» сессию «Сопроводительная и поддерживающая терапия: что сделано, и что предстоит сделать».
Во время сессии эксперты RUSSCO, в том числе члены правления Общества – проф., д.м.н. Олег Александрович Гладков (Челябинск), к.м.н. Антон Николаевич Жигулев (Пермь) и Елена Владимировна Карабина (Тула), рассказали коллегам со всей России о текущем статусе практических рекомендаций по поддерживающей терапии, о реальных возможностях обеспечения лекарственными препаратами онкологических больных для проведения поддерживающей терапии в настоящее время, а также о том, как должна выглядеть идеально организованная поддерживающая и сопроводительная терапия в современных условиях.

Благотворительный забег «Самое время жить»
24 сентября 2023 МОСКВА

РАК МОЛОЧНОЙ ЖЕЛЕЗЫ: СНОВА ОБ ОБЛУЧЕНИИ ЛИМФОУЗЛОВ. ДАННЫЕ ВТОРИЧНОГО АНАЛИЗА ИССЛЕДОВАНИЯ SWOG S1007
Отношение к облучению регионарных лимфоколлекторов при
раке молочной железы (РМЖ)
менялось весьма значительно на
протяжении десятилетий. Крупный анализ группы Early Breast
Cancer Trialists' Collaborative
Group 2014 года [1] в целом убедил мировое онкологическое сообщество в том, что даже в случае
минимального поражения регионарных лимфоузлов, даже после
радикальной мастэктомии и даже
при проведении адъювантного
системного лечения добавление
лучевой терапии на грудную
стенку и зоны лимфооттока дает
преимущества в плане снижения
риска рецидива и уменьшения
смертности от РМЖ. Показания
к облучению у этой категории
пациенток расширились, поток
больных в центры лучевой терапии вырос, однако сомнения все
равно оставались в отношении
группы больных с благополучным прогнозом.
В июле 2023 года в журнале JAMA
Oncology были опубликованы
результаты повторного анализа
данных мультицентрического
проспективного рандомизированного исследования SWOG
S1007 [2], касающиеся именно
пациенток с ограниченным поражением лимфоузлов и благоприятным прогнозом. Основной вопрос, который поставили
перед собой исследователи из 11
американских центров: а не перелечиваем ли мы этих больных?
Какова частота локорегионарных
рецидивов среди пациентов, которые не получают облучение регионарных узлов после операции
по поводу рака молочной железы
с низкой степенью рецидива с вовлечением от 1 до 3 узлов? Есть ли
группа пациентов, которая не будет проигрывать от де-эскалации
лечения, заключающейся в отказе
от адъювантной лучевой терапии?
В этом вторичном анализе исследования SWOG S1007 пациенты с
положительным гормональным
статусом, HER2-отрицательным
РМЖ и с полученными результатами анализа оценки риска рецидива по данным теста Oncotype
DX 21 (не более 25 баллов) были
рандомизированы только на гормонотерапию либо химиотерапию
с последующей эндокринной терапией. Проспективно собранная
информация о лучевой терапии
(прежде всего в отношении облучения зон регионарных лимфоузлов, как минимум, надключичной
области) была получена от 4871
пациентки; данные были проанализированы с июня 2022 года по
апрель 2023 года.
Из 4871 пациентки (средний возраст 57 [18-87] лет) 3947 (81,0%) сообщили о получении того или иного варианта лучевой терапии. Из 3852 пациентов, получивших лучевую терапию и имевших полную информацию об облученных зонах, 2274 (59,0%) отметили облучение зон лимфоузлов. При медиане наблюдения 6,1 года кумулятивная частота локорегионарных рецидивов к 5 годам составила 0,85% среди пациенток, перенесших органосохраняющую операцию и лучевую терапию с захватом лимфоузлов, 0,55% после органосохраняющей операции с лучевой терапией без облучения лимфоузлов, 0,11% после мастэктомии с лучевой терапией и 1,7% после мастэктомии без лучевой терапии. Аналогично низкий риск ЛРР наблюдался в группе, получавшей эндокринную терапию без химиотерапии. Выживаемость без ипсилатерального прогрессирования не различалась в зависимости от проведения облучения лимфоузлов (у женщин в пременопаузе отношение рисков составило 1,03; 95% ДИ, 0,74-1,43; P=,87; в постменопаузе - HR, 0,85; 95% ДИ, 0,68- 1,07; P= .16). Таким образом, этот повторный анализ клинического исследования SWOG S1007, основанный на биологических особенностях РМЖ и поиске подгруппы наиболее благоприятного прогноза с N1, показал, что частота ЛРР была низкой даже у пациентов, не получавших облучения лимфоузлов. Безрецидивная выживаемость не была связана с радиотерапией на регионарные зоны; отсутствие химиотерапии среди подобных пациентов не является независимым показанием для обязательного применения облучения лимфоузлов. Столь низкий риск ЛРР действительно ставит под сомнение необходимость рутинного расширения объемов облучения.
Источники:
1. EBCTCG (Early Breast Cancer Trialists' Collaborative Group); McGale P, Taylor C, Correa C, et al. Effect of radiotherapy after mastectomy and axillary surgery on 10-year recurrence and 20-year breast cancer mortality: meta-analysis of individual patient data for 8135 women in 22 randomised trials. Lancet. 2014 Jun 21;383(9935):2127-35. doi: 10.1016/ S0140-6736(14)60488-8. Epub 2014 Mar 19. Erratum in: Lancet. 2014 Nov 22;384(9957):1848. PMID: 24656685; PMCID: PMC5015598.
2. Jagsi R, Barlow WE, Woodward
WA, et al. Radiotherapy Use and
Incidence of Locoregional Recurrence
in Patients With Favorable-Risk,
Node-Positive Breast Cancer Enrolled
in the SWOG S1007 Trial. JAMA
Oncol. 2023 Jul 6:e231984. doi:
10.1001/jamaoncol.2023.1984. Epub
ahead of print. PMID: 37410451;
PMCID: PMC10326730.
«АБСКОПАЛЬНЫЙ ЭФФЕКТ»: ПОХОРОНЫ ИДЕИ – ИЛИ МЫ ЧТО-ТО ДЕЛАЕМ НЕ ТАК?..»
Именно так озаглавил свой пост
в Twitter Piet Ost, главный автор
проспективного рандомизированного исследования 2 фазы
CHEERS, результаты которого
были опубликованы в июльском
номере журнала JAMA Oncology
[1]. В кооперации с известными
онкологами Европы, исследователи из 5 онкологических центров
Бельгии постарались определить,
является ли комбинация лучевой
терапии в субаблативных дозах
(способных, тем не менее, активировать иммунный ответ) и иммунотерапии перспективной в лечении больных с олигометастазами
солидных опухолей. Увы, ответ
оказался разочаровывающим.
На подобную комбинацию возлагали надежды онкологи всего
мира. Первые исследования по
этой проблеме принесли неоднозначные результаты. Если добавление SBRT на метастазы немелкоклеточного рака легкого на
фоне проводимой иммунотерапии пембролизумабом бесспорно
улучшили отдаленные результаты, увеличив частоту абскопальных эффектов, улучшив локальный контроль и снизив риск
смерти от НМРЛ [2], или в случае
метастатической меланомы [3],
то при опухолях головы и шеи и
раке молочной железы, увы, подобная комбинация никаких
преимуществ не принесла [4,5].
Проспективных исследований
пока немного, поэтому результаты работы бельгийских авторов
особенно ожидались.
«Насколько нам известно, это
крупнейшее на сегодняшний
день исследование по рандомизированной оценке комбинации
лучевой терапии и ингибиторов
контрольных точек»,– отметили
исследователи. В многоцентровое
исследование CHEERS было вовлечено 99 пациентов из 5 бельгийских центров, включенных
в исследование в период с марта 2018 г. по октябрь 2020 г., 3 из
них были исключены из анализа
в связи с отзывом согласия. Пациенты в возрасте 18 лет и старше с местнораспространенной
или метастатической меланомой,
почечно-клеточным раком, уротелиальным раком, плоскоклеточным раком головы и шеи или
немелкоклеточным раком легкого были случайным образом
распределены либо в контрольную группу (n=52), либо в экспериментальную группу (n=47).
Большинство пациентов – 73% в
контрольной группе и 78% в экспериментальной группе – имели
более 3 поражений на исходном
уровне. Кроме того, большинство
из них прошли по крайней мере 1
предшествующую линию системного лечения. Медиана возраста в
обеих группах составила 66 лет,
и большинство пациентов были
мужчинами. Подавляющее большинство имело IV стадию заболевания. Уротелиальная карцинома
была наиболее распространенной
опухолью в обеих группах, составив 31% пациентов в контрольной
группе и 36% в экспериментальной группе. Большинство пациентов (55%) в контрольной группе
ранее получали лучевую терапию
по сравнению с меньшим количеством больных в экспериментальной группе (40%). Пациенты
были рандомизированы (1:1) для
получения иммунотерапии антиPD-1 или анти- PD-1 препаратами
в соответствии со стандартом лечения (контрольная группа) или в
сочетании со стереотаксической
лучевой терапией на метастатические очаги в режиме 3 фракции
по 8 Гр, максимум на 3 очага, до
второго или третьего цикла иммунотерапии, в зависимости от
частоты введения (экспериментальная группа). Препараты и
схемы иммунотерапии, а также
режимы дозирования включали
внутривенное введение ниволумаба (Опдиво) по 240 мг каждые 2
недели или 480 мг каждые 4 недели, внутривенное введение пембролизумаба (Китруда) по 200 мг
каждые 3 недели и внутривенное
введение атезолизумаба (Тецентрик) по 1200 мг каждые 3 недели.
Стратификация была в соответствии с гистологическими данными опухоли и распространенностью метастатического процесса
(3 и менее или более 3 очагов).
Первичной конечной точкой была выживаемость без прогрессирования (ВБП) в соответствии с критериями оценки иммунного ответа при солидных опухолях. Ключевые вторичные конечные точки включали общую выживаемость (ОВ), частоту объективных ответов, частоту местного контроля и токсические эффекты. Эффективность оценивалась в популяции, получавшей лечение по протоколу, а безопасность оценивалась в общей популяции пациентов, получавших лечение. В отношении побочных эффектов разницы между группами отмечено не было. Острые нежелательные явления (НЯ), связанные с лечением, любой степени тяжести наблюдались у 79% и 78% пациентов в контрольной и экспериментальной группах соответственно, а НЯ 3/4 степени встречались у 18% пациентов в обеих группах. Наиболее частые НЯ включали утомляемость и зуд, которые наблюдались у 35% пациентов в контрольной группе и у 42% пациентов в экспериментальной группе. Один случай пневмонита 3 степени был расценен как связанный с лучевой терапией.
Рисунок 1.
Основные данные и результаты
исследования CHEERS [1].
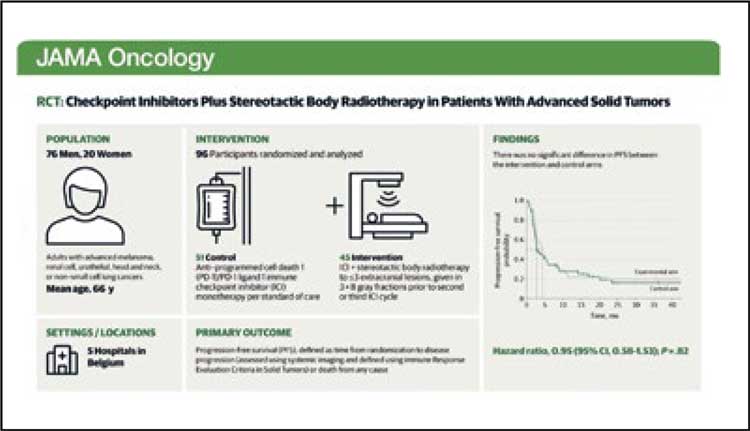
Увы, улучшения общей выживаемости (ОВ) или выживаемости без прогрессирования (ВБП) после добавления субаблативной стереотаксической лучевой терапии к однокомпонентному ингибитору контрольных точек иммунного ответа для олигометастатических пациентов с солидными опухолями отмечено не было, хотя тенденция к улучшению отдаленных результатов прослеживалась. Медиана ВБП составила 2,8 месяца (95% ДИ, 2,5-8,4) при использовании только иммунотерапии против 4,4 месяца (95% ДИ, 2,8–7,8) при добавлении лучевой терапии (HR, 0,95; 95% ДИ, 0,58-1,53; P= .82). Медиана ОВ составила 11,0 (95% ДИ, 9,0 – не достигнуто) и 14,3 (95% ДИ, 11,0 – не достигнуто) месяцев соответственно (ОР 0,82; 95% ДИ 0,48-1,41; P=0,47). Исследователи также сообщили о незначительной разнице в частоте объективных ответов 22% и 27% в каждой соответствующей группе (P=0,56). Но при этом локальный контроль очагов составил 75% среди пациентов, получавших лучевую терапию, у 15 из которых (33%) наблюдался полный ответ. Иммунный полный ответ, определенный по RECIST, был наиболее полным общим ответом у 8% и 16% пациентов в контрольной и экспериментальной группах соответственно.
Исследователи отметили несколько ограничений своей работы, в том числе неоднородность популяции пациентов и, как следствие, небольшие размеры выборки для стратификации. Проведение предшествующей лучевой терапии также было частым явлением в контрольной группе, и это могло привести к недооценке клинической пользы экспериментального лечения. Возможно, увеличение числа пациентов изменило бы результаты в пользу комбинации, и более крупные исследования, вероятно, продемонстрируют это. Возможно, лучевая терапия была бы более эффективна в плане развития абскопального эффекта, если б была применена в момент прогрессирования, как отметили в комментариях некоторые ученые. И, наконец, вполне вероятно, что комбинация SBRT и иммунотерапии не является универсальной и работает далеко не при всех опухолях, и в большинстве случаев срабатывает так называемый «badscopal effect», как отмечает профессор Ralph Weichselbaum (см. rosoncoweb.ru/ news/oncology/2023/06/01/). «Двигаясь вперед, мы стремимся к дальнейшему выяснению иммунологических эффектов лучевой терапии и определению прогностических биомаркеров для отбора пациентов в исследовательском анализе in silico и in vitro исследуемой популяции CHEERS»,– заключили исследователи. «В этом рандомизированном клиническом исследовании 2 фазы, несмотря на то, что добавление субаблативной стереотаксической лучевой терапии к монотерапии ингибиторами контрольных точек не привело к клинически значимому абскопальному эффекту в общей популяции пациентов, результаты показывают, что сочетать оба метода лечения в этом контексте вполне безопасно, и это достаточно важная информация для планирования будущих испытаний. Недавние данные свидетельствуют о том, что облучение всех метастатических очагов более высокими дозами облучения в выбранной популяции пациентов может быть более многообещающей стратегией для оптимизации системного контроля заболевания». В любом случае, каждый пациент, получающий иммунотерапию по поводу метастатического процесса и имеющий показания к лучевой терапии на один или несколько очагов, может безопасно получать это лечение – это демонстрирует уже немалое количество исследований.
Источники:
1. Spaas M, Sundahl N, Kruse V, et al. Checkpoint inhibitors in combination with stereotactic body radiotherapy in patients with advanced solid tumors: the CHEERS phase 2 randomized clinical trial. JAMA Oncol. Published online July 6, 2023. doi:10.1001/ jamaoncol.2023.2132
2. Theelen WSME, Chen D, Verma V, et al. Pembrolizumab with or without radiotherapy for metastatic non-small-cell lung cancer: a pooled analysis of two randomised trials. Lancet Respir Med. 2021 May;9(5):467-475. doi: 10.1016/ S2213-2600(20)30391-X. Epub 2020 Oct 20. Erratum in: Lancet Respir Med. 2021 Mar;9(3):e29. PMID: 33096027.
3. Chicas-Sett R, Zafra J, RodriguezAbreu D, et al. Combination of SABR With Anti-PD-1 in Oligoprogressive Non-Small Cell Lung Cancer and Melanoma: Results of a Prospective Multicenter Observational Study. Int J Radiat Oncol Biol Phys. 2022 Nov 15;114(4):655-665. doi: 10.1016/j. ijrobp.2022.05.013. Epub 2022 May 18. PMID: 35595158.
4. McBride SM, Sherman EJ, Tsai CJ, et al. A phase II randomized trial of nivolumab with stereotactic body radiotherapy (SBRT) versus nivolumab alone in metastatic (M1) head and neck squamous cell carcinoma (HNSCC). J Clin Oncol 2018;36:abstr 6009
5. Chmura SJ, Winter KA, Woodward WA, et al. NRG-BR002: A phase IIR/III trial of standard of care systemic therapy with or without stereotactic body radiotherapy (SBRT) and/or surgical resection (SR) for newly oligometastatic breast cancer (NCT02364557). J Clin Oncol. 2022;40(suppl 16):1007. doi:10.1200/ JCO.2022.40.16_suppl.1007
ОЧЕРЕДНАЯ ПОПЫТКА ЭСКАЛАЦИИ ДОЗЫ: ГЛИОБЛАСТОМА
Комплексное лечение злокачественных глиом головного мозга, подразумевающее удаление опухоли с последующей химиолучевой терапией, является в настоящее время единственным адекватным подходом к лечению этих крайне коварных опухолей. Тем не менее, результаты пока не внушают оптимизма, глиобластома рецидивирует у подавляющего большинства пациентов в течение 1,5-2 лет. Очередную попытку улучшить отдаленные результаты предприняла группа авторов из 20 центров Франции в своем проспективном рандомизированном исследовании 3 фазы SPECTRO GLIO [1], сделав акцент на эскалации дозы лучевой терапии на ложе опухоли свыше традиционных 60 Гр. Ранее было показано, что магнитно-резонансная спектроскопическая томография (MRSI) позволяет по ряду показателей предсказать очаг возможного рецидива, и исследователи поставили цель проанализировать влияние эскалации дозы облучения на зону риска рецидива под контролем MRSI на общую выживаемость (ОВ) пациентов с впервые диагностированной глиобластомой. В это мультицентрическое исследование 3 фазы (NCT01507506) были включены 180 пациентов с глиобластомой, средний возраст которых составлял 61 год (диапазон 26–84 года), в период с марта 2011 по март 2018 гг. Большинство пациентов (85%) подверглись хирургической резекции, а 50,6% имели неметилированный ген MGMT. Из 113 пациентов, поддающихся оценке, 95,5% имели глиобластому IDH дикого типа. Пациенты были случайным образом распределены в группу стандартной лучевой терапии в дозе 60 Гр (n=90) или группу эскалации дозы (n=90), с одновременным бустом до 72 Гр под контролем MRSI на область метаболических изменений, ложе опухоли и остаточные очаги контрастного усиления. Все пациенты получали темозоломид во время облучения и в течение 6 месяцев после его окончания. Базовые характеристики были хорошо сбалансированы между группами.
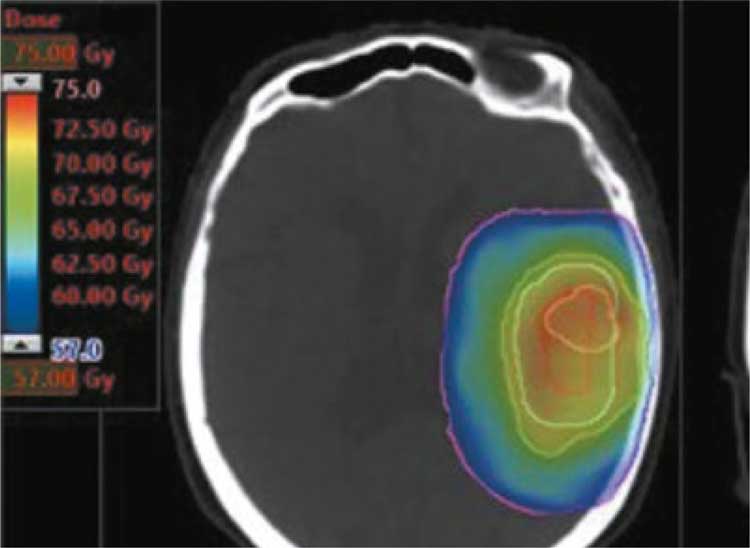
При среднем сроке наблюдения 43,9 месяцев медиана ОВ составила 22,6 месяцев в стандартной группе и 22,2 месяца в группе с высокими дозами. В нескорректированном анализе (отношение рисков [HR], 0,90; 95% ДИ, 0,64– 1,27; P=0,5526) или в мультивариантном анализе (скорректированное HR, 0,91; 95% ДИ, 0,64-1,29; P=0,594) не было значительных различий в ОВ между группами. Медиана ВБП составила 8,6 месяцев в стандартной группе и 7,8 месяцев в высокодозной группе. В нескорректированном анализе (HR, 1,0; 95% ДИ, 0,80–1,48; P = 0,6027) или многофакторном анализе (скорректированный HR, 1,10; 95% ДИ, 0,80–1,50; Р=0,567) различий между группами в ВБП не было.
Нежелательные явления (НЯ) были зарегистрированы у всех пациентов. Общие НЯ, неврологические НЯ и гематологические НЯ в целом были сопоставимы между группами. Однако головные боли чаще встречались в группе стандартной дозы, чем в группе высокой дозы (59,1% и 44% соответственно; P=0,0484). Неврологический дефицит, напротив, чаще отмечен в группе эскалации дозы, чем в группе со стандартной дозой (67,5% и 51,1% соответственно; P=0,0299).
Частота псевдопрогрессии была сходной в группах (14,4% и 16,7%). Интересно, что для пациентов с метилированным MGMT медиана общей выживаемости составляла 38 месяцев (95% IC [23,2; NR]) в группе эскалации дозы по сравнению с 28,5 месяцами (95% IC [21,1; 35,7]) для пациентов, получивших стандартные 60 Гр.
«Учитывая высокую радиорезистентность глиобластомы, можно
предположить, что доза на область буста должна быть намного
выше, чем та, которую мы подводили», — отмечают исследователи. «Определение объема зоны
буста, возможно, требует мультимодального подхода и должно
включать несколько метаболических и функциональных методов
визуализации».
Источники:
Laprie A, Noel G, Chaltiel L, et
al. Randomized phase III trial of
metabolic imaging-guided dose
escalation of radio-chemotherapy
in patients with newly diagnosed
glioblastoma (SPECTRO GLIO trial).
Neuro Oncol. 2023 Jul 7:noad119.
doi: 10.1093/neuonc/noad119. Epub
ahead of print. PMID: 37417948.
ГЛИОБЛАСТОМА: И СНОВА ПОИСКИ ИНТЕНСИФИКАЦИИ ДОЗЫ
На этот раз попытку улучшить
результаты лечения предприняли индийские авторы в своем исследовании 2 фазы HART-GBM
[1], опубликованном в июльском
номере журнала Journal of NeuroOncology. Основываясь на том, что
большинство рецидивов глиобластомы случаются в пределах поля
ранее проведенного облучения, они
предположили, что эскалация дозы
на ложе удаленной опухоли путем
интенсификации режима лучевой
терапии улучшит показатели выживаемости. Первые результаты
исследования уже были опубликованы ранее и показали безопасность
подобного подхода. Июльская публикация была призвана продемонстрировать отдаленные 5-летние
результаты.
Всего 89 пациентов, прооперированных по поводу глиобластомы головного мозга, были рандомизированы
в группу стандартного химиолучевого лечения (60 Гр за 30 фракций
на фоне темозоломида) и гипофракционированного курса (60 Гр за
20 фракций, опять-таки с темозоломидом). Впоследствии все пациенты
получали темозоломид в адъювантном режиме.
Для анализа оказались доступны
данные 83 пациентов. Средний период наблюдения составил 18,9 мес.
В отношении общей выживаемость
интенсифицированный HART режим показал преимущества: медиана ОВ составила 26,6 мес. против 22,4
мес. при традиционной ХЛТ, а 5-летняя ОВ отличалась в пользу HART в
несколько раз – 18,4% против 3,8%.
К сожалению, эта яркая разница в
численном выражении оказалась
статистически недостоверной, так
же, как и медиана выживаемости
без прогрессирования. Тем не менее,
подобный вариант интенсификации
лечения может быть более предпочтительным по сравнению со стандартным, требуется большее количество пациентов и проведение более
крупных исследований 3 фазы.
Рисунок 1.
Кривые общей выживаемости
в зависимости от режима ХЛТ

Источник:
Mallick S, Kunhiparambath H, Gupta
S, Benson R, Sharma S, Laviraj MA,
Upadhyay AD, Julka PK, Sharma D,
Rath GK. Hypofractionated accelerated
radiotherapy (HART) with concurrent
and adjuvant temozolomide in newly
diagnosed glioblastoma: a phase II
randomized trial (HART-GBM trial). J
Neurooncol. 2018 Oct;140(1):75-82. doi:
10.1007/s11060-018-2932-3. Epub 2018
Jun 23. PMID: 29936695.
НОВОСТИ ASCO 2023 / ВЗРЫВНЫЕ ИЗМЕНЕНИЯ ВО ВСЕХ ПЕРВЫХ ЛИНИЯХ ТЕРАПИИ В ОНКОГИНЕКОЛОГИИ. ASCO 2023: «ЗОЛОТОЙ СТАНДАРТ» В ОНКОГИНЕКОЛОГИИ СТАНОВИТСЯ «ПЛАТИНОВЫМ»
Автор: Тюляндина Александра Сергеевна
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России,
доктор медицинских наук, Москва
Этот год заставил нас задуматься
над уже произошедшими, продолжающимися и грядущими изменениями в лечении больных с онкогинекологической патологией. Еще
совсем недавно, читая курс лекций
ординаторам, я всегда говорила:
неважно, какая органопринадлежность или гистологический подтип
опухоли у пациентки с онкогинекологической патологией – назначая
паклитаксел и карбоплатин/цисплатин в первой линии, вы никогда не
ошибетесь. Это наш неизменный
мировой «золотой стандарт» уже в
течение последних 25-30 лет. В действительности оказалось, что стандарт пошатнуть невозможно, но он
обрастает элегантными современными аксессуарами. Давайте начнем
в них разбираться.
Рак яичников
Революционное исследование DUO-O затмило даже late breaking abstract на ASCO в 2023 году и является темой множественных дискуссий среди экспертного сообщества [1]. Самая главная особенность этого исследования в том, что это пока единственная работа, где иммунотерапия смогла показать позитивные результаты. Дизайн исследования, в котором участвовало 1130 пациенток, включал три рукава:
1. контрольная группа включала химиотерапию паклитакселом и карбоплатином + бевацизумаб во время химиотерапии и затем в поддерживающем режиме 15 мес.;
2. группа 2 – химиотерапия + бевацизумаб + иммунотерапия дурвалумабом совместно с химиотерапией и затем в поддерживающем режиме 24 мес.;
3. третий рукав включал химиотерапию, бевацизумаб, дурвалумаб и
поддерживающую терапию олапарибом после окончания химиотерапии в течении 24 мес.
Первичной конечной точкой явРисунок 1. ВБП в исследовании DUO-O в зависимости от HRD статуса
Рисунок 2. Финальные результаты ПЖ больных раком шейки матки
в исследовании KEYNOTE 826
ляется медиана времени до прогрессирования (ВБП). Обратите
внимание, что статистическая гипотеза носит иерархический характер, и предварительный анализ
включал оценку ВБП между 1-й
и 3-й когортами сперва в группе
HRD-положительных больных без
мутации в генах BRCA1/2, в случае
позитивного результата проводился
анализ в группе HRD-негативных
пациенток. Предварительные данные продемонстрировали, что исследование позитивное. В группе
больных с HRD+ статусом получено
достоверное увеличение медианы
ВБП с 23 до 37,3 мес., со снижением
риска прогрессирования на 51% (HR
0,49; 95% ДИ 0,34-0,69). Предварительный анализ результатов в подгруппе больных с HRD-негативным
статусом также показал статистически значимое увеличение в когорте
больных, получавших тройную комбинацию: медиана ВБП составила
20,9 мес. и 17,4 мес. в группе одного
бевацизумаба (HR 0,68 [0,54-0,86]).
На момент окончания лечения – через 24 мес. – 40% больных не имели
прогрессирования в группе бевацизумаба, олапариба, дурвалумаба,
тогда как в группе одного бевацизумаба – только 24%. Подгруппа,
включающая бевацизумаб с дурвалумабом, не показала достоверного
преимущества против одного VEGF
ингибитора. Первичное импульсивное чувство – это желание, чтобы
иммунотерапия наконец-то вошла
в лечение больных раком яичников
и показала преимущество в группе
больных без нарушений в системе
репарации ДНК, а это 50% больных,
которым мы не могли ничего предложить за последние 20 лет. Однако
на какие нюансы стоит обратить
внимание в данном исследовании.
Во-первых, у нас нет адекватной
контрольной группы. Например,
для больных с HRD+ статусом без
мутаций BRCA стандартом считается монотерапия PARP ингибитором или комбинация бевацизумаба
и олапариба. Таким образом, встает
вопрос: а нужно ли нам добавлять
ингибитор контрольных точек иммунного ответа к этой комбинации?
Ответа на этот вопрос мы пока не
получим. Во-вторых, отметим, что
стоимость такого дорогостоящего лечения значимо увеличивает
финансовую нагрузку на систему
здравоохранения всех стран мира.
Поэтому необходимо четко осознавать ту пользу, которую от этого
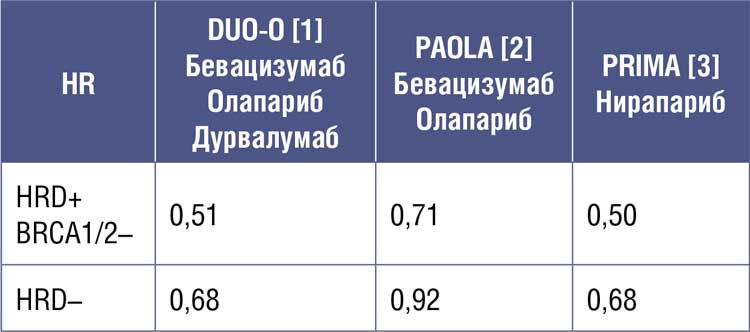
современного лечения может получить пациентка. Например, при непрямом сравнении относительных
рисков прогрессирования (HR) назначение одного PARP-ингибитора
нирапариба в исследовании PRIMA
имеет такой же показатель, как
тройная комбинация олапариба,
бевацизумаба и дурвалумаба (см.
таблицу 1). В-третьих, при внимательном анализе кривых на графиках стоит отметить, что при достоверном выигрыше в 3,5 мес. при
использовании тройного коктейля
против одного бевацизумаба не
наблюдается сохраняющегося расхождения кривых после окончания терапии (см. график 1). Таким
образом, продемонстрированные
предварительные результаты исследования DUO-O не погружают нас в
эйфорию, а оставляют нас в интригующем напряжении и заставляют
ожидать финальных результатов исследования с последующим поданализом общей выживаемости (ОВ).
Таблица 1.
Относительные риски прогрессирования
в исследованиях по изучению иммунотерапии
и PARP-ингибиторов при первичном раке яичников
Рак шейки матки
Изменения в терапии первой линии
лечения первичного метастатического или рецидивирующего рака
шейки матки назрели еще 2021 году.
На ASCO 2023 были озвучены финальные результаты исследования
KEYNOTE 826 [4]. Напоминаю, что
это рандомизированное исследование III фазы, ставившее перед собой
задачу сравнить добавление пембролизумаба (35 введений) к терапии
паклитакселом и препаратами платины ± бевацизумаб. В исследование было включено 617 пациенток,
первичными конечными точками
являлись ВБП и продолжительность
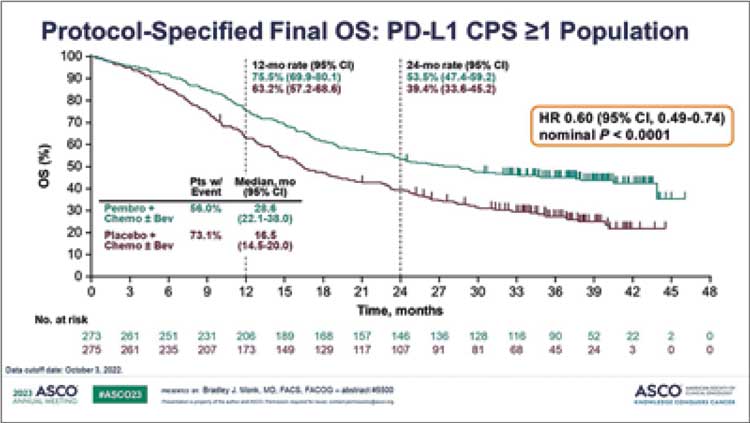
жизни (ПЖ). Финальные результаты
по общей выживаемости показали
достоверное снижение риска смерти
на 40% в подгруппе пациенток с PDL1 СPS ≥1 при добавлении к терапии
пембролизумаба. Медиана ПЖ в
группе стандартной терапии составила 16,5 мес., в группе с добавлением пембролизумаба – 28,6 мес. (HR
0,60; 95% ДИ 0,49-0,74). Те больные,
которым был противопоказан бевацизумаб по тем или иным причинам,
также выигрывали от добавления
чекпойнт ингибитора. В связи с этим
FDA еще в 2021 году регистрирует
пембролизумаб в первой линии лечения больных диссеминированным
или рецидивирующим раком шейки
матки с PD-L1 СPS ≥1. Данное показание уже внесено в рекомендации
NCCN и с 2023 года планируется
быть включенным в рекомендации
RUSSCO. Это приводит к нескольким
будущим трудностям: например, что
нам назначать данным пациенткам
при прогрессировании после первой
линии, ведь сейчас стандартом по
данным исследования II фазы является пембролизумаб. В исследовании
KEYNOTE 826, если мы посмотрим
внимательно на графики, отмечается
сохранение расхождения кривых, и
24 месяца переживает 53% пациенток по сравнению с 39,4% в группе
контроля (рис.2). Нет сомнений, что
такой четверной коктейль значительно увеличивает стоимость лечения,
но и достоверно увеличивает продолжительность жизни больных, сохраняя длительный контроль над болезнью у половины пациенток. Стоит
отметить, что подгрупповой анализ
показал: добавление пембролизумаба демонстрирует достоверное улучшение результатов выживаемости
вне зависимости от назначения бевацизумаба. Однако он не показал достоверного увеличения ОВ в группе
первично метастатических больных
(а это 20% пациенток). Четких объяснений на этот счет нет, возможно,
это связано с агрессивным течением заболевания у данной категории
больных, где эффект иммунотерапии
не успевает реализоваться.
Рисунок 1.
ВБП в исследовании DUO-O в зависимости от HRD статуса

Рисунок 2.
Финальные результаты ПЖ больных раком шейки матки
в исследовании KEYNOTE 826
Рак эндометрия
В первичном лечении рака эндометрия происходят аналогичные
изменения. Совсем недавно мы
говорили об отсутствии эффективных опций для лечения диссеминированного или рецидивирующего рака эндометрия. Наш
«золотой стандарт» умеренно контролирует процесс с достижением
медианы ПЖ примерно 15 месяцев. Совсем недавно произошли
глобальные изменения в лечении
прогрессирования после первой
линии с исключением стандартной
цитостатической терапии и плотным внедрением пембролизумаба
для больных с дефицитом в системе
репарации ДНК (dMMR) и при его
отсутствии (pMMR) – усиление иммунотерапии TKI ингибитором, в
данном случае комбинации пембролизумаба и ленватиниба. Научное
сообщество ожидало результатов
исследования LEAP-001, где изучалась вышеуказанная комбинация
в качестве замены паклитакселу и
карбоплатину. Однако интрига оборвалась после озвучивания двух исследований по изучению ингибиторов контрольных точек иммунного
ответа в рамках первой линии лечения, что заставляет нас с марта 2023
года вести бурные дискуссии.
В марте 2023 года на конференции
SGO озвучиваются результаты исследования по изучению пембролизумаба вместе с химиотерапией
паклитакселом плюс карбоплатином у пациенток с метастатическим
раком эндометрия и в рамках адъювантной терапии III-IV стадий в
сравнении с одним «золотым стандартом» [5]. В исследовании было
показано достоверное улучшение
результатов при добавлении пембролизумаба у всех пациенток вне
зависимости от MMR статуса. Наилучший результат получен в подгруппе больных с dMMR, в когорте
пембролизумаба медиана ВБП не была достигнута, в когорте плацебо
– 6 мес., 74% больных, получивших
пембролизумаб, переживает 12 мес.
без прогрессирования против 38%
в группе контроля (HR 0,30; 95%
ДИ 0,19-0,48, P<0,001). В подгруппе
pMMR результаты не столь впечатляющие, но все же достоверные: в
группе иммунотерапии – 13,1 мес., в
группе плацебо – 8,7 мес. (HR 0,54;
95% ДИ 0,41-0,71; P<0,001).
Рисунок 3.
ВБП у пациенток с dMMR в исследовании RUBY в зависимости
от оценки исследователями и независимой центральной командой
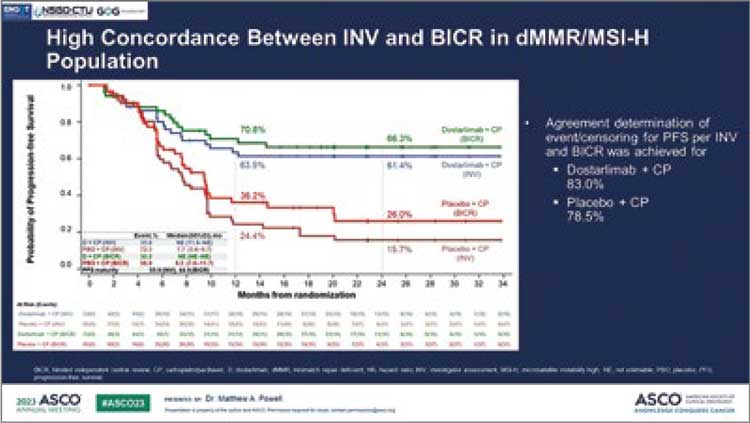
Рисунок 4.
ВБП в общей популяции в исследовании RUBY в зависимости
от оценки исследователями и независимой центральной командой
На ASCO 2023 подтверждается значимость иммунотерапии у больных
раком эндометрия в адъювантной
терапии и при метастатическом
процессе в качестве первой линии
лечения, где подробно обсуждается
исследование RUBY. В работу включены 494 пациентки с аналогичными критериями и дизайном, что и
в предыдущем исследовании. Контрольный рукав включал больных,
получавших «золотой стандарт»
паклитакселом и карбоплатином, в
экспериментальной группе пациентки получали «золотой стандарт» +
достарлимаб в течение 3 лет. Анализ
сравнения оценки прогрессирования исследователями и независимой
командой показал идентичный результат: у пациенток с dMMR статусом медиана ВБП не достигнута при
назначении достарлимаба, в группе
одной химиотерапии – 7,7 мес. (HR
0,28; 95% ДИ 0,16-0,49; P<0,0001). В
общей популяции, включая больных
с отсутствием дефицита в системе
репарации ДНК (pMMR), также наблюдается значимый положительный тренд с сохранением длительного контроля над болезнью у 36%
больных: медиана ВБП в группе достарлимаба – 11,8 мес. против 7,9 мес.
в группе плацебо (HR 0,64; 95% ДИ 0,50-0,80; P<0,0001). Предварительные данные по продолжительности
жизни также показывают значимое
преимущество от добавления достарлимаба.
Авторы провели полноценный анализ качества жизни больных, где
показали, что к 7-му циклу терапии
с достарлимабом достоверно улучшается качество жизни больных по
сравнению с пациентками, которые
получали только цитостатическую
терапию [7]. К 13-му циклу терапии
сохраняется та же самая тенденция,
однако она становится статистически незначимой (р=0,06). Лечение с
использованием иммунотерапии достоверно быстрее и чаще улучшало
физической состояние пациенток,
позволяло вернуться к своей повседневной деятельности, улучшало
эмоциональный, когнитивный статус, сохраняло активное социальное
взаимодействие.
Таким образом, добавление иммунотерапии на первом этапе лечения
больных раком эндометрия стало
значимым прорывом, который мы
ранее никогда не наблюдали у данных пациенток. Это нашло отражение к включению комбинаций с
пембролизумабом и достарлимабом.
Подтверждение необходимости назначения чекпойнт ингибиторов в
первой линии лечения и адъювантной терапии уже нашло свое отражение в рекомендациях NCCN
2023 года и готовится к включению
в российские рекомендации. Будет
оставаться открытым вопрос, что
мы будем назначать пациенткам при
прогрессировании на химиотерапии
вместе с иммунотерапией в последующем.
Подводя итоги, хочется отметить, что мы с вами наблюдаем радостную и в то же самое время затруднительную картину, демонстрирующую новые показания для иммунотерапии, которые открываются для пациенток в онкогинекологии. Причем одновременно в трех наиболее частых встречаемых онкогинекологических патологиях. Многие мои коллеги бросились считать и сравнивать стоимость новой терапии с нашим дешевым и всем доступным «золотым стандартом» – таксанами с платиной. Даже не хочу этого делать сейчас, чтобы сильно не огорчаться, поскольку осознаю, что это увеличение стоимости лечения не в два и не в три раза. В настоящий момент наша задача совместно с государством и фармацевтическим сообществом попытаться найти взаимодействие для поиска баланса и достижения большей доступности наиболее эффективного лечения пациенткам, страдающим от злокачественных гинекологических новообразований. А в заключение хочется отметить, что «золотой стандарт» побить невозможно, его можно только дополнить.
Литература:
1. Harter P, et al. DUO-O: A randomized phase III trial of durvalumab (durva) in combination with chemotherapy and bevacizumab (bev), followed by maintenance durva, bev and olaparib (olap), in newly diagnosed advanced ovarian cancer patients. Journal of Clinical Oncology. 2023; 37 (15 suppl.), abstr 5598.
2. Ray-Coquard I, et al. Olaparib plus Bevacizumab as First-Line Maintenance in Ovarian Cancer. N Engl J Med. 2019; 381: 2416-2428.
3. Gonzalez-Martin A, et al. Niraparib in Patients with Newly Diagnosed Advanced Ovarian Cancer. N Engl J Med. 2019; 381: 2391-2402.
4. Monk B, et al. KEYNOTE-826 Update Confirms Survival Benefit With Addition of Pembrolizumab to First-Line Chemotherapy in Cervical Cancer. Journal of Clinical Oncology. 2023; 37 (15 suppl.), abstr 5500.
5. Eskander R, et al. Pembrolizumab plus Chemotherapy in Advanced Endometrial Cancer. N Engl J Med. 2023; 388: 2159- 2170.
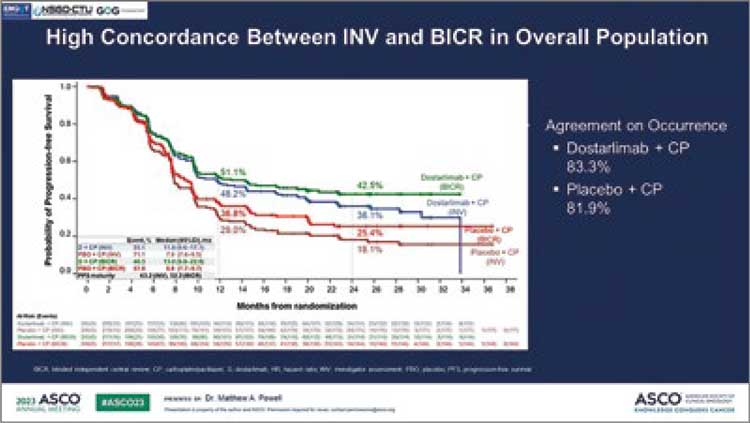
6. Powell M, et al. Dostarlimab for primary advanced or recurrent (A/R) endometrial cancer (EC): Outcomes by blinded independent central review (BICR) of the RUBY trial (ENGOT-EN6-NSGO/ GOG-3031/RUBY). Journal of Clinical Oncology. 2023; 37 (15 suppl.), abstr 5503.
7. Mirza M, et al. Patient-reported
outcomes (PROs) in primary advanced or
recurrent endometrial cancer (pA/rEC) for
patients (pts) treated with dostarlimab plus
carboplatin/paclitaxel (CP) as compared to
CP in the ENGOT-EN6/GOG3031/RUBY
trial. Journal of Clinical Oncology. 2023;
37 (15 suppl.), abstr 5504.
Цикл вебинаров ДЛЯ ПОДГОТОВКИ К ЭКЗАМЕНУ ESMO. ОПУХОЛИ ЖКТ

НОВОСТИ ASCO 2023 / НЕМЕЛКОКЛЕТОЧНЫЙ РАК ЛЕГКОГО
Автор: Моисеенко Федор Владимирович
ГБУЗ «Санкт-Петербургский клинический научнопрактический центр
специализированных видов медицинской помощи (онкологический) им. Н.П. Напалкова»,
доктор медицинских наук, Санкт-Петербург
В течение последних трех лет формат
взаимодействия между специалистами как внутри страны, так и на
международной арене существенно
изменился. Ведущую роль в этих изменениях сыграла пандемия COVID,
которая на долгое время существенно ограничила возможности путешествий. Надо сказать, что подобная
«изоляция» привела не к снижению
сотрудничества или интенсивности образовательных мероприятий,
а скорее наоборот. Тем не менее,
конгресс ASCO сохраняет свои значимые позиции как мероприятие с
самым большим числом представленных новинок. Это утверждение в
полной мере относится и к немелкоклеточному раку легкого.
Надо сказать, что в этом году на конгрессе было представлено немного
«practice changing» новостей. Текущий этап можно охарактеризовать
как период дальнейшего уточнения
места ингибиторов контрольных
точек в тактике лечения, а также появление пока на далеком горизонте, в
качестве второй или третьей линий
терапии, серьезнейшего конкурента – конъюгатов, которые в ближайшие несколько лет будут определять
инновационную повестку, во всяком
случае при НМРЛ [1].
Иммунотерапия
Возвращаясь к применению ингибиторов контрольных точек, надо
сказать, что представленные в этом
году данные существенно упрочили их место на ранних этапах
лечения. Так, вслед за представленными в прошлом году результатами исследования CHECKMATE
816 сразу несколько работ в 2023
году подтвердили общую концепцию крайне высокой эффективности неоадъювантного применения
данного класса препаратов. Четыре
цикла комбинации пембролизумаба
и платинового дуплета в исследовании KEYNOTE-671, комбинация
пембролизумаба и рамуцирумаба
(EPOC1710: EAST ENERGY), 2 введения ниволумаба в комбинации
с ингибитором LAG-3, уже зарегистрированным FDA при меланоме
кожи (NEOpredict-Lung), а также 3
цикла ториплимаба в комбинации
с платиновым дуплетом позволили в сходной степени подтвердить
крайне высокую частоту полных и
больших патоморфологических регрессов при локализованном НМРЛ
[2-4]. Надо сказать, что кроме подтверждения общей концепции об
обогащении выборки чувствительными к ИКТ пациентами с ростом
уровня экспрессии PD-L1, что было
уже многократно показано для всех
этапов применения ИКТ при НМРЛ,
в большинстве новых исследований
были представлены системные попытки выявления подгрупп, которые получат наибольший выигрыш
от их применения. Таким образом,
концептуальная целесообразность
применения этого класса препаратов
при локализованном НМРЛ до операции может считаться доказанной,
что, однако, выявляет большое число
открытых вопросов. Среди них, например, то, какие группы пациентов
необходимо начинать лечить с неоадъювантного этапа – пока максимальное преимущество получают
больные с III операбельной стадией и в меньшей степени – со II. Как
оптимально формировать тактику в
зависимости от глубины и выраженности патоморфологического ответа,
нуждаются ли больные с полным регрессом в продолжении адъювантного этапа и, наоборот, обоснованно ли
продолжение адъювантного лечения
у больных, не достигших выраженного ответа после предоперационного лечения? Видимо, получение
ответов на эти вопросы и определит
развитие в лечении локализованного
НМРЛ в ближайшие годы.
Некоторая стагнация в развитии инновационных подходов наблюдается в отношении паллиативного лечения. После представления крайне важных, но недостаточно оптимистичных данных об отдаленных результатах применения иммунотерапии, например, в исследованиях KEYNOTE-189 и KEYNOTE-407, и неудач в применении ингибиторов других контрольных точек, например TIGIT, было продолжено уточнение возможностей определения наиболее чувствительных групп на основании комплексного использования большого числа доступных клинических маркеров, например, системного воспаления и других. По нашему мнению, есть определенная надежда на то, что подобный подход позволит в будущем уже на ранних этапах определять наиболее чувствительные группы и, как с таргетной терапией, проводить исследования именно внутри них.
Таргетная терапия
В таргетной терапии наиболее ярким
событием в этом году можно считать
подтверждение целесообразности
проведения 3 лет адъювантной терапии больным локализованным
НМРЛ с мутациями EGFR [5]. На
прошедшем мероприятии были
представлены данные о существенном снижении вероятности гибели
в течение 5 лет (на 12% для II-IIIA
стадий и на 10% для IB-IIIA стадий).
Надо сказать, что целесообразность
назначения таргетного препарата в
адъювантном режиме была показана для всех стадий и не зависела от
применения цитостатической терапии, а единственный нюанс касался
группы с L858R, для которой HR был
значительно выше (0,68 против 0,35
для ex19del). Таким образом, на настоящий момент целесообразность
проведения этого варианта лечения
не вызывает сомнения, а будущее
развитие должно быть направлено на то, чтобы идентифицировать
больных, которым осимертиниб помогает избежать прогрессирования,
не перелечивать излеченных и без
адъювантной терапии пациентов, а
также интенсифицировать или изменить подход к больным, у которых
развивается прогрессирование, несмотря на адъювантную таргетную
терапию. Открытым также остается
вопрос о возможности экстраполяции результатов применения осимертиниба при EGFR мутированном НМРЛ на опухоли, ассоциированные
с другими активирующими мутациями, проведение подобных крупных
исследований для которых в ближайшей перспективе крайне маловероятно.
Остальные новинки таргетного лечения касались в первую очередь оптимизации подхода к лечению больных
с редкими мутациями, для части из
которых существующие препараты –
осимертиниб, афатиниб – могут быть
вполне оптимальным вариантом
(например, комплексные мутации с
T790M или G719X) [6]. В то же время
достижение удовлетворительных показателей для пациентов с инсерциями в 20 экзоне требует разработки
новых лекарственных препаратов,
которые находятся на настоящий
момент в изучении и предрегистрационных исследованиях. Одним из
новых примеров является сунвозертиниб [7].
В отношении же основных групп
больных с активирующими молекулярными нарушениями полученные вновь данные существенно не
изменили уже сформировавшихся
представлений. Так, дополнение
анти-EGFR комбинацией из цитостатических препаратов (AGAIN) существенно повышает время до
прогрессирования, но значительно
скромнее действует на общую продолжительность жизни. Любопытно,
что подобный подход практически
никак не повлиял на относительно
скромные результаты применения
соторасиба у больных с мутацией
KRAS, что, по-видимому, потребует
дальнейшего осмысления подходов к
лечению этой группы [8]. Достигнутые на настоящий момент результаты монотерапии ингибиторами ALK
являются максимально возможными
при применении изолированного
воздействия на этот белок. Так, два
вновь представленных препарата
TGRX-326 и SY-3505 продемонстрировали крайне сходные с ингибиторами 2 и 3 поколений результаты
(60% ЧОО после кризотиниба, 35%
после ИТК второго поколения и 72%
у нелеченных пациентов) [9,10].
Одна из наиболее оптимистичных
областей в таргетной терапии (с появлением амивантамаба) – область
преодоления резистентности к осимертинибу, которая ранее являлась
уделом применения цитостатических
препаратов. Так, комбинация этого
препарата и другого ИТК EGFR 3-го
поколения лазертиниба у больных с
высоким уровнем экcпрессии MET
при тестировании материала, полученного после прогрессирования на
осимертинибе, позволяет достичь
ответа у 61% больных с медианой
12,2 месяца.
Конъюгаты
Тем не менее, самые драматические
события происходят в области применения конъюгатов – препаратов, сочетающих в себе таргетное
действие антитела и нетаргетное
действие высокотоксичного противоопухолевого препарата. На настоящий момент сразу несколько
препаратов активно изучаются при
опухолях легкого. Это и телизотузумаб ведотин при МЕТ-позитивных
опухолях, датопотомаб при TROP2-
позитивных и, наконец, дерукстекан
при мутациях HER2. К настоящему
моменту стало известно о крайне
обнадеживающих результатах применения этих препаратов у больных, уже получивших таргетные или
иммуномодулирующие препараты
[11,12]. Так, трастузумаб дерукстекан (конъюгат стандартного трастузумаба и дерукстекана – ингибитора топоизомеразы) в исследовании
DESTINY-Lung01 позволил достичь
ответа у 54,9% пациентов c мутацией HER2 на фоне медианы времени
до прогрессирования 8,2 месяца.
Чуть более низкие показатели были
достигнуты при экспрессии HER2
– значительно более широкой и
многочисленной группе при НМРЛ:
26,5-34,1% ЧОО и 5,7-6,7 мес. медианы ВДП, что, однако, не мешает
надеяться на скорейшее начало применения этого препарата и для этих
пациентов. Тем не менее, уже сейчас
анонсированы многочисленные работы, включающие комбинации с
платиносодержащими дуплетами и
ингибиторами контрольных точек,
что позволяет предположить в ближайшем будущем следующий этап
смены парадигмы лечения НМРЛ.
Источники:
1. Shastry M, Gupta A, Chandarlapaty S, Young M, Powles T, Hamilton E. Rise of Antibody-Drug Conjugates: The Present and Future. American Society of Clinical Oncology Educational Book. 2023; 43, e390094. doi:10.1200/edbk_390094.
2. Liberman M, Kato T, Tsuboi M, Lee S-H, He J, Gao S, ... Spicer J. KEYNOTE-671: Randomized, double-blind, phase 3 study of pembrolizumab or placebo plus platinum-based chemotherapy followed by resection and pembrolizumab or placebo for early stage NSCLC. Journal of Clinical Oncology. 2023; 41 (17_suppl): LBA100- LBA100. doi:10.1200/JCO.2023.41.17_ suppl.LBA100.
3. Pont BD, Hartemink K, Wiesweg M, Vanbockrijck M, Darwiche K, Hegedus B, ... Plönes T. Surgical outcomes of patients with resectable non-small-cell lung cancer receiving neoadjuvant immunotherapy with nivolumab plus relatlimab or nivolumab: Findings from the prospective, randomized, multicentric phase II study NEOpredict-Lung. Journal of Clinical Oncology. 2023; 41 (16_suppl): 8500-8500. doi:10.1200/JCO.2023.41.16_suppl.8500.
4. Wu L, Zhang W, Zhang P, Wang W, Fang W, Xing W, ... Biosciences SJ. Perioperative toripalimab + platinumdoublet chemotherapy vs chemotherapy in resectable stage II/III non-small cell lung cancer (NSCLC): Interim eventfree survival (EFS) analysis of the phase III Neotorch study. Journal of Clinical Oncology. 2023; 41 (36_suppl): 425126- 425126. doi:10.1200/JCO.2023.41.36_ suppl.425126.
5. Tsuboi M, John T, Kato T, Majem M, Grohé C, Wang J, ... Wu Y-L. Overall survival analysis from the ADAURA trial of adjuvant osimertinib in patients with resected EGFR-mutated (EGFRm) stage IBIIIA non-small cell lung cancer (NSCLC). Journal of Clinical Oncology. 2023; 41 (17_suppl): LBA3-LBA3. doi:10.1200/ JCO.2023.41.17_suppl.LBA3.
6. Kubota K, Shimokawa M, Hashimoto K, Kawashima Y, Sakamoto T, Wakui H, ... Ohe Y. Uncommon EGFR mutations conducted with osimertinib in patients with NSCLC (UNICORN): A phase 2 study. Journal of Clinical Oncology. 2023; 41 (16_suppl): 9045-9045. doi:10.1200/ JCO.2023.41.16_suppl.9045.
7. Yang JC-H, Chiu C-H, Hsu P-C, Mitchell P, Chang Cl, John T, ... Zhou C. Efficacy and safety of sunvozertinib in treatment naïve NSCLC patients with EGFR exon20 insertion mutations. Journal of Clinical Oncology. 2023; 41 (16_suppl): 9073-9073. doi:10.1200/JCO.2023.41.16_ suppl.9073.
8. Sakata S, Azuma K, Uemura T, Tsuchiya-Kawano Y, Yoshioka H, Osuga M, ... Yamamoto N. The primary endpoint analysis of SCARLET study: A single-arm, phase II study of sotorasib plus carboplatinpemetrexed in patients with advanced nonsquamous, non-small cell lung cancer with KRAS G12C mutation (WJOG14821L). Journal of Clinical Oncology. 2023; 41 (16_suppl): 9006-9006. doi:10.1200/ JCO.2023.41.16_suppl.9006.
9. Hu X, Li X, Li Y, Wang K, Wang P, Jiang L, ... Sun Y. Efficacy and safety of SY-3505, a third-generation ALK TKI, in ALK-positive advanced non-small cell lung cancer: Results from a phase I/ II, multi-center study. Journal of Clinical Oncology. 2023; 41 (16_suppl): 9110-9110. doi:10.1200/JCO.2023.41.16_suppl.9110.
10.Ma Y, Yang N, Wang Z, Jin W, Li X, Liu Y, ... Zhang L. First-in-human, multicenter phase I study of TGRX-326 in patients with advanced ALK-positive non-small cell lung cancer. Journal of Clinical Oncology. 2023; 41 (16_suppl): 9113-9113. doi:10.1200/ JCO.2023.41.16_suppl.9113.
11.Oaknin A, Lang JM, Ciombor KK, Ray-Coquard IL, Oza AM, Yonemori K, ... Meric-Bernstam F. TROPIONPanTumor03: Phase 2, multicenter study of datopotamab deruxtecan (Dato-DXd) as monotherapy and in combination with anticancer agents in patients (pts) with advanced/metastatic solid tumors. Journal of Clinical Oncology. 2023; 41 (16_ suppl): TPS3153-TPS3153. doi:10.1200/ JCO.2023.41.16_suppl.TPS3153.
12.Makker V, Oaknin A, Oh D-Y,
Banerjee SN, Martin AG, Jung KH, ... Lee
J-Y. Efficacy and safety of trastuzumab
deruxtecan (T-DXd) in patients (pts) with
HER2-expressing solid tumors: DESTINYPanTumor02 (DP-02) interim results.
Journal of Clinical Oncology. 2023; 41(17_
suppl): LBA3000-LBA3000. doi:10.1200/
JCO.2023.41.17_suppl.LBA3000.
НОВОСТИ ASCO 2023 / РЕЗУЛЬТАТЫ С КОНФЕРЕНЦИИ ASCO 2023 (РАК ТОЛСТОЙ КИШКИ) – ИЛИ ЗАПИСКИ ИЗ ТЕЛЕГРАМА
Автор: Федянин Михаил Юрьевич
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России,
доктор медицинских наук, Москва
В 2022 году с целью доведения информации с зарубежных конференций до ординаторов отделения
Алексей Александрович Трякин
создал телеграм-канал «Новости
онкологии». Первоначально было
только 22 подписчика – сотрудники отделения химиотерапии №2
НМИЦ онкологии им. Н.Н. Блохина. В дальнейшем насыщение контентом перешло в руки Румянцева
Алексея Александровича, который
обеспечивает жизнь канала между конференциями. Особенность
данного информационного ресурса
– в независимости мнений, критическом освящении результатов новых
исследований и отсутствии рекламы.
В момент же больших онкологических конференций канал взрывается
постами, когда уже 8 администраторов в онлайн-режиме публикуют
краткие выжимки из работ. Этот год
не стал исключением, только во время конференции ASCO 2023 процесс
присоединения новых подписчиков,
как сказали бы в отношении препарата, приобрел характер нелинейной
фармакокинетики.
Будучи одним из администраторов,
отмечу, что работа в канале определила и изменение характера представления материала: нужно поместить в один пост не просто тезисы
исследования (не поместятся), не
сухой вывод работы (если не специалист в конкретной области, то непонятно, какое это имеет отношение
для практики) и не упрощенный
текст (все-таки читают коллеги). Поэтому для себя вывел формулу – краткое введение в проблему, краткое
изложение дизайна и результатов
исследования и рецензия на работу. И все это в рамках самоцензуры,
так как могут читать молодые специалисты. Именно из таких постов,
посвященных раку толстой кишки,
опубликованных и не очень, и решил
сделать заметку в газету
Ранний рак толстой кишки
Современный алгоритм выбора
адъювантной химиотерапии при II
стадии учитывает наличие неблагоприятных факторов прогноза, так
как на всей группе таких пациентов
эффективность профилактики минимальна [1]. Все имеющиеся факторы (индекс T4, наличие сосудистой,
лимфоваскулярной, периневральной
инвазии, операция на фоне перфорации, R1 резекция, изучение менее
12 лимфозулов и т.д.) пришли из ретроспективных исследований, но тем
не менее закрепились в клинической
практике. Одним из ключевых факторов, определяющих адекватность
стадирования и качество хирургии и
патоморфологического исследования,
является число изученных лимфоузлов [2]. Вопрос, что будет, если повысить пороговое значение данного
показателя до 20, сохранится ли прогностическое влияние?
В совместной работе нидерландских и
южнокорейских исследователей проведен анализ 12730 пациентов со II и
III стадией рака толстой кишки. За 10
лет в клиниках удалось достичь ситуации, когда у 99% оперированных
больных изучалось более 12 лимфоузлов. Оказалось, что в такой ситуации
следующее прогностическое пороговое значение лимфоузлов составляет 20. Причем именно для II стадии
данный фактор оказывал наиболее
значимое влияние на прогноз, как в
азиатской популяции (6-летняя ОВ
составила в группе ≥20 лимфоузлов
88,9% против 82,7% в группе <20 лимфоузлов; ОР 1,59; 95% ДИ 1,2-2,09),
так и в европейской популяции пациентов (6-летняя ОВ в группе ≥20 лимфоузлов 76,9% против 68,7%; ОР 1,43;
95% ДИ 1,26-1,6) [3].
Другой подход определения рисков
прогрессирования в онкологии основан на создании различных экспрессионных моделей, по типу Oncotype
Dx, или инфильтрации опухоли различными классами лимфоцитов,
однако проспективной валидации
по оценке предикторных свойств
данных подходов при раке толстой
кишки не представлено. Тем не менее,
скорее всего, данные методы будут
полностью замещены определением
минимальной резидуальной болезни
(МРБ) после хирургического лечения
с помощью определения циркулирующей опухолевой ДНК (цоДНК).
На ASCO 2023 были обновлены результаты проспективной программы
из Японии – CIRCULATE-Japan, а
точнее его подисследования GALAXY.
Отобрав 2083 пациентов II-IV стадии
после радикального хирургического
лечения, авторы оценили наличие
МРБ с помощью цоДНК методом
Signatera. При отсутствии в плазме
крови цоДНК к 4 неделе двухлетняя
выживаемость без признаков болезни
составила более 95%, тогда как при положительных результатах теста – 50%
(ОР 12; 95% ДИ 9,1-15; р<0,0001). При
этом наихудший прогноз был среди
пациентов с положительной цоДНК
с наличием мутации в гене BRAF –
25%. В то же время авторы показали, что если к 12 неделе происходит
конверсия цоДНК с положительного
результата на негативный результат
теста, то прогноз улучшается [4]. Эти
результаты лишний раз доказывают
значимость оценки цоДНК при раке
толстой кишки после операции и возможность отказа от адъювантного
лечения при негативных значениях
теста, что подтверждается прошлогодними результатами исследования
DYNAMIC – проспективного рандомизированного исследования по выбору адъювантной химиотерапии в
зависимости от наличия информации
по цоДНК.
В то же время остается ряд вопросов, один из которых – сроки оценки
цоДНК после операции, так как если
забирать для анализа плазму крови
через 4 недели с даты операции, результаты теста и назначение адъювантной терапии в итоге приходится в
сроки 80 дней. В то же время известно,
что чем позже начинать адъювантную
химиотерапию, тем менее выражен ее
профилактический эффект. На этот
вопрос ответило крупное исследование, представленное на ASCO GI
2023, по сравнению частоты выявления цоДНК при заборе крови в различные временные точки после операции – через 0-2, 3-4, 5-6, 7-8, 9-10,
11-12 недель Проведен анализ 14425
пациентов с колоректальным раком
I-III стадии, при этом у 450 пациентов
была доступна полная информация
по заболеванию. Оказалось, что после
2 недель частота выявления цоДНК
в первые 2 недели максимальна и
составляет 21,5%, но в дальнейшем
стабилизируется на уровне 17%. В то
же время в группе с полной информацией процент положительного теста
в первые 2 недели составил 18,4% и
значимо не менялся до 9 недели [5].
То есть можно сделать вывод, что забор крови для оценки цоДНК можно
спокойно делать через 2 недели после
операции, когда обычно пациент приходит за результатами гистологического исследования.
Другой вопрос, что делать, если в процессе наблюдения стала выявляться
цоДНК? Были представлены предварительные результаты исследования
INTERCEPT, в котором регулярно
в процессе наблюдения после радикального лечения 3744 пациентов с
колоректальным раком II-IV стадии
выполняли забор плазмы крови.
При обследовании в случае выявлены цоДНК, а таких пока выявлено
184 пациента, у 49% были выявлены
радиологические признаки прогрессирования заболевания [6]. С другой
стороны, исследование пока не отвечает на опрос, что делать в случае выявления цоДНК и отсутствия радиологического прогрессирования. Ведь
сейчас, когда мы видим рост РЭА без
радиологических признаков прогрессирования, мы продолжаем наблюдение.
Попытка назначить всем неоадъювантную химиотерапию при III
стадии рака ободочной кишки до
настоящего времени не увенчалось
успехом: в исследовании FOXTROT
– улучшение выживаемости без признаков болезни, но не общей выживаемости (ОВ) [7], в исследовании
OPTICAL – улучшение ОВ без влияния на выживаемость без признаков
болезни (ВБПБ) [8] и в исследовании
PRODIGE 22 ни тот, ни другой показатель выживаемости улучшить не удалось [9]. Не стало исключением и еще
одно рандомизированное исследование – NEOCOL – среди пациентов
с Т3 с инвазией более 5 мм, Т4, N0-2
проведение предоперационной химиотерапии с включением оксалиплатина и фторпиримидинов не улучшило
ни ВБПБ, ни ОВ [10]. Таким образом,
нужно понимать, что с помощью неоадъювантной химиотерапии мы не
улучшим показатели выживаемости
при раке ободочной кишки, но, возможно, снизим риск послеоперационных осложнений.
Основной вопрос в лечении местнораспространенного рака прямой
кишки – кому и какое предоперационное лечение нужно назначать. Можно
проводить короткий курс лучевой
терапии с или без консолидирующей
химиотерапии или пролонгированный курс химиолучевого лечения с
или без индукционной или консолидирующей химиотерапии, или можно проводить только предоперационную химиотерапию без лучевого
воздействия, или сразу оперировать
на первом этапе – всего 7 вариантов.
В рамках газетной заметки не будем
даже пытаться ответить на этот вопрос, а лишь приведем еще 8 вариант
предоперационного лечения. В рандомизированном исследовании III фазы
PROSPECT сравнили классическую
химиолучевую предоперационную
терапию с персонализированным
подходом – проведение 6 курсов терапии по схеме FOLFOX и в случае, если
опухоль уменьшается на ≥20%, выполняется операция, если менее 20%
– проводится химиолучевая терапия
с последующей операцией. Только
9,5% пациентам в исследуемой группе
потребовалось проведение химиолучевой терапии, при этом доказана
неменьшая эффективность данного
подхода в сравнении с классическим
предоперационным лечением в отношении выживаемости без признаков
болезни. В то же время значимо улучшилась функция кишечника и сексуальная функция в группе экспериментальной терапии. Основная критика
работы связана с критериями включения пациентов – T2N+, T3N-, T3N+,
кандидат на сфинктер-сохранную
резекцию на момент рандомизации,
то есть практически отсутствовали
пациенты с низкорасположенными
опухолями (3%), так как у части таких
больных возможно на первом этапе
просто провести хирургическое лечение, и им даже не понадобится проводить и адъювантную химиотерапию.
Такой отбор пациентов объясняет и
высокий уровень полных патоморфологических ответов в обеих группах –
на уровне 20% [11].
Другой ортодоксальный подход – выполнение хирургического лечения с
последующей адъювантной химиотерапией при низкорасположенных
опухолях без предоперационного
лечения. Такая методика была выбрана за стандартное лечение в рандомизированном исследовании из
Японии NAIR, в качестве экспериментального подхода выступала предоперационная химиотерапия – 6-12
недель по схеме FOLFOX или XELOX
в зависимости от ответа опухоли с
последующим хирургическим лечением. Включались пациенты со стадией T3NлюбоеM0, расположенные в
пределах 5 см от анального края или
3 см от зубчатой линии. С помощью
предоперационной химиотерапии
авторам удалось численно увеличить
3-летнюю безрецидивную выживаемость на 4,5%, без влияния на выживаемость до развития отдаленных
метастазов и ОВ, зато отмечено улучшение анальной функции в группе
неоадъювантного лечения [12]. В
этой работе действительно был относительно высокий риск локальных
рецидивов в группе только хирургии,
с чем должна по идее справляться
предоперационная лучевая терапия.
Но получается, что у ряда пациентов
можно отказаться от классического
химиолучевого лечения. При этом
полный отказ от лучевого лечения
в пользу только неоадъювантной
химиотерапии (4-6 курсов по схеме
FOLFOX) при местнораспространенном раке прямой кишки не увеличивает частоту локальных рецидивов по
обновленным результатам исследования FOWARC [13]. С другой стороны,
если мы хотим отказаться от хирургического лечения и достичь полного клинического ответа, желательно
выбрать пролонгированную химиолучевую терапию с последующей
консолидирующей химиотерапией в
течение 16-18 недель, что подтверждают результаты исследования OPRA
и анализ опыта клиники MSKCC [14].
Причем в последней работе удалось
доказать, что оптимально в рамках
тотального неоадъюванта проводить
именно пролонгированную химиолучевую терапию, нежели короткий
курс лучевой терапии.
Лучевые терапевты не отставали и пытались доказать, что можно отказаться и от хирургии, и от химиотерапии
при раке прямой кишки. На ASCO GI
2023 были представлены предварительные результаты рандомизированного исследования OPERA: классическая химиолучевая терапия (СОД 54
Гр) против химиолучевой терапии с
последующим брахитерапевтическим
бустом в 90 Гр с помощью методики
Папильона. В качестве популяции
для исследования авторы выбрали пациентов с небольшими низкорасположенными опухолями – T2N0M0.
Автором удалось достичь уровня
реализации органосохранного подхода в 97% против 63% при опухолях в
пределах 3 см от анального края [15].
Осталось дождаться отдаленных результатов исследования, особенно
интересна частота поздних лучевых
осложнений.
В отсутствии каких-либо клинических исследований в обычной клинической практике в случае, если проводилась неполноценная тотальная
неоадъювантная терапия (менее 16
недель), после операции химиотерапевты пытаются доделать оставшиеся
курсы химиотерапии. На ASCO 2023
были представлены тезисы ретроспективного анализа базы данных из
Китая, в которых оценили эффективность адъювантной химиотерапии
среди пациентов с III патоморфологической стадией, кому провели менее
16 недель предоперационной химиотерапии с или без лучевого компонента. Оказалось, что 3-летняя выживаемость без признаков болезни в
случае проведения адъювантного лечения была незначимо хуже в случае
послеоперационной химиотерапии:
44,7% против 56,5% (ОР 1,19; 95% ДИ
0,6246-2,267; р=0,597) [16]. Осталось
проверить это в рандомизированном
исследовании.
Метастатический рак
толстой кишки
Считалось, что оптимальным портретом для назначения анти-EGFR антител при неоперабельном метастатическом раке толстой кишки является
левосторонняя локализация и дикий
тип генов RAS. Доказательством
этому служили результаты проспективного рандомизированного исследования III фазы по сравнению
режимов первой линии FOLFOX c
бевацизумабом или FOLFOX с панитумумабом – PARADIGM. Последний
режим значимо улучшил показатели общей выживаемости (ОР 0,82;
95,798% ДИ 0,68-0,99; р=0,031) [17].
С другой стороны, возникал вопрос,
можно ли отказаться от ориентации
на локализацию опухоли при выборе таргетного агента в пользу молекулярного генетического профиля,
хотя бы учитывая классические биомаркеры, применяемые при раке толстой кишки, – wtRAS, wtBRAF, MSS.
В исследовании PARADIGM изучив
в качестве источника генетической
информации цоДНК выделили подгруппу пациентов с wtRAS, wtBRAF,
MSS – эффективность комбинации
FOLFOX с панитумумабом стала
выше, но локализации по-прежнему
влияла на эффективность таргетного препарата: при правосторонней
локализации даже в этой селектированной популяции пациентов комбинация FOLFOX с панитумумабом
не улучшила общую выживаемость в
сравнении с бевацизумабом (ОР 0,94;
95% ДИ 0,6-1,48; р=0,78) [18]. С другой
стороны, при MSI и/или mBRAF комбинация с бевацизумабом была эффективнее даже при левосторонней
локализации.
Исследователи не остановились на достигнутом и отобрали пациентов с отсутствием альтераций, ассоциированных с резистентностью к анти-EGFR
терапии по 10 генам (wtRAS, wtBRAF,
MSS, отсутствие гиперэкспрессии или
амплификации Her-2/neu, амплификации MET, wtEGFR, wtALK, wtRET,
wtPTEN, wtNTRK). Только при таком
фенотипе наконец-то удалось отойти
от дифференцировки по локализации опухоли и при правосторонней
локализации увидеть преимущества
панитумумаба над бевацизумабом
(ОР 0,82) [19]. Правда, это уменьшило
выборку при правосторонней локализации практически наполовину. И
хотя для рекомендации применения
мультигенных панелей по отбору пациентов на таргетные препараты вне
зависимости от локализации опухоли
еще далеко – необходима валидация
и регистрация данной тест системы
– уже сейчас при назначении антиEGFR антител необходимо отбирать
пациентов с wtRAS, wtBRAF, MSS, отсутствием гиперэкспрессии или амплификации Her-2/neu.
Такое молекулярное субтипирование
даже по 4 биомаркерам позволяет и в
каждой из подгрупп применять специализированное лечение. Так, были
представлены результаты проспективного исследования по сравнению
различных дозировок трастузумаба
дерукстекана при метастатическом
раке толстой кишки с гиперэкспрессией Her-2/neu. Оказалось, что применение меньшей дозы (5,4 мг/кг 1
раз в 3 недели) показывало большую
частоту объективных ответов (ЧОО)
– 37,8%, чем применение дозировки 6,4 мг/кг – 27,5%. Препарат был
активен и после ранее проведенной
анти-Her2 терапии, и в подгруппе пациентов с сопутствующей мутацией в
генах RAS, правда в меньшей степени,
чем при диком типе гена. В отличие
от рака молочной железы, при аденокарциномах ЖКТ прослеживается
четкая корреляция между степенью
экспрессии и эффективностью трастузумаба дерукстекана: препарат
активен при гиперэкспрессии 3+ – частота объективных эффектов более
50%; при экспрессии 2+ и подтвержденной амплификацией гена – всего
7% [20].
При мутации в гене BRAF (V600)
возможно применение комбинации
BRAF ингибиторов с анти-EGFR
антителами. Все больше работ стало появляться с изучением назначения данной комбинации вместе с
химиотерапией. И если комбинация
иринотекана вемурафениба и цетуксимаба во 2 и последующих линиях
в рандомизированном исследовании
увеличивал медиану выживаемости
без прогрессирования лишь с 2 до 4,2
мес. [21], то применение данной комбинации уже в первой линии определяет частоту объективных ответов
на уроне 68,8%, а медиану ВБП 11,9
мес., что значимо было выше в сравнении с режимом FOLFIRI с бевацизумабом [22]. В связи с этим ожидаем
результатов исследования III фазы
BREAKWATER по изучению комбинации FOLFOX, энкорафениба и цетуксимаба в первой линии метастатического рака толстой кишки с mBRAF.
Результаты которого, по-видимому,
будут позитивными и изменят клиническую практику
При микросателлитно нестабильном
(MSI) фенотипе ничего нового, меняющего практику, не сообщалось, за
исключением подтверждения факта,
что определение мутационной нагрузки в опухоли при MSS не может
являться предиктором эффективности иммунотерапии при раке толстой
кишки [23]. В то же время на конференции WCGIC 2023 был представлен
анализ течения болезни и эффективности адъювантной химиотерапии
при T4N0M0 с MSI. Авторы показали,
что прогноз пациентов с T4N0M0 с
MSI или MSS одинаков и пациенты
с MSI выигрывают от адъювантной
химиотерапии, что в принципе и
было представлено в рекомендациях RUSSCO еще несколько лет назад
[24]. Пользуясь случаем, нельзя не
упомянуть и публикации этого года
в журнале JCO Prec Med. В которой
исследователи из Китая, сравнив эффективность монотерапии анти-PD1
антител и комбинации их с химиотерапий при метастатическом раке
толстой кишки с микросателлитно
нестабильным фенотипом, пришли
к выводу, что добавление химиотерапии значимо лучше как в отношении
непосредственной эффективности,
так и выживаемости, чем только ингибитор иммунных контрольных
точек [25]. Заставляет задуматься и
постерная работа из Генуи, в которой
пациентам с метастатическим раком
толстой кишки и MSI на 2-3 курсе
терапии пембролизумабом проводилась стереотаксическая лучевая терапия на один из очагов с целью запуска
абскопального эффекта – только у 4
из 14 включенных пациентов был зарегистрирован объективный ответ
[26]. То есть, насколько бы ни была
заманчива теория, она требует проспективной валидации.
С другой стороны, перечисленные
подтипы – явление нечастое, а большинство популяции представляет
собой пациентов с мутацией в генах
RAS, для которых значимых прорывов до сих пор не было. До конференции ASCO 2023 уж было известно, что в подгруппе пациентов с
мутацией в гене KRAS G12C, которая
встречается в 2-3% наблюдений, относительно эффективным подходом
является сочетание специфического
ингибитора соторасиба или адаграсиба с анти-EGFR антителами. Именно
такие комбинации сейчас проходят
рандомизированные исследования
при раке толстой кишки во второй
линии. Относительная эффективность представлена небольшой длительностью ответа – медиана обычно
порядка 5 месяцев [27], в связи с чем
заманчивой видится комбинация
данного подхода с химиотерапией,
тем более что при применении соторасиба с пеметрекседом и карбоплатином при НМРЛ в первой линии при
аналогичной мутации она показывает
потрясающие 88,9% объективных ответов [28]. На ASCO 2023 представлены результаты анализа подгруппы
«H» в исследовании Code BreaK 101:
комбинация режима FOLFIRI с соторасибом и панитумумабом во 2 и
последующих линиях метастатического рака толстой кишки с mKRAS
G12C продемонстрировала 55% объективных ответов, однако данные по
выживаемости без прогрессирования
(ВБП) не сообщены [29].
В связи с развитием методов оценки цоДНК возродился интерес к поиску ситуации, когда при выявлении в опухоли мутации в генах RAS в процессе лечения она перестает определяться. То есть создаются предпосылки к возможному назначению анти-EGFR антител. Такой феномен получил название NeoRAS. В более ранних исследованиях данная ситуация, в контексте изучения опухолевого материала, была нечаста и по результатам работы с наибольшим числом пациентов описывалась у 1,6% пациентов [30]. На ASCO 2023 года представили результаты исследования из Японии – GOZILA. Включив в итоговый анализ данные 478 пациентов с метастатическим раком толстой кишки и с мутацией в генах RAS, при взятии образца крови при прогрессировании на любой из линий лечения, мутация в плазме крови отсутствовала у 19% пациентов. После отбора пациентов, у которых цоДНК присутствовала (выявлялись мутации в других генах), данный процент уменьшился до 9,8%. Шанс реализации феномена NeoRAS повышался среди пациентов без метастазов в печени и уменьшался при наличии мутаций в гене KRAS с локализацией во 2 экзоне. В исследовании планируется в дальнейшем оценить у таких пациентов эффективность анти-EGFR терапии, но пока сообщено лишь об одном объективном ответе среди 6 пролеченных пациентов, при этом пациенту проводилась терапия по схеме иринотекан с цетуксимабом; среди двух пациентов на монотерапии анти-EGFR антителами при первом же обследовании было диагностировано прогрессирование [31]. Поэтому пока данный подход требует проспективной валидации, так как известно, что феномен исчезновения мутации может носить кратковременный транзиторный характер [32], а также определяться недостаточным объемом опухолевой нагрузки при специфических сайтах метастазирования (легкие, брюшина, лимфоузлы) [33]. Отдельно следует коснуться и исследований по поддерживающей терапии. Напомню, что после завершения 8-12 курсов индукционной химиотерапии при метастатическом раке толстой кишки можно пациента оставить под наблюдением, перейти на интермитирующий характер лечения или назначать поддерживающую терапию по схеме фторпиримидины с бевацизумабом или анти-EGFR антитела с или без режима de Gramont. Первый вариант ведения пациентов интересен тем, что пациент может отдохнуть без лечения, а при прогрессировании ему можно повторно назначить ранее прекращенную схему лечения, как это было в исследовании IMPROVE – при применении режима FOLFIRI с панитумумабом (отдых после 8 курсов). При этом показано увеличение такого параметра эффективности, как ВБП на лечении. То есть учитывались события прогрессирования при повторном назначении данного режима после отдыха. Тогда как в контрольной группе, в которой режим FOLFIRI с панитумумабом проводился до прогрессирования или неприемлемой токсичности, события ограничивались лишь первой линией. Совершенно ожидаемо, что в экспериментальной группе такой критерий был лучше. На ASCO 2023 сообщили результаты ОВ, они оказались неразличимы между сравниваемыми лечебными подходами. Недостатком исследования также было отсутствие группы с поддерживающей терапией по схеме панитумумаб с режимом de Gramont [34]. Таким образом, в разнообразии вариантов ведения пациентов после 8 курсов индукционной химиотерапии необходимо выделение клинических факторов для выбора оптимальной стратегии, чему были посвящены несколько постерных работ.
Основным поставщиком таких работ явилось исследование Panama по сравнению панитумумаба с de Gramont или только de Gramont после 8 курсов терапии первой линии FOLFOX с панитумумабом. Авторы пришли к выводу, что в отношении ВБП добавление ко фторпиримидинам антиEGFR антитела было эффективным при метастазах в печени с размером очагов более 5 см, а также при отсутствии метастазов в лимфоузлах. Однако в отношении ОВ получена лишь тенденция к улучшению при метастазах в печени более 5 см [35]. В другом поданализе было показано негативное значение при 3-кратном различии в размерах диаметра наименьшего и наибольшего по размерам очага в печени, что, возможно, требует более агрессивного лечения [36]. Это косвенно подтверждается результатами поданализа исследования ERMES, в котором сравнили поддерживающую терапию цетуксимабом после 8 курсов по схеме FOLFIRI с цетуксимабом и продолжение полноценного режима до прогрессирования или неприемлемой токсичности. Отмечено, что в случае достижения раннего уменьшения опухоли, определяемого как уменьшение на ≥20% суммы таргетных очагов на 8 неделе индукционного режима лечения, возможно деэскалировать терапию до монотерапии анти-EGFR антителом. В обратной ситуации выигрывал более интенсивный подход в лечении [37]. То есть можно гипотетизировать, что в случае эффекта на первой линии, особенно при небольших проявлениях болезни к концу 8 курса, можно действительно оставить пациента на минимальной поддерживающей терапии или предоставить полноценные лечебные каникулы. В ситуации стабилизации или при большой опухолевой нагрузке желательно не уменьшать интенсивность лечения менее комбинации de Gramont с антиEGFR антителами, а может быть и продолжать иринотекан-содержащий режим до прогрессирования или непереносимости. Так ли это справедливо – посмотрим в последующих исследованиях. Так ли это оправданно и для схем с бевацизумабом – вероятно да, и ранее нашей группой были выявлены аналогичные тенденции [38].
Если говорить о 3 и последующих линиях лечения, то необходимо вспомнить, что с января 2023 года стандарты лечения в данной клинической ситуации поменялись в мире в связи с публикацией результатов исследования SUNLIGHT. Авторы показали, что комбинация препарата TAS-102 с бевацизумабом была значимо лучше монотерапии TAS-102 как в отношении ВБП, так и ОВ. Причем было показано достижение медианы ОВ на уровне 10 месяцев [39]. Тем не менее, был и ряд огорчений. Так, сначала в пресс-релизе сообщили о негативных результатах исследования LEAP-017 по сравнению комбинации ленватиниба с пембролизумабом и монотерапии регорафенибом или TAS-102 на выбор исследователя. Уже в презентации материалов на прошедшей после ASCO европейской конференции WCGIC 2023 стало понятно, что не удалось статистически значимо улучшить ОВ. Однако, как было известно и ранее, выигрыш наблюдался в группе пациентов без метастазов в печени (ОР 0,65; 95% ДИ 0,42-0,99), причем поражение печени являлось фактором стратификации, а отсутствие метастазов в органе отмечалось у 30% популяции исследования [40]. Тем не менее, это требует отдельного исследования.
А сейчас смеем надеяться на позитивные результаты рандомизированного исследования при метастатическом раке толстой кишки с MSS без метастазов в печени в 3 линии лечения сравнения комбинации ботенсилимаба (анти-CTLA4 антитела с модифицированным фрагментом) и балстилимаба (анти-PD1 антитела) с регорафенибом, набор в которое идет в том числе и в РФ. Пока довольствуемся результатами Ia/Ib фазы, в которой исследователям удалось в описываемой клинической ситуации при применении данной иммунологической комбинации достигнуть у 42% пациентов объективных ответов [41]. Другое направление – поиск предикторов эффективности химиоиммунотерапии при MSS фенотипе опухоли. Ранее было сообщено о негативных результатах исследования по сравнению режима FOLFOXIRI с бевацизумабом с добавлением или без атезолизумаба – AtezoTRIBE [42]. Однако применение такого теста, как Immunoscore IС, который учитывает экспрессию PDL и соотношение CD3+ и CD8+ лимфоцитов в опухоли, позволило в группе высокого значения теста снизить относительный риск прогрессирования на 53% при добавлении анти-PDL антитела [43]. Обещают в 2024 году начать рандомизированное исследование в данной группе пациентов.
В общем, хотя и не было прорывных, как в прошлом году, сообщений, опубликованные работы позволяют внести отдельные штрихи в картину клинических рекомендаций по лечению рака толстой кишки. А в эру цифровизации конференций и скорости информатизации врачей и пациентов путем чтения новостных онкологических каналов от авторов таких каналов требуется беспристрастный и неангажированный подход в представлении результатов исследований, желательно с юмором.
Источники:
1. Федянин М.Ю., Гладков О.А., Гордеев С.С., Карачун А.М., Козлов Н.А., Мамедли З.З. и соавт. Практические рекомендации по лекарственному лечению рака ободочной кишки, ректосигмоидного соединения и прямой кишки. Злокачественные опухоли: Практические рекомендации RUSSCO. 2022; #3s2 (том 12), 401–454.
2. Федянин М.Ю., Трякин А.А., Буланов А.А., Гордеев С.С., Кузьмичев Д.В., Мамедли З.З., Козлов Н.А., Тюляндин С.А. К вопросу о числе лимфатических узлов, необходимых к изучению при раке толстой кишки II стадии. Тазовая хирургия и онкология. 2019; 9(1): 42-50.
3. Jeon J, Shen L, Kim Y, et al. The number of lymph nodes examined as a poor prognosis factor in stage II and stage III colon cancer patients undergoing curative surgery. J Clin Oncol. 2023; 41 (suppl 16), abstr 3612.
4. Oki E, Kotani D, Nakamura Y, et al. Circulating tumor DNA dynamics as an early predictor of recurrence in patients with radically resected colorectal cancer: Updated results from GALAXY study in the CIRCULATE-Japan. J Clin Oncol. 2023; 41 (suppl 16), abstr 3521.
5. Cohen SA, Kasi PM, Aushev VN, et al. Kinetics of postoperative circulating cellfree DNA and impact on minimal residual disease detection rates in patients with resected stage I-III colorectal cancer. J Clin Oncol. 2023; 41 (suppl 4), abstr 5.
6. Dasari A, Bent AH, Alfaro-Munoz K, et al. Association of positive ctDNA-based minimal residual disease assays during surveillance and undiagnosed concomitant radiographic recurrences in colorectal cancer (CRC): Results from the MD Anderson INTERCEPT program. J Clin Oncol. 2023; 41 (suppl 16), abstr 3522.
7. Morton D, Seymour M, Magill L, et al. Preoperative Chemotherapy for Operable Colon Cancer: Mature Results of an International Randomized Controlled Trial. J Clin Oncol. 2023; 41: 1541-1552.
8. Hu H, Huang M, Li Y, et al. Perioperative chemotherapy with mFOLFOX6 or CAPOX for patients with locally advanced colon cancer (OPTICAL): A multicenter, randomized, phase 3 trial. J Clin Oncol. 2022; 40: 3500-3500.
9. Karoui M, Gallois C, Piessen G, et al. Does neoadjuvant FOLFOX chemotherapy improve the prognosis of high-risk stage II and III colon cancers? Three years’ followup results of the PRODIGE22 phase II randomized multicentre trial. Colorectal Dis. 202123:1357-1369.
10.Jensen Lars Henrik, Kjaer Monica Linda, Larsen Finn Ole, et al. Phase III randomized clinical trial comparing the efficacy of neoadjuvant chemotherapy and standard treatment in patients with locally advanced colon cancer: The NeoCol trial. J Clin Oncol. 2023; 41 (suppl 17), abstr LBA3503.
11.Schrag D, Shi Q, Weiser MR, et al. PROSPECT: A randomized phase III trial of neoadjuvant chemoradiation versus neoadjuvant FOLFOX chemotherapy with selective use of chemoradiation, followed by total mesorectal excision (TME) for treatment of locally advanced rectal cancer (LARC) (Alliance N1048). J Clin Oncol. 2023; 41 (suppl 17), abstr LBA2.
12.Tsukada Y, Kawashima Y, Fujita F, et al. Neoadjuvant chemotherapy (NAC) followed by total mesorectal excision (TME) and adjuvant chemotherapy versus TME followed by adjuvant chemotherapy in very low-lying clinical (c) T3 rectal cancer (NAIR): A multicenter, randomized, openlabel, phase 2/3 trial. J Clin Oncol. 2023; 41 (suppl 16), abstr 3519.
13.Zhang J, Chi P, Lan P, et al. Long-term outcome of neoadjuvant mFOLFOX6 with or without radiation versus fluorouracil plus radiation for locally advanced rectal cancer: A multicenter, randomized phase III trial. J Clin Oncol. 2023; 41 (suppl 16), abstr 3505.
14.Verheij FS, Omer DMR, Williams H, et al. Sustained organ preservation in rectal cancer patients treated with total neoadjuvant therapy: Long-term results of the OPRA trial. J Clin Oncol. 2023; 41 (suppl 16), abstr 3520.
15.Myint AS. Do nonoperative modality (NOM) treatments of rectal cancer compromise the chance of cure? Final surgical salvage results from OPERA phase 3 randomised trial (NCT02505750). J Clin Oncol. 2023; 41 (suppl 4), abstr 6.
16.Cai R, Zhang J, Cai Y, et al. Adjuvant chemotherapy in ypStage III locally advanced rectal cancer after neoadjuvant treatment with an oxaliplatin-based regimen. J Clin Oncol. 2023; 41 (suppl 16), abstr e15628.
17.Yoshino T, Watanabe J, Shitara K, et al. Panitumumab (PAN) plus mFOLFOX6 versus bevacizumab (BEV) plus mFOLFOX6 as first-line treatment in patients with RAS wild-type (WT) metastatic colorectal cancer (mCRC): Results from the phase 3 PARADIGM trial. J Clin Oncol. 2022; 40 (suppl 17), abstr LBA1.
18.Yamazaki K, Muro K, Watanabe J, et al. Efficacy of panitumumab in patients with left-sided disease, MSS/MSI-L, and RAS/ BRAF WT: A biomarker study of the phase III PARADIGM trial. J Clin Oncol. 2023; 41 (suppl 16), abstr 3508.
19.Shitara K, Muro K, Watanabe J, et al. Negative hyperselection of patients with RAS wild-type metastatic colorectal cancer for panitumumab: A biomarker study of the phase III PARADIGM trial. J Clin Oncol. 2023; 41 (suppl 4), abstr 11.
20.Raghav KPS, Siena S, Takashima A, et al. Trastuzumab deruxtecan (T-DXd) in patients (pts) with HER2-overexpressing/ amplified (HER2+) metastatic colorectal cancer (mCRC): Primary results from the multicenter, randomized, phase 2 DESTINY-CRC02 study. J Clin Oncol. 2023; 41 (suppl 16), abstr 3501.
21.Kopetz S, Guthrie KA, Morris VK, et al. Randomized Trial of Irinotecan and Cetuximab With or Without Vemurafenib in BRAF-Mutant Metastatic Colorectal Cancer (SWOG S1406). J Clin Oncol. 2021 Feb 1; 39(4): 285-294.
22.Chen Y, Zhu D, Wei Y, Xu J. VIC regimen (vemurafenib/irinotecan/cetuximab) versus bevacizumab plus chemotherapy as firstline treatment for BRAF V600E-mutated advanced colorectal cancer. J Clin Oncol. 2023; 41 (suppl 16), abstr 3596.
23.Gandara DR, Agarwal N, Gupta S, et al. Tumor mutational burden (TMB) measurement from an FDA-approved assay and real-world overall survival (rwOS) on single-agent immune checkpoint inhibitors (ICI) in over 8,000 patients across 24 cancer types. J Clin Oncol. 2023; 41 (suppl 16), abstr 2503.
24.Ahmed F, Selfridge J, Kakish H, et al. The outcome of resected stage II colon cancer patients with deficient mismatch repair T4 tumors: A National Cancer Database analysis. Ann of Oncol. 2023; Vol.34, Suppl.1: S170.
25.Chen M, Wang Z, Liu Z, et al. PD-1/ PD-L1 Inhibitor Plus Chemotherapy Versus PD-1/PD-L1 Inhibitor in Microsatellite Instability Gastrointestinal Cancers: A Multicenter Retrospective Study. JCO Precis Oncol. 2023 Mar; 7: e2200463.
26.Gandini A, Martelli V, Belgioia L, et al. The controversial abscopal effect: A singlecenter experience about the combination of stereotactic radiotherapy with pembrolizumab in patients with metastatic dMMR/MSI-H colorectal cancer. J Clin Oncol. 2023; 41 (suppl 16), abstr 2608.
27.Pant S, Yaeger R, Spira AI, et al. KRYSTAL-1: Activity and safety of adagrasib (MRTX849) in patients with advanced solid tumors harboring a KRASG12C mutation. J Clin Oncol. 2023; 41 (suppl 36), abstr 425082.
28.Sakata S, Akamatsu H, Azuma K, et al. The primary endpoint analysis of SCARLET study: A single-arm, phase II study of sotorasib plus carboplatinpemetrexed in patients with advanced nonsquamous, non-small cell lung cancer with KRAS G12C mutation (WJOG14821L). J Clin Oncol. 2023; 41 (suppl 16), abstr 9006.
29.Hong DS, Kuboki Y, Strickler JH, et al. Sotorasib (Soto) plus panitumumab (Pmab) and FOLFIRI for previously treated KRAS G12C-mutated metastatic colorectal cancer (mCRC): CodeBreaK 101 phase 1b safety and efficacy. J Clin Oncol. 2023; 41 (suppl 16), abstr 3513.
30.Henry J, Willis J, Parseghian CM, et al. NeoRAS: Incidence of RAS reversion from RAS mutated to RAS wild type. J Clin Oncol. 2020; 38 (suppl 4), abstr 180.
31.Osumi H, Shinozaki E, Nakamura Y, et al. NeoRAS wild-type metastatic colorectal cancer in the SCRUM-Japan GOZILA study. J Clin Oncol. 2023; 41 (suppl 16), abstr 3506.
32.Wu FTH, Topham JT, O'Callaghan CJ, et al. Reversion of RAS mutations in metastatic colorectal cancer in the CCTG CO.26 clinical trial. J Clin Oncol. 2023; 41 (suppl 16), abstr 3567.
33.Bando H, Nakamura Y, Taniguchi H, et al. Effects of Metastatic Sites on Circulating Tumor DNA in Patients With Metastatic Colorectal Cancer. JCO Precis Oncol. 2022 Apr; 6: e2100535.
34.Avallone A, Giuliani F, Nasti G, et al. Intermittent or continuous panitumumab plus FOLFIRI (FOLFIRI/PANI) for firstline treatment of patients (pts) with RAS/ BRAF wild-type (wt) metastatic colorectal cancer (mCRC): An update of survival/ toxicity and preliminary results of genomic alterations from IMPROVE study. J Clin Oncol. 2023; 41 (suppl 16), abstr 3571.
35.Sommerhäuser G, Kurreck A, Beck A, et al. Impact of number and size of colorectal metastases (CRM) on survival in patients with RAS wild-type metastatic colorectal cancer treated within the PanaMa trial (AIO KRK 0212). J Clin Oncol. 2023; 41 (suppl 16), abstr 3551.
36.Sommerhäuser G, Kurreck A, Beck A, et al. Size-related heterogeneity of colorectal liver metastases (CRLM) in patients with advanced RAS wild-type metastatic colorectal cancer (mCRC) treated in the PanaMa trial: Implication for treatment decisions. J Clin Oncol. 2023; 41 (suppl 16), abstr 3553.
37.Orlandi A, Pinto C, Calegari MA, et al. Early tumor shrinkage (ETS) as clinical factor to select maintenance with cetuximab (cet) monotherapy in RAS/BRAF wild-type (wt) metastatic colorectal cancer (mCRC) patients (pts): A secondary endpoint analysis of the ERMES study. J Clin Oncol. 2023; 41 (suppl 16), abstr 3603.
38.Федянин М.Ю., Трякин А.А., Полянская Е.М., и др. Факторы, ассоциированные с эффективностью поддерживающей химиотерапии при метастатическом раке толстой кишки. Тазовая хирургия и онкология. 2016; 6(2): 8-17.
39.Prager GW, Taieb J, Fakih M, et al. Trifluridine–Tipiracil and Bevacizumab in Refractory Metastatic Colorectal Cancer. N Engl J Med. 2023; 388: 1657-1667.
40.Kawazoe A, Xu R, Passhak M, et al. Lenvatinib Plus Pembrolizumab vs Standard of Care for Previously Treated Metastatic Colorectal Cancer (mCRC): The phase 3 LEAP-017 study 017 Study. Ann of Oncol. 2023; Vol 34, Suppl.1: S179.
41.El-Khoueiry AB, Fakih M, Gordon MS, et al. Results from a phase 1a/1b study of botensilimab (BOT), a novel innate/ adaptive immune activator, plus balstilimab (BAL; anti-PD-1 antibody) in metastatic heavily pretreated microsatellite stable colorectal cancer (MSS CRC). J Clin Oncol. 2023; 41 (suppl 4), abstr LBA8.
42. Antoniotti C, Rossini D, Pietrantonio F, et al. Upfront FOLFOXIRI plus bevacizumab with or without atezolizumab in the treatment of patients with metastatic colorectal cancer (AtezoTRIBE): a multicentre, open-label, randomised, controlled, phase 2 trial. Lancet Oncol. 2022 Jul; 23(7): 876-887.
43.Antoniotti C, Rossini D, Pietrantonio
F, et al. FOLFOXIRI plus bevacizumab
and atezolizumab as upfront treatment
of unresectable metastatic colorectal
cancer (mCRC): Updated and overall
survival results of the phase II randomized
AtezoTRIBE study. J Clin Oncol. 2023; 41
(suppl 16), abstr 3500.
НОВОСТИ ASCO 2023 / ASCO 2023: ЧТО ТАМ В МИРЕ ОНКОУРОЛОГИИ?
Автор: Румянцев Алексей Александрович
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России,
кандидат медицинских наук, Москва
В июне 2023 года прошел очередной
ежегодный конгресс ASCO 2023.
Огромное количество новостей
из мира онкоурологии. В этом небольшом материале постараемся
рассказать о наиболее практически
значимых из них.
ddMVAC – новый стандарт
неоадъювантной
химиотерапии мышечноинвазивного рака мочевого
пузыря
На ASCO 2023 представлены финальные данные рандомизированного исследования III фазы VESPER
(n=500) по изучению эффективности
режима ddMVAC в периоперационной терапии уротелиального рака.
Включались цисплатин-подходящие
пациенты с мышечно-инвазивным
раком и рандомизировались в соотношении 1:1 в группу гемцитабина 1250 мг/м2 день 1, 8 в сочетании с цисплатином 70 мг/м2 день 1
(GC) каждые 21 день или в группе
ddMVAC (метотрексат 30 мг/м2 день
1, винбластин 3 мг/м2 день 2, доксорубицин 30 мг/м2 день 2, цисплатин
70 мг/м2 день 2) с поддержкой Г-КСФ
[1,2]. Медиана наблюдения на момент представления данных составила 5 лет.
По результатам исследования показатель 5-летней общей выживаемости (ОВ) в общей популяции этого
исследования составил 64% в группе ddMVAC и 56% в группе GC (HR
0,77; p=0,078), а среди пациентов,
получавших лечение в неоадъювантном режиме (n=437), – 66% и 57%
соответственно (HR 0,71; p=0,032).
Также было отмечено достоверное
увеличение опухоль-специфической
выживаемости в общей популяции
исследования (72% и 59%; HR 0,63;
p=0,004) и в неоадъювантной подгруппе (75% и 60%; HR 0,56; p=0,001).
Переносимости исследуемого режима лечения была удовлетворительной. Весь запланированный объем
лечения получили 66% и 58% пациентов в группе GC (4 курса) и группе
ddMVAC (6 курсов) соответственно.
Данные по частоте развития наиболее частых нежелательных явлений
представлены в диаграмме ниже
(рис.3).
Рисунок 1.
Дизайн исследования VESPER
Рисунок 2.
Общая выживаемость пациентов в исследовании VESPER

Рисунок 3.
Частота развития наиболее распространенных нежелательных
явлений в исследовании VESPER
* – статистически значимые различия.
Финальные результаты VESPER подтверждают высокую эффективность
режима ddMVAC в неоадъюванте
мышечно-инвазивного рака мочевого пузыря. Несколько портит идеРисунок 1. Дизайн исследования VESPER
Рисунок 2. Общая выживаемость пациентов в исследовании VESPER
Рисунок 3. Частота развития наиболее распространенных нежелательных
явлений в исследовании VESPER
* – статистически значимые различия.
Рисунок 4. Общая выживаемость в исследовании THOR
Рисунок 5. Подгрупповой анализ эффективности терапии в исследовании THOR
альную картину тот факт, что за счет
небольшого количества включенных
«адъювантных» пациентов различия
по ОВ в общей популяции исследования не достигли статистической
достоверности, но это вряд ли должно влиять на общую интерпретацию
результатов исследования.
Рисунок 4.
Общая выживаемость в исследовании THOR

Рисунок 5.
Подгрупповой анализ эффективности терапии в исследовании THOR
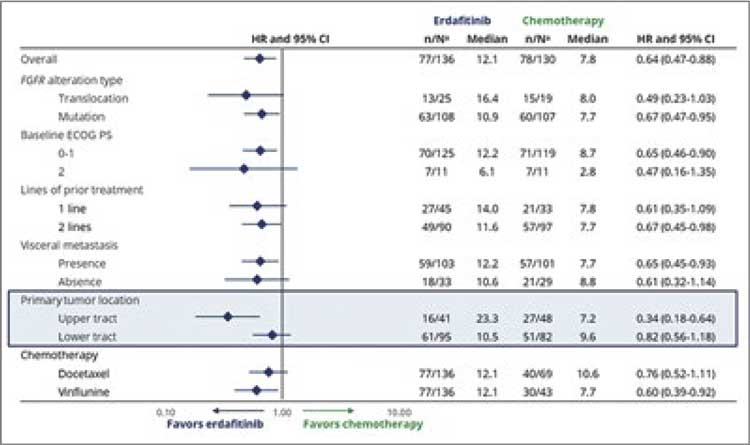
Эрдафитиниб в лечении
FGFRalt метастатического
рака мочевого пузыря:
исследование III фазы THOR
Исследование III фазы THOR
(n=266) – сравнение эффективности
селективного FGFRi эрдафитиниба
и стандартной химиотерапии во
2-3 линии терапии уротелиального
рака (доцетаксел или винфлунин)
[3]. На ASCO 2023 представлены
результаты когорты 1 данного исследования, в которую включались
пациенты, ранее получившие PD-1/
PD-L1 антагонисты. Первичная конечная точка достигнута: медиана
ОВ составила 12,1 мес. в группе эрдафитиниба по сравнению с 7,8 мес.
в группе химиотерапии (HR 0,64;
p=0,005). Медиана ВБП составила
5,6 и 2,7 мес. соответственно (HR
0,58; p=0,0002). В подгрупповом
анализе – наибольшая эффективность в отношении ОВ при опухолях верхних отделов мочевыводящих путей (HR 0,34; 95% ДИ
0,18-0,64). RR – 45,6% против 11,5%.
В подгрупповом анализе нельзя не
обратить внимание на результаты
применения препаратов в подгруппе больных с опухолями верхних и
нижних отделов мочевыводящих путей – именно в последней подгруппе
была отмечена наиболее высокая эффективность исследуемого препарата, медиана ОВ в группе эрдафитиниба составила 23,3 мес. по сравнению
с 7,2 мес. в контрольной группе (HR
0,34; 95% ДИ 0,18-0,64), в то время
как среди пациентов с опухолями
нижних отделов достоверных различий отмечено не было (медиана 10,5
и 9,6 мес.; HR 0,82; 95% ДИ 0,56-1,18).
Пембролизумаб/ленватиниб,
пембролизумаб/акситиниб
в первой линии терапии
метастатического рака
почки: обновленные
результаты исследований III
фазы CLEAR и KEYNOTE-426
Представлены финальные результаты по общей выживаемости из
рандомизированного исследования
III фазы CLEAR (n=712) – сравнение комбинации ленватиниба/пембролизумаба и монотерапии сунитинибом в первой линии терапии
метастатического светлоклеточного
рака почки. Ранее – в этом несомненно позитивном исследовании – при
медиане наблюдения 26,6 мес. было
продемонстрировано достоверное
увеличение ряда ключевых конечных точек, включая ОВ (медиана не
достигнута ни в одной из групп; HR
0,66; p=0,005), ВБП (23,9 против 9,2
мес.; HR 0,39; p<0,001) пациентов и
частоту объективного ответа (71% и
36%; p<0,001). В этот раз нам показали данные с медианой наблюдения
>48 мес. По результатам – медиана
ОВ составила 53,7 мес. в группе ленватиниба/пембролизумаба и 54,3
мес. в группе сунитиниба (HR 0,79;
p=0,042), показатель 1-летней ОВ – 80,4% и 69,6%, 3-летней – 66,4% и
60,2% соответственно [4].
Различия в ОВ пациентов между
группами остаются достоверными,
но в первую очередь – за счет предотвращения «ранних» смертей, видимо,
в первую очередь за счет тех пациентов, у которых значительная распространенность опухолевого процесса
представляет собой значимую угрозу. Дополнительные подгрупповые
анализы ОВ продемонстрировали отсутствие различий в эффективности терапии среди пациентов с
благоприятным прогнозом (HR 0,94;
95% ДИ 0,58-1,52) и снижение риска смерти при неблагоприятном/
промежуточном прогнозе (HR 0,74;
95% ДИ 0,57-0,96). Если дробить эти
группы еще дальше – основное преимущество было обеспечено именно
неблагоприятной прогностической
группой (HR 0,47; 95% ДИ 0,25-0,87).
Ожидаемо, что между группами
был выявлен серьезный дисбаланс
с точки зрения последующего применения иммунотерапевтических
агентов – 15% в группе комбинации
и 55% в группе сунитиниба. Могло
ли большее количество терапевтических опций во 2+ линиях обеспечить постепенное уменьшение
различий в рисках смерти? Конечно! Исследователи дополнительно продемонстрировали данные
по ОВ пациентов с поправкой на
последующие линии терапии – в
этом анализе медиана ОВ не была
достигнута в группе ленватиниба/
пембролизумаба и составила 32 мес.
в группе сунитиниба (HR 0,55; 95%
ДИ 0,44-0,69).
При этом группа благоприятного
прогноза достоверно выигрывала с
точки зрения другой ключевой конечной точки – медианы ВБП, здесь
медиана ВБП составила 28,6 мес.
в группе комбинации и 12,9 мес. в
контрольной группе (HR 0,50; 95%
ДИ 0,35-0,71), в группе промежуточного или неблагоприятного прогноза данные показатели составили
22,1 и 5,9 мес. соответственно (HR
0,43; 95% ДИ 0,34-0,55).
Одновременно с CLEAR представлены результаты 5-летнего наблюдения из исследования III фазы
KEYNOTE-426 (n=801) – пембролизумаб/акситиниб против сунитиниба в первой линии терапии
метастатического светлоклеточного
рака почки. В соответствии с данными, представлявшимися ранее,
комбинация пембролизумаба и акситиниба достоверно увеличивала
ОВ пациентов (HR 0,68) и ВБП (HR
0,71) по сравнению с монотерапией
сунитинибом [5].
Медиана наблюдения на момент
публикации текущих данных составляет 67 мес. По результатам –
медиана ВБП составляет 15,7 мес. в
группе пембролизумаба/акситиниба и 11,1 мес. в группе сунитиниба
(HR 0,69; 95% ДИ 0,59-0,81), а медиана ОВ – 47,2 и 40,8 мес. соответственно (HR 0,84; 95% ДИ 0,71-0,99).
При «разбивке» пациентов на группы прогноза – пациенты с благоприятным прогнозом не выигрывают с точки зрения ОВ (HR 1,10; 95%
ДИ 0,79-1,54), в отличие от CLEAR
различия по ВБП здесь оказались
недостоверными (HR 0,76; 95% ДИ
0,57-1,02). А вот среди пациенток с
промежуточным/неблагоприятным
прогнозом применение комбинации пембролизумаба и акситиниба
позволило увеличить медиану ОВ с
29,3 до 42,2 мес. по сравнению с монотерапией сунитинибом (HR 0,76;
95% ДИ 0,62-0,93), медиану ВБП –
с 8,3 до 13,8 мес. (HR 0,68; 95% ДИ
0,56-0,82).
Как и в CLEAR, исследователи из
KEYNOTE-426 решили проверить
гипотезу о влиянии последующей
терапии на общую выживаемость
пациентов – и опять последующую
иммунотерапию получили 27% из группы комбинации и 80% из контрольной группы. Проведен анализ
общей выживаемости с поправкой
на последующую терапию – достоверный выигрыш в пользу комбинации (HR 0,67; 95% ДИ 0,52-0,84).
Таким образом, среди пациентов
благоприятной прогностической
группы назначение интенсифицированной терапии не позволяет
увеличить общую выживаемость
пациентов – за счет наличия эффективных опций последующей терапии для этих больных. Интересно, будут ли учтены новые данные
в следующей версии клинических
рекомендаций.
Рисунок 6.
Общая выживаемость в исследовании CLEAR
Рисунок 7.
Общая выживаемость в исследовании CLEAR с поправкой
на последующую терапию.

Рисунок 8.
Общая выживаемость в исследовании KEYNOTE-426
Рисунок 9.
Результаты лечения благоприятной прогностической группы
в исследовании KEYNOTE-426
Несветлоклеточный рак
почки: пембролизумаб/
ленватиниб в первой линии
терапии – исследование
KEYNOTE-B61 и кое-что еще
Представлены результаты исследования KEYNOTE-B61, которое,
возможно, изменит нашу практику
лечения несветлоклеточных подтипов рака почки [6]. Нерандомизированное исследование II фазы,
первая линия терапии, один рукав,
режим лечения – пембролизумаб 200
мг в/в капельно день 1 + ленватиниб
20 мг ежедневно, каждые 21 день. В
исследовании приняло участие 158
пациентов, медиана наблюдения составила 14,9 мес. По результатам исследования объективный ответ на
терапию отмечен у 78 (49%) пациентов:
• папиллярный рак (n=93): 50%, в т.ч. 6% полных ответов;
• хромофобный рак (n=29): 28% объективных ответов;
• неклассифицируемые опухоли (n=21): 52% объективных ответов;
• опухоли, ассоциированные с транслокациями (n=6): 67%
• объективных ответов;
• другие варианты (n=9): 56% объективных ответов, 11% полных ответов.
Рисунок 10.
Waterfall plot по частоте и выраженности объективных ответов
на терапию пембролизумабом и ленватинибом
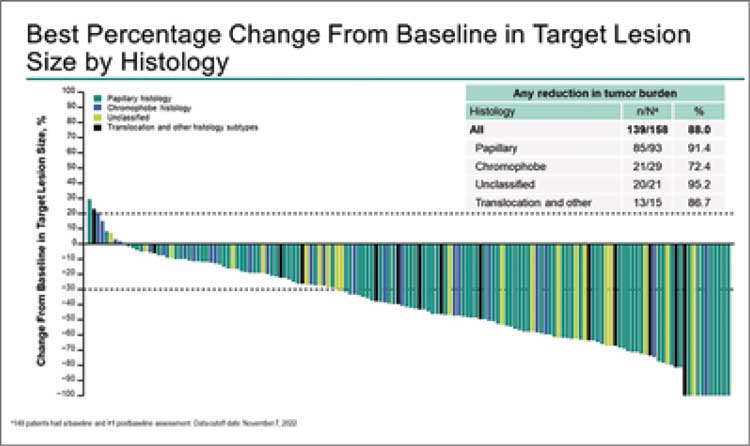
Рисунок 11.
Общая выживаемость пациентов с несветлоклеточными подтипами рака почки в зависимости от наличия или отсутствия саркоматоидной
дифференцировки опухоли и варианта терапии
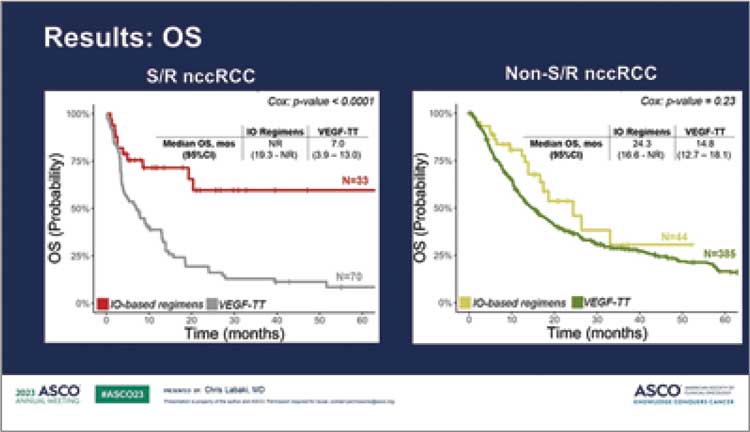
Медиана ВБП составила 18 мес., а
показатель 12-месячной ВБП – 63%.
Медиана общей выживаемости не
достигнута, 1-летняя ОВ – 82%. Скоро узнаем, приведут ли эти данные к
тому, что мы начнем лечить рак почки комбинацией пембролизумаба и
ленватиниба вне зависимости от гистологического подтипа опухоли.
В этом же контексте можно упомянуть еще одно исследование – ретроспективную работу по лечению
несветлоклеточного рака почки, проведенную с помощью анализа базы
данных IMDC (n=532). Авторы работы сфокусировали свое внимание на
проблеме лечения несветлоклеточного рака почки с саркоматоидными
чертами опухоли и эффективности
применения иммуноонкологических режимов лечения в данной категории пациентов. По результатам
исследования у пациентов с саркоматоидными подтипами опухоли
применение иммуноонкологических
режимов лечения позволяло достоверно повысить частоту объективного ответа на терапию (34,5% против
10,9% на фоне монотерапии антиVEGF препаратами; p=0,006), а также общую выживаемость пациентов
(медиана не достигнута против 7,0
мес.; p<0,0001), в то же время среди
пациентов без саркоматоидных черт
опухоли эффективность иммуноонкологических режимов не отличалась от монотерапии анти-VEGF
препаратами [7]. Перефразируя слова советского плаката – «Требуйте
указания наличия или отсутствия
саркоматоидных черт в опухоли!».
Низкие дозы ниволумаба
в лечении рака почки:
ретроспектива из Индии
Иммунотерапия давно и прочно
обосновалась в лечении метастатического рака почки; например, в
соответствии с клиническими рекомендациями RUSSCO комбинации
иммуноонкологических и таргетных препаратов – стандарт лечения
пациентов в любой прогностической группе. Очень широко этот метод лечения применяется и при других онкологических заболеваниях
– и завоевывает все новые позиции.
В виде короткого абстракта наши
коллеги из Индии опубликовали результаты ретроспективного исследования (n=58) по оценке эффективности низких доз ниволумаба
при лечении рака почки. Исследование не было рандомизированным
– те пациенты, кто мог себе позволить получить ниволумаб в полной
дозе, получали его в полной дозе
(n=27), те, кто не мог, – в различных
режимах дозирования начиная с 40
мг каждые 2 недели (n=26). Большинство пациентов (81%) получали
ниволумаб в первой линии терапии,
наиболее часто используемыми ингибиторами тирозинкиназ были
ленватиниб (47%) и кабозантиниб
(34%). По результатам – достоверных различий в медиане ВБП между
группами пациентов выявлено не
было (17 мес. в группе низкой дозы
ниволумаба и 21 мес. в группе высокой дозы; p=0,75), в то же время
медиана ОВ была несколько выше в
группе низкой дозы (не достигнута
и 21 мес. соответственно; p=0,017)
[8].
Конечно, это исследование обладает массой ограничений: сумбурный
дизайн, ретроспективный характер,
небольшой размер выборки и так
далее. Но – оно чуть-чуть добавляет данных к той доказательной
базе, что используемые в настоящее
время дозы иммунотерпевтических агентов завышены и, проведя
соответствующие исследования,
мы сможем получить «большее за
меньшее» и повысить доступность
иммунотерапии.
Кабозантиниб после
прогрессирования
рака почки на фоне
иммунотерапии:
исследование реальной
клинической практики
Heng D. и коллеги представили в
виде постерного доклада результаты исследования реальной клинической практики по оценке эффективности терапии кабозантинибом
и другими тирозинкиназными ингибиторами (акситиниб, пазопаниб,
сунитиниб, ленватиниб + эверолимус) после прогрессирования рака
почки на фоне ранее проведенной
иммунотерапии (ниволумаб/ипилимумаб, ниволумаб или пембролизумаб). Крупное ретроспективное исследование – включено 783
пациента. По результатам исследования применение кабозантиниба
достоверно улучшало ответ на терапию – 62,5% по сравнению с 46,0%
в контрольной группе (p=0,0002),
но не влияло на общую выживаемость (медиана ОВ 19,2 и 19,1 мес.;
HR 1,05; p=0,735) и оказывало только пограничное влияние на время
до начала следующей линии терапии (будем считать суррогатом для
ВБП). Достаточно существенные
различия в частоте ответа, но которые не транслировались в выживаемость пациентов, – не проясняют
оптимальные подходы к лечению,
но могут быть важны для тех, у кого
есть симптомы опухолевого процесса.
Лучевая терапия на
первичную опухоль при
de novo метастатическом
раке предстательной
железы с малым объемом
метастатического
поражения: новые
данные из PEACE-1
Представлены новые данные из
рандомизированного исследования
III фазы PEACE-1. Ранее из этой работы мы узнали об эффективности
«триплета» АДТ, доцетаксела и абиратерона при de novo метастатическом раке предстательной железы,
сейчас нам представили результаты второй предзапланированной
первичной конечной точки – оценить влияние облучения первичной
опухоли на общую выживаемость
пациентов. Дизайн исследования
и подходы к его статистическому
анализу были специально спланированы для оценки этого аспекта
лечения. В исследовании приняло
участие 1172 пациента, медиана наблюдения составила 6,1 лет [9].
Что в результате? Проведение лучевой терапии на первичную опухоль
у пациентов не смогло улучшить результаты лечения пациентов, медиана ОВ составила 6,9 лет в группе без
лучевой терапии и 7,5 лет в группе
с ее проведением (HR 0,98; p=0,86).
Дополнительно были проанализированы результаты лечения в зависимости от применения абиратерона: группа пациентов, получавших
АДТ + абиратерон + лучевую терапию, характеризовалась наилучшими результатами выживаемости по
сравнению с остальными подгруппами пациентов, однако различия
в сравнении с группой абиратерона
не достигли статистической достоверности (HR 0,81; p=0,29).
В то же время облучение первичной
опухоли достоверно увеличивало
время до развития серьезных нежелательных явлений со стороны мочеполовой системы по сравнению с
пациентами, которые не получали
данный вид лечения (p=0,0006). На
мой взгляд, это можно имплементировать в рутинную клиническую
практику следующим образом: если
у пациента малый объем метастатического поражения и первичная
опухоль бессимптомная и не угрожает их появлением на момент начала лечения – проведение лучевой
терапии нецелесообразно, в остальных случаях – пользуемся.
Источники:
1. Pfister C, Gravis G, Flechon A, et al. Multicenter randomized phase III trial of dose-dense methotrexate, vinblastine, doxorubicin, and cisplatin (dd-MVAC) or gemcitabine and cisplatin (GC) as perioperative chemotherapy for muscle-invasive bladder cancer (MIBC): Overall survival (OS) data at 5 years in the GETUG/AFU V05 VESPER trial. JCO. 2023; 41 (17_suppl): LBA4507-LBA4507. doi:10.1200/ JCO.2023.41.17_suppl.LBA4507.
2. Pfister C, Gravis G, Fléchon A, et al. Randomized Phase III Trial of Dose-dense Methotrexate, Vinblastine, Doxorubicin, and Cisplatin, or Gemcitabine and Cisplatin as Perioperative Chemotherapy for Patients with Muscle-invasive Bladder Cancer. Analysis of the GETUG/ AFU V05 VESPER Trial Secondary Endpoints: Chemotherapy Toxicity and Pathological Responses. European Urology. 2021; 79 (2): 214-221. doi: 10.1016/j.eururo.2020.08.024.
3. Yohann Loriot, et al. Phase 3 THOR study: Results of erdafitinib (erda) versus chemotherapy (chemo) in patients (pts) with advanced or metastatic urothelial cancer (mUC) with select fibroblast growth factor receptor alterations (FGFRalt). Journal of Clinical Oncology. 2023 June 10. 41 (17_suppl): LBA4619-LBA4619.
4. Motzer RJ, Porta C, Eto M, et al. Final prespecified overall survival (OS) analysis of CLEAR: 4-year follow-up of lenvatinib plus pembrolizumab (L+P) vs sunitinib (S) in patients (pts) with advanced renal cell carcinoma (aRCC). JCO. 2023; 41 (16_suppl): 4502- 4502. doi: 10.1200/JCO.2023.41.16_ suppl.4502.
5. Rini BI, Plimack ER, Stus V, et al. Pembrolizumab plus axitinib versus sunitinib as first-line therapy for advanced clear cell renal cell carcinoma: 5-year analysis of KEYNOTE-426. JCO. 2023; 41 (17_suppl): LBA4501-LBA4501. doi: 10.1200/JCO.2023.41.17_suppl. LBA4501.
6. Lee CH, Gurney H, Atduev V, et al. First-line lenvatinib + pembrolizumab treatment across non-clear cell renal cell carcinomas: Results of the phase 2 KEYNOTE-B61 study. JCO. 2023; 41 (16_suppl): 4518-4518. doi: 10.1200/ JCO.2023.41.16_suppl.4518.
7. Labaki C, Bakouny Z, Lemelin A, et al. Efficacy of first-line (1L) immunotherapy (IO)-based regimens in patients with sarcomatoid and/or rhabdoid (S/R) metastatic non-clear cell renal cell carcinoma (nccRCC): Results from the International Metastatic Renal Cell Carcinoma Database Consortium (IMDC). JCO. 2023; 41 (16_suppl): 4519-4519. doi: 10.1200/JCO.2023.41.16_suppl.4519.
8. John AO, Georgy JTT, Joel A, et al. Nivolumab usage patterns combined with TKI for mRCC: Financial toxicity and clinical outcomes from self-paying patients in India–Is low dose an option when access is limited? JCO. 2023; 41 (16_suppl): e16544-e16544. doi: 10.1200/JCO.2023.41.16_suppl.e16544.
9. Bossi A, Foulon S, Maldonado
X, et al. Prostate irradiation in men
with de novo, low-volume, metastatic,
castration-sensitive prostate cancer
(mCSPC): Results of PEACE-1, a
phase 3 randomized trial with a 2x2
design. JCO. 2023; 41 (17_suppl):
LBA5000-LBA5000. doi: 10.1200/
JCO.2023.41.17_suppl.LBA5000.
НОВОСТИ ASCO 2023 / ОПУХОЛИ ГОЛОВЫ И ШЕИ
Автор: Болотина Лариса Владимировна
МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИЦ радиологии» Минздрава России,
доктор медицинских наук, доцент РАН, Москва
Прошедший конгресс ASCO 2023 в
разделе опухолей головы и шеи не
был ознаменован представлением
результатов исследований, способных изменить существующую клиническую практику. Несколько работ
обсуждались в рамках презентаций
и в последующих дискуссиях, однако
большее число исследований были
представлены на постерной сессии.
Ожидаемо многие материалы касались протоколов, проведенных китайскими и индийскими учеными.
Наиболее интересными и, возможно,
в ближайшее время признанными
целесообразными к включению в
клинические рекомендации, представляются несколько исследований,
посвященных назофарингеальному
раку.
Как и большинство протоколов, первое исследование, о котором хотелось бы упомянуть, было проведено
в Китае, являющемся эндемичным
регионом для рака носоглотки (РН),
в частности, ассоциированного с вирусом Эпштейна-Барр. Исследование III фазы охватило 240 больных
из 4 китайских центров, с местнораспространенным РН (T1-4N2-
3M0), которым исходно была проведена стандартная химиолучевая
терапия (ХЛТ): цисплатин 100 мг/
м2 в 1, 22, 43 дни + ЛТ 45-70 Гр за 33
фракции 5 дней в неделю, 7 недель.
После завершения ХЛТ пациенты
рандомизировались на 2 группы в зависимости от варианта последующей
адъювантной химиотерапии (АХТ).
Одна группа получала исторически
устоявшийся режим PF (5-фторурацил 1 г/м2 в 1-4 дни + цисплатин
80 мг/м2 в 1 день, 1 раз в 4 недели, 3
курса), а экспериментальная группа – комбинацию GC (гемцитабин
1 г/м2 в 1, 8 дни + цисплатин 80 мг/
м2 в 1 день, 1 раз в 3 недели, 3 курса).
Медиана наблюдения за больными
составила 40 месяцев. При анализе
3-летней выживаемости без прогрессирования (ВБП) было отмечено
превосходство в группе, получавшей
схему GC: 83,9% против 71,5% (HR
0,54). Одновременно авторами в этой
группе был зафиксирован более высокий уровень гематологической токсичности: лейкопения – 52% против
29%, нейтропения – 32% против 16%.
Частота развития мукозитов и потери слуха оказалась сопоставимой
между группами: 23% против 28% и
5% против 9%. В заключении авторы
пришли к выводу о том, что комбинация гемцитабин/цисплатин является
более эффективной при проведении
АХТ местнораспространенного РН
после ХЛТ [1].
Обсуждая представленные данные,
д-р Glenn Hanna из Dana-Farber
Cancer Institute, Бостон, США, сделал акцент на том, что сложность
интерпретации результатов состоит
в том, что уже существуют данные
об эффективности индукционной
ХТ (ИХТ), а также индукционной
химиоиммунотерапии (ИХИТ) у
этой популяции больных, что привело к снижению интереса к изучению
пост-ХЛТ. Все большее число исследователей нацелены на изучение
именно ИХТ/ИХИТ с возможностью
проведения на втором этапе, в том
числе, только ЛТ (вместо ХЛТ).
Еще одна работа – JUPITER-02, касающаяся лечения РН, – также была
представлена китайскими коллегами [2]. Это рандомизированное,
двойное слепое исследование 3 фазы
по сравнению торипалимаба (антиPD1) против плацебо в комбинации
с гемцитабином и цисплатином в
первой линии терапии рецидивного
или метастатического рака носоглотки. Первое представление результатов состоялось на конгрессе ASCO
2021. В текущем году были опубликованы финальные данные в отношении общей выживаемости. Пациенты с рецидивным/метастатическим
РН (n=289) были рандомизированы
(1:1) для введения торипалимаба
240 мг (n=146) или плацебо (n=143)
в сочетании с химиотерапией GC
каждые 3 недели, максимально до 6
циклов, с последующей монотерапией торипалимабом или плацебо 1
раз в 3 недели до прогрессирования
заболевания, непереносимой токсичности или завершения 2-летнего
срока лечения. Факторами стратификации были статус ECOG (0 против
1) и характер заболевания (рецидив
против первично метастатического
РН). Первичной конечной точкой
была ВБП по оценке независимого
наблюдательного комитета. Вторичные конечные точки включали ОВ и
безопасность.
Торипалимаб в сочетании с химиотерапией гемцитабин-цисплатин (GP)
продемонстрировал значительное
улучшение ВБП по сравнению с одной химиотерапией в качестве режима первой линии, о чем было доложено в 2021 году (медиана ВБП 21,4
против 8,2 мес.; HR 0,52; p<0,0001).
К текущему году медиана наблюдения составила 30,1 мес. Достоверное
улучшение ОВ наблюдалось в группе
торипалимаба по сравнению с группой плацебо: HR 0,63 (95% ДИ 0,45-
0,89), p=0,0083. Медиана ОВ не была
достигнута в группе торипалимаба
и составила 33,7 мес. в группе плацебо. Показатели выживаемости через 2 и 3 года оказались равны 78,0%
против 65,1% и 64,5% против 49,2%
соответственно. Преимущество от
добавления торипалимаба было отмечено почти у всех участников,
включая подгруппы как с высокой,
так и с низкой экспрессией PD-L1 (на
опухолевых или иммунных клетках).
Никаких новых сигналов безопасности в группе торипалимаба после
промежуточного отчета выявлено не
было. Частота нежелательных явлений (НЯ) ≥3 степени (89,7% против
90,2%) и летальных исходов (3,4%
против 2,8%) была одинаковой в двух
группах. Таким образом, авторы сделали выводы о том, что добавление
торипалимаба к химиотерапии GС
в качестве терапии 1 линии лечения
рецидивного/метастатического рака
носоглотки обеспечило клинически
значимое увеличение ОВ и ВБП при
управляемом профиле безопасности. Эти результаты подтверждают
целесообразность использования
торипалимаба в сочетании с химиотерапией в клинической практике в
качестве нового стандарта лечения.
Еще один протокол китайских исследователей изучал целесообразность
добавления анти-PD1 агента синтилимаба на этапе ИХТ и последующей
ХЛТ при местнораспространенном
РН стадии III-IVA [3]. Из 9 центров
были включены 245 пациентов, распределенных в 2 группы: одна получала 3 курса ИХТ гемцитабином и
цисплатином с последующей ХЛТ
с цисплатином. Вторая группа на
протяжении аналогичного лечения
получала параллельно синтилимаб,
дополнительно 6 введений которого продолжались на адъювантном
этапе. Первичной целью была бессобытийная выживаемость. При медиане наблюдения за больными в 42
мес. 3-летняя БСВ составила 86,1%
в группе синтилимаба и 76% в группе стандартного лечения (HR 0,59;
p=0,019). В протоколе дополнительно изучались биомаркеры, способные предсказать целесообразность
добавления иммунотерапии к стандартной лечебной схеме. Исследовались такие маркеры, как третичные
лимфоидные структуры (TLS), PDL1 и экспрессия генов. Оказалось,
что выигрыш от добавления синтилимаба был отмечен у пациентов
с TLS (HR 0,18; 95% ДИ 0,04-0,81;
p=0,011) в отличие от участников без
наличия TLS (HR 0,94; 95% ДИ 0,50-
1,76; p=0,85). Токсические реакции
ТР 3-4 степеней несколько чаще регистрировались в экспериментальной группе (74,2% против 65,4%), в
том числе иммуноопосредованные
(9,6% против 0,9%). Авторы приходят к заключению о том, что добавление синтилимаба к стандартной
ИХТ с последующей ХЛТ приводит
к достоверному увеличению БСВ и
обладает благоприятным профилем
токсичности. Вероятнее всего, TLS
может рассматриваться как предиктор эффективности синтилимаба.
Интерес научного комитета вызвало
исследование и д-ра Glenn Hanna,
результаты которого были представлены на устной постерной сессии [4].
В рамках представленного протокола
изучалась эффективность первого
в своем классе биспецифического
белка BCA101 к EGFR и TGFβ, обладающего модулирующим действием. Ранее он был изучен как в
монотерапии, так и в комбинации с
пембролизумабом у пациентов с распространенными солидными ЗНО.
На конгрессе были представлены
промежуточные данные по лечению
BCA101 + пембролизумаб (BCA101
1500 мг в/в в 1, 8, 15 дни, пембролизумаб 200 мг в/в в 1 день 3-недельного
цикла) расширенной когорты пациентов с рецидивирующим/метастатическим плоскоклеточным раком
головы и шеи с PD-L1 CPS≥1 в первой линии. Среди 18 пациентов ЧОО
составила 44%, а частота контроля
заболевания (ЧКЗ) – 67%. Важным
представляется то, что ответы были
зафиксированы у ВПЧ-негативных
пациентов (ЧОО 56%). Длительность
достигнутого ответа превысила 6 месяцев. ТР наблюдались у 20% пациентов, среди нежелательных явлений
(НЯ) преобладала анемия, наблюдались и характерные для анти-EGFR
агентов кожные реакции. Авторы
планируют продолжить исследования в данном направлении с учетом
полученных высоких результатов и в
привлекательном режиме с полным
исключением цитостатиков.
Следующим исследованием, обсуждаемым экспертами, было исследование DEPEND, проведенное Чикагским университетом
[5]. Дизайн включал возможность
деэскалации ХЛТ с цисплатином
в зависимости от эффективности
ИХИТ. На первом этапе пациенты
с местнораспространенным ВПЧнегативным, ВЭБ-негативным плоскоклеточным раком головы и шеи
(включая РН и рак околоносовых
пазух) получали 3 курса ХИТ ниволумаб + карбоплатин + паклитаксел. Для больных, опухоль которых
регрессировала более чем на 50%,
предусматривалось проведение на
втором этапе ХЛТ в меньшей дозе –
66 Гр. Остальные пациенты получали
ХЛТ в стандартной дозе 70-75 Гр и на
регионарные зоны 45-50 Гр. После завершения этапа ХЛТ все пациенты
получали 9 циклов поддерживающей
ИТ ниволумабом. Несмотря на то,
что медиана наблюдения составила
лишь 14 месяцев, а в исследовании
было всего 36 пациентов, результаты
представляются весьма интересными. Частота достижения глубокого
ответа составила 54%, что позволило этим пациентам получить более
низкую дозу ХЛТ. На данном сроке
наблюдения 2-летняя ВБП (79%) и
ОВ (86%) выглядят в группе деэскалации многообещающими. Таким
образом, авторы предполагают, что
достигнутый ответ на ИХИТ может
служить фактором стратификации
при выборе объема ХЛТ у больных
с ВПЧ-отрицательным ПРГШ в клинической практике.
Группой европейских авторов были
представлены результаты интересного исследования 2 фазы, посвященного изучению возможностей
применения в 1 линии терапии адаптированного режима ХИТ у больных рецидивным/метастатическим
ПРГШ, не подходящих для цисплатин-содержащей терапии [6]. Шестьдесят четыре участника (34,4% ранее
получали цисплатин, максимальный
возраст 90 лет) независимо от уровня экспрессии PD-L1 (у 37,3% PD-L1
CPS≥20) получали 4 цикла ХТ (карбоплатин AUC2 + паклитаксел 80
мг/м2 в 1, 8 и 15 дни) и дурвалумаб
в дозе 1500 мг каждые 4 недели в течение максимум 12 месяцев. Первичной конечной точкой являлась ОВ
через 12 месяцев. Медиана наблюдения составила 27,1 мес. Авторам
удалось получить впечатляющие результаты, превзошедшие показатель
РКИ KN048: медиана ВБП составила
7,0 мес., медиана ОВ – 18 мес., а показатель 2-летней ОВ достиг 45%, ЧОО
– 71% (у 7 зафиксирован ПО). Медиана длительности достигнутого ответа составила практически полгода
(5,9 мес.). НЯ фиксировались у всех
пациентов (связанные с дурвалумабом – 84,4%, с ХТ – 96,9%), однако реакции G≥3 отмечены только у 20,3%
пациентов (среди них нейтропения
составила 54,7%). Прекратить лечение в связи с ТР пришлось лишь 3,1%
участников. Авторы сделали вывод о
том, что изученная комбинация оказалась высокоэффективной у больных, не подлежащих стандартной
химиотерапии на основе цисплатина,
и может быть хорошей опцией в качестве терапии 1 линии у пациентов
с плоскоклеточным раком головы и
шеи. Гематологическая токсичность,
по мнению исследователей, может
быть снижена путем использования
Г-КСФ. Запланировано проведение
III фазы.
Очередная оригинальная работа
была представлена индийскими авторами из Tata Memorial Hospital [7].
Исследователи обосновывают актуальность спланированного и проведенного ими исследования 3 фазы
тем, что в странах с ограниченными
экономическими ресурсами использование режимов лекарственной
терапии, указанных в клинических
рекомендациях, возможно только
ограниченному числу больных. В
связи с этим авторы сравнили эффективность NCCN-утвержденных
схем второй линии при ПРГШ, которые врачи выбирали по своему
усмотрению, с исследовательской
триплетной метрономной терапией.
Из 16 медицинских центров были
набраны 114 пациентов с платинорефрактерным ПРГШ, разделенные
на 2 группы. Исследовательская группа (n=55) получала лечение по схеме
метотрексат 9 мг/м2 внутрь еженедельно + целекоксиб (НПВП, ингибитор ЦОГ-2) 200 мг внутрь 2 раза
в день ежедневно + эрлотиниб 150
мг внутрь ежедневно. Вторая группа
(контрольная, n=59) получала терапию по выбору врача (ТВВ), среди
которой были ниволумаб, пембролизумаб, цетуксимаб, таксаны, афатиниб, 5-ФУ/капецитабин. Первичной
конечной точкой была выбрана ОВ.
Среди вторичных целей оценивалась
ВБП. Медиана времени наблюдения
составила 258 дней. В результате медиана ОВ оказалась статистически
достоверно выше в экспериментальном рукаве (181 день против 123
дней; HR 0,58; р=0,003). Показатель
6-месячной ОВ составил 52,9% против 14,8%. Медиана ВБП достигла
120 дней против 70 дней в группе метрономной и стандартной терапии
соответственно (HR 0,5; р=0,001).
Исследователи заключили, что данное исследование 3 фазы позволило
продемонстрировать преимущество
триплетной метрономной терапии
в отношении ВБП и ОВ в качестве 2
линии над NCCN-утвержденными
режимами лекарственной терапии.
Однако представляется маловероятным, что разработанная схема
сможет быть предложена в качестве
альтернативы режимов, доказавших
свою эффективность в рамках многоцентровых международных исследований, включенных в клинические
рекомендации ведущих профессиональных сообществ.
Кроме более привычных для клинической практики классов препаратов в лечении ПРГШ, на конгрессе ASCO прозвучали данные двух интересных исследований по возможностям применения вакцин в лечении этой патологии. Были обновлены данные об индивидуализированной неоантигенной противораковой вакцине TG4050, а также озвучены первые клинические данные о комбинации ISA101b (peltopepimut-S) с анти-PD-1 агентом цемиплимабом.
Вакцина TG4050 в РКИ фазы I исследовалась у пациентов с ВПЧотрицательным ПРГШ III-IV стадий
после проведенного радикального
хирургического вмешательства и завершения адъювантной ХЛТ (n=15)
[8]. Контрольная группа (n=16) после
завершения радикального лечения
находилась под динамическим наблюдением. Вакцина изготовлялась
для каждого пациента на основе
определения 30 различных антигенов, выделенных с помощью NGS.
Исходно препарат вводился еженедельно на протяжении 6 недель (период индукции), далее 1 раз в 3 недели
до общей длительности 1 год. Медиана наблюдения за основной группой
составила 9,2 мес., а за группой контроля – 7,6 мес. Авторы отметили,
что у всех пациентов, получавших
TG4050, развился специфический
иммунный ответ (несмотря на то,
что исходно пациенты имели нефункциональные иммунные клетки
или низкий/отрицательный уровень
экспрессии PD-L1), что было подтверждено результатами дополнительного иммунологического тестирования, и на момент представления
данных у них сохранялась ремиссия.
В группе контроля подтвержденный
рецидив был зафиксирован у 2 больных. О ТР сообщено не было, авторы
лишь упоминают о том, что вакцина
хорошо переносится и позволяет индуцировать Т-клеточный ответ при
«холодных» опухолях. Алессандро
Рива, председатель и главный исполнительный директор компанииразработчика, считает, что TG4050
демонстрирует свой потенциал для
продления ремиссии пациентов после операции, и полученные данные
являются основой для ускоренного внедрения этой инновационной
терапии в рекомендации по адъювантному лечению ВПЧ-негативного
ПРГШ. Пока же запланировано проведение исследования II фазы, которое может быть начато во второй половине 2023 года.
Многообещающие с точки зрения
авторов результаты по применению
комбинации ISA101b и цемиплимаба были получены в исследовании 2
фазы при лечении 26 пациентов с рецидивирующим и/или метастатическим раком ротоглотки, положительным статусом вируса папилломы
человека типа 16 (ВПЧ16), у которых
опухоль прогрессировала в течение 6
месяцев иммунотерапии 1 или 2 линии пембролизумабом или ниволумабом [9]. ISA101b (peltopepimut-S)
представляет собой вакцину против
ВПЧ-специфических онкобелков Е6/
Е7 и обладает способностью при введении вместе с цемиплимабом индуцировать специфическую экспансию
Т-клеток, нацеленных на ВПЧ16.
Препарат вводится подкожно 100
мкг/пептид в 1, 29 и 50 дни с цемиплимабом внутривенно 350 мг 1 раз
в 3 недели на протяжении 6 месяцев.
При отсутствии прогрессирования
далее продолжают только введение
вакцины. При медиане наблюдения
16,2 недели у 11,5% испытуемых был
зафиксирован ЧО, у 50% – стабилизация и у 30,8% – прогрессирование
заболевания. Среди НЯ 3 степени
отмечались эритремия в месте введения вакцины и диарея. Медиана
ОВ составила 8,1 месяца. Авторы
считают, что уникальной особенностью изученной комбинации является возобновление противоопухолевого эффекта анти-PD1-терапии
при добавлении терапевтической
вакцины. Еще в сентябре 2021 года
Управление по санитарному надзору
за качеством пищевых продуктов и
медикаментов США (FDA) предоставило ISA101b обозначение Fast Track
для одобрения в лечении рецидивирующих/метастатических HPV16-
положительных орофарингеальных
карцином.
Источники:
1. Lin-Quan Tang. Concurrent chemoradiotherapy followed by adjuvant cisplatin-gemcitabine versus cisplatin-5-fluorouracil chemotherapy for N2-3 nasopharyngeal carcinoma: A multicentre, open-label, randomised, controlled, phase 3 trial. 2023 ASCO Annual Meeting. Abstract 6000.
2. Hai-Qiang Mai. Final overall survival analysis of JUPITER-02: A phase 3 study of toripalimab versus placebo in combination with gemcitabine and cisplatin as first-line treatment for recurrent or metastatic nasopharyngeal carcinoma (NPC). 2023 ASCO Annual Meeting. Abstract 6009.
3. Jun Ma. PD-1 blockade with sintilimab plus induction chemotherapy and concurrent chemoradiotherapy (IC-CCRT) versus IC-CCRT in locoregionally-advanced nasopharyngeal carcinoma (LANPC): A multicenter, phase 3, randomized controlled trial (CONTINUUM). 2023 ASCO Annual Meeting. Abstract 6002.
4. Glenn J. Hanna. Dose expansion results of the bifunctional EGFR/TGFβ inhibitor BCA101 with pembrolizumab in patients with recurrent, metastatic head and neck squamous cell carcinoma. 2023 ASCO Annual Meeting. Abstract 6005.
5. Ari Rosenberg. Neoadjuvant nivolumab, paclitaxel, and carboplatin followed by response-stratified chemoradiation in locoregionally advanced HPV negative head and neck squamous cell carcinoma (HNSCC): The DEPEND trial. 2023 ASCO Annual Meeting. Abstract 6007.
6. Jerome Fayette. Results of the multicenter phase II FRAIL-IMMUNE trial evaluating the efficacy and safety of durvalumab combined with weekly paclitaxel carboplatin in first-line in patients (pts) with recurrent/metastatic squamous cell carcinoma of the head and neck (R/M SCCHN) not eligible for cisplatin-based therapies. 2023 ASCO Annual Meeting. Abstract 6003.
7. Rushabh Kiran Kothari. Phase 3 randomized study for evaluation of physician choice Rx and triple metronomic as second-line therapy in head and neck cancer (CRSF 2021- HN-001). 2023 ASCO Annual Meeting. Abstract 6004.
8. Christian H.H. Ottensmeier. Safety and immunogenicity of TG4050: A personalized cancer vaccine in head and neck carcinoma. 2023 ASCO Annual Meeting. Abstract 6082.
9. Anthony H Kong. Phase 2 study
of ISA101b (peltopepimut-S) and
cemiplimab in patients with advanced
HPV16+ oropharyngeal cancer who
failed anti-PD1 therapy. 2023 ASCO
Annual Meeting. Abstract 6028.
НОВОСТИ ASCO 2023 / НОВЫЕ ДАННЫЕ ПО ЛЕЧЕНИЮ МЕЛАНОМЫ
Автор: Проценко Светлана Анатольевна
ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России,
доктор медицинских наук, Санкт-Петербург
На ASCO 2023 было представлено
достаточно большое количество исследований по эффективности противоопухолевой терапии как ранних, так и распространенных стадий
меланомы.
Адъювантная терапия
меланомы кожи
Jason J. Luke представил финальные результаты выживаемости без отдаленных метастазов при применении пембролизумаба в адъювантном лечении у пациентов IIB/C стадии меланомы кожи в исследовании KEYNOTE-716. В исследовании сравнивались две группы: первая – с использованием пембролизумаба (487 пациентов) и вторая группа - плацебо (489 пациентов). Промежуточные анализы KEYNOTE-716 показали, что адъювантная терапия пембролизумабом улучшает выживаемость без отдаленных метастазов и рецидивов заболевания [1]. При медиане наблюдения 39,4 месяца 320 пациентов в группе пембролизумаба завершили курс лечения, а 163 – прекратили лечение, в группе плацебо 367 пациентов завершили лечение, а 119 досрочно его прекратили. 36-месячная выживаемость без отдаленных метастазов была значительно выше в группе пембролизумаба по сравнению с группой плацебо, составив 84,4% против 74,7% соответственно, а коэффициент риска (ОР) составил 0,59 (рис.1).
Рисунок 1.
KEYNOTE-716: выживаемость без отдаленных метастазов (DMFS)
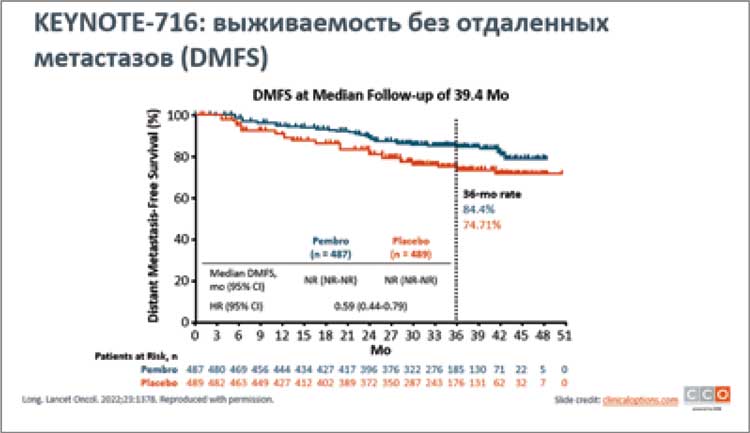
Применение пембролизумаба ассоциировалось с преимуществами выживаемости без отдаленных метастазов у пациентов со стадиями IIB и IIC (ОР 0,62 и 0,57 соответственно), хотя различия между группами были незначительными; лечение оказалось эффективным во всех обследованных подгруппах. Обновленные анализы безрецидивной выживаемости (БРВ) были аналогичными: показатели БРВ за 39,4 месяца составили 76,2% для группы пембролизумаба и 63,4% для группы плацебо (ОР 0,62) (рис.2).
Рисунок 2.
KEYNOTE-716: безрецидивная выживаемость (RFS).
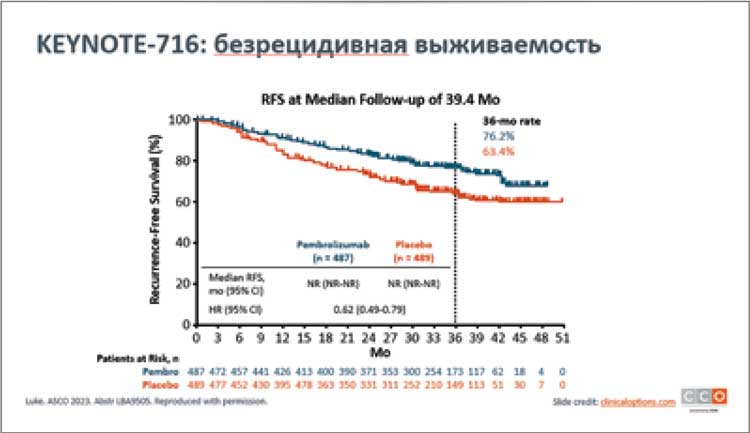
Преимущество
пембролизумаба отмечено во всех
обследованных подгруппах. Никаких
новых сигналов безопасности зарегистрировано не было. Финальный анализ показателей выживаемости без
отдаленных метастазов подтверждает, что пембролизумаб является стандартной адъювантной терапией для
пациентов с IIB/C стадией меланомы.
Анализ биомаркеров исследования
KEYNOTE-716 находится на рассмотрении и будет представлен позднее.
На ASCO 2023 заявлено о новом исследовании с применением таргетной
терапии энкорафениб + биниметиниб в адъювантном режиме у пациентов с IIB/C стадией и наличием
мутации BRAF V600 [2]. Энкорафениб в комбинации с биниметинибом является хорошо переносимым
и эффективным вариантом лечения,
обеспечивающим высокие показатели безрецидивной и общей выживаемости при неоперабельной или
метастатической меланоме. Акцент
перенесен на раннюю стадию заболевания с целью предотвращения
рецидива. Известно, что 18% пациентов со стадией IIB и 25% пациентов со
стадией IIC умирают из-за меланомы
в течение 10 лет после постановки
диагноза [3]. Для таких пациентов
в настоящее время одобрена только
иммунотерапия. Существует потребность в большем количестве вариантов лечения заболевания II стадии с
мутацией BRAF. Авторами сообщается об исследовании COLUMBUS-AD
(NCT05270044), которое представляет собой международное рандомизированное, плацебо-контролируемое,
тройное слепое многоцентровое исследование III фазы, в котором будет
оценена эффективность комбинации
энкорафениб + биниметиниб в сравнении с плацебо у пациентов с резецированной меланомой IIB/C стадии
и наличием мутации в гене BRAF
V600. Будет зарегистрировано примерно 815 пациентов. Более 170 центров из 26 стран мира примут участие
в исследовании, проводимом в сотрудничестве с Европейской организацией по исследованию и лечению
рака (EORTC). Пациенты будут получать энкорафениб + биниметиниб
или плацебо в течение 12 месяцев или
до рецидива заболевания. Основной
целью исследования является оценка
эффективности комбинации энкорафениб+ биниметиниб для увеличения БРВ. Второстепенными целями
являются сравнение выживаемости
без отдаленных метастазов (DMFS), общей выживаемости (OВ), качества жизни, связанного со здоровьем
(QoL), а также безопасности и переносимости между двумя группами, а
также предоставление дополнительных фармакокинетических данных.
COLUMBUS-AD является первым
рандомизированным исследованием
III фазы для оценки адъювантной
таргетной терапии BRAF/MEK ингибиторами при меланоме IIB/C стадии.
Перспективным направлением являются исследования с применением комбинированной иммунотерапии, включая персонализированную противоопухолевую вакцину на основе мРНК. Adnan Khattak на ASCO 2023 г. представил первый анализ выживаемости без отдаленных метастазов (DMFS) в открытом рандомизированном исследовании II фазы mRNA4157-P201/KEYNOTE-942, в котором сравнивались комбинация мРНК4157/V940 + пембролизумаб (n=107) и монотерапия пембролизумабом (n=50) по поводу резецированной меланомы высокого риска IIIB/C/D и IV стадии [4]. V940 - это новая персонализированная противоопухолевая вакцина на основе мРНК, которая кодирует до 34 опухолевых неоантигенов, специфичных для пациента. Предыдущие отчеты показывают, что комбинированная терапия V940 + пембролизумаб связана со значительным увеличением БРВ по сравнению с монотерапией пембролизумабом (18-месячная БРВ 78,6% против 62,2%, ОР 0,56). Комбинированная терапия была связана со значительным улучшением показателей DMFS по сравнению с монотерапией, при этом показатели DMFS за 18 месяцев составили 91,8% против 76,8% соответственно (ОР 0,347, р=0,0063) (рис.3).
Рисунок 3. Исследование II фазы KEYNOTE-942.
Кривые выживаемости без отдаленных метастазов

Несмотря на небольшое количество
событий в каждой группе (9/107 в
группе комбинированной терапии,
12/50 в группе монотерапии), можно
предположить, что добавление V940
к адъювантной иммунотерапии задерживает отдаленные рецидивы.
Предварительный анализ циркулирующей опухолевой ДНК (ctDNA)
позволяет предположить, что отрицательный статус ctDNA связан с
преимуществами DMFS для обеих
групп лечения, но в большей степени для комбинированной группы.
мРНК-4157-P201/KEYNOTE-942 является первым рандомизированным
исследованием, демонстрирующим
взаимосвязь между применением
индивидуализированной неоантигенной вакцины со значительным
улучшением показателей БРВ и
DMFS. Комбинация неоантигенной
вакцины и пембролизумаба показала
более высокую показатели выживаемости по сравнению со стандартным
лечением только пембролизумабом.
Исследование III фазы для подтверждения этих результатов у пациентов с
резецированной меланомой высокого риска начнется в ближайшем будущем, и планируются исследования,
включающие дополнительные типы
опухолей.
Неоадъювантная терапия
меланомы кожи
Irene L.M. Reijers представлен анализ трехлетних результатов исследований PRADO и OpACIN-neo для определения преимуществ, связанных с хирургическим вмешательством и неоадъювантной терапией у пациентов с меланомой III стадии. Исследование OpACIN-neo (n=86) отличалось универсальным подходом, в рамках которого пациенты получали неоадъювантно ниволумаб + ипилимумаб (nivo + ipi) с последующей лимфодиссекцией (TLND) без адъювантной системной терапии, хотя некоторые пациенты получали адъювантную лучевую терапию. Исследование PRADO (n=99) отличалось персонализированным подходом, при котором лечение пациентов проводилось по-разному в зависимости от патоморфологического ответа. Пациенты, у которых был достигнут значительный патологический ответ (MPR; жизнеспособная опухоль <=10%) после неоадъювантной nivo + ipi, не проходили TLND и адъювантную терапию, в то время как пациенты, у которых был достигнут частичный патологический ответ (pPR) или отсутствие ответа (pNR), подвергались TLND и адъювантной системной терапии, причем некоторые пациенты получали адъювантную лучевую терапию. Исходные характеристики и частота патоморфологических реакций были сопоставимы для обеих когорт. Хирургическое вмешательство не повлияло на результаты выживаемости среди пациентов с MPR, перенесших TLND (исследование OpACIN-neo; n=53), по сравнению с теми, кто не получал TLND (исследование PRADO, n=59), при этом показатели БРВ составили 96% и 93% соответственно, и показатели выживаемости без отдаленных метастазов (DMFS) составили 98% в обеих группах (рис.4).
Рисунок 4. Исследование II фазы KEYNOTE-942. Кривые выживаемости без отдаленных метастазов
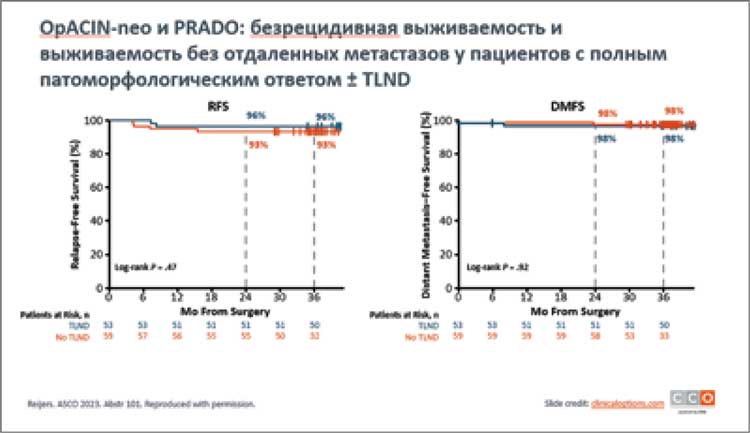
Ни один из пациентов в этих группах не получал адъювантную терапию, что позволяет предположить, что адъювантная терапия может быть излишней для пациентов, достигших MPR. Проведение адъювантной терапии ассоциировалось с улучшением выживаемости среди пациентов с pNR: 36-месячная БРВ составила 64% у пациентов, которые получали адъювантную системную терапию (n=17) по сравнению с 36% у пациентов, которые не получали адъювантную системную терапию (n=17), и 36-месячная DMFS составила 70% по сравнению с 52% соответственно (рис.5).
Рисунок 5. Исследование II фазы KEYNOTE-942. Кривые выживаемости без отдаленных метастазов

Предварительные данные, полученные в небольших группах пациентов,
получавших адъювантную терапию
ниволумабом (n=7), по сравнению
с пациентами, получавшими адъювантную таргетную терапию дабрафенибом/траметинибом (n=10),
позволяют предположить, что иммунотерапия может быть связана с
лучшими показателями выживаемости пациентов с pNR. Адъювантная
лучевая терапия также была связана
с улучшением выживаемости среди
пациентов с pNR, которые не получали адъювантную терапию, хотя
размеры выборки для этих групп
были очень малы. Полученные данные указывают на то, что пациентам
с выраженным патологическим ответом на неоадъювантную блокаду
иммунных контрольных точек может не потребоваться применение
TLND и адъювантной системной
терапии для достижения положительных результатов выживаемости.
Для пациентов, которые не ответили
на неоадъювантную иммунотерапию
ингибиторами контрольных точек
иммунного ответа, адъювантная системная терапия улучшит показатели
выживаемости, и адъювантная блокада контрольных точек иммунного
ответа может обеспечить больше
преимуществ по сравнению с таргетной терапией. Этот анализ подтверждает практику персонализации
адъювантной терапии, основанной
на патоморфологическом ответе опухоли пациента на неоадъювантную
иммунотерапию, ограничивая терапию тем, что необходимо для долгосрочного контроля заболевания.
Таким образом, достижение полного
или почти полного патоморфологического ответа после проведенной
неоадъювантной терапии у пациентов с меланомой III стадии приводит
к высоким результатам БРВ и DMFS.
Дополнительная операция с полной
диссекцией лимфатических узлов у
этих пациентов практически не повлияла на результаты БРВ или DMFS.
Пациенты без 90% регресса опухоли
или отсутствием полного патологического регресса получат пользу от
последующей адъювантной системной терапии. Добавление лучевой
терапии не принесло явной пользы
к системной адъювантной терапии у
пациентов без 90% регресса или полного патологического ответа.
Исследования неоадъювантной
терапии меланомы продолжаются. Особенный интерес вызывают
возможности предоперационного
системного лечения пациентов с
меланомой слизистых. Результаты исследования NeoPlus II фазы неоадъювантной комбинированной терапии
ленватиниб + пембролизумаб при
резектабельной меланоме слизистых
представлены китайскими учеными.
По состоянию на декабрь 2022 года
было зарегистрировано 19 пациентов
(из них 14 женщин) с медианой наблюдения 49 недель (95% ДИ, 38--60).
Средний возраст пациентов составил
57 лет. Первичные локализации опухоли включали: 8 – женские половые
органы, 6 – аноректальная область, 4
– органы головы и шеи, 1 – пищевод.
У 12 (63%) пациентов был локальный
процесс, у 7 (37%) – с наличием вовлеченных регионарных лимфатических узлов. Мутации KIT или NRAS
были представлены у 5 пациентов.
Больные получали ленватиниб по 20
мг в сутки и пембролизумаб по 200 мг
каждые 3 недели в течение 2 циклов
с последующим оперативным вмешательством. Терапия пембролизумабом после операции продолжалась до
15 циклов. Первичная конечная точка
исследования – полный патоморфологический ответ (pCR).
Операция проведена 15 пациентам. У 2 больных достигнут полный патоморфологический ответ (13,3 %), у 1 пациента – почти полный ответ (MPR), у 3 пациентов (40%) – частичный патоморфологический ответ (pPR); (6/15,95%ДИ 16-67%) (рис. 6,7).
Рисунок 6. Исследование NeoPlus: неоадъювантная ленватиниб + пембролизумаб при резектабельной меланоме слизистых. Частота патоморфологического ответа.
Рисунок 7. . Исследование NeoPlus: неоадъювантная ленватиниб + пембролизумаб при резектабельной меланоме слизистых. Клинические случаи.
Отказались от операции 4 пациента.
Медиана БРВ не достигнута. Данные
ИГХ исследования опухоли показали более высокую плотность CD8+
Т-клеток у ответивших на лечение
больных (р=0,04). Наиболее распространенными нежелательными явлениями были протеинурия (6,32%), гипотиреоз (6,32%), дисфония (5,26%), у
одного пациента (5%) было повышение АЛТ 3 степени. Токсичности 4-5
степени не наблюдалось.
Авторами сделаны следующие выводы: комбинация пембролизумаба
и ленватиниба в качестве неоадъювантной терапии при меланоме
слизистых является безопасным методом лечения. Предварительные
данные показали многообещающий
патоморфологический ответ с повышением инфильтрации CD8+
Т-клетками.
Необходимо дальнейшее изучение
неоадъювантного лечения при меланоме слизистых.
Терапия метастатической
меланомы
Современная противоопухолевая терапия метастатической меланомы за последние годы претерпела большие изменения. Именно с метастатических форм меланомы кожи началось применение современной таргетной и иммунотерапии. На сегодняшний день известны результаты длительной выживаемости пациентов на фоне комбинированной иммунотерапии ниволумаб + ипилимумаб (рис.8) [7].
Рисунок 8. Исследование Checkmate 067: ипилимумаб + ниволумаб при метастатической меланоме. Кривые общей выживаемости.
Однако остается проблема резистентности к иммунотерапии. Почему не
все пациенты отвечают на лечение и
как преодолеть эту проблему? Очевидно, что исследования, посвященные
резистентности к анти-PD1 терапии
заслуживают внимание клиницистов.
В исследовании RELATIVITY-047
комбинация ниволумаб плюс релатлимаб (NIVO + RELA) сравнивалась с
монотерапией ниволумабом (NIVO) у
нелеченых ранее пациентов с нерезектабельной меланомой. На ASCO 2023
были представлены дополнительные
результаты 2-летнего наблюдения [8].
В результате рандомизации 355 пациентов получили ниволумаб + релатлимаб и 359 – только ниволумаб. Медиана наблюдения составила 25,3 месяца.
Результаты дополнительного наблюдения подтверждают преимущество
комбинации NIVO + RELA в сравнении с NIVO по показателям БРВ, ОВ,
частоте объективного ответа (ЧОO).
Также меланома-специфическая выживаемость (MSS) оказалась выше в
группе NIVO + RELA (медиана не достигнута) в сравнении с NIVO (46,6
мес.). Данные представлены в таблице
1 и на рис.1,2.
Последующую системную терапию
получили 131 (36,9%) пациент в группе NIVO + RELA and 136 (37,9%) – в
группе NIVO. Частота осложнений,
приведших к прекращению терапии, составила 17,2% и 8,6% соответственно. Осложнения 3-4 степени,
связанные с лечением, наблюдались у
78 (22,0%) пациентов в группе NIVO
+ RELA и у 43 (12,0%) – в группе
NIVO, отмечено 6 смертельных случаев (NIVO + RELA, n = 4; NIVO, n
= 2). Новых осложнений, связанных
с лечением, со времени последнего
анализа среза данных не отмечено.
Комбинированная иммунотерапия с применением ингибиторов
контрольных точек ниволумаб +
ипилимумаб и ниволумаб + релатлимаб одобрены в качестве возможных опций лечения первой линии
для пациентов с прогрессирующей
меланомой на основе результатов
RELATIVITY-047 (NIVO + RELA против NIVO) и CheckMate 067 (NIVO
+ IPI или NIVO против IPI) исследований. Препарат релатлимаб не зарегистрирован в РФ, ожидается его
регистрация. Прямого исследования
по сравнению этих комбинаций не
проводилось. На основании непрямого сравнения двух видов лечения
отмечено, что результаты эффективности были схожими, хотя тенденции
в пользу NIVO + IPI наблюдались в
определенных подгруппах (с наличием мутации в гене BRAF или повышенным более чем в два раза уровнем
лактатдегидрогеназы). Нежелательные явления 3-4 степени имели место
у 23% и 61% пациентов, получавших
NIVO + RELA и NIVO + IPI, соответственно; нежелательные явления
любой степени тяжести, приводящие
к отмене лечения, отмечались у 17%
и 40% пациентов соответственно.
Таким образом, непрямое сравнение
двух режимов лечения предполагает,
что применение в первой линии терапии комбинации NIVO + RELA может иметь сопоставимую эффективность и лучшую переносимость, чем
NIVO + IPI у пациентов с прогрессирующей меланомой (табл.2). Результаты следует интерпретировать с
осторожностью, учитывая различия
в дизайне исследования и изменения
в структуре лечения с течением времени [9].
Таблица 1.
RELATIVITY-047: комбинация ниволумаб плюс релатлимаб* (NIVO
+ RELA) против монотерапии ниволумабом. Показатели безрецидивной выживаемости (PFS), общей выживаемости (OS), частоты объективного ответа
(ORR), меланома-специфической выживаемости (MSS)

Таблица 2.
Эффективность первой линии терапии комбинаций ниволумаб +
релатлимаб (NIVO + RELA) против ниволумаб + ипилимумаб (NIVO + IPI)
при метастатической меланоме

В настоящее время исследуются новые анти-LAG3 моноклональные
антитела для лечения пациентов как
с метастатической, так и резектабельной меланомой. Мультицентровое
нерандомизированное открытое исследование I фазы комбинации антиLAG3 антитела fianlimab + cemiplimab
(анти-PD-1) показало положительные результаты при распространенной меланоме у нелеченных ранее
анти-PD-1/PD-L1 препаратами пациентов. Включено 98 больных, две
когорты (80 пациентов), не леченные
прежде анти-PD-1/PD-L1 терапией,
получали fianlimab + cemiplimab в
качестве первой или второй линии,
а третья когорта пациентов (18 человек) имели в анамнезе неоадъювантную или адъювантную терапию (не
ранее 6 месяцев после ее окончания).
Первичной конечной точкой была
ЧОО, которая составила 61%, включая 12% полных и 49% частичных
ответов [10]. Медиана длительности
ответа (DOR) не была достигнута,
медиана БРВ составила 15 месяцев
(рис.10).
Рисунок 9.
RELATIVITY-047: релатлимаб в комбинации с ниволумабом
у пациентов с метастатической меланомой. Кривые общей выживаемости
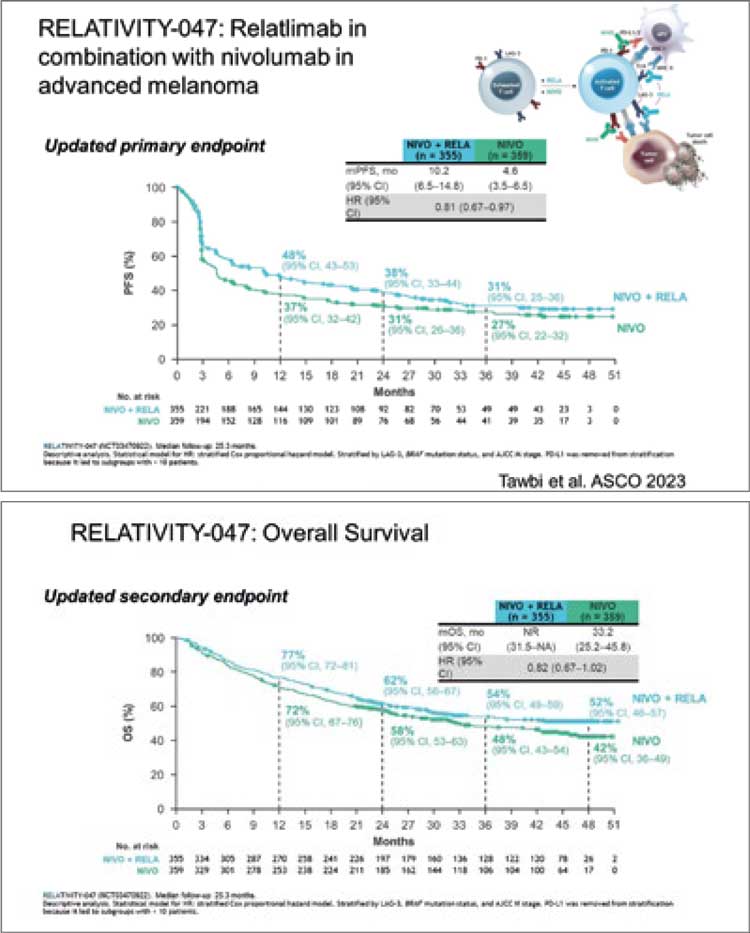
Рисунок 10.
RELATIVITY-047: релатлимаб в комбинации с ниволумабом
у пациентов с метастатической меланомой. Кривые общей выживаемости
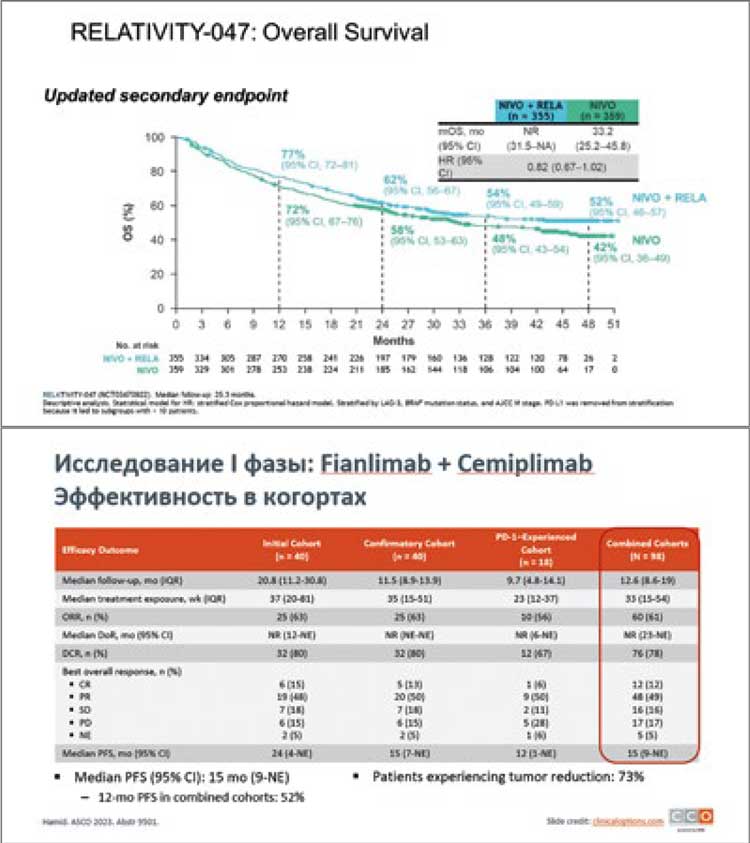
Ответы на лечение были сходными у
пациентов, которые ранее не получали адъювантную или неоадъювантную терапию, по сравнению с теми,
кто ее получал. ЧОО составила 60,9%
и 61,5% соответственно, медиана
DOR не была достигнута ни в одной
из групп, а медиана БРВ составила
13,3 месяца и 11,8 месяцев соответственно. Клинические преимущества
комбинированной терапии наблюдались во всех когортах пациентов
и при всех уровнях экспрессии PDL1 и LAG-3. Профиль безопасности
был аналогичен результатам предыдущих исследований монотерапии
cemiplimab и другими препаратами
против PD-(L)1. Иммуноопосредованные нежелательные явления отмечены у 65,3% пациентов, и 16,3%
пациентов прекратили лечение из-за
побочных эффектов. Таким образом, которых наблюдаются ИоНЯ в результате лечения ингибиторами контрольных точек иммунного ответа,
демонстрируют значительно лучшие
результаты по сравнению с пациентами без токсичности. Однако данные
о воздействии конкретных ИоНЯ в
настоящее время отсутствуют. Представлена реальная когорта пациентов
с метастатической меланомой, которые проходили лечение иммуноонкологическими препаратами в качестве
первой линии в период с 2014 по 2020
годы. Проведен анализ лечения 395
пациентов, 65,4% из которых получали моно анти-PD-1 терапию, 24,3%
- комбинированную иммунотерапию
и 10,3% пациентов - анти- CTLA-4
[11]. Средний возраст составил 68
лет (от 12 до 99 лет), 57% составляли
мужчины. Медиана периода наблюдения составила 24,5 месяца. ИоНЯ
любой степени тяжести наблюдались
у 72% (299) пациентов, у 26% (104)
больных отмечались ИоНЯ высокой
степени тяжести. Наиболее частыми
ИоНЯ были следующие осложнения:
дерматологические (n = 110, 27,8%),
витилиго (n = 48, 12,1%), ревматологические (n = 68, 17,2%), желудочнокишечные (n = 66, 16,7%) и эндокринные (n = 61, 15,4%). Развитие ИоНЯ
было связано со значительно более
длительной медианой БРВ (19,3 мес.
против 4,5 мес.; ОР 0,46, р=0,001) и
медианой ОВ (55 мес. против 16,9
мес.; ОР 0,44, р=0,001). Специфическими ИоНЯ, которые были достоверно связаны с улучшением выживаемости, были ревматологические
(ОР 0,34 для БРВ, p = 0,001; ОР 0,38
для OВ, p= 0,001), дерматологические
(ОР 0,58 для БРВ, p = 0,001; ОР 0,54
для OВ, p = 0,001), витилиго (ОР 0,30
для БРВ, p = 0,001; ОР 0,29 для OВ, p
= 0,001) и эндокринопатии (ОР 0,6
для БРВ, p = 0,01; ОР 0,52 для OВ, p =
0,001). Авторами сделан вывод о том,
что развитие ревматологических, витилиго и других дерматологических
заболеваний во время лечения ингибиторами контрольных точек коррелирует с заметным преимуществом
в выживаемости. Эти ИоНЯ могут
отражать гиперактивированный иммунный ответ и, таким образом, могут служить значимыми клиническими биомаркерами.
Подводя итоги, хочется отметить,
что несмотря на имеющиеся успехи в
лечении пациентов с меланомой, достаточно много вопросов остаются
нерешенными и, возможно, в этом
нам помогут дополнительные данные
проведенных клинических испытаний, результаты новых исследований
и, безусловно, фундаментальная работа наших экспериментаторов.
Источники указаны на сайте:
https://rosoncoweb.ru/news/oncology/2023/07/31/
ИССЛЕДОВАНИЕ SONIA СТАВИТ ПОД СОМНЕНИЕ НАЗНАЧЕНИЕ ИНГИБИТОРОВ CDK4/6 В ПЕРВОЙ ЛИНИИ ГОРМОНОТЕРАПИИ МЕТАСТАТИЧЕСКОГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ
Автор: С.А.Тюляндин
Председатель Российского общества клинической онкологии,
профессор, доктор медицинских наук, Москва
Для меня самым интересным докладом на прошедшем конгрессе ASCO
было представление исследования
SONIA, проведенное у больных метастатическим гормоночувствительным (HR+) HER2-негативным раком
молочной железы (РМЖ). Это академическое национальное исследование, инициированное голландскими
онкологами и профинансированное
голландским правительством, ставило цель определить оптимальное
с точки зрения эффективности, токсичности и экономики использование совместного применения гормонотерапии и ингибиторов CDK4/6.
Проведенные рандомизированные
исследования (PALOMA-2 с пальбоциклибом, MONALEESA-2 с рибоциклибом, MONARCH-3 с абемациклибом) убедительно свидетельствовали,
что комбинация ингибиторов ароматазы и CDK4/6 в первой линии достоверно и существенно увеличивает медиану времени до прогрессирования
(HR=0,54-0,58), а для рибоциклиба и
абемациклиба показано и достоверное увеличение продолжительности
жизни. На основании этого во все
клинические рекомендации, в том
числе и в практические рекомендации RUSSCO, было записано, что
при проведении первой линии гормонотерапии метастатических больных целесообразно использование
комбинации ингибиторов ароматазы
и CDK4/6. Однако это неизменно порождало вопрос о необходимости использования комбинации у всех больных в первой линии, предполагая что
существуют пациенты, которые будут
демонстрировать хороший и длительный противоопухолевый эффект
только на ингибиторах ароматазы и
которым можно назначить ингибиторы CDK/6 во второй линии.
Дизайном исследования SONIA предполагалась рандомизация всех больных для проведения первой линии гормонотерапии ингибиторами ароматазы или их комбинации с ингибиторами CDK4/6 (рис.1).
Рисунок 1.
Дизайн исследования SONIA

При прогрессировании больным, получившим
комбинацию, назначали фулвестрант,
получившим только ингибиторы ароматазы – комбинацию фулвестранта и
ингибиторов CDK4/6. Основным критерием эффективности была PFS2, т.е.
медиана времени от рандомизации до
прогрессирования на фоне второй линии гормонотерапии фулвестрантом.
Вторичными критериями были качество жизни, общая выживаемость
и экономическая эффективность. В
исследование разрешалось включать
пре- и постменопаузальных больных
с измеряемыми или оцениваемыми
проявлениями метастатического процесса, не получавших лекарственной
терапии по поводу метастатической
болезни (разрешалась предшествующая нео- и/или адъювантная терапия)
с отсутствием клинических признаков висцерального кризиса. Стратификация проводилась в зависимости
от приема конкретного ингибитора
CDK4/6, наличия висцеральных метастазов, предшествующей нео- или
адъювантной гормонотерапии. Статистическая гипотеза предполагала,
что назначение CDK4/6 в первой линии на основании оценки PFS2 уменьшит относительный риск прогрессирования на 35% (HR<0,65).
Для этого потребовалось включить в исследование 1040 больных с медианой возраста 63 года, в основном постменопаузальных (86%) с наличием висцеральных метастазов (56%). Ранее нео- или адъювантная химиотерапия и гормонотерапия были проведены у 40% и 49% соответственно. Палбоциклиб, рибоциклиб и абемациклиб назначались 91%, 8% и 1% больных соответственно. Медиана наблюдения составила 37 месяцев. Лечение CDK4/6 в первой линии существенно увеличило медиану PFS1 c 16,1 до 24,7 мес., что соответствует достоверному снижению относительного риска прогрессирования на 41% (HR=0,59; p<0,0001). Однако при оценке PFS2 в зависимости от назначения CDK4/6 в первой и второй линиях (основная конечная точка исследования) разница между двумя группами потеряла свою достоверность и составила 31 и 26,8 мес. соответственно (HR=0,87; p=0,10) (рис.2). Подгрупповой анализ не позволил определить пациентов, у которых наблюдался выигрыш PFS2 от назначения CDK4/6 в первой линии. Также не отмечено разницы в продолжительности жизни в обеих группах (рис.3).
Рисунок 2. Медиана времени до второго прогрессирования PFS2
Рисунок 3. Кривые общей выживаемости
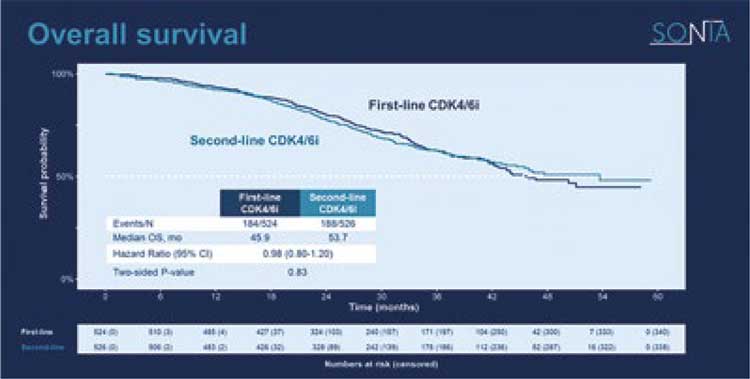
При оценке
качества жизни получен одинаковый
счет в обеих группах по опроснику
FACT-B. Однако было отмечено, что
при назначении ингибиторов CDK4/6
в первой линии зарегистрировано на 42% больше осложнений 3-4 степени,
в основном за счет нейтропении, анемии, тромбоцитопении и нарушения
функции печени. Авторы подсчитали, что продолжительность приема
CDK4/6 при назначении в первой и
второй линиях составила 24,6 и 8,1
мес. соответственно, что увеличило
стоимость лечения примерно на 200
000 USD на каждого больного при использовании в первой линии.
Авторы этого академического исследования попытались ответить на важный для клиницистов вопрос о месте
комбинации ингибиторов ароматазы
и CDK4/6 в лечении гормонозависимого HER2-негативного метастатического РМЖ. Исследование SONIA
подтвердило эффективность комбинации в первой линии, увеличив медиану PFS на 8,6 мес. и уменьшив относительный риск прогрессирования
на 41%. Эти цифры существенно не
отличаются от результатов регистрационных клинических исследований.
В случае прогрессирования после
комбинации прогноз больных, получающих один фулвестрант, значительно хуже в сравнении с комбинацией
фулвестранта и ингибиторов CDK4/6,
что приводит к выравниванию кривых PFS2. Но SONIA оставляет неотвеченным важный вопрос: кому нам
следует назначить комбинацию в первой линии и кто может обойтись без
нее, оставив получение ингибиторов
CDK4/6 для второй линии. Возможно, более детальный анализ окончательных результатов исследования
сможет определить эти популяции
пациентов. Есть еще одно сомнение.
В исследовании SONIA в качестве
ингибитора CDK4/6 у подавляющего
большинства больных использовался
палбоциклиб (два других ингибитора CDK4/6 были зарегистрированы
в Нидерландах значительно позднее,
когда исследование было в ходу). В исследовании PALOMA-2 этот препарат
в комбинации с летрозолом в первой
линии достоверно увеличил медиану
PFS, но не увеличил общую выживаемость, в отличие от исследований
с рибоциклибом и абемациклибом.
Что, если представить результаты
исследования, подобного SONIA, с
рибоциклибом или абемациклибом
с выигрышем комбинации в первой
линии в PFS, одинаковой продолжительностью PFS2, но с достоверным
увеличением продолжительности
жизни? Породило ли это дискуссию о месте ингибиторов CDK4/6? Требуются новые исследования по определению биомаркеров, которые позволят персонализировать назначение
ингибиторов CDK4/6 в различных популяциях пациентов. Результаты исследования SONIA свидетельствуют,
что назначение ингибиторов CDK4/6
во второй линии после прогрессирования на ингибиторах ароматазы является эффективной опцией и может
применяться наравне с их назначением в первой линии.
Заканчивая свою презентацию исследования SONIA, доктор Сонке задал
следующие вопросы сидящим в аудитории: «Будучи на месте больного,
выбрали ли бы вы лечение, которое
не улучшает качество жизни и не увеличивает ее продолжительность? Как
доктор, будете ли вы рекомендовать
такое лечение, которое одновременно
сопровождается увеличением частоты серьезных побочных эффектов в 2
раза? Как администратор, ответственный за финансирование противоопухолевой терапии, считаете ли вы стоящими затраты дополнительных 200
000 USD на подобное лечение?» Результаты исследования SONIA заставляют сомневаться в положительных
ответах на поставленные вопросы.
Источник:
Sonke GS, et al. Primary outcome
analysis of the phase 3 SONIA trial
(BOOG-2017-03) on selecting the
optimal position of cyclin-dependent
kinases 4 and 6 (CDK4/6) inhibitors
in patients with hormone receptor
positive, HER2-negative advanced
breast cancer. 2023 ASCO Annual
Meeting. Abstract LBA1000.
КОММЕНТАРИИ ЭКСПЕРТОВ
Авторы: Жуков Николай Владимирович
ФГБУ «НМИЦ Детской гематологии, онкологии и иммунологии им. Д. Рогачева»,
доктор медицинских наук, профессор, Москва
Жукова Людмила Григорьевна
ГБУЗ «Московский клинический научный центр им. А.С. Логинова ДЗМ»,
доктор медицинских наук, член-корр. РАН, Москва
О ЧЕМ НА САМОМ ДЕЛЕ РАССКАЗАЛА SONIA?
SONIA оказалось одним из самых обсуждаемых (а иногда – на повышенных тонах) исследований, результаты которого были озвучены на последнем конгрессе ASCO. Пожалуй, его действительно
можно назвать «провокационным», так как его результаты ставят
под сомнение парадигму использования CDK4/6 ингибиторов для
лечения распространенного люминального HER2-негативного
РМЖ, сложившуюся в последнее время.
После публикации в 2019 году результатов исследований
MONALESSA 3 и 7, показавших увеличение общей выживаемости
при использовании рибоциклиба в качестве первой линии терапии, алгоритм использования этих препаратов казался абсолютно
понятным. Как и любой вариант терапии, доказательно (более того,
не только статистически, но и клинически значимо) продлевающий жизнь больных, CDK4/6 ингибиторы необходимо помещать
в первую линию лечения. Ведь в переводе на «человеческий язык»
увеличение общей выживаемости в ситуациях, когда препарат
может быть назначен пациентам контрольной группы после прогрессирования, обозначает, что для части больных (а по данным
исследования MONALESSA – немалой, около 10-15% в пятилетнем
горизонте) начало терапии без CDK4/6 оказывается фатальным. К
сожалению, финальные результаты исследования другого CDK4/6
ингибитора – палбоциклиба – не показали увеличения общей выживаемости. Это заставило усомниться в том, что увеличение ОВ
– класс-эффект препаратов из данной группы. Однако для рибоциклиба, в том числе и в силу появления результатов MONALESSA-2
и обновленных результатов исследований MONALESSA-3, не остается сомнений в том, что для части больных назначение препарата в первой линии является жизнеспасающим. Таким образом, с
некоторыми нюансами (расхождение во мнениях о наличии/отсутствии класс-эффекта) CDK4/6 стали восприниматься как оптимальный вариант первой линии лечения. И это несмотря на то,
что препараты зарегистрированы и для использования во второй
линии терапии, где тоже показали увеличение ОВ.
Казалось бы, основное направление теперь понятно: рибоциклиб
(для тех, кто считает, что класс-эффекта нет) или любой из CDK4/6
(для тех, кто так не считает) – оптимальное лечение в первой линии. Думаю, что вы согласитесь, что такое же решение мы принимаем для большинства препаратов, показавших увеличение ОВ
при их использовании в первой линии. Вряд ли кому-то придет в
голову переместить трастузумаб при HER2+ РМЖ или алектиниб
при ALK+ НМРЛ во вторую линию, несмотря на то, что и там они
показали свою эффективность.
Но тут «пришла» SONIA, и мир попытался «перевернуться» с ног
на голову. Большое исследование (N=1050) организовано академической группой с целью ответить на вопрос: что произойдет,
если все пациенты контрольной группы (т.е. начавшие лечение с
монотерапии ингибиторами ароматазы) получат CDK4/6 ингибиторы после прогрессирования. Это действительно можно назвать
основным отличием SONIA от «регистрационных» исследований
CDK4/6 (и подавляющего большинства препаратов, которые мы
используем в своей клинической практике при РМЖ и других
опухолях) в качестве первой линии терапии. В регистрационных
исследованиях пациентки из контрольной группы МОГЛИ получить CDK4/6 после прогрессии, в SONIA же – они получали эту
терапию в обязательном порядке. Исследование предусматривало
100% перекрест – все пациенты из контрольной группы, начавшие
лечение ингибиторами ароматазы, после прогрессии получали терапию фулвестрантом и одним из CDK4/6 ингибиторов по выбору
врача. Аналогично, все пациенты группы, получавшей в качестве
первой линии лечения терапию комбинацией CDK4/6 и ингибитора ароматазы, после прогрессирования получали монотерапию
фулвестрантом.
Что же сказала SONIA устами исследователей на конференции
ASCO 2023? Ответ оказался обескураживающим. Да, если смотреть
выживаемость без прогрессирования на первой линии лечения, то
CDK4/6 ингибиторы однозначно «бьют» монотерапию ингибиторами ароматазы. Причем с ожидаемыми цифрами медиан. Но вот
если смотреть ВБП 2 (время от начала первой линии до прогрессирования на второй линии), то оказывается, что этот показатель
абсолютно идентичен в обеих группах. К сожалению, графиков по
ВПБ на фоне терапии 2 линии отдельно исследователи не показали,
но очевидно напрашивается объяснение, что CDK4/6 ингибиторы
обеспечивают одинаковый выигрыш (и, скорее всего, выигрывают
те же больные) как при использовании их в 1 линии терапии, так и
во второй. Главное, чтобы подобное лечение получили все больные.
Ну, и вишенкой на торте явился анализ общей выживаемости, не
обнаруживший различий между группами, начавшими терапию
с комбинации CDK4/6 ингибиторами или с моноэндокринотерапии. При этом ожидаемо, что длительность использования CDK4/6
ингибиторов в контрольной группе была значимо меньше (как и
всегда во второй линии), как и абсолютное число нежелательных
явлений >3 степени. Заканчивая выступление, презентирующий
автор сделал выводы, которые хорошо укладываются в известный
нам рекламный слоган «Ели не видно разницы, зачем платить больше» – при «переносе» CDK4/6 ингибиторов во вторую линию ВБП
2 и ОВ одинаковы, а время использования, а значит и цена терапии
и токсичность, меньше. А значит, подобный подход является оптимальным. Собственно, эти выводы кажутся весьма логичными и в
связи с этим были акцептированы многими специалистами.
Но, увы, мы вынуждены с этим не согласиться, так как нам кажется, что SONIA говорит нам совсем про другое. Да, если смотреть
только на судьбу контрольной группы, то можно прийти к выводу,
что оптимальная терапия спасает часть больных, даже если она назначена во второй линии. И с этим трудно не согласиться, так как
для тех, кто «опрокинул» монотерапию ингибиторами ароматазы
в первой линии, CDK4/6 ингибиторы – однозначно оптимальная
терапия (во всяком случае для большинства из них). Но что же по
поводу группы, которая начала с CDK4/6 ингибиторов? Является
ли монотерапия фулвестрантом оптимумом для 100% из них? Простыми словами – готовы ли вы любому пациенту после прогрессии
на CDK4/6 ингибиторах дать монотерапию фулвестрантом (или
любой другой вариант моноэндокринотерапии)? Думаю, что ответ
будет – однозначно «нет». Как минимум, больные с прогрессией в
первые полгода лечения скорее всего получат либо химиотерапию,
либо комбинацию с алпелисибом, если есть мутация PIK3CA. А
таких быстрых прогрессоров в SONIA было немало: при первом
же обследовании (через 3 месяца) кривая выживаемости группы,
получавшей CDK4/6 ингибиторы, обвалилась примерно на 7-8%,
при втором (через 6 месяцев) – еще на столько же. Еще одним вопросом к SONIA является то, что при заявленной возможности использовать любой CDK4/6 ингибитор это все же было практически
исследование «одного препарата» – 90% больных в обеих группах
получали палбоциклиб. А это, если вы не забыли, препарат, который не показал увеличения ОВ при использовании в первой линии
лечения, но при этом подобное увеличение было отмечено во второй. Так что при всем желании (абсолютно искреннем) сэкономить
деньги и уменьшить токсичность, SONIA не кажется исследованием, опираясь на результаты которого можно принять решение о
«перемещении» CDK4/6 ингибиторов во вторую линию в качестве
оптимальной стратегии лечения. С нашей точки зрения, отсутствие
выигрыша в ВБП 2 и ОВ в исследовании SONIA связано не с тем,
что назначение оптимальной терапии во второй линии лечения
контрольной группы позволяет поднять результаты терапии до сопоставимых с пациентами, начавшими лечение с CDK4/6 ингибиторов. Результаты удалось сравнять благодаря тому, что основная
группа получила субоптимальное с точки зрения ОВ лечение, как в
первой (в силу того, что использовался препарат, увеличения ОВ не
показавший и в регистрационном исследовании), так и во второй
линии, так как часть больных (быстрые прогрессоры) получала терапию, которую вы никогда не рискнете дать им в реальной клинической практике (монотерапию фулвестрантом).
ASCO 2023: ЧТО ПОКАЗАЛОСЬ МНЕ ИНТЕРЕСНЫМ ИЗ ПРЕДСТАВЛЕННЫХ ДАННЫХ О ТЕРАПИИ РАННЕГО РМЖ?
Автор: Жукова Людмила Григорьевна
ГБУЗ «Московский клинический научный центр им. А.С. Логинова ДЗМ»,
доктор медицинских наук, член-корр. РАН, Москва
Данные последнего ASCO, касающиеся терапии раннего рака молочной железы (рРМЖ), не стали пока
ни судьбоносными, ни меняющими
нашу практику. Но кое-что было не
только интересным, но и полезным
для понимания правильности наших,
казалось бы, уже устоявшихся подходов в терапии РМЖ ранних стадий.
Два сообщения, касающиеся
HR+HER2- раннего РМЖ, и два по
HER2-позитивному РМЖ, были отобраны экспертами ASCO как наиболее значимые в терапии раннего
РМЖ. В этой заметке я остановлюсь
на одном из них.
Дебаты о месте ингибиторов CDK4/6
в лечении раннего HR+HER2- рака
молочной железы не утихают уже
на протяжении нескольких лет, начиная с исследований PENELOPE-B
и PALLAS (с палбоциклибом), не показавших преимуществ данного подхода и перекинувшихся на успешное,
с точки зрения достигнутых к 4 годам
наблюдения результатов, исследование MonarchE (с абемациклибом), которое, кстати, привело к регистрации
показания применения последнего в
комбинации со стандартной эндокринотерапией в адъювантном режиме
у пациентов группы высокого риска
прогрессирования.
Очевидно, что результатов исследования эффективности в адъювантном режиме еще одного из класса
CDK4/6 ингибиторов – рибоциклиба,
единственного, применение которого
имеет подтвержденное увеличение
общей выживаемости и в первой, и во
2 линиях терапии распространенного
РМЖ, мы ждали с огромным нетерпением.
В первый же день работы конгресса
Dennis Slamon представил результаты второго запланированного промежуточного анализа исследования
III фазы NATALEE (NCT03701334),
посвященного оценке эффективности адъювантного применения
рибоциклиба в комбинации со стандартной эндокринотерапией у пациентов с гормоночувствительным
HER2-отрицательным РМЖ II и III
стадий, в том числе и без метастазов
в лимфатических узлах (28% от всех
включенных в исследование пациентов имели статус лимфоузлов N0), что
принципиально отличалось от популяции исследования MonarchE (адъювантное применение абемациклиба
в комбинации со стандартной эндокринотерапией у пациентов группы
высокого риска прогрессирования,
то есть только N+).
С одной стороны, представленные
результаты исследования NATALEE
(n=5101) свидетельствуют о статистически достоверном улучшении
показателя 3-летней выживаемости
без событий, относящихся к инвазивному раку (iDFS), при добавлении
рибоциклиба к стандартной эндокринотерапии: 90,4% в группе рибоциклиба по сравнению с 87,1% в группе только гормонотерапии (HR (95%
CI) 0,748 [0,618-0,906]; р=0,0014), то
есть снижение относительного риска развития события iDFS на 25%. С
другой стороны, не следует забывать,
что на момент представления данных медиана наблюдения составляет
только 34 месяца и пока лишь 20,2%
участников группы терапии рибоциклибом завершили лечение в течение
3 запланированных лет, да и 2 года
адъювантной терапии завершили
только 56,8% пациентов. Но следует
признать, что эти результаты пока
являются совсем незрелыми, и потребуется еще несколько лет, чтобы
ответить на вопрос, станет ли рибоциклиб еще одним из группы CDK4/6
ингибиторов, применение которого в
адъювантном режиме действительно
изменит нашу практику. Учитывая
дизайн исследования, предполагающий использование рибоциклиба не
только у пациентов группы высокого риска прогрессирования, но и у
более благоприятной, в частности c
N0 статусом лимфоузлов, ожидание
«вызревания» данных делает интерес
к исследованию NATALEE наиболее
острым.
Для получения ответов на эти вопросы нам придется набраться терпения и ждать, но бесспорным уже сейчас является подтверждение хорошей и приемлемой по спектру нежелательных явлений переносимости рибоциклиба в адъювантном режиме. Это и не удивительно, так как в адъювантном режиме предполагается использование дозы препарата 400 мг, а не 600 мг, которые являются пока стандартными при лечении распространенной болезни.
Источник:
Slamon D, et al. Ribociclib
and endocrine therapy as adjuvant
treatment in patients with HR+/HER2−
early breast cancer: Primary results from
the phase III NATALEE trial. J Clin
Oncol. 2023; 41 (suppl 17; abstr LBA500).
МНЕНИЕ. 10 ИЗМЕНЕНИЙ, КОТОРЫЕ Я СДЕЛАЮ В СВОЕЙ ПРАКТИЧЕСКОЙ РАБОТЕ ПОСЛЕ ПОСЕЩЕНИЯ ASCO 2023
Jeffrey J. Kirshner, MD, FACP, FASCO, Central New York (HOACNY) in East Syracuse
Ten Practice Changes I Will Make After Attending ASCO 2023
1. Надеюсь, что в ближайшее время будет одобрено лечение воразидинибом, которое можно будет предложить пациентам с удаленной олигодендроглиомой или астроцитомой grade 2 с мутацией IDH. Mellinghoff представил убедительные данные на пленарном заседании (LBA1): у пациентов, рандомизированных для приема препарата, медиана ВБП составила 27,7 месяца по сравнению с 11,1 месяца у больных, получавших плацебо. Очевидно, остаются вопросы относительно продолжительности ответа и влияния на ОВ, а также о том, как использовать препарат у пациентов, ранее получавших химиотерапию и/или лучевую терапию.
2. Теперь я могу рекомендовать отказ от рутинного использования облучения больных раком прямой кишки с хорошим и промежуточным прогнозом и оставить этот метод для тех, кто не отвечает на индукционную FOLFOX. Schrag представил результаты большого исследования PROSPECT, которые продемонстрировали не меньшую эффективность при селективном использовании химиолучевого лечения с ожидаемым снижением поздней токсичности (LBA2). 5-летняя безрецидивная выживаемость составила 80,8% у 585 пациентов, рандомизированных в группу селективного облучения, и 78,6% у 543 пациентов, рандомизированных в группу лучевой терапии в качестве стандарта лечения. ОВ и выживаемость без локального рецидива также были одинаковыми в обеих группах.
3. Я могу предложить пациентам с лимфомой Ходжкина III и IV стадии схему лечения, включающую иммунотерапию в качестве терапии первой линии. Такой подход кажется более эффективным и менее токсичным, чем режим BV-AVD, ставший стандартом лечения. Как сообщил Herrera на пленарном заседании (LBA4), замена брентуксимаба ведотина ниволумабом (N-AVD) в SWOG S1826 привела к улучшению одногодичной ВБП с 86% до 94%, с меньшим количеством смертей и меньшим количеством отдаленных токсических эффектов, таких как нейропатия.
4. Я предложу избранным пациентам
с НМРЛ II и III стадии как предоперационную, так и адъювантную иммунотерапию в дополнение к неоадъювантной химиотерапии. Wakelee
сообщил о первых результатах исследования KEYNOTE-671 (LBA100)
на отдельной сессии, продемонстрировав улучшение БРВ и тенденцию
к улучшению OВ. У 397 пациентов,
получавших пембролизумаб вместе
с препаратами платины в неоадъювантном режиме с последующим
адъювантным лечением пембролизумабом в течение 13 циклов, была
более высокая БРВ по сравнению с
400 пациентами, получавшими плацебо (62,4% против 40,6%), и более
высокая ОВ (80,9% против 77,6%).
). Частота патологического полного
ответа также была выше в группе неоадъювантной терапии пембролизумабом (18,1% против 4,0%).
5. Теперь у нас есть еще один вариант, который можно добавить к адъювантной эндокринной терапии больных с высоким риском рака молочной железы. Slamon представил первый отчет об эффективности подхода в исследовании NATALEE (LBA500). Всего 5101 пациентка была рандомизирована в группу рибоциклиба или плацебо в течение 3 лет в дополнение к одному из нестероидных ингибиторов ароматазы. Наблюдалось значительное улучшение 3-летней ипсилатеральной ВБП у пациентов, получавших рибоциклиб, по сравнению с теми, кто принимал плацебо, причем препарат был вполне переносимым. 3-летняя иВБП улучшилась с 87,1% до 90,4%, и также наблюдается тенденция к улучшению ОВ. Следует отметить, что требования к включению в исследование были более широкими, чем в исследованиях PALLAS и MonarchE, и что доза рибоциклиба (400 мг) была ниже, чем доза, используемая для лечения пациентов с метастазами.
6. Я не буду автоматически добавлять ингибитор CDK в схемы лечения всех моих пациенток с метастатическим раком молочной железы, получающих ингибитор ароматазы в качестве терапии первой линии после того, как Sonke сообщил о результатах голландского исследования SONIA. ВБП2 (время от рандомизации до второго объективного прогрессирования заболевания или смерти) была эквивалентной, если ингибитор CDK откладывался и применялся с фулвестрантом у пациентов с прогрессированием на фоне только эндокринной терапии (LBA1000). Медиана ВБП2 составила 31,0 и 27,8 месяцев соответственно в стандартной и отсроченной группах. Отсрочка ингибирования CDK привела к снижению общей токсичности и снижению затрат на лечение.
7. При лечении больных метастатическим раком молочной железы капецитабином я буду использовать более низкую фиксированную дозу 1500 мг два раза в день, 7 дней приема/7 дней перерыва. Как сообщил Khan (ABS1007), эта схема была столь же эффективной и менее токсичной, чем схема с более высокими дозами: 2 недели приема/1 неделя перерыва. Медиана ВБП составила 13,9 мес. в группе 7/7 и 14,6 мес. в контрольной группе. ОВ через 36 месяцев также была одинаковой (21,2% против 19,6%). Токсичность 2–4 степени снижалась с 49% до 25% при фиксированной более низкой дозе. Только 7,5% пациентов, получавших фиксированную схему лечения, прекратили лечение по сравнению с 28,8% пациентов, получавших стандартную схему.
8. Я буду использовать высокодозовый режим MVAC при лечении мышечно-инвазивного рака мочевого пузыря методом неоадъювантной химиотерапии. Pfister представил результаты французского исследования VESPER (LBA4507), которые продемонстрировали, что шесть циклов ddMVAC привели к улучшению 5-летней ОВ с 57% до 66% по сравнению с четырьмя циклами гемцитабина/цисплатина. Для достижения этих превосходных результатов было важно поддерживать плотность дозы.
9. Я предложу пациентам с меланомой стадии IIB и IIC адъювантную терапию пембролизумабом. Luke представил 39-месячное наблюдение пациентов из исследования KEYNOTE-716 (LBA9505). У 487 больных, рандомизированных для лечения пембролизумабом в течение 1 года, 3-летняя выживаемость без отдаленных метастазов составила 84,4% по сравнению с 74% у 489 пациентов, получавших плацебо. Общая ВБП составила 76,2% против 63,4%. Данные ОВ еще не созрели, но в предыдущих адъювантных исследованиях с биологическими препаратами была обнаружена корреляция между ВБП и OВ.
10. Теперь я буду рекомендовать
больным раком молочной железы и
желудочно-кишечного тракта, получающим лечение капецитабином,
наносить на руки обычный безрецептурный 1% гель диклофенака
(Вольтарен) два раза в день, чтобы
снизить частоту развития ладонноподошвенного синдрома (ЛПС). Исследование D-TORCH, о котором сообщила компания Batra (ABS12005),
продемонстрировало снижение ЛПС
2 степени и выше и снижение частоты редукции дозы капецитабина, а
также улучшение качества жизни. По
сравнению с частотой ЛПС 18,1% у
133 пациентов в группе плацебо, частота ЛПС составила всего 6,1% у 130
пациентов, получавших гель диклофенак. Только 3,8% пациентов в группе геля нуждались в снижении дозы
капецитабина по сравнению с 15% в
контрольной группе. Все подгруппы
получили выигрыш, при этом гель
нетоксичен и относительно недорог.
Источники:
1. INDIGO: A global, randomized, double-blinded, phase 3 study of vorasidenib versus placebo in patients with residual or recurrent grade 2 glioma with an IDH1/2 mutation. Ingo K. Mellinghoff, Martin J. Van Den Bent, Deborah T. Blumenthal, et al. Journal of Clinical Oncology 2023 41:17_suppl, LBA1-LBA1
2. PROSPECT: A randomized phase III trial of neoadjuvant chemoradiation versus neoadjuvant FOLFOX chemotherapy with selective use of chemoradiation, followed by total mesorectal excision (TME) for treatment of locally advanced rectal cancer (LARC) (Alliance N1048). Deborah Schrag, Qian Shi, Martin R. Weiser, et al; Alliance for Clinical Trials in Oncology. Journal of Clinical Oncology 2023 41:17_suppl, LBA2-LBA2
3. SWOG S1826, a randomized study of nivolumab(N)-AVD versus brentuximab vedotin(BV)-AVD in advanced stage (AS) classic Hodgkin lymphoma (HL). Alex Francisco Herrera, Michael Leo LeBlanc, Sharon M. Castellino, et al. Journal of Clinical Oncology 2023 41:17_suppl, LBA4- LBA4
4. KEYNOTE-671: Randomized, double-blind, phase 3 study of pembrolizumab or placebo plus platinum-based chemotherapy followed by resection and pembrolizumab or placebo for early stage NSCLC. Heather A. Wakelee, Moishe Liberman, Terufumi Kato, et al. Journal of Clinical Oncology 2023 41:17_suppl, LBA100- LBA100
5. Ribociclib and endocrine therapy as adjuvant treatment in patients with HR+/HER2- early breast cancer: Primary results from the phase III NATALEE trial. Dennis J. Slamon, Daniil Stroyakovskiy, Denise A. Yardley, et al. Journal of Clinical Oncology 2023 41:17_suppl, LBA500-LBA500 6. Primary outcome analysis of the phase 3 SONIA trial (BOOG 2017- 03) on selecting the optimal position of cyclin-dependent kinases 4 and 6 (CDK4/6) inhibitors for patients with hormone receptor-positive (HR+), HER2-negative (HER2-) advanced breast cancer (ABC). Gabe S. Sonke, Annemiek Van Ommen - Nijhof, Noor Wortelboer, et al. Journal of Clinical Oncology 2023 41:17_suppl, LBA1000- LBA1000
7. Randomized trial of fixed dose capecitabine compared to standard dose capecitabine in metastatic breast cancer: The X-7/7 trial. Qamar J. Khan, Colleen Bohnenkamp, Taylor Monson, et al. Journal of Clinical Oncology 2023 41:16_suppl, 1007-1007
8. Dose-Dense Methotrexate, Vinblastine, Doxorubicin, and Cisplatin or Gemcitabine and Cisplatin as Perioperative Chemotherapy for Patients With Nonmetastatic MuscleInvasive Bladder Cancer: Results of the GETUG-AFU V05 VESPER Trial. Christian Pfister, Gwenaelle Gravis, Aude Fléchon, et al., for the VESPER Trial Investigators. Journal of Clinical Oncology 2022 40:18, 2013-2022
9. Pembrolizumab versus placebo as adjuvant therapy in stage IIB or IIC melanoma: Final analysis of distant metastasis-free survival in the phase 3 KEYNOTE-716 study. Jason J. Luke, Paolo Antonio Ascierto, Muhammad Adnan Khattak, et al. Journal of Clinical Oncology 2023 41:17_suppl, LBA9505-LBA9505
10.Randomized double-blind, placebocontrolled study of topical diclofenac in
prevention of hand-foot syndrome in
patients receiving capecitabine. AKHIL
Santhosh, Atul Batra, akash kumar, et
al. Journal of Clinical Oncology 2023
41:16_suppl, 12005-12005
ДЕПРЕССИЯ И ТРЕВОЖНЫЕ СОСТОЯНИЯ НЕ УВЕЛИЧИВАЮТ РИСК ЗАБОЛЕТЬ ЗЛОКАЧЕСТВЕННЫМИ ОПУХОЛЯМИ
Автор: С.А.Тюляндин
Председатель Российского общества клинической онкологии,
профессор, доктор медицинских наук, Москва
Думаю, что большинство практикующих онкологов согласятся
с утверждением, что у оптимистически настроенных больных
злокачественными новообразованиями в отличие от депрессивных заболевание протекает более
благоприятно, и чаще наблюдается польза от проведения противоопухолевого лечения. Не уверен,
что есть научные доказательства
подобного рода наблюдениям, но
можно предположить, что оптимистическая нацеленность на
лечение стимулирует лечащих
врачей использовать наиболее радикальные лечебные методики,
активные препараты и их комбинации, проводить большее число
линий терапии, что в конечном
итоге может оказать позитивное
влияние на отдаленные результаты. Депрессивные и тревожные
больные менее привержены к назначенной терапии, хуже субъективно и объективно переносят лечение, что требует снижения доз,
перерывов и прекращения терапии. Возможно, именно эти ощущения, легли в основу гипотезы,
что депрессивные и тревожные состояния не только ухудшают прогноз заболевшего злокачественной
опухолью, но и увеличивают риск
самой заболеваемости. Проведенные исследования по заболеваемости в общей популяции и среди
пациентов с депрессией продемонстрировали противоречивые
результаты. Для получения более
достоверных данных был проведен мета-анализ 18 исследований о
связи депрессии и тревожных состояний с заболеваемостью злокачественными опухолями.
Критериями включения в проведенный мета-анализ были:
публикация выполнененого исследования, четкие определения
постановки диагноза депрессии
и тревожного состояния, наблюдение за пациентами с оценкой
динамики выраженности депрессии и тревожного состояния,
описание постановки диагноза
злокачественной опухоли, оценка
других факторов, влияющих на
возникновение злокачественного
процесса (возраст, пол, курение,
употребление алкоголя, питания,
физической активности и др.), ретроспективный характер исследования, т.е. постановка диагноза депрессии и тревожного состояния
предшествовало диагнозу злокачественной опухоли. В результате
в опубликованный мета-анализ
было включено 319613 больных с
депрессий и тревожными состояниями, у 25803 из которых при наблюдении была диагностирована
злокачественная опухоль. Средний возраст пациентов во включенных исследованиях варьировал от 27 до 68 лет, пропорция
женщин от 25% до 100%. В связи с
частотой заболеваемости удалось
оценить характер взаимосвязи депрессии и тревожного состояния
с колоректальным раком, раком
легкого, молочной железы, простаты, алкоголь-ассоциированными
и злокачественными опухолями,
обусловленными курением.
В результате проведенного анализа не отмечено взаимосвязи
между диагнозом и выраженностью симптомов депрессии и тревожного состояния и заболеваемостью колоректальныим раком,
раком молочной железы и простаты, алкоголь-ассоциированными опухолями. Отмечено увеличение частоты возникновения
рака легкого у пациентов с диагнозом депрессия (HR=1,53 95%CI
1,25-2,00) и тревожные состояния
(HR=1,60 95%CI 1,18-2,18). Одновременно отмечено увеличение
заболеваемости всеми ассоциированным с курением злокачественными опухолями, как у больных
с депрессией, так и у пациентов с
тревожными состояниями. После
дополнительного анализа авторы
сделали вывод, что именно курение, которое часто сопровождает
психические расстройства, ответственно за повышенную заболеваемость раком легкого.
Таким образом, не получено убедительных свидетельств, что
психические расстройства в виде
депрессии и тревожного состояния повышают риск заболевания
злокачественными опухолями.
Курение на фоне психических
расстройств ответственно за повышенный риск заболеть раком
легкого и другими ассоциированными с курением опухолями.
Источник:
van Tuijl LA, Basten M,
Pan K-Y, et al. Depression, anxiety,
and the risk of cancer: an individual
participant data meta-analysis.
Cancer, published оnline 07 August
2023
XXVII РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС 2023
14 - 16 НОЯБРЯ 2023 МОСКВА
