Дорогие коллеги, дорогие друзья!
Первый летний месяц оказался чрезвычайно богатым на научные мероприятия различного уровня, среди которых ежегодный конгресс ASCO, без сомнения, является наиболее ожидаемым и насыщенным. Июньский номер газеты полностью посвящен обзору исследований, представленных на конгрессе; наши эксперты...

Данте Габриэль Россетти.
Святая лилия. 1874. Холст, масло. 48,3 × 45,7 см Британская галерея Тейт, Лондон
Наум Коржавин. 1972
*** Уже июнь. Темней вокруг кусты. И воздух — сух. И стала осень ближе. Прости меня, Господь… Но красоты Твоей земли уже почти не вижу. Всё думаю, куда ведут пути, Кляну свой век и вдаль смотрю несмело, Как будто я рождён был мир спасти, И до всего другого нет мне дела. Как будто не Тобой мне жизнь дана, Не Ты все эти краски шлешь навстречу…

НОВОСТИ ASCO 2024 / ASCO 2024: МЕТАСТАТИЧЕСКИЙ РАК МОЛОЧНОЙ ЖЕЛЕЗЫ
Не оставляет сомнения, что состоявшийся конгресс отмечен широким наступлением конъюгатов моноклональных антител и цитостатиков (ADC – antibodydrug conjugate) в терапии РМЖ...
RUSSCO ОБ ИЗМЕНЕНИЯХ В ОНКОЛОГИИ В 2024 ГОДУ
7 июня Российское общество клинической онкологии (RUSSCO) провело в Москве конференцию «Лучшее по материалам конференции ASCO», которая рассмотрела вопросы, касающиеся лечения рака молочной железы, сарком, опухолей головы и шеи, рака толстой и прямой кишки и др., а также поддерживающей терапии...
ВТОРОЙ МОЛОДЕЖНЫЙ ОНКОЛОГИЧЕСКИЙ САММИТ ПРОШЕЛ В МОСКВЕ
Молодежный комитет RUSSCOjr Российского общества клинической онкологии провел 8 июня в Москве Второй молодежный онкологический саммит, во главе угла которого оказались критичное отношение к инновациям, эмоциональные дискуссии оптимистов и скептиков от онкологической науки...

НОВОСТИ ASCO 2024 / РАК ПОЧКИ. БЕЗ ПАНИКИ! АВЕЛУМАБ С АКСИТИНИБОМ НЕ УЛУЧШИЛИ ОБЩУЮ ВЫЖИВАЕМОСТЬ ПАЦИЕНТОВ С МЕТАСТАТИЧЕСКИМ РАКОМ ПОЧКИ
Прогресс в лечении метастатического почечноклеточного рака (ПКР) очевиден: значимый вклад привнесла первая линия иммунотаргетной и двойной иммунотерапии, эффективные последующие...

НОВОСТИ ASCO 2024 / РАК МОЧЕВОГО ПУЗЫРЯ
Третий и четвертый дни ASCO 2024 ознаменовались устной и постерной сессиями, посвященными лечению уротелиального рака. Основные герои на арене – конечно, ингибиторы контрольных точек иммунитета и конъюгаты.

НОВОСТИ ASCO 2024 / ПО СЛЕДАМ ASCO 2024. ОПУХОЛИ ГОЛОВЫ И ШЕИ
Прошедший в июне 2024 года ежегодный конгресс ASCO в отношении опухолей головы и шеи не принес исследований, способных изменить текущую клиническую практику. Между тем следует...
НОВОСТИ ASCO 2024 / ASCO 2024: ОПЕРАБЕЛЬНЫЙ РАК МОЛОЧНОЙ ЖЕЛЕЗЫ
Все интересные доклады, посвященные лечению операбельного рака молочной железы (РМЖ), я разделил на две группы. В первой группе представлены исследования, которые пытались улучшить результаты лечения за счет использования новых препаратов или новых комбинаций. Во вторую группу включены исследования биомаркеров...

НОВОСТИ ASCO 2024 / САРКОМЫ. HIGHLIGHTS
Дорогие читатели, телеграм-каналы в первую неделю июня были просто перегружены рассылками и новостями ASCO. Здесь представлены работы, которые по сути являлись наиболее яркими, обсуждались в последний день и...

НОВОСТИ ASCO 2024 / РАК ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
Исследования, представленные на конгрессе ASCO 2024 по раку предстательной железы (РПЖ), не изменят нашу клиническую практику, но, безусловно, требуют внимания, будто говоря: «Так делать не надо»...

НОВОСТИ ASCO 2024 / РАК ВЕРХНИХ ОТДЕЛОВ ЖКТ
В этом году на ASCO были представлены результаты целого ряда исследований, которые могут повлиять на нашу ежедневную практику лечения пациентов с опухолями желудка и пищевода. Одно из самых нашумевших...

НОВОСТИ ASCO 2024 / МНЕНИЕ. ESOPEC: ПРЕЖДЕВРЕМЕННЫЙ РЕКВИЕМ ПО РЕЖИМУ CROSS
Сложно не согласиться с тем, что исследование ESOPEC [1] стало одним из тех, что наделали больше всего шума на ASCO, прежде всего, со стороны приверженцев неоадъювантной химиолучевой терапии при раке пищевода. Многие эксперты международного уровня высказались по этому поводу, не только на своих страницах в соцсетях, но и в комметариях на официальных сайтах сообществ, поэтому...

НОВОСТИ ASCO 2024 / НОВОЕ В МИРЕ ОНКОГИНЕКОЛОГИИ
В статье – краткий обзор наиболее примечательных (по мнению автора) исследований конгресса Американского общества клинической онкологии (ASCO) и попытка понять, какое влияние эти результаты могут...

НОВОСТИ ASCO 2024 / «О БЕДНОМ ГУСАРЕ ЗАМОЛВИТЕ СЛОВО», ИЛИ РЕЗУЛЬТАТЫ ХИРУРГИЧЕСКИХ ИССЛЕДОВАНИЙ ПРИ РАКЕ ТОЛСТОЙ КИШКИ НА ASCO 2024
На больших онкологических конгрессах основное место в докладах занимают результаты исследований новых молекул, дорогостоящих и пока мало применимых, но прорывных технологий лекарственной терапии...

НОВОСТИ ASCO 2024 / ТОРАКАЛЬНАЯ ОНКОЛОГИЯ: СОВРЕМЕННЫЕ ВОЗМОЖНОСТИ И НЕРАЗРЕШЕННЫЕ ВОПРОСЫ
Мелкоклеточный рак легкого (МРЛ), в отличие от немелкоклеточного, не обладает большим разнообразием применяемых лечебных подходов. Стандартом лечения у большинства больных с локализованными стадиями остается...
НОВОСТИ ASCO 2024 / ПО СЛЕДАМ ASCO 2024: ИССЛЕДОВАНИЕ CROWN
Одним из главных событий конференции ASCO 2024 стала публикация долгожданных результатов исследования CROWN, направленного на сравнение эффективности лорлатиниба и кризотиниба в первой линии лечения пациентов с распространенным немелкоклеточным раком легкого (НМРЛ) и активирующей мутацией ALK...
Анонс
-

12-14 НОЯБРЯ 2024
XVIII РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС 2024
Москва
-

11-14 сентября 2024 г. Holiday Inn Sokolniki (г. Москва)
ШКОЛА НАУЧНЫХ ИССЛЕДОВАНИЙ ДЛЯ МОЛОДЫХ ОНКОЛОГОВ
участие бесплатное грант на исследование
Дорогие коллеги, дорогие друзья!
Первый летний месяц оказался чрезвычайно богатым на научные мероприятия различного уровня,
среди которых ежегодный конгресс ASCO, без сомнения, является наиболее ожидаемым и насыщенным. Июньский номер газеты полностью посвящен
обзору исследований, представленных на конгрессе;
наши эксперты отобрали наиболее интересные и обсуждаемые из них для своих статей, снабдив обзоры
оригинальными слайдами презентаций. Еще немало
публикаций по результатам этих исследований нас
ждет впереди – но пищу для размышлений мы с вами
уже получили. Посмотрим, как новые данные отразятся на нашей практической деятельности и насколько они изменят существующие рекомендации.
В конце июня состоялись еще две конференции международного уровня – ESMO GYN и ESMO GI, посвященные проблемам лечения больных с опухолями женской половой сферы и ЖКТ. Краткие обзоры
вы уже можете видеть на сайте и в Telegram канале
RUSSCO, а также в следующем, июльском, номере газеты. Оставайтесь с нами!
Лето завладело нами полностью, мы приблизились к
пику этого времени года – и, как всегда, с сожалением
отмечаем, как быстро летят летние дни!.. Тем не менее, будем же наслаждаться каждой минутой, впитывать солнце, тепло и краски лета каждой клеточкой,
чтоб их хватило на долгие осень и зиму, чтоб это лето
вновь не пролетело незамеченным!..
Хорошего отдыха тем, кто уже в отпуске!
Ваша команда RUSSCO
Данте Габриэль Россетти.
Святая лилия. 1874. Холст, масло. 48,3 × 45,7 см
Британская галерея Тейт, Лондон

Наум Коржавин. 1972
***
Уже июнь. Темней вокруг кусты.
И воздух — сух. И стала осень ближе.
Прости меня, Господь… Но красоты
Твоей земли уже почти не вижу.
Всё думаю, куда ведут пути,
Кляну свой век и вдаль смотрю несмело,
Как будто я рождён был мир спасти,
И до всего другого нет мне дела.
Как будто не Тобой мне жизнь дана,
Не Ты все эти краски шлешь навстречу…
Я не заметил, как прошла весна,
Я так зимы и лета не замечу.
НОВОСТИ ASCO 2024 / ASCO 2024: МЕТАСТАТИЧЕСКИЙ РАК МОЛОЧНОЙ ЖЕЛЕЗЫ
Автор: Тюляндин Сергей Алексеевич
Заслуженный деятель науки РФ, главный научный сотрудник отделения
противоопухолевой лекарственной терапии №2 ФГБУ «НМИЦ онкологии им. Н.Н. Блохина»
Минздрава России, член правления RUSSCO, профессор, доктор медицинских наук, Москва
Не оставляет сомнения, что состоявшийся конгресс отмечен широким наступлением конъюгатов моноклональных антител и цитостатиков (ADC – antibodydrug conjugate) в терапии РМЖ. Не все попытки назначения ADC и их комбинирования с другими препаратами увенчались успехом, но нельзя не видеть постепенную и уверенную замену стандартной химиотерапии на конъюгаты при лечении метастатического РМЖ.
Abstract 1005
Энфортумаб-ведотин (ЭФ) –
ADC, в котором моноклональное
антитело связывается с белком
нектин-4 на мембране опухолевой клетки, а цитостатик ведотин
блокирует работу топоизомеразы
I. Клетки РМЖ, принадлежащие
к тройному негативному и люминальному фенотипам, экспрессируют белок нектин-4 на своей
мембране, что предполагало перспективность назначения ЭФ в
этой популяции больных. Ранее
ЭФ продемонстрировал высокую
противоопухолевую активность
у больных раком мочевого пузыря и был зарегистрирован FDA по
этому показанию. В исследование
II фазы включались больные, получившие не более 2 линий химиотерапии по поводу метастатического процесса. Повторить такой
успех у больных РМЖ не получилось: объективный ответ зарегистрирован у 15,6% и 19% больных с люминальным и тройным
негативным фенотипом соответственно и медианой времени до
прогрессирования (PFS) 5,5 и 3,5
мес. соответственно. Сомнительно, что полученные результаты
будут стимулировать дальнейшее
изучение ЭФ у больных РМЖ.
Abstract LBA 1004
На этапе предклинических исследований был обнаружен синергетический противоопухолевый эффект ADC и ингибиторов
контрольных точек иммунного
ответа. Повреждение опухолевой ДНК, вызванное воздействием ADC, запускает активацию
сигнального пути STING, ответственного за продукцию гамма
интерферона, который в свою
очередь повышает цитотоксичность эффекторных Т-клеток,
ответственных за реализацию
противоопухолевого иммунитета, и уменьшает число регуляторных T-лимфоцитов, его подавляющих. Сацитузумаб говитекан
(CГ) – конъюгат моноклонального антитела к рецептору TROP2,
который регулирует кальциевый
обмен в клетках, и ингибитора
топоизомеразы I SN38. Ранее СГ
продемонстрировал высокую
противоопухолевую активность
и был зарегистрирован для лечения больных метастатическим
тройным негативным РМЖ с
прогрессированием после стандартной химиотерапии. С учетом
высокой экспрессии TROP2 на
мембране клеток люминального
РМЖ было проведено рандомизированное исследование II фазы
у больных метастатическим HR+/
HER2- РМЖ c прогрессированием после 1-2 линий гормонотерапии и 1 линии химиотерапии. В
исследование было включено 110
больных, которые были рандомизированы в группу только СГ
или комбинации СГ с пембролизумабом. Медиана PFS составила 8,1 мес. для комбинации и 6,2
мес. для СГ, что соответствует
недостоверному снижению относительного риска прогрессирования на 19% (HR 0,81; p=0,37). В
группе PD-L1-позитивных больных (CPS≥1) медианы PFS составили 11,1 и 6,7 мес. (HR 0,62;
p=0,23) соответственно. Общая
выживаемость существенно не
отличалась в двух группах: 18,6
мес. для комбинации и 18,0 мес.
для СГ. Таким образом, теория
не выдержала испытания практикой, и наши надежды на синергизм противоопухолевого эффекта между ADC и ингибиторами
контрольных точек иммунного
ответа в этой популяции больных
не оправдались.
Abstract 1009
Продолжается победное шествие трастузумаба дерукстекана (ТД) у больных с гиперэкспрессией HER2. Ранее в
исследовании DESTINY-Breast 03
TД продемонстировал большую
противоопухолевую эффективность по сравнению с трастузумабом эмтанзином в качестве второй линии анти-HER2 терапии.
Исследование DESTINY-Breast07
в рамках II фазы изучало эффективность монотерапии ТД и его
комбинации с пертузумабом в качестве первой линии у метастатических HER2-позитивных больных. Разрешалось проведение
нео- и/или адъювантной терапии,
которая должна быть завершена
не менее чем за 12 мес. до начала
терапии ТД. В исследование было
включено 124 больных (табл.1), у
большинства из которых болезнь
впервые диагностирована на этапе диссеминации и характеризовалась наличием экспрессии рецепторов эстрогенов.
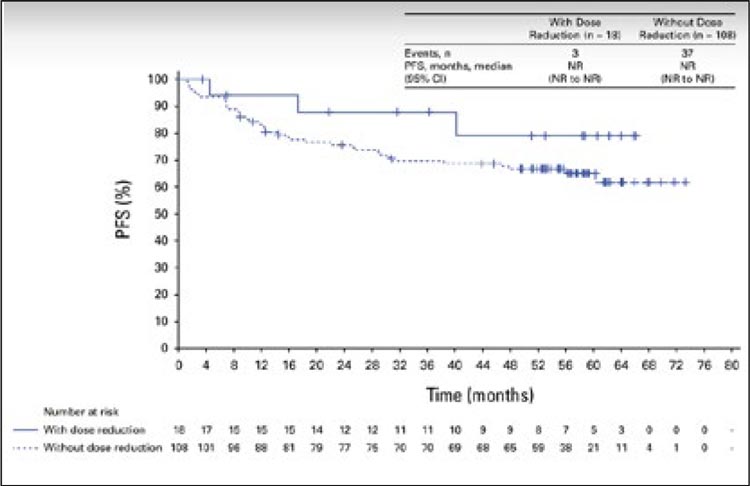
Частота объективного ответа составила 76% и 84% при назначении
ТД в монотерапии и в комбинации
с пертузумабом, одногодичная PFS
– 80,8% и 89,4% соответственно.
Токсичность терапии была ожидаема и контролируема, развитие
пневмонита была отмечено у 14/124
больных (11,2%). Только у одной
больной был зарегистрирован
пневмонит 3 степени. При медиане
времени наблюдения 24 мес. 62,7% и
65% больных продолжают лечение
ТД в монотерапии и в комбинации
соответственно. Высокая эффективность ТД послужила основанием проведения рандомизированного лечения DESTINY-Breast09 по
сравнению комбинации THP (таксотер, трастузумаб, пертузумаб) с
ТД в монотерапии и в комбинации
с пертузумабом в качестве первой
линии лечения метастатического
HER2-позитивного РМЖ. Будем
ждать результатов.
Abstract LBA1000
Ну и, наконец, еще одна победа ТД,
теперь у больных с низкой экспрессией HER2 (low: HER2 1+ и 2+ без амплификации; ultralow: 0, но имеется
слабое окрашивание мембраны менее 10% опухолевых клеток). В популяции больных люминальным РМЖ
частота обнаружения HER2-low и
ultralow составляет 60-65% и 20-25%
соответственно. Для больных метастатическим гормоночувствительным РМЖ сегодня существует эффективная первая линия системной
терапии комбинацией ингибиторов
ароматазы и CDK4/6, обеспечивающей медиану PFS 20 и более месяцев.
Все последующие линии гормонотерапии (фулвестрант + алпелисиб) и
химиотерапии обладают существенно меньшей эффективностью с медианой PFS, не превышающей 6-7
месяцев. Таким образом, существует
объективная потребность разработки новых лечебных подходов в случае в развития гормонорезистентности у больных люминальным РМЖ.
Исследование DESTINY-Breast06 во
многом является повторением одноименного исследования за номером
04, в котором ТД продемонстрировал достоверно большую противоопухолевую активность по сравнению
с химиотерапией по выбору врача у
больных HER2-low люминального
и тройного негативного фенотипов,
что послужило регистрацией ТД
по этому показанию. В исследование DESTINY-Breast06 включались
только больные HR+/HER2 РМЖ с
прогрессированием после 2 и более
линий гормонотерапии, ранее не
получавших химиотерапию, у которых в опухолевой ткани определялась экспрессия HER2- как low, так и
ultralow. В исследование было включено 713 больных с HER2-low и 153
больных с HER2-ultralow, у 30% из
которых диагноз метастатического
РМЖ установлен впервые, 85% имели висцеральные метастазы, медиана
предшествующих линий гормонотерапии составляла 2, 53% пациенток
имели в анамнезе адъювантную химиотерапию. Больные рандомизировались в группу ТД и химиотерапии
по выбору врача: капецитабин (получали 60%), наб-паклитаксел (24%) и
паклитаксел (16%).
При медиане наблюдения 18 мес.
медиана PFS в группе HER2-low составила 13,2 мес. для ТД и 8,1 мес.
для химиотерапии, что соответствует достоверному снижению относительного риска прогрессирования на
38% (HR 0,62; p<0,0001). Для больных
HER2-ultralow ТД увеличил PFS с 8,3
до 13,2 мес. и снизил относительный
риск прогрессирования на 22%. При
данном сроке наблюдения не отмечено достоверных различий в продолжительности жизни в изученных
группах. Частота объективного эффекта для больных с HER2-low составила 56,5% и 32,2% при назначении
ТД и химиотерапии соответственно,
для HER2-ultralow – 61,8% и 26,6%
соответственно. Частота ассоциированных с лечением побочных эффектов 3 и более степени составила 40,6%
в группе ТД и 31,4% в группе химиотерапии, что потребовало отмены ТД
у 14% больных, прерывания лечения
и снижения дозы у 48% и 25% соответственно. Основными побочными эффектами ТД были тошнота и
рвота, слабость и нейтропения. У 49
(11,3%) пациенток зарегистрирован
пневмонит, из них 3 (0,7%) пациентки погибли от этого осложнения. На
основании анализа исследования
DESTINY-Breast06 авторы делают
вывод о высокой противоопухолевой активности ТД, назначение которого является эффективной опцией
лечения больных метастатическим
РМЖ HR+ c экспрессией HER2 low
или ultralow в случае резистентности
к ранее проведенной стандартной
гормонотерапии.
Остается актуальным поиск путей
повышения эффективности гормонотерапии у больных люминальным
метастатическим РМЖ.
Abstract 1003
Больные люминальным РМЖ с
прогрессированием в течение 12
мес. после окончания адъювантной
гормонотерапии демонстрируют
меньшую чувствительность к последующим линиям гормонотерапии.
Для больных с мутацией PIK3CA в
рамках рандомизированного исследования III фазы изучалась комбинация палбоциклиба и фулвестранта
в сочетании с новым ингибитором
PIK3CA инвалисибом или плацебо.
Тройная комбинация с инвалисибом достоверно увеличила медиану
PFS с 7,3 до 15 мес., что соответствует снижению относительного риска
прогрессирования на 57% (HR 0,43;
p<0,0001). Этот выигрыш сочетался
с высокой частотой токсичности 1-3
степени, характерной для ингибиторов PIK3CA: гипергликемия (59%),
диарея (48%), стоматит (52%), кожная сыпь (25%). Несмотря на столь
высокую токсичность, пациенты
дают примерно одинаковую оценку
качества жизни, физической активности и работоспособности в обеих
группах. Возможно, комбинация с
инвалисибом будет еще одной опцией первой линии гормонотерапии
метастатических больных с мутацией PIK3CA, в первую очередь тех, кто
спрогрессировал на фоне адъювантной гормонотерапии или в короткие
сроки после ее окончания. Большинство больных в этом исследовании с
прогрессией после тройной комбинации в дальнейшем получали химиотерапию. Не получится ли, что
существующая стратегия назначения
в первой линии гормонотерапии ингибиторов ароматазы и CDK4/6, c
последующей второй линией комбинацией ингибиторов PIK3CA и фулвестранта, даст более длительный
контроль над болезнью в сравнении
с тройной комбинацией? В данном
исследовании только 17% больных
контрольной группы получили алпелисиб в качестве второй линии
гормонотерапии, что не позволяет
оценить это предположение и, возможно, потребует еще одного клинического исследования.
Abstract LBA 1002
У больных с метастатическим
HER2+/HR+ РМЖ в качестве системной терапии чаще всего используется химиотерапия и антиHER2 терапия с последующей
поддержкой гормонами. Авторы в
рамках рандомизированного исследования II фазы попытались
оценить эффективность комбинации трастузумаба, палбоциклиба и
ингибитора ароматазы экземестана
± выключение функции яичников
в сравнении с химиотерапией по
выбору врача (TDM-1, трастузумаб
с капецитабином или эрибулином)
в качестве второй линии лечения.
Исследование было прекращено
досрочно в связи с плохим набором пациентов. Большинство из
73 включенных больных ранее получили локальное лечение и адъювантную химиотерапию (64%),
имели висцеральные метастазы
(56%) и в качестве первой линии
терапии лечились комбинацией
трастузумаба, пертузумаба с таксанами, TDM-1. Медиана PFS составила 9,1 и 7,7 мес. в экспериментальной и контрольной группах,
что соответствует достоверному
снижению относительного риска
прогрессирования на 48% (HR 0,52;
p=0,03). Частота частичного объективного эффекта составила 19%
и 7%, контроля над заболеванием
– 62% и 64% в экспериментальной
группе и группе химиотерапии соответственно. Побочные эффекты
3-4 степени чаще регистрировали
в экспериментальной группе по
сравнению с контрольной (61% и
50% соответственно) за счет нейтропении, анемии и тромбоцитопении. Изученная комбинация
трастузумаба, палбоциклиба и экземестана не уступает по противоопухолевой активности стандартным режимам химиотерапии при
проведении второй линии системной терапии, например, после комбинации трастузумаба, пертузумаба и таксанов у больных HER2+/
HR+ РМЖ.
Adstract LBA1001
Нужно ли продолжать ингибирование CDK4/6 при проведении
второй линии гормонотерапии,
если прогрессирование наступило
на фоне комбинации ингибиторов
ароматазы и CDK4/6? Это актуально для больных с отсутствием
мутации гена PIK3CA (для этих
больных существует алпелисиб)
или ESR1 (для этих больных на
Западе существует эласцентрант).
Исследования II фазы по продолжению приема палбоциклиба дали
отрицательный ответ, при добавлении рибоциклиба к фулвестранту после комбинации палбоциклиба и ингибиторов ароматазы
медиана PFS была достоверно увеличена с 2,8 до 5,3 мес. В исследовании III фазы postMONARCH 368
больных были рандомизированы
для продолжения гормонотерапии
фулвестрантом или комбинацией
фулвестранта с абемациклибом. В
первой линии 59% больных получали палбоциклиб, 33% – рибоциклиб и 8% абемациклиб. Комбинация достоверно увеличила PFS с
5,3 до 6 мес. (HR 0,73; p=0,02). Наибольший выигрыш от комбинации
получили пациенты, длительно
(более 12 мес.) получавшие первую
линию с включением палбоциклиба и отсутствием висцеральных
метастазов. Можно предположить,
что именно для этой популяции
пациенток может быть оправдано добавление абемациклиба при
проведении второй линии.
Abstract 1021
Больные РМЖ с нарушением гомологичной репарации ДНК вследствие герминальной мутацией генов
BRCA1/2 выигрывают от назначения
PARP-ингибитора олапариба. Будет
ли полезен этот препарат в случае
иных механизмов нарушения этого репаративного пути в опухолевой клетке? В исследовании II фазы
TBCRC048 включались больные
метастатическим РМЖ с соматическими мутациями sBRCA1/2, герминальной мутацией gPALB, мутациями
генов ATM и CHEK2, получившие не
более 1-2 линии системной терапии
(гормональной или химиотерапевтической). Предварительные данные
свидетельствовали об эффективности олапариба при gPALB и sBRCA1/2
и ее отсутствии при мутации АТМ и
СНЕК2. В связи с этим протоколом
предусматривался дополнительный
набор пациентов с gPALB и sBRCA1/2,
результаты лечения которых и были
доложены. В расширенную когорту
включено 24 больных с gPALB2, у 18
(75%) которых на фоне лечения олапарибом отмечен объективный противоопухолевый эффект (1CR, 17PR),
медиана времени до прогрессирования составила 9,6 мес. У 30 больных
(15 sBRCA1 и 15 sBRCA2) частота
объективного эффекта составила 37%
(1 CR, 10 PR) c медианой PFS 7,2 мес.
Авторы делают вывод о клинически
значимой противоопухолевой активности олапариба у больных с наличием gPALB и sBRCA1/2 и необходимости тестирования для определения
этих биомаркеров.
Abstract 1014
Сегодня при проведении первой линии гормонотерапии метастатического люминального рака молочной
железы рекомендовано добавление
одного из ингибиторов CDK4/6: рибоциклиба, абемациклиба или палбоциклиба. Достоверное увеличение
медианы PFS и OS при назначении
их комбинаций с ингибиторами ароматазы было доказано в больших
рандомизированных исследованиях,
с одним исключением: палбоциклиб
достоверно увеличил только медиану
PFS, но не OS. Но это в рандомизированных исследованиях, куда включаются больные по строгим критериям,
которые не всегда соответствуют характеристикам пациенток, которых
мы лечим в реальной клинической
практике. Именно поэтому огромное
значение имеет изучение эффективности этих препаратов вне рамок
клинических исследований. С этой
целью в Италии проведено изучение
результатов лечения больных метастатическим HR+/HER2- РМЖ, получавших гормонотерапию первой линии
с включением ингибиторов CDK4/6 в
рутинной практике. В случае прогрессирования в качестве второй линии
гормонотерапии был назначен фулвестрант. В исследование PALMARES-2
было включено 1850 пациенток, которым проводили лечение палбоциклибом (750 больных), рибоциклибом (676) или абемациклибом (424).
Медиана PFS для всех включенных в
исследование больных составила 34,9
мес., что на 9-10 мес. продолжительнее PFS в регистрационных исследованиях этих препаратов. Это особая
чувствительность итальянок к гормонотерапии? Или поздняя диагностика прогрессирования, искусственно
увеличивающая продолжительность
PFS? Медиана общей выживаемости составила 66,6 мес. Показано, что
абемациклиб и рибоциклиб в сравнении палбоциклибом достоверно
снижают риск прогрессирования на
29% (HR 0,71; p=005) и 19% (HR 0,81;
p=0,048) соответственно, в то время
как разница между ними недостоверна. Обнаружено, что абемациклиб и
рибоциклиб эффективнее у больных
с люминальным В фенотипом и у пременопаузальных больных, при de novo
метастатическом РМЖ. Абемациклиб
эффективнее палбоциклиба при наличии метастазов в печени. У больных
пожилого возраста и наличии метастазов в кости все 3 препарата демонстрировали равную эффективность.
Таким образом, предварительные результаты исследования PALMARES-2
свидетельствуют о большей эффективности абемациклиба и рибоциклиба в сравнении с палбоциклибом
в реальной клинической практике при
проведении первой линии гормонотерапии у больных метастатическим
HR+/HER2- РМЖ у больных с неблагоприятным прогнозом. При этом все
три препарата демонстрируют равную
эффективность у больных пожилого
возраста и у больных с только метастатическим поражением скелета
RUSSCO ОБ ИЗМЕНЕНИЯХ В ОНКОЛОГИИ В 2024 ГОДУ
7 июня Российское общество клинической онкологии (RUSSCO)
провело в Москве конференцию
«Лучшее по материалам конференции ASCO», которая рассмотрела
вопросы, касающиеся лечения
рака молочной железы, сарком,
опухолей головы и шеи, рака толстой и прямой кишки и др., а также
поддерживающей терапии.
Конференция началась с обсуждения рака молочной железы, в частности, что изменилось в практике
с ASCO/ESMO 2023 г. и какова значимость полученных результатов
для нашей клинической практики?
Открывая сессию, Сергей Алексеевич Тюляндин, член Правления
RUSSCO, главный научный сотрудник отделения противоопухолевой
лекарственной терапии №2 ФГБУ
«НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, профессор,
д.м.н., сказал, что конгресс ASCO –
своего рода ориентир для онкологов
из любой страны, а для RUSSCO –
еще и возможность сверить результаты исследований, доложенных
там, с собственными практическими рекомендациями.

А член Правления RUSSCO, заместитель директора ГБУЗ «Московский клинический научный центр
им. А.С. Логинова ДЗМ», член-корр.
РАН, д.м.н. Людмила Григорьевна
Жукова добавила: «Хотя по раку
молочной железы прорыва не случилось, но интересные результаты
на ASCO докладывались. О них сегодня и пойдет речь, ведь в любом
случае наша конференция проводится для удобства отечественных
онкологов, являясь обзорной, дополняющей картину научных событий и в других нозологиях».
Из докладов коллег из Москвы и
Санкт-Петербурга участники конференции смогли получить подробные обзоры и анализ результатов
исследований по метастатическому
и раннему РМЖ, а также нескольких исследований, продемонстрировавших эффективность лечения
пациенток в период их беременности.
Затем председатель RUSSCO, зав.
отделением противоопухолевой лекарственной терапии ФГБУ «Центральная клиническая больница с
поликлиникой» Управления делами
Президента РФ, проф., д.м.н. Дмитрий Александрович Носов сообщил, что в сфере лечения рака почки на ASCO в основном говорилось
о дальнейшем развитии уже существующих исследований, после чего
и о них, и об исследованиях рака мочевого пузыря и предстательной железы обзорно рассказали Э.Р. Исраелян, врач-онколог онкологического
отделения лекарственных методов
лечения (химиотерапевтическое)
№4 ФГБУ «НМИЦ онкологии им.
Н.Н. Блохина» Минздрава России,
и М.И. Волкова, врач онкологического отделения №8 Онкологического центра №1 ГКБ им. С.С. Юдина
ДЗМ, д.м.н.
Докладывая о саркомах мягких тканей, Николай Владимирович Жуков,
руководитель отдела междисциплинарной онкологии ФГБУ «НМИЦ
Детской гематологии, онкологии
и иммунологии им. Д. Рогачева»,
проф., д.м.н., отметил, что на ASCO
в этот раз прошло сразу 9 сессий
по данной теме, но информации,
способной повлиять на изменение
клинической практики, фактически
не оказалось. При этом достаточное
количество исследований было посвящено прогнозам на будущее.

Присутствующие специалисты сошлись в единодушном мнении, что
результаты, доложенные на ASCO
в этом году, следует считать своего
рода «затишьем перед бурей», то
есть перед прорывными результатами, ожидаемыми в ближайшее
время не только в лечении упомянутых ЗНО, но и опухолей гепатобилиарной зоны, онкогинекологии:
рака яичников, тела и шейки матки,
а также других нозологий.
Развернутые результаты исследований и комментарии экспертов
можно будет получить из записей
конференции, которые в ближайшее время планируется разместить
на сайте RosOncoWeb.ru.
ВТОРОЙ МОЛОДЕЖНЫЙ ОНКОЛОГИЧЕСКИЙ САММИТ ПРОШЕЛ В МОСКВЕ
Молодежный комитет RUSSCOjr
Российского общества клинической
онкологии провел 8 июня в Москве
Второй молодежный онкологический саммит, во главе угла которого
оказались критичное отношение к
инновациям, эмоциональные дискуссии оптимистов и скептиков от
онкологической науки.

Как сообщил член правления
RUSSCO, председатель Комитета
молодых онкологов RUSSCOjr, зав.
отделением лекарственных методов
лечения злокачественных опухолей
№4 НИИ клинической онкологии
ФГБУ «НМИЦ онкологии им. Н.Н.
Блохина» Минздрава России, к.м.н.
Алексей Александрович Румянцев:
«Своим отношением к инновационным опциям терапии, появившимся
за последнее время, поделились молодые специалисты по лечению онкоурологических заболеваний (Э.Р.
Исраелян), рака молочной железы
(К.С. Гречухина), рака легкого (А.С.
Данилова).

Огромное внимание было уделено проблемам лечения онкологических пациентов, оказавшихся на завершающем этапе своего жизненного пути, во время сессии «Лечить нельзя помиловать» (совместное председательство онкологов Е.В. Глазковой и В.И. Евдокимова и онкопсихолога М.В. Решетникова). На ней обсуждались стратегии сообщений плохих новостей пациентам и их родственникам, острые вопросы того, как долго нужно лечить пациентов с неизлечимыми заболеваниями и тяжелыми состояниями. Поднимались и проблемы современных клинических исследований – почему иногда научные работы завершаются невнятными результатами?»
Кроме того, молодые ученые обсудили проект RUSSCO по разработке
критериев оценки клинической эффективности противоопухолевых
препаратов.
НОВОСТИ ASCO 2024 / РАК ПОЧКИ. БЕЗ ПАНИКИ! АВЕЛУМАБ С АКСИТИНИБОМ НЕ УЛУЧШИЛИ ОБЩУЮ ВЫЖИВАЕМОСТЬ ПАЦИЕНТОВ С МЕТАСТАТИЧЕСКИМ РАКОМ ПОЧКИ
Автор: Тимофеев Илья Валерьевич
Директор Бюро по изучению рака
Прогресс в лечении метастатического почечноклеточного
рака (ПКР) очевиден: значимый
вклад привнесла первая линия
иммунотаргетной и двойной иммунотерапии, эффективные последующие линии сглаживают
изначальные недостатки, терапия становится универсальной,
подходящей любому пациенту.
На ASCO 2024 были представлены результаты более глубокого и
длительного изучения имеющихся опций.
Окончательные долгожданные
результаты общей выживаемости
(ОВ) и выживаемости без прогрессирования (ВБП) пациентов
с метастатическим светлоклеточным ПКР, получавших в первой
линии терапии авелумаб в комбинации с акситинибом в исследовании Javelin Renal 101, были
представлены на устной сессии
[1]. Из всех вариантов иммунотаргетной терапии в этом исследовании был самый долгий период наблюдения – более 5 лет.
Несмотря на некоторые преимущества в абсолютных цифрах,
комбинация не привела к статистически значимому улучшению
ОВ по сравнению с монотерапией
сунитинибом. Так, в популяции
ITT медиана ОВ составила 44,8
месяца в группе авелумаб + акситиниб и 38,9 месяца в группе
сунитиниба (HR=0,88). Среди пациентов с PD-L1-положительным
статусом медиана ОВ составила
43,2 и 36,2 месяца (HR=0,86) соответственно. При этом профессор
Motzer с соавторами продемонстрировал значительное увеличение ВБП и частоты объективных
и стойких ответов в группе пациентов, получавших авелумаб и
акситиниб.
Стоит ли нам расстроиться и запаниковать? Точно нет!
Во-первых, ничего неожиданного не произошло. Для всех
иммунотаргетных комбинаций
отношение рисков (HR) смерти
вращается вокруг 0,8 [2-4]. Для
комбинаций авелумаба или пембролизумаба с акситинибом уже
известна 5-летняя общая выживаемость, превышающая 30%. У
нас не было таких данных в эпоху
ингибиторов тирозинкиназы, и
эти улучшения связаны с компонентом иммунотерапии.
Во-вторых, большинство противоопухолевых препаратов, для
которых данные по ОВ были незрелыми на момент одобрения
FDA, не продемонстрировали
значительного улучшения ОВ
после одобрения и длительного
наблюдения [5]. Соответственно,
данная комбинация не стала исключением.
В-третьих, в исследовании Javelin Renal 101 наблюдалось достоверное снижение риска прогрессирования болезни на 34% при терапии авелумабом и акситинибом, что привело к почти трехкратному увеличению числа пациентов, остающихся без прогрессирования в течение 5 лет, по сравнению с сунитинибом. Ответ на лечение наблюдался более чем у половины больных, получавших комбинацию, что было в два раза выше, чем в группе сунитиниба. Таким образом, улучшение ОВ определенно не связано с самим сунитинибом в первой линии. Почему же тогда результаты ОВ достоверно не отличались? Сходство кривых ОВ с большой вероятностью можно объяснить тем, что пациенты в обеих группах в случае прогрессирования получали эффективную последующую терапию, которая и улучшила ОВ, как было продемонстрировано в исследованиях CheckMate 025 и METEOR [6,7]. Напомню, что в регистрационном исследовании самого сунитиниба медиана ОВ составила 26,4 месяца [8]. Сейчас мы получили значение – 38,9 месяца. За эти годы сунитиниб стал лучше работать? Вряд ли. За эти годы появились эффективные последующие линии – ниволумаб, кабозантиниб, ленватиниб + эверолимус.
В исследовании Javelin Renal
101 половина пациентов, получавших сунитиниб, перешла на
ингибиторы контрольных точек
(ниволумаб), а другая половина
— на таргетные препараты. При
прогрессировании болезни на
авелумабе и акситинибе ингибиторы VEGF(R) назначались в половине случаев, но последующая
иммунотерапия – лишь в 19% по
понятным причинам. При сопоставлении групп по последующей
терапии ингибиторами PD-1(L1)
кривые Каплана-Мейера разошлись в пользу авелумаба и акситиниба (HR=0,76)!
Более того, эта идея подтверждается результатами в подгруппе с плохим прогнозом, где риск
смерти пациентов на иммунотаргетной терапии был достоверно
снижен на 43% (p=0,0076), а ОВ
увеличилась вдвое по сравнению
с группой, принимавшей только
сунитиниб. Можно предположить, что пациенты с изначально плохим прогнозом с меньшей
вероятностью получат последующие линии терапии, что подчеркивает существенный вклад первой линии.
Следовательно, наличие эффективных вариантов последующей
терапии в рутинной практике,
безусловно, полезно, но их влияние в рандомизированных исследованиях, где изучается первая линия, нельзя игнорировать.
Вот почему ОВ, на мой взгляд, не
является адекватной первичной
конечной точкой в таких исследованиях. Лично я твердо уверен,
что ОВ должна быть вторичной
конечной точкой в эпоху эффективных последующих линий. Однако, если мы всё же стремимся
продемонстрировать разницу в
ОВ в качестве первичной конечной точки в исследовании терапии первой линии, нам следует
выбрать дизайн исследования с
заранее запланированными последующими линиями терапии.
Примеры включают исследование SWITCH, исследование
RECORD-3 или исследование
DremSeq для меланомы [9-11]. Такой подход гарантирует, что когорты будут хорошо сбалансированы по последующей терапии, и
обеспечивает более четкое понимание воздействия каждой линии
лечения на ОВ.
Итак, призываю не паниковать и
продолжить применение иммунотаргетной терапии в первой
линии с переходом на эффективные последующие линии в случае
прогрессирования болезни в рутинной практике. Этот подход в
конечном итоге приведет к тому,
что больше пациентов останется
без прогрессирования и проживет более пяти лет, как мы видим
в исследовании Javelin Renal 101.
Источники:
- Motzer RJ, Penkov K, Uemura H, et al. Avelumab + axitinib vs sunitinib in patients (pts) with advanced renal cell carcinoma (aRCC): Final overall survival (OS) analysis from the JAVELIN Renal 101 phase 3 trial. 2024 ASCO Annual Meeting, abstract 4508.
- Rini BI, Plimack ER, Stus V, et al. Pembrolizumab plus axitinib versus sunitinib as first-line therapy for advanced clear cell renal cell carcinoma: 5-year analysis of KEYNOTE-426. J Clin Oncol. 2023; 41 (suppl 17; abstr LBA4501).
- Motzer RJ, Porta C, Eto M, et al. Lenvatinib Plus Pembrolizumab Versus Sunitinib in First-Line Treatment of Advanced Renal Cell Carcinoma: Final Prespecified Overall Survival Analysis of CLEAR, a Phase III Study. J Clin Oncol. 2024 Apr 10; 42(11): 1222-1228.
- Powles T, Burotto M, Escudier B, et al. Nivolumab plus cabozantinib versus sunitinib for first-line treatment of advanced renal cell carcinoma: extended follow-up from the phase III randomised CheckMate 9ER trial. ESMO Open. 2024 Apr 19; 9(5): 102994.
- Naci H, Zhang Y, Woloshin S, et al. Overall survival benefits of cancer drugs initially approved by the US Food and Drug Administration on the basis of immature survival data: a retrospective analysis. Lancet Oncol. 2024 May 13; S1470-2045(24)00152-9.
- Motzer RJ, Escudier B, George S, et al. Nivolumab versus everolimus in patients with advanced renal cell carcinoma: Updated results with longterm follow-up of the randomized, open-label, phase 3 CheckMate 025 trial. Cancer. 2020 Sep 15; 126(18): 4156-4167.
- Choueiri TK, Escudier B, Powles T, et al. Cabozantinib versus everolimus in advanced renal cell carcinoma (METEOR): final results from a randomised, open-label, phase 3 trial. Lancet Oncol. 2016 Jul; 17(7): 917-927. doi: 10.1016/S1470-2045(16)30107-3.
- Motzer RJ, et al. Overall Survival and Updated Results for Sunitinib Compared With Interferon Alfa in Patients With Metastatic Renal Cell Carcinoma. J Clin Oncol. 2023 Apr 10; 41(11): 1965-1971.
- Eichelberg C, Vervenne WL, De Santis M, et al. SWITCH: A Randomised, Sequential, Open-label Study to Evaluate the Efficacy and Safety of Sorafenib-sunitinib Versus Sunitinib-sorafenib in the Treatment of Metastatic Renal Cell Cancer. Eur Urol. 2015 Nov; 68(5): 837-47.
- Knox JJ, Barrios CH, Kim TM, et al. Final overall survival analysis for the phase II RECORD-3 study of firstline everolimus followed by sunitinib versus first-line sunitinib followed by everolimus in metastatic RCC. Ann Oncol. 2018 Nov 1; 29(11): 2269. 11.Atkins MB, Lee SJ, Chmielowski B, et al. Combination Dabrafenib and Trametinib Versus Combination Nivolumab and Ipilimumab for Patients With Advanced BRAF-Mutant Melanoma: The DREAMseq TrialECOG-ACRIN EA6134. J Clin Oncol. 2023 Jan 10; 41(2): 186-197
НОВОСТИ ASCO 2024 / РАК МОЧЕВОГО ПУЗЫРЯ
Автор: Гречухина Катерина Сергеевна
Заведующая химиотерапевтическим отделением
ГБУЗ «Московский клинический научный центр
им. А.С. Логинова», к.м.н., Москва
Третий и четвертый дни ASCO 2024
ознаменовались устной и постерной
сессиями, посвященными лечению
уротелиального рака. Основные герои на арене – конечно, ингибиторы
контрольных точек иммунитета и
конъюгаты.
Рисунок 1.
Дизайн исследования CheckMate901.
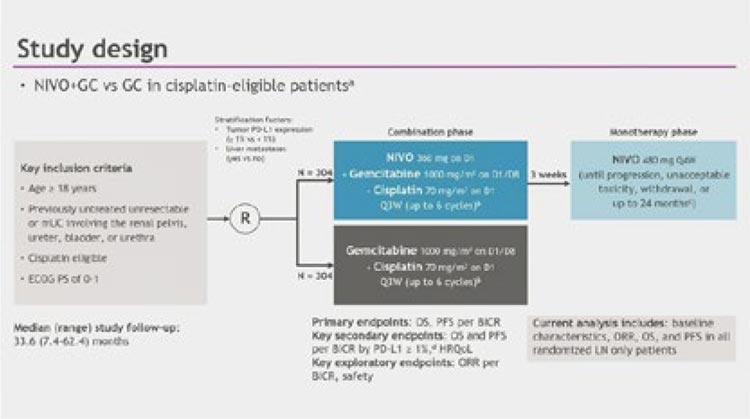
Были представлены данные апостериорного анализа пациентов, достигших полного ответа, в исследовании CheckMate901 с последующим дополнительным анализом пациентов, у которых наблюдалось изолированное поражение лимфатических узлов [1]. Напомним, что в этом исследовании оценивалась эффективность upfront комбинации ниволумаб + GC (гемцитабин-цисплатин) в терапии нерезектабельного уротелиального рака. Дизайн схематично представлен на рисунке 1.
Ранее представленные данные демонстрировали значимое преимущество в общей (HR 0,78; 95% CI 0,63-0,96; p=0,02) и выживаемости без прогрессирования (HR 0,72; 95% CI 0,59-0,88; p=0,001). Одной из конечных точек в исследовании стала оценка частоты объективного ответа, которая достигла 57,6% в группе Ниво+GC (в сравнении с 43,1% в группе GC). На ASCO 2024 был представлен дополнительный post hoc анализ. При окончательном анализе оказалось, что полный ответ был достигнут у 16,8% пациентов в обеих группах.
Рисунок 2.
Характеристика пациентов, достигших полного
ответа в исследовании CheckMate901
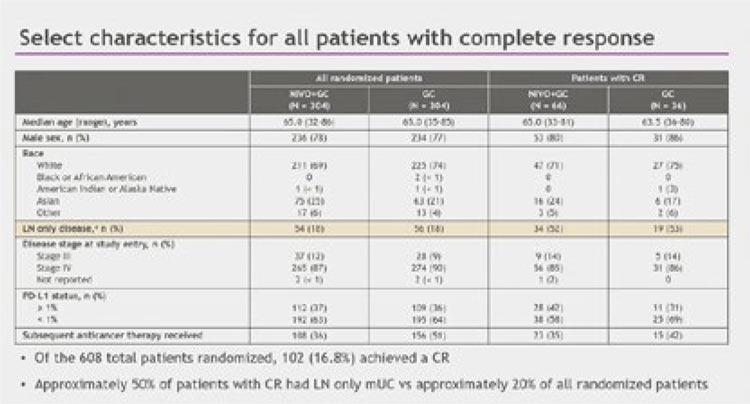
Среди них изолированное поражение лимфатических узлов было отмечено более чем у половины пациентов в обеих группах: 51,5% в группе Ниво+GC и 52,8% в группе GC (рис.2). Был проведен эксплораторный анализ, характеристики пациентов с изолированным поражением лимфатических узлов представлены на рисунке 3.
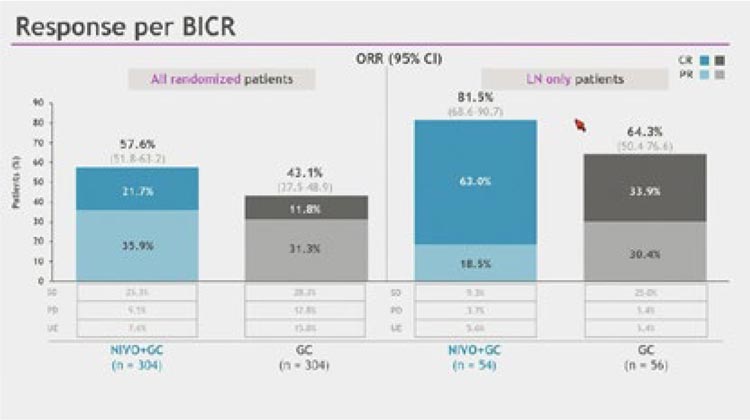
Среди всех включенных в исследование пациентов с изолированным
поражением лимфатических узлов
54 получили комбинированную
терапию (Ниво+GC) и 65 – химиотерапию GC (рис.4). В подгруппе
lymph-node only частота объективного ответа составила 81,5% (95% CI
68,6-90,7) в группе Ниво+GC против
64,3% (95% CI 50,4-76,6%) в группе
GC. Частота достижения полного ответа также была в пользу комбинированной группы и составила 63,0%
и 33,9% соответственно.
Рисунок 3.
Избранные характеристики пациентов
с изолированным поражением лимфатических узлов
в исследовании CheckMate901.
Рисунок 4.
Частота достижения объективного ответа во всей
популяции и среди пациентов с изолированным поражением
лимфатических узлов в исследовании CheckMate901.
Безусловно, локализация метастатического поражения лимфатических узлов также может являться
независимым неблагоприятным
прогностическим и предиктивным
фактором. Как продемонстрировано на рисунке 5, исследователи распределили пациентов с lymph-node
only болезнью на три группы: с вовлечением тазовых, забрюшинных
и отдаленных лимфоузлов. Частота
достигнутого объективного ответа
была сопоставима между группами:
79,4%, 76,7% и 80,0% соответственно.
Однако при этом частота полного ответа была выше в пользу тазовых и
забрюшинных лимфоузлов: 61,8% и
63,3%, тогда как при поражении отдаленных лимфоузлов она составила
40,0%.
Рисунок 5.
Частота достижения объективного ответа
в зависимости от локализации метастатических
лимфоузлов в исследовании CheckMate901.
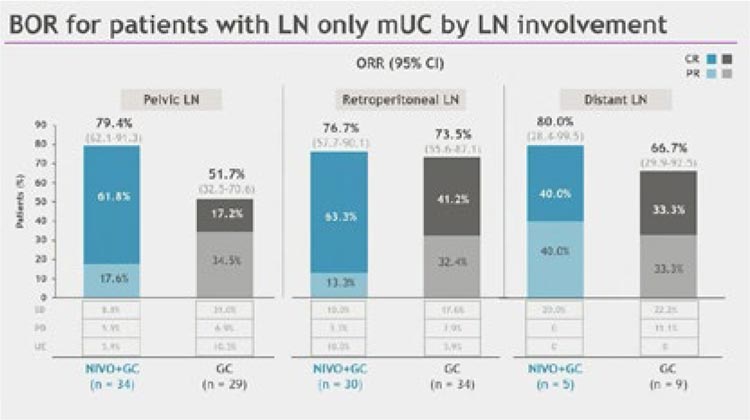
Рисунок 6.
Интервал без лечения среди подгрупп пациентов
с изолированным вовлечением лимфоузлов и достигших
полного ответа в исследовании CheckMate901.
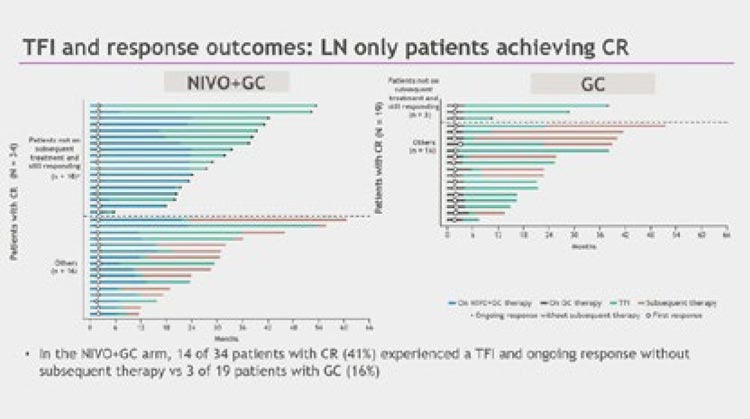
Также был представлен анализ длительности интервала без лечения у
пациентов с изолированным поражением лимфоузлов и достигших
полного ответа. Добавление ниволумаба к режиму GC позволило дать
«передышку» в терапии 41% пациентов против 16% в группе GC (рис.6).
В анализируемых подгруппах медиана времени до достижения полного
ответа была практически одинаковой и составила приблизительно 2
месяца. При этом медиана длительности ответа не была достигнута
в группе Ниво+GC в сравнении с
8,7 месяца в рукаве GC. Частота достижения полного ответа через 12
месяцев от старта терапии в группе
ниволумаба более чем в два раза
превысила этот показатель в группе
GC: 70% vs 32%, что дополнительно
указывает на важную роль ниволумаба в увеличении длительности
ответа.
Медиана общей выживаемости в
группе пациентов с изолированным
поражением лимфатических узлов
составила 46,3 (95% CI 24,0-НД)
мес. в группе Ниво+GC против 24,9
(95% CI 21,4-29,9) мес. в группе GC
(HR 0,58; 95% CI 0,34-1,00) (рис.7).
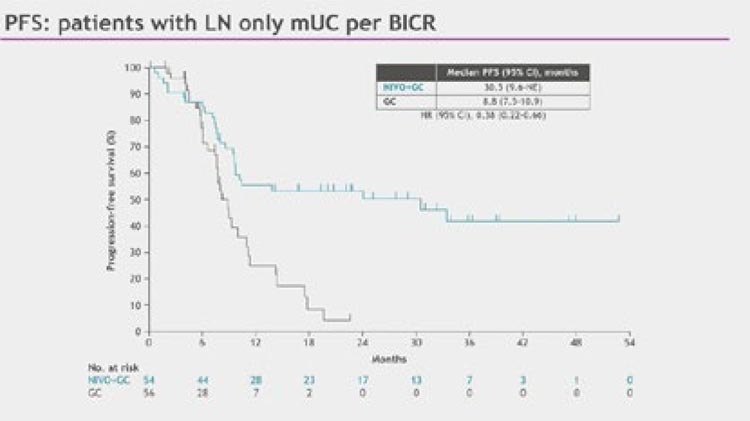
Медиана выживаемости без прогрессирования в lymph-node only
популяции пациентов составила
30,5 (95% CI 9,6-НД) мес. в группе
с добавлением ниволумаба против
8,8 (95% CI 7,5-10,9) мес. в группе
без него (HR 0,38; 95% CI 0,22-0,66)
(рис.8).
Рисунок 7.
Общая выживаемость среди пациентов
с изолированным вовлечением лимфоузлов в исследовании
CheckMate901.
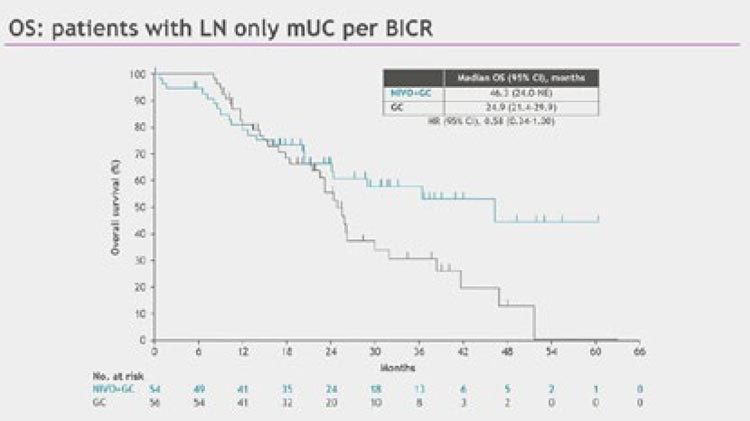
Рисунок 8.
Медианы выживаемости без прогрессирования
среди пациентов с изолированным вовлечением лимфоузлов
в исследовании CheckMate901.
Таким образом, даже без проведения дополнительного однофакторного анализа становится очевидным, что изолированное поражение
лимфатических узлов является благоприятным прогностическим фактором, поскольку более половины
пациентов, достигших полного ответа в исследовании CheckMate901,
были именно с таким распространением. Добавление ниволумаба
позволило увеличить длительность
контроля над заболеванием, что экстраполировалось с увеличением
медианы общей выживаемости и
выживаемости без прогрессирования.
ASCO 2024 не оставил без внимания и авелумаб, а точнее отдаленные результаты пациентов с небольшой опухолевой нагрузкой,
которые получили лечение в рамках исследования JAVELIN Bladder
100 (post hoc анализ) [2]. Показано, что небольшая опухолевая нагрузка является независимым предиктивным фактором ответа на
иммунотерапию. Под «небольшой
опухолевой нагрузкой» понимали либо отсутствие висцеральных
метастазов, либо изолированное
поражение лимфатических узлов
на момент рандомизации. Во всех
подгруппах была продемонстрирована схожая медиана общей выживаемости: при невисцеральной
локализации 31 против 17 мес.,
при изолированном поражении
лимфоузлов – 32 против 23 мес.,
при тазовой/забрюшинной локализации лимфоузлов – 31 против
20 мес. (рис.9). Очевидно, что преимущество также экстраполировалось и на выживаемость без прогрессирования. Новых сигналов по
безопасности получено не было.
Рисунок 9.
Общая выживаемость в post hoc анализе JAVELIN Bladder 100 в зависимости от локализации
метастатического поражения лимфатических узлов.
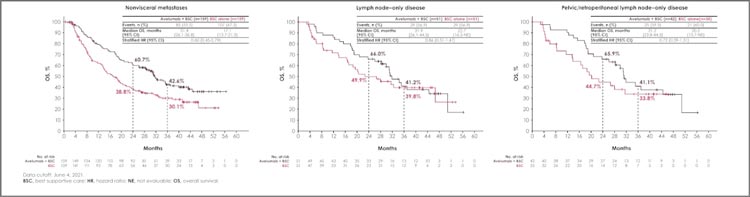
Рисунок 10.
Медиана общей выживаемости, ранее
представленная в исследовании EV-302.
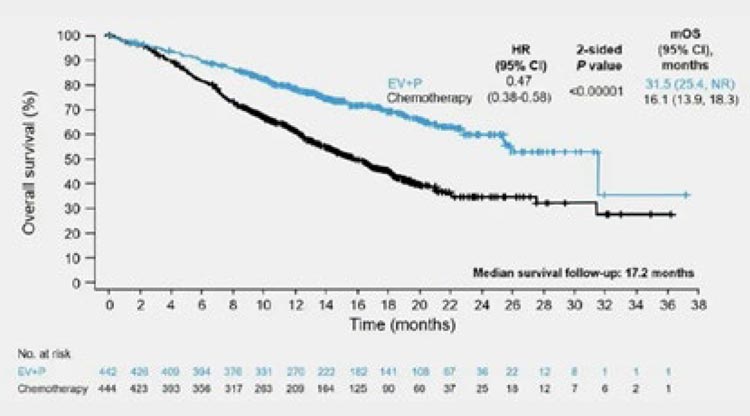
Целый ряд исследований, представленных на ASCO 2024, был посвящен
изучению энфортумаба ведотина
(EV). Напомним, что результаты исследования EV-302 перевернули золотой стандарт первой линии терапии
распространенного уротелиального
рака (рис.10), снизив относительный
риск смерти на 53% (HR 0,47; 95% CI
0,38-0,58) при назначении комбинации энфортумаб ведотина и пембролизумаба в сравнении с классическим
режимом GC/GemCarb.
Согласно дизайну исследования, пациенты рандомизировались в два рукава в соотношении 1:1 в группу EV
+ пембролизумаб либо в группу платиносодержащей химиотерапии (GC
или GemCarb).
Был представлен подгрупповой анализ пациентов в зависимости от их
возможности получать цисплатинсодержащую химиотерапию в исследовании EV-302 (n=408 так называемых cisplatin-ineligible и n=478
cisplatin-eligible) [3,4]. В сравнении с
популяцией ITT пациенты, не подходящие для терапии цисплатином,
были старше, имели худший соматический статус по шкале ECOG, также
среди них было больше пациентов с
локализацией первичной опухоли в
верхней отделах мочевыводящих путей.
Вновь был сделан акцент на критериях невозможности терапии цисплатином. Большая часть пациентов не
могла получать цисплатин в связи с
изначально сниженной скоростью
клубочковой фильтрации менее 60
мл/мин (83,6%); кроме этого, причинами стали потеря слуха 2 и более степени, ECOG2, сердечная недостаточность и комбинация этих факторов. В
результате 97,6% пациентов, которым
не могла проводиться терапия цисплатином, получили карбоплатин.
В группе cisplatin-ineligible в сравнении с химиотерапией комбинация
EV+Пембро позволила увеличить
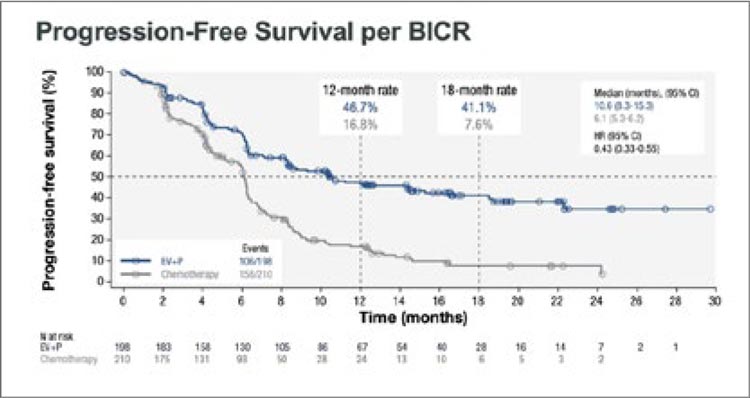
медиану выживаемости без прогрессирования с 6,1 до 10,6 мес. (0,43; 95%
CI 0,33-0,55; p<0,00001), график представлен на рисунке 11.
Рисунок 11.
Выживаемость без прогрессирования в группе
cisplatin-ineligible в исследовании EV-302.
Медиана общей выживаемости не была достигнута в группе
EV+Пембро, при этом данный показатель в группе химиотерапии составил 12,7 (95% CI 11,4-15,5) мес.
(HR 0,43; 95% CI 0,31-0,59; p<0,00001)
(рис.12).
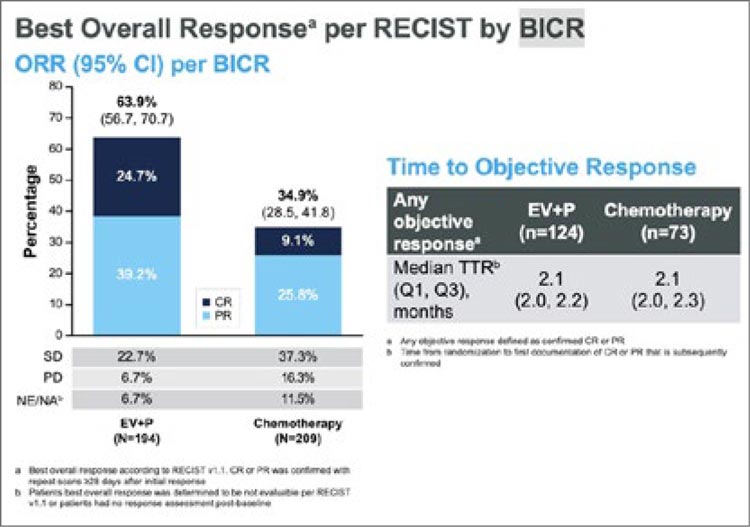
Частота объективного ответа в группе пациентов, не подходящих для терапии цисплатином, составила 35% в
группе химиотерапии и 64% в группе
EV+Пембро. При этом полный ответ был достигнут практически в три
раза чаще в группе EV+Пембро: 9%
против 25% (рис.13). Медиана длительности ответа не была достигнута в группе EV+Пембро, а в группе
химиотерапии составила 6,6 (95% CI
5,6-10,2) мес.
Рисунок 12.
Общая выживаемость в группе cisplatin-ineligible
в исследовании EV-302.
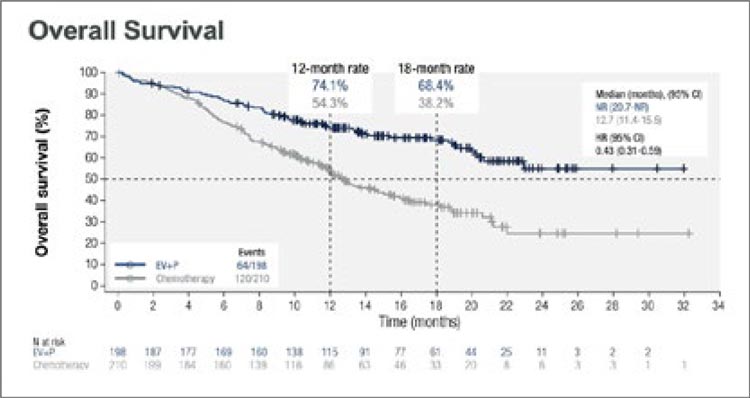
Рисунок 13.
Частота объективного ответа в группе cisplatinineligible в исследовании EV-302.
В группе cisplatin-eligible медиана
выживаемости без прогрессирования составила 14,6 мес. в группе
EV+Пембро против 6,6 мес. в группе
«чистой» химиотерапии, при этом
относительный риск прогрессирования снижался на 52% (HR 0,48; 95%
CI 0,38-0,62), график представлен на
рисунке 14.
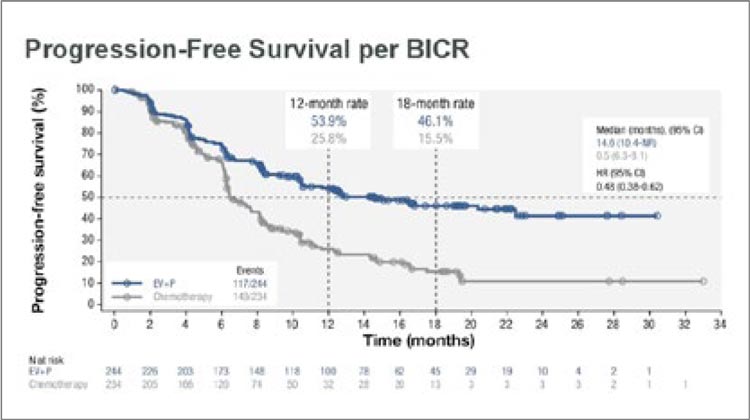
Медиана общей выживаемости в данной подгруппе пациентов, как показано на рисунке 15, составила 31,5 и 18,4
мес. для EV+Пембро и химиотерапии
соответственно, снизив относительный риск смерти на 47% (HR 0,53; 95% CI 0,39-0,72).
Частота объективного ответа в группе пациентов, подходящих для терапии цисплатином, составила 70,8% в
группе EV+Пембро, полный ответ из
них достигнут у 32,5%. В группе химиотерапии эти показатели составили 53% и 15,5% соответственно. Время достижения объективного ответа
было сопоставимым: его медиана составила 2,1 мес. Важно отметить, что
медиана длительности ответа не была
достигнута в группе EV+Пембро, в
то время как в группе химиотерапии
она составила 8,3 мес. Частота нежелательных явлений в обеих группах
была абсолютно сопоставима с таковой в ITT.
Рисунок 14.
Общая выживаемость в группе cisplatin-ineligible
в исследовании EV-302.
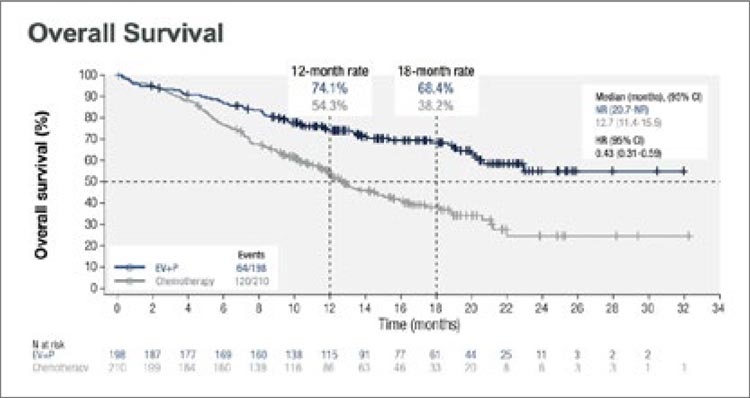
Рисунок 15.
Выживаемость без прогрессирования в группе
cisplatin-eligible в исследовании EV-302.
Все более интересной становится такая конечная точка, как результаты,
репортируемые пациентами (patient
reported outcomes, PROs), которая
также оценивалась и в исследовании EV-302 при помощи объективных опросников EORTC QLQ-C30
(EORTC Quality of Life Questionnaire)
и BPI-SF (Brief Pain Inventory Short
Form) [5]. Анкетирование в отношении симптомов (потеря аппетита,
запоры, диарея, слабость, тошнота/
рвота, боли и др.), функционального
состояния и социальной адаптации
проводилось до начала терапии, еженедельно в течение 12 недель, далее
каждые 3 месяца при follow-up визитах. Запланированным анализом выступили время до прогрессирования
болевого синдрома и среднее изменение интенсивного болевого синдрома
к 26-й неделе исследования (BPI-SF).
При помощи EORTC-QLQ-C30 оценивали время до подтвержденного
ухудшения состояния.
Среди всех рандомизированных пациентов (n=886) в полной мере опросники были заполнены у 731 пациента. На момент старта терапии приблизительно треть пациентов страдала от болевого синдрома, который они оценивали от умеренного до сильного (5 баллов и выше). Уровень комплаенса у пациентов различался между группами, оставаясь более 70% к 29-й неделе в группе EV+Пембро, а в группе химиотерапии он сохранился лишь до 17-й недели.
Показатели медианы времени до прогрессирования болевого синдрома
уже были представлены ранее, однако напомним, что они составили 14,2
мес. для группы EV+Пембро против
10,0 мес. в группе платиносодержащей химиотерапии. Наибольшее
уменьшение интенсивности испытываемой боли к 26-й неделе было отмечено также в группе EV+Пембро:
–0.61 и –0.03 соответственно.
Пациенты, которые испытывали от
умеренной до сильной боли на момент начала терапии EV+Пембро,
отметили улучшение состояния уже
через 3 недели. В последующем эта
разница сохранялась и до 26-й недели
(рис.16).
Рисунок 16.
Общая выживаемость в группе cisplatin-eligible
в исследовании EV-302.
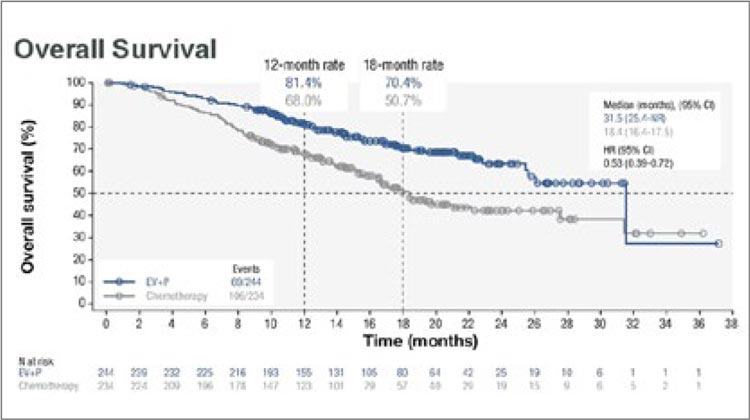
Рисунок 17.
Изменение интенсивности болевого синдрома.
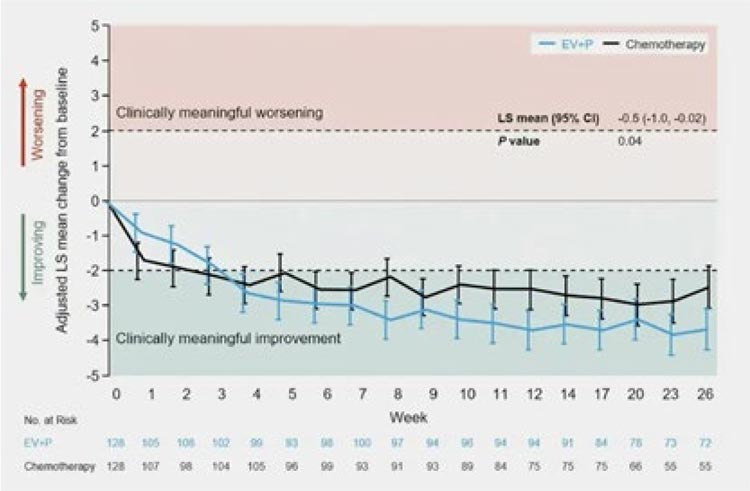
Результаты заполнения опросника
EORTC QLQ-C30 продемонстрировали, что пациенты, которые получали
EV+Пембро, имели кратковременное
ухудшение состояния к третьей неделе, которое к 4-й неделе возвращалось к показателю начальной точки,
в то время как платиносодержащая
химиотерапия (вне зависимости от
цис-/карбоплатина) значимо ухудшала качество жизни пациентов уже с
1-й недели терапии.
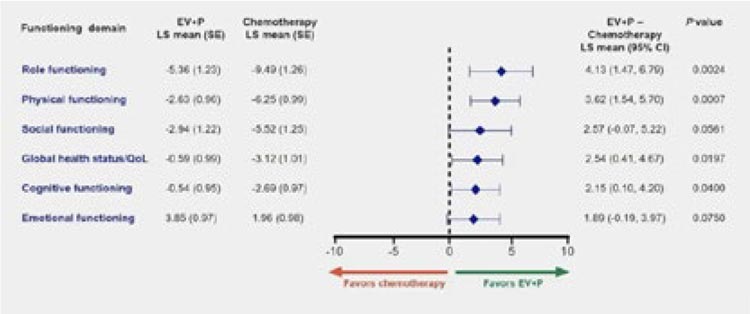
Форест-плот, демонстрирующий
сводные данные по изменению качества жизни пациентов по опроснику EORTC-QLQ-C30, показал,
что время до подтвержденного
ухудшения состояния составило
5,9 мес. для группы EV+Пембро и
3,2 мес. в группе химиотерапии (HR
0,98; 95% CI 0,79-1,2).
Возвращаясь к характеристике
включенных в EV-302 пациентов,
обращает на себя внимание то, что
всего лишь 1,3% пациентов, включенных в EV-302, имели неуротелиальный рак. Стоит отметить,
что до 25% пациентов с опухолями
мочевого пузыря имеют неуротелиальный компонент. Обычно эта когорта пациентов недопредставлена
(как в случае EV-302) или вовсе не
включается в клинические исследования. Существующие данные позволяют предположить, что EV как
конъюгат с моноклональным антителом к нектину-4 и пембролизумаб
могут быть эффективными при неуротелиальном подтипе. Авторы
представили дизайн небольшого
исследования II фазы, в которое на
сегодняшний день продолжается
набор пациентов с неуротелиальным или смешанным подтипом
рака мочевого пузыря [6]. При
этом не включаются пациенты с
нейроэндокринными карциномами, опухолями неэпителиального
происхождения. Дизайн исследования схематично представлен на
рисунке 18. Первичной конечной
точкой авторы выбрали оценку частоту достижения объективного
ответа. Среди вторичных конечных
точек: выживаемость без прогрессирования, общая выживаемость,
длительность ответа, безопасность,
качество жизни и частота развития
саркопении.
Рисунок 18.
Изменение качества жизни в разрезе различных
аспектов в исследовании EV-302
В результате дополнительных данных можно сделать выводы о том,
что комбинация EV с пембролизумабом не только приводит к увеличению медианы выживаемости без
прогрессирования и общей выживаемости, но и приводит к снижению
интенсивности болевого синдрома и
не ухудшает значимо качество жизни. Осталось только наконец-то начать лечить пациентов этой опцией
в реальной клинической практике,
чего мы все очень ждем. И, конечно,
дождаться результатов небольшого
исследования по изучению эффективности комбинации при редких
гистологических формах рака мочевого пузыря.
Наконец, были доложены двухлетние результаты исследования
EV-103, которое посвящено роли
монотерапии EV в неоадъювантном режиме у пациентов, которым
невозможно проведение терапии
цисплатином [7]. Напомним, как
уже писали в предыдущем выпуске
новостей, что прогноз пациентов,
которым невозможно проведение
цисплатин-содержащей химиотерапии, остается довольно неблагоприятным. При невозможности проведения хирургического лечения
нужно либо все-таки постараться
провести то самое радикально хирургическое лечение, либо прибегнуть к химиолучевой терапии
(напомним, что карбоплатин-содержащая терапия не применяется
в периоперационной или неоадъювантной опции). Ранее с этой точки
зрения были освещены результаты
исследования SURE-01.
Исследование Ib/II фазы EV-103
является многокогортным, и на
ASCO 2024 представляли результаты терапии когорты Н [7]. В нее
включались пациенты с мышечноинвазивным раком мочевого пузыря cT2-4aN0M0, которым было
невозможно проведение цисплатин-содержащей терапии. Важным
условием была операбельность
пациента (не резектабельность на
момент включения!) с точки зрения возможности выполнения радикальной цистэктомии и тазовой
лимфодиссекции в последующем.
Пациенты получали 3 цикла EV,
после чего им проводилось хирургическое лечение в указанном объеме. На ASCO 2023 были представлены многообещающие результаты:
одногодичная бессобытийная выживаемость составила 76,4% (95%
CI 52,2-89,4), частота полного патоморфологического ответа – 36,4%
(95% CI 17,2–59,3), а частота патоморфологического down-staging’а
составила 50,0%. В этом году доложены обновленные результаты.
Все 3 запланированных цикла были
проведены 86,4% пациентов, все
включенные пациенты перенесли
хирургическое лечение, при этом
не было отмечено токсичности, задерживающей операцию: медиана
времени от завершения терапии EV
до выполнения радикальной цистэктомии – 1,8 мес. Частота pCR
составила 36,4% (95% CI 17,2-59,3),
частота патоморфологического
down-staging’а – 50,5% (95% CI 28,2-
71,8). При этом авторы исследования обращают особое внимание на
двухлетнюю бессобытийную выживаемость, которая составила 62,0%
(95% CI 38,2-78,9), а в группе пациентов, достигших полного патоморфоза, и вовсе не была достигнута
(для не достигших составила 18,8
мес.) (рис.19).
Рисунок 19.
Дизайн исследования II фазы по оценке
эффективности EV+Пембро у пациентов с неуротелиальными
опухолями мочевого пузыря.
Более того, 36,4% пациентов получили последующую адъювантную
противоопухолевую терапию, самым частым режимом (9,1%) был
пембролизумаб. Профиль безопасности EV был сопоставим с таком
в других исследованиях, новых данных о безопасности не получено,
однако три пациента погибли ввиду
развития острого повреждения почек, острой сердечной недостаточности, тромбоэмболии легочной
артерии (все случае не связаны с
терапией). Выходит, что постепенно EV становится универсальным
игроком на поле терапии рака мочевого пузыря, смещаясь с поздних
к первой линии терапии, а теперь и
находя свою нишу в неоадъювантном режиме.
Наконец, одним из важных представленных исследований стало изучение влияния дозы энфортумаба
ведотина (EV) на клинические исходы у пациентов с местнораспространенным или метастатическим
уротелиальным раком [8]. Напомним, что EV был одобрен не только
в комбинации с пембролизумабом в
первой линии уротелиального рака
(в результате исследования EV-302),
но и до этого в монотерапии для
местнораспространенной или метастатической формы болезни (на основании данных EV-201 и EV-301),
приводя к увеличению общей выживаемости при относительно благоприятном профиле токсичности.
В монотерапии EV применялся внутривенно в дозе 1,25 мг/кг 3Q4W, в
дальнейшем, согласно протоколу,
доза редуцировалась на усмотрение
исследователя (1,25 → 1,0 → 0,75 мг/
кг). Авторами исследования была
поставлена задача оценить взаимосвязь между концентрацией EV
в плазме (которая, очевидно, изменяется при редукции дозы) и между
клиническими исходами у пациентов. Анализ проводили на основании данных пациентов из EV-101,
EV-201 и EV-301. Фармакокинетический анализ проводили в разных
временных точках на протяжении
первых двух циклов, а также перед
началом последующих циклов терапии. Характеристики включенных в
эти исследования пациентов были
сопоставимы и вполне ожидаемы
для предлеченной когорты пациентов.
Напомним, что в исследовании
I фазы EV-101 доза EV 1,25 мг/кг
3Q4W позволила достичь высокой частоты объективного ответа
(42,9% в сравнении с 21,4% и 18,5%
при меньших дозах), что подтверждается и фармакокинетическим
анализом. Более того, сохранение
дозоинтенсивности режима EV
было ассоциировано с большей вероятностью достижения объективного ответа.
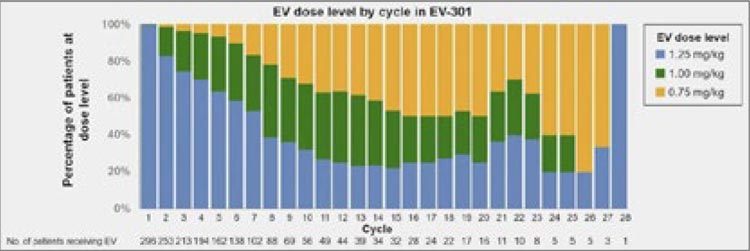
Редукция дозы в проведенных исследованиях потребовалась значимой части пациентов: до 1,0 мг/кг у
41,1% в EV-201 и 35,% в EV-301; до
0,75 мг/кг у 13,6% в EV-201 и 11,1%
в EV-301. Большинство пациентов
в EV-301 получили дозу 1,25 мг/кг
вплоть до 7-го цикла, однако затем
частота редукции дозы повышалась
(рис.20).
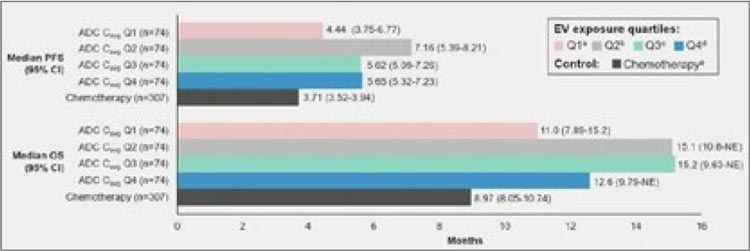
Важно отметить, что пациенты, у
которых был достигнут объективный ответ, продолжали терапию,
и их клинический выигрыш также
продолжал нарастать, несмотря на
редукцию дозы или перерывы в лечении. Меньшая доза EV достоверно была ассоциирована с меньшим
риском кожной токсичности G3, периферической полинейропатии G2
и гипергликемии G3 (все p<0,0001).
Очень важно ответить, что даже
несмотря на редукцию дозы, у EV
сохранялось преимущество перед
химиотерапией как в плане выживаемости без прогрессирования,
так и в общей выживаемости, что
отражено на рисунке 21.
Рисунок 20.
Бессобытийная выживаемость вне зависимости
от достижения полного патоморфоза (А) и с учетом
достижения pCR (B).
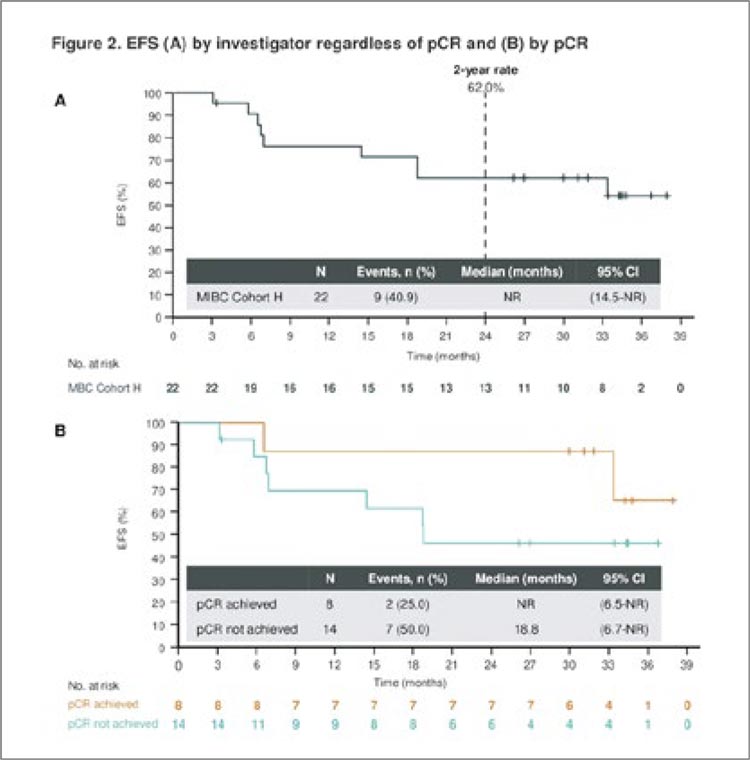
Рисунок 21.
Распределение дозоинтенсивности
в исследованиях.
Авторы приходят к выводу, что эффект EV является дозозависимым,
и подержание более высокой дозы
(т.е. 1,25 мг/кг 3Q4W) ассоциировано с большей вероятностью достижения объективного ответа.
Редукция дозы – нередкое явление,
особенно по мере увеличения количества циклов терапии, однако эффективность терапии EV сохраняется и при ступенчатом снижении
дозы препарата.
Ведотин очевидно выглядит как
привлекательная мишень для разработки новых препаратов. Так, одна
из работ посвящена исследованию
III фазы: диситамаб ведотин в комбинации с пембролизумабом против химиотерапии в первой линии лечения HER2+ рака мочевого пузыря [9]. Учитывая далекую перспективу применения этого препарата, не будем останавливаться
на этой работе, однако скажем коротко, что в монотерапии HER2+
рака мочевого пузыря этот препарат уже продемонстрировал себя
многообещающе.
Ряд работ был также посвящен лечению немышечно-инвазивного
рака мочевого пузыря, резистентного к БЦЖ-терапии: освещались
результаты позитивного исследования II фазы кретостимогена гренаденорепвека в сочетании с пембролизумабом и анонсировано
исследование 1/2 фазы по внутрипузырному введению деталимогена вораплазмида [10,11]. Однако пока эти названия препаратов
больше напоминают нам названия
космических кораблей.
Рисунок 22.
Преимущество EV над химиотерапией
сохраняется даже в редуцированной дозе.
Также были продемонстрированы данные post hoc анализа пациентов, которые не ответили на
пембролизумаб в исследовании
KEYNOTE-057, посвященном
терапии резистентного к БЦЖтерапии немышечно-инвазивного
рака мочевого пузыря высокого риска [12]. Всего было 144 пациента,
у которых не наблюдалось эффекта от терапии пембролизумабом.
Среди 144 пациентов на сегодняшний день 39 пациентам проведена
upfront радикальная цистэктомия
(≤4 месяцев после подтвержденной
неудачи), 33 пациентам – отсроченная (>4 месяцев), а 72 пациентам проведено органосохранное
лечение. Медиана выживаемости
без прогрессирования не была достигнута во всех трех группах, а
частота 36-месячного показателя
выживаемости составила 78%, 68%
и 86% соответственно. Медиана
общей выживаемости не достигнута во всех трех группах.
В результате это анализа показано,
что онкологические исходы абсолютно сопоставимы у пациентов,
которые либо перенесли радикальную цистэктомию, либо получили
органосохраняющее лечение. При
этом важно отметить, что срок выполнения радикальной цистэктомии не влиял значимо на показатели выживаемости.
Вот таким выдался ASCO 2024 для
любителей уротелиального рака.
Появляется все больше дополнительных данных для уже анонсированных опций, появляются новые
«космические корабли», о которых
мы пока только слышим…
Источники:
- Matt D. Galsky, et al. Characterization of complete responders to nivolumab + gemcitabinecisplatin vs gemcitabine-cisplatin alone and patients with lymph node-only metastatic urothelial carcinoma from the CheckMate 901 trial. JCO. 2024; 42: 4509-4509.
- Joaquim Bellmunt, et al. Avelumab first-line maintenance (1LM) for advanced urothelial carcinoma (aUC): Long-term outcomes from JAVELIN Bladder 100 in patients (pts) with low tumor burden. JCO. 2024; 42: 4566- 4566.
- Michiel Simon Van Der Heijden, et al. Enfortumab vedotin (EV) with pembrolizumab (P) versus chemotherapy (chemo) in previously untreated locally advanced or metastatic urothelial carcinoma (la/ mUC): Analysis of the cisplatin (cis)- ineligible population from EV-302/ KEYNOTE-A39. JCO. 2024; 42: 4563- 4563.
- Jens Bedke, et al. Enfortumab vedotin (EV) with pembrolizumab (P) versus chemotherapy (chemo) in previously untreated locally advanced or metastatic urothelial carcinoma (la/mUC): Analysis of cisplatin (cis)- eligible population from EV-302/ KEYNOTE-A39. JCO. 2024; 42: 4562- 4562.
- Shilpa Gupta, et al. Patient-reported outcomes (PROs) from a randomized, phase 3 trial of enfortumab vedotin plus pembrolizumab (EV+P) versus platinum-based chemotherapy (PBC) in previously untreated locally advanced or metastatic urothelial cancer (la/mUC). JCO. 2024; 42: 4502-4502.
- Bassel Nazha, et al. Enfortumab vedotin plus pembrolizumab in the treatment of locally advanced or metastatic bladder cancer of variant histology: A phase II study. JCO. 2024; 42: TPS4615-TPS4615.
- Peter H. O'Donnell, et al. Study EV-103: Neoadjuvant treatment with enfortumab vedotin monotherapy in cisplatin-ineligible patients with muscle invasive bladder cancer (MIBC) – 2-year event-free survival and safety data for Cohort H. JCO. 2024; 42: 4564-4564.
- Daniel P. Petrylak, et al. Impact of exposure on outcomes with enfortumab vedotin in patients with locally advanced or metastatic urothelial cancer. JCO. 2024; 42: 4503-4503.
- Matt D. Galsky, et al. Phase 3 study of disitamab vedotin with pembrolizumab vs chemotherapy in patients with previously untreated locally advanced or metastatic urothelial carcinoma that expresses HER2 (DV-001). JCO. 2024; 42: TPS4616-TPS4616.
- Roger Li, et al. Final results of CORE001: A phase-2, single arm study of cretostimogene grenadenorepvec in combination with pembrolizumab in patients with BCG-unresponsive, nonmuscle invasive bladder cancer with carcinoma in situ. JCO. 2024; 42: 4601- 4601.
- Richard Bryce, et al. A phase 1/2 study of EG-70 (detalimogene voraplasmid) intravesical monotherapy for patients with BCG-unresponsive non-muscle invasive bladder cancer with carcinoma in situ. JCO. 2024; 42: TPS4626- TPS4626.
- Roger Li, et al. Outcomes of patients with bacillus CalmetteGuérin-unresponsive high-risk nonmuscle-invasive bladder cancer who demonstrated nonresponse to pembrolizumab in KEYNOTE-057: A post hoc analysis. JCO. 2024; 42: 4597- 4597.
НОВОСТИ ASCO 2024 / ПО СЛЕДАМ ASCO 2024. ОПУХОЛИ ГОЛОВЫ И ШЕИ
Авторы: Болотина Лариса Владимировна
Заведующая отделением химиотерапии МНИОИ им. П.А. Герцена – филиала
ФГБУ «НМИЦ радиологии» Минздрава России, член правления RUSSCO,
доктор медицинских наук, доцент РАН, Москва
Рубан Максим Сергеевич
Аспирант отделения химиотерапии МНИОИ им. П.А. Герцена –
филиала ФГБУ «НМИЦ радиологии» Минздрава России, Москва
Прошедший в июне 2024 года ежегодный конгресс ASCO в отношении
опухолей головы и шеи не принес
исследований, способных изменить
текущую клиническую практику.
Между тем следует отметить существенный уклон в изучение новых
режимов и подходов в лечении назофарингеального рака. Ожидаемо
сохранилась тенденция, сформировавшаяся в последние годы, по
значимому увеличению числа работ
китайских исследователей.
Среди презентаций, отобранных для
докладов, представляет несомненный интерес исследование innovaTV
207, из которого были представлены
результаты по когорте С (Part С) [1].
Это открытое, глобальное, многоцентровое исследование 2 фазы, проведенное в научных центрах США.
Основной целью общего протокола
являлась оценка эффективности
монотерапии тизотумабом ведотином или его комбинации с другими
противоопухолевыми препаратами
при распространенных стадиях различных солидных опухолей. Предпосылками к формированию когорты
С послужило то, что для пациентов с
рецидивным/метастатическим плоскоклеточным раком головы и шеи
эффективные опции 2 и последующих линий лекарственной терапии
крайне ограничены. В данной когорте препарат использовался в качестве монотерапии у предлеченных
(не более 3 предшествующих линий)
пациентов с рецидивным/метастатическим плоскоклеточным раком головы и шеи. Тизотумаб ведотин (ТВ)
представляет собой конъюгат антитело-лекарственное средство, состоящий из моноклонального антитела
к тканевому фактору (ТФ, III фактор
системы свертывания крови), соединенного при помощи линкера с
монометилауристатином Е (ММАЕ).
Предварительного исследования
экспрессии ТФ не требуется, так как
она наблюдается в 88% при ОГШ. Дополнительно можно отметить, что
тизотумаб ведотин одобрен FDA для
пациенток с предлеченным раком
шейки матки.
В когорту С были включены 40 пациентов, из которых отдельно были выделены 25 участников, получавших
ТВ во 2-3 линиях. Первичной конечной точкой была выбрана ЧОО.
Все пациенты получали ТВ 1,7 мг/кг
каждые 2 недели. Следует отметить,
что в качестве предшествующих линий больные получили чек-пойнт
ингибитор и 80% – дополнительно
препараты платины. Назначение ТВ
позволило в общей когорте получить
ЧОО 32,5%, а при использовании
препарата во 2-3 линиях ЧОО увеличилась до 40%. Частота контроля
над заболеванием (ЧКЗ) оказалась
равна 42,5% и 52,0% соответственно.
Медиана длительности ответа составила 5,6 месяца. Наиболее частыми
нежелательными явлениями были
периферическая полинейропатия
(40%, 3 и более степеней – 10%), запор (32,5%), а также конъюнктивит,
снижение аппетита и слабость (30%).
Прервать лечение из-за токсических
реакций (ТР) пришлось 15% участников. Авторы делают вывод о том,
что тизотумаб ведотин в качестве
монотерапии продемонстрировал
обнадеживающую противоопухолевую активность у предлеченных
пациентов с рецидивным/метастатическим плоскоклеточным раком головы и шеи. Профиль безопасности
был управляемым и соответствовал
предыдущим данным при монотерапии тизотумабом ведотином.
В настоящее время в исследовании
innovaTV 207 продолжается набор
пациентов в когорты F, где препарат
будет изучаться в 1 линии терапии, и
E (2-3 линии).
Следующая серия работ посвящена
назофарингеальному раку. BEACON
– китайское многоцентровое, рандомизированное, плацебо-контролируемое, двойное слепое исследование 3
фазы, которое оценивало эффективность добавления антитела к PD-1
тислелизумаба к индукционной
(ИХТ) у пациентов с местнораспространенной назофарингеальной карциномой [2]. Предпосылкой к этому
протоколу послужили данные о том,
что после проведения одного их стандартных вариантов противоопухолевого лечения (ИХТ с последующей
химиолучевой терапией – ХЛТ) к 5
годам практически у 20% пациентов
наблюдается прогрессирование болезни. Авторы выдвинули гипотезу
о том, что добавление иммунотерапии (ИТ) к ИХТ активирует клональную экспансию Т-лимфоцитов,
что будет способствовать усилению иммунного ответа перед ХЛТ.
В протокол были включены 450
пациентов с III-IVA стадией рака
носоглотки (за исключением T3N0
и T3N1 при поражении только ретрофарингеального лимфоузла),
которые разделялись в равной пропорции на 2 группы. Первая группа
получала экспериментальную терапию: 3 курса гемцитабин + цисплатин с добавлением тислелизумаба.
Вторым этапом проводилась ХЛТ
с цисплатином 100 мг/м2 (3 введения), после завершения которой пациенты получали дополнительно до
8 циклов тислелизумаба. Контрольная группа получала аналогичный
режим ИХТ и ХЛТ с добавлением
плацебо. Первичной целью была
частота полного ответа (ПО) и выживаемость без прогрессирования
(ВБП) (рис.1).
В экспериментальной группе 77,3%
больных имели распространенность
по лимфоколлекторам N2-N3 и 64%
соответствовали стадии IVA. Вирус
Эпштейна-Барр (ВЭБ) >1500 копий/
мл обнаружен у 42% участников. При
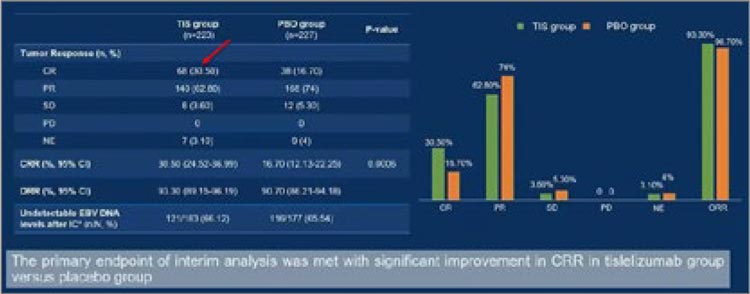
оценке первичной цели было отмечено удвоение достижения частоты ПО
при добавлении к ИХТ тислелизумаба: 30,5% против 16,7% (рис.2).
Рисунок 1.
Дизайн исследования BEACON, первичные
и вторичные конечные точки.
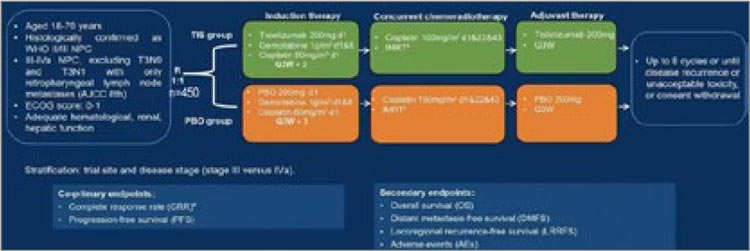
Рисунок 2.
Частота ПО в исследовании BEACON.
Режим хорошо переносился пациентами и имел управляемый профиль безопасности. Отмена терапии из-за ТР потребовалась только 2,28% пациентов экспериментальной группы. По второй первичной точке данные будут представлены позднее.
Второе исследование группы китайских авторов заслуживает наибольшего внимания. Это также
многоцентровое, проспективное,
рандомизированное, контролируемое исследование 3 фазы, которое
было посвящено изучению эффективности добавления эндостара к
ХЛТ с цисплатином у пациентов с
местнораспространенной назофарингеальной карциномой (НФК) [3].
Эндостар представляет собой рекомбинантный человеческий эндостатин – антиангиогенный препарат,
ингибирует экспрессию VEGF-A,
VEGF-C, VEGF-D (одобрен в Китае
для лечения НМРЛ). Предпосылками для проведения данного протокола явились результаты наблюдения за пациентами исторической
группы с местнораспространенной
назофарингеальной карциномой.
После проведения стандартного
лечения – ХЛТ с цисплатином – к 5
годам у 30-35% пациентов отмечено
развитие рецидивов/метастазов.
Гипотеза, которая легла в основу
выбора препарата для добавления
в режим стандартного лечения,
основана на том, что гипоксия является фактором, приводящим к
резистентности опухоли к ЛТ и ХТ.
Эндостар уменьшает гипоксию, подавляя патологический ангиогенез
и нормализуя сосудистую систему
опухоли, что приводит к повышению ее радио- и химиочувствительности. Протокол объединил
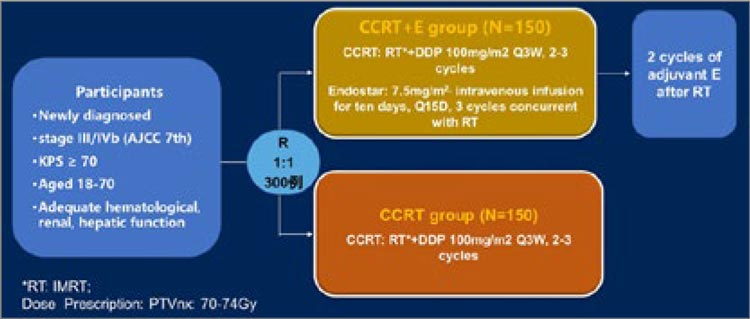
300 пациентов с III-IVB стадией
НФК (7 AJCC), разделенных на
2 группы. Одна группа получала
стандартную ХЛТ с цисплатином
(IMRT 70-74 Гр), а экспериментальная группа в дополнение к этому
получала введения эндостара на
протяжении ХЛТ, а также 2 дополнительных курса после ее завершения (рис.3). Первичной конечной
точкой была избрана ВБП. Однако
среди вторичных конечных точек
оценивалась общая выживаемость
(ОВ), выживаемость без отдаленных метастазов (ВБОМ), а также
выживаемость без локального рецидива (ВБЛР).
Рисунок 3.
Дизайн исследования.
Более чем у 87% больных опухоль
имела морфологическую структуру недифференцированного
носоглоточного рака. Распространенность, соответствующая Т3,
наблюдалась у 44%, а N3 – у 19,3%
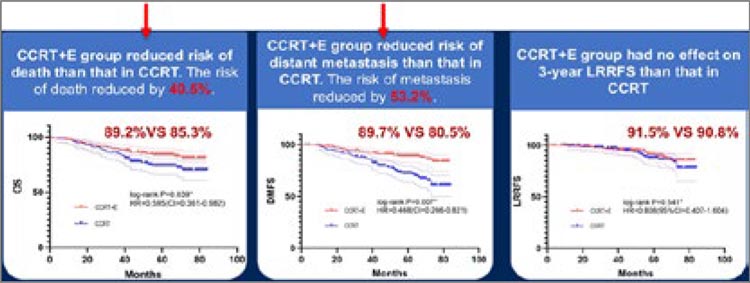
больных экспериментальной группы. Исследование оказалось позитивным: добавление эндостара
позволило увеличить показатель
3-летней БРВ до 84,8% против
75,1% (HR 0,544; р=0,011) группы
стандартной терапии (рис.4).
Но более важным оказалось увеличение 3-летней ОВ (89,2% против
85,3%; HR 0,595; р=0,039) и ВБОМ
(89,7% против 80,5%; HR 0,468;
р=0,007). Различий в отношении
ВБЛР отмечено не было (91,5%
против 90,8%; HR 0,808; р=0,541)
(рис.5).
Рисунок 4.
Показатели ВБП в группе ХЛТ + эндостар и ХЛТ.
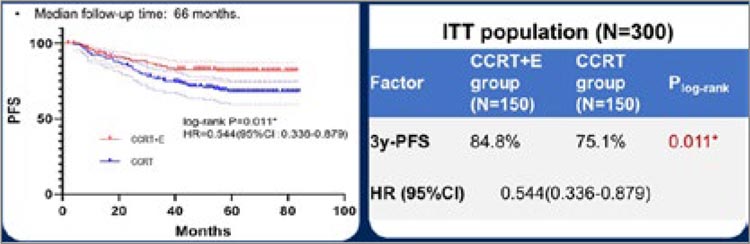
Рисунок 5.
Показатели ОВ, ВБОМ и ВБЛР в группе ХЛТ +
эндостар и ХЛТ.
Достоверные различия были отмечены в отношении ПО, которая составила для группы эндостара 90%
против 80,7% (р=0,022). Наиболее часто ПО регистрировался в отношении лимфоузлов (92,5% против
81,5%; HR 0,005). Как ни удивительно, но частота ТР III-IV ст. оказалась ниже в экспериментальной
группе – 61,7% против 66%. Нежелательных явлений (НЯ), обычно
связываемых с антиангиогенной
терапией, зафиксировано не было.
В заключении авторы делают вывод о том, что предложенный вариант ХЛТ, вероятно, сможет стать
новым стандартом лечения данной
группы пациентов.
Другое исследование – DIPPER,
открытое, многоцентровое, рандомизированное, контролируемое
исследование 3 фазы по оценке
эффективности адъювантного назначения ингибитора PD-1 камрелизумаба у пациентов с местнораспространенной НФК [4]. Авторы
исходят из того, что НФК характеризуется богатой инфильтрацией
лимфоцитами, что делало ее структуру похожей на некоторые виды
лимфомы. Частота гиперэкспрессии PD-L1 при НФК составляет
>80%. Возможными опциями для
лечения местнораспространенного
назофарингеального рака является
ИХТ с последующей ХЛТ. Однако
даже при использовании такого
объема противоопухолевого лечения у 20% пациентов фиксируется
рецидив заболевания в течение
ближайших 5 лет. Дополнительной
предпосылкой к целесообразности
инкорпорирования иммунотерапии в стратегию лечения местнораспространенного процесса являются результаты терапии 1 линии
лечения с использованием химиоиммунотерапии. Имеются позитивные результаты как минимум
3 РКИ с применением камрелизумаба, торипалимаба и тизлелизумаба, которые продемонстрировали преимущество от добавления
иммунотерапевтического агента
в отношении увеличения ВБП.
Кроме того, адъювантное применение анти-PD1/PD-L1 препарата
при ряде ЗНО оказало позитивное
влияние на показатели бессобытийной и ОВ. В протокол DIPPER
китайскими авторами включено
450 пациентов НФК с распространенностью T4N1M0 – T1-4N2-3,
которые завершили 3 курса ИХТ
по схеме гемцитабин + цисплатин и курс ХЛТ (IMRT 70 Гр + 2
введения цисплатина 100 мг/м2).
Участники рандомизировались на
2 группы, одна из которых получала в течение года адъювантную ИТ
камрелизумабом, а вторая находилась под наблюдением. Первичной
точкой была избрана бессобытийная выживаемость (БСВ). Среди
вторичных точек изучались ВБОМ
и ВБЛР.
У 88% пациентов опухоль соответствовала T3-T4, и 35% имели N3.
Отдельно следует отметить, что
ВЭБ-позитивные опухоли были отмечены лишь у 8-12% участников.
Однако нет сведений о том, при
каком числе копий вируса статус
расценивался как позитивный.
Полный объем запланированной
адъювантной терапии (АТ) получили 81% пациентов. По той или
иной причине лечение было прервано у 19% больных, однако только у 2,9% – по причине развития
НЯ. В результате авторам удалось
продемонстрировать выигрыш от
добавления АТ камрелизумабом:
3-летняя БСВ составила 86,9% в
экспериментальной группе и 77,4%
в группе, получившей стандартную
терапию (HR 0,56; р=0,012). Также
достоверно более высокие показатели ВБОМ (92,4% против 84,5%;
HR 0,54; р=0,037) и ВБЛР (92,8%
против 87%; HR 0,53; р=0,046) были
отмечены в исследуемой группе
(рис.6).
Рисунок 6.
Показатели БСВ, ВБОМ и ВБЛР в группах ИХТ +
ХЛТ + камрелизумаб vs ИХТ + ХЛТ.
Различий в ОВ к настоящему времени отмечено не было (96,4% против 92,9%; HR 0,80; p=0,587). При
подгрупповом анализе выигрыш
наблюдался для всех подгрупп, и
авторам не удалось выделить популяцию, получившую наибольшую пользу от назначения камрелизумаба в адъювантном режиме.
НЯ 3-4 ст. в экспериментальной
группе составили 11,2%, а отменить лечение из-за токсичности
пришлось лишь 2,9% участников.
Наиболее частой ТР, характерной
для применения камрелизумаба,
была реактивная капиллярная гиперплазия, которая отмечена среди
85,8% больных, имевших ТР. Однако в подавляющем большинстве
случаев данный вид токсичности
имел 1-2 степени выраженности.
Таким образом, авторы делают выводы о снижении риска рецидива
заболевания или смерти на 44% на
фоне адъювантной терапии камрелизумабом у пациентов с местнораспространенной НФК (T4N1M0
или T1-4N2-3M0).
Авторы еще одного американского
многоцентрового, рандомизированного, плацебо-контролируемого исследования 2 фазы PATHWay
поставили перед собой цель оценить эффективность пембролизумаба в адъювантном режиме у
пациентов с плоскоклеточным раком головы и шеи высокого риска
рецидива [5]. Авторы руководствовались тем, что в настоящее время
чекпойнт-ингибиторы доказали
свою эффективность и одобрены
для лечения распространенного
плоскоклеточного рака головы и
шеи. Однако данных в отношении
использования ИТ в адъювантном
режиме мало. Большинство проведенных исследований оказались
негативными, но в них недостаточно была представлена популяция пациентов после сальважных
хирургических вмешательств. В
протокол исследователи включили 100 пациентов с местнораспространенным ПРГШ III, IVA,
IVB стадий после хирургического
лечения, у которых риск развития
рецидива, по оценке авторов, превышал 40-50%. Половина участников получала АТ пембролизумабом в течение 1 года, тогда как
вторая половина находилась под
наблюдением. Первичной целью
была ВБП. При прогрессировании
процесса пациентам группы наблюдения разрешался кроссовер
в группу терапии пембролизумабом.
Рисунок 7.
Показатели ВБП в группе АТ пембролизумабом vs
наблюдение (подгруппы B, F).
Исследователи сформировали 6
подгрупп в зависимости от характера риска рецидива. Наибольшее
число составили пациенты с позитивным хирургическим краем
(n=37) или ранее перенесшие 2 и
более операции по поводу рецидивов (n=37). В общей популяции
была достигнута статистически
значимая разница в показателях
ВБП в пользу исследовательской
группы (HR=0,61), а показатели ОВ
не различались между группами.
Ожидаемо наибольшая польза в
отношении ВБП наблюдалась среди пациентов после операций R1
(HR 0,34; р=0,016) и после многократных ранее проведенных операций по поводу локальных рецидивов (HR 0,48; р=0,057) (рис.7).
Традиционно было уделено внимание эффективности вакцин к
HPV-16, которые исследуются как
в монорежиме, так и в комбинации с иммунотерапевтическими
средствами. Однако пока можно
утверждать лишь о безопасности
и хорошей переносимости такого
вида противоопухолевого лечения.
Несколько вакцин демонстрируют
клиническую активность и перспективны в лечении рака головы и
шеи, ассоциированного с ВПЧ. Однако ни одна вакцина еще не одобрена FDA и не входит в стандарты
лечения. Создается впечатление,
что комбинация вакцин против
ВПЧ с чекпойнт-ингибиторами сопровождается большей частотой
объективного ответа по сравнению
с монотерапией (рис. 8).
Рисунок 8.
Исследования по изучению вакцин к ВПЧ.
Суммируя основные результаты
прошедшего конгресса, можно
сделать несколько выводов:
Появляется все больше данных в
отношении эффективности конъюгатов антитело-лекарственное
средство в лечении больных рецидивным/метастатическим раком головы и шеи. В перспективе
данные препараты могут стать эффективной опцией поздних линий
терапии.
Получены данные об эффективности анти-PD-1 антител при добавлении к ИХТ и в качестве консолидирующей терапии у пациентов с
местнораспространенной назофарингеальной карциномой. Отсутствие данных по ОВ пока не позволяет сделать однозначные выводы.
Добавление антиангиогенного
препарата эндостар к ХЛТ с цисплатином у пациентов с местнораспространенной НФК позволило статистически значимо
улучшить показатели ВБП и ОВ.
Полученные данные позволяют
предположить вероятный новый
стандарт лечения данных пациентов. Отсутствуют данные об
эффективности других антиангиогенных средств.
Получены обнадеживающие результаты эффективности вакцин
против HPV-16 в комбинации с
чекпойнт-ингибиторами, однако
для подтверждения требуются дополнительные исследования.
Источники:
- Sun L, Fayette J, et al. Tisotumab vedotin in head and neck squamous cell carcinoma: update analysis from innovaTV 207 Part C. https://ascopubs.org/. doi/10.1200/ JCO.2024.42.16_suppl.6012.
- Hai-Qiang Mai, Sai Lan Liu, et al. Tislelizumab versus placebo combined with induction chemotherapy followed by concurrent chemoradiotherapy and adjuvant tislelizumab or placebo for locoregionally advanced nasopharyngeal carcinoma: Interim analysis of a multicenter, randomized, placebo-controlled, double-blind, phase 3 trial.
- Min Kang, Daiyuan Ma, et al. Endostar combined with concurrent chemoradiotherapy versus concurrent chemoradiotherapy alone for locoregionally advanced nasopharyngeal carcinoma (LA-NPC): A phase III, prospective, randomisedcontrolled, multicenter clinical trial.
- Jun Ma, Ying Sun, et al. Adjuvant PD-1 blockade with camrelizumab in high-risk locoregionally advanced nasopharyngeal carcinoma (DIPPER): A multicenter, open-label, phase 3, randomized controlled trial.
- Pearson AT, Seiwert TY, et al. A randomized, double-blind, placebocontrolled phase II study of adjuvant pembrolizumab versus placebo in patients with head and neck squamous cell cancers at high risk for recurrence: The PATHWay study
НОВОСТИ ASCO 2024 / ASCO 2024: ОПЕРАБЕЛЬНЫЙ РАК МОЛОЧНОЙ ЖЕЛЕЗЫ
Все интересные доклады, посвященные лечению операбельного рака
молочной железы (РМЖ), я разделил
на две группы. В первой группе представлены исследования, которые пытались улучшить результаты лечения
за счет использования новых препаратов или новых комбинаций. Во
вторую группу включены исследования биомаркеров, которые помогают
определить показания к проведению
нео- или адъювантной терапии и следить за результатами ее проведения.
Начнем с первой.
1. Новые препараты и комбинации
Abstract 502
Для лечения больных тройным негативным РМЖ на этапе неоадъювантной терапии широко используются комбинации с препаратами
платины на основании исследований
BrightNess и KEYNOTE522. Но у нас
не было проведено ни одного проспективного рандомизированного
исследования по оценке платиновых
комбинаций на этапе адъювантной
терапии. И вот корейские коллеги
сообщили результаты исследования
PEARLY, в рамках которого больные
операбельным тройным негативным
РМЖ I-III стадий получали либо неоадъювантную или адъювантную
терапию АС (60/600 мг/м2) × 3 нед. ×
4 курса и затем паклитаксел 80 мг/м2
еженедельно 12 нед. или доцетаксел
(75 мг/м2) × 3 нед. × 4 курса, либо к
вышеуказанной терапии на каждом
курсе добавляли введение карбоплатина (AUC5). Первичной конечной
точкой была выбрана 5-летняя безрецидивная выживаемость (БРВ).
В исследование было включено 868
больных, большинство из которых
получили неоадъювантную терапию (71%), имели I-II стадии (79%),
наличие метастазов в аксиллярные
лимфоузлы диагностировано у 49%
пациентов.
При медиане наблюдения 57 мес.
5-летняя БРВ составила в контрольной группе 75,1% и в группе карбоплатина 82,3%, что соответствует
снижению относительного риска
прогрессирования на 33% (HR=0,67;
p=0,012). При запланированном подгрупповом анализе снижение риска
прогрессирования при проведении
неоадъювантной и адъювантной терапии с включением карбоплатина
составило 31% и 74% соответственно. Также выигрыш от добавления
карбоплатина наблюдался во всех
изученных подгруппах (возраст, TN,
BRCA статус, выбор таксанов). Показатели 5-летней общей выживаемости (OS) пока остаются незрелыми и
составляют 90,7% и 87% для группы
карбоплатина и контроля, что соответствует недостоверному снижению
относительного риска смерти на 35%
(HR=0,65; p=0,057). Частота pCR у
больных, получавших неоадъювантную терапию, составила 46% в группе
карбоплатина и 39,4% в группе контроля.
Включение карбоплатина в схему лечения увеличило частоту осложнений
3-4 степени за счет увеличения гематологической токсичности (частота
фебрильной нейтропении возросла с
17,1% до 24,7%, тромбоцитопении – с
0,5% до 3,5%) и тошноты и рвоты (с
2,6% до 6%). По результатам анализа
опросников качество жизни в обеих
группах было примерно одинаковым.
Авторы делают вывод, что включение карбоплатина в схемы системной
терапии операбельного тройного негативного РМЖ улучшает результаты лечения по показателю 5-летней
безрецидивной выживаемости. Выигрыш от добавления карбоплатина
отмечается как при проведении неоадъювантной, так и адъювантной
терапии, что открывает возможности
использования платиновых комбинаций послеоперационно при этом фенотипе опухоли.
Abstract 500
Еще одно исследование у больных
тройным негативным фенотипом. В
итальянском исследовании для интенсификации терапии использовали ингибитор PD-L1 авелумаб. При
этом фенотипе чаще чем при других
наблюдается присутствие в опухоли
лимфоцитов (TILs) и экспрессия PDL1, что предсказывает эффект ингибиторов контрольных точек иммунного ответа, к которым и относится
авелумаб. В исследование включали
больных, получивших адъювантную
(pT2N1, pT3-4N0-1, pTлюбаяN2-3)
или неоадъювантную (с наличием
резидуальной опухоли после ее проведения) химиотерапию (антрациклины + таксаны), которые были рандомизированы в группу наблюдения
(контроль) или авелумаба. Интервал
между окончанием химиотерапии и
операцией и началом лечения авелумабом в дозе 10 мг/кг каждые 2 нед. ×
52 нед. не должен был превышать 10
недель. В случае необходимости лучевая терапия проводилась на фоне авелумаба. Первичной конечной точкой
была безрецидивная выживаемость
(БРВ), вторичными точками были
БРВ в группе больных PD-L1+ и ОВ.
В исследование было включено 477
больных, из которых только 18% получили адъювантную химиотерапию.
У больных с резидуальной опухолью
после неоадъювантной терапии частота RCB2-3 составляла 63% и 50%
в группе авелумаба и контроля соответственно. При медиане наблюдения
52 мес. 3-летняя БРВ составила 68,3%
в группе авелумаба и 63,2% в контроле, что соответствует недостоверному снижению относительного риска
прогрессирования на 19% (HR=0,81;
p=0,172). При этом добавление авелумаба привело к достоверному увеличению ОВ c 76,3% в контроле до
84,8%, что соответствует снижению
относительного риска смерти на 34%
(HR=0,66; p=0,035). При незапланированном анализе DDFS (БРВ без
отдаленных метастазов) отмечено ее
увеличение с 67,9% до 75,4%, что соответствует снижению относительного риска отдаленного метастазирования на 30%. Лечение авелумабом
досрочно прекратили 27% больных,
в основном вследствие прогрессирования и токсичности. Основными побочными эффектами авелумаба были
гипо- и гипертироидизм 1-2 степени
(17,9%), диарея 1-2 степени (7,2%), лабораторные нарушения.
Подводя итоги этого формально негативного исследования, авторы
считают, что, учитывая позитивное
влияние на ОВ и DDFS, адъювантное
назначение авелумаба может играть
роль при лечении больных тройным
негативным РМЖ с плохим прогнозом.
Abstract 587
На фоне относительной неудачи авелумаба интересными выглядят результаты вакцинотерапии РМЖ, которые были представлены в виде постера. Речь идет о пептидной вакцине тецемотид (Tecemotide, липосомальный BLP25) против гликопротеина MUC1, экспрессия которого обнаруживается на 90% опухолевых клеток РМЖ. Ранее эта вакцина в водорастворимой форме была изучена в исследовании START у больных III стадией НМРЛ после химиолучевой терапии. Результаты его были опубликованы в 2014 году в Lancet Oncology и свидетельствовали, что проведение вакцинотерапии не увеличивает общую продолжительность жизни в сравнении с плацебо. И вот теперь липосомальная форма вакцины была изучена при операбельном РМЖ. В рамках исследования II фазы больные HER2- РМЖ при проведении стандартной неоадъювантной системной терапии рандомизировались на совместное введение тецемотида или плацебо. В исследование было включено 400 пациенток люминальным А (получали неоадъювантную гормонотерапию в течение 6 мес.), люминальным В и тройным негативным фенотипами (химиотерапия 4 курса ЕС и 4 курса доцетаксела). Основным критерием эффективности была частота RCB0/1. Отдаленные результаты исследования прослежены у 291 пациентки, из которых 236 получали химиотерапию. Добавление тецемотида достоверно не увеличило частоту морфологических ответов RCB0/1, которая составила 36,4% и 31,5% в группе тецемотида и плацебо (p=0,42) Однако при медиане наблюдения 7 лет 80,8% больных, получивших тецемотид, были живы без признаков отдаленного метастазирования в сравнении с 64,7% в группе плацебо, что соответствует снижению относительного риска прогрессирования без отдаленных метастазов (DDFS) на 47% (HR=0,53; p=0,005). OВ на отметке 7 лет составила 83,0% и 68,2% в группе тецемотида и плацебо соответственно (HR=0,53; p=0,008). Выигрыш от добавления тецемотида был получен у больных, получавших неоадъювантную химиотерапию. Авторы делают вывод, что добавление пептидной вакцины тецемотид против MUC1 к проводимой стандартной неоадъювантной химиотерапии улучшает отдаленные результаты больных РМЖ люминального B и тройного негативного фенотипов. Это интересный и неожиданный результат. Остается понять, почему сообщаются результаты лечения только 291 пациентки из 400 включенных, получить более подробную информацию об эффективности вакцины в зависимости от фенотипов и других прогностических факторов. Было бы интересно узнать дальнейшие планы, если таковые имеются, изучения липосомальной формы вакцины как при РМЖ, так и при других нозологиях. Будем ждать публикацию этого интригующего исследования, которое, возможно ответит на эти вопросы.
2. Биомаркеры
Abstract 505
В исследовании RxPonder изучалась
целесообразность назначения химиотерапии больным HR+/HER2- T1-
2N1 с хорошим и умеренным прогнозом (RS≤25) по данным геномного
теста OncotypeDx. Было показано,
что от назначения химиотерапии
выигрывают больные с сохраненной
менструальной функцией. В этом
исследовании деление на менструирующих и менопаузальных больных
проводилось на основании опроса
(последняя менструация более 12
мес.) и возраста (все больные старшее
55 лет считались менопаузальными,
независимо от того, сколько времени прошло с последней менструации). Авторы данного исследования
предложили использовать определение анти-Мюллерова гормона для
оценки функционального состояния
яичников больных, участвовавших
в исследовании RxPonder. В исследование включали пременопаузальных
больных (1346 пациенток) моложе
55 лет, у 21% которых обнаружен
сниженный до постменопаузального уровня значения анти-Мюллеров
гормон. Постменопаузальный уровень анти-Мюллерова гормона обнаружен у 3% больных в возрасте моложе 45 лет, у 15% в возрасте 45-49 лет
и у 52% в возрастной группе 50 лет
и старше. У больных с постменопаузальным уровнем анти-Мюллерова
гормона проведение адъювантной
химиотерапии не улучшает отдаленные результаты лечения. Авторы делают вывод, что определение
анти-Мюллерова гормона помогает
с большей точностью, чем возраст,
наличие или отсутствие менструаций, другие гормоны, определить
группу больных, у которых можно
безопасно отказаться от проведения
адъювантной химиотерапии и ограничиться проведением только адъювантной гормонотерапии. Это интересное исследование, которое может
быть использовано в нашей стране,
где в условиях отсутствия геномного
теста трудно выделить группу больных с безопасным отказом от химиотерапии.
Abstract LBA 507
Современные технологии позволяют
определять в плазме пациента наличие циркулирующей опухолевой
ДНК (цоДНК), что, теоретически,
позволяет точнее оценивать прогноз
пациента и определять выбор адекватной терапии, особенно при ранних стадиях заболевания. Динамика
цоДНК в процессе лечения может
свидетельствовать об эффективности
терапии, позволяет выявлять раннее прогрессирование и определять
механизмы резистентности к проводимой терапии. Но это теоретически.
Практически определение цоДНК
не стало рутинной практикой, и сегодня нет рекомендаций, как нужно
ее использовать и какой метод определения цоДНК является оптимальным для этих целей. В связи с вышеперечисленным большой научный
интерес представляет определение
опухолевой ДНК в ходе исследования
monarchE, изучавшего целесообразность назначения комбинации ингибиторов ароматазы и абемациклиба * Динамика цоДНК была прослежена у 831 пациентки из
группы цоДНК– и у 58 из группы цоДНК+.
в качестве адъювантной терапии у
больных HR+/HER2- РМЖ высокого
риска. Опухолевую ДНК определяли
с помощью персонального (приготовленного на основе секвенирования ДНК опухоли пациентки) набора
Signatera TM компании Natera. Для
этого 910 больным, включенным в исследование, определяли цоДНК до начала лечения и в сроки 3, 6 и 24 мес. от
начала лечения. В процессе лечения
и наблюдения больных, включенных
в исследование, частота инвазивного
рецидива составила 27%. При этом
до начала лечения цоДНК+ была обнаружена у 8% больных, из них у 59%
цоДНК продолжала определяться,
а у 41% исчезла в процессе лечения.
Среди пациентов с цоДНК– у 10% она
появилась в ходе лечения. Наличие
цоДНК перед началом терапии свидетельствовало о крайне неблагоприятном прогнозе пациентки: 4-летняя
iDFS составила 20% в сравнении с
79,1% у цоДНК– больных.
Таблица 1.
Влияние динамики цоДНК на 4-летнюю iDFS.
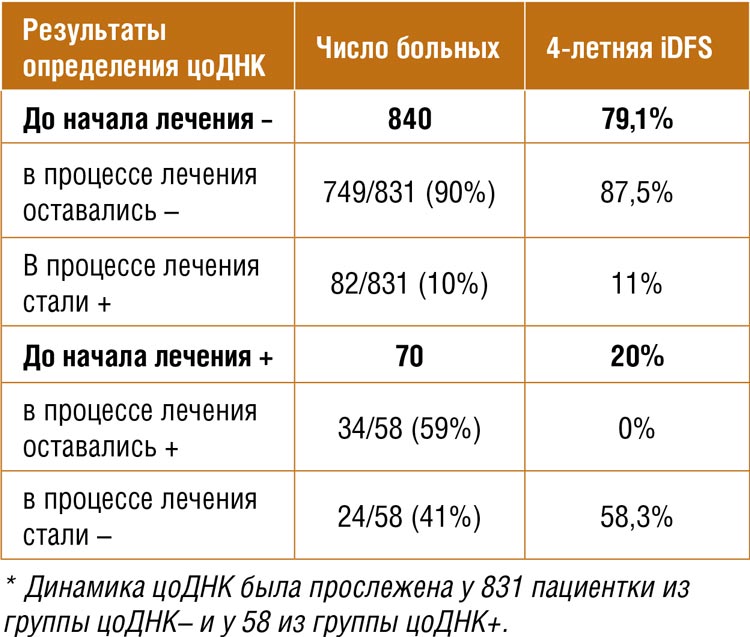
Динамика поведения цоДНК определяла прогноз больных (см. табл.1). Появление цоДНК в процессе лечения
ассоциировалось со значительным
повышением частоты рецидивов, в
то время как исчезновение цоДНК
улучшало прогноз пациенток. У всех
больных с постоянным присутствием цоДНК до начала и в процессе
лечения зарегистрировано развитие
рецидива в течение 4 лет. Медиана
интервала между появлением цоДНК
в крови и радиологическими/клиническими признаками рецидива составили от 7 до 19 мес. (самый короткий
срок у тех, у кого цоДНК появилась
в процессе лечения). Таким образом,
наличие цоДНК ассоциировано с плохим прогнозом. Больные с цоДНК+
до начала лечения имеют высокий
риск прогрессирования и нуждаются
в интенсификации лечения. Было бы
интересно проанализировать, как интенсификация в виде абемациклиба
влияла на динамику цоДНК, но этот
важный аспект остался пока без ответа. Также пока остались без ответа
и другие вопросы: что можно сделать
в случае появления цоДНК в ходе лечения и можно ли с помощью теста
Signatera TM определить механизмы
резистентности к проводимой терапии. Надеюсь, что дальнейший анализ этих очень важных данных позволит оценить полезность определения
цоДНК для оценки прогноза, эффективности лечения и выбора терапии с
учетом механизмов резистентности в
случае прогрессирования.
Abstract 543
И наконец еще об одном важном исследовании, которое окажет влияние
на наш подход в лечении больных
РМЖ.
Для больных с HR+ РМЖ после оперативного вмешательства
обязательным компонентом адъювантной терапии является гормонотерапия, проведение которой
достоверно улучшает отдаленные
результаты. Однако существует
«серая зона» – пациентки с низкой
иммуногистохимической экспрессией рецепторов эстрогенов (РЭ) от
1% до 10%. Больные с низкой экспрессией РЭ биологически сходны
с пациентами тройным негативным
фенотипом, поэтому им практически
в обязательном порядке назначается
нео- или адъювантная химиотерапия. Вопрос о целесообразности назначения адъювантной гормонотерапии с учетом потенциально низкой
чувствительности к ней остается дискутабельным. В отсутствие рандомизированных исследований большое
значение имеет оценка лечения этих
больных в реальной клинической
практике в зависимости от проведения адъювантной гормонотерапии
или отказа от нее. В представленное
на конгрессе исследование включались пациентки с низкими РЭ (1-10%
по данным иммуногистохимии),
получавшие лечение за период 2018-
2020 гг. по данными Национального
ракового регистра США.
Другими критериями включения
были стадия I-III и проведенная химиотерапия, предоперационно или
адъювантно. Авторы исследования
включали больных, получавших
химиотерапию, справедливо полагая, что именно эти больные имели плохой прогноз и высокий риск
прогрессирования, что с большей
вероятностью позволит выяснить
значение для них адъювантной гормонотерапии. За период 2018-2020
гг. в регистре представлены результаты лечения 354 378 больных с HR+
РМЖ I-III стадий, из которых 10 362
(3%) имели низкую экспрессию РЭ.
Из них 7018 больных получали химиотерапию предоперационно (62%)
или адъювантно (38%). Медиана возраста пациенток составила 55 лет,
рецепторы прогестерона отсутствовали у 73%, медиана Ki67 составляла
58%, grade 3 определялась у 73%, cN+
– у 35% больных. Адъювантная гормонотерапия не проводилась 2948
(42%) больным, чаще тем, у кого отсутствовали рецепторы прогестерона, имелись Ki67>20%, grade 3, сN0,
получившие неоадъювантную химиотерапию.
При медиане наблюдения 3 года отмечено достоверное снижение 3-летней OВ с 92,3% в случае проведения
адъювантной гормонотерапии до
89,1% в случае ее отказа, что соответствует достоверному увеличению
относительного риска смерти на 25%
(HR=1,25; p=0,01) у больных без проведения адъювантной гормонотерапии с учетом всех факторов (возраст,
коморбидность, раса, год постановки
диагноза, клиническая и морфологическая стадия заболевания). Был
проведен дополнительный анализ
целесообразности назначения гормонотерапии у больных с неоадъювантной химиотерапией в зависимости от морфологического ответа
на нее. У 49% больных с pCR отказ
от проведения гормонотерапии не
оказал существенного влияния на
OВ (недостоверное увеличение риска
смерти на 6%), в то время как у больных с резидуальной опухолью отказ
достоверно повышает относительный риск смерти на 27%. Авторы делают вывод, что отказ от проведения
адъювантной гормонотерапии больным с низкой экспрессией РЭ является распространенной практикой
(42%) по данным Национального
ракового регистра США. Такой отказ ведет к достоверному увеличению относительного риска смерти
на 25% с учетом всех клинических
и прогностических факторов. Отказ
от проведения адъювантной гормонотерапии у больных с резидуальной опухолью после проведенной
неоадъювантной химиотерапии достоверно увеличивает риск смерти
на 27%. В отсутствие рандомизированных исследований адъювантная
гормонотерапия должна быть рекомендована всем больных РМЖ с
низкой экспрессией РЭ.
НОВОСТИ ASCO 2024 / САРКОМЫ. HIGHLIGHTS
Автор: Тарарыкова Анастасия Алексеевна
Врач-онколог отдела общей онкологии НИИ клинической онкологии им. акад. РАН и
РАМН Н.Н. Трапезникова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина»
Минздрава России, экандидат медицинских наук, Москва
Дорогие читатели, телеграм-каналы в первую неделю июня были
просто перегружены рассылками
и новостями ASCO. Здесь представлены работы, которые по
сути являлись наиболее яркими,
обсуждались в последний день и
были представлены серьезными
саркомными группами.
Final results of a randomized
phase II/III study comparing
perioperative adriamycin plus
ifosfamide and gemcitabine plus
docetaxel for high-grade soft tissue
sarcomas: Japan Clinical Oncology
Group study JCOG1306 (abstract
11503)
Несмотря на то, что стандарт
предоперационной терапии сарком мягких тканей, казалось бы,
уже понятен (тому подтверждение хотя бы исследование Gronchi
A, 2020 [1]), дискуссии о том, так
ли это при всех гистологических
подтипах, продолжают витать в воздухе и соблазнять на проведение еще одного исследования.
В этом году японская саркомная
группа представила свои результаты, причем рандомизированные.
Сравнивали два рабочих режима – адриамицин и ифосфамид
с гемцитабином и доцетакселом.
Ранее, в 2020 году, промежуточные результаты показали, что
GemTax якобы НЕ хуже. Расчетная двухлетняя общая выживаемость (ОВ) составила 94,3%
(95% ДИ 83,4-98,1%) при AI и
91,6% (80,9-96,4%) при GemTax
(ОР 2,55; 95% ДИ 0,80-8,14). Были
отобраны пациенты с операбельной первичной саркомой мягких
тканей конечности или туловища
2/3 Gr по FNCLCC и III стадией
по AJCC (7-е издание) или с операбельным первым рецидивом.
Режим AI: адриамицин 60 мг/
м2 и ифосфамид 10 г/м2, режим
GemTax: гемцитабин 1800 мг/м2
и доцетаксел 70 мг/м2, для всех
режимов интервал в 3 недели. Выполняли 3 курса до операции и 2
курса после. Первичной конечной
точкой III фазы была общая выживаемость. В период с февраля
2014 г. по сентябрь 2018 г. в общей
сложности было включено 143 пациента, а 5-летнее наблюдение завершилось в сентябре 2023 г., при
этом 70 и 73 пациента были распределены в два рукава соответственно режимам (AI и GemTax).
При окончательном анализе при
медиане наблюдения 6 лет расчетная 5-летняя ОВ составила 90,0%
(95% ДИ 80,1-95,1%) при AI и 76,1%
(64,5-84,4%) при GemTax (ОР 2,67;
95% ДИ 1,23-5,80). Расчетная
5-летняя выживаемость без прогрессирования составила 65,2%
(95% ДИ 52,7-75,2%) для AI и 57,4%
(45,2-67,8%) при GemTax (ОР 1,33;
95% ДИ 0,81-2,18).
Т.е. победителем снова выходит
AI. Вроде бы ничего нового, но
это снова не закрывает вопрос с
GemTax или ADIC при, например,
ангиосаркомах и лейомиосаркомах. Так, мы ждем результаты КИ
по предоперационной терапии
забрюшинных лейомиосарком. В
этом исследовании не было пациентов с ангиосаркомой, недифференцированной плеоморфной
саркомой, липосаркомой, лейомиосаркомой, фибросаркомой,
синовиальной, плеоморфной
рабдомисаркомой, ангиосаркомой и злокачественной опухолью из оболочек периферических
нервов. Вообще вопрос отбора
пациентов для периоперационной терапии очень актуален;
предположение о том, что тот же
SARCULATOR перестал соответствовать настоящим реалиям,
поднимался еще в том году, когда
итальянская саркомная группа
вычленила миксоидную липосаркому из исследования Gronchi.
Также тут не учитывался фактор
лечебного патоморфоза и смены
режима, опять же сами критерии
оценки лечебного патоморфоза.
Интересна доза доцетаксела в 70
мг/м2, она может объясняться
желанием исследователей снизить токсичность режима, как
еще один приоритет в сторону
GemTax. В общем, вопросов с
каждым разом все больше и больше, но это исследование мы все
же добавляем в копилку (рандомизированными исследованиями
в саркомах не разбрасываются) и
ставим очередной плюсик в сторону AI.
Рисунок 1-4.
Характеристики пациентов и непосредственные результаты исследования JCOG1306
SU2C-SARC032: A randomized
trial of neoadjuvant RT and surgery
with or without pembrolizumab
for soft tissue sarcoma (abstract
11504)
Желание достигнуть синергизма
в лечении, потенцировать эффект и в принципе преодолеть
резистентность при саркомах в
последнее время изучается не
только в доклинических исследованиях, но уже доходит до
рандомизированных исследований. Здесь рассматривается идея
комбинации лучевой терапии и
иммунотерапии неоадъювантно,
далее операция и адъювантно
пембро.
В исследование были набраны
пациенты с липосаркомой или
недифференцированной плеоморфной саркомой конечностей
или туловища III стадии, которых
рандомизировали в две группы:
неоадъювантная лучевая терапия
(50 Гр за 25 фракций) плюс операция и изучаемая схема лечения с
пембролизумабом. Пембролизумаб вводили в дозе 200 мг каждые
3 недели 3 курса до операции (до,
во время и после лучевой терапии) и до 14 адъювантных курсов. Первичной конечной точкой
была 2-летняя ВБП. В период с
июля 2017 г. по ноябрь 2023 г. в
исследование было включено 143
пациента, преимущественно с недифференцированной плеоморфной саркомой (85%) и 3 степенью
злокачественности (64%). Медиана периода наблюдения составила
24,1 мес. ВБП в изучаемой группе
значительно выше, чем в группе
сравнения (ОР 0,57; 90% ДИ 0,35-
0,91; p=0,023). Расчетный 2-летний показатель ВБП составляет
53% (90% ДИ 43-66%) для группы
сравнения против 70% (90% ДИ
61-81%) для изучаемой. В настоящее время нет статистически значимой разницы в выживаемости
без локального рецидива (ОР 0,55;
95% ДИ 0,21-1,42), DDFS (ОР 0,57;
95% ДИ 0,32-1,01) или ОВ (HR 0,39;
95% ДИ 0,14-1,12). У пациентов
с саркомами 3 степени злокачественности ВБП улучшилась при
применении пембролизумаба (ОР
0,47; 95% ДИ 0,25-0,89), но никаких различий в ВБП не наблюдалось при опухолях 2 степени (ОР
1,21; 95% ДИ 0,35-4,18).
Исследование позитивное, интересно, что ранее на ASCO были
представлены результаты по синергизму трабектедина с лучевой
терапией. Здесь комбинация сработала как при липосаркоме, так
и при недифференцированной
плеоморфной саркоме. Идея расшевелить саркому комбинацией
с лучевой терапией находит все
больше подтверждений.
Рисунок 5.
ВБП в группах по данным исследования SU2C-SARC032
Sintilimab, doxorubicin and ifosfamide (AI) as first-line treatment in patients with advanced
undifferentiated pleomorphic
sarcoma (UPS), synovial sarcoma
(SS), myxoid liposarcoma (MLPS)
and de-differentiated liposarcoma
(DDLPS): A single arm phase 2
trial (abstract 11505)
Еще одна потенцирующая комбинация и положительный результат, но уже ИТ (синтилимаб)
со стандартом первой линии AI.
Включали пациентов с распространенной недифференцированной плеоморфной саркомой
(UPS), синовиальной саркомой
(SS), миксоидной липосаркомой
(MLPS) и дедифференцированной липосаркомой (DDLPS), которые ранее не получали системного лечения. Схема лечения
включала: синтилимаб (200 мг,
1 день), ADM (60 мг/м2, 1 день) и
IFO (1,8 г/м2/день, 1-5 дни), раз в
3 недели в течение до 6 курсов с
последующей поддерживающей
терапией синтилимабом до прогрессирования заболевания, неприемлемой токсичности или до
2 лет. Первичной конечной точкой была частота объективного
ответа согласно RECIST 1.1.
В период с июня 2020 г. по июнь
2023 г. в исследование было включено 46 пациентов, оценке подлежали данные 41 пациента. ORR
составил 68,3% (28/41): 7/8 (87,5%)
UPS, 13/20 (65,0%) SS, 3/3 (100%)
MLPS и 5/10 (50%) с DDLPS. При
медиане наблюдения 28,0 мес.
(95% ДИ 9,4-46,7) медиана ВБВ
и ОS составили 9,0 мес. (95% ДИ
6,5-11,5) и 19,9 мес. (95% ДИ 14,9-
24,9) соответственно. Наиболее
частыми нежелательными явлениями ≥3 степени были лейкопения (50,0%), нейтропения (45,7%),
тромбоцитопения (21,7%), анемия
(21,7%) и фебрильная нейтропения (21,7%).
Рисунок 6.
Непосредственные результаты исследования ImmunoSarc II
ImmunoSarc II master trial (phase
II of sunitinib and nivolumab):
Results from the dedifferentiated
chondrosarcoma (DDCS) cohort–A
GEIS, ISG and UCL study (abstract
11506)
Переходим к костным саркомам,
а именно попытке растормошить
их так же, как мягкотканные. Причем выбор по гистотипу очень интересный – дедифференцированная хондросаркома (DDCS). Здесь
исследований очень мало (читай
– нет), вроде и хондросаркома, но
с компонентном в виде остеоида,
т.е. по сути – остеосаркома, но не
совсем, а если быть проще – хуже
по прогнозу. Результаты ИТ при
остеосаркоме и классической
хондросаркоме негативные, а тут
как бы нечто не совсем определенное. Предпосылки для выбора
схемы – результаты основного исследования IMMUNOSARC I, из учавшего сунитиниб в сочетании
с ниволумабом при нескольких
подтипах саркомы, где была обнаружена потенциальная активность при DDCS, что привело к
созданию определенной когорты
в рамках исследования II фазы
IMMUNOSARC II.
Пациенты получали сунитиниб в
дозе 37,5 мг/день в течение 14 дней
(фаза индукции), а затем 25 мг/
день в сочетании с ниволумабом
240 мг каждые 2 недели до прогрессирования заболевания или
непереносимости. Основной конечной точкой была 6-месячная
ВБП, по крайней мере, 14 из 23
пациентов должны быть без прогрессирования.
В период с декабря 2019 г. по октябрь 2023 г. было включено 24 пациента со средним возрастом
60 лет (38-76 лет). Пациенты ранее получали в среднем 1 (0-2)
линию терапии. В общей сложности можно было оценить 23
пациента со средней продолжительностью наблюдения 20,1 мес.
(95% ДИ 11,6-28,6). Медиана ВБП
составила 5,6 мес. (95% ДИ 4,5-
6,7); 6-месячная PFSR составила
10 из 23 пациентов (46%); медиана общей выживаемости 10,3
мес. (95% ДИ 6,7-13,9). Из 19 пациентов с измеримым ответом
по RECIST 5 пациентов (26,3%)
достигли частичного ответа, у
10 (52,6%) наблюдалась стабилизация заболевания и у 4 (21,1%)
– прогрессирование. Причинами прекращения лечения были
прогрессирование у 21 пациента
(87%) и токсичность у 1 пациента
(4,2%), при этом у двух пациентов
(8,4%) лечение продолжалось.
Исследование негативное, но (!)
если посмотреть в сравнении с
другими результатами ИТ при
костных саркомах, или даже просто при DDCS – очень даже неплохо (частичный ответ 26,3%!).
Эта комбинация точно заслуживает дальнейшего изучения.
Рисунок 7.
Структура HS-20093
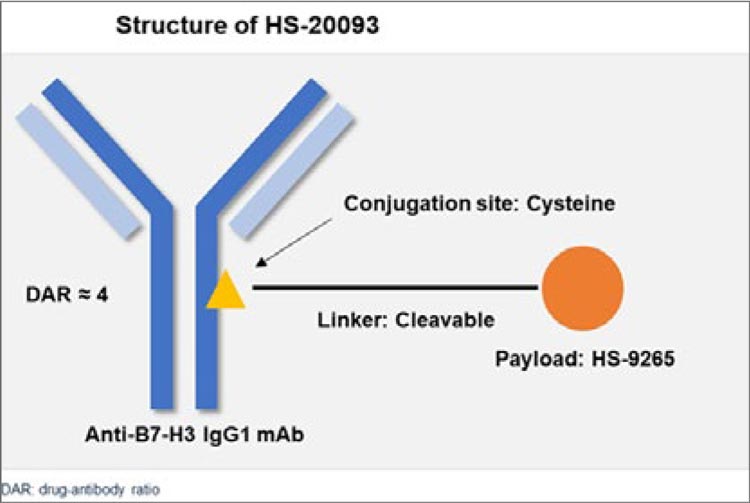
ARTEMIS-002: Phase 2 study of
HS-20093 in patients with relapsed
or refractory osteosarcoma
(abstract 11507)
Рецидивирующая или, что еще
хуже, рефрактерная остеосаркома имеет очень плохой прогноз, после сорафениба или регорафениба предложить нам особо нечего. HS-20093 представляет собой
новый конъюгат антитело-лекарственное средство (ADC), нацеленный на B7-H3 – протеин, высокоэкспрессируемый на мембране
клеток остеосаркомы. Он показал
свою предположительную противоопухолевую активность в исследовании I фазы ARTEMIS-001.
Сегодня нам показали результаты лечения пациентов, получавших HS-20093 в исследовании
ARTEMIS-002.
Исследование представляет собой
открытое исследование II фазы с
участием двух групп пациентов с
остеосаркомой или другими саркомами, прогрессировавшими на
фоне стандартного системного
лечения. На основании результатов исследования I фазы пациенты были рандомизированы для
получения HS-20093 в дозе 8 мг/
кг либо 12 мг/кг каждые 3 недели
в соотношении 1:1. Первичной конечной точкой была частота объективного ответа (ЧОО) согласно
RECIST1.1. Экспрессию B7-H3
ретроспективно оценивали с помощью ИГХ в материале остеосаркомы.
Всего с июня по декабрь 2023 г.
было включено 34 пациента с
остеосаркомой, получивших HS20093 в дозе 8,0 мг/кг (n=15) или
12,0 мг/кг (n=19). Средний возраст
составил 21,5 года (диапазон: 18-
65). Исходно у большинства пациентов была IV стадия заболевания (32/34, 94,1%) и метастазы
в легкие (28/34, 82,4%). Двадцать
два пациента (64,7%) ранее получали терапию ≥3 линий. Двадцать
шесть пациентов (76,5%) получили 4 линии стандартной химиотерапии, состоящей из платины,
антрациклинов, ифосфамида и
метотрексата. Нежелательные
явления, возникшие во время
лечения (TEAE), произошли у 33
пациентов (97,1%). Распространенными TEAE 3/4 степени (≥5%)
были нейтропения, лейкопения,
тромбоцитопения, лимфопения
и анемия. Частота прекращения
приема, отмены дозы и снижения дозы составила 2,9%, 11,8%
и 23,5% соответственно. TEAE,
приведшего к смерти, не было.
На момент среза данных (25 декабря 2023 г.) медиана времени наблюдения составила 4,1 мес. (95%
ДИ 1,4-5,5) среди 21 пациента,
поддающегося оценке ответа (11
получали 8 мг/кг и 10 – 12,0 мг/кг).
ЧОО при дозе 12,0 мг/кг HS-20093
составила 20,0%. Два подтвержденных частичных ответа наблюдались у пациентов, получавших
дозу 12,0 мг/кг, и сохранялись до
последнего наблюдения, из которых самая длительная продолжительность ответа составила
4,0 мес. Уровень контроля роста
заболевания составил 81,8% (9/11)
и 100% (10/10) у пациентов, принимавших 8 мг/кг и 12,0 мг/кг.
Медиана выживаемости без прогрессирования у всех 21 пациента
не достигнута. Никакой корреляции между ответом опухоли и
уровнем экспрессии B7-H3 не наблюдалось.
Пока что это самые интересные
данные по рефрактерной остеосаркоме, набор в КИ продолжается, будем надеяться, что интерес
не пропадет, по крайней мере,
предпосылок сейчас к этому нет.
Особенно, если он приблизится
или превзойдет результаты сорафениба/регорафениба.
SARC037: Phase II results of
trabectedin given as a 1-hour (h)
infusion in combination with low
dose irinotecan in patients (pts)
with relapsed/refractory Ewing
sarcoma (ES) (abstract 11508)
Трабектедин добрался и до Юинга. Доклинические данные свидетельствуют о том, что он подавляет онкогенный фактор
ES, EWS::FLI1. Это подавление
требует пороговой концентрации трабектедина и усиливается
низкими дозами иринотекана.
Предварительная клиническая
активность и изменение транскриптома EWS::FLI1 наблюдались
у пациентов в I фазе SARC037.
Во II фазе трабектидин назначался в дозе 1 мг/м2 в виде 1-часовой
инфузии в 1 день, а иринотекан
в дозе 25 мг/м2 внутривенно во
2-й и 4-й дни, интервал 3 недели. Ключевыми критериями отбора были слитый транскрипт
EWS::FLI1, возраст ≥6 лет, ECOG
≤2 и возможность выполнить
биопсию. Первичная конечная
точка заключалась в определении
частоты объективных ответов
(ЧОО).
В период с 12.2022 г. по 12.2023
г. было набрано 18 пациентов,
средний возраст 21 год (9-43). В
среднем у пациентов было 3 (1-7)
предшествующих линий терапии, включая иринотекан у 67%
пациентов. Из 16 пациентов, подлежащих оценке эффекта, у 5 наблюдался частичный ответ, а у 2
пациентов – стабилизация. Два
пациента ожидают оценки, а еще
два исключены из исследования
до первой оценки из-за токсичности. Среднее время ответа составило 2,6 мес., 6-месячная ВБП
составила 37,7% (95% ДИ 18,3-
77,7%). Большинству пациентов
было проведено молекулярное
профилирование, тестирование
транслокации, а также сбор, количественный анализ и анализ
ктДНК. Подгруппе пациентов
была проведена биопсия до и после лечения для секвенирования
РНК и оценки влияния воздействия препарата на транскриптом EWS::FLI1.
Анализ корреляции продолжается и еще не был доложен, но
первичная конечная точка достигнута, опять же – имеются
частичные ответы. Набор небольшой, но группа пациентов
специфическая, полагаем, что
все-таки такая комбинация имеет место быть.
Источники:
- Gronchi A, Palmerini E, Quagliuolo V, Martin Broto J, Lopez Pousa A, Grignani G, Brunello A, Blay JY, Tendero O, Diaz Beveridge R, Ferraresi V, Lugowska I, Merlo DF, Fontana V, Marchesi E, Braglia L, Donati DM, Palassini E, Bianchi G, Marrari A, Morosi C, Stacchiotti S, Bagué S, Coindre JM, Dei Tos AP, Picci P, Bruzzi P, Casali PG. Neoadjuvant Chemotherapy in High-Risk Soft Tissue Sarcomas: Final Results of a Randomized Trial From Italian (ISG), Spanish (GEIS), French (FSG), and Polish (PSG) Sarcoma Groups. J Clin Oncol. 2020 Jul 1; 38(19): 2178-2186. doi: 10.1200/ JCO.19.03289. Epub 2020 May 18. PMID: 32421444.
- Tanaka K, et al. Final results of a randomized phase II/III study comparing perioperative adriamycin plus ifosfamide and gemcitabine plus docetaxel for high-grade soft tissue sarcomas: Japan Clinical Oncology Group study JCOG1306 (abstract 11503).
НОВОСТИ ASCO 2024 / РАК ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
Автор: Исраелян Эдгар Рудикович
Врач-онколог онкологического отделения лекарственных методов лечения (химиотерапевтическое)
№4 ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
Исследования, представленные
на конгрессе ASCO 2024 по раку
предстательной железы (РПЖ), не
изменят нашу клиническую практику, но, безусловно, требуют внимания, будто говоря: «Так делать не
надо».
ECOG-ACRIN EA8153
(CHAARTED2): кабазитаксел +
абиратерон vs абиратерон после терапии доцетакселом
В исследовании CHAARTED комбинация АДТ и доцетаксела против
только АДТ продемонстрировала
высокую эффективность, особенно в группе пациентов с большим
объемом распространения (висцеральные метастазы и/или ≥4 очагов
в костях, включая ≥1 вне позвоночного столба или таза), улучшив общую выживаемость (ОВ) [1]. Какой
опции отдать предпочтение при
развитии кастрационной резистентности? В исследовании реальной
клинической практики наиболее
назначаемыми агентами были абиратерона ацетат/преднизон (АА/п)
и энзалутамид (≈70%), а также кабазитаксел (≈12%) [2].
В проспективное рандомизированное исследование ECOG-ACRIN
EА8153 были включены пациенты
с мКРРПЖ после прогрессирования на доцетакселе в гормоночувствительной фазе и рандомизированы в 2 группы: АА/п +
кабазитаксел (n=111) и АА/п (n=112).
Стратификационными факторами
явились: ECOG статус (0 против
1-2), время от начала АДТ до развития кастрат-резистентности (≤12
мес. и >12 мес.), наличие/отсутствие
висцеральных очагов. Первичная конечная точка – радиологическая выживаемость без прогрессирования
(рВБП). Характеристики пациентов
не различались между обеими группами. У большинства ECOG 0, сумма баллов по Глисону 8-10, медиана
ПСА – 13 нг/мл.
Рисунок 1.
ВБП в группах по данным исследования
ECOG-ACRIN EА8153.
Рисунок 2.
Подгрупповой анализ ВБП
Медиана рВБП в группах комбинации АА/п + кабазитаксел и АА/п
составила 14,9 и 9,9 мес. (ОР 0,73;
95% ДИ 0,59-0,90; р=0,049) соответственно.
При подгрупповом анализе больший выигрыш от химиогормональной комбинации отмечен у пациентов <65 лет, ECOG 0, с временем до
развития кастрационной резистентности ≤12 мес., без висцеральных
метастазов.
Время до ПСА прогрессирования
оказалось длиннее в группе комбинации – 10 против 6,1 мес. (ОР
0,60; 95% ДИ 0,44-0,83; р=0,002). ОВ
статистически значимо не различалась между группами, в то же время
мощность исследования не рассчитана под данную вторичную конечную точку
Вероятно, результаты исследования
EA8153 не изменят нашу клиническую практику по нескольким причинам: пограничная значимость
различий в рВБП, частое назначение
ингибиторов андрогенного сигнала
(ИАС) в гормоночувствительную
фазу, а также необходимость последовательного использования активных опций лечения [3].
Рисунок 3.
ОВ по данным исследования ECOG-ACRIN EА8153

CYCLONE 2: абемациклиб + абиратерона ацетат в лечении мКРРПЖ
Андрогены являются митогенным
активатором циклина D, который,
образуя комплекс с р21 и CDK4/6,
приводит к быстрому переходу клетки из фазы G1 в S. Абемациклиб –
ингибитор CDK4/6, продемонстрировавший свою эффективность в
лечении гормонозависимого рака
молочной железы. Сможет ли комбинация ингибитора CDK4/6 и ИАС
продемонстрировать свой синергизм
на практике?
В исследование II/III фазы CYCLONE
2 включались пациенты с мКРРПЖ,
не получавшие ранее ИАС, допускалось проведение терапии доцетакселом в гормоночувствительной
фазе. Адаптивный дизайн протокола
предполагал 3 части: оценка безопасности, оценка эффективности, расширение когорты в случае подтверждения статистической гипотезы.
Первичная конечная точка – рВБП.
Стратификационные факторы: доцетаксел в гормоночувствительную
фазу, радиологическое прогрессирование и измеряемые очаги болезни.
Пациенты в группах не различались
по основным характеристикам. В
итоге не было достигнуто значимых
различий в рВБП между группами:
абемациклиб + АА/п 22 мес. против
20,3 мес. в группе АА/п (ОР 0,83; 95%
ДИ 0,62-1,11; р=0,212).
При подгрупповом анализе нельзя
однозначно выделить когорту больных, получивших больший выигрыш
от назначения комбинации иCDK4/6
и ИАС, возможно, пациенты с суммой баллов по Глисону ≥8, высоким
уровнем ПСА имели некое преимущество, но это неточно. Также не отмечено достоверных различий и по
большинству вторичных конечных
точек: ОВ (ОР 0,927; 95% ДИ 0,669-
1,285), время до симптомного прогрессирования (ОР 0,768; 95% ДИ
0,522-1,131), время до ухудшения болевого синдрома (ОР 0,935; 95% ДИ
0,665-1,314) – в отличие от времени
до ПСА прогрессирования (ОР 0,637;
95% ДИ 0,474-0,856).
Наиболее часто встречаемые нежелательные явления ≥3 степени в группе абемациклиба и АА/п – анемия
(13,6% против 4,3% в группе АА/п),
нейтропения (12,6% против 0,5%),
повышение АЛТ (8,7% против 6,5%).
В исследовании CYCLONE 2 не достигнута первичная конечная точка,
не получены значимые различия во
вторичных конечных точках, ожидаемый биологический синергизм
между иCDK4/6 и ИАС не оправдал
себя. А может, дело в выборе ингибитора циклин-зависимых киназ? Но
это совсем другая история...
Рисунок5.
ВБП в группах исследования CYCLONE 2
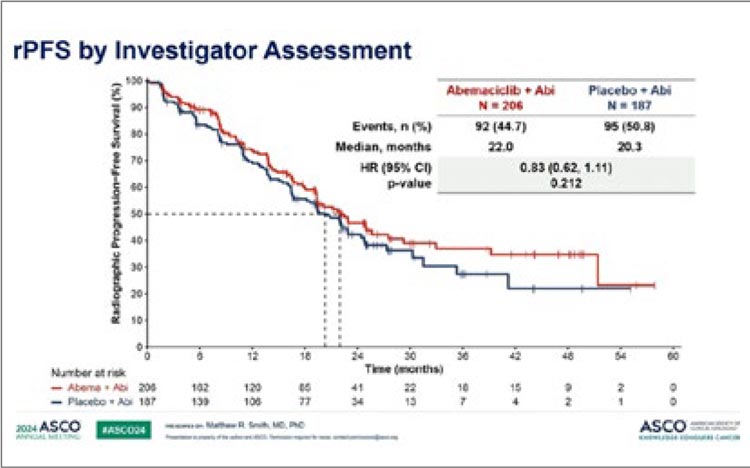
Рисунок 6.
Показатели ВБП по данным исследования MAST
Рисунок 7.
ОВ в исследовании PSMAfore: обновленные данные
The MAST trial: влияние метформина на снижение частоты прогрессирования среди пациентов с РПЖ
низкого риска
Метформин – один из наиболее часто применяемых противодиабетических препаратов – не раз изучался
в качестве компонента противоопухолевой терапии, тем не менее, его
роль остается неясной [4].
Ранее было продемонстрировано замедление прогрессирования РПЖ
в группе пациентов, получавших
метформин [5]. Возникла гипотеза,
окажет ли влияние прием метформина на прогрессирование локализованного РПЖ в группе пациентов,
находящихся под активным наблюдением?
В исследование MAST включено 407
пациентов с гистологически подтвержденным РПЖ низкого риска
(сумма баллов по Глисону <6 в <1/3
столбцов, <50% опухолевой ткани
в каждом столбце, ПСА ≤10 нг/мл,
клиническая стадия Т1с-Т2а), выбравших опцию активного наблюдения.
Пациенты рандомизированы в 2
группы: метформин 850 мг 2 раза
в день внутрь (n=204) или плацебо
(n=203) до 3 лет. Всем пациентам
производилась повторная биопсия предстательной железы через 18 и
36 месяцев. Первичная конечная
точка – время до прогрессирования,
определяемое как необходимость в
проведении лечения (простатэктомия, лучевая терапия, гормонотерапия) или патоморфологическое
прогрессирование (>1/3 позитивных столбцов, >50% опухолевой
ткани в каждом столбце, паттерн по
Глисону ≥4). Медиана возраста пациентов составила 63 года, у большинства (>90%) стадия T1c.
Прием метформина не позволил
улучшить выживаемость без прогрессирования (р=0,63).
В подгрупповом анализе продемонстрировано некоторое негативное
влияние метформина на ВБП для
пациентов с ИМТ ≥30, суммой баллов по Глисону ≥8.
Метформин не смог отдалить прогрессирование заболевания в наиболее благоприятной подгруппе
пациентов с РПЖ. Не пора ли поставить точку в этом вопросе и использовать этот препарат только по
его прямому показанию? Личная
позиция автора заметки – пора.
Рисунок 8-9.
Основные результаты исследования PSMAfore
Второй промежуточный анализ
исследования PSMAfore: оценка
качества жизни и болевого синдрома
На ESMO 2023 был представлен
1 промежуточный анализ данной
работы, в котором достигнута первичная конечная точка – рВБП (ОР
0,41; 95% ДИ 0,29-0,56) [6].
Напомним, в данное исследование
включались пациенты с мКРРПЖ
после прогрессирования на ИАС
второго поколения, с ПСМАпозитивными очагами, не получавшие терапию таксанами (за
исключением использования в неоадъюванте).
Пациенты рандомизированы в
группу радионуклидной терапии
(РНТ) – 177-Lu-PSMA-617 либо
другого ИАС, допускался кроссовер в группе антиандрогенов на
ПСМА-таргетную терапию.
При первом срезе данных ОВ не
различалась между группами (ОР
0,80; 95% ДИ 0,48-1,33), вероятно,
за счет высокой частоты кроссовера (84,2% пациентов с радиологическим прогрессированием из
группы ИАС получили РНТ).
На ASCO 2024 представлены обновленные данные по ОВ, также не
достигшие различий (ОР 0,98; 95%
ДИ 0,75-1,28).
ПСМА-таргетная терапия позволила отдалить время до ухудшения качества жизни (FACT-P total
score: ОР 0,59; 95% ДИ 0,47-0,72;
EQ-5D-5L utility score: ОР 0,61; 95%
ДИ 0,50-0,76). Не менее важно, что
РНТ также увеличила время до
ухудшения болевого синдрома.
Несмотря на успехи 177-лютеция
в достижении первичной конечной точки и некоторых вторичных
(качество жизни по различным
шкалам), контрольная группа в
данном исследовании не отвечает
современной клинической практике. Известно, что замена одного
нового антиандрогена на другой
является низкоэффективной опцией, а высокая частота кроссовера с ИАС на РНТ «съела» различия
в рВБП, не улучшив ОВ.
Безусловно, не все пациенты являются кандидатами для терапии
таксанами, и результаты данного
исследования можно экстраполировать в первую очередь на данную подгруппу больных.
Рисунок 10-11.
Показатели ОВ после прогрессирования в группах исследования ARASENS
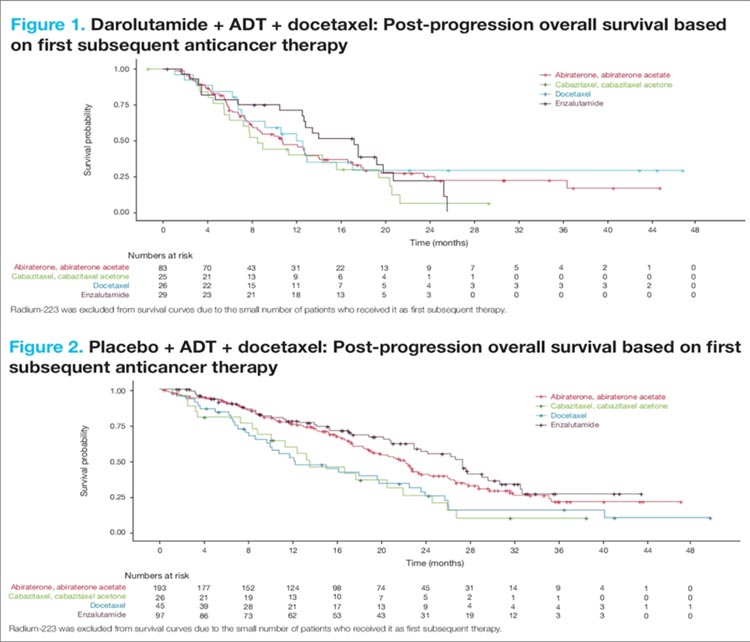
Терапия после прогрессирования на даролутамиде + доцетакселе + АДТ: post hoc анализ исследования ARASENS
На ASCO GU 2022 были представлены данные исследования
ARASENS по изучению роли
триплета в лечении пациентов с
гормоночувствительным раком
предстательной железы. Добавление даролутамида к доцетакселу
и АДТ позволило статистически
значимо снизить риск смерти на
32,5% (p<0,001) [7]. При проведении поданализа в зависимости от
объема и риска поражения наибольший выигрыш от тройной
комбинации отмечен среди пациентов с большим объемом/риском
метастатического процесса, что
послужило поводом использования триплета в реальной клинической практике (но на основе
АА/п).
А что делать в случае прогрессирования? На постерной сессии
ASCO 2024 представлены данные
пациентов, у которых отмечено
прогрессирование: 315 пациентов
из группы даролутамида и 495 из
группы плацебо. Последующие
линии получили 57% и 76% пациентов соответственно. В группе
даролутамида в 90% случаев назначались ИАС или ХТ, не отмечено различий в ОВ в зависимости от
лечебной опции. В группе плацебо
большинство пациентов (78%) получили в следующей линии ИАС,
который и продемонстрировал
больший выигрыш в ОВ нежели
ХТ (медиана, 23 против 13,5 мес.).
Рисунок 12.
Основные результаты исследования PLATIPARP
PLATIPARP trial: поддерживающая терапия PARP ингибитором
(PARPi) после индукционной
платиносодержащей ХТ
Примерно у трети пациентов с мКРРПЖ отмечаются альтерации в системе гомологичной рекомбинации (HRR). Данные двух проспективных рандомизированных исследований демонстрируют эффективность монотерапии PARPi среди пациентов с мутациями в системе HRR [8,9]. Известно, что чувствительность опухоли к платиновой ХТ коррелирует с чувствительностью и к PARPi. В исследование II фазы PLATIPARP включались пациенты с наличием мутаций в системе HRR, получившие ранее таксаны и/или ИАС, но не PARPi. Проводилась индукционная ХТ (ИХТ) в режиме: доцетаксел 60 мг/м2 + карбоплатин AUC5, 1 раз в 21 день, всего до 4 курсов, далее поддерживающая терапия рукапарибом по 600 мг 2 раза в сутки внутрь до прогрессирования либо непереносимой токсичности. Первичная конечная точка – клиническая/ радиологическая ВБП. Согласно статистической гипотезе, было необходимо включить в исследование 20 пациентов для снижения риска прогрессирования на 50% (предполагаемая ВБП 18,2 мес.).
В период с 2018 по 2021 год включено 18 пациентов (завершение
набора связано с остановкой предоставления рукапариба производителем). У 8 пациентов отмечена мутация BRCA2, у 7 – АТМ, у
3 – BRCA1, по 1 – PALB2, FANCA,
CHD1/SPOP. ВБП во всей когорте
составила 8,1 мес., ОВ – 18 мес., у
пациентов с мутациями в генах BRCA1/2 – 17,7 и 26,9 мес. соответственно.
ИХТ с последующей поддержкой
рукапарибом не достигла первичной конечной точки, так еще
и оказалась хуже исторического
контроля (9,1 мес. на монотерапии олапарибом).
В недавнем анализе FDA продемонстрировано, что мутации не
во всех генах системы HRR ассоциированы с эффективностью
добавления PARPi. Наилучшие
результаты достигнуты для 4 генов: BRCA1/2, PALB2, CDK12 [10].
Возможно, более строгие критерии включения (4 гена, а не вся
HRR панель) позволят данному
подходу улучшить результаты в
сравнении с монотерапией PARPi.
Ответ на это предположение даст
лишь проспективное рандомизированное исследование.
Источники:
- Sweeney CJ, Chen YH, Carducci M, et al. Chemohormonal Therapy in Metastatic Hormone-SensitiveProstate Cancer. New England Journal of Medicine. 2015; 373(8): 737- 746. doi:10.1056/NEJMOA1503747.
- Watson A, Gagnon R, Batuyong E, Alimohamed NS, Lee-Ying RM. Sequence decision making for cabazitaxel (Cbz) versus abiraterone (Abt) or enzalutamide (Enz) postdocetaxel (Dtx) in a publicly funded health care system. 2021; 39 (6_suppl): 57-57. doi:10.1200/JCO.2021.39.6.
- de Wit R, de Bono J, Sternberg CN, et al. Cabazitaxel versus Abiraterone or Enzalutamide in Metastatic Prostate Cancer. New England Journal of Medicine. 2019; 381(26): 2506-2518. doi:10.1056/NEJMOA1911206.
- Lord SR, Harris AL. Is it still worth pursuing the repurposing of metformin as a cancer therapeutic? British Journal of Cancer. 2023; 128(6): 958-966. doi:10.1038/s41416- 023-02204-2.
- Kim R, Song M, Shihn J, et al. Correlation between metformin intake and prostate cancer. Cardiovascular prevention and Pharmacotherapy. 2023; 5(3): 91-97. doi.org/10.36011/cpp.2023.5.e12.
- ESMO Congress 2023 | OncologyPRO. Accessed June 15, 2024. https://oncologypro.esmo. org/meeting-resources/esmocongress-2023/phase-iii-trial-of177lu-lu-psma-617-in-taxane-naivepatients-with-metastatic-castration resistant-prostate-cancer-psmafore.
- Smith MR, Hussain M, Saad F, et al. Darolutamide and Survival in Metastatic, Hormone-Sensitive Prostate Cancer. New England Journal of Medicine. 2022; 386(12): 1132-1142. doi:10.1056/ NEJMOA2119115.
- de Bono J, Mateo J, Fizazi K, et al. Olaparib for Metastatic CastrationResistant Prostate Cancer. New England Journal of Medicine. 2020; 382(22): 2091-2102. doi:10.1056/ NEJMOA1911440.
- Fizazi K, Piulats JM, Reaume MN, et al. Rucaparib or Physician’s Choice in Metastatic Prostate Cancer. New England Journal of Medicine. 2023; 388(8): 719-732. doi:10.1056/ NEJMOA2214676.
- Fallah J, Xu J, Weinstock C, et al. Efficacy of Poly(ADP-ribose) Polymerase Inhibitors by Individual Genes in Homologous Recombination Repair Gene-Mutated Metastatic Castration-Resistant Prostate Cancer: A US Food and Drug Administration Pooled Analysis. Journal of Clinical Oncology. 2024; 42(14): 1687-1698. doi:10.1200/JCO.23.02105.
НОВОСТИ ASCO 2024 / РАК ВЕРХНИХ ОТДЕЛОВ ЖКТ
Автор: Евсеев Владислав Николаевич
Заведующий отделением химиотерапии, Клиника МЕДСИ Санкт-Петербург,
Эксперт фонда «Не Напрасно», Санкт-Петербург
В этом году на ASCO были представлены результаты целого ряда исследований, которые могут повлиять на
нашу ежедневную практику лечения
пациентов с опухолями желудка и
пищевода. Одно из самых нашумевших исследований – ESOPEC
[1], в котором сравнивали эффективность двух подходов к лечению
операбельной аденокарциномы
пищевода: проведение предоперационной химиолучевой терапии
(в режиме CROSS) или периоперационная химиотерапия по схеме
FLOT. Оба этих варианта улучшают
результаты лечения по сравнению
с проведением хирургического лечения, но до сих пор у нас не было
прямого сравнения этих подходов.
Рисунок 1.
Показатели общей выживаемости по данным
исследования ESOPEC
В исследовании ESOPEC пациенты c cT1N+ или cT2-T4aNлюбой рандомизировались в две группы: половине пациентов проводили периоперационную терапию по схеме FLOT, вторая половина получала химиолучевую терапию с паклитакселом и карбоплатином, доза лучевой терапии – 41,4 Гр. Первичной конечной точкой была выбрана общая выживаемость. Оказалось, что периоперационная химиотерапия приводит к улучшению показателя общей выживаемости – медиана увеличилась с 37 месяцев в группе химиолучевой терапии до 66 месяцев в группе химиотерапии. Пятилетняя выживаемость также была выше при периоперационной химиотерапии – 38,7% по сравнению с 50,6% в группе ХЛТ. При этом 5 лет без признаков рецидива прожили 44,4% пациентов в группе химиотерапии и только 30,9% в группе химиолучевой терапии. Частота послеоперационных осложнений значимо не отличалась между группами – осложнения 3-4 степени по шкале Клавьен-Диньдо возникли у 29,8% в группе FLOT и 27,7% в группе химиолучевой терапии, 30-дневная послеоперационная летальность составила 1% и 1,7% соответственно. Примерно 2/3 пациентов начали адъювантную часть лечения и только около половины закончили все запланированные циклы послеоперационной химиотерапии. Эти данные похожи на результаты предыдущих исследований и реальной практики.
Рисунок 2.
Частота полных патоморфологических ответов в
исследовании ECOG-ACRIN EA2174
В другом периоперационном исследовании ECOG-ACRIN EA2174
[2] оценивалась эффективность добавления препарата ниволумаб в
предоперационную химиолучевую
терапию при лечении аденокарциномы пищевода или пищеводножелудочного перехода. Пока что
доступны только «короткие» результаты наблюдения, и оказалось,
что такая интенсификация лечения
не приводит к улучшению частоты
полных патоморфологических регрессов. Тем не менее, наблюдение
продолжается, и это исследование
должно ответить еще на ряд дополнительных вопросов, например, на
вопрос, нужно ли проводить после
операции комбинированную иммунотерапию по схеме ниволумаб
+ ипилимумаб. Правда, не очень
понятно, насколько нас будут интересовать эти результаты в свете результатов исследования ESOPEC.
Рисунок 3.
Показатели выживаемости в группах по данным
исследования IKF-575/RENAISSANCE
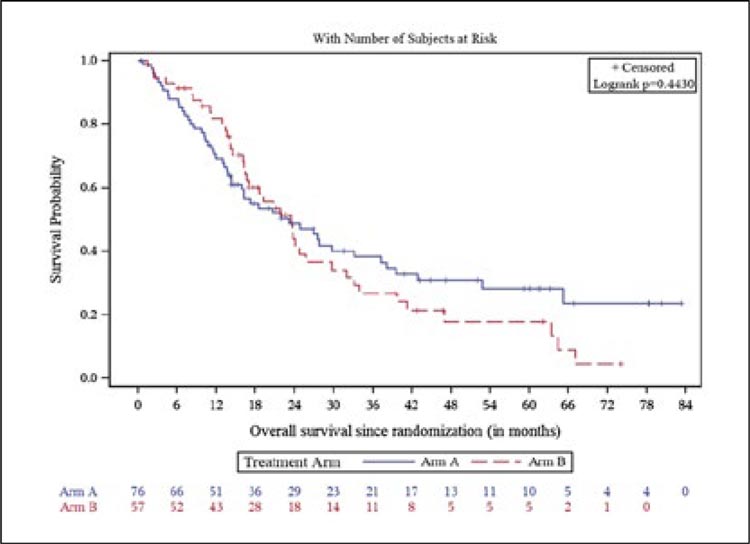
В этом году на ASCO были представлены результаты исследования IKF575/RENAISSANCE [3], в котором
исследователи пытались ответить на
вопрос, нужно ли проводить хирургическое лечение при ограниченном
метастатическом раке желудка после
интенсивной химиотерапии (стандартным режимом был FLOT с возможностью добавления трастузумаба или ниволумаба в зависимости
от результатов иммуногистохимического исследования). Пациенты
после достижения объективного
ответа или стабилизации на фоне 4
циклов химиотерапии рандомизировались на 2 группы: продолжение
только системной терапии или попытка проведения хирургического
вмешательства.
Исследование продемонстрировало
отсутствие улучшение общей выживаемости в группе хирургического лечения. При этом изначально
кривая выживаемости пациентов
в группе хирургического лечения
даже «проваливалась», вероятно,
из-за послеоперационных осложнений или невозможности вовремя
возобновить системную терапию.
Подгрупповой анализ показал, что
единственная группа с потенциальной пользой от хирургического лечения – пациенты с изолированным
метастатическим поражением забрюшинных лимфатических узлов.
Другие пациенты (с ограниченным
канцероматозом или метастатическим поражением печени) от хирургического лечения однозначно не
выигрывали.
Еще одна работа, удостоившееся
устного доклада, – исследование
ARMANI [4]. В ней изучалась концепция «switch-maintenance», то
есть переключения с одного режима
химиотерапии на другой в качестве
«поддерживающего» варианта лечения. Конкретно в этом исследовании после 3 месяцев химиотерапии
по схеме FOLFOX пациенты рандомизировались в одну из двух групп:
продолжение терапии по прежней
схеме еще на протяжении 3 месяцев с дальнейшей поддерживающей
терапией фторпиримидинами или переключение на химиотерапию по
схеме паклитаксел + рамуцирумаб.
Первичной конечной точкой была
выбрана выживаемость без прогрессирования. Такой выбор удивляет
по целому ряду причин: во-первых,
не очень понятно, зачем нам показатель выживаемости без прогрессирования, когда мы фактически
оцениваем эффективность двух
последовательных схем лечения
против объединения этой терапии
в одну линию лечения. Хочется посмотреть, насколько более ранний
старт терапии паклитакселом и
рамуцирумабом влияет именно на
общую выживаемость. Во-вторых,
общая выживаемость пациентов с
метастатическим раком желудка
не такая большая, чтобы дожидаться результатов этого исследования слишком долго.
Рисунок 4.
Показатель ВБП в группах по данным исследования ARMANI
Авторам удалось показать улучшение по основной конечной точке:
медиана ВБП составила 6,6 мес.
в группе паклитаксела с рамуцирумабом и 3,5 мес. в контрольной
группе. Общая выживаемость
также оказалась выше в группе
«переключения терапии» – 12,6
мес. против 10,4 мес. в контрольной группе. Ранний переход на паклитаксел с рамуцирумабом также
увеличил частоту контроля над заболеванием – 85,3% против 54,0%,
но частота объективных ответов
на лечение значимо не отличалась
(18,9% против 15,7%).
К этим результатам нужно относиться критически. Во-первых, в
контрольной группе только 45%
пациентов получили в последующем терапию по схеме паклитаксел + рамуцирумаб. Это затрудняет интерпретацию исследования,
ведь дело могло быть не в том, что
пациенты получали паклитаксел с
рамуцирумабом как «поддержку»,
а в том, что они все обязательно
получили эту терапию. Во-вторых,
частота осложнений 3 и более степени была выше в группе «переключения терапии» почти в 2 раза
– 40,4% против 20,7% в контрольной группе. Предсказуемо оказалась выше частота периферической нейропатии, артериальной
гипертензии и венозных тромбозов.
Рисунок 5.
Подгрупповой анализ результатов метаанализа [6]
Среди постерных докладов было
похожее по смыслу исследование, в котором в качестве «switchmaintenance» использовался препарат регорафениб [5]. Несмотря
на то, что был определенный тренд
к улучшению показателей общей и
беспрогрессивной выживаемости,
он не достиг статистической значимости.
На ASCO 2024 был также представлен очередной систематический обзор и метаанализ роли
периоперационной химиотерапии
при микросателлитно-нестабильном раке желудка [6]. В этой работе проанализировано 19 исследований, суммарно включавших
1500 пациентов, и в очередной
раз показано отсутствие пользы
от проведения периоперационной
химиотерапии. Причем при проведении подгрупповых анализов
оказалось, что преимуществ не
имеют ни пациенты со II, ни с III
стадией заболевания, вне зависимости от времени проведения
химиотерапии – до операции или
после нее.
Рисунок 6.
Подгрупповой анализ исследования CheckMate-649 [8]
Среди постеров были обновленные 4-летние результаты исследования CheckMate-648 [7], в котором оценивалась эффективность
иммунотерапии препаратом ниволумаб в комбинации с химиотерапией по схеме 5-фторурацил
+ цисплатин в 1-й линии терапии
плоскоклеточного рака пищевода.
Один из важных вопросов, который стоит перед практическими
врачами, – понять, кому необходима комбинация, а у кого добавление иммунотерапии не приводит к улучшению результатов.
Классически для определения
показаний мы используем показатель CPS (combined positivity
score), и в обновленных данных
было показано, что мы можем использовать значение 5 как критерий назначения комбинированной химиоиммунотерапии. В
обновленном анализе исследования CheckMate-649 [8], в котором
изучалась роль иммунотерапии в
1 линии лечения аденокарциномы, была подтверждена уже привычная для нас граница – уровень
CPS, равный 10.
Источники
- Jens Hoeppner, Thomas Brunner, Florian Lordick, et al. Prospective randomized multicenter phase III trial comparing perioperative chemotherapy (FLOT protocol) to neoadjuvant chemoradiation (CROSS protocol) in patients with adenocarcinoma of the esophagus (ESOPEC trial). J Clin Oncol. 2024; Vol.42, №17 suppl.
- Jennifer Rachell Eads, Noah Graham, Micheal K. Gibson, et al. A phase II/ III study of peri-operative nivolumab (nivo) and ipilimumab (ipi) in patients (pts) with locoregional esophageal (E) and gastroesophageal junction (GEJ) adenocarcinoma: Results of the neoadjuvant pathologic complete response (pCR) rate (ECOG-ACRIN EA2174). J Clin Oncol. 2024; Vol.42, №16 suppl.
- Salah-Eddin Al-Batran, Sylvue Lorenzen, Jorge Riera, et al. Effect of chemotherapy/targeted therapy alone vs. chemotherapy/targeted therapy followed by radical surgical resection on survival and quality of life in patients with limited-metastatic adenocarcinoma of the stomach or esophagogastric junction: The IKF-575/RENAISSANCE phase III trial. J Clin Oncol. 2024; Vol.42, №17 suppl.
- Filippo Pietrantonio, Giovanni Randon, Sara Lonardi, et al. Ramucirumab plus paclitaxel as switch maintenance versus continuation of oxaliplatin-based chemotherapy in patients (pts) with advanced HER2- negative gastric or gastroesophageal junction (GEJ) cancer: The ARMANI phase III trial. J Clin Oncol. 2024; Vol.42, №17 suppl.
- Angela Damato, Domenico Bilancia, Francesco Iachetta, et al. Phase II randomized study of maintenance therapy with regorafenib (REGO) versus placebo after first-line platinum and fluoropyrimidines-based chemotherapy in HER2 negative locally advanced/metastatic gastric (GC) or gastroesophageal junction (GEJ) cancer: Results of a-MANTRA study (GOIRC-05-2016). J Clin Oncol. 2024; Vol.42, №16 suppl.
- Baike Liu, Zhaolun Cai, Yuan Yin, et al. Perioperative chemotherapy for patients with gastric cancer with microsatellite instability or deficient mismatch repair: A systematic review and meta-analysis. J Clin Oncol. 2024; Vol.42, №16 suppl.
- Ian Chau, Jaffer A. Ajani, Yuko Kitagawa, et al. Nivolumab (NIVO) plus chemotherapy (chemo) or ipilimumab (IPI) vs chemo as first-line (1L) treatment for advanced esophageal squamous cell carcinoma (ESCC): 45-month (mo) follow-up from CheckMate 648. J Clin Oncol. 2024; Vol.42, №16 suppl. 8. Elena Elimova, Kohei Shitara, Marlus H. Moehler, et al. Nivolumab (NIVO) + chemotherapy (chemo) vs chemo as first-line (1L) treatment for advanced gastric cancer/gastroesophageal junction cancer/esophageal adenocarcinoma (GC/GEJC/EAC): 4-year follow-up of CheckMate 649. J Clin Oncol. 2024; Vol.42, №16 suppl.
НОВОСТИ ASCO 2024 / МНЕНИЕ. ESOPEC: ПРЕЖДЕВРЕМЕННЫЙ РЕКВИЕМ ПО РЕЖИМУ CROSS
Автор: Деньгина Наталья Владимировна
Заведующая радиологическим отделением ГУЗ «Областной клинический онкологический диспансер»,
директор Центра лучевой терапии «R-Spei», член правления RUSSCO,
главный редактор Газеты RUSSCO и сайта RosOncoWeb, кандидат медицинских наук, Ульяновск
Сложно не согласиться с тем, что
исследование ESOPEC [1] стало
одним из тех, что наделали больше всего шума на ASCO, прежде
всего, со стороны приверженцев
неоадъювантной химиолучевой терапии при раке пищевода.
Многие эксперты международного уровня высказались по этому
поводу, не только на своих страницах в соцсетях, но и в комметариях на официальных сайтах
сообществ, поэтому позволю себе
лишь несколько кратких заметок.
Да, периоперационная ХТ улучшает показатели ОВ у больных
раком пищевода и гастро-эзофагеального перехода (ГЭП) в сравнении с только операцией, в том
числе и с аденокарциномой, как
это было продемонстрировано в
исследовании MAGIC [2] с применением схемы ECF (5-летняя
ОВ 36% против 23%), и в исследовании FLOT4 [3], где схема FLOT
сравнивалась с ECF (HR 0,77, после чего FLOT стал стандартом
периоперационной ХТ) – но и
неоадъювантная ХЛТ в режиме
CROSS [4] также улучшала показатели выживаемости! В сравнении
с upfront хирургией: 5-летняя ОВ
47% против 34%, при этом и ВБП,
локальный контроль, частота R0
резекций были значительно лучше, не говоря уже о 29% полных
патоморфологических регрессов.
В сравнении с режимом MAGIC
в исследовании NEO-AEGIS [5]
неоадъювантный режим CROSS
не проиграл по показателям ОВ и
ВБП за 3 года, но продемонстрировал лучшие R0 и pCR.
Так ли все однозначно в исследовании ESOPEC? В группе CROSS
большее число пациентов имели
Т3-4 и cN+ в сравнении с группой
FLOT. При этом схема работала
не хуже: меньше пациентов вышли после операции с R1 и ypN+
(3,9% против 5,2% и 44,4% против 48,7% соответственно), а если
суммировать частоту полных и
почти полных регрессий опухоли, то CROSS даже выиграл (52,7%
против 43,4%). Возможно, полный
эффект не успел реализоваться до
операции у большинства пациентов, в любом случае, если вести
речь о подходе Watch&Wait – без
локального метода, коим является лучевая терапия, это будет бессмысленно.
Большое недоумение вызывает
тот факт, что только 68% пациентов в ESOPEC завершили курс неоХЛТ, даже в таких смешных дозах лучевой терапии, как 41,4 Гр.
Очевидно, треть больных ограничились и меньшими дозами
ЛТ, и меньшим числом введений
химиопрепаратов, что не могло
не отразиться на отдаленных результатах. В подобной ситуации
сравнивать мощную четырехкомпонентную схему химиотерапии
до и после операции и недолгий
(в пределах месяца) курс неоадъювантной ХЛТ, тем более в субоптимальных дозах, некорректно. Возможно, выполнение всей
программы или повышение дозы
ЛТ до 45-50 Гр могло бы продемонстрировать иные результаты.
Тем более, что разница в ОВ за 3
года не столь драматична: 57% и
51%. Кстати, и pCR в группе FLOT
оказался ниже такового из классического исследования CROSS:
19% против 29% (среди аденокарцином – 23%).
Относительно недавнее исследование CheckMate-577 [6] по применению ниволумаба в адъюванте после неоХЛТ и операции
в случае резидуальной опухоли
продемонстрировало достоверное улучшение результатов ВБП,
в том числе и у больных аденокарциномой пищевода и ГЭП (медиана ВБП – 19,4 мес. против 11,1 мес.
в группах ниволумаба и плацебо).
Выдержал бы периоперационный
режим FLOT «конкуренцию» с
подобным комплексным подходом? Однозначный ответ сейчас
никто не даст – но и ручаться за
FLOT, полагаю, никто не будет.
При наличии результатов
ESOPEC – будут ли пациенты,
которым мы все равно предпочтем провести лечение в режиме
CROSS (возможно, с вариациями
дозы), а не FLOT? Без сомнения!
В первую очередь, это более ослабленные больные (ибо режим
FLOT более токсичен), пациенты,
для которых рассматривается вариант только консервативного
лечения, а также больные с более
высоким риском локального рецидива, скажем, cT4bN0. А посему сбрасывать со счетов хорошо
освоенный радиотерапевтами
подход с проведением неоХЛТ у
резектабельных пациентов с опухолями пищевода и ГЭП – даже
если это редкая в нашей стране
аденокарцинома – не стоит.
Источники
- Jens Hoeppner, Thomas Brunner, Florian Lordick, et al. Prospective randomized multicenter phase III trial comparing perioperative chemotherapy (FLOT protocol) to neoadjuvant chemoradiation (CROSS protocol) in patients with adenocarcinoma of the esophagus (ESOPEC trial). J Clin Oncol. 2024; Vol.42, №17 suppl.
- Cunningham D, et al.; MAGIC Trial Participants. Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer. N Engl J Med. 2006 Jul 6; 355(1): 11-20. doi: 10.1056/NEJMoa055531. PMID: 16822992.
- Al-Batran SE, et al.; FLOT4- AIO Investigators. Perioperative chemotherapy with fluorouracil plus leucovorin, oxaliplatin, and docetaxel versus fluorouracil or capecitabine plus cisplatin and epirubicin for locally advanced, resectable gastric or gastro-oesophageal junction adenocarcinoma (FLOT4): a randomised, phase 2/3 trial. Lancet. 2019 May 11; 393(10184): 1948-1957. doi: 10.1016/S0140-6736(18)32557-1. Epub 2019 Apr 11. PMID: 30982686.
- Shapiro J, et al.; CROSS study group. Neoadjuvant chemoradiotherapy plus surgery versus surgery alone for oesophageal or junctional cancer (CROSS): long-term results of a randomised controlled trial. Lancet Oncol. 2015 Sep; 16(9): 1090-1098. doi: 10.1016/S1470-2045(15)00040-6. Epub 2015 Aug 5. PMID: 26254683.
- Reynolds JV, et al. Trimodality therapy versus perioperative chemotherapy in the management of locally advanced adenocarcinoma of the oesophagus and oesophagogastric junction (Neo-AEGIS): an openlabel, randomised, phase 3 trial. Lancet Oncol. September 18, 2023. https://doi.org/10.1016/S2468- 1253(23)00243-1.
- Kelly RJ, et al.; CheckMate 577 Investigators. Adjuvant Nivolumab in Resected Esophageal or Gastroesophageal Junction Cancer. N Engl J Med. 2021 Apr 1; 384(13): 1191- 1203. doi: 10.1056/NEJMoa2032125. Erratum in: N Engl J Med. 2023 Feb 16; 388(7): 672. doi: 10.1056/NEJMx220014. PMID: 33789008
НОВОСТИ ASCO 2024 / НОВОЕ В МИРЕ ОНКОГИНЕКОЛОГИИ
Автор: Румянцев Алексей Александрович
Заведующий отделением лекарственных методов лечения злокачественных опухолей №4
НИИ клинической онкологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина»
Минздрава России, председатель Комитета молодых онкологов RUSSCOjr,
член правления RUSSCO, кандидат медицинских наук, Москва
В статье – краткий обзор наиболее примечательных (по мнению
автора) исследований конгресса Американского общества клинической онкологии (ASCO) и попытка понять, какое влияние эти
результаты могут оказать на нашу
ежедневную практику лечения
онкогинекологических пациентов.
Финальные результаты по общей выживаемости рандомизированного исследования III
фазы SOC-1 – вторичные циторедукции при распространенном раке яичников (абстракт
5520)
Крупное (n=357) рандомизированное исследование III фазы,
проведено в Китае [1,2]. Пациентки с платиночувствительными рецидивами рака яичников
отобраны в соответствии с критериями модели iMODEL [3]. В
соответствии с представленными
данными, при медиане наблюдения 82,5 мес. в группе вторичных
циторедукций медиана общей
выживаемости (ОВ) составила
58,1 мес. по сравнению с 52,1 мес.
в контрольной группе (отношение
рисков [HR] 0,80; p=0,109) – тренд
в пользу увеличения ОВ в группе
вторичной циторедукции, который не достиг статистической
достоверности. Медиана выживаемости без прогрессирования составила 18,0 мес. в группе вторичных циторедукций по сравнению
с 11,9 мес. в контрольной группе
(HR 0,55; p<0,0001).
При этом (что важнее) среди пациенток, которым была выполнена полная вторичная циторедукция, медиана ОВ составила 73,0 мес. по сравнению с 52,1 мес. в группе контроля, 34,8 мес. в группе неполных (то есть с любой остаточной опухолью) циторедукций (HR 0,41; 95% ДИ 0,26-0,63) – кривые Каплана-Майера на рисунке 1. Эти результаты почему-то не вошли в презентацию на ASCO, но были любезно показаны в одновременной публикации [4].
Рисунок 1.
Кривые Каплана-Майера по общей выживаемости
пациенток в исследовании SOC-1 в зависимости
от выполнения вторичной циторедукции и наличия
резидуальной опухоли
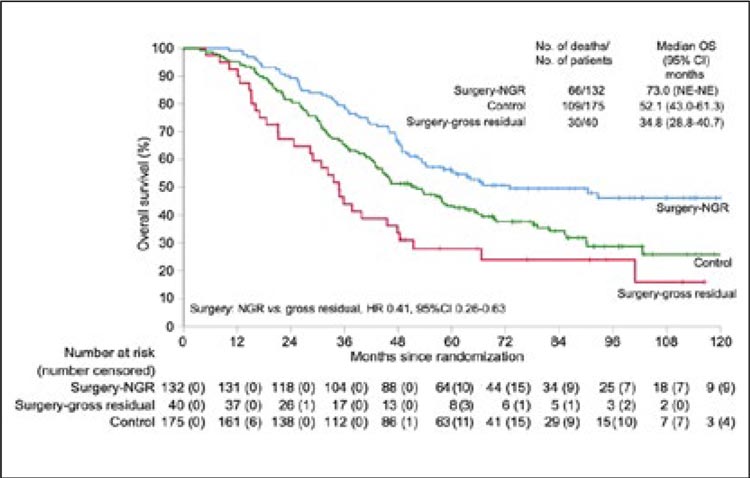
Кроме того, дополнительный анализ показал, что 35% пациенток в группе контроля в итоге прошли хирургическое лечение при последующих рецидивах. При учете этого фактора различия в пользу группы вторичных циторедукций также достигли статистической достоверности (HR 0,76; 95% ДИ 0,58-0,99).
Интерпретация результатов и
перспективы: третье, наряду с
DESKTOP III и GOG-0213, рандомизированное исследование по
роли вторичных циторедукций при рецидивах рака яичников –
результаты этих трех работ суммированы в таблице ниже. Результаты SOC-1 в целом дополняют то,
что мы знали ранее из исследования DESKTOP III: выполнение
вторичной циторедукции позволяет существенно улучшить результаты лечения рецидивов рака
яичников, но только в том случае,
если удается достичь полной циторедукции. Соответственно, соблюдение критериев отбора для
выполнения таких вмешательств
позволяет адекватно отобрать
подходящих пациентов. В качестве
таких шкал можно использовать
критерии AGO SCORE (DESKTOP
III) или iMODEL (SOC-1).
Таблица 1.
Результаты вторичных циторедукций по данным трех РКИ

Отказ от лимфаденэктомии при
распространенном РЯ после первичной/интервальной циторедукции – рандомизированное
исследование III фазы CARACO
(абстракт LBA5505)
Многоцентровое рандомизированное исследование, включившие
379 пациенток с III-IVA стадиями
рака яичников; набор в исследование длился в течение 12 лет – с
2008 по 2020 год, но за этот период
времени авторы не смогли набрать
изначально запланированное количество пациентов (n=450), что
сами исследователи связывают с
публикацией результатов исследования LION. Критерии включения
предполагали участие пациенток
без явного метастатического поражения лимфатических узлов перед выполнением хирургического
вмешательства, причем допускалось включение пациенток как на
этапе первичных, так и интервальных циторедукций. Дизайн исследования представлен на рисунке 2.
Рисунок 2.
Дизайн исследования CARACO

По результатам исследования
не было выявлено достоверных
различий в ВБП пациенток в зависимости от выполнения лимфаденэктомии: медиана ВБП составила 14,8 мес. в группе отказа
от выполнения лимфаденэктомии
по сравнению с 18,5 мес. в группе
выполнения данной процедуры
(HR 0,96; p=0,712), медиана ОВ составила 48,9 и 58,8 мес. (HR 0,92;
p=0,489) соответственно. Кривые
Каплана-Майера представлены
на рисунке 3. Результаты в группе интервальной циторедукции
были схожи, однако прослеживался некоторый тренд к ухудшению
ОВ в группе отказа от лимфаденэктомии в группе интервальных
циторедукций (HR 0,86; p=0,280)
– рисунок 4. Отказ от выполнения
лимфаденэктомии привел к достоверному уменьшению частоты
выраженной кровопотери (29%
против 39%; p=0,049), повторных
хирургических вмешательств
(3,1% против 8,3%; p=0,031).
Рисунок 3.
Кривые Каплана-Майера по ВБП и ОВ пациенток в исследовании CARACO
Рисунок 4.
Кривые Каплана-Майера по ВБП и ОВ в исследовании CARACO – подгруппа
интервальных циторедукций
Интерпретация результатов и
перспективы: результаты исследования CARACO подтверждают
данные LION – другого крупного
рандомизированного исследования (n=647), продемонстрировавшего отсутствие улучшения
выживаемости пациентов после
выполнения забрюшинной лимфаденэктомии [7]. Ключевое отличие исследования CARACO –
включение в том числе пациенток
после неоадъювантной химиотерапии, в то время как LION был
проведен в контексте выполнения первичных циторедуктивных
вмешательств.
Именно в популяции неоадъювантной химиотерапии оставался нерешенным вопрос, нужно ли выполнять забрюшинную лимфаденэктомию. Отчасти CARACO отвечает на этот вопрос – при отсутствии исходных данных за метастатическое поражение забрюшинных лимфатических узлов выполнять данную процедуру после неоадъювантной химиотерапии не нужно. Тем не менее, у нас по-прежнему нет ответа, что делать с теми пациентками, у которых метастатическое поражение лимфатических узлов определялось до начала проведения неоадъювантной химиотерапии и отмечена регрессия их размеров до нормальных. Им – нужно выполнять лимфаденэктомию?
Рандомизированное несравнительное исследование II фазы NEO – неоадъювантный олапариб при платиночувствительных рецидивах рака яичников (абстракт 5506)
Небольшое рандомизированное исследование II фазы (n=44, проанализирована эффективность у 36 пациенток), дизайн – на рисунке 5. Включались пациентки с платиночувствительными рецидивами рака яичников (>6 мес. с момента завершения платиносодержащей химиотерапии) вне зависимости от мутационного статуса генов BRCA1/2, ранее не получавшие ингибиторы PARP, которым при первичной оценке распространенности опухолевого процесса могла быть выполнена повторная циторедукция. Все включенным больным проводилась неоадъювантная терапия олапарибом в течение 6 недель с последующим выполнением вторичной циторедукции и рандомизацией в группу продолжения терапии олапарибом или проведения 4-6 курсов платиносодержащей химиотерапии с поддерживающей терапией олапарибом после ее завершения [8].
Рисунок 5.
Дизайн исследования II фазы NEO по изучению
неоадъювантной терапии олапарибом при платиночувствительных рецидивах рака яичников
Рисунок 6.
Кривые Каплана-Майера по выживаемости без прогрессирования и общей
выживаемости в исследовании NEO
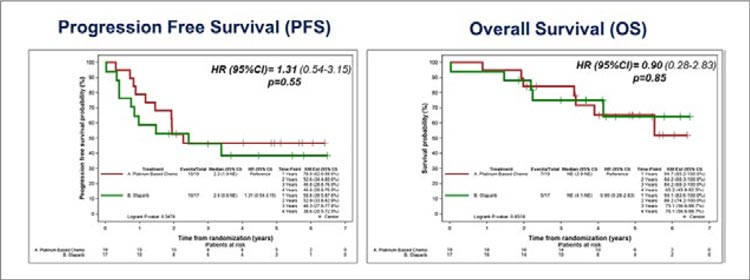
По результатам, при медиане наблюдения 4 года медиана ВБП составила 2,4 года в группе только олапариба по сравнению с 2,3 года в группе химиотерапии (HR 1,31; p=0,55), медиана ОВ не достигнута ни в одной из групп исследования (HR 0,90; p=0.85) – рисунок 6.
Интерпретация результатов и перспективы: мягко говоря, своеобразный дизайн исследования, который совершенно точно не укладывается в текущую логику принятия решений при рецидивах рака яичников, малый объем выборки и тенденция к ухудшению ВБП пациенток в группе «только олапариба». Очевидно, что это исследование не должно каким-либо образом влиять на нашу текущую практику лечения рецидивов рака яичников.
Рандомизированное исследование III фазы RTOG 0724/GOG0724 – добавление химиотерапии
после адъювантной химиолучевой терапии у пациенток с высоким риском прогрессирования
рака шейки матки после хирургического лечения (абстракт
5504)
Исследование III фазы (n=236), посвященное очередной попытке улучшить результаты лечения прооперированных пациенток с ранними клиническими (IA2- IIA) стадиями рака шейки матки, которые прошли хирургическое лечение и оказались в группе высокого риска прогрессирования вследствие выявленного поражения параметриев, тазовых или парааортальных лимфатических узлов. Включенным пациенткам проводилась химиолучевая терапия с радиомодификацией цисплатином с последующей рандомизацией в группе наблюдения (стандартный подход) или проведения 4 курсов адъювантной химиотерапии паклитакселом и карбоплатином. Стратификация– в соответствии с планируемым проведением брахитерапии (без брахитерапии – 56%), модальностью проведения лучевой терапии (IMRT – 59% пациенток) и выбранной дозой лучевой терапии (50,4 Гр – 69% пациенток) [9]. По результатам исследования (ожидаемо?) дополнительное проведение адъювантной химиотерапии не позволило улучшить результаты лечения пациенток. Показатель 3-летней БРВ составил 76,9% в группе ХЛТ + ХТ по сравнению с 76,2% в группе только ХЛТ (HR 1,05; p=0,56), показатель 3-летней ОВ – 89,0% и 87,3% соответственно (HR 0,91; p=0,40). В многофакторном анализе отказ от проведения брахитерапии (HR 3,32; p<0,0001), суммарная доза ЛТ <50 Гр (HR 3,29; p=0,0014) были достоверно ассоциированы с повышением риска прогрессирования заболевания, но не проведение химиотерапии (HR 0,92; p=0,78).
Рисунок 7.
Дизайн исследования RTOG 0724/GOG-0724
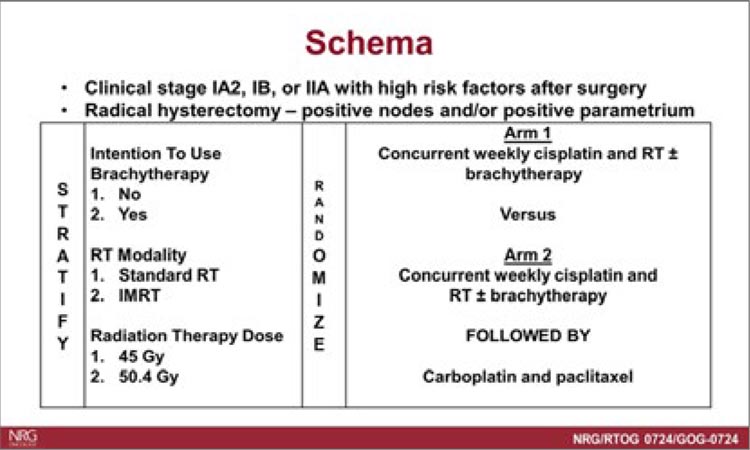
Рисунок 8.
Кривые Каплана-Майера по безрецидивной
выживаемости пациенток в исследовании RTOG 0724/GOG0724
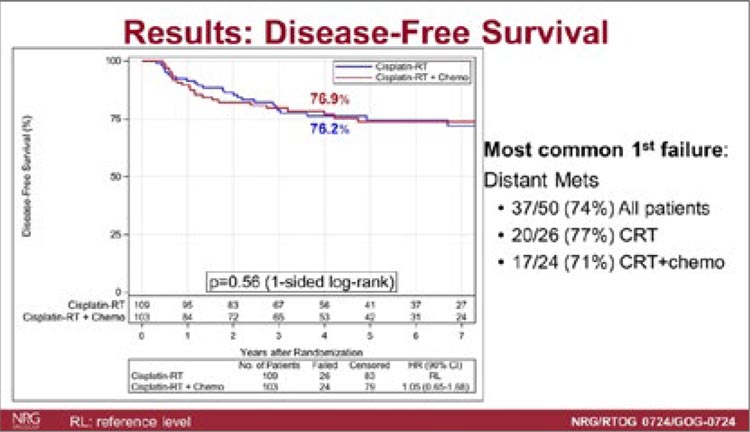
Интерпретация результатов и
перспективы: как и исследование
OUTBACK [10], результаты данного
исследования не показали какоголибо позитивного влияния на отдаленные результаты лечения при
дополнительном проведении химиотерапии после химиолучевой
терапии. Совершенно точно – этого делать не нужно. С другой стороны, исследование INTERLACE
[11] ранее продемонстрировало
возможности химиотерапии значительно улучшать результаты лечения пациенток – но только перед
проведением самостоятельной химиолучевой терапии. Видимо, это
и есть место этого метода лечения
при местнораспространенном раке
шейки матки.
Долговременные результаты проведения эндокринотерапии при I
стадии рака эндометрия у пациенток в пременопаузе (абстракт 5508)
Данный вариант лечения активно применяется как метод сохранения фертильности для пациенток с I стадией рака эндометрия для пациенток в пременопаузе. Ретроспективное исследование, проведенное при помощи базы данных NCDB. Включались пациентки в возрасте от 18 до 49 лет с I стадией эндометриоидного (G1-2) подтипа рака эндометрия. Проанализированы результаты лечения 15849 пациенток (14662 – гистрэктомия на первом этапе, 1187 – эндокринотерапия). Отмечено значимое увеличение частоты использования этого варианта лечения – с 5,2% в 2004 году до 13,8% в 2020 году (p<0,0001). Для оценки влияния проведения эндокринотерапии на отдаленные результаты лечения методом «псевдорандомизации» (propensity-score matching) были сформированы две сопоставимые по своим характеристикам группы пациенток (n=2078), балансировка проведена в соответствии с возрастом пациенток, расой, статусом страхования, местом проживания, годом постановки диагноза, стадией опухолевого процесса, степью злокачественности опухоли, а также типом клиники, где проводилось лечение [12]. По результатам исследования, в сформированной популяции пациенток 5-летняя ОВ составила 98,5% в группе первичной гистерэктомии по сравнению 96,8% в группе первичной эндокринотерапии (HR 1,84; 95% ДИ 1,06-3,21) – неожиданно, но проведение эндокринотерапии на первом этапе лечения было ассоциировано с достоверным повышением риска смерти по сравнению с выполнением гистерэктомии на первом этапе (рис.9). В подгрупповом анализе у пациенток младше 40 лет негативного влияния выявлено не было (HR 1,00; 95% ДИ 0,5-2,00), негативный тренд был обусловлен возрастной категорией 40-49 лет (HR 4,94; 95% ДИ 1,89-12,91) (рис.10).
Рисунок 9.
Кривые Каплана-Майера по результатам
применения эндокринотерапии при раке тела матки на
первом этапе лечения по сравнению с первоначальным
выполнением гистерэктомии
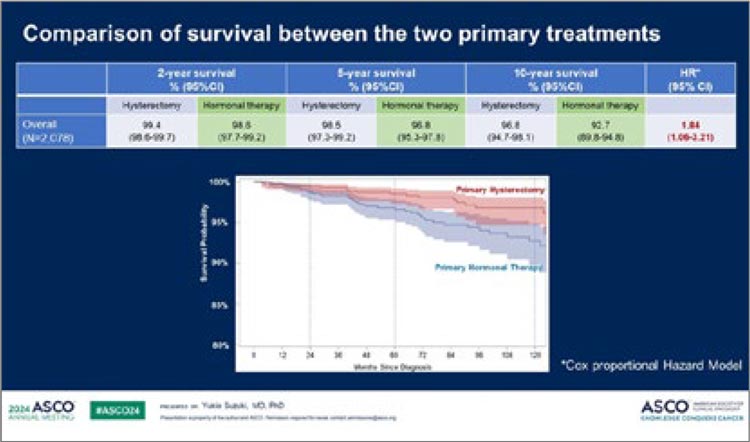
Рисунок 10.
Результаты ретроспективного исследования по
влиянию проведения эндокринотерапии при раке тела матки
с зависимости от возраста пациентов
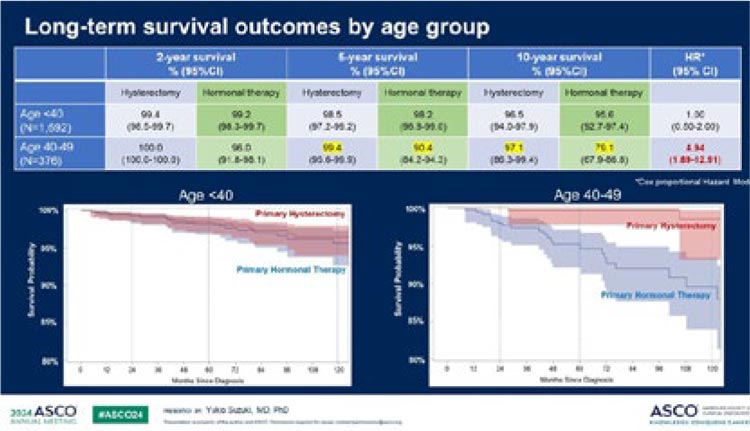
Интерпретация результатов и
перспективы: в российские клинические рекомендации в настоящее время внесена опция
проведения самостоятельной эндокринотерапии для пациенток с
раком эндометрия низкой степени злокачественности для пациенток репродуктивного возраста
при соблюдении ряда условий и
информировании пациенток о
необходимости удаления матки
после родов или при достижении
возраста, когда планирование беременности неактуально. Проведенное исследование демонстрирует, что использование такого
варианта лечения должно быть
ограничено популяцией пациенток в возрасте до 40 лет. В более
позднем возрасте использование
такого подхода представляется
неоправданным в связи с более
чем 4-кратным повышением риска смерти.
Почему так происходит – не вполне понятно, но в первую очередь
стоит думать о большей частоте
встречаемости агрессивных подтипов рака эндометрия, которая
возрастает по мере увеличения
возраста пациенток [13]. В свою
очередь, не секрет, что при проведении рутинного светооптического исследования материала
часть агрессивных гистотипов
будет пропущена и ошибочно
классифицирована как «добрые»
low-grade эндометриоидные опухоли. Вероятно, эта категория пациенток должна рассматриваться
как первоочередная для выполнения молекулярного определения
подтипа рака эндометрия перед
принятием каких-либо решений о
назначении эндокринотерапии. В
любом случае, эти данные должны оказать влияние на практику
органосохраняющего лечения при
раке эндометрия.
Источники
- Zang R, Zhu J, Liu J, et al. Secondary cytoreduction followed by chemotherapy versus chemotherapy alone in platinum-sensitive relapsed ovarian cancer (SOC-1): A final overall survival analysis of a multicenter, open-label, randomized, phase 3 trial. J Clin Oncol. 2024; 42(16_suppl): 5520-5520. doi:10.1200/ JCO.2024.42.16_suppl.5520.
- Shi T, Zhu J, Feng Y, et al. Secondary cytoreduction followed by chemotherapy versus chemotherapy alone in platinum-sensitive relapsed ovarian cancer (SOC-1): a multicentre, open-label, randomised, phase 3 trial. Lancet Oncol. 2021; 22(4): 439-449. doi:10.1016/S1470-2045(21)00006-1.
- Tian WJ, Chi DS, Sehouli J, et al. A Risk Model for Secondary Cytoreductive Surgery in Recurrent Ovarian Cancer: An Evidence-Based Proposal for Patient Selection. Ann Surg Oncol. 2012; 19(2): 597-604. doi:10.1245/s10434-011-1873-2.
- Jiang R, Feng Y, Chen Y, et al. Surgery versus no surgery in platinumsensitive relapsed ovarian cancer: final overall survival analysis of the SOC-1 randomized phase 3 trial. Nat Med. Published online June 1, 2024. doi:10.1038/s41591-024-02981-0.
- Harter P, Sehouli J, Vergote I, et al. Randomized Trial of Cytoreductive Surgery for Relapsed Ovarian Cancer. N Engl J Med. 2021; 385(23): 2123- 2131. doi:10.1056/NEJMoa2103294.
- Coleman RL, Spirtos NM, Enserro D, et al. Secondary Surgical Cytoreduction for Recurrent Ovarian Cancer. N Engl J Med. 2019; 381(20): 1929-1939. doi:10.1056/ NEJMoa1902626.
- Harter P, Sehouli J, Lorusso D, et al. A Randomized Trial of Lymphadenectomy in Patients with Advanced Ovarian Neoplasms. N Engl J Med. 2019; 380(9): 822-832. doi:10.1056/NEJMoa1808424.
- Lheureux S, May T, Wilson MK, et al. Phase II randomized multicentre study of neoadjuvant olaparib in patients with platinum sensitive relapsed high grade serous ovarian cancer: The NEO trial. J Clin Oncol. 2024; 42 (16_suppl): 5506- 5506. doi:10.1200/JCO.2024.42.16_ suppl.5506.
- Jhingran A. Adjuvant chemotherapy following concurrent chemoradiation (CRT) in patients with high-risk early-stage cervical carcinoma following radical hysterectomy: Results of NRG oncology/RTOG 0724/GOG-0724. J Clin Oncol. 2024; 42 (suppl 16); abstr 5504.
- Mileshkin LR, Moore KN, Barnes EH, et al. Adjuvant chemotherapy following chemoradiotherapy as primary treatment for locally advanced cervical cancer versus chemoradiotherapy alone (OUTBACK): an international, openlabel, randomised, phase 3 trial. Lancet Oncol. 2023; 24(5): 468-482.doi:10.1016/S1470-2045(23)00147-X.
- McCormack M, Gallardo Rincón D, Eminowicz G, et al. LBA8 A randomised phase III trial of induction chemotherapy followed by chemoradiation compared with chemoradiation alone in locally advanced cervical cancer: The GCIG INTERLACE trial. Ann Oncol. 2023; 34: S1276. doi:10.1016/j. annonc.2023.10.028.
- Suzuki Y, Huang Y, Havrilesky LJ, et al. Long-term survival outcomes for hormonal therapy inpremenopausal patients with clinical stage I endometrial cancer. J Clin Oncol. 2024; 42 (16_suppl): 5508- 5508. doi:10.1200/JCO.2024.42.16_ suppl.5508.
- Wakkerman FC, Wu J, Putter H, et al. Prognostic impact and causality of age on oncological outcomes in women with endometrial cancer: a multimethod analysis of the randomised PORTEC-1, PORTEC-2, and PORTEC-3 trials. Lancet Oncol. 2024; 25(6): 779-789. doi:10.1016/ S1470-2045(24)00142-6.
НОВОСТИ ASCO 2024 / «О БЕДНОМ ГУСАРЕ ЗАМОЛВИТЕ СЛОВО», ИЛИ РЕЗУЛЬТАТЫ ХИРУРГИЧЕСКИХ ИССЛЕДОВАНИЙ ПРИ РАКЕ ТОЛСТОЙ КИШКИ НА ASCO 2024
Автор: Федянин Михаил Юрьевич
Руководитель химиотерапевтической службы ГБУЗ «ММКЦ «Коммунарка» ДЗМ»,
научный консультант ФГБУ «Национальный медикохирургический Центр им. Н.И. Пирогова»
Министерства здравоохранения РФ,
старший научный сотрудник ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России,
член правления RUSSCO, доктор медицинских наук, Москва
На больших онкологических
конгрессах основное место в докладах занимают результаты
исследований новых молекул,
дорогостоящих и пока мало применимых, но прорывных технологий лекарственной терапии.
Это, кстати, касалось и прошедшей конференции ASCO 2024. Но,
к сожалению, прошло мимо колоректального рака (КРР). Зато при
данной нозологии было представлено много хирургических работ,
результаты которых обычно проходят вне заголовков новостных
лент. Мы с вами не будет уподобляться мировой прессе и поговорим о лечении ранних стадий.
Ранние стадии
Возможности хирургии при
местнораспространенном раке
прямой кишки достигли небывалых высот: частота рецидивов
в опытных клиниках ниже 2%,
расширяются возможности хирургии при верхнеампулярном
и среднеампулярном раке без
факторов риска без предоперационного лечения, активно применяется лапароскопическая и
роботическая хирургия. В то же
время полноценных данных о
безопасности с онкологических
позиций роботических подходов
при раке прямой кишки до настоящего времени не было. На
конференции ASCO 2024 представлены результаты рандомизированного исследования III фазы
по сравнению лапароскопической и роботической хирургии
при раке прямой кишки нижне- и среднеампулярной локализации и стадией cT1-3N0-1 или
ypT1-3NxM0. Основным критерием эффективности была выбрана частота локорегионарного прогрессирования при наблюдении
3 года. Коллеги из Китая, рандомизировав 1171 пациента при
медиане наблюдения 43 месяца,
отметили статистически значимо меньший уровень 3-летнего
рецидивирования в группе роботической хирургии: 1,6% против
4% (ОР 0,451; 95% ДИ 0,221-0,920;
р=0,025). Показатели 3-летней
выживаемости без признаков болезни (ВБПБ) также были выше
в экспериментальном рукаве:
87,2% против 83,4% (ОР 0,738;
95% ДИ 0,555-0,982; р=0,036). Показатели общей выживаемости
(ОВ) не различались. То есть роботическая хирургия возможна,
осталось попасть к хирургу не на
кривой обучения.
Еще один новый подход в хирургии рака прямой кишки, который
активно внедрялся в последние
годы, – выполнение трансанальной тотальной мезоректумэктомии (ТМЭ). Последователи
данной технологии надеялись на
меньшее число рецидивов при
выполнении данного варианта
классической операции. Представлены результаты исследования III фазы по сравнению
трансанальной ТМЭ и лапароскопической ТМЭ из Китая –
TaLaR. После рандомизации 1099
больных раком прямой кишки
I-III стадии с локализацией ниже
складки брюшины авторы не
нашли различий в частоте локальных рецидивов между хирургическими подходами и доказали не меньшую эффективность
трансанальной ТМЭ стандартному подходу в ВБПБ (ОР 0,86; 95%
ДИ 0,63-1,18; р for noninf. <0,001).
При подгрупповом анализе новый метод ТМЭ был несколько
лучше в отношении ВБПБ у мужчин, с локализацией опухоли
ниже 3 см и размерами образования более 3 см.
Еще один спорный вопрос, который попытались разрешить на
конференции ASCO 2024, также
касался хирургии, но уже рака
ободочной кишки – необходимость выполнения расширенной
лимфодиссекции. Напомню, ранее российские ученые-хирурги
представляли предварительные
данные по сравнению D2 и D3
лимфодиссекции в рамках проспективного исследования III
фазы COLD. Авторы работы показали, что уже при анализе первых нескольких десятков пациентов при D3 лимфодиссекции
увеличивается число случаев III
стадии болезни. Однако в этой
группе было больше на 24% пациентов со степенью инвазии опухоли Т3. Поэтому до получения
окончательных данных вопрос
о необходимости расширения
лимфодиссекции оставался открытым. Не дожидаясь окончательных результатов российского исследования, коллеги из
Китая представили результаты
рандомизированной работы III
фазы RELARC – сравнения D2
лимфодиссекции и тотальной
мезоколической эксцизии при
раке правых отделов ободочной
кишки. Рандомизировав 1072 пациента, исследователи не выявили различий ни в ВБПБ (ОР 0,74;
95% ДИ 0,54-1,02; р=0,06), ни в ОВ
(ОР 0,7; 95% ДИ 0,43-1,16; р=0,17).
При подгрупповом анализе в
случае N2 отмечено улучшение
ВБПБ при расширении хирургического объема (ОР 0,35; 95% ДИ
0,18-0,69).
Когда речь идет о лечении ранних стадий колоректального
рака, нельзя обойти исследования по неоадъювантной системной терапии и, в частности, иммунотерапии при MSI/dMRR.
После публикации промежуточных результатов неоадъювантной терапии достарлимабом при
MSI-ассоциированном местнораспространенном раке прямой
кишки, а именно 100% полных
клинических эффектах, рекомендации многих стран изменились.
Однако не было данных по отдаленной выживаемости. Может
быть, полный клинический эффект нестойкий, и на самом деле
опухолевые клетки переживают
атаку иммунной системы, как и
химиотерапию? Данный тезис,
по-видимому, неверен, так как
по обновленным данным лечения
достарлимабом уже 48 пациентов при медиане наблюдения 26,3
месяца ни у одного больного не
зарегистрировано прогрессирования. При этом полный клинический эффект регистрировался
у всех после 27 недели лечения,
при оценке же в более ранние
сроки – по результатам биопсии
на 10-20 неделе – резидуальные
проявления сохранялись примерно у 20% больных.
После публикации исследований
NICHE1-2 и работы с достарлимабом уже накопился и собственный опыт в РФ по назначению
ингибиторов иммунных контрольных точек в неоадъюванте при резектабельных стадиях
КРР. Этот опыт, как и реальная
практика в других странах, показывает не 100% ответ, всегда
найдется пациент, который рано
или поздно запрогрессирует. Почему так происходит? Известно,
что при метастатическом раке
уровень мутационной нагрузки
(TMB) значимо коррелирует с эффективностью иммунотерапии
при MSI. Почему не использовать
эту информацию при построении дизайна исследований с неоадъювантной иммунотерапией,
и насколько она справедлива для
резектабельных стадий? Именно
так поступили исследователи в
работе NEOPRISM-CRC – при III
стадии или II стадии с факторами риска MSI-ассоциированного
КРР и TMB ≥6 мутаций на мегабазу проводили 3 неоадъювантных курса пембролизумабом перед хирургией; при TMB
менее 6 – оперировали после 1
курса пембролизумаба. Медиана
TMB составила 42 мутации/Mb.
При этом удалось найти только
одного пациента с TMB менее 6.
Полный патоморфологический
эффект после 3 курсов пембролизумаба составил 53%. Теперь
становится понятно, почему неоадъювантное назначение иммунотерапии с резектабельными
стадиями КРР при MSI более эффективно, чем при метастатическом заболевании – практически
нет пациентов с низким TMB. С
другой стороны, если хотите получить полные клинические или
полные патоморфологические
эффекты у 100%, нужно проводить 27 недель лечения, а не 12
недель. И основной вопрос к исследованию: зачем при T3N0 с
фактором риска вообще проводить неоадъювантную терапию
даже с иммунотерапией?
Продолжая тему КРР, ассоциированного с MSI, вспомним, что
пока нет прямого ответа на вопрос, лучше ли комбинация ипилимумаба с ниволумабом в монотерапии анти-PD1 антителом
при метастатическом КРР. Тем
более этот вопрос открыт и при
резектабельных стадиях: с одной
стороны есть пролонгированная
терапия с достарлимабом, с другой – короткий курс ипилимумаба с ниволумабом или короткий
курс терапии пембролизумабом с
разными результатами непосредственной эффективности. Исследователи из Китая провели рандомизированное исследование II
фазы по сравнению 2 курсов синтилимаба (анти-PD1 антитело) и 1
курса комбинации синтилимаба
и IBI310 (анти-CTLA4 антитело) в
неоадъюванте при IIb-III стадии
КРР. Частота полных патоморфологических эффектов в группе
комбинации составила 80% против 47,7% в группе синтилимаба.
Не хватает данных по ВБПБ и
сравнения с пролонгированной
монотерапией анти-PD1 антителом, чтобы понять все риски комбинированной иммунотерапии,
которая в данной работе привела
к развитию иммуноопосредованных побочных эффектов у 42,3%
пациентов.
К сожалению, частота встречаемости MSI/dMRR невысокая при
КРР, тем более при раке прямой
кишки. Поэтому в последнем
случае у большинства пациентов
при местнораспространенном
характере поражения органа рассматривается предоперационное
лечение. И все активнее внедряются в практику подходы тотальной неоадъювантной терапии,
когда индукционную химиотерапию комбинируют с пролонгированной химиолучевой терапией
(исследование PRODIGE 23) или
короткий курс лучевой терапии
комбинируют с консолидирующей химиотерапией (исследование RAPIDO). В обоих подходах
достигается повышение частоты
полных патоморфологических
эффектов до 27%, но значимо не
улучшаются (по log rank) показатели ОВ. В исследовании RAPIDO
даже увеличилась частота локальных рецидивов в группе тотального неоадъюванта. Однако в это
исследование включались пациенты с большим распространением, чем в исследовании PRODIGE
23. А что получится, если взять
более обширные местнораспространенные опухоли (mrT4a-b;
T3c-d с EMVI+; N2; mrf+) и скомбинировать пролонгированную
химиолучевую терапию с тотальной неоадъювантной химиотерапией, проведя 1 курс по схеме
XELOX до ХЛТ, 2 курса во время
ХЛТ и 3 курса в консолидации –
после ХЛТ? Именно такой подход
изучили исследователи из Китая
в работе III фазы TNTCRT, сравнив с химиолучевым лечением.
Как и ожидалось, удалось за счет
эскалации предоперационного
лечения достигнуть тех же 27%
полных патоморфологических
эффектов, но снова не удалось
улучшить показали ОВ (ОР 0,814;
95% ДИ 0,490-1,353; р=0,426).
Поэтому с помощью тотального неоадъюванта вам не удастся
улучшить ОВ, но достигнуть,
когда это необходимо, снижения
стадии и улучшения качества
хирургии можно. Однако лучше
всего данный подход (ХЛТ с последующей консолидацией в течение 16-18 недель химиотерапии
комбинацией фторпиримидинов
с оксалиплатином) использовать
у пациентов с местнораспространенным раком прямой кишки и
низкой локализацией опухоли,
когда планируется калечащая
операция. Такой подход, по результатам исследования OPRA,
позволяет практически у 40%
получить полный клинический
эффект и сохранить орган. Только есть одно условие: если взялись за тотальный неоадъювант,
нужно проводить 16-18 недель
химиотерапевтического лечения.
Уменьшение числа курсов данного лечения до 12 и менее недель
не гарантирует такого успеха. В
частности, исследование POLISH
II и представленное на ASCO 2024
исследование из Китая III фазы
KONCLUDE подтверждают данный тезис.
Если говорить о длительности
адъювантной терапии при III
стадии KPP, то по результатам
программы IDEA для достижения максимально возможных
значений 5-летней ОВ достаточно
проведения 3 месяцев терапии по
схеме XELOX даже в группе неблагоприятного прогноза. Так ли
это в реальной практике? Проведя в Нидерландах сравнение результатов адъювантного лечения
4258 пациентов с III стадий КРР,
которым назначалась терапия в
течение 6 месяцев или в течение
3 месяцев, авторы работы не увидели различий в показателях выживаемости ни на всей выборке
пациентов, ни в группе неблагоприятного прогноза. Такие находки позволяют более критично подходить к адъювантному
лечению. Так, в случае T4N+ или
T1-3N2, возможно, после 4 курсов в режиме XELOX оставшиеся
курсы провести монотерапией
фторпиримидинами. Что касается сроков начала адъювантного лечения, было известно, что
после истечения 8 недель с даты
операции профилактический
эффект от послеоперационной
химиотерапии при КРР начинает
теряться и практически нивелируется, если лечение начинают
через 12-16 недель. Однако закономерно встает вопрос: может
быть, нужно начинать адъювантную химиотерапию раньше, в течение первых 4 или даже первых
2 недель с даты операции, и мы
получим улучшение показателей
выживаемости? К сожалению,
по результатам исследования III
фазы из Южной Кореи, которое
представили на ASCO 2024, раннее начало профилактической
химиотерапии по схеме FOLFOX
при III стадии КРР (медиана начала химиотерапии в экспериментальной группе составила 2
недели) не улучшило показатели
3-годичной ВБПБ: 86,9% против
86,6% в группе стандартного лечения (р=0,672).
Кстати, порадовали исследователи из Израиля попыткой имплементации ПЭТ/КТ в ранний
послеоперационный период с
целью довыявления отдаленного
метастазирования. Коллеги применяли данный диагностический
метод у 134 пациентов с III стадией КРР в течение 3 месяцев с даты
операции. У 13,4% пациентов
были выявлены отдаленные проявления болезни, которым в 27,7%
случаях химиотерапия была дополнена локальными методами
лечения. Можно было бы сразу
внести данную опцию в клинические рекомендации, но, как всегда, есть нюансы: через 3 месяца
после операции, в соответствии
с большинством рекомендаций,
необходимо проводить обследование, поэтому желательно
было иметь группу сравнения со
стандартным набором исследовательских процедур; также наряду в проявлениями болезни у
аналогичного процента больных
(13,4%) были даны и ложноположительные результаты ПЭТ/КТ.
Таким образом, данный подход
при КРР остается пока в рамках
уточняющего метода обследования, и его просто так не нужно
назначать сразу после операции.
Метастатический рак
Онкологи при КРР с метастазами в печени с осторожностью
относились к трансплантации
печени. Это было связано как со
скромными результатами ранее
проведенных небольших нерандомизированных исследований,
так и невозможностью понять
портрет пациента, которому данный подход реализовать. Так, в 3
ранее проведенных нерандомизированных исследованиях (SEKA
I, SEKA II, TOSCA) критерии
включения несколько отличались
и, соответственно, показатели
5-летней ОВ варьировали от 13%
до 60%. В реальной клинической
практике в США более чем за 10
лет удалось найти в регистре 46
пациентов, которым по поводу метастазов КРР в печени выполнена трансплантация органа.
Показатели 5-летней ОВ значимо не отличались у таковых при
трансплантации печени, которая
была выполнена по поводу гепатоцеллюлярного рака или холангиокарциномы. То есть надежда
на то, что такой подход при КРР
сработает, сохранялась. Оставалось учесть некоторые аспекты
для планирования рандомизированного исследования. А именно:
при истинно неоперабельном метастатическом поражении печени
вероятность перевода случайно
в операбельное состояние невысокая – 5-15%, во второй линии –
менее 6%, да и ожидаемая продолжительность жизни на системной
терапии также известна – в частности, 5-летняя ОВ не превышает
5-10%. Эффективность же трансплантации печени оценивается
(что пришло из неонкологических заболеваний) в показателях 5-летней ОВ желательно не
менее 50%. Учитывая такой потенциальный выигрыш, число
пациентов для подобного рандомизированного исследования
должно было быть небольшим.
Причем критерии отбора должны
быть довольно строгими, чтобы
минимизировать шанс экстрапеченочного прогрессирования в
ближайшее время. По-видимому,
это должны быть пациенты с хорошим соматическим статусом, в
возрасте ≤65 лет, с изолированным неоперабельным поражением печени, которое контролируется на фоне системной терапии
(не менее 3 месяцев и не более 3
линий) и в отношении которых
невозможно применить другие
локальные методы лечения, при
этом желательна благоприятная
в прогностическом плане биология опухоли (например, без мутации в гене BRAF).
Коллеги из Франции в исследовании TRANSMET, отобрав по описанным критериям 94 пациента,
рандомизировали их или в группу трансплантации печени, или в
группу продолжения системной
терапии. В качестве первичного
критерия эффективности взята
5-летняя ОВ – все как положено. Медиана времени ожидания
трансплантации в исследуемой
группе после рандомизации составила 51 день (от 30 до 65). Из 47
пациентов девяти не проведена
трансплантация вследствие прогрессирования, 3 были ретрансплантированы, 1 погиб в послеоперационном периоде. С учетом
даже этих пациентов, то есть на
ITT популяции, 5-летняя ОВ составила 57% против 13% в группе
системного лечения (в последней
19% пациентов прооперировали, включая у 2 трансплантации)
(ОР 0,37). В популяции же Per
Protocol, то есть среди тех, кому
выполнена трансплантация, а в
группе контроля не проводилась
хирургия печени, показатели
5-летней ОВ составили 73% и 9%
соответственно. Сказать, что это
излечивающая процедура, пока
трудно, хотя 40% пациентов после
трансплантации по-прежнему
без признаков болезни. Рекомендации придется переписать, может быть, ужесточив критерии,
учитывая, что потенциально
операбельные пациенты в этом
исследовании, судя по контрольной группе, все же были. Можно
предположить, что после сообщения данных результатов центры трансплантологии в стране
будут переполнены пациентами
с колоректальным раком, однако
таких пациентов на самом деле
не так много – порядка 2-3% от
общей популяции, Тем не менее,
в абсолютных цифрах их гораздо
больше, чем пациентов с ГЦР и
холангиокарциномой.
В ситуации же с резектабельными метастазами в печени считалось, что при неблагоприятном
онкологическом прогнозе желательно проведение предоперационной химиотерапии, а при
благоприятном прогнозе можно
начинать лечение с хирургии. Почему среди всех локальных методов лечения была выбрана хирургия? Потому что по результатам
метаанализа, в том числе и рандомизированных исследований,
хирургия обеспечивала лучший
локальный контроль и отдаленные показатели выживаемости,
чем, например, радиочастотная
абляция (РЧА). Но, как известно, просто еще не научились к
тому времени отбирать больных
на РЧА. А что если взять пациентов с не более чем 10 очагами
в печени и размерами не более 3
см? Именно так и поступили исследователи из Нидерландов, дополнительно подключив центры
из Италии и Бельгии в работе
COLLISION. Причем чтобы пациенты и хирурги не передумывали, рандомизацию проводили
интраоперационно. В качестве
основного критерия выбрали
ОВ! Исследование досрочно было
прекращено, так как статгипотеза по неменьшей эффективности была выполнена при промежуточном запланированном
анализе (ОР 1,042). Не отмечено
различий ни в ВБП (ОР 0,982), ни
в локальном контроле (ОР 0,833).
Все хорошо, но смущает низкая
медиана наблюдения – всего 27
месяцев, а также хотелось посмотреть различные подгруппы
по объему поражения печени.
Да и исследователи в группе РЧА
в случае сомнений в радикальности процедуры хирургически
удаляли наиболее крупный очаг,
то есть исследовательскую группу лучше было бы назвать РЧА ±
хирургия.
Еще одна клиническая ситуация, которая отличается от двух выше приведенных, – наличие экстрапеченочных операбельных проявлений болезни. Коллеги из Нидерландов решили оценить возможность циторедукции при мультиорганном поражении КРР. Были представлены результаты рандомизированного исследования III фазы ORCHESTRA, в котором пациенты с возможностью удаления не менее 80% проявлений болезни рандомизировались или в группу системной терапии в самостоятельном варианте, или в группу циторедукции, как хирургии, так и лучевой терапии или РЧА, после 3-4 курсов терапии по схеме FOLFOX ± бевацизумаб. Первичным критерием эффективности также выбрали ОВ. При медиане наблюдения 32,2 месяца различий в ОВ не получено (ОР 0,88), также не различалась и ВБП (ОР 0,88). Можно выдохнуть: все-таки разумный подход – стремление к радикальной операции, ну максимум R1 резекции, с тщательным отбором пациентов при мультиорганных метастазах – победил над оголтелой хирургией. С другой стороны, в группе пациентов, которым выполнялась циторедукция в объеме не менее 100%, также не отмечено выигрыша в выживаемости, что противоречит результатам многих ретроспективных исследований. По-видимому, это связано с необходимостью тщательного отбора пациентов на такие операции.
И хотя планировалось посвятить обзор только локальным методам лечения, невозможно обойти и вопросы системной, как писал выше, дорогостоящей и пока мало применимой прорывной технологии лекарственной терапии метастатического рака. На ASCO GI 2024 уже представляли предварительные результаты CheckMate 8HW – ипилимумумаб с ниволумабом (IPINIVO) против химиотерапии с таргетной терапии в 1 линии метастатического КРР с MSI/dMMR. Результаты по выигрышу в ВБП были потрясающими (ОР 0,21). Но изюминка исследования заложена в сравнении IPINIVO и NIVO в монорежиме – чтобы быть полностью уверенным в том, какая должна быть 1 линия в данной клинической ситуации. Но исследователи продолжают нагнетать интригу (а может в ОВ различий нет?), представив на ASCO 2024 продолжение сравнения группы химиотерапии и IPINIVO. Несмотря на кроссовер на иммунотерапию в группе контроля в 67%, ВБП2 – время от начала 1 линии и прогрессирования во второй линии – была в пользу IPINIVO (0,27). Ждем ESMO 2024, а пока смотрите клинические рекомендации и назначайте иммунотерапию в 1 линии.
Предположим, у вас есть потенциально эффективная молекула, которую вы хотите изучить при КРР в химиорефрактерной ситуации. Выбирайте в качестве сравнения регорафениб – если не улучшите ОВ, так хотя бы ниже будет токсичность. Именно так поступили исследователи в работе ARC-9. В исследовании Ib/ II фазы сравнили регорафениб и ингибитор рецепторов к аденозину (Etrumadenant) в комбинации с анти-PD1 антителом (zimberelimab) и реинтродукцией режима FOLFOX с бевацизумабом. Авторы значимо улучшили ВБП (ОР 0,27) и ОВ (0,37) в исследовательской группе. И если ранее уже было известно по ряду ретроспективных работ, что реинтродукция химиотерапии значимо лучше регорафениба по частоте объективных эффектов и ВБП, то полученное улучшение ОВ впечатляет. Может быть, это связано с небольшим числом пациентов в работе, а может быть при прямом проспективном сравнении реинтродукции и регорафениба ОВ выше при химиотерапии. Низкая частота ОЭ подсказывает, что это не эффект добавления иммунотерапии. Почему коллеги не ввели еще 3 рукав с просто реинтродукцией химиотерапии – загадка, надеюсь в III фазе исправятся.
Другое направление в иммунотерапии – биспецифические антитела. Например, можно создать молекулу, с одной стороны специфичную для рецептора к эпидермальному фактору роста (EGFR), а с другой – связывающуюся с CD28+ Т-лимфоцитов. И получается, что опухоли, экспрессирующие EGFR, насыщаются лимфоцитами – и, как считают исследователи, «холодные» в отношении иммунотерапии опухоли становятся «горячими». Именно такое антитело – REGN7075 – было изучено в рамках I фазы в монорежиме, а также в сочетании с анти-PD1 антителом (семиплимабом). Из 94 включенных пациентов 65% были с КРР и MSS. В монотерапии у пациентов с КРР и MSS и без метастазов в печени частичный эффект зарегистрирован у 20%, контроль болезни – у 80%. Интересно дождаться результатов комбинации с семиплимабом, но результаты заслуживают внимание уже сейчас, и препарат, по-видимому, пойдет дальше.
Если для других опухолей основным направлением развития фармацевтики является изучение конъюгатов, то для рака толстой кишки либо мишень невалидна, либо сами препараты неэффективны. Представлены результаты I фазы применения конъюгата M9140, который представляет собой антитело к гликопротеину на поверхности опухолевых клеток – CEACAM5 (экспрессирован более чем у 90% пациентов с КРР), соединенное с ингибитором топоизомеразы I экзатеканом. У 3 из 40 включенных предлеченных пациентов зарегистрирован подтвержденный ОЭ, контроль болезни отмечен у 65%; медиана ВБП составила 6,6 месяца. Вряд ли с такими результатами стоит идти сразу в 3 фазу, желательно найти биомаркер – может быть, интенсивность экспрессии мишени, а может быть это будет активность фермента UGT1A1, так как отмечен дозозависимый эффект.
В заключение хочется отметить,
что улучшение выживаемости, а
точнее уменьшение смертности
среди пациентов с КРР в первую
очередь достигается правильной имплементацией всех опций
лечения (хирургии, лучевой терапии, системной терапии) при
ранних стадиях. Поэтому онколог может от чего-то отказаться с
целью уменьшения токсичности
и улучшения качества жизни, а
где-то на консилиумах настоять
на проведении активной хирургической тактики. Поэтому и хирургические исследования, и работы лучевых терапевтов крайне
важны в деятельности химиотерапевта.
НОВОСТИ ASCO 2024 / ТОРАКАЛЬНАЯ ОНКОЛОГИЯ: СОВРЕМЕННЫЕ ВОЗМОЖНОСТИ И НЕРАЗРЕШЕННЫЕ ВОПРОСЫ
Автор: Боровков Иван Максимович
Врач-онколог, аспирант отделения торакальной онкологии
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина»
Минздрава России, медицинский переводчик в сфере
профессиональной коммуникации, Москва
Мелкоклеточный рак
легкого
Мелкоклеточный рак легкого (МРЛ),
в отличие от немелкоклеточного, не
обладает большим разнообразием
применяемых лечебных подходов.
Стандартом лечения у большинства
больных с локализованными стадиями остается химиолучевая терапия,
а для пациентов с распространенным
заболеванием – самостоятельная химиотерапия с возможным добавлением ингибиторов контрольных точек. Хирургическое вмешательство
при МРЛ хоть и остается теоретически возможным, но применимо у абсолютного меньшинства пациентов
(≈5%) и только при условии морфологического подтверждения статуса
N0. Попытки расширить приведенные стандарты или интенсифицировать первую линию терапию нередко
оказываются безуспешными. Но случаются и исключения из правил, одним из которых стало исследование
ADRIATIC, попробовавшее переложить протокол PACIFIC на популяцию больных с МРЛ.
Исследование ADRIATIC включило
730 пациентов с мелкоклеточным раком легкого I-III ст. после ХЛТ (СОД
60-66 Гр или 45 Гр) и, при отсутствии
прогрессирования, рандомизировало их в экспериментальные (консолидирующая терапия дурвалумабом
1 раз в 4 недели, n=264; 4 курса терапии дурвалумаб + тремелимумаб с
переходом на поддерживающую терапию дурвалумабом 1 раз в 4 недели) и контрольную (плацебо, n=266)
группы. Факторами стратификации
являлись стадия заболевания (I/
II против III) и наличие в анамнезе
профилактического облучения головного мозга (ПОГМ), а в качестве
первичной конечной точки были выбраны общая (ОВ) и безрецидивная
(ВБП) выживаемость в группах ХЛТ
+ дурвалумаб и ХЛТ + плацебо. Анализируемые группы были хорошо
сбалансированы, а доля ПОГМ в обеих группах составила 53,8% (рис.1).
Рисунок 1.
Характеристика пациентов в исследовании ADRIATIC.
Добавление консолидирующей терапии дурвалумабом позволило увеличить медиану общей выживаемости до 55,9 мес. по сравнению с 33,4
мес. в группе плацебо (ОР 0,73; 95%
ДИ 0,57-0,93; p=0,0104), а показатели
двух- и трехлетней ОВ в анализируемых группах составили 68% и 56,5%
(дурвалумаб) против 58,5% и 47,6%
(плацебо) соответственно (рис.2).
Аналогичным образом улучшалась
и медиана выживаемости без прогрессирования – 16,6 против 9,2 мес.
(ОР 0,76; 95% ДИ 0,61-0,95; p=0,0161).
При этом, по данным проведенного
подгруппового анализа, ни наличие
в анамнезе ПОГМ, ни стадия заболевания не оказывали достоверного
влияния на эффективность лечебных
подходов.
Лечение характеризовалось удовлетворительным профилем безопасности с частотой нежелательных явлений (НЯ) 3-4 ст. в экспериментальной
и контрольной группах 24,3% и 24,2%
соответственно. В то же время, в экспериментальной группе достоверно
чаще выявлялся пневмонит – 38%
против 30,2% (любой степени) и 3,0%
против 2,6% (3-4 ст.) (рис.3).
Рисунок 2.
Общая выживаемость в исследовании ADRIATIC.
Рисунок 3.
Структура нежелательных явлений в исследовании
ADRIATIC.
Таким образом, исследование
ADRIATIC предлагает нам новый
(хоть и давно известный) подход к лечению пациентов с нерезектабельным
локализованным или местнораспространенным мелкоклеточным раком
легкого. Данные по влиянию добавления к терапии тремелимумаба пока
представлены не были, будем ждать
их в ближайшее время.
Было на ASCO 2024 представлено и
другое исследование из области мелкоклеточного рака легкого – BEAT-SC,
направленное на оценку интенсификации первой линии терапии распространенного МРЛ за счет добавления
бевацизумаба к схеме EP + атезолизумаб. Протокол включил 333 пациента
и рандомизировал их в группы EP +
атезолизумаб + бевацизумаб (4 курса,
затем поддержка атезолизумаб + бевацизумаб, n=166) и EP + атезолизумаб
+ плацебо (4 курса, затем поддержка атезолизумаб + плацебо, n=164).
Первичной конечной точкой была
выбрана выживаемость без прогрессирования, а общая выживаемость
использовалась в качестве вторичной
точки (что очень важно, в контексте
полученных результатов).
К сожалению, амбициозное название
работы не оправдалось. Добавление
бевацизумаба к привычной схеме не
только не улучшило общую выживаемость пациентов, но и нумерически
ухудшило ее по сравнению с группой
контроля – медиана ОВ составила 13
и 16,6 мес. соответственно (ОР 1,22;
95% ДИ 0,89-1,67; p=0,2212) (рис.4а).
Однако первичная конечная точка
исследования все-таки была достигнута – комбинация EP + атезолизумаб + бевацизумаб действительно
позволила увеличить медиану ВБП
до 5,7 мес. по сравнению с 4,4 мес. в
группе контроля (ОР 0,70; 95% ДИ
0,54-0,90; p=0,0060) (рис.4б). Частота
нежелательных явлений 3-4 ст. между
группами достоверно не различалась
– 85,5% против 86%.
Рисунок 4.
Общая (А) и безрецидивная (Б) выживаемость в
исследовании BEAT-SC.
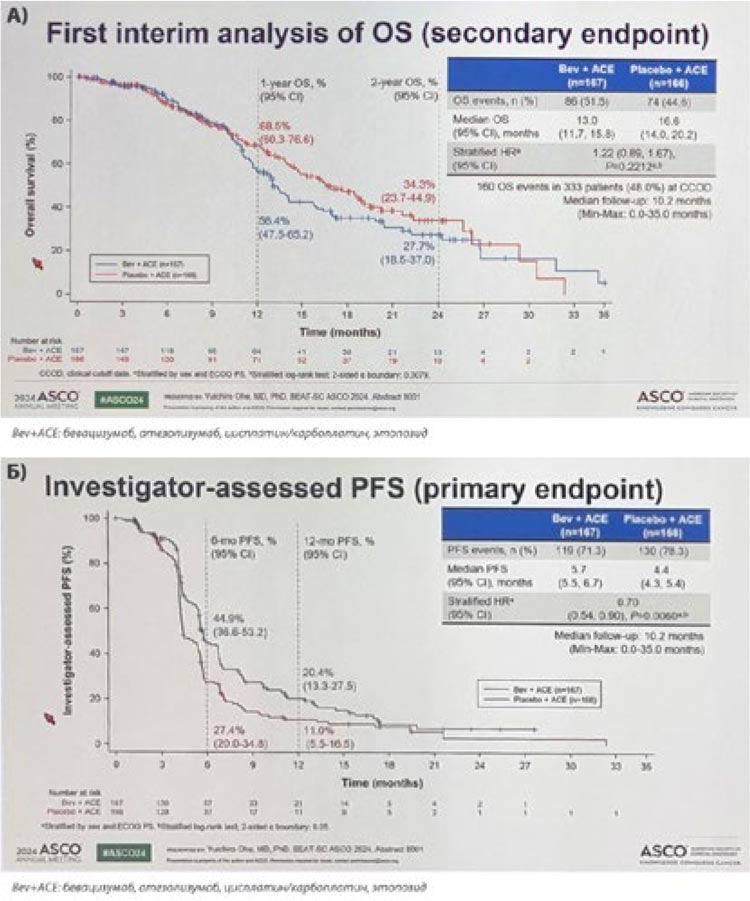
Несмотря на негативное влияние на
общую выживаемость, сами авторы
расценивают исследование как положительное, ссылаясь на достижение
первичной конечной точки (выживаемость без прогрессирования) и
аргументируя ухудшение общей выживаемости в экспериментальной
группе «незрелостью данных». Войдет ли данный режим в реальную
клиническую практику с подобными
результатами? Крайне маловероятно,
хоть авторы и обещают продолжить
наблюдение за показателем ОВ.
Резектабельный рак
пищевода и пищеводножелудочного перехода
За последние годы статус главного
источника новостей среди злокачественных опухолей верхних отделов
желудочно-кишечного тракта прочно закрепился за раком желудка.
Иногда к нему также присоединяется и аденокарцинома пищеводножелудочного перехода, перетягивая
на себя часть достижений старшего
брата со слоганом «me too». В то же
время изучение рака пищевода как
самостоятельной нозологии достаточно редко приводит к крупным
новостям, меняющим практику,
оставляя онкологов лишь с дополнительным анализами уже знакомых
исследований CROSS и NeXT. Стал
ли исключением уходящий академический год? Как ни странно, несмотря на заметное число новых работ,
ответ на данный вопрос не такой
однозначный.
В первую очередь, следует обратить
внимание на новые работы в области
хирургического лечения рака пищевода – MONET [4] и MODERN3 [5].
Исследование MONET оценивало
влияние торакоскопического доступа
при выполнении операции типа K.C.
McKeown у пациентов с резектабельным раком пищевода (сT1-3N1-2)
и рандомизировало их в группы
торакоскопического (n=150) и торакотомного (n=150) доступов. Все
хирурги перед включением в исследование должны были предоставить
подтверждения самостоятельного
выполнения не менее 30 подобных
вмешательств и пройти личное собеседование с экспертами Японского
общества малоинвазивной хирургии
(Japan Society for Endoscopic Surgery,
JSES). Авторы показали, что отказ от
торакотомии с пользу малоинвазивного доступа приводил к достоверному увеличению 3-летней общей
выживаемости (ОВ) до 82% (95% ДИ
73,8-87,8%) по сравнению с 70,9% (95%
ДИ 61,6-78,4%) в группе контроля, а
показатель ОР составил 0,64 (98,8%
ДИ 0,34-1,21) (рис.5). Аналогичным
образом улучшалась и 3-летняя выживаемость без прогрессирования
(ВБП) – 72,9% против 61,9%. При этом
частота послеоперационных осложнений между группами достоверно не
различалась, а доля R0-резекций была
достоверно выше в экспериментальной группе (95,3% против 90,0%).
Рисунок 5.
Общая и безрецидивная выживаемость
в исследовании MONET.
Авторы MODERN3 обратились к
другой дискутабельной теме – целесообразности профилактического
удаления надключичных лимфатических узлов (No 104) в ходе расширенной трехзональной лимфодиссекции при опухолях верхне- и
среднегрудного отделов пищевода.
Согласно представленным данным,
исследование придерживается дизайна non-inferiority и для подтверждения не меньшей эффективности
отказа от диссекции надключичных
лимфоузлов должно включить 480
пациентов (по 240 в каждую группу,
one-sided alpha 5%, мощность 70%,
дельта non-inferiority 6% при оценке
3-летней ОВ). Рациональность данной работы объясняется высоким
риском поражения лимфатических
узлов шеи при плоскоклеточном раке
верхне-/среднегрудного отделов пищевода и отсутствием единого мнения о необходимом объеме шейной
лимфодиссекции среди экспертов в
Японии и странах Запада. Так, в систематическом обзоре Hagens E.R.C.
и соавт., включившем данные 8952
пациентов, метастазы в шейных лимфоузлах по данным гистологического
исследования выявлялись при раке
верхнегрудного отдела пищевода у
14% (pT1) и 21% (pT2-4) пациентов,
а при раке среднегрудного отдела – у
3% и 5% соответственно [6]. При этом
отдельное изучение лимфоузлов шеи
показало, что риск метастатического
поражения надключичных групп не
превышает 10% справа и 5% слева
при локализации опухоли как в верхнегрудном, так и в среднегрудном
отделах. Тем не менее, имеющиеся
рандомизированные исследования
не смогли доказать достоверное влияние 3F-лимфодиссекции на показатели общей и безрецидивной выживаемости [7,8], что оставляет
открытым вопрос о необходимости
расширенной диссекции и подчеркивает практическую значимость подобных MODERN3 работ. Исследование было инициировано в августе
2022 года и впервые представлено на
ASCO GI 2023, остается дождаться
результатов.
Другим важным вопросом являлся
выбор оптимальной тактики комбинированного лечения местнораспространенного рака пищевода. Длительное время золотым стандартом
оставался протокол CROSS – химиолучевая терапия (ЛТ СОД 41,4 Гр, химиотерапия по схеме карбоплатин +
паклитаксел еженедельно), позволяющая увеличить медиану общей выживаемости в общей популяции пациентов до 48,6 мес. по сравнению с
24 мес. в группе только хирургического лечения (ОР 0,68; 95% ДИ 0,53-0,88;
p=0,003). Однако одним из основных
ограничений исследования являлась
выбранная популяция, состоящая на
75% из пациентов с аденокарциномой
пищевода/пищеводно-желудочного
перехода и лишь на 25% из больных
с плоскоклеточным раком [9]. Подгрупповой анализ экспериментальной группы показал, что медиана ОВ
среди пациентов с плоскоклеточным
вариантов была также вдвое выше,
чем у больных с аденокарциномой
(81,6 против 43,2 мес.), что поставило
под вопрос широкую применимость
данного метода без учета гистологического типа. Публикация результатов исследования NeXT, показавших
высокую эффективность неоадъювантной химиотерапии по схеме
DCF, еще больше расширило спектр
возможностей лечения плоскоклеточного рака пищевода [10]. Но что
же оставалось для аденокарциномы
пищевода и пищеводно-желудочного
перехода?
Главным руководством к действию
с 2019 года являлось исследование
FLOT4, показавшее возможность
увеличения медианы ОВ у пациентов
с аденокарциномой желудка и пищеводно-желудочного перехода (Siewert
1-3) до 50 мес. при проведении периоперационной ХТ по схеме FLOT по
сравнению с 35 мес. в группе периоперационного проведения ECF/ECX.
Однако исследуемая популяции лишь
на 23-24% состояла из пациентов с
опухолями Siewert 1 и не проводила
прямого сравнения с другими «конкурирующими» методами лечения,
что не позволяло с полной уверенностью экстраполировать результаты
на широкую популяцию пациентов с
аденокарциномой пищевода.
Одна из первых попыток прямого
сравнения ХЛТ и ХТ у данных пациентов была предпринята авторами исследования Neo-AEGIS, представленного в ноябре 2023 года [12].
Протокол включил 377 пациентов
с аденокарциномой пищевода/пищеводно-желудочного перехода и
рандомизировал их в экспериментальную группу периоперационного
проведения ECF/ECX (до 2018 года,
по 3 курса до и после операции) или
FLOT (с 2018 года, по 4 курса до и после операции) и контрольную группу
химиолучевой терапии (СОД 41,4 Гр,
ХТ по схеме карбоплатин + паклитаксел еженедельно). При этом, в отличие от исследования Al-Batran S.E.
и соавт., выборка состояла преимущественно из пациентов с опухолями
пищевода и пищеводно-желудочного перехода Siewert 1 (67% и 71% в
экспериментальной и контрольной
группах соответственно). Несмотря
на это, достоверных различий между
группами получено не было. При медиане наблюдения в 38,8 мес. медиана
ОВ составила 48,0 мес. в группе ХТ и
49,2 мес. в группе ХЛТ (ОР 1,03; 95%
ДИ 0,77-1,38; p=0,82), а медиана ВБП
– 32,4 и 24,0 мес. соответственно (ОР
0,89; 95% ДИ 0,68-1,17; p=0,41) (рис.6).
Однако данное исследование характеризуется крайне важным ограничением – набор пациентов в период
пандемии COVID-19 был досрочно
прекращен на отметке в 70% от запланированного для подтверждения
non-inferiority объема, что сигнализирует о заведомо недостаточной
мощности работы и требует настороженного отношения к полученным
результатам, оставляя на тот момент
вопрос о выборе оптимальной тактики по-прежнему открытым.
Но попытки разрешить дилемму выбора между ХЛТ и FLOT у пациентов
с аденокарциномой пищевода не прекращались. Авторы представленного
на ASCO 2024 исследования ESOPEC
[13] сравнили эффективность предоперационной химиолучевой терапии
по протоколу CROSS и периоперационной химиотерапии по схеме FLOT.
Работа включила 438 пациентов с резектабельными опухолями (cT1N1-3,
cT2-4aN0-3) и рандомизировала их в
экспериментальную (FLOT, n=221) и
контрольную (CROSS, n=217) группы. У большей части пациентов опухоль имела местнораспространенный характер (cT3/4 – 80,5%, cN1-3
– 79,7%), что соотносится с данными
реальной клинической практики. В
отличие от Neo-AEGIS, в ESOPEC
проведение периоперационной терапии по схеме FLOT позволило достоверно увеличить медиану общей
выживаемости до 66 мес. по сравнению с 37 мес. в группе ХЛТ, а 3-летняя
ОВ в двух группах составила 57,4% и
50,7% соответственно (ОР 0,70; 95%
ДИ 0,53-0,92; p=0,012) (рис.7). Периоперационная ХТ также ассоциировалась с увеличением частоты полных
патоморфологических ответов до
19,3% против 13,5% в контрольной
группе. Данное исследование были
признано положительным, с предложением передать FLOT статус метода
«первого выбора» при аденокарциноме пищевода и пищеводно-желудочного перехода.
Рисунок 6.
Общая выживаемость в исследовании Neo-AEGIS
Рисунок 7.
Общая выживаемость в исследовании ESOPEC
Возвращаясь к нашему первому вопросу – стал ли 2023/24 год исключением из правил, подарив нам множество новых опций лечения рака
пищевода? Ответ кроется в характеристике, которую многие эксперты
дали прошедшему конгрессу ASCO
2024: этот год привнес вклад в наше
понимание многих вопросов, или
«enriched our understanding». Так, показанная в MONET применимость
отказа от торакотомии в пользу торакоскопии при субтотальных резекциях пищевода несомненно «обогащает
наше понимание» возможностей, однако использование данного подхода технически возможно далеко не у
всех пациентов и не во всех клиниках.
Во-вторых, изучение необходимости
шейной лимфодиссекции и, в частности, удаления 104 группы лимфоузлов, при опухолях верхне-/среднегрудного отделов пищевода является
крайне важным направлением, но
для имплементации в клиническую
практику потребует проведения множества других, уточняющих исследований. Но делает ли неоднозначность
ряда приведенных работ данный год
«неудачным»? Нет, ведь именно из
таких промежуточных результатов
складывается мозаика данных, которые в какой-то момент позволят нам
кардинально поменять подход к лечению больных.
Источники:
- NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®). Small Cell Lung Cancer. Version 3.2024. June 11, 2024.
- David R. Spigel, et al. ADRIATIC: Durvalumab (D) as consolidation treatment (tx) for patients (pts) with limited-stage small-cell lung cancer (LSSCLC). JCO. 2024; 42: LBA5-LBA5. DOI:10.1200/JCO.2024.42.17_suppl. LBA5.
- Yuichiro Ohe, et al. BEAT-SC: A randomized phase III study of bevacizumab or placebo in combination with atezolizumab and platinum-based chemotherapy in patients with extensivestage small cell lung cancer (ES-SCLC). JCO. 2024; 42: 8001-8001. DOI:10.1200/ JCO.2024.42.16_suppl.8001.
- Hiroya Takeuchi, et al. A randomized controlled phase III trial comparing thoracoscopic esophagectomy and open esophagectomy for thoracic esophageal cancer: JCOG1409 (MONET trial). JCO. 2024; 42: 249-249. DOI:10.1200/ JCO.2024.42.3_suppl.249.
- Tsunoda S, et al; the Japan Esophageal Oncology Group of Japan Clinical Oncology Group. A multicenter randomized controlled trial of esophagectomy with or without prophylactic supraclavicular node dissection: a phase 3 trial (JCOG2013, MODERN3). Jpn J Clin Oncol. 2023 Jun 28; 53(9): 858-62. doi: 10.1093/jjco/ hyad071. PMCID: PMC10473275.
- Hagens ERC, van Berge Henegouwen MI, Gisbertz SS. Distribution of Lymph Node Metastases in Esophageal Carcinoma Patients Undergoing Upfront Surgery: A Systematic Review. Cancers (Basel). 2020 Jun 16; 12(6): 1592. doi: 10.3390/cancers12061592. PMID: 32560226; PMCID: PMC7352338.
- Nishihira T, Hirayama K, Mori S. A prospective randomized trial of extended cervical and superior mediastinal lymphadenectomy for carcinoma of the thoracic esophagus. Am J Surg. 1998; 175: 47-51.
- Li B, Zhang Y, Miao L, et al. Esophagectomy with three-field versus two-field lymphadenectomy for middle and lower thoracic Esophageal cancer: long-term outcomes of a randomized clinical trial. J Thorac Oncol. 2021; 16: 310-7.
- Shapiro J, et al; CROSS study group. Neoadjuvant chemoradiotherapy plus surgery versus surgery alone for oesophageal or junctional cancer (CROSS): long-term results of a randomised controlled trial. Lancet Oncol. 2015 Sep; 16(9): 1090-1098. doi: 10.1016/ S1470-2045(15)00040-6. Epub 2015 Aug 5. PMID: 26254683.
- Ken Kato, et al. A randomized controlled phase III trial comparing two chemotherapy regimen and chemoradiotherapy regimen as neoadjuvant treatment for locally advanced esophageal cancer, JCOG1109 NExT study. Journal of Clinical Oncology. 2022; 40 (4_suppl): 238-238.
- Al-Batran SE, et al.; FLOT4-AIO Investigators. Perioperative chemotherapy with fluorouracil plus leucovorin, oxaliplatin, and docetaxel versus fluorouracil or capecitabine plus cisplatin and epirubicin for locally advanced, resectable gastric or gastro-oesophageal junction adenocarcinoma (FLOT4): a randomised, phase 2/3 trial. Lancet. 2019 May 11; 393(10184): 1948-1957. doi: 10.1016/S0140-6736(18)32557-1. Epub 2019 Apr 11. PMID: 30982686.
- Reynolds JV, et al.; NeoAEGIS Investigators and Trial Group. Trimodality therapy versus perioperative chemotherapy in the management of locally advanced adenocarcinoma of the oesophagus and oesophagogastric junction (NeoAEGIS): an open-label, randomised, phase 3 trial. Lancet Gastroenterol Hepatol. 2023 Nov; 8(11): 1015-1027. doi: 10.1016/S2468-1253(23)00243-1. Epub 2023 Sep 18. PMID: 37734399; PMCID: PMC10567579.
- Hoeppner J, Brunner T, Lordick F, et al. Prospective randomized multicenter phase III trial comparing perioperative chemotherapy (FLOT protocol) to neoadjuvant chemoradiation (CROSS protocol) in patients with adenocarcinoma of the esophagus (ESOPEC trial). J Clin Oncol. 2024; 42 (suppl 17): LBA1. doi:10.1200/ JCO.2024.42.17_suppl.LBA1.
НОВОСТИ ASCO 2024 / ПО СЛЕДАМ ASCO 2024: ИССЛЕДОВАНИЕ CROWN
Одним из главных событий конференции ASCO 2024 стала публикация долгожданных результатов исследования CROWN,
направленного на сравнение
эффективности лорлатиниба и
кризотиниба в первой линии
лечения пациентов с распространенным немелкоклеточным
раком легкого (НМРЛ) и активирующей мутацией ALK. Исследовательский протокол включил
296 пациентов с ALKмут. НМРЛ
и рандомизировал их в экспериментальную (лорлатиниб 100 мг
1 раз в день, n=149) и контрольную (кризотиниб 250 мг 2 раза в
день, n=147) группы. В качестве
первичной конечной точки была
выбрана выживаемость без прогрессирования (ВБП), а вторичные конечные точки включали
общую выживаемость (ОВ), частоту объективных ответов и
распространенность нежелательных явлений. Анализ мутаций
в циркулирующей опухолевой
ДНК осуществлялся с помощью
методики секвенирования следующего поколения (NGS).
Авторами были получены беспрецедентные результаты. При
медиане наблюдения в 60,2 и 55,1
мес. в общей популяции медиана
выживаемости без прогрессирования в экспериментальной
группе достигнута не была, а в
группе контроля составила 9,1
мес. (ОР 0,19; 95% ДИ 0,13-0,27).
5-летняя выживаемость без прогрессирования в двух группах составила 60% и 8% соответственно
(рис.1).
Рисунок 1.
Выживаемость без прогрессирования
в исследовании CROWN.
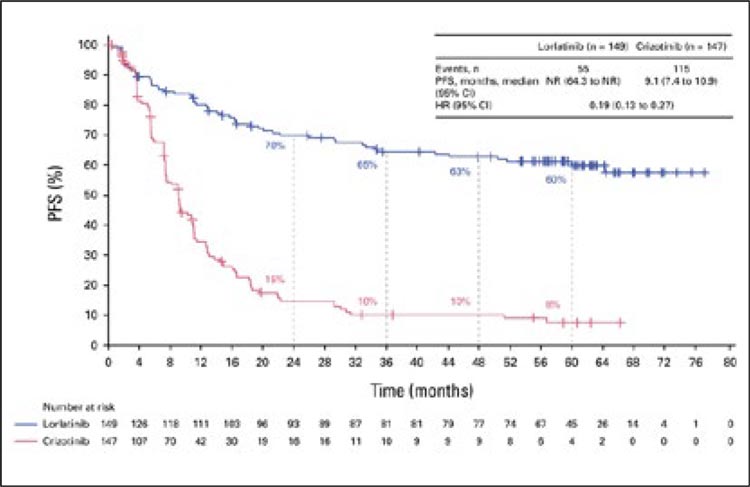
Среди пациентов с наличием метастазов в ЦНС на момент начала
лечения определялись аналогичные результаты. Так, применение
лорлатиниба ассоциировалось с
достоверным увеличением 5-летней ВБП до 53% (ОР 0,08; 95% ДИ
0,04-0,19), в то время как в контрольной группе все пациенты
выбыли из исследования по прошествии 2 лет. Более того, у 83%
пациентов в экспериментальной
группе интракраниальный контроль заболевания сохранялся
даже через 5 лет, на момент проведения запланированного интервального анализа (рис.2).
Рисунок 2.
Выживаемость без интракраниального
прогрессирования среди пациентов с метастазами в ЦНС.
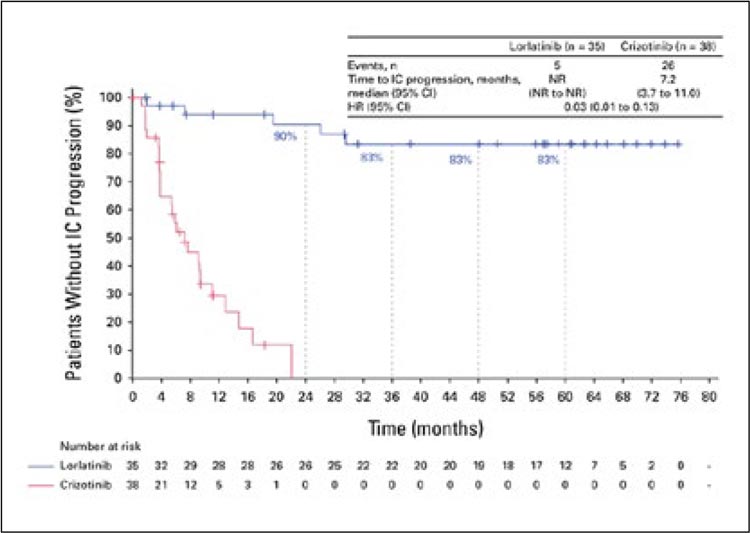
Объективный ответ был зарегистрирован у 81% и 63% пациентов
в двух группах соответственно.
Медиана длительности ответа,
как и в случае в ВБП, в экспериментальной группе достигнута
не была, а в контрольной группе
не превышала 9,2 мес. К сожалению, подобная эффективность
сопровождалась высокой частотой нежелательных явлений.
Так, НЯ 3-4 ст. выявлялись у 77%
в экспериментальной группе и
57% в группе контроля. При этом
среди нежелательных явлений в
группе лорлатиниба преобладали гипертриглицеридемия (25%
против 0%), гиперхолестеролемия (21% против 0%), набор веса
(23% против 2%) и артериальная
гипертензия (12% против 1%). Нежелательные явления потребовали редукцию доз у 23% и 15%
пациентов соответственно. Тем
не менее, проведенный post hoc
анализ показал, что редукция
дозы лорлатиниба в первые 16 недель лечения не ассоциировалась
с достоверным ухудшением ВБП
(рис.3).
Рисунок 3.
Выживаемость без прогрессирования
в зависимости от редукции дозы.