Дорогие коллеги, дорогие друзья!
Июнь – особый месяц для нас: несмотря на занятость, проблемы, поездки, есть повод собраться с коллегами и поздравить друг друга с Днем Медицинского работника. Наша профессия, медицина, клиническая работа, научная деятельность – это то, что с нами на всю жизнь, несмотря на все сложности, глобальные или локальные, которые были, есть и будут на пути.

Густав Климт. Гигиея. Фрагмент картины «Медицина»
(Роспись потолка для Венского Университета) 1901 год. Уничтожена в 1945 г.
ВОПРОСЫ ОРГАНИЗАЦИИ РАБОТЫ ВРАЧЕЙ-ОНКОЛОГОВ ОБСУЖДАЛИСЬ НА IX КОНФЕРЕНЦИИ RUSSCO «РАК ЛЕГКОГО И ДРУГИЕ ОПУХОЛИ ГРУДНОЙ КЛЕТКИ» В САНКТ-ПЕТЕРБУРГЕ
В процессе дискуссии главные врачи региональных онкодиспансеров рассматривали сценарии решения важных вопросов, возникающих в работе руководителей крупных профильных учреждений: кадровые вопросы, взаимодействие с пациентами, логистика внутри стационара и др.

ПОДДЕРЖАНИЕ ЗДОРОВОГО ОБРАЗА ЖИЗНИ ДВУКРАТНО СНИЖАЕТ РИСК СМЕРТИ БОЛЬНЫХ ОПЕРАБЕЛЬНЫМ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ
Много лет занимаясь лечением больных злокачественными опухолями вообще и раком молочной железы в частности...

ПЕРВЫЙ МОЛОДЕЖНЫЙ ОНКОЛОГИЧЕСКИЙ САММИТ СОСТОЯЛСЯ В МОСКВЕ
Молодежный комитет RUSSCOjr Российского общества клинической онкологии 23 июня провел Первый молодежный онкологический саммит.
НОВОСТИ ASCO 2023 / САРКОМЫ
Проспективное исследование ISGSTS-1001 по оценке эффективности гистотип-специфичной неоадъювантной химиотерапии высокозлокачественных мягкотканных сарком до сих пор приносит свои плоды и новую пищу для размышлений. Логичным было продолжить набор и воспользоваться имеющимися данными для ответа на новые вопросы. В этот раз авторы исследования поставили себе...
НОВОСТИ ASCO 2023 / САРКОМЫ
Десмоидный фиброматоз (ДФ) часто возникает во время беременности или после родов. Руководство по планированию новой беременности во время активного наблюдения или после резекции DF было ограничено в плане рекомендаций. Авторы международного ретроспективного наблюдательного исследования поставили себе задачу...
НОВОСТИ ASCO 2023 / КАХЕКСИЯ: ПАТОФИЗИОЛОГИЧЕСКИЙ ПОДХОД
В одной из секций 2 дня конгресса, посвященной раковой кахексии, были представлены результаты исследования ранней фазы I, где рассматривался путь передачи сигналов JAK-STAT как мишень для кахексии [1]....
УГОЛОК РАДИОТЕРАПЕВТА / СНОВА ОБ SBRT / ПРЕДОПЕРАЦИОННАЯ СТЕРЕОТАКСИЧЕСКАЯ РАДИОТЕРАПИЯ/РАДИОХИРУРГИЯ НА МЕТАСТАЗЫ В ГОЛОВНОМ МОЗГЕ: ПЕРСПЕКТИВНЫЙ ПОДХОД?..
Любой радиотерапевт, еще будучи доктором в процессе обучения, осведомлен о ряде преимуществ предоперационного облучения как первичных опухолей, так и любых вторичных очагов, если...
УГОЛОК РАДИОТЕРАПЕВТА / СНОВА ОБ SBRT / СТЕРЕОТАКСИЧЕСКАЯ РАДИОХИРУРГИЯ ПРОТИВ КОНВЕНЦИОНАЛЬНОЙ ЛУЧЕВОЙ ТЕРАПИИ МЕТАСТАЗОВ В ПОЗВОНОЧНИКЕ: БИТВА НЕ ВЫИГРАНА
Не секрет, что лучевая терапия – один из наиболее эффективных методов уменьшения болевого синдрома при метастазах в костях, и эффективность его, по данным разных авторов, составляет 50-75%. Боль – это основная цель, на которую направлено облучение, и именно по динамике болевого синдрома в первую...
УГОЛОК РАДИОТЕРАПЕВТА / СНОВА ОБ SBRT / ЕСТЬ ЛИ МЕСТО SBRT В ЛЕЧЕНИИ БОЛЬНЫХ С III СТАДИЕЙ РАКА ЛЕГКОГО?
Примерно треть больных раком легкого на момент диагностики имеют местнораспространенные опухоли. У многих из них процесс нерезектабелен, или сами пациенты неоперабельны с медицинской точки зрения. В подобных ситуациях ведущим методом лечения становится химиолучевая терапия с последующим добавлением консолидации дурвалумабом, что, по данным исследования...
УГОЛОК РАДИОТЕРАПЕВТА / СНОВА ОБ SBRT / БЛОКИРОВАНИЕ КЛЮЧЕВОГО ИММУННОГО БЕЛКА УЛУЧШАЕТ РЕЗУЛЬТАТЫ ЛУЧЕВОЙ ТЕРАПИИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ
До 60% онкологических больных получают лучевую терапию, но она, увы, не всегда помогает. Новое исследование из Чикагского университета направлено на преодоление устойчивости к лучевой терапии путем подавления ключевого белка и активного подключения иммунной системы....
Дорогие коллеги, дорогие друзья!
Июнь – особый месяц для нас: несмотря на занятость, проблемы, поездки, есть повод собраться с коллегами и поздравить друг друга с Днем Медицинского работника. Наша профессия, медицина, клиническая работа, научная деятельность – это то, что с нами на всю жизнь, несмотря на все сложности, глобальные или локальные, которые были, есть и будут на пути.
Когда-то в далеком 1894 году великий австрийский художник Густав Климт получил чрезвычайно престижный и масштабный заказ: ему предстояло написать три полотна, которые должны были украсить потолок большого актового зала главного здания Венского университета. Одна из частей триптиха носила название «Медицина» и, по мнению заказчиков, должна была олицетворять победу науки над болезнями – но работа Климта выглядела совсем иначе, скорее, мрачно реалистично, ибо далеко не всегда побеждают наука и разум, зачастую болезнь оказывается сильнее. После многочисленных жалоб Климт вернул аванс и продал университетскую серию частным коллекционерам. Увы, участь «Медицины», так же как «Юриспруденции» и «Философии», оказалась печальна: нацисты вывезли их из Австрии, при дальнейшем отступлении картины погибли в сожженном замке Иммендорф в 1945 году. Но «Медицина» Климта не умерла. Сохранился эскиз, выполненный маслом, он хранится в Музее Израиля. По эскизам и черно-белым фотографиям современные технологии воссоздали первоначальную палитру красок и других утраченных работ. Все же наука восторжествовала, дав новую жизнь, пусть и несколько в ином качестве.
Медицина, наша любовь, переживает в России сложные времена, но мы продолжаем работать, помогая нашим пациентам, подкрепляя наши знания новыми научными фактами. В июньском номере газеты мы начинаем публиковать новости недавно прошедшего конгресса ASCO 2023, более полная информация будет представлена в июльском выпуске. Радиотерапевты, возможно, найдут для себя новые данные на развороте газеты под заголовком «Уголок радиотерапевта». О последних новостях общества вы всегда можете ознакомиться на сайте rosoncoweb.ru. Вступая в разгар лета и отпусков, желаем вам всем, дорогие коллеги, бодрости духа и тела, оптимизма, мира и больше теплых и радостных дней. С нашим праздником!
Команда RUSSCO
Густав Климт. Гигиея. Фрагмент картины «Медицина»
(Роспись потолка для Венского Университета) 1901 год. Уничтожена в 1945 г.

ВОПРОСЫ ОРГАНИЗАЦИИ РАБОТЫ ВРАЧЕЙ-ОНКОЛОГОВ ОБСУЖДАЛИСЬ НА IX КОНФЕРЕНЦИИ RUSSCO «РАК ЛЕГКОГО И ДРУГИЕ ОПУХОЛИ ГРУДНОЙ КЛЕТКИ» В САНКТ-ПЕТЕРБУРГЕ
14 апреля в Санкт-Петербурге состоялась панельная дискуссия администраторов здравоохранения,
которая прошла во время работы IX конференции RUSSCO «Рак легкого и другие
опухоли грудной клетки». Своеобразная деловая игра руководителей онкологических
стационаров крупнейших российских городов (Москва, Санкт-Петербург, Красноярск, Самара,
Казань и др.) была посвящена вопросам оптимизации организации онкологической помощи.
В процессе дискуссии главные врачи региональных онкодиспансеров
рассматривали сценарии решения
важных вопросов, возникающих
в работе руководителей крупных
профильных учреждений: кадровые вопросы, взаимодействие с пациентами, логистика внутри стационара и др.
Модерировал дискуссию Александр Валерьевич Петровский, член Правления RUSSCO, заместитель директора по образовательной деятельности ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, к.м.н., который обобщил все идеи, предложенные участниками, разложив их на пять сегментов с предложениями:
• восприятие пациентом того, как с ним происходит общение, лечение, сервис в лечебном учреждении – необходимо больше времени для общения пациента и врача;
• недостаточная мотивация врачей для того, чтобы чувствовать свое значение для работы клиники и всей системы – повышение мотивации за счет различных программ тимбилдинга, более активного участия в составлении клинических рекомендаций, формулирование конкретных задач для каждого конкретного врача по его развитию, чтобы он понимал, что он делает хорошо, для чего делает и чем это ему воздастся;
• работа клиники, улучшение систем организации работы конкретного медучреждения – информатизация, уход от бумажных форм учета, упрощенный доступ к электронным историям болезни, внедрение бережливого производства, руководители клиник должны сами понимать, как внедрять современные процессы (для этого необходимо обучение), проводить контроль качества работы руководителей и сотрудников медучреждений, должен быть план развития клиники (с учетом текущей ситуации в стране), госклиникам надеяться не только на госфинансирование, но и на другие источники, например, ДМС (привлечение финансовых ресурсов страховых компаний);
• улучшение всей системы медпомощи, преемственность этапов лечения – наладить передачу пациентов по всем уровням помощи и всем этапам комбинированного лечения, например, из ЦАОПов в онкологические диспансеры и центры. Это необходимо для того, чтобы не терялись информация, план лечения, было взаимодействие врачей из разных сегментов. Продумать возможность различных форм финансирования лечения эффективных для пациента и бережливых для государства (ОМС, ВМП, бюджетные средства, программа 14 высокозатратных нозологий, частные средства и т.п.);
• локальные инициативы – внедрение чекапов, тестирование на
мутации, внедрение различных
регистров (нозология, возраст,
беременность, редкие мутации и
т.п.).
Эксперты в лице Бурмистрова Михаила Владимировича, заместителя
главного врача по медицинской части ГБУЗ «Республиканская клиническая больница» МЗ Республики
Татарстан (Казань), профессора,
д.м.н., Зукова Руслана Александровича, главного врача КГБУЗ «Красноярский краевой клинический
онкологический диспансер им.
А.И. Крыжановского», профессора,
д.м.н., Модестова Андрея Арсеньевича, директора и члена совета
директоров АО «Медскан», к.м.н.,
и Орлова Андрея Евгеньевича,
главного врача ГБУЗ «Самарский
областной клинический онкологический диспансер», главного внештатного онколога Министерства
здравоохранения Самарской области, д.м.н., предложили свое видение вопроса и темы для дискуссии:
• отношение к пациенту, право выбора пациентом лечебного учреждения, сервис во время лечения;
• создание позитивного имиджа медучреждения, в том числе и самой темы онкологии; • юридическая защита врача, устранение презумпции виновности врача;
• структурирование тарифов по категориям, гибкость коммерческих систем, реструктуризация и централизация системы;
• информатизация процессов, единая система, дата-центры, цифровизация истории болезни, внедрение искусственного интеллекта.
• Единодушным мнением всех
участников дискуссии основное
внимание в обсуждении решили
уделить мотивации врача.

А.Е. Орлов:
– Мотивация и общение – две
взаимосвязанных составляющих
процесса. Первая включает в себя
материальную и нематериальную
заинтересованность. Когда мы постоянно говорим, что у медицинских работников низкий уровень
зарплаты, то это не означает, что
только он первичен. Важен и процесс создания в медучреждении
определенных комфортных условий
работы, возможностей саморазвития, самореализации, образования
и совершенствования навыков.
К сожалению, в рамках тарифов
сложно премировать врачей за переработки. На сегодня существующие
в государственных медучреждениях
критерии оценки и стимулирующих
выплат каждого сотрудника фактически не отвечают реалиям и их
надо менять, беря за образец опыт
частных клиник, поэтому в дело
вступают нематериальные механизмы.
А.А. Модестов:
– Если сравнивать мотивационную
составляющую в государственных и
частных медучреждениях, то начать
надо со времени. В госучреждениях
на прием отводится 22 мин. на пациента, по факту получается – 15 мин.
За это время сложно успеть раздеть
больного, осмотреть, вынести диагноз, записать результаты. В частных
же на каждого пациента отводится 1
час (согласно утвержденного расписания приемов), что позволяет досконально разобраться в проблемах
пациента, осмотреть его, ответить
на вопросы и вынести правильный
вердикт по лечению. Это сближает врача и пациента, что позволяет
вдумчиво и более качественно вести
курс лечения в дальнейшем.
В госучреждении, сколько бы врач
не принял пациентов сверх нормы,
никто этого не учитывает как серьезную дополнительную нагрузку. В лучшем случае, добавят 0,25%
ставки. Тут особенно можно выделить онкоурологов, специалистов
по опухолям головы и шеи. Такая
ситуация нередко приводит к эмоциональному выгоранию.

В частных же медучреждениях и
оклады сотрудников выше, и им
идет процент от общей выручки (10-
25% от оклада). Также у них очень
развита сервисная часть работы с
пациентом: позвонят или напишут
СМС с назначенным временем,
адресом, инструкциями подготовки
и т.д., приглашая на прием, потом
еще раз напомнят. Внутри клиники
также обеспечат маршрутизацию,
прикрепив менеджера по сопровождению.
Предлагаю и в госучреждениях продумать систему, как уже сделано в
Москве, когда так называемые социальные медиаторы (не обязательно
имеющие высшее образование) сопровождают пациента от регистратуры до кабинета, помогают с любыми немедицинскими вопросами.
Это могут быть люди, которые за
небольшие деньги готовы работать,
а не сидеть дома. Естественно, это
нагрузка на онкодиспансеры, но несущественная.
Р.А. Зуков:
– У нас есть операторы (не медики),
которые помогают разгрузить онкологов, заполняя различные формы
документов (у врачей на это уходит по несколько часов в день). Это
можно назвать «побочным эффектом» внедрения информатизации.
Но для такой технической работы
не обязательно отвлекаться врачу.
Кроме того, есть волонтеры. Они помогают нам в отношении уязвимых
и маломобильных категорий пациентов. Главное, подготовить людей к
такому виду деятельности. В нашем
медуниверситете даже есть специальная программа обучения.
М.В. Бурмистров:
– Для российских врачей, как и для
любого другого человека, на мой
взгляд, ключевыми составляющими
мотивации являются финансовая,
социальное признание (награды,
стимулирующие благодарности руководства), то есть, в первую очередь, не кнут, а пряник, и идейная
мотивация, когда человек готов
работать бесплатно ради высокой
идеи.
Подводя итоги дискуссии, участники согласились со следующими выводами:
• для врачей важна сопричастность к коллективу, к клинике;
• важно, когда у коллектива есть руководитель-лидер, на которого хочется равняться, который способен вести учреждение по пути развития, заботясь о каждом члене коллектива;
• врач должен понимать, что он часть коллектива, и его вклад важен для развития клиники, ее статуса и имиджа коллектива в целом, то есть он сам должен соответствовать учреждению, в котором работает, иначе не будет ни личностного роста, ни самоуважения, как специалиста;
• врач должен быть уверен, что он защищен в нынешних условиях, в том числе юридически, когда снимается стресс от постоянного ощущения вины из-за большого числа жалоб;
• необходимо снижать объем рутинной административной работы врача;
• очень высоко значение нематериальной мотивации.
Материал подготовил С. Сидоров
(пресс-секретарь RUSSCO)
ПОДДЕРЖАНИЕ ЗДОРОВОГО ОБРАЗА ЖИЗНИ ДВУКРАТНО СНИЖАЕТ РИСК СМЕРТИ БОЛЬНЫХ ОПЕРАБЕЛЬНЫМ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ
Автор: С.А.Тюляндин
Председатель Российского общества клинической онкологии,
профессор, доктор медицинских наук, Москва
Много лет занимаясь лечением
больных злокачественными опухолями вообще и раком молочной
железы в частности, знаешь, как
трудно дается даже один процент
снижения смертности от этого заболевания. Многие противоопухолевые препараты, рекомендованные для лечения больных раком
молочной железы, чья разработка
стоила сотни миллионов-миллиардов долларов, демонстрируют снижение относительного риска смертности на 20-25%, что в абсолютных
цифрах 5-летней общей выживаемости дает выигрыш не более 4-5%.
Тем удивительнее данные наблюдательного исследования DELCaP,
демонстрирующие двукратное снижение смертности при соблюдении
здорового образа жизни больных
после проведенного лечения операбельного рака молочной железы.
Рисунок 1.
Кривые безрецидивной (A) и общей (B) выживаемости больных
в зависимости от величины индекса ИЗО (низкий, промежуточный, высокий).
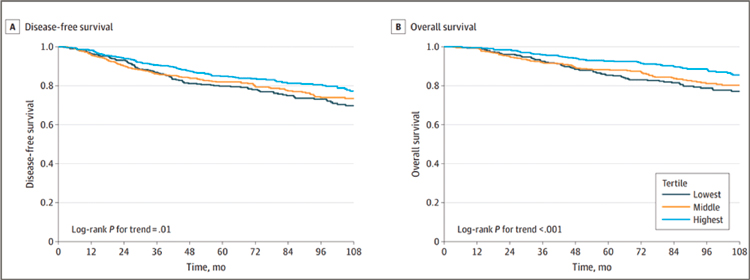
Многие национальные противораковые общества и ВОЗ публикуют
рекомендации соблюдения здорового образа жизни для профилактики злокачественных опухолей.
Они в обязательном порядке включают следующие рекомендации:
1. поддержание здорового веса в зависимости от возраста;
2. сохранение физической активности;
3. включение в рацион питания овощей и фруктов, цельнозерновых продуктов;
4. ограничение потребления красного и обработанного мяса и продуктов быстрого питания (fast food);
5. ограничение сахаросодержащих напитков;
6. избегать употребление спиртных напитков;
7. отказ от курения.
Известно, что некоторые рекомендации из вышеперечисленного
списка оказывают положительное
влияние на прогноз больных раком
молочной железы. В частности, физическая активность (занятие йогой), поддержание здорового веса
снижают риск прогрессирования
этой опухоли. Однако неизвестно
влияние всех рекомендаций по здоровому образу жизни в комплексе
на прогноз и течение рака молочной
железы.
Для оценки такого влияния авторы разработали комбинированный
индекс здорового образа (ИЗО)
жизни. Выполнение каждой из вышеперечисленных рекомендаций
дает 1 балл, частичное выполнение
– 0,5 балла, отказ от выполнения –
0 баллов. Таким образом, каждый оцененный пациент мог иметь индекс от 0 при полном несоблюдении
всех рекомендаций до максимальных 7 баллов при полном выполнении всех перечисленных. Задачей
было оценить влияние ИЗО в целом
и каждой рекомендации в отдельности на риск прогрессирования и
смертности у больных операбельным раком молочной железы. Для
этого в исследование DELCaP были
включены больные I-III стадиями
рака молочной железы, получавшие
лечение после операции в рамках
исследования S021 по изучению
адъювантного одновременного или
последовательного назначения доксорубицина, циклофосфана и паклитаксела. Все больные заполняли
подробный опросник касательно
возраста, социально-экономического статуса и здорового образа жизни до лечения, после его окончания,
через 1 и 2 года после включения в
исследование. Каждый опросник
был оценен для определения ИЗО,
средняя величина четырех ИЗО
давала итоговое значение ИЗО для
оценки соблюдения здорового образа жизни в течение 2 лет для каждого больного. В зависимости от полученной величины ИЗО больные
делились на группы низкого (≤3),
промежуточного (3,5-4) и высокого
(4,5-7) индекса. Конечными точками
исследования были безрецидивная
и общая выживаемость.
В исследование были включены
1340 больных средним возрастом
51 год, из которых 52% находились в
менопаузе. За среднее время наблюдения (7,7 года) зарегистрировано
310 (23,1%) случаев прогрессирования и 227 (16,6%) смертельных исходов. При однофакторном анализе было обнаружено, что наряду с
менопаузальным статусом, числом
позитивных лимфоузлов, наличием
рецепторов стероидных гормонов
и фенотипом опухоли, ИЗО достоверно влияет на риск прогрессирования и смерти. При высоком ИЗО
в сравнении с низким отмечается
достоверное снижение риска прогрессирования на 37% (HR=0,63;
p<0,001) и смерти на 58% (HR=0,42;
p<0,001). Не отмечено достоверной
разницы в выживаемости у больных с промежуточным ИЗО в сравнении с низким или высоким. Однако больные с промежуточным и
высоким ИЗО вместе взятые имеют
достоверное снижение риска смерти
на 30%. Было показано, что каждый
из перечисленных факторов (отказ
от курения, физическая активность,
включение в рацион достаточного
количества овощей и фруктов и отказ от сахаросодержащих напитков)
был ассоциирован с достоверным
снижением риска прогрессирования и смерти. Не зафиксировано достоверного влияния употребления
алкоголя, красного мяса и fast-food,
индекса веса тела, взятого каждого
в отдельности, на отдаленные результаты. В качестве критического
замечания следует отметить использование авторами показателя общей
выживаемости. Было бы интересно
узнать, какое влияние поддержание
здорового образа жизни оказывает
на специфическую выживаемость,
очищенную от летальных исходов
по другим причинам.
Авторы делают вывод, что больные
операбельным раком молочной
железы придерживающиеся рекомендации здорового образа жизни,
демонстрируют лучшие отдаленные
результаты. Поддержание здорового
образа жизни является эффективной интервенцией, не уступающей
по результативности адъювантной
системной терапии. Лечащие доктора должны донести данную информацию до своих пациентов и,
по возможности, контролировать
ее выполнение так, как мы контролируем выполнение адъювантной
терапии.
Источник:
Cannioto RA, Attwood KM, Davis EW.
Adherence to cancer prevention lifestyle
recommendations before, during, and
2 years after treatment for high-risk
breast cancer. JAMA Network Open.
2023; 6(5): e2311673. doi:10.1001/
jamanetworkopen.2023.11673.
ПЕРВЫЙ МОЛОДЕЖНЫЙ ОНКОЛОГИЧЕСКИЙ САММИТ СОСТОЯЛСЯ В МОСКВЕ
Молодежный комитет
RUSSCOjr Российского общества клинической онкологии 23
июня провел Первый молодежный онкологический саммит.
Открыл его председатель Комитета молодых онкологов
RUSSCO, член Правления
RUSSCO, старший научный сотрудник онкологического отделения лекарственных методов
лечения (химиотерапевтическое) №4 ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава
России, к.м.н. Алексей Александрович Румянцев, который не только
представил присутствующим молодежный Комитет RUSSCO, но и
рассказал о планах его работы, в том
числе о школах молодых ученых,
Телеграм-канале RUSSCOjr и др.

Первым на саммите выступил Михаил Юрьевич Федянин, член Правления RUSSCO, руководитель химиотерапевтической службы ГБУЗ «ММКЦ «Коммунарка» ДЗМ», научный консультант ФГБУ «Национальный медико-хирургический Центр им. Н.И. Пирогова» Министерства здравоохранения РФ, д.м.н. Рассказав об общей финансовой ситуации в онкологии (а это – важнейший вопрос для онкологов всего мира), он довел до слушателей результаты различных научных анализов соотношений экономических затрат на лечение одного пациента и экономической эффективности результатов такого лечения, основанных на зарубежных и отечественных материалах.

Резюмируя выступление, М.Ю. Федянин, в частности, сказал: «Настало время и у нас вводить критерии эффективности и стоимости лечения в клинические рекомендации». Кроме того, во время работы саммита молодые ученые смогли получить ответы и на другие острые и актуальные вопросы, например:
• Есть ли порог у готовности платить за инновации?
• Как найти исследования, поддерживающие принятие правильных решений?
• Клинические рекомендации и
офф-лейбл. Что вперед?
В конце саммита состоялась
живая дискуссия с аудиторией,
в которой эксперты RUSSCO
обсудили различные сферы онкологической науки и практики
– от образования до взаимоотношений в коллективах, от принятия решений до оплаты труда
врача и баланса личной жизни и
работы.
НОВОСТИ ASCO 2023 / САРКОМЫ
Проспективное исследование ISGSTS-1001 по оценке эффективности гистотип-специфичной неоадъювантной химиотерапии высокозлокачественных мягкотканных сарком до сих пор приносит свои плоды и новую пищу для размышлений. Логичным было продолжить набор и воспользоваться имеющимися данными для ответа на новые вопросы. В этот раз авторы исследования поставили себе задачу проспективно охарактеризовать гистологический ответ (лечебный патоморфоз) после неоадъювантной химиотерапии и исследовать его взаимосвязь с исходом заболевания.
В работу были включены те пациенты, которым в исследовании ISGSTS-1001 была проведена оценка
гистологического ответа опухоли
в послеоперационном материале.
Учитывались следующие морфологические изменения после лечения:
остаточные окрашиваемые опухолевые клетки, некроз, кровоизлияние,
склероз, склерогиалиноз и фиброгистиоцитарная реакция с гемосидерином. Патоморфологи в каждом
исследовательском центре проанализировали и оценили каждое из
этих изменений во всех представленных образцах (рис.1). Первичной
конечной точкой была безрецидивная выживаемость (БРВ).
Рисунок 1.
Оценка гистопатологических изменений
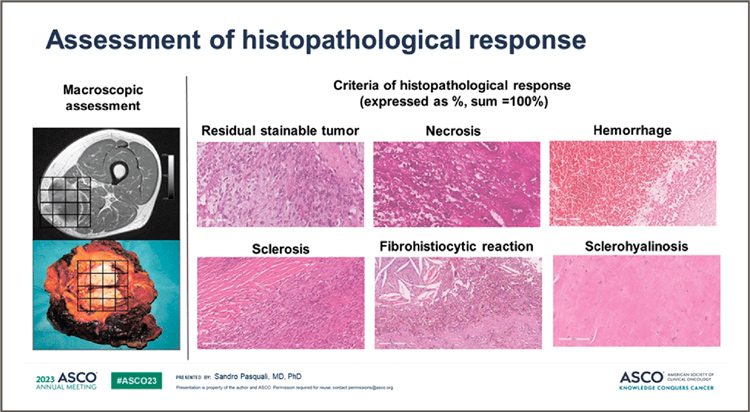
Гистологический ответ оценили
у 201 из 287 рандомизированных
пациентов (у 47 было выполнено
повторное иссечение, у 7 не было
хирургического вмешательства и
у 32 опухоль не подлежала оценке
после широкого иссечения). Время
наблюдения в среднем составило
89 месяцев (IQR: 75-102 месяца).
Исследование показало, что наличие (0,1%) окрашиваемых опухолевых клеток (N=194, 96%) не было
связано с БРВ (HR=1,47; 95% ДИ
0,36-5,98; P=0,591). Наличие (≥1%)
некроза (N=169; 84%) ассоциировалось с более короткой безрецидивной выживаемостью (HR=3,11;
95% ДИ 1,36-7,14; P=0,007). А наличие склерогиалиноза >0,20% (N=42,
21%) было связано с более низким
риском рецидива (HR=0,51; 95%
ДИ 0,28-0,94; P=0,031) (рис.2).
Рисунок 2.
Безрецидивная выживаемость в зависимости
от наличия некроза или склерогиалиноза
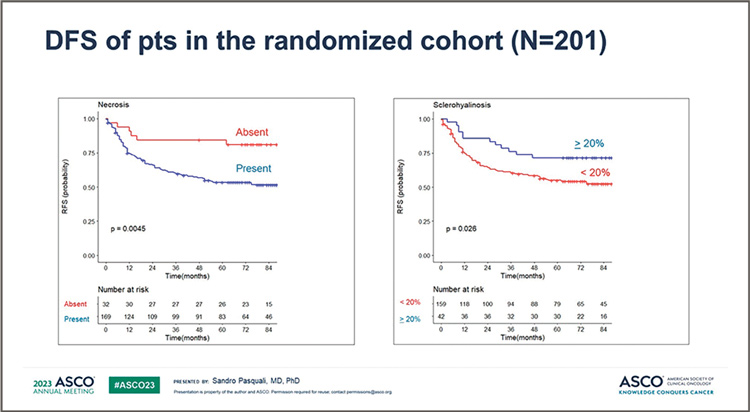
Эти результаты подтвердились, когда
были исключены пациенты, которым проводилась предоперационная
лучевая терапия (N=32). У пациентов, рандомизированных в группу с
неоадъювантной химиотерапией на
основе антрациклина и ифосфамида
(N=98), склерогиалиноз >20% (N=24,
24,5%) сохранил связь с более низким риском рецидива (HR=0,24; 95%
ДИ 0,09-0,67; P=0,007) (рис.3).
Рисунок 3.
БРВ в когорте больных, получавших неоадъювантную ХТ
с антрациклинами и ифосфамидом
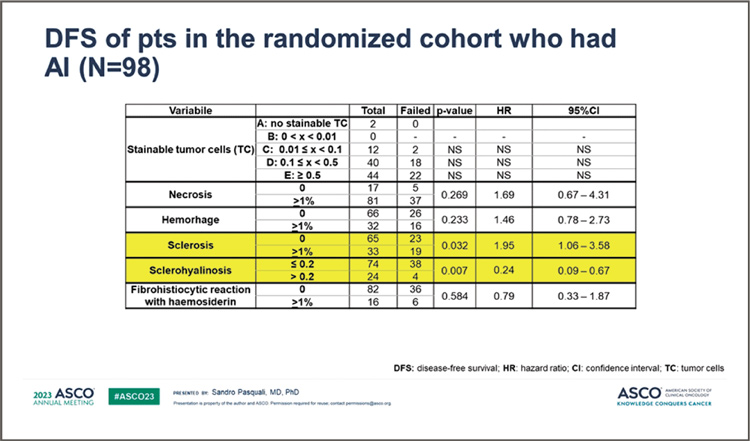
Это первое исследование, в котором проспективно оценили гистологический ответ высокозлокачественной мягкотканной саркомы
после неоадъювантной ХТ. Предыдущие классификации гистологического ответа при мягкотканых
саркомах основаны на консенсусе
экспертов и имеют ограниченную
прогностическую значимость, в
отличие, например, от остеосаркомы или саркомы Юинга. В этом
исследовании остаточные окрашиваемые опухолевые клетки,
которые считаются наиболее значимыми изменениями после лечения, не стратифицируют риск для
пациентов (рис.4), в то время как
склерогиалиноз (>20%) выделяет
пациентов с лучшим результатом
после неоадъювантной ХТ. Является ли взаимосвязь склерогиалиноза с БРВ опухоль-ассоциированной
(т.е. как положительный прогностический фактор) или вызванной
лечением (т.е. как биомаркер ответа), остается выяснить в будущих
исследованиях.
Рисунок 4.
Наличие остаточных опухолевых клеток не коррелирует с результатами лечения ни в одной из подгрупп
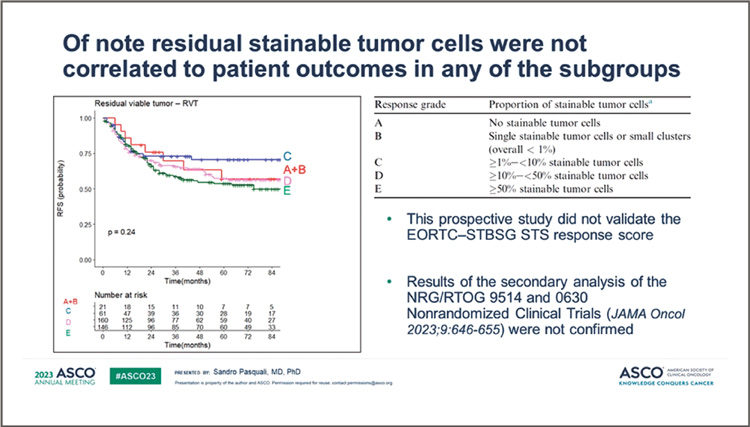
Источник:
Sandro Pasquali, et al.
Histopathological response (HR) after
neoadjuvant chemotherapy (ChT) for
high-risk soft tissue sarcomas (STS): A
planned analysis of the ISG-STS-1001
trial. 2023 ASCO Annual Meeting.
Abstract 11511.
НОВОСТИ ASCO 2023 / САРКОМЫ
Десмоидный фиброматоз (ДФ)
часто возникает во время беременности или после родов. Руководство по планированию новой
беременности во время активного наблюдения или после резекции DF было ограничено в плане
рекомендаций. Авторы международного ретроспективного наблюдательного исследования поставили себе задачу оценить риск
прогрессирования в перинатальном периоде [1].
В период с 2000 по 2020 гг. были
опрошены женщины детородного возраста с диагнозом ДФ,
вопросы были посвящены беременности (NCT05284305). Были
оценены те случаи, когда диагноз
был установлен во время беременности или после. Первичной
конечной точкой было прогрессирование/рецидив ДФ в течение
1 года после родов. Вторичными
конечными точками были спонтанная регрессия, начало активного лечения и акушерские риски
(рис.1).
Рисунок 1.
Влияние беременности у женщин с ДФ

Из 483 опрошенных пациенток
120 (24,8%) отложили беременность, 32 (6,6%) прервали и/или
232 (48%) избежали беременности
(в 93,3%, 50% и 72,9% случаев изза ДФ) соответственно. 147 беременностей у 131 пациентки наступили одновременно с диагнозом
или после него: 26 (17,7%, группа
А) одновременно с диагнозом, 48
(32,7%, группа В) после удаления
ДФ и 73 (49,7%, группа С) с ДФ
остались под наблюдением. Расчетная вероятность прогрессирования составила 12,0% (95% ДИ
2,0-48,4) во время беременности
и 15,8% (5,6-37,5) в послеродовом
периоде; для беременностей после установления диагноза (группы В и С) эти показатели составили 5,1% (0,4-40,0) и 9,0% (1,8-35,0).
При многофакторном анализе
возраст на момент беременности и размер первичной опухоли
были значимыми факторами риска прогрессирования. Расчетная
вероятность спонтанной регрессии составила 3,6% (95% ДИ 0,2-
40,7) во время беременности и
7,1% (95% ДИ 0,3-67,2) в послеродовом периоде. Также 18,4% (7/38)
спонтанно регрессировали после
прогрессирования заболевания,
спровоцированного беременностью, 17,4% (4/23) – в группах В и
С. Лечение по поводу прогрессирования заболевания потребовалось у 11,4% (9/79) в послеродовом
периоде и у 6,3% (4/63) в группах
В и С. Акушерские осложнения
были сопоставимы с популяционными данными в развитых
странах.
Авторы исследования приходят к
выводу, что после постановки диагноза ДФ беременность считается безопасной с риском прогрессирования заболевания 5% во
время беременности и 9% после
родов. Лечение требуется только в 6%. Спонтанная регрессия
встречается реже, но происходит даже после первоначального
прогрессирования. На решение
пациентов о деторождении, повидимому, повлиял их диагноз
ДФ. Это исследование подтверждает рекомендации о том, что
варианты фертильности должны
быть обсуждены совместно с экспертами, обладающими опытом
ведения пациентов с ДФ.
Рисунок 2.
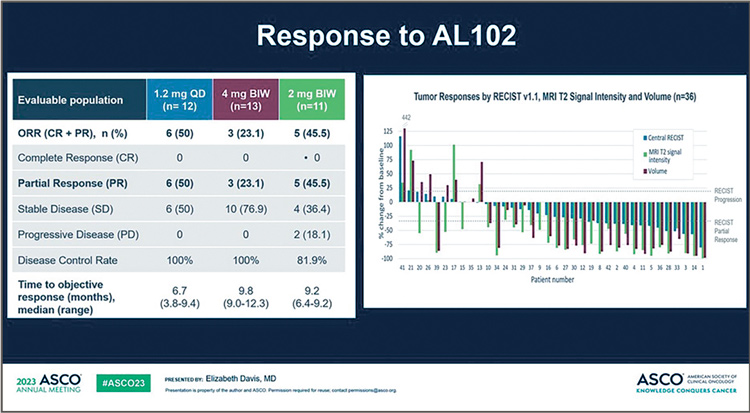
Ответ на AL102
Ингибиторы гамма-секретазы
(GSI) продемонстрировали противоопухолевую активность в
отношении ДФ. AL102 является
сильнодействующим перорально доступным селективным GSI,
который исследуется для лечения
ДФ. RINGSIDE (AL-DES-01) – это
исследование II/III фазы для пациентов с прогрессирующим ДФ
[2]. В открытом исследовании II
фазы (часть A) взрослые с прогрессирующей ДФ (одномерный
рост ≥10% в течение 18 месяцев
или боль, ассоциированная с ДФ
и требующая неопиоидных препаратов) были рандомизированы для трех режимов дозирования: 1,2 мг один раз в день, 2 мг
прерывисто два раза в неделю (2
дня через 5 дней перерыва) или
4 мг прерывисто два раза в неделю. Пациенты, завершившие
II фазу исследования, переходят
на открытое расширенное исследование (OLE). Третья фаза
RINGSIDE (часть B) представляет
собой двойное слепое плацебоконтролируемое исследование, в
котором оценивается выбранный
режим дозирования из II фазы
(1,2 мг один раз в день), где выживаемость без прогрессирования
(ВБП) является первичной конечной точкой. Во второй день ASCO
были представлены обновленные
результаты эффективности и безопасности II фазы RINGSIDE.
Включение всех 42 пациентов во II фазу было завершено по состоянию на март 2022 г. По состоянию на 3 января 2023 г. медиана времени в исследовании составляла 10,5 месяца (диапазон 0,8- 14,7), и 30 пациентов (71,4%) все еще находились в исследовании, из них 10 (23,8%) перешли на стадию OLE исследования. Средний возраст составил 39,9 года, 73,8% были женщинами, а 69% ранее получали лекарственную терапию по поводу ДФ. Лучшим ответом в поддающейся оценке популяции был частичный ответ у 6/12 пациентов (50%) для 1,2 мг, у 3/13 пациентов (23,1%) для 4 мг и у 5/11 пациентов (45,5%) для 2 мг. Уровень контроля заболевания составил 100%, 91% и 97% в данных группах соответственно. Постоянный паттерн более глубокого, более быстрого и устойчивого ответа наблюдалась при дозе 1,2 мг. Среднее изменение объема по сравнению с исходным уровнем составило -51,9% для 1,2 мг, -9,5% для 4 мг и -15,2% для 2 мг на 16 неделе исследования; -76,4%, -35,5% и -51,2% соответственно на 28 неделе. Аналогичные закономерности наблюдались для процентных изменений интенсивности сигнала Т2 по сравнению с исходным уровнем, что свидетельствует о снижении клеточности опухоли. В соответствии с механизмом действия GSI пятью наиболее частыми нежелательными явлениями, возникающими во время лечения 1-2 степени, были диарея, тошнота, утомляемость, алопеция и сухость кожи. Осложнения 3 степени, связанные с приемом препарата, были зарегистрированы у 26,2% пациентов при всех испытанных дозах. По оценке исследователей, осложнения 4-й или 5-й степени тяжести, связанные с AL102, не наблюдались.
В этом исследовании II фазы
профиль безопасности AL102
соответствовал классу препаратов GSI. Опухолевый ответ,
уменьшение объема и снижение
Т2-сигнала наблюдались ранее
в группе, принимавшей 1,2 мг, с
более глубоким и сохраняющимся ответом на лечение. Эта доза
была выбрана для исследования
III фазы RINGSIDE, которое в настоящее время стартует во многих странах.
Представлены первые результаты применения ипилимумаба
и ниволумаба в когорте с ДФ в
исследовании SWOG S1609 по
двойной блокаде анти-CTLA-4 и
анти-PD-1 при редких опухолях
(DART). DART – это проспективное открытое многоцентровое/
многокогортное исследование II
фазы комбинации ипилимумаба (1 мг/кг внутривенно каждые
6 недель) и ниволумаба (240 мг
внутривенно каждые 2 недели).
Первичная конечная точка включает частоту объективных ответов (ЧОО), а вторичные конечные
точки включают выживаемость
без прогрессирования (ВБП),
общую выживаемость (ОВ), стабилизацию заболевания (СЗ) >6
месяцев и токсичность [3].
Были проанализированы шестнадцать поддающихся оценке пациентов (средний возраст 37 лет)
с десмоидными опухолями. Расположение опухолей: 8 – брюшная полость; 3 – нижняя конечность: 2 – верхняя конечность; 2
– таз и 1 в области шеи. ЧОО составила 18,8% у 3 пациентов, достигших частичного ответа: 40%
регрессии с продолжающейся продолжительностью ответа более 30 месяцев; 83% регресс (ВБП
16 месяцев) и 71% регресс (ВБП 8,4
месяца). Следует отметить, что у
3 пациентов была стабилизация
заболевания (3/16, 18,8%) с некоторым уменьшением размеров
опухоли и стойким ответом; 23%
регрессия с ВБП 1820+ дней; 6%
регрессия с ВБП 902 дня; 1% регрессия с ВБП 1147+ дней. Общий
показатель клинической пользы
(отсутствие прогрессирования
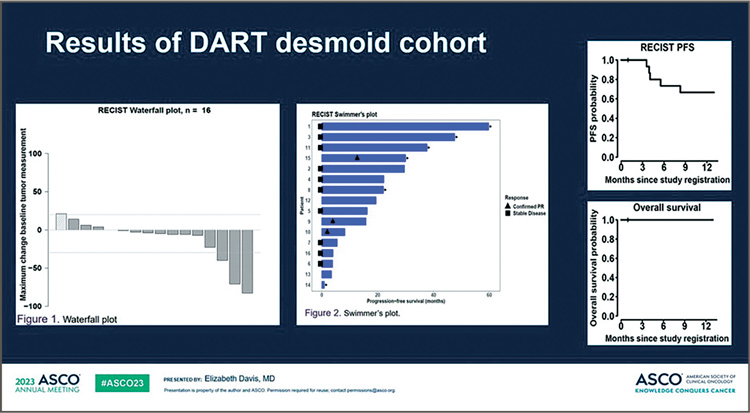
>6 месяцев) составил 62,5%. Медиана ВБП составила 17,9 месяца,
6-месячная ВБП – 69%, 1-летняя
ВБП – 62% (рис.3). Все пациенты
были живы через 1 год; медиана
ОВ не подлежала оценке. Наиболее частыми нежелательными
явлениями были утомляемость
(43,8%, n=7), тошнота (37,5%,
n=6), гипотиреоз (31,3%, n=5), диарея, гипертиреоз, головная боль
и надпочечниковая недостаточность (25%, n=4 каждый). Было
8 случаев (50%) нежелательных
явлений 3-4 степени, 7 случаев
нежелательных явлений привели
к прекращению лечения. Нежелательных явлений 5 степени не
зафиксировано.
Ипилимумаб плюс ниволумаб
при лечении десмоидных опухолей привели к ЧОО 18,8% и общим показателем клинической
пользы 62,5% с наблюдаемыми
стойкими ответами. Это первое
проспективное исследование, демонстрирующее эффективность
данной комбинации при десмоидном фиброматозе.
Рисунок 3.
Результаты исследования DART, когорта больных
с ДФ
Представлено пилотное исследование по оценке эффективности
ленватиниба и пембролизумаба при некоторых типах сарком
[4]. Пациенты, у которых был по
крайней мере один предшествующий режим лекарственного
лечения, но ≤3, были включены в одну из пяти когорт (по 10
в каждой): A – лейомиосаркома
(LMS), B – недифференцированная плеоморфная саркома (UPS),
C – ангиосаркома и эпителиоидная гемангиоэндотелиома (EHE),
D – синовиальная саркома (SS) и
злокачественная опухоль из оболочки периферических нервов
(MPNST) и E – остеосаркома (OS)
и хондросаркома (CS). Пациенты
получали начальную 2-недельную стартовую дозу ленватиниба 20 мг перорально ежедневно.
Впоследствии пембролизумаб
вводили по 200 мг внутривенно
каждые 21 день. Первичной конечной точкой для каждой когорты была наилучшая частота
объективных ответов (ЧОО), зарегистрированная к 27 неделе.
Комбинацию считали заслуживающей дальнейшего изучения,
если в когорте наблюдались 2 или
более ответов. Вторичные конечные точки включали ВБП, ОВ,
продолжительность ответа и безопасность комбинации.
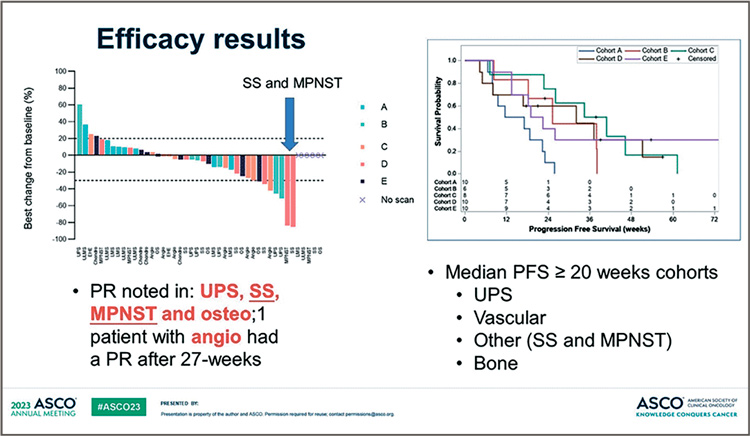
Рисунок 4.
Результаты исследования [4]
По состоянию на 31 января 2023
г. когорты A, D и E завершили набор. Лучшим ответом в когорте
LMS была стабилизация заболевания. В когорте D зафиксировано 3 частичных ответа: 2 при SS
и 1 при радиоиндуцированной
MPNST. В когорте Е у одного из
6 пациентов с ОС наблюдался частичный ответ. На сегодняшний
день из 6 пациентов с ангиосаркомой отмечен 1 случай частичного ответа (с первичным поражением надпочечников), которое
произошло после заранее установленного 27-недельного периода времени. У одного из 5 поддающихся оценке пациентов в
когорте B также отмечен частичный ответ. Среди 44 пациентов
наиболее частыми НЯ были артериальная гипертензия (56,8%),
диарея (45,5%), протеинурия
(45,5%), утомляемость (40,9%),
головная боль (36,4%) и тошнота
(36,4%). Наиболее частыми НЯ ≥3
степени были артериальная гипертензия (13,6%), одышка (6,8%),
несердечная боль в груди (6,8%),
обмороки (6,8%).
Таким образом, в данном пилотном исследовании активный ответ был отмечен среди пациентов
с остеосаркомой, злокачественной опухолью из оболочки периферических нервов, ангиосаркомой и синовиальной саркомой. В
когорте лейомиосаркомы ответов
не зафиксировано, а ВБП была
низкой. Набор в когорты B и C
продолжается.
В продолжающемся открытом
одноцентровом исследовании по
оценке эффективности комбинации ретифанлимаба с гемцитабином + доцетакселом у пациентов
с неоперабельной или метастатической саркомой мягких тканей
высокой степени злокачественности и ранее не получавшим
лечения была достигнута многообещающая медиана ВБП (по
сравнению с историческим контролем) [5].
Рисунок 5,6.
Клиническая активность комбинации при разных
типах сарком и данные по эффективности лечения в зависимости от гистологического подтипа [5]
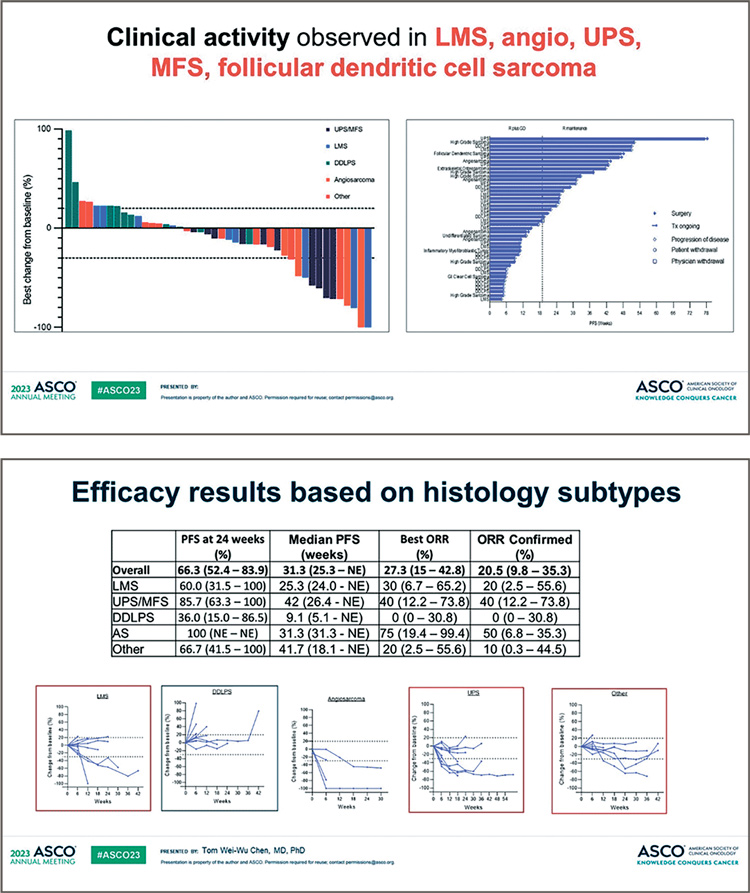
Ретифанлимаб в дозе 375 мг добавляли к схеме гемцитабин +
доцетаксел в 1-й день, начиная
со 2-го цикла, и продолжали в
качестве «поддерживающей»
монотерапии после завершения
6 циклов ХТ (рис.5,6). Первичной конечной точкой является
ВБП через 24 недели. По состоянию на 11 января 2023 г. было
зарегистрировано 43 пациента,
получавших данную комбинацию. Были набраны когорты с
лейомиосаркомой (LMS), недифференцированной плеоморфной
саркомой (UPS), миксофибросаркомой (MFS), дедифференцированной липосаркомой (DDLPS) и
другими подтипами. Из 41 поддающегося оценке пациента наилучший общий ответ составил
22% (95% ДИ 11-38). Ответы наблюдались при недифференцированной плеоморфной саркоме/
миксофибросаркоме (n=4), лейомиосаркоме (2), ангиосаркоме
(2) и фолликулярной дендритноклеточной саркоме (1). Медиана
ВБП составила 32,7 недели (95%
ДИ 26,4 – NE), а медиана продолжительности ответа – 24 недели
(95% ДИ 15 – NE). У восемнадцати (42%) пациентов наблюдалось
по крайней мере одно нежелательное явление 3 или 4 степени,
связанное с лечением. Наиболее
распространенными (>5%) были
анемия (16%), нейтропения (9%),
фебрильная нейтропения (7%),
инфекция легких (7%) и лейкопения (7%). У семи пациентов (16%)
был пневмонит. Шесть пациентов
(14%) прекратили лечение из-за
токсичности, в том числе пять с
пневмонитом.
Анализ первичной конечной точки в данном исследовании еще
предстоит сделать. Что касается
безопасности, то по сравнению
с гемцитабином + доцетакселом в данном случае отмечалась более
высокая частота пневмонита.
Доклинические модели показали,
что трабектедин может достигать
сывороточных концентраций, достаточно высоких для подавления
доминирующего онкогена саркомы
Юинга (т.е. фактора транскрипции
EWS::FLI1), и что этот эффект сохраняется при последующем введении низких доз иринотекана. В
нижеупомянутом многоцентровом
исследовании [6] трабектедин вводили в виде 1-часовой инфузии в
1-й день и низкую дозу иринотекана внутривенно на 2-й и 4-й день,
интервал цикла составил 21 день.
Дозолимитирующую токсичность
оценивали в первом цикле. Первичными задачами было определить
рекомендуемую дозу и безопасность комбинации.
С января 2021 г. по декабрь 2022 г.
в 5 центрах было набрано 20 пациентов со средним возрастом 18 лет
(диапазон 10-59 лет). Пациенты получали в среднем 4 (диапазон 2-9)
предшествующих линий терапии,
включая иринотекан у 60% пациентов. Нежелательные явления,
возникшие в результате лечения
3-4 степени, которые наблюдались
у ≥10% пациентов, включали: повышение активности АЛТ/АСТ,
повышение уровня креатининфосфокиназы, фебрильную нейтропению, анемию, лимфопению,
нейтропению и тромбоцитопению.
Было 2 случая респираторных НЯ 5
степени тяжести. Рекомендованная
доза составила 1,0 мг/м2 для трабектедина и 25 мг/м2 для иринотекана.
При этом при данной и выше дозах
препаратов наблюдались 4 случая
частичного ответа, 6 случаев стабилизации заболевания среди 14
поддающихся оценке пациентов.
Учитывая клиническую пользу, наблюдаемую при данной комбинации, авторы планируют расширить
возраст включения пациентов во
вторую часть II фазы исследования
(рис.7).
Рисунок 7.
Результаты исследования [6]
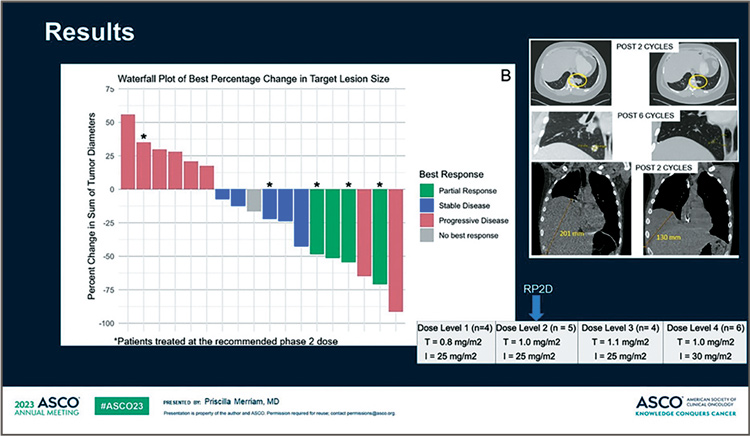
Селинексор (KPT-330) (S), низкомолекулярный ингибитор медиатора
ядерного экспорта экспортина-1
(XPO-1), способен снижать экспрессию мРНК и белка продуктов
гена репарации повреждений ДНК,
проявляя в доклинических экспериментах синергизм с агентами повреждения ДНК, такими как гемцитабин.
В связи с этим в исследование I/
II фазы [7] были набраны взрослые пациенты с прогрессирующей
СМТ, у которых в анамнезе было до
2 предшествующих линий терапии
и подтвержденный диагноз недифференцированной плеоморфной
саркомы (UPS), лейомиосаркомы
(LMS), альвеолярной саркомы мягких тканей (ASPS), или остеосаркома (ОС).
Селинексор (1, 8 и 15 дни) и гемцитабин (1 и 8 дни) вводили в четырех дозах:
• L1: 60 мг + 1000 мг/м2, 30 мин.;
• L2: 60 мг + 1000 мг/м2 (10 мг/м2/ мин.);
• L3: 60 мг + 1200 мг/м2 (10 мг/м2/ мин.);
• L4: 80 мг + 1200 мг/м2 (10 мг/м2/
мин.).
Классический дизайн 3+3 использовался для определения рекомендуемой дозы II фазы на основе
дозолимитирующей токсичности,
наблюдаемой в течение первого
21-дневного цикла. Исследования
in vitro проводились на клеточных
линиях лейомисаркомы и остеосаркомы для проверки синергизма
комбинации.
Рисунок 8.
Данные исследования по применению KPT-330
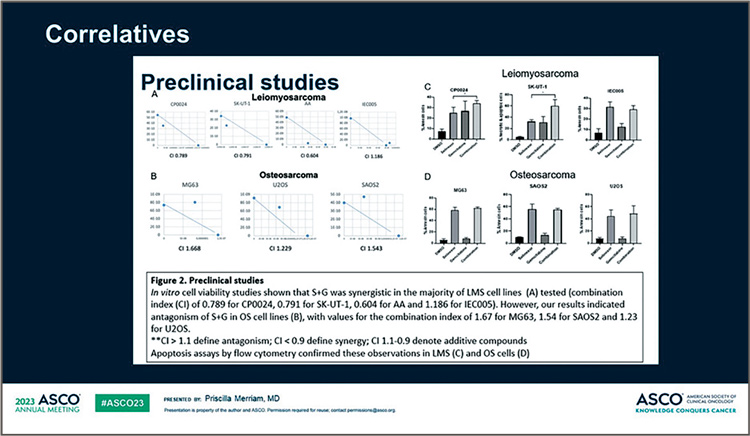
В период с ноября 2020 г. по июнь
2022 г. было набрано 17 пациентов
со средним возрастом 50 лет (22-71
год). Были представлены следующие гистологические типы: 9 случаев лейомиосаркомы (52,9%), 6
остеосарком (35,3%), 1 случай альвеолярной саркомы и 1 синовиальная
саркома (5,9%). Три пациента получали лечение на каждом из первых 3
уровней и 8 пациентов на уровне L4.
Только один случай дозолимитирующей токсичности наблюдался
в L4 (тромбоцитопения 4 степени),
поэтому дозы препаратов на этом
уровне были выбраны как рекомендуемые дозы II фазы. Токсичность
3-4 степени включала нейтропению
(52,9%), тромбоцитопению (41,2%),
фебрильную нейтропению (11,8%),
анемию, тошноту, астению, рвоту,
алопецию и повышение уровня
липазы (по 5,9%). Было зарегистрировано 3 случая частичного ответа,
7 – стабилизации заболевания и 7
– прогрессирование. Медиана ВБП
для лейомиосаркомы составила 7
месяцев (95% ДИ 3-11). Никакой
значимой клинической активности
при остеосаркоме не наблюдалось.
Исследования жизнеспособности
клеток in vitro показали, что данная
комбинация проявляла синергизм
в большинстве протестированных
клеточных линий лейомиосаркомы
(комбинированный индекс 0,789
для CP0024, 0,791 для SK-UT-1, 0,604
для AA и 1,186 для IEC005). Однако
результаты исследования показали
антагонизм в клеточных линиях
остеосаркомы со значениями комбинированного индекса 1,67 для
MG63, 1,54 для SAOS2 и 1,23 для
U2OS. Анализы апоптоза с помощью проточной цитометрии подтвердили эти наблюдения в клетках
лейомиосаркомы и остеосаркомы.
И поэтому в настоящий момент
комбинация селинексора и гемцитабина в рекомендуемой дозе 80 мг
+ G 1200 мг/м2 (10 мг/м2/мин.) требует дальнейшего изучения в фазе
II, особенно в отношении лейомиосаркомы.
Источники:
1. Marco Fiore, et. al. Impact of pregnancy in women with desmoid fibromatosis: An international retrospective observational study. 2023 ASCO Annual Meeting. Abstract 11513.
2. Mrinal M. Gounder, et al. RINGSIDE, phase 2/3 trial of AL102 for treatment of desmoid tumors (DT): Phase 2 results. 2023 ASCO Annual Meeting. Abstract 11515.
3. Young Kwang Chae, et al. A phase II basket trial of dual anti-CTLA-4 and anti-PD-1 blockade in rare tumors (DART) SWOG S1609: The desmoid tumors (cohort 27). 2023 ASCO Annual Meeting. Abstract 11516.
4. Sujana Movva, et al. A pilot study of lenvatinib plus pembrolizumab in patients with advanced sarcoma. 2023 ASCO Annual Meeting. Abstract 11517.
5. Evan Rosenbaum, et al. Interim results of a phase II trial of first line retifanlimab (R) plus gemcitabine and docetaxel (GD) in patients (pts) with advanced soft tissue sarcoma (STS). 2023 ASCO Annual Meeting. Abstract 11518.
6. Patrick Grohar, et al. SARC037: Results of phase I study of trabectedin given as a 1-hour (h) infusion in combination with low dose irinotecan in relapsed/refractory Ewing sarcoma (ES). 2023 ASCO Annual Meeting. Abstract 11519.
7. Javier Martin Broto, et al. SELISARC: A Spanish Sarcoma Group (GEIS) phase I/II trial of selinexor plus gemcitabine in selected sarcoma subtypes – Results of the phase I part. 2023 ASCO Annual Meeting. Abstract 11520.
Материал подготовила:
Тарарыкова
Анастасия Алексеевна
НИИ клинической онкологии
им. акад. РАН и РАМН Н.Н.
Трапезникова ФГБУ «НМИЦ
онкологии им. Н.Н. Блохина»
Минздрава России, Москва
НОВОСТИ ASCO 2023 / КАХЕКСИЯ: ПАТОФИЗИОЛОГИЧЕСКИЙ ПОДХОД
В одной из секций 2 дня конгресса, посвященной раковой кахексии, были представлены результаты исследования ранней фазы I, где рассматривался путь передачи сигналов JAK-STAT как мишень для кахексии [1].
В исследовании применялся препарат руксолитиниб – селективный ингибитор JAK-киназ (JAK1 и JAK2).
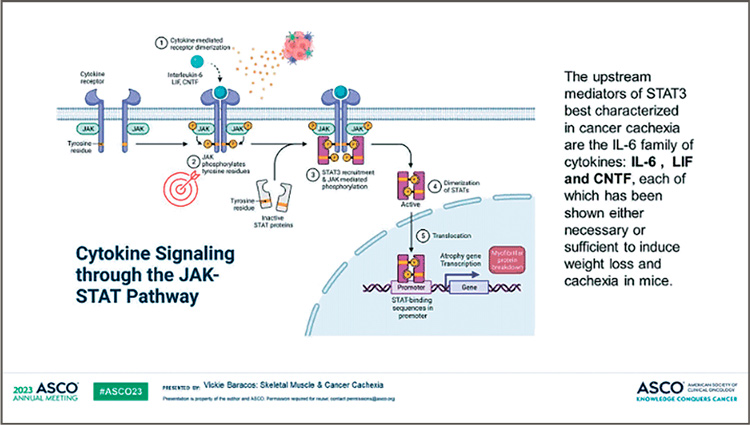
Показания для его применения включали стероидную резистентность при реакции «трансплантат против хозяина», миелофиброз, истинную полицитемию. Активированные JAK-киназы, воздействуя на цитокиновые рецепторы, активируют STAT-белки, которые моделируют экспрессию генов
Медиаторы STAT3 наиболее характерны для раковой кахексии и относятся к семейству Il-6 цитокинов, каждый из них оказался достаточным чтобы вызвать потерю веса и кахексию у мышей (рис.1).
Рисунок 1.
Цитокиновый сигнальный путь
активацией JAK-STAT.
Основные выводы исследования:
• препараты с действием, направленным на мышечную ткань, являются частью терапии кахексии, основанной на механизмах мышечной регуляции анаболизма и катаболизма;
• ключевые аспекты биологии
мышц хоть и понятны, но требуют большей информации.
Актуальность нутритивной поддержки у онкологических пациентов не снижает свою значимость.
На этой сессии ASCO обсуждались вопросы о необходимости
базового скрининга нутритивной
недостаточности у пациентов после постановки диагноза, во время
и после лечения.
Пациенты из группы риска должны быть направлены к диетологу
для углубленной оценки питания.
Необходимо не забывать и про
экономическую составляющую,
обсуждать вопросы внедрения нутритивной поддержки в систему
здравоохранения, проводить клинические исследования, собирать
мультидисциплинарные команды.
В финальном слайде коллеги представили выводы данной сессии:
1. Необходима оптимизация аппетита (препаратами и/или упражнениями) и потребления пищи.
2. Мышечная масса зависит от нутриентов и сигналов к сокращению для анаболизма, роста и клеточной пролиферации.
3. Необходима мультидисциплинарная команда специалистов для поиска мультимодального пути решения проблемы.
4. Крайне желательно участие в
клинических исследованиях по
лечению кахексии.
Источники:
1. Vickie Baracos (Canada). Skeletal muscle and cancer cachexia. Education session «Current Therapeutic Targets in Cancer Cachexia: Pathophysiologic Approach». June 3rd, 2023.
2. Jill Hamilton-Reeves (USA).
Nutrient signaling and multimodality
approaches for cancer cachexia.
Education session «Current
Therapeutic Targets in Cancer
Cachexia: Pathophysiologic
Approach». June 3rd, 2023.
УГОЛОК РАДИОТЕРАПЕВТА / СНОВА ОБ SBRT / ПРЕДОПЕРАЦИОННАЯ СТЕРЕОТАКСИЧЕСКАЯ РАДИОТЕРАПИЯ/РАДИОХИРУРГИЯ НА МЕТАСТАЗЫ В ГОЛОВНОМ МОЗГЕ: ПЕРСПЕКТИВНЫЙ ПОДХОД?..
Любой радиотерапевт, еще будучи доктором в процессе обучения,
осведомлен о ряде преимуществ
предоперационного облучения как
первичных опухолей, так и любых
вторичных очагов, если операция
по удалению стоит в плане лечения,
но по каким-то причинам сразу к
ней не прибегают. Облучать реальную опухоль (а не участок фиброза
или некую полость после операции)
всегда удобнее, как в плане оконтуривания, планирования лучевой
терапии, так и для последующей
оценки ответа ее на неоадъювантное лечение. Опухолевые клетки до
операции лучше оксигенированы, а
значит более радиочувствительны, в
том числе и к традиционным фракциям. Предоперационный курс может привести к уменьшению размеров опухоли вплоть до ее полного
регресса, и это мы нередко наблюдаем в нашей клинической практике.
Без сомнения, нет ничего идеального, любой подход имеет как свои
преимущества, так и недостатки.
Но если в отношении ряда опухолей (рак прямой кишки, пищевода
и др.) предоперационная лучевая
или химиолучевая терапия – это
стандарт, то для опухолей головного
мозга, как первичных, так и метастатических, подобный подход – скорее
эксперимент, поскольку в этих ситуациях приоритет однозначно отдан
хирургии на первом этапе или только стереотаксической радиохирургии/радиотерапии, хотя в литературе присутствуют немногочисленные
данные о возможностях и такого варианта комбинированного лечения.
В июньском номере журнала JAMA
Oncology опубликованы результаты
многоцентрового когортного исследования по применению стереотаксической радиохирургии/радиотерапии на предоперационном этапе
у больных с солидными опухолями
различных локализаций с метастазами в головном мозге. Из нескольких очагов хотя бы один должен был
быть пролечен методом SBRT с последующей запланированной резекцией, при этом радиохирургия на
оставшиеся очаги также была разрешена. Облучение проводилось либо
однократно в дозе 15 Гр, либо в дозе
24 Гр за 3 фракции; резекция выполнялась спустя 1-4 дня (в среднем 2
дня). Первичные конечные точки
включали локальные рецидивы,
распространение по оболочкам, побочные эффекты облучения, общую
выживаемость; мультифакторный
анализ прогностических факторов
был выполнен в соответствии с этими критериями.
В когортное исследование было
включено 404 пациента (из них 214
женщин (53%); средний возраст –
60,6 лет) с 416 резецированными
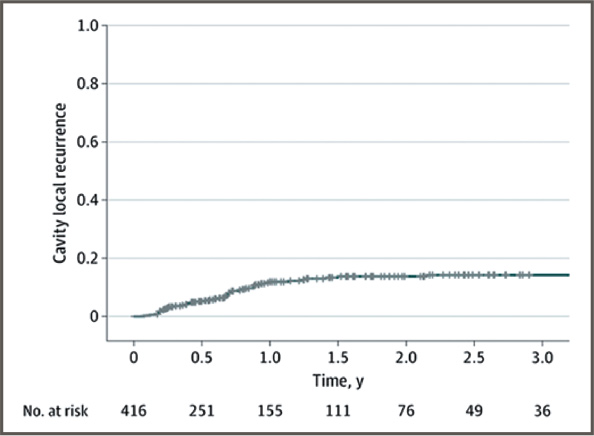
очагами в головном мозге. Частота
локальных рецидивов в ложе удаленной опухоли за 2 года составила
13,7% (рис.1). Это выгодно отличается от ранее опубликованных рядом исследователей показателей локальных рецидивов от 22% до 39%
после послеоперационной однофракционной SRS и приблизительно 25% после послеоперационной
фракционированной SRS. Наличие
других отдаленных метастазов, полнота резекции, фракционирование,
тип хирургии (кускование против
резекции единым блоком) и первичный тип опухоли были связаны
с риском локального рецидива в полости. Опухоли гастроинтестинального тракта рецидивировали в ложе
чаще, чем, к примеру, немелкоклеточный рак легкого (HR 3,0; 95% ДИ
0,95-9,30; P=0,06). Фракционированная предоперационная SRS (то есть
3 фракции) была связана с более
низким риском развития рецидива
в полости по сравнению с одиночной фракцией. Средняя доза при
подведении 3 фракций (СОД 24 Гр)
имела более высокую биологически
эффективную дозу (43,2 Гр) по сравнению с 37,5 Гр для одной фракции
15 Гр. Влияние фракционирования
на предоперационную SRS является областью продолжающихся исследований и будет более подробно
описано в будущих исследованиях.
Рисунок 1.
Частота локальных
рецидивов в ложе
2-летняя частота поражения оболочек мозга составила 5,8%, при этом
полнота резекции, тип первичной
опухоли и расположение в задней
черепной ямке были связаны с повышенным риском. Двухлетняя частота лучевых осложнений любой
степени составила 7,4%, при этом отступ от края более 1 мм и первичная
меланома были связаны с более высоким риском осложнений. Медиана
ОВ составила 17,2 месяца (95% ДИ
14,1-21,3 месяца), при этом наличие
системного процесса, полнота резекции и тип первичной опухоли были
самыми мощными прогностическими факторами, связанными с ОВ.
Послеоперационные осложнения
возникли у 31 из 404 больных (7,7%).
Одиннадцать случаев являли собой
1 или 2 степени осложнений (пневмоцефалия, инфекция, замедленное
заживление ран, внутричерепное
кровоизлияние или гематома). Двадцать событий (5%) были осложнениями 3-5 степени (внутричерепное
кровоизлияние, инсульт, раневая
инфекция/расхождение швов, судороги, ликворная утечка или гидроцефалия). Было 2 случая осложнений 5 степени: послеоперационная
гидроцефалия, которая потребовала
лечения с установкой вентрикулоперитонеального шунта, и послеоперационное внутричерепное кровоизлияние, повлекшее за собой смерть
пациента.
В этом исследовании частота локальных рецидивов в ложе, осложнения облучения и поражение оболочек после предоперационной SRS оказались
весьма низки, что позволила авторам
сделать вывод, что фракционированная стереотаксическая радиотерапия
до операции может быть более предпочтительной в плане снижения риска рецидивов в ложе, но утверждать
это в полной мере можно будет после
получения результатов исследований 3 фазы. Кстати, уже начался набор пациентов в рандомизированное
клиническое исследование фазы 3 по
сравнению предоперационной и послеоперационной SRS (NRG BN012)
(NCT05438212).
Источник:
Prabhu RS, Akinyelu
T, Vaslow ZK, et al. Risk Factors for
Progression and Toxic Effects After
Preoperative Stereotactic Radiosurgery for
Patients With Resected Brain Metastases.
JAMA Oncol. Published online: June 08,
2023. doi:10.1001/jamaoncol.2023.1629.
УГОЛОК РАДИОТЕРАПЕВТА / СНОВА ОБ SBRT / СТЕРЕОТАКСИЧЕСКАЯ РАДИОХИРУРГИЯ ПРОТИВ КОНВЕНЦИОНАЛЬНОЙ ЛУЧЕВОЙ ТЕРАПИИ МЕТАСТАЗОВ В ПОЗВОНОЧНИКЕ: БИТВА НЕ ВЫИГРАНА
Не секрет, что лучевая терапия –
один из наиболее эффективных
методов уменьшения болевого
синдрома при метастазах в костях,
и эффективность его, по данным
разных авторов, составляет 50-75%.
Боль – это основная цель, на которую направлено облучение, и именно по динамике болевого синдрома
в первую очередь оценивается эффект лечения. Объективные ответы
со стороны очагов, предотвращение
патологических переломов и т.д. –
это, как правило, цели вторичные.
К лучевой терапии всегда было
принято прибегать при наличии
болезненных метастазов в костях,
описано и протестировано немало
паллиативных режимов, от единичной фракции до весьма длительных
фракционированных курсов – выбор делает врач-радиотерапевт в
каждой конкретной ситуации. С
относительно недавних пор стереотаксическая радиотерапия или
радиохирургия (СРХ) метастазов в
позвонках или других костях применяется достаточно регулярно,
однако имеет ли метод какие-либо
явные преимущества перед старым
добрым конвенциональным облучением (кЛТ), прежде всего в плане обезболивания, – пока ответа на
этот вопрос нет
Авторы мультицентрового проспективного рандомизированного исследования 3 фазы NRG Oncology’s
RTOG 0631 в очередной раз решили
изучить эту проблему. Пациенты с
предполагаемой продолжительностью жизни свыше 6 месяцев, с метастатическим очагами в позвонках
в количестве не более 3, визуализированными на МРТ, были рандомизированы в соотношении 2:1 на
СРХ в дозе 16-18 Гр однократно с
минимальными отступами от края
очага или на конвенциональное облучение в дозе 8 Гр с захватом 1 позвонка выше и ниже пораженного.
Каждый пациент заполнял опросник с 10-балльной шкалой боли до
начала лечения и был прослежен в
дальнейшем как минимум в течение 3 месяцев (вплоть до 24 мес.),
поскольку первичной конечной
точкой был субъективный ответ на
лечение на отрезке 3 месяца. Если
боль уменьшалась минимум на 3
пункта без увеличения дозы обезболивающих, то это было расценено
как улучшение. Отсутствие эффекта или варьирование в пределах 1-2
пунктов от первоначального уровня
было принято за стабилизацию, а
усиление боли на 3 и более пунктов
– за прогрессирование. Вторичными конечными точками исследования были скорость наступления
эффекта и его продолжительность,
а также побочные эффекты. В итоге
было включено 339 пациентов, 209
в группу СРХ (со средним уровнем
болевого синдрома в 6,06 на момент
начала лечения) и 130 в группу кЛТ
(5,88 – средний базовый уровень
боли).
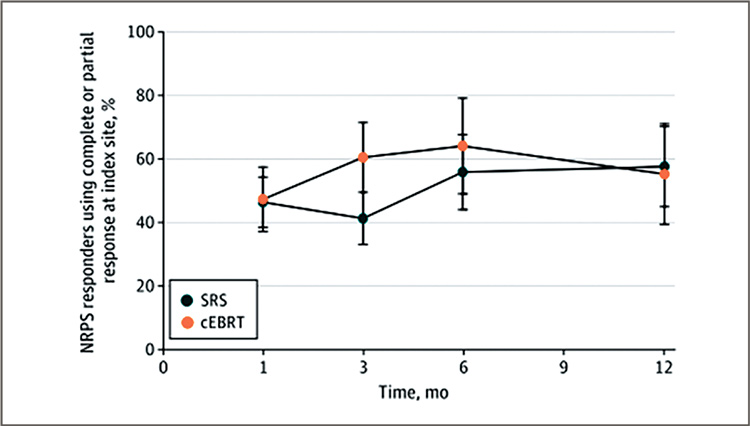
На момент первой оценки – 3 месяца – никаких преимуществ применение СРХ в плане снижения боли
пациентам не принесла: 41,3% и
60,5% больных ответили на лечение
(рис.1). Никакой значимой разницы
в выраженности изменений также
не зафиксировано: снижение боли
в среднем составило 2,98 пункта в
группе СРХ против 3,93 пункта при
применении кЛТ. К 12 месяцам пропорции ответивших больных выровнялись.
Результаты также показывают отсутствие различий в появлении новых
метастазов между группами СРХ и
кЛТ (43,5% против 43,9% соответственно; P=0,96) или прогрессировании уже известных метастазов
(34,0% против 42,3%; P=0,12). Показатели выживаемости через 12 и
24 месяца составили 44,3% и 31,5%
для группы СРХ и 53,1% и 31,5% для
группы кЛТ (HR 0,91; 95% ДИ 0,69-
1,20; Р=0,51).
Острые нежелательные явления любой степени тяжести, связанные с лечением, в течение 3 месяцев не выявили различий между группами (7,7% против 7,7%; P=0,99). Точно так же не было замечено различий в поздних эффектах (5,6% против 3,4%; Р=0,38). Было 3 пациента, у которых была зафиксирована поздняя токсичность 4 степени, связанная с лечением (2 в группе СРХ и 1 в группе кЛТ, причина – сепсис или лимфопения). Частота компрессионных переломов позвонков через 24 месяца составила 19,5% после СРХ и 21,6% после кЛТ.
Рисунок 1.
Пропорции пациентов с положительным
(частичным или полным) ответом на облучение
Основной вывод, сделанный авторами: в этом рандомизированном клиническом исследовании превосходство СРХ перед конвенциональным облучением в плане эффективности уменьшения болевого синдрома – первичной конечной точки исследования – через 3 месяца не отмечено. Однако применение более высоких доз, подводимых с помощью стереотаксических методик, может иметь большое значение для больных с олигометастазами радиорезистентных опухолей (рак почки, меланома, саркомы) в костях, где конвенциональная лучевая терапия, скорее всего, бессильна.
Источник:
Samuel Ryu, et al.
Stereotactic Radiosurgery vs Conventional
Radiotherapy for Localized Vertebral
Metastases of the Spine. Phase 3 Results of
NRG Oncology/RTOG 0631 Randomized
Clinical Trial. JAMA Oncology. June
2023. Vol.9, №6, P.800-807.
УГОЛОК РАДИОТЕРАПЕВТА / СНОВА ОБ SBRT / ЕСТЬ ЛИ МЕСТО SBRT В ЛЕЧЕНИИ БОЛЬНЫХ С III СТАДИЕЙ РАКА ЛЕГКОГО?
Примерно треть больных раком легкого на момент диагностики имеют
местнораспространенные опухоли.
У многих из них процесс нерезектабелен, или сами пациенты неоперабельны с медицинской точки зрения.
В подобных ситуациях ведущим
методом лечения становится химиолучевая терапия с последующим
добавлением консолидации дурвалумабом, что, по данным исследования PACIFIC [1], показало реальное
улучшение отдаленных результатов:
медиана ОВ увеличилась с 29,1 до
47,5 месяца, а абсолютный 5-летний
прирост ОВ составил 9,5%.
Тем не менее, локальный контроль
остается сложной задачей. Результаты ряда исследований до эры поддерживающей терапии дурвалумабом
показали, что местный регионарный
контроль независимо коррелировал с долгосрочной выживаемостью
[2]. В целом частота общего ответа
на стандартное химиолучевое лечение в настоящее время составляет
от 50% до 70%, при этом на полный
ответ приходится менее 5%. Через 1
год местно-регионарные рецидивы
возникают примерно в 15% случаев.
Подавляющее большинство из них
возникают в пределах поля облучения и по краю его и ассоциируются с
отдаленным прогрессированием [3].
Кроме того, рецидив в поле связан с
более короткой общей выживаемостью (p<0,001) [4].
Совершенствование методов лучевой терапии позволяет увеличить
дозу на опухоли, что может быть потенциально полезным и в случае с
НМРЛ. Так, лучевая терапия с модулированной интенсивностью (IMRT)
связана с меньшим количеством тяжелых пневмонитов и более низкими
дозами на сердце. Стереотаксическая
лучевая терапия, подразумевающая
подведение высоких доз к очагу в
кратчайшие сроки и максимально
конформно, также способна внести
вклад в локальный контроль. В дополнение к этим потенциальным
преимуществом метода не забудем и
про иммуномодулирующие эффекты SBRT, которые, вероятно, могут
повысить эффективность иммунотерапии при местнораспространенном заболевании. Однако НМРЛ III
стадии представляет собой гетерогенную популяцию с точки зрения
размера опухоли, локализации, поражения узлов и характеристик пациентов, поэтому пока SBRT не входит
в существующие стандарты лечения
подобных больных. При этом, как
оказалось, метод нередко применялся для увеличения дозы на первичной опухоли, в том числе и в рамках
клинических исследований, и в реальной клинической практике. Так,
по данным исследования PACIFIC-R,
дозы лучевой терапии варьировали
от 8 до 92 Гр. Что это как не SBRT
буст?
В грядущем июльском номере журнала Cancer Treatment Reviews опубликованы результаты систематического обзора по применению SBRT,
как самостоятельно, так и в качестве
добавления (буста) к стандартному
курсу облучения у больных с НМРЛ
III стадии с вовлеченными лимфоузлами [5]. Поиск по базам данных
дал 1788 уникальных работ, среди
28 отобранных 18 соответствовали
критериям включения.
В большинстве включенных исследований проводилась стандартная
лучевая/химиолучевая терапия на
опухоль и вовлеченные лимфоузлы с последующим повышением
дозы методом SBRT на первичную
опухоль или опухоль и лимфоузлы;
буст, как правило, подводился в 2
или 3 фракции. В двух работах исследователи проводили полноценный курс SBRT на первичную опухоль и нормофракционированное
облучение лимфоузлов. Основным
преимуществом этой стратегии является применение абляционной
дозы к опухоли с ограничением риска гипофракционирования и его
серьезной токсичности для структур средостения. Так, в исследовании фазы 2, включавшем периферические опухоли ≤5 см, Martel-Lafay
et al. выполняли стандартное облучение лимфоузлов с последующей
SBRT опухоли в дозе 54 Гр за 3 фракции [6]. Они достигли многообещающей медианы ОВ в 51,6 месяца
только с одним случаем радиационного пневмонита 3 степени!
В большинстве исследований применялись альтернативные схемы SBRT,
чтобы совместить их с одновременной химиотерапией. В результате
среди подобных пациентов со средним возрастом от 63 до 73 лет авторы получили весьма ограниченную
медиану ОВ в интервале от 10 до 22
месяцев. Графики и таблицы пока
недоступны всеобщему обзору, поскольку статья только готовится к
публикации – но подобные данные
не могут не заинтересовать. Несмотря на значительный прогресс в
лечении местнораспространенного
НМРЛ, локальный контроль еще
предстоит улучшить. Подходящим
способом может быть использование технических инноваций ЛТ
и интеграция SBRT в ведение этих
пациентов либо вместо, либо в дополнение к стандартной. Этот метод
лечения, кроме того, сокращает продолжительность лечения и его логистическую нагрузку как для пациентов, так и для лиц, осуществляющих
уход. Поскольку речь идет о высоких биологически эффективных дозах (выше 100 Гр), необходимо строго соблюдать ограничения по дозам
для проксимального отдела бронховаскулярного дерева и пищевода.
Необходимы дальнейшие исследования, включающие и поддерживающую иммунотерапию. Поэтому на
данный момент применение SBRT
у больных с местнораспространенным раком легкого может осуществляться только в рамках клинических исследований – но результаты
их могут быть многообещающими.
Источники:
1. Spigel DR, Faivre-Finn C, Gray JE, et al. Five-Year Survival Outcomes From the PACIFIC Trial: Durvalumab After Chemoradiotherapy in Stage III NonSmall-Cell Lung Cancer. J Clin Oncol. 2022; 40: 1301-1311.
2. Machtay M, Paulus R, Moughan J, et al. Defining Local-Regional Control and Its Importance in Locally Advanced Nonsmall Cell Lung Carcinoma. J Thorac Oncol. 2012; 7: 716-722.
3. Offin M, Shaverdian N, Rimner A, et al. Clinical outcomes, local-regional control and the role for metastasis-directed therapies in stage III non-small cell lung cancers treated with chemoradiation and durvalumab. Radiother Oncol. 2020; 149: 205-211.
4. Taugner J, Eze C, Käsmann L, et al. Pattern-of-failure and salvage treatment analysis after chemoradiotherapy for inoperable stage III non-small cell lung cancer. Radiat Oncol. 2020; 15: 148.
5. Allignet B, De Ruysscher D, MartelLafay I, Waissi W. Stereotactic body radiation therapy in unresectable stage III non-small cell lung cancer: A systematic review. Cancer Treat Rev. 2023 May 19; 118: 102573. doi: 10.1016/j. ctrv.2023.102573. Epub ahead of print. PMID: 37210766.
6. Martel-Lafay I, Monnet I, LardyCleaud A, et al. Feasibility of Stereotactic
Body Radiation Therapy on Unresectable
Stage III NSCLC with Peripheral Primary
Tumor: A Prospective Study (GFPC 01-
14). Curr Oncol. 2021; 28: 3804-3811.
УГОЛОК РАДИОТЕРАПЕВТА / СНОВА ОБ SBRT / БЛОКИРОВАНИЕ КЛЮЧЕВОГО ИММУННОГО БЕЛКА УЛУЧШАЕТ РЕЗУЛЬТАТЫ ЛУЧЕВОЙ ТЕРАПИИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ
До 60% онкологических больных
получают лучевую терапию, но она,
увы, не всегда помогает. Новое исследование из Чикагского университета направлено на преодоление
устойчивости к лучевой терапии
путем подавления ключевого белка
и активного подключения иммунной системы.
Исследование, опубликованное 25
мая в журнале Cancer Cell [1], показывает, как медикаментозное ингибирование YTHDF2 (или просто
Y2) – белка, подавляющего иммунный ответ после лучевой терапии,
– может улучшить результаты облучения отдельно или в сочетании
с иммунотерапией. Это воздействие
также предотвращает появление и
прогрессирование отдаленных метастазов, это делает Y2 многообещающей мишенью для будущих комбинированных лечебных подходов.
«Эти результаты имеют потенциальное клиническое значение, потому что мы можем не только усилить локальный эффект облучения,
но и устранить неблагоприятные
отдаленные осложнения лучевой
терапии», — говорит профессор
Weichselbaum, заведующий кафедрой радиационной и клеточной
онкологии в Калифорнийском университете в Чикаго, главный автор
исследования и один из авторов
теории олигометастазов, о которой
так много и часто говорят в последнее время. Профессор Weichselbaum
полагает, что результаты этого исследования могут изменить стандартную практику лучевой терапии.
Abscopal vs «bad-scopal»
Лучевая терапия иногда вызывает
так называемый абскопальный эффект, когда локальное облучение одного из множественных очагов опухоли вызывает уменьшение и других
очагов в других участках тела. Это
явление встречается редко, но считается, что оно связано с активацией
иммунной системы. Облучение стимулирует иммунный ответ, в частности, производство большего количества антигенпрезентирующих
клеток и CD8+ Т-клеток, но также и
негативные эффекты, ослабляющие
противоопухолевый иммунный
ответ. Клетки крови особого типа,
называемые супрессорными клетками миелоидного происхождения
(MDSC), мигрируют к месту опухоли и ингибируют иммунный ответ,
блокируя противоопухолевое действие CD8+ Т-клеток. Этот массивный приток MDSC также препятствует действию иммунотерапии,
которая предназначена для того,
чтобы стимулировать иммунную
систему для борьбы с опухолями.
Профессор Weichselbaum и доктор Chuan He проанализировали
результаты ряда клинических исследований и отметили: если после
облучения у пациентов повышался
уровень MDSC, у них были зафиксированы худшие результаты лечения. MDSC также стимулировали
повышенную экспрессию Y2 после
лучевой терапии. Генетический и
эпигенетический анализ показал,
что индукция Y2 активирует миграционные и иммуносупрессивные
функции MDSC в опухоли и во всем
организме. В большинстве случаев
Y2-экспрессия также, по-видимому,
способствовала росту и прогрессированию отдаленных метастазов
после облучения, что профессор
Weichselbaum назвал «эффектом
плохого обзора» (bad scope effect):
«Об этом эффекте мало известно,
но он кажется гораздо более распространенным, чем реальный абскопальный эффект».
Двойной эффект
Ранее проведенные исследования
группы профессора Weichselbaum
показали, что родственный белок
под названием YTHDF1 (Y1) также
препятствует эффектам иммунотерапии, и когда он заблокирован, иммунная система лучше справляется
с опухолями. Y1 и Y2 используются
для распознавания различных модификаций РНК и регулирования
множества биологических процессов: так, Y1 способствует трансляции
мРНК в белки, Y2 разрушает мРНК,
хотя их роль в иммунных процессах,
в том числе связанных с лучевой терапией и иммунотерапией, до сих
пор не изучена.
Профессор Ralph Weichselbaum (слева) и коллеги с факультета химии
университета Чикаго обнаружили потенциальный способ улучшить
результаты лучевой терапии

В данном исследовании команда под
руководством доктора Liangliang
Wang, штатного научного сотрудника лаборатории профессора
Weichselbaum, работала с моделями мышей, у которых был блокирован ген, ответственный за производство Y2. Когда этим мышам
проводили облучение опухолей,
лечение было более эффективным
и предотвращало «bad microscopal»
эффект метастазирования отдаленных опухолей. В этих моделях, где
Y2 был подавлен, MDSC также были
ограничены в своей способности
мигрировать в опухоли и подавлять
иммунный ответ.
Работая с коллегами из Китайской
академии наук, группа исследователей также идентифицировала небольшую молекулу под названием
DC-Y13, которая блокирует Y2, воспроизводя «эффект генетического
нокаута». В лабораторных исследованиях на мышах этот препарат
продемонстрировал лучший ответ
на лучевую и иммунотерапию – как
при генетической делеции Y2.
Профессор Weichselbaum считает,
что Y2 может играть важную роль
как в качестве таргета, так и в качестве биомаркера. Пациенты, у
которых по результатам скрининга после начала лучевой терапии
отмечен высокий уровень MDSC,
продуцирующих Y2, могут получать соответствующий препарат.
Такую стратегию можно сочетать с
другими методами лечения, такими
как иммунотерапия или, к примеру, технология, подразумевающая
использование наночастиц для доставки лекарственных соединений
непосредственно в опухоль.
Источник:
Liangliang Wang, Ralph
R. Weichselbaum, et al. YTHDF2
inhibition potentiates radiotherapy
antitumor efficacy. Cancer Cell. 2023
May 25, in press.