Дорогие коллеги, дорогие друзья!
Июньский выпуск газеты RUSSCO - перед вами. Основным событием июня для онколога в любой точке мира был и есть ежегодный конгресс ASCO, и мы в этом номере начинаем публикацию новостей, а также статей, посвященных самым последним событиям онкологической науки, которых мы каждый год ждем с таким нетерпением. Наиболее полная информация с конгресса по

Роберт Ауэр.
«Аллегория медицинской науки». Холст, масло. 1914 г.

ЦИРКУЛИРУЮЩАЯ ОПУХОЛЕВАЯ ДНК ДЛЯ РЕШЕНИЯ ВОПРОСА О НЕОБХОДИМОСТИ АДЪЮВАНТНОЙ ТЕРАПИИ. НОВЫЙ ВИД «ТАРГЕТНОСТИ»?
Обсуждая вопросы таргетной терапии, мы каждый раз заостряли внимание на том, что «таргетность» – это не вопрос знания мишени для терапии, это возможность предсказать эффект лечения на

РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС - 2022
ЭЛАСЕСТРАНТ – ПЕРВЫЙ SERD, ПРОДЕМОНСТРИРОВАВШИЙ СВОЮ ЭФФЕКТИВНОСТЬ, В ПОЗДНИХ ЛИНИЯХ ЛЕЧЕНИЯ ГОРМОНОЗАВИСИМОГО HER2-НЕГАТИВНОГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ EMERALD
18 мая 2022 года в журнале Journal of Clinical Oncology опубликованы результаты исследования 3 фазы EMERALD [1], посвященного изучению эффективности эласестранта в поздних линиях терапии гормонозависимого HER2-негативного рака молочной железы (РМЖ)...
CHECKMATE 816: НИВОЛУМАБ В КОМБИНАЦИИ С ХИМИОТЕРАПИЕЙ В НЕОАДЪЮВАНТНОМ РЕЖИМЕ ПРИ ОПЕРАБЕЛЬНОМ НЕМЕЛКОКЛЕТОЧНОМ РАКЕ ЛЕГКОГО IB-IIIA СТАДИИ
В исследование 3 фазы CheckMate 816 были включены пациенты с первично операбельным немелкоклеточным раком легкого IB-IIIA стадии с ECOG статусом 0-1....

ДИСКУССИОННАЯ СЦЕНА. ОЛИГОМЕТАСТАТИЧЕСКАЯ БОЛЕЗНЬ: ОБЛУЧАТЬ ИЛИ ОПЕРИРОВАТЬ?
Чтобы ответить на вопрос, готова ли лучевая терапия (ЛТ), особенно в форме высокодозной стереотаксической ЛТ (SBRT), заменить хирургию для лечения олигометастатической болезни (ОМБ)...
РЕЗОЛЮЦИЯ ЭКСПЕРТНОГО СОВЕТА 31.05.2022 РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ
Тема экспертного совета: «Рассмотрение вопроса о целесообразности включения пегилированного липосомального доксорубицина (ПЛД) в клинические рекомендации по лечению мРМЖ»...

КОМАндировка
Сельским врачам, фельдшерам и медсестрам посвящается ...
НОВОСТИ ASCO 2022: ТРАСТУЗУМАБ ДЕРУКСТЕКАН ЭФФЕКТИВЕН ПРИ HER2-LOW РАКЕ МОЛОЧНОЙ ЖЕЛЕЗЫ. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ DESTINY-BREAST 04
DESTINY-Breast 04 – первое исследование, в котором продемонстрирована эффективность трастузумаба дерукстекана в поздних линиях терапии при диссеминированном раке молочной железы (РМЖ)....
НОВОСТИ ASCO 2022: НОВЫЕ ПЕРСПЕКТИВЫ, НОВЫЕ МИШЕНИ ТАРГЕТНОЙ ТЕРАПИИ. ЭРДАФИТИНИБ – ИНГИБИТОР FGFR1-4. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ RAGNAR
У человека описано 4 функционально активных рецептора FGFR (FGFR1-4). Сигнальный путь FGF/ FGFR играет важную роль в таких процессах онтогенеза, как появление зародышевых листиков, закладка нервной трубки и формирование конечностей, а в более поздний период – ангиогенеза и ремоделирования сосудистой сети. Активация рецепторов семейства FGFR приводит к...

ASCO 2022: ЧТО ТАМ НОВОГО В ОНКОГИНЕКОЛОГИИ?
В июне 2022 года традиционно прошел очередной конгресс Американского общества клинической онкологии – ASCO 2022. В ходе прошедшего мероприятия были представлены результаты ряда...

ПРЕПАРАТЫ ПЛАТИНЫ В НЕОАДЪЮВАНТНОЙ ТЕРАПИИ ТРОЙНОГО НЕГАТИВНОГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ. КОГДА ПОРА ПОСТАВИТЬ ТОЧКУ В ДИСКУССИИ?
Важность проведения неоадъювантной химиотерапии при тройном негативном раке молочной железы сегодня уже не вызывает бурных дебатов среди онкологов. При этом роль препаратов платины...

КЛИНИЧЕСКИЕ И ПОВЕДЕНЧЕСКИЕ СИМПТОМЫ У ПАЦИЕНТА, СООБЩАЮЩИЕ О НЕОБХОДИМОСТИ КОНСУЛЬТАЦИИ ПСИХОЛОГА
Дисциплина «Онкопсихология» в нашей стране пока еще не включена в программу обучения врача онколога, но существуют программы повышения квалификации врачей в области психологии в...

ФОРТЕКА
Возможность победить
Анонс
-

ДАТЫ САММИТА УТОЧНЯЮТСЯ
ESMO VIRTUAL SAMMIT RUSSIA ESMO-RUSSCO 2022 саммит
-

15 -17 ноября 2022
РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС - 2022
Дорогие коллеги, дорогие друзья!
Июньский выпуск газеты RUSSCO - перед вами. Основным событием июня для онколога в любой точке мира был и есть ежегодный конгресс ASCO, и мы в этом номере начинаем публикацию новостей, а также статей, посвященных самым последним событиям онкологической науки, которых мы каждый год ждем с таким нетерпением. Наиболее полная информация с конгресса по различным локализациям опухолей будет представлена уже в июльском номере.
Июнь – это наш с вами месяц. Принимая поздравления пациентов, обнимая коллег, мысленно окидывая взором пройденный отрезок профессионального пути, каждый из нас, наверняка, даже если мимолетно, думает: не жалею ли я, что стал
врачом? Правильно ли сделан был выбор в пользу вечного
стресса ответственности, отказа от личной жизни, ненормированного рабочего дня, недосыпа, постоянной учебы, гнета
разнообразных проверок, вечно трезвонящего телефона, щемящей боли из-за уходящего пациента – но и радости огромной, когда получилось помочь человеку, продлить жизнь или
сделать ее полноценной, избавив пациента от болезни?.. Мы,
онкологи, каждодневно на распутье, подобно главной фигуре
этой не слишком известной картины хорватского художника
XIX-XX веков Роберта Ауэра. Медицина (в образе Гигиеи, богини здоровья, с чашей и змеёй в руках) и мы, медики, ежеминутно оцениваем и пытаемся понять, можем ли мы помочь
хрупкой страдающей жизни, решаем, надо ли вмешиваться
нашими методами для ее спасения – или лучше отказать в
этом, не причиняя лишних и, увы, бессмысленных страданий,
определяем, что должно быть в чаше – живительное снадобье
или плацебо? Эта мудрость не дается свыше – к ней мы идем
долгие годы, через удачи, ошибки, приобретая опыт и беспристрастие, и далеко не каждому дано пройти такой путь к настоящему Профессионализму. Да пребудет он с каждым из нас!
Наикрепчайшего здоровья вам и уверенных шагов вперед - к
беспредельному врачебному совершенству!
…Вечный подвиг - он вам по плечу,
Ваши руки - бессонны и святы,
Низко вам поклониться хочу,
Люди в белых халатах.
Люди в белых халатах,
Низко вам поклониться хочу.
Ваша команда RUSSCO
Роберт Ауэр.
«Аллегория медицинской науки». Холст, масло. 1914 г.

ЦИРКУЛИРУЮЩАЯ ОПУХОЛЕВАЯ ДНК ДЛЯ РЕШЕНИЯ ВОПРОСА О НЕОБХОДИМОСТИ АДЪЮВАНТНОЙ ТЕРАПИИ. НОВЫЙ ВИД «ТАРГЕТНОСТИ»?
Автор: Жуков Николай Владимирович
ФГБУ «НМИЦ Детской гематологии, онкологии
и иммунологии им. Д. Рогачева», Москва
Обсуждая вопросы таргетной терапии, мы каждый раз заостряли
внимание на том, что «таргетность»
– это не вопрос знания мишени для
терапии, это возможность предсказать эффект лечения на основании
наличия этой мишени. Именно возможность (и необходимость) предварительного проведения теста, позволяющего выделить выигрывающую
популяцию, делает терапию истинно
прецизионной и высокоэффективной в отобранной популяции больных, «спасая» остальных от неэффективного у них лечения, а бюджет
здравоохранения от – необоснованных трат.
Однако до недавнего времени все
тесты для назначения таргетной терапии предусматривали лишь определение каких-либо характеристик
опухоли (активация сигнального
пути, наличие рецепторов, мутаций
и т.д.). Но при этом существовала
острая необходимость в другой таргетности – подтверждении наличия
в организме остаточной опухоли
(микрометастазов), являющейся мишенью для назначения адъювантной
терапии. Проведение адъювантной
терапии всегда было сопряжено с
пониманием того, что мы перелечиваем значительную долю больных,
которые и так уже излечены хирургически (не имеют микрометастазов),
для того, чтобы увеличить шанс на
излечение тех, у кого эти микрометастазы есть (и, соответственно, есть
точка приложения для проводимой
терапии). К сожалению, отличить
одних от других мы не могли и поэтому лечили всех. Или почти всех
– отказывая в проведении адъювантной терапии пациентам с благоприятным «групповым» прогнозом, т.е.
больным, у которых по совокупности
клинико-морфологических характеристик подразумевалось, что риск
наличия микрометастазов слишком мал, чтобы оправдать назначение адъювантной терапии. Однако
групповой прогноз далеко не всегда
был точен: мы понимали, что среди
пациентов с благоприятным прогнозом все равно есть больные, которые
имеют микрометастазы, и для них
отказ от проведения адъювантной
терапии мог быть фатальным. Ровно
так же, как среди больных с неблагоприятным прогнозом, которым эта
терапия проводится, немало больных, уже излеченных хирургически,
а значит получающих лечение впустую. Так было и при колоректальном раке, где при «неблагоприятной»
III стадии проведение адъювантной
химиотерапии приводило к увеличению выживаемости, а при «благоприятной» II – нет. Однако клиническая
практика показывала, что далеко не
все больные II стадией заболевания
излечиваются хирургически, рецидивы нередки, а значит у многих из них
точка приложения для адъювантной
терапии все же есть. В связи с этим
части больных со II стадией все равно
назначалась адъювантная терапия,
но опять же исходя из «группового»
прогноза – наличия дополнительных
неблагоприятных прогностических
факторов. Однако, возможно, скоро
рутинная практика изменится, т.к.
появились данные о способности
циркулирующей опухолевой ДНК
стать тем самым таргентным маркером, отвечающим на вопрос – есть ли
в организме больного точка приложения для терапии, позволяющая надеяться на выигрыш от проводимого
лечения, или от него лучше отказаться, т.к. пациент и так уже излечен.
В исследовании DYNAMIC, представленном на ASCO 2022 [1] и параллельно опубликованном в NEJM
[2], 455 пациентов с радикально прооперированным раком толстой кишки
II стадии были рандомизированы в
соотношении 2:1 на проведение адъювантной терапии в соответствии с
результатами определения циркулирующей опухолевой ДНК или на терапию в соответствии с имеющимися
стандартными клиническими рекомендациями, основанными на «групповом прогнозе» (стадия Т, количество исследованных лимфатических
узлов, наличие перфорации кишки
и т.д.). В экспериментальной группе
поводом для назначения адъювантной терапии (оксалиплатин-содержащая схема или монотерапия фторпиримидинами) являлось наличие
циркулирующей опухолевой ДНК в
образцах крови, полученных через 4
или 7 недель после хирургического
лечения. В случае, если циркулирующая опухолевая ДНК не выявлялась,
пациент оставлялся под динамическим наблюдением без проведения
химиотерапии.
По результатам исследования оказалось, что значимо меньше больных
в экспериментальной группе потребовали проведения химиотерапии:
15,3% против 27,9% в контрольной
группе, где решение о проведении
терапии принималось на основании
«группового» прогноза. При этом
двухлетняя безрецидивная выживаемость (БРВ) между группами статистически значимо не различалась
(критерии non-inferiority были соблюдены), составив 93,5% в экспериментальной группе против 92,4% в
контрольной. Среди больных экспериментальной группы, не имевших
циркулирующей опухолевой ДНК
в крови и, соответственно, не получивших адъювантной терапии, трехлетняя БРВ составила 92,5%, при наличии циркулирующей опухолевой
ДНК и проведении адъювантной терапии – 86,4%. БРВ среди пациентов
контрольной группы, которые были
отнесены к низкому риску рецидива
и не получили адъювантной терапии,
БРВ составила 96,7%.
Таким образом, определение циркулирующей опухолевой ДНК, возможно, наконец станет инструментом,
позволяющим действительно индивидуализировать адъювантное лечение, назначая его лишь пациентам,
имеющим для него мишень – остаточные опухолевые клетки.
Источники:
1. ASCO 2022. Abstract LBA100. Presented: June 4, 2022.
2. Tie J, Cohen JD, Lahouel K, Lo SN, Wang Y, Kosmider S, Wong R, Shapiro J, Lee M, Harris S, Khattak A, Burge M, Harris M, Lynam J, Nott L, Day F, Hayes T, McLachlan SA, Lee B, Ptak J, Silliman N, Dobbyn L, Popoli M, Hruban R, Lennon AM, Papadopoulos N, Kinzler KW, Vogelstein B, Tomasetti C, Gibbs P; DYNAMIC Investigators. Circulating Tumor DNA Analysis Guiding Adjuvant Therapy in Stage II Colon Cancer. N Engl J Med. 2022 Jun 4. doi: 10.1056/ NEJMoa2200075. Epub ahead of print. PMID: 35657320.
РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС - 2022

ЭЛАСЕСТРАНТ – ПЕРВЫЙ SERD, ПРОДЕМОНСТРИРОВАВШИЙ СВОЮ ЭФФЕКТИВНОСТЬ, В ПОЗДНИХ ЛИНИЯХ ЛЕЧЕНИЯ ГОРМОНОЗАВИСИМОГО HER2-НЕГАТИВНОГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ EMERALD
18 мая 2022 года в журнале
Journal of Clinical Oncology опубликованы результаты исследования 3 фазы EMERALD [1],
посвященного изучению эффективности эласестранта в поздних
линиях терапии гормонозависимого HER2-негативного рака молочной железы (РМЖ).
Работа вызывает большой клинический интерес, так как это
первое успешное исследование 3
фазы, демонстрирующее эффективность нового перорального
селективного деструктора эстрогеновых рецепторов (SERD).
Ранее два SERD амсенестрант
(Ameera-3, Sanofi) и гиредестрант
(Acelera, Roche) не продемонстрировали эффективности в
поздних линиях терапии гормонозависимого HER2-негативного
РМЖ.
Активное внедрение в рутинную практику новых препаратов таргетной терапии (ингибиторов CDK4/6, mTOR, PI3K)
при РЭ+/РП+ HER2-негативном
РМЖ, назначающихся в комбинации с гормонотерапией, привело к острой нехватке именно
гормональных партнеров. Большинство пациентов успевают
получить гормонотерапию в адъювантных режимах или в первых линиях лечения, что делает
затруднительным назначение
эффективной комбинации, так
как опции гормонотерапии исчерпаны. Еще одной проблемой
является выявление у 20-40% пациенток, ранее получавших ингибиторы ароматазы, мутации в
гене ESR1, приводящей к лиганднезависимой активации эстрогенового рецептора.
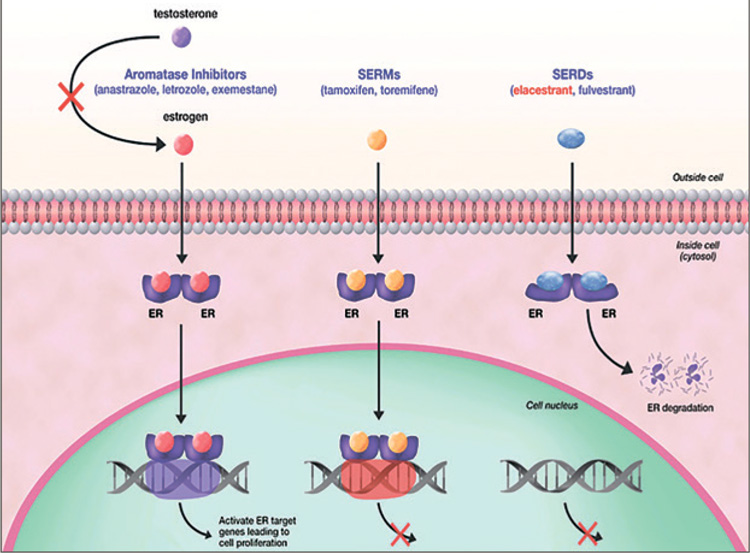
Эласестрант – селективный нестероидный пероральный деструктор эстрогеновых рецепторов (SERD) (рис.1). In vivo была
продемонстрирована эффективность эласестранта на ксенотрансплантатных моделях, резистентных к ингибиторам CDK4/6,
фулвестранту и с точечными
мутациями в гене ESR1 (Y537S и
D538G).
Рисунок 1.
Механизм действия гормонотерапии при
гормонозависимом HER2-негативном раке молочной железы.
В исследование EMERALD было включено 477 пациенток в менопаузе со статусом ECOG 0-1, в анамнезе у которых была 1 или 2 линии эндокринотерапии с включением ингибиторов CDK4/6 и/ или 1 линия химотерапии по поводу диссеминированного или неоперабельного местнораспространенного гормонозависимого HER2-негативного РМЖ.
Пациентки были рандомизированы в 2 лечебные группы (1:1):
• эласестрант (n=239) 400 мг 1 раз в день per os, терапия до прогрессирования заболевания или неприемлемой токсичности;
• терапия по выбору исследователя (n=238) – фулвестрант,
анастрозол, летрозол или экземестан в стандартном дозовом
режиме до прогрессирования
заболевания или неприемлемой
токсичности.
Стратификация в группы проводилась в зависимости от распространенности заболевания, статуса мутации ESR1 (Cuardant360
CDx) и предшествующей терапии.
Первичной конечной точкой исследования была медиана выживаемости без прогрессирования
(ВБП) в группе пациенток с мутацией в гене ESR1, вторичными
– медианы общей выживаемости
(ОВ) и ВБП, частота объективного ответа, токсичность и переносимость терапии в общей группе
больных.
Медиана возраста пациенток в
исследовании достигла 63 лет
(24-89), у 47,8% выявлена мутация в гене ESR1 и в 43,4% случаях
в анамнезе 2 линии эндокринотерапии.
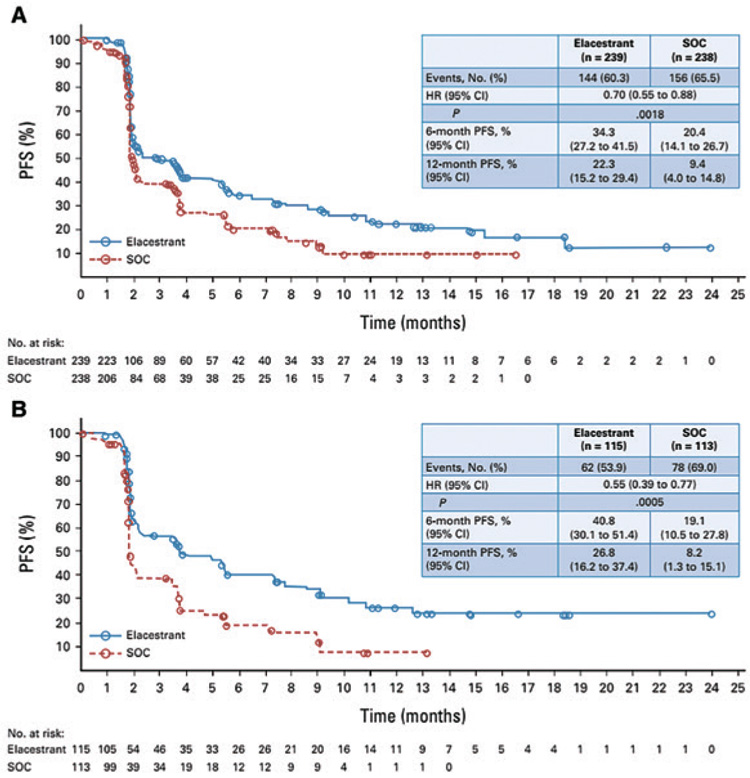
При медиане длительности наблюдения в 15,1 мес. медиана ВБП
была значимо выше при назначении эласестранта в сравнении
с терапией по выбору исследователя как в общей группе – 2,8
мес. против 1,9 мес. (ОР=0,77; 95%
ДИ 0,55-0,88; p=0,002), так и при
наличии мутации в гене ESR1 –
3,8 мес. и 1,9 мес. (ОР=0,55; 95%
ДИ 0,39-0,77; p=0,0005) соответственно (рис.2, A и B).
Назначение эласестранта в сравнении со стандартной гормонотерапией позволило увеличить
12-месячную ВБП в общей когорте пациентов с 9,4% до 22,3% и в
когорте пациентов с мутацией
ESR1 с 8,2% до 26,8% соответственно.
Рисунок 2.
A – выживаемость без прогрессирования в общей
группе больных; B – выживаемость без прогрессирования
в группе пациентов с мутацией в гене ESR1.
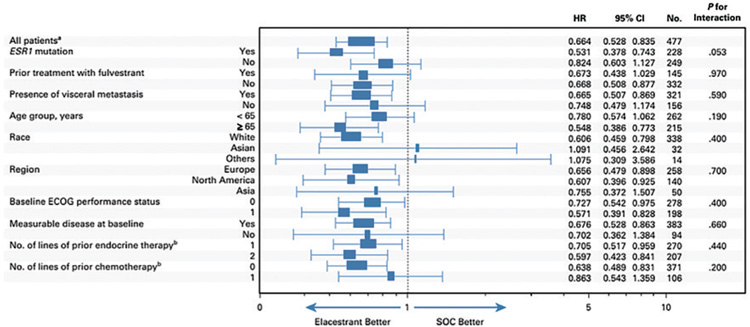
При подгрупповом однофакторном анализе было показано, что
эффективность эласестранта не
зависит от распространенности заболевания (наличия висцеральных метастазов), статуса
ECOG, количества линий эндокринотерапии и химиотерапии
в анамнезе, при максимальном
выигрыше у пациентов с мутацией в гене ESR1, старше 65 лет и ранее не получавших фулвестрант
(рис.3).
Рисунок 3.
Однофакторный анализ
Медианы ОВ в лечебных группах
не достигнуты, при 12-месячной
ОВ в группе с эласестрантом в
79,3% и 73,3% в группе стандартной терапии. В когорте пациентов с мутацией ESR1 12-месячная
ОВ составила 82,6% и 73,6% соответственно.
Нежелательные явления (НЯ)
в группах эласестранта и стандартной гормонотерапии преимущественно не превышали 1-2
степени и были представлены
тошнотой (35,0% и 18,8%), слабостью (19,0% и 18,8%), рвотой
(19,0% и 8,3%), снижением аппетита (14,8% и 9,2%) и болью
в суставах (14,3% и 16,2%). НЯ
3-4 степени отмечены у 64 (27%)
пациентов, получавших эласестрант, и у 47 (20,5%) в группе
стандартной эндокринотерапии.
В когорте эласестранта наблюдались НЯ 3-4 степени – тошнота
(2,5%), боли в спине (2,5%) и повышение АЛТ (2,1%), а в когорте
эндокринотерапии по выбору
исследователя – тошнота (0,9%),
слабость (0,9%) и диарея (0,9%);
15 и 10 пациентов соответственно прекратили терапию из-за неприемлемой токсичности.
Таким образом, эласестрант продемонстрировал эффективность
в поздних линиях терапии гормонозависимого HER2-негативного рака молочной железы и приемлемый и управляемый профиль
токсичности.
Источники:
1. Francois-Clement Bidard, Virginia G. Kaklamani, Patrick Neven, et al. Elacestrant (oral selective estrogen receptor degrader) Versus Standard Endocrine Therapy for Estrogen Receptor-Positive, Human Epidermal Growth Factor Receptor 2-Negative Advanced Breast Cancer: Results From the Randomized Phase III EMERALD Trial. Journal of Clinical Oncology. Published online: May 18, 2022. DOI: 10.1200/JCO.22.00338.
2. Aditya Bardia, Philippe Aftimos,
Teeru Bihani, et al. EMERALD: Phase
III trial of elacestrant (RAD1901)
vs endocrine therapy for previously
treated ER+ advanced breast cancer
Future Oncology. October 2019, Vol.15,
Issue 28, P.3209. https://doi.org/10.2217/
fon-2019-0370.
CHECKMATE 816: НИВОЛУМАБ В КОМБИНАЦИИ С ХИМИОТЕРАПИЕЙ В НЕОАДЪЮВАНТНОМ РЕЖИМЕ ПРИ ОПЕРАБЕЛЬНОМ НЕМЕЛКОКЛЕТОЧНОМ РАКЕ ЛЕГКОГО IB-IIIA СТАДИИ
В исследование 3 фазы CheckMate 816 были включены пациенты с первично операбельным немелкоклеточным раком легкого IB-IIIA стадии с ECOG статусом 0-1.
358 пациентов были рандомизированы в 2 лечебные группы
(1:1):
• группа 1 (n=179): ниволумаб 360 мг в комбинации с платиносодержащей химиотерапией 1 раз в 3 недели, до 3 циклов;
• группа 2 (n=179): 3 курса платиносодержащей химиотерапии
(ХТ) 1 раз в 3 недели.
Хирургический этап лечения проводился в течении 6 недель после
завершения последнего курса неоадъювантной терапии. В дальнейшем пациенты могли получить 4
курса адъювантной ХТ и/или лучевую терапию.
Первичными конечными точками
исследования были медиана выживаемости без прогрессирования и
частота достижения полного патоморфологического ответа, вторичными – медиана общей выживаемости и токсичность терапии.
Почти 94% пациентов в группе
ХТ в комбинации ниволумабом и
84,7% в группе только ХТ завершили все запланированные курсы неоадъювантной терапии, хирургическое лечение выполнено 83,2% и
75,4% больным в группах соответственно. Курсы адъювантной ХТ
проведены 11,9% больных в группе
с иммунотерапией и 22,2% в группе
только ХТ.
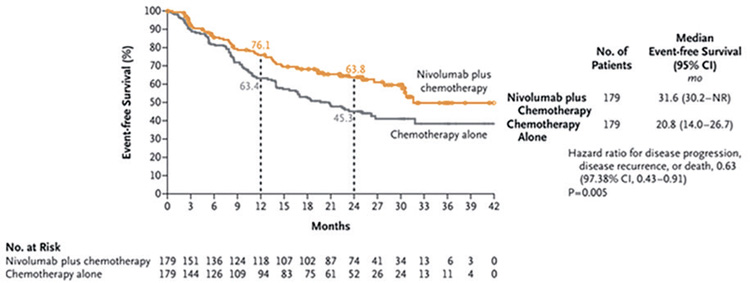
При медиане времени наблюдения
в 21 мес. медиана ВБП в группе ХТ
с ниволумабом достигла 31,6 мес.
против 20,8 мес. в группе только
неоадъювантной ХТ (ОР=0,63;
97,38% ДИ 0,43-0,91; p=0,005). Добавление ниволумаба к ХТ позволило увеличить 12-месячную ВБП
с 63,4% до 76,1% и 24-месячную
ВБП с 45,3% до 63,8% (рис.1).
При однофакторном анализе было
показано, что максимальная эффективность от добавления ниволумаба к ХТ отмечена у пациентов
моложе 65 лет, со статусом ECOG 0,
стадией IIIA, неплоскоклеточным НМРЛ и уровнем экспрессии PD-L1
в опухоли более 1.
Рисунок 1.
Выживаемость без прогрессирования.
Частота достижения полного патоморфологического ответа была
значимо выше в группе пациентов,
получающих ниволумаб в комбинации с ХТ, – 24% против 2,2% (рис.2).
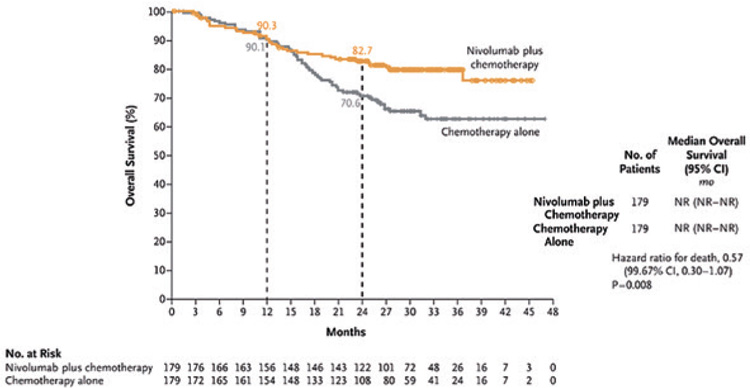
Медиана ОВ не достигнута, при
промежуточном анализе ОВ оказалась значимо выше в группе неоадъювантной ХТ в комбинации с
ниволумабом в сравнении только
с ХТ (ОР=0,57; 96,7% ДИ 0,30-1,07;
p=0,008; рис.3).
Рисунок 2.
Частота достижения полного
патоморфологического ответа.
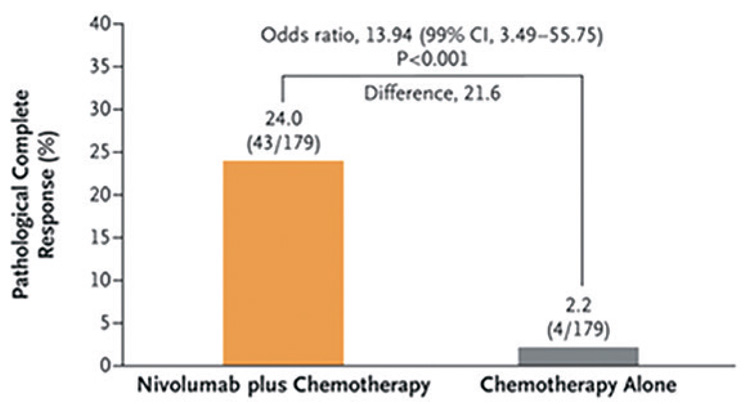
Рисунок 3.
Общая выживаемость.
Нежелательные явления (НЯ) любой
степени зарегистрированы у 92,6%
больных в группе ХТ в комбинации ниволумабом и 97,2% в группе только ХТ. НЯ 3 и 4 степени отмечены у
33,5% и 36,9% пациентов в когортах
соответственно и преимущественно были представлены нейтропенией
(8,5% и 11,9%). НЯ послужили причиной прекращения терапии в 10,2%
случаях в группе ХТ с иммунотерапией и в 9,7% – в группе только ХТ.
НЯ, связанные с ниволумабом, были
в большинстве случаев представлены сыпью (8,5%) и у 2 больных зарегистрирован иммуноопосредованный пневмонит (1,1%).
Источник:
Forde PM, Spicer J, Lu
S, Provencio M, et al. Neoadjuvant
Nivolumab plus Chemotherapy in
Resectable Lung Cancer. N Engl J Med.
2022; 386: 1973-85. DOI: 10.1056/
NEJMoa2202170.
ДИСКУССИОННАЯ СЦЕНА. ОЛИГОМЕТАСТАТИЧЕСКАЯ БОЛЕЗНЬ: ОБЛУЧАТЬ ИЛИ ОПЕРИРОВАТЬ?
Божественный луч,
Катана самурая,
Битва началась
(дискуссионное хайку)

Автор: Митин Тимур
Университет Здоровья и Науки Орегона,
Отделение радиационной медицины, Портленд, США
Чтобы ответить на вопрос, готова
ли лучевая терапия (ЛТ), особенно в форме высокодозной стереотаксической ЛТ (SBRT), заменить
хирургию для лечения олигометастатической болезни (ОМБ), сначала нам нужно дать определение
олигометастатической болезни, потом рассмотреть ключевые (то есть
проспективные рандомизированные) исследования по добавлению
локального воздействия на метастатические очаги – с применением
хирургии или SBRT – к системному
или поддерживающему лечению и
только потом решать, какая методика на сегодняшний день предпочтительнее с точки зрения доказательной медицины.
Термин «олигометастазы» был
сформулирован в 1995 году [1]
двумя радиотерапевтами – Samuel
Hellman и Ralph Weichselbaum, один
был президентом ASCO, другой
в 2018 году получил престижную
премию ASCO Karnofsky Memorial
Award. Пролечив тысячи больных
с изолированными метастазами в
паллиативных целях и затем наблюдая за ними в клинике, они убедились, что часть больных могут жить
годами либо совсем без прогрессирования, либо с изолированным
метахронным прогрессированием,
которое, опять-таки, может быть
контролировано применением ЛТ.
Национальный институт онкологии США дает очень размытое
определение ОМБ для проведения
локального лечения: присутствие
«ограниченного» количества метастатических очагов в одном или
двух органах. Интересно, что количественное определение олигометастатического состояния пришло
из ретроспективных клинических
исследований у пациентов с раком
предстательной железы (РПЖ), которые показали, что у больных с количеством метастатических очагов
РПЖ от 1 до 5 выживаемость была
значительно лучше, чем у пациентов
с большим количеством очагов [2,3].
Так возникла магическая цифра 5, прописанная в последующих протоколах по локальному лечению ОМБ.
Зачем пришел он,
Самурай с острым мечом?
Он не знает сам
Консенсусная конференция мировых экспертов по РПЖ в 2017 году
[4] показала, что 10% экспертов
вообще не признавали понятие
ОМБ. А среди других 90% экспертов мнения разделились по количеству очагов, при котором можно
пациенту поставить диагноз ОМБ
– две трети проголосовали за определение от 1 до 3 очагов. Одна из
самых серьезных проблем в подсчете метастатических очагов – это
чувствительность радиологической
диагностики. Онкологам хорошо
известно, что у пациента с двумятремя очагами мРПЖ по данным
остеосцинтиграфии ПСМА ПЭТ
может выявить десятки или сотни
очагов. Поэтому очень важно определиться и договориться, на основании каких диагностических исследований определять количество
метастатических очагов.
Хирурги стали браться за лечение
пациентов с метастазами уже 100
лет назад. Так, в 1927 году в Лондоне
доктор Edwards прооперировал пациента, у которого через 6 лет после
ампутации ноги из-за саркомы конечности развился метастатический
очаг в легком [5]. В 1933 г. в Бостоне
доктор Churchill провел лобэктомию
у пациента с синхронным раком
почки [6]. В 1971 г. в центре Memorial
Sloan Kettering в Нью-Йорке доктор
Beattie систематически стал оперировать пациентов с метастазами
остеосаркомы в легких. Он прооперировал 29 больных и опубликовал
сначала свой первый опыт, а в дальнейшем и отдаленные результаты
своего клинического однорукавного
эксперимента, в котором отметил 4
пациентов, проживших более 19 лет,
правда, требовавших до 9 последовательных хирургических вмешательств в течение этих лет [7]. В отсутствие других способов лечения
таких, как правило, молодых, пациентов с метастазами остеосарком в
легкие хирургический подход без
рандомизированного исследования
стал стандартом лечения, и врачи
считали неэтичным запуск рандомизированного исследования по
резекции против наблюдения таких
пациентов. Запомним это ключевое
исследование, мы к нему еще вернемся.
Было принято считать, что без хирургического вмешательства у пациентов с метастазами шанс прожить
5 лет был близок к нулю. Поэтому
любая публикация по использованию хирургического вмешательства
с результатами лучше, чем нулевая
общая выживаемость, считалась позитивным исследованием и продолжала поддерживать хирургическую
практику.
Но в 2010 году было запущено рандомизированное исследование
PulMiCC [8]. Оно проводилось в
13 госпиталях Великобритании и
одном центре в Сербии. Девяносто
три пациента с метастатическими
очагами колоректального рака в
легких (от 1 до 6 очагов) были рандомизированы на хирургическое
вмешательство против наблюдения.
Группы были хорошо сбалансированы путем рандомизации пациентов,
использование химиотерапии было
нечастым и одинаковым между друмя группами, и никто не умер или
пострадал от самого хирургического вмешательства – то есть операции были проведены на высоком
уровне грамотными и опытными
специалистами. Медиана общей
выживаемости составила 3,5 года в
хирургической группе и 3,8 года в
группе наблюдения! Таким образом,
это единственное рандомизированное исследование по использованию хирургии – и оно негативное.
Более того, оно ставит под большое
сомнение абсолютно ВСЕ ретроспективные или однорукавные проспективные исследования по использованию хирургии у пациентов
с метастазами, так как показало, что
без хирургического вмешательства
далеко не все пациенты сразу умирают, и многие, как, например, более
одной трети пациентов без операции
в исследовании PulMiCC, достигают
5-летней общей выживаемости.
Теперь обсудим наиболее интересные рандомизированные исследования по использованию
стереотаксической ЛТ у больных с
олигометастазами. Проспективное
рандомизированное исследование 2
фазы у больных с олигометастатическим НМРЛ было проведено между
2012 и 2016 годами в 3 институтах,
среди которых MD Anderson был
лидирующим. Больные с 3 или менее
очагами без признаков прогрессии
после первой линии химиотерапии
(ХТ) были рандомизированы либо
на поддерживающую терапию, либо
на аблативную в виде хирургического удаления очагов или облучения их. Нужно заметить, что в исследовании допускался перекрест:
больным, которые прогрессировали
после системного лечения, или тем,
у которых ХТ сопровождалась высокой токсичностью, разрешалось
получать аблативную терапию даже
если по рандомизации они попали
в группу изначально без аблативной
терапии.
Хоть операция была прописана в протоколе исследования, в действительности только 4 процента были пролечены чисто хирургическим методом, поэтому это исследование больше поддерживает радиотерапевтическую практику, чем хирургическую. Первичной целью была выживаемость без прогрессирования, и исследование было остановлено раньше времени после промежуточного анализа, который показал достоверное улучшение по основному показателю – с 4 до 12 месяцев [9]. У 5 больных отмечены осложнения 3 степени, но ни у одного не было 4 или 5 степени токсичности. Более продолжительный период наблюдения показал, что пациенты, рандомизированные на аблативную терапию, имели явные преимущества в общей выживаемости: 41 против 17 месяцев (p=0,017) [10]. Более того, выживаемость после изначального прогрессирования также была выше, если больные получали локальное лечение в момент прогрессирования.
Еще более важное исследование – SABR-COMET, рандомизированное исследование 2 фазы, – поставило своей основной целью определить преимущества в ОВ у больных с метастатическим раком любых локализаций при условии контроля над первичной опухолью и при наличии не более 5 метастазов. Все больные были пролечены локально только методом стереотаксической ЛТ, по протоколу, подразумевающему агрессивные дозы и режимы фракционирования. Между 2012 и 2016 годами 99 больных из Канады, Шотландии, Нидерландов и Австралии были включены в это исследование, у большинства пациентов было не более 3 очагов.
Результаты, опубликованные в Журнале клинической онкологии в 2020 году, показали практически 2-кратную разницу в медиане ОВ, статистически значимую [11]. Хочу обратить ваше внимание на несколько ключевых моментов этого исследования. Во-первых, достаточно маленькая разница в медиане выживаемости без прогрессирования – 6 месяцев – при намного более существенном выигрыше в медиане ОВ говорит о том, что лечение пациентов в этом исследовании ПОСЛЕ прогрессирования болезни играло большую роль в достижении улучшения в показателях ОВ. Известно, что применение системного лечения не отличалось в двух группах исследования. Протокол разрешал – и даже рекомендовал – пациентам в группе стереотаксической ЛТ пройти дополнительные курсы SBRT (назовем это сальважной стереотаксической ЛТ) в случае олигопрогрессирования болезни. Таким образом, именно дополнительные курсы облучения, скорее всего, и повлияли на 2-кратную разницу в ОВ в этом исследовании.
Сальважная SBRT понадобилась значительному числу пациентов в исследовании. Среди пациентов, чья выживаемость перевалила через 5-летнюю отметку, 30% получили дополнительные курсы ЛТ. Ну и, наконец, не было замечено серьезной разницы между друмя группами по времени до развития новых метастатических очагов. Это говорит о том, что новые очаги уже присутствовали до рандомизации и начала лечения, только были микроскопическими и не были изначально выявлены. В течение нескольких месяцев после рандомизации пациентов эти очаги выросли – с одинаковой скоростью в обеих группах – и стали уже макроскопическими. Таким образом, важный вывод по использованию SABR при лечении олигометастатической болезни – нужно понимать и ожидать, что у многих пациентов невидимые на момент диагностики очаги увеличатся в размерах со временем и станут видимыми. Если эти очаги можно пролечить сальважной SBRT – аккуратно и грамотно, без серьезной токсичности – то такой подход значительно увеличивает продолжительность жизни пациентам с изначально олигометастатической болезнью.
Еще раз подчеркну – SBRT должна проводиться грамотно и аккуратно, поскольку может потенциально привести к серьезным последствиям. Так, в исследовании SABRCOMET 3 больных в группе SBRT умерли по причинам, связанным с проведенным лечением.
Группа INDIGO уже с 2016 года занимается проведением мастерклассов по оконтуриванию и планированию ЛТ в России под эгидой RUSSCO. В апреле 2017 года мы провели мастер-класс по SBRT печени, a в прошлом июне – мастеркласс по SBRT легкого. Эти два органа, пожалуй, самые сложные с точки зрения стереотаксиса, и я рекомендую российским радиотерапевтам ознакомиться с материалами этих мастер-классов. Вероятно, настало время посвятить очередной мастер-класс лечению ОМБ, чтобы консолидировать всю клиническую информацию. Еще раз напомню, что 3 из 66 пациентов в исследовании SABR-COMET имели токсичность 5 степени, поэтому радиотерапевтам необходимы знания и опыт проведения SBRТ, чтобы эта методика помогала, а не вредила нашим пациентам.
Еще до совсем недавнего времени SBRТ опережала хирургию по олимпийской системе, с двумя позитивными рандомизированными исследованиями против одного негативного. На ежегодном конгрессе ASCO в начале июня были представлены результаты рандомизированного исследования NRGBR002 [12], в котором 60 пациентов с олигометастатическим раком молочной железы (мРМЖ, до 4 метастатических очагов с пролеченной первичной опухолью) были рандомизированы на системную терапию с добавлением аблативной терапии на все очаги (93% получили SBRN) , а другие 63 – только на системное лечение. Добавление аблативной терапии не увеличило безпрогрессивную и общую выживаемости. Это исследование напоминает нам, что не все раковые заболевания можно лечить одним способом, и в ближайшем будущем нужно будет методично и тщательно исследовать, каким пациентам, с какими подгруппами и подтипами различных опухолей будет правильно добавлять SBRT к системному лечению. На данный момент у пациенток с мРМЖ такой подход не поддерживается доказательной медициной.
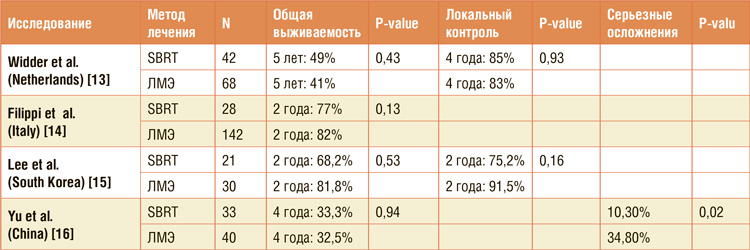
Итак, можем ли мы сказать однозначно, что эра хирургии закончилась, и теперь пациентов с олигометастатической болезнью – кроме мРМЖ – нужно лечить только SBRT? Для такого вывода нам потребуется крупное рандомизированное исследование 3 фазы, в котором пациентов рандомизируют на хирургию и SBRT. Такого исследования не было, нет и скорее всего никогда не будет, поэтому однозначного вывода мы сделать не сможем. Но давайте посмотрим на 4 небольших ретроспективных исследования из разных стран (табл.1), которые сравнили результаты у больных с метастатическими очагами в легких, пролеченных SBRТ и хирургически.
Голландское и южнокорейское исследования включали пациентов с разными нозологиями, тогда как итальянское исследование проанализировало только пациентов с колоректальным первичным раком. Обратите внимание, что и локальный контроль, и отдаленные показатели ОВ в целом схожи между пациентами, пролеченными двумя методиками. Однозначного выигрыша у хирургии нет, и это при том, что хирургия во всех четырех центрах в этих исследованиях предлагалась пациентам как наилучший вариант лечения, а SBRT – либо тем, кого хирурги не брали на операцию, либо тем, кто отказывался от хирургии. То есть во всех этих 4 ретроспективных исследованиях при равных онкологических результатах двух методик лечения мы бы ожидали увидеть лучшие показатели ОВ в группе более молодых и здоровых пациентов, которым врачи в клиниках прежде всего предлагали операцию.
А вот серьезные побочные эффекты лечения были выше в хирургической группе китайского исследования – 35% против 10%, и эта разница была статистически значимая, в пользу SBRT. Более того, мы уже говорили о том, что по результатам, опубликованным Memorial Sloan Kettering центром в Нью-Йорке, хирургия стала стандартом лечения пациентов с метастазами остеосаркомы в легкие. Так вот, четвертое ретроспективное исследование из Китая в нашей таблице анализирует именно пациентов с остеосаркомами в легких, демонстрируя равную и достаточно хорошую 4-летнюю ОВ. Да, исследование маленькое – всего 73 пациента, да ретроспективное, да, ничего само по себе не доказывает. Но и ранняя публикация из Memorial Sloan Kettering, напомню, была основана на ретроспективном анализе 29 прооперированных пациентов. Полагаю, что хирургия теперь для таких пациентов больше не является золотым или единственным стандартом, у пациентов однозначно есть не просто выбор, но и право делать выбор в пользу SBRT.
SBRT – стереотаксическая ЛТ, ЛМЭ – легочная метастазэктомия
И последний момент в пользу SBRT – это потенциальное взаимодействие ЛТ и иммунотерапии. Совокупный анализ двух рандомизированных исследований, опубликованный в прошлом году, по добавлению аблативной ЛТ к пембролизумабу у пациентов с мНМРЛ был основан на 148 пациентах с медианой наблюдения в 33 месяца [17]. Совокупный анализ показал значительную разницу в достижении абскопального эффекта – то есть уменьшения очага ВНЕ зоны облучения (20% против 42%), а также значительную разницу в медиане беспрогрессивной выживаемости (4,5 месяца против 9 месяцев), и самое важное для пациентов и онкологов – это разница в медиане общей выживаемости (9 месяцев против 19 месяцев, HR 0,67, p=0,0004). Эти цифры поддерживают гипотезу, что лучевая терапия взаимодействует с иммунотерапией, вероятно, вследствие разрушения опухолевых клеток, когда ЛТ обнажает опухолевые антигены антигенраспознающим клеткам, активирует или потенциирует противоопухолевый иммунный ответ, ведущий к дальнейшему уменьшению опухолевой массы. Все больше пациентов со злокачественными опухолями получают иммунотерапию, поэтому при наличии олигометастазов, вероятно, стоит прежде всего рассмотреть именно SBRT, а не хирургию, поскольку опубликованных данных о взаимодействии хирургии и иммунотерапии – нет.
Итак, перед вами пациент с олигометастатической болезнью. Какую
методику локального контроля
олигометастатических очагов лучше выбрать? Рандомизированного
исследования, сравнивающего две
методики, – нет и не будет. Существует масса ретроспективных наблюдений, которые обозначают
гипотезу, что добавление либо хирургии, либо SBRT к системному
лечению или наблюдению улучшает онкологические показатели. Но
верить таким ретроспективным
исследованиям нельзя, их результаты ничего не доказывают. Рандомизированных исследований мало.
Мы уже увидели, что единственное
рандомизированное исследование
по добавлению хирургии – PulMiCC
– оказалось негативным. 2 рандомизированных исследования по
добавлению SBRT показали улучшения в ОВ пациентов. Представленное недавно на конгрессе ASCO
исследование по добавлению SBRT
пациенткам с олигометастатическим мРМЖ оказалось негативным.
Кроме этих результатов у SBRT есть
еще несколько преимуществ: можно
облучить все мишени сразу, одновременно, даже если они в разных
органах, что упрощает задачу. SBRT
– процедура, проводимая в клинике амбулаторно, без надобности пациенту оставаться в госпитале на ночь.
Каждая фракция на каждый очаг
обычно занимает 20-30 минут, всего
пациенты получают от 3 до 5 фракций, то есть это всего неделя, когда
пациент проводит всего пару часов
в день в онкологической клинике и
идет домой к своим близким. Чаще
всего мы назначаем SBRT, когда у
пациентов запланирован отдых от
системного лечения, и таким образом им не приходится прерывать
или отменять свое системное лечение. SBRT может потенциировать
эффект иммунотерапии, хотя исследования в этой области еще только
начинаются и еще рано обещать пациентам достижение абскопального
эффекта и однозначное улучшение в
онкологических показателях. Пожалуй, единственный плюс операции
– это возможность получить дополнительный материал для гистологического или молекулярного анализа. Если эта информация поможет
скорректировать системное лечение
– то, конечно, нужно рассмотреть в
такой ситуации хирургический метод.
Итак, когда уже мы сможем отказаться от хирургии в лечении пациентов с олигометастатической
болезнью? Если мы считаем, что у
пациента действительно олигометастатическая болезнь по результатам
современных и качественных диагностических исследований, если
гистологический или молекулярный
анализ очагов не требуется, если
пациенту рекомендуется локальное
лечение на все очаги и – что крайне
важно – если мы уверены в своих
возможностях провести грамотную
SBRT на все очаги, то мы можем отказаться от хирургии в пользу SBRT
прямо сейчас.
Источники:
1. Hellman S, Weichselbaum RR. Oligometastases. J Clin Oncol. 1995 Jan; 13(1): 8-10.
2. Soloway MS, Hardeman SW, Hickey D, Raymond J, Todd B, Soloway S, Moinuddin M. Stratification of patients with metastatic prostate cancer based on extent of disease on initial bone scan. Cancer. 1988 Jan 1; 61(1): 195- 202.
3. Singh D, Yi WS, Brasacchio RA, Muhs AG, Smudzin T, Williams JP, Messing E, Okunieff P. Is there a favorable subset of patients with prostate cancer who develop oligometastases? Int J Radiat Oncol Biol Phys. 2004 Jan 1; 58(1): 3-10.
4. Gillessen S, Attard G, Beer TM, et al. Management of Patients with Advanced Prostate Cancer: The Report of the Advanced Prostate Cancer Consensus Conference APCCC 2017. Eur Urol. 2018 Feb; 73(2): 178-211.
5. Edwards AT. J Thorac Surg. 1934; 107-124.
6. Barney J, Churchill E. J Urology. 1939; 42: 269-276.
7. Beattie EJ, Harvey JC, Marcove R, Martini N. Results of multiple pulmonary resections for metastatic osteogenic sarcoma after two decades. J Surg Oncol. 1991 Mar; 46(3): 154-5.
8. Milosevic M, Edwards J, Tsang D, Dunning J, Shackcloth M, Batchelor T, Coonar A, Hasan J, Davidson B, Marchbank A, Grumett S, Williams NR, Macbeth F, Farewell V, Treasure T. Pulmonary Metastasectomy in Colorectal Cancer: updated analysis of 93 randomized patients – control survival is much better than previously assumed. Colorectal Dis. 2020 Oct; 22(10): 1314-1324.
9. Gomez DR, Blumenschein GR Jr, Lee JJ, et al. Local consolidative therapy versus maintenance therapy or observation for patients with oligometastatic non-small-cell lung cancer without progression after firstline systemic therapy: a multicentre, randomised, controlled, phase 2 study. Lancet Oncol. 2016 Dec; 17(12): 1672- 1682.
10.Gomez DR, Tang C, Zhang J, et al. Local Consolidative Therapy Vs. Maintenance Therapy or Observation for Patients With Oligometastatic NonSmall-Cell Lung Cancer: Long-Term Results of a Multi-Institutional, Phase II, Randomized Study. J Clin Oncol. 2019 Jun 20; 37(18): 1558-1565.
11.Palma DA, Olson R, Harrow S, et al. Stereotactic Ablative Radiotherapy for the Comprehensive Treatment of Oligometastatic Cancers: Long-Term Results of the SABR-COMET Phase II Randomized Trial. J Clin Oncol. 2020 Sep 1; 38(25): 2830-2838.
12.Chmura et al. J Clin Oncol. 2022; 40 (suppl 16; abstr 1007).
13.Widder J, Klinkenberg TJ, Ubbels JF, Wiegman EM, Groen HJ, Langendijk JA. Pulmonary oligometastases: metastasectomy or stereotactic ablative radiotherapy? Radiother Oncol. 2013; 107: 409-13.
14.Filippi AR, Guerrera F, Badellino S, Ceccarelli M, Castiglione A, Guarneri A, et al. Exploratory analysis on overall survival after either surgery or stereotactic radiotherapy for lung oligometastases from colorectal cancer. Clin Oncol (R Coll Radiol). 2016; 28: 505-12.
15.Lee YH, Kang KM, Choi HS, Ha IB, Jeong H, Song JH, et al. Comparison of stereotactic body radiotherapy versus metastasectomy outcomes in patients with pulmonary metastases. Thorac Cancer. 2018; 9: 1671-9.
16.Yu W, Liu Z, Tang L, Lin F, Yao Y,
Shen Z. Efficacy and safety of stereotactic
radiosurgery for pulmonary metastases
from osteosarcoma: experience in 73
patients. Sci Rep. 2017; 7: 17480.
17.Theelen et al. Lancet Respir Med.
2021 May; 9(5): 467-475.

Лучом надежды
Время не остановить,
Не трать его зря
Автор: Пикин Олег Валентинович
Заведующий торакальным хирургическим отделением МНИОИ им. П.А. Герцена – филиала
ФГБУ «НМИЦ радиологии» Минздрава России, доктор медицинских наук, Москва
Учитывая тот факт, что рак легкого относят к высокоагрессивным злокачественным опухолям,
характеризующимся ранним
лимфогенным и гематогенным
метастазированием, и основные
исследования, посвященные роли
локального воздействия (операции или лучевой терапии) на олигометастазы, преимущественно
касались больных раком легкого,
позвольте оценить эффективность этих двух локальных методов именно на примере олигометастатического рака легкого.
Итак, основным методом лечения
локализованных форм немелкоклеточного рака легкого (НМРЛ) является хирургический в сочетании
с химио- или химиолучевой терапией. При выявлении отдаленных
метастазов рака легкого до недавнего времени использовали только
лекарственную противоопухолевую терапию. Однако накопление
опыта лечения больных НМРЛ с
изолированными отдаленными
метастазами позволило S. Hellman
и R. Weichelbaum в 1995 году сформулировать концепцию олигометастатической болезни, под которой понимают выявление от 1 до 3
(иногда до 5) отдаленных метастазов в одном органе синхронно или
метахронно [1]. При этом частота
солитарных метастазов у больных
НМРЛ не превышает 7,0% [2]. Согласно последней классификации
TNM (2017 г.), среди больных с
отдаленными метастазами выделяют подгруппу с внутриторакальными метастазами M1a (плевра,
противоположное легкое) и экстраторакальными метастазами –
M1b (головной мозг, надпочечник,
брыжейка кишки, грудная стенка
и т.д.). Внедрение в клиническую
практику ПЭТ/КТ позволило более
точно диагностировать олигометастазы у больных раком легкого и
планировать тот или иной метод
лечения. В настоящее время при
выявлении олигометастазов возможно использовать лучевую терапию, хирургию, химио-, таргетную
и иммунотерапию [3]. Когда и почему более целесообразно рассматривать хирургический метод в
лечении больных с отдаленными
олигометастазами НМРЛ?
Прежде всего эта опция может
быть применена у больных с метастазом в противоположное легкое,
при случайно выявленной диссеминации по плевре, солитарном
метастазе в головной мозг, надпочечник, грудную стенку, брыжейку кишки и т.д., и при анализе
эффективности хирургического
метода имеет смысл рассматривать
больных, у которых была удалена
первичная опухоль (т.е. выполнена операция на легком) и удален
отдаленный метастаз. Наиболее
перспективной является группа
больных с солитарным метастазом НМРЛ в головной мозг. Проведенные исследования показали
высокую эффективность хирургического метода в лечении данной
категории больных: 5-летняя выживаемость после удаления солитарного метастаза из головного
мозга с последующей операцией
на первичном очаге в виде лобэктомии составляет 18-25% [4-6]. По
нашим данным, 5 лет после удаления солитарного метастаза из
головного мозга пережили 20,6%
(медиана составила 23,0 мес.) [7].
Клиническая ситуация у больных
раком легкого с метастазом в головной мозг может развиваться
драматически. Часто больные обращаются по экстренным показаниям к неврологу в связи с появлением общемозговой или очаговой
неврологической симптоматики.
При скрининговом обследовании
помимо образования в головном
мозге нередко по КТ органов грудной клетки в легком выявляют периферическое образование. В этой
ситуации в случае солитарного поражения головного мозга целесообразно выполнить операцию по
удалению метастаза из головного
мозга, что позволяет устранить
жизнеугрожающие явления компрессии тканей головного мозга
и верифицировать диагноз с возможностью проведения иммуногистохимического и молекулярно-генетического исследования. После
реабилитации больного проводят
уточняющую диагностику, направленную на определение статуса T и
N. Чрезвычайно важным является
определение статуса лимфатических узлов средостения (N2) путем
биопсии через стенку пищевода
или трахеи, а при необходимости
и медиастиноскопии. При выявлении метастазов в лимфатических узлах средостения операция
на легком нецелесообразна из-за
крайне неблагоприятного прогноза [4,6,8]. По нашим данным, в
группе больных с солитарным метастазом в головной мозг и N2+ ни
один больной не пережил 16 мес.
после операции [7]. В этой ситуации предпочтение следует отдавать
лекарственной терапии. Неоспоримым преимуществом вышеуказанной тактики является надежный
локальный контроль как над метастатическим, так и над первичным
очагом и получение достаточного
материала для полноценного морфологического исследования, что
крайне важно для выбора варианта
лекарственного лечения в случае
изменения плана лечения и отказа от операции на легком. Вторая,
важная в практическом отношении ситуация касается больных с
ограниченной диссеминацией по
плевре. Иногда при торакоскопии
или торакотомии у больных периферически раком легкого выявляют ограниченную диссеминацию
по париетальной плевре. У хирурга
возникает естественный вопрос:
есть ли смысл выполнить циторедуктивную операцию в объеме
лобэктомии и плеврэктомии или
же ограничиться биопсией плевры? Ряд авторов показывают преимущество циторедуктивной хирургии по сравнению с биопсией
в виде увеличения продолжительности жизни данной категории
больных [6, 9]. Наши данные также
подтверждают, что выполнение лобэктомии с плеврэктомией позволяет добиться 5-летней выживаемости у 12,0% больных (медиана
– 13 мес.) [7].
Метастатическое поражение надпочечника у больных НМРЛ является неблагоприятным фактором
прогноза [10]. По нашим данным,
ни один больной после адреналэктомии не пережил 24 месяцев.
Совсем иная ситуация при выявлении метастаза в противоположное
легкое. По данным большинства
авторов, 5-летняя выживаемость
после удаления метастаза из противоположного легкого превышает
30,0% [4, 6, 8]. В нашем исследовании 5-летняя выживаемость составила 18,0% [7].
Значительно реже в клинической
практике встречаются больные с
изолированным метастазом рака
легкого в грудную стенку, брыжейку кишки, мягкие ткани бедра,
что делает хирургическое лечение безальтернативным. Так, нам
пришлось оперировать больного
с метастазом НМРЛ в брыжейку
сигмовидной кишки. Течение заболевания осложнилось кишечным
кровотечением, что потребовало
выполнения экстренной операции.
Больной прожил после операции
3,5 года и умер от прогрессирования заболевания в виде множественных метастазов в головной
мозг.
Значимыми факторами неблагоприятного прогноза при хирургическом лечении больных с олигометастазами НМРЛ независимо от
их локализации являются поражение средостенных лимфатических
узлов (N2+) и синхронное выявление метастазов. Выявление на дооперационном этапе метастатического поражения внутригрудных
лимфатических узлов ставит под
сомнение целесообразность выполнения операции как на первичном очаге, так и по удалению отдаленного метастаза. В этой ситуации
предпочтение нужно отдавать консервативным методам лечения. Таким образом, алгоритм предоперационной диагностики у больных с
олигометастазами НМРЛ должен
включать обязательное стадирование лимфатических узлов средостения (ПЭТ-КТ, транспищеводную/трансбронхиальную биопсию
или медиастиноскопию).
Наиболее эффективно хирургическое лечение у больных с солитарным метастазом НМРЛ в головной
мозг, противоположное легкое и у
группы больных с ограниченной
диссеминацией по плевре (медиана
продолжительности жизни составила 23, 12 и 11 мес. соответственно). Значительно хуже результаты
при метастазе в надпочечник – медиана продолжительности жизни
не превышает 9 месяцев [7].
Какие же преимущества хирургического метода перед лучевой терапией?
В первую очередь – это радикальность операции, т.е. возможность
обеспечения R0 резекции.
Во-вторых, клиницист получает гистологический материал для проведения иммуногистохимического и молекулярно-генетического исследования с последующей коррекцией терапии. Следовательно, исключается вероятность применения лучевой терапии при отсутствии морфологической верификации олигопрогрессирования.
В-третьих, у больных с наличием образования в противоположном легком всегда существует вероятность самостоятельной злокачественной опухоли другой гистологической структуры, что делает применение хирургического метода абсолютно оправданным при достаточных функциональных резервах больного.
В-четвертых, удаление метастаза из головного мозга быстро приводит к регрессу общемозговой и очаговой симптоматики, устраняя жизнеугрожающее состояние.
В-пятых, оперативное вмешательство позволяет ликвидировать осложнения опухолевого процесса (кровотечение, распад).
К сожалению, на сегодняшний день отсутствуют рандомизированные исследования, сравнивающие эффективность хирургии и лучевой терапии в лечении больных НМРЛ с олигометастазами. Вряд ли в ближайшее время можно будет ожидать проведения подобных исследований из-за большой разнородности исследуемых групп и ограничения использования того или иного метода.
Таким образом, агрессивная хирургия у больных с изолированными олигометастазами НМРЛ (головной мозг, противоположное легкое, ограниченная диссеминация по плевре) оправдана при отсутствии метастазов в лимфатических узлах средостения. Адреналэктомия и плеврэктомия при обширной диссеминации не имеет преимуществ перед консервативным лечением. При олигометастазах, в случае противопоказаний к хирургическому лечению может быть использована стереотаксическая лучевая терапия.
Источники:
1. Hellman S, Weichselbaum R. Oligometastases. J Clin Oncol. 1995; 13: 8-10.
2. De Pas T, De Braud F, Catalano G, Veronesi G, Leo F, et al. Oligometastatic non-small cell lung cancer: a multidisciplinary approach in the positron emission tomographic era. Ann Thorac Surg. 2007; 83: 231-235.
3. McCall N, Higgins K. Radiotherapy for oligometastatic Non-Small Cell Lung Cancer: past, present and future. 2021; 17(35): 313-319.
4. Casiraghi M, Bertolaccini L, Sedda G, Petrella F, Galetta D, et al. Lung cancer surgery in oligometastatic patients: outcome and survival. Eur J Cardiothorac Surg. 2020; 57(6): 1173- 1180.
5. Van Schil PE, Hendricks M, Carp L, Lauwers PR. Surgery for oligometastatic disease in non-smallcell lung cancer. Expert Rev Anticancer Ther. 2008; 8(12): 1931-1938.
6. Fernandes R, Lau R, Ho J, Yu P, Chow S, et al. Evidence for surgical resection in oligometastatic lung cancer. J Thorac Dis. 2019; 11(7): S969-S975.
7. Пикин О.В., Трахтенберг А.Х., Глушко В.А., Колбанов К.И., Зайцев А.М., Амиралиев А.М., Вурсол Д.А., Картовещенко А.С. Хирургическое лечение больных немелкоклеточным раком легкого с резектабельными отдаленными метастазами. Онкология. Журнал им. П.А. Герцена. 2014; 2(4): 11-18.
8. Lampridis S. The role of surgery in oligometastatic non-small-cell lung cancer. Eur J Cardiothorac Surg. 2021; 59(4): 926.
9. Ren YJ, She YL, Dai CY, Jiang GN, Fei K, Chen C. Primary tumour resection showed survival benefits for non-small-cell lung cancer with unexpected malignant pleural dissemination. Ineract CardioVasc Thorac Surg. 2016; 22: 321-326.
10.Tanvetyanon T, Robinson
LA, Schell MJ, et al. Outcomes
of adrenalectomy for isolated
synchronous v metachronous adrenal
metastases in non-small cell lung
cancer: a systematic review and pooled
analysis. J Clin Oncol. 2008; 26: 1142-
1147.
Результаты голосования: Олигометастатическая болезнь:
облучать или оперировать?*

*https://www.rosoncoweb.ru/news/oncology/2022/06/08/
Всего проголосовало: 22
РЕЗОЛЮЦИЯ ЭКСПЕРТНОГО СОВЕТА 31.05.2022 РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ
Тема экспертного совета: «Рассмотрение вопроса о целесообразности
включения пегилированного липосомального доксорубицина (ПЛД)
в клинические рекомендации по лечению мРМЖ»
Место проведения мероприятия: онлайн.
Время проведения: 17:00-19:00.
Председатель:
Тюляндин Сергей Алексеевич, доктор медицинских наук, профессор, заслуженный деятель науки Российской Федерации, председатель Российского
общества клинической онкологии (RUSSCO), главный научный сотрудник
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва.
Приглашенные эксперты:
• Артамонова Елена Владимировна, доктор медицинских наук, зав. отделением химиотерапии №1 ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, зав. кафедрой онкологии и торакальной хирургии ФПК ГБУЗ МОНИКИ им. М.Ф. Владимирского, профессор кафедры онкологии и лучевой терапии РНИМУ, Москва.
• Болотина Лариса Владимировна, доктор медицинских наук, профессор, руководитель отделения химиотерапии МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИЦ радиологии» Минздрава России, Москва.
• Гладков Олег Александрович, доктор медицинских наук, Заслуженный врач РФ, директор «Эвимед», главный редактор по поддерживающей терапии RUSSСO, Челябинск.
• Горяинова Алла Юрьевна, врач-онколог, зав. координационным отделом лекарственного обеспечения ГБУЗ «Краевой онкологический диспансер №1», Краснодар.
• Жукова Людмила Григорьевна, доктор медицинских наук, профессор РАН, заместитель директора ГБУЗ «Московский клинический научный центр имени А.С. Логинова ДЗМ», Москва.
• Коваленко Елена Игоревна, старший научный сотрудник, к.м.н., отделение химиотерапии №1 ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва.
• Королева Ирина Альбертовна, доктор медицинских наук, профессор кафедры клинической медицины последипломного образования Медицинского университета «Реавиз», Самара.
• Новичкова Татьяна Станиславовна, врач-онколог, заместитель главного врача по клинико-экспертной работе и контролю качества ГУЗ «Забайкальский краевой онкологический диспансер», Чита.
• Семиглазова Татьяна Юрьевна, доктор медицинских наук, ведущий научный сотрудник, заведующая научным отделом инновационных методов терапевтической онкологии и реабилитации, профессор отделения аспирантуры и ординатуры ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, профессор кафедры онкологии ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России, Санкт-Петербург.
Мировым сообществом признано,
что рак молочной железы (РМЖ) является глобальной проблемой современной онкологии. Данное заболевание долгие годы остается ведущим
в структуре заболеваемости злокачественными опухолями.
Современная противоопухолевая
терапия злокачественных новообразований существенно увеличила
продолжительность жизни онкологических пациентов. В этой связи
актуальным вопросом является сохранение качества жизни пациентов,
завершивших противоопухолевое
лечение. Одним из значимых отсроченных токсических эффектов
противоопухолевой лекарственной
терапии рака является сердечно-сосудистая патология. Лекарственная
терапия (химиотерапия, таргетная
терапия) и лучевая терапия могут
вызвать сердечно-сосудистые осложнения, проявляющиеся в отдаленные сроки после завершения
лечения.
Основой цитостатической терапии
рака молочной железы, особенно
при проведении инициальной химиотерапии, являются, помимо таксанов, антрациклины, повышающие
риск возникновения осложнений со
стороны сердечно-сосудистой системы. Кумулятивная доза антрациклинов является ведущим фактором риска развития сердечно-сосудистых
осложнений и ограничивает дальнейшее применение антрациклинов.
По данным ESMO 2012 года, использование антрациклинов сопровождается развитием антрациклиновых кардиомиопатий с частотой до
5% случаев через 1 год после окончания химиотерапии.
В реальной клинической практике
химиотерапевтами и радиотерапевтами зачастую недооценивается
риск развития кардиотоксических
повреждений, связанных с проводимым лечением. Важной в решении
проблемы сердечно-сосудистых осложнений, индуцированных противоопухолевым лечением, является
мультидисциплинарная работа химиотерапевта, радиотерапевта и кардиолога. Консультация кардиолога и
мониторинг ЭХО-КГ необходимы до
начала терапии антрациклинами и
повторно в процессе лечения.
При лечении мРМЖ у пациентов,
имеющих факторы высокого риска
развития сердечно-сосудистых осложнений, пегилированный липосомальный доксорубицин может
рассматриваться как возможная
альтернатива традиционным антрациклинам (доксорубицин, эпирубицин). Меньшая токсичность
пегилированного липосомального
доксорубицина доказана в крупных
международных клинических исследованиях III фазы.
В рандомизированном исследовании III фазы проводилось сравнение
пегилированного липосомального
доксорубицина (ПЛД) в дозе 50 мг/
м2 1 раз в 4 недели и традиционного доксорубицина 60 мг/м2 1 раз в
3 недели в 1 линии терапии мРМЖ
(O’Brien, 2004 г.). В исследование
было включено 509 пациентов. По
эффективности ПЛД не уступает
традиционному доксорубицину по
показателю общей выживаемости
и выживаемости без прогрессирования, но за счет пегилированной
липосомальной формы в 3 раза
снижает риск кардиотоксичности
(7% против 26%). Пегилированный
липосомальный доксорубицин обладает лучшим профилем переносимости не только за счет меньшей
кардиотоксичности, но также снижает частоту тошноты (37 % против 53%) и рвоты (19% против 31%),
реже вызывает алопецию (20% против 66%) и нейтропению (4% против
10%). Пегилированный липосомальный доксорубицин имеет больший
интервал между введениями по
сравнению с доксорубицином (1 раз
в 4 недели).
В рандомизированном исследовании III фазы проводилось сравнение
пегилированного липосомального
доксорубицина (ПЛД) и капецитабина в 1 линии терапии мРМЖ
(Jäger`a, 2010 г.). В исследование
было включено 210 пациентов. Пегилированный липосомальный
доксорубицин и капецитабин продемонстрировали сходные результаты
по ВБП (медиана 6,7 мес. против 7,1
мес.). Предшествующее применение
антрациклинов (в адъювантном режиме) явилось негативным фактором в отношении эффективности
капецитабина: медиана ВБП у больных без антрациклинов составила
9,0 мес., с антрациклинами – 4,8 мес.
(р=0,0098). Предшествующее назначение антрациклинов существенно
не влияло на эффективность пегилированного липосомального доксорубицина, медиана ВБП у больных без
антрациклинов – 6,9 мес., с антрациклинами – 5,9 мес. Пегилированный
липосомальный доксорубицин показал лучший профиль безопасности в сравнении с капецитабином,
меньше отмечалось тромбоэмболических событий (2% против 10%,
p=0,033), меньше кардиологических осложнений (9% против 12%,
p=0,4999), не отмечалось диареи 3-4
ст., в отличие от капецитабина (12%).
В обеих группах одним из наиболее
частых осложнений являлся ладонно-подошвенный синдром, наиболее
часто в группе с пегилированным
липосомальным доксорубицином
(36% против 25%, p=0,1352).
В рандомизированном исследования III фазы проводилось сравнение
пегилированного липосомального
доксорубицина (ПЛД) с винорелбином и комбинированной терапией
винбластином с митосмицином С у
пациентов c доказанной таксановой
резистентностью во 2 линии терапии мРМЖ (Keller`a, 2004 г.). В исследование включена 301 пациентка.
Показано, что пегилированный липосомальный доксорубицин не уступает по эффективности препаратам
сравнения у таксан-рефрактерных
пациентов по ВБП и ОВ, достоверно превосходит по ВБП в подгруппе
больных (n=44), ранее не получавших антрациклины (медианы составили 5,8 мес. в группе ПЛД и 2,1 мес.
в группе сравнения). Пегилированный липосомальный доксорубицин
показал лучший профиль безопасности в сравнении с винорелбином,
реже отмечалась тошнота 3-4 ст. (3%
против 7%) и нейтропения 3-4 ст. (2%
против 8%). Наиболее частые нежелательные явления при применении
пегилированного липосомального
доксорубицина были управляемыми
и проявлялись ладонно-подошвенным синдромом 3-4 ст. (19%) и стоматитом 3-4 ст. (5%).
Согласно инструкции к применению,
пегилированный липосомальный
доксорубицин показан при лечении
метастатического рака молочной
железы при наличии показаний к терапии антрациклинами, в том числе
в случае повышенного риска кардиологических осложнений и при неэффективности терапии таксанами.
При обзоре международных рекомендаций стоит отметить указание
на липосомальную форму доксорубицина в лечении HER2-негативного
метастатического рака молочной железы. В рекомендациях ESMO 2021
года липосомальные антрациклины
могут использоваться для повторной
терапии в случае интервала без признаков заболевания более 12 месяцев
после применения антрациклинов
(II, B) или в случаях, когда антрациклины не применялись ранее. В
рекомендациях NCCN 2022 года
доксорубицин, включая липосомальный доксорубицин, указан в разделе
предпочтительных режимов терапии
HER2-негативного метастатического
рака молочной железы.
В рамках проведения экспертного
совета был проведен опрос специалистов онкологических диспансеров РФ. В опросе приняли участие
148 онкологов из 47 регионов, из
них с опытом лечения мРМЖ более
10 лет – 49%, менее 5 лет – 29%, 5-10
лет – 22%. Результаты выглядят следующим образом: 53% респондентов
ответили, что не всем пациентам
перед началом терапии антрациклинами выполняется ЭХО-КГ, из них
37% отметили в качестве причины
отсутствие технической возможности; 55% респондентов ответили,
что частота кардиотоксичности у
пациентов, получающих «простой»
доксорубицин, встречается в 1-10%
случаев; 37% респондентов имеют
опыт назначения пегилированного
липосомального доксорубицина, из
них 73% имеют опыт лечения мРМЖ
более 10 лет. Большинство назначают
ПЛД при HER2-негативном мРМЖ
(тройной негативный – 63%, люминальный тип – 49%), по 22% назначают пегилированный липосомальный
доксорубицин в 1 и 2 линиях терапии, 71% респондентов – в 3+ линии
терапии.
Девяносто восемь процентов респондентов отметили клинические
ситуации, при которых рассмотрели бы целесообразность применения пегилированного липосомального доксорубицина, а именно:
• 64% – у пациентов с сердечнососудистыми заболеваниями в анамнезе;
• 51% – при сниженной ФВЛЖ;
• 42% – у пациентов с развившейся кардиотоксичностью при лечении «простым» доксорубицином;
• 37% при достижении рекомендуемой кумулятивной дозы «простого» доксорубицина.
Таким образом, обсудив результаты клинических исследований,
данные международных рекомендаций и клинический опыт, Экспертный совет пришел к следующему заключению:
В качестве одной из терапевтических опций рекомендовать
рабочей группе рассмотреть
возможность включения пегилированного липосомального
доксорубицина в клинические
рекомендации МЗ РФ по лечению рака молочной железы для
пациенток с метастатическим
РМЖ, которым показана терапия
антрациклинами, при наличии
противопоказаний к назначению
традиционных антрациклинов.
КОМАндировка
Автор: Александр Евгеньевич Панкратов,
радиотерапевт, в прошлом — успешно практикующий педиатр.
Записки врача и фотографию считает неотъемлемой
частью своей жизни. «КОМАндировка» публикуется в сокращении.
Сельским врачам, фельдшерам
и медсестрам посвящается
Опять телефонный звонок оторвал меня от работы над историями болезней. Три телефона,
которые находятся в нашей ординаторской, трезвонят по очереди
в течение всего дня с интервалами от двух до пяти минут. Стоит
войти в кабинет, начинаешь ощущать себя диспетчером, а не врачом. Поднимаю трубку местного:
- Нейрохирургия, врач Степанов.
- Игорь Алексеевич, это Елена Васильевна (наш зам. главврача по детству), спуститесь ко мне быстренько.
- Иду.
Сейчас опять за что-нибудь
будут ругать. Ну и ладно, моя совесть чиста, и я ничего не боюсь,
даже увольнения. С пятого этажа
спускаюсь на первый.
В кабинете, кроме Елены Васильевны, сидел какой-то
плотный крупный выбритый
мужчина лет шестидесяти, который при моем появлении встал и
протянул мне руку
- Вот, Игорь Алексеевич,
познакомьтесь – главный врач
Абышинской ЦРБ, Мурад Закиевич. Игорь Алексеевич – наш хороший педиатр, очень легкий на
подъем. Надо поехать на месяц в
Абышино поработать педиатром
– Мурад Закиевич очень просит.
Мы пожали друг другу
руки. После непродолжительной
беседы и обсуждения условий я
дал согласие. Можно было, конечно, отказаться, но мне захотелось испытать на своей шкуре
работу сельского врача. Самый
большой минус – то, что останутся без меня мои пациенты,
но думаю, они поймут и простят,
порекомендую им на этот период
другого доктора. Придя домой, я
начал страшно сожалеть о своей
«легкости на подъем» и ее возможных последствиях, но слово сказано, дело сделано. Что ни
делается, все к лучшему. Друзья провожали меня как в ссылку.
ПРИЕЗД
Солнечное затмение

Дорога в район показалась
долгой и нудной. Километры на
счетчике спидометра прибавлялись очень медленно. Наконец я приехал в Абышино – центр самого дальнего района нашей области. Село было татарским. Увидев
первых встречных людей, я остановился и спросил, как проехать
к больнице. Пожилая татарка ответила: «Поезжай налево, потом
прямо, потом опять налево, сразу увидишь большой дом – это и
будет больница». Последовав рекомендациям, я выехал на окраину села. Признаков больницы не
обнаруживалось. После третьей
остановки и очередного вопроса: «Извините, а где находится
больница?», передо мной оказались табличка: «Место стоянки
авто медработников» и крылечко приемного покоя Центральной районной больницы. Потом
я убедился, что местные жители
постоянно путают слова «право»
и «лево». Пришлось учить татарский язык, по крайней мере,
самые необходимые мне слова и
выражения. В итоге, проехав 176
километров за 2,5 часа, я вошел в
двухэтажное здание стационара,
которое было построено в 1932
году, а совсем недавно подвергнуто, как это сейчас называется,
сайдингу, т.е. полностью облицовано рифленым железом и его
ярко синяя крыша была видна за
километр. В кабинете приемного
покоя меня встретил дежурный
врач – Ангам Сардарович. Как
только он услышал, что я врачпедиатр, приехавший к ним на
работу, он сразу вывел из кабинета двух экстренных больных,
а лицо медсестры расцвело в радушной улыбке. Познакомились.
Имена и отчества врача и медсестры – Сарии Рустамовны, пока
не забыл, сразу записал на клочок
бумаги. Пока ждали главного, дежурный доктор рассказал, что он
сам здесь недавно, всего несколько месяцев, по специальности он
дерматовенеролог, а при больнице состоит сейчас в должности
заместителя главного врача (по
каким-то там вопросам). Живет
он не в Абышино, а в Лапкино и
вынужден каждый день ездить на
работу за тридцать километров.
Впоследствии выяснился и резон,
ради которого терпится такое неудобство.
Ничего в этом мире не бывает просто так, и если человек добровольно обрекает себя на какие-то лишения, то, значит, впереди или позади этих лишений существует какая-то более значимая выгода.
Тем временем подошел вызванный по телефону главный
врач – Мурад Закиевич. Оказывается, он ждал меня еще с утра
и в течение дня не раз звонил
в больницу, справляясь о моем
приезде. Сели в машину и поехали смотреть мое жилье. Дорога была в ужасном состоянии,
всюду в асфальте были вырезаны
прямоугольные ямы глубиной на
четверть колеса. Через неделю
их заасфальтировали, и теперь
на этих местах оказались кочки.
Дорога являлась главной улицей
села и называлась улицей Свободы. Вдруг дорогу перегородила
корова, пришлось снизить скорость почти до нуля; сейчас как
раз был час, когда коровы возвращались по домам с выпаса. Коров,
их лепешки и ямы я старался по
возможности объезжать. Вдоль
улицы тянулись сначала одноэтажные дома, один из которых
был с двумя башенками из красного кирпича – дом судьи, потом
по одну сторону улицы расположились двухэтажки, больше похожие на двухуровневые гаражи,
а на противоположной стороне –
собственно, гаражи, сделанные из
товарных вагонов. Из одного вагона, если его разрезать пополам,
получается два гаража. Гаражи
принадлежали жильцам двухэтажек. Этот район села назывался
городок. Вот показался дом, в котором мне предстояло прожить
полтора месяца – трехэтажное,
трехподъездное здание – самое
высокое в селе и по местным понятиям достаточно престижное.
Обшарпанный панельный дом с
малюсенькими зарешеченными
балкончиками. Если бы со мной
не сидел главный врач, уверенно
показывавший дорогу, я бы ни
за что не подумал, что к подъезду можно проехать на машине по
тому довольно крутому спуску,
коряво выложенному бетонными
плитами, из которых торчала арматура. К тому же этот спуск был
сам не шире машины и заканчивался поворотом под углом в девяносто градусов. Мой подъезд средний. Этаж второй. Это оказалась двухкомнатная квартира
со всеми удобствами, холодильником, как потом выяснилось,
неработающим, телевизором,
видеомагнитофоном, музыкальным центром, которые работали, но были мне совершенно не
нужны. Квартира была в крайне
запущенном состоянии, видимо,
в ней не убирались около года, а
по всем столам валялись испорченные продукты, около десятка
колод игральных карт, стояли
початые бутылки с водкой и нераскупоренные с пивом, просроченным на несколько месяцев. У
разложенного дивана на ковре
валялся замусоленный сборник
кроссвордов, над всеми кроссвордами кто-то потрудился, но
были разгаданы лишь слова,
определение которых знает каждый детсадник; в слове «паром»
было две ошибки – «порром».
Затем поехали обратно в
больницу, на территории которой располагались капитальные
больничные гаражи, один из них
был предоставлен в мое личное
пользование.
Завтра к 8.00 на работу. Я опять вернулся на квартиру и выгрузил вещи, когда возвращался в гараж - уже стемнело, пришлось включить фары. Гараж оказался очень просторным – свободно уместился бы и грузовик. Пришлось немного повозиться, чтобы извлечь из салона автомашины привезенный из города велосипед, около 4-х часов назад на его погрузку ушел почти час. Но старания были оправданы – ездить на работу на велосипеде одно удовольствие, и от транспорта не зависишь, и время экономишь, и по пути делаешь зарядку. И вообще, велосипед – первый транспорт на деревне.
В первый день до работы
меня довез заведующий поликлиникой - Марат Талгатович.
Оказалось, что мы живем с ним в
соседних подъездах одного дома.
От дома до работы на машине 2
минуты езды, на велосипеде – 5,
пешком – 15. В последующие дни
я ездил на велосипеде или ходил
пешком, не считая тех случаев,
когда приходилось ездить на машине «скорой помощи».
Внутри больница оказалась очень старой, ветхой и давно не видевшей ремонта, но эта
убогость компенсировалась чистотой и приветливостью, опытностью и исполнительностью
персонала. Полы моются по пять
раз на дню, сестры в чистых выглаженных халатах. Из кранов
течет только холодная, просто ледяная артезианская вода, но зато
над каждой раковиной висит по
три – четыре чистых полотенца
– для рук врача, для рук медсестры и для перчаток. Перед каждой лестницей и в конце каждой
лестницы лежит чистая влажная
тряпка для обуви.
В дождливые дни все входящие в больницу, кроме персонала, разувались, оставляя свои ботинки, туфли и калоши практически на крыльце. На двери в детское отделение висит объявление «Вход в отделение без обуви». Напоминаний и грозных вахтеров не требовалось.
ЗНАКОМСТВА
В ординаторской меня
встретили доктора больницы
– Азалия Минзакиевна – врачофтальмолог, она же эндоскопист, самая бодрая, неунывающая и симпатичная, которая
только что обрадовалась, что в
следующем месяце ей поставили дежурства только через день.
Альмир Рахимович – анестезиолог-реаниматолог, в следующем
месяце дежурит каждый день и
анестезиологом-реаниматологом,
и хирургом, очень похож на почтальона Печкина, любит пошутить. Марат Талгатович – терапевт, невысокого роста, с усами,
удачно пародирует начальников,
пожалуй, самый умудренный
опытом и ответственный доктор.
Позже Марат Талгатович рассказывал: «Я после распределения
три года работал в тайге на зоне.
В радиусе пятисот километров
больше ни одного врача не было.
Мне все приходилось самому делать. И инфаркты лечить, и операции полостные выполнять,
одну даже пластическую сделал – пришил мочку уха, и зубы удалять, корни выдалбливал. Переживал сильно, дежурил у тяжелых больных, хотя, если помрет,
никто не спросит и не накажет.
Зэк? – Зэк. Тайга? – Тайга. – Никто не спросит, закопают в тайге и все. Но нас ведь учили быть
ответственными. Я, как приехал,
электрокардиограф себе выписал, сразу отвадил зэков под боли
в сердце «косить». Он придет, за
грудь держится, а я ему кардиограмму сниму и говорю, что все
тут нормально, враз поток «больных» уменьшился. Мог бы целый
роман автобиографический написать. Когда во врачебно-летной
комиссии в Свердловске работал, пришлось в пику летчикам
с парашютом прыгнуть. Четыре
прыжка сделал. При первом надколенник сломал, при последнем сотрясение мозга заработал.
Много интересного было». Азалия Рахимовна – гинеколог, она
же врач УЗИ, сестра Альмира
Рахимовича. Земфира Рафисовна – гинеколог, по-моему, больше
других разбирается в местной
жизни и может подсказать, кто
есть кто и что, где и как. Азалия
Николаевна – тоже гинеколог, параллельно, как я слышал, занимается каким-то бизнесом, связанным с общественным питанием.
Удивила меня тем, что постоянно
выковыривала из холодильника
лед в чашку и с удовольствием
его ела. Зимой лучшим лакомством для нее служат сосульки. В
общем, Азалий среди врачей так
же много, как и гинекологов, хотя
больница больше нуждается в
хирургах, которых нет ни одного.
После знакомства все разошлись
на обход по палатам. Детское отделение располагается на первом
этаже и, помимо коридора, представлено двумя палатами – на
шесть и на четыре койки.
На первый день у меня в
палате было четверо пациентов
– две лакунарные ангины, герпетическая ангина и острый обструктивный бронхит. Девочку с
лакунарной ангиной я выписал
на следующий день.
К одиннадцати часам, скорригировав назначения и оформив
истории болезней, я уже пошел на
амбулаторный прием в поликлинику. Поликлиника располагалась за три дома от больницы и,
в будущем, иногда приходилось
ходить с приема в поликлинике
в приемное отделение больницы,
чтобы оказать помощь и при необходимости госпитализировать
привезенного ребенка.
Медсестра педиатрического
кабинета, Римма Галеевна, оказалась очень опытной и полностью
заменяла районного педиатра в
периоды его отсутствия.
Работа в поликлинике на
селе в принципе ничем не отличается от работы в поликлинике
в городе. Пациентов было много, и все были больные. Очень
много детей страдало ангиной:
бегают по жаре, потом пьют ледяную воду из крана. Надо будет
по этому поводу оформить предупреждающий настенный бюллетень для родителей. Хотя я не
любитель санпросветработы, но
в данном случае, мне кажется, это
необходимо сделать.

В середине дня в кабинет
заглянул Альмир Рахимович, ведущий хирургический прием в
соседнем кабинете: «Игорь Алексеевич, какую дозу ампициллина
можно назначить двухлетнему
ребенку?».
В ближайшие дни все доктора под каким-нибудь предлогом заходили посмотреть, как у
меня идет работа.
Кроме ангины, приводили
детей с бронхитом, пневмонией,
стоматитом, ОРВИ, пиодермией, вегетососудистой дистонией,
головными болями, гастритами,
эпилепсией, малышей приносили
на прививки и профилактические осмотры. Для многих было
новостью, что трехмесячного ребенка нельзя поить коровьим молоком и кормить манной кашей.
Многие дети были пониженного
питания. Люди живут очень бедно. Пришлось вспоминать дозировки препаратов, которые в городе почти не используются, уже
устарели, но зато относительно
дешевы. Кого-то приходилось
класть в больницу только потому, что у родителей нет денег ни
на какие лекарства, даже самые
дешевые.
…
Завтра первое августа, суббота.
Успел постирать халат. Поглажу
завтра утром перед дежурством,
ведь не в восемь же утра за мной
приедут.
ПЕРВОЕ ДЕЖУРСТВО
В восемь утра я только проснулся,
что было легкой безответственностью. Только успел умыться,
как приехал водитель.
- Я за вами. – Эта фраза
звучала на протяжении месяца
еще много и много раз.
В приемном покое сидел
парень, с левой голени и бедра
которого полностью сошла обгоревшая кожа. Рядом сидел избитый мужчина. Обработали раны
первого, освидетельствовали
второго. Тут привели мальчишку,
у которого из раны на локте выделялся гной. Мне пока только приходилось ставить диагнозы и отдавать распоряжения. Медсестра
развела края глубокой колотой
раны зажимом, выпустила гной,
промыла рану, наложила повязку. Потом был дедушка с гипертоническим кризом и стенокардией, положил его в больницу.
Вроде бы пока все. Водитель отвез меня домой, и я наконец смог
позавтракать. После завтрака
достал из сумки мятый халат, который пришлось надевать неглаженым. Включил утюг. В дверь
постучали.
- Я за вами. – Утюг пришлось выключить, и положить
халат обратно в сумку
Приемное отделение представляло собой всего одну комнату, десять квадратных метров,
и малюсенький коридор, в котором умещался всего один стул и,
при необходимости, могли уместиться носилки, если убрать
стул. Комната по совместительству служила офисом «скорой
помощи», на подоконнике стояла
рация – связь с машиной скорой
помощи, телефон, который звонил, когда кто-то набирал «03»,
и кипы каких-то журналов. Второй телефон стоял на столе – это
была связь внутри села; чтобы
позвонить в другое село или город, приходилось заказывать
разговор через телеграфно-телефонную станцию. За эти сутки
мне пришлось три раза заказывать переговоры с областной
клинической больницей в городе
и трижды с ЦРБ Грачевки, автоматическая линия есть только у
главного врача. Вдоль одной из
стен тянулись шкафы с медикаментами, перевязочным материалом и прочими изделиями медицинского назначения. На шкафах
лежали ящики и чемоданчики с
надписями «Врачебно-сестринская укладка», «Противочумная
укладка», «Противохолерная
укладка» и тому подобное; стоял портативный электрокардиограф. У противоположной стены
расположились перевязочный
стол, сухожаровой шкаф и кушетка. Письменный стол стоял
торцом к окну.
На кушетке лежал мужчина
с гипертоническим кризом. Давление снижалось плохо, мы уже
применили весь арсенал имеющихся средств, которые могут
снизить давление – дибазол с папаверином, лазикс, адельфан, эуфиллин и магнезию. Клофелина
в больнице не было в принципе,
но он появился после моего выступления на очередной пятиминутке и содействия Азалии Минзакиевны. Только был достигнут
эффект, и пациенту стало лучше,
как фельдшер, Галина Ивановна,
привезла мужика с алкогольным
отравлением, в сопоре, судороги она купировала еще дома. В
этом случае мне пришлось, наоборот, поднимать давление, которое сейчас было 50 и 30 мм.рт.
ст. Обоих госпитализировали,
сделал назначения, наладили
инфузионные системы, а в приемное отделение жена привела
мужа с разрезанным пальцем –
ногтевая фаланга едва на чем-то
держалась. Мужчина работал с
электропилой. Лето на селе – период высокого травматизма, и
сегодня в этом я буду убежден
еще не раз. Обработали рану, а
водитель скорой помощи поехал
за Альмиром Рахимовичем, который в подобных случаях исполнял обязанности хирурга. Пока
Альмир Рахимович оперировал
палец, мы с Галиной Ивановной
поехали по очередному вызову.
Вообще-то, на скорой помощи
существует только фельдшерская
бригада, и доктора почти никогда
не выезжают к больному, но тут
был особый случай, а у меня было
время. У двадцатидевятилетнего
мужчины оказались очень деликатные жалобы – вторые сутки
не прекращалась эрекция. Ввели
анальгетики, спазмолитики – без
эффекта. Достаю сотовый телефон, с которым не расстаюсь ни
днем, ни ночью, звоню урологам
в город – у одного телефон отключен, второй не берет трубку,
третий ответил, это моя институтская подруга – Алина. Алина,
со своим кавказским темпераментом, сразу начала кричать:
- Игорь, это приапизм.
Немедленно отправляй в стационар в город.
Отвезли несчастного в приемное отделение – надо было
оформить направление, вызвали
водителя, который, как и я, дежурил на дому, и на втором «уазике»
отправили больного в город, в
больницу N1.
Альмир Рахимович зашил
распиленный палец, и мы опять
были развезены по домам. До
следующего обращения больного
в больницу.
Наконец я погладил халат.
Только повесил его на плечики –
стук в дверь.
- Я за вами.

Кладу халат в сумку. Теперь
не стыдно будет перед больными,
а то в мятом халате чувствовал
себя не в своей тарелке, правда,
в работе забывал про это, ладно
хоть в чистом. В институте, еще
на первом или втором курсе, наш
преподаватель анатомии, мудрейший человек, как-то сделал
замечание одному неряшливому
студенту в грязном халате:
- Халат может быть мятым,
может быть с заплатами, но всегда
должен быть чистым.
Это, наверное, как человек, подумалось мне сейчас, который может быть уставшим, может быть бедным, но всегда должен быть честным.
На этот раз в приемном покое сидел парень со льдом на левом предплечье – упал с сеновала
на пятую точку, в падении ударился рукой о балку. Летом здесь
падения с сеновала так же распространены, как зимой падения на
льду. Жалуется на головную боль,
головокружение, тошноту, сонливость.
Осмотрел пострадавшего – ушиб мягких тканей предплечья, сотрясение головного мозга. Парень стал утверждать, что головой не ударялся и очень удивился, узнав, что сотрясение можно «заработать», ударившись тем местом, которым он ударился.
Закон парных случаев, тут же «скорая» привезла сорокалетнего мужчину «подшофе» со дня рождения, с кровотечением из уха. Брат ударил трехлитровым чайником полным воды по голове – вся клиника сотрясения мозга, а когда сделали снимки черепа – перелом височной кости. Вызвал из города санавиацию, и через три часа ушибленного отправили в нейрохирургическое отделение областной больницы. Сам отправился пока домой.

Успел пообедать, или поужинать. Если судить по частоте принятия пищи – то пообедать, а если по времени суток – то, скорее, поужинать. Одним словом – поел. Не успел помыть посуду – тук-тук:
– Я за вами.
В приемном покое двое.
Снимки уже сделаны и сохнут на окне и на сухожаровом шкафе. На кушетке лежит мужчина средних лет – по
снимкам - перелом третьей плюсневой кости со смещением отломков, упал из кузова машины,
когда разгружал сено; на стуле сидит и стонет дед – перевернулся на
мотороллере, опять же сено вез,
да мотороллером по спине деду
и пришлось – отделался ушибом
позвоночника и мягких тканей
спины, приличным ушибом. Пока
первого отправляли в травматологическое отделение ЦРБ Грачевки,
а второго определили к себе, приехала машина санавиации – забрала перелом височной кости.
Кстати, интересно получается – служба называется санавиацией, но никакой авиацией не располагает. Дело в том, что раньше,
когда в области были непроезжие
дороги, у областной больницы
был договор с аэропортом и, при
необходимости отправляться в
район, аэропорт выделял вертолет
или самолет. Доктор ехал на аэродром на машине, затем летел до
места, возможно, близкой к селу
посадки. А дальше опять, в зависимости от дорожных условий и
удаленности от места посадки, на
машине, на санях, на бронетранспортере (были и такие случаи)
или пешком до больного. Бывало,
что зимой самолет на лыжах садился на поле, от самолета до дороги доктора везли на тракторе,
потом на машине. Когда лыжи самолета уходили под наст, летчики
откапывали их лопатами, а специально хранимой кувалдой сбивали
с них лед.
Звонок на «скорую». Поехали с Галиной Ивановной к температурящему ребенку. Ребенку оказалось восемнадцать лет, и был он
на голову выше меня. Температура
37,5. В комнате раздражающе мигала под потолком лампа дневного
света, покрутил лампу – перестала
мерцать, свет стал равномерным,
стало легче дышать. От госпитализации «ребенок» отказался, но
девяностолетняя бабушка Матрена, к которой он приехал погостить, просто рассыпалась в благодарностях за то, что приехали,
посмотрели, рекомендации дали,
лампу починили.
А в приемном покое тем временем ждал нашего возвращения
парень с орхоэпидидимитом. Болен второй день, приехал вчера
из города, где от госпитализации
отказался, а теперь хуже стало,
затемпературил высоко. Положили к себе в хирургическое отделение, которое пока держится
на анестезиологе – Альмире Рахимовиче. Как ни странно, парня
удалось вылечить консервативно.
Затем Галина Ивановна привезла
женщину с обострением хронического холецистита и гипертоническим кризом, давление было
двести сорок и сто тридцать. Что
было первичным, что вторичным
– сказать сложно, но однозначно
было взаимосвязано и поддерживало друг друга.
Сегодня был просто какойто день гипертонических кризов
и травматизма.
равматизма.
Время было около двенадцати ночи, когда милиционер привез мальчика пятнадцати лет. Ребенок был бледен и загибался от
боли в животе, стонал.
- Что болит?
- Живот сильно болит, – простонал мальчишка.
- Что случилось?
- Я шел мимо мечети и в
темноте провалился в какую-то
яму, ударился животом.
И чего ж их по ночам носит.
Спать уже пора.
- Ложись, посмотрю твой
живот. Живот был, как доска.
Милиционер тем временем рассказывал:
- Иду мимо мечети, в яме кто-то стонет. Достал – оказался сосед. Вот быстро привез, у меня машина рядом была.
- Не могу больше лежать – еще больнее живот. И ребенок, держась одной рукой за живот, другой за спинку стула, скрючившись, сел на кушетке. И тихо стонал. На лице было выражение нестерпимой боли. Сомнений не было – разрыв селезенки. Давление нормальное, гемодинамика стабильная.
Медсестра приемного покоя тут же взволнованно и тихо, чтобы не слышал ребенок, начала делиться историей:
- У него два месяца назад старшего брата похоронили. Поехал в город поступать в училище, там, на улице избили, в больнице умер. Родителям даже не сообщили, они его только через пять дней в морге нашли. А ведь у него при себе все документы были. Не дай бог с этим что случится, мать совсем с ума сойдет. Она у нас в регистратуре в поликлинике работает.

Пока созванивался через переговорный пункт с хирургом
из Грачевки, привезли Азалию
Рахимовну, она быстро сделала
УЗИ – селезенка и другие органы вроде бы целы, но в брюшной
полости много свободной жидкости. Давление нормальное, гемодинамика стабильная. Ребенку
хуже. В «уазике» решили не везти
– можно не довезти. До Грачевки,
где есть хирург и все условия для
проведения полостной операции,
шестьдесят пять километров, дорога – одна из бед России, плюс
ночная тьма. Разложили переднее
сиденье «десятки» – кто-то приехал из родственников – кое-как,
с величайшими предосторожностями и максимальной скоростью
разместили мальчика. Давление
нормальное, гемодинамика стабильная. Сопровождающей поехала медсестра – Галия-апа, хотя,
конечно, должен был сопровождать реаниматолог. Но весь район оставлять без реаниматолога и
без хирурга в его лице тоже было
нельзя.
НОВОСТИ ASCO 2022: ТРАСТУЗУМАБ ДЕРУКСТЕКАН ЭФФЕКТИВЕН ПРИ HER2-LOW РАКЕ МОЛОЧНОЙ ЖЕЛЕЗЫ. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ DESTINY-BREAST 04
DESTINY-Breast 04 – первое исследование, в котором продемонстрирована эффективность трастузумаба
дерукстекана в поздних линиях терапии при диссеминированном раке
молочной железы (РМЖ).
HER2-low рак молочной железы
представляет собой молекулярный
подтип РМЖ, характеризующийся
низким уровнем экспрессии рецептора HER2 (ИГХ 1+ или ИГХ2+/FISH
отрицательный) (рис.1)
Рисунок 1.
HER2-low рак
молочной железы.

Исследование DESTINY-Breast 04
– многоцентровое исследование 3
фазы, в котором пациенты с HER2-
low диссеминированным РМЖ
в поздних линиях лечения получали
трастузумаб дерукстекан 5,4 мг/кг
или терапию по выбору исследователя (капецитабин, эрибулин, гемцитабин, наб-паклитаксел).
• Первичной конечной точкой исследования была медиана ВБП при гормонопозитивном (ГР+) РМЖ, вторичными – медиана ВБП в общей группе больных и общая выживаемость.
• В когорте ГР+ РМЖ назначение трастузумаба дерукстекана позволило достигнуть медианы ВБП в 10,1 мес. против 5,4 мес. при терапии по выбору исследователя (p<0,0001) (рис.2).
• В общей группе пациентов назначение трастузумаба дерукстекана позволило достигнуть медианы ВБП в 9,9 мес. против 5,1 мес. при терапии по выбору исследователя (p<0,0001) (рис.2).
Рисунок 2.
Выживаемость без прогрессирования.
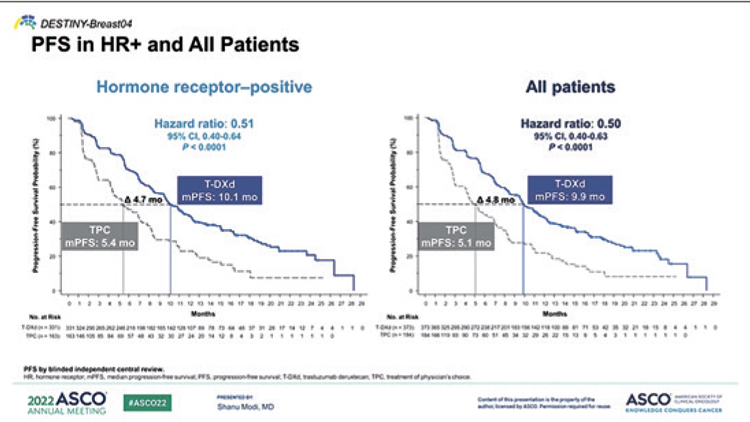
• Медиана общей выживаемости в группе трастузумаба дерукстекана при ГР+ РМЖ достигла 23,8 мес., а в группе терапии по выбору исследователя – 17,5 мес. (p=0,0028) (рис.3).
• Назначение трастузумаба дерукстекана в сравнении со стандартной терапией позволило увеличить и медиану общей выживаемости во всей группе пациентов с 16,8 до 23,4 мес. (p=0,0010) (рис.3).
Рисунок 3.
Общая выживаемость.
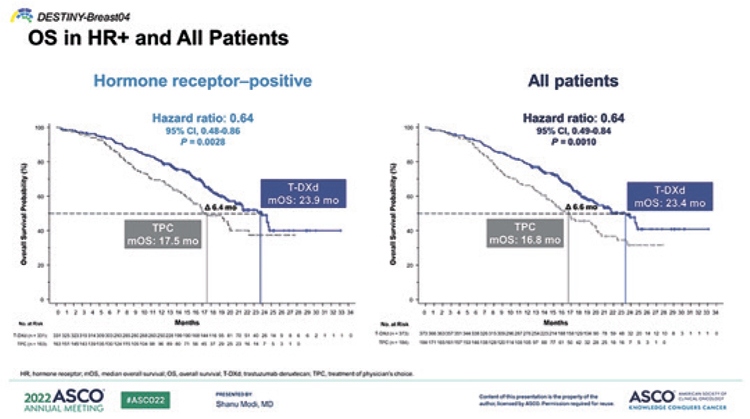
• Спектр нежелательных явлений
оказался управляемым и ожидаемым в группах трастузумаба дерукстекана и терапии по выбору
исследователя и был преимущественно представлен тошнотой
(73% и 24%), слабостью (48% и
42%), алопецией (38% и 33%),
рвотой (34% и 10%), анемией (33%
и 23%), снижением аппетита (29%
и 16%), тромбоцитопенией (24% и
9%), повышением уровня АСТ и
АЛТ (24% и 23%) и запорами (21%
и 13%) соответственно.
• Частота пневмонитов любой
степени выраженности в когорте
трастузумба дерукстекана составила 12,1%: 1 степени – 3,5%,
2 степени – 6,5%, 3 – 1,3%, 4 – 0, 5
степени – 0,8%.
Результаты исследования DESTINYBreast 04, без сомнения, стали одним
из наиболее ярких событий ASCO
2022.
НОВОСТИ ASCO 2022: НОВЫЕ ПЕРСПЕКТИВЫ, НОВЫЕ МИШЕНИ ТАРГЕТНОЙ ТЕРАПИИ. ЭРДАФИТИНИБ – ИНГИБИТОР FGFR1-4. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ RAGNAR
Рецепторы фактора роста
фибробластов (FGFR)
У человека описано 4 функционально активных рецептора FGFR
(FGFR1-4). Сигнальный путь FGF/
FGFR играет важную роль в таких
процессах онтогенеза, как появление зародышевых листиков, закладка нервной трубки и формирование
конечностей, а в более поздний период – ангиогенеза и ремоделирования сосудистой сети. Активация рецепторов семейства FGFR приводит
к индуцированию MAPK-каскада
(RAS–RAF–MEK1/2– ERK1/2) и
PI3K–AKT. Мутации и реанжировки в гене FGFR приводят к активации сигнального пути FGF/FGFR.
Эрдафитиниб – селективный пероральный pan-FGFR ингибитор,
утвержденный в США и 13 других
странах на основании результатов
исследования 2BLC2001 в качестве
опции терапии при уротелиальной
карциноме c альтерацией в гене
FGFR. В работе 2BLC2001 было продемонстрировано, что назначение
эрдафитиниба в этой группе больных позволяет достигнуть ЧОО 40%
при КРО в 80% (рис.2).
Рисунок 1.
Строение рецептора фактора роста
фибробластов.
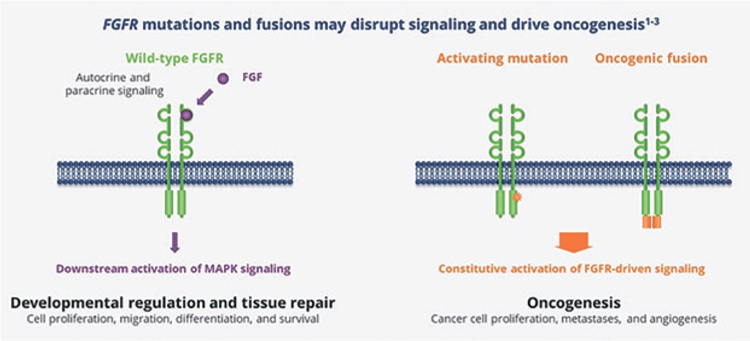
Рисунок 2.
Эффективность
эрдафитиниба при
уротелиальной карциноме
c альтерацией в гене FGFR.
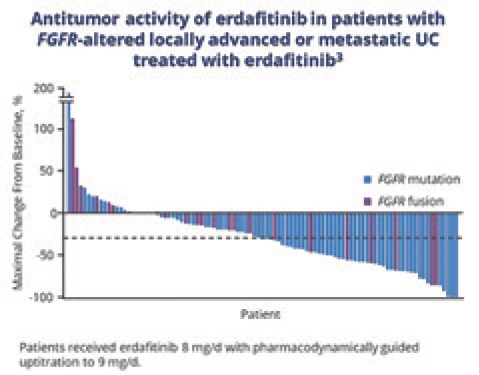
Исследование RAGNAR – многоцентровое, мультикогортное исследование, в котором изучалась
эффективность эрдафитиниба у 178
пациентов с различными подтипами солидных опухолей с альтерациями гене FGFR (мутации, реанжировки, gene fusion).
В работу было включено 178 больных старше 6 лет, в анамнезе у
которых была хотя бы 1 линия
лекарственного лечения по поводу диссеминированного злокачественного новообразования. У 56
пациентов (31,5%) была выявлена
мутация в гене FGFR и у 122 (68,5%)
– gene fusion.
Первичной конечной точками была
частота объективного ответа (ОО),
вторичными – длительность ответа,
контроль роста опухоли (КРО), медиана выживаемости без прогрессирования (ВБП) и общая выживаемость (ОВ).
Из 178 пациентов, включенных в
исследование, у 17% была верифицирована холангиокарцинома, у
16% – глиома высокой степени злокачественности, у 8% – рак молочной железы и у 7% – рак поджелудочной железы (рис.3).
Рисунок 3.
Характеристика
пациентов, включенных
в исследование.
Результаты, представленные на
конгрессе ASCO2022, многообещающие. При медиане времени наблюдения в 11 месяцев:
КРО более 4 мес. достигнут у 48,9% пациентов, при медиане длительности ответа в 7,1 мес. (рис.4);
Рисунок 4.
Эффективность
терапии эрдафитинибом.
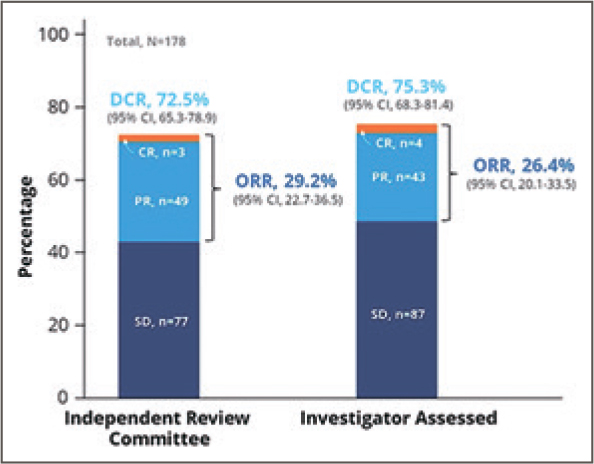
медиана ВБП составила 5,2 мес., при медиане ОВ в 10,9 мес.
При оценке эффективности терапии в зависимости от нозологии объективный ответ в 100% случаях достигнут при раке щитовидной железы, двенадцатиперстной кишки и слюнной железы. При раке молочной железы и холангиокарциноме частота ОО достигла 42,9% и 41,9%, при КРО – 71,4% и 90,3% соответственно. (рис.5).
Рисунок 5.
. Эффективность терапии эрдафитинибом
в зависимости от гистологического подтипа опухоли.
Токсичность терапии была характерной для этого класса препаратов; так, гиперфосфатемия любой степени была выявлена у 68,5% пациентов при гиперперфосфатемии 3 степени и выше у 5,6% больных, диарея – у 57,9% и 4,5%, стоматит – у 52,8% и 9,0%, сухость в ротовой полости – у 48,3% и 0,6%, сухость кожи – у 33,7% и 1,7%, ладонно-подошвенный синдром – у 32,0% и 6,2% и запоры – у 30,3% и 1,1% соответственно.
Источник:
Yohann Loriot, Martin
H. Schuler, Gopa Iyer, et al. Tumor
agnostic efficacy and safety of erdafitinib
in patients (pts) with advanced solid
tumors with prespecified fibroblast growth
factor receptor alterations (FGFRalt) in
RAGNAR: Interim analysis (IA) results.
3007 Oral Abstract Session ASCO 2022.
ASCO 2022: ЧТО ТАМ НОВОГО В ОНКОГИНЕКОЛОГИИ?
Автор: Румянцев Алексей Александрович
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава
России, кандидат медицинских наук, Москва
В июне 2022 года традиционно
прошел очередной конгресс Американского общества клинической онкологии – ASCO 2022. В
ходе прошедшего мероприятия
были представлены результаты
ряда исследований в лечении
онкогинекологических заболеваний.
«Поддержка» рукапарибом
после первоначального
лечения распространенного
рака яичников:
исследование III фазы
ATHENA-MONO
Результаты рандомизированного
исследования III фазы ATHENAMONO (n=538) продемонстрировали эффективность применения
ингибитора PARP рукапариба в
качестве поддерживающей терапии распространенного рака
яичников (РЯ). Включались пациентки с III-IV стадиями РЯ,
после первичной или интервальной циторедукции, завершившие
первую линии системной химиотерапии, рандомизация осуществлялась в соотношении 4:1 в
группу рукапариба или плацебо.
Стратификация осуществлялась
в соответствии с HRD-статусом
пациенток (по FoundationOne
CDx), по типу циторедукции
(первичная или интервальная) и
наличию резидуальной опухоли
после химиотерапии. Первичной
конечной точкой исследования
была выживаемость без прогрессирования (ВБП) с последовательной оценкой ВБП в группе
HRD+ пациенток и в общей популяции пациенток. Одновременно
с докладом результатов исследования на ASCO 2022 результаты
исследования были опубликованы в Journal of Clinical Oncology
[1].
По результатам исследования медиана ВБП среди HRD+ пациенток составила 28,7 мес. в группе
рукапариба по сравнению с 11,3
мес. в группе плацебо (отношение
рисков [ОР] 0,47; p=0,0004), а в
общей популяции исследования
– 20,2 и 9,2 мес. соответственно
(ОР 0,52; p<0,0001). Примечательно, что среди HRD-негативных пациенток (то есть с отсутствием
мутаций в генах BRCA1/2 и других нарушений гомологичной
рекомбинации) также было выявлено улучшение результатов в
группе рукапариба по сравнению
с плацебо – медиана ВБП составила 12,1 и 9,1 мес. соответственно (ОР 0,65; pnominal = 0,0284).
Почему это интересно: еще один
ингибитор PARP продемонстрировал свою эффективность в
поддерживающей терапии рака
яичников после первоначального
лечения, причем «за пределами»
мутаций в генах BRCA1/2. Кроме
того, ATHENA-MONO является
первой частью проекта исследований ATHENA – в рамках его
«второй половинки», ATHENACOMBO, изучается эффективность комбинации рукапариба и
ниволумаба в той же популяции
пациенток [2].
MITO-23: эффективность
поддерживающей
терапии трабектедином
при рецидивах BRCAассоциированного
РЯ или РЯ с «BRCAподобным» фенотипом
– рандомизированное
исследование III фазы
В исследование MITO-23 включались пациентки с рецидивами BRCA-ассоциированного
рака яичников или с т.н. «BRCAподобным» (BRCAness) фенотипом, который определялся как
последовательный ответ на ≥2
или более линий платиносодержащей химиотерапии. Рандомизация осуществлялась 1:1 в
группу трабектедина 1,3 мг/м2
каждый 21 день или в группу химиотерапии по выбору лечащего
врача (гемцитабин, паклитаксел,
пегилированный липосомальный доксорубицин, топотекан
или карбоплатин) Первичной
конечной точкой исследования
была общая выживаемость (ОВ),
вторичные конечные точки
включали ВБП, частоту объективного ответа (ЧОО), профиль
безопасности терапии. Всего в
исследование было включено 244 пациентки. По результатам исследования медиана ОВ составила 15,8 мес. в группе трабектедина
по сравнению с 17,9 мес. в группе
стандартной химиотерапии (ОР
1,15; p=0,304), медиана ВБП – 4,9
и 4,4 мес. соответственно (ОР
1,03; p=0,848). Преимуществ применения трабектедина не было
выявлено ни в одной из подгрупп
пациенток, включая подгруппу
пациенток с мутациями BRCA1/2
[3].
Почему это интересно: в результате ранее проведенных исследований была сформулирована
гипотеза, что трабектедин может быть эффективнее неплатиновой химиотерапии в лечении
BRCA-ассоциированного РЯ. Результаты исследования MTO-23
опровергают эту гипотезу – трабектедин оказался не лучше химиотерапии в контрольной группе.
Бевацизумаб в первой линии
терапии распространенного
светлоклеточного рака
яичников: многоцентровое
ретроспективное
исследование
На ASCO 2022 были представлены результаты многоцентрового
ретроспективного исследования,
посвященного изучению эффективности добавления бевацизумаба к первоначальной терапии
распространенного (III/IV) светлоклеточного РЯ, проведенного
в Японии. Всего в работу было
включено 145 пациенток, сформированные группы были сбалансированы по основным характеристикам. По результатам
исследования медиана ВБП составила 29,7 мес. в группе бевацизумаба по сравнению с 12,5 мес. в
контрольной группе (p=0,023),
медиана ОВ – 51,4 мес. и 34,7 мес.
соответственно (p=0,085). При
проведении многофакторного
анализа применение бевацизумаба достоверно увеличивало ВБП
(ОР 0,55; p=0,011) и ОВ пациенток
(ОР 0,54; p=0,019) [4].
Почему это интересно: распространенный светлоклеточный РЯ
характеризуется неблагоприятным прогнозом по сравнению с
другими гистотипами этого заболевания. Отсутствие результатов
рандомизированных исследований еще более затрудняет лечение
данной категории пациенток. Это
исследование показывает, что
применение бевацизумаба в составе первой линии противоопухолевой терапии может улучшать
отдаленные результаты лечения
этого заболевания. Безусловно,
необходимы дальнейшие «проверочные» исследования в данной
области, но будут ли они проведены? А пока – можно пользоваться тем, что есть.
Неоадъювантная
терапия абемациклибом
и фулвестрантом при
нерезектабельном low-grade
раке яичников: пилотное
исследование II фазы
Были представлены результаты
небольшого исследования II фазы
(n=15), посвященного изучению
эффективности неоадъювантной
терапии комбинацией фулвестранта и ингибитора CDK4/6 абемациклиба при нерезектабельном
РЯ низкой степени злокачественности (low-grade) у пациенток, которые ранее не получали противоопухолевой терапии. Включенным
пациенткам проводилась терапия
фулвестрантом 500 мг в/м каждые
28 дней (1 курс – день 1, 15) в сочетании с абемациклибом 150 мг
внутрь 2 раза в день ежедневно.
Пациентки в пременопаузе дополнительно получали гозерелин
с целью овариальной супрессии.
Терапия проводилась до достижения резектабельности опухолевого процесса или прогрессии
заболевания, после выполнения
хирургического этапа лечения
проводилось еще 4 курса терапии
абемациклибом и фулвестрантом,
далее – поддерживающая терапия
летрозолом. При выявлении прогрессирования назначалась стандартная химиотерапия [5].
По результатам исследования у 7
(47%) пациенток был достигнут частичный ответ, у 5 (33%) пациенток – стабилизация процесса.
Среди «ответивших» пациенток
на момент сбора данных у 3 была
выполнена интервальная циторедукция, у всех удалось достичь
полного удаления всех видимых
проявлений заболевания.
Почему это интересно: low-grade
рак яичников, как и другие «редкие» гистотипы этого заболевания, нечасто попадает в поле
зрения исследователей. Неоадъювантная эндокринотерапия комбинацией абемациклиба и фулвестранта позволила достичь крайне
высоких показателей частоты объективного ответа при исходно нерезектабельном опухолевом процессе. Результаты этой небольшой
«пилотной» работы, естественно,
не изменят нашу практику лечения данной категории пациенток,
но могут способствовать проведению более масштабных исследований в данной области – напомним,
что на фоне «стандартной» химиотерапии частота объективного ответа при low-grade раке яичников
составляет около 10%.
Эффективность терапии
олапарибом и прогноз
в зависимости от
«локализации» мутаций
в генах BRCA1/2
В подгрупповом анализе исследования III фазы PAOLA (n=806, в
т.ч. BRCAmut=235), в котором оценивалась эффективность поддерживающей терапии олапарибом
и бевацизумабом после первой
линии терапии РЯ, было показано, что эффект ингибиторов PARP
может зависеть от расположения
мутации в структуре гена. Авторы работы продемонстрировали, что пациенты с мутациями в
ДНК-связывающем домене BRCA1
могут иметь наибольшие преимущества от применения олапариба. В то же время, пациентки с
аналогичными мутациями в гене
BRCA2 характеризовались благоприятным прогнозом вне зависимости от применения олапариба
(таблица) [6].
Таблица. Эффективность терапии олапарибом в зависимости от локализации мутаций в генах BRCA1/2
Почему это интересно: любопытные данные, показывающие, что
популяция пациенток с BRCAассоциированным раком яичников также может являться гетерогенной с точки зрения прогноза
и чувствительности к различным
терапевтическим агентам. Ждем
дальнейших работ в этой области.
Анализ «генетического
портрета» светлоклеточных
опухолей
На ASCO 2022 были представлены результаты крупного исследования (n=861), посвященного
геномному анализу различных
злокачественных светлоклеточных опухолей женской репродуктивной системы и почечноклеточного рака. В исследование
были включены образцы светлоклеточного рака почки (30,5%),
яичников (39%), эндометрия
(23,9%) и других локализаций
(3,3%), была проанализирована
экспрессия 648 генов, участвующих в регуляции различных
метаболических процессов (ангиогенез, гликолиз, оксидативное
фосфорилирование, гипоксия,
метаболизм жирных кислот).
Результаты исследования продемонстрировали, что светлоклеточный рак почки явно отличается от остальных «похожих»
новообразований, а различные
светлоклеточные опухоли женской репродуктивной системы
практически неотличимы друг от
друга с точки зрения своего «генетического портрета» [7].
Почему это интересно: светлоклеточные опухоли характеризуются высокой агрессивностью течения и низкой чувствительностью к традиционной противоопухолевой терапии. Результаты недавно представленного подгруппового анализа исследования Study 309, посвященного изучению эффективности терапии комбинацией ленватиниба и пембролизумаба при рецидивах рака эндометрия (РЭ), показали высокую эффективность этой комбинации при светлоклеточном варианте РЭ – медиана общей выживаемости составила 19,9 мес. группе иммунотаргетной терапии по сравнению с 8,7 мес. в группе стандартной химиотерапии (ОР 0,34; 95% ДИ 0,15-0,78) [8]. Возможно ли экстраполировать эти данные на другие светлоклеточные опухоли репродуктивной системы? Вероятно, да – необходимы дальнейшие исследования.
Источники:
1. Monk BJ, et al. A Randomized, Phase III Trial to Evaluate Rucaparib Monotherapy as Maintenance Treatment in Patients With Newly Diagnosed Ovarian Cancer (ATHENA–MONO/GOG3020/ENGOT-ov45). J. Clin. Oncol. 2022. JCO.22.01003. doi:10.1200/ JCO.22.01003.
2. Monk BJ, et al. ATHENA (GOG3020/ENGOT-ov45): a randomized, phase III trial to evaluate rucaparib as monotherapy (ATHENA-MONO) and rucaparib in combination with nivolumab (ATHENACOMBO) as maintenance treatment following frontline platinum-based chemotherapy in ovarian cancer. Int. J. Gynecol. Cancer. 2021; 31: 1589- 1594.
3. Scambia G, et al. Randomized phase III trial on trabectedin (ET743) single agent versus clinician’s choice chemotherapy in recurrent ovarian, primary peritoneal, or fallopian tube cancers of BRCAmutated or BRCAness phenotype patients (MITO23). doi:10.1200/ JCO.2022.40.17_suppl.LBA5504.
4. Seki T, et al. Bevacizumab in first-line chemotherapy to improve the survival outcome for advanced ovarian clear cell carcinoma: A multicenter, retrospective analysis. doi:10.1200/JCO.2022.40.16_ suppl.5502.
5. Cobb LP, et al. A pilot phase II study of neoadjuvant fulvestrant plus abemaciclib in women with advanced low-grade serous carcinoma. doi:10.1200/JCO.2022.40.16_ suppl.5522.
6. Labidi-Galy SI, et al. Efficacy of maintenance olaparib plus bevacizumab in patients with newly diagnosed advanced ovarian cancer according to BRCA mutation genotype in the phase III PAOLA-1/ENGOT-ov25 trial. J. Clin. Oncol. 2022; 40: 5571-5571.
7. Haribhakti N, et al. Genomic analysis of clear cell carcinoma. J. Clin. Oncol. 2022; 40: 5548-5548.
8. Colombo N, et al. Outcomes by
Histology and Prior Therapy With
Lenvatinib Plus Pembrolizumab vs
Treatment of Physician’s Choice in
Patients With Advanced Endometrial
Cancer (Study 309/KEYNOTE-775).
doi:10.1016/j.annonc.2021.08.1169.
ПРЕПАРАТЫ ПЛАТИНЫ В НЕОАДЪЮВАНТНОЙ ТЕРАПИИ ТРОЙНОГО НЕГАТИВНОГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ. КОГДА ПОРА ПОСТАВИТЬ ТОЧКУ В ДИСКУССИИ?
Автор: Глазкова Елена Владимировна
Заведующая онкологическим отделением противоопухолевой лекарственной терапии
ГБУЗ «ММКЦ «Коммунарка» ДЗМ», кандидат медицинских наук, Москва
Важность проведения неоадъювантной химиотерапии при
тройном негативном раке молочной железы сегодня уже не
вызывает бурных дебатов среди
онкологов. При этом роль препаратов платины в режимах неоадъювантной химиотерапии
рака молочной железы регулярно
обсуждается, но единого мнения
экспертов по данному вопросу
так и не получено.
Достижение полной патоморфологической регрессии является
одной из основных целей проведения неоадъювантной химиотерапии при тройном негативном
раке молочной железы, данный
подход позволяет нам не только
оценить прогноз пациентки, но
и индивидуализированно эскалировать адъювантную терапию
для больных, не достигших полной патоморфологической регрессии.
Мы располагаем данными нескольких рандомизированных
исследований, в которых изучался вклад препаратов платины в
вероятность достижения полной
патоморфологической регрессии
при тройном негативном раке
молочной железы. В исследовании GeparSixto карбоплатин
был добавлен к комбинации паклитаксела, непегилированного
липосомального доксорубицина,
а также бевацизумаба для части
больных. Добавление карбоплатина позволило увеличить частоту достижения полной патоморфологической регрессии с 36,9%
до 53,2% (р=0,005), что привело
к увеличению 3-летней безрецидивной выживаемости с 75,8%
до 86,1% (р=0,024), однако достоверных различий в 3-летней
общей выживаемости получено
не было. Ожидаемо, добавление
карбоплатина в комбинацию
неоадъювантной ХТ было ассоциировано с повышением гематологической токсичности, в
частности, тромбоцитопении 3-4
степени до 14% [1].
В исследовании III фазы
BrighTNess пациентки с тройными негативными опухолями молочной железы были разделены
на следующие группы терапии:
• паклитаксел 80 мг/м2 еженедельно, 12 введений;
• паклитаксел 80 мг/м2 + карбоплатин AUC2 еженедельно, 12
введений;
• паклитаксел 80 мг/м2 + карбоплатин AUC2 еженедельно, 12 введений + велипариб 100 мг/ сут. ежедневно/плацебо.
• Второй этап химиотерапии
предполагал проведение 4 курсов антрациклин-содержащей
терапии.
Дизайн данного исследования
подразумевал сравнение частоты достижения полной патоморфологической регрессии между
группами монотерапии паклитаксела и комбинацией паклитаксела, карбоплатина и велипариба,
а также группы паклитаксела и
карбоплатина против комбинации с исследуемым препаратом.
Таким образом, мощность исследования не предполагала оценки
вклада карбоплатина в частоту
достижения пПР в сравнении с
монотерапией паклитакселом.
Частота достижения пПР на фоне
применения паклитаксела составила 31%, в группе комбинации паклитаксела, карбоплатина
и велипариба – 58% (р<0,0001).
Частота достижения полной патоморфологической регрессии в
группе терапии паклитакселом
и карбоплатином составила 53%,
но говорить о статистической
значимости очевидных различий
мы не могли [2].
В 2021 году на конгрессе ESMO
были представлены результаты
4-летней бессобытийной выживаемости пациенток, принявших участие в исследовании
BrighTNess. 4-летняя бессобытийная выживаемость в группе
терапии паклитакселом составила 68,5%, а в группе комбинации
с карбоплатином – 79,3% (р=0,02),
при этом достоверных различий
в общей выживаемости в течение
периода наблюдения не получено. Данные об отсутствии увеличения общей выживаемости, а
также значительное повышение
токсичности терапии при добавлении нового агента значительно снижали позиции препаратов
платины в неоадъювантных режимах ХТ раннего тройного негативного РМЖ [3].
В апреле 2022 года опубликованы
результаты метаанализа 8 рандомизированных исследований
(2425 пациенток) применения
препаратов платины в неоадъювантной ХТ тройного негативного РМЖ [4].
По данным метаанализа, применение карбоплатина в режимах
неоадъювантной ХТ тройного
негативного РМЖ позволяет снизить риск рецидива на 40% (HR
0,66; р<0,001). Отдельного внимания заслуживают обобщенные
данные по общей выживаемости
пациенток данных исследований.
Применение препаратов платины
приводит к достоверному увеличению общей выживаемости
при тройном негативном РМЖ
(HR 0,68; p=0,02; рис.1). Таким образом, сегодня мы располагаем
достаточным количеством данных, чтобы говорить о важности
проведения платиносодержащей
химиотерапии при данном агрессивном подтипе рака молочной
железы.
Рисунок 1.
Обобщенные данные ОВ и БРВ метаанализа
N. Pathak и соавт. [4]
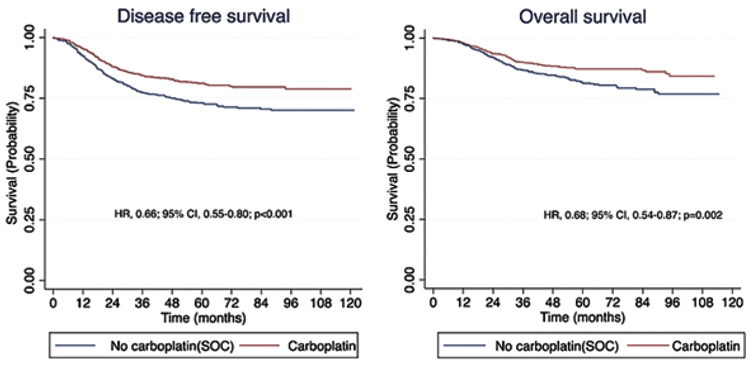
Источники:
1. S. Loibl, et al. Survival analysis of carboplatin added to an anthracycline/taxane-based neoadjuvant chemotherapy and HRD score as predictor of response – final results from GeparSixto. Ann Oncol. 2018; 29: 2341-2347.
2. Loibl S, et al. Addition of the PARP
inhibitor veliparib plus carboplatin
or carboplatin alone to standard
neoadjuvant chemotherapy in triplenegative breast cancer (BrighTNess):
a randomised, phase 3 trial. The
Lancet Oncology. 2018; 19: 497-509.
КЛИНИЧЕСКИЕ И ПОВЕДЕНЧЕСКИЕ СИМПТОМЫ У ПАЦИЕНТА, СООБЩАЮЩИЕ О НЕОБХОДИМОСТИ КОНСУЛЬТАЦИИ ПСИХОЛОГА
Автор: Вагайцева Маргарита Валерьевна
Кандидат психологических наук, медицинский психолог СПб ГКУЗ «Хоспис №1», Лахта,
клинический психолог отделения реабилитации ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» МЗ РФ,
директор Ассоциации онкопсихологов СевероЗападного региона
Дисциплина «Онкопсихология» в
нашей стране пока еще не включена в программу обучения врача
онколога, но существуют программы повышения квалификации врачей в области психологии
в онкологии. Такое повышение
квалификации предполагает как
освоение навыков профилактики вторичной психологической
травмы, так и формирование
представления о симптомах, сигнализирующих о целесообразности привлечения медицинского
психолога, специализирующего в
направлении «Онкология».
В ведущих профильных организациях медицинские (клинические) психологи входят в штатное
расписание мультидисциплинарной бригады отделения реабилитации. Сегодня деятельность
медицинских психологов становится более регламентированной.
Пишутся внутренние «Стандарты оказания помощи» (СОП),
иногда их называют «Стандарты операционных действий».
СОПы – это внутренние регламентирующие документы, которые доступны всем сотрудникам
организации и призваны также
улучшать межпрофессиональное
взаимодействие в коллективе. В
СОПах прописываются цели, задачи, ведущие методы и основные
техники оказания каждого вида
психологической помощи. Также
описываются маркеры применения метода. Из СОПа врач может
почерпнуть, какие клинические
или поведенческие симптомы
говорят о целесообразности, а зачастую необходимости направления пациента на консультацию
онкопсихолога.
Пациенты с онкологической патологией – это люди, которые
живут в условиях постоянного
и повторяющегося воздействия
травматических стрессоров, иными словами, в ситуации пролонгированного дистресса.
Дистрессом принято называть
состояние страдания, то есть
чрезвычайного эмоционального
напряжения, при котором человек не может полностью адаптироваться к стрессовым факторам,
обусловленным трудной жизненной ситуацией. Дистресс несет в
себе высокий риск дезадаптации.
Принято считать, что дистресс –
это фактор, существенно влияющий на качество жизни пациента.
Психологические исследования
показывают, что онкологические
больные не утрачивают свой психический статус под влиянием
ситуации заболевания, то есть
сохраняют сознание в пределах
собственной индивидуальной
нормы. При этом онкологические
больные почти постоянно живут
в ситуации высокого уровня неопределенности, обусловленной
слабой предсказуемостью течения
заболевания. Собственно, фактор
неопределенности перспективы
лечения тяжелого хронического
заболевания с высоким уровнем
витальной угрозы и приводит к
формированию чрезвычайного
эмоционального напряжения в
длительном периоде – дистрессу.
Исследования показали, что у
большинства онкологических
больных дистресс предъявляется в виде непатологических
эмоциональных реакций. Таких,
например, как растерянность,
подавленность, беспокойство,
тревога, страх. Непатологические
эмоциональные реакции являются эмоциональными состояниями, которые адекватны ситуации,
носят кратковременный характер
и обратимы, то есть не приводят
к устойчивым психическим повреждениям. Оговоримся только,
что речь идет о людях, не имеющих психической патологии в
анамнезе.
При проявлениях непатологических эмоциональных реакций
сохраняются работоспособность
человека, критичность его к себе
и способность к коммуникации.
При этом человек испытывает
постоянное воздействие травматических стрессоров – угроза
жизни, отсутствие гарантий выздоровления, побочные эффекты
лечения и изменения социального статуса. У каждого этапа течения онкологического заболевания наблюдается специфическая
для этапа дистрессирующая нагрузка, которая может приводить
к дезадаптации. Помощь людям
в ситуации дистресса при выявлении непатологических эмоциональных реакций оказывают
медицинские психологи. В нашем
случае это медицинские психологи с повышением квалификации
в области онкологии – онкопсихологи.
Чаще всего онкологические пациенты слабо сориентированы в
возможностях онкопсихологии и
слабо мотивированы к обращению за таким видом помощи. При
этом известно, что дезадаптированный человек непроизвольно оказывает влияние на свое
окружение, подкрепляя реакции
избегания у потенциальных носителей онкологического заболевания.
Таким образом, роль врача онколога в профилактике мифологизации рака в первую очередь проявляется в своевременной маршрутизации потенциально дезадаптивного онкологического пациента за получением психологической помощи как на стационарном лечении, так и в ходе амбулаторного приема.
Итак, каковы маркеры целесообразности назначения консультации онкопсихолога.
В первую очередь это ситуации,
требующие диагностики суицидальных рисков: ампутации
конечностей, молодой возраст,
угроза жизни, риск утраты значимого лица (мать ребенка с онкологической патологией). В этих
случаях онкопсихолог проводит
минимальную диагностику и
предоставляет заключение, включающее оценку суицидального
риска у пациента.
Симптомы
клинические
Ни один врач не пропустит выраженные симптомы – тахикардию, гипервентиляцию, дезориентацию, спутанность, яркие
аффективные проявления, выраженное снижение контроля
импульсов, выраженные проявления нарушений работы мозга. Также очевидны проявления
острой реакции на стресс, то есть
— транзиторное расстройство
значительной тяжести, которое
развивается у лиц без видимого
психического расстройства в ответ на исключительный физический и эмоциональный стресс.
Такие состояния обычно проходят в течение нескольких часов
или дней и могут оказаться вне
поля наблюдения врача онколога.
Важно помнить, что в случае
онкологического заболевания
транзиторное расстройство значительной тяжести может носить
не единичный характер и иметь смешанную и меняющуюся картину, когда ни один из симптомов не преобладает длительно, но
синдром способен закрепляться
и своеобразно предъявлять себя
в зависимости от преморбидных
особенностей личности пациента.
Выше мы уже упоминали о том,
что онкологические пациенты –
это люди без выраженной клинической симптоматики эмоциональных нарушений, которые
чаще имеют достаточный когнитивный резерв и способность
к рационализации и анализу.
Тяжесть их эмоционального состояния диктуется тяжестью основного онкологического заболевания, а также сопутствующими
хроническими заболеваниями.
Следует помнить, что тахикардия, потливость, приливы могут
являться вегетативными признаками тревоги.
В таких случаях эмоциональные
нарушения субклинической формы, такие как депрессия, тревога,
беспокойство, нарушения сна,
часто имеют фоновый характер
и в достаточной мере контролируются пациентами во время
врачебного приема. Исследования показывают, что в кабинете врача онколога большинство
пациентов стремятся обсуждать
симптомы основного заболевания, а не свое эмоциональное состояние.
Что должно вызвать настороженность врача: незначительные
проявления недоверчивости, фоновое возбуждение, контролируемая агрессия, снижение концентрации внимания, забывчивость,
речевые сбои, общий астенический фон настроения пациента,
упоминания о расстройствах сна.
Такие проявления могут быть
симптомами дистресса. Квалифицировать уровень дистресса
должен медицинский/клинический психолог, специализирующийся в области онкологии.
Симптомы
поведенческие
В связи с тем, что клинические
симптомы не носят выраженный характер, а пациент чаще
всего склонен утаивать состояния подавленности или перевозбуждения от врача онколога
(исключение составляют люди
с выраженными истероидными чертами личности), целесообразно ориентироваться на особенности поведения человека в
ситуации пролонгированного
дистресса. Например, признаки
неадекватного социального взаимодействия – агрессия, пассивность или отстраненность пациента на приеме врача. Кроме
явного тремора конечностей или
состояния ступора, пациент невербально, позой и жестами может сигнализировать о вытесняемых состояниях тревоги, тоски,
гнева или отчаяния.
Целесообразно назначить консультацию онкопсихолога, если:
наблюдаемый пациент кажется
вам слишком суетливым, обеспокоенным, говорливым, отстраненным, подавленным, заторможенным, раздражительным или
придирчивым;
пациент хоть иногда упоминает о том, что он чувствует себя
непонятым, одиноким, виноватым, постоянно переживающим
страх, забывчивым, постоянно
уставшим, не ощущающим радости и не находящим смысла.
Врач онколог, заподозривший
во время приема дезадаптивную
тенденцию состояния дистресса,
может мягко проинформировать
пациента о том, что подобные
состояния (любые из вышеперечисленных клинических или
поведенческих симптомов) неизбежны в ситуации онкологического заболевания. «Так бывает,
когда человек болен. Наши специалисты онкопсихологи помогут адаптироваться к ситуации
заболевания вам и вашим близким». Возможно, на заверения
пациента, что он «не псих», врачу
придется добавить, что онкопсихологи работают только с психическими здоровыми людьми
и обеспечивают реабилитацию
личности человека в ситуации
онкологического заболевания.
Надеюсь, что в вашей команде
онкопсихолог есть.
О методах работы онкопсихолога
мы поговорим в следующий раз.
С уважением,
Вагайцева Маргарита Валерьевна
ФОРТЕКА
Возможность победить
