
ASCO 2021: ОБЗОР ИССЛЕДОВАНИЙ НЕМЕЛКОКЛЕТОЧНОГО РАКА ЛЕГКОГО
ASCO 2021 было богато на события в области лечения немелкоклеточного рака легкого (НМРЛ). Кратко расскажу о наиболее интересных и важных для клинической практики результатах. У больных операбельным НМРЛ, несомненно, главным событием стали результаты исследования IMpower01...

9 - 11 НОЯБРЯ 2021
РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС
РАКФОНД ОБЪЯВЛЯЕТ НОВЫЙ КОНКУРС НАУЧНО-ИССЛЕДОВАТЕЛЬСКИХ ПРОЕКТОВ В ОБЛАСТИ ОНКОЛОГИИ
Цель программы – предоставить финансирование и дополнительную поддержку ученым и врачам, работающим в России, для стимулирования и продвижения исследований в области онкологии, поиска и разработки новых способов профилактики, диагностики и лечения онкологических заболеваний. Принимаются заявки на проведение исследований в области онкологии по следующим направлениям:

ASCO 2021: НОВОСТИ В ТЕРАПИИ ОПУХОЛЕЙ ГОЛОВЫ И ШЕИ
Прошедший в текущем году конгресс ASCO в разделе плоскоклеточного рака головы и шеи не был ознаменован представлением значимых клинических исследований, которые могли бы уже сейчас изменить текущую клиническую практику. Тем не менее, были доложены данные, которые могут в будущем...

РАК ПИЩЕВОДА И ЖЕЛУДКА. НОВОСТИ ASCO 2021
Вопрос о необходимости наблюдения после радикального лечения при многих опухолях остается открытым. Активно наблюдать имеет смысл только при тех нозологиях, при которых ранняя диагностика рецидива приводит к улучшению продолжения жизни. На ASCO 2021 были представлены данные...

НОВОСТИ ASCO 2021: КОЛОРЕКТАЛЬНЫЙ РАК С МУТАЦИЕЙ В ГЕНЕ BRAF
С увеличением покрытия молекулярно-генетическим тестированием популяции пациентов с метастатическим колоректальным раком все чаще в клинической практике встречаются больные с мутацией в гене BRAF и все актуальнее становится вопрос, можно ли применять стандартные подходы в...

НАИБОЛЕЕ ЗНАЧИМЫЕ ИССЛЕДОВАНИЯ ПО РАННЕМУ РАКУ МОЛОЧНОЙ ЖЕЛЕЗЫ, ПРЕДСТАВЛЕННЫЕ НА ЕЖЕГОДНОМ КОНГРЕССЕ ASCO 2021
С 4 по 8 июня 2021 года состоялась очередная конференция Американского общества клинической онкологии (American Society of Clinical Oncology, ASCO). В данном обзоре мы представляем наиболее значимые исследования, которые касались раннего рака молочной железы.

НОВОЕ В ЛЕЧЕНИИ МЕТАСТАТИЧЕСКОГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ ПО ДАННЫМ ASCO 2021
Комбинация ингибиторов CDK4/6 и гормонотерапии (ГТ) в настоящее время является золотым стандартом 1-2 линий лечения метастатического рака молочной железы (мРМЖ), так как она продемонстрировала увеличение частоты объективного ответа (ЧОО), выживаемости без прогрессирования (ВБП) и...

ASCO 2021: КУДА ДВИЖЕТСЯ ГИНЕКОЛОГИЯ?
Без длительных прелюдий и грусти о втором конгрессе ASCO в онлайн-формате перейдем к важным событиям, которые оказались значимыми в жизни каждого специалиста-онколога, занимающегося онкогинекологией...

ПОПУЛЯЦИОННОЕ ИССЛЕДОВАНИЕ СКРИНИНГА РАКА ЯИЧНИКА ПОТЕРПЕЛО НЕУДАЧУ
ам представлялось, что скрининг, позволяющий диагностировать злокачественную опухоль на раннем бессимптомном этапе ее развития и немедленно начать лечение с высоким шансом на излечение, – важнейший и оптимальный путь снижения смертности. Однако опыт скрининговых программ при раке...
ПО МАТЕРИАЛАМ ASCO 2021: ТЕРАПИЯ НА ОСНОВЕ CAR-T – ЧТО МЫ ИМЕЕМ В 2021 ГОДУ?
Первым препаратом на основе CAR T-клеток, представленным для регистрации Управлению по контролю над качеством пищевых продуктов и лекарственных средств США (FDA), был тисагенлеклейсел Т для лечения пациентов в возрасте не старше 25 лет с рецидивирующим или рефрактерным В-клеточным острым лимфобластным лейкозом (В-ОЛЛ). Самым последним препаратом, зарегистрированным FDA, был идекабтаген виклейсел для лечения ...

КЛЮЧЕВЫЕ НОВОСТИ ASCO 2021, ПОСВЯЩЕННЫЕ МЕЛАНОМЕ
C 4 по 8 июня 2021 года на прошедшем в формате онлайн ежегодном конгрессе Американской ассоциации клинических онкологов (ASCO) ведущие эксперты представили наиболее значимые достижения в лечении и профилактике меланомы. Краткий анонс ключевых докладов на ASCO 2021 по...
Анонс
-

9 - 11 НОЯБРЯ 2021
РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС
ASCO 2021: ОБЗОР ИССЛЕДОВАНИЙ НЕМЕЛКОКЛЕТОЧНОГО РАКА ЛЕГКОГО
Автор: С.А.Тюляндин
Председатель Российского общества клинической онкологии
ASCO 2021 было богато на события в области лечения немелкоклеточного рака легкого (НМРЛ).
Кратко расскажу о наиболее интересных и важных для клинической
практики результатах.
У больных операбельным НМРЛ,
несомненно, главным событием
стали результаты исследования
IMpower01, продемонстрировавшего перспективность назначения
атезолизумаба адъювантно [ASCO
2021, abstract 8500]. В исследование включались больные IB-IIIA
стадиями немелкоклеточного рака
легкого, которые после выполнения операции и окончания адъювантной химиотерапии цисплатиновыми дуплетами (цисплатин +
один из следующих: пеметрексед,
доцетаксел, гемцитабин или винорельбин) были рандомизированы
в группу наблюдения или атезолизумаба, который назначали в дозе
200 мг каждые 3 недели, 16 введений. Основными критериями эффективности было последовательное определение безрецидивной
выживаемости в группе больных
II-IIIA стадией с позитивной экспрессий PD-L1 >1% по результатам теста SP263, затем в группе
больных II-IIIA независимо от экспрессии PD-L1, затем в группе всех
включенных в исследование больных (IB-IIIA стадии), затем общая
выживаемость для всех включенных больных. В настоящем отчете
представлены предварительные
данные оценки безрецидивной
ASCO 2021:
ОПУХОЛИ ГОЛОВЫ
И ШЕИ
ASCO 2021:
ОПУХОЛИ ЖКТ
C.2 C.3 C.6 C.8 C.17
выживаемости 1005 больных,
включенных в исследование.
При медиане наблюдения 32 мес.
в группе больных II-IIIA стадией
с позитивной экспрессией PD-L1
введение атезолизумаба достоверно снизило риск прогрессирования на 34%. Выигрыш от назначения препарата уменьшается, но
сохраняет потенциальную достоверность по мере включения в анализ всех больных II-IIIA стадиями
независимо от экспрессии PD-L1
и включения в анализ больных IB
стадией. Данные по общей выживаемости не сообщаются в связи с
коротким периодом наблюдения.
Введение атезолизумаба сопровождалось развитием побочных эффектов 3-4 степени у 22% больных
в сравнении с 11% в группе наблюдения. Досрочное прекращение
введения препарата вследствие
токсичности потребовалось 18%
больных. Смерть от токсичности
атезолизумаба зарегистрирована у
4 (0,8%) пациентов.
Авторы делают вывод, что добавление атезолизумаба после
окончания адъювантной химиотерапии достоверно уменьшает
риск прогрессирования у больных
II-IIIA стадией, особенно при наличии экспрессии PD-L1. Короткий период наблюдения не позволяет ответить на вопрос, как
долго иммунотерапия будет сдерживать процесс метастазирования и транслируется ли снижение
риска прогрессирования в увеличение общей выживаемости больных. А именно последнее является
основным критерием эффективности любого адъювантного лечения.
В исследовании Checkmate-816 изучалась возможность назначения
ниволумаба совместно с платиносодержащей химиотерапией в
сравнении с химиотерапией только в качестве предоперационной терапии [ASCO 2021, abstract
8503]. В это исследование было
включено 358 больных Ib-III стадиями НМРЛ, которые получали
либо комбинацию ниволумаба в
дозе 360 мг и двухкомпонентной
платиносодержащей химиотерапии каждые 3 недели 3 курса, либо
только химиотерапию. Основным
критерием эффективности была частота полной морфологической
регрессии опухоли. Она составила 24% в группе комбинации и 2%
в группе химиотерапии только.
После лечения комбинацией ниволумаба и химиотерапии достоверно чаще удавалось выполнить
R0 резекцию в сравнении с химиотерапией только: 83% и 75% соответственно. Лечение комбинацией сопровождалось умеренной
токсичностью, частота 3-4 степени
которой составила 34% по сравнению с 37% в группе химиотерапии
только. Продолжается наблюдение
за больными для оценки отдаленных результатов лечения. Авторы
делают предварительные выводы,
что предоперационное назначение
ниволумаба совместно с химиотерапией приводит к выраженному морфологическому эффекту в
сравнении с химиотерапией, что
позволяет у большего числа пациентов выполнить R0 резекцию.
В рандомизированном исследовании VIOLET сравнивали непосредственные и отдаленные результаты видеоассистированной
торакоскопической (VATS) и открытой лобэктомии у 503 больных
с сТ1-3N0-1M0 НМРЛ [ASCO 2021,
abstract 8504]. Выполнение торакоскопической операции ассоциировалось с меньшим болевым
синдромом, меньшей частотой осложнений в ходе госпитализации
и в течение 30 дней после выписки, меньшей частотой повторных
госпитализаций, более короткой
госпитализацией (4 дня при VATS
и 5 дней при открытой операции),
более быстрым функциональным
восстановлением. Среди больных
с наличием N1 51% после VATS
и 45% после открытой операции
получали адъювантную химиотерапию. Частота рецидивов заболевания в течение года составила
7,7% в группе VATS и 8,1% в группе открытой лобэктомии. Безрецидивная и общая выживаемость
не имели достоверных статистических отличий в обеих группах.
Авторы делают вывод, что VATS
является безопасной альтернативой открытой операции и должна
стать стандартным подходом в
связи с более быстрым функциональным восстановлением после
проведенной операции.
Программы скрининга и возросшие возможности ранней диагностики НМРЛ увеличили частоту I
стадии НМРЛ. Это сделало актуальным изучение эффективности
стереотаксической лучевой терапии как альтернативы хирургическому лечению. В исследование
STARS было включено 80 больных
I стадией НМРЛ (Т<3 см), с отсутствием других проявлений болезни по данным ПЭТ и EBUS [ASCO
2021, abstract 8506]. Больным назначалась стереотаксическая лучевая терапия 54 Гр за 3 фракции
при периферической локализации
опухоли и 50 Гр за 4 фракции при
центральной. В качестве исторического контроля использовали
опыт выполнения VATS лобэктомии с медиастинальной диссекцией у больных I стадии. При медиане наблюдения 5 лет 5-летняя
безрецидивная выживаемость и
общая выживаемость при проведении лучевой терапии составили
77% и 87% соответственно. Показатель 5-летней общей выживаемости для оперативного лечения
был 84%, что заставляет авторов
сделать вывод о перспективности
проведения стереотаксической лучевой терапии при I стадии НМРЛ.
Из других докладов стоит упомянуть, что при 5-летнем наблюдении исследования PACIFIC отмечается сохранение 10% выигрыша
в общей выживаемости (43% vs
33%) при добавлении дурвулюмаба
в качестве консолидации химиолучевой терапии в сравнении с наблюдением у больных III стадией
НМРЛ [ASCO 2021, abstract 8511].
В исследовании IMPACT показано,
что назначение гефитиниба адъювантно в течение 2 лет не улучшает
отдаленные результаты по сравнению с платиносодержащей химиотерапией у больных НМРЛ после
R0 резекции с наличием мутации
гена EGFR [ASCO 2021, abstract
8511]. В исследовании CTONG
периоперационное назначение
эрлотиниба не привело к улучшению безрецидивной и общей
выживаемости по сравнению с
периоперационной химиотерапией у больных EGFR-позитивным
НМРЛ [ASCO 2021, abstract 8502].
По данным двух последних исследований у больных операбельным
НМРЛ с наличием активирующей
мутации EGFR следует назначать
адъювантную химиотерапию.
У больных диссеминированным
НМРЛ наиболее интересные исследования касались разработки
новых противоопухолевых препаратов. Одной из наиболее частых
мутаций при НМРЛ является мутация гена EGFR, что предсказывает высокую чувствительность
опухоли к ингибиторам тирозинкиназы рецептора EGF. Однако
несмотря на первоначальный выраженные противоопухолевый
эффект, в последующем у большинства больных развивается
прогрессирование заболевания
вследствие развития различных
механизмов резистентности. В
этом случае нам необходимо определить конкретный механизм резистентности, изучив полученный
при повторной биопсии образец
опухоли или плазму. Однако это
помогает не всем больным. У части из них, даже получив образец
опухоли, не удается определить
причину резистентности. И лишь
для части больных с известными
механизмами резистентности у
нас имеются эффективные лекарства (как осимертиниб при наличии мутации Т790М). Вот почему
актуальным является поиск лекарственных препаратов, способных контролировать активный
EGFR-сигнальный путь независимо от механизма резистентности.
Патритумаб дерукстекан является конъюгатом моноклонального
антитела к рецептору HER3 (один
из семейства рецепторов EGF)
и ингибитора топоизомеразы I
экзетекана. Рецептор HER3 часто экспрессирован на мембране
клеток рака легкого и, образуя с
рецептором EGFR (HER1) димер
после соединения с фактором роста EGF, активирует сигнальный
путь. Патритумаб дерукстекан
был изучен в процессе I фазы у 57
больных НМРЛ с наличием мутации EGFR и прогрессированием
после лечения ингибиторами тирозинкиназы (86% больных получали осимертиниб) [ASCO 2021,
abstract 9007]. Частота объективного эффекта составила 39% при
медиане времени до прогрессирования 8,2 мес. Эффект наблюдался независимо от различных
механизмов резистентности, а
также получения платиновой химиотерапии перед назначением
патритумаба дерукстекана. Препарат продемонстрировал высокую эффективность у больных с
наличием метастатического поражения ЦНС (частота объективного эффекта 32% и медиана
времени до прогрессирования 8,2
мес.). Препарат обладал привычным для цитостатиков спектром токсичности 3-4 степени:
тромбоцитопения, нейтропения,
слабость. У 7 больных развилось
интерстициальное поражение легких. Отмена препарата в связи с
токсичностью потребовалась 8%
пациентов. Проводимые в настоящее время исследования позволят
оценить эффективность и токсичность препарата у большего числа
больных и при различных клинических ситуациях.
В течение многих лет не удавалось
найти эффективный ингибитор
белка K-RAS, высокая активность
которого вследствие мутации гена
была ответственна за агрессивность злокачественных опухолей.
Мутация гена K-RAS – одна из
наиболее часто определяемых мутаций в клетках злокачественных
опухолей. Например, она встречается у 94% больных протоковым
раком поджелудочной железы и
у 40% больных колоректальным
раком. У больных НМРЛ частота
мутации гена K-RAS составляет
13%. Препарат соторасиб является ингибитором мутированного
K-RAS белка-передатчика сигнала
(мутация P.G.12C) и в рамках II
фазы был изучен у 126 больных
НМРЛ с наличием мутации K-RAS
и прогрессированием после стандартного лечения [ASCO 2021,
abstract 9003]. Впервые отмечен
выраженный противоопухолевый
эффект при назначении ингибиторов K-RAS, который зафиксирован у 37% больных с медианой
продолжительности 11 мес. Контроль заболевания достигнут у
81% больных, медиана времени до
прогрессирования составила 6,8
мес., а общая продолжительность
жизни – 12,5 мес. Препарат обладал хорошей переносимостью,
наиболее частыми осложнениями
3-4 степени были повышение ALT/
AST (6%) и диарея (4%). Лечение
по причине токсичности было
прекращено у 7% больных. Успех
препарата явился основанием для
проведения III фазы по сравнению
сотарасиба с доцетакселом у ранее
леченных больных НМРЛ с мутацией в гене K-RAS.
Были сообщены 2-летние результаты исследования CheckMate
9LA, которое сравнивало эффективность комбинации ниволумаба и ипилимумаба на фоне 2
курсов химиотерапии со стандартными 4 курсами химиотерапии у больных НМРЛ [ASCO 2021,
abstract 9000]. Медиана продолжительности составила 15,8 и 11,0
мес. соответственно, общая 2-летняя выживаемость – 38% и 26%,
что свидетельствует о достоверном снижении риска смерти на
28% (HR=0,72). Выигрыш от назначения комбинации иммунотерапии и химиотерапии отмечался
независимо от экспрессии PD-L1.
Авторы делают вывод, что 2 введения ниволумаба и ипилимумаба совместно с двумя курсами
химиотерапии являются эффективной первой линий лекарственной терапии больных НМРЛ.
FDA провело мeтаанализ всех выполненных рандомизированных
исследований, в которых сравнивали эффективность первой
линии ингибиторов PD-1/PD-L1
только и их комбинации с химиотерапией у больных метастатическим НМРЛ с умеренной экспрессией PD-L1 (1-49% опухолевых
клеток) [ASCO 2021, abstract 9001).
В метаанализ вошли 2108 больных, для которых медиана общей
продолжительности в группе
иммунотерапии только и комбинации иммунотерапии и химиотерапии составила 14,5 и 21,4
мес., что соответствует снижению
риска смерти на 32%. Преимущество комбинации было отмечено
во всех анализируемых подгруппах (возраст, статус ECOG, статус
курения). Полученные данные
четко указывают на необходимость комбинирования иммунотерапии и химиотерапии при
проведении первой линии НМРЛ
у больных с умеренной экспрессией PD-L1.
9 - 11 НОЯБРЯ 2021

РАКФОНД ОБЪЯВЛЯЕТ НОВЫЙ КОНКУРС НАУЧНО-ИССЛЕДОВАТЕЛЬСКИХ ПРОЕКТОВ В ОБЛАСТИ ОНКОЛОГИИ
Цель программы – предоставить финансирование и дополнительную поддержку ученым и врачам, работающим в России, для стимулирования и продвижения исследований в области онкологии, поиска и разработки новых способов профилактики, диагностики и лечения онкологических заболеваний. Принимаются заявки на проведение исследований в области онкологии по следующим направлениям:
• Клинические исследования: интервенционные, рандомизированные (предпочтительно), направленные на изучение методов и средств профилактики, диагностики, мониторинга и лечения злокачественных новообразований, реабилитации и качества жизни онкологических больных
• Трансляционные исследования: поиск и изучение биомаркеров для диагностических и прогностических целей, подбора терапии • Фундаментальные исследования
Победитель конкурса получит финансирование от РакФонда в размере до 500 000 рублей на выполнение исследовательского проекта, а также экспертную помощь в доработке дизайна и протокола исследования и статистической обработке данных и доступ к онлайн-сервису для проведения клинических исследований Энроллми.ру.
Результаты конкурса будут
объявлены 9-11 ноября 2021 года
в ходе XXV Российского онкологического конгресса. Зарегистрировать и подать заявку
можно до 10 сентября 2021 на
сайте rakfond.org

ASCO 2021: НОВОСТИ В ТЕРАПИИ ОПУХОЛЕЙ ГОЛОВЫ И ШЕИ
Автор: Болотина Лариса Владимировна
МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИЦ радиологии» Минздрава России, Москва
Прошедший в текущем году конгресс ASCO в разделе плоскоклеточного рака головы и шеи не был ознаменован представлением значимых клинических исследований, которые могли бы уже сейчас изменить текущую клиническую практику. Тем не менее, были доложены данные, которые могут в будущем явиться основой для таких изменений. Так, были сообщены результаты исследования III фазы JUPITER-02 (РКИ по изучению торипалимаба – анти-PD1 МАТ/плацебо в сочетании с ХТ цисплатин + гемцитабин в 1 линии рецидивного/метастатического рака носоглотки) [1]. Протокол объединял 289 нелеченных пациентов, которые рандомизировались на 2 группы, одна из которых в дополнение к ХТ GemCis получала торипалимаб максимально до 2 лет. Было продемонстрировано достоверное увеличение медианы ВБП в исследовательской группе с абсолютным приростом более 3 месяцев (8,0 vs 11,7 мес.). Выигрыш в мВБП не зависел от уровня эксперссии PD-L1. ЧОО и длительность ответа также увеличились при добавлении торипалимаба: ЧОО 77,4% vs 66,4%; длительность ответа 10,0 vs 5,7 мес. На момент проведения анализа медиана ОВ не достигнута ни в одной группе. Нежелательные реакции были сопоставимы между группами, за исключением иммуноопосредованных реакций, которые ожидаемо чаще фиксировались в основной группе, как любой степени, так и значимых степеней выраженности (любой степени – 39,7% vs 18,9%; 3+ степеней – 7,5 vs 0,7%). На основании впечатляющей эффективности в отношении ВБП авторы делают вывод о потенциальном изменении стандартов лечения распространенного назофарингеального рака. Дополнительно в виде устного доклада был представлен первый анализ исследования противоопухолевой активности векторной иммунотерапии на основе аренавируса, которую применяли у больных с HPV-ассоциированными ЗНО [2]. Большинство пациентов имели опухоли ротоглотки. Авторами из Memorial Sloan Kettering Cancer Center изучались препараты HB-201 (вирус лимфоцитарного хориоменингита) и HB-202 (вирус Pichinde), которые назначались в различных режимах монотерапии внутривенно с/без дополнительного интратуморального введения. Основной задачей на данном этапе была оценка переносимости терапии. Нежелательные реакции той или иной степени были зафиксированы у 84% пациентов, дозолимитирующей токсичности отмечено не было. Основным видом нежелательных реакций 3+ степени была слабость. Авторами определен наиболее эффективный режим применения исследованных препаратов: внутривенные инфузии каждые 3 недели, что обеспечило контроль над заболеванием в 72,7% наблюдений для монорежима HB-201 и 100% при использовании двойной терапии. У 2 из 38 пациентов достигнут ПО и у 34,5% – регрессия опухоли той или иной степени. После данного вида терапии наблюдался высокий уровень HPV-специфических T лимфоцитов, что, возможно, будет предсказывать ответ на проводимое лечение. Исследования в данном направлении продолжаются. Помимо дискуссий было представлено несколько абстрактов, посвященных вопросам лекарственной терапии как резектабельного, так и рецидивного/метастатического ПРГШ. Абстракт тайваньских авторов посвящен результатам биомаркерного анализа исследования II фазы ALPHA [3]. Это однорукавное исследование, в котором 29 пациентов с платинорефрактерным рецидивным/метастатическим ПРГШ получали ежедневно афатиниб 40 мг в сутки в сочетании с пембролизумабом 200 мг в/в каждые 3 недели. Локализация первичной опухоли: полость рта – 19 больных, ротоглотка – 6, гортаноглотка – 2, гортань – 2. Первичной целью была оценка ЧОО. PD-L1 TPS ≥50 составил 24,1%; CPS ≥20 – 27,6%. TMB >10 не выявлен ни у одного пациента. Нежелательные реакции 3+ степеней были представлены сыпью, диареей, паранихиями и мукозитом. ЧОО составила 41,4% и во всех случаях была представлена ЧО. Медиана ВБП составила 4,1 месяца (95% CI 1,9-6,3), медиана ОВ 8,4 месяца (95% CI 4,1-10,8). У пациентов с высоким уровнем экспрессии PD-L1 отмечен более высокий шанс достичь ОО (TPS ≥50: ORR=0,71; CPS ≥20: ORR=0,63). Амплификация EGFR вероятно также являлась предиктором ответа на лечение (ORR: 3/3, 100%). Потеря или мутации MTAP являлись предиктором резистентности к данному виду терапии (ORR: 0/5, 0%), более низкой ВБП (HR 4,21, [95% CI 1,34-13,24], p=0,014), и ОВ (HR 4,20 [95% CI 1,32- 13,41], p=0,015). Девяти пациентам была выполнена биопсия опухоли до начала лечения и после его завершения для анализа экспрессии генов. Было отмечено увеличение экспрессии mRNA HLA-A, HLA-B, CXCL13, CXCL9 и CD8A в образцах после завершения терапии. У одного пациента была выявлена новая мутация MTAР. Вывод авторов: афатиниб может изменять микроокружение опухоли и увеличивать эффективность (ЧОО) пембролизумаба у больных ПРГШ. Высокий уровень PD-L1, амплификация EGFR и потеря/мутации MTAP могут рассматриваться как биомаркеры иммунотерапии. Однако с учетом очень небольшого числа больных представляется преждевременным брать за основу полученные закономерности и, конечно, требуются более масштабные исследования для убедительного суждения и практическом использовании всех изученных биомаркеров. Несомненный интерес представляет работа американских авторов, которые изучили роль неоадъювантного (НА) однократного назначения пембролизумаба у больных резектабельной формой местнораспространенного ПРГШ [4]. В исследование включены 92 пациента (рак полости рта – 88%, рак гортани – 8%, HPVнегативный рак ротоглотки – 3%), которым однократно назначался пембролизумаб 200 мг, а через 1-3 недели проводилась операция. В послеоперационном периоде дополнительно проводилось введение 6 доз пембролизумаба в аналогичном режиме на фоне лучевой терапии до СОД 60-66 Гр или химиолучевой терапии с добавлением еженедельных введений цисплатина 40 мг/м2 × 6 для пациентов с промежуточным и высоким риском прогрессирования. Первичной целью исследования являлась 1-годичная БРВ. Патологический ответ от неоадъювантного введения пембролизумаба оценивался путем анализа опухолевого некроза и/или гистиоцитарной инфильтрации и наличия гигантоцитов. Ответ на НА этап разделяли на 3 типа: отсутствие ответа при объеме некроза <20%, частичный (ЧПО) – при ≥20% и <90%, масштабный (МПО) – при ≥90%. Послеоперационное лечение пембролизумабом получили 76 пациентов, и для них был оценен показатель 1-годичной БРВ. У 86% до начала лечения опухоль расценивалась как T3/4 и 65% ≥N2. У 53% был определен высокий риск прогрессирования (позитивный хирургический край – 45%, экстракапсулярное распространение – 78%). У 64% отмечен PD-L1 CPS ≥1. Медиана наблюдения была 20 месяцев, 1-годичная БРВ составила 67% для больных группы высокого риска (95% CI 0,52-0,85) и 93% (95% CI 0,84-1) для группы промежуточного риска. Среди 80 больных, для которых был проанализирован патологический ответ, зафиксировано отсутствие ответа у 48 человек, ЧО у 26 и МО у 6 больных. При достижении ЧПО/МПО отмечено достоверное увеличение 1-летней БРВ в сравнении с больными без патологического ответа на лечение: 100% vs 68%, p=0,01; HR=0,23. При этом не отмечено влияние уровня экспрессии PD-L1 CPS ≥1 на данный показатель, но в этой подгруппе чаще удавалось достичь ЧПО и МПО (p=0,0007). ЧПО/MПО при PD-L1 CPS <1, ≥1 и ≥20 зафиксирован в 20%, 55% и 90% соответственно. Среди НР отмечены дисфагия (15%), нейтропения (15%), кожные реакции и воспаления зоны операции (10%) и мукозиты (9%). Основным выводом авторов было заключение о том, что ЧПО на неоадъювантное применение пембролизумаба ассоциируется с PD-L1 CPS ≥1 и обеспечивает высокий показатель БРВ у больных резектабельной формой местнораспространенного ПРГШ. Но, пожалуй, самым интригующим было сообщение группы авторов из США, которые в рамках межинститутского исследования II фазы сравнивали эффективность двух доз пембролизумаба на предоперационном этапе при резектабельном местнораспространенном ПРГШ [5]. Авторы предположили, что двукратное введение в сравнении с одной дозой позволит достичь патологического ответа >50% (pTR-2) у половины больных. Пациенты получали 2 введения пембролизумаба за 42 и 21 день до операции. Ответ распределялся на 3 уровня: pTR-0 – отсутствие ответа, pTR-1 – некроз >10-49%, pTR-2 – некроз >50%, масштабный ответ – некроз >90%. Первичной целью была оценка частоты pTR-2. В исследование вошли 29 пациентов с клиническими стадиями T2 (n=6), T3 (n=5), T4 (n=18) и N0/1 (n=17), N2 (n=12), эффективность оценена у 25 из них. У 44% больных зафиксирован pTR-2, среди них в 16% – масштабный ПО, включая 4% полного ПО со стороны первичного очага. Вывод авторов состоит в том, что проведение 2 введений пембролизумаба в сравнении с одним приводит к удвоению частоты pTR-2 (44% vs 22%) (данные по pTR-2 после одного введения были получены этой же группой исследователей ранее, о чем сообщалось на конгрессе ASCO 2019 года). В настоящее время проводится исследование III фазы, которое, вероятнее всего, позволит получить более убедительные результаты в отношении оптимального объема предоперационного этапа иммунотерапии при резектабельном местнораспространенном ПРГШ. В этом же ключе была представлена работа корейских авторов, в которой предварительный анализ касался сравнительной эффективности однократного введения дурвалумаба (1500 мг – 16 больных) или дурвалумаба с тримелимумабом (1500 мг +75 мг – 20 больных) у 36 пациентов с потенциально резектабельным ПРГШ II, III и IVA стадий. Через 2-8 недель выполнялась операция. Послеоперационная ЛТ/ХЛТ применялась в зависимости от стандартов клиники с последующим назначением дурвалумаба каждые 4 недели в течение 1 года. Первичная опухоль локализовалась в гортаноглотке, гортани или полости рта. У половины больных в каждой группе опухоли были HPV-позитивные. Распространенность процесса была сопоставима между группами: cT1/T2/T3/T4 (6,3%/37,5%/31,3%/25,0% в группе Дурва, 10,0%/25,0%/40,0%/25,0% в группе Дурва + Треми); cN0/N1/N2/ N3 (25,0%/18,8%/50,0%/6,3% в группе Дурва, 30,0%/30,0%/40,0%/0% в группе Дурва + Треми). Уменьшение размеров опухоли более чем на 30% зафиксировано в 43,7% (7/16), включая 2 больных с ПО в группе монотерапии Дурва, и в 20,0% (4/20) на комбинации Дурва + Треми. HPV-позитивные опухоли ассоциировались численно с большим ответом на лечение (средне сокращение размеров опухоли –21,8% при p16-позитивных vs. –6,4% при p16- негативных). Патоморфологический ответ измерялся некрозом (в среднем 10,3% на монотерапии Дурва и 5,5% в группе Дурва + Треми), фиброзом (в среднем 13,4% на монотерапии Дурва, 10,3% в группе Дурва + Треми) и воспалительной инфильтрацией (в среднем 15,0% в группе Дурва, 5,8% в группе Дурва + Треми) и не зависел от HPV статуса. В выводах авторы делают предположение о том, что изученные режимы иммунотерапии являются безопасными и могут быть потенциальными для клинического применения. Однако исследование пока продолжается. Кроме этого, были представлены работы, в которых исследователи проводят поиск возможностей увеличения эффективности иммунотерапии у пациентов с рецидивами ПРГШ после платиносодержащей терапии. Кооперированной группой были представлены результаты исследования II фазы по оценке эффективности 2 линии комбинации eftilagimod alpha (растворимый белок LAG-3) и пембролизумаба [7]. В протокол включены 38 пациентов независимо от уровня экспрессии PD-L1 (локализация первичного очага: полость рта – 29%, ротоглотка – 37%, гортаноглотка – 18%, гортань – 16%). Пациенты получали Efti 30 мг подкожно каждые 2 недели, всего 8 введений, и затем каждые 3 недели 9 введений. Пембролизумаб назначался в дозе 200 мг каждые 3 недели общей длительностью до 2 лет. Эффект оценен у 35 пациентов и был представлен ПО в 11%, ЧО – в 20%, и в 9% зафиксирована стабилизация. У 46% отмечалось прогрессирование заболевания. Т.о., ЧОО составила 31,4 % (95% CI 16,9-49,3%). Медиана ВБП оказалась 2,1 месяца, к полугоду без признаков прогрессирования оставались 35% больных. Медиана ОВ на момент представления данных (46% событий) составила 12,6 месяца. Среди НР фиксировались кашель (18%), астения (16%), диспноэ (11%), слабость (13%), диарея (11%), гипотиреоидизм (11%), инфекции верхних дыхательных путей (11%) и боли в спине (11%). Авторы делают вывод о том, что комбинация eftilagimod alpha с пембролизумабом является безопасным режимом лечения и демонстрирует впечатляющую противоопухолевую активность во 2 линии при ПРГШ после платиносодержащей химиотерапии. Повторюсь, что в настоящее время сформированные подходы к лечению ПРГШ остаются неизменными. Повлиять на изменение клинических рекомендаций смогут только более зрелые данные исследований 3 фазы.
Список литературы:
1. Xu Ruihua. JUPITER-02 Study (NCT03581786) is a randomized, double-blind, placebo-controlled, international multi-center Phase III clinical study to compare the efficacy and safety of Toripalimab versus placebo in combination with Gemcitabine/ Cisplatin, as a first-line treatment for patients with recurrent or metastatic nasopharyngeal carcinoma.
2. Alan Loh Ho. A Study of TheraT® Vector(s) Expressing HPV 16+ in Patients With HPV 16+ Confirmed Cancers.
3. Hsiang-fong Kao, Bin-Chi Liao, YenLin Huang. Afatinib and pembrolizumab for recurrent or metastatic head and neck squamous cell carcinoma (ALPHA Study): A phase II study with biomarker analysis.
4. Trisha Michel Wise-Draper, Vinita Takiar, Michelle Lynn Mierzwa. Association of pathological response to neoadjuvant pembrolizumab with tumor PD-L1 expression and high disease-free survival (DFS) in patients with resectable, local-regionally advanced, head and neck squamous cell carcinoma (HNSCC).
5. Ravindra Uppaluri, Rebecca Chernock, Mena Mansour. Enhanced pathologic tumor response with two cycles of neoadjuvant pembrolizumab in surgically resectable, locally advanced HPV-negative head and neck squamous cell carcinoma (HNSCC).
6. Hye Ryun Kim, Chang Gon Kim. Interim analysis for window of opportunity trial of single dose preoperative durvalumab (D) with or without tremelimumab (T) for operable head and neck squamous cell carcinoma (HNSCC).
7. Irene Brana, Martin Forster. Results
from a phase II study of eftilagimod
alpha (soluble LAG-3 protein) and
pembrolizumab in patients with PDL1 unselected metastatic second-line
squamous head and neck carcinoma.
РАК ПИЩЕВОДА И ЖЕЛУДКА. НОВОСТИ ASCO 2021
Автор: Трякин Алексей Александрович
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
РАК ПИЩЕВОДА
Операбельный рак пищевода
Наблюдение после радикального лечения
Вопрос о необходимости наблюдения после радикального лечения при многих опухолях остается открытым. Активно наблюдать имеет смысл только при тех нозологиях, при которых ранняя диагностика рецидива приводит к улучшению продолжения жизни. На ASCO 2021 были представлены данные исследования ENSURE, в котором больные раком пищевода после хирургического лечения рандомизировались в группу активного наблюдения (КТ 1 раз в год на протяжении 3 лет) либо обследования при симптомах прогрессирования заболевания. Оказалось, что активное наблюдение ассоциировалось с достоверным увеличением 5-летней общей выживаемости (ОВ) с 43,2% до 47,9%, причем наибольший выигрыш отмечался у пациентов после одного хирургического лечения или с ypTis-T2 [1].
Адъювантная терапия
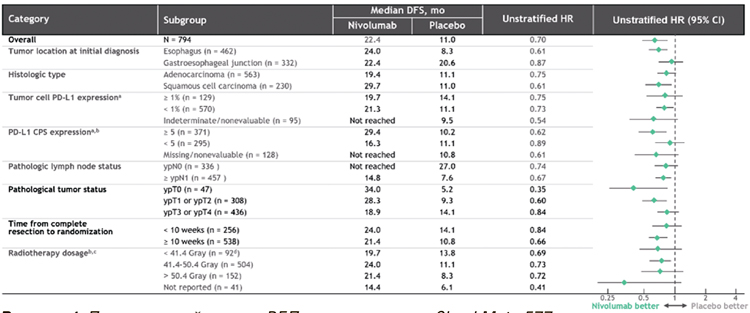
До 2020 года в клинических рекомендациях не существовало опции адъювантной терапии после хирургического лечения как при аденокарциноме, так и при плоскоклеточном раке. На ESMO 2020 были представлены результаты исследования III фазы CheckMate 577, где пациенты после предоперационной химиолучевой терапии (ХЛТ), не достигшие полного лечебного патоморфоза, получали 1 год терапии ниволумабом. На ASCO 2021 были доложены обновленные результаты, показавшие, что выигрыш в выживаемости без прогрессирования (ВБП) наблюдается у пациентов с экспрессией PD-L1 CPS≥5 (рис.1) [2].
Рисунок 1.
. Подгрупповой анализ ВБП в исследовании CheckMate 577.
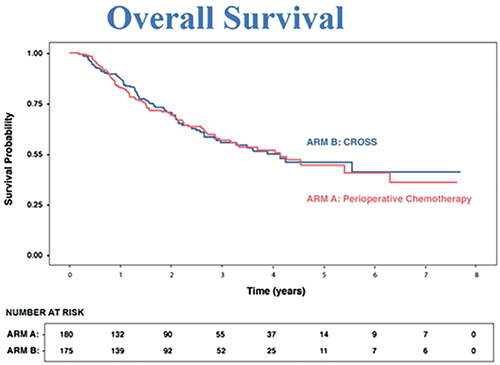
Периоперационная химиотерапия (ХТ) или ХЛТ при аденокарциноме пищевода?
До настоящего времени оставался неотвеченным вопрос о преимуществе
одного из подходов в лечении аденокарциномы пищевода – предоперационной ХЛТ и периоперационной
химиотерапии (ХТ). На ASCO 2021
были представлены результаты исследования Neo-AEGIS, в котором
больные аденокарциномой пищевода cT2-3N0-3M0 рандомизировались в группу ХТ (режим ECF или ЕОХ)
или в группу ХЛТ (CROSS, еженедельные паклитаксел + карбоплатин+ ЛТ до СОД 41,4Гр). Лучевая
терапия не увеличила частоту несостоятельности анастомоза или
послеоперационную летальность,
однако показатели ОВ в обеих группах также были схожими (рис.2) [3].
Таким образом, пациентам с резектабельной аденокарциномой пищевода предпочтительным вариантом
лечения (учитывая простоту и лучшую переносимость) представляется периоперационная ХТ по программе FLOT.
Рисунок 2.
Общая выживаемость пациентов с аденокарциномой пищевода, получавших предоперационную ХЛТ
или периоперационную ХТ.
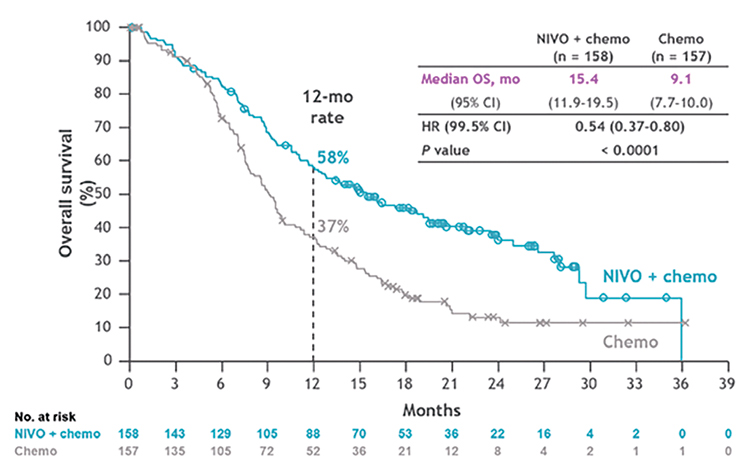
Лечение метастатического плоскоклеточного рака пищевода
До 2020 года единственным вариантом первой линии терапии метастатического плоскоклеточного
рака пищевода была химиотерапия
– цисплатин с фторпиримидинами или таксаны с производными платины. На ESMO 2020 были представлены результаты исследования
KEYNOTE-590, показавшего, что у
пациентов с PD-L1 CPS ≥10 добавление к ХТ пембролизумаба достоверно увеличивает частоту объективного ответа (ЧОО), ВБП и ОВ [4],
что сразу нашло отражение в клинических рекомендациях Минздрава
России.
Эстафету успешной интеграции иммунотерапии в первую линию лечения подхватил ниволумаб. В исследовании CheckMate 648, доложенном
на ASCO 2021, пациенты рандомизировались в группы ХТ (цисплатин +
фторурацил), ХТ + ниволумаб и ниволумаб + ипилимумаб [5]. У пациентов с PD-L1 TPS ≥1 в группе ниволумаб + ХТ отмечалось достоверное
улучшение в показателях ЧОО (с 20%
до 54%), ВБП (с 4,4 до 6,9 мес.) и ОВ
(с 9,1 до 15,4 мес.), что делает данный
режим одной из предпочтительных
опций (наряду с пембролизумабом)
первой линии терапии (рис.3). Двойная комбинация ниволумаб + ипилимумаб также показала достоверное
преимущество по сравнение с одной
ХТ, однако в меньшей степени, чем
ниволумаб + ХТ, что ограничивает
применение безхимиотерапевтического режима лишь пациентами с
противопоказаниями к ХТ.
Рисунок 3.
Общая выживаемость больных
в исследовании CheckMate 648.
РАК ЖЕЛУДКА
Из исследований, меняющих нашу
клиническую практику, стоит
упомянуть два исследования, касающихся первой линии терапии.
Еще на ESMO 2020 были представлены результаты исследования CHECKMATE-649, в котором
в качестве первой линии терапии
аденокарциномы пищевода, желудка и пищеводно-желудочного
перехода изучалось добавление
ниволумаба к режимам FOLFOX/
XELOX [6]. Статистический анализ предполагал иерархический
дизайн, где первоначально было
необходимо показать улучшение
ОВ в группе с CPS ≥5, далее с CPS
≥1 и потом уже на всех пациентах.
В группе химиоиммунотерапии
у пациентов с CPS ≥5 (60% всех
больных) удалось достичь значимого увеличения ОВ – медианы с
11,1 до 14,4 мес. (HR 0,71; 95% ДИ
0,59-0,86), 1-летняя ОS выросла с
46% до 57%. Увеличилась также
и ЧОО – с 45% до 60%. Выигрыш
в ОS отмечался как в подгруппе
с CPS ≥1, так и у всех пациентов.
Однако результаты поданализа
эффективности лечения в зависимости от экспрессии PD-L1 представлены не были. Тем не менее,
на основании этих данных FDA в
апреле 2021 г. зарегистрировало
комбинацию ниволумаба с ХТ в качестве первой линии терапии
метастатического рака желудка
вне зависимости от экспрессии
PD-L1.
На ASCO 2021 были доложены
обновленные результаты исследования, из которого следует, что
польза от добавления ниволумаба
в отношении ВБП и ОВ наблюдается только у пациентов с экспрессией PD-L1 CPS ≥5, хотя повышение
ЧОО наблюдалось во всех подгруппах (рис. 4).
Данная опция для пациентов с
PD-L1 CPS ≥5 нашла свое отражение в клинических рекомендациях
Минздрава по лечению рака пищевода и желудка.
В лечении HER2-позитивного рака
желудка с момента регистрации
трастузумаба в первой линии терапии никакого прогресса не наблюдалось. Лишь в 2020 г. были
представлены оптимистичные
результаты исследования с трастузумабом дерукстеканом во
второй-третьей линиях. На ASCO
2021 были представлены предварительные результаты исследования KEYNOTE-811, где пациенты
в качестве первой линии терапии
получали ХТ + трастузумаб ± пертузумаб. Исследование завершено,
но пока были представлены лишь
данные по ЧОО, которая выросла
с 51,9% до фантастических 74,4%
[7]. Вдохновленное этими результатами, FDA в мае 2021 г. сразу же
зарегистрировало данную комбинацию в качестве первой линии.
Хочется верить, что на этот раз
уважаемая организация не приняла скоропалительного решения
и вскоре мы увидим позитивные
результаты по ВБП и ОВ.
Рисунок 3.
Эффективность терапии в зависимости от экспрессии PD-L1 в исследовании
CHECKMATE-649.
Список литературы:
1. Jessie A Elliott, Sheraz Markar, Fredrik Klevebro, et al. ENSURE: An international multicenter study exploring whether surveillance after esophageal cancer surgery impacts oncological and quality-of-life outcomes. J Clin Oncol 39, 2021 (suppl 15; abstr 4032).
2. Kelly RJ, Ajani J, Kuzdzal J, et al. Adjuvant nivolumab (NIVO) in resected esophageal or gastroesophageal junction cancer (EC/GEJC) following neoadjuvant chemoradiotherapy (CRT): Expanded efficacy and safety analyses from CheckMate 577. ASCO 2021 #4003.
3. Reynolds J, Preston S, O'Neill B, et al. Neo-AEGIS (Neoadjuvant trial in Adenocarcinoma of the Esophagus and Esophago-Gastric Junction International Study): Preliminary results of phase III RCT of CROSS versus perioperative chemotherapy (Modified MAGIC or FLOT protocol). ASCO 2021 #4004.
4. Kato K, Sun J, Shah MA, et al. Pembrolizumab plus chemotherapy versus chemotherapy as first-line therapy in patients with advanced esophageal cancer: The phase 3 KEYNOTE-590 study. Annals of Oncology, 2020, 31 (suppl_4): S1142-S1215. 10.1016/ annonc/annonc325.
5. Ian Chau, Yuichiro Doki, Jaffer A. Ajani, et al. Nivolumab (NIVO) plus ipilimumab (IPI) or NIVO plus chemotherapy (chemo) versus chemo as first-line (1L) treatment for advanced esophageal squamous cell carcinoma (ESCC): First results of the CheckMate 648 study. J Clin Oncol 39, 2021 (suppl 15; abstr LBA4001).
6. Moehler M, Shitara K, Garrido M, et al. Nivolumab (nivo) plus chemotherapy (chemo) versus chemo as first-line (1L) treatment for advanced gastric cancer/ gastroesophageal junction cancer (GC/ GEJC)/esophageal adenocarcinoma (EAC): First results of the CheckMate 649 study. Annals of Oncology, 2020, 31 (suppl_4): S1142-S1215. 10.1016/ annonc/annonc325.
7. Yelena Y. Janjigian, Akihito
Kawazoe, Patricio Eduardo Yanez, et al.
Pembrolizumab plus trastuzumab and
chemotherapy for HER2+ metastatic
gastric or gastroesophageal junction (G/
GEJ) cancer: Initial findings of the global
phase 3 KEYNOTE-811 study. J Clin
Oncol 39, 2021 (suppl 15; abstr 4013).
НОВОСТИ ASCO 2021: КОЛОРЕКТАЛЬНЫЙ РАК С МУТАЦИЕЙ В ГЕНЕ BRAF
Автор: Федянин Михаил Юрьевич
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
С увеличением покрытия молекулярно-генетическим тестированием популяции пациентов с метастатическим колоректальным раком все чаще в клинической практике встречаются больные с мутацией в гене BRAF и все актуальнее становится вопрос, можно ли применять стандартные подходы в лечении рака толстой кишки с данной альтерацией или нет. К настоящему времени уже известно об агрессивном течении данного подтипа опухоли [1] с медианой продолжительности жизни пациентов с момента начала первой линии терапии в академических центрах всего 11,7 месяца [2], низкой эффективности добавления анти-EGFR моноклональных антител к химиотерапии [1], частотой встречаемости в РФ 5% [3], эффективности во второй и последующих линиях лечения комбинации BRAF ингибиторов с анти-EGFR антителами [4]. В данной статье рассмотрим, на какие вопросы удалось ответить исследователям по результатам работ, представленных на ASCO 2021 года, касаемых метастатического рака толстой кишки с мутацией в гене BRAF. Несмотря на внедрение молекулярно-генетического профилирования при метастатическом колоректальном раке, можно видеть, что в зависимости от региона земного шара даже в современных условиях имеется значимое отставание в определении мутационного статуса гена BRAF. И если в восточной Азии, западной Европе, Северной Америке и Австралии частота определения профиля гена BRAF находится на уровне 88-97%, то уже в восточной Европе, Африке/Индии/Ближнем Востоке и Южной Америке она составляет всего 47%, 67% и 52% соответственно [5]. Вероятно, в РФ частота определения мутационного статуса гена BRAF находится на уровне восточной Европы. А здесь принципиально помнить, что кроме негативного предикторного значения в отношении эффективности добавления анти-EGFR антител к химиотерапии, наличие мутации в гене BRAF определяет эффективность нового лечебного подхода – сочетания ингибитора BRAF с анти-EGFR моноклональным антителом. Так, в рандомизированном исследовании III фазы BEACON при сравнении комбинации BRAF ингибитора (энкорафениба), анти-EGFR антитела (цетуксимаба) с или без MEK ингибитора (биниметиниба) и комбинации иринотекана или режима FOLFIRI с цетуксимабом во 2-3 линии лечения больных метастатическим раком толстой кишки с мутацией в гене BRAF применение тройной или двойной комбинации таргетных препаратов привело к увеличению в 10 раз частоты объективных эффектов (26,8 и 19,5% соответственно) в сравнении с контрольной группой (1,8%). При этом наибольшая частота объективных эффектов зарегистрирована при применении тройной комбинации во второй линии терапии – 28%. Применение комбинации BRAF, MEK ингибитора и анти-EGFR антитела также привело к снижению риска смерти на 40% (ОР 0,6; 95% ДИ 0,47-0,75; р<0,0001), что вылилось и в увеличение медианы продолжительности жизни до 9,3 месяца в сравнении с 5,9 месяца в группе контроля. При этом не отмечено различий между двойной и тройной комбинацией таргетных препаратов ни в отношении выживаемости без прогрессирования, ни в отношении общей выживаемости (ОР 0,95; 95% ДИ 0,74-1,21) [4, 6]. Тем не менее, встает вопрос, почему не все пациенты отвечают на лечение, какие механизмы резистентности к данному типу лечения развиваются, есть ли клинические факторы, которые позволяют отобрать пациентов с наибольшим выигрышем от назначения таргетной терапии, есть ли перспективы применения данной комбинации и в первой линии лечения. Известно, что пациенты с поражением печени и легких чаще встречаются среди долгожителей с мутацией в гене BRAF [7]. Анализ двух баз данных (TCGA и GSE39582) с информацией суммарно о 1035 пациентах с колоректальным раком, из которых 172 имели BRAF (V600E) мутацию, позволил выявить в качестве негативного прогностического фактора при данной альтерации экспрессию гена HPSE (р=0,037, при многофакторном анализе ОР 1,97, р=0,044). При этом экспрессия данного гена встречается у 48,2% при BRAF мутации. Интересно, что при выключении гена HPSE в клеточных линиях рака толстой кишки с мутацией BRAF (V600E) значимо нарушалось формирование колоний и происходил арест клеточного цикла на этапе G0/G1 большинства опухолевых клеток [8]. Можно вспомнить и результаты исследования прогностических факторов при мутации в гене BRAF среди пациентов, которым проводилась терапия таргетными препаратами (ингибиторами BRAF с анти-EGFR антителами с или без ингибиторов МЕК) в исследовании BEACON. При хорошем функциональном статусе (ECOG 0) и нормальном уровне РЭА медиана общей выживаемости не была достигнута, при одном неблагоприятном факторе прогноза (ECOG1 или повышенный уровень РЭА) медиана составила 13,5 месяца, при двух факторах неблагоприятного прогноза – 5,6 месяца [9]. Исследователи пошли дальше и изучили, как характер первой линии лечения влияет на результаты таргетной терапии. Среди пациентов, которые принимали участие в исследовании BEACON, 64% больных получали предшествующую терапию с включением бевацизумаба в группе тройной таргетной блокады, а в группе двойной таргетной терапии 55%, 95% и 88% проводилась предшествующая терапия с включением оксалиплатина, 20% и 14% – режимом FOLFOXIRI соответственно. В группе энкорафениба и цетуксимаба медиана общей выживаемости всегда была выше в сравнении с контрольной группой (FOLFIRI/ иринотекан с цетуксимабом) независимо от предшествующего лечения. При этом наибольший выигрыш наблюдался среди пациентов, которым проводилась предшествующая терапия бевацизумабом на протяжении более 4 месяцев (10,7 месяца против 4,4 месяца соответственно) [10]. Следующим шагом исследователи оценили эффективность лечения таргетной терапии в зависимости от молекулярного подтипа опухоли. Удалось провести молекулярно-генетический анализ и субтипирование у 527 из 665 пациентов (79,2%). При этом 84,6% больных относились к CMS1 (иммунному) или CMS4 (мезенхимальному) подтипу. Различий по эффективности между общей популяцией пациентов в исследовании и когортой пациентов анализа биомаркеров не получено, что позволило сделать следующий этап работы. Авторы выявили, что частота объективных эффектов при мезенхимальном подтипе была выше при применении тройной таргетной блокады (33,3% против 19,2%, в группе энкорафениба и цетуксимаба) [11]. Xu с соавторами, проведя секвенирование 520 генов образцов опухоли и ДНК плазмы крови 22 больных раком толстой кишки с мутацией в гене BRAF, которым проводилась терапия BRAF ингибитором в комбинации с цетуксимабом с или без траметиниба, также попытались выявить причины резистентности к таргетному лечению. Опухолевый материал и плазма крови брались перед началом терапии и при прогрессировании. Частота объективных эффектов и контроля болезни составила 32% и 86% соответственно; 7 пациентов продолжали лечение на момент публикации. Совместно с BRAF мутацией исследователи выявили у 91% пациентов мутации в гене TP53, у 36,4% – мутации в гене RNF43, у 31,8% – LRP18 и APC, у 22,7% – гена PIK3CA и у 18,2% – гена RECQL4. Среди пациентов с мутациями в генах RNF43 или RECQL4 отмечалась наиболее длительная выживаемость без прогрессирования. В то же время наихудший прогноз течения болезни был при наличии мутаций в генах PPP2R2A, RUNX1T1 и генах тиНачало на стр. 4 розинкиназных рецепторов сигнальных путей. Однако данные находки свидетельствуют больше о прогнозе заболевания, а не являются предикторами первичной резистентности. Более интересная часть работы – что появилось в геноме у 15 пациентов, у которых развилось прогрессирование; наиболее часто выявлялась амплификация гена МЕТ (27%) и амплификация генов BRAF, KRAS, NRAS – по 20% каждого. При этом в генах RAS в 83% появлялись мутации в кодоне Q61 [12]. Таким образом, как и при терапии ингибиторами EGFR при раке легкого с мутацией гена EGFR, нас ждет реализации аналогичных подходов в исследованиях по преодолении резистентности к таргетной терапии. Дальнейший поиск подгрупп с наибольшей эффективностью таргетной терапии у пациентов с мутацией в гене BRAF может нас привести и к подгрупповому анализу исследования BEACON. В нем было показано, что значимый выигрыш от тройной или двойной таргетной блокады реализуется среди пациентов с микросателлитным стабильным фенотипом (MSS) (ОР 0,52, 95% ДИ 0,39-0,69 и ОР 0,48, 95% ДИ 0,36-0,64 соответственно). Тогда как при микросателлитной нестабильности (MSI) значимого эффекта в сравнении с контрольной группой в отношении общей выживаемости получено не было (ОР 0,7, 95% ДИ 0,29-1,67 и ОР 0,74, 95% ДИ 0,29-1,89 соответственно) [4]. Это может быть связано как с небольшой выборкой пациентов с MSI, так и с действительно меньшей эффективностью таргетной терапии в связи с большим числом сопутствующих мутаций в геноме клеток вследствие нарушений в системе репараций неспаренных оснований. Последний факт определяет эффективность в данной группе пациентов ингибиторов иммунных контрольных точек и ставит перед нами вопрос, что лучше назначать в лечении пациентов с мутацией в гене BRAF и наличием MSI – таргетную или иммунотерапию и влияет ли наличие мутации в гене BRAF на эффективность иммунотерапии. На последний вопрос отвечают результаты метаанализа, представленные на конференции ASCO 2021. Исследователи объединили данные 3 исследований, включившие 178 пациентов, и показали, что наличие мутации в гене BRAF при MSI не влияет на эффективность (шанс достижения объективного эффекта) ингибиторов иммунных контрольных точек (ОШ 1,04; 95% ДИ 0,48-2,25) [13]. Аналогичные данные были получены при анализе проспективной когорты пациентов с MSI группы клиник из Франции, которым проводилась терапия различными вариантами ингибиторов иммунных контрольных точек, но уже в отношении выживаемости без прогрессирования (ОР 1,2; 95% ДИ 0,52-2,76; р=0,6) [14]. Таким образом, видна прогностическая гетерогенность группы пациентов с BRAF мутаций. Если рассматривать другие лечебные опции в терапии пациентов с метастатическим раком толстой кишки и мутацией в гене BRAF, следует остановиться еще на 2 вопросах – оптимальном режиме первой линии терапии и эффективности метастазэктомии. К началу 2021 года на первый вопрос онкологи отвечали, что возможно применять в первой линии как режим FOLFOXIRI с бевацизумабом, так и FOLFOX с бевацизумабом. И если более интенсивный режим приводит к большей частоте объективных эффектов, то в сравнении со стандартной двойной комбинацией не улучшает ни выживаемость без прогрессирования, ни общую выживаемость [15, 16]. И можно провести дифференциацию в назначении того или иного режима, как и при других молекулярных типах метастатического колоректального рака: если требуется циторедукция – выбор за режимом FOLFOXIRI с бевацизумабом, если контроль болезни – достаточно FOLFOX с бевацизумабом. Однако имеются еще и результаты исследования VOLFI, в котором добавление к режиму FOLFOXIRI панитумумаба (анти-EGFR антитела) увеличивает частоту достижения объективных эффектов с 22,2% до 71,4% (ОШ 8,75; 95% ДИ 0,9-84,8). Правда, данные результаты получены при анализе всего 16 пациентов, 2 из которых имели не V600E мутации [17]. На конференции ASCO 2021 были представлены результаты проспективного рандомизированного исследования II фазы (FIRE-4.5) по сравнению эффективности комбинации FOLFOXIRI с бевацизумабом и FOLFOXIRI с цетуксимабом в первой линии терапии метастатического рака толстой кишки с мутацией в гене BRAF. Всего было рандомизировано 108 пациентов в отношении 1:2. В качестве первичного критерия эффективности была выбрана частота объективных эффектов – предполагалось, что при применении анти-EGFR антитела данный показатель будет больше. Оказалась обратная ситуация: при добавлении бевацизумаба к режиму FOLFOXIRI частота объективных эффектов была выше – 66,7% против 52% в группе цетуксимаба. Аналогично и медиана выживаемости без прогрессирования превалировала в группе антиангиогенного препарата (8,3 месяца против 5,9 месяца; ОР 1,8; р=0,03). И если при левосторонней локализации первичной опухоли значимых различий в эффективности между сравниваемыми группами не было, то при правосторонней локализации однозначно выигрывал бевацизумаб [18]. Таким образом, даже при применении интенсивных режимов химиотерапии необходимо добавлять при мутации в гене BRAF бевацизумаб. А насколько эффективен подход применения таргетной терапии, направленной на BRAF молекулу, в первой линии при раке толстой кишки? В 2020 году были представлены результаты исследования ANCHOR по применению комбинации энкорафениба, биниметиниба и цетуксимаба в первой линии лечения. Исследователи сообщили о 50% объективных эффектов, 85% частоты контроля болезни и медиане выживаемости без прогрессирования всего 4,9 месяца [19]. Конечно, при косвенном сравнении с химиотерапией и бевацизумабом показатели выживаемости без прогрессирования проигрывают, но достаточный процент контроля болезни позволяет рассматривать данный терапевтический подход в первой линии в случае невозможности назначения химиотерапии, например, при нарастающем нарушении функции органов, низком функциональном статусе. В то же время достигнутые показатели непосредственной эффективности в исследовании ANCHOR легли в основу инициации проспективного рандомизированного исследования III фазы BREAKWATER по сравнению в первой линии лечения комбинации энкорафениба и цетуксимаба (группа А), режима FOLFOX или FOLFIRI с энкорафенибом и цетуксимабом (группа B – химиотерапевтический компонент будет определен по результатам первой части исследования) и химиотерапии (FOLFOX или XELOX или FOLFIRI или FOLFOXIRI) с или без бевацизумаба (группа С) [20]. Появление в арсенале онкологов интенсивных режимов химиотерапии с высоким потенциалом перевода метастазов рака толстой кишки в операбельное состояние, прогностическую гетерогенность популяции больных с мутацией в гене BRAF определяет публикацию все большего числа работ по оценке возможности метастазэктомии в данной популяции пациентов. На конференции ASCO 2021 были представлены результаты трех таких исследований. В исследовании Zhang с соавторами 46 из 119 пациентам с мутацией в гене BRAF после системного лечения было выполнено хирургическое удаление метастазов. Медиана общей выживаемости в группе оперированных больных не была достигнута, тогда как в группе только системного лечения составила 8,3 месяца (р<0,001). Данный эффект хирургии метастазов в отношении улучшения общей выживаемости был подтвержден и при многофакторном регрессионном анализе [21]. В исследовании российских авторов пошли дальше и сравнили выживаемость пациентов после метастазэктомии в зависимости от мутационного фенотипа: 26 пациентов с мутацией в гене BRAF, 56 пациентов с мутацией в генах RAS и 43 пациента с диким типом генов RAS и BRAF. Медиана общей выживаемости составила 26 месяцев, 38 месяцев и не была достигнута соответственно (ОР 1,5; 95% ДИ 1,0-2,4; р=0,06). Интересно, что проведение периоперационной химиотерапии при мутации в гене BRAF не влияла на показатели выживаемости [22]. Аналогичный методологический подход был реализован и в финском проспективном исследовании Finnish RAXO: было идентифицировано 289 пациентов с диким типом генов RAS и BRAF, 529 пациентов с мутациями генов RAS и 88 с мутацией в гене BRAF. Первичная резектабельность метастазов описана у 32%, 29% и 15%, а переход в операбельное состояние в процессе лечения – еще у 16%, 13% и 7% соответственно. Медиана общей выживаемости при выполнении R0/R1 резекции органов с метастазами составила 89 месяцев в группе дикого типа генов, 69 месяцев в группе мутаций в генах RAS и 30 месяцев в группе мутации гена BRAF (ОР 3,11; 95% ДИ 1,49-6,49) [23]. Несмотря на сравнительно худшие показатели общей выживаемости после метастазэктомии в группе мутации BRAF, из исследования в исследование достигается медиана продолжительности жизни на уровне 30 месяцев, что значимо выше в сравнении с пациентами, у которых проводится только системная терапия, что позволяет говорить о возможности применения хирургического подхода по удалению метастазов у отобранных пациентов и с данным мутационным фенотипом. Таким образом, по результатам конференции ASCO 2021, для пациентов с метастатическим раком толстой кишки и мутацией в гене BRAF подтверждена эффективность комбинации химиотерапии с бевацизумабом в первой линии лечения; описана возможность у отобранной подгруппы пациентов выполнения метастазэктомии; подчеркнута эффективность применения комбинации BRAF ингибитора и анти-EGFR антитела начиная со второй линии независимо от характера первой линии лечения; лучшие показатели выживаемости при применении тройной таргетной блокады при наличии мезенхимального фенотипа опухоли; эффективность иммунотерапии при сочетании мутации в гене BRAF и MSI. Теперь будем ждать результатов WGICС 2021 и ESMO 2021.
Источники:
1. Yuan Z-X, Wang X-Y, Qin Q-Y, et al. The prognostic role of BRAF mutation in metastatic colorectal cancer receiving antiEGFR monoclonal antibodies: a metaanalysis. PLoS ONE. 2013; 8(6):e65995. doi:10.1371/journal.pone.0065995.
2. Modest DP, Ricard I, Heinemann V, et al. Outcome according to KRAS-, NRASand BRAF-mutation as well as KRAS mutation variants: pooled analysis of five randomized trials in metastatic colorectal cancer by the AIO colorectal cancer study group. Ann Oncol. 2016 Sep; 27(9): 1746- 53. doi: 10.1093/annonc/mdw261.
3. Федянин М.Ю., Эльснукаева Х.Х., Демидова И.А., и др. Колоректальный рак с мутацией в гене BRAF в Российской Федерации: эпидемиология и клинические особенности. Результаты многоцентрового исследования. Медицинский совет. 2021 (4S).
4. Tabernero J, Grothey A, Van Cutsem E, et al. Encorafenib Plus Cetuximab as a New Standard of Care for Previously Treated BRAF V600E-Mutant Metastatic Colorectal Cancer: Updated Survival Results and Subgroup Analyses from the BEACON Study J Clin Oncol. 2021 Feb 1; 39(4): 273-284. doi: 10.1200/ JCO.20.02088.
5. Desai J, Kopetz S, Grothey A, et al. Global BRAF testing practices in metastatic colorectal cancer (mCRC). J Clin Oncol 39, 2021 (suppl 15; abstr e15523). DOI: 10.1200/JCO.2021.39.15_suppl.e15523.
6. Kopetz S, Grothey A, Yaeger R, et al. Encorafenib, Binimetinib, and Cetuximab in BRAF V600E-Mutated colorectal cancer. N Engl J Med. 2019 Oct 24; 381(17): 1632-1643. doi: 10.1056/ NEJMoa1908075.
7. Morris VK, Kee BK, Overman MJ, et al. Clinical and pathologic factors associated with survival in BRAFV600E colorectal cancers. J Clin Oncol 38: 2020 (suppl; abstr 4047). DOI: 10.1200/ JCO.2020.38.15_suppl.4047.
8. Liu M, Xu X, Peng K, et al. The role of HPSE in BRAF V600E-mutant colorectal cancer. J Clin Oncol 39, 2021 (suppl 15; abstr 3530). DOI: 10.1200/ JCO.2021.39.15_suppl.3530.
9. Montañá JR, Martini G, Baraibar I, et al. Patient and tumor characteristics as determinants of overall survival (OS) in BRAF V600 mutant (mt) metastatic colorectal cancer (mCRC) treated with doublet or triplet targeted therapy. J Clin Oncol 38: 2020 (suppl; abstr 4112). DOI: 10.1200/JCO.2020.38.15_suppl.4112. 10.Kopetz S, Aderka D, Grothey A, et al. Overall survival (OS) with encorafenib (enco) + cetuximab (cetux) in BEACON CRC: Effect of prior therapy for BRAF V600E-mutant metastatic colorectal cancer (mCRC). J Clin Oncol 39, 2021 (suppl 15; abstr 3583). DOI:
10.1200/ JCO.2021.39.15_suppl.3583.
11.Kopetz S, Murphy DA, Pu J, et al. Molecular correlates of clinical benefit in previously treated patients (pts) with BRAF V600E-mutant metastatic colorectal cancer (mCRC) from the BEACON study. J Clin Oncol 39, 2021suppl 15; abstr 3513). DOI: 10.1200/ JCO.2021.39.15_suppl.3513.
12.Xu T, Wang X, Changsong Q, et al. Genomic profiles of BRAF inhibitor resistance mechanisms in metastatic colorectal cancer. J Clin Oncol 39, 2021 (suppl 15; abstr e15527). DOI: 10.1200/ JCO.2021.39.15_suppl.e15527.
13.Park R, da Silva LL, Lee S, et al. Impact of BRAF mutations on prognosis and immunotherapy response in microsatellite instability/mismatch repair deficient metastatic colorectal cancer: A systematic review and meta-analysis. J Clin Oncol 39, 2021 (suppl 15; abstr 3557). DOI: 10.1200/JCO.2021.39.15_ suppl.3557.
14.Colle R, Cachanado M, Rousseau A, et al. Parameters associated with outcomes in pretreated MSI/dMMR metastatic colorectal cancer (mCRC) treated with immune checkpoint inhibitors (ICI): Subgroup analysis of a prospective cohort. J Clin Oncol 39, 2021 (suppl 15; abstr 3580). DOI:10.1200/ JCO.2021.39.15_suppl.3580.
15.Fedyanin M, Polyanskaya E, Elsnukaeva H, et al. FOLFOXIRI versus FOLFOX or FOLFIRI with targeted therapy in patients with mutant BRAF metastatic colorectal cancer: A systematic review and metaanalysis. Meditsinskiy sovet = Medical Council. 2020; (20): 125-132. (In Russ.) https://doi.org/10.21518/2079- 701X-2020-20-125-132.
16.Cremolini C, Antoniotti C, Stein A, et al. Individual patient data meta-analysis of FOLFOXIRI plus bevacizumab versus doublets plus bevacizumab as initial therapy of unresectable metastatic colorectal cancer. J Clin Oncol. 2020 Aug 20; JCO2001225. doi: 10.1200/ JCO.20.01225.
17. Modest DP, Martens UM, RieraKnorrenschild J, et al. FOLFOXIRI Plus Panitumumab As First-Line Treatment of RAS Wild-Type Metastatic Colorectal Cancer: The Randomized, Open-Label, Phase II VOLFI Study (AIO KRK0109). J Clin Oncol. 2019 Dec 10; 37(35): 3401- 3411. doi: 10.1200/JCO.19.01340.
18.Stintzing S, Heinrich K, Tougeron D, et al. Randomized study to investigate FOLFOXIRI plus either bevacizumab or cetuximab as first-line treatment of BRAF V600E-mutant mCRC: The phase-II FIRE-4.5 study (AIO KRK-0116). J Clin Oncol 39, 2021 (suppl 15; abstr 3502). DOI: 10.1200/ JCO.2021.39.15_suppl.3502. Начало на стр. 5
19.Grothey A, Tabernero J, Taieb J, et al. ANCHOR CRC: a single-arm, phase 2 study of encorafenib, binimetinib plus cetuximab in previously untreated BRAF V600Emutant metastatic colorectal cancer. Ann Oncol. 2020; 31(S3): S243. Doi: https://doi.org/10.1016/j. annonc.2020.04.484.
20.Kopetz S, Grothey A, Yaeger R, et al. BREAKWATER: Randomized phase 3 study of encorafenib (enco) + cetuximab (cetux) ± chemotherapy for first-line (1L) treatment (tx) of BRAF V600Emutant (BRAFV600E) metastatic colorectal cancer (mCRC). J Clin Oncol 39, 2021 (suppl 15; abstr TPS3619). DOI: 10.1200/JCO.2021.39.15_suppl. TPS3619.
21.Zhang J, Shen C, Li J, et al. Clinicopathologic features and impact of metastasectomy in patients with BRAFmutant metastatic colorectal cancer. J Clin Oncol 39, 2021 (suppl 15; abstr e15547). DOI:10.1200/JCO.2021.39.15_ suppl.e15547.
22.Fedyanin M, Elsnukaeva K,
Demidova I, et al. Metastasectomy in
colorectal carcinoma (CRC) patients
(pts) with mBRAF: Prospective database
analysis. J Clin Oncol 39, 2021 (suppl
15; abstr e15549). DOI:10.1200/
JCO.2021.39.15_suppl.e15549.
23.Osterlund PJ, Osterlund E, Uutela
A, et al. Resectability, conversion
and resections rates, and outcomes
in RAS&BRAF wildtype (wt), RAS
mutant (mt) and BRAFmt metastatic
colorectal cancer (mCRC) subgroups in
the prospective Finnish RAXO-study.
J Clin Oncol 39, 2021 (suppl 15; abstr
3532). DOI:10.1200/JCO.2021.39.15_
suppl.3532.
НАИБОЛЕЕ ЗНАЧИМЫЕ ИССЛЕДОВАНИЯ ПО РАННЕМУ РАКУ МОЛОЧНОЙ ЖЕЛЕЗЫ, ПРЕДСТАВЛЕННЫЕ НА ЕЖЕГОДНОМ КОНГРЕССЕ ASCO 2021
Авторы: Хорошилов Максим Викторович
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
Артамонова Елена Владимировна
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
С 4 по 8 июня 2021 года состоялась очередная конференция Американского общества клинической онкологии (American Society of Clinical Oncology, ASCO). В данном обзоре мы представляем наиболее значимые исследования, которые касались раннего рака молочной железы.
1) Одними из наиболее ожидаемых были промежуточные результаты исследования III фазы OlympiA (Abstract LBA01).
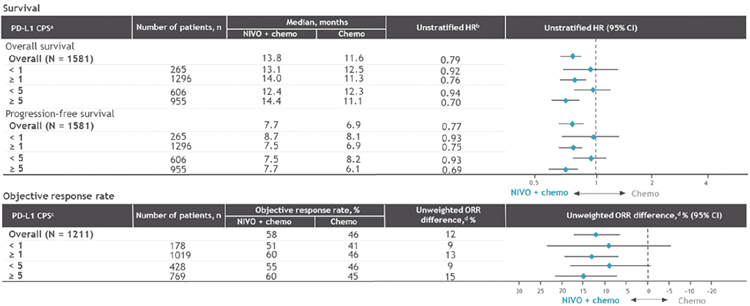
Исследование посвящено изучению эффективности применения PARPингибитора олапариба в сравнении с плацебо у больных ранним gBRCAm HER2-негативным РМЖ группы высокого риска в адъювантном режиме. Набор в исследование велся с 2014 года и суммарно проанализированы данные 1836 пациенток высокого риска, под которым авторы понимали следующее: ТН РМЖ при ≥pT2 или ≥pN1 до проведения АХТ или отсутствие достижения полного патоморфологического ответа (pCR) после неоадъювантной химиотерапии (НАХТ); люминальный РМЖ с ≥4 пораженными лимфоузлами до проведения АХТ или при отсутствии достижения pCR и индексе CPS-EG≥3 (комбинированная прогностическая шкала с включением клинико-патологической стадии и степени злокачественности [G]) после НАХТ. Пациентки рандомизировались 1:1 и в адъювантном режиме в течение года принимали олапариб или плацебо. При люминальном подтипе допускалось применение олапариба на фоне АГТ ± золендроновая кислота (спустя год исследования прием АГТ продолжался). При тройном негативном (ТН) подтипе РМЖ с резидуальной опухолью не назначался капецитабин в адъювантном режиме в связи с отсутствием доказанной эффективности на момент начала исследования. Были доложены следующие результаты: при медиане наблюдения в 2,5 года 3-летняя выживаемость без инвазивных проявлений заболевания (ВБиП) составила 85,9% в группе олапариба и 77,1% в группе плацебо (95% ДИ 4,5- 13,0), риск рецидива или смерти был на 42% статистически достоверно ниже в группе олапариба по сравнению с плацебо (95% ДИ 0,41-0,82; p<0,001). 3-летняя выживаемость без отдаленных метастазов составила 87,5% в группе олапариба и 80,4% в группе плацебо (95% ДИ 3,0-11,1; ОР отдаленного метастазирования и смерти 0,57 [95% ДИ 0,39-0,83; p<0,001]). В группе олапариба наблюдалось меньшее количество смертей (59 Ола против 86 Пл), хотя достичь заданную границу достоверности при р<0,01 не удалось (ОР=0,68; 95% ДИ 0,44-1,05; р=0,02). Профиль нежелательных явлений при приеме олапариба в представленном исследовании был схож с результатами прошлых исследований препарата. Более 1% пациенток имели проявления токсичности 3 степени в виде анемии (8,7%), нейтропении (4,8%), лейкопении (3,0%) и усталости (1,8%). Частота серьезных нежелательных явлений и побочных эффектов, включая миелодиспластический синдром или острый миелоидный лейкоз, злокачественного новообразования (8,7% против 8,4%) и пневмонита (2,6% против 4,6%), не увеличивалась у пациентов в группе олапариба.
2) Представлены результаты исследования II фазы NEOTALA (Abstract 505).
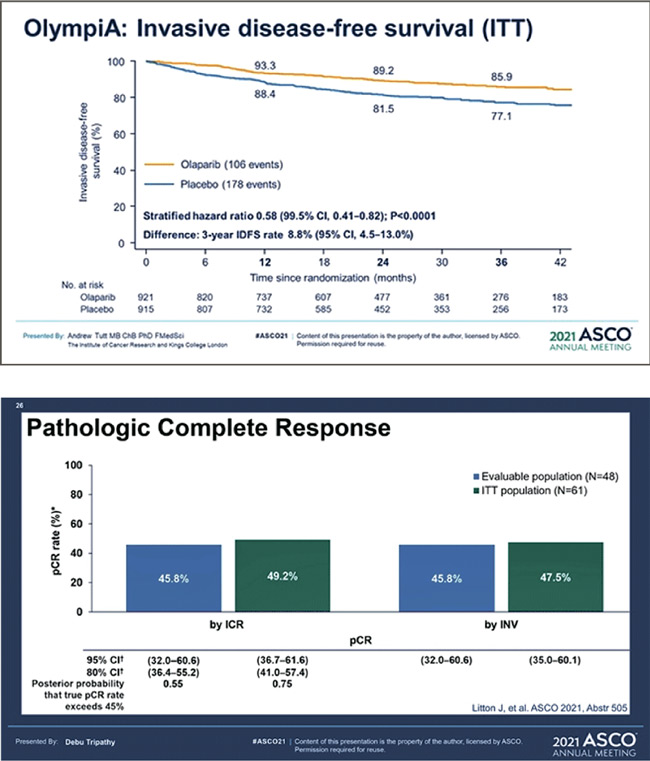
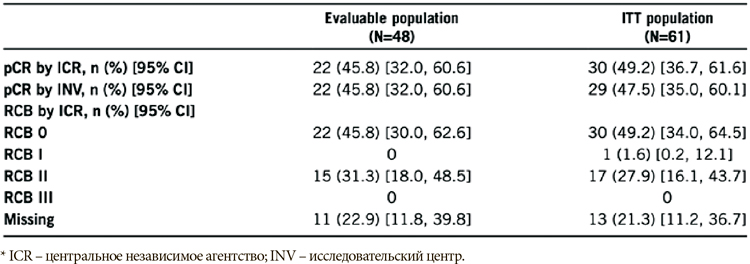
Активно ведется изучение и другого PARP ингибитора – талазопариба, который уже зарегистрирован для применения при местнораспространенном и метастатическом HER2- негативном раке молочной железы с наличием gBRCAm. В представленной работе изучалась эффективность и переносимость талазопариба в неоадъювантном режиме у пациенток с ТН подтипом раннего рака молочной железы, имеющих gBRCA1/2m. Целью исследования была центральная независимая оценка достижения полного патоморфологического ответа (pCR) через 24 недели неоадъювантной терапии талазопарибом с последующим оперативным лечением. Всего в исследование включена 61 пациентка, однако оценка эффекта проводилась только у группы получивших не менее 80% суммарной дозы талазопариба с момента включения до оценки pCR и у пациенток, запрогрессировавших до момента оценки патоморфоза (N=48). По результатам исследования можно сделать вывод, что талазопариб имеет удовлетворительный профиль токсичности. Среднее время приема препарата 23,3 недели, средняя кумулятивная доза 84,5%. Из нежелательных явлений отмечались усталость у 78,7% (3 степени – 3,3%), тошнота у 68,9% (3 степени – 1,6%), алопеция у 57,4% (2 степени – 3,3%), 2 пациентки прекратили лечение в связи с анемией 3 степени и 1 пациентка – в связи с головокружением 3 степени. Результаты достижения полных патоморфологических ответов можно детально рассмотреть в предложенной таблице. В выводах авторы отмечают, что талазопариб в неоадъювантном режиме хорошо переносится пациентами и имеет сопоставимые данные достижения полного патоморфологического ответа по сравнению со стандартными режимами НАХТ, включающими антрациклины и таксаны.
3) Не менее интересным также был первый анализ общей выживаемости исследования WSGADAPT HR-/HER2+, представленный в ходе конгресса N. Harbeck (Abstract 503).
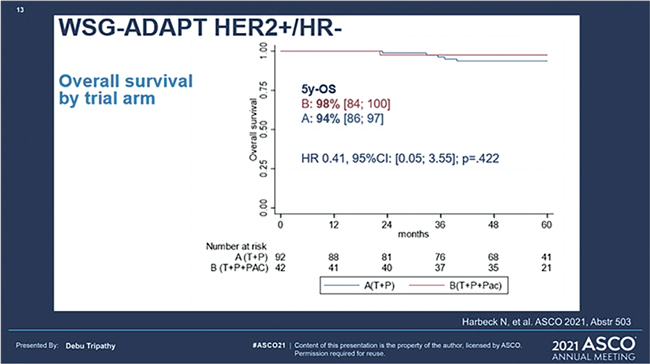
Исследование было направлено на изучение возможности деэскалации лечения при раннем HER2-позитивном нелюминальном раке молочной железы. Всего включены 134 пациентки с cT1- T4c, cN0-3, HR-, HER2-позитивные, 60% из которых имели сТ2-4, 42% имели клинически пораженные лимфоузлы. Случайным образом пациентки рандомизировались на 2 группы: первая группа получала в неоадъювантном режиме 4 курса химиотаргетной терапии трастузумабом и пертузумабом с добавлением паклитаксела еженедельно 12 введений, а вторая группа получала таргетную терапию по той же схеме, но без применения паклитаксела. Оперативное лечение начиналось спустя 3 недели после окончания лекарственной терапии. Если было достижение pCR, то по решению исследователя адъювантная химиотерапия могла не проводиться. Ранее уже были доложены результаты по первичной конечной точке, которой являлась частота полного патоморфологического ответа (ypT0/ is, ypN0). Стоит учесть, что в группе только таргетной терапии учитывались исключительно пациентки, имеющие ранний ответ, что расценивалось как низкая клеточность (менее 500 клеток опухоли в поле зрения) и/ или снижение ki67 более чем на 30% при повторной биопсии опухоли через 3 недели от начала лечения. Были достигнуты следующие значения: 90% pCR в группе химиотаргетной терапии и 34% в группе без применения химиопрепаратов. Стоит отметить, что у пациенток с HER2 low, под которым понимали 1+; 2+ по ИГХ и позитивных по FISH (ориг. IHC 1+/2+ and FISH positive) и/или с базально-подобным подтипом (подтвержденным PAM50), не было зафиксировано ни одного полного патоморфоза. Столь выраженная разница, казалось бы, должна была отрицательно повлиять на отдаленные показатели Начало на стр. 6 выживаемости, однако вернемся к текущему докладу, где представлены первые отдаленные результаты. При медиане наблюдения в 5 лет не было достоверной разницы в выживаемости между исследуемыми группами (триплет против дуплета): ВБП 98% и 87% соответственно (ОР=0,32; р=0,144); выживаемость без отдаленных проявлений болезни (ВБоП) 98% и 92% соответственно (ОР=0,34; р=0,313); общая выживаемость (ОВ) 98% и 94% соответственно (ОР=0,41; р=0,422). Отмечается, что пациентки, достигшие pCR (N=69), имели лучшие показатели 5-летней выживаемости без инвазивных проявлений болезни независимо от группы: 98% и 82% соответственно (ОР=0,14; р=0,011). Также отмечается ухудшение результатов ВБоП (р=0,029) и безинвазивной выживаемости (р=0,068) у пациенток с HER2 low и/или без раннего ответа на проводимую терапию. Вопрос о деэскалации режимов химиотерапии при высокочувствительных опухолях все еще остается открытым, необходимо больше результатов подобных исследований с похожим дизайном, некоторые из которых уже ведутся – COMPASS и DECRESCENDO.
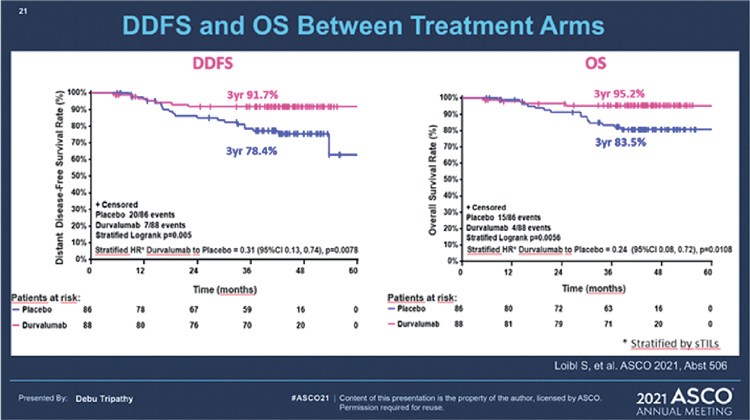
4) Представлены отдаленные результаты исследования II фазы GeparNuevo (Abstract 506).
В представленной работе изучается анти-PD-L1 чекпоинт ингибитор дурвалумаб в комбинации с неоадъювантной химиотерапией при ТН РМЖ. Основной целью исследования было увеличение частоты достижения полного патоморфологического ответа. В исследование включались прежде не леченные пациентки с ТН РМЖ и первичной опухолью >2 см. Перед началом лечения, с целью стратификации, оценивался уровень стромальных инфильтрирующих опухоль лимфоцитов (сИОЛ), статус PD-L1, а также уровень ki67. Всего рандомизированы 174 пациентки в 2 группы, которые получали неоадъювантную химиотерапию по схеме: 12 курсов наб-паклитаксела еженедельно и затем 4 курса EC (эпирубицин/циклофосфамид), сопровождающихся дурвалумабом 1 раз в 4 недели в 1 группе. Иммунотерапию начинали с одной дозы дурвалумаба за 2 недели до основного блока химиотерапии, что исследователи прозвали «фазой окна» (режим с «окном» был закрыт независимым комитетом после набора в исследование 117 пациенток в связи с долгим временем до начала химиотерапии – в среднем 47,7 дней). Ранее уже были доложены первые результаты. Полный патоморфоз (ypT0; ypN0) был достигнут у 53,4% в группе дурвалумаба и у 44,2% в группе плацебо (ОР 1,45; 95% ДИ 0,80-2,63; р=0,224). Эффект иммунотерапии наиболее ярко проявил себя при сравнении групп с двухнедельным «окном» и без него: pCR 61% против 41,4% в контрольной группе (ОР 2,22; 95% ДИ 1,06-4,64; р=0,035). Отмечена связь с уровнем сИОЛ при оценке до начала лечения: при высоком уровне (>60%) pCR достигался чаще независимо от группы (ОР 3,09; 95% ДИ 1,12-8,52; р=0,005). Статус PD-L1 также имел значение. Во всей популяции больных pCR достигнут у 54,3% пациенток, имеющих позитивный статус, и у 30% с негативным (р=0,048). Новые данные освещают отдаленные результаты. При медиане наблюдения в 42,2 месяца 3-летняя выживаемость без инвазивных проявлений заболевания (ВБиП) в группе пациенток, достигших pCR, была 92% против 71,9% у не достигших (ОР 0,54; 95% ДИ 0,27-1,09; р=0,0559); 3-летняя выживаемость без отдаленных метастазов – 91,4% в группе дурвалумаба и 76,9% в группе плацебо (ОР 0,37; 95% ДИ 0,15-0,87; р=0,0148); 3-летняя ОВ – 95,1% и 83,1% соответственно (ОР 0,26; 95 ДИ 0,09-0,79; р=0,0076). Не отмечено статистически значимой разницы в ВБиП, выживаемости без отдаленных метастазов и ОВ в группах, получивших 2-недельное «окно» перед курсом ХТ и без него. Выводы авторов: дурвалумаб в комбинации с химиотерапией, несмотря на незначительный прирост в pCR и отсутствие адъювантного лечения, улучшил отдаленные результаты.
Список литературы:
1. J Clin Oncol 39, 2021 (suppl 15; abstr LBA1).
2. J Clin Oncol 39, 2021 (suppl 15; abstr 554).
3. J Clin Oncol 39, 2021 (suppl 15; abstr 504).
4. J Clin Oncol 39, 2021 (suppl 15; abstr 506).

НОВОЕ В ЛЕЧЕНИИ МЕТАСТАТИЧЕСКОГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ ПО ДАННЫМ ASCO 2021
Авторы: Жуликов Ярослав Андреевич
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
Артамонова Елена Владимировна
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
HR+ HER2- рак молочной железы
1) Представлены обновленные результаты по общей выживаемости исследования PALOMA-3 (abstr. 1000).
Комбинация ингибиторов CDK4/6 и гормонотерапии (ГТ) в настоящее время является золотым стандартом 1-2 линий лечения метастатического рака молочной железы (мРМЖ), так как она продемонстрировала увеличение частоты объективного ответа (ЧОО), выживаемости без прогрессирования (ВБП) и, в некоторых исследованиях, общей выживаемости (ОВ). В исследовании III фазы PALOMA-3 было показано, что добавление палбоциклиба к фулвестранту во второй линии гормонотерапии метастатического HR+HER2- рака молочной железы достоверно увеличивает медиану ВБП. Однако анализ ОВ при медиане наблюдения в 44,8 месяца не показал достоверных различий между изучаемыми группами, хотя отмечалось существенное численное преимущество медианы ОВ в группе палбоциклиба. Медиана ОВ составила 34,9 месяца в группе палбоциклиба против 28,0 месяцев в группе плацебо (отношение рисков [ОР] 0,814; 95% доверительный интервал [ДИ] 0,644- 1,029; р=0,0429). На ASCO2021 были доложены обновленные данные по ОВ при медиане наблюдения 73,3 месяца. Добавление палбоциклиба к фулвестранту достоверно улучшило 5-летнюю ОВ по сравнению с фулвестрантом – 23,3% против 16,8% (ОР 0,81; 95% ДИ 0,65- 0,99; p=0,0221). Подгрупповой анализ исследования показал, что достоверные различия наблюдались во всех подгруппах, кроме пациенток с гормонорезистентным раком (прогрессирование на предыдущей линии гормонотерапии в сроки менее 6 мес.) и получивших ранее химиотерапию.
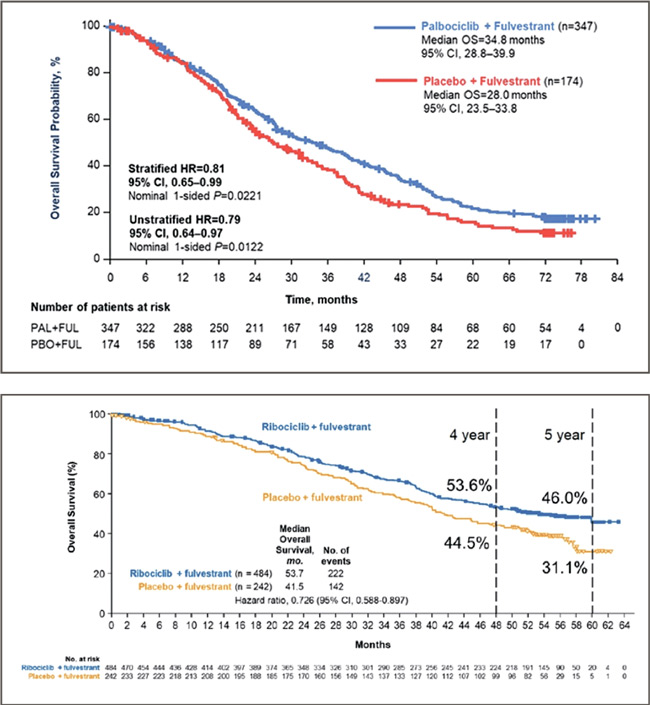
2) Представлены обновленные результаты по общей выживаемости исследования MONALEESA-3 (abstr. 1001).
В исследовании III фазы
MONALEESA-3 ранее было продемонстрировано статистически значимое улучшение ОВ при добавлении
рибоциклиба к фулвестранту в 1-й
или 2-й линии терапии пациенток
в постменопаузе с метастатическим
HR+HER2- раком молочной железы.
Медиана ОВ не была достигнута в
группе рибоциклиба и составила 40
месяцев в группе плацебо (ОР 0,72;
95% ДИ 0,57-0,92; р=0,00455).
На ASCO2021 были представлены данные по ОВ при медиане наблюдения 56,3 месяца. Медиана
ОВ составила 53,7 месяца в группе
рибоциклиба против 41,5 месяца в
группе плацебо (ОР 0,73; 95% ДИ
0,59-0,90). Преимущество в ОВ от
добавления рибоциклиба к фулвестранту наблюдалось как при назначении в 1-й (медиана ОВ не достигнута против 51,8 мес. [ОР 0,64;
95% ДИ 0,46-0,88]), так и во 2-й
линии терапии (медиана ОВ 39,7
против 33,7 мес. [ОР 0,78; 95% ДИ
0,59-1,04]). Таким образом, продемонстрированное ранее преимущество в ОВ при добавлении рибоциклиба к фулвестранту сохраняется
при медиане наблюдения 4,5 года.
3) Представлены результаты исследования DAWNA-1 (abstr. 1002).
В клиническом исследовании III фазы DAWNA-1 сравнивалась эффективность комбинации нового ингибитора CDK4/6 далпициклиба в комбинации с фулвестрантом по сравнению с фулвестрантом и плацебо во второй и последующих линиях терапии метастатического HR+HER2- рака молочной железы у пациенток в постменопаузе. Первичной конечной точкой была медиана ВБП. В исследование включена 361 пациентка, которые рандомизировались 2:1 в группы далпициклиба и плацебо. При медиане наблюдения 10,5 месяца было показано, что добавление далпициклиба к фулвестранту достоверно улучшает медиану ВБП – 15,7 месяца против 7,2 месяца (ОР 0,42; 95% ДИ 0,31-0,58; р<0,0001). Наиболее частыми нежелательными явлениями 3-4 степени в группе далпициклиба были нейтропения (84,2%) и лейкопения (62,1%). Частота серьезных нежелательных явлений составила 5,8% в группе далпициклиба по сравнению с 6,7% в группе плацебо. Отмена лечения в связи с возникновением нежелательных явлений была зарегистрирована у 2,5% пациентов в группе далпициклиба по сравнению с 3,3% в группе плацебо. Таким образом, добавление далпициклиба к фулвестранту достоверно улучшает ВБП по сравнению с фулвестрантом во 2-й и последующей линиях гормонотерапии метастатического HR+HER2- рака молочной железы и может стать еще одной опцией стандартной терапии.
HER2+ рак молочной железы
1) Представлены результаты исследования sysucc-002 (abstr. 1003).
Комбинация химиотерапии и двойной анти-HER2 блокады с последующим переходом на комбинацию гормонотерапии с продолжением анти-HER2 терапии по-прежнему является стандартом первой линии метастатического люминальном HER2 положительного рака молочной железы. В исследовании II фазы PERTAIN продемонстрирована эффективность комбинации гормонотерапии и анти-HER2 терапии в первой линии терапии HR+ HER2+ рака молочной железы. Однако исследований, сравнивавших эффективность анти-HER2 терапии в комбинации с химиотерапией или гормонотерапией, не опубликовано. В исследовании III фазы, проведенном в Китае и имевшем дизайн noninferiority, сравнивалась эффективность трастузумаба в комбинации с гормонотерапией по выбору специалиста (ингибиторы ароматазы, тамоксифен, торемифен) и химиотерапии по выбору специалиста (доцетаксел, винорельбин, капецитабин) в первой линии терапии HR+HER2+ метастатического рака молочной железы. Верхней границей non-inferiority выбрано ОР прогрессирования заболевания 1,35. В исследование включены 392 пациентки, рандомизированные на группы химиотерапии и гормонотерапии 1:1. Медиана ВБП составила 14,8 месяца в группе химиотерапии против 19,2 месяца в группе гормонотерапии (HR 0,88; 95% ДИ 0,71-1,09; рnon-inferiority<0,0001). Проведение химиотерапии было ассоциировано со значимым увеличением нежелательных явлений 3-4 степени. Подгрупповой анализ показал, что наибольшую выгоду от назначения химиотерапии в комбинации с трастузумабом получили пациентки с безрецидивным интервалом после первичного лечения ≤24 месяцев (ОР 1,39; 95% ДИ 0,97-1,98; р=0,016). Таким образом, назначение комбинации трастузумаба и гормонотерапии не ухудшает ВБП по сравнению с химиотерапией с трастузумабом в 1-й линии терапии HR+ HER2+ рака молочной железы, преимущество от назначения химиотерапии наблюдалось у пациентов с коротким интервалом без прогрессирования. Данное исследование – первое сравнительное исследование химиотерапии и гормонотерапии в сочетании с анти-HER2 терапией в 1-й линии лечения. Однако пациенты в данном исследовании не получали пертузумаб, который в комбинации с трастузумабом и таксанами является стандартом первой линии терапии HR+HER2+ рака молочной железы. Соответственно, неизвестно, отразилось бы добавление пертузумаба на результатах данного исследования.
Тройной негативный рак молочной железы
1) Представлены результаты исследования FUTURE-C-PLUS (abstr. 1007).
В настоящее время активно изучается
иммунотерапия при метастатическом
тройном негативном РМЖ. В исследовании II фазы FUTURE-C-PLUS
изучалась эффективность комбинации камрелизумаба (анти-PD-1),
наб-паклитаксела и фамитиниба
(низкомолекулярный ингибитор тирозинкиназ VEGFR-2, PDGFR, c-kit)
в первой линии метастатического
или неоперабельного иммуномодулятивного (IM) подтипа тройного негативного рака молочной железы. IM
подтип был определен как экспрессия
CD8+ по данным иммуногистохимического исследования не менее 10%. В
исследование включено 48 пациенток,
получивших камрелизумаб (200 мг
внутривенно каждые 2 недели), набпаклитаксел (100 мг/м2 внутривенно
в 1, 8, 15 дни 28-дневного цикла) и фамитиниб (20 мг внутрь 1 раз в сутки,
непрерывно). Частота объективного
ответа (ЧОО) составила 81,3% (39 из
48), что является самым высоким показателем ЧОО при метастатическом
тройном негативном раке молочной
железы; для сравнения ЧОО на фоне
терапии антрациклинами составляет
30-50%, комбинацией антрациклинов и циклофосфаида – 45-55%, таксанами – 37-54%, комбинацией набпаклитаксела и атезолизумаба при
положительной экспрессии PD-L1
– 58,9%. Медиана времени до достижения ответа в данном исследовании
составила 1,8 месяца. При медиане
наблюдения 9 месяцев медиана ВБП и
продолжительности ответа не достигнуты, 62,5% пациентов продолжают
лечение без признаков прогрессирования заболевания. Наиболее частыми нежелательными явлениями 3-4
степени стали нейтропения (33,3%), в
том числе фебрильная нейтропения
(10,4%), анемия (10,4%), тромбоцитопения (8,3%), гипертензия (4,2%),
гипотиреоз (4,2%), сепсис (2,1%) и иммунный миокардит (2,1%). Частота отмены терапии в связи с возникновением нежелательных явлений составила
6,3%. У двух пациентов наблюдались
серьезные нежелательные эффекты,
связанные с лечением. Не сообщалось
о случаях смерти, связанной с нежелательными явлениями терапии. Комбинация камрелизумаба (анти-PD-1),
наб-паклитаксела и фамитиниба
показала многообещающие результаты в первой линии терапии метастатического тройного негативного
рака молочной железы, ожидаются
результаты проспективного рандомизированного исследования FUTURESUPER (NCT 04395989), изучающего
эффективность данной комбинации.
ASCO 2021: КУДА ДВИЖЕТСЯ ГИНЕКОЛОГИЯ?
Автор: Тюляндина Александра Сергеевна
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
Без длительных прелюдий и грусти о втором конгрессе ASCO в онлайн-формате перейдем к важным событиям, которые оказались значимыми в жизни каждого специалиста-онколога, занимающегося онкогинекологией.
Рак шейки матки
Единственное исследование, которые было вынесено в late-breaking abstracts по онкогинекологии, это исследование OUTBACK, которое должно было ответить на вопрос, быть или не быть адъювантной ХТ при раке шейки матки [1]. Учитывая, что исследование докладывалось в пленарной сессии, мы с нетерпением ждали результатов этой интриги. Вся медицинская общественность, занимающаяся онкогинекологией, ожидала результаты исследования OUTBACK, поскольку идея усиления эффекта ХЛТ у больных раком шейки матки за счет добавления системного лечения витает уже давно. Опубликованные метаанализы нерандомизированных исследований показывали возможное преимущество за счет добавления цитостатического системного лечения в адъювантном режиме. Таким образом, изучение данного подхода в рандомизированной работе было необходимо. В этом году на ASCO2021 были доложены результаты исследования OUTBACK. В анализ включались больные раком шейки матки с Ib1- IVA стадия (N=926), которые рандомизировались на два рукава: группу стандартного лечения с использованием химиолучевой терапии (ХЛТ) и исследовательскую группу, где пациенты получали после ХЛТ 4 курса адъювантной химиотерапии (ХТ) с использованием паклитаксела и карбоплатина. Первичной конечной точкой исследования являлась продолжительность жизни (ПЖ). Сразу оговорюсь, что исследование оказалось негативным, то есть добавление адъювантной ХТ к ХЛТ не увеличивало ни медиану ПЖ, ни медиану ВБП: 5-летняя общая выживаемость составила 71% в группе ХЛТ и 72% в группе ХЛТ+ХТ. В подгрупповом анализе также не было получено достоверного улучшения результатов лечения при использовании комбинации двух методов. Стоит отметить, что также не отмечено улучшение частоты объективного ответа при использовании системной адъювантной терапии, однако достоверно возрастала токсичность, а начать адъювантную терапию смогли только 78% больных. Таким образом, ХЛТ продолжает оставаться стандартом лечения больных раком шейки матки с локальными неоперабельными стадиями. Напомню, что несколько лет назад, также на ASCO, докладывались результаты, показавшие неэффективность неоадъювантной ХТ перед ХЛТ. Рак эндометрия В условиях современной тенденции к минимализации трат на наблюдение пациентов любопытно исследование TOTEM при раке тела матки. Исследователи изучили период наблюдения больных (N=1884), включенных в 5 исследований по первичному лечению рака тела матки (ENDCAT, ENSURE, OPAL, NEMO и TOPCAT-G) [2]. Идеей исследования было сравнить два вида наблюдения (минимальное или интенсивное) за больными после адекватного первичного лечения в зависимости от групп риска. Для больных с низким риском прогрессирования минимальный объем исследования включал только общее обследование, включающее гинекологический осмотр каждые 6 мес.; интенсивное наблюдение включало в себя общее обследование каждые 4 мес. первые полтора года, затем раз в год, цитологические мазки раз в год и КТ исследование трех зон раз в год. Для больных с высоким риском прогрессирования минимальный объем исследования включал общее обследование каждые 4 мес. первые 2 года, затем 1 раз в полгода, и КТ трех зон 1 раз в год только первые 2 года наблюдения. Интенсивное наблюдение для той же категории больных включало общее обследование каждые 4 мес. в течении 5 лет, СА125 каждые 4 мес., мазки 1 раз в год и КТ трех зон 1 раз в год. Результаты исследования показали, что минимальный объем наблюдение достаточен во всех группах больных независимо от риска прогрессирования. Медианы ВБП и ПЖ были одинаковыми вне зависимости от числа проведенных обследований. Отказ от лучевой диагностики не приводил к большему числу возникновения отдаленных метастазов. Таким образом, авторы заключили, что при наблюдении за первичными больными раком эндометрия нет необходимости в цитологическом исследовании, анализе динамики маркера СА125 и возможна минимализация числа КТ исследований и его необязательное использование у больных с низкой вероятностью возникновения прогрессирования. Эти заключения позволяют нам более взвешено и финансово-экономически разумно подойти к назначению обследований при динамическом наблюдении за пациентками с раком эндометрия.
Рак яичников
Следуя традициям, исследования по изучению рака яичников превалировали над всеми остальными. Во-первых, стоит отметить очередной промах иммунотерапии в лечении рака яичников, которая никак не может найти свою нишу в лечении данной патологии. Кому интересно будет узнать, что добавление пембролизумаба к стандартной неоадъювантной терапии с последующим его продолжением после циторедуктивной операции не дает ничего в исследовании III фазы, можете почитать абстракт 5500 [3]. Второй важной работой было исследование III фазы BOOST, которое ставило задачу ответить на вопрос, как длительно надо продолжать поддерживающую терапию бевацизумабом после первой линии лечения [4]. Исследование было начало еще в 2011 году, когда вышли первые данные, носящий позитивный характер по использованию поддержки бевацизумабом в течении 15 мес. Напомню, что финальные данные ICON7 показали отсутствие преимуществ от добавления бевацизумаба у всех включенных больных, а в исследовании GOG218 только у больных с IV стадией отмечалось увеличение медианы ПЖ. Возвращаемся к исследованию BOOST: включив в работу 927 больных, авторы продемонстрировали, что продление поддерживающей терапии бевацизумабом до 30 мес. не позволяет достичь увеличения ни медианы ВБП, ни медианы ПЖ. Поэтому, если вы все же решите назначать бевацизумаб вместе с ХТ первой линии, то не превышайте 15 мес. в поддерживающем режиме. Третьим, и довольно любопытным, оказалось исследование III по изучению введения пафолацианина натрия для оценки распространенности болезни интраоперационно [5]. На самом деле, это небольшое исследование, которое может перевернуть всю хирургию рака яичников в будущем. Напомню, что, к сожалению, лишь несколько хирургов в мире достигли своего максимума в агрессивных подходах к лечению рака яичников, удаляя все видимые образования при выраженной распространенности процесса и медиане длительности операции 6 часов. При этом набирающая популярность хирургия после неоадъювантной терапии требует меньших усилий в связи с выраженным эффектом на цитостатическую терапию, тем самым уменьшается объем оперативного вмешательства с целью достижения полной циторедукции. Напомню, что в большинстве своем опухолевые клетки рака яичников экспрессируют фолатные рецепторы в большом количестве (97%). Изучаемый препарат позволяет увидеть в флюоресцентном свечении те зоны, которые визуально кажутся интактными. Изучение брюшины под люминесцентной лампой позволяет увидеть в 33% случаев пораженные участки брюшины, которые визуально не изменены при обычной ревизии брюшной полости, но при гистологическом исследовании в них определяется наличие опухолевых клеток. У больных, которым выполняется первичная циторедукция, эти зоны видны в 17,9% случаев, а при интервальной циторедукции эта цифра возрастает до 39,7%. Чувствительность метода составляет 83%. Авторы планируют начать III фазу исследования по сравнению данного метода с обычной хирургической тактикой по удалению видимых проявлений болезни. Таким образом, если эта методика окажется перспективной, то при интервальной циторедукции хирурги должны будут удалять как видимые, так и невидимые проявления болезни, а это значит, что объемы хирургических вмешательств будут приближены к таковым, как и при первичной циторедукции. Скорее всего следствием этого интерес хирургического сообщества к интервальным циторедукциям будет снижен. Те, кто интересуется первыми исследованиями новых молекул и препаратов, могут заинтересоваться большим числом новых и перспективных работ, посвященных этому разделу. Отдельно также хочу отметить появление совсем небольших работ, посвященных попыткам понять, что нам назначать после PARP ингибиторов. Хотя ASCO2021 не принесло в онкогинекологию значимых исследований, которые могут изменить клинические рекомендации, но позволяет определить новые направления для нашего дальнейшего развития. Читайте, слушайте, участвуйте!
Список литературы:
1. Linda R. Mileshkin L, et al. Adjuvant chemotherapy following chemoradiation as primary treatment for locally advanced cervical cancer compared to chemoradiation alone: The randomized phase III OUTBACK Trial (ANZGOG 0902, RTOG 1174, NRG 0274). J Clin Oncol 39, 2021 (suppl 15; abstr LBA3).
2. Ciccone G, et al. Intensive versus minimalist follow-up in patients treated for endometrial cancer: A multicentric randomized controlled trial (The TOTEM study – NCT00916708). J Clin Oncol 39, 2021 (suppl 15; abstr 5506).
3. Ray-Coquard I, et al. Efficacy and safety results from neopembrov study, a randomized phase II trial of neoadjuvant chemotherapy (CT) with or without pembrolizumab (P) followed by interval debulking surgery and standard systemic therapy ± P for advanced highgrade serous carcinoma (HGSC): A GINECO study. J Clin Oncol 39, 2021 (suppl 15; abstr 5500).
4. Pfisterer J, et al. Optimal treatment duration of bevacizumab (BEV) combined with carboplatin and paclitaxel in patients (pts) with primary epithelial ovarian (EOC), fallopian tube (FTC) or peritoneal cancer (PPC): A multicenter open-label randomized 2-arm phase 3 ENGOT/GCIG trial of the AGO Study Group, GINECO, and NSGO (AGO-OVAR 17/BOOST, GINECO OV118, ENGOT Ov-15, NCT01462890). J Clin Oncol 39, 2021 (suppl 15; abstr 5501)
5. Tanyi J, et al. Phase 3, randomized,
single-dose, open-label study to
investigate the safety and efficacy
of pafolacianine sodium injection
(OTL38) for intraoperative imaging of
folate receptor positive ovarian cancer.
J Clin Oncol 39, 2021 (suppl 15; abstr
5503).
ПОПУЛЯЦИОННОЕ ИССЛЕДОВАНИЕ СКРИНИНГА РАКА ЯИЧНИКА ПОТЕРПЕЛО НЕУДАЧУ
Автор: С.А.Тюляндин
Председатель Российского общества клинической онкологии
Нам представлялось, что скрининг, позволяющий диагностировать злокачественную опухоль на раннем бессимптомном этапе
ее развития и немедленно начать лечение с высоким шансом на
излечение, – важнейший и оптимальный путь снижения смертности. Однако опыт скрининговых программ при раке молочной
железы, простаты и легкого несколько остудил наш энтузиазм в
связи незначительным выигрышем в снижении смертности при
существенных материальных затратах. Кроме того, скрининг выявил ряд проблем, в частности, существенное увеличение числа
больных с латентными формами заболевания или с подозрением
на наличие опухоли, требующих существенных диагностических
и терапевтических усилий для постановки правильного диагноза и соответствующего лечения, к чему были не готовы системы
здравоохранения в странах, осуществляющих скрининг.
Рак яичника характеризуется скрытым течением, поздней диагностикой у подавляющего большинства
больных, что требует длительного дорогостоящего лечения и сопровождается высокой смертностью
вследствие прогрессирования заболевания. Поэтому были понятны и обоснованы намерения изучить
возможность программы скрининга для выявления болезни на ранней стадии и последующей терапии
с целью оценить влияние на снижение смертности от рака яичников. С этой целью в Великобритании
в течение 2001-2004 годов в исследование по эффективности скрининга рака яичников были включены
202562 женщины в возрасте 50-74 года, которые были рандомизированы в три группы. Первая группа (50625 женщин) ежегодно сдавала тест CA-125, при его повышении повторяли тест через 6 недель
или выполняли трансвагинальную сонографию. Вторая группа (50623) ежегодно выполняла трансвагинальную сонографию и в случае подозрения дополнительно выполнялся тест СА-125. В третьей
контрольной группе (101314) проводили лишь наблюдение и обследование в случае возникновения
симптомов заболевания. Все больные с выявленным раком яичников получали лечение в крупных
госпиталях национальной системы здравоохранения с наличием специалистов онкогинекологов. Основным критерием эффективности была смертность от рака яичников и фаллопиевых труб.
При медиане наблюдения 16 лет рак яичников был диагностирован у 2055 женщин, частота обнаружения составила 1% во всех трех группах. В первой группе, где в качестве основного теста использовали
определение CA-125, отмечена большая частота обнаружения болезни в стадии I (на 47%) и меньшая
частота в стадии IV (на 25%) по сравнению с контролем. В группе с трансвагинальной сонографией распределение по стадиям выявленных пациентов существенно не отличалось от контрольной группы.
Однако более раннее выявление заболевания не привело ни к снижению смертности, ни к большей
продолжительности жизни заболевших пациентов по сравнению с контролем. Всего умерло 1206 больных, и кривые выживаемости Каплана-Майера для всех трех групп идут одинаково, число умерших
больных составило 0,6% в каждой группе.
Таблица 1.
Распределение больных раком яичников по стадиям в различных группах.
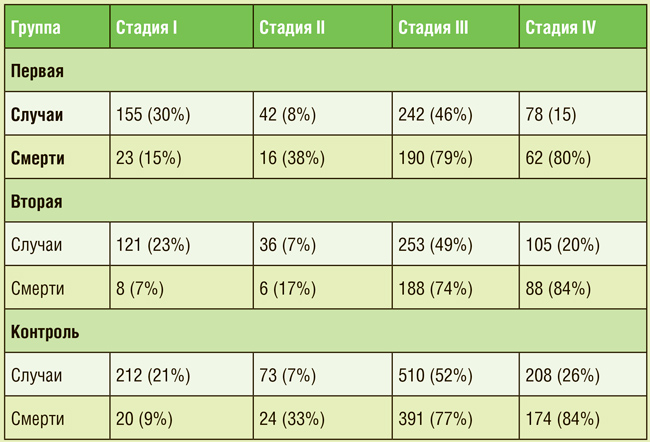
Таким образом, апробированные программы скрининга с определением СА-125 и трансвагинальной сонографией не способны уменьшить смертность от рака яичников. Требуется более точный метод диагностики, который еще только предстоит разработать. Авторы подчеркивают, что от момента начала изучения тестирования СА-125 и трансавагинальной сонографии как возможных методов скрининга до получения результатов популяционного рандомизированного исследования потребовалось более 30 лет. Это означает, что даже в случае появления эффективного диагностического метода для скрининга потребуется еще как минимум 20 лет для получения доказательств, подтверждающих его эффективность, прежде чем рекомендовать в широкую практику.
Литература:
Menon U, Gentry-Maharaj A, Burnell M, et al. Ovarian cancer population screening and mortality after longterm follow-up in the UK Collaborative Trial of Ovarian Cancer Screening (UKCTOCS): a randomised controlled trial. Lancet
2021, published online May 12.
ПО МАТЕРИАЛАМ ASCO 2021: ТЕРАПИЯ НА ОСНОВЕ CAR-T – ЧТО МЫ ИМЕЕМ В 2021 ГОДУ?
КОММЕРЧЕСКИЕ
ПРЕПАРАТЫ ДЛЯ
КЛЕТОЧНОЙ ТЕРАПИИ
НА ОСНОВЕ CAR T
Первым препаратом на основе CAR T-клеток, представленным для регистрации Управлению по контролю над качеством пищевых продуктов и лекарственных средств США (FDA), был тисагенлеклейсел Т для лечения пациентов в возрасте не старше 25 лет с рецидивирующим или рефрактерным В-клеточным острым лимфобластным лейкозом (В-ОЛЛ). Самым последним препаратом, зарегистрированным FDA, был идекабтаген виклейсел для лечения пациентов с рецидивирующей или рефрактерной множественной миеломой. Между этими двумя ключевыми препаратами были зарегистрированы еще пять препаратов: аксикабтаген силолейсел, тисагенлеклейсел (два отдельных регистрационных удостоверения), брексукабтаген аутолейсел и лисокабтаген маралейсел для лечения агрессивной и медленно прогрессирующей В-клеточной неходжкинской лимфомы (таблица 1).
Таблица 1.
Коммерческие препараты для CAR T-клеточной терапии.
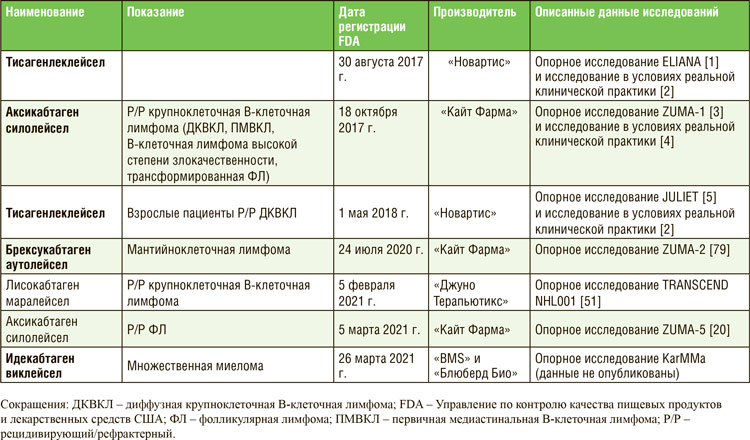
Эти препараты изготавливаются из аутологичных клеток, полученных от пациента методом афереза, и содержат химерный антигенный рецептор (CAR), действие которого направлено на ассоциированный с заболеванием линейный антиген (CD19 для B-клеточных гемобластозов, BCMA для множественной миеломы). Трансген CAR внедряется в клетки с использованием ретровирусного (аксикабтаген и брексукабтаген) или лентивирусного (все остальные препараты) вектора с дефектом репликации и содержит костимулирующую молекулу (CD28 для аксикабтагена и брексукабтагена; CD137, также известный как 4-1BB, для всех остальных препаратов). Согласно требованию FDA, перед инфузией препарата необходимо проведение лимфодеплеции, включающей флударабин и циклофосфамид (кроме применения тисагенлеклейсела у взрослых пациентов с В-клеточной неходжкинской лимфомой, которым вместо этого можно назначить бендамустин или полностью отказаться от химиотерапии, если количество лейкоцитов у пациента составляет 1×109/л или менее за неделю до инфузии). Лисокабтаген уникален тем, что содержит заданное соотношение CD4 и CD8 клеток, равное 1:1. Примечательно, что все эти продукты CAR T-клеток зарегистрированы регуляторным органом на основании исследований, проведенных в одной группе, со средним объемом выборки (92 пациента с детским ОЛЛ, 74-344 пациента с неходжкинской лимфомой и 140 пациентов с множественной миеломой). Последующие сообщения по результатам регистровых исследований в реальной клинической практике в значительной мере подтвердили данные, полученные в опорных исследованиях: частота полного ответа (ПО) на тисагенлеклейсел у пациентов с В-ОЛЛ составила 81% в опорном исследовании ELIANA и 86% в популяции из 255 пациентов, проходивших лечение в условиях реальной клинической практики, а расчетная 12-месячная бессобытийная выживаемость составила 50% и 52% соответственно [1,2]. При лечении крупноклеточной В-клеточной лимфомы аксикабтагеном в опорном исследовании ZUMA-1 ПО и 12-месячная выживаемость без прогрессирования составили 58% и 44% соответственно по сравнению с 64% и 45% соответственно в популяции из 275 пациентов в условиях реальной клинической практики [3,4]. В опорном исследовании JULIET частота ПО при лечении крупноклеточной В-клеточной лимфомы тисагенлеклейселом составила 40% по сравнению с 40% в популяции из 155 пациентов в условиях реальной клинической практики [2,5]. Эти результаты обобщены в таблице 2.
Таблица 2.
Результаты применения коммерческих и перспективных препаратов для CAR T-клеточной терапии.
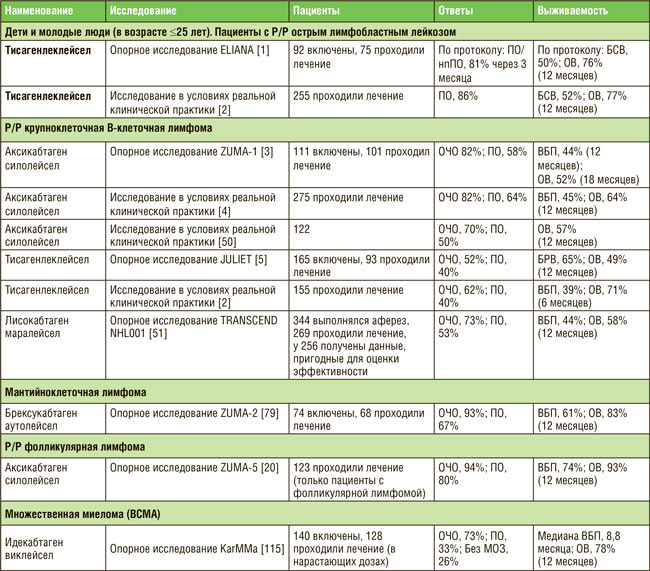
Для назначения CAR T-клеточной терапии в Соединенных штатах медицинский центр должен быть аккредитован Организацией по аккредитации клеточной терапии (Foundation for Accreditation of Cellular Therapy), а лечащий врач должен пройти обучение в соответствии со стратегией оценки и снижения рисков в рамках программы по оценке безопасности лекарственного препарата, что определено FDA как обязательное условие. Пациенты должны оставаться в пределах досягаемости (обычно имеется в виду возможность доехать на машине за 2 часа) от медицинского центра, где проводится лечение, в течение не менее 4 недель после применения препарата, что связано с его возможными токсическими эффектами, такими как синдром высвобождения цитокинов и синдром нейротоксичности, ассоциированный с иммунными клетками, которые требуют особой бдительности, мониторинга и лечения. Все препараты, кроме тисагенлеклейсела, необходимо вводить в стационарных условиях, и пациента следует наблюдать ежедневно в течение как минимум 7 дней. Около 130 центров в США были аккредитованы для лечения пациентов тисагенлеклейселом и 35 центров – для лечения лисокабтагеном.
РАННИЕ КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ CAR T-КЛЕТОК
Помимо упомянутых выше регистрационных исследований, в одноцентровых или небольших многоцентровых исследованиях изучали другие препараты на основе CAR T (таблица 3).

Таблица 3.
Примечательные клинические исследования ранней фазы.
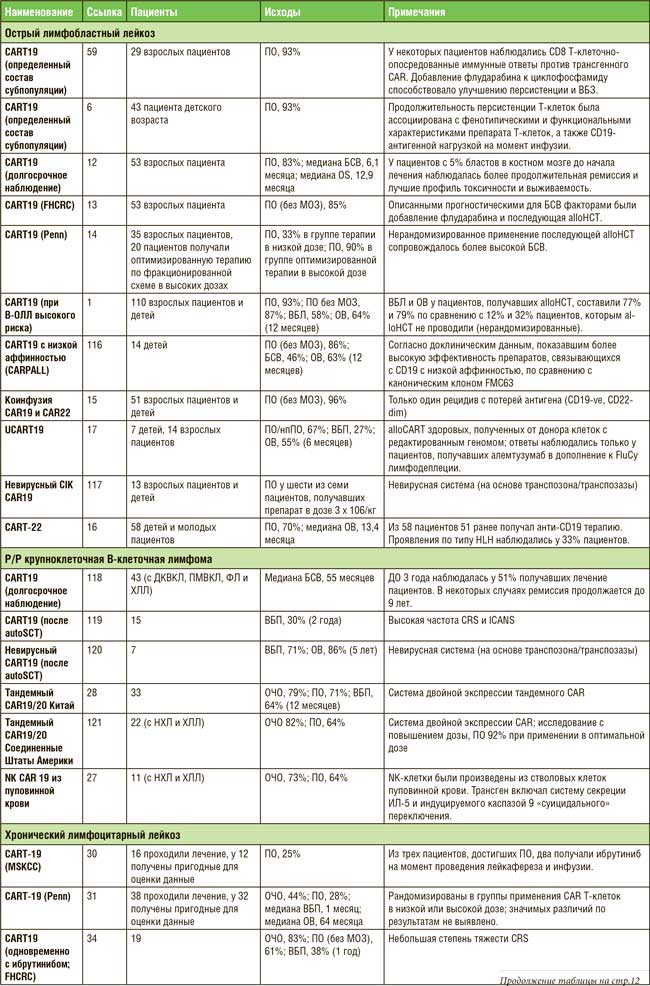
Несмотря на ограничения, связанные с перекрестными сравнениями
данных исследований, полученные
клинические результаты оказались
достаточно воспроизводимыми при
оценке различных препаратов в разных медицинских учреждениях и
разных странах. Это наблюдение указывает на надежность платформы
CAR T-клеток и в некоторой степени
позволяет прояснить вопросы взаимодействия CAR T-клеток с биологическими аспектами заболевания и
организма пациента.
При В-ОЛЛ инфузия анти-CD19 CAR
T-клеток неизменно способствует высокой частоте выраженного, измеримого ПО без признаков остаточного заболевания. Как показано в таблице
3, у 322 взрослых пациентов и детей в
семи разных исследованиях частота
ПО составила от 83% до 93%.
К сожалению, у многих пациентов наблюдается рецидив, и безрецидивная
выживаемость через 12 месяцев составляет приблизительно 50%. У пациентов с персистирующими и сохраняющими свою функциональность
CAR T-клетками (о чем свидетельствует продолжающаяся В-клеточная
аплазия) рецидив чаще всего возникает вследствие потери CD19 [6,7].
Потеря CD19 происходит вследствие
мутаций или эпигенетических изменений, вероятно, в уже существующих субклонах злокачественных
клеток [8-10]. Недостаточная экспансия или персистенция CAR T-клеток
после инфузии препарата как причина неэффективности лечения при
ОЛЛ встречается реже и может быть
связана с наследственной или индуцированной дисфункцией Т-клеток
[11]. Факторами, которые, по всей
видимости, предохраняют от развития рецидива, являются длительность
персистенции Т-клеток, низкая антигенная нагрузка и консолидирующая
трансплантация аллогенных гемопоэтических стволовых клеток [6,12-14].
CAR T-клетки, специфичные более
чем к одному B-клеточному антигену, можно использовать для уменьшения последствий ускользания от
действия препаратов, не содержащих
антиген клеток лейкоза, либо последовательно (например, применение
анти-CD22 CAR T-клеток после неэффективности предшествующей CD19-
специфичной терапии), либо одновременно (например, одновременная
инфузия CART19 и CART22 или применение препаратов, содержащих
CAR с двойной специфичностью)
[15,16]. Еще одной примечательной
недавней разработкой для лечения
пациентов с В-ОЛЛ является применение Т-клеток, полученных от здоровых доноров, у которых вероятность
развития реакции «трансплантат против хозяина» исключается благодаря
«выключению» гена Т-клеточного
рецептора. Следует отметить, что экспансия T-клеток и развитие клинических ответов, по-видимому, требуют
добавления высокоактивного иммуносупрессивного анти-CD52 моноклонального антитела, алемтузумаба, для предотвращения иммунного
отторжения этих несопоставимых с
человеческим лейкоцитарным антигеном клеток [17].
При В-клеточной неходжкинской
лимфоме частота ПО была ниже, чем
при В-ОЛЛ, но эти ответы, как правило, были продолжительными. Например, долгосрочное последующее
наблюдение в исследовании JULIET
демонстрирует, что 60% ответивших
на лечение пациентов через 5 лет все
еще находились в ремиссии [18]. Механизмы, лежащие в основе неэффективности CAR T-клеточной терапии,
при В-клеточной неходжкинской
лимфоме изучены не так хорошо, как
при В-ОЛЛ. В частности, экспансия
или персистенция T-клеток коррелировала с ответом при лимфоме в
меньшей степени, чем при В-ОЛЛ
[19-20]. Вместо этого более значимую
прогностическую роль, по-видимому,
играют исходная опухолевая нагрузка, характеристики препарата
CART19 («память» и многофункциональность) и ответ на лимфодеплецию (повышение «благоприятных» цитокинов, таких как интерлейкин
[ИЛ]-7, ИЛ-15 или моноцитарный
хемоаттрактантный белок-1) [21-26].
Примечательные недавние разработки включают исследование тандемных анти-CD19/CD20 CAR T-клеток,
при применении которых частота
ПО составила 71%, а 12-месячная
выживаемость без прогрессирования – 64%, и первая демонстрация
генно-инженерных анти-CD19 естественных киллеров, полученных из
стволовых клеток пуповинной крови
здорового человека, при применении
которых частота ПО на раннем этапе
наблюдения составила 64% [27,28].
Хотя пациенты с хроническим лимфоцитарным лейкозом были среди первых кандидатов на CAR T-клеточную
терапию, клиническая разработка
этих препаратов для применения при
хроническом лимфоцитарном лейкозе несколько запаздывает по сравнению с разработкой для лечения ОЛЛ
или неходжкинской лимфомы. При
хроническом лимфоцитарном лейкозе частота ПО ниже, чем при неходжкинской лимфоме (приблизительно
25% по критериям Международного
семинара по хроническому лимфоцитарному лейкозу [International
Workshop on Chronic Lymphocytic
Leukemia]), хотя, как и в случае неходжкинской лимфомы, наблюдается очень долговременная ремиссия
[29-31]. Устойчивая ремиссия ассоциирована с более высокой частотой
встречаемости CD27+CD45RO7- CD8
T-клеток и клеток с другими профилями генной экспрессии, связанными
с «памятью» и STAT3, в образцах, полученных при аферезе [32]. Примечательно, что применение ингибитора
тирозинкиназы Брутона ибрутиниба
в сочетании с CAR T-клетками может
способствовать повышению частоты
ПО [33,34].
Были опубликованы результаты ряда
исследований со средним объемом
выборки с изучением таргетной терапии множественной миеломы препаратами направленного действия
на BCMA. Частота ПО в целом была
высокой (45-86%), а медиана выживаемости без прогрессирования в некоторых более масштабных исследованиях составила 12-15 месяцев.
Однако при относительно коротком
периоде наблюдения доказательств
плато выживаемости было получено
немного [35-38]. В настоящее время разрабатывается новый подход с
использованием невирусной (основанной на транспозоне/транспозазе)
трансдукции в процессе, что приводит к относительному обогащению
стволовыми Т-клетками памяти, более медленной кинетике экспансии
Т-клеток и низкой частоте синдрома
высвобождения цитокинов при общей частоте ответа 57% после однократного применения [39].
CD30 представляет собой валидированную мишень для иммунотерапии
при лимфоме Ходжкина. Применение аутологичных анти-CD30 CAR
T-клеток при лимфоме Ходжкина
было изучено у 41 пациента в двух
разных центрах, и частота ПО у 32 пациентов с количеством данных, достаточным для оценки, составила 59%. К
сожалению, выживаемость без прогрессирования через 1 год составила
всего 36% [40].
Как можно заметить, в литературе отсутствуют опубликованные данные
исследований с применением CAR
T-клеток при миелоидных гемобластозах. Имеются ранние свидетельства того, что CAR T-клетки могут
оказывать действие при миелоидных
гемобластозах, например, два из пяти
пациентов с острым миелоидным
лейкозом достигли ПО после инфузии анти-CD123 CAR T-клеток (данные опубликованы в виде абстракта)
[41]. На момент написания статьи в
24 исследования по всему миру был
открыт набор пациентов с острым
миелоидным лейкозом, в семи исследованиях набор еще не начинался,
три были досрочно прекращены, два
отменены, одно исследование было
активным, но без набора пациентов, и
только одно исследование было завершено. Изучаемые мишени при миелоидных гемобластозах: CD123, CD33,
CLEC12A или NKG2D лиганды при
использовании аутологичных, аллогенных клеток или клеток от универсальных доноров с редактированным
геномом.
Таблица 3.
Примечательные клинические исследования ранней фазы. (продолжение).
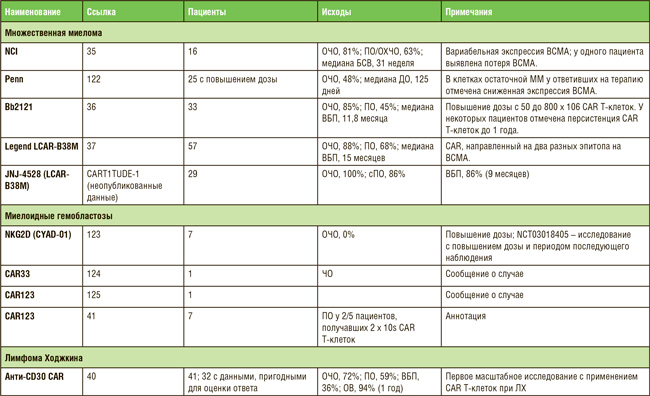
Сокращения: alloCART – аллогенные CAR T-клетки; alloHCT – трансплантация аллогенных гемопоэтических клеток; B-ОЛЛ – B-клеточный острый лимфобластный лейкоз; CD19-ve – CD19-негативный; ХЛЛ – хронический лимфоцитарный лейкоз; ПО – полный ответ; нпПО – ПО с неполным гематологическим восстановлением; CRS – синдром высвобождения цитокинов; ВБЗ – выживаемость без признаков заболевания; dim – сниженный; ДВККЛ – диффузная крупноклеточная В-клеточная лимфома; ДО – длительность ответа; БСВ – бессобытийная выживаемость; ФЛ – фолликулярная лимфома; FluCy – флударабин/циклофосфамид; ЛХ – лимфома Ходжкина; HLH – гемофагоцитарный лимфогистиоцитоз; ICANS – синдром нейротоксичности, ассоциированный с иммунными клетками; ВБЛ – выживаемость без лекоза; ММ – множественная миелома; без МОЗ – без минимального остаточного заболевания; NK – естественный киллер; ОЧО – общая частота ответа; ОВ – общая выживаемость; ВБП – выживаемость без прогрессирования; ПМВКЛ – первичная медиастинальная В-клеточная лимфома; ЧО – частичный ответ; Р/Р – рецидивирующий/ремиттирующий; сПО – строгий полный ответ; SCT – трансплантация стволовых клеток; ОХЧО – очень хороший частичный ответ.
НЕРЕШЕННЫЕ ВОПРОСЫ
Несмотря на установленную частоту ответа на лечение, его продолжительность и некоторые параметры, связанные с клиническими исходами, отдельные важные вопросы все еще остаются нерешенными. • Учитывая появление CD19- негативных и CD22-dim (со сниженной экспрессией CD22) рецидивов при ОЛЛ, следует ли создавать все будущие варианты CAR T-клеточной терапии как мультитаргетные, и если да, то какие мишени (подобные CD19 и CD22) следует использовать, и каков оптимальный дизайн подобных конструктов? • Можно ли проводить повторное лечение пациентов, у которых первая инфузия CAR T-клеток оказалась неэффективной? У пациентов, получавших повторное лечение аксикабтагеном после рецидива в исследовании ZUMA-1 (пациенты с агрессивной В-клеточной неходжкинской лимфомой), у которых наблюдались признаки ответа на первую инфузию и отсутствовали свидетельства потери CD19, наблюдался ограниченный ответ на повторную терапию [42]. У пациентов, включенных в исследование ZUMA-5 (с медленно прогрессирующей В-клеточной неходжкинской лимфомой), которые получали повторную терапию в соответствии со сходными критериями, напротив, наблюдалась польза от повторного лечения [43]. Эти данные являются предварительными и основаны на изучении небольшой группы пациентов, поэтому их следует рассматривать с осторожностью. • Когда пациентов с неходжкинской лимфомой следует направлять на CAR T-клеточную терапию? Ретроспективные данные свидетельствуют о тенденции к более благоприятным исходам в случае более раннего начала CAR T-клеточной терапии (например, после двух линий химиотерапии или после трансплантации аутологичных стволовых клеток после двух линий химиотерапии), чем более позднего (например, после, по меньшей мере, трех линий химиотерапии или после дополнительной терапии после трансплантации аутологичных стволовых клеток) [44]. Аналогично, ретроспективное intentto-treat сравнение CAR T-клеточной терапии или трансплантации аллогенных гемопоэтических клеток при многократно рецидивирующей диффузной крупноклеточной В-клеточной лимфоме показало, что через 12 месяцев была отмечена значимо меньшая безрецидивная смертность (3% по сравнению с 21% в пользу CAR T-клеточной терапии; p=0,04), в то время как различия по частоте рецидивов, выживаемости без прогрессирования и общей выживаемости не были статистически значимыми [45]. • Можно ли CAR T-клеточную терапию начинать в более ранние сроки У пациентов с неходжкинской лимфомой? В одноцентровом ретроспективном наблюдательном исследовании, в котором сравнивали исходы у 69 пациентов, получавших CAR T-клеточную терапию, со 146 случаями исторического контроля, было показано улучшение ПО, выживаемости без прогрессирования и общей выживаемости в пользу CAR T-клеточной терапии [46]. Определенный ответ на этот важный вопрос будет получен тогда, когда появятся результаты исследований фазы III по оценке терапии второй линии с применением аксикабтагена, тисагенлеклейсела или лисокабтагена в сравнении со стандартной терапией (соответственно исследований ZUMA-7, NCT03391466; BELINDA, NCT03570892; или TRANSFORM, NCT03575351). Аксикабтаген изучается в многоцентровом открытом исследовании фазы II в одной группе после двух циклов химиоиммунотерапии первой линии у пациентов с крупноклеточной В-клеточной лимфомой высокого риска (ZUMA-12). Предварительные данные, полученные в этом исследовании, продемонстрировали частоту ПО на уровне 74%, обусловленный высокой частотой встречаемости CCR7+CD45RA+ «наивных» клеток [47]. • Каковы механизмы развития и зависимость ответа на CAR T-клеточную терапию или ее неэффективности при множественной миеломе? По сравнению с результатами анализов при ОЛЛ и неходжкинской лимфоме, причины неэффективности CAR T-клеточной терапии на сегодняшний день по-прежнему достаточно туманны, за исключением некоторого количества предварительных данных наблюдений. Т-клетки, выделенные у пациентов на раннем этапе терапии множественной миеломы лучше подходят для производства CAR T-клеток, чем клетки, полученные от пациентов на поздней стадии заболевания [48]. Слабую экспрессию BCMA можно подавить с помощью терапии ингибитором гаммасекретазы, и этот подход в настоящее время изучается в клиническом исследовании (NCT03502577). Примечательно, что недавно был выявлен один случай биаллельной потери BCMA после CAR T-клеточной терапии, что позволяет предположить, что по крайней мере в этом случае экспрессия BCMA была решающим фактором для выживания клеток множественной миеломы [49]. Также в клинических исследованиях (NCT03710421, NCT04142619) изучается CS1-специфическая CAR T-клеточная терапия. • Какова роль аллогенных продуктов, полученных от здоровых доноров? Перевесит ли их иммуногенность очевидные преимущества (более упорядоченные производство и логистика, более здоровые Т-клетки)? Этот подход в настоящее время изучается для CD19, BCMA и CD123. Каково, если имеется, преимущество использования эффекторных клеток, отличных от α/β T-клеток (например, естественных киллеров, естественных киллеров/Т-клеток, γ/δ T-клеток)?
МЕХАНИЗМЫ РАЗВИТИЯ И ЛЕЧЕНИЕ КРАТКОВРЕМЕННЫХ И ДОЛГОВРЕМЕННЫХ ТОКСИЧЕСКИХ ЭФФЕКТОВ CAR T-КЛЕТОЧНОЙ ТЕРАПИИ
Краткосрочные токсические эффекты CAR T-клеточной терапии
К краткосрочным токсическим эффектам CAR T-клеточной терапии
относятся синдром высвобождения
цитокинов и неврологические токсические эффекты. Синдром высвобождения цитокинов (CRS) и токсическое
действие на нервную систему, также
известное как синдром нейротоксичности, ассоциированный с иммунными эффекторными клетками,
являются известными ключевыми
препятствиями широкого распространения CAR T-клеточной терапии.
Системные симптомы и проявления,
связанные с CRS, включают высокую
лихорадку, озноб, дрожь, синусовую
тахикардию, миалгии и повышенную
утомляемость. Возможно также возникновение более тяжелых проявлений токсичности, таких как гипотензия, гипоксия, аритмии, снижение
фракции выброса левого желудочка
и другие нарушения функций органов-мишеней. От 7% до 47% пациентов, получающих коммерческие препараты CAR T-клеток, для лечения
проявлений токсичности требуется
интенсивная терапия [1,50,51]. Токсическое действие на органы-мишени
при развитии CRS проявляется обратимой почечной недостаточностью,
повышением печеночных ферментов,
снижением уровней электролитов,
цитопениями и коагулопатией. Неврологические токсические эффекты
проявляются различным образом и
с разной степенью тяжести: от легкого тремора кистей или слабо выраженного нарушения речи до афазии, судорог и оглушения. Описан
случай отека головного мозга после
CAR T-клеточной терапии на фоне
тяжелой неврологической токсичности [52,53]. Частота отмеченных
токсических эффектов коммерческих
препаратов для CAR T-клеточной
терапии приведена в таблице 4. Неврологические токсические эффекты
почти всегда возникают после эпизода лихорадки, хотя описаны и отсроченные проявления [7,54,55]. Однако
лечение токсических эффектов CAR
T-клеточной терапии со временем
становится все эффективнее на фоне
более глубокого понимания основных
движущих факторов и более широкого применения тоцилизумаба и кортикостероидов.
Хотя для достижения противоопухолевого эффекта необходима экспансия CAR T-клеток, которая считается
биомаркером ответа на терапию, увеличение максимального количества
CAR T-клеток также сопровождается
повышенным риском развития CRS
и неврологических токсических эффектов. В этиологии CRS и неврологической токсичности показана роль
многих сывороточных цитокинов
и воспалительных белков, хотя для
разных препаратов CAR T-клеток
описывали роль разных белков. К
этим белкам относятся фактор некроза опухоли-α, интерферон-γ, ИЛ-2,
гранзим B и гранулоцитарно-макрофагальный колониестимулирующий
фактор, которые CAR T-клетки могут продуцировать сами по себе при
взаимодействии с антигеном-мишенью; ИЛ-1, ИЛ-6, ИЛ-8, ИЛ-10, ИЛ-5,
интерферон-γ-индуцируемый белок
10, моноцитарный хемоаттрактантный белок-1, макрофагальный воспалительный белок-α и оксид азота,
продуцируемые далее по ходу каскада реакций миелоидными клетками
и «фоновыми» клетками; а также
ANG2 и фактор Виллебранда, продуцируемые активированными эндотелиальными клетками [1,54,56-58].
Во время CRS повышены уровни реактантов острой фазы, ферритина и
С-реактивного белка, которые можно
отслеживать с помощью общедоступных лабораторных анализов. При
применении любого конкретного
препарата CAR T-клеток более высокие дозы клеточного препарата, изменения в технике обработки клеток и
добавление флударабина к циклофосфамиду в качестве кондиционирующей химиотерапии может повышать
риск токсических эффектов, хотя
применение этих схем также может
способствовать более выраженному
противоопухолевому ответу [16,59-
61]. Бремя вовлечения костного мозга
в патологический злокачественный
процесс может сопровождаться повышением риска развития тяжелого
CRS у пациентов с ОЛЛ или неходжкинской лимфомой [61]. Как вовлечение костного мозга в злокачественный процесс у пациентов с ОЛЛ, так
и поражение лимфатических узлов у
пациентов с диффузной крупноклеточной В-клеточной лимфомой ассоциировано с более высоким риском
тяжелых неврологических токсических эффектов [24,54]. Повышение
маркеров активации эндотелия и диссеминированного внутрисосудистого
свертывания ассоциировано с развитием тяжелого CRS и неврологической токсичностью [54,61,62]. Было
выявлено, что структура CAR играет
свою роль в повышении риска токсических эффектов, и более ранние проявления токсичности и более высокий риск развития неврологических
токсических эффектов были описаны
при использовании конструктов CAR,
имеющих костимулирующий домен
CD28 [63]. Варианты в шарнирном и
трансмембранном доменах влияют на
частоту неврологических токсических
эффектов, и продемонстрировано,
что на продукцию цитокинов и токсичность виляет множество аспектов
структуры CAR [55,64].
Опубликовано множество шкал
оценки степени тяжести CRS и неврологических токсических эффектов
[12,63,65,66], из которых самая последняя – шкала Американского общества
специалистов по трансплантации и
клеточной терапии (ASTCT), описанная в работе Lee с соавт. [67], которая
занимает все более заметное место
(таблица 5). Применение различных
систем оценки тяжести в клинических
исследованиях, изучающих доступные сегодня в продаже препараты для
CAR T-клеточной терапии, затрудняют сравнение профилей токсичности каждого препарата. Представленная
ASTCT система оценки тяжести CRS обладает тем преимуществом, что
проста и удобна в использовании и в первую очередь учитывает состояние
гемодинамики и дыхательной системы.
Таблица 4.
Отмеченные нежелательные явления и применение тоцилизумаба и кортикостероидов в клинических исследованиях зарегистрированных FDA препаратов CAR T-клеток.
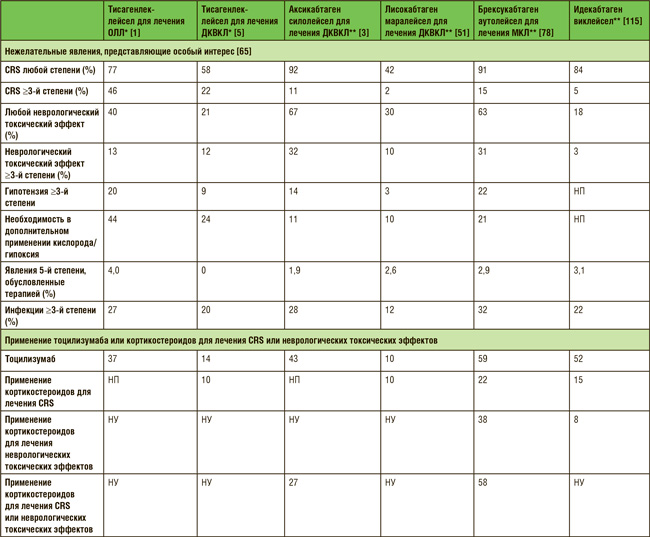
Сокращения: ОЛЛ – B-клеточный острый лимфобластный лейкоз; CRS – синдром высвобождения цитокинов; ДКВКЛ – диффузная крупноклеточная В-клеточная лимфома; МКЛ – мантийноклеточная
лимфома; НУ – не указано.
* Степень тяжести CRS оценивали, как описано Porter с соавт. [66].
** Степень тяжести CRS оценивали по критериям от 2014 г., как описано Lee с соавт. [65]. Степень тяжести неврологических токсических эффектов оценивали по Общим терминологическим критериям
для оценки нежелательных явлений, версии 4.03, во всех исследованиях.
При этом следует отметить, что
эта система не учитывает токсическое
действие на другие органы-мишени.
Также при использовании Общих
терминологических критериев для
оценки нежелательных явлений, системы оценки CARTOX CRES и системы оценки синдрома нейротоксичности, ассоциированной с иммунными
эффекторными клетками, можно получить разные результаты при оценке степени тяжести неврологических
токсических эффектов [63,67,68]. При
этом все чаще используют систему
оценки синдрома нейротоксичности,
ассоциированной с иммунными эффекторными клетками.
Лечение синдрома высвобождения
цитокинов. Симптоматическая терапия пациентов с CRS предусматривает коррекцию системных симптомов,
как правило, с помощью антипиретиков, инфузионной терапии по необходимости даже при незначительных
потерях и мониторинга гемодинамических показателей. Пациентов, которым инфузия CAR T-клеток проводится в амбулаторных условиях, и
у которых появляется лихорадка или
развиваются новые неврологические
симптомы, необходимо госпитализировать для мониторинга [69,70].
Симптоматическая терапия госпитализированных пациентов после инфузии CAR T-клеток описана в таблице 6. Поскольку после инфузии CAR
T-клеток наблюдался синдром лизиса
опухоли [71,72] даже в отсутствие химиотерапии [72], у пациентов с более
высокой опухолевой нагрузкой необходимы профилактическое применение аллопуринола и гидратация.
В первый месяц после инфузии CAR
T-клеток часто возникают цитопении,
которые, по крайней мере отчасти,
связаны с кондиционирующей химиотерапией. Однако CAR T-клетки
могут оказывать миелосупрессивный
эффект, поскольку случаи цитопении
наблюдались в отсутствие химиотерапии [72], и продолжительность цитопении, по-видимому, была связана с
тяжестью CRS [61,73].
Вопрос о дополнительном применении факторов роста при нейтропении
является спорным, поскольку при
применении факторов риска гипотетически существует риск усугубления
CRS, но у пациентов с нейтропенией
совершенно точно существует риск
инфекции. Применение гранулоцитарно-макрофагального колониестимулирующего фактора после инфузии
CAR T-клеток противопоказано из-за
риска усугубления CRS [70]. Рекомендовано отложить дополнительное
применение фактора роста, например, филграстима или пегфилграстима, на 3 недели после инфузии CAR
T-клеток и вплоть до разрешения CRS
[70,74], но при использовании этого
подхода обязательно следует учитывать риск инфекции у конкретного
пациента. Хотя коагулопатия часто
наблюдается при тяжелом CRS, массивные кровотечения возникают нечасто. Мониторинг и заместительное
введение фибриногена могут быть
особенно необходимы при CRS 3-й и
4-й степени, когда, согласно описанным случаям, возможно развитие тяжелой гипофибриногенемии [75]. Продолжается изучение роли антицитокиновой и кортикостероидной
терапии при CRS. Для лечения CRS,
опосредованного терапией с применением иммунных эффекторных
клеток, FDA зарегистрировало тоцилизумаб, моноклональное антитело с
направленным действием на рецептор ИЛ-6, который чаще всего назначают как препарат выбора при CRS.
Кортикостероиды обычно оставляют в качестве резервных препаратов
для терапии второй линии [63], поскольку, согласно ранним наблюдениям, после применения высоких доз
кортикостероидов экспансия CAR
T-клеток уменьшается [76]. Единого
согласованного мнения по поводу пороговых доз при применении антицитокиновой или кортикостероидной
терапии не существует ввиду отсутствия масштабных рандомизированных исследований. Основные подходы предусматривают применение
тоцилизумаба при наличии заданного
перечня гемодинамических изменений и токсических проявлений со стороны органов-мишеней [69,77] или
применение на основании наблюдаемой степени тяжести CRS [56,63,77], с
последующей кортикостероидной терапией в случае развития рефрактерного CRS. Множество групп исследователей рекомендуют рассматривать
вопрос о применении тоцилизумаба в
случае CRS 2-й степени по критериям
ASTCT [72] и настоятельно рекомендуют в случае CRS 3-й степени [56,70].
Применение тоцилизумаба предлагалось в случаях устойчивой лихорадки,
рефрактерной к применению антипиретиков [63]. Однако, по общему
мнению, решение о применении тоцилизумаба следует принимать с учетом токсического действия на органымишени и наличия сопутствующих
заболеваний у каждого конкретного
пациента. Ретроспективные анализы
результатов клинического применения аксикабтагена силолейсела [3] и
брексукабтагена аутолейсела [78] показали отсутствие четких различий
по частоте ответа на лечение у пациентов, получавших тоцилизумаб или
кортикостероидную терапию для
коррекции токсических эффектов,
по сравнению с пациентами, которые не получали эти препараты, однако использование более высоких
суммарных доз кортикостероидов,
более длительное их применение и
более раннее начало использования
может отрицательно сказаться на
выживаемости после применения
аксикабтагена силолейсела [79].
Для оценки различных стратегий
раннего вмешательства были проведены проспективные исследования с участием небольшого числа
пациентов (таблица 7). Использование упреждающих стратегий применения тоцилизумаба и/или кортикостероидов в низких дозах при
CRS невысокой степени тяжести по
сравнению с различными принятыми в учреждениях стандартными
подходами привело к снижению
частоты тяжелого CRS без явного
изменения экспансии CAR T-клеток
и без усугубления неврологической
токсичности [80-82]. Аналогично,
профилактическое применение тоцилизумаба в определенные интервалы времени вне зависимости от
развития токсических эффектов, по
всей видимости, способствует снижению частоты тяжелого CRS без
отчетливого увеличения неврологической токсичности [83,84] и без
изменения экспансии CAR T-клеток
[84]. Раннее назначение тоцилизумаба и/или кортикостероидов, повидимому, не снижает частоту или
длительность ответа на лечение
[80-82,84], хотя невозможно сделать
однозначные выводы на основании
данных, полученных в этих небольших выборках и при использовании
нерандомизированных дизайнов.
Опыт применения альтернативных
фармакологических препаратов для
лечения CRS в клинических исследованиях остается ограниченным.
В случаях рефрактерного к тоцилизумабу CRS использовали ситуксимаб, анакинру и этанерцепт, но оптимальная схема применения этих
препаратов с учетом использования кортикостероидов неизвестна
[1,85,86].
Описано применение при рефрактерном к стероидам CRS циклофосфамида, антитимоцитарного глобулина и алемтузумаба, однако, эти
данные ограничены [1].
Таблица 5.
Оценка степени тяжести синдрома высвобождения цитокинов согласно
Консенсусу Американского общества специалистов по трансплантации и клеточной терапии.
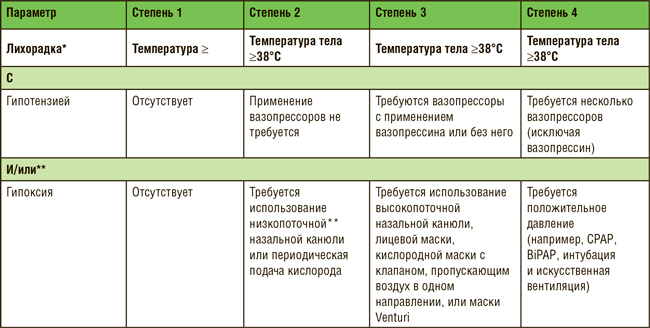
Сокращения: BiPAP – двухфазная вентиляция с положительным давлением в дыхательных путях; CPAP – постоянное положительное давление в
дыхательных путях; CRS – синдром высвобождения цитокинов.
* Лихорадка: определялась как повышение температуры тела ≥38°C, не объясняемое никакой другой причиной. Наличие лихорадки больше не
требуется для определения в последующем степени тяжести CRS у пациентов, у которых развился CRS и которые затем получают антипиретики или
антицитокиновую терапию. В этих случаях степень тяжести CRS определяется по степени гипотензии и/или гипоксии.
** Степень тяжести CRS определяется по более тяжелому явлению: гипотензии или гипоксии, не объясняемых другими причинами.
† Низкопоточная назальная канюля – канюля, скорость потока кислорода через которую составляет ≤6 л/мин. К низкопоточному режиму также относится
периодическая подача кислорода. Высокопоточная назальная канюля – это канюля, скорость потока кислорода через которую составляет 6 л/мин.
По материалам Lee с соавт. [65]. Воспроизведено в соответствии с условиями Creative Commons Attribution-NonCommercial-No Derivatives License (CC
BY NC ND).
Таблица 6.
Симптоматическая терапия после инфузии CAR T-клеток.
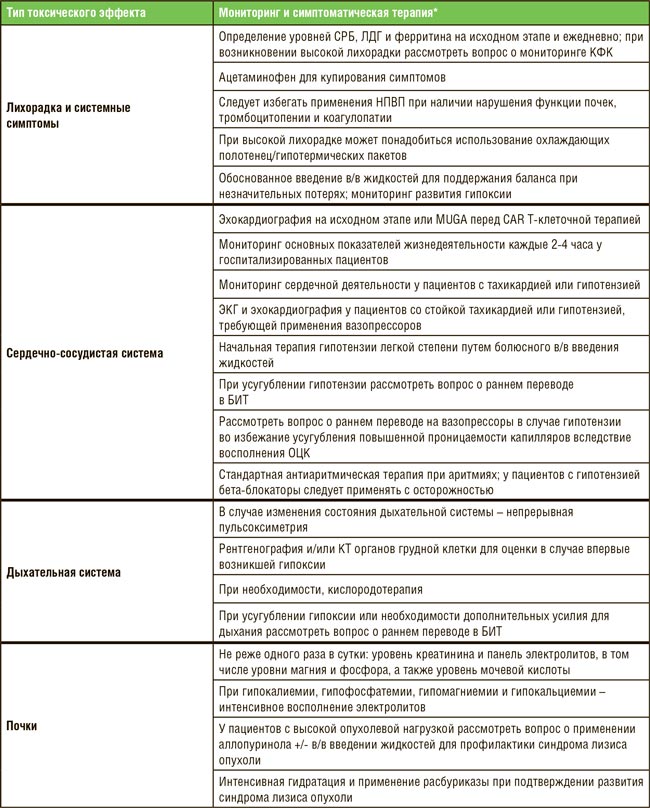
Изучается применение других фармакологических препаратов для профилактики и лечения CRS, в том числе таргетных препаратов, воздействующих на сигнальный путь JAK-STAT-киназ, таких как итацитиниб (NCT04071366) [87-89]. Гемофагоцитарный лимфогистиоцитоз – нечастое осложнение CAR T-клеточной терапии. Неясно, является ли гемофагоцитарный лимфогистиоцитоз отдельной нозологической единицей со своим собственным патофизиологическим механизмом, или он представляет собой проявление тяжелого CRS. Предложенными критериями связанного с CAR T-клеточной терапией гемофагоцитарного лимфогистиоцитоза являются максимальный уровень ферритина в сыворотке более 10 000 нг/мл и не менее двух дополнительных критериев, связанных с нарушением функции почек, печени или легких, и/или изменениями в костном мозге (таблица 6) [63]. Терапия первой линии гемофагоцитарного лимфогистиоцитоза заключается в лечении сопутствующего CRS или неврологических токсических эффектов тоцилизумабом и/или кортикостероидами. Этопозид использовали в случаях недостаточного ответа на тоцилизумаб и кортикостероиды. Описаны случаи успешного лечения гемофагоцитарного лимфогистиоцитоза анакинрой, хотя эти данные ограничены [16]. Лечение неврологических токсических эффектов Мониторинг неврологического статуса после инфузии CAR T-клеток играет важную роль в раннем распознавании и лечении неврологических токсических эффектов. Госпитализированным пациентам необходимо проводить неврологическое обследование по меньшей мере раз в день, в том числе объективный неврологический осмотр и оценку по шкале оцени энцефалопатии, ассоциированной с иммунными эффекторными клетками [67] или по шкале Корнелла для оценки детского делирия [67], а при наличии неврологических токсических эффектов – чаще. МРТ головного мозга может помочь в оценке неврологической токсичности, если у пациента стабильная гемодинамика, и состояния дыхательных путей не препятствует проведению МРТ, особенно в тяжелых случаях, когда выявление отека головного мозга может потребовать интенсификации кортикостероидной терапии. Исключить другую, например, инфекционную, этиологию изменений психического статуса, а также измерить давление открытия позволяет люмбальная пункция. Однако наличие тромбоцитопении, коагулопатии и тяжелое состояние пациента могут послужить препятствиями к проведению процедуры. Полноценно оценить неврологический дефицит и отследить изменения в динамике поможет осмотр невролога. Тоцилизумаб в большей степени влияет на CRS, чем на неврологические токсические эффекты [54], поэтому в качестве терапии первой линии при неврологической токсичности, как правило, используНачало на стр. 14 ют кортикостероиды. До сих пор остается нерешенным вопрос о том, что высокие суммарные дозы кортикостероидов могут повлиять на эффективность CAR T-клеточной терапии [79]. Оптимальные пороговые дозы и сроки применения кортикостероидов не установлены, хотя рекомендуется рассмотреть вопрос о кортикостероидной терапии при развитии синдрома нейротоксичности, ассоциированного с иммунными эффекторными клетками, 2-й степени, и настоятельно рекомендуется – при развитии синдрома 3-4 степени тяжести [70]. В исследовании ZUMA-1 в когорте для оценки безопасности раннее применение кортикостероидов после введения аксикабтагена силолейсела для лечения неврологических токсических эффектов 1-й степени способствовало снижению частоты развития неврологической токсичности 3-й или более высокой степени и при этом не влияло на эффективность терапии у небольшого числа пациентов [81], но необходимы дополнительные исследования. В доклинических исследованиях была показана эффективность анакинры в лечении неврологической токсичности [90], при ограниченных свидетельствах клинической эффективности [91], хотя место этого препарата в алгоритме лечения токсических эффектов и то, какую роль он играет в применении стероид-сберегающего подхода, неизвестно. Установленной оптимальной схемы терапии второй линии для рефрактерной к стероидам неврологической токсичности не существует. В этих случаях было описано интратекальное введение кортикостероидов и химиотерапия [92], но необходимы дополнительные исследования. Повышенные уровни гранулоцитарно-макрофагального колониестимулирующего фактора ассоциированы с более высокой степенью тяжести неврологических токсических эффектов, поэтому изучается профилактическое применение нейтрализующего антитела гранулоцитарно-макрофагального колониестимулирующего фактора, лензилумаба, для предотвращения развития неврологической токсичности и CRS [93]. Также активно изучаются способы оптимизации конструкции препарата CAR T-клеток для минимизации токсичности, включая внедрение «суицидальных» генов и фармакологических «переключателей» генов [87,88,94-96].
Долговременные токсические эффекты CAR T-клеточной терапии
В-клеточная аплазия, гипогаммаглобулинемия и инфекции относятся к долговременной токсичности. Деплеция нормальных
В-клеток и нормальных плазматических клеток является ожидаемым проявлением токсичности
анти-CD19 и анти-BCMA CAR
T-клеточной терапии соответственно. Деплеция В-клеток также была описана после анти-CD22
CAR T-клеточной терапии [97].
Коррекцию гипогаммаглобулинемии можно проводить путем
заместительной терапии иммуноглобулином. Предложенным
пороговым значением для назначения заместительной терапии иммуноглобулином является уровень иммуноглобулина G
менее 400-500 г/дл или наличие
серьезной или рецидивирующей инфекции [70,98]. У пациентов, получавших анти-C19 CAR
T-клеточную терапию по поводу
неходжкинской лимфомы, наблюдалось восстановление популяций
нормальных В-клеток [5,99], хотя
у детей и молодых пациентов с
В-клеточным ОЛЛ, получавших
тисагенлеклейсел, определяемые
В-клетки чаще служили предвестником рецидива [1,7].
Риск инфекции у пациентов после CAR T-клеточной терапии
может обуславливаться множеством факторов. К ним относятся
деплеция нормальных В-клеток
или плазматических клеток, вызванная непосредственным воздействием CAR T-клеток, деплеция лимфоцитов и гранулоцитов,
вызванная кондиционирующей
химиотерапией, антицитокиновой терапией и применением кортикостероидов по поводу CRS или неврологической токсичности,
а также снижение иммунитета,
вызванное основным онкологическим заболеванием пациента.
Таблица 6.
Симптоматическая терапия после инфузии CAR T-клеток. (Продолжение).
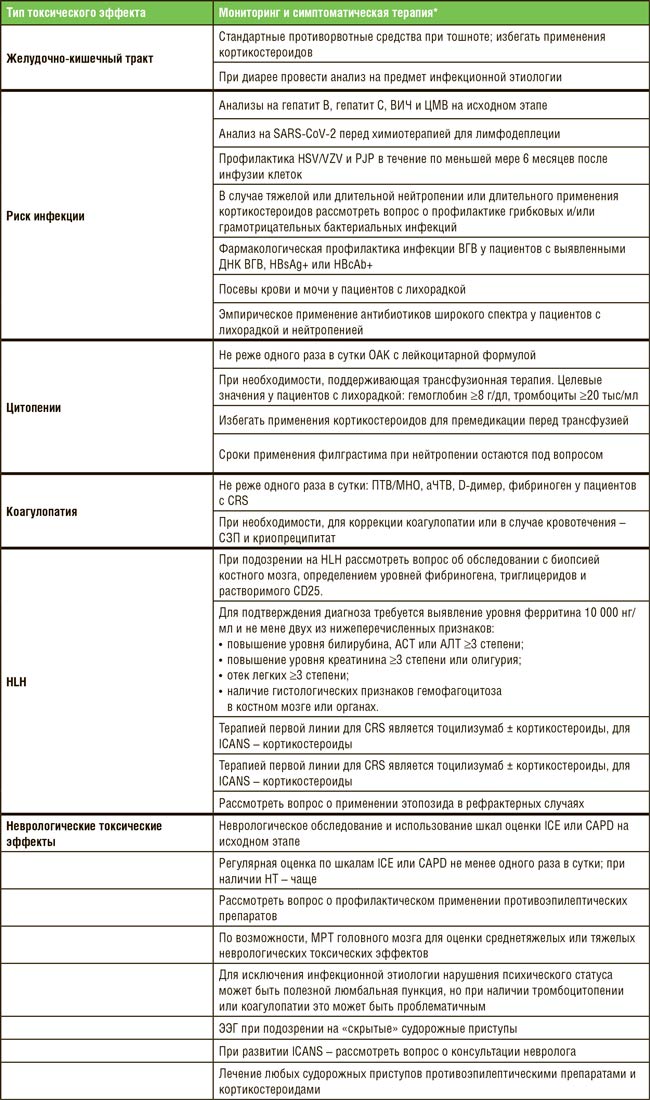
Сокращения: АЛТ – аланинаминотрансфераза; аЧТВ – активированное частичное тромбопластиновое время; АСТ –
аспартатаминотрансфераза; CAPD – шкала Корнелла для оценки детского делирия (Cornell Assessment of Pediatric Delirium); ОАК – общий анализ крови; ЦМВ – цитомегаловирус; КФК – креатинфосфокиназа; СРБ – C-реактивный белок;
CRS – синдром высвобождения цитокинов; ЭКГ – электрокардиограмма(-графия); ЭЭГ – электроэнцефалограмма(-
графия); СЗП – свежезамороженная плазма; HBcAb+ – положительный результат анализа на антитела к сердцевинному
антигену вируса гепатита B; HbsAg – положительный результат анализа на поверхностный антиген вируса гепатита
B; ВГВ – вирус гепатита B; HLH – гемофагоцитарный лимфогистиоцитоз; HSV – вирус простого герпеса; ICANS
– синдром нейротоксичности, ассоциированный с иммунными эффекторными клетками; ICE – энцефалопатия,
ассоциированная с иммунными эффекторными клетками; БИТ – блок интенсивной терапии; в/в – внутривенно; ЛДГ
– лактатдегидрогеназа; MUGA – радиоизотопная вентрикулография; НПВП – нестероидные противовоспалительные
препараты; НТ – неврологическая токсичность; PJP – пневмония, вызванная Pneumocystis jiroveci; ПТВ/МНО –
протромбиновое время/международное нормализованное отношение; SARS-CoV-2 – тяжелый острый респираторный
синдром, вызванный коронавирусом 2 типа; VZV – вирус ветряной оспы.
* Некоторые рекомендации относятся к госпитализированным пациентам
Сообщалось о случаях смерти от инфекционных осложнений после CAR T-клеточной терапии, и наблюдались бактериальные, вирусные и грибковые инфекции [16,71,100-103]. Более тяжелый CRS ассоциируется с более высоким риском инфекции [101,102]. В первые 28 дней после инфузии клеток риск инфекции может быть выше, чем в последующие дни, но инфекции возникают и позднее [101,104]. Описана реактивация цитомегаловирусной инфекции после CAR T-клеточной терапии [78,101], что особенно является проблемой после применения имеющегося в продаже препарата аллогенных CAR T-клеток, если для снижения риска отторжения клеточного трансплантата применяются анти-CD52 антитела. В клиническом исследовании аллогенного препарата UCART19, в котором перед инфузией CAR T-клеток вводили алемтузумаб, у 24% пациентов развились вирусные инфекции 3-й или более высокой степени, в том числе реактивация цитомегаловирусной инфекции 3-й степени у 4,8% [17]. При использовании этой схемы, а также при применении аутологичных клеток, необходимы обследование на цитомегаловирусную инфекцию и мониторинг цитомегаловирусной нагрузки после инфузии CAR T-клеток, особенно если для лечения токсических эффектов назначаются кортикостероиды [103]. При наличии у пациента серьезной или неконтролируемой активной инфекции лимфодеплецию и CAR T-клеточную терапию необходимо отложить [70,98]. Аналогично, хотя имеются некоторые данные, свидетельствующие о том, что можно безопасно продолжать CAR T-клеточную терапию во время пандемии SARS-CoV-2, при условии соблюдения необходимых предосторожностей и надлежащего планирования [105], перед началом кондиционирующей химиотерапии необходимо обследование на SARS-CoV-2, и в случае выявления инфекции терапию следует отложить [106]. Рекомендуется использование ацикловира или валацикловира для профилактики вирусных инфекций, триметоприма-сульфаметоксазола или альтернативного препарата для профилактики пневмонии, вызванной Pneumocystis jirovecii, а также противогрибковых препаратов в случае тяжелой нейтропении или длительного применения кортикостероидов; во время периодов нейтропении также можно рассмотреть вопрос о профилактике грамотрицательных бактериальных инфекций [98,103]. Имеются рекомендации по срокам вакцинации пациентов, получающих анти-CD19 CAR T-клеточную терапию [98], хотя проспективная оценка эффективности вакцинации у таких пациентов не проводилась.
ДЛИТЕЛЬНЫЕ ЦИТОПЕНИИ
После применения препаратов
для CAR T-клеточной терапии с
направленным действием на CD19
и BCMA описаны случаи цитопений продолжительностью более
1 месяца, а в некоторых случаях – продолжительностью от нескольких недель до нескольких
месяцев [1,36,51,73,104,107,108].
Цитопении 3-й или более высокой
степени продолжительностью более 28 дней были отмечены у 32%
пациентов, получавших тисагенлеклейсел, и с такой же частотой
наблюдались у детей и молодых
людей с ОЛЛ, а также у взрослых
пациентов с диффузной крупноклеточной В-клеточной лимфомой [1,5].
Также цитопении 3-й или более
высокой степени продолжительностью до 29 дней были отмечены у 37% пациентов, получавших
лисокабтаген маралейсел [51]. Цитопении 3-й или более высокой
степени продолжительностью более 3 месяцев наблюдались у 17%
пациентов с диффузной крупноклеточной В-клеточной лимфомой, которые получали аксикабтаген силолейсел в исследовании
ZUMA-1 [3], и у 26% пациентов,
получавших брексукабтаген аутолейсел по поводу мантийноклеточной лимфомы [78]. Этиология длительной миелосупрессии
до конца не ясна. Возможными
факторами риска являются CRS
высокой степени, более выраженное вовлечение костного мозга в
злокачественный процесс на исходном уровне, меньшее исходное
количество клеток крови, предшествующая трансплантация
стволовых клеток и конструкция
CAR [61,73,109,110]. При длительных цитопениях продолжительностью более месяца необходимо
выполнить анализ аспирата и
биоптата костного мозга, чтобы
исключить прогрессирование злокачественного поражения костного мозга или миелодисплазию.
Если другой этиологии не выявлено, тактика ведения должна
включать тщательный лабораторный мониторинг формулы крови,
трансфузионную поддержку и,
при необходимости, применение
факторов роста. Описаны единичные случаи применения агониста
рецепторов тромбопоэтина элтромбопага у пациентов с тяжелыми длительными цитопениями
[35,110], однако неясно, вызвал ли
восстановление кроветворения
лекарственный препарат, или состояние разрешилось с течением
времени.
Таблица 7.
Стратегии раннего вмешательства с применением тоцилизумаба и/или кортикостероидов при синдроме высвобождения цитокинов и нейротоксичности).

Сокращения: BiPAP – двухфазная вентиляция с положительным давлением в дыхательных путях; CPAP – постоянное положительное давление в
дыхательных путях; CRS – синдром высвобождения цитокинов.
* Лихорадка: определялась как повышение температуры тела ≥38°C, не объясняемое никакой другой причиной. Наличие лихорадки больше не
требуется для определения в последующем степени тяжести CRS у пациентов, у которых развился CRS и которые затем получают антипиретики или
антицитокиновую терапию. В этих случаях степень тяжести CRS определяется по степени гипотензии и/или гипоксии.
** Степень тяжести CRS определяется по более тяжелому явлению: гипотензии или гипоксии, не объясняемых другими причинами.
† Низкопоточная назальная канюля – канюля, скорость потока кислорода через которую составляет ≤6 л/мин. К низкопоточному режиму также относится
периодическая подача кислорода. Высокопоточная назальная канюля – это канюля, скорость потока кислорода через которую составляет 6 л/мин.
По материалам Lee с соавт. [65]. Воспроизведено в соответствии с условиями Creative Commons Attribution-NonCommercial-No Derivatives License (CC
BY NC ND).
РЕАКЦИЯ «ТРАНСПЛАНТАТ ПРОТИВ ХОЗЯИНА»
При проведении терапии с применением аллогенных CAR T-клеток существует потенциальный риск развития реакции «трансплантат против хозяина». Развитие реакции «трансплантат против хозяина» было описано при применении аутологичных CAR T-клеток, полученных от пациентов, у которых наблюдалось полное приживление донорских клеток после аллогенной трансплантации стволовых клеток [59,111]; после инфузии донорских CAR T-лимфоцитов у пациентов, которым ранее была проведена аллогенная трансплантация стволовых клеток [72]; а также после инфузии аллогенных коммерческих препаратов CAR T-клеток [17]. К счастью, в большинстве случаев реакция «трансплантат против хозяина» наблюдается редко: с частотой от 0% до 10% [7,17,59,72,111-114]. У реципиентов, у которых на исходном этапе отсутствовала или была минимально выражена реакция «трансплантат против хозяина», в последующем она была управляемой. В этих случаях важен правильный выбор пациентов, поскольку наличие тяжелой или неконтролируемой реакции «трансплантат против хозяина» на исходном этапе у реципиентов ранее проведенной трансплантации аллогенных стволовых клеток может послужить препятствием к проведению CAR T-клеточной терапии.
Заключение
Арсенал препаратов для CAR
T-клеточной терапии гемобластозов быстро расширяется. По мере
накопления опыта применения в
клинических исследованиях и в
условиях реальной клинической
практики следующей задачей будет
систематическое и беспристрастное изучение соответствующего
места CAR T-клеточной терапии
среди широкого спектра методов лечения наших пациентов с
использованием химиотерапии,
иммунотерапии и низкомолекулярных ингибиторов сигнальных
путей. Уникальным потенциалом
CAR T-клеточной терапии является возможность однократного
курса терапии с возможностью излечения за счет длительного иммунологического надзора, что может
послужить оправданием высокой
первоначальной экономической и
логистической нагрузки.
КЛЮЧЕВЫЕ НОВОСТИ ASCO 2021, ПОСВЯЩЕННЫЕ МЕЛАНОМЕ
Автор: Утяшев Игорь Аглямович
Институт Онкологии Хадасса, Москва
C 4 по 8 июня 2021 года на прошедшем в формате онлайн ежегодном конгрессе Американской ассоциации клинических онкологов (ASCO) ведущие эксперты представили наиболее значимые достижения в лечении и профилактике меланомы. Краткий анонс ключевых докладов на ASCO 2021 по меланоме представлен в этом обзоре.
Адъювантная терапия меланомы кожи
Kenneth F. Grossmann и соавт. [1] представили финальные результаты рандомизированного исследования III фазы S1404 (NCT02506153, Abstract 9501) в ходе которого у пациентов с резецированной меланомой кожи высокого риска IIIA-IVC стадии (по классификации AJCC 7), ранее не получавших иммунотерапию, после выполнения радикального удаления опухоли назначали в течение 1 года либо пембролизумаб 200 мг (n=640), либо стандартную терапию по выбору исследователя. С учетом периода набора пациентов в это исследования (с декабря 2015 г. по октябрь 2017 г.) стандартом адъювантной терапии в то время были высокие дозы ипилимумаба (10 мг/кг, n=421) или высокие дозы интерферона-альфа 2b (ИФН2b, n=146). В исследование были рандомизированы 1345 пациентов. 11% имели IIIA(N2), 49% – IIIB, 34% – IIIC и 6% – IV стадию заболевания по классификации AJCC7. При финальном анализе результатов исследования авторы обнаружили, что пациенты, получавшие пембролизумаб, имеют достоверно лучшие результаты безрецидивной выживаемости (БРВ) в сравнении с контрольной группой, в которую объединили пациентов, получавших высокие дозы ипилимумаба или высокие дозы ИФН-2b. Отношение рисков (ОР) прогрессирования заболевания составило 0,740 (99,6% ДИ 0,57-0,95) в пользу пембролизумаба. При этом между группой пембролизумаба и контрольной группой (ипилимумаб/ ИФН-2b) не было выявлено статистически значимых отличий в общей выживаемости (ОВ) как в общей популяции рандомизированных пациентов, так и в подгруппе пациентов с экспрессией в опухоли PD-L1 >1%. При анализе нежелательных явлений профиль токсичности пембролизумаба был наиболее благоприятным. Результаты исследования S1404 схожи с результатами исследования CheckMate 238, представленными Jeffrey Weber и соавт. [2] на ESMO 2020, в котором оценивали эффективность адъювантной иммунотерапии ниволумабом у пациентов с меланомой высокого риска IIIB/C и IV стадии (AJCC 2007) меланомы кожи после радикальной резекции в сравнении с адъювантной терапией высокими дозами ипилимумаба (10 мг/ кг). Несмотря на статистически значимое различие в БРВ, ОР прогрессирования заболевания 0,71 (95% ДИ 0,60-0,86) в пользу ниволумаба, ОВ в группе пациентов, получавших ниволумаб, также была идентична группе пациентов, получавших ипилимумаб. Оба исследования свидетельствуют о существенном вкладе в общую выживаемость пациентов с меланомой кожи последующих режимов терапии, эффективных при метастазировании заболевания.
Терапия диссеминированной меланомы кожи
В этом году на ASCO 2021 были представлены обновленные данные двух
крупных рандомизированных исследований III фазы по терапии метастатической МК.
Jedd D. Wolchok и соавт. [3] представили обновленные результаты 6,5-летнего наблюдения за пациентами,
принимающими участие в исследовании CheckMate 067 (NCT01844505,
Abstract 9506). Напомню, это легендарное рандомизированное плацебо-контролируемое исследование 3
фазы, продемонстрировавшее стойкое увеличение ОВ и выживаемости
без прогрессирования (ВБП) у ранее
нелеченых пациентов с неоперабельной меланомой, получавших комбинацию ипилимумаба + ниволумаба
(ипи+ниво), в сравнении с монотерапией ниволумабом (ниво) и монотерапией ипилимумабом (ипи). Ранее
при 5-летнем анализе результатов
исследования ОВ в группе ипи+ниво
составила 52%, в группе ниво – 44%,
а в группе ипи – 26%. При этом БРВ
в группе ипи+ниво составила 36%,
в группе ниво – 29%, а в группе ипи
– 8%. При анализе 6,5-летних результатов наблюдения за пациентами
медиана общей продолжительности
жизни в группе ипи+ниво составила 72,1 месяца, в группе ниво – 36,9
месяца, а в группе ипи – 19,9 месяца.
При этом БРВ в группе ипи+ниво составила 36%, в группе ниво – 29%, а в
группе ипи – 8% (см. таблицу 1).
Таблица 1.
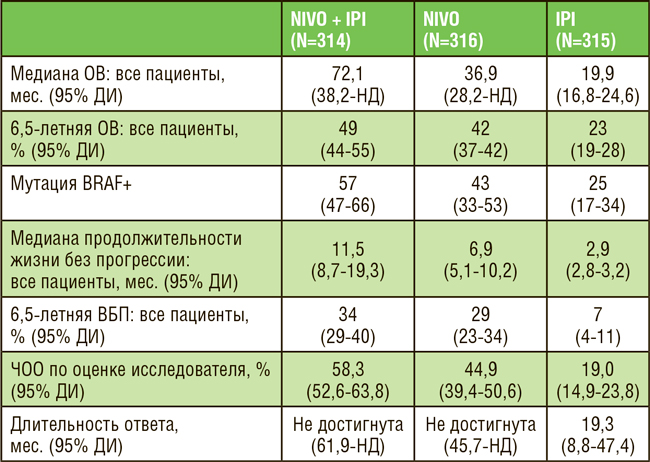
Медиана времени от рандомизации в исследование CheckMate 067 до начала последующей системной терапии в группе ипи+ниво не достигнута (95% ДИ 59,6-НД), в группе ниво – 25,2 мес. (95% ДИ 16,0-43,2), а в группе ипи – 8,0 мес. (95% ДИ 6,5-8,7). Последующую системную терапию в группе ипи+ниво получили 36% пациентов, в группе ниво – 49%, а в группе ипи – 66% пациентов. Медиана времени без лечения, при анализе которой исключили пациентов, выбывших из наблюдения перед началом последующей системной терапии, составила: для группы ипи+ниво – 27,6 мес. (диапазон 0-83.0), для группы ниво – 2,3 мес. (диапазон 0,2-81,6), в группе ипи – 1,9 мес. (диапазон 0,1- 81,9). Среди живых пациентов, за которыми продолжено наблюдение, доля никогда не получавших последующую системную терапию в группе ипи+ниво составила 81% (112/138), в группе ниво – 74% (84/114), а в группе ипи – 43% (27/63). Нежелательные явления (НЯ) 3/4 степени, связанные с проводимым лечением, в группе ипи+ниво наблюдали у 59% пациентов, в группе ниво – у 24%, а в группе ипи – у 28%. В сравнении с 5-летним анализом результатов исследования CheckMate 067, при 6,5-летнем анализе данных новых видов НЯ и новых случаев смерти, связанных с НЯ, не зафиксировано. Представленные на ASCO 2021 результаты 6,5-летнего наблюдения за участниками исследования CheckMate 067 на сегодняшний день являются самыми длительными среди всех опубликованных исследований III фазы по терапии метастатической меланомы с использованием комбинированной иммунотерапии ингибиторами контрольных точек или таргетной терапии. Reinhard Dummer и соавт. [4] представили обновленные результаты анализа 5-летней ОВ у пациентов, принимающих участие в рандомизированном исследовании III фазы COLUMBUS (NCT01909453, Abstract 9507). В этом исследовании оценивали эффективность терапии BRAF-позитивной метастатической меланомы кожи с использованием комбинации BRAF и MEK ингибиторов энкорафениба и биниметиниба (энко+бини). В контрольной группе пациенты получали либо монотерапию BRAF ингибитором вемурафенибом (вем), либо монотерапию BRAF ингибитором энкорафенибом (энко). В исследовании приняли участие 577 пациентов с неоперабельной меланомой, не получавшие ранее таргетную терапию BRAF/ MEK ингибиторами. В исследование могли быть включены пациенты, спрогрессировавшие на иммунотерапии. Минимальный период наблюдения за пациентами составил 65,2 месяца. Медиана общей продолжительности жизни в группе энко+бини составила 33,6 мес. (95% ДИ 24,4-39,2), 5-летняя ОВ в группе энко+бини составила 34,7% (95% ДИ 28,0-41,5), при медиане наблюдения за пациентами в течение 70,4 мес. У пациентов с нормальным уровнем ЛДГ, получавших комбинацию энко+бини, 5-летняя ОВ составила 45,1% (95% ДИ 36,5-53,2). Медиана общей продолжительности жизни, 5-летняя ОВ у пациентов, получавших энко или вем, а также подгрупповой анализ этих показателей в зависимости от исходного уровня ЛДГ и количества пораженных метастазами органов представлены в таблице 2. 5-летняя выживаемость без прогрессии в группе энко+бини составила 22,9%, в группе энко – 19,3%, а в группе вем – 10,2%. ЧОО в группе энко+бини составила 64,1% (95% ДИ 56,8-70,8), в группе энко – 51,5% (95% ДИ 44,3-58,8), а в группе вем – 40,8% (95% ДИ 33,8-48,2). Медиана длительности ответа в группе энко+бини составила 18,6 мес., в группе энко – 15,5 мес., а в группе вем – 12,3 мес. Представленные 5-летние результаты ОВ пациентов, получавших комбинацию энко+бини в исследовании COLUMBUS (34,7%, 95% ДИ 28,0- 41,5), очень схожи с результатами 5-летней ОВ пациентов, получавших комбинацию дабрафениба и траметиниба в объединенном исследовании COMBI-D/V (34%, 95% ДИ 30-38), представленными на конгрессе ASCO в 2019 году [5]. При этом следует признать, что 5-летняя ОВ пациентов с исходно повышенным уровнем ЛДГ, составившая в исследовании COLUMBUS 9,1% (95% ДИ 3,3-18,4), свидетельствует о невысокой эффективности комбинации энко+бини у пациентов с неблагоприятным прогнозом.
Первая линия терапии диссеминированной меланомы кожи
Alexander M. Eggermont и соавт.
представили результаты оценки эффективности повторного назначения
пембролизумаба у спрогрессировавших пациентов в двойном слепом
исследование III фазы EORTC 1325/
KEYNOTE-054 (NCT02362594,
Abstract 9500). В первой части исследования пациенты с III стадией
меланомы после радикального удаления пораженных метастазами
лимфоузлов были рандомизированы
1:1 в две группы. Первая группа пациентов (n=514) получала в течение
года в адъювантном режиме пембро,
во второй группе пациенты получали плацебо (n=505). Ранее опубликованные результаты первой части
исследования продемонстрировали
улучшение безрецидивной выживаемости [6] (ОР 0,57; 98,4% ДИ 0,43-
0,74; p<0,001) и выживаемости без
отдаленных метастазов [7] (ОР 0,60;
95% ДИ 0,49-0,73; p<0,0001) в группе
пациентов, получавших в адъювантном режиме пембро. Во второй части
исследования спрогрессировавших
пациентов (без метастазов в головной мозг и ECOG 0-2) из обеих групп
(пембро и плацебо) расслепляли. В
дальнейшем, если прогрессирование
заболевания выявлено в срок, превышающий 6 месяцев после окончания адъювантной иммунотерапии
пембро, пациентам могла быть повторно назначена терапия пембро
(речеллендж). Пациенты, получавшие в первой части исследования в
адъювантном режиме плацебо, при
прогрессировании могли получать
пембро (кроссовер). Продолжительность терапии пембро при диссеминированной меланоме не превышала
двух лет либо до прогрессирования
заболевания или непереносимой токсичности. При анализе базы данных
исследования (срез данных от 16 октября 2020 г.) выявлено, что в первой
части исследования в группе плацебо
Таблица 2.
спрогрессировали 298 (59%) пациентов, из которых 155 пациентов перешли во вторую часть исследования
и получили пембро (кроссовер). Среди пациентов, получивших в первой
части исследования в адъювантном
режиме пембролизумаб, 12-месячный цикл терапии закончили 297 пациентов (58%). Из них у 47 пациентов
прогрессирование заболевания было
выявлено в срок, превышающий 6
месяцев после окончания адъювантной иммунотерапии пембро в первой части исследования. Повторную
терапию пембролизумабом (речеллендж) провели 20 пациентам из 47.
Среди 175 пациентов, которым была
начата терапия пембро во второй
части исследования (155 кроссовер
и 20 речеллендж), 160 пациентов завершили лечение пембролизумабом:
24 пациента полностью закончили
2-летний курс, у 88 пациентов развилось прогрессирование заболевания, у 20 развилась токсичность, 21
пациенту лечение было прекращено по решению исследователей и 7
пациентов завершили терапию по
другим причинам. 15 пациентов продолжали терапию пембролизумабом
на момент анализа данных. В таблице 3 представлены характеристики
пациентов и результаты лечения во
второй части исследования. Среднее
количество доз пембро в группе
кроссовер составило 12, а в группе
речеллендж 5,5. Медиана времени
наблюдения за пациентами в группе
кроссовер составило 41 мес., а в группе речеллендж 19 мес.
В группе всех пациентов кроссовер
(n=155) 3-летняя выживаемость без
прогрессии составила 32,2%, медиана продолжительности жизни без
прогрессирования составила 8,5 мес.
(95% ДИ 6-15). Медиана времени от
начала терапии пембро до прогрессирования заболевания во второй
части исследования у спрогрессировавших пациентов с резецированной
III-стадией меланомы составила 14
месяцев (95% ДИ 5-27), а у пациентов
с неоперабельной III/IV стадией заболевания медиана составила 8 месяцев (95% ДИ 5-15).
В группе пациентов кроссовер с IV
стадией, у которых было возможно
проанализировать ответ на лечение
(n=80), ЧОО достигла 39% (у 14 пациентов [18%] полный ответ, у 17 пациентов [21%] частичный ответ). 2-летняя выживаемость без прогрессии с
момента достижения объективного
ответа у этих пациентов составила
69% (95% ДИ 48-83). 3-летняя выживаемость без прогрессии составила
31%, а медиана продолжительности
жизни без прогрессии составила 6,1
мес. (95% ДИ 4-15).
В группе пациентов речеллендж, у
которых было возможно проанализировать ответ на лечение (n=9),
ЧОО была ниже и достигла только
11% (у 1 пациента [11%] достигнут
ПО, у 3 пациентов – СЗ и у 5 пациентов – прогрессирование заболевания). 1-летняя выживаемость без
прогрессирования среди всех пациентов в группе речеллендж (n=20)
составила 40%, при этом медиана
продолжительности жизни без прогрессии составила 4,1 месяца (95%
ДИ 2,6-НД).
При планировании исследования
EORTC 1325/KEYNOTE-054 авторы
пытались оценить влияние адъювантной иммунотерапии анти-PD1 моноклональным антителом (мАТ)
на общую выживаемость.
Таблица 3.
Вопрос, на который должно было ответить это исследование, состоял в том, нужно ли лечить пациента с прооперированной III стадией меланомы сразу или лечение следует проводить только в случае дальнейшего прогрессирования заболевания, поскольку появление высокоэффективных методов терапии метастатической меланомы нивелирует эффект адъювантной терапии, выравнивая кривые ОВ. Для этого в дизайне исследования и была добавлена группа кроссовер. Возможность кроссовер предоставляет пациенту, получавшему в первой части исследования плацебо, доступ к исследуемому препарату в случае прогрессирования. Эффективность монотерапии пембро в группе кроссовер оказалась очень схожа с эффективностью первой линии анти-PD1 мАТ в исследованиях KEYNOTE-006 [8], CheckMate 067 [9] (группа пембро). При этом важно отметить, что среди пациентов в группе кроссовер доля пациентов с запущенными подстадиями метастатической меланомы (M1c/d) была существенно меньше, чем в исследованиях KEYNOTE-006 и CheckMate 067 (группа пембро). Анализ результатов повторного назначения пембролизумаба (речеллендж) в исследовании EORTC 1325/ KEYNOTE-054 показал низкую эффективность такого подхода. Хотя ранее в исследованиях KEYNOTE-001 [10], KEYNOTE-006 [8], Jansen, Y и соавт. [11], Betof Warner, A и соавт. [12] эффективность речелленжда была выше. Данные по ОВ пока недоступны, однако уже сейчас известно, что только половина из спрогрессировавших пациентов, получавших в первой части исследования плацебо, во второй части исследования перешла в группу кроссовер. Неясно, какое лечение получали остальные. Ответы на эти вопросы мы получим в ближайшие годы. Evan J. Lipson и соавт. представили первые результаты международного рандомизированного двойного слепого клинического исследования II/III фазы RELATIVITY-047 (CA224-047), в котором изучали эффективность комбинации релатлимаба (рела) с ниволумабом (ниво) с фиксированной дозой обоих препаратов в сравнении с монотерапией ниволумабом в первой линии терапии метастатической меланомы (NCT03470922, Abstract 9503) [13]. Релатлимаб представляет собой человеческое IgG4 LAG-3-блокирующее мАТ. Лимфоцит-активирующий ген 3 (LAG-3) регулирует один из внутриклеточных сигнальных путей контроля иммунного надзора, который ингибирует активность T-лимфоцитов. LAG-3-зависимый сигнальный путь активирован при многих злокачественных опухолях, включая меланому. Блокирование LAG-3 восстанавливает эффекторную функцию истощенных Т-лимфоцитов. Комбинация релатлимаба и ниволумаба (рела+ниво) обладает синергизмом и способна усиливать противоопухолевый иммунный ответ. В исследовании RELATIVITY-047 принимали участие пациенты, не получавшие ранее лечения по поводу диссеминированной меланомы (n=714). Пациенты были рандомизированы 1:1 в две группы. В экспериментальной группе (n=355) пациенты получали каждые 4 недели комбинацию с фиксированной дозой, состоящую из релатлимаба в дозе 160 мг и ниволумаба в дозе 480 мг. В контрольной группе (n=359) пациенты получали каждые 4 недели монотерапию ниволумабом в дозе 480 мг. В обеих группах пациенты были хорошо сбалансированы по демографическим и прогностическим факторам. Стратификацию проводили по экспрессии LAG-3, экспрессии PD-L1, статусу BRAF-мутации и М-подстадии заболевания по классификации AJCC (8-й пересмотр). Первичной целью исследования был анализ выживаемости без прогрессии (ВБП) по RECIST v.1.1, который проводила заслепленная независимая центральная комиссия. Вторичными целями исследования были анализ общей выживаемости (ОВ) и частоты объективного ответа (ЧОО). Дополнительно в исследовании оценивали ВБП и безопасность в заранее определенных подгруппах. Медиана наблюдения за пациентами составила 13,2 мес. Медиана продолжительности жизни без прогрессии в группе рела+ниво составила 10,1 мес. (95% ДИ 6,4-15,7). Медиана продолжительности жизни без прогрессии в группе ниво составила 4,6 мес. (95% ДИ 3,4-5,6) ОР прогрессирования составило 0,75 (95% ДИ 0,6- 0,9; P=0,0055) в пользу комбинации рела+ниво. 1-летняя ВБП в группе рела+ниво составила 47,7% (95% ДИ 41,8-53,2), а в группе ниво – 36,0% (95% ДИ 30,5-41,6). У пациентов, получивших комбинацию рела+ниво, ВБП во всех заранее определенных подгруппах была выше. Таким образом, применение комбинации рела+ниво в первой линии терапии диссеминированной меланомы имеет статистически значимое преимущество в ВБП над монотерапией ниволумабом. Частота нежелательных явлений, обусловленных проводимой терапией, 3/4 степени была выше в группе комбинированной терапии рела+ниво и составила 18,9%, а в группе ниво – 9,7%. В группе рела+ниво было зафиксировано 3 случая летальных исходов, обусловленных проводимым лечением, а в группе ниво – 2 случая. Частота прекращения лечения из-за связанных с терапией нежелательных явлений любой степени в группе рела+ниво составила 14,6%, а в группе ниво – 6,7%. Исследование RELATIVITY-047 является первым клиническим исследованием III фазы, продемонстрировавшим клинически значимое преимущество двойной блокады LAG-3 и PD-1 сигнальных путей с помощью комбинации рела+ниво с фиксированной дозой обоих препаратов. Комбинация рела+ниво хорошо переносится пациентами и имеет управляемый профиль токсичности, непредвиденных побочных эффектов у пациентов, получивших рела+ниво, не выявлено. Поскольку первичная цель исследования была достигнута, мы с нетерпением ожидаем результатов анализа ОВ и ЧОО.
Лечение пациентов с диссеминированной меланомой, резистентных к анти-PD-1/анти- PD-L1 ингибиторам
Ana Maria Arance и соавт. представили обновленные результаты исследования LEAP-004
(NCT03776136, Abstract 9504) [14].
В этом клиническом исследовании принимали участие пациенты
с диссеминированной меланомой
после подтвержденной по iRECIST
прогрессии на терапии анти-PD-1/
анти-PD-L1 ингибиторами в монорежиме или в комбинации с антиCTLA4 мАТ в течение 12 недель от
последнего введения ингибиторов
контрольных точек. При этом пациент должен был получить не менее
двух курсов иммунотерапии. Пациенты получали ленватиниб (ленва)
в дозе 20 мг внутрь ежедневно +
пембролизумаб (пембро) 200 мг в/в
каждые 3 недели. Всего было запланировано не более 35 введений пембролизумаба. Лечение проводили
до прогрессирования или непереносимой токсичности. Первичной
целью исследования был анализ
ЧОО по RECIST 1.1, проводимый
заслепленной независимой центральной комиссией. Вторичными
целями исследования были продолжительность жизни без прогрессии
и длительность ответа по RECIST
1.1, проводимые заслепленной независимой центральной комиссией,
анализ ОВ и безопасности терапии.
Опубликованные ранее результаты этого открытого одногруппового исследования II фазы свидетельствовали об эффективности и
управляемом профиле токсичности
комбинации ленватиниба (ленва)
и пембролизумаба (пембро) у этой
группы пациентов [15]. ЧОО составила 21,4%, медиана длительности
ответа 6,3 мес. ЧОО у пациентов,
спрогрессировавших на предшествующей комбинированной терапии анти-PD-1 + анти-CTLA-4, составила 31%. На ASCO 2021 были
представлены обновленные результаты анализа ЧОО для отдельных
подгрупп пациентов. Всего в исследование было включено 103 пациента. Средний возраст пациентов
составил 63 года. У 68% была выявлена M1c/M1d подстадия заболевания. У 55,3% пациентов выявлено
однократное повышение уровня
ЛДГ относительно верхней границы
нормы (ВГН) (у 20,4% – более чем
2-кратное повышение ЛДГ относительно ВГН). 58,3% пациентов получили >2 линий предшествующей
терапии, 94,2% пациентов получали
терапию по поводу диссеминированной меланомы, 32% пациентов
ранее получали BRAF ± MEK ингибиторы. При медиане наблюдения
15,3 месяца (в диапазоне 12,1-19,0
мес.) на момент анализа результатов 17,5% пациентов продолжают
получать исследуемую терапию.
ЧОО по оценке заслепленной независимой центральной комиссии
осталась на уровне 21,4% (95% ДИ
13,9-30,5), при этом частота полных
ответов возросла с 2 до 3. Частота
контроля над заболеванием достигла 66%. Медиана длительности
ответа достигла 8,2 месяца, а 9-месячная длительность ответа, рассчитанная по методу Каплан-Майер, составила 37,2%.
ЧОО у пациентов, прогрессирующих на ранее проведенной комбинированной иммунотерапии
анти-PD-1 + анти-CTLA-4 (n=30),
составила 33,3. ЧОО у пациентов,
получавших анти-PD-1/анти-PD-L1
мАТ только в адъювантном режиме
(n=11), составила 18,2%. ЧОО у пациентов с первичной резистентностью (т.е. имевших наилучший ответ на лечение в виде стабилизации
или прогрессирования заболевания
на фоне иммунотерапии анти-PD-1/
анти-PD-L1 мАТ по поводу диссеминированной формы заболевания) (n=62) составила 22,6%. ЧОО
у пациентов с вторичной резистентностью (т.е. когда после полного или
частичного ответа на предшествующую иммунотерапию анти-PD-1/
анти-PD-L1 мАТ по поводу диссеминированной формы заболевания у
пациента было зафиксировано прогрессирование заболевания) (n=22)
составила 22,7%.
В общей популяции пациентов медиана продолжительности жизни без
прогрессии составила 4,2 мес. (95%
ДИ 3,8-7,1), а медиана общей продолжительности жизни – 14,0 мес. (95%
ДИ 10,8-НД). 1-летняя ВБП – 17,8%,
1-летняя ОВ – 54,5%, соответственно.
У 96,1% пациентов наблюдали НЯ
любой степени, связанные с лечением, из них у 45,6% пациентов наблюдали НЯ 3-4 степени, у 1% пациентов
– 5 степени (тромбоцитопения). У
7,8% пациентов из-за НЯ, связанных
с лечением, пришлось отменить терапию ленва и/или пембро. У 56,3%
пациентов НЯ, связанные с лечением, привели к снижению дозы ленва.
Комбинация ленва+пембро обладает
клинически значимой эффективностью и способна вызывать стойкие
ответы у пациентов с диссеминированной меланомой, спрогрессировавших на предшествующей терапии анти-PD-1/анти-PD-L1 мАТ,
а также на комбинации анти-PD-1
+ анти-CTLA-4 мАТ независимо
от первичной или приобретенной
резистентности к иммунотерапии
анти-PD-1/анти-PD-L1 мАТ. При
этом профиль безопасности комбинации ленва+пембро в исследовании
LEAP-004 соответствовал результатам предыдущих исследований этой
комбинации препаратов, новых НЯ
выявлено не было.
Лифилюцел – новое направление в лечении метастатической меланомы, рефрактерной к иммунотерапии
Джеймс Ларкин и соавт. представили результаты открытого многоцентрового исследования II фазы
C-144-01 (NCT02360579, Abstract
9505) [16], в котором оценивали
эффективность и безопасность
клеточного препарата лифилюцел
у пациентов с метастатической меланомой, спрогрессировавших на
иммунотерапии анти-PD-1 мАТ
и таргетной терапии (ТТ) BRAFi
± MEKi (в случае BRAF V600 позитивной меланомы). Lifileucel
(LN-144) – это клеточный препарат из аутологичных криоконсервированных лимфоцитов, инфильтрирующих опухоль (TIL),
уже продемонстрировавший
ранее свою эффективность у пациентов с метастатической меланомой, рефрактерной к иммунотерапии и ТТ [17]. На ASCO 2021
были представлены обновленные
(срез данных 14 декабря 2020 г.)
результаты 28-месячного наблюдения за пациентами в когорте 2
(n=66), а также анализ эффективНачало на стр. 18
ности адоптивной TIL-терапии
лифилюцелом в зависимости от
ответа и продолжительности ранее проводимой иммунотерапии
анти-PD-1 мАТ.
Таблица 4.
Однофакторный регрессионный анализ длительности ответа по Коксу.
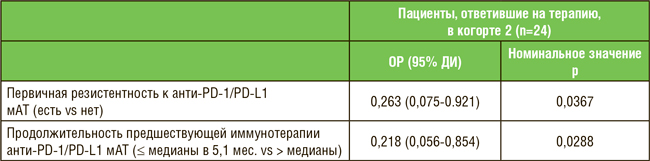
Для производства лифилюцела в исследовательских центрах у пациента проводили резекцию опухоли, далее образцы отправляли в централизованную GMP-сертифицированную лабораторию для получения аутологичных TIL. Весь процесс производства лифилюцела занимал 22 дня. Перед введением лифилюцела пациенту в течение недели проводили немиелоаблативную лимфодеплецию с использованием комбинации циклофосфамида (2 дня) и флударабина (5 дней). Далее пациенту однократно вводили лифилюцел и до 6 доз интерлейкина 2 (ИЛ-2). ЧОО оценивали по критериям RECIST 1.1. Исходные характеристики пациентов: среднее количество предшествующих линий терапии у пациентов, принимавших участие в исследовании, составило 3,3. Перед включением в исследование 100% пациентов получали антиPD-1 мАТ; 80% – анти-CTLA-4 мАТ; 23% – BRAFi/MEKi. Пациенты исходно имели большой объем опухолевого поражения – в среднем суммарный размер таргетных очагов составлял 106 мм. У 42% пациентов было выявлено метастатическое поражение печени и головного мозга. 40,9% пациентов имели повышенный уровень ЛДГ. ЧОО по оценке исследователя составила 36,4% (3 ПО, еще один ПО был зафиксирован на 24 месяце наблюдения, 21 ЧО). Средняя продолжительность ответа не была достигнута при медиане периода наблюдения 28 месяцев (диапазон 2,2-35,2 мес.). У пациентов, ответивших на лечение, среднее количество ранее проведенных линий анти-PD-1 иммунотерапии составило 1,5 (диапазон 1-4), а средняя кумулятивная продолжительность предшествующих линий анти-PD-1 иммунотерапии составила 4,4 мес. (диапазон 1,4- 22,5 мес.). В таблице 4 представлены данные, свидетельствующие о значимом увеличении продолжительности ответа на TIL-терапию у пациентов с первичной резистентностью к предшествующей иммунотерапии анти-PD-1 мАТ и более короткой продолжительностью предшествующей иммунотерапии анти-PD-1 мАТ. При более длительном наблюдении за участниками исследования C-144- 01 новых видов нежелательных явлений не выявлено. Представленные данные подтверждают высокую эффективность лифилюцела у сильно предлеченных пациентов, нечувствительных к иммунотерапии анти-PD-1 мАТ. Всего лишь однократное введение этого препарата вызывает развитие объективных ответов у 36,4% пациентов, при этом медиана длительности ответа до сих пор не достигнута (при 28-месячном наблюдении). При более длительном наблюдении увеличивается и количество полных ответов. Интересно, что длительность ответа на адоптивную TIL-иммунотерапию лифилюцелом положительно коррелирует с первичной резистентностью к иммунотерапии анти-PD-1 мАТ и более короткой кумулятивной продолжительностью иммунотерапии анти-PD-1 мАТ. Объяснение этому феномену находится в механизме действия лифилюцела, который нам еще предстоит изучить. Но уже сейчас становится понятно, что появился новый, или хорошо забытый старый, метод лечения пациентов с метастатической меланомой, нечувствительной к иммунотерапии анти-PD-1 мАТ. Причем применять этот метод следует как можно раньше уже при первых признаках резистентности к иммунотерапии.
Источники:
1. J Clin Oncol 39, 2021 (suppl 15; abstr 9501). 10.1200/JCO.2021.39.15_ suppl.9501.
2. Annals of Oncology (2020) 31 (suppl 4): S672-S710. 10.1016/annonc/ annonc280.
3. Journal of Clinical Oncology 39, no. 15_suppl (May 20, 2021) 9506-9506. 10.1200/JCO.2021.39.15_suppl.9506.
4. Journal of Clinical Oncology 39, no. 15_suppl (May 20, 2021) 9507-9507. 10.1200/JCO.2021.39.15_suppl.9507.
5. Journal of Clinical Oncology 37, no. 15_suppl (May 20, 2019) 9507-9507. 10.1200/JCO.2019.37.15_suppl.9507.
6. N Engl J Med 2018; 378:1789-1801. 10.1056/NEJMoa1802357.
7. Lancet Oncol. 2021;22(5):643-654. 10.1016/S1470-2045(21)00065-6.
8. Lancet Oncol. 2019;20(9):1239-1251. doi:10.1016/S1470-2045(19)30388-2.
9. N Engl J Med 2019; 381:1535-1546. DOI: 10.1056/NEJMoa1910836.
10.Ann Oncol. 2019; 30(4):582-588. doi:10.1093/annonc/mdz011.
11.Ann Oncol. 2019; 30(7):1154-1161. doi:10.1093/annonc/mdz110.
12.J Clin Oncol. 2020; 38(15):1655-1663. doi:10.1200/JCO.19.01464.
13.Journal of Clinical Oncology 39, no. 15_suppl (May 20, 2021) 9503-9503. doi:10.1200/JCO.2021.39.15_suppl.9503.
14.Journal of Clinical Oncology 39, no. 15_suppl (May 20, 2021) 9504-9504. doi:10.1200/JCO.2021.39.15_suppl.9504.
15.Annals of Oncology (2020) 31 (suppl_4): S1142-S1215. 10.1016/ annonc/annonc325.
16.J Clin Oncol 39, 2021 (suppl 15; abstr 9505) DOI:10.1200/JCO.2021.39.15_ suppl.9505.
17.Journal of Clinical Oncology 38,
no. 15_suppl (May 20, 2020) 10006-
10006. DOI: 10.1200/JCO.2020.38.15_
suppl.10006.