Дорогие коллеги, дорогие друзья!
Мечтать нужно о большем. Или о большом, как угодно. «Dream big!» - как говорят англичане. Мировая литература, искусство, судьбы известных людей, добившихся успеха прежде всего стремлением к нему, имеют множество подтверждений тому, и ...

Джон Лавери (John Lavery).
Анна Павлова. 1911 год, холст, масло. Художественная галерея Келвингроув, Глазго
Аполлон Майков.
В чем счастье? 1889 г.
НОВОСТИ ОБЩЕСТВА / ИТОГИ РЕАЛИЗАЦИИ НАЦИОНАЛЬНОЙ ПРОГРАММЫ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ «СОВЕРШЕНСТВОВАНИЕ МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКОЙ ДИАГНОСТИКИ В РОССИЙСКОЙ ФЕДЕРАЦИИ С ЦЕЛЬЮ ПОВЫШЕНИЯ ЭФФЕКТИВНОСТИ ПРОТИВООПУХОЛЕВОГО ЛЕЧЕНИЯ» В 2024 ГОДУ
Российское общество клинической онкологии 13 марта 2025 г. провело очередное рабочее совещание (в дистанционном формате) лабораторий-участников и партнеров проекта Национальной программы RUSSCO.

НОВОСТИ ОБЩЕСТВА / МОРФОЛОГИЧЕСКИЙ ОТВЕТ НА НЕОАДЪЮВАНТНОЕ ЛЕЧЕНИЕ КОМБИНАЦИЕЙ FLOT ОПРЕДЕЛЯЕТ ПОЛЬЗУ ЕЕ АДЪЮВАНТНОГО ПРИМЕНЕНИЯ У БОЛЬНЫХ ОПЕРАБЕЛЬНЫМ РАКОМ ЖЕЛУДКА
Для пациентов с местнораспространенной аденокарциномой желудка и пищеводно-желудочного перехода рекомендуемым методом лечения является периоперационная химиотерапия комбинацией FLOT (4 курса до и 4 курса после оперативного...

НОВОСТИ ESTRO / НОВЫЕ ГОРИЗОНТЫ ЛУЧЕВОЙ ТЕРАПИИ: ОСНОВНЫЕ ИССЛЕДОВАНИЯ, ПРЕДСТАВЛЕННЫЕ НА КОНГРЕССЕ ESTRO 2025
Вена, 2-6 мая 2025 г.: в столице Австрии прошел ежегодный конгресс Европейского общества терапевтической радиационной онкологии (ESTRO 2025), собравший около 7000 специалистов из более чем 80 стран. На этом ведущем мировом форуме

ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / 9MW2821 – НОВЫЙ КОНЪЮГАТ К NECTIN-4 – СРЕДИ ПАЦИЕНТОВ С РАСПРОСТРАНЕННЫМИ СОЛИДНЫМИ ОПУХОЛЯМИ: МНОГОЦЕНТРОВОЕ ИССЛЕДОВАНИЕ I/II ФАЗЫ
Многие из нас еще даже «не держали в руках» энфортумаб ведотин (EV), как уже китайские коллеги представили новую молекулу – 9MW2821 – конъюгат антитела к Nectin-4 с цитостатиком ММАЕ, отличием которого от EV является новый линкер

ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / POSEIDON TRIAL: ДУРВАЛУМАБ/ ТРЕМЕЛИМУМАБ ЭФФЕКТИВЕН ПРИ ВЫСОКОЙ TMB
В исследовании III фазы POSEIDON (NCT03164616) тремелимумаб в первой линии + дурвалумаб и химиотерапия на основе платины продемонстрировали статистически значимое улучшение PFS (HR 0,72; 95% ДИ 0,60-0,86) и ...
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / КЛИНИКО-МОЛЕКУЛЯРНЫЙ ПРОФИЛЬ И ЭФФЕКТИВНОСТЬ АНТИ-HER2 ТЕРАПИИ ПРИ HER2-АМПЛИФИЦИРОВАННОМ РАКЕ БИЛИАРНОГО ТРАКТА
В Journal of Clinical Oncology опубликован объединенный анализ исследований SCRUM-Japan GOZILA и MONSTAR-SCREEN, в котором авторы оценили молекулярный профиль у пациентов с метастатическим раком желчных путей с амплификацией...

ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / СТАРАЯ ДОБРАЯ МАГНЕЗИЯ
Одна из наиболее читаемых публикаций журнала JAMA на прошлой неделе – статья американских авторов о роли внутривенного введения магнезии для снижения платина-ассоциированной токсичности со стороны почек. Острое повреждение...
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / НИРАПАРИБ + АБИРАТЕРОНА АЦЕТАТ (АА) В ПЕРВОЙ ЛИНИИ МКРРПЖ: ФИНАЛЬНЫЕ ДАННЫЕ ИССЛЕДОВАНИЯ MAGNITUDE
До сих пор не утихают споры о том, кому же в большей степени показана комбинация PARPингибитора и антиандрогена – всем пациентам либо только с мутацией в генах HRR, либо вовсе ограничиться больными с мутацией BRCA1/2. Особенностью...
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / ХОЛЕСТЕРИН ПРОТИВ ИММУНИТЕТА: КАК ОПУХОЛЬ УСКОЛЬЗАЕТ ОТ ТЕРАПИИ
Недавняя статья в журнале Experimental & Molecular Medicine (12.05.2025) привлекла внимание многих исследователей и специалистов по лечению колоректального рака...
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / ИССЛЕДОВАНИЕ INDIGO: ВОРАСИДЕНИБ ЗАМЕДЛЯЕТ РОСТ МУТАНТНЫХ ГЛИОМ GRADE 2 С IDH-МУТАЦИЕЙ
Глиомы Grade 2 с мутацией в гене IDH1 или IDH2 — это медленно растущие инфильтративные опухоли головного мозга у взрослых. У многих пациентов без признаков высокого риска (например, без усиления контраста на МРТ) лечение...

УГОЛОК РАДИОТЕРАПЕВТА / ПРОФИЛАКТИЧЕСКОЕ ОБЛУЧЕНИЕ МОЛОЧНЫХ ЖЕЛЕЗ: 10-ЛЕТНИЕ РЕЗУЛЬТАТЫ
На XXI Российском онкологическом конгрессе в Москве в 2017 году профессор Ella Evron из Израиля впервые представила результаты проспективного нерандомизированного исследования по профилактическому облучению контралатеральной...
УГОЛОК РАДИОТЕРАПЕВТА / CRISEC: НЕОАДЪЮВАНТНАЯ ХИМИОЛУЧЕВАЯ ТЕРАПИЯ И ПОСЛЕДОВАТЕЛЬНОЕ ВВЕДЕНИЕ ТИСЛЕЛИЗУМАБА ПРИ ПЛОСКОКЛЕТОЧНОМ РАКЕ ПИЩЕВОДА
Продолжаются попытки улучшить результаты комплексного лечения рака пищевода с включением иммунотерапии как компонента системной терапии. В майском номере журнала Radiotherapy and Oncology опубликованы результаты одноцентрового
Анонс
-

20-21 ИЮНЯ 2025
ТРЕТИЙ МОЛОДЕЖНЫЙ ОНКОЛОГИЧЕСКИЙ САММИТ
КОНФЕРЕНЦИЯ RUSSCO ЛУЧШЕЕ ПО МАТЕРИАЛАМ КОНФЕРЕНЦИИ ASCO
-
18 ОКТЯБРЯ 2025
ЭКЗАМЕН ESMO
МОСКВА
-

11-13 ДЕКАБРЯ 2О25
XXIX РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС 2025
МОСКВА
Дорогие коллеги, дорогие друзья!
Мечтать нужно о большем. Или о большом, как угодно. «Dream big!» - как говорят англичане. Мировая литература, искусство, судьбы известных людей, добившихся успеха прежде всего стремлением к нему, имеют множество подтверждений тому, и каждый из нас назовет минимум пару примеров, возможно, и из своей жизни. Сэр Джон Левери (Лавери) родился в Белфасте в католической семье, он был сыном обедневшего проповедника. Его отец утонул во время эмиграции в Америку в 1859 году, когда Джону было три года, мать умерла вскоре после этого. Мальчика отправили в Глазго в фотостудию помощником ретушера, где он обнаружил в себе любовь к рисунку и живописи в возрасте 17 лет. Его последующая жизнь – упорные шаги в поисках своего места в искусстве, поступление в академию, стремление к дальнейшей учебе – Глазго, Лондон, Париж, организация своей художественной группы приверженцев идеалам натурализма «The Glasgow Boys», работа, путешествия, признание, членство в Королевской академии, знакомство с Анной Павловой и череда портретов великой балерины в студии – которые, тем не менее, выглядели воплощением ее грации и экспрессии на сцене. Сама великая балерина – незаконнорожденная дочь банкира и его горничной, дитя-обуза, не знавшее любви и поддержки в юности, мечтала стать танцовщицей. Мечты о большем и стремление сделать все возможное для их осуществления – они помогают свернуть горы.
Каждый из нас мечтает о бОльшем. Или о большОм, будь то личное или профессиональное. Врачу, онкологу не стоит прятать или откладывать желания под скатерть, «на потом», ибо любой персональный шаг вперед может послужить великому делу спасения жизней.
Дорогие коллеги, молодые онкологи, мечтайте о большем! Используйте любую возможность сделать шаг вперед в нашей профессии. Участвуйте в дискуссиях на конференциях, вебинарах, очно и онлайн, Российское общество клинической онкологии предлагает немалый их выбор и абсолютно бесплатно; изучайте языки, испытайте свои силы и знания, зарегистрировавшись на экзамен ESMO; подайте заявку на участие в любом из мероприятий RUSSCO, включая ежегодный Российский онкологический конгресс. Информацию об этом вы всегда найдете на сайте RosOncoWeb. Есть огромная вероятность, что именно вы – следующее поколение лидеров российской (возможно, и мировой) онкологии. DREAM BIG!
Ваша команда RUSSCO
Джон Лавери (John Lavery).

Аполлон Майков.
***
В чем счастье?..
В жизненном пути
Куда твой долг велит — идти,
Врагов не знать, преград не мерить,
Любить, надеяться и — верить.
НОВОСТИ ОБЩЕСТВА / ИТОГИ РЕАЛИЗАЦИИ НАЦИОНАЛЬНОЙ ПРОГРАММЫ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ «СОВЕРШЕНСТВОВАНИЕ МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКОЙ ДИАГНОСТИКИ В РОССИЙСКОЙ ФЕДЕРАЦИИ С ЦЕЛЬЮ ПОВЫШЕНИЯ ЭФФЕКТИВНОСТИ ПРОТИВООПУХОЛЕВОГО ЛЕЧЕНИЯ» В 2024 ГОДУ
Российское общество клинической онкологии 13 марта 2025 г. провело очередное рабочее совещание (в дистанционном формате) лабораторий-участников и партнеров проекта Национальной программы RUSSCO.
Участники совещания обсудили результаты работы за 2024 год и планы на 2025 год, о которых рассказала исполнительный директор RUSSCO, д.м.н. Вера Витальевна Карасева.
С актуальной темой «Законодательство, регламентирующее МГД в онкологии» выступила Ирина Анатольевна Демидова, заведующая молекулярно-биологической лабораторией МГОБ №62, к.м.н.
Опытом использования метода NGS в рутинной молекулярно-генетической диагностике поделилась Анна Михайловна Строганова, к.м.н., НМИЦ онкологии им. Н.Н. Блохина.
Якунина Елена Юрьевна, заведующая клиническо-диагностической лабораторией КГБУЗ КККОД им. А.И. Крыжановского» (г. Красноярск), и Колесникова Елена Александровна, руководитель молекулярно-генетической лаборатории НИИКО НОКОД, к.б.н. (г. Нижний Новгород), рассказали о работе в их лабораториях, о сложностях и путях их преодоления.
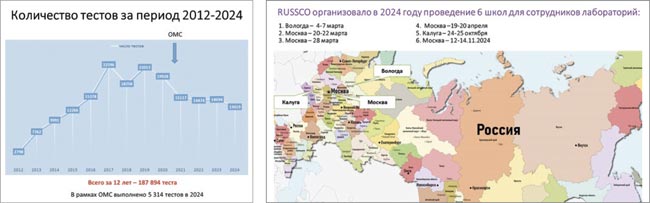
За 13 лет существования Программы силами врачей, Общества и партнеров удалось объединить в единую сеть специализированные Центры молекулярной диагностики, в которых осуществляются высокотехнологичные диагностические процедуры, что дало толчок к развитию молекулярно-генетической диагностики в Российской Федерации.
За эти годы мы смогли привлечь в Программу более 3 850 онкологов, включить в работу 83 региона России, выполнить 187 894 теста для 9 нозологий.
Биообразцы пациентов направлялись в 27 лабораторий, включая референсные центры, работающие в рамках ОМС. Было выполнено 187 894 теста для пациентов с различными злокачественными опухолями, которые получили возможность определить их прогноз и определиться с тактикой лечения, что является огромным достижением программы.
В 2024 году в рамках Программы было продиагностировано 11 503 пациента, выполнено 13 019 тестов, из них 5 664 теста было выполнено методом NGS. Осуществлена маршрутизация образцов в 10 лабораторий и референсные центры, где проведено 5 314 тестов в рамках программы Госгарантий.
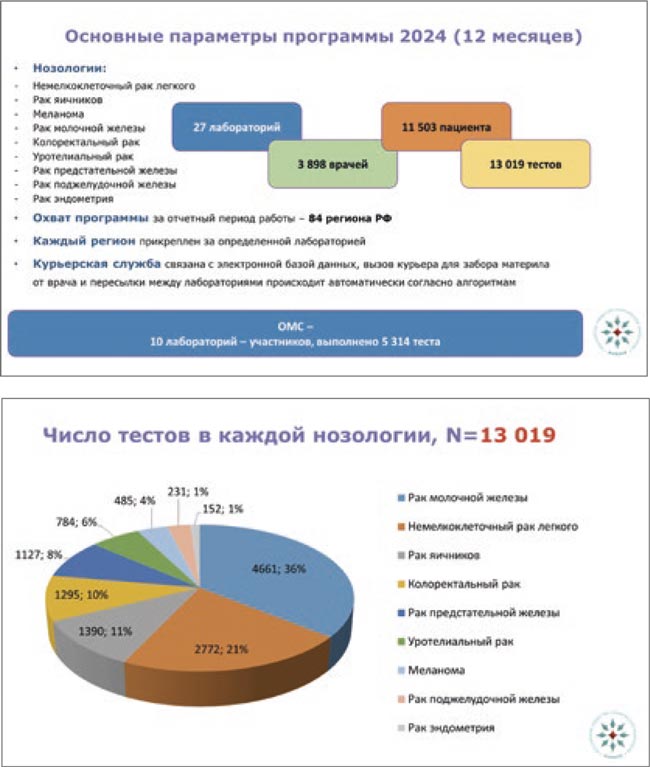
Из общего числа пациентов было протестировано 3 710 (32,3%) мужчин и 7 793 (67,7%) женщины. По количеству пациентов лидирует Приволжский ФО – 3 554 человека, Сибирский ФО – 2 635, ЦФО – 2 236, Северо-Западный ФО – 1 015, ДВФО – 710, Уральский ФО – 681, ЮФО – 408, Северо-Кавказский ФО – 264 человека.
36% тестов по Программе выполнено для нозологии рак молочной железы, при НМРЛ – 21%, при раке яичников – 11%, колоректальном раке – 10%, остальные нозологии – меньше 10%, они отражены на диаграмме.
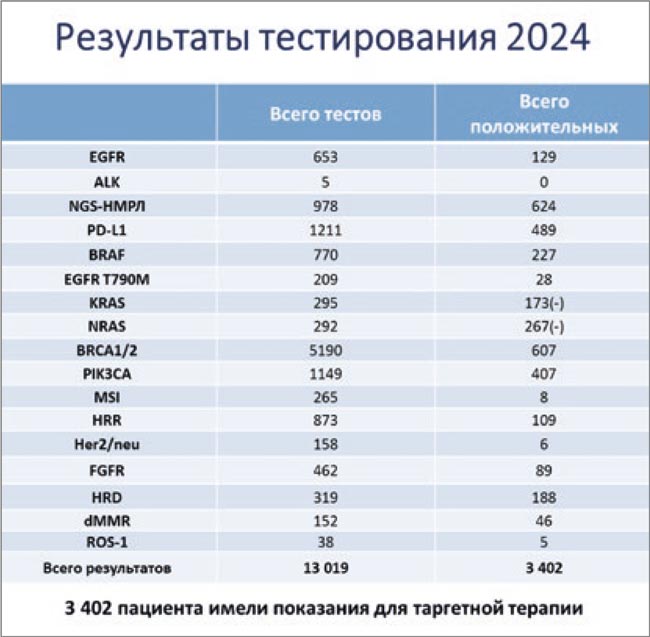
В рамках Программы проводились исследования генетических нарушений генов EGFR, BRAF, PIK3CA, FGFR, методом NGS тестировались гены BRCA1/2 и HRD, HRR и в раке легкого; транслокации ALK и ROS1; исследование уровня экспрессии PD-L1. На слайде представлены данные по количествам выполненных тестов и положительных результатов.
Общее число пациентов, для которых результаты теста оказались значимыми при выборе терапии, составило 3 402 человека.
Большую и неоценимую работу по поддержке врачей и лабораторий выполняет коллектив Горячей линии проекта, осуществляющий техническую поддержку врачей с 06:00 до 18:00 по московскому времени. В 2024 году 3 сотрудника Горячей линии приняли и сделали более 4 000 звонков, что в среднем составляет 24 в день, зарегистрировали на медицинской онлайн-платформе RUSSCO, обучили и проинформировали о проекте, методах тестирования и алгоритме отправок 472 новых врача. Ежедневно специалистами горячей линии обрабатывается 50-60 электронных писем и огромный массив полученной информации.
Общество уже много лет проводит обучающие школы по ПЦРдиагностике в лабораториях РФ при поддержке партнеров Программы: в 2024 году прошло 6 мероприятий. Во время школ происходит обмен опытом с ведущими специалистами референсных лабораторий при погружении в текущую лабораторную практику
Выражаем огромную благодарность нашим преподавателям школ ПЦРдиагностики за подготовку учебных материалов, разборы протоколов EGFR, BRCA-тестирований, за интерпретацию и оценку результатов работы на местах, обсуждение особенностей методик и работы оборудования в каждой конкретной лаборатории.
В планах Общества на 2025 год:
- продолжение тестирований в рамках Национальной Программы;
- работа с маршрутизацией образцов в рамках ОМС;
- организация 10 школ ПЦРдиагностики в регионах РФ;
- онлайн-консультации молекулярных генетиков по интерпретации заключений NGS-тестирований на сайте www.cancergenome.ru;
- контроль качества МГТ.
Соколова Ольга Васильевна, заместитель медицинского директора Российского общества клинической онкологии
Морозова Ольга Михайловна, ведущий специалист МГД Российского общества клинической онкологии
НОВОСТИ ОБЩЕСТВА / МОРФОЛОГИЧЕСКИЙ ОТВЕТ НА НЕОАДЪЮВАНТНОЕ ЛЕЧЕНИЕ КОМБИНАЦИЕЙ FLOT ОПРЕДЕЛЯЕТ ПОЛЬЗУ ЕЕ АДЪЮВАНТНОГО ПРИМЕНЕНИЯ У БОЛЬНЫХ ОПЕРАБЕЛЬНЫМ РАКОМ ЖЕЛУДКА
Автор: Тюляндин Сергей Алексеевич
Заслуженный деятель науки РФ,
главный научный сотрудник отделения противоопухолевой лекарственной терапии
№2 ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России,
член правления RUSSCO, профессор, доктор медицинских наук,
Москва
Для пациентов с местнораспространенной аденокарциномой желудка и пищеводно-желудочного перехода рекомендуемым методом лечения является периоперационная химиотерапия комбинацией FLOT (4 курса до и 4 курса после оперативного лечения 5-фторурацилом, лейковорином, оксалиплатином и доцетакселом), продемонстрировавшая увеличение как безрецидивной, так и общей выживаемости. Данная комбинация обладает умеренной токсичностью, и примерно 90% больных могут получить все 4 цикла на предоперационном этапе. Проведение химиотерапии на послеоперационном этапе накладывается на нелегкое восстановление после проведенного травматичного хирургического вмешательства. Многие пациенты не могут начать адъювантную химиотерапию в связи с ослабленным состоянием, а многие, начав ее, вынуждены прекратить досрочно. Число завершивших адъювантный режим не превышает 50-60% вследствие чаще всего нарастания общей слабости, периферической нейропатии, потери веса и ухудшения общего состояния по шкале ECOG. Все это ставит под сомнение терапевтическую пользу от проведения адъювантного этапа. Авторы данной работы попытались изучить, может ли морфологический ответ на неоадъювантное лечение комбинацией FLOT определить пользу от ее адъювантного применения.
В исследование включали больных местнораспространенной аденокарциномой желудка и гастроэзофагеального перехода, которые получили неоадъювантную FLOT и перенесли операцию в период 2017-2022 гг. в 43 клиниках Европы. Эффективность неоадъювантного лечения оценивали по степени регрессии опухоли (TRG) согласно классификации Колледжа американских патологов (CAP), которая основана на оценке процента жизнеспособных опухо- левых клеток. Согласно этой классификации, выделяли CAP-TRG 0-1, который предполагает отсутствие жизнеспособных опухолевых клеток (полный эффект) и наличие редких отдельно лежащих жизнеспособных клеток или групп клеток (практически полный эффект), CAP-TRG 2 – остаточная опухоль с очевидной регрессией (частичный эффект) и CAP-TRG 3 – обширная резидуальная опухоль (отсутствие эффекта). Результаты продолжительности жизни пациентов, которым была и не была проведена комбинация FLOT на адъювантном этапе, сравнивались с использованием метода Каплана-Майера.
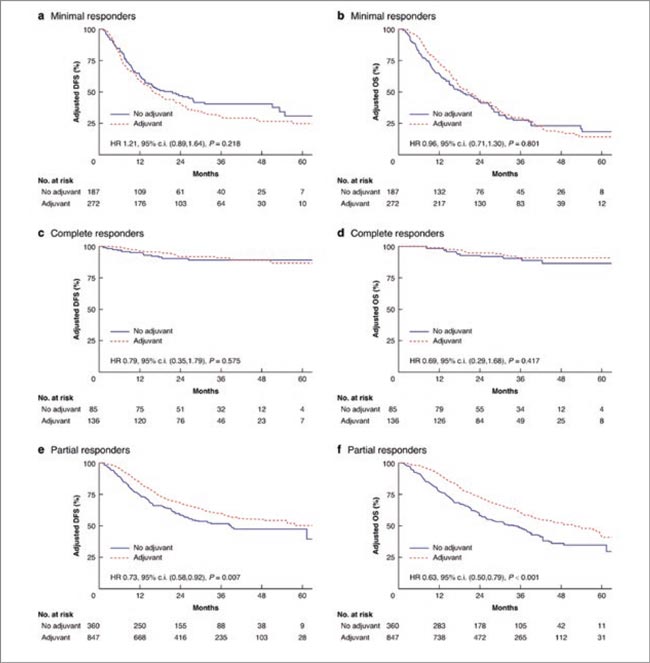
Всего в исследование было включено 1887 пациентов: 459 больных – без эффекта (CAP-TRG 3), 221 – полный или практический полный эффект (CAP-TRG 0-1) и 1207 – частичный эффект (CAP-TRG 2). Медиана наблюдения составила 25,5 мес. В группе без эффекта от проведенной неоадъювантной терапии не было отмечено разницы в безрецидивной (HR 1,03; р=0,836) и общей (HR=0,96; р=0,801) выживаемости между теми, кто получил и не получил адъювантную FLOT. В группе полной или практически полной регрессии также не отмечено разницы в безрецидивной (HR=0,88; р= 0,724) и общей (HR=0,69; р=0,343) выживаемости между теми, кто получил и не получил адъювантную FLOT. В группе частичной регрессии адъювантная FLOT обеспечила значительное достоверное снижение относительного риска прогрессирования на 32% (HR=0,68; р<0,001) и на 45% – относительного риска смерти (HR=0,55; р<0,001).
Данное исследование еще раз показывает сомнительную пользу от проведения адъювантного этапа периопериционной химиотерапии FLOT у больных с отсутствием противоопухолевого эффекта на неоадъювантном этапе. В качестве критерия эффекта терапии использовали морфологическую классификацию регрессии опухоли, которая не является стандартной для морфологического заключения удаленной опухоли в нашей стране. Это оставляет нам принятие решения о проведении или отказе от проведения адъювантного лечения на основании оценки противоопухолевого эффекта по критериям RECIST (что не всегда применимо для оценки первичной опухоли желудка и мелких лимфоузлов), морфологического заключения о наличие лечебного патоморфоза в удаленной опухоли и общего состояния пациента. Но результаты данного исследования позволяют нам с большей смелостью отказаться от адъювантного этапа, если не отмечено клинических признаков регрессии опухоли, морфологически не обнаружено признаков лечебного патоморфоза, а общее состояние пациента после операции заставляет усомниться в его способности завершить запланированные 4 курса химиотерапии FLOT. В исследовании не было обнаружено достоверного выигрыша от проведения адъювантной терапии и у больных с полным или практически полным морфологическим эффектом. Однако нельзя не заметить, что проведение адъювантного этапа у этой группы больных привело к недостоверному снижению относительного риска прогрессирования на 12% и относительного риска смерти на 31%. Небольшое количество пациентов с полной или практической полной регрессией недостаточно для статистически достоверной оценки клинической пользы адъювантного FLOT, что предполагает рекомендацию его проведения этой группе. Очевидна польза от проведения адъювантного этапа у больных с частичной регрессией опухоли по данным клиники и морфологии. Именно им следует стараться завершить запланированные 4 курса адъювантного FLOT.
Источники:
- College of American Pathologists. Protocol for the examination of specimens from patients with carcinoma of the stomach. Protocol Posting Date: February 2020.
- SPACE-FLOT Investigators. Pathological response guides adjuvant 5-fluorouracil, leucovorin, oxaliplatin, and docetaxel (FLOT) chemotherapy in surgically resected gastro-oesophageal cancer (SPACEFLOT): international cohort study. British Journal of Surgery. 2025 Mar 28; 112(4): znaf056. Published online: April 2025. https://doi.org/10.1093/bjs/ znaf056.
НОВОСТИ ESTRO / НОВЫЕ ГОРИЗОНТЫ ЛУЧЕВОЙ ТЕРАПИИ: ОСНОВНЫЕ ИССЛЕДОВАНИЯ, ПРЕДСТАВЛЕННЫЕ НА КОНГРЕССЕ ESTRO 2025
Автор: Алексей Черчик
Врач, радиационный онколог,
Paul Scherrer Institute,
Швейцария
Вена, 2-6 мая 2025 г.: в столице Австрии прошел ежегодный конгресс Европейского общества терапевтической радиационной онкологии (ESTRO 2025), собравший около 7000 специалистов из более чем 80 стран. На этом ведущем мировом форуме были представлены новейшие достижения в области клинической лучевой онкологии, радиобиологии, медицинской физики и технологий. Главной темой стали инновационные подходы, способные преобразить практику лучевой терапии: укороченные схемы об лучения(гипофракционирован ие), интеграция иммунотерапии в комбинации с лучевой терапией, персонализированный подбор лечения по молекулярным маркерам, а также органосохраняющие стратегии, улучшающие качество жизни пациентов. В данной статье представлен обзор ключевых результатов восьми крупных исследований, озвученных на конгрессе ESTRO 2025, которые имеют непосредственное значение для клинической практики радиотерапевтов.
Исследование FAST-Forward: одна неделя вместо трех при лечении рака молочной железы
FAST-Forward (Великобритания) – масштабное рандомизированное исследование III фазы, включившее более 4000 пациенток с ранним раком молочной железы, которое сравнивало 3 гипофракционированнных режима (40 Гр за 15 фракций, 26 и 27 Гр за 5 фракций), – подтвердило равную эффективность и безопасность укороченного курса лучевой терапии по сравнению с традиционным. Согласно представленным 10-летним данным, пятидневный курс послеоперационного облучения (всего 1 неделя, 5 фракций, суммарная доза 26 Гр) обеспечивает такой же уровень контроля заболевания, как и стандартная трехнедельная схема (15 фракций, 40 Гр). За 10 лет локальный контроль при 40 Гр составил 3,6%, 27 Гр – 3,0%, 26 Гр – 2,0%. Долгосрочные показатели локального рецидивирования и выживаемости не отличаются между группами, а частота поздних лучевых осложнений не увеличивается при сокращении курса. Поздние осложнения со стороны нормальных тканей по данным клиницистов (оценка за 10 лет) составили: при 26 Гр – сопоставимы с 40 Гр, при 27 Гр – более высокая частота уплотнения и фиброза тканей. Эстетические результаты, сообщенные пациентом (внешний вид, отек, какие-либо симптомы): при 26 Гр – сопоставимо с 40 Гр, при 27 Гр – немного худшие результаты. Этот окончательный анализ подтверждает ранее опубликованные 5-летние результаты, которые уже привели к изменениям стандартов лечения. Таким образом, однонедельная гипофракционированная радиотерапия окончательно зарекомендовала себя как новый стандарт для большинства пациентов с ранним раком молочной железы, позволяя существенно снизить нагрузку на пациенток и систему здравоохранения без компромисса в эффективности. Ускорение лечения означает меньше визитов в клинику и больший комфорт для женщин, что особенно важно для пожилых и живущих далеко от центров пациентов, а также оказалось ценным во время пандемии COVID-19, когда стремились минимизировать время пребывания больных в стационаре.
Исследование HYPO-RT-PC: двe с половиной недели вместо восьми при лечении рака предстательной железы
HYPO-RT-PC (Швеция, группа Scandinavian) – крупное клиническое исследование (1200 пациентов, промежуточный и высокий риск локализованного рака простаты) – продемонстрировало, что двухнедельный курс радиотерапии не уступает стандартному восьминедельному по отдаленным результатам. В этом протоколе ультрагипофракционированной терапии применялось всего 7 сеансов облучения (суммарно 42,7 Гр за 2,5 недели) вместо классических 39 сеансов (78 Гр за ≈8 недель). По прошествии 10 лет наблюдения безрецидивные показатели оказались аналогичными: доля пациентов без возврата болезни и без необходимости дополнительного лечения составила 72% в группе короткого курса против 65% в группе стандартной терапии. Общая 10-летняя выживаемость практически идентична (≈81% vs 79%), а специфическая смертность от рака простаты – всего 4% в обеих группах. Важным является то, что профили побочных эффектов не различались: поздние лучевые реакции со стороны мочевого пузыря и кишечника наблюдались с сопоставимой частотой и в основном были легкой или умеренной степени. Эти результаты окончательно подтверждают, что сокращенная до 2-3 недель схема облучения простаты не ухудшает долгосрочный контроль заболевания и не повышает токсичность. Таким образом, ультрагипофракционированная лучевая терапия может быть с уверенностью предложена подходящим пациентам как более удобный и экономичный вариант лечения, позволяющий быстрее вернуться к обычной жизни без потери эффективности.
Персонализированная адъювантная терапия рака эндометрия: результаты исследования PORTEC-4a
PORTEC-4a (международное многоцентровое исследование) впервые предоставило убедительные доказательства того, что молекулярный анализ опухоли может помочь избежать лишнего облучения у части пациенток с раком эндометрия среднего риска, одновременно выявляя тех, кому необходима более интенсивная терапия. В исследование были включены 592 женщины из 8 европейских стран с опухолями промежуточного и высокого промежуточного риска после хирургического лечения. Пациенток рандомизировали на стандартный подход (назначение всем адъювантной вагинальной брахитерапии после операции) либо на персонализированное лечение на основе молекулярного профиля опухоли. В экспериментальной группе проводилось молекулярно-генетическое тестирование удаленных опухолей и в зависимости от выявленных факторов риска принималось решение: женщинам с благоприятным молекулярным профилем воздержаться от лучевой терапии, а пациенткам с неблагоприятным профилем – напротив, усилить лечение, проведя не только брахитерапию, но и наружное облучение таза.
Ключевые выводы PORTEC-4a: примерно 46% пациенток в группе с молекулярным профилированием избежали лучевой терапии вовсе, не показав ухудшения результатов (их выживаемость и контроль болезни остались отличными). Одновременно у подгруппы с неблагоприятными молекулярными особенностями была реализована стратегия усиленного облучения (лучевая терапия малого таза), что привело к значимому улучшению локорегионарного контроля: частота рецидива в этой группе составила лишь 8,4%, тогда как у схожих пациенток, пролеченных по стандарту без учета профиля (только брахитерапия), рецидивы достигали 30,5%. Таким образом, применение молекулярных маркеров позволяет четче определить необходимость лучевой терапии: почти половину больных можно безопасно избавить от облучения и потенциальных побочных эффектов, тогда как определенные неблагоприятные опухолевые профили сигнализируют о необходимости интенсификации адъювантного лечения для снижения риска возврата болезни. По словам авторов, этот подход знаменует серьезный шаг к более персонифицированной терапии рака эндометрия, при которой каждая пациентка получит ровно столько лечения, сколько требуется по биологии ее опухоли – не больше и не меньше. В перспективе такие результаты изменят клинические рекомендации, позволив многим женщинам избежать лишнего воздействия, а тем, кому грозит рецидив – получить своевременно более эффективное лечение.
Кардиосберегающая техника при лучевой терапии рака легкого: первый анализ проекта RAPID-RT
RAPID-RT (Великобритания) – новаторское исследование в области рака легкого, применяющее модель «быстрого обучения» (rapid-learning) на основе реальных клинических данных. В отличие от классических клинических исследований, которые длятся годами и включают ограниченный, строго отобранный контингент пациентов, подход rapid-learning предполагает оперативный сбор и анализ данных от всех пациентов, получающих лечение, с целью быстрого выявления эффективных изменений в терапии. В центре внимания проекта RAPID-RT – проблема защиты сердца при облучении легких. Известно, что при облучении немелкоклеточного рака легкого опухоль часто находится вблизи сердца, и значительная доза на сердечную мышцу может приводить к ухудшению выживаемости из-за поздних кардиальных осложнений. Исследователи из Манчестера, опираясь на предыдущие данные о высокой радиочувствительности верхней части сердца, внедрили в рутинную практику новую кардиосберегающую методику: ограничение дозы на критическую зону верхушки сердца (так называемая cardiac avoidance area) в пределах ≈19,5 Гр (в эквиваленте) на курс лечения, если это возможно без ущерба для полного покрытия опухоли.
В рамках RAPID-RT проанализированы данные 1708 пациентов c НМРЛ I-III стадии, получавших радикальную лучевую терапию в одном центре с января 2021 г. по февраль 2025 г. Из них 922 пациента были пролечены по стандартной технике до апреля 2023 г., а 786 пациентов – уже с применением новой кардиосберегающей методики (начиная с момента ее внедрения). Важно, что дизайн исследования максимально инклюзивный: в сбор данных включены практически все больные, проходившие лечение в этот период (лишь 1 из 786 человек возразил против использования своих данных), что позволяет оценивать эффективность нововведения на репрезентативной популяции без искусственных критериев исключения. Первоначальные результаты выглядят обнадеживающе: отмечена тенденция к повышению 12-месячной выживаемости у пациентов, лечившихся с ограничением дозы на сердце, по сравнению с исторической группой без такой техники. Иными словами, снижение лучевой нагрузки на критическую зону сердца, по предварительным данным, действительно может привести к лучшим исходам рака легкого уже через год после терапии. Оба подхода – и стандартный, и новый – показали сопоставимые показатели по локальному контролю опухоли, так как главным отличием являлась только доза на сердце.
Проект RAPID-RT продемонстрировал не только клиническую ценность самой кардиосберегающей методики, но и эффективность подхода быстрого обучения для оценки инноваций в реальном времени. Вместо того чтобы ждать несколько лет завершения рандомизированного исследования, клиницисты смогли практически сразу увидеть пользу нового подхода и оперативно скорректировать протоколы. Президент ESTRO профессор Маттиас Гуккенбергер подчеркнул, что RAPID-RT – прекрасный пример того, как современные технологии и анализ больших данных позволяют быстрее внедрять улучшения в практику: сочетание передовых техник планирования с накоплением реальных данных лечения делает радиотерапию одновременно более безопасной и более эффективной. В будущем планируется продолжение наблюдения за этой когортой: будут оценены долгосрочная выживаемость, отдаленные кардиотоксические эффекты и подтверждение статистической значимости улучшения результатов. Тем не менее, уже сейчас RAPID-RT рассматривается как важный шаг к более «умной» и всеобъемлющей оценке модификаций в лучевой терапии, особенно там, где проведение классических РКИ затруднено.
Иммунотерапия плюс радиотерапия при раке прямой кишки: результаты исследований STELLAR III и STELLAR II
STELLAR III (Китай) – крупнейшее рандомизированное исследование III фазы в области местнораспространенного рака прямой кишки, представленное на конгрессе, – показало, что сокращенный курс предоперационной терапии может улучшить отдаленные исходы по сравнению со стандартным лечением. В исследовании приняли участие 591 пациент с местнораспространенным РПК, которых рандомизировали на две неоадъювантные группы: стандартную длительную химиолучевую терапию (5-5,5 недель облучения с сопутствующей химиотерапией) против экспериментального укороченного протокола – короткий курс радиотерапии (5 фракций высокодозного облучения в течение одной недели) с последующей системной химиотерапией, после чего выполнялась хирургическая операция. Через 5 лет наблюдения выживаемость пациентов, получивших новый короткий протокол, оказалась на 8,4% выше, чем в группе стандартной химиолучевой терапии. При этом качество жизни и функция аноректальной области (контроль кишечника и др.) не отличались между группами после лечения, что свидетельствует об отсутствии добавочной токсичности у более интенсивного по времени режима. Таким образом, ускоренная комбинация короткого курса облучения с химиотерапией позволяет достичь не худших, а порой и лучших онкологических результатов, существенно сокращая продолжительность лечения перед операцией. Это приносит пользу пациентам (меньше дней терапии, но та же эффективность) и облегчает нагрузку на ресурсы клиники. Специалисты назвали результаты STELLAR III потенциально новым стандартом неоадъювантной терапии: краткая высокоинтенсивная радиотерапия в сочетании с химиопрепаратами может заменить длительную схему без ущерба для онкологического контроля. В настоящее время исследователи планируют развить этот успех – уже начаты новые протоколы, в которых к укороченной схеме добавляется иммунотерапия, чтобы проверить, улучшит ли это выживаемость еще больше и кому из пациентов такой усиленный подход дает наибольший выигрыш.
STELLAR II (Китай) – другое важное исследование, результаты которого дополняют выводы STELLAR III, – было посвящено непосредственному повышению частоты полного регресса опухоли за счет добавления иммунотерапии. В многоцентровом рандомизированном испытании фазы II/III пациенты с местнораспространенным раком прямой кишки получали стандартное неоадъювантное лечение (в данном случае использовалась схема короткого курса облучения, аналогичная вышеописанной, плюс химиотерапия), а исследуемая группа дополнительно получала иммунопрепарат синтилимаб (ингибитор PD-1). Цель состояла в том, чтобы усилить уничтожение опухолевых клеток за счет активации иммунной системы и тем самым повысить долю случаев, когда после завершения консервативного лечения в организме не остается признаков опухоли. Результаты оказались весьма впечатляющими: в группе с иммунотерапией у 45,5% пациентов опухоль полностью исчезла (достигнут полный клинико-патологический ответ), тогда как в группе без иммунопрепарата такой полный эффект наблюдали лишь у 25% больных. Иначе говоря, добавление ингибитора PD-1 почти удвоило вероятность полного излечения опухоли до операции. Хотя на фоне иммунотерапии отмечалось несколько больше побочных эффектов, в целом токсичность оставалась управляемой и приемлемой. Подобный скачок результатов потенциально означает, что значительно большее число пациентов сможет избежать травматичной хирургической операции вообще – ведь если опухоль полностью регрессировала в ответ на консервативное лечение, можно перейти к стратегии наблюдения (watch and wait) вместо непосредственной резекции прямой кишки. Исследование STELLAR II продолжается на этапе III фазы для оценки влияния такого комбинированного подхода на долгосрочную выживаемость. Если преимущества подтвердятся, это ознаменует новую эру органосохраняющего лечения при раке прямой кишки: комбинированная радиохимиоиммунотерапия перед операцией может повысить излечиваемость и позволить максимуму пациентов сохранить орган, избегая снижения качества жизни, связанного с радикальными операциями (стомой, функциональными нарушениями и т.д.).
Комбинация дурвалумаба с лучевой терапией: исследование PRIME-RT при раке прямой кишки
PRIME-RT (Великобритания) – пилотное исследование II фазы, представившее альтернативный взгляд на сочетание иммунотерапии с лучевой терапией при раке прямой кишки. В отличие от китайских работ STELLAR, в которых иммунопрепарат добавлялся к стандартному курсу в рамках больших испытаний, проект PRIME-RT проводился на базе нескольких клиник Великобритании и включил всего 46 пациентов с местнораспространенным РПК – однако получил очень ценные предварительные данные. Все пациенты получали расширенный неоадъювантный курс лечения, сочетавший лучевую терапию и иммунопрепарат дурвалумаб (ингибитор PD-L1) перед операцией. При этом применяли либо короткий 5-дневный курс облучения, либо классическую длительную химиолучевую терапию – с одинаковым иммунным препаратом, что позволило оценить, какой режим лучше сочетается с иммунотерапией. Через 6 месяцев после завершения лечения было проведено тщательное обследование: оказалось, что у 52% пациентов достигнут полный ответ и они смогли перейти на тактику наблюдения вместо немедленной хирургии. Особо впечатляющими были результаты в подгруппе больных, получивших короткий курс облучения + дурвалумаб: там полный регресс опухоли наблюдался у 67% пациентов. Это намного выше, чем исторические показатели ответов при стандартных подходах, и указывает на сильный синергизм короткого гипофракционированного облучения с иммунотерапией. В группе с длительной химиолучевой терапией и дурвалумабом доля полных ответов была ниже: для сравнения, общая комбинированная цифра по исследованию 52% достигается именно благодаря превосходному результату в подгруппе с коротким курсом.
По словам руководителя исследования профессора Кэмпбелла Роксбурга (Глазго), хотя выборка была небольшой, результаты обнадеживают: похоже, что добавление дурвалумаба способно значительно увеличить вероятность уничтожения опухоли до операции, особенно на фоне короткой интенсивной радиотерапии. Это может означать, что часть пациентов вовсе избавится от необходимости хирургической резекции, если подтвердить стойкость ответа со временем. Разумеется, такие выводы требуют проверки в более масштабных исследованиях – сейчас планируются дальнейшие испытания, чтобы выяснить, почему одни опухоли отвечают лучше других и как оптимально комбинировать иммунопрепараты с тем или иным режимом облучения. Цель дальнейших работ – разработать более персонализированный подход в неоадъювантной терапии рака прямой кишки, позволяющий максимизировать органосохранение без компромисса в онкологических исходах. Если удастся подтвердить нынешние результаты на больших выборках, это может заметно изменить стандарты лечения: комбинация лучевой терапии с иммунными агентами станет эффективной альтернативой хирургии у определенной категории больных, еще раз подчеркнув ключевую роль радиотерапии в органосохраняющем лечении рака прямой кишки.
Органосохраняющее лечение раннего рака прямой кишки: данные исследования STAR-TREC
STAR-TREC (международное исследование, Европа) – первое в своем роде рандомизированное исследование, которое напрямую сравнило стандартную операцию и консервативные органосохраняющие методики у пациентов с ранними стадиями рака прямой кишки. Традиционно даже при относительно начальных формах РПК стандартом считалась радикальная хирургия (тотальная мезоректумэктомия), включающая удаление прямой кишки с мезоректумом. Несмотря на эффективность в отношении контроля болезни, такая операция нередко ведет к тяжелым последствиям: нарушению функции кишечника (недержание кала), сексуальной дисфункции, а у значительной доли пациентов формируется постоянная стома, резко снижающая качество жизни. В последние годы в онкологии возникла идея отсроченного хирургического вмешательства или отказа от него у тех больных, у которых после неоадъювантной химиолучевой терапии достигнут полный регресс опухоли (подход watch-and-wait). Однако ранее отсутствовали проспективные данные высокого уровня для поддержки такой тактики на ранних стадиях рака прямой кишки. Исследование STARTREC восполнило этот пробел: в нем участвовали 344 пациента с опухолями ранней и средней стадии, которых рандомизировали на разные варианты предоперационного лечения: либо стандартная немедленная хирургия (после минимальной предоперационной терапии), либо один из органосохраняющих протоколов – короткий курс облучения (5 фракций высоких доз за неделю) или классический длительный курс химиолучевой терапии (25 фракций с химиотерапией). В органосохраняющих ветвях после лучевой терапии пациенты наблюдались: операция выполнялась только при наличии остаточной или продолжающей расти опухоли, иначе хирургического вмешательства избегали. Через 1 год после начала лечения были подведены первые итоги. Ключевой показатель – доля пациентов, которым удалось избежать радикальной операции благодаря полному либо почти полному регрессу опухоли. В группе длительной химиолучевой терапии без операции таких больных оказалось 80%: подавляющему большинству удалось сохранно провести год без признаков прогрессирования, не прибегая к хирургии. В группе короткого курса облучения органосохранение удалось удержать у 61% пациентов, что хоть и ниже, но тоже весьма значимо. Оба примененных консервативных подхода показали высокую эффективность и при этом хорошую переносимость: серьезных острых осложнений не отмечено, токсичность была минимальной. Проще говоря, если после лучевой (или химиолучевой) терапии опухоль исчезла, то многих больных можно наблюдать без немедленной операции, тщательно отслеживая возможное возвращение болезни.
STAR-TREC уже сейчас называют исследованием, меняющим правила игры. Впервые получено прямое подтверждение, что подход «сначала радиотерапия – потом по необходимости хирургия» может соперничать с операцией по онкологическим результатам у отобранных пациентов. Это открывает путь к более щадящему и пациентоориентированному лечению: сохранение органа означает сохранение функции кишечника и избежание стомы, что кардинально улучшает качество жизни вылеченных от рака людей. Безусловно, требуется длительное наблюдение за участниками (будут оцениваться многолетние показатели локального контроля, выживаемости и др., а при признаках регресса заболевания пациентам проведут спасительную операцию). Тем не менее, уже накопленных данных достаточно, чтобы инициировать пересмотр клинических рекомендаций: органосохраняющий подход может стать обоснованной опцией для пациентов с ограниченными формами рака прямой кишки, особенно учитывая те тяжелые последствия, которых удается избежать. В совокупности с успехами добавления иммунотерапии (STELLAR, PRIME-RT) исследование STAR-TREC отражает всё больший фокус современной радиотерапии на органосбережение – стремление не только вылечить рак, но и по возможности сохранить органы и функции пациента.
Снижение дозы лучевой терапии при раннем раке анального канала: результаты исследования PLATO-ACT4
PLATO-ACT4 (Великобритания) – важное клиническое исследование, меняющее стандарты лечения рака анального канала начальных стадий. Программа PLATO включала серию исследований, нацеленных на персонализацию доз лучевой терапии при плоскоклеточном раке анального канала в зависимости от распространенности процесса. В рамках испытания ACT4 оценивалась целесообразность снижения суммарной дозы при раннем (T1-T2N0) раке анального канала. Стандартная химиолучевая терапия плоскоклеточного рака ануса на протяжении последних десятилетий предполагала дозу облучения ≈50,4 Гр на опухоль (по 1,8 Гр × 28 фракций) в сочетании с химиопрепаратами (митомицин C + фторопиримидины). Это обеспечивало высокий процент излечения, однако сопровождалось значительной острой токсичностью (проктиты, дерматиты) и не исключало долгосрочных функциональных нарушений. При небольшом объеме опухоли врачи задавались вопросом: можно ли вылечить ее меньшей дозой и, соответственно, с меньшими побочными эффектами? Исследование ACT4 стало первым рандомизированным испытанием, проверившим этот подход.
В ACT4 включили 160 пациентов с ранним раком анального канала. Все получили стандартную сопутствующую химиотерапию (митомицин C однократно + капецитабин ежедневно на период облучения), но лучевая терапия различалась: две трети пациентов были рандомизированы в группу пониженной дозы (dosereduced IMRT), где суммарная очаговая доза составила 41,4 Гр (за 23 фракции), тогда как треть больных получила стандартную дозу 50,4 Гр (28 фракций). Оценивались как онкологические исходы, так и качество жизни. Полученные результаты подтвердили, что снижение дозы не приводит к ухудшению контроля опухоли. 3-летняя безрецидивная выживаемость (отсутствие локорегионального отказа лечения) составила 87,6% в группе сниженной дозы против 83,6% при стандартной схеме – тем самым достигнут критерий non-inferiority (нижняя граница доверительного интервала для экспериментальной группы выше заданного порога 80%). 3-летняя общая выживаемость при сниженной дозе даже оказалась несколько выше: 98,1% против 92,6% (разница, возможно, случайна из-за небольшого размера выборки, но в любом случае выживаемость превосходная в обеих группах). Важно подчеркнуть, что ни в одной из групп не отмечено изолированных рецидивов в регионарных лимфоузлах, несмотря на то, что профилактическая доза на зоны лимфооттока была ниже в экспериментальной группе (34,5 Гр vs 40 Гр). Таким образом, уменьшение дозы не скомпрометировало эффективность лечения раннего рака анального канала.
Что касается переносимости, то выигрыш в снижении токсичности также был продемонстрирован. По данным опросников качества жизни, суммарное ухудшение самочувствия и функций кишечника в остром периоде было сходным в обеих группах, но уже к 6-му месяцу после лечения показатели вернулись к исходному уровню. При этом отмечено различие в восстановлении половой функции: в группе сниженной дозы пациенты восстановили половую активность к тому же 6-месячному сроку, тогда как в группе стандартной дозы сексуальная функция оставалась сниженной по сравнению с исходным уровнем. Это свидетельствует в пользу более щадящего влияния низкодозового режима на деликатные структуры, отвечающие за качество жизни. Исходя из совокупности данных, авторы делают вывод, что сокращенная доза (41,4 Гр) при T1- T2N0 раке анального канала в сочетании с химиотерапией достаточна для достижения высоких показателей излечения, но при этом обеспечивает лучшую переносимость. Такой режим позволяет снизить нагрузку на пациентов и систему здравоохранения (меньше сеансов облучения, меньше побочных эффектов), не жертвуя контролем над опухолью. Результаты ACT4 уже опубликованы в The Lancet Oncology и, как отмечалось на ESTRO 2025, должны быть учтены в клинических рекомендациях. Дозосберегающий режим IMRT можно рассматривать как новый стандарт лечения ранних стадий рака анального канала – особенно у пациентов с положительным по p16 статусом опухоли (большинство участников исследования были p16-позитивными, что характерно для этиологии, связанной с вирусом папилломы человека). Это значительное достижение демонстрирует, что современная лучевая терапия становится всё более узконаправленной и щадящей, подстраиваясь под характеристики опухоли ради сохранения качества жизни пациентов.
В заключение, конгресс ESTRO 2025 подтвердил статус лучевой терапии как одного из наиболее динамично развивающихся направлений онкологии. Представленные исследования показали, как пересмотр привычных подходов – будь то сокращение длительности лечения или снижение дозы, добавление новых препаратов или новых технологий планирования – позволяет значительно улучшить исходы для пациентов. Гипофракционированные режимы при раке молочной железы и простаты уже стали новой нормой, подтвержденной долгосрочными данными. Персонализированные решения на основе биологии опухоли (как в PORTEC4a) помогают избежать избыточного лечения и сконцентрироваться на тех, кто в нем действительно нуждается. Комбинация радиотерапии с иммунотерапией и химиотерапией (исследования STELLAR, PRIME-RT) прокладывает путь к органосохраняющему лечению даже при распространенных опухолях, расширяя шансы пациентов на жизнь без инвалидизирующих операций. Одновременно технический прогресс (пример RAPID-RT) и оптимизация доз (ACT4) повышают безопасность и эффективность лучевой терапии, уменьшая ее побочные эффекты. Все эти достижения, представленные на ESTRO 2025, найдут отражение в клинических рекомендациях и повседневной практике лучевых терапевтов, приближая нас к цели – максимально эффективному и гуманному лечению рака.
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / 9MW2821 – НОВЫЙ КОНЪЮГАТ К NECTIN-4 – СРЕДИ ПАЦИЕНТОВ С РАСПРОСТРАНЕННЫМИ СОЛИДНЫМИ ОПУХОЛЯМИ: МНОГОЦЕНТРОВОЕ ИССЛЕДОВАНИЕ I/II ФАЗЫ
Автор: Исраелян Эдгар Рудикович
Врач-онколог отделения противоопухолевой лекарственной терапии
ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина»
Минздрава России, Москва
Многие из нас еще даже «не держали в руках» энфортумаб ведотин (EV), как уже китайские коллеги представили новую молекулу – 9MW2821 – конъюгат антитела к Nectin-4 с цитостатиком ММАЕ, отличием которого от EV является новый линкер (IDconnect, предназначенный для формирования сайт-специфичных дисульфидных связей).
Безопасность и переносимость (первичные конечные точки) вышеуказанного конъюгата изучены в исследовании I/II фазы среди пациентов с диссеминированным уротелиальным раком, раком шейки матки, раком пищевода и трижды негативным РМЖ, у которых отмечено прогрессирование после ≥1 линии стандартной терапии. Вторичные конечные точки – частота объективных ответов, длительность ответа (ДО), ВБП и ОВ.
В исследование включено 274 пациента, при медиане наблюдения 8,6 мес.:
- у 97,4% пациентов отмечено ≥1 НЯ; наиболее часто – гематологическая токсичность, гепатотоксичность, сенсорная нейропатия;
- НЯ 3 степени, связанные с лечением, отмечены у 57,7%; привели к прекращению терапии у 3,9% больных (наиболее часто сенсорная нейропатия 1,6%);
- не отмечено интерстициального поражения легких;
- преимущественному большинству пациентов терапия проведена в дозе 1,25 мг/кг;
- когорта пациентов с УР (n=37): ЧОО – 54,1%, частота контроля над заболеванием – 91,9%; медиана ДО – 7,8 мес., медиана ВБП – 7,4 мес., медиана ОВ – 14,6 мес.;
- когорта пациенток с РШМ (n=53): ЧОО – 32,1%, частота контроля над заболеванием – 81,1%; мДО – 6,3 мес., мВБП – 3,9 мес., мОВ – 16 мес.;
- корта пациенток с ТНРМЖ (n=20): ЧОО – 50%, частота контроля над заболеванием – 80%; мДО – 4 мес., мВБП – 5,8 мес., мОВ – 12,2 мес.;
- самые скромные результаты получены при раке пищевода (n=43): ЧОО – 14%, частота контроля над заболеванием – 67,4%; мДО – 4 мес., мВБП – 3,7 мес., мОВ – 8,2 мес.
- Интересен тот факт, что эффективность 9MW2821 не зависела от экспрессии Nectin-4.
Рисунок 1.
Основные результаты исследования по локализациям опухоли
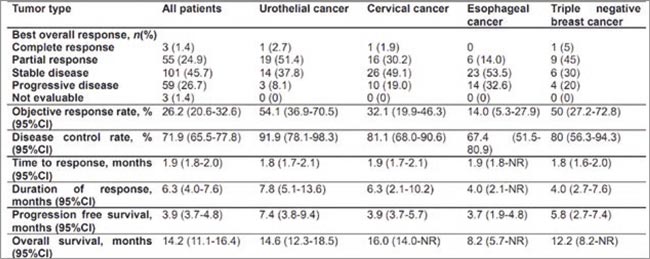
На довольно предлеченной азиатской популяции пациентов новый конъюгат продемонстрировал обнадеживающие результаты и приемлемую токсичность в сравнении с другими агентами, основанными на ММАЕ, особенно у пациентов с мУР. Начаты исследования II и III фаз в различных нозологиях (мУР, мРШМ, мТНРМЖ) с данным препаратом. Нам остается лишь ждать результаты и надеяться, что в европейской популяции препарат сработает так же.
Источник:
Zhang J, et al. 9MW2821, a next-generation Nectin-4 targeting antibody-drug conjugate, in patients with advanced solid tumors: a first-inhuman, open label, multicenter, phase I/II study. Annals of Oncology. Articles in Press, April 25, 2025.
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / POSEIDON TRIAL: ДУРВАЛУМАБ/ ТРЕМЕЛИМУМАБ ЭФФЕКТИВЕН ПРИ ВЫСОКОЙ TMB
Автор: Фатеева Анастасия Валерьевна
Заместитель главного врача по медицинской части
ГБУЗ «Приморский краевой онкологический диспансер»,
член общества RUSSCO, член ESMO, секретарь
регионального общества RUSSCO, Владивосток
В исследовании III фазы POSEIDON (NCT03164616) тремелимумаб в первой линии + дурвалумаб и химиотерапия на основе платины продемонстрировали статистически значимое улучшение PFS (HR 0,72; 95% ДИ 0,60-0,86) и OS (HR 0,77; 95% ДИ 0,65-0,92) по сравнению с монотерапией у пациентов с EGFR/ALK мНМРЛ дикого типа. На основании этих результатов тремелимумаб + дурвалумаб и химиотерапия были одобрены для лечения пациентов с мНМРЛ в первой линии.
Мутационная нагрузка опухоли (TMB), определяемая как количество соматических мутаций, присутствующих в ДНК, полученной из крови (bTMB) или ткани опухоли (tTMB), имеет потенциал в качестве прогностического биомаркера эффективности иммунотерапевтического лечения, в частности, при комбинированной терапии анти-PD-(L) 1 + анти-CTLA-4, независимо от экспрессии PD-L1. TMB является суррогатом неоантигенной нагрузки опухоли, и ранее было показано, что экспрессия TMB и PD-L1 являются независимыми прогностическими переменными в отношении ответа на иммунотерапию.
По данным метаанализов было показано, что у пациентов с НМРЛ с высоким уровнем TMB иммунотерапия была связана с улучшением PFS, OS и ORR по Рисунок 1. Графики Каплана-Майера общей выживаемости по группам лечения и высокому/низкому статусу TMB в крови: A) в подгруппе bTMB ≥20 mut/Mb и B) в подгруппе bTMB <20 mut/Mb сравнению с только химиотерапией.
Рисунок 1.
Графики Каплана-Майера общей выживаемости по
группам лечения и высокому/низкому статусу TMB в крови:
A) в подгруппе bTMB ≥20 mut/Mb и B) в подгруппе bTMB <20
mut/Mb
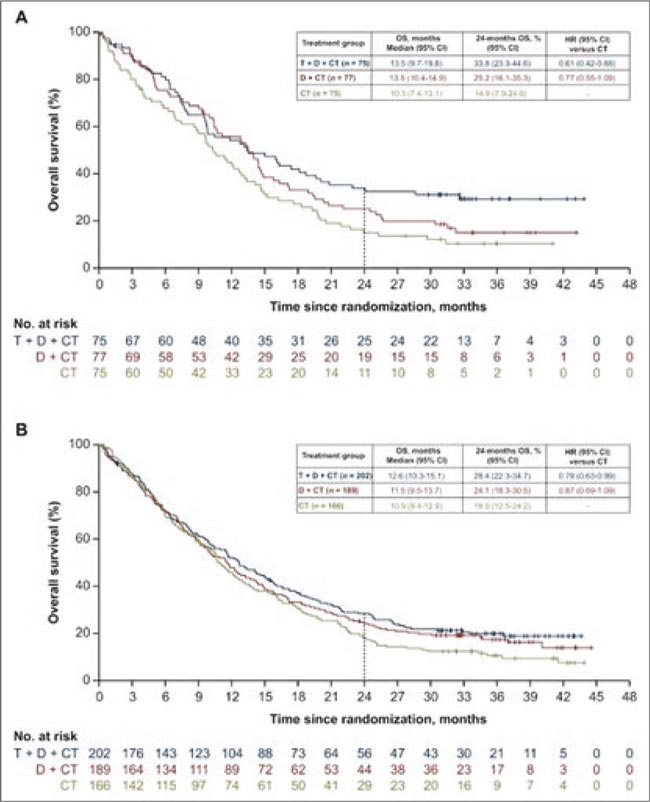
В ESMO Open опубликован подгрупповой анализ исследования POSEIDON, в котором оценили эффективность дурва/треме в зависимости от пороговых значений bTMB и tTMB.
Результаты:
- Образцы плазмы до начала лечения были получены от 958/1013 (94,6%) рандомизированных пациентов из популяции ITT.
- 784/958 образцов (81,8%) были исследованы на наличие bTMB, в том числе 277 в группе T+D+ХT, 266 в группе D+ХT и 241 в группе ХT.
- Образцы тканей, взятые до лечения для оценки tTMB, были доступны у 895/1013 рандомизированных пациентов из популяции ITT.
- У 545/895 (60,9%) образцов, из которых можно было определить наличие tTMB, в том числе у 184 в группе T+D+ХT, у 191 в группе D+ХT и у 170 в группе ХT.
- Анализ OS для группы T+D+ХT по сравнению с группой ХT показал, что при каждом снижении уровня bTMB величина преимущества OS казалась большей среди пациентов в подгруппах с высоким уровнем bTMB, чем в подгруппах с низким уровнем bTMB.T+D+ХT по сравнению с ХT, как в подгруппе bTMB ≥20 mut/Mb (mOS 13,5 vs 10,3 мес.; HR 0,61), так и в подгруппе bTMB <20 mut/ Mb (mOS 12,6 vs 10,9 мес.; HR 0,79).
- Кроме того, более высокий bTMB был связан с улучшением OS и PFS и в подгруппах с PD-L1 <1% или ≥1% для групп T+D+ХT и D+ХT по сравнению с группой ХT.
- Частота объективных ответов также была выше в группе T+D+ХT по сравнению с группой ХT в обеих группах bTMB ≥20 и <20 mut/Mb (42,7% vs 21,3% и 38,3% vs 23,8% соответственно).
- В рамках исследования tTMB на момент прекращения данных первичного анализа OS аналогичное преимущество OS в группах T+D+ХT и D+ХT по сравнению с группой ХT наблюдалось в популяциях tTMB (HR 0,79 и 0,76 соответственно) и ITT (HR 0,77 и 0,86 соответственно).
- Анализ OS при пороговых значениях tTMB 10, 13 и 16 mut/Мб показал, что OS для группы T+D+ХT по сравнению с группой ХT в подгруппах с высоким и низким tTMB при каждом пороге составил 0,63 по сравнению с 0,94 (95% ДИ 0,70-1,27); 0,53 по сравнению с 0,90 и 0,43 (95% ДИ 0,24-0,79) против 0,90 соответственно. Кроме того, медиана OS в группе T+D+ХT увеличивалась с увеличением пороговых значений для tTMB-high, но не увеличивалась в группе ХT.
Таким образом, результаты этого исследования хоть и демонстрируют тот факт, что комбинированная терапия улучшает исходы при высокой TMB, однако на сегодняшний день рутинное тестирование на TMB, как признают сами авторы, все еще неоправданно. Тем не менее, в своем анализе исследователи продемонстрировали, что TMB и PDL-1 могут коррелировать (низкий TMB = низкая экспрессия PDL-1 и наоборот), что делает TMB также значимым предиктором оценки на иммунотерапию.
Источник:
Peters S, et al. Durvalumab with or without tremelimumab in combination with chemotherapy in first-line metastatic non-small-cell lung cancer: outcomes by tumor mutational burden in POSEIDON. ESMO Open. Vol.10, Iss. 5, 105058.
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / КЛИНИКО-МОЛЕКУЛЯРНЫЙ ПРОФИЛЬ И ЭФФЕКТИВНОСТЬ АНТИ-HER2 ТЕРАПИИ ПРИ HER2-АМПЛИФИЦИРОВАННОМ РАКЕ БИЛИАРНОГО ТРАКТА
В Journal of Clinical Oncology опубликован объединенный анализ исследований SCRUM-Japan GOZILA и MONSTAR-SCREEN, в котором авторы оценили молекулярный профиль у пациентов с метастатическим раком желчных путей с амплификацией HER2, а также эффективность анти-HER2 терапии для этой когорты больных и её влияния на общую выживаемость.
Из 439 пациентов, включенных в исследования, 43 имели амплификацию HER2. В HER2- позитивной когорте с помощью NGS были выявлены наиболее частые мутации: TP53, BRAF. При этом мутации KRAS были обнаружены у 22% пациентов без амплификации HER2, но отсутствовали у пациентов с амплификацией HER2 (р<0,001).
Разницы в ОВ в позитивных и негативных когортах не было: медиана ОВ – 17,7 мес. (95% ДИ 11,8-24,6) у пациентов с амплификацией HER2 и 16,9 мес. (95% ДИ 15,6-19,3) у пациентов без амплификации HER2, что свидетельствует о том, что HER2- амплификация сама по себе не является прогностическим фактором, влияющим на ОВ. Тем не менее, добавление антиHER2 терапии оказало позитивное влияние на ОВ в когорте HER2-позитивных пациентов: мОВ пациентов, получавших анти-HER2 терапию, составила 24,3 мес., что было значительно дольше, чем у пациентов, не получавших анти-HER2 терапию – 12,1 мес. (HR 0,39; 95% ДИ 0,23- 0,82; p=0,011). ORR и DCR составили 34% и 76% соответственно; мВБП – 6,6 мес. (95% ДИ 4,2-7,1). На сегодняшний день в рекомендациях RUSSCO достаточно подробно описано о необходимости определения HER2-статуса у пациентов с метастатическим раком билиарного тракта. Несмотря на то, что применение анти-HER2 терапии в I линии сегодня рутинно не проводится для этой когорты пациентов, вопрос о персонализированном подходе ко II линии актуален.
Источник:
Рисунок 1.
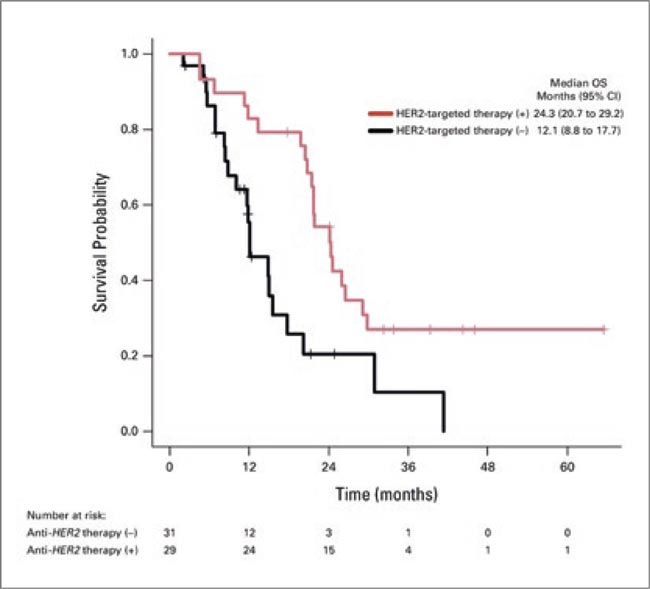
Kanae Inoue, et al. Clinicomolecular Profile and Efficacy of Human Epidermal Growth Factor Receptor 2 (HER2)-Targeted Therapy for HER2-Amplified Advanced Biliary Tract Cancer. JCO Precis Oncol. 2025; 9: e2400718. doi: 10.1200/PO-24-00718.
Материал подготовила А.В. Фатеева
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / СТАРАЯ ДОБРАЯ МАГНЕЗИЯ
Автор: Деньгина Наталья Владимировна
Заведующая радиологическим отделением
ГУЗ «Областной клинический онкологический диспансер»,
директор Центра лучевой терапии «R-Spei»,
член правления RUSSCO, главный редактор Газеты RUSSCO
и сайта RosOncoWeb, кандидат медицинских наук,
Ульяновск
Одна из наиболее читаемых публикаций журнала JAMA на прошлой неделе – статья американских авторов о роли внутривенного введения магнезии для снижения платина-ассоциированной токсичности со стороны почек. Острое повреждение почек является довольно частым осложнением химиотерапии цисплатином, порой приводящим к смерти пациента. Оно повышает восприимчивость и к внепочечным побочным эффектам цисплатина и других выводимых почками химиотерапевтических препаратов, а также ставит под угрозу возможность дальнейшего применения цисплатина и других выводимых почками препаратов, особенно когда повреждение почек необратимо. Было Рисунок 1. Частота острого повреждения почек или смерти у пациентов, получавших магнезию и не получавших, анализ по подгруппам продемонстрировано, что профилактическое в/в введение магния ослабляет почечную токсичность на животных моделях, однако его влияние у людей не было оценено надлежащим образом.
Рисунок 1.
Частота острого повреждения почек или смерти у пациентов, получавших магнезию
и не получавших, анализ по подгруппам
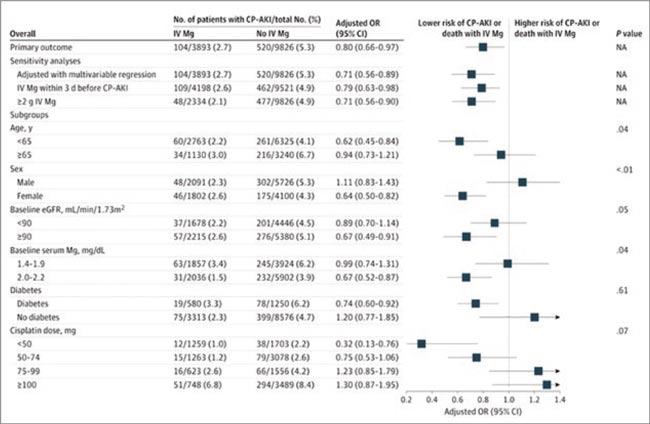
Это когортное исследование проводилось в 5 крупных онкологических центрах США и включало взрослых пациентов со злокачественными опухолями, получавшими ХТ, которым в период с 2006 по 2022 год была введена первая доза цисплатина внутривенно. Анализ данных проводился с февраля по декабрь 2024 года. Сравнение проводилось между двумя группами: получавшие в/в магнезию с 1 дня на фоне цисплатина или нет. Цисплатин-ассоциированная токсичность определялась как 2-кратное или более увеличение уровня креатинина в сыворотке от исходного уровня или получение заместительной почечной терапии в течение 14 дней после первой дозы внутривенного цисплатина. Модели были скорректированы с учетом демографических данных, сопутствующих заболеваний, лабораторных показателей, получения сопутствующей нефротоксической противораковой терапии, места, года введения цисплатина и дозы цисплатина.
В исследование было включено в общей сложности 13719 пациентов (медиана возраста 59 [49-67] лет), из которых 3893 (28,4%) получили внутривенно магнезию в первый день химиотерапии цисплатином. Средняя доза внутривенного магния составила 2 (1-2) г. В итоге магнезия снизила риск значимых НЯ со стороны почек на 20%: НЯ в виде ассоциированной с цисплатином почечной токсичности или смерти произошли у 104 из 3893 пациентов (2,7%), которые получили внутривенный магний, и у 520 из 9826 (5,3%), которые не получили его (скорректированное отношение шансов 0,80; 95% ДИ 0,66-0,97). Пациенты с eGFR 90 мл/мин/1,73 м2 или выше и более высокими исходными значениями сывороточного магния (например, 2,0-2,2 мг/дл), по-видимому, больше всего выиграли от внутривенного введения магнезии. Женщины и пациенты моложе 65 лет также имели больше преимуществ от профилактики магнием, чем мужчины и пожилые пациенты. Результаты были схожими по ряду анализов чувствительности и по вторичным конечным точкам, включая НЯ со стороны почек через 90 дней.
Это многоцентровое когортное исследование показало, что профилактическое внутривенное введение магния перед началом лечения цисплатином – безопасная, простая и недорогая процедура – снижает риск ассоциированной с ним почечной токсичности по сравнению с теми пациентами, кто не получал магний. Для подтверждения этих результатов необходимы рандомизированные клинические испытания, но ничего не мешает применять этот доступный препарат уже сейчас.
Источник:
Gupta S, Glezerman IG, Hirsch JS, et al. Intravenous Magnesium and Cisplatin-Associated Acute Kidney Injury. JAMA Oncol. Published online: April 24, 2025. doi:10.1001/jamaoncol.2025.0756.
Материал подготовила Н.В. Деньгина
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / НИРАПАРИБ + АБИРАТЕРОНА АЦЕТАТ (АА) В ПЕРВОЙ ЛИНИИ МКРРПЖ: ФИНАЛЬНЫЕ ДАННЫЕ ИССЛЕДОВАНИЯ MAGNITUDE
До сих пор не утихают споры о том, кому же в большей степени показана комбинация PARPингибитора и антиандрогена – всем пациентам либо только с мутацией в генах HRR, либо вовсе ограничиться больными с мутацией BRCA1/2. Особенностью исследования MAGNITUDE является распределение больных в заведомо определенные когорты: HRR-дефицитную и HRR-профицитную, вторая закрыта в 2022 году по решению IMDC.
Ранее уже продемонстрировано преимущество в рВБП (первичная конечная точка) в группе PARPi + АА в когорте HRRmut по сравнению с монотерапией АА, а сейчас представлены данные и по важным вторичным конечным точкам – ОВ, время до симптомного прогрессирования и время до инициации ХТ. В анализ включено 423 пациента (53% с мутациями BRCA1/2). Группы сбалансированы по основным характеристикам, но неблагоприятные прогностические факторы (пожилой возраст, метастатическое поражение костей и висцеральных органов) превалировали в группе комбинации.
Рисунок 1.
Общая выживаемость в HRR+ популяции (А) и в подгруппе с BRCA1/2 мутациями
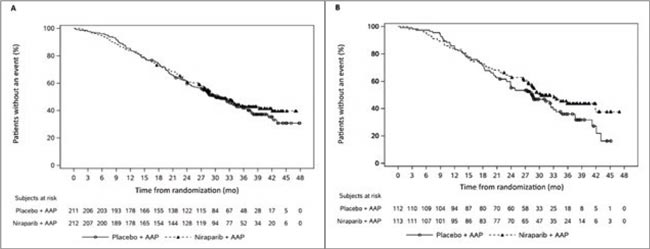
При медиане наблюдения 37,3 мес. отмечено:
- большее число пациентов в контрольной группе получило последующее лечение (52,1% vs 38,7%), последующая терапия PARPi проведена 13,7% в группе монотерапии АА и 1,9% в группе комбинации;
- ! ОВ не различалась между группами (HR 0,93; p=0,585); отмечен тренд в сторону улучшения ОВ в подгруппе BRCA1/2mut, получивших комбинацию (HR 0,78; p=0,183);
- при использовании IPCW анализа (поправка по последующим линиям терапии) ОВ в группе комбинации выше, чем в контрольной (HR 0,71; p=0,031) для когорты HRRпозитивных пациентов;
- при поправке по исходным прогностическим факторам отмечен тренд в сторону большей эффективности комбинации в HRR-позитивной популяции (HR 0,785; p=0,066) и достоверное преимущество для BRCA1/2mut когорты (HR 0,663; p=0,024);
- время до симптомного прогрессирования не достигнуто в группе PARPi и АА и составило 30,6 мес. в группе монотерапии (р=0,0002);
- время до инициации ХТ также не достигнуто в группе комбинации и составило 35,8 мес. в группе монотерапии (р=0,022).
При финальном анализе данной работы не отмечено преимущества комбинации в отношении ОВ. Сами исследователи предположили, что на это могли повлиять как исходные неблагоприятные факторы, так и последующие линии терапии. Проведение анализов ОВ с поправкой на эти факторы продемонстрировало тренд в сторону лучших результатов в группе комбинации. Должен ли подобный результат лимитировать нас в использования комбинации в 1-й линии мКРРПЖ? Нет! А тестировать пациентов на мутации в системе HRR точно следует.
Источник:
Chi Kim N, et al. Niraparib and Abiraterone Acetate plus Prednisone in Metastatic Castration-resistant Prostate Cancer: Final Overall Survival Analysis for the Phase 3 MAGNITUDE Trial. European Urology Oncology. Articles in Press: May 05, 2025.
Материал подготовил Э.Р. Исраелян
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / ХОЛЕСТЕРИН ПРОТИВ ИММУНИТЕТА: КАК ОПУХОЛЬ УСКОЛЬЗАЕТ ОТ ТЕРАПИИ
Недавняя статья в журнале Experimental & Molecular Medicine (12.05.2025) привлекла внимание многих исследователей и специалистов по лечению колоректального рака.
Рисунок 1.
Индуцированный лучевой терапией биосинтез
холестерина ингибирует активацию cGAS–STING
и способствует резистентности колоректального рака
к лечению
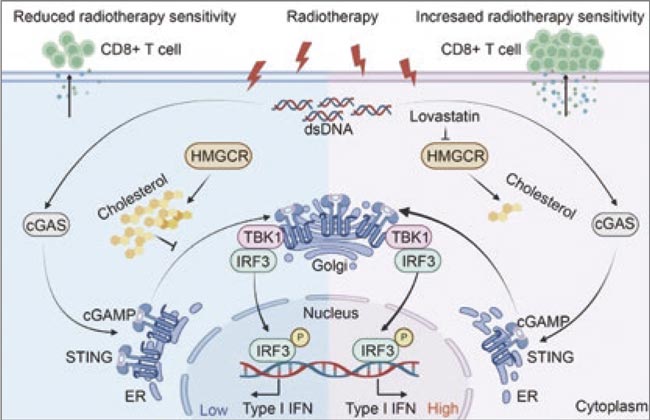
Исследователи выявили новый механизм резистентности колоректального рака (КРР) к лучевой терапии (ЛТ):
- облучение индуцирует синтез холестерина в опухолевых клетках;
- холестерин ингибирует активацию пути cGAS–STING, критически важного для запуска противоопухолевого иммунного ответа;
- в результате – снижение инфильтрации CD8+ Т-клеток, ослабление иммунитета и снижение эффективности ЛТ.
Клиническая корреляция заключается в следующем: пациенты с высоким уровнем HMGCR и холестерина хуже отвечают на ЛТ. Их опухоли менее инфильтрированы CD8+ Т-клетками.
Однако было предложено решение: ингибитор HMGCR ловастатин восстанавливает активацию cGAS– STING, усиливает иммунный ответ и делает опухоли чувствительнее к облучению.
В доклинических моделях было показано:
- снижение роста опухоли;
- рост CD8+ инфильтрации;
- синергия с ЛТ без дополнительных токсичностей.
Авторы пришли к выводу, что комбинация статинов и ЛТ может стать новым направлением терапии КРР. Путь открыт для клинических испытаний.
Источник:
Zhu L, Tang Z, et al. Cholesterol biosynthesis induced by radiotherapy inhibits cGAS–STING activation and contributes to colorectal cancer treatment resistance. Exp Mol Med. 2025. doi: 10.1038/s12276-025- 01457-6.
Материал подготовил А. Черчик
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / ИССЛЕДОВАНИЕ INDIGO: ВОРАСИДЕНИБ ЗАМЕДЛЯЕТ РОСТ МУТАНТНЫХ ГЛИОМ GRADE 2 С IDH-МУТАЦИЕЙ
Глиомы Grade 2 с мутацией в гене IDH1 или IDH2 — это медленно растущие инфильтративные опухоли головного мозга у взрослых. У многих пациентов без признаков высокого риска (например, без усиления контраста на МРТ) лечение откладывают, отдавая предпочтение подходу наблюдения и выжидания, чтобы избежать долгосрочных последствий химио- и радиотерапии. Ворасидениб — пероральный ингибитор, который проходит через гематоэнцефалический барьер и блокирует мутантные ферменты IDH1/2, снижающие клеточную дифференцировку через выработку онкометаболита 2-гидроксиглутарата. В проспективном рандомизированном исследовании INDIGO (фаза 3) приняли участие пациенты с остаточными или рецидивирующими глиомами 2 степени после операции, которые ранее не получали дополнительного лечения; всего 331 пациент были рандомизированы в группу ворасидениба или плацебо.
Рисунок 1.
ВПБ и наиболее частые НЯ в группах
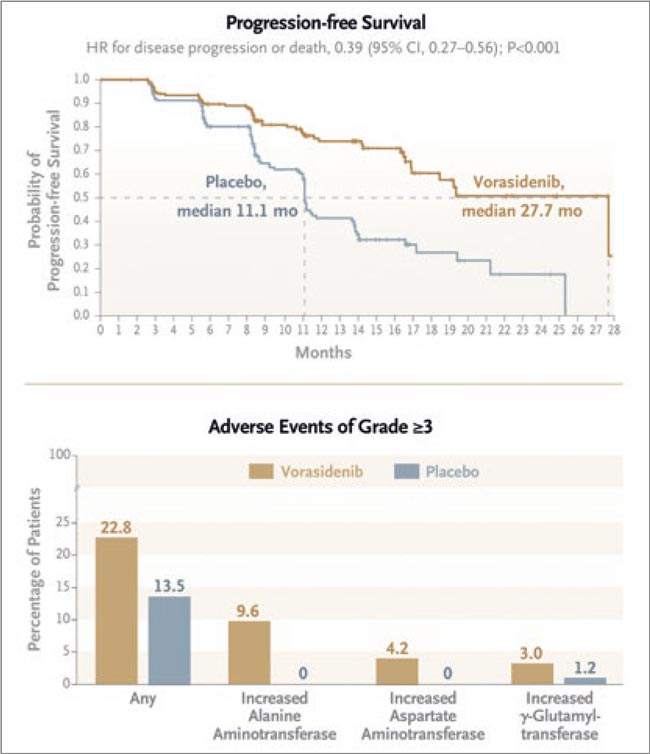
Результаты:
- Медиана выживаемости без прогрессирования (ВБП): 27,7 месяца в группе ворасидениба против 11,1 месяца в группе плацебо. Также было существенно отсрочено начало следующего этапа терапии (ХТ/ ЛТ/повторная операция).
- Побочные эффекты ворасидениба в целом были умеренными. Нежелательные явления 3 степени и выше — у 22,8% (против 13,5% в группе плацебо), чаще всего — повышение АЛТ.
Что это значит для клинической практики?
Это первое таргетное лечение, которое демонстрирует значимое улучшение ВБП и отдаляет начало токсичной терапии у пациентов с IDH-мутантными глиомами Grade 2. Ворасидениб может изменить стандарт подхода "Watch&Wait", открывая новое окно возможностей для лечения.
В настоящее время проводятся исследования в изучению его роли в лечении более агрессивных глиом и в комбинациях с другими препаратами.
Источник:
Mellinghoff I.K., et al. Vorasidenib in IDH1- or IDH2-Mutant Low-Grade Glioma. N Engl J Med 2023;389(7):589-601. doi: 10.1056/ NEJMoa2304194.
Материал подготовил А. Черчик
УГОЛОК РАДИОТЕРАПЕВТА / ПРОФИЛАКТИЧЕСКОЕ ОБЛУЧЕНИЕ МОЛОЧНЫХ ЖЕЛЕЗ: 10-ЛЕТНИЕ РЕЗУЛЬТАТЫ
Автор: Деньгина Наталья Владимировна
Заведующая радиологическим отделением
ГУЗ «Областной клинический онкологический диспансер»,
директор Центра лучевой терапии «R-Spei»,
член правления RUSSCO, главный редактор Газеты RUSSCO
и сайта RosOncoWeb, кандидат медицинских наук,
Ульяновск
На XXI Российском онкологическом конгрессе в Москве в 2017 году профессор Ella Evron из Израиля впервые представила результаты проспективного нерандомизированного исследования по профилактическому облучению контралатеральной молочной железы у пациенток с BRCA-мутантным ранним РМЖ. В дальнейшем были презентации на крупнейших конгрессах, включая ASCO 2018, публикации в журналах, вызывавшие немалое количество дискуссий. Время летит быстро, и вот 8 мая 2025 года в журнале JAMA были представлены уже отдаленные 10-летние результаты этого исследования 2 фазы.
Напомним: с мая 2007 г. по октябрь 2017 г. в исследование было включено 162 больных раком молочной железы с BRCA1/2 мутациями, которые помимо лучевой терапии на ипсилатеральную железу могли делать выбор: облучить контралатеральную железу (80 пациенток, 49,4%) или оставаться под наблюдением (82 пациентки, 50,6%), при этом профилактическая мастэктомия была допустима. Первичная конечная точка – частота возникновения контралатерального РМЖ (кРМЖ) за 10 лет. Также авторы оценили период времени до возникновения кРМЖ.
Рисунок 1.
Кумулятивная частота контралатерального РМЖ
в группах
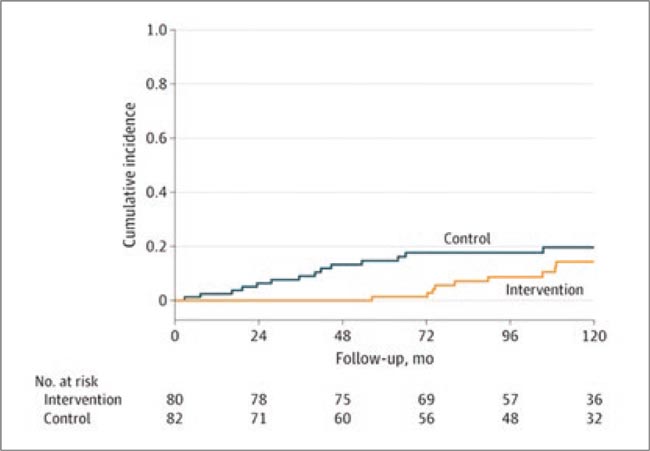
За прошедшие 10 лет (средний период наблюдения составил 10,4 года) у 15 пациенток контрольной группы (18,3%) и 11 из группы облучения (13,8%) отмечено появление кРМЖ; девяти пациенткам из группы наблюдения (10,9%) была выполнена мастэктомия и профилактическая контралатеральная МЭ, в отличие от 1 (1,3%) из группы профилактического облучения. При этом медиана срока до появления второй опухоли существенно различалась в группах: 40 мес. в контрольной против 90 мес. в группе облучения (р<0,001).
Частота возникновения ипсилатеральных рецидивов, других опухолей, метастазов и др. не различалась в группах. Значительная отсрочка в развитии кРМЖ и ипсилатеральных рецидивов подразумевает, что облучение, вероятнее всего, воздействует на субклиническую опухоль, и чисто превентивный эффект менее вероятен. Тем не менее, подобный подход, несмотря на противоречивость, заслуживает дальнейшего изучения в рандомизированных исследованиях.
Источник:
Evron E, Corn BW, Goldberg H, et al. Prophylactic Irradiation of the Contralateral Breast for BRCA Carriers With Early Breast Cancer: A Nonrandomized Clinical Trial. JAMA Oncol. Published online: May 08, 2025. doi:10.1001/ jamaoncol.2025.0901.
УГОЛОК РАДИОТЕРАПЕВТА / CRISEC: НЕОАДЪЮВАНТНАЯ ХИМИОЛУЧЕВАЯ ТЕРАПИЯ И ПОСЛЕДОВАТЕЛЬНОЕ ВВЕДЕНИЕ ТИСЛЕЛИЗУМАБА ПРИ ПЛОСКОКЛЕТОЧНОМ РАКЕ ПИЩЕВОДА
Продолжаются попытки улучшить результаты комплексного лечения рака пищевода с включением иммунотерапии как компонента системной терапии. В майском номере журнала Radiotherapy and Oncology опубликованы результаты одноцентрового исследования второй фазы, Китай, включившего 30 пациентов с резектабельным или потенциально резектабельным плоскоклеточным раком грудного отдела пищевода. Пациенты получали неоадъювантную химиолучевую терапию: лучевая терапия в дозе 41,4 Гр за 23 фракции и химиотерапия — паклитаксел, связанный с альбумином, 50-100 мг/м2 и карбоплатин AUC2 еженедельно. Через один день после завершения облучения начиналось введение тислелизумаба 200 мг 1 раз в 3 недели трижды. Хирургическое вмешательство выполнялось через 9–10 недель после начала иммунотерапии. Первичной конечной точкой была выбрана частота полных патоморфологических регрессов.
Ключевые результаты:
- Полный патоморфологический ответ достигнут у 37,5%;
- Выраженный патоморфологический ответ — у 87,5%;
- R0 резекция выполнена у 100% оперированных больных;
- Двухлетняя общая выживаемость составила 83,3%;
- Двухлетняя безрецидивная выживаемость — 79,2%, при этом рецидивы наблюдались только у пациентов без полного ответа.
Профиль безопасности:
- Последовательное применение тислелизумаба не вызывало отсрочек операций;
- Тяжёлых послеоперационных осложнений не зафиксировано;
- Большинство побочных эффектов были гематологическими и, вероятно, связаны с предыдущей химиолучевой терапией;
Пациенты отмечали улучшение общего самочувствия и качества жизни на фоне иммунотерапии. Дополнительно авторами было отмечено, что в группе с профилактическим облучением лимфоузлов частота полного ответа составила 53,8%, тогда как в группе с облучением только вовлеченной в опухолевый процесс зоны — 18,2%.
Это указывает на возможное влияние объёма облучения на эффективность терапии, хотя вопрос достаточно спорный.
Основные выводы авторов:
- Комбинация химиолучевой терапии с последующим тислелизумабом безопасна и перспективна;
- Лучшие результаты наблюдаются у пациентов с полным патологическим ответом.
Авторы подчёркивают необходимость более масштабных рандомизированных исследований третьей фазы для подтверждения результатов и уточнения оптимальных режимов терапии.
Источник:
J. Yang et al. Neoadjuvant chemoradiotherapy plus sequential tislelizumab followed by surgery for esophageal carcinoma (CRISEC study): A single-arm, bicentric, phase 2 trial. Radiotherapy and Oncology V. 206, May 2025, 110797. doi: 10.1016/j.radonc.2025.110797.
Материал подготовил А. Черчик