Дорогие коллеги, дорогие друзья!
В мае по улицам наших мегаполисов, городов и городочков плывет запах сирени. Тонкий элегантный аромат, столь любимый создателями парфюма и нами, вдохновил многих художников на создание реалистичных полотен, с которых он, этот лиловобело-розовый аромат, льется прямо в душу, создавая ощущение состоявшейся весны...

П.П.Кончаловский. Сирень.
1951 г. Холст, масло, 79х95 см. Латвийский Национальный художественный музей, Рига
Александр Блок.
*** Запевающий сон, зацветающий цвет, Исчезающий день, погасающий свет. Открывая окно, увидал я сирень. Это было весной - в улетающий день...
ПЕРВАЯ СОВМЕСТНАЯ КОНФЕРЕНЦИЯ RUSSCO, ОНКОЦЕНТРА №1 ГКБ ИМ. С.С. ЮДИНА И НИЖЕГОРОДСКОГО ОБЛАСТНОГО КЛИНИЧЕСКОГО ОНКОЛОГИЧЕСКОГО ДИСПАНСЕРА «ОПУХОЛИ ГОЛОВЫ И ШЕИ» В НИЖНЕМ НОВГОРОДЕ
25 мая в стенах Нижегородского онкологического диспансера прошла масштабная первая конференция «Опухоли головы и шеи», коорая проводилась Российским обществом...
RUSSCO НА II МОСКОВСКОЙ ОНКОЛОГИЧЕСКОЙ КОНФЕРЕНЦИИ «СТОЛИЦА ИННОВАЦИОННОЙ ОНКОЛОГИИ – 2024»
24 мая в рамках работы II Московской онкологической конференции «Столица инновационной онкологии – 2024» перед ее участниками с актуальным докладом «Роль профессиональных ассоциаций в клинических исследованиях» выступил председатель Российского общества клинической онкологии (RUSSCO)...
НОВОСТИ ESTRO 2024
С 3 по 7 мая 2024 года в Глазго (Великобритания) проходит очередной ежегодный конгресс Европейского общества радиационных терапевтических онкологов (ESTRO). Традиционно все сессии...

ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / БИОМАРКЕРНЫЙ АНАЛИЗ МОЧИ ПОЗВОЛЯЕТ СОКРАТИТЬ ЧИСЛО ЦИСТОСКОПИЙ У ПАЦИЕНТОВ С НМИРМП ВЫСОКОГО РИСКА
Стандартом наблюдения за пациентами высокого риска прогрессирования с немышечно-инвазивным раком мочевого пузыря (НМИРМП) является проведение цистоскопии каждые 3 месяца в...
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / ЭФФЕКТИВНОСТЬ КОМБИНАЦИИ НОГАПЕНДИКИНА АЛЬФА ИНБАКИЦЕПТА И БЦЖ СРЕДИ ПАЦИЕНТОВ, НЕ ОТВЕТИВШИХ НА БЦЖ
Опции лечения для пациентов, не ответивших на вакцину БЦЖ, крайне ограниченны и сводятся в большинстве случаев к радикальной цистэктомии (РЦЭ). На конгрессе Американской урологической...
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / РОЛЬ РЕИНДУКЦИИ ИММУНОТЕРАПИИ ПОСЛЕ ПРОГРЕССИРОВАНИЯ НА ИММУНОТАРГЕТНОЙ КОМБИНАЦИИ ПРИ РАКЕ ПОЧКИ
Наиболее часто назначаемым препаратом во 2 линии лечения диссеминированного рака почки после иммунотаргетной терапии (ИТТ) в 1 линии является кабозантиниб. А какова роль повторного...

ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / ОБНОВЛЕННЫЕ ДАННЫЕ 5-ЛЕТНЕГО НАБЛЮДЕНИЯ В ИССЛЕДОВАНИИ CHECKMATE 040
Журнал Annals of Oncology опубликовал обновленные данные 5-летнего наблюдения за пациентами с метастатическим гепатоцеллюлярным раком (ГЦР), которые получали комбинацию ниволумаба с...
ESMO BREAST CANCER 2024: ПРИМЕНЕНИЕ ЭКСЕМЕСТАНА + OС В АДЪЮВАНТНОМ РЕЖИМЕ УЛУЧШАЕТ ПОКАЗАТЕЛИ ВЫЖИВАЕМОСТИ У ПАЦИЕНТОК С ИНВАЗИВНОЙ ДОЛЬКОВОЙ КАРЦИНОМОЙ МОЛОЧНОЙ ЖЕЛЕЗЫ (ОБНОВЛЕНИЯ ДАННЫХ ОБЪЕДИНЕННОГО АНАЛИЗА SOFT/TEXT)
16 мая 2024 года на конгрессе ESMO Breast Cancer, который проходит в настоящее время в Берлине, были представлены дополнительные обновленные результаты исследований III фазы SOFT/TEXT...
КОМПЛЕКСНЫЙ ОБЗОР МЕТОДОВ ЛЕЧЕНИЯ МЕТАСТАЗОВ КОЛОРЕКТАЛЬНОГО РАКА
22 мая Current Oncology Reports опубликовал большой обзор по всем существующим методам лечения метастазов колоректального рака (КРР): от хирургического лечения и химиотерапии до SBRT и...
КТО ИЗ ПАЦИЕНТОВ С МЕТАСТАТИЧЕСКИМ РАКОМ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ ВЫИГРЫВАЕТ ОТ ПОДДЕРЖИВАЮЩЕЙ ТЕРАПИИ ЛЕЙКОВОРИНОМ И ФТОРУРАЦИЛОМ В ПЕРВОЙ ЛИНИИ ТЕРАПИИ?
Результаты ретроспективного поданализа многоцентрового клинического исследования II фазы PA NOP T I MOX - P RODIG E - 3 5 , опубликованные в журнале The Oncologist, демонстрируют...
STAS: НОВЫЙ ПРОГНОСТИЧЕСКИЙ ФАКТОР ПРИ НЕМЕЛКОКЛЕТОЧНОМ РАКЕ ЛЕГКОГО
Локализованные стадии немелкоклеточного рака легкого (T1-2N0) характеризуются наиболее благоприятным прогнозом и у большинства пациентов не требуют проведения адъювантной...
FDA ОДОБРИЛО ИСПОЛЬЗОВАНИЕ КОМБИНАЦИИ АМИВАНТАМАБА И ПЛАТИНОСОДЕРЖАЩЕЙ ХИМИОТЕРАПИИ В ЛЕЧЕНИИ РАСПРОСТРАНЕННОГО НЕМЕЛКОКЛЕТОЧНОГО РАКА ЛЕГКОГО С МУТАЦИЕЙ В 20 ЭКЗОНЕ EGFR
Альтерации в 20 экзоне гена EGFR занимают третье место (12%) по распространенности среди пациентов с немелкоклеточным раком легкого, но характеризуются практически полной...
«А ВОТ БЫЛ У МЕНЯ СЛУЧАЙ…», ИЛИ «ОХОТНИЧЬИ ЗАПИСКИ» ОНКОЛОГОВ / СТИРАЯ ГРАНИ
В рутинной практике врача клинициста очень часто встречаются ситуации, когда пациент не подлежит ни одному из имеющихся на сегоднящний день в арсенале онкологов видов специального...
Анонс
-

12-14 НОЯБРЯ 2024
XVIII РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС 2024
Москва
-

11-14 сентября 2024 г. Holiday Inn Sokolniki (г. Москва)
ШКОЛА НАУЧНЫХ ИССЛЕДОВАНИЙ ДЛЯ МОЛОДЫХ ОНКОЛОГОВ
участие бесплатное, грант на исследование
Дорогие коллеги, дорогие друзья!
В мае по улицам наших
мегаполисов, городов и городочков плывет запах сирени. Тонкий элегантный
аромат, столь любимый
создателями парфюма и
нами, вдохновил многих
художников на создание
реалистичных полотен, с
которых он, этот лиловобело-розовый аромат, льется прямо в душу, создавая
ощущение состоявшейся
весны.
Художника советской эпохи Петра Кончаловского
нередко называют «живописцем сирени». В сезон
цветения, по воспоминаниям близких, он писал
сирень каждый день. Быть
в 30-40-е годы в Советском
Союзе «чистым» живописцем – задача непростая.
Кончаловскому удалось,
он умудрился стать классиком советской живописи и при этом не писать
вождей мирового пролетариата. За многолетний период его активной работы
сиреневые букеты стали
своеобразным атрибутом
его творчества, превратились в излюбленный персонаж. Они никогда не повторялись – каждый раз
он писал их как бы заново,
в другом эмоциональном
ключе, оставаясь при этом
неизменным лишь в интересе к реальной действительности. Кажется, в его
клубящуюся сирень можно
зарыться с головой, ощущая на лице ее щекочущую
нежность, вдыхая ее необыкновенный запах.
С ароматом сирени, с первым майским загаром на лицах мы вступаем в Лето – и это придает нам новых сил. На проходящих мероприятиях – ежегодных конференциях и крупных международных конгрессах – мы приобретаем новые знания и с ними возвращаемся в реальность. Пусть далеко не всегда ожидания и действительность совпадают, наш интеллектуальный багаж всегда будет с нами и никогда нас не подведет. Первый летний номер газеты почти целиком будет посвящен новостям ASCO 2024. А пока мы знакомимся с данными исследований, представленными на конгрессе ESTRO в мае, с новостями крупных журналов – и планируем нашу встречу на XXVIII Российском онкологическом конгрессе!
Доброго лета, дорогие друзья!
Ваша команда RUSSCO
П.П.Кончаловский. Сирень.
1951 г. Холст, масло, 79х95 см. Латвийский Национальный художественный музей, Рига

Александр Блок.
***
Запевающий сон, зацветающий цвет,
Исчезающий день, погасающий свет.
Открывая окно, увидал я сирень.
Это было весной - в улетающий день.
Раздышались цветы - и на темный карниз
Передвинулись тени ликующих риз.
Задыхалась тоска, занималась душа,
Распахнул я окно, трепеща и дрожа.
И не помню - откуда дохнула в лицо,
Запевая, сгорая, взошла на крыльцо.
1902 год
ПЕРВАЯ СОВМЕСТНАЯ КОНФЕРЕНЦИЯ RUSSCO, ОНКОЦЕНТРА №1 ГКБ ИМ. С.С. ЮДИНА И НИЖЕГОРОДСКОГО ОБЛАСТНОГО КЛИНИЧЕСКОГО ОНКОЛОГИЧЕСКОГО ДИСПАНСЕРА «ОПУХОЛИ ГОЛОВЫ И ШЕИ» В НИЖНЕМ НОВГОРОДЕ
25 мая в стенах Нижегородского
онкологического диспансера прошла масштабная первая конференция «Опухоли головы и шеи»,
коорая проводилась Российским
обществом клинической онкологии (RUSSCO), Онкологическим
центром №1 ГКБ им. С.С. Юдина
ДЗМ и ГАУЗ НО НИИКО НОКОД
Представительность конференции подтверждена участием в ней виднейших экспертов-онкологов из Москвы,
Санкт-Петербурга, Ульяновска,
Владимира и других городов России. Среди спикеров и модераторов
были и члены Правления RUSSCO:
Л.В. Болотина, Н.В. Деньгина, И.А.
Покатаев. А открывал конференцию главный врач ГАУЗ НО НИИКО «Нижегородский областной
клинический онкологический диспансер», д.м.н. Сергей Викторович
Гамаюнов.

Для участия в конференции было
заявлено 26 докладов, представленных в четырех различных секциях:
- Мультимодальный подход к лечению местнораспространенных опухолей головы и шеи
- Хирургическое лечение и регионарная химиоинфузия при опухолях головы и шеи
- Лечение редких опухолей головы и шеи
- Сессия по лучевой терапии
Следует отметить, что в течение
многих лет лечение опухолей головы и шеи было предметом интереса в основном хирургов и радиологов, однако, благодаря прорыву в
лечении химиотерапевтическими
препаратами, появились новые
перспективы в лечении онкологических пациентов с данными ЗНО. На
сегодняшний день именно открывшиеся возможности современной
медицины позволяют успешно и
эффективно лечить опухоли головы
и шеи. В то же время опухоли головы и шеи стали занимать значимую
часть в общей статистике по выявлению среди других онкологических
заболеваний.

Поэтому, рассказывая о реальной
клинической практике лечения в
Москве пациентов с подобными
диагнозами, Илья Анатольевич Покатаев, член Правления RUSSCO,
руководитель службы химиотерапевтического лечения Онкологического центра № 1 ГКБ им. С.С. Юдина ДЗМ, д.м.н., высказал следующее
мнение: «Результаты, достигнутые
в борьбе с опухолями головы и шеи,
получены благодаря выработке единых алгоритмов диагностирования,
лечения и наблюдения за больными.
А это возможно только при постоянном обмене опытом и информацией на подобных мероприятиях, за
что отдельное спасибо Российскому
обществу клинической онкологии».
В большинстве докладов отмечалось и то, что сегодня в онкологических
центрах, занимающихся лечением
опухолей головы и шеи, выполняется полный комплекс лечебных
мероприятий, включая комбинированное лечение: лучевая и химиотерапия вместе с оперативным вмешательством. Кроме того, проводятся
малотравматичные, органосохраняющие и восстановительные пластические операции, что крайне важно
для пациентов данного профиля
онкологии.

Проведенная конференция позволила коллегам, собравшимся из различных регионов страны, не только
обменяться опытом, но и обсудить
новые подходы в лечении различных опухолей головы и шеи.
Ее закономерным итогом стало единодушное пожелание участников
проводить конференции RUSSCO,
посвященные опухолям головы и
шеи, на постоянной основе с расширением спектра тем и докладов.
RUSSCO НА II МОСКОВСКОЙ ОНКОЛОГИЧЕСКОЙ КОНФЕРЕНЦИИ «СТОЛИЦА ИННОВАЦИОННОЙ ОНКОЛОГИИ – 2024»
24 мая в рамках работы II Московской онкологической конференции «Столица инновационной онкологии – 2024» перед ее
участниками с актуальным докладом «Роль профессиональных
ассоциаций в клинических исследованиях» выступил председатель Российского общества клинической онкологии (RUSSCO),
заведующий онкологическим отделением противоопухолевой
лекарственной терапии (с дневным стационаром) ФГБУ «Центральная клиническая больница» Управления делами Президента РФ, профессор РАН, д.м.н. Дмитрий Александрович Носов.

В докладе была подробно раскрыта заявленная тема, а в качестве
иллюстраций использовались конкретные данные, полученные в
результате проведенных под эгидой RUSSCO клинических исследований, в том числе по Национальной Программе «Совершенствование молекулярно-генетической диагностики в Российской
Федерации с целью повышения эффективности противоопухолевого лечения». Также Д.А. Носов рассказал и о существующих
барьерах на пути реализации академических проспективных кооперированных клинических исследований, которые жизненно
необходимы профессиональному сообществу.
НОВОСТИ ESTRO 2024
Автор: Деньгина Наталья Владимировна
Заведующая радиологическим отделением
ГУЗ «Областной клинический онкологический диспансер», к.м.н, Ульяновск
С 3 по 7 мая 2024 года в Глазго
(Великобритания) проходит очередной ежегодный конгресс Европейского общества радиационных терапевтических онкологов
(ESTRO). Традиционно все сессии
конгресса условно разделены по
специальностям: для клиницистов (радиационных онкологов),
медицинских физиков, операторов (их называют radiotherapists),
а также есть блок брахитерапии и
междисциплинарные блоки. Вот
несколько наиболее интересных
новостей с конгресса.
Традиционно живой интерес вызвала сессия по лучевой терапии
олигометастазов, в лечении которых локальные методы, в том
числе и облучение, играют немалую роль. Итальянские авторы презентовали данные рандомизированного исследования 2
фазы RADIOSA по применению
короткого курса АДТ в комбинации с SBRT по поводу олигорецидивного гормоночувствительного рака простаты. Оптимальная
последовательность использования этих методов пока не определена. Исследователи включили пациентов с биохимическим
рецидивом ранее радикально
пролеченного рака простаты, с
рецидивом в регионарных лимфоузлах (N1), отдаленных узлах
(M1a) или в костях (M1b) в количестве максимум 3, в хорошем
статусе по ECOG (0-1б). Рандомизация шла в группы только SBRT
на рецидивные очаги (БЭД свыше
100 Гр за 3-5 фракций) или SBRT
в комбинации с коротким курсом
АДТ (до 6 месяцев), было набрано
по 51 пациенту в каждую группу
и отслежены минимум 6 месяцев
(медиана – 31 месяц). Первичная
конечная точка – выживаемость
без клинически явного прогрессирования.
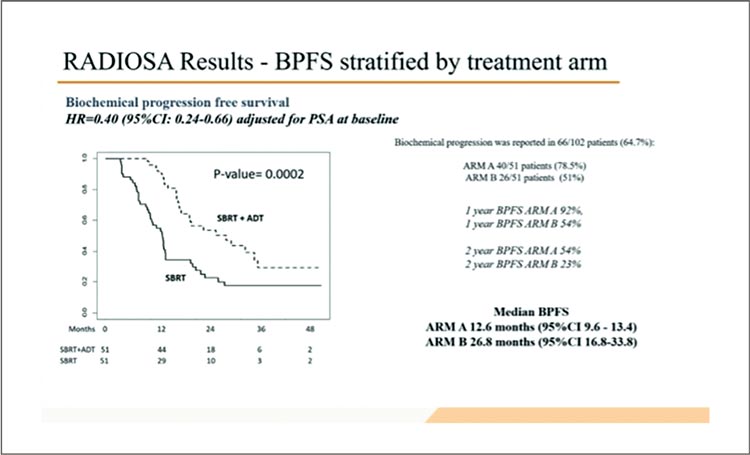
Комбинация SBRT и АДТ привела к достоверному преимуществу в плане почти двукратного
увеличения выживаемости без
биохимического прогрессирования (медиана составила 12,6 мес.
в группе SBRT и 26,8 мес. в группе комбинации) (рис.1).
Рисунок 1.
Выживаемость без биохимического
прогрессирования
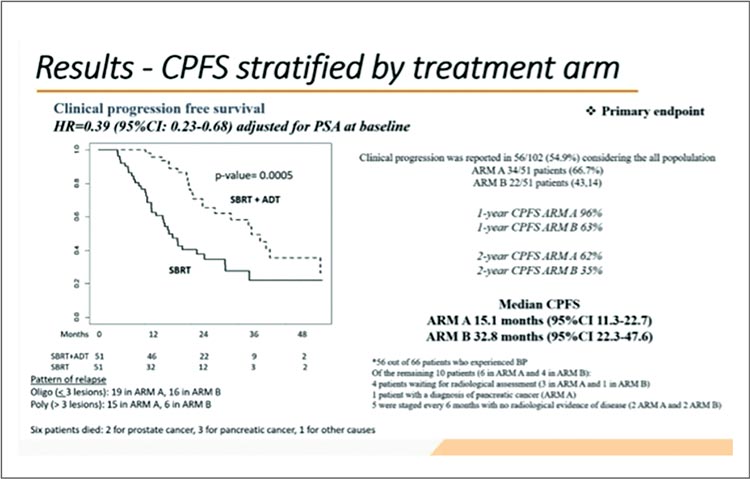
Выживаемость без клинически
явного прогрессирования также
оказалась достоверно лучше в
группе комбинации с медианой
32,8 мес. по сравнению с 15,1 мес.
после только SBRT (рис.2). Однако
для пациентов с более благоприятными характеристиками (ПСА
0-2 нг/мл на момент включения,
период от проведенного первичного лечения до SBRT более
43 месяцев) можно рассмотреть
только SBRT как вполне приемлемую опцию. Интересно, что в
группе комбинации последующие рецидивы преимущественно
относились к категории «олиго»,
Рисунок 2.
Выживаемость без клинически явного
прогрессирования в группах.
в отличие от группы SBRT, где
полиметастатические поражения
встречались значительно чаще.
О роли SBRT в лечении болезненных метастазов в костях (особенно в позвонках) споры ведутся
не один год. Долгое время сравнительные исследования не показывали преимуществ SBRT над
конвенциональным облучением,
однако число исследований по
этой проблеме растет, и, возможно, вскоре чаши весов склонятся именно в сторону SBRT, если
этому подходу удастся преодолеть известные недостатки паллиативного облучения малыми
дозами (более трети больных не
имеют никакого эффекта, у 2/3
эффект неполный с продолжительностью не более 3-6 месяцев и т.д.). Профессор Matthias
Guckenberger из Швейцарии
представил данные рандомизированного исследования 3 фазы
по сравнению результатов SBRT и
конвенциональной лучевой терапии метастазов в позвоночнике.
Пациенты были рандомизированы 1:1 в группу конвенциональной ЛТ (30 Гр за 10 фракций или
20 Гр за 5, 30 пациентов) и SBRT
(40 Гр за 5 фракций при отсутствии эпидурального вовлечения
и 48,5 Гр за 10 фракций в случае
эпидурального вовлечения, всего
33 пациента) на пораженный позвонок. Первичная конечная точка – частота зафиксированного
уменьшения болевого синдрома
на ≥2 пункта по аналоговой шкале боли в течение 6 месяцев после
лечения, и она была достигнута
у 69,4% больных в группе SBRT
в сравнении с 41,9% из группы
низкодозного облучения (р=0,02) в ITT популяции. Среди пролеченных по протоколу на момент
6-месячной оценки преимущество SBRT было еще более ярким: 78,1% против 43,3%, р=0,005.
При этом достоверной разницы
в отношении частоты достижения полного противоболевого
эффекта достигнуто не было.
Прогрессивное усиление боли
встречалось чаще после конвенционального облучения (41,9%
против 22,2%), но опять-таки без
статистической достоверности.
Лечение было вполне толерантно, без увеличения токсичности
при высокодозном облучении.
Таким образом, к настоящему
моменту 4 из 6 имеющихся рандомизированных исследований 3
фазы подтвердили большую эффективность SBRT для снижения
болевого синдрома у больных с
метастазами в костях. Практикующим радиотерапевтам стоит
преодолеть некий консерватизм
в лечении подобных пациентов:
профессор Guckenberger отметил, что набор в исследуемую группу
шел гораздо медленнее именно по
причине того, что врачи крайне
неохотно брали пациентов на высокодозное облучение.
Результаты рандомизированного мультицентрического однорукавного исследования 2 фазы ETOP-CHESS по применению мультимодального лечения (иммунохимиотерапия + SBRT + операция) у больных с олигометастатическим НМРЛ с количеством метастазов не более 3) также были представлены профессором Guckenberger на сессии Proffered Papers по раку легкого. Пациенты получали весьма интенсивное лечение: дурвалумаб 1500 мг каждые 3 недели 4-6 введений, химиотерапия (карбоплатин/паклитаксел каждые 3 недели, 4-6 циклов), а также SBRT на все олигометастатические очаги. После оценки результатов лечения больные без прогрессирования подвергались радикальному лечению первичной опухоли (оперативному или лучевому). По версии авторов, подобная схема способна улучшить результаты ВБП за 12 мес. в сравнении с историческими. С 2019 по 2022 гг. набрано 49 больных, из которых 47 начали лечение, и из них 11 (31%) были прооперированы, а 24 (69%) получили лучевую терапию; 33 продолжили получать дурвалумаб в поддерживающем режиме. Токсичности 4-5 степени не было отмечено. Увы, исследование оказалось негативным, не достигнув ожидаемых результатов ВБП за 12 месяцев. В ITT популяции из 49 пациентов 1-годичная ВБП достигла лишь 45%, что оказалось ниже ожидаемого (50%). Более чем у четверти пациентов отмечено прогрессирование после индукционной фазы, наиболее часто – отдаленное. При этом 1-годичная общая выживаемость (75%) позволила исследователям продолжить работу в этом направлении, интенсифицировав индукционный этап добавлением тремелимумаба (CHESS – когорта 2).
В продолжении темы рака легкого: роль лучевой терапии в лечении больных резектабельным N2 НМРЛ оставалась дискутабельной на протяжении многих лет. Пальма первенства перешла к неоадъювантной химиоиммунотерапии. Авторы швейцарского проспективного мультицентрического исследования 2 фазы SAKK 16/18 постарались оценить иммуномодулирующую роль лучевой терапии на неоадъювантном этапе: пациенты с резектабельным НМРЛ T1-4 N2 M0 получали химиотерапию (цисплатин/доцетаксел 3 цикла раз в 3 недели), 1 дозу дурвалумаба 1500 мг + лучевую терапию на первичную опухоль (в трех режимах: А – 20 Гр за 10 фракций, В – 5 фракций по 5 Гр или С – 3 фракции по 8 Гр), затем шли на операцию, в случае неполной резекции получали ЛТ, а затем продолжали иммунотерапию дурвалумабом в течение года. Первичной конечной точкой была выбрана бессобытийная выживаемость за 12 месяцев. Надо отметить, что авторы крайне щепетильно отнеслись к анализу качества лучевой терапии, поставив в приоритет жесткие ограничения по дозам на критических органах и максимальное избегание облучения медиастинальных лимфоузлов для реализации большего иммунного ответа, при этом даже допускалось частичное покрытие PTV. На данный момент в исследование набрано 68 пациентов, в предварительный анализ был включен 31 пациент, кто получил ПХТ, 29 продолжили этап иммунолучевой терапии и 25 (81%) были прооперированы. У 28% из них достигнут полный патоморфологический ответ, причем только в группах более концентрированного облучения (группы В и С), у остальных пациентов получен большой ответ с менее 10% жизнеспособных клеток. При этом у 60% больных произошло уменьшение индекса N. Лечение оказалось вполне толерантным, без задержек в операции по причине токсичности, отсутствием послеоперационной летальности и только 1 случаем токсичности 4 степени (эмпиема плевры). Исследователи продолжают набирать больных до запланированного количества (90), и окончательные результаты появятся еще не скоро; хотелось бы узнать, сыграют ли небольшие дозы ЛТ позитивную роль в улучшении отдаленных результатов выживаемости.
Итальянское проспективное исследование 2 фазы с интригующим названием START-NEWERA оценивает роль SABR в лечении местнораспространенного НМРЛ для снижения риска локального рецидива. В 2023 году были опубликованы данные в отношении токсичности, а на конгрессе в Глазго авторы представили 5-летние результаты по локальным рецидивам. В исследование набрано 80 пациентов с нерезектабельным мрНМРЛ в статусе 0-2 балла по ECOG, не подходящих для одновременной ХЛТ. Анализ построен на данных 50 прослеженных больных. Пациенты, способные получать ХТ, проходили 3 курса, затем SABR (5 последовательных фракций на первичную опухоль и вовлеченные л/узлы по данным ПЭТ-КТ, в биологически эквивалентных дозах 59,5-72 Гр – 17 больных, 34%); те, кто по состоянию не подходил для проведения ХТ, получали только SABR (23 больных, 46%). Больные с PD-L1≥1% продолжали консолидирующую терапию дурвалумабом (10 больных, 20%). Токсичности 3 степени не было отмечено. Наиболее явными предикторами локальных рецидивов стали плоскоклеточный рак и доза SABR менее 40 Гр. При этом медиана выживаемости без локальных рецидивов за 5 лет не была достигнута; показатель 5-летней ВБЛР составил 64%. Медиана ОВ составила 53 месяца, при 46% за 5 лет – весьма обнадеживающие результаты для группы ослабленных и коморбидных больных, не подходящих для классической схемы лечения местнораспространенного нерезектабельного НМРЛ.
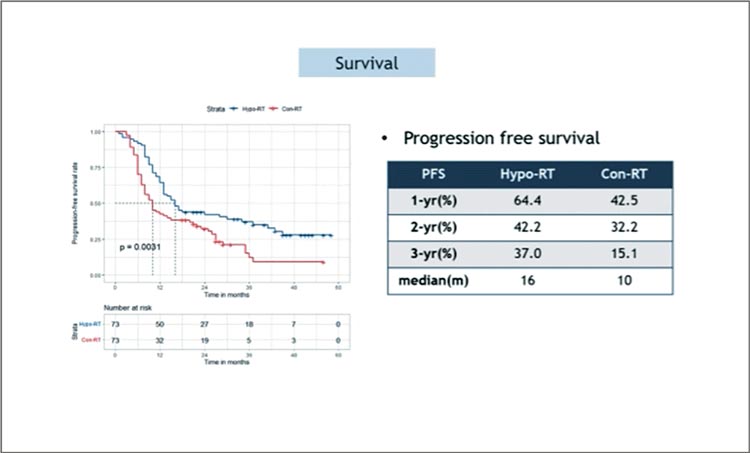
Применение томотерапии в лечении больных раком легкого рассматривается как вариант снижения токсичности со стороны критических органов и, возможно, повышения эффективности лечения, однако доказательств этого было крайне мало и только в ретроспективных работах. Китайские авторы инициировали проспективное мультицентрическое исследование 3 фазы по сравнению результатов химиолучевого лечения 2 групп больных с нерезектабельным НМРЛ – с применением гипофракционированного облучения на аппарате томотерапии (20 фракций по 3 Гр на фоне 2 курсов платиносодержащей ХТ, 73 пациента) или с использованием традиционного фракционирования методом IMRT на фоне также 2 курсов ПХТ (73 пациента); в качестве консолидации проводилось еще 2 цикла ХТ по прежней схеме. В качестве первичной конечной точки выбрана 3-летняя ОВ. И этот показатель был значимо лучше в группе гипофракционированного облучения методом томотерапии за все 3 года, что пациенты были прослежены (р=0,022), медиана ОВ составила 41 мес. против 30 мес. в группе традиционного фракционирования (рис.3). Преимущество отмечено и в отношении ВБП (рис.4), а показатель локорегионального контроля оказался более чем в 2 раза выше в исследуемой группе: 60,9% за 3 года в сравнении с 26,0% в группе контроля. Токсичность была схожей и достоверно не различалась.
Авторы предполагают, что умеренная интенсификация ХЛТ с применением метода томотерапии может стать методом выбора для данной категории больных. Смущает отход от уже ставшей стандартной схемы лечения с консолидацией дурвалумабом и возврат к отвергнутой консолидирующей химиотерапии – объяснений тому авторы не дали.
Рисунок 3.
Общая выживаемость в группах гипо-РТ и конв-РТ.
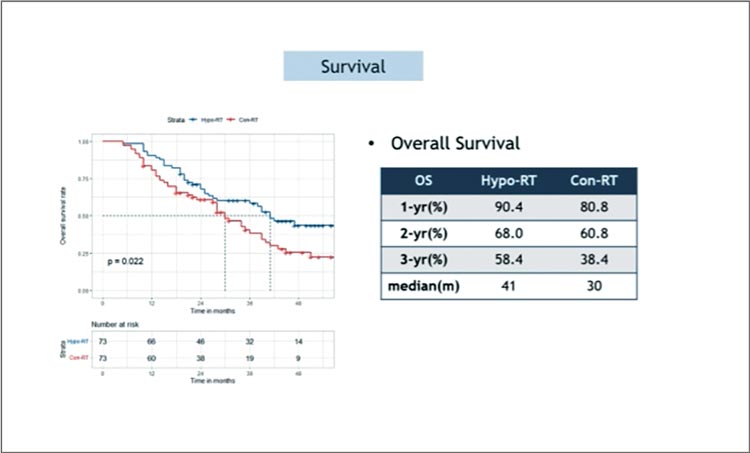
Рисунок 4.
Выживаемость без прогрессирования в группах
гипо-РТ и конв-РТ.
На каждом крупном мероприятии по радиационной онкологии проблеме лучевой терапии рака предстательной железы – в разных ее аспектах – уделяется много внимания. Конгресс в Глазго не стал исключением, но подробно хочется остановиться на одной работе, автор которой получил премию профессора Donal Hollywood (одного из ранее избранных президентов сообщества, который, увы, умер от рака до вступления в должность) за лучшее исследование, отобранное для презентации результатов на конгрессе ESTRO.
Главный исследователь хорошо знаком российским онкологам и радиотерапевтам, поскольку он минимум дважды принимал участие в Российском онкологическом конгрессе. Это Piet Ost, профессор бельгийского университета Гента, радиационный онколог центра Iridium Netwerk Антверпена, молодой, но широко известный в мире радиационной онкологии по выдающимся исследованиям в области рака простаты и локальной и комбинированной терапии метастазов различных опухолей. По мнению Shankar Siva, профессор Piet Ost своей презентацией высоко поднял планку профессиональной коммуникации в среде радиационных онкологов – и действительно, лаконичность, яркость изложения и глубина содержания всегда отличали его доклады. Вполне возможно, это один из будущих президентов ESTRO.
Итак, 6 мая 2024 года на конгрессе были впервые представлены результаты весьма ожидаемого проспективного рандомизированного исследования 2 фазы STORM, в котором авторы поставили перед собой цель выяснить, какой вариант лучевой терапии предпочесть для локального лечения больных раком простаты с олигорецидивами в лимфоузлах малого таза – SBRT на метастатические лимфоузлы или элективное облучение всех лимфоузлов малого таза. Чтобы понять степень неопределенности в этом вопросе, достаточно сказать, что накануне презентации результатов STORM на конгрессе в Глазго состоялась дискуссия, в которой победу одержала SBRT (61% специалистов против 39% тех, кто поддержал облучение всего малого таза), тогда как в подобных дебатах десятью днями раньше на APCCC24 (Advanced Prostate Cancer Consensus Conference 2024) в Лугано смешанная аудитория специалистов по лечению рака простаты отдала методу лишь 3%!
Дизайн исследования прост и элегантен. Ранее радикально пролеченные пациенты (n=196) с признаками метастатического поражения лимфоузлов таза (по статистике на них более 50% всех рецидивов) на фоне роста ПСА рандомизированы между 06.2018 г. и 04.2021 г. в группу SBRT (3 фракции по 10 Гр на область вовлеченного лимфоузла, 99 больных) либо в группу облучения всего малого таза (45 Гр за 25 фракций, буст на вовлеченные лимфоузлы и облучение ложа простаты были разрешены, n=97). В обеих группах допускалось проведение АДТ в течение 6 месяцев. Большинство пациентов в группах ранее прошли радикальную простатэктомию (63% и 52%), меньшее число больных были пролечены методом радикальной лучевой терапии (8% и 15%), примерно треть лечились комбинированным методом. Более половины пациентов в обеих группах имели солитарные метастазы в лимфоузлах на момент включения в исследование. Медиана периода наблюдения – 34 месяца.
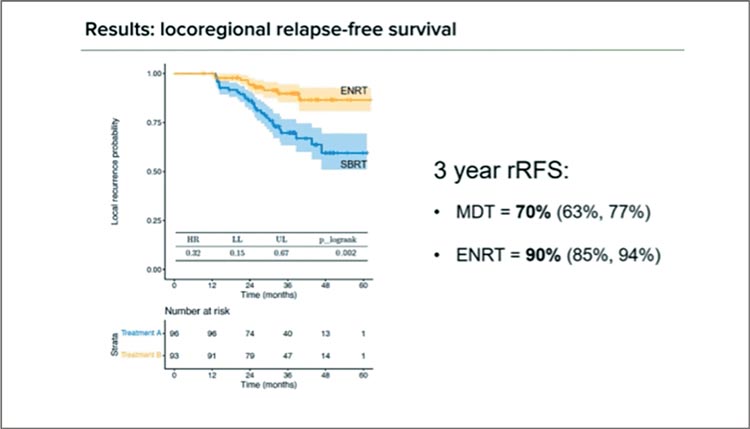
Гастроинтестинальная токсичность 2+ степени в течение 2 лет оказалась весьма низкой и схожей между двумя группами: 5,3% в группе SBRT и 6,6% в группе элективного облучения лимфоузлов малого таза (ENRT). Осложнения 2+ степени со стороны мочеполовых органов также отмечены практически у одинакового числа пациентов и, на удивление, встречались и в группе высокопрецизионной лучевой терапии (22,2% и 26,5%); причиной тому, вероятнее всего, стало облучение ложа простаты. Чаще оно применялось в сочетании с ENRT, риск осложнений в этом случае оказался выше более чем в 2 раза. Наконец, основные результаты продемонстрировали, какой подход стал победителем. And the winner is… Elective Nodal Radiotherapy, то есть облучение малого таза! Выживаемость без биохимического рецидива за 3 года в группе ENRT оказалась достоверно и много выше: 69% против 47% (HR 0,55; p-logrank 0,01; рис.5), также как и выживаемость без локорегионарного рецидива – 90% против 70% (HR 0,32; p-logrank 0,002; рис.6).
Рисунок 5.
Выживаемость без биохимического
рецидива в группах.
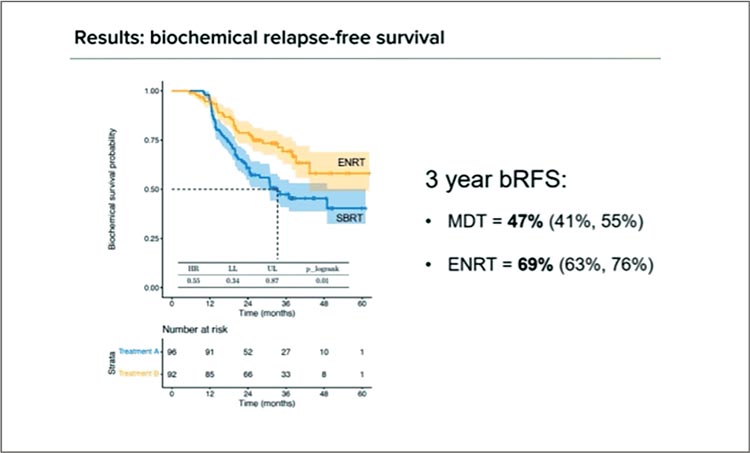
Рисунок 6.
Выживаемость без локорегионарных рецидивов.
При этом рецидивы в лимфоузлах встречались в 8 раз чаще у больных из группы SBRT (25% против 3%), тогда как рецидивы в ложе простаты или комбинированные локорегионарные рецидивы были достаточно редки в обеих группах (рис.7). Отмечено, что отказ от облучения ложа простаты повышает риск рецидива в этой зоне, но при этом риск урогенитальных осложнений ниже – для практикующего врача это всегда поиск баланса.
Данные по выживаемости без отдаленных метастазов требуют более длительного периода наблюдения, как выяснилось. По прошествии 3 лет обязательного наблюдения за пациентами отмечено всего 33 события – что, без сомнения, очень хорошо для больных.
Рисунок 7.
Локализация локорегионарных рецидивов.
Начавшись всего в 2 центрах Бельгии, исследование STORM привлекло несколько центров в Норвегии, Швейцарии, Италии, Испании и даже Австралии, в очередной раз продемонстрировав ценность командной работы, практически поставив точку в споре в отношении выбора оптимального локального подхода при олигорецидивах рака простаты в лимфоузлах таза.
Сессии «Late-breaking clinical trials» всегда привлекают наибольшее внимание аудитории, так случилось и в предпоследний день конгресса, когда результаты ожидаемых исследований были представлены весьма известными авторами.
David Palma представлял данные часто упоминаемого ORATOR2 по применению деэскалации у больных с ВПЧ-позитивным плоскоклеточным раком головы и шеи. Деэскалация может подразумевать уменьшение дозы лучевой терапии или отказ от лекарственной терапии (при использовании консервативного подхода) либо снижение объемов оперативного вмешательства с применением трансоральной хирургии и возможного отказа от адъювантной терапии. Ряд исследований по деэскалации (HN002, E3311, RTOG 1016, DeESCALaTE), увы, не преуспели, и пока других данных в литературе нет; в настоящее время только ожидаются результаты 3-рукавного исследования 3 фазы HN-005 по сравнению радикального ХЛЛ (70 Гр + цисплатин), деэскалированного ХЛЛ (60 Гр + цисплатин; набор в эту группу прекращен) или иммунорадиотерапии (60 Гр + ниволумаб). ORATOR2 поставило целью исследовать 2 подхода с деэскалацией у пациентов с ВПЧпозитивным орофарингеальным раком T1-2 N0-2, которые были рандомизированы на 2 группы: лучевая терапия в дозе 60 Гр с добавлением еженедельного цисплатина в случае N2 и возможной сальважной операцией при наличии остаточной опухоли; первичная операция – TORS с шейной лимфодиссекцией, дополненной адъювантной ЛТ (50-60 Гр) при наличии факторов риска. Первые результаты по токсичности были опубликованы в 2022 году, предполагалось набрать 140 пациентов в обе группы, но авторы были вынуждены остановить исследование раньше времени по причине неприемлемой токсичности 5 степени в группе хирургического лечения; к тому моменту данные по ОВ (как первичная конечная точка) и вторичные цели были еще незрелыми, требовался минимум 2-летний период наблюдения. В течение 2018-2019 гг. всего 61 пациент был включен в 9 центрах Канады и Австралии, медиана наблюдения составила 3,7 года.
В итоге консервативный подход (лучевая терапия ± цисплатин) одержал уверенную победу. ОВ за 2 года составила 100% в группе ЛТ и 90% в группе хирургического лечения, р=0,041 (рис.8).
Рисунок 8.
Общая выживаемость в группах ЛТ и Х по данным
исследования ORATOR2.
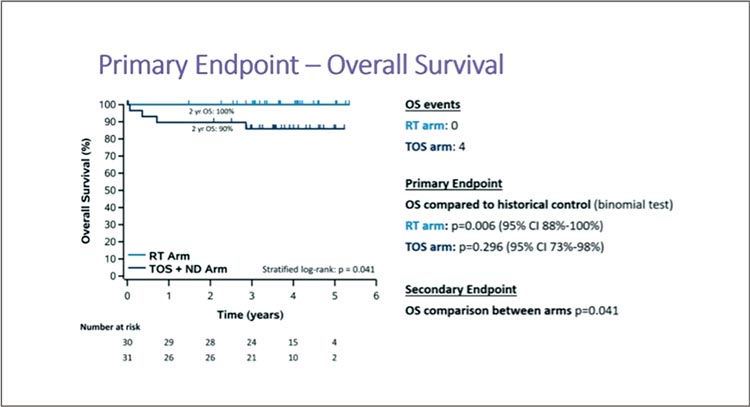
Более того, за 2 года в группе ЛТ не было зафиксировано случаев прогрессирования (БРВ – 100%), тогда как в группе Х БРВ составила 84%. Токсичность оказалась сопоставима между группами, с небольшим преимуществом в пользу группы Х в виде меньшей частоты осложнений 2-3 степени, таких как анорексия и дисгезия, т.е. нарушение вкусовых ощущений. При этом группа ЛТ достоверно выиграла в отношении лучшего качества жизни по таким факторам, как социальная адаптация, применение анальгетиков и ряд других. Несмотря на ряд ограничений (малое число пациентов в исследовании, сомнительное качество хирургического вмешательства, с 6,4% кровотечений 5 степени), ORATOR2 не поддерживает TORS в качестве деэскалационного подхода в лечении больных ВПЧ-позитивным орофарингеальным раком.
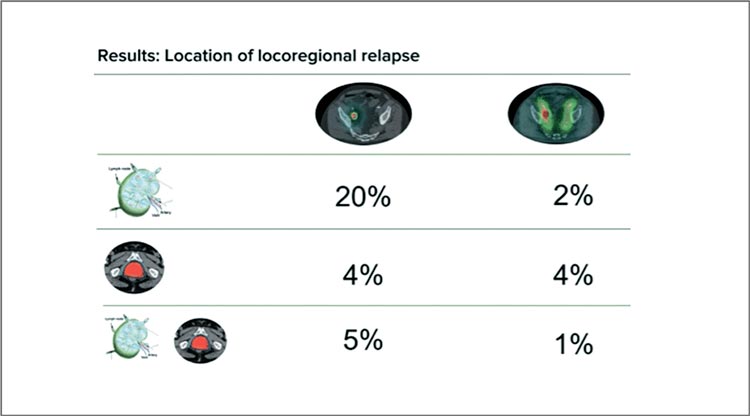
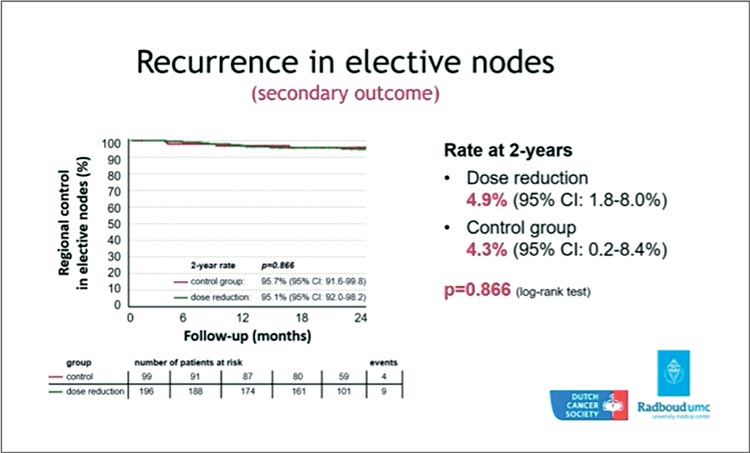
Исследователи из Нидерландов представили данные мультицентрического исследования по применению деэскалации – уменьшения элективной дозы на лимфоузлах. В исследование было включено 300 пациентов с плоскоклеточным раком гортани, нижней части глотки и ротоглотки в стадии T2-4 N0-2 M0 для получения только радикальной ЛТ (без ХТ): 68 Гр в течение 5,5 недель, 6 дней в неделю на область первичной опухоли, определяемой по ФДГ-ПЭТ/КТ, и 50 Гр (по 1,46 Гр за фракцию) в группе контроля или 43 Гр (1,26 Гр за фракцию) в группе деэскалации на лимфоузлы шеи. Большинство пациентов были очень возрастные, поэтому о ХЛЛ речь не шла. Период наблюдения составил 2 года. Первичная конечная точка – нормальное питание спустя 1 год после лечения, вторичные конечные точки – частота рецидивов в области элективно облученных лимфоузлов. В итоге разницы в основных результатах между группами не было, и исследование расценено как негативное. Однако в группе деэскалации частота применения назогастральных зондов оказалась достоверно ниже, чем в контрольной: 10,7% против 19,2%, р=0,047. Частота ксеростомий на 3 месяц после лечения, что во многом определяет качество жизни, также была достоверно ниже в исследуемой группе – 46% против 60%, р=0,025. Главный вопрос – насколько деэскалация безопасна? Авторы продемонстрировали отсутствие разницы как в частоте рецидивов в области лимфоузлов (4,9% против 4,3%, р=0,866) (рис.9), так и в отношении ОВ за 2 года, даже с небольшим численным преимуществом деэскалации (83,3% против 78,7%, р=0,481). Остается непонятным, какая пропорция ВПЧ-позитивных пациентов была включена в работу.
Рисунок 9.
Частота рецидивов в области облученных
лимфоузлов в группе деэскалации и контрольной группе.
Итальянские авторы представили 5-летние результаты мультицентрического международного исследования 3 фазы IRMA по сравнению результатов облучения всей молочной железы и парциального облучения у больных ранним инвазивным раком молочной железы с размером первичной опухоли менее 3 см, pN0-1 после органосохраняющей операции и адъювантной терапии согласно принятым стандартам. Тема не нова, но, видимо, радиотерапевтическому сообществу нужно больше данных, чтобы начать более широко использовать вариант парциального облучения у пациенток с ранним РМЖ. Первичная конечная точка исследования – частота испсилатеральных рецидивов, вторичные – ОВ, БРВ, бессобытийная выживаемость, время до регионарного рецидива или до отдаленного рецидива плюс ранние и поздние побочные эффекты. Период набора – 2007- 2019 гг., 35 европейских центров. Средний период наблюдения составил 8 лет. Число включенных пациентов впечатляет: 1602 – в группе APBI, 1623 – в группе WBI, пациенты были хорошо сбалансированы по характеристикам между группами. Частота ипсилатеральных рецидивов была низка в обеих группах (рис.10), 5-летняя кумулятивная частота регионарных и отдаленных рецидивов не различалась (0,4% против 0,4%, 1,4% против 1,3% в группах APBI и WBI соответственно). Никаких отличий в 5-летней ВБП и ОВ также не отмечено (95,4% против 95,2% и 97,6% против 97% соответственно).
Рисунок 10.
Частота ипсилатеральных рецидивов РМЖ в
группах APBI и WBI.
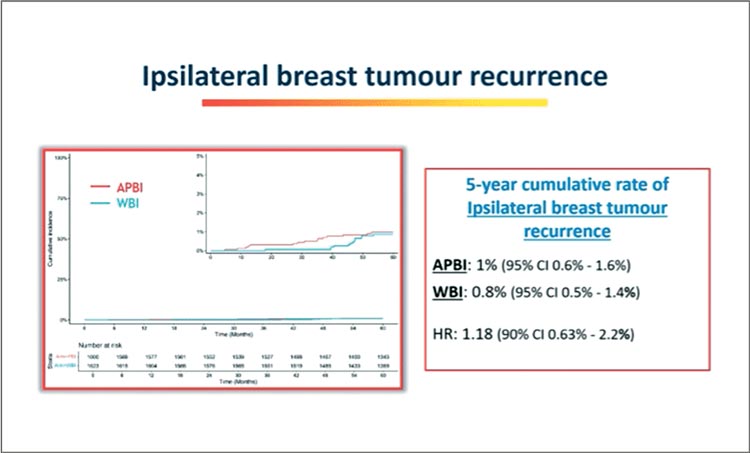
При этом в очередной раз подтвердилось основное преимущество парциального облучения: снижение риска вторичных опухолей. Частота в группе APBI составила 2,4% в сравнении с 3,8% при облучении всего объема молочной железы (HR 0,63; р=0,03). Однако токсичность была выше в группе парциального облучения, что привело к небольшому снижению косметического эффекта за 5 лет. В любом случае, технология APBI имеет право на существование, и данные исследования IRMA вновь подтвердили non-inferiority подобного подхода. Авторы планируют дополнительный анализ в группе тех пациентов, кто не получал системное лечение.
И снова животрепещущий вопрос в отношении ЛТ рака молочной железы: облучение парастернальных лимфоузлов. Данные о том, что облучение этой зоны приводит к улучшению отдаленных результатов, в частности, ОВ, в настоящее время преподносятся как факт – несмотря на то, что разница в показателях между группами IMN+ и IMN- составляет 1,5-3% (по данным нескольких рандомизированных исследований (MA20, EORTC 22922, DBCG IMN)). Датские авторы вновь вернулись у этой теме, чтобы понять, есть ли вклад от облучения парастернальных лимфоузлов в современную эру адъювантного лечения больных РМЖ, предположив, что ЛТ на эту зону снижает риск отдаленных рецидивов, что, в свою очередь, снижает риск смерти от РМЖ и увеличивает ОВ. При этом исследование DBCG IMN2 было инициировано уже в эпоху современной адъювантной лекарственной терапии (с применением таксанов, летрозола, трастузумаба и др.) и современной ЛТ с предлучевой подготовкой, основанной на КТ-топометрии, предыдущие крупные исследования типа EBCTCG метаанализа включали пациентов, получавших лечение более старыми комбинациями и даже с технологией 2D ЛТ. В национальное мультицентрическое (6 центров Дании) популяционное исследование включены больные РМЖ N+, получавшие ЛТ, при этом в группу IMN+ входили 2194 пациенток, в группу IMN- 2347. Конечные цели включали частоту отдаленных рецидивов, смертность от РМЖ, ОВ (первичная конечная точка). К настоящему времени имеются 15-летние результаты, которые демонстрируют следующее. Частота отдаленных рецидивов оказалась выше в группе IMN- (26,9% против 25,1%; р=0,025), смертность от РМЖ также выше (23,6% против 21,4%; HR 0,84; р=0,008). Наконец, облучение парастернальных л/узлов привело к достоверному увеличению ОВ за 15 лет (65,0% против 60,8%; HR 0,85; р=0,002) (рис.11). При этом эффект наблюдался во всех группах больных – с разным числом пораженных узлов, латеральной или медиальной/центральной локализацией опухоли.
Рисунок 11.
Общая выживаемость в группах IMN+ и IMN-.
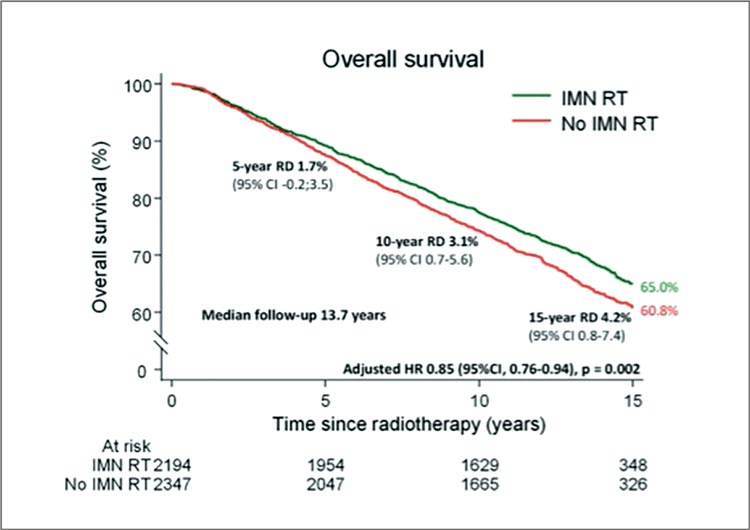
Смертность от кардиальной токсичности была крайне мала в
обеих группах, не превысив и
1% за 15 лет, тогда как разница
в смертности от РМЖ численно
была ниже в группе IMN+ (21,4%
против 23,6% за 15 лет). В заключение авторы сделали вывод, что
даже в эпоху современной адъювантной терапии РМЖ облучение парастернальной зоны дает
ряд преимуществ в отдаленных
результатах. При этом идентифицировать группы пациентов, у которых можно было бы безопасно
избежать ЛТ на внутригрудные
лимфоузлы, авторам не удалось.
Примем к сведению.
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / БИОМАРКЕРНЫЙ АНАЛИЗ МОЧИ ПОЗВОЛЯЕТ СОКРАТИТЬ ЧИСЛО ЦИСТОСКОПИЙ У ПАЦИЕНТОВ С НМИРМП ВЫСОКОГО РИСКА
Материал подготовил Э.Р. Исраелян
Стандартом наблюдения за пациентами высокого риска прогрессирования с немышечно-инвазивным раком мочевого пузыря
(НМИРМП) является проведение цистоскопии каждые 3 месяца в течение первых 2 лет наблюдения. Данная манипуляция
безопасна, но, тем не менее, может быть сопряжена с риском
мочевой инфекции, кровотечения и болевым синдромом. На
конгрессе EAU 2024 в Париже
был представлен пресс-релиз исследования по оценке возможности замены цистоскопии на биомаркерный анализ мочи (оценка
уровня 5 таргетных мРНК –
XpertA test).
В исследование включено 313 пациентов с НМИРМП высокого риска, они были рандомизированы
в 2 группы: стандартный подход
(регулярные цистоскопии) и экспериментальный подход (1 цистоскопия и 2 биомаркерных исследования мочи в течение года).
Пациенты с позитивным результатом тестирования приглашались
для проведения цистоскопии.
При наблюдении в течение 2 лет
44% последующих посещений онкоуролога пациентами из группы биомаркерного тестирования включали
цистоскопию по сравнению с ≈100%
среди пациентов из группы стандартного подхода.
Исследователи также обнаружили,
что анализ мочи может выявить рецидив заболевания до того момента,
как это будет обнаружено визуально. Более чем у 50% пациентов с
«ложноположительным» тестом при
дальнейшем наблюдении выявлены
признаки заболевания по данным
цистоскопии.
Подобный подход деэскалации инвазивных манипуляций выглядит
привлекательным, однако стоит дождаться окончательных результатов
исследования, возможно, что уже на
ASCO 2024.
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / ЭФФЕКТИВНОСТЬ КОМБИНАЦИИ НОГАПЕНДИКИНА АЛЬФА ИНБАКИЦЕПТА И БЦЖ СРЕДИ ПАЦИЕНТОВ, НЕ ОТВЕТИВШИХ НА БЦЖ
Материал подготовил Э.Р. Исраелян
Опции лечения для пациентов, не ответивших на вакцину БЦЖ, крайне ограниченны и сводятся в большинстве случаев к радикальной цистэктомии (РЦЭ). На конгрессе Американской урологической ассоциации в мае 2024 года представлены промежуточные результаты открытого многоцентрового исследования QUILT по оценке эффективности комбинации N-803 (ногапендекин альфа инбакицепт – НАИ) и БЦЖ для пациентов высокого риска с немышечно-инвазивным РМП и CIS ± Ta/T1 папиллярной опухолью (когорта А) после ТУР.
Все включенные пациенты (n=77) ранее получили БЦЖ терапию, 48% больных получили также внутрипузырную ХТ и иммунотерапию. Пациентам проводилось внутрипузырное введение НАИ 400 мкг с БЦЖ один раз в неделю в течение 6 недель (первая индукция). Допускалось проведение второй индукции в случае отсутствия полного ответа (ПО) к третьему месяцу. Поддерживающая терапия БЦЖ и НАИ проводилась согласно общепринятым стандартам. Первичная конечная точка – частота полных ответов.
Результаты:
- полный ответ достигнут у 65% пациентов;
- эффективность комбинации продемонстрирована вне зависимости от числа ранее проведенных введений БЦЖ (<12 введений – 70%, ≥12 – 69%);
- медиана длительности ответа – 26,6 мес. (95% ДИ 0,9–НД);
- у 61,3% пациентов длительность полного ответа более 1 года, а у 53,2% – более 2 лет.
Среди НЯ чаще всего отмечались
(≥15%): креатининемия, дизурия,
гематурия, мочевая инфекция и
пирексия.
НАИ является суперагонистом
IL-15 и приводит к активации и
пролиферации NK-клеток, CD8+
и CD4+ Т-лимфоцитов. Синергизм между БЦЖ и НАИ позволил добиться длительного ПО и
избежать РЦЭ для весомой части
пациентов, что стало основанием
к регистрации данной комбинации FDA.
Источник:
FDA approves nogapendekin alfa inbakicept-pmln for
BCG-unresponsive non-muscle invasive bladder cancer.
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / РОЛЬ РЕИНДУКЦИИ ИММУНОТЕРАПИИ ПОСЛЕ ПРОГРЕССИРОВАНИЯ НА ИММУНОТАРГЕТНОЙ КОМБИНАЦИИ ПРИ РАКЕ ПОЧКИ
Материал подготовил Э.Р. Исраелян
Наиболее часто назначаемым препаратом во 2 линии лечения диссеминированного рака почки после
иммунотаргетной терапии (ИТТ) в
1 линии является кабозантиниб. А
какова роль повторного использования иммунотерапии (ИТ)? В исследовании CONTACT-03 добавление атезолизумаба к кабозантинибу
после прогрессирования на ИТТ не
улучшило ни ВБП, ни ОВ. А какова
эффективность добавления ИТ к
кабозантинибу в реальной клинической практике?
Из базы данных Flatiron были получены данные пациентов, получивших после прогрессирования на 1
линии ИТТ кабозантиниб в монорежиме либо в комбинации с ИТ.
Первичные конечные точки - время
до следующей линии (ВСЛ) и ОВ.
В исследование включены данные
348 пациентов (280 получали кабозантиниб в монорежиме).
После применения метода псевдорандомизации:
- ВСЛ составила 8,5 мес. (95% ДИ, 7.1-12) и 12 мес. (95% ДИ, 10 - НД) для кабозантиниба и кабозантиниба + ИТ, соответственно; отношение рисков (ОР) с поправкой на прогноз по IMDC 0.74 (95% ДИ, 0.49-1.12);
- ОВ от начала 2 линии составила 20 мес. и 21 мес. для монотерапии и комбинации, соответственно; ОР 1.15 (95% ДИ, 0.73-1.79).
Результаты данного анализа согласуются с исследованием CONTACT-03,
и добавление ИТ к кабозантинибу
во 2й линии на текущий момент нецелесообразно.
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / ОБНОВЛЕННЫЕ ДАННЫЕ 5-ЛЕТНЕГО НАБЛЮДЕНИЯ В ИССЛЕДОВАНИИ CHECKMATE 040
Материал подготовила А.В. Фатеева
Журнал Annals of Oncology опубликовал обновленные данные
5-летнего наблюдения за пациентами с метастатическим гепатоцеллюлярным раком (ГЦР),
которые получали комбинацию
ниволумаба с ипилимумабом после предшествующей терапии сорафенибом.
Напомним, что в данном исследовании 148 пациентов были рандомизированы на 3 группы лечения
(1:1:1):
- группа А: ниволумаб 1 мг/кг и ипилимумаб 3 мг/кг 3 раза в сутки (4 цикла), далее ниволумаб 240 мг 1 раз в 2 недели;
- группа В: ниволумаб 3 мг/кг и ипилимумаб 1 мг/кг 3 раза в сутки (4 цикла), далее ниволумаб 240 мг 1 раз в 2 недели;
- группа С: ниволумаб 3 мг/кг Q2W и ипилимумаб в дозе 1 мг/кг Q6W.
В предыдущем отчете при медиане наблюдения 36 месяцев ЧОО
и ОВ в группе А были значимо
лучше по сравнению с группами
В и С.
В данном обновленном анализе
при медиане наблюдения 60 месяцев:
- ОВ составила 29% для группы А, 19% для группы В и 21% для группы С соответственно;
- медиана ОВ – 22,2 месяца (95% ДИ 9,4-54,8), 12,5 месяца (95% ДИ 7,6-16,5) и 12,7 месяца (95% ДИ 7,4- 30,5) для 3 групп соответственно;
- ЧОО – 34%, 27% и 29%. Важно отметить, что в группе А было больше пациентов с уровнем АФП <400.
Таким образом комбинация ниволумаба 1 мг/кг и ипилимумаба
3 мг/кг, 4 курса, с последующим
продолжением монотерапии ниволумабом продолжает демонстрировать эффективность во
2-й линии терапии в течении 5
лет наблюдения. Данная комбинация включена в рекомендации
RUSSCO.
Источник:
Melero I, et al.
Nivolumab plus ipilimumab
combination therapy in patients
with advanced hepatocellular
carcinoma previously treated with
sorafenib: 5-year results from
CheckMate 040. Annals Oncol. May
22, 2024. https://doi.org/10.1016/j.
annonc.2024.03.005.
ESMO BREAST CANCER 2024: ПРИМЕНЕНИЕ ЭКСЕМЕСТАНА + OС В АДЪЮВАНТНОМ РЕЖИМЕ УЛУЧШАЕТ ПОКАЗАТЕЛИ ВЫЖИВАЕМОСТИ У ПАЦИЕНТОК С ИНВАЗИВНОЙ ДОЛЬКОВОЙ КАРЦИНОМОЙ МОЛОЧНОЙ ЖЕЛЕЗЫ (ОБНОВЛЕНИЯ ДАННЫХ ОБЪЕДИНЕННОГО АНАЛИЗА SOFT/TEXT)
Материал подготовила А.В. Фатеева
16 мая 2024 года на конгрессе ESMO
Breast Cancer, который проходит в
настоящее время в Берлине, были
представлены дополнительные обновленные результаты исследований
III фазы SOFT/TEXT.
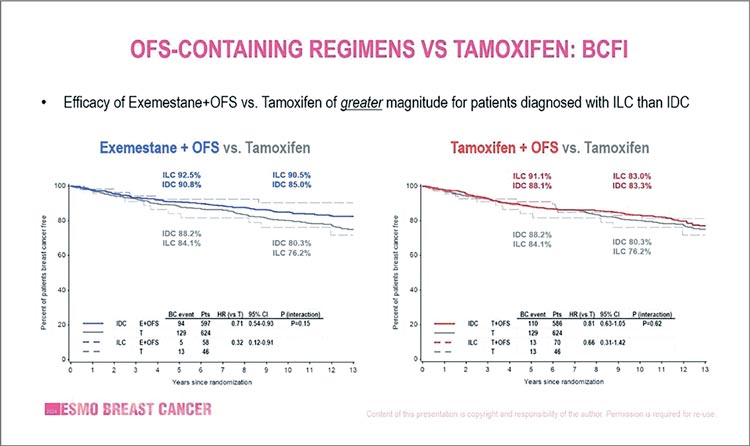
Напомним, что в объединенном анализе SOFT/TEXT сравнивались результаты у 4690 женщин в пременопаузе с HR+ ранним раком молочной
железы, рандомизированных на 5 лет
лечения эксеместаном в сочетании
с овариальной супрессией (OС) по
сравнению с тамоксифеном + OС.
После 9-летней медианы наблюдения
эксеместан + OС значительно улучшили безрецидивную выживаемость
(ВБП) и отдаленный интервал без рецидивов, но не общую выживаемость
(OВ), по сравнению с тамоксифеном
+ OС.
Опубликованные в прошлом году
результаты 12-летнего наблюдения
продемонстрировали абсолютные
улучшения как при 12-летней ВБП
(+4,6%), так и при отдаленный интервал без рецидивов (+1,8%) в популяции ITT.
Общая выживаемость была отличной при обоих методах лечения, но
не улучшалась при применении эксеместана + OС (90,1% против 89,1%
у пациенток, которым назначали тамоксифен + OС); отсутствие улучшения выживаемости при применении
эксеместана + OС, по крайней мере
частично, объясняется ранними,
стойкими благоприятными исходами
при применении тамоксифена + ОС в
HER2-позитивной подгруппе.
При этом среди пациенток с HER2-
отрицательными опухолями (86,0%
популяции с ITT) абсолютное улучшение 12-летней OВ при применении
эксеместана + OС составило 2,0% (HR
0,85; 95% ДИ 0,70-1,04) и 3,3% у тех,
кто получал химиотерапию (45,9%
популяции с ITT).
Общее улучшение выживаемости
было клинически значимым у пациенток из группы высокого риска, например, у женщин в возрасте <35 лет
(4,0%) и у женщин с опухолями >2 см
(4,5%) или 3 степени (5,5%).
Рисунок 1.
Результаты анализа SOFT/TEXT: интервал без рецидива в группах больных
с люминальными А и В опухолями.
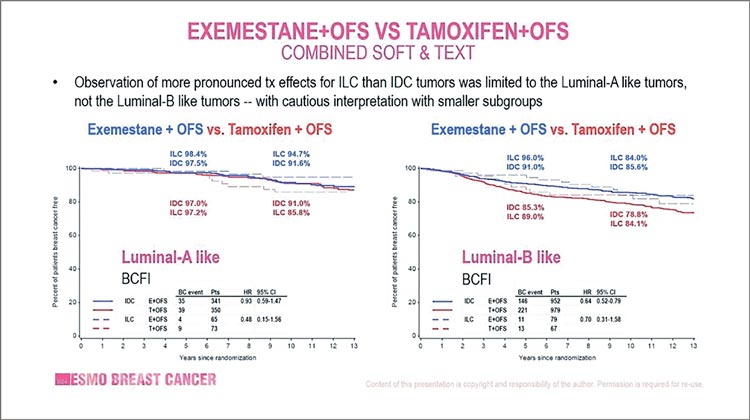
Дополнительный анализ, представленный на конгрессе ESMO, показал для нас очень важные данные. В
результате 12-летнего наблюдения
было продемонстрировано, что выживаемость пациенток с инвазивным
дольковым раком (n=345) значительно улучшается от комбинации эксеместана + OС по сравнению с только
тамоксифеном и тамоксифеном + OС.
Отдаленный интервал до рецидива в
группах сравнения эксеместан + OС
vs тамоксифен + OС для люминального А подтипа инвазивного долькового рака составил 98,4% против 94,7%
(HR 0,48; 95% ДИ 0,15-1,56) и 96,0%
против 84,0% (HR 0,70; 95% ДИ 0,31-
1,58) для люминального В подтипа соответственно.
Рисунок 2.
Результаты анализа SOFT/TEXT: результаты в группах с дольковым и протоковым
раком.
Абсолютный выигрыш выживаемости также был продемонстрировал
в пользу эксеместана + OС против
только тамоксифена (HR 0,32; 95% ДИ
0,12-0,91) у пациенток с инвазивным
дольковым раком.
Таким образом, результаты данного
анализа демонстрируют значимое
снижение риска рецидива в адъювантной терапии при приеме эксеместана с овариальной супрессией по
сравнению с тамоксифеном ± овариальной супрессией у пациенток в пременопаузе с инвазивным дольковым
раком молочной железы. Этот анализ
позволит более тщательно отбирать
пациенток, которым эксеместан в сочетании с овариальной супрессией
принесет большую пользу, чем тамоксифен.
КОМПЛЕКСНЫЙ ОБЗОР МЕТОДОВ ЛЕЧЕНИЯ МЕТАСТАЗОВ КОЛОРЕКТАЛЬНОГО РАКА
Материал подготовила А.В. Фатеева
22 мая Current Oncology Reports опубликовал большой обзор по всем
существующим методам лечения
метастазов колоректального рака
(КРР): от хирургического лечения и
химиотерапии до SBRT и трансартериальной химиоэмболизации.
Тактика лечения пациента с метастазами КРР требует мультидисциплинарного подхода и должна учитывать
распространенность процесса, состояние больного, биологию опухоли, мутационный статус. Данный обзор объединяет все текущие знания о
преимуществах и вариантах различных методов лечения.
Если тезисно, то:
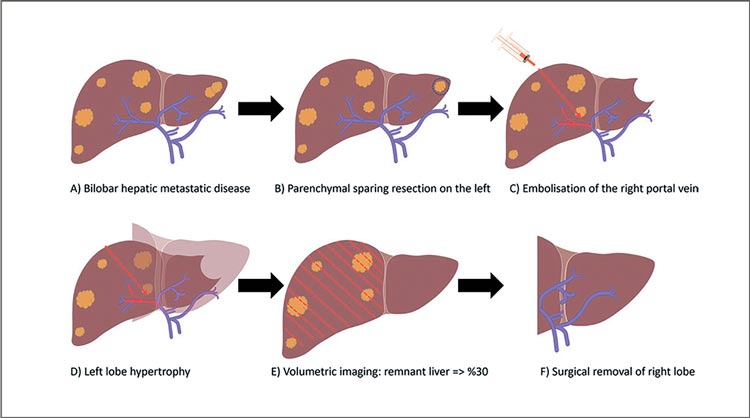
- МРТ с гепатоспецифическим контрастом (гадоксетиновая кислота) более чувствительна и специфична при выявлении метастазов КРР в печени, особенно небольших поражений, и у пациентов со стеатозом печени после химиотерапиию
- Только 20% пациентов считаются операбельными на момент постановки диагноза.
- В хирургическом лечении метастазов КРР приоритетным является достижение резекции R0 при сохранении по крайней мере 30% RLV или отношения RLV к массе тела ≥0,5%. При этом для пациентов с мутацией RAS может быть полезным рассмотреть анатомическую резекцию (вместо резекции с сохранением паренхимы) и/или более широкий хирургический край (>1 см) для оптимизации хирургического подхода. Однако дебаты об этом ещё продолжаются.
- Рекомендуемая продолжительность периоперационной химиотерапии составляет 6 мес., с учетом пред- и послеоперационной, на основании результатов исследования EORTC 40983.
- В исследовании III фазы CAIRO5 (n=300) у пациентов с неоперабельными метастазами в печень и правосторонней локализацией опухоли с мутацией RAS/BRAF комбинация FOLFOXIRI + бевацизумаб на срок до 6 мес. улучшила ВБП по сравнению с FOLFOX/FOLFIRI + бевацизумаб (11 мес. vs 9 мес.).
- Для пациентов с MSI-H и без противопоказаний к иммунотерапии оправдано применение ингибиторов контрольных точек, на основании результатов KEYNOTE-177 и CheckMate142.
- SBRT обеспечивает превосходный локальный контроль по сравнению с радиочастотной абляцией (RFA) при опухолях размером более 2 см. Данные метаанализа демонстрируют 1- и 2-летнюю ОВ 67% и 57% соответственно.
- Предпочтение в пользу трансартериальной химиотерапии стоит отдавать у пациентов с обширными поражениями печени и тем, кто не подходит для хирургического лечения (рис.1).
Рисунок 1.
Выбор лечебного подхода
при множественном поражении печени.
Источник:
Karaoğlan BB, Öz DK,
Araz MS, et al. Advancements in the
Management of Synchronous Colorectal
Liver Metastases: A Comprehensive
Review of Surgical, Systemic, and Local
Treatment Modalities. Curr Oncol Rep.
2024. https://doi.org/10.1007/s11912-
024-01548-z.
КТО ИЗ ПАЦИЕНТОВ С МЕТАСТАТИЧЕСКИМ РАКОМ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ ВЫИГРЫВАЕТ ОТ ПОДДЕРЖИВАЮЩЕЙ ТЕРАПИИ ЛЕЙКОВОРИНОМ И ФТОРУРАЦИЛОМ В ПЕРВОЙ ЛИНИИ ТЕРАПИИ?
Материал подготовила А.В. Фатеева
Результаты ретроспективного поданализа многоцентрового клинического исследования II фазы
PA NOP T I MOX - P RODIG E - 3 5 ,
опубликованные в журнале The
Oncologist, демонстрируют любопытные данные о наличии предикторов, влияющих на эффективность
стратегии поддерживающей терапии
LV-5FU2 у пациентов с метастатическим раком поджелудочной железы в
первой линии терапии.
Ранее в данном исследовании было
показано, что поддерживающая стратегия после 8 курсов FOLFIRINOX
не влияла на частоту ВБП через 6
месяцев (42,9% против 47,1%) и медиану ОВ (11,2 месяца против 10,1
месяца) по сравнению с 12 циклами
FOLFIRINOX, а также была связана
с большей медианой выживаемости
без ухудшения показателей качества
жизни. Однако предположение о
том, что стратегия поддерживающей
терапии может быть полезна далеко
не для всех пациентов, позволила исследователям провести дальнейший
анализ, целью которого стало выявление клинико-биологических факторов, которые могли бы предсказать
прогноз и пользу поддерживающей
стратегии LV5FU2 на основе анализа
пациентов, включенных в исследование PANOPTIMOX-PRODIGE-35.
В качестве потенциальных предикторов у пациентов, разделенных на
группы А и В (группа А (n=88) получала 12 курсов FOLFIRINOX и группа В (n=91) – 8 курсов FOLFIRINOX
с последующей поддерживающей
терапией), оценивалось влияние
возраста, пола, индекса массы тела,
ECOG, первичной резекции опухоли, количества метастатических
очагов, наличия метастазов в печени
или по брюшине, соотношения нейтрофилы/лимфоциты, количества
тромбоцитов, уровня гемоглобина,
количества лейкоцитов, уровня щелочной фосфатазы, общего билирубина, альбумина в сыворотке крови
и уровня СА19,9.
Первичной конечной точкой
была медиана ВБП. В результате
было обнаружено, что пациенты
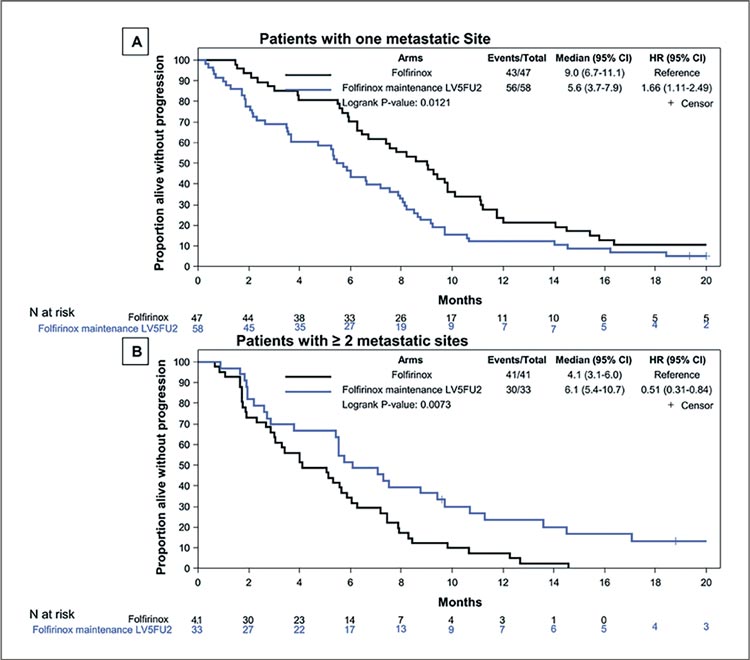
с наличием только 1 метастатического очага имели более длительную ВБП в группе 12 курсов
FOLFIRINOX, чем в группе 8 курсов FOLFIRINOX с поддерживающей терапией (9,0 мес. против
5,6 мес.; HR 1,66; 95% ДИ 1,11-2,49;
р=0,01). Но у пациентов с ≥2 метастатическими очагами польза от поддерживающей терапии
оказалась статистически значимой по сравнению с 12 курсами
FOLFIRINOX (6,1 мес. против 4,1 мес.; HR 0,51; 95% ДИ 0,31-0,84;
р=0,009) (рис.1).
Рисунок 1.
ВБП в группах в зависимости от количества
метастатических очагов.
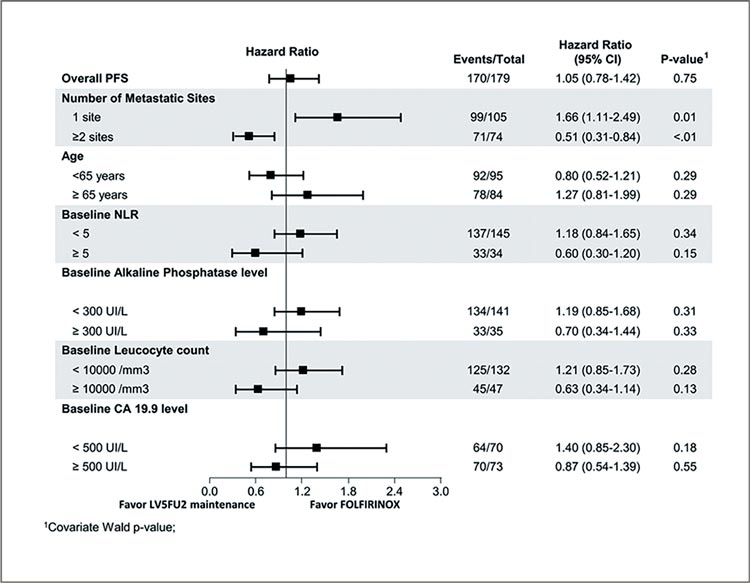
Кроме того, исследование показало наличие пользы от поддерживающей терапии в зависимости и
от других факторов, например, от
стратегии поддерживающей терапии в большей степени выигрывают
пациенты с высоким уровнем СА19-
9 (рис.2).
Результаты данного поданализа наверняка могут быть полезны и для
нашей практики в плане более тщательного отбора пациентов для стратегии поддерживающей терапии.
В рекомендациях RUSSCO сегодня
допускается перевод пациентов на
поддерживающую терапию фторпиримидинами после 16 недель
mFOLFIRINOX в первой линии терапии.
Рисунок 2.
Показатели ВБП в подгрупповом анализе.
Источник:
Boisteau E, et al., for the
PRODIGE 35 Investigator/Collaborators.
Clinico-biological factors predicting the
benefit of the LV5FU2 maintenance
strategy as a first-line therapy in patients
with metastatic pancreatic cancer, The
Oncologist. 2024; oyae079. https://doi.
org/10.1093/oncolo/oyae079.
STAS: НОВЫЙ ПРОГНОСТИЧЕСКИЙ ФАКТОР ПРИ НЕМЕЛКОКЛЕТОЧНОМ РАКЕ ЛЕГКОГО
Локализованные стадии немелкоклеточного рака легкого (T1-2N0) характеризуются наиболее благоприятным прогнозом и у большинства
пациентов не требуют проведения
адъювантной химиотерапии. Тем не
менее, даже ранние стадии НМРЛ
неоднородны по своим молекулярно-генетическим и гистологическим
характеристикам и могут быть дополнительно классифицированы на
подгруппы низкого и высокого риска. К негативным гистологическим
факторам относят низкую степень
дифференцировки опухоли (G3),
наличие лимфо-васкулярной (LVI),
периневральной (Pn) или плевральной инвазии (PL) и размер опухоли
>3 см. Авторы опубликованного в
2022 году исследования показали,
что наличие LVI или опухоли >2
см ассоциируется с достоверным
ухудшением показателей общей выживаемости (ОВ) и выживаемости
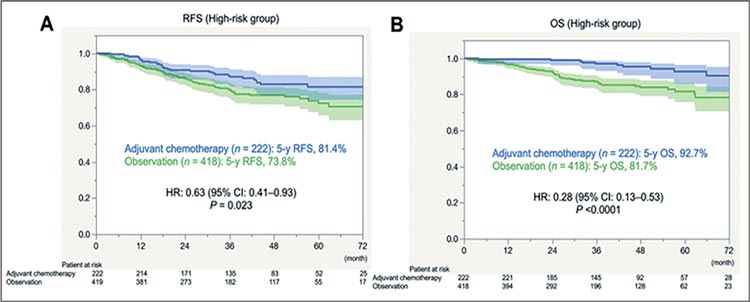
без прогрессирования, а также коррелирует с эффективностью адъювантной химиотерапии (АПХТ) [1].
Так, проведение АПХТ у пациентов с
I ст. НМРЛ в группе высокого риска
позволило увеличить 5-летнюю ОВ
до 92,7% по сравнению с 81,7% (ОР
0,28; p<0,0001) и 5-летнюю ВБП до
81,4% по сравнению с 73,8% (ОР 0,63;
p=0,023) (рис.1).
Рисунок 1.
ВБП и ОВ при проведении АПХТ пациентам
с факторами высокого риска.
Поиск других потенциальных маркеров привел к идентификации в
2015 году нового фактора – распространения опухоли по воздушным
пространствам (Spread Through Air
Spaces, STAS), характеризующегося
аналогичным влиянием на выживаемость больных. В настоящий момент
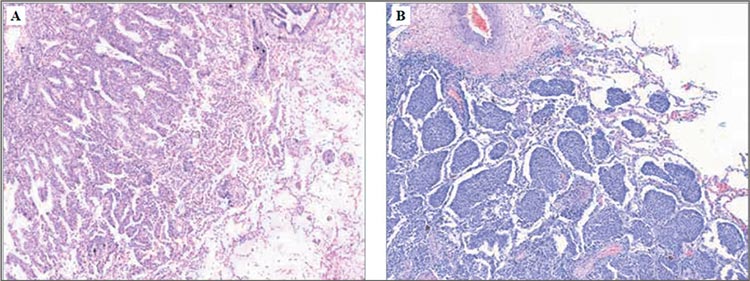
под данным термином подразумевается наличие в просветах альвеол
вблизи опухолевого узла солидных,
микропапиллярных структур и единичных опухолевых клеток (рис.2)
[2]. Считается, что STAS связано с дефицитом белка E-кадгерина и сигнализирует о нарушении адгезивных
свойств опухолевых клеток и, как
следствие, повышенном риске гематогенного распространения. В то же
время, прямое прогностическое значение данного маркера длительное
время оставалось неизвестным, что
не позволяло инкорпорировать его в
клиническую практику.
В марте 2024 года в Journal of Thoracic
Oncology были опубликованы результаты крупного исследования,
включившего данные 4061 пациента
с I ст. НМРЛ после проведенного радикального хирургического лечения
[3]. Первичные конечные точки работы включали оценку выживаемости без прогрессирования и общей
выживаемости у пациентов с наличием или отсутствием STAS. Помимо этого, было изучено влияние объема хирургического вмешательства
(лобэктомия/сублобарная резекция)
на отдаленные результаты лечения в
зависимости от статуса данного маркера.
Рисунок 2.
STAS при аденокарциноме (A) и плоскоклеточном
раке легкого (B). Окраска гематоксилином и эозином, х100.
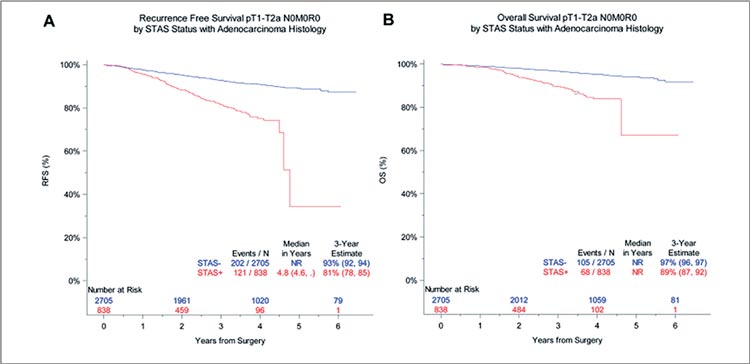
Распространение опухоли по воздушным пространствам определялось у 23,7% пациентов с аденокарциномой и у 16,8% с плоскоклеточным
раком, а также превалировало среди
больных >65 лет (p<0,0001), с высокозлокачественными опухолями
(G3-4, p<0,0001), лимфоваскулярной инвазией (p<0,0001), плевральной инвазией (p<0,0001) и T>3 см
(p=0,0002). Как и в предшествующих работах, идентификация STAS
являлась негативным прогностическим фактором вне зависимости от
гистологического варианта НМРЛ.
При аденокарциноме STAS ассоциировалось со статистически достоверным снижением 3-летней выживаемости без прогрессирования
до 81% (p<0,0001) и 3-летней общей
выживаемости до 89% (p<0,0001)
по сравнению с 93% и 97% среди
STAS-негативных пациентов соответственно (рис.3). Полученные данные также были подтверждены по
результатам одномерного (p<0,001)
и многомерного (p<0,001) анализов
с поправкой на возраст, пол, гистологический тип опухоли, степень
злокачественности, размер опухоли,
объем вмешательства, LVI и Pl.
Рисунок 3.
ВБП и ОВ в зависимости от статуса STAS при
аденокарциноме легкого.
В то же время обнаружение STAS
при плоскоклеточной и «прочих» гистологических формах НМРЛ коррелировало с более выраженным ухудшением показателей выживаемости.
Так, распространение опухоли по
воздушным пространствам сопровождалось снижением 3-летней ВБП
до 67% (по сравнению с 79%, p=0,008)
и 3-летней ОВ до 71% (по сравнению
с 86%, p=0,004) (рис.4).
Рисунок 4.
ВБП и ОВ в зависимости от статуса STAS
при «прочих» гистологических вариантах НМРЛ.
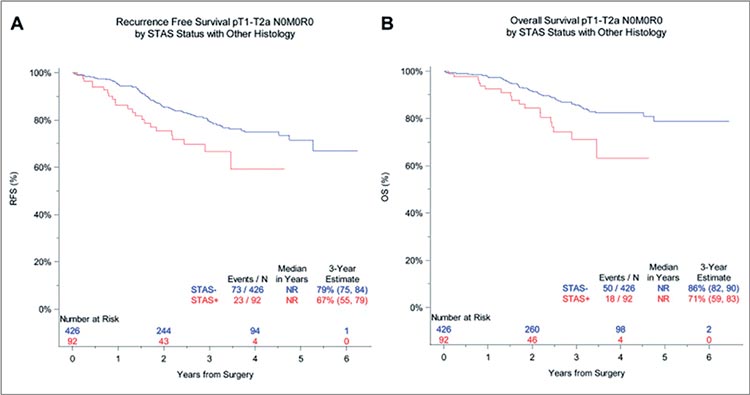
Рисунок 5.
Общая выживаемость в зависимости
от объема хирургического вмешательства при STAS.
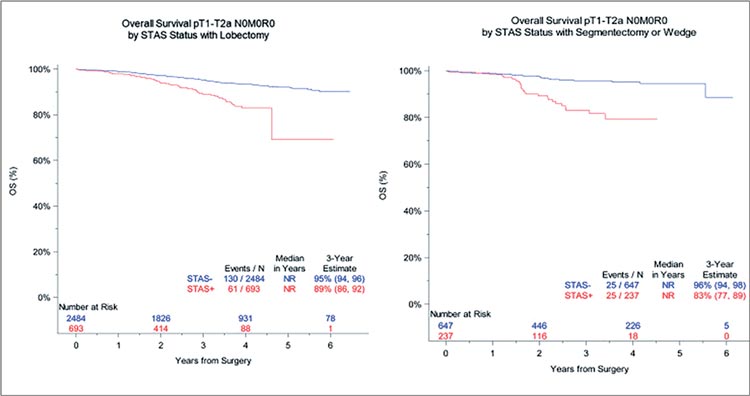
Не меньший интерес представляет влияние объема хирургического
вмешательства при STAS на отдаленные результаты лечения НМРЛ.
Напомним, не так давно в рамках исследований CALGB 140503/Alliance
[4] и JCOG0802 [5] была продемонстрирована равная эффективность
лобэктомий (ЛЭ) и сублобарных резекций (СЛР) у пациентов с I ст. заболевания. Авторами данной работы, в свою очередь, были получены
несколько отличающиеся результаты. Так, обнаружение STAS в морфологическом материале ассоциировалось со снижением 3-летней ВБП до
73% и ОВ до 83% при выполнении
сублобарной резекции по сравнению с 82% и 89% при выполнении
лобэктомии соответственно (рис.5).
В то же время, подобное сравнение
является непрямым, а оценка влияния объема вмешательства на ОВ
(p=0,618) и ВБП (p=0,748) в рамках
подгруппового анализа не подтвердила достоверность различий, что
не позволяет однозначно говорить
о неприменимости сублобарных
резекций при наличии STAS. Идентификация в тканях лимфоваскулярной инвазии, напротив, ассоциировалась с достоверным снижением
ВБП при выполнении СЛР (p<0,001).
Таким образом, распространение
опухоли по воздушным пространствам является перспективным
прогностическим маркером при немелкоклеточном раке легкого. Полученные результаты позволили IASLC
рекомендовать его включение в 9
пересмотр классификации TNM по
НМРЛ. Однако, несмотря на свою
перспективность, важным недостатком STAS является невозможность
его оценки в рамках предоперационного обследования, что значительно ограничивает его практическую применимость с точки зрения
определения оптимального объема
операции. Более того, ввиду отсутствия крупных проспективных работ по изучению влияния АПХТ на
показатели выживаемости при STAS,
изолированная ценность данного
маркера пока остается ограниченной. Тем не менее, дальнейшее изучение STAS является верным вектором развития, а также способно
значительно расширить наше
представление о I стадии НМРЛ
и индивидуализировать тактику
лечения I ст. НМРЛ при накоплении критической массы научных
данных.
Источники:
- Tsutani Y, Imai K, Ito H, Miyata Y, Ikeda N, Nakayama H, Okada M. Adjuvant Chemotherapy for Highrisk Pathologic Stage I Non-Small Cell Lung Cancer. Ann Thorac Surg. 2022 May; 113(5): 1608-1616. doi: 10.1016/j.athoracsur.2021.04.108. Epub 2021 Jun 26. PMID: 34186090.
- Завьялова М.В. и соавт. Особенности распространения опухоли по воздушным пространствам у пациентов с немелкоклеточным раком легкого. Клин. эксп. морфология. 2023; 12(2): 25-35. DOI: 10.31088/CEM2023.12.2.25-35.
- Travis WD, et al. The International Association for the Study of Lung Cancer (IASLC) Staging Project for Lung Cancer: Recommendation to Introduce Spread Through Air Spaces as a Histologic Descriptor in the Ninth Edition of the TNM Classification of Lung Cancer. Analysis of 4061 Pathologic Stage I NSCLC. J Thorac Oncol. 2024 Mar 18; S1556-0864(24)00122-9. doi: 10.1016/j.jtho.2024.03.015. Epub ahead of print. PMID: 38508515.
- Altorki N, et al. Lobar or Sublobar Resection for Peripheral Stage IA Non-Small-Cell Lung Cancer. N Engl J Med. 2023 Feb 9; 388(6): 489-498. doi: 10.1056/NEJMoa2212083. PMID: 36780674; PMCID: PMC10036605.
- Saji H, et al.; West Japan Oncology Group and Japan Clinical Oncology Group. Segmentectomy versus lobectomy in small-sized peripheral non-small-cell lung cancer (JCOG0802/WJOG4607L): a multicentre, open-label, phase 3, randomised, controlled, noninferiority trial. Lancet. 2022 Apr.
FDA ОДОБРИЛО ИСПОЛЬЗОВАНИЕ КОМБИНАЦИИ АМИВАНТАМАБА И ПЛАТИНОСОДЕРЖАЩЕЙ ХИМИОТЕРАПИИ В ЛЕЧЕНИИ РАСПРОСТРАНЕННОГО НЕМЕЛКОКЛЕТОЧНОГО РАКА ЛЕГКОГО С МУТАЦИЕЙ В 20 ЭКЗОНЕ EGFR
Автор: Материал подготовил И.М. Боровков
Альтерации в 20 экзоне гена EGFR
занимают третье место (12%) по
распространенности среди пациентов с немелкоклеточным раком
легкого, но характеризуются практически полной нечувствительностью опухоли к зарегистрированным ингибиторам тирозинкиназы
(ИТК), демонстрирующим высокую
эффективность при мутациях Del19
или L858R. Низкая чувствительность к классическим ИТК обусловлена измененной конформацией
активного центра рецептора, не позволяющей таргетным препаратам
эффективно блокировать его сигнальный путь. Единственной возможной опцией лечения подобных
больных длительное время оставалось проведение платиносодержащей химиотерапии, позволяющей добиться объективного ответа
(ОО) у 23-29% пациентов и обеспечивающей медиану выживаемости
без прогрессирования (ВБП) от 3,4
до 6,9 мес. и медиану общей выживаемости (ОВ) от 16,2 до 24,3 мес.
Новые возможности терапии данной группы пациентов были впервые представлены в 2021 году с
публикацией результатов исследования I фазы CHRYSALIS, показавшего применимость нового биспецифического антитела к рецептору
EGFR c инсерцией в 20 экзоне (ex20)
и рецептору MET амивантамаба.
Терапия амивантамабом ассоциировалась с большей частотой объективных ответов (40%), высокой
длительностью ответа (>6 мес. у
63%) и благоприятным профилем
токсичности (нежелательные явления 3 ст. выявлены у 16%), что
мотивировало его дальнейшее изучение [1-2]. Так, осенью 2023 года
были опубликованы результаты
исследования III фазы PAPILLON,
включившего 308 пациентов с
распространенным ex20 EGFRмутированным НМРЛ [3]. Пациенты рандомизировались в группы
комбинированной химиотаргетной
терапии (экспериментальная группа) и химиотерапии с плацебо (контрольная группа) в соотношении 1 к
1, а в качестве первичной конечной
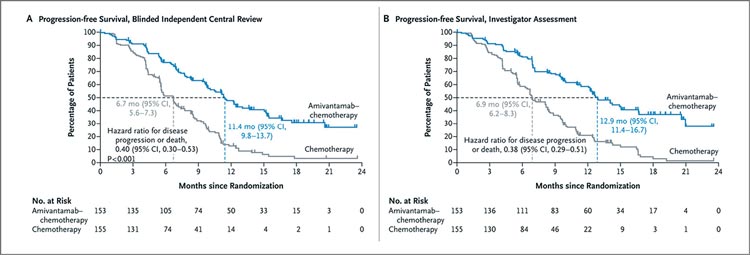
точки была выбрана выживаемость
без прогрессирования. Авторы показали, что сочетанное применение
амивантамаба и платиносодержащей химиотерапии приводило к
достоверному улучшению медианы
выживаемости без прогрессирования до 11,4 мес. по сравнению с 6,7
мес. в группе контроля (ОР 0,40;
95% ДИ 0,30-0,53; p<0,001). При
интервальном анализе данных на
18 месяце наблюдения показатель
ВБП в двух группах составил 31% и
3% соответственно, а проведенный
подгрупповой анализ продемонстрировал однозначное преимущество комбинации независимо
от факторов стратификации. Полный или частичный ответ был зарегистрирован у 73% пациентов в
экспериментальной группе и 47%
в группе контроля (ОР 1,50; 95%
ДИ 1,32-1,68; p<0,001). Медиана
длительности сохранения эффекта
составила 9,7 мес. в группе амивантамаба/химиотерапия и 4,4 мес. в
группе контроля, а на момент проведения анализа в двух группах
49% и 17% больных соответственно продолжали получать терапию.
Помимо этого, отмечалась тенденция к улучшению общей выживаемости в группе комбинированной
терапии, однако данные пока не
достигли статистической зрелости
(ОР 0,67; 95% ДИ 0,42-1,09; p=0,11).
Профиль безопасности в группе
комбинированной терапии характеризовался развитием нежелательных явлений >3 ст. у 75% пациентов
по сравнению с 54% в группе химиотерапии. При этом среди НЯ в обеих
группах преобладали нейтропения
(33% против 23%) и анемия (11%
против 12%), а у 7-11% пациентов в
группе с амивантамабом было отмечено развитие дерматологической
токсичности >3 степени.
Рисунок 1.
Выживаемость без прогрессирования в PAPILLON.
На основании представленных данных 1 марта 2024 года амивантамаб
в комбинации с платиносодержащей химиотерапией был зарегистрирован FDA в качестве терапии
1 линии у пациентов с распространенным ex20 EGFR-мутированным
немелкоклеточным раком легкого
[4]. Тем не менее, в реальной практике неизбежно возникает вопрос
оптимального метода тестирования пациентов. Так, например,
анализ биологического материала
методом полимеразной цепной
реакции (ПЦР) ассоциируется с
почти 50% вероятностью ложноотрицательного результата при мутациях в 20 экзоне EGFR. Метод
секвенирования следующего поколения (NGS) обладает значительно большей чувствительностью,
но характеризуется высокой «финансовой токсичностью», требует
длительного времени для проведения и доступен далеко не во всех
клиниках и городах, что создает
дополнительные трудности. Таким образом, расширение спектра
терапевтических возможностей
является, несомненно, важным
приобретением клинической онкологии, но в то же время поднимает
важный вопрос – кому из пациентов и на каком этапе действительно
показано проведение расширенного генетического секвенирования
для обеспечения максимальной
эффективности лечения.
Источники:
1. Nagasaka M, Goto K, Gomez JE, et
al. Amivantamab in combination with
chemotherapy in patients with advanced
non-small cell lung cancer (NSCLC).
Presented at: the 2021 World Conference
on Lung Cancer, virtual, September 8,
2021. e-poster.
2. Sabari JK, Shu CA, Park K, et al.
Amivantamab in post-platinum EGFR
Exon 20 insertion mutant non-small
cell lung cancer. Presented at: IASLC
2020 World Conference on Lung Cancer
Singapore. January 28-31, 2021. Abstract
OA04.04.
3. Zhou C, et al.; PAPILLON
Investigators. Amivantamab plus
Chemotherapy in NSCLC with EGFR
Exon 20 Insertions. N Engl J Med.
2023 Nov 30; 389(22): 2039-2051. doi:
10.1056/NEJMoa2306441. Epub 2023
Oct 21. PMID: 37870976.
4.www.esmo.org/oncology-news/fdaapproves-amivantamab-vmjw-for-egfrexon-20-insertion-mutated-non-smallcell-lung-cancer-indications.
«А ВОТ БЫЛ У МЕНЯ СЛУЧАЙ…», ИЛИ «ОХОТНИЧЬИ ЗАПИСКИ» ОНКОЛОГОВ / СТИРАЯ ГРАНИ
Авторы: Зиновьев А.И.
заведующий отделением радиотерапии ГБУЗ «ООКД» г. Пензы, к.м.н. Пенза
Дмитриев С.П.
врач – онколог, заведующий 9 онкологическим отделением
опухолей головы и шеи ГАУЗ НО НИИКО «Нижегородский областной онкологический диспансер», Пенза
Сайко М.А.
врач–онколог, радиотерапевт отделения радиотерапии ГБУЗ «ООКД» г. Пензы, Пенза
В рутинной практике врача клинициста очень часто встречаются ситуации, когда пациент не подлежит
ни одному из имеющихся на сегоднящний день в арсенале онкологов
видов специального лечения и переводится в категорию паллиативной
группы, на симптоматическое лечение.
Наш клинический случай, возможно, заинтересует кого-то из практикующих докторов, клиницистов
и диагностов, и подведет к мысли о
том, что не все так однозначно в нашей работе.
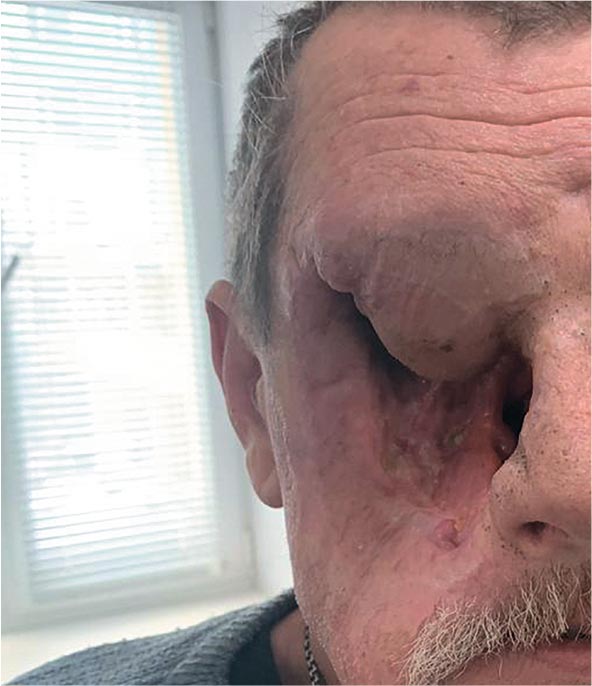
Рисунок 1.
Пациент Н. до начала хирургического лечения
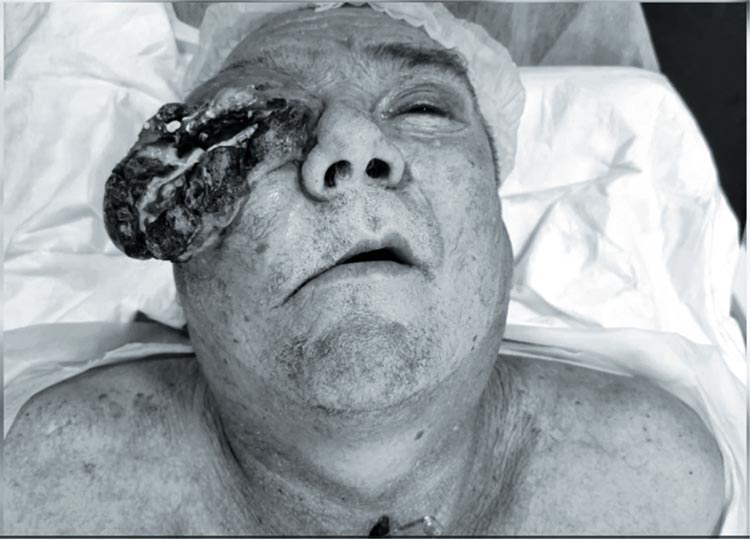
Пациент Н., 1968 года рождения, попал в наше поле зрения с диагнозом плоскоклеточный рак правой верхнечелюстной пазухи сТ4N0M0G2
- IV стадия. Из анамнеза известно,
что в июне 2022 года пациент был
экстренно госпитализирован в ЛОР
отделение ПОКБ им. Н.Н.Бурденко
на оперативное лечение. Выполнена
гайморотомия справа с биопсией.
Верифицирован умереннодифференцированный плоскоклеточный
рак. Консультирован в НМИЦ онкологии Герцена, первым этапом показано проведение 2 курсов ПХТ по
схеме DCF. Увы, лечение не принесло
эффекта, и, с учетом отрицательной
динамики на фоне ПХТ, проведена
ПЭТ/КТ с повторной консультацией в НМИЦ. Предложено хирургическое лечение, от которого пациент
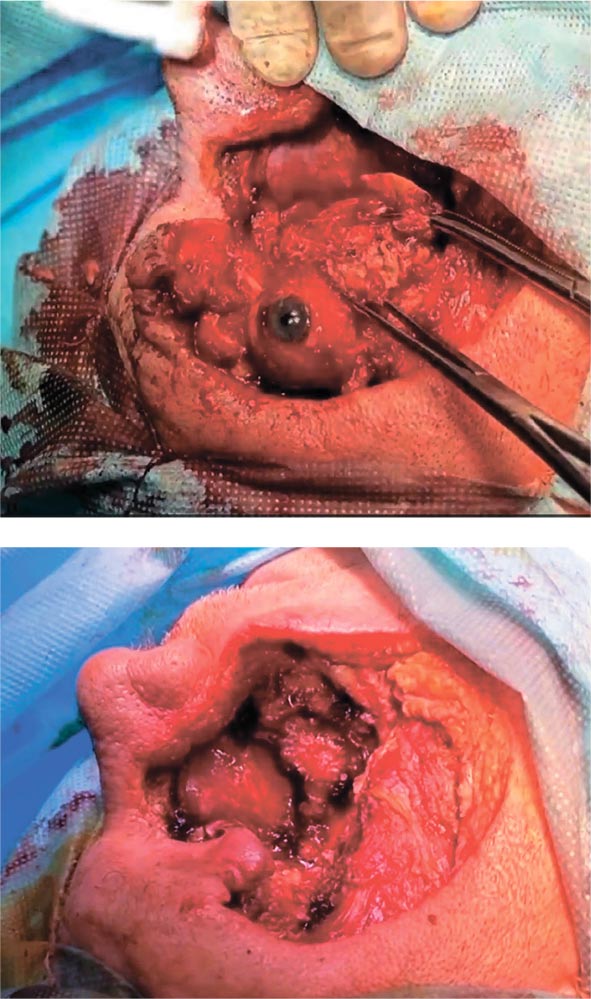
отказался, но при повторной консультации согласился на хирургический этап. 21 апреля 2023 г. в ООО «КДЛ на Измайлова» выполнена фациальная резекция без восстановления покровных тканей. Объем удаленных тканей был колоссальный
(рис.2,3), но пациент был выписан
из клиники на 6-е сутки. Повторный
консилиум по результату морфологического исследования удаленного
материала постановил необходимость химиолучевой терапии (ХЛТ)
по радикальной программе.
Рисунок 2,3.
Этапы
хирургического лечения
пациента.
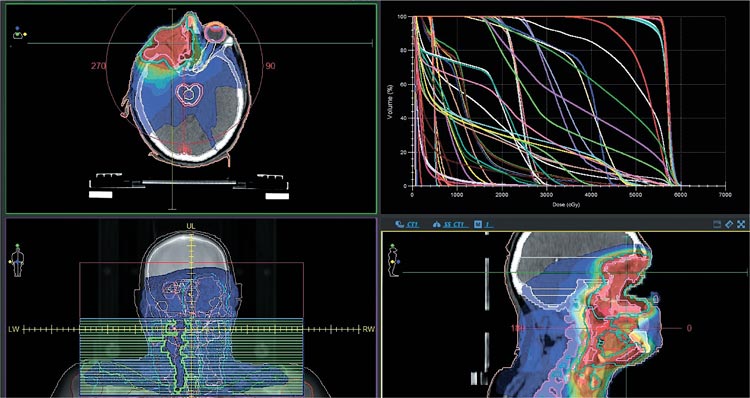
В отделении радиотерапии на базе
ГБУЗ "ООД" г. Пенза, в период с
24.05.2023 по 14.07.2023 проведен радикальный курс ХЛТ на линейном
ускорителе Elekta Infinity c КТ планированием, объёмной плоскостной
визуализацией мишени XVI, использованием систем индивидуальной фиксации головы и шеи термопластической маской, в РОД = 2 Гр,
СОД = 70 Гр на ложе опухоли и 54 Гр
на зоны регионарного лимфооттока
на фоне химиотерапии цисплатином
100 мг/м2 в 1-й, 22-й, 43-й дни. Первые недели проводимого лечения
продемонстрировали его хорошую
переносимость, очищение раневой
поверхности и постепенное закрытие язвенного дефекта. Полный курс
был благополучно завершен.
По данным МРТ от 29.11.2023
убедительных данных за наличие
продолженного роста в зоне резекции не было. По МРТ головного мозга от 17.01.2024 в зоне резекции признаков продолженного
роста также не было, но отмечены
вторичные воспалительные изменения в околоносовых пазухах, преимущественно клетках
решетчатой кости справа, а также
структурные изменения в белом
веществе правой лобной доли, вероятно, ассоциированные с продолженным ростом опухоли. На
остеосцинтиграфии от 31.01.2024
выявлена патологическая гиперфиксация радиофармпрепарата в
костях свода черепа справа, грудных позвонках, ребрах левой половины грудной клетки.
Рисунок 4.
Планируемый облучаемый объем
После установленного в феврале
2024 года прогрессирования пациент о продолжения лечения отказался. Продолжительность его жизни
после завершения лечения составила 7 месяцев, общая (с момента выявления) – 19 месяцев. Тем не менее,
остаются открытыми вечные для
практикующего онколога вопросы.
Стоит ли бороться за пациентов
паллиативной группы и прилагать
максимальные усилия, чтобы попытаться перевести их в группу, подлежащую радикальному лечению,
если предполагаемая продолжительность жизни составляет менее
года? Стоит ли рассматривать таких
пациентов на оперативное лечение
(даже с санитарной целью, с учетом
большого опухолевого объема?)
с предполагаемым последующим
пересмотром тактики специального лечения? К сожалению, нам не
удалось добиться длительной ремиссии у нашего пациента. Однако
пациент, тем не менее, перешагнул
одногодичный порог выживаемости при изначальном массивном
местнораспространенном процессе,
все это время оставался сохранным,
без прогрессирования заболевания
и даже был работоспособен. Наш
случай в очередной раз показывает,
что в современных условиях у докторов есть возможности продлить
жизнь больному, применяя не только лекарственную терапию, но и локальные методы, есть возможности
биться до конца, даже когда случай
выходит за грани существующих
стандартов.
Рисунок 5.
Пациент в
процессе лучевой терапии,
СОД = 24 Гр.
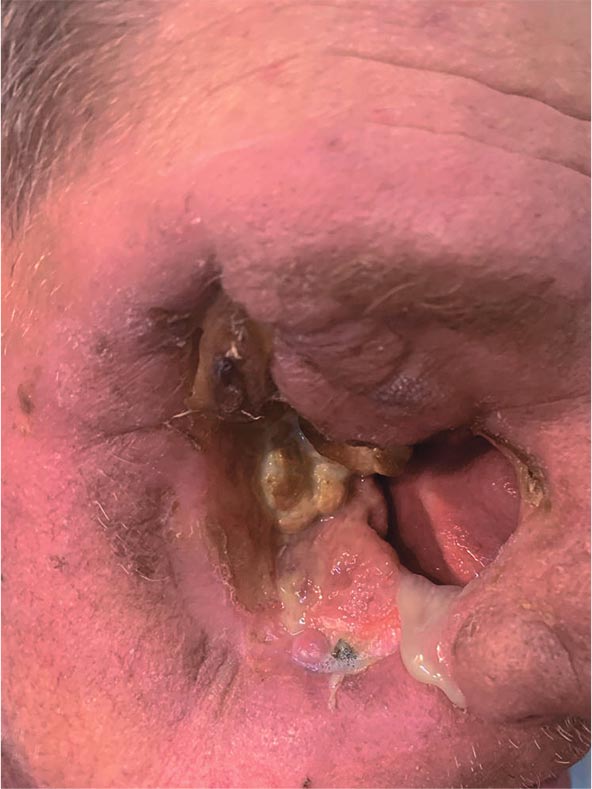
Рисунок 6.
Вид пациента
ближе к концу курса ЛТ,
СОД = 70 Гр
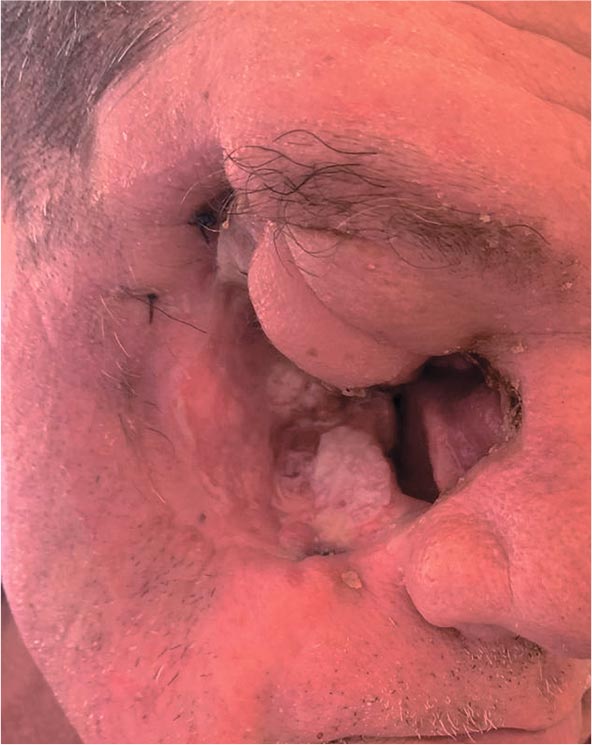
Рисунок 7.
Пациент через
6 месяцев после завершения
радикального курса ЛТ.