Дорогие коллеги, дорогие друзья!
Мы в пяти минутах от июньского лета, солнца, тепла – и от целой череды важных научных мероприятий, среди которых очередной конгресс ASCO, ESMO-RUSSCO саммит, а также конференция RUSSCO «Лучшее по материалам международных симпозиумов и конгрессов 2022». По-прежнему более десяти семинаров и вебинаров по различным темам будет проведено обществом в разных регионах страны. Сложно сказать, в каких условиях нам всем

Джон Уильям Уотерхаус «Нарциссы»,
1912. Холст, масло. Частная коллекция
***
Федор Сологуб. В мае

НЕОАДЪЮВАНТНАЯ ХИМИОИММУНОТЕРАПИЯ НЕМЕЛКОКЛЕТОЧНОГО РАКА ЛЕГКОГО
Уверенное шествие иммунотерапии, начавшееся у больных метастатическим немелкоклеточным раком легкого (НМРЛ) с прогрессированием после цисплатиновой химиотерапии, продолжившееся в первой линии и...

РАЗМЫШЛЕНИЯ В ОТРЫВЕ ОТ РУТИНЫ. ЛЕЧИТЬ ИЛИ ВЫЛЕЧИТЬ?
30 марта исполнилось уже 11 лет с момента регистрации FDA первого препарата из группы ингибиторов контрольных точек иммунитета (ИКТИ) – ипилимумаба. Хотя иногда хочется сказать – не уже 11 лет, а всего 11 лет, и эта...
ПУБЛИКАЦИИ В КРУПНЫХ НАУЧНЫХ ЖУРНАЛАХ: РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ ORATOR
Еще в доковидную эру на конгрессе ASCO 2019 года впервые были представлены результаты очень ожидаемого, неоднократно до этого упоминаемого и анонсируемого (до самого выступления авторов) рандомизированного исследования 2 фазы ORATOR по сравнению результатов хирургического и химиолучевого лечения рака ротоглотки с акцентом на снижение токсичности лечения...

КОММЕНТАРИЙ ЭКСПЕРТА
Налево пойдешь – коня потеряешь, направо пойдешь – ...

КОММЕНТАРИЙ ЭКСПЕРТА
Крайне интересное сообщение о результатах исследования ORATOR. Исследование касается исключительно ранних стадий рака ротоглотки T1-2N0-2M0. У этих пациентов есть достаточно неплохая...

КОММЕНТАРИЙ ЭКСПЕРТА
Естественно, мы, хирурги-онкологи, ожидали от исследования неоспоримых преимуществ хирургического лечения над консервативными методами и с нетерпением ждали его окончания. Однако...
НОВОСТИ ESMO BREAST 2022
С 3 по 5 мая в Берлине состоялась конференция ESMO Breast Cancer 2022, представляем результаты некоторых исследований в кратком обзоре. Патритумаб дерукстекан (HER3-DXd) при раннем гормонопозитивном HER2- негативном раке молочной железы: результаты исследования SOLTI TOTHER3. Part A....

ДИСКУССИОННАЯ СЦЕНА. СТРАТЕГИЯ «WATCH & WAIT» В РАДИКАЛЬНОМ ЛЕЧЕНИИ РАКА ПРЯМОЙ КИШКИ: ЗА И ПРОТИВ
Стремление к оптимизации результатов лечения местнораспространенного рака прямой кишки привело к созданию различных режимов комбинированной терапии. Целый ряд исследований первой...
НОВОСТИ ELCC 2022
Результаты исследования II фазы PACIFIC-6 по применению консолидирующей иммунотерапии дурвалумабом после завершенного последовательного химиолучевого лечения у больных с нерезектабельным НМРЛ III стадии были представлены на Европейском конгрессе по раку легкого 31 марта 2022 года. До сих пор дурвалумаб был рекомендован для поддерживающей терапии у...

НОВЫЕ РЕКОМЕНДАЦИИ ASTRO ПО ВЕДЕНИЮ ПАЦИЕНТОВ С МЕТАСТАТИЧЕСКИМ ПОРАЖЕНИЕМ ГОЛОВНОГО МОЗГА
В мае 2022 года Американское общество радиационной онкологии (ASTRO) опубликовало новые клинические рекомендации по ведению пациентов с метастатическим поражением головного мозга...

ЧТОБЫ ПОМНИТЬ: ПСИХОЛОГИЧЕСКОЕ СОСТОЯНИЕ ПАЦИЕНТА НА ЭТАПАХ ЛЕЧЕНИЯ
Каждый пациент со злокачественными опухолями испытывает огромную стрессовую нагрузку. Редко встречается человек, который не переживает за наличие опухолевого процесса у себя. Само...

ЗНАКОМЬТЕСЬ: КРАСНОДАРСКОЕ РЕГИОНАЛЬНОЕ ОТДЕЛЕНИЕ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ (RUSSCO)
Краснодарский край находится в северо-западной части Северного Кавказа и входит в состав Южного федерального округа. Численность населения Краснодарского края по данным...

ЭРА КОМБИНАЦИЙ: НОВАЯ ВЕХА В ЛЕЧЕНИИ ПОЧЕЧНО-КЛЕТОЧНОГО РАКА
На протяжении последних нескольких лет мы видим смену парадигмы лечения онкологических заболеваний: от таргетных препаратов – к иммунологически активным, от монотерапии ...

ЭКСТИМИЯ
Терапия полностью в срок
Анонс
-

ДАТЫ САММИТА УТОЧНЯЮТСЯ
ESMO VIRTUAL SAMMIT RUSSIA ESMO-RUSSCO 2022 саммит
-

18 -19 июня 2022
конференция RUSSCO ЛУЧШЕЕ ПО МАТЕРИАЛАМ МЕЖДУНАРОДНЫХ СИМПОЗИУМОВ И КОНГРЕССОВ 2022
Дорогие коллеги, дорогие друзья!
Мы в пяти минутах от июньского лета, солнца, тепла – и от целой череды важных научных мероприятий, среди которых очередной конгресс ASCO, ESMO-RUSSCO саммит, а также конференция RUSSCO «Лучшее по материалам международных симпозиумов и конгрессов 2022». По-прежнему более десяти семинаров и вебинаров по различным темам будет проведено обществом в разных регионах страны. Сложно сказать, в каких условиях нам всем придется работать в ближайшие месяцы или годы, но для стремления к новым знаниям и усовершенствованию собственной профессиональной деятельности не должно быть преград. Зарегистрироваться на подавляющее большинство мероприятий можно на сайте rosoncoweb.ru.
В майском номере газеты вас ожидает знакомство с региональным сообществом RUSSCO в Краснодаре. «Дискуссионная сцена» поднимет проблему актуальности подхода Watch & Wait в лечении рака прямой кишки, возможные «за» и «против» выжидательной тактики, которая в последнее время рассматривается как приемлемая даже хирургами. Вопрос выбора только консервативного лечения или хирургического (дополненного облучением или/и химиотерапией) у пациентов с ВПЧ-позитивным плоскоклеточным раком головы и шеи обсуждают наши эксперты по данным исследования ORATOR. Чрезвычайно важная информация представлена в статье на основе материалов недавних рекомендаций ASTRO по ведению больных с метастазами в головной мозг – на заметку каждому практикующему онкологу. Новости с прошедших весной европейских конгрессов по раку легкого и раку молочной железы также могут быть интересны многим.
До долгожданной поры отпусков – лишь несколько взмахов крыльев. А значит, пока не время расслабляться! Удачного вступления в лето, дорогие читатели!
Команда RUSSCO
Джон Уильям Уотерхаус «Нарциссы»,
1912. Холст, масло. Частная коллекция

***
Майские песни!
Нежные звуки!
Страсть их слагала, поёт их весна.
Радость, воскресни!
Злоба и муки —
Призраки страшные зимнего сна.
Злые виденья
Раненой жизни,
Спите до срока в мятежной груди!
Ключ вдохновенья,
На душу брызни,
Чувства заснувшие вновь разбуди!
Федор Сологуб. В мае
НЕОАДЪЮВАНТНАЯ ХИМИОИММУНОТЕРАПИЯ НЕМЕЛКОКЛЕТОЧНОГО РАКА ЛЕГКОГО
Автор: С.А.Тюляндин
Председатель Российского общества
клинической онкологии, Москва
Уверенное шествие иммунотерапии, начавшееся у больных метастатическим немелкоклеточным раком легкого (НМРЛ) с прогрессированием после цисплатиновой химиотерапии, продолжившееся в первой линии и адъювантной терапии, достигло начальной точки лечения операбельных больных – неоадъювантной системной терапии. В апрельском номере New England Journal of Medicine опубликованы результаты рандомизированного исследования CheckMate 816, в котором изучалась целесообразность добавления ниволумаба к химиотерапии на предоперационном этапе. В настоящее время неоадъювантная химиотерапия показана больным, которым по данным клинического стадирования необходимо проведение адъювантной химиотерапии. Перенос системного лечения на предоперационный этап имеет несколько преимуществ перед адъювантной терапией. Это позволяет уменьшить размеры опухоли и выполнить операцию в менее травматичном варианте с большой частотой R0 резекций, определить чувствительность опухоли к проведенной терапии, что важно для последующего выбора адъювантного лечения. Достижение полного морфологического ответа после проведенной предоперационной системной терапии достоверно и значительно снижает риск прогрессирования, в то время как больные с резидуальной опухолью демонстрируют высокий риск прогрессирования и должны в первую очередь рассматриваться как кандидаты на проведение адъювантной терапии. Рандомизированные исследования по использованию предоперационной химиотерапии показали улучшение 5-летней безрецидивной выживаемости по сравнению с системной адъювантной терапией на 5-6% при очень скромной частоте достижения pCR в 4%. Все это указывает на недостаточную эффективность химиотерапии и необходимость ее повышения. Ингибиторы PD-1/PDL1 в комбинации с химиотерапией первой линии существенно увеличили эффективность последней у больных метастатическим НМРЛ с экспрессией PD-L1. Все это послужило основанием для проведения исследования CheckMate 816 [1].
В исследование включались больные НМРЛ IB(≥4 см)–IIIA стадиями (TNM 7-е издание), ECOG 0-1, с наличием биопсии опухоли, позволяющей определить гистологию, экспрессию PD-L1 (которая определялась антителами 28-8 Agilent Dako), мутационную нагрузку, мутацию EGFR и транслокацию ALK. Больные с активирующими мутациями в исследование не включались. Все они получали 3 курса каждые 3 недели предоперационной химиотерапии (цисплатин/карбоплатин и паклитаксел/пеметрексед для аденокарциномы, цисплатин и гемцитабин для плоскоклеточного рака) и были рандомизированы в группу ниволумаба 360 мг в 1 день каждого курса химиотерапии или плацебо. Операция выполнялась в течение 6 недель после окончания предоперационной терапии, после чего разрешалось по решению врача проводить 4 курса адъювантной химиотерапии и лучевую терапию. В качестве конечных точек были выбраны частота pCR (отсутствие опухолевых клеток в первичной опухоли и удаленных лимфоузлах) и безрецидивная выживаемость, вторичными были общая выживаемость, частота R0 резекций, токсичность и частота послеоперационных осложнений.
В исследование было включено 358
больных с медианой возраста 65 лет,
преимущественно мужчины (71%),
со стадией IIIA (64%), плоскоклеточным раком (51%) и экспрессией
PD-L1 ≥1% (50%). Полностью запланированный объем предоперационной терапии получили 94% в
группе ниволумаба и 85% в группе
химиотерапии. Хирургическое лечение было выполнено у 83,2 % и
71,4% соответственно, наиболее
частой причиной отказа от операции были прогрессирование болезни (6,5% и 9,5% соответственно),
плохое функциональное состояние
и отказы больных. Медиана продолжительности выполнения операции и частота выполнения пневмонэктомий была ниже в группе
ниволумаба в сравнении с химиотерапией, частота выполнения R0
резекций составила 83,2% и 77,8%
соответственно. Адъювантную химиотерапию получали 12% и 21%
больных соответственно.
При минимальном сроке наблюдения 21 мес. медиана безрецидивной
выживаемости составила 31,6 мес.
в группе ниволумаба и 20,8 мес. в
группе химиотерапии, что соответствует достоверному снижению
относительного риска прогрессирования на 37% (HR=0,63; р=0,005).
Показатель 2-летней безрецидивной выживаемости составил 63,8%
и 45,3% соответственно. При подгрупповом анализе наибольший
выигрыш в увеличении безрецидивной выживаемости зарегистрирован у больных IIIA стадии, с аденокарциномой и экспрессией PD-L1
≥1%. Частота pCR составила 24,0% в
группе ниволумаба и 2,2% в группе
химиотерапии. У больных, достигших pCR, 2-летняя безрецидивная
выживаемость составляет >95%, у
больных с резидуальной опухолью
медиана этого показателя составляет 26,6 мес. в группе ниволумаба
и 18,4 мес. в группе химиотерапии.
Медиана общей выживаемости не
была достигнута в обеих группах,
2-летняя общая выживаемость составляет 82,7% и 70,6% соответственно, что свидетельствует о тенденции уменьшения риска смерти
на 43% (HR=0,53; р=0,008), которая
не достигла достоверности согласно
статистической гипотезе.
Частота осложнений 3-4 степени
при проведении неоадъювантной
терапии составила 33,5% в группе
ниволумаба и 36,9% в группе химиотерапии, среди которых наиболее
часто встречалась нейтропения.
Прекращение лечения вследствие
токсичности потребовалось 10%
больных в каждой группе. Частота
иммуноопосредованных реакций
1-2 степени была низкой, наиболее часто встречалась кожная сыпь
(8,5%). Фатальные исходы на фоне
лечения отмечены у 3 больных в
группе химиотерапии. Выполнение
операции было задержано вследствие токсичности у 3,4% больных
в группе ниволумаба и у 5,1% в
группе химиотерапии. Послеоперационные осложнения 3-4 степени
зарегистрированы у 11,4% и 14,8%
больных соответственно. У двух
больных в группе ниволумаба зарегистрирована смерть в послеоперационном периоде в результате
тромбоэмболии и разрыва аорты.
На основании проведенного исследования авторы делают вывод, что
добавление ниволумаба к неоадъювантной химиотерапии позволяет
достигнуть с большой частотой pCR
и улучшить показатели безрецидивной выживаемости без серьезного
увеличения токсичности и частоты
послеоперационных осложнений.
Не оспаривая сделанные выводы,
хотелось бы сделать уточнение, что
выигрыш от добавления ниволумаба был получен только у больных с
экспрессией PD-L1. Увеличение безрецидивной выживаемости в большой степени происходит за счет 24%
больных, достигших pCR. У 76%
больных с резидуальной опухолью
прогноз остается неблагоприятным,
так как половина из них демонстрирует прогрессирование заболевание
в течение 2,5 лет после хирургии. Все
это оставляет привкус неудовлетворенности при чтении результатов
исследования CheckMate 816 и сравнении их с результатами исследований NEOSTAR и NADIM.
В исследовании II фазы NEOSTAR
использование комбинации ниволумаба и ипилимумаба в качестве неоадъювантной терапии увеличило
частоту pCR до 38% по сравнению с
10% при назначении ниволумаба [2].
Эта комбинация рекомендована для
дальнейшего изучения в качестве
предоперационной, в том числе и
совместно с химиотерапией. Возможность их совместного использования была продемонстрирована
в исследовании CheckMate 9LA у
больных метастатическим НМРЛ
[3]. В исследовании NADIM 46 больным НМРЛ IIIA стадии в качестве
неоадъювантной системной терапии назначали 3 курса комбинации
ниволумаба и химиотерапии (карбоплатин-паклитаксел), что позволило 41 больному выполнить операцию. pCR была зарегистрирована
у 26 (63%) из 41 оперированных пациентов. В послеоперационном периоде всем больным назначали адъювантную терапию ниволумабом в
течение года. Показатель 2-летней
безрецидивной выживаемости для
всех 46 больных, включенных в исследование, составил 77%, 35 (85%)
из 41 оперированных больных живы
без прогрессирования.
Приведенные выше исследования
дают подсказку, как можно повысить
эффективность предоперационной
терапии и увеличить частоту pCR,
которая в исследовании CheckMate
816 остается, с моей точки зрения,
неудовлетворительной. Комбинация ингибитора рецептора CTLA4
и ингибитора PD-1/PD-L1 доказали свой синергизм в повышении
противоопухолевой активности и
в комбинации с химиотерапией у
больных метастатическим НМРЛ
и могут быть мощным индукционным режимом. Представляется целесообразным в адъюванте вместо
химиотерапии продолжение ингибирования сигнального пути PD-1/
PD-L1 для предотвращения развития прогрессирования, особенно у
больных с резидуальной опухолью.
Этот поход хорошо работал у больных НМРЛ в исследовании NADIM
и у больных операбельным раком
молочной железы в исследовании
KEYNOTE 522, продемонстрировав увеличение показателей безрецидивной выживаемости как
у больных с наличием pCR, так и
резидуальной опухоли. Будем надеяться, что проводящиеся в настоящее время исследования определят
оптимальный режим предоперационной химиоиммунотерапии
для лечения операбельных больных НМРЛ. Заслуга исследования
CheckMate 816 состоит в том, что
оно первым доказало перспективность этого подхода в лечении этой
популяции пациентов.
Литература:
1. Forde PM, Spicer J, Lu S, et
al. Neoadjuvant nivolumab plus
chemotherapy in reseactable lung
cancer. N.E.J.M. Published online:
April 12, 2022.
2. Provencio M, Nadal E, Insa A, et
al. Neoadjuvant chemotherapy and
nivolumab in resectable non-small-cell
lung cancer (NADIM): an open-label,
multicentre, single-arm, phase 2 trial.
Lancet Oncol. 2020; 21: 1413-22.
3. Paz-Ares L, Ciuleanu TE, Cobo
M, et al. First-line nivolumab plus
ipilimumab combined with two cycles
of chemotherapy in patients with nonsmall-cell lung cancer (CheckMate
9LA): an international, randomised,
open-label, phase 3 trial. Lancet Oncol.
2021; 22: 198-211.
4. Cascone T, William WN, Weissferdt
A, et al. Neoadjuvant nivolumab
or nivolumab plus ipilimumab in
operable non-small cell lung cancer:
the phase 2 randomized NEOSTAR
trial. Nat. Med. 2021; 27: 504-14.
РАЗМЫШЛЕНИЯ В ОТРЫВЕ ОТ РУТИНЫ. ЛЕЧИТЬ ИЛИ ВЫЛЕЧИТЬ?
Авторы: Жуков Николай Владимирович
ФГБУ «НМИЦ Детской гематологии, онкологии
и иммунологии им. Д. Рогачева», Москва
Жукова Людмила Григорьевна
«Московский клинический научный центр
им. А.С. Логинова ДЗМ», Москва
30 марта исполнилось уже 11 лет с
момента регистрации FDA первого
препарата из группы ингибиторов
контрольных точек иммунитета
(ИКТИ) – ипилимумаба. Хотя иногда хочется сказать – не уже 11 лет,
а всего 11 лет, и эта двойственность
неспроста. Если задуматься о том,
насколько прочно ИКТИ вошли в
нашу клиническую практику – это
очевидные «уже 11 лет»: более 1,5
десятков нозологий, несчетное количество показаний в рамках этих
нозологий, 7 препаратов из класса,
зарегистрированных у нас и еще
больше за рубежом. Препараты кажутся уже привычной рутиной, а
нерешенным является лишь вопрос,
какой конкретно препарат выбрать
для этого пациента или назначить
ИКТИ в первую или в последующие
линии лечения. Но если задаться вопросом, а что реально кроме цифр
выживаемости (безусловно, приятных и окрыляющих, но все же просто утилитарных цифр, таких же как
цифры при описании исследований
цитостатической терапии или таргетной терапии) дали нам препараты из группы ИКТИ – вот здесь, нам
кажется, необходимо использовать
«всего только 11 лет». Мы находимся лишь на начальных этапах понимания и осознания того, что принципиально нового принесли ИКТИ
в нашу клиническую практику.
А и действительно, что нам дает этот
класс препаратов? Надежду на полное излечение и бесконечный эффект при конечном по длительности
лечении? Вроде бы мы все говорим
об этом с трибун, но при этом (пока
еще позволяют ресурсы) лечим многих больных годами или вообще до
прогрессирования или непереносимой токсичности. Универсальность
эффекта? Увы, тоже нет – в ряде
нозологий препараты просто неэффективны, а в некоторых весьма
«скромно» эффективны, и кривые
выживаемости выглядят как при
классическом паллиативном лечении с конечным эффектом терапии.
Да и сами препараты оказываются
далеко не идентичны, судя по успехам и неудачам в рамках одних и тех
же нозологий (например, пембролизумаб и ниволумаб при НМРЛ).
Вопросов много, но основной из них
все же – действительно ли впервые
с эпохи ранних успехов химиотерапии мы получили вариант лечения,
способный вылечить (не сдержать,
не контролировать, а реально вылечить) макроскопическую болезнь,
т.е. пациента с наличием неудаленных макроскопических проявлений
болезни. Но и здесь, к счастью, тоже
происходят сдвиги в понимании.
Первая из статей, которую хотелось
бы привести в доказательство происходящих сдвигов в сознании, – исследование существующих трендов
в лечении больных с ранними стадиями меланомы и метастазами в
сигнальном лимфатическом узле. До
недавнего времени частым подходом к данной клинической ситуации
было выполнение полной лимфатической диссекции с последующим
наблюдением (до получения данных
об эффективности адъювантной терапии) или адъювантной терапией
(после публикации соответствующих исследований). Несмотря на то,
что результаты исследований свидетельствовали о том, что выполнение
полной лимфодиссекции в подобной
ситуации дает лишь дополнительную стадирующую информацию (у
части больных происходило увеличение стадии N и общей стадии за
счет выявления дополнительных
пораженных лимфатических узлов)
и не влияет на выживаемость, нам
было дискомфортно оставлять возможные неудаленные определяемые
опухолевые очаги в организме пациента. Более того, и регистрационные
исследования, на основании которых в нашу клиническую практику
вошла адъювантная терапия меланомы (как с использованием ИКТИ,
так и таргетных препаратов), также
предусматривали перед ее началом
выполнение полной лимфодиссекции пациентам, у которых были поражены сигнальные лимфатические
узлы. Но как показывает исследование, опубликованное в журнале Annals of surgery [1], подобный
подход быстро уходит в прошлое.
Анализ включил в себя данные 1109
больных с меланомой и поражением
сигнального лимфатического узла,
проходивших лечение в 21 центре
США, Европы и Австралии с 2017
по 2019 годы. Несмотря на столь
короткий временной интервал и
некоторые различия в зависимости
от региона и клинической ситуации
(стадии Т и размера очага в пораженном лимфатическом узле), тенденции оказались однозначными
– частота выполнения полной лимфатической диссекции снизилась
с 28% до 8%, а частота назначения
адъювантной системной терапии
возросла с 30% до 60%. И, как нам
кажется, это не просто цифры – это
прямое подтверждение происходящих «сдвигов» в сознании – от
чисто хирургического подхода для
всех определяемых опухолевых очагов (как это, например, осталось в
лечении рака молочной железы, где
при наличии пораженного сигнального лимфатического узла полная
лимфодиссекция остается обязательным компонентом лечения) или
выжидательной тактики, но опять
же с прицелом на хирургию в случае реализации макрометастазов в
лимфоузлы, к попытке системного
излечения в том числе и возможных
существующих макроочагов. А это,
в свою очередь, поднимает вопрос:
а какова будет в ближайшее время
роль локального лечения у пациентов с опухолями, при которых
существует высокая вероятность
системного излечения за счет использования ИКТИ (или, возможно, других вариантов системного
лечения). Можно и нужно ли удалять макроскопически пораженные
лимфатические узлы перед началом
адъювантной терапии? Какова роль
отступа от первичной опухоли в
случае, если пациенту планируется
адъювантное лечение?
И касаются эти вопросы не только
меланомы. Еще одним вариантом
опухолей, где можно рассчитывать
на реально драматический эффект
ИКТИ, является колоректальный
рак с микросателлитной нестабильностью/дефицитом системы
репарации ошибочно спаренных
оснований (MSI/dMMR). Недавно
опубликованное исследование [2]
свидетельствует о том, что у этих
пациентов даже в поздних линиях
лечения ограниченный по длительности (1 год) курс иммунотерапии
может приводить к достижению
длительной неподдерживаемой ремиссии. В исследование было включено 57 больных с MSI-H/dMMR
метастатическим колоректальным
раком, ранее получавших фторпиримидины, оксалиплатин и иринотекан с или без таргетной терапии.
В рамках исследования больные
получали ниволумаб 3 мг/кг вместе
с ипилимумабом 1 мг/кг каждые
3 недели, 4 цикла, с последующим
введением ниволумаба 3 мг/кг каждые 2 недели до прогрессии или
максимально 1 года терапии (что
наступит раньше). Для пациентов, у
которых после отмены терапии развивалась прогрессия заболевания,
предусматривалось возобновление
терапии ниволумабом. Половина
больных, включенных в исследование, получили как минимум 3
линии предшествующей терапии, у
18% имелась мутация BRAF V600E,
у 56% заболевание развилось на
фоне синдрома Линча. Первичной
целью исследования была частота
объективного ответа по критериям
RECIST и iRECIST, которая составила 59,7%. Контроль заболевания составил 86,0% по критериям RECIST
и 87,7% по критериям iRECIST (в
связи с наличием одного случая
псевдопрогрессии). Однако гораздо
более важными в свете обсуждаемой темы являются отдаленные
результаты лечения. При медиане
наблюдения 34,5 месяца очевидным
стало формирование плато выживаемости на очень «высоких» показателях: одногодичная выживаемость
без прогрессирования по критериям
RECIST составила 75,4%, 2- и 3-летняя – 70,0%. Таким образом, одного
года терапии оказалось достаточно
для достижения длительной ремиссии у 70% больных, что транслировалось и во впечатляющие цифры
3-летней общей выживаемости –
73,1%. Отдельному анализу были
подвергнуты 42 пациента, которые
не имели прогрессирования по
окончанию 1-годичного курса терапии. В этой группе 2-летняя выживаемость без прогрессирования
составила 92,9%. Прогрессирование
было отмечено лишь у 4 больных из
этой группы, трое из которых повторно получили ниволумаб, что у
двоих привело к достижению длящейся на момент публикации ремиссии. Таким образом, было отмечено, что шанс на прогрессирование
у пациентов, достигших ремиссии и
удержавших ее на протяжении одного года терапии, крайне невелик
даже после ее прекращения.
Однако стоит признать, что в этих
цифрах все равно есть большая
доля неопределенности в отношении шанса на излечение (и возможности излечения как такового).
Очевидно, что под излечением мы
все же понимаем полную ремиссию
– т.е. отсутствие видимых проявлений болезни. С использованием
ИКТИ все обстоит не совсем так. В
ряде случаев наблюдается новая, не
описанная для других видов терапии ситуация «сосуществования»
пациента и болезни в условиях прекращения терапии – у больного сохраняются макроскопические опухолевые очаги (т.е. достигается не
полная, а частичная ремиссия, или
даже стабилизация), однако они не
прогрессируют даже на фоне остановки терапии. И подобный феномен очевидно требует дальнейшего
изучения – как в отношении длительности сохранения подобного
«сосуществования», так и понимания механизмов его развития и
сохранения на фоне прекращения
терапии.
Источники:
1. Broman KK, Hughes TM, Bredbeck
BC, Sun J, Kirichenko D, et al;
International High Risk Melanoma
Consortium. International Center-Level
Variation in Utilization of Completion
Lymph Node Dissection and Adjuvant
Systemic Therapy for Sentinel Lymph
Node Positive Melanoma at Major
Referral Centers. Ann Surg. 2022 Jan 27.
doi: 10.1097/SLA.0000000000005370.
Epub ahead of print. PMID: 35129464.
2. Cohen R, Meurisse A, Pudiarz T,
et al. One-year duration of nivolumab
plus ipilimumab in patients with
microsatellite instability-high/mismatch
repair-deficient metastatic colorectal
cancer: Long-term follow-up of the
GERCOR NIPICOL phase II study.
2022 ASCO Gastrointestinal Cancers
Symposium. Abstract 13. Presented
February 1, 2022.
ПУБЛИКАЦИИ В КРУПНЫХ НАУЧНЫХ ЖУРНАЛАХ: РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ ORATOR
Еще в доковидную эру на конгрессе ASCO 2019 года впервые
были представлены результаты
очень ожидаемого, неоднократно
до этого упоминаемого и анонсируемого (до самого выступления
авторов) рандомизированного исследования 2 фазы ORATOR по
сравнению результатов хирургического и химиолучевого лечения
рака ротоглотки с акцентом на
снижение токсичности лечения.
Традиционно осложнения всегда
ассоциируются именно с лучевой
или химиолучевой терапией – ксеростомией, нарушением вкусового
восприятия, глотания, остеорадионекрозом. Ретроспективные
сравнительные исследования прошлого десятилетия показали, что
трансоральная роботизированная хирургия (TORS) может быть
более предпочтительной в плане
снижения осложнений, однако
прямые проспективные сравнения
не проводились. ORATOR, по сути,
единственное на данный момент
рандомизированное исследование по сравнению хирургического
подхода и химиолучевой терапии
у больных ВПЧ-позитивным орофарингеальным раком, включало,
впрочем, малое число больных из
нескольких центров Канады и Австралии – по 34 пациента в каждой группе. Авторы намеревались
продемонстрировать возможности
трансоральной хирургии (TORS) с
более традиционным методом лучевой терапии в плане уменьшения
нарушений глотания при раннем
раке ротоглотки и показать преимущества элегантного хирургического вмешательства в сравнении с
токсичным радикальным облучением [1]. Оценка производилась
с помощью специальных шкал и
опросников. Попытка не удалась:
последствия облучения оказались
менее значительны в плане усугубления дисфагии, чем TORS,
хотя разница не соответствовала уровню клинически значимых
изменений. Облучение показало
преимущества и в плане меньшего болевого синдрома с меньшим
потреблением анальгетиков, и менее выраженного тризма, и более
низкого риска кровотечений. При
этом показатели выживаемости,
общей и безрецидивной, за 5 лет не
отличались между группами.
Тем не менее, работа была продолжена, Оратор снова взял слово. В
конце апреля 2022 года в журнале
JAMA Oncology вышла публикация авторов исследования с представлением результатов ORATOR,
касающихся, в первую очередь,
именно осложнений лечения, в
том числе отдаленных [2]. Пациенты (n=61) с Т1-2 N0-2 (согласно 8
классификации) получали либо радикальный курс лучевой терапии
до СОД 60 Гр (при поражении лимфоузлов – на фоне еженедельной
химиотерапии цисплатином 40 мг/
м2), либо TORS с шейной лимфодиссекцией ± адъювантное лучевое
лечение в зависимости от полученного морфологического результата
(50 Гр за 25 фракций или 60 Гр за 30
при наличии факторов риска – позитивный край резекции или экстранодальное распространение).
Авторы постарались хорошо сбалансировать больных по базовым
характеристикам. Однако разница
в лечебных объемах была порой
значительна (уни- и билатеральные
лимфодиссекции, наличие или отсутствие адъювантного облучения,
наложение трахеостом и т.д.), тогда как в группе ХЛТ лечение было
практически одинаковым у всех
больных.
По сути, оба лечебных подхода
явились вариантами деэскалации
стандартного лечения: для ХЛТ использовались дозы меньшие, чем
обычно (60 Гр), а режим применения цисплатина подразумевал еженедельное введение в небольших
дозах, TORS же, будучи вариантом
малоинвазивного вмешательства,
способна минимизировать ухудшение качества жизни.
Увы, в группе TORS отмечено 2
смертельных случая, связанных с
оперативным лечением, поэтому
осложнения 5 степени составили 7%, в связи с чем исследование
было завершено. В группе ХЛТ
смертельных случаев не было. В
целом частота осложнений 2 степени и выше была примерно одинаКОММЕНТАРИЙ ЭКСПЕРТА
Poetae nascuntur, oratores fiunt
(Поэтами рождаются, ораторами становятся)
— Марк Туллий Цицерон
Митин Тимур
Университет Здоровья
и Науки Орегона,
Отделение радиационной
медицины, Портленд,
США
ковой (67% в группе ХЛТ и 71% в
группе TORS). При этом значимой
разницы в показателях качества
жизни в соответствии со шкалами MDADI, EORTC и др. не было,
они оставались высокими в обеих
группах. Кривые общей выживаемости и выживаемости без прогрессирования представлены на
рисунке 1, но все же требуют более
длительного периода наблюдения
за пациентами.
Рисунок 1.
Общая выживаемость и выживаемость без прогрессирования
по данным исследования ORATOR [2].
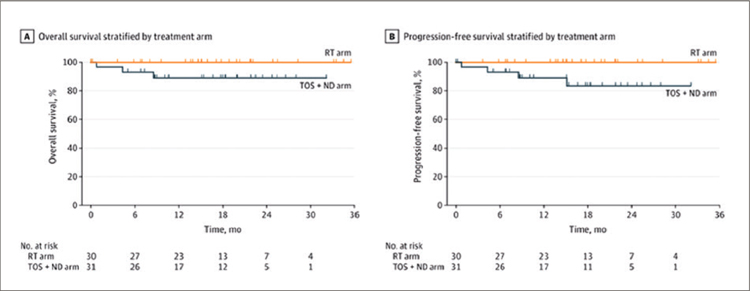
В итоге авторы сделали вывод, что
деэскалация хирургического лечения с переходом на TORS связана
с повышенным риском неприемлемой токсичности, в т.ч. фатальных кровотечений, тогда как
осложнения лучевой терапии имели иной профиль. Маловероятно,
что результаты этого небольшого,
рано завершенного исследования
позволят отказаться от дальнейшего применения трансоральной
хирургии, при этом химиолучевая
терапия остается испытанным и
надежным методом лечения. Эти
данные, скорее, еще раз подтверждают необходимость полноценного
информирования пациентов о возможных последствиях и влиянии
данных двух методов на качество
жизни и предоставления пациенту
собственного выбора.
Источники:
1. Nichols AC, et al. A phase II
randomized trial for early-stage
squamous cell carcinoma of the
oropharynx: Radiotherapy versus
trans-oral robotic surgery (ORATOR).
J Clin Oncol. 2019; 37 (suppl; abstr
6006).
2. Palma DA, Prisman E, Berthelet
E, et al. Assessment of Toxic
Effects and Survival in Treatment
Deescalation With Radiotherapy vs
Transoral Surgery for HPV-Associated
Oropharyngeal Squamous Cell
Carcinoma: The ORATOR2 Phase
2 Randomized Clinical Trial. JAMA
Oncol. Published online: April 28, 2022.
doi:10.1001/jamaoncol.2022.0615.
КОММЕНТАРИЙ ЭКСПЕРТА
Автор: Митин Тимур
Университет Здоровья и Науки Орегона,
Отделение радиационной медицины, Портленд, США
Poetae nascuntur, oratores fiunt
(Поэтами рождаются, ораторами становятся)
— Марк Туллий Цицерон
Налево пойдешь – коня потеряешь, направо пойдешь – ...
Перед таким былинным камнем оказывается большинство
пациентов с локализованным
раком ротоглотки. Идти дальше обязательно надо – прогноз
у многих пациентов, особенно с
ВПЧ-ассоциированными ранними опухолями, очень хороший,
но путь впереди трудный, болезненный, и пациенту нужно достаточно быстро принять решение,
какую дорогу выбрать – хирургическую или радиотерапевтическую.
Более ранние хирургические подходы с включением операции,
подразумевающей широкое иссечение, мандибулотомию, разделение мышц дна полости рта,
продемонстрировали высокую
частоту не только осложнений,
но и смертности в ряде наблюдательных исследований прошлого века (Parsons JT, Mendenhall
WM, Stringer SP, et al. Squamous
cell carcinoma of the oropharynx:
surgery, radiation therapy, or both.
Cancer. 2002; 94: 2967-80). По этой
причине рак ротоглотки исторически было принято лечить с
применением лучевой терапии.
Добавление химиотерапии улучшило онкологические результаты, в том числе и выживаемость
(Blanchard P, Baujat B, Holostenco V,
et al. Meta-analysis of chemotherapy
in head and neck cancer (MACHNC): a comprehensive analysis by
tumour site. Radiother Oncol. 2011;
100: 33-40), правда, ценой более
высокой токсичности, с повышением риска смерти от осложнений
лечения, по давним литературным данным, до 3% (Machtay M,
Moughan J, Trotti A, et al. Factors
associated with severe late toxicity
after concurrent chemoradiation
for locally advanced head and neck
cancer: an RTOG analysis. J Clin
Oncol. 2008; 26: 3582-89).
Развитие минимально инвазивных хирургических подходов, в
том числе и трансоральной лазерной микрохирургии (TLM) и
трансоральной роботизированной хирургии (TORS), привело к
возрождению операции в качестве первичного лечебного метода
для рака ротоглотки. В США процент больных с опухолями Т1-2,
получающих хирургическое лечение на 1 этапе, вырос с 56% в 2004
году до 82% в 2013 по причине
предпочтений самих пациентов
и соображений сниженной токсичности лечения и улучшенного качества жизни (Cracchiolo JR,
Baxi SS, Morris LG, et al. Increase
in primary surgical treatment of T1
and T2 oropharyngeal squamous
cell carcinoma and rates of adverse
pathologic features: National Cancer
Data Base. Cancer. 2016; 122: 1523-
32).
Предпочтение трансоральной роботизированной хирургии было
так велико, что авторы первого
канадского-австралийского исследования ORATOR, запущенного в августе 2012 года, с трудом
находили пациентов, готовых
на рандомизацию. Шестьдесят
восемь больных за 5 лет все же
прошли лечение по протоколу, половина была рандомизирована на
TORS с шейной лимфодиссекцией с последующим адъювантным
лечением, как это предписывала
клиническая практика: адъювантная лучевая терапия до 60 Гр
за 30 фракций в пределах 6 недель
после операции была рекомендована больным с промежуточным
риском (pT3-4, близкий край резекции, вовлеченные лимфоузлы,
лимфоваскулярная инвазия). В
случаях высокого риска рецидива
(позитивный край или экстранодальное распространение) назначалась адъювантная ХЛТ до 64
Гр за 30 фракций. Другая группа
пациентов была рандомизирована на ЛТ в дозе 70 Гр, и 72% из них
получили одновременную ХЛТ
из-за наличия клинически вовлеченных л/узлов.
Первичной конечной точкой исследования было качество жизни в связи с глотанием в течение 1 года – которое неожиданно оказалось в пользу нехирургического подхода, статистически и в абсолютных цифрах, хотя разница не была клинически значимой и со временем нивелировалась. Это был первый урок из Первого Оратора: к значительному улучшению качества жизни трансоральная операция, как первый этап лечения вместо ХЛТ, не привела. Второй урок – оба рукава в исследовании ORATOR продемонстрировали отличные результаты ОВ при p16-позитивных опухолях (составивших >92% за 2 года), и стало очевидно, что прогрессирование опухоли – локальное, региональное или отдаленное – может быть часто благополучно вылечено сальважной операцией, ЛТ или системной терапией, в том числе и иммунотерапией. И, наконец, третий урок – доселе недооцененный риск кровотечения после TORS. ORATOR обозначил 4 случая кровотечения 2 степени или выше – все из них случились в группе TORS с лимфодиссекцией, включая 2 случая токсичности 2 степени, 1 – 4 степени и 1 смерть.
Исследование вызвало немало жарких дебатов. Основная критика была направлена на хирургов, проводивших TORS для пациентов исследования; бытует мнение, что они не были достаточно профессионально подготовлены, вследствие чего результаты операции оказались субоптимальные.
В следующем протоколе авторы постарались устранить эти проблемы. Поскольку запуск исследования, набор больных и наблюдение за ними требуют значительного времени, авторы не хотели, чтобы результаты ORATOR2 устарели и не соответствовали клинической практике уже в скором будущем. Они сделали ставку на предположении, что деэскалация лечения станет уже скоро стандартной для ВПЧ-позитивного рака ротоглотки: радикальная (химио)лучевая терапия до 60 Гр за 30 фракций и адъювантная лучевая терапия до 50 Гр за 25 фракций в случае негативного края резекции и отсутствия экстранодального распространения (ЭНР). При позитивном крае или ЭНР пациенты получали 60 Гр за 30 фракций, но, что важно, – без одновременной химиотерапии.
Чтобы устранить все сомнения в отношении качества хирургии, важным требованием исследования стало то, что операции должны были выполняться высококвалифицированными хирургами, которые 1) проходили дополнительное обучение и практику от 1 года до 3 лет в аккредитованных программах после окончания специализированной хирургической резидентуры по ОГШ, 2) самостоятельно выполнили минимум 20 трансоральных орофарингеальных резекций, 3) представили оперативные заметки по 10 из этих случаев, 4) провели минимум 5 орофарингеальных резекций в течение последнего года, 5) провели минимум 30 шейных лимфодиссекций в течение года. Все хирурги, участвующие в исследовании, проверялись на качество хирургического вмешательства после каждых 5 хирургических вмешательств главным исследователем ORATOR2.
В исследовании настоятельно рекомендовалось, чтобы все хирургические пациенты подверглись трахеостомии, чтобы обеспечить защиту дыхательных путей из-за отека и кровотечения, поскольку это было сочтено причиной токсичности 5 степени в исследовании ORATOR. Из соображений предосторожности протокол требовал закрытия исследования, если смертность, связанная с лечением, достигала 5% или выше в любой из исследуемых групп. Из-за этого требования исследование и пришлось закрыть после того, как среди 31 пациента, рандомизированного в группу TORS, произошло 2 (7%) связанных с лечением летальных исхода, оба из которых произошли после того, как пациенты были оперированы TORS. Один пациент умер от ротоглоточного кровотечения в больнице на 4-й день после перенесенной резекции хорошо латерализованного рака основания языка, несмотря на наложенную трахеостому и лигирование ипсилатеральной наружной сонной артерии во время операции. Второй пациент умер от остеомиелита шейных позвонков, развившегося на ипсилатеральной стороне позвоночника через 110 дней после операции. Это осложнении связано с высоким (43%) риском смертности (Carpentier C, Bobillier C, Blanchard D, et al. Spondylodiscitis after transoral robotic surgery: Retrospective 7-case series from the GETTEC group. Eur Ann Otorhinolaryngol Head Neck Dis. 2019; 136(3): 179-183).
Поскольку исследование было закрыто раньше времени, мы никогда не узнаем его «победителя», особенно в отношении первичной конечной точки – общей выживаемости. Былинный камень так и будет продолжать лежать перед пациентами, но все же оба Оратора показали врачам и пациентам, что TORS не является однозначно наилучшим решением ни с точки зрения онкологических результатов, ни с точки зрения качества жизни. В США, с нынешними темпами вакцинации против ВПЧ, частота орофарингеальных раков будет возрастать среди более пожилых людей (70-83 лет) с 16,8 на 100 000 в 2018 г. до 29 на 100 000 в 2045 г. (Zhang Y, Fakhry C, D’Souza G. Projected Association of Human Papillomavirus Vaccination With Oropharynx Cancer Incidence in the US, 2020-2045. JAMA Oncol. 2021; 7(10): e212907), в то время как заболеваемость у более молодых пациентов начнет снижаться. В ближайшие несколько десятилетий орофарингельный рак, связанный с ВПЧ, станет болезнью пожилых пациентов, для которых нехирургический выбор в целом может быть более подходящим.
Хорошие и, как показали Ораторы, в целом схожие результаты и хирургического, и радиотерапевтического подхода в лечении ВПЧассоциированного локализованного рака ротоглотки делают еще более необходимым мультидисциплинарное обследование каждого пациента, обсуждение всех вариантов лечения, строгого контроля хирургического и радиотерапевтического качества лечения в каждой клинике с оценкой хирургического объема, квалификации врачей и соблюдения правил оконтуривания и планирования лучевой терапии.
Я всегда говорю своим пациентам, что иметь выбор в тактике лечения сложно, так как это требует от пациента принятия важного решения – но намного хуже, когда этого выбора нет.
Если бы неправильный путь был обозначен табличкой «Неправильный путь»,
никто туда и не сунулся. Проблема в том, что такие таблички никто не ставит
— Тибор Фишер, «Хорошо быть Богом»
КОММЕНТАРИЙ ЭКСПЕРТА
Автор: Романов Илья Станиславович
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России,
доктор медицинских наук, Москва
Крайне интересное сообщение о результатах исследования
ORATOR. Исследование касается
исключительно ранних стадий
рака ротоглотки T1-2N0-2M0.
У этих пациентов есть достаточно неплохая опция лечения – лучевая или химиолучевая терапия при наличии регионарных
метастазов. При этом если мы
начнем перечислять осложнения
и проблемы химиолучевого лечения, боюсь, нам не хватит двух
страниц при кратком изложении.
Это и два месяца тяжелейшего
процесса лечения с постоянными
болями при глотании, и поздние
осложнения с сухостью во рту,
стоматологическими проблемами, опасностью развития остеорадионекроза. Раньше альтернативой этому была открытая
хирургия, например, с хирургическим доступом в виде срединной мандибулотомии, трахеостомой, носопищеводным зондом.
Современная эндоскопическая
хирургия (это не только хирургия с использованием робота)
позволяет выполнять резекции
опухолей ротоглотки красиво
и элегантно под контролем микроскопа. Не надо только путать
это с кустарными тонзиллэктомиями, которые выполняются
по старинке как в ЛОР-практике.
При этом не надо забывать, что
хирургия ротоглотки требует
одномоментного удаления зон
регионарного метастазирования
как с профилактической, так
и с лечебной целью. Идея такого исследования, как ORATOR,
как раз и делает попытку предложить пациенту выполнение
аккуратной операции на первом
этапе с минимальным вредом
для его функционального и эстетического статуса и полной оценкой прогностических признаков
его опухолевого процесса, таких
как наличие регионарных метастазов, экстракапсулярной инвазии, периневральной инвазии.
В дальнейшем после такой операции пациент, возможно, вообще
избежит лучевую терапию или
получит ее в сниженной дозе.
Несмотря на неудачу, постигшую
авторов этого исследования, мне
кажется, что оно не последнее
в попытках выполнить деэскалацию лечебных режимов при раке
ротоглотки.
КОММЕНТАРИЙ ЭКСПЕРТА
Автор: Саприна Оксана Александровна
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России,
кандидат медицинских наук, Москва
Естественно, мы, хирурги-онкологи,
ожидали от исследования неоспоримых преимуществ хирургического
лечения над консервативными методами и с нетерпением ждали его
окончания. Однако преждевременное прекращение исследования за
счет высокой частоты осложнений
в хирургической группе и опубликованные результаты по выживаемости и качеству жизни пациентов
на этот раз сыграли в пользу радиотерапевтов. Конечно, частота непосредственных осложнений в группе
хирургического лечения, даже при
использовании малоинвазивных
технологий, не может быть ниже таковой в группе консервативной терапии, и это необходимо обсуждать
с пациентом на этапе планирования
лечения. Если говорить о качестве
жизни пациентов в хирургической
группе, то, на мой взгляд, оно должно
различаться, хотя бы у больных после односторонней и двусторонней шейных лимфодиссекций, даже без адъювантной лучевой терапии, и сравнение неравнозначных групп вряд ли
оправданно. Рассчитывать на лучшее
качество жизни после малоинвазивного хирургического вмешательства
на области ротоглотки с шейной
лимфодиссекцией, возможно двусторонней, и с последующей лучевой терапией, даже в СОД 50 Гр, несколько
сомнительно. Неоспоримым является факт необходимости возможной
стратификации риска и персонализированной тактики после хирургического этапа, но с учетом полученных
результатов выбор остается за пациентом. Главная задача – обеспечить
баланс между безопасностью, эффективностью лечения и качеством жизни пациентов. Элегантная малоинвазивная хирургия – только в качестве
единственного метода лечения.
НОВОСТИ ESMO BREAST 2022
С 3 по 5 мая в Берлине состоялась
конференция ESMO Breast Cancer
2022, представляем результаты
некоторых исследований в кратком обзоре.
Патритумаб дерукстекан
(HER3-DXd) при раннем
гормонопозитивном HER2-
негативном раке молочной
железы: результаты
исследования SOLTI TOTHER3. Part A.
В исследовании была продемонстрирована возможность
активации противоопухолевого иммунного ответа при раннем гормонопозитивном HER2-
негативном раке молочной
железы (РМЖ) на фоне нового
конъюгата патритумаба дерукстекана (HER3-DXd).
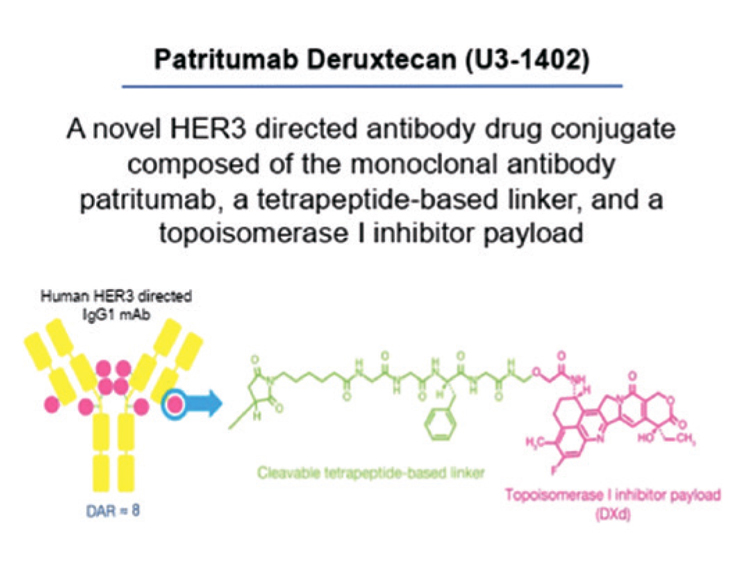
Патритумаб дерукстекан представляет собой конъюгат IgG1 к
рецептору HER3 и ингибитора
топоизомеразы I типа (рис.1). В
нескольких доклинических исследованиях было показано, что
назначение HER3-DXd приводит к снижению экспрессии PD1, LAG-3 и TIM-3 на опухолевых
клетках и увеличению инфильтрации опухоли CD8+ TILs, CD4+
TILs и NK-клетками.
Рисунок 1.
Патритумаб дерукстекан, схема.
В SOLTI TOT-HER3 Part A было
включено 77 пациентов с первично операбельным гормонопозитивным HER2-отрицательным
РМЖ, с опухолями более 1 см в
диаметре и Ki-67 >10%. Большинство пациентов, включенных в
исследование, были в пременопаузе (56%), с размером первичной
опухоли сT2 (52%) и без метастазов в регионарных лимфатических узлах (71%).
До введения HER3-DXd пациентам выполнялась биопсия опухоли, в которой оценивался уровень CelTIL (комбинированный
биомаркер, основанный на опухолевой клеточности и количестве опухоль-инфильтрирующих
лимфоцитов), повторная биопсия
выполнялась через 21 день после первой дозы HER3-DXd. Первичной конечной точкой исследования была динамика уровня
CelTIL у пациентов с экспрессией
ERBB3.
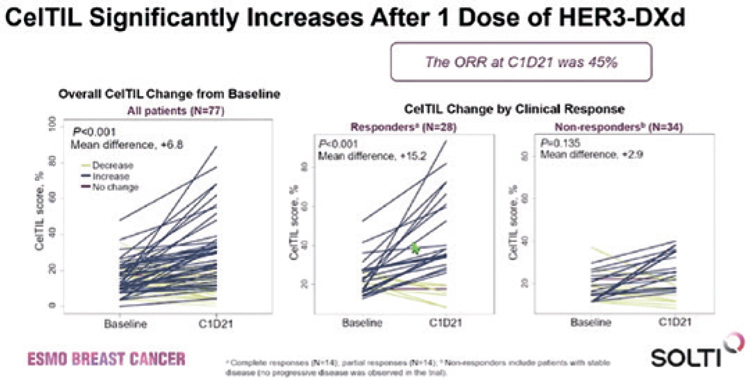
У большинства пациентов к 21
дню 1 курса было достигнуто увеличение уровня CelTIL (медиана
+6,8) при частоте достижения
объективного ответа в 45% (28
пациентов). В группе пациентов с
объективным ответом (ОО) медиана роста CelTIL составила +15,2,
при этом в 14 случаях (23%) зарегистрирован полный ответ и в
14 (23%) – частичный (рис.2). При
анализе не было выявлено связи
между уровнем экспрессии ERBB3
и динамикой CelTIL. Также было
показано увеличение уровня экспрессии генов иммунного ответа,
таких как CD68 и CD4, и подавление активности генов пролиферации, включая MKI67 и CCNB1.
Рисунок 2.
Изменение уровня CelTIL после 1 дозы HER3-DXd
Нежелательные явления (НЯ) 3
степени и более зарегистрированы у 14% пациентов и были представлены нейтропенией (8%),
повышением уровня ферментов
печени (3%) и диареей (1%).
На конгрессе были представлены первые результаты DS8201-
A-U105 – это исследование 1b
фазы, посвященное изучению
эффективности комбинации трастузумаба дерукстекана (T-DXd)
и ниволумаба в поздних линиях
лечения у пациентов РМЖ с экспрессией HER2 (IHC 3+ или IHC
2+/ISH+ и HER2 low). В работу
было включено 48 больных. Добавление ниволумаба к T-DXd
позволило достигнуть медианы
ВБП в 11,6 мес. в группе пациентов с HER2-положительным
РМЖ и 7,0 мес. в группе с низкой
экспрессией HER2, при частоте
ОО в 65,6% и 50,0% соответственно (рис.3).
Рисунок 3.
Эффективность T-DXd в комбинации с ниволумабом.
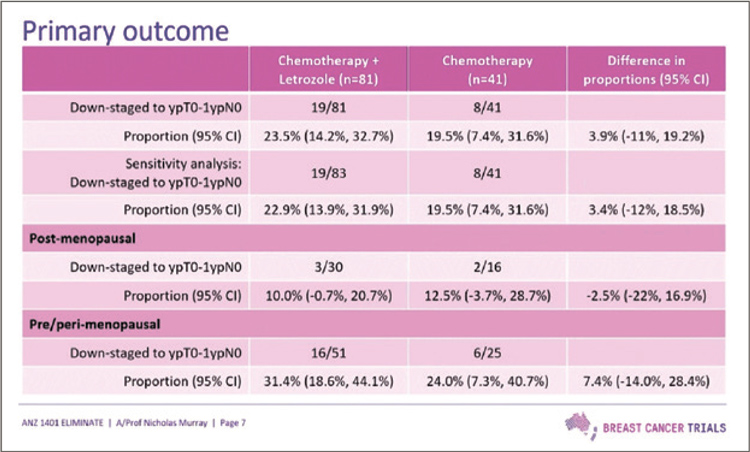
На конгрессе были представлены
результаты рандомизированного
исследования ELIMINATE, посвященного изучению добавления летрозола к антрациклин/
таксан-содержащей неоадъювантной химиотерапии (НАХТ).
В работу включены 134 пациентки cо II-III стадией гормонопозитивного HER2-негативного
РМЖ, рандомизированные в две
лечебные группы (2:1): ХТ в комбинации с летрозолом (±ГРГ) или
только химиотерапия. Первичной конечной точкой исследования было достижение уpT0-1N0.
Представленные данные продемонстрировали нецелесообразность добавления летрозола к
антрациклин/таксан-содержащей НАХТ. Подробно результаты
представлены на рисунке 4.
Рисунок 4.
Результаты исследования ELIMINATE.
Эффективность анти-HER2 терапии
у больных РМЖ с метастазами в головной мозг является актуальной
проблемой. Впервые представлены
результаты небольшого исследования 2 фазы TUXEDO-1, посвященные эффективности T-DXd у
пациентов с HER2-позитивным
диссеминированным РМЖ с симптомным метастатическим поражением головного мозга. При медиане
времени наблюдения в 11 мес. медиана ВБП достигла 14,0 мес. (рис.5А)
при частоте объективного ответа
по очагам в головном мозге в 73,3%
(11/15) (рис.5Б). Нежелательные явления преимущественно не превышали 1-2 степени и были представлены слабостью (86,7%), тошнотой
(46,7%) и диареей (26,7%). Пневмонит 2 степени зарегистрирован у 1
пациента и в 1 случае отмечено клинически значимое снижение фракции выброса левого желудочка.
Рисунок 5.
А – выживаемость без прогрессирования,
Б – частота достижения объективного ответа.

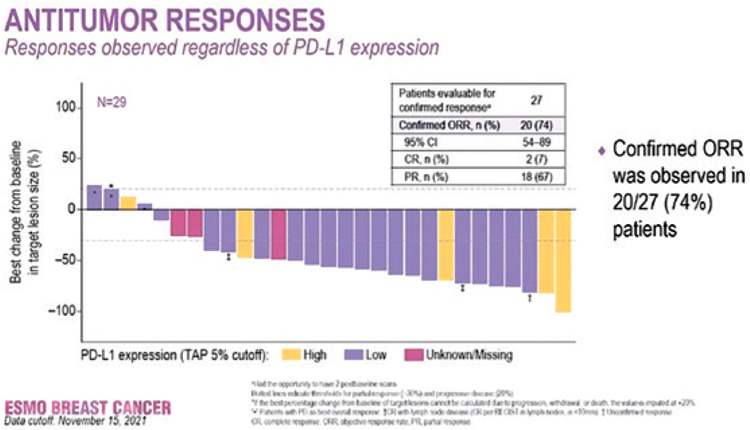
На конгрессе доложены первые результаты исследования 1b/2 фазы BEGONIA, посвященного изучению датопотомаба дерукстекана (Dato-DXd) 6 мг/кг в комбинации с дурвалумабом (D) 1120 мг каждые 3 недели в первой линии терапии неоперабельного местнораспространенного или диссеминированного трижды негативного РМЖ. В исследование включено 29 пациентов, из которых 24 продолжают терапию в настоящий момент.
При медиане времени наблюдения в 3,9 мес. частота достижения ОО составила 74% (20/27) (рис.6). НЯ любой степени зарегистрированы у всех пациентов и преимущественно представлены стоматитом (69%), тошнотой (66%) и алопецией (66%). НЯ 3-4 степени отмечены у 8 больных (28%), что в 4 случаях потребовало редукции дозы Dato-DXd.
Рисунок 6.
Частота достижения объективного ответа.
Источники:
1. Prat A, Falato C, Pare Brunet L, и др.
Patritumab deruxtecan (HER3-DxD)
на ранней стадии HR+/HER2- рака
молочной железы: окончательные
результаты исследования SOLTI
TOT-HER3 window of opportunity. Ann
oncol. 2022; 33 (suppl_3): S165-S174. doi:
10.1016/annonc/annonc890.
2. Hamilton EP, Shapiro CL, Boni
V. Primary analysis from DS8201-
A-U105: A 2-part, open label, phase 1btrial assessing trastuzumab deruxtecan
(T-DXd) with nivolumab (nivo) in
patients (pts) with HER2-expressing
advanced breast cancer. Annals of
Oncology. 2022; 33 (suppl_3): S194-S223.
10.1016/annonc/annonc894.
3. Randomized trial of neoadjuvant
chemotherapy with or without concurrent
aromatase inhibitor therapy to downstage
ER+ve breast cancer: Breast Cancer
Trials group ANZ 1401 ELIMINATE
trial. Annals of Oncology. 2022; 33
(suppl_3): S164-S165. 10.1016/j.
annonc.2022.03.107.
4. Bartsch R, Berghoff AS, Furtner J, et
al. Trastuzumab-deruxtecan (T-DXd) in
HER2-positive breast cancer patients (pts)
with active brain metastases: Primary
outcome analysis from the TUXEDO-1
trial. Ann Oncol. 2022; 33(suppl_3):
S194-S223. doi:10.1016/annonc/
annonc894.
5. Schmid P, Jung KH, Wysocki PJ, et
al. Datopotamab deruxtecan (DatoDXd) + durvalumab (D) as first-line
(1L) treatment for unresectable locally
advanced/metastatic triple-negative
breast cancer (a/mTNBC): Initial results
from BEGONIA, a phase Ib/II study. Ann
Oncol. 2022; 33(suppl_3): S194-S223.
doi:10.1016/annonc/annonc894.
ДИСКУССИОННАЯ СЦЕНА. СТРАТЕГИЯ «WATCH & WAIT» В РАДИКАЛЬНОМ ЛЕЧЕНИИ РАКА ПРЯМОЙ КИШКИ: ЗА И ПРОТИВ
Авторы: Карачун Алексей Михайлович
Доктор медицинских наук, профессор ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России и кафедры онкологии
СевероЗападного государственного медицинского университета им. И.И. Мечникова, Санкт-Петербург
Самсонов Денис Владимирович
Врач онколог отделения абдоминальной онкологии ФГБУ «НМИЦ онкологии
им. Н.Н. Петрова» Минздрава России, кандидат медицинских наук, Санкт-Петербург
СТРАТЕГИЯ «WATCH & WAIT» В РАДИКАЛЬНОМ ЛЕЧЕНИИ РАКА ПРЯМОЙ КИШКИ:
УСЛОВНО ПРОТИВ, ИЛИ НУЖНО ЛИ ДОБИВАТЬСЯ ПОЛНОГО
ОТВЕТА ВСЕМИ СПОСОБАМИ?
Стремление к оптимизации
результатов лечения местнораспространенного рака прямой
кишки привело к созданию различных режимов комбинированной
терапии. Целый ряд исследований
первой половины нашего столетия
способствовали появлению данных
о предпочтительности предоперационного облучения с химиотерапией как более безопасного и эффективного.
Группой специалистов под руководством A. Habr-Gama была сформулирована безоперационная стратегия лечения больных раком прямой
кишки с активным наблюдением после достигнутого полного клинического ответа [1]. Указанная тактика
получила название «Watch & Wait».
Другим исследователям не удалось
достичь таких же впечатляющих
результатов, что первоначально вызывало скепсис и спровоцировало
широкую дискуссию в литературе.
Однако в последующем указанная
лечебная тактика получила широкое признание и (с определенными
оговорками) была рекомендована
руководствами авторитетных онкологических организаций.
Для того, чтобы составить современную характеристику стратегии
«Watch & Wait» и ее целесообразности, постараемся дать ответы на
ряд вопросов. В чем преимущество
полного клинического ответа на лечение? Как мы можем повлиять на
частоту полного регресса опухоли?
В современных реалиях обязательно
ли добиваться полного ответа?
Преимущества достигнутого полного клинического ответа для пациента представляются вполне очевидными. Возможность избежать
операции позволяет избавиться от
риска послеоперационных осложнений, развития синдрома низкой
передней резекции прямой кишки
(который встречается в 40-90% случаев), а также постоянной стомы.
Все эти факторы крайне негативно отражаются на качестве жизни
больных. При этом предполагается, что отдаленные онкологические
результаты у пациентов, не оперированных после неоадъювантного
лечения в связи с полным клиническим ответом, сопоставимы с подобными показателями больных
после радикального хирургического вмешательства. Таким образом,
основные преимущества безоперационной стратегии – в значимом
улучшении качества жизни. Однако
остается ряд сомнений.
1. Как увеличить шансы на полный
регресс опухоли? Один из основных
инструментов – тщательный отбор
пациентов [2]. Более ранние стадии
опухоли характеризуются более высокой вероятностью достичь полного ответа на терапию. Поэтому те
исследования, куда включена такая
категория пациентов, демонстрируют относительно высокую частоту
полных регрессов опухоли. И хоть
стандартным в отношении больных
с низким риском рецидива является
хирургическое лечение, в последнее
время подобный сценарий все чаще
рассматривается для низко локализованных опухолей (как сфинктеросохраняющая технология). Ну а ранние ретроспективные работы [3],
где представлены итоги наблюдения
за пациентами, отказавшимися от
операции или имевшими к ней медицинские противопоказания (т.е.
не прошедшими селекцию), демонстрируют гораздо худшие результаты (с прогрессированием у каждого
второго больного).
Осуществлялись попытки повысить
шанс на полный регресс опухоли
путем эскалации дозы лучевой терапии. Коллектив A. Habr-Gama сообщил о увеличении частоты полного
ответа у больных категории cT2N0
до 87,5% при дозе 54 Гр (в сравнении
с 56,6% при 50,4 Гр) [4]. Датские исследователи, увеличив дозу до 60
Гр, диагностировали полный клинический ответ у 40 из 51 облученного пациента cT2-3N0-1 [5]. А вот
группа специалистов из Пенсильвании, ретроспективно изучив национальную онкологическую базу
данных, не отметила никаких преимуществ увеличения дозы более 54
Гр [6]. Надо, однако, заметить, что
исследование включало большую
долю пожилых пациентов, имевших
противопоказания к хирургическому лечению.
Брахитерапия – тоже метод повышения дозы облучения на опухоли.
В последнее время опубликованы
результаты исследований, в которых, помимо дистанционной химиолучевой терапии, применены
различные варианты брахитерапии,
что позволило достигнуть полного клинического ответа в 53-86%
случаев [7-10]. Надо отметить, что
в указанных работах преобладали
больные более ранними стадиями рака. Кроме того, технические
аспекты выполнения брахитерапии
пока не стандартизированы.
Другим вариантом модификации
лучевой терапии является краткосрочное крупнофракционное облучение (5 фракций по 5 Гр). Рандомизированное исследование
Stockholm III [11] не было нацелено
на изучение частоты полных клинических ответов и предполагало хирургическое лечение в обязательном
порядке. Оно продемонстрировало
частоту полного патоморфологического регресса после крупнофракционной терапии в 10,4%, а после
облучения в стандартном режиме –
в 2,2%. Логично предположить, что
частота полных клинических ответов при 5×5 Гр тоже должна быть
выше. Правда, пациенты получали
длительные курсы лучевой терапии
без радиосенсибилизатора. В отдельных работах частота полного
клинического ответа после крупных
фракций могла достигать и 30%, но
количество включенных в них пациентов было невелико. К сожалению,
пока недостаточно данных, чтобы
понять, имеет ли крупнофракционная лучевая терапия преимущества
над стандартной химиолучевой.
Открытым остается вопрос и об интеграции новых радиосенсибилизаторов. Опубликованные в 2010 году
итоги проспективного рандомизированного исследования ACCORD
[12] показали, что совместное использование оксалиплатина с 5-фторурацилом в ходе химиолучевой
терапии, вопреки ожиданиям, не
увеличило частоту полного регресса опухоли. Исследовалась возможность использования иринотекана,
цетуксимаба, бевацизумаба – но
пока стандартом остаются фторпиримидины (инфузионный 5-фторурацил либо таблетированный капецитабин).
Большие надежды возлагаются на
использование консолидирующей
либо индукционной химиотерапии
в сочетании с облучением. Подобная
тактика уже присутствует в различных клинических рекомендациях
(в том числе и отечественных). Она
преследует цель не только улучшить
местный контроль, но и предотвратить отдаленное распространение
опухоли в предоперационном периоде. Однако оптимальные режимы
химиотерапии и кратность циклов
– не определены. Американскими
авторами [13] были опубликованы
итоги нерандомизированного проспективного исследования 2 фазы,
где пациенты подвергались хирургическому лечению после стандартного курса химиолучевой терапии
через 6 недель, либо получали дополнительно 2, 4 или 6 циклов
консолидирующей химиотерапии
FOLFOX6 до операции. Частота полного патоморфологического регресса составила 18%, 25%, 30% и 38%
соответственно. Однако неясно, в
какой степени эти различия связаны
с прямым эффектом химиотерапии,
а в какой – с увеличением интервала
ожидания, который составил соответственно 6, 12, 16 и 20 недель. В
исследовании EXPERT-C [14] добавление таргетной терапии (цетуксимаб) к индукционной химиотерапии также не повысило частоту
полных ответов, хотя отмечен более
высокий уровень R0 резекции. Но
исследования продолжаются. Так, в
центре MSKCC в Нью-Йорке начато
рандомизированное исследование
(NCT02008656), посвященное сравнительному анализу результатов
индукционной и консолидирующей
химиотерапии. Изучается этот вопрос и у нас в стране. Специалистами
НМИЦ онкологии им. Н.Н. Блохина инициировано многоцентровое
проспективное рандомизированное
исследование (NCT04135313) эффективности комбинации индукционной и консолидирующей химиотерапии СарОх.
В современной литературе можно
найти результаты нерандомизированных исследований, демонстрирующих возможность достигнуть
полного регресса рака прямой кишки после неоадъювантной химиотерапии без облучения. Отдельные
авторы [15-17] сообщают о полном
ответе с частотой 25-33%. Однако
отсутствие групп сравнения и малое
количество наблюдений в данных
работах не позволяют пока делать
выводы о преимуществах данного
метода относительно стандартной
тактики лечения.
2. Когда оценивать результаты
консервативного лечения? Технически простым, но не менее важным
методом повышения степени регресса опухоли является увеличение
временного интервала между завершением неоадъювантной терапии и
моментом оценки достигнутого результата. Анализ опубликованных
на текущий момент исследований,
ориентированных на оценку стратегии «Watch & Wait», показал, что
диагностика полного клинического
ответа производилась в широком
временном интервале от 4 до 20 недель [2]. Следовательно, оптимальный интервал для оценки полного
регресса к настоящему времени, к
сожалению, все еще не определен.
В 1999 году были опубликованы
результаты рандомизированного
исследования Lyon R90-01 [18], авторы которого отметили нарастание
явлений постлучевого регресса к 6-8
неделе после облучения в сравнении
с 2-недельным периодом ожидания. Анализ данных, полученных в
рамках Голландского хирургического колоректального аудита (Dutch
Surgical Colorectal Audit, DSCA) [19],
показал оптимальный временной
интервал после завершения химиолучевой терапии до хирургического
лечения в 10-11 недель. В 2016 г. были
сообщены промежуточные результаты британского проспективного
рандомизированного исследования
NCT01037049 [20], продемонстрировавшие значимое нарастание выраженности постлучевого регресса
к 12 неделе наблюдения в сравнении
с 6-недельным сроком после завершения химиолучевой терапии. В
том же году представлены итоги III
фазы французского мультицентрового рандомизированного исследования GRECCAR-6 [21], авторы
которого не отметили преимуществ
11-недельного интервала ожидания
перед 7-недельным по выраженности постлучевого регресса. В 2021 г.
опубликован объединенный анализ
результатов лечения 3085 больных
раком прямой кишки из 7 рандомизированных исследований [22].
Отмечено, что 95% всех случаев
полного патоморфологического ответа диагностированы в течение
первых 10 недель после завершения
облучения. Дальнейшее ожидание
не влияло на частоту местных рецидивов, отдаленных метастазов и
общую выживаемость. Авторы сделали вывод, что оптимальный срок
ожидания для достижения полного
ответа – 10 недель. Современные
клинические рекомендации по лечению рака прямой кишки регламентируют хирургическое лечение после завершения лучевой терапии в
сроки от 4 до 16 недель. Таким образом, к сожалению, на данном этапе
у специалистов нет единого мнения
о том, какой период ожидания после
облучения допустим, а какой – уже
неприемлем и опасен возобновлением роста опухоли.
3. К вопросу о «спасительной хирургии». Накопленный к настоящему времени опыт позволяет предполагать, что стратегия «Смотри и
Жди» является безопасной и эффективной у пациентов с достигнутым
полным ответом. Так, опубликованные в 2017 году результаты метаанализа 23 исследований не показали
достоверных различий в частоте
местного рецидива, канцер-специфической смертности и общей выживаемости между подвергнутыми
наблюдению пациентами с полным
клиническим ответом и больными,
у которых полный патоморфологический регресс диагностирован
после радикального вмешательства
[23]. Частота локального возобновленного роста в течение первых 2
лет составила 15,7%, при этом 95,4%
пациентов подверглись «спасительной хирургии».
С другой стороны, безрецидивная
выживаемость в том же метаанализе
оказалась достоверно лучше у оперированных пациентов с полным
патоморфологическим ответом.
Имеются сообщения [24, 25], что у
лиц с возобновленным опухолевым
ростом достоверно возрастал риск
отдаленного метастазирования, или
публикации [26], демонстрирующие
худшую отдаленную выживаемость
при полном клиническом ответе в
сравнении с полным патоморфологическим.
В связи с более выраженным фиброзом «спасительная» хирургия
при возобновленном росте представляется технически более сложной процедурой и сопровождается
большим количеством осложнений,
чем плановое оперативное вмешательство [2]. У 2-3% пациентов «спасительная» хирургия неосуществима из-за нерезектабельной местной
инвазии [27].
При отказе от оперативного вмешательства требуется длительный
и плотный динамический мониторинг в специализированных центрах, что не всегда удобно и доступно не всем пациентам.
4. Надежная диагностика полного
регресса. Еще одной проблемной
стороной описываемой стратегии
является невозможность на данном
этапе развития диагностических
технологий надежно регистрировать полный регресс опухоли прямой кишки. Так, эндоскопический
метод не обладает достаточной чувствительностью [28-30]. Сомнительна польза рутинного выполнения
биопсий. Проведенные исследования не демонстрировали преимущества данного подхода перед оптической оценкой эндоскописта [30], да
и количество ложноотрицательных
результатов велико.
Эталонным методом оценки постлучевого регресса в настоящее время
стала магнитно-резонансная томография. Однако результаты опубликованного в 2016 году голландского метаанализа [31] показали, что
МРТ может быть более полезной
для исключения полного ответа,
чем для его подтверждения. Самую
серьезную проблему представляет
регистрация состояния лимфатического аппарата прямой кишки. По
данным другого метаанализа (тоже
из Нидерландов), чувствительность
и специфичность МРТ при диагностике регионарных метастазов
составляет 76,5%, и 59,8% соответственно [32].
Позитронно-эмиссионная томография тоже не продемонстрировала
лучших результатов, чувствительность при обнаружении полного регресса опухоли составила 67% [33].
Основным недостатком метода является невысокая специфичность,
обусловленная накоплением радиофармпрепарата в тканях при наличии воспалительных изменений.
Другими словами, в настоящее время мы ограничены в возможностях
диагностики полного клинического
ответа.
5. Применение щадящих оперативных вмешательств. А нужно ли
добиваться полного ответа, если при
«почти полном» возможно использование щадящих малоинвазивных
технологий, дающих аналогичные
онкологические результаты и позволяющих сохранить на высоком
уровне качество жизни? Этот вопрос сейчас активно изучается, в
том числе и в России [34]. Так, итальянское одноцентровое проспективное рандомизированное исследование [35], результаты которого
были опубликованы в 2012 году, не
показало достоверных различий в
общей и безрецидивной выживаемости, частоте локального рецидива и отдаленного метастазирования у облученных больных раком
прямой кишки cT2N0M0 после
тотальной мезоректумэктомии и
трансанальной эндоскопической
микрохирургии. Аналогичные результаты отметило французское
проспективное рандомизированное многоцентровое исследование
GRECCAR2 [36] для пациентов категории cT2-3N0-1.
6. Отсутствие прямых проспективных сравнительных исследований.
В большинстве системных обзоров,
посвященных стратегии «Смотри и
Жди», авторы осторожно ссылаются на отсутствие в настоящее время
достаточного количества долгосрочных наблюдений и ратуют за
увеличение количества проспективных исследований. Окончательное мнение о безопасности тактики
«Watch & Wait» могло бы сформулировать рандомизированное исследование. Однако маловероятно, что
оно когда-либо будет осуществлено.
Следует ожидать высокий уровень
нарушений протокола подобного
исследования вследствие отказа значительного количества пациентов
с полным клиническим ответом от
выполнения обширных операций.
Все же, в завершении, скажем слово
в защиту тактики «Watch & Wait».
Впечатляют высокие показатели
общей (91,7-93,8%) и безрецидивной (82,7-89,2%) выживаемости,
которые демонстрирует, согласно
опубликованным систематическим
обзорам [26, 37, 38], эта лечебная
тактика.
Заключение
Стратегия «Watch & Wait» в настоящий момент представляется
довольно безопасной. Однако отсутствие достаточного количества
долгосрочных наблюдений требует
продолжения проспективных многоцентровых исследований, чтобы
подтвердить эффективность данного подхода, не уступающую радикальному хирургическому лечению.
Требуется формулировка более четких критериев отбора пациентов для
тактики «наблюдения и ожидания»,
разработка надежных технологий
диагностики полного клинического
ответа, определение оптимальных
сроков регистрации регресса опухоли и режимов последующего наблюдения. Решение указанных проблем
поможет ответить на вопрос – обязательно ли всякий раз добиваться
полного ответа?
Источники:
1. Habr-Gama A, Perez RO, Nadalin W, et al. Operative versus nonoperative treatment for stage 0 distal rectal cancer following chemoradiation therapy: long-term results. Ann Surg. 2004; 240: 711-717. doi: 10.1097/01.sla.0000141194.27992.32.
2. Lopez-Campos F, Martín-Martín M, Fornell-Perez R, et al. Watch and wait approach in rectal cancer: Current controversies and future directions. World J Gastroenterol. 2020; 26(29): 4218-4239. doi: 10.3748/wjg.v26.i29.4218.
3. Lim L, Chao M, Shapiro J, et al. Longterm outcomes of patients with localized rectal cancer treated with chemoradiation or radiotherapy alone because of medical inoperability or patients refusal. Dis Colon Rectum. 2007; 50(12): 2032-2039. doi: 10.1007/s10350-007-9062-x.
4. Habr-Gama A, São Julião GP, Vailati BB, et al. Organ preservation in cT2N0 rectal cancer after neoadjuvant chemoradiation therapy: the impact of radiation therapy doseescalation and consolidation chemotherapy. Ann Surg. 2019; 269(1): 102-107. doi: 10.1097/SLA.0000000000002447.
5. Appelt AL, Ploen J, Harling H, et al. High-dose chemoradiotherapy and watchful waiting for distal rectal cancer: a prospective observational study. Lancet Oncol. 2015; 16(8): 919-927. doi: 10.1016/S1470- 2045(15)00120-5.
6. Wegner RE, Hasan S, Renz PB, et al. Definitive chemoradiation for rectal cancer: is there a role for dose escalation? A National Cancer Database Study. Dis Colon Rectum. 2019; 62(11): 1336-1343. doi: 10.1097/ DCR.0000000000001468.
7. Sun Myint A, Smith FM, Gollins S, et al. Dose escalation using contact X-ray brachytherapy after external beam radiotherapy as nonsurgical treatment option for rectal cancer: outcomes from a singlecenter experience. Int J Radiat Oncol Biol Phys. 2018; 100(3): 565-573. doi: 10.1016/j. ijrobp.2017.10.022.
8. Gérard JP, Barbet N, Gal J, et al. Planned organ preservation for early T2-3 rectal adenocarcinoma: A French, multicentre study. Eur J Cancer. 2019; 108: 1-16. doi: 10.1016/j.ejca.2018.11.022.
9. Garant A, Magnan S, Devic S, et al. Image guided adaptive endorectal brachytherapy in the nonoperative management of patients with rectal cancer. Int J Radiat Oncol Biol Phys. 2019; 105(5): 1005-1011. doi: 10.1016/j.ijrobp.2019.08.042.
10.Smith FM, Al-Amin A, Wright A, et al. Contact radiotherapy boost in association with 'watch and wait' for rectal cancer: initial experience and outcomes from a shared programme between a district general hospital network and a regional oncology centre. Colorectal Dis. 2016; 18(9): 861-870. doi: 10.1111/codi.13296.
11.Erlandsson J, Lörinc E, Ahlberg M, et al. Tumour regression after radiotherapy for rectal cancer – Results from the randomised Stockholm III trial. Radiother Oncol. 2019; 135: 178-186. doi: 10.1016/j. radonc.2019.03.016.
12.Gerard J-P, Azria D, Gourgou-Bourgade S, et al. Comparison of two neoadjuvant сhemoradiotherapy regimens for locally advanced rectal cancer: results of the phase III trial ACCORD 12/0405-Prodige 2. J Clin Oncol. 2010; 28(10): 1638-1644. doi: 10.1200/JCO.2009.25.8376.
13.Garcia-Aguilar J, Chow OS, Smith DD, et al. Timing of Rectal Cancer Response to Chemoradiation Consortium. Effect of adding mFOLFOX6 after neoadjuvant chemoradiation in locally advanced rectal cancer: a multicentre, phase 2 trial. Lancet Oncol. 2015; 16(8): 957-966. doi: 10.1016/ S1470-2045(15)00004-2.
14.Dewdney A, Cunningham D, Tabernero J, et al. Multicenter randomized phase II clinical trial comparing neoadjuvant oxaliplatin, capecitabine, and preoperative radiotherapy with or without cetuximab followed by total mesorectal excision in patients with highrisk rectal cancer (EXPERT-C). J Clin Oncol. 2012; 30(14): 1620-1627. doi: 10.1200/ JCO.2011.39.6036.
15.Uehara K, Hiramatsu K, Maeda A, et al. Neoadjuvant oxaliplatin and capecitabine and bevacizumab without radiotherapy for poor-risk rectal cancer: N-SOG 03 phase II trial. Jpn J Clin Oncol. 2013; 43(10): 964-971. doi: 10.1093/jjco/hyt115.
16.Fernandez-Martos C, Brown G, Estevan R, et al. Preoperative chemotherapy in patients with intermediate-risk rectal adenocarcinoma selected by high-resolution magnetic resonance imaging: the GEMCAD 0801 phase II multicenter trial. Oncologist. 2014; 19(10): 1042-1043. doi: 10.1634/ theoncologist.2014-0233/.
17. Schrag D, Weiser MR, Goodman KA, et al. Neoadjuvant chemotherapy witho ut routine use of radiation therapy for patients with locally advanced rectal cancer: a pilot trial. J Clin Oncol. 2014; 32(6): 513-518. doi: 10.1200/JCO.2013.51.7904.
18.Francois Y, Nemoz CJ, Baulieux J, et al. Influence of the interval between preoperative radiation therapy and surgery on downstaging and on the rate of sphinctersparing surgery for rectal cancer: the Lyon R90-01 randomized trial. J Clin Oncol. 1999; 17(8): 2396-2402. doi: 10.1200/ JCo.1999.17.8.2396.
19.Sloothaak DA, Geijsen DE, van Leersum NJ, et al. Optimal time interval between neoadjuvant chemoradiotherapy and surgery for rectal cancer. Br J Surg. 2013; 100(7): 933- 939. doi: 10.1002/bjs.9112.
20.Evans J, Bhoday J, Sizer B, et al. Results of a prospective randomised control 6 vs 12 trial: Is greater tumour downstaging observed on post treatment MRI if surgery is delayed to 12-weeks versus 6-weeks after completion of neoadjuvant chemoradiotherapy? Ann oncol. 2016; 27 (suppl 6). doi: 10.1093/annonc/ mdw370.01.
21.Lefevre JH, Mineur L, Kotti S, et al. Effect of interval (7 or 11 weeks) between neoadjuvant radiochemotherapy and surgery on complete pathologic response in rectal cancer: a multicenter, randomized, controlled trial (GReCCAR-6). J Clin Oncol. 2016; 34(31): 3773-3780. doi: 10.1200/ JCo.2016.67.6049.
22.Gambacorta MA, Masciocchi C, Chiloiro, et al. Timing to achieve the highest rate of pCR after preoperative radiochemotherapy in rectal cancer: a pooled analysis of 3085 patients from 7 randomized trials. Radiother Oncol. 2021; 154: 154-160. doi: 10.1016/j. radonc.2020.09.026.
23.Dossa F, Chesney TR, Acuna SA, Baxter NN. A watch-and-wait approach for locally advanced rectal cancer after a clinical complete response following neoadjuvant chemoradiation: a systematic review and meta-analysis. Lancet Gastroenterol Hepatol. 2017; 2(7): 501-513. doi: 10.1016/S2468- 1253(17)30074-2.
24.Dattani M, Heald RJ, Goussous G, et al. Oncological and survival outcomes in watch and wait patients with a clinical complete response after neoadjuvant chemoradiotherapy for rectal cancer: a systematic review and pooled analysis. Ann Surg. 2018; 268(6): 955-967. doi: 10.1097/ SLA.0000000000002761.
25.Smith JJ, Strombom P, Chow OS, et al. Assessment of a watch-and-wait strategy for rectal cancer in patients with a complete response after neoadjuvant therapy. JAMA Oncol. 2019; 5(4): e185896. doi: 10.1001/ jamaoncol.2018.5896.
26.van der Valk MJM, Hilling DE, Bastiaannet E, et al. CJH IWWD Consortium. Long-term outcomes of clinical complete responders after neoadjuvant treatment for rectal cancer in the International Watch & Wait Database (IWWD): an international multicentre registry study. Lancet. 2018; 391 (10139): 2537-2545. doi: 10.1016/S0140- 6736(18)31078-X.
27.Habr-Gama A, Gama-Rodrigues J, São Julião GP, et al. Local recurrence after complete clinical response and watch and wait in rectal cancer after neoadjuvant chemoradiation: impact of salvage therapy on local disease control. Int J Radiat Oncol Biol Phys. 2014; 88(4): 822-828. doi: 10.1016/j. ijrobp.2013.12.012.
28.Maas M, Lambregts DM, Nelemans PJ, et al. Assessment of clinical complete response after chemoradiation for rectal cancer with digital rectal examination, endoscopy, and MRI: selection for organ-saving treatment. Ann Surg Oncol. 2015; 22(12): 3873-3880. doi: 10.1245/s10434-015-4687-9.
29.Lim SG, Kim YB, Oh SY. Clinical significance of the endoscopic finding in predicting complete tumor response to preoperative chemoradiation therapy in rectal cancer. World J Surg. 2016; 40(12): 3029-3034. doi: 10.1007/s00268-016-3661- 4.
30.van der Sande ME, Maas M, Melenhorst J,et. al. Predictive value of endoscopic features for a complete response after chemoradiotherapy for rectal cancer. Ann Surg. 2021; 274(6): e541-e547. doi: 10.1097/ SLA.0000000000003718.
31.de Jong EA, ten Berge JC, Dwarkasing RS, et al. The accuracy of MRI, endorectal ultrasonography, and computed tomography in predicting the response of locally advanced rectal cancer after preoperative therapy: A metaanalysis. Surgery. 2016; 159(3): 688- 699. doi: 10.1016/j.surg.2015.10.019.
32.van der Paardt MP, Zagers MB, BeetsTan RG, et al. Patients who undergo preoperative chemoradiotherapy for locally advanced rectal cancer restaged by using diagnostic MR imaging: a systematic review and meta-analysis. Radiology. 2013; 269(1): 101-112.
33.van Stiphout RG, Valentini V, Buijsen J, et al. Nomogram predicting response after chemoradiotherapy in rectal cancer using sequential PET-CT imaging: a multicentric prospective study with external validation. Radiother Oncol. 2014; 113(2): 215-222. doi: 10.1016/j.radonc.2014.11.002.
34.Карачун А.М., Самсонов Д.В. Хирургическая тактика при «почти полном» ответе рака прямой кишки на неоадъювантную терапию: тотальная мезоректумэктомия или локальное иссечение? Вопросы онкологии. 2021; 67(1): 40-43. doi: 10.37469/0507-3758-2021-67-1-40-43.
35.Lezoche E, Baldarelli M, Lezoche G, et al. Randomized clinical trial of endoluminal locoregional resection versus laparoscopic total mesorectal excision for t2 rectal cancer after neoadjuvant therapy. B J surg. 2012; 99(9): 1211-1218. doi: 10.1002/bjs.8821.
36.Rullier E, Vendrely V, Asselineau J, et al. Organ preservation with chemoradiotherapy plus local excision for rectal cancer: 5-year results of the GRECCAR 2 randomised trial. Lancet Gastroenterol Hepatol. 2020; 5(5): 465-474. doi: 10.1016/s2468- 1253(19)30410-8.
37. Sammour T, Price BA, Krause KJ, Chang GJ. Nonoperative management or «Watch and Wait» for rectal cancer with complete clinical response after neoadjuvant chemoradiotherapy: a critical appraisal. Ann Surg Oncol. 2017; 24(7): 1904-1915. doi: 10.1245/s10434-017-5841-3.
38.Dattani M, Heald RJ, Goussous G, et al. Oncological and survival outcomes in Watch and Wait patients with a clinical complete response after neoadjuvant chemoradiotherapy for rectal cancer: a systematic review and pooled analysis. Ann Surg. 2018; 268(6): 955-967. doi: 10.1097/ SLA.0000000000002761.
Автор: Черных Марина Васильевна
Заместитель директора НИИ КиЭР ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, доцент кафедры онкологии,
радиотерапии ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» МЗ России, кандидат медицинских наук, Москва
АРГУМЕНТЫ ЗА, ИЛИ СОВЕРШЕННОЛЕТИЕ ПОДХОДА «WATCH & WAIT»: ПОРА ЛИ «ВЫХОДИТЬ В СВЕТ»?

В среде онкопроктологов давно
появилось устойчивое выражение «палец Абр-Гамы», и с 2004
года вместе с идеей об ограничении показаний к хирургии рака
прямой кишки этот палец тянется к нам вот уже почти 18 лет. Попробуем проанализировать, дотянулись ли до нас своим перстом
бразильские ученые и смогли ли
они вдохнуть жизнь в новый подход?
Разумеется, нельзя не упомянуть
истоки, пусть даже известные
большинству читателей: в 2004
г. была опубликована работа
Habr-Gama и соавт. [1], в которой
продемонстрированы результаты наблюдения за пациентами с
полным клиническим ответом в
сравнении с больными, которым
проводилось хирургическое удаление опухолей прямой кишки.
И, несмотря на ретроспективный
характер исследования, отсутствие разницы безрецидивной
и общей выживаемости в обеих
группах пациентов всколыхнуло онкологическую общественность, дав начало новой парадигме.
Некоторые онкологические сообщества (в том числе и RUSSCO) уже включили тактику «Watch & Wait» в свои клинические рекомендации, правда, с некоторыми оговорками, но, тем не менее, по сей день идут споры о правомерности этого подхода.
Исходными противоречиями, о которых высказывались онкологи, были определение группы наиболее подходящих пациентов для данной тактики, а именно степень распространения опухоли и особенности диагностики (точность и специфичность МРТ и эндоУЗИ), отсутствие единых стандартов оценки достижения полного ответа и подходов к наблюдению. Также можно было услышать о несопоставимых (не в пользу «ожидания и наблюдения») результатах общей и безрецидивной выживаемости.
Восемнадцать лет – время, за которое человек во многих странах становится совершеннолетним. Попробуем оценить, насколько целостной и оправданной стала за это время обсуждаемая тактика в сравнении со своим «старшим братом» – комплексным подходом к лечению с хирургическим этапом во главе.
1. Качество жизни. Прошедшие 18 лет поменяли онкологию в целом. Появление как новых лекарственных средств и технологий лучевой терапии, так и методологий их применения значительно улучшило основные показатели помощи. И наконец-то онкологи стали уделять пристальное внимание уровню качества жизни своих пациентов. Многие из нас понимают, что в некоторых случаях (чем ниже резекция, тем таких случаев больше) колостомия для пациента может быть более предпочтительна, чем сохранение естественного заднего прохода (по причине инконтиненции). Однако, уверена, никто не будет спорить с тем, что даже наличие временной стомы пугает пациентов. И, разумеется, увеличивает суммарный риск послеоперационных осложнений в том случае, если планируется восстановление кишечной непрерывности. Но к этому можно вернуться позже, а пока подробнее остановиться на показателях уровня качества жизни, например, на результатах работы Hupkens и соавт., в которой проводилось сравнение показателей уровня качества жизни (по шкалам QLQ-C30, QLQ-CR38, Vaizey, International Index of Erectile Function and Female Sexual Function Index и International Prostate Symptom Score) пациентов, к которым применялась тактика «наблюдение и ожидание», и пациентов, которым выполнялись хирургические вмешательства (ТМЕ). Согласно шкале QLQ-C30, пациенты в группе «Watch & Wait» имели достоверное преимущество по следующим параметрам: общее физическое самочувствие (46,3 против группы TME: 35,8, p=0,04), социальная интеграция (46,4 против группы TME: 35,7, p=0,04), когнитивные функции (47,5 против группы TME: 35,5, p=0,02). Не будем перечислять все достоверные преимущества уровня качества жизни пациентов в группе «Watch & Wait», но заострим внимание на том, что эта группа реже испытывала финансовые трудности по сравнению с пациентами группы ТМЕ (34,7 против 48,6, p=0,04) – не это ли весомое доказательство состоятельности «младшего брата» [2]?
2. Отдаленные результаты. Но в сторону шутки: пренебрегать возможностью выздороветь в пользу уровня качества жизни – сомнительный подход. Если для человека становление взрослым есть возможность отвечать за свои действия и быть ответственным, то наиболее актуальные показатели состоятельности подхода в онкологии – общая и безрецидивная выживаемость. Может ли детище труда уже международных групп онкологов (в том числе и IWWD) быть достаточно самостоятельным, чтобы получить постоянную регистрацию в клинических рекомендациях?
По данным метаанализа Dossa и соавт., на основании анализа данных 23 исследований (суммарно 867 пациентов), частота местных рецидивов в группе наблюдения (после полного клинического ответа) достоверно не отличалась от таковой в группе пациентов, которым проводилось хирургическое лечение (с полным морфологическим ответом) (ОР 1,46, 95% ДИ 0,70-3,05), равно как и не было отмечено достоверной разницы показателей общей выживаемости (ОР 0,73, 95% ДИ 0,35-1,51), канцер-специфическая выживаемость также не отличалась между группами пациентов (ОР 0,87, 95% ДИ 0,38-1,99) [3]. Выводы данной работы подтверждены также метаанализом авторов из Австралии: Kong и соавт. также не выявили достоверной разницы в показателях ОВ и БРВ между пациентами с полным клиническим ответом после неоадъювантного лечения и пациентами после хирургического лечения после достижения полного клинического ответа [4]. Таким образом, данные как минимум двух метааналитических работ подтверждают главный онкологический тезис – общая выживаемость пациентов с полным клиническим ответом при тактике «наблюдения и ожидания» не компрометирована в сравнении с группой хирургии (в рамках комплексного лечения).
3. Риски оперативного вмешательства. Не будем забывать и о том, что оправданный отказ от хирургического вмешательства (а иногда даже от двух – в случае закрытия превентивной стомы) также снижает риск смерти, ассоциированной с оперативными вмешательствами: даже в современных условиях он достигает 2% (чаще, чем каждый сотый пациент) [5]. Что уж говорить о послеоперационных осложнениях: по данным систематического обзора литературы, а именно 53 проспективных когортных и 45 рандомизированных исследований, частота раневой инфекции может достигает 7% (95% ДИ 5-8), несостоятельностей анастомозов – 11% (95% ДИ 10-12); сепсиса – 12% (95% ДИ 9-16) [5].
4. Диагностирование полного ответа. За почти две декады усовершенствовались и подходы к изучению полного клинического ответа, равно как и появились последовательности диагностических исследований, позволяющие с высокой точностью выявить локальный рецидив опухоли (local regrowth). Так, в своей работе Maas и соавт. при комбинации пальцевого осмотра, эндоскопии и МРТ заявили о 98% точности выявления полного клинического ответа [6]. Более того, поиски способов как выявления полного клинического ответа, так и местного рецидива повышают уровень подготовки специалистов диагностического звена.
5. Экономический аспект. Вспоминая поговорку империалистического мира «If you are so smart show me your money», хочется поговорить еще и об очень важном аспекте: состоятелен ли совершеннолетний (метод) в экономическом плане? Разумеется, выполнение МРТ органов малого таза и эндоскопии каждые три месяца на протяжении первых трех лет – статья расходов для государства. Но стоит посчитать, сколько можно сэкономить средств на невыполнении как мезоректумэктомий, так и восстановлений непрерывности толстой кишки. Памятуя об осложнениях хирургического этапа, необходимо не забыть о стоимости койко-дня в круглосуточном стационаре, который может растянуться и до месяца.
Чем можно закончить эти рассуждения? Совершеннолетие можно было бы отпраздновать салютом, но мы понимаем, что поспешный шаг может привести к неприятным последствиям. Несмотря на то, что в научной литературе имеются неоспоримые доказательства эффективности подхода «Watch & Wait», для большинства консервативного мира онкологов требуется немного больше: рандомизированные исследования. Не сомневаемся, что впереди нас ждут подтверждения состоятельности метода «Watch & Wait», а пока в рамках НМИЦ и федеральных центров будет продолжен набор в группы когортных исследований и попытки интенсификации неоадъювантной терапии (к примеру, многообещающее исследование TORCH с использованием иммунотерапии после короткого курса ДЛТ [7]).
Источники:
1. Habr-Gama A, Perez RO, Nadalin W, et al. Operative versus nonoperative treatment for stage 0 distal rectal cancer following chemoradiation therapy: long-term results. Ann Surg. 2004; 240: 711-717. doi: 10.1097/01. sla.0000141194.27992.32.
2. Hupkens BJP, et al. Quality of Life in Rectal Cancer Patients After Chemoradiation: Watch-and-Wait Policy Versus Standard Resection – A Matched-Controlled Study. Dis. Colon Rectum. United States, 2017. Vol.60, №10, P.1032-1040.
3. Dossa F, et al. A watch-and-wait approach for locally advanced rectal cancer after a clinical complete response following neoadjuvant chemoradiation: a systematic review and meta-analysis. Lancet Gastroenterol. Hepatol. Netherlands, 2017. Vol.2, №7, P.501-513.
4. Kong JC, et al. Outcome and Salvage Surgery Following «Watch and Wait» for Rectal Cancer after Neoadjuvant Therapy: A Systematic Review. Dis. Colon Rectum. United States, 2017. Vol.60, №3, P.335-345.
5. Paun BC, et al. Postoperative complications following surgery for rectal cancer. Ann. Surg. United States, 2010. Vol.251, №5, P.807-818.
6. Maas M, et al. Assessment of Clinical Complete Response After Chemoradiation for Rectal Cancer with Digital Rectal Examination, Endoscopy, and MRI: Selection for Organ-Saving Treatment. Ann. Surg. Oncol. 2015. Vol.22, №12, P.3873- 3880.
7. Wang Y, et al. Short-course
radiotherapy combined with
CAPOX and Toripalimab for
the total neoadjuvant therapy of
locally advanced rectal cancer:
a randomized, prospective,
multicentre, double-arm, phase II
trial (TORCH). BMC Cancer. 2022.
Vol.22, №1, P.274.
Результаты голосования: «Watch & Wait»: да или нет?*

*https://www.rosoncoweb.ru/news/oncology/2022/05/11/
Всего проголосовало: 72
НОВОСТИ ELCC 2022
В марте состоялся очередной Европейский конгресс по раку легкого, и ряд новых данных могут показаться интересными.
PACIFIC-6: перспектива
для возрастных
и ослабленных пациентов
с нерезектабельным
НМРЛ III стадии
Результаты исследования II фазы
PACIFIC-6 по применению консолидирующей иммунотерапии
дурвалумабом после завершенного последовательного химиолучевого лечения у больных с нерезектабельным НМРЛ III стадии были
представлены на Европейском
конгрессе по раку легкого 31 марта
2022 года. До сих пор дурвалумаб
был рекомендован для поддерживающей терапии у пациентов без
прогрессии после радикального
одновременного химиолучевого лечения, однако далеко не все
пациенты способны перенести
подобный вариант комбинации
химиотерапии и ионизирующего излучения в силу его большей
токсичности и своей ослабленности. Исследование PACIFIC-6,
включившее 117 больных с нерезектабельным НМРЛ и серьезной
сопутствующей патологией либо
в статусе ECOG 2 балла, имело
своей главной целью определение
частоты развития осложнений
3-4 степени. В течение 6 месяцев
эта частота составила 4,3% (5 пациентов, из них у 2 – пневмонит).
В течение всего периода лечения
(медиана 32 недели) побочные эффекты любой степени были отмечены у 77% больных, у 19% – 3-4
степени, что привело к прерыванию лечения у 21% и 16% соответственно. Самой частой причиной
оказался пневмонит (10%).
Изначальная ослабленность пациентов и невозможность проведения более токсичного, но более эффективного одновременного химиолучевого лечения подразумевают худшие отдаленные результаты. По данным PACIFIC-6, медиана ВБП составила 10,9 мес., а одногодичная ВБП – 49,6% (рис.1). При этом медиана общей выживаемости оказалась равна 25 мес. – выше, чем это удавалось достичь ранее при проведении только ХЛТ, тем более у ослабленных больных.
Рисунок 1.
Эффективность дурвалумаба после последовательной
ХЛТ у больных с нерезектабельным НМРЛ 3 стадии (European Lung
Cancer Congress 2022, Abstract 108MO).
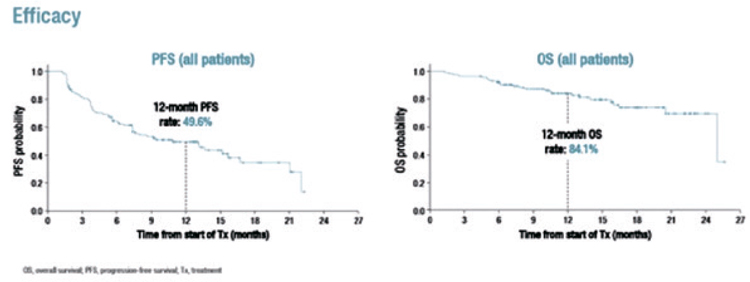
Таким образом, несмотря на относительно небольшое количество пациентов в исследовании, но именно тех, кто всегда представлял наибольшую проблему для мультидисциплинарного консилиума (в возрасте старше 65 лет, с сопутствующей патологией и ECOG 2), токсичность лечения оказалась сопоставимой с таковой из исследования PACIFIC, и первые отдаленные результаты обнадеживают.
Источник: Garassino MC, et
al. Safety and efficacy outcomes
with durvalumab after sequential
chemoradiotherapy (sCRT) in
Stage III, unresectable NSCLC
(PACIFIC-6). European Lung Cancer
Congress 2022, Abstract 108MO.
Китайское исследование III фазы
FURLONG исследовало эффективность фурмонертиниба
(AST2818) в сравнении с гефитинибом среди 358 ранее не предлеченных азиатских пациентов с
НМРЛ IIIB/IIIC/IV стадий с мутацией в гене EGFR (exon19del или
L858R). В Китае более половины
больных НМРЛ имеют мутации,
поэтому поиск новых эффективных препаратов из группы ИТК с
целью преодоления резистентности лечения всегда актуален.
Период наблюдения составил 21 месяц, и выживаемость без прогрессирования, как первичная
конечная точка, оказалась значительно лучше с фурмонертинибом, чем с гефитинибом (20,8
против 11,1 мес.; HR 0,44; 95% CI
0,34-0,58; p<0,0001) (рис.2). Осложнения 3 степени и выше отмечены у 11% больных в группе фурмонертиниба в сравнении с 18% из
группы гефитиниба.
В дальнейшем авторы планируют
сравнить результаты этого исследования с данными FLAURA
China с осимертинибом, который,
относясь к последнему поколению
ИТК, продемонстрировал лучшие
отдаленные результаты по сравнению с более ранними препаратами.
Рисунок 2.
ВБП в исследовании FURLONG
(European Lung Cancer Congress 2022, Abstract 1O).
Еще один препарат из группы ИТК – оритиниб (SH-1028)
– был оценен в исследовании 2
фазы на 227 пациентах с местнораспространенным или метастатическим раком легкого с
мутацией EGFR T790M. Частота
объективных ответов составила
60,4% (95% CI 53,7-66,8), частота контроля над заболеванием –
92,5% (95% CI 88,3-95,6), медиана
ВБП – 12,6 мес. (95% CI 9,7-15,3).
Наиболее частыми осложнениями, связанными с лечением, оказались диарея (42%), повышение
КФК крови (24%) и лейкопения
(13%). В целом результаты этого
исследования с оритинибом оказались схожими с таковыми из
исследования AURA3 с осимертинибом. И, безусловно, изучение
альтернативных вариантов ИТК
третьего поколения вместо осимертиниба может быть полезным
в случае ограниченного доступа к
препарату или противопоказаний.
Источники:
1. Shi Y, et al. Furmonertinib versus gefitinib in treatment-naïve EGFR mutated non-small cell lung cancer: a randomized, double-blind, multicenter, phase III study (FURLONG). European Lung Cancer Congress 2022, Abstract 1O.
2. Zhou C, et al. Oritinib (SH-1028),
a third-generation EGFR tyrosine
kinase inhibitor in locally advanced
or metastatic NSCLC patients with
positive EGFR T790M: results of a
single-arm phase II trial. European
Lung Cancer Congress 2022, Abstract
7MO.
Хирургическое лечение:
билобкэтомии в сравнении
с лобэктомиями
и пульмонэктомиями
Билобэктомия является относительно редкой процедурой, и результаты периоперационной выживаемости недостаточно изучены в сравнении с другими резекциями легких. На Европейском конгрессе по раку легкого 2022 были представлены реальные данные из большой базы данных США, продемонстрировавшие, что периоперационная выживаемость после билобэктомии хуже, чем после лобэктомии, и сравнима с результатами левосторонней пневмонэктомии, что подчеркивает необходимость тщательной стратификации риска и информированности пациента перед операцией.
В этот ретроспективный анализ базы данных Общества торакальных хирургов (STS) были включены пациенты, перенесшие плановую лобэктомию (n=69471), билобэктомию (n=2911) или пневмонэктомию (n=5152) по поводу рака легкого с 2009 по 2017 гг. Первичная конечная точка, то есть 30-дневная периоперационная летальность, отмечена у 2,6% пациентов, перенесших билобэктомию, что значительно больше, чем у пациентов, перенесших левостороннюю лобэктомию (1,0%; скорректированное отношение рисков [HR] 0,44; 95% ДИ 0,34- 0,56; р<0,01) или правостороннюю лобэктомию (1,1%; ОР 0,47; 95% ДИ 0,36-0,60; р<0,01). 30-дневная периоперационная смертность при билобэктомии была аналогична таковой при левосторонней пневмонэктомии (3,5%; HR 1,32; 95% ДИ 0,95-1,85; p=0,10), но лучше, чем при правосторонней пневмонэктомии (7,0%; HR 2,76; 95% ДИ 2,01-3,81; р<0,01). Верхняя билобэктомия имела небольшое, но значимое нескорректированное преимущество в 30-дневной выживаемости по сравнению с нижней билобэктомией (p=0,04).
Рисунок 3.
Выживаемость после билобэктомии в сравнении
с лобэктомией или пневмонэктомией.
Тот факт, что, даже когда после билобэктомии остается одна доля справа, смертность оказывается сравнимой с таковой при удалении всего левого легкого, удивляет. В соответствии с результатами анализа показания к билобэктомии должны быть максимально четкими, хотя это все еще выполняемая операция, и с точки зрения функциональности пациенты действительно должны выигрывать от того, что остается больше легочной паренхимы.
Источник:
Li A, et al. Respect the middle lobe:
perioperative survival of bilobectomy
compared to lobectomy and
pneumonectomy. European Lung
Cancer Congress 2022, Abstract
109MO.
Данные о качестве жизни, полученные в исследовании
POSEIDON, подтверждают предыдущие выводы об эффективности двухкомпонентной схемы
иммунотерапии в сочетании с химиотерапией по сравнению с одной только химиотерапией.
В данных, представленных на
ELCC 2022, риск TTD (времени
до ухудшения глобального состояния здоровья/качества жизни (QoL)), оцененный с помощью
опросников EORTC QLQ-C30/
LC13, был снижен при применении тройного режима тремелимумаб плюс дурвалумаб плюс
химиотерапия по сравнению с одной химиотерапией у пациентов
с метастатическим НМРЛ дикого
типа EGFR/ALK. TTD было пролонгировано для большинства
симптомов, включая физическую
активность и одышку, при тройном режиме по сравнению с только химиотерапией. Эти данные
явились продолжением результатов POSEIDON, представленных в
сентябре 2021 года.
В исследовании POSEIDON 1013 пациентов с метастатическим НМРЛ были рандомизированы в соотношении 1:1:1 для получения терапии первой линии: тремелимумаб плюс дурвалумаб плюс химиотерапия на основе платины, затем дурвалумаб каждые 4 недели до прогрессирования; дурвалумаб плюс химиотерапия, затем дурвалумаб до прогрессирования, или только химиотерапия. Данные, представленные в 2021 году, показали, что комбинация на основе тройной иммунотерапии значительно улучшила общую выживаемость (ОВ) и выживаемость без прогрессирования по сравнению с одной химиотерапией (J Thorac Oncol. 2021; 16 (C10 Suppl): S844). Тенденция к улучшению ОВ при использовании двойной комбинации по сравнению с одной химиотерапией не достигла статистической значимости. Частота нежелательных явлений, связанных с лечением, и прекращение лечения из-за них были численно выше в группе тройной комбинации по сравнению с группой химиотерапии.
Источник:
Garon EB, et al. Patient-reported
outcomes (PROs) with 1L durvalumab
(D), with or without tremelimumb (T),
plus chemotherapy (CT) in metastatic
(m) NSCLC: Results from POSEIDON.
European Lung Cancer Congress 2022,
Abstract 5MO.
НОВЫЕ РЕКОМЕНДАЦИИ ASTRO ПО ВЕДЕНИЮ ПАЦИЕНТОВ С МЕТАСТАТИЧЕСКИМ ПОРАЖЕНИЕМ ГОЛОВНОГО МОЗГА
Автор: Шейко Андрей Владимирович
ГБУЗ ВО «Областной клинический онкологический диспансер»,
Владимир
В мае 2022 года Американское общество радиационной онкологии
(ASTRO) опубликовало новые клинические рекомендации по ведению
пациентов с метастатическим поражением головного мозга [1]. Примечателен тот факт, что гайдлайны
ASTRO, посвященные данной непростой категории пациентов, не
обновлялись без малого десять лет.
В опубликованном руководстве
обсуждены аспекты, касающиеся
современных методов лучевой терапии (стереотаксическая радиохирургия (SRS), лучевая терапия всего
объема головного мозга с исключением гиппокампа), а также возможностей современной системной
терапии.
Рабочая группа ASTRO попыталась дать ответы на четыре ключевых вопроса:
1. показания к SRS как к единственному методу лечения интактных метастазов в головной
мозг;
2. показания к пред- и послеоперационной SRS, облучению всего
объема головного мозга (ОВГМ)
или наблюдению при резецированных ранее метастазах в головной мозг;
3. показания к ОВГМ при интактных метастазах в головной мозг;
4. определение рисков симптоматического радионекроза при
ОВГМ и/или SRS.
Вопрос 1
• SRS в монорежиме рекомендована всем пациентам в состоянии ECOG 0-2 при наличии интактных метастазов в головной мозг в количестве не более четырех (уровень убедительности рекомендаций (УУР) – сильный, качество доказательств – высокое).
• SRS также условно рекомендована пациентам в состоянии ECOG 0-2 при наличии интактных метастазов в головной мозг в количестве от 5 до 10 (УУР – условный, качество доказательств – низкое).
• При диаметре метастатического очага менее 2,0 см рекомендована однократная SRS в дозе 20-24 Гр. В случае высокого риска радионекроза (например, при превышении дозного ограничения в 12 Гр на 10 см3 объема паренхимы головного мозга (весь объем интактного головного мозга плюс (!) таргетные очаги) при планировании однократной SRS возможно принятие решения в пользу проведения фракционированной SRS в режиме 27 Гр/3 фракции или 30 Гр/5 фракций (УУР – сильный, качество доказательств – среднее).
• При диаметре метастатического очага ≥2,0 см, но <3,0 см условно рекомендована однократная SRS в дозе 18 Гр. В случае высокого риска радионекроза при планировании однократной SRS возможно принятие решения в пользу проведения фракционированной SRS в режиме 27 Гр/3 фракции или 30 Гр/5 фракций (УУР – условный, качество доказательств – низкое).
• При диаметре метастатического очага ≥3,0 см, но <4,0 см условно рекомендована фракционированная SRS в режиме 27 Гр/3 фракции или 30 Гр/5 фракций. В случае выбора однократной SRS может быть использована доза 15 Гр. В случае имеющегося масс-эффекта, независимо от диаметра метастаза, необходим мультидисциплинарный подход с участием нейрохирурга и решением вопроса о возможности нейрохирургического пособия (УУР – условный, качество доказательств – низкое).
• При диаметре метастатического очага >4,0 см условно рекомендовано нейрохирургическое лечение, при невозможности – фракционированная SRS. В условиях дефицита клинических данных SRS при диаметре метастаза >6,0 см не рекомендуется (УУР – условный, качество доказательств – низкое).
• Локальное лечение метастатических очагов в качестве первого этапа (при выполнении описанных выше условий) рекомендовано всем пациентам с симптомными метастазами, кому планируется дальнейшая системная лекарственная терапия (УУР – сильный, качество доказательств – низкое).
• При бессимптомном метастатическом поражении головного мозга
в случае планирования тропной к
ЦНС системной терапии условно
рекомендован мультидисциплинарный подход, ориентированный на качество жизни пациента,
с обязательной оценкой безопасности отсрочки локальных методов лечения. При этом должны
быть учтены такие факторы, как
размеры и количество метастазов, их расположение в паренхиме головного мозга, вероятность
ответа на системную терапию,
доступность тщательного нейроонкологического наблюдения
и методов сальважной терапии
(УУР – условный, качество доказательств – мнение эксперта).
При локализации метастатических
очагов в непосредственной близости от высокоприоритетных критических структур (ствол головного
мозга, зрительные тракты) возможно снижение предписанной дозы
SRS или преднамеренный дефицит
дозного покрытия таргетных очагов. Однако следует учитывать, что
более выраженный локальный контроль наблюдается при достижении
биологически эффективной дозы в
очаге (BED10) ≥50 Гр (из расчета α/β
метастатического очага = 10 Гр).
Очередность локальных методов лечения и системной терапии, воздействующей на ЦНС, или иммунотерапии (анти-PD-1 или анти-CTLA4)
до сих пор не определены ввиду
отсутствия убедительных данных
рандомизированных исследований.
Ранее в рекомендациях ASCO-SNOASTRO, опубликованных в Journal of
Clinical Oncology также в 2022 году
[2], сообщалось о возможности отсрочить локальное лечение пациентам с интракраниальными бессимптомными метастазами:
• EGFR-позитивного немелкоклеточного рака легкого (НМРЛ) при назначении осимертиниба;
• ALK-позитивного НМРЛ при назначении алектиниба/бригатиниба/церитиниба;
• BRAF-V600-позитивной меланомы при назначении дабрафениба + траметиниба;
• меланомы (независимо от BRAFстатуса) при назначении ниволумаба + ипилимумаба;
• HER2-позитивном раке молочной железы, спрогрессировавшем после терапии трастузумабом, пертузумабом и/или трастузумаб эмтанзином, при назначении комбинации трастузумаба + тукатиниба + капецитабина.
• Во всех вышеперечисленных случаях локальное лечение метастазов в головной мозг может быть отсрочено до появления признаков интракраниального прогрессирования (УУР – слабый, качество доказательств – низкое).
Вопрос 2
С целью улучшения локального
контроля всем пациентам с резецированными метастазами в головной
мозг рекомендована лучевая терапия (SRS или ОВГМ) (УУР – сильный, качество доказательств – высокое).
С целью сохранения нейрокогнитивных функций и качества жизни
пациентам с резецированными метастазами и ограниченным количеством интактных метастазов рекомендован отказ от ОВГМ в пользу
SRS (УУР – сильный, качество доказательств – среднее).
В качестве возможной альтернативы послеоперационной SRS пациентам с резектабельными метастазами
условно рекомендовано проведение
предоперационной SRS (УУР – условный, качество доказательств –
низкое).
Рекомендованные ASTRO дозы однократной послеоперационной SRS
представлены в таблице 1. Учитывая неправильную форму хирургических полостей, однократная SRS
возможна лишь при максимальном
диаметре полости <5,0 см. С целью
снижения риска развития радионекроза возможно также использование фракционированной SRS, однако убедительных рекомендаций по
дозным режимам, подтвержденных
результатами рандомизированных
исследований, пока не представлено. Одноцентровые исследования,
рассматривающие фракционированную SRS, нередко имеют результатом публикацию внутреннего протокола лечения, что может оказаться подспорьем для выбора
режима облучения при невозможности однократной SRS (например,
протокол лечения метастатического поражения головного мозга Онкологического центра принцессы
Маргарет [3]).
Таблица 1.
Дозные режимы однократной послеоперационной SRS.
Вопрос 3
• В случае невозможности проведения нейрохирургического лечения и/или SRS пациентам с метастазами в головной мозг при благоприятном прогнозе (оцененном по Прогностической шкале общей выживаемости при метастатическом поражении головного мозга в зависимости от первичного диагноза [4]) рекомендовано ОВГМ (30 Гр/10 фракций) (УУР – сильный, качество доказательств – высокое).
• При планировании ОВГМ пациентам группы благоприятного прогноза рекомендовано исключение гиппокампа из объема облучения. Исключение гиппокампа нецелесообразно лишь в случае локализации метастатического очага в непосредственной близости от гиппокампальной зоны или в случае лептоменингеального характера метастазирования (УУР – сильный, качество доказательств – высокое).
• При проведении ОВГМ или ОВГМ с исключением гиппокампа рекомендовано назначение мемантина (1-я неделя – 5 мг каждое утро; 2-я неделя – 5 мг каждое утро и вечер; 3-я неделя – 10 мг каждое утро и 5 мг каждый вечер; 4-24-я недели по 10 мг утром и вечером во время и после проведения ОВГМ) (УУР – сильный, качество доказательств – низкое).
• Проведение ОВГМ после SRS пациентам группы благоприятного прогноза с ограниченным количеством метастазов не рекомендовано. ОВГМ в дополнение к SRS возможно для усиления интракраниального контроля (например, при множественных рецидивирующих метастазах в головной мозг и/или высокой скорости метастазирования в головной мозг), а также в условиях ограниченного доступа пациента к тщательному динамическому наблюдению (например, невозможность выполнения МРТ каждые 2-3 месяца в течение первого года) и к быстрому началу сальважного лечения (нейрохирургии или SRS) (УУР – сильный, качество доказательств – высокое).
• Пациентам группы неблагоприятного прогноза рекомендовано
раннее начало симптоматического и паллиативного лечения для
контроля над неврологическими
симптомами. При принятии решения в пользу ОВГМ более предпочтительно использование ускоренных режимов облучения (20
Гр/5 фракций) (УУР – сильный,
качество доказательств – среднее).
Вопрос 4
При планировании однократной SRS превышение дозного ограничения в 12 Гр на 10 см3 объема паренхимы головного мозга (весь объем интактного головного мозга плюс таргетные очаги) не рекомендовано во избежание симптоматического радионекроза. При невозможности выполнить ограничение V12Гр ≤10 см3 рекомендовано рассмотреть фракционированную SRS (УУР – условный, качество доказательств – низкое).
До сих пор остается дискутабельным вопрос комбинации лекарственной терапии (например, ингибиторами тирозинкиназы) и SRS. Данные, появляющиеся в ходе немногочисленных исследований, противоречивы в отношении вклада подобных комбинаций в развитие радионекроза.
Графическое описание клинических сценариев для пациентов с ограниченным количеством метастазов в головной мозг представлено на рисунке 1, для пациентов с более массивным поражением головного мозга – на рисунке 2.
Рисунок 1.
Рекомендации по ведению пациентов с ограниченным
количеством метастазов в головной мозг.
Рисунок 2.
Рекомендации по ведению пациентов с распространенным метастатическим поражением головного мозга.
Литература:
1. Gondi V, Bauman G, Bradfield L, et al. Radiation Therapy for Brain Metastases: An ASTRO Clinical Practice Guideline [published online ahead of print, 2022 May 6]. Pract Radiat Oncol. 2022; S1879- 8500(22)00054-6. doi:10.1016/j. prro.2022.02.003.
2. Vogelbaum MA, Brown PD, Messersmith H, et al. Treatment for Brain Metastases: ASCO-SNO-ASTRO Guideline [published correction appears in J Clin Oncol. 2022 Apr 20; 40(12): 1392. J Clin Oncol. 2022; 40(5): 492-516. doi:10.1200/JCO.21.02314.
3. Princess Margaret Cancer Centre Clinical Practice Guidelines. Central Nervous System, Brain metastases. 2019.
4. reference.medscape.com/
calculator/357/brain-metastasesprognostic-index
ЧТОБЫ ПОМНИТЬ: ПСИХОЛОГИЧЕСКОЕ СОСТОЯНИЕ ПАЦИЕНТА НА ЭТАПАХ ЛЕЧЕНИЯ
Автор: Сакаева Дина Дамировна
Заместитель главного врача по онкологии КГ «Мать и Дитя»,
доктор медицинских наук, профессор, Уфа
Каждый пациент со злокачественными опухолями испытывает
огромную стрессовую нагрузку.
Редко встречается человек, который не переживает за наличие
опухолевого процесса у себя.
Само заболевание порождает
массу психологических реакций.
Выделяют 5 стадий психологической реакции на диагноз. Исследователь Коблер Росс (1969)
установила, что большинство
больных проходят следующие
стадии:
• Отрицание или шок
• Гнев
• «Торговля»
• Депрессия
• Принятие
Первая стадия включает в себя
отрицание самого заболевания
пациентом. Человек начинает слушать мнение и посещает
многих врачей либо решает не
обращаться за медицинской помощью.
Вторая стадия – это эмоциональный всплеск, обращенный
на медицинский персонал («Почему нельзя выпить волшебную
таблетку, чтобы все исчезло?»),
родственников («Моя жена часто
провоцирует ссоры») и судьбу
(«Почему именно я заболел?»). В
этот период не следует что-то отвечать, а также впадать в панику
вместе с больным, ведь пациент
просто вытаскивает наружу свои
негативные эмоции.
Третья стадия основана на попытках продления жизни самыми разными способами
(обращение к экстрасенсам, ясновидящим, приобретение различных магических средств).
На четвертой стадии приходит
понимание серьезности заболевания. Пациент поникший, может избегать свой круг общения,
перестает заниматься своими
любимыми делами и изолируется
в одиночестве.
Пятая стадия – это достаточно
спокойная психологическая реакция, но ее достигает не каждый. Пациент начинает бороться
и заниматься своими любимыми
делами, планируя свою жизнь с
пользой для себя и своих близких. Надо заметить, что есть и
свои исключения, не всегда каждый человек проходит все стадии психологической реакции.
Пациент может дойти только до
третьей или вовсе вернуться на
первую стадию. Но понимание
психики больного на этих стадиях необходимо. Оказывая психологическую поддержку и проводя лечение пациенту, необходимо
учитывать стадию, на которой
он находится. Ведь психологические проблемы – это не только предвестник депрессии, но и
мощный фактор, подавляющий
иммунную систему, играющую
огромную роль в выздоровлении
онкологических больных.
Психологическое состояние
на этапах лечения
Выделяют три важных этапа в
лечении ЗНО, которые также сказываются на психическом здоровье пациента (А.В. Гнездилов,
2001).
Диагностический этап самый
психотравмирующий. В этот период пациенту требуется особое
внимание и спокойный режим
жизни. Самый характерный для
данного этапа – тревожно-депрессивный синдром (панические атаки, тревоги, мысли о
смерти). Пациент начинает жаловаться на головные боли, вялость,
усталость и плохой сон. Многие
начинают думать о смерти и похоронных ритуалах, хоронить
себя заживо. Они постоянно
ищут, но не могут найти причину возникновения заболевания,
анализируют в памяти всю свою
жизнь, задумываются о правильности диагноза. Такие пациенты
нуждаются в огромной заботе
своих близких, а их лечение требует от врача больших усилий.
В предоперационный (предлечебный) этап психологические
расстройства и переживания возрастают. В ожидании хирургического вмешательства у некоторых
больных возникаю отрицательные эмоции, появляются мысли
об отказе от оперативного вмешательства.
В большинстве случаев после
операции стихает депрессия и
негативных эмоций становится
меньше, так как для многих операция становится неким психологическим облегчением.
Возвращение домой – данный
этап отличается гораздо большей
эффективностью психотерапии,
нежели психофармакологического лечения. Больной может
стремиться к самоизоляции, и
решение этой проблемы падает
на плечи родных. Изменяется
привычный порядок жизни, распорядок дня, хобби и любимые
дела. Попытки взбодрить и вернуть к обычной жизни лучше делать осторожно. Депрессивный
настрой пациента обусловлен не
только болезнью – с новой силой
вспыхивают старые раны и переживания. Также значение имеют
изменение внешности, потеря
привлекательности и привычного самочувствия, переживания
об интимной жизни.
Каждый из этапов лечения онкологических больных несет огромную психологическую нагрузку, к
которой нужно отнестись с особым пониманием, чтобы она не
сказалась на здоровье больного.
ЗНАКОМЬТЕСЬ: КРАСНОДАРСКОЕ РЕГИОНАЛЬНОЕ ОТДЕЛЕНИЕ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ (RUSSCO)
Краснодарский край находится
в северо-западной части Северного Кавказа и входит в состав
Южного федерального округа.
Численность населения Краснодарского края по данным Росстата составляет 5 687 378 чел. на
2022 год, край занимает третье
место среди регионов Российской Федерации после Москвы и
Московской области. Городское
население составляет 55%. Уровень урбанизации значительно
ниже, чем в среднем по стране –
около 75%. Краснодарский край
– многонациональный, живописный регион страны, в котором сплоченно живет множество национальностей со своей
культурой и ценностями.
Министерство здравоохранения
Краснодарского края принимает активное участие в реализации
регионального проекта «Борьба
с онкологическими заболеваниями», который реализует задачи
Национального проекта «Здравоохранение» в отношении снижения
смертности от онкологических заболеваний к 2024 году. К методам
выполнения задач проекта можно
отнести переоснащение государственных бюджетных учреждений
здравоохранения, оказывающих
специализированную помощь онкологическим больным, а также
открытие центров амбулаторной
онкологической помощи (ЦАОП)
и повышение доступности специализированной и высокотехнологичной медицинской помощи.
Расширение возможностей диагностики и лечения злокачественных
новообразований в связи с модернизацией онкологической службы
края обуславливает необходимость
регулирования маршрутизации пациентов. Основным нормативным
документом, регламентирующим
организацию работы онкологической службы и маршрутизации онкобольных в регионе, явился приказ министерства здравоохранения
Краснодарского края от 28 февраля
2020 г. №913Н «О совершенствовании маршрутизации онкологических пациентов в Краснодарском
крае». В дальнейшем приказ был
усовершенствован, и в настоящее время онкологическая служба Краснодарского края включает
трехуровневную систему оказания
специализированной медицинской
помощи онкологическим больным
в соответствии с приказом МЗ КК
№7795 от 30 декабря 2021 года «Об
организации медицинской помощи
взрослому населению при онкологических заболеваниях и маршрутизации взрослых пациентов со злокачественными новообразованиями
в Краснодарском крае» (в редакции
приказа МЗ КК №1155 от 25.02.2022
«О внесении изменений в приказ
министерства здравоохранения
Краснодарского края от 30.12.2021
№7795 «Об организации медицинской помощи взрослому населению
при онкологических заболеваниях и
маршрутизации взрослых пациентов со злокачественными новообразованиями в Краснодарском крае»).
Первый уровень представлен 56
медицинскими организациями, где
имеются первичные онкологические
кабинеты, а также 19 Центрами амбулаторной онкологической помощи.
Второй уровень оказания онкологической помощи осуществляется в 4
межтерриториальных онкологических диспансерах (ГБУЗ «Армавирский онкологический диспансер»,
ГБУЗ «Онкологический диспансер
№2» г. Сочи, ГБУЗ «Онкологический
диспансер №3» г. Новороссийск,
ГБУЗ «Онкологический диспансер
№4» г. Ейск).
Третий уровень – оказание высокотехнологичной специализированной медицинской помощи в ГБУЗ
«Клинический онкологический
диспансер №1» и в онкологических
отделениях ГБУЗ «Научно-исследовательский институт – Краевая
клиническая больница №1 им. проф.
С.В. Очаповского», ГБУЗ «Краевая
клиническая больница №2». Лечение взрослых онкогематологических
больных осуществляется в онкологических диспансерах края, гематологическом отделении ГБУЗ «Городская больница г. Новороссийска».
Дети до 18 лет с новообразованиями
получают лечение в ГБУЗ «Детская
краевая клиническая больница».
В настоящее время в медицинских
организациях Краснодарского края
функционируют 1276 круглосуточных стационарных коек для лечения
взрослых пациентов со злокачественными новообразованиями, 2
реабилитационных койки и 100 –
для лечения детей. Койки дневного
стационара – 371.
Главный врач ГБУЗ Клинический онкологический диспансер №1
Р.А. Мурашко

Председатель регионального отделения RUSSCO, заведующая
9 онкологическим отделением Макарова Ю.М. и сотрудники
9 онкологического отделения ГБУЗ КОД №1

Основная локация регионального отделения Российского общества клинической онкологии RUSSCO – Клинический онкологический диспансер №1 г. Краснодар. Главный врач Клинического онкологического отделения №1 г. Краснодар, кандидат медицинских наук Мурашко Роман Алексеевич оказывает всестороннюю поддержку специалистам онкологического диспансера в профессиональном и научном развитии, а также инициирует сотрудничество учреждения со всероссийскими научными сообществами и научно-исследовательскими институтами. Региональное отделение RUSSCO в Краснодаре было создано в 2010 году. Первым председателем отделения стала Давиденко Ирина Сергеевна, доктор медицинских наук, заведующая 1 и 2 отделениями химиотерапии ГБУЗ КОД №1. На базе этих отделений был основан исследовательский центр, который до настоящего времени принимает активное участие в отечественных и международных клинических исследованиях. Необходимо отметить, что д.м.н. Давиденко Ирина Сергеевна в качестве главного исследователя воспитала профессиональную команду врачей-исследователей, что позволило многим пациентам края получать современную высокоэффективную терапию в условиях существовавшего дефицита лекарственных препаратов. В настоящий момент региональное отделение RUSSCO возглавляет врач высшей квалификационной категории, заведующая 9 онкологическим отделением Макарова Юлия Михайловна. Региональное отделение насчитывает 93 члена RUSSCO, среди которых 32 онколога-химиотерапевта, 4 радиотерапевта, 1 клинический фармаколог, 1 специалист по молекулярной диагностике; среди них 3 кандидата медицинских наук. Краснодарский краевой онкодиспансер №1 – первое в России медицинское учреждение онкологического профиля, получившее сертификат Европейского общества медицинской онкологии ESMO. Также он стал одним из первых онкологических диспансеров в России, в арсенал которого в 2014 году поступила роботизированная хирургическая система Da Vinci. В составе клинического онкологического диспансера №1 функционирует 12 онкологических отделений хирургического и химиотерапевтического профиля, 2 радиотерапевтических отделения, 2 гематологических отделения общей мощностью 877 коек. В состав диспансера также входят поликлиническое отделение и диагностические отделения. Всего в стенах диспансера трудятся 324 врача, из них 6 докторов медицинских наук, 35 кандидатов медицинских наук. Сотрудники онкологических отделений регулярно участвуют в мероприятиях RUSSCO, проводят вебинары, круглые столы с разборами клинических случаев эффективных стратегий терапии при различных нозологиях и нетипичных осложнений лекарственной терапии.
Благодаря активной и всесторонней поддержке администрации и министерства здравоохранения Краснодарского края ГБУЗ КОД №1 постоянно развивается. В практическую деятельность внедряются инновационные методы лечения. К значительным организационным достижениям онкологической службы относится внедрение в Краснодарском крае Популяционного ракового регистра на программном обеспечении, подготовленном сотрудниками НИИ онкологии им. Н.Н. Петрова. Это способствовало существенному повышению достоверности статистической информации и оперативности ее получения. Регистр является инструментом контроля работы онкологической службы края. База данных ПРР составляет более 360 тысяч наблюдений. В ГБУЗ КОД №1 с 2011 года работает года молекулярно-генетическая лаборатория, функционирование которой позволяет персонализировать тактику ведения пациентов, а также информировать родственников о необходимости генетического тестирования. Основные молекулярно-генетические исследования, входящие в клинические рекомендации Министерства здравоохранения Российской Федерации, выполняются в лаборатории ГБУЗ КОД №1. Для реализации молекулярно-генетического тестирования, превышающего технические возможности лаборатории, предусмотрены программы взаимодействия с ведущими онкологическими клиниками страны.
Показательные мастер-классы из операционных диспансера транслируются на весь регион с онлайн-участием врачей из других онкоучреждений Краснодарского края (Армавирского, Сочинского, Новороссийского и Ейского онкодиспансеров). Проведение телемедицинских консультаций на предмет лекарственной терапии онкологических пациентов с участием врачей-онкологов ГБУЗ КОД №1 дает возможность определить оптимальную тактику ведения пациента из отдаленного района, не способного лично посетить специалистов ГБУЗ КОД №1.
Проведение массовой профилактической работы в рамках краевого профилактического проекта «Кубань против рака» стало одной из основных задач краевой онкослужбы. Целью проекта является повышение доступности онкологической помощи для населения южного региона. Он включает ежемесячные выездные профилактические акции в муниципальные образования специалистов краевого онкодиспансера, еженедельные выезды в отделенные населенные пункты бригад онкологов для обследования групп населения, а также почти ежедневные выезды мобильного маммографического комплекса с целью ранней диагностики рака молочной железы. Также в онкологических диспансерах края регулярно проводятся тематические Дни открытых дверей.
Врачи-онкологи 10, 11, 12
онкологических отделений
ГБУЗ КОД №1, члены регионального
отделения RUSSCO

Для реализации большей части задач по оптимизации лекарственного обеспечения и маршрутизации пациентов со злокачественными новообразованиями в крае решением Главного врача ГБУЗ КОД №1 в 2019 г. создан координационный отдел лекарственного обеспечения. Пациенты, имеющие показания к проведению противоопухолевой лекарственной терапии, после выполнения необходимого комплекса обследований и диагностических манипуляций направляются на врачебный консилиум (ВК) химиотерапевтов, функционирующий на базе координационного отдела, лечащими врачами – онкологами диспансерно-поликлинического и других подразделений онкологического диспансера. Консилиум в своей работе опирается на действующие клинические рекомендации Министерства здравоохранения Российской Федерации, Российского общества клинический онкологии, федеральные и локальные нормативные акты. В среднем за неделю работы в координационном отделе проводится 227 ВК (от 148 до 365), всего за год – порядка 12 000 ВК. В ЦАОП края направляется еженедельно в среднем 36 пациентов, за год это количество составляет около 4200 человек. По вопросам планирования лекарственного льготного обеспечения пациентов со злокачественными новообразованиями еженедельно специалистами координационного отдела проводится в среднем 100 консультаций онкологов медицинских организаций края, за год – около 5200 консультации в различных форматах взаимодействия с использованием широкого спектра каналов связи (посредством видеоселекторных совещаний и телекоммуникационных технологий, электронной почты, телефонного канала, мессенджеров и личных визитов специалистов-онкологов края в формате проведения круглых столов).
На XXV Российском онкологическом конгрессе первый заместитель главного врача (по лекарственному обеспечению) ГБУЗ КОД №1, кандидат медицинских наук Шаров Сергей Викторович в своем докладе представил показатели лекарственного обеспечения пациентов онкологического профиля в Краснодарском крае. Он подчеркнул необходимость централизации координирования всех видов лекарственного обеспечения, оптимальной маршрутизации и разъяснительной работы с пациентами по механизмам получения лекарственной терапии в условиях роста онкологической заболеваемости, возрастающей потребности в дорогостоящих лекарствах и недостаточного уровня финансирования. Безусловно, функции координационного отдела лекарственного обеспечения расширяются в связи с актуализацией показаний для таргетной и иммунотерапии злокачественных заболеваний и необходимостью внедрения в практику молекулярно-генетического тестирования новых мишеней терапии именно для разработки адекватной тактики ведения и индивидуализации выбора стратегии лечения пациентов. Возможности подобного тестирования появляются на основе научного сотрудничества с ведущими научно-исследовательскими институтами страны при содействии врачей-онкологов координационного отдела лекарственного обеспечения, являющимися сотрудниками кафедры онкологии Кубанского государственного медицинского университета.
Также сотрудники отделений лекарственных методов лечения, онкологи поликлинического отделения и специалисты координационного отдела вовлечены в программы молекулярно-генетического тестирования RUSSCO, оперативно получая информацию о генетическом портрете опухоли. В координационном отделе лекарственного обеспечения ведется реестр лекарственных препаратов, назначаемых пациентам на врачебных консилиумах для получения по льготному обеспечению. Подобный учет информации позволяет проследить обеспечение пациента препаратом в кратчайшие сроки, предоставляет возможность выполнять статистические расчеты эффективности лечения с подгрупповыми анализами, участвовать в наблюдательных исследованиях реальной клинической практики. Пациенты имеют возможность обратиться к специалистам отдела для коррекции нежелательных явлений лечения при невозможности их купирования по месту жительства. Во время пандемии новой коронавирусной инфекции COVID-19 специалисты координационного отдела лекарственного обеспечения ГБУЗ КОД №1 ежедневно вели прием пациентов для выработки оптимальной тактики лечения и маршрутизации с учетом возможностей амбулаторного назначения лекарственной терапии в рамках льготного обеспечения, являвшейся предпочтительной стратегией во время пандемии.
Лауреаты премии «Будем жить!»:
главный врач Мурашко Р.А. в номинации «Лучшее учреждение», первый
заместителя главного врача (по
лекарственному обеспечению) Шаров С.В. – «Жемчужина профессии»,
в номинации «Лучшее отделение»
– заведующая координационным отделом лекарственного обеспечения
Горяинова А.Ю.

Вебинары и лекции для пациентов,
организованные обществом
«Здравствуй» в 2020-2022 гг.

Неотъемлемой частью работы специалистов ГБУЗ КОД №1 является сотрудничество с пациентской организацией «Здравствуй» для освещения наиболее актуальных тем в онкологии путем проведения тематических встреч и онлайн-вебинаров и с целью получения обратной связи для своевременного реагирования на проблемы пациентов. Так, были выбраны наиболее интересные темы для проведения вебинаров: «Меланома. Новости диагностики и лечения», «Лекарственное обеспечение: как изменились подходы к лечению в период COVID-19», «ВПЧ-ассоциированный рак в практике онколога: кто виноват и что делать? Вопросы профилактики вирусных инфекция в эпоху COVID-19», «Карцинома Меркеля: современные возможности диагностики и лечения», «Кардиотоксичность химиотерапевтических препаратов. Осложнения после пройденного лечения», «Неотложные состояния в онкологии», «Рак почки: профилактика, диагностика, лечение», «Наследственные синдромы, ассоциированные с развитием онкологических заболеваний». В июле 2021 года в Краснодаре проведен Форум онкологических пациентов, где выступили с докладами специалисты ГБУЗ КОД №1, а также ведущие эксперты страны.
Пациенты в лице общественной организации «Здравствуй» выдвинули на получение ежегодной премии «Будем жить!» специалистов КОД №1. Лауреатами премии в номинациях «Лучшее учреждение», «Жемчужина профессии» и «Лучшее отделение» стали главный врач ГБУЗ КОД №1 Мурашко Роман Алексеевич, первый заместитель главного врача (по лекарственному обеспечению) Шаров Сергей Викторович и заведующая координационным отделом лекарственного обеспечения Горяинова Алла Юрьевна.
Доклады специалистов ГБУЗ КОД №1 на всероссийских конференциях: Шаров
С.В., Леонов А.А., XXV Российский онкологический конгресс; доклад Горяинова А.Ю., Большая конференция RUSSCO с международным участием «Рак
молочной железы»; Стукань А.И., III Осенний онкологический онлайн-марафон «ONLINE-ОСЕНЬ»; Стукань А.И., VII Конгресс специалистов по лечению
опухолей головы и шеи; Стукань А.И., Всероссийский конгресс Российского
общества онкомаммологов, 2021; Леонов А.А., XII Съезд онкологов и радиологов стран СНГ; Горяинова А.Ю., III Онкологический онлайн-марафон
«ONLINE-весна»

Необходимо отметить, что ГБУЗ КОД №1 является клинической базой Кубанского государственного медицинского университета, где осуществляет подготовку врачебных кадров для онкологической службы кафедра онкологии с курсом торакальной хирургии ФПК и ППС ФГБОУ ВО КубГМУ Минздрава России. Заведует кафедрой заслуженный врач Российской Федерации, кавалер Ордена Почета, дважды лауреат премии «Призвание», Герой труда РФ, главный торакальный хирург Краснодарского края, член европейских научных обществ, доктор медицинских наук, профессор, академик РАН Владимир Алексеевич Порханов. Врачи-онкологи координационного отдела лекарственного обеспечения Горяинова Алла Юрьевна и Стукань Анастасия Игоревна, являясь ассистентами кафедры, участвуют в реализации научно-исследовательских проектов кафедры, утвержденных независимым этическим комитетом в 2020 и 2021 гг.: «Изучение внутриопухолевой гетерогенности и механизма репрограммирования генома раковой клетки для разработки стратегий клеточной терапии рака» и «Анализ клинических и молекулярно-генетических предикторов эффективности терапии метастатического рака молочной железы».
Коллектив специалистов по лекарственному лечению ГБУЗ КОД №1
регулярно публикует тезисы и статьи в базах ВАК и Scopus, описывающие необычные клинические
случаи, эффективность и нежелательные явления новых методов
лечения, а также свои оригинальные исследования. Несмотря на
ряд сложностей в организационном плане во время пандемии
COVID-19 в 2021-2022 гг., специалисты ГБУЗ КОД №1 представили
результаты своей клинической и
научной деятельности в виде тезисов и докладов на всероссийских
научных конгрессах и конференциях. До начала пандемии, в феврале 2020 года, в Краснодаре была
с успехом проведена Большая конференция RUSSCO «Рак легкого и
опухоли грудной локализации».
ЭРА КОМБИНАЦИЙ: НОВАЯ ВЕХА В ЛЕЧЕНИИ ПОЧЕЧНО-КЛЕТОЧНОГО РАКА
На протяжении последних нескольких лет мы видим смену парадигмы лечения онкологических
заболеваний: от таргетных препаратов – к иммунологически активным, от монотерапии –
к комбинациям. Этот процесс смело можно назвать второй революцией в области лечения,
в том числе и, рака почки: иммунотаргетные комбинации и двойная иммунотерапия показывают
в разы более высокую эффективность, при этом характеризуются приемлемой переносимостью
для пациентов, в сравнении с монотерапией таргетными препаратами, которые также в свое время
стали прорывом в лечении больных с метастатическим почечно-клеточным раком (мПКР).
В апреле в России была зарегистрирована новая комбинация препаратов ленватиниб +
пембролизумаб в качестве терапии 1-й линии мПКР. Мы попросили Бориса Яковлевича Алексеева,
д.м.н., профессора, заместителя генерального директора по научной работе ФГБУ «НМИЦ
радиологии» Минздрава РФ, рассказать о результатах клинического исследования CLEAR,
в котором изучались эффективность и переносимость данной комбинации, поделиться своим
мнением о перспективе использования комбинированных режимов в лечении больных раком почки.
– Уважаемый Борис Яковлевич, недавно были опубликованы результаты клинического исследования
(КИ) III фазы CLEAR, в котором
сравнивалась эффективность и
безопасность данной комбинации
с недавним «золотым стандартом»
1-й линии, сунитинибом, у пациентов с метастатическим почечноклеточным раком. Какие данные,
полученные в ходе этого КИ, Вы
считаете наиболее клинически
значимыми? Как комбинация проявила себя в подгрупповых анализах?
– Результаты исследования действительно впечатляют: по ряду конечных точек получены самые высокие на сегодняшний день показатели в сравнении с аналогичными при использовании других комбинаций в 1-й линии терапии. Например, в исследовании CLEAR медиана выживаемости без прогрессирования (ВБП) в общей группе пациентов достигла двух лет. Это максимальная ВБП, которая когда-либо была продемонстрирована в клинических исследованиях препаратов для лечения рака почки. До недавнего времени наибольшее значение ВБП для пациентов, получающих комбинированную лекарственную терапию в 1-й линии, ограничивалось 17 месяцами. При подгрупповом анализе у пациентов с хорошим прогнозом заболевания (шкала IMDC) медиана ВБП составила 28 месяцев, а в группе пациентов с плохим и промежуточным прогнозом – 22 месяца. Эти показатели существенно выше ВБП у пациентов, которые получали монотерапию сунитинибом (5,9 мес и 12,9 мес, соответственно).
На сегодняшний день – это максимальные цифры, ни в одном из исследований нет более высоких показателей. Еще один важный результат – очень высокая частота объективных ответов (ЧОО) для комбинации ленватиниб + пембролизумаб: 71% - в общей группе пациентов (в сравнении с 36% в группе сунитиниба), 16% полных ответов (4% - в группе сунитиниба). В группе пациентов с хорошим прогнозом ЧОО составила 68% и 72% - в группе пациентов с промежуточным прогнозом. В ходе КИ также была отмечена схожая низкая частота прогрессии заболевания: в группе пациентов с хорошим прогнозом – всего 3%, в подгруппах с промежуточным и плохим прогнозом – 6%.
Комбинация ленватиниб + пембролизумаб также продемонстрировала преимущество по показателю общей выживаемости в сравнении с сунитинбом. Снижение риска смерти у пациентов, получающих комбинированный режим, составило 34%. Таким образом, общий и подгрупповой анализ показали, что комбинация выигрывает по сравнению в монотерапией сунитинибом и обеспечивает значительное клиническое преимущество для больных мПКР независимо от группы прогноза заболевания.
– Борис Яковлевич, как Вы считаете, какие данные, полученные в КИ
наиболее весомы с точки зрения
доказательной медицины, и какие
наиболее важны с точки зрения конечного результата для пациента?
– С точки зрения доказательной
медицины, по всем конечным точкам исследования было достигнуто
статистически достоверное преимущество по сравнению с группой
сравнения (ВБП, ЧОО, ОВ), причем
очень выраженное. Если говорить
о пациентах, то для них значимы
все показатели: и увеличение продолжительности жизни, и хорошее
качество этой жизни, и регрессия
метастатических очагов. Данное КИ
показало, что терапия комбинацией
позволяет достигать высоких результатов по всем вышеуказанным
параметрам.
– Насколько важно, по Вашему
мнению, бороться за объективные
или полные ответы в терапии первой линии?
– На мой взгляд, это очень важно,
потому что объективный ответ,
во-первых, коррелирует с общей
выживаемостью. Во-вторых, объективный ответ имеет очень большое
значение для больных с метастазами, т.к. метастатическое поражение
может сопровождаться различными
нарушениями, например, болевым
синдромом, нарушением функции
дыхания из-за сдавливания дыхательных путей, нарушением желчеотведения (в результате сдавления желчевыводящих путей может
развиваться желтуха) и др. Все эти
симптомы существенно ухудшают
качество жизни больных, иногда
угрожают жизни вообще, помимо
осложнений, связанных с метастазами. Поэтому их обратное развитие имеет огромное значение. Если
говорить о полной регрессии и полных ответах, то в ряде случаев такой
результат может коррелировать с
полным выздоровлением.
– Существует мнение, что комбинированная терапия может переноситься хуже, чем лечение одним
препаратом. Как Вы считаете, насколько это опасение оправданно?
– Такое мнение, с одной стороны, конечно, оправданно, поскольку при применении комбинаций мы сталкиваемся с комбинированным профилем нежелательных явлений, то есть на токсичность одного препарата накладывается токсичность другого. При этом спектр нежелательных реакций может быть схожим, а может различаться. Но если говорить, например, о частоте отмены лечения вследствие развития нежелательных явлений, то комбинация ленватиниб + пембролизумаб не проигрывает сунитинибу: по причине развития побочных эффектов в группе сунитиниба от лечения отказались 14% больных, в группе ленватиниб + пембролизумаб – 13%.
– Чем объясняется высокий процент редукции дозы ленватиниба
или временной приостановки лечения для ленватиниба, пембролизумаба? Есть ли в данных опциях
клиническая польза для пациента?
– Нужно помнить, что развитие токсичности коррелирует с эффективностью терапии. В частности, при
лечении пациентов сунитинибом в
комбинации с эверолимусом было
показано, что токсичность коррелирует с увеличением выживаемости
больных, по крайней мере, ВБП. То
есть, токсичность – это предиктор
большей эффективности лечения,
но, с другой стороны, с ней, несомненно, нужно работать. Снижение
дозы – это весьма результативный
способ борьбы с токсичностью, который позволяет не отменять эффективного лечения. Снижая дозу
ленватиниба, мы можем уменьшить
выраженность побочных эффектов
или вообще их полностью купировать и продолжить терапию, которая приносит пользу больному.
– При использовании комбинированных режимов в 1-й линии лечения (в частности, комбинации ленватиниб + пембролизумаб), как, на
Ваш взгляд, меняется стратегия
выбора терапии 2-й линии? Остается ли место для монотерапии в
последующих линиях?
– Однозначного ответа на эти вопросы нет, т.к. нет большого опыта в выборе препаратов 2-й линии после комбинаций, он только накапливается. Когда в 1-й линии используются в комбинации два таких эффективных препарата как ленватиниб + пембролизумаб, прежде всего, нужно ответить на вопрос, когда заболевание начало прогрессировать. Если мы наблюдаем прогрессирование на фоне отмены пембролизумаба, то в последующем можно вернуться к иммунотерапии. Если на фоне иммунотаргетной терапии, то, скорее всего, целесообразно рассмотреть назначение таргетного препарата. На сегодняшний день можно сказать, что, скорее всего, это будет монотерапия препаратом, который не применялся в 1-й линии, не комбинированный режим.
– Имея возможность назначить
ленватиниб в 1-й линии в комбинации с пембролизумабом либо во
2-й линии в комбинации с эверолимусом, как Вы считаете, в каком
случае пациент получит наибольшую выгоду от терапии?
– Это тоже сложный вопрос, на который нет однозначного ответа.
Конечно, ввиду высокой эффективности комбинации ленватиниба с
пембролизумабом врачи заинтересованы в такой терапии, но есть категория больных, которые не смогут
ее получить. Некоторым пациентам
иммунологически активные препараты противопоказаны вообще.
Это больные с аутоиммунными заболеваниями в стадии декомпенсации (субкомпенсации), например с
бронхиальной астмой, псориазом,
аутоиммунным колитом и др. Кроме того, ограничения использования комбинированных режимов в
клинической практике могут быть
связаны с немедицинскими проблемами.
Следует отметить, что многие больные до сих пор в первой линии получают ингибиторы тирозинкиназных рецепторов, сунитиниб, пазопаниб, в монотерапии. В этом случае ленватиниб в кобмбинации с эверолимусом во 2-й линии будет, безусловно, одним из самых логичных и эффективных режимов терапии.
– Каким Вы видите ближайшее будущее для пациентов с метастатическим ПКР? Привнесут ли новые
комбинации серьезный вклад в
улучшение отдаленных результатов лечения, в том числе, в продолжительность жизни пациентов?
Можем ли мы мечтать о полном
излечении части пациентов?
– Перспективы, конечно, связаны с комбинированными режимами, в т. ч. с новыми, которые сейчас исследуются. Представляют интерес комбинации ингибиторов контрольных точек иммунитета с некоторыми цитокиновыми препаратами, с интерлейкинами. Многообещающе выглядит и применение тройных комбинаций, включающих, например, ингибитор CTLA-4, ингибитор PD-1 и таргетный препарат. Вклад лекарственных комбинаций уже понятен и доказан: они приводят к увеличению ВБП, общей выживаемости по сравнению с монотерапией. Это говорит о том, что в комбинированные режимы более предпочтительны, чем монотерапия таргетными препаратами. Что касается полного излечения, то у некоторых пациентов мы уже можем говорить о таком прогнозе при применении иммунотаргетных комбинаций, реже - монотерапии. Имеется в виду полная регрессия опухолевых очагов с очень длинным периодом без прогрессирования, вплоть до 10 лет, что позволяет, условно, рассматривать такой результат как полное излечение. Но пока все-таки речь идет о небольшом проценте больных, поэтому мы очень осторожны в таких оценках. В любом случае, часть пациентов может надеяться на полное излечение. Мы к этому движемся.
При поддержке компании Эйсай
ЭКСТИМИЯ
Терапия полностью в срок
