
КОГО И КАК УСПЕШНО БУДУТ ЛЕЧИТЬ АМЕРИКАНСКИЕ ОНКОЛОГИ В 2040 ГОДУ
Известно, что предсказания – вещь ненадежная. Другое дело – научное прогнозирование. Что нас, онкологов, ждет через 20 лет, с больными какими злокачественными опухолями мы будем встречаться чаще?

9 - 11 НОЯБРЯ 2021
РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС
РАКФОНД ОБЪЯВЛЯЕТ НОВЫЙ КОНКУРС НАУЧНО-ИССЛЕДОВАТЕЛЬСКИХ ПРОЕКТОВ В ОБЛАСТИ ОНКОЛОГИИ
Цель программы – предоставить финансирование и дополнительную поддержку ученым и врачам, работающим в России, для стимулирования и продвижения исследований в области онкологии, поиска и разработки новых способов профилактики, диагностики и лечения онкологических заболеваний.
АДЪЮВАНТНАЯ ИММУНОТЕРАПИЯ У БОЛЬНЫХ НЕМЕЛКОКЛЕТОЧНЫМ РАКОМ ЛЕГКОГО
Ну вот свершилось! Иммунотерапия демонстрирует свою эффективность при проведении адъювантной системной терапии операбельного немелкоклеточного рака легкого. Опубликованы в кратком виде результаты промежуточного анализа исследования iMpower010, которые будут представлены на предстоящем ASCO 2021. В этом исследовании изучался вопрос о целесообразности добавления иммунотерапии атезолизумабом после окончания адъювантной химиотерапии у радикально прооперированных больных немелкоклеточным раком легкого...


РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И РЕАЛЬНАЯ КЛИНИЧЕСКАЯ ПРАКТИКА ИММУНОТЕРАПИИ НЕМЕЛКОКЛЕТОЧНОГО РАКА ЛЕГКОГО. ЧТО-ТО ЯВНО ИДЕТ НЕ ТАК, НО ЧТО, И ЧТО С ЭТИМ ДЕЛАТЬ?
Адаптируя результаты клинических исследований в реальную практику, мы обычно понимаем, что в жизни речь идет о несколько (или даже сильно) другом контингенте больных по сравнению с теми, кто участвовал в регистрационных испытаниях.
«ШКОЛА КЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ ДЛЯ МОЛОДЫХ ОНКОЛОГОВ» ПОЛУЧИЛА ПОДДЕРЖКУ ФОНДА ПРЕЗИДЕНТСКИХ ГРАНТОВ!
Это образовательный курс, состоящий из лекций и практических занятий, с предварительным отбором участников экспертами РакФонда на основе представленных на конкурс синопсисов исследовательских протоколов. Ведущие эксперты в области онкологии в ходе практических занятий помогут подготовить протоколы исследований молодых онкологов, лучшие будут профинансированы грантами на исследования.

АДЪЮВАНТНАЯ ИММУНОТЕРАПИЯ ОПЕРАБЕЛЬНОГО РАКА ПИЩЕВОДА
ПУ больных местнораспространенным раком пищевода одной из популярных опций является проведение химиолучевой терапии с последующим выполнением оперативного вмешательства.


ИМЕЕТ ЛИ ИММУНОТЕРАПИЯ ВТОРОЙ ШАНС ПРИ ЛЕЧЕНИИ МЕТАСТАТИЧЕСКОЙ МЕЛАНОМЫ КОЖИ? ПОВТОРНЫЙ ЗАХОД НА ПОСАДКУ
Какова эффективность комбинации анти-CTLA-4 + анти-PD-1 моноклональных антител (мАТ) при ее назначении пациентам с метастатической меланомой, прогрессирующим на иммунотерапии анти-PD-1/анти-PD-L1 мАТ в монорежиме?


100 МОНОКЛОНАЛЬНЫХ АНТИТЕЛ БЫЛИ ОДОБРЕНЫ FDA В КАЧЕСТВЕ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
Спустя тридцать пять лет после одобрения FDA первого моноклонального антитела на эти биопрепараты ежегодно приходится почти пятая часть разрешенных агентством новых лекарственных средств. Тем временем количество антител, поступающих в клинику, быстро растет. Так, если на исследования и регистрацию первых 50 антител ушло 29 лет, то следующие 50 антител были открыты...
FDA ПРЕДОСТАВИЛО УСКОРЕННОЕ ОДОБРЕНИЕ САЦИТУЗУМАБА ГОВИТЕКАНА ДЛЯ ЛЕЧЕНИЯ РАСПРОСТРАНЕННОГО УРОТЕЛИАЛЬНОГО РАКА
Сацитузумаб говитекан представляет собой конъюгат-антитело – лекарственное средство, состоящее из моноклональное антитела, нацеленного на белок Trop-2, который экспрессируется на опухолевых клетках, и SN-38, ингибитора топоизомеразы I, связанного с антителом через гидролизуемый линкер. 13 апреля 2021 года Управление по контролю над качеством пищевых продуктов и лекарственных препаратов США (FDA) предоставило ускоренное...
FDA ОДОБРИЛО АМИВАНТАМАБ ПРИ НМРЛ С ИНСЕРЦИЕЙ В 20 ЭКЗОНЕ ГЕНА EGFR
Управление по контролю над качеством пищевых продуктов и лекарственных препаратов США (FDA) одобрило амивантамаб (Rybrevant) для лечения больных диссеминированным немелкоклеточным раком легкого (НМРЛ) с инсерцией в 20 экзоне гена EGFR. Амивантамаб был одобрен на основании результатов исследования 1 фазы CHRYSALIS (NCT02609776). ...
РОЛЬ АПИКСАБАНА В ЛЕЧЕНИИ ВЕНОЗНЫХ ТРОМБОЭМБОЛИЧЕСКИХ ОСЛОЖНЕНИЙ У БОЛЬНЫХ С АКТИВНЫМ РАКОМ
Связь венозных тромбоэмболических осложнений (ВТЭО), объединяющих тромбоэмболию легочной артерии (ТЭЛА) и тромбоз глубоких вен нижних конечностей (ТГВ), с онкологическими заболеваниями хорошо известна. Установлено, что риск ВТЭО у онкологических больных в 4 раза выше, чем в популяции [1], а у каждого пятого пациента с активным онкологическим заболеванием возникает первый эпизод ВТЭО. С другой стороны...
НОВЫЕ ВОЗМОЖНОСТИ ТЕРАПИИ В ПОЗДНИХ ЛИНИЯХ РАКА ШЕЙКИ МАТКИ
Тизотумаб ведотин представляет собой конъюгат, состоящий из моноклонального антитела к тканевому фактору (ТФ), соединенного при помощи линкера с монометилауристатином Е (ММАЕ). Тканевый фактор (тромбопластин) является III фактором системы свертывания крови и входит в состав мембран большинства клеток нашего организма за исключением эндотелия и клеток крови. ...

Анонс
-

9 - 11 НОЯБРЯ 2021
РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС
КОГО И КАК УСПЕШНО БУДУТ ЛЕЧИТЬ АМЕРИКАНСКИЕ ОНКОЛОГИ В 2040 ГОДУ
Автор: С.А.Тюляндин
Председатель Российского общества клинической онкологии
Известно, что предсказания – вещь
ненадежная. Другое дело – научное
прогнозирование. Что нас, онкологов, ждет через 20 лет, с больными
какими злокачественными опухолями мы будем встречаться чаще?
Возможно, что такого рода прогнозы
способны перенастроить онкологическую службу для эффективной работы в будущем.
С этой точки зрения представляет
интерес работа американских коллег,
которые на основании изучения динамики заболеваемости и смертности 10 наиболее часто встречаемых
опухолей в США спрогнозировали
заболеваемость и смертность от них
в 2040 году.
Хорошая новость, что заболеваемость наиболее частыми опухолями
увеличится не очень существенно.
Более того, у мужчин она снизится
за счет уменьшения заболеваемости
раком легкого за счет отказа от курения, повышения эффективности
ранней диагностики и лечения и раком простаты за счет отказа от скрининга и более эффективной терапии.
В результате рак простаты выпадет
из первой пятерки, в то время как рак
легкого сохранит свое второе место
по частоте заболевания, уступив лидерство меланоме, частота которой
увеличится в 2 раза. Ожидается стабильная динамика заболеваемости
колоректальным раком и раком мочевого пузыря. Новичком в первой
пятерке в 2040 году будет рак почки,
частота которого увеличится с 46 до
76 тысяч.
Таблица 1. Заболеваемость часто встречаемыми
опухолями в США (в тыс. больных).
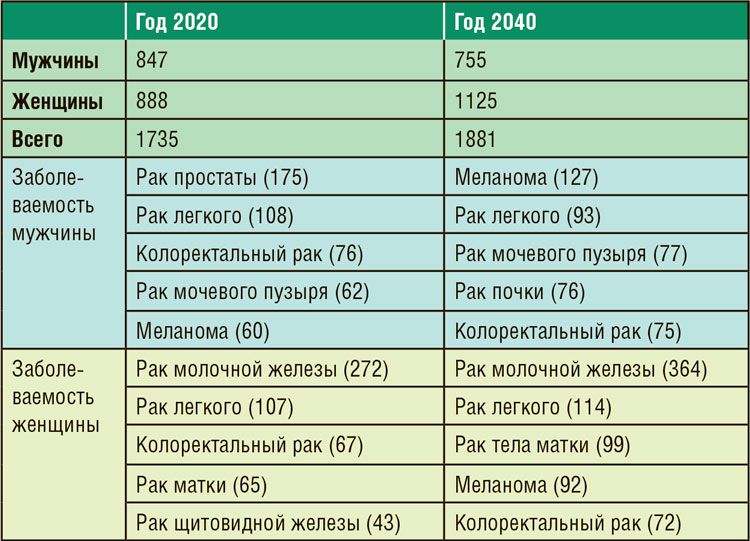
Таблица 2. Смертность от часто встречаемых
опухолей в США (в тыс. больных).
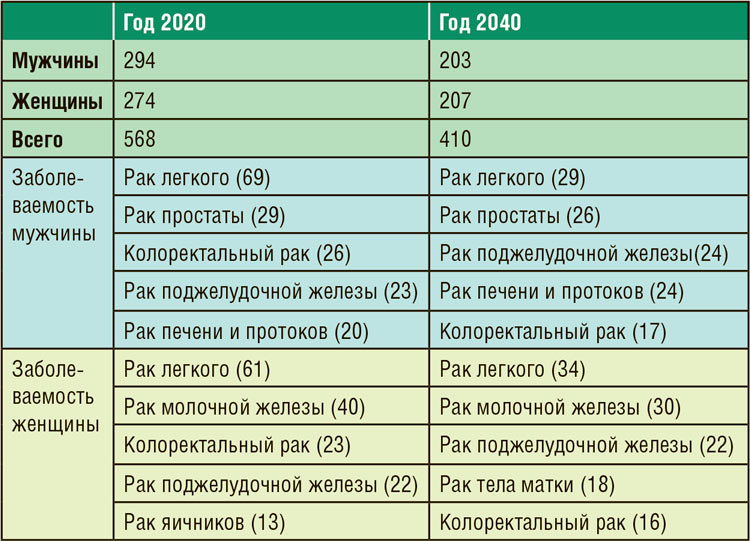
Весь прирост заболеваемости произойдет за счет женского населения. Заметно вырастет заболеваемость раком молочной железы и тела матки. Женщины опередят мужчин по заболеваемости раком легкого. Частота встречаемости меланомой у женщин, по аналогии с мужчинами, вырастет более чем в 2 раза (с 41 до 92 тыс.). Авторы дают оптимистичный прогноз о снижении смертности в 2040 году, несмотря на рост заболеваемости. У мужчин из первой пятерки опухолей-убийц замечательную динамику продемонстрирует рак легкого, который хотя и останется на первом месте, но число умерших больных поэтой причине сократится более чем в 2 раза. Медленно, но верно на верхние позиции у мужчин, как и у женщин, выходит смертность от рака поджелудочной железы, в то время как смертность от других новообразований остается примерно прежней. У женщин прогнозируется существенное снижение смертности от рака легкого и рака молочной железы на фоне значительного роста заболеваемости, умеренное увеличение числа умерших с 12 до 18 тыс. от рака тела матки, что прямо пропорционально росту заболеваемости на 50%. Очевидно, что в 2040 году США потребуется существенно большее количество онкодерматологов в связи с эпидемией меланомы у всего населения страны, независимо от пола. Снижение смертности от рака легкого и рака молочной железы происходит в том числе и за счет широкомасштабный программы скрининга, для организации которых потребуются врачи диагностических специальностей. Колоректальный рак демонстрирует постепенное снижение заболеваемости и смертности вследствие скрининга. Сегодня 66% американского населения участвуют в программе скрининга рака толстой кишки. Выполнение колоноскопии и удаление потенциально опасных полипов ответственно как за снижение заболеваемости, так и за постановку диагноза в ранних стадиях. Серьезное опасение вызывают растущие высокими темпами заболеваемость и смертность от рака толстой кишки у молодого населения страны. Еще большой проблемой представляется рост заболеваемости раком поджелудочной железы, печени и желчных протоков. Отсутствие программ ранней диагностики и эффективной терапии является причиной роста смертности от этих заболеваний. Как данный прогноз можно экстраполировать на российскую действительность? Российская статистика также свидетельствует о росте заболеваемости меланомой, что требует подготовки специалистов для ранней диагностики и лечения, активного информирования населения о растущей угрозе и формирования онкологической настороженности, профилактики избыточного воздействия ультрафиолета. У нас только наметился слабый тренд в снижении заболеваемости раком легких у мужчин при растущей заболеваемости у женщин. В России продолжается рост заболеваемости раком молочной железы и толстого кишечника. Нам не добиться существенного снижения смертности без программ ранней диагностики этих заболеваний. Еще большую опасность представляет рост заболеваемости и смертности в нашей стране раком поджелудочной железы, печени, желчных протоков. Это будет тормозить достижение заявленных показателей смертности от злокачественных опухолей в рамках национальной программы «Онкология».
Литература:
Rahib L, Wehner MR, Matrisian LM,
et al. Estimated projection of US cancer
incidence and death in 2040. JAMA
Network Open. 2021; 4:e214708.
9 - 11 НОЯБРЯ 2021

РАКФОНД ОБЪЯВЛЯЕТ НОВЫЙ КОНКУРС НАУЧНО-ИССЛЕДОВАТЕЛЬСКИХ ПРОЕКТОВ В ОБЛАСТИ ОНКОЛОГИИ
Цель программы – предоставить финансирование и дополнительную поддержку ученым и врачам, работающим в России, для стимулирования и продвижения исследований в области онкологии, поиска и разработки новых способов профилактики, диагностики и лечения онкологических заболеваний.
Принимаются заявки на проведение исследований в области онкологии по следующим направлениям:
• Клинические исследования: интервенционные, рандомизированные (предпочтительно), направленные на изучение методов и средств профилактики, диагностики, мониторинга и лечения злокачественных новообразований, реабилитации и качества жизни онкологических больных
• Трансляционные исследования: поиск и изучение биомаркеров для диагностических и прогностических целей, подбора терапии
• Фундаментальные исследования
Победитель конкурса получит финансирование от РакФонда в размере до 500 000 рублей на выполнение исследовательского проекта, а также экспертную помощь в доработке дизайна и протокола исследования и статистической обработке данных и доступ к онлайн-сервису для проведения клинических исследований Энроллми.ру.
Результаты конкурса будут
объявлены 9-11 ноября 2021 года
в ходе XXV Российского онкологического конгресса.

АДЪЮВАНТНАЯ ИММУНОТЕРАПИЯ У БОЛЬНЫХ НЕМЕЛКОКЛЕТОЧНЫМ РАКОМ ЛЕГКОГО
Автор: С.А.Тюляндин
Председатель Российского общества клинической онкологии
Ну вот свершилось! Иммунотерапия демонстрирует свою эффективность при проведении адъювантной
системной терапии операбельного
немелкоклеточного рака легкого.
Опубликованы в кратком виде результаты промежуточного анализа
исследования iMpower010, которые
будут представлены на предстоящем
ASCO 2021. В этом исследовании изучался вопрос о целесообразности
добавления иммунотерапии атезолизумабом после окончания адъювантной химиотерапии у радикально
прооперированных больных немелкоклеточным раком легкого. В исследование включались больные IB-IIIA
стадиями немелкоклеточного рака
легкого, которые после выполнения
операции и окончания адъювантной
химиотерапии цисплатиновыми дуплетами (цисплатин + один из следующих: пеметрексед, доцетаксел,
гемцитабин или винорельбин) были
рандомизированы в группу наблюдения или атезолизумаба, который назначали в дозе 200 мг каждые 3 недели
16 введений. Основными критериями эффективности были последовательное определение безрецидивной
выживаемости в группе больных
II-IIIA стадией с позитивной экспрессий PD-L1 >1% по результатам теста
SP263, затем в группе больных II-IIIA
независимо от экспрессии PD-L1, затем в группе всех включенных в исследование больных (IB-IIIA стадии),затем общая выживаемость для всех включенных больных.
Таблица. Безрецидивная выживаемость (DFS)
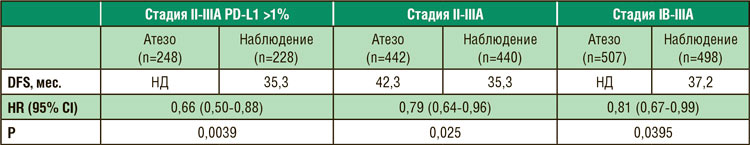
* НД – медиана не достигнута.
В настоящем отчете представлены предварительные данные оценки безрецидивной выживаемости 1005 больных, включенных в исследование. При медиане наблюдения 32 мес. в группе больных II-IIIA стадией с позитивной экспрессией PD-L1 введение атезолизумаба достоверно снизило риск прогрессирования на 34%. Выигрыш от назначения препарата уменьшается, но сохраняет потенциальную достоверность, по мере включения в анализ всех больных II-IIIA стадиями независимо от экспрессии PD-L1 и включения в анализ больных IB стадией. Данные по общей выживаемости не сообщаются в связи с коротким периодом наблюдения. Введение атезолизумаба сопровождалось развитием побочных эффектов 3-4 степени у 22% больных в сравнении с 11% в группе наблюдения. Досрочное прекращение введения препарата вследствие токсичности потребовалось 18% больных. Смерть от токсичности атезолизумаба зарегистрирована у 4 (0,8%) пациентов. Авторы делают вывод, что добавление атезолизумаба после окончания адъювантной химиотерапии достоверно уменьшает риск прогрессирования у больных II-IIIA стадией, особенно при наличии экспрессии PD-L1. Эти первые результаты открывают широкие перспективы использования иммунотерапии у больных операбельными стадиями немелкоклеточного рака легкого. Ранее в нерандомизированных исследованиях была показана способность короткого курса иммунотерапии индуцировать иммунный морфологически подтвержденный противоопухолевый эффект вплоть до полного. Этот эффект потенцируется совместным применением ингибиторов PD-1/PD-L1 с химиотерапией с достижением полного морфологического эффекта у 30-59% больных. Еще одним свойством совместного назначения химиотерапии и иммунотерапии является их способность индуцировать экспрессию PD-L1 на иммунных и резидуальных опухолевых клетках. И это открывает перспективы для адъювантного продолжения иммунотерапии после выполнения радикальной операции. Проводящиеся в настоящее время исследования должны уточнить показания к назначению и оптимальное место иммунотерапии и возможности комбинации с другими методами лечения (химиотерапия, лучевая терапия) у больных операбельным немелкоклеточным раком легкого. Предварительные результаты исследования iMpower010 вселяют надежду, что иммунотерапия будет важным и, возможно, обязательным компонентом лечения больных операбельным немелкоклеточным раком легкого.
Литература:
Wakelee HA, Altorki NK, Zhou C, et
al. IMpower010: Primary results of a
phase III global study of atezolizumab
versus best supportive care after adjuvant
chemotherapy in resected stage IB-IIIA
non-small cell lung cancer (NSCLC).
ASCO 2021, abstract 8500.

РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И РЕАЛЬНАЯ КЛИНИЧЕСКАЯ ПРАКТИКА ИММУНОТЕРАПИИ НЕМЕЛКОКЛЕТОЧНОГО РАКА ЛЕГКОГО. ЧТО-ТО ЯВНО ИДЕТ НЕ ТАК, НО ЧТО, И ЧТО С ЭТИМ ДЕЛАТЬ?
Автор: Жуков Николай Владимирович
ФГБУ «НМИЦ Детской гематологии, онкологии и иммунологии им. Д.Рогачева», Москва
Адаптируя результаты клинических исследований в реальную практику, мы обычно понимаем, что в жизни речь идет о несколько (или даже сильно) другом контингенте больных по сравнению с теми, кто участвовал в регистрационных испытаниях. Клинические исследования, имеющие формальные (по ECOG, сопутствующей патологии) и неформальные (врачи-исследователи предпочитают не включать «потенциально проблемных» пациентов, даже если они подходят формально) критерии отбора, всегда работают с более «рафинированной» группой больных, чем те, кого потом будут лечить этим же препаратом «в полях». Есть и другие особенности клинических исследований – часть пациентов с наиболее неблагоприятным прогнозом (формально попадающие под критерии включения исходно) могут «отпадать» в процессе скрининга перед включением. Если этот процесс долгий (например, ожидание подтверждения из центральной лаборатории, занимающее месяц), больные просто прогрессируют, их состояние ухудшается и они перестают соответствовать критериям включения, или врач сам принимает решение, что не готов так долго ждать и начинает терапию вне рамок исследования. Именно поэтому исследования «реальной клинической практики» – проходящие уже после регистрации препарата и оценивающие его эффективность и безопасность в общей популяции больных – являются неотъемлемой частью «принятия» препаратов специалистами. Но, увы, зачастую широко озвучиваются они лишь в том случае, если совпадают с результатами клинических исследований или есть очевидная причина (например, значимо и очевидно худший «состав» пациентов, получающих терапию в рутинных условиях). Как ни странно, но большинство «позитивных» исследований реальной клинической практики инициируются все теми же компаниями, которые эти препараты и производят. С одной стороны, это похвально, однако… Исследования, инициированные академическими или медицинскими учреждениями, иногда оказываются не столь радостными для производителей, регуляторов и медицинского сообщества. Увы, данные реальной клинической практики по использованию ингибиторов контрольных точек иммунитета (ИКТИ) в качестве первой линии лечения немелкоклеточного рака легкого (НМРЛ) оказались совсем далеки от тех цифр, которые были озвучены в регистрационных исследованиях. В ретроспективном когортном исследовании, проведенном в США и включившем около 20 000 пациентов, получавших лечение за счет одной из наиболее распространенной в этой стране «базовой» страховки – Medicare, данные реальной клинической практики различались с результатами, полученными в исследованиях, не на проценты, а в разы. Так, например, в реальной практике медиана общей выживаемости больных, получавших пембролизумаб в качестве монотерапии, составила лишь 11,4 месяца, что на 15 месяцев (т.е. более чем вдвое) меньше, чем медиана общей выживаемости в рамках регистрационного исследования, приведшего к внедрению монотерапии пембролизумабом в эту самую реальную клиническую практику (KEYNOTE-024). Интересно отметить, что в рамках рутинной клинической практики выживаемость больных, получавших моноиммунотерапию пембролизумабом, оказалась даже ниже, чем выживаемость больных, получавших комбинацию химиотерапии (пеметрексед/препараты платины) и пембролизумаба, в то время как в рамках исследований все было наоборот – пациенты с высоким уровнем экспрессии PD-L1 (≥50%), подлежащие монотерапии, имели значимо лучшую общую выживаемость, чем больные с преимущественно меньшим уровнем экспрессии, для которых использовалась комбинация (непрямое сравнение между исследованиями). Но при этом все равно и в группе комбинированной терапии из практики Medicare медиана выживаемости больных, составившая 12,9 месяца, была примерно на 10 месяцев меньше, чем в регистрационном исследовании KEYNOTE-189, послужившем поводом для внедрения этого режима в практику. И несмотря на то, что эксперты, комментировавшие это исследование для портала Medscape [1], в качестве основного вывода пришли к заключению, что по его результатам врачам и пациентам нужно быть более реалистичными в отношении ожиданий от эффективности иммунотерапии при диссеминированном НМРЛ, сохраняется вопрос – почему? Почему данные реальной клинической практики и клинических исследований расходятся настолько? И нужно ли с той же степенью «реализма» относиться к другим областям применения ИКТИ, или это ситуация, характерная только для рака легкого? А что с другими вариантами лечения НМРЛ – например, таргетной терапией? Можем ли мы надеяться на воспроизведение замечательных цифр, получаемых в рамках клинических исследований, в реальной клинической практике? И что же нам с этими цифрами делать – сокращать контингент больных, получающих ИКТИ, до 100% критериев отбора в регистрационные исследования, а остальных пациентов отправлять на альтернативное (скорее всего просто симптоматическое) лечение, или все же пытаться лечить, при этом понимая, что магнитуда выигрыша будет значительно меньше (если будет вообще)? К сожалению, анализ исследования реальной клинической практики [2], послужившего поводом для всех этих вопросов, однозначных ответов на них не дает. Как говорилось выше, в это исследование вошли 19 529 пациентов из США (медиана возраста 73,8 года), которые в интервале между 2016 и 2019 годами за счет страховки Medicare получали первую линию системной терапии по поводу распространенного НМРЛ. Из них 3079 получили монотерапию пембролизумабом, 5159 – платиносодержащую терапию с пеметрекседом, 9866 – платину и таксаны и 1425 – платину, пеметрексед и пембролизумаб. Авторы отметили крайне быструю адаптацию иммунотерапии клиниками – если в 2016 году лишь 0,7% больных, застрахованных Medicare, получали ИКТИ в качестве первой линии лечения НМРЛ, то в 2018 году таких больных было уже 42,4%. Однако скорость адаптации, совершенно очевидно связанная с большими надеждами на значимо большую эффективность, не привела к ожидаемым результатам. Так, выживаемость больных, получавших монотерапию пембролизумабом, оказалась даже статически значимо (р<0,001) меньше, чем выживаемость больных, получавших комбинацию платины и таксанов, и сопоставима с выживаемостью больных, получавших только химиотерапию комбинацией препаратами платины и пеметрекседа – 11 против 11,7 против 11,1 месяца соответственно. Несмотря на то, что различия в пользу химиотерапии составили лишь 0,7 месяца и их высокая статистическая значимость очевидно результат очень большого числа больных, включенных в исследование, очевидно, что результаты использования монотерапии пембролизумабом оказались очень далеки от ожидаемых по результатам опубликованных регистрационных клинических исследований. Пациенты, получавшие химиоиммунотерапию пембролизумаб/пеметрексед/препараты платины, к счастью, все же имели статистически значимо лучшую выживаемость (р=0,02), чем больные, получавших только химиотерапию пеметрексед/препараты платины, однако различия вряд ли можно назвать драматическими: 11,7 против 11,2 месяца соответственно. Разумеется, несмотря на то, насколько обескураживающими выглядят эти цифры, с нашей точки зрения это не связано с тем, что пембролизумаб по какой-то причине хуже работает у больных в общей популяции. И уж точно не является следствием какой-то манипуляции с данными в регистрационном исследовании. Проблема связана с тем, что общая популяция при НМРЛ скорее всего значимо отличается от популяции в исследованиях. Зачастую это просто «другие» больные, не похожие на тех, кто участвовал в исследованиях. И если доля таких пациентов среди тех, кому мы все же решаем проводить лечение в реальной практике, оказывается значительной, то мы и видим совсем другие цифры по эффективности и безопасности лечения. Судя по всему, при НМРЛ это именно так – «перевес» в реальной клинической практике как раз за «неподходящими» пациентами, которых все же (в силу отсутствия реальных альтернатив) хочется полечить. Но привычное по другим болезням «расширение» показаний (которое периодически неплохо работает, кстати) не подходит для этих больных. Да, нам хочется помочь всем – в том числе и пациентам в тяжелом состоянии, тем, кого мы никогда бы не включили в клинические исследования. Но, судя по всему, если это и помогает, то очень и очень нечасто. Косвенно это иллюстрируется и данными цитируемого исследования. Возможно, что основным критерием для назначения монотерапии пембролизумабом был даже не уровень экспрессии PD-L1 (который, кстати, в статье не указан и не анализировался), а общее состояние пациента и его способность (точнее неспособность) перенести химиотерапию. В рамках исследования монотерапию пембролизумабом статистически значимо чаще получали пациенты в возрасте 70 лет и более, женщины и больные, имевшие значимо больший исходный риск смерти. Да и в целом когорта больных, получавших лечение в рамках данного исследования реальной клинической практики, была в среднем на 10 лет старше больных из исследований регистрационных. Вполне возможно, что часть подобных пациентов все же получает долгосрочный выигрыш от лечения, который проявится через большие сроки наблюдения (медиана времени наблюдения за больными в исследовании была лишь 18 месяцев), однако выигравших, очевидно, будет немного, т.к. к этим срокам в регистрационных исследованиях уже имелись однозначные цифры, свидетельствовавшие о преимуществе иммунотерапии. В любом случае, на настоящий момент данное исследование является четким посылом для того, чтобы задуматься о целесообразности назначения иммунотерапии при НМРЛ в случае, если пациент значимо отличается от критериев отбора в регистрационные исследования.
Ссылки:
1. www.medscape.com/ viewarticle/951797
2. JAMA Netw Open. 2021;
4(5):e2111113. doi:10.1001/
jamanetworkopen.2021.11113.
«ШКОЛА КЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ ДЛЯ МОЛОДЫХ ОНКОЛОГОВ» ПОЛУЧИЛА ПОДДЕРЖКУ ФОНДА ПРЕЗИДЕНТСКИХ ГРАНТОВ!
Несколько слов о проекте:
Это образовательный курс, состоящий из лекций и практических занятий, с предварительным отбором участников экспертами РакФонда на основе представленных на конкурс синопсисов исследовательских протоколов. Ведущие эксперты в области онкологии в ходе практических занятий помогут подготовить протоколы
исследований молодых онкологов, лучшие будут профинансированы грантами на исследования.
Отбор проектов для дальнейшего финансирования будет проводиться по выстроенным в Фонде процедурам
оценки проектов на основании экспертизы, проведенной с участием членов Экспертного Совета РакФонда.
Уникальность проекта заключается в возможности для молодых ученых на практике подготовить протоколы исследований под наставлением ведущих мировых экспертов в области и затем реализовать свои проекты при финансовой поддержке РакФонда.
Эта школа — уникальный синтез инструментов для улучшения теоретической базы, практической подготовки и реализации исследований молодыми учеными России на высоком мировом уровне
АДЪЮВАНТНАЯ ИММУНОТЕРАПИЯ ОПЕРАБЕЛЬНОГО РАКА ПИЩЕВОДА
ПУ больных местнораспространенным раком пищевода одной из популярных опций является проведение химиолучевой терапии с последующим выполнением оперативного вмешательства. В апреле этого года подведены итоги 10-летнего наблюдения за больными в исследовании CROSS по сравнению эффективности химиолучевой терапии с последующей операцией и только хирургическим лечением [1,2]. В качестве химиолучевой терапии использовали еженедельное введение паклитаксела в дозе 50 мг/м2 и карбоплатина AUC×2 в течение 5 недель на фоне лучевой терапии СОД 41,4 ГР за 23 фракции. Операция выполнялась в промежутке в течение 4-6-недель после завершения химиолучевого этапа. В исследование было включено 366 больных раком пищевода T1N1M0 и T2-3N0-1M0 как с аденокарциномой, так и с плоскоклеточным раком. Частота выполнения R0 резекции составила 92% и 69% в группе химиолучевого лечения и операции соответственно. Морфологически полная регрессия опухоли при проведении химиолучевого лечения отмечена у 29% больных, чаще при плоскоклеточном раке, чем при аденокарциноме. Частота послеоперационных осложнений была одинаковой в обеих группах, послеоперационная летальность составила 4% в обеих группах. При медиане наблюдения 147 мес. 10 летняя общая выживаемость составила 38% в группе комбинированной терапии и 25% в группе только хирургии, что соответствует достоверному снижению риска смерти на 30% (HR=0,70; p=0,004). Преимущество химиолучевой терапии с последующей операцией было отмечено во всех анализируемых подгруппах. Анализ кривых выживаемости показал, что выигрыш в улучшении выживаемости при проведении комбинированного лечения реализовался в первые 5 лет, после 5 лет смертность в обеих группах была одинаковой. Из 178 больных, получивших химиолучевую терапию, 84 умерли от прогрессирования заболевания и 32 – от других причин, эти же цифры для 188 хирургических пациентов составили 121 и 22 соответственно. Частота локорегиональных и отдаленных метастазов составила 21% и 40% в группе комбинации и 40% и 50% в группе хирургии соответственно. Результаты исследования CROSS послужили мощным стимулом использования тримодального подхода (химиолучевая терапия и операция) у больных местнораспространенным раком пищевода независимо от гистологии опухоли. С учетом хорошей переносимости еженедельного введения паклитаксела и карбоплатина и их сочетания с проводимой лучевой терапией этот режим остается одним из самых популярных. В настоящее время проводится сравнения комбинации паклитаксела и карбоплатина с комбинацией FLOT как компонента химиолучевой терапии у больных аденокарциномой пищевода. У больных плоскоклеточным раком изучается комбинация цисплатина, 5-фторурацила с добавлением или без доцетаксела. Проводимые исследования помогут определиться с наилучшим режимом проведения химиолучевой терапии у больных раком пищевода в зависимости от гистологического строения опухоли. Несмотря на достоверное улучшение отдаленных результатов лечения больных раком пищевода, большинство из них погибает от прогрессирования процесса за счет появления как локорегиональных, так и отдаленных метастазов. Это делает актуальным проведение адъювантной системной терапии для снижения риска прогрессирования, особенно у больных, у которых при проведении химиолучевой терапии не достигнута морфологически подтвержденная полная регрессия опухоли. До сих пор при этой локализации не показана польза от использования адъювантного лечения, включая адъювантную химиотерапию. В этой связи результаты проведенного исследования по использованию иммунотерапии в качестве адъювантной терапии после окончания мультимодального лечения больных раком пищевода являются первым позитивным сигналом. В исследовании CheckMate 577 в качестве адъювантной терапии использовали ниволумаб, который ранее продемонстрировал клиническую эффективность в качестве второй-третьей линии терапии у больных диссеминированным раком пищевода с резистентностью к ранее проведенной химиотерапии [3]. В исследование CheckMate 577 включались больные II-III стадиями рака пищевода или гастроэзофагеального перехода с R0 резекцией остаточной после химиолучевой терапии опухоли. Разрешалось включение больных как плоскоклеточным раком, так и аденокарциномой, которым в соотношении 2:1 назначали ниволумаб 240 мг в/в каждые 2 недели в течение года или плацебо. Основным критерием эффективности была медиана времени до прогрессирования. Среди 794 включенных больных II и III стадии на момент постановки диагноза диагностированы у 35% и 65% соответственно, аденокарцинома и плоскоклеточный рак встречались в 71% и 29% случаев, опухоль локализовалась в пищеводе или гастроэзофагеальном переходе у 60% и 40% больных. У все больных в удаленном материале определялась остаточная опухоль, у 57% больных имелись остаточные метастазы в региональных лимфоузлах (ypN1+). Экспрессия PD-L1 на опухолевых клетках >1% определялась у 17% больных. При медиане наблюдения 24 мес. назначение ниволумаба адъювантно достоверно увеличило медиану времени до прогрессирования по сравнению с плацебо с 11 мес. до 22,4 мес., что соответствует снижению риска прогрессирования на 39% (HR=0,69; p<0,001). Позитивный эффект ниволумаба отмечался независимо от экспрессии PD-L1 в опухоли и был отмечен у больных с аденокарциномой (11,1 и 19,4 мес.) и плоскоклеточным раком (11,0 и 29,7 мес.). Ниволумаб снижал как риск локорегионального (17% в группе плацебо и 12% в группе ниволумаба), так и отдаленного (39% и 29%) прогрессирования. Медиана времени до развития отдаленных метастазов составила 28,3 мес. в группе ниволумаба и 17,6 мес. в группе плацебо. Частота побочных эффектов 3-4 степени, обусловленных проводимым лечением, составила 13% в группе ниволумаба и 8% в группе плацебо. Лечение было досрочно прекращено по причине токсичности у 9% и 3% больных соответственно. Наиболее частыми побочными эффектами были слабость, диарея, кожная сыпь. Авторы делают вывод о клинической пользе проведения адъювантной терапии ниволумабом в течение года у больных раком пищевода с остаточной опухолью после проведенной химиолучевой терапии и последующей R0 резекции. Это открывает новую опцию по использованию иммунотерапии в качестве адъювантной терапии у больных раком пищевода. Проводимые клинические исследования изучают вопрос назначения ингибиторов контрольных точек иммунного ответа после проведения химиолучевой терапии вместо хирургического лечения (KEYNOTE-975) или после проведения периоперационной химиотерапии без лучевой терапии (KEYNOTE-585). Хотелось бы верить, что позитивные результаты ChekMate 577 являются предвестником активного использования иммунотерапии при операбельном раке пищевода, итогом чего будет улучшение отдаленных результатов, так необходимых для этой группы больных.
Литература:
1. Van Hagen P, Hulshof MC, van Lanschot JJ, et al. Preoperative chemoradiotherapy for esopgageal or junctional cancer. N. Engl. J. Med. 2012; 366: 2074-84.
2. Van Hagen P, van Lanschot JJ, Hulshof MC, et al. Ten-year outcome of neoadjuvant chemoradiotherapy plus surgery for esophageal cancer: the randomized controlled CROSS study. J. Clin. Oncol. Published online: April 23, 2021.
3. Kelly RJ, Ajani JA, Kuzdzal J, et
al. Adjuvant nivolumab in resected
esophageal or gastroesophageal junction
cancer. N. Engl. J. Med. 2021; 384: 1191-
203.

ИМЕЕТ ЛИ ИММУНОТЕРАПИЯ ВТОРОЙ ШАНС ПРИ ЛЕЧЕНИИ МЕТАСТАТИЧЕСКОЙ МЕЛАНОМЫ КОЖИ? ПОВТОРНЫЙ ЗАХОД НА ПОСАДКУ
Автор: Утяшев Игорь Аглямович
Институт Онкологии Хадасса, Москва
Какова эффективность комбинации анти-CTLA-4 + анти-PD-1 моноклональных антител (мАТ) при ее назначении пациентам с метастатической меланомой, прогрессирующим на иммунотерапии анти-PD-1/анти-PD-L1 мАТ в монорежиме? Ответ на этот вопрос, волнующий сегодня многих онкологов и пациентов с метастатической меланомой кожи, попытались получить Ines Pires da Silva и соавторы в статье, опубликованной в майском номере престижного журнала The Lancet Oncology [1]. Авторы представили результаты ретроспективного исследования, результаты которого показали, что пациенты, резистентные к уже проведенной иммунотерапии анти-PD-1/анти-PD-L1 мАТ и получающие комбинированную иммунотерапию ипилимумабом и анти-PD-1 мАТ, имеют лучший результат лечения в сравнении с пациентами, получающими только монотерапию ипилимумабом. В работе проанализированы результаты лечения пациентов с неоперабельной меланомой (III и IV стадии) из 15 меланомных центров Австралии, Европы и США. Все пациенты прогрессировали на фоне монотерапии анти-PD-1/ анти-PD-L1 мАТ (ниволумабом, пембролизумабом или атезолизумабом) и в последующем, с февраля 2011 г. по февраль 2020 г., получали либо монотерапию ипилимумабом, либо комбинацию ипилимумаба с анти-PD-1 мАТ. Обязательным условием включения пациентов в исследование было наличие прогрессирования или рецидива меланомы на фоне или после предшествующей терапии ниволумабом, пембролизумабом или атезолизумабом или в адъювантном режиме, или для лечения метастатической формы меланомы. Всего в исследовании проанализировали 355 пациентов, из которых 193 получили комбинацию ипилимумаба с анти-PD-1 мАТ, а 162 получали только ипилимумаб. Медиана наблюдения составила 22,1 мес. (межквартильный размах = 9,5-30,9 мес.). Объективный ответ был зафиксирован у 60 пациентов (31%), получивших комбинированную иммунотерапию, и у 21 пациента (13%) в подгруппе получавших только ипилимумаб (P<0,0001). Доля полных ответов в группе комбинированной терапии составила 11%, а в группе монотерапии ипилимумабом – только 2%, частота контроля над заболеванием – 40% и 27% соответственно (P=0,016). Медиана общей выживаемости в группе комбинированной иммунотерапии составила 20,4 мес. (95% доверительный интервал (ДИ) 12,7-34,8 мес.), а в группе монотерапии ипилимумабом – 8,8 мес. (95% ДИ 6,1-11,3 мес.), отношение рисков (ОР) = 0,5, 95% ДИ 0,38-0,66, P<0,0001. 1-летняя общая выживаемость составила 58% (95% ДИ 51-66%) против 38% (95% ДИ 31-48%) в пользу комбинированной иммунотерапии. Медиана выживаемости без прогрессирования в группе комбинированной иммунотерапии составила 3,0 мес. (95% ДИ 2,6- 3,6 мес.) против 2,6 мес. в группе ипилимумаба (ОР=0,69; 95% ДИ 0,55-0,87; P=0,0019). 1-летняя безрецидивная выживаемость в группе комбинированной иммунотерапии составила 24% (95% ДИ 19-32%), а в группе монотерапии ипилимумабом – 12% (95% ДИ 8-19%). Нежелательные явления (НЯ) ≥3 степени, обусловленные лечением, были выявлены у 31% пациентов в группе комбинированной иммунотерапии и у 33% пациентов в группе монотерапии ипилимумабом, при этом наиболее частыми НЯ были диарея или колит (12% против 20% в пользу комбинированной терапии) и повышение уровня АЛТ или АСТ (12% против 9% соответственно). В группе пациентов, получавших монотерапию ипилимумабом, зафиксирован один случай смерти спустя 26 дней после последнего введения препарата, обусловленный перфорацией толстой кишки на фоне иммуноопосредованного панколита. НЯ 3-4 степени во время проведенной ранее монотерапии антиPD-1/анти-PD-L1 мАТ наблюдали у 5 пациентов в группе комбинированной иммунотерапии и у 6 пациентов в группе ипилимумаба. При этом у двух пациентов в группе комбинированной иммунотерапии и у трех пациентов в группе монотерапии ипилимумабом НЯ 3-4 степени повторно возникли на фоне исследуемой терапии (пневмонит 3 степени, панкреатит, гепатит и гемолитическая анемия). В своей работе авторы пришли к выводу, что у пациентов, резистентных к терапии анти-PD-1/ анти-PD-L1 мАТ, применение комбинации ипилимумаба с анти-PD-1 мАТ более эффективно, чем монотерапия ипилимумабом. Комбинированная иммунотерапия обладает более высокой частотой объективных ответов на лечение с более длительной выживаемостью без прогрессирования и общей продолжительностью жизни при сопоставимой частоте НЯ 3-5 степени. Комбинированная иммунотерапия ипилимумабом и анти-PD-1 мАТ является более предпочтительным вариантом второй линии иммунотерапии в сравнении с монотерапией ипилимумабом у пациентов с диссеминированной меланомой. Следует признать, что, несмотря на прорыв в лечении метастатической меланомы, который мы наблюдаем в последнее десятилетие, обусловленный применением таргетной терапии BRAFi/MEKi и иммунотерапии анти-PD-1/ анти-PD-L1/анти-CTLA-4 мАТ, большая часть пациентов резистентны к монотерапии антиPD-1/анти-PD-L1 мАТ. Практически ежедневно в клинической практике онкологи сталкиваются с вопросом: что же назначить пациенту, спрогрессировавшему на терапии анти-PD-1/антиPD-L1 мАТ? И если у пациентов с BRAF-мутированной меланомой возможно назначение таргетной терапии BRAFi/MEKi, в том числе повторное (так называемый re-challenge), то у пациентов без мутаций BRAF и c-kit выбор последующих линий системной терапии ограничен иммунотерапией ипилимумаб-содержащими режимами или химиотерапией цитостатиками. В последнее время появляется все больше публикаций, свидетельствующих об эффективности комбинации ипилимумаба с анти-PD-1 мАТ у пациентов, резистентных к терапии анти PD-1/анти-PD-L1 мАТ. Так, например, Daniel J. Olson и соавторы [2] опубликовали в майском номере Journal of Clinical Oncology первое проспективное исследование применения иммунотерапии пембролизумабом (200 мг) в комбинации с низкими дозами ипилимумаба (1 мг/кг) у пациентов, спрогрессировавших на монотерапии анти-PD-1/антиPD-L1 мАТ. В свое исследование авторы включили 60 пациентов с прогрессированием болезни на фоне терапии анти-PD-1 мАТ и 10 пациентов с прогрессированием на режимах, содержащих анти-PD-1/анти-PD-L1 мАТ (за исключением анти-CTLA4 мАТ). 13 пациентов получали предшествующую терапию анти-PD-1/ анти-PD-L1 мАТ в адъювантном режиме. Медиана времени предшествующей терапии анти-PD-1/ анти-PD-L1 мАТ составила 4,8 мес. У 5 пациентов на фоне терапии был отмечен полный ответ, у 15 – частичный ответ, при этом частота ответов по irRECIST достигла 29%. Медина выживаемости без прогрессирования составила 5,0 мес., а медиана общей выживаемости – 24,7 мес. НЯ 3-4 степени, обусловленные проводимым лечением, наблюдали у 27%. Таким образом, на сегодняшний день результаты опубликованных клинических исследований свидетельствуют о потенциальной эффективности комбинации анти CTLA-4 + анти-PD-1 мАТ у пациентов с метастатической меланомой кожи и прогрессированием болезни после предшествующей терапии анти-PD-1/анти-PD-L1 антителами, что позволяет назначить эту комбинацию в реальной клинической практике.
Источники:
1. Pires da Silva I, Ahmed T, Reijers ILM, et al. Ipilimumab alone or ipilimumab plus anti-PD-1 therapy in patients with metastatic melanoma resistant to anti-PD-(L)1 monotherapy: a multicentre, retrospective, cohort study [published online ahead of print, 2021 May 11]. Lancet Oncol. 2021; S1470-2045(21)00097-8. doi:10.1016/ S1470-2045(21)00097-8.
2. Olson DJ, Eroglu Z, Brockstein B, et
al. Pembrolizumab Plus Ipilimumab
Following Anti-PD-1/L1 Failure in
Melanoma [published online ahead
of print, 2021 May 4]. J Clin Oncol.
2021; JCO2100079. doi:10.1200/
JCO.21.00079.
Уважаемые коллеги!
С удовольствием сообщаем, что решением ВАК от 09.12.2020 г. журнал «Злокачественные опухоли» включен в перечень рецензируемых научных изданий по специальности «Онкология». С 2010 г. журнал является официальным печатным изданием Российского общества клинической онкологии (RUSSCO) и входит в перечень журналов, рецензируемых ВАК, по двум специальностям – «Онкология» и «Хирургия».
Членами редакционной коллегии журнала являются ведущие отечественные и зарубежные эксперты в области молекулярной биологии, лекарственного лечения, лучевой терапии и хирургического лечения злокачественных новообразований. В журнале публикуются оригинальные статьи авторов о проведенных научных, клинических и фундаментальных исследованиях, лекции и актуальные обзоры по проблемам диагностики и лечения злокачественных новообразований, а также интересные клинические случаи.
Необходимо отметить, что качество публикуемых работ неуклонно повышается, что делает журнал одним из наиболее престижных, объективных и высоко цитируемых в своей области.
Редакционный совет и редакционная коллегия продолжают работать над совершенствованием качества публикуемых статей. К сожалению, в отдельных случаях время от подачи статьи до ее публикации в журнале затягивается, поскольку повышение качества публикуемых работ требует постоянной коммуникации между автором и рецензентами. Редакционная коллегия планирует сделать взаимодействие между автором и рецензентами максимально эффективным. Вы можете загрузить свою статью в режиме онлайн, перейдя по ссылке: www. malignanttumors.org/jour/.
Мы ждем ваших новых публикаций и надеемся на плодотворное сотрудничество!
С уважением,
Д.А. Носов
Главный редактор, проф,. д.м.н.,
руководитель онкологического отделения ЦКБ УД Президента РФ
ул. Маршала Тимошенко д.15, член-правления RUSSCO
e-mail: nosov@mail.ru
Раб. тел.: +7(499) 141-43-55

100 МОНОКЛОНАЛЬНЫХ АНТИТЕЛ БЫЛИ ОДОБРЕНЫ FDA В КАЧЕСТВЕ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
Спустя тридцать пять лет после
одобрения FDA первого моноклонального антитела на эти биопрепараты ежегодно приходится
почти пятая часть разрешенных
агентством новых лекарственных
средств. Тем временем количество
антител, поступающих в клинику,
быстро растет. Так, если на исследования и регистрацию первых 50
антител ушло 29 лет, то следующие
50 антител были открыты, изучены
и одобрены всего за 6 лет, с 2015 по
2021 годы. Ожидается, что следующая сотня будет одобрена менее
чем за 10 лет.
Лидерами по одобрению являются антитела, применяющиеся
в онкологии и онкогематологии.
Суммарно в этих областях было
одобрено 41 антитело. Кроме того,
в клинических исследованиях в
данный момент изучается 106 антител, созданных для лечения рака, и
в 2 раза меньше для лечения других
болезней (51).
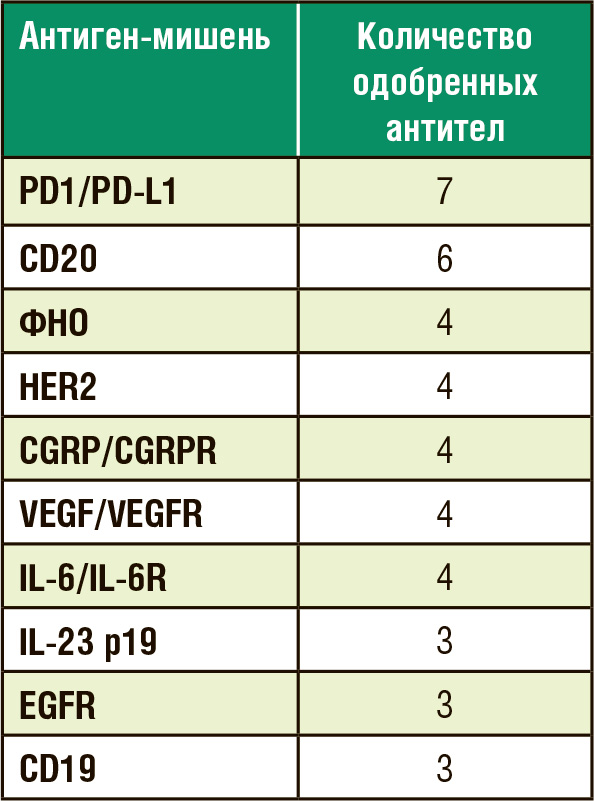
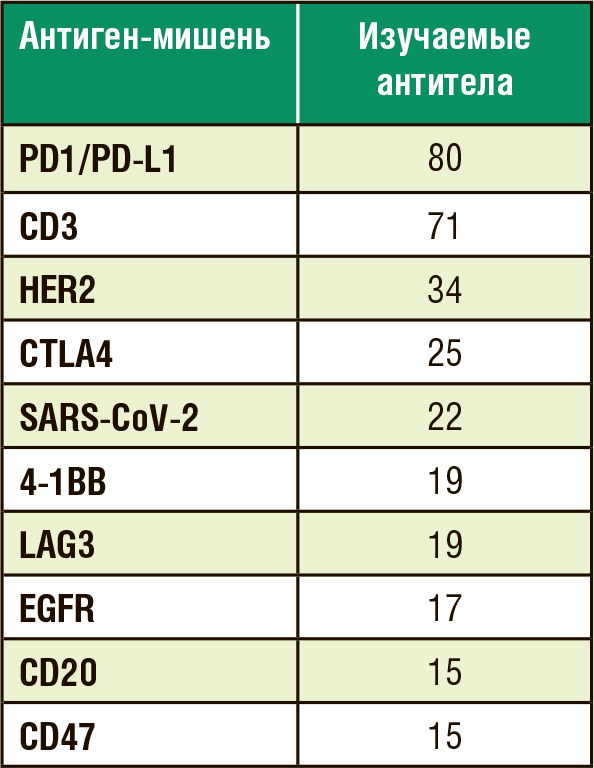
В таблице представлены антигены,
против которых зарегистрированы
терапевтические антитела.
Клиническая привлекательность
моноклональных антител уже давно очевидна.
Они обладают исключительной специфичностью и сродством как к сывороточным антигенам, так и к мишеням на поверхности
клеток. Различные формы антител
могут быть использованы для связывания циркулирующих белков, для
прямого блокирования сигнальных
путей, для управления интернализацией и деградацией рецепторов на
поверхности клетки, для доставки
низкомолекулярных агентов к определенным типам клеток, для активации противоопухолевого иммунного
ответа. В то время как медицинские
химики годами трудятся, чтобы открыть малые молекулы-ингибиторы,
обладающие активностью против
заданной цели, открытие антител может занять всего несколько месяцев.
Также клинические исследования
эффективности антител оказываются успешными в 2 раза чаще по сравнению с малыми молекулами-ингибиторами. Согласно проведенному
анализу 569 антител, вошедших в
клинические исследования 1 фазы по
одному или нескольким показаниям
в период с 2005 по 2014 годы, 22%
дошли до стадии регистрации.
По данным The Antibody Society, в
клинической разработке в настоящее
время находится около 870 антител,
но 36% из них приходятся только на
десять мишеней.
Коммерческое значение антител еще
более очевидно. Согласно базе данных Cortellis, по объему продаж в
2019 году на антитела приходилось
9 из 20 лучших лекарственных препаратов. Совокупный доход от этих 9
антител в 2019 году составил 75 млрд.
долларов США.
Лидером является адалимумаб (компания AbbVie), блокирующий фактор некроза опухоли, с объемом продаж 19,6 млрд. долларов.
Второе и третье место занимают «онкологические» антитела – пембролизумаб и ниволумаб. Ингибитор PD1
компании Merck & Co. пембролизумаб принес компании более 11 млрд.
долларов в 2019 году и может приносить до 24 млрд. долларов к 2025 году.
Ингибитор PD1 компании Bristol
Myers Squibb ниволумаб принес 8
млрд. долларов в 2019 году и, как
ожидается, в ближайшее время преодолеет порог в 10 млрд. долларов.
Продажи бевацизумаба в мире в 2019
году составили 7,1 млрд., трастузумаба – 6,1 млрд., деносумаба – 5 млрд.,
пертузумаба – 3,6 млрд.
Новые формы антител существенно расширят область применения и возможности терапии на основе антител. К ним относятся биспецифические антитела, слитые белки, конъюгаты и фрагменты антител.
Источники: журнал Nature Reviews
Drug Discovery, веб-сайт FDA, вебсайт ASCO.
FDA ПРЕДОСТАВИЛО УСКОРЕННОЕ ОДОБРЕНИЕ САЦИТУЗУМАБА ГОВИТЕКАНА ДЛЯ ЛЕЧЕНИЯ РАСПРОСТРАНЕННОГО УРОТЕЛИАЛЬНОГО РАКА
Сацитузумаб говитекан представляет собой конъюгат-антитело – лекарственное средство, состоящее из моноклональное антитела, нацеленного на белок Trop-2, который экспрессируется на опухолевых клетках, и SN-38, ингибитора топоизомеразы I, связанного с антителом через гидролизуемый линкер. 13 апреля 2021 года Управление по контролю над качеством пищевых продуктов и лекарственных препаратов США (FDA) предоставило ускоренное разрешение на применение сацитузумаба говитекана (Trodelvy, Immunomedics Inc.) для лечения пациентов с местнораспространенным или метастатическим уротелиальным раком, которые ранее получали химиотерапию на основе препаратов платины и ингибиторы PD-1 или PD-L1. Эффективность и безопасность препарата оценивались в одноранговом многоцентровом исследовании TROPHY, в котором участвовали 112 пациентов с местнораспространенным или метастатическим уротелиальным раком, резистентным к предыдущим линиям химиотерапии и иммунотерапии. Пациенты получали сацитузумаб говитекан в дозе 10 мг/кг внутривенно в первый и восьмой дни 21-дневного цикла лечения. Основными конечными точками эффективности были частота объективных ответов (ЧОО) и продолжительность ответа, оцененные независимым комитетом с использованием критериев RECIST 1.1. Подтвержденная ЧОО составила 27,7% (95% ДИ 19,6-36,9), из которых 5,4% были полными и 22,3% частичными. Медиана продолжительности ответа составила 7,2 месяца (95% ДИ 4,7-8,6). Наиболее частыми нежелательными явлениями (частота >25%) у пациентов, получающих сацитузумаб говитекан, были нейтропения, тошнота, диарея, утомляемость, алопеция, анемия, рвота, запор, снижение аппетита, сыпь и боли в животе.
Источник: веб-сайт FDA
FDA ОДОБРИЛО АМИВАНТАМАБ ПРИ НМРЛ С ИНСЕРЦИЕЙ В 20 ЭКЗОНЕ ГЕНА EGFR
Управление по контролю над качеством пищевых продуктов и лекарственных препаратов США (FDA) одобрило амивантамаб (Rybrevant) для лечения больных диссеминированным немелкоклеточным раком легкого (НМРЛ) с инсерцией в 20 экзоне гена EGFR. Амивантамаб был одобрен на основании результатов исследования 1 фазы CHRYSALIS (NCT02609776). Проблема первичной резистентности НМРЛ с драйверными мутациями к ингибиторам тирозинкиназ (ИТК) активно изучается. Существует множество механизмов первичной резистентности, такие как инсерция в 20 экзоне гена EGFR или амплификация гена с-met, приводящая к гиперэкспрессии рецептора MET и активации RAS/RAF/ MEK/MAPK, PI3K/AKT и c-SRC сигнальных путей. Амивантамаб (Rybrevant) – биспецифическое антитело к рецептору EGFR c инсерцией в 20 экзоне и рецептору MET. CHRYSALIS (NCT02609776) – это открытое, многоцентровое исследование 1 фазы по изучению амивантамаба в монотерапии и в комбинации с лазертинибом (YH25448) – ИТК EGFR третьего поколения. Исследование CHRYSALIS было спланировано для изучения безопасной дозы амивантамаба в монотерапии и в комбинации с лазертинибом, эффективности и токсичности. Исследование имело сложный дизайн: на первом этапе проводилась оценка безопасности различных доз амивантамаба (дизайн «3+3»), на втором – эффективность и токсичность терапии. В первой части исследования было показано, что доза амивантамаба 1050-1400 мг в зависимости от массы тела является приемлемой. В настоящий момент опубликованы результаты терапии нескольких рукавов исследования CHRYSALIS.
Монотерапия амивантамабом
В группе монотерапии амивантамабом основной задачей была оценка частоты достижения объективного ответа (ОО), вторичными точками – длительность ответа, уровень клинической пользы, медиана выживаемости без прогрессирования (МВБП) и общая выживаемость (МОВ) и токсичность. Большинство участников были некурящими (53%), женщинами (59%) с медианой возраста 62 года. Медиана количества линий предшествующей терапии – 2 (1- 7): 100% пациентов ранее получили химиотерапию на основе платинового дуплета, 46% иммунотерапию и 25% ИТК. При медиане наблюдения в 8,3 мес. (95% ДИ 6,5-10,9), частота достижения ОО в группе амивантамаба составила 40% (95% ДИ 29-51): 3 полных ответа и 29 частичных. Длительность объективного ответа достигла 11,1 мес. (95% ДИ 6,9-НД). Стабилизация болезни на фоне терапии зарегистрирована у 39 пациентов (48%), при уровне клинической пользы в 74% (95% ДИ 63-83%). У 63% пациентов, достигших ответа, эффект терапии сохранялся более 6 мес. и в 47% случаях – более 9 мес. Прогрессирование болезни на фоне терапии отмечено у 8 пациентов (10%). МВБП составила 8,3 мес. (95% ДИ 6,5-10,9), а МОВ – 22,8 мес. (95% ДИ 14,6-НД). Нежелательные явления (НЯ) 3 степени и выше зарегистрированы у 16% участников исследования, НЯ 4-5 степеней – у 9%. В 4% случаях НЯ послужили причиной прекращению терапии, редукция дозы и перерывы в лечении из-за токсичности потребовались 13% и 21% пациентов соответственно. Наиболее частыми НЯ любой степени, связанными с влиянием на рецептор EGFR, были сыпь (86%), паронихии (42%), стоматит (18%), кожный зуд (17%), а с ингибированием сигнальных путей от MET – гипоальбуминемия (15%) и периферические отеки (10%). Также у 66% пациентов были зарегистрированы инфузионные реакции, в большинстве случаев на первом введении.
Амивантамаб в комбинации с лазертенибом
В виде небольшого абстракта опубликованы предварительные данные об эффективности комбинации амивантамаба в дозе 1050-1400 мг с лазертинибом в дозе 250 мг. Эффективность терапии оценена у 45 больных, не получавших химиотерапию, у которых прогрессирование болезни наступило на лечении осимертинибом. В этой небольшой группе пациентов частота ОО составила 36% (95% ДИ 22-51), в том числе 1 полный ответ и 15 частичных ответов. При медиане времени наблюдения 8,2 мес. (1,0-11,8) МВБП составила 4,9 мес. (95% ДИ 3,7-8,3). Данные о токсичности комбинации не представлены.
Литература:
1. FDA approves first targeted therapy for subset of non-small cell lung cancer. News release. FDA. May 21, 2021. Accessed: May 21, 2021. bit.ly/3fCjEyT.
2. Sabari JK, Shu CA, Park K, et al. Amivantamab in post-platinum EGFR Exon 20 insertion mutant non-small cell lung cancer. Presented at: IASLC 2020 World Conference on Lung Cancer Singapore. January 28-31, 2021. Abstract OA04.04.
3. Joshua Bauml, Byoung Chul Cho,
Keunchil Park, et al. Amivantamab
in combination with lazertinib
for the treatment of osimertinibrelapsed, chemotherapy-naïve
EGFR mutant (EGFRm) non-small
cell lung cancer (NSCLC) and
potential biomarkers for response.
Abstract 9006, ASCO 2021.
РОЛЬ АПИКСАБАНА В ЛЕЧЕНИИ ВЕНОЗНЫХ ТРОМБОЭМБОЛИЧЕСКИХ ОСЛОЖНЕНИЙ У БОЛЬНЫХ С АКТИВНЫМ РАКОМ
Панченко Елизавета Павловна
Д.м.н., профессор, Научно-исследовательский институт клинической кардиологии им. А.Л. Мясникова
Проблема венозных
тромбозов у больных
активным раком
Связь венозных тромбоэмболических осложнений (ВТЭО), объединяющих тромбоэмболию легочной артерии (ТЭЛА) и тромбоз глубоких вен нижних конечностей (ТГВ), с онкологическими заболеваниями хорошо известна. Установлено, что риск ВТЭО у онкологических больных в 4 раза выше, чем в популяции [1], а у каждого пятого пациента с активным онкологическим заболеванием возникает первый эпизод ВТЭО. С другой стороны, у 10% больных с непровоцированным ВТЭО в течение 1-го года находят рак. По данным регистра GARFIELD-VTE, отследившего судьбу более 10000 больных ВТЭО, более половины (54%) из них умирают по причине онкологических заболеваний. Факторы риска ВТЭО у больного с активным раком обусловлены не только характеристиками самого пациента (возраст, пол, наличие сопутствующих заболеваний и тромбофилий), но и характеристикой самой опухоли, включая локализацию, гистологическую характеристику, стадию заболевания. Среди факторов риска, связанных с лечением, имеет значение не только хирургическое лечение и факт иммобилизации в виде постельного режима, но и специфическая терапия рака, включающая химиотерапию, иммунотерапию, применение препаратов, стимулирующих эритропоэз, а также установку «портов» и центральных венозных катетеров. Способствуют развитию ВТЭО у онкологических больных имеющиеся выраженная экспрессия тканевого фактора опухолевыми клетками и активация системы свертывания крови (ССК), сопровождающаяся повышением маркеров активации ССК, микрочастиц и Д-Димера. Хорошо известно, что не все опухоли одинаково тромбогенны. По данным [2], ВТЭО наиболее часто встречаются у больных с раком поджелудочной железы (19%), желудка (15,8%), легких (13,9%), яичников (11%), кишечника (10,6%) и мочевого пузыря (8,2%). Течение и лечение ВТЭО у больных активным раком наиболее тяжелое. Эти пациенты чаще умирают, а также переносят больше крупных кровотечений и рецидивов ВТЭО, чем больные ВТЭО без онкозаболевания. Современные рекомендации по лечению ВТЭО у больных с онкозаболеванием рекомендуют в первые 6 месяцев лечение подкожными инъекциями НМГ. Преимущество НМГ перед АВК в лечении ВТЭО у онкобольных было показано в ряде исследований и их метаанализе [3-8]. К сожалению, как сообщалось Khorana et al [9], только 50% больных с рак-ассоциированным тромбозом полноценно лечатся инъекциями НМГ, и причина этому – необходимость ежедневных подкожных инъекций. Прямые оральные антикоагулянты в профилактике ВТЭО у больных раком Появление доказательств сравнимой эффективности и безопасности четырех ПОАК (дабигатран, ривароксабан, апиксабан и эдоксабан) с традиционной терапией НМГ и дальнейшим переходом на АВК привело к их одобрению для лечения ВТЭО [10-15]. Но эффективность и безопасность ПОАК по сравнению с длительной терапией НМГ у больных ВТЭО и раком до недавнего времени ограничивалась единичными исследованиями. В 2018 г. были обнародованы результаты двух рандомизированных исследований (Hokusai VTE Cancer и SELECT-D), в которых соответственно эдоксабан и ривароксабан сравнивались с дальтепарином. Многоцентровое рандомизированное исследование Hokusai VTE Cancer [16], включившее 1050 больных с ракассоциированными ВТЭО, продемонстрировало преимущества эдоксабана перед дальтепарином в отношении профилактики рецидивов ВТЭО у онкологических пациентов, но при этом ассоциировалось с увеличением риска больших кровотечений (табл. 1). Стоит подчеркнуть, что разница в частоте крупных кровотечений была за счет увеличения частоты кровотечений из верхних отделов ЖКТ. Результаты второго проспективного открытого рандомизированного исследования SELECT-D были опубликованы в июле 2018 г. [17]. В это небольшое исследование, не достигшее достаточной статистической мощности, включили 406 больных раком с признаками острого ВТЭО. Результаты оказались похожими на результаты исследования с эдоксабаном: частота рецидивов ВТЭО в группе ривароксабана оказалась меньше, но количество кровотечений больше, в основном за счет кровотечений из ЖКТ у больных с раком желудка и пищевода (4 из 11 больных в группе ривароксабана против 1 из 19 в группе далтепарина). Увеличение частоты кровотечений у этих больных привело к изменению протокола исследования, заключавшегося в исключении пациентов с указанной выше патологией ЖКТ от участия в исследовании. И, наконец, в 2019 г. было опубликовано небольшое исследование ADAM [18], в котором у 287 пациентов с рак-ассоциированным ВТЭО сравнили еще один ПОАК – апиксабан и дальтепарин. Как видно из данных, представленных в табл. 1, первый опыт применения апиксабана оказался обнадеживающим в отношении как эффективности, так и безопасности. В рекомендациях Европейского общества кардиологов по диагностике и лечению ТЭЛА, обновленных в 2019 г. [19] совместно с Европейским респираторным обществом, впервые эдоксабан и ривароксабан рекомендованы для лечения рак-ассоциированных ВТЭО с классом доказательности II и уровнями соответственно B и C. По всей видимости, недостаточная мощность исследования SELECT-D явилась основанием для определения позиции ривароксабана в лечении ракассоциированного ВТЭО в виде уровня С (мнение экспертов).
Результаты исследования Caravaggio (апиксабан против дальтепарина у больных активным раком и острым ВТЭО)
В марте 2020 г. на сессии Американского колледжа кардиологов (ACC) были доложены результаты проспективного рандомизированного открытого исследования Caravaggio [20], которое предполагало продемонстрировать, что назначение перорального апиксабана с целью предотвращения рецидивов ВТЭО у больных с ракассоциированным ВТЭО окажется не хуже результатов при подкожных инъекциях НМГ и при этом не вызовет увеличения крупных кровотечений. Исследование было международным, рандомизированным, контролируемым и открытым. В исследование включали больных с верифицированным раком при наличии у них симптомного или случайно выявленного проксимального ТГВ нижних конечностей, или симптомной ТЭЛА, или случайно обнаруженной ТЭЛА на уровне сегментов легких и проксимальнее. Случайно обнаруженными считали ТГВ/ТЭЛА, выявленные с помощью визуализирующих методов, выполненных не с целью диагностики ВТЭО. Среди всей популяции включенных больных частота случайно выявленных ВТЭО составила около 20%. Больной мог иметь любой тип рака, кроме базально-клеточной или чешуйчато-клеточной карциномы кожи, первичной опухоли мозга или метастазов в мозг и острой лейкемии. Активным раком считались следующие состояния: диагноз «онкозаболевание», установленный в течение не более 6 месяцев до включения в исследование, проводимая терапия рака на момент включения или в течение 6 месяцев до рандомизации, поздние стадии рака или наличие метастазов. Раком в анамнезе считалось онкозаболевание, диагностированное не более двух лет назад до включения в исследование, подобных пациентов в исследовании оказалось около 20%. В исследование не включали больных моложе 18 лет, с III или IV cт. физической активности по шкале ECOG (Eastern Cooperative Oncology Group), с ожидаемой продолжительностью жизни менее 6 месяцев, принимавших лечебные дозы НМГ, НФГ, фондапаринукса, АВК в течение трех дней до рандомизации, при наличии иных показаний к лечению антикоагулянтами, сопутствующей терапии сильными ингибиторами CYP-3A4 и P-gp, а также нуждающихся в приеме клопидогрела, далтепарина, тикагрелора или аспирина в дозе >165 мг в день или двойной антитромбоцитарной терапии. Исключением также было наличие активного кровотечения или противопоказаний к назначению антикоагулянтов из-за высокого риска кровотечения при уровнях Hb <8 г/дл, тромбоцитов <75×109/л и КлКр <30 мл/мин. Протокол исследования заключался в том, что пациенты, соответствующие описанным выше критериям, рандомизировались с помощью интерактивной онлайн-системы в соотношении 1:1 в группы апиксабана или дальтепарина и стратифицировались по типам «симптомное» или «случайно найденное ВТЭО». Случайно найденные ВТЭО составили не более 20% в каждой из групп. Лечение с помощью НФГ, НМГ или фондапаринукса до рандомизации допускалось в течение не более 72 ч. Апиксабан назначался per os в дозе 10 мг 2 раза в день в течение 7 дней, а затем доза уменьшалась до 5 мг 2 раза в день. Дальтепарин назначался в виде подкожных инъекций один раз в сутки в дозе 200 МЕ на один кг веса в течение первого месяца, а затем доза уменьшалась до 150 IU на один кг веса пациента. Максимально возможная доза дальтепарина составляла 18000 МЕ в сутки. Антикоагулянтная терапия продолжалась 6 месяцев, после чего пациенты продолжали наблюдаться еще в течение 30 дней. Конечными точками эффективности был верифицированный рецидив проксимального ТГВ или ТЭЛА в период лечения с отдельным анализом проксимального ТГВ нижних конечностей (симптомного или случайно найденного), симптомного ТГВ верхних конечностей, симптомной или случайно найденной ТЭЛА. Конечной точкой безопасности было большое кровотечение, определявшееся как острое кровотечение, сопровождающееся одним или более следующими признаками: снижение Hb ≥2 г/л; потребовавшее переливания ≥2 упаковок эритромассы; кровотечение в критический орган: внутричерепное, в спинной мозг, внутриглазное, в перикард, внутрисуставное, внутримышечное с синдромом сдавления или ретроперитонеальное, фатальное или кровотечение, потребовавшее хирургического вмешательства. Конечная точка безопасности анализировалась в период лечения плюс в 72 ч после приема последней дозы антикоагулянта. Визиты пациентов осуществлялись через 1, 3, 6 и 7 месяцев после рандомизации. С апреля 2017 по июнь 2019 г. в 119 центрах было рандомизировано 1170 больных, из них 1155 пациентов были включены в модифицированный ITT (Intention To Treat) анализ, объединявший больных, получивших хотя бы одну дозу препарата (576 пациентов в группу апиксабана и 579 больных в группу дальтепарина). Демографические и клинические характеристики больных обеих групп оказались похожими. Средний возраст больных был 67 лет, больных мужского пола было около 50%. Больных с сочетанием ТГВ и ТЭЛА было около 50%, только с ТГВ – 50%, у 20% больных ВТЭО было случайно найденным. Активный рак был у подавляющего большинства больных (97%), у 68% больных имелись метастазы или локальный рецидив опухоли. При включении в исследование 62% больных получали специфическое лечение рака, четверть больных получала его в предшествующие 6 месяцев и 60% больных получали его в период лечения ВТЭО. Среди включенных в исследование больных с ВТЭО колоректальный рак был отмечен в 21% случаев, рак легкого – в 17%, рак молочной железы – у 13% больных. Гинекологические раки отмечались у 10%, поджелудочной железы – у 7,5%, рак верхних отделов ЖКТ – 4,7%. Раки крови отмечались у 7,5% больных. Первичная конечная точка эффективности – рецидивы ВТЭО в группе апиксабана – составила 5,6%, а в группе дальтепарина – 7,9% (ОР 0,63; 95% ДИ 0,37-1,07; P<0,001 для «не хуже»; P=0,09 для «лучше»). Первичная конечная точка безопасности – большие кровотечения – отмечалась в 3,8% случаев в группе апиксабана и у 4,0% больных, получавших дальтепарин (ОР 0,82; 95% ДИ 0,40-1,69; P=0,60). Большие ЖКТкровотечения в процессе лечения были зафиксированы у 11 больных (1,9%) в группе апиксабана и у 10 больных (1,7%), получавших дальтепарин. Из них из верхних отделов ЖКТ соответственно 5 и 6, а из нижних – 6 и 4 кровотечения. Клинически значимых кровотечений из ЖКТ было 11 в группе апиксабана и 15 в группе дальтепарина, из них из верхних отделов ЖКТ соответственно 2 и 8, а из нижних отделов – 9 и 7 кровотечений. Большие неЖКТкровотечения отмечены соответственно у 11 (1,9%) и 13 (2,2%) больных. В группе дальтепарина было два фатальных кровотечения, а у пациентов, получавших апиксабан, фатальных кровотечений не было. За период исследования (210 дней) в группе апиксабана умерло 135 больных (23,4%), а среди больных, получавших дальтепарин, – 153 (26,4%). Основной причиной смерти был рак, от которого умерло 85,2% в группе апиксабана и 88,2% больных, лечившихся дальтепарином, кроме этого в каждой группе было по четыре смерти, связанной с ВТЭО, и по две смерти по причине кровотечений. Анализ исходов в подгруппах, сформированных на основании характеристик включенных больных, выявил взаимодействие лишь в отношении эффективности лечения ВТЭО в зависимости от возраста. Значение «р для взаимодействия» в подгруппах больных, получавших апиксабан и дальтепарин, сформированных по возрасту «моложе 65 лет»; «65-75 лет» и «старше 75 лет», составило 0,0065. Таким образом, результаты исследования СARAVAGGIO продемонстрировали, что пероральная форма апиксабана не уступает подкожным инъекциям дальтепарина в лечении ВТЭО у больных с активным раком. Продемонстрированная эффективность апиксабана устойчиво сохраняется во всех подгруппах больных и, несомненно, свидетельствует в пользу использования ПОАК в лечении больных с рак-ассоциированным венозным тромбозом. Следует отметить, что абсолютное число ВТЭО было меньше в группе апиксабана за счет меньшего числа рецидивирующей ТЭЛА: 19 (3,3%) против 32 (5,5%), ОР 0,87, 95% ДИ 0,34-2,21. Стоит отметить, что кривые накопления ВТЭО в группах апиксабана и дальтепарина разошлись через 30 дней, когда по условиям протокола суточная доза дальтепарина уменьшалась на 50 МЕ/кг веса пациента. Частота больших кровотечений, включая ЖКТ-кровотечения, оказалась одинаковой у больных в группе апиксабана и дальтепарина, что является основным отличием от результатов исследований SELECT-D и Hokusai-cancer, в которых ривароксабан и эдоксабан продемонстрировали больше геморрагических осложнений, чем дальтепарин (табл. 1). Следует подчер¬кнуть близкую частоту больших кровотечений в группе дальтепарина во всех исследованиях с ПОАК. Кровотечений, не соответствующих критериям больших, было больше в группе апиксабана, что в целом совпадает с данными, полученными с другими ПОАК в аналогичной ситуации [5, 16, 17]. В исследовании CARAVAGGIO оказались пациенты с наиболее часто встречающимися видами рака. Большинство больных имели так называемый активный рак, требующий противоопухолевой терапии. Пациентов с опухолями желудочно-кишечного тракта было около одной трети (колоректальный рак – 20%, рак поджелудочной железы – 7,5%, рак верхних отделов ЖКТ – 4,5%). Наиболее тромбогенные опухоли – рак легких и поджелудочной железы – отмечались соответственно у 17% и 7,5% больных в каждой группе. При включении в исследование не было ограничений, связанных с видом проводимой противоопухолевой терапии, и различные ее варианты одинаково часто применялись в группах апиксабана и дальтепарина. В каждой группе около 20% больных получали антиметаболиты; 15% пациентов – препараты на основе платины; 9% – моноклональные антитела; таксаны – 7%; гормональную терапию – 10% больных, при этом один пациент мог получать более одного противоопухолевого препарата. Следует отметить, что пациенты, включенные в исследование CARAVAGGIО, были достаточно тяжелыми, около 30% больных умерло в период исследования. Самой частой причиной смерти (более 85%) в обеих группах был рак, фатальные ВТЭО отмечались у 4 (3%) больных в группе апиксабана и 4 (2,6%) больных в группе дальтепарина. Следует отметить, что по данным [21] в популяции онкопациентов в целом смерть от ТЭЛА существенно выше и составляет около 9%. Кровотечений как причины смерти было немного, по два в каждой группе, причем оба фатальных кровотечения в группе апиксабана произошли более чем через 3 дня после отмены апиксабана. В исследовании CARAVAGGIO были и ограничения, связанные с отсутствием плацебо – инъекций дальтепарина, что сделало исследование открытым. Причиной тому послужили этические соображения, касающиеся нежелательности дополнительных инъекций у тяжелых онкологических больных. Кроме того, в исследования не включали больных моложе 18 лет, а также пациентов с поражением головного мозга по соображениям безопасности. Несмотря на то, что кровотечений из ЖКТ не было больше в группе апиксабана, анализ их частоты не был запланирован в виде специальной конечной точки. Размер исследования не был достаточным для анализа кровотечений, тем не менее, исследование CARAVAGGIO оказалось самым крупным из всех, в которых изучалась эффективность и безопасность ПОАК у пациентов с ракассоциированными ВТЭО.
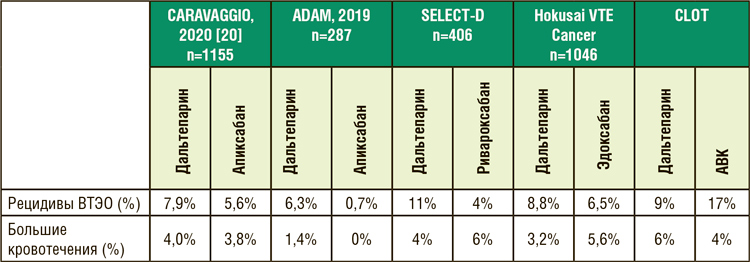
Таблица 1. Накопительная частота рецидивов ВТЭО и больших кровотечений
за 6 месяцев у онкобольных, получающих антикоагулянты [5, 16, 17, 18, 20].
Заключение
Следует подчеркнуть, что пероральный апиксабан оказался не хуже подкожных инъекций далтепарина при лечении ВТЭО у онкологических больных. В отличие от исследований с ривароксабаном и эдоксабаном, у больных, получавших апиксабан, не отмечено увеличения риска больших кровотечений, в том числе из желудочно-кишечного тракта, поэтому результаты самого крупного на сегодняшний день исследования CARAVAGGIO увеличивают долю онкобольных с ВТЭО, которые могут лечиться ПОАК, включая больных с раком ЖКТ. Есть все основания полагать, что рекомендации Европейского общества кардиологов по диагностике и лечению ТЭЛА, опубликованные в сентябре 2019 г., будут в ближайшее время обновлены за счет добавления апиксабана в перечень препаратов, рекомендованных для лечения рак-ассоциированных венозных тромбозов.
Литература :
1. Heit J.A., O’Fallon W.M., Petterson T.M., Lohse C.M., Silverstein M.D., Mohr D.N. Relative Impact of risk factors for deep vein thrombosis and pulmonary embolism: a populationbased study. Arch Intern Med. 2002;162(11):1245-1248. doi: 10.1001/ archinte.162.11.1245.
2. Khorana A., Dalal M., Lin J., Connolly G.C. Incidence and predictors of venous thromboembolism (VTE) among ambulatory high-risk cancer patients undergoing chemotherapy in the United States. Cancer. 2013;119(3):648-555. doi: 10.1002/ cncr.27772.
3. Lee A.Y., Kamphuisen P.W., Meyer G., Bauersachs R., Janas M.S., Jarner M.F., Khorana A.A. Tinzaparin vs warfarin for treatment of acute venous thromboembolism in patients with active cancer: a randomized clinical trial. JAMA. 2015;314(7):677-686. doi: 10.1001/jama.2015.9243.
4. Deitcher S.R., Kessler C.M., Merli G., Rigas J.R., Lyons R.M., Fareed J. Secondary prevention of venous thromboembolic events in patients with active cancer: enoxaparin alone versus initial enoxaparin followed by warfarin for a 180-day period. Clin Appl Thromb Hemost. 2006;12(4):389- 396. doi: 10.1177/1076029606293692.
5. Lee A.Y., Levine M.N., Baker R.I., Bowden C., Kakkar A.K., Prins M. et al. Low-molecular-weight heparin versus a coumarin for the prevention of recurrent venous thromboembolism in patients with cancer. N Engl J Med. 2003;349:146-153. doi: 10.1056/ NEJMoa025313.
6. Meyer G., Marjanovic Z., Valcke J., Lorcerie B., Gruel Y., SolalCeligny P. et al. Comparison of low-molecular- weight heparin and warfarin for the secondary prevention of venous thromboembolism in patients with cancer: a randomized controlled study. Arch Intern Med. 2002;162(15):1729-1735. doi: 10.1001/ archinte.162.15.1729.
7. Hull R.D., Pineo G.F., Brant R.F., Mah A.F., Burke N., Dear R. et al. Long-term low-molecular-weight heparin versus usual care in proximalvein thrombosis patients with cancer. Am J Med. 2006;119(12):1062-1072. doi: 10.1016/j.amjmed.2006.02.022.
8. Posch F., Konigsbrugge O., Zielinski C., Pabinger I., Ay C. Treatment of venous thromboembolism in patients with cancer: a network metaanalysis comparing efficacy and safety of anticoagulants. Thromb Res. 2015;136(3):582-589. doi: 10.1016/j. thromres.2015.07.011.
9. Khorana A., Yannicelli D., McCrae K.R., Milentijevic D., Crivera C., Nelson W.W., Schein J.R. Еvaluation of US prescription patterns: are treatment guidelines for cancer-associated venous thromboembolism being followed? Thromb Res. 2016;145:51-53. doi:
10.1016/j.thromres.2016.07.013. 10.Schulman S., Kearon C., Kakkar A.K., Mismetti P., Schellong S., Eriksson H. et al. RE-COVER Study Group. Dabigatran versus warfarin in the treatment of acute venous thromboembolism. N Engl J Med. 2009;361(2):2342-2352. doi: 10.1056/ NEJMoa0906598.
11.EINSTEIN Investigators, Bauersachs R., Berkowitz S.D., Brenner B., Decousus H., Gallus A.S., Lensing A.W. et al. Oral rivaroxaban for symptomatic venous thromboembolism. N Engl J Med. 2010;363(26):2499-2510. doi: 10.1056/ NEJMoa1007903.
12.EINSTEIN-PE Investigators, Buller H.R., Prins M.H., Lensin A.W., Decousus H., Jacobson B.F., Minar E. et al. Oral rivaroxaban for the treatment of symptomatic pulmonary embolism. N Engl J Med. 2012;366(14):1287- 1297. doi: 10.1056/NEJMoa1113572.
13.Prins M.H., Lensing W.A.A., Bauersachs R., van Bellen B., Bounameaux H., Brighton T.A. et al. Oral rivaroxaban versus standard therapy for the treatment of symptomatic venous thromboembolism: a pooled analysis of the EINSTEIN-DVT and PE randomized studies. Thromb J. 2013;11(1):21. doi: 10.1186/1477- 9560-11-21.
14.Agnelli G., Buller H.R., Cohen A., Curto M., Gallus A.S., Jonson M. et al. Oral apixaban for the treatment of acute venous thromboembolism. N Engl J Med. 2013;369(9):799-808. doi: 10.1056/NEJMoa1302507.
15.Hokusai-VTE Investigators, Buller H.R., Decousus H., Grosso M.A. et al. Edoxaban versus warfarin for the treatment of symptomatic venous thromboembolism. N Engl J Med. 2013;369(15):1406-1415. doi: 10.1056/ NEJMoa1306638.
16.Raskob G.E., van E.N., Verhamme P., Carrier M., Di Nisio M., Garcia D. et al. Edoxaban for the treatment of cancer-associated venous thromboembolism. N Engl J Med. 2018;378(7):615-624. doi: 10.1056/ NEJMoa1711948.
17.Young A.M., Marshall A., Thirlwall J., Chapman O., Lokare A., Hill C. et al. Comparison of an oral factor Xa inhibitor with low molecular weight heparin in patients with cancer with venous thromboembolism: results of a randomized trial (SELECT-D). J Clin Oncol. 2018;36(20):2017-2023. doi: 10.1200/JCO.2018.78.8034.
18.McBane R., Wysokinski W. E., LeRademacher J.G., Zemla T., Ashrani A., Tafur A. et al. Apixaban and Dalteparin in Active MalignancyAssociated Venous Thromboembolism: The ADAM VTE Trial. J Thromb Haemost. 2020;18(2):411-421. doi: 10.1111/jth.14662.
19.Konstantinides S.V., Meyer G., Becattini C., Bueno H., Geersing G.-J., Harjola V.-P. et al. 2019 ESC Guidelines for the diagnosis and management of acute pulmonaryembolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020;41(4):543-603. doi: 10.1093/ eurheartj/ehz405.
20.Agnelli G., Becattini C., Meyer G., Murioz A., Huisman M.V., Connors J.M. et al. Apixaban for the Treatment of Venous Thromboembolism Associated with Cancer. N Eng J Med. 2020. doi: 10.1056/NEJMoa1915103.
21.Khorana A.A., Francis C.W.,
Culakova E., Kuderer N.M., Lyman
G.H. Thromboembolism is a leading
cause of death in cancer patients
receiving outpatient chemotherapy.
J Thromb Haemost. 2007;5(3):632-
634. doi: 10.1111/j.1538-
7836.2007.02374.x.

НОВЫЕ ВОЗМОЖНОСТИ ТЕРАПИИ В ПОЗДНИХ ЛИНИЯХ РАКА ШЕЙКИ МАТКИ
В мае 2021 г. в Lancet oncology представлены результаты исследования 2 фазы innovaTV204 по изучению эффективности и безопасности тизотумаба ведотина у больных диссеминированным раком шейки матки (РШМ).
Тизотумаб ведотин
Тизотумаб ведотин представляет собой конъюгат, состоящий из моноклонального антитела к тканевому фактору (ТФ), соединенного при помощи линкера с монометилауристатином Е (ММАЕ). Тканевый фактор (тромбопластин) является III фактором системы свертывания крови и входит в состав мембран большинства клеток нашего организма за исключением эндотелия и клеток крови. Частота экспрессии тромбопластина на мембранах опухолевых клетках различна, так при раке шейки матки она достигает 100%, при НМРЛ – 34-88%, при раке эндометрия – 14-100%, при раке простаты – 47-75%, при раке яичников – 75-100%, а при раке пищевода определяется в 43-91% случаев. Высокий уровень экспрессии ТФ ассоциирован с агрессивным течением болезни и плохим прогнозом. Механизм действия тизотумаба ведотина следующий: конъюгат доставляет цитотоксический агент ММАЕ к клеткам-мишеням, антитело к ТФ связывается с ТФ на поверхности клеток, интернализируется и перемещается в эндосому. В эндосоме разрушается линкер и высвобождается ММАЕ, который ингибирует полимеризацию тубулина в веретене деления, вследствие чего блокируется переход клетки из фазы G2 в фазу M клеточного цикла. Остановка клеточного цикла на этом этапе вызывает апоптоз опухолевой клетки.
Исследование innovaTV204
В исследование innovaTV204 были включены пациентки, ранее получившие две и более линий терапии и с зарегистрированным прогрессированием болезни на фоне стандартной платиносодержащей терапии ± бевацизумаб. Пациентки получали тизотумаб ведотин в режиме 2 мг/кг (максимальная суммарная доза не должна была превышать 200 мг) в/в 1 раз в 3 недели. Лечение продолжалось до прогрессирования или непереносимой токсичности. Основным критерием эффективности была частота достижения объективного ответа, вторичными точками – длительность ответа, время до достижения ответа, выживаемость без прогрессирования (ВБП), общая выживаемость (ОВ) и безопасность терапии. Оценка эффекта проводилась у всех пациенток, получивших хотя бы одно введение исследуемого препарата. С 2018 по 2019 гг. в исследование было включено 102 больных. На момент анализа медиана времени наблюдения составила 10,0 мес. Объективный ответ зарегистрирован у 24% пациенток (7 [7%] полных ответов и 17 [17%] частичных ответов) при контроле роста опухоли в 72%. Медиана ВБП достигла 4,2 мес. при медиане ОВ в 12,1 мес. У пациенток с ОО медиана длительности ответа составила 8,3 мес. при времени до достижения ответа в 1,4 мес. Основными нежелательными явлениями (НЯ) любой степени были алопеция (38%), носовые кровотечения (30%), тошнота (27%), конъюнктивит (26%), слабость (26%) и сухой кератоконъюнктивит (23%). НЯ 3 степени и выше зарегистрированы у 28 пациенток и были представлены нейтропенией (3%), слабостью (2%), изъязвлением роговицы (2%) и периферической полинейропатией (2%). За период исследования четыре пациентки погибли, но только одна смерть была связанна с терапией – причиной стал септический шок, одна пациентки погибла от кишечной непроходимости, а причины смерти еще 2 больных неизвестны. Исследователи делают вывод, что у пациенток с метастатическим РШМ тизотумаб ведотин демонстрирует клинически значимую эффективность и приемлемый и управляемый профиль токсичности.
Литература:
1. Coleman R, Lorusso D, Gennigens C, et al. Efficacy and safety of tisotumab vedotin in previously treated recurrent or metastatic cervical cancer (innovaTV 204/GOG-3023/ENGOT-cx6): a multicentre, open-label, single-arm, phase 2 study. Lancet Oncol. 2021; 22(5): 609-619. doi:10.1016/ S1470- 2045(21)00056-5.
2. Coleman R, Lorusso D, Gennigens C,
et al. Tisotumab vedotin in previously
treated recurrent or metastatic cervical
cancer: results from the phase 2
innovaTV 204/GOG-3023/ENGOTcx6 study. Presented at: 2020 ESMO
Virtual Congress; September 19-21,
2020; Virtual. Abstract LBA32.
