Дорогие коллеги, дорогие друзья!
Весна вступила в свои права: теплые вещи припрятаны до осени, солнце заставляет щуриться, на коже появляется первый легкий загар. Где-то далеко отсюда цветет сакура, усыпая розовыми лепестками мир, где-то — ярко-желтый кустарник дрок, а на...

Джордж Генри. Японка с веером. 1894, холст, масло.
Художественная галерея Келвингроув, Глазго.
ОДЗАВА РОАН (1725–1803)
С горечью смотрю, как осыпаются цветы вишни у хижины...
НОВОСТИ ОБЩЕСТВА / ПАМЯТИ М.И. ДАВЫДОВА
24-25 апреля в Санкт-Петербурге состоится XI Конференция RUSSCO «Рак легкого и другие опухоли грудной клетки» совместно с Пятым национальным онкопульмонологическим конгрессом. Оба мероприятия посвящены памяти...
НОВОСТИ ОБЩЕСТВА / ИЗУЧЕНИЕ ЧАСТОТЫ МУТАЦИЙ В РОССИЙСКОЙ ПОПУЛЯЦИИ БОЛЬНЫХ С ОНКОЛОГИЧЕСКИМИ ЗАБОЛЕВАНИЯМИ С ЦЕЛЬЮ ИЗУЧЕНИЯ ЭПИДЕМИОЛОГИИ ДРАЙВЕРНЫХ МУТАЦИЙ
Изучение частоты мутаций в российской популяции больных с онкологическими заболеваниями с целью изучения эпидемиологии драйверных мутаций В рамках программы Российского общества клинической онкологии (RUSSCO)...

НОВОСТИ ОБЩЕСТВА / ОПРЕДЕЛЕН ПОБЕДИТЕЛЬ ИНТЕНСИВА RUSSCO ПО ОНКОГИНЕКОЛОГИИ
30 марта завершил свою работу интенсив RUSSCO по онкогинекологии. Интенсив длился три дня и включал в себя лекционный курс, а также практические мастер-классы по лечению рака шейки матки, эндометрия и яичников.

ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / ТАРГЕТНАЯ ТЕРАПИЯ НМРЛ С МУТАЦИЯМИ RET И NTRK: ОБНОВЛЕННЫЕ ДАННЫЕ
Одним из наиболее эффективных видов лекарственного лечения распространенного немелкоклеточного рака легкого на сегодняшний день, несомненно, является таргетная терапия. Мы уже неоднократно писали о достижениях осимертиниба,

ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / «НЕ ХЛЕБОМ ЕДИНЫМ…», ИЛИ ОТКАЗ ОТ ОПЕРАЦИИ ПРИ РАКЕ МОЛОЧНОЙ ЖЕЛЕЗЫ
Тема отказа от хирургического вмешательства при раке молочной железы в последнее время становится столь же популярной и обсуждаемой, насколько казалась нереальной еще некоторое время назад. Казалось бы, что здесь обсуждать?

ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / КОММЕНТАРИЙ ЭКСПЕРТА
Получены свидетельства о возможности отказа от выполнения хирургического лечения у больных раком молочной железы с противоопухолевым ответом на неоадъювантную системную терапию

ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / FDA ОДОБРИЛО КАБОЗАНТИНИБ ДЛЯ ВЗРОСЛЫХ И ДЕТЕЙ ОТ 12 ЛЕТ И СТАРШЕ С PNET И EPNET
26 марта FDA одобрила кабозантиниб для пациентов с ранее пролеченными неоперабельными местнораспространенными или метастатическими, высокодифференцированными нейроэндокринными опухолями поджелудочной железы (pNET) и
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / SUNNIFORECAST TRIAL: ИПИЛИМУМАБ/НИВОЛУМАБ ПРОТИВ СТАНДАРТНОЙ ТЕРАПИИ ПРИ НЕСВЕТЛОКЛЕТОЧНОМ ПОЧЕЧНОКЛЕТОЧНОМ РАКЕ (НСПКР) – II ФАЗА
В рекомендациях NCCN одобренными опциями первой линии терапии пациентов с нсПКР являются кабозантиниб (имеет преимущества над сунитинибом по данным SWOG1500), а также ниволумаб/кабозатиниб и пембролизумаб/ленватиниб ...
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / HIMALAYA TRIAL: ДАННЫЕ 5-ЛЕТНЕЙ ОБЩЕЙ ВЫЖИВАЕМОСТИ
Исследование III фазы HIMALAYA показало, что протокол STRIDE (однократное введение тремелимумаба с введением дурвалумаба до прогрессирования или непереносимой токсичности) улучшил общую выживаемость (ОВ) по сравнению с...
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / ПРЕДИКТОРЫ ЭФФЕКТИВНОСТИ PD-1 ИНГИБИТОРОВ ПРИ НМРЛ
В небольшом ретроспективном китайском исследовании проведен интересный анализ, в рамках которого у пациентов, получавших чек-пойнт ингибиторы в первой линии по поводу метастатического НМРЛ, оценивались уровни соотношения
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / МЕТААНАЛИЗ ВЛИЯНИЯ ПОТЕРИ HER2-ПОЗИТИВНОСТИ ПОСЛЕ НЕОАДЪЮВАНТНОЙ ТЕРАПИИ У HER2+ ПАЦИЕНТОК С РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ НА ДОЛГОСРОЧНЫЙ ПРОГНОЗ
В журнале Cancer treatment опубликован метаанализ и систематический обзор 8 исследований, оценивающий выживаемость пациенток и риск рецидива с потерей HER2-позитивности после неоадъювантной терапии. Как известно, выбор стратегии...
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / ИССЛЕДОВАНИЕ III ФАЗЫ CODEBREAK 300, СОТОРАСИБ + ПАНИТУМУМАБ В ТЕРАПИИ ХИМИОРЕЗИСТЕНТНОГО МКРР С МУТАЦИЕЙ KRAS G12C: ОБНОВЛЕННЫЕ РЕЗУЛЬТАТЫ АНАЛИЗА ОВ
11 апреля 2025 года в JCO опубликованы обновленные результаты анализа общей выживаемости (ОВ) в исследовании III фазы CodeBreaK 300, в котором изучалась эффективность препарата соторасиб в комбинации с панитумумабом по сравнению со...
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / NEO-PEMBRO TRIAL: НЕОАДЪЮВАНТНАЯ ТЕРАПИЯ ПЕМБРОЛИЗУМАБОМ ПРИ СЕРОЗНОМ РАКЕ ЯИЧНИКОВ IV СТАДИИ
Многократные попытки иммунотерапии улучшить результаты лечения распространенного рака яичников (РЯ) оказались безуспешны. Тем не менее, существует гипотеза, что паклитаксел и карбоплатин способны переводить опухоль из «холодной» ...

УГОЛОК РАДИОТЕРАПЕВТА / УЛЬТРАКОРОТКИЕ КУРСЫ ЛУЧЕВОЙ ТЕРАПИИ ПРИ РАКЕ МОЛОЧНОЙ ЖЕЛЕЗЫ: ЛУЧШЕ МЕНЬШЕ, ДА ЛУЧШЕ?
Еще некоторое время назад адъювантное облучение при раке молочной железы занимало пятьшесть недель минимум – и никак иначе. Сегодня подобные режимы практически не используются, более того, исследователи стремятся показать, что
УГОЛОК РАДИОТЕРАПЕВТА / ДЛЯ САМЫХ СМЕЛЫХ: ОДНОФРАКЦИОННАЯ SBRT ВИСЦЕРАЛЬНЫХ ОЧАГОВ
Рубрику «Уголок радиотерапевта» вскоре можно будет переименовывать в «Уголок новостей SBRТ» или наподобие того – ибо в последнее время подавляющее большинство новостей радиационной онкологии касаются применения SABR/SBRT в ...

ОНКОЛОГИЧЕСКИЕ МИФЫ И РЕАЛЬНОСТЬ: СПРОСИ СВОЕГО ВРАЧА
Российское общество клинической онкологии на своих ресурсах провело опрос онкологических пациентов с целью узнать их мнение об основных мифах и ограничениях, возникающих в процессе и после лечения опухолей...
ЭТО ИНТЕРЕСНО / ВОЗРАСТ 70+ БЕЗ ХРОНИЧЕСКИХ ЗАБОЛЕВАНИЙ – ВСЕ ОСУЩЕСТВИМО
Численность пожилых людей в мире в последние несколько десятилетий возросла, однако 80% пожилых людей имеют по крайней мере одно хроническое заболевание. Содействие здоровому старению можно отнести к глобальным приоритетам

Академия RUSSCO ДЛЯ ПОДГОТОВКИ К ЭКЗАМЕНУ ESMO*
18 ОКТЯБРЯ 2025 ГОДА В МОСКВЕ ПРОЙДЕТ ЭКЗАМЕН ESMO
Анонс
-

23-24 МАЯ 2025
КОНФЕРЕНЦИИ RUSSCO ИММУНООКОЛОГИЯ АГНОСТИЧЕСКИЕ МАРКЕРЫ В ОНКОЛОГИИ
ЯРОСЛАВЛЬ
-

27-28 МАЯ 2025
XI КОНФЕРЕНЦИЯ RUSSCO ПОДДЕРЖИВАЮЩАЯ ТЕРАПИЯ
САНКТ-ПЕТЕРБУРГ
Дорогие коллеги, дорогие друзья!
Весна вступила в свои права: теплые вещи припрятаны до осени, солнце заставляет щуриться, на коже появляется первый легкий загар. Где-то далеко отсюда цветет сакура, усыпая розовыми лепестками мир, где-то — ярко-желтый кустарник дрок, а на наших газонах - разноцветье тюльпанов и нарциссов и благоухание яблонь в садах. Дышится полной грудью, хочется надеяться на самое лучшее и доброе.
В апреле Российское общество клинической онкологии проводит четыре тематических конференции, одна из которых - по раку легкого - посвящена памяти академика М.И.Давыдова. Его имя вошло в историю отечественной онкологии, апрельский номер газеты мы начинаем с воспоминаний учеников и коллег Михаила Ивановича и уверены: эта копилка воспоминаний может быть пополнена еще тысячами теплых слов людей, которые его знали. Начинается подготовка программы ноябрьского Российского онкологического конгресса, и мы традиционно предлагаем каждому из вас активно принять участие в формировании программы. Присылайте ваши предложения, пожелания, тезисы, статьи и заявки на участие с докладами, мы все заинтересованы в расширении географии участников и лекторов.
В апрельском номере появилась новая рубрика, касающаяся мифов и слухов в онкологии, о которых нас так часто спрашивают наши пациенты. Надеюсь, краткая информация, развенчивающая эти мифы, пригодится нам всем в общении с больными.
Время отпусков пока не наступило, работы впереди, как всегда, много. Тем не менее, пусть наша работа будет в радость каждому, и пусть весна способствует этому!
Увидимся в мае!
Ваша команда RUSSCO
Джордж Генри. Японка с веером. 1894, холст, масло.
Художественная галерея Келвингроув, Глазго.

ОДЗАВА РОАН (1725–1803)
С горечью смотрю, как осыпаются
цветы вишни у хижины
Все ночи и дни
я ждал: ну когда же, когда же
они зацветут?!
А соцветья желанные вишен
опадают, едва распустившись…
НОВОСТИ ОБЩЕСТВА / ПАМЯТИ М.И. ДАВЫДОВА
24-25 апреля в Санкт-Петербурге состоится XI Конференция RUSSCO «Рак легкого и другие опухоли грудной клетки» совместно с Пятым национальным онкопульмонологическим конгрессом. Оба мероприятия посвящены памяти академика Михаила Ивановича Давыдова – человека, которого в онкологическом мире России знали все.
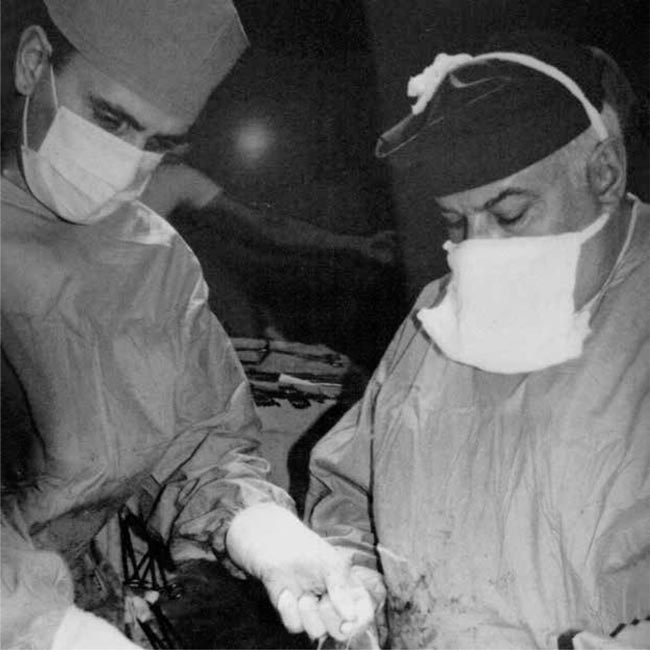
***
— Будучи в высшей степени талантливым клиницистом и гениальным хирургом, Михаил Иванович ломал существующую действительность! Разрабатывал новые подходы, доступы, варианты пластики различных органов и магистральных сосудов, виды пищеводных соустий, объемы лимфодиссекции в торакальной и абдоминальной хирургии, онкоурологии, онкогинекологии, голове-шее, онкоортопедии… Практически нет ни одного раздела хирургии злокачественных новообразований, где он не оставил бы свой глубокий след профессионала. И на самом деле, он создал у нас в стране онкохирургию в ее современном прочтении, определив ее главные принципы! Михаил Иванович – один из лучших хирургов мира. Он обладал потрясающе красивой виртуозной хирургической техникой! Он превратил ремесло, коим по сути своей является хирургия – в искусство. «Паганини в хирургии» – это про него! Великое наслаждение и эстетическое удовольствие было с ним работать в операционной! От природы он обладал феерическим даром артистизма и, как следствие, искрометным юмором. Поэтому приглашение отправиться с ним на охоту всегда воспринималось нами, учениками, как высочайшая награда, сулившая интереснейшее времяпрепровождение.
Всю свою жизнь Давыдов спасал жизни пациентов, а порой и их родственников. Истинный пассионарий – он вел нас, учеников, за собой и менял наши судьбы! Ушла Эпоха… Личность мирового масштаба
Иван Сократович Стилиди,
академик РАН, профессор, главный
внештатный специалист-онколог
Минздрава Российской Федерации,
директор ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава
России— Врачом не становятся – им
рождаются. В случае с Михаилом
Ивановичем это выражение становится аксиомой.

***
Михаил Иванович Давыдов – это личность, роль которой в становлении современной отечественной онкологии невозможно переоценить. На протяжении многих лет он возглавлял Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина, будучи оперирующим хирургом, на счету которого огромное количество операций и тысячи спасенных жизней. В 1993 году после окончания медицинского института меня направили на стажировку в торакальное отделение онкологического центра им. Н.Н. Блохина. Мой куратор выдал мне операционный костюм и отправил в операционную смотреть хирургические вмешательства, выполняемые хирургами центра. Я несколько был разочарован, не покидало стойкое ощущение, что все знания, полученные в годы учебы, я усвоил недостаточно хорошо. Это ощущение было связано с непониманием происходящего во время этих операций с написанным и обозначенным в иллюстрациях в атласах, которые изучал во время обучения в ВУЗе. Проведя в таком режиме две недели, я вернулся к куратору и поделился своими впечатлениями и страхами, на что куратор сказал: «Отлично, значит, ты правильно воспринял урок. Теперь тебе будет с чем сравнить. Пойдем на операцию к Давыдову». Это было одним из самых ярких впечатлений в моей жизни, когда я увидел, как оперирует Михаил Иванович. Виртуозная, агрессивная и в то же время эстетичная хирургия, доведенная до уровня искусства. Это был ключевой момент в выборе профессии торакоабдоминального хирурга. С тех пор и по сей день я не перестаю восхищаться личностью своего учителя, его профессионализмом, человеческими качествами, мудростью. Кажущиеся неразрешимыми ситуации, за которыми стояли реальные человеческие жизни и судьбы – и способность шефа скоординировать и объединить в единое целое все службы центра, внушить уверенность и твердость в принятии решений – все это потрясало. И все это происходило ежедневно, без перерывов и выходных дней. Научная и практическая деятельность академика Михаила Ивановича Давыдова была посвящена совершенствованию существующих и разработке новых методов оперативного лечения опухолей легкого, пищевода, желудка, средостения. Он разработал принципиально новую методику внутриплевральных желудочно-пищеводных и пищеводно-кишечных анастомозов, отличающуюся оригинальностью технического выполнения, безопасностью и высокой физиологичностью. Разработанная им методика выполнения медиастинальной и ретроперитонеальной лимфодиссекции позволила улучшить результаты лечения больных раком пищевода, желудка, легкого.
Михаил Иванович впервые в онкохирургии стал проводить операции с пластикой полой вены, легочной артерии, аорты. Им был разработан метод комбинированной резекции пищевода с циркулярной резекцией и пластикой трахеи при раке пищевода, осложненном пищеводно-трахеальным свищом.
Под руководством академика Давыдова защищено 57 докторских и 50 кандидатских диссертаций. Он является автором и соавтором более 900 научных работ, включая 34 монографии и 9 научно-методических фильмов.
Михаил Иванович создал отечественную школу торакоабдоминальной хирургии, его ученики сегодня занимают лидирующие позиции не только в Российской онкологической службе, но и на территории всех государств постсоветского пространства.
О Михаиле Ивановиче Давыдове, как о ярком человеке, выдающемся ученом, виртуозном хирурге, талантливом организаторе, необыкновенном наставнике и великой личности, можно говорить очень много и долго, и все равно не хватит времени. Мне сказочно повезло, что в начале своего профессионального пути я встретил этого замечательного человека, и это предопределило мою дальнейшею жизнь. Сегодня подрастает молодое, талантливое поколение хирургов, онкологов, которые только начинают свой жизненный путь в специальности, выбрав эту сложную и благородную профессию. Я хочу обратиться к ним напутствием, цитатой своего великого учителя, академика Михаила Давыдова: «Я люблю эту профессию и считаю ее важной и нужной. И результат этой деятельности – миллионы спасенных жизней. Только этого одного обстоятельства достаточно для того, чтобы рекомендовать талантливым и преданным делу людям заниматься медициной».
Ариф Керимович Аллахвердиев,
д.м.н., заведующий отделом торакоабдоминальной хирургии МКНЦ
им. А.С. Логинова, заведующий кафедрой онкологии и онкохирургии
Российского университета медицины

***
— Впервые Михаила Ивановича я увидел в 1997 году на трибуне съезда онкологов в Санкт-Петербурге. Тогда я поступил в клиническую ординатуру и попал в Ленинградский областной онкологический диспансер, где в то время мой шеф и учитель Ласло Дюлович Роман внедрял хирургические вмешательства по поводу рака пищевода. И выступление Михаила Ивановича было посвящено этой проблеме. Я до сих пор помню мощнейшую энергетику и харизму, распространяющиеся от трибуны, под воздействие которых попал я и все наше отделение. Это было первое впечатление и, как часто это бывает, оно определило отношение к личности и профессионалу.
Потом были многочисленные конференции с переполненными залами во время докладов Михаила Ивановича. Никто из нас не мог себе позволить пропустить хоть один из них. Были личные встречи в кулуарах…
Я не помню точно тот год, но вдруг кто-то принес видеокассету (нынешняя молодежь, неверное, уже и не знает, что были такие) с любительской записью гастрэктомии в исполнении Михаила Ивановича Давыдова. Если бы существовало выражение «засмотреть до дыр», то оно должно было быть применено в отношении этой кассеты. Мы смотрели и пробовали повторять. Снова смотрели и снова пробовали… Ну и, конечно, я не могу не вспомнить 2016 год, когда Михаил Иванович принял наше приглашение участвовать в конгрессе «Белые ночи». Мне посчастливилось тогда ассистировать ему «вживую». Невероятная харизма, искрометный юмор, филигранная техника и его «колхозник, кто так вяжет…» навсегда впечатались в память.
Говорят, в юности звезды светят ярче, и деревья были большими, но я бы так не сказал об академике Михаиле Ивановиче Давыдове. Он и в моей юности, и в зрелости светил ярко, и, несомненно, его имя впечатано золотыми буквами в историю мировой онкохирургии. Целое поколение российских онкохирургов искренне считают Михаила Ивановича своим Учителем. И я лишь один из этого поколения.
Алексей Михайлович Карачун,
д.м.н., профессор, заведующий отделением абдоминальной онкологии, ведущий научный сотрудник
НМИЦ онкологии им. Н.Н. Петрова, профессор кафедры онкологии
Северо-Западного государственного медицинского университета
им. И.И. Мечникова, СанктПетербург

***
— С Михаилом Ивановичем я познакомился относительно близко в ноябре 2008 года, когда приехал в РОНЦ им. Н.Н. Блохина на месячную стажировку по торакоабдоминальной онкохирургии. Наш Казанский Республиканский онкологический диспансер стал научным филиалом центра, и меня первого отправили на учебу. Почему относительно? Я и раньше знал, что есть такой выдающийся академик Михаил Иванович Давыдов, да и потом мои встречи с ним были не столь частыми и долгими по времени, как мне мечталось бы. Но какие это были встречи! В отношении Михаила Ивановича не хотелось бы просто упоминать такие эпитеты, как «великий», «выдающийся», «знаменитый» и тому подобное – это было и так абсолютно ясно при его жизни, и особенно отчетливо и больно осознаешь все это, когда такой удивительный человек уходит от нас.
Помню, был фильм по произведениям Сергея Довлатова «Конец прекрасной эпохи» – вот лучше и не скажешь об уходе из нашей жизни Михаила Ивановича. Ушла не только эпоха виртуозного хирурга, мыслителя и организатора, ушла и эра настоящего Учителя с большой буквы. Его операциями, которые проходили в атмосфере делового спокойствия и хорошего словесного сопровождения, можно было любоваться бесконечно. Харизматичный, яркий, талантливый человек практически во всех сферах жизни, спортсмен и музыкант, интеллектуал и эрудит. А какой он был рассказчик! С ним можно было разговаривать часами на любые темы от хирургии до охоты и политики, отмечая тонкий юмор и великое умение достойно встретить гостя. Не всегда понятый властью и не всегда услышанный ею, хотя бы даже в отношении его прогнозов и предложений по исправлению ситуации в нашей отрасли. А ведь все сбылось, что он говорил!
Таким вот светлым и умным человеком Михаил Иванович остался навсегда в моей памяти. Конец прекрасной и Великой эпохи – все-таки не удержался я, упомянул-таки слово о его величии.
Михаил Владимирович Бурмистров,
д.м.н., профессор, заместитель
главного врача по медицинской части Республиканской клинической
больницы, заведующий кафедрой
хирургических болезней ИФМиБ КФУ, Казань

НОВОСТИ ОБЩЕСТВА / ИЗУЧЕНИЕ ЧАСТОТЫ МУТАЦИЙ В РОССИЙСКОЙ ПОПУЛЯЦИИ БОЛЬНЫХ С ОНКОЛОГИЧЕСКИМИ ЗАБОЛЕВАНИЯМИ С ЦЕЛЬЮ ИЗУЧЕНИЯ ЭПИДЕМИОЛОГИИ ДРАЙВЕРНЫХ МУТАЦИЙ
Изучение частоты мутаций в российской популяции больных с онкологическими заболеваниями с целью изучения эпидемиологии драйверных мутаций В рамках программы Российского общества клинической онкологии (RUSSCO) «Совершенствование молекулярно-генетической диагностики в Российской Федерации с целью повышения эффективности противоопухолевого лечения» в течение трех лет проходит отдельный проект: изучение эпидемиологии частоты мутаций на основании данных, собранных в региональных лабораториях. В проекте участвует 41 регион. Программа стимулировала создание лабораторий и поддержку уже существующих для выполнения высокотехнологичных диагностических процедур, что дало толчок к развитию молекулярно-генетической диагностики в Российской Федерации.
Региональные лаборатории работают самостоятельно, выполняя в полной или неполной мере весь арсенал тестов на мутации и экспрессии, необходимых для определения прогноза заболевания и лечебной тактики. В том случае, если новые региональные лаборатории не могут пока выполнить определенные виды тестов, Программа RUSSCO продолжает выполнять их в рамках Национальной программы.
Каждому тесту, внесенному в программу, присваивается деперсонифицированный код. Собираются данные о поле, возрасте, регионе проживания пациента, морфологическом варианте опухоли, типе выявленной мутации.
За три годы работы проекта «Частота мутаций» собраны данные о более чем 85 820 тестирований. Изучалась частота таких геномных альтераций, как EGFR, ALK, ROS1, BRAF при меланоме, BRCA при раке яичников и раке молочной железы, мутации в генах RAS, PIK3CA, экспрессию PD-L1 при немелкоклеточном раке легкого, раке молочной железы и уротелиальном раке.
В данном сообщении мы приводим валовые результаты изучения частоты геномных альтераций, так как, несмотря на достаточно большое количество изученных параметров, сделать эпидемиологические расчеты из-за недостаточного количества данных по регионам представляется затруднительным. Но все же из общего числа тестов 22 691 на наличие мутации в гене EGFR альтерации были обнаружены в 5 142 случаях, что составило 22,66%, что несколько превышает показатель частоты из других литературных источников. Транслокации в гене ALK были обнаружены в 362 случаях из 3 921 тестирований, что составило 9,23%, что в принципе согласуется с данными в популяции больных EGFR-негативным немелкоклеточным раком легкого. Транслокации в гене ROS1 были изучены в 1 419 случаях, также в популяции больных EGFR-негативным немелкоклеточным раком легкого, в 40 из них диагностирована транслокация, что составило 2,82%. Частота мутации в гене BRAF была исследована в 13 768 образцах меланомы, мутации обнаружены в 4 706 случаях, что составило 34,18%. Этот показатель несколько ниже литературных данных, возможно, имел значение характер материала, например, при рецидивах частота выявления мутаций в гене BRAF ниже, чем в первичной опухоли. Вероятно, определенную роль сыграл производитель реагентов для тестирования. Частота мутаций в генах BRCA1/2 при раке молочной железы составила 10,49%, а в абсолютных цифрах из 24 592 случаев мутация выявлена в 2 580. Частота мутаций в этих генах при раке яичников составила 17,62% – 1 166 случаев из 6 616 выполненных тестов. В целом эти результаты соответствуют данным, представленным в литературе, что подтверждает высокую экспертизу генетиков в региональных лабораториях. По остальным данным, собранным в рамках проекта «Частота мутаций», пока недостаточно данных для опубликования результатов. Проект продолжается, что позволит в будущем получить больше данных для анализа.
Российское общество клинической онкологии благодарит всех участников проекта «Частота мутаций» за кропотливый труд по сбору данных для изучения эпидемиологии драйверных мутаций у онкологических пациентов на территории РФ.
Автор: Соколова Н.С.
НОВОСТИ ОБЩЕСТВА / ОПРЕДЕЛЕН ПОБЕДИТЕЛЬ ИНТЕНСИВА RUSSCO ПО ОНКОГИНЕКОЛОГИИ
30 марта завершил свою работу интенсив RUSSCO по онкогинекологии. Интенсив длился три дня и включал в себя лекционный курс, а также практические мастер-классы по лечению рака шейки матки, эндометрия и яичников.
Участниками интенсива стали специалисты из разных регионов нашей страны, а также доктора из Узбекистана и Республики Беларусь. Экспертами нового курса стали ведущие специалисты в области онкогинекологии в нашей стране: д.м.н. Нечушкина Валентина Михайловна, к.м.н. Румянцев Алексей Александрович, к.м.н. Дубинина Анастасия Викторовна, д.м.н. Покатаев Илья Анатольевич, к.м.н. Уткин Дмитрий Олегович, а также члены комитета RUSSCO junior – Исраелян Эдгар Рудикович, Дудина Ирина Александровна, Анохин Алексадр Юрьевич и Фатеева Анастасия Валерьевна.
Совместно с экспертами были рассмотрены вопросы лечения достаточно сложных клинических ситуаций, в том числе редких опухолей яичников, что позволило углубить понимание и подходы к лечению этих заболеваний. Участники получили бесценный практический опыт, который они смогут применить в своей профессиональной деятельности, а также новейшие научные знания, способные изменить подход к лечению пациентов.
Во время интенсива участники традиционно активно накапливали баллы для формирования своего личного рейтинга, который затем оценивался экспертами и наставниками программы. Как и было анонсировано ранее, главным призом для одного из участников интенсива станет уникальная возможность посетить XXIX Российский онкологический конгресс, который пройдет с 11 по 13 ноября в Москве.
В результате по итогам всех трех дней активной работы, а также результатам итогового тестирования, почетное звание победителя интенсива по онкогинекологии присвоено Алисе Андреевне Коркиной, врачу-онкологу из отделения противоопухолевой лекарственной терапии №13 ГБУЗ «Городской клинический онкологический диспансер» в Санкт-Петербурге.
Второе место по количеству набранных баллов досталось Антоновой Софье Александровне, г. СанктПетербург, и Пардабековой Олесе Анатольевне из Москвы. Третье почетное место заняла Сиз Наталья Андреевна, г. Гомель (Республика Беларусь).
Коркина Алиса Андреевна
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / ТАРГЕТНАЯ ТЕРАПИЯ НМРЛ С МУТАЦИЯМИ RET И NTRK: ОБНОВЛЕННЫЕ ДАННЫЕ
Автор: Боровков Иван Максимович
Врач-онколог, аспирант отделения торакальной
онкологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина»
Минздрава России, медицинский переводчик
в сфере профессиональной коммуникации, Москва
Одним из наиболее эффективных видов лекарственного лечения распространенного немелкоклеточного рака легкого на сегодняшний день, несомненно, является таргетная терапия. Мы уже неоднократно писали о достижениях осимертиниба, алектиниба и лорлатиниба, упоминали перспективны комбинаций новых поколений препаратов (например, амивантамаба и лазертиниба), а также наблюдали за взлетами и падениями ингибиторов TROP2. Однако помимо основных таргетируемых мутаций у небольшого числа пациентов могут быть выявлены и более редкие альтерации, такие как RET и слияние генов NTRK, чья встречаемость не превышает 1,4-2,5% и 1% соответственно, но характеризуется крайне высокими ожидаемыми результатами лечения [1].
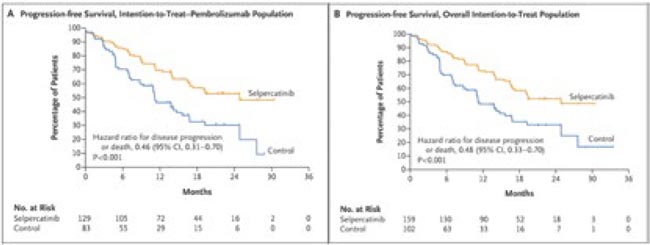
Ранее мы уже говорили о мультикиназном ингибиторе селперкатинибе, показавшем эффективность у пациентов с мутацией RET в исследовании LIBRETTO-431 [2]. Авторы показали, что применение данного препарата ассоциировалось с увеличением медианы выживаемости без прогрессирования (ВБП) до 24,8 мес. по сравнению с 11,2 мес. в группе больных, получавших платиносодержащую химиотерапию с добавлением пембролизумаба (ОР 0,46; 95% ДИ 0,31-0,70; p<0,001) (рис.1). При этом добавление к ПХТ пембролизумаба, согласно результатам дополнительного анализа данной популяции, не оказывало значимого влияние на расположение кривых выживаемости.
Рисунок 1.
Выживаемость без прогрессирования в LIBRETTO-431
В феврале 2025 года были представлены обновленные результаты другого схожего исследования по применению селперкатиниба LIBRETTO-001 (I/II фаза). Авторы включили 247 пациентов с распространенным НМРЛ, ранее получавших химиотерапию, и 69 пациентов, не получавших никакого лечения. При этом важно отметить, что группа предлеченных больных допускала наличие неограниченного числа линий терапии, включая ингибиторы контрольных точек (58,3%) и мультикиназные ингибиторы, такие как кабозантиниб, вандетаниб, ленватиниб и др. (31,6%). У 31,2% и 23,2% пациентов в группах наличия или отсутствия предшествующего лечения на старте определялись метастазы в головном мозге.
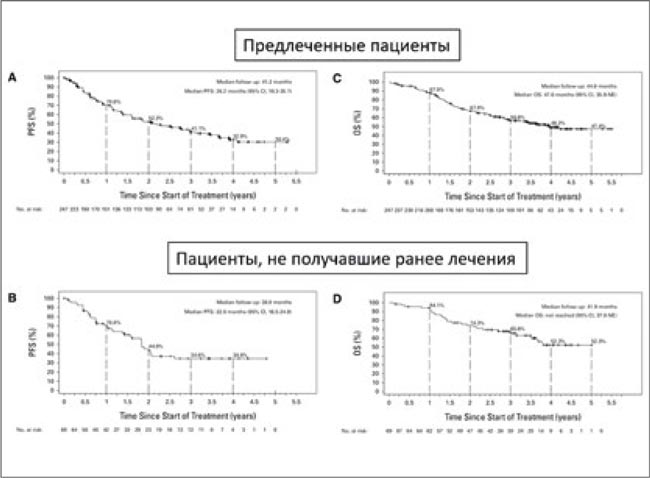
Частота объективных ответов в данных группах составила 62% и 83%, а частота полных ответов – 8% и 7% соответственно. При медиане наблюдения в 41,2 мес. для предлеченных пациентов и 38,9 мес. для пациентов, не получавших ранее терапию, медиана выживаемости без прогрессирования составила 26,2 и 41,2 мес. Не менее впечатляющие данные получены и в отношении общей выживаемости (ОВ). Так, применение селперкатиниба позволило достичь медианы общей выживаемости в 47,6 мес. в группе предлеченных пациентов (медиана наблюдения 44,6 мес., цензурированы данные 56% больных), а в группе «naive» пациентов данный показатель и вовсе достигнут не был (медиана наблюдения 41,9%, цензурированы данные 62% больных). Трехлетняя общая выживаемость в двух группах составила 62% и 66% (рис.2).
Рисунок 2.
ВБП и ОВ в исследовании LIBRETTO-001
У пациентов с наличием метастазов в ЦНС на момент начала лечения частота объективных и полных ответов составила соответственно 85% и 27%, а длительность ответа – 9,4 мес. Медиана ВБП в ЦНС составила 11,0 мес. Данные по токсичности соответствуют представленным в предыдущих исследованиях с частотой артериальной гипертензии ≥3 ст. 19% и увеличением концентрации АЛТ/АСТ ≥3 ст. 10/15%. Редукция дозы потребовалась у 49% больных, а временная приостановка лечения или полное его прекращение – у 70% и 11% пациентов, однако лишь у 4% это было связано явлениями специфической токсичности препарата.
В отношении мутаций NTRK мы редко получаем новые данные, что связано в первую очередь с их крайне низкой распространенностью. Одной из последних крупных новостей стали результаты исследования Cho BC и соавт. по применению энтректиниба, представленные еще в феврале 2024 года [3]. Работа включила всего 51 пациента с местнораспространенным/диссеминированным НМРЛ и слиянием генов NTRK. У 27,5% больных в анамнезе уже было ≥2 линий терапии, а у 39,2% на старте лечения определялись метастазы в головном мозге.
Частота объективных ответов составила 62,7%, при этом полный ответ был выявлен у 11,8% пациентов. Медиана ВБП в общей популяции составила 28 мес., а среди больных с метастазами в ЦНС – 28,3 мес. Медиана ВБП по ЦНС достигнута не была (погибшие пациенты были цензурированы при проведении анализа). Медиана общей выживаемости достигла в общей выборке 41,5 мес. Лечение характеризовалось удовлетворительным профилем безопасности с частотой нежелательных явлений 3 ст. 14,5%. Сопоставимые данные по эффективности и токсичности доступны и в отношении ларотректиниба [4].
Таким образом, мы видим, что наличие мутаций RET и NTRK хоть и идентифицируется у абсолютного меньшинства пациентов, но может означать для них перспективу крайне длительного контроля заболевания при сохранении удовлетворительного качества жизни даже при наличии метастазов в головном мозге и «тяжелой» предлеченности. Следовательно, попытки выявить данные мутации оправданны (хоть и весьма затратны) и могут быть рекомендованы, при условии наличия технических и финансовых возможностей.
Источники:
- Gou Q, Gou Q, Gan X, et al. Novel therapeutic strategies for rare mutations in non-small cell lung cancer. Sci Rep. 2024; 14: 10317. https://doi.org/10.1038/s41598-024- 61087-2.
- Zhou C, Solomon B, Loong HH, Park K, Pérol M, Arriola E, Novello S, Han B, Zhou J, Ardizzoni A, Mak MP, Santini FC, Elamin YY, Drilon A, Wolf J, Payakachat N, Uh MK, Rajakumar D, Han H, Puri T, Soldatenkova V, Lin AB, Lin BK, Goto K; LIBRETTO-431 Trial Investigators. First-Line Selpercatinib or Chemotherapy and Pembrolizumab in RET FusionPositive NSCLC. N Engl J Med. 2023 Nov 16; 389(20): 1839-1850. doi: 10.1056/NEJMoa2309457. Epub 2023 Oct 21. PMID: 37870973; PMCID: PMC10698285.
- Cho BC, Chiu CH, Massarelli E, Buchschacher GL, Goto K, Overbeck TR, Loong HHF, Chee CE, Garrido P, Dong X, Fan Y, Lu S, Schwemmers S, Bordogna W, Zeuner H, Osborne S, John T. Updated efficacy and safety of entrectinib in NTRK fusionpositive non-small cell lung cancer. Lung Cancer. 2024 Feb; 188: 107442. doi: 10.1016/j.lungcan.2023.107442. Epub 2023 Dec 15. PMID: 38171156.
- Alexander E. Drilon, et al. Long-term efficacy and safety of larotrectinib in patients with TRK fusion lung cancer. Journal of Clinical Oncology. 2024; Vol.42, Number 16_suppl. https://doi. org/10.1200/JCO.2024.42.16_ suppl.8570.
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / «НЕ ХЛЕБОМ ЕДИНЫМ…», ИЛИ ОТКАЗ ОТ ОПЕРАЦИИ ПРИ РАКЕ МОЛОЧНОЙ ЖЕЛЕЗЫ
Автор: Деньгина Наталья Владимировна
Заведующая радиологическим отделением ГУЗ «Областной клинический онкологический диспансер»,
член правления RUSSCO, главный редактор Газеты RUSSCO и сайта RosOncoWeb, к.м.н.,
Ульяновск
Тема отказа от хирургического вмешательства при раке молочной железы в последнее время становится столь же популярной и обсуждаемой, насколько казалась нереальной еще некоторое время назад. Казалось бы, что здесь обсуждать? Зачем отказываться от хорошо освоенной, не слишком сложной операции, приносящей избавление от опухоли и при необходимости заканчивающейся одномоментной реконструкцией? Однако операция есть операция, и, несмотря на несложность лампэктомии или мастэктомии с аксиллярной лимфодиссекцией, задокументированные многими исследованиями осложнения этих хирургических процедур нельзя считать незначительными. Инфицирование, кровотечения, хроническая боль, парестезии, серомы, лимфедема и неудовлетворительный косметический и психологический эффект могут повлиять на качество жизни и встречаются примерно в 30% случаев. Кроме того, около 60% больных трижды негативным и HER2- позитивным РМЖ имеют полный патоморфологический ответ на неоадъювантное лечение, что ставит под сомнение необходимость операции.
Исследователи из 7 американских центров инициировали однорукавное проспективное нерандомизированное исследование 2 фазы в марте 2017 года, набор осуществлялся до ноября 2021 года, и в конце 2024 года авторы проанализировали полученные результаты, которые были опубликованы 28 марта в журнале JAMA Oncology. Основной вопрос, который они ставили перед собой, – какова же частота рецидивов в ипсилатеральной молочной железе у пациенток с полным ответом на неоадъювантную системную терапию (НАПХТ), определяемым методом чрескожной биопсии под визуальным контролем, которые локально были пролечены только радиотерапией, без операции на молочной железе? Соответственно, первичной конечной точкой выбрана частота ипсилатеральных рецидивов.
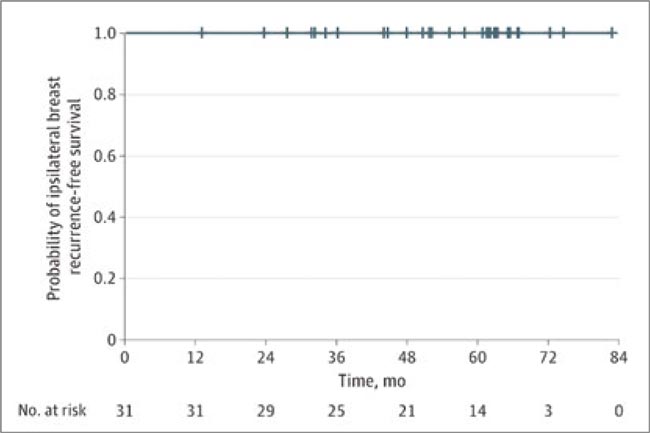
Рисунок 1.
Частота ипсилатеральных рецидивов (0%)
Всего было включено 50 пациенток в возрасте старше 40 лет с cT1-2N0- 1M0 ТНРМЖ (21 больная, 48%) или HER2-позитивным РМЖ (29, 52%), прошедших НАПХТ, у которых была обнаружена остаточная опухоль в молочной железе менее 2 см. Им всем была произведена пункция под УЗИ контролем, и в случае, если в материале не было найдено инвазивного рака или опухоли in situ, хирургическое лечение не проводилось. Те пациентки, у которых изначально было зарегистрировано N+, подвергались таргетной аксиллярной диссекции при подтверждении pCR в молочной железе. В дальнейшем всем пациенткам проводилась лучевая терапия на молочную железу в СОД 40,05 Гр за 15 фракций и буст на ложе опухоли 14 Гр. При вовлеченности лимфоузлов допускалось облучение с захватом региональных зон и с применением традиционного фракционирования. Кроме того, у больных были взяты образцы крови для определения циркулирующих опухолевых клеток (ЦОК) и циркулирующей опухолевой ДНК (цоДНК) в начале лечения и на отрезках 6 месяцев и 1 год после окончания.
В итоге отказ от операции никак не сказался на результатах: частота ипсилатеральных рецидивов составила 0% на протяжении 5 и более лет. Более того, общее качество жизни, связанное со здоровьем, включая физическое, социальное/ семейное, эмоциональное, функциональное и связанное с РМЖ благополучие, значительно возросло с течением времени.
Таким образом, НАПХТ и лучевая терапия продемонстрировали отличные результаты даже при отказе от операции у отобранной популяции пациенток с РМЖ – опухолью, которую традиционно оперировали в течение многих десятилетий. Тенденция прослеживается: за последнее время хирургия рака молочной железы постепенно и вполне безопасно деэскалировалась, перейдя от радикальной мастэктомии через органосохраняющую операцию и подмышечную диссекцию узлов к биопсии сторожевого узла, исключая биопсию сторожевого узла у отдельных пациентов и даже позволяя проводить вмешательства меньшего объема в случае положительного ответа после неоадъюванта. Безусловно, малое число больных и ограниченный период наблюдения за ними (около 56 месяцев) не позволяют делать далеко идущие выводы уже сейчас, но продолжающиеся исследования по отказу от операции при РМЖ (корейское OPTIMIST NCT05505357 KBCSG-24 и др.) в свое время принесут весьма интересные данные.
Источник:
H. M. Kuerer, et al. Selective Elimination of Breast Surgery for Invasive Breast Cancer. A Nonrandomized Clinical Trial. JAMA Oncol. doi:10.1001/ jamaoncol.2025.0207. Published online: March 28, 2025.
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / КОММЕНТАРИЙ ЭКСПЕРТА
Автор: Тюляндин Сергей Алексеевич
Заслуженный деятель науки РФ, главный научный сотрудник отделения
противоопухолевой лекарственной терапии №2
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России,
член правления RUSSCO, профессор, доктор медицинских наук, Москва
Получены свидетельства о возможности отказа от выполнения хирургического лечения у больных раком молочной железы с противоопухолевым ответом на неоадъювантную системную терапию
В декабрьском номере газеты RUSSCO мы обсуждали первые результаты исследования, изучавшего возможность отказа от операции у больных раком молочной железы с доказанным полным морфологическим эффектом после окончания неоадъювантной системной терапии. Этому было посвящено исследование II фазы, инициированное исследователями из MD Anderson Cancer Center и проведенное в семи клиниках США.
Напомню, что в это исследование включались больные старше 40 лет с тройным негативным или HER2- позитивным раком молочной железы T1-2 N+ (не более 4 клинически определяемых л/узлов), которым проведена неоадъювантная системная терапия (AC-T для тройного негативного и TC c двойной блокадой для HER2+), желающие сохранить молочную железу. До начала терапии проводилось клипирование первичной опухоли, при подозрении на метастазы в подмышечные лимфоузлы выполнялась их цитологическая верификация и при обнаружении метастазов – клипирование. После окончания неоадъювантной системной терапии выполнялась маммография и сонография для определения наличия остаточной опухоли. После этого под контролем УЗИ проводилась вакуум-ассистированная кор-биопсия (VACB) иглой 9G в зоне расположения клипсы или в расположении резидуальной опухоли, если таковая была обнаружена при обследовании, с целью получения не менее 12 биопсий. При отсутствии в полученных биопсиях опухолевых клеток операция не выполнялась, больным с морфологическим подтверждением резидуальной опухоли проводилось оперативное лечение. Пациенткам с наличием cN+ производили прицельную диссекцию клипированных л/у, и в случае отсутствия признаков наличия резидуальной опухоли в молочной железе и лимфоузлах операции на молочной железе не было. Все больные получали лучевую терапию на молочную железу (40 Гр за 15 фракций или 50 Гр за 25) и дополнительный буст 14 Гр за 7 фракций. Больные наблюдались каждые 6 месяцев с выполнением маммографии в течение 5 лет. При подозрении на рецидив заболевания выполнялась сонография и/или МРТ и при показаниях биопсия. Основным критерием эффективности была частота развития ипсилатерального рецидива у больных без оперативного лечения.
В первоначальной публикации по результатам 2-летнего наблюдения сообщалось о 50 включенных больных c медианой возраста 62 года, 29 (58%) из них были HER2+, а у 9 (18%) определялись метастазы в подмышечные лимфоузлы. Средний размер первичной опухоли до лечения составил 2,3 см, после проведения неоадъювантной терапии – 0,9 см. Полный радиологический эффект был зарегистрирован у 17 (34%) больных. Среднее число VACB составило 15, что позволило определить полный морфологический ответ у 31 (62%) и резидуальную опухоль у 19 (38%) больных, которым была выполнена операция. Из 19 больных с выполненной операций у 7 из них не обнаружено резидуальной опухоли при морфологическом исследовании удаленного материала, у 12 больных морфологически была подтверждена резидуальная опухоль. Наличие метастатического поражения подмышечных лимфоузлов не было обнаружено ни у одной больной после их удаления.
По результатам 5-летнего наблюдения ни у одной больной из 31 без выполненной операции после подтверждения полной морфологической регрессии по данным VACB не отмечено прогрессирования заболевания и показатель безрецидивной и общей выживаемости составил 100%. Важной составляющей исследования был анализ оценки качества жизни и удовлетворенности проведенного лечения. Пациентки сообщили о сравнительно высоком уровне комфорта в связи с их первоначальным решением участвовать в исследовании и отказаться от операции, при этом средний (SD) базовый балл по шкале сожаления о принятом решении составил 15,2 из 100. Через 5 лет средний (SD) балл по шкале сожаления о принятом решении составил 2,5, что значительно ниже базового уровня. Общее качество жизни, включая физическое, социальное/семейное, эмоциональное, функциональное и специфическое для рака молочной железы благополучие, значительно улучшилось с течением времени. Средний композитный балл FACT-B+4 составил 120,7 из 148 на исходном уровне по сравнению с 126,7 (10,6) через 5 лет (P=0,04). Пациентки сообщали о минимальных косметических различиях между молочными железами, а также о наличии боли и отека молочной железы и нарушения функции верхней конечности.
В этом нерандомизированном клиническом исследовании у тщательно отобранных пациентов с тройным негативным и HER2-позитивным раком молочной железы и отсутствием резидуальной опухоли после проведенной неоадъювантной системной терапии по данным VACB удалось отказаться от оперативного вмешательства. В качестве локальной терапии была использована лучевая терапия. Все это позволило получить отличные онкологические результаты, о чем свидетельствует 100% 5-летняя безрецидивная выживаемость, хорошее качество жизни и высокая удовлетворенность проведенным лечением. Однако не стоит забывать, что столь впечатляющие результаты были получены при лечении только 31 пациентки. Кроме того, прежде чем рекомендовать данную методику, было бы полезно получить больше данных о точности VACB в определении достижения морфологически полной регрессии, включая данные о частоте ложно-позитивных и ложно-негативных результатов. Эти сведения могли бы уточнить необходимость проведения лучевой терапии на молочную железу в случае отказа от операции у больных с полным морфологическим ответом по данным VACB. В настоящее время в Южной Корее проводится многоцентровое однорукавное исследование OPTIMIST (NCT05505357- KBCSG-24), изучающее отказ от выполнения оперативного лечения у пациентов с прогнозируемым полным морфологическим ответом после неоадъювантной системной терапии. Только после позитивных результатов этого исследования и других исследований можно будет говорить об изменении роли хирургического лечения у больных раком молочной железы.
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / FDA ОДОБРИЛО КАБОЗАНТИНИБ ДЛЯ ВЗРОСЛЫХ И ДЕТЕЙ ОТ 12 ЛЕТ И СТАРШЕ С PNET И EPNET
Автор: Фатеева Анастасия Валерьевна
Заместитель главного врача по медицинской части
ГБУЗ «Приморский краевой онкологический диспансер»,
член общества RUSSCO, член ESMO,
секретарь регионального общества RUSSCO,
Владивосток
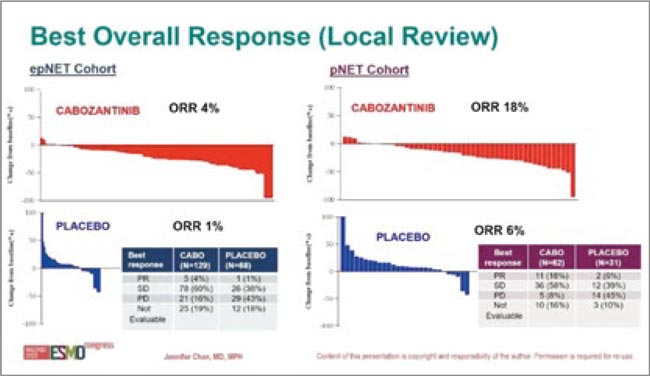
26 марта FDA одобрила кабозантиниб для пациентов с ранее пролеченными неоперабельными местнораспространенными или метастатическими, высокодифференцированными нейроэндокринными опухолями поджелудочной железы (pNET) и высокодифференцированными внепанкреатическими нейроэндокринными опухолями (epNET). Одобрение произошло на основании результатов исследования III фазы CABINET. В исследовании в качестве первичной конечной точки оценивалась ВБП.
В когорту pNET вошли 99 пациентов, получавших кабозантиниб по 60 мг перорально один раз в день или плацебо до прогрессирования или непереносимой токсичности в соотношении 2:1.
- Медиана ВБП составила 13,8 мес. (95% ДИ 8,9-17,0) в группе кабозантиниба и 3,3 мес. (95% ДИ 2,8-5,7) в группе плацебо (отношение рисков 0,22 [95% ДИ 0,12-0,41]; p<0,0001).
- Общая частота ответов составила 18% (95% ДИ 10-30) и 0 (95% ДИ 0-11) в соответствующих группах. В когорту epNET вошли 199 пациентов для получения вышеуказанной схемы кабозантиниба или плацебо до прогрессирования заболевания или непереносимой токсичности также в соотношении 2:1.
- Медиана ВБП составила 8,5 мес.
(95% ДИ 6,8-12,5) в группе кабозантиниба и 4,2 мес. (95% ДИ 3,0-5,7) в
группе плацебо (отношение рисков
0,40 [95% ДИ 0,26-0,61]; p<0,0001)
(рис.2).
Рисунок 1. ВБП в когорте pNET
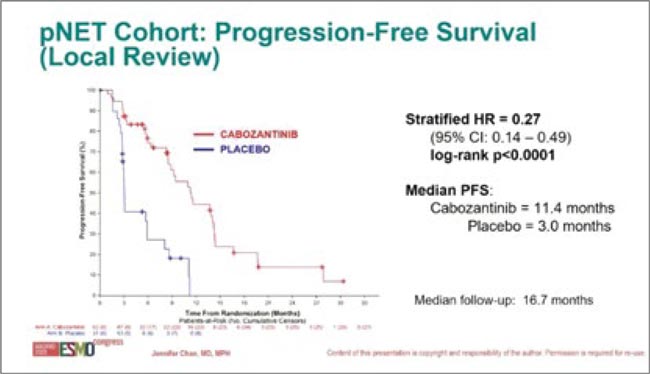
Рисунок 2. ВБП в когорте epNET

- Общая частота ответов составила 5% (95% ДИ 2,2-11) и 0 (95% ДИ 0,5) в соответствующих группах.
Рекомендуемая доза кабозантиниба для взрослых и детей в возрасте от 12 лет с массой тела ≥40 кг составляет 60 мг перорально один раз в день до прогрессирования заболевания или непереносимой токсичности.
Рисунок 3.
Общая частота ответов на лечение в когортах
Рекомендуемая доза для детей в возрасте от 12 лет с массой тела менее 40 кг составляет 40 мг перорально один раз в день до прогрессирования заболевания или неприемлемой токсичности.
Источник:
Jennifer A. Chan, et al. Phase 3 Trial of Cabozantinib to Treat Advanced Neuroendocrine Tumors. N Engl J Med. 2025; 392: 653-665. DOI: 10.1056/NEJMoa2403991.
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / SUNNIFORECAST TRIAL: ИПИЛИМУМАБ/НИВОЛУМАБ ПРОТИВ СТАНДАРТНОЙ ТЕРАПИИ ПРИ НЕСВЕТЛОКЛЕТОЧНОМ ПОЧЕЧНОКЛЕТОЧНОМ РАКЕ (НСПКР) – II ФАЗА
В рекомендациях NCCN одобренными опциями первой линии терапии пациентов с нсПКР являются кабозантиниб (имеет преимущества над сунитинибом по данным SWOG1500), а также ниволумаб/кабозатиниб и пембролизумаб/ленватиниб (по данным позитивных исследований II фазы с первичной конечной точкой ЧОО).
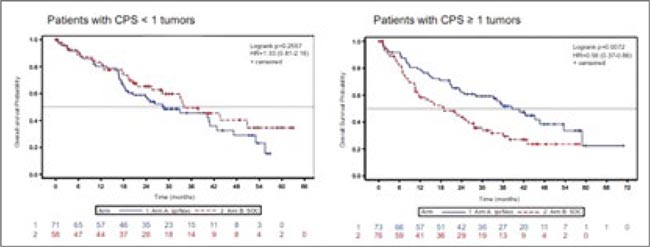
Рандомизированное исследование SUNNIFORECAST является первым, в котором иммуносодержащая комбинация (ипилимумаб/ниволумаб) сравнивается со стандартным лечением (>80% пациентов получили сунитиниб) при нсПКР. Первичная конечная точка – однолетняя ОВ.
При медиане 21,5 мес.:
- однолетняя ОВ составила 78% и 68% (р=0,026) в группах ИТ и стандартного подхода соответственно;
- мОВ равнялась 33,2 и 25,2 мес. (р=0,163) в экспериментальной и контрольной группах;
- мВБП: 5,4 и 5,7 мес. соответственно;
- ЧОО выше в группе ИТ (33% vs 20%);
- пациенты с CPS >1 имели явный выигрыш в ОВ от ипи/ниво (HR 0,56; p=0,0072).
Рисунок 1.
ОВ в зависимости от CPS
По сути, мы получили очередное исследование, в котором иммуноонкологическая комбинация оказалась лучше сунитиниба при мПКР, но уже и при несветлоклеточном подтипе. Гораздо интереснее было бы сравнение с кабозантинибом, но стоит учесть, что набор в работу начат в 2017 году, а первые данные о преимуществе кабозантиниба появились лишь в 2021 году. В любом случае, арсенал наших возможностей при нсПКР расширяется, что не может не радовать.
Источник:
Bergmann L, Albiges L, Ahrens M, Gross-Goupil M, Boleti E, et al.; Interdisciplinary Renal Cell Carcinoma Working Group of the DKG (IAGN). Prospective Randomised Phase-II Trial of Ipilimumab/Nivolumab versus Standard of Care in non-clear cell Renal Cell Cancer – Results of the SUNNIFORECAST Trial. Ann Oncol. 2025 Apr 1; S0923-7534(25)00124-3. doi: 10.1016/j.annonc.2025.03.016. PMID: 40180121
Материал подготовила А.В. Фатеева
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / HIMALAYA TRIAL: ДАННЫЕ 5-ЛЕТНЕЙ ОБЩЕЙ ВЫЖИВАЕМОСТИ
Исследование III фазы HIMALAYA показало, что протокол STRIDE (однократное введение тремелимумаба с введением дурвалумаба до прогрессирования или непереносимой токсичности) улучшил общую выживаемость (ОВ) по сравнению с сорафенибом у пациентов с неоперабельным гепатоцеллюлярным раком (ГЦР). В Journal of Hepatology опубликованы обновленные данные уже 5-летнего наблюдения. И на сегодняшний день это первое исследование III фазы, в котором сообщаются результаты 5-летней ОВ для неоперабельного ГЦР.
Основные результаты:
- 1171 участник был рандомизирован в группы STRIDE (n=393), монотерапии дурвалумабом (n=389) и сорафенибом (n=389).
- Доля участников, продолжавших наблюдение через 5 лет, составила 19,8% (78/393) в группе STRIDE и 9,8% (38/389) в группе сорафениба.
- Доля участников, которые продолжали получать исследуемое лечение в течение 5 лет, составила 5,1% (20/393) в группе STRIDE и 1,6% (6/389) в группе сорафениба.
- Медиана наблюдения составила 62,49 и 59,86 мес. для STRIDE и сорафениба соответственно.
- В итоге ОВ HR для STRIDE по сравнению с сорафенибом составила 0,76 (0,65-0,89). Показатели 60-месячной ОВ – 28,7% и 12,7% соответственно.
- В группе STRIDE 83 из 393 (21,1%) участников живут уже 5 лет по сравнению с 45 из 389 (11,6%) участников в группе сорафениба.
Рисунок 1.
Общая выживаемость в группах
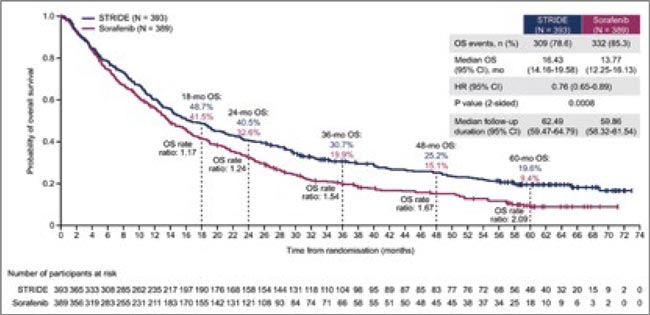
Таким образом, протокол STRIDE продолжает демонстрировать долгосрочную эффективность у пациентов с неоперабельным ГЦР.
Источник:
Lorenza Rimassa, et al. Five-year overall survival update from the HIMALAYA study of tremelimumab plus durvalumab in unresectable HCC. Journal of Hepatology. Published online: April 11, 2025. https://doi.org/10.1016/j. jhep.2025.03.033.
Материал подготовила А.В. Фатеева
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / ПРЕДИКТОРЫ ЭФФЕКТИВНОСТИ PD-1 ИНГИБИТОРОВ ПРИ НМРЛ
В небольшом ретроспективном китайском исследовании проведен интересный анализ, в рамках которого у пациентов, получавших чек-пойнт ингибиторы в первой линии по поводу метастатического НМРЛ, оценивались уровни соотношения нейтрофилов к лимфоцитам (NLR), соотношения лимфоцитов к моноцитам (LMR), индекс системного иммунного воспаления (SII).
Всё это простые и доступные клинические биомаркеры, однако на сегодняшний день не имеющие клинического применения.
Результаты исследования показали, что у пациентов с исходным коэффициентом NLR <0,68 был самый высокий показатель ЧОО – 61,8%, тогда как у пациентов с коэффициентом SII ≥0,74 ЧОО была самой низкой – всего 36,5%.
- Коэффициент NLR, SII через 6 недель и коэффициент SII достоверно коррелировали с ЧОО терапии ICIs.
- У пациентов с коэффициентом NLR <0,68 ЧООа был выше, чем у пациентов с коэффициентом NLR ≥0,68 (61,8% против 39,1%; р=0,012).
- У пациентов с SII через 6 недель <531,26 ЧОО была более высокой, чем у пациентов с SII через 6 недель 531,26 (61,4% против 38,8%; p=0,012).
- У пациентов с коэффициентом SII <0,74 ЧОО была выше, чем у пациентов с коэффициентом SII ≥0,74 (58,3% против 36,5%; р=0,017). При оценке выживаемости была показана статистически значимая связь ВБП и уровней NLR, LMR и SII:
- пациенты с коэффициентом NLR <0,68 имели значительно более длительную ВБП по сравнению с пациентами с коэффициентом NLR ≥0,68 (p=0,005);
- аналогичные результаты наблюдались у пациентов с NLR через 6 недель <2,72 (p=0,040), исходным LMR <1,34 (p=0,011), SII через 6 недель <531,26 (p=0,010), у всех из которых улучшилась ВБП.
Рисунок 1.
Показатели ВБП в зависимости от уровней NLR,
LMR и SII
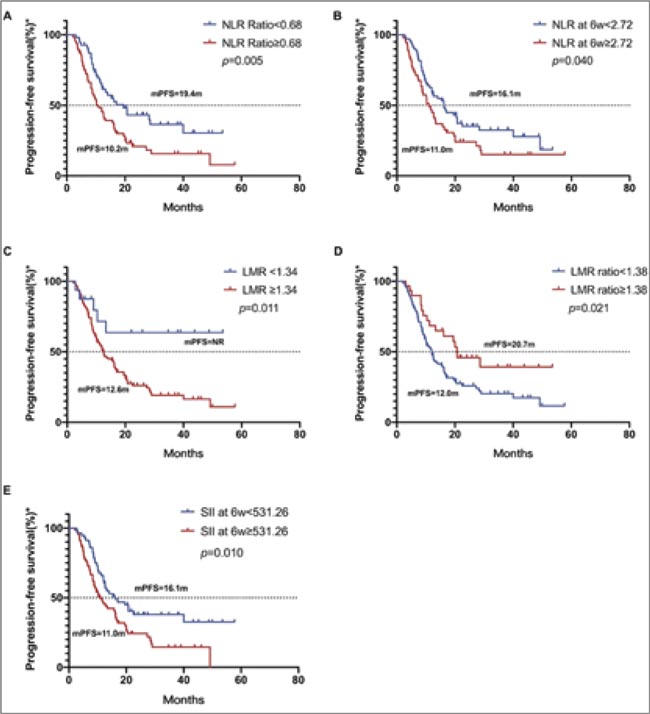
Можно ли, опираясь на эти данные, как и на некоторые другие (опубликованные ранее), однозначно говорить о том, что факторы периферического воспаления могут быть валидными предикторами эффективности чек-пойнт ингибиторов, как и PDL-1? Скорее всего, пока нет… Но тема все равно интересная.
Материал подготовила А.В. Фатеева
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / МЕТААНАЛИЗ ВЛИЯНИЯ ПОТЕРИ HER2-ПОЗИТИВНОСТИ ПОСЛЕ НЕОАДЪЮВАНТНОЙ ТЕРАПИИ У HER2+ ПАЦИЕНТОК С РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ НА ДОЛГОСРОЧНЫЙ ПРОГНОЗ
В журнале Cancer treatment опубликован метаанализ и систематический обзор 8 исследований, оценивающий выживаемость пациенток и риск рецидива с потерей HER2-позитивности после неоадъювантной терапии. Как известно, выбор стратегии дальнейшей постнеоадъювантной терапии у HER2-позитивных пациенток связан с RCB, а повторное определение HER2 является необязательным в текущей реальной практике.
Тем не менее, результаты метаанализа продемонстрировали ухудшение показателей выживаемости у пациенток с потерей HER2:
- ухудшение DFS/IDFS/RFS (HR 1,85; 95% ДИ 1,31-2,61; р=0,0005);
- ухудшение OS (HR 2,37; 95% ДИ 1,27-4,41; р=0,0065).
Рисунок 1.
Влияние потери HER2-позитивности на
выживаемость без прогрессирования
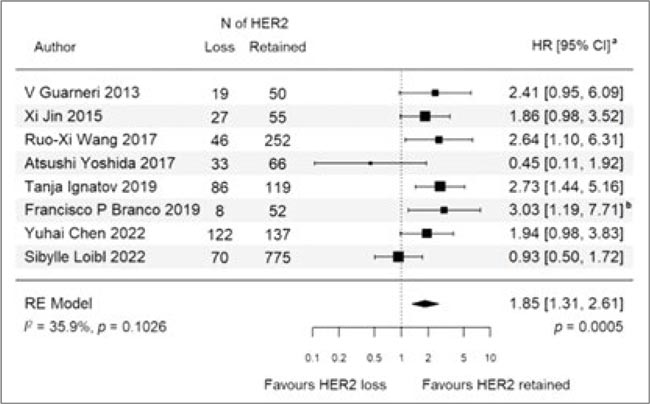
Рисунок 2.
Влияние потери HER2-позитивности на общую
выживаемость
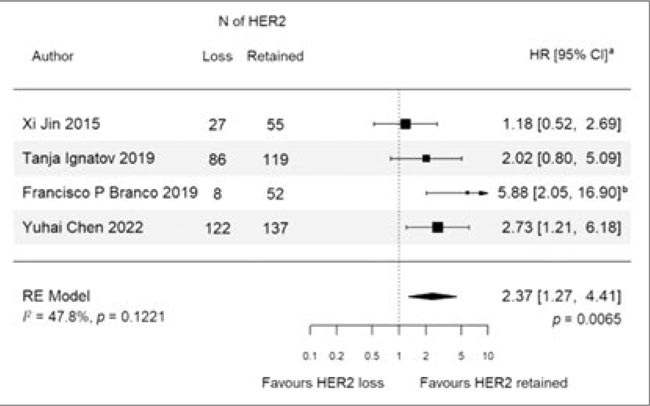
Доля потери HER2 во всей исследуемой популяции составила 21,4%. Как предполагают авторы исследования, одним из возможных факторов, способствующих ухудшению прогноза у пациентов с потерей HER2, была возможная неэффективность постнеоадъювантной HER2-терапии, которая проводилась далее. При этом далее они задаются интересным и провокационным вопросом: можем ли мы предполагать, что в таком случае анти-HER2 терапия будет неэффективна?
Спорный, неоднозначный, сложный вопрос.
При этом мы помним, что в исследовании KATHERINE не было продемонстрировано неэффективности трастузумаба и T-DM1 у пациентов с потерей HER2, поскольку сравнение данных между группами с потерей и сохранением HER2 не указывало на отсутствие пользы.
А что вы думаете об этом?
Источник: Nakatani Shunsuke, et al. Impact of loss of HER2 positivity following neoadjuvant therapy in HER2-positive breast cancer patients on long-term prognosis: A systematic review and meta-analysis. Cancer Treatment Reviews. 2025 Apr; Vol.135, 102923.
Материал подготовила А.В. Фатеева
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / ИССЛЕДОВАНИЕ III ФАЗЫ CODEBREAK 300, СОТОРАСИБ + ПАНИТУМУМАБ В ТЕРАПИИ ХИМИОРЕЗИСТЕНТНОГО МКРР С МУТАЦИЕЙ KRAS G12C: ОБНОВЛЕННЫЕ РЕЗУЛЬТАТЫ АНАЛИЗА ОВ
11 апреля 2025 года в JCO опубликованы обновленные результаты анализа общей выживаемости (ОВ) в исследовании III фазы CodeBreaK 300, в котором изучалась эффективность препарата соторасиб в комбинации с панитумумабом по сравнению со стандартной терапией по выбору исследователя (трифлуридином/ типирацилом или регорафенибом) в лечении пациентов с химиорезистентным метастатическим колоректальным раком (мКРР) и мутацией KRAS G12C.
В исследование было рандомизировано 160 пациентов; 85,0% из них получили две или более предыдущих линий терапии. Первичный анализ результатов при медиане наблюдения 7,4 мес. показал преимущество комбинации соторасиба в дозе 960 мг с панитумумабом в снижении риска прогрессирования или смерти на 52% по сравнению со стандартной терапией у предлеченных пациентов с мутацией KRAS G12C.
Хотя исследование CodeBreaK 300 не было рассчитано на выявление статистически значимых различий в общей выживаемости, а размер выборки исследования не был достаточно мощным, проверка гипотезы ОВ с использованием стратифицированного логрангового критерия была запланирована в соответствии с протоколом на уровне 50% зрелости, когда у 80 пациентов в исследовании фиксировались мониторируемые события (время от рандомизации до смерти по любой причине).
Результаты обновленного анализа ОВ:
- При медиане наблюдения в 13,5 мес. медиана ОВ в группе соторасиб 960 мг + панитумумаб не была достигнута (HR 0,70; 95% CI 0,41-1,18; двусторонний P = 0,20), а медиана ОВ в группе соторасиб 240 мг + панитумумаб (HR 0,83; 95% CI 0,49-1,39; двусторонний P = 0,50) составила 11,9 мес. по сравнению с 10,3 мес. в группе контроля (терапия на выбор исследователя).
- Тенденция общей выживаемости при применении исследуемой комбинации в заранее определенных ключевых подгруппах соответствовала таковой в популяции ITT, однако небольшой размер выборки некоторых подгрупп привел к широким доверительным интервалам.
- Хотя кроссовер был разрешен после первичного анализа, на момент финального анализа ОВ официального переключения на терапию в рамках протокола не произошло, 15 (27,8%) пациентов в группе контроля получили ингибитор KRAS G12C плюс антитело к EGFR вне протокола.
- Специальный анализ чувствительности для корректировки смешивающих эффектов начала последующей терапии, представляющий интерес, показал стратифицированный HR 0,65 (95% CI 0,28-1,37) для комбинации соторасиб 960 мг + панитумумаба по сравнению с группой контроля 0,84 (95% CI 0,44-1,58).
Таким образом, CodeBreaK 300 – первое исследование III фазы, изучавшее эффективность комбинаций ингибитора KRAS G12C с ингибитором EGFR, продемонстрировавшее статистически значимое увеличение ВБП по сравнению со стандартной терапией химиорезистентного мКРР у пациентов с мутацией KRAS G12C. Важно, что оно не было достаточно мощным и не было запланировано для обнаружения статистически значимых различий в ОВ из-за малого размера выборки вследствие редкости этой популяции пациентов.
Но, несмотря на отсутствие статистически значимых различий в этом предварительно запланированном анализе ОВ, комбинация соторасиба с панитумумабом может предполагать потенциальное относительное снижение риска смерти на 30,0% по сравнению со стандартной терапией. Эти результаты подтверждают, что польза, обеспечиваемая комбинацией соторасиб 960 мг + панитумумаб в отношении ВБП и ЧОО, предполагает потенциальное улучшение ОВ даже при том, что около трети пациентов в контрольной группе получали комбинацию ингибиторов KRASG12C вне протокола.
Последующая терапия ингибитором KRAS G12C с ингибитором EGFR у 27,8% пациентов в группе контроля вне исследования могла повлиять на интерпретацию результатов ОВ. Медиана ОВ, не достигнутая после 13,6 мес. по сравнению с медианой 10,3 мес. в контрольной группе, а также HR 0,70 указывают на то, что даже в отсутствии статистически достоверных различий улучшение OВ может быть особенно значимым, особенно с учетом преимуществ в ВБП.
Источник:
F. Pietrantonio, et al. Overall Survival Analysis of the Phase III CodeBreaK 300 Study of Sotorasib Plus Panitumumab Versus Investigator's Choice in Chemorefractory KRAS G12C Colorectal Cancer. JCO. 2025 April 11. JCO-24-02026. https://doi. org/10.1200/JCO-24-02026.
Материал подготовила А.В. Фатеева
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / NEO-PEMBRO TRIAL: НЕОАДЪЮВАНТНАЯ ТЕРАПИЯ ПЕМБРОЛИЗУМАБОМ ПРИ СЕРОЗНОМ РАКЕ ЯИЧНИКОВ IV СТАДИИ
Многократные попытки иммунотерапии улучшить результаты лечения распространенного рака яичников (РЯ) оказались безуспешны. Тем не менее, существует гипотеза, что паклитаксел и карбоплатин способны переводить опухоль из «холодной» в «горячую» за счет усиления презентации антигенов, экспрессии PD-L1 и устранения иммуносупрессивных клеток.
В данное исследование II фазы были включены пациентки с РЯ IV стадии, которым планировалось выполнение интервальной циторедукции. Всем пациенткам проводилась терапия в стандартном режиме ТС, пембролизумаб добавлялся со второго по шестой курсы к ХТ в дозе 200 мг, далее еще 7 курсов в дозе 400 мг, 1 раз в 6 недель. Выполнялась биопсия метастатических очагов до лекарственного лечения, после 1 курса ХТ и во время хирургического лечения. Первичная конечная точка – оценка иммуноактивирующей способности ИТ в сочетании с режимом ТС
В исследование включены 34 пациентки. При медиане наблюдения 52,8 мес. получены следующие результаты:
- 1 курс ХТ в режиме ТС привел к значимому увеличению отношения CD8+/FOXP3+ (показатель иммунной активности) (p=0,003).
- Добавление пембролизумаба к ТС также продемонстрировало увеличение инфильтрации CD8+ T-клеток (р=0,001) и росту отношения CD8+/ FOXP3+, особенно в группе пациенток с выраженным лекарственнным патоморфозом (р=0,008). У 27% пациенток отмечен выраженный лекарственный патоморфоз (CRS3).
- мВБП у пациенток с CRS3 не достигнута и составила 11,4 мес. в группе CRS1/2 (неполный патоморфоз) (р=0,001).
- мОВ у пациенток с CRS3 не достигнута и составила 23,5 мес. в группе CRS1/2 (неполный патоморфоз) (р=0,009).
! После одного курса химиоиммунотерапии (ХИТ) отмечено увеличение экспрессии PD-L1, что привело к росту CPS (р=0,005).
- Уровни CPS ≥5 и ≥10 оказались прогностически значимыми для достижения полного патоморфоза (р=0,036 и р=0,002 соответственно).
- Нормализация циркулирующих опухолевых ДНК до хирургического лечения отмечена у всех пациенток с CRS3 и у 14% в группе CRS1/2 (р=0,0001), а также коррелировала с улучшением ВБП (р<0,0001) и ОВ (p=0,0003) вне зависимости от патоморфоза.
Рисунок 1.
Дизайн исследования
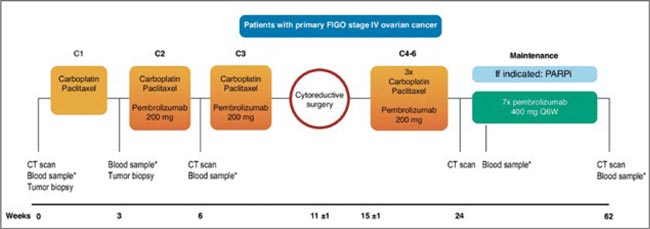
Рисунок 2.
Результаты исследования: ответ со стороны
таргетных очагов, ВБП, ОВ в целом и в зависимости от
выраженности ответа
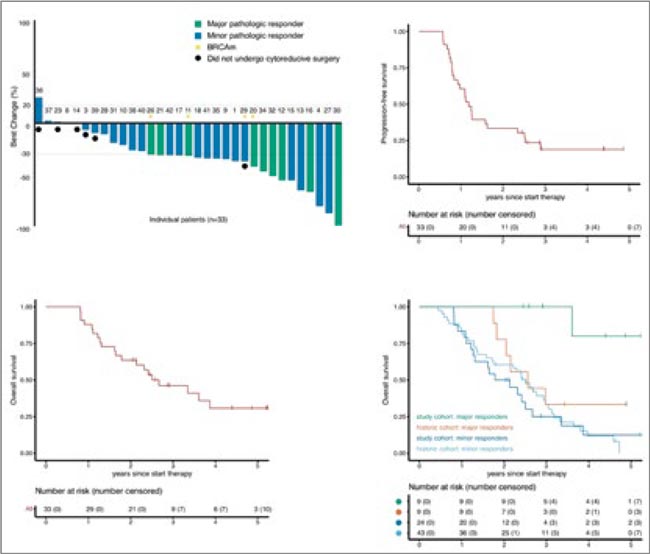
Данная работа, по сути, является больше гипотезогенерирующей, чем клинически значимой. Треть пациенток может достигнуть полного патоморфоза, ассоциированного с улучшением отдаленных результатов, при добавлении пембролизумаба. Вероятно, есть необходимость продолжить изучение ИТ в 1 линии распространенного РЯ. Будем следить за ситуацией дальше.
Источник:
Aronson, SL, Thijssen, B, Lopez-Yurda M, et al. Neo-adjuvant pembrolizumab in stage IV high-grade serous ovarian cancer: the phase II NeoPembro trial. Nat Commun. 2025; 16: 3520. https://doi.org/10.1038/s41467- 025-58440-y.
Материал подготовила А.В. Фатеева
УГОЛОК РАДИОТЕРАПЕВТА / УЛЬТРАКОРОТКИЕ КУРСЫ ЛУЧЕВОЙ ТЕРАПИИ ПРИ РАКЕ МОЛОЧНОЙ ЖЕЛЕЗЫ: ЛУЧШЕ МЕНЬШЕ, ДА ЛУЧШЕ?
Автор: Деньгина Наталья Владимировна
Заведующая радиологическим отделением ГУЗ «Областной клинический онкологический диспансер»,
член правления RUSSCO, главный редактор Газеты RUSSCO и сайта RosOncoWeb, к.м.н.,
Ульяновск
Еще некоторое время назад адъювантное облучение при раке молочной железы занимало пятьшесть недель минимум – и никак иначе. Сегодня подобные режимы практически не используются, более того, исследователи стремятся показать, что ультракороткие курсы лучевой терапии при раке молочной железы схожи по токсичности и равноэффективны длительным и имеют право на существование. В разгар ковида – в 2020 году – были опубликованы весьма позитивные результаты исследований FAST и FASTForward [1, 2] по применению 5 фракций на молочную железу вместо гипофракционированных 3-недельных курсов, причем были представлены зрелые 5- и 10-летние результаты. Ультракороткий режим был взят на вооружение, но речь шла только об облучении молочной железы.
Рисунок 1.
Ранняя и поздняя токсичность облучения:
А – во время облучения, В – через 3 месяца, С – через 6
месяцев, D – при финальной оценке
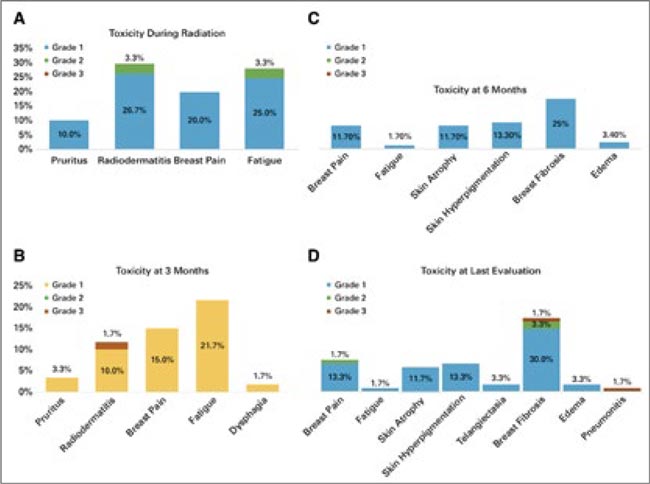
В мартовском номере журнала Journal of Clinical Oncology бразильские авторы представили результаты нерандомизированного одноцентрового проспективного исследования 2 фазы по применению ультрагипофракционированного облучения больных раком молочной железы не только после органосохраняющих операций, но и после мастэктомий, причем с захватом зон лимфоузлов. Пациентки в возрасте 65 и старше лет получали 5 фракций по 5,7 Гр через день, первичной конечной точкой исследования была токсичность.
Рисунок 2.
Безрецидивная выживаемость в зависимости
от стадии
Всего было включено для анализа 60 пациентов, медиана наблюдения составила 42,5 месяца (диапазон 13,8-66,2 мес.). Большинство имели стадию I (56,6%, n=34) или II (33,3%, n=20). Облучение регионарных лимфатических узлов было проведено у 22% (n=13) пациентов. Во время лечения у половины (51%) больных отмечена острая токсичность 1 или 2 степени, при этом не было зарегистрировано ни одного случая токсичности 3 степени. Поздние осложнения включали 1,7% (n=1) фиброза 3 степени и 1,7% – пневмонит 3 степени. Облучение регионарных лимфатических узлов не было связано со статистически значимым увеличением риска токсичности (P=0,194). Косметический эффект до лечения и спустя 10 недель после него был схожим (P=0,223), также как и через 26 недель (P=0,615) после облучения.
Рисунок 3.
Общая выживаемость в зависимости от стадии
Качество жизни не страдало, в том числе и у больных с расширенными объемами облучения. Рецидивы отмечены у двух пациентов (с локорегиональным и с отдаленным рецидивом) и у пяти пациентов – с отдаленными метастазами. Вероятность 3-летней безрецидивной выживаемости составила 81,7%, а 3-летней общей выживаемости – 86,7%.
Авторы сделали вывод, что это исследование добавило данных к уже имеющимся в отношении безопасности ультрагипофракционированной лучевой терапии у пожилых больных РМЖ, демонстрируя низкие показатели токсичности. Результаты косметического эффекта, качества жизни и выживаемости соответствуют таковым при применении умеренно гипофракционированных режимов, что вкупе делает вполне возможным укорочение адъювантных курсов до 5 фракций в качестве жизнеспособного и эффективного варианта лечения для этой демографической группы, особенно в контексте персонализированного подхода и оптимизации ресурсов.
Источники:
- Murray Brunt A, et al. Ten-Year Results of FAST: A Randomized Controlled Trial of 5-Fraction Whole-Breast Radiotherapy for Early Breast Cancer. Journal of Clinical Oncology. 2020; Vol.38, №28. https://doi.org/10.1200/ JCO.19.02750.
- Murray Brunt A, Haviland JS, Wheatley DA, et al. Hypofractionated breast radiotherapy for 1 week versus 3 weeks (FAST-Forward): 5-year efficacy and late normal tissue effects results from a multicentre, non-inferiority, randomised, phase 3 trial. Lancet. 2020; 395: 1613-1626.
- Marcel Fang, et al. Phase II Evaluation of UltraHypofractionated Postoperative Radiation Therapy for Breast Cancer: Toxicity and Efficacy in a Single-Center Nonrandomized Prospective Study. JCO Global Oncol. 2025; 11: e2400277.
УГОЛОК РАДИОТЕРАПЕВТА / ДЛЯ САМЫХ СМЕЛЫХ: ОДНОФРАКЦИОННАЯ SBRT ВИСЦЕРАЛЬНЫХ ОЧАГОВ
Рубрику «Уголок радиотерапевта» вскоре можно будет переименовывать в «Уголок новостей SBRТ» или наподобие того – ибо в последнее время подавляющее большинство новостей радиационной онкологии касаются применения SABR/SBRT в лечении различных видов опухолей, как первичных, так и метастатических, в комбинации с другими методами или в самостоятельном варианте. Поток информации растет, и нам необходимо «держать руку на пульсе».
В недавнем номере Красного журнала ASTRO появились данные проспективного мультицентрического однорукавного исследования 2 фазы SMART ONE по применению всего 1 фракции стереотаксического облучения под МРТ навигацией. Однофракционная SBRT для опухолей висцеральных локализаций применяется редко, что, вероятно, связано с опасениями по поводу риска «упустить» опухоль изпод визуального контроля из-за неоптимального качества КТсканирования на обычных линейных ускорителях (ЛУ).
Рисунок 1.
Лечебный план для однофракционного стереотаксического облучения метастаза в печени (40 Гр)
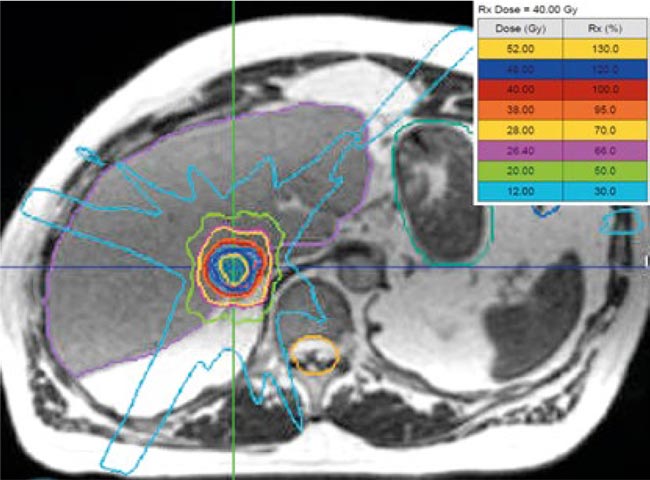
Облучение на ЛУ с магнитнорезонансным (МРТ) контролем – это новая технология, подразумевающая более эффективную визуализацию, которая может способствовать безопасному проведению однофракционной SBRT.
Американские авторы из 2 академических центров проводили лечение методом однофракционной SBRT на 0,35 Тесла MR-ЛУЭ на первичные или метастатические очаги в легких (в дозах 30 - 34 Гр за фракцию; биологически эквивалентная доза (BED10) = 120-149,6 Гр), печени (35-40 Гр; BED10 = 157,5-200 Гр), поджелудочной железе (25 Гр; BED10 = 87,5 Гр), надпочечниках (25 Гр), почках (25 Гр) и брюшных/тазовых лимфатических узлах (25 Гр). Основные цели исследования включали осуществимость и безопасность подобного подхода – ведь ранее подобные дозы крайне редко применялись; кроме того, постановка контрастных меток (fiducials) также не была обязательной.
В исследование было включено 30 пациентов с 32 очагами в период с июня 2021 года по июнь 2023 года, средний возраст – 69 лет. Большинство больных имели колоректальный рак (50%) и рак легкого (34%). У двоих пациентов облучению подвергались первичные опухоли ранних стадий (рак поджелудочной железы и рак легкого). Основные локализации облучаемых метастатических очагов: легкие (34,4%), надпочечники (28,1%), лимфоузлы (18,8%), печень (15,6%) и поджелудочная железа (3,1%). Средний диаметр облучаемых образований – 1,7 см.
Рисунок 2.
Локальный контроль за 12 мес
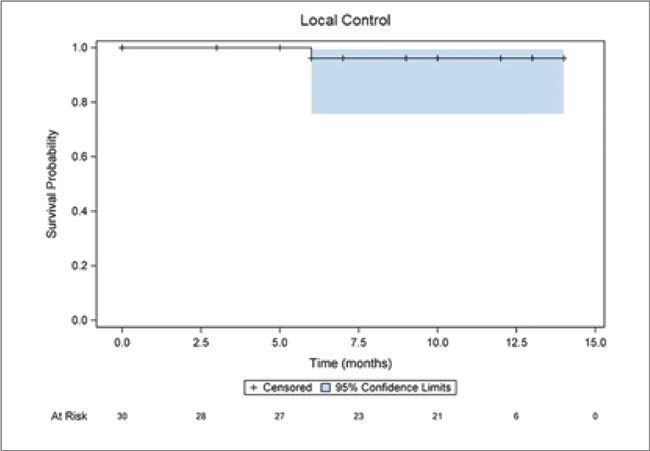
Рисунок 3.
Общая выживаемость за 12 мес
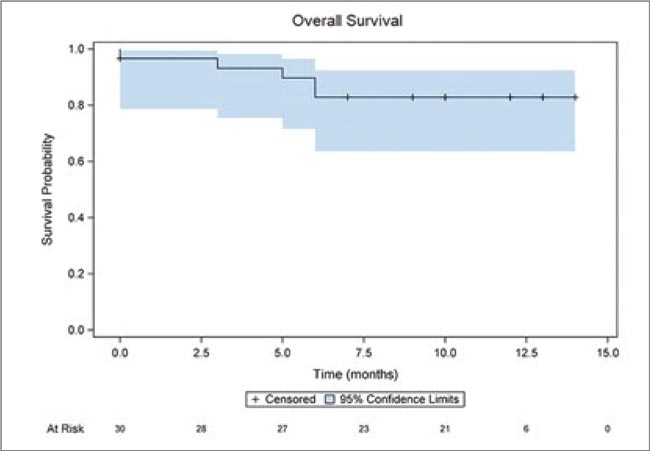
Основные цели были достигнуты: лечение признано безопасным и технически хорошо осуществимым; было отмечено только одно раннее осложнение (нежелательное явление – НЯ) 3 степени, вероятнее всего связанное с однофракционной SBRT. Поздних НЯ третьей степени не наблюдалось. Общее время нахождения в лечебной комнате составило менее 90 минут для 87,1% поставленных планов. Показатели локального контроля, ВБП и OВ (вторичные контрольные точки) за один год составили 96,2% (95% ДИ 88,8-100%), 82,9% (95% ДИ 69,2-96,5%) и 86,3% (95% ДИ 73,8-98,8%) соответственно.
Авторы пришли к выводу, что подобный подход должен стать стандартом лечения метастатических и первичных висцеральных очагов. Необходимы будущие исследования для оценки эскалации дозы одной фракции, особенно для опухолей, располагающихся вблизи полостных органов ЖКТ, поскольку долгосрочный локальный контроль может быть улучшен при увеличении BED10 свыше 100 Гр. Также необходима разработка проспективных исследований, которые прояснят оптимальный подбор пациентов для одно- или многофракционной SBRT.
Источник:
M. D. Chuong, C. Rojas, C. Glide-Hurst, et al. Stereotactic magnetic resonance-guided adaptive radiation therapy in one fraction (SMART ONE): a multicenter, single-arm, phase 2 trial, International Journal of Radiation Oncology, Biology, Physics. 2025. https://doi.org/10.1016/j. ijrobp.2025.03.030.
Материал подготовила Н.В. Деньгина
ОНКОЛОГИЧЕСКИЕ МИФЫ И РЕАЛЬНОСТЬ: СПРОСИ СВОЕГО ВРАЧА
Автор: Евсеев Владислав Николаевич
Заведующий отделением химиотерапии, Клиника МЕДСИ
Санкт-Петербург, Эксперт фонда «Не Напрасно»,
Санкт-Петербург
Российское общество клинической онкологии на своих ресурсах провело опрос онкологических пациентов с целью узнать их мнение об основных мифах и ограничениях, возникающих в процессе и после лечения опухолей. Всего в опросе приняли участие 130 человек из разных регионов страны и с разными заболеваниями. На основании этих ответов были составлены ответы об основных заблуждениях, которые могут снижать качество жизни пациентов или мешать в процессе лечения. Это поможет создать для пациентов общий источник информации и помочь с возвращением к привычному образу жизни.
МИФ 1. ОНКОЛОГИЧЕСКИМ ПАЦИЕНТАМ НЕЛЬЗЯ ПРИНИМАТЬ ПОЛИВИТАМИННЫЕ КОМПЛЕКСЫ

Мнение в опросе: Примерно одна треть (33,1%) пациентов считает, что принимать поливитаминные комплексы нельзя.
Ответ: Прием витаминов в привычных дозах не приводит к повышению риска рецидива или ухудшению течения опухоли. Важно, что прием избыточных доз (превышающих стандартные) действительно может навредить.
Подробнее:
Одно из самых частых заблуждений и опасений пациентов и их родственников заключается в том, что прием поливитаминных комплексов приводит к повышению риска рецидива опухоли. При этом примерно половина населения принимает подобные препараты [1].
К счастью, для ответа на этот вопрос были проведены исследования, которые показали, что прием поливитаминных комплексов не повышает риски рецидива и не ухудшает прогноз у пациентов с опухолями молочной железы и кишечника [2, 3]. Еще в одной научной работе прием поливитаминных комплексов не оказал негативного влияния на прогноз у пациентов с самыми разными онкологическими заболеваниями [4]. К сожалению, и значимого положительного эффекта на продолжительность жизни такие добавки также не оказали.
Вероятнее всего, прием подобных добавок не приводит и к повышенному риску развития онкологических заболеваний в целом. Например, в исследовании почти 50 000 мужчин регулярный прием поливитаминных комплексов не снизил и не повысил риски развития рака предстательной железы [5].
В ряде случаев врач, наоборот, может посоветовать прием поливитаминных комплексов или каких-то отдельных витаминов. Это может потребоваться в следующих ситуациях:
- После удаления желудка может возникать дефицит витамина B12 и фолиевой кислоты, поэтому врач может посоветовать контролировать уровень этих витаминов или периодически проходить лечение для профилактики их снижения [6, 7].
- На фоне гормонотерапии рака молочной железы может назначаться прием витамина D3 и кальция с целью профилактики развития остеопороза [8].
Отдельно надо сказать, что навредить приемом витаминов все же возможно. Например, в Норвежском исследовании прием витамина B12 и фолиевой кислоты приводил к повышению риска развития рака легкого у некоторых групп людей [9]. Но тут надо отметить – в исследовании применялись высокие дозы (400 мкг в день), в десятки и сотни раз превышающие обычную суточную потребность (2-3 мкг в день для взрослого человека). Это лишь показывает, что во всем важна мера.
Ссылки на источники
- Weighing up the evidence for multivitamins. Nature Portfolio, accessed 16 april 2025.
- Kimmie Ng, et al. Multivitamin Use Is Not Associated With Cancer Recurrence or Survival in Patients With Stage III Colon Cancer: Findings From CALGB 89803. JCO. 2010; 28: 4354-4363.
- Kwan ML, Greenlee H, Lee VS, et al. Multivitamin use and breast cancer outcomes in women with early-stage breast cancer: the Life After Cancer Epidemiology study. Breast Cancer Res Treat. 2011; 130: 195-205. https://doi. org/10.1007/s10549-011-1557-4.
- Park Y, Farhat Z, Liao LM, et al. Multivitamin use and all-cause and cause-specific mortality in cancer survivors. Br J Cancer. 2024; 130: 82- 87. https://doi.org/10.1038/s41416- 023-02421-9.
- Zhang Y, Song M, Mucci LA, Giovannucci EL. Regular, LongDuration Multivitamin Use and Risk of Overall and Aggressive Prostate Cancer in the Health Professionals Follow-Up Study. Journal of Urology [Internet]. 2022 Sep 1 [cited 2025 Apr 16]; 208(3): 633-40. https://doi.org/10.1097/ JU.0000000000002735.
- Bahardoust Mansoura; Mousavi Safad, Ziafati Hassana, Alipour Homanf, Haghmoradi Meisamg, Olamaeian Faranaka, Tayebi Alia, Tizmaghz Adnana. Vitamin B12 deficiency after total gastrectomy for gastric cancer, prevalence, and symptoms: a systematic review and meta-analysis. European Journal of Cancer Prevention. May 2024. 33(3): 208-216. DOI: 10.1097/ CEJ.0000000000000838.
- Kim HI, Hyung WJ, Song KJ, et al. Oral Vitamin B12 Replacement: An Effective Treatment for Vitamin B12 Deficiency After Total Gastrectomy in Gastric Cancer Patients. Ann Surg Oncol. 2011; 18: 3711-3717. https://doi. org/10.1245/s10434-011-1764-6.
- Coleman R, et al. Bone Health in Cancer Patients: ESMO Clinical Practice guideline. Ann Oncol. 2014; 25(suppl 3): iii124eiii137.
- Ebbing M, Bønaa KH, Nygård O, et al. Cancer Incidence and Mortality After Treatment With Folic Acid and Vitamin B12. JAMA. 2009; 302(19): 2119-2126. doi:10.1001/jama.2009.1622
МИФ 2. ОНКОЛОГИЧЕСКИМ ПАЦИЕНТАМ НЕЛЬЗЯ ПРОВОДИТЬ МАССАЖ
Мнение в опросе: Больше половины пациентов считают (55,4%), что проведение массажа онкологическим пациентам противопоказано.
Ответ: Массаж безопасен для онкологических пациентов и даже может помогать бороться с некоторыми осложнениями лечения или опухоли. В процессе лечения могут потребоваться определенные меры предосторожности во время проведения массажа.
Подробнее:
На данный момент нет убедительных научных данных о том, что проведение массажа может увеличивать риски рецидива у пациентов со злокачественными опухолями или каким-то образом ухудшать их прогноз. Например, в одном из исследований проведение лимфодренажной терапии после хирургического лечения рака молочной железы не привело к увеличению риска рецидива [1].
Проведение массажа непосредственно над опухолью стоит избегать, но опытный массажист всегда может это учитывать и проводить массаж других зон тела [2]. Существует много техник проведения массажа и всегда можно попробовать подобрать какую-то из них для конкретного пациента. Более того, массаж изучается как способ сопроводительной терапии для лечения слабости в процессе проведения лечения [3]. Например, предполагается, что мягкий массаж стоп или спины может уменьшать слабость в процессе химиотерапии [4]. Другие исследования говорят о том, что массаж может уменьшать выраженность тревоги и болевого синдрома после операций [5].
Тем не менее, могут быть определенные ограничения в проведении массажа в процессе лечения [6]:
• Если проводилось хирургическое вмешательство, необходимо дать достаточно времени на заживление всех послеоперационных ран. • При проведении химиотерапии может возникать целый ряд осложнений, которые требуют аккуратности при проведении массажа. Например, при снижении уровня тромбоцитов глубокий или интенсивный массаж может оставлять синяки, а массаж в зоне кожных осложнений может приводить к их ухудшению или неприятным ощущениям. • У людей с установленной портсистемой стоит избегать проведение массажа в этой зоне. • После проведения лучевой терапии кожа может быть воспаленная и очень чувствительная. Пока она не восстановится, стоит ограничить массаж другими зонами тела. Массажные масла и сам массаж могут усиливать болевые ощущения и дискомфорт в области воспаления.
Если вы проходите активное лечение в настоящий момент, то стоит обсудить с вашим лечащим врачом, какие могут быть ограничения для проведения массажа, но стоит понимать, что сам по себе массаж не ускорит рост опухоли и не повлияет на риск ее распространения.
Ссылки на источники
- The Risk of Breast Cancer Recurrence in Patients Receiving Lymphedema Physical Therapy: A Retrospective Cohort Study. Liu, Jung-TaiHsu, TzuWen et al. Archives of Physical Medicine and Rehabilitation. Vol.95, Issue 10, e45.
- Karda IWAM, Wan Ismail WF, Kamal AF. Massage manipulation and progression of osteosarcoma, does it really correlate: a combination of prospective and retrospective cohort study. Sci Rep. 2023; 13: 18541. https:// doi.org/10.1038/s41598-023-45808-7.
- Nurpadila Nurpadila, Mulhaeriah Mulhaeriah, Moh. Syafar Sangkala. Effects of massage therapy on cancer related fatigue: A systematic review. Enfermería Clínica. 2021; Vol.31, Suppl.5, P.S692-S696.
- Alizadeh Javad, et al. The effect of massage therapy on fatigue after chemotherapy in gastrointestinal cancer patients. Supportive Care In Cancer. Vol.29. DOI: 10.1007/s00520-021- 06304-8.
- Cole JS, Olson AD, DupontVersteegden EE. The Effects of Massage Therapy in Decreasing Pain and Anxiety in Post-Surgical Patients With Breast Cancer: A Systematic Review and MetaAnalysis. Glob Adv Integr Med Health. 2024 Apr 16; 13: 27536130241245099. DOI: 10.1177/27536130241245099. PMID: 38633004; PMCID: PMC11022679.
- Does Massage Spread Cancer? Cancer Council, iHEARD. Accessed: April 16, 2025.
МИФ 3. ОНКОЛОГИЧЕСКИМ ПАЦИЕНТАМ НЕЛЬЗЯ ЗАГОРАТЬ

Мнение в опросе: Примерно 8 из 10 пациентов (83,1%) считают, что загорать нельзя
Ответ: Солнце и загар не влияют на риски рецидива заболевания, но на фоне некоторых вариантов лечения солнечные лучи могут усиливать побочные эффекты лечения. Кроме того, важно помнить, что избыточное нахождение на солнце и походы в солярии вредны для всех людей из-за повышения рисков развития опухолей кожи.
Подробнее
Для большинства онкологических заболеваний не существует научных данных о том, что солнце может негативно влиять на риски рецидива. Это значит, что не стоит опасаться того, что нахождение под солнцем или поездка в более теплое место приведет к рецидиву опухоли. Исключениями могут быть опухоли кожи, для некоторых из которых загар после установленного диагноза может немного повышать риски рецидива. Для пациентов, перенесших лечение онкологических заболеваний, важно соблюдать те же правила, что и для всех остальных людей – использовать солнцезащитные крема, избегать солнечных ожогов, стараться не находиться под солнцем в пиковые часы.
В процессе лечения кожа может быть более чувствительной к воздействию солнца. А некоторые лекарственные препараты, используемые для лечения онкологических заболеваний, могут вызывать фоточувствительность кожи – повышенную восприимчивость кожи к солнечным лучам. В результате человек может столкнуться с появлением сыпи, волдырей, покраснения кожи даже при недолгом пребывании на не сильном солнце. Такие препараты могут использоваться для лечения рака легкого, меланомы, опухолей толстой и прямой кишки.
Также нужно помнить, что ультрафиолетовое излучение у всех людей повышает риск развития опухолей кожи. Например, сильные солнечные ожоги с появлением пузырей на коже повышают риски развития базалиомы и плоскоклеточного рака кожи примерно в 2 раза [1]. Кроме того, солнечные лучи вызывают большую часть видимых признаков старения кожи [2]. Поэтому избегать избыточного нахождения на солнце нужно, но не из-за рисков рецидива.
Ссылки на источники
- Iannacone MR, Wang W, Stockwell HG, O'Rourke K, Giuliano AR, Sondak VK, Messina JL, Roetzheim RG, Cherpelis BS, Fenske NA, Rollison DE. Patterns and timing of sunlight exposure and risk of basal cell and squamous cell carcinomas of the skin-a case-control study. BMC Cancer. 2012 Sep 20; 12: 417. DOI: 10.1186/1471- 2407-12-417. PMID: 22994655; PMCID: PMC3517361.
- Amaro-Ortiz A, Yan B, D'Orazio JA. Ultraviolet radiation, aging and the skin: prevention of damage by topical cAMP manipulation. Molecules. 2014 May 15; 19(5): 6202-19. DOI: 10.3390/molecules19056202. PMID: 24838074; PMCID: PMC4344124.
МИФ 4. ПОСЛЕ УСТАНОВЛЕННОГО ОНКОЛОГИЧЕСКОГО ДИАГНОЗА МОЖНО ПРОДОЛЖАТЬ КУРИТЬ

Мнение в опросе: Каждый 5-й пациент (22,3%) считает, что продолжать курить после установленного диагноза можно
Ответ: Продолжение курения после постановки диагноза негативно сказывается на результатах лечения и повышает риски столкнуться со второй злокачественной опухолью. Отказ от курения может облегчить проведение любого вида противоопухолевой терапии.
Подробнее
Продолжение курения также повышает риск столкнуться со второй злокачественной опухолью [1]. Например, у пациентов с раком легкого риски второй опухоли легкого возрастают в 2 раза, а отказ от курения, наоборот, позволяет снизить их на 80% [2]. Курение также негативно влияет на результаты хирургического лечения. Например, у курильщиков повышаются риски осложнений со стороны послеоперационной раны, возрастают риски повторной интубации (применения искусственной вентиляции легких), увеличивается длительность госпитализации [3]. Причем отказ от курения перед операцией может помочь устранить часть этих негативных эффектов и делает хирургическое лечение более безопасным [4].
При проведении лучевой терапии риски осложнений тоже выше у курильщиков [5]. Причем это не ограничено только одним видом опухоли, а можно увидеть и при облучении опухолей головы и шеи, и опухолей шейки матки, и многих других. А некоторые исследования и вовсе показывают, что продолжение курения во время лучевой терапии может приводить к ухудшению результатов лечения и более высокой устойчивости опухолей к этому методу лечения [6].
Есть экспериментальные данные, что даже пассивное курение может снижать эффективность некоторых химиопрепаратов [7]. А исследования из реальной практики показывают, что у курильщиков выше риски развития тошноты, снижения веса и проблем с кожей на фоне противоопухолевой терапии [8].
Таким образом, курение имеет много негативных факторов даже у людей с установленным диагнозом онкологического заболевания – лечение переносится хуже, эффективность его снижается, а риски столкнуться с еще одной опухолью, наоборот, увеличиваются. Отказ от курения – важный компонент лечения любой злокачественной опухоли.
Ссылки на источники
- Tabuchi T, et al. Tobacco smoking and the risk of subsequent primary cancer among cancer survivors: a retrospective cohort study. Annals of Oncology. Vol.24, Issue 10, 2699-2704
- Aredo Jacqueline V, et al. Tobacco Smoking and Risk of Second Primary Lung Cancer. Journal of Thoracic Oncology. Vol.16, Issue 6, 968-979.
- Fan Chiang YH, Lee YW, Lam F, Liao CC, Chang CC, Lin CS. Smoking increases the risk of postoperative wound complications: A propensity score-matched cohort study. Int Wound J. 2023 Feb; 20(2): 391-402. DOI: 10.1111/iwj.13887. Epub 2022 Jul 9. PMID: 35808947; PMCID: PMC9885463.
- Thomsen T, Villebro N, Møller AM. Interventions for preoperative smoking cessation. Cochrane Database Syst Rev. 2014 Mar 27; 2014(3): CD002294. DOI: 10.1002/14651858.CD002294. pub4. PMID: 24671929; PMCID: PMC7138216.
- Haghparast Mohammad, et al. Tobacco smoking influences the side effects of radiation therapy-managed patients with various malignancies: A systematic review. Journal of Medical Imaging and Radiation Sciences. Vol.55, Issue 4, 101430.
- George P. Browman, Gene Wong, Ian Hodson, Jinka Sathya, Rosemary Russell, Lisa McAlpine, Peter Skingley, and Mark N. Levine. Influence of Cigarette Smoking on the Efficacy of Radiation Therapy in Head and Neck Cancer. N Engl J Med. 1993; 328: 159-163. DOI: 10.1056/ NEJM199301213280302.
- Sadhasivam B, Manyanga J, Ganapathy V, Acharya P, Bouharati C, Chinnaiyan M, Mehta T, Mathews B, Castles S, Rubenstein DA, et al. Exposure to Secondhand Smoke Extract Increases Cisplatin Resistance in Head and Neck Cancer Cells. Int. J. Mol. Sci. 2024; 25: 1032. https://doi. org/10.3390/ijms2502103. 8. Luke J. Peppone, et al. The Effect of Cigarette Smoking on Cancer Treatment-Related Side Effects. The Oncologist. 2011; 16: 1784-792.
ЭТО ИНТЕРЕСНО / ВОЗРАСТ 70+ БЕЗ ХРОНИЧЕСКИХ ЗАБОЛЕВАНИЙ – ВСЕ ОСУЩЕСТВИМО
Численность пожилых людей в мире в последние несколько десятилетий возросла, однако 80% пожилых людей имеют по крайней мере одно хроническое заболевание. Содействие здоровому старению можно отнести к глобальным приоритетам любой системы здравоохранения любой страны. Это способствует поддержанию более высокого качества жизни, снижению расходов на здравоохранение. Диета является первым ведущим поведенческим фактором риска неинфекционных заболеваний и смертности во всем мире и вторым после употребления табака среди пожилых людей.
В мартовском номере журнала NATURE MEDICINE опубликованы данные крупного популяционного анализа, который показал: из более чем 105 000 участников с 30-летним сроком наблюдения только 9,3% достигли здорового старения (то есть возраст 70 лет, без каких-либо хронических заболеваний). Их диета была в значительной степени связана с этим результатом.
Итак, чуть подробнее.
Рисунок 1.
Многопараметрические скорректированные
ассоциации между диетическими факторами и здоровым
старением в основном объединенном наборе данных
(n=105 015)
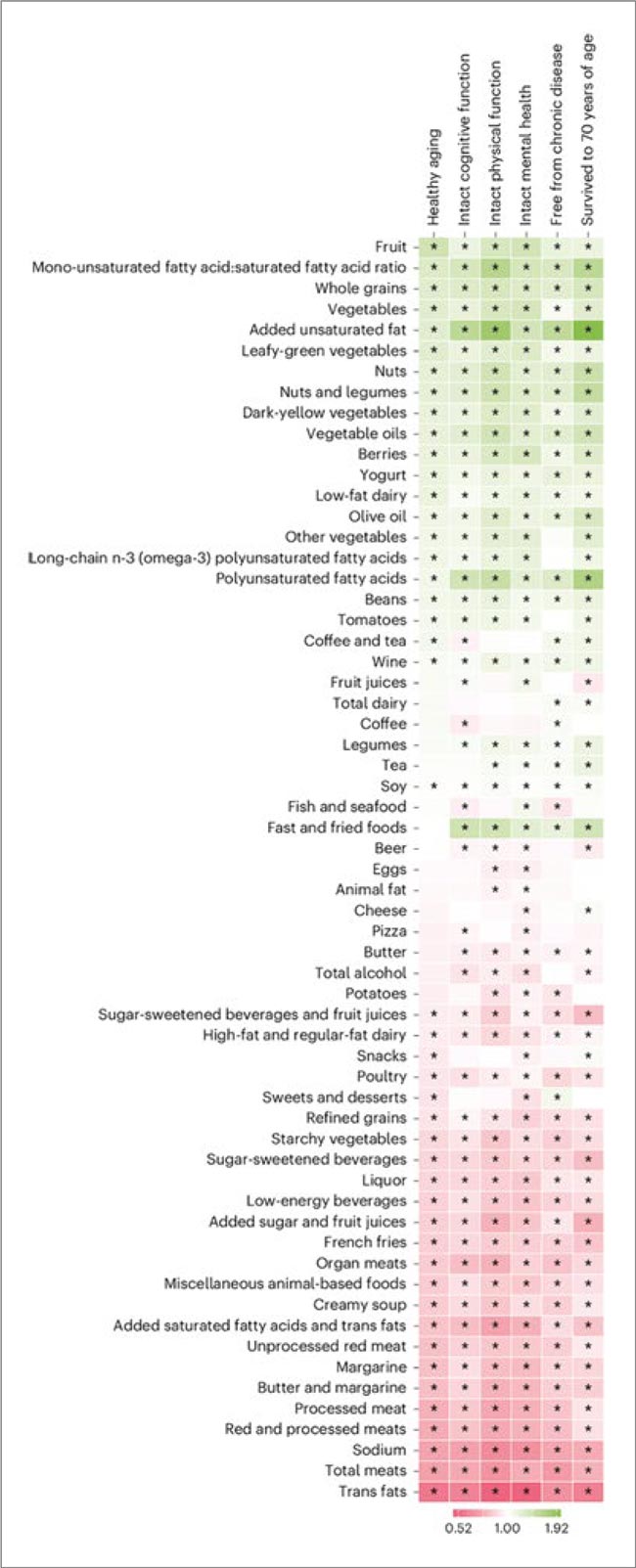
Американские, канадские и датские авторы выстроили анализ на основании данных пролонгированного опроса из Исследования здоровья медсестер (Nurses’Health Study, 1986-2016) и Исследования по наблюдению медицинских работников (Health Professionals Follow-Up Study, 1986-2016), сосредоточившись только на участниках в возрасте 40-70 лет и изучив связь долгосрочного соблюдения восьми режимов питания и потребления ультраобработанных продуктов со здоровым старением, оцениваемым по показателям когнитивного, физического и психического здоровья, а также с возможностью дожить до 70 лет без хронических заболеваний.
Эти 8 паттернов питания включали следующие: Альтернативный индекс здорового питания (AHEI), Альтернативный средиземноморский индекс (aMED), Диетические подходы к остановке гипертонии (DASH), Средиземноморское вмешательство DASH при нейродегенеративной задержке (MIND), здоровая растительная диета (hPDI), Планетарный индекс диеты здоровья (PHDI), эмпирически воспалительная диетическая модель (EDIP), эмпирический диетический индекс гиперинсулинемии (EDIH) и потребление ультраобработанной пищи (UPF). После наблюдения в течение 30 лет 9771 (9,3%) участников достигли здорового старения, 7602 (10,8%) в NHS и 2169 (6,2%) в HPFS. В объединенных когортах 39 769 (37,9%) достигРисунок 1. Многопараметрические скорректированные ассоциации между диетическими факторами и здоровым старением в основном объединенном наборе данных (n=105 015) ли возраста 70 лет, 23 908 (22,8%) остались свободными от 11 наиболее распространенных хронических заболеваний, 35 555 (33,9%) сохранили интактную когнитивную функцию, 29 543 (28,1%) интактную физическую функцию и 27 842 (26,5%) сохранили неизмененное психическое здоровье.
Более строгое соблюдение всех диетических схем было связано с более высокими шансами на здоровое старение. Рисунок 1 иллюстрирует связи между отдельными диетическими факторами и здоровым старением и его отдельными доменами. В то время как более высокое потребление фруктов, цельного зерна, овощей, добавленных ненасыщенных жиров, орехов, бобовых и обезжиренных молочных продуктов было связано с более высокими шансами здорового старения, более высокое потребление трансжиров, соли, общего мяса, а также красного и обработанного мяса было связано с более низкими шансами. Эти продукты или питательные вещества также были последовательно связаны с каждым доменом здорового старения. Дополнительное потребление ненасыщенных жиров, включая полиненасыщенные жирные кислоты, было особенно связано с достижением возраста 70 лет и сохранностью физических и когнитивных функций.
Для оценки ОШ использовались логистические регрессии и были скорректированы по возрасту на исходном уровне (1986), когорте (пол), ИМТ, происхождению (европейцы, азиаты, афроамериканцы, другие), статусу курения (никогда, бывший, активный курильщик: 1-14 сигарет в день, 15- 24 сигареты в день и ≥25 сигарет в день), потреблению алкоголя (г в день), физической активности, приему поливитаминов когдалибо (да/нет), семейному анамнезу инфаркта миокарда (да/нет), семейному анамнезу диабета 2 типа, семейному анамнезу рака, семейному анамнезу деменции (да/нет), постменопаузальному статусу (да/нет) и использованию менопаузальных гормонов (нет, в прошлом или в настоящее время; только для женщин), СЭС на исходном уровне, семейному положению (да/нет), проживание в одиночестве когда-либо (да/ нет) и история депрессии (да/нет) в объединенных когортах. OR больше 1,0 обозначены зеленым; OR ниже 1,0 обозначены розовым; более темный цвет указывает на более сильную связь.
Более высокое потребление фруктов, овощей, цельного зерна, ненасыщенных жиров, орехов, бобовых и обезжиренных молочных продуктов было связано с более высокими шансами на здоровое старение, тогда как более высокое потребление трансжиров, соли, сладких напитков и красного или обработанного мяса (или и того, и другого) было обратно пропорционально тому. Авторы пришли к выводу, что диетические модели, богатые растительными продуктами, с умеренным включением полезных продуктов животного происхождения, могут улучшить общее здоровое старение, направляя будущие рекомендации диетологов по питанию. Вроде бы ничего нового – но задуматься еще раз стоит.
Источник:
Anne-Julie Tessier, et al. Optimal dietary patterns for healthy aging. Nature Medicine. 2025 March 24. https://doi.org/10.1038/s41591- 025-03570-5.
Академия RUSSCO ДЛЯ ПОДГОТОВКИ К ЭКЗАМЕНУ ESMO*
