БОРИС РЫЖИЙ 1997
Красавица в осьмнадцать лет, Смотри, как тихо мы стареем: Всё тише музыка и свет Давно не тот, и мы робеем, ....

Пил, Рембрандт (Rembrandt Peale).
Рубенс Пил с геранью (Rubens Peale with a geranium). 1801, холст, масло. Национальная галерея искусств, Вашингтон.
…А какие у вас ассоциации с апрелем?
У тех, кто постарше, наверняка, это конкурсы чтецов: «В апреле, именно в апреле, весною, именно весной…» и так далее, про капели, отпенившиеся метели, лучи, что летели, и сердца, что добрели...
ИТОГИ РЕАЛИЗАЦИИ В 2023 ГОДУ НАЦИОНАЛЬНОЙ ПРОГРАММЫ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ «СОВЕРШЕНСТВОВАНИЕ МОЛЕКУЛЯРНОГЕНЕТИЧЕСКОЙ ДИАГНОСТИКИ В РОССИЙСКОЙ ФЕДЕРАЦИИ С ЦЕЛЬЮ ПОВЫШЕНИЯ ЭФФЕКТИВНОСТИ ПРОТИВООПУХОЛЕВОГО ЛЕЧЕНИЯ»
Российское общество клинической онкологии 22 марта 2023 года провело в Москве очередное очное рабочее совещание лабораторий-участников проекта Национальной Программы RUSSCO «Совершенствование молекулярно-генетической диагностики в Российской Федерации с целью повышения эффективности противоопухолевого лечения»...
1 МАЯ НАЧИНАЕТСЯ ПРИЕМ ЗАЯВОК В ШКОЛУ НАУЧНЫХ ИССЛЕДОВАНИЙ ДЛЯ МОЛОДЫХ ОНКОЛОГОВ
Школа научных исследований для молодых онкологов, партнером которой выступает Российское общество клинической онкологии (RUSSCO), – это уникальный синтез инструментов для улучшения теоретической базы, практической подготовки и реализации исследований молодыми российскими учеными на мировом уровне...

РЕГИОНАЛЬНОЕ ОТДЕЛЕНИЕ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ (RUSSCO) ЕВРЕЙСКОЙ АВТОНОМНОЙ ОБЛАСТИ
Еврейская автономная область – субъект Российской Федерации, входит в состав Дальневосточного федерального округа. Административный центр – город Биробиджан. Область была образована 7 мая 1934 года из Биробиджанского еврейского национального района...
25 мая 2024 года на базе ГАУЗ НО НИИКО Нижегородского областного клинического онкологического диспансера состоится совместная конференция RUSSCO, Онкологического центра №1 ГКБ им. С.С.Юдина и ОКОД г.Нижний Новгород. Мы приглашаем потенциальных участников посетить мероприятие очно или подключиться онлайн после регистрации на сайте. Сегодня мы публикуем тезисы, присланные членами Комитета молодых онкологов RUSSCO в соавторстве с коллегами.
1. Результаты лучевой терапии в режиме гипофракционирования у пациентов со злокачественными новообразованиями головы и шеи...

РАЗМЫШЛЕНИЯ В ОТРЫВЕ ОТ РУТИНЫ / ЯБЛОЧКИ ОТ ТЕТИ SONIA… ЧТО НАМ ДЕЛАТЬ С РЕЗУЛЬТАТАМИ ИССЛЕДОВАНИЙ С ПОЛНЫМ ИЛИ ПОЧТИ ПОЛНЫМ ПЕРЕКРЕСТОМ?
Не успели отшуметь дебаты, связанные с исследованием SONIA [1], воспринятым многими коллегами как однозначное доказательство возможности «безболезненно» переместить CDK4/6 ингибиторы во 2 линию терапии распространенного люминального HER2-негативного РМЖ (мРМЖ), как вдруг… «беда» (или радость, кому как…) пришла откуда не ждали...

ДИКЛОФЕНАК ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ЛАДОННО-ПОДОШВЕННОГО СИНДРОМА КАПЕЦИТАБИНА
Одним из частых и ухудшающих качество жизни наших пациентов осложнений на фоне лечения капецитабином является ладонно-подошвенный синдром (ЛПС), выражающийся в покраснении, отеке ...
SABR В ПЕРВИЧНОМ ЛЕЧЕНИИ НЕОПЕРАБЕЛЬНОГО РАКА ПОЧКИ: ВОЗРАСТАЮЩИЙ ИНТЕРЕС
Отношение к лучевой терапии первичного рака почки на протяжении десятилетий имело полярный характер: от широкого применения пролонгированных курсов адъювантного облучения ложа...
РАК ЛЕГКОГО 1 СТАДИИ – МИШЕНЬ ДЛЯ ИОНОВ УГЛЕРОДА
Стандартным лечением рака легкого 1 стадии, согласно международным и отечественным рекомендациям, является хирургический метод – лобэктомия с медиастинальной лимфодиссекцией...

ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / ПРОГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ ЦИРКУЛИРУЮЩЕЙ ОПУХОЛЕВОЙ ДНК ПРИ НЕМЕЛКОКЛЕТОЧНОМ РАКЕ ЛЕГКОГО
Применение лекарственной терапии на предоперационном или послеоперационном этапах в рамках комбинированного лечения местнораспространенного немелкоклеточного рака легкого (НМРЛ)...

ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / CHECKMATE 901: НИВОЛУМАБ В КОМБИНАЦИИ С ГЕМЦИТАБИНОМ И ЦИСПЛАТИНОМ ПРИ ДИССЕМИНИРОВАННОМ УРОТЕЛИАЛЬНОМ РАКЕ
Ранее изучавшийся подход добавления иммунотерапии (ИТ) к платиносодержащей химиотерапии (ХТ) в 1-й линии не продемонстрировал своей эффективности...
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / ECOG-ACRIN E2810: ЭФФЕКТИВНОСТЬ ПАЗОПАНИБА ПОСЛЕ ПОЛНОЙ МЕТАСТАЗЭКТОМИИ ПРИ РАКЕ ПОЧКИ
Оптимальная тактика лечения пациентов после полной метастазэктомии (ПМЭ) почечноклеточного рака (ПКР) все еще не определена. Неоднократные попытки улучшить выживаемость без признаков болезни (ВБПБ) при применении тирозинкиназных ингибиторов (ТКИ) в адъювантном режиме оказались безуспешны. В JCO 26 марта 2024 года представлены финальные результаты исследования...
14 СЕНТЯБРЯ 2024 ГОДА В МОСКВЕ ПРОЙДЕТ ЭКЗАМЕН ESMO
По соглашению между ESMO и RUSSCO в этом году Москва вошла в число нескольких площадок в мире, где 14 сентября 2024 года состоится экзамен ESMO. Это уникальная возможность молодым специалистам попробовать свои силы в отношении знаний медицинской онкологии. В Словении и Швейцарии этот экзамен уже стал обязательной письменной частью для получения сертификата...
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / CASPIAN: ВОЗМОЖНОСТИ И ПРОГНОСТИЧЕСКИЕ ФАКТОРЫ ТЕРАПИИ ПЕРВОЙ ЛИНИИ РАСПРОСТРАНЕННОГО МЕЛКОКЛЕТОЧНОГО РАКА ЛЕГКОГО
Современный стандарт лечения распространенного мелкоклеточного рака легкого (МРЛ) продиктован результатами исследования IMpower133 и заключается в проведении 4 курсов противоопухолевой терапии на основе препаратов платины, этопозида и ингибитора контрольных точек (ИКТ) атезолизумаба [1]. Комбинированная терапия позволила увеличить медиану общей...
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / PACIFIC-2: ПРОВЕДЕНИЕ ТЕРАПИИ ДУРВАЛУМАБОМ ОДНОВРЕМЕННО С ХЛТ НЕ УЛУЧШАЕТ ВЫЖИВАЕМОСТЬ ПАЦИЕНТОВ С НМРЛ ПО СРАВНЕНИЮ С КОНСОЛИДИРУЮЩИМ ВАРИАНТОМ ЛЕЧЕНИЯ
Основным вариантом лечения пациентов с нерезектабельным местнораспространенным немелкоклеточным раком легкого является проведение одновременной химиолучевой терапии с последующей поддерживающей терапией дурвалумабом. В регистрационном исследовании PACIFIC подобный подход обеспечивал улучшение 5-летней общей выживаемости (ОВ) до 42,9% по...
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / ELCC 2024: ОБНОВЛЕННЫЕ ДАННЫЕ
21 марта 2024 года на European Lung Cancer Congress (ELCC 2024) были представлены обновленные результаты исследований FLAURA2, MARIPOSA-2 и MARIPOSA. В конце 2023 года авторы FLAURA2 показали возможность увеличения выживаемости без прогрессирования (ВБП) у пациентов с диссеминированным EGFR-мутантным НМРЛ при проведении...
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / ПРЕДИКТОРНОЕ ЗНАЧЕНИЕ ЭКСПРЕССИИ PD-L1 ПРИ ПРОВЕДЕНИИ НЕОАДЪЮВАНТНОЙ ХИМИОИММУННОЙ ТЕРАПИИ НМРЛ
Изучение возможностей химиоиммунной терапии (ХИТ) при местнораспространенном немелкоклеточном раке легкого (НМРЛ) является одним из наиболее актуальных направлений клинической онкологии. К сожалению, широкое применение данного подхода лимитируется высокой стоимостью препаратов, что мотивирует попытки уточнения показаний для их назначения за счет
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / OPTICAL TRIAL: МОЖНО ЛИ ОТКАЗАТЬСЯ ОТ НЕОАДЪЮВАНТНОЙ ХИМИОТЕРАПИИ ПРИ МЕСТНОРАСПРОСТРАНЕННОМ РАКЕ ВЕРХНЕАМПУЛЯРНОГО ОТДЕЛА ПРЯМОЙ КИШКИ?
Пациенты с местнораспространенным раком средне- и нижнеампулярного отдела прямой кишки (ПК) представляют собой гетерогенную группу, требующую персонализированного подхода и тщательного предоперационного планирования в виду высоких рисков операционных осложнений и возможности значительного ухудшения качества жизни. Методом выбора у таких больных могут...
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / ВОЗМОЖНОСТИ И ПЕРСПЕКТИВЫ ПОДКОЖНОГО ВВЕДЕНИЯ ИММУНОТЕРАПЕВТИЧЕСКИХ ПРЕПАРАТОВ
Иммунотерапия стала важным компонентом системного противоопухолевого лечения, характеризующимся высокой длительностью терапии, достигающей у ряда больных нескольких лет. При этом подобная длительность лечения «привязывает» пациента к лечебному учреждению, вынуждая его совершать регулярные визиты для проведения очередной многочасовой инфузии, что приводит к...
ЭФФЕКТИВНОСТЬ АЛПЕЛИСИБА В РЕАЛЬНОЙ КЛИНИЧЕСКОЙ ПРАКТИКЕ: ДАННЫЕ ТРЕТЬЕГО ПРОМЕЖУТОЧНОГО АНАЛИЗА ИССЛЕДОВАНИЯ PROSPERITY
В настоящее время вопрос об оптимальной последовательности лечения метастатического гормонозависимого HER2- отрицательного рака молочной железы (HR+ HER2- мРМЖ) остается открытым. Для оценки ситуации в России было начато исследование PROSPERITY - проспективное наблюдательное исследование для описания клинических исходов, схем лечения, характеристик пациентов с....
Анонс
-

17 -18 Мая 2024 Санкт-Петербург
ПОДДЕРЖИВАЮЩАЯ ТЕРАПИЯ
X КОНФЕРЕНЦИЯ RUSSCO
-

25 Мая 2024
ОПУХОЛИ ГОЛОВЫ И ШЕИ
СОВМЕСТНАЯ КОНФЕРЕНЦИЯ
-
7 - 8 Июня 2024
ЛУЧШЕЕ ПО МАТЕРИАЛАМ КОНФЕРЕНЦИИ ASCO
ВТОРОЙ МОЛОДЕЖНЫЙ ОНКОЛОГИЧЕСКИЙ САММИТ
-

14 Сеньтября 2024
ЭКЗАМЕН ESMO
Москва
БОРИС РЫЖИЙ 1997
Красавица в осьмнадцать лет,
Смотри, как тихо мы стареем:
Всё тише музыка и свет
Давно не тот, и мы робеем,
Но всё ж идём в кромешный мрак.
Но слышишь, музыка иная
Уже звучит - негромко так,
Едва-едва, моя родная.
Когда-нибудь, когда-нибудь,
Когда не знаю, но наверно
Окажется прекрасным путь,
Казавшийся когда-то скверным.
В окно ворвутся облака,
Прольётся ливень синеокий,
И музыка издалека
Сольётся с музыкой далёкой.
В сей музыкальный кавардак
Войдут две маленькие тени -
От летней музыки на шаг,
На шаг от музыки осенней.
Пил, Рембрандт (Rembrandt Peale).
Рубенс Пил с геранью (Rubens Peale with a geranium).
1801, холст, масло. Национальная галерея искусств, Вашингтон.

…А какие у вас ассоциации с апрелем?
У тех, кто постарше, наверняка,
это конкурсы чтецов: «В апреле,
именно в апреле, весною, именно
весной…» и так далее, про капели,
отпенившиеся метели, лучи, что
летели, и сердца, что добрели. У
кого-то – ассоциации с розыгрышами, у кого-то – с Днем космонавтики. А кто-то до сих пор вспоминает сказку о 12 месяцах, где
юная героиня стремилась именно
к юноше Апрелю, щедрому на россыпи первоцветов и первые, понастоящему теплые лучи солнца.
На первой странице апрельского номера нашей газеты – тоже
юноша с цветком. Американский художник Чарльз Уилсон
Пил назвал многих своих детей
в честь известных художников,
в том числе и двух своих сыновей - Рембрандта и Рубенса.
Рембрандт впоследствии сам
стал художником, и на картине
он написал своего брата Рубенса в возрасте 17 лет. Рубенс же,
у которого было плохое зрение
(обратите внимание на две пары
очков), начал рисовать только
в позднем возрасте, но сначала
он сосредоточился на изучении
садоводства и ботаники. Рембрандт изображает Рубенса с
геранью — тогда очень редким
видом цветка. Считается, что
это первая герань, выращенная
в Соединенных Штатах. Ее положение на переднем плане картины и то, как Рубенс бережно
держит горшок, свидетельствуют о важности растения – и вместе они смотрятся вполне поапрельски.
Обращаемся в первую очередь
к вам, дорогие новые члены
RUSSCO и RUSSCO Junior, молодые, активные и по-хорошему
амбициозные! Позвольте апрелю сподвигнуть вас на многое
– начало или завершение диссертаций, написание новых
статей или тезисов, подачу заявок на участие в конференциях
RUSSCO и Российском онкологическом конгрессе. В этом номере вы увидите несколько тезисов от молодых онкологов для
совсем юной – первой! – конференции RUSSCO по опухолям
головы и шеи, которая пройдет в
мае в Нижнем Новгороде. Присоединяйтесь, если эта тема вам
интересна, а если не очень – участвуйте в других мероприятиях
общества, информация о которых всегда есть на сайте. В номере вы также найдете немало
статей от группы молодых авторов – подумайте, не хотелось бы
вам присоединиться к команде
«Прочти об этом раньше, чем
твой пациент»?
Журнал «Злокачественные опухоли» и газета общества также
ждут новых имен.
Расцветайте, онкологи! Доброй Весны!
Ваша,
Команда RUSSCO
ИТОГИ РЕАЛИЗАЦИИ В 2023 ГОДУ НАЦИОНАЛЬНОЙ ПРОГРАММЫ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ «СОВЕРШЕНСТВОВАНИЕ МОЛЕКУЛЯРНОГЕНЕТИЧЕСКОЙ ДИАГНОСТИКИ В РОССИЙСКОЙ ФЕДЕРАЦИИ С ЦЕЛЬЮ ПОВЫШЕНИЯ ЭФФЕКТИВНОСТИ ПРОТИВООПУХОЛЕВОГО ЛЕЧЕНИЯ»

Российское общество клинической
онкологии 22 марта 2023 года провело в Москве очередное очное рабочее
совещание лабораторий-участников
проекта Национальной Программы
RUSSCO «Совершенствование молекулярно-генетической диагностики
в Российской Федерации с целью повышения эффективности противоопухолевого лечения».
В совещании приняли участие и были
председателями совещания: Хатьков
Игорь Евгеньевич, директор ГБУЗ
«Московский клинический научнопрактический центр имени А.С. Логинова ДЗМ», главный внештатный
специалист-онколог Департамента
здравоохранения Москвы, заведующий кафедрой факультетской хирургии лечебного факультета МГМСУ,
академик РАН, д.м.н., профессор, и
Носов Дмитрий Александрович,
председатель правления Российского
Общества Клинической Онкологии
(RUSSCO), заведующий онкологическим отделением противоопухолевой лекарственной терапии ФГБУ
«Центральная клиническая больница
с поликлиникой» Управления делами
Президента РФ, д.м.н., профессор.
Представители 31 лаборатории из
различных регионов страны собрались в ГБУЗ МКНЦ им. А.С. Логинова ДЗМ, где ознакомились с работой молекулярно-генетической и
патоморфологической лабораторий
Центра, заслушали отчет RUSSCO о
результатах реализации Программы,
в том числе контроля качества тестирования, и образовательных программах для лабораторий в 2023 году,
а также обсудили регламенты молекулярно-генетических тестирований.
Были обсуждены актуальные вопросы и будущие направления NGS тестирования, контроля качества NGS,
доступные на сегодня платформы
секвенирования и импортозамещение в современных реалиях, а также
особенности биоинформатической
обработки данных.
Многолетняя практика проведения
подобных рабочих совещаний подтверждает их важность не только с
точки зрения обмена информацией
и опытом, но и в целях расширения
возможностей молекулярно-генетического тестирования с одновременным улучшением качества проводимых тестов.
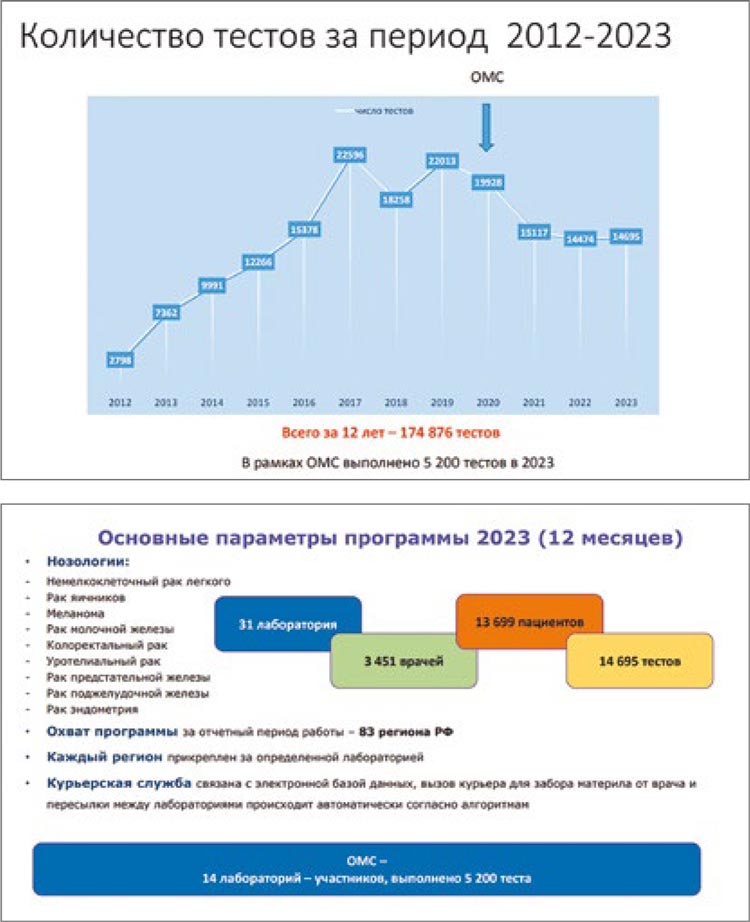
За 12 лет существования Программы
силами врачей, общества RUSSCO
и партнеров удалось объединить в
единую сеть специализированные
центры молекулярной диагностики,
в которых осуществляются высокотехнологичные диагностические процедуры, что дало толчок к развитию
молекулярно-генетической диагностики в Российской Федерации.
За эти годы мы смогли привлечь в
Программу более 3 450 онкологов,
включить в работу 83 региона России, выполнить 174 876 тестов для 9
нозологий.
Биообразцы пациентов направлялись в 31 лабораторию, включая референсные лаборатории, в рамках
ОМС. Было выполнено 174 876 тестов
для пациентов с различными злокачественными опухолями, которые
получили возможность определить
их прогноз и определиться с тактикой
лечения, что является огромным достижением
В 2023 году в рамках Программы
было продиагностировано 13 699 пациентов, выполнено 14 695 тестов, из
них 6 258 тестов было выполнено методом NGS. Осуществлена маршрутизация образцов в 14 лабораторий и
референсные центры, где проведено
5200 тестов в рамках программы Госгарантий.
Из общего числа пациентов было
протестировано 2 730 (19,9%) мужчин и 10 969 (81,1%) женщин. По
количеству пациентов традиционно
лидирует ЦФО – 3 834 человека, Сибирский ФО – 3 042, Приволжский
ФО – 2 859, Северо-Западный ФО –
1 490, Уральский ФО – 893, ДВФО –
872, ЮФО – 364, Северо-Кавказский
ФО – 345 человек.
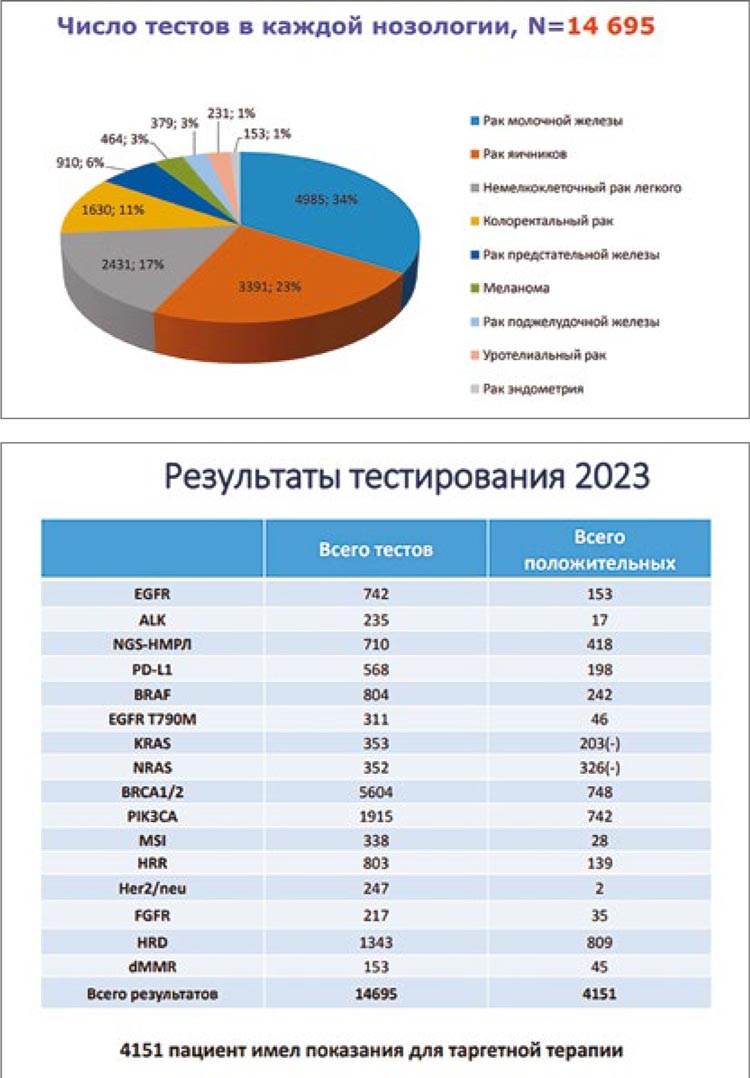
34% тестов по Программе выполнено
для нозологии рак молочной железы,
при раке яичников – 23%, при НМРЛ
– 17%, колоректальном раке – 11%,
остальные нозологии – меньше 10%,
данные отражены в диаграмме.
В рамках Программы проводились
исследования генетических нарушений генов EGFR, BRAF, PIK3CA,
FGFR, методом NGS тестировались
гены BRCA1/2 и HRD, HRR, транслокации ALK, исследование уровня
экспрессии PD-L1. На слайде представлены данные по количествам выполненных тестов и положительных
результатов.
Общее число пациентов, для которых
результаты теста оказались значимыми при выборе терапии, составило 4
151 человек.
Большую и неоценимую работу по
поддержке врачей и лабораторий
выполняет коллектив Горячей линии проекта, осуществляющий техническую поддержку врачей с 06:00
до 18:00 по московскому времени. В
2023 году 3 сотрудника Горячей линии приняли и сделали 9 604 звонка,
что в среднем составляет 39 в день,
зарегистрировали на медицинской
онлайн-платформе RUSSCO, обучили и проинформировали о проекте,
методах тестирования и алгоритме
отправок 452 новых врача. Ежедневно специалистами горячей линии обрабатывается 60-70 электронных писем и огромный массив полученной
информации.
С 2020 года RUSSCO осуществляет
контроль качества в рамках проекта
«Совершенствование молекулярногенетической диагностики в Российской Федерации с целью повышения
эффективности противоопухолевого
лечения», в котором принимают участие лаборатории и эксперты Российского общества клинической онкологии
В 2023 году был проведен один раунд контроля качества тестирования
генов BRCA методом NGS. В итоге
лаборатория ФИЦ ФТМ г. Новосибирск под руководством Субботовской Анны Игоревны успешно прошла раунд.
Также совместно с ФГБНУ МГНЦ им.
акад. Н.П. Бочкова были проведены 2
цикла повышения квалификации для
сотрудников лабораторий из регионов РФ по теме «Методы работы с
мультигенными панелями в практической онкогенетике». В этих циклах
учащиеся прошли все этапы тестирования методом NGS:
- Выделение ДНК
- Получение библиотек для NGS
- Запуск секвенирования мультигенных панелей
- Снятие результатов секвенирования мультигенных панелей
- Интерпретация полученных результатов
Цель данного проекта – улучшение
качества тестирования в лабораториях Российской Федерации.
Общество уже много лет проводит обучающие школы по ПЦРдиагностике в лабораториях РФ при
поддержке партнеров Программы: в
2023 году прошло 10 мероприятий.
Во время школ происходит обмен
опытом с ведущими специалистами
референсных лабораторий при погружении в текущую лабораторную
практику.
Выражаем огромную благодарность
нашим преподавателям школ ПЦРдиагностики за подготовку учебных
материалов, разборы протоколов EGFR, BRCA-тестирований, за интерпретацию и оценку результатов работы на местах, обсуждение особенностей методик и работы оборудования
в каждой конкретной лаборатории.
В планах Общества на 2024 год:
- продолжение тестирований в рамках Национальной Программы;
- работа с маршрутизацией образцов в рамках ОМС;
- организация 13 школ ПЦРдиагностики в регионах РФ;
- онлайн-консультации молекулярных генетиков по интерпретации заключений NGS-тестирований на сайте www.cancergenome.ru;
- проведение сессии RUSSCO по вопросам молекулярно-генетических тестирований на VI Всероссийской конференции «Опухолевые маркеры: молекулярно-генетические и клинические аспекты», г. ГорноАлтайск.
Соколова Ольга Васильевна,
заместитель медицинского директора по программе молекулярно-генетической диагностики Российского общества клинической онкологии
1 МАЯ НАЧИНАЕТСЯ ПРИЕМ ЗАЯВОК В ШКОЛУ НАУЧНЫХ ИССЛЕДОВАНИЙ ДЛЯ МОЛОДЫХ ОНКОЛОГОВ

Школа научных исследований для
молодых онкологов, партнером
которой выступает Российское
общество клинической онкологии (RUSSCO), – это уникальный синтез инструментов для
улучшения теоретической базы,
практической подготовки и реализации исследований молодыми российскими учеными на
мировом уровне. В ходе лекций
и индивидуальных консультаций
лучшие российские и международные специалисты в онкологии,
медицинской статистике и клинических исследованиях с энтузиазмом будут делиться знаниями по
организации и проведению самих исследований от дизайна и построения
гипотезы до обработки данных и публикаций результатов работы.
Очный курс стартует 4 сентября 2024
г. в Москве. В течение четырех дней
не менее 20 талантливых молодых
ученых под руководством ведущих
экспертов смогут подготовить и доработать протокол собственного исследования, на выходе получив готовый инструмент для его инициации
и проведения. Финальные протоколы будут представлены экспертному
жюри для участия в конкурсном
отборе на потенциальное финансирование, которое обеспечит
РакФонд.
Прием заявок стартует 1 мая (и
продлится до 31 июля). Принять
участие в Школе могут ученыеонкологи в возрасте до 45 лет,
ведущие и/или планирующие
научные исследования в области
онкологии. Заявить об участии
можно на сайте rakfond-shkola.ru.
Обучение бесплатное. Проект реализуется при поддержке Фонда
президентских грантов.
РЕГИОНАЛЬНОЕ ОТДЕЛЕНИЕ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ (RUSSCO) ЕВРЕЙСКОЙ АВТОНОМНОЙ ОБЛАСТИ
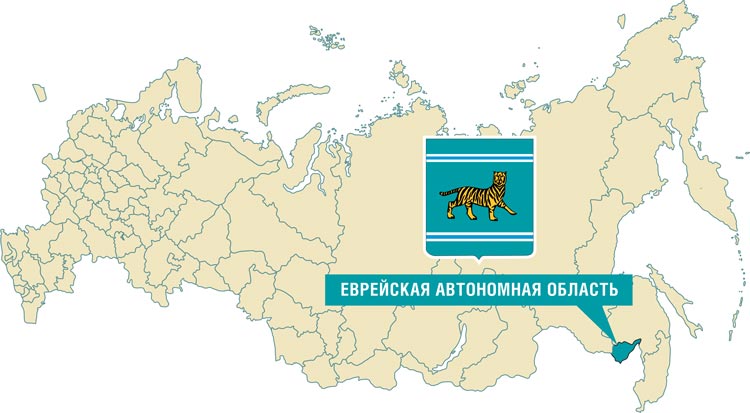
Еврейская автономная область –
субъект Российской Федерации,
входит в состав Дальневосточного
федерального округа. Административный центр – город Биробиджан.
Область была образована 7 мая 1934
года из Биробиджанского еврейского национального района Дальневосточного края. Граничит на юге
с Китаем (по реке Амур), на западе
– с Амурской областью, на востоке
– с Хабаровским краем. В 2010 году
евреи составляли приблизительно
1,5% населения области (~1700 человек). В России есть только одна
автономная область – еврейская.
Несмотря на то, что многие другие
автономные области, образованные по национальному признаку,
стали республиками, еврейская так
и осталась единственной в своем
роде автономной областью. ЕАО –
единственный субъект Российской
Федерации, имеющий статус автономной области, единственное в
мире, помимо Израиля, еврейское
административно-территориальное
образование с официальным юридическим статусом и единственный
в мире регион, где идиш наделен
статусом официального языка.
Уникальность этой области заключается в том, что своего государства или хотя бы автономии
у евреев не было с того момента,
когда римляне ликвидировали
свою провинцию Иудею в 1 веке
нашей эры. С тех пор евреи разошлись по всему миру, но больше
всего их было в Европе. В СССР
же евреев было больше, чем в любой другой стране, по некоторым
данным, около 2,5 миллионов человек.
В конце 20-х годов место для евреев все-таки нашли – на Дальнем Востоке, на границе с Китаем,
небольшая территория вокруг
города Биробиджан. В 1930 году
население Биробиджанского национального района (будущей Еврейской автономной области) составляло около 38 000 человек, 2,5
тысячи из которых были евреи.
И тем не менее, это единственное, помимо Израиля, который образовался значительно позже (в 1948 году), еврейское административно-территориальное образование с официальным юридическим статусом.
Территория Еврейской автономной области составляет 36,3 тыс. км2 (0,2% территории Российской Федерации). Расстояние от Биробиджана до Москвы – 8361 км. В области 5 муниципальных районов, 1 городской округ, 10 городских и 17 сельских поселений. Расстояние между областным центром и населенными пунктами от 10 до 250 км. Расстояние в районах от ЦРБ до ФАПов от 8 до 80 км. Плотность населения – 4,31 человека на 1 км2.
В 2023 году в целом на территории области зарегистрировано 644 случаев заболеваний онкопатологией, из них у детей от 0 до 17 лет – 5 заболеваний. Из общего числа больных с впервые в жизни выявленным злокачественным новообразованием имели первично-множественные опухоли – 63, из них 13 у пациентов с впервые в жизни установленным диагнозом.
Впервые на учет в онкологическом диспансере взято 502 пациентов. Среди детского населения в возрасте от 0 до 17 лет на диспансерный учет поставлено 5 детей.
До 1993 года онкологическая помощь населению Еврейской автономной области осуществлялась онкологическим кабинетом областной больницы.
С 1970 г. в штатном расписании областной поликлиники впервые появляется должность врача-онколога.
Кабинет онколога был организован в 1974 г., с вводом в строй нового здания поликлиники областной больницы, он располагался на I этаже, занимал 3 помещения, включавшие в себя кабинет приема, смотровую комнату, перевязочную (операционную).

Длительное время, с 1984 по 1996 гг., работа кабинета осуществлялась под руководством хирурга-онколога Каца Александра Иосифовича. Онкокабинет этого времени – это до 10,5 тыс. посещений в год.
Специализированное стационарное лечение осуществлялось в хирургическом отделении областной больницы г. Биробиджан, где было развернуто 5, а в дальнейшем 20 онкологических коек, также под руководством хирурга-онколога Каца А.И. (на данный момент действующий заведующий отделением противоопухолевой терапии). Больные из районов области проходили противоопухолевое лечение, симптоматическую терапию по месту жительства, руководствуясь рекомендациям онкологов Хабаровского онкологического диспансера и областного онколога.
В связи с выводом Еврейской автономной области из состава Хабаровского края возникла потребность в организации своей онкологической службы. И с 1 марта 1993 года на базе ОГБУЗ «Инфекционная больница» было открыто онкологической отделение на 43 койки.
С 1 марта 1994 года онкологическое отделение приобрело статус «Областной онкологический диспансер». Организована поликлиника диспансера, расположенная на первом этаже трехэтажного жилого дома на 65 посещений в смену. Руководителем диспансера стал врач-онколог Малышев А.И.
С января 2012 года стационарные отделения хирургического и противоопухолевого профиля были переведены на базу ОГБУЗ «Областная больница». Стационарное отделение расположилось на втором этаже ОГБУЗ «Областная больница». Госпитализация больных проводится автономно от приемного отделения ОГБУЗ «Областная больница».
В структуре стационара учреждения были развернуты 56 коек.
На базе ОГБУЗ «Инфекционная больница» развернут рентген-кабинет, где проводятся рентгенографические и рентгеноскопические исследования и маммография (общие кабинеты для больных поликлиники и стационара). На этой же базе с 2015 года развернута патологоанатомическая лаборатория и с 2016 года клинико-диагностическая лаборатория. Патологоанатомическая лаборатория (прижизненные патологоанатомическое исследования операционного и биопсионного материала) оснащена современным оборудованием. В поликлинике ОГБУЗ «Онкологический диспансер» функционируют кабинеты онкологов с операционной, кабинеты для приема маммологических, гинекологических, урологических больных, кабинет онколога-химиотерапевта, кабинет доврачебной медицинской помощи и терапевта, кабинет функциональной диагностики, кабинет диспансерного наблюдения, кабинет ультразвуковой диагностики, процедурный кабинет и палата дневного стационара на 3 койки, где проводятся все виды инфузий и амбулаторная химиотерапия.
С ноября 2017 года в здании Областного государственного бюджетного учреждения «Многофункциональный центр предоставления государственных и муниципальных услуг в Еврейской автономной области» открыто диагностическое отделение, где оборудован кабинет магнитнорезонансного (МРТ) и спирального компьютерного томографа (СКТ).
В отделении имеются эндоскопические кабинеты, кабинеты ультразвуковой диагностики. В эти кабинеты направляются больные, подлежащие ультразвуковым, эндоскопическим и другим исследованиям, не только из онкологического стационара и поликлиники, но и больные всех лечебных учреждений города на договорной основе.
С 10 декабря 2018 года в поликлинике онкологического диспансера открыт кабинет паллиативной помощи онкологическим больным.
В районах Еврейской автономной области развернуты смотровые кабинеты. На территории ЕАО действует государственная программа Еврейской автономной области «Борьба с онкологическими заболеваниями» на период с 2019 по 2024 г. от 25 июня 2019 года № 218-рп. Согласно этим программам правительство ЕАО проводит работу по закупке и переоснащению новым медицинским оборудованием для онкологического диспансера.
На данный момент в нашем диспансере работают 24 врача различных специальностей, в том числе и главный врач. Около 50% врачей являются молодыми специалистами, не достигшими 40 лет. Высшую категорию имеют 10 специалистов, первую категорию – 1 специалист, вторую категорию – 3 специалиста. В онкодиспансере работают 5 отличников здравоохранения, доктора, имеющие награды «За заслуги перед отечественным здравоохранением». Первый руководитель диспансера врач-онколог Малышев А.И. был заслуженным врачом РФ и имел научную степень.
Региональное отделение Российского общества клинической онкологии (RUSSCO) ЕАО является молодым, в связи с чем всего насчитывает 5 членов, среди которых онкологи, химиотерапевты, хирурги, врачи первичного приема (21%). Основано региональное отделение 17 октября 2023 г. Председателем регионального отделения является Мурзина Юлия Ивановна, врач высшей категории отделения противоопухолевой терапии ОГБУЗ «Онкологический диспансер», г. Биробиджан. Но несмотря на большую отдаленность от столицы, небольшой размер центра, наши доктора активно участвуют в межрегиональных конференциях, вебинарах в качестве слушателей, также с докладами клинических случаев, участвуют в клинических исследованиях, ежегодно посещают Российский онкологический конгресс, прослушивают онлайн-вебинары, организованные RUSSCO.
Все врачи неоднократно стажировались в клиниках Москвы, Санкт-Петербурга, Киева, Владивостока, Казани, Томска, поэтому их профессиональный уровень соответствует сегодняшнему уровню диагностики и лечения.
Опыт работы врачей обобщен в научных статьях, представленных на научно-практических конференциях.
В 2012 г. зав. хирургическим отделением, врач высшей категории А.В. Ерофеев стал лауреатом премии «Лучший хирург года» на региональном уровне, а также в 2022 г. участвовал в интенсиве «Академия рака желудка», организованным НМИЦ онкологии им. Н.Н. Блохина.

12 сентября 2023 г. по итогам премии А.И. Савицкого в номинации «Химиотерапевт года» лауреатом стала врач-онколог Юлия Мурзина (проект – «Работа врача-химиотерапевта в условиях небольшого учреждения»), также 16-17 марта 2024 г. она стала участником онлайн-интенсива на тему «Рак молочной железы», организованного Российским обществом клинической онкологии и онлайн-проектом «Школа химиотерапевтов».

Онкологический диспансер активно проводит просветительную работу среди населения, со специалистами первичного звена, осуществляет выезды в отдаленные населенные пункты, активно участвует в выявлении онкозаболеваний, формировании маршрутизации, сокращая сроки до постановки диагноза и до начала лечения.
В диагностике и лечении руководствуемся клиническими, практическими рекомендациями, при разборе сложных случаев активно используем опцию ТМК.
Использование новых современных технологий позволяет не
останавливаться на достигнутом.
25 мая 2024 года на базе ГАУЗ НО НИИКО Нижегородского областного клинического онкологического диспансера состоится совместная конференция RUSSCO, Онкологического центра №1 ГКБ им. С.С.Юдина и ОКОД г.Нижний Новгород. Мы приглашаем потенциальных участников посетить мероприятие очно или подключиться онлайн после регистрации на сайте. Сегодня мы публикуем тезисы, присланные членами Комитета молодых онкологов RUSSCO в соавторстве с коллегами.

1. Результаты лучевой терапии
в режиме гипофракционирования
у пациентов со злокачественными
новообразованиями головы
и шеи.
Автор: Ложков А.А.,Мозерова Е.Я.,
Сарычева М.М., Сабельникова Ж.Е.,
Печерица А.Ю., Тимохина Д.М,,
Рогачева Д.А.
Место работы:
ГАУЗ ЧОКЦОиЯМ
Эл.почта: al615@mai.ru
Цель
Оценить результаты лучевой
терапии в режиме гипофракционирования у пациентов, получивших лечение по поводу злокачественных новообразований
головы и шеи.
Материалы и методы
В исследование включен 31 пациент со злокачественными новообразованиями головы и шеи, все
они получили лучевую терапию
в ЧОКЦОиЯМ в режиме гипофракционирования, РОД=2,75 Гр
до СОД=55 Гр за 20 фракций в период с 2020 по 2022 год. Средний
возраст пациентов составил 66,2
года, мужчин было 24 человека, женщин-7. Распределение по
локализациям: полость рта – 16
больных, ротоглотка - 6, гортань
– 7. Распределение по стадиям: I
стадия – 1 пациент, II - 4, III - 12,
IV – 14 больных. У 18 пациентов
лучевая терапия проводилась
адъювантно после хирургического лечения, у 13 - в качестве
самостоятельного лечения. Лекарственная радиомодификация
не проводилась у 18 пациентов
из-за наличия противопоказаний, связанных с общим статусом
и сопутствующей патологией, у 13
больных не было показаний для
проведения химиотерапии.
Результаты
Двухлетняя общая выживаемость составила 35,3%. При проведении лучевой терапии в качестве адъювантного лечения
после оперативного вмешательства 1-летняя выживаемость составила 91,7%; 2-летняя - 83,3%;
в самостоятельном варианте
1-летняя выживаемость составила 24,2%; 2-летняя - 0%. Различия
в выживаемости были статистически достоверными. Неизлеченность имела место у 100 %
пациентов, получивших лучевую
терапию в самостоятельном варианте. У послеоперационных
пациентов после лечения в двух
случаях имело место рубцовое
сужение пищевода, требующее
наложение гастростомы, в одном
случае - остеомиелит нижней челюсти.
Заключение
Применение лучевой терапии в режиме гипофракционирования после хирургического лечения позволяет достигать приемлемых онкологических результатов при сокращении времени лечения. В качестве единственного метода может рассматриваться как вариант паллиативного воздействия.
Дата: 02.03.2024
2. Предоперационные предикторы малигнизации синоназальной инвертированной папилломы
Автор: Морозова Н.А., Колядич Ж.В.
Место работы:
Республиканский научно-практический центр онкологии и
медицинской радиологии им. Н.Н. Александрова
Эл.почта: natalim-22@yandex.ru
Цель
Определить факторы риска малигнизации синоназальной инвертированной папилломы на
предоперационном этапе.
Материалы и методы
Материалом исследования послужили данные 108 пациентов с
синоназальной инвертированной
папилломой с/без малигнизации,
наблюдавшихся в РНПЦ ОМР им.
Н.Н. Александрова, за период с 2010
по 2023 годы. Малигнизация СИП в
плоскоклеточный рак (ПКР) выявлена у 36 (33,3%) пациентов. Анализ
факторов риска малигнизации СИП
проводился по следующим показателям: возраст, табакокурение, употребление алкоголя, место жительства, образование, онкоанамнез,
количество сопутствующих заболеваний, длительность затрудненного
носового дыхания, выделения из полости носа, носовое кровотечение,
гипо-/аносмия, полипозный риносинусит (ПРС), количество предшествующих хирургических вмешательств по поводу ПРС, вовлечение
анатомических областей полости
носа в опухолевый процесс.
Результаты
В мультивариантный анализ включены 5 показателей: возраст, табакокурение, носовое кровотечение, ПРС,
негативное расположение опухоли
(орбита, или основание черепа, или
клиновидная пазуха). Для удобства
практического использования модели выделены 2 класса – низкого и
высокого риска малигнизации СИП.
Для определения принадлежности
к классу необходимо рассчитать общий балл, суммируя баллы по каждому из 5-и показателей: возраст – годы
умножить на 0,4, табакокурение – 11
баллов, носовое кровотечение – 14
баллов, ПРС – 10 баллов, негативное
расположение опухоли – 20 баллов.
К классу высокого риска относят пациентов с количеством баллов более
46. В класс высокого риска вошли 43
(39,8%) пациента, и риск малигнизации СИП для них составил 62,8%
(95% ДИ 46,7-77,0%). В класс низкого
риска вошли 65 (60,2%) пациентов,
риск для них составил 13,8% (ДИ 6,5-
24,7%). Чувствительность метода составила 75,0%, специфичность 77,8%.
Пациентам группы высокого риска
рекомендована повторная биопсия
опухоли под наркозом.
Заключение
Разработана прогностическая классификация, позволяющая отнести пациентов, страдающих синоназальной инвертированной папилломой, к классу низкого и высокого рисков малигнизации на основе комплекса дооперационных параметров.
Дата: 27.03.2024
3. Роль иммунотерапии в лечении плоскоклеточного рака головы и шеи после прогрессирования на платиносодержащей химиотерапии в реальной клинической практике
Автор: Стативко О.А., Носова М.В., Царева Е.В.,
Шангина И.А., Ибрагимова М.Р., Зуева Е.В.,
Латкин В.Г., Соболев М.М., Кучевская О.А.,
Арапова О.И., Сабитов Э.Р., Антонова Т.Г.,
Кравцов С.А., Покатаев И.А., Галкин В.Н.
Место работы:
Онкологический центр №1 ГКБ имени С.С. Юдина
Эл.почта: olesya_stativko@mail.ru
Цель
Иммунотерапия (ИТ) является
стандартом второй и последующих
линий терапии плоскоклеточного
рака головы и шеи, прогрессирующего после платиносодержащей
химиотерапии (ХТ). Для определения эффективности ИТ в реальной
практике в российской популяции
было проведено ретроспективное
исследование.
Материалы и методы
Включались пациенты с прогрессированием заболевания на фоне
химиолучевой терапии с цисплатином или карбоплатином в качестве
радиомодификатора и пациенты,
получавшие препараты платины по
поводу рецидивирующего или метастатического процесса. Первичными конечными точками были выживаемость без прогрессирования
(ВБП) и общая выживаемость (ОВ).
Результаты
Идентифицировано 137 пациентов, получавших ИТ ниволумабом
с 2020 по 2023 г., из них 26 женщин
(19%), 111 мужчин (81%). Медиана
возраста составила 61 год (36-83).
По локализации первичной опухоли распределение было следующим:
ротоглотка – 49 (36%) пациентов,
полость рта – 32 (23%), гортань –
25 (18%), гортаноглотка – 24 (18%),
верхнечелюстная пазуха – 4 (3%),
носоглотка – 3 (2%). Статус PD-L1
был определен у 45 (33%) пациентов:
CPS ≥20 был у 11 (24%) пациентов,
CPS ≥1-19 у 16 (36%) и CPS=0 – у 18
(40%) пациентов. 52 (38%) пациента
на момент назначения ИТ имели отдаленные метастазы. Большинство
(106, или 77%) пациентов получали
ниволумаб по поводу платинорефрактерного процесса, определяемого как прогрессирование на фоне
или в течение <6 месяцев после введения препарата платины, однако 31
пациенту (23%) ИТ была назначена
при прогрессировании в срок >6 месяцев. При медиане наблюдения 26
месяцев медиана ВБП во всей популяции составила 3,0 месяца (95% ДИ
2,18 – 3,82), медиана ОВ – 8,0 месяцев
(95% ДИ – 5,11-10,89). У пациентов с
отдаленными метастазами мОВ составляла всего 6,0 месяцев (95% ДИ
4,16 – 7,84), тогда как при лечении
рецидивирующего местнораспространенного процесса – 11,0 месяцев (95% ДИ 7,79 – 14,21, p=0,237).
Медиана ОВ у пациентов с CPS>1
составила 11 месяцев (95% ДИ 5,60
– 16,41), а при PDL-негативном статусе – 7 месяцев (95% ДИ 2,19-11,81).
Заключение
Полученные результаты коррелируют с данными регистрационного исследования. Больший выигрыш от назначения иммунотерапии имели пациенты с PDLпозитивным статусом.
Дата: 15.04.2024
РАЗМЫШЛЕНИЯ В ОТРЫВЕ ОТ РУТИНЫ / ЯБЛОЧКИ ОТ ТЕТИ SONIA… ЧТО НАМ ДЕЛАТЬ С РЕЗУЛЬТАТАМИ ИССЛЕДОВАНИЙ С ПОЛНЫМ ИЛИ ПОЧТИ ПОЛНЫМ ПЕРЕКРЕСТОМ?
Автор: Жуков Николай Владимирович
ФГБУ «НМИЦ Детской гематологии, онкологии и иммунологии им. Д. Рогачева»,
доктор медицинских наук, профессор, Москва
Не успели отшуметь дебаты, связанные с исследованием SONIA
[1], воспринятым многими коллегами как однозначное доказательство возможности «безболезненно» переместить CDK4/6
ингибиторы во 2 линию терапии
распространенного люминального HER2-негативного РМЖ
(мРМЖ), как вдруг… «беда» (или
радость, кому как…) пришла откуда не ждали – от опухоли, которая, в отличие от люминального
мРМЖ, вряд ли воспринимается
как способная простить неоптимальный выбор первой линии лечения – НМРЛ. Но факт остается
фактом – если идти «в фарватере»
тех, кто воспринял исследование
SONIA как руководство к действию, то исследование APPLE
(яблоко) ставит под сомнение целесообразность использования
осимертиниба в качестве первой
линии лечения НМРЛ с активирующими мутациями в гене
EGFR. И так как речь идет не о
конкретном исследовании (паре
исследований), а, как нам кажется, о нарождающейся тенденции,
напомним предысторию вопроса…
Итак, про SONIA. После публикации результатов исследований
MONALESSA-2, 3 и 7, показавших
увеличение общей выживаемости при использовании рибоциклиба в качестве первой линии
терапии люминального мРМЖ,
алгоритм использования CDK4/6
ингибиторов казался абсолютно
понятным. Ведь мы привыкли,
что любой вариант терапии, доказанно продлевающий жизнь
больных, необходимо помещать
в первую линию лечения, даже
если эти препараты хорошо работают и в последующих линиях.
А значит, рибоциклиб (для тех,
кто считает, что класс-эффекта
у CDK4/6 ингибиторов нет) или
любой из CDK4/6 (для тех, кто так
не считает) – оптимальное лечение первой линии. Это наша рутинная практика, то есть такое же
решение мы принимаем для всех
препаратов, показавших увеличение ОВ при их использовании
в первой линии. И до недавнего
времени вряд ли кому-то пришло
бы в голову переместить трастузумаб при HER2+ РМЖ или алектиниб при ALK+ НМРЛ во вторую
линию, несмотря на то, что и там
они тоже показали свою эффективность.
Но тут «пришла» SONIA. Исследование, организованное с целью
ответить на вопрос, что произойдет, если все пациенты контрольной группы (т.е. начавшие лечение с монотерапии ингибиторами
ароматазы) получат CDK4/6 ингибиторы после прогрессирования.
Это было основным отличием
SONIA от «регистрационных»
исследований CDK4/6 в качестве
первой линии терапии (и вообще
от большинства регистрационных исследований в онкологии). В
регистрационных исследованиях
пациентки из контрольной группы МОГЛИ получить CDK4/6
после прогрессии, но многие так
и не получили их во 2 и даже последующих линиях лечения, в
SONIA же был 100% «перекрест»
– все пациенты из контрольной
группы, начавшие лечение только
ингибиторами ароматазы, после
прогрессии получали терапию
одним из CDK4/6 ингибиторов по
выбору врача.
Результат исследования оказался
обескураживающим. Да, выживаемость без прогрессирования
на первой линии лечения у больных, получавших CDK4/6 ингибиторы, была ожидаемо выше,
чем в контрольной группе, получавшей только ингибиторы ароматазы. Но вот выживаемость
без прогрессирования 2 (ВБП-2,
суммарное время от начала первой линии до прогрессирования
на второй линии) оказалась абсолютно идентична в обеих группах. Но наиболее практически
значимым явилось то, что и в отношении общей выживаемости
не было обнаружено различий
между группами, получившими
комбинации с CDK4/6 ингибиторами в качестве первой или
второй линии лечения. При этом
длительность использования CDK4/6 ингибиторов в контрольной группе была значимо меньше
(как и почти всегда во второй линии), как и абсолютное число нежелательных явлений >3 степени.
Из этого был сделан вывод: если
при «переносе» CDK4/6 ингибиторов во вторую линию ВБП-2 и
ОВ одинаковы, а время использования, а значит и цена терапии, и
токсичность, меньше, то там этим
препаратам и место. Этот вывод
был активно поддержан многими коллегами, особенно занимающимися не только лечением
РМЖ, так как выглядел как возможность высвободить ресурсы
на что-то более полезное (например, на тот же НМРЛ, где уж точно адекватная терапия 1 линии
является жизнеспасающей). Увы,
даже приведенные аргументы
о некоторых «проблемах» с дизайном SONIA не имели особого
успеха. Но, как оказалось, SONIA
открыла дорогу другим подобным исследованиям. И раз уж мы
сказали А, то нужно думать, что
говорить дальше.
Итак, исследование APPLE. Сразу
оговоримся, оно гораздо меньше
по объему, чем SONIA, а также
оно не ставило своей основной
целью сравнивать два разных
варианта лечения. Его первичной задачей было выявить целесообразность мониторинга
развития мутации Т790М, обуславливающей резистентность к
ингибиторам EGFR I поколения
(гефитиниб), при помощи анализа циркулирующей опухолевой
ДНК (цоДНК). В исследовании
было 3 группы пациентов, которые согласно рандомизации 1:1:1
получали терапию 1 линии осимертинибом (группа А), гефитинибом с переходом на осимертиниб по факту выявления мутации
Т790М в цоДНК или радиологической прогрессии по RECIST – в
зависимости, что наступит раньше (группа В), и инициальную терапию гефетинибом с переходом
на осимертиниб по факту радиологической прогрессии (группа
С). Исследование достигло своей
первичной цели, показав, что при
использовании анализа цоДНК
удается раньше перейти на терапию 2 линии осимертинибом и
больше пациентов удерживают
эффект к 18 месяцам терапии [2].
Однако, как легко заметить, в исследовании было два варианта
лечения, сильно напоминающие
исследование SONIA, – «основная» группа, исходно получавшая
осимертиниб с переходом на альтернативную терапию на усмотрение врача после прогрессии
(группа А, n=53), и группы B и C
(n=103), в которых лечение начиналось с гефитиниба, а после прогрессии происходил «перекрест»
– больным в плановом порядке
назначался осимертиниб. Несмотря на то, что в рамках исследования APPLE лишь 80% больных
получили осимертиниб в качестве последующей терапии, это
было значимо больше, чем 47%
больных контрольной группы,
получивших осимертиниб после
прогрессии на гефитинибе в регистрационном исследовании [3].
Но, увы (или УРА), как и в исследовании SONIA, этого хватило
для того, чтобы между группами
не было выявлено статистически
(и клинически) значимых различий в общей выживаемости.
Рисунок 1.
Показатели ОВ по данным
исследования APPLE
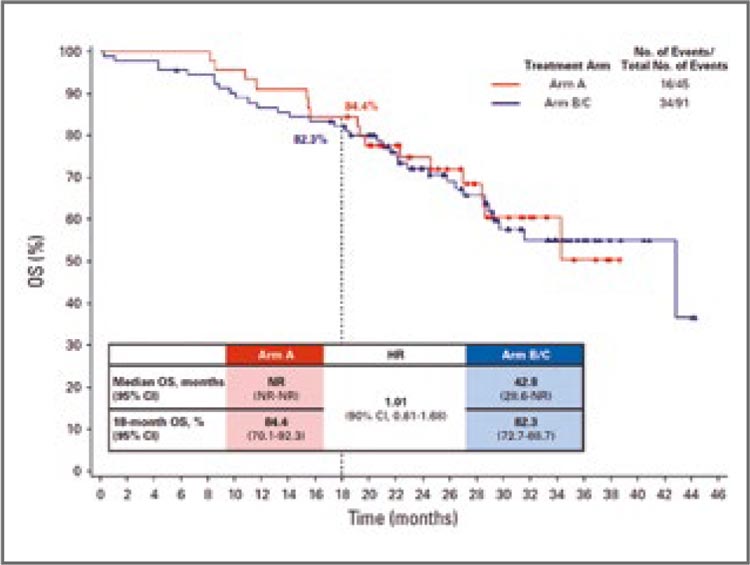
Да, данное исследование нельзя
назвать точной копией исследования SONIA по многим причинам.
Вопрос последовательности терапии не был первичной конечной
точкой исследования APPLE, оно
было значимо меньше по числу
включенных больных, чем SONIA,
не все больные контрольной группы получили осимертиниб после
прогрессирования. Были и различия в «медицинской» составляющей результатов. Так, несмотря
на равенство в общей выживаемости, за период наблюдения в
рамках исследования пациенты
из групп В/С, начавших терапию
с гефитиниба, статистически значимо чаще сталкивались с развитием ЦНС прогрессирования,
чем больные из группы А, получившие осимертиниб инициально. Однако, что интересно, в отличие от SONIA, где применение
CDK4/6 в качестве второй линии
лечения было значимо короче,
чем инициальная терапия этими
же препаратами, в APPLE выживаемость без прогрессирования
на осимертинибе была как минимум одинакова вне зависимости
от того, применялся ли он в 1 или
2 линии лечения, хотя в числовом
выражении ВБП во второй линии
была даже больше (рис.2). Таким
образом получается, что начало
терапии с гефитиниба позволяло
пациентам дольше оставаться на
таргетной терапии без перехода
на химиотерапевтическое лечение, хоть и ценой большего шанса
на прогрессирование в ЦНС.
Рисунок 2.
Выживаемость без
прогрессирования на терапии осимертинибом.
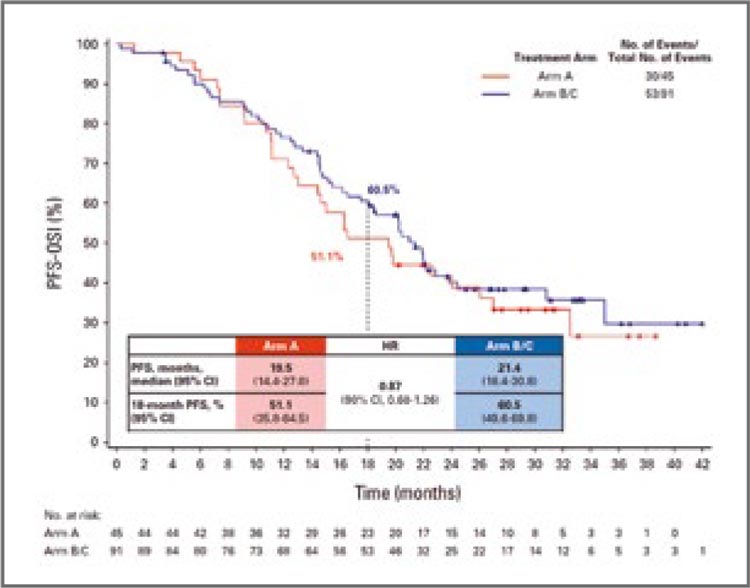
Однако, повторимся, смысл этой
заметки, как нам кажется, не в
том, чтобы поставить под сомнение необходимость использования осимертиниба в качестве
первой линии лечения (хотя, возможно, об этом и имеет смысл
задуматься). Как нам кажется,
исследования подобного рода
открывают к дискуссии вопрос
о том, что произойдет, если в регистрационных исследованиях
будет полный перекрест. И что же
нам делать с ранее проведенными
исследования инновационных
препаратов? Готовы ли мы проверить этот подход на трастузумабе,
пертузумабе, T-DM1, алектинибе,
ингибиторах контрольных точек
и PARP-ингибиторах? Что будет,
если 100% больных смогут получить их после прогрессирования
на менее «инновационной» терапии первой линии?
Источники:
- Sonke GS, et al. Primary outcome analysis of the phase 3 SONIA trial (BOOG-2017-03) on selecting the optimal position of cyclin-dependent kinases 4 and 6 (CDK4/6) inhibitors in patients with hormone receptor positive, HER2-negative advanced breast cancer. 2023 ASCO Annual Meeting. Abstract LBA1000.
- Remon J, Besse B, Aix SP, Callejo A, Al-Rabi K, Bernabe R, Greillier L, Majem M, Reguart N, Monnet I, Cousin S, Garrido P, Robinet G, Garcia Campelo R, Madroszyk A, Mazières J, Curcio H, Wasąg B, Pretzenbacher Y, Fournier B, Dingemans AC, Dziadziuszko R. Osimertinib treatment based on plasma T790M monitoring in patients with EGFR-mutant non-small-cell lung cancer (NSCLC): EORTC Lung Cancer Group 1613 APPLE phase II randomized clinical trial. Ann Oncol. 2023 May; 34(5): 468-476. doi: 10.1016/j.annonc.2023.02.012. Epub 2023 Feb 28. PMID: 36863484.
- Ramalingam SS, Vansteenkiste J, Planchard D, Cho BC, Gray JE, Ohe Y, Zhou C, Reungwetwattana T, Cheng Y, Chewaskulyong B, Shah R, Cobo M, Lee KH, Cheema P, Tiseo M, John T, Lin MC, Imamura F, Kurata T, Todd A, Hodge R, Saggese M, Rukazenkov Y, Soria JC; FLAURA Investigators. Overall Survival with Osimertinib in Untreated, EGFRMutated Advanced NSCLC. N Engl J Med. 2020 Jan 2; 382(1): 41-50. doi: 10.1056/NEJMoa1913662. Epub 2019 Nov 21. PMID: 31751012.
ДИКЛОФЕНАК ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ЛАДОННО-ПОДОШВЕННОГО СИНДРОМА КАПЕЦИТАБИНА
Автор: Тюляндин Сергей Алексеевич
Заслуженный деятель науки РФ, главный научный сотрудник отделения противоопухолевой
лекарственной терапии №2 ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России,
член правления RUSSCO, профессор,доктор медицинских наук, Москва
Одним из частых и ухудшающих
качество жизни наших пациентов осложнений на фоне лечения
капецитабином является ладонно-подошвенный синдром (ЛПС),
выражающийся в покраснении,
отеке и появления трещин на коже
с выраженным болевым синдромом при механическом воздействии на воспаленные участки.
Хотя патогенез ЛПС до конца не
изучен, он может быть обусловлен
повреждением глубоких капилляров на подошвах стоп и ладонях рук, что приводит к реакции
воспалительного типа, связанной
с повышенной активностью ферментов циклооксигеназы-2 (ЦОК2). Вероятно, возникновение ЛПС
может быть связано с нарушением нормального метаболизма
капецитабина ферментами тимидинфосфорилаза и дигидропиримидиндегидрогеназа в тканях
и печени. Попытки использовать
локальное применение кремов
с витамином А или мочевиной
оказывали лишь слабый симптоматический эффект, но не предотвращали развитие самого осложнения. С учетом вовлеченности в
развитие ЛПС ЦОК-2 представлялось перспективным использование ингибиторов этого фермента
для профилактики и лечения этого осложнения. В рандомизированном исследовании при лечении 139 больных капецитабином
пероральный прием ингибитора
ЦОК-2 целекоксиба достоверно
снижал частоту ЛПС 2-3 степени
с 29,6% в контрольной группе до
14,7% [1]. Однако целекоксиб не
рекомендован к широкому применению в связи с проблемами
безопасности приема препарата
вследствие возможного развития
сердечно-сосудистых (инфаркт
миокарда, инсульты) и желудочно-кишечных (мукозиты, острые
язвы с возможным желудочным
или кишечным кровотечением)
осложнений. Поэтому перспективным представлялось изучить
влияние локального применения
другого ингибитора ЦОК-2 – диклофенака, широко используемого для лечения различных воспалительных процессов суставов и
мягких тканей.
В исследование предполагалось заслепленно рандомизировать больных, получавших капецитабин,
в группу локального назначения
диклофенака или плацебо [2]. Гель
диклофенака в концентрации 1%
наносился 2 раза в день в дозе 1 г
(примерно размер дистальной фаланги мизинца) на чистую сухую
кожу обеих рук как на ладонной,
так и на тыльной поверхностях, не
имеющую порезов, открытых ран,
инфекций и сыпи. Лечение диклофенаком начинали одновременно
с приемом капецитабина и продолжали в течение 12 недель. Оценивалась частота и выраженность
ладонного синдрома 2-3 степени.
В качестве плацебо использовался
питательный крем.
В исследование было включено
319 больных, из которых большинство участников составляли
женщины (71,1%), а наиболее частым диагнозом был рак молочной
железы (56,3%). Среди пациентов
с раком ЖКТ наиболее частым
первичным был колоректальный
рак (55,6%). В целом 58,9% получали комбинированную химиотерапию, а остальные получали капецитабин в качестве монотерапии.
В подгруппе комбинированной
химиотерапии оксалиплатин был
наиболее частым химиотерапевтическим препаратом, используемым с капецитабином.
По истечении 12 недель у 25 пациентов (9,5%) развился ладонный
синдром 2-3 степени, из которых
5 (3,8%) были в группе диклофенака и 20 (15,0%) в группе плацебо
(P=0,003). В группе диклофенака
ладонный синдром 2 и 3 степени
наблюдался у 2 (1,5%) и 3 (2,3%)
пациентов соответственно, тогда
как в группе плацебо распределение составило 13 (9,8%) и 7 (5,3%)
пациентов. Ладонный синдром 1-3
степени наблюдался у 8 (6,1%) пациентов в группе диклофенака и
у 24 (18,1%) пациентов в группе
плацебо. Снижение дозы капецитабина из-за ладонного синдрома
наблюдалось реже в группе диклофенака, чем в группе плацебо
(3,8% против 13,5%). Не было выявлено влияния пола пациентов,
типа химиотерапии, локализации
опухоли на эффект диклофенака
в предотвращении ладонного синдрома.
Данное исследование обладает рядом недостатков. Оценка влияния
диклофенака произведена в течение первых 12 недель лечения, и
неизвестно, что случилось с пациентами после этого срока. Кроме
того, несмотря на название исследования, применение диклофенака и оценка ЛПС ограничились
только руками. Это объясняется
авторами более высокой частотой
ладонного синдрома на фоне капецитабина, обусловленной высокой
концентрации тимидинфосфорилазы в ладонях, фермента, ответственного за превращение капецитабина в его активную форму
– фторурацил.
Все это не должно ограничивать
возможность назначения диклофенака в виде геля для профилактики и лечения ЛПС на фоне
отсутствия эффективных препаратов. На рынке доступны несколько препаратов диклофенака
в виде геля с концентрацией 1%
(Вольтарен, Диклофенак-Тева,
Диклофарм), которые могут быть
использованы для совместного
применения с капецитабином и
накопления своего собственного
опыта.
Литература:
- Zhang RX, Wu XJ, Wan DS, et al. Celecoxib can prevent capecitabinerelated hand-foot syndrome in stage II and III colorectal cancer patients: Result of a single-center, prospective randomized phase III trial. Ann Oncol. 2012, 23: 1348-1353.
- Santhosh A, Sharma A, Bakhshee S, et al. Topical diclofenac for prevention of capecitabine-associated hand-foot syndrome: a double-blind randomized controlled trial. JCO. 2024. Published online: February 27, 2024.
SABR В ПЕРВИЧНОМ ЛЕЧЕНИИ НЕОПЕРАБЕЛЬНОГО РАКА ПОЧКИ: ВОЗРАСТАЮЩИЙ ИНТЕРЕС
Отношение к лучевой терапии первичного рака почки на протяжении
десятилетий имело полярный характер: от широкого применения пролонгированных курсов адъювантного облучения ложа удаленной почки
до практически полного отказа от
них по причине неэффективности,
как было продемонстрировано несколькими анализами. Почечноклеточная карцинома являет собой
пример классической радиорезистентности при облучении малыми
дозами, однако при этом нам известно множество примеров великолепного эффекта высокодозного
облучения метастазов рака почки,
в частности, в головном мозге, ведь
именно с этого когда-то и начиналась
радиохирургия. Лучевой терапии
первичных опухолей почки отводилась более чем скромная роль сугубо паллиативного метода: только
в случае нерезектабельного рака
при наличии болей или макрогематурии. Однако попытки высокодозного облучения, причем не только
фотонного, но и протонного, а также
нейтронами, предпринимались исследователями во всем мире, и хоть
общее число пациентов в этих ретроспективных работах было невелико,
результаты порой удивляли.
В январе 2024 года был опубликован
систематический обзор Siva et al. [1]
по результатам высокодозного облучения методом SBRT/SABR 822
неоперабельных больных почечноклеточным раком из 36 исследований. Медиана частоты локального
контроля составила 94,1% (диапазон
70,0-100), 5-летняя выживаемость
без прогрессирования – 80,5% (95%
ДИ 72-92), а 5-летняя общая выживаемость – 77,2%. (95% ДИ 65-89).
Авторы обзора обращают внимание
на четыре ключевых клинических
вопроса. Во-первых, оптимальное
фракционирование дозы составляло
25-26 Гр за одну фракцию или 42-48
Гр за три фракции для более крупных опухолей. Во-вторых, рутинная
биопсия после лечения не рекомендуется, поскольку она не позволяет предсказать исход заболевания.
В-третьих, SBRT при первичном почечноклеточном раке единственной
почки безопасна и эффективна. Наконец, были описаны рекомендации
по наблюдению после лечения, которые включают поперечно-осевую
визуализацию брюшной полости,
включая почки и надпочечники, и
обследование грудной клетки каждые 6 месяцев. Этот систематический
обзор и практическое руководство
поддерживают практику SBRT при
первичном почечноклеточном раке
как безопасного и эффективного
стандартного варианта лечения. Но
для дальнейшего продвижения данного опыта и внесения метода в рекомендации, несомненно, необходимы
рандомизированные сравнительные
исследования с хирургическим вмешательством и инвазивными абляционными методами лечения.
В мартовском номере того же журнала (Lancet Oncology) были опубликованы данные уже проспективного
исследования 2 фазы TROG 15.03
FASTRACK II [2], оценившего результаты SABR у первичных больных
с верифицированным почечноклеточным раком. Это международное
нерандомизированное исследование
второй фазы проводилось в семи
центрах Австралии и одном центре
Нидерландов. Пациенты, имеющие солитарный очаг в почке, были
расценены как неоперабельные по
медицинским показаниям, имели
высокий риск осложнений после
операции или отказались от хирургического вмешательства; мультидисциплинарное решение о необходимости активного лечения было
обязательным.
Ключевыми критериями исключения были: скорость клубочковой
фильтрации менее 30 мл/мин. на 1,73
м2, предыдущая системная терапия
почечноклеточного рака, предыдущая высокодозная лучевая терапия
в непосредственной близости от очага, опухоли размером более 10 см и
прямое контактирование опухоли
с кишечником. Пациенты получали либо одну фракцию SABR в дозе
26 Гр для опухолей с максимальным
диаметром 4 см и менее, либо 42 Гр
за три фракции для опухолей с максимальным диаметром от 4 до 10 см.
Первичной конечной точкой был
локальный контроль, определяемый
как отсутствие прогрессирования
первичного почечноклеточного рака.
При условии, что локальный контроль в течение 1 года составит 90%,
нулевая гипотеза 80% или менее считалась нецелесообразной для перехода к будущему рандомизированному
контролируемому исследованию.
В период с 28 июля 2016 г. по 27 февраля 2020 г. было включено 70 пациентов. Средний возраст составил 77
лет (IQR 70-82), 49 (70%) мужчин и
21 (30%) женщина. Средний размер
опухоли составил 4,6 см (IQR 3,7-
5,5). Все пациенты имели опухоли
T1-T2a и N0-N1. Из общего числа 23
пациента получили 1 фракцию SABR
в дозе 26 Гр и 47 больных – 42 Гр за
три фракции. Медиана периода наблюдения составила 43 месяца (IQR
38-60). Локальный контроль через 12
месяцев от начала лечения составил
100% (р<0,0001), таковым он сохранялся и на протяжении последующего периода наблюдения. Общая
выживаемость за 5 лет составила
100% (см. рисунок). У семи (10%)
пациентов наблюдались нежелательные явления, связанные с лечением,
3-й степени, наиболее часто – тошнота и рвота (3 [4%] пациента), боль в
животе, боку или в области опухоли
(4 [6%] больных), толстокишечная
непроходимость (2 [3%] больных) и
диарея (один пациент, 3%). При этом
НЯ 4-й степени не наблюдалось, и
смертей, связанных с лечением или
опухолевым процессом, также не зарегистрировано.
Рисунок 1.
Общая выживаемость в группах
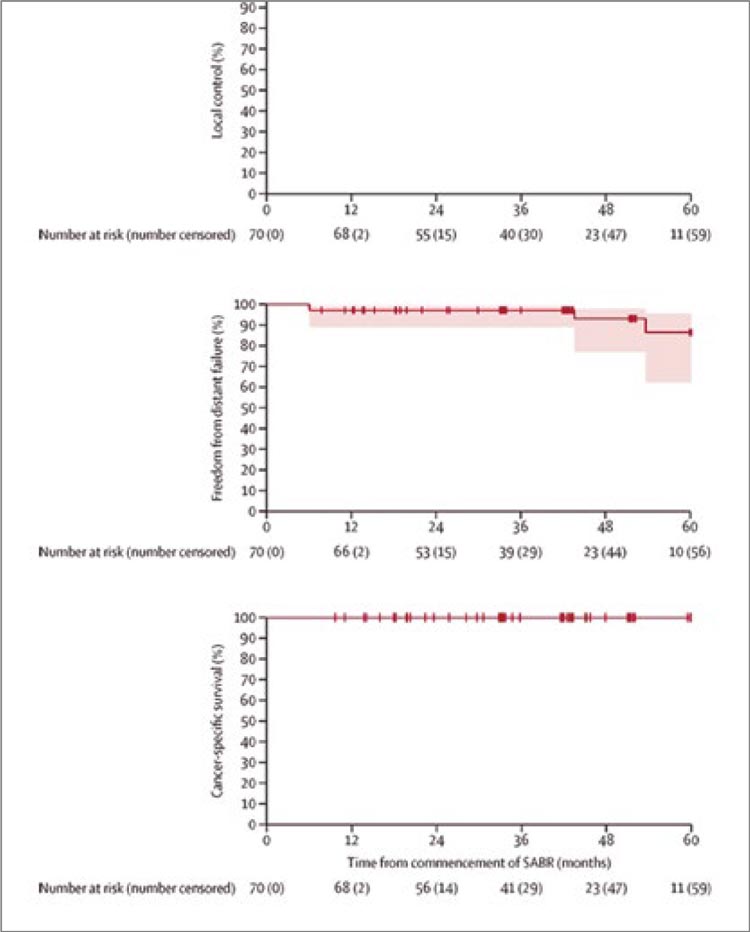
Насколько нам известно, это первое
многоцентровое проспективное
клиническое исследование по эффективности радикального нехирургического лечения пациентов с первичным почечноклеточным раком,
продемонстрировавшее приемлемый профиль побочных эффектов и
удовлетворительную функцию почек
после SABR. Вкупе с уже имеющимися ретроспективными данными
и систематическими обзорами эти
результаты подтверждают необходимость планирования будущих
рандомизированных исследований
по применению SABR в сравнении с
хирургическим вмешательством при
первичном почечноклеточном раке.
Источники:
Siva S, et al. Stereotactic body radiotherapy for primary renal cell carcinoma: a systematic review and practice guideline from the International Society of Stereotactic Radiosurgery (ISRS). Lancet Oncology. January 2024; Vol.25, Issue 1, e18-e28.
Siva S, et al. Stereotactic ablative body
radiotherapy for primary kidney cancer
(TROG 15.03 FASTRACK II): a nonrandomised phase 2 trial. Lancet Oncol.
2024 Mar 01; 25(3) 308-316.
РАК ЛЕГКОГО 1 СТАДИИ – МИШЕНЬ ДЛЯ ИОНОВ УГЛЕРОДА
Стандартным лечением рака легкого
1 стадии, согласно международным
и отечественным рекомендациям,
является хирургический метод – лобэктомия с медиастинальной лимфодиссекцией. Однако в последние
годы стереотаксическая лучевая
терапия раннего рака легкого занимает все более уверенные позиции в
лечении, причем не только тех пациентов, которые не подходят для операции по соматической патологии
или категорически отказываются от
вмешательства на грудной клетке.
Три продолжающихся в настоящее
время крупных проспективных исследования по сравнению результатов радикальной операции и SBRT
при раке легкого весьма успешно
набирают операбельных пациентов
в группу лучевой терапии.
Свой вклад в решение этого вопроса внесли японские исследователи,
опубликовав в одном из недавних
выпусков журнала Journal of Thoracic
Oncology результаты проспективной
работы по применению альтернативного вида ионизирующего излучения – ионов углерода – в лечении
больных с 1 стадией рака легкого
[1]. Исследование инициировано в
2016 году, данные стекались из всех
центров ионной терапии, которых в
Японии больше, чем в других странах.
Ионы углерода имеют ряд физических и биологических преимуществ
перед фотонным излучением [2].
Уникальное распределение дозы по
глубине с конечным диапазоном, а
также резкая боковая полутень позволяют увеличить дозу на облучаемый объем по сравнению с фотонной терапией, минимизируя при
этом дозу на окружающие нормальные ткани, а относительная биологическая эффективность ионов даже
выше, чем у протонов по отношению
к фотонам (коэффициент 2-3).
Всего 136 пациентов с операбельным
раком легкого 1 стадии были включены в мультицентрическое проспективное наблюдательное исследование в период с мая 2016 по июнь
2018 гг. Средний период наблюдения
составил 56 месяцев. Подавляющее
большинство больных (117, или
86%) имели 1А стадию и 19 (14%) –
1В стадию. Морфологическое подтверждение не было получено у 37%
больных, большинство пациентов
имели опухоли периферической локализации. Используемые режимы
облучения были следующими: 50 Гр
(по RBE – относительной биологической эффективности) за 1 фракцию,
54-64 Гр за 4 фракции, 64-72 Гр за
12-16 фракций – в том случае, если
более короткие курсы облучения
не подходили по дозиметрическим
параметрам (ограничению доз на
критических органах). Пациенты с
опухолями эндобронхиальной локализации получали 54 Гр за 9 фракций.
Пятилетняя общая выживаемость,
раково-специфическая выживаемость, выживаемость без прогрессирования и локальный контроль
составили 81.8% (95%CI: 75.1 – 89.2),
91.2% (95% CI: 86.0 – 96.8), 65.9%
(95% CI: 58.2 – 74.6) и 95.8% (95% CI:
92.3 – 99.5) соответственно (рис.1).
Мультивариантный анализ показал,
что возраст (до 77 лет) явился значимым благоприятным фактором для
выживаемости (p = 0.018), а возраст
в сочетании с коэффициентом плотности опухоли – для ВБП (p = 0.010
и p = 0.004). Токсичность 3 степени (клинически значимый лучевой
пневмонит) зафиксирован только у
одного пациента, а осложнений 4+
степени не было.
Рисунок 1.
Пятилетние результаты исследования
(ОВ, РСВ, ВПБ, ЛК).
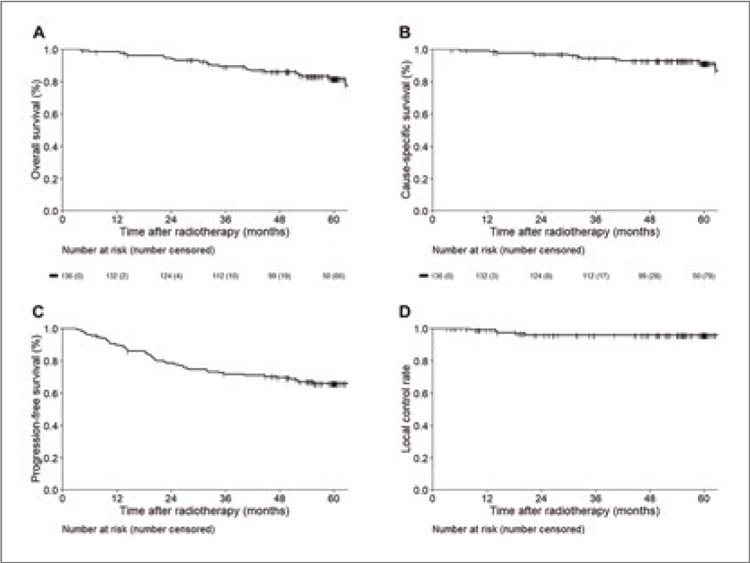
Число центров ионной терапии ограниченно в мире, поэтому в ближайшие годы этот вариант лучевой терапии в широкую практику не войдет. Однако это еще одно свидетельство того, что для определенной категории пациентов с ранним раком легкого SBRT является методом выбора и позволяет получить отличные отдаленные результаты.
Источники:
- Nobuteru Kubo, et al. Five-Year Survival Outcomes After Carbon-Ion Radiotherapy for Operable Stage I NSCLC: A Japanese National Registry Study (J-CROS-LUNG). Journal of Thoracic Oncology Vol. 19 No. 3: 491– 499.
- Ohno T. Particle radiotherapy with carbon ion beams. EPMA J. 2013;4:1 – 7.
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / ПРОГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ ЦИРКУЛИРУЮЩЕЙ ОПУХОЛЕВОЙ ДНК ПРИ НЕМЕЛКОКЛЕТОЧНОМ РАКЕ ЛЕГКОГО
Материал подготовил: И.М. Боровков
Применение лекарственной терапии на предоперационном или послеоперационном этапах в рамках
комбинированного лечения местнораспространенного немелкоклеточного рака легкого (НМРЛ) давно
стало стандартным подходом. В то
же время локализованные стадии
представлены более гетерогенной
группой пациентов, требующей дополнительной оценки ряда молекулярно-генетических характеристик
для идентификации пациентов с
повышенным риском прогрессирования заболевания и назначения соответствующей терапии. Одним из
возможных направлений подобной
диагностики является определение
циркулирующей опухолевой ДНК
(цоДНК), что уже показало свою
высокую предиктивную и прогностическую эффективность при колоректальном раке (DYNAMIC trial,
[1]). Однако возможности опухольагностического применения данного
маркера пока мало изучены.
В январе 2024 года были опубликованы результаты систематического обзора и метаанализа, направленного на оценку прогностического значения предоперационного выявления цоДНК у пациентов с I-III ст. резектабельного НМРЛ [2]. Работа включила данные 11 исследований и 1068 пациентов, среди которых определение статуса цоДНК проводилось с помощью секвенирования нового поколения (Next-generation sequencing, NGS), а в качестве первичных конечных точек были выбраны показатели общей выживаемости (ОВ) и выживаемости без прогрессирования (ВБП).
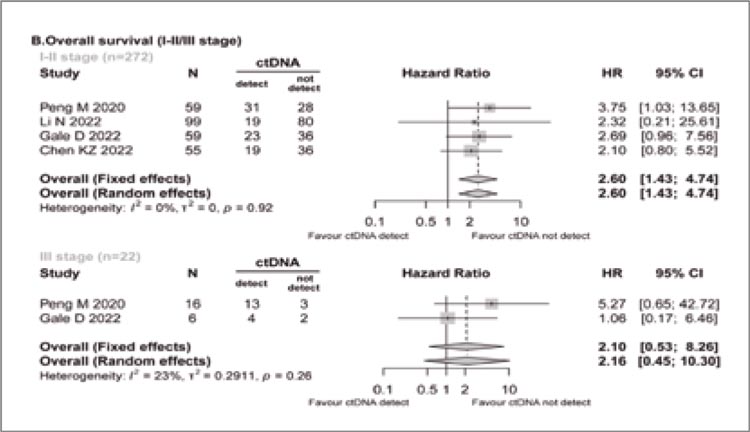
Авторы показали, что выявление цоДНК на предоперационном этапе является важным предиктивным фактором, коррелирующим со стадией заболевания, определяющим его прогноз и эффективность адъювантной терапии. Так, по данным 6 исследований, циркулирующая опухолевая ДНК экспрессировалась у 27,9% пациентов с I-II ст. (163/584) и 63% пациентов с III ст. (85/135). При этом при I-II ст. позитивная цоДНК ассоциировалась с достоверным ухудшением показателей ОВ (ОР 2,60; I2=0%) и ВБП (ОР 2,84; I2=0%), а при III ст. подобной зависимости выявлено не было (рис.1). В то же время анализ показателей выживаемости пациентов без дополнительной стратификации по стадии заболевания не только подтвердил снижение выживаемости без прогрессирования, но и показал ухудшение ОВ в общей популяции пациентов (ОР 2,77; 95% ДИ 1,67-4,58; I2=0%).
Рисунок 1.
Влияние положительной цоДНК перед операцией
на общую выживаемость при I-II и III ст. НМРЛ
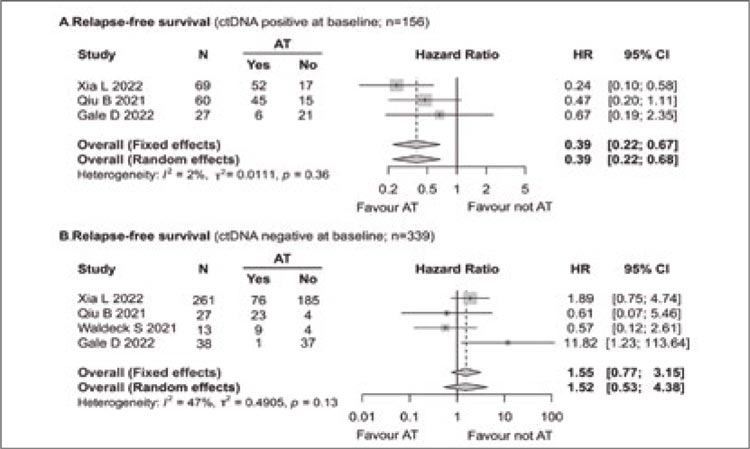
В дополнение к этому в 4 исследованиях оценивалось влияние цоДНК на эффективность адъювантной химиотерапии (АХТ). Было выявлено, что проведение АХТ ассоциировалось с достоверным улучшением выживаемости без прогрессирования (ОР 0,39; 95% ДИ 0,22-0,67; I2=2%) в группе положительной предоперационной цоДНК (103/156, 66,03%) и не коррелировало с ВБП (ОР 1,55; 95% ДИ 0,77-3,15; I2=43%) у пациентов без экспрессии данного маркера (рис.2). Анализ общей выживаемости в данном контексте не проводился в связи с малым объемом клинических данных.
Рисунок 2.
Влияние АХТ на выживаемость без
прогрессирования в зависимости от статуса цоДНК
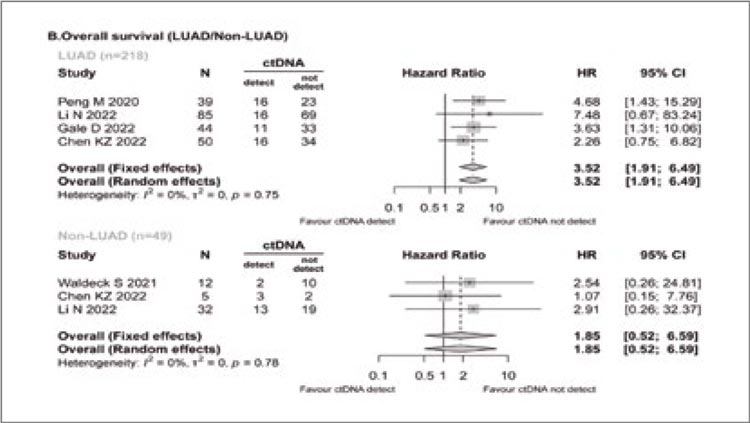
Прогностическое значение цоДНК также зависело от гистологической формы заболевания. По данным 7 включенных работ, цоДНК определялась с разной вероятностью при аденокарциноме (118/551, 21,42%) и прочих вариантах НМРЛ (54/99, 54,55%), а ее негативное прогностическое значение для показателей ОВ (ОР 3,52; 95% ДИ 1,91-6,49; I2=0%) и ВБП (ОР3,46; 95% ДИ 2,37-5,05; I2=0%) отмечалось лишь у пациентов с аденокарциномой легкого (рис.3).
Рисунок 3.
Влияние цоДНК на общую выживаемость при
аденокарциноме легкого (LUAD) и прочих гистологических
вариантах (non-LUAD)
Метаанализ демонстрирует клиническую применимость определения статуса цоДНК при НМРЛ и открывает дорогу для будущих проспективных исследований этого направления. Однако ряд вопросов остается без ответов. Например, имеет ли прогностическое значение временной интервал, в который производится определение цоДНК, и не изменится ли он при ликвидации цоДНК после хирургического вмешательства? Так, авторы другого опубликованного в 2022 году метаанализа пришли к выводу, что идентификация данного маркера в течение 3-14 дней после операции обладает большей предиктивной чувствительностью по сравнению с предоперационным выявлением [3]. Не меньший интерес вызывает отсутствие корреляции между показателями выживаемости и экспрессией цоДНК у пациентов с плоскоклеточным раком легкого. Авторы аргументируют подобные результаты тем фактом, что плоскоклеточный рак в большей мере ассоциируется с возникновением местных рецидивов, в то время как цоДНК чаще служит фактором риска гематогенной диссеминации, более характерной для аденокарциномы, что могло привести к большему числу ложно-негативных результатов при математической и статистической обработке данных. Однако подобное объяснение не может служить поводом как для активного применения определения цоДНК, так и для отказа от него, что мотивирует дальнейшее изучение искомой методики.
Таким образом, определение цоДНК при различных злокачественных новообразованиях (в частности, при НМРЛ) сохраняет свою диагностическую актуальность и может привести в будущем к уменьшению значимости клинических факторов риска с увеличением роли цоДНКориентированного назначения адъювантной терапии.
Источники:
- Tie J, Cohen JD, Lahouel K, Lo SN, Wang Y, Kosmider S, Wong R, Shapiro J, Lee M, Harris S, Khattak A, Burge M, Harris M, Lynam J, Nott L, Day F, Hayes T, McLachlan SA, Lee B, Ptak J, Silliman N, Dobbyn L, Popoli M, Hruban R, Lennon AM, Papadopoulos N, Kinzler KW, Vogelstein B, Tomasetti C, Gibbs P; DYNAMIC Investigators. Circulating Tumor DNA Analysis Guiding Adjuvant Therapy in Stage II Colon Cancer. N Engl J Med. 2022 Jun 16; 386(24): 2261-2272. doi: 10.1056/NEJMoa2200075. Epub 2022 Jun 4. PMID: 35657320. PMCID: PMC9701133.
- Lu J, Feng Y, Guo K, et al. Prognostic value of preoperative circulating tumor DNA in non-small cell lung cancer: a systematic review and meta-analysis. J Cancer Res Clin Oncol. 2024; 150, 25. https://doi.org/10.1007/s00432-023- 05550-z.
- Wang B, et al. Prognostic potential of circulating tumor DNA detection at different time periods in resectable nonsmall cell lung cancer: evidence from a meta-analysis. Crit Rev Oncol Hematol. 2022; 177: 103771.
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / CHECKMATE 901: НИВОЛУМАБ В КОМБИНАЦИИ С ГЕМЦИТАБИНОМ И ЦИСПЛАТИНОМ ПРИ ДИССЕМИНИРОВАННОМ УРОТЕЛИАЛЬНОМ РАКЕ
Материал подготовил: Э.Р. Исраелян
Ранее изучавшийся подход добавления иммунотерапии (ИТ)
к платиносодержащей химиотерапии (ХТ) в 1-й линии не продемонстрировал своей эффективности в отличие от концепции
поддерживающей ИТ после завершения ХТ. Сможет ли ниволумаб переломить ситуацию в пользу химиоиммунотерапии (ХИТ)?
В рандомизированное исследование III фазы CheckMate 901
включено 608 пациентов с местнораспространенным нерезектабельным/метастатическим уротелиальным раком (УР), не имеющих
противопоказаний к цисплатину.
Пациенты были рандомизированы
в 2 группы: гемцитабин/цисплатин
(GC) и ниволумаб + GC с последующей поддержкой ниволумабом
до 2 лет. Первичными конечными
точками явились ОВ и ВБП.
Рисунок 1.
Общая выживаемость в группах
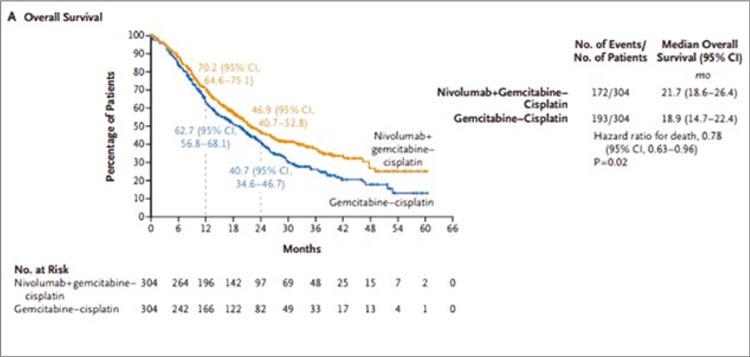
При медиане наблюдения 33,6 мес. получены следующие результаты:
- мОВ: 21,7 мес. в группе ниволумаб + GC и 18,9 мес. в группе GC (ОР=0,78; 95% ДИ 0,63-0,96; р=0,02);
- мВБП: 7,9 и 7,6 мес. в группах ниволумаб + GC и GC соответственно (ОР=0,72; 95% ДИ 0,59-0,88; р=0,001);
- ЧОО: 57,6% и 43,1% в группах ниволумаб + GC и GC соответственно (полный ответ ~ в 2 раза выше в группе ниволумаба – 21,7%);
- НЯ 3-4 степени отмечены у 61,8% и 51,7% пациентов в группах ниволумаб + GC и GC соответственно (привели к отмене терапии в 21,1% и 17,4% случаев).
В поданализе выигрыш от добавления ниволумаба получили
пациенты практически всех подгрупп, однако наибольший положительный эффект отмечен
среди мужчин <65 лет, без исходного метастатического поражения печени и предшествовавшей
системной противоопухолевой
терапии.
Рисунок 2.
Выживаемость без прогрессирования
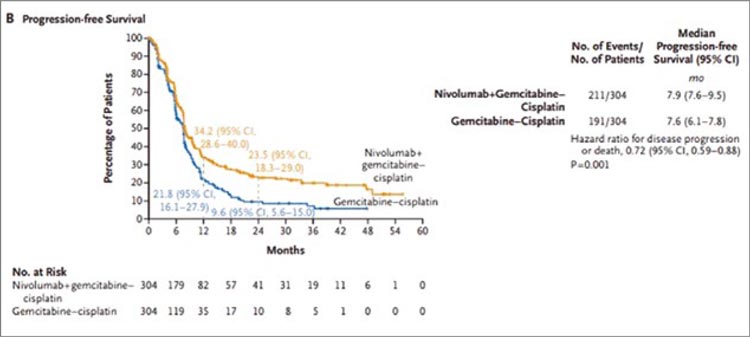
В поданализах ранее проведенных исследований с ХИТ
(KEYNOTE-361, IMvigor 130) виден тренд в пользу улучшения
отдаленных результатов лечения
для пациентов, получивших цисплатин, а не карбоплатин. Позитивные результаты CheckMate
901 открывают дорогу химиоиммунотерапии в 1-й линии УР, но
только для цисплатин-пригодных
пациентов. В связи с этим возникает практически значимая
дилемма: ниволумаб сразу либо
авелумаб в поддержке?
Источник:
Michiel S. van der
Heijden, et al. Nivolumab plus
Gemcitabine-Cisplatin in Advanced
Urothelial Carcinoma. N Engl J Med
2023; 389: 1778-1789. DOI: 10.1056/
NEJMoa2309863.
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / ECOG-ACRIN E2810: ЭФФЕКТИВНОСТЬ ПАЗОПАНИБА ПОСЛЕ ПОЛНОЙ МЕТАСТАЗЭКТОМИИ ПРИ РАКЕ ПОЧКИ
Материал подготовил: Э.Р. Исраелян
Оптимальная тактика лечения
пациентов после полной метастазэктомии (ПМЭ) почечноклеточного рака (ПКР) все еще не
определена. Неоднократные попытки улучшить выживаемость
без признаков болезни (ВБПБ)
при применении тирозинкиназных ингибиторов (ТКИ) в адъювантном режиме оказались безуспешны. В JCO 26 марта 2024
года представлены финальные
результаты исследования ECOGACRIN E2810.
Рисунок 1.
Выживаемость без признаков болезни
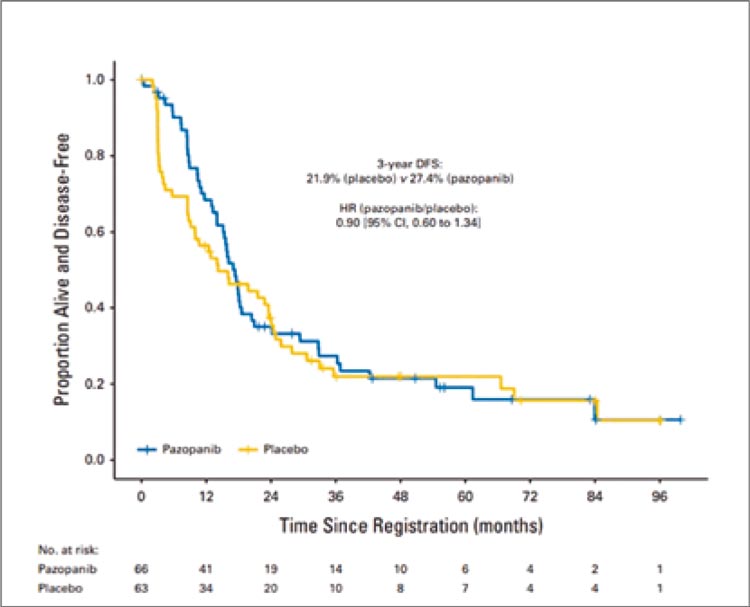
В данное рандомизированное плацебо-контролируемое исследование
III фазы включались пациенты со
светлоклеточным ПКР после нефрэктомии (до или во время ПМЭ)
и полной метастазэктомии, подтвержденной радиологическим
обследованием. Пациенты были
рандомизированы в 2 группы: пазопаниб 200 мг 4 раза в сутки внутрь
или плацебо. Первичная конечная
точка – ВБПБ. Согласно статистической гипотезе запланировано включение 180 пациентов, однако в связи
с медленным набором рандомизировано 128 пациентов.
При медиане наблюдения 60,5 мес.:
- 3-летняя ВБПБ: 27,4% в группе пазопаниба и 21,9% в группе плацебо (ОР=0,9; 95% ДИ 0,6-1,34; р=0,29);
- 3-летняя ОВ: 81,9% и 91,4% в группах пазопаниба и плацебо соответственно (ОР=2,55; 95% ДИ 1,23-5,27; р=0,012);
- нежелательные явления 3-4 степени: у 70% в группе пазопаниба и у 41% в группе плацебо соответственно; отмечена 1 смерть в группе пазопаниба, связанная с терапией (внутримозговое кровоизлияние).
Не отмечено статистически значимых различий в ВБПБ среди пациентов с исходно одним или несколькими метастатическими сайтами
(р=0,87), временем до развития метастазов, подвергнутых ПМЭ, <1
года или >1 года (р=0,25).
В исследование RESORT (сорафениб
vs плацебо после ПМЭ) также было
включено меньше пациентов, чем
запланировано, что не позволило
достичь необходимой мощности и
продемонстрировать позитивные
результаты. В KEYNOTE-564 включено по 6% пациентов после ПМЭ в
группы адъювантного пембролизумаба или плацебо, в поданализе продемонстрирован тренд в сторону
улучшения ОВ в группе иммунотерапии (ОР=0,51; 95% ДИ 0,15-1,75).
Очевидно, следует сконцентрироваться на изучении иммунотерапии
у данной категории пациентов, а
ТКИ оставить на полноценную 1-ю
линию терапии.
Источник: Leonard J. Appleman, et al. Randomized, Double-Blind Phase III Study of Pazopanib Versus Placebo in Patients With Metastatic Renal Cell Carcinoma Who Have No Evidence of Disease After Metastasectomy: ECOGACRIN E2810. Journal of Clinical Oncology. 2024 March 26. https://doi. org/10.1200/JCO.23.01544.
14 СЕНТЯБРЯ 2024 ГОДА В МОСКВЕ ПРОЙДЕТ ЭКЗАМЕН ESMO
Глубокоуважаемые коллеги!
По соглашению между ESMO и RUSSCO в этом году Москва вошла в число нескольких
площадок в мире, где 14 сентября 2024 года состоится экзамен ESMO. Это уникальная
возможность молодым специалистам попробовать свои силы в отношении знаний медицинской онкологии. В Словении и Швейцарии этот экзамен уже стал обязательной
письменной частью для получения сертификата медицинского онколога. Он представляет собой 100 тестовых заданий на английском языке, на которые необходимо ответить в
течение 150 минут. Вопросы касаются, в основном, диагностики и лекарственного лечения злокачественных новообразований, около 10% из них посвящены онкогематологии.
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / CASPIAN: ВОЗМОЖНОСТИ И ПРОГНОСТИЧЕСКИЕ ФАКТОРЫ ТЕРАПИИ ПЕРВОЙ ЛИНИИ РАСПРОСТРАНЕННОГО МЕЛКОКЛЕТОЧНОГО РАКА ЛЕГКОГО
Материал подготовил: И.М. Боровков
Современный стандарт лечения
распространенного мелкоклеточного рака легкого (МРЛ) продиктован результатами исследования IMpower133 и заключается
в проведении 4 курсов противоопухолевой терапии на основе
препаратов платины, этопозида
и ингибитора контрольных точек
(ИКТ) атезолизумаба [1]. Комбинированная терапия позволила
увеличить медиану общей выживаемости (ОВ) до 12,3 мес. по сравнению с 10,3 мес. в группе химиотерапии по схеме EP (ОР 0,70; 95%
ДИ 0,54-0,91; p=0,007), а медиану
выживаемости без прогрессирования (ВБП) – до 5,2 мес. против
4,3 мес. (ОР 0,77; 95% ДИ 0,62-0,96;
p=0,02).
В феврале 2024 года были опубликованы дополненные результаты
рандомизированного исследования III фазы CASPIAN, исследовавшего возможности применения комбинации схемы EP с ИКТ
дурвалумабом (анти- PD-L1) ± тремелимумабом (анти-CTLA-4) у пациентов с различной экспрессией
PD-L1 и мутационной нагрузкой
(tumor mutational burden, TMB).
Работа включила 805 пациентов с
распространенным МРЛ без предшествующего лечения в анамнезе,
рандомизированных в группы EP
с дурвалумабом (группа A, n=268),
EP с дурвалумабом и тремелимумабом (группа B, n=268) и EP
(контрольная группа, n=269). В качестве первичной конечной точки
была выбраны общая выживаемость (ОВ), а вторичные конечные
точки включали выживаемость
без прогрессирования и частоту
объективных ответов (ЧОО). Дизайн исследования предполагал
использование мощности в 96% и
показателя ошибки первого рода
(α) ≤0,04.
Первые результаты исследования
опубликовали еще в 2019 году, а
обновленные данные были представлены в 2022 году. Авторы
продемонстрировали увеличение
медианы ОВ в группе A до 12,9
мес. по сравнению с 10,5 мес. в
контрольной группе (ОР 0,71; 95%
ДИ 0,60-0,86; p=0,0003) и 3-летней
ОВ до 17,6% против 5,8% соответственно (рис.1).
Рисунок 1.
Общая выживаемость в группе EP с дурвалумабом
в исследовании CASPIAN
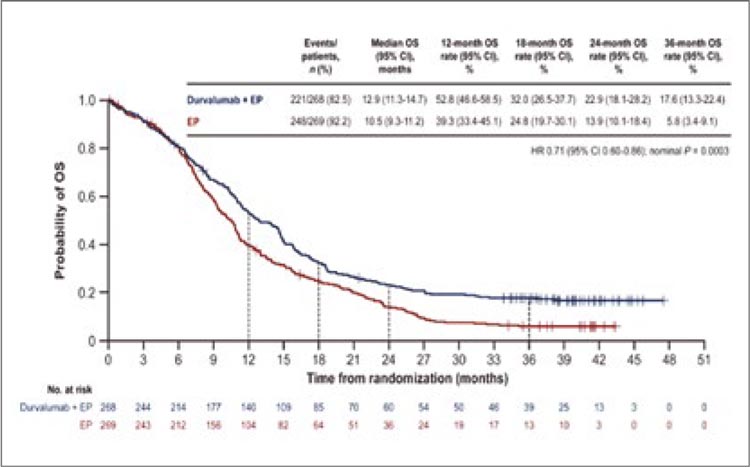
Добавление к комбинации EP и
дурвалумаба ингибитора CTLA-4
тремелимумаба, в свою очередь,
не приводило к достоверному
улучшению отдаленных результатов лечения с медианой ОВ в 10,4
мес. в группе B против 10,5 мес.
в контрольной группе (ОР 0,82;
95% ДИ 0,68-1,00; p=0,045) [2]. При
этом промежуточный анализ, опубликованный в 2021 году, показал,
что 3-летняя ОВ в группе B составила 15,3% (ОР 0,81; 95% ДИ 0,67-
0,97; p=0,0200). Подобный результат заметно выше аналогичного
в контрольной группе, однако
по-прежнему не превосходит комбинацию EP и дурвалумаба без добавления анти-CTLA-4 агента. Более того, применение комбинации
двух ингибиторов контрольных
точек с EP характеризовалось достоверным увеличением частоты
нежелательных явлений (НЯ) 5 ст.
и аутоиммунных нежелательных
явлений 3-4 ст. соответственно до
10% и 14% по сравнению с 5% и 5%
в группе A и 6% и <1% в контрольной группе. Частота общих НЯ 3-4
ст. между группами оставалась на
сопоставимом уровне (группа А –
60%, группа B – 63%, контрольная
группа – 59%).
Таким образом, добавление тремелимумаба к комбинации EP и
дурвалумаба не приводит к достоверному улучшению общей
выживаемости и сопровождается увеличением риска развития
летальных или аутоиммунных
осложнений, что делает данную
комбинацию нецелесообразной и
малоприменимой в общей популяции больных.
Попытки дополнительно сузить
показания для назначения высокотоксичной терапии в рамках
дальнейшего изучения искомой
популяции позволили авторам
проанализировать влияние на
результаты лечения таких факторов, как экспрессия PD-L1 и статус
TMB [3]. Для оценки PD-L1 авторы
использовали антитело SP263 и
систему VENTANA, а анализ проводился по показателям экспрессии на клетках опухоли (tumor
cells, TC) и иммунных клетках
(immune cells, IC). Показатель TMB
оценивался с помощью системы
FoundationOne, а для стратификации использовался показатель
TMB >10 мутаций на мегабазу, поскольку именно данное значение
ассоциировалось с достоверным
увеличением эффективности
двойной иммунной блокады при
НМРЛ [4]. Для итоговой оценки
PD-L1 и TMB были доступны данные 54,4% и 35,2% пациентов соответственно (biomarker-available
population, BEP).
Авторы показали, что экспрессия
PD-L1 >1% определялась у 5,7%
пациентов на опухолевых клетках
(TC) и у 25,8% пациентов на иммунных клетках (IC). При исследовании корреляции экспрессии
PD-L1 и эффективности терапии
по схеме EP + дурвалумаб (группа
А) не было выявлено достоверных
различий между группами PD-L1
≥1% и <1% (рис.2а).
Рисунок 2a.
Влияние экспрессии PD-L1 на эффективность
терапии по схеме EP + дурвалумаб
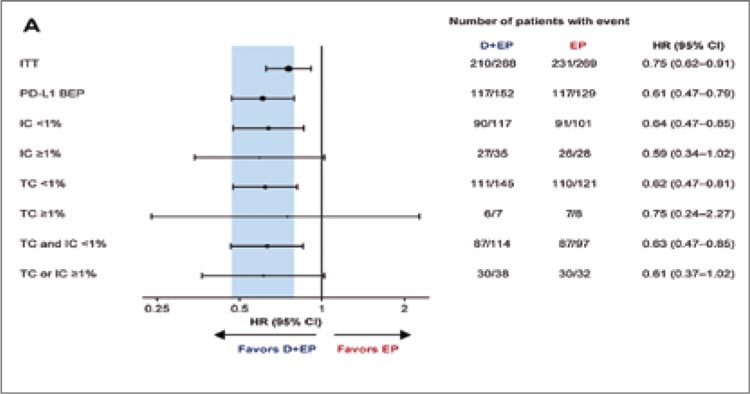
В группе EP + дурвалумаб + тремелимумаб (группа B) экспрессия
PD-L1 >1%, напротив, ассоциировалась с улучшением показателя
ОВ по сравнению с химиотерапией по схеме EP: ОР в группе B при
TC ≥1% и IC ≥1% составило 0,42
и 0,53 против 0,76 и 0,88 в группе
контроля (рис.2b).
Рисунок 2b.
Влияние экспрессии PD-L1 на эффективность
терапии по схеме EP + дурвалумаб + тремелимумаб
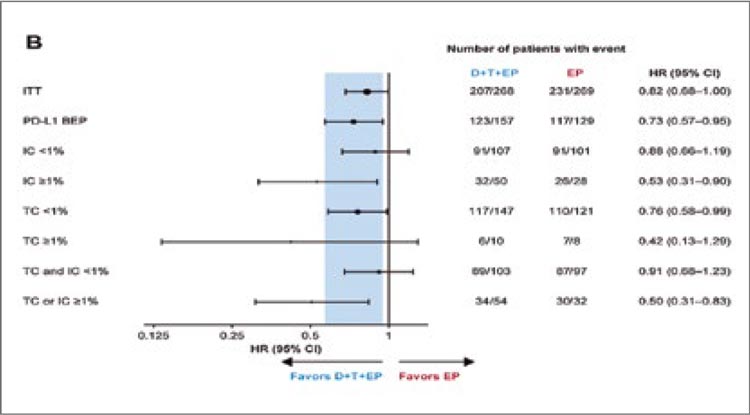
Более того, именно положительная
экспрессия PD-L1 являлась фактором, определяющим наибольшую
эффективность добавления тремелимумаба к комбинации EP +
дурвалумаб, что было подчеркнуто при построении кривых выживаемости Каплана-Майера (рис.3).
Тем не менее, полученные данные являются результатом post-hoc анализа. Авторы упоминают
об определенной разнородности
сравниваемых выборок ввиду разного функционального статуса, а
также различной распространенности и локализации метастазов
на момент начала терапии, что требует дальнейших исследований.
Количество мутаций на мегабазу,
в отличие от экспресии PD-L1, не
оказывало достоверного влияния
на эффективность терапии ни в
одной из групп (группа А против EP: p=0,916; группа B против
EP: p=0,672) и не коррелировало
с экспрессией PD-L1. Так, частота
одновременного наличия IC ≥1% и
TMB ≥10 мутаций на мегабазу не
превышала 11,6%, что предполагает отсутствие достоверной связи
между данными маркерами.
Рисунок 3.
Общая выживаемость в группах с различной
экспрессией PD-L1
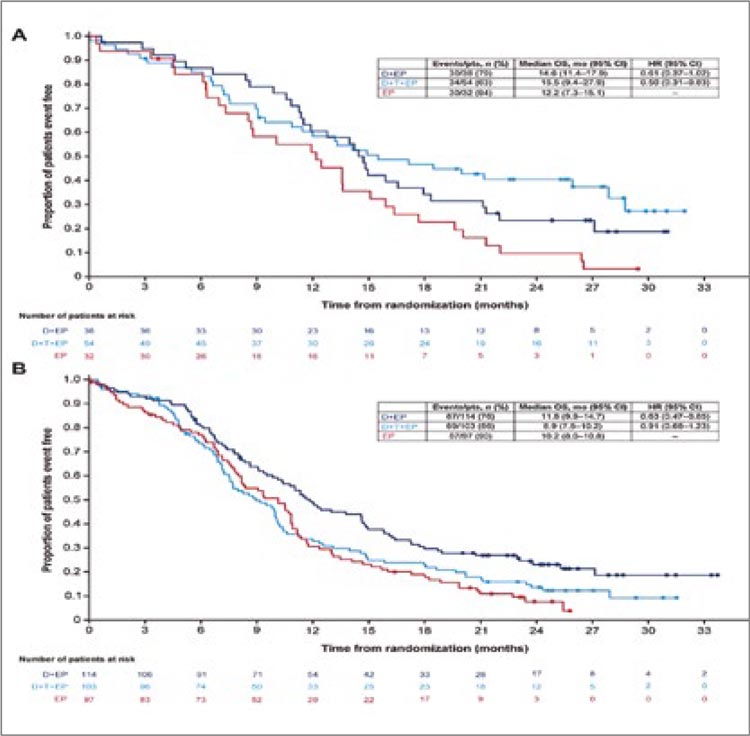
Таким образом, применение комбинации EP и дурвалумаба является эффективным методом противоопухолевой терапии в первой
линии лечения распространенного мелкоклеточного рака легкого независимо от статуса PD-L1
и мутационной нагрузки. Добавление к данной схеме ингибитора
CTLA-4 тремелимумаба не приводит к достоверному увеличению
общей выживаемости в общей
популяции, но может ассоциироваться с улучшением отдаленных
результатов лечения среди пациентов с PD-L1 >1%. Тем не менее,
ввиду ограниченности представленных результатов и высокого
риска осложнений на фоне двойной иммунной блокады данное
предположение требует предварительного подтверждения в рамках
отдельного исследовательского
протокола.
Источники:
- Horn L, et al; IMpower133 Study Group. First-Line Atezolizumab plus Chemotherapy in Extensive-Stage Small-Cell Lung Cancer. N Engl J Med. 2018 Dec.
- Paz-Ares L, Chen Y, Reinmuth N, Hotta K, Trukhin D, Statsenko G, et al. Durvalumab, with or without tremelimumab, plus platinumetoposide in first-line treatment of extensive-stage small-cell lung cancer: 3-year overall survival update from CASPIAN. ESMO Open. 2022; 7: 100408.6; 379 (23): 2220-2229. doi: 10.1056/NEJMoa1809064. Epub 2018 Sep 25. PMID: 30280641.
- Paz-Ares L, et al. Durvalumab ± Tremelimumab + Platinum-Etoposide in Extensive-Stage Small Cell Lung Cancer (CASPIAN): Outcomes by PD-L1 Expression and Tissue Tumor Mutational Burden. Clin Cancer Res. 2024 Feb 16; 30(4): 824-835. doi: 10.1158/1078-0432.CCR-23- 1689. PMID: 37801329; PMCID: PMC10870117.
- Ready N, et al. First-line nivolumab plus ipilimumab in advanced nonsmall-cell lung cancer (CheckMate 568): outcomes by programmed death ligand 1 and tumor mutational burden as biomarkers. J Clin Oncol. 2019; 37: 992-1000.
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / PACIFIC-2: ПРОВЕДЕНИЕ ТЕРАПИИ ДУРВАЛУМАБОМ ОДНОВРЕМЕННО С ХЛТ НЕ УЛУЧШАЕТ ВЫЖИВАЕМОСТЬ ПАЦИЕНТОВ С НМРЛ ПО СРАВНЕНИЮ С КОНСОЛИДИРУЮЩИМ ВАРИАНТОМ ЛЕЧЕНИЯ
Материал подготовил: И.М. Боровков
Основным вариантом лечения
пациентов с нерезектабельным
местнораспространенным немелкоклеточным раком легкого является проведение одновременной
химиолучевой терапии с последующей поддерживающей терапией дурвалумабом. В регистрационном исследовании PACIFIC
подобный подход обеспечивал
улучшение 5-летней общей выживаемости (ОВ) до 42,9% по
сравнению с 33,4% в группе ХЛТ
+ плацебо, а медиана общей выживаемости в группах составила
47,5 и 29,1 мес. соответственно
(ОР 0,72; 95% ДИ 0,59-0,89) [1]. В
то же время основным показанием для проведения консолидирующей иммунотерапии в данном
протоколе являлось отсутствие
прогрессирования заболевания
на момент завершения ХЛТ, риск
которого, по данным разных авторов, приближается к 30% [2-3].
Попытки предупредить подобную диссеминацию или местный
рецидив опухоли у трети больных
привели к инициации исследования PACIFIC-2, основной задачей
которого являлась оценка эффективности и безопасности одновременной химиоиммунолучевой
терапии с дурвалумабом [4].
Авторы включили 328 пациентов
с нерезектабельным НМРЛ III ст.
без предшествующего лечения в
анамнезе и рандомизировали их
(2:1) в группы одновременной с
ХЛТ (экспериментальная группа)
или поддерживающей (контрольная группа) терапии дурвалумабом. Согласно представленным
в марте 2024 года на ELCC 2024
результатам, авторам не удалось
добиться достоверного увеличения выживаемости. Экспериментальная и контрольная группы
были хорошо сбалансированы по
количеству пациентов с экспрессией PD-L1>1% (51% и 55% соответственно), стадии заболевания
(IIIb ст. – 49,8% и 46,8%) и гистологическому варианту НМРЛ
(плоскоклеточный рак – 55,3% и
47,7%). При медиане наблюдения в
30,5 мес. медиана выживаемости
без прогрессирования (ВБП) составила 13,8 мес. при одновременном проведении химиоиммуннолучевой терапии и 9,4 мес. в
группе контроля (ОР 0,85; 95% ДИ
0,65-1,12), однако статистический
анализ не подтвердил статистическую достоверность полученных
различий (p=0,247) (рис.1).
Рисунок 1.
Выживаемость без прогрессирования в PACIFIC-2
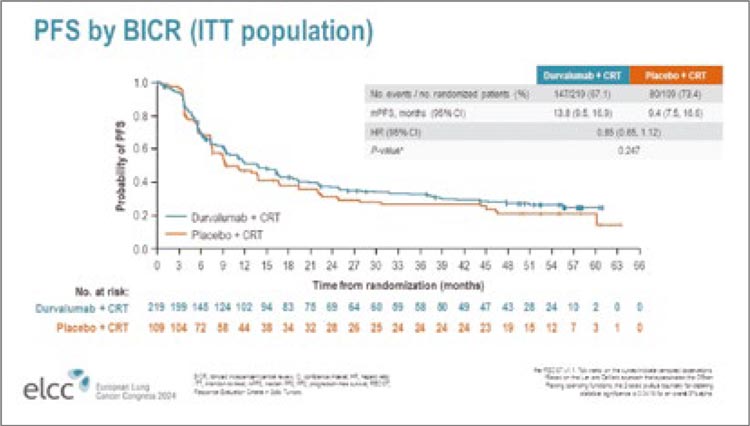
Оценка показателя общей выживаемости (ОВ), в свою очередь, не
продемонстрировала даже статистически недостоверного улучшения результатов лечения (ОР 1,03;
95% ДИ 0,78-1,39; p=0,823). Частота
объективных ответов также была
сопоставима между группами –
60,7% (95% ДИ 53,9-67,2%) и 60,6%
(95% ДИ 50,7-69,8%). Профиль безопасности лечения в группе одновременной ХЛТ с дурвалумабом по
сравнению с последовательным режимом характеризовался большей
частотой нежелательных явлений
3-4 ст., развившихся в первые 4 месяца лечения (57,1% против 52,8%),
и большим риском развития осложнений, приведших к смерти (6,8%
против 4,6%).
Можно заключить, что инициация
терапии дурвалумабом на этапе
проведения одновременной ХЛТ
несколько отдаляет наступление
прогрессирования (хоть и статистически недостоверно), но не оказывает никакого влияния на общую
выживаемость больных. Более того,
прогрессирование на фоне дурвалумаба будет являться противопоказанием для проведения иммунотерапии во II линии лечения, что
дополнительно ухудшит онкологический прогноз и, очевидно, сузит
диапазон потенциальных лечебных
опций для данного пациента. Таким
образом, стандартом для неоперабельных пациентов по-прежнему
остается проведение одновременной ХЛТ с поддерживающей терапией дурвалумабом, а проблема
прогрессирования 30% пациентов
на фоне ХЛТ продолжает оставаться открытой.
Источники:
1. Spigel DR, Faivre-Finn C, Gray JE,
Vicente D, Planchard D, Paz-Ares L,
Vansteenkiste JF, Garassino MC, Hui
R, Quantin X, Rimner A, Wu YL,
Özgüroğlu M, Lee KH, Kato T, de
Wit M, Kurata T, Reck M, Cho BC,
Senan S, Naidoo J, Mann H, Newton
M, Thiyagarajah P, Antonia SJ. FiveYear Survival Outcomes From thePACIFIC Trial: Durvalumab After
Chemoradiotherapy in Stage III NonSmall-Cell Lung Cancer. J Clin Oncol.
2022 Apr 20; 40(12): 1301-1311. doi:
10.1200/JCO.21.01308. Epub 2022 Feb
2. Erratum in: J Clin Oncol. 2022 Jun
10; 40(17): 1965. PMID: 35108059;
PMCID: PMC9015199.
2. Fukui T, Hosotani S, Soda I,
Ozawa T, Kusuhara S, Kakegawa
MI, Kasajima M, Hiyoshi Y, Igawa
S, Yokoba M, Mitsufuji H, Kubota
M, Katagiri M, Sasaki J, Ishiyama H,
Naoki K. Current status and progress
of concurrent chemoradiotherapy
in patients with locally advanced
non-small cell lung cancer prior to
the approval of durvalumab. Thorac
Cancer. 2020 Apr; 11(4): 1005-1014.
doi: 10.1111/1759-7714.13357. Epub
2020 Feb 14. PMID: 32057187;
PMCID: PMC7113036.
3. Taugner J, Eze C, Käsmann L,
Roengvoraphoj O, Gennen K, Karin
M, Petrukhnov O, Tufman A, Belka
C, Manapov F. Pattern-of-failure
and salvage treatment analysis after
chemoradiotherapy for inoperable stage
III non-small cell lung cancer. Radiat
Oncol. 2020 Jun 9; 15(1): 148. doi:
10.1186/s13014-020-01590-8. PMID:
32517716; PMCID: PMC7285541.
4. Bradley JD, et al. Durvalumab in
Combination with Chemoradiotherapy
for Patients with Unresectable, Stage III
NSCLC: Final Results from PACIFIC-2.
European Lung Cancer Congress 2024,
LBA1.
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / ELCC 2024: ОБНОВЛЕННЫЕ ДАННЫЕ
Материал подготовил: И.М. Боровков
21 марта 2024 года на European
Lung Cancer Congress (ELCC
2024) были представлены обновленные результаты исследований FLAURA2, MARIPOSA-2 и
MARIPOSA.
В конце 2023 года авторы
FLAURA2 показали возможность увеличения выживаемости
без прогрессирования (ВБП) у
пациентов с диссеминированным EGFR-мутантным НМРЛ
при проведении одновременной химиотаргетной терапии с
осимертинибом до 25,5 мес. по
сравнению с 16,7 мес. в группе
монотерапии осимертинибом.
Согласно представленным на ELCC 2024 обновленным данным, комбинированная терапия
также ассоциируется с увеличением показателя выживаемости
до начала 2 линии (30,7 против
25,4 мес., ОР 0,73) и выживаемости без прогрессирования после
начала 2 линии терапии (ВБП2,
ОР 0,70). Помимо этого, при проведении интервального анализа
на момент 30 месяцев наблюдения была выявлена тенденция
к статистически достоверному
увеличению показателя общей
выживаемости (ОР 0,75; 95% ДИ
0,57-0,97; p=0,0280), не достигшая
пока предустановленной отметки статистической значимости в
p≤0,000001 (рис.1) [1].
Рисунок 1.
Второй интервальный анализ общей
выживаемости в FLAURA2
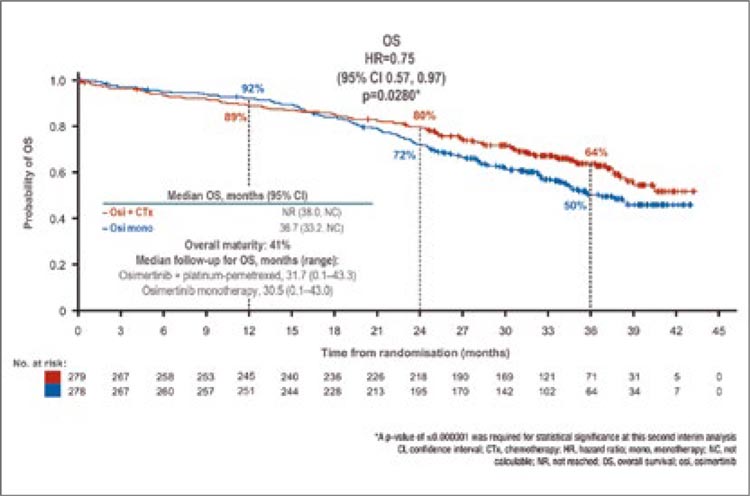
Схожие данные были представлены авторами исследования
MARIPOSA-2. Напомним, данный протокол исследовал возможность комбинированного
применения MEK-ингибитора
амивантанаба и химиотерапии
при проведении 2 линии терапии распространенного EGFRмутантного НМРЛ, что приводило к увеличению ВБП до 23,7
мес. по сравнению с 16,6 мес. в
группе химиотерапии. Согласно
представленным на ELCC 2024
обновленным данным, подобный
подход также ассоциируется с
увеличением медианы выживаемости до прекращения лечения
(11,0 против 4,5 мес., ОР 0,37),
времени до начала следующий
линии терапии (ОР 0,42) и выживаемости без прогрессирования
после начала 2 линии терапии (ОР
0,60) [2]. Помимо этого, анализ
опросников пациентов показал,
что проведение химиотаргетной
терапии сопровождается увеличением медианы времени до появления клинических проявлений заболевания (14,9 против 13,0
мес., ОР 0,74). Однако это утверждение пока не получило статистического подтверждения (p=0,10)
и требует повторной оценки при
последующих интервальных анализах [3].
Не менее любопытные данные
были получены при проведении
эксплораторного анализа в исследовании MARIPOSA. Ранее
авторы показали, что комбинирование EGFR (лазертиниб) и
MEK (амивантанаб) ингибиторов
при проведении 1 линии терапии
распространенного EGFR-мут.
НМРЛ приводило к аналогичному FLAURA2 увеличению ВБП
(23,7 мес. против 16,6 мес. при
монотерапии осимертинибом),
но сопровождалось выраженной
токсичностью, требующей коррекции дозы/отмены амивантанаба через 4 месяца «почти у
половины» пациентов. Интерес
вызывает тот факт, что плохая
переносимость и необходимость
регулирования дозовой интенсивности, судя по всему, не влияли на эффективности лечения.
Так, при медиане наблюдения в 22
мес. медиана выживаемости без
прогрессирования в группе отмены амивантанаба составила 27,5
мес., а в группе терапии полного
объема – 25,7 мес. К сожалению,
более детальная информация по
профилю безопасности, общей
выживаемости и результатам
статистической обработки попрежнему представлена не была.
Тем не менее, имеющиеся результаты уже демонстрируют необходимость детального изучения
минимально необходимой длительности терапии, ее дозовой
интенсивности, а также уточнения показаний для проведения
подобного высокотоксичного лечения с учетом имеющихся альтернатив.
Источники:
- Valdiviezo Lama NI, et al. First-line (1L) osimertinib (osi) ± platinum-pemetrexed in EGFRmutated (EGFRm) advanced NSCLC: FLAURA2 post-progression outcomes. European Lung Cancer Congress 2024, Abstract 4O.
- Gentzler RD, et al. Amivantamab plus chemotherapy vs chemotherapy in EGFR-mutant advanced NSCLC after progression on osimertinib: A postprogression analysis of MARIPOSA-2. European Lung Cancer Congress 2024, Abstract 3MO.
- Tomasini P, et al. Amivantamab plus chemotherapy vs chemotherapy in EGFR-mutant advanced NSCLC after progression on osimertinib: Secondary analyses of patient-relevant endpoints from MARIPOSA-2. European Lung Cancer Congress 2024, Abstract 8P.
- García Campelo MR, et al. Effect of amivantamab dose interruptions on efficacy and safety of first-line amivantamab plus lazertinib in EGFR-mutant advanced NSCLC: Exploratory analyses from the MARIPOSA study. European Lung Cancer Congress 2024, Abstract 5MO.
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / ПРЕДИКТОРНОЕ ЗНАЧЕНИЕ ЭКСПРЕССИИ PD-L1 ПРИ ПРОВЕДЕНИИ НЕОАДЪЮВАНТНОЙ ХИМИОИММУННОЙ ТЕРАПИИ НМРЛ
Материал подготовил: И.М. Боровков
Изучение возможностей химиоиммунной терапии (ХИТ) при
местнораспространенном немелкоклеточном раке легкого
(НМРЛ) является одним из наиболее актуальных направлений
клинической онкологии. К сожалению, широкое применение
данного подхода лимитируется
высокой стоимостью препаратов,
что мотивирует попытки уточнения показаний для их назначения
за счет идентификации различных прогностических маркеров,
к числу которых относится, в первую очередь, уровень экспрессии
PD-L1. Так, авторы подгруппового анализа CheckMate816 показали, что негативный уровень
экспрессии не приводит к достоверному увеличению бессобытийной выживаемости (Event-free
Survival) при добавлении к НАХТ
ниволумаба. На основании полученных результатов Европейское
агентство лекарственных средств
(EMA) отказало в регистрации
подобному подходу для данной
категории больных. В то же время последние исследования периоперационного проведения ХИТ
демонстрируют противоречащие
друг другу данные по предиктивному значению PD-L1 и допускают
возможность улучшения онкологического прогноза даже при негативной экспрессии, что подчеркивает необходимость дальнейшего
уточнения этого вопроса.
В апреле 2024 года в JAMA Oncology
был опубликован крупный метаанализ, включивший 5431 пациента из 43 исследований (в т.ч.
CheckMate 816,8, KEYNOTE-671,
Рисунок 1. Влияние экспрессии PD-L1 и III ст. НМРЛ на
общую выживаемость
Рисунок 2. Влияние экспрессии PD-L1 на показатель EFS
NADIM II, AEGEAN, Neotorch,
Checkmate 77T, TD-FOREKNOW
и RATIONALE 315), сравнивших
эффективность предоперационного проведения ХТ и ХИТ
у больных с НМРЛ с PD-L1>1%
и PD-L1<1% [1]. Основными задачами работы служили оценка
показателей общей (ОВ) и бессобытийной (EFS) выживаемости,
частоты R0-резекций и полных
патоморфологических ответов. В
выборке преобладали пациенты с
плоскоклеточным раком (55,6%) и
III ст. заболевания (72,1%).
Авторы выявили положительное влияние ХИТ на показатель
ОВ в общей популяции пациентов (ОР 0,65; 95% ДИ 0,54-0,79;
I2=0%) и подгруппах больных с
PD-L1>1% (ОР 0,49; 95% ДИ 0,33-
0,73; I2=48,5%) и III стадией (ОР
0,67; 95% ДИ 0,53-0,85; I2=0%).
В подгруппе PD-L1-негативных
больных подобного влияния, действительно, выявлено не было
(ОР 0,89; 95% ДИ 0,66-1,19; I2=0%),
что соотносится с заключением
EMA (рис.1).
Рисунок 1. Влияние экспрессии PD-L1 и III ст. НМРЛ на
общую выживаемость
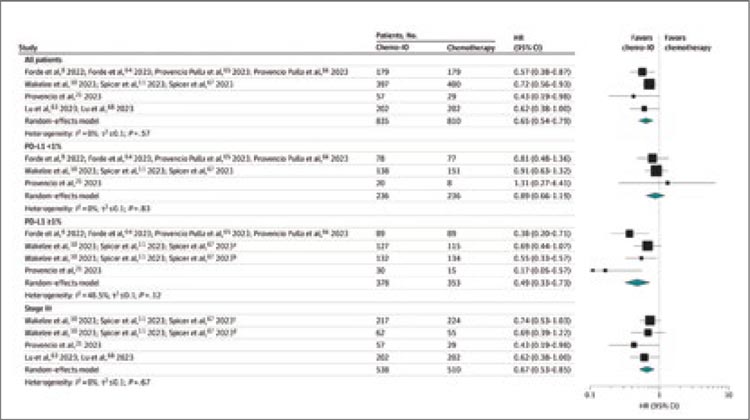
Анализ бессобытийной выживаемости показал, на первый взгляд,
схожие результаты – было выявлено достоверное улучшение EFS
в общей популяции больных при
проведении химиоиммунной терапии (ОР 0,59; 95% ДИ 0,52-0,67;
I2=14,9%). Однако, в отличие от
общей выживаемости, подобный
выигрыш отмечался как среди PDL1-позитивных (PD-L1 1-50% – ОР
0,56, 95% ДИ 0,42-0,73, I2=41,3%;
PD-L1>50% – ОР 0,40, 95% ДИ 0,28-
0,56, I2=32,1%), так и среди PD-L1 негативных пациентов (ОР 0,74; 95%
ДИ 0,62-0,89; I2=0%) (рис.2). Помимо
этого, химиоиммунотерапия приводила к достоверному увеличению
частоты полных патоморфологических ответов независимо от экспрессии PD-L1 (относительный риск
5,52; 95% ДИ 4,25-7,15; I2=27,4%) и
несколько увеличивало вероятность
проведения органосохраняющего
хирургического лечения.
Рисунок 2;Влияние экспрессии PD-L1 на показатель EFS

Таким образом, авторы метаанализа заключают, что экспрессия PDL1 не является абсолютным предиктором эффективности пред-/
периоперационной химиоиммунной терапии и не может служить
единственным показанием для ее
назначения. Тем не менее, попытка сузить показания в реальной
клинической практике диктуется
вовсе не желанием «обделить» пациента, а стремлением максимизировать эффективность проводимого лечения. В таком контексте
интерес вызывает потенциальное
влияние стажа курения. Известно,
что вышеперечисленные протоколы включали преимущественно активных курильщиков, в то
время как доля некурящих, редко
демонстрирующих хороший ответ на ХИТ, не превышала 10-15%.
Возможно, именно для данной
категории больных проведение
химиотерапии без ингибиторов
контрольных точек будет являться
наиболее оптимальным подходом.
Источник:
Sorin M, Prosty
C, Ghaleb L, et al. Neoadjuvant
Chemoimmunotherapy for NSCLC
A Systematic Review and MetaAnalysis. JAMA Oncology. Published
online: 21 March 2024. doi:10.1001/
jamaoncol.2024.0057.
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / OPTICAL TRIAL: МОЖНО ЛИ ОТКАЗАТЬСЯ ОТ НЕОАДЪЮВАНТНОЙ ХИМИОТЕРАПИИ ПРИ МЕСТНОРАСПРОСТРАНЕННОМ РАКЕ ВЕРХНЕАМПУЛЯРНОГО ОТДЕЛА ПРЯМОЙ КИШКИ?
Материал подготовил: И.М. Боровков
Пациенты с местнораспространенным раком средне- и нижнеампулярного отдела прямой кишки (ПК)
представляют собой гетерогенную
группу, требующую персонализированного подхода и тщательного
предоперационного планирования
в виду высоких рисков операционных осложнений и возможности
значительного ухудшения качества
жизни. Методом выбора у таких
больных могут служить методики
лучевой терапии с консолидирующей химиотерапией, одновременная
химиолучевая терапия или недавно
появившаяся опция проведения 6
курсов НАХТ без лучевой терапии
(PROSPECT trial) [1]. В то же время,
протокол лечения местнораспространенного рака верхнеампулярного отдела ПК более унифицирован и
чаще всего включает проведение 12
недель противоопухолевой терапии.
Но насколько необходим системный
компонент на предоперационном
этапе при «высоком» расположении
опухоли и может ли он быть заменен
адъювантным лечением при выявлении объективных клинико-лабораторных показаний?
В апреле 2024 года в JCO были опубликованы результаты рандомизированного исследования III фазы
OPTICAL, главной задачей которого
была оценка показателя 3-летней выживаемости без прогрессирования
[2]. Данная работа включила 744 пациентов с местнораспространенным
(сТ3с-4) раком верхнеампулярного
отдела прямой кишки (дистальная
граница опухоли >12 см от анального канала) и рандомизировала их в
группы НАХТ (6 курсов mFOLFOX6
или 4 курса CAPOX, n=371) и хирургии up-front (n=373). Вторичными
конечными точками служили общая
выживаемость и частота полных
патоморфологических ответов, послеоперационных осложнений и R0-
резекций.
При медиане наблюдения в 48 мес.
показатель 3-летней выживаемости без прогрессирования составил
82,1% в группе НАХТ против 77,5%
в группе up-front хирургии (ОР 0,74;
95% ДИ 0,54-1,03). Также авторы сообщили о тенденции к улучшению
общей выживаемости (ОР 0,44; 95%
ДИ 0,25-0,77), однако более детальные данные в открытом доступе пока
представлены не были. Частоты R0
резекций достоверно не различалась
между группами (98%), а частота
полных патоморфологических ответов в группе НАХТ составила 7%.
Помимо этого, проведение НАХТ
ассоциировалось со снижением патоморфологической стадии заболевания – при гистологическом исследовании опухоль, соответствующая
pT3-4, выявлялась у 77% больных в
группе НАХТ и у 94% в группе первичной хирургии.
Проведенный в данном исследовании анализ выживаемости демонстрирует отсутствие достоверного
влияния НАХТ на ближайший онкологических прогноз больных. Однако в отсутствие в открытом доступе
подробных данных уместно вспомнить про ряд прогностических факторов, способных повлиять на полученные результаты. Во-первых, ни в
критериях включения, ни в описании выборки не упоминается статус
MSI-H, ассоциирующийся с низкой
эффективностью химиотерапии и
высокой эффективностью предоперационной иммунотерапии [3],
что могло скомпрометировать показатели выживаемости. Во-вторых,
в литературе описана прямая связь
между глубиной патоморфологического ответа опухолей прямой кишки и показателями выживаемости
[4-5], что дополнительно мотивирует
применение противоопухолевой терапии при местнораспространенном
процессе. Наконец, одним из наиболее актуальных направлений клинической онкологии сегодня является
применение цоДНК ориентированного назначения пред-/послеоперационного системного лечения, в связи с чем было бы крайне интересно
посмотреть на корреляцию экспрессии цоДНК до/после хирургического
вмешательства с эффективностью
проводимой терапии, как это было
сделано в исследовании DYNAMIC
[6]. До тех пор, пока мы не увидим
ответы на подобные вопросы, отказ
от проведения НАХТ по-прежнему
может оставаться лишь одной из возможных опций, но никак ни однозначным методом выбора
Источники:
1. Schrag D, et al. Preoperative Treatment
of Locally Advanced Rectal Cancer. N
Engl J Med. 2023 Jul 27; 389(4): 322-334.
doi: 10.1056/NEJMoa2303269. Epub
2023 Jun 4. PMID: 37272534; PMCID:
PMC10775881.
2. Hu H, et al.; OPTICAL study group.
Neoadjuvant Chemotherapy With
Oxaliplatin and Fluoropyrimidine Versus
Upfront Surgery for Locally Advanced
Colon Cancer: The Randomized, Phase III
OPTICAL Trial. J Clin Oncol. 2024 Apr 2;
JCO2301889. doi: 10.1200/JCO.23.01889.
Epub ahead of print. PMID: 38564700.
3. Cercek A, et al. PD-1 Blockade in
Mismatch Repair-Deficient, Locally
Advanced Rectal Cancer. N Engl J Med.
2022 Jun 23; 386(25): 2363-2376. doi:
10.1056/NEJMoa2201445. Epub 2022
Jun 5. PMID: 35660797; PMCID:
PMC9492301.
4. Sell NM, et al. Ten-year survival after
pathologic complete response in rectal
adenocarcinoma. J Surg Oncol. 2021 Jan;
123(1): 293-298. doi: 10.1002/jso.26247.
Epub 2020 Oct 6. PMID: 33022797.
5. Ulusoy C, Kamalı GH, Nikolovski
A. Analysis of Survival in Complete
Pathological Response after Long-Course
Chemoradiotherapy in Patients with
Advanced Rectal Cancer. Curr Oncol. 2023
Jan 12; 30(1): 1054-1064. doi: 10.3390/
curroncol30010081. PMID: 36661730;
PMCID: PMC9857960.
6. Tie J, et al.; DYNAMIC Investigators.
Circulating Tumor DNA Analysis Guiding
Adjuvant Therapy in Stage II Colon Cancer.
N Engl J Med. 2022 Jun 16; 386(24): 2261-
2272. doi: 10.1056/NEJMoa2200075. Epub
2022 Jun 4. PMID: 35657320; PMCID:
PMC9701133.
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ / ВОЗМОЖНОСТИ И ПЕРСПЕКТИВЫ ПОДКОЖНОГО ВВЕДЕНИЯ ИММУНОТЕРАПЕВТИЧЕСКИХ ПРЕПАРАТОВ
Материал подготовил: И.М. Боровков
Иммунотерапия стала важным
компонентом системного противоопухолевого лечения, характеризующимся высокой длительностью терапии, достигающей у ряда больных
нескольких лет. При этом подобная
длительность лечения «привязывает» пациента к лечебному учреждению, вынуждая его совершать
регулярные визиты для проведения
очередной многочасовой инфузии,
что приводит к определенному снижению качества жизни и лишнему
напоминанию о факте заболевания.
Сегодня, в эру прецизионной медицины и персонализации медицинской помощи, улучшение качества
и комфорта жизни онкологических
больных является не менее важным
направлением развития науки, чем
увеличение показателей выживаемости, что мотивировало активное
изучение возможностей сокращения длительности инфузии и отказа от парентеральных форм введения в пользу транскутанного.
Впервые возможность подкожного введения иммунотерапевтических агентов была показана на
примере атезолизумаба в августе
2023 года в исследовании III фазы
IMscin001 [1]. В данный протокол
были включены пациенты с нерезектабельным немелкоклеточным
раком легкого (НМРЛ) III-IV ст.,
с противопоказаниями к проведению химиолучевой терапии,
отсутствием предшествующей
иммунотерапии в анамнезе и/или
неэффективностью первой линии
платиносодержащей химиотерапии. Атезолизумаб вводился подкожно (экспериментальная группа, n=247) в дозе 1875 мг (15 мл,
125 мг/мл) или внутривенно (контрольная группа, n=124) в дозе
1200 мг 1 раз в 3 недели. Авторы
показали, что атезолизумаб характеризовался схожей биодоступностью через 8 часов после 1 курса
в группах подкожного и внутривенного введения со средней концентрацией 89 нг/мл (коэффициент вариации (CV) – 43%) и 85
нг/мл (CV – 33%) соответственно
(рис.1).
Рисунок 1.
Средняя
концентрация атезолизумаба
через 8 часов после первого
введения
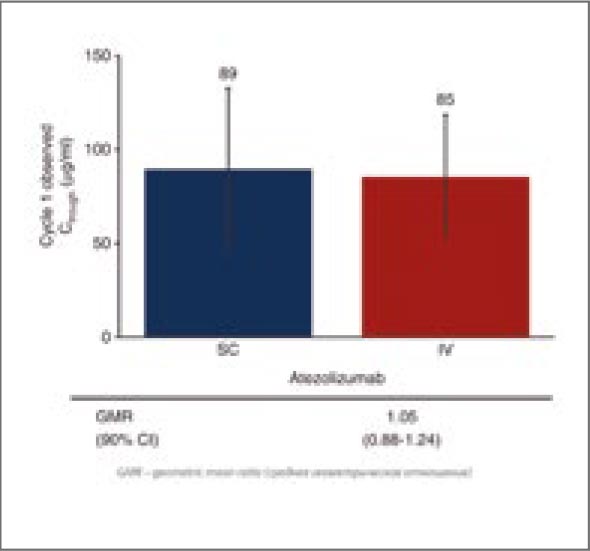
Эффективность терапии также
достоверно не различалась. При
медиане наблюдения в 4,7 мес.
медиана выживаемости без прогрессирования составила 2,7 мес.
в экспериментальной группе
против 2,8 мес. в группе контроля (ОР 1,08; 95% ДИ 0,82-1,41), а
объективный ответ опухоли был
выявлен у 12% и 10% пациентов
соответственно (рис.2). Профиль
безопасности был сопоставим
между группами с общей частотой нежелательных явлений (НЯ),
связанных с терапией, 37,7% в экспериментальной группе и 37,9%
в группе контроля. В то же время
подкожное введение ассоциировалось с несколько меньшей частотой НЯ 3-4 ст. – 17,8% против
25,8%, но сопровождалось большим числом местных реакций в
зоне введения (4,5% против 0%).
Продолжением данной работы
стало исследование IMscin002,
представленное в марте 2024 года
на конференции ELCC (European
Lung Cancer Conference) [2]. Авторы показали, что подкожное введение препарата являлось предпочтительным вариантом терапии
среди 70,3% пациентов по сравнению с 21,1% больных, выбравших
продолжение внутривенных введений. В качестве основных преимуществ транскутанной формы
терапии пациенты отмечали сокращение длительности пребывания в клинике (64,4%), меньший
дискомфорт при введении препарата (46%) и снижение чувства
тревоги (29,9%) (рис.3).
Рисунок 2.
Медианы выживаемости без прогрессирования и частота объективных ответов
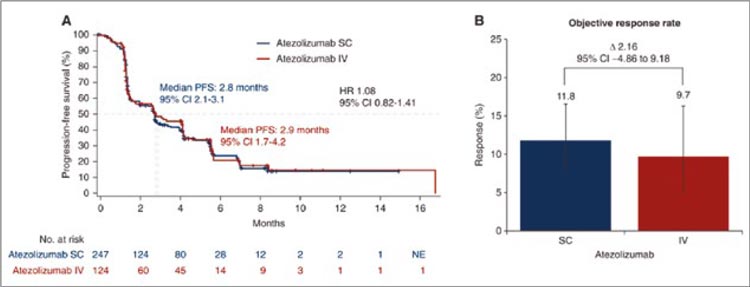
Рисунок 3.
Наиболее предпочтительная форма проведения иммунотерапии по результатам
IMscin002
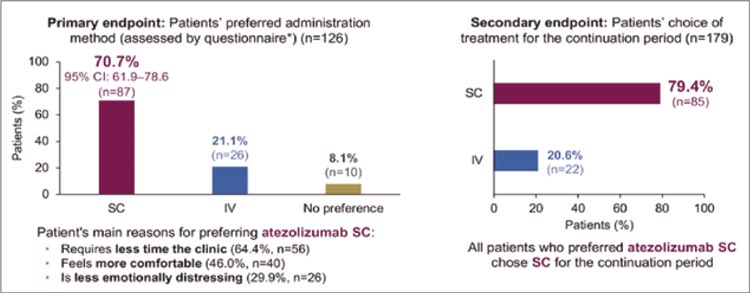
Таким образом, отказ от внутривенного введения препаратов в
пользу подкожных форм является
предпочтительным вариантом терапии, не приводящим (в отношении атезолизумаба) к ухудшению
онкологического прогноза больных
или увеличению риска нежелательных явлений и ассоциирующимся
с улучшением субъективной переносимости лечения. Конечно, для
полноценного смещения парадигмы
потребуется проведение большего
числа работ с подтверждением отсутствия негативного влияния на
показатели выживаемости, однако
имеющиеся данные уже демонстрируют перспективность и значимость
данного направления научной мысли.
Источники:
- Burotto M, et al. IMscin001 Part 2: a randomised phase III, openlabel, multicentre study examining the pharmacokinetics, efficacy, immunogenicity, and safety of atezolizumab subcutaneous versus intravenous administration in previously treated locally advanced or metastatic non-small-cell lung cancer and pharmacokinetics comparison with other approved indications. Ann Oncol. 2023 Aug; 34(8): 693-702. doi: 10.1016/j.annonc.2023.05.009. Epub 2023 Jun 1. Erratum in: Ann Oncol. 2024 Jan 8. PMID: 37268157.
- Cappuzzo F, et al. Primary results from IMscin002: A study to evaluate patient (pt)- and healthcare professional (HCP)- reported preferences for atezolizumab (atezo) subcutaneous (SC) vs intravenous (IV) for the treatment of NSCLC. European Lung Cancer Congress 2024, Abstract 244MO.
ЭФФЕКТИВНОСТЬ АЛПЕЛИСИБА В РЕАЛЬНОЙ КЛИНИЧЕСКОЙ ПРАКТИКЕ: ДАННЫЕ ТРЕТЬЕГО ПРОМЕЖУТОЧНОГО АНАЛИЗА ИССЛЕДОВАНИЯ PROSPERITY
Е.В. Артамонова1 , Л.Ю. Владимирова2 , Л.Г.Жукова3 , Е.В.Карабина4 , Е.И.Коваленко1 , Т.В.Виноградова5 , А.В.Шкрадюк6 , Р.С.Жихорев7 , Д.Ю.Юкальчук8 , Я.А.Тюгина9 , Н.В.Фадеева10, А.В.Емшанов11, Е.Н.Ногина12, Л.М.Воронкова13, А.С.Дергунов14, Е.И.Россоха15, Н.В.Леушина16, О.В.Миронов17, С.В.Аверьянова18, А.В.Султанбаев19, А.Ю.Горяинова20, Т.Ю.Семиглазова21, Р.П.Литвинов22
- ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, г. Москва;
- ФГБУ «НМИЦ онкологии» МЗ РФ, г. Ростов-на-Дону;
- ГБУЗ г. Москвы «МКНЦ им. А.С. Логинова» ДЗМ, г. Москва;
- ГУЗ «Тульский областной клинический онкологический диспансер», г. Тула;
- ГАУЗ СО «Свердловский областной онкологический диспансер», г. Екатеринбург;
- ГБУЗ РК «Крымский республиканский онкологический клинический диспансер имени В.М Ефетова», г. Симферополь;
- ГБУЗ «Московская городская онкологическая больница № 62 ДЗМ», г. Москва;
- ГБУЗ «Областной онкологический диспансер», г. Иркутск;
- ОБУЗ «Ивановский областной онкологический диспансер», г. Иваново
- ГАУЗ «Челябинский областной клинический центр онкологии и ядерной медицины» г. Челябинск;
- ГБУ РО «Онкологический диспансер», г. Ростов на Дону;
- ГБУЗ НО «Новосибирский областной клинический онкологический диспансер», г. Новосибирск;
- ГБУЗ «Республиканский онкологический диспансер» МЗ РСО-Алания, г. Владикавказ;
- ГБУЗ «Тверской областной клинический онкологический диспансер», г. Тверь;
- КГБУЗ «Алтайский краевой онкологический диспансер», г. Барнаул;
- БУЗ Удмуртской Республики «Республиканский клинический онкологический диспансер имени Сергея Григорьевича Примушко МЗ Удмуртской Республики», г. Ижевск;
- ГБУЗ «Тамбовский областной онкологический клинический диспансер» г. Тамбов;
- ГУЗ «Областной клинический онкологический диспансер» г. Саратов;
- ГАУЗ РКОД Минздрава РБ; г. Уфа
- ГБУЗ «Клинический онкологический диспансер № 1», г. Краснодар;
- ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, г. Санкт-Петербург;
- ГБУЗ МО «Подольская областная клиническая больница»; г. Подольск.
В настоящее время вопрос об оптимальной последовательности лечения метастатического гормонозависимого HER2- отрицательного рака молочной железы (HR+ HER2- мРМЖ) остается открытым. Для оценки ситуации в России было начато исследование PROSPERITY - проспективное наблюдательное исследование для описания клинических исходов, схем лечения, характеристик пациентов с HR+ HER2- мРМЖ, начинающих лечение рибоциклибом в комбинации с эндокринной терапией, алпелисибом в комбинации с фулвестрантом, моноэндокринной (моноЭТ) терапией или химиотерапией (ХТ) в реальной клинической практике в РФ. Основной целью PROSPERITY стала оценка продолжительности лечения рибоциклибом + ЭТ, алпелисибом + фулвестрантом, моноЭТ и ХТ в зависимости от линии терапии у женщин с HR+HER2- мРМЖ в рутинной практике [1]. В исследование были включены пациентки старше 18 лет c подтвержденным диагнозом местнораспространенного или метастатического HR+HER2- РМЖ (после прогрессирования на предшествующей терапии или de novo), которым была назначена терапия рибоциклибом, алпелисибом, моноЭТ или ХТ не более, чем за 4 недели до начала участия в исследовании [1].
На момент составления третьего промежуточного отчета (5
мая 2023 года) набор пациентов
в PROSPERITY продолжался. В
период с июля 2021 года до окончания сбора данных для третьего
промежуточного анализа в исследование было включено 2149
пациенток (65% от планируемого набора) с HR+HER2- рРМЖ в
64 онкологических центрах. Из
2149 пациенток в группу рибоциклиб + ЭТ было включено 1296
пациенток, в группу алпелисиб +
фулвестрант - 200, в группу моноЭТ - 336, в группу химиотерапии
- 317. Окончание набора запланировано на июль 2023 года, а окончание наблюдения - на июль 2025
года. Ключевые исходные (на дату
начала участия в исследовании)
демографические и клинические
характеристики представлены в
таблице.
Таблица.
Исходные демографические и клинические данные пациенток, включённых
в исследование PROSPERITY на дату окончания сбора данных для третьего промежуточного
анализа (05.05.2023)
Медиана возраста пациенток составила 60 лет (диапазон от 24 до 94 лет). Существенных различий по демографическим показателям между разными группами лечения не было. На момент включения в исследование у 98,7% пациенток были обнаружены метастазы РМЖ, причем более половины пациенток (59,2%) имели 4 и более метастазов. Чаще всего встречались костные (65,0%) и висцеральные (53,3%) метастазы. Более половины (57,8%) включенных в исследование пациенток имели оценку "1" по шкале ECOG. Третий промежуточный анализ данных исследования PROSPERITY позволяет сделать предварительные выводы о распределении видов лечения по линиям терапии (таблица). Назначение рибоциклиба + ЭТ происходит преимущественно в 1 и 2 линиях терапии, что соответствует международным и российским клиническим рекомендациям для лечения распространенного РМЖ: в группе рибоциклиб + ЭТ 62,1% пациентов получают терапию в 1 линии и 22,2% - во 2 линии. Алпелисиб + фулвестрант чаще назначают в поздних линиях терапии – большинство пациентов (36,0%) получают терапию в ≥4 линии, 24,5% - в 3 линии и только 34,0% - во 2 линии, в то время как опубликованные данные реальной клинической практики демонстрируют преимущество алпелисиба в комбинации с фулвестрантом перед стандартными видами терапии [2].
Стоит отметить, что по сравнению с первым промежуточным анализом данных (дата среза данных 01.06.2022), уровень тестирования на мутацию в гене PIK3CA в среднем вырос более, чем в 4 раза [3]. Если на момент первого промежуточно анализа в группе рибоциклиба тест был выполнен лишь у 7,2% пациенток, в группе моноЭТ – у 6,3%, в группе ХТ – у 18,3%, то на момент третьего промежуточного анализа в группе рибоциклиба, моноЭТ и ХТ доля пациенток, у которых был выполнен тест, составила 37,8%, 32,1% и 41,0% соответственно [3]. При этом частота встречаемости мутации в гене PIK3СA для разных групп находится в диапазоне 32- 37%, что соответствует ранее опубликованным данным по российской популяции пациентов [4,5]. Однако в каждой группе порядка 60% пациентам все еще не было проведено определение статуса мутации в гене PIK3CA, несмотря на то, что согласно клиническим рекомендациям, тестирование на наличие мутаций PIK3CA рекомендуется проводить всем пациентам с HR+HER2- рРМЖ при обнаружении первых признаков метастазирования, а также пациентам, получающим любой вид терапии метастатического РМЖ [6].
На момент составления третьего промежуточного анализа в группах рибоциклиб + ЭТ, моноЭТ и ХТ произошло недостаточно событий для оценки эффективности терапии. Далее будут представлены промежуточные результаты для группы алпелисиб + фулвестрант, в которой у 61 пациента из 115 (53%) наступили события, что позволяет провести промежуточный анализ времени до прекращения лечения по любой причине (time to treatment failure, TTF, первичная конечная точка), выживаемости без прогрессирования и общей выживаемости (вторичные конечные точки). Медиана продолжительности наблюдения в группе алпелисиба составила 6,0 месяцев.
В группе препарата алпелисиб медиана TTF составила 6,2 месяца (95% ДИ: 5,1-7,2), мВБП - 6,7 месяцев (95% ДИ: 6,1 – 8,3), а мОВ - 19,3 (95% ДИ: 13,0 – НД).
Учитывая, что в исследовании PROSPERITY алпелисиб назначался в более поздних линиях, чем в исследовании BYLieve, сравнивать полученные результаты сложно. Однако, несмотря на то что в исследовании PROSPERITY пациенты были более предлеченными, мВБП была выше, чем в когорте С исследования BYLieve (мВБП 5,6 месяца, 35% пациентов получали алпелисиб в качестве терапии второй линии и 60% - в качестве терапии третьей линии) [7]. В ретроспективном исследовании реальной практики, представленном O'Shaughnessy J. et al., у пациентов, получавших алпелисиб после предшествующего применения фулвестранта, мВБП в 3 линии составила 4,0 месяца [8]. Полученные данные следует интерпретировать с осторожностью, поскольку более высокий показатель мВБП может быть обусловлен меньшей частотой снижения дозы алпелисиба в PROSPERITY по сравнению с BYLieve, а также меньшей частотой применения химиотерапии (11,5% в PROSPERITY против 36,5% в когорте С BYLieve). Кроме того, популяция, набранная в более поздних линиях в PROSPERITY, может быть обогащена пациентами с более индолентным течением РМЖ и более высокой мВБП.
На момент составления третьего промежуточного отчета хотя бы одно нежелательное явление (НЯ) было отмечено у 432 (32,8%) из 1316 пациентов в группе рибоциклиба; у 111 (47,2%) из 235 пациентов в группе алпелисиба, у 68 (14,8%) из 460 в группе моноЭТ и у 160 (30,9%) из 518 пациентов в группе химиотерапии. НЯ были второй по частоте причиной (после прогрессирования заболевания) прекращения лечения (популяция для оценки безопасности включала пациентов, которые были изначально распределены в группы исследования, а также тех, кто был переведен из одной группы в другую). Доля пациентов, навсегда прекративших лечение по причине НЯ, составила 2,7% в группе рибоциклиба (36/1316), 8,0% в группе алпелисиба (19/235) и 3,8% в группе ХТ (12/317). В группе моноЭТ никто из пациентов не прекратил лечение по причине НЯ. Доля пациентов, у которых была снижена первоначальная доза препарата, не превышала 10% во всех группах.
В PROSPERITY частота снижения дозы алпелисиба составила 7% (16/235), а частота отмены терапии из-за НЯ – 8,0% (19/235), 10/235 (4,2%) пациентов прекратили прием алпелисиба из-за гипергликемии, 1,3% (3/235) - из-за диареи, 0,9% (2/235) - из-за сыпи. Следует отметить, что в исследовании SOLAR-1 частота снижения дозы и частота прекращения из-за НЯ составили 63,9% и 25% соответственно [8]. Подобная разница может быть связана с более эффективной профилактикой основных нежелательных явлений – гипергликемии и сыпи [9-11]. Таким образом, результаты третьего промежуточного анализа данных исследования PROSPERITY дают предварительное представление о демографических и клинических характеристиках пациенток с HR+HER2- рРМЖ, которые получают терапию рибоциклибом, алпелисибом, моноЭТ или ХТ в условиях рутинной клинической практики в России и позволяют сформулировать предварительные выводы об эффективности изучаемых подходов:
- В рутинной практике врачи назначают рибоциклиб преимущественно в 1-2 линиях терапии, в то время как алпелисиб чаще назначают в более поздних линиях (34,0% во 2 линии, 24.5% в 3 линии, 36,0% в ≥ 4 линии);
- Уровень тестирования PIK3CA остается низким, в то время как определение мутации в гене PIK3CA рекомендовано всем пациентам с HR+HER2- мРМЖ (только 30% пациентов были протестированы в группе рибоциклиб + ЭТ и других группах);
- Данные промежуточного анализа эффективности алпелисиба согласуются и даже превосходят ранее опубликованные результаты клинических исследований;
- Частота НЯ и отмены лечения изза НЯ в исследовании PROSPERITY ниже, чем в клинических исследованиях (8% против 25% в исследовании SOLAR-1), что может свидетельствовать как об эффективной профилактике НЯ, так и о проблемах с их репортированием в рутинной практике.
На момент составления отчета данные по эффективности были еще
незрелыми, требуется более продолжительное время наблюдения; окончательные результаты исследования
PROSPERITY с полным анализом
эффективности различных видов
терапии HR+ HER2- рРМЖ в реальной практике по отдельным линиям
терапии будут представлены в рамках финального отчета. Сравнение
с данными клинических исследований, представленное выше, имеет
определенные ограничения и должно интерпретироваться с осторожностью как косвенное сравнение,
проведенное с использованием несопоставимых выборок и исходных
характеристик пациентов.
Литература:
1. Sokolova TN, Aleksakhina SN, Yanus GA, Sultanbaev AV, Menshikov KV, Lysenko AN, Zukov RA, Zyuzyukina AV, Mu
2. runova YuN, Rossokha EI, Bakharev SY, Basova EA, Kasmynina TA, Shumskaya IS, Bakshun YaI, Musaeva KS, Khasanova AI, Dmitri
3. evVN, BolievaMB, Gadzaova CH, Petrenko OL, Maksimov DA, Vladimirov VI, Goldberg VE, Popova NO, Kibisheva MV, Khamgo
4. kovZM, VasilyevAE, Iyevleva AG, Imyanitov EN. The frequency and spectrum of PIK3CA mutations in patients with estrogen re
5. ceptor-positive HER2-negative advanced breast cancer residing in various regions of Russia. Journal of Modern Oncology. 2021; 6. 23 (1): 61–67. DOI :10.26442/18151434.2021.1.200744
7. Литература:
8. 1. Study Protocol CLEE011ARU01: A prospective observational study to describe clinical outcomes, treatment patterns, patients characteristics among patients with HR+/HER2-advanced BC initiating treatment with Risarg® (ribociclib), Piqray® (alpelisib), endocrine therapy or chemotherapy in routine clinical practice in Russia (PROSPERITY). Available at: https://clinicaltrials.gov/ct2/show/ NCT04943497. Дата последнего доступа: 02.11.2023.
9. 2. Turner S et al. Oncologist. 2021;26(7):e1133-e1142.
10.3. Артамонова Е.В., Владимирова Л.Ю., Жукова Л.Г. с соавт. Промежуточные данные исследования PROSPERITY – проспективного наблюдательного исследования по оценке клинических исходов, схем лечения и характеристик пациенток с HR+ HER2- распространенным РМЖ, получающих лечение с применением препарата рибоциклиб, препарата алпелисиб, эндокринной терапии или химиотерапии в условиях рутинной клинической практики в России. Газета RUSSCO. 2023; 3. http://gazeta. russco.org/vypusk032023 Дата последнего доступа на сайт: 02.11.2023.
11.4. Соколова Т.Н. с соавт. Клинико-морфологические особенности опухолей молочной железы с мутациями PIK3CA у российских больных: наблюдательное исследование. Современная Онкология. 2022;24(1):12–23. DOI: 10.26442/18151434.2022.1.201435
12.5. Rajadurai P. et al. PIK3CA Registry: A Noninterventional, Descriptive, Retrospective Cohort Study of PIK3CA Mutations in Patients With Hormone Receptor-Positive (HR+), Human Epidermal Growth Factor Receptor 2-Negative (HER2−) Advanced Breast Cancer (ABC). Presented at SABCS 2021. P5-13-25.
13.6. Клинические рекомендации. Рак молочной железы. 2021. https:// cr.minzdrav.gov.ru/recomend/379_4 (Дата последнего доступа 02.11.2023).
14.7. Chia S, et al. Alpelisib + endocrine therapy in patients with PIK3CA-mutated, hormone receptor– positive, human epidermal growth factor receptor 2–negative, advanced breast cancer: Analysis of all 3 cohorts of the BYLieve study.J Clin Oncol. 2023 41:16_ suppl, 1078-1078.
15.8. O'Shaughnessy J. et al. Journal of Clinical Oncology 2022 40:16_suppl, 1055-1055.
16.9. Мазурина Н.В., Артамонова Е.В., Белоярцева М.Ф. и др. Консенсус по профилактике и коррекции гипергликемии у пациентов, получающих терапию препаратом алпелисиб. Современная Онкология. 2020; 22 (4): 56–59. Шливко И.Л., Гаранина О.Е., Артамонова Е.В., Ганьшина И.П., Жукова Л.Г., Королева И.А., Миченко А.В., Семиглазова Т.Ю., Филоненко Д.А. Консенсус по профилактике и коррекции сыпи у пациентов, получающих терапию препаратом алпелисиб. Современная Онкология. 2021;23(4):572–576. DOI: 10.26442/18151434.2021.4.201275
17. 10. Filonenko D. and Zhukova
L. Prophylactic use of metformin in
patients on alpelisib treatment. Journal
of Clinical Oncology 2022 40:16_suppl,
e13040-e13040.