Дорогие коллеги, дорогие читатели апрельского номера газеты!
Наша работа всегда была, есть и будет немалой частью нашей жизни. Именно любимое дело по- *** Над домами, домами, домами голубые висят облака — вот они и останутся с нами на века, на века, на века. Только пар, только белое в синем над громадами каменных плит… никогда никуда мы не сгинем, Мы прочней и нежней, чем гранит. Пусть разрушатся наши скорлупы, геометрия жизни...
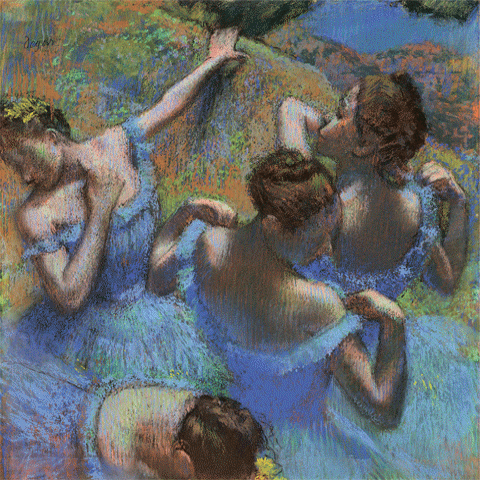
Эдгар Дега
Голубые танцовщицы. 1987. Бумага, пастель. 65 × 65 см. Музей искусств им. А. С. Пушкина, Москва
***
Над домами, домами, домами голубые висят облака — вот они и останутся с нами на века, на века, на века. Только пар, только белое в синем ....
ИТОГИ РЕАЛИЗАЦИИ В 2021 ГОДУ НАЦИОНАЛЬНОЙ ПРОГРАММЫ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ «СОВЕРШЕНСТВОВАНИЕ МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКОЙ ДИАГНОСТИКИ В РОССИЙСКОЙ ФЕДЕРАЦИИ С ЦЕЛЬЮ ПОВЫШЕНИЯ ЭФФЕКТИВНОСТИ ПРОТИВООПУХОЛЕВОГО ЛЕЧЕНИЯ»
В 2021 году Российское общество клинической онкологии отмечало 10-летний юбилей Национальной Программы RUSSCO «Совершенствование молекулярно-генетической диагностики в Российской Федерации с целью повышения эффективности противоопухолевого лечения»

ОНКОЛИТИЧЕСКИЕ ВИРУСЫ В СОЧЕТАНИИ С НИВОЛУМАБОМ ДЕМОНСТРИРУЮТ УСТОЙЧИВЫЙ ОТВЕТ ПРИ НЕМЕЛАНОМНОМ РАКЕ КОЖИ ГОЛОВЫ И ШЕИ
Внутриопухолевое введение онколитического вируса RP1 в комбинации с ингибитором точек иммунного контроля ниволумабом продемонстрировало устойчивую противоопухолевую активность у...

КОНФЕРЕНЦИЯ RUSSCO
ОНКО-УРОЛОГИЯ

РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС - 2022
Открытый прием заявок
ОДОБРЕНО FDA В МАРТЕ
11 марта 2022 г. Управление по контролю над качеством пищевых продуктов и лекарственных средств США (FDA) одобрило олапариб в адъювантной терапии раннего HER2-негативного рака молочной железы (РМЖ) у пациентов группы высокого риска с герминальными клинически значимыми мутациями в генах BRCA1 и BRCA2 (gBRCAm). Регистрация олапариба в качестве адъювантной...
ПУБЛИКАЦИИ В КРУПНЫХ НАУЧНЫХ ЖУРНАЛАХ
24 марта 2022 г. в журнале The New England of Medicine опубликованы результаты исследования 3 фазы DESTINY-Breast03, одного из самых ярких исследований 2021 года, целью которого было сравнение эффективности трастузумаба дерукстекана и трастузумаба эмтанзина в поздних линиях терапии HER2-позитивного рака молочной железы (РМЖ)...

10 ЛЕТ НАЦИОНАЛЬНОЙ ПРОГРАММЕ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ
СОВЕРШЕНСТВОВАНИЕ МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКОЙ ДИАГНОСТИКИ В РОССИЙСКОЙ ФЕДЕРАЦИИ

ДИСКУССИОННАЯ СЦЕНА.
«To PORT or not to PORT» – это, пожалуй, одна из наиболее дискутабельных тем в радиационной онкологии последних лет. При этом крупные рандомизированные исследования, такие как Lung-ART...

ЛЕКАРСТВЕННАЯ ТЕРАПИЯ ОПУХОЛЕЙ ЖКТ С АКЦЕНТОМ НА РАМУЦИРУМАБ
Рамуцирумаб – гуманизированное моноклональное антитело к рецепторам сосудисто-эндотелиального фактора роста 2 типа, является стандартом лекарственной терапии 2-й линии при...

ОНКОПСИХОЛОГИЯ В РОССИИ: ВЕЛИЧИНА ПРОБЛЕМЫ
Возьмем обычный российский город – региональный центр под названием Ульяновск. Великая река Волга, на берегах которой располагается город, в этом месте самая широкая и местами напоминает...

Микеланджело Буонарроти.
Сотворение Адама. ок. 1511?, фрагмент

ОНКОПСИХОЛОГИЯ: ИСТОРИЯ ВОПРОСА
Мы живем в такое время, когда врачу онкологу просто невозможно работать, не зная основ онкопсихологии. Много лет я практикую, имея вторую специальность – психолог. Эта рубрика явилась

ESMO VIRTUAL SAMMIT RUSSIA

МЕТАБОЛИЧЕСКАЯ ТЕРАПИЯ И ЕЕ ПЕРСПЕКТИВЫ В ЛЕЧЕНИИ БОЛЬНЫХ СО ЗЛОКАЧЕСТВЕННЫМИ ОПУХОЛЯМИ
Одним из признаков злокачественной опухоли является изменение метаболических свойств клеток [1]. К ним относятся:

ПОДМЕЧЕНО ОНКОЛОГОМ: БУДЕМ ЖИТЬ!
«Путевые заметки и короткие эссе из жизни онколога стали неотъемлемой частью жизни практикующего врача»

ОПДИВО+ЕВРОЙ
Для лечения опухолей ЖКТ
Анонс
-

15 -16 апреля 2022
конференция RUSSCO ОПУХОЛИ ЖКТ
-

28-29 апреля 2022
конференция RUSSCO ОНКО-УРОЛОГИЯ
-

19 -20 мая 2022
VIII РОССИЙСКАЯ КОНФЕРЕНЦИЯ ПОДДЕРЖИВАЮЩАЯ ТЕРАПИЯ В ОНКОЛОГИИ
Дорогие коллеги, дорогие читатели апрельского номера газеты!
Наша работа всегда была, есть и будет немалой частью нашей жизни. Именно любимое дело по- *** Над домами, домами, домами голубые висят облака — вот они и останутся с нами на века, на века, на века. Только пар, только белое в синем над громадами каменных плит… никогда никуда мы не сгинем, Мы прочней и нежней, чем гранит. Пусть разрушатся наши скорлупы, геометрия жизни земной, — оглянись, поцелуй меня в губы, дай мне руку, останься со мной. А когда мы друг друга покинем, ты на крыльях своих унеси только пар, только белое в синем, голубое и белое в си… Борис Рыжий. Над домами зволяет сохранять хладным ум в трудные дни, и, уверена, многие из нас сейчас посвящают большую часть времени именно работе. Мероприятия Российского общества клинической онкологии – это не просто возможность получать новые знания, информацию о результатах недавних исследований, но и поддерживать прежний ритм жизни, несмотря на неопределенность и нервозность текущих дней. В апреле нас ждут три больших конференции RUSSCO – по иммуноонкологии, опухолям ЖКТ и онкоурологии, причем последняя конференция проводится впервые. Семинары и вебинары также пройдут в соответствии с расписанием, а оргкомитет ежегодного Российского онкологического конгресса вплотную начал подготовку к крупнейшему научному мероприятию ноября. Ждем ваших предложений по программе конгресса, чтоб сделать ее максимально интересной для каждого из вас!
В апрельском номере газеты помимо новостей из крупных журналов, данных о новых препаратах, одобренных к применению, традиционной Дискуссионной сцены, посвященной спорной проблеме – адъювантной лучевой терапии немелкоклеточного рака легкого – мы открываем Уголок онкопсихолога, полагая, что информация об этом аспекте нашей работы, незаслуженно обойденном стороной в процессе подготовки онколога, окажется полезной.
Теплого и плодотворного апреля вам, дорогие коллеги! Не забывайте помимо работы и всяческих забот радоваться солнцу, восхищаться нежными красками весны, от которых так отвык глаз за полгода зимней серости, перелистывать альбомы с картинами любимых художников, слушать музыку, смотреть фильмы, читать и перечитывать прозу и стихи, проводить время с близкими – ощущая жизнь во что бы то ни стало.
Команда RUSSCO
Эдгар Дега
Голубые танцовщицы. 1987. Бумага, пастель. 65 × 65 см. Музей искусств им. А. С. Пушкина, Москва
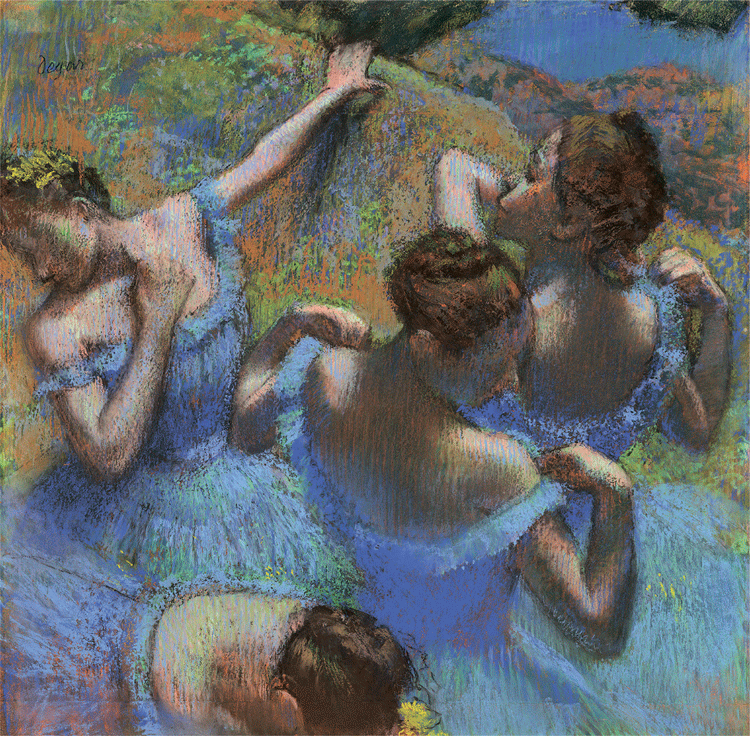
***
Над домами, домами, домами
голубые висят облака —
вот они и останутся с нами
на века, на века, на века.
Только пар, только белое в синем
над громадами каменных плит…
никогда никуда мы не сгинем,
Мы прочней и нежней, чем гранит.
Пусть разрушатся наши скорлупы,
геометрия жизни земной, —
оглянись, поцелуй меня в губы,
дай мне руку, останься со мной.
А когда мы друг друга покинем,
ты на крыльях своих унеси
только пар, только белое в синем,
голубое и белое в си…
Борис Рыжий.
Над домами
ИТОГИ РЕАЛИЗАЦИИ В 2021 ГОДУ НАЦИОНАЛЬНОЙ ПРОГРАММЫ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ «СОВЕРШЕНСТВОВАНИЕ МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКОЙ ДИАГНОСТИКИ В РОССИЙСКОЙ ФЕДЕРАЦИИ С ЦЕЛЬЮ ПОВЫШЕНИЯ ЭФФЕКТИВНОСТИ ПРОТИВООПУХОЛЕВОГО ЛЕЧЕНИЯ»
В 2021 году Российское общество
клинической онкологии отмечало
10-летний юбилей Национальной
Программы RUSSCO «Совершенствование молекулярно-генетической диагностики в Российской
Федерации с целью повышения эффективности противоопухолевого
лечения»
За время существования Программы
силами врачей, Общества и партнеров удалось объединить в единую
сеть специализированные Центры
молекулярной диагностики, в которых осуществляются высокотехнологичные диагностические процедуры,
что дало толчок к развитию молекулярно-генетической диагностики в
Российской Федерации. За 10 лет мы
смогли привлечь в Программу более
2600 онкологов, включить в работу 85
регионов России.
Биообразцы пациентов направлялись
в 43 лаборатории, включая референсные лаборатории в рамках ОМС, было
выполнено 141 601 тестов для пациентов с различными злокачественными
опухолями, пациенты получили возможность определить их прогноз и
определиться с тактикой лечения, что
является огромным достижением.
В 2021 году в рамках Программы было
продиагностировано 12 304 пациентов, выполнено 15 117 тестов, из них
6124 теста – методом NGS. Осуществлена маршрутизация образцов в 8
лабораторий и референсные центры,
где проведено 2183 тестов в рамках
программы Госгарантий. В тестирования были включены новые нозологии:
уротелиальный рак и рак предстательной железы. Запущены новые виды
тестирований – HRR при раке предстательной железы и FGFR при уротелиальном раке.
Из 12 304 пациентов было протестировано 4752 мужчин (38,6%) и 7552
женщин (61,4%). По количеству пациентов традиционно «лидирует» ЦФО
– 3735 человек, Сибирский ФО – 2208,
Приволжский ФО – 2118, Северо-Западный ФО – 1391, Уральский ФО –
918, ДВФО – 896, ЮФО – 768, СевероКавказский ФО – 270 человек.
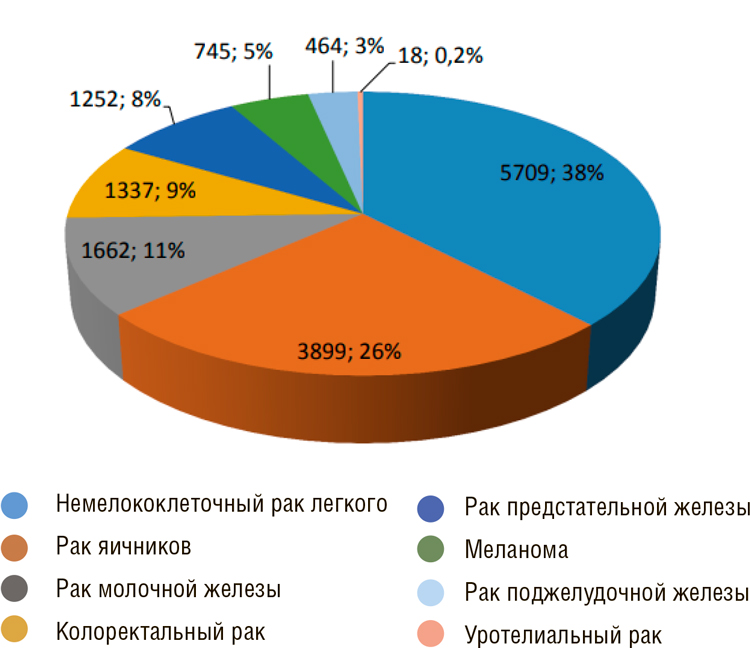
38% тестов по Программе выполнено
для нозологии НМРЛ, при раке яичников – более 26%, остальные нозологии
(колоректальный рак, рак молочной
железы и рак предстательной железы)
в примерно одинаковых пропорциях.
При раке поджелудочной железы и
уротелиальном раке выполнено пока
небольшое количество тестов.
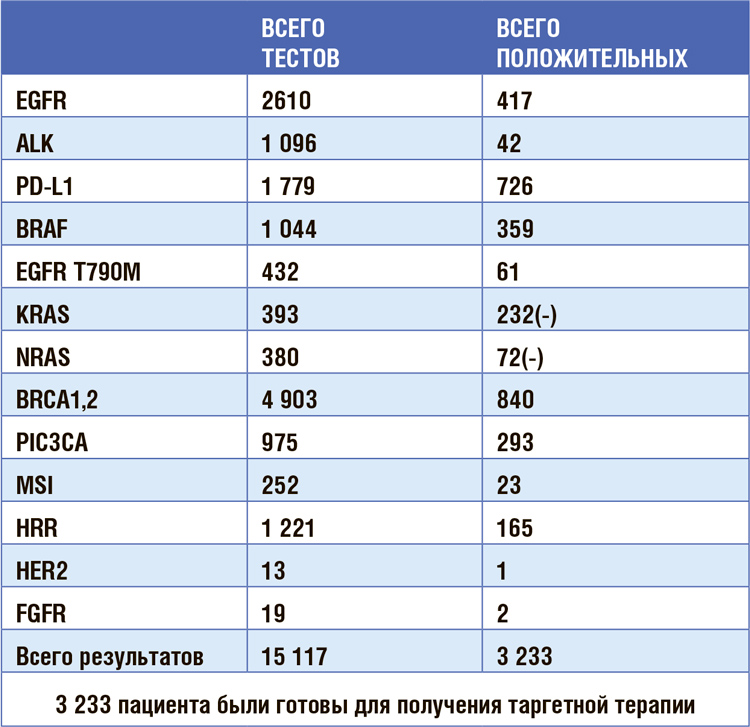
В рамках Программы проводились исследования генетических нарушений
генов EGFR, BRAF, PIK3CA, FGFR,
методом NGS тестировались гены
BRCA1/2 и HRR, транслокации ALK,
исследование уровня экспрессии PDL1. На рисунке представлены данные
по количествам выполненных тестов
и положительных результатов, возглавляют же таблицу по количествам
тестов BRCA и EGFR.
Общее число пациентов, для которых
результаты теста оказались значимыми для выбора терапии, составило
3233 человек.
КОЛИЧЕСТВО ТЕСТОВ ЗА ПЕРИОД 2012-2021

Российское общество клинической
онкологии с 2021 года реализует свой проект по контролю качества: проведены раунды внутреннего контроля качества по EGFR (г. Воронеж),
PIK3CA при поддержке ООО «Новартис Фарма» (для 13 лабораторий Программы), также проведены 2 раунда
международного контроля качества
EMQN при поддержке ООО «АстраЗенека Фармасьютикалз». Удалось
обеспечить схемами внешнего контроля качества 35 лабораторий из 21
региона: по EGFR (35 лабораторий),
BRCA (16 лабораторий), HRR (7 лабораторий).
В августе стартовал пилотный проект «Программа контроля качества по
определению мутаций в гене EGFR».
Первым участником этого проекта
стала лаборатория молекулярной генетики Воронежского областного патологоанатомического Бюро (БУЗ ВО
ВОПАБ).
С 8 декабря 2021 года лаборатория ВО
ПАБ г. Воронеж приступила к выполнению исследований в рамках Программы. Лаборатория определяет мутации в гене EGFR в образцах опухоли
пациентов с диагнозом рак легкого.
Качество выдаваемых лабораторией
результатов было подтверждено Программой контроля качества по определению мутаций в гене EGFR и участием в Международной программе
внешнего контроля качества EMQN.
ВСЕГО
ТЕСТОВ
ВСЕГО
ПОЛОЖИТЕЛЬНЫХ
EGFR 2610 417
ALK 1 096 42
PD-L1 1 779 726
BRAF 1 044 359
EGFR T790M 432 61
KRAS 393 232(-)
NRAS 380 72(-)
BRCA1,2 4 903 840
PIC3CA 975 293
MSI 252 23
HRR 1 221 165
HER2 13 1
FGFR 19 2
Всего результатов 15 117 3 233
3 233 пациента были готовы для получения таргетной терапии
При поддержке компании «Новартис»
в 2021 году осуществлен контроль качества PIK3CA (гормонорецептор-положительный HER2-отрицательный
метастатический рак молочной железы) в 13 лабораториях.
Благодарим экспертов по контролю
качества Демидову Ирину Анатольевну, к.м.н., заведующую молекулярнобиологической лабораторией МГОБ
№62 ДЗ Москвы, и Филипенко Максима Леонидовича, к.б.н., заведующего лабораторией фармакогеномики
ИХБФМ СО РАН, за разработку протоколов контроля качества по EGFR и
PIK3CA (соответственно), подготовку
необходимого комплекта биообразцов для валидируемых лабораторий,
за интерпретацию и оценку результатов.
В 2021 году в рамках Программы обществом проделана большая работа:
• проведены 5 образовательных мероприятий, школ молекулярных генетиков для сотрудников центров, врачей-онкологов: 20-21 мая 2021 – Воронеж, 7-8 июня 2021 – Владивосток, 13-14 июля 2021 – Томск, 11 ноября 2021 – Москва, 10 декабря 2021 – Москва;
• 2 рабочих совещания – 17 февраля
2021 и 19 августа 2021 (в формате
онлайн);
• осуществлен проект «Оценка опыта
применения автоматической системы «Идилла» для выполнения молекулярно-генетических исследований
в патоморфологической лаборатории
методом ПЦР в реальном времени» в
ГКБ 40, Коммунарка,
г. Москва, и ОКОД г. Ярославль.
ЧИСЛО ТЕСТОВ В КАЖДОЙ НОЗОЛОГИИ, N=15 117
РЕЗУЛЬТАТЫ ТЕСТИРОВАНИЯ 2021
КОНТРОЛЬ КАЧЕСТВА МГД 2021.

В планах контроля качества на 2022 год:
1. Создание собственного контроля
качества лабораторий:
• RAS (10 лабораторий), экспертная группа – Цуканов А.С., д.м.н., ГНЦК им. Рыжих, г. Москва; Моляка Ю.К., к.м.н., ГБУЗ КОД №1, г. Краснодар;
• BRAF (9 лабораторий), экспертная группа – Бодунова Н.А., к.м.н., МКНЦ им. Логинова, г. Москва; Повилайтите П.Е., к.б.н., ГУЗ РО «Патологоанатомическое бюро», г. Ростов-на-Дону; Национальный БиоСервис, СПб.
2. Организация проведения
международного контроля качества
EMQN (при поддержке спонсоров)
– BRAF при меланоме и PIK3CA при
РМЖ.
Соколова О.В., заместитель медицинского директора по программе
молекулярно-генетической диагностики Российского общества клинической онкологии»
ОНКОЛИТИЧЕСКИЕ ВИРУСЫ В СОЧЕТАНИИ С НИВОЛУМАБОМ ДЕМОНСТРИРУЮТ УСТОЙЧИВЫЙ ОТВЕТ ПРИ НЕМЕЛАНОМНОМ РАКЕ КОЖИ ГОЛОВЫ И ШЕИ
Автор: Болотина Лариса Владимировна
МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ
радиологии» Минздрава России, Москва
Внутриопухолевое введение онколитического вируса RP1 в комбинации с ингибитором точек иммунного контроля ниволумабом
продемонстрировало устойчивую
противоопухолевую активность у
пациентов с немеланомным раком
головы и шеи, согласно данным,
представленным на Междисциплинарном симпозиуме по опухолям
головы и шеи в 2022 году. Результаты исследования I/II фазы IGNYTE
подтвердили устойчивое клиническое преимущество у большинства пациентов, получавших комбинированный вариант лечения,
включая достижение ответов при
четырех различных типах опухолей
(плоскоклеточный рак, ангиосаркома, карцинома Меркеля и базальноклеточная карцинома).
Авторы исследования также сообщили о том, что регрессия опухоли
наблюдалась как в очагах введения
вируса, так и в тех, которые не подвергались введению препарата, что
расценивалось как системный иммунный ответ. Медиана длительности ответа на момент среза данных
достигнута не была.
Профессор Jiaxin Niu, заместитель
директора программы по раку легкого и директор программы по ОГШ
в Banner MD Anderson Cancer Center,
заявил, что очень впечатлен значимой частотой полных регрессий при
плоскоклеточном раке. Около 50%
больных в данной когорте достигли
полного ответа, что является абсолютно беспрецедентным.
Предпосылки и детали
исследования
RP1 – онколитический вирус простого герпеса 1 с усиленной активностью (HSV-1), который экспрессирует сливающий (фузогенный)
гликопротеин также, как гранулоцитарно-макрофагальный колониестимулирующий фактор. Талимоген лагерпарепвек (Talimogene
laherparepvec), являющийся HSV-1
первого поколения, был одобрен
FDA для лечения распространенной
меланомы и в настоящее время рутинно используется в клинической
практике.
«Онколитические вирусы длительное время изучались в качестве
противоопухолевой иммунотерапии, – сообщил д-р Ниу. – Биоинженерные вирусы могут избирательно
инфицировать и реплицировать в
опухолевых клетках, запуская их
иммуногенную гибель. Это может
приводить к активации врожденного и адаптивного иммунитета».
Согласно утверждению д-ра Ниу,
доклинические исследования RP1
продемонстрировали его высокую
противоопухолевую активность и
иммунноопосредованную гибель
опухолевых клеток.
Часть открытого мультицентрового мультикогортного исследования
II фазы IGNYTE объединила около
270 пациентов из 5 когорт, включая
30 участников с немеланомными
опухолями кожи без предшествующего лечения PD-1/PD-L1 ингибиторами. Включенные пациенты получали внутриопухолевое введение
RP1 (до 10 мл) в один или несколько
поверхностных и/или более глубоко
расположенных (в т.ч. висцеральных) очагов. После инъекций проводилось системное введение ниволумаба. Комбинированное лечение
осуществлялось в течение 8 циклов
с последующей поддерживающей
терапией ниволумабом. Допускалось дополнительное использование
RP1 с/без применения ниволумаба.
Первичной целью была оценка частоты объективного ответа (ЧОО)
и безопасности терапии. Вторичные
конечные точки включали длительность ответа, частоту полного ответа (ПО), частоту контроля над заболеванием (ЧКЗ), выживаемость без
прогрессирования (ВБП), а также
1-годичную и 2-летнюю общую выживаемость (ОВ).
Около 50% больных достигли ПО.
Д-р Ниу сообщил об особенно высоком уровне ПО среди больных с
плоскоклеточным раком кожи. Из
15 пациентов, включенных в данную
когорту, 7 достигли ПО.
При сравнении результатов исследования с иммунотерапией семиплимабом (cemiplimab-rwlc) при
плоскоклеточном раке кожи, который позволил достичь ПО у 7-15%,
д-р Ниу назвал уровень ПО на терапию RP1 в сочетании с ниволумабом, равный 47%, поразительным и
беспрецедентным. Более того, при
добавлении к непосредственным результатам частичного ответа и стабилизации ЧКЗ увеличилась до 70%
у больных плоскоклеточным раком
кожи, достигнув клинической значимости на изученном варианте
комбинированной терапии.
Кроме того, многообещающий уровень ответа был зафиксирован для
ангиосаркомы, карциномы Меркеля
и базальноклеточного рака.
Профиль безопасности
Комбинация внутриопухолевого
введения RP1 с чек-пойнт ингибитором имела удовлетворительную
переносимость. У нескольких участников были отмечены симптомы
простуды, включая умеренную температуру и озноб, которые обычно
сопровождали первые два введения
препарата. У одного пациента наблюдалось развитие иммуноопосредованного миокардита, что было
связано с применением ниволумаба.
Кроме того, автор исследования отметил, что для введения препарата
в висцеральные очаги требуется
привлечение интервенционного
радиолога с возможностью использования дополнительной УЗ или КТ
навигации.
Полученные данные поддерживают обоснованность проводимого
в настоящее время регистрационного клинического исследования
CERPASS, в котором изучается комбинация RP1 с семиплимабом в
сравнении с монотерапией семиплимабом при плоскоклеточном
раке кожи (значительная часть пациентов, включенных в исследование, будет иметь локализацию первичной опухоли на коже головы и
шеи).
Экспертное мнение
По мнению профессора Faye M.
Johnson из Техасского Университета
MD Anderson Cancer Center, предварительные результаты выглядят
очень впечатляющими. Уровень
объективного ответа оказался несколько выше, чем можно было
ожидать от монотерапии PD1 ингибитором, а уровень ПО – существенно выше. Если достигнутый ответ
будет устойчивым, комбинация PR1
с ниволумабом представляется отличной опцией для пациентов с распространенным плоскоклеточным
раком кожи при наличии очагов,
подходящих для внутриопухолевого введения препарата.
Основные положения
• Комбинация ниволумаба с внутриопухолевым введением онколитического вируса RP1 в целом хорошо переносится и обеспечивает высокую противоопухолевую активность у пациентов с немеланомными опухолями, локализующимися на коже головы и шеи.
• Исследование включало участников из США, Великобритании и Европы
Источник:
Niu J, Milhem M,
Vanderwalde AM, et al. Safety
and efficacy of RP1 + nivolumab in
patients with non-melanoma skin
cancer of the head and neck: Results
from IGNYTE phase 1/2 multi-cohort
clinical trial. 2022 Multidisciplinary
Head and Neck Cancers Symposium.
Abstract 12. Presented February 25,
2022.
КОНФЕРЕНЦИЯ RUSSCO
ОНКО-УРОЛОГИЯ

РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС - 2022

ОДОБРЕНО FDA В МАРТЕ
ОЛАПАРИБ В АДЪЮВАНТНОЙ ТЕРАПИИ ПРИ РАННЕМ BRCA-АССОЦИИРОВАННОМ
РАКЕ МОЛОЧНОЙ ЖЕЛЕЗЫ С ВЫСОКИМ РИСКОМ РЕЦИДИВА
11 марта 2022 г. Управление по контролю над качеством пищевых продуктов и лекарственных средств
США (FDA) одобрило олапариб
в адъювантной терапии раннего
HER2-негативного рака молочной
железы (РМЖ) у пациентов группы
высокого риска с герминальными
клинически значимыми мутациями
в генах BRCA1 и BRCA2 (gBRCAm).
Регистрация олапариба в качестве
адъювантной терапии проведена на
основании данных, полученных в исследовании OlympiA.
Исследование OlympiA
OlympiA – многоцентровое рандомизированное исследование 3 фазы,
в котором изучалась целесообразность назначения олапариба в течение 1 года у больных ранним РМЖ
с gBRCAm, ранее получавших адъювантную или неоадъювантную терапию.
Критериями включения были:
• для пациентов, получивших неоадъювантную терапию, – наличие инвазивной резидуальной опухоли в молочной железе или лимфатических узлах (RCB II-III);
• для пациентов, получивших адъювантную терапию, при трижды
негативном РМЖ – pT ≥2 или
pN+, а при гормонозависимом РМЖ – поражение метастазами ≥4
регионарных лимфатических узлов
и высокий риск рецидива по CPSEG (score CS+EG >3).
Пациенты, включенные в исследование, должны были завершить все запланированные курсы химиотерапии и лучевую терапию как минимум за 2 недели до начала приема олапариба. Пациенты c гормонозависимым РМЖ получали олапариб в комбинации с гормонотерапией. Первичной конечной точкой исследования была выживаемость без инва
Всего 1836 пациентов рандомизированы в две лечебные группы (1:1):
• олапариб 300 мг 2 раза в день per os ежедневно в течение 1 года;
• плацебо 2 раза в день per os ежедневно в течение 1 года.зивного рака молочной железы
(IDFS), вторичными – общая выживаемость и безопасность.
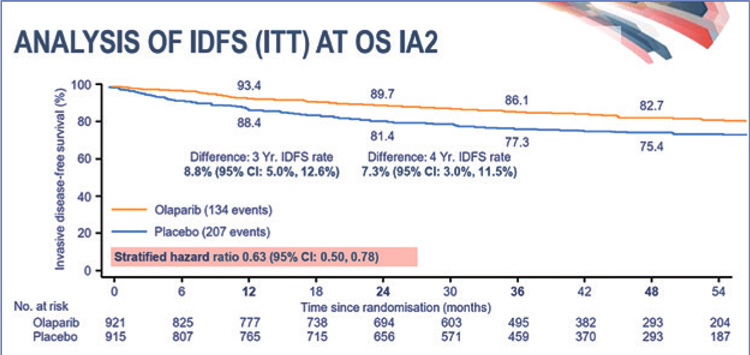
В марте 2022 г. представлены обновленные результаты исследования
OlympiA. Назначение олапариба позволило статистически значимо увеличить трехлетнюю IDFS с 77,3% до
86,7% и четырехлетнюю IDFS с 75,4%
до 82,7% (рис.1).
Рисунок 1.
Выживаемость без инвазивного рака молочной
железы.
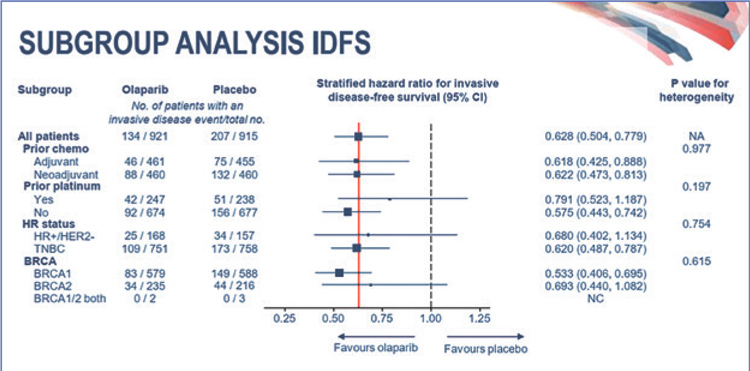
При подгрупповом анализе показано, что преимущество от назначения
олапариба в IDFS не зависело от назначения адъювантной или неоадъювантной терапии, максимальный
выигрыш отмечен у пациентов с
ТНРМЖ, не получавших платиносодержащую химиотерапию, и с мутациями в гене BRCA1 (рис.2).
Рисунок 2.
Подгрупповой анализ.
Токсичность терапии была ожидаемой и управляемой. Нежелательные
явлеРЕЛАТЛИМАБ В КОМБИНАЦИИ С НИВОЛУМАБОМ В ПЕРВОЙ ЛИНИИ ТЕРАПИИ
МЕТАСТАТИЧЕСКОЙ МЕЛАНОМЫния в группе олапариба и плацебо не превышали 1-2 степени и были
представлены тошнотой (57% и 25%),
слабостью (40% и 27%), анемией (24%
и 4%), рвотой (23% и 8%), головной болью (20% и 17%), диарей (18% и 14%),
нейтропенией (16% и 7%), лейкопенией (16% и 6%) и снижением аппетита (13% и 6%) соответственно. НЯ 3
степени и более зарегистрированы у
24,5% в группе олапариба и у 11,3% в
группе плацебо и послужили причиной прекращения лечения у 10,8% и
4,6% пациентов соответственно.
Источники:
1. A.N.J. Tutt, J. Garber, R.D. Gelber, K-A. Phillips, A. Eisen, O.T. Johannsson. VP1-2022: Pre-specified event driven analysis of Overall Survival (OS) in the OlympiA phase III trial of adjuvant olaparib (OL) in germline BRCA1/2 mutation (gBRCAm) associated breast cancer. Published: March 16, 2022.
2. Сайт FDA.
РЕЛАТЛИМАБ В КОМБИНАЦИИ С НИВОЛУМАБОМ В ПЕРВОЙ ЛИНИИ ТЕРАПИИ
МЕТАСТАТИЧЕСКОЙ МЕЛАНОМЫ
18 марта 2022 г. Управление по контролю над качеством пищевых продуктов и лекарственных средств
США (FDA) также одобрило релатлимаб в комбинации с ниволумабом
(OPDUALAG) в первой линии терапии метастатической меланомы.
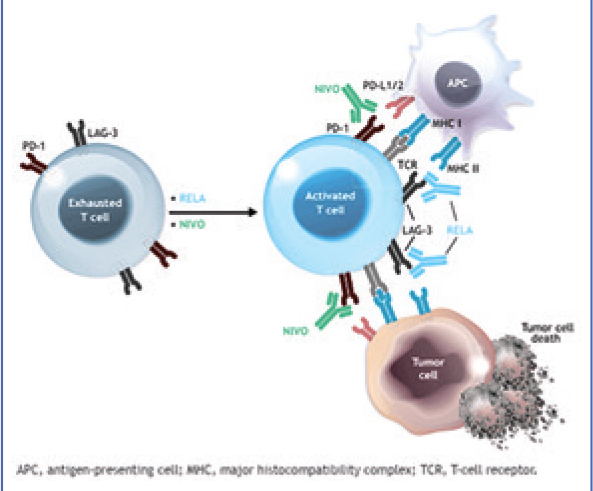
Релатлимаб – моноклональное антитело (IgG4), которое блокирует взаимодействие между рецептором
LAG-3 и его лигандами – главным
комплексом гистосовместимости 2
класса (MHC II) и FGL1. LAG-3 – экспрессируется на активированных
CD4+ и CD8+ Т-клетках, а также на
естественных киллерах (NK-клетках).
Связывание LAG-3 с MHC II и FGL1
приводит к ингибированию пролиферации и активации Т-клеток и нарушению их эффективной функции.
Релатлимаб потенциирует иммунный
ответ посредством блокады связывания LAG-3 с MHC II и FGL1 (рис.3).
RELATIVITY-047 – исследование II/
III фазы, в котором изучалась комбинация релатлимаба и ниволумаба в
сравнении с монотерапией ниволумабом в первой линии лечения метастатической меланомы.
Рисунок 3.
Механизм действия
релатлимаба в комбинации
с ниволумабом.
Пациенты были рандомизированы в 2 лечебные группы (1:1):
• ниволумаб 480 мг в/в капельно 1 раз в 4 недели (n=359);
• ниволумаб 480 мг в/в капельно
в комбинации с релатлимабом 160 мг в/в кап. 1 раз в 4 недели
(OPDUALAG) (n=355).
Лечение продолжалось до прогрессирования заболевания, неприемлемой
токсичности или отзыва согласия.
Пациенты были стратифицированы
в лечебные группы в зависимости от
уровня экспрессии LAG-3 (≥1% или
<1%) и PD-L1 (≥1% или <1%), BRAF
статуса и распространенности заболевания.
Первичной конечной точкой исследования была выживаемость без прогрессирования (ВБП), вторичными –
общая выживаемость (ОВ) и частота
объективного ответа (ЧОО).
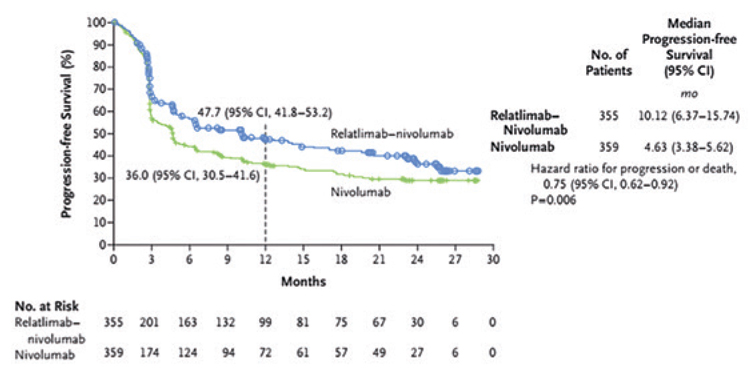
При медиане времени наблюдения в
13,2 мес. медиана ВБП в группе комбинированной терапии достигла
10,12 мес. против 4,63 мес. в группе
ниволумаба (ОР=0,75; 95% ДИ 0,62-
0,92; р=0,006), при 12-месячной ВБП в
47,7% и 36,0% соответственно. Таким
образом, добавление релатлимаба к
ниволумабу в общей группе больных
позволило снизить риск прогрессирования на 25% (рис.4).
Рисунок 4.
Выживаемость без прогрессирования в общей группе
больных.
При подгрупповом анализе было показано, что у пациентов с PD-L1 ≥1
монотерапия ниволумабом значимо
не уступает по эффективности комбинации и достигает 14,7 мес. против
15,7 мес. (ОР=0,95; 95% ДИ 0,68-1,33).
Максимальное преимущество от
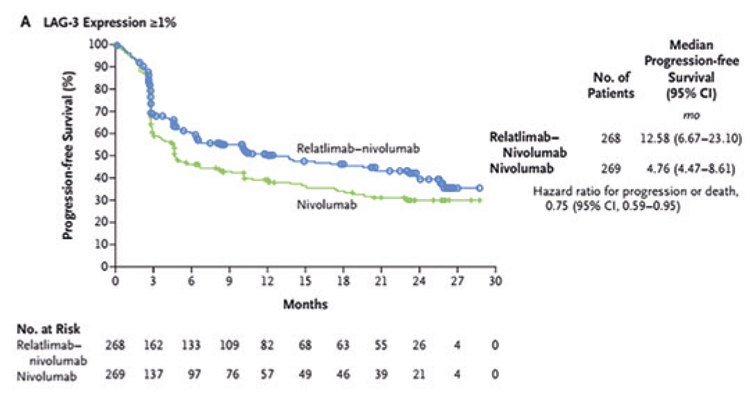
добавления релатлимаба было достигнуто при экспрессии LAG-3 ≥1%,
его добавление позволило увеличить
медиану ВБП с 4,76 мес. до 12,58 мес.
(ОР=0,75; 95% ДИ 0,59-0,95) (рис.5).
НЯ) любой степени были зарегистрированы у 97,2% пациентов в
группе комбинированной иммунотерапии и у 94,4% в группе только ниволумаба и были преимущественно
представлены зудом (23,4% и 15,9%),
слабостью (23,1% и 12,8%), сыпью
(15,5% и 12,0%), артралгией (14,4% и
7,2%), гипотиреозом (14,4% и 12,0%),
диареей (13,5% и 9,2%) и витилиго
(10,4% и 9,7%). НЯ 3 степени и выше
отмечены у 40,3% и 33,4 % больных и
послужили причиной прекращения
лечения в 14,6% и 6,7% случаях соответственно.
Рисунок 5.
Выживаемость без прогрессирования при LAG-3 ≥1%.
Трое пациентов погибли на фоне
терапии в группе с релатлимабом,
причинами смерти стали пневмонит,
отек легких и гемофагоцитарный
лимфогистиоцитоз. В группе ниволумаба смерть, связанная с лечением,
зарегистрирована у 2 больных (сепсис и пневмония).
Источники:
1. Сайт FDA.
2. Hussein A. Tawbi, Dirk
Schadendorf, Evan J. Lipson. N Engl J
Med. 2022; 386: 24-34. DOI: 10.1056/
NEJMoa2109970.
ПУБЛИКАЦИИ В КРУПНЫХ НАУЧНЫХ ЖУРНАЛАХ
ТРАСТУЗУМАБ ДЕРУКСТЕКАН И ТРАСТУЗУМАБ ЭМТАНЗИН В ПОЗДНИХ ЛИНИЯХ
ТЕРАПИИ HER2-ПОЗИТИВНОГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ. РЕЗУЛЬТАТЫ
ИССЛЕДОВАНИЯ DESTINY-BREAST03
24 марта 2022 г. в журнале The
New England of Medicine опубликованы результаты исследования
3 фазы DESTINY-Breast03, одного из самых ярких исследований
2021 года, целью которого было
сравнение эффективности трастузумаба дерукстекана и трастузумаба эмтанзина в поздних линиях терапии HER2-позитивного
рака молочной железы (РМЖ).
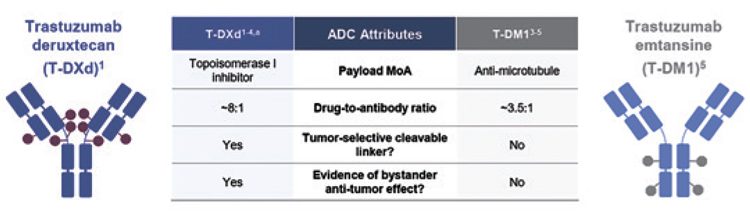
Трастузумаб дерукстекан (T-DXd)
и трастузумаб эмтанзин (T-DM1)
являются конъюгатами гуманизированного моноклонального
антитела (IgG1) к рецептору HER2
и цитостатика (рис.1).
Рисунок 1.
Трастузумаб дерукстекан и трастузумаб эмтанзин,
структура.
В исследование DESTINY-Breast03
были включены пациенты, ранее
получавшие терапию таксанами
и трастузумабом по поводу диссеминированного или местнораспространенного неоперабельного HER2-позитивного РМЖ.
В исследование рандомизировано 524 пациента (1:1):
• трастузумаб дерукстекан 5,4 мг/ кг в/в капельно 1 раз в 3 недели (n=261);
• трастузумаб эмтанзин 3,6 мг/
кг в/в капельно 1 раз в 3 недели
(n=263).
Первичной конечной точкой исследования была выживаемость
без прогрессирования (ВБП), вторичными – общая выживаемость,
частота достижения объективного ответа и токсичность терапии.
При медиане времени наблюдения в 16,2 мес. и 15,3 мес. медиана ВБП в группе T-DXd не была достигнута, а в группе T-DM1
составила 6,8 мес. (ОР=0,28; 95%
ДИ 0,22-0,37; p<0,001), при 12-месячной ВБП в 75,8% и 34,1% соответственно (рис.2). При подгрупповом анализе показано,
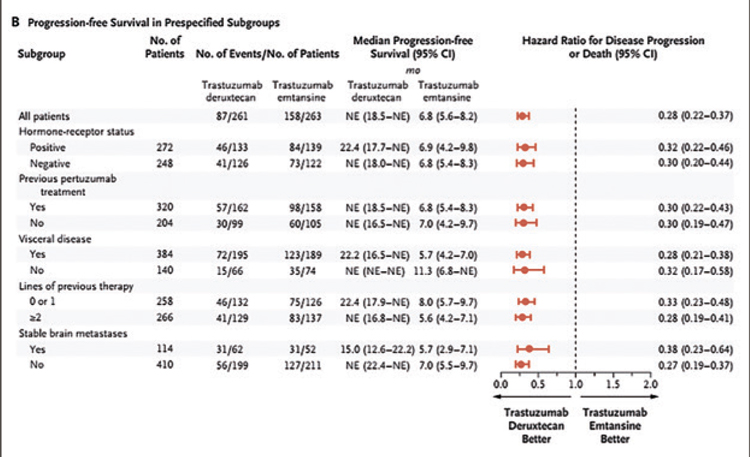
что терапия T-DXd в сравнении
с T-DM1 позволяет значимо увеличить медиану ВБП независимо
от рецепторного статуса опухоли,
терапии пертузумабом в анамнезе, наличия висцеральных метастазов и метастазов в головной
мозг и количества предшествующих линий лекарственного лечения (рис.3).
Рисунок 2.
Выживаемость без прогрессирования.
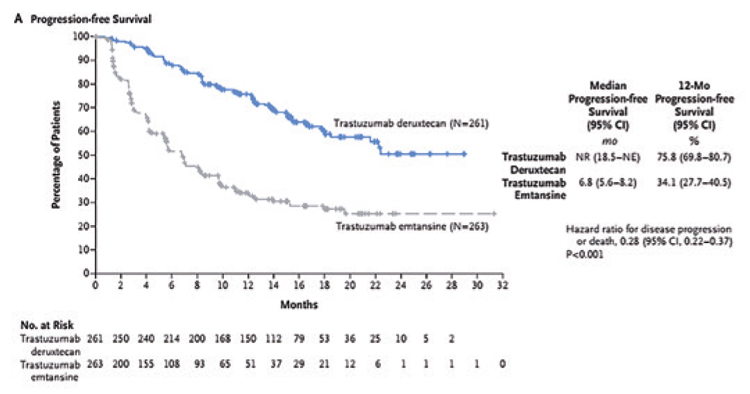
Рисунок 3.
Подгрупповой анализ эффективности трастузумаба
дерукстекана и трастузумаба эмтанзина.
Частота достижения объективного ответа достигла 79,7% (16,1%
– полный ответ) в группе T-DXd
и 34,2% (8,7% – полный ответа) в
группе T-DM1.
Частота развития нежелательных
явлений (НЯ) любой степени составила 98,1% и 86,6% в группах
T-DXd и T-DM1, при частоте НЯ
3 степени и более в 52,1% и 48,3%
соответственно. НЯ ≥3 в группах
T-DXd и T-DM1 были представлены нейтропенией (19,1% и 3,1%),
анемией (5,8% и 4,2%), тромбоцитопенией (7,0% и 24,9%), слабостью (5,1% и 0,8%), повышением
уровня АСТ (0,8% и 5,0%) и АЛТ
(1,6% и 4,6%). Ни одной смерти,
связанной с терапией, в группах
зарегистрировано не было.
Пневмонит на фоне терапии
T-DXd был зарегистрирован у 27
пациентов (10,5%): 1 степени – у 7
больных, 2 степени – у 18 и 3 степени – в 2 случаях.
Источник:
J. Cortés, S.B. Kim, W.
P. Chung, S.A. Im, Y.H. Park, et al.
Trastuzumab Deruxtecan versus
Trastuzumab Emtansine for Breast
Cancer. N Engl J Med. 2022; 386: 1143-
54. DOI: 10.1056/NEJMoa2115022.
PACIFIC-6: ПЕРСПЕКТИВА ДЛЯ ВОЗРАСТНЫХ
И ОСЛАБЛЕННЫХ ПАЦИЕНТОВ
С НЕРЕЗЕКТАБЕЛЬНЫМ НМРЛ III СТАДИИ
Результаты исследования II фазы
PACIFIC-6 по применению консолидирующей иммунотерапии дурвалумабом после завершенного
последовательного химиолучевого
лечения у больных с нерезектабельным НМРЛ III стадии были представлены на Европейском конгрессе
по раку легкого 31 марта 2022 года.
До сих пор дурвалумаб был рекомендован для поддерживающей терапии у пациентов без прогрессии
после радикального одновременного химиолучевого лечения, однако
далеко не все пациенты способны
перенести подобный вариант комбинации химиотерапии и ионизирующего излучения в силу его большей
токсичности и своей ослабленности.
Исследование PACIFIC-6, включившее 117 больных с нерезектабельным НМРЛ и серьезной сопутствующей патологией либо в статусе
ECOG 2 балла, имело своей главной
целью определение частоты развития осложнений 3-4 степени. В
течение 6 месяцев эта частота составила 4,3% (5 пациентов, из них у
2 – пневмонит). В течение всего периода лечения (медиана – 32 недели)
побочные эффекты любой степени
были отмечены у 77% больных, и у
19% - 3-4 степени, что привело к прерыванию лечения у 21% и 16%, соответственно. Самой частой причиной
оказался пневмонит (10%).
Изначальная ослабленность пациентов и невозможность проведения
более токсичного, но более эффективного одновременного химиолучевого лечения, подразумевают худшие отдаленные результаты. По
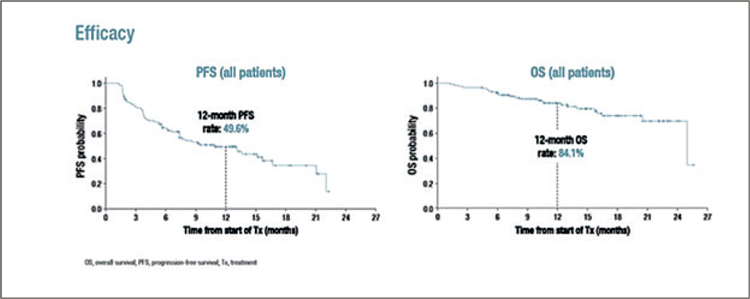
данным PACIFIC-6, медиана ВБП
составила 10,9 мес., а одногодичная
ВБП – 49,6% (рис.1). При этом медиана общей выживаемости оказалась
равна 25 мес. - выше, чем это удавалось достичь ранее при проведении
только ХЛТ, тем более у ослабленных больных.
Таким образом, несмотря на относительно небольшое количество пациентов в исследовании, но именно
тех, кто всегда представлял наибольшую проблему для мультидисциплинарного консилиума (в возрасте старше 65 лет, с сопутствующей
патологией и ECOG 2), токсичность
лечения оказалась сопоставимой с
таковой из исследования PACIFIC, и
первые отдаленные результаты обнадеживают.
Рисунок 1.
Эффективность дурвалумаба после последовательной
ХЛТ у больных с нерезектабельным НМРЛ 3 стадии (European Lung
Cancer Congress 2022, Abstract 108MO).
Источник:
Garassino MC, et al. Safety
and efficacy outcomes with durvalumab
after sequential chemoradiotherapy
(sCRT) in Stage III, unresectable
NSCLC (PACIFIC-6). European Lung
Cancer Congress 2022, Abstract 108MO
10 ЛЕТ НАЦИОНАЛЬНОЙ ПРОГРАММЕ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ

ДИСКУССИОННАЯ СЦЕНА.
Автор: Гордон Константин Борисович
МРНЦ им. А. Цыба – филиала ФГБУ «НМИЦ радиологии»
Минздрава России, Обнинск
ПОСЛЕОПЕРАЦИОННАЯ ЛУЧЕВАЯ ТЕРАПИЯ
НЕМЕЛКОКЛЕТОЧНОГО РАКА ЛЕГКОГО: ДА ИЛИ НЕТ?
Аргументы ЗА
«To PORT or not to PORT» – это,
пожалуй, одна из наиболее дискутабельных тем в радиационной
онкологии последних лет. При этом
крупные рандомизированные исследования, такие как Lung-ART
(2021) и PORT (1998), вроде бы, ставят однозначную точку в данном
вопросе: послеоперационная лучевая терапия не показана рутинно
больным немелкоклеточным раком
легких с N2 при условии полной резекции.
Однако при внимательном рассмотрении результатов складывается
впечатление, что все не так уж однозначно.
Итак, целесообразность проведения послеоперационной лучевой
терапии (PORT) у радикально прооперированных больных немелкоклеточным раком легкого вот уже
на протяжении более 2 десятков лет
волнует умы исследователей и практикующих врачей – с тех пор, как в
конце 90-х годов 20 века появились
результаты первого крупного метаанализа, продемонстрировавшего
крайне негативное влияние облучения на общую выживаемость прооперированных больных [1]. Однако
важным было то, что все же нашлась
группа больных, у которых PORT не
ухудшала, а, пожалуй, даже немного
улучшала результаты лечения – это
пациенты с НМРЛ III стадии и N2.
Еще одним существенным недостатком данного метаанализа (с современной точки зрения) было то, что из почти 2000 включенных больных большая часть получала даже не конформную, а просто 2D-лучевую терапию, при котором огромный объем здоровой ткани, как легочной, так и средостения, в том числе сердце, получали значительную лучевую нагрузку. До начала активного и повсеместного внедрения технологий 3D-конформной ЛТ и модуляции интенсивности пучка излучения еще должно было пройти несколько лет. А основные неудачи применения PORT как раз и были, как сразу отметили авторы, связаны именно с неожиданно высокой токсичностью облучения, в том числе результирующего снижения показателей выживаемости. И также не стоит забывать о том, что в те времена было принято облучать все группы лимфоузлов средостения, а не выборочно, как это делается сейчас. Очевидно, такой подход только увеличивал токсичность лечения. Еще одним серьезным недостатком анализа является неоднородность доз и режимов фракционирования. В метаанализ были включены как классические режимы по 2 Гр до 60 Гр, так и скорее паллиативные, к примеру, 30 Гр за 10 фракций.
Но самым шокирующим итогом стал сам факт того, что PORT заметно ухудшала результаты лечения больных с НМРЛ – как минимум на 7% в течение 2 лет наблюдения (95% CI 3-10), снижая ОВ с 55% до 48%. Эти цифры во многом сформировали мнение о целесообразности PORT на десятилетия вперед, оставив для дискуссии лишь одну группу – с N2 и III стадией.
Шли годы, развивались технологии, добавлялись новые исследования в «копилку» работ по адъювантному облучению при раке легкого, но ситуация оказывалась прежней: добавление лучевой терапии, по уже сформированному мнению исследователей, не только не улучшало, но даже ухудшало общую выживаемость прооперированных пациентов.
На протяжении нескольких лет, тем не менее, международные клинические рекомендации включали лучевой метод на адъювантном этапе, но только для определенной категории пациентов – с R+ резекцией и поражением лимфоузлов средостения (N2), именно благодаря одному выводу метаанализа 1998 года. Более того, ряд исследований продемонстрировал преимущества облучения у таких больных, в частности, данные крупного анализа на основе Национальной базы данных США от Robinson et al. [2], однако четких доказательств этого не было, поскольку данные были преимущественно ретроспективными. Тем не менее, прибавка в выживаемости была весьма ощутимой: медиана ОВ составила 45 против 40 месяцев (без PORT), а 5-летняя ОВ – 39,3% против 34,8% (без PORT).
В этой связи отчаянно требовались результаты проспективных рандомизированнЭто исследование стало основным аргументом специалистов, выступающих против применения PORT у пациентов с N2. Однако если присмотреться внимательно, то вывод, сделанный главным исследователем Cecile Le Pechoux, – это то, что только 3D-конформная PORT не может быть рекомендована как стандарт адъювантного лечения больных с II/III стадией НМРЛ с N2: «Lung ART evaluated 3D conformal PORT after… Conformal PORT cannot be recommended as the standard of care».ых исследований. Главным нерешенным вопросом попрежнему оставался только один: дает ли PORT преимущества у пациентов с вовлеченными лимфоузлами средостения (N2)? Результаты долгожданного рандомизированного исследования 3 фазы Lung ART были представлены на конгрессе ESMO в 2020 году, публикация появилась ближе к началу 2022 года [3]. Lung ART, инициированное еще в 2007 году, было призвано оценить роль адъювантного облучения средостения с применением современных технологий лучевой терапии у адекватно стадированных и радикально прооперированных больных НМРЛ с N2. Всего 501 пациент был включен, из них 252 получали PORT в течение 5 недель, а 249 вошли в контрольную группу. В итоге выживаемость без прогрессирования составила 47,1% с PORT и 43,8% в группе наблюдения, без статистической достоверности (p=0,16), общая выживаемость за 3 года оказалась также сопоставима (66,5% с PORT против 68,5% в контроле). При этом PORT почти наполовину снизила риск рецидива в средостении (25% против 46%) – но ценой более высокой сердечно-легочной токсичности, ставшей причиной смерти у 16,2% больных против 2,0% в группе контроля. В целом кардиопульмональные осложнения 3-4 степени отмечены у 10,8% пациентов после PORT и у 4,9% из наблюдаемых больных.
Это исследование стало основным
аргументом специалистов, выступающих против применения PORT
у пациентов с N2. Однако если присмотреться внимательно, то вывод,
сделанный главным исследователем
Cecile Le Pechoux, – это то, что только 3D-конформная PORT не может
быть рекомендована как стандарт
адъювантного лечения больных с
II/III стадией НМРЛ с N2: «Lung
ART evaluated 3D conformal PORT
after… Conformal PORT cannot
be recommended as the standard of
care».
В отношении иных методик лучевой
терапии (IMRT, VMAT, протоны)
этот вопрос по-прежнему остается
открытым, так как фактором, определяющим прогноз выживаемости,
и здесь оставалась преимущественно лучевая токсичность.
Свою лепту в эту неопределенность
в отношении места PORT вносил
и тот факт, что проблемой клинических исследований была, есть и
будет некая «стерильность» среды,
когда в анализ включаются специально отобранные клинические случаи, идет абсолютное соблюдение
протокола, а пациенты добросовестно выполняют все рекомендации.
Сомнительные случаи безжалостно
отсеиваются, и вот мы уже имеем
приемлемые для авторов результаты
В медицине существует немало
примеров, когда препарат или метод лечения, демонстрировавший
эффективные результаты во время идеальных условий проведения
протокола, с треском проваливался
в «реальной» жизни. Увы, но и врачи, и пациенты, и даже сотрудники
фармацевтической фабрики, расфасовывающие таблетки по блистерам,
– все могут допускать преднамеренные, но чаще – непреднамеренные
ошибки.
Если же мы берем наш конкретный
случай послеоперационного облучения рака легкого, то сразу же сталкиваемся с огромным количеством
вовлеченных специалистов, начиная от хирургов и патоморфологов
и заканчивая физиками и лучевыми
терапевтами.
Проспективное рандомизированное исследование китайских авторов PORT-c [4], на наш взгляд, в
очередной раз поставило жирное
многоточие на проблеме послеоперационного облучения больных с
резектабельным НМРЛ III стадии
с поражением лимфоузлов средостения (N2), предоставив скорее
больше аргументов «за», чем «против». За период с 2009 по 2017 год
были рандомизированы 394 пациента с IIIA pN2 стадией НМРЛ, но
в окончательный анализ вошли 364
больных (184 в группе PORT, 180 в
группе контроля). Трехлетняя ВБП
в группе PORT составила 40,5% против 32,7% в контрольной группе,
при этом медиана выживаемости
также была выше в группе PORT –
22,6 мес. против 18,6 мес. в контроле
(HR 0,84; 95% CI 0,65-1,09; P=0,20).
И вновь, несмотря на номинально
превосходящие результаты в группе
PORT, статистической значимости
они не возымели.
Однако когда авторы проанализировали результаты лечения 310
больных, лечение и наблюдение за
которыми велось в абсолютном соответствии с протоколом исследования, значимые различия в ВБП в
пользу группы PORT все же были
найдены (42,8% против 30,6%; HR
0,75; 95% CI 0,57-1,00; P=0,05). Выживаемость без локальных рецидивов ожидаемо и значимо была выше
в исследуемой группе (71,9% против
58,4%; HR 0,56; 95% CI 0,39-0,80).
Особенно стоит отметить, что авторы провели фактически несколько
статистических анализов, включая:
1) всю популяцию (mITT), 2) строгих приверженцев протокола (PP),
3) пролеченных «как есть» (AT).
Ни один из аналитических подходов
не продемонстрировал убедительного влияния PORT на общую выживаемость, хотя в группе PP было
отмечено увеличение ВБП после
проведения облучения (HR 0,75).
Среди факторов, которые затрудняют правильную интерпретацию
данных, авторы отмечают именно
невысокую степень приверженности лечению. Как было уже отмечено ранее, это частое явление, и
мы все понимаем, что «идеальных»
пациентов просто не существует и
всегда могут быть отклонения от запланированного курса лечения. Мы
живем в реальном мире, в котором
достаточно большое количество непрогнозируемых интеракций, потенциально влияющих на исходы
лечения, и это не всегда касается
именно медицинской части. Поэтому очень важен выбор метода терапии, который будет полезен вне зависимости от строгости следования
протоколу.
Компилируя полученные данные с
результатами LungART, наши китайские коллеги также делают вывод о том, что проведение послеоперационной конформной! лучевой
терапии при IIIA pN2 стадии и полной резекции опухоли не улучшает
результаты лечения в целом, хотя
имеются и некоторые положительные моменты (например, локальный контроль, приемлемая токсичность и т.д.).
Время и технологии не стоят на месте. То же исследование Lung-ART,
PORT-С и, в первую очередь, PORT
метаанализ были инициированы
в конце 80-х – начале 2000-х годов,
когда о массовом использовании
модулированных методик облучения только начинали мечтать.
Значит ли это, что современная
PORT может улучшить результаты
лечения больных НМРЛ N2? Вполне
возможно.
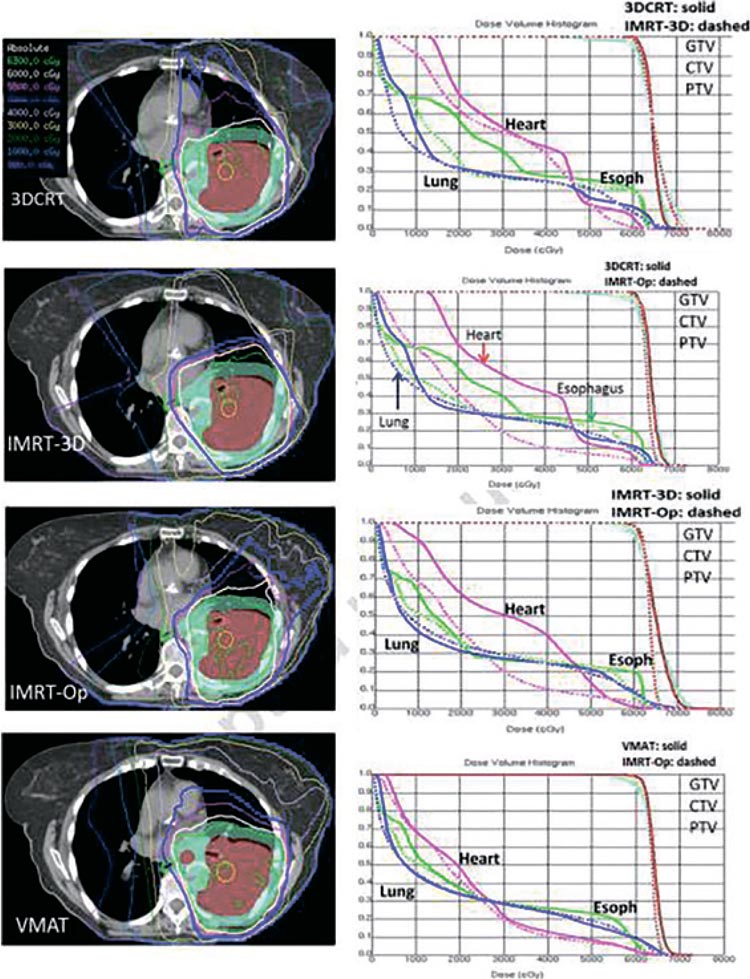
Так, в 2015 году руководитель службы лучевой терапии MD Anderson
профессор Chang делает однозначный вывод о необходимости использования только модулированных методик (рис.1) при облучении
рака легкого, в ином же случае токсичность лечения может нивелировать потенциальные выигрыши [5].
Далее, если уже критически разобрать результаты Lung-AR, то бросается в глаза следующее: было обнаружено, что пациенты, получавшие
PORT, вроде как не имели существенной разницы в 3-летней безрецидивной выживаемости (DFS) или
OS по сравнению с пациентами, которые не облучались, хотя получена
15% (!) прибавка в DFS у пациентов,
получавших PORT. Среди пациентов, получивших PORT, было меньше смертей из-за прогрессирования
и рецидивов в средостении, но это
нивелировалось увеличением сердечно-легочных осложнений 3-4 степени и даже летальных исходов из-за
токсичности, связанной с лечением.
Очевидно, что объективную критику
Lung-ART не в состоянии выдержать,
потому как 89% пациентов облучали
с использованием устаревшей к сегодняшнему дню 3D-конформной
лучевой терапии, что напрямую ассоциировано с увеличением сердечной
и легочной токсичности по сравнению с модулированными по интенсивности методиками (IMRT). Выходит, что больные заведомо получали
лечение по методике, имеющей более
высокие риски осложнений.
Тем не менее, всего лишь на основе
тезисов об отрицательных результатах этого исследования роль PORT
для НМРЛ III-N2 R0 стадии была категорически отвергнута на конгрессе
ESMO.
Рисунок 1.
Дозиметрические планы различных методик
лучевой терапии, применяемых при лечении рака легкого.
В исследовании PORT-C, напротив,
89% больных получали IMRT. И хотя
абсолютного доказательства пользы PORT авторы не увидели, тем не
менее, как было описано ранее, при
определенных условиях PORT имеет
смысл.
Вероятнее всего, определяющим
фактором является количество и локализация пораженных лимфоузлов.
Так, в PORT-C улучшение DFS было
отмечено у больных с 4+ пораженными лимфоузлами. В еще более раннем исследовании Matsuguma et al [6]
было показано, что облучение улучшает результаты при многоуровневом поражении лимфоколлекторов,
а также для больных, у которых отмечаются резидуальные лимфоузлы
после индукционной химиотерапии
[7-9].
Однако и по сей день не было рандомизированных исследований на этот
счет.
Наличие/отсутствие экстракапсулярной инвазии также может быть
фактором, при котором стоит проводить PORT. Так, Moretti et al еще
в 2009 году показали, что послеоперационное облучение у больных без
экстракапсулярной инвазии в лимфоузлах заметно повышает OS и не
влияет на результаты при наличии
таковой [10].
Стоит отметить, что патоморфологическая классификация уже давно
играет не самую главную роль в выборе тактики лекарственного лечения. Вероятно, молекулярно-генетический анализ может быть полезен
и для лучевого лечения. К примеру,
Wu et al [11] пришли к выводу, что у
пациентов с EGFR+ НМРЛ, которым
будут проводить терапию осимертинибом, смысл в PORT автоматически отпадает. А тем, у кого ничего
из классической триады (EGFR, ALK,
ROS) не определяется и, соответственно, не так много эффективных
опций системной терапии, локальные методы (облучение) могут принести заметную пользу
Подводя итоги, хочется отметить,
что решение вопроса о целесообразности PORT при НМРЛ N2 R0
лежит, на наш взгляд, совершенно
не в плоскости примитивного выбора «да или нет». Аргументы «за»
и «против» всегда могут быть подвергнуты сомнению, что и продемонстрировал данный обзор. При
этом становится почти очевидно,
что существуют патоморфологические и молекулярно-генетические
предпосылки, при наличии которых облучение можно и нужно
проводить, и делать исключительно
современными методиками: IMRT,
VMAT, протоны (табл.1) [12], однако этот вопрос требует тщательного изучения и инициации рандомизированных исследований.
Источники:
1. Postoperative radiotherapy in nonsmall-cell lung cancer: systematic review and meta-analysis of individual patient data from nine randomised controlled trials. PORT Meta-analysis Trialists Group. Lancet (London, England). 1998; 352(9124): 257-263.
2. Robinson CG, Patel AP, Bradley JD, et al. Postoperative radiotherapy for pathologic N2 non-small-cell lung cancer treated with adjuvant chemotherapy: a review of the National Cancer Data Base. J Clin Oncol. 2015 Mar 10; 33(8): 870-6. Doi: 10.1200/JCO.2014.58.5380. Epub 2015 Feb 9. PMID: 25667283; PMCID: PMC4348635.
3. Le Pechoux C, Pourel N, Barlesi F, et al. Postoperative radiotherapy versus no postoperative radiotherapy in patients with completely resected non-small-cell lung cancer and proven mediastinal N2 involvement (Lung ART): an open-label, randomised, phase 3 trial. Lancet Oncol. 2022 Jan; 23(1): 104-114. Doi: 10.1016/ S1470-2045(21)00606-9. Epub 2021 Dec 15. PMID: 34919827.
4. Hui Z, Men Y, Hu C, et al. Effect of Postoperative Radiotherapy for Patients With pIIIA-N2 Non-Small Cell Lung Cancer After Complete Resection and Adjuvant Chemotherapy: The Phase 3 PORT-C Randomized Clinical Trial. JAMA Oncol. Published online June 24, 2021. Doi: 10.1001/ jamaoncol.2021.1910.
5. Chang JY. Intensity-modulated radiotherapy, not 3 dimensional conformal, is the preferred technique for treating locally advanced lung cancer. Semin Radiat Oncol. 2015; 25(2): 110-116. Doi: 10.1016/j. semradonc.2014.11.002.
6. Matsuguma H, Nakahara R, Ishikawa Y, Suzuki H, Inoue K, Katano S, Yokoi K. Postoperative radiotherapy for patients with completely resected pathological stage IIIA-N2 non-small cell lung cancer: focusing on an effect of the number of mediastinal lymph node stations involved. Interactive Cardiovascular And Thoracic Surgery. 2008; 7(4): 573-577. https://doi. org/10.1510/icvts.2007.174342.
7. Amini A, Correa AM, Komaki R, Chang JY, Tsao AS, Roth JA, Swisher SG, Rice DC, Vaporciyan AA, Lin SH. The role of consolidation therapy for stage III non-small cell lung cancer with persistent N2 disease after induction chemotherapy. The Annals Of Thoracic Surgery. 2012; 94(3): 914-920. https://doi.org/10.1016/j. athoracsur.2012.04.088.
8. Sawyer TE, Bonner JA, Gould PM, Foote RL, Deschamps C, Trastek VF, Pairolero PC, Allen MS, Lange CM, Li H. Effectiveness of postoperative irradiation in stage IIIA non-small cell lung cancer according to regression tree analyses of recurrence risks. The Annals Of Thoracic Surgery. 1997; 64(5): 1402-1408. https:// doi.org/10.1016/S0003-4975(97)00908- 9.
9. Betticher DC, Hsu Schmitz SF, Tötsch M, Hansen E, Joss C, von Briel C, Schmid RA, Pless M, Habicht J, Roth AD, Spiliopoulos A, Stahel R, Weder W, Stupp R, Egli F, Furrer M, Honegger H, Wernli M, Cerny T, Ris HB. Mediastinal lymph node clearance after docetaxel-cisplatin neoadjuvant chemotherapy is prognostic of survival in patients with stage IIIA pN2 non-small-cell lung cancer: a multicenter phase II trial. Journal Of Clinical Oncology. 2003; 21(9): 1752-1759. https:// doi.org/10.1200/JCO.2003.11.040.
10.Moretti L, Yu DS, Chen H, Carbone DP, Johnson DH, Keedy VL, Putnam JB Jr, Sandler AB, Shyr Y, Lu B. Prognostic factors for resected non-small cell lung cancer with pN2 status: implications for use of postoperative radiotherapy. The Oncologist. 2009; 14(11): 1106- 1115. https://doi.org/10.1634/ theoncologist.2009-0130.
11.Wu YL, Tsuboi M, He J, John T, Grohe C, Majem M, Goldman JW, Laktionov K, Kim SW, Kato T, Vu HV, Lu S, Lee KY, Akewanlop C, Yu CJ, de Marinis F, Bonanno L, Domine M, Shepherd FA, Zeng L; ADAURA Investigators. Osimertinib in Resected EGFR-Mutated Non-Small-Cell Lung Cancer. The New England Journal Of Medicine. 2020; 383(18): 1711-1723. https://doi. org/10.1056/NEJMoa2027071.
12.Liu J, Ladbury C, Kim J, Raz D,
Erhunmwunsee L, West HJ, Williams
T, Salgia R, Massarelli E, Amini A.
Postoperative Radiation Therapy Should
Be Used for Completely Resected Stage
III-N2 NSCLC in Select Patients. Journal
Of Thoracic Oncology. 2022; 17(2):
194-196. https://doi.org/10.1016/j.
jtho.2021.08.006.
Автор: Панкратов Александр Евгеньевич
Врач-радиотерапевт, ООО «ПЭТ-Технолоджи
Балашиха», Балашиха
Аргументы ПРОТИВ
Главный принцип врачевания – Noli
nocere (не навреди – лат.) Чтобы
следовать этому принципу, нужно
быть абсолютно уверенным, что ты,
если не сделаешь лучше, то хотя бы
не навредишь. И вот почти четверть
века в среде радиотерапевтов (и не
только) остается актуальным вопрос – выполнять или воздержаться от лучевой терапии у пациентов
с немелкоклеточным раком легкого
(НМРЛ) со статусом поражения лимфатических узлов N2 после хирургического лечения? Чтобы ответить на
этот вопрос, нужно решить уравнение с несколькими неизвестными,
где по одну сторону знака «равно»
будет стоять «лучевая терапия», а
по другую – «безопасность + эффективность». К неизвестным же мы
отнесем риски и вероятности, числа
которым не счесть. Соответственно,
и абсолютной уверенности в безопасности такого лечения быть не
может, пока мы с этими неизвестными не разберемся. Благодаря многочисленным исследованиям, многие
неизвестные раскрыты, но очевидность, что между «лучевая терапия» и «безопасность + эффективность»
должен стоять знак «равно», а не «не
равно», пока отсутствует. Попробуем
разобраться с этими неизвестными, а
затем определимся и с аргументами,
почему при стандартном подходе мы
будем ПРОТИВ лучевой терапии в
адьювантном режиме при N2 статусе
лимфоузлов у пациентов с НМРЛ, и
почему между «лучевая терапия» и
«безопасность + эффективность» в
рутинном алгоритме выбора лечебной тактики должен стоять знак «не
равно».
Для начала вспомним, что такое N2
стадия? Это, согласно классификации TNM и клинического стадирования при раке легкого, поражение
ипсилатеральных медиастинальных
и/или субкаринальных лимфатических узлов [1]. Именно эти группы
лимфоузлов находятся на критически близком расстоянии от такого
критического органа, как сердце.
Надо заметить, жизненно важного
органа. Соответственно, когда мы
решаемся воздействовать высокими
дозами радиации на область лимфоколлектора N2, мы гарантированно
будем воздействовать на миокард
и коронарные артерии, на клапаны
сердца и на самые крупные сосуды –
аорту, легочные артерии и легочные
вены, по которым в единицу времени протекает наибольшее количество крови. Воздействуя излучением
на область N2, мы также облучаем
большой пул форменных элементов крови, протекающей по этим
крупным сосудам. Эндотелиальные
клетки обладают высокой радиочувствительностью, и дозы выше 2
Гр могут запускать воспалительные
каскады, способствующие развитию
атеросклероза. В сочетании с протромботическим состоянием при
злокачественной опухоли это может
привести к таким осложнениям, как
стенокардия, острый коронарный
синдром, инфаркт миокарда, злокачественные аритмии и смерть [2],
что продемонстрировано во многих
исследованиях. Ретроспективный
анализ 748 пациентов с местнораспространенным НМРЛ, получавших лучевую терапию, убедительно
свидетельствует о том, что, несмотря
на конкурирующий риск смерти от
рака и короткую продолжительность
жизни у пациентов с местнораспространенным НМРЛ, существует высокий риск серьезных неблагоприятных сердечных событий (major
adverse cardiac events, МАСЕ) в течение 2 лет после лучевой терапии, а
доза излучения на сердце является
независимым предиктором MACE
степени ≥3 CTCAE [3]. Очевидно,
что лучевая терапия ускоряет развитие ишемической болезни сердца
(ИБС), но доза облучения критических структур сердца при раке легкого систематически не изучалась. Когортное исследование 701 пациента
с местнораспространенным НМРЛ,
получавших торакальную лучевую
терапию в больницах Гарвардского
университета в период с 1 декабря
2003 г. по 27 января 2014 г., показало,
что оптимальные пограничные дозы
для сердца могут различаться в зависимости от наличия предшествующей ИБС. Показатель V15 (то есть
объем органа, получающий дозу 15
Гр) для левой передней нисходящей
коронарной артерии ≥10% является
независимой оценкой вероятности MACE и смертности от всех причин,
особенно у пациентов без ИБС, а V15
для левого желудочка ≥1% придает
повышенный риск MACE среди пациентов с ИБС [4].
Если до недавних пор мы могли опираться только на рандомизированные
и ретроспективные исследования и
их метаанализы прошлого века, то теперь мы можем рассмотреть результаты двух современных крупных рандомизированных контролируемых
исследований III фазы, оценивающих
целесообразность адъювантной лучевой терапии при полностью резецированном НМКРЛ со статусом N2.
Итак, Lung ART (мультицентровое,
набор 2007-2018 гг., в исследование
был включен 501 пациент) и PORT-C
(одноцентровое, набор 2008-2019 гг.,
приняли участие 364 пациента).
Оба исследования показали, что
PORT уменьшает местно-регионарные рецидивы, но не увеличивает
выживаемость, и возражения против PORT, таким образом, вызывают
некоторую путаницу при принятии
клинических решений [5]. В исследовании Lung ART фактическая частота медиастинального рецидива в
контрольной группе составила 46%,
а PORT значительно снизила частоту
до 25%, в то время как 3-летняя общая
выживаемость в контрольной группе
составила 69% (95% ДИ 61-75%) и
67% (95% ДИ 59-73%), оказавшись
ниже в группе PORT. Трехлетняя
безрецидивная выживаемость составила 47% (95% ДИ 40-54) с PORT по
сравнению с 44% (37-51) без PORT, а
медиана безрецидивной выживаемости составила 30,5 мес. (95% ДИ 24-
49) в группе PORT и 22,8 мес. (17-37)
в контрольной группе (отношение
рисков 0,86; 95% ДИ 0,68-1,08; р=0,18)
Наиболее частыми нежелательными
явлениями 3-4 степени были пневмонит (13 [5%] из 241 пациента в
группе PORT против одного [<1%] из
246 в контрольной группе), лимфопения (9 [4%] против 0) и усталость
(шесть [3%] против одного [<1%]) [6].
Надо отметить, что 89% пациентов в
группе PORT из Lung ART получили
3D-конформную лучевую терапию, а
в исследовании PORT-C 89% пациентов лечили IMRT. Фактические средние значения при PORT-C V20 для
легких и V30 для сердца составляли
16,7% и 10,4% соответственно (V20
для легких и V30 для сердца составляли 23% и 15% при Lung ART) [5].
Ключевым выводом исследования
Lung ART является значительное увеличение ранней и поздней степени
сердечно-легочной токсичности 3-5
степени при проведении PORT (7% и
20% для PORT по сравнению 3,2% и
7,7% без PORT соответственно), что
объясняет отсутствие достоверной
разницы в общей выживаемости.
В исследовании PORT-C показатели
3-летней общей выживаемости составили 78,3% против 82,8% (HR 1,02;
P=0,93), а LRFS – 66,5% против 59,7%
(HR 0,71; 95% ДИ 0,51-0,97; P=0,03)
соответственно. Для 310 пациентов,
пролеченных в соответствии с протоколом (140 с PORT и 170 с наблюдением), PORT значительно улучшила DFS (42,8% против 30,6%; HR
0,75; 95% ДИ 0,57-1,00; P=0,05), но не
общую выживаемость (HR 0,83; 95%
ДИ 0,53-1,30; P=0,41). Частота только местных рецидивов в течение 3 лет
составила 9,5% и 18,3% в 2 группах
соответственно [7].
Кроме того, объемы и дозы облучения в обоих следованиях тоже отличались. Если в Lung ART суммарная
доза облучения (СОД) составляла
54 Гр при большем объеме облучения и 3D-конформной технике, то в
PORT-C подводилась СОД 50 Гр при
технике IMRT и меньшем объеме облучения, что в целом не сильно отразилось на общей выживаемости пациентов в обоих исследованиях.
Еще важно заметить, что ни в том,
ни в другом исследовании не сопоставлялась эффективность лечения
в зависимости от морфологической
принадлежности опухоли и не учитывалось использование таргетной
терапии осимертинибом в адъювантном режиме или при прогрессии. Но
есть исследование, в котором сравнили ответ на ПОРТ при аденокарциноме легкого (АКЛ) и при плоскоклеточном раке легкого (ПКРЛ). И
разница оказалась очень заметной.
В период с октября 2010 г. по сентябрь 2016 г. был проведен ретроспективный анализ 288 пациентов с
полностью резецированным НМРЛ
pIIIA-N2 в Пекинской больнице, который состоял из 194 случаев АКЛ и
85 случаев ПКРЛ. Было 42 (21,6%) пациента, получавших PORT в случаях
АКЛ, и 19 (22,3%) пациентов, получавших PORT при ПКРЛ.
Среди 194 больных с АКЛ 1-, 3- и
5-летняя ОВ в группе PORT составляли 95,2%, 61,9% и 40,0% соответственно, а в группе без PORT – 90,1%, 63,3%
и 45,0% (р=0,948). Использование
адъювантной химиотерапии (АХТ)
и индекс курения ≥400 были прогностическими факторами 5-летней
частоты ОВ, выживаемости без локального рецидива и выживаемости
без отдаленных метастазов. С другой
стороны, среди 85 случаев ПКРЛ 1-,
3- и 5-летняя ОВ в группе PORT составили 94,7%, 63,2% и 63,2% соответственно, тогда как в группе без PORT
– 86,4%, 48,5% и 37,1% (р=0,026). В
этой группе использование PORT
было благоприятным прогностическим фактором для 5-летней ОВ,
LRFS и DMFS [8].
Чтобы назначить или не назначить
правильное лечение, необходимо
быть уверенным в объеме выполненного хирургического лечения,
когда радикальность предполагает:
1) свободные (чистые) края резекции
мягких тканей вокруг опухоли, бронхиальной, венозной, артериальной
культей (R0), 2) должно быть удалено
как минимум 6 лимфоузлов, из которых 3 – внутрилегочные и 3 – медиастинальные (из которых минимум
1 – субкаринальный), 3) не должно
быть экстракапсулярного распространения в л/у, 4) высший из удаленных средостенных л/у должен быть
негативным [9].
Таким образом, мы приблизились
к аргументам ПРОТИВ назначения
PORT как стандартного лечения при
НМРЛ стадии pIII N2, выявив отдельные неизвестные в уравнении,
где «лучевая терапия» далеко не всегда равна «безопасность + эффективность»:
Назначение адъювантной лучевой терапии при НМКЛ рIII-N2 стадии существенно повышает кардиопульмональную токсичность у всех пациентов, что повышает риск смертности, связанной с лечением. Повышение безрецидивной выживаемости в общей когорте пациентов не увеличивает общую выживаемость. За счет облучения пула циркулирующих клеток и непораженных лимфатических узлов PORT может провоцировать лимфопению, что может отражаться на иммунном статусе. При наиболее распространенной (в частности, в России) технологии 3D-конформной лучевой терапии PORT дополнительно увеличивает кардиопульмональную токсичность в связи с повышением доз на критических органах. PORT не дает преимуществ в общей выживаемости у пациентов с аденокарциномой, но может быть полезен при плоскоклеточном раке легкого. Отсутствуют рандомизированные исследования, сравнивающие PORT с таргетной терапией, в то время как последняя показывает заметную эффективность даже при остаточной опухоли при меньшей токсичности. В отсутствие повсеместного однозначно применяемого подхода к объему лимфодиссекции, маркированию удаленных лимфоузлов по уровням, скрупулезного морфологического исследования операционного материала с учетом оценки всех критериев радикальности хирургического этапа лечения при действительно радикальной операции назначение PORT может ухудшить результаты этой операции или быть недостаточным при ее нерадикальности.
Соответственно, PORT не может
быть общепринятой практикой адъювантного лечения на основании
только стадии заболевания и уровня
пораженных лимфатических узлов и,
скорее, принесет вред, чем пользу
Источники:
1. Lim Wanyin, et al. The 8th lung cancer TNM classification and clinical staging system: review of the changes and clinical implications. Quantitative Imaging In Medicine And Surgery. 2018; Vol.8, 7: 709-718. Doi: 10.21037/ qims.2018.08.02.
2. Díaz-Gavela Ana Aurora, et al. Breast Radiotherapy-Related Cardiotoxicity. When, How, Why. Risk Prevention and Control Strategies. Cancers. 4 Apr. 2021; Vol.13, 7: 1712. Doi: 10.3390/cancers13071712.
3. Katelyn M. Atkins, Bhupendra Rawal, et al. Cardiac Radiation Dose, Cardiac Disease, and Mortality in Patients With Lung Cancer. Journal of the American College of Cardiology. 2019; Vol.73, Issue 23. doi. org/10.1016/j.jacc.2019.03.500.
4. Atkins Katelyn M, et al. Association of Left Anterior Descending Coronary Artery Radiation Dose With Major Adverse Cardiac Events and Mortality in Patients With Non-Small Cell Lung Cancer. JAMA oncology. 2021; Vol.7, 2: 206-219. doi:10.1001/ jamaoncol.2020.6332.
5. Zhu L, Xia B, Ma S. Postoperative radiotherapy for patients with completely resected stage IIIA-N2 non-small cell lung cancer: opt-in or opt-out. Torac Cancer. 2022; 13: 659- 663. https://doi.org/10.1111/1759- 7714.14335. 6. Le Pechoux Cecile, et al. Postoperative radiotherapy versus no postoperative radiotherapy in patients with completely resected non-small-cell lung cancer and proven mediastinal N2 involvement (Lung ART): an open-label, randomised, phase 3 trial. The Lancet Oncology. 2022; Vol.23, 1: 104-114. Doi: 10.1016/S1470- 2045(21)00606-9.
7. Hui Zhouguang, et al. Effect of Postoperative Radiotherapy for Patients With pIIIA-N2 Non-Small Cell Lung Cancer After Complete Resection and Adjuvant Chemotherapy: The Phase 3 PORT-C Randomized Clinical Trial. JAMA Oncology. 2021; Vol.7, 8: 1178-1185. Doi: 10.1001/ jamaoncol.2021.1910.
8. Tian Cuimeng, et al. Postoperative radiotherapy for patients with completely resected pathological stage IIIA-N2 non-small cell lung cancer: a preferential benefit for squamous cell carcinoma. Radiology And Oncology. 3 Dec. 2020; Vol.55, 1: 66-76. Doi: 10.2478/raon-2020-0070.
9. Rami-Porta Ramón, et al. Complete
resection in lung cancer surgery:
proposed definition. Lung cancer
(Amsterdam, Netherlands). 2005;
Vol.49, 1: 25-33. Doi: 10.1016/j.
lungcan.2005.01.001.
Результаты голосования: Итак, PORT: да или нет?*

*https://www.rosoncoweb.ru/news/oncology/2022/04/05-1/
Всего проголосовало: 39
ЛЕКАРСТВЕННАЯ ТЕРАПИЯ ОПУХОЛЕЙ ЖКТ С АКЦЕНТОМ НА РАМУЦИРУМАБ
Автор: Бесова Наталия Сергеевна
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина»
Минздрава России, Москва
Рамуцирумаб – гуманизированное моноклональное антитело к
рецепторам сосудисто-эндотелиального фактора роста 2 типа,
является стандартом лекарственной терапии 2-й линии при диссеминированной аденокарциноме
желудка и пищеводно-желудочного перехода (ДРЖ/ПЖП). Согласно результатам исследования
RAINBOW, комбинация рамуцирумаба с паклитакселом по сравнению с паклитакселом обеспечивает значимое увеличение медианы
общей выживаемости (ОВ) на второй линии лечения с 7,4 до 9,6 мес.
(p=0,017) и медианы выживаемости без прогрессирования (ВБП) с
2,86 до 4,4 мес. (p<0,0001) [1].
Однако применение паклитаксела
во второй линии лечения может
быть лимитировано периферической нейропатией вследствие назначения оксалиплатина в составе
режимов первой линии лечения. В
исследовании RAINBOW частота
нейротоксичности любой степени
комбинации паклитаксела с рамуцирумабом составила 46%. В связи
с этим актуально изучение новых
комбинаций рамуцирумаба с химиопрепаратами, не обладающими
нейротоксичностью.
На ASCO GI 2022 г. представлены
финальные результаты клинического исследования II фазы комбинации
рамуцирумаба с иринотеканом, эффективность которого во 2-й линии
лечения не уступает эффективности
паклитаксела при ДРЖ/ПЖП [2].
Главным параметром оценки эффективности комбинации была ВБП на
2-й линии лечения. Согласно статистической гипотезе для достижения
МВБП, равной 4 мес. по сравнению с
2,5 мес. в группе исторического контроля, при мощности исследования
85,7% α=0,05 (односторонний р) необходимо включение 40 пациентов.
Схема лечения включала рамуцирумаб по 8 мг/кг в 1 и 15 дни + иринотекан по 180 мг/м2 в 1 и 15 дни каждые 28 дней. С декабря 2017 г. по май
2021 г. было включено 40 больных.
Все пациенты получали в 1-й линии
платиновые режимы, 6 – ингибиторы контрольных точек, у 8 пациентов
был HER2-позитивный ДРЖ. При
медиане наблюдения 7,7 мес. медиана
ВБП составила 4,6 мес. (95% ДИ 2,7-
5,4). Из 31 пациента, у которых был
оценен непосредственный эффект
лечения, у 9 (29%) был достигнут
объективный эффект (1 полная и 8
частичных регрессий опухоли) и у 5
(16%) – стабилизация болезни более
6 мес. Наиболее частыми побочными эффектами лечения были диарея,
рвота и нейтропения, нейропатии
3-4 степени тяжести не было отмечено. Таким образом, комбинация
рамуцирумаба с иринотеканом является эффективной и хорошо переносимой комбинацией 2-й линии лечения при ДРЖ/ПЖП и может входить
в стандарты терапии 2-й линии.
Еще одно исследование II фазы на
эту же тему было проведено в США
и посвящено изучению эффективности комбинации рамуцирумаба с
TAS-102 (FTD-TPI) при рефрактерном ДРЖ/ПЖП [3]. Режим лечения
содержал рамуцирумаб, вводимый
внутривенно по 8 мг/кг в 1 и 15 дни,
в комбинации с TAS-102, который
давали перорально по 35 мг/м2 дважды в день в дни 1-5 и 8-12 каждые 28
дней. Главной целью была оценка
6-месячной ОВ, дополнительными –
оценка ВБП, объективного эффекта
и профиля безопасности. В исследование было включено 23 больных с
медианой возраста 62 года (от 23 до
74 лет), медиана линий предшествующей химиотерапии составила 1 (1
линия – у 14 пациентов, 2 и более – у
9), первичная опухоль локализовалась в желудке у 4 больных, в области
ПЖП – у 19. Шестимесячная ОВ составила 56,2%, медиана ОВ – 6,2 мес.
(95% ДИ 5,4-7,0), медиана ВБП – 4,9
мес. при медиане наблюдения 2,3 мес.
Из 17 пациентов, оцененных по непосредственному эффекту, у 1 (6%)
была зарегистрирована частичная
регрессия и у 15 (88%) – стабилизация болезни. Прогрессирование
болезни стало причиной окончания
лечения у 11 пациентов, токсичность
лечения – у 8, четверо больных отозвали согласие. Наиболее частыми
побочными эффектами лечения
были диарея (39%), утомляемость
(39%) и гипертензия (39%). У 11
пациентов (48%) были отмечены
побочные эффекты 3 и 4 степени
тяжести, наиболее часто регистрировались нейтропения (17%) и анемия
(13%). По заключению авторов, комбинация рамуцирумаба с TAS-102 на
данной популяции больных показала
частоту контроля заболевания, подобную результатам, полученным в
Азии. Комбинация обладает умеренной активностью при ДРЖ/ПЖП, но
может быть исследована во второй
линии лечения после режимов, содержащих иммуноонкологические
препараты в составе первой линии.
В настоящее время организовано
рандомизированное исследование II
фазы по сравнительному изучению
рамуцирумаба в комбинации с TAS102 или паклитакселом.
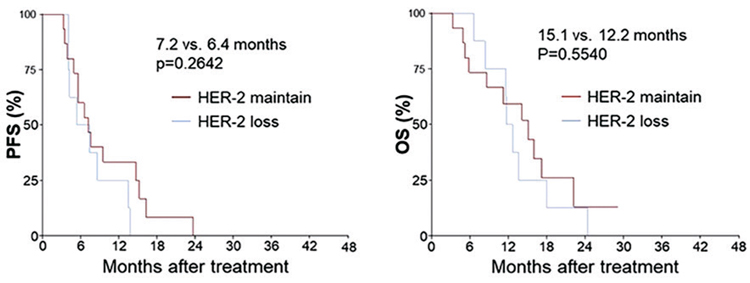
Рисунок 1.
Исследование RAM-HER. Выживаемость без прогрессирования и общая выживаемость
больных, утративших и не утративших HER2-позитивность после 1-й линии лечения.
В исследовании RAINBOW был
проведен анализ эффективности
применения комбинации рамуцирумаба с паклитакселом в сравнении с паклитакселом у пациентов
с HER2-позитивным ДРЖ/ПЖП,
получивших в составе 1-й линии лечения трастузумаб. У этой категории
больных комбинация рамуцирумаба
с паклитакселом также показала превосходящую эффективность по сравнению с паклитакселом: медианы ОВ
составили 11,4 и 7,0 мес. (ОШ=0,68;
95% ДИ 0,24-1,41; p=0,02963), медианы ВБП – 4,2 и 2,7 мес. (ОШ=0,4; 95%
ДИ 0,19-0,82; p=0,01) для рамуцирумаба с паклитакселом и паклитаксела
соответственно [4].
В мультицентровом корейском исследовании Ib/II фазы HER-RAM
[5] оценивали переносимость и эффективность добавления трастузумаба к рамуцирумабу и паклитакселу во второй линии лечения
HER2-позитивного ДРЖ/ПЖП
после прогрессирования на лекарственной терапии 1-й линии, включавшей трастузумаб. Трастузумаб
вводили в нагрузочной дозе 4 мг/кг в
день 1, затем по 2 мг/кг на 1,15 и 22
дни, рамуцирумаб – по 8 мг/кг в 1 и
15 дни, паклитаксел – в дозе 80 мг/
м2 (редукция дозы до 70 мг/м2 при
выраженной токсичности) в 1, 8 и 15
дни каждые 28 дней. После оценки
переносимости комбинации в рамках 1b фазы исследование было продолжено в рамках II фазы, главным
параметром оценки была ВБП, дополнительными – объективный эффект, частота контроля заболевания,
ОВ и токсичность. Редукции дозы
паклитаксела не было ни у одного
пациента. В исследование включено
50 больных, медиана возраста – 60
лет (от 29 до 82), преобладали мужчины (40/50). Исходно (до начала
1-й линии) у 39 пациентов опухоль
была HER2-позитивной ИГХ 3+ и
у 11 – ИГХ 2+/FISH+. На 2-й линии
лечения при медиане наблюдения
18,8 мес. медиана ВБП и медиана
ОВ составили 7,0 мес. (95% ДИ 4,9-
9,2 мес.) и 13,6 мес. (95% ДИ 9,5-17,6
мес.) соответственно. Объективный
эффект был зарегистрирован у 54%
больных (27/50), полная регрессия –
у 1, частичная регрессия – у 26, частота контроля заболевания составила
96% (48/50). После 1-й линии лечения (по данным повторной биопсии)
HER2-позитивность была утеряна у 8 из 23 больных, что не сказалось на
результатах лечения: медианы ВБП у
больных, утративших и продолжающих экспрессировать HER2, составили 6,4 и 7,2 мес. (p=0,2642), медианы
ОВ – 12,2 и 15,1 мес. (р=0,5540).
Наиболее частыми побочными эффектами были нейтропения (64%, 3-4
степени – 52%) с 1 случаем фебрильной нейтропении, периферическая
сенсорная нейропатия и анорексия.
Гастроинтестинальное кровотечение
отмечено в 6 случаях, гастроинтестинальных перфораций не зарегистрировано. Гипертензия зафиксирована у 3 пациентов: у 1 – 1-2 степени,
у 2 – 3 степени тяжести. Таким образом, комбинация трастузумаба с
рамуцирумабом и паклитакселом
является высокоэффективной комбинацией 2-й линии после прогрессирования HER2-позитивного
ДРЖ/ПЖП на фоне трастузумабсодержащей 1-й линии лечения
вне зависимости от утраты HER2-
позитивности.
Источники:
1. Wilke H, Muro K, Cutsem EV, Oh S-C.l, Bodoky G, Shimada Y, Hironaka S, Sugimoto N, Lipatov O, Kim T-Y, Cunningham D, Rougier P, Komatsu Y, Ajani J, Emig M, Carlesi R, Ferry D, Chandrawansa K, Schwartz JD, Ohtsu A. Ramucirumab plus paclitaxel versus placebo plus paclitaxel in patients with previously treated advanced gastric or gastrooesophageal junction adenocarcinoma (RAINBOW): a double blind, randomised phase 3 trial. Lancet Oncol. 2014; 15: 1224-35. DOI: https://doi.org/10.1016/S1470- 2045(14)70420-6.
2. Haeseong Park, Aravind Sanjeevaiah, Peter Joel Hosein, Rutika Mehta, Ramon Jin, Patrick Grierson, Rama Suresh, Olivia Aranha, Nikolaos A. Trikalinos, Nusayba Ali Bagegni, Katrina Sophia Pedersen, KianHuat Lim, Andrew B. Nixon, Jason Mills, Ryan Fields, Benjamin R. Tan, Jingxia Liu, Amberly Brown, Andrea wang-gillam, A. Craig Lockhart. Ramucirumab and irinotecan in patients with previously treated gastroesophageal adenocarcinoma: Final analysis of a phase II trial. DOI: 10.1200/JCO.2022.40.4_suppl.284.
3. Rutika Mehta, Richard D. Kim, Maria E Martinez Jimenez, Kirsten Blue, Trenton Avriett, Emily Kelbert, Kara Miller, Christopher Ray, Tiffany Valone, Woojoo Lee, Youngchul Kim, Dae Won Kim A phase II study of TAS-102 (FTD/TPI) in combination with ramucirumab (RAM) in advanced, refractory gastric (GC) or gastroesophageal junction (GEJ) adenocarcinomas (GEAs). DOI: 10.1200/JCO.2022.40.4_suppl.302.
4. De Vita F, Borg C, Farina G, Geva R, Carton I, Cuku H, Wei R, Muro K. Ramucirumab and paclitaxel in patients with gastric cancer and prior trastuzumab: subgroup analysis from RAINBOW study. Future Oncology. 15(23): 2723-2731. DOI: 10.2217/fon2019-0243.
5. Sun Young Rha, Chang Gon Kim,
Minkyu Jung, Hyo Song Kim, Choongkun Lee, Hei-Cheul Jeung, Dong-Hoe
Koo, Woo Kyun Bae, Dae Young
Zang, Hyunki Kim, Hyun Cheol
Cheol Chung. Multicenter phase Ib/
II study of second-line trastuzumab,
ramucirumab, and paclitaxel
in patients with HER2-positive
advanced gastric or gastroesophageal
junction cancer: Updated HER-RAM
study with biomarker analysis. DOI
10.1200/JCO.2022.40.4_suppl.330.
ОНКОПСИХОЛОГИЯ В РОССИИ: ВЕЛИЧИНА ПРОБЛЕМЫ
Авторы: Деньгина Наталья Владимировна
ГУЗ «Областной клинический онкологический диспансер»,
Ульяновск
Вагайцева Маргарита Валерьевна
ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» МЗ РФ
Возьмем обычный российский город
– региональный центр под названием
Ульяновск. Великая река Волга, на берегах которой располагается город, в
этом месте самая широкая и местами
напоминает море. По площади регион сопоставим с площадью Голландии и превосходит Бельгию. В самом
городе есть мощный комплекс самолетостроения, производящий крупнейшие самолеты для транспортной
авиации. Есть автомобильный завод
под известной в России маркой УАЗ,
каждый из нас знает, как выглядят
производимые здесь машины. Есть
крупный центр атомных реакторов,
на базе которого создан научно-исследовательский институт. Центр
производит практически весь спектр
радиоизотопов, используемых в различных целях, прежде всего, в медицине. В частности, есть только два
центра в мире, где производят калифорний 252, один из них наш, второй
– в Соединенных Штатах. Есть региональный онкологический центр,
где проводится лечение пациентам
города и области. В регионе есть даже
свой протонный центр, пока – самый
крупный в России. Есть хоспис, один
из первых в России. Но – нет НИ ОДНОГО онкопсихолога, к которому
онкологи могли бы направлять своих
пациентов. Полагаю, что это, скорее,
типичная ситуация для России. Мы
строим центры, ставим новые аппараты, создаем новые приказы по организации онкологической службы
– но забываем о тех ситуациях, когда
все усилия врачей, все организационные потуги, все вложенные деньги
могут быть перечеркнуты гибелью
пациента, не получившего квалифицированной помощи специалиста –
не онколога, а психолога, в ряде случаев – психиатра.
Пациент, 64 года, сохранный, без явной сопутствующей патологии, начал курс гормонотерапии и лучевой
терапии по поводу рака простаты 3
стадии. Внезапно уже в первой половине курса начал отмечать резкую
слабость в конечностях, вскоре он
просто не мог вставать с постели.
Полностью обследован, никакой патологии, способной вызвать подобные явления, не обнаружено. И только доверительный разговор лечащего
врача тет-а-тет с пациентом позволил
выявить истинные причины этой
клинической ситуации: пациент был
полностью подавлен самим фактом
проведения гормонотерапии, по его
мнению, убивавшей в нем мужчину,
и был готов дойти до самоубийства.
Отмена гормональной терапии полностью изменила ситуацию, пациент
благополучно закончил лечение, посещая сеансы психолога. Страшно
подумать, что абсолютно курабельного пациента с хорошим прогнозом
могли бы выписать как неизлечимого!
чала курса послеоперационного химиолучевого лечения по поводу рака
языка вместо традиционной сухости
в полости рта открылось почти профузное слюнотечение, сопровождавшееся ощущением инородного тела
в глотке; любая попытка произнести
слово приводила к рвотному рефлексу. Многократные обследования
не выявили причин для подобных
симптомов, но позволили заподозрить иную природу этих явлений,
что было подтверждено психологом. Пациентка – учитель начальной
школы, для которой ее оперированный язык был основным «рабочим
инструментом» (она даже не умела
писать сообщения на телефоне!), –
поставила крест на своей жизни, понимая, что не способна более владеть
этим инструментом так, как прежде.
Назначение инъекционных, а затем
таблетированных антидепрессантов
и всего пара бесед с психологом позволили полностью завершить курс
лечения, впоследствии пациентка
полностью восстановилась и вышла
на работу
Наверняка подобные примеры есть
почти у каждого из нас. Попытки понять, как же обстоят дела в России с
онкопсихологической помощью, продемонстрировали следующие факты:
1. По приказу министерства здравоохранения РФ об организации
онкологической службы в России,
который регулярно обновляется,
должность онкопсихолога в штатное
расписание онкологического учреждения не входит. Отчасти по этой
причине в большинстве регионов
онкопсихологическая служба отсутствует как таковая, в лучшем случае
есть разрозненные психологи общего профиля, оказывающие помощь
онкологическим больным и их родственникам, преимущественно уже
на финальных этапах жизни. Должность онкопсихолога без сомнения
должна быть в штате сотрудников
онкологического учреждения, и это
нужно закреплять приказом.
2. В России нет отдельной специализации – онкопсихология. Существует несколько очных программ повышения квалификации в ведущих
профильных центрах. Зачастую же
обучение тех психологов, которые
хотят посвятить себя именно работе
с онкологическими пациентами, осуществляется «виртуально», людьми,
не имеющими практического опыта в
этом направлении. В России нет единой утвержденной государственной
программы. Программы, созданные
разными авторами в различных центрах, абсолютно разные по содержанию и качеству, многие центры постдипломной подготовки ваяют свои
собственные программы (это сейчас
в тренде), но многое в них взято с
потолка. В идеале повышать квалификацию психолога нужно по программам действующих и опытных
онкопсихологов. Наблюдение показывает, что программы «теоретиков»
не помогают в практической работе, а
самостоятельная «пристрелка в бою»
может приводить к вторичной травматизации как пациента, так и специалиста.
3. В программу обучения врача онколога не включено ни одного занятия,
посвященного онкопсихологии. При
том, что, например, в НМИЦ онкологии имени Петрова наработана значительная методологическая база для
медицинских работников. Полагаем,
подавляющее большинство из нас все
еще просто не знают, какие клинические или поведенческие симптомы у
пациента должны заставить нас задуматься не только о дообследовании,
но и о консультации у психолога. На
наш взгляд, это большой пробел в
нашем образовании, который требует восполнения путем внесения изменений в программы обучения, что
всегда чревато немалыми бюрократическими сложностями. Поэтому пока
это только личная инициатива врача. Ряд университетов или крупных
медицинских центров предлагают
в рамках курсов повышения квалификации врачей специальные курсы
по онкопсихологии; сложно сказать,
пользуются ли они популярностью.
4. Тем не менее, онкопсихология в
России существует. По мнению специалистов, она более активно начала
развиваться в течение последних 10
лет при активном участии корифеев
российской онкопсихологии – сначала в составе крупных онкологических
центров, затем при различных фондах и общественных организациях, а
также отдельно. Так, например, с середины 70-х годов ХХ века в НМИЦ
онкологии имени Петрова (ранее
– НИИ) проводятся исследования,
оказывается практическая психологическая помощь, формируется отечественная методологическая база
переподготовки врачей и психологов.
В Республиканском онкологическом
центре Казани имеется отделение
паллиативной и психологической
помощи, основанное в 2017 году, в
котором работают 2 психолога и 2
психотерапевта. Они консультируют
и пациентов центра, и ведут пациентов в отделении, куда они госпитализируются в среднем на 10 дней, чаще
это больные раком молочной железы.
Как правило, пациентов направляют
врачи различных отделений центра,
но бывают и самообращения. В настоящее время не менее 1200-1600
пациентов ежегодно получают необходимую помощь в этом отделении
плюс проводятся тренинги с медперсоналом при выявлении признаков
выгорания по результатам тестирования. И хотя сегодня повышение квалификации проходят специалисты из
многих регионов страны (к примеру,
институт практической психологии
Иматон в Санкт-Петербурге силами
онкопсихологов НМИЦ онкологии
имени Петрова предоставляет регулярную программу с 2014 года), к сожалению, далеко не все профильные
учреждения здравоохранения открывают штатные единицы онкопсихологов.
С 2009 года проводятся ежегодные
конгрессы онкопсихологов России,
которые пока демонстрируют одно:
трудоустроенных квалифицированных в области онкопсихологии специалистов все еще очень мало. Среднее число участников съездов – около
200, в период пандемии можно было
зарегистрировать до 400 подключений – но это не обязательно онкопсихологи, но и просто интересующиеся,
и не только Россия, но и ближайшие
страны-соседи (Беларусь, Казахстан,
Таджикистан, Литва, Абхазия). В 2010
году в Санкт-Петербурге зарегистрирована первая и пока единственная
Ассоциация онкопсихологов СевероЗападного региона России. В ее состав
входит подавляющее большинство
штатных онкопсихологов профильных учреждений Санкт-Петербурга,
а также психологи Москвы и ряда
ближайших регионов. Ассоциация
имеет свои страницы в социальных
ресурсах, составляет методические
рекомендации, памятки для врачей,
представители ее участвуют в клинических консилиумах в крупных
центрах.
Таким образом, онкопсихология в
России представлена – но крайне неравномерно по регионам и развивается скорее хаотично, причина – отсутствие поддержки государства.
На XXIV Российском онкологическом конгрессе в 2020 году состоялась
совместная сессия ASTRO-RUSSCO,
посвященная ментальным расстройствам и психологическим особенностям у онкологических больных
на фоне лечения, эта же сессия была
принята на ежегодном конгрессе
ASTRO, прошедшем в смешанном
формате в сентябре 2021 года, и ведущие радиационные онкологи мира,
включая президента ASCO профессора Lorie Pierce, безоговорочно согласились участвовать с докладами в
ней – что еще раз подчеркивает актуальность проблемы.
Наша абсолютная уверенность состоит в том, что о психологических
трудностях у наших пациентов необходимо помнить и заботиться
каждому практикующему онкологу, а
путь пациента, нуждающегося в психологической помощи, от онколога к
психологу должен быть максимально
коротким и беспрепятственным.
Микеланджело Буонарроти.
Сотворение Адама. ок. 1511?, фрагмент

ОНКОПСИХОЛОГИЯ: ИСТОРИЯ ВОПРОСА
Мы живем в такое время, когда
врачу онкологу просто невозможно работать, не зная основ онкопсихологии. Много лет я практикую, имея вторую специальность
– психолог. Эта рубрика явилась
результатом стремления и желания приобщить коллег к новым
знаниям и познакомить с интереснейшим направлением – онкопсихологией.
Немного о терминах и истории вопроса.
Онкопсихология – направление,
возникшее на стыке психологии,
психотерапии, онкологии и этики,
которое исследует влияние психологических факторов на возникновение и течение болезни. Цель ее
– изучение психологических особенностей онкологических больных, особенностей реакции на заболевание и способов совладания
с этой ситуацией. Предпосылкой
ОНКОПСИХОЛОГИЯ: ИСТОРИЯ ВОПРОСА
ее возникновения стало развитие
психоонкологии, которая является частью онкологии и изучает
психологические и социальные
аспекты онкологических заболеваний.
Психоонкология – это междисциплинарная область, охватывающая широкий спектр задач
организации медицинской и психологической помощи пациентам
и их семьям, психообразования и
обучения персонала, взаимодействующего с больными, лечения
психических расстройств и решения психосоциальных проблем
на протяжении всего онкозаболевания. Эта область знаний появилась в последней четверти ХХ
века, когда встал вопрос о качестве
жизни онкологического пациента.
Таким образом, психоонкология
возникла и развивается в рамках
онкологии, в то время как онкопсихология является психологической дисциплиной.
Какие исторические предпосылки
привели к развитию психоонкологии?
Успехи в развитии хирургии, лучевой терапии и химиотерапии
привели к развитию социальной
дискуссии о целесообразности
информирования пациентов о заболевании и предполагаемой терапии, а также введения информированного согласия на лечение,
создающего юридические предпосылки для открытого диалога
врача и пациента о методах и результатах диагностики, вариантах
лечения. В 60-е годы в США начались первые дебаты о вопросе целесообразности сокрытия диагноза онкологического заболевания от
пациента. Психиатры в этих оживленных дискуссиях, мотивируя
возможным развитием чрезмерно
сильной эмоциональной реакции
и формированием психических
нарушений, занимали позицию,
поддерживающую сохранение от
пациента тайны о его состоянии,
в то время как онкологи занимали противоположную позицию.
Исследование с использованием
опросника Окена в 1961 году показало, что более 90% врачей США
обычно не раскрывали диагноз пациенту, а уже в 1978 году 97% врачей стали рассказывать пациентам
правду об их диагнозе. В течение
этих 17 лет успехи онкологии стали
более очевидными, стало известно
о случаях выздоровления от рака,
что и позволило более открыто говорить с пациентом.
Итак, возникновение психоонкологии относится к 1975 году, когда
стало возможно открыто говорить
с пациентами о диагнозе «рак» и их
отношении к своему заболеванию.
Появилось большое количество
пациентов, вошедших в ремиссию
и открыто говоривших о своем
излечении. А еще знаменитости
стали позволять СМИ сообщать
публике о своем диагнозе: Форд и
Рокфеллер в 1975 году сообщили о
своей болезни, а также Роллин, которая написала книгу «Сначала ты
плачешь» о пути, который он прошла с момента постановки диагноза рак молочной железы.
В 1976 году Ван Дам в Нидерландах разработал первый протокол
исследований психосоциальных
факторов, что дало толчок исследованиям качества жизни пациентов под эгидой Европейской
организации по исследованиям
и обучению в сфере онкологии.
Одновременно Национальному
институту рака в США при поддержке Национальной группы
клинических исследований рака и
лейкемии было поручено разработать междисциплинарную модель
помощи. Группа психиатров под
руководством Холланд провела исследования пациентов, вошедших
в ремиссию на ранних стадиях болезни после прохождения лечения,
и разработала опросник для оценки психосоциальных параметров с
помощью телефонного интервью.
В 1975 г. в Сан Антонио провели
первую конференцию по национальным исследованиям в психоонкологии, организованную
Фоксом; 25 сотрудников пытались
решить проблемы, связанные с
отсутствием количественного измерения таких субъективных симптомов, как боль, тревога и депрессия.
Группа психиатров, работавшая с
1951 года в Memorial Slow Кettering,
была выделена в академическое
подразделение в 1977 году и начала
развивать клиническую деятельность и разрабатывать программы
постдипломного образования. Более 300 специалистов было обучено
на этой базе.
Исследования Вейсмана и Уордена
в рамках проекта «Омега» Массачусетского общественного госпиталя дали много информации
о психоэмоциональной реакции
пациентов на диагноз рак, на основании этих данных появилось
первое клиническое руководство
по психоонкологии, опубликованное в 1989 году.
Работы поведенческих психологов
дали импульс для разработки программ профилактики рака и исследований, посвященных изменению
образа жизни для уменьшения риска развития рака. В это же время
Аарсон в Европе, Селла и коллеги
в США разработали опросники
качества жизни, которые мы используем сейчас в клинических исследованиях.
С 1992 года издается ежемесячный
журнал «Психоонкология», который публикует материалы исследований в области психологических, социальных и поведенческих
аспектов онкологических заболеваний и выступает как официальный журнал Международного
общества психосоциальной онкологии, Британского и Американского обществ психосоциальной
онкологии.
В 1997 году была организована
международная сеть из 18 онкологических клиник, которая разработала первый стандарт психосоциального лечения и порядка его
предоставления в комплексном лечении онкологического заболевания. Рекомендации требуют, чтобы все пациенты онкологической
клиники проходили процедуры
первичной и последующей оценки уровня дистресса. Скрининг на
этапе госпитализации проводится
устно, письменно или на компьютере и называется «термометр дистресса». Оценка в 4 балла и более
указывает, что пациенту необходимо проконсультироваться с психиатром или психологом для более
детальной оценки.
Следующим шагом стала стандартизация и включение психосоциальных вмешательств в комплексную помощь онкологическим
больным. В Австралии, Канаде и
Великобритании были разработаны клинические руководства по
психосоциальному лечению в клинической онкологии.
Психоонкология теперь определяется как область онкологии,
имеющая дело с двумя аспектами
болезни:
1. психоэмоциональными реакциями пациентов и их семей на всех стадиях болезни, а также психосоциальной нагрузкой на персонал;
2. психологическими, социальными и поведенческими факторами,
которые способствуют возникновению рака и выживаемости.
Несмотря на гигантский прогресс
в развитии психоонкологии, в
России, к сожалению, психосоциальная поддержка все еще не является обязательной при уходе за
пациентами с онкологическими
заболеваниями и остается доступной далеко не всем. Насущной потребностью является стандартизация в России международных
моделей психофармакотерапии
и психотерапевтической помощи онкологическим пациентам, а
также программ реабилитации на
различных этапах лечения.
Большая задача – подготовка специалистов к работе в составе междисциплинарной команды, обучение интегративным подходам,
учитывающим также роль психосоциальных факторов при лечении онкологического заболевания.
ESMO VIRTUAL SAMMIT RUSSIA

МЕТАБОЛИЧЕСКАЯ ТЕРАПИЯ И ЕЕ ПЕРСПЕКТИВЫ В ЛЕЧЕНИИ БОЛЬНЫХ СО ЗЛОКАЧЕСТВЕННЫМИ ОПУХОЛЯМИ
Авторы: Чубенко Вячеслав Андреевич,
к.м.н., зав. отделением химиотерапии
солидных опухолей Моисеенко Владимир Михайлович,
д.м.н., профессор директор
Санкт-Петербургский клинический научно-практический
центр специализированных видов медицинской помощи (онкологический)
Одним из признаков злокачественной опухоли является изменение метаболических свойств клеток [1].
К ним относятся:
1) нарушение регуляции утилизации глюкозы и аминокислот,
2) активация “новых” способов получения питательных веществ,
3) использование промежуточных продуктов гликолиза и цикла трикарбоновых кислот для биосинтеза никотинамидадениндинуклеотида фосфата (НАДФ),
4) повышенная потребность в азоте,
5) изменения в регуляции генов метаболизма,
6) метаболические взаимодействия с микроокружением [2].
Особенностью является выраженная гетерогенность энергетического гомеостаза опухолевых клеток вследствие огромного числа причин, в том числе:
1) молекулярного фенотипа (KRAS-мутация; Her2/neu гиперэкспрессия; EGFR-мутация; BRCA-мутация и др.),
2) стадии опухолевого процесса,
3) локализации первичной опухоли или метастаза,
4) размера опухоли,
5) этапа клеточного цикла (S-фаза, M-фаза, G0, 1, 2 – фазы),
6) условий микроокружения [3].
Более 100 лет прошло с тех пор, как Отто Варбург провел первые экспериментальные исследования метаболизма в опухолевых клетках, 74 года с момента внедрения Сидни Фарбер антифолатов в лечение лейкоза и 20 лет изучения взаимосвязи онкогенов и способов потребления энергии [4]. Однако, к сожалению, на сегодняшний день, подобные аспекты не учитываются при планировании лекарственной терапии. Кроме того, без внимания остаются метаболические особенности клеток микроокружения (например, фибробластов) и иммунной системы, которые играют ключевую роль в инициации опухоли и ее прогрессии. Безусловно, терапевтические воздействия на ключевые метаболические мишени как в опухолевых клетках, так и в ее микроокружении, могут быть перспективной стратегией с точки зрения влияния на контроль злокачественного роста и продолжительность жизни больных. К ним относятся:
1) Исключение важнейших метаболитов,
2) Голодание и ограничение калорий, кетодиета,
3) Физические нагрузки,
4) Ингибирование отдельных этапов метаболизма,
5) Использование метаболических особенностей опухолей как “ахиллесову пяту”,
6) Перегрузка клеток глюкозой,
7) Борьба с закислением микроокружения,
8) Потенцирование эффективности стандартной терапии.
Исключение важнейших
метаболитов
Впервые в 1988 году Prager M. и
Baechtel F. продемонстрировали зависимость роста клеток рака почки
от наличия в среде аспарагиназы
[5]. Данный фермент гидролизует
основные энергетические субстраты светлоклеточного рака, такие как
аспарагин и глутамин (около 2-3%).
К 6 дню эксперимента лишь 6% злокачественных клеток оставались
жизнеспособными по сравнению с
66% в обычных условиях. На сегодняшний день аспарагиназа входит в
стандарты лечения острого лимфобластного лейкоза у детей [6]. Интересно отметить, что эффективность
подобного лечения коррелирует с
экспрессией аспарагин синтетазы в
злокачественных клетках. Li H. с соавторами протестировали 225 метаболитов в 928 клеточных линиях 20
типов опухолей [7]. Оказалось, что
в случае снижения функции данного фермента в различных видах
опухолей (чаще при раке желудка и
печени) отмечалось значительное
подавление опухолевого роста. Эти
результаты позволяют предположить, что лечение аспарагиназой в
случае наличия предиктивного маркера (отсутствие фермента или его
гиперметилирование) может рассматриваться как перспективный метод
метаболической терапии различных
солидных опухолей [7].
Голодание и ограничение
калорий, кетодиета
Ограничение калорий, изменение
характера питания и различные
диетические подходы зарекомендовали себя в лечении различных
заболеваний, в т.ч. трудноизлечимой эпилепсии у детей, сахарного диабета 2 типа, ожирения,
дисбактериоза. В исследовании
II фазы (DIRECT) продемонстрирована эффективность голодимитирующей диеты у больных
ранним раком молочной железы
на фоне неоадъювантной химиотерапии по сравнению с обычным режимом питания [8]. При
этом оценивался как клинический ответ, так и влияние на качество жизни (восприятие болезни,
переносимость химиотерапии).
Голод-имитирующая диета включала в себя растительную пищу с
низким содержанием аминокислот. Она представляла собой суп,
бульон, витамины и чай в течение
3-х дней до цикла химиотерапии
и в день цитостатического лечения. При этом калорийность рациона снижалась с первого (~1200
ккал) до 2-4 дня (~200 ккал). В
итоге, у больных на фоне депривации основных энергетических
субстратов была более выражена
стрессоустойчивость и лучшая
переносимость проводимой химиотерапии. Кроме того, согласно опросникам по качеству жизни, у них нарастали показатели
эмоционального, физического,
ролевого, когнитивного и социального функционирования. При
этом снижались параметры усталости, тошноты и бессонницы [8].
Таким образом, подобный подход
может быть рассмотрен как дополнительная опция к проводимой стандартной терапии.
Кетогенная диета (КД) – это режим питания с высоким содержанием жиров, несколько ограниченным потреблением белков и
очень низким содержанием углеводов, который имитирует метаболизм в состоянии голодания,
вызывая выработку кетоновых
тел [9]. Соотношение основных
нутриентов представлено в таблице 1.
Таблица 1.
Характеристика кетогенной диеты
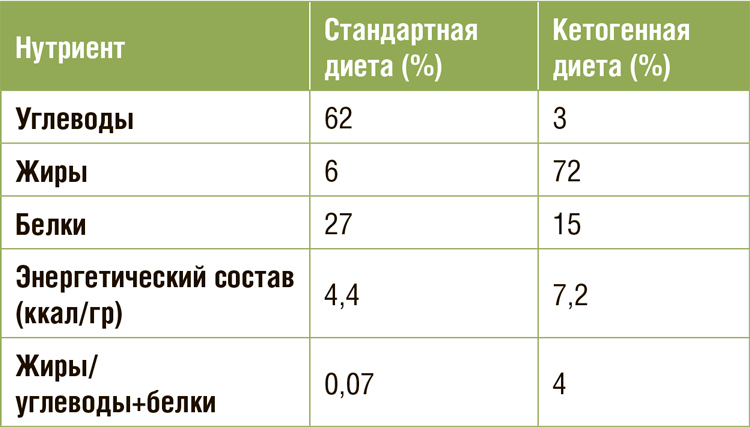
Особенностью КД, в отличие от
голодания, является сохранение
калорий, необходимых для энергетического метаболизма клеток.
В норме образование кетоновых
тел происходит в печени за счет продукции ацетил кофермента А
(ацетил-коА) и окисления жирных
кислот. Кетогенез контролируется
инсулином и глюкагоном. Зачем
нужны кетоновые тела? Они являются альтернативным источником
энергии для клеток головного мозга, поперечнополосатой и сердечной мускулатуры, однако не могут
использоваться раковыми клетками.
Как известно, основным источником энергии для опухоли является
глюкоза. Для того, чтобы поддерживать высокий пролиферативный потенциал в злокачественных
клетках активирован гликолиз
даже в присутствии кислорода (эффект Варбурга). Таким образом,
терапевтический подход в депривации основного нутриента может
быть эффективным с точки зрения
торможения их роста. В случае КД
опухолевые клетки имеют ограниченный доступ к глюкозе и не могут использовать кетоновые тела
для производства энергии в связи
с измененной функцией митохондрий, а также снижением ферментативной активности потребления
кетонов [9].
Положительным аспектом КД является возможность потенцировать эффект химиотерапии или лучевой терапии, например, при раке легкого или нейробластоме [9]. Кроме того, наблюдается синергизм при применении ингибиторов контрольных точек [9]. В экспериментальных работах было показано, что 3-β-гидроксибутират подавляет экспрессию PD-L1 в миелоидных клетках, увеличивая число CXCR3+ Т-клеток и экспрессию интерферона 1. Ключевым механизмом является активация AMPK, которая фосфорилирует PD-L1, что приводит к его последующей деградации [9].
Что касается клинических результатов, то в рандомизированном исследовании применения КД у больных раком молочной железы, получающих стандартную химиотерапию, было отмечено значительное снижение фактора некроза опухоли α (ФНО-α) после 12 недель терапии (р<0,001), повышение интерлейкина-10 (ИЛ-10) (р<0,001), снижение уровня инсулина (р<0,002), а также уменьшение размеров опухоли и снижение стадии процесса при местнораспространенном новообразовании по сравнению с контрольной группой (27 и 6 мм, р=0,01) [10].
Физические нагрузки
Эпидемиологические исследования демонстрируют снижение риска развития около 13 видов злокачественных опухолей на фоне физической активности [11]. Очевидно, что в основе этого эффекта лежит перепрограммирование метаболических процессов в организме в целом. При этом предклинические исследования на грызунах показывают, что бег на колесе, на беговой дорожке или плавание снижают частоту возникновения опухолей, их рост и метастазирование независимо от выбранной модели (перевиваемые или индуцированные) [11]. С чем это может быть связано? Физические упражнения изменяют возможные регуляторные механизмы роста злокачественных опухолей, что неизбежно сопровождается выраженными метаболическими изменениями. К ним относятся: изменение кровотока, регуляция pH, активация симпатической нервной системы, гипертермия, изменение концентрации половых гормонов и гормонов “стресса” (инсулин, лептин, глюкокортикоиды, катехоламины), изменение уровня циркулирующих экзосом, цитокинов и миокинов, а также факторов роста, деактивация сигнальных путей (HIPPO/YAP или Akt/mTOR), повышение активности иммунной системы за счет эпинефрин-зависимой стимуляции (ИФН1, NK-клетки), снижение функции опухолевой лактатдегидрогеназы (ЛДГ) и, тем самым, подавление секреции лактата в микроокружени [11]. В недавно опубликованном клиническом исследовании влияния физической нагрузки на эффективность неоадъювантной химиотерапии у больных раком пищевода было установлено значительное уменьшение объема опухоли по сравнению с контрольной группой: TRG 1–3 n=15/20 (75%) и n=7/19 (36,8%), p=0,025, соответственно. При этом было отмечено сокращение размеров региональных лимфатических узлов (42,9% и 15,8%, р=0,089, соответственно) и изменение иммунологических показателей (CD3, CD8, ИЛ-6, VEGF, ИФН1, ФНО-α) [11].
Ингибирование отдельных этапов метаболизма
Важным аспектом, с учетом гетерогенности опухолевого метаболизма, является поиск предиктивных маркеров перед назначением препаратов, влияющих на отдельные этапы энергетического гомеостаза. Например, к ним относятся:
1) низкий уровень экспрессии аспарагин синтетазы в клетках солидных опухолей (рак желудка или рак печени), что может коррелировать с эффективностью L-аспарагиназы;
2) мутация в гене KEAP1 в клетках аденокарциномы легкого, активирующая экспрессию цистеин/ глутамат переносчика xCT (SLC7A11), который выделяет из клетки глутамат в обмен на цистеин, необходимый для образования глутатиона. В этой связи блокада xCT сульфасалазином может быть эффективной с точки зрения подавления антиоксидантной защиты в злокачественных клетках [4]. Кроме того, данный генетический дефект определяет глутамин в качестве основного источника энергии в опухоли. Эти данные теоретически дают перспективу применения ингибиторов глутаминазы;
3) нарушение функции гена фонХиппель Линдау (pVHL) при светлоклеточном раке почки приводит к активации фактора 1, индуцированного гипоксией (HIF-1α). Данный факт является предиктором возможного эффективного подавления гликолиза;
4) мутация в гене KRAS в клетках рака поджелудочной железы может быть предиктором эффективного влияния на метаболизм незаменимых аминокислот [12]. Кроме того, клинический интерес представляет активация аутофагии в опухолевых клетках на фоне подавления функции KRAS-MEK-ERK сигнального пути, например, таргетными препаратами (траметиниб). Это связано с активацией сигнального каскада LKB1-AMPK-ULK, который регулирует данный процесс. На моделях клеточных линий было показано, что одним из ингибиторов аутофагии является гидроксихлорохин (антималярийный препарат). В итоге на фоне его применения в дозе 1200 мг/сутки с траметинибом 2 мг/сутки был зарегистрирован частичный регресс опухоли поджелудочной железы с нормализацией биомаркера СА19-9 у больного, резистентного к стандартной терапии [12];
5) экспрессия MYC прогнозирует возможность влияния на метаболизм глутамина в различных опухолях [5];
6) мутация в генах IDH1 и 2 приводит к торможению образования
2-гидроксиглутората и способствует росту клеток острого миелолейкоза. На сегодняшний день
одобрены 2 ингибитора данных
мишеней в клинической практике
(энасидениб и ивосидениб) [4].
Использование метаболических особенностей опухолей как «ахиллесову пяту» (витамин С и ферроптоз)
Ферроптоз – это один из сравнительно недавно открытых (в 2012 г.) механизмов клеточной гибели. В отличие
от некроза, апоптоза, пироптоза или
аутофагии он обусловлен накоплением в клетке свободных радикалов
(активных форм кислорода) из-за железо-опосредованного перекисного
окисления липидов [13]. Считается,
что опухолевые клетки в большей
степени подвержены ферроптозу в
связи с их выраженной пролиферативной и метаболической активностью. Данное обстоятельство делает
подобный механизм клеточной гибели перспективной терапевтической
мишенью.
Витамин С является незаменимым
микроэлементом благодаря множеству функций, которые он выполняет
в организме. Его “незаменимость” у
человека определяется отсутствием
фермента гулонолактон оксидазы,
необходимого для синтеза витамина С в связи с окислением глюкозы.
Витамин С в организме является
кофактором гидроксилирования
пролина и лизина, необходимых для
синтеза коллагена типа 1. Кроме того,
его стандартные дозы являются компонентом антиоксидантной защиты
[14].
Одно из первых рандомизированных
исследований, в котором оценивалась
эффективность витамина С у больных злокачественными опухолями,
было проведено Creagan E. с соавторами в 1979 г. Значимых различий, с
точки зрения, общей выживаемости,
лечебного эффекта и качества жизни
достигнуто не было. Похожие данные
были получены Moertel с соавторами
у больных метастатическим колоректальным раком [14].
В последующих экспериментальных работах была предпринята попытка объяснить полученные негативные результаты. Оказалось, что основное терапевтическое значение имеет доза препарата и способ его введения. Предклинические и клинические исследования показали, что при внутривенном введении в высоких дозах витамин С оказывает противоопухолевое действие. Благодаря сложной фармакокинетике подобный эффект наблюдается при достижении его концентрации в плазме не менее 0,25 ммоль. Регуляция транспорта витамина С в опухолевую ткань осуществляется транспортерами (SVCT и GLUT), экспрессия которых зависит от типа клеток. Основным противоопухолевым механизмом действия витамина С является индукция образования свободных радикалов вследствие реакции Фентона. Важно отметить, что помимо общепризнанных прооксидантных эффектов, витамин С модулирует ферменты TET, способствующие деметилированию ДНК, и действует как кофактор гидроксилаз HIF, активность которых необходима для протеасомной деградации HIF-1α. Указанные особенности открывают новые возможности лечения опухолей со специфическими молекулярными дефектами (например, наличие KRAS-мутации, гиперэкспрессия HIF-1α или изменения TET2, IDH1/2 и WT1). Более того, действие витамина С на уровне ДНК может стать рациональной основой для комбинированной терапии с ингибиторами PARP и гипометилирующими агентами. На сегодняшний день растет число публикаций о клинической эффективности высоких доз витамина С [14]. В нашей клинической практике у пожилого больного с диссеминированным колоректальным раком (KRAS-мутация) при прогрессировании после 3-х линий лекарственной терапии было отмечено снижение биомаркера РЭА с 1661 до 188 нг/мл и торможение роста метастатических очагов на фоне внутрипеченочной инфузии высоких до витамина С при отсутствии клинически значимых побочных эффектов и субъективном улучшении общего состояния.
Перегрузка клетки глюкозой (гипертермия с перекислением)
В конце прошлого столетия достаточно активно проводили экспериментальные работы для изучения
влияния гипертермии на pH опухолевого микроокружения, а также на
метаболизм злокачественных клеток
[15]. На примере саркомы Юшида
при помощи капиллярного электрода изучали внеклеточный и внутриклеточный pH in vivo как в опухолевых, так и в нормальных клетках у
крыс линии Вистар. Оказалось, что
в обычных условиях опухоль, печень
и желудочно-кишечный тракт имели сходный pH в микроокружении
(7,05–7,3). При этом внутриклеточный pH в опухоли был всегда выше
(7,2), чем в нормальных клетках (6,8–
7,1). В случае лечебной гипертермии
крысы (420С в течение 1 часа) изменений внутри- и внеклеточного pH
не наблюдалось. Если же в этих условиях вводили глюкозу (6 гр/кг, уровень глюкозы в плазме 22 ммоль/л, в
течение 6 часов), то кислотность опухолевого микроокружения заметно
снижалась (до 6,6) и сохранялась в
течение 12–14 часов на достигнутом
уровне. При этом изменений pH
внутри злокачественной клетки не
наблюдалось. Однако в гистологических срезах было отмечено снижение
эффективности гликолиза и окислительного фосфорилирования. Важно
отметить, что в подобных экспериментальных условиях pH в нормальных клетках и их микроокружении
не изменялась. Таким образом, был
отмечен синергетический эффект
гипертермии и гипергликемии с точки зрения торможения метаболизма
опухолевой клетки [15].
Борьба с закислением микроокружения
Кислотность (pH) – является одной из важнейших особенностей
метаболизма опухолевой клетки.
Обычно наблюдается внеклеточный ацидоз и внутриклеточный
алкалоз или ощелачивание. Подобный градиент обеспечивает
возможность пролиферации клеток, защиту от апоптоза, метаболическую адаптацию, миграцию и
инвазивную способность клеток,
активность микроокружения (иммунной системы и фибробластов).
Безусловно, понимание механизмов pH-зависимого поведения
клеток обеспечит развитие новой
терапевтической стратегии опухолей [16].
В предклинических работах было
показано, что у мышей на фоне
приема бикарбоната натрия наблюдается меньшее число метастазов и увеличивается продолжительность жизни. Кроме того,
алкализация микроокружения
потенцирует эффект ингибиторов
контрольных точек. Клинические
исследования также подтверждают подобную гипотезу. У больных
диссеминированным раком поджелудочной железы наблюдалось
значительное увеличение продолжительности жизни на фоне приема бикарбоната по сравнению с
контрольной группой (15,4 и 10,8
мес, соответственно; р<0,005) [16].
Потенцирование эффективности стандартной терапии
Оксид азота (NO) является стабильным свободным радикалом, который
участвует во многих физиологических и патологических процессах
в организме. В предклинических
работах было показано, что NO повышает эффективность химио- и
лучевой терапии, особенно в случае
выраженной гипоксии в опухоли, за
счет усиления кровотока и снижения потребления кислорода [17]. В
качестве терапевтической стратегии
было предложено введение доноров
NO. Однако данный подход оказался
весьма токсичным в связи с системной вазодилатацией и гипотензией,
а также малоэффективным из-за замедления кровотока в опухоли, усугубления гипоксии и снижения pH.
Альтернативой является стимуляция
продукции NO за счет назначения
L-аргинина, как эндогенного субстрата фермента синтетазы оксида
азота (NOS). Существует 3 изоформы данного белка. При этом в опухолевой ткани, как и при воспалении,
и гипоксии, значение приобретает
NOS2. Наибольшая экспрессия фермента наблюдается в клетках рака молочной железы, рака легкого, а также
в церебральных метастазах. Назначение L-аргинина активно используется для лечения больных с эндотелиальной дисфункцией и генетической
патологией митохондрий для улучшения микроциркуляции. При этом
подобный подход нивелирует гемодинамические нарушения, которые обусловлены гиперпродукцией
NO. В этой связи достаточно перспективным является применение
L-аргинина в NOS-экспрессирующих
опухолях в качестве сенсибилизатора
к повреждению ДНК на фоне стандартной терапии в результате NOиндуцированного подавления метаболизма. В качестве доказательства
подобной концепции было проведено исследование у 63 больных с метастатическим поражением головного
мозга. Одна группа больных (n=31)
получала 10 г L-аргинина внутрь за 1
час перед каждой фракцией облучения (1,6 Гр, 20 фракций, СОД 32 Гр).
Другой группе (n=32) проводилось
только облучение головного мозга.
Объективный ответ составил 22%
в группе контроля и 77,4% в группе
L-аргинина, р<0,001, соответственно.
При этом клинический эффект наблюдался у 93,5% больных по сравнению с контрольной группой (50%)
[17].
Таким образом, метаболизм опухолевой клетки является сложным и
пластичным процессом с выраженной гетерогенностью в зависимости
от различных факторов. Безусловно,
на сегодняшний день предпринимаются попытки поиска ключевых
мишеней энергетического гомеостаза опухолевой клетки с целью терапевтического воздействия для увеличения продолжительности жизни
больных. Без сомнения, подобное направление является перспективной
стратегией лекарственной терапии
злокачественных опухолей. Основными проблемами, которые требуют
решения, являются:
- общее отношение к раку как генетическому заболеванию без учета метаболических последствий этих молекулярно-генетических нарушений; - отсутствие эффективной модели для изучения метаболической терапии; - наличие параллельных путей и пластичность опухолевых процессов;
- интер- и интратуморальная гетерогенность метаболизма;
- возможность переключения метаболизма при отсутствии необходимых источников энергии и биоматериала;
- схожесть метаболических процессов в опухолевой и здоровой ткани;
- отсутствие интереса “большой”
фармы.
Литература:
1. Hanahan, D. Hallmarks of Cancer: New Dimensions // Cancer Discov.-2022.-V. 12.-p. 31-46
2. Pavlova, N., Thompson C. The Emerging Hallmarks of Cancer Metabolism // Cell Metab.-2016.-V. 23.-p. 27-47
3. Kerk S., Papagiannakopoulos T., Shah Y., Lyssiotis C. Metabolic networks in mutant KRAS-driven tumours: tissue specificities and the microenvironment // Nat Rev Cancer.-2021
4. Stine Z., Schug Z., Salvino J., Dang C. Targeting cancer metabolism in the era of precision oncology // Nat Rev Drug Discov .-2021
5. Prager M., Baechtel F. Human renal carcinoma: asparagine independence with asparaginase susceptibility in culture // Cancer Lett.-1988.- V. 43.-p. 191-195
6. Douer D., Gökbuget N., Stock W., Boissel, N. Optimizing use of L-asparaginase-based treatment of adults with acute lymphoblastic leukemia // Blood Rev.-2021.-V. 100908
7. Li H. The landscape of cancer cell line metabolism // Nat Med.-2019.-V. 25.-p. 850-860
8. Lugtenberg R. Quality of life and illness perceptions in patients with breast cancer using a fasting mimicking diet as an adjunct to neoadjuvant chemotherapy in the phase 2 DIRECT (BOOG 2013-14) trial // Breast Cancer Res Treat.-2021.-V. 185.-p. 741-758
9. Zhu H. Ketogenic diet for human diseases: the underlying mechanisms and potential for clinical implementations // Signal Transduct Target Ther.-2022.-V. 7.-p. 11
10. Seyfried T. N. Consideration of Ketogenic Metabolic Therapy as a Complementary or Alternative Approach for Managing Breast Cancer // Front Nutr.-2020.-V. 7.-N 21
11. Hojman P., Gehl J., Christensen J., Pedersen B. Molecular Mechanisms Linking Exercise to Cancer Prevention and Treatment // Cell Metab.-2018.-V. 27.-p. 10-21
12. Kinsey C. Protective autophagy elicited by RAF→MEK→ERK inhibition suggests a treatment strategy for RASdriven cancers // Nat Med.-2019.-V. 25.-p. 861
13. Xu G., Wang H., Li X., Huang R., Luo L. Recent progress on targeting ferroptosis for cancer therapy // Biochem Pharmacol.-2021.-114584
14. Zasowska-Nowak A., Nowak P., Ciałkowska-Rysz, A. High-Dose Vitamin C in Advanced-Stage Cancer Patients // Nutrients.-2021.-V. 13
15. Lee S. Quo Vadis Oncological Hyperthermia // Front Oncol.- 2020.-V.- 10.-p. 1690
16. Hamaguchi R. Effects of Alkalization Therapy on Chemotherapy Outcomes in Advanced Pancreatic Cancer: A Retrospective Case-Control Study // In Vivo.-2020.-V. 34.-p. 2623-2629
17. Marullo R. The metabolic
adaptation evoked by arginine
enhances the effect of radiation in
brain metastases // Science Advances.-
2021.-V. 7
ПОДМЕЧЕНО ОНКОЛОГОМ: БУДЕМ ЖИТЬ!
В ТАКСИ
Наталья ДЕНЬГИНА
«Путевые заметки и короткие эссе из жизни онколога стали
неотъемлемой частью жизни практикующего врача»
1.
День перелетов-переездов. Из Внуково в Домодедово вызвала «Яндекс.Такси», настроилась на долгий путь. В облике длинноволосого седобородого водителя неясно проступало что-то богемное; подумала – а, показалось. Полдороги ехали молча, потом – слово за слово – разговорились, пока не выяснилось, что почти земляки («Ох, давненько там не был!..»). С восклицания – «Мог ли я, профессиональный музыкант, подумать, что стану таксистом!» – начался монолог. – Бас-гитарист. Шесть лет по гастролям, двадцать пять – по ресторанам отпел, ещё пять – аранжировщиком. А с января – вот это... Коллектив? Да вы, наверное, не помните. Группа «Ласковый бык». Помните?! (Быстрый поворот через плечо: оценил возраст, в глазах заискрилось – помнят! Ни фига не помню, только название – вместе с «Ласковым маем» крутилось, правда, реже). – Да-а-а, залы собирали! Я с гастролей привозил от пятисот до полутора тыщ – это как сейчас тыщ двести! В шоколаде жили, классно было... – Блохин-то умер года три назад (основатель «Быка»). Молодой, да-а, но больной весь – цирроз. А чего ждать, если он за концерт по четыре бутылки водки выпивал? Месяца за три до этого по скайпу созванивались, все говорил: давай, Мишаня, соберём основной состав да проедем с гастролями, да со старыми хитами! Планировал – а будто прощался. Я и сам-то случайно в больницу попал, и диабет выявился – теперь вот на диете сижу. Зато похудел. – У меня сейчас одна надежда: что на обратном пути из Домодедово за наличку повезу. А то и заправиться не на что… Помог достать чемодан, в усах-бороде мелькнула улыбка, блеснул шарм человека, проведшего больше полжизни на сцене – да и разошлись. Утро стало грустным, несмотря на солнце.
2.
Питер. Еду в такси по Невскому в час пик. Мой шеф лавирует между авто и встаёт на светофоре. Из автобуса справа наполовину высовывается водитель, щурится на солнце и лениво так говорит моему: «Вообще-то выезжать на встречку нехорошо-о-о…» Мой старательно тянет длинную шею в дальнее от себя окно, кивает понимающе и признает: «Да я это... перепутал». Всовывается обратно и втискивает машину перед автобусом. Я представила себе подобный диалог в другом городе. Наверное, потому тут и голуби по проезжей части безбоязненно ходят. Я таю, Питер!
3.
Начало учебного года отметилось солнечным и ветреным утром. С Волги дуло так, что хотелось закутаться во что-нибудь объемное. Потоптавшись минут десять среди немногочисленных «правильных» родителей, сопроводивших своих чад в новый класс, была решительно отправлена на работу, потому как нечего позорить взрослого человека перед новыми одноклассниками своими требованиями надеть куртку. Размышляя о том, как чадо дойдёт по такому ветру в курточке до «Губернаторского», уселась в такси – старую серую «Волгу» с не менее пожилым водителем в кепочке. – Как-то свободно тут, хоть и второе сентября, странно... Рано ещё? Через час, чую, не протолкнешься. – Вы тоже провожали в школу? Класс какой? У-у-у, десятиклассница – это уже практически взрослая, почти невеста! Я вот тут дня четыре назад девчушку подвозил, ее парень провожал. Вот нацеловывались! Спрашиваю ее потом: замуж собираешься? Не-е-ет, говорит, я ещё школьница, 11 класс! А уж как лобзал, как лобзал! Ну да самые те годы, чтоб целоваться… – Нда-а-а, вот и сентябрь... У меня третий внук закончил пятый класс, в шестой идёт. Спрашиваю: Никитк, соскучился по школе, поди? А он мне: дед, даже не напоминай! Не любят они школу нынче: ни школу, ни учителей, да... Я помню, для нас учитель был сродни Богу! Наша классная дама носила прическу, ну, такую – уши закрыты были. А однажды, помню, причесывается, я глянул – батюшки! А у неё уши-то – такие же, как и у нас всех! Вот открытие было для меня! А сейчас? То драку устроят с учителем, то нож в спину воткнут. Куда страна катится? Приехали. Пожелали друг другу доброго сентября – и «Волга», покачивая широким задом, отправилась к другим клиентам, которых, видимо, ждала такая же уютная поездка с неспешными разговорами.
4.
Шереметьево. 45 минут до мероприятия, тогда как на гуглнавигаторе – час десять минут
пути. Нервяк. Подруливает «шкода» с большим водителем, похожим на актера... ммм... эээ... вспомню потом.
Парой слов обнадеживает, выруливает на платную трассу, уже экономим минут десять, есть надежда успеть хотя бы к концу. 5
– Откуда вы? О, у меня хороший друг живет в Димитровграде, это же недалеко? Во-о-от! Был там.
– Мечтаю, чтоб сын поступил в Ульяновскую школу авиации. Я и сам обожаю небо, да-а. Вот там я себя комфортно чувствую, как дома. Особые ощущения: ширь, свобода, маневренность! Вот нырять меня не заставите – ни-ни. Помню, лет пятнадцать мне было, поехал сам – один! – на перекладных к будущей жене, которая с тещей-ду... мамой своей неумной в приморском городке отдыхала. Горд был неимоверно: доехал! Нашёл! Лежим на пляже, а с ними тетя-подруга, как свинка из мультика «Ну, погоди!»: шляпа – во, бюст 35-й, живот 135-й, рассказывает про дочь, что за лейтенанта замуж вышла: и все у них в военном городке зашибись, и талонов на питание завались... А теща моя будущая, дура которая, – то есть, неумная женщина, и говорит: «Вот бы, Маш, и нам такого лейтенанта, да?» При мне?! Который героически, за тыщи километров к любимой приехал, пацан пятнадцати лет! Встал я и пошёл к морю. Щас как уплыву от вас, думаю. Сам-то спортивный был парень, а попал в отлив: отплыл, берег далеко – и как начало утягивать ещё дальше! И вдруг – по ноге прошлось чтото гладкое, упругое, может, медуза большая, может, ещё кто. Обмер! Кое-как рывками выгреб, кинулся на берег, дышу, как рыба, думаю: земля-а-а-а!.. песо-о-очек!.. воздуу-ух!.. и Нинвасильна, теща будущая моя, милая женщина-а-а!.. и больше не буду-у-у один далеко!.. Недавно, уже взрослыми, в Эгейском море совершили заплыв на четверых, мы с супругой и друг с женой. А оно ж чистейшее, морето, за сотни метров дно видно. И вот друг решил прикольнуться: на песчаном дне наши тени видны, мы плывём себе, а он и говорит: бли-и-ин, там – она! Плывет к нам! Бл.., все назад! Глянул вниз – а там тень движется. Я ка-а-ак дристанул к берегу! Они мне орут и ржут: «Куда?! А жену спасать?»
– Старшему 27 уже, мать внуков хочет, а он – сам дитя ещё. Есть же вот это дурацкое выражение: если нам не жилось хорошо, пусть хоть у них все будет. Помните 90-е? И я никогда не забуду, как теща приезжала в гости, привозила батон, пакет молока и груду костей из магазина. Где мясо с тех костей, науке неизвестно, но кости – это как минимум бульон, тушеная на нем же картошка – почти роскошь. Сын родился – вот и мы так же: все что захочешь – на! Где только не был. И икра тебе всякая, и гувернантки. Во-от, вы правы: они в любых условиях вырастут, дети, их лишь любить надо. Но попробуй вразуми молодых родителей.
– С младшим у них 12 лет разницы. Не-ет, мы и не планировали второго. Все казалось: денег недостаточно, не обеспечим по полной – хотя жили хорошо. Но жизнь подсказала, где истинные ценности. Ехали как-то осенью от родственников, настроение – во! Природа, воздух, золотая осень. Летел – словно ветер по трассе. Малый сзади спал, мы с женой впереди пристёгнуты. Пошёл на обгон нескольких машин – а впереди «Рено» вильнул внезапно, я, чтоб не столкнуться, взял влево – и в кювет вылетели. Нет, обошлось. Машина в хлам, восстановлению не подлежала уже, конечно. Хорошая машина была, надёжная. Жену в больницу увезли, мы с сыном ушибами отделались. Словно Бог нам сверху погрозил (тут мой шеф размашисто помахал пальцем на фоне паузы), мол, задумайся, что есть важного в жизни. И подумали мы: а вот если б не обошлось? Если б с сыном непристегнутым что случилось? Для чего жить тогда? На кой эта жизнь нам, выжившим идиотам? Для чего мы в ней? И решили, что это – знак. Казалось: э-э, молодые, с ползахода забеременеем. Ан нет, четыре месяца понадобилось. И вот ведь магия цифр: случилось то происшествие с нами 29 сентября в 9.40 – а Глеб родился спустя год, 29 сентября в 9.20! Чтоб всю жизнь помнили тот урок, что семью нашу счастливо пополнил.
– Долго не мог смириться с тем, что таксистом стал – а ведь уж скоро два года как таксую, жизнь заставила. Но, столкнувшись с охранниками, понял: это ещё далеко не самое дно. Как мне сказали, если ты поработал охранником больше трех месяцев и остался – вот это херово: мало кто из нормальных людей готов больше трёх месяцев холодный борщ из банки хлебать... Успели. Распрощались. Пожелали друг другу.
Как интересно и как странно: с некоторыми людьми никогда больше
не встретишься – а помнить о них
продолжаешь.
ОПДИВО+ЕВРОЙ
Для лечения опухолей ЖКТ
