КОНГРЕСС AACR2021: РОССИЙСКИЙ ИНГИБИТОР FGFR2 АЛОФАНИБ ПРОДЕМОНСТРИРОВАЛ УДОВЛЕТВОРИТЕЛЬНЫЙ ПРОФИЛЬ БЕЗОПАСНОСТИ У БОЛЬНЫХ РАКОМ ЖЕЛУДКА В ПЕРВОЙ ЧАСТИ КЛИНИЧЕСКОГО ИССЛЕДОВАНИЯ 1B ФАЗЫ
Алофаниб (МНН) является низкомолекулярным аллостерическим селективным ингибитором, деформирующим экстрацеллюлярную часть рецептора фактора роста фибробластов 2 типа (FGFR2) на поверхности опухолевой клетки. В исследованиях на животных было показано, что ингибирование этого рецептора приводит к торможению роста опухоли. Ингибирующая концентрация препарата составляет 7-9 нмоль/л в зависимости от изоформы FGFR2.

10 -11 ИЮНЯ 2021
ESMO VIRTUAL SUMMIT RUSSIA
КОНГРЕСС AACR2021: ТИСЛЕЛИЗУМАБ В ИССЛЕДОВАНИИ RATIONALE 303 И СИНТИЛИМАБ В ИССЛЕДОВАНИИ ORIENT-3 ПРОДЕМОНСТРИРОВАЛИ ЭФФЕКТИВНОСТЬ У БОЛЬНЫХ МЕТАСТАТИЧЕСКИМ РАКОМ ЛЕГКОГО
Два новых китайских ингибитора PD-1 показали эффективность у пациентов с метастатическим немелкоклеточным раком легкого, ранее получавших платиновый дуплет. В обоих исследованиях сравнение было с доцетакселом. В первом исследовании 3 фазы RATIONALE 303 (N=805) тислелизумаб (tislelizumab), модифицированное анти-PD-1 антитело с минимальным связыванием FcγR на макрофагах (потенциальный механизм резистентности к...
КОНГРЕСС AACR2021: ВПЕРВЫЕ ПРОДЕМОНСТРИРОВАНО ДОСТОВЕРНОЕ УЛУЧШЕНИЕ ОБЩЕЙ ВЫЖИВАЕМОСТИ БОЛЬНЫХ МЕТАСТАТИЧЕСКОЙ УВЕАЛЬНОЙ МЕЛАНОМОЙ. УЛУЧШИЛ ЕЕ ПЕРВЫЙ ИЗ КЛАССА ПРЕПАРАТ НА ОСНОВЕ Т-КЛЕТОЧНОГО РЕЦЕПТОРА – ТЕБЕНТАФАСП
Пациенты с метастатической увеальной меланомой имеют неблагоприятный прогноз, показатель общей выживаемости в течение 1 года составляет 52%. В рандомизированных исследованиях не было доказано, что системное лечение оказывает значимое влияние на продолжительность жизни. Тебентафасп (tebentafusp) – это биспецифический слитой белок, состоящий из Т-клеточного рецептора (TCR), слитого с эффектором анти-CD3, активирующий Т-клетки...

9 — 11 НОЯБРЯ МОСКВА
РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС
КОНГРЕСС AACR2021: НИВОЛУМАБ В КОМБИНАЦИИ С ПЛАТИНОВЫМ ДУПЛЕТОМ ОКАЗАЛСЯ ЭФФЕКТИВНЫМ В НЕОАДЪЮВАНТНОЙ ТЕРАПИИ НЕМЕЛКОКЛЕТОЧНОГО РАКА ЛЕГКОГО
Неоадъювантный ниволумаб в комбинации с химиотерапией показал обнадеживающие результаты у больных резектабельным немелкоклеточным раком легкого (НМРЛ) IB-IIIА стадий. Первичная конечная точка – частота полных патологических ответов – была достигнута. Вторая первичная конечная точка – бессобытийная выживаемость – в процессе анализа. У пациентов с неметастатическим НМРЛ хирургическое вмешательство играет главную роль, однако у...

ЛЕКАРСТВЕННАЯ ТЕРАПИЯ РАКА ЖЕЛУДКА. БУДУЩЕЕ ЗА БИОМАРКЕРАМИ?
Пациентам с неоперабельным и/ или метастатическим раком желудка и раком пищеводно-желудочного перехода (РЖ/РЖП) как правило необходима системная терапия. Для большинства пациентов стандартом лечения остается химиотерапия1 4 , исключение составляют небольшое число пациентов с опухолями определенных молекулярных подтипов. Трастузумаб, представляющий собой моноклональное антитело, прицельно действующее на HER2...
НИВОЛУМАБ В КОМБИНАЦИИ С ПРЕПАРАТАМИ ПЛАТИНЫ И ФТОРПИРИМИДИНАМИ – НОВЫЙ СТАНДАРТ ТЕРАПИИ ПЕРВОЙ ЛИНИИ ДИССЕМИНИРОВАННОГО РАКА ЖЕЛУДКА
Комбинация химио- и иммунотерапии активно изучается и внедряется в рутинную клиническую практику при различных солидных опухолях, рак желудка (РЖ) – не исключение. Однако до 2020 года успехи иммунотерапии РЖ были скромными. С 2017 г. на основании результатов исследований ATTRACTION-2 и Check Mate032 ниволумаб в монотерапии, вне зависимости от уровня PDL1 или СPS, является вариантом выбора в поздних линиях лечения больных РЖ [1, 3]...
НОВЫЕ ДАННЫЕ ИССЛЕДОВАНИЯ 218 (NCT03173560) ПО ОЦЕНКЕ ПРИМЕНЕНИЯ КОМБИНИРОВАННОГО РЕЖИМА ЛЕНВАТИНИБ ПЛЮС ЭВЕРОЛИМУС ПРИ РАСПРОСТРАНЕННОМ ПОЧЕЧНО-КЛЕТОЧНОМ РАКЕ: IKCS 2020 (INTERNATIONAL KIDNEY CANCER SYMPOSIUM 2020)1
Результаты исследования 218 (фазы 2), в котором сравнивали безопасность и эффективность двух стартовых доз ленватиниба (18 мг и 14 мг один раз в сутки*), перорального мультитаргетного ингибитора тирозинкиназ в комбинации с эверолимусом (5 мг один раз в сутки) у пациентов со светлоклеточным почечно-клеточным раком (ПКР) после антиангиогенной терапии (допускалось предшествующее применение антагонистов PD-1/PD-L1), были...
НОВЫЙ СТАНДАРТ ЛЕЧЕНИЯ ТРОЙНОГО НЕГАТИВНОГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ В ПОЗДНИХ ЛИНИЯХ ТЕРАПИИ
Рецептор Trop-2 (TACSTD2), как и рецептор EpCAM (TACSTD1), входит в семейство рецепторов TACSTD и в норме экспрессируется на поверхности как нормальных, так и трансформированных эпителиальных клеток и участвует в регуляции пролиферации, клеточной адгезии и миграции. Гиперэкспрессия рецептора Trop-2 выявляется при многих солидных опухолях и в большинстве случаев ассоциируется с неблагоприятным прогнозом...
KRASG12C – НОВАЯ МИШЕНЬ ПРИ НЕМЕЛКОКЛЕТОЧНОМ РАКЕ ЛЕГКОГ0
Частота встречаемости миссенс-мутации G12C (замена глицина на цистеин) в гене KRAS при НМРЛ достигает 14%. До 2020 года, несмотря на четыре десятилетия поисков, ни один анти-KRAS препарат не показал своей эффективности и не был внедрен в клиническую практику. В декабре 2020 г. Управление по контролю за качеством пищевых продуктов и лекарственных средств (FDA) США присвоило статус «прорывной терапии» препарату...

Анонс
-

10 -11 ИЮНЯ 2021
ESMO VIRTUAL SUMMIT RUSSIA
-

9 - 11 НОЯБРЯ 2021
РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС
КОНГРЕСС AACR2021: РОССИЙСКИЙ ИНГИБИТОР FGFR2 АЛОФАНИБ ПРОДЕМОНСТРИРОВАЛ УДОВЛЕТВОРИТЕЛЬНЫЙ ПРОФИЛЬ БЕЗОПАСНОСТИ У БОЛЬНЫХ РАКОМ ЖЕЛУДКА В ПЕРВОЙ ЧАСТИ КЛИНИЧЕСКОГО ИССЛЕДОВАНИЯ 1B ФАЗЫ
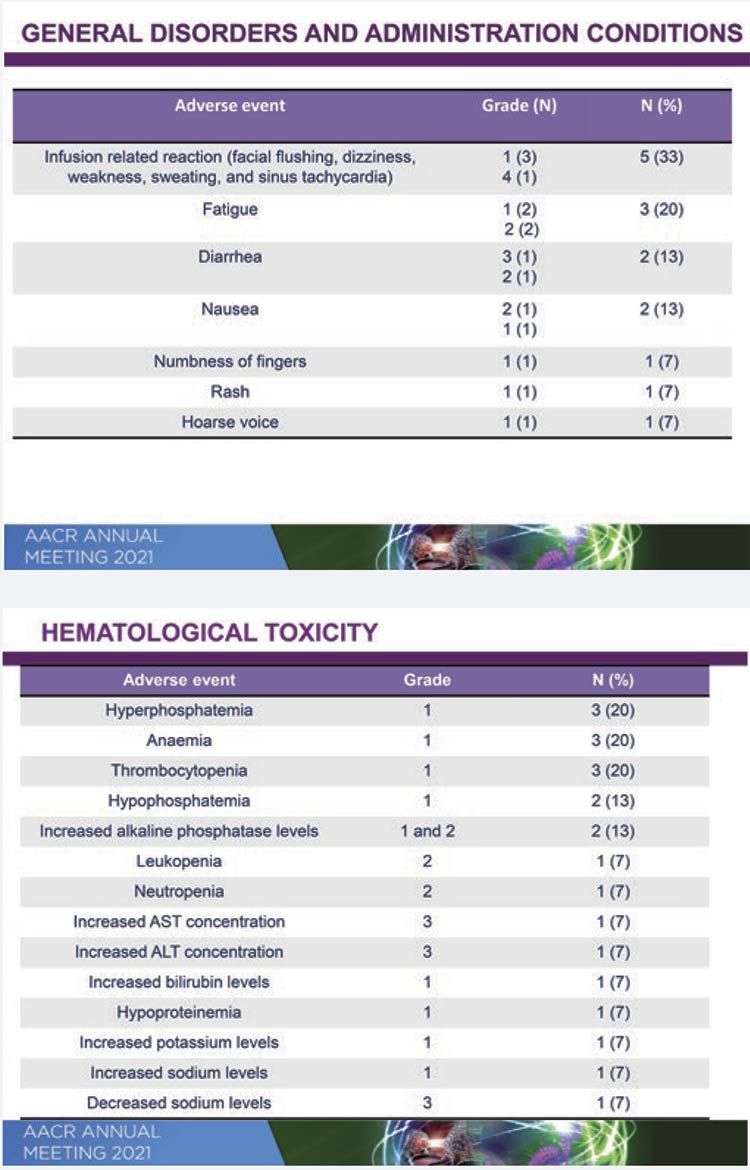
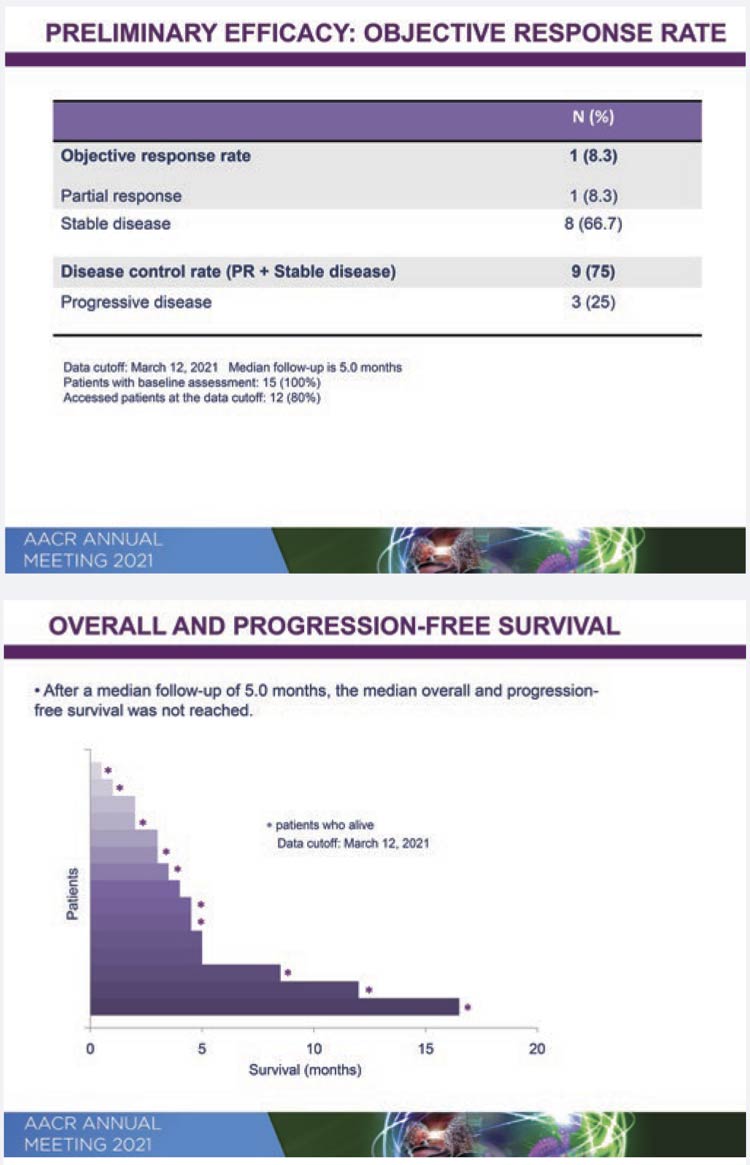
Алофаниб (МНН) является низкомолекулярным аллостерическим селективным ингибитором, деформирующим экстрацеллюлярную часть рецептора фактора роста фибробластов 2 типа (FGFR2) на поверхности опухолевой клетки. В исследованиях на животных было показано, что ингибирование этого рецептора приводит к торможению роста опухоли. Ингибирующая концентрация препарата составляет 7-9 нмоль/л в зависимости от изоформы FGFR2. Клиническое исследование RPT835GC1B было спланировано для изучения безопасной дозы алофаниба, фармакокинетики, предварительной эффективности, а также корреляции амплификации FGFR2 с эффективностью у больных метастатическим раком желудка. ПациКОНГРЕСС AACR 2021 ЛЕКАРСТВЕННАЯ ТЕРАПИЯ РАКА ЖЕЛУДКА C.2 C.4 C.8 C.11 енты с аденокарциномой до включения в исследование получили все возможные опции стандартного лечения, и ресурс дальнейшей терапии был исчерпан. Дизайн исследования включал 2 части: оценку безопасности различных доз (стандартный дизайн «3+3») и оценку предварительной эффективности в расширенной когорте. Первые результаты (оценка безопасности различных доз) были представлены на конгрессе Американской ассоциации по изучению рака (AACR), 10 апреля 2021. Алофаниб в самой высокой дозе (350 мг/м2 в сутки, ежедневно, 5 раз в неделю) переносился удовлетворительно, максимальная переносимая доза не была достигнута. У 27% больных были выявлены нежелательные явления 3 степени и выше. Диарея, инфузионные реакции, снижение уровня натрия и повышение ферментов печени были наиболее серьезными осложнениями (3 степень). Нежелательные явления всех степеней (1-3) наблюдались у 80% больных. Гиперфосфатемия – классспецифический побочный эффект – отмечался в 20% случаев (1 степень токсичности). Зависимости токсичности от дозы выявлено не было. Что касается предварительной эффективности, несмотря на серьезную предлеченность больных (53% имели 3-6 линий предшествующей терапии), частота контроля над болезнью составила 75%, частота ответов – 8,3% с продолжительностью ответа 16,5 месяца. При медиане наблюдения 5 месяцев медианы общей выживаемости и выживаемости без прогрессирования не были достигнуты. Исследование продолжается. В нем принимают участие российские центры Москвы, Санкт-Петербурга, Омска и Ростова-на-Дону.
Источник:
Ilya Tsimafeyeu, Galina
Statsenko, Anastasia Mochalova,
Natalia Trenina, Vyacheslav Kurakin,
Natalia Besova, Kristina Novoselova,
Natalia Abramova, Ekaterina
Obarevich, Alina Kashanova,
Margarita Suetina, Vladimir
Moiseyenko, Mikhail Byakhov, Elena
Artamonova, Liubov Vladimirova,
Sergei Tjulandin. Session Phase I
Clinical Trials, Abstract CT113, 2021
AACR Annual meeting.
10 -11 ИЮНЯ 2021

КОНГРЕСС AACR2021: ТИСЛЕЛИЗУМАБ В ИССЛЕДОВАНИИ RATIONALE 303 И СИНТИЛИМАБ В ИССЛЕДОВАНИИ ORIENT-3 ПРОДЕМОНСТРИРОВАЛИ ЭФФЕКТИВНОСТЬ У БОЛЬНЫХ МЕТАСТАТИЧЕСКИМ РАКОМ ЛЕГКОГО
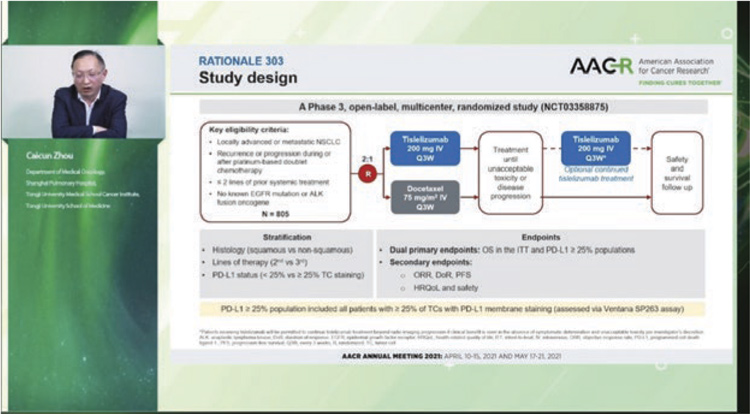
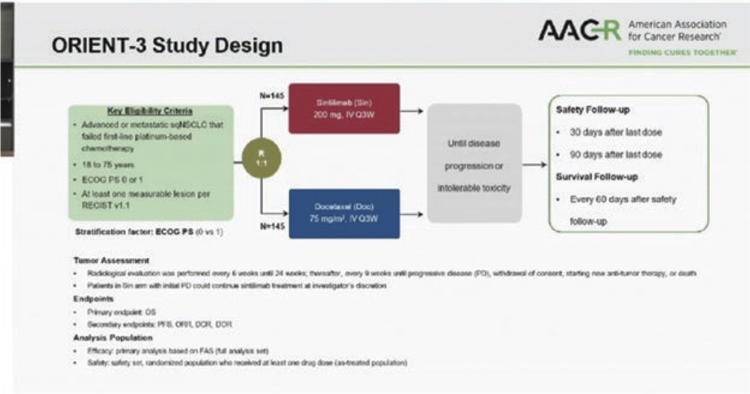
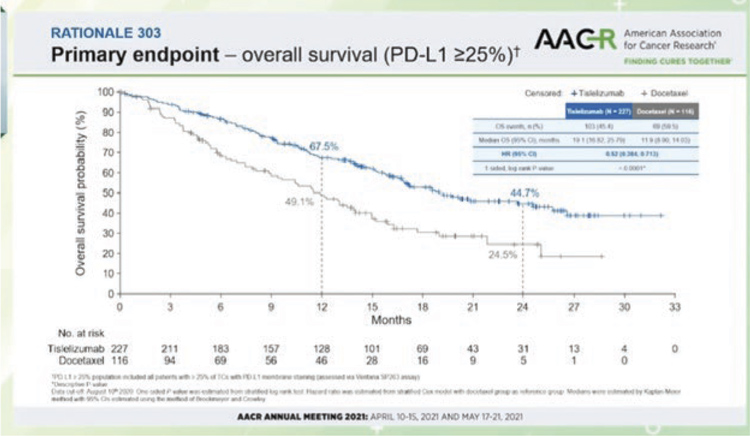
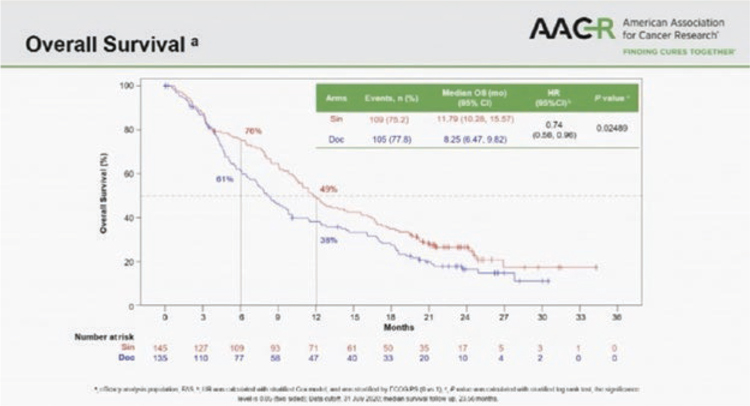
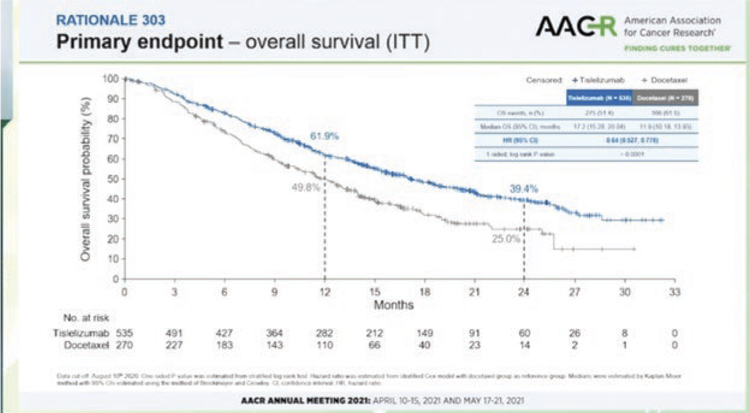
Два новых китайских ингибитора PD-1 показали эффективность у пациентов с метастатическим немелкоклеточным раком легкого, ранее получавших платиновый дуплет. В обоих исследованиях сравнение было с доцетакселом. В первом исследовании 3 фазы RATIONALE 303 (N=805) тислелизумаб (tislelizumab), модифицированное анти-PD-1 антитело с минимальным связыванием FcγR на макрофагах (потенциальный механизм резистентности к ингибиторам контрольных точек), изучался у больных аденокарциномой и привел к снижению риска смерти на 36% (медиана общей выживаемости 17,2 мес. по сравнению с 11,9 мес. на доцетакселе, P<0,0001) в общей популяции и на 48% (медианы 19,1 мес. и 11,9 мес. соответственно) у больных с экспрессией PD-L1 >25%. Во втором исследовании 3 фазы ORIENT-3 изучался анти-PD-1 ингибитор синтилимаб (sintilimab, совместная разработка китайской компании и Lilly) во второй линии терапии метастатического плоскоклеточного рака легкого. Снижение риска смерти при лечении синтилимабом составило 28% (медиана общей выживаемости 11,79 мес. и 8,25 мес. в группе доцетаксела), частота ответов – 25,5% и 2,2%, медиана выживаемости без прогрессирования – 4,3 мес. и 2,79 мес.
Источники:
Zhou, et al. AACR 2021, Session CTMS04
– Disease-Oriented Innovative Clinical
Research and Trials. Abstract CT039.
Shi, et al. AACR 2021, Session CTMS04
– Disease-Oriented Innovative Clinical
Research and Trials. Abstract CT041.
КОНГРЕСС AACR2021: ВПЕРВЫЕ ПРОДЕМОНСТРИРОВАНО ДОСТОВЕРНОЕ УЛУЧШЕНИЕ ОБЩЕЙ ВЫЖИВАЕМОСТИ БОЛЬНЫХ МЕТАСТАТИЧЕСКОЙ УВЕАЛЬНОЙ МЕЛАНОМОЙ. УЛУЧШИЛ ЕЕ ПЕРВЫЙ ИЗ КЛАССА ПРЕПАРАТ НА ОСНОВЕ Т-КЛЕТОЧНОГО РЕЦЕПТОРА – ТЕБЕНТАФАСП
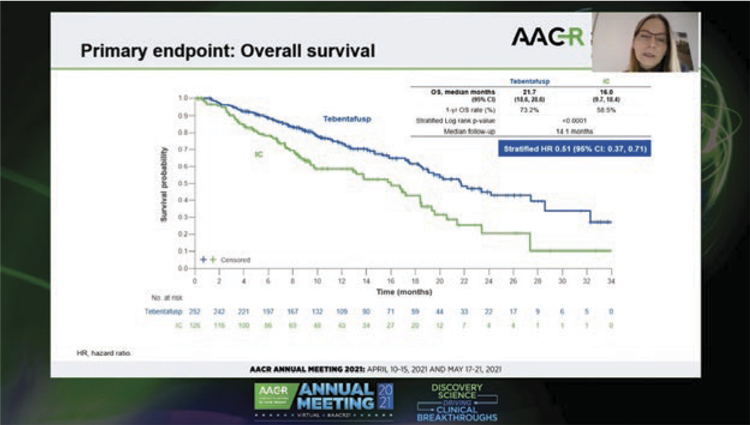
Пациенты с метастатической увеальной меланомой имеют неблагоприятный прогноз, показатель общей выживаемости в течение 1 года составляет 52%. В рандомизированных исследованиях не было доказано, что системное лечение оказывает значимое влияние на продолжительность жизни. Тебентафасп (tebentafusp) – это биспецифический слитой белок, состоящий из Т-клеточного рецептора (TCR), слитого с эффектором анти-CD3, активирующий Т-клетки против белка-мишени gp100+. В предшествующих исследованиях препарат продемонстрировал многообещающую активность у больных с метастатической увеальной меланомой, получавших ранее терапию. На пленарной сессии конгресса AACR были представлены результаты клинического исследования 3 фазы, в котором изучалась эффективность тебентафаспа в первой линии терапии. В этом рандомизированном открытом исследовании пациенты с метастатической увеальной меланомой, стратифицированные по уровню ЛДГ, были распределены случайным образом в соотношении 2:1 в группу тебентафаспа или в группу терапии по выбору врача (пембролизумаб, ипилимумаб или дакарбазин). Первичной конечной точкой была общая выживаемость, определяемая как время от рандомизации до смерти от любой причины. Другим главным критерием была оценка общей выживаемости у пациентов, получавших тебентафасп и имеющих сыпь в течение первой недели, по сравнению с пациентами второй группы, получавшими иммунотерапию. Вторичные конечные точки включали безопасность, частоту объективных ответов, выживаемость без прогрессирования и частоту контроля над болезнью. 378 пациентов были рандомизированы в группу тебентафаспа (N=252) и в группу лечения по выбору врача (пембролизумаб (N=103), ипилимумаб (N=15) и дакарбазин (N=7)). Тебентафасп значимо увеличил общую выживаемость (HR=0,51; P<0,0001) во всей популяции больных. Так, 1-летняя общая выживаемость составила 73,2% (95% ДИ 66,3-78,9) в исследуемой группе по сравнению с 57,5% (95% ДИ 47,0-66,6) в контрольной группе. Медиана общей выживаемости была 21,7 мес. и 16 мес. соответственно. Положительный эффект на общую выживаемость тебентафаспа наблюдался во всех подгруппах, в том числе у пациентов с сыпью и уровнем ЛДГ выше нормы. Также исследователи отметили, что показатели выживаемости без прогрессирования, медиана которой составила 3,3 мес. и 2,9 мес. (HR=0,73), не отразились негативно на результатах общей выживаемости. Частота ответов в группах была 9% и 5%, а контроль над болезнью был достигнут у 46% и 27% больных. Наиболее частые нежелательные явления, связанные с лечением, включали гипертермию кожи, зуд и сыпь. Эти эффекты разрешались по частоте и тяжести уже после первых 3-4 доз препарата и в целом купировались при помощи стандартной сопроводительной терапии. В группе тебентафаспа частота прекращения лечения из-за нежелательных явлений была низкой (<4%), летальных исходов, связанных с лечением, не было. Авторы сделали вывод об эффективности и удовлетворительной переносимости тебентафаспа в первой линии терапии метастатической увеальной меланомы. Исследование было закрыто независимым комитетом по мониторингу данных при первом же промежуточном анализе в связи с доказанной эффективностью препарата.
Источник:
Jessica C Hassel, et al.
Session CTPL01 – Phase III Clinical
Trials: Dedicated to the Memory of José
Baselga. AACR 2021.
9 — 11 НОЯБРЯ МОСКВА

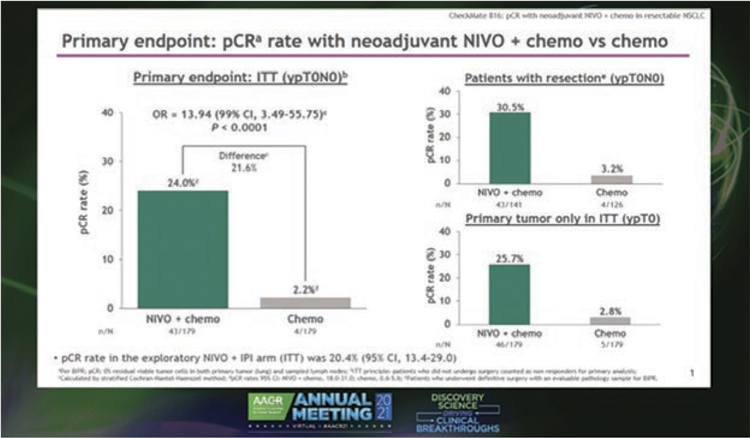
КОНГРЕСС AACR2021: НИВОЛУМАБ В КОМБИНАЦИИ С ПЛАТИНОВЫМ ДУПЛЕТОМ ОКАЗАЛСЯ ЭФФЕКТИВНЫМ В НЕОАДЪЮВАНТНОЙ ТЕРАПИИ НЕМЕЛКОКЛЕТОЧНОГО РАКА ЛЕГКОГО
Неоадъювантный ниволумаб в
комбинации с химиотерапией показал обнадеживающие результаты
у больных резектабельным немелкоклеточным раком легкого (НМРЛ)
IB-IIIА стадий. Первичная конечная
точка – частота полных патологических ответов – была достигнута.
Вторая первичная конечная точка
– бессобытийная выживаемость – в
процессе анализа.
У пациентов с неметастатическим
НМРЛ хирургическое вмешательство играет главную роль, однако у
30-80% больных, перенесших резекцию, возникают рецидивы. Неоадъювантная или адъювантная химиотерапия рекомендуется пациентам
с высоким риском рецидива; однако
польза от неоадъювантной химиотерапии незначительна, а полный патологический ответ (pCR) невысок.
Хотя иммунотерапия, нацеленная на
PD-1, показала преимущества в выживаемости при метастатическом
НМРЛ, результаты исследования 3
фазы при операбельном раке еще не
сообщались. В нерандомизированном исследовании 2 фазы неоадъювантный ниволумаб в монорежиме
или в сочетании с химиотерапией
показал обнадеживающие результаты pCR.
В рандомизированном исследовании CheckMate 816 ниволумаб в
комбинации с платиновым дуплетом сравнивался только с неоадъювантной химиотерапией. Пациенты
с IB-IIIA стадиями согласно классификации AJCC (7 пересмотр), без
мутаций и статусом ECOG 0-1 были
рандомизированы в группу ниволумаба 360 мг + химиотерапия каждые
3 недели (N=179) или в группу химиотерапии каждые 3 недели (N=179).
В обеих группах терапия проводилась за 3 цикла до хирургического
лечения. Основными конечными
точками были pCR, оцениваемый
заслепленным независимым комитетом патологов, и бессобытийная
выживаемость. pCR был определен
как 0% жизнеспособных опухолевых клеток в удаленном легком и
лимфатических узлах; пациенты,
которые не подвергались хирургическому вмешательству, считались
не ответившими на лечение. Общая
выживаемость, частота патологических ответов (MPR; ≤10% жизнеспособной опухоли как в легких, так
и в лимфатических узлах), а также
время до отдаленных метастазов
или смерти являлись вторичными
конечными точками.
Исходные характеристики были сбалансированы между группами. Неоадъювантный ниволумаб + химиотерапия значительно увеличивал
pCR по сравнению с химиотерапией:
24,0% против 2,2%, отношение шансов 13,94, P<0,0001. Улучшение pCR
в группе ниволумаба по сравнению
с только химиотерапией было значимым во всех ключевых подгруппах,
включая стадию заболевания (IB/
II [26,2% против 4,8%]; ≥IIIA [23,0%
против 0,9%]), PD-L1 (<1% [16,7%]
против 2,6%]; ≥1% [32,6% против
2,2%]) и мутационную нагрузку
(низкая [22,4% против 1,9%]; высокая [30,8% против 2,7%]). Ниволумаб
с химиотерапией также улучшил показатели MPR (36,9% против 8,9%), а
также показатели частоты объективного ответа (53,6% против 37,4%) и
радиографического снижения стадии (30,7% против 23,5%). Хирургическое лечение удалось провести
у 83,2% пациентов, получавших ниволумаб и химиотерапию, и у 75,4%,
получавших только химиотерапию.
Значимых отличий в токсичности
между группами не было.
Таким образом, авторы делают вывод, что исследование CheckMate 816
достигло своей первичной конечной
точки со статистически значимым
улучшением pCR в группе неоадъювантной иммунотерапии ниволумабом в сочетании с химиотерапией.
Профиль безопасности ниволумаба
+ химиотерапия соответствовал
известному профилю этого комбинированного режима, а добавление
ниволумаба не снижало возможность выполнения операции. Итак,
CheckMate 816 – первое исследование 3 фазы с позитивными результатами иммунотерапии в неоадъювантном режиме.
Источник: Patrick M. Forde, et al.
Session CTPL01 – Phase III Clinical
Trials: Dedicated to the Memory of José
Baselga. AACR 2021.

ЛЕКАРСТВЕННАЯ ТЕРАПИЯ РАКА ЖЕЛУДКА. БУДУЩЕЕ ЗА БИОМАРКЕРАМИ?
Пациентам с неоперабельным и/ или метастатическим раком желудка и раком пищеводно-желудочного перехода (РЖ/РЖП) как правило необходима системная терапия. Для большинства пациентов стандартом лечения остается химиотерапия1 4 , исключение составляют небольшое число пациентов с опухолями определенных молекулярных подтипов. Трастузумаб, представляющий собой моноклональное антитело, прицельно действующее на HER2, добавляется к химиотерапии пациентов с опухолями HER2+5 . Пембролизумаб, моноклональное антитело против PD-1, используется в качестве терапии второй линии у пациентов с опухолями, имеющими определенные характеристики, например, фенотип с высокой микросателлитной нестабильностью (MSI-H) или высокую мутационную нагрузку опухоли (TMB), определенную как ≥10 мутаций на мегабазу (мут/Мб) или как терапию третьей линии для пациентов с опухолями, экспрессирующими PD-L1 (комбинированная положительная оценка в баллах (CPS) ≥1)6. Другое антитело против PD-1, ниволумаб, приводит к улучшению общей выживаемости (ОВ) при использовании в качестве терапии более поздней линии в общей популяции без отбора пациентов, а также в сочетании с химиотерапией в качестве терапии первой линии (CheckMate-649).7,8 Несмотря на эти достижения, прогноз для пациентов с поздними стадиями РЖ/ РЖП остается неблагоприятным, а медиана ОВ составляет приблизительно 1 год. При этом преобразование достижений в нашем понимании молекулярной биологии РЖ/РЖП в персонализированный подход к лечению намного уступает тому прогрессу, который был достигнут в лечении некоторых других типов опухолей, таких как немелкоклеточный рак легкого.9 В настоящее время единственными установленными биомаркерами, связанными с эффективностью определенных методов лечения у пациентов с РЖ/РЖП на поздней стадии являются положительный статус по HER2, статус MSI-H и экспрессия PD-L1. Разделение опухолей на морфологические подтипы, а именно классификация по Lauren на опухоли кишечного и диффузного типа10, позволяет различать их по клинико-патологическим характеристикам и прогнозу (он хуже для пациентов с опухолями диффузного типа), однако эта классификация не позволяет проводить терапевтическую стратификацию. В попытке решить эту проблему были идентифицированы несколько подтипов опухолей, основываясь на их молекулярных характеристиках, эти характеристики затем использовались при отборе пациентов для испытаний таргетного действия некоторых препаратов.11,12. В этом обзоре описывается схема современной молекулярной классификации РЖ/РЖП на поздних стадиях, включая оценку молекулярной гетерогенности и иммунологического профиля в попытке выявить биомаркеры, которые можно использовать для новой прецизионной стратегии лечения. Кроме того, в обзоре освещаются разработки в области молекулярно-направленной терапии и обсуждаются перспективы на будущее.
Ключевые моменты
Молекулярные подтипы рака, такие как представленные в Атласе генома
рака (TCGA), основанные на молекулярном профилировании рака желудка и желудочно-пищеводного соединения (РЖ/РЖП), имеют разные
молекулярные и клинические характеристики.
Молекулярная гетерогенность является основной причиной частых неудач клинических исследований биомаркеров у пациентов с РЖ/РЖП
и может быть оценена с помощью анализа циркулирующей опухолевой
ДНК (цоДНК).
В настоящее время проходят исследования новых препаратов, в том числе, ингибиторов рецепторных тирозинкиназ, моноклональных антител и
конъюгатов антитела с лекарственным средством в рамках исследований
лечения, управляемого биомаркерами.
Секвенирование как ДНК опухолевой ткани, так и цоДНК может быть
использовано для выявления изменений, которые могут быть мишенями для терапии, включая редкие изменения, что позволяет использовать
Молекулярная
классификация
В 2014 году в рамках проекта Атлас генома рака (TCGA)13 путем
проведения неконтролируемого
кластерного анализа числа соматических копий, секвенирования
всего экзома, метилирования ДНК,
секвенирования матричной РНК и
микроРНК и использования данных по массиву белков из 295 первичных аденокарцином РЖ/РЖП
были выявлены четыре подтипа
рака: ассоциированный с вирусом
Эпштейна-Барр (ВЭБ), MSI, хромосомно нестабильный (CIN) и геномно стабильный (GS) подтипы
14. ВЭБ-ассоциированный рак РЖ/
РЖП чаще всего встречается в проксимальных отделах желудка (дно и
тело) у пациентов, которые обычно
являются относительно молодыми
(средний возраст при постановке
диагноза - 58–60 лет) мужчинами, и,
как правило, с гистологически плохо дифференцированной опухолью
с высоким уровнем инфильтрации
иммунными клетками и экспрессией
PD-L1 и PD-L215 19. Наиболее заметной молекулярной характеристикой
рака РЖ/РЖП, ассоциированного
с ВЭБ, в TCGA и других исследованиях является их экстремальный
фенотип метилирования островков
CpG.20,21 Эти виды рака также часто
содержат повторяющиеся мутации в
PIK3CA, ARID1A, а также BCOR, и,
следовательно, могут быть мишенями для будущих препаратов.
MSI - это молекулярный фенотип,
возникающий в результате нарушения функции репарации ошибок в
подборе нуклеотидов ДНК (MMR)
из-за метилирования MLH1 промотора или мутаций генов, связанных
с MMR22,23. Приблизительно 15%
случаев MSI-H РЖ/РЖП связаны с
синдромом Линча - наследственным синдромом предрасположенности
к развитию рака, вызванным мутациями зародышевой линии в генах
MMR 24,25. MSI-H РЖ/РЖП обычно
характеризуется плотной инфильтрацией лимфоцитами и широко
распространенной экспрессией белков иммунных контрольных точек,
таких как PD-L1, что подчеркивает в целом высокую иммуногенность этого подтипа19,26. В исследование TCGA
была выделена небольшая подгруппа
(9 из 462, 1,9%) гипермутированных
опухолей, не связанных с MSI-H, которые были классифицированы как
гипермутированные с преимущественно однонуклеотидными вариантами (SNV)27.
CIN представляет собой РЖ/РЖП с
выраженной анеуплоидией, определяемой большой потерей генетического материала на уровне хромосомы и/или ее плеча14. Этот подтип был
наиболее частым (50%), и опухоли
этого подтипа особенно распространены в проксимальном отделе
желудка, РЖП и кардии. Ключевые
характеристики включают увеличенное количество мутаций TP53 (71%
опухолей) и рецидивирующих амплификаций генов, кодирующих рецепторные тирозинкиназы (RTK; такие как EGFR, ERBB2, ERBB3, FGFR2,
JAK2 и MET), KRAS или NRA, медиаторы клеточного цикла и VEGFA,
некоторые из которых являются потенциальными мишенями.
Злокачественные опухоли Ж/ЖП, не
имеющие характеристик, связанных
с любым из вышеперечисленных
подтипов, TCGA классифицировал
как GS.14. Этот тип опухоли преимущественно локализуется в дистальном отделе желудка, обычно имеет
диффузный гистологический подтип
и тенденцию развития в более молодом возрасте (средний возраст 59
лет на момент постановки диагноза).
Наиболее заметные молекулярные
характеристики опухолей этой группы включают увеличение количества
мутаций CDH1 или же RHOA или
межхромосомных транслокаций
между CLDN18 и ARHGAP26/6, которые являются взаимоисключающими и связаны с эпителиально-мезенхимальным переходом (ЭМП)28
31. Несмотря на плохой прогноз у пациентов с опухолями этого подтипа, который в значительной степени обусловлен резистентностью
к цитотоксическим агентам из-за их
мезенхимальной природы, наличие
рецидивирующих мутаций говорит
о потенциале разработки таргетных терапевтических стратегий.
Конкретные примеры включают
ингибирование ROS1 у пациентов с
CDH1 - мутантным раком32 и ингибирование FAK у пациентов с опухолями, несущими мутации RHOA33.
В первоначальном исследовании
TCGA не изучалась взаимосвязь
между подтипом опухоли и клиническим исходом, хотя в это было
сделано в последующих исследованиях. Анализ 699 образцов тканей,
полученных при хирургических
операциях пациентов с РЖ/РЖП,
перенесших гастрэктомию D2, показал, что подтип ВЭБ связан с самым
лучшим прогнозом, а GS - с самым
худшим. Более того, была выявлена статистически значимая связь
между подтипом TCGA и прогнозом, независимо от других клинико-патологических характеристик.34.
Клинические последствия наличия
определенного подтипа TCGA были
также описаны в отчете о таргетном секвенировании биопсийных
образцов 295 пациентов с метастатическим РЖ/РЖП35. В отличие от
когорты TCGA (которая включала
опухоли всех стадий, хотя преимущественно стадии II – III), опухоли
типа MSI-H составляли только 3%
всех опухолей. У пациентов с опухолями MSI-H была короче выживаемость без прогрессирования (ВБП)
при прохождении цитотоксической
химиотерапии, но при этом у них с
большей вероятностью развивался
продолжительный ответ на ингибиторы иммунных контрольных точек.
Аналогично, в другом исследовании
авторы разделили 410 пациентов с
метастатическим РЖ/РЖП на четыре подтипа, которые похожи на
классификацию TCGA, но не совсем
соответствуют ей, а именно - подтипы с дефицитом репарации несоответствия ДНК (MMR-D), ВЭБ, HER2
+ и другие. При использовании методов иммуногистохимии (ИГХ) и
гибридизации in situ (FISH)36 исследователи обнаружили, что пациенты с подтипом MMR-D (5,9%) имеют
более короткую ВБП при лечении
цитотоксической химиотерапией
на первой линии, и при этом также
получают наибольшую пользу от
антител против PD-1. Эти результаты указывают на клиническую
значимость классификации TCGA
и других связанных молекулярных
классификаций и подчеркивают потенциал для трансформации этих
знаний в стратегию прецизионного
лечения онкологических заболеваний.
Азиатская группа по исследованию
рака (ACRG) разработала несколько иную молекулярную классификацию, основанную на анализе 251
первичной опухоли РЖ/РЖП.37 Они
разделяли опухоли на четыре подтипа в соответствии с сигнатурами
экспрессии генов: MSI, микросателлитная стабильная (MSS)/EMT, MSS/
TP53+ или MSS/TP53-, которые в
какой-то степени совпадали с подтипами TCGA. Подтип EMT имел
наименьшее количество мутаций.
В подтипе MSS/TP53+ было увеличено количество мутаций в APC,
ARID1A, KRAS, PIK3CA и SMAD4 в
то время как очаговые амплификации ERBB2, EGFR, CCNE1 и CCND1
были обнаружены только в подтипе
MSS/TP53. Анализ выживаемости
(медиана последующего наблюдения 86,4 месяца) показал, что подтип
MSI имеет наилучший прогноз, за
которым следуют MSS/TP53+, MSS/
TP53- и MSS/EMT.
Анализ опухолевого материала и
циркулирующей опухолевой ДНК
(цоДНК) у 61 пациента с поздней
стадией РЖ/РЖП показал, что как
классификация TCGA, так и ACRG
коррелируют с эффективностью
монотерапии пембролизумабом.38. У
большинства пациентов с MSI-H или
ВЭБ-положительными опухолями
развивался ответ на лечение (шесть
из семи с опухолями MSI-H и шесть
из шести с ВЭБ-положительными
опухолями), в то время как ни у одного пациента с опухолью EMT не
было ответа. Интересно отметить,
что у единственного пациента с опухолью MSI-H, который не ответил
на лечение, была очень гетерогенная экспрессия внутриопухолевых
MLH1, что свидетельствует о неоднородности статуса MSI-H. Применимость классификации ACRG
для прогноза клинических исходов,
включая эффективность ингибитора контрольных точек, требует дальнейшего изучения.
Существуют определенные ограничения для возможности использования данных TCGA для клинической стратификации. Во-первых,
интерпретация анализа иммунных
профилей достаточно ограничена,
потому что образцы, содержащие
<60% ядер опухолевых клеток были
исключены, что возможно привело
к исключению из анализа опухолей с наибольшей инфильтрацией
иммунными клетками. Во-вторых,
данные исследования секвенирования РНК одной клетки указывают
на значительное обогащение опухолевого микроокружения (TME) РЖ/
РЖП транскрипционно гетерогенными стромальными клетками, макрофагами, дендритными клетками
и регуляторными T (Treg) -лимфоцитами независимо от молекулярного подтипа опухоли.39. В-третьих,
классификация TCGA была в основном основана на геномном и транскриптомном анализах, что частично
отражает то, что массивы белков с
обращенной фазой, используемые
для анализа протеома, были ограничены доступностью антител. Таким
образом, для протеомной характеристики необходимо использовать
более комплексный подход. В протеогеномном анализе опухолевого материала 80 пациентов с диффузным
РЖ/РЖП с ранним началом (<45
лет) исследователи смогли успешно
разделить образцы на четыре подтипа, связанных с пролиферацией иммунным ответом, метаболизмом
или инвазией.40 В-четвертых, данные
TCGA получены только из анализа
образцов первичных опухолей и не
учитывают различия, часто значительные, между первичными и метастатическими опухолями.
Молекулярная гетерогенность
РЖ/РЖП характеризуется высоким уровнем как геномной, так и фенотипической вариабельности даже в пределах одной опухоли, и эта гетерогенность считается основной причиной частой неудачи клинических исследований, основанных на биомаркерах 41–50. Например, известно, что опухоли HER2+ РЖ/ РЖП имеют вариабельные уровни экспрессии HER2 с зарегистрированной частотой внутриопухолевой гетерогенности 5–79% из-за различий в определении гетерогенности (включая, например, наличие клеток ИГХ 3+ в <10% опухолевой области51 или клеток ИГХ 2+ или 3+ в 10–90% опухолевых клеток52) 51 59 и, как правило, выше, чем при HER2+ раке молочной железы 60,61. Кроме того, пациенты с гетерогенной экспрессией HER2 в первичной опухоли имеют значительно более короткую ВБП при лечении схемами химиотерапии первой линии, содержащими трастузумаб, чем пациенты с гомогенной экспрессией HER2.58,59,62. Разница в экспрессии HER2 между первичными опухолями и метастазами также наблюдалась в 1–14% случаев РЖ/РЖП.63–69. Например, данные исследования GASTHER1 демонстрируют, что пациенты с HER2+ заболеванием, идентифицированным с помощью повторного биопсийного отбора образцов первоначально HER2– первичных опухолей или посредством оценки рецидивирующих и/или метастатических поражений, характеризовались ВБП после схем химиотерапии первой линии, содержащих трастузумаб, аналогичную таковой для пациентов с HER2+ заболеванием при первоначальной оценке. Эти наблюдения подтверждают необходимость повторных оценок этой молекулярной характеристики.70 Таргетная терапия, направленная на HER2, может уничтожить HER2- экспрессирующие раковые клетки, но далее это приводит к пролиферации HER2-отрицательных клонов. Этот эффект был зарегистрирован приблизительно у 30% пациентов с опухолями HER2+ РЖ/РЖП, которые получали химиотерапию первой линии, содержащую трастузумаб 71,72. Следует отметить, что у пациентов с потерей HER2 после лечения трастузумабом в первой линии, получавших трастузумаб эмтанзин (T-DM1) в качестве терапии второй линии, объективных ответов не наблюдалось, и у этих пациентов также была более короткая ВБП, чем у пациентов без потери HER2.72. HER2+ РЖ/РЖП также может сопровождаться сверхэкспрессией других RTK73,74. Эти и другие сопутствующие геномные изменения, такие как аберрации в сигнальном пути PI3K и амплификации генов, кодирующих белки клеточного цикла, были связаны с первичной резистентностью к трастузумабу.75,76. Возникновение изменений, связанных с резистентностью, также может быть вызвано эволюционным давлением, создаваемым HER2-таргетной терапией. Технические достижения позволили провести анализ цоДНК и помогают провести оценку механизмов резистентности, присутствующей только в подгруппе опухолевых клеток, за счет возможности секвенирования геномных изменений, присутствующих в опухолевых клетках во всем организме.12,77. Исследования Wang и коллег показали, что мутации PIK3CA/R1/C3 или ERBB2/4, обнаруженные в цоДНК на исходном уровне, связаны с худшей ВБП. Кроме того, эти исследователи обнаружили, что NF1 мутации, идентифицированные с помощью генотипирования цоДНК в динамике, возникли у 2 из 24 пациентов с HER2+ РЖ/РЖП, получавших трастузумаб78, которые, как они подтвердили, создают резистентность к блокаде HER2 in vitro. Аналогичным образом, было установлено, что приобретенные амплификации MET также являются механизмом резистентности к афатинибу у пациентов с HER2+ РЖ/РЖП, как показало секвенирования цоДНК и было подтверждено анализом образцов, полученных при проведении посмертной аутопсии79. В настоящее время остается неясным, возникают ли приобретенные изменения в результате селекции ранее существовавших субклонов или они появляются в результате продолжающегося мутагенеза во время HER2-таргетной терапии; поэтому для уточнения механизмов приобретенной резистентности необходимы дополнительные исследования. Таким образом, пространственная (гетерогенная экспрессия HER2 и сопутствующие изменения) и временная (потеря экспрессии HER2 и приобретенные изменения) гетерогенность потенциально связаны с резистентностью к таргетной терапии, направленной на HER2, и ее нужно преодолевать путем разработки новых препаратов и/или стратегий лечения. Пространственная и временная геномная гетерогенность также наблюдалась в других подтипах РЖ/ РЖП при анализе цоДНК. Исследования Pectasides и коллег выявили расхождения между изменениями, присутствующими в первичных и парных метастатических поражениях у 10 (36%) из 28 пациентов с РЖ/ РЖП, с гораздо более высоким уровнем конкордантности (87,5%) между метастатическими поражениями и цоДНК80. Было установлено, что геномная неоднородность также является механизмом резистентности к таргетным препаратам, прицельно действующим на другие изменения, такие как амплификации EGFR81,82, слияния FGFR283 и амплификации MET84. Испытания таргетной терапии включали анализ цоДНК с целью выявления пациентов, которые в противном случае могли бы исключаться из исследования, если бы проводилась только биопсия опухоли, отрицательной по биомаркерам11,12,85,86.
Иммунологические профили
В настоящее время отбор пациентов с РЖ/РЖП для иммунотерапии основан на балльной оценке CPS для PD-L1, которая рассчитывается как количество клеток PD-L1+, включая опухолевые клетки, макрофаги и лимфоциты, деленное на общее количество опухолевых клеток, умноженное на 100. РЖ/ РЖП с CPS ≥1 считается PD-L1- положительным. Как упоминалось ранее, опухоли Ж/ЖП MSI-H или ВЭБ-положительного подтипа имеют разные иммунологические профили, которые влияют на чувствительность к ингибиторам контрольных точек. Данные, опубликованные в мае 2020 года, показывают, что более половины всех опухолей CIN содержат мало CD8+ T-клеток, но при этом содержат высокие уровни CD68+ макрофагов, и что опухоли GS обогащены CD4+ T-клетками, опухоль-ассоциированными макрофагами и B-клетками, причем половина из них также содержит третичные лимфоидные структуры87. Таким образом, таргетная терапия, воздействующая на иммуносупрессивные макрофаги или другие активируемые иммуносупрессивные пути может повысить эффективность иммунотерапии у пациентов с опухолями подтипа CIN или GS. Другой анализ >1000 образцов, взятых у пациентов с раком желудка, показал, что такой рак у пациентов неазиатского происхождения характеризуется более высокой экспрессией маркеров Т-клеток (CD3, CD45R0 и CD8), большей экспрессией генов, связанных с CTLA4, в цитотоксических Т-клетках и снижением экспрессии маркера иммуносупрессивных Treg клеток FOXP3 по сравнению с опухолями у пациентов азиатского происхождения88. Обнаруженное различие требует дальнейшей оценки, включая сравнение частоты ответа на лечение ингибиторами контрльных точек в этих группах в ходе клинических исследований.
Молекулярно-таргетная терапия
Таргетная терапия, нацеленная на HER2 Сверхэкспрессия HER2 присутствует в 15–25% случаев РЖ и до 30% случаев рака РЖП.57,89 91 Исследование ToGA, рандомизированное исследование фазы III с участием 584 пациентов с метастатическим РЖ/РЖП HER2+, продемонстрировало, что добавление трастузумаба к двойной схеме химиотерапии фторпиримидином и цисплатином значительно улучшает ОВ5 (таблица 1). Положительный статус по HER2 определялся главным образом как ИГХ 3+ (однородное окрашивание мембраны >30% опухолевых клеток) или положительный результат флуоресцентной гибридизации in situ (FISH) (соотношение ERBB2:CEP17 ≥2,0). Однако на основании апостериорного поискового анализа, который показал, что добавление трастузумаба обеспечивает еще более выраженное улучшение продолжительности жизни (в среднем 16,0 месяцев против 11,8 месяцев; ОР 0,65) у пациентов с высоким уровнем экспрессии HER2, определяемым как ИГХ 2+ и FISH-позитивный или ИГХ 3+ статус5 , был достигнут консенсус в том, что HER2-положительность следует определять как ИГХ 2+ и FISH-положительность или ИГХ 3+статус92,93. В настоящее время трастузумаб в комбинации с химиотерапией является стандартной терапией первой линии для пациентов с HER2+ РЖ/РЖП на поздней стадии. После успеха исследования ToGA в нескольких рандомизированных исследованиях III фазы была проведена оценка эффективности других видов таргетной терапии, направленной против HER2, у пациентов с HER2+ РЖ/РЖП: лапатиниб в комбинации с капецитабином и оксалиплатином в качестве терапии первой линии (TRIO-013/LOGiC)41; пертузумаб и трастузумаб в комбинации с фторпиримидином и цисплатином в качестве терапии первой линии (JACOB)42; лапатиниб в комбинации с паклитакселом во второй линии (TyTAN)43; и T-DM1 во второй линии (GATSBY)44. Однако ни одно из этих исследований не продемонстрировало улучшения по ОВ (дополнительная таблица 1). До настоящего времени не удалось выяснить, почему таргетные препараты против HER2, позволяющие успешно улучшить ОВ у пациентов с раком молочной железы HER2 +, не приносят такой же пользы больным РЖ/РЖП, хотя возможным объяснением может быть влияние такого фактора, как гетерогенность экспрессии HER2. Экспрессия HER2 часто утрачивается после начального лечения трастузумабом; более того, в исследованиях TyTAN и GATSBY при отборе пациентов для получения таргетной терапии второй линии, направленной на HER2, было разрешено проводить тестирование на HER2 архивных образцов опухолевой ткани, собранных перед терапией первой линии трастузумабом.43,44. Действительно, анализ образцов, взятых у участников исследования GATSBY, показал более низкую эффективность T-DM1 у пациентов с гетерогенными (30–79% доли положительно окрашенных опухолевых клеток) или очаговыми (<30%) образцами экспрессии HER2 по сравнению с гомогенной экспрессией (≥80%), даже у пациентов с опухолями, имеющими статус ИГХ 3+ при включении в исследование94. Сопутствующие геномные изменения также могут вносить вклад в резистентность к таргетной терапии, направленной на HER2. В исследовании с участием 32 пациентов с HER2+ РЖ/РЖП, получавших лапатиниб плюс капецитабин и оксалиплатин, исходный уровень CCNE1 амплификации были связаны с более низким уровнем ответа, как показало исследование 16 образцов, проанализированных с использованием секвенирования следующего поколения (NGS)95. Кроме того, динамический мониторинг цоДНК выявил новые амплификации MYC, EGFR, FGFR2 и MET, которые появились после прогрессирования заболевания. Было установлено, что возможными источниками приобретенной резистентности также могут быть мутации в PIK3CA/R1/C3, ERBB2/4 и NF179. Для преодоления врожденной и приобретенной резистентности были разработаны новые таргетные препараты и комбинации, прицельно действующие на HER2. Одним из таких подходов является разработка трастузумаба дерукстекана (T-DXd), состоящего из антитела, блокирующего HER2, присоединенного к цитотоксическому ингибитору топоизомеразы I через расщепляемый линкер на основе тетрапептида. Этот препарат обладает побочным эффектом уничтожения клеток, поскольку высвобожденное лекарственное средство способно воздействовать на окружающие клетки, в том числе те, которые не экспрессируют HER2, и возникающая в результате гибель клеток способствует развитию противоопухолевого иммунитета96. Этот механизм действия особенно привлекателен для лечения опухолей с гетерогенной экспрессией HER2. В рандомизированном исследовании фазы II (DESTINY-Gastric01) с участием пациентов с метастатическим HER2+ РЖ/РЖП, которые получали по крайней мере две предыдущие линии терапии, включая трастузумаб, применение T-DXd привело к значительно более высокой частоте ответа на лечение и более длительной выживаемости, чем химиотерапия97 (таблица 1). Возникшие во время лечения нежелательные явления 3 степени и выше чаще встречались у пациентов, получавших T-DXd, чем у пациентов, получавших химиотерапию (85,6% против 56,5%), хотя большинство из них поддавались лечению путем модификации дозы. Следует отметить, что у 10% пациентов развилась интерстициальная болезнь легких хотя в большинстве случаев явление было 1−2 степени тяжести. Основываясь на этих данных, T-DXd был одобрен в Японии и США для применения у пациентов с ранее леченным HER2+РЖ/РЖП. T-DXd также обладал противоопухолевым действием у пациентов с низким уровнем экспрессии HER2 (ИГХ 2+ и FISH– или ИГХ 1+)98, что возможно, было результатом побочного эффекта препарата. В настоящее время проводятся исследования NCT03821233, NCT03602079 и NCT03255070, в которых оценивается действие нескольких других таргетных препаратов, направленных против HER2, у пациентов с HER2+ РЖ/РЖП. Таргетные препараты, нацеленные на HER2, могут усиливать экспрессию PD-1 или PD-L1, увеличивать степень инфильтрации опухоли иммунными клетками и увеличивать презентацию антигена с помощью дендритных клеток99,100, что может повысить эффективность антител против PD-1 и PD-L1101,102. Подтверждая эту концепцию, данные исследования in vivo выявили синергизм противоопухолевой активности между блокадой HER2 и PD-1 на моделях трансгенных мышей HER2+103. В одногрупповом исследовании фазы II, в котором 37 пациентов с метастатическим РЖ/РЖП получали в качестве терапии первой линии пембролизумаб, трастузумаб и химиотерапию, у 26 (70%) ВБП составляла ≥6 месяцев104. После получения этого многообещающего результата было начато рандомизированное исследование III фазы для оценки эффективности комбинации пембролизумаб в комбинации с трастузумабом и химиотерапией (NCT03615326), которое продолжается в настоящее время105. Также сейчас проходят оценку сходные комбинации препаратов, включающие маргетуксимаб, антитело против HER2 с повышенной аффинностью к обоим аллелям активирующего рецептора Fc (CD16A), пембролизумаб, в исследовании Ib/ II фазы с участием пациентов с ранее леченным HER2+ РЖ/РЖП106, антитело против PD-1 ретифанлимаб или биспецифическое антитело против PD-1/анти-LAG3 теботелимаб в сочетании с химиотерапией в исследовании II/III фазы с участием пациентов с поздней стадией заболевания, ранее не получавших лечения (NCT04082364). Данные исследования Ib/II фазы маргетуксимаба в комбинации с пембролизумабом показали частоту объективного ответа (ЧОО) 18,48% 107. Наконец, проходит оценку комбинация T-DXd и дурвалумаба, антитела против PD-L1, в исследовании I/II фазы (NCT04379596). Другие новые таргетные препараты, мишенью которых является HER2, включают тукатиниб, низкомолекулярный ингибитор тирозинкиназы (TKI), который приводил к улучшению ОВ в комбинации с трастузумабом и капецитабином у пациентов с HER2+ раком молочной железы. В ксенотрансплантатных моделях РЖ/РЖП двойное таргетное воздействие на HER2 препаратами тукатиниб и трастузумаб превосходило по своей активности действие каждого из этих препаратов по отдельности108. В настоящее время продолжается исследование II/III фазы, посвященное изучению эффективности тукатиниба, трастузумаба, рамуцирумаба и паклитаксела у пациентов с ранее леченным HER2+ РЖ/РЖП (NCT04499924). Другие новые препараты включают ZW25, биспецифическое антитело, которое одновременно связывается с внеклеточными доменами 2 и 4 HER2 (сайты связывания трастузумаба и пертузумаба, соответственно)109. Доклинические исследования свидетельствуют о высоком уровне противоопухолевой активности при различных уровнях экспрессии HER2 и более высокую эффективность по сравнению с трастузумабом и пертузумабом110. В исследовании I фазы с участием пациентов с HER2-положительными солидными опухолями ZW25 хорошо переносился и приводил к ЧОО 33% в подгруппе РЖ/РЖП111. В настоящее время проводится исследование II фазы (NCT04276493), оценивающее действие комбинации ZW25 с химиотерапией и тислелизумабом - антителом против PD-1.
Таргетная терапия, нацеленная на FGFR2
Амплификации FGFR2 наблюдаются приблизительно в 5% случаев РЖ/РЖП, их количество увеличено в подтипах CIN и GS и они связаны с плохим прогнозом112 114. Высокий уровень клональной амплификации FGFR2 ассоциируется с наличием ответа на ингибирование FGFR как в доклинических моделях, так и в моделях ксенотрансплантации опухолей пациента (PDX) РЖ/РЖП 115 117. Тем не менее, в рандомизированном исследовании II фазы (SHINE) не удалось продемонстрировать улучшение ВБП при применении панFGFR TKI AZD4547 по сравнению с паклитакселом в терапии второй линии пациентов с метастатическим РЖ/РЖП, содержащим амплификации FGFR245. Изучение корреляций в рамках этого исследования выявило внутриопухолевую гетерогенность амплификации FGFR2, хотя при этом не было четкой корреляции между гетерогенностью и ответом на лечение AZD4547. В этой ситуации более эффективной альтернативой мог бы быть футибатиниб, необратимый и высокоселективный ингибитор FGFR1–4, который полностью подавляет FGFR2118,119. Футибатиниб в настоящее время проходит исследования II фазы с участием пациентов с солидными опухолями поздней стадии, несущими изменения FGFR, включая пациентов с РЖ/ РЖП без амплификацией FGFR2 (NCT02052778)120. Еще один препарат-кандидат - бемаритузумаб, афукозилированное моноклональное антитело против FGFR2b изоформы рецептора, возникающей в результате альтернативного сплайсинга, которая часто сверхэкспрессируется при РЖ/РЖП с амплификацией FGFR2. В исследовании I фазы у 5 (17,9%) из 28 пациентов с FGFR2 амплификацией, выявленной методом FISH, был подтвержденный ответ на бемаритузумаб121. Данные рандомизированного исследования II фазы показывают, что добавление бемаритузумаба к модифицированной схеме FOLFOX6 (mFOLFOX6) (включающей 5-фторурацил, лейковорин и оксалиплатин) улучшает как ВБП, так и ОВ у пациентов с ранее нелеченым распространенным РЖ/РЖП со сверхэкспрессией FGFR2b (NCT03343301)85,122. Аллостерический ингибитор FGFR2 алофаниб подобно моноклональным антителам связывается с надмембранной частью FGFR2 и вне зависимости от изоформы блокирует рецептор. Согласно предварительным данным исследования Ib фазы, представленным на конгрессе AACR 2021, частота контроля над болезнью составляет 75%, медианы ВБП и ОВ не были достигнуты при медиане наблюдения 5 мес. у больных метастатическим раком желудка, исчерпавших ресурс стандартной терапии.
Таргетная терапия, нацеленная на EGFR
Приблизительно у 5–10% пациентов с РЖ/РЖП отмечается амплификация EGFR или сверхэкспрессия EGFR, которые связаны с
плохим прогнозом74,123. Проведенные крупные рандомизированные
клинические исследования не продемонстрировали какого-либо значительного улучшения выживаемости при применении таргетной
терапии, нацеленной на EGFR46–48, в
общей популяции без выбора подходящих пациентов; однако анализ биомаркеров в исследованиях
EXPAND124 и COG125 говорит о ее
возможной эффективности у пациентов с опухолями, экспрессирующими
высокие уровни EGFR, тем самым
поддерживая выбор пациентов с
такими опухолями для будущих исследований. Гетерогенность опухоли
- еще один фактор, который потенциально ограничивает эффективность
терапии, направленной на EGFR.
Используя серийное секвенирование
цоДНК, Maron и его коллеги установили, что коамплификации ERBB2,
KRAS, NRAS, MYC и CCNE1, а также
мутации в KRAS и GNAS, наряду с гетерогенностью амплификаций EGFR
являются вероятным механизмом
первичной резистентности к антителам против EGFR, таким как ABT-806
и цетуксимаб81. В этом же исследовании было обнаружено, что появление EGFR-отрицательных клонов, делеций PTEN, амплификаций или мутаций KRAS, амплификаций NRAS,
MYC и ERBB2 и мутаций GNAS может быть потенциальным источником приобретенной резистентности.
Аналогично, другая группа исследователей сообщила о позитивных
результатах лечения пациента с амплификациями EGFR в клетках рака
желудка, а также с множественными
приобретенными мутациями EGFR
и амплификацией MET после монотерапии цетуксимабом82. В попытке
преодолеть резистентность к таргетной терапии, направленной на EGFR,
было разработано несколько стратегий, включая комбинации антител
против EGFR и ADC126-128.
Таблица 1. Отдельные исследования с применением биомаркерной таргетной терапии у пациентов с раком РЖ/РЖП
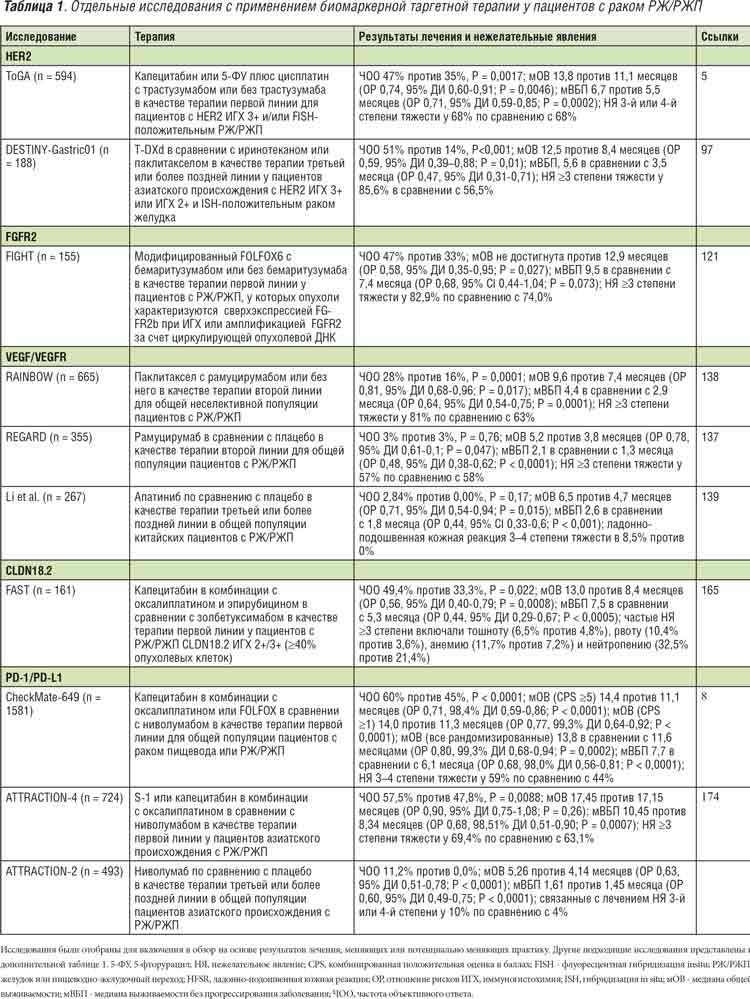
Таргетная терапия, нацеленная на MET.
Действие таргетных препаратов, нацеленных на MET, изучалось в больших рандомизированных исследованиях с включением пациентов с MET-положительным РЖ/РЖП, хотя ни один из этих препаратов до настоящего времени не улучшил ОВ49,50. Тем не менее, исследование METGastric46, в котором пациенты с MET 2+/3+ РЖ/РЖП (определяемым как опухоли с умеренным (2+) или сильным (3+) ИГХ окрашиванием на MET в ≥50% опухолевых клеток) получали онартузумаб, моноклональные антитела против МЕТ в комбинации с mFOLFOX6, выявило тенденцию к увеличению ОВ при добавлении онартузумаба. Этот результат говорит о возможной пользе таргетной терапии, направленной на MET у пациентов с РЖ/РЖП с высокими уровнями экспрессии MET или амплификацией MET. Действительно, несмотря на то, что исследование II фазы, в котором пациенты с РЖ/РЖП с амплификацией MET получали MET TKI AMG 337, было остановлено из-за более низкой, чем ожидалось, ЧОО129, зонтичное исследование VIKTORY обнаружило многообещающую ЧОО в 50% при применении саволитиниба, MET TKI, в подгруппе из 20 больных раком желудка с амплификацией MET11. Пропуск экзона MET 14, который был выявлен у 3 из 42 больных раком желудка, также требует дальнейших исследований возможности его использования в качестве биомаркера ответа на таргетную терапию, направленную на МЕТ130,131. Как и при других видах рака с амплификацией RTK, молекулярная гетерогенность также способствует резистентности к таргетной терапии, нацеленной на МЕТ в популяции пациентов с РЖ/ РЖП с амплификацией MET. Анализ цоДНК пациентов с MET амплифицированным РЖ/РЖП, получавших таргетную терапию, направленную на MET, выявил, что коамплификация ERBB2 и EGFR, а также мутации в KRAS являются механизмом резистентности84. Кроме того, динамический анализ образцов на основе цоДНК пациентов, получавших саволитиниб в исследовании VIKTORY, выявил, что конкретные мутации MET D122bV/N/H и Y1230C, равно как высокие уровни амплификации MET представляют собой механизм приобретенной резистентности132.
Антиангиогенная терапия.
Доклинические исследования на животных моделях РЖ/РЖП показывают, что эти опухоли секретируют проангиогенные цитокины 133,134, и, таким образом являются обоснованием для использования антиангиогенной терапии у пациентов с РЖ/ РЖП. Тем не менее клинический опыт применения этого подхода до сих пор был неоднозначным. Исследования AVAGAST и AVATAR, изучающие добавление бевацизумаба, антитела против VEGFA, к химиотерапии в качестве терапии первой линии, не показали улучшения ОВ по сравнению с применением одной химиотерапией135,136. Напротив, рамуцирумаб, антитело против VEGFR2, значительно улучшал ОВ в комбинации с паклитакселом по сравнению с паклитакселом отдельно (RAINBOW) и в качестве монотерапии по сравнению с плацебо (REGARD) во терапии второй линии137,138 (таблица 1). Апатиниб, TKI, который избирательно ингибирует VEGFR2, также улучшил ОВ по сравнению с плацебо у пациентов с РЖ/РЖП, которые ранее получали как минимум две линии химиотерапии в рандомизированном исследовании III фазы, проведенном в Китае139 (таблица 1). Однако данные международного рандомизированного исследования III фазы (ANGEL) не подтвердили это преимущество в выживаемости140. Кроме того, проводятся рандомизированные испытания других TKI, нацеленных на VEGFR, таких как регорафениб и фруквинтиниб (NCT02773524 и NCT03223376). Эффективность антиангиогенной терапии до сих пор оценивалась в общей популяции без отбора пациентов с РЖ/РЖП из-за отсутствия надежных прогностических биомаркеров. В исследовании AVAGAST анализ биомаркеров у пациентов с высокими уровнями VEGFA в плазме и низкой экспрессией нейропилина-1 до начала терапии наблюдалось улучшение общей выживаемости при лечении бевацизумабом141. Однако анализ биомаркеров плазмы в образцах, взятых у пациентов из исследования RAINBOW не выявил каких-либо прогностических маркеров получения полезного эффекта при лечении рамуцирумабом142. Кроме того, в исследовании REGARD оценивали как экспрессию VEGFR2 в опухоли, методом ИГХ, так и циркулирующие ангиогенные биомаркеры, такие как VEGFC и VEGFD, а также растворимые VEGFR1 и VEGFR3, причем ни один из них не оказался прогностическим143.
Ингибиторы PARP.
Сигнатура, связанная с дефицитом гомологичной рекомбинации (HRD), была выявлена в 7–12% случаев РЖ/ РЖП,144 при этом мутации зародышевой линии в генах, связанных с репарацией ДНК путем гомологичной рекомбинации, таких как BRCA1, PALB2 а также RAD51C были найдены в 3% случаев145; указанные изменения предлагается использовать в качестве методов прогнозирования эффективности комбинации химиотерапевтических препаратов на основе платины и ингибиторов поли (АДФ-рибоза) полимеразы (PARP) при нескольких типах рака. Однако клиническое значение HRD при РЖ/РЖП остается неясным. Анализ корреляций в рамках исследования REAL3, в котором пациенты с РЖ/ РЖП получали ингибитор PARP олапариб в комбинации с паклитакселом, выявили связь между большим уменьшением гетерозиготности и более длительным периодом ОВ, что говорит о возможности использования HRD или других форм геномной нестабильности в качестве биомаркеров146. Тем не менее, другое исследование не выявило корреляции между крупномасштабными переходами состояний (еще один показатель HRD) и ВБП у пациентов, получавших терапию на основе платины144. Необходимы дальнейшие исследования с использованием метода, полностью охватывающего все возможные степени HRD. Рандомизированное исследование III фазы выявило тенденцию к более длительной выживаемости при добавлении олапариба к паклитакселу как в общей популяции пациентов с распространенным раком желудка, так и у пациентов с опухолями без мутаций ATM, хотя разница не была статистически значимой147. Более того, ни одна из определенных молекулярных подгрупп, в том числе с экспрессией HRD или ATM, не показала улучшения результатов148. Это отсутствие активности может свидетельствовать о том, что доза олапариба, используемая в данном исследовании, была ниже, чем доза, применяемая в качестве монотерапии у пациентов с другими типами опухолей149-153, поэтому активность ингибиторов PARP в виде монотерапии у пациентов с РЖ/РЖП и HRD может потребовать дальнейшей оценки. Эффективность комбинаций ингибиторов PARP с ингибиторами контрольных точек или антиангиогенными агентами была предположена как в доклинических, так и в клинических исследованиях при нескольких типах рака154–159. В настоящее время проводится рандомизированное исследование II фазы поддерживающей терапии памипарибом у пациентов с ответом на химиотерапию на основе платины при метастатическом раке желудка (NCT03427814), а также исследования ингибиторов PARP в сочетании с ингибиторами ангиогенеза и иммунотерапией (NCT03008278), NCT04209686 и NCT02678182).
Таргетная терапия, нацеленная на клаудин 18.2 .
Клаудин 18.2 (CLDN18.2) - это компонент межклеточных соединений160, как правило, не экспрессирующийся в нормальных тканях, кроме слизистой оболочки желудка, но сильно экспрессирующийся в клетках разных злокачественных опухолей, включая РЖ/РЖП и особенно рак желудка диффузного типа161. Как упоминалось ранее, слияния CLDN18 – ARHGAP26/6 были выявлены у 15% пациентов с РЖ/РЖП, преимущественно с подтипом GS,14 и среди более молодых пациентов с отдаленными метастазами и метастазами в лимфатические узлы, которые как правило имели плохой прогноз и/или резистентность к химиотерапии162. Почти во всех случаях РЖ/РЖП с наличием слияния CLDN18–ARHGAP26/6 экспрессируют CLDN18.2162. Препараты, прицельно действующие на CLDN18.2, включают золбетуксимаб, химерное антитело IgG1, которое вызывает антителозависимую и комплемент-зависимую цитотоксичность163. Монотерапия золбетуксимабом привела к ЧОО 9% и показателю контроля над заболеванием у 23% пациентов с ранее леченным раком пищевода или РЖ/РЖП в исследовании II фазы MONO164. Рандомизированное исследование II фазы (FAST) продемонстрировало, что добавление золбетуксимаба к химиотерапии первой линии приводит к улучшению результатов ВБП и ОВ у пациентов с CLDN18.2-положительным РЖ/ РЖП165 (таблица 1). Анализ подгрупп выявил корреляцию между экспрессией CLDN18.2 в ≥70% опухолевых клеток и лучшей ОВ (ОР 0,44). В настоящее время проходят два исследования III фазы (NCT03504397 и NCT03653507), в которых оцениваются эффективность золбетуксимаба в сочетании с химиотерапией в качестве терапии первой линии для пациентов с высокими уровнями экспрессии CLDN18.2 (≥75% опухолевых клеток), такая стратификация включает примерно 30% всех пациентов с РЖ/РЖП166. Другие подходы к таргетной терапии, нацеленной на CLDN18.2 включают химерный рецептор для антигена (CAR) на Т-клетках и биспецифический активатор Т-клеток (BiTE). Антигенные рецепторы (CAR) на Т-клетках, специфические для CLDN18.2, приводят к частичной или полной элиминацию опухоли в CLDN18.2-положительных PDX моделях с многообещающим уровнем активности (объективные ответы у трех из семи пациентов, включая один полный ответ) и приемлемыми профилями токсичности в первом исследовании с участием человека167,168. В настоящее время продолжаются и другие исследования (NCT04400383, NCT04404595 и NCT04467853). Кроме того, в настоящее время проводится исследование I фазы с участием пациентов с РЖ/РЖП (NCT04260191) соединения AMG 910, биспецифического активатора Т-клеток (BiTE), разработанного для взаимодействия CD3- положительных иммунных клеток с CLDN18.2-положительными опухолевыми клетками.
Ингибиторы иммунных контрольных точек.
Ингибиторы контрольных точек стимулируют и запускают терапевтический противоопухолевый иммунный ответ более общим образом, хотя эти препараты также можно рассматривать как таргетные агенты, прицельно действующие на молекулярном уровне, поскольку они специфически связываются с определенными мишенями, такими как PD-1 и PD- L1; кроме того, PD- L1 используется в качестве биомаркера, помогающего управлять лечением антителами против PD-1 в определенных условиях. Результаты применения этих препаратов у пациентов с РЖ/РЖП изначально были многообещающими. Ниволумаб, моноклональное антитело анти-PD-1, продлевал ОВ азиатских пациентов с РЖ/РЖП по сравнению с плацебо в качестве терапии третьей линии или более поздней линии в исследовании ATTRACTION-2, что привело к одобрению ниволумаба для лечения у пациентов с РЖ/РЖП в нескольких азиатских странах, включая Японию, Южную Корею, Тайвань и Сингапур7 (таблица 1). В глобальном исследовании II фазы (KEYNOTE-059) 28 пациентов с РЖ/РЖП получали анти-PD-1 антитело пембролизумаб в качестве третьей или более поздней линии терапии с ЧОО 11,6%6 . ЧОО составила 15,5% у пациентов с PDL1+ заболеванием (определяемым как комбинированная положительная оценка в баллах ≥1 с использованием анализа pharmDx-223 ИГХ). Эти данные привели к тому, что FDA одобрило применение пембролизумаба у пациентов с раком PD-L1+ РЖ/РЖП с прогрессированием заболевания, по крайней мере, на двух предыдущих линиях терапии. В условиях терапии второй линии (KEYNOTE-061) пембролизумаб существенно не улучшал ВБП и ОВ по сравнению с паклитакселом у пациентов с PD-L1+ (CPS ≥1) РЖ/РЖП169 (таблица 1). Аналогичным образом, пембролизумаб не уступал химиотерапии с точки зрения ОВ170. Пересечение кривых выживаемости в обоих исследованиях свидетельствует о том, что у некоторых пациентов, получавших пембролизумаб, было раннее прогрессирование заболевания и плохие исходы. Тенденция к улучшению исходов у пациентов с заболеванием подтипа MSI-H, высокой экспрессией PD-L1 (CPS ≥10) и высокой ТМБ (≥10 мут/Мб), наблюдаемой при поисковом анализе данных этих исследований171 173, свидетельствует о том, что эти биомаркеры могут дать возможность выбирать пациентов, которые с наибольшей вероятностью выиграют ингибиторы на ранних линиях терапии. Данные, представленные на Ежегодном конгрессе ESMO 2020 года из исследования III фазы CheckMate-649, оценивающего добавление ниволумаба к 5-фторпиримидину и оксалиплатину в качестве терапии первой линии у пациентов с РЖ/РЖП, показали, что это исследование достигло основных конечных точек по как ОВ, так и по ВБП у пациентов с PD-L1 CPS ≥5 (определено с помощью теста PharmDx 28-8 ИГХ), а также вторичных конечных точек по ОВ у пациентов с PD-L1 CPS ≥1 и ОВ у всех рандомизированных пациентов8 (таблица 1). Между тем, в исследовании III фазы ATTRACTION-4, которое проводилось в азиатских странах без отбора пациентов на основе экспрессии PD-L1, добавление ниволумаба к химиотерапии привело к улучшению ВБП, хотя и с большей долей пациентов (66%), получавших последующую терапию, чем в исследовании CheckMate-649 (39%)174, что потенциально размывает положительное влияние ниволумаба на ОВ, наблюдаемое в этом исследовании (таблица 1). Вместе эти результаты подтверждают более высокую эффективность ниволумаба у пациентов с более высокими уровнями экспрессии PD-L1 и принятие химиотерапии в комбинации с ниволумабом в качестве стандартного лечения первой линии. В 2021 году комбинация ниволумаба с химиотерапией в первой линии была одобрена FDA. 16 июня 2020 г. пембролизумаб был одобрен FDA для лечения пациентов с солидными опухолями с высоким TMB (≥10 мут/Мб) на основании более высокой ЧОО (30,3% (27,1% после исключения опухолей MSI-H) по сравнению с 6,7%) и более высокой ВБП у пациентов с высоким TMB, получавших пембролизумаб в исследовании KEYNOTE-158175. Данные нескольких других исследований также указывают на то, что высокий уровень TMB является предиктором ответа на монотерапию анти-PD-1 у пациентов с поздними стадиями РЖ/РЖП 171,172. Эти выводы требуют дальнейшей оценки TMB как биомаркера в других исследованиях, таких как CheckMate-6498. Помимо этого проводится оценка и других подходов, разработанных для повышения эффективности ингибиторов контрольных точек у пациентов с РЖ/РЖП. Для преодоления действия иммуносупрессивных клеток, таких как клетки Treg, которые предположительно отвечают за резистентность к блокаде PD-1176 179, к антителам против PD-1 добавляют мультикиназные ингибиторы, такие как регорафениб или ленватиниб, которые ингибируют инфильтрацию опухоли Т-клетками в доклинических моделях опухолей180 182. Действительно, комбинации, содержащие антитела против PD-1 плюс TKI, такие как регорафениб плюс ниволумаб или ленватиниб плюс пембролизумаб, продемонстрировали многообещающую эффективность в исследованиях ранних фаз с участием пациентов с раком желудка с ЧОО 44% и 69% соответственно183,184, что требует дальнейшей оценки в рандомизированных исследованиях (NCT04662710).
Терапия, основанная на селекции пациентов в зависимости от биомаркеров
Доступность технологий высокопроизводительного секвенирования
и разработка соответствующих таргетных методов лечения сместила
молекулярную стратификацию пациентов с РЖ/РЖП для включения
в исследования таргетных препаратов с парадигмы «один тест - один
препарат» на сложные комплексные
подходы. Ярким примером является
VIKTORY, зонтичное исследование,
проведенное в Южной Корее, в котором пациентов с метастатическим
раком желудка распределяли в одно
из 10 клинических исследований II
фазы терапии второй линии на основе восьми биомаркеров (RAS аберрации, TP53 мутации, PIK3CA мутации
и/или амплификации, MET амплификации, сверхэкспрессия МЕТ, все
отрицательные, TSC2 дефицит или
RICTOR амплификация)11. Из 715
пациентов, для которых было можно
провести геномное профилирование тканей или цоДНК, 105 (14,7%)
были распределены в одно из клинических исследований на основании
идентифицированного биомаркера.
Высокие уровни эффективности
были отмечены в группе монотерапии саволитинибом, при этом ЧОО
составила 50% среди 20 пациентов с
МЕТ-амплифицированным раком
желудка. По сравнению с пациентами, получающими традиционную
терапию второй линии, такую как
рамуцирумаб в комбинации с паклитакселом, химиотерапия на основе
таксана или химиотерапия на основе
иринотекана, у пациентов, получающих управляемую биомаркерами
терапию, была пролонгированная
ВБП и ОВ, что указывает на то, что
стратегии терапевтического отбора,
управляемые биомаркерами, в этих
условиях являются реалистичными
и эффективными.
Точно так же улучшение выживаемости наблюдалось в исследовании
II фазы PANGEA, в котором добавление антител, нацеленных на
HER2, MET, FGFR2, EGFR, PD-1 или
VEGFR2, к химиотерапии проходило
оценку применения в качестве терапии от первой до третьей линии для
пациентов с опухолями, содержащими амплификации ERBB2, амплификации MET, амплификации FGFR2,
амплификации EGFR, биомаркеры
для иммунотерапии (MSI-H, ВЭБположительный, CPS ≥10 и TMB ≥15
мут/Мб) и изменения MAPK и/или
PIK3CA, либо негативные во всех
случаях, соответственно185. Если наблюдались геномные расхождения
между первичными и метастатическими опухолями (что имело место у
35% пациентов), лечение выбиралось
на основе геномных профилей метастатических очагов. Показатель выживаемости в течение 1 года во всех
подгруппах составил 66% по сравнению с гипотетическим показателем
выживаемости в течение 1 года, равным 63%, что означает достижение
заранее определенной первичной
конечной точки.
После этих успехов проводятся широкомасштабные скрининговые исследования путем секвенирования,
предназначенные для отбора подходящих пациентов для исследований
на основе наличия целевых изменений, способных быть мишенями,
таких как BRAFV600E186 и NTRK187,
ALK188 и слияния ROS1189, которые
являются исключительно редкими
(распространенность <1%) среди
пациентов с РЖ/РЖП. Первым из
этих начинаний стал GISCREEN,
общенациональный проект по скринингу биомаркеров опухолей ЖКТ
с использованием тканевого секвенирования, который был запущен
в Японии в 2015 году. Анализ образцов 513 пациентов с РЖ/РЖП
выявил высокую распространенность мутаций TP53 (47,8%) и большое количество изменений, имеющих низкую распространенность,
с распределением типа «длинный
хвост»190. Это исследование выявило
несколько очень редких перестроек: слияния FGFR3–TACC3 и EGFR
вариант III, обе перестройки были у
двух пациентов (0,4%), а также слияния WIPF2-ERBB2 и GOPC–ROS1
каждое у одного пациента (0,2%). Далее был начат проект GOZILA, в котором использовалось комплексное
секвенирование цоДНК для быстрого скрининга пациентов с РЖ/РЖП
на соответствие критериям исследования. Генотипирование цоДНК
выявило геномные изменения с
распространенностью, аналогичной тем, которые наблюдаются при
генотипировании тканей, включая
редкие изменения, такие как слияния
NTRK1191. Сравнение полезности
проектов GI-SCREEN и GOZILA показало, что генотипирование цоДНК
ускоряет включение пациентов в
исследование за счет сокращения
продолжительности скрининга без
снижения качества идентификации
пациентов или эффективности таргетных препаратов191. Сокращение
времени отбора пациентов обусловлено ускорением получения образца,
выделения и секвенирования ДНК.
Результаты GOZILA свидетельствуют о пользе разработки клинических
исследований для пациентов с распространенными солидными опухолями с редкими изменениями, в
том числе для пациентов с РЖ/РЖП
(UMIN000033182 и JapicCTI-194707).
Эти результаты служат обоснованием для использования секвенирования тканей и цоДНК в рутинном
лечении пациентов для выявления
целевых изменений, способных служить мишенями для терапии, включая редкие изменения, с целью точного выбора лечения.
Направления
дальнейших исследований.
Успех исследований по оценке молекулярной стратификации, таких как
VIKTORY, PANGEA и GI-SCREEN/
GOZILA, позволяет предположить,
что уже не за горами эра рутинного
комплексного молекулярного профилирования РЖ/РЖП на поздних
стадиях (рис. 1). Перед началом терапии первой линии следует проводить специфические молекулярные
тесты, такие как ИГХ для HER2 или
PD-L1, а также тестирование MSI,
основанное на ПЦР, чтобы выбрать
пациентов, которым с большой вероятностью принесет пользу таргетная
терапия, направленная на HER2, или
иммунотерапия. Сегодня растет потребность в профилировании опухолевых тканей на основе секвенирования, а более широкое внедрение
таких подходов должно привести
к расширению участия пациентов
в исследованиях таргетных препаратов, прицельно действующих на
молекулярном уровне, особенно в
учреждениях, имеющих доступ к
разнообразной программе клинических исследований. Секвенирование цоДНК может быть полезным
за счет ускорения тестирования не
только для идентификации целевых
изменений до начала терапии первой
линии, но и в качестве метода для характеристики клональной эволюции
и механизмов резистентности, включая гетерогенность опухоли после
прогрессирования заболевания 191.
Кроме того, использование мультимодальных молекулярных анализов
может служить обоснованием для
новых терапевтических стратегий,
управляемых биомаркерами, путем
углубления нашего понимания роли
дополнительных биомаркеров, которые не являются непосредственными мишенями для терапии, но, тем
не менее, связаны с эффективностью лечения или резистентностью к нему.
Рис. 1. Выбор таргетной терапии, управляемой биомаркерами, при РЖ/РЖП.
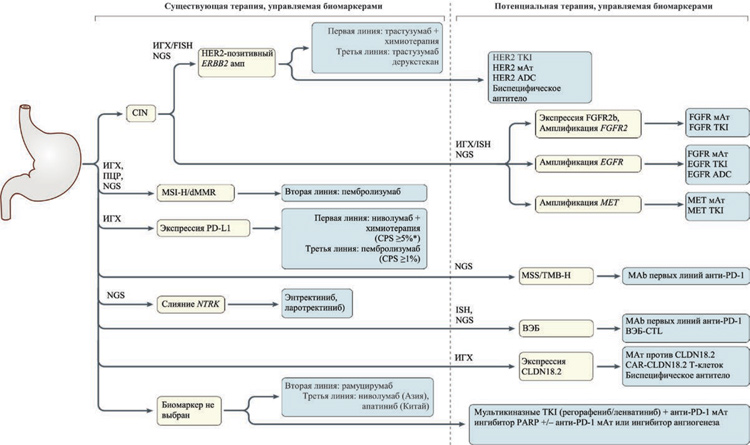
Этот алгоритм предоставляет руководство по выбору доступных в настоящее время таргетных методов лечения, управляемых биомаркерами, протестированных с использованием комплексных стратегий молекулярного профилирования, которые включают иммуногистохимию (ИГХ) и секвенирование ДНК опухолевой ткани и/или циркулирующей опухолевой ДНК (цТДНК). *
Указывает на большую эффективность в этой популяции. ADC, конъюгат антитело-лекарственный препарат; CAR, химерный рецептор антигена; CLDN18.2, клаудин 18.2; ЦТЛ, цитотоксический Т-лимфоцит; CPS, комбинированная положительная оценка в баллах; ВЭБ, вирус Эпштейна-Барр; ИГХ, иммуногистохимия; FISH, гибридизация in situ; мАт, моноклональное антитело;
dMMR - дефицит репарации ошибочно спаренных нуклеотидов; MSI-H, высокая микросателлитная нестабильность; MSS, микросателлитная стабильность; NGS, секвенирование следующего
поколения; PARP, поли (АДФ-рибоза) полимераза; PD-1, программируемая гибель клеток 1; PD-L1, лиганд-1 белка программируемой гибели клеток; TKI, ингибитор тирозинкиназы; TMB-H,
высокая мутационная нагрузка опухоли.
Заключение
В настоящее время в рутинной клинической практике используются только три биомаркера для отбора пациентов на поздних стадиях РЖ/ РЖП с целью проведения таргетной терапии: HER2-положительность для трастузумаба и T-DXd, статус MSI и экспрессия PD-L1 для применения антител против PD-1. Помимо этих редких успехов, отрицательные результаты нескольких исследований таргетных препаратов, нацеленных на молекулы, вероятно, отражают недостаточное присутствие в этих исследованиях пациентов с опухолями, несущими целевое изменение, служащее мишенью для препаратов. Более того, исключительно редкие биомаркеры, такие как слияния генов, требуют проведения широкомасштабного скрининга из-за трудностей выявления таких изменений в клинической практике. Между тем, более глубокое понимание биологии опухоли позволило лучше разобраться в существующей корреляции между молекулярными подтипами рака, гетерогенностью опухоли и чувствительностью и/или резистентностью к таргетной терапии у пациентов с РЖ/РЖП. Надеемся, что эти знания будут способствовать более широкому внедрению прецизионной медицины, использующей молекулярно-таргетную терапию пациентов с РЖ/РЖП, в ближайшем будущем.
Список литературы представлен в
разделе «Новости онкологии» сайта
RosOncoWeb. Статья подготовлена
по результатам обзора Nakamura с
соавторами
НИВОЛУМАБ В КОМБИНАЦИИ С ПРЕПАРАТАМИ ПЛАТИНЫ И ФТОРПИРИМИДИНАМИ – НОВЫЙ СТАНДАРТ ТЕРАПИИ ПЕРВОЙ ЛИНИИ ДИССЕМИНИРОВАННОГО РАКА ЖЕЛУДКА
Комбинация химио- и иммунотерапии активно изучается и внедряется в рутинную клиническую практику при различных солидных опухолях, рак желудка (РЖ) – не исключение. Однако до 2020 года успехи иммунотерапии РЖ были скромными. С 2017 г. на основании результатов исследований ATTRACTION-2 и Check Mate032 ниволумаб в монотерапии, вне зависимости от уровня PDL1 или СPS, является вариантом выбора в поздних линиях лечения больных РЖ [1, 3]. 16 апреля 2021 г. FDA (Food and Drug Administration) на основе результатов исследований ATTRACTION-4 и CheckMate 649 одобрило ниволумаб в комбинации с химиотерапией в первой линии лечения пациентов диссеминированным и местнораспространенным РЖ независимо от уровня PD-L1 или СPS.
ATTRACTION-4
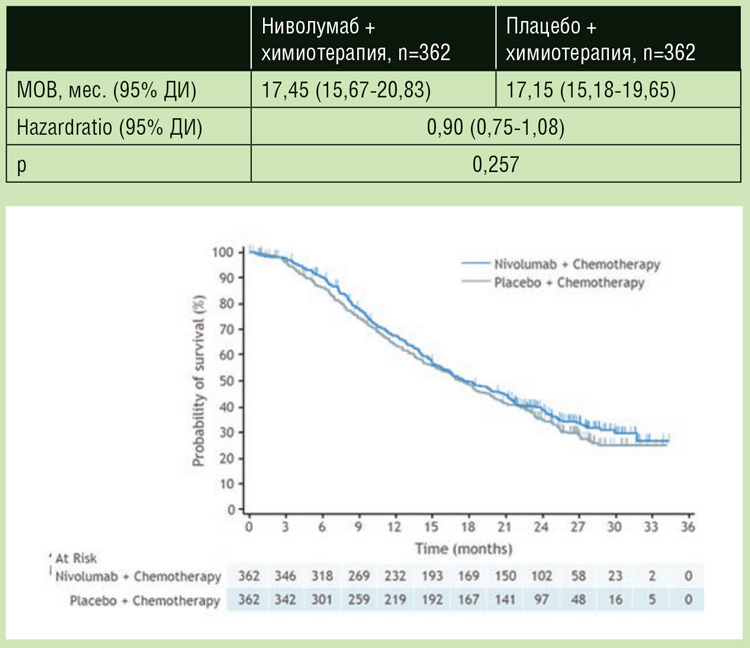
В исследовании 3 фазы ATTRACTION-4 у пациентов с местнораспространенным, неоперабельным или диссеминированным HER2 отрицательным РЖ, ранее не получавших терапии по поводу метастатического процесса, с ECOG статусом 0-1 изучалась целесообразность добавления ниволумаба к первой линии лечения SOX/CapeOX. Пациенты были рандомизированы в соотношении 1:1 в группу (n=362) SOX/CapeOX в комбинации с ниволумабом 360 мг в/в кап. 1 раз в 3 недели или в группу (n=362) SOX/ CapeOX с плацебо. Лечение продолжалось до прогрессирования или непереносимой токсичности. Пациенты были стратифицированы в соответствии со статусом ECOG, экспрессией PD-L1 на клетках опухоли, распространенностью болезни и страной проживания. Первичными конечными точками исследования были медиана выживаемости без прогрессирования (МВБП), оцененная независимым центральным комитетом, и медиана общей выживаемости (МОВ). МВБП, оцененная исследователями, частота объективного ответа (ЧОО), КРО, время до достижения ответа и безопасность терапии являлись вторичными конечными точками. Статус PD-L1 определялся в образцах опухолей у всех пациентов с использованием иммуногистохимического набора 28-8 pharmDx. У большинства пациентов, включенных в исследование, был впервые выявленный ДРЖ (77,3-77,1%), диффузный подтип опухоли (53,0- 48,6%), число пораженных органов более 2 (70,2-71,0%) и экспрессия PD-L1 <1 (84,0-84,5%). При медиане наблюдения в 11,6 мес. в исследовании было продемонстрировано статистически значимое увеличение МВБП без увеличения МОВ. МВБП в группе ХТ с ниволумабом достигла 10,45 мес., в контрольной группе – 8,34 мес. (HR=0,68; 95% ДИ 0,51-0,90; p=0,0007), при 12-месячной ВБП в 45,4% и 30,6% соответственно (рис.1). Таким образом, добавление ниволумаба позволило снизить риск прогрессирования болезни на 32%. МОВ в группе ХТ в комбинации ниволумабом составила 17,45 мес. и 17,15 мес. с плацебо (HR=0,90; 95% ДИ 0,75-1,08; p=0,257) (рис.2). ОО в группе ХТ с ниволумабом зарегистрирован у 57,5% пациентов, в группе с плацебо – у 47,8% (p=0,0088), при равной медиане времени до достижения ответа в 1,4 мес. Особый интерес представляет медиана длительности ответа, достигнутого на терапии; так, в группе ХТ с ниволумабом она составила 12,91 мес. против 8,67 мес. в группе с плацебо. Переносимость нового режима была приемлемой, добавление ниволумаба к химиотерапии несколько увеличило частоту нежелательных явлений (НЯ) 3 степени и выше с 64,8% до 71,4%, НЯ послужили причиной прекращения терапии у 7,3% и 10,6% пациентов соответственно. В группе ХТ в комбинации с ниволумабом чаще были зарегистрированы такие иммуноопосредованные НЯ ≥3 степени, как эндокринные нарушения (2,2%), сыпь (3,9%), пульмониты (1,1%) и инфузионные реакции (3,3%).
Рисунок 1. График выживаемости без прогрессирования болезни в лечебных группах.
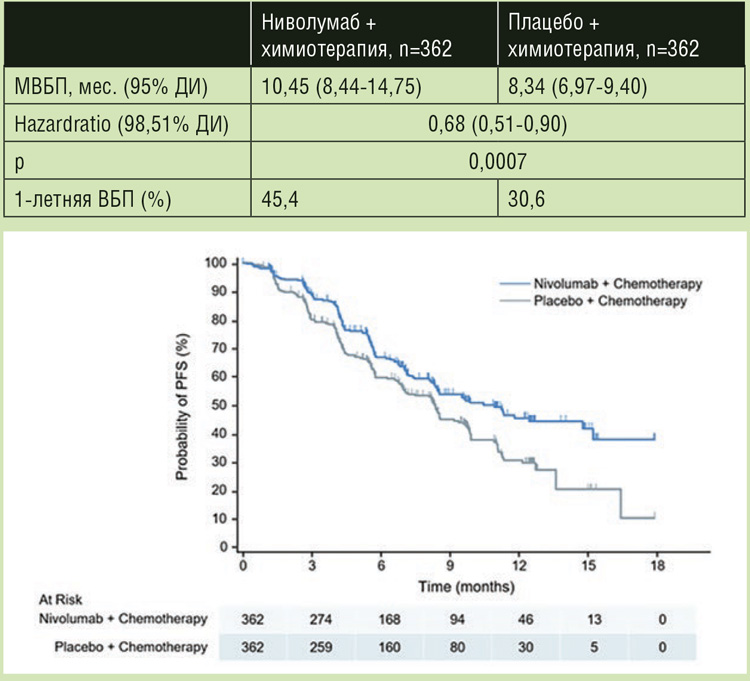
Рисунок 2.
CheckMate 649
На ESMO 2020 г. были представлены результаты открытого рандомизированного исследования
III фазы CheckMate 649, в котором больные местнораспространенным, нерезектабельным или
диссеминированным РЖ в качестве первой линии лечения получали ниволумаб в комбинации с
ипилимумабом или химиотерапию
(FOLFOX6/XELOX) в комбинации
с ниволумабом или только химиотерапию. Пациенты были рандомизированы в группы в соотношении
1:1:1 и стратифицированы в соответствии с уровнем экспрессии PDL1 на опухолевых клетках, страной
проживания, статусом ECOG и
режимом химиотерапии (XELOX
или FOLFOX). В настоящий момент
доступны результаты второй и третьей групп.
Исследование обладало сложным
иерархический дизайном, первоначально было необходимо доказать, что добавление ниволумаба
к химиотерапии позволяет значимо увеличить МОВ в группе с CPS
≥5, далее с CPS ≥1 и потом уже у
всех пациентов. Соответственно,
первичными конечными точками
исследования были МОВ и МВБП
у пациентов при CPS ≥5, а ЧОО,
МОВ и МВБП (CPS ≥1, CPS ≥10 и во
всей группе) являлись вторичными
конечными точками.
Статус PD-L1 определялся в образцах опухолей у всех пациентов с использованием иммуногистохимического набора 28-8 pharmDx.
При медиане наблюдения в 12,1
мес. у пациентов с CPS >5 МОВ в
группе ХТ с ниволумабом (n=473)
составила 14,1 мес. против 11,1
мес. в группе только химиотерапии
(n=482) (HR=0,71; 95% ДИ 0,59-0,86;
p<0,0001) (рис.3). Таким образом,
добавление ниволумаба к стандартной химиотерапии позволило
снизить риск смерти на 29% и увеличить МОВ на 3,3 мес.
Комбинация ниволумаба с химиотерапией (XELOX или FOLFOX)
позволила статистически значимо увеличить МОВ как у пациентов с CPS >1 с 11,3 мес. до 14,0
мес. (HR=0,77; 95% ДИ 0,64-0,92;
p=0,0001), так и в общей группе – с
11,6 мес. до 13,8 мес. (HR=0,80; 95%
ДИ 0,68-0,94; p=0,0002).
Добавление ниволумаба к химиотерапии продемонстрировало значимое увеличение МВБП во всех
подгруппах: при CPS >1 c 6,9 мес.
до 7,5 мес. (HR=0,74; 95% ДИ 0,65-
0,85), при CPS >5 с 6,0 мес. до 7,7
мес. (HR=0,68; 95% ДИ 0,56-0,81;
p<0,0001) и в общей группе с 6,9
мес. до 7,7 мес. (HR=0,77; 95% ДИ
0,68-0,87).
В подгруппе пациентов с CPS >5
комбинация ниволумаба и ХТ позволила достигнуть ЧОО в 60% (ПО
– 12% и ЧО – 48%) против 45% (ПО
– 7 % и ЧО – 38%) в группе только
химиотерапии (p<0,0001). Медианы времени до достижения ответа
в группах были равными и составили 1,5 мес. Медиана длительности ответа в группе с ниволумабом
(n=226) – 9,5 мес. против 7,0 мес. в
контрольной группе (n=177).
НЯ ≥3 степени были зарегистрированы у 59% больных (n=462) в
группе с ниволумабом и у 44% в
контрольной группе, НЯ послужили причиной завершения терапии
в 17% (n=131) и 9% (n=67) случаев
соответственно. Наиболее частыми нежелательными явлениями,
зарегистрированными у ≥20% пациентов, получавших комбинацию ниволумаба с химиотерапией,
были полинейропатия, тошнота,
слабость, диарея, рвота, снижение
аппетита, боли в животе, запор и
боли в мышцах. Иммуноопосредованные НЯ ≥3 степени были представлены эндокринными нарушениями (<1%), пульмонитами (2%) и
гепатитами (4%). От НЯ, связанных
с лечением, погибло 12 пациентов в
группе с ниволумабом и 4 пациента
в контрольной группе.
На основании данных, представленных в исследованиях, рекомендуется два дозовых режима ниволумаба:
• 360 мг в/в кап. 1 раз в 3 недели в
комбинации с химиотерапией на
основе платины и фторпиримидинов, цикл 3 недели;
• 240 мг в/в кап. 1 раз в 2 недели в
комбинации с химиотерапией на
основе платины и фторпиримидинов, цикл 2 недели
Рисунок 3.
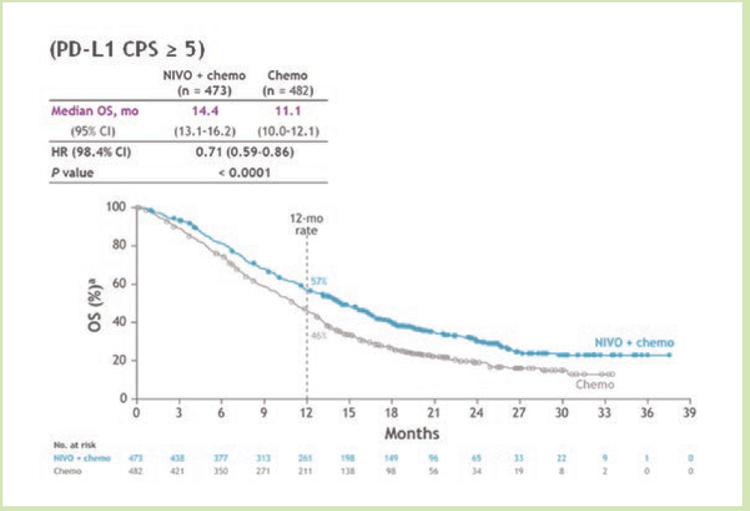
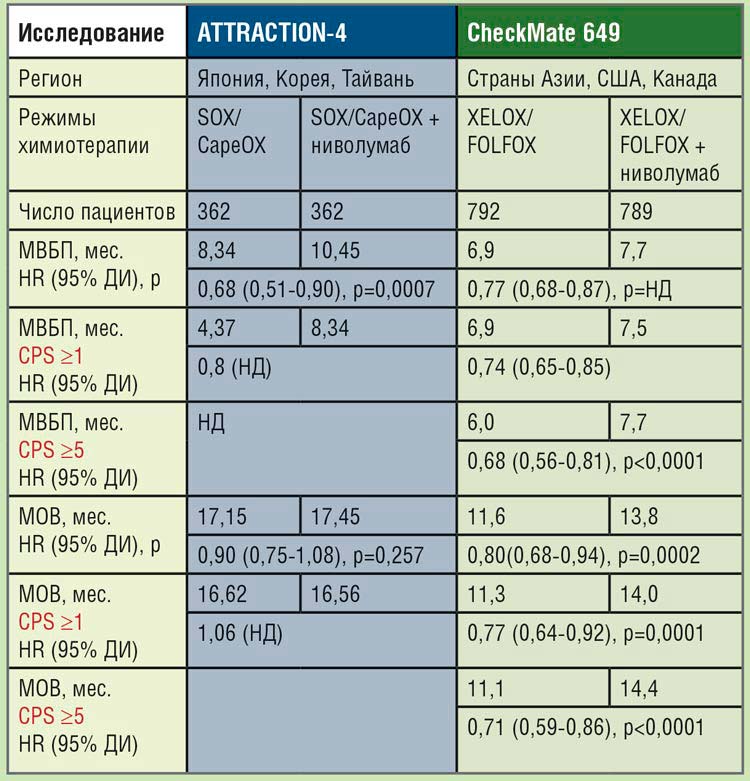
Источники:
1. Kang YK, Boku N, Satoh T, Ryu MH, Chao Y, Kato K, Chung HC, Chen JS, Muro K, Kang WK, Yeh KH, Yoshikawa T, Oh SC, Bai LY, Tamura T, Lee KW, Hamamoto Y, Kim JG, Chin K, Oh DY, Minashi K, Cho JY, Tsuda M, Chen LT. Nivolumab in patients with advanced gastric or gastro-oesophageal junction cancer refractory to, or intolerant of, at least two previous chemotherapy regimens (ONO-4538-12, ATTRACTION-2): a randomised, double-blind, placebocontrolled, phase 3 trial. Lancet. 2017 Dec 2; 390(10111): 2461-2471.
2. Geng Y, Wang H, Lu C, Li Q, Xu B, Jiang J, Wu C. Expression of costimulatory molecules B7-H1, B7-H4 and Foxp3+ Tregs in gastric cancer and its clinical significance. Int J Clin Oncol. 2015 Apr; 20(2): 273-81.
3. Janjigian YY, Bendell J, Calvo E, et al. CheckMate-032 study: efficacy and safety of nivolumab and nivolumab plus ipilimumab in patients with metastatic esophagogastric cancer. J Clin Oncol 2018; 36(28): 2836-2844.
4. Moehler M, Shitara K, Garrido M, et al. Nivolumab plus chemotherapy vs chemo as first-line treatment for advanced gastric cancer/ gastroesophageal junction cancer/ esophageal adenocarcinoma: First results of the CheckMate 649 study. ESMO Virtual Congress 2020. Abstract LBA6_PR. Presented September 21, 2020.
5. Boku N, Ryu M, Oh D, et al. Nivolumab plus chemotherapy vs chemotherapy alone in patients with previously untreated advanced or recurrent gastric/gastroesophageal junction cancer: ATTRACTION-4 (ONO-4538-37) study. ESMO Virtual Congress 2020. Abstract LBA7_PR. Presented September 21, 2020.
6. Веб-сайт FDA.
НОВЫЕ ДАННЫЕ ИССЛЕДОВАНИЯ 218 (NCT03173560) ПО ОЦЕНКЕ ПРИМЕНЕНИЯ КОМБИНИРОВАННОГО РЕЖИМА ЛЕНВАТИНИБ ПЛЮС ЭВЕРОЛИМУС ПРИ РАСПРОСТРАНЕННОМ ПОЧЕЧНО-КЛЕТОЧНОМ РАКЕ: IKCS 2020 (INTERNATIONAL KIDNEY CANCER SYMPOSIUM 2020)1
Результаты исследования 218 (фазы
2), в котором сравнивали безопасность и эффективность двух стартовых доз ленватиниба (18 мг и 14
мг один раз в сутки*), перорального мультитаргетного ингибитора
тирозинкиназ в комбинации с эверолимусом (5 мг один раз в сутки)
у пациентов со светлоклеточным
почечно-клеточным раком (ПКР)
после антиангиогенной терапии
(допускалось предшествующее применение антагонистов PD-1/PD-L1),
были представлены на Международном симпозиуме по раку почки
(IKCS 2020). Результаты свидетельствуют, что более низкая стартовая
доза ленватиниба (14 мг) не достигла
порога не меньшей эффективности
в сравнении с уже зарегистрированной стартовой дозой (18 мг).
Целью данного рандомизированного открытого исследования фазы 2
было оценить, обладает ли стартовая доза препарата ленватиниб 14
мг один раз в сутки в комбинации с
эверолимусом в дозе 5 мг один раз в
сутки аналогичной эффективностью
при лучшем профиле безопасности
по сравнению с ранее одобренной
стартовой дозой препарата ленватиниб 18 мг один раз в сутки в такой же
комбинации с эверолимусом в дозе 5
мг один раз в сутки.
Первичной конечной точкой эффективности являлась не меньшая эффективность препарата ленватиниб
в дозе 14 мг по сравнению с дозой
18 мг в виде частоты объективного
ответа (ЧОО) на 24 неделе (ЧООН24)
(отношение шансов: >0,76; значение
P: ≤0,045) согласно заключению исследователей на основании критериев оценки ответа при солидных
опухолях (RECIST верс. 1.1).
Первичной конечной точкой безопасности являлась частота непереносимых нежелательных явлений
степени 2, возникших во время лечения (НЯВЛ), или любых НЯВЛ
степени ≥3, возникших в течение 24
недель после рандомизации в группе
14 мг по сравнению с группой 18 мг.
К ключевым вторичным конечным
точкам относились частота объективных ответов (ЧОО), выживаемость без прогрессирования (ВБП),
общая выживаемость (ОВ) и безопасность.
В исследование были включены 343
пациента. По данным первичного анализа эффективности (n=311
пациентов) среди пациентов, получавших ленватиниб в более низкой
стартовой дозе (14 мг) ЧООН24 не
достигла показателя не меньшей
эффективности (отношение шансов
ЧООН24: 0,88 [90% ДИ:0,59–1,32]; Р:
0,2676). Показатели ЧООН24 среди
пациентов, начавших лечение в дозе
14 мг и 18 мг, составили 32,1% (95%
ДИ: 24,7–39,4) и 34,8% (95% ДИ:
27,3–42,3) соответственно. По данным первичного анализа безопасности (n=309) частота непереносимых
НЯВЛ степени 2 или любых НЯВЛ
степени ≥3 была сходной в группах
14 мг и 18 мг: 82,8% и 79,6% (P:
0,4763) соответственно. Комбинация
ленватиниба в стартовой дозе 18 мг и
эверолимуса в дозе 5 мг обладала таким же профилем безопасности, как
и в предыдущем исследовании фазы
2 (исследование 205).
По данным анализа безопасности
в группах пациентов, получавших
препарат ленватиниб
в дозах 14 мг и 18 мг (все пациенты,
которые были рандомизированы и
получили хотя бы одну дозу исследуемого препарата, n=341), НЯВЛ
привели:
• к прекращению лечения в 32,4% и
26,8% случаев соответственно;
• к прерыванию лечения в 74,6% и
83,3% случаев соответственно;
• к снижению дозы в 67,6% и 69,6%
случаев соответственно.
ЧОО (по данным первичного анализа эффективности, n=311) для пациентов, получавших ленватиниб в
стартовых дозах 14 и 18 мг, составила 34,6% (95% ДИ: 27,1-42,1) и 40,6%
(95% ДИ: 32,9-48,4) соответственно
(отношение шансов: 0,77 [90% ДИ:
0,52–1,14]).
Медиана ВБП и медиана ОВ были
численно выше у пациентов, получавших ленватиниб в дозе 18 мг, по
сравнению с получавшими препарат
в дозе 14 мг:
• медиана ВБП составила 11,1 месяца
(95% ДИ: 9,0–12,9) среди пациентов,
получавших 14 мг, по сравнению с
14,7 месяца (95% ДИ: 11,1–20,3) среди пациентов, получавших 18 мг
соответственно; и
• медиана OВ составила 27,0 месяцев
(95% ДИ: 18,3-НД) среди пациентов,
получавших 14 мг, и не была достигнута (НД) (95% ДИ: 23,8-НД) среди
пациентов, получавших 18 мг.
Наиболее частые НЯВЛ любой степени тяжести (≥20%) в группах 14
мг и 18 мг включали диарею (68,2% и
72,0%), гипертензию (30,1% и 35,7%),
протеинурию (22,5% и 35,7%), снижение аппетита (35,3% и 34,5%) и
тошноту (30,6% и 31,0%). Серьезные
НЯВЛ (≥2%) наблюдались у 49,1%
пациентов, получавших препарат
ленватиниб в дозе 14 мг, и у 48,8%
пациентов, получавших препарат
ленватиниб в дозе 18 мг.
Исследование 218 проводилось в
рамках пострегистрационных обязательств перед Управлением по контролю качества пищевых продуктов
и лекарственных средств США и
Европейским агентством по лекарственным средствам (EMA) после
присвоения статуса приоритетного рассмотрения заявки (в США) и
одобрения комбинации ленватиниб
плюс эверолимус для лечения пациентов с распространенным почечноклеточным раком, ранее получавших антиангиогенную терапию.
В данном обзоре обсуждается исследовательское применение препаратов, одобренных в Российской Федерации*. Обзор не призван делать
заключения в отношении эффективности и безопасности. Гарантии того,
что какое-либо исследовательское
применение одобренных в Российской Федерации препаратов приведет к успешному завершению
клинической разработки или получению одобрения в Российской Федерации, отсутствуют.
*Препарат Ленвима® (ленватиниб)
зарегистрирован в РФ для терапии
взрослых пациентов с распространенным ПКР (стартовая доза 18
мг) в комбинации с эверолимусом
(стартовая доза 5 мг) после одного
курса таргетной терапии ингибиторами рецепторов фактора роста
эндотелия сосудов. Данное исследование содержит не зарегистрированный в РФ режим дозирования. Информация предоставлена
для подтверждения одобренной в
РФ дозировки 18 мг2
.
Cсылки: 1. Sumanta K. Pal et al. Phase
II trial of lenvatinib (LEN) at two starting
doses + everolimus (EVE) in patients
(pts) with renal cell carcinoma (RCC):
Results by independent imaging review
(IIR) and prior immune checkpoint
inhibition (ICI). Journal of
Clinical Oncology 2021 39:6_suppl, 307-
307. 2. Инструкция по медицинскому
применению препарата ЛЕНВИМА®:
РУ ЛП 003398 от 29.12.2015 с изменениями от 30.12.2020.

ООО «Эйсай»
117342, Россия, г. Москва, Профсоюзная ул., д. 65, стр. 1, этаж 21, Бизнес-центр «Лотте»
Тел.: +7 (495) 580-7026, +7 (495) 580-7027
E-mail: info_russia@eisai.net, www.eisai.ru
КРАТКАЯ ИНСТРУКЦИЯ ПО ПРИМ ЕНЕНИЮ ПРЕПАРАТА ЛЕНВИМА ® (ленватиниб) Показания: для терапии пациентов с прогрессирующим местно-распространенным или метастатическим дифференцированным (папиллярным, фолликулярным, из клеток Гюртле) раком щитовидной железы, рефрактерным к терапии радиоактивным йодом; для монотерапии взрослых пациентов с прогрессирующим или неоперабельным гепатоцеллюлярным раком, ранее не получавших системной терапии; в комбинации с эверолимусом для терапии взрослых пациентов с распространенным почечно-клеточным раком, после одного предшествующего курса таргетной терапии ингибиторами рецепторов фактора роста эндотелия сосудов; в комбинации с пембролизумабом для терапии пациентов с распространенным раком эндометрия (в случае отсутствия высокой микросателлитной нестабильности (MSI-H) или нарушений системы репарации ДНК (dMMR)) с прогрессированием заболевания после предшествующей системной терапии, которым не показанохирургическое лечение или лучевая терапия. Противопоказания: гиперчувствительность к действующему веществу или другим компонентам препарата, беременность, период грудного вскармливания, возраст до 18 лет (данные по эффективности и безопасности отсутствуют), хронические заболевания почек в терминальной стадии (данные по эффективности и безопасности отсутствуют). С осторожностью: пациентам с артериальной гипертензией; протеинурией; нарушением функции почек; почечная недостаточность / гастроинтестинальной токсичностью; сердечной дисфункцией; синдромом обратимой задней энцефалопатии /синдром обратимой задней лейкоэнцефалопатии; с печеночной недостаточностью; с риском тромбоэмболии артерий; с риском кровотечений; тромбоцитопенией, возможностью образовании фистул и гастроинтестинальной перфорации; возможностью удлинения интервала QT; с врожденным синдромом удлиненного интервала QT; с застойной сердечной недостаточностью; брадиаритмией; при одновременной терапии лекарственными препаратами, удлиняющими интервал QT (необходим мониторинг ЭКГ); при гипотиреозе; нарушении подавления уровня ТТГ в крови, дисфункции щитовидной железы; в случае хирургических вмешательств, в случае планируемых инвазивных стоматологических процедур, ухудшении заживления ран; старше 75 лет. Способ применения и дозы: внутрь, 1 раз в сутки, не зависимо от приема пищи. Рекомендованная суточная доза препарата ЛЕНВИМА составляет: дифференцированный рак щитовидной железы (ДРЩЖ) — 24 мг (две капсулы 10 мг и одна капсула 4 мг); гепатоцеллюлярный рак - 8 мг (две капсулы 4 мг) для пациентов с массой тела <60 кг и 12 мг (три капсулы 4 мг) для пациентов с массой тела ≥60 кг; распространенный почечно-клеточный рак (ПКР) — 18 мг (одна капсула 10 мг и две капсулы 4 мг) в комбинации с 5 мг эверолимуса один раз в сутки; рак эндометрия (РЭ) — составляет 20 мг (две капсулы 10 мг) один раз в сутки в комбинации с 200 мг пембролизумаба в виде внутривенной инфузии в течение 30 минут каждые 3 недели. Суточная доза может быть пересмотрена в соответствии с планом управления доза/токсичность. Лечение должно продолжаться пока присутствует клиническая польза, либо до проявления неприемлемой токсичности. Рекомендации по коррекции дозы содержатся в полной версии инструкции. Побочное действие: очень часто (≥1/10): инфекция мочевыводящих путей, тромбоцитопения, лейкопения, нейтропения, гипотиреоз, повышение уровня ТТГ в крови, гипокальциемия, гиперхолестеринемия, гипокалиемия, снижение аппетита, снижение массы тела, бессонница, головная боль, головокружение, дисгевзия, кровотечения, артериальная гипертензия, артериальная гипотензия, дисфония, диарея, боль в животе, рвота, тошнота, воспаление полости рта, боль в полости рта, запор, диспепсия, сухость слизистой оболочки полости рта, синдром ладонно-подошвенной эритродизестезии, сыпь, алопеция, боль в спине, артралгия, миалгия, боль в конечностях, костно-мышечная боль, протеинурия, утомляемость, астения, периферический отек, повышение концентрации билирубина в крови, гипоальбуминемия, повышение активности АЛТ, АСТ. Часто (≥1/100, 1/10<): лимфопения, обезвоживание, гипомагниемия, острое нарушение мозгового кровообращения, инфаркт миокарда, сердечная недостаточность, удлинение интервала QT, снижение фракции выброса, гиперхолестеринемия, тромбоэмболия легочной артерии, фистула прямой кишки, метеоризм, повышение активности липазы, амилазы, повышение активности ГГТ, ЩФ, ТТГ, печеночная недостаточность, печеночная энцефалопатия, нарушение функции печени, почек; холецистит, эпизоды почечной недостаточности, печеночная энцефалопатия, повышение концентрации креатинина, мочевины в крови, гиперкератоз, чувство дискомфорта. Нечасто (≥ 1/1000 < 1/100) перинеальный абсцесс, инфаркт селезёнки, синдром обратимой задней энцефалопатии, монопарез, расслоение аорты, транзиторная ишемическая атака, панкреатит, пневмоторакс, oстеонекроз челюсти, нефротический синдром, нарушение заживления ран, повреждение клеток печени/гепатит.
Перед назначением любого препарата, упомянутого в данном материале, пожалуйста, ознакомьтесь с полной инструкцией по применению, предоставляемой компанией-производителем. Компания Эйсай не рекомендует применять препараты компании способами, отличными от описанных в инструкции по применению.
Пожалуйста, ознакомьтесь с полной инструкцией по применению препарата Ленвима® (РУ: ЛП-003398 от 29.12.2015, c изменениями от 30.12.2020).
RU-LENA-21-00113, март 2021
НОВЫЙ СТАНДАРТ ЛЕЧЕНИЯ ТРОЙНОГО НЕГАТИВНОГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ В ПОЗДНИХ ЛИНИЯХ ТЕРАПИИ
Рецептор Trop-2 (TACSTD2), как и
рецептор EpCAM (TACSTD1), входит в семейство рецепторов TACSTD
и в норме экспрессируется на поверхности как нормальных, так и
трансформированных эпителиальных клеток и участвует в регуляции
пролиферации, клеточной адгезии и
миграции. Гиперэкспрессия рецептора Trop-2 выявляется при многих
солидных опухолях и в большинстве
случаев ассоциируется с неблагоприятным прогнозом.
Рисунок 1. Сигнальные пути рецептора Trop-2.
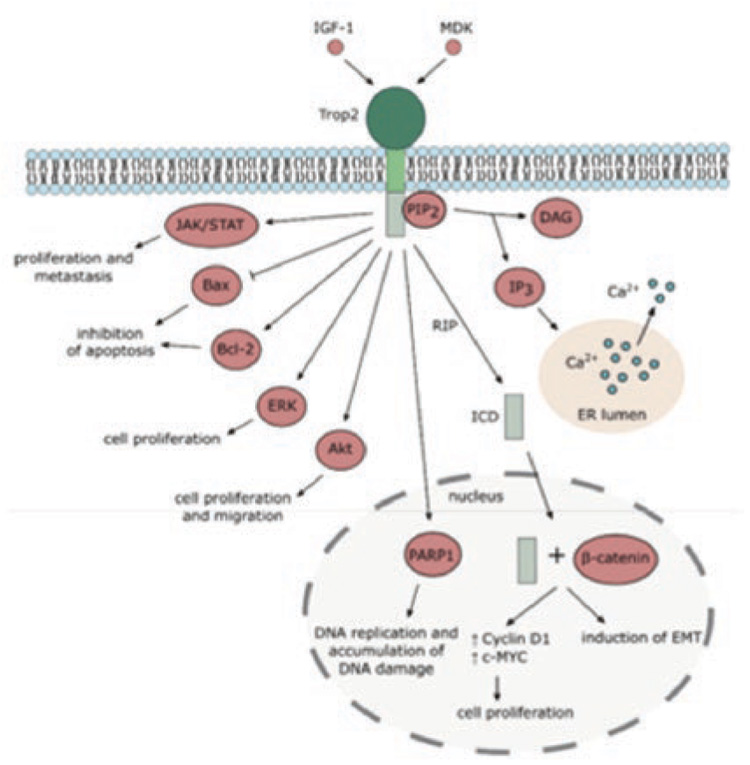
Сацитузумаб говитекан (Trodelvy,
IMMU-132, SG) представляет собой
конъюгат, состоящий из моноклонального антитела против трансмембранного рецептора Trop 2
(trophoblast cell-surface antigen 2) и
активного метаболита иринотекана,
ингибитора топоизомеразы I – говитекана (SN-38).
В апреле 2020 г. на основании результатов исследования 1/2 фазы IMMU-132-01 сацитузумаб говитекан получил ускоренное одобрение FDA для
лечения больных диссеминированным ТНРМЖ, ранее получивших не
менее 2 линий терапии по поводу метастатической болезни. В IMMU-132-
01 при медиане наблюдения в 9,7 мес.
применение SG при ТНРМЖ (n=108)
позволило достигнуть медианы выживаемости без прогрессирования
(МВБП) в 5,5 мес., медианы общей
выживаемости (МОВ) в 12,7 мес. при
частоте объективного ответа (ЧОО)
в 31%. В исследовании было показано, что уровень экспрессии Trop-2
не коррелирует с эффективностью
терапии.
7 апреля 2021 г. на основании данных,
полученных в исследовании 3 фазы
ASCENT, сацитузумаб говитекан получил постоянное одобрение FDA
для больных местнораспространенным или метастатическим ТНРМЖ,
ранее получивших две и более линиихимиотерапии, но как минимум одну
по поводу диссеминированного процесса.
Рисунок 2. Строение сацитузумаба говитекана.
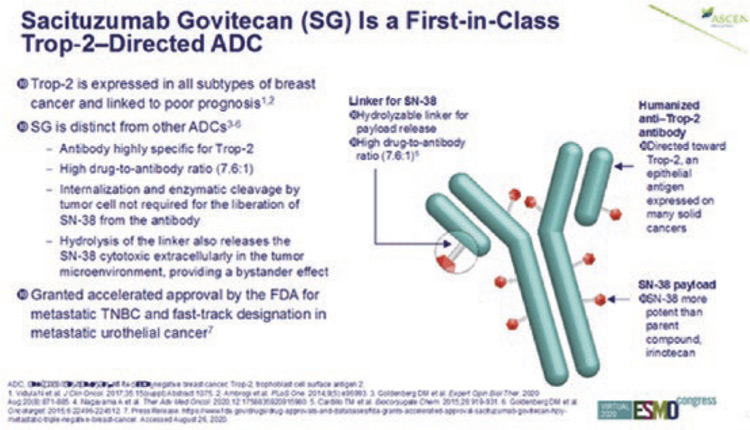
Исследование ASCENT (NCT02574455)
В исследование ASCENT было включено 489 больных ТНРМЖ, которые ранее получили как минимум две линии химиотерапии, одну из которых по поводу метастатической болезни. Пациенты были рандомизированы в две группы в соотношении 1:1: первая группа (n=267) получала сацитузумаб говитекан в одобренном ранее режиме 10 мг/кг в 1 и 8 дни каждого 21 дневного цикла, вторая (n=262) – терапию по выбору врача (ТВВ) – эрибулин, капецитабин, винорельбин или гемцитабин. Лечение проводилось до прогрессирования или непереносимой токсичности. Первичной конечной точкой исследования была выживаемость без прогрессирования болезни, оцененная независимым центральным комитетом, вторичными – общая выживаемость, частота достижения объективного ответа, контроля роста и безопасность терапии. Средний возраст пациентов в исследовании составил 53-54 года, 60% участников имели статус ECOG 1, а ТНРМЖ впервые был установлен у 70% (выявлено изменение суррогатного молекулярно-биологического подтипа опухоли после предшествующего лечения). Стратификацию проводили с учетом количества предшествующих линий химиотерапии, наличия метастазов в головном мозге и географического региона. МВБП и МОВ были достоверно выше в группе сацитузумаба говитекана в сравнении с когортой ТВВ и достигли 5,6 мес. против 1,7 мес. (p<0,001) и 12,1 мес. против 6, 7 мес. (p<0,001) соответственно, что позволило снизить риск прогрессирования болезни на 59%, а риск смерти – на 52%. Подгрупповой анализ продемонстрировал преимущество сацитузумаба говитекан во всех когортах больных. Токсичность сацитузумаба говитекана была несколько выше; так, нейтропения ≥3 в группе сацитузумаба говитекана наблюдалась у 51% больных против 33% в группе ТВВ, анемия – у 8% и 5%, диарея – у 10% и <1% и фебрильная нейтропения зарегистрирована у 6% и 2% пациентов соответственно. Частота редукции доз в группах была сопоставима и составила 22% (сацитузумаб говитекан) и 26% (ТВВ). В группе сацитузумаба говитекана смертей, связанных Рисунок 1. Сигнальные пути рецептора Trop-2. Рисунок 2. Строение сацитузумаба говитекана. Сацитузумаб говитекан (Trodelvy, IMMU-132, SG) представляет собой конъюгат, состоящий из моноклонального антитела против трансмембранного рецептора Trop 2 (trophoblast cell-surface antigen 2) и активного метаболита иринотекана, ингибитора топоизомеразы I – говитекана (SN-38). В апреле 2020 г. на основании результатов исследования 1/2 фазы IMMUПациенты были рандомизированы в две группы в соотношении 1:1: первая группа (n=267) получала сацитузумаб говитекан в одобренном ранее режиме 10 мг/кг в 1 и 8 дни каждого 21 дневного цикла, вторая (n=262) – терапию по выбору врача (ТВВ) – эрибулин, капецитабин, винорельбин или гемцитабин. Лечение проводилось до прогрессирования или непереносимой токсичности. Первичной конечной точкой исследования была выживаемость без прогрессирования болезни, оцененная независимым центральным комитетом, вторичными – общая выживаемость, частота достижения объективного ответа, контроля роста и безопасность терапии. Средний возраст пациентов в исследовании составил 53-54 года, 60% участников имели статус ECOG 1, а ТНРМЖ впервые был установлен у 70% (выявлено изменение суррогатного молекулярно-биологического подтипа опухоли после предшествующего лечения). Стратификацию проводили с учетом количества предшествующих линий химиотерапии, наличия метастазов в головном мозге и географического региона. МВБП и МОВ были достоверно выше в группе сацитузумаба говитекана в сравнении с когортой ТВВ 132-01 сацитузумаб говитекан получил ускоренное одобрение FDA для лечения больных диссеминированным ТНРМЖ, ранее получивших не менее 2 линий терапии по поводу метастатической болезни. В IMMU-132- 01 при медиане наблюдения в 9,7 мес. применение SG при ТНРМЖ (n=108) позволило достигнуть медианы выживаемости без прогрессирования (МВБП) в 5,5 мес., медианы общей выживаемости (МОВ) в 12,7 мес. при частоте объективного ответа (ЧОО) в 31%. В исследовании было показано, что уровень экспрессии Trop-2 не коррелирует с эффективностью терапии. 7 апреля 2021 г. на основании данных, полученных в исследовании 3 фазы ASCENT, сацитузумаб говитекан получил постоянное одобрение FDA для больных местнораспространенным или метастатическим ТНРМЖ, ранее получивших две и более линии с лечением, зарегистрировано не было, а в группе ТВВ один пациент погиб от сепсиса, развившегося на фоне фебрильной нейтропении. НЯ послужили причиной прекращения терапии в группе сацитузумаба говитекана в 4,7% и 5,4% случаях в группе ТВВ. Таким образом, сацитузумаб говитекан – новый стандарт терапии больных метастатическим ТНРМЖ в поздних линиях лечения.
Источники:
1. Bardia A, et al. ASCENT: A randomized phase 3 study of sacituzumab govitecan (SG) vs treatment of physician’s choice (TPC) in patients (pts) with previously treated metastatic triplenegative breast cancer (mTNBC). ESMO Virtual Congress 2020, LBA17.
2. Bardia, A, Mayer IA, Diamond JR, Moroose RL, Isakoff SJ, Starodub AN, Shah NC, O’Shaughnessy J, Kalinsky K, Guarino M, et al. Efficacy and Safety of Anti-Trop-2 Antibody Drug Conjugate Sacituzumab Govitecan (IMMU-132) in Heavily Pretreated Patients With Metastatic Triple-Negative Breast Cancer. J. Clin. Oncol. 2017, 35, 2141-214.
3. Bardia A, Mayer IA, Vahdat LT, Tolaney SM, Isakoff SJ, Diamond JR, O’Shaughnessy J, Moroose RL, Santin AD, Abramson VG, et al. Sacituzumab Govitecan-hziy in Refractory Metastatic Triple-Negative Breast Cancer. N. Engl. J. Med. 2019, 380, 741-75.
4. FDA grants regular approval to sacituzumab govitecan for triple-negative breast cancer. News release. FDA. April 7, 2021. Accessed April 7, 2021. https://bit. ly/3fOWhUD.
5. FDA approves Trodelvy, the first
treatment for metastatic triple-negative
breast cancer shown to improve
progression-free survival and overall
survival. News release. Gilead Sciences,
Inc. April 7, 2021. Accessed April 7, 2021.
https://bwnews.pr/39RHwf
KRASG12C – НОВАЯ МИШЕНЬ ПРИ НЕМЕЛКОКЛЕТОЧНОМ РАКЕ ЛЕГКОГ0
Частота встречаемости миссенс-мутации G12C (замена глицина на цистеин) в гене KRAS при НМРЛ достигает 14%. До 2020 года, несмотря на четыре десятилетия поисков, ни один анти-KRAS препарат не показал своей эффективности и не был внедрен в клиническую практику. В декабре 2020 г. Управление по контролю за качеством пищевых продуктов и лекарственных средств (FDA) США присвоило статус «прорывной терапии» препарату соторасиб для лечения больных местнораспространенным и метастатическим НМРЛ с мутацией KRASG12C на основании результатов исследования 2 фазы CodeBreaK 100 trial. В январе 2021 г. на World Conference on Lung Cancer были представлены обновленные результаты исследования 1/2 фазы CodeBreaK 100 trial (NCT03600883), в котором у 126 больных метастатическим НМРЛ с мутацией KRASG12C, ранее получавших от одной до трех линий терапии, в том числе платиносодержащие комбинации и/или иммунотерапию, оценивалась эффективность и токсичность перорального ингибитора KRASG12C соторасиба в дозе 960 мг в день. Первичной конечной точкой исследования была частота достижения объективного ответа (ОО). Более чем 80% больных, включенных в исследование, ранее получали как химио-, так и иммунотерапию. При медиане наблюдения в 12,2 мес. оценка эффекта лечения выполнена у 124 пациентов. При контроле роста опухоли в 80,6% ОО зарегистрирован у 46 больных (37,1%), в том числе у 3 пациентов – полный ответ. Медина выживаемости без прогрессирования (МВБП) достигла 6,8 мес. при медиане длительности ответа в 10 мес. Нежелательные явления наблюдались у 69,8% пациентов и привели к редукции дозы у 22,2% больных и прекращению лечения в 7,1% случаев. Нежелательные явления 3-й степени и выше зарегистрированы у 19,8% пациентов и были представлены повышением АЛТ (6,3%) и АСТ (5,6%), диареей (4,0%) и пневмонитом (0,8%). Смертей, связанных с лечением, не было. В марте 2021 г. на European Lung Cancer Virtual Congress Gregory Riely из Memorial Sloan Kettering Cancer Center и Weill Cornell из Medical College in New York представили результаты исследования KRYSTAL-1 (NCT03785249), в котором продемонстрирована эффективность еще одного высокоселективного перорального необратимого ингибитора KRASG12C адаграсиба при НМРЛ. KRYSTAL-1 (NCT03785249) – это мультикогортное исследование 1/2 фазы, в которое были включены пациенты с солидными опухолями с мутацией KRASG12C, в том числе и больные местнораспространенным и диссеминированным НМРЛ, ранее получавшие химио- и иммунотерапию. Группа НМРЛ состояла из 79 пациентов, у большинства был ECOG статус 1 (78%) и 92% больных ранее получали химио- и иммунотерапию. 95% пациентов курили и в 96% случаях опухоль была представлена аденокарциномой. Эффективность адаграсиба в дозе 600 мг 2 раза в день была оценена у 51 пациента, ОО зарегистрирован в 45% случаях (у 23 пациентов), у 26 больных на фоне терапии отмечена стабилизация болезни, таким образом, контроль роста опухоли составил 96%. Наиболее частыми нежелательными явлениями, зарегистрированными у ≥20% пациентов (n=110, в том числе у 31 больного из других когорт) были тошнота (54%), диарея (48%), рвота (34%), слабость (28%) и повышение уровня АСТ (17%) и АЛТ (20%), которые привели к прекращению лечения в 4,5% случаев. Нежелательные явления 3-й степени и выше зарегистрированы у 30% больного и были представлены астенией (6%), повышением АЛТ (5%) и АСТ (5%) и удлинением интервала QT (3%). Были зарегистрированы 2 смерти, ассоциированные с терапией, причиной послужили пневмонит и сердечная недостаточность, развившиеся во время лечения. В исследованиях CodeBreaK 100 trial (NCT03600883) и KRYSTAL-1 (NCT03785249) отдельно освещен вопрос эффективности анти-KRAS терапии у пациентов с НМРЛ сomutations STK11, ассоциированной с резистентностью к иммунотерапии, KRASG12C. В работах показано, что эффективность соторасиба и адаграсиба при наличии мутации STK11 возрастает и составляет 72% и 64% соответственно.
Источники:
1. Second drug targeting KRASG12C shows benefit in mutated non-smallcell lung cancer. News release. European Society for Medical Oncology. March 29, 2021. Accessed March 29, 2021. https:// bit.ly/3rrYKGI.
2. Riely G, Ou SI, Rybkin I, et al. KRYSTAL-1: Activity and Preliminary Pharmacodynamic (PD) Analysis of Adagrasib (MRTX849) in Patients (Pts) With Advanced Non-Small- Cell Lung Cancer (NSCLC) Harboring KRASG12C Mutation. J Thoracic Oncol. 2021; 16(suppl 4): 99O_PR. https://bit. ly/3rvczEd.
3. Li BT, Skoulidis F, Falchook G, et al. CodeBreaK 100: Registrational Phase 2 Trial of Sotorasib in KRAS p.G12C Mutated Non-small Cell Lung Cancer. Presented at: International Association for the Study of Lung Cancer 2020 World Conference on Lung Cancer; January 28- 31, 2021; virtual. Abstract PS01.07.
4. Веб-сайт FDA.
