Дорогие коллеги, дорогие друзья!
Цветочный аромат просачивается сквозь закрытые окна и проникает в ноздри, где бы мы не находились – мы в разгаре весны, цветения, надежд!.. Краски мая волнуют, пробуждают чувства, настраивают на романтический лад – или просто дают новый стимул к жизни...

Огюст Ренуар.
Сад на улице Корто на Монмартре. 1876. Холст, масло, 152×97 см. Музей искусств Карнеги, Питтсбург, США.
Владислав Ходасевич. Ищи меня. 1917 г.
Ищи меня в сквозном весеннем свете. Я весь — как взмах неощутимых крыл, Я звук, я вздох, я зайчик на паркете, Я легче зайчика: он — вот, он есть, я был. Но, вечный друг, меж нами нет разлуки! Услышь, я здесь. Касаются меня...

ПОСЛЕДНИЕ НОВОСТИ ЕЖЕГОДНОГО СЪЕЗДА АМЕРИКАНСКОГО ОБЩЕСТВА ГИНЕКОЛОГИЧЕСКОЙ ОНКОЛОГИИ (SGO) 2023 ГОДА
В течение многих лет больным раком тела матки после оперативного лечения рекомендовалась адъювантная дистанционная лучевая терапия с добавлением внутриполостной в отдельных случаях...

XXVII РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС 2023
14 - 16 НОЯБРЯ 2023 МОСКВА
ИНФИЛЬТРАЦИЯ ЛИДОКАИНОМ ОПУХОЛИ УЛУЧШАЕТ РЕЗУЛЬТАТЫ ЛЕЧЕНИЯ БОЛЬНЫХ ОПЕРАБЕЛЬНЫМ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ
Фантастически провокационная и интересная работа опубликована индийскими коллегами в Journal Clinical Oncology. Давно известно, что хирургическое удаление опухоли сопровождается увеличением числа циркулирующих в кровотоке опухолевых клеток, что может способствовать развитию прогрессирования заболевания. Многочисленные попытки оценить и уменьшить негативный эффект операционной травмы на прогноз больных раком молочной железы за счет использования предоперационной инъекции прогестерона...
АДЪЮВАНТНАЯ ХИМИОТЕРАПИЯ НЕ УЛУЧШАЕТ РЕЗУЛЬТАТЫ ХИМИОЛУЧЕВОЙ ТЕРАПИИ МЕСТНОРАСПРОСТРАНЕННОГО РАКА ШЕЙКИ МАТКИ
Химиолучевая терапия (ХЛТ) является стандартным методом лечения больных местнораспространенным раком шейки матки в нашей стране и мире. Этот метод лечения позволил увеличить 5-летнюю выживаемость в этой популяции с 60% до 66% по данным метаанализов. Показатель 5-летней безрецидивной выживаемости составляет 58%, означающий, что более 40% пациенток имеют прогрессирование болезни, которое у большинства из них приведет к летальному исходу. Это является стимулом для попыток улучшения результатов химиолучевого лечения....

ЗНАКОМЬТЕСЬ: РЕГИОНАЛЬНОЕ ОТДЕЛЕНИЕ RUSSCO НИЖЕГОРОДСКОЙ ОБЛАСТИ
Нижегородская область – субъект Российской Федерации в центре европейской части России. Входит в состав Приволжского...
АСТРАХАНСКИЕ ОНКОПАЦИЕНТЫ ПОЛУЧИЛИ «КНИГОТЕРАПИЮ» ОТ RUSSCO
День начался с посещения областной детской клинической больницы им. Н.Н. Силищевой, где в онкологическом отделении с маленькими пациентами и их родителями пообщалась известный детский писатель Анна Гончарова. Живое общение и вовлечение детей в игровой процесс позволили им отвлечься от ежедневных процедур, придали дополнительных сил для того, чтобы легче бороться с...
ЦЕДИРАНИБ В МОНОТЕРАПИИ ИЛИ В КОМБИНАЦИИ С ЛЕНАЛИДОМИДОМ ПРИ ДИФФЕРЕНЦИРОВАННОМ РАКЕ ЩИТОВИДНОЙ ЖЕЛЕЗЫ, РЕЗИСТЕНТНОМ К РАДИОЙОДТЕРАПИИ
В настоящий момент больным дифференцированным раком щитовидной железы (РЩЖ), резистентным к радиойодтерапии и без драйверных мутаций в генах NTRK, ALK, RET или BRAF, возможно назначение сорафениба, ленватиниба, вандатениба, сунитиниба или пазопаниба при ожидаемой медиане выживаемости без прогрессирования (мВБП) на фоне лечения в 11-18 мес. и частоте...

КОНФЕРЕНЦИЯ "ЛУЧШЕЕ ПО МАТЕРИАЛАМ КОНФЕРЕНЦИИ ASCO" ПЕРВЫЙ МОЛОДЕЖНЫЙ ОНКОЛОГИЧЕСКИЙ САММИТ
20 - 23 ИЮНЯ 2023

ПОМОГАЕТ ЛИ СТЕРЕОТАКСИС НА ОЛИГОПРОГРЕССИРУЮЩИЕ ОЧАГИ У ПАЦИЕНТА С МЕТАСТАТИЧЕСКИМ ПОЧЕЧНОКЛЕТОЧНЫМ РАКОМ? КАЖЕТСЯ, ДА
В клинической практике стандартный подход при прогрессировании метастатического заболевания заключается в смене линии системной терапии...

Приглашаем специалистов в области онкологии принять участие в конкурсном отборе на получение Премии им. акад. А.И. Савицкого!
Организаторы мероприятия – Российское общество клинической онкологии (RUSSCO) и Ассоциация онкологов России – отмечают, что Премия является символом глубочайшего признания и...
НОВОСТИ КРУПНЫХ ЖУРНАЛОВ/BREAKING: НОВОЕ РАНДОМИЗИРОВАННОЕ ИССЛЕДОВАНИЕ ДЕМОНСТРИРУЕТ ПРЕИМУЩЕСТВО ПРИМЕНЕНИЯ SBRT У БОЛЬНЫХ НМРЛ IV СТАДИИ С EGFR МУТАЦИЕЙ
Ингибиторы тирозинкиназы рецептора эпидермального фактора роста (EGFR-TKI) обладают значительным терапевтическим эффектом при лечении распространенного немелкоклеточного рака легкого (НМРЛ) с мутациями EGFR. Однако приобретенная резистентность значительно ограничивает выигрыш от их применения в отношении выживаемости пациентов с НМРЛ с мутацией EGFR. Меж тем стереотаксическая лучевая терапия (SBRT) как на первичную опухоль...
НОВОСТИ КРУПНЫХ ЖУРНАЛОВ/ЭФФЕКТИВНОСТЬ И БЕЗОПАСНОСТЬ ТРАБЕКТЕДИНА В КОМБИНАЦИИ С ЛУЧЕВОЙ ТЕРАПИЕЙ У ПАЦИЕНТОВ С МИКСОИДНОЙ ЛИПОСАРКОМОЙ: ДАННЫЕ НЕРАНДОМИЗИРОВАННОГО КЛИНИЧЕСКОГО ИССЛЕДОВАНИЯ 2 ФАЗЫ
Миксоидная липосаркома (МЛС) представляет собой подтип саркомы мягких тканей (МТС), который характеризуется специфическими генетическими транслокациями, продуцирующими транскрипты слияния FUS-DDIT3 или, реже, EWSR1-DDIT3. Местные рецидивы возникают в 10-20% случаев...
НОВОСТИ КРУПНЫХ ЖУРНАЛОВ/ТРАСТУЗУМАБ ДЕРУКСТЕКАН ПРИ HER2 ПОЗИТИВНОЙ КАРЦИНОСАРКОМЕ ТЕЛА МАТКИ. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ STATICE
Карциносаркома тела матки - редкое злокачественное новообразование эндометрия, в настоящий момент расценивается как аденокарцинома с метапластическим компонентом опухоли. При карциносаркоме тела матки экспрессия рецептора HER2 выявляется в 1 из 3 случаев (HER2 3+ в 5%-25%, HER2 2+ в 15%-35%, HER2 1+ в 20%-40%)...
ПОВТОРНЫЕ БИОПСИИ НОВООБРАЗОВАНИЙ ЛЕГКИХ – ПОКАЗАНИЯ, ПРОТИВОРЕЧИЯ, РЕЗУЛЬТАТЫ
Несмотря на широкий арсенал технологий, позволяющих получить ткань для морфологического исследования при периферических образованиях и очагах легких, биопсия под контролем мультиспиральной компьютерной томографии (МСКТ) наиболее распространена в силу относительной простоты воспроизведения, а также высокой чувствительности и специфичности, достигающих...
НОВАЯ КОНЦЕПЦИЯ ОБЕЗБОЛИВАНИЯ В ОНКОЛОГИИ
Проблема обезболивания в онкологии является крайне актуальной и многогранной: это обусловлено распространенностью болевого синдрома у онкологических пациентов, значимым влиянием боли на качество жизни, психический статус, приверженность лечению и прогноз, эволюционированием болевого синдрома с течением времени, спецификой принципов подбора противоболевой...
ЭТО ИНТЕРЕСНО/ЧТО НУЖНО ЗНАТЬ О ТРЕХ РАСПРОСТРАНЕННЫХ ЗАБЛУЖДЕНИЯХ О ЕДЕ И РИСКЕ РАЗВИТИЯ РАКА
Еда – это нечто глубоко личное. Наш рацион отражает нашу культурную самобытность, отдает дань уважения нашим предкам, помогает нам общаться друг с другом и служит для физического и эмоционального питания. С какой бы стороны вы ни посмотрели на это, питание является важной частью нашей жизни.
Анонс
-

20 - 23 ИЮНЯ 2023
КОНФЕРЕНЦИЯ "ЛУЧШЕЕ ПО МАТЕРИАЛАМ КОНФЕРЕНЦИИ ASCO"
ПЕРВЫЙ МОЛОДЕЖНЫЙ ОНКОЛОГИЧЕСКИЙ САММИТ
-

4 ИЮЛЯ 2023 12:30-14:30
СЕССИЯ ROSSCO. СОПРОВОДИТЕЛЬНЯ И ПОДДЕРЖИВАЮЩАЯ ТЕРАПИЯ: ЧТО СДЕЛАНО, И ЧТО ПРЕДСТОИТ СДЕЛАТЬ
В рамках IX ПЕТЕРБУРГСКОГО МЕЖДУНАРОДНОГО ОНКОЛОГИЧЕСКОГО ФОРУМА "БЕЛЫЕ НОЧИ 2023"
-

14 - 16 НОЯБРЯ 2023 МОСКВА
XXVII РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС 2023
XXVII РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС 2023
Дорогие коллеги, дорогие друзья!
Цветочный аромат просачивается сквозь закрытые окна и проникает в ноздри, где бы мы не находились – мы в разгаре весны, цветения, надежд!.. Краски мая волнуют, пробуждают чувства, настраивают на романтический лад – или просто дают новый стимул к жизни.
В нашем сообществе тоже обновление: мы избираем членов правления на последующие три года, и голосовать за них будут представители всех региональных сообществ RUSSCO в июне этого года. Этот ответственный момент совпадет с еще одним важным мероприятием: Первым молодежным онкологическим саммитом и конференцией по материалам конгресса ASCO 2023. Интенсивность нашей с вами деятельности продолжает нарастать! Действительно, событие онкологического года уже близко – ежегодный конгресс ASCO состоится уже в начале июня, мы планируем каскад кратких новостей на сайте rosoncoweb.ru, а также более подробное изложение результатов наиболее свежих исследований по различным локализациям с комментариями наших экспертов на страницах газеты и сайта в июне-июле 2023 года.
При этом не будем забывать о надвигающемся главном онкологическом событии года – XXVII Российском онкологическом конгрессе. Подготовка идет полным ходом, предложения рассматриваются оргкомитетом, мы с нетерпением ждем от вас тезисов – это не просто шанс представить свои данные в виде публикации, постера или доклада, но и возможность выиграть награду за лучший представленный материал.
А на страницах нашей газеты мы ждем вас – с интересными клиническими случаями, с размышлениями или темами для дискуссий по наиболее интересным аспектам онкологической тематики. Сайт и газета RUSSCO, а также журнал «Злокачественные опухоли» всегда открыты для вас, ваших статей и ваших предложений!
Удачного вступления в Лето, дорогие друзья!
Ваша команда RUSSCO
Огюст Ренуар.
Сад на улице Корто на Монмартре. 1876. Холст, масло, 152×97 см.
Музей искусств Карнеги, Питтсбург, США.

Владислав Ходасевич. Ищи меня. 1917 г.
***
Ищи меня в сквозном весеннем свете.
Я весь — как взмах неощутимых крыл,
Я звук, я вздох, я зайчик на паркете,
Я легче зайчика: он — вот, он есть, я был.
Но, вечный друг, меж нами нет разлуки!
Услышь, я здесь. Касаются меня
Твои живые, трепетные руки,
Простёртые в текучий пламень дня.
Помедли так. Закрой, как бы случайно,
Глаза. Ещё одно усилье для меня —
И на концах дрожащих пальцев, тайно,
Быть может, вспыхну кисточкой огня.
ПОСЛЕДНИЕ НОВОСТИ ЕЖЕГОДНОГО СЪЕЗДА АМЕРИКАНСКОГО ОБЩЕСТВА ГИНЕКОЛОГИЧЕСКОЙ ОНКОЛОГИИ (SGO) 2023 ГОДА
Автор: С.А.Тюляндин
Председатель Российского общества клинической онкологии,
профессор, доктор медицинских наук, Москва
В течение многих лет больным раком тела матки после оперативного лечения рекомендовалась адъювантная дистанционная лучевая
терапия с добавлением внутриполостной в отдельных случаях.
Проведение адъювантной лучевой
терапии существенно снизило
частоту локальных (культя влагалища, полость малого таза), но не
решило проблему развития отдаленных метастазов, которые остаются основной причиной смерти
этой группы пациентов, особенно
в случае местнораспространенного процесса. В рандомизированном исследовании GOG 122 было
показано преимущество в общей
выживаемости при проведении
химиотерапии по сравнению с
радиотерапией у больных местнораспространенным процессом,
которая и стала стандартом лечения для этой популяции пациенток. Но проведение химиотерапии
не решило проблему локальных
рецидивов, частота которых достигала 20%. Поэтому логичным
представлялось проведение исследования PORTEC-3, в котором
сравнивалась эффективность
одновременной химиолучевой терапии и лучевой терапии только
у больных с высоким риском прогрессирования, включая больных
III стадией. Проведение химиолучевой терапии снизило риск развития прогрессирования и смерти
от рака тела матки на 30% при проведении химиолучевой терапии в
сравнении с лучевой. Наибольший выигрыш от этого получили
больные III стадии. В итоге, несмотря на высокую токсичность, химиолучевая терапия становится
еще одним стандартным методом
адъювантной терапии больных III
стадией.
Поэтому с таким интересом ожидались результаты рандомизированного исследования GOG-258,
которое сравнивало два стандартных подхода у больных III стадией: химиотерапию и одновременную химиолучевую терапию. В
исследование было включено 813
больных III стадией (IIIC1 и IIIC2
составляли 75% от всех включенных). Химиолучевая терапия
включала введения цисплатина 50
мг/м2 в 1 и 29 дни и дистанционную лучевую терапию на полость
таза и параортальные лимфоузлы
до СОД 45 Гр с последующими 4
курсами химиотерапии карбоплатином AUC×5 и паклитакселом 175
мг/м2 каждые 3 недели. В группе
химиотерапии больные получали
6 курсов химиотерапии карбоплатином и паклитакселом в тех же
дозах. При медиане наблюдения 4
года 5-летняя безрецидивная выживаемость составила 59% и 58%
в группе химиолучевой и химиотерапии соответственно [1]. Проведение химиолучевой терапии
уменьшило частоту локальных
рецидивов в 2 раза (во влагалище
– 2% и 7%, в региональных лимфоузлах – 11% и 20%), но сочеталось
с большой частотой отдаленных
метастазов (27% и 21%). Частота
осложнений 3-5 степени составила
58% в группе химиолучевой терапии и 63% в группе химиотерапии.
На съезде SGO были озвучены
результаты 10-летней общей выживаемости в двух группах [2].
За время наблюдения умерло 134
больных в группе химиолучевой
терапии и 125 больных в группе
химиотерапии (HR=1,05). Химиолучевая терапия не улучшила общую выживаемость ни в одной из
анализированных подгрупп: возраст, стадия заболевания, гистология, индекс массы тела, наличие
резидуальной болезни после выполнения операции. Авторы делают вывод, что у больных III стадией достаточно проведения одной
химиотерапии и дополнение ее
лучевой терапией не дает никаких
преимуществ.
Без сомнения, результаты этого
исследования стимулируют активную дискуссию о роли лучевой
терапии у больных местнораспространенным процессом. Нельзя не
видеть, что одним из возможных и
потенциально достижимых путей
улучшения безрецидивной выживаемости является снижение
локальных рецидивов, частота
которых в исследовании GOG-258
оставила 27%. В комментариях к
этому исследованию мнения специалистов разделились. Специалисты лекарственного лечения
считают, что для больных раком
эндометрия с низким риском прогрессирования (I-II стадия) достаточно проведения только лучевой
терапии, а для III стадии только
химиотерапии. Радиотерапевты
склонны сохранить лучевую терапию для больных III стадии в
виде одновременной химиолучевой терапии или отдельно в виде
сэндвича (после 3 курсов химиотерапии с последующим продолжением адъювантной химиотерапии
до 6 курсов) или последовательно
(сначала 6 курсов химиотерапии,
а затем лучевая терапия). В сегодняшних рекомендациях АОР рекомендован сэндвич для больных
III стадии. В практических рекомендациях RUSSCO записано, что
у больных раком тела матки III-IV
стадий после циторедуктивных
операций целесообразно проведение ХТ. Будет интересно узнать
мнение российских специалистов
о результатах исследования GOG
258 и необходимости изменений в
отечественных клинических рекомендациях.
Интригующим представляется
пилотное исследование предоперационного назначения 2 курсов
(56 дней) олапариба у больных распространенным серозным раком
яичников с наличием мутации в
генах BRCA1/2, RAD51C/D и PALB2.
Это исследование ставило целью
изучение возможности проведения такого лечения; было включено всего 15 больных III-IV стадией, из которых 11 имели мутацию
BRCA1 и 6 – IV стадию. Авторы зарегистрировали частичный ответ
у 54% больных, снижение CA-125
на 75% и более – у 75% больных. На
фоне лечения было зарегистрировано только одно нежелательное
явление 3 стадии (анемия), остальные побочные эффекты были слабо
выражены. По окончанию приема
олапариба операция была выполнена у 13 больных, еще одна пациентка была прооперирована после
проведения ей химиотерапии и у
одной операция не была возможна
вследствие прогрессии заболевания. У всех 13 прооперированных
больных удалось выполнить оптимальную циторедукцию (размеры
остаточной опухоли менее 1 см),
при этом у одной больной отмечен
полный лечебный патоморфоз. Затем 10 больных получили 6 курсов
химиотерапии карбоплатином и
паклитакселом, а 3 пациентки отказались от химиотерапии и сразу
перешли на поддержку олапарибом. При медиане наблюдения 12
мес. прогрессия отмечена у 3 из 15
больных.
Данное исследование – первый
опыт использования на предоперационном этапе таргетной терапии у больных раком яичников с
целью оценки возможности такого
подхода. Но одновременно это и
демонстрация потенциала олапариба у больных, ранее не подвергавшихся лекарственной терапии,
без признаков лекарственной резистентности. Известно, что наибольшую противоопухолевую
активность от применения олапариба мы ожидаем у больных с
платиночувствительными опухолями. Показано, что у части больных с платиночувствительными
опухолями мы можем получить
полный лечебный патоморфоз,
возможно, при более длительном
приеме олапариба, что позволит
избежать им назначения химиотерапии. Но в этом случае важно уже
на раннем этапе применения препарата (возможно, как раз после 2
курсов) провести оценку и определить больных с субоптимальным
ответом, которым показано немедленное выполнение циторедукции
или назначение платиносодержащей химиотерапии в случае невозможности ее выполнения. Назначение олапариба на первом этапе
может быть использовано при общем плохом состоянии больной с
наличием герминальной мутации
BRCA1/2 вследствие распространенности опухолевого процесса,
когда мы не решаемся на проведение платиносодержащей химиотерапии.
Источник:
1. Matei DE, Enserro D, Kudrimoti M, et al. Overall survival in NRG258, a randomized phase III trial of chemoradiation vs. chemotherapy alone for locally advanced endometrial carcinoma. 2023 SGO Annual Meeting on Women’s Cancer. Presented: March 25, 2023.
2. Matei D, Filiaci V, Randall ME, et al. Adjuvant chemotherapy plus radiation for locally advanced endometrial cancer. N Engl J Med. 2019; 380: 2317- 2326.
3. Westin SN, Michael V, Fellman BM,
et al. Neoadjuvant window trial in
newly diagnosed BRCA mutant ovarian
cancer. Society of Gynecologic Oncology
2023 Annual Meeting on Women’s
Cancer. Presented: March 26, 2023.
XXVII РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС 2023
14 - 16 НОЯБРЯ 2023 МОСКВА

ИНФИЛЬТРАЦИЯ ЛИДОКАИНОМ ОПУХОЛИ УЛУЧШАЕТ РЕЗУЛЬТАТЫ ЛЕЧЕНИЯ БОЛЬНЫХ ОПЕРАБЕЛЬНЫМ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ
Фантастически провокационная
и интересная работа опубликована индийскими коллегами в
Journal Clinical Oncology. Давно
известно, что хирургическое удаление опухоли сопровождается
увеличением числа циркулирующих в кровотоке опухолевых клеток, что может способствовать
развитию прогрессирования заболевания. Многочисленные попытки оценить и уменьшить негативный эффект операционной
травмы на прогноз больных раком молочной железы за счет использования предоперационной
инъекции прогестерона, интраоперационной инъекции циклофосфана, выполнения операции
в различные периоды менструального цикла не имели успеха.
С этой целью индийские коллеги
предложили использовать локальную анестезию лидокаином,
инфильтрируя анестетиком ткань
молочной железы по периферии
опухоли. Известно, что лидокаин подавляет функцию мембранных кальциевых канальцев
и активность внутриклеточной
Src-киназы. Потенциально это
должно снизить пролиферативную активность опухолевых клеток, их способность к инвазии и
метастазированию.
Для доказательства этой гипотезы было проведено рандомизированное исследование в 11 госпиталях Индии, где больных раком
молочной железы T1-2N0-1, которым планировалось выполнение
органосохраняющей операции
или мастэктомии, рандомизировали в группу предоперационной локальной анестезии или без
нее. Факторами стратификации
были размер первичной опухоли
и менопаузальный статус. Критериями исключения были выполненная для постановки диагноза
эксцизионная биопсия и любая
предоперационная системная
терапия. После начала общего
наркоза (пропофол) проводили
локальную анестезию 0,5% лидокаином (в дозе не более 4,5 мг/
кг), вводя препарат в ткань по
периферии первичной опухоли
в 6 направлениях (сверху, снизу,
спереди, сзади, медиально и латерально). Операция начиналась
после 5-7 минут от завершения
локальной анестезии. В контрольной группе больные получали
такое же анестезиологическое пособие без выполнения локальной
анестезии. Послеоперационно
больные получали адъювантную химиотерапию (при N0 – 4
курса антрациклин-содержащей
комбинацией, при N1 к антрациклин-содержащей комбинации
добавляли 12 недель таксанов).
Адъювантная лучевая терапия
проводилась всем больным с органосохраняющей операцией и
N1. Всем больным с наличием рецепторов стероидных гормонов
назначали гормональную терапию: тамоксифен в случае пременопаузы, ингибиторы ароматазы
для постменопаузы. Мониторинг
за больными проводили каждые 6
месяцев. Основными критериями
эффективности были инвазивная
безрецидивная выживаемость и
общая выживаемость.
В исследование было включено
1583 больных с медианой возраста 51 год, опухоль Т2 диагностирована у 75% больных, N1 – у
45%, grade 3 – у 74%, рецептор-позитивная опухоль – у 67%, HER2-
позитивная и тройная негативная – у 20% и 24% соответственно.
Органосохраняющая операция
была выполнена у 62% пациенток,
75% получили лучевую терапию,
среди HER2-позитивных больных лишь 35% получили трастузумаб в адъюванте. При медиане наблюдения 69 месяцев 5-летняя
безрецидивная инвазивная выживаемость составила 86,6% в
группе локальной анестезии и
82,6% в группе контроля, что соответствует достоверному снижению относительного риска прогрессирования на 26% (HR=0,74;
p=0,017). При подгрупповом анализе снижение риска прогрессирования наблюдалось во всех изученных подгруппах независимо
от возраста, менструального и
рецепторного статуса, степени
дифференцировки, фенотипа,
объема оперативного вмешательства. Лишь одна треть больных
HER2-позитивным раком молочной железы получала трастузумаб, но выигрыш от проведения
локальной анестезии наблюдался
независимо от его получения.
Проведение локальной анестезии уменьшило риск локального
инвазивного рецидива в течение
5 лет с 4,1% до 3,2%, риск отдаленных метастазов – с 10,9% до
8,1%. Показатель 5-летней общей
выживаемости составил 90,1 % и
86,4% соответственно с достоверным снижением относительного
риска смерти на 29% (HR=0,71;
p=0,019). При многофакторном
анализе выполнение локальной
анестезии сохранило свое достоверное влияние на снижение риска как рецидива, так и смерти.
Не отмечено нежелательных побочных эффектов от проведения
локальной анестезии.
Авторы указывают на простоту и
доступность выполнения локальной анестезии лидокаином, которая по данным проведенного рандомизированного исследования
достоверно улучшает прогноз
больных операбельным раком
молочной железы, снижая риск
прогрессирования на 26% и риск
смерти на 29%. Подчеркивается,
что эта методика уместна только для тех больных, у которых
на предоперационном этапе не
проводилась системная терапия
(химиотерапия, анти-HER2 терапия, гормонотерапия). В качестве
сравнения достигнутых в этом
исследовании результатов адъювантное назначение дорогостоящих абемациклиба или олапариба снижает риск инвазивного
прогрессирования на 34% и 37%
соответственно, а риск смерти от
назначения олапариба – на 32%. В
мире ежегодно заболевают раком
молочной железы 2,3 млн. женщин, из них у 40-50% имеется операбельная стадия заболевания.
Выполнение локальной анестезии
при оперативном вмешательстве
могло бы сохранить 100 000 дополнительных жизней ежегодно.
Было бы желательно подтвердить
индийский опыт своим собственным исследованием с последующим внесением в клинические
рекомендации в случае получения позитивных результатов.
Источник:
Badwe RA, Parmar V, Nair N, et al.
Effect of peritumoral infiltration of local
anesthetic before surgery on survival in
early breast cancer. J.Clin. Oncol. 2023.
Published online: April 6, 2023.
АДЪЮВАНТНАЯ ХИМИОТЕРАПИЯ НЕ УЛУЧШАЕТ РЕЗУЛЬТАТЫ ХИМИОЛУЧЕВОЙ ТЕРАПИИ МЕСТНОРАСПРОСТРАНЕННОГО РАКА ШЕЙКИ МАТКИ
Химиолучевая терапия (ХЛТ)
является стандартным методом лечения больных местнораспространенным раком шейки
матки в нашей стране и мире.
Этот метод лечения позволил
увеличить 5-летнюю выживаемость в этой популяции с 60%
до 66% по данным метаанализов. Показатель 5-летней безрецидивной выживаемости
составляет 58%, означающий,
что более 40% пациенток имеют прогрессирование болезни,
которое у большинства из них
приведет к летальному исходу.
Это является стимулом для попыток улучшения результатов
химиолучевого лечения. Одним
из таких возможных путей является добавление адъювантной
химиотерапии после окончания
ХЛТ, целесообразность которого
изучалась в ходе исследования
OUTBACK.
В это рандомизированное исследование, проводимое в США,
Австралии, Новой Зеландии,
Китае, Канаде, включались больные старше 18 лет с диагнозом
рак шейки матки (плоскоклеточный и аденосквамозный рак,
аденокарцинома) в стадии IB1
c метастазами в региональные
лимфоузлы, IB2, II, IIIB или IVA.
Участники рандомизировались
в группу стандартной ХЛТ (40
мг/м2 цисплатина еженедельно
5 недель на фоне дистанционной
терапии на полость малого таза
РОД 1,8 Гр и СОД 45-50,4 Гр и
брахитерапии) и группу ХЛТ с
добавлением через 4 недели после ее окончания 4 курсов адъювантной химиотерапии(АХТ)
карбоплатином AUC×5 и паклитакселом 155 мг/м2 каждые
3 недели. Основным критерием
эффективности была 5-летняя
общая выживаемость.
В период 2011-2017 гг. в исследование было включено 926 больных с медианой возраста 46 лет,
с наличием плоскоклеточного
рака у 81%, медианой максимального диаметра первичной опухоли 5 см, с наличием метастазов в
региональных лимфоузлах у 50%
пациенток. По стадиям болезни
больные распределились следующим образом: IB1-2/IIA – 33%,
IIB – 43%, IIIB-IVA – 24%. ХЛТ в
полном объеме (не менее СОД 45
Гр дистанционной терапии и запланированный объем брахитерапии, все 5 введений цисплатина) завершили по 77% больных в
обеих группах. Из 465 больных
в группе АХТ 102 (22%) отказались от ее проведения, 200 (43%)
больных закончили запланированные 4 курса без редукции
доз и увеличения интервалов.
При медиане наблюдения 60 мес.
5-летняя общая выживаемость
составила 72% в группе АХТ и
71% в группе ХЛТ только, разница статистически недостоверна
(HR=0,90; p=0,81). Кумулятивная
смертность от рака шейки матки
составила 21% и 24% (р=0,21). Показатель 5-летней безрецидивной выживаемости составил 63%
и 62% соответственно (HR=0,86;
p=0,58). Следует отметить, что
на отсечке 3 года разница в безрецидивной выживаемости составила 4% в пользу АХТ (70% и
66%). Среди больных, кто закончил полный объем ХЛТ, 5-летняя общая выживаемость составила 74% в группе АХТ и 71%
в группе ХЛТ только (HR=0,81;
p=0,15). При подгрупповом анализе ни в одной из анализируемых подгрупп не было получено
достоверного улучшения общей
или безрецидивной выживаемости от добавления АХТ, но она
достоверно ухудшала отдаленные результаты лечения в группе
больных старше 60 лет.
Характер и частота прогрессирования были одинаковыми в обеих группах: изолированное локорегиональное прогрессирование
зарегистрировано у 12% больных
в группе АХТ и у 11% в группе
ХЛТ, отдаленные метастазы – у
13% и 15% соответственно. При
возникновении прогрессирования подавляющее большинство
больных получали химиотерапию. Частота побочных эффектов 3-4 степени составила 81% в
группе АХТ и 62% в группе ХЛТ
только. Наиболее часто наблюдали выраженную гематологическую токсичность и слабость. В
группе АХТ 24% пациенток демонстрировали длительную периферическую нейропатию.
Авторы исследования OUTBACK
делают вывод, что добавление
адъювантной химиотерапии
после окончания запланированной ХЛТ не улучшает отдаленные результаты лечения больных местнораспространенным
раком шейки матки. Таким
образом, стандартным методом лечения больных местнораспространенным ракой шейки
матки остается ХЛТ, как это и написано в клинических рекомендациях RUSSCO.
Источник:
Mileshkin LR, Moore KN, Barnes EH,
et al. Adjuvant chemotherapy following
chemoradiotherapy as primary
treatment for locally advanced cervical
cancer versus chemoradiotherapy alone
(OUTBACK): an international, openlabel, randomised, phase 3 trial. Lancet
Oncol. 2023. Published online: April 17
ЗНАКОМЬТЕСЬ: РЕГИОНАЛЬНОЕ ОТДЕЛЕНИЕ RUSSCO НИЖЕГОРОДСКОЙ ОБЛАСТИ
Нижегородская область – субъект
Российской Федерации в центре
европейской части России. Входит в состав Приволжского федерального округа. Административный центр – Нижний Новгород.
Один из крупнейших регионов
Центральной России. Население –
3 081 002 чел. (2023).
Региональное отделение RUSSCO Нижегородской области было организовано в 2012 году. В настоящее время оно насчитывает более 100 членов в своем составе, из них радиотерапевтов – 15, химиотерапевтов – 30, хирургов – 40, морфологов – 25, лучевых диагностов – 5; в сообществе состоит 7 докторов медицинских наук, 5 профессоров, 10 кандидатов медицинских наук. Председателем регионального отделения в настоящее время является Канищева Надежда Викторовна, заведующая радиологическим отделением ГБУЗ НО «Нижегородский областной клинический онкологический диспансер», кандидат медицинских наук. Ежегодно совместно с RUSSCO проводятся круглые столы по актуальным вопросам лечения ЗНО, на которых выступают спикеры из нашего региона и других учреждений страны. Только в 2022 году состоялось 3 вебинара RUSSCO с участием специалистов НОКОД: по поддерживающей терапии в онкологии, по иммунотерапии уротелиального рака и по меланоме.
Нижегородский областной клинический онкологический диспансер является уникальным медицинским учреждением, оказывающим специализированную и высокотехнологичную медицинскую помощь населению по профилю «Онкология». С 2020 года его возглавляет Сергей Викторович Гамаюнов, кандидат медицинских наук.

Начало развития онкологической службы в Нижегородской области датируется 1933 годом, когда онкологическому отделению областной больницы присвоили функции краевого онкологического диспансера. В 1951 году была проведена реорганизация областного онкологического диспансера, он выделен в самостоятельное областное учреждение. Городской онкологический диспансер в Горьком был организован в 1945 году, онкологический диспансер в Дзержинске – в 1959 году. 15 января 2010 г. произошла реорганизация онкологического диспансера путем слияния трех учреждений в единое юридическое лицо – ГБУЗ НО «Нижегородский областной клинический онкологический диспансер».

ГБУЗ НО «НОКОД» имеет в своем составе 4 подразделения:
• Стационар № 1 находится по адресу: г. Нижний Новгород, ул. Родионова, д.190;
• Стационар № 2 – г. Нижний Новгород, Анкудиновское шоссе, д.1;
• Стационар № 3 – г. Дзержинск, ул. Ватутина, д.39, ул. Маяковского, д.28, пер. Западный, д.1;
• Консультативная поликлиника – г. Нижний Новгород, ул. Деловая, д.11/1.
• Коечный фонд Нижегородского
онкодиспансера составляет 730
коек, в том числе 553 круглосуточные койки, 18 коек отделения
анестезиологии и реанимации, 159
коек дневного пребывания.
В диспансере развернута работа
узкопрофильных отделений: лучевой терапии, полихимиотерапии,
эндоскопических методов лечения,
торакальной онкологии, маммологии, онкогинекологии, онкопроктологии, опухолей головы и шеи,
абдоминальной онкологии, онкоурологии. В стационарах диспансера
за год получают лечение свыше 25
тысяч человек, выполняется свыше
9 тысяч операций. Организована
работа отделения реабилитации,
диагностических отделений, централизованных цитологических
лабораторий. На базе организационно-методического отдела функционирует популяционный раковый регистр. В консультативной
поликлинике ежегодно выполняется более 100 тыс. посещений (500
посещений в день, 250 посещений
в смену). На базе консультативной
поликлиники организована служба
психологической помощи для пациентов с онкологическими заболеваниями и их родственников.
На сегодняшний день в диспансере трудится 1004 человека, из них
186 врачей, среди которых 4 профессора, 5 докторов медицинских
наук, 25 кандидатов медицинских
наук, растет количество соискателей ученых степеней. Есть патенты Российской Федерации на
изобретения, много публикаций
как в отечественных, так и в зарубежных медицинских изданиях,
диспансер является клинической
базой кафедры онкологии Нижегородской медицинской академии.
В 2018 году онкологической службе Нижегородской области исполнилось 85 лет. Все эти годы служба
аккумулирует силы, знания и опыт
для борьбы со злокачественными
новообразованиями. На 2019-2024
гг. запланирована реализация федерального проекта «Борьба с онкологическими заболеваниями».
Это один из основных проектов
глобального национального проекта «Здравоохранение». Поставлены
серьезные и масштабные задачи:
снижение к 2024 году смертности от
злокачественных новообразований
до 186,2 случая на 100 тыс. человек,
увеличение до 63% доли злокачественных новообразований, выявленных на ранних стадиях, а также
уменьшение одногодичной летальности до 17,3%. Основные направления – оснащение клинической базы
современным оборудованием, создание сети центров амбулаторной
онкологической помощи (ЦАОП),
а также повышение квалификации
работников на местах.
В отделении опухолей молочной
железы НОКОД осуществляются
органосохраняющие операции на
молочной железе при РМЖ начальных стадий, проводятся онкопластические операции с применением
современной хирургической техники, осуществляются реконструктивно-пластические операции по
восстановлению молочной железы
как собственными тканями, так и
различными алломатериалами (искусственными изделиями), а также
осуществляется и выполнение симметризирующих операций. Используются все варианты реконструкции
молочной железы, кроме микрохирургических.
3-е онкологическое отделение
противоопухолевой лекарственной
терапии проводит лекарственное
(химиотерапия, эндокринная терапия, иммунотерапия, таргетная
терапия) лечение пациентов с различными солидными опухолями.
Лечение проводится с использованием современных препаратов.
Круглосуточный стационар рассчитан на 45 коек, дневной стационар – на 29 коек. Профильными
направлениями в деятельности являются: маммология, гинекология,
опухоли головы и шеи. В отделении
есть необходимая материально-техническая база для проведения современной лекарственной терапии
злокачественных новообразований
и защиты персонала от вредных воздействий химиопрепаратов.
Особые методы проведения химиотерапии, проводимые в отделении:
многосуточные непрерывные инфузии химиопрепаратов при помощи
помп; введение химиопрепаратов
с использованием систем длительного венозного доступа (портов);
внутриполостное введение химиопрепаратов (внутриплевральное,
внутрибрюшинное). Для лечения
пациентов используются современные химиопрепараты как импортного, так и отечественного производства. Врачи отделения участвуют
в отечественных и международных
онкологических конгрессах, семинарах, повышая теоретические знания.
Лабораторная служба ГБУЗ НО
«НОКОД» отвечает всем современным требованиям диагностики, позволяющим проводить быстрое и эффективное комплексное
обследование пациента, благодаря
постоянной модернизации лабораторного оснащения, внедрению
наиболее информативных методов исследования, оснащению
КДЛ автоматическими системами
и компьютерами, быстро анализирующими полученные результаты:
это автоматические/полуавтоматические анализаторы ведущих
фирм-производителей США, Японии, стран Европы, Китая (Roche,
Abbott, Instrumentation laboratory,
Carl Zeiss, Leica, Mindray). В КДЛ
выполняется весь необходимый
перечень исследований для пациентов, поступивших на химиотерапевтическое, лучевое и
плановое оперативное лечение:
общеклинические, гематологические, биохимические, иммуногематологические, коагулологические,
иммунологические (определение
гормонов и онкомаркеров). В
КДЛ регулярно осуществляется
многоуровневый контроль качества лабораторных исследований
в соответствии с установленными
требованиями, что гарантирует
высокую точность диагностических исследований.

Отделение фотодинамической
терапии и флюоресцентной диагностики начало работать в ГБУЗ
«НОКОД» с 1 мая 2011 года. Это
относительно новый метод лечения злокачественных опухолей,
который может применяться как
самостоятельно, так и в дополнение к стандартным методам лечения: хирургии, лучевой терапии и
химиотерапии.
Основными показаниями к фотодинамической терапии являются
опухоли наружных локализаций
(опухоли кожи, слизистой полости
рта, языка, вульвы, шейки матки)
и локализации, доступные для осмотра с помощью эндоскопической
техники (пищевод, желудок, трахея, крупные бронхи, мочевой пузырь).
Отделение оснащено современным
диагностическим и лечебным оборудованием. Для комфортного и
безопасного нахождения пациентов
организована специальная палата с
возможностью соблюдения светового режима.
В стационаре №1 ежегодно проводится более 4000 операций. Из
них более 3000 оперативных вмешательств сопровождаются тем
или иным видом анестезиологического пособия. В стационаре №1
функционируют 6 операционных,
оснащенных современным оборудованием. В отделении имеются 5
наркозных станций Примус-Драггер, позволяющих проводить все
виды анестезий, в том числе ингаляционными анестетиками (севоран) в сочетании с регионарной
(эпидуральной, спиномозговой)
анестезией. Благодаря этому происходит раннее пробуждение и
активизация больных после тяжелых, длительных операций.
В состав отделения анестезиологии
и реанимации ГБУЗ НО НОКОД
входят 12 реанимационных коек. В
стационарах диспансера развернуты палаты реанимации: в стационаре №1 – на 3 койки, в стационаре
№2 – на 9 коек. В палатах реанимации осуществляется интенсивное
наблюдение, уход, интенсивная
терапия и, если требуется, временное замещение жизненно важных
функций органов и систем организма пациентов. В отделении
широко применяются такие современные методы, как мультимодальное обезболивание на основе
эпидуральной аналгезии и современное лечебное питание (энтеральное и парентеральное). Палаты реанимации оборудованы всем
необходимым оборудованием. В
отделении внедрена методика имплантации венозных портов для
проведения длительной инфузионной и химиотерапии у онкологических больных.
5-е онкологическое отделение радиотерапии
В настоящее время, отделение располагает стационаром на 109 коек,
семью каньонами, в которых размещены современные аппараты
для проведения лучевой терапии,
операционной, хранилищем радиоактивных источников, рентгентерапевтическими кабинетами.
С 2010 года Нижегородская область участвовала в приоритетном
национальном проекте «Здоровье»,
в том числе по онкологии. В ходе
проекта и по программе модернизации обновлен весь парк лучевых
аппаратов. Были закуплены самые
современные аппараты для проведения лучевой терапии: линейные ускорители электронов Novalis
TX (Varian, США), Clinac 600C
(Varian, США), оба ускорителя оснащены навигационной системой
BrainLab (Германия), аппараты для
брахитерапевтического лечения
MultiSource. Также в отделении
успешно проводится лечение опухолей кожи на рентгенотерапевтических аппаратах Рентген-ТА и
внутритканевая гамма-терапия.
Для планирования программы
лучевой терапии, используется
16-срезовый компьютерный томограф фирмы General Electric. В 2021
году в рамках регионального проекта «Борьба с онкологическими
заболеваниями» приобретен линейный ускоритель TrueBeam STx
(Varian). В 2022 году приобретены
два линейных ускорителя Halcyon
с комплектами современного дозиметрического оборудования и
фиксирующих устройств.
На линейных ускорителях проводится лечение по самым современным методикам: IMRT, RapidArc,
Arc, SRS, SRT, SBRT опухолей различных локализаций. В отделении
проводится облучение и детей
со злокачественными новообразованиями из онкологического,
гематологического, нейрохирургического отделений областной
детской больницы. Лечение проводится при консультативной
поддержке НМИЦ ДГОИ им. Дмитрия Рогачева.

Линейный ускоритель NOVALIS
TX – один из самых современных
аппаратов в мире. На нем можно
применять любые методы из арсенала современной радиологии,
в том числе радиохирургический
метод лечения, позволяющий лечить доброкачественные и злокачественные опухоли головного
мозга – менингиомы, невриномы,
первичные злокачественные опухоли и метастазы в головном мозге.
В операционной радиологического отделения проводятся «малые»
хирургические вмешательства,
внедрена новая методика рентгенхирургического лечения – хемоэмболизация у онкологических
больных, производится установка
внутритканевых радиоактивных
источников, функционируют 2 медицинских хирургических лазера
ИК-диапазона («Рябина», «Креолка») для проведения различных
хирургических вмешательств по
поводу опухолей наружных локализаций (кожа, слизистые).
В 2019 году в рамках реализации Государственной программы
РФ «Развитие здравоохранения»
приобретены новый брахитерапевтический аппарат Saginova,
рентгентерапевтический аппарат
Рентген-ТА, комплекс для лечения
опухолей предстательной железы
микроисточниками I-131.
С 2021 года активно применяется
HDR брахитерапия предстательной железы.
Штат радиологического отделения
включает 20 врачей, 11 медицинских физиков, обслуживающих
радиотерапевтические аппараты, и
36 медицинских сестер. Три врача
отделения имеют ученую степень
кандидата медицинских наук, четверо – высшую квалификационную категорию по специальности
«Радиотерапия».
Отделение участвует в исследовательских протоколах и различных
аудитах. Ведутся исследовательские работы совместно с ННГУ им.
Лобачевского и ПИМУ по влиянию
различных режимов облучения на
биологические свойства опухолевых клеток и диагностике лучевых
повреждений при ОКТ. За три года
пролечено более 10000 пациентов.
Из них с применением стереотаксических методик более 450.

6-е онкологическое отделение абдоминальной онкологии
Основными направлениями работы отделения онкоколопроктологии являются лечение злокачественных новообразований
ободочной и прямой кишки, а
также доброкачественных и злокачественных заболеваний органов брюшной полости и малого
таза. Оперативные вмешательства
выполняются преимущественно
лапароскопическим доступом с
использованием современных технологий. При местнораспространенных опухолях с вовлечением в
опухолевый процесс соседних органов и крупных сосудов выполняются расширенные радикальные
операции с реконструктивно-пластическим этапом. При заболеваниях прямой кишки использую
современную аппаратуру позволяет выполнять сфинктеросохраняющие операции без постоянной
колостомы.
Активно внедряются технологии
трансанальной хирургии с использованием аппаратуры премиум-класса компании RICHARD
WOLF GmbH по удалению больших ворсинчатых опухолей и ранних раков прямой кишки без единого разреза на животе.
Одним из приоритетных направлений является сохранение хорошего
качества жизни больных после
операций, пациенты готовятся к
хирургическому лечению по технологии fast track хирургии. Минимальная подготовка до операции с
ранней активацией пациента после хирургического вмешательства, раннее питание позволяют
пациенту быстро адаптироваться
и вернутся к привычной жизни.
Подбор методов анестезии, минимально инвазивных способов оперативного лечения, оптимального
контроля боли и активного послеоперационного восстановления (в
том числе ранние пероральное питание и мобилизация) уменьшает
стрессовые реакции и дисфункцию
органов, значительно сокращая
время, необходимое для полного
восстановления. Работая в тесной
взаимосвязи с нашей эндоскопической службой, на базе отделения
осуществляются эндоскопические
внутриполостные резекции доброкачественных и злокачественных
образований кишечника.
В отделении организована квалифицированная помощь пациентам
с коло- и илеостомами, разрабатываются индивидуальные программы реабилитации, позволяющие
больным в короткие сроки вернуться к привычной деятельности.
7-е онкологическое отделение онкогинекологии
На базе отделения проводится лечение больных с опухолевыми и предопухолевыми заболеваниями женских
половых органов различной локализации. Освоены и применяются новые методы диагностики и лечения
опухолей женской половой сферы.
Ежегодно выполняется 850 оперативных вмешательств. Отделение
рассчитано на 30 коек.
Хирургическое лечение злокачественных новообразований
женской репродуктивной сферы
является приоритетным направлением, с акцентом на лапароскопические вмешательства и органосохраняющие операции.
8-е онкологическое отделение торакальной онкологии
В отделении развернуто 40 коек,
здесь осуществляется лечение онкологических больных с заболеваниями легких, средостения,
щитовидной и молочной желез,
производятся операции на коже и
мягких тканях. В практической деятельности широко используются
малоинвазивные методы оперирования с использованием высокотехнологического оборудования.
Торакоскопия в настоящее время является основным методом в диагностике заболеваний легких и плевры.
Более 50% операций, выполняемых в
отделении, – видеоассистированные,
что улучшает результаты лечения и
уменьшает период реабилитации пациентов. Для диагностики патологии
средостения широко используется
медиастиноскопия.
Врачи отделения неоднократно обучались в ведущих учреждениях России, Австрии, Израиля. При необходимости осуществляется заочная
консультация пациентов специалистами из Москвы, Казани, Австрии,
Израиля.
В ряде случаев проводится химиотерапия. Врачами осуществляется консультативная помощь больным в диспансерном отделении нашей клиники и других клиниках города.
9-е онкологическое отделение опухолей головы и шеи
В отделении проводится лечение:
опухолей кожи, опухолей мягких
тканей. Выполняются лимфаденэктомии, биопсии лимфатических узлов. Выполняются операции при
опухолях щитовидной железы,
слюнных желез, гортани, глотки, полости рта, языка, нижней и
верхней челюсти. Выполняются
операции пластики глотки, реконструкции нижней челюсти, пластические операции при дефектах
тканей лица и шеи.
Онкологическое отделение радионуклидной диагностики
В стенах учреждения ГБУЗ НО
«Нижегородский областной клинический онкологический диспансер» радиоизотопная лаборатория была открыта в 70-х годах
прошлого столетия под руководством выдающего ученого, профессора Николая Евгеньевича
Яхонтова. В настоящее время
радиоизотопная лаборатория оснащена современным оборудованием и является единственным
отделением в регионе. В год в лаборатории проводится свыше 2,5
тыс. исследований с использованием препаратов, меченных радиоактивным изотопом «Технеций – 99mTc». В настоящее время в радиоизотопной лаборатории ГБУЗ
НО «НОКОД» проводятся такие
востребованные радиоизотопные
исследования, как остеосцинтиграфия, сцинтиграфия щитовидной железы, сцинтиграфия сторожевых лимфатических узлов.
12-е онкологическое отделение онкоурологии
Онкологическое отделение оказывает специализированную медицинскую помощь пациентам с
опухолями мочевыделительной
системы, надпочечников, опухолевой и неопухолевой патологией
органов малого таза. Ежегодно в
отделении проходит более 1200
хирургических операций в год.
В отделении выполняются оперативные вмешательства любой
сложности, комбинированные
мультивисцеральные резекции
органов брюшной полости и малого таза, миниинвазивные, лапароскопические операции, операции
с применением радиочастотной
термоабляции, фотодинамической терапии. На базе отделения
развернут Поволжский Центр
тазовой хирургии, который углубленно занимается хирургическими и онкологическими проблемами малого таза. Совместно
с отделением химиотерапии и
радиологии проводится комбинированное лечение, в 2020 году
внедрена методика низко- и высокодозной брахитерапии предстательной железы.
АСТРАХАНСКИЕ ОНКОПАЦИЕНТЫ ПОЛУЧИЛИ «КНИГОТЕРАПИЮ» ОТ RUSSCO
16 мая Российское общество клинической онкологии
(RUSSCO) провело в Астрахани благотворительную акцию
«Книготерапия» с участием известных российских писателей
и передачей книг в лечебные учреждения города.

День начался с посещения областной детской клинической
больницы им. Н.Н. Силищевой,
где в онкологическом отделении с
маленькими пациентами и их родителями пообщалась известный
детский писатель Анна Гончарова.
Живое общение и вовлечение детей в игровой процесс позволили
им отвлечься от ежедневных процедур, придали дополнительных
сил для того, чтобы легче бороться с недугами. Положительных
эмоций добавили и книги Анны
Сергеевны, переданные в дар больнице. Многие из них она подписала по просьбе детей. Всю встречу
снимали местные телеканалы.
Затем гости посетили Астраханский областной клинический онкологический диспансер, где общение
продолжилось уже со взрослыми
пациентами. Открыла мероприятие
главврач Лиана Юрьевна Нежинская, которая сообщила, что, начиная с книг, привезенных из Москвы,
в онкодиспансере будут созданы
мини-библиотечки в каждом отделении.

Встречу вел главный редактор портала «Книжное обозрение» Александр
Набоков, рассказавший об акции
«Книготерапия RUSSCO», которая
проходит уже в пятом российском
городе, и книгах, привезенных специально для больничных библиотек.
С прветствием к собравшимся обратилась заместитель министра
здравоохранения области Светлана Николаевна Смирнова. Она
отметила важную социальную
значимость акции «Книготерапия
RUSSCO» и предложила проводить
подобные мероприятия на постоянной основе.

С видеообращением к астраханцам обратилась писатель Галина
Куликова, заострившая внимание
на безусловной позитивной роли
подобных акций, проводимых Российским обществом клинической
онкологии на протяжении трех лет.
А. Гончарова поделилась своими
впечатлениями от общения с детьми, представила свои книги, а потом подписала книги для библиотеки онкодиспансера.
Состоялся и пресс-подход к местным журналистам. Представители
телевидения, печатных СМИ и интернет-изданий получили исчерпывающие ответы на разнообразные
вопросы, касающиеся как творчества писателей, так и перспектив
акции; в частности, представители
RUSSCO сообщили, что на осень
«Книготерапия» запланирована в
Оренбурге.

В завершение встречи состоялся
акт дарения книг. Всего в больницы
Астрахани было передано более 200
книг издательств «Белый город»,
«АСТ», «Вече», продюсерского центра «Динамо», в том числе с автографами, как А. Гончаровой, так и Г.
Куликовой, С. Лукьяненко и др.
ЦЕДИРАНИБ В МОНОТЕРАПИИ ИЛИ В КОМБИНАЦИИ С ЛЕНАЛИДОМИДОМ ПРИ ДИФФЕРЕНЦИРОВАННОМ РАКЕ ЩИТОВИДНОЙ ЖЕЛЕЗЫ, РЕЗИСТЕНТНОМ К РАДИОЙОДТЕРАПИИ
В настоящий момент больным дифференцированным раком щитовидной железы (РЩЖ), резистентным к
радиойодтерапии и без драйверных
мутаций в генах NTRK, ALK, RET
или BRAF, возможно назначение сорафениба, ленватиниба, вандатениба, сунитиниба или пазопаниба при
ожидаемой медиане выживаемости
без прогрессирования (мВБП) на
фоне лечения в 11-18 мес. и частоте
достижения объективного ответа
в 63%. Разработка новых стратегий лечения радийодрезистентного
РЩЖ – это актуальная задача.
Цедираниб является низкомолекулярным пероральным ингибитором
рецепторов VEGFR-1,2,3, а также
c-Kit, а леналидомид обладает антинеопластическими, антиангиогенными и иммуномодулирующими
свойствами.
В исследование были включены
пациенты старше 18 лет, с ECOG
статусом от 0-2 и верифицированным дифференцированным РЩЖ
(папиллярным, фолликулярным и
гюртлеклеточным).
Исследование обладало сложным,
ступенчатым дизайном. Первый
этап был разработан как классическое исследование 1 фазы, основной
задачей которого являлось определение дозового режима. Второй этап
– рандомизированное исследование
второй фазы, первичной конечной
точкой которого была медиана выживаемости без прогрессирования
(ВБП), вторичными – частота достижения объективного ответа (ЧОО),
медиана общей выживаемости (ОВ)
и токсичность терапии.
На первом этапе (1 фаза) исследования оптимальный дозовый режим
терапии был определен как цедираниб 30 мг ежедневно и леналидомид
15 мг в дни с 1 по 21, курс 28 дней.
На втором этапе (2 фаза) пациенты
были рандомизированы в 2 группы
в соотношении 2:1:
• группа А (n=39) – цедираниб 30 мг 1 раз в день, курс 28 дней;
• группа В (n=71) – цедираниб 30 мг ежедневно и леналидомид 15 мг в дни с 1 по 21, курс 28 дней.
• Большинство пациентов были
женщинами (59%) с медианой возраста в 63 года и ECOG 0-1, 23%
больных ранее получали антиVEGF терапию.
При медиане времени наблюдения
в 11 мес. медиана ВБП в группе цедираниба составила 14,8 мес. и 11,3
мес. в группе комбинированной терапии (p=0,36) (рис.1).
Рисунок 1.
. График выживаемости
без прогрессирования в 2 группах
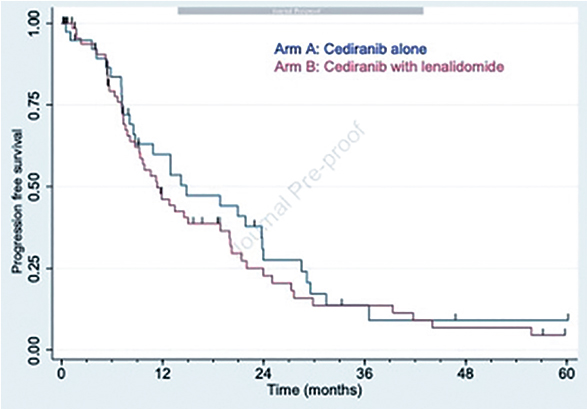
Частота объективного ответа составила 44% как в группе цедираниба, так и в группе комбинации цедираниба и леналидамида
(p=0,99). При подгрупповом анализе показано, что у пациентов,
ранее не получавших анти-VEGF
терапию, частота ОО составила
53% и 43% против 11% и 44% в лечебных группах соответственно.
Медиана общей выживаемости не
достигнута, при зарегистрированной 2-летней ОВ в 64,8% в группе
монотерапии и 75,3% при комбинированном лечении.
Нежелательные явления 3-й степени или выше, связанные с лечением, были представлены астенией
(26% в группе А и 26% в группе В),
гипертонией (26% и 28%) и диареей (15% и 12%). НЯ 3-й степени,
которые чаще зарегистрированы
при применении цедираниба и леналидомида в сравнении с только
цедиранибом, включали протеинурию (5,1% и 8,7%), мышечную
слабость (0% и 5,8%) нейтропению
(2,6% и 16%), тромбоцитопению
(0% и 4,3%) и лимфопению (0% и
4,3%).
Не существует рандомизированных исследований, сравнивающих
между собой мультикиназные ингибиторы, можно только сопоставить результаты различных работ
(табл.1).
Таблица1.
Эффективность тирозинкиназных ингибиторов при дифференцированном раке щитовидной железы.
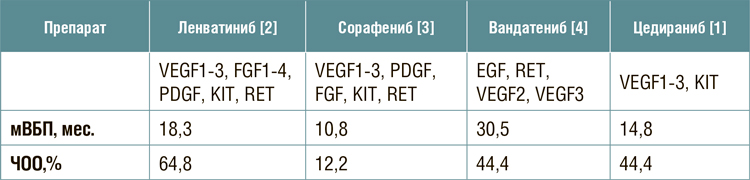
Таким образом цедираниб может
быть еще одной эффективной опцией терапии при дифференцированном раке щитовидной железы.
Источники:
1. Rosenberg AJ, Liao CY, Karrison T, de Souza JA, Worden FP, Libao B, Krzyzanowska MK, Hayes DN, Winquist E, Saloura V, Prescott K, Villaflor VM, Seiwert TY, Schechter RB, Stadler WM, Cohen EEW, Vokes EE, A multicenter open-label randomized phase II study of cediranib with or without lenalidomide in iodine 131-refractory differentiated thyroid cancer. Annals of Oncology. 2023. doi: https://doi.org/10.1016/j. annonc.2023.05.002.
2. Brose MS, Nutting CM, Jarzab B, Elisei R, Siena S, Bastholt L, et al. DECISION investigators Sorafenib in radioactive iodine-refractory, locally advanced or metastatic differentiated thyroid cancer: a randomised, doubleblind, phase 3 trial. Lancet. 2014; 384 (9940): 319-28. 10.1016/S0140- 6736(14)60421-9.
3. Brose MS, Nutting CM, Jarzab B, Elisei R, Siena S, Bastholt L, et al. DECISION investigators Sorafenib in radioactive iodine-refractory, locally advanced or metastatic differentiated thyroid cancer: a randomised, doubleblind, phase 3 trial. Lancet. 2014; 384 (9940): 319-28. 10.1016/S0140- 6736(14)60421-9.
4. Wells SA JR, Robinson BG, Gagel
RF, Dralle H, Fagin JA, Santoro M, et
al. Vandetanib in patients with locally
advanced or metastatic medullary
thyroid cancer: a randomized,
double-blind phase III trial. J Clin
Oncol. 2012; 30(2): 134-41. 10.1200/
JCO.2011.35.5040.
КОНФЕРЕНЦИЯ "ЛУЧШЕЕ ПО МАТЕРИАЛАМ КОНФЕРЕНЦИИ ASCO" ПЕРВЫЙ МОЛОДЕЖНЫЙ ОНКОЛОГИЧЕСКИЙ САММИТ
20 - 23 ИЮНЯ 2023

ПОМОГАЕТ ЛИ СТЕРЕОТАКСИС НА ОЛИГОПРОГРЕССИРУЮЩИЕ ОЧАГИ У ПАЦИЕНТА С МЕТАСТАТИЧЕСКИМ ПОЧЕЧНОКЛЕТОЧНЫМ РАКОМ? КАЖЕТСЯ, ДА
Авторы: Усычкин Сергей Владимирович
Заведующий отделением лучевой терапии Hadassah Medical Moscow, Москва
Митин Тимур
Университет Здоровья и Науки Орегона, Отделение радиационной медицины, Портленд, США
Тимофеев Илья Валерьевич
Директор Бюро по изучению рака (Россия), член Международного комитета ASCO (США), член научного комитета Колледжа Европейской Школы Онкологии (ESCO)
Деньгина Наталья Владимировна
Заведующая радиологическим отделением ГУЗ «Областной клинический онкологический диспансер», директор Центра лучевой терапии «R-Spei», к.м.н, Ульяновск
В клинической практике стандартный подход при прогрессировании
метастатического заболевания заключается в смене линии системной терапии, без различий между
олигометастатическим и полиметастатическим прогрессированием.
Однако последовательная смена
линий системной терапии обычно
связана с сокращением интервала
времени до прогрессирования и нарастанием токсичности от системного лечения.
В последнее время применение
стереотаксической аблативной
лучевой терапии (SABR) все чаще
рассматривается в контексте олигопрогрессии метастатического
почечноклеточного рака (мПКР),
как правило, с целью продления текущей системной терапии и экономии последующих линий системного лечения.
Schoenhals et al. [1] представили результаты лечения 36 пациентов со
светлоклеточным мПКР с олигопрогрессией из группы с благоприятным риском (27,8%) или промежуточным риском (61,1%) IMDC.
SABR была выполнена на олигопрогрессирующие очаги (от 1 до 3) вне
зависимости от общего количества
метастатических очагов, после чего
пациенты продолжали получать
текущую линию терапии до прогрессирования. При дальнейшем
прогрессировании у 11 пациентов
также были отмечены олигопрогрессирующие очаги, на которые
проводились повторные сеансы
SABR. Медиана модифицированной
выживаемости без прогрессирования (мВБП) от момента SABR до
прогрессии составила 9,2 мес., медиана общей выживаемости от момента SABR до прогрессии – 43,4 мес. В
этом исследовании авторами также было продемонстрировано, что
проведение SABR во время лечения
ингибиторами контрольных точек
(ИКТ) было связано с более длительной ВБП (>28,4 мес., p=0,0001) по
сравнению с ингибиторами mTOR
или ингибиторами VEGF. На основе
этих многообещающих результатов
та же команда исследователей из
MDACC разработала исследование
фазы II [2], в которое были включены 20 пациентов с мПКР, получавшие различные линии системной
терапии (с первой по четвертую). У
большинства пациентов были синхронные метастазы (60%), и всем
этим пациентам была выполнена
циторедуктивная нефрэктомия.
При включении в исследование системная терапия была представлена
ИКТ у 8 больных, ИТК также у 8 пациентов и комбинированными схемами лечения у 4 пациентов. Через
1 год 44,2% больных оставались на
той же линии системной терапии.
Медиана времени от SABR до начала новой линии системной терапии
(мВБП) составила 11,1 мес., при этом
медиана времени от начала системной терапии до прогрессирования
и перехода на другую линию (SABRaided systemic therapy) оказалась 24,4
мес. Выживаемость без прогрессирования на текущей линии лекарственной терапии составила 84,7%
в течение 1 года и 50,8% – в течение
2 лет. Cheung et al. [3] сообщили о
сходных результатах в проспективном исследовании у пациентов с
олигопрогрессией на системной терапии ИТК. Тридцать семь больных
с мПКР были включены в этом исследование и пролечены по поводу
57 олигопрогрессирующих очагов. У
большинства (54%) были метахронные олигометастатические очаги и
заболевание IMDC промежуточного риска (68%). Медиана продолжительности терапии ИТК до олигопрогрессии составила 18,6 мес., что
больше показателей, полученных в
исследовании Checkmate-214 [4] и
Keynote-426 [5] (8,4 и 11,1 мес. соответственно). Медиана длительности
сохранения текущей линии системной терапии составила более 1 года.
Пациенты с более индолентным
развитием метастатического процесса [3], а также с меньшим общим количеством метастатических
очагов на момент проведения SABR
[2], вероятно, получают наибольший выигрыш в выживаемости по
сравнению с другими пациентами с
олигопрогрессией мПКР при проведении SABR на отдельные очаги.
Клинический случай
Пациент К, 1984 г.р., некурящий.
Заболел с января 2011 года (на тот
момент ему было лишь 27 лет), когда отметил примесь крови в моче.
При обследовании выявлено объемное
образование правой почки. В феврале
2011 г. выполнена радикальная нефрэктомия справа. Гистологическое
исследование показало светлоклеточный гипернефроидный рак Grade
3, c врастанием опухоли в капсулы
почки, но без инвазии в просвет лоханки, в 5 исследованных лимфоузлах
без признаков опухолевых клеток.
Стадия II – T2N0M0. С февраля 2011
по 2016 г. пациент находился только
под динамическим наблюдением.
В августе 2016 г. отмечено прогрессирование заболевания. По данным КТ
выявлены множественные метастатические очаги в легких, лимфоузлах
средостения, печени, лимфоузлах ворот печени, по брюшине. Их общее
количество превышало 100.
С августа 2016 г. начата таргетная
терапия Сутентом (сунитиниб) в
дозе 50 мг. По данным контрольных
обследований в ноябре 2016 г. отмечена частичная регрессия очагов
вплоть до полной регрессии части
из них, без признаков дальнейшего
прогрессирования, однако у пациента присутствовал ладонно-подошвенный синдром 2 степени, а также практически постоянный сухой,
непродуктивный кашель, вероятнее
всего, связанный с наличием увеличенного бифуркационного лимфоузла
размером 2,7×1,6×2,8 см.
В рамках клинического исследования
Ib фазы (VOLGA Study [6]) по изучению безопасности и эффективности стереотаксической лучевой
терапии (SBRT) у пациентов с экстракраниальными метастазами почечноклеточного рака, получающих
стандартную таргетную терапию
или иммунотерапию ингибиторами
контрольных точек, в ноябре 2016 г. в
Ульяновском областном клиническом
онкологическом диспансере пациенту
была проведена стереотаксическая
3D-конформная лучевая терапия
(SBRT) на область бифуркационного
лимфоузла в средостении с РОД 6 Гр,
5 сеансов до СОД 30 Гр. За время лечения были отмечены только явления
лучевого эзофагита 1 ст., которые
успешно разрешились при консервативном лечении. После курса SBRT
пациент продолжил прием сунитиниба до октября 2020 г., при этом
кашель постепенно уменьшился, несмотря на то, что по размерам облученный лимфоузел оставался стабильным.
В ноябре 2020 г. отмечен первый
эпизод олигопрогрессии в виде роста
единичного метастатического очага
во втором ребре справа, сопровождавшегося патологическим переломом.
С декабря 2020 по март 2021 г. пациент получил 3 курса иммунотерапии
по схеме ниволумаб + ипилимумаб
с последующей стабилизацией опухолевого процесса. С апреля 2021 г.
пациент продолжает получать ниволумаб по настоящее время в поддерживающем режиме.
В феврале 2022 г. отмечен второй
эпизод олигопрогрессии в виде увеличения метастатического очага в S3
правого легкого, появления во 2 ребре
справа остеолитического компонента, увеличения мягкотканного компонента метастатического очага в
правой подвздошной кости (рис.1).
Рисунок 1.
Олигопрогрессия на фоне поддерживающей терапии ниволумабом

Учитывая олигометастатическое прогрессирование, на междисциплинарном
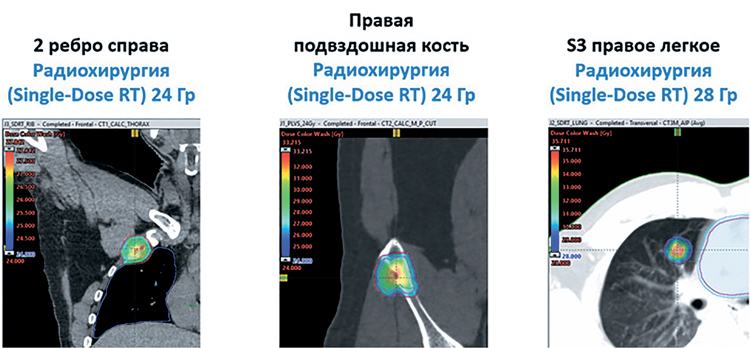
консилиуме института онкологии Хадасса Москва пациенту был рекомендован курс стереотаксической аблативной лучевой терапии (SABR) на олигопрогрессирующие очаги и продолжение текущей линии лекарственной терапии
(ниволумаб). В мае 2022 г. в клинике Хадасса Москва проведена SABR по протоколу однократного облучения высокой разовой дозой (Single-Dose Radiation
Therapy) 24 Гр на очаг во 2 ребре справа и очаг в крыле правой подвдошной кости с мягкотканным компонентом, 28 Гр на очаг в S3 правого легкого (рис.2).
Рисунок 2.
SABR на 3 очага олигопрогрессии (май 2022 г.)
Далее пациент продолжил получать ниволумаб. По данным контрольных обследований отмечена стабилизация заболевания: отсутствие новых очагов,
постепенное уменьшение размеров облученных очагов (рис.3)
Рисунок 3.
Динамика со стороны очагов, пролеченных в мае 2022 г.
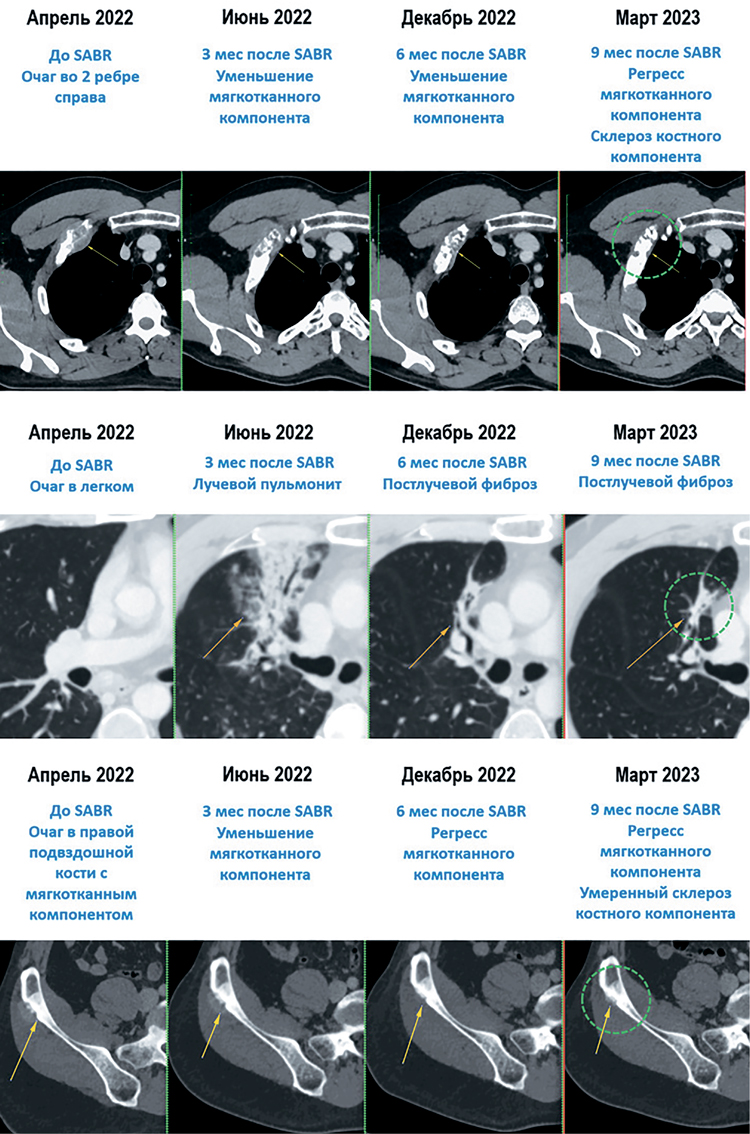
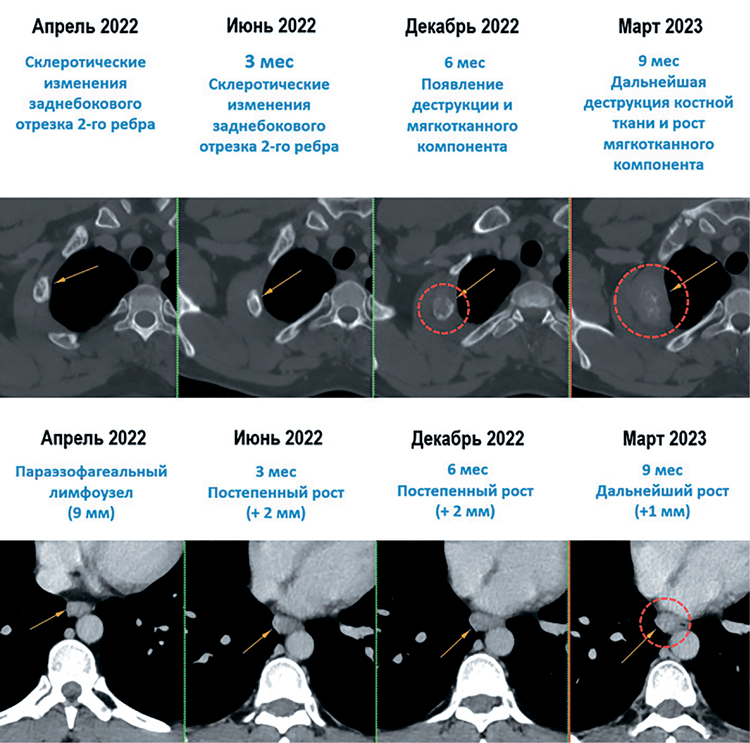
В марте 2023 г. отмечен третий эпизод олигопрогрессии в виде продолженного
роста метастатического очага в заднем отрезке 2-го ребра справа, также выявлено увеличение параэзофагеального лимфоузла на уровне нижнегрудного отдела пищевода (рис.4). При этом отмечен полный рентгенологический ответ
по ранее пролеченному очагу в S3 правого легкого (только признаки постлучевого фиброза легкого на месте очага), а также полный ответ мягкотканного
компонента ранее облученного очага в крыле правой подвздошной кости.
Рисунок 4.
Олигопрогрессирующие очаги
Далее пациент продолжил получать ниволумаб. По данным контрольных обследований отмечена стабилизация заболевания: отсутствие
новых очагов, постепенное уменьшение размеров облученных очагов
(рис.3).
В марте 2023 г. отмечен третий эпизод олигопрогрессии в виде продолженного роста метастатического очага в заднем отрезке 2-го ребра справа, также выявлено увеличение параэзофагеального лимфоузла
на уровне нижнегрудного отдела пищевода (рис.4). При этом отмечен
полный рентгенологический ответ по ранее пролеченному очагу в S3
правого легкого (только признаки постлучевого фиброза легкого на месте очага), а также полный ответ мягкотканного компонента ранее
облученного очага в крыле правой подвздошной кости.
Учитывая повторное олигопрогрессирование на прежней линии лекарственной терапии, на консилиуме Института онкологии Хадасса было
рекомендовано проведение повторного курса SABR на метастатический очаг в заднем отрезке 2-го ребра справа и метастатический очаг
в параэзофагеальном лимфоузле на уровне нижне-грудного отдела пищевода до СОД 35 Гр, РОД 7 Гр, 5 сеансов, а также продолжение иммунотерапии ниволумабом.
Рисунок 5.
. Пациент К.: течение заболевания и лечения, общая схема
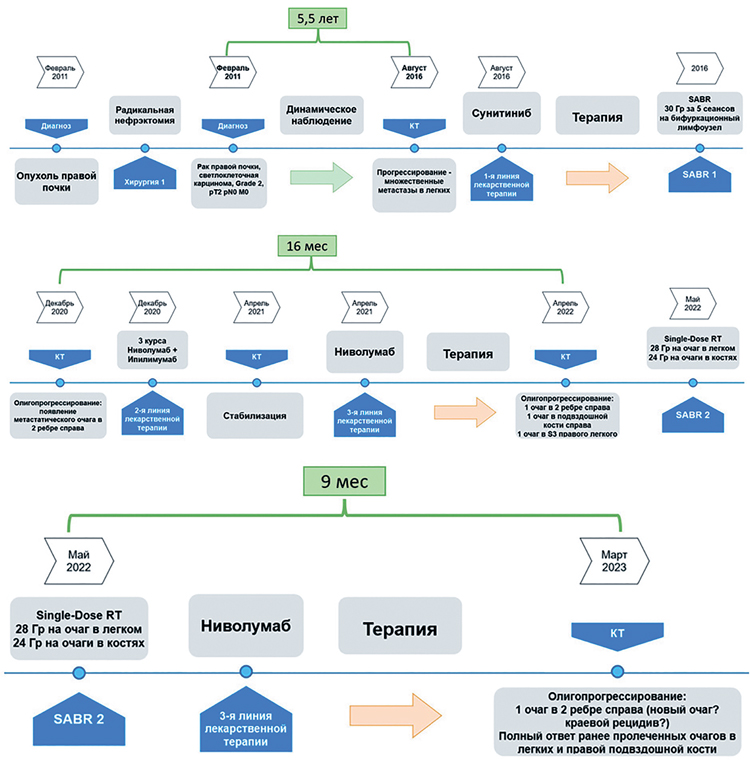
Таким образом, в данном случае у
пациента с множественными метастатическими очагами почечноклеточного рака удалось продлить
текущую, вторую линию лекарственной терапии ингибиторами
контрольных точек (ниволумаб) как
минимум на 9 мес. от момента стереотаксической аблативной лучевой
терапии на 3 олигопрогрессирующих очага, а общая длительность текущей линии системной терапии на
данный момент составила более 24
мес. У пациента отмечена хорошая
переносимость лечения, отсутствие
каких-либо серьезных нежелательных явлений как со стороны очагов,
пролеченных с помощью лучевой терапии однократной высокой разовой
дозой (Single-Dose RadioTherapy), так
и хорошая переносимость лекарственного лечения в целом.
Этот клинический случай не доказывает сам по себе, что применение
SBRT приведет к улучшению в общей
выживаемости пациента, однако ее
своевременное применение, дающее
возможность продолжить ниволумаб и поддерживать локальный
контроль заболевания, несомненно,
придало сил и надежды пациенту и
команде его онкологов, поскольку
это отсрочило необходимость менять курс системного лечения. Такие клинические случаи генерируют
гипотезу об эффекте аблативной ЛТ
при олигопрогрессировании мРП и
являются важной базой для дальнейшего изучения такой методики лечения пациентов в рамках проспективного клинического исследования. А
наш молодой пациент за более чем
12-летний период своего лечения
продолжал работать без длительных
перерывов, растить детей, ездить в
отпуск с семьей и жить полной жизнью.
Литература:
1. Schoenhals JE, Mohamad O, Christie A, et al. Stereotactic Ablative Radiation Therapy for Oligoprogressive Renal Cell Carcinoma. Adv Radiat Oncol. 2021; 6(5): 100692. Published: 2021 May 26. doi:10.1016/j.adro.2021.100692.
2. Hannan R, Christensen M, Hammers H, et al. Phase II Trial of Stereotactic Ablative Radiation for Oligoprogressive Metastatic Kidney Cancer. Eur Urol Oncol. 2022; 5(2): 216-224. doi:10.1016/j. euo.2021.12.001.
3. Cheung P, Patel S, North SA, et al. Stereotactic Radiotherapy for Oligoprogression in Metastatic Renal Cell Cancer Patients Receiving Tyrosine Kinase Inhibitor Therapy: A Phase 2 Prospective Multicenter Study. Eur Urol. 2021; 80(6): 693-700. doi:10.1016/j.eururo.2021.07.026.
4. Motzer RJ, Tannir NM, McDermott DF, et al. Nivolumab plus Ipilimumab versus Sunitinib in Advanced Renal-Cell Carcinoma. N Engl J Med. 2018; 378(14): 1277-1290. doi:10.1056/NEJMoa1712126.
5. Powles T, Plimack ER, Soulières D, et al. Pembrolizumab plus axitinib versus sunitinib monotherapy as first-line treatment of advanced renal cell carcinoma (KEYNOTE-426): extended follow-up from a randomised, open-label, phase 3 trial [published correction appears in Lancet Oncol. 2020 Dec; 21(12):e553]. Lancet Oncol. 2020; 21(12): 1563-1573. doi:10.1016/S1470-2045(20)30436-8.
6. Dengina N, Mitin T, Gamayunov S,
et al. Stereotactic body radiation therapy
in combination with systemic therapy
for metastatic renal cell carcinoma: a
prospective multicentre study. ESMO
Оpen. 2019; 4:e000535. doi:10.1136/
esmoopen-2019-000535.
Приглашаем специалистов в области онкологии принять участие в конкурсном отборе на получение Премии им. акад. А.И. Савицкого!

Организаторы мероприятия – Российское общество клинической
онкологии (RUSSCO) и Ассоциация онкологов России – отмечают, что Премия является символом глубочайшего признания и
одновременно надежды на дальнейшее плодотворное сотрудничество при оказании помощи при онкологических заболеваниях.
Торжественная церемония вручения Премии пройдет в рамках
VI Международного форума онкологии и радиотерапии
на площадке Центра международной торговли по адресу:
г. Москва, Краснопресненская наб., 12.
Премия им. акад. А.И. Савицкого включает десять номинаций.
Среди специалистов:
• Химиотерапевт года
• Хирург года
• Радиотерапевт года
• Онкогематолог года
• Медицинская сестра года
• Молодой онколог года
• Диагност года
• Восходящая звезда (с международным участием)
• За верность профессии
Среди проектов:
• Проект года
(социальной или научно-образовательной направленности)
Прием заявок открыт с 10 апреля до 11 июня 2023 года
в Личном кабинете участника.
Узнать подробнее о мероприятии и подать заявку на участие
в конкурсном отборе можно на сайте award.final-session.ru
НОВОСТИ КРУПНЫХ ЖУРНАЛОВ/BREAKING: НОВОЕ РАНДОМИЗИРОВАННОЕ ИССЛЕДОВАНИЕ ДЕМОНСТРИРУЕТ ПРЕИМУЩЕСТВО ПРИМЕНЕНИЯ SBRT У БОЛЬНЫХ НМРЛ IV СТАДИИ С EGFR МУТАЦИЕЙ
Ингибиторы тирозинкиназы рецептора эпидермального фактора роста (EGFR-TKI) обладают
значительным терапевтическим
эффектом при лечении распространенного немелкоклеточного
рака легкого (НМРЛ) с мутациями EGFR. Однако приобретенная резистентность значительно
ограничивает выигрыш от их
применения в отношении выживаемости пациентов с НМРЛ
с мутацией EGFR. Меж тем стереотаксическая лучевая терапия
(SBRT) как на первичную опухоль, так и на метастазы в сочетании с EGFR-TKI может быть безопасна и эффективна, позволяя
отсрочить наступление момента
развития резистентности и тем
самым пролонгируя терапевтические возможности в лечении этих
больных. Подобную гипотезу
предложили китайские авторы и
протестировали ее в своем недавно
опубликованном в «Зеленом журнале» (Radiotherapy&Oncology,
апрель 2023 г.) проспективном
рандомизированном мультицентрическом исследовании II фазы
[1].
Пациенты были набраны из 4
разных больниц в Ухане, Китай. У всех гистологически был
подтвержден НМРЛ с мутацией EGFR (19DEL или 21L858R) и
установлена стадия IV (олигометастатический процесс с количеством отдаленных метастазов ≤5,
наиболее частые их локализации
– легкие, кости, печень, надпочечники). Пациенты, получившие
лечение EGFR-TKI первой линии,
включая гефитиниб, эрлотиниб
и икотиниб, и достигшие стабилизации или частичного ответа,
были через три месяца включены в исследование. Подходящие
участники были случайным образом распределены (1:1) для получения SBRT в комбинации с
EGFR-TKI или только терапии
EGFR-TKI. В комбинированной
группе проводилось облучение
различных опухолевых очагов в
дозах от 30 до 50 Гр за пять фракций. Учитывая короткую продолжительность SBRT, применение
ИТК продолжалось и во время
лучевой терапии. Первичной
конечной точкой была выживаемость без прогрессирования заболевания (ВБП), а вторичными
конечными точками были общая
выживаемость (ОВ) и безопасность лечения.
В период с 4 мая 2018 г. по 20 декабря 2019 г. было включено 62
пациента, и, увы, исследование
было закрыто досрочно с этими
62 из предполагаемых 72 пациентов из-за медленного набора.
Зарегистрированные больные
были случайным образом распределены для получения SBRT
плюс EGFR-TKI (n=31) или только
EGFR-TKI (n=31). Один пациент,
который был рандомизирован
в группу SBRT в комбинации с
EGFR-TKI, отказался от SBRT во
время лечения, и 61 пациент был
включен в модифицированный
анализ mITT. Таким образом,
30 больных рандомизированы в
группу комбинации SBRT плюс
EGFR-TKI и 31 пациент – в группу
EGFR-TKI. По состоянию на дату
окончания клинического исследования (14 февраля 2022 г.) медиана периода наблюдения составила 29,4 месяца. Медиана ВБП в
группе EGFR-TKI и группе комбинации составила 9,0 мес. против
17,6 мес. (отношение рисков [HR]
= 0,52, 95% доверительный интервал [95% CI] 0,31-0,89; P=0,016),
а медиана общей выживаемости
составила 23,2 мес. против 33,6
мес. (ОР [95% ДИ] 0,53 [0,30-0,95];
P=0,026). Ни в одной из групп не
наблюдалось токсичности 3-й
степени или выше, нежелательные явления 2-й степени составили 50% в группе EGFR-TKI + SBRT,
в то время как в группе EGFR-TKI
– 45,2% (рис.1).
Рисунок 1.
ВБП и ОВ в группах только таргетной терапии
или комбинации (А и В), а также в зависимости от мишеней, выбранных
для облучения (первичной опухоли, метастазов или первичной
опухоли + метастазов, С и D) [1]
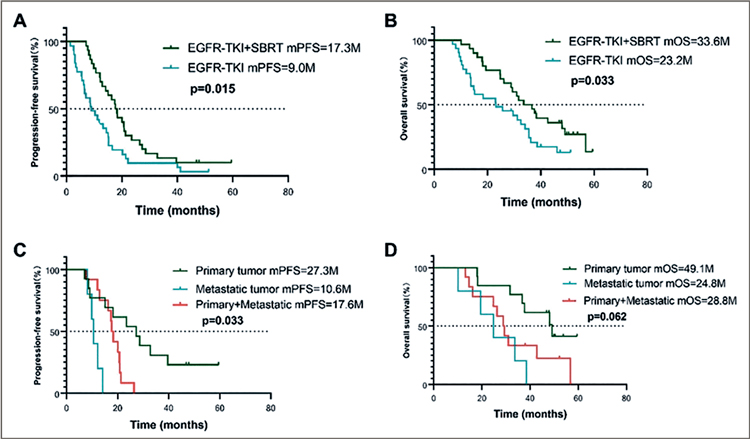
В итоге добавление SBRT значительно отсрочило проявление приобретенной устойчивости к ингибиторам тирозинкиназы EGFR и продлило ВБП и ОВ пациентов. Лучевая терапия только на первичный очаг, возможно, предпочтительнее облучения метастатических очагов. Данные этой работы схожи с результатами недавнего и более успешного исследования SYNDAS [2], подтверждая их. В SYNDAS большее количество пациентов (133) также были рандомизированы в группы ИТК или комбинации ИТК с лучевой терапией, и исследование было завершено раньше времени, продемонстрировав явные преимущества добавления облучения (рис.2). Медиана ВБП составила 12,5 мес. против 20,2 мес. для групп ИТК и комбинации (p<0,001) соответственно, а медиана ОВ – 17,4 мес. против 25,5 мес. (p<0,001) также в пользу комбинированного лечения. При этом необходимо отметить, что дозы лучевой терапии в этих 2 исследованиях варьировали от 25 до 50 Гр за 5 фракций, что, тем не менее, давало преимущества в отдаленных результатах, предполагая, что даже «немного облучения» в комбинации с ИТК лучше, чем без облучения. Ряд экспертов полагает, что, учитывая низкую токсичность комбинации, в ряде случаев возможно и повысить дозы SBRT, если опухолевый очаг имеет «безопасное» расположение.
Рисунок 2.
ВБП и ОВ при использовании только
ИТК или комбинации ИТК+ЛТ в исследовании SYNDAS [2]
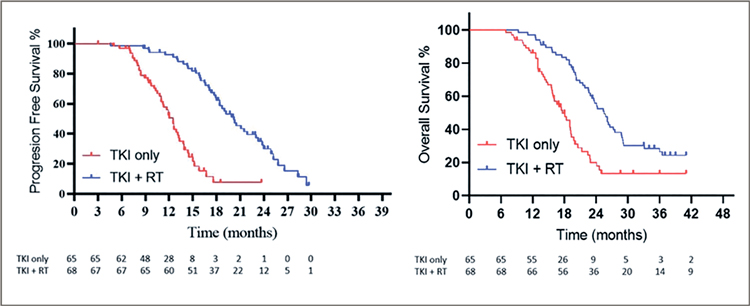
Для подтверждения полученных выводов, несомненно, необходимы дальнейшие исследования, но научное онкологическое сообщество уже с большим энтузиазмом восприняло результаты этих работ, расценив их как прорыв в лечении олигометастатического НМРЛ.
Источники:
1. Peng P, Gong J, Zhang Y, Zhou S, Li Y, Han G, Meng R, Chen Y, Yang M, Shen Q, Chu Q, Xia S, Zhang P, Zhang L, Chen Y, Zhang L. EGFR-TKIs plus stereotactic body radiation therapy (SBRT) for stage IV Non-small cell lung cancer (NSCLC): A prospective, multicenter, randomized, controlled phase II study. Radiother Oncol. 2023 Apr 25; 184: 109681. doi: 10.1016/j. radonc.2023.109681. Epub ahead of print. PMID: 37105304.
2. Wang XS, Bai YF, Verma V,
et al. Randomized Trial of FirstLine Tyrosine Kinase Inhibitor
With or Without Radiotherapy for
Synchronous Oligometastatic EGFRMutated NSCLC. J Natl Cancer Inst.
2022 Jan 30: djac015. doi: 10.1093/jnci/
djac015. Epub ahead of print. PMID:
35094066.
НОВОСТИ КРУПНЫХ ЖУРНАЛОВ/ЭФФЕКТИВНОСТЬ И БЕЗОПАСНОСТЬ ТРАБЕКТЕДИНА В КОМБИНАЦИИ С ЛУЧЕВОЙ ТЕРАПИЕЙ У ПАЦИЕНТОВ С МИКСОИДНОЙ ЛИПОСАРКОМОЙ: ДАННЫЕ НЕРАНДОМИЗИРОВАННОГО КЛИНИЧЕСКОГО ИССЛЕДОВАНИЯ 2 ФАЗЫ
Миксоидная липосаркома (МЛС)
представляет собой подтип саркомы мягких тканей (МТС), который
характеризуется специфическими
генетическими транслокациями,
продуцирующими транскрипты
слияния FUS-DDIT3 или, реже,
EWSR1-DDIT3. Местные рецидивы возникают в 10-20% случаев,
в то время как отдаленные метастазы могут развиваться в 30-60%
случаев даже через несколько лет
после постановки первоначального диагноза, с преимущественным
поражением мягких тканей и костей, не легких. Гистологически
пациенты с опухолями, гиперклеточность которых превышает 5%,
считаются подверженными высокому риску развития отдаленных
метастазов и смерти от этого заболевания. В отличие от других подтипов липосаркомы (например,
дедифференцированной липосаркомы), MЛС более чувствительны
к классической химиотерапии
первой линии с антрациклинами,
а также проявляют чувствительность к трабектедину, который
действует как таргетный препарат, преодолевая блок липогенной дифференцировки клеток,
обусловленный транслокацией
хромосом опухоли.
Эти характеристики привели к
старту исследования по неоадъювантной терапии трабектедином
при местнораспространенной
МЛС, которое показало частоту
ответа 24% [1]. В этом исследовании пациенты с МТС высокого
риска были до операции рандомизированы для получения либо
антрациклина и ифосфамида,
либо химиотерапии, адаптированной к гистотипу, а для пациентов с MЛС химиотерапия с
учетом гистотипа трабектедином
показала те же результаты, что и
после антрациклинов с ифосфамидом.
Кроме того, миксоидная липосаркома обладает более высокой радиочувствительностью, чем все другие МТС. Действительно, лучевая
терапия (ЛТ) часто используется на
предоперационном этапе с целью
уменьшения опухоли и обеспечения адекватных хирургических
условий. Более того, некоторые
доклинические данные о синергической активности показали, что
трабектедин проявляет радиочувствительность, являясь синхронизатором клеточного цикла, вызывая блокаду S-фазы и торможение
клеток в G2/M фазах клеточного
цикла, наиболее чувствительными
к лучевой терапии.
По этим причинам комбинация трабектедина и ЛТ при МЛС кажется логичной и заслуживающей изучения, что побудило инициирование европейского исследования по изучению эффективности подобной комбинации. Данные фазы 1 исследования уже были опубликованы [2], показав благоприятный профиль безопасности при комбинации трабектедина в дозе 1,5 мг/м2 и ЛТ (45 Гр) за 25 фракций в подгруппе из 14 пациентов с местнораспространенной операбельной МЛС.
Международное открытое нерандомизированное клиническое исследование 2 фазы [3], недавно опубликованное в журнале JAMA Oncology, с участием 46 пациентов с миксоидной липосаркомой проводилось в 4 центрах в Испании, 1 в Италии и 2 во Франции с 1 июля 2016 года по 30 сентября 2019 года. Все пациенты имели гистологический, централизованно подтвержденный диагноз локализованной резектабельной миксоидной липосаркомы конечности или туловища.
Трабектедин вводили в дозе, рекомендованной по результатам фазы 1 (1,5 мг/м2), внутривенно в течение 24 часов каждые 21 день, всего 3 цикла. Лучевую терапию начинали после завершения первой инфузии трабектедина (цикл 1, день 2). Пациенты получали 25 фракций облучения общей дозой 45 Гр. Операцию планировали через 3-4 недели после введения последнего предоперационного цикла и не раньше, чем через 4 недели после окончания предоперационной ЛТ. Основной целью исследования был общий ответ на лечение. Вторичными конечными точками были безрецидивная выживаемость и патоморфологический ответ.
Всего было включено 46 пациентов. Четыре пациента не подлежали оценке. Средний возраст составлял 43 года (диапазон 18-77 лет). В целом, 9 из 41 больных (22%) достигли частичного ответа после неоадъювантной терапии трабектедином и ЛТ, при этом 5 из 39 пациентов (13%) достигли полного патоморфологического ответа, и 20 из 39 пациентов (51%) имели 10% или менее от жизнеспособной оставшейся опухоли. Частичный ответ в соответствии с критериями Choi наблюдался у 24 из 29 поддающихся оценке пациентов (83%), и ни у одного пациента не было прогрессирования заболевания. Лечение переносилось хорошо.
При медиане наблюдения 37 месяцев (диапазон 16-62 месяца) ни
один пациент не умер, тогда как у
7 из 42 был зарегистрирован рецидив заболевания. Среднее время
до рецидива составило 15 месяцев (диапазон от 8 до 51 месяца).
Из этих пациентов у 1 из 7 возник
местный рецидив, а у 6 из 7 развились отдаленные метастазы. Соответствующая 4-летняя общая выживаемость составила 100%, тогда
как безрецидивная выживаемость
составила 84% (95% ДИ, 73–96%,
рис.1).
Рисунок 1.
Выживаемость без прогрессирования за 4 года
по данным исследования [3].
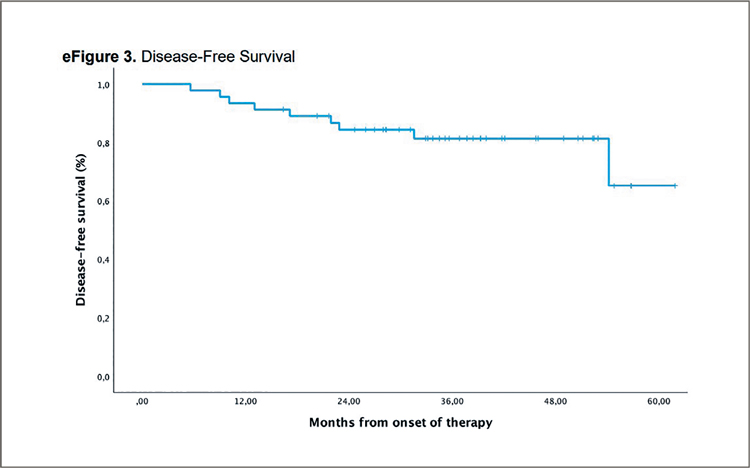
Хотя первичная конечная точка
этого нерандомизированного клинического исследования фазы 2 не
была достигнута (общий ответ при
солидных опухолях у ≥70% пациентов), результаты показывают, что
эта комбинация хорошо переносилась и явилась весьма эффективной с точки зрения развития патоморфологического ответа. Таким
образом, комбинация трабектедина
и ЛТ может стать перспективной в
лечении подобных больных, прежде
всего в плане переносимости.
Источники:
1. Gronchi A, Bui BN, Bonvalot S, et al. Phase II clinical trial of neoadjuvant trabectedin in patients with advanced localized myxoid liposarcoma. Ann Oncol. 2012;23(3):771-776. doi:10.1093/ annonc/mdr265
2. Gronchi A, Hindi N, Cruz J, et al. Trabectedin and Radiotherapy in Soft Tissue Sarcoma (TRASTS): results of a phase I study in myxoid liposarcoma from Spanish (GEIS), Italian (ISG), French (FSG) sarcoma groups. EClinicalMedicine. 2019;9:35- 43. doi:10.1016/j.eclinm.2019.03.007
3. Sanfilippo R, Hindi N, Cruz Jurado
J, et al. Effectiveness and Safety of
Trabectedin and Radiotherapy for
Patients With Myxoid Liposarcoma: A
Nonrandomized Clinical Trial. JAMA
Oncol. 2023;9(5):656–663. doi:10.1001/
jamaoncol.2023.0056
НОВОСТИ КРУПНЫХ ЖУРНАЛОВ/ТРАСТУЗУМАБ ДЕРУКСТЕКАН ПРИ HER2 ПОЗИТИВНОЙ КАРЦИНОСАРКОМЕ ТЕЛА МАТКИ. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ STATICE
Карциносаркома тела матки - редкое
злокачественное новообразование
эндометрия, в настоящий момент
расценивается как аденокарцинома
с метапластическим компонентом
опухоли. При карциносаркоме тела
матки экспрессия рецептора HER2
выявляется в 1 из 3 случаев (HER2 3+
в 5%-25%, HER2 2+ в 15%-35%, HER2
1+ в 20%-40%).
Трастузумаб дерукстекан (T-DXd)
представляет собой конъюгат, состоящий из моноклонального антитела
к рецептору HER2 и ингибитора топоизомеразы I. Препарат уже продемонстрировал высокую эффективность при HER2 позитивном раке
молочной железы и HER2 положительном раке желудка.
В исследование STATICE были включены больные карциносаркомой
тела матки, ранее уже получавшие
стандартную терапию на основе препаратов платины и паклитаксела по
поводу диссеминированного процесса. Рандомизированы больные с
уровнем экспрессии HER2 от 1+ до
3+. Пациентки получали T-DXd в
дозе от 6,4 мг/кг до 5,4 мг/кг 1 раз в
21 день.
Первичной конечной точкой исследования была частота достижения объективного ответа (ЧОО), вторичными – медианы выживаемости без прогрессирования (ВБП), общей выживаемости (ОВ) и токсичность терапии.
С декабря 2014 г. по июнь 2020 г. в исследование было включено 84 больных, 51 больная была исключен из исследования: 50 женщин в связи с отсутствием экспрессии HER2 на поверхности опухолевых клеток и 1 пациентка - из-за бурного прогрессирования заболевания.
У 33 больных оценена токсичность терапии (у 14 в дозовом режиме 6,4 мг/кг, у 19 – 5,4 мг/кг), а эффективность - у 32 пациенток (в группе с высоким уровнем HER2 у 22 и у 10 в группе с низким уровнем HER2). Пациенты были условно разделены на 2 лечебные когорты в зависимости от уровня экспрессии рецептора HER2. ЧОО в группе с высоким уровнем HER2 достигла 54,5% и 70,0% в группе с низким уровнем экспрессии при длительности ответа в 6,9 мес. и 8,1 мес. соответственно (рис.1).
Рисунок 1.
А) ЧОО в группе пациентов с высокой экспрессией HER2;
B) ЧОО в группе пациентов с низкой экспрессией HER2
Медиана ВБП в общей группе пациентов составила 6,7 месяцев: 6,2 мес. при высоком уровне экспрессии HER2 и 6,7 мес. - при низком. Медиана ОВ в общей когорте больных достигла 15,8 месяцев: 13,3 мес. при высоком уровне экспрессии HER2, а при низком не достигнута.
Подробно результаты исследования представлены в таблице 1.
Таблица 1.
Результаты исследования STATICE
НЯ 3-й степени и выше зарегистрированы у 20 пациентов (61%), они преимущественно были представлены нейтропенией (27%), анемией (24%) и лимфопенией (21%). НЯ 3-й степени чаще встречались у пациентов, получавших T-DXd в дозе 6,4 мг/кг, чем у тех, кто получал в дозе 5,4 мг/кг (13 (93%) и 7 (37%) соответственно). Смертей, связанных с терапией, зарегистрировано не было. Наиболее частым НЯ, приводящими к отмене терапии, были пневмонит (6 [18%] пациентов) и астения (2 [6%] пациента). Пневмонит зарегистрирован у 9 больных (27%) и преимущественно не превышал 1-й или 2-й степени.
Источник :
1. Tadaaki Nishikawa, Kosei
Hasegawa, Koji Matsumoto et al.
Trastuzumab Deruxtecan for Human
Epidermal Growth Factor Receptor
2–Expressing Advanced or Recurrent
Uterine Carcinosarcoma (NCCH1615):
The STATICE Trial. DOI: 10.1200/
JCO.22.02558 Journal of Clinical
Oncology 41, no. 15 (May 20, 2023)
2789-2799.
ПОВТОРНЫЕ БИОПСИИ НОВООБРАЗОВАНИЙ ЛЕГКИХ – ПОКАЗАНИЯ, ПРОТИВОРЕЧИЯ, РЕЗУЛЬТАТЫ
Автор: Есаков Юрий Сергеевич
№3 ГБУЗ «Городская клиническая онкологическая больница №1
Департамента здравоохранения Москвы» (ГБУЗ «ГКОБ №1 ДЗМ»), к.м.н., Москва
Несмотря на широкий арсенал технологий, позволяющих получить ткань
для морфологического исследования
при периферических образованиях и
очагах легких, биопсия под контролем
мультиспиральной компьютерной
томографии (МСКТ) наиболее распространена в силу относительной
простоты воспроизведения, а также
высокой чувствительности и специфичности, достигающих 90% и
97% соответственно [1]. Расширение
возможностей систем интраоперационной навигации, таких как КТфлюороскопия, электромагнитная
навигация, биопсия с использованием
коаксильных игл, позволяет достичь
чувствительности метода в 95,2% [2].
До сегодняшнего дня актуальна дискуссия о показаниях к верификации
первичных очагов легких, оценке результатов неинформативных исследований и диагностической ценности
повторной биопсии при различных
заболеваниях легких.
Показания и противоречия
Периферические новообразования
легких необходимо дифференцировать с первичными и вторичными
злокачественными опухолями, специфическими воспалительными изменениями (туберкулезом легких),
доброкачественными процессами
(очаговым фиброзом, интерстициальными заболеваниями легких,
пневмониями и др.) [3,4]. Несмотря
на принципиальную настороженность в отношении онкологической
природы случайно выявленного
образования в легком, важно подчеркнуть, что более 90% подобных находок доброкачественные
[5]. Так, в исследованиях National
Lung cancer Screening Trial (NLST),
DANTE, NELSON, MILD, ITALUNG
онкологическая природа среди всех
выявленных очагов была подтверждена в 1,4%, 2,5%, 0,9%, 0,5% и 1,5%
наблюдений соответственно. Эти
цифры можно соотнести с частотой
верификации НМРЛ (1,4%) при обследовании пациентов со случайно
выявленными очагами в легких вне
скрининга [6]. В соответствии с рекомендациями Американской рабочей
группы по профилактическим мероприятиям (USPSTF, U.S. Preventive
Services Task Force), скрининг НМРЛ
рекомендовано дополнять биопсией
подозрительных образований у пациентов в возрасте 55-80 лет со стажем курения 30 пачка-лет и более,
которые продолжают курить на данный момент или бросили в течение
последних 15 лет. Помимо курения
к факторам риска РЛ относят возраст, отягощенный онкологический
анамнез, интерстициальные болезни
легких, эмфизему, а также длительное
воздействие асбеста, урана и радона
[4].
До сегодняшнего дня программы
скрининга НМРЛ в России носят в
большей степени исследовательский
характер и не оказывают существенного влияния на смертность от рака
легкого даже в мегаполисах, в связи
с чем в рутинной клинической практике терапевты, пульмонологи и хирурги чаще встречают пациентов со
случайно выявленными очагами в
легких, что требует подходов отличных от рекомендаций, разработанных
на основе скрининговых исследований. Тем не менее, соотношение случайно выявленных очагов в легких с
факторами риска НМРЛ может иметь
важное прогностическое значение и
оказывать влияние на выбор тактики
ведения пациентов.
Согласно рекомендациям Британского торакального общества (BTS), при
случайно выявленном новообразовании в легком размером 5 мм и более
нужно оценить структуру опухоли
(солидная/субсолидная), скорость
ее роста, риск злокачественности по
модели Брока и данным позитронно-эмиссионной томографии (ПЭТ).
Трансторакальная биопсия может
быть предложена при размере солидного компонента в очаге более 8 мм,
при риске злокачественности >10% и
скорости удвоения объема опухоли
<600 дней [7].
Основной задачей при трансторакальной биопсии сегодня остается
исключение злокачественной природы при впервые выявленном очаге в
легком и дифференциальный диагноз
обнаруженных новообразований
при генерализации опухоли внеторакальной локализации. Важно подчеркнуть, что при впервые выявленном
солитарном очаге в легком у потенциально операбельного пациента и высоком риске его злокачественной природы по данным рентгенологического
обследования в морфологической верификации нет необходимости, и пациенту может быть рекомендовано
хирургическое лечение на первом этапе. Подкреплена подобная позиция
может быть в первую очередь сравнительно низкой частотой ошибок при
соблюдении протоколов британского
торакального общества (BTS) в сочетании с высокой вариабельностью
результатов при неинформативном
результате трансторакальной биопсии, которая, вероятнее всего, потребует отсроченного хирургического
лечения [7]. Так, при удалении медленно растущих очагов в легких доброкачественная их природа может
варьировать в широких пределах – от
9% до 64%, в то время как применение
рекомендаций Британского торакального общества (BTS Guidelines) может
снизить частоту ошибок до 5% [3].
Особую группу составляют пациенты с отягощенным коморбидным
фоном, которым запланирована дистанционная лучевая терапия или лекарственное лечение, а также группа
больных, настаивающих на верификации заболевания до начала лечения.
Именно для пациентов с высоким
риском хирургического лечения, множественным характером поражения
легких, высокой вероятностью неопухолевого генеза заболевания вопрос
верификации и информативности, в
том числе повторной биопсии, имеет
особое значение.
Морфологическая верификация показана также пациентам с ограниченными функциональными возможностями, которым не может быть
предложена операция, а также пациентам, которым по клиническим данным показано проведение нехирургического лечения (химио- или лучевой
терапии) [6].
Периферические очаги в легких, обнаруженные в ходе динамического контроля на фоне ранее подтвержденного
онкологического заболевания, представляют особую проблему как для
радиологической диагностики, так
и для верификации. В легкие могут
метастазировать все виды опухолей,
однако наиболее часто преобладают
колоректальный рак, рак молочной
железы, саркомы мягких тканей, меланома, рак щитовидной железы [8].
В работе Quint L.E. и соавт. проанализирована морфологическая верификация очагов в легких у 149 пациентов с отягощенным онкологическим
анамнезом. У пациентов с первичными опухолями головы и шеи, мочеточников, молочной железы, шейки
матки, желчных протоков яичников,
пищевода, предстательной железы и
желудка чаще был подтвержден первично-множественный метахронный
рак легкого, в то время как пациенты с
первичной карциномой слюнных желёз, надпочечников, толстой кишки,
почки, щитовидной железы, тимуса
и мочевого пузыря имели примерно
равную вероятность метастатического и первичного рака легкого; при
первичной меланоме, саркоме и раке
яичка очаги в легких были преимущественно метастатической природы.
В исследовании Mery C.M. и соавт.
первично-множественный НМРЛ и
метастатическое поражение легких
у пациентов с онкологическим анамнезом диагностированы в 41% и 38%
наблюдений соответственно.
Биопсия под контролем НДКТ – безопасная и хорошо отработанная процедура. Тем не менее, опыт конкретного
медицинского учреждения и хирурга
определяет широкий диапазон информативности и спектра осложнений, которые могут возникать во
время манипуляции. В большинстве
ситуаций, при наличии соответствующих показаний, плюсы от выполнения ТТБ превышают возможные
риски. Абсолютными противопоказаниями к проведению ТТБ являются
острые состояния, в частности, тяжелые нарушения ритма сердца, нестабильная стенокардия, декомпенсация
хронической сердечной недостаточности и др. К относительным противопоказаниям относятся нарушения
гемостаза, хроническая почечная или
печеночная недостаточность, хроническая обструктивная болезнь легких
тяжелой степени с объемом форсированного выдоха за 1 секунду менее 1 л/
сек или менее 35% от должной, легочная гипертензия, перенесенная пневмонэктомия, невозможность обеспечения безопасной траектории для
доступа к образованию, затрудненный контакт с пациентом, сложности
в обеспечении необходимой укладки
пациента на столе и др. Однако перечисленные противопоказания имеют относительный характер и могут
быть интерпретированы по-разному
в зависимости от конкретной клинической ситуации и опыта хирурга.
Существенно важнее выделить «абсолютное» противопоказание к любому
интервенционному исследованию,
когда его результаты не повлияют на
тактику лечения пациента.
Оценка диагностической
значимости исследования
Несмотря на большое количество
исследований, посвященных оценке
результатов ТТБ под КТ, истинная
клиническая эффективность метода остается предметом дискуссий.
Информативность ТТБ под контролем МСКТ в разных исследованиях
варьирует в широких пределах. Так,
чувствительность метода составляет
72-97%, специфичность – 86,5-100%,
диагностическая точность – 86,5-98%
[3,4,9-11]. Показатели клинической
эффективности ТТБ под контролем
КТ зависят от многих обстоятельств:
техники выполнения биопсии, опыта
врача, группы анализируемых пациентов и многих других факторов. Таким образом, с учетом гетерогенности
больных в исследованиях объективно
оценить общую эффективность метода сложно.
Для оценки эффективности ТТБ под
визуальным контролем было проведено многоцентровое исследование
Lee и соавт. Авторами проанализированы результаты 9384 первичных
ТТБ у 9239 пациентов под контролем
рентгеноскопии или КТ. Чувствительность, специфичность и точность метода составили 82,5%, 86,5% и 91,1%
соответственно. Частота диагностических ошибок составила 8,9%, риск
ошибки возрастал при размере образования ≤2 см, субсолидной структуре опухоли, доброкачественной
природе образования [12]. Интерес
представляет работа Lee и соавт. 2014
г., в которой тем же авторским коллективом на выборке из 1153 пациентов показатели чувствительности,
специфичности и точности были значительно выше – 95,7%, 100% и 97%
соответственно [9]. Разница показателей клинической эффективности
может косвенно свидетельствовать
об отсутствии значимого вклада объема ранее выполненных процедур
в результативность исследования с
одной стороны и влиянии большого количества факторов (размера и
плотности очага, методики биопсии,
онкологического анамнеза, эмфиземы
легкого, морфологической службы и
др.) на конечный результат биопсии
с другой.
В работе Welborn и соавт. проанализированы результаты ТТБ под КТконтролем у 955 пациентов (средний
размер образования составил 3,0±2,1
см): чувствительность, специфичность и диагностическая точность
составили 87,5%, 94,5% и 89,1% соответственно с частотой постпункционного пневмоторакса до 26,4%.
Относительно высокие значения
специфичности авторы объясняют
продолжительным наблюдением пациентов у торакальных хирургов до
первой попытки верификации диагноза, что предопределяло значительную уверенность в злокачественной
природе образования [11].
Отдельного внимания заслуживает
анализ биопсий, выполненных пациентам с очагами размером менее 20
мм и/или очагов «матового стекла».
Так, в исследовании Tian и соавт. чувствительность и специфичность при
биопсии очагов средним размером
1,8±0,6 см (у 560 пациентов) составили 92% и 98,6%, а диагностическая
точность – 94,6%. Авторами сделан
вывод, что факторами, отрицательно влияющими на диагностическую
точность, были размер очага <10 мм,
расположение новообразования в
нижней доле легкого и развитие пневмоторакса во время проведения биопсии [13].
В работе Huang и соавт. диагностическая точность трансторакальной биопсии под контролем МСКТ для очагов диаметром ≤1,5 см (n=43) и >1,5
см (n=155) составили 83,7% и 96,8%
соответственно [2], что также свидетельствует о снижении информативности биопсии при исследовании
малых периферических образований
легких. Однако на более крупных
выборках пациентов, в частности, в
работе Yun и соавт., статистически
значимой разницы между биопсией
солидных и субсолидных образований получено не было – авторы оценили клиническую эффективность
ТТБ у 354 пациентов, из которых в
54 наблюдениях образования легких
имели субсолидную структуру. В обеих группах чувствительность метода
составила 83%, специфичность – 99%,
общая точность – 87,6%. Несмотря на
отсутствие статистически значимых
различий в результатах биопсии частично-солидных и солидных очагов
в легких обращает на себя внимание
сравнительно низкое отрицательное
предсказательное значение исследования – 58,3% против 70,9% соответственно, что может оставлять поле
для дискуссии при решении вопроса
о биопсии или первичном хирургическом лечении для пациентов с длительно наблюдаемыми очагами матового стекла. Помимо этого, авторами
не оценены результаты повторных
биопсий в обеих группах. В метаанализе DiBardino и соавт. проанализировано 48 исследований биопсии под
контролем КТ. Общая диагностическая точность метода составила 92,1%,
чувствительность – 92,1%, специфичность – 100%. Авторами отмечено
отрицательное влияние структуры
очага в легком в виде матового стекла
на диагностическую точность биопсии несмотря на то, что размер опухоли менее 10 мм значимо не снижал
точность (92,6%) и чувствительность (88,7%) исследования [14].
Таким образом, в большинстве работ
отмечены высокие показатели клинической эффективности трансторакальной биопсии периферических
очагов в легких под контролем КТ.
Однако существуют низкоинформативные результаты исследования, на
основании которых нельзя достоверно дифференцировать злокачественный и доброкачественный процесс
и, следовательно, считать биоптат
диагностическим [15]. Исключение
подобных результатов из расчета
клинической эффективности может
существенно завышать чувствительность изучаемого метода. Оценка
истиной распространенности малоинформативных результатов может
сформировать более корректное
представление о клинической эффективности различных вариантов
малоинвазивной верификации периферических образований в легких и
влиять на выбор тактики обследования пациентов.
При сопоставлении показателей чувствительности, специфичности и точности трансторакальной биопсии под
контролем МСКТ с количеством выполненных биопсий в исследовании
увеличение количества пациентов не
приводит к значимому росту показателей клинической эффективности
исследования. Так, в работах с количеством пациентов/биопсий более 1000
показатели диагностической точности сравнимы с аналогичными значениями в группах с меньшим числом
пациентов.
На диагностическую значимость влияют факторы различной природы,
в частности, участки субсолидной
структуры в исследуемом очаге, количество образцов, получаемых во
время исследования, объем биоптата,
длительность наблюдения у специалистов и степень уверенности в злокачественной природе образования,
размер опухоли и др. [3,5]. Наиболее
значимыми факторами, оказывающими влияние на эффективность
методики в проведенных ранее исследованиях, были малый размер образования, развитие осложнений во
время манипуляции, наличие участков «матового стекла» (GGO), количество точек, из которых получен биоптат, локализация опухоли, структура
образования и его доброкачественная
природа [12-14].
Частота неинформативных
исследований
Суммарно неинформативные результаты трансторакальной биопсии по
данным разных авторов составляют
от 15% до 32,4% от всех исследований
[2,5,18]. Одна из нерешенных проблем морфологической верификации
посредством пункционных методик
– получение ложноположительных
и ложноотрицательных результатов.
Ложноположительный результат
трансторакальной биопсии при подозрении на НМРЛ – казуистически
редкое явление, встречающееся менее чем в 2% наблюдений, в отличие
от ложноотрицательного результата,
при котором вероятность подтверждения опухолевой природы очага в
легком, по данным Borelli C. и соавт.,
может достигать 67% [17]. Негативное
предсказательное значение неинформативной биопсии новообразований
легкого по данным разных авторов
варьирует в широких пределах – от
33% до 68% [15,18]. Истинная оценка
ошибочных результатов в реальной
клинической практике бывает сложна и в сомнительных случаях требует
дополнительной инвазивной диагностики.
В метаанализе Сhae K. и соавт. проанализированы результаты 35059
трансторакальных биопсий новообразований легких под контролем
МСКТ в 143 исследованиях. В 6,8%
наблюдений после успешной биопсии материала было недостаточно для
дифференциального диагноза между
злокачественной и доброкачественной природой новообразования.
Группа малоинформативных биопсий
представляет интерес в первую очередь потому, что при дополнительном
обследовании частота недиагностированного опухолевого поражения
легких достигает 59,3% по сравнению
с неспецифическими и специфическими доброкачественными результатами биопсии (20,6% и 1,5% соответственно). Малоинформативные
исследования могут снизить чувствительность и специфичность ТТБ-КТ
до 4,5% и 10,7% соответственно, а
вероятность получения малоинформативного материала во время биопсии при первично злокачественном и
доброкачественном очаге в легком составила 4,4% и 10,4% соответственно
[17]. Получение малоинформативного материала значительно повышает
необходимость выполнения дополнительных исследований (в том числе
включающих ПЭТ-КТ) или хирургических манипуляций (повторной
биопсии, торакоскопической биопсии
легкого) [15].
Малоинформативный результат
трансторакальной биопсии наиболее вероятен при неспецифических
доброкачественных очагах и новообразованиях легких – таких, как
очаговый пневмофиброз, пневмония,
хроническое воспаление и др.; может достигать 20,6%, в то время как
специфические доброкачественные
образования значительно реже ассоциированы с недиагностическим результатом – 1,5%. Неспецифические
результаты трансторакальной биопсии не имеют отличий от неинформативных результатов в связи с необходимостью выполнения повторной
биопсии и/или более инвазивных
процедур, таких как диагностическая
торакоскопия [19].
Частая причина малоинформативной
биопсии новообразований легкого
– атипичная аденоматозная гиперплазия (AAH), периферическая фокальная пролиферация атипичных
кубовидных эпителиальных клеток
вдоль альвеол и бронхиол [16]. Атипичная аденоматозная гиперплазия
– предраковое поражение, при котором дифференциальная диагностика
на основании биопсийного материала
с пре- или минимально инвазивной
аденокарциномой может быть затруднена. Частота подтверждения злокачественной опухоли в окончательном
диагнозе после первичной верификации аденоматозной гиперплазии по
данным биопсии достигает 88,9%, что
сопоставимо с частотой окончательного диагноза при подозрении на атипичные клетки по цитологическому
исследованию (91,1%) [17].
Результаты повторных
биопсий
Работы, посвященные повторным
биопсиям новообразований легких,
редки. Несмотря на то, что частота
неинформативного результата интервенционной диагностики может достигать 22-28%, исследований клинической эффективности изолированно
повторных биопсий нет. Однако существует множество показателей,
оценивающих финальную морфологию очагов легких, на основании которых можно принимать решение в
отношении как повторной биопсии,
хирургического пособия, так и динамического наблюдения. Необходимо
отметить, что далеко не во всех исследованиях при первично мало- или
неинформативном результате биопсии авторы рекомендуют повторную
верификацию.
В ретроспективном анализе Mills и
соавт. из 867 биопсий (выполненных
у 772 пациентов, средний размер образования – 3,5±2,5 см) технически
успешными были 87,2%. Повторные
биопсии были выполнены у 88 (10,1%)
пациентов. Показаниями к повторным биопсиям наиболее часто были
необходимость в дополнительном
материале для молекулярного анализа, наличие другого подозрительного
образования, неинформативные образцы, а также развитие резистентности к химиотерапии в процессе лекарственного лечения НМРЛ.
В исследовании Boreli C. и соавт. проведена ретроспективная оценка информативных и неинформативных
результатов 183 биопсий очагов в
легких у 170 пациентов. Неинформативный результат был получен после
33 (18%) из 183 первичных биопсий,
после чего пациенты были направлены на повторную биопсию, операцию
или наблюдение в 7, 18 и 8 случаях соответственно. Авторы подчеркивают,
что в 22 (66,7%) наблюдениях неинформативных биопсий в итоге была
подтверждена злокачественная природа опухоли легкого. Независимыми
факторами риска неинформативной
биопсии были размер опухоли менее
20 мм и ее истинная доброкачественная природа [15].
Нами проанализирован собственный
опыт выполнения трансторакальных
биопсий первичных и вторичных новообразований легких под контролем
МСКТ на базе городской клинической онкологической больницы №1
г. Москва в период с октября 2019 г.
по декабрь 2020 г. Суммарно выполнено 176 биопсий у 158 больных с
медианой возраста 70 (63-77) лет. Из
158 пациентов первая биопсия была
информативной у 139 (87,97%) больных (95% ДИ 81,98-92,16%). Повторные биопсии выполнили 18 (11,39%)
пациентам из 158. Из 18 пациентов,
отобранных на повторную биопсию,
исследование было информативным
у 16 (89,89%, 95% ДИ 67-97%).
В работах Tongbai и соавт., Otto и
соавт. верификация НМРЛ при повторной биопсии составила 63% и
55% соответственно [16]. В нашем
исследовании у пациентов с малоинформативным результатом биопсии
при дальнейшем обследовании злокачественная природа новообразований подтверждена у 23% пациентов
с доброкачественными результатами
ТТБ, у 23,5% с малоинформативными
биопсиями и у 43% с неинформативными биопсиями. У 36,8% пациентов
с отрицательным результатом первичной биопсии был диагностирован
НМРЛ. В крупных исследованиях частота диагностики НМРЛ у пациентов после неинформативной первой
трансторакальной биопсии варьирует
от 20,6% до 59,3% [19].
В исследовании Yountong Ma и соавт.
оценена корреляция между неинформативным результатом первичной
биопсии новообразований легких, их
радиологической характеристикой
и финальным морфологическим исследованием. Так, из 1525 первичных
биопсий неинформативными были
243 (15,9%) из которых 80 были отобраны для повторного исследования.
Повторные исследования включали
биопсию, хирургическое лечение или
динамическое наблюдение, в ходе которых удалось окончательно установить морфологический диагноз. Так,
в 34 (42%) наблюдениях из 81 была
подтверждена злокачественная природа опухоли. Авторами сделан вывод о том, что изолированная оценка
подозрительных очагов по модели
Herder или Brock имеет низкое предсказательное значение в отношении
НМРЛ, в то время как при получении
в первичном биоптате организующейся пневмонии имел место наименьший риск подтверждения рака
легкого [20]. При высокой вероятности злокачественной природы новообразования легкого по данным
МСКТ и неинформативной первой
биопсии может быть рекомендована
повторная биопсия.
Заключение
Трансторакальная биопсия новообразований и очагов в легких – высокоинформативный метод исследования,
позволяющий с высокой точностью
верифицировать морфологический
диагноз у подавляющего числа пациентов. Особую группу составляют
пациенты с неинформативным результатом первичной биопсии, доля
которых составляет от 12% до 32%.
Сегодня отсутствуют общепринятые
рекомендации по ведению пациентов с неинформативным результатом
морфологического исследования.
Выбор метода дополнительной диагностики – повторной биопсии, торакоскопической резекции легкого или
динамического наблюдения – должен
быть основан на мультидисциплинарной оценке рентгенологической
семиотики, локализации, размеров и
количестве очагов в легких, динамики
их роста, онкологического анамнеза,
состояния паренхимы легкого и коморбидного фона пациента.
Литература:
Zhu J, Wang X, Qu Y, Wen Z. CT-guided core needle biopsy of the lung in patients with primary malignancy suspected of lung metastasis: 5-year experience from a single institution. Diagn IntervRadiol. 2021; 27: 534-541. DOI: 10.5152/dir.2021.20042.
Huang MD, Weng HH, Hsu SL, et al. Accuracy and complications of CT-guided pulmonary core biopsy in small nodules: A single-center experience. Cancer Imaging. 2019; Vol.19, №1, P.1-10.
McNulty W, Baldwin D. Management of pulmonary nodules. BJR Open. 2019; 1: 20180051.
Khan T, Usman Y, Abdo T, et al. Diagnosis and management of peripheral lung nodule. Annals of Translational Medicine. 2019; Vol.7, №15, P.348-348.
Lee KH, Lim KY, Suh YJ, Hur J, Han DH, Kang MJ, Choo JY, Kim C, Kim JI, Yoon SH, Lee W, Park CM. Nondiagnostic Percutaneous Transthoracic Needle Biopsy of Lung Lesions: A Multicenter Study of Malignancy Risk. Radiology. 2019 Mar; 290(3): 814-823. DOI: 10.1148/ radiol.2018181482.
Callister MEJ, Baldwin DR, Akram AR, Barnard S, Cane P, Draffan J, et al. British Thoracic Society guidelines for the investigation and management of pulmonary nodules. Thorax. 2015; 70 Suppl 2(Suppl 2): ii1-54. doi: https://doi. org/10.1136/thoraxjnl-2015-207168. BTS guideline for pulmonary nodules. Guideline of the British Thoracic Society Onno Mets and Robin Smithuis the Academical Medical Centre, Amsterdam and the Alrijne Hospital, Leiderdorp, the Netherlands. http://www.radiologyassistant.nl/en/ p59d9bb5a1bbd7/ bts-guideline-forpulmonary-nodules.html.
Hanamiya M, Aoki T, Yamashita Y, Kawanami S, Korogi Y. Frequency and significance of pulmonary nodules on thin-section CT in patients with extrapulmonary malignant neoplasms. EurJRadiol. 2012; 81: 152-7. doi: https:// doi.org/10.1016/j.ejrad.2010.08.013. Lee SM, Park CM, Lee KH, et al. C-arm cone-beam CT-guided percutaneous transthoracic needle biopsy of lung nodules: Clinical experience in 1108 patients. Radiology. 2014; Vol.271, №1, P.291-300. Качур А.К., Шрайнер И.В., Лядов В.К. Опыт работы онкологических учреждений. Вопросы онкологии. 2016; Т.62, №5, C.676–679.
Welborn SL, Ohori NP, Nason KS. Percutaneous computed tomographyguided biopsy performed by thoracic surgeons in 955 patients: A paradigm shift in image-guided thoracic procedures. Journal of Thoracic and Cardiovascular Surgery. 2019; Vol.157, №3, P.1239-1245. Lee KH, Lim KY, Suh YJ, et al. Diagnostic accuracy of percutaneous transthoracic needle lung biopsies: A multicenter study. Korean Journal of Radiology. 2019; Vol.20, №8, P.1300-1310.
Tian P, Wang Y, Li L, et al. CT-guided transthoracic core needle biopsy for small pulmonary lesions: Diagnostic performance and adequacy for molecular testing. Journal of Thoracic Disease. 2017; Vol.9, №2, P.333-343.
DiBardino DM, Yarmus LB, Semaan RW. Transthoracic needle biopsy of the lung. Journal of Thoracic Disease. 2015; Vol.7, Suppl 4, P.S304–S316.
Borelli C, Vergara D, Simeone A, Pazienza L, Castorani G, Graziano P, Di Micco C, Quarato CMI, Sperandeo M. CT-Guided Transthoracic Biopsy of Pulmonary Lesions: Diagnostic versus Nondiagnostic Results. Diagnostics. 2022; 12, 359. https:// doi.org/10.3390/diagnostics12020359. Tongbai T, McDermott S, Kiranantawat N, et al. Non-Diagnostic CT-Guided Percutaneous Needle Biopsy of the Lung: Predictive Factors and Final Diagnoses. Korean Journal of Radiology. 2019; Vol.20, №11, P.1515-1526.
Chae KJ, Hong H, Yoon SH, et al Nondiagnostic Results of Percutaneous Transthoracic Needle Biopsy: A Metaanalysis [Электронныйресурс]. Sci. Rep. 2019; Vol.9, №1, P.12428. https://www. nature.com/articles/s41598-019-48805- x#citeas.
Fontaine-Delaruelle C, Souquet P-J, Gamondes D, Pradat E, De Leusse A, Ferretti GR, Couraud S. Negative predictive value of transthoracic coreneedle biopsy: A multicenter study. Chest. 2015; 148: 472-480.
Kim JI, Park CM, Kim H, Lee JH, Goo JM. Non-specifc benign pathological results on transthoracic core-needle biopsy: how to diferentiate false-negatives? Eur. Radiol. 2017; 27: 3888-3895. https://doi. org/10.1007/s00330-017-4766-3.
Ma Y, Byrne SC, Gange C Jr, Hunsaker
AR, Hammer MM. Radiologic-Pathologic
Correlation for Nondiagnostic CTGuided
Lung Biopsies Performed for the Evaluation
of Lung Cancer. AJR Am. J. Roentgenol.
2020; 215: 116-120.
НОВАЯ КОНЦЕПЦИЯ ОБЕЗБОЛИВАНИЯ В ОНКОЛОГИИ
Демьяновская Екатерина Геннадьевна, врач-невролог, к.м.н.,
ГБУЗ «Инфекционная клиническая больница №1» ДЗМ, доцент кафедры неврологии
ФГБУ «Центральная государственная медицинская академия»
Проблема обезболивания в онкологии является крайне актуальной
и многогранной: это обусловлено
распространенностью болевого
синдрома у онкологических пациентов, значимым влиянием боли
на качество жизни, психический
статус, приверженность лечению
и прогноз, эволюционированием
болевого синдрома с течением времени, спецификой принципов подбора противоболевой терапии, а
также возможными медицинскими,
техническими и административными сложностями в проведении
адекватного обезболивания [1-4].
Контроль боли является важным
направлением помощи онкологическим пациентам, эффективность
управления болью определяет такие
важнейшие аспекты качества жизни больных, как физическая активность, эмоциональное состояние,
сон, социальное функционирование
[8].
Новообразование рассматривается как ведущая причина боли, однако приблизительно у 10% пациентов с онкологическими заболеваниями в качестве причины болевого синдрома диагностируются другие патологии, не имеющие отношения к новообразованию [11], существенный вклад в генез боли может вносить противоопухолевая терапия и паранеопластические процессы, остеопороз на фоне терапии, фантомные боли после ампутаций [9]. Европейская ассоциация паллиативной помощи признает, что онкологическая боль имеет смешанный генез (невропатический и ноцицептивный) [12].
Проблемы реализации права на обезболивание в онкологии
Исходя из того, что иногда невозможно полностью купировать боль у каждого пациента, цель обезболивания заключается в уменьшении выраженности боли до уровня, который обеспечивает приемлемое для пациента качество жизни [16]. Медикаментозные методики обезболивания при ЗНО предполагают назначение лекарственных препаратов разных групп, согласно рейтингу «лестницы обезболивания», которая была предложена ВОЗ в 1986 году [16]. Исследования показывают, что более половины (63%) пациентов с умеренной или тяжелой болью при ЗНО продолжают испытывать боль, несмотря на прием анальгетиков [17]. Кроме того, согласно схеме ступенчатого обезболивания ВОЗ, основным классом препаратов при лечении болевого синдрома у онкологических пациентов являются опиоидные анальгетики. Однако их применение сопряжено с общеизвестными административными и законодательными сложностями, опиоидофобией среди врачей и больных, высоким риском развития целого ряда нежелательных явлений (НЯ): запоров, тошноты, сонливости, снижения когнитивных функций, утомления, повышенного риска потери равновесия (риск падений), а также иммуносупрессии [18]. СледуНОВАЯ КОНЦЕПЦИЯ ОБЕЗБОЛИВАНИЯ В ОНКОЛОГИИ ет также отметить вероятное снижение на фоне применения опиоидов возможности пациентов адекватно изъявить свою законную волю, т.к. у представителей властных структур и юрисдикции могут возникать обоснованные сомнения в дееспособности пациентов из-за НЯ, связанных с центральными эффектами анальгетиков опиоидного ряда. При этом у каждого гражданина нашей страны есть право на облегчение боли, связанной с заболеванием и (или) медицинским вмешательством, доступными методами и лекарственными препаратами. Это прописано в Федеральном законе (ФЗ РФ от 21.11.11 г. № 323-ФЗ, гл. 4, ст. 19.5.4). Однако на практике реализация в полной мере этого права затрудняется. В результате каждый второй врач обеспокоен юридическими вопросами, связанными с назначением опиоидов онкологическим пациентам [15].
Способы введения
анальгетиков при ЗНО
По алгоритмам ВОЗ и общепризнанной современной концепции
терапии хронической боли в онкологии наиболее безопасными и эффективными препаратами, обеспечивающими наилучшее качество жизни
(кроме терминальных стадий заболевания), признаны неинвазивные
формы опиоидных анальгетиков, т.е.
препараты для перорального приема
[16]. Однако в реальной практике у
определенных контингентов пациентов назначение пероральных препаратов может оказаться невозможным или сильно затрудненным. В
качестве примеров можно привести
больных с дисфагией, неконтролируемой рвотой или обструкцией желудочно-кишечного тракта (ЖКТ),
а также с когнитивным дефицитом,
при снижении уровня сознания [20].
Пероральное применение препаратов затрудняется также наличием
орофациальной боли при опухолях
головы и шеи, которая может возникать или усиливаться на определенных этапах противоопухолевой
терапии. Не всегда принятый внутрь
препарат будет обладать ожидаемой
биодоступностью: причиной значительного снижения биодоступности пероральных препаратов может
быть предшествующее оперативное
вмешательство на органах ЖКТ [7].
При нарушениях функции печени,
связанных с ЗНО или протекающих
независимо, может нарушаться биодоступность препаратов, подвергающихся системному метаболизму
– этот момент приобретает особое
значение с учетом того, что цитостатики относятся к препаратам, потенциально способным часто вызывать
лекарственное поражение печени
[21].
При этом далеко не все способы парентерального применения обезболивающих препаратов в онкологии
можно считать оптимальными. Доступным в домашних условиях считается применение трансдермальных
терапевтических систем (ТТС) с опиоидами. Однако в случае кахексии, у
пациентов старшего возраста, при
выраженной потливости или при
высокой температуре окружающего воздуха абсорбция через кожу
активного вещества из ТТС с опиоидами (например, с фентанилом)
значительно снижается, как и при
нарушении правил применения таких ТТС [7]. Также использование
ТТС с включением в состав фентанила не рекомендовано при лихорадке
вследствие неуправляемой фармакокинетики активного вещества, а также при аллергических реакциях на
клейкую основу пластыря [7].
Подбор препарата для
лечения прорывной боли
При хронической онкологической
боли анальгетик должен вводиться
регулярно с целью предотвращения,
а не устранения боли после её возникновения. Однако даже на фоне
относительно стабильной и адекватно контролируемой медикаментозно основной боли может возникать
транзиторное усиление боли - прорывная боль [11]. По своему генезу
она является смешанной и, как правило, сочетает в себе ноцицептивный и невропатический компоненты
[20]. Прорывная боль отличается
крайне высокой интенсивностью,
мучительностью, значительно ухудшает физическое и психическое состояние, нарушает сон и ежедневную
активность, в итоге способствуя снижению качества жизни пациентов.
В качестве терапии неотложной помощи при прорывной боли рекомендовано дополнительное применение
анальгетиков, т.е. регулярно принимаемые анальгетики длительного
или короткого действия при необходимости должны быть дополнены
средствами быстрого действия для
купирования прорывной боли. Наряду с этим, специалисты подчеркивают, что препарат для лечения
прорывной боли должен обладать
хорошим профилем безопасности,
хорошо сочетаться с опиоидными
препаратами, которые назначены
для базового, «фонового» обезболивания [23]. К новым, современным
анальгетикам предъявляются высокие требования: обеспечение выраженного обезболивающего действия,
отсутствие лекарственной зависимости, низкая ассоциированность с
НЯ, характерными для опиоидов, и
предоставление безопасной альтернативы пероральным препаратам
при ЗНО [7].
Перспективные тенденции
обезболивания в онкологии
Одним из перспективных направлений инновационной разработки является создание и отбор селективных
молекул, взаимодействующих с μ1-
опиоидными рецепторами, но при
этом лишенных многих побочных
эффектов опиоидов [25]. В рамках
данного направления активно изучается обезболивание с помощью
пептидных препаратов. В качестве
возможных кандидатов на роль
анальгетиков на основе пептидов
особое внимание привлекла группа
производных дерморфина – гептапептида с высокой биологической
активностью, выделенного из кожи
амфибий. Целью модификации в
процессе выбора молекулы-кандидата на роль будущего лекарственного
средства было создание соединения с повышенной стабильностью
и биологической активностью при
минимуме риска НЯ. В результате исследователи остановились на
последовательности H-Tyr-D-ArgPhe-Gly-NH2 (тирозил-D-аргинилфенилаланил-глицинамид), которая
имеет близкий к природному аминокислотный состав, достаточную
стабильность соединения и высокую
аффинность к рецепторам [27].
Напомним, что антиноцицептивный эффект морфина реализуется благодаря связыванию с
μ-опиоидными рецепторами. В свою
очередь, выделяют 2 подтипа данных
рецепторов: μ1 и μ2. Принято считать, что стимуляция μ1-рецепторов
вызывает супраспинальную анальгезию, а эффекты μ2-рецепторов ответственны за спинальную анальгезию, эйфорию, угнетение дыхания,
миоз, ослабление перистальтики
желудочно-кишечного тракта и т.д.
Следовательно, с целью снижения
вероятности развития данных НЯ
оптимальным механизмом действия
анальгетика сегодня представляется селективное влияние на μ1-
рецепторы, что дает возможность
обеспечить обезболивание при минимизации риска НЯ, свойственных
опиоидам. В частности, тирозил-Dаргинил-фенилаланил-глицинамид
является высокоспецифичным агонистом μ1-опиоидных рецепторов
и практически не взаимодействует
с остальными типами опиоидных
рецепторов [30]. Данная молекула
сегодня доступна в клинической
практике в виде лекарственного препарата Тафалгин – единственного на
текущий момент зарегистрированного пептидного анальгетика, получившего статус лекарственного препарата на территории Российской
Федерации [31]. Тафалгин выпускается в виде раствора для подкожного
введения, 4 мг/мл, 1 ампула содержит
1 мл раствора препарата [31].
Активная основа препарата Тафалгин активирует антиноцицептивную систему путем формирования процесса торможения в кальциевых каналах N-типа. Препарат нарушает межнейронную передачу болевых импульсов на разных уровнях центральной нервной системы, а также изменяет интенсивность восприятия боли, воздействуя на высшие отделы головного мозга [30]. Благодаря этому механизму обеспечивается противоболевой эффект. Тафалгин показал сродство как к периферическим, так и к центральным рецепторам, однако преимущественно рецепторно-опосредованное связывание происходит на спинальном уровне антиноцицепции.
Минимизация вероятности развития НЯ, характерных для опиоидных препаратов из-за влияния на другие типы опиоидных рецепторов, обеспечивается благодаря высокому таргетному сродству Тафалгина именно к μ1-опиоидным рецепторам. Это позволило достичь высокой активности действующего вещества препарата и благоприятного профиля его безопасности. В частности, минимизировано влияние на сердечно-сосудистую систему, дыхательную систему, обеспечено отсутствие эйфоризирующего действия, физического и психологического привыкания. Препарат характеризуется низким наркогенным потенциалом даже при длительном применении. Следует отметить также благоприятный фармакокинетический профиль препарата Тафалгин. Быстрая абсорбция и быстрое достижение Cmax в плазме крови при подкожном введении (в среднем 15 мин после многократного подкожного введения при междозовом интервале 8 часов), а также фармакологическая активность исходной молекулы способствуют скорому развитию клинического эффекта. После введения в организм происходит интенсивное распределение не только в кровяном русле, но и в периферических тканях. Тафалгин быстро выводится и, благодаря пептидному строению активной молекулы, не кумулируется в организме, не нарушает физиологическую десенсибилизацию и регенерацию функционирования рецепторов после их активирования, и по этой причине не вызывает развития толерантности к его обезболивающему действию при повторных введениях [31].
Тафалгин: взгляд с позиций
доказательной медицины
На доклиническом этапе исследования in vitro было подтверждено, что Тафалгин является антагонистом кальциевых каналов N-типа. В доклинических экспериментах было показано, что содержание препарата в крови крыс после введения определяется на протяжении 4 ч, период полувыведения составляет 0,85 ч, биодоступность составляет 82,16%, при этом в биоматериале метаболиты активного вещества не обнаруживаются, в моче и кале исходное вещество не определяется. Также в опытах на бодрствующих лабораторных животных (в частности, крысах, морских свинках) было показано, что Тафалгин не влияет на состояние сердечно-сосудистой и дыхательной систем у животных в период бодрствования. Также не было выявлено местнораздражающего действия лекарственной формы. Летальных случаев среди животных не было зарегистрировано. В тестах по отдергиванию хвоста от теплового воздействия было показано прямое дозозависимое анальгетическое действие Тафалгина при однократном подкожном введении в диапазоне доз от 0,1 до 5 мг/кг массы тела животного. Наиболее выраженный анальгетический эффект был зарегистрирован при введении Тафалгина крысам в дозе 4,5 мг/кг массы тела, и он превосходил анальгетический эффект морфина гидрохлорида у мышей [28].
Все проведенные клинические исследования I-III фазы соответствовали международным правилам Good Clinical Practice (GCP). Клиническое исследование I фазы продемонстрировало хорошие безопасность и переносимость различных доз Тафалгина при однократном подкожном введении здоровым добровольцам. В ходе эскалации достигнута максимальная доза препарата 7 мг, при этом не зарегистрировано ни одного случая дозолимитирующей токсичности. Максимальная концентрация препарата в крови достигалась уже через 30 мин после его введения, активное вещество распределялось не только в кровяном русле, но и в периферических тканях, и приблизительно за 15 часов препарат полностью выводился из системного кровотока. Врачи-исследователи оценили переносимость Тафалгина у всех добровольцев как «хорошую» или «отличную» [7].
Исследованием II фазы стало открытое многоцентровое рандомизированное исследование по изучению эффективности, безопасности и фармакокинетических параметров препарата Тафалгин у пациентов с болевым синдромом, связанным с онкозаболеваниями [7]. В нем приняли участие 42 пациента с онкологической болью в возрасте от 41 до 70 лет, у 85,71% были сопутствующие заболевания (вне обострения). Изучалось и сравнивалось обезболивающее действие Тафалгина и морфина. Все участники достигли достаточного обезболивающего эффекта на фоне применения Тафалгина (первичная конечная точка). Было показано, что даже минимальная исследованная разовая доза тафалгина (2 мг) при средней суточной дозе в подгруппе на 10-е сутки 8,33 мг была достаточно эффективна. Таким образом, Тафалгин контролировал выраженность болевых ощущений так же хорошо, как и морфин. При оценке безопасности оказалось, что Тафалгин не только не вызывал опиоидассоциированных НЯ, но и способствовал их снижению у пациентов, получавших ранее морфин.
Опубликованы также результаты открытого сравнительного многоцентрового рандомизированного исследования III фазы по изучению эффективности и безопасности препарата Тафалгин, раствор для подкожного введения, у пациентов с болевым синдромом, связанным с онкозаболеваниями [25]. В нем приняли участие 179 пациентов в возрасте от 18 до 80 лет включительно, протокол реализовался на базе пяти клинических центров нашей страны. Первичной конечной точкой эффективности была частота сохранения ответа на обезболивающую терапию к 28-му дню, и было показано, что обезболивающая активность Тафалгина у онкологических пациентов не меньше, чем таковая у морфина. При этом частота выявляемости пациентов со случаями НЯ при терапии Тафалгином была статистически значимо меньше относительно пациентов, получавших морфин перорально (36,69% против 72,88%) [25].
На пострегистрационном этапе проводится простое слепое сравнительное многоцентровое рандомизированное исследование III фазы по изучению эффективности и безопасности препарата Тафалгин, раствор для подкожного введения, у пациентов с болевым синдромом в раннем послеоперационном периоде.
Тафалгин в реальной
клинической практике
Несомненно, высокоэффективный
и не требующий предметно-количественного учета препарат будет востребован не только в онкологии и
паллиативной помощи, но и других
областях медицины: в неврологии,
терапии, травматологии, хирургии,
анестезиологии и реаниматологии,
ревматологии и гериатрии. В литературе уже представлен первый опыт
успешного применения препарата
Тафалгин в лечении хронического
болевого синдрома у онкологической
пациентки с плохой переносимостью традиционных опиоидов (трамадола, тапентадола, морфина) [32].
Пациентка Б. 67 лет с диагнозом рак
левой молочной железы ypT1N0M0
Iа стадии, проведено хирургическое
лечение в 2010 году. В 2018 появились
жалобы на боль в поясничном отделе
позвоночника с иррадиацией в левую ягодичную область. Принимала
в течение 1 недели кетопрофен по 50
мг 2–3 раза в сутки, однако анальгетический эффект был недостаточный. Терапию скорректировали, добавив миорелаксант центрального
действия сирдалуд по 2 мг (1 раз вечером) и антиконвульсант габапентин по 300 мг 2 раза в сутки. Болевой
синдром регрессировал. В течение 3
лет, с 2018 по 2021 годы, пациентку
болевой синдром не беспокоил, она
вела активный образ жизни, однако
в апреле 2021 года отметила неприятные ощущения в нижнегрудном и
в поясничном отделах позвоночника,
в теле грудины и правой плечевой
кости, в костях таза слева. В связи с
наличием болевого синдрома средней степени тяжести и неэффективностью нестероидных противовоспалительных препаратов назначены
трамадол по 100 мг 2–3 раза в сутки
в таблетках, эторикоксиб по 60 мг в
таблетках 1 раз в сутки (14 дней), габапентин по 300 мг в капсулах 3 раза
в сутки. Снижение интенсивности
боли оказалось незначительным –
на 15–20%. Пациентке был назначен
тапентадол ретард в таблетках по 50
мг 2 раза в сутки, затем 100 мг 2 раза
в сутки, однако приемлемого уровня
обезболивания достигнуть не удалось, несмотря на титрацию дозы тапентадола до 400 мг/сут в сочетании
с адъювантами – прегабалином по 75
мг 3 раза в сутки и диклофенаком по
50 мг 1 раз в сутки в виде ректальных
суппозиториев.
Была проведена дополнительна диагностика с целью выявления источников боли: ими оказались литические очаги в костях. Было принято решение о проведении дистанционной лучевой терапии и рекомендована лекарственная терапия эксеместаном по 25 мг/сут внутрь ежедневно + эверолимус по 10 мг/сут внутрь ежедневно, деносумаб в дозе 120 мг подкожно 1 раз в 4 недели. Болевой синдром был настольно тяжелым, что оказалось невозможным выполнить дистанционную лучевую терапию, поскольку пациентка не могла лежать на жесткой поверхности, и, как следствие, потребовалась новая ротация на более сильный анальгетик. Исходя из таблицы эквианальгетических доз опиоидных анальгетиков, назначен морфин в таблетках пролонгированного действия по 30 мг 2 раза в сутки, лорноксикам по 4 мг 2 раза в сутки, прегабалин по 75 мг 1 раз в сутки. После первой таблетки морфина пациентка отметила весьма значительное снижение интенсивности боли – на 40% (до 2 баллов), но через 2–3 ч возникли выраженная тошнота и рвота, в связи с чем дозу морфина снизили и назначили таблетки морфина лонг в дозе 10 мг по 2 таблетки 2 раза в сутки, а также метоклопрамид по 10 мг внутримышечно 2 раза в сутки, галоперидол в каплях до 3 мг/сут.
На фоне проводимой терапии рвота
нивелировалась, но оставалась выраженная, плохо купируемая тошнота. Дозу морфина снизили снова
до 10 мг 2 раза в сутки, на фоне чего
болевой синдром усилился, но был
«терпимым». Через 2–3 недели после окончания лучевой терапии боль
уменьшилась настолько, что стало
возможным отказаться от приема
всех анальгетиков, включая морфин.
В последующие 3 месяца боль оставалась слабой. Однако в ноябре 2021 г. у
пациентки возобновились сильные
боли в правой плечевой кости, она
начала прием морфина в таблетках
по 10 мг 2 раза в сутки, лорноксикама
по 4 мг 2 раза в сутки, прегабалина
по 75 мг 1 раз в сутки. Боль контролировалась плохо, а повышение дозы
морфина сопровождалось выраженной тошнотой и иногда рвотой.
В декабре 2021 года пациентке предложено участие в клиническом
исследовании III фазы (открытое
сравнительное многоцентровое рандомизированное исследование по изучению эффективности и безопасности препарата Тафалгин), получено
согласие. Уже через 1 ч после первой
инъекции препарата Тафалгин пациентка отметила полную редукцию
боли. Последующая инъекция потребовалась через 10 ч. Прорывов
боли, требующих дополнительных
анальгетиков, в 1-й день не зафиксировано. Ночью пациентка впервые
за долгое время спала спокойно. На
2-й день для полноценного контроля
боли введены 3 инъекции препарата
Тафалгин по 4 мг подкожно в 07:35,
16:00, 22:05, на фоне которых не выявлено никаких НЯ, а интенсивность
боли оставалась низкой. Эта схема
введения оказалась достаточно эффективной, со слов пациентки, она
впервые за последнее время достигла
такого хорошего анальгетического
эффекта, смогла выспаться, появился аппетит, увеличилась физическая
активность. Согласно условиям протокола с подобранной схемой
терапии препаратом Тафалгин пациентка выписана домой, ей выданы
препарат и дневники. За весь период
участия в исследовании болевой синдром купировался хорошо, прорывов боли не наблюдалось, ночной сон
восстановился, пациентка за время
наблюдения прибавила в весе на 5
кг за счет восстановления аппетита.
По данным лабораторных и инструментальных методов исследования,
а также оценки жизненно важных
функций организма клинически значимых отклонений не было зарегистрировано.
Заключение
По данным проведенных исследований, Тафалгин показал высокую
анальгетическую активность, при
этом значимо лучший профиль безопасности в сравнении с морфином, в том числе у пациентов, ранее
получавших опиоидные анальгетики [7,25]. Препарат может применяться для лечения выраженной
и умеренной боли в том числе при
злокачественных новообразованиях
у пациентов с длительным прогнозом жизни. Тафалгин может применяться в случаях, когда необходимо
избегать физического и психологического привыкания, воздействия на
трансформацию химиотерапевтических препаратов в печени и почках,
а также при неэффективности и непереносимости НПВС.
Список литературы:
1. van den Beuken-van Everdingen MH, de Rijke JM et al. Prevalence of pain in patients with cancer: A systematic review of the past 40 years. Ann Oncol 2007; 18:1437-1449.
2. Вершинина С.Ф., Стуков А.Н. Противоболевая терапия в онкологии // Психофармакол. биол. наркол. — 2007. — Т. 7, № 1. — С. 1471–1477.
3. World Health Organization. WHO Guidelines for the Pharmacological and Radiotherapeutic Management of Cancer Pain in Adults and Adolescents. Geneva: World Health Organization. 2018.
4. Верткин А.Л., Тополянский А.В., Гирель О.И. Эффективное обезболивание в онкологии. РМЖ. 2003;26:1455.
5. Фармакотерапия хронического болевого синдрома у взрослых пациентов при оказании паллиативной помощи в стационарных и амбулаторно-поликлинических условиях. Методические рекомендации. ФГБУ «ФНИМЦ им. П.А. Герцена» Минздрава России.М., 2015.
6. Тафалгин: инновационный анальгетик с уникальными свойствами. Инновационаня фармакотерапия. 2022;6(10);1-7.
7. Косоруков В. С., Абузарова Г. Р., Захарочкина Е. Р. и др. Тафалгин – отечественный инновационный тетрапептидный препарат для подкожного введения: обзор результатов клинических исследований I и II фаз. Опухоли головы и шеи 2022;12(2):89– 107.
8. Зотов П.Б. (2015). Хроническая боль в паллиативной онкологии: клинические аспекты оценки интенсивности алгий. Тюменский медицинский журнал, 17 (4), 35-42.
9. Абузарова Г.Р., Дарьялова С.Л.,
Сарманаева Р.Р. Нейропатическая
боль в онкологии. Онкология. Журнал
им. П.А. Герцена. 2013;2(4):86 90.
10.Абузарова Г.Р. (2018). Боль в онкологии: грани проблемы. Медицинский совет, (10), 97-100.
11.Когония Л.М., Новиков Г.А., Орлова Р.В., Сидоров А.В. Практические рекомендации по лечению хронического болевого синдрома у онкологических больных. Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2020 (том 10).
12.Caraceni A., Geoff rey H. et al. Use of opioid analgesics in the treatment of cancer pain: evidence-based recommendations from the EAPC. Lancet Oncol. 2012; 13 (2): 58—68.
13.Харченко Ю.А. Адекватная оценка боли – залог е` успешного лечения// Universum: Медицина и фармакология: электрон. научн. журн. 2014. № 4(5).
14.Зотов П.Б. (2015). Хроническая боль в паллиативной онкологии: клинические аспекты оценки интенсивности алгий. Тюменский медицинский журнал, 17 (4), 35-42.
15.Peker L, Celebi N, Canbay O, et al. Doctors’ opinions, knowledge and attitudes towards cancer pain management in a university hospital. Agri. 2008;20:20–30.
16.WHO guidelines for the pharmacological and radiotherapeutic management of cancer pain in adults and adolescents. 2018. Available at: https://www.who.int/publications/i/item/ 9789241550390.
17.Breivik H, Cherny N, Collett B, de Connno F, Filbet M, Foubert AJ, Cohen R, Dow L. Cancer-related pain: A panEuropean survey of prevalence, treatment, and patient attitudes. Ann Oncol 2009; 20:1420-1433.
18.Bennett M., Paice J.A., Wallace M. Pain and opioids in cancer care: benefits, risks, and alternatives. Am Soc Clin Oncol Educ Book 2017;37:705–13.
19.Абузарова, Г. Р., Хороненко, В. Э., & Сарманаева, Р. Р. (2015). Опиоидные анальгетики для терапии хронической боли у онкологических больных в России. История вопроса и перспективы. Анестезиология и реаниматология, 60 (1), 19-25.
20.Mercadante S. Options for treating pain in cancer patients with dysphagia. Drugs 2017;77(6):629–35.
21.П о л у н и н а Т . Е . , МаевИ.В.Лекарственный гепатит // Consilium medicum. Приложение к журналу Consilium medicum. Гастроэнтерология. 2008. №1. С.3–10.
22.Fürst P., Lundström S., Klepstad P., Strang P. Continuous subcutaneous infusion for pain control in dying patients: experiences from a tertiary palliative care center. BMC Palliat Care 2020;19(1):172.
23.Абузарова Г.Р., Лапина С.Е., Сарманаева Р.Р. «Прорывная боль» – новый термин, не новая проблема. Российский журнал боли 2017;54(3–4):8–17.
24.Paice JA, Portenoy R, Lacchetti C, et al. Management of chronic pain in survivors of adult cancers: American Society of Clinical Oncology clinical practice guideline. J Clin Oncol. 2016; 34: 3325-3345.
25.Абузарова Г.Р., Косоруков В.С., Гамзелева О.Ю., Сарманаева Р.Р., Бражникова Ю.В. Эффективность и безопасность препарата Тафалгин у пациентов с онкологической болью. Результаты открытого сравнительного многоцентрового рандомизированного клинического исследования. Онкология. Журнал им. П.А. Герцена. 2022;11(5):38–48.
26.Yaksh TL, Woller SA, Ramachandran R, Sorkin LS. The search for novel analgesics: targets and mechanisms. F1000Prime Rep. 2015 May 26;7:56.
27.Ì. Broccardo, V. Erspamer, G. Falconieri, et al. Br. J. Pharmacol., 73 (3), 625 – 631 (1981); doi: 10.1111 / j.1476- 5381. 1981.tb16797.
28.Иванова Е.А., Воронина Т.А., Коробов Н.В., Косоруков В.С. Изучение длительности и дозозависимости анальгетического действия тетрапептида H-Tyr-D-Arg-Phe-Gly-NH2 (Тафалгин) - в сравнении с морфина гидрохлоридом. Химико-фармацевтический журнал. 2022; 56(9):8-12.
29.Колесников Ю.А., Беспалов А.Ю., Драволина О.А., Звартау Э.Э. Фармакология мю-опиоидов: пути развития. СПб: ФГБОУ ВО ПСПбГМУ им. акад. И.П. Павлова, 2021, с. 16.
30.Абузарова Г.Р., Сарманаева Р.Р., Алексеева Г.С., Бражникова Ю.В. Клинический случай применения нового селективного μ1-опиоидного анальгетика Тафалгин при лечении хронической боли онкологического генеза. Современная Онкология. 2022;24(3):314–319.
31.Государственный реестр лекарственных средств. Сайт https:// grls.rosminzdrav.ru/Grls_View_ v2.aspx?routingGuid=44a02fe4-6c34- 4405-a96a-986f4879b61e Дата обращения 23.04.2023.
32.Абузарова Г.Р., Сарманаева Р.Р.,
Алексеева Г.С., Бражникова Ю.В.
Клинический случай применения
нового селективного μ1-опиоидного
анальгетика Тафалгин при лечении
хронической боли онкологического генеза. Современная Онкология.
2022;24(3):314–319.
ЭТО ИНТЕРЕСНО/ЧТО НУЖНО ЗНАТЬ О ТРЕХ РАСПРОСТРАНЕННЫХ ЗАБЛУЖДЕНИЯХ О ЕДЕ И РИСКЕ РАЗВИТИЯ РАКА
Автор: Jyoti Patel
MD, FASCO, главный редактор Cancer.Net
Еда – это нечто глубоко личное.
Наш рацион отражает нашу культурную самобытность, отдает дань
уважения нашим предкам, помогает нам общаться друг с другом
и служит для физического и эмоционального питания. С какой бы
стороны вы ни посмотрели на это,
питание является важной частью
нашей жизни.
Часто повышенное внимание
уделяется питанию в связи с профилактикой, лечением и выздоровлением от рака. Для многих онкологических пациентов еда – это
одна из немногих вещей, которую
они могут контролировать во время лечения.
Мы знаем, что соблюдение здоровой диеты и поддержание здорового веса важны для снижения
риска развития злокачественной
опухоли. Но эти меры также могут
помочь онкологическим больным
лучше переносить специфическое
лечение – лучевую и химиотерапию, другие виды системного лечения и оперативное вмешательство.
Каждое из них способно повлиять
на аппетит и энергию, подвергая
пациентов риску недоедания и развития сильной слабости. Это может помешать достижению цели
поддержания постоянного веса во
время рака.
Несмотря на обилие разнообразных «советов от знатоков», нет ни
одного продукта, который снизил
бы риск развития рака или избавил
бы от уже существующей опухоли.
Более важно сосредоточиться на сбалансированной диете, которая включает достаточное количество белка,
полезных жиров, цельного зерна, а
также витаминов и минералов.
Вот некоторые из распространенных
мифов о раке и еде, которые должны
быть развенчаны.
Миф №1: Важно «уморить» раковые
клетки голодом, исключив сахар
Правда: да, глюкоза питает все клетки организма, включая опухолевые.
Даже если вы не потребляете сахар
или углеводы, ваш организм будет
расщеплять жир и белок, чтобы для
обеспечения себя этим важнейшим
источником энергии. Таким образом, исключать сахар из своего рациона не только сложно, не нужно,
но и просто невозможно. Тем не
менее, ограничение сахара важно
для предотвращения чрезмерного
увеличения веса, которое реально
увеличивает риск развития рака. Сосредоточьтесь на том, чтобы избегать
избытка сахара и вместо этого выбирайте сложные углеводы из цельных
пищевых источников.
Миф №2: «Суперпродукты» могут
вылечить рак.
Правда: хотя здоровое питание,
богатое фруктами и овощами, цельнозерновыми продуктами и сложными углеводами, может снизить
риск развития рака, употребление
всего 1 или 2 «суперпродуктов»
не защитит вас от болезни. Суперпродуктами порой называют чернику, брокколи, авокадо, малину
и другие фрукты, овощи или специи, такие как, например, куркума.
Это правда, что здоровая, сбалансированная диета может помочь
снизить риск развития рака, но
маловероятно, что какой-то один
продукт сам по себе будет иметь
большое значение.
Миф №3: Держитесь подальше от соевых продуктов.
Правда: употребление в пищу соевых продуктов не влияет на риск
развития рака, в том числе рака молочной железы. Соевые продукты,
такие как тофу и соевое молоко,
содержат изофлавоны. Изофлавоны могут имитировать действие эстрогена, но имеют гораздо более сглаженные эффекты.
Немалое число исследований
показали, что ни соевые продукты, ни изофлавоны не влияют на
риск развития рака.
Источник:
Jyoti Patel. What
to Know About 3 Common
Misconceptions Around Food and
Cancer Risk. Cancer.Net. Published
online: April 25, 2023.