Дорогие коллеги, дорогие друзья!
Весна набирает ход, вступая в наши города. Солнечный свет встречает нас утром, пробиваясь сквозь шторы, и провожает нас вечером с работы. Еще несколько теплых дней – и растают сугробы, высохнет слякоть, и немедленно пробьется живучая молодая зелень меж слежавшихся прошлогодних листьев, заполняя чернеющие проталины газонов. Настоящая весна еще впереди, жаждущая...

Ян Вермеер. Бокал вина. 1660.
Холст, масло. 66.3 × 76.5 см.
Саша Чёрный.
Уже с панелей смерзшуюся грязь, Ругаясь, скалывают дворники лихие, Уже ко мне забрел сегодня «князь», Взял теплый шарф и лыжи беговые... «Весна, весна! – пою, как бард,– Несите зимний хлам в ломбард».
МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКАЯ ДИАГНОСТИКА: КОНТРОЛЬ КАЧЕСТВА
Российское общество клинической онкологии в течение 12 лет проводит программу «Совершенствование молекулярно-генетической диагностики в Российской Федерации с целью повышения эффективности противоопухолевого лечения». Более 150 000 тестов выполнено за этот период при 9 нозологических формах рака. Благодаря этому у нескольких десятков тысяч пациентов появилась
RUSSCO ПРОВЕЛО СОВЕЩАНИЕ РОССИЙСКИХ ГЕНЕТИКОВ
Российское общество клинической онкологии (RUSSCO) проводит в Москве рабочее совещание с партнерами Национальной Программы RUSSCO «Совершенствование молекулярно-генетической диагностики в Российской Федерации с целью повышения эффективности противоопухолевого лечения»...
11 лет СОВЕРШЕНСТВОВАНИЕ МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКОЙ ДИАГНОСТИКИ В РОССИЙСКОЙ ФЕДЕРАЦИИ
http://www.cancergenome.ru/
ОНКОЛОГ Д.Г. ЗАРИДЗЕ: «БОРЬБА С ВЕЙПАМИ ПРИВЕЛА К УВЕЛИЧЕНИЮ ЗАБОЛЕВАЕМОСТИ РАКОМ ЛЕГКОГО ОТ КУРЕНИЯ ТРАДИЦИОННЫХ СИГАРЕТ»
Об этом заявил известный онколог, доктор медицинских наук, профессор, член-корреспондент РАМН Давид Георгиевич Заридзе на закрытом заседании Экспертного Совета в Госдуме по развитию конкуренции на рынках никотиносодержащей продукции...

КРАТКИЙ ОБЗОР КОНФЕРЕНЦИИ ASCO GU 2023: ГЕРМИНОГЕННЫЕ ОПУХОЛИ И РАК ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
В феврале 2023 года прошел очередной конгресс по злокачественным опухолям мочеполовой системы Американского общества клинического онкологии (ASCO GU 2023). Вашему вниманию...

РЕГИОНАЛЬНОЕ ОТДЕЛЕНИЕ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ АЛТАЙСКОГО КРАЯ
Алтайский край (АК) является крупным аграрным субъектом Российской Федерации (РФ), расположенным на юго-востоке Западной Сибири, в 3419 км от Москвы...

XXVII РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС 2023
14 - 16 НОЯБРЯ 2023 МОСКВА

ПУТЕШЕСТВИЕ ИЗ ЗОНЫ КОМФОРТА И ОБРАТНО
Всем привет! Меня зовут Елена Глазкова, в настоящий момент я заведую круглосуточным химиотерапевтическим стационаром в Коммунарке, но так было не всегда…
PACIFIC В РЕАЛЕ: ПОСЛЕДНИЕ ДАННЫЕ ИССЛЕДОВАНИЯ PACIFIC-R
В февральском номере журнала Journal of Thoracic Oncology были представлены обновленные результаты известного исследования PACIFIC-R [1]. Опираясь на данные PACIFIC [2], изменившего обычную тактику ведения больных местнораспространенным немелкоклеточным раком легкого (НМРЛ) III стадии и определившего год консолидирующей терапии дурвалумабом после радикальной...
НИНТЕДАНИБ В ЛЕЧЕНИИ РАДИАЦИОННОГО ПНЕВМОНИТА: РЕЗУЛЬТАТЫ РАНДОМИЗИРОВАННОГО ИССЛЕДОВАНИЯ 2 ФАЗЫ
Радиационный пневмонит – немалая проблема, которую зачастую сами радиотерапевты не видят, поскольку «классические» сроки развития этого грозного осложнения лучевой терапии на область грудной клетки превышают 2-4 недели после ее окончания, и только особая повышенная чувствительность легочной паренхимы, о которой пока невозможно знать заранее, становится причиной...
ИММУНОРАДИОТЕРАПИЯ ПРИ ОЛИГОМЕТАСТАТИЧЕСКОМ РАКЕ ПОЧКИ: ИССЛЕДОВАНИЕ RAPPORT
Олигометастатический рак в настоящее время находится в фокусе наиболее пристального внимания онкологов всего мира. Это та клиническая ситуация, когда максимально агрессивное воздействие оказывается сродни радикальному при неметастатических опухолевых процессах в большинстве случаев, стирая грань между паллиативным и радикальным лечением.
ПРОМЕЖУТОЧНЫЕ ДАННЫЕ ИССЛЕДОВАНИЯ PROSPERITYПРОСПЕКТИВНОГО НАБЛЮДАТЕЛЬНОГО ИССЛЕДОВАНИЯ ПО ОЦЕНКЕ КЛИНИЧЕСКИХ ИСХОДОВ, СХЕМ ЛЕЧЕНИЯ И ХАРАКТЕРИСТИК ПАЦИЕНТОК С HR+/HER2-РАСПРОСТРАНЕННЫМ РМЖ, ПОЛУЧАЮЩИХ ЛЕЧЕНИЕ С ПРИМЕНЕНИЕМ ПРЕПАРАТА РИБОЦИКЛИБ, ПРЕПАРАТА АЛПЕЛИСИБ, ЭНДОКРИННОЙ ТЕРАПИИ ИЛИ ХИМИОТЕРАПИИ В УСЛОВИЯХ РУТИННОЙ КЛИНИЧЕСКОЙ ПРАКТИКИ В РОССИИ
Лекарственную терапию метастатического гормонозависимого HER2- отрицательного рака молочной железы...

«ЕСЛИ НА КЛЕТКЕ СЛОНА ПРОЧТЁШЬ НАДПИСЬ «БУЙВОЛ», НЕ ВЕРЬ ГЛАЗАМ СВОИМ!» (К. Прутков)
Добрый день, дорогие коллеги. Продолжая цикл «охотничьих записок», я впервые (к стыду своему) задумался над смыслом этой фразы К. Пруткова, которая всегда мне казалась абсолютно понятной.
ProtecT: ДВЕНАДЦАТЬ ЛЕТ НАБЛЮДЕНИЯ
Исследования, произведенные на основании аутопсий, демонстрируют, что опухоли простаты возникают гораздо раньше и гораздо чаще, нежели демонстрирует любая статистика, и при этом мужчины в течение длительного времени не имеют ни малейшего понятия об их существовании. Примерно у 29% мужчин в возрасте от 30 до 40 лет обнаруживаются маленькие злокачественные...
СОВЕТЫ КАТАЛОГИЗАТОРА
Мировая литература изобилует огромным количеством великолепных произведений, и наверняка многие из нас мысленно жалели, что одной жизни не хватит, чтоб прочитать всё, что хотелось бы. Ежегодно появляются новые авторы, публикуются сотни тысяч новых книг, и разобраться в подобном многообразии порой неимоверно сложно. Можно ориентироваться на списки номинантов и...
БЕГ НА ДЛИННЫЕ ДИСТАНЦИИ НЕ ИЗНАШИВАЕТ СУСТАВЫ
Большое исследование среди марафонцев предполагает, что бег на длинные дистанции не приводит выраженному износу суставов, который спровоцировал бы артрит коленного или тазобедренного суставов. Исследователи считают, что эти результаты противоречат давно устоявшейся догме о том, что бег увеличивает риск развития подобных артритов...
ЛУЧЕВАЯ ТЕРАПИЯ ПРИ БОЛЕЗНИ АЛЬЦГЕЙМЕРА: ДАННЫЕ ПИЛОТНОГО КЛИНИЧЕСКОГО ИССЛЕДОВАНИЯ
Результаты этого маленького пилотного исследования были только что – 17 марта 2023 года – опубликованы в «Красном журнале» ASTRO (International Journal of Radiation Oncology, Biology and Physics), а уже успели вызвать немало обсуждений и споров между онкологами различных стран, от принятия подобного подхода как чрезвычайно интересного и многообещающего до...
Анонс
-

30-31 Марта 2023
РАК МОЛОЧНОЙ ЖЕЛЕЗЫ
X КОНФЕРЕНЦИЯ RUSSCO
-

13-14 Апреля 2023
РАК ЛЕГКОГО И ДРУГИЕ ОПУХОЛИ ГРУДНОЙ КЛЕТКИ
IX КОНФЕРЕНЦИЯ RUSSCO
-

20-21 Апреля 2023
ОНКОУРОЛОГИЯ
V КОНФЕРЕНЦИЯ RUSSCO
-

25-26 Майя 2023
СОПРОВОДИТЕЛЬНАЯ ТЕРАПИЯ
IX КОНФЕРЕНЦИЯ RUSSCO
-

22-23 Июня 2023
«ЛУЧШЕЕ ПО МАТЕРИАЛАМ КОНФЕРЕНЦИИ ASCO». ПЕРВЫЙ МОЛОДЕЖНЫЙ ОНКОЛОГИЧЕСКИЙ САММИТ
КОНФЕРЕНЦИЯ
-

14 - 16 НОЯБРЯ 2023 МОСКВА
XXVII РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС 2023
XXVII РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС 2023
Дорогие коллеги, дорогие друзья!
Весна набирает ход, вступая в наши города. Солнечный свет встречает нас утром, пробиваясь сквозь шторы, и провожает нас вечером с работы. Еще несколько теплых дней – и растают сугробы, высохнет слякоть, и немедленно пробьется живучая молодая зелень меж слежавшихся прошлогодних листьев, заполняя чернеющие проталины газонов. Настоящая весна еще впереди, жаждущая любви и необъяснимой радости, красок, цветов, особого весеннего воздуха с привкусом дымка с близлежащих дач, новых встреч, новых поездок, новых впечатлений.
Российское общество клинической онкологии ждет вас всех на
своих Больших конференциях
в марте, апреле и мае. Немалое количество интересных тем в отношении онкогинекологии, онкоурологии, рака молочной железы,
рака легкого и сопроводительной
терапии будет обсуждено на этих
важных для нас мероприятиях.
И не забудьте, что работа по программе будущего ноябрьского
XXVII Российского онкологического конгресса начата, и мы
ждем ваших предложений по темам сессий, пленарных лекций
и докладов с возможным вашим
участием, дорогие коллеги, ведь
это отличный шанс для каждого
из нас не просто высказать свое
мнение, поучаствовать в дискуссии, но и оставить свое имя в
истории конгресса в виде публикации или видеозаписи.
Мы надеемся, что мартовский
номер газеты, который выйдет
не только в онлайн формате, но
и в печатном виде, предоставит
вам немало интересной информации и о работе общества и его
региональных отделений (в фокусе марта – Алтай!), и по данным
исследований крупных научных
журналов и конференций, и для
души – которой как никогда в
течение года хочется тепла и радости. Мы от всего сердца шлем
наши мартовские поздравления
дорогим коллегам – прелестным
женщинам, онкологам различных
специальностей, хирургам, диагностам – всем, кто читает этот
номер, и желаем весенней, интуитивной, подсознательной радости
и абсолютной гармонии в каждой
минуте этой весны!
Ваша команда RUSSCO
Ян Вермеер. Бокал вина. 1660.
Холст, масло. 66.3 × 76.5 см. Берлинская картинная галерея, Берлин, Германия
Уникальная экспозиция 28 (из имеющихся 35) работ Яна Вермеера проходит
в настоящее время (с 4 февраля по 4 июня 2023 года) в Rijksmuseum, Амстердам.

Саша Чёрный.
Пробуждение весны. 1909 г.
***
Вчера мой кот взглянул на календарь
И хвост трубою поднял моментально,
Потом подрал на лестницу, как встарь,
И завопил тепло и вакханально:
«Весенний брак! Гражданский брак!
Спешите, кошки, на чердак...»
И кактус мой – о, чудо из чудес! –
Залитый чаем и кофейной гущей,
Как новый Лазарь, взял да и воскрес
И с каждым днем прет из земли всё пуще.
Зеленый шум... Я поражен:
«Как много дум наводит он!»
Уже с панелей смерзшуюся грязь,
Ругаясь, скалывают дворники лихие,
Уже ко мне забрел сегодня «князь»,
Взял теплый шарф и лыжи беговые...
«Весна, весна! – пою, как бард,–
Несите зимний хлам в ломбард».
Сияет солнышко. Ей-богу, ничего!
Весенняя лазурь спугнула дым и копоть,
Мороз уже не щиплет никого,
Но многим нечего, как и зимою, лопать...
Деревья ждут... Гниет вода,
И пьяных больше, чем всегда.
Создатель мой! Спасибо за весну! –
Я думал, что она не возвратится,–
Но... дай сбежать в лесную тишину
От злобы дня, холеры и столицы!
Весенний ветер за дверьми...
В кого б влюбиться, черт возьми!
МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКАЯ ДИАГНОСТИКА: КОНТРОЛЬ КАЧЕСТВА
Российское общество клинической
онкологии в течение 12 лет проводит программу «Совершенствование молекулярно-генетической диагностики в Российской Федерации
с целью повышения эффективности противоопухолевого лечения».
Более 150 000 тестов выполнено за
этот период при 9 нозологических
формах рака. Благодаря этому у нескольких десятков тысяч пациентов
появилась возможность получать
инновационную таргетную и иммунотерапию. В последние два года
Российское общество клинической
онкологии осуществляет программу
по сбору данных о частоте встречаемости мутаций в опухолях различных локализаций, выполняет
анализ полученных данных и на его
основании проводит раунды по контролю качества.
В феврале 2023 года завершен 5 раунд внешнего контроля качества
тестирования мутации EGFR лабораторий. В этом раунде по контролю
качества приняли участие 9 молекулярно-генетических лабораторий.
Целью контрольного раунда было
определение валидности всех этапов выполнения анализа – от верификации поступившего образца до
выдачи заключения по результатам
исследования.
Лабораториям, занимающимся в
реальной практике соответствующим тестированием, были предложены контрольные материалы,
приготовленные из фиксированных
в формалине и залитых в парафин
образцов биопсийного/операционного материала, содержащего опухолевую ткань. Все образцы были
приготовлены в патоморфологическом отделении онкологической
клиники референсного класса с
соблюдением правил первичной
преаналитической обработки, верифицированы квалифицированным онкопатологом, подтверждено
наличие опухолевой ткани в различном процентном соотношении
(от 15% до 80%). Мутационный
статус гена EGFR был определен
в двух молекулярно-генетических
лабораториях экспертного класса с
помощью коммерческих наборов,
имеющих регистрацию на территории РФ: набора для выделения
ДНК cobas® DNA Sample Preparation
Kit и набора для ПЦР в реальном
времени cobas EGFR Mutation Test
v2 компании Roche Diagnostics и с
помощью валидированной панели
для высокопроизводительного секвенирования. Выбраны 15 образцов
с полным совпадением статуса гена
EGFR. Контрольные образцы были
изготовлены в виде четырех 5-микронных срезов на предметных стеклах, последний из них окрашивался гематоксилином и эозином для
контроля достаточного количества
опухолевой ткани и проведения макродиссекции по необходимости.
На проведение тестирования образцов лабораториям давался временной промежуток 21 календарный
день. На три образца участник контроля качества формировал заключение с интерпретацией результата.
Экспертная группа проводила оценку в баллах по каждому этапу тестирования и, при необходимости,
давала рекомендации.
Для проведения экспертной оценки
результатов были приглашены пять
высококвалифицированных специалистов – руководители и ведущие
специалисты пяти лабораторий экспертного/референсного класса, в
течение многих лет занимающихся
данным видом тестирования, являющиеся руководителями и членами
правления профессиональных организаций, специализирующихся в
генетической диагностике.
Экспертом в раунде контроля качества EGFR была заведующая молекулярно-биологической лабораторией ГБУЗ МГОБ №62 г. Москвы
к.м.н. Демидова И.А. Экспертом
были подготовлены протоколы по
прохождению контроля, сопоставимые с европейскими требованиями
к контролю качества.
Мы благодарим экспертную группу
молекулярных генетиков за помощь
в проведении раунда контроля качества, интерпретацию результатов
и оценку, а также лично Демидову
Ирину Анатольевну за руководство
этим раундом контроля качества.
Поздравляем с успешным прохождением контроля качества 7 лабораторий следующих медицинских
учреждений:
• Государственное бюджетное учреждение здравоохранения города Москвы «Московский клинический научный центр имени А.С. Логинова Департамента здравоохранения города Москвы»
• Санкт-Петербургское государственное бюджетное учреждение здравоохранения «Городской клинический онкологический диспансер»
• Государственное бюджетное учреждение здравоохранения «Тамбовский областной онкологический клинический диспансер»
• Государственное бюджетное учреждение здравоохранения «Волгоградский областной клинический онкологический диспансер»
• Государственное бюджетное учреждение здравоохранения Нижегородской области «Нижегородский областной клинический онкологический диспансер»
• Общество с ограниченной ответственностью «Геномед»
• Общество с ограниченной ответственностью «Гемотест»
Соколова Н.С., специалист по
программе молекулярно-генетической диагностики Российского
общества клинической онкологии

RUSSCO ПРОВЕЛО СОВЕЩАНИЕ РОССИЙСКИХ ГЕНЕТИКОВ
Российское общество клинической онкологии (RUSSCO) проводит в
Москве рабочее совещание с партнерами Национальной Программы
RUSSCO «Совершенствование молекулярно-генетической диагностики
в Российской Федерации с целью повышения эффективности противоопухолевого лечения».

Представители 35 лабораторий из различных регионов страны собрались в НМИЦ онкологии им. Н.Н. Блохина Минздрава России, где ознакомились с работой молекулярно-генетической лаборатории Центра,
заслушали отчет RUSSCO о результатах реализации Программы, в том
числе контроля качества тестирования и образовательных программ в
2022 году, а также обсудили регламенты молекулярно-генетических тестирований.

Многолетняя практика проведения подобных рабочих совещаний подтверждает их важность не только с точки зрения обмена информацией и
опытом, но и в целях расширения возможностей молекулярно-генетического тестирования с одновременным улучшением качества проводимых
тестов.
11 лет СОВЕРШЕНСТВОВАНИЕ МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКОЙ ДИАГНОСТИКИ В РОССИЙСКОЙ ФЕДЕРАЦИИ

ОНКОЛОГ Д.Г. ЗАРИДЗЕ: «БОРЬБА С ВЕЙПАМИ ПРИВЕЛА К УВЕЛИЧЕНИЮ ЗАБОЛЕВАЕМОСТИ РАКОМ ЛЕГКОГО ОТ КУРЕНИЯ ТРАДИЦИОННЫХ СИГАРЕТ»
Об этом заявил известный онколог, доктор медицинских наук,
профессор, член-корреспондент
РАМН Давид Георгиевич Заридзе
на закрытом заседании Экспертного Совета в Госдуме по развитию конкуренции на рынках никотиносодержащей продукции.
По его словам, борьба с вейпами
привела к увеличению распространенности курения традиционного табака. Это в свою очередь
привело к росту заболеваемости
раком легкого и высокой смертности населения.
«У нас в первый раз за много лет
выросла заболеваемости раком
легкого среди женщин. Это указывает на то, что распространенность курения среди женщин
растет, иначе быть не может.
Об этом свидетельствует и
статистика ВЦИОМ: с 2016
года показатель среди женщин
вырос с 17% до 21%. Значит, последние пять лет, пока мы боролись с вейпами, а не с курением
сигарет, получился вот такой
плачевный результат», – рассказал Заридзе.
«Совершенно очевидно, что
электронные системы нагревания табака (ЭСДН) наносят
значительно меньше вреда здоровью. Когда говорят, что мы
еще мало знаем об этих продуктах, то это не так. Мы знаем
достаточно. Известно, что лицензируемый, легальный товар
рака не вызывает. Да, наверняка они вызывают патологические изменения, особенно они
опасны для детей и подростков,
беременных женщин. Но они
могут быть полезны для курильщиков, которые переходят
целиком от курения к потреблению электронных сигарет», –
отметил Заридзе.
Помимо этого, онколог высказался и о регулярных неподтвержденных случаях смертей подростков от курения ЭСДН. По мнению
Заридзе, статьи СМИ на эту тему
вряд ли можно воспринимать
серьезно. Ведь что касается безопасности ЭСДН, то по лицензированным продуктам существуют
серьезные и проверенные данные:
умереть от использования качественного никотиносодержащего
изделия невозможно – устройства не содержат концентрации
веществ, которые могут мгновенно привести к летальному исходу.
«Случай с мальчиком в Барнауле, который, якобы, умер от
электронных сигарет, опровергли. Доказали, что это не
так. Да даже если бы и так, то
сколько человек умирает от паленой водки, от курения – это
миллионы людей! Если что-то
запрещать, то в первую очередь надо запретить сигареты.
Логика требует именно этого.
Мой опыт и осведомленность
подсказывают, что последние
лет пять, а то и больше, Дума
борется с вейпами, а не с курением традиционных сигарет, что
привело к стагнации борьбы с
курением в России с соответствующими отрицательными
последствиями», – заключил онколог.
Реальная причина смертей
подростков
Эксперты в области никотиносодержащей продукции обратили внимание на одну из причин
смерти российских подростков,
это разновидность токсикомании – сниффинг. Во всех происшествиях, когда подросток
якобы умер от курения вейпа,
всегда рядом с телом находят
сигарету, баллончик с газом или
дезодоранты. Однако паралич
дыхательных путей, отек легких
и мозга, остановка сердца больше похожи именно на симптомы
жертв сниффинга.
Сниффинг – это практика, во время которой ребенок вдыхает газ
из зажигалок или баллончиков,
в том числе из дезодорантов для
их заправки. Нет определенной
смертельной дозы – дети могут
умереть от удушья при первом
применении. Группа риска – дети
от 9-17 лет. Зажигалки и газовые
баллончики для их заправки
можно купить на каждом шагу.
На продажу нет ограничения по
возрасту. В школах ведется просвещение насчет употребления
алкоголя, табака и наркотиков,
но мало уделяется проблеме токсикомании. Вдыхая газ, ребенок
получает чувство опьянения и
эйфории. В состав баллончиков
входят пропан, бутан и изобутан. Их не относят к наркотикам
и группе особой токсичности. В
этом и вся беда их доступности.
При вдыхании газ сразу попадает
в кровь, минуя все защитные барьеры: печень и ЖКТ. У организма просто нет шансов на защиту
от кислородного голодания, которое провоцирует газ, вытесняя
кислород. Происходит гипоксия головного мозга, что ведет
к галлюцинациям, странным и
острым ощущениям, изменению
сознания.
Так, по данным из открытых источников, с 2016-2022 гг. от интоксикации умерло более тысячи
детей.
«Очевидно, что молодые люди
умирают не от курения ЭСДН, а
от вдыхания паров более ядовитых веществ. Безусловно, надо
комплексно бороться с подростковой зависимостью и токсикоманией, но не путем запретов, а
конструктивными методами.
Нужно проводить грамотную
воспитательную работу среди
молодежи, а также создать целостную систему государственного регулирования отрасли
ЭСДН. Запрет вейпов может
привести к еще большему развитию черного рынка, на котором
будет реализовываться некачественный и взрывоопасный товар», – рассказал директор СПИНИ Дмитрий Владимиров.
Эксперты отрасли считают: безответственное и халатное отношение родителей к своим детям
также является причиной опасных увлечений подростков. Важно контролировать незаконный
оборот различной продукции в
школах и применять жесточайшее наказание для школьников,
которые этим занимаются, и их
родителей.
«Родители, особенно в переходном возрасте, должны проявлять повышенный интерес к
жизни своих детей, обращать
внимание на их самочувствие,
интересоваться увлечениями и
хобби, беседовать, а самое главное – рассказывать о вреде употребления наркотиков, алкоголя и курения, к чему это может
привести. Когда будет проводиться грамотная и планомерная работа с подростками на
всех уровнях, начиная от семьи
и заканчивая государственными учреждениями, мы добьемся
того, что искореним проблему
детской токсикомании», – заключил психолог Александр Лысенко.
КРАТКИЙ ОБЗОР КОНФЕРЕНЦИИ ASCO GU 2023: ГЕРМИНОГЕННЫЕ ОПУХОЛИ И РАК ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
Автор: Румянцев Алексей Александрович
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России,
кандидат медицинских наук, Москва
В феврале 2023 года прошел очередной конгресс по злокачественным
опухолям мочеполовой системы
Американского общества клинического онкологии (ASCO GU 2023).
Вашему вниманию – краткий обзор
примечательных исследований с
данной конференции. Естественно,
он не является всеобъемлющим – в
целом конференция была на редкость богата на хорошие доклады.
Здесь – про рак предстательной железы и герминогенные опухоли.
Хирургическое лечение
при II стадии семиномы:
промежуточный анализ
исследования COTRIMS
Семиномные герминогенные
опухоли – пример одной из наиболее прогностически благоприятных злокачественных опухолей
человека, излечение возможно у
90% и более пациентов даже при
распространенных стадиях заболевания. По этой причине внимание исследователей во многом
переключилось на разработку
менее токсичных подходов к лечению, направленных на максимальное сохранение качества
жизни пациенток и минимизацию отдаленных негативных последствий терапии. В проспективном исследовании COTRIMS
приняли участие 30 пациентов с
IIA/IIB стадиями семиномы, которые ранее не получали химиотерапию или лучевую терапию;
оценивалась эффективность выполнения «трафаретной» забрюшинной лимфаденэктомии. Пациенты с распространенной IIB
или IIC стадиями семиномы исключались из исследования, равно как и пациенты с позитивными опухолевыми маркерами. При
медиане наблюдения 29,4 мес.
прогрессирование заболевания
было отмечено у 2 (6,7%) пациентов, что меньше заложенного
в статистическую гипотезу исследования 20%. Авторы работы
отмечают высокую безопасность
выполняемых хирургических
вмешательств, в частности, развитие осложнений >3a степени не
было отмечено ни у одного пациента [1].
Почему это интересно: возможность внедрения в практику менее
токсичных подходов к лечению
– очень ценная опция для пациентов с высокой вероятностью излечения, хотя очевидно, что хирургическое лечение и химиотерапия
обладают совершенно различными
спектрами отдаленных осложнений. Без рандомизированных исследований поставить точку в этом
вопросе не получится. Еще один
заслуживающий внимания аспект
в этом исследовании – отсутствие
опухолевого роста в удаленных
лимфатических узлах у 2 (6,7%)
пациентов, что подчеркивает важность корректной интерпретации
радиографических находок, чтобы
избежать ненужного лечения.
Обновленная классификация
риска развития рецидива
при I стадии семиномных
герминогенных опухолей
Вопрос необходимости проведения адъювантной терапии при I
стадии семиномы всегда вызывает некоторую головную боль у
медицинских онкологов. С одной
стороны, 1 курс карбоплатина не
обладает доказанной отдаленной
токсичностью и почти во всех случаях прекрасно переносится пациентами, с другой – зачем его проводить, если «почти наверняка» у
пациента и так не будет рецидива,
а если и будет – «почти наверняка»
его получится вылечить.
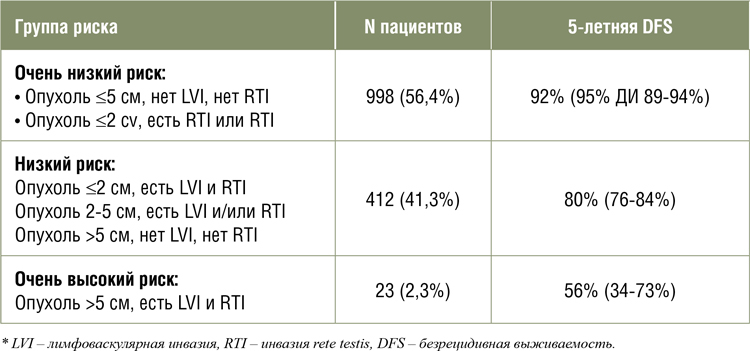
В представленном многоцентровом исследовании была разработана новая прогностическая
модель, предсказывающая риск
прогрессирования при первой
стадии семиномы. Разработанная модель основана на трех факторах, рутинно определяемых в
клинической практике: размер
опухоли, наличие лимфоваскулярной инвазии (LVI) и инвазии
rete testis (RTI). В исследовании
приняли участие 1016 пациентов
с I стадией семиномы, с медианой
наблюдения 7,7 лет; прогрессирование опухолевого процесса было
зарегистрировано у 149 (14,7%)
пациентов. Путем проведения
многофакторного регрессионного анализа авторы смогли поделить всех пациентов на 3 группы
риска развития рецидива заболевания, результаты – в таблице
ниже [2].
Почему это интересно: выглядит как адекватный инструмент
оценки риска прогрессирования
при I стадии семиномы, превосходящий существующую модель.
Адъювантная терапия важная
для пациентов с очень высоким
риском, явно не нужна при очень
низком риске и может обсуждаться при низком риске – с учетом
пожеланий пациента и возможности адекватного динамического
наблюдения (читать как «с учетом комплаентности пациента»).
Ограничения этого исследования
– малое количество пациентов в
группе высокого риска, и, безусловно, хотелось бы увидеть внешнюю валидацию модели.
KEYNOTE-921: пембролизумаб
и доцетаксел при
метастатическом
кастрационно-резистентном
раке предстательной железы
– рандомизированное
исследование III фазы
Никогда раньше и вот опять –
«неожиданно» негативное исследование, пембролизумаб провалился при раке предстательной
железы. В исследование III фазы
KEYNOTE-921 было включено
1030 предлеченнных пациентов
с метастатическим кастрационно-резистентным раком предстательной железы (КРРПЖ).
Медиана выживаемости без прогрессирования (ВБП) составила
8,6 мес. в группе пембролизумаба
и доцетаксела и 8,3 мес. в группе
плацебо и доцетаксела (ОР 0,85;
p=0,033), медиана общей выживаемости (ОВ) – 19,6 и 19,0 мес. соответственно (ОР 0,86; p=0,168).
Так как в качестве первичной конечной точки была выбрана комбинация ВБП и ОВ [3].
Почему это интересно: очередное негативное исследование по
изучению роли иммунотерапии
при заболевании, которое как
будто бы и изначально не демонстрировало чувствительности к
этому варианту воздействия. При
этом небольшое увеличение медианы ВБП может свидетельствовать, что каким-то редким пациентам иммунотерапия все-таки
помогает. Но в целом – «большая»
3 фаза, и все усилия напрасны.
Как и деньги. Вероятно, возможности иммунотерапии вышли на плато, и пора прекратить ее исследования в неотобранных популяциях пациентов?
TALAPRO-2: талазопариб
+ энзалутамид при
кастрационно-резистентном
раке предстательной железы
Результаты плацебо-контролируемого исследования TALAPRO-2
продемонстрировали улучшение
ВБП пациентов с КРРПЖ на фоне
терапии комбинацией энзалутамида и талазопариба по сравнению с одним энзалутамидом.
В исследование было включено
805 пациентов с общим статусом
по шкале ECOG ≤1 балла, ранее
получавших терапию доцетакселом или абиратероном. Рандомизация осуществлялась в группу
энзалутамида 160 мг в сутки в сочетании с талазопарибом 0,5 мг/
сутки или в группу энзалутамида
в сочетании с плацебо.
По результатам исследования
медиана радиографической ВБП
не была достигнута в группе
талазопариба и составила 21,9
мес. в группе плацебо (ОР 0,63;
p<0,001). При этом преимущество
применения талазопариба было
отмечено вне зависимости от
HRR-статуса опухоли, как среди
пациентов с HRR-дефицитными
(ОР 0,46; p=0,004), так и с HRRпрофицитными опухолями (ОР
0,66; p=0,009). По другим конечным точкам, включая частоту
объективного ответа, биохимического ответа, также было
выявлено преимущество талазопариба. При этом частота нежелательных явлений 3-4 степени составила 71,9% и 40,6%,
соответственно – практически
двукратный рост частоты различных осложнений. Данные по
общей выживаемости «незрелые»
на момент анализа данных, однако явной тенденции к снижению
риска смерти на фоне талазопариба не прослеживается (ОР 0,89;
p=0,35) [4].
Почему это интересно: судя по
отмеченным цифрам медианы
ВБП, комбинация представляется эффективной – и токсичной,
несмотря на то, что выбранная
доза талазопариба была в два
раза меньше, чем в исследованиях «монотерапии» этим препаратом. И включались-то в исследование только физически крепкие
пациенты, которых не так много
в реальной практике. Отсутствие
улучшения общей выживаемости
может стать критичным для этой
комбинации, так как в первую
очередь важно убедиться, что
использование двух препаратов
сразу будет более эффективным,
чем их последовательное назначение. Отдельный аспект – как и
в исследовании PROPEL (абиратерон + олапариб) мы не видим
какой-либо роли для выполнения HRR-тестирования при раке
предстательной железы. Плохой
тест?
TRITON-3: рукапариб
против доцетаксела или
«новых» антиандрогенов при
кастрационно-резистентном
раке предстательной железы
В это исследование включались
«отобранные» пациенты с наличием патогенных мутаций в генах
BRCA1/2 или ATM, которые ранее не получали химиотерапию.
Пациенты рандомизировались в
группу рукапариба 600 мг 2 раза
в сутки (n=270) или в контрольную группу (n=135), где допускалось проведение монотерапии
доцетакселом, абиратероном или
энзалутамидом – на выбор лечащего врача. Первичной конечной
точкой исследования была ВБП,
для которой ранее было продемонстрировано достоверное
улучшение в группе рукапариба,
сейчас же были доложены данные по промежуточному анализу ОВ (~60% зрелости данных). В
подгруппе BRCA-мутированных
пациентов медиана ОВ составила 24,3 мес. в группе рукапариба
и 20,8 мес. в контрольной группе
(ОР 0,81; p=0,208), медиана ВБП
– 11,2 и 6,4 мес. соответственно
(ОР 0,50; p<0,001). В общей популяции исследования медиана ОВ
составила 23,6 и 20,9 мес. соответственно (ОР 0,94; p=0,670), медиана ВБП – 10,2 и 6,4 мес. соответственно (ОР 0,61; p=0,003) [5].
Почему это интересно: PARPингибиторы могут быть эффективны в монотерапии при
КРРПЖ, по крайней мере – в отобранной по соответствующим
биомаркерам популяции. Посмотрим, что будет дальше с показателями ОВ пациентов.
MAGNITUDE: нирапариб
+ абиратерон против
абиратерона при HRRпозитивном КРРПЖ
И еще одно исследование по ингибиторам PARP – MAGNITUDE,
рандомизированное исследование III фазы, в которое было
включено 423 пациента с КРРПЖ
с наличием патогенных мутаций
в генах BRCA1/2 или мутациями
в других генах «семейства» HRR
(HRR+). В группу нирапариба с
абиратероном было рандомизировано 212 пациентов, в группе
плацебо с абиратероном – 211 пациентов. Медиана ВБП составила
16,7 и 13,7 мес. соответственно
(ОР 0,76; p=0,028), преимущество
было еще более выраженным среди BRCA-мутированных пациентов – медиана ВБП 19,5 и 10,9 мес.
соответственно (ОР 0,55; p<0,001).
Достоверных различий в общей
выживаемости пациентов не
было выявлено (среди всех пациентов – ОР 1,01; p=0,948; BRCA+
когорта – 0,88; p=0,551), но авторам очень хотелось эти различия
найти. Кто ищет, тот всегда найдет, и в специально проведенном
многофакторном анализе была
отмечена тенденция к снижению
риска смерти пациентов после
устранения «дисбаланса» между
группами (ОР 0,68; p=0,0793) [6].
Почему это интересно: еще одна
комбинация на основе ингибиторов PARP демонстрирует эффективность среди отобранных
пациентов. Ждем дальнейшие
данные.
Источники:
1. Heidenreich A, Seelemeyer F, Paffenholz P, Pfister DA. Interim analysis of the prospective COTRIMS (Cologne Trial of Retroperitoneal Lymphadectomy in Metastatic Seminoma) trial. J Clin Oncol. 2023; 41(6_suppl): 409-409. doi:10.1200/JCO.2023.41.6_suppl.409.
2. Boormans J, Sylvester R, AnsonCartwright L. European Association of Urology (EAU) Testicular Cancer Guidelines Panel: A new prognostic factor risk group classification for patients with clinical stage 1 seminoma in active surveillance. 2023; 41 (suppl_6; abstr 410). doi:10.1200/JCO.2023.41.6_ suppl.410.
3. Petrylak DP, Ratta R, Matsubara N, Korbenfeld EP, Gafanov R. Pembrolizumab plus docetaxel for patients with metastatic castrationresistant prostate cancer (mCRPC): Randomized, double-blind, phase 3 KEYNOTE-921 study. J Clin Oncol. 2023; 41 (suppl 6, abst 19).
4. Agarwal N, Azad A, Carles J, Fay A, Matsubara N. TALAPRO-2: Phase 3 study of talazoparib (TALA) + enzalutamide (ENZA) versus placebo (PBO) + ENZA as first-line (1L) treatment in patients (pts) with metastatic castration-resistant prostate cancer (mCRPC). J Clin Oncol. 2023; 41 (suppl6; abstr LBA17).
5. Bryce A, Piulats JM, Reaume M, Ostler P, McDermott RS. Rucaparib for metastatic castration-resistant prostate cancer (mCRPC): TRITON3 interim overall survival and efficacy of rucaparib vs docetaxel or second-generation androgen pathway inhibitor therapy. J Clin Oncol. 2023; 41 (suppl_6; abstr 18).
6. Efstathiou E, Smith R, Sandhu
S, Attard G, Saad M. Niraparib
(NIRA) with abiraterone acetate and
prednisone (AAP) in patients (pts) with
metastatic castration-resistant prostate
cancer (mCRPC) and homologous
recombination repair (HRR) gene
alterations: Second interim analysis
(IA2) of MAGNITUDE. J Clin Oncol.
2023; 41 (suppl 6; abstr 170).
РЕГИОНАЛЬНОЕ ОТДЕЛЕНИЕ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ АЛТАЙСКОГО КРАЯ
Алтайский край (АК) является
крупным аграрным субъектом Российской Федерации (РФ), расположенным на юго-востоке Западной
Сибири, в 3419 км от Москвы. Территория края составляет 168 тыс. кв.
м, по площади занимает 24-е место
в РФ и 10-е место в Сибирском федеральном округе. В регионе расположено 10 городских округов и 58
муниципальных районов.
Численность населения АК в 2022
году составила 2 268 179 чел. (1,6%
населения России), из них: мужчин
– 46,2%, женщин – 53,8%. Отличительной особенностью региона является высокая доля сельского населения – 42,6% (по России – 25,2%).
Онкологическая служба АК стала развиваться с 1946 года, после
вышедших в 1945 году Постановления и Приказа Народных Комиссаров СССР «О мероприятиях
по улучшению онкологической
помощи населению». Непосредственное начало онкологической
службы на Алтае положил Приказ
Краевого отдела здравоохранения
от 09.07.1946 г.: благодаря ему был
открыт первый онкологический
кабинет на базе поликлиники №4
города Барнаул. В 1947 году Приказом Краевого отдела здравоохранения в г. Барнаул был открыт
Краевой онкологический диспансер, чуть позже – городской
онкодиспансер, их объединение
в Алтайский краевой онкологический диспансер произошло в
1994 году. Около 40 лет онкологическую службу Алтайского края
возглавлял д.м.н., профессор,
член-корреспондент РАЕ Александр Федорович Лазарев. На базе
КГБУЗ «АКОД» располагается
кафедра онкологии и лучевой терапии с курсом ДПО ФГБОУ ВО
«Алтайский государственный медицинский университет» МЗ РФ.

В настоящее время КГБУЗ
«АКОД» – мощный, хорошо оснащенный региональный специализированный центр, которым
руководит д.м.н. Игорь Владиславович Вихлянов. Диспансер
обеспечивает высокий уровень
специализированной амбулаторно-поликлинической и стационарной помощи онкологическим
пациентам в Алтайском крае.
Кроме того, в АК функционирует
еще 2 онкодиспансера в городах
Рубцовск и Бийск, что обусловАЛТАЙСКИЙ КРАЙ
лено территориальными особенностями края: большая протяженность, высокий удельный вес
жителей сел, низкая плотность
населения. Совокупный коечный
фонд трех диспансеров составляет 770 коек в круглосуточных стационарах (615 онкологических,
150 радиотерапевтических коек)
и 192 – в дневных:
1. КГБУЗ «Алтайский краевой онкологический диспансер» г. Барнаул – 570 коек;
2. КГБУЗ «Онкологический диспансер» г. Бийск – 125 коек;
3. КГБУЗ «Онкологический диспансер» г. Рубцовск – 75 коек.
Структура онкологической службы Алтайского края
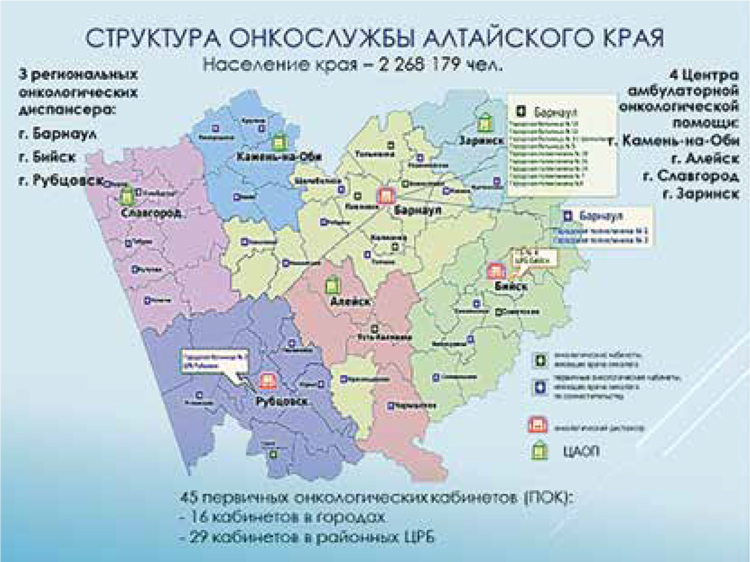
В рамках реализации региональной
программы (РП) «Борьба с онкологическими заболеваниями» в крае
открыто 4 ЦАОПа с дневными стационарами на базах ЦРБ.
Ежегодно в крае регистрируется
около 12000 новых случаев злокачественных новообразований (ЗНО).
Показатели онкологической заболеваемости в АК на протяжении
многих последних лет превышают
аналогичные общероссийские показатели более чем на 22%. Так, в
2022 году «грубый» показатель заболеваемости в крае составил 524,5
на 100 тысяч населения (в РФ в 2021
г. – 396,9‰). Показатель заболеваемости первично-множественными ЗНО составил 63,8 на 100 тыс.
населения, что в 2 раза превышает
российский показатель (в РФ в 2021
г. – 39,9‰).
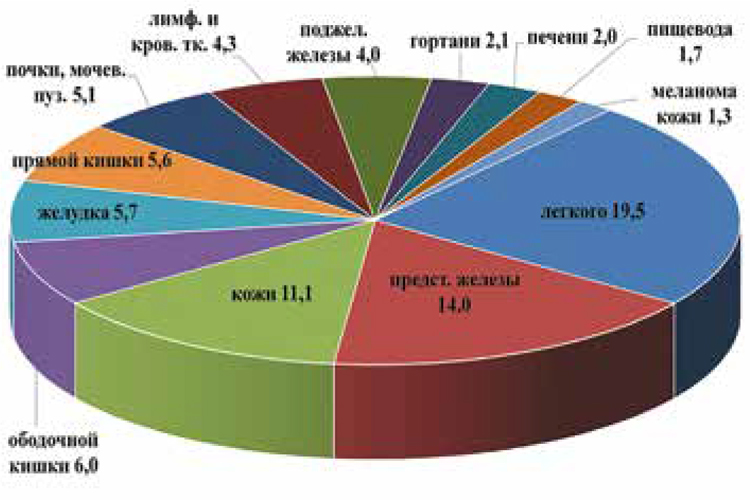
В структуре заболеваемости мужского населения первые места занимают: рак легких, трахеи и бронхов – 19,5%, предстательной железы
– 14,0%, кожи – 11,1%, ободочной
кишки – 6,0%, желудка – 5,7%.
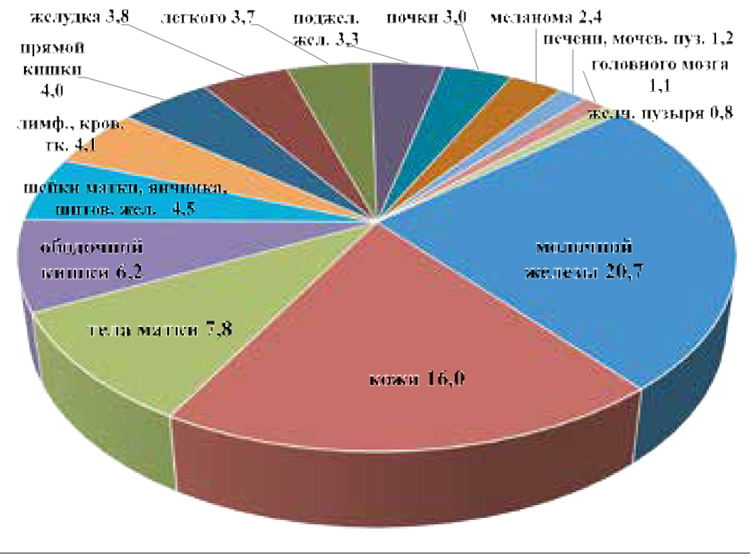
У жительниц АК лидирует рак молочной железы – 20,7%, новообразования кожи – 16,0%, тела матки
– 7,8%, ободочной кишки – 6,2%, шейки матки, яичника и щитовидной железы в равных пропорциях – по 4,5%.
Структура первичной заболеваемости ЗНО, мужчины, %
Структура первичной заболеваемости ЗНО, женщины, %
По Федеральной программе
«Борьба с онкологическими заболеваниями» за период 2019-2022
гг. в региональные онкодиспансеры было поставлено 277 единиц
медицинского оборудования на
общую сумму 2 711,85 млн. руб.,
в том числе «тяжелое» оборудование: 2 линейных ускорителя,
2 аппарата брахитерапии, рентгенодиагностический комплекс,
видеоэндоскопические комплексы, специализированный мультиспиральный компьютерный томограф, магнитно-резонансный
томограф, роботизированная система гистологической и иммуногистохимической диагностики с
архивированием, гамма-детектор
для интраоперационных исследований.
Оснащение радиотерапевтического комплекса новейшим
лечебно-диагностическим оборудованием позволило проводить лучевое лечение онкологических заболеваний на высоком
уровне. Более 80% пациентов
получают лечение по методике
3D-конформного облучения на
высокоэнергетическом линейном
ускорителе. Внедрены методики брахитерапии при опухолях анального канала и пищевода. С 2020 года
при проведении лучевой терапии
используется методика глубокой
гипертермии на аппарате Цельсиус
(Германия, 2019).
Кроме того, произошло значительное увеличение финансирования
онкологической службы в части лекарственного обеспечения. Большая
часть этих средств расходуется на
приобретение современных таргетных и иммуноонкологических препаратов, которые преимущественно
используются в дневных стационарах. Это заметно повышает доступность специализированной помощи
и улучшает качество жизни пациентов.
Создание в 2011 году лаборатории
молекулярной диагностики позволило внедрить в клиническую
практику уникальные методики,
основанные на исследовании генетического материала для персонифицированного подхода к выбору
лекарственного лечения пациентов.
Благодаря непосредственному участию Российского общества клинической онкологии (RUSSCO)
было организовано обучение наших специалистов по молекулярной
диагностике на курсах повышения
квалификации, выездных межрегиональных информационно-практических школах по ПЦР-диагностике
В рамках Национальной программы
RUSSCO «Совершенствование молекулярно-генетической диагностики в Российской Федерации с целью
повышения эффективности противоопухолевого лечения» с 2013
года лаборатория молекулярной
диагностики КГБУЗ «АКОД» имеет
возможность участвовать в выполнении международных программ по
внешнему контролю качества – как
российского, так и международного
уровня.
Многолетнее сотрудничество
RUSSCO с патологоанатомической
лабораторией позволило не только обучать наших специалистов
и внедрять новые методики, но и
обеспечивать поставки химических
реактивов (антител D5F3 к тирозинкиназе) для выявления опухолей,
подлежащих таргетной терапии в
Сибирском и Дальневосточном Федеральных округах.
Ежегодно проводится до 45 тыс.
исследований операционно-биопсийного материала с применением
ИЦХ, ИГХ, молекулярно-генетических, гибридизационных исследований «in situ», c определением
мутаций в генах EGFR, BRAF, KRAS,
NRAS и экспрессии ALK, ROS1, PDL1, MSI и Her-2-new. В 2022 году
успешно освоена и внедрена методика определения мутации в гене
PIK3CA при гормоноположительном HER-2-neu отрицательном раке
молочной железы.
Одним из основных этапов маршрутизации пациентов со ЗНО является онкологическая поликлиника.
Мощность поликлинического отделения КГБУЗ «АКОД» составляет
450 посещений в смену, прием ведут
29 врачей-онкологов. В течение года
консультативную помощь получают
более 160 тысяч жителей Алтайского края, разных регионов Сибири и
Дальнего Востока, а также ближнего
зарубежья. В поликлинике проводится полный комплекс лабораторно-диагностических исследований:
эндоскопических, рентгенологических, ультразвуковых, радиоизотопных, КТ- и МРТ-исследований.
В клинических отделениях КГБУЗ
«АКОД» ежегодно выполняется около 7200 оперативных вмешательств,
в том числе видеоэндоскопические
операции при опухолях грудной и
брюшной полостей, при опухолях
мочеполовой системы; реконструктивно-пластические операции, радикальные органосохраняющие
операции с БСЛУ и онкопластические резекции при ЗНО молочных
желез в различных модификациях;
радикальные операции с удалением
сторожевых лимфатических узлов
при меланоме кожи и др. С декабря
2020 года функционирует рентгеноперационная, освоены и внедрены
методы селективной рентгенэндоваскулярной эмболизации сосудов
опухолей печени, мочевого пузыря,
опухолей мочеполовой системы;
рентгенохирургическое чрезкожное
наружное и наружно-внутреннее
дренирование желчных протоков,
эндоваскулярная окклюзия артерий
органов малого таза, чрескожная
радиочастотная абляция опухолей
печени под рентгеновским и ультразвуковым контролем и другие.
Коллектив – особая гордость нашего диспансера. Сегодня у нас работают более тысячи сотрудников: 200 врачей, 15 человек – специалисты с высшим немедицинским образованием (биологи, медицинские физики), 349 специалистов со средним медицинским образованием. В коллективе 3 доктора медицинских наук и 1 доктор биологических наук, 21 кандидат медицинских наук, 6 Заслуженных врачей Российской Федерации, 1 Заслуженный работник здравоохранения РФ, 10 сотрудников отмечены значком «Отличник здравоохранения», 7 человек – лауреаты конкурсов «Лучший врач года». Около 230 специалистов (врачей и медицинских сестер) имеют высшую квалификационную категорию.

Региональное отделение Российского
общества клинической онкологии
(RUSSCO) Алтайского края насчитывает 13 членов, председателем является заместитель главного врача
по ОМР КГБУЗ «АКОД» к.м.н. Федоскина Алла Владимировна. Ежегодно на высоком профессиональном уровне проводятся российские
научно-практические конференции
с международным участием, образовательные семинары, мастер-классы,
где наши врачи и медсестры совершенствуют свои знания и активно
выступают с докладами, разборами
клинических случаев.
Совместно с RUSSCO организуются
и проводятся вебинары с образовательной целью. Благодаря RUSSCO
наши специалисты обеспечены
«настольной Библией онколога» –
Практическими рекомендациями
Российского общества клинической
онкологии.
В крае внедрена программа наставничества, проводится активная работа по поддержке молодых специалистов.
С целью повышения доступности и раннего выявления онкологических заболеваний организован консультативный прием врачами-онкологами КГБУЗ «АКОД» в формате «День открытых дверей», когда пациенты имеют возможность обратиться в поликлинику без направления и предварительного обследования. Проводятся ежегодные акции: «Скажи раку нет», «Профилактика рака молочной железы», «Покажи свою родинку» и др. В октябре 2022 года КГБУЗ «АКОД» участвовал в акции в рамках Всероссийского проекта по профилактике и диагностике онкологических заболеваний «Рак боится смелых. Убедись, что ты здоров!» С 2022 года специалисты КГБУЗ «АКОД» внедрили новую форму выездной работы в ЦАОПы – «Алтайский онкопатруль». Цель данного мероприятия – консультативный прием врачами КГБУЗ «АКОД», обучение специалистов ЦАОПов выполнению методики трепан-биопсии молочной железы, организация на рабочих местах мастер-классов по проведению и интерпретации рентгенологических, ультразвуковых, эндоскопических исследований, а также проведение мастер-классов для фельдшеров смотровых кабинетов и ФАПов.
Для эффективной организации
этой работы проводятся встречи
с органами местного самоуправления в части решения вопроса
транспортного сообщения из прикрепленных населенных пунктов
до медицинской организации c расписанием, адаптированным под
работу ЦАОПа, обеспечения наглядной навигации на территории
расположения ЦАОПа, остановок
непосредственно возле ЦАОПа. Решаются вопросы предоставления
мер социальной поддержки врачам
и средним медицинским работникам ЦАОПов: выплата по программе
«Земский доктор» подъемного пособия, предоставление и оплата жилья.
Большое значение имеют информационные технологии, развивающиеся и внедряемые в крае.
На региональном портале внедрен
модуль «Онкомониторинг» для контроля за соблюдением сроков обследования пациентов с подозрением
на ЗНО. Сотрудниками ОМО КГБУЗ
«АКОД» ежедневно проводится
мониторинг их соблюдения. При
возникновении риска нарушения
сроков обследования специалисты
ОМО связываются с МО прикрепления для определения причин нарушения и помощи в обследовании
пациентов. Внедрена электронная
система плановой госпитализации,
что позволяет контролировать сроки начала лечения и соблюдения
межкурсовых интервалов.
В крае внедрен Модуль диспансерного наблюдения за пациентами с
ЗНО. На информационном портале
Территориального ракового регистра ежемесячно формируется и
размещается план диспансерных
осмотров в разрезе медицинских
организаций. Утверждены правила
проведения диспансерного наблюдения, схема территориального закрепления, оптимальный перечень диагностических исследований для его
проведения. Организовано активное
приглашение и запись пациентов в
КГБУЗ «АКОД» через сall-центр.
Внедряются СОПы по диспансерному осмотру основных локализаций в
электронном формате.
Регулярно по субботам в поликлинических отделениях региональных
онкодиспансеров проводится День
диспансерного пациента.
Активно используется возможность
телемедицинских консультаций
(ТМК) с ведущими Федеральными
научно-медицинскими центрами. В
свою очередь и мы проводим ТМК
по вопросам дообследования, диагностики и тактики лечения с первичными медицинскими организациями и ЦАОПами.
Критерием оценки эффективности
работы онкологической службы в
крае может служить снижение показателя смертности от ЗНО с 221,8‰
в 2014 г. до 215,0‰ в 2022 г., а также
показателя одногодичной летальности с 24,8% до 23,4% соответственно, несмотря на высокий уровень
заболеваемости. О хорошей работе
алтайских онкологов косвенно свидетельствует показатель накопления
контингента пациентов со ЗНО, состоявших на учете в медицинских
организациях края, который составил 73403 человек. Из них 43897
пациентов находятся под диспансерным наблюдением 5 и более лет,
что составило почти 60% от всего
контингента больных.
XXVII РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС 2023
14 - 16 НОЯБРЯ 2023 МОСКВА

ПУТЕШЕСТВИЕ ИЗ ЗОНЫ КОМФОРТА И ОБРАТНО
Автор: Глазкова Елена Владимировна
ГБУЗ «ММКЦ «Коммунарка» ДЗМ»,
кандидат медицинских наук, Москва
Всем привет! Меня зовут Елена Глазкова, в настоящий момент я заведую
круглосуточным химиотерапевтическим стационаром в Коммунарке,
но так было не всегда…
С первых дней ординатуры я грызла гранит онкологического знания
в отделении клинической фармакологии и химиотерапии онкоцентра
им. Н.Н. Блохина, которое в ходе
естественной эволюции центра претерпело сначала метаморфозы названия, а потом и переосмысление
миссии химиотерапевтов внутри
центра. Онкологический научный
центр – храм онкологии, где всегда
были (и есть) мудрые старшие товарищи, до уровня знаний которых
можно только тянуться. Каждый в
центре стремится углубиться в свою
область знания и стать экспертом
настолько, насколько возможно. Помимо очевидных плюсов – а специалисты центра знают все и даже немножко больше о тех заболеваниях,
лечением которых они занимаются,
– есть и минусы, так как по мере
усугубления «тяжести» этой специализации возникает внегласное деление на экспертов по лечению рака
правой и левой молочной железы.
Этот уровень значений транслируется на всех причастных, и каждый
врач той «галактики», в которой я
обитала, имел высокий уровень базовых представлений об онкологии.
Даже психиатр, с которой мы работали, лихо различала схемы неоадъювантной терапии рака молочной
железы и, вероятно, уже сама могла
бы назначать химиотерапию.
В определенный момент времени
накопилась критическая масса, которая привела к тому, что высокий
уровень специализации оформился
официально, и в течение какого-то
времени я работала в отделении, которое специализируется на лечении
рака молочной железы.
Сразу следует оговориться, что научная составляющая федеральных
центров с каждым годом все больше
и больше стала похожа на стандартную терапию, эдакая наука под завесой КСГ, мы все чаще стали говорить
не только о новых исследованиях, но
и о маржинальности схем терапии,
среднем чеке госпитализации и правильности заполнения формы 057у.
В апреле 2022 года мне поступило
неожиданное предложение попробовать себя не в качестве онколога
на флагманском крейсере отечественной медицины, а начать сеять
зерно онкологической адекватности
на одной из планет, принадлежащей
системе Департамента Здравоохранения г. Москвы (далее – ДЗМ)
– планете Коммунарка (далее – планета К.), которая к этому моменту
героически победила в войне против уже не очень новой коронавирусной инфекции и готовилась начать сражаться с неинфекционными
заболеваниями – ну что же, старт и
ракеты вперед…
Планета К. находится на некотором отдалении от привычной мне
онковселенной (как физически, так
и на момент моей высадки идеологически), но, высадившись на ее
поверхность, я была столь поражена ее красотой и хорошим климатом (в том числе – благодаря центральному кондиционированию),
что решила здесь остаться. Немало
времени ушло, чтобы выучить все
тропы, а про некоторые потайные
лазы между отделениями и корпусами, уверена, я до сих пор не знаю.
Говорят, некоторые лестницы здесь
могут менять свое направление, но
это не точно.
И вот в июньский день большая экспедиция онкологов высадилась на планете К., солидная часть экипажа уже странствовала до этого по галактике ДЗМ, а немалая часть моей команды жили на спутнике планеты К., который назывался ГКБ 40. Лично для меня это был первый опыт взаимодействия с городской системой здравоохранения.
Конечно, я практически сразу повстречала аборигенов планеты, которые обитали на основном полушарии. Здесь меня поджидал хтонический ужас – они оказались не онкологами. И живых онкологов они не видели. Мы не только по-разному смотрели на мир, мы говорили на разных языках – они не понимали слов, которые я говорю, я же не понимала слов, которые говорили они, это порождало взаимное недопонимание. Каждый совместный пациент становился тем самым слоном в окружении слепых индийских мудрецов. «Неонкологи» постоянно недоумевали – зачем пытаться лечить метастатический рак, всячески меня жалели, искренне считая, что мне приходится заниматься бесперспективным и неблагодарным делом. Также «неонкологи» с удивлением смотрели на наши осложнения. С упорством, достойным лучшего применения, они называли фебрильную нейтропению «нейтропенической лихорадкой», но это можно уже отнести к местному диалекту. Несмотря на языковой барьер, это оказались очень приветливые и готовые к коммуникации и совместной работе люди, все так или иначе пытались оказать помощь новому сотруднику. Это очень удивляло после работы на флагманском крейсере.
Так как я оказалась в многопрофильном стационаре, то помимо онкологической части с привычными нам «плановыми госпитализациями», я узнала, что людей могут привезти в больницу на космическом шаттле скорой помощи, и уже на этапе госпитализации может оказаться, что помимо инфаркта у человека может быть рак. На этом моменте к нему могут позвать онколога – и здесь ему может повезти, мы вовремя поймем, что происходит с пациентом, выявим и купируем аутоиммунную реакцию, начнем специфическую терапию. Но чаще – это оказываются пациенты с паллиативным статусом или сепсисом или и тем и другим сразу.
При этом по коморбидному пациенту я могу собрать самый настоящий мультидисциплинарный консилиум или же просто пойти смотреть отягощенного пациента сразу с кардиологом, и спустя полгода я стала понимать слова, которые говорят мне неврологи, кардиологи и неонкологические хирурги, тоже стала немного аборигеном планеты К., еще немного – и стану настоящим врачом.
К «неонкологической части» больницы мое простое и основное впечатление о работе – механизм работает хорошо, так как стационар многопрофильный, есть множество протоколов, которые унифицируют и ускоряют путь пациента в критическом состоянии – протоколы для пациентов с политравмой, подозрением на ОНМК, «код синий». Онкологический компонент работы больницы пока работает преимущественно в ручном режиме, но именно сейчас мы предпринимаем все усилия, чтобы настроить навигацию, привнеся сюда все те знания, которые смогли почерпнуть ранее, и, естественно, стараемся к ним добавить что-то новое.
Потом было знакомство с новой территорией, на которой обитали онкологи, – Центром Амбулаторной Онкологической Помощи. Каждое слово в этой фразе достойно того, чтобы быть написанным с большой буквы! Это удивительное место, где все находятся в нечеловеческих условиях, и это основная суть работы ЦАОП. Врачи-онкологи должны успеть провести полноценный прием пациента за 15 минут, а в свободное время заняться медицинской документацией, телемедициной и докладом пациентов на онкологическом консилиуме. Те же 15 минут на общение с врачом есть и у пациентов. Подробно про жизнь нашего ЦАОП можно узнать из предыдущей заметки Владимира Евдокимова.
Пациенты, которые приходят в ЦАОП, значительно отличаются от тех людей, которых я привыкла видеть в федеральном центре. В последние приходят в основном мотивированные люди, которые осознали свой диагноз и хотя бы чуть-чуть поискали информацию о том, где помощь оказывается на экспертном уровне, которые готовы к некоторым организационным трудностям и вооружены пониманием того, что они сами – не система ОМС, не Центр, не лечащий врач, а они сами – в первую очередь заинтересованы в результатах лечения. Пациенты в ЦАОП зачастую не понимают, что с ними происходит, зачем это все нужно (ну не успевает врач за 15 минут оторваться от емиас и с ним поговорить), каков прогноз заболевания, и зачастую горизонт планирования терапии на ближайший месяц тоже.
И пациент в ЦАОП не принимает участия в онкологическом консилиуме, то есть он весьма отстранен от планирования его судьбы на ближайшее время. Обычно пациент предстает перед консилиумом очно либо по своему крайнему настоянию, либо если необходимо собрать специалистов, чтобы уточнить функциональный статус пациента. Сам же консилиум представляет собой странное действо (мы помним про специалистов по левой и правой молочной железе): на химиотерапевтическом консилиуме есть не только рак молочной железы, но и колоректальный рак, рак легкого, почки и даже глиобластомы (помогите!), и ты как химиотерапевт должен принять решение, а количество заявок (150+), которые поданы на текущую дату, делают консилиум похожим на блиц-опрос и паническую игру на выживание. Поэтому очень скоро пришлось вспомнить не только то, чему меня учили в ординатуре, но и оперативно понять, что произошло в этих нозологиях за последние годы.
Прошел практически год – я воспринимаю этот опыт очень полезным для себя. Конечно, федеральные центры являются прекрасным местом, чтобы полюбить свою специальность, познакомиться со своими учителями и стать грамотными специалистами, пусть и несколько узкого спектра. Работа в городе и многопрофильном стационаре заставила меня в кратчайшие сроки начать мыслить шире как онколог и видеть нозологии вне молочной железы, а также шире как врач – смотреть на пациента не только с позиции онколога. А опыт жизни именно на планете К. учит командной работе, это место за год стало моим домом (особенно хорошо это видно по времени считывания пропуска на КПП).
Надеюсь, что мой опыт был полезен.
Всегда ваша,
Елена Глазкова с планеты К.
PACIFIC В РЕАЛЕ: ПОСЛЕДНИЕ ДАННЫЕ ИССЛЕДОВАНИЯ PACIFIC-R
В февральском номере журнала Journal of Thoracic Oncology
были представлены обновленные
результаты известного исследования PACIFIC-R [1]. Опираясь
на данные PACIFIC [2], изменившего обычную тактику ведения
больных местнораспространенным немелкоклеточным раком
легкого (НМРЛ) III стадии и
определившего год консолидирующей терапии дурвалумабом
после радикальной химиолучевой терапии нерезектабельного
в качестве нового стандарта медицинской помощи, PACIFIC-R
было направлено на оценку
«реальных» результатов консолидирующей иммунотерапии
в различных странах мира на
основании данных участников,
зарегистрированных по Программе раннего доступа (EAP). В
программу было зачислено 1399
пациентов из 11 стран с морфологически подтвержденным нерезектабельным НМРЛ III стадии;
анализ проведен на основании
данных, полученных с сентября
2017 г. по декабрь 2018 г., средний
период наблюдения составил 23,5
месяца. Первичными конечными
точками были общая выживаемость (ОВ) и выживаемость без
прогрессирования (ВБП) в реальной практике (rwPFS). Показатели выживаемости оценивались
в представляющих интерес подгруппах, а нежелательные явления (НЯ) рассматривались как
вторичные конечные точки.
Несмотря на осторожность в отношении перекрестных сравнений, результаты, тем не менее,
впечатляют. Частота rwPFS через
2 года в PACIFIC-R была аналогична ВБП пациентов, включенных в PACIFIC за такой же срок,
с медианой rwPFS 21,7 мес. (95%
ДИ 19,1-24,5) в PACIFIC-R при
медиане ВБП 17,2 мес. в PACIFIC
в группе дурвалумаба (95% ДИ
13,1-23,9). На момент анализа
медиана ОВ в PACIFIC-R достигнута не была, однако примерно
71,2% пациентов были живы спустя 24 месяца.
Данные PACIFIC-R действительно важны: они дают представление о вероятных результатах
лечения тех ключевых групп
больных, которые не подходили
бы для участия в исследовании
PACIFIC (например, пациенты
со статусом ECOG 2 или прошедшие не одновременную, а последовательную химиолучевую
терапию), но для которых консолидация дурвалумабом также
может давать преимущества, тем
самым потенциально расширяя
масштабы консолидирующей иммунотерапии. Кроме того, терапия дурвалумабом свыше 1 года
была разрешена во всех регионах, кроме Франции. PACIFIC-R
также охватил более широкий
круг пациентов с точки зрения
возраста в группе дурвалумаба
(PACIFIC-R: 26-88 лет; PACIFIC:
31-84 года), причем 21,2% включенных больных были в возрасте
от 70 до 75 лет и 10% – в возрасте
старше 75 лет.
PACIFIC-R продемонстрировал
весьма благоприятные результаты
у пациентов с неплоскоклеточным
раком по сравнению с плоскоклеточным (медиана rwPFS 25,3 мес.
против 14,6 мес. соответственно),
со стадией IIIA по сравнению с IIIB
или IIIC (медиана rwPFS 23,7 мес. по
сравнению с 19,2 мес.) и PD-L1 экспрессией больше или равной 1% по
сравнению с менее 1% (22,4 мес. против 15,6 мес.), аналогично данным
PACIFIC. В результате последнего
наблюдения программа раннего доступа была скорректирована с октября 2018 года: предпочтение отдавалось пациентам, опухоли которых
имели PD-L1 ≥1%.
Анализ PACIFIC-R также подчеркивает растущую роль программы
расширенного доступа, уже выходящей за рамки простого обеспечения
доступа к лечению. Большинство
EAP теперь интегрируют сбор доказательств в схемы возмещения
расходов, предоставляя исследователям реальные данные о применимости лечения за пределами строгих
рамок клинических испытаний и
определении ключевых подгрупп,
достойных дальнейшего изучения.
Так, большее количество пациентов
в PACIFIC-R, получавших последовательную ХЛТ, были в возрасте
старше 70 лет (40,8% против 29,0%)
и имели стадию IIIB или IIIC заболевания (61,7% против 50,7%). Эти
данные отражают всем известные
реалии: комплекс сопутствующих
заболеваний пациента, проблемы с
доступом к медицинской помощи и
другие человеческие факторы, которые могут привести к тому, что пациенты не будут способны получать
одновременную ХЛТ. Хотя rwPFS
была численно выше среди тех, кто
получил оХЛТ по сравнению с пХЛТ
(медиана 23,7 мес. против 19,3 мес.),
преимущества в rwPFS были обнаружены даже в группе пХЛТ, и это
дает надежду, что такие пациенты
могут получить реальный выигрыш
от дурвалумаба. В продолжающемся
исследовании PACIFIC-5 будет проведено проспективное сравнение
консолидирующей терапии дурвалумабом после оХЛТ и пХЛТ.
Оптимальный промежуток времени
от завершения ХЛТ до начала дурвалумаба также оставался неопределенным в исследовании PACIFIC-R,
в отличие от PACIFIC, где введение
препарата могло начаться в течение 14 дней после ХЛТ и позже,
вплоть до 42 дней. В исследовании
PACIFIC-R 1,2% пациентов начали
дурвалумаб в течение 14 дней после
ХЛТ, 30,1% – в течение 42 дней и 1%
– более 6 месяцев после завершения
ХЛТ. Медиана rwPFS была немного
лучше у тех, кто начал дурвалумаб
менее чем за 42 дня по сравнению
с теми, кто получал его отсроченно
(более чем через 42 дня после завершения ХЛТ) – 25,7 мес. против 20,8
мес.
Частота нежелательных явлений
(НЯ) при применении дурвалумаба
явилась другим критическим компонентом этого анализа: у 46,7%
пациентов в PACIFIC-R отмечены
НЯ в целом, при этом 16,5% испытывали НЯ, приведшие к прекращению лечения, 9,5% из которых
были связаны с пневмонитом или
интерстициальным заболеванием легких. Эти результаты лучше,
чем в PACIFIC, где 96,8% пациентов имели какие-либо осложнения,
которые у 15,4% привели к прекращению лечения в группе дурвалумаба. Переносимость дурвалумаба
в исследовании PACIFIC-R, таким
образом, кажется обнадеживающей, но может также отражать
менее строгие требования к сбору
данных по НЯ в реальной практике.
Без сомнения, данные PACIFIC-R
актуальны и показательны, но исследование также обнажает проблемы, где необходимо получить
больше данных [3]. Во-первых,
хотя программа раннего доступа
допускала пациентов с ECOG PS
2, только 2% зарегистрированных
имели ECOG 2 балла или даже
ниже. Авторы признают отсутствие
данных по статусу у 448 пациентов,
поэтому делать значимые выводы
об этой группе, к сожалению, невозможно. Во-вторых, пациенты в
программе раннего доступа получали дозы лучевой терапии от 8 до
92 Гр (обязательная доза при оХЛТ
в PACIFIC составляла 54-74 Гр, трое
получили <54 Гр). Когорта пациентов в PACIFIC-R включала широкий круг тех больных, кто получал
паллиативную лучевую терапию,
и тех, кто получил дозы выше, чем
предписано стандартами оХЛТ.
Таким образом, вопрос об оптимальной дозе ЛТ, необходимой
для получения положительного
эффекта от последующей консолидации дурвалумабом при НМРЛ III
стадии, также остается открытым.
Интересно отметить, что rwPFS
была лучше у пациентов, получавших цисплатин (24,4 мес.) по сравнению с карбоплатином (18,8 мес.)
в PACIFIC-R. Поэтому PACIFIC-R,
как и PACIFIC, пока не дает ответ,
какой режим химиотерапии мог
бы быть оптимальным, хотя данные весьма интересны. Наконец,
первоначальный дизайн программы раннего доступа позволял продолжить приема дурвалумаба до
прогрессирования заболевания, и
средняя продолжительность приема составила 334,5 дня, то есть 11,0
месяцев. В частности, в PACIFIC-R
19,8% пациентов получали дурвалумаб более 12 месяцев, 4,2% получали его более 14 месяцев, 47,1%
завершили прием на 11,9 месяца
и по крайней мере один пациент
получил 33+ месяца лечения (диапазон: 1-1029 дней). Это значительно расширяет временную шкалу
анализа в PACIFIC-R и может исказить интерпретацию результатов,
связанных со средней продолжительностью приема дурвалумаба в
реальном мире. Эти данные снова
подчеркивают открытый вопрос
об оптимальной продолжительности консолидирующей иммунотерапии – вопрос, изучаемый в
настоящее время исследованиями
PACIFIC-6 и GEMSTONE-301.
В заключение можно сказать, что в отношении лечения местнораспространенного НМРЛ PACIFIC-R способствует пониманию эффективности подобного варианта терапии для нерезектабельной III стадии. Впереди оценка вклада неоадъювантной химиоиммунотерапии для пациентов с резектабельными опухолями III стадии (исследования NADIM2 и CheckMate 816). Кроме того, недавно опубликованные результаты исследования фазы 2 COAST показывают, что комбинация дурвалумаба с олеклумабом или монализумабом обеспечивает численно лучшую ВБП, чем дурвалумаб в отдельности, идентифицируя комбинации иммунотерапевтических препаратов как новую область, которая может поднять планку терапии для стадии III НМРЛ. Важно, что необходимо проделать дополнительную работу, чтобы уточнить тактику лечения III стадии НМРЛ на основе биологических свойств опухоли. Мы знаем, что пациенты с НМРЛ III стадии с мутацией EGFR вряд ли получат преимущество в выживаемости от дурвалумаба на основании данных PACIFIC. Роль дурвалумаба в онкоген-зависимых подгруппах НМРЛ III стадии пока остается малоизученной. Но в целом авторов PACIFIC-R можно поздравить с тем, что они продемонстрировали реальные преимущества консолидирующей терапии дурвалумабом при нерезектабельном НМРЛ III стадии в реальной практике, показав, как эта парадигма может быть применена, и подчеркнув еще раз ценность программ раннего доступа как для лечения, так и для исследований.
Источники:
1. Girard N, Bar J, Garrido P, et al. Treatment characteristics and realworld progression-free survival in patients with unresectable stage III NSCLC who received durvalumab after chemoradiotherapy: findings from the PACIFIC-R study. J Thorac Oncol. 2023; 18: 181-193.
2. Antonia SJ, Villegas A, Daniel D, et al. Overall survival with durvalumab after chemoradiotherapy in stage III NSCLC. N Engl J Med. 2018; 379: 2342-2350.
3. Caroline O’Leary, Jarushka
Naidoo. PACIFIC in the Real World.
J Thorac Oncol 2023; 18(2): 133-135.
НИНТЕДАНИБ В ЛЕЧЕНИИ РАДИАЦИОННОГО ПНЕВМОНИТА: РЕЗУЛЬТАТЫ РАНДОМИЗИРОВАННОГО ИССЛЕДОВАНИЯ 2 ФАЗЫ
Радиационный пневмонит – немалая проблема, которую зачастую сами радиотерапевты не
видят, поскольку «классические»
сроки развития этого грозного
осложнения лучевой терапии на
область грудной клетки превышают 2-4 недели после ее окончания, и только особая повышенная
чувствительность легочной паренхимы, о которой пока невозможно знать заранее, становится
причиной развития молниеносного, порой фатального, пневмонита в ближайшие дни после
окончания облучения.
Современные стандарты лечения больных со злокачественными опухолями внутригрудных
локализаций предусматривают
комплексное лечение при отсутствии осложнений, в частности,
при местнораспространенном
немелкоклеточном раке легкого
после проведенного радикального химиолучевого лечения пациенту показана консолидирующая
иммунотерапия дурвалумабом. В
этом случае сам факт наличия лучевого пневмонита может сыграть
роковую роль в судьбе пациента,
став противопоказанием при 2+
стадии или при затянувшемся
течении, поэтому возможные варианты быстрого купирования
радиационного пневмонита настолько приветствуются в современной медицине.
Основной целью исследования II
фазы по применению нинтеданиба в комбинации с преднизолоном
была безопасность и эффективность препарата для купирования
радиационного пневмонита 2+
степени [1]. Нинтеданиб – тройной ингибитор ангиокиназы,
блокирующий рецепторы фактора роста эндотелия сосудов 1-3
(VEGFR 1-3), рецепторы тромбоцитарного фактора роста α
и β (PDGFR α и β) и рецепторы
фактора роста фибробластов 1-3
(FGFR 1-3), через которые реализуется активность киназы. Нинтеданиб конкурентно взаимодействует с АТФ-связывающим
участком этих рецепторов и блокирует внутриклеточную передачу сигналов, которая крайне важна для пролиферации и
выживания эндотелиальных, а
также периваскулярных клеток
(перицитов и гладкомышечных
клеток сосудов), а также особенно важна для пролиферации,
миграции и трансформации фибробластов, представляющих основные патологические механизмы идиопатического легочного
фиброза (ИЛФ). Таким образом,
нинтеданиб используется для
лечения идиопатического легочного фиброза, патофизиологические пути которого сходны с
подострой фазой радиационного
пневмонита (РП).
Пациенты с недавно диагностированным РП 2+ степени были
рандомизированы в соотношении 1:1 для получения нинтеданиба или плацебо в дополнение
к стандартной 8-недельной терапии преднизолоном. Первичной конечной точкой было отсутствие легочных обострений в
течение одного года. Вторичные
конечные точки включали любые
симптомы, о которых сообщали
пациенты, и функциональные
тесты легких. Анализ Каплана-Мейера использовался для
оценки вероятности отсутствия
легочных обострений. Исследование, однако, было закрыто досрочно из-за медленного набора
больных, но успело привлечь
внимание многих радиационных
онкологов мира.
Рисунок
Частота клинически
явных радиационных
пневмонитов в группах
нинтеданиба и плацебо.
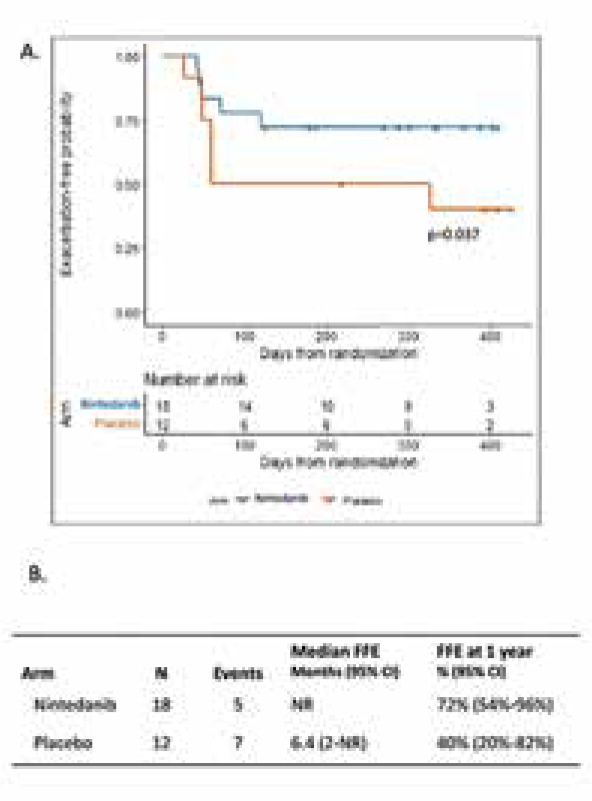
В период с октября 2015 г. по февраль 2020 г. было включено 34
пациента. Из 30 поддающихся
оценке пациентов 18 были рандомизированы в экспериментальную группу A (нинтеданиб +
преднизолон) и 12 – в контрольную группу B (плацебо + преднизолон). Отсутствие обострения
процесса в течение одного года
составило 72% (95% ДИ 54-96%) в
группе А и 40% (95% ДИ 20-82%)
в группе В (р=0,037). В группе A
было зарегистрировано 16 нежелательных явлений G2+, возможно или вероятно связанных
с лечением, по сравнению с 5
случаями в группе плацебо. За
период исследования в группе
А было три случая смерти из-за
сердечной недостаточности, прогрессирующей дыхательной недостаточности и тромбоэмболии
легочной артерии соответственно.
Авторы сделали вывод, что при
добавлении нинтеданиба к преднизолону действительно наблюдалось улучшение течения легочного пневмонита. Необходимы
дальнейшие исследования по
применению препарата для лечения РП.
Источник:
Rimner A, et al.
Randomized, phase II, placebocontrolled trial of nintedanib for the
treatment of radiation pneumonitis.
Int J Radiat Oncol Biol Phys.
2023 March 06. DOI: https://doi.
org/10.1016/j.ijrobp.2023.02.030.
ИММУНОРАДИОТЕРАПИЯ ПРИ ОЛИГОМЕТАСТАТИЧЕСКОМ РАКЕ ПОЧКИ: ИССЛЕДОВАНИЕ RAPPORT
Олигометастатический рак в
настоящее время находится в
фокусе наиболее пристального
внимания онкологов всего мира.
Это та клиническая ситуация,
когда максимально агрессивное
воздействие оказывается сродни
радикальному при неметастатических опухолевых процессах
в большинстве случаев, стирая
грань между паллиативным и радикальным лечением.
Так, комбинация стереотаксической лучевой терапии (SBRT)
и иммунотерапии при олигометастатическом раке почки способна значительно улучшить отдаленные результаты лечения,
хотя проспективные данные пока
не слишком обширны для подтверждения этого факта. Рандомизированное исследование 1/2
фазы RAPPORT было призвано
продемонстрировать безопасность и эффективность SBRT в
комбинации с пембролизумабом
(8 введений 1 раз в 3 недели).
Рисунок
Отдаленные результаты лечения олигометастатического рака почки по данным исследования RAPPORT.
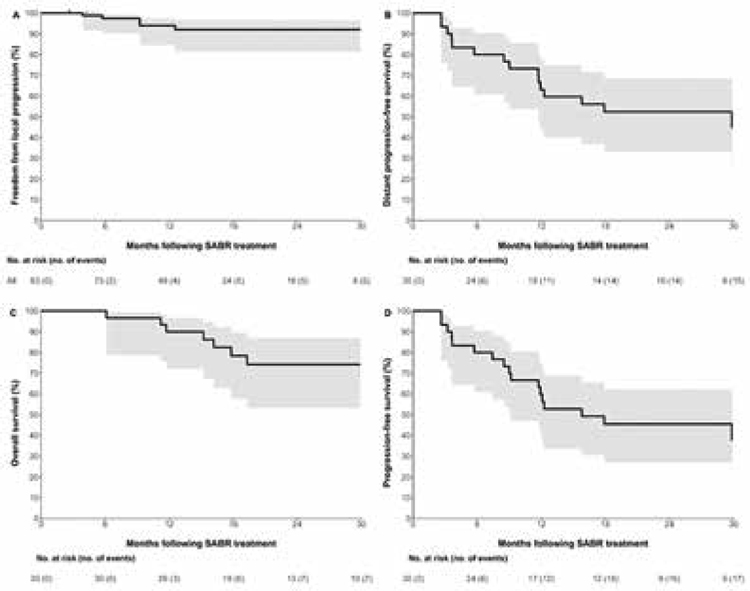
В исследование были включены
30 больных с олигометастатическим раком почки (средний
возраст – 62 года) со средним
периодом наблюдения 28 месяцев. Пациентам проводилось облучение всех олигометастазов (в
целом – 83 очага, в среднем – по
3 на каждого больного) в дозе 20
Гр за 1 фракцию либо (при невозможности) – 10 фракций по 3 Гр.
Затем пациенты получали пембролизумаб 200 мг 1 раз в 3 недели до 8 введений. Большинство
облученных очагов было в легких (43), лимфоузлах (12), костях
(11), а также мягких тканях (9) и
надпочечниках (8). Клинически
выраженные осложнения были
ограничены только 3 степенью
и отмечены у 13% (4) больных:
пневмонит (2), одышка (1) и повышение щелочной фосфатазы
(1), что в целом расценивается как
абсолютно приемлемый уровень токсичности. Выживаемость без
локального прогрессирования за
2 года составила 92%, при этом
общий ответ на лечение – 63% при
локальном контроле 83%. Общая
выживаемость за 1 и 2 года составила 90% и 74% соответственно, а
выживаемость без прогрессирования за те же сроки – 60% и 45%.
SABR и короткий курс пембролизумаба при олигометастатическом омПКР хорошо переносятся
и обеспечивают отличный местный контроль. Стойкий ответ на
лечение и обнадеживающая ВБП,
без сомнения, требуют дальнейшего изучения.
Источник:
Shankar Siva, Mathias
Bressel, Simon T. Wood, Mark G.
Shaw, Sherene Loi, Shahneen K.
Sandhu, Ben Tran, Arun A. Azad,
Jeremy H. Lewin, Katharine E.
Cuff, Howard Y. Liu, Daniel Moon,
Jeremy Goad, Lih-Ming Wong,
Michael LimJoon, Jennifer Mooi,
Sarat Chander, Declan G. Murphy,
Nathan Lawrentschuk, David
Pryor. Stereotactic Radiotherapy
and Short-course Pembrolizumab
for Oligometastatic Renal Cell
Carcinoma – The RAPPORT Trial.
European Urology. 2022; Vol.81,
Issue 4, P.364-372. ISSN 0302-
2838. https://doi.org/10.1016/j.
eururo.2021.12.006.
ПРОМЕЖУТОЧНЫЕ ДАННЫЕ ИССЛЕДОВАНИЯ PROSPERITYПРОСПЕКТИВНОГО НАБЛЮДАТЕЛЬНОГО ИССЛЕДОВАНИЯ ПО ОЦЕНКЕ КЛИНИЧЕСКИХ ИСХОДОВ, СХЕМ ЛЕЧЕНИЯ И ХАРАКТЕРИСТИК ПАЦИЕНТОК С HR+/HER2-РАСПРОСТРАНЕННЫМ РМЖ, ПОЛУЧАЮЩИХ ЛЕЧЕНИЕ С ПРИМЕНЕНИЕМ ПРЕПАРАТА РИБОЦИКЛИБ, ПРЕПАРАТА АЛПЕЛИСИБ, ЭНДОКРИННОЙ ТЕРАПИИ ИЛИ ХИМИОТЕРАПИИ В УСЛОВИЯХ РУТИННОЙ КЛИНИЧЕСКОЙ ПРАКТИКИ В РОССИИ
Е.В. Артамонова1 , Л.Ю.Владимирова2 , Л.Г. Жукова3 , Р.В. Орлова4 , Е.В. Карабина5 ,
Е.И. Коваленко1 , Р.С. Жихорев6 , Е.Н. Ногина7 , Я.А. Тюгина8 , А.В. Шкрадюк9 , Д.Ю. Юкальчук10
1 ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, г. Москва;
2 ФГБУ «НМИЦ онкологии» МЗ РФ, г. Ростов-на-Дону;
3 ГБУЗ г. Москвы «МКНЦ им. А.С. Логинова» ДЗМ, г. Москва;
4 СПбГБУЗ «Городской клинический онкологический диспансер», г. Санкт-Петербург;
5 ГУЗ «Тульский областной клинический онкологический диспансер», г. Тула;
6 ГБУЗ "Московская городская онкологическая больница № 62 ДЗМ", г. Москва;
7 ГБУЗ НО "Новосибирский областной клинический онкологический диспансер", г. Новосибирск;
8 ОБУЗ «Ивановский областной онкологический диспансер», г. Иваново;
9 ГБУЗ РК «Крымский республиканский онкологический клинический диспансер имени В.М Ефетова», г. Симферополь;
10 ГБУЗ «Областной онкологический диспансер», г. Иркутск.
Лекарственную терапию метастатического гормонозависимого HER2- отрицательного рака молочной железы, согласно российским клиническим рекомендациям и рекомендациям ESMO предлагается начинать с применения комбинации ингибиторов циклинзависимых киназ 4 и 6 (CDK4/6) в комбинации с эндокринной терапией (ЭТ) как наиболее эффективной терапевтической опции, хотя в ряде случаев и оговаривается возможность применения ЭТ в монорежиме (моноЭТ) [1-3]. Пациентам с мутацией гена PIK3CA при прогрессировании заболевания рекомендовано назначение таргетного препарата алпелисиба в комбинации с фулвестрантом [1-6].
Несмотря на то, что результаты клинических исследований свидетельствуют о преимуществах комбинированной эндокринной терапии, в
стандартной клинической практике
по-прежнему в качестве инициального лечения часто назначают химиотерапию (ХТ) и моноэндокринную терапию (моноЭТ) [7-11]. Для того чтобы
оценить ситуацию в России, было
начато исследование PROSPERITY -
проспективное неинтервенционное
наблюдательное исследование для
описания клинических исходов, схем
лечения, характеристик пациентов с
HR+ HER2- мРМЖ, начинающих лечение препаратами рибоциклиб, алпелисиб, моноЭТ или ХТ в реальной
клинической практике в РФ [11].
Рисунок 1.
Дизайн исследования PROSPERITY [9, 11].

Дизайн исследования приведён на рисунке 1. Критерии включения: взрослые пациентки с HR+ HER2- мРМЖ с
ECOG ≤ 2, которым по решению лечащего врача был назначен рибоциклиб,
алпелисиб, моноЭТ или ХТ до включения исследования и которые начали прием рибоциклиба, алпелисиба,
моноЭТ или ХТ в течение 0-28 дней до
подписания информированного согласия на участие в данном исследовании. Критерии невключения (хотя бы
1 из следующих): пациенты с ожидаемой продолжительностью жизни < 3
мес; пациенты, участвующие в других
интервенционных клинических исследованиях на момент включения в
исследование; пациенты, получающие
активное лечение онкологических заболеваний, отличных от РМЖ, на момент включения в исследование.
Основной целью PROSPERITY стала
оценка времени до прекращения терапии рибоциклибом, алпелисибом,
моноЭТ и ХТ в семи федеральных
округах Российской Федерации и в
целом, в зависимости от линии терапии у женщин с HR+ HER2- мРМЖ
в рутинной практике. Ключевые дополнительные цели данного исследования включали демографическую
характеристику пациентов, а также
оценку клинических характеристик
(линии терапии, статуса эндокриночувствительности, статуса ECOG,
локализации метастазов, возраста,
статуса менопаузы, коморбидных состояний, статуса мутации PIK3CA);
оценку доли пациентов, получающих каждый вид терапии в 1, 2 и др.
линиях; оценку выживаемости без
прогрессирования (ВБП), общей выживаемости (ОВ), времени до химиотерапии, частоты и причин прекращения терапии и снижения дозы
препаратов, качества жизни.
Полученные результаты могут быть
полезны в выборе последовательности предпочтительных режимов
при лечении пациенток с HR+ HER2-
мРМЖ [12].
Набор в исследование PROSPERITY
идет с июля 2021 г. до июля 2023 г.;
окончание наблюдения запланировано на июль 2025 г. В настоящее
время доступны результаты первого
промежуточного анализа (дата среза данных 1 июня 2022 г.). В выборку
для анализа включена 801 пациентка
с HR+ HER2- мРМЖ (24% от запланированного) из 59 клинических центров, расположенных в различных
регионах РФ: 473 пациенткам был
назначен рибоциклиб, 54 пациенткам
– алпелисиб, 143 пациенткам – моноЭТ и 131 пациенткам – ХТ. Ключевые
исходные демографические и клинические характеристики приведены в
Таблице 1.
Медиана возраста пациенток составила 60 лет (разброс от 24 до 85 лет). У
97,3% пациенток были выявлены метастазы РМЖ, причём 53,7% пациенток имели 4 и более метастазов. Чаще
всего встречались костные (64,7% от
общей популяции) и висцеральные
(57,4%) метастазы РМЖ.
Медиана времени от выявления РМЖ
до включения пациентки в исследование составляла 47 месяцев (41 месяц
в группе рибоциклиба, 47 месяцев в
группе ХТ, 48 месяцев в группе моноЭТ и 64 месяцев в группе алпелисиба).
При этом медиана времени от постановки диагноза распространенного
РМЖ до включения в исследование
была порядка 6 месяцев (от 4 месяцев
в группе рибоциклиба до 27 месяцев в
группе алпелисиба). 52,1% пациенток
имели оценку «1» по шкале ECOG.
Большинство пациенток, включенных в исследование, имели избыточную массу тела: медиана индекса
массы тела (ИМТ) во всей популяции
составляла 27,6 и была сопоставима
во всех группах. Этот показатель особенно важен для пациентов, у которых выявлена мутация в гене PIK3CA
и которым рекомендовано назначение алпелисиба с фулвестрантом.
ИМТ > 25 кг/м2 является фактором
риска развития гипергликемии и требует профилактического назначения
метформина перед приемом препарата алпелисиб, согласно консенсусу по
профилактике и коррекции гипергликемии [13].
К сожалению, исследование PROSPERITY выявило низкий уровень тестирования на мутации в гене PIK3CA в российской клинической практике: в группе рибоциклиба тест был выполнен лишь у 7,2% пациенток, в группе моноЭТ – у 6,3%, в группе ХТ – у 18,3%. И это несмотря на то, что согласно клиническим рекомендациям тестирование на наличие PIK3CAмутаций необходимо проводить всем пациентам с HR+ HER2- рРМЖ при обнаружении первых признаков метастазирования, а также пациентам, получающим любой вид терапии метастатического РМЖ [2,3].

На момент представленного промежуточного анализа данных исследования PROSPERITY 01.06.2022 у 155
(19,4%) пациенток были отмечены нежелательные явления (НЯ), наиболее
частым из которых была нейтропения (6,2%, n=50). В большинстве случаев возникшая нейтропения была
легкой и средней степени тяжести,
и лишь у 2-х пациенток – тяжелой
степени. Частота других НЯ не превышала 5%. Новых сигналов безопасности в отношении рибоциклиба или
алпелисиба выявлено не было. 28 пациенток (3,5%) выбыли из исследования, из них 22 пациентки (2,7%) умерли (10 из-за прогрессирования РМЖ,
9 в результате развития СНЯ, 3 по
другим причинам) и 6 пациенток выбыли из исследования по иным причинам; ни в одном из случаев смерть
пациентов по оценке исследователей
не была связана с приемом рибоциклиба или алпелисиба. Подробный
анализ профиля нежелательных явлений в каждой группе терапии будет
представлен в рамках финального
анализа данных исследования.
Таким образом, результаты промежуточного анализа данных исследования PROSPERITY дают
предварительное представление о
демографических и клинических
характеристиках пациенток с HR+
HER2- рРМЖ, которые получают
терапию рибоциклибом, алпелисибом, ЭТ или ХТ в условиях рутинной
клинической практики в России. Эти
результаты поднимают вопрос о недостаточной распространённости
тестирования на наличие мутаций
PIK3CA в нашей стране, хотя возможности для бесплатного тестирования
в РФ есть:
• Национальная Программа RUSSCO «Совершенствование молекулярно-генетической диагностики в Российской Федерации с целью повышения эффективности противоопухолевого лечения»;
• Программа поддержки диагностики заболеваний РМЖ, меланома Aston Health;
• Программа «Активный пациент»
на базе ООО «Лаборатория
"Гемотест";
• АНО «Развитие научных исследований в медицине».
Таблица 1.
Исходные демографические и клинические данные пациенток,
включённых в исследование PROSPERITY на дату первого промежуточного анализа (01.06.2022)
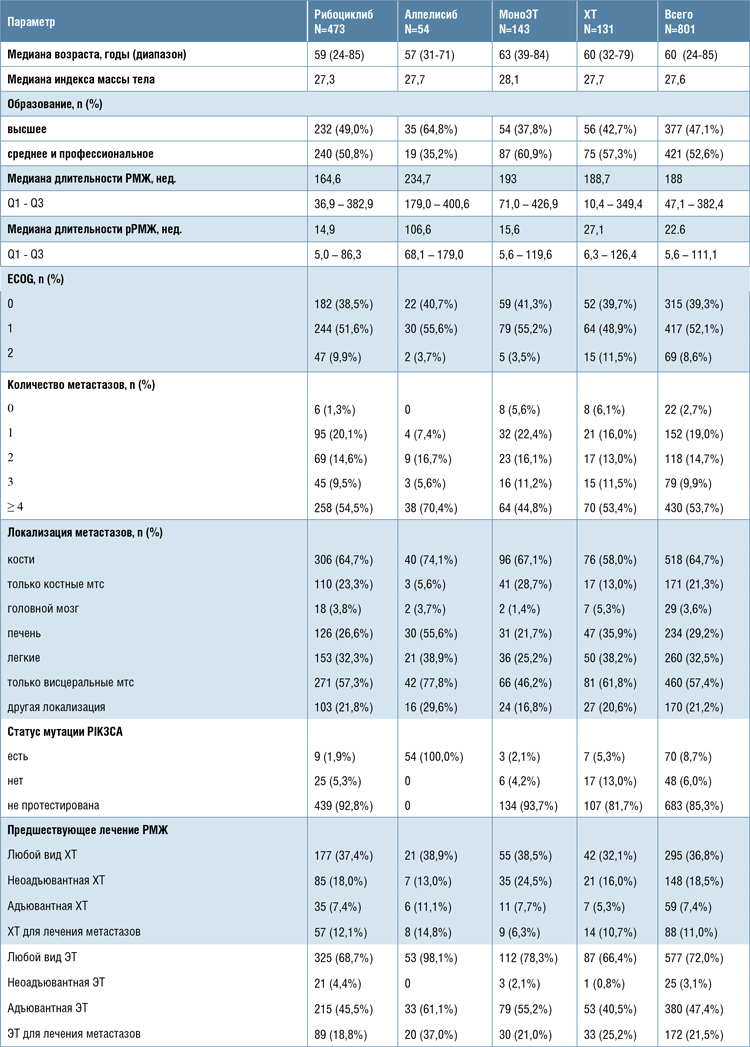
Поскольку исследование
PROSPERITY всё ещё находится в
стадии набора пациенток, результаты по эффективности лечения
пока не поддаются оценке.
Спонсор исследования:
ООО «Новартис Фарма».
Литература:
1. Клинические рекомендации. Рак молочной железы. 2021. http:// cr.rosminzdrav.ru/schema/379 (Дата последнего доступа 07.11.2022).
2. Gennari A. et al. ESMO Clinical Practice Guideline for the diagnosis, staging and treatment of patients with metastatic breast cancer. Annals of Oncology. 2021. DOI:https://doi.org/10.1016/j. annonc.2021.09.019
3. Тюляндин С.А. с соавт. Практические рекомендации RUSSCO#3s2, 2021 (том11).09.
4. Противоопухолевая лекарственная терапия: национальное руководство / под ред. В.А. Горбуновой, М.Б. Стениной – Москва: ГЭОТАР-Медиа, 2022 (серия «Национальные руководства»), 708 с., 1500 экз.
5. Рак молочной железы: руководство для врачей / под ред. Д.А. Рябчикова, А.В. Петровского – Москва: ГЭОТАР-Медиа, 2023, 400 с.: ил. – DOI: 10.33029/9704-7400-0-BRC-2023-1-400, ISBN 978-5-9704-7499-0, 3000 экз. Лекарственное лечение метастатического рака молочной железы, стр. 251- 278. Под редакцией Е.В. Артамоновой
6. Артамонова Е.В., Коваленко Е.И. Системное лечение рака молочной железы (издание 2-е, исправленное и дополненное). М.: Рекламное агентство «Ре Медиа», 2021, 128 с., 5000 экз. ISBN978-5-6044975-1-7
7. Fasching, P.A.et al. (2018) ‘Real-world effectiveness of ribociclib + aromatase inhibitor, or endocrine monotherapy, or chemotherapy as first-line treatment in postmenopausal women with HR-positive, HER2-negative locally advanced or metastatic breast cancer: The RIBANNA study’, Annals of Oncology, 29, p.viii89. doi:10.1093/annonc/mdy271.275.
8. Hortobagyi, G.N. et al. (2016) ‘Ribociclib as First-Line Therapy for HR-Positive, Advanced Breast Cancer’, The New England Journal of Medicine, 375(18), pp.1738–1748. doi:10.1056/ NEJMoa1609709.
9. Slamon D.J. et al. (2018) ‘Phase III Randomized Study of Ribociclib and Fulvestrant in Hormone Receptor-Positive, Human Epidermal Growth Factor Receptor 2-Negative Advanced Breast Cancer: MONALEESA-3’, Journal of Clinical Oncology:36(24),pp.2465–2472. doi:10.1200/JCO.2018.78.9909.
10.Tripathy, D. et al. (2018) ‘Ribociclib plus endocrine therapy for premenopausal women with hormone-receptor-positive, advanced breast cancer (MONALEESA-7): a randomized phase 3 trial’, The Lancet. Oncology, 19(7), pp.904–915.doi:10.1016/ S1470-2045(18)30292-4.
11.Study Protocol CLEE011ARU01: A prospective observational study to describe clinical outcomes, treatment patterns, patients characteristics among patients with HR+/HER2- advanced BC initiating treatment with Risarg® (ribociclib), Piqray® (alpelisib), endocrine therapy or chemotherapy in routine clinical practice in Russia (PROSPERITY). Available at: https://clinicaltrials.gov/ct2/show/ NCT04943497. Дата последнего доступа: 21.01.2023.
12.Жукова Л.Г. Исследование PROSPERITY и опыт применения алпелисиба в Московском клиническом научном центре им. А.С. Логинова, в статье “Ведение пациентов с гормонозависимым HER2-отрицательным метастатическим раком молочной железы: данные рандомизированных исследований и клинической практики”. Современная Онкология. 2022;24(1): 24–29. DOI:10.26442/18151434.2022. 1.201466.
13.Мазурина Н.В., Артамонова Е.В.,
Белоярцева М.Ф. и др. Современная
Онкология. 2020; 22 (4): 56–59.
«ЕСЛИ НА КЛЕТКЕ СЛОНА ПРОЧТЁШЬ НАДПИСЬ «БУЙВОЛ», НЕ ВЕРЬ ГЛАЗАМ СВОИМ!» (К. Прутков)
— А ВОТ БЫЛ У МЕНЯ СЛУЧАЙ..." ИЛИ "ОХОТНИЧЬИ ЗАПИСКИ" ОНКОЛОГОВ"
Автор: Жуков Николай Владимирович
ФГБУ «НМИЦ Детской гематологии, онкологии и иммунологии им. Д. Рогачева»,
РНИМУ им. Н.И. Пирогова, доктор медицинских наук, профессор, Москва
Добрый день, дорогие коллеги. Продолжая цикл «охотничьих записок»,
я впервые (к стыду своему) задумался над смыслом этой фразы К. Пруткова, которая всегда мне казалась
абсолютно понятной. Мне казалось,
что не верить нужно обязательно
надписи – ведь в клетке слон, значит
надпись неверная. Но, выбрав для
названия этого клинического случая данное высказывание, я понял,
что смысл фразы гораздо глубже и
ироничней. Она «действует в обе
стороны» – глаза видят и надпись, и
животное в клетке, а вот чему конкретно из того, что они видят, не верить, эта крылатая фраза совершенно не говорит. Это предстоит решать
нам, обладателям тех самых глаз.
Итак, в сентябре прошлого года у
меня зазвонил телефон. Это был
один из сотрудников нашего Центра
(не медик), у родственницы которого «случилась взрослая онкология».
Увы, учитывая, что центр педиатрический, это мой «крест» как взрослого онколога в кругу педиатров и немедицинского персонала. У всех есть
родственники, друзья, друзья друзей
и просто знакомые, которые в силу
гораздо более частой встречаемости
опухолей у взрослых заболевают с
завидной регулярностью… Но, если
честно, я всегда рад помочь, так как
если мы не будем помогать друг другу, это будет совсем уж плохой мир.
Обращения поступают часто, но
чаще всего бывает достаточно лишь
дать «направление» к кому-то из коллег взрослых онкологов, посоветовать клинику или чуть «подправить»
терапию – но это был другой случай
(хотя сначала таким он не выглядел).
Речь шла о пациентке 67 лет, онкологический анамнез которой начался
в 2016 году, когда ей была проведена
тиреоидэктомия по поводу местнораспространенной опухоли щитовидной железы. Согласно морфологическому исследованию с ИГХ, речь
шла о медуллярном раке щитовидной
железы. К сожалению, в марте 2022
года (спустя 6 лет) болезнь рецидивировала, и в настоящий момент у
пациентки были выявлены множественные метастатические очаги на
плевре правого гемиторакса. Пациентка находилась в процессе терапии
вандетанибом, который ей не очень
помогал – очаги на плевре имели
тенденцию к росту, при этом на фоне
приема отмечалась потеря веса, выраженная артериальная гипертензия,
выраженная астения. Смысл вопроса
родственников заключался в следующем: что же еще можно сделать для
лечения пациентки. И, собственно,
ответ казался относительно очевидным – попытка перехода на альтернативный препарат (кабозантиниб),
параллельное тестирование на мутацию RET и при позитивном результате – поиск возможности «достать»
селективные RET-ингибиторы в случае неэффективности/токсичности
попытки терапии кабозантинибом.
Но детальный анализ документации
показал, что «на клетке была неправильная надпись». Только на протяжении всего лечения, к сожалению,
никто в ней не усомнился. Итак, присланные медицинские документы
были многочисленны, но достаточно
скудны по содержанию. Они свидетельствовали о том, что пациентка
находились одновременно под контролем государственной онкологической службы, частной клиники и
эндокринолога, и, на первый взгляд,
отражали вполне здравый «онкологический» подход. Как я сказал выше,
в 2016 году было выявлено образование щитовидной железы, по поводу
чего она была оперирована в частной
клинике в объеме тиреоидэктомии и
лимфодиссекции лимфоузлов шеи.
Заключительный диагноз (после
морфологического исследования с
ИГХ) – медуллярный рак щитовидной железы T4N0M0. Судя по всему,
местная распространенность болезни
в пределах органа была столь велика,
что патоморфологи даже не указали
исходную локализацию процесса.
Операция осложнилась эпизодом
гипопаротиреоза, купировавшимся
самостоятельно без потребности в
хронической заместительной терапии. В послеоперационном периоде
была проведена лучевая терапия. Пациентка была крайне «комплаентна»,
регулярно проходила все рекомендованные контрольные обследования,
регулярно посещала эндокринолога
для коррекции заместительной терапии. Однако в 2021 году было отмечено появление болей в спине. Как
ни странно, первым на это обратил
внимание эндокринолог, который в
апреле 2022 года направил больную
на КТ органов грудной клетки, где и
были выявлены изменения по плевре.
Была выполнена биопсия, и при морфологическом исследовании с ИГХ
(мономорфная экспрессия хромогранина, синпатофизина, кальцитонина,
вариабельная экспрессия TTF-1, фокальная CD 56, отсутствие экспрессии РЭА, MUM1, тироглобулина,
кальретинина, CK 5/6, напсина А, СВ
45) был поставлен диагноз метастазов
медуллярного рака щитовидной железы. Судя по спектру исследованных
маркеров и тексту заключения ИГХ
(полученный иммунопрофиль опухолевых клеток более характеризует медуллярную карциному), было видно,
что у патолога возникали сомнения,
но он трактовал их в сторону первоначального диагноза. Также у пациентки
появились некие диссоциативно-когнитивные нарушения на фоне атеросклероза сосудов головного мозга, которые кочевали из выписки в выписку
в качестве сопутствующего диагноза
(что косвенно свидетельствовало о
выраженности имеющихся изменений, но при этом каких-либо обследований, подтверждающих генез изменений, в выписках не содержалось).
Итак, получив патоморфологическое
подтверждение диагноза, доктора назначили абсолютно правильное для
него лечение – вандетаниб, которое
пациентка и стала получать с мая 2022
года. Но токсичность лечения оказалась ожидаемо высока (гипертензия,
астения), а вот противоопухолевого
эффекта, к сожалению, не последовало. В общем, вполне типичная
история. Однако что-то меня в этой
истории насторожило – а именно,
что при диагнозе «медуллярный рак
щитовидной железы» в выписках не
содержалось информации об уровне кальцитонина и РЭА. При этом в
одном из анализов, приведенных в
эпикризе, я увидел значимое повышение кальция (3,7 ммоль/л при норме для локальной лаборатории 2,55
ммоль/л) и креатинина, и это при том,
что у пациентки не было выявлено
метастазов в кости и не описывалось
болезней почек. Собственно, это и
заставило меня запросить дополнительные анализы биохимический,
уровень кальцитонина, РЭА и исследование других гормонов, если проводились. Как оказалось, все это было
у пациентки на руках, все это видели
все врачи, которые ее наблюдали (и
онколог в государственной и частной
клинике, и эндокринолог, и консультанты из федеральных клиник). И на
самом деле правильный диагноз был
написан в этих анализах крупными
буквами – надо было лишь задуматься и понять, чему должны «верить
глаза» – записи патоморфолога или
клинической картине. Вот этот диагноз в виде анализа крови, взятого
эндокринологом перед тем, как направить пациентку на КТ по поводу
болей в спине (аналогичные анализы
со схожими результатами были взяты и позже, уже в онкологическом
учреждении). Надеюсь, что после
такой преамбулы (а может и без нее)
вы тоже легко поставите правильный
диагноз нашей больной:
• Т4 свободный – 21,5 пкмоль/л (норма 10,6-22,7)
• ТТГ – 0,159 мМЕ/л (норма 0,16-3,94) • Кальцитонин – 0,99 пкг/мл (норма 0-9,82)
• Паратиреоидный гормон (ПТГ) интактный – 90,57 пмоль/л (норма 1,6-6,9)
• Кальций общий – 3,63 ммоль/л (норма 2,20-2,55)
• Кальций ионизированный – 2,02
ммоль/л (норма 1,13-1,32)
Правильно! У пациентки совсем не
медуллярный рак щитовидной железы, для которого характерно повышение кальцитонина, а рак паращитовидной железы – повышен уровень
ПТГ и кальция. И не противоопухолевая терапия ей нужна в данный
конкретный момент, а экстренная
коррекция уровня кальция, на жизнеугрожающий уровень которого и очевидные связанные с ним симптомы
(почечная недостаточность, гипертензия и те самые загадочные диссоциативно-когнитивные нарушения)
никто не обратил внимания. Было
очевидно, что пациентка страдала
не от объема опухолевой массы, который был весьма невелик, а именно
от гиперкальциемии, которая представляла для нее непосредственную
и весьма существенную проблему.
Учитывая, что гиперкальциемий на
заре своей онкологической карьеры
я видел много, первые и быстрые рекомендации были просты: отменить
вандетаниб (в связи с токсичностью
и неэффективностью), обратиться в
стационар для проведения гидратации, компенсации электролитного
баланса, как можно скорее начать введение деносумаба (предпочтительно)
или бисфосфонатов, если деносумаб
недоступен. Ну и в плановом порядке
отправить гистологические препараты на пересмотр в какую-нибудь федеральную клинику, снабдив в обязательном порядке сопроводительным
письмом об уровне гормонов и кальция (чтобы наконец поставить правильный диагноз, а не посмотреть, а
сможет ли очередной патолог сделать
это, не имея описания клиники). Учитывая, что это была дистанционная
консультация по документам, разумеется, я сопроводил это все обычной
преамбулой о том, что это не может
быть прямым руководством к действию/бездействию, а окончательное
решение принимает лечащий врач,
несущий всю ответственность и располагающий всей информацией о состоянии больной и т.д.
В отношении же лечения основного
заболевания (рака паращитовидной
железы) было сложнее. Честно признаюсь, это был первый рак паращитовидной железы, который я видел
в своей жизни (но уверен, что большинство из вас не видели его вовсе),
поэтому перед тем, как писать ответ
с рекомендациями, я прочел, что же
пишут по поводу этой крайне редкой
болезни. Пришлось почитать. Увы,
как оказалось, эффективных вариантов лечения этой опухоли не существует: она резистентна к химиотерапии и лучевой терапии, мишеней для
таргетной терапии не содержит. Но
по характеру течения в отношении
накопления опухолевой массы заболевание весьма индолентно (что, собственно, наблюдалось и у нашей пациентки – время до рецидива более 5
лет, небольшой и клинический незначимый объем поражения). Основную
проблему представляет гиперкальциемия, вызванная гиперсекрецией
ПТГ, которая без адекватной коррекции и убивает большинство больных
задолго до того, как опухолевый объем начинает представлять для них
проблему. Поэтому основная задача
в лечении этих больных – нормализация и поддержание уровня кальция.
Что, собственно, на интуитивном
уровне я и рекомендовал сделать.
Примерно через месяц пришло заключение от патологов из СанктПетербурга, куда были отправлены
на пересмотр гистологические препараты с сопроводительным письмом о клинике и уровне гормонов.
Без неожиданностей (для меня) в
нем было написано – ну конечно же
это рак паращитовидной железы, как
можно было перепутать.
Ну и появились первые результаты
лечения больной – стабилизация размеров опухолевых очагов, значимое
соматическое улучшение, нормализация уровня кальция и креатинина, но
при этом был отмечен выраженный
рост уровня ПТГ, который даже «вылетел» за верхние границы, которые
может определять анализатор. Но,
собственно, это было ожидаемо – на
фоне коррекции уровня кальция
опухоль, сохранившая остатки «поведения» нормальной паращитовидной железы, по принципу обратной
связи старалась этот уровень кальция поднять. Изо всех сил. Но мы
справились и с этим, так как кроме
привычных нам остеомодифицирующих агентов (деносумаб), которые
были использованы для экстренной
помощи больной при выраженной
гиперкальциемии, при раке паращитовидных желез применяется особый
класс препаратов – кальцимиметики,
которые онкологам гораздо менее
знакомы, поскольку чаще используются другими специалистами, борющимися с более частыми причинами
гиперфункции паращитовидных
желез (почечная недостаточность).
Принцип действия этих препаратов
– «обман» клеток паращитовидной
железы, создающий у нее «иллюзию»
избытка кальция. Препарат из этой
группы – цинакальцет – и был назначен нашей пациентке, что привело к
снижению уровня ПТГ.
Вот, собственно, почти и все. И,
как обычно, в конце письмо от родственников: «Мама чувствует себя
в ДИНАМИКЕ удовлетворительно:
1) восстановилась память и логика
на 100 процентов, 2) стали гулять
на улице уже по 40 минут, а раньше приходилось помогать встать
с кровати, 3) стала лучше кушать,
появился аппетит, 4) стала как и
прежде много читать, пользуется
свободно смартфоном, раньше не
могла, смотрит телевизор, интересуется новостями, 5) больше стала
следить за своей внешностью, 6)
помогает на кухне, 7) меньше стала
уставать».
Мораль: если патоморфолог написал
один диагноз, а вы видите второй, необязательно, что прав патоморфолог.
Хотя, конечно, крайне важно этот
диагноз видеть, задумываясь о нестыковках и несоответствиях между
имеющимся и настоящим диагнозом.
ProtecT: ДВЕНАДЦАТЬ ЛЕТ НАБЛЮДЕНИЯ
Исследования, произведенные на основании аутопсий, демонстрируют, что опухоли простаты возникают гораздо раньше и гораздо чаще, нежели демонстрирует любая статистика, и при этом мужчины в течение длительного времени не имеют ни малейшего понятия об их существовании. Примерно у 29% мужчин в возрасте от 30 до 40 лет обнаруживаются маленькие злокачественные опухоли в простате, и этот процент возрастает до 64% в промежутке между 60 и 70 годами. При этом лишь 1 из 38 больных раком простаты умирает по данной причине, тогда как более 2/3 мужчин в возрасте за 70 продолжают жить с этой опухолью и погибают от других заболеваний. Различия в потенциальной агрессивности этих опухолей, отчасти определяемая патоморфологами с использованием шкалы Глисон, могут являться причиной того, что часть опухолей персистирует десятилетиями, отличаясь медленным ростом, не метастазируя, никогда не обнаруживая себя симптомами и не угрожая жизни. Осознание того, что рак простаты с низкой степенью злокачественности способен вести себя столь индолентно, со временем привело к дискуссиям, не нанесёт ли максимум вреда именно лечебное вмешательство в подобных ситуациях (операция, лучевая или гормональная терапия), которое однозначно спасло бы жизнь пациентам с опухолями высокой степени злокачественности. Специалисты NCCN в своих рекомендациях в отношении рака простаты не только низкого риска (опухоль T1-T2a, Gleason≤6, уровень простатоспецифического антигена (ПСА) на момент диагностики ≤10 нг/ мл), но даже и промежуточного (Т2b-T2c, Gleason - 7, ПСА – 10- 20 нг/мл) советовали при выборе тактики решения, прежде всего, отталкиваться от ожидаемой продолжительности жизни пациента. Если она не превышает 10 лет, то можно ограничиться только наблюдением за данным больным без принятия каких-либо решительных мер специфического воздействия на опухоль. Если ожидаемая продолжительность жизни, скорее всего, превысит 10 лет, тогда можно рассматривать и другие варианты тактики ведения пациента, среди которых, впрочем, активное наблюдение (анализ крови на ПСА не чаще одного раза в шесть месяцев при наличии клинических проявлений, а также несколько других исследований) является не просто допустимой опцией, а первым из предлагаемых экспертами вариантов для больных раком простаты низкого риска.
Рисунок 1.
Нарушения мочевыделительной функции (А – недержание мочи, В – ношение прокладок) по группам наблюдения,
радикальной простатэктомии и лучевой терапии.
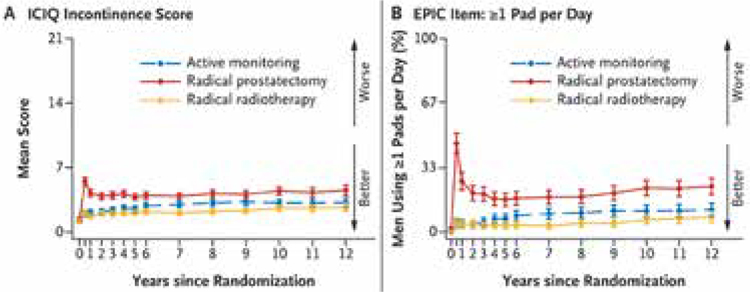
В конце 2016 года были впервые
опубликованы результаты так называемого «Исследования века»
- ProtecT - проведенного британскими учеными [1,2]. В этом исследовании больные не только
были рандомизированы в группы
скрининга рака простаты и отказа от скрининга. Рандомизация также подразумевала отбор
больных с установленным диагнозом рака простаты низкого и
промежуточного риска в группы наблюдения, дистанционной
лучевой терапии и операции.
Наиболее важный вывод работы
состоял в том, что не было обнаружено никаких различий в раково-специфической выживаемости за 10 лет в этих трех группах. Отмечены определенные различия в характере побочных эффектов лечения. Несостоятельность
мочевого пузыря и сексуальная
дисфункция были выше в группе
хирургического лечения, тогда
как осложнения со стороны кишечника – в группе лучевой терапии. Данные этой колоссальной
работы означают необходимость
скрупулезного обсуждения всех
лечебных опций для больного с
впервые выявленным раком простаты низкого и промежуточного
риска в мультидисциплинарной
команде, а также поддерживают
тактику активного наблюдения в
качестве изначально более предпочтительной стратегии, подразумевая, что около 50% больных в
определенный момент за период
наблюдения могут начать получать лечение, хирургическое либо
лучевое.
Рисунок 2.
. Нарушения эректильной функции в группах (А – сохранение сексуальной потенции, В – частота эректильной дисфункции)
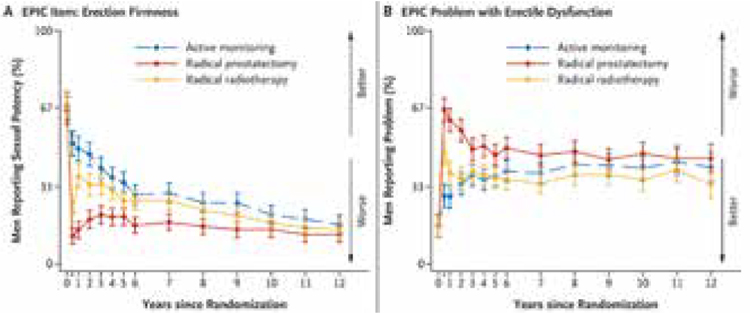
В недавнем номере New England
Journal of Medicine были опубликованы результаты уже 12-летнего наблюдения за всеми пациентами из исследования ProtecT
[3], представившие надежные и
подробные данные в отношении
долгосрочного эффекта трех различных тактик ведения больных раком простаты низкого и
промежуточного риска - простатэктомии, лучевой терапии
и активного мониторинга - на
мочевыделительную, половую
функцию и функцию кишечника и связанное с этим качество
жизни. Непроизвольное подтекание мочи, требующее ношения
прокладок, отмечено у 18–24%
пациентов из группы простатэктомии в сравнении с 9-11% в
группе активного наблюдения и
3-8% в группе лучевой терапии
(рис.1). Эрекция, достаточная для
совершения полового акта, сохранялась у 18% больных в группе простатэктомии через 7 лет после лечения по сравнению с 30% в
группе активного наблюдения и
27% после лучевой терапии; при
этом все отметили более низкие
уровни потенции к 12 годам наблюдения (рис.2). Никтурия (мочеиспускание минимум два раза
за ночь) наблюдалась у 34% в группе простатэктомии по сравнению
с 48% в группе в группе лучевой
терапии и 47% в группе активного наблюдения через 12 лет. Неудержание кала отмечено у 12% в
группе лучевой терапии по сравнению с 6% в других группах к 12
году наблюдения. В группе активного отслеживания наблюдалось
более постепенное возрастное
снижение половой функции и
функции мочеиспускания, что не
являлось эффектом радикальных
методов лечения. В целом показатели качества жизни на основании опросов 1643 пациентов из 3
групп оказались схожими (рис.3).
В любом случае эти данные позволяют пациентам с впервые диагностированным локализованным раком простаты низкого и
промежуточного риска и их врачам найти тот компромисс между
вредом и пользой различных вариантов радикального лечения и
принять более информированное
и взвешенное решения в отношении тактики.
Рисунок 3.
Качество жизни пациентов в группах активного наблюдения, радикальной простатэктомии и радикальной лучевой терапии
(А – физическое здоровье, В – ментальное здоровье, С – тревожность, D – депрессия).
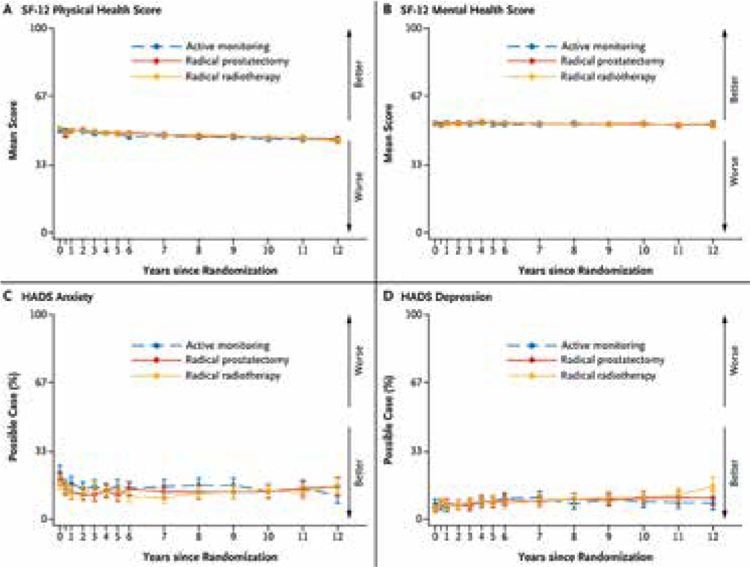
Источники:
1. Hamdy FC, Donovan JL, Lane JA, et al.; ProtecT Study Group. 10-Year outcomes after monitoring, surgery, or radiotherapy for localized prostate cancer. N Engl J Med. 2016 Oct 13;375(15):1415-1424.
2. Donovan JL, Hamdy FC, Lane JA, et al.; ProtecT Study Group. Patientreported outcomes after monitoring, surgery, or radiotherapy for prostate cancer. N Engl J Med. 2016 Oct 13;375(15):1425-1437.
3. Jenny L. Donovan, et al. PatientReported Outcomes 12 Years
after Localized Prostate Cancer
Treatment. New Eng J Med 2023,
published March 11, 2023. DOI:
10.1056/EVIDoa2300018
СОВЕТЫ КАТАЛОГИЗАТОРА
Мировая литература изобилует огромным количеством великолепных произведений, и наверняка многие из нас мысленно жалели, что одной жизни не хватит, чтоб прочитать всё, что хотелось бы. Ежегодно появляются новые авторы, публикуются сотни тысяч новых книг, и разобраться в подобном многообразии порой неимоверно сложно. Можно ориентироваться на списки номинантов и победителей различных литературных премий, на рекомендации крупных издательств или популярных журналов, наконец, на советы друзей - но всегда есть риск, что выбранная по этому принципу книга, несмотря на восторженные рецензии, не станет твоей, не займет достойное место в личной библиотеке любимых авторов.
Ознакомиться с новинками современной европейской литературы в настоящее время еще
сложнее. Тем не менее, это возможно – если прибегнуть к советам тех людей, для которых
регулярное прочтение огромного
количества книг стало не просто
увлечением или любовью, но и
профессией.
Наша новая рубрика – «Советы
каталогизатора», в которой мы
планируем знакомить читателей
газеты с малоизвестными российским любителям литературы
и искусства произведениями с
помощью человека, который разбирается в этом глубоко и досконально.
Чарли Хау

Чарли Хау (Charlie Howe) – выпускник университетов Сассекса и Рединга, специалист по европейской литературе, в прошлом – книжный дилер, на протяжении 5 лет работает каталогизатором редких и антикварных книг и манускриптов для английского аукционного дома Tooveys, любитель поэзии и искусства, поклонник русской классической литературы, особенно Чехова. «Более всего я люблю предвкушение от встречи с чьей-либо коллекцией книг и узнавание её владельца через них, потому что книги – они словно симптомы, позволяющие осветить каждый уголок человеческой души».
Хавьер Мариас

Итак, знакомьтесь: Хавьер Мариас
(Javier Marias, 1951-2022 гг.), известный испанский писатель, переводчик, журналист. Окончил факультет
английской филологии в Университете Комплутенсе в Мадриде, в 1980-
х годах преподавал испанскую литературу в университете Оксфорда,
обладатель огромного количества
премий.
Charlie Howe: «Поклонники творчества Хавьера Мариаса до сих пор
пребывают в трауре по причине
его безвременной смерти в возрасте 70 лет от ковида в сентябре 2022
года. Его романы имеют отчетливое
испанское звучание. Они часто начинаются с мелодрамы, напоминающей фильмы Педро Альмодовара
или даже испанские мыльные оперы, – но всегда любопытствующий,
настороженный и бдительный голос берет верх, и вскоре философия становится даже более явной и
актуальной, нежели сама сюжетная
линия. Неудивительно, что некие
навязчивые идеи Мариаса столь
близки ему – и столь притягательны
для читателя.
Отец Мариаса, Хулиан (Julian
Marias), был известным испанским
философом. Во время гражданской
войны в Испании он был предан
близким соратником, что стало немалым ударом для него и семьи, в
результате чего в течение довольно
долгого времени семья жила в Америке, где Хулиан мог преподавать.
Это ощущение предательства и его
ответвления во времени прослеживаются и в произведениях Хавьера
Мариаса, будучи особенно очевидными в «Thus Bad Begins» (начало
фразы из III акта шекспировского
«Гамлета» - «Thus bad begins and
worse remains behind», что чаще переводится как «Плох первый шаг, но
худший недалёк» - ред.). Возможная
свобода, ирония и двусмысленность
современного и изысканного языка
Мариаса присутствуют в каждом
романе. Часто главный персонаж
отвлекается, вплоть до нескольких
страниц, от основного значения какого-либо слова и показывает, что
перевод – это психологический акт,
в такой же степени, как и любое другое действие.
Несмотря на уход Мариаса, у его почитателей сегодня есть небольшой
повод для радости, поскольку англоязычная версия последнего романа
«Томас Невинсон» была опубликована недавно, уже после смерти его
ярчайшего автора, с узнаваемыми
растянутыми, по-прустовски, фразами Мариаса. «Томас Невинсон»
- это роман-компаньон великолепного романа «Берта Исла», опубликованного в 2018 году, в котором
представлен рассказ Томаса о его
жизни в качестве шпиона. Тема
шпионажа для Мариаса была весьма регулярной: это способ увидеть
и понять состояние человека на объективном уровне. Очень необычно
встречать писателя, который исследует вопросы сознания, желания,
времени и памяти, и при этом имеет
новый и оригинальный взгляд на
очень старые, вечные темы».
От редактора: из почти 2 десятков произведений Мариаса на русский язык переведены лишь четыре («Все души» 1989 года, «Белое сердце» 2002 года, «В час битвы завтра вспомни обо мне» 2002 года - все три вышли в издательстве Амфора - и «Дела твои, любовь» 2013 года, издательство Corpus). Сложно рассчитывать на то, что в ближайшие годы мы увидим новые переводы книг Мариаса – а жаль, чертовски жаль… Этот автор стал моим персональным литературным открытием нового года. «Плотное», почти без абзацев, чтиво затягивает, мысли автора переплетаются с твоими собственными. Закрыв последнюю страницу, распутываешь нить повествования с конца до начала и наоборот, расплетая связи между героями, ощущая телом и душой запахи, боль, кожу, мокрую от дождя ткань шерстяного пальто, страх, онемение, обжигающий виски в горле – и многое другое. Думаю, еще предстоит понять, чем автор настолько умело захватывает твое внимание, что книгу не хочется откладывать, даже когда одолевает сон… а впрочем – надо ли озадачиваться этим?
Лаура Найт

Лаура Найт (Laura Knight, 1877- 1970 гг.), возможно, самая известная английская художница, представительница постимпрессионизма в живописи, первая женщина-живописец, принятая в действительные члены Королевской академии искусств, кавалер ордена Британской империи. Работала преимущественно в Англии. После окончания Первой мировой войны специализировалась на портретах актёров цирка, театра и балета, в том числе из Русского балета Дягилева, а в годы Второй мировой войны получила официальный пост военного художника, войдя в журналистскую группу, освещавшую Нюрнбергский процесс, делала зарисовки сцен из зала суда над нацистскими преступниками.
Лаура Найт «Читающая девушка» 1910

Гравюра Лауры Найт «Мадонна»
была создана 100 лет назад – в 1923
году. Эта завораживающая работа – портрет Лидии Лопуховой (так
же известной, как Лидия Лопокова),
известной русской балерины, покинувшей Россию в 1910 году и присоединившейся к группе Дягилева. Родилась в Санкт-Петербурге, входила
в труппу Мариинки, после отъезда
танцевала в паре с Нижинским, была
знакома с Пикассо, который не раз
писал ее портреты, со Стравинским
и многими другими известнейшими
деятелями искусства. Супруга крупнейшего европейского ученого-экономиста Джона Мейнарда Кейнса.
Гравюра Лауры Найт «Мадонна»

Charlie Howe: «В фокусе гравюры –
великолепные глаза Лидии, необъятные, словно вмещающие в себя
целый мир, но эта необъятность
выглядит так, будто Лидия никогда и ни единой душе не расскажет
о том, что творится внутри нее,
там не менее, прекрасно осознавая это. Желание или печаль, или
нечто, что не передать словами –
возможно, в глазах женщины они
выглядят одинаково. Наверное,
поэтому Лаура Найт назвала этот
портрет «Мадонной» – хоть и без
ребенка, ибо ее брак с Мэйнардом
оставался бездетным. Было мнение, что это произошло по причине гомосексуальности супруга,
однако письма Лидии и Кейнса
показывают, что это не так, и брак
их был глубоким, счастливым и
невероятно сексуальным. Каковы
бы ни были намерения Найт при
создании портрета – мне очень
нравится результат. Некоторое
время назад я пытался купить эту
гравюру на аукционе – но, увы, она
оказалась недосягаемой…»
БЕГ НА ДЛИННЫЕ ДИСТАНЦИИ НЕ ИЗНАШИВАЕТ СУСТАВЫ
Автор: Nancy Lapid,
Reuters Health
Большое исследование среди марафонцев предполагает, что бег на длинные дистанции не приводит выраженному износу суставов, который
спровоцировал бы артрит коленного или тазобедренного суставов.
Исследователи считают, что эти результаты противоречат давно
устоявшейся догме о том, что бег увеличивает риск развития подобных артритов.

В рамках исследования опросы были разосланы примерно 38 000 бегунов, зарегистрированных для участия в Чикагских марафонах 2019 и
2021 годов, и были получены заполненные опросы почти от 4000 человек. Средний возраст бегунов составлял 44 года, половина опрошенных
преодолела более пяти марафонов. В целом 7,3% респондентов сообщили о наличии остеоартрита тазобедренного или коленного сустава или
того и другого. Подавляющее большинство из них с большей вероятностью имели в анамнезе травму колена или бедра, пожилой возраст,
семейный анамнез артрита и более высокий индекс массы тела, как
сообщил доктор Мэтью Хартвелл из Калифорнийского университета
в Сан-Франциско с коллегами на ежегодном собрании Американской
академии хирургов-ортопедов (AAOS) в Лас-Вегасе. При этом совокупное количество лет бега, количество завершенных марафонов, еженедельный пробег и средний темп бега не были связаны с вероятностью
развития артрита.
«Эти результаты могут быть применены работниками здравоохранения для информирования пациентов о рисках и преимуществах бега, а
также в качестве основы для пересмотра существующих рекомендаций
по бегу и сохранению здоровья суставов», – заключили исследователи.
Исследование находит оптимальный вариант
восстановления распространенной травмы колена
Сроки операции по восстановлению разрыва ключевой связки, стабилизирующей колено, – передней крестообразной связки (ПКС) – может
повлиять на результаты, сообщили исследователи на собрании AAOS.
Разрывы передней крестообразной связки являются одними из наиболее распространенных травм колена и особенно часто возникают у
спортсменов, занимающихся такими видами спорта, как футбол, американский футбол и баскетбол. Пациентам часто требуется хирургическое вмешательство, чтобы полностью восстановить функцию коленного сустава.
Исследователи использовали большую страховую базу данных для изучения 11 867 пациентов, перенесших операцию по восстановлению
ПКС в период с 2015 по 2018 год. В целом 76,1% перенесли операцию в
течение двух месяцев после диагностики травмы. Чаще всего это имело
место у подростков с разрывами связки.
Исследователи обнаружили, что восстановление ПКС через 6-8 недель
после постановки диагноза сопряжено с наименьшим риском необходимости дополнительных процедур во время первоначальной операции и повторной операции в течение следующих двух лет.
Операция, выполненная в более ранние сроки, была связана с большей
потребностью во вторичной процедуре, включающей манипуляции на
колене под анестезией или хирургическое удаление рубцовой ткани,
чтобы восстановить полный диапазон движений.
Однако по мере увеличения времени ожидания операции доля пациентов, нуждающихся в одномоментном восстановлении разрыва хряща
коленного сустава или мениска, также увеличилась с 9,1% через 2 месяца до 20,5%, если восстановление было отложено более чем на шесть
месяцев после травмы.
«Мы считаем, что данные этой большой группы пациентов дают ценную информацию об оптимальных сроках реконструкции передней крестообразной связки, – отметил руководитель исследования доктор Алан Чжан из Калифорнийского университета в Сан-Франциско. – Существует риск послеоперационной тугоподвижности коленного сустава, если операция проводится слишком рано, но есть риск накопления травм мениска и отказа трансплантата ПКС, если операция откладывается более чем на 6 месяцев».
ЛУЧЕВАЯ ТЕРАПИЯ ПРИ БОЛЕЗНИ АЛЬЦГЕЙМЕРА: ДАННЫЕ ПИЛОТНОГО КЛИНИЧЕСКОГО ИССЛЕДОВАНИЯ
Результаты этого маленького пилотного исследования были только что – 17 марта 2023 года – опубликованы в «Красном журнале» ASTRO (International Journal of Radiation Oncology, Biology and Physics), а уже успели вызвать немало обсуждений и споров между онкологами различных стран, от принятия подобного подхода как чрезвычайно интересного и многообещающего до категорического отрицания самой вероятности применения лучевой терапии при данной патологии. Без сомнения, тема чрезвычайно актуальна: до сих пор деменция Альцгеймера остается нерешенной проблемой, и каких-либо существенных сдвигов в лечении этого заболевания не было сделано.
Меж тем, несколько доклинических исследований показали, что малые дозы ионизирующего излучения вполне могут стать примером нефармакологического подхода и даже новой лечебной опцией для таких пациентов. Эффекты малых доз на мозговую ткань, без сомнения, многогранны, но есть мнение, что в первую очередь эффект реализуется через клетки микроглии, играющие важную роль в фагоцитозе нейронального дебриса (остатков клетки) и сокращении синапсов для поддержания гомеостаза микроокружения мозговой ткани. Регуляция микроглиальных клеток может стать потенциальным лечебным методом при болезни Альцгеймера. Как показывает одно из исследований, их количество увеличивается примерно к 4 неделе после облучения всего объема головного мозга в дозе 10 Гр за 5 фракций и продолжает возрастать в дальнейшем. Возможность нейрогенеза у мышей в эксперименте не исключалась авторами как долгосрочный эффект облучения [1].
Как правило, все немногочисленные исследования по этой проблеме касались ранних стадий деменции. Вышеупомянутое пилотное исследование включало всего 5 пациентов (3 женщины, 2 мужчин) с ранней стадией деменции Альцгеймера, и основной целью авторов было показать безопасность малых доз облучения при этой патологии, в первую очередь, в отношении нейрокогнитивной, визуальной, офтальмологической функций [2]. Все пациенты (в возрасте не менее 55 лет, с ожидаемой продолжительностью жизни более 12 месяцев) с подтвержденными (по данным ПЭТ и другими методами) критериями болезни Альцгеймера, но способныe заполнить необходимые для оценки опросники, получили 5 фракций по 2 Гр на весь объем головного мозга в течение недели. Лечение оказалось безопасным, без явных побочных эффектов, за исключением временной аллопеции. У троих больных отмечено явное улучшение с возвратом по основным показателям (в первую очередь в отношении когнитивных функций) на средний уровень; у одного пациента отмечена стабилизация. Авторы предполагают, что подобная работа должна быть продолжена в более крупных проспективных исследованиях – которые, впрочем, в настоящее время продолжают набор больных в различных центрах мира.
Источники:
1. M. Chung et al. Clinical Approach of Low-Dose Whole-Brain Ionizing Radiation Treatment. Journal of Alzheimer’s Disease 80 (2021) 941–947
2. C. Leland Rogers, et al. Lowdose whole brain radiation therapy
for Alzheimer's dementia: Results
from a pilot trial in human subjects.
IJROBP 2023, published: March 17,
2023DOI:https://doi.org/10.1016/j.
ijrobp.2023.03.044