Дорогие коллеги, дорогие друзья!
За окном – все признаки Весны, как в детских учебниках по природоведению: день стал длиннее, ночи – короче, все чаще слышится пение птиц, осели и потемнели сугробы, где-то уже побежали ручьи. Природа жива и готова проснуться. Этого ждали мы все -хотя весна пришла иной, стылой, серой. Почти повсюду холод, и российским рекам еще долго томиться под толстым слоем льда. Но...

Джим Уильям Годвард (1861-1922) «Лициния»
1918 г., холст, масло. Частная коллекция
Иосиф Бродский
Стихи о принятии мира.

ГЕНЫ ПРЕДРАСПОЛОЖЕННОСТИ ВОЗНИКНОВЕНИЯ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ
В прошлом году были опубликованы результаты двух важных популяционных исследований, посвященных изучению генов предрасположенности возникновения рака молочной железы.

ОПУХОЛИ ЖКТ
Конференция RUSSCO

КЛИНИЧЕСКИЕ РАЗРАБОТКИ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ В ОНКОЛОГИИ ЗА ПОСЛЕДНИЕ 10 ЛЕТ
Общее количество лекарственных препаратов, которые находились в клинических разработках в 2021 году, составило более 6000, что на 68% превысило показатели 2016 года. Продолжаются...

ДИСКУССИОННАЯ СЦЕНА. КОГДА ФИНАЛ БЛИЗОК: ЛЕЧИТЬСЯ, ЧТОБЫ ЖИТЬ – ИЛИ ЖИТЬ, ЧТОБЫ ЛЕЧИТЬСЯ?
К сожалению, лечение большинства больных с диссеминированными солидными «взрослыми» опухолями носит паллиативный характер, а значит, рано или поздно пациент подходит к черте, когда...

КОММЕНТАРИЙ ЭКСПЕРТА Жить, чтобы лечиться – чтобы жить
Эх!.. Баттлы и дискуссии. Когда двух людей просят доказать, что серое – это, скорее, белое, либо, скорее, черное – в результате они или согласятся, что серое, как ни крути, и есть серое, или будут глупо
НОВОСТИ ASCO GU 2022
ИНГИБИТОРЫ PARP ПРИ МЕТАСТАТИЧЕСКОМ КАСТРАЦИОННОРЕЗИСТЕНТНОМ РАКЕ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ. Результаты исследований PROpel и MAGNITIDE и TROPHY-U-01 COHORT 3. САЦИТУЗУМАБ ГОВИТЕКАН В КОМБИНАЦИИ С ПЕМБРОЛИЗУМАБОМ ПРИ МЕТАСТАТИЧЕСКОМ УРОТЕЛИАЛЬНОМ РАКЕ и ОБНОВЛЕННЫЕ РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ KEYNOTE-564. ЭФФЕКТИВНОСТЬ АДЪЮВАНТНОЙ ТЕРАПИИ ПЕМБРОЛИЗУМАБОМ У ПАЦИЕНТОВ С ПОЧЕЧНОКЛЕТОЧНЫМ РАКОМ

ЛИНПАРЗА
олапариб
НОВОСТИ ASCO GU 2022
ARASENS. ДАРОЛУТАМИД В КОМБИНАЦИИ С ДОЦЕТАКСЕЛОМ И АНДРОГЕН-ДЕПРИВАЦИОННОЙ ТЕРАПИЕЙ В 1 ЛИНИИ ЛЕЧЕНИЯ МЕТАСТАТИЧЕСКОГО ГОРМОНОЧУСТВИТЕЛЬНОГО РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ и CYPIDES TRIAL. ODM-208 В ПОЗДНИХ ЛИНИЯХ ТЕРАПИИ ДИССЕМИНИРОВАННОГО КАСТРАЦИОННО-РЕЗИСТЕНТНОГО РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ и 1B/2 EV-103. РЕЗУЛЬТАТЫ ТЕРАПИИ В КОГОРТЕ H. ЭНФОРТУМАБ ВЕДОТИН В НЕОАДЪЮВАНТНОЙ ТЕРАПИИ МЫШЕЧНО-ИНВАЗИВНОГО РАКА МОЧЕВОГО ПУЗЫРЯ

ПОДДЕРЖИВАЮЩАЯ ТЕРАПИЯ В ОНКОЛОГИИ
VIII РОССИЙСКАЯ КОНФЕРЕНЦИЯ
ПУБЛИКАЦИИ В КРУПНЫХ НАУЧНЫХ ЖУРНАЛАХ
ЦЕМИПЛИМАБ ПРИ РЕЦИДИВАХ РАКА ШЕЙКИ МАТКИ. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ EMPOWER-CERVICAL 1 [1] и ТУКАТИНИБ В КОМБИНАЦИИ С ТРАСТУЗУМАБОМ И КАПЕЦИТАБИНОМ В ПОЗДНИХ ЛИНИЯХ ТЕРАПИИ HER2-ПОЗИТИВНОГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ. Результаты исследования HER2CLIMB
CHECKMATE 648: ИММУНОТЕРАПИЯ В ПЕРВОЙ ЛИНИИ ЛЕЧЕНИЯ ДИССЕМИНИРОВАННОГО ПЛОСКОКЛЕТОЧНОГО РАКА ПИЩЕВОДА
В феврале 2022 г. в журнале The New England Journal of Medicine опубликованы результаты открытого рандомизированного исследования 3 фазы CheckMate 648, направленного на изучение эффективности иммунотерапии в первой линии лечения диссеминированного плоскоклеточного рака пищевода. Пациенты, включенные в исследование, были рандомизированы в 3 лечебные группы...

КИТРУДА
Препарат Китруда - единственный PD-1 ингибитор, увеличивающий общую выживаемость у пациентов с распространенным ТНРМЖ. в комбинации с XT

РИСК ВОЗНИКНОВЕНИЯ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ У НОСИТЕЛЕЙ ГЕРМИНАЛЬНЫХ МУТАЦИЙ ГЕНОВ BRCA1/2
Все мы уже четко усвоили, что выявление герминальной мутации генов BRCA1/2 предполагает развитие наследственного рака молочной железы и/или яичников. В последние годы было обнаружено,...

МНОГО ПОЛЬЗЫ ИЗ НИЧЕГО… И – НИЧЕГО…
Признаемся, мы достаточно активно отслеживаем новостную ленту онкологических событий, и порталы Medscape, AscoPost, MedPage, ClinicalCareOptions, Rosoncoweb и т.д. каждый день...

ПОДМЕЧЕНО ЧЕЛОВЕКОМ: БУДЕМ ЖИТЬ!
Don't bend the stick!" — «Не перегибай палку!»

АКЦЕНТ НА ИММУНОТЕРАПИЮ: КАК ЭТО ИЗМЕНИТ ПРАКТИКУ
Основная часть докладов на ежегодной конференции ASCO GI 2022, прошедшей в Сан-Франциско 20-22 февраля 2022 г., была посвящена изучению роли и места иммунотерапии в лечении...

10 ЛЕТ НАЦИОНАЛЬНОЙ ПРОГРАММЕ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ
СОВЕРШЕНСТВОВАНИЕ МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКОЙ ДИАГНОСТИКИ В РОССИЙСКОЙ ФЕДЕРАЦИИ
Анонс
-

8 апреля 2022
конференция RUSSCO ИММУНООНКОЛОГИЯ
-

15 -16 апреля 2022
конференция RUSSCO ОПУХОЛИ ЖКТ
-

19 -20 мая 2022
VIII РОССИЙСКАЯ КОНФЕРЕНЦИЯ ПОДДЕРЖИВАЮЩАЯ ТЕРАПИЯ В ОНКОЛОГИИ
Дорогие коллеги, дорогие друзья!
За окном – все признаки Весны,
как в детских учебниках по природоведению: день стал длиннее,
ночи – короче, все чаще слышится пение птиц, осели и потемнели сугробы, где-то уже побежали
ручьи. Природа жива и готова
проснуться. Этого ждали мы все -хотя весна пришла иной, стылой,
серой. Почти повсюду холод, и
российским рекам еще долго томиться под толстым слоем льда.
Но каждый день нас приближает
к Настоящей Весне.
RUSSCO продолжает работу. Впереди, в марте и апреле – конференции по онкогинекологии, по опухолям ЖКТ, семинары и вебинары по регионам в соответствии с составленной программой. На страницах мартовского номера газеты и на сайте мы попрежнему знакомим вас с последними достижениями мировой онкологической науки – данными, представленными в крупных научных журналах и в материалах недавно прошедшего симпозиума ASCO GU 2022. «Дискуссионная сцена» марта посвящена одной из вечно актуальных и наиболее сложных для каждого из нас дилемм – продолжать ли лечение онкологического пациента, приблизившегося к финальной черте, или отказаться от него, даже если какие-то опции еще остаются. В рубрике «Размышления в отрыве от рутины» ведущие онкологи страны Н.В.Жуков и Л.Г.Жукова снова подбрасывают нам интересную тему для обдумывания и, возможно, принятия к действию. Нам действительно о многом нужно задуматься сейчас – пока просыпается природа. Позвольте всех прелестных дам, читающих эти строки, поздравить с промелькнувшим Международным днём 8 Марта. Мы с детства всегда привычно желали друг другу здоровья, любви и мирного неба над головой. Все эти пожелания порой казались обычными, даже банальными – но именно они и есть составляющие настоящего Счастья. Здоровья, Любви, Мира и настоящей Весны каждому из вас, дорогие читатели!
Наталья Деньгина, главный
редактор газеты RUSSCO
и сайта rosoncoweb.ru
Джим Уильям Годвард (1861-1922) «Лициния»
1918 г., холст, масло. Частная коллекция

Иосиф Бродский
Автор: Иосиф Бродский
Стихи о принятии мира.
***
Все это было, было.
Все это нас палило.
Все это лило, било,
вздергивало и мотало,
и отнимало силы,
и волокло в могилу,
и втаскивало на пьедесталы,
а потом низвергало,
а потом — забывало,
а потом вызывало
на поиски разных истин,
чтобы начисто заблудиться
в жидких кустах амбиций,
в дикой грязи простраций,
ассоциаций концепций
и – среди просто эмоций.
Но мы научились драться
и научились греться
у спрятавшегося солнца
и до земли добраться
без лоцманов, без лоций,
но – главное – не повторяться.
Нам нравится постоянство.
Нам нравятся складки жира
на шее у нашей мамы,
а также наша квартира,
которая маловата
для обитателей храма.
Нам нравится распускаться.
Нам нравится колоситься.
Нам нравится шорох ситца
и грохот протуберанца,
и, в общем, планета наша,
похожа на новобранца,
потеющего на марше.
ГЕНЫ ПРЕДРАСПОЛОЖЕННОСТИ ВОЗНИКНОВЕНИЯ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ
Автор: С.А.Тюляндин
Председатель Российского общества
клинической онкологии, Москва
В прошлом году были опубликованы результаты двух важных
популяционных исследований,
посвященных изучению генов
предрасположенности возникновения рака молочной железы.
В исследование Breast Cancer
Association Consortium (BCAC)
было включено 60 тысяч больных раком молочной железы и
53 тысячи здоровых женщин [1].
У всех включенных проведено
секвенирование 34 генов с известной предрасположенностью
и с подозрением на ее наличие
для определения нарушений рамок считывания генов (proteintruncating variants) и точечных
мутаций в патогенных доменах.
Было определено, что нарушения
рамок считывания 5 генов (ATM,
BRCA1, BRCA2, CHEK2, PALB2)
ассоциированы с развитием рака
молочной железы с высокой достоверностью (p<0,0001), и еще 4
гена (BARD1, RAD51C, RAD51D,
TP53) повышали относительный
риск возникновения рака молочной железы более чем в 2 раза
(HR>2,0) с меньшей достоверностью (p<0,05). Для остальных 19
генов относительный риск возникновения рака молочной железы составлял существенно менее
2.0, что не позволяло утверждать
об имеющейся предрасположенности. Точечные мутации генов
ATM, CHEK2 и TP53 были достоверно ассоциированы с возникновением рака молочной железы
(p<0,001) с примерно одинаковым
значением относительного риска,
как и при нарушении рамок считывания данных генов. При наличии мутаций генов ATM и CHEK2
возрастал риск возникновения
позитивного по экспрессии стероидных рецепторов РМЖ, в то
время как мутации генов BARD1,
BRCA1, BRCA2, PALB2, RAD51C
и RAD51D ассоциировались с рецептор-отрицательным РМЖ.
Рисунок 1.
Риск возникновения РМЖ у носительниц мутации
в течение жизни [1].
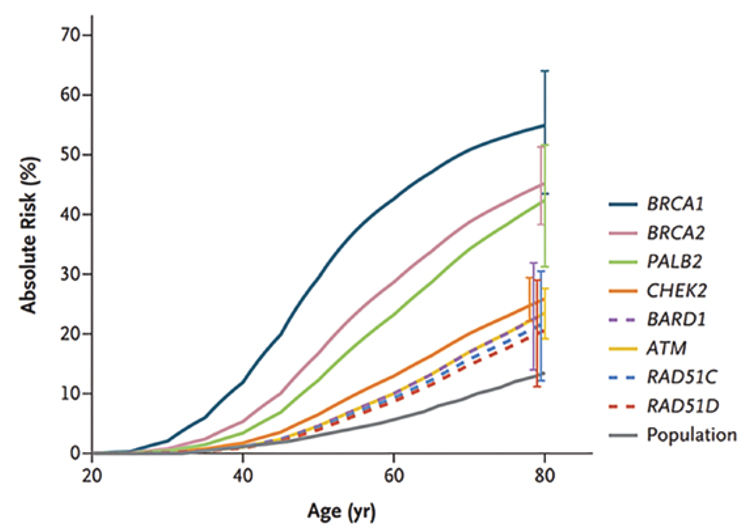
В исследовании группы
Cancer Risk Estimates Related to
Susceptibility (CARRIERS) было
проведено секвенирование 28
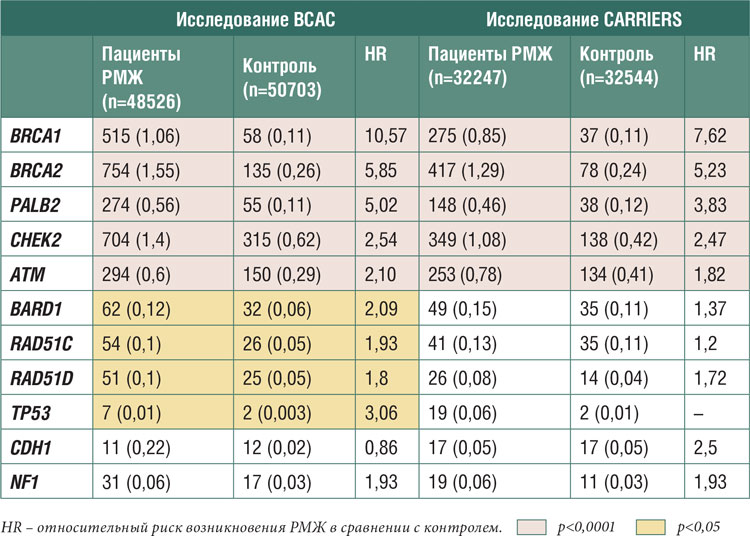
генов с возможной предрасполоТаблица 1. Взаимосвязь между частотой патогенных вариантов генов предрасположенности
к РМЖ и относительным риском развития заболевания [1,2].
Рисунок 1. Риск возникновения РМЖ у носительниц мутации
в течение жизни [1].
женностью к развитию РМЖ у
32247 больных и 32544 здоровых
женщин [2]. Наличие мутации в
12 генах было ассоциировано с
риском развития РМЖ. Наибольший риск отмечен при мутации
генов BRCA1/2, умеренный риск –
при мутации PALB2. Патогенные
варианты генов BARD1, RAD51C
и RAD51D ассоциированы с повышенным риском возникновения рецептор-негативного и
тройного негативного фенотипов
РМЖ, в то время как мутации
генов ATM, CDH1, CHEK2 предрасполагали к возникновению
рецептор-позитивного РМЖ.
Мутации в остальных 16 генах
не влияли на увеличение частоты
возникновения РМЖ.
Таблица 1.
Взаимосвязь между частотой патогенных вариантов генов предрасположенности
к РМЖ и относительным риском развития заболевания [1,2].
Оба эти исследования указывают
на необходимость расширения
панели генов для диагностики наследственного РМЖ. Патогенные
мутации генов BRCA1/2, определенные с помощью секвенирования последнего поколения,
ответственны примерно за 50%
всех наследственных вариантов.
За другую половину ответственны
мутации в других генах предрасположенности. На состоявшейся
конференции по диагностике и
лечению раннего рака молочной
железы в Сент-Галлене в 2021 году
две трети участников проголосовали за расширение панели генов,
необходимых для определения наследственной природы заболевания [3]. Это важно для организации скрининга носительниц этих
генов. Для больных с высоким риском предрасположенности вследствие патогенных мутаций генов
BRCA1/2 и PALB2 рекомендовано
раннее начало скрининга с 30 лет
с использованием маммографии и
магнитно-ядерной томографии и
последующим выполнением профилактической двухсторонней
мастэктомии после 40 лет. При
умеренном риске предрасположенности (BARD1, CHEK2, CDH1)
рекомендовано раннее начало
скрининга, при низкой частоте обнаружения патогенных мутаций и
низком риске предрасположенности (ATM, NF1, RAD51C, RAD51D)
выбор скрининговой стратегии
может определяться семейным
анамнезом. Знание наличия патогенных вариантов генов предрасположенности у больных РМЖ
может оказать помощь в выборе
лекарственной терапии, в частности, в назначении препаратов
платины или PARP-ингибиторов,
поскольку большинство из них относится к системе гомологичной
репарации спаренных оснований
молекулы ДНК.
К сожалению, сегодня в стране
возможно за средства ОМС выполнить секвенирование генов
BRCA1/2 только у заболевших, да
и то не во всех регионах. В стране
нет программ генетического тестирования здоровых людей при
подозрении на наличие наследственной предрасположенности.
Такое тестирование может быть
проведено на платной основе.
Его можно осуществить в Медико-генетическом научном центре
(г. Москва) или воспользоваться
сервисом компании «ОнкоАтлас»,
у которой есть набор для секвенирования Соло-HRR.
Источники:
1. Dorling L, Carvalho S, Allen J, et al. Breast cancer risk genes – association analysis in more than 113,000 women. N. Engl. J. Med. 2021; 384: 428-439.
2. Hu C, Hart SN, Gnanaolivu R, et al. A population-based study of genes previously implicated in breast cancer. N. Engl. J. Med. 2021; 384: 440-451.
3. Burstein HJ, Curigliano G, Thürlimann
B, Weber WP, Poortmans P, Regan MM,
Senn HJ, Winer EP, Gnant M; Panelists
of the St Gallen Consensus Conference.
Customizing local and systemic therapies
for women with early breast cancer: the St.
Gallen International Consensus Guidelines
for treatment of early breast cancer 2021.
Ann. Oncol. 2021; 32(10): 1216-1235.
ОПУХОЛИ ЖКТ

КЛИНИЧЕСКИЕ РАЗРАБОТКИ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ В ОНКОЛОГИИ ЗА ПОСЛЕДНИЕ 10 ЛЕТ
Автор: Вера Витальевна Карасева
Исполнительный директор RUSSCO,
ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России, Москва
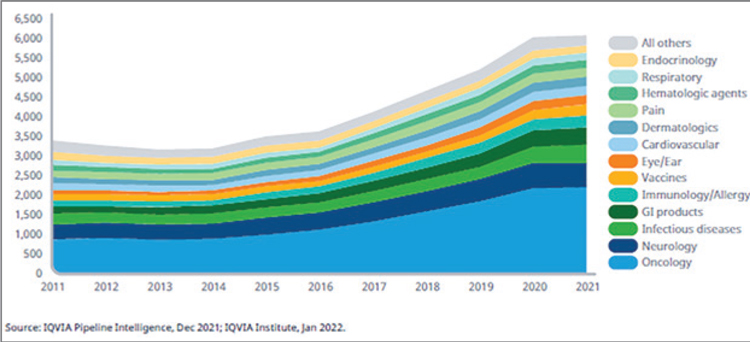
Общее количество лекарственных
препаратов, которые находились
в клинических разработках в 2021
году, составило более 6000, что на
68% превысило показатели 2016
года. Продолжаются разработки инновационных средств и вакцин, направленных на лечение заболеваний
в различных терапевтических областях, несмотря на изменение акцентов в период пандемии COVID-19.
Наибольшее число исследований
лекарственных средств проводится
в области онкологии, гастроэнтерологии и неврологии. При этом доля
лекарственных препаратов, направленных на лечение инфекционных
заболеваний и вакцин, в последнее
время уменьшалась, но после начала пандемии COVID-19 отмечается
значительный рост этого сегмента.
Панель препаратов в клинических
разработках вышла на плато в 2021
г. (всего 6085 продуктов). При этом
рост изучаемых препаратов в активной стадии исследования (от I фазы
до подачи заявки в регуляторные
органы) составил менее 1% по сравнению с 2020 г. Но по сравнению с
2016 г. отмечено увеличение на 68%.
Выход на плато в 2021 г., вероятнее
всего, связан с замедлением научной
деятельности в результате продолжающейся пандемии. Исследования
в области онкологии остаются наиболее быстро развивающимися и составляют 37% (2226 препаратов) от
общего числа в 2021 г
В онкологии количество препаратов,
находящихся в клинических разработках, возросло вдвое, начиная с
2011 года, а наибольший рост отмечается с 2016 года.
Число препаратов в клинических разработках с I фазы до подачи на
регистрацию в различных терапевтических областях, 2011–2021 гг.
Число препаратов в клинических разработках с I фазы до подачи
на регистрацию в различных терапевтических областях: 2011 год
в сравнении с 2021 годом.
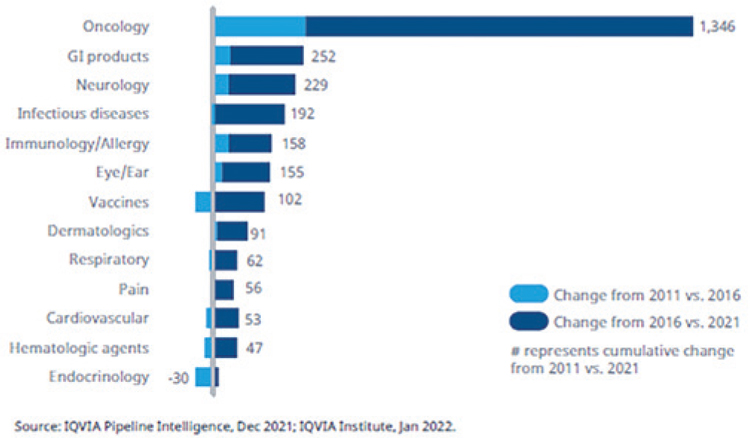
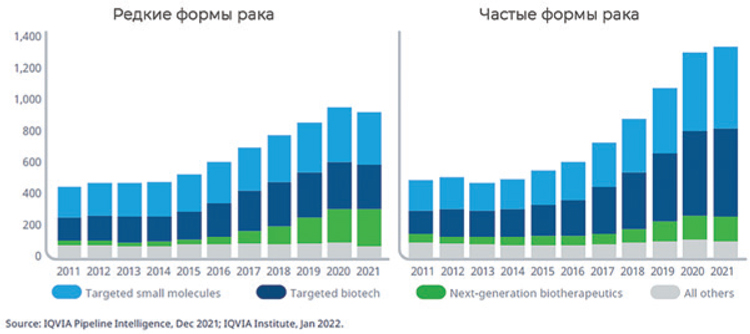
В 2021 году 930 препаратов находились в разработке для лечения
редких онкологических заболеваний, что составляет 42% от общего числа исследуемых препаратов в онкологии. Показатель успеха в
регистрации препаратов для редких
онкологических заболеваний достигает 16%, что почти в 10 раз больше,
чем успех, достигаемый для частых
форм злокачественных новообразований. Вероятность того, что эти
препараты перейдут в более поздние
фазы исследований и в итоге придут
в клиническую практику, очень высока. Таргетная низкомолекулярная
терапия и биотерапия продолжают
развиваться как для лечения редких,
так и для более частых форм злокачественных новообразований. Они
включают большое число новых
средств для иммунотерапии, ингибиторов контрольных точек и ингибиторов киназ. Несмотря на то, что
биотерапевтические препараты следующего поколения представляют
все же меньшую долю в общем объеме клинических разработок, клеточная, генная и РНК-терапия представляется более перспективной для
персонализированной терапии в
онкологии. Так, биотерапия следующего поколения для лечения редких
видов опухолей составляет четверть
в клинических разработках. Поскольку применение большинства
таргетных препаратов или препаратов следующего поколения связано с
выявлением генетических мутаций
или других биомаркеров, использование сопутствующей диагностики
должно стать более доступным, чтобы обеспечить более точное и эффективное лечение онкологических
пациентов.
В 2021 году 930 препаратов находились в разработке для лечения редких онкологических заболеваний, что составляет 42% от общего числа исследуемых препаратов в онкологии. Показатель успеха в регистрации препаратов для редких онкологических заболеваний достигает 16%, что почти в 10 раз больше, чем успех, достигаемый для частых форм злокачественных новообразований. Вероятность того, что эти препараты перейдут в более поздние фазы исследований и в итоге придут в клиническую практику, очень высока. Таргетная низкомолекулярная терапия и биотерапия продолжают развиваться как для лечения редких, так и для более частых форм злокачественных новообразований. Они включают большое число новых средств для иммунотерапии, ингибиторов контрольных точек и ингибиторов киназ. Несмотря на то, что биотерапевтические препараты следующего поколения представляют все же меньшую долю в общем объеме клинических разработок, клеточная, генная и РНК-терапия представляется более перспективной для персонализированной терапии в онкологии. Так, биотерапия следующего поколения для лечения редких видов опухолей составляет четверть в клинических разработках. Поскольку применение большинства таргетных препаратов или препаратов следующего поколения связано с выявлением генетических мутаций или других биомаркеров, использование сопутствующей диагностики должно стать более доступным, чтобы обеспечить более точное и эффективное лечение онкологических пациентов.
Число клинических разработок от I фазы до подачи на регистрацию в
зависимости от типа злокачественного новообразования: 2011-2021 гг.
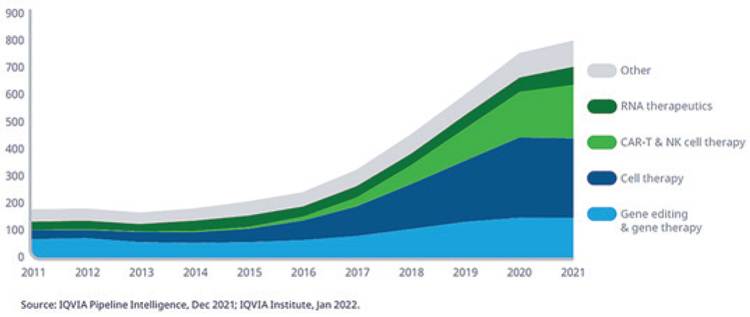
В 2021 году 804 биотерапевтических препарата следующего поколения находились на разных этапах клинических разработок от I фазы до регистрации регуляторными агентствами в различных терапевтических областях. Под термином «препараты следующего поколения» понимают клеточную терапию, генную терапию, редактирование генома, подавление нукледотидов и РНК или мРНК терапию. Количество исследований биотерапевтических препаратов следующего поколения возросло на 27% по равнению с 2016 годом. Клеточная терапия составляет наибольшую долю клинических разработок в этом направлении, и более 40% из них изучаются для лечения преимущественно часто встречающихся солидных опухолей. Несмотря на то, что изучение терапии CAR-T и естественными клетками-киллерами (NK) началось в 2012 году, 199 препаратов находятся в клинических разработках, что занимает 2 место среди биотерапевтических препаратов, находящихся в исследованиях. Значительное количество нежелательных явлений в клинических исследованиях привело к разработке профилактических мер для обеспечения более высокого уровня безопасности пациентов при исследовании этой группы препаратов.
Биотерапевтические препараты следующего поколения в клинических
разработках от I фазы до подачи в регуляторные органы в различных
терапевтических областях, 2011-2021 гг.
Предклинические и клинические разработки биотерапевтических
препаратов следующего поколения в различных терапевтических
областях, 2011-2021 гг.
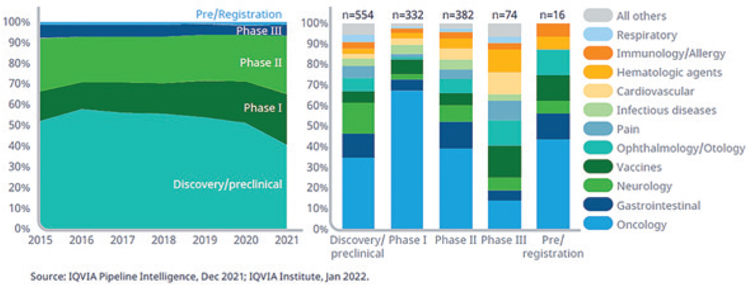
Почти две трети (886) исследований
биотерапевтических препаратов следующего поколения находятся на
ранних фазах исследований (предклиническая и I фаза) и меньшее количество на поздних, подчеркивая
быструю эволюцию этих методов
лечения на сегодняшний день. Число открытий и доклинических исследований лекарственных средств
следующего поколения значительно
снизилось в 2021 г., вероятно, в результате перерывов в работе с 2020
по 2021. Онкология по-прежнему
составляет основную часть разработок биотерапевтических препаратов
нового поколения, однако растет
количество исследований и в других
областях медицины.
В настоящее время более 3200 компаний и более 200 академических или
исследовательских групп по всему
миру участвуют в создании и клинических разработках лекарственных
средств в разных областях медицины.
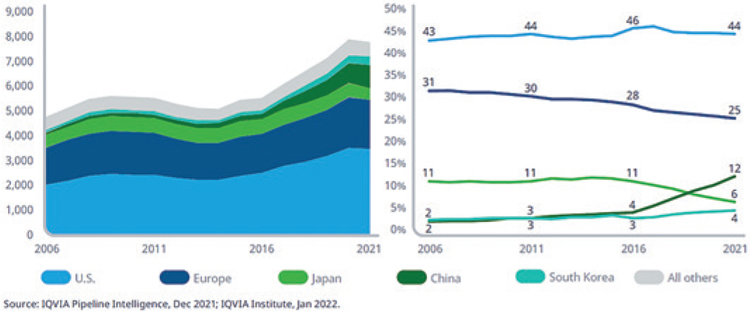
Доля США в мировом объеме исследований во всех областях медицины
остается неизменной и за последние
15 лет сохраняется на уровне 40%.
Доля Европы снизилась с 31% до 25%
за последние 15 лет, при этом абсолютное количество активных программ выросло на 32% — с 1492 до
1966. Компании со штаб-квартирой
в Японии столкнулись со снижением доли исследовательского объема с 11% до 6% в 2021 году. Лекарственные препараты от компаний со
штаб-квартирой в Китае уже сейчас
составляют 12% от общего числа
клинических разработок (5 лет назад
их доля составляла 4%, а в 2006 году
– 2%), что связано с недавними большими инвестициями, сделанными
в области естественных наук в этой
стране. Доля Южной Кореи остается
относительно стабильной, несмотря
на значительный рост перспективных исследований на ранней стадии.
Число препаратов в клинических разработках от I фазы до регистрации
и доля разработок по странам, 2006-2021 гг.
ДИСКУССИОННАЯ СЦЕНА. КОГДА ФИНАЛ БЛИЗОК: ЛЕЧИТЬСЯ, ЧТОБЫ ЖИТЬ – ИЛИ ЖИТЬ, ЧТОБЫ ЛЕЧИТЬСЯ?
Автор: Жуков Николай Владимирович
ФГБУ «НМИЦ Детской гематологии, онкологии
и иммунологии им. Д. Рогачева», Москва
К сожалению, лечение большинства больных с диссеминированными солидными «взрослыми» опухолями носит паллиативный характер,
а значит, рано или поздно пациент
подходит к черте, когда дальнейшая
противоопухолевая терапия уже не
принесет ему пользы. С этим, думаю,
вряд ли многие поспорят – тех, кто
готов вводить противоопухолевые
препараты, облучать или оперировать до последнего вздоха пациента, я практически не встречал (хотя
были и такие, но их было подавляющее меньшинство). Однако с ситуацией, когда лечение проводилось
значимо дольше, чем приносило
пользу больному, мне приходилось
сталкиваться гораздо чаще. Особенно характерно это оказалось для
«детской» практики (в которую я
погружаюсь все больше и больше),
где онкологи/гематологи-педиатры,
искренне мотивированные на куративное лечение, периодически
переносят его подходы, равно как и
«азарт», на лечение паллиативное,
однако и во взрослой онкологии подобные ситуации не редки. Но, как
мне кажется, основной вопрос не в
том, останавливаться ли с терапией
(очевидно, что рано или поздно надо
будет это делать), а основной вопрос
– когда останавливаться. Ведь, согласно многочисленным исследованиям, проведенным в разных странах, разными группами, получается
один и тот же результат: в случае,
если предполагаемая продолжительность жизни пациента невелика
(обычно речь идет о 3-6 месяцах),
то активная позиция врача, проводящего попытки лекарственного
или другого противоопухолевого
лечения, помещающего больного в
отделение интенсивной терапии для
продления жизни, этой самой жизни
не прибавляет, но при этом значимо
ухудшает ее качество по сравнению
с позицией «отпустить» пациента
пожить дома или в клинике, проводящей паллиативное лечение (хосписе) [1].
Но как определить, когда и не рано,
и не поздно – а «в самый раз» остановиться в своих попытках воздействовать на опухоль и признать, что
настало время лишь симптоматической терапии? Подобный вопрос не
является праздным, так как несвоевременная «остановка» может значимо повлиять на судьбу больного:
преждевременный «стоп» лишает
пациента возможности получить
эффективное лечение (о чем наверняка скажет мой «оппонент»), но и
переход «черты целесообразности»
приводит к неразумному использованию небезграничных ресурсов системы здравоохранения, ненужной
токсичности и потере качества жизни на фоне проведения бесполезного
для пациента лечения. Другими словами, как определить, живет ли наш
пациент благодаря тому, что мы его
лечим (т.е. наше лечение продлевает
его жизнь или хотя бы улучшает ее
качество), или он живет благодаря
биологии болезни, которая дает нам
возможность продолжать лечение,
не приносящее никакой пользы –
больной живет, потому что мы его
лечим, или мы его лечим, потому что
он живет?
«Хорошо», если при данном заболевании просто нет дополнительных
опций, которые можно было бы использовать, тогда все становится
ясным само собой – лечить больше
нечем, а значит и незачем. Но таких
заболеваний остается все меньше и
меньше, да и варианты с off-label никто не отменял – в большинстве случаев при желании всегда можно найти, что применить во 2, 3, 5 или 10
линии терапии. Если честно, я далек
от идеи строго ограниченного числа
линий терапии – 2 (3, 4 или 5), потом – всё, домой вне зависимости от
клинической ситуации. Более того, я
искренне уверен, что далеко не все
методы лечения можно (и нужно)
пропускать через исследования III
фазы с общей выживаемостью в качестве первичной конечной точки.
Многие режимы «поздних» линий
мы с успехом внедрили и используем
на основании II фаз, не приведших к
регистрации по данному показанию,
особенно это касается режимов, использующих цитостатики, «вышедшие в тираж», регистрацию которых
в поздних линиях, конечно, никто и
никогда не будет «спонсировать» из
чисто научного интереса, и они так
и останутся off-label с точки зрения
регистратора, «ущербными» с точки зрения апологетов доказательной
медицины. Да и в силу разнообразия
клинических сценариев, которое нарастает с каждой последующей линией терапии, выявить выигрыш в
усредненной популяции становится
все сложнее, но это не значит, что его
вообще нет. Личный опыт показывает, что популяция, выигрывающая
от подобного лечения, есть – пациенты с действительно глубокими и
долгими ремиссиями на фоне поздних линий терапии. Но есть и другой
опыт – когда после остановки лечения пациенты жили еще достаточно
долго (значимо дольше, чем на фоне
бесконечных попыток «помочь») и
не хуже, чем на его фоне, при этом
не испытывая побочных эффектов
терапии.
На самом деле я вряд ли так сильно отличаюсь от своего «оппонента». Скорее всего, и он, как человек
профессиональный и адекватный,
уверен, что лечение должно проводиться лишь до той поры, пока
оно приносит клинически значимую пользу конкретному пациенту
– сдерживает прогрессию опухоли,
уменьшает симптомы, продлевает
жизнь. И пока не доказано обратное,
видя противоопухолевый эффект
от используемого режима, и я, и он
предполагаем, что достигаем этих
целей. Вопрос лишь в том, когда же
наступает тот момент, когда ожидаемая польза терапии уже не окупает
ее цену, или вообще отсутствует. И
кто должен этот момент определять?
Тут, увы, как говорил один из «ответственных работников» политического фронта (не ручаюсь за дословность), проходит тонкая красная
линия, которую нельзя пересекать,
но о том, где она конкретно проходит, вы узнаете, только когда ее пересечете.
Как определить эту линию? Исходя
из рекомендаций? Наверное, но только отчасти – да. Беда в том, что однозначных рекомендаций об отказе от
терапии не так уж и много, и они, как
ни странно, касаются ранних линий
лечения. Например, взять немелкоклеточный рак легкого (НМРЛ) без
драйверных мутаций с ECOG 3-4:
здесь в рекомендациях мы видим однозначный призыв даже не начинать
лечение, а сразу отправить больного
«на симптоматику». Но всегда ли мы
следуем даже этим рекомендациям?
А если это молодой пациент, изъявляющий осмысленное желание бороться до конца, родственники которого готовы обеспечить адекватное
сопроводительное лечение? А если
это не исходно ECOG 3-4, а ухудшение состояния у пациента с ALKпозитивным НМРЛ, которого мы
лечили анти-ALK-терапией уже 4-5-
6 лет и успели сродниться, а запасы
таргетных опций уже закончились
и осталась только химиотерапия?
А если речь идет о 3 безуспешных
линиях химиотерапии (именно безуспешных, т.е. вообще без эффекта)
и попытки облучения у больной распространенным раком молочной
железы с поражением только кожи
и мягких тканей – да, лечение явно
неэффективно, но проживет она
еще долго. Остановиться, отправив
домой или в хоспис, или пробовать
что-то еще? Может быть, хотя бы с
«психотерапевтической» целью, чтобы у пациентки не было ощущения
что ее «бросили» – подумает врач, да
и назначит 4, а потом и 5 линию терапии. И, возможно, у кого-то даже добьется временного эффекта, что поддержит его в следующих подобных
попытках, большинство из которых,
к сожалению, будут безуспешными.
Так как же определить точку финальной попытки? Да, безусловно, есть
рекомендации, но как было сказано
выше, далеко не для всех ситуаций,
и далеко не «универсальные» (всегда имеющие исключение). Да, есть
критерии (хотя тоже неоднозначные,
не универсальные) об определении
той самой предполагаемой продолжительности жизни в 3-6 месяцев,
которая является поводом для прекращения противоопухолевого лечения. Но, в любом случае, если нет
императивных рекомендаций, врач,
принимая решение, исходит из своих представлений о «добре и зле».
И вот здесь, как нам кажется, кроется основная причина неадекватно
позднего прекращения лечения. Мотивации:
1. Раз пациент в состоянии получить лечение – значит должен что-то получать (лечить всегда лучше, чем оставить в покое – далеко не доказанный аргумент).
2. Если я продолжаю лечить и назначу что-то «в дорогу», пациент умрет более спокойно, т.к. у него не будет ощущения, что от него отказались (увы, оно просто возникнет чуть позже – остановиться все равно придется).
3. Родственники хотят сделать все возможное (родственники хотят это сделать не для него, а для себя – чтобы СЕБЯ нельзя было в чем-то упрекнуть, когда пациент умрет, ибо «мы сделали все, что могли»).
4. Мне дискомфортно говорить с пациентом, что все закончилось, лучше уж попробовать что-нибудь.
5. Вдруг я сейчас откажусь от лечения, а он (родственники) обратятся в другую клинику, где все же дадут терапию и получат эффект, а я буду выглядеть глупо…
Эти мотивации, как мне кажется, являются абсолютно неправильными, т.к. они представлены мотивами всех сторон «процесса» (врача, родственников) – кроме мотиваций самого пациента. Да и озвученная мотивация самого пациента иногда может быть весьма условной (хотя, без сомнений, именно она должна быть ведущей при принятии решения): кто-то не хочет «расстраивать» родственников и готов продолжить лечение, которого сам не хочет, ктото не до конца понимает реальные перспективы, а доктор не в состоянии их адекватно донести.
И здесь есть весьма простой и нетрудозатратный путь к осмысленному (а может быть, и правильному, но об этом судить вам) решению проблемы с определением места залегания красной линии – представить, что бы выбрали в этой ситуации для себя вы сами. Не для папы, ни для мамы, ни для жены/ мужа или близких друзей (тут может включиться фактор «чтобы не в чем себя было упрекнуть»), а именно для самого себя – человека, которого вы знаете, который знает все о возможных вариантах лечения или нелечения. И если ваш выбор будет «лечить», смело предлагайте терапию пациенту. Но, скорее всего, в ряде случаев вы однозначно скажете «нет», причем не только в отношении 3-4-5 линии лечения – возможно, и в отношении первой. Нет – не оправдывает ожидаемый выигрыш ожидаемых потерь. А значит, если пациент сам не настаивает на продолжении лечения, можно и признаться, что мы больше ничего не можем сделать. Сначала признаться себе, потом – ему. КОММЕНТАРИЙ ЭКСПЕРТА Жить, чтобы лечиться – чтобы жить
Источники:
1. Earle CC, Landrum MB, Souza JM, Neville BA, Weeks JC, Ayanian JZ. Aggressiveness of cancer care near the end of life: is it a quality-of-care issue? J Clin Oncol. 2008 Aug 10; 26(23):3860-6. doi: 10.1200/JCO.2007.15.8253.
2. Reljic T, Kumar A, Klocksieben FA,
Djulbegovic B. Treatment targeted at
underlying disease versus palliative care in
terminally ill patients: a systematic review.
BMJ Open. 2017 Jan 6; 7(1):e014661. doi:
10.1136/bmjopen-2016-014661. PMID:
28062473; PMCID: PMC5223692.
КОММЕНТАРИЙ ЭКСПЕРТА Жить, чтобы лечиться – чтобы жить
Автор: Митин Тимур
Университет Здоровья и Науки Орегона,
Отделение радиационной медицины, Портленд, США
Эх!.. Баттлы и дискуссии. Когда двух
людей просят доказать, что серое
– это, скорее, белое, либо, скорее,
черное – в результате они или согласятся, что серое, как ни крути, и есть
серое, или будут глупо отстаивать
свои позиции. Последний вариант я
наблюдаю, когда задеты честь, опыт
и экономическая зависимость профессионала, отстаивающего свою
точку зрения. Ну, скажем, оперировать или облучать.
Но у нас идет философский дискурс на тему смерти. Когда ее принять – чуть раньше или чуть позже.
Как себя вести в последние месяцы,
недели и дни, как ее встретить. Более того, обсуждаем мы не свое собственное решение для себя, которое
– увы – встанет и перед нами когдато, а решение онколога для своего
пациента, у которого свои собственные представления, страхи, надежды
и традиции. Нам бы потребовалось
намного больше времени, чтобы попытаться вникнуть во все детали
составляющего этого решения, которое часто бывает переменчивым: сегодня кажется, что сил больше
нет бороться – а с утра пациент
просыпается с новым настроем.
Мой оппонент призывает использовать формулу «признаться себе».
Я с ним полностью согласен. И думаю, что этой формулой руководствуются – осознанно или неосознанно – большинство наших коллег
клиницистов. Проблема в том, что
каждый врач индивидуален, а следовательно, мнение и решение будут индивидуальны и субъективны.
Один врач «для себя» решит, что все,
дальше – красная черта. Другой решит, что черта еще далеко, а надежда
умирает последней.
После окончания медицинской школы для того, чтобы поступить в специализированную 4-годичную ординатуру по радиотерапии, я провел
год в общей интернатуре, где лечил
госпитализированных пациентов с
различными заболеваниями. Интернатура была в небольшом городском
госпитале в штате Орегон – первом
штате в США, где была легализована
эвтаназия. Духом свободы от перелечивания до смерти были пронизаны все лекции, все обсуждения с
пациентами. Хорошо помню, как к
нам попал пациент с сильной одышкой. КТ грудной клетки показала
местнораспространненную опухоль,
биопсия была сразу выполнена и
подтвердила плоскоклеточный рак.
Заведующий отделением пришел обсудить диагноз с пациентом и представил ему варианты лечения III
стадии НМРЛ, делая упор на слишком маленький шанс на излечение
и на слишком тяжелые осложнения
после существующих вариантов лечения – операции, химиотерапии и
лучевой терапии. Хоспис в том разговоре стоял на первом месте.
После окончания годовой общей интернатуры я оказался в мекке (или
одной из мекк) американской онкологии – Гарвардской клинике в Бостоне. Четыре года радиотерапевтического обучения были разбиты на
3-месячные ротации по разным нозологиям, и моя первая ротация оказалась связана с патологией ЦНС. Не
закончив свою первую ротацию, я
пришел к директору ординатуры и
сказал, что сделал ошибку с выбором
медицинского направления, мол,
прошу мне разрешить уйти в другую
область. Мне было больно и дико
смотреть, как пациентам с метастазами в мозг прикручивали тяжеленную железную скобку к черепу, с
которой они проводили целый день
в нашей клинике, чтобы к вечеру получить стереотаксическое облучение
на очередную опухоль [1]. Порой такие пациенты приходили к нам в 10-
й, 15-й, 20-й раз, и иногда я узнавал,
что они умирали ночью после облучения – не из-за облучения, а потому что системное прогрессирование
уже давно перешло через красную
линию, но им врачи не предлагали
остановиться, а вселяли надежду,
что локальный контроль поможет
удержать развитие болезни
Директор моей программы меня
внимательно выслушал и согласился
со мной, что такой подход – не единственный и не самый правильный, и
попросил меня дать шанс радиотерапии. Последующие ротации убедили
меня, что радиотерапия – это, прежде всего, клиническая онкология,
сочетающая в себе и знания о биологии рака, и хорошее представление
о возможных системных вариантах
и их побочных эффектах, и умение
работать в мультидисциплинарной
команде, и главное – умение услышать пациента, помочь преодолеть
все стадии принятия страшного диагноза и поддержать пациента в его
решении. А уж техническая сторона ЛТ – какую дать дозу, за сколько
фракций и на какие оконтуренные
участки – это просто необходимая
база знаний, со временем и опытом
переходящая в своего рода искусство.
В своей клинической практике моя
позиция особенно не отличается от
позиции моего «оппонента», как мне
кажется по его великолепным лекциям и статьям. Более того, те, кто
слышал мои доклады и участвовал в
мастер-классах по оконтуриванию,
хорошо знают мое кредо – мы, радиотерапевты, первые должны подвергать сомнению необходимость
назначения курса ЛТ каждому пациенту. Если облучение не приводит
к улучшению качества и/или продолжительности жизни, то и частые
и редкие побочные эффекты ЛТ
должны быть аккуратно взвешены
против вероятного улучшения локального контроля. Я против адъювантного облучения пациента после
радикальной простатэктомии, если
послеоперационный ПСА не увеличен, против послеоперационной лучевой терапии при 3 стадии НМРЛ,
против послеоперационной ЛТ у пожилых (свыше 65 лет) пациенток с 1
стадией люминального РМЖ.
Вернемся к теме неизлечимых онкологических пациентов. Как радиотерапевт, я не должен принимать
решение о назначении энной линии
системного лечения и понимаю, насколько это решение тяжело принимать моим коллегам химиотерапевтам. А вот назначение паллиативной
ЛТ очень часто связано с принятием решения о целесообразности
системного лечения. И это, на мой
взгляд, неверная формула. Паллиативная ЛТ зачастую используется
редко, поздно и неправильно во
многих центрах или не используется вообще, потому что исторически
использовалась именно так – редко,
поздно и неправильно. Пока у онкологического пациента есть симптомы, связанные с ростом опухоли
(болевой синдром, кровотечение,
обструкция, неврологических отклонения), паллиативная ЛТ в режиме от одной до пяти фракций –
эффективный способ уменьшить
симптоматику без значимой токсичности. Облучать стереотаксисом
трехмиллиметровый очаг в мозгу
на последней стадии лечения – это
то самое неправильное использование ЛТ, из-за которого я чуть было
не бросил мою профессию. А вот
назначить несколько фракций на
кровоточащую опухоль, облучить
средостение, когда увеличивающийся лимфоузел давит на пищевод
или трахею, – это правильно всегда,
когда пациенту это нужно. Если пациент страдает и хочет уменьшения
своих симптомов и готов приехать в
радиотерапевтическое отделение на
короткий курс облучения – я не могу
себе представить, где бы я прочертил
красную линию, после которой я бы
отказал пациенту. Даже пациентам,
которых ведет служба хосписа, одна
фракция паллиативной ЛТ может
дать больше, чем постоянно увеличивающиеся дозы морфина. Если
дозы морфина возрастают быстро,
способность пациентов общаться адекватно с семьей, родными и
любимыми людьми в течение последних недель и дней значительно
нарушается. Опиаты заглушают возможность полно проживать моменты оставшейся жизни: делиться уроками мудрости с детьми и внуками,
смотреть в глаза любимых людей,
пересматривать любимые фильмы
и вспоминать самые значительные
эпизоды жизни. Паллиативная помощь и программа хосписа, несомненно, нужна таким пациентам – и
паллиативная ЛТ должна быть частью этой помощи, без длительных
курсов, с возможностью получить
консультацию, укладку, оконтуривание, планирование и само лечение
в течение всего нескольких часов
одного дня. Это возможно. Это правильно. И если пациенту два часа,
проведенные в радиотерапевтическом отделении, помогли на следующий день уменьшить дозу морфина,
и пациент смог открыть глаза и в последний раз улыбнуться своим близким – это лечение было своевременное и правильное.
Несколько лет назад ко мне на консультацию пришел пациент со своей
женой. Он был гражданским пилотом, она была стюардессой. Он приехал в наш город, чтобы дожить свои
считанные дни, ни о каком лекарственном лечении не было больше
разговоров. Страдая накоплением
плевральной жидкости из-за диагноза НМРЛ, пациент ранее получил
плевральный катетер, вокруг которого стала расти опухоль. Катетер
хуже работал, пациент задыхался и
страдал от боли в той части грудной
клетки, где опухоль вышла на поверхность. Я облучал пациента, дав
несколько сеансов с явной положительной динамикой. Он прожил еще
3 месяца, смог организовать встречу
с родственниками, друзьями и коллегами на белоснежном мексиканском пляже. Сеансы паллиативной
ЛТ, вероятно, продлили ему жизнь,
но главное – сделали его последние
дни более счастливыми, наполненными, качественными. Я не ставил
перед ним никаких красных линий.
Он знал, что летит на пустом баке, и
сам принимал решение, когда закончить свой полет.
В конце 2016 года вышла статья в
журнале Ланцет – анализ рандомизированного исследования QUARTZ
из Великобритании и Австралии, в
котором больные с НМРЛ с метастазами в мозг, которые не были кандидатами для краниотомии или стереотаксической радиохирургии, были
рандомизированны либо на лечение
стероидами, либо на стероиды плюс
облучение всего мозга в режиме 20
грей за 5 фракций [2]. Анализ не показал никаких преимуществ в облучении всего мозга – не только с
точки зрения общей выживаемости,
но и с точки зрения качества жизни
больных. А в январе 2017 года, сразу
после рождественских и новогодних
праздников, прежде абсолютно здорового 50-летнего мужчину привезли в мою больницу в бессознательном состоянии. МРТ мозга показала
большое количество мелких метастатических очагов – «слишком много, чтобы иx посчитать», как было
написано в заключении радиолога.
КТ грудной клетки показал опухоль
в легком с увеличенными лимфатическими узлами – картина метастатического рака легкого, впервые диагностированного. Меня попросили
проконсультировать его. Когда я вошел в его палату, то увидел рядом с
пациентом его молодую жену в полной растерянности, двух пацанов лет
12 и 8. Они не были готовы к этому
диагнозу, свалившемуся на них как
гром среди бела дня, они не были
готовы потерять своего отца и мужа,
даже не попрощавшись с ним.
Это было очень сложное для меня
решение. Пациент без сознания,
результаты рандомизированного
исследования – всё говорило мне,
что нужно объяснить семье безысходность положения, извиниться за
невозможность помочь и покинуть
палату пациента. Но на меня смотрели три пары глаз, и они просили
о помощи, просили хотя бы дать им
надежду. Я объяснил жене пациента,
что скорее всего облучение не поможет, рассказал ей про рандомизированное исследование. Но она попросила попробовать... Мы в тот же
день начали курс облучения всего
мозга – в режиме 20 Гр за 5 фракций.
Через 2 дня пациент пришел в себя,
на последнюю фракцию он пришел
сам в наше отделение – на своих ногах. Через неделю ему сделали бронхоскопию с биопсией лимфоузлов,
и гистологический анализ показал
аденокарциному с мутацией EGFR.
Мой коллега – медицинский онколог – назначил курс терапии препаратом эрлотиниб. Спустя год этот
пациент вернулся ко мне с болями в
шее. К тому моменту он продолжал
работать, пришел на прием со своей
женой, дети были в школе. Я облучил его шейные позвонки в паллиативном режиме, боль значительно
уменьшилась, и через пару месяцев
после этого вся семья переехала из
дождливого Портленда в солнечный Майами. Как хорошо, что я не
прочертил красную линию этому
пациенту в январе 2017 года, а исполнил желание его жены – просто
попробовать, дать шанс. Если бы мы
принимали решение «для себя», то,
вероятно, результаты рандомизированного исследования QUARTZ
определили бы наше решение – мы
воспитаны в системе координат фаз
исследования. Крупное исследование 3 фазы давит на нас, клинических онкологов, сильнее, чем родительское «так надо».
Результаты рандомизированных исследований нам нужно знать, обязательно нужно. Но и понимать,
что онкология не стоит не месте,
– тоже, ибо с каждым годом мы открываем новые мутации, находим к
ним новые препараты, и нам нужно
учиться интегрировать в свою клиническую практику старые навыки
и новые знания, а иногда пытаться
заглянуть в будущее и попытаться
предугадать, как будут лечить в недалеком будущем. Лечить «для себя»
– значит иногда не дать шанс, о котором мы не подозреваем, значит
иногда раньше времени опустить
свои руки и сказать пациенту, чтобы он опустил свои. На мой взгляд,
нужно говорить пациенту правду,
обрисовывать реалистичную картину, основанную на статистических
данных из клинических исследований, – а потом слушать и слышать
ответ пациента. И если пациент хочет жить, чтобы лечиться, в надежде, что благодаря лечению он будет
жить, значит, нужно быть рядом и
вместе выбирать методику лечения.
Иногда это просто наблюдение, чисто паллиативное вмешательство, во
многих случаях – поиски новых клинических исследований различных
фаз, как в своих центрах, так и в конкурирующих центрах, находящихся
либо через дорогу, либо через океан.
Источники:
1. Safaee M, Burke J, Mcdermott M. Techniques for the Application of Stereotactic Head Frames Based on a 25- Year Experience. Cureus. 2016 March 25; 8(3): e543.
2. Mulvenna P, Nankivell M, Barton R,
Faivre-Finn C, Wilson P, McColl E, Moore
B, Brisbane I, Ardron D, Holt T, Morgan S,
Lee C, Waite K, Bayman N, Pugh C, Sydes
B, Stephens R, Parmar MK, Langley RE.
Dexamethasone and supportive care with
or without whole brain radiotherapy in
treating patients with non-small cell lung
cancer with brain metastases unsuitable
for resection or stereotactic radiotherapy
(QUARTZ): results from a phase 3, noninferiority, randomised trial. Lancet. 2016
Oct 22; 388(10055): 2004-2014.
Рисунок. Нина Митин, 15 лет.

НОВОСТИ ASCO GU 2022
ИНГИБИТОРЫ PARP ПРИ МЕТАСТАТИЧЕСКОМ КАСТРАЦИОННОРЕЗИСТЕНТНОМ РАКЕ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ.
Результаты исследований PROpel и MAGNITIDE
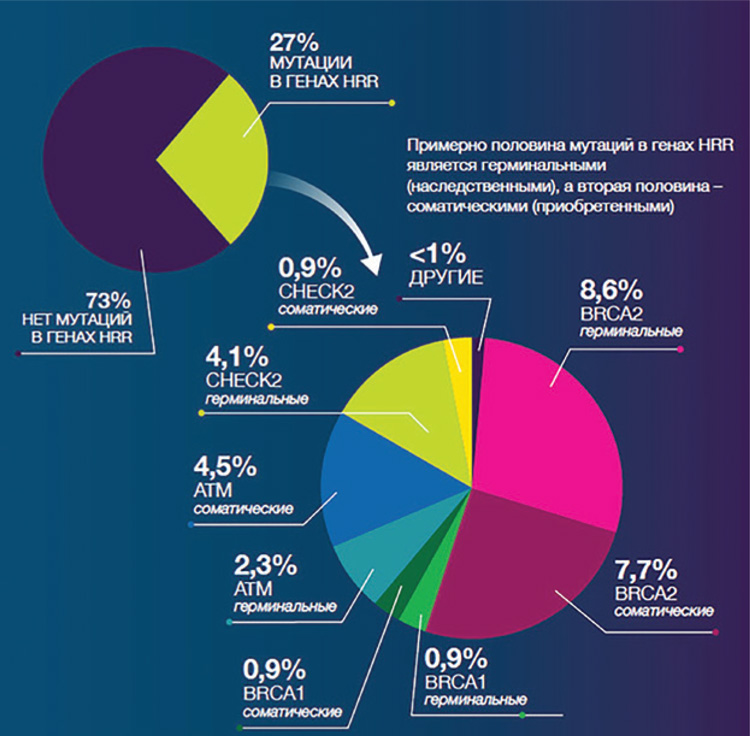
Частота выявления герминальных и соматических мутаций в
генах гомологичной рекомбинации ДНК (HRR) при кастрационно-резистентном раке предстательной железы (КРРПЖ)
может достигать 15-25% (BRCA1,
BRCA2, FANC, ATM, PALB2,
RAD50, RAD51, NBN, MRE11,
BLM, и ATR.). Большая часть
мутаций при метастатическом
КРРПЖ выявляется в гене BRCA2
(8,6%, рис.1).
Рисунок 1.
Распространенность мутаций в генах (HRR)
при раке предстательной железы.
На ASCO Genitourinary Cancers
Symposium 2022 представлены
результаты двух исследований,
посвященных изучению эффективности ингибиторов PARP при
мКРРПЖ. Объективно нельзя
сравнивать эти два исследования,
так как изучались разные препараты в различных популяциях
больных.
PROpel
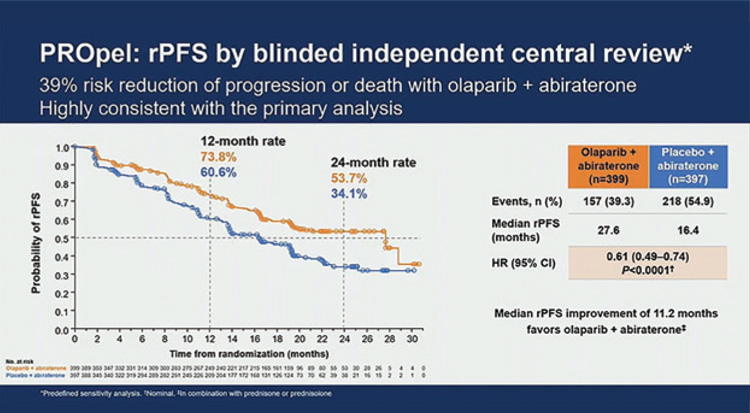
В исследовании 3 фазы PROpel
было показано, что добавление
олапариба к абиратерону и преднизолону позволяет достигнуть
rPFS (выживаемость без прогрессирования) 24,8 мес. при
мКРРПЖ независимо от наличия
мутаций в генах семейства HRR.
796 пациентов, включенных в исследование, были рандомизированы в 2 лечебные группы в соотношении 1:1:
• олапариб 200 мг 2 раза в день + абиратерон 1000 мг/сут. (+ преднизолон 10 мг/сут.);
• плацебо + абиратерон 1000 мг/
сут. (+ преднизолон 10 мг/сут.).
Больные в исследовании были стратифицированы в группы в зависимости от локализации метастазов и предшествующей терапии на основе таксанов. Первичной конечной точкой исследования была rPFS, вторичными – общая выживаемость, частота достижения объективного ответа, частота выявления герминальных и соматических мутаций в генах HRR и токсичность терапии. Средний возраст участников исследования составил 69,5 лет, у большинства (70,1%) ECOG статус был оценен как 0. В группе олапариба мутации в генах HRR выявлены у 27,8% пациентов, в группе плацебо – у 29,0%. В общей когорте пациентов добавление олапариба к абиратерону и преднизолону позволило увеличить rPFS с 16,4 мес. до 27,6 мес. (ОР=0,61; 95% ДИ 0,49-0,74), однолетнюю ВБП – с 60,6% до 73,8% и двухлетнюю ВБП – с 34,1% до 53,7% (рис.2).
Рисунок 2.
rPFS в исследовании PROpel.
Частота объективного ответа в
группе с олапарибом достигла
58,5% против 48,1% в группе плацебо.
Частота регистрации НЯ любой
степени в группе олапариба достигла 97,2%, развитие НЯ 3 степени выше отмечено у 47,2%. Токсичность послужила причиной
прекращения терапии у 13,8%
больных этой когорты.
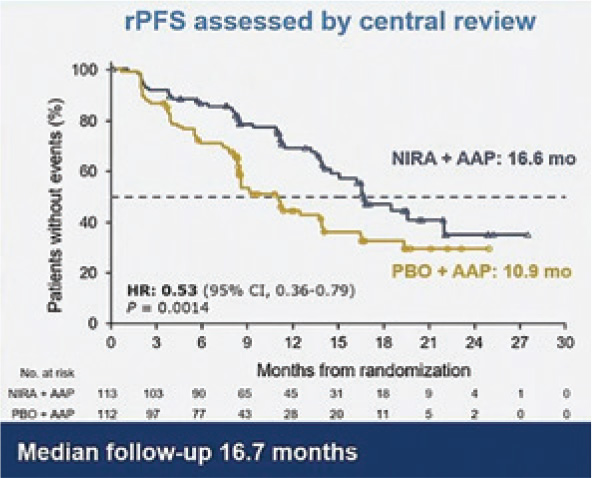
MAGNITUDE
В исследовании 3 фазы
MAGNITUDE было показано, что
добавление нирапариба к абиратерону и преднизолону позволяет
значимо увеличить rPFS в 1 линии
терапии мКРРПЖ у пациентов с
мутацией в генах HRR.
В работу были включены пациенты с ECOG 0-1, которые могли
получать абиратерон 1000 мг/сут.
(+ преднизолон 10 мг/сут.) в качестве 1 линии терапии мКРРПЖ не
более 4 месяцев до момента включение в исследование.
Пациенты были рандомизированы в 2 лечебные группы (1:1):
• нирапариб 200 мг 1 раз в день + абиратерон 1000 мг/сут. (+ преднизолон 10 мг/сут);
• плацебо + абиратерон 1000 мг/
сут. (+ преднизолон 10 мг/сут.).
Первичной конечной точкой исследования была rPFS у пациентов с мутациями в генах BRCA1/2, вторичными – время до назначения химиотерапии, время до клинического прогрессирования, частота достижения объективного ответа и общая выживаемость. Пациенты были стратифицированы в группы в зависимости от предшествующей терапии и нарушений в генах системы HRR. При медиане времени наблюдения в 18,6 мес. в когорте пациентов с мутациями в генах BRCA1/2 rPFS в группе с нирапарибом достигла 16,6 мес. против 10,9 мес. в группе с плацебо (ОР=0,53; 95% ДИ 0,36- 0,79; p=0,0014) (рис.3).
Рисунок 3.
rPFS в когорте пациентов
с нарушением в генах
BRCA1/2.
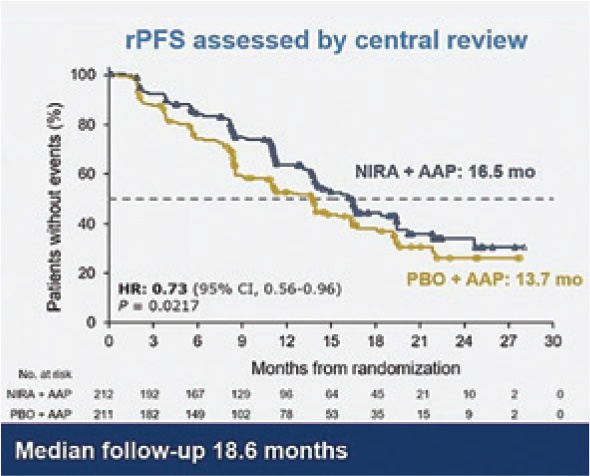
В общей популяции пациентов с нарушением в генах HRR добавление нирапариба к абиратерону и преднизолону позволило увеличить rPFS с 13,7 мес. до 16,5 мес. (ОР=0,73; 95% ДИ 0,56-0,96; p=0,0217) (рис.4).
Рисунок 4.
rPFS во всей когорте
пациентов с нарушением
в генах HRR.
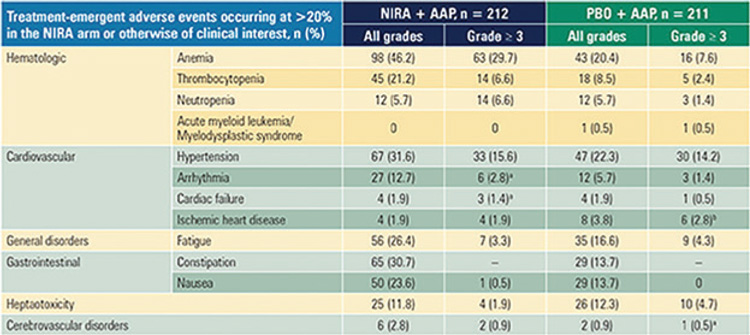
В группе пациентов с мутациями в генах системы HRR назначение нирапариба позволило значимо увеличить время до назначения химиотерапии (ОР=0,59; 95% ДИ 0,39-0,89; p=0,0108), время до клинического прогрессирования (ОР=0,69; 95% ДИ 0,47-0,90; p=0,0444) и частоту достижения ответов с 28% до 60% (p<0,001). Таким образом, назначение нирапариба в комбинации с абиратероном и преднизолоном позволяет снизить риск прогрессирования на 47% в группе пациентов с мутациями в генах BRCA1/2 и на 27% – при наличии мутаций в генах системы HRR. НЯ любой степени зарегистрированы у 99,1% пациентов в группе нирапариба и были преимущественно представлены анемией (46,2%), гипертензией (31,6%) и запорами (30,7%), частота НЯ 3-4 степени в этой группе достигла 67%. НЯ привели к прекращению терапии у 9% больных этой когорты.Подробно НЯ, зарегистрированные в исследованиях PROpel и MAGNITUDE, представлены на рисунке 5.
Рисунок 5.
Нежелательные явления, зарегистрированные
в исследованиях PROpel и MAGNITUDE.
Источники:
1. Chi KN, Rathkopf DE, Smith MR, et al. Phase 3 MAGNITUDE study: first results of niraparib (NIRA) with abiraterone acetate and prednisone (AAP) as first-line therapy in patients (pts) with metastatic castrationresistant prostate cancer (mCRPC) with and without homologous recombination repair (HRR) gene alterations. J Clin Oncol. 2022; 40 (suppl 6): 12. doi:10.1200/ JCO.2022.40.6_suppl.012.
2. Saad F, Armstrong AJ, ThieryVuillemin A, et al. PROpel: phase III trial of olaparib (ola) and abiraterone (abi) versus placebo (pbo) and abi as first-line (1L) therapy for patients (pts) with metastatic castrationresistant prostate cancer (mCRPC). J Clin Oncol. 2022; 40 (suppl 6): 11. doi:10.1200/JCO.2022.40.6_ suppl.011.
3. Hussain M, Mateo J, Fizazi K, et al. Survival with olaparib in metastatic castration-resistant prostate cancer. N Eng J Med. 2020; 383(24): 2345- 2357. doi:10.1056/NEJMoa2022485.
4. Clarke N, Wiechno P, Alekseev
B, et al. Olaparib combined with
abiraterone in patients with
metastatic castration-resistant
prostate cancer: a randomised,
double-blind, placebo-controlled,
phase 2 trial. Lancet Oncol. 2018;
19(7): 975-986. doi:10.1016/S1470-
2045(18)30365-6.
TROPHY-U-01 COHORT 3. САЦИТУЗУМАБ ГОВИТЕКАН В КОМБИНАЦИИ
С ПЕМБРОЛИЗУМАБОМ ПРИ МЕТАСТАТИЧЕСКОМ УРОТЕЛИАЛЬНОМ РАКЕ
TROPHY-U-01 – мультикогортное
исследование 2 фазы. На ASCO
Genitourinary Cancers Symposium
2022 представлены результаты лечения пациентов 3 когорты. В этой
группе изучалась эффективность
сацитузумаба говитекана в комбинации с пембролизумабом во
второй линии лечения метастатического уротелиального рака после терапии на основе препаратов
платины. Первичной конечной
точкой исследования было частота достижения объективного ответа (ЧОО), вторичными – частота контроля роста опухоли (КРО),
выживаемость без прогрессирования и токсичность терапии.
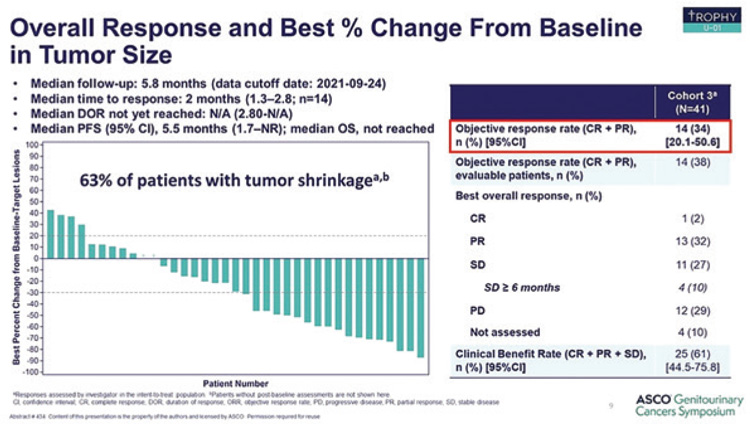
Терапию сацитузумабом говитеканом получил 41 пациент, доза 10 мг/кг в/в кап. в 1, 8 дни в комбинации с пембролизумабом 200 мг в/в кап. в 1 день, курс составлял 21 день. При медиане времени наблюдения в 5,8 мес. ЧОО составила 34% (1 полный ответ и 13 частичных ответов), при КРО в 44%, 6-месячной ВБП в 47% и медиане ВБВ в 5,5 мес. (рис.6). НЯ любой степени были преимущественно представлены диареей (76%), тошнотой (59%), анемией (56%), нейтропенией (44%) и астенией (59%). НЯ 3 степени и выше зарегистрированы у 59% пациентов: диарея (24%), анемия (20%), фебрильная нейтропения (10%), утомляемость (7%) и астения (5%).
Рисунок 6.
Непосредственные результаты эффективности
сацитузумаба говитекана в комбинации с пембролизумабом.
Источник:
The combination of
the Trop-2-directed antibody-drug
conjugate (ADC) sacituzumab
govitecan (SG) and the checkpoint
inhibitor pembrolizumab appears
to have activity in patients with
metastatic urothelial cancer (mUC)
who experience disease progression
after platinum-based chemotherapy,
according to results of the phase
2 TROPHY-U-01 Cohort 3 study
(Abstract 434).
ОБНОВЛЕННЫЕ РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ KEYNOTE-564.
ЭФФЕКТИВНОСТЬ АДЪЮВАНТНОЙ ТЕРАПИИ ПЕМБРОЛИЗУМАБОМ
У ПАЦИЕНТОВ С ПОЧЕЧНОКЛЕТОЧНЫМ РАКОМ
В исследование KEYNOTE-564
были включены пациенты с почечноклеточным раком после радикального хирургического лечения,
относящиеся к группам среднего
риска (pT2, G4 или наличие саркоматоидного компонента в опухоли, N0M0 или pT3, любой степени
дифференцировки, N0M0) и высокого риска (pT4, любая G, N0M0
или любая pT, любая G, N+M0). У
5,8% больных помимо нефрэктомии было выполнено удаление
солитарных мягкотканных метастазов (одновременно с нефрэктомией).
Первичной конечной точкой терапии была безрецидивная выживаемость (БРВ), вторичными – общая выживаемость и токсичность. Пациенты были рандомизированы в 2 лечебные группы (1:1):
• пембролизумаб 200 мг в/в кап. 1 раз в 3 недели (n=496) до 17 циклов терапии;
• плацебо в/в кап. 1 раз в 3 недели (n=498) до 17 циклов терапии.
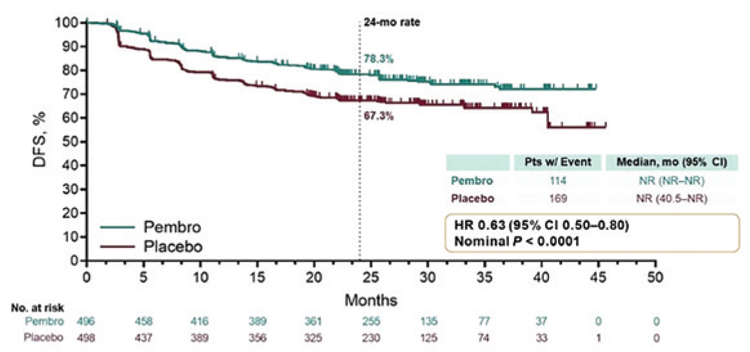
Средний возраст больных, включенных в исследование, составил 60 лет, 86% пациентов относились к группе среднего риска, в 11% случаев в опухоли присутствовал саркоматоидный компонент. При медиане времени наблюдения в 30,1 мес. медиана БРВ не была достигнута ни в одной из групп, за 24 месяца БРВ достигла 78,3% в группе пембролизумаба против 67,3% в группе плацебо (ОР= 0,63; 95% ДИ 0,50-0,80; p<0,0001) (рис.7).
Рисунок 7.
Безрецидивная выживаемость.
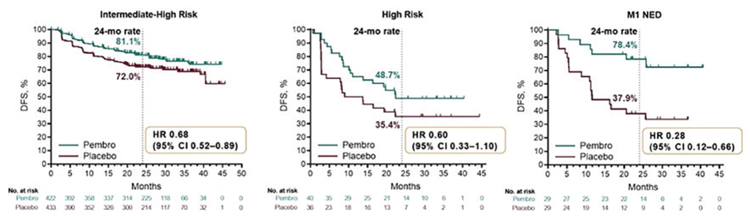
В подгрупповом анализе было показано, что назначение пембролизумаба в адъювантном режиме позволяет увеличить двухлетнюю ВБР на 9,5% в группе высокого и промежуточного риска и на 13,3% в группе только высокого риска прогрессирования (рис.8).
Рисунок .
Безрецидивная выживаемость в зависимости от группы риска.
Спектр нежелательных явлений,
зарегистрированных во время терапии, был ожидаемым и управляемым и более подробно представлен на рисунке 9.
Рисунок 9.
Токсичность терапии.
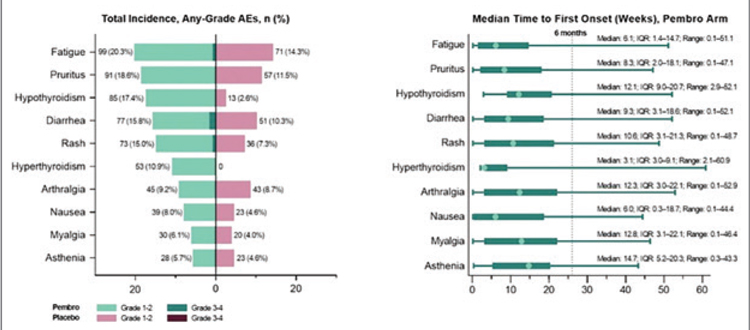
Источник:
Toni K. Choueiri, Piotr Tomczak, Se Hoon Park, et al. Pembrolizumab as post nephrectomy adjuvant therapy for patients with renal cell carcinoma: Results from 30-month follow-up of KEYNOTE-564. J Clin Oncol. 2022; 40 (suppl 6; abstr 290). DOI 10.1200/JCO.2022.40.6_suppl.290.
ЛИНПАРЗА
олапариб

НОВОСТИ ASCO GU 2022
ARASENS. ДАРОЛУТАМИД В КОМБИНАЦИИ С ДОЦЕТАКСЕЛОМ И АНДРОГЕН-ДЕПРИВАЦИОННОЙ ТЕРАПИЕЙ В 1 ЛИНИИ ЛЕЧЕНИЯ МЕТАСТАТИЧЕСКОГО ГОРМОНОЧУСТВИТЕЛЬНОГО РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
Даролутамид является нестероидным антагонистом андрогеновых рецепторов (АР), обладающим высокой аффинностью к его лиганд-связывающему домену АР. Взаимодействие даролутамида с АР приводит к подавлению транслокации АР в ядро клетки и опосредованной АР транскрипции. ARASENS – рандомизированное исследование 3 фазы, изучающее целесообразность добавления даролутамида к доцетакселу и андроген-депривационной (АДТ) терапии в 1 линии лечения метастатического гормоночуствительного рака предстательной железы (мГЧ РПЖ). Пациенты, всклоченные в исследование, были рандомизированы в 2 лечебные группы (1:1):
• доцетаксел 75 мг/м2 до 6 курсов в комбинации с АДТ и даролутамидом 600 мг/сут. (n=651);
• доцетаксел 75 мг/м2 до 6 курсов в комбинации с АДТ и плацебо (n=654).
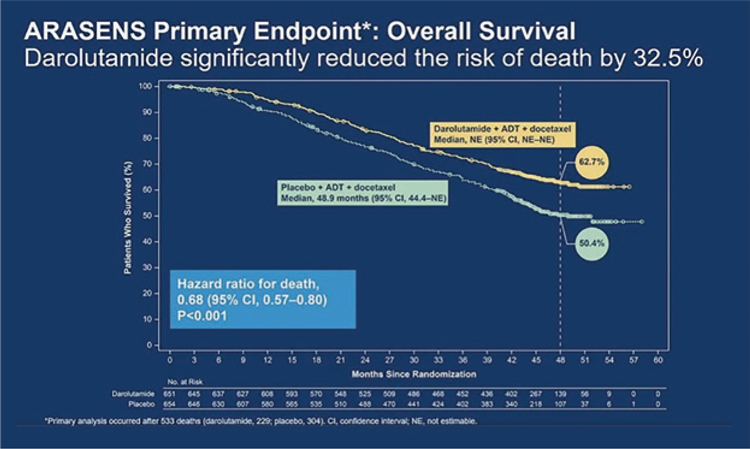
Терапия в режиме АДТ и даролутамид или плацебо продолжалась до прогрессирования или неприемлемой токсичности. Первичной конечной точкой исследования была общая выживаемость (ОВ), вторичными – время до развития кастрационно-резистентного рака предстательной железы (КР РПЖ), время до клинического прогрессирования, время до начала следующей системной противоопухолевой терапии и время до усиления болевого синдрома. Медиана возраста пациентов в исследовании составила 67 лет, у большинства участников (71,1%) ECOG статус был 0, в 78,2% случаях индекс Глисона был 8 и более. Пациенты были стратифицирован в группы в зависимости от распространенности заболевания и уровня ЩФ. Медиана ОВ в группе с плацебо составила 48,9 мес., в группе с даролутамидом она не была достигнута, при четырехлетней ОВ в 50,4% и 62,7% в обеих когортах соответственно. Таким образом, добавление даролутамида к стандартной терапии позволило статистически значимо снизить риск смерти на 32,5% (ОР=0,57; 95% ДИ 0,67-0,80, р<0,001) (рис.1).
Рисунок 1.
. Общая выживаемость в группах с даролутамидом
и плацебо..
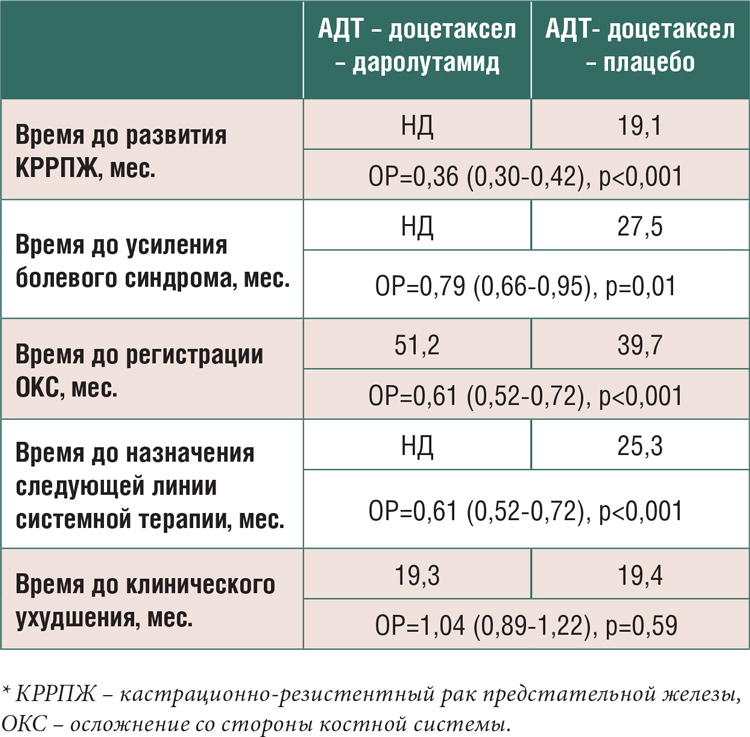
Более подробно результаты исследования ARASENS представлены в
таблице 1.
Таблица 1.
Результаты исследования ARASENS.
НЯ 3 степени и более зарегистрированы у 70,2% больных в группе с
даролутамидом и у 67,5% пациентов
в группе с плацебо и были преимущественно представлены нейтропенией (33,7% и 34,2%), фебрильной
нейтропенией (7,8% и 7,4%), гипертензией (6,4% и 4,2%), анемией
(4,8% и 5,1%), пневмонией (3,2%
и 3,1%) и гипергликемией (2,8% и
3,7%). НЯ привели к прекращению
терапии в 13,5% и 10,6% случаях и
привели к смерти 27 и 26 больных в
каждой из групп.
CYPIDES TRIAL. ODM-208 В ПОЗДНИХ ЛИНИЯХ ТЕРАПИИ ДИССЕМИНИРОВАННОГО
КАСТРАЦИОННО-РЕЗИСТЕНТНОГО РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
У более чем половины больных
КР РПЖ, прогрессирующих на
фоне терапии абиратероном и
энзалутамидом, сохраняется высокая экспрессия АР на клетках
опухоли. К изменению структуры
и функциональной активности
АР наиболее часто приводят мутации в гене АР, чаще всего в 4-8
экзонах, кодирующих лиганд-связывающий домен, что делает возможной активацию АР другими
метаболитами стероидогенеза –
тестостероном и дегидротестостероном.
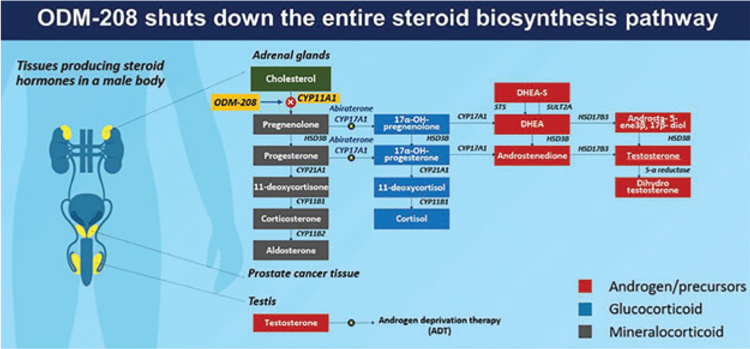
ODM-208 – первый пероральный нестероидный ингибитор
CYP11A1, блокирующий превращение холестерола в прегненолон.
Инактивация CYP11A1 приводит
к нарушению стероидогенеза, в
том числе глюкокортикоидов и
минералокортикоидов (рис.2.).
Рисунок 2.
Механизм действия ODM-208
CYPIDES Trial – это исследование 1/2 фазы. Дизайн исследования состоит из 2 частей:
• Оценка безопасности различных доз (стандартный дизайн «3+3»)
• Оценка предварительной эффективности
В исследование были включены пациенты, ранее получавшие не менее 1
линии гормонотерапии и не менее 1
линии химиотерапии на основе таксанов.
К январю 2022 года 44 пациента получили ODM-208 в комбинации с заместительной глюкокортикоидной и
минералокортикоидной терапией и
на фоне продолжения АДТ.
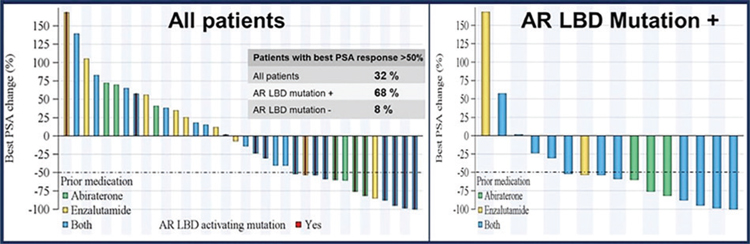
У 12 (33%) из 36 оцененных пациентов отмечено снижение уровня ПСА
более чем на 50% от исходного уровня. В группе пациентов с точечными
мутациями в гене АР, приводящими
к изменению в лиганд-связывающем
домене, частота снижения уровня ПСА ≥50% достигла 68% (10/15)
(рис.3).
Рисунок 3.
Эффективность терапии ODM-208.
НЯ 3 степени, потребовавшие перерыв в лечении и терапии высокими
дозами стероидов, зарегистрированы у 15 (37%) из 41 больного.
Подбор оптимальной дозы ODM-208
продолжается.
1B/2 EV-103. РЕЗУЛЬТАТЫ ТЕРАПИИ В КОГОРТЕ H. ЭНФОРТУМАБ ВЕДОТИН
В НЕОАДЪЮВАНТНОЙ ТЕРАПИИ МЫШЕЧНО-ИНВАЗИВНОГО РАКА МОЧЕВОГО ПУЗЫРЯ
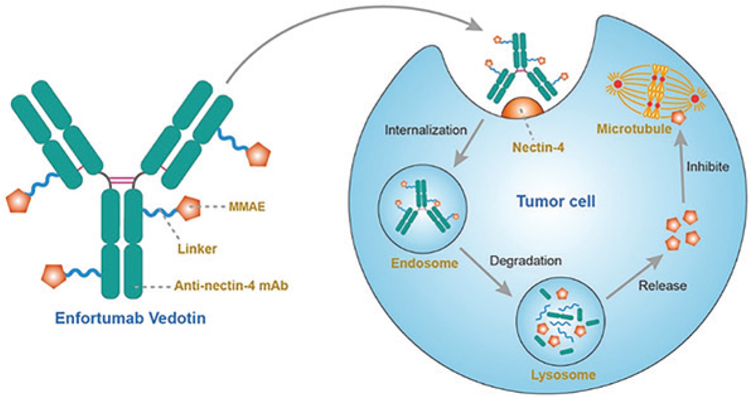
Энфортумаб ведотин – конъюгат моноклонального антитела к нектину-4,
молекуле клеточной адгезии, которая
имеет высокую частоту экспрессии
при уротелиальном раке, и цитотоксического препарата – монометила
ауристатина Е (ММАЕ), разрушающего микротрубочки (рис.4.).
Рисунок 4.
Энфортумаб ведотин.
В исследовании EV-103 в когорту H
были включены больные мышечноинвазивным раком мочевого пузыря
(сT2-T4aN0M0), с ECOG статусом
0-2, которым было потенциально возможно выполнение радикального хирургического лечения с тазовой лимфодиссекцией. Всем пациентам была
показана неоадъювантная цисплатин-содержащая химиотерапия, однако проведение ее было невозможно
по различным причинам. Причинами
отказа от проведения химиотерапии
на основе платины были низкий клиренс креатина, потеря слуха и функциональный статус пациента.
Пациенты, включенные в исследование, получали неоадъювантно 3 курса энфортумаба ведотина в режиме 1,25 мг/кг в 1, 8 дни, цикл 21 день. Через 4-12 недель после последнего введения энфортумаба ведотина больным выполнялось радикальное хирургическое лечение с тазовой лимфодиссекцией. Первичной конечной точкой исследования была частота достижения pCR. В когорту H были включены 22 пациента с медианой возраста в 74 года. Распространенность процесса на момент начала терапии была оценена как cT2N0 у 68,2% больных, cT3N0 – у 27,3% и cT4aN0 – в 4,5% случаев соответственно. Девятнадцать из 22 больных завершили все 3 запланированных курса терапии, и всем 22 пациентам было выполнено радикальное хирургическое лечение с тазовой лимфодиссекцией в установленные сроки. Частота достижения pCR составила 36,4%, а снижение стадии до ypT0, ypTis, ypTa, ypT1 и N0 зарегистрировано у половины больных (50%). НЯ, зафиксированные на фоне терапии, были преимущественно представлены слабостью (45,5%), алопецией (36,4%) и дисгевзией (36,4%). НЯ 3 степени и более зарегистрированы у 18,2%. Трое пациентов погибли во время исследования, смерть больных не была связана с терапией. В двух случаях гибель наступила в течение 30 дней после оперативного вмешательства, причинами стали тромбоэмболия и остановка сердца.
Источники:
1. Daniel P. Petrylak, Thomas W. Flaig, Nataliya Mar, et al. Study EV-103 Cohort H: Antitumor activity of neoadjuvant treatment with enfortumab vedotin monotherapy in patients (pts) with muscle invasive bladder cancer (MIBC) who are cisplatin-ineligible. Journal of Clinical Oncology. February 2022; 40 (6_suppl): 435-435. DOI: 10.1200/ JCO.2022.40.6_suppl.435.
2. Matthew R. Smith, Maha Hussain, Fred Saad, et al. Darolutamide and Survival in Metastatic, HormoneSensitive Prostate Cancer. The New England Journal Of Medicine. February 17, 2022. DOI: 10.1056/ NEJMoa2119115.
3. Karim Fizazi, Natalie Cook,
Philippe Barthélémy, et al. Phase
1 results of the ODM-208 first-inhuman phase 1-2 trial in patients with
metastatic castration-resistant prostate
cancer (CYPIDES). Journal of Clinical
Oncology. 2022 Feb 20; 40 (6_suppl):
18. DOI: 10.1200/JCO.2022.40.6_
suppl.018.
ПОДДЕРЖИВАЮЩАЯ ТЕРАПИЯ В ОНКОЛОГИИ

ПУБЛИКАЦИИ В КРУПНЫХ НАУЧНЫХ ЖУРНАЛАХ
ЦЕМИПЛИМАБ ПРИ РЕЦИДИВАХ РАКА ШЕЙКИ МАТКИ.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ EMPOWER-CERVICAL 1 [1]
10 февраля 2022 г. в журнале New England Journal of Medicine опубликованы результаты исследования 3 фазы, посвященные изучению эффективности цемиплимба при рецидивах рака шейки матки (РШМ). Цемиплимаб (LIBTAYO®) – моноклональное полностью человеческое антитело (IgG4), высокоаффинное к рецептору PD-1, блокирующее взаимодействие между рецептором PD-1 и его лигандами. Цемиплимаб одобрен FDA для лечения плоскоклеточного рака кожи и немелкоклеточного рака легкого. В работу включены женщины диссеминированным РШМ, ранее получившие химиотерапию на основе препаратов платины по поводу метастатического заболевания с ECOG статусом 0-1. Пациенты (n=608) были рандомизирован в две лечебные группы (1:1):
• Цемиплимаб (n=304) 350 мг в/в 1 раз в 21 день
• Терапия по выбору исследователя (n=304):
• гемцитабин 1000 мг/м2 в/в в 1, 8 дни, курс 21 день;
• винорельбин 30 мг/м2 в/в в 1, 8 дни, курс 21 день;
• пеметрексед 500 мг/м2 в/в в 1 день, курс 21 день;
• топотекан 1-1,25 мг/м2 в/в в 1-5 дни, курс 28 дней;
• иринотекан 100-125 мг/м2 в/в в 1,8,15 и 22 дни, курс 42 дня.
Пациентки были стратифицированы в зависимости от гистологического типа (аденокарцинома или плоскоклеточный рак), проведения терапии бевацизумабом в анамнезе, статуса ECOG и по региону проживания. Первичной конечной точкой исследования была общая выживаемость (ОВ), вторичными – выживаемость без прогрессирования (ВБП), частота достижения объективного ответа (ЧОО), длительность ответа и качество жизни. У большинства пациентов, включенных в исследование, был плоскоклеточный рак (77,8%), ECOG статус 1 (53,5%) и одна линия терапии в анамнезе (58,2%). При медиане времени наблюдения в 16,8 мес. медиана ОВ в группе цемиплимаба достигла 12,0 мес. против 8,5 мес. в группе терапии по выбору исследователя (ОР=0,69; 95% ДИ 0,56-0,84, p<0,001) (рис.1).
Рисунок 1.
Общая выживаемость.
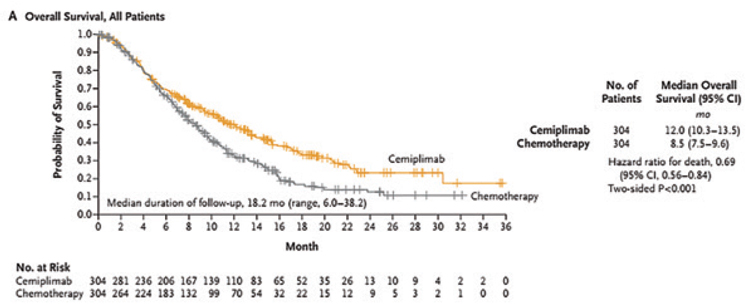
При подгрупповом анализе по гистологическому подтипу опухоли при плоскоклеточном раке шейки матки назначение цемиплимаба позволило увеличить медиану ОВ с 8,8 до 11,1 мес. (ОР=0,73; 95% ДИ 0,58-0,91; p<0,006), при аденокарциноме – с 7,0 до 13,3 мес. (ОР=0,56; 95% ДИ 0,36-0,85).
Преимущество цемиплимаба над стандартной химиотерапией не зависело от статуса ECOG и терапии бевацизумабом в анамнезе.
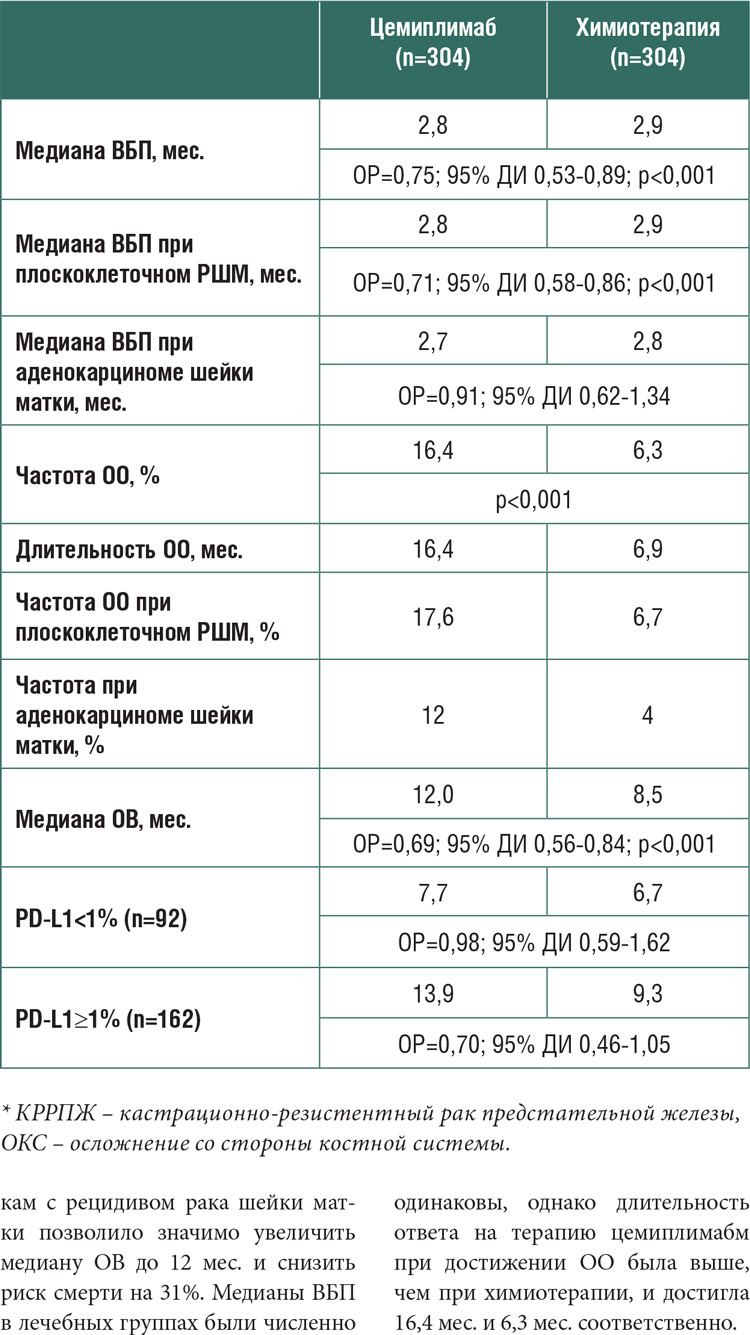
Подробно результаты исследования представлены в таблице 1.
Рисунок 1.
Общая выживаемость.
Нежелательные явления (НЯ) любой степени были зарегистрированы у 88,3% пациентов в группе
с цемиплимабом и у 91,4% в группе химиотерапии. НЯ 3 степени и
выше отмечены у 45% и 53,4% больных соответственно и были представлены анемией (12% и 26%),
инфекцией мочевыводящих путей
(5% и 2,8%) и нейтропенией (1,0%
и 9,0%). Токсичность послужила
причиной прекращения терапии у
26 (8,7%) пациентов в группе иммунотерапии и у 15 (5,2%) – в группе химиотерапии. Иммуноопосредованные НЯ наблюдались у 15,7%
больных в группе цемиплимаба и
0,7% – в контрольной группе.
Заключение
Назначение цемиплимаба пациент кам с рецидивом рака шейки матки позволило значимо увеличить
медиану ОВ до 12 мес. и снизить
риск смерти на 31%. Медианы ВБП
в лечебных группах были численно
одинаковы, однако длительность
ответа на терапию цемиплимабм
при достижении ОО была выше,
чем при химиотерапии, и достигла
16,4 мес. и 6,3 мес. соответственно.
ТУКАТИНИБ В КОМБИНАЦИИ С ТРАСТУЗУМАБОМ И КАПЕЦИТАБИНОМ В ПОЗДНИХ
ЛИНИЯХ ТЕРАПИИ HER2-ПОЗИТИВНОГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ.
Результаты исследования HER2CLIMB
В феврале 2022 г. в журнале Annals
of Oncology опубликованы финальные результаты исследования 3 фазы
HER2CLIMB, посвященные эффективности тукатиниба в комбинации
с трастузумабом и капецитабином в
поздних линиях терапии HER2 позитивного рака молочной железы [2].
В апреле 2020 г. на основании предварительных результатов исследования
HER2CLIMB тукатиниб в комбинации с трастузумабом и капецитабином был зарегистрирован FDA в
поздних линиях терапии диссеминированного HER2-позитивного рака
молочной железы [3].
Тукатиниб (ONT-380, Tukysa®) – тирозинкиназный ингибитор, нарушающий передачу по MAPK- и PI3K/
AKT-киназным путям благодаря нарушению аутофосфорилирования
субмембранных доменов рецепторов
HER2 и HER3 (рис.2).
Рисунок 2.
Рисунок 2. Механизм действия тукатиниба.
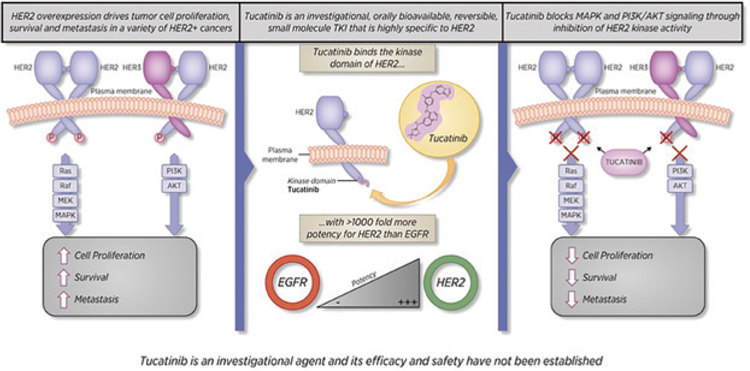
В исследование были включены больные HER2-позитивным диссеминированным РМЖ, ранее получавшие
трастузумаб, пертузумаб и T-DM1. В
большинстве случаев это были пациенты моложе 65 лет (83,5%), с ECOG
статусом 1 (55,3%). У 48% пациентов
были метастазы в головной мозг.
Первичной конечной точкой
HER2CLIMB была выживаемость без
прогрессирования (ВБП), вторичными – ВБП у пациентов с метастазами
в головной мозг, ОВ, частота достижения объективного ответа (ОО)
и контроля роста опухоли (КРО),
длительность ОО и токсичность терапии.
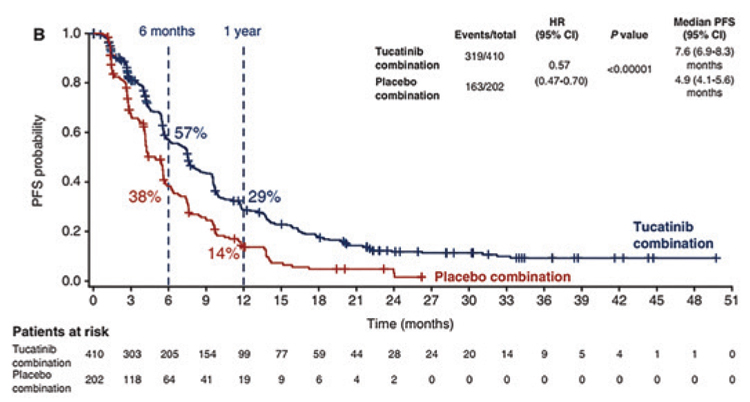
612 пациентов были рандомизированы в 2 лечебные группы в соотношении 2:1: Капецитабин 2000 мг/м2/сут. с 1 по 14 дни и трастузумаб (нагрузочная доза 8 мг/кг) 6 мг/кг в день 1, курс 21 день, в комбинации с тукатинибом 300 мг 2 раза в день, ежедневно (n=410) Капецитабин 2000 мг/м2/сут. с 1 по 14 дни и трастузумаб (нагрузочная доза 8 мг/кг) 6 мг/кг в день 1, курс 21 день, в комбинации с плацебо (n=202) Медиана выживаемости без прогрессирования составила 7,6 мес. в группе двойной анти-HER2 терапии и капецитабина против 4,9 мес. в группе сравнения (ОР=0,57; 95% ДИ 0,47- 0,70; p<0,00001), при однолетней ВБП в 29% и 14% соответственно (рис.3).
Рисунок 3.
Медиана выживаемости без прогрессирования
Объективные ответы в группе с тукатинибом зарегистрированы у 41%
больных против 23% в контрольной
группе (p=0,00008), при КРО – в 85,6
% и 81,3% соответственно.
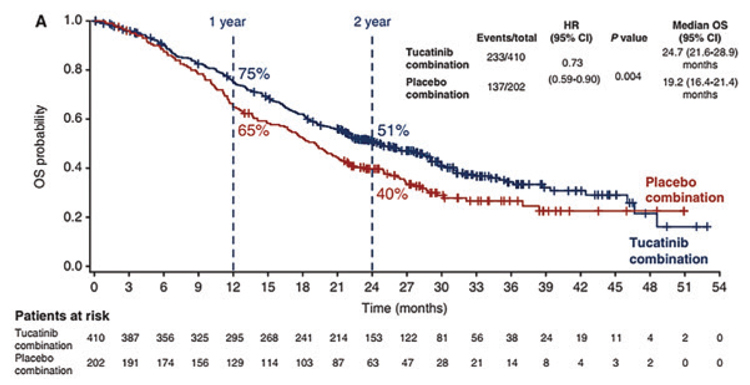
При медиане времени наблюдения в
29,6 мес. медиана ОВ с группы с тукатинибом достигла 24,7 мес. против
19,2 мес. в группе плацебо (ОР=0,73;
95% ДИ 0,59-0,90; p=0,004), при двухлетней ОВ в 51% и 40% соответственно (рис.4).
Рисунок 4.
Медиана общей выживаемости.
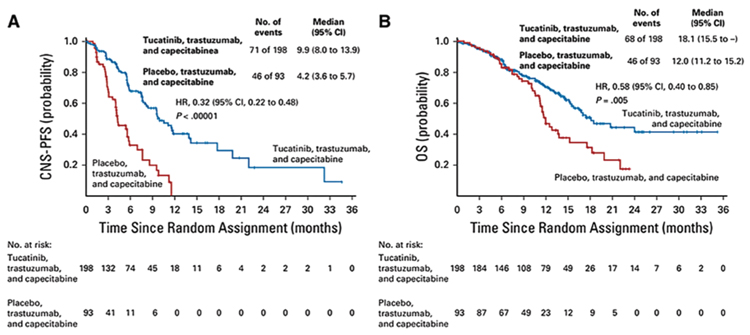
Особый интерес вызывают результаты лечения у пациентов с метастазами в головной мозг. Результаты терапии этой группы опубликованы ранее в журнале Journal of Сlinical Oncology. В этой когорте больных медиана ВБП в группе с тукатинибом достигла 9,9 мес. и 4,1 мес. в группе плацебо (ОР=0,36; 95% ДИ 0,22-0,48; p<0,00001), при одногодичной ВБП в 40,2% и 0%. Медиана ОВ была также значимо выше при терапии тукатинибом 18,1 мес. против 12,0 мес. (ОР=0,58; 95% ДИ 0,22-0,48; p<0,00001). Таким образом, назначение тукатиниба при HER2- позитивном РМЖ с метастазами в головной мозг позволило снизить риск прогрессирования на 68% и риск смерти на 42% (рис.5) [2].
Рисунок 5.
Результаты терапии пациентов с метастазами в головной мозг.
При подгрупповом анализе было продемонстрировано значимое увеличение ОВ в группе тукатиниба у пациентов моложе 65 лет, с отрицательным
статусом гормональных рецепторов,
при метастазах в головном мозге и с
ECOG 0. Нежелательные явления 3 степени и
выше несколько чаще регистрировались в группе тукатиниба (60,6%)
по сравнению с группой плацебо
(51,3%) и были преимущественно представлены диареей (13,1% и
8,6%), ладонно-подошвенным синдромом (14,1% и 9,1%), слабостью
(5,4% и 3,6%), тошнотой (4,0% и 3,6%)
и повышением АСТ (4,7% и 0,5%) и
АЛТ (5,7% и 0,5%). НЯ послужили
причиной прекращения терапии у
52 (12,9%) и 23 (11,7%) пациентов в
группах соответственно и привели к
смерти 6 (1,5%) и 5 (2,5%) участников
исследования.
Новые возможности терапии диссеминированного HER2-позитивного
рака молочной железы позволяют
значимо улучшить результаты лечения, что отражается в ежегодном
численном увеличение медианы ОВ.
Источники:
1. Tewari KS, Monk BJ, Vergote I, et al; Investigators for GOG Protocol 3016 and ENGOT Protocol En-Cx9. Survival with Cemiplimab in Recurrent Cervical Cancer. N Engl J Med. 2022 Feb 10; 386(6): 544-555.
2. Curigliano G, Mueller V, Borges V, et al. Tucatinib versus placebo added to trastuzumab and capecitabine for patients with pretreated HER2+ metastatic breast cancer with and without brain metastases (HER2CLIMB): final overall survival analysis. Ann Oncol. 2022 Mar; 33(3): 321-329. doi: 10.1016/j. annonc.2021.12.005. Epub 2021 Dec 23.
3. Nancy U Lin, Virginia Borges,
Carey Anders, et al. Intracranial
Efficacy and Survival With Tucatinib
Plus Trastuzumab and Capecitabine
for Previously Treated HER2-Positive
Breast Cancer With Brain Metastases in
the HER2CLIMB Trial DOI: 10.1200/
JCO.20.00775. Journal of Clinical
Oncology. 38, no.23 (August 10, 2020)
2610-2619.
CHECKMATE 648: ИММУНОТЕРАПИЯ В ПЕРВОЙ ЛИНИИ ЛЕЧЕНИЯ ДИССЕМИНИРОВАННОГО ПЛОСКОКЛЕТОЧНОГО РАКА ПИЩЕВОДА
В феврале 2022 г. в журнале The
New England Journal of Medicine
опубликованы результаты открытого рандомизированного
исследования 3 фазы CheckMate
648, направленного на изучение
эффективности иммунотерапии
в первой линии лечения диссеминированного плоскоклеточного
рака пищевода.
Пациенты, включенные в исследование, были рандомизированы в 3
лечебные группы в соотношении
1:1:1:
• n=321: ниволумаб 240 мг в/в капельно в 1, 14 дни в комбинации с цисплатином 80 мг/м2 в/в кап. в 1 день и 5-ФУ 800 мг/м2 в/в кап. в 1-5 дни (PF), цикл 28 дней;
• n=325: ниволумаб 3 мг/кг в/в кап. 1 раз в 14 дней в комбинации с ипилимумабом 1 мг/кг 1 раз в 6 недель;
• n=324: цисплатин 80 мг/м2 в/в
кап. в 1 день в комбинации с
5-ФУ 800 мг/м2 в/в кап. в 1-5 дни
(PF), цикл 28 дней
Первичными конечными точками
исследования были общая выживаемость (ОВ) и выживаемость без
прогрессирования (ВБП), вторичными – частота достижения объективного ответа (ОО), длительность ОО и токсичность терапии.
Большинство пациентов, включенных в исследование, были
мужчинами старше 60 лет, с впервые выявленным диссеминированным плоскоклеточным раком
пищевода и ECOG 1.
Ниволумаб в комбинации
с химиотерапией против
химиотерапии
При медиане времени наблюдения в 13 мес. в группе пациентов с PDL≥1% медиана ОВ была значимо выше при комбинации PF с иммунотерапией, чем в группе только химиотерапии, и достигла 15,4 мес. и 9,1 мес. соответственно (ОР 0,54; 99,5% ДИ 0,37-0,80; p<0,001), при 12-месячной выживаемости в 58% и 37%. В общей группе пациентов добавление ниволумаба к PF позволило увеличить медиану ОВ с 10,7 мес. до 13,2 мес., снизить риск смерти на 26% (ОР 0,74; 99,1% ДИ 0,58-0,96; p=0,002) (рис.1).
Рисунок 1.
A – общая выживаемость в когорте пациентов с PD-L≥1%.
B – общая выживаемость в общей группе больных

Медиана ВБП при PD-L≥1% была значимо выше при комбинации химиотерапии с ниволумабом и достигла 6,9 мес. против 4,4 мес. (ОР 0,65; 98,5% ДИ 0,46-0,92; p=0,002), однако в общей группе больных добавление иммунотерапии к PF не привело к значимому увеличению медианы ВБП (рис.2).
Рисунок 2.
С – выживаемость без прогрессирования в когорте пациентов с PD-L≥1%.
D – выживаемость без прогрессирования в общей группе больных
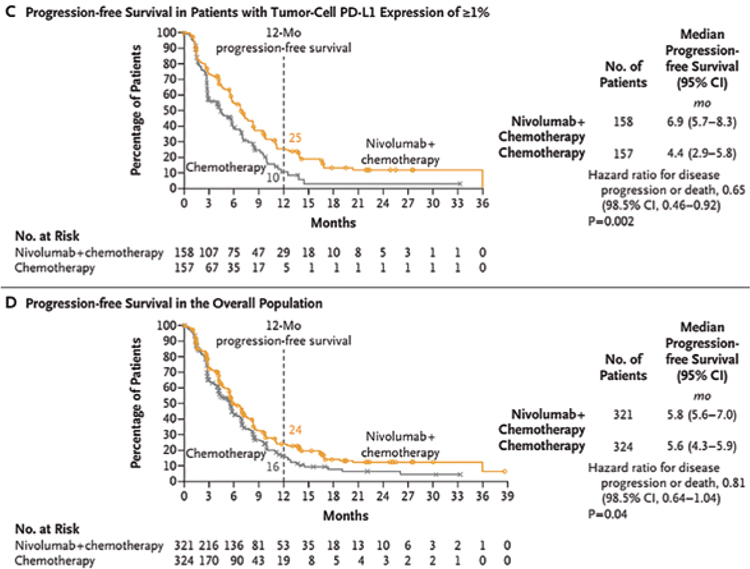
Комбинация CF и ниволумаба позволила увеличить частоту объективных ответов при PD-L≥1%
с 20% до 53% и в общей группе
больных с 27% до 47%, а медиану
длительности ответа с 5,7 мес. до
8,4 мес. и с 7,1 мес. до 8,2 мес. соответственно.
Ниволумаб в комбинации
с ипилимумабом vs
химиотерапия
При PD-L≥1% медиана ОВ в группе комбинированной иммунотерапии была значимо выше, чем в группе химиотерапии, и достигла 13,7 мес. против 9,1 мес. (ОР 0,64; 98,6% ДИ 0,46-0,90; p=0,001), при 12-месячной общей выживаемости в 57% и 37% соответственно. В общей когорте пациентов медиана ОВ при назначении ниволумаба в комбинации с ниволумабом составила 12,7 мес. против 10,7 мес. в группе только химиотерапии (ОР 0,78; 98,2% ДИ 0,62-0,98; p=0,01; рис.3).
Рисунок 3.
A – общая выживаемость в когорте пациентов с PD-L≥1%.
B – общая выживаемость в общей группе больных.
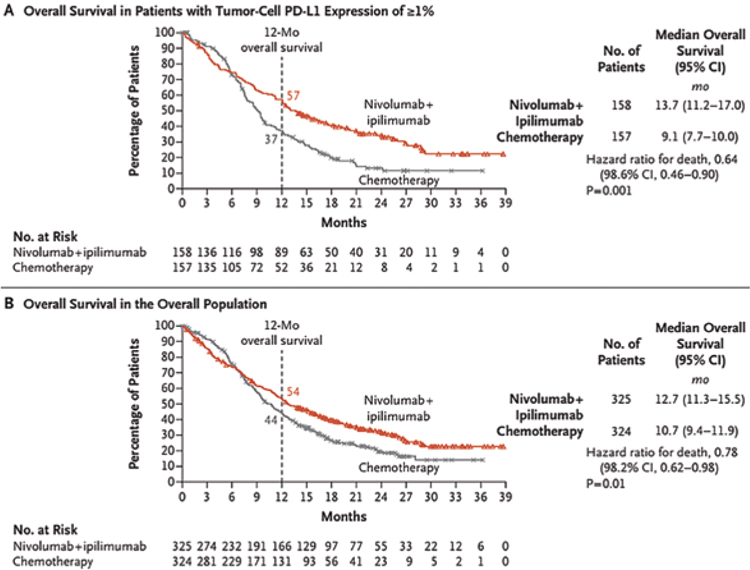
Медианы ВБП ни при PD-L≥1%, ни в общей когорте значимо не различались и составили 4,0 мес. и 4,4 мес. и 2,9 мес. и 5,6 мес. соответственно. При PD-L≥1% частота достижения ОО была выше в группе комбинированной иммунотерапии и составила 35% против 20% в группе химиотерапии при медиане длительности ОО в 11,8 мес. и 5,7 мес. соответственно. Нежелательные явления (НЯ) 3 степени и выше зарегистрированы у 47% пациентов в группе ниволумаба и PF, у 32% – в группе комбинированной иммунотерапии и у 36% – в группе только химиотерапии и послужили причиной прекращения терапии в 9%, 13% и 5% случаях соответственно. НЯ ≥3 степени были преимущественно представлены тошнотой (4%, 1%, 3%), стоматитом (6%, 0%, 2%), анемией (10%, 1%, 6%) и нейтропенией (8%, 0%, 8%). Подробно результаты исследования CheckMate 648 представлены в таблице 1.
Таблица1.
. Результаты исследования CheckMate 648.
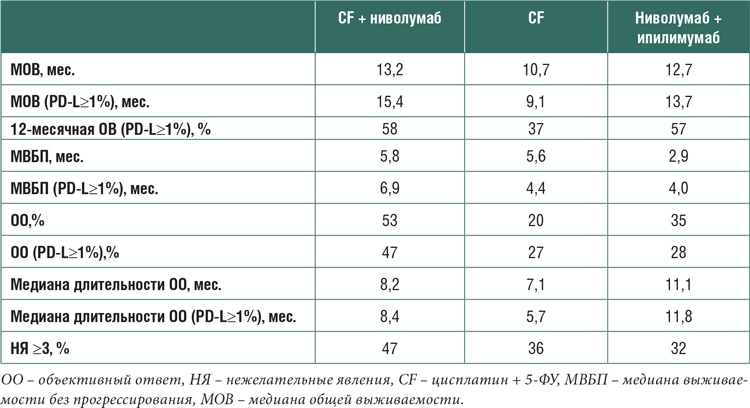
Источник:
Yuichiro Doki,
Jaffer A. Ajani, Ken Kato, et al.
Nivolumab Combination Therapy
in Advanced Esophageal SquamousCell Carcinoma. N Engl J Med.
2022; 386: 449-462. DOI: 10.1056/
NEJMoa2111380.
КИТРУДА

РИСК ВОЗНИКНОВЕНИЯ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ У НОСИТЕЛЕЙ ГЕРМИНАЛЬНЫХ МУТАЦИЙ ГЕНОВ BRCA1/2
Автор: С.А.Тюляндин
Председатель Российского общества
клинической онкологии, Москва
Все мы уже четко усвоили, что выявление герминальной мутации
генов BRCA1/2 предполагает развитие наследственного рака молочной железы и/или яичников.
В последние годы было обнаружено, что эти мутации повышают риск развития рака простаты
у мужчин и рака поджелудочной
железы независимо от пола. Больным-носителям мутации генов
BRCA1/2 показано лечение PARPингибиторами.
А есть ли взаимосвязь герминальных мутаций генов BRCA1/2 c
другими злокачественными опухолями? Для обнаружения такой
взаимосвязи требуется наблюдение за большим количеством носителей мутации. Это стало возможным в рамках консорциума
специалистов, диагностирующих
наследственные мутации BRCA1/2
(Consortium of Investigators of
Modifiers of BRCA1/2). В базе данных этой группы находилось 3184
и 2157 семьи носителей мутации
BRCA1 и BRCA2 соответственно,
что позволило включить для анализа 14979 носителей мутации и
проследить возникновение у них
злокачественных заболеваний
и возраст (очень часто приблизительный) их диагностики. Все
носители были прослежены до
момента возникновения злокачественного новообразования или
до возраста 80 лет. Относительный риск заболевания высчитывался на основании заболеваемости Великобритании в период
2008-2012 гг.
При анализе данных обнаружено
увеличение риска заболеваемости
у носителей мутации BRCA1 раком молочной железы у мужчин,
желчного пузыря и желчных протоков, поджелудочной железы,
желудка и колоректальным раком
независимо от пола (см. табл.1).
При этом отмечается возникновение рака желудка в молодом возрасте (моложе 65 лет). У носителей
мутации гена BRCA2 повышен
риск заболеваемости раком молочной железы и простаты у мужчин и, независимо от пола, раком
желудка и поджелудочной железы. При этом риск заболеть раком
желудка выше у женщин в сравнении с мужчинами (6,68 против
2,76), а рак поджелудочной железы возникает преимущественно в
молодом возрасте (моложе 65 лет).
Для других 17 злокачественных
опухолей не отмечено связи наличия мутации генов BRCA1/2 с повышением риска заболеваемости.
Частота возникновения той или
иной опухоли у носителя конкретной мутации (абсолютный
риск) к 80 годам представлена в
таблице 2. При наличии мутации
гена BRCA1 к 80 годам из тысячи
носителей рак молочной железы у
мужчин будет диагностирован у
4, рак поджелудочной железы – у
29 мужчин и 23 женщин, рак желудка – у 16 мужчин и 7 женщин.
Мутация гена BRCA2 будет ответственна за возникновение к 80
годам из 1000 ее носителей: рака
молочной железы – у 38 мужчин,
рака поджелудочной железы – у
30 мужчин и 23 женщин, рака желудка – у 35 мужчин и 35 женщин,
рака простаты – у 269 мужчин.
Таблица1.
Относительный риск (OP) заболеваемости
у носителей мутации в сравнении с популяционным риском..
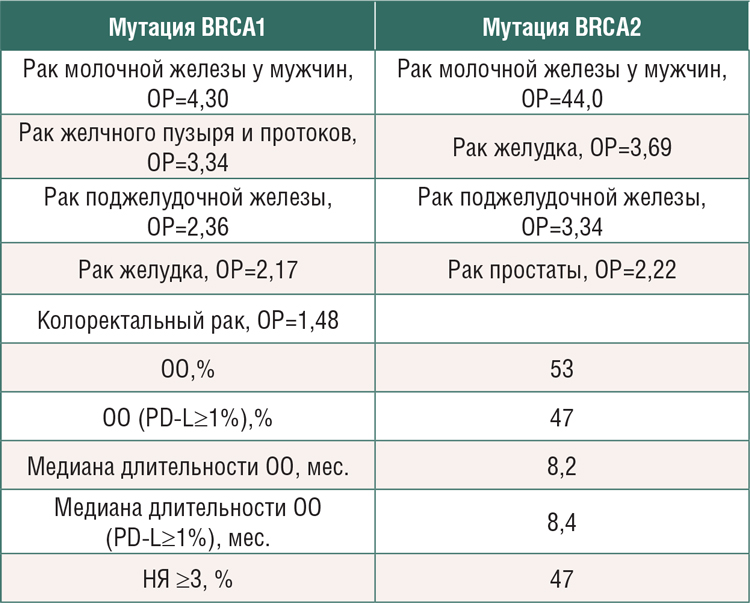
Таблица 2. Абсолютный риск возникновения к 80 годам злокачественной опухоли у носителей мутации генов BRCA1/2
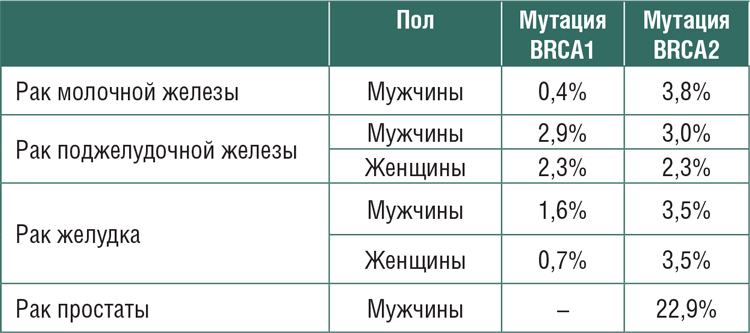
Изучив возможную взаимосвязь наличия герминальной мутации генов BRCA1/2 с возникновением 22 злокачественных опухолей (кроме рака молочной железы и рака яичников), было подтверждено увеличение риска заболевания для рака молочной железы и простаты у мужчин, а также рака поджелудочной железы и желудка. Выявлена тенденция увеличения риска возникновения колоректального рака и рака желчного пузыря и протоков, которая нуждается в дополнительном исследовании. Для других 18 опухолей, включая меланому и опухоли мочеполовой сферы, не было обнаружено такой взаимосвязи. Это не значит, что ее нет, но это требует для обнаружения наблюдения большего числа носителей мутации. Данное исследование указывает на целесообразность тестирования больных раком желудка, особенно женщин, на предмет обнаружения мутации BRCA1/2. Это потенциально может открыть новую опцию лекарственного лечения рака желудка с мутацией BRCA1/2 – PARP ингибиторы.
Литература:
Li S, Silvestri V, Leslie G, et al. Cancer
risks associated with BRCA1 and
BRCA2 pathogenic variants J. Clin.
Oncol. Published online: January 25,
2022.
МНОГО ПОЛЬЗЫ ИЗ НИЧЕГО… И – НИЧЕГО…
Авторы: Жуков Николай Владимирович
ФГБУ «НМИЦ Детской гематологии,
онкологии и иммунологии им. Д. Рогачева», Москва
Жукова Людмила Григорьевна
«Московский клинический научный центр
им. А.С. Логинова ДЗМ», Москва
Признаемся, мы достаточно активно отслеживаем новостную
ленту онкологических событий,
и порталы Medscape, AscoPost,
MedPage, ClinicalCareOptions,
Rosoncoweb и т.д. каждый день
подбрасывают нам 10-15-20 сообщений, содержащих несколько десятков новостей, касающихся нашей специальности.
Иногда они действительно содержат результаты знаковых
исследований или очень интересные комментарии экспертов,
однако в значительной части содержат информацию, которую
можно охарактеризовать как
«много шума из ничего». Но периодически приходят сообщения, которые можно было бы
охарактеризовать диаметрально
противоположно – как «много
пользы из ничего», когда какаято простая, легко воспроизводимая и безвредная методика
оказывается вдруг крайне эффективной. Ну, или, как минимум,
делает явную «заявку на успех».
Например, метод отслеживания
симптомов заболевания и признаков токсичности в реальном
времени, показавший прибавку
в общей выживаемости, сопоставимую с самыми эффективными
лекарствами.
Но вот что интересно: когда
польза (или потенциальная польза) проистекает действительно из очень простого, дешевого
метода, а не от дорогостоящего
препарата, она всегда проходит
незамеченной в нашем новостном пространстве. А если она не
замечена в нем, то неизвестна и
не принята сообществом на вооружение. Получается, что вроде
бы есть простой метод, который
только возьми и адаптируй, и будет «счастье», т.е. много пользы
реально из ничего – а в ответ «ничего», никакой реакции. Новость,
о которой мы хотим рассказать,
относится как раз к такой категории. Честно, мы трижды проверили нашу новостную ленту в надежде, что кто-то уже посвятил
ей хотя бы несколько слов. Увы.
А новость стоит того. Вообще
никаких усилий – и, возможно,
выигрыш, сопоставимый с внедрением одного или двух современных препаратов. При этом,
как нам кажется, прислушаться
к этим данным должны не только практикующие онкологи (для
которых реализация вряд ли будет представлять большую проблему), но и представители одной
из отечественных фармацевтических компаний, выведшей на рынок свой эффективный препарат
из класса ингибиторов контрольных точек иммунитета (ИКТИ).
Возможно, простая модификация идущих и планируемых протоколов, обговаривающая время
начала и окончания инфузии
препарата, позволит им добиться
(без всяких дополнительных затрат) более высоких результатов
его использования.
Итак, 12 ноября в Lancet Oncology
(между прочим) была опубликована статья, посвященная лечению 299 больных с метастатической меланомой, показавшая
значимое влияние на общую выживаемость (барабанная дробь!)
времени дня (утреннее или дневное против вечернего), когда проводилась инфузия ИКТИ [1].
В исследование включались пациенты, которые получили 4 или
более инфузий ИКТИ (ипилимумаб, ниволумаб, пембролизумаб
или комбинацию) между 2012 и
2020 годами. В результате при
медиане наблюдения 27 месяцев
было показано, что каждые дополнительные 20% инфузируемого объема ИКТИ, полученные
после 16:30 часов дня, приводили
к 31% увеличению относительного риска смерти (HR 1,31; 95%
ДИ 1,00-1,71; p=0,046). Проведение мультивариантного анализа,
как и анализа с подбором пары
(по возрасту, общему состоянию,
уровню ЛДГ, использованию кортикостероидов и необходимости
лучевой терапии на головной
мозг), подтвердили, что инфузия в вечерние часы является
независимым неблагоприятным
прогностическим фактором. В
анализе с подбором пары медиана выживаемости составила 4,8
года для больных, получивших
«вечернюю» инфузию ИКТИ (более 20% после 16:30), и не была
достигнута в группе, у которой
более 80% дозы было введено до
16:30 (р=0,038). Дополнительной
весомости полученным данным
придают кривые выживаемости
на всю группу (В) и в анализе с
подбором пары (А). Очевидно,
что подобным кривым могут позавидовать многие исследования
лекарственных препаратов, в том
числе и ИКТИ при некоторых
других заболеваниях.
Несмотря на то, что на первый
взгляд полученные результаты
могут вызвать улыбку (кто-то
скажет, что можно было бы еще
посмотреть, а не зависел ли эффект от дня недели, фазы луны
или 13 числа месяца), подобный
анализ, как и магическое время
4:30 после полудня, имеют теоретическое обоснование. Так, например, выбор 16:30 в качестве
водораздела основывается на ранее проведенных исследованиях
в области вакцин, показавших,
что эффективность иммунного
ответа была выше при введении
вакцины до этого времени. Есть и
теоретические данные о том, что
наша иммунная система подвержена значимым циркадным (временным) колебаниям, влияющим
на ее активность.
Безусловно, идеальным было бы
проведение рандомизированного исследования (которое авторы
планируют), т.к. можно предположить, например, что более
позднюю инфузию все же получали пациенты с худшим состоянием, допустим, которым требовался больший объем обследований
перед ее проведением или которые
позже «доходили» до клиники, где
проводится инфузия. Или что
наблюдаемые различия попросту обусловлены «игрой случая».
Но необходимые действия столь
просты – нужно лишь переместить всех больных, получающих
инфузию ИКТИ, на первую или
раннюю вторую половину дня, а
потенциальный выигрыш столь
велик (стоит еще раз взглянуть
на графики), что нам кажется, это
можно адаптировать и до проведения рандомизированных исследований. Во всяком случае, очень
хочется надеяться, что результаты
этого исследования не постигнет
судьба исследований по «хронотерапии» колоректального рака, которые так и не дошли до практики
[2,3]. И чтобы этого не случилось,
в МКНЦ им. Логинова в ближайшее время все инфузии ИКТИ будут смещены на первую половину
дня. В худшем случае – мы потом
посмеемся над собой, но в лучшем
– будем пожинать плоды простого
действия с большими позитивными последствиями.
Источники:
1. Qian DC, Kleber T, Brammer B, et al. Effect of immunotherapy time-ofday infusion on overall survival among patients with advanced melanoma in the USA (MEMOIR): A propensity scorematched analysis of a single-centre, longitudinal study. Lancet Oncol. 2021; 22: 1777-1786.
2. Lévi F, Zidani R, Misset JL. Randomised multicentre trial of chronotherapy with oxaliplatin, fluorouracil, and folinic acid in metastatic colorectal cancer. International Organization for Cancer Chronotherapy. Lancet. 1997 Sep 6; 350(9079): 681-6. doi: 10.1016/s0140- 6736(97)03358-8. PMID: 9291901.
3. Giacchetti S, Bjarnason G, Garufi C, Genet D, Iacobelli S, Tampellini M, Smaaland R, Focan C, Coudert B, Humblet Y, Canon JL, Adenis A, Lo Re G, Carvalho C, Schueller J, Anciaux N, Lentz MA, Baron B, Gorlia T, Lévi F; European Organisation for Research and Treatment of Cancer Chronotherapy Group. Phase III trial comparing 4-day chronomodulated therapy versus 2-day conventional delivery of fluorouracil, leucovorin, and oxaliplatin as first-line chemotherapy of metastatic colorectal cancer: the European Organisation for Research and Treatment of Cancer Chronotherapy Group. J Clin Oncol. 2006 Aug 1; 24(22): 3562-9. doi: 10.1200/JCO.2006.06.1440. PMID: 16877722.
ПОДМЕЧЕНО ЧЕЛОВЕКОМ: БУДЕМ ЖИТЬ!
Нина Митин (Nina Mitin), 15 лет, живет в Портленде, штат Орегон, США. Нина родилась в Бостоне, когда ее папа учился в медицинской школе. В детстве начала заниматься рисунком в студии русского педагога. Кроме русского и английского языков, она изучает французский, японский и корейский. Мечтает стать врачом.
Любимая русская фраза,
которую теперь знают её
американские друзья —
"Don't bend the stick!" —
«Не перегибай палку!»





АКЦЕНТ НА ИММУНОТЕРАПИЮ: КАК ЭТО ИЗМЕНИТ ПРАКТИКУ
Автор: Наталия Сергеевна Бесова
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина»
Минздрава России, Москва
Основная часть докладов на ежегодной конференции ASCO GI
2022, прошедшей в Сан-Франциско
20-22 февраля 2022 г., была посвящена изучению роли и места
иммунотерапии в лечении злокачественных опухолей желудочнокишечного тракта.
Результаты многочисленные рандомизированных клинических исследований, проведенных в разных
странах и с различными ингибиторами контрольных точек (пембролизумаб, ниволумаб, синтилимаб,
тислелизумаб), доказали превосходящую эффективность комбинации блокаторов рецепторов PD-1 с
химиотерапией (ХТ) по сравнению
с одной только химиотерапией в
первой линии лечения больных распространенным раком желудка и
пищевода. Одна из сессий была посвящена уточнению показаний к назначению данной комбинации. Профессором F. Lordiсk представлены
подгрупповые анализы эффективности иммунотерапии в комбинации с химиотерапией при различных уровнях экспрессии PD-L1 при
аденокарциноме желудка и пищевода и плоскоклеточном раке пищевода (исследования KEYNOTE-590,
CheckMate-648, CheckMate-649,
KEYNOTE-062), результаты которых ранее не были доложены. Согласно представленным данным,
улучшение общей выживаемости
от комбинации ингибиторов контрольных точек с ХТ по сравнению
с одной только ХТ в первой линии
лечения достигается при плоскоклеточном раке пищевода при уровне
экспрессии PD-L1 CPS ≥10 для пембролизумаба + ХТ и TPS ≥1% для ниволумаба с ХТ, при аденокарциноме
желудка и пищеводно-желудочного
перехода при уровне экспрессии
PD-L1 CPS ≥5. Назначение ингибиторов контрольных точек в первой
линии лекарственной терапии рака
желудка и пищевода при более низком уровне экспрессии PD-L1 нецелесообразно.
Во второй линии лечения при диссеминированной аденокарциноме
желудка перспективным направлением является комбинация ингибиторов контрольных точек с
ингибиторами неоангиогенеза и
химиотерапией. Если по результатам I/II фазы назначение паклитаксела с ниволумабом во 2-й линии
лечения 48 пациентам позволило
добиться медианы выживаемости
без прогрессирования (МВБП) в 3,9
мес., медианы общей выживаемости
(МОВ) в 11,2 мес., то добавление к
этой комбинации рамуцирумаба
увеличило МВБП 43 больных до 5,1
мес. и МОВ – до 13,1 мес
При HER2-позитивной аденокарциноме желудка, согласно данным
исследования KEYNOTE 811, комбинация пембролизумаба с трастузумабом и ХТ по сравнению со
стандартной комбинацией трастузумаба с ХТ в первой линии лечения увеличила объективный ответ
с 51,9% до 74,4% (p=0,00008), частоту полных регрессий – с 3% до 11%,
медиану длительности эффекта – с
9,5 мес. до 10,6 мес.
При раке анального канала с высоким риском рецидива проводится
изучение комбинации химиолучевой терапии с иммуноонкологическими препаратами. В исследовании CORINTH химиолучевая
терапия с фторпиримидинами и
митомицином С включает также 8
введений пембролизумаба, и оценивается переносимость лечения.
В исследовании EA2165 после химиолучевой терапии применяют
ниволумаб, главная цель – оценка
выживаемости без прогрессирования. При метастатическом раке
анального канала проводится рандомизированное исследование
EA2176, включающее первичных
пациентов, которым после рандомизации проводят ХТ паклитакселом и карбоплатином или аналогичную ХТ + ниволумаб, главная
цель исследования – сравнение
выживаемости без прогрессирования. В рамках II фазы изучается
химиолучевая терапия ± дурвалумаб при местнораспространенном
процессе, эффективность mDCF
± атезолимумаб при распространенном анальном раке, ниволумаб
± ипилимумаб при рефрактерном
анальном раке.
При HER2-позитивном раке желудка, согласно результатам исследования DESTINY-Gastric-01, в
3 и последующих линиях лечения
трастузумаб дерукстекан в дозе 6,4
мг/м2 каждые 3 недели по сравнению со стандартной ХТ 2-й линии
паклитакселом или иринотеканом
увеличивал объективный ответ с
14,3% до 51,3% (p<0,001), продолжительность ответа – с 3,9 до 12,5 мес.
и МОВ – с 8,9 мес. до 12,5 мес. При
HER2-позитивном диссеминированном колоректальном раке с гиперэкспрессией HER2/neu в опухоли
ИГХ3+ или ИГХ2+/FISH+ (исследование DESTINY-CRC01) применение трастузумаба дерукстекана во
2-й и последующих линиях обеспечило достижение объективного эффекта у 45,3% больных при МВБП
6,9 мес. и МОВ 15,5 мес. У пациентов с меньшим уровнем экспрессии
HER2 в опухоли результаты лечения
были намного скромнее.
Французское клиническое исследование II фазы NEONIPIGA было посвящено изучению эффективности
неоадъювантной двойной иммунной блокады ниволумабом + ипилимумабом с послеоперационной адъювантной терапией ниволумабом
при локализованном MSI-H/dMMR
аденокарциноме желудка или пищеводно-желудочного перехода.
Полный патоморфоз по Mandard
(TR G1) был достигнут у 58,6% из 29
больных.
При диссеминированном раке поджелудочной железы комбинация
синтилимаба (ингибитор PD-1) с
режимом mFOLFIRINOX в первой
линии лечения по сравнению с одной ХТ в режиме mFOLFIRINOX
привела к значимому увеличению
частоты объективного ответа с
23,9% до 50% (p<0,05), что, однако,
не привело к увеличению выживаемости без прогрессирования или
общей выживаемости.
При гепатоцеллюлярном раке в настоящее время имеется широкий
выбор режимов лекарственной терапии как первой, так и второй линии.
Одним из стандартов 1-й линии является комбинация атезолизумаба с
бевацизумабом. На ASCO GI были
представлены результаты рандомизированного исследования III фазы
HYMALAYA по сравнительному изучению эффективности и токсичности сорафениба, дурвалумаба и комбинации STRIDE (тремелимумаб
300 мг в день 1 + дурвалумаб 1500 мг
каждые 4 недели) в первой линии лечения больных распространенным
гепатоцеллюлярным раком, не подлежащих локорегионарной терапии.
Главная цель – сравнение общей
выживаемости (ОВ) при STRIDE и
сорафенибе, второй ключевой параметр – сравнение ОВ при лечении дурвалумабом и сорафенибом.
Согласно полученным результатам,
МОВ при лечении STRIDE составила 16,4 мес., при лечении сорафенибом – 13,8 мес. (p=0,0035; HR=0,78),
общая выживаемость при лечении
дурвалумабом (16,6 мес.) была не
меньше, чем при лечении сорафенибом. Таким образом, комбинация
STRIDE является претендентом на
стандарт первой линии лечения при
гепатоцеллюлярном раке.
Однако лекарственная терапия достигла своего плато, дальнейшие
перспективы в повышении эффективности лечения связывают с
исследованиями по изучению эффективности комбинации трансартериальной химиоэмболизации
(ТАХЭ) с иммуноонкологическими
препаратами как в монорежиме, так
и в комбинациях с антиангиогенными препаратами или мультикиназными ингибиторами протеинкиназ.
Согласно результатам исследования LAUNCH, комбинация ТАХЭ
с ленватинибом при диссеминированном гепатоцеллюлярном раке по
сравнению с одним ленватинибом
позволила увеличить как частоту
объективного эффекта, так и беспрогрессивную и общую выживаемость.
При билиарном раке в исследовании
TOPAZ-1 сравнивали эффективность ХТ первой линии гемцитабином с цисплатином с эффективностью этого же режима в комбинации
с дурвалумабом (анти-PD-L1). Главная цель исследования достигнута
уже при промежуточном анализе:
получено значимое увеличение
общей выживаемости при комбинации дурвалумаба с ХТ по сравнению с одной только ХТ: МОВ
12,8 мес. против 11,5 мес. (p=0,021),
МВБП также была выше при лечении дурвалумабом с ХТ – 7,2 мес.
против 5,1 мес. (p=0,001).
При диссеминированном колоректальном раке представлены результаты небольшого исследования I/II
фазы по изучению эффективности
энкорафениба, цетуксимаба и ниволумаба у больных с MSS и наличием
BRAF V600E мутации в опухоли. Результаты совпадают с результатами
исследования BEACON: объективный эффект составил 50%, МВБП –
7,4 мес., МОВ – 15,1 мес.
При диссеминированном колоректальном раке с олигометастазами
обсуждались вопросы места и времени локальных методов лечения,
подчеркивалась необходимость их
применения с целью увеличения
общей выживаемости больных. Обсуждалась проблема интенсификации химиотерапии, определения ее
места в комплексном подходе к лечению операбельного рака прямой
кишки, индивидуализации подхода
в зависимости от наличия факторов
риска рецидива заболевания.
Представлены интересные результаты исследования при местнораспространенном плоскоклеточном
раке пищевода. В рандомизированном исследовании JCOG 1109 NExT
проведено сравнение эффективности предоперационной химиолучевой терапии (2 курса цисплатин
100 мг/м2 в день 1 + 5-ФУ по 1000
мг/м2 в виде 24-часовой инфузии в
1-5 дни каждых 3 недель + лучевая
терапия в суммарной дозе 41,4 Гр) и
предоперационной ХТ в режиме CF
(цисплатин 80 мг/м2 в день 1 + 5-ФУ
по 800 мг/м2 в виде 24-часовой инфузии в 1-5 дни каждых 3 недель, 2
курса) и DCF (доцетаксел 70 мг/м2 в
день 1 + цисплатин 70 мг/м2 в день 1
+ 5-ФУ по 750 мг/м2 в виде 24-часовой инфузии в 1-5 дни каждых 3 недель, 3 курса) при плоскоклеточном
раке пищевода клинических стадий
IB, II, III (но не T4) согласно 7 редакции классификации UICC-TNM.
Минимальный период наблюдения
составил 36 мес. Главный параметр
сравнения – общая выживаемость.
Медиана общей выживаемости при
NeoCF составила 5,6 лет, при химиолучевой терапии – 7,6 лет, при
NeoDCF – не достигнута, 3-годичная общая выживаемость составила соответственно 62,6%, 68,3%
и 72,1%. Общая выживаемость
была значимо выше при неоадъювантной терапии в режиме DCF по
сравнению с CF (стратифицированный log-rank: односторонний
p=0,006; HR=0,68), при NeoCF и
химиолучевой терапии – не различалась (стратифицированный
log-rank: односторонний p=0,12;
HR=0,84). Согласно выводам авторов, неоадъювантная химиотерапия в режиме DCF, но не химиолучевая терапия, увеличивает общую
выживаемость пациентов.
10 ЛЕТ НАЦИОНАЛЬНОЙ ПРОГРАММЕ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ
