
Бархатная революция в лечении рака эндометрия, которая не должна остаться незамеченной в нашей стране
Рак эндометрия (РЭ) – самое распространенное заболевание в онкогинекологии, которое позволяет себя обнаружить на ранних стадиях в связи с быстрыми появлениями симптомов болезни...

15-17 апреля. Москва
Конференция RUSSCO Опухоли ЖКТ

22-23 апреля. Москва
Большая конференция RUSSCO Меланома и другие опухоли кожи
Ингибирование WEE1 при серозном раке эндометрия – новый подход к лекарственной терапии в будущем?
Серозный рак эндометрия представляет собой отдельный гистологический подтип опухолей тела матки, молекулярные характеристики которого предполагают частую дисрегуляцию клеточного цикла в сочетании с высоким уровнем стресса репликации, вызванного онкогенами. Данный тип опухоли встречается менее чем у 10% больных раком тела матки и имеет агрессивное течение. WEE1 является ключевым регулятором контрольных точек клеточного цикла G2 / M- и S-фаз. Поскольку клетки с нарушенной регуляцией клеточного цикла и высоким репликационным стрессом могут быть чувствительны к ингибированию WEE1, представляется целесообразным избирательное блокирование этой киназы...

Хирургическое лечение эпителиального рака яичников: стагнация или движение вперед?
Выживаемость при эпителиальном раке яичников (ЭРЯ) улучшается по мере уменьшения объема опухоли в результате оперативного вмешательства, особенно у женщин, у которых была достигнута полная хирургическая циторедукция...
10 Лет успеха эрибулина: от морской губки до прогностических маркеров эффективности
28 января в рамках Большой конференции RUSSCO по раку молочной железы (РМЖ) состоялся сателлитный симпозиум компании Эйсай.
Изменение стандартов лечения метастатического рака пищевода: регистрация пембролизумаба в комбинации с химиотерапией
22 марта 2021 года Управление по контролю над качеством пищевых продуктов и лекарственных средств США (FDA) одобрило пембролизумаб в сочетании с химиотерапией на основе препаратов платины и фторпиримидинов для лечения пациентов с метастатическим или местнораспространенным раком пищевода или гастроэзофагеального перехода (опухоли выше желудочно-пищеводного перехода на 1-5 сантиметров)...
Трифлуридин/типирацил у пациентов с метастатическим раком пищеводно-желудочного перехода: подгрупповой анализ исследования 3 фазы.
Выживаемость пациентов с распространенным раком пищеводно -желудочного перехода (РПЖП) остается низкой; при этом существует недостаток данных по РПЖП из исследований, оценивающих различные препараты в лечении рака желудка (РЖ) в целом. Трифлуридин/типирацил был одобрен в США и ЕС для терапии пациентов с метастатическим РПЖП и РЖ, ранее получавших лечение, по результатам исследования 3 фазы TAGS. В настоящее время были опубликованы результаты подгруппового анализа этого исследования в зависимости от локализации первичного очага (РПЖП или РЖ)...
Лучевая терапия рака предстательной железы с адъювантной андрогендепривационной терапией(адт) улучшает время без прогрессирования болезни по сравнению с неоадъювантной адт
По-прежнему нет ясности в отношении влияния последовательности АДТ и лучевой терапии на исходы рака простаты. Авторы крупного метаанализа, опубликованного в Журнале клинической онкологии (ASCO), оценили эффективность неоадъювантной и адъювантной АДТ на фоне лучевой терапии. Для поиска использовались базы данных MEDLINE (1966-2018)...

Комментарии эксперта по статье "лучевая терапия рака предстательной железы..."
В клинической онкологии встречаются ситуации, когда два негативных исследования в совокупности приводят к позитивному результату: минус на минус = плюс...
Комбинация ниволумаба и кабозантиниба становится новой опцией терапии метастатического рака почки
22 января 2021 года Управление по контролю над качеством пищевых продуктов и лекарственных средств США (FDA) одобрило комбинацию ингибитора PD-1 ниволумаба и таргетного препарата кабозантиниба в качестве терапии первой линии у пациентов с распространенным почечно-клеточным раком (ПКР). Ранее результаты рандомизированного исследования 3 фазы CheckMate 9ER, в котором оценивали эффективность ниволумаба в комбинации с кабозантинибом в первой линии метастатического светлоклеточного ПКР, были представлены на конгрессе ESMO 2020. 651 пациент был стратифицирован по шкале риска IMDC, экспрессии PD-L1 и региону и рандомизирован в соотношении 1:1...

Комментарии эксперта по статье "комбинация ниволумаба и кабозантиниба становится новой опцией..."
Комбинация ниволумаба и кабозантиниба оказалась эффективной, что позволяет ее рассматривать в качестве терапии первой линии метастатического светлоклеточного ПКР. Безусловно, у нас нет еще отдаленных результатов наблюдения...
Журнал «злокачественные опухоли» включен в перечень рецензируемых научных изданий по специальности «онкология»
Уважаемые коллеги! С удовольствием сообщаем, что решением ВАК от 09.12.2020 г. журнал «Злокачественные опухоли» включен в перечень рецензируемых научных изданий по специальности «Онкология». С 2010 г. журнал является официальным печатным изданием Российского общества клинической онкологии (RUSSCO) и входит в перечень журналов, рецензируемых ВАК, по двум специальностям – «Онкология» и «Хирургия». Членами редакционной коллегии журнала являются ведущие отечественные и зарубежные эксперты в области молекулярной биологии, лекарственного лечения, лучевой терапии и хирургического лечения злокачественных новообразований. ..
Управление лечением при использовании комбинации леватиниб+эверолимус у пациентов с метастатическим почечноклеточным раком в условиях глобальной эпидемии COVID-19
д.м.н., проф. Борис Яковлевич Алексеев, заместитель генерального директора по научной работе ФГБУ «Национальный медицинский исследовательский радиологический центр» Минздрава России, ученый секретарь Российского общества онкоурологов (Москва); чл.-корр. РАН, д.м.н., проф. Всеволод Борисович Матвеев, зам. директора по научной и ФГБУ «НМИЦ радиологии» Минздрава России (Москва)...

Итоги конференции russco «рак легкого и опухоли средостения»
Подводя итоги состоявшейся 12-13 марта онлайн-конференции Рос - сийского общества клинической онкологии (RUSSCO) «Рак легкого и опухоли средостения»...

Новая редакция NCCN по НМРЛ
Последние изменения в новой ре - дакции The NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines) for Non-Small Cell Lung Cancer (NSCLC) Version 4.2021 в раз - деле молекулярно-генетической ди - агностики можно назвать в какой-то степени революционными...

Анонс
-

15-17 апреля 2021
Конференция RUSSCO «Опухоли ЖКТ»
-

23-24 апреля 2021
Конференция RUSSCО «Меланома и другие опухоли кожи»
-

20-21 мая 2021
VII Российская конференция «Поддерживающая терапия в онкологии»
-

9-11 ноября 2021
XXV (юбилейный) Российский онкологический конгресс
Бархатная революция в лечении рака эндометрия, которая не должна остаться незамеченной в нашей стране
Автор: Тюляндина Александра Сергеевна
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
Рак эндометрия (РЭ) – самое распространенное заболевание в онкогинекологии, которое позволяет
себя обнаружить на ранних стадиях в связи с быстрыми появлениями симптомов болезни, поэтому
на передовой лечения РЭ оказываются хирурги онкогинекологи. У
большинства пациенток, у которых
болезнь выявляется на ранних стадиях, сохраняется высокий шанс
быть излеченными. Для достижения этой задачи необходимым
фактором является совместная командная работа хирурга, морфолога, лучевого терапевта и химиотерапевта. Правильное стадирование
заболевания, выявление факторов
риска прогрессирования определяют в последующем необходимость
адъювантного лечения в том или
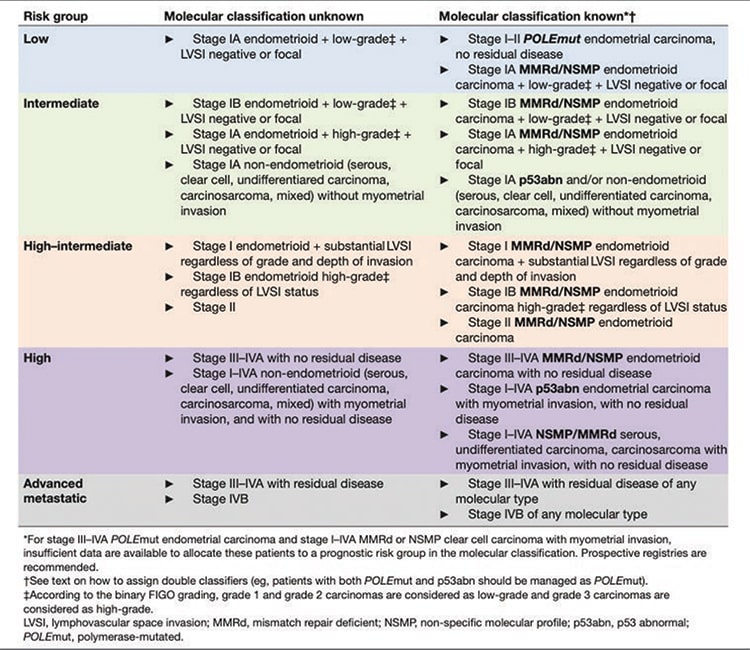
ином объеме, которое является залогом успешного лечения. В настоящий момент мы используем морфологическую классификацию,
которая определяет группу риска, в
которую входит пациентка, исходя
из гистологического подтипа опухоли, степени злокачественности,
наличия эмболов в лимфатических
сосудах и инвазии в миометрий
(см. табл. 1). Для больных ранними
стадиями и благоприятным прогнозом достаточно адекватного
хирургического лечения. Тогда как
для неблагоприятного прогноза,
наоборот, необходимо назначение
адъювантной ХТ и/или ЛТ. Трудности заключаются при выборе
адъювантного лечения у пациенток с промежуточным риском,
где проводится ЛТ, чаще всего это
брахитерапия при адекватном хирургическом вмешательстве.
Таблица 1. Классификации прогностических групп, используемые в лечении рака эндометрия.
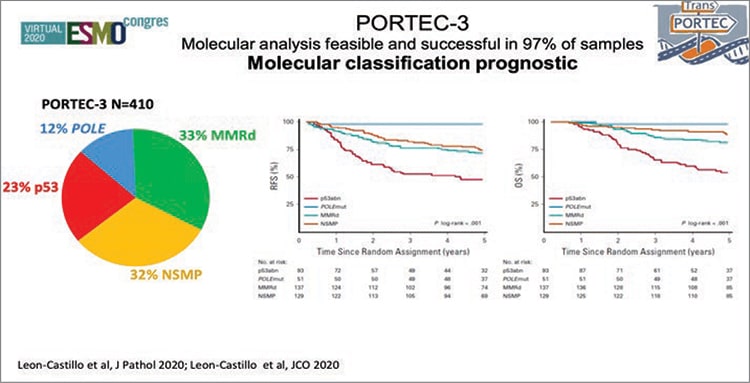
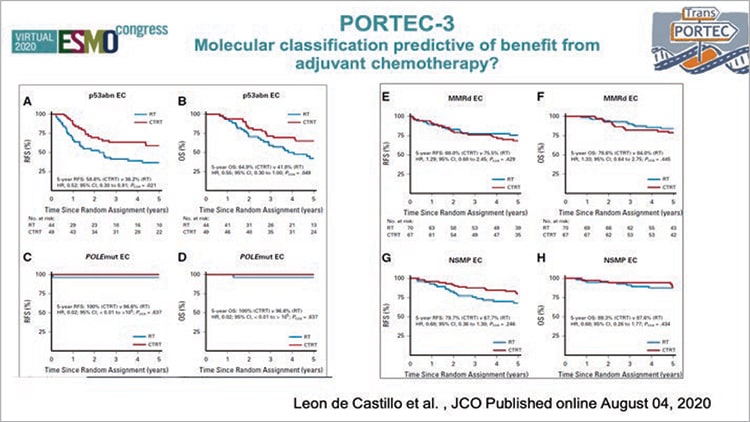
Выделение группы высокого-промежуточного прогноза всегда ставило перед специалистами вопросы о необходимости активного системного воздействия. В мировой литературе опубликовано несколько рандомизированных работ с целью определения наиболее адекватного объема адъювантного лечения. Самым крупным и обсуждаемым было исследование PORTEC-3. Это исследование оценивало эффективность адъювантной совместной химиотерапии и лучевой терапии против только лучевой терапии у пациенток высоким риском рака эндометрия. Напомню, что анализ 2019 года продемонстрировал увеличение как медианы времени без прогрессирования (ВБП), так и медианы продолжительности жизни (ПЖ) для больных РЭ с высоким риском, к которому относится стадия I и высокая степень злокачественности с глубокой инвазией миометрия и/ или лимфоваскулярной инвазией; II и III стадии; I-III стадии у больных с серозной или светлоклеточной аденокарциномой [1]. Авторы отметили, что с наибольшей эффективностью такой комбинированный подход имеет преимущество у больных III стадией РЭ и у пациенток с серозным подтипом. В связи с этим в рекомендациях, в том числе в нашей стране, назначение адъювантного системного лечения начинается при III стадии рака эндометрия и при агрессивных гистологических подтипах, начиная с I стадии [2]. В 2020 году авторы PORTEC-3 не остановились, а продолжили изучать эффективность адъювантной терапии в зависимости от молекулярных характеристик опухоли [3]. Оценив 423 образца опухолевой ткани пациенток, принимавших участие в исследовании, был проведен анализ частоты встречаемости мутаций POLE, нарушений в системе репарации неспаренных оснований (MMRd), нарушений белка p53 или отсутствии вышеуказанных изменений (NSMP). Данный анализ позволил определить 4 основных молекулярных подтипа РЭ: мутация POLE встречалась в 12% (N=51) случаев, MMRd – у трети больных – 33% (N=137), нарушения белка р53 – в 23% (N=93) и NSMP – у 32% (N=129) соответственно (рис. 1).
Рисунок 1. Молекулярная прогностическая классификация у больных раком эндометрия.
Каждая из 4 подгрупп отличалась разными цифрами выживаемости. Наиболее благоприятное течение вне зависимости от типа адъювантного лечения и факторов прогноза отмечалось у больных с мутацией POLЕ (98%), практически ни у одной больной не было выявлено прогрессирование (5-летняя БРВ – 98%). Тогда как при наличии мутации p53 отмечались худшие показатели выживаемости (5-летняя БРВ – 48%). Назначение адъювантной ХТ не улучшало результаты лечения у пациенток с мутацией POLE (5-летняя БРВ 100% в группе комбинированного лечения и 98% в группе ЛТ). Для больных с нарушениями р53 отмечалось значимое снижение возникновения рецидивов при назначении системного адъювантного лечения (5-летняя БРВ для комбинированного лечения – 59%, для ЛТ – 36%; р=0,019). Для MMRd и NSMP различия не были получены. Эти тренды выживаемости были оценены в нескольких ретроспективных анализах опухолевых образцов больных РЭ, позволившие заявить о новой прогностической роли не гистологической классификации опухоли и патоморфологических факторов риска, а молекулярногенетической классификации, где наиболее благоприятным прогнозом обладают опухоли с мутацией POLE, самым неблагоприятным – новообразования с повреждением р53, а все остальные подтипы попадают в группу умеренного риска (рис. 2)
Рисунок 2. Предиктивная роль молекулярной классификации при раке эндометрия
в зависимости от вида адъювантного лечения.
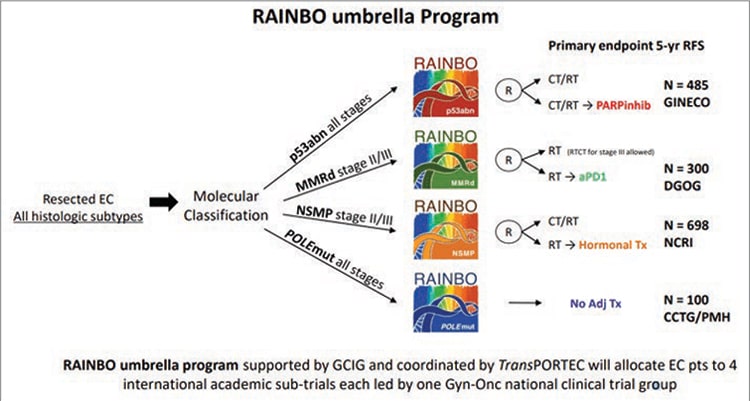
На основании этих данных клиницисты поставили вопрос о необходимости проведения проспективных исследований по оценке адъювантной терапии РЭ в зависимости от молекулярно-генетического подтипа. В настоящий момент идут два крупных проспективных исследования. Одно из них называется PORTEC-4A, где включаются больные только с I стадией РЭ, которые в зависимости от молекулярных факторов прогноза рандомизируются либо в группу наблюдения, при промежуточном риске назначается только брахитерапия, при высоком риске – дистанционная ЛТ (ERBT). Вторым исследованием является зонтичное исследование RAINBO, где пациенты в зависимости от стадии, молекулярного подтипа набираются в 4 когорты, где происходит рандомизация в зависимости от вида терапии: адъювантная ЛТ, ЛТ+ХТ или наблюдение, а также добавляются препараты направленного действия (см. рис. 3).
Рисунок3. Дизайн исследования RAINBO.
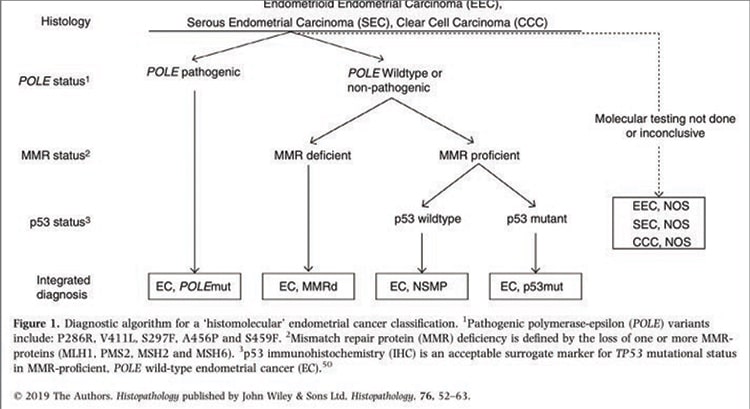
Результаты этих исследований будут ожидаться с нетерпением научным сообществом. Несмотря на отсутствие проспективных данных, европейское онкогинекологическое общество ESGO совместно с ESTRO публикуют новые рекомендации по лечению рака эндометрия в январе 2021 года [5]. Уже сегодня эксперты предлагают перейти на молекулярно-генетическую классификацию для определения показаний к адъювантной терапии. Для этого предложена схема из трех последовательных тестов, которую необходимо выполнять всем больным РЭ с эндометриоидной, серозной и светлоклеточной аденокарциномами: определение мутации POLE методом ПЦР, в случае ее отсутствия – выявление микросателлитной нестабильности (ИГХ). В случае MSS в опухоли – тест на р53 (методом ПЦР или ИГХ) (рис. 4).
Рисунок 4. Алгоритм тестирования
для определения молекулярного подтипа РЭ.
Исходя из этого в
таблице 1 представлено сравнение
патоморфологической и молекулярно-генетической классификаций.
Особенностью новой классификации является то, что при наличии
мутации POLE пациентки РЭ относятся к хорошему прогнозу и требуют только наблюдения. Тогда как в
настоящий момент многие пациенты с I-II стадией и факторами риска
получают адъювантное лечение, то
есть существует вероятность «перелечивания» таких больных. И наоборот, наличие нарушений p53, даже
при первой стадии, требует назначения адъювантной ХТ и ЛТ как при
III-IVA стадии РЭ. То есть по старой
классификации это благоприятный
и промежуточный группы риска для
эндометриоидной аденокарциномы,
требующие наблюдения или только
ЛТ. Два других молекулярных подтипа (MSI-H и NSMP) пока относятся к промежуточному и промежуточному-высокому риску, и тактика
адъювантного лечения в настоящий
момент не меняется.
На мой взгляд, это большой шаг
вперед в лечении и классификации
РЭ, если не назвать очередной революцией. Но в то же самое время
этот шаг требует от нас новых усилий и ставит трудные задачи перед
специалистами, поскольку не везде
в нашей стране доступны анализ
и правильная интерпретация ИГХ
исследований для выявления MSI
и нарушений р53. Определение мутации POLE пока недоступно в нашей стране. С другой стороны, уже
сейчас понятно, что определение
микросателлитной нестабильности
всем больным РЭ является необходимым знанием для выбора лечения при возникновении рецидивов
заболевания, поскольку влияет на
выбор терапии с использованием
чекпойнт-ингибиторов и ингибиторов тирозинкиназы. Следовательно,
определение этого маркера после
первичного хирургического лечения
будет также являться важным подспорьем в будущем.
Часть экспертов будет говорить о
слишком раннем внедрении такого
подхода с использованием молекулярной классификации к определению тактики адъювантного лечения,
поскольку отсутствуют данные проспективных рандомизированных
исследований. С другой стороны,
примеры других онкологических
патологий, таких как рак легкого,
меланома, колоректальный рак, показывают нам, что молекулярногенетические характеристики опухоли имеют большее значение, чем
гистологический подтип опухоли в
определении прогноза и тактики лечения. Поэтому переход и внедрение
молекулярной классификации РЭ —
это дело времени.
Исходя из этого в таблице 1 представлено сравнение патоморфологической и молекулярно-генетической классификаций. Особенностью новой классификации является то, что при наличии мутации POLE пациентки РЭ относятся к хорошему прогнозу и требуют только наблюдения. Тогда как в настоящий момент многие пациенты с I-II стадией и факторами риска получают адъювантное лечение, то есть существует вероятность «перелечивания» таких больных. И наоборот, наличие нарушений p53, даже при первой стадии, требует назначения адъювантной ХТ и ЛТ как при III-IVA стадии РЭ. То есть по старой классификации это благоприятный и промежуточный группы риска для эндометриоидной аденокарциномы, требующие наблюдения или только ЛТ. Два других молекулярных подтипа (MSI-H и NSMP) пока относятся к промежуточному и промежуточному-высокому риску, и тактика адъювантного лечения в настоящий момент не меняется. На мой взгляд, это большой шаг вперед в лечении и классификации РЭ, если не назвать очередной революцией. Но в то же самое время этот шаг требует от нас новых усилий и ставит трудные задачи перед специалистами, поскольку не везде в нашей стране доступны анализ и правильная интерпретация ИГХ исследований для выявления MSI и нарушений р53. Определение мутации POLE пока недоступно в нашей стране. С другой стороны, уже сейчас понятно, что определение микросателлитной нестабильности всем больным РЭ является необходимым знанием для выбора лечения при возникновении рецидивов заболевания, поскольку влияет на выбор терапии с использованием чекпойнт-ингибиторов и ингибиторов тирозинкиназы. Следовательно, определение этого маркера после первичного хирургического лечения будет также являться важным подспорьем в будущем. Часть экспертов будет говорить о слишком раннем внедрении такого подхода с использованием молекулярной классификации к определению тактики адъювантного лечения, поскольку отсутствуют данные проспективных рандомизированных исследований. С другой стороны, примеры других онкологических патологий, таких как рак легкого, меланома, колоректальный рак, показывают нам, что молекулярногенетические характеристики опухоли имеют большее значение, чем гистологический подтип опухоли в определении прогноза и тактики лечения. Поэтому переход и внедрение молекулярной классификации РЭ — это дело времени.
Список литературы:
1. de Boer SM, Powell ME, Mileshkin L, et al. Adjuvant chemoradiotherapy versus radiotherapy alone in women with high-risk endometrial cancer (PORTEC-3): Patterns of recurrence and post-hoc survival analysis of a randomised phase 3 trial. Lancet Oncol. 2019; 20:1273-1285.
2. Нечушкина В.М., Коломиец Л.А., Кравец О.А., Морхов К.Ю., Новикова Е.Г., Новикова О.В. и соавт. Практические рекомендации по лекарственному лечению рака тела матки и сарком матки. Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2020 (том 10), 14.
3. León-Castillo A, de Boer SM, Powell ME, et al. Molecular classification of the PORTEC-3 trial for highrisk endometrial cancer: impact on prognosis and benefit from adjuvant therapy. J Clin Oncol. 2020; 38: 3388- 97.
4. León Castillo A, Gilvazquez E,
Nout R, et al. Clinicopathological and
molecular characterisation of «multiple
classifier» endometrial carcinomas. J
Pathol. 2020; 250: 312-22.
5. Concin N, Matias-Guiu X, Vergote
I, et al. ESGO/ESTRO/ESP guidelines
for the management of patients with
endometrial carcinoma Int J Gynecol
Cancer. 2021 Jan; 31(1): 12-39.
15-17 апреля. Москва

22-23 апреля. Москва

Ингибирование WEE1 при серозном раке эндометрия – новый подход к лекарственной терапии в будущем?
Серозный рак эндометрия представляет собой отдельный гистологический подтип опухолей тела матки, молекулярные характеристики которого предполагают частую дисрегуляцию клеточного цикла в сочетании с высоким уровнем стресса репликации, вызванного онкогенами. Данный тип опухоли встречается менее чем у 10% больных раком тела матки и имеет агрессивное течение. WEE1 является ключевым регулятором контрольных точек клеточного цикла G2 / M- и S-фаз. Поскольку клетки с нарушенной регуляцией клеточного цикла и высоким репликационным стрессом могут быть чувствительны к ингибированию WEE1, представляется целесообразным избирательное блокирование этой киназы. Адавосертиб является мощным и селективным ингибитором киназы WEE1, продемонстрировавшим эффективность в доклинических и ранних клинических исследованиях. В одноцентровое исследование 2 фазы с двустадийным дизайном были включены 34 пациентки с распространенным серозным раком эндометрия (карциносаркомы были критерием исключения). Пациентки должны были получить не менее одной линии платиносодержащей химиотерапии в анамнезе. Адавосертиб назначался в дозе 300 мг, перорально, с 1 по 5 и с 8 по 12 дни каждого 21-дневного цикла. Лечение проводилось до прогрессирования болезни. Первичными конечными точками были частота объективных ответов и 6-месячная выживаемость без прогрессирования. 10 больных ответили на лечение адавосертибом. Полный ответ на терапию был зафиксирован в одном случае. Таким образом, частота объективных ответов составила 29,4%. Медиана продолжительности ответа была 9 месяцев. 6-месячная выживаемость без прогрессирования составила 47,1%, а медиана – 6,1 мес. Что касается токсичности, то наиболее частыми нежелательными явлениями, связанными с лечением, были диарея (76,5%), утомляемость (64,7%), тошнота (61,8%) и гематологические события. При анализе биомаркеров не было обнаружено четкой корреляции клинической активности со специфическими молекулярными изменениями. Авторы делают вывод, что монотерапия адавосертибом продемонстрировала обнадеживающие результаты эффективности у женщин с серозной карциномой матки. Дальнейшее изучение препарата будет продолжено в исследовании 3 фазы.
Источник:
Joyce F. Liu, et al. J Clin Oncol. 2021 Mar 11. JCO2003167.
doi: 10.1200/JCO.20.03167.
Хирургическое лечение эпителиального рака яичников: стагнация или движение вперед?
По материалам статьи Дэвида Фелпса (Imperial College Healthcare NHS Trust, Лондон),
подготовлено редакцией Газеты RUSSCO.
Введение
Выживаемость при эпителиальном раке яичников (ЭРЯ) улучшается по мере уменьшения объема опухоли в результате оперативного вмешательства, особенно у женщин, у которых была достигнута полная хирургическая циторедукция. Тем не менее радикальность вмешательства сама по себе не решает проблему улучшения выживаемости и может приводить к увеличению частоты осложнений. Например, теперь стало ясно, что радикальная лимфаденэктомия при оперативном лечении рака яичников (РЯ) не обязательна, если отсутствуют пальпируемые лимфатические узлы [1]. Результаты последних исследований неизбежно приведут нас к поиску лучших способов достижения полной хирургической циторедукции, снижения частоты осложнений во время и после операции, определения пораженных лимфатических узлов и выбора более индивидуализированных методов оперативного лечения. Новые технологии получили широкое распространение в других областях хирургии, например, нейронавигационные системы в нейрохирургии, робот-ассистированные операции в онкоурологии, капсульная эндоскопия в гастроэнтерологии, однако при лечении ЭРЯ новые технологии пока еще не внедрены в рутинную практику и находятся на этапе изучения. В наш век технологий и искусственного интеллекта появляется множество возможных хирургических методик для лечения ЭРЯ. В обзоре д-ра Дэвида Фелпса и соавторов [2] обсуждаются имеющиеся и новые быстроразвивающиеся технологии, которые могут увеличить частоту полной хирургической циторедукции, улучшить интраоперационную диагностику и достичь хирургических преимуществ в сравнении с текущими методами.
Технологии массспектрометрии (МС)
Интраоперационная диагностика злокачественного потенциала опухолевидного образования яичников на ранней стадии затруднена, но более очевидна при метастатическом заболевании. У более молодых женщин с ранними стадиями заболевания важно поставить точный диагноз перед принятием решения об удалении репродуктивных органов. Развиваются новые интраоперационные технологии диагностики опухолей, основанные на системах МС. Системы на основе МС используют липидомику тканей как «отпечатки пальцев» для определения гистологического диагноза за несколько секунд. При МС с десорбционно-электроспрейной ионизацией (ДЭСИ-МС) распыляют растворитель на ткани и анализируют вторичные ионы, которые отталкиваются от тканей [3]. Данная технология обладает отличной диагностической точностью для ЭРЯ ex vivo с прогностической точностью 99,6% на поэлементной основе (pixel-by-pixel). MassSpec Pen использует ДЭСИ-МС и позволяет достигать впечатляющей диагностической точности в условиях лаборатории (диагностической точность 94,7%, площадь под кривой 0,98 [нормальный яичник в сравнении с ЭРЯ]) [4]. МС с быстрой испарительной ионизацией (REIMS) использует электрохирургическую диатермию, такую как интеллектуальный хирургический скальпель (iKnife), для получения при рассечении богатых липидами тканевых аэрозолей [5]. iKnife использовался для диагностики ЭРЯ ex vivo и in vivo с впечатляющей точностью (чувствительность 97,4%, специфичность 100% [нормальный яичник в сравнении с ЭРЯ]) [5]. Дополнительная валидация приведет к отличной диагностической точности при ЭРЯ (100%). Кроме того, существует возможность дифференциальной диагностики пограничных опухолей яичников и ЭРЯ (чувствительность 90,5%, специфичность 89,7%) [5], что имеет важное значение для женщин, которые желают сохранить фертильность. Технологии на основе лазеров, использование которых позволяет получать образцы тканей толщиной всего несколько микрон, находятся в разработке и могут проложить путь к новой эпохе в хирургии с достижением полной микроскопической циторедукции. Одним из основных преимуществ данных технологий является их способность выявлять опухолевые ткани на микроскопическом уровне [3-5]. Широко принято, что удаление макроскопической опухоли предвещает улучшение выживаемости. Возможно, удаление микроскопической опухоли станет следующей сменой концепции в циторедуктивной хирургии. В настоящее время неясно, какие системы будут приняты для практического использования, так как пока ни одно из устройств не присутствует на рынке и не было зарегистрировано для применения кроме как в рамках проведения исследований.
Роботизированные системы
Роботизированные системы улучшают эргономику операции, обеспечивая манипулирование инструментами за пределами естественныхограничений объема движений запястья хирурга. После появления первого робота в 1985 году на рынке наблюдается рост интереса к этой проблеме, но робот-ассистированная хирургия при ЭРЯ пока не получила широкого распространения. В одном метаанализе, сравнивающем лапаротомию и робот-ассистированную лапароскопическую операцию при оперативном лечении ЭРЯ, значимых различий в исходах выявлено не было [6]. Хотя восемь исследований включали стадии I-IV по FIGO (Международная федерация акушеров и гинекологов), только четыре исследования включали какие-либо данные по выживаемости. Исследование не смогло показать онкологическую безопасность и частоту рецидивов в зависимости от стадии заболевания или гистологического типа опухоли. При этом наблюдалось снижение кровопотери, длительности послеоперационной госпитализации и частоты осложнений, но эти преимущества были достоверны только при сравнении робот-ассоциированной хирургии с лапаротомией – преимуществ при сравнении роботизированной хирургии с лапароскопическими вмешательствами не наблюдалось. Другое исследование сравнивало эффективность робот-ассистированного лапароскопического вмешательства и традиционной лапароскопической хирургии при ЭРЯ стадии I и показало значительно меньшую частоту перехода к открытой операции (7,2% в сравнении с 17,9%, P<0,001; отношение шансов [ОШ] с коррекцией: 0,49, 95% доверительный интервал [ДИ]: 0,33- 0,73) [7]. После многофакторной коррекции исследование не смогло показать каких-либо значимых различий выживаемости при сравнении роботизированной хирургии с традиционным лапароскопическим вмешательством. Робот-ассистированное вмешательство может быть полезно в условиях неоадъювантной терапии. Роботизированная хирургия позволяла достичь оптимальной частоты циторедукции 100% (остаточная опухоль ≤1 см) с отсутствием остаточных явлений болезни в 82,5% случаев (n=57). Послеоперационное восстановление было быстрым (84% пациенток были выписаны домой в течение двух дней после операции), и отмечалось улучшение общей выживаемости (ОВ) и выживаемости без прогрессирования (ВБП) (робот-ассистированная хирургия в сравнении с лапаротомией; ОВ: 37,8 мес. в сравнении с 47,2 мес., P=0,04 / ВБП: 13,9 мес. в сравнении с 20,6 мес., P=0,005). Авторы пришли к заключению, что применение робот-ассистированной интервальной циторедукции возможно у тщательно отобранных пациенток [8]. Тем не менее, ограничения данного исследования включали небольшое количество пациенток, ретроспективный сбор данных и нерандомизированный дизайн. Роль роботизированной хирургии различается при различных стадиях ЭРЯ, а также при первичном и неоадъювантном лечении. Прежде чем сделать однозначные выводы о потенциальных преимуществах роботизированных методов в оперативном лечении ЭРЯ, необходимо провести крупные проспективные рандомизированные контролируемые исследования в отобранных когортах пациенток.
Флуоресцентные визуализационные системы
Индоцианин зеленый применялся для надежного определения лимфатического дренажа при ранних стадиях рака яичников, включая выявление сигнального лимфатического узла. В одном исследовании сигнальные лимфатические узлы были выявлены при 88,9% первичных оперативных вмешательств по поводу ЭРЯ, и у четырех пациенток с поражением лимфатических узлов в 100% были выявлены сигнальные узлы [9]. Исследование лимфаденэктомии у пациенток с распространенными новообразованиями яичников (Lymphadenectomy In Ovarian Neoplasms, LION) показало отсутствие преимуществ в отношении выживаемости при систематической лимфаденэктомии макроскопически нормальных лимфатических узлов у женщин, у которых была достигнута полная хирургическая циторедукция [1]. Преимущество для выживаемости наблюдалось только при удалении узлов с признаками поражения. Это уменьшает вероятность достижения пользы в отношении выживаемости за счет иссечения пораженных лимфатических узлов у пациенток с невыраженным поражением в связи с невозможностью определения таких узлов. Биопсия сигнальных узлов была бы логичным следующим этапом для оценки прогностического эффекта удаления пораженных лимфоузлов. Возможно прицельное иссечение сигнального узла и выполнение селективной лимфаденэктомии маркированных лимфоузлов для снижения частоты осложнений [10]. При оперативном лечении ЭРЯ относительно успешно использовались другие интраоперационные методики флуоресцентной визуализации. Рецепторы фолиевой кислоты альфа, экспрессируемые 90-95% ЭРЯ, можно успешно выявлять интраоперационно с использованием излучения ближнего инфракрасного диапазона [11]. Одно исследование показало удаление дополнительных 29% злокачественных очагов при использовании флуоресцентной визуализации [11]. Кроме того, наномолекулярный зонд, соединенный с бактериофагом, который связывается с белком SPARC, позволяет выполнять удаление опухолевой ткани при интраоперационной визуализации [12]. Это ассоциировалось с улучшением выживаемости в моделях у мышей (контроль в сравнении с удалением при визуализации, выживаемость 18 дней в сравнении с 40,5 дня; P=0,039, отношение рисков: 0,26, 95% ДИ: 0,07-0,93). Оперативное лечение после проведения химиотерапии при наличии в опухоли кальцификации и фиброза затрудняет определение границ опухоли. Это важное действие, которое должно быть выполнено во время операции, целью которой всегда является достижение полной хирургической циторедукции. Точное определение границ поражения приобретает особое значение после публикации результатов исследования DESKTOP III, в котором показано улучшение ОВ и ВБП у женщин при достижении полной хирургической циторедукции в условиях рецидива после химиотерапии [13]. Возможности флуоресцентных визуализационных систем пока не изучались при рецидивах опухолей – это является интересным направлением для новых исследований.
Технология PlasmaJet™
PlasmaJet использует кинетическую энергию и точно контролируемые термические эффекты для испарения микрослоев ткани [14]. Высокоэнергетическая струя аргонной плазмы рассекает ткани без воздействия на ткани электрическим током, ограничивая распространение тепла и повреждение окружающих тканей [14,15]. Контролируемая глубина рассечения оптимально применяется на поверхности кишечника, брюшины и диафрагмы. В обзорах использования PlasmaJet при ЭРЯ не сообщается о вреде или дополнительных осложнениях при достижении полной хирургической циторедукции у 79,0-84,3% пациенток [15,16]. При использовании PlasmaJet на висцеральной брюшине кишечника и его брыжейки образования свищей не наблюдалось. Авторы пришли к выводу, что устройство может эффективно использоваться для диссекции брюшины и лечения опухолей диафрагмальной локализации (резекция или абляция), а также для диссекции висцеральной брюшины кишечника и его брыжейки. Карциноматоз брыжейки кишечника, брюшины и диафрагмы относятся к наиболее распространенным участкам, не поддающимся хирургическому лечению, поэтому можно предположить, что PlasmaJet будет приводить к повышению частоты полной хирургической циторедукции. Однако для проведения оперативных вмешательств в данных областях требуется хирургический опыт, и только появление нового устройства само по себе не обязательно приведет к изменению частоты достижения полной циторедукции. Для достижения значимых результатов потребуется обучение врачей и изменение философии хирургии. В 2013 г. было одобрено проведение рандомизированного контролируемого исследования для оценки полезности и эффективности PlasmaJet в достижении полной циторедукции, но набор пациентов был завершен в 2017 г., и результаты до сих пор не опубликованы [17]. Тем не менее, опубликованные на настоящий момент данные других исследований позволяют предположить, что PlasmaJet безопасен, и имеет смысл изучить его применение в контролируемых должным образом исследованиях для оценки возможностей при оперативном лечении ЭРЯ.
Заключение
В настоящее время много новых интересных технологий изучается в хирургическом лечении ЭРЯ. Данные методы еще не распространены в хирургической практике в онкогинекологии, что может быть частично связано с уровнем доказательства, коммерческой доступностью, а частично – с нежеланием применять новые технологии. Для практикующих онкогинекологов важно следить за быстро развивающимися технологиями на современном этапе развития хирургии, чтобы иметьвозможность предложить пациенткам наилучшие варианты. Также онкогинекологи могут участвовать и сотрудничать в многоцентровых клинических исследованиях для скорейшего достижения новых целей. Очевидно, что хирургия в современном мире быстро меняется, и мы должны принимать этот развивающийся мир и те преимущества, которые он может нам дать.
Источники:
1. Harter P, et al. A randomized trial of lymphadenectomy in patients with advanced ovarian neoplasms. N. Engl. J. Med. 2019; 380: 822-32.
2. Phelps DL, Saso S, Ghaem-Maghami S. Is ovarian cancer surgery stuck in the dark ages?: a commentary piece reviewing surgical technologies. Br J Cancer. 2020 Nov; 123(10): 1471-1473.
3. Doria M, et al. Epithelial ovarian carcinoma diagnosis by desorption electrospray ionization mass spectrometry imaging. Sci. Rep. 2016; 6: 39219.
4. Zhang J, et al. Nondestructive tissue analysis for ex vivo and in vivo cancer diagnosis using a handheld mass spectrometry system. Sci. Transl. Med. 2017; 9: eaan3968.
5. Phelps DL, et al. The surgical intelligent knife distinguishes normal, borderline and malignant gynaecological tissues using rapid evaporative ionisation mass spectrometry (REIMS). Br. J. Cancer. 2018; 118: 1349-58.
6. Shi C, et al. Comparison of efficacy of robotic surgery, laparoscopy, and laparotomy in the treatment of ovarian cancer: a meta-analysis. World J. Surg. Oncol. 2019; 17: 162.
7. Facer B, et al. Survival outcomes for robotic-assisted laparoscopy versus traditional laparoscopy in clinical stage I epithelial ovarian cancer. Am. J. Obstet. Gynecol. 2020; 222: 474.e1-474.e12.
8. Abitbol J, et al. Incorporating robotic surgery into the management of ovarian cancer after neoadjuvant chemotherapy. Int. J. Gynecol. Cancer. 2019; 29: 1341- 1347.
9. Uccella S, et al. Sentinel-node biopsy in early-stage ovarian cancer: preliminary results of a prospective multicentre study (SELLY). Am. J. Obstet. Gynecol. 2019; 221: 324.e1-e10.
10.Kimmig R, et al. Early ovarian cancer surgery with indocyaninegreen-guided targeted compartmental lymphadenectomy (TCL, pelvic part). J. Gynecol. Oncol. 2017; 28: e68.
11.Hoogstins CE, et al. A novel tumorspecific agent for intraoperative nearinfrared fluorescence imaging: a translational study in healthy volunteers and patients with ovarian cancer. Clin. Cancer Res. 2016; 22: 2929-2938.
12.Ceppi L, et al. Real-time single-walled carbon nanotube-based fluorescence imaging improves survival after debulking surgery in an ovarian cancer model. ACS Nano. 2019; 13: 5356-65.
13.Du Bois A, et al. Randomized phase III study to evaluate the impact of secondary cytoreductive surgery in recurrent ovarian cancer: final analysis of AGO DESKTOP III/ENGOT-ov20. J. Clin. Oncol. 2020; 38(Suppl.): 6000.
14.Plasma Surgical. PlasmaJet Online. www.plasmasurgical.com/plasmajet-2/ (2020).
15.Nieuwenhuyzen-de Boer GM, et al. Evaluation of effectiveness of the PlasmaJet surgical device in the treatment of advanced stage ovarian cancer (PlaComOv-study): study protocol of a randomized controlled trial in the Netherlands. BMC Cancer. 2019; 19: 58.
16.Prodromidou A, et al. The emerging role of neutral argon plasma (PlasmaJet) in the treatment of advanced stage ovarian cancer: a systematic review. Surg. Innov. 2020.
17.ISRCTN registry. A pilot randomised controlled trial to evaluate the utility and efficacy of neutral argon plasma (PlasmaJet®) as a new technology in achieving complete debulking of advanced Epithelial Ovarian Cancer Online. www. isrctn.com/ISRCTN26261491 (2019).
10 Лет успеха эрибулина: от морской губки до прогностических маркеров эффективности
Статья предоставлена компанией Eisai.
Публикуется в редакции авторов.
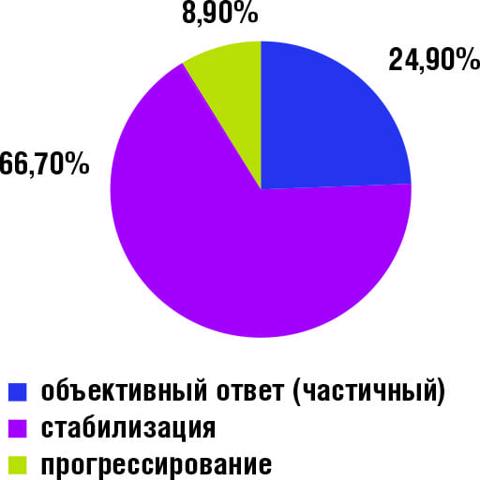
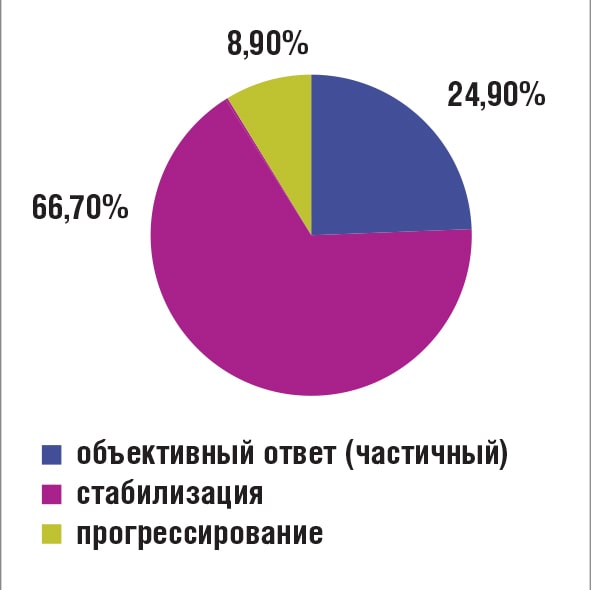
28 января в рамках Большой конференции RUSSCO по раку молочной железы (РМЖ) состоялся сателлитный симпозиум компании Эйсай. В симпозиуме приняли участие д.м.н., руководитель отделения химиотерапии МНИОИ им. П.А. Герцена - филиала ФГБУ «НМИЦ радиологии» МЗ РФ Лариса Владимировна Болотина; д.м.н., руководитель отдела межидисциплинарной онкологии НМИЦ ДГОИ им. Д. Рогачева МЗ РФ Николай Владимирович Жуков и д.м.н., проф. кафедры онкологии и паллиативной медицины ФГБОУ ДПО «РМАНПО» МЗ РФ Ирина Владимировна Колядина. Открыл мероприятие Н.В. Жуков. Он отметил, что эрибулин находится в широкой клинической практике уже 10 лет, а это большой срок. За такой период «совместной жизни», как и в человеческих взаимоотношениях многое становится рутиной, привычкой. Однако оживлять отношения лучше всего помогают «приятные сюрпризы» - неожиданные эффекты «сверх ожидаемого». Освещению этих 10 лет «совместной жизни» онкологов c препаратом эрибулин (Халавен) Н.В. Жуков и посвятил свою лекцию. От истоков до настоящих дней: 10 лет «совместной жизни» - уже давно рутина, но не без приятных сюрпризов Эти 10 лет, безусловно, прошли не просто так не только для эрибулина, в течение этого времени поменялось очень многое в онкологии в целом и в лечении рака молочной железы, в частности. На момент появления эрибулина использовался иной подход к химиотерапии, нежели сегодня. 10 лет назад онкологи были убеждены, что любой метастатический РМЖ нужно начинать лечить агрессивно с комбинированной терапии, и лишь когда ее эффективность будет исчерпана – переходить на паллиативную монотерапию. В итоге на ранних этапах заболевания, когда можно было бы «отделаться малой кровью» пациенты получали агрессивное высокотоксичное лечение, а затем, когда и опухоль уже резистентна и резервы исчерпаны, оказывалось, что ее вполне можно было бы контролировать гораздо менее токсичной моно-химотерапией. Поэтому потребовалось достаточно много усилий для того, чтобы просто передвинуть щадящий подход монотерапии (любой) в начало лечение и лишь потом понять потенциальные преимущества эрибулина как варианта этой монотерапии и определить его место в лечении метастатического РМЖ (мРМЖ). В то время, как цитостатики капецитабин, винорелбин, гемцитабин, иксабепелон, препараты платины не улучшали общую выживаемость, эрибулин в первом же исследовании продемонстрировал ее увеличение [1]. Итак, с течением времени из лечения метастатической болезни «уходила агрессия». Если в рекомендациях NCCN 2010 года комбинации присутствовали, то в рекомендациях 2021 г. комбинаций cреди предпочтительных вариантов лечения нет [2,3]. Закономерно, эрибулин перешел в более раннюю линию терапии мРМЖ. В многоцентровом анализе с участием 459 пациенток распространенным РМЖ эрибулин в реальной российской клинической практике продемонстрировал сходную с регистрационными исследованиями эффективность. Препарат хорошо переносился, а если токсичность и возникала, то являлась хорошо управляемой. Сегодня с уверенностью мы можем сказать, что эрибулин решает одновременно две задачи лечения мРМЖ: увеличивает продолжительность жизни пациентам, сохраняя ее качество. Это позволяет применять эрибулин в течение длительного срока: в анализе российского клинического опыта каждая пятая пациентка имела выживаемость без прогрессирования (ВБП) в два раза выше, в сопоставлении с медианой ВБП в общей популяции[4]. Длительные эффекты имели место независимо от того, в какой линии применялся эрибулин, т.е. это зависело не от линии лечения, а от особенностей биологии опухоли, хотя эффективность эрибулина при раннем назначении (2-3 линии) достоверно была выше в общей популяции данного анализа [4]. Докладчик привел и результаты зарубежных исследований эрибулина при мРМЖ в рутинной клинической практике, в которых были получены сопоставимые результаты [5]. В заключении своего доклада, Н.В. Жуков отметил, что эрибулин - правильный выбор для рутинной клинической практики у пациенток с HER2- мРМЖ. Время для лечения эрибулином наступает у всех больных мРМЖ, и история этого метода далеко не закончена. От исследований к клинической практике: первые результаты объединенного российского опыта использования эрибулина после CDK4/6 ингибиторов И.В. Колядина в начале своего выступления указала, что существенную роль в лечении пациенток с люминальным HER2- РМЖ играет гормонотерапия. Однако, в первый год комбинированной терапии с CDK4/6 ингибиторами рецидив болезни имеет каждая 5 пациентка вне зависимости от эндокринного партнера, используемого в схеме [6]. Выбор дальнейшего алгоритма лечения (продолжить эндокринотерапию или переключить на химиотерапию) у больных после прогрессирования на CDK4/6 ингибиторах является актуальной задачей. Эрибулин показал высокую эффективность у больных с HER2-отрицательным метастатическим РМЖ после прогрессирования на антрациклинах и таксанах. Далее И.В. Колядина представила данные российского многоцентрового анализа с участием 54 пациенток с CDK4/6-резистентным HR+HER2- мРМЖ в возрасте 29-79 лет, получавших химиотерапию эрибулином. Продолжительность ответа на комбинированную эндокринотерапию с CDK4/6 ингибиторами составила от 2 до 38 мес (среднее время продолжительности ответа – 9,07 мес). На фоне терапии эрибулином медиана ВБП составила 10 мес. У большинства пациенток (66,7%) отмечена длительная стабилизация заболевания (Рис. 1).
Рисунок 1. Оценка ответа
на терапию эрибулином
пациенток с CDK4/6-
резистентным HR+HER2-
мРМЖ.
При этом клинические факторы и факторы, ассоциируемые с лечением (возраст, различные CDK4/6 ингибиторы, различные линии применения CDK4/6 ингибиторов различные эндокринные партнеры) не влияли на эффективность терапии эрибулином, т.е. она была равноэффективна в различных группах и клинических ситуациях. В целом первый российский анализ использования эрибулина после прогрессирования с использованием CDK4/6 ингибиторов показал многообещающие результаты: эрибулин назначался в ранних линиях лечения (60% - во 2-й, 30% - в 3-й линии); лечение эрибулином имело благоприятный профиль безопасности – нежелательные явления отмечены у 34,5% больных, редукция дозы эрибулина на 1 уровень у 16,7%, на 2 уровня – у 1,9%, отмена терапии из-за токсичности – у 3,7% пациентов. В заключение И.В. Колядина поблагодарила всех российских онкологов, принимавших участие в выше представленном анализе данных. От общего к частному: прогностические маркеры эффективности Понимая, что сегодня эрибулин стал неотъемлемой лечебной опцией различных биологических типов мРМЖ, закономерно поставить вопрос о том, можно ли каким-то образом выделить группу пациентов, которые получат максимальную пользу от его назначения в отношении общей продолжительности жизни? Л.В. Болотина представила две работы, опубликованные в 2020 г. Авторы одной из них сформулировали гипотезу о способности эрибулина опосредованно влиять на иммунную регуляцию при мРМЖ, чем объясняется его большее влияние на ОВ в сравнении с ВБП. Было установлено, что при пороговом значении соотношение нейтрофилы/лимфоциты (СНЛ) 3 - низкий уровень ассоциируется с увеличением ОВ независимо от варианта лечения [7]. Эти данные позволяют предположить, что СНЛ может быть общим прогностическим маркером в отношении ОВ. Также авторы сделали вывод, что абсолютное число лейкоцитов (АЧЛ) может быть более специфичным маркером увеличения ОВ для терапии эрибулином, чем СНЛ (но не ТВВ). Не может не обратить на себя внимание простота исследования АЧЛ, что позволит отбирать пациентов на терапию эрибулином с большим ожидаемым преимуществом в отношении ОВ, подчеркнула докладчик. В другой работе с участием 144 женщин с HER2- мРМЖ (108 ER +, 36 ER-) в группе пациентов с ER+/ HER2- мРМЖ продемонстрировано, что сохранение уровня АЧЛ ≥ 1 тыс./микролитр к моменту начала применения эрибулина является надежным и универсальным, а также доступным маркером ОВ как при первичном использовании эрибулина, так и при его повторном назначении [8]. Наилучшие результаты наблюдались при длительном ответе на первичное назначение в сочетании повторным применением эрибулина. Обобщая представленные данные, Л.В. Болотина заключила, что эрибулин является высокоэффективной лечебной опцией при мРМЖ. АЧЛ является специфичным маркером увеличения ОВ при терапии эрибулином. Высокое АЧЛ ≥ 1 тыс./микролитр является значимым и независимым предиктором более длительной ОВ при терапии эрибулином (целесообразно рассмотреть более раннее применение эрибулина, чтобы избежать снижения АЧЛ на фоне предшествующих линий ХТ). При отсутствии эффекта на последующих после первичного применения эрибулина линиях терапии у больных с ER + HER2- мРМЖ, при сохранении АЧЛ ≥ 1 тыс./микролитр, следует рассмотреть возможность повторного использования эрибулина.
Литература:
1. Cortes J. et al. Eribulin monotherapy versus treatment of physician's choice in patients with metastatic breast cancer (EMBRACE): a phase 3 open-label randomised study //The Lancet. – 2011. – Т. 377. – №. 9769. – С. 914-923.
2. Invasive Breast Cancer. NCCN Practice Guidelines in Oncology – v.2 2010
3. Invasive Breast Cancer. NCCN Practice Guidelines in Oncology – v.1 2021
4. Горбунова В.А., Колядина И.В., Коваленко Е.И., Манзюк Л.В. с соавт. Эффективность и безопасность эрибулина при HER2- отрицательном метастатическом раке молочной железы: данные многолетнего опыта из реальной клинической практики в России. Современная онкология. 2019; 21 (1): 12–23.
5. Mougalian SS, et al. Poster presented at the Miami Beach Breast Cancer Conference March 7-8, 2019 Miami, Florida (Abstract ID 733)
6. Finn R.S. et al. N Engl J Med. 2016; 375: 1925-1936; Hortobagyl G.N. et al Ann Oncol. 2018; 29: 1541-1547; Goetz M.R. et al. J Clin Oncol. 2017; 35: 3638- 3648
7. Miyoshi Y. et al. High absolute lymphocyte counts are associated with longer overall survival in patients with metastatic breast cancer treated with eribulin - but not with treatment of physician’s choice - in the EMBRACE study //Breast Cancer. – 2020. – Т. 27. – №. 4. – С. 706-715.
8. Watanabe J. et al. A maintained
absolute lymphocyte count predicts
the overall survival benefit from
eribulin therapy, including eribulin
re-administration, in HER2-negative
advanced breast cancer patients: a singleinstitutional experience //Breast cancer
research and treatment. – 2020. – Т. 181.
– №. 1. – С. 211-220.
Статья предоставлена компанией Eisai. Публикуется в редакции авторов.
Изменение стандартов лечения метастатического рака пищевода: регистрация пембролизумаба в комбинации с химиотерапией
22 марта 2021 года Управление
по контролю над качеством
пищевых продуктов и лекарственных средств США (FDA)
одобрило пембролизумаб в
сочетании с химиотерапией
на основе препаратов платины и фторпиримидинов для
лечения пациентов с метастатическим или местнораспространенным раком пищевода
или гастроэзофагеального перехода (опухоли выше желудочно-пищеводного перехода
на 1-5 сантиметров), которые
не являются кандидатами на
хирургическое лечение или
химиолучевую терапию.
Эффективность оценивалась в многоцентровом
рандомизированном плацебоконтролируемом исследовании
KEYNOTE-590, в котором принимали участие 749 пациентов,
соответствующих указанным
выше критериям. Статус PD-L1
определялся централизованно в
образцах опухолей у всех пациентов с использованием иммуногистохимического набора 22C3
PharmDx. Пациенты были рандомизированы в соотношении 1:1 в
группу пембролизумаба в комбинации с цисплатином и 5-фторурацилом или в группу плацебо с
цисплатином и 5-фторурацилом.
Лечение проводилось до неприемлемой токсичности или прогрессирования заболевания.
Основными показателями эффективности были общая выживаемость (ОВ) и выживаемость
без прогрессирования (ВБП) на
основании анализа исследователей в соответствии с модифицированными критериями RECIST
1.1 (оценка не более 10 целевых
очагов и максимум 5 целевых
очагов в органе).
В исследовании было продемонстрировано статистически значимое улучшение ОВ и ВБП у
пациентов, рандомизированных
в группу пембролизумаба с химиотерапией. Так, медиана ОВ
составила 12,4 месяца (95% ДИ
10,5-14,0) в группе пембролизумаба по сравнению с 9,8 месяца
(95% ДИ 8,8-10,8) в контрольной
группе (HR=0,73; p<0,0001). Медиана ВБП составила 6,3 (95%
ДИ 6,2-6,9) и 5,8 месяца (95%
ДИ 5,0-6,0) соответственно
(HR=0,65; p<0,0001).
Наиболее частыми нежелательными явлениями, зарегистрированными у ≥20%
пациентов, получавших комбинацию пембролизумаба
и химиотерапии в исследовании KEYNOTE-590, были
тошнота, запоры, диарея, рвота, стоматит, утомляемость/
астения, снижение аппетита и
потеря веса.
Рекомендуемая доза пембролизумаба при раке пищевода
составляет 200 мг каждые 3
недели или 400 мг каждые 6
недель.
Узнать больше можно на конференции RUSSCO «Опухоли ЖКТ» 15-17 апреля 2021, в онлайн-формате.
Источник:
веб-сайт FDA.
Трифлуридин/типирацил у пациентов с метастатическим раком пищеводно-желудочного перехода: подгрупповой анализ исследования 3 фазы.
Выживаемость пациентов с распространенным раком пищеводно -желудочного перехода (РПЖП) остается низкой; при этом существует недостаток данных по РПЖП из исследований, оценивающих различные препараты в лечении рака желудка (РЖ) в целом. Трифлуридин/типирацил был одобрен в США и ЕС для терапии пациентов с метастатическим РПЖП и РЖ, ранее получавших лечение, по результатам исследования 3 фазы TAGS. В настоящее время были опубликованы результаты подгруппового анализа этого исследования в зависимости от локализации первичного очага (РПЖП или РЖ). Пациенты с метастатическим РЖ/ РПЖП, ранее получившие как минимум 2 линии системной терапии, рандомизировались в соотношении 2:1 в группу трифлуридина/типирацила или в группу плацебо в сочетании с наилучшей поддерживающей терапией. Был проведен запланированный субанализ для оценки эффективности и безопасности в зависимости от локализации первичной опухоли. Из 507 рандомизированных пациентов у 145 (29%) был РПЖП, а у 360 (71%) – РЖ. Базовые харакРис. Общая выживаемость в группе РПЖП (слева) ив группе РЖ (справа), месяцы теристики были схожими между подгруппами, за исключением большей доли пациентов, получивших ранее как минимум 3 линии терапии, в подгруппе РПЖП (72% против 59% в подгруппе РЖ). Выигрыш в выживаемости отмечен для обеих подгрупп. Отношение рисков (HR) трифлуридина/ типирацила против плацебо для общей выживаемости составило 0,75 (95% ДИ 0,50-1,11) у пациентов с РПЖП и 0,67 (95% ДИ 0,52-0,87) у пациентов с РЖ. Нежелательные явления степени тяжести 3 и выше наблюдались у 75 (77%) и 192 (81%) пациентов, получавших трифлуридин/типирацил в подгруппе РПЖП и РЖ, соответственно. Новых проблем с безопасностью выявлено не было. Авторы делают вывод, что как у пациентов с РЖ, так и у пациентов с РПЖП, трифлуридин/типирацил показал клиническую пользу и управляемый профиль безопасности в исследовании TAGS.
Рис. Общая выживаемость в группе РПЖП (слева) ив группе РЖ (справа), месяцы.
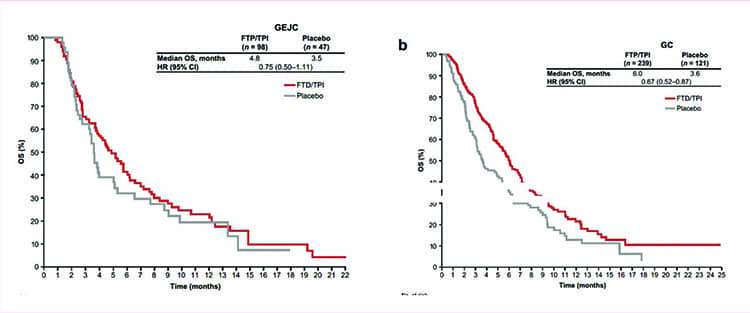
Источник:
Mansoor W, …
Van Cutsem E. Trifluridine/
tipiracil in patients with metastatic
gastroesophageal junction cancer: a
subgroup analysis from the phase 3
TAGS study. Gastric Cancer. 2021
Mar 13.
Узнать больше можно на конференции RUSSCO «Опухоли ЖКТ» 15-17 апреля 2021, в онлайн-формате
Лучевая терапия рака предстательной железы с адъювантной андрогендепривационной терапией(адт) улучшает время без прогрессирования болезни по сравнению с неоадъювантной адт
По-прежнему нет ясности в отношении влияния последовательности АДТ и лучевой терапии на исходы рака простаты. Авторы крупного метаанализа, опубликованного в Журнале клинической онкологии (ASCO), оценили эффективность неоадъювантной и адъювантной АДТ на фоне лучевой терапии. Для поиска использовались базы данных MEDLINE (1966-2018), Embase (1982-2018), ClinicalTrials.gov и материалы конференций (1990-2018), в которых были идентифицированы 2 рандомизированных исследования – Ottawa 0101 и NRG 9413 онкологической группы по лучевой терапии. В исследовании Ottawa 0101 пациенты рандомизировались в группы неоадъювантной/параллельной АДТ или адъювантной кратковременной АДТ после лучевой терапии. В исследовании 9413 с факториальным дизайном рандомизации 2×2 больные также распределялись в группы неоадъювантной/параллельной АДТ или адъювантной кратковременной АДТ. В настоящем метаанализе первичной конечной точкой была выживаемость без прогрессирования (ВБП). Медиана наблюдения составила 14,9 года. Всего было включено 1065 пациентов (531 в группу неоадъювантной терапии и 534 – в группу адъювантной терапии). ВБП была значительно лучше в группе адъювантного подхода (отношение рисков [HR] 1,25, P=0,01). Так, 15-летняя ВБП составила 29% и 36% соответственно. Частота биохимических рецидивов (HR=1,37; P=0,002), частота отдаленных метастазов (HR=1,40; P=0,04) и выживаемость без метастазов (HR=1,17; P=0,050) также были лучше в случае адъювантной терапии. Отличий в токсичности 3 степени и выше отмечено не было: например, частота нежелательных явлений со стороны органов ЖКТ составила 2% против 3% (P=0,33), а со стороны органов мочеполовой системы – 5% против 5% (P=0,76) в группе неоадъювантной и адъювантной терапии. Авторы сделали вывод, что последовательность лучевая терапия – адъювантная АДТ представляется более эффективной по сравнению с последовательностью неоадъювантная АДТ и лучевая терапия у больных локализованным раком предстательной железы без какого-либо увеличения долгосрочной токсичности.
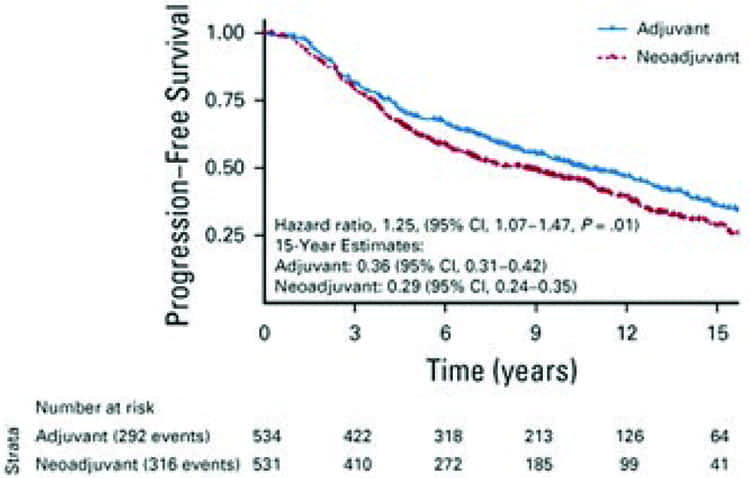
Источник:
Daniel E Spratt, et al. J Clin Oncol. 2021 Jan 10; 39(2): 136-144.
Ссылки:
1. Chang JY, Senan S, Paul MA, Mehran RJ, Louie AV, Balter P, Groen HJ, McRae SE, Widder J, Feng L, van den Borne BE, Munsell MF, Hurkmans C, Berry DA, van Werkhoven E, Kresl JJ, Dingemans AM, Dawood O, Haasbeek CJ, Carpenter LS, De Jaeger K, Komaki R, Slotman BJ, Smit EF, Roth JA. Stereotactic ablative radiotherapy versus lobectomy for operable stage I non-small-cell lung cancer: a pooled analysis of two randomised trials. Lancet Oncol. 2015 Jun; 16(6): 630-7. doi: 10.1016/S1470-2045(15)70168-3. Epub 2015 May 13.
2. Theelen WSME, Chen D, Verma V, Hobbs BP, Peulen HMU, Aerts JGJV, Bahce I, Niemeijer ALN, Chang JY, de Groot PM, Nguyen QN, Comeaux NI, Simon GR, Skoulidis F, Lin SH, He K, Patel R, Heymach J, Baas P, Welsh JW. Pembrolizumab with or without radiotherapy for metastatic non-smallcell lung cancer: a pooled analysis of two randomised trials. Lancet Respir Med. 2020 Oct 20: S2213-2600(20)30391-X. doi: 10.1016/S2213-2600(20)30391-X. Epub ahead of print. PMID: 33096027.
3. Malone S, Roy S, Eapen L, E C, MacRae R, Perry G, Bowen J, Samant R, Morgan S, Craig J, Malone K, Grimes S. Sequencing of Androgen-Deprivation Therapy With External-Beam Radiotherapy in Localized Prostate Cancer: A Phase III Randomized Controlled Trial. J Clin Oncol. 2020 Feb 20; 38(6): 593-601. doi: 10.1200/ JCO.19.01904. Epub 2019 Dec 12.
4. Roach M, Moughan J, Lawton CAF, Dicker AP, Zeitzer KL, Gore EM, Kwok Y, Seider MJ, Hsu IC, Hartford AC, Horwitz EM, Yamoah K, Jones CU, Michalski JM, Lee WR, Pisansky TM, Rabinovitch R, Rotman M, Pryzant RM, Kim HE, Thomas CR Jr, Shipley WU, Sandler HM. Sequence of hormonal therapy and radiotherapy field size in unfavourable, localised prostate cancer (NRG/RTOG 9413): long-term results of a randomised, phase 3 trial. Lancet Oncol. 2018 Nov; 19(11): 1504-1515. doi: 10.1016/S1470- 2045(18)30528-X.
5. Ментальные нарушения у больных раком простаты на фоне радикального лечения. проф. Daniel Spratt, University of Michigan, США (rosoncoweb.ru/events/2020/11/11/ video/).
6. Spratt DE, Malone S, Roy S, Grimes S, Eapen L, Morgan SC, Malone J, Craig J, Dess RT, Jackson WC, Hartman HE, Kishan AU, Mehra R, Kaffenberger S, Morgan TM, Reichert ZR, Alumkal JJ, Michalski J, Lee WR, Pisansky TM, Feng FY, Shipley W, Sandler HM, Schipper MJ, Roach M 3rd, Sun Y, Lawton CAF. Prostate Radiotherapy With Adjuvant Androgen Deprivation Therapy (ADT) Improves Metastasis-Free Survival Compared to Neoadjuvant ADT: An Individual Patient Meta-Analysis. J Clin Oncol. 2021 Jan 10; 39(2): 136-144. doi: 10.1200/JCO.20.02438. Epub 2020 Dec 4. PMID: 33275486.
7. Zietman AL, Nakfoor BM, Prince EA, Gerweck LE. The effect of androgen deprivation and radiation therapy on an androgen-sensitive murine tumor: an in vitro and in vivo study. Cancer J Sci Am. 1997 Jan-Feb; 3(1): 31-6. PMID: 9072305.
8. Granfors T, Damber JE, Bergh A, Landström M, Löfroth PO, Widmark A. Combined castration and fractionated radiotherapy in an experimental prostatic adenocarcinoma. Int J Radiat Oncol Biol Phys. 1997 Dec 1; 39(5): 1031-6. doi: 10.1016/s0360-3016(97)00559-2. PMID: 9392541.
9. Kaminski JM, Hanlon AL, Joon DL,
Meistrich M, Hachem P, Pollack A. Effect
of sequencing of androgen deprivation
and radiotherapy on prostate cancer
growth. Int J Radiat Oncol Biol Phys. 2003
Sep 1; 57(1): 24-8. doi: 10.1016/s0360-
3016(03)00539-x. PMID: 12909211.
Комментарии эксперта по статье "лучевая терапия рака предстательной железы..."
Автор: Тимур Митин
Университет Здоровья и Науки Орегона, Портленд, США
В клинической онкологии встречаются ситуации, когда два негативных исследования в совокупности
приводят к позитивному результату: минус на минус = плюс. В области лучевой терапии мы уже обсуждали прежде совокупный анализ [1]
двух независимых незаконченных
рандомизированных испытаний
3-й фазы – STARS и ROSEL, который был опубликован в журнале
Lancet Oncology в 2015 году и показал улучшенную 3-летнюю общую
выживаемость среди пациентов с
1-й стадией НМРЛ, рандомизированных на нехирургическое лечение
(3-летняя общая выживаемость 95%
у пациентов, рандомизированных
на стереотаксическую аблативную
ЛТ, против 79% у пациентов, рандомизированных на лобэктомию; HR
0,14; p=0,037). Несколько месяцев
назад мы обсуждали на этих страницах объединенный анализ [2]
двух негативных исследований по
добавлению ЛТ к пембролизумабу
у пациентов с мНМРЛ. В объединенном анализе была значительная
и достоверная разница в медиане
общей выживаемости (8,7 мес. против 19,2 мес.; HR 0,67; p=0,0004) при
добавлении ЛТ. И в том, и в другом
случае – совокупные анализы, если
в них верить, должны были бы глобально поменять клинический подход и тактику лечения: пациентов с
1-й стадией НМРЛ более не оперировать, а пациентов с 4-й стадией
НМРЛ отправлять сразу на ЛТ, как
только назначается пембролизумаб.
Для таких глобальных изменений
в клинической практике нужны
дополнительные проспективные
исследования, которые убедят и
радиотерапевтов, и хирургов, и медицинских онкологов. И главное,
конечно, самих пациентов, за которыми остается последнее слово и
выбор тактики лечения.
Что же касается последовательности
АДТ и ЛТ при лечении локализованного рака предстательной железы – тут все должно быть намного
проще. Рандомизированное исследование Ottawa 0101 было опубликовано в JCO в 2019 году [3]. 432 пациента с РПЖ получили 6 месяцев
ЛУЧЕВАЯ ТЕРАПИЯ РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ С АДЪЮВАНТНОЙ АНДРОГЕНДЕПРИВАЦИОННОЙ ТЕРАПИЕЙ (АДТ) УЛУЧШАЕТ ВРЕМЯ БЕЗ ПРОГРЕССИРОВАНИЯ
БОЛЕЗНИ ПО СРАВНЕНИЮ С НЕОАДЪЮВАНТНОЙ АДТ
По-прежнему нет ясности в отношении влияния последовательности
АДТ и лучевой терапии на исходы
рака простаты. Авторы крупного метаанализа, опубликованного в Журнале клинической онкологии (ASCO),
оценили эффективность неоадъювантной и адъювантной АДТ на фоне
лучевой терапии.
Для поиска использовались базы данных MEDLINE (1966-2018), Embase
(1982-2018), ClinicalTrials.gov и материалы конференций (1990-2018), в
которых были идентифицированы 2
рандомизированных исследования
– Ottawa 0101 и NRG 9413 онкологической группы по лучевой терапии.
В исследовании Ottawa 0101 пациенты рандомизировались в группы
неоадъювантной/параллельной АДТ
или адъювантной кратковременной
АДТ после лучевой терапии. В исследовании 9413 с факториальным дизайном рандомизации 2×2 больные
также распределялись в группы неоадъювантной/параллельной АДТ или
адъювантной кратковременной АДТ.
В настоящем метаанализе первичной
конечной точкой была выживаемость
без прогрессирования (ВБП).
Медиана наблюдения составила 14,9
года. Всего было включено 1065 пациентов (531 в группу неоадъювантной
терапии и 534 – в группу адъювантной терапии). ВБП была значительно
лучше в группе адъювантного подхода (отношение рисков [HR] 1,25,
P=0,01). Так, 15-летняя ВБП составила 29% и 36% соответственно.
Частота биохимических рецидивов
(HR=1,37; P=0,002), частота отдаленных метастазов (HR=1,40; P=0,04)
и выживаемость без метастазов
(HR=1,17; P=0,050) также были лучше
в случае адъювантной терапии.
Отличий в токсичности 3 степени и
выше отмечено не было: например,
частота нежелательных явлений со
стороны органов ЖКТ составила
2% против 3% (P=0,33), а со стороны
органов мочеполовой системы – 5%
против 5% (P=0,76) в группе неоадъювантной и адъювантной терапии.
Авторы сделали вывод, что последовательность лучевая терапия – адъювантная АДТ представляется более
эффективной по сравнению с последовательностью неоадъювантная
АДТ и лучевая терапия у больных локализованным раком предстательной
железы без какого-либо увеличения
долгосрочной токсичности.
Источник: Daniel E Spratt, et al. J Clin
Oncol. 2021 Jan 10; 39(2): 136-144.
Ссылки:
1. Chang JY, Senan S, Paul MA, Mehran
RJ, Louie AV, Balter P, Groen HJ, McRae
SE, Widder J, Feng L, van den Borne BE,
Munsell MF, Hurkmans C, Berry DA,
van Werkhoven E, Kresl JJ, Dingemans
AM, Dawood O, Haasbeek CJ, Carpenter
LS, De Jaeger K, Komaki R, Slotman BJ,
Smit EF, Roth JA. Stereotactic ablative
radiotherapy versus lobectomy for
operable stage I non-small-cell lung cancer:
a pooled analysis of two randomised trials.
Lancet Oncol. 2015 Jun; 16(6): 630-7. doi:
10.1016/S1470-2045(15)70168-3. Epub
2015 May 13.
2. Theelen WSME, Chen D, Verma V,
Hobbs BP, Peulen HMU, Aerts JGJV,
Bahce I, Niemeijer ALN, Chang JY,
de Groot PM, Nguyen QN, Comeaux
NI, Simon GR, Skoulidis F, Lin SH, He
K, Patel R, Heymach J, Baas P, Welsh
JW. Pembrolizumab with or without
radiotherapy for metastatic non-smallcell lung cancer: a pooled analysis of two
randomised trials. Lancet Respir Med.
2020 Oct 20: S2213-2600(20)30391-X.
doi: 10.1016/S2213-2600(20)30391-X.
Epub ahead of print. PMID: 33096027.
3. Malone S, Roy S, Eapen L, E C, MacRae
R, Perry G, Bowen J, Samant R, Morgan S,
Craig J, Malone K, Grimes S. Sequencing
of Androgen-Deprivation Therapy With
External-Beam Radiotherapy in Localized
Prostate Cancer: A Phase III Randomized
Controlled Trial. J Clin Oncol. 2020
Feb 20; 38(6): 593-601. doi: 10.1200/
JCO.19.01904. Epub 2019 Dec 12.
4. Roach M, Moughan J, Lawton CAF,
Dicker AP, Zeitzer KL, Gore EM, Kwok Y,
Seider MJ, Hsu IC, Hartford AC, Horwitz
EM, Yamoah K, Jones CU, Michalski
JM, Lee WR, Pisansky TM, Rabinovitch
R, Rotman M, Pryzant RM, Kim HE,
Thomas CR Jr, Shipley WU, Sandler
HM. Sequence of hormonal therapy and
radiotherapy field size in unfavourable,
localised prostate cancer (NRG/RTOG
9413): long-term results of a randomised,
phase 3 trial. Lancet Oncol. 2018 Nov;
19(11): 1504-1515. doi: 10.1016/S1470-
2045(18)30528-X.
5. Ментальные нарушения у больных раком простаты на фоне радикального лечения. проф. Daniel
Spratt, University of Michigan, США
(rosoncoweb.ru/events/2020/11/11/
video/).
6. Spratt DE, Malone S, Roy S, Grimes
S, Eapen L, Morgan SC, Malone J, Craig
J, Dess RT, Jackson WC, Hartman HE,
Kishan AU, Mehra R, Kaffenberger S,
Morgan TM, Reichert ZR, Alumkal JJ,
Michalski J, Lee WR, Pisansky TM, Feng
FY, Shipley W, Sandler HM, Schipper
MJ, Roach M 3rd, Sun Y, Lawton CAF.
Prostate Radiotherapy With Adjuvant
Androgen Deprivation Therapy (ADT)
Improves Metastasis-Free Survival
Compared to Neoadjuvant ADT: An
Individual Patient Meta-Analysis. J Clin
Oncol. 2021 Jan 10; 39(2): 136-144. doi:
10.1200/JCO.20.02438. Epub 2020 Dec 4.
PMID: 33275486.
7. Zietman AL, Nakfoor BM, Prince
EA, Gerweck LE. The effect of androgen
deprivation and radiation therapy on an
androgen-sensitive murine tumor: an in
vitro and in vivo study. Cancer J Sci Am.
1997 Jan-Feb; 3(1): 31-6. PMID: 9072305.
8. Granfors T, Damber JE, Bergh A,
Landström M, Löfroth PO, Widmark A.
Combined castration and fractionated
radiotherapy in an experimental prostatic
adenocarcinoma. Int J Radiat Oncol Biol
Phys. 1997 Dec 1; 39(5): 1031-6. doi:
10.1016/s0360-3016(97)00559-2. PMID:
9392541.
9. Kaminski JM, Hanlon AL, Joon DL,
Meistrich M, Hachem P, Pollack A. Effect
of sequencing of androgen deprivation
and radiotherapy on prostate cancer
growth. Int J Radiat Oncol Biol Phys. 2003
Sep 1; 57(1): 24-8. doi: 10.1016/s0360-
3016(03)00539-x. PMID: 12909211.
АДТ и были рандомизированы на
стандартную дистанционную лучевую терапию на предстательную
железу (76 Грей за 38 фракций) либо
с самого начала АДТ (сочетанноеадъювантное лечение), либо через
4 месяца после начала АДТ (неоадъювантное-сочетанное лечение).
10-летняя выживаемость без биохимического рецидива была выше у
пациентов, рандомизированных на
сочетанное-адъювантное лечение
(87,4% против 80,5%), но без статистической достоверности (p=0,10).
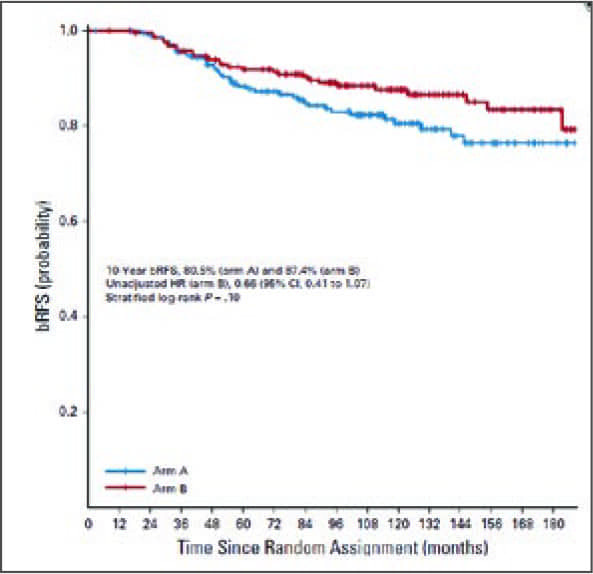
Очень схожую 7-процентную разницу в показателях 10-летней выживаемости без прогрессирования опубликовали авторы исследования RTOG
9413 в 2018 году в журнале Lancet
Oncology [4]. Если сравнивать 317 пациентов, получивших ЛТ (70,2 Грей за
39 фракций) на предстательную железу до начала 4-месячного курса АДТ,
и 316 пациентов, которые сначала
получили 2 месяца АДТ, а потом ЛТ
во время 3-го и 4-го месяца АДТ, то
10-летняя выживаемость без прогрессирования была 23,5% против 30,2% в
пользу адъювантной АДТ
Доктор Спратт, который выступал
на Конгрессе RUSSCO в ноябре
2020 года [5], и ведущие эксперты
по РПЖ в Северной Америке провели совокупный метаанализ [6]
этих двух крупных исследований и
установили, что 7-процентая разница между показателями 15-летней ВБП (29% против 36%) при
большем количестве пациентов
имеет статистическую достоверность (отношение рисков [HR] 1,25;
P=0,01).
В США в большинстве центров до
сего момента практиковалось неоадъювантное-сочетанное лечение.
Это было связано с давно опубликованными доклиническими исследованиями (Zietman 1997 [7],
Granfors, 1997 [8], Kaminski, 2003
[9]), на которых базировались потом все клинические протоколы
в США. Такой подход легко было
объяснить и для самого себя, и для
пациента: «сначала опухоль станет
меньше под воздействием АДТ, а
затем ЛТ – при равных дозах – будет более эффективной». Честно говоря, такой подход был проще для
врачей и пациентов – можно было
бы не спешить, у радиотерапевтов
было аж 2 месяца после начала АДТ,
чтобы пригласить пациента на консультацию, потом провести предлучевую топометрическую подготовку и не спешить с оконтуриванием
и началом лучевой терапии. Часто
пациенты планировали свою жизнь
– важные события, путешествия – в
эти два месяца до начала ЛТ. Что ж,
теперь нужно не зевать, а начинать
лечение сразу, как мы привыкли с
пациентами других нозологий – раком пищевода, легкого. При этом
«теперь» – это не сегодня, а через
несколько месяцев, когда все пациенты будут вакцинированы от
коронавируса и визит в клинику
лучевой терапии не будет для них
потенциально опасным. Важно
помнить, что в совокупном анализе
др. Спратта и его команды после 15
лет наблюдения не было достоверной разницы в опухоль-специфической и общей выживаемости между
двумя группами пациентов. Поэтому для 75-летнего пациента с локализованным раком предстательной
железы среднего риска на сегодняшний день я бы порекомендовал
начать с АДТ, получить вакцину от
коронавируса и уже потом вернуться в клинику для прохождения курса лучевой терапии.
Комбинация ниволумаба и кабозантиниба становится новой опцией терапии метастатического рака почки
22 января 2021 года Управление по контролю над качеством пищевых продуктов и лекарственных средств США (FDA) одобрило комбинацию ингибитора PD-1 ниволумаба и таргетного препарата кабозантиниба в качестве терапии первой линии у пациентов с распространенным почечно-клеточным раком (ПКР). Ранее результаты рандомизированного исследования 3 фазы CheckMate 9ER, в котором оценивали эффективность ниволумаба в комбинации с кабозантинибом в первой линии метастатического светлоклеточного ПКР, были представлены на конгрессе ESMO 2020. 651 пациент был стратифицирован по шкале риска IMDC, экспрессии PD-L1 и региону и рандомизирован в соотношении 1:1 в группу ниволумаба в дозе 240 мг внутривенно, каждые 2 недели и кабозантиниба 40 мг перорально 1 раз в сутки (N=323) или в группу сунитиниба 50 мг перорально в режиме 4/2 (N=328). Лечение проводилось до прогрессирования заболевания или неприемлемой токсичности. Первичной конечной точкой была выживаемость без прогрессирования по данным оценки слепого независимого центрального анализа. Вторичные конечные точки включали общую выживаемость, частоту объективных ответов и безопасность. При медиане наблюдения 18,1 месяца все три конечные точки были достигнуты. Комбинация по сравнению с сунитинибом достоверно увеличила выживаемость без прогрессирования (HR=0,51; P<0,0001; медиана 16,6 и 8,3 мес. соответственно), общую выживаемость (HR=0,60; P=0,0010; медианы не достигнуты) и частоту объективных ответов (55,7% и 27,1%; P<0,0001). 8% и 4,6% больных достигли полного ответа соответственно. Медиана продолжительности ответа составила 20,2 мес. против 11,5 мес. В группе комбинации нежелательные явления 3 степени и выше, обусловленные лечением, наблюдались у 60,6% больных, в группе сунитиниба – у 50,9%. Токсичность привела к прекращению приема сунитиниба у 8,8% больных, ниволумаба или кабозантиниба – у 15,3%, комбинации – у 3,1%, только ниволумаба – у 5,6% и только кабозантиниба – у 6,6%. Наиболее частыми (≥20%) нежелательными явлениями у пациентов, получавших комбинацию ниволумаба и кабозантиниба, были диарея, утомляемость, гепатотоксичность, ладонно-подошвенный синдром, стоматит, сыпь, гипертония, гипотиреоз, мышечно-скелетные боли, снижение аппетита, тошнота, боль в животе, кашель и инфекции верхних дыхательных путей. Рекомендуемый FDA режим включает 240 мг ниволумаба каждые 2 недели (30-минутная внутривенная инфузия) или 480 мг каждые 4 недели (30-минутная внутривенная инфузия) в сочетании с кабозантинибом 40 мг перорально один раз в день до прогрессирования заболевания или неприемлемой токсичности.
Источник:
веб-сайт FDA
Комментарии эксперта по статье "комбинация ниволумаба и кабозантиниба становится новой опцией..."
Автор: Тимофеев Илья Валерьевич
Главный редактор Газеты RUSSCO, Институт онкологии Хадасса, Москва
Комбинация ниволумаба и кабозантиниба оказалась эффективной, что
позволяет ее рассматривать в качестве терапии первой линии метастатического светлоклеточного ПКР.
Безусловно, у нас нет еще отдаленных
результатов наблюдения, однако первые данные впечатляют. При использовании комбинации риск прогрессирования заболевания снижается
почти на 50%, риск смерти на 40%, у
половины пациентов развиваются
ответы на лечение, которые являются длительными. Впервые в качестве
терапии рака почки Европейское
общество медицинской онкологии
(ESMO), не дожидаясь официальной
регистрации комбинации в Европейском союзе, включило ее в свои рекомендации.
Целесообразность сочетания таргетного препарата и иммунотерапии в первой линии не вызывает
сомнения. Кабозантиниб изучался в
монотерапии у ранее не получавших
лечение пациентов в исследовании
CABOSUN, но результаты эффективности были довольно дискутабельными – кривые выживаемости
кабозантиниба и сунитиниба перекрестились.
Акситиниб – другой компонент схем
первой линии с иммунотерапией –
также в монорежиме не продемонстрировал преимуществ в рандомизированном исследовании 3 фазы.
Что касается ингибиторов контрольных точек, то уже минимум 3 исследования 2 фазы четко указывают
– ни пембролизумаб, ни ниволумаб
в монотерапии не имеют тех «революционных» цифр, которые дают
комбинации.
Комбинации – залог успеха терапии:
кабозантиниб с ниволумабом, акситиниб с пембролизумабом, акситиниб с авелумабом и в скором будущем, как нам сообщил пресс-релиз
компаний, ленватиниб с пембролизумабом.
Использовать комбинацию ниволумаба и кабозантиниба можно вне зависимости от группы риска, что делает ее универсальной.
С другой стороны, расплата за сочетание двух механизмов действия – это
увеличение токсичности. Авторы исследования CheckMate 9ER заведомо
в этом режиме снизили дозу кабозантиниба до 40 мг, ведь в монотерапии
кабозантиниб, не самый простой
препарат с позиций нежелательных
явлений, используется в дозе 60 мг.
Тем не менее, несмотря на снижение дозы, мы увидели более высокие
уровни токсичности, например, по
сравнению с комбинацией ниволумаба и ипилимумаба, если сопоставить
цифры с результатами исследования
CheckMate 214, что может несколько
ограничить возможности применения кабозантиниба/ниволумаба. Например, у пациентов, имеющих сопутствующие заболевания или риск
кардиотоксичности, можем ли мы
смело назначить таргетно-иммунную
комбинацию? Длительное наблюдение позволит собрать больше данных
по безопасности, переносимости и
частоте отмены терапии при продолжительном ее использовании
Журнал «злокачественные опухоли» включен в перечень рецензируемых научных изданий по специальности «онкология»
Уважаемые коллеги! С удовольствием сообщаем, что решением ВАК от 09.12.2020 г. журнал «Злокачественные опухоли» включен в перечень рецензируемых научных изданий по специальности «Онкология». С 2010 г. журнал является официальным печатным изданием Российского общества клинической онкологии (RUSSCO) и входит в перечень журналов, рецензируемых ВАК, по двум специальностям – «Онкология» и «Хирургия». Членами редакционной коллегии журнала являются ведущие отечественные и зарубежные эксперты в области молекулярной биологии, лекарственного лечения, лучевой терапии и хирургического лечения злокачественных новообразований. В журнале публикуются оригинальные статьи авторов о проведенных научных, клинических и фундаментальных исследованиях, лекции и актуальные обзоры по проблемам диагностики и лечения злокачественных новообразований, а также интересные клинические случаи. Необходимо отметить, что качество публикуемых работ неуклонно повышается, что делает журнал одним из наиболее престижных, объективных и высоко цитируемых в своей области. Редакционный совет и редакционная коллегия продолжают работать над совершенствованием качества публикуемых статей. К сожалению, в отдельных случаях время от подачи статьи до ее публикации в журнале затягивается, поскольку повышение качества публикуемых работ требует постоянной коммуникации между автором и рецензентами. Редакционная коллегия планирует сделать взаимодействие между автором и рецензентами максимально эффективным. Вы можете загрузить свою статью в режиме онлайн, перейдя по ссылке: www.malignanttumors.org/jour/. Мы ждем ваших новых публикаций и надеемся на плодотворное сотрудничество!
С уважением, Д.А. Носов
Главный редактор, проф,. д.м.н

Управление лечением при использовании комбинации леватиниб+эверолимус у пациентов с метастатическим почечноклеточным раком в условиях глобальной эпидемии COVID-19
д.м.н., проф. Борис Яковлевич Алексеев, заместитель генерального директора по научной работе ФГБУ «Национальный медицинский исследовательский радиологический центр» Минздрава России, ученый секретарь Российского общества онкоурологов (Москва); чл.-корр. РАН, д.м.н., проф. Всеволод Борисович Матвеев, зам. директора по научной и ФГБУ «НМИЦ радиологии» Минздрава России (Москва); д.м.н., проф. Дмитрий Александрович Носов, руководитель онкологического отделения противоопухолевой терапии ФГБУ «Центральная клиническая больница с поликлиникой» Управления делами Президента РФ (Москва); к.м.н. Павел Сергеевич Борисов, главный врач АНО МИЦЛТ ЮНИНОВА, врач онколог, ФГБУ НМИЦ ОНКОЛОГИИ Н.Н. Петрова МЗ РФ (Санкт-Петербург); д.м.н. Мария Игоревна Волкова, ведущий научный работник отделения урологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России (Москва); к.м.н. Алексей Сергеевич Калпинский, старший научный сотрудник отделения онкоурологии Московского научно-исследовательского онкологического института имени П.А. Герцена — филиала ФГБУ «НМИЦ радиологии» Минздрава России (Москва); Илья Валерьевич Тимофеев, директор Бюро по изучению рака почки (Москва) и д.м.н. Евгений Анатольевич Усынин, заведующий отделением общей онкологии НИИ онкологии ФГБУ «Томский национальный исследовательский медицинский центр Российской академии наук» (Томск) приняли участие в мероприятии в качестве экспертов. Всемирная организация здравоохранения объявила о пандемии коронавируса, приводящего к острому респираторному синдрому (COVID-19). Онкологические больные, в том числе пациенты с почечно-клеточным раком (ПКР), более восприимчивы к инфекциям из-за системного иммуносупрессивного состояния, вызванного злокачественными новообразованиями и непосредственно противоопухолевым лечением. Дискуссию вызывает вопрос, какие препараты таргетной терапии более предпочтительны принимая во внимание ситуацию с новой коронавирусной инфекцией. Комбинация ленватиниб+эверолимус cогласно утвержденным в этом году рекомендациям Ассоциации онкологов России (AOP) является стандартом терапии второй линии [1]. Режимом предпочтения при этом является применение ниволумаба или кабозатиниба, альтернативным режимом кроме комбинации ленватиниба и эверолимуса является терапия акситинибом. У отдельных пациентов могут применяться в монотерапии эверолимус, сунитиниб или пазопаниб. При выборе терапии второй линии мПКР с учетом особенностей глобальной пандемии COVID-19 исходя из соотношения риск-польза невозможно отдать предпочтение каким-либо препаратам, в каждом случае следует руководствоваться индивидуальными особенностями пациента и поставленными терапевтическими целями. Чтобы свести к минимуму риск заражения COVID-19 в ЛПУ, следует по возможности воздерживаться от терапии препаратами, требующими внутривенного введения. Вместе с тем следует оценивать вероятность развития НЯ, поскольку они могут повлечь за собой необходимость обращения в ЛПУ, при котором остается высоким риск заражения COVID-19. В условиях пандемии COVID-19 следует придерживаться следующих рекомендаций:
1. Следует в целом стремиться минимизировать использование каких-либо комбинаций терапии, влекущих за собой синергию НЯ по каждому из компонентов комбинации. Вместе с тем возможно рекомендовать использование комбинации ленватиниба и эверолимуса для таргетной терапии рПКР с учетом профиля и частоты возникающих нежелательных явлений (НЯ), тщательным мониторингом НЯ и своевременными мерами по их коррекции.
2. В соответствии с данными клинических исследований и реальной клинической практики наибольшую выгоду от применения комбинации ленватиниб+эверолимус получают пациенты с хорошим и промежуточным прогнозом, наличием клинических симптомов мПКР, большой опухолевой нагрузкой, с быстрым прогрессированием на первой линии терапии и наличием первичной резистентности.
3. Перед назначением комбинации ленватиниба и эверолимуса необходимо собрать подробный анамнез с целью выяснить наличие сопутствующих хронических заболеваний, организовать заполнение пациентом опросника качества жизни. Также необходимы консультация кардиолога, ЭКГ, Эхо-КГ, терапевта, стандартное обследование для подтверждения прогрессирования рПКР, общий и БХ-анализ крови, включая уровень общего холестерина, триглицеридов, а также определение гормонального статуса.
4. Существующие рекомендации по коррекции режима таргетной терапии при развитии НЯ и лечения НЯ достаточно детально проработаны, также респираторная токсичность, иммуносупрессия с присоединением инфекции не являются лидирующими по распространенности НЯ, поэтому в условиях пандемии COVID-19 нет необходимости их пересмотра. Вместе с тем, в условиях пандемии новой коронавирусной инфекции требуется более тщательный мониторинг НЯ. При наличии пневмонита любой степени следует отменить таргетную терапию до получения отрицательного ПЦР-теста на SARS-CoV-2. Пациенты с НЯ респираторного ряда нуждаются в дифференциальной диагностике с COVID-19 и дальнейших соответствующих полученному диагнозу лечебных мероприятиях. При назначении КТ следует оценивать его пользу и риск заражения COVID-19 в месте выполнения исследования.
Рисунок 1. Ленватиниб + эверолимус: комбинация профилей токсичности с разными
механизмами.
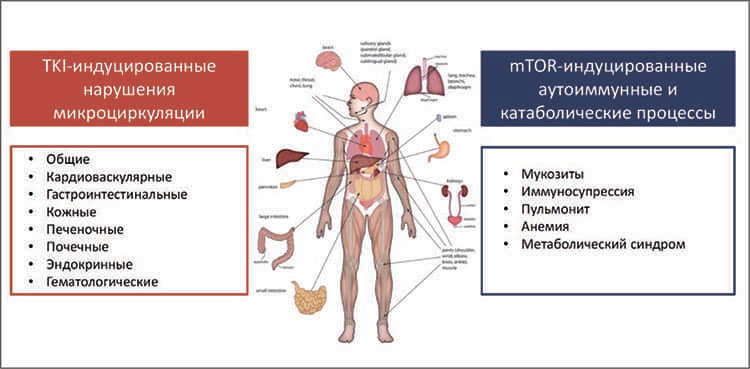
5. Получающим таргетную терапию пациентам с диагностированной COVID-19 необходимо прервать терапию до получения отрицательного ПЦР-теста на SARS-CoV-2. Пациенты, находящиеся в контакте с больными с подтвержденной COVID-19, не должны стартовать с таргетной терапией или продолжать ее до получения отрицательного ПЦР-теста на SARS-CoV-2.
6. При назначении комбинации ленватиниба и эверолимуса пациенту и его близким родственникам следует дать рекомендации о возможности развития наиболее частых НЯ, включая гипотиреоз и диарею, а также о способах их купирования. Также в ситуации пандемии новой коронавирусной инфекции следует особо обратить внимание пациента на вероятность развития у него респираторных НЯ, обусловленных таргетной терапией.
7. Использование информационных материалов об НЯ при таргетной терапии комбинацией ленватиниба и эверолимуса для пациентов очень полезно и способствует экономии времени лечащего врача.
8. Для контроля возникновения основных НЯ необходимо внедрить в рутинную клиническую практику использование пациентом дневников и опросников (в т.ч. для самоконтроля), позволяющих зафиксировать возможно упускаемые в ходе общения с врачом аспекты, контролировать вес и калораж пищи, АД, ЧДД, температуру тела, измерение окружности конечностей.
9. С целью минимизации риска заражения COVID-19 в ЛПУ забор крови для анализов должен осуществляться путем вызова сотрудника лаборатории на дом к пациенту. Обязательным является мониторирование показателей крови первых 4-6 циклов терапии. Если пациент находится без выраженной печеночной, почечной токсичности, гипергликемии, гиперлипидемии первые 4 цикла терапии – далее можно снижать частоту анализов до 1 раза в 4-6 недель.
10. При возникновении НЯ 2-й степени тяжести (включая диарею более 5 раз в сутки, неконтролируемую АГ) следует отдать предпочтение дистанционной связи с лечащим врачом для рассмотрения вопроса о назначения симптоматического лечения, снижении дозировки или отмены таргетной терапии. Обязательного визита пациента в ЛПУ требуют респираторные проблемы и развитие дыхательной недостаточности, а также других жизнеугрожающих состояний.
11. Для дистанционной связи с пациентом для мониторирования НЯ и обсуждения мер их коррекции недостаточно электронной почты; следует использовать телефон, сервисы конференц-связи, мессенджеры с возможностью аудио- и видеозвонков. В рандомизированном многоцентровом исследовании HOPE 205 комбинация ленватиниба с эверолимусом показала высокую противоопухолевую активность: частота объективных ответов (ЧОО) – 43%, беспрогрессивная выживаемость (БПВ) – 14,6 месяцев, общая выживаемость (ОВ) – 25,5 месяца [2]. [2,3] Профиль нежелательных явлений (НЯ) и лабораторных отклонений в исследовании 205 и данных реальной клинической практики был одинаков. При использовании комбинации ленватиниба (ингибитор тирозинкиназы, англ. tyrosine kinase inhibitor, TKI) и эверолимуса (ингибитор mTOR) их НЯ также комбинируются, т.е. происходит сочетание профилей токсичности с разными механизмами развития (рис. 2, 3).
Рисунок 2. Дифференциальная диагностика генеза
нежелательных явлений
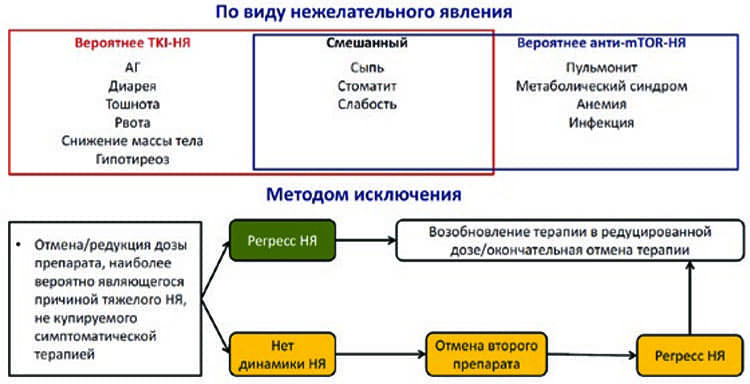
Ленватиниб при этом обуславливает общие, кардиоваскулярные, гастроинтестинальные, кожные, печеночные, почечные, эндокринные, гематологические TKI-индуцированные нарушения микроциркуляции, а эверолимус – mTOR-индуцированные аутоиммунные и катаболические процессы (мукозиты, имуносупрессия, пульмонит, анемия, метаболический синдром). НЯ при использовании комбинации ленватилиба и эверолимуса развиваются в большинстве случаев и реализуются в течение первых 4-х недель. Их частота и степень тяжести снижается после 4-6 циклов терапии. Данные НЯ являются дозозависимыми и исчезают после отмены терапии. Исходя из этого, ключевыми компонентами ведения пациентов, получающих комбинацию ленватиниба и эверолимуса, являются выявление факторов риска; предоставление должного объема информации о возможности возникновения НЯ и их характере для пациентов, мониторинг с целью раннего выявления НЯ, оценка степени тяжести НЯ, дифференциальная диагностика между индуцированными TKI (ленватиниб) и анти-mTOR-препаратом (эверолимус) НЯ, выбор тактики коррекции режима противоопухолевой терапии, а также Выбор адекватной тактики лечения НЯ в зависимости от зоны поражения и степени тяжести. Следует принимать во внимание и факторы риска развития НЯ. Для НЯ, индуцированных TKI, таковыми являются заболевания кожи, сердечно-сосудистые заболевания, хронические заболевания ЖКТ, гипотиреоз, хронические заболевания печени, хронические заболевания почек, предшествующее назначение TKI. Для НЯ, индуцированных анти-mTOR-препаратом – аутоиммунные заболевания, хронические заболевания легких недавно перенесенные инфекционные заболевания, хронические вирусные и бактериальные инфекции [4]. Для раннего выявления НЯ рекомендуется следующий мониторинг: 1) Активное выявление жалоб, таких как слабость, тошнота, рвота, диарея, кашель, одышка, лихорадка 2) Осмотр и физикальное обследование (особое внимание следует обращать на снижение массы тела, наличие сыпи, повышение АД) 3) Регулярные анализы крови: мониторинг гемоглобина, уровня глюкозы, холестерина, триглицеридов, показателей функции печени и почек. Для определения тактики ведения пациента с НЯ необходимо определить степень его тяжести. Всего выделяют пять степеней тяжести:
1 - Бессимптомное течение (требуется только наблюдение, таргетная терапия остается без изменений);
2 - Есть симптомы, необходимо лекарственное лечение: возможна отмена лечения до регрессии симптомов до ≤1 степени с возобновлением терапии в прежней или редуцированной на 1 уровень дозе;
3 - Тяжелые симптомы, ограничение самообслуживания, показано лекарственное лечение: отмена лечения до регрессии симптомов до ≤1 степени с возможным возобновлением терапии в сниженной на 1 уровень дозе;
4 - Жизнеугрожающие симптомы, показана отмена комбинированной таргетной терапии, интенсивная терапия/реанимация;
5 - Смерть
Рекомендации по коррекции доз приведены на рисунке 4.
Рисунок 4. Рекомендации по коррекции доз при возникновении нежелательных явлений при
применении таргетной терапии комбинацией ленватиниба и эверолимуса (адаптировано из [2,5]).
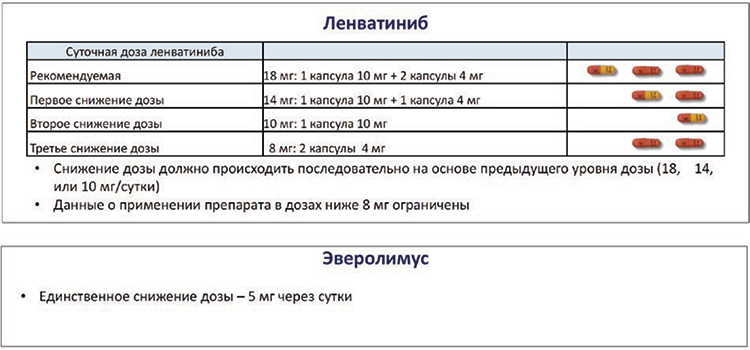
Рисунок 5. Алгоритм действий при артериальной гипертензии на фоне таргетной терапии [5]
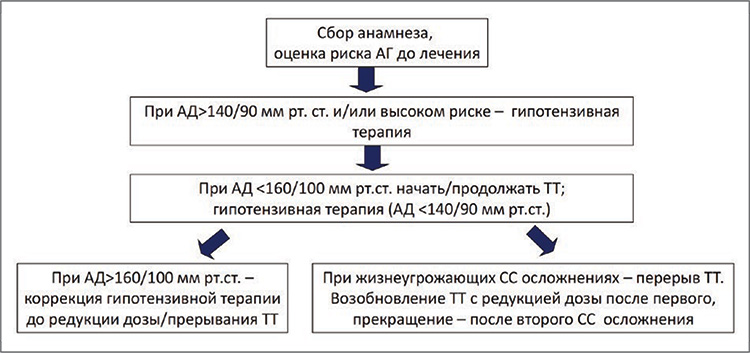
Доказательных исследований в отношении борьбы с тошнотой и рвотой у пациентов, получающих TKI нет, однако обычно в научной литературе упоминается применение метоклопрамида, антагонистов серотониновых рецепторов и дексаметазона. Также отсутствуют рекомендации по лечению стоматита у пациентов, получающих TKI при рПКР. В этих условиях необходимо ориентироваться на общие рекомендации и советы, имеющие различный уровень доказательности(УД) [14]. Так, рекомендациями по профилактике стоматита (УД I-II) являются: соблюдать гигиену полости рта (>1 полоскания в сутки, не доказана эффективность какого-либо из агентов); избегать острой пищи; использовать мягкую зубную щетку и детскую зубную пасту. Совет по профилактике стоматита (УД III-IV): использовать препараты цинка (усиливает вкус сладкого, соленого, горького). Рекомендации по лечению стоматита разработаны только для пациентов, получающих высокодозную ХТ и ДЛТ при опухолях головы и шеи. Советом по лечению стоматита (УД III-IV) является полоскание рта раствором доксепина 0,5%. При анорексии и кахексии изучалось применение медрогсипрогестеронацетата (МПА), эйкосапентаноловой кислоты, L-карнитина, талидомида. Рандомизированное исследование показало, что наиболее эффективна комбинация всех агентов [15]. Алгоритм действий при артериальной гипертензии на фоне применения таргетной терапии приведен на рисунке [5]. При гипертензии, вызванной TKI, предпочтительными препаратами являются антагонисты рецепторов ангиотензина II типа, ингибиторы ангиотензин-превращающего фермента, блокаторы Ca++ каналов и вазодилататоры. Менее эффективны бета-адреноблокаторы и диуретики. При этом следует избегать назначения некоторых блокаторов Са++ каналов (верапамил, дилтиазем), поскольку они являются ингибиторами цитохрома P450, что может повлечь межлекарственные взаимодействия [16,17].
Таблица 1. Тактика ведения получающих таргетную
терапиюпациентов с гиперлипидемией [17,19].
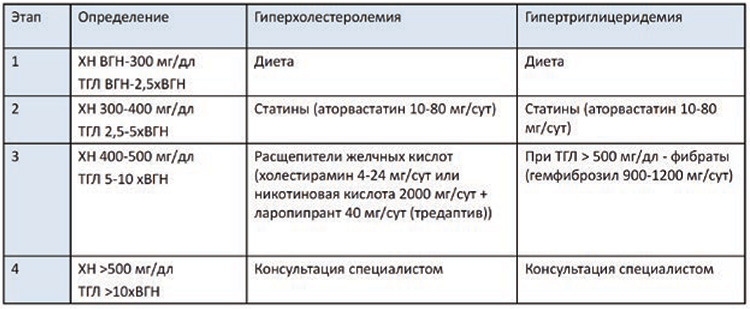
Таблица 2. Тактика ведения получающих таргетную терапию пациентов с гипергликемией [17,19].
Алгоритм действий для контроля гипотиреоза на фоне таргетной терапии включает сбор анамнеза и оценку ТТГ до лечения. При наличии изменений – терапию следует начинать после медикаментозной коррекции и выполнять оценку ТТГ каждые 4 недели (частота оценки тиреоидной функции определяется цикличностью секреции ТТГ). При развернутом гипотиреозе (ТТГ>N, низкий FTI, симптомы) – необходимо применять тиреоидные гормоны, при ТТГ>N, отсутствии симптомов гипотиреоза – ограничиться продолжением оценки ТТГ каждые 4 недели, При нормальном уровне ТТГ оценку его уровня следует производить каждые 8 недель [17,18]. Тактика ведения пациентов с гиперлипидемией и гипергликемией приведена в таблицах 1 и 2, соответственно [17,19]. Исходя из этих данных, была определена тактика лечения возникших на фоне таргетной терапии комбинацией ленватиниба и эверолимуса нежелательных явлений у пациентки Б. (см. рис. 6).

Тактика ведения пациента с неинфекционным пневмонитом приведена в таблице 3 [17,20]. Таким образом, комбинированная таргетная терапия ленватинибом и эверолимусом ассоциирована с предсказуемым комбинированным профилем токсичности, сочетающем НЯ, специфичные для TKI и антиmTOR. НЯ ≥3 степени тяжести наблюдаются у >10% больных, в т.ч. диарея – у 19%, слабость – у 18%, артериальная гипертензия – у 13% пациентов. Большинство НЯ развивается в течение первого цикла лечения, поддается контролю и регрессирует через 6-9 месяцев после старта терапии. Основная цель лечения осложнений таргетной терапии – избежать развития жизнеугрожающих состояний, не редуцируя дозы/не прерывая противоопухолевой терапии.
Таблица 3. Тактика ведения получающего таргетную терапию
пациента с неинфекционным пневмонитом.
Список литературы :
1. Клинические рекомендации. Рак паренхимы почки. Ассоциация онкологов России. 2020. Электронный ресурс. Режим доступа: [https://endoexpert.ru/dokumenty-iprikazy/utverzhdennye-klinicheskierekomendatsii-rak-parenkhimypochki-deystvushchie-2020-g/ ]. Дата доступа: 22.07.2020
2. Motzer, R. J., Hutson, T. E., Glen, H., Michaelson, M. D., Molina,A., Eisen, T., ... & Melichar, B. (2015). Lenvatinib, everolimus, and the combination in patients with metastatic renal cell carcinoma: a randomised, phase 2, openlabel, multicentre trial. The lancet oncology, 16(15), 1473-1482.
3. Volkova, M., Samuseva, O. I., Olshanskaya, A. S., & Matveev, V. B. (2018). Lenvatinib in combination with everolimus in metastatic renal cell carcinoma (mRCC) resistant to antiangiogenic targeted therapy: An initial Russian experience. Journal of Clinical Oncology 2018 36:15_ suppl, e16562-e16562 DOI: 10.1200/ JCO.2018.36.15_suppl.e16562
4. Danlos, F. X., Voisin, A. L., Dyevre, V., Michot, J. M., Routier, E., Taillade, L., ... & Massard, C. (2018). Safety and efficacy of anti-programmed death 1 antibodies in patients with cancer and pre-existing autoimmune or inflammatory disease. European Journal of Cancer, 91, 21-29.
5. Инструкция по применению лекарственного препарата для медицинского применения Ленвима; РУ № ЛП 003398; Дата регистрации: 29.12.2015г. (с изменениями от 06.12.2016г.)
6. Placidi, E., Marciani, L., Hoad, C. L., Napolitano, A., Garsed, K. C., Pritchard, S. E., ... & Gowland, P. A. (2012). The effects of loperamide, or loperamide plus simethicone, on the distribution of gut water as assessed by MRI in a mannitol model of secretory diarrhoea. Alimentary pharmacology & therapeutics, 36(1), 64-73.
7. Karthaus, M., Ballo, H., Abenhardt, W., Steinmetz, T., Geer, T., Schimke, J., ... & Messmann, H. (2005). Prospective, double-blind, placebo-controlled, multicenter, randomized phase III study with orally administered budesonide for prevention of irinotecan (CPT11)-induced diarrhea in patients with advanced colorectal cancer. Oncology, 68(4-6), 326-332.
8. Lenfers, B. H. M., Loeffler, T. M., Droege, C. M., & Hausamen, T. U. (1999). Substantial activity of budesonide in patients with irinotecan (CPT-11) and 5-fluorouracil induced diarrhea and failure of loperamide treatment. Annals of oncology, 10(10), 1251- 1253.
9. Dueno, M. I., Bai, J. C., Santangelo, W. C., & Krejs, G. J. (1987). Effect of somatostatin analog on water and electrolyte transport and transit time in human small bowel. Digestive diseases and sciences, 32(10), 1092- 1096.
10. Zachariah, B., Gwede, C. K., James, J., Ajani, J., Chin, L. J., Donath, D., ... & Kachnic, L. A. (2010). Octreotide acetate in prevention of chemoradiation-induced diarrhea in anorectal cancer: randomized RTOG trial 0315. Journal of the National Cancer Institute, 102(8), 547-556.
11. Österlund, P., Ruotsalainen, T., Korpela, R., Saxelin, M., Ollus, A., Valta, P., ... & Joensuu, H. (2007). Lactobacillus supplementation for diarrhoea related to chemotherapy of colorectal cancer: a randomised study. British journal of cancer, 97(8), 1028-1034.
12. Von Bültzingslöwen, I., Adlerberth, I., Wold, A. E., Dahlen, G., & Jontell, M. (2003). Oral and intestinal microflora in 5‐fluorouracil treated rats, translocation to cervical and mesenteric lymph nodes and effects of probiotic bacteria. Oral microbiology and immunology, 18(5), 278-284.
13. Bowen, J. M., Stringer, A. M., Gibson, R. J., Yeoh, A. S., Hannam, S., & Keefe, D. M. (2007). VSL# 3 probiotic treatment reduces chemotherapy-induced diarrhoea and weight loss. Cancer biology & therapy, 6(9), 1445-1450.
14. Lalla, R. V., Bowen, J., Barasch, A., Elting, L., Epstein, J., Keefe, D. M., ... & Raber‐Durlacher, J. E. (2014). MASCC/ISOO clinical practice guidelines for the management of mucositis secondary to cancer therapy. Cancer, 120(10), 1453-1461.
15. Mantovani, G., Macciò, A., Madeddu, C., Serpe, R., Massa, E., Dessì, M., ... & Contu, P. (2010). Randomized phase III clinical trial of five different arms of treatment in 332 patients with cancer cachexia. The Oncologist. 2010;15:200-211.
16. Mancia, G. (2007). 2007 ESH-ESC Practice Guidelines for the Management of Arterial Hypertension. Eur Heart J, 28, 1462- 1536.
17. Волкова М.И. методические рекомендации для врачей М. 2015
18. Garber, J. R., Cobin, R. H., Gharib, H., Hennessey, J. V., Klein, I., Mechanick, J. I., ... & Woeber for the American Association of Clinical Endocrinologists and American Thyroid Association Taskforce on Hypothyroidism in Adults, K. A. (2012). Clinical practice guidelines for hypothyroidism in adults: cosponsored by the American Association of Clinical Endocrinologists and the American Thyroid Association. Thyroid, 22(12), 1200-1235.
19. Bays, H. E., Jones, P. H., Brown, W. V., & Jacobson, T. A. (2014). National Lipid Association annual summary of clinical lipidology 2015. Journal of clinical lipidology, 8(6), S1-S36.
20. Di Lorenzo, G., Porta, C., Bellmunt, J., Sternberg, C., Kirkali, Z., Staehler, M., ... & Buonerba, C. (2011). Toxicities of targeted therapy and their management in kidney cancer. European urology, 59(4), 526- 540.
Статья предоставлена компанией Eisai. Публикуется в редакции авторов.
Итоги конференции russco «рак легкого и опухоли средостения»
Подводя итоги состоявшейся 12-13 марта онлайн-конференции Рос - сийского общества клинической онкологии (RUSSCO) «Рак легкого и опухоли средостения», член про - граммного комитета конференции, главврач Нижегородского област - ного клинического онкологический диспансера, к.м.н. Сергей Викторо - вич Гамаюнов, отметил, что особый интерес у участников вызвало об - суждение программы скрининга, а также данных о том, как изменился рак легкого за последние двадцать лет (это и морфологические, и моле - кулярно-генетические особенности) и что нового появилось в инстру - ментальных методах диагностики.
Сергей Викторович Гамаюнов
«Во-первых, хочу заострить внима
-
ние на создании специальной секции,
в работе которой были отражены
основные изменения в биологии рака
легкого. Во-вторых, поскольку опухо
-
ли средостения – это очень сложная
локализация, которая характеризу
-
ется широким спектром различных
нозологий и требует особых под
-
ходов к выбору тактики лечения,
было принято решение вынести эту
проблему в название конференции,
уделив ей отдельное внимание», – до
-
бавил Сергей Викторович.
Большой интерес участников кон
-
ференции подтверждается и ста
-
тистическими данными: за два дня
работы в двух виртуальных залах
около 700 посетителей из более чем
70 регионов России и 11 зарубежных
стран смогли поучаствовать в 10 на
-
учных сессиях, 7 сателлитных сим
-
позиумах и специальной панельной
дискуссии, прослушать 4 устано
-
вочных лекции и более 50 докладов
и выступлений спикеров из 8 рос
-
сийских регионов и 4 зарубежных
стран.
Для тех, кто не смог лично участво
-
вать в работе конференции, но же
-
лает ознакомиться с ее материалами,
сообщаем, что в течение месяца на
сайте RosOncoWeb.ru будут выложе
-
ны записи основных сессий, лекций
и докладов.
Новая редакция NCCN по НМРЛ
Автор:Демидова Ирина Анатольевна
Московская городская онкологическая больница №62, Москва
Последние изменения в новой ре
-
дакции The NCCN Clinical Practice
Guidelines in Oncology (NCCN
Guidelines) for Non-Small Cell Lung
Cancer (NSCLC) Version 4.2021 в раз
-
деле молекулярно-генетической ди
-
агностики можно назвать в какой-то
степени революционными.
Эксперты приняли решение зна
-
чительно увеличить количество
биомаркеров, рекомендуемых к
определению, добавив к выявлению
мутаций в генах EGFR и BRAF, пере
-
строек генов ALK и ROS1, экспрес
-
сии PDL1 дополнительно детекцию
нарушений сплайсинга 14 экзона
гена MET, перестроек генов NTRK
1/2/3 и RET.
Рекомендовано также выполнять
молекулярно-генетическое тестиро
-
вание при любой гистологической
форме НМРЛ, в том числе при пло
-
скоклеточном раке без учета возрас
-
та, пола и статуса курения.
В качестве оптимального вида те
-
стирования предпочтение отдается
одновременному исследованию па
-
нелей генов, поощряется исполь
-
зование высокопроизводительно
-
го секвенирования с включением
генов-мишеней как частых, так и
редких генетических аберраций.
При этом рекомендуется поэтапное
проведение секвенирования ДНК, а
затем РНК образцов.
Внесены также изменения в тести
-
рование мутаций гена EGFR: реко
-
мендовано определение последова
-
тельности инсерций 20 экзона, что
связано с последними данными о
чувствительности некоторых инсер
-
ций к таргетной терапии.
Среди новых, заслуживающих вни
-
мание (emerging) маркеров обо
-
значены мутации гена HER2 и ам
-
плификация высокой степени гена
МЕТ. В то же время из этой группы
исключено определение мутацион
-
ной нагрузки, что связано с недоста
-
точными данными о значении этого
маркера как предиктора эффектив
-
ности иммунотерапии при НМРЛ и
неоднозначностью существующих
подходов к тестированию.
