Дорогие коллеги, дорогие друзья!
Мы почти дожили до весны, лишь пара шагов до календарной и сколько-то – до настоящей, теплой, красочной. Очень хочется сбросить стылый, черно-белый февраль с плеч, словно отяжелевшую зимнюю одежду – но всему свой черед, и каждый шаг этой зимы должен быть терпеливо пройден… Несмотря на самое начало года, Российское общество клинической онкологии уже провело...

И.Айвазовский. Корабль среди бурного моря. 1887
Холст, масло. 97x62,5 см. Эрмитаж, Санкт-Петербург
Борис Пастернак. 1912
* * * Февраль. Достать чернил и плакать! Писать о феврале навзрыд, Пока грохочущая слякоть Весною черною горит. Достать пролетку. За шесть гривен, Чрез благовест, чрез клик колес, Перенестись туда, где ливень Еще шумней чернил и слез. ...
4 ФЕВРАЛЯ – ВСЕМИРНЫЙ ДЕНЬ БОРЬБЫ С ОНКОЛОГИЧЕСКИМИ ЗАБОЛЕВАНИЯМИ
ТЕЛЕМОСТ RUSSCO: РЕГИОНЫ О СВОИХ ДОСТИЖЕНИЯХ. 5 февраля Российское общество клинической онкологии (RUSSCO) совместно с Московским онкологическим обществом провели очередную ежегодную перекличку достижений...

ЗНАКОМЬТЕСЬ: РЕГИОНАЛЬНОЕ ОТДЕЛЕНИЕ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ ОРЕНБУРГСКОЙ ОБЛАСТИ
Оренбургская область – один из крупнейших регионов Российской Федерации, входит в состав Приволжского федерального округа. Территория составляет 124 тыс. кв. км, население – 2033,1 тыс. чел...
ДИСКУССИОННЫЙ КЛУБ «ТОЧКА ЗРЕНИЯ». КОНСЕНСУС ЭКСПЕРТОВ И МОЛОДЫХ ОНКОЛОГОВ
Новый формат онлайн-конференций успешно стартовал на площадке RUSSCO. Так, 2 декабря прошлого года и уже 27 января нынешнего состоялось 2 заседания дискуссионного клуба, темами которых стало обсуждение вопросов организации медицинской помощи. О том, что обсуждали молодые онкологи с экспертами, рассказываем в нашем пост-релизе...

ЕЩЕ РАЗ ОБ АНТРАЦИКЛИНАХ ПРИ ПРОВЕДЕНИИ АДЪЮВАНТНОЙ ХИМИОТЕРАПИИ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ
Многие годы антрациклины являлись основой комбинаций для лечения рака молочной железы. Однако их потенциальная отсроченная кардиотоксичность и риск индукции острых миелоидных лейкозов был стимулом создания безантрациклиновых комбинаций, обладающих сравнимой эффективностью, но меньшей токсичностью. Особенно это актуально при проведении адъювантной...

РАКФОНД ОБЪЯВЛЯЕТ НОВЫЙ КОНКУРС НАУЧНО-ИССЛЕДОВАТЕЛЬСКИХ ПРОЕКТОВ В ОБЛАСТИ ОНКОЛОГИИ
До 15 апреля принимаются заявки на проведение исследований...

SAN ANTONIO BREAST CANCER SYMPOSIUM 2023 ГЛАЗАМИ УЧАСТНИКА
В начале декабря 2023 года в городе Сан Антонио (штат Техас, США) прошел 46 ежегодный симпозиум по раку молочной железы. Одна из крупнейших в мире конференций собрала около 10 000....

ЛЕЧЕНИЕ НЕМЕЛКОКЛЕТОЧНОГО РАКА ЛЕГКОГО: ЧТО ИМЕЕМ К НАЧАЛУ 2024
Лучевая терапия в самостоятельном варианте или в сочетании с одновременной/последовательной химиотерапией (химиолучевая терапия, ХЛТ) заняла крепкие позиции в лечении местнораспространенных форм немелкоклеточного рака ...

ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ. КРИТИЧЕСКИЙ ВЗГЛЯД НА РЕЗУЛЬТАТЫ CLEAR...
16 января 2024 года в Journal of Clinical Oncology были опубликованы результаты долговременного, заранее спланированного анализа выживаемости пациентов в исследовании CLEAR – открытого рандомизированного исследования 3

PRESTO TRIAL: ИНТЕНСИФИКАЦИЯ АНДРОГЕН-ДЕПРИВАЦИОННОЙ ТЕРАПИИ (АДТ) ПРИ БИОХИМИЧЕСКОМ РЕЦИДИВЕ РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
Согласно текущим рекомендациям, пациентам с биохимическим рецидивом рака предстательной железы из группы высокого риска (временем удвоения ПСА (ВУПСА) ≤9 мес. и ISUP Grade 4-5) после радикальной простатэктомии (РПЭ) ...

РОЛЬ ПЭТ/КТ С FAPI В ДИАГНОСТИКЕ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ ЛЕГКОГО И ОРГАНОВ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА
Длительное время наиболее информативным методом радионуклидной диагностики в общей популяции онкологических больных являлась позитронно-эмиссионная...

КОММЕНТАРИЙ ЭКСПЕРТА
При назначении пациенту того или иного диагностического теста необходимо понимать цель данного назначения и могут ли потенциально его результаты повлиять на тактику лечения. Если с этих позиций рассмотреть результаты исследования по сравнению ПЭТ/КТ с использованием в
POUT TRIAL: АДЪЮВАНТНАЯ ХИМИОТЕРАПИЯ ПРИ УРОТЕЛИАЛЬНОМ РАКЕ ВЕРХНИХ МОЧЕВЫХ ПУТЕЙ
До публикации первых результатов исследования POUT в 2020 году стандартным подходом для пациентов с локализованным и местнораспространенным уротелиальным раком верхних мочевых путей (урВМП) после радикальной нефроуретерэктомии (РНУ) являлось наблюдение. Продемонстрированное улучшение выживаемости без признаков болезни (ВБПБ) при применении адъювантной ХТ (аХТ) (ОР 0,45; р=0,0001) позволило зарегистрировать данную опцию в

КОММЕНТАРИЙ ЭКСПЕРТА
Главный вопрос на сегодняшний день: какой вариант адъювантной терапии для пациентов с уротелиальным раком верхних мочевых путей (лоханка, мочеточник) является наиболее предпочтительным – химиотерапия или анти-PD1 ...
РАК НОСОГЛОТКИ: ТОЛЬКО ЛУЧЕВОЙ ТЕРАПИИ ДОСТАТОЧНО ПОСЛЕ ИНДУКЦИОННОЙ ПХТ
Хорошая новость для радиотерапевтов: индукционная терапия позволяет отказаться от токсичного одновременного химиолучевого лечения и ограничиться только радикальным курсом лучевой терапии при раке носоглотки, как показывает многоцентровое рандомизированное исследование 3 фазы, проведенное в 5 центрах Китая с 2015 по 2018 гг...
CHECKMATE 649: ОБНОВЛЕННЫЕ РЕЗУЛЬТАТЫ
21 февраля JCO опубликовал результаты 3-летнего наблюдения в исследовании CheckMate 649 по изучению эффективности комбинированной химиоиммунотерапии у пациентов с метастатическими формами рака желудка, гастроэзофагеального перехода и аденокарциномы пищевода. Напомним, что первые промежуточные данные продемонстрировали улучшение всех показателей эффективности, включая общую выживаемость и выживаемость без
Анонс
-

12 - 13 апреля 2024
РАК ЛЕГКОГО И ДРУГИЕ ОПУХОЛИ ГРУДНОЙ КЛЕТКИ
X КОНФЕРЕНЦИЯ RUSSCO
Дорогие коллеги, дорогие друзья!
Мы почти дожили до весны, лишь пара шагов до календарной
и сколько-то – до настоящей, теплой, красочной. Очень хочется
сбросить стылый, черно-белый февраль с плеч, словно отяжелевшую зимнюю одежду – но всему свой черед, и каждый шаг
этой зимы должен быть терпеливо пройден…
Несмотря на самое начало года, Российское общество клинической онкологии уже провело несколько своих больших конференций, а в марте нас ждет целых три – по иммуноонкологии и агностическим маркерам в онкологии, онкогинекологии
и раку молочной железы, с насыщенной и даже интригующей
программой. Еще есть время зарегистрироваться и принять
участие, получив, без сомнения, немало интересной информации от ведущих экспертов и молодых спикеров. Кстати, февральский номер газеты представит вам статьи и небольшие
новостные заметки от команды молодых онкологов. Надеемся,
что с их помощью рубрика «Прочти об этом раньше, чем твой
пациент» будет регулярно пополняться свежими новостями из
крупных журналов или сайтов онкологических сообществ.
RUSSCO начинает подготовку к XXVIII Российскому онкологическому конгрессу, главному событию года в нашем сообществе. Мы благодарны всем респондентам, откликнувшимся
на опрос в отношении предыдущего конгресса, и ждем ваших
предложений по тематикам сессий и предпочтительному формату их проведения в грядущем ноябре – ведь месяцы пролетают так быстро. Возможно, благодаря вам, трибуны конгресса
явят нам новых докладчиков и новые интересные данные!
Движемся в сторону Весны!
Ваша команда RUSSCO
И.Айвазовский. Корабль среди бурного моря. 1887
Холст, масло. 97x62,5 см. Эрмитаж, Санкт-Петербург

Борис Пастернак. 1912
* * *
Февраль. Достать чернил и плакать!
Писать о феврале навзрыд,
Пока грохочущая слякоть
Весною черною горит.
Достать пролетку. За шесть гривен,
Чрез благовест, чрез клик колес,
Перенестись туда, где ливень
Еще шумней чернил и слез.
Где, как обугленные груши,
С деревьев тысячи грачей
Сорвутся в лужи и обрушат
Сухую грусть на дно очей.
Под ней проталины чернеют,
И ветер криками изрыт,
И чем случайней, тем вернее
Слагаются стихи навзрыд.
4 ФЕВРАЛЯ – ВСЕМИРНЫЙ ДЕНЬ БОРЬБЫ С ОНКОЛОГИЧЕСКИМИ ЗАБОЛЕВАНИЯМИ
ТЕЛЕМОСТ RUSSCO: РЕГИОНЫ О СВОИХ ДОСТИЖЕНИЯХ
5 февраля Российское общество клинической онкологии
(RUSSCO) совместно с Московским онкологическим обществом провели очередную ежегодную перекличку достижений
российской онкологии.
Специалисты из Благовещенска,
Абакана, Тюмени, Оренбурга,
Брянска и Москвы во Всемирный
день борьбы с онкологическими
заболеваниями поделились со
всей страной достигнутыми в их
регионах успехах.
Телемост открыли и модерировали: Игорь Евгеньевич Хатьков,
председатель Московского онкологического общества, главный
внештатный специалист-онколог Депздрава Москвы, директор
ГБУЗ «Московский клинический
научно-практический центр имени А.С. Логинова ДЗМ», академик РАН, профессор, и Дмитрий
Александрович Носов, председатель RUSSCO, заведующий
отделением противоопухолевой
лекарственной терапии ФГБУ
«Центральная Клиническая Больница с Поликлиникой» Управления делами Президента РФ, главный внештатный онколог ГМУ УД
Президента РФ, профессор, д.м.н.
Первыми слово взяли коллеги из
Благовещенска. Заведующий отделением абдоминальной и торакальной онкологии, врач онколог,
врач рентгенэндоваскулярных
методов диагностики и лечения
Борис Валентинович Васильев
подробно рассказал об интервенционной радиологии и развитии
службы РХМДиЛ в Амурской
области. В частности, о том, что
именно интервенционной радиология позволяет выполнить задачу морфологической верификации диагноза с минимальной
травматичностью и высокой точностью.
Первое же выступление вызвало интерес участников телемоста. А И.Е. Хатьков, сказав, что Московский клинический научный центр им. А.С. Логинова использует подобные методы, пригласил дальневосточных коллег к сотрудничеству.
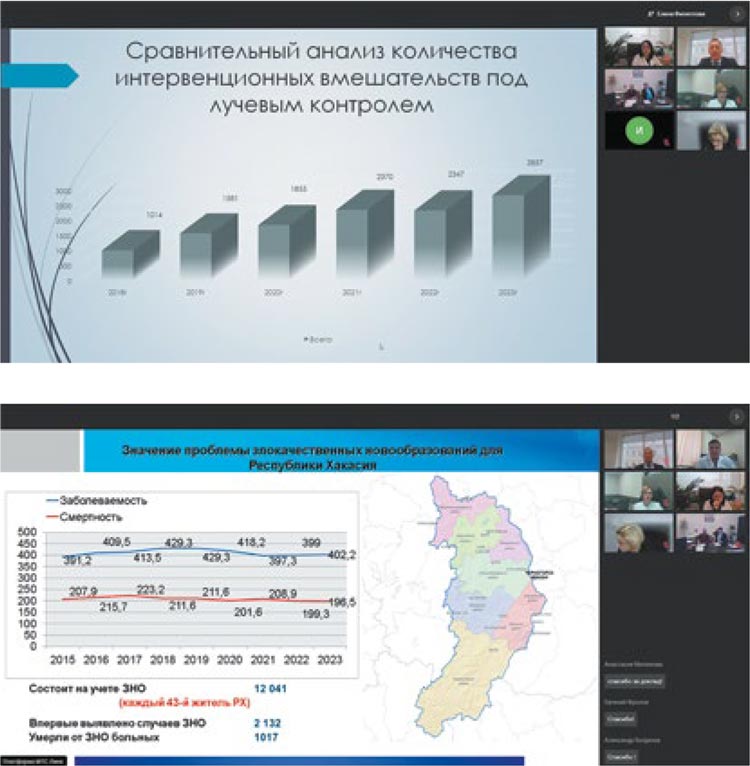
Затем председатель регионального
отделения RUSSCO в Республике
Хакассия, заместитель главного
врача по лечебной работе ГБУЗ
РХ «Республиканский клинический онкологический диспансер»,
к.м.н. Максим Олегович Максимов довел до слушателей информацию о реализации в регионе
Федеральной программы «Борьба
с онкологическими заболеваниями», в частности, о первом опыте
радиотерапевтического лечения:
«Если совсем недавно наши пациенты вынуждены были уезжать
лечиться в Красноярск, то сегодня, особенно после открытия в
2022 году радиологического корпуса, уже жителям южных районов
Красноярского края и Республики
Тыва проще приезжать к нам. Это
стало возможным в рамках реализации Федеральной программы и
помощи красноярских коллег в обучении кадров».
М.О. Максимов не стал скрывать,
что проблемы все же остаются, и
назвал две основных: недостаточное финансирование, которого
пока не хватает на содержание новейшего оборудования, и нехватка
специалистов, уже имеющих опыт
работы, способных сразу включиться в процесс лечения без дополнительного обучения.
Тему реализации Федеральной
программы в своем регионе продолжила Валерия Игоревна Павлова, главный внештатный специалист онколог Депздрава Тюменской
области, доцент кафедры онкологии, радиологии и радиотерапии
ФГБОУ ВО ТГМУ, заместитель
директора – главного врача по клинической работе ГАУЗ ТО «МКМЦ
«Медицинский город», к.м.н., сообщившая, что в регионе работают
уже 6 ЦАОПов, а в 2024 году откроются еще 2. Специалистов для них
активно готовят в местных вузах.
Валерия Игоревна напомнила, что
Тюмень была одним из первых регионов, внедривших раннюю диагностику ЗНО. Именно поэтому в
области смертность ниже, чем во
многих других регионах. Залогом
достижения хороших результатов
она назвала и централизацию онкологических служб на базе МКМЦ
«Медицинский город».
Коллеги из Оренбурга, продолжившие телемост, были восхищены
результатами тюменских врачей,
назвав их ориентиром для других.
Хотя им тоже было чем поделиться.
Лев Александрович Кудяков, главный врач ГАУЗ «Оренбургский областной клинический онкологический диспансер», доцент кафедры
онкологии ФГБОУ ВО ОрГМУ МЗ
России, к.м.н., доложил о технологиях раннего выявления онкологических заболеваний, внедренных в их области. В частности, он сказал:
«Хотя в нашей области скрининговые программы реализуются менее
трех лет, мы тоже добились положительных успехов, так, на сегодня
мы осуществляем 5 видов скрининга,
и в этом году внедрим еще два – рака
желудка и стоматологический».
Кроме того, Л.А. Кудяков отметил,
что эффективность первичной
профилактики ЗНО достигается и благодаря взаимодействию с общественными организациями и внедрению искусственного интеллекта.
«Нейромонитор: опыт применения
при операциях на щитовидной железе в условиях ГАУЗ «Брянский областной онкологический диспансер»
– так звучала тема доклада, заявленного брянскими коллегами. И надо
отметить, что ее название весьма
актуальна для этого региона, поскольку до сих пор им приходится
бороться с последствиями Чернобыльской катастрофы.
В своем выступлении врач-онколог отделения онкологии №2 ГАУЗ БООД Даниил Николаевич Гутто отметил, что проблема преобладания рака щитовидной железы у местного населения по сравнению с другими ЗНО остается. Выражается это в послепандемийном росте числа заболевших. Затем он поделился опытом применения нейромонитора, который активно используется на практике, и привел цифру – на сегодня в диспансере проведено уже 70 операций с его помощью. Были продемонстрированы и конкретные примеры его работы во время таких операций.
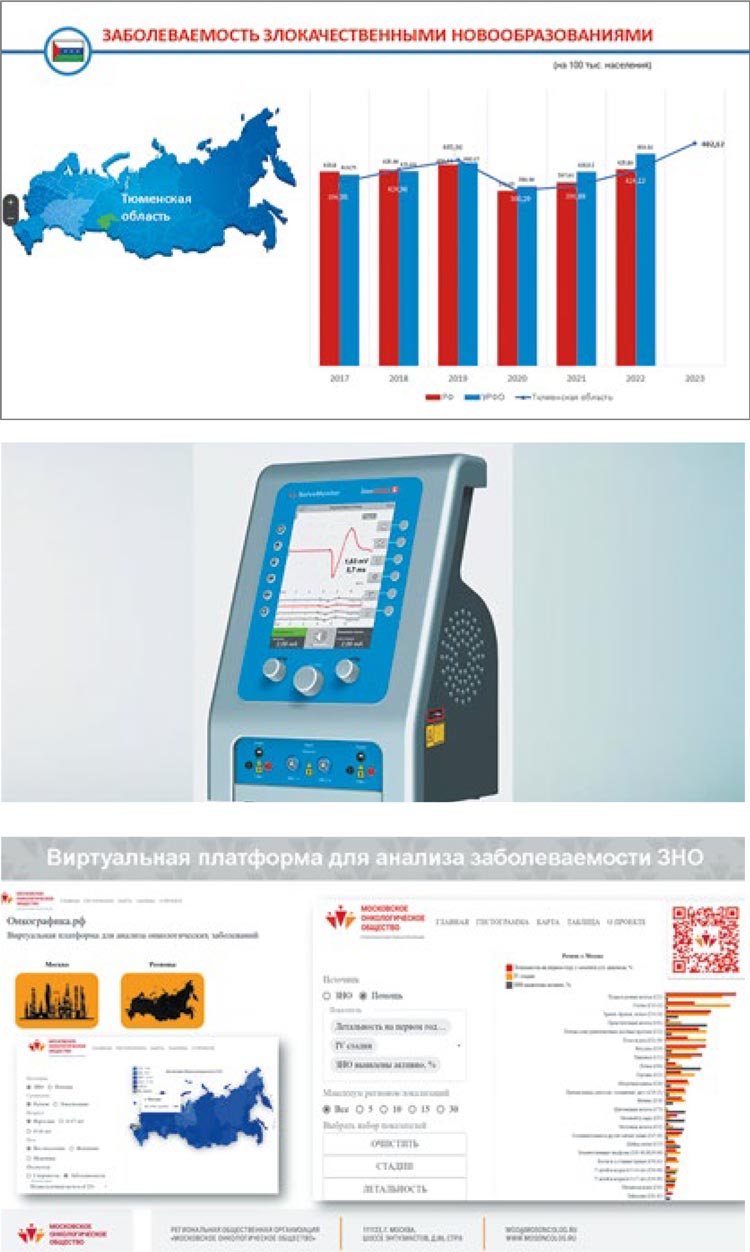
Завершала телеэстафету Москва.
Об аспектах работы Московского
онкологического общества в рамках
Федеральной программы «Борьба с
онкологическими заболеваниями»
и ее первых итогах рассказала заместитель главного внештатного
специалиста-онколога Депздрава
Москвы, профессор, д.м.н. Ирина
Ивановна Андреяшкина, которая
осветила конкретные направления
деятельности МОО: внедрение новейших препаратов в клинические
исследования, проведение аналитической работы на примере виртуальной платформы «Онкографика.
ру» (анализ заболеваемости ЗНО),
консолидация данных различных
проектов 5 онкоцентров, что позволяет делать более точные прогнозы
на ближайшее будущее.
И.И. Адреяшкина призвала коллег
из регионов вступать в МОО и подтвердила готовность делиться своими наработками и взаимодействовать со всеми заинтересованными
структурами.
В финале телемоста И.Е. Хатьков
и Д.А. Носов не только поблагодарили участников за возможность
обмена уникальным региональным
опытом, отметили, что все выступления лишний раз убеждают в необходимости чаще общаться, брать
лучшее друг у друга, повышая в
итоге эффективность и качество
лечения, но и выразили надежду на
расширение формата телемоста, вовлечение в его работу всё большего
числа регионов.
С полной версией телемоста можно
будет ознакомиться в ближайшее
время на сайте RosOncoWeb.ru.
ЗНАКОМЬТЕСЬ: РЕГИОНАЛЬНОЕ ОТДЕЛЕНИЕ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ ОРЕНБУРГСКОЙ ОБЛАСТИ
Оренбургская область – один из
крупнейших регионов Российской Федерации, входит в состав
Приволжского федерального
округа. Территория составляет
124 тыс. кв. км, население – 2033,1
тыс. чел. Область расположена
на стыке двух частей света – Европы и Азии, имеет границы с
Татарстаном, Башкортостаном и
Челябинской областью на севере,
с Казахстаном – на востоке и юге,
Самарской областью – на западе.
С учетом особенностей географического положения и протяженности
Оренбургской области онкологическая служба региона представлена
3 профильными учреждениями: на
западе области – онкологическое
отделение в составе БСМП г. Бузулук, на востоке – ГАУЗ «Орский
онкологический диспансер», центральные районы области и общее
руководство онкологической службой – ГАУЗ «ООКОД».
Оренбургская область считается
неблагоприятной с онкологической точки зрения территорией со
стабильно высоким уровнем заболеваемости злокачественными
новообразованиями в последние
годы, превышая ряд показателей по
Российской Федерации на 3-9 процентов. Ежегодно в Оренбургской
области регистрируется свыше 9000
новых случаев заболеваний ЗНО.
14 февраля 2011 года на собрании
инициативной группы сотрудников
Оренбургского областного клинического онкологического диспансера было принято решение об учреждении регионального отделения
Межрегиональной общественной
организации «Общество онкологов-химиотерапевтов», которое в
дальнейшем реорганизовано в Общероссийскую общественную организацию «Российское общество
клинической онкологии».
За время существования региональное отделение проводило активную работу по популяризации
передовых методов и технологий
в диагностике и лечении онкологических заболеваний, внедрения
основ доказательной медицины в
повседневную практику, передового опыта онкологов России и зарубежных стран. В настоящий момент
отделение насчитывает более 30
членов, планируется включение в
ряды молодых специалистов. Председателем регионального отделения
является врач-онколог Ширинкин
Вадим Борисович.

Мастер-класс «Парааортальная лимфаденэктомия в онкогинекологии»
В 2023 году на базе ГАУЗ «ООКОД»
в онлайн-формате проведены вебинары по лекарственной терапии в
урологии, лекарственной терапии
опухолей головы и шеи, опухолей
ЖКТ (сотрудниками ГАУЗ «ООКОД» представлены доклады и
клинические наблюдения), проведен мастер-класс с участием проф.
Берлева И.В. и проф. Карачуна А.М.
(ФГБУ «НМИЦ онкологии им. Н.Н.
Петрова» Минздрава России, СанктПетербург) на тему «Парааортальная
лимфаденэктомия в онкогинекологии» с выполнением операций различными хирургическими доступами. Результаты, особенности доступа
и методика выполнения лимфаденэктомии были доложены на следующий день в рамках III съезда онкологов Оренбургской области на
секционном заседании под эгидой
RUSSCO.
Наиболее незабываемым в 2023
году было мероприятие «Книготерапия RUSSCO» с участием пациентов, в том числе и детского
отделения. Маленькие пациенты онкологического диспансера
были полностью поглощены и
очарованы детским писателем
Анной Гончаровой, которая на несколько часов вырвала их и родителей из сложной суровой повседневности в мир сказок, радости и
волшебства. Также члены регионального отделения RUSSCO принимали участие во всех знаковых
мероприятиях организации –
конференции «Редкие опухоли в
онкогинекологии», «Лучшее по
материалам конференции ASCO»
и, конечно же, в XXVII Российском онкологическом конгрессе.
ДИСКУССИОННЫЙ КЛУБ «ТОЧКА ЗРЕНИЯ». КОНСЕНСУС ЭКСПЕРТОВ И МОЛОДЫХ ОНКОЛОГОВ
Новый формат онлайн-конференций успешно стартовал на площадке RUSSCO. Так, 2 декабря прошлого года и уже 27 января нынешнего
состоялось 2 заседания дискуссионного клуба, темами которых стало обсуждение вопросов организации медицинской помощи. О том,
что обсуждали молодые онкологи с
экспертами, рассказываем в нашем
пост-релизе.
2 декабря 2023 года эксперты
RUSSCO совместно с молодыми
онкологами обсудили правовые и
практические аспекты применения клинических и практических
рекомендаций, а также особенности офф-лейбл применения лекарственных препаратов. В связи
с постановлением Правительства
Российской Федерации от 17.11.2021
года №1968 «Об утверждении Правил поэтапного перехода медицинских организаций к оказанию
медицинской помощи на основе
клинических рекомендаций» все
медицинские организации должны
полностью подготовиться и перейти
на работу на основе клинических рекомендаций (далее – КР) уже в 2024
году. А пока готовился этот пострелиз, в Государственной Думе было
принято решение о переносе сроков
полного перехода на КР уже на 2025
год. И хотя сути темы дискуссии это
не меняет, вопросы правоприменения как КР, так и иных источников
информации в практике принятия
врачебных решений остаются до сих
пор. Накопив достаточно вопросов,
комитет молодых онкологов и региональный проект «Школа химиотерапевтов» вышли с инициативой
обсудить с экспертами данную тему,
подняв в том числе вопросы обновления КР, применения международных гайдлайнов, офф-лейбл назначения лекарственных препаратов и
др.
Участниками первого дискуссионного клуба стали:
- к.м.н. Румянцев А.А., ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва;
- д-р Фатеева А.В., ГБУЗ «Приморский краевой онкологический диспансер», ФГБОУ ВО ТГМУ Минздрава России, Владивосток;
- д-р Парсаданова Э.Л., ГБУЗ «Сахалинский онкологический диспансер», ФГБОУ ВО ТГМУ Минздрава России, Южно-Сахалинск;
- к.м.н. Жигулёв А.Н., ГБУЗ ПК «Пермский краевой онкологический диспансер», Пермь;
- д.м.н., профессор Зуков Р.А., главный врач КГБУЗ «Красноярский краевой клинический онкологический диспансер им. А.И. Крыжановского», заведующий кафедрой онкологии и лучевой терапии с курсом ПО, ГБОУ ВПО «Красноярский государственный медицинский университет им. проф. В.Ф. Войно-Ясенецкого», Красноярск;
- д.м.н. Новик А.В., старший научный сотрудник отдела терапевтической онкологии ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, доцент кафедры онкологии СПбГПМУ, СанктПетербург;
- к.м.н. Батухтина Ю.В., КГБУЗ «Красноярский краевой клинический онкологический диспансер им. А.И. Крыжановского», доцент кафедры онкологии и лучевой терапии с курсом ПО, ГБОУ ВПО «Красноярский государственный медицинский университет им. проф. В.Ф. Войно-Ясенецкого», Красноярск.
Обсуждение проходило на протяжении двух часов. За это время
экспертам удалось ответить на все
вопросы. Тезисно рассказываем об
итогах встречи и важных моментах,
которые стоит учесть при организации внутренних процессов оказания
медицинской помощи в своих медицинских учреждениях.
- Исполнение КР является обязательным в связи с закреплением данного требования в п.2.1 ч.1 ст.79 №323-ФЗ. Однако КР не подменяют мышления врача, в связи с чем стоит не забывать о персональной ответственности врача за каждое принятое решение.
- Актуальными и утвержденными КР являются только КР, размещенные в рубрикаторе Минздрава России. Даже КР, действующие до 2022 года, если они по-прежнему размещены в Рубрикаторе, являются актуальными и требующими исполнения. При этом важно знать, что конец 2023 года и январь 2024 года будут ознаменованы публикацией обновленных КР по некоторым нозологиям.
- Практические рекомендации RUSSCO по поддерживающей терапии являются важной составляющей КР. Фактически ссылки на рекомендации RUSSCO, размещенные в КР, приравнивают их к КР и делают обязательными.
- Любое несовпадение рекомендаций RUSSCO по лечению пациентов с КР, также как несовпадение с иными источниками (например, международные гайдлайны), требует согласования тактики на первом этапе через Врачебную комиссию. Стоит четко различать в медицинской организации понятия и функционал Врачебной комиссии и Врачебного консилиума и проработать данный вопрос с врачами в своих медицинских организациях.
- КР могут содержать в себе оффлейбл назначения. В тексте КР данные назначения отмечаются знаком «#». Для назначений офф-лейбл лекарственных препаратов, включенных в КР, не требуется особых правил. Решение о назначении в таком случае может принять врачебный консилиум, включающий в себя врача – радиотерапевта, химиотерапевта и хирурга (согласно Приказу Минздрава России №116н).
- Для назначения офф-лейбл, включенных в иные источники, следует соблюдать следующий алгоритм: назначение рассматривает и подтверждает Врачебная комиссия, пациент подписывает информированное добровольное согласие на применение терапии вне инструкции к препарату, после чего может быть сформирован врачебный консилиум.
- Так как Врачебная комиссия и Консилиум регулируются соответствующими Приказами и Порядками Минздрава России, в случае выбора тактики, не включенной в КР, медицинская документация должна содержать оба протокола. Подмена одного понятия другим не допускается.
- КР являются одной из важных составляющих клинико-статистических групп (далее – КСГ). Фактически любой вид лечения, отсутствующий в КР, не попадает в КСГ. В случае лекарственной терапии любая схема, отсутствующая в КСГ, может кодироваться только по схемам «прочие». Убыточность применения данной схемы не должна стать причиной отказа от назначения того или иного вида лечения, если у пациента имеются жизненные показания. Аналогично это касается любых отрицательных схем в КСГ.
- КР являются не единственным важным источником, необходимым для исполнения в каждой медицинской организации. Стандарты медицинской помощи, КР и порядок организации – три «кита», на которых основывается организация медицинской помощи. Соблюдение всех трех является обязательным.
27 января специалисты обсудили изменения в КСГ 2024 года. Специальным гостем и экспертом заседания стала начальник отдела способов оплаты медицинской помощи управления экономики и финансирования здравоохранения ФГБУ ЦЭККМП Минздрава России Оксана Сергеевна Плахотник, которая презентовала коллегам ключевые изменения в КСГ на 2024 год.
Как показал анализ утвержденных
бюджетов и опубликованной в 2023
году программы государственных
гарантий, финансирование медицинской помощи в 2024 году в большей степени заточено на развитие
профилактики, амбулаторной помощи и диспансерного наблюдения,
нежели на вошедшее в практику последних лет совершенствование стационарной медицинской помощи.
Изменения коснулись и стационарной помощи по онкологии.
Во втором заседании дискуссионного клуба приняли участие:
- к.м.н. Румянцев А.А., ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва;
- д-р Фатеева А.В., ГБУЗ «Приморский краевой онкологический диспансер», ФГБОУ ВО ТГМУ Минздрава России, Владивосток;
- •к.м.н. Жигулёв А.Н., ГБУЗ ПК «Пермский краевой онкологический диспансер», Пермь;
- д.м.н., профессор Зуков Р.А., главный врач КГБУЗ «Красноярский краевой клинический онкологический диспансер им. А.И. Крыжановского», заведующий кафедрой онкологии и лучевой терапии с курсом ПО, ГБОУ ВПО «Красноярский государственный медицинский университет им. проф. В.Ф. Войно-Ясенецкого», Красноярск;
- к.м.н. Комаров Ю.И., заместитель директора по организационнометодической работе, доцент методического аккредитационносимуляционного центра ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, Санкт-Петербург;
- •д-р Евдокимов В.И., заведующий онкологическим отделением №1 в ЦАОП ММКЦ «Коммунарка», Москва.
Кроме того, к обсуждению подключились члены правления RUSSCO и
специалисты из регионов. Обсуждение было посвящено вопросам
лекарственной терапии. Вот тезисы
прошедшего обсуждения.
- В основе модели расчета объема финансирования противоопухолевой лекарственной терапии в 2024 году учтены средневзвешенные фактические закупочные цены на лекарственные препараты.
- Кроме того, увеличены используемые в расчетах стоимости противоопухолевой лекарственной терапии показатели массы и площади поверхности тела взрослого пациента по профилю «онкология»: с 70 кг до 72,3 кг и с 1,79 м2 до 1,83 м2.
- КСГ 2024 года обновилось с учетом клинических рекомендаций по 7 нозологиям, обновления которых состоялись в 2022 году. Так, в группировщике появились комбинации BRAF-ингибиторов с цетуксимабом, внесены изменения в схемы противоопухолевой лекарственной терапии сарком. К сожалению, в новый группировщик не вошли схемы из клинических рекомендаций 2023 года (меланома, рак мочевого пузыря и рак почки), в связи с чем становится затруднительным исполнять обновленные клинические рекомендации. Единственным вариантом применения новых схем может быть использование кода «прочие схемы: sh9003».
- В новый группировщик добавлены 33 новые схемы. Отличной новостью стало включение в КСГ схем с применением эмпегфилграстима 7,5 мг. Исключено 25 схем, включая схемы с препаратами из списка неЖНВЛП. Эти изменения коснулись наб-паклитаксела и алпелисиба. Единственной альтернативой применения схем с препаратами неЖНВЛП, в том числе других препаратов, отсутствующих в КСГ (например, трабектидин, трастузумаб дерукстекан), может быть разгруппировка под кодом st36.012. Данную работу необходимо проводить с территориальным фондом ОМС в своем регионе. Важно помнить, что для разгруппировки данного кода КСГ нельзя использовать международные непатентованные и торговые наименования лекарственных препаратов.
- В 2024 году разработана многоуровневая система КСЛП, по 3 уровня для круглосуточного и дневного стационаров. КСЛП разработано для сопроводительной терапии. Если в 2023 году существовал только один уровень КСЛП с коэффициентами для круглосуточного стационара 0,63 (16 360,14 руб.) и дневного стационара 1,20 (18 034,92 руб.), то в 2024 году минимальное значение коэффициента для круглосуточного стационара составило 0,17 (4 760,66 руб.), а максимальное – 1,53 (42 845,95), 0,29 (4 647,52) и 2,67 (42 789,26) для дневного стационара соответственно.
- Новшество 2024 года связано с особым контролем по 19 наименованиям противоопухолевых лекарственных препаратов, перед назначением которых требуется обязательное предварительное проведение молекулярно-генетических и/или иммуногистохимических исследований. Среди этих препаратов оказались: абемациклиб, алектиниб, вемурафениб, гефитиниб, дабрафениб, кобиметиниб, кризотиниб, лапатиниб, олапариб, осимертиниб, палбоциклиб, панитумумаб, пертузумаб, рибоциклиб, талазопариб, траметиниб, трастузумаб, трастузумаб эмтанзин, церитиниб. Это означает, что медицинским организациям придется в обязательном порядке предоставлять сведения о результатах проведенных молекулярно-генетических или иммуногистохимических исследований перед подачей закрытых случаев с указанными препаратами на оплату. Наилучшим выходом из этой ситуации для медицинских организаций является качественное оформление протоколов врачебных консилиумов, в которых будут отражены все необходимые результаты исследований пациента. Планируется, что список препаратов «на особом контроле» будет расширяться.
- Наибольшее количество обсуждений в дискуссии вызвали вопросы дефицитности и профицитности схем. Возможно ли составить КСГ так, чтобы все схемы были профицитными? Ответ – однозначно нет. Необходимо понимать, что КСГ разработаны с учетом соблюдения экономического баланса, при котором любой дефицит перекрывается профицитом.
- Сопроводительная терапия. В ходе обсуждения эксперты коснулись и вопроса компенсирования расходов на сопроводительную терапию вне КСЛП. В результате была анонсирована совместная работа ЦЭККМП и экспертов RUSSCO в части разработки отдельных КСГ на различные виды сопроводительной терапии. Данный проект планируется реализовать до конца 2024 года, и ориентировочно в 2025 году мы будем ожидать КСГ для сопроводительной терапии.
Подробности обсуждений можно будет просмотреть на сайте RosOncoWeb.ru.
Фатеева Анастасия Валерьевна
ЕЩЕ РАЗ ОБ АНТРАЦИКЛИНАХ ПРИ ПРОВЕДЕНИИ АДЪЮВАНТНОЙ ХИМИОТЕРАПИИ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ
Автор: С.А.Тюляндин
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России ,
профессор, доктор медицинских наук, Москва
Многие годы антрациклины являлись основой комбинаций для
лечения рака молочной железы.
Однако их потенциальная отсроченная кардиотоксичность
и риск индукции острых миелоидных лейкозов был стимулом
создания безантрациклиновых
комбинаций, обладающих сравнимой эффективностью, но меньшей токсичностью. Особенно
это актуально при проведении
адъювантной химиотерапии у
больных с операбельным раком
молочных желез с ожидаемой
длительной продолжительностью
жизни. Проведенные сравнительные исследования адъювантной
химиотерапии антрациклиновыми и безантрациклиновыми комбинациями привели к выводу об
их примерно равной эффективности у больных люминальными
фенотипами и большей противоопухолевой эффективностью
антрациклиновых комбинаций
у больных с тройным негативным раком. В то же время их недавний метаанализ EBCTCG,
включивший 100 000 больных
HER2-негативным раком молочной железы сделал вывод о преимуществе антрациклиновых
комбинаций независимо от возраста, фенотипа и стадии пациенток. Этот метаанализ анализировал 86 рандомизированных
исследований, многие из которых
были проведены много лет назад и использовали устаревшие с
позиции сегодняшнего дня комбинации. Вот почему интересны
результаты совместного анализа
3 крупных рандомизированных
исследований, которые сравнивали 6 курсов популярных комбинаций таксанов (доцетаксела или
паклитаксела) с циклофосфамидом и 6 курсов тройной комбинации, содержащей таксаны, циклофосфамид и доксорубицин.
В совместный анализ были
включены 4181 больная HER2-
негативным фенотипом, участвующих в исследованиях USOR-06-
090, B-46 и B-49, 35% из которых
были моложе 50 лет, у 69% определялась экспрессия рецепторов
эстрогенов и/или прогестерона,
у 40% отсутствовали метастазы в
регионарные лимфоузлы и у 51%
опухоль характеризовалась высокой степенью злокачественности.
Основной задачей объединенного
анализа было доказательство не
худшей инвазивной безрецидивной выживаемости (ИБРВ) таксан-содержащих комбинаций по
сравнению с антрациклиновыми
(дизайн non-inferiority). При медиане наблюдения 7 лет 5-летняя
ИБРВ составила 85,1% и 86,7%
соответственно с увеличением
риска прогрессирования при использовании таксан-содержащих
комбинаций на 14% (HR=1,14; 95%
ДИ 1,04-1,25) c выходом верхней
границы доверительного интервала за предельно допустимую
величину 1,18. Это означает недоказанность не худшей эффективности таксановых комбинаций по
показателю ИБРВ. Использование
антрациклин-содержащих комбинаций достоверно уменьшало
риск развития рецидива заболевания, но увеличивало риск кардитоксичности (8 и 3 больных),
лейкоза (7 и 1) и смерти от причин,
не связанных с раком молочной
железы (62 и 34). Все это привело
к выравниванию показателей общей 5-летней выживаемости, которая составила 91,8% и 92,4% для
таксан- и антрациклин-содержащих комбинаций соответственно.
При подгрупповом анализе ИБРВ
антрациклин-содержащие комбинации демонстрировали достоверное преимущество у больных
с тройным негативным раком,
во всех других подгруппах достоверной разницы не отмечено.
Общая выживаемость во всех изученных подгруппах достоверно
не отличалась.
Авторы делают вывод, что результаты объединенного анализа не дали основания утверждать о не меньшей эффективности таксан-содержащих комбинаций по сравнению с антрациклиновыми. Последние достоверно эффективнее у больных тройным негативным фенотипом за счет снижения риска прогрессирования, но одновременного увеличения поздних осложнений (кардиотоксичности, вторичного лейкоза) и риска смерти от других причин, не связанных с раком молочной железы, у всех больных. Отсутствие достоверного выигрыша по ИБРВ и равная общая выживаемость у больных люминальными фенотипами указывает, что большинству больных с экспрессией рецепторов стероидных гормонов достаточно проведения таксан-содержащей адъювантной химиотерапии. Для больных тройным негативным раком антрациклины остаются важным компонентом комбинаций для адъювантного лечения. В практических рекомендациях RUSSCO от 2023 года именно таксан-содержащие комбинации (TC 4 или 6 курсов в зависимости от риска прогрессирования) указаны как приоритетные для проведения адъювантной химиотерапии люминального рака молочной железы высокого риска.
Литература:
- Early Breast Cancer Trialists’ Collaborative Group (EBCTCG). Anthracycline-containing and taxanecontaining chemotherapy for earlystage operable breast cancer: A patientlevel meta-analysis of 100,000 women from 86 randomised trials. Lancet. 2023; 401: 1277-1292.
- Geyer CE, Blum JL, Yothers G, et al. Long-term follow-up of the anthracyclines in early breast cancer trials (USOR 06-090, NSABP B-46-I/ USOR 07132, and NSABP B-49 [NRG Oncology]). J.Clin.Oncol. Published online: February 9, 2024.
РАКФОНД ОБЪЯВЛЯЕТ НОВЫЙ КОНКУРС НАУЧНО-ИССЛЕДОВАТЕЛЬСКИХ ПРОЕКТОВ В ОБЛАСТИ ОНКОЛОГИИ

До 15 апреля принимаются заявки на проведение исследований по следующим направлениям:
- Клинические исследования: интервенционные, рандомизированные (предпочтительно), направленные на изучение методов и средств профилактики, диагностики, мониторинга и лечения злокачественных новообразований, реабилитации и качества жизни онкологических больных.
- Трансляционные исследования: поиск и изучение биомаркеров для диагностических и прогностических целей, подбора терапии.
- Фундаментальные исследования.

Победитель конкурса получит финансирование
от РакФонда в размере до 1 миллиона рублей
на выполнение исследовательского проекта.
Регистрация заявок до 10 апреля 2024 года.
Результаты конкурса будут объявлены 1 июля 2024 года.
Подробные условия участия в конкурсе и инструкции
по подаче заявок: www.rakfond.org/rfp-2024-01-ru/
SAN ANTONIO BREAST CANCER SYMPOSIUM 2023 ГЛАЗАМИ УЧАСТНИКА
Авторы: Криворотько Пётр Владимирович
ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России,
доктор медицинских наук, профессор, Санкт-Петербург
Амиров Николай Сергеевич
ФГБУ «НМИЦ онкологии им. Н.Н. Петрова»
Минздрава России, Санкт-Петербург
В начале декабря 2023 года в городе Сан Антонио (штат Техас,
США) прошел 46 ежегодный симпозиум по раку молочной железы. Одна из крупнейших в мире
конференций собрала около 10
000 участников из 102 стран. Основными темами, которые были
освещены в рамках симпозиума,
стали деэскалация локорегионарных методов воздействия и индивидуализация лечения с использованием таргетных препаратов.
Деэскалация
локорегионарного лечения
Интересными с точки зрения
снижения объема лечебного воздействия на аксиллярную область
без ухудшения онкологических
результатов стали результаты
исследований SENOMAC и NRG
Oncology/NSABP B-51/RTOG
1304, а также результаты метаанализа EBCTCG.
В соответствии с результатами
исследования SENOMAC возможно отказаться от выполнения
аксиллярной лимфодиссекции
(АЛД) у пациентов, которым первым этапом выполнено оперативное вмешательство и у которых
выявлены метастазы в 1 или 2
сигнальных лимфоузлах, в том
случае, если в дальнейшем возможно проведение лучевой терапии.
В исследование включались пациенты с диагнозом рак молочной железы (РМЖ) сТ1-3N0M0,
которым в качестве первого этапа лечения выполнялось хирургическое вмешательство; 89%
пациентов в обеих группах в последующем подверглись лучевой терапии, включая облучение
лимфоузлов. Всего в исследование было включено 2540 больных
с 1-2 пораженными сигнальными
лимфатическими узлами, которые были рандомизированы в
две группы: группа аксиллярной
лимфодиссекции (n=1205) и группа без аксиллярной лимфодиссекции (n=1335)
Цель исследования, крупнейшего
на сегодняшний день по данному
вопросу, состояла в том, чтобы
заполнить пробелы в существующих данных. Аналогичные
результаты были получены в исследовании ACOSOG Z0011 около
десяти лет назад, но обширные
критерии исключения вызвали
вопросы об экстраполяции полученных данных на общую популяцию пациентов. Отталкиваясь
от этого, формировались критерии включения в исследование
SENOMAC. Мастэктомия была
выполнена у 36,2% пациенток, наличие экстранодального распространения наблюдалось у 34,3%,
Т3 стадия была в 5,8% случаев,
почти 20% пришлось на дольковую карциному, 40% были в возрасте 65 лет и старше, а медианный размер опухоли составил 20
(0,2-155) мм.
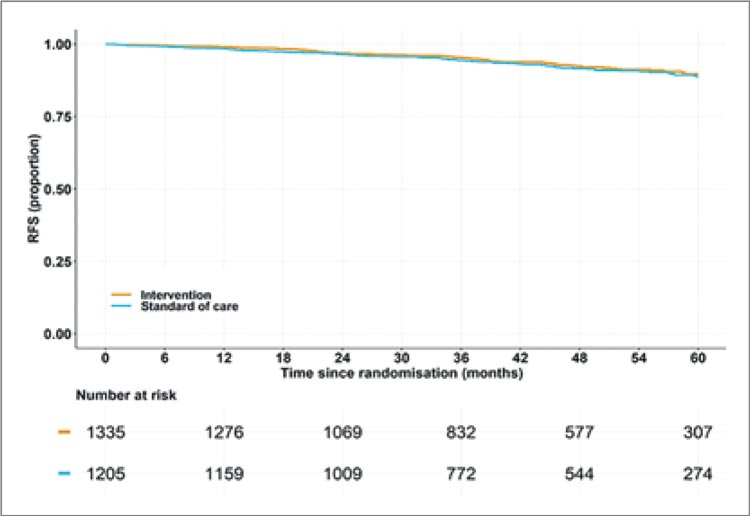
При медиане наблюдения 47 месяцев безрецидивная выживаемость (БРВ) была практически
идентичной в обеих группах: рецидивы наблюдались у 8% пациентов в группе выполнения лимфодиссекции и у 7,1% в группе без
лимфодиссекции. Рассчитанная
5-летняя БРВ составила 88,7%
в группе АЛД против 89,7% в
группе без АЛД (HR 0,89; 95% ДИ
0,66-1,19; non-inferiority р<0,001)
(рис.1).
Рисунок 1.
Результаты исследования SENOMAC:
рассчитанная 5-летняя безрецидивная выживаемость.
В течение 2 лет ожидаются данные
по общей выживаемости, которая
является первичной конечной точкой исследования. По данным подгруппового анализа результаты исследования не зависели от объема
операции, стадии, возраста, количества пораженных лимфоузлов и
биологического подтипа опухоли.
Таким образом, у пациентов с первичным РМЖ стадии Т1-3N0 с 1
или 2 метастатически пораженными лимфоузлами возможно отказаться от выполнения аксиллярной
лимфодиссекции вне зависимости
от объема оперативного вмешательства на молочной железе, при условии, что в дальнейшем будет проведена лучевая терапия.
На этой же сессии был представлен
доклад Совместной группы по исследованию раннего рака молочной
железы (Early Breast Cancer Trialists’
Collaborative Group, EBCTCG), известной в онкологическом сообществе крупными метаанализами.
Продемонстрированы результаты
метаанализа, включавшего 20285
женщин из почти 30 различных
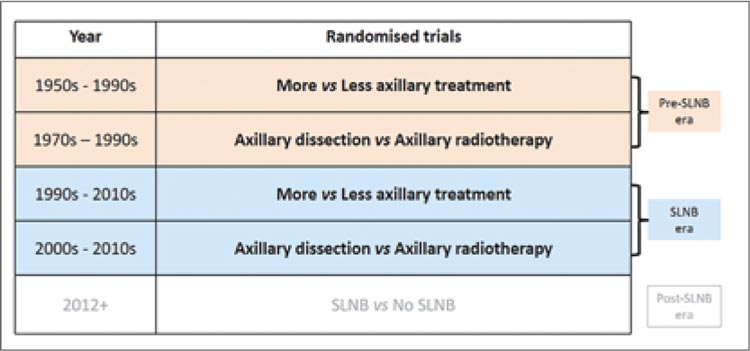
исследований, в котором сравнивалось влияние объема хирургического вмешательства на частоту рецидивов и на частоту осложнений.
Объем хирургического вмешательства был разделен на «больший объем» и «меньший объем» в связи с тем, что в метаанализе использовались исследования за период с 1950 по 2010 гг. В течение этого времени аксиллярная хирургия прошла через несколько ключевых периодов, включая период исследований до изучения биопсии сигнальных лимфатических узлов (БСЛУ), период исследований непосредственно БСЛУ и период после БСЛУ (рис.2).
Рисунок 2.
Метаанализ EBCTCG: распределение
проанализированных исследований на периоды
При медиане наблюдения 10 лет частота локорегионарных рецидивов
не отличалась между пациентами,
перенесшими более или менее обширную операцию на аксиллярной
области (RR 0,91; 95% ДИ 0,78-1,06;
Р=0,22). Авторы продемонстрировали аналогичные результаты в отношении отдаленных рецидивов,
смертности от рака молочной железы и смерти от любых причин.
Однако колоссальная разница наблюдалась в частоте осложнений.
Для оценки частоты развития лимфедемы авторы оценивали относительно недавние исследования, которые наиболее релевантны в плане
современного лечения.
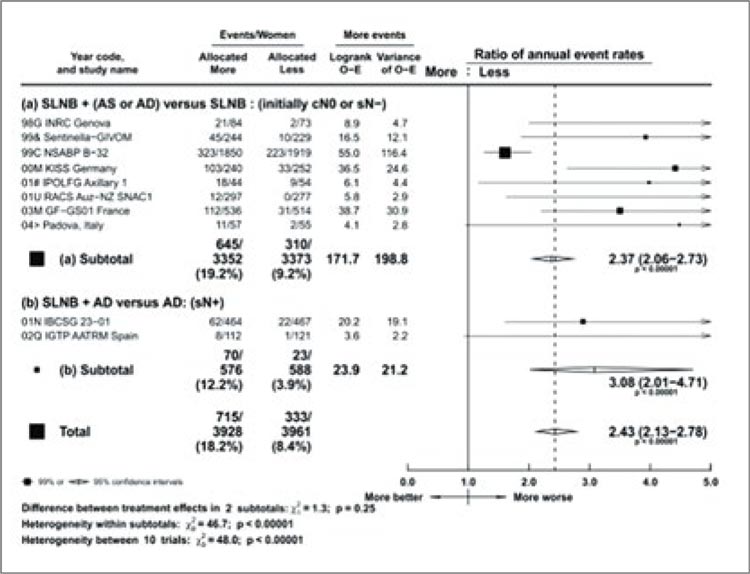
Частота развития лимфедемы в
группе более обширного хирургического вмешательства была в 2,5
раза больше по сравнению с менее
обширным хирургическим вмешательством (OR 2,43; 95% ДИ 2,13-
2,78) (рис.3).
Рисунок 3.
Метаанализ EBCTCG: риск развития лимфедемы
в зависимости от объема выполненного хирургического
вмешательства.
Еще одним важным исследованием
в области регионарного лечения, результаты которого были представлены на SABCS 2023, является NRG
Oncology/NSABP B-51/RTOG 1304.
Давно ведутся споры о необходимости облучения зон регионарного
лимфооттока при конверсии статуса
лимфоузлов из позитивного в негативный на фоне неоадъювантной
системной терапии. В это исследование было включено 1556 женщин,
которые были рандомизированы в
две группы: группу облучения регионарных лимфоузлов (n=821) и группу
без облучения регионарных лимфоузлов (n=820). Средний возраст составил 52 года. Около 60% опухолей
соответствовали стадии Т2, а остальные поровну были распределены
между стадиями Т1 и Т3. Трижды
негативный биологический подтип
наблюдался в почти 25% случаев, около 50% случаев были представлены
HER2-позитивными опухолями. Распределение между объемом хирургического вмешательства на молочной
железе (мастэктомия и органосохранные операции) и на подмышечной области (АЛД против БСЛУ) было приблизительно одинаковым.
У всех пациенток статус лимфатических узлов соответствовал стадии
cN1, что подтверждалось с помощью
биопсии на момент постановки диагноза. Для включения в исследование
по результатам послеоперационного
гистологического заключения статус
лимфоузлов должен был соответствовать стадии ypN0. В качестве первичной конечной точки оценивался
интервал без инвазивного рецидива рака молочной железы (Invasive
Breast Cancer Recurrence-free Interval,
IBCRFI). По результатам исследования статистически значимой разницы
между группами не наблюдалось. Так,
в группе облучения IBCRFI составил 92,7%, а в группе без облучения
– 91,8% (HR 0,88; 95% ДИ 0,60-1,29;
p=0,51) (рис.4).
Рисунок 4.
Результаты исследования NRG Oncology/NSABP
B-51/RTOG 1304: интервал без инвазивного рецидива рака
молочной железы (IBCRFI).
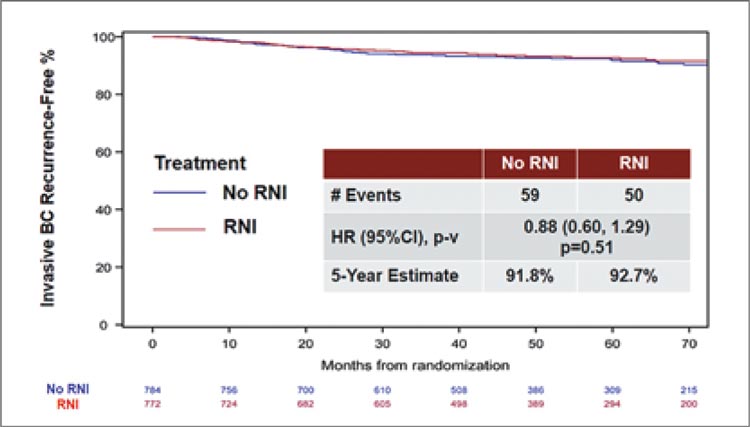
5-летняя выживаемость без заболевания (disease-free survival, DFS) также
статистически значимо не отличалась
между подгруппами: 88,5% в группе
облучения и 88,3% в группе без облучения регионарных лимфоузлов (HR
1,06; 95% ДИ 0,79-1,44; p=0,69).
HER2-позитивный рак
молочной железы
Окончательные результаты исследования KATHERINE подтвердили преимущество адъювантного назначения
препарата трастузумаб-эмтанзин (TDM1) по сравнению со стандартным
трастузумабом у пациентов с резидуальной опухолью после неоадъювантной терапии по поводу HER2-
позитивного РМЖ.
В исследование было включено 1486
пациентов, которые были рандомизированы 1:1 в группу T-DM1 или
в группу трастузумаба. В 2018 году
были представлены первые результаты, согласно которым назначение
T-DM1 приводило к статистически
значимому улучшению показателей
3-летней выживаемости без инвазивного заболевания по сравнению с
трастузумабом (88,3% против 77%).
Однако для оценки общей выживаемости требовалось более длительное наблюдение. Представленный
на SABCS окончательный анализ позволил заполнить этот пробел и подтвердить эффективность назначения
T-DM1.
Семилетняя выживаемость без инвазивного заболевания составила 80,8%
в группе T-DM1 против 67,1% в группе трастузумаба (HR 0,54; 95% ДИ
0,44-0,66; p<0,0001). Семилетняя общая выживаемость составила 89,1%
против 84,4% в группе T-DM1 и в
группе трастузумаба соответственно
(HR 0,66; 95% ДИ 0,51-0,87; p=0,0027)
(рис.5).
Рисунок 5.
Результаты исследования KATHERINE: 7-летняя
общая выживаемость.

Анализ безопасности не показал новых побочных эффектов при более
длительном наблюдении, а нежелательные явления 3 степени и выше наблюдались только у 0,4% пациентов в
обеих группах.
Интересными данными в рамках постерной сессии поделились авторы
исследования APHINITY. Представлен подгрупповой анализ эффективности назначения двойной таргетной
блокады в адъювантном режиме по
сравнению с назначением только трастузумаба в зависимости от статуса
рецепторов эстрогена (ER) и рецепторов HER2. В анализ были включены
4782 пациента. Польза от добавления
пертузумаба наблюдалась во всех подгруппах (HR 0,77; 95% ДИ 0,65-0,92).
Наибольший выигрыш наблюдался
в подгруппе пациентов с HER2 FISH
low/ER+ опухолями (рис.6).
Рисунок 6. Результаты исследования APHINITY: forest plot для выживаемости без инвазивного заболевания.

HER2 FISH классифицировался на
следующие категории: low (2≤FISH<5)
и high (FISH≥5). Обе категории в соответствии с алгоритмами Колледжа
американских патологов классифицируют РМЖ как HER2-позитивный.
HR-позитивный рак
молочной железы
Одной из самых обсуждаемых
тем стало представление результатов исследования INAVO120, в
котором изучалась роль препарата инаволисиба в комбинации с
палбоциклибом и фулвестрантом
в качестве 1 линии терапии у пациентов с PIK3CA-мутированным
HR-позитивным HER2-негативным
местнораспространенным или метастатическим раком молочной железы. В группе сравнения пациенты
получали плацебо в комбинации с
палбоциклибом и фулвестрантом.
Обязательным критерием включения было прогрессирование заболевания во время лечения или в
течение 12 месяцев после завершения адъювантной гормонотерапии
и отсутствие предшествующей терапии по поводу метастатического
заболевания.
В исследование включено 325 пациентов. В качестве первичной конечной точки оценивалась выживаемость без прогрессирования (ВБП),
которая составила 15,0 мес. в группе инаволисиба и 7,3 мес. в группе
плацебо (HR 0,43, 95% ДИ 0,32-0,59;
p<0,0001) (рис.7). Период наблюдения был недостаточным для оценки
общей выживаемости, тем не менее, наблюдался позитивный тренд
в пользу применения инаволисиба
(stratified HR 0,64; 95% ДИ 0,43-0,97;
p=0,0338 (заложенный статистически значимый порог p<0,0098)).
Рисунок 7. Результаты исследования INAVO120: выживаемость без прогрессирования.

В рамках этой же сессии были представлены окончательные результаты
исследования NATALEE. В это исследование было включено 1748 пациентов с HR+/HER2- ранним РМЖ
(стадия II и III). Пациенты были
рандомизированы 2:1 в группу адъювантного назначения препарата
из группы ингибиторов ароматазы
в комбинации с рибоциклибом и в
группу назначения только ингибиторов ароматазы (анастразол или
летрозол). Представленные 3-летние результаты продемонстрировали преимущество назначения
рибоциклиба в отношении выживаемости без инвазивного заболевания: 90,7% против 87,6% (HR
0,749; 95% ДИ 0,628-0,829; p=0,0006)
(рис.8).
Рисунок 8. Результаты исследования NATALEE: 3-летняя выживаемость без инвазивного заболевания.

В 3-летних показателях общей выживаемости (HR 0,892; 95% ДИ 0,661-1,203) не было показано статистически значимых различий. Однако для достоверной оценки требуется более длительное наблюдение.
Представлены результаты исследования MONARCH-3, в котором изучалась роль ингибитора CDK4/6
абемациклиба в комбинации с одним из ингибиторов ароматазы в
качестве первой линии терапии
постменопаузальных женщин с распространенным HR+/HER2- РМЖ.
Ранее опубликованные данные по
выживаемости без прогрессирования: 28,2 мес. в группе абемациклиба и 14,8 мес. в группе только ингибитора ароматазы (HR 0,540; 95%
ДИ 0,418-0,698; p=0,000002) привели к повсеместному одобрению для
рутинного применения регуляторными органами по всему миру.
Показатели общей выживаемости
были представлены на SABCS 2023
и составили 66,8 мес. в группе применения абемациклиба и 54,7 мес.
в группе без абемациклиба (HR
0,804; 95% ДИ 0,637-1,015; p=0,0664)
(рис.9).
Рисунок 9. Результаты исследования MONARCH-3: общая выживаемость.
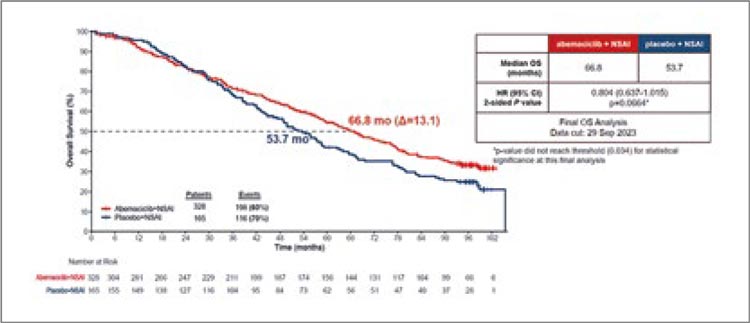
Рисунок 10. Результаты исследования KEYNOTE-756: частота достижения pCR в зависимости от экспрессии PD-L1.

Рисунок 11. Результаты исследования Checkmate-7FL: частота достижения pCR в зависимости от экспрессии PD-L1 и от используемого метода определения экспрессии PD-L1.

Несмотря на то, что разница между
группами составила 13,1 мес. и клиническая значимость применения
абемациклиба не вызывает сомнений, достичь статистически значимых различий исследователям не
удалось.
Иммунотерапия при раннем
раке молочной железы
На данный момент существуют
данные об эффективности иммунотерапии только при трижды негативном РМЖ. На SABCS 2023
были представлены предварительные результаты исследований
KEYNOTE-756 и Checkmate-7FL, в
которых иммунотерапия применяется при HR-позитивном РМЖ.
В исследовании KEYNOTE-756 препарат пембролизумаб используется в неоадъювантном режиме в комбинации с химиотерапией по сравнению с плацебо в комбинации с химиотерапией у пациентов с ранним HR+/HER2- РМЖ. В качестве первичных конечных точек оценивается частота достижения полного патоморфологического ответа (pCR) и бессобытийная выживаемость (EFS). Представленные результаты промежуточного анализа демонстрируют частоту pCR 24,3% в группе пембролизумаба и 15,6% в группе плацебо (∆ 8,5 [4,2–12,8]; p=0,0005). В подгрупповом анализе в зависимости от экспрессии PD-L1 наибольшая частота достижения pCR наблюдалась при PD-L1 CPS ≥20 и составила 53,6% в группе пембролизумаба против 36,4% в группе плацебо (∆ 17,4 [5,1–29,1]).
Похожие результаты наблюдаются в
исследовании Checkmate-7FL, в котором изучается роль применения препарата ниволумаб в неоадъювантном
режиме в комбинации с химиотерапией по сравнению с группой плацебо с химиотерапией у пациентов
высокого риска с HR+/HER2- РМЖ
низкой степени дифференцировки.
В качестве первичной конечной точки оценивалась частота достижения
pCR. Предварительные результаты
были доложены на конгрессе ESMO
2023: частота pCR в группе ниволумаба составила 24,5% против 13,8% в
группе только химиотерапии (∆ 10,5
[4,0–16,9]; p=0,0021). В рамках SABCS
2023 доложены результаты подгруппового анализа эффективности в
зависимости от различных биомаркеров, в том числе в зависимости от
используемого метода определения
PD-L1. Частота достижения pCR при
использовании метода Ventana PDL1 SP142 и при результате PD-L1 ≥1
составила 44,3% в группе ниволумаба и 20,2% в группе плацебо (∆ 24,1
[10,1–36,7]). Частота достижения pCR
при использовании метода Dako 28-8
алгоритм CPS и при результате CPS
≥20 составила 78,9% в группе ниволумаба и 26,7% в группе плацебо (∆ 52,3
[18,6–72,4]).
Источники:
- Jana de Boniface. Recurrence-free survival following sentinel node-positive breast cancer without completion axillary lymph node dissection – first results from the international randomized SENOMAC trial. SABCS 2023. Oral presentation. GS02-06.
- Gurdeep Mannu. Overview of Axillary Treatment in Early Breast Cancer: patientlevel meta-analysis of long-term outcomes among 20,273 women in 29 randomised trials. SABCS 2023. Oral presentation. GS02-05.
- Eleftherios Mamounas. Loco-Regional Irradiation in Patients with Biopsy-proven Axillary Node Involvement at Presentation Who Become Pathologically Node-negative After Neoadjuvant Chemotherapy: Primary Outcomes of NRG Oncology/ NSABP B-51/RTOG 1304. SABCS 2023. Oral presentation. GS02-07.
- Sibylle Loibl. Phase III study of adjuvant ado-trastuzumab emtansine vs trastuzumab for residual invasive HER2-positive early breast cancer after neoadjuvant chemotherapy and HER2- targeted therapy: KATHERINE final IDFS and updated OS analysis. SABCS 2023. Oral presentation. GS03-12.
- Evandro de Azambuja. The benefit of adjuvant pertuzumab and trastuzumab according to estrogen receptor and HER2 expression: sub-analysis of the APHINITY trial. SABCS 2023. Oral poster presentation. PS09-04.
- Komal Jhaveri. Phase III study of inavolisib or placebo in combination with palbociclib and fulvestrant in patients with PIK3CA-mutant, hormone receptorpositive, HER2-negative locally advanced or metastatic breast cancer: INAVO120 primary analysis. SABCS 2023. Oral presentation. GS03-13.
- Gabriel Hortobagyi. Ribociclib (RIB) + nonsteroidal aromatase inhibitor (NSAI) as adjuvant treatment in patients with HR+/ HER2− early breast cancer: final invasive disease–free survival (iDFS) analysis from the NATALEE trial. SABCS 2023. Oral presentation. GS03-03.
- Matthew Goetz. MONARCH 3: Final overall survival results of abemaciclib plus a nonsteroidal aromatase inhibitor as first-line therapy for HR+, HER2- advanced breast cancer. SABCS 2023. Oral presentation. GS01-12.
- Joyce O'Shaughnessy. Phase 3 study of neoadjuvant pembrolizumab or placebo plus chemotherapy, followed by adjuvant pembrolizumab or placebo plus endocrine therapy for early-stage high-risk ER+/ HER2− breast cancer: KEYNOTE-756. SABCS 2023. Oral presentation. GS01-02.
- Sherene Loi. Biomarker Results in Highrisk Estrogen Receptor Positive, Human Epidermal Growth Factor Receptor 2 Negative Primary Breast Cancer Following Neoadjuvant Chemotherapy ± Nivolumab: an Exploratory Analysis of CheckMate 7FL. SABCS 2023. Oral presentation. GS01-01.
ЛЕЧЕНИЕ НЕМЕЛКОКЛЕТОЧНОГО РАКА ЛЕГКОГО: ЧТО ИМЕЕМ К НАЧАЛУ 2024
Автор: Боровков Иван Максимович
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина»
Минздрава России, Москва
ХИРУРГИЧЕСКОЕ
ЛЕЧЕНИЕ
Лучевая терапия в самостоятельном
варианте или в сочетании с одновременной/последовательной химиотерапией (химиолучевая терапия,
ХЛТ) заняла крепкие позиции в
лечении местнораспространенных
форм немелкоклеточного рака легкого (НМРЛ).
Ключевой работой нынешнего десятилетия стало исследование PACIFIC,
предложившее пациентам с местнораспространенным раком легкого альтернативу хирургическому
вмешательству в виде конкурентной
ХЛТ с последующей консолидацией
дурвалумабом. Высокая эффективность этого подхода мотивировала
более детальное изучение различных вариантов проведения ХЛТ, что
привело к появлению ряда важных
проспективных работ, о которых мы
хотели бы сегодня поговорить.
В первую очередь стоит коротко упомянуть опубликованные в конце 2022 года обновленные результаты исследования PACIFIC, включившего 713 пациентов с III стадией заболевания [1]. Было показано, что проведение иммунотерапии дурвалумабом на протяжении одного года (1 раз в 2 недели, 10 мг/кг) после ХЛТ по радикальной программе (СОД 60-66 Гр и 2-3 курсов химиотерапии на основе препаратов платины) обеспечивает улучшение 5-летней общей выживаемости (ОВ) до 42,9% по сравнению 33,4% в группе ХЛТ+плацебо, а медиана выживаемости в группах составляет 47,5 и 29,1 мес. соответственно (ОР 0,72; 95% ДИ 0,59- 0,89; рис.1). Проведенный post-hoc анализ показал, что главным предиктором высокой эффективности консолидирующей иммунотерапии являлась положительная экспрессия PD-L1>1% (ОР 0,61), а в группе негативной экспрессии, напротив, отмечалась тенденция к снижению общей выживаемости (рис.2).Доказанная эффективность подобного подхода не только предложила новую лечебную опцию, но и мотивировала дальнейшее ее изучение. Так, в 2022 году были опубликованы результаты небольшого исследования II фазы PACIFIC-6, целью которого стало изучение переносимости дурвалумаба в дозе 1500 мг 1 раз в 4 недели (до 24 курсов) и влияния последовательной химиолучевой терапии c подобным дозовым режимом на эффективность лечения [2]. Авторы показали, что токсичность 3-4 ст. развилась у 18,8% пациентов, а у 21,4% стала причиной прекращения лечения. Для сравнения: оригинальный протокол (10 мг/кг 1 раз в 2 недели) приводил к развитию НЯ 3-4 ст. у 30,5% пациентов. Изменение дозовой интенсивности также приводило к некоторому уменьшению показателя 2-летней выживаемости без прогрессирования (ВБП) – 35,3% против 45% в исследовании PACIFIC (рис.3).
Рисунок 1.
Пятилетняя общая и безрецидивная выживаемость
по данным PACIFIC.
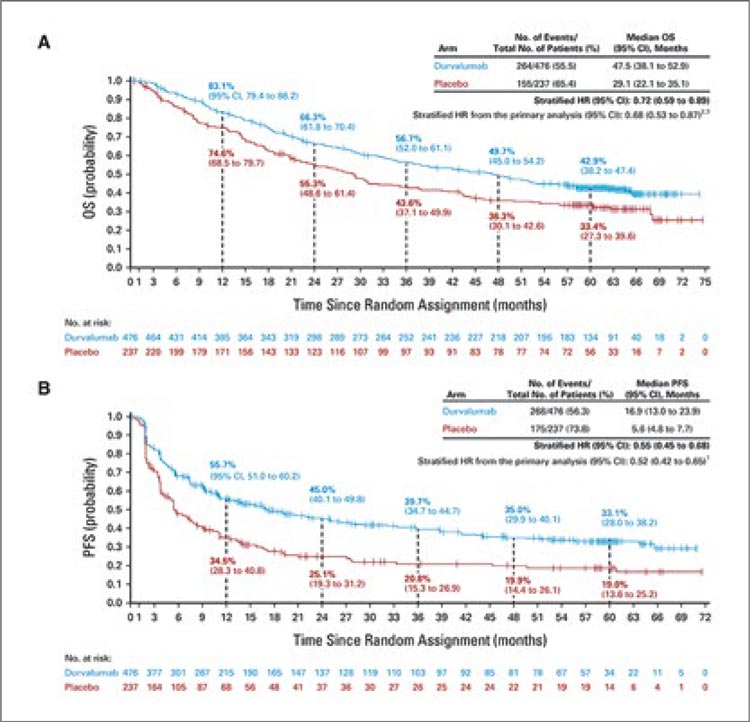
Рисунок 2.
Влияние PD-L экспрессии на эффективность
консолидирующей терапии дурвалумабом.
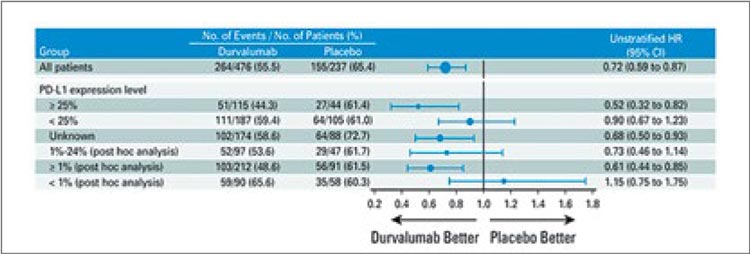
Рисунок 3.
Выживаемость без прогрессирования
в исследовании PACIFIC-6.

Несмотря на это, исследование показало, что пролонгация лечения
является применимой опцией и
может быть выбрана у ряда пациентов. Однако PACIFIC-6 подвергается
аргументированной критике ввиду
недостаточно четкой стратификации пациентов по возрасту и сопутствующей патологии, отсутствию
подгруппового анализа по показателю экспрессии PD-L1 и, главное,
меньшей медиане длительности лечения (32 недели против 40 недель в
PACIFIC), что не согласуется с картиной меньшей или сопоставимой токсичности [3].
Также изучалась возможность одновременного проведения ХЛТ и иммунотерапии. Однако в конце 2023
года компания AstraZeneca сообщила
о недостижении авторами исследования PACIFIC-2 первичной конечной точки, заключавшейся в улучшении показателя выживаемости без
прогрессирования при проведении
конкурентной ХЛТ с одновременной
иммунотерапией дурвалумабом. К
сожалению, детальное описание полученных негативных результатов
по состоянию на февраль 2024 года
опубликовано не было, что делает
дальнейший анализ данной работы
невозможным [4].
В декабре 2023 года были опубликованы результаты небольшого однорукавного исследования II фазы
SPIRAL-RT [5]. Дизайн работы предполагал оценку 1-годичной выживаемости без прогрессирования на фоне
самостоятельной ЛТ (СОД 54-66 Гр)
и консолидирующей терапии дурвалумабом у пациентов с III ст. НМРЛ и
противопоказаниями к проведению
химиотерапии (n=33). Авторы показали, что отказ от проведения химиотерапии приводит к достоверному
снижению 1-годичной ВБП до 39,1%
(исторический контроль в PACIFIC
– 55,7%) и общей выживаемости до
71,7% (83,1% в PACIFIC) (рис.4). Частота нежелательных явлений составила 39,4%.
Рисунок 4.
Выживаемость без прогрессирования и общая
выживаемость в SPIRAL-RT.

Не меньший интерес вызывает влияние снижения дозы ионизирующего
излучения на отдаленные результаты лечения. Ответить на него взялись авторы исследования DUART,
предварительные данные которого
были доложены на конференции
ESMO 2023 в Мадриде [6]. Исследование включило 102 пациента с III
cт. НМРЛ и противопоказаниями к
проведению химиотерапии. Больные
были рандомизированы в группы
стандартной (60 Гр ± 10%) или «паллиативной» ЛТ (СОД 40-54 Гр) с последующей терапией дурвалумабом
(1500 мг 1 раз в 4 недели до года).
Авторы показали, что снижение суммарной очаговой дозы ассоциируется со снижением 1-годичных показателей как безрецидивной (40,2% в
группе стандартной ЛТ против 29,3%
в группе паллиативной ЛТ), так и
общей выживаемости (67% против
56,3%) (рис.5). Тем не менее, для формулировки окончательных выводов
необходимо дождаться публикации
всех результатов исследования.
Рисунок 5.
Выживаемость без прогрессирования и общая
выживаемость в DUART.
Консолидация результатов приведенных исследований демонстрирует четкую корреляцию между сохранением дозовой интенсивности лучевой терапии, одномоментностью химиотерапии и эффективностью лечения (рис.6). Можно заключить, что методом выбора у неоперабельных пациентов с III стадией по-прежнему является проведение одновременной химиолучевой терапии с консолидирующей иммунотерапией дурвалумабом при наличии положительной экспрессии PD-L1. В то же время «щадящие» режимы являются хорошей опцией для тех больных, кто в силу старшего возраста или выраженности сопутствующей патологии не может претендовать на полноценное лечение по протоколу PACIFIC.
Рисунок 6.
Сводная таблица исследований PACIFIC, PACIFIC-6
и DUART

Take-home Message:
- Одномоментная химиолучевая терапия (СОД 60-66 Гр) с консолидирующей терапией дурвалумабом является методом выбора при лечении неоперабельных пациентов с III ст. НМРЛ.
- Эффективность терапии дурвалумабом коррелирует с уровнем экспрессии PD-L.
- Снижение суммарной очаговой дозы и отказ от проведения химиотерапии ассоциируются с улучшением переносимости лечения, но приводят к снижению показателей общей и безрецидивной выживаемости.
Источники:
- Spigel DR, et al. Five-Year Survival Outcomes From the PACIFIC Trial: Durvalumab After Chemoradiotherapy in Stage III NonSmall-Cell Lung Cancer. J Clin Oncol. 2022 Apr 20; 40(12): 1301-1311. doi: 10.1200/JCO.21.01308. Epub 2022 Feb
- Erratum in: J Clin Oncol. 2022 Jun 10; 40(17): 1965. PMID: 35108059; PMCID: PMC9015199.
- Garassino MC, et al. Durvalumab After Sequential Chemoradiotherapy in Stage III, Unresectable NSCLC: The Phase 2 PACIFIC-6 Trial. J Thorac Oncol. 2022 Dec; 17(12): 1415-1427. doi: 10.1016/j.jtho.2022.07.1148. Epub 2022 Aug 9. PMID: 35961520.
- Zhao B, Li H, Wu J, Ma W. Durvalumab After Sequential Chemoradiotherapy Is Safe for Stage III, Unresectable NSCLC: Results From Phase 2 PACIFIC-6 Trial. J Thorac Oncol. 2023 Jan; 18(1): e1- e2. doi: 10.1016/j.jtho.2022.09.002. PMID: 36543435.
- www.astrazeneca.com/mediacentre/press-releases/2023/update-onpacific-2-phase-iii-trial-for-imfinzi. html.
- Yamada T, et al. A phase 2 trial of durvalumab treatment following radiation monotherapy in patients with non-small cell lung cancer ineligible for stage III chemoradiotherapy: The SPIRALRT study. Eur J Cancer. 2023 Dec; 195: 113373. doi: 10.1016/j. ejca.2023.113373. Epub 2023 Oct 22. PMID: 37890349.
- oncologypro.esmo.org/ meeting-resources/esmo-congress/ durvalumab-after-radiotherapy-rtin-patients-with-unresectable-stageiii-nsclc-ineligible-for-chemotherapyct-primary-results-from-the-duart-s.
КОМБИНИРОВАННОЕ
ЛЕЧЕНИЕ
Одной из наиболее обсуждаемых тем
прошедшего года стало появление
новых возможностей комбинированного лечения немелкоклеточного
рака легкого (НМРЛ) с проведением
периоперационной химиоиммунной
терапии.
Идея сочетания двух направлений системного лечения не нова и была представлена еще в исследовании CheckMate 816 [1]. Данная работа включала пациентов с IB-IIIA ст. с резектабельными опухолями и отсутствием драйверных мутаций ALK и EGFR. Больные были рандомизированы в экспериментальную группу с химиоиммунотерапией (3 курса ниволумаба 360 мг 1 раз в 3 недели + платиносодержащая ХТ на выбор исследователя) и контрольную группу (плацебо и платиносодержащая ХТ 3 курса 1 раз в 3 недели), с последующим хирургическим лечением в обеих группах. Было показано, что применение комбинированной терапии приводит не только к достоверному увеличению частоты полных патоморфологических ответов (pCR 24% против 2,2%; ОШ 13,94; 99% ДИ 3,49- 55,75; p<0,001), но и к улучшению непосредственных онкологических результатов лечения (рис.1). Медиана бессобытийной выживаемости (event-free survival, EFS) в экспериментальной группе (ниволумаб + химиотерапия) составила 31,6 мес. против 20,8 мес. в группе контроля (ОР 0,63; 97,38% ДИ 0,43-0,91; p=0,005). При этом профиль безопасности лечения оставался удовлетворительным с частотой нежелательных явлений (НЯ) 3-4 ст. 33,5% и 36,9% в экспериментальной и контрольной группах соответственно. Проведенный подгрупповой анализ показал, что данная схема лечения была наиболее эффективна среди пациентов с положительной экспрессией PD-L1 (>1%) и IIIa ст. заболевания.
Рисунок 1.
Частота полных патоморфологических
ответов в зависимости от стадии
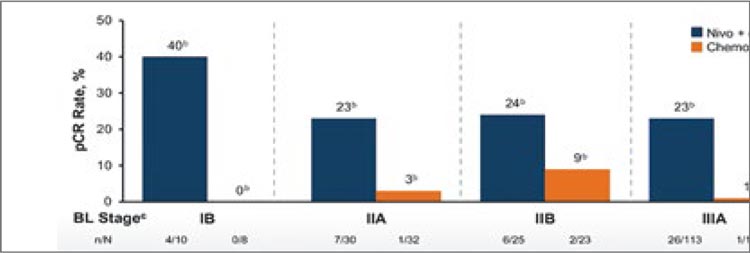
Наибольший выигрыш по частоты pCR наблюдался среди пациентов с ранними стадиями и независимо от экспрессии PD-L1. Все это позволило FDA 4 марта 2022 года зарегистрировать данную комбинацию для неоадъювантного лечения резектабельного НМРЛ [2]. Обновленные в мае 2023 года данные также подтвердили большую эффективность комбинированной терапии с увеличением показателя 3-летней EFS до 57% по сравнению с 43% при проведении только химиотерапии (ОР 0,68) (рис.2).
Рисунок 2.
Трехлетняя бессобытийная выживаемость при
предоперационном введении нволумаба.

Успехи предоперационной терапии
ниволумабом не могли остаться незамеченными, что вылилось в разработку и инициацию целого ряда
схожих по дизайну работ, главной
задачей которых служило улучшение
выживаемости пациентов за счет добавления к уже известной формуле
адъювантного иммунотерапевтического компонента.
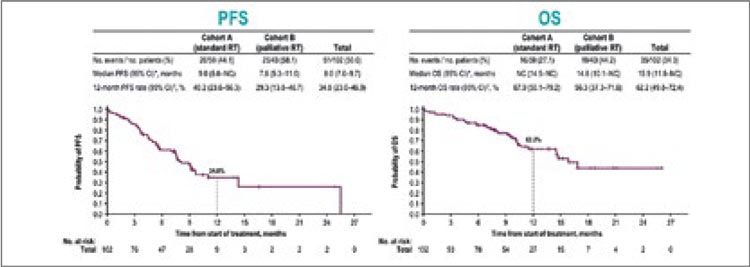
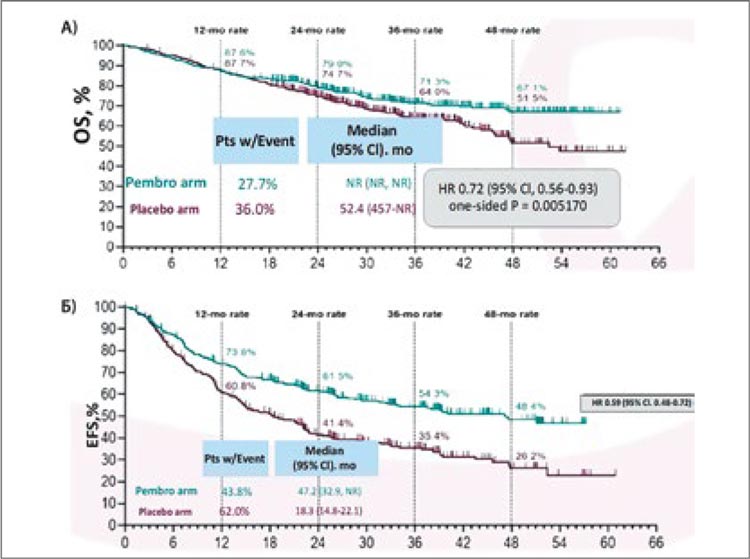
Так, одними из первых в октябре 2023 года были представлены результаты исследования III фазы Keynote-671 [3]. Исследование включало пациентов с II-IIIb ст. (n=397) вне зависимости от наличия у них драйверных мутаций и рандомизировало их либо в группу периоперационного введения пембролизумаба (4 курса по 200 мг 1 раз в 3 недели до операции, 13 курсов по 200 мг 1 раз в 3 недели после операции) с неоадъювантной платиносодержащей ХТ на выбор исследователя, либо в контрольную группу с 4 курсами ХТ и периоперационным введением плацебо. Авторы показали, что проведение 4 курсов неоадъювантной химиоиммунотерапии с адъювантным введением пембролизумаба на протяжении 1 года привело к значимому улучшению 3-летней общей выживаемости (ОВ) до 71,3% против 64% в группе только неоадъювантной химиотерапии (НАХТ) (ОР 0,72; 95% ДИ 0,56-0,93; p=0,005170) и 2-летней бессобытийной выживаемости (EFS) до 62,4% против 40,6% (ОР 0,58; 95% ДИ 0,46-0,72; p<0,0001) (рис.3а,б). Медиана общей и бессобытийной выживаемости в экспериментальной группе за период наблюдения достигнута не была.
Рисунок 3.
Общая (А) и бессобытийная (Б) выживаемость при
периоперационном введении пембролизумаба.
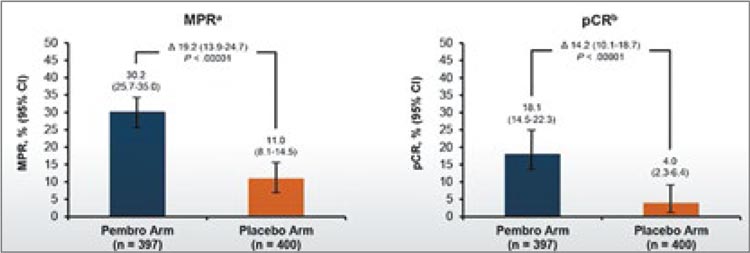
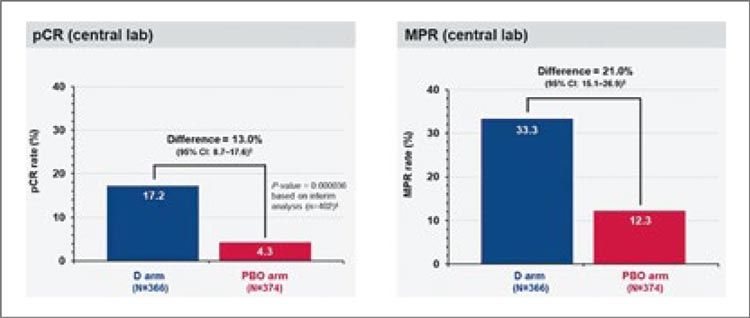
Аналогично исследованию CheckMate 816, проведение неоадъювантной химиоиммунотерапии улучшало частоту полных (18,1% против 4%) и больших патоморфологических ответов (30,2% против 11%) (рис.4). Тем не менее, по данным подгруппового анализа, применение данной схемы ассоциировалось с улучшением отдаленных результатов лечения лишь у пациентов c IIIА стадией и уровнем экспрессии PD-L TPS >1%. Также интенсификация терапии приводила к росту частоты нежелательных явлений. Так, НЯ 3-4 ст. были выявлены у 44,9% пациентов в группе периоперационного введения пембролизумаба и у 37,3% пациентов в группе НАХТ (тошнота – 54,5% против 51,4%; нейтропения – 42,7% против 42,1%; анемия – 36,1% против 33,8%). Частота аутоиммунных НЯ любой степени, в свою очередь, достигла в экспериментальной группе 25,3% против 10,5% в группе контроля. На основании полученных данных периоперационное назначение пембролизумаба было одобрено FDA 16 октября 2023 года [4].
Рисунок 4.
Частота mPR и pCR при предоперационном
введении пембролизумаба.
Не менее резонансным стало исследование III фазы AEGEAN [5]. Данная работа обладала схожим дизайном и включала пациентов с II-IIIВ ст. (n=786) и отсутствием драйверных мутаций ALK и EGFR. Пациентам в экспериментальной группе предлагалось проведение химиоиммунной терапии дурвалумабом (4 курса по 1500 мг 1 раз в 3 недели до операции, 12 курсов по 1500 мг 1 раз в 4 недели после операции) с неоадъювантной платиносодержащей ХТ на выбор исследователя, а группе контроля – плацебо в сочетании с конвенциональной ХТ. Авторы показали, что подобный подход, как и в Keynote 671, обеспечивает достоверное улучшение бессобытийной выживаемости (в экспериментальной группе медиана не достигнута, в контрольной группе – 25,9 мес., ОР 0,68; 95% ДИ 0,53-0,88; p=0,004) и увеличение частоты pCR (17,2% против 4,2%) и mPR (33,3% против 12,3%) (рис.5).
Рисунок 5.
Бессобытийная выживаемость при
периоперационном введении дурвалумаба.
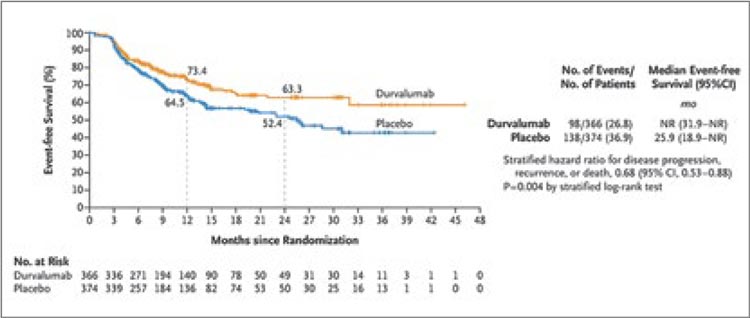
Интервальный анализ, проведенный на 24 месяце наблюдения, продемонстрировал сохраняющуюся тенденцию к дальнейшему расхождению кривых EFS в общей популяции больных (2-летняя EFS 63,3% в группе дурвалумаба против 52,4% в группе плацебо) (рис.6). Дополнительными факторами высокой эффективности при проведении подгруппового анализа выступили активное курение на момент терапии (ОР 0,48) и наличие IIIА ст. заболевания (ОР 0,57), а экспрессия PD-L1, напротив, не оказала достоверного влияния на исход лечения. Профиль безопасности лечения также оставался удовлетворительным, с частотой НЯ 3-4 ст. и аутоиммунных НЯ любой степени соответственно 42,3% и 23,5% в группе дурвалумаба против 43,4% и 9,8% в группе плацебо. Однако малый период наблюдения и отсутствие доказанного влияние на общую выживаемость на данный момент не позволяют FDA официально зарегистрировать указанную схему.
Рисунок 6.
Частоты mPR и pCR при предоперационном
введении дурвалумаба.
Разумеется, исследователи не обошли стороной и периоперационное введение ниволумаба, опубликовав в конце 2023 года результаты сразу 2 профильных работ NADIM II и CheckMate 77T [4,5]. Авторы продемонстрировали аналогичное Keynote 671 и AEGEAN улучшение EFS, pCR и mPR. Однако больший интерес в данных работах вызывает стремление авторов идентифицировать новые факторы прогноза на фоне проведения периоперационной иммунотерапии. Так, в исследовании NADIM II было показано, что, помимо ожидаемого положительного влияния на эффективность терапии экспрессии PD-L1 TPS >1%, важным негативным предиктором служило наличие на старте лечения циркулирующей опухолевой ДНК (цоДНК) >5%, что также коррелировало с размером первичной опухоли (рис.7).
Рисунок 7.
Прогностическое значение цоДНК на старте
лечения резектабельного НМРЛ.
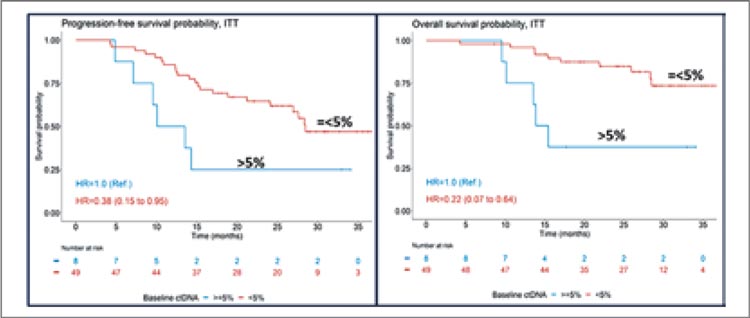
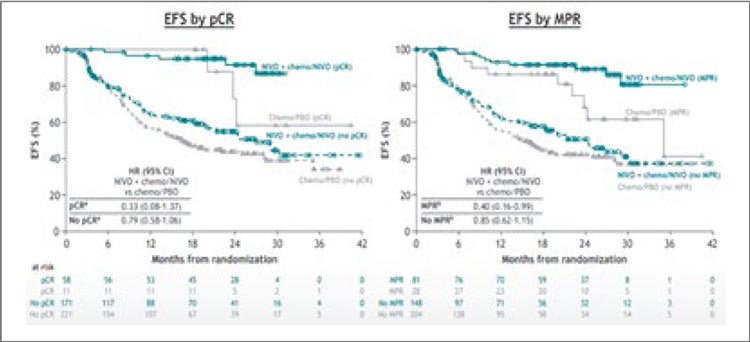
Проведение противоопухолевой терапии приводило к полной элиминации цоДНК у 67% пациентов (18 из 27) в группе ниволумаба с химиотерапией и у 44% (4 из 9) в группе плацебо с химиотерапией, но вопрос влияния подобного ответа со стороны цоДНК на прогноз заболевания все еще остается открытым и требует дальнейшего изучения [4]. Авторы CheckMate 77T, в свою очередь, изучили влияние pCR и mPR на бессобытийную выживаемость пациентов. Было показано, что реализация pCR и mPR имеет независимое положительное прогностическое значение, при этом наибольшая роль патоморфологического ответа отмечается именно в группе проведения иммунной терапии (рис.8).
Рисунок 8.
Прогностическое значение pCR и mPR.
Все вышеуказанные работы, несмотря на некоторые различия в
дизайне и исследуемых препаратах,
демонстрируют схожий характер
улучшения непосредственных и отдаленных результатов комбинированного лечения, а опубликованные
подгрупповые анализы позволяют
нам выявить картину среднестатистического больного, имеющего
наибольшие шансы на выигрыш от
подобной терапии: курильщик, с
местнораспространенным опухолевым процессом, соответствующим
IIIА cт., и положительной экспрессией PD-L1. Подобные результаты
не только упрощают идентификацию «идеального» пациента, но и
мотивируют более активное применение методик предоперационного
N-стадирования и определение в
первичном биопсийном материале
экспрессии PD-L1.
Take-home Message:
Периоперационное проведение химиоиммунотерапии обеспечивает
значимое улучшение отдаленных результатов лечения (EFS, OS) и увеличение частоты полных патоморфологических ответов.
Профиль безопасности лечения характеризуется сопоставимой с предоперационной ХТ частотой нежелательных явлений 3-4 ст., но большей частотой аутоиммунных реакций
любой степени.
Независимыми предикторами высокой эффективности лечения являются положительная экспрессия PD-L1,
большой стаж курения и IIIА стадия
заболевания.
Источники:
- Forde PM, et al; CheckMate 816 Investigators. Neoadjuvant Nivolumab plus Chemotherapy in Resectable Lung Cancer. N Engl J Med. 2022 May 26; 386(21): 1973-1985. doi: 10.1056/NEJMoa2202170. Epub 2022 Apr 11. PMID: 35403841; PMCID: PMC9844511.
- www.fda.gov/drugs/resourcesinformation-approved-drugs/ fda-approves-neoadjuvantadjuvant-pembrolizumab-resectablenon-small-cell-lung-cancer.
- Wakelee H, et al.; KEYNOTE-671 Investigators. Perioperative Pembrolizumab for Early-Stage NonSmall-Cell Lung Cancer. N Engl J Med. 2023 Aug 10; 389(6): 491-503. doi: 10.1056/NEJMoa2302983. Epub 2023 Jun 3. PMID: 37272513.
- www.fda.gov/drugs/resourcesinformation-approved-drugs/ fda-approves-neoadjuvantnivolumab-and-platinum-doubletchemotherapy-early-stage-non-smallcell-lung.
- Heymach JV, et al. Design and Rationale for a Phase III, Double-Blind, Placebo-Controlled Study of Neoadjuvant Durvalumab + Chemotherapy Followed by Adjuvant Durvalumab for the Treatment of Patients With Resectable Stages II and III non-small-cell Lung Cancer: The AEGEAN Trial. Clin Lung Cancer. 2022 May; 23(3): e247-e251. doi: 10.1016/j.cllc.2021.09.010. Epub 2023 May 17. PMID: 34819266.
- Provencio M, et al. Perioperative Nivolumab and Chemotherapy in Stage III Non-Small-Cell Lung Cancer. N Engl J Med. 2023 Aug 10; 389(6): 504-513. doi: 10.1056/NEJMoa2215530. Epub 2023 Jun 28. PMID: 37379158.
- Liu SY, et al. Neoadjuvant nivolumab with or without platinum-doublet chemotherapy based on PD-L1 expression in resectable NSCLC (CTONG1804): a multicenter open-label phase II study. Signal Transduct Target Ther. 2023 Dec 6; 8(1): 442. doi: 10.1038/s41392-023- 01700-4. PMID: 38057314; PMCID: PMC10700550.
ХИМИОЛУЧЕВАЯ
ТЕРАПИЯ
Лучевая терапия в самостоятельном
варианте или в сочетании с одновременной/последовательной химиотерапией (химиолучевая терапия,
ХЛТ) заняла крепкие позиции в
лечении местнораспространенных
форм немелкоклеточного рака легкого (НМРЛ).
Ключевой работой нынешнего десятилетия стало исследование PACIFIC,
предложившее пациентам с местнораспространенным раком легкого альтернативу хирургическому
вмешательству в виде конкурентной
ХЛТ с последующей консолидацией
дурвалумабом. Высокая эффективность этого подхода мотивировала
более детальное изучение различных вариантов проведения ХЛТ, что
привело к появлению ряда важных
проспективных работ, о которых мы
хотели бы сегодня поговорить.
В первую очередь стоит коротко упомянуть опубликованные в конце 2022 года обновленные результаты исследования PACIFIC, включившего 713 пациентов с III стадией заболевания [1]. Было показано, что проведение иммунотерапии дурвалумабом на протяжении одного года (1 раз в 2 недели, 10 мг/кг) после ХЛТ по радикальной программе (СОД 60-66 Гр и 2-3 курсов химиотерапии на основе препаратов платины) обеспечивает улучшение 5-летней общей выживаемости (ОВ) до 42,9% по сравнению 33,4% в группе ХЛТ+плацебо, а медиана выживаемости в группах составляет 47,5 и 29,1 мес. соответственно (ОР 0,72; 95% ДИ 0,59- 0,89; рис.1). Проведенный post-hoc анализ показал, что главным предиктором высокой эффективности консолидирующей иммунотерапии являлась положительная экспрессия PD-L1>1% (ОР 0,61), а в группе негативной экспрессии, напротив, отмечалась тенденция к снижению общей выживаемости (рис.2).
Рисунок 1.
Пятилетняя общая и безрецидивная выживаемость
по данным PACIFIC
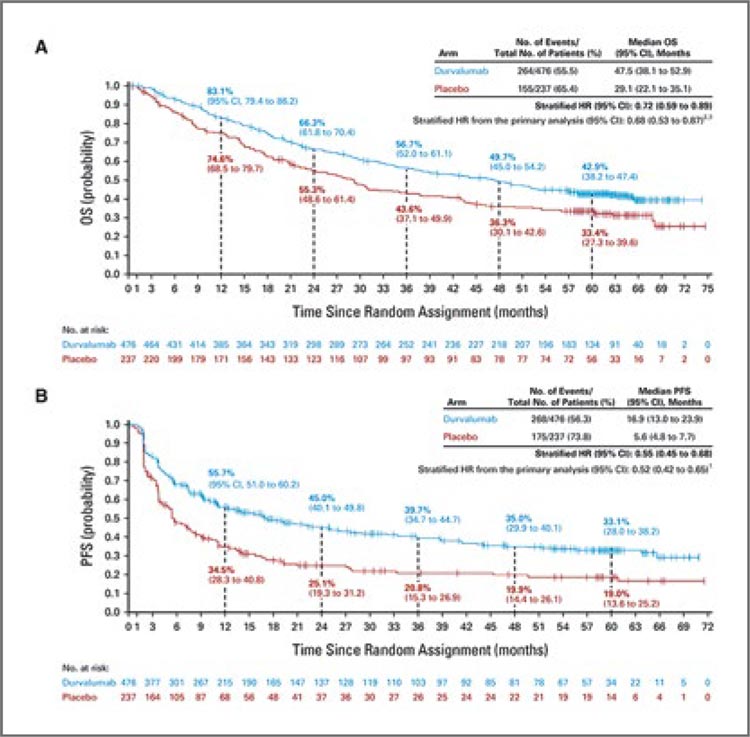
Рисунок 2.
Влияние PD-L экспрессии на эффективность
консолидирующей терапии дурвалумабом.
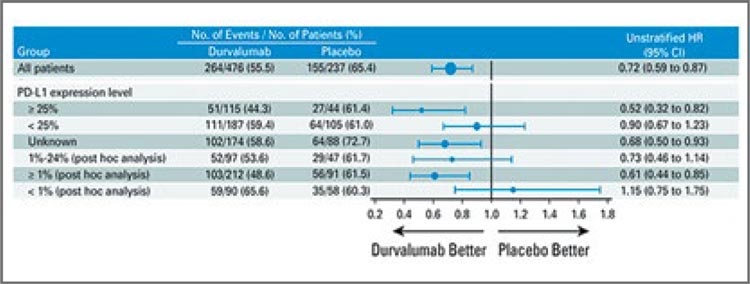
Доказанная эффективность подобного подхода не только предложила новую лечебную опцию, но и мотивировала дальнейшее ее изучение. Так, в 2022 году были опубликованы результаты небольшого исследования II фазы PACIFIC-6, целью которого стало изучение переносимости дурвалумаба в дозе 1500 мг 1 раз в 4 недели (до 24 курсов) и влияния последовательной химиолучевой терапии c подобным дозовым режимом на эффективность лечения [2]. Авторы показали, что токсичность 3-4 ст. развилась у 18,8% пациентов, а у 21,4% стала причиной прекращения лечения. Для сравнения: оригинальный протокол (10 мг/кг 1 раз в 2 недели) приводил к развитию НЯ 3-4 ст. у 30,5% пациентов. Изменение дозовой интенсивности также приводило к некоторому уменьшению показателя 2-летней выживаемости без прогрессирования (ВБП) – 35,3% против 45% в исследовании PACIFIC (рис.3).
Рисунок 3.
Выживаемость
без прогрессирования
в исследовании PACIFIC-6
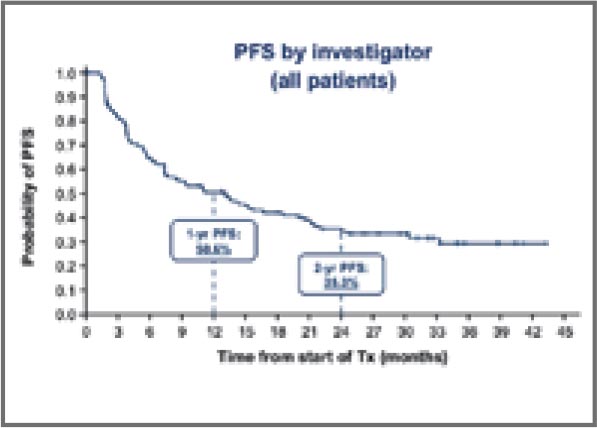
Несмотря на это, исследование показало, что пролонгация лечения является применимой опцией и может быть выбрана у ряда пациентов. Однако PACIFIC-6 подвергается аргументированной критике ввиду недостаточно четкой стратификации пациентов по возрасту и сопутствующей патологии, отсутствию подгруппового анализа по показателю экспрессии PD-L1 и, главное, меньшей медиане длительности лечения (32 недели против 40 недель в PACIFIC), что не согласуется с картиной меньшей или сопоставимой токсичности [3].
Также изучалась возможность одновременного проведения ХЛТ и иммунотерапии. Однако в конце 2023
года компания AstraZeneca сообщила
о недостижении авторами исследования PACIFIC-2 первичной конечной точки, заключавшейся в улучшении показателя выживаемости без
прогрессирования при проведении
конкурентной ХЛТ с одновременной
иммунотерапией дурвалумабом. К
сожалению, детальное описание полученных негативных результатов
по состоянию на февраль 2024 года
опубликовано не было, что делает
дальнейший анализ данной работы
невозможным [4].
В декабре 2023 года были опубликованы результаты небольшого одно-рукавного исследования II фазы SPIRAL-RT [5]. Дизайн работы предполагал оценку 1-годичной выживаемости без прогрессирования на фоне самостоятельной ЛТ (СОД 54-66 Гр) и консолидирующей терапии дурвалумабом у пациентов с III ст. НМРЛ и противопоказаниями к проведению химиотерапии (n=33). Авторы показали, что отказ от проведения химиотерапии приводит к достоверному снижению 1-годичной ВБП до 39,1% (исторический контроль в PACIFIC – 55,7%) и общей выживаемости до 71,7% (83,1% в PACIFIC) (рис.4). Частота нежелательных явлений составила 39,4%. Не меньший интерес вызывает влияние снижения дозы ионизирующего излучения на отдаленные результаты лечения. Ответить на него взялись авторы исследования DUART, предварительные данные которого были доложены на конференции ESMO 2023 в Мадриде [6]. Исследование включило 102 пациента с III cт. НМРЛ и противопоказаниями к проведению химиотерапии. Больные были рандомизированы в группы стандартной (60 Гр ± 10%) или «паллиативной» ЛТ (СОД 40-54 Гр) с последующей терапией дурвалумабом (1500 мг 1 раз в 4 недели до года). Авторы показали, что снижение суммарной очаговой дозы ассоциируется со снижением 1-годичных показателей как безрецидивной (40,2% в группе стандартной ЛТ против 29,3% в группе паллиативной ЛТ), так и общей выживаемости (67% против 56,3%) (рис.5). Тем не менее, для формулировки окончательных выводов необходимо дождаться публикации всех результатов исследования.
Рисунок 4.
Выживаемость без прогрессирования и общая
выживаемость в SPIRAL-RT.

Рисунок 5.
Выживаемость без прогрессирования и общая
выживаемость в DUART
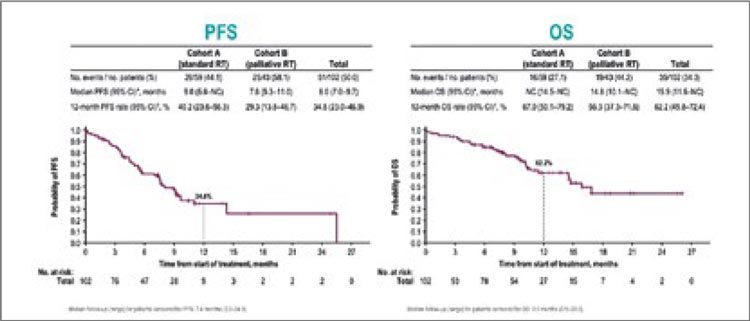
Консолидация результатов приведенных исследований демонстрирует четкую корреляцию между сохранением дозовой интенсивности лучевой терапии, одномоментностью химиотерапии и эффективностью лечения (рис.6). Можно заключить, что методом выбора у неоперабельных пациентов с III стадией по-прежнему является проведение одновременной химиолучевой терапии с консолидирующей иммунотерапией дурвалумабом при наличии положительной экспрессии PD-L1. В то же время «щадящие» режимы являются хорошей опцией для тех больных, кто в силу старшего возраста или выраженности сопутствующей патологии не может претендовать на полноценное лечение по протоколу PACIFIC.
Рисунок 6.
Сводная таблица исследований PACIFIC, PACIFIC-6
и DUART

Take-home Message:
Одномоментная химиолучевая терапия (СОД 60-66 Гр) с консолидирующей терапией дурвалумабом
является методом выбора при лечении неоперабельных пациентов
с III ст. НМРЛ.
Эффективность терапии дурвалумабом коррелирует с уровнем экспрессии PD-L.
Снижение суммарной очаговой
дозы и отказ от проведения химиотерапии ассоциируются с улучшением переносимости лечения,
но приводят к снижению показателей общей и безрецидивной выживаемости.
Источники:
- Spigel DR, et al. Five-Year Survival Outcomes From the PACIFIC Trial: Durvalumab After Chemoradiotherapy in Stage III NonSmall-Cell Lung Cancer. J Clin Oncol. 2022 Apr 20; 40(12): 1301-1311. doi: 10.1200/JCO.21.01308. Epub 2022 Feb
- Erratum in: J Clin Oncol. 2022 Jun 10; 40(17): 1965. PMID: 35108059; PMCID: PMC9015199.
- Garassino MC, et al. Durvalumab After Sequential Chemoradiotherapy in Stage III, Unresectable NSCLC: The Phase 2 PACIFIC-6 Trial. J Thorac Oncol. 2022 Dec; 17(12): 1415-1427. doi: 10.1016/j.jtho.2022.07.1148. Epub 2022 Aug 9. PMID: 35961520.
- Zhao B, Li H, Wu J, Ma W. Durvalumab After Sequential Chemoradiotherapy Is Safe for Stage III, Unresectable NSCLC: Results From Phase 2 PACIFIC-6 Trial. J Thorac Oncol. 2023 Jan; 18(1): e1-e2. doi: 10.1016/j.jtho.2022.09.002. PMID: 36543435.
- www.astrazeneca.com/mediacentre/press-releases/2023/update-onpacific-2-phase-iii-trial-for-imfinzi. html.
- Yamada T, et al. A phase 2 trial of durvalumab treatment following radiation monotherapy in patients with non-small cell lung cancer ineligible for stage III chemoradiotherapy: The SPIRAL-RT study. Eur J Cancer. 2023 Dec; 195: 113373. doi: 10.1016/j. ejca.2023.113373. Epub 2023 Oct 22. PMID: 37890349. 6. oncologypro.esmo.org/ meeting-resources/esmo-congress/ durvalumab-after-radiotherapy-rt-inpatients-with-unresectable-stage-iiinsclc-ineligible-for-chemotherapy-ctprimary-results-from-the-duart-s.
ТАРГЕТНАЯ
ТЕРАПИЯ
2023 год значительно расширил спектр опций консервативного лечения как локализованного, так и распространенного рака легкого, что во многом обусловлено публикацией летом 2023 года положительных результатов исследования ADAURA, продемонстрировавшего улучшение ОВ в общей популяции больных с IbIIIa ст. (ОР 0,49; 95,03% ДИ 0,33-0,73; p<0,001) [1]. Эта работа не только показала высокую эффективность осимертиниба у пациентов с активирующими мутациями EGFR (делеция в 19 экзоне или L858R), но и открыла целое новое направление развития клинической и экспериментальной онкологии – применение таргетных препаратов в адъювантном режиме. Одним из первых идейных наследников ADAURA стало исследование III фазы ALINA, включившее 257 пациентов с резектабельным НМРЛ Ib-IIIa ст. и мутацией ALK [2]. После радикального хирургического лечения пациенты рандомизировались в экспериментальную группу с алектинибом (600 мг 2 раза в день в течение 2 лет, n=130) и контрольную группу с проведением 4 курсов платиносодержащей химиотерапии на выбор исследователя. Стратификация проводилась по стадии заболевания (II и IIIa ст.) и расе пациентов (азиаты и не азиаты), а первичной конечной точкой являлась оценка показателя выживаемости без прогрессирования (ВБП). При медиане наблюдения в 27,9 мес. 2-летняя ВБП составила 93,8% в группе алектиниба против 63% в группе АПХТ (ОР 0,24; 95% ДИ 0,13-0,45), а ВБП в ЦНС – 98,4% против 85,8% (ОР 0,22; 95% ДИ 0,08- 0,58) (рис.2). Стадия заболевания не оказывала клинически значимого влияние на эффективность алектиниба (табл.1). Токсичность лечения была сопоставима между группами: нежелательные явления (НЯ) 3-4 ст. выявлялись у 38% пациентов при применении алектиниба и 37% при проведении химиотерапии. Непереносимая токсичность в группах алектиниба и АПХТ являлась причиной отмены лечения у 5% и у 12,5% больных, а необходимость редукции доз лекарственных препаратов была выявлена в 26% и 10% случаев соответственно. Однако отсутствие данных по влиянию на общую выживаемость пока не позволяет сделать окончательный вывод об эффективности применения алектиниба в адъювантном режиме. При этом FDA уже присвоило данному исследованию статус «приоритетного рассмотрения», а обсуждение целесообразности регистрации данной схемы лечения запланировано на май 2024 года [3]. Помимо исследования ALINA, целесообразность адъювантной терапии алектинибом на данный момент изучается в исследованиях II фазы NAUTIKA1 и ALNEO и в исследовании III фазы HORIZON-01.
Таблица 1. Влияние стадии заболевания на выживаемость без прогрессирования.
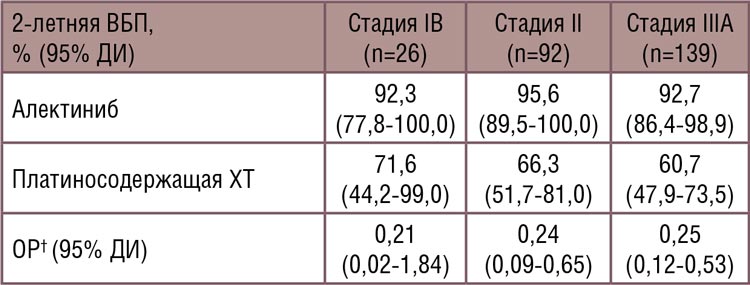
Рисунок 1.
Общая выживаемость в исследовании ADAURA.T
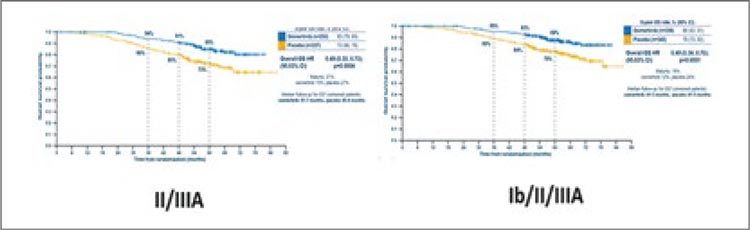
Рисунок 2.
Выживаемость без прогрессирования
и выживаемость без прогрессирования в ЦНС
в исследовании ALINA.

Не менее ожидаемым является исследование III фазы LIBRETTO-432,
изучающее влияние адъювантного применение селперкатиниба
у пациентов с Ib-IIIa ст. НМРЛ и
транслокацией гена RET [4]. Предположение о высокой эффективности подобного подхода основывается на результатах недавнего
исследования LIBRETTO-431, показавшего целесообразность использования селперкатиниба в качестве
2-летняя ВБП,
% (95% ДИ)
Стадия IB
(n=26)
Стадия II
(n=92)
Стадия IIIA
(n=139)
Алектиниб 92,3
(77,8-100,0)
95,6
(89,5-100,0)
92,7
(86,4-98,9)
Платиносодержащая ХТ 71,6
(44,2-99,0)
66,3
(51,7-81,0)
60,7
(47,9-73,5)
ОР† (95% ДИ) 0,21
(0,02-1,84)
0,24
(0,09-0,65)
0,25
(0,12-0,53)
препарата первой линии терапии у
RET-положительных больных с IIIbIV ст. неплоскоклеточного НМРЛ, не
получавших ранее какого-либо системного лечения [5].
Пациентам в экспериментальной группе назначался селперкатиниб в дозе 160 мг два раза в день (n=159). В качестве группы контроля была выбрана ПХТ по схеме карбоплатин/ цисплатин + пеметрексед с возможным добавлением пембролизумаба по выбору исследователя. При прогрессировании на фоне терапии в группе контроля допускался кроссовер с переходом на терапию селперкатинибом. При средней продолжительности наблюдения в 19 мес. медиана длительности терапии составила 16,7±8,3 мес. в группе селперкатиниба и 9,8±7,2 мес. в группе контроля. Анализ общей популяции выявил достоверное увеличение медианы ВБП в экспериментальной группе до 24,8 мес. против 11,2 мес. (ОР 0,46; 95% ДИ 0,31-0,70; p<0,001). При этом добавление к ПХТ пембролизумаба, согласно результатам дополнительного анализа данной популяции (n=83), не оказывало значимого влияние на положение кривых выживаемости (рис.3).
Рисунок 3.
Выживаемость без прогрессирования
в исследовании LIBRETTO-431.

Как в экспериментальной, так и в контрольной группах лечение сопровождалась выраженной токсичностью с высокой распространенностью НЯ ≥3 степени (70% против 57% соответственно). Терапия селперкатинибом чаще приводила к удлинению интервала QT (9%), росту трансаминаз печени (13-22%) и развитию артериальной гипертензии (20%), а проведение ПХТ преимущественно сопровождалось нейтропенией (28%) и анемией (10%). Явления токсичности потребовали редукции доз препаратов у 51% и 29% пациентов в экспериментальной и контрольной группе, а также стали непосредственной причиной остановки лечения у 10% и 2% пациентов соответственно. Таким образом, профиль безопасности селперкатиниба сложно назвать полностью управляемым, что может потенциально ограничить популяцию больных, претендующих на данный вид терапии, а отсутствие данных по влиянию препарата на общую выживаемость, как и в случае с исследованием ALINA, пока не позволяет делать окончательные выводы. Тем не менее, FDA уже сообщило о рассмотрении данного режима в рамках протокола ускоренного одобрения (accelerated approval) [6]. Переходя к обсуждению таргетной терапии распространенных форм НМРЛ, нельзя не упомянуть исследования FLAURA2 и MARIPOSA. Успех исследования ADAURA неизбежно возродил интерес сообщества к ингибиторам EGFR и, в частности, изучению возможностей сочетания осимертиниба с химиотерапией у EGFR-положительных больных с метастатическим НМРЛ, что легло в основу протокола FLAURA2 [7]. Исследование включало пациентов без предшествующего системного лечения. Первичной конечной точкой данной работы служила ВБП, а вторичные конечные точки включали оценку ОВ, частоту объективных ответов и токсичность лечения. Пациентам в экспериментальной группе (n=279) проводилось 4 курса платиносодержащей химиотерапии с пеметрекседом и осимертинибом (80 мг 1 раз в день) с последующим переходом на поддержку пеметрекседом и осимертинибом до прогрессирования или непереносимой токсичности, а группа контроля получала только осимертиниб в аналогичных дозах. Авторы показали, что комбинированный подход позволяет достоверно увеличить 2-летнюю ВБП до 57% по сравнению c 41% при монотерапии осимертинибом, а медиана ВБП в группах составила 25,5 мес. против 16,7 мес. (ОР 0,62; 95% ДИ 0,49-0,79; p<0,0001). При этом наибольшее расхождение кривых выживаемости отмечалось в группе с исходным поражением ЦНС до начала лечения – 24,9 мес. против 13,8 мес. (ОР 0,47; 95% ДИ 0,33-0,66). Для сравнения, в группе без метастазов в ЦНС медиана ВБП составила 27,6 мес. на фоне химиотаргетной терапии и 21,0 мес. при монотерапии осимертинибом (ОР 0,75; 95% ДИ 0,55-1,03) (рис.4).
<
Рисунок 4.
Выживаемость без прогрессирования
в исследовании FLAURA2.
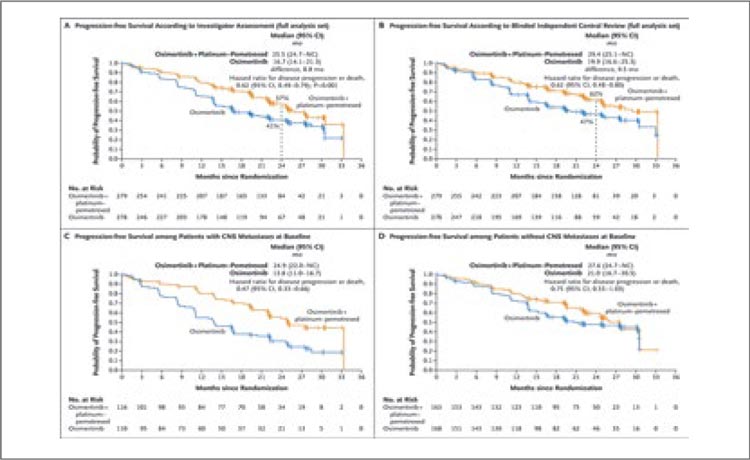
Комбинированная терапия чаще
приводила к развитию объективных
ответов (83% против 76%), а также ассоциировалась с большей его
длительностью, чем в группе монотерапии осимертинибом (24 мес.
против 15,3 мес.). Однако высокая
эффективность подобного подхода
стоила также и кратного увеличения
токсичности с развитием НЯ ≥3 ст.
(преимущественно гематологического характера) у 64% больных в
группе комбинированного лечения
против 27% в группе контроля, что
явилось причиной прекращения
терапии у 11% и 6% пациентов соответственно. Таким образом, сочетание осимертиниба с конвенциональной химиотерапией может
служить хорошей опцией лечения
для пациентов с диссеминированным
EGFR-мутированным НМРЛ без
предшествующего лечения и высоким функциональным статусом, особенно при наличии поражения ЦНС,
но требует тщательного контроля со
стороны химиотерапевта для своевременного выявления и коррекции
НЯ.
Идейным наследником этого протокола стало исследование MARIPOSA, авторы которого взялись изучить эффективность комбинированной таргетной терапии ингибиторами EGFR (лазертениб) и MEK (амивантанаб) при EGFR-мутированном диссеминированном НМРЛ [8]. В качестве группы контроля, как и во FLAURA2, выступала монотерапия осимертинибом. Было показано, что сочетание данных препаратов приводит к достоверному увеличению медиану ВБП до 23,7 мес. по сравнению с 16,6 мес. в группе контроля (ОР 0,70; 95% ДИ 0,58-0,85; p<0,001) (рис.5). Данных по достоверному улучшению общей выживаемости на данный момент получено не было (ОР 0,80; 95% ДИ 0,61-1,05; p=0,1), как и не была представлена в открытый доступ полная картина профиля безопасности терапии, что не позволяет однозначно рекомендовать данную схему всем пациентам. Тем не менее, полученные результаты предполагают, что комбинация таргетных препаратов, несмотря на ожидаемо более высокую стоимость, может служить альтернативой химиотаргетной терапии у пациентов с наличием противопоказаний для проведения химиотерапии, а это, несомненно, является ценным приобретением в копилке лечебных опцией диссеминированного НМРЛ.
Рисунок 5.
Выживаемость без прогрессирования
в исследовании MARIPOSA.

Take-home Message:
ALINA trial: проведение адъювантной терапии алектинибом у ALKпозитивных больных достоверно
увеличивает ВБП (93,8% против
63,8%) и ВБП в ЦНС (98,4% против
85,8%) при управляемом профиле
токсичности.
LIBRETTO-431: использование селперкатиниба в первой линии терапии метастатического НМРЛ у
RET-позитивных больных ассоциируется с почти двукратным увеличением ВБП (24,8 мес. против 11,2 мес. в группе ХТ с/без пембролизумаба),
однако сопровождается развитием
НЯ ≥3 ст. у 70% пациентов.
FLAURA2: сочетание осимертиниба с
химиотерапией у EGFR-позитивных
больных с распространенным НМРЛ
достоверно увеличивает показатель
ВБП (25,5 мес. против 16,7 мес. при
монотерапии осимертинибом), но
ассоциируется с большей частотой
НЯ ≥3 ст. (64% против 27%).
MARIPOSA: комбинирование EGFR
(лазертиниб) и MEK (амивантанаб)
ингибиторов при проведении 1 линии терапии распространенного
EGFR-мут. НМРЛ приводит к аналогичному FLAURA2 увеличению
ВБП (23,7 мес. против 16,6 мес. при
монотерапии осимертинибом) и,
предположительно, может служить
альтернативой данному протоколу у
пациентов с противопоказаниями к
проведению химиотерапии.
Источники:
- Tsuboi M, et al.; ADAURA Investigators. Overall Survival with Osimertinib in Resected EGFR-Mutated NSCLC. N Engl J Med. 2023 Jul 13; 389(2): 137-147. doi: 10.1056/NEJMoa2304594. Epub 2023 Jun 4. PMID: 37272535.
- Solomon BJ, Ahn JS, Dziadziuszko R, et al. Efficacy and safety of adjuvant alectinib versus chemotherapy in patients with early-stage ALK+ non-small cell lung cancer. ESMO Congress 2023. Abstract LBA2. Presented: October 21, 2023.
- www.onclive.com/view/fda-grantspriority-review-to-adjuvant-alectinibfor-early-stage-alk-nsclc.
- Tsuboi M, et al. LIBRETTO-432, a phase III study of adjuvant selpercatinib or placebo in stage IB-IIIA RET fusionpositive non-small-cell lung cancer. Future Oncol. 2022 Sep; 18(28): 3133- 3141. doi: 10.2217/fon-2022-0656. Epub 2022 Aug 11. PMID: 35950566.
- Zhou C, et al.; LIBRETTO-431 Trial Investigators. First-Line Selpercatinib or Chemotherapy and Pembrolizumab in RET Fusion-Positive NSCLC. N Engl J Med. 2023 Nov 16; 389(20): 1839-1850. doi: 10.1056/NEJMoa2309457. Epub 2023 Oct 21. PMID: 37870973; PMCID: PMC10698285.
- Romero D. Activity of selpercatinib confirmed in phase III trials. Nat Rev Clin Oncol. 2024; 21: 5. https://doi. org/10.1038/s41571-023-00837-z.
- Planchard D, et al.; FLAURA2 Investigators. Osimertinib with or without Chemotherapy in EGFRMutated Advanced NSCLC. N Engl J Med. 2023 Nov 23; 389(21): 1935-1948. doi: 10.1056/NEJMoa2306434. Epub 2023 Nov 8. PMID: 37937763.
- Cho BC, et al. LBA14 Amivantamab plus lazertinib vs osimertinib as firstline treatment in patients with EGFRmutated, advanced non-small cell lung cancer (NSCLC): Primary results from MARIPOSA, a phase III, global, randomized, controlled trial. Annals of Oncology. 2023 Oct; Vol.34, Suppl.2, S1306.
ПРОЧТИ ОБ ЭТОМ РАНЬШЕ, ЧЕМ ТВОЙ ПАЦИЕНТ. КРИТИЧЕСКИЙ ВЗГЛЯД НА РЕЗУЛЬТАТЫ CLEAR...
Автор: Евдокимов Владимир Игоревич
ЦАОП ММКЦ «Коммунарка», Москва Титова Татьяна Александровна
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России,
кандидат медицинских наук, Москва Исраелян Эдгар Рудикович
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина»
Минздрава России, Москва Боровков Иван Максимович
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина»
Минздрава России, Москва Фатеева Анастасия Валерьевна,
ГБУЗ «ПРиморский краевой онкологический диспансер», Владивосток
16 января 2024 года в Journal of Clinical Oncology были опубликованы результаты долговременного, заранее спланированного анализа выживаемости пациентов в исследовании CLEAR – открытого рандомизированного исследования 3 фазы, в котором сравнивались два лечебных подхода у пациентов с распространенным почечноклеточным раком, ранее не получавших какую-либо системную терапию [1,2]. Напомним: пациенты были рандомизированы (1:1:1) для приема ленватиниба (20 мг в день перорально, 21-дневные циклы) плюс пембролизумаб (200 мг внутривенно каждые 21 день; группа ленватиниба и пембролизумаба), ленватиниба (18 мг в день перорально) плюс эверолимус (5 мг в день перорально; группа ленватиниба плюс эверолимус) в 21-дневных циклах или сунитиниб (50 мг в день перорально, 4 недели приема и 2 недели перерыва; группа сунитиниба). На момент публикации в апреле 2023 года комбинация ленватиниба и пембролизумаба была признана наиболее эффективной и рекомендованной для 1 линии терапии подобных больных. На первый и незамутненный взгляд – результаты говорили сами за себя, об этом свидетельствовало расхождение кривых выживаемости без прогрессирования: медиана ВБП при применении сунитиниба в монорежиме составила 9,2 мес. (95% ДИ 6,0-11,0), тогда как комбинация показала значимое преимущество – 23,3 мес. (95% ДИ 20,8-27,7). И, разумеется, на любом пленарном заседании количество точек лазерной указки, помещающихся между кривыми, и дальше вызывало бы восторг у коллег. Однако восторгаться, к сожалению, пока поводов мало, так как данные по общей выживаемости требуют детального разбора.
По результатам оценки выживаемости медиана в группе сунитиниба составила 53,4 мес. (95% ДИ 40,9-NE) против 53,7 мес. (95% ДИ 48,7-NE), а кривые выживаемости (как можно видеть на графике, рис.1) слились воедино уже на 4 году наблюдения, в том числе и при отдельном, ранее не запланированном анализе групп промежуточного и плохого прогноза по IMDC – что позволяет сделать однозначный вывод: назначение комбинированного лечения не делает жизнь большинства наших пациентов с метастатическим раком почки дольше и лучше.
Рисунок 1.
Кривые общей выживаемости в исследовании
CLEAR [2].
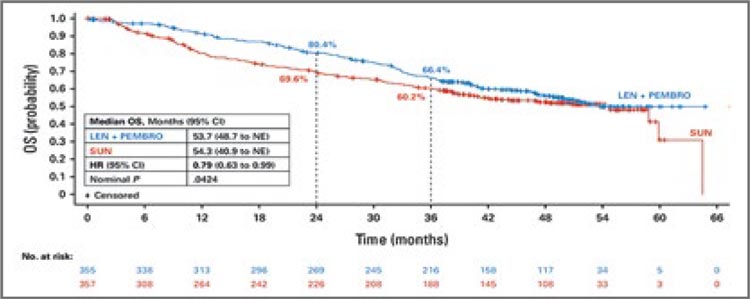
Однако следует признать целесообразность назначения комбинированного лечения при заболевании высокого риска по IMDC, значимом и симптомном распространении, требующем объективного и быстрого ответа на проводимую терапию. В частности, по 5-летним результатам исследования CLEAR [2] частота объективного ответа в группе сунитиниба в два раза меньше, чем в группе комбинации пембролизумаб + ленватиниб (36,7% против 71,3%, ОР 1,94), хотя не стоит забывать и о большей токсичности комбинации, которая может стать условным препятствием в реализации ответа.
Но почему оказалось так, что комбинация не продлевает жизнь?
В исследовании CLEAR комбинация ленватиниба и пембролизумаба применялась для лечения метастатического рака почки любой степени риска по шкале IMDC. Однако на основании этой и других работ проводились метаанализы для оценки роли комбинированного лечения в группе благоприятного риска. В частности, в метаанализе испанских авторов [3] было продемонстрировано полное отсутствие выигрыша в общей выживаемости (HR=0,99; 95% ДИ 0,69-1,43). Возможно, отчасти за счет пациентов группы благоприятного риска в исследовании CLEAR результаты несколько «размываются», так как исходно эти пациенты не могут выиграть от комбинированной терапии и влияют на общую кривую выживаемости. Напомню, что таковых пациентов было ≈30% в каждой группе.
Также можно предположить, что дело и в последующих линиях терапии, которые могли повлиять на кривые выживаемости. Тем не менее, в приложении к статье указано, что только 68,7% пациентов получили последующую линию терапии после сунитиниба, из них 45,4% пациентов получили другой TKI ингибитор, и лишь 54,6% пациентов познакомились с иммунотерапией. Таким образом, маловероятно, что это могло значимо исказить результаты исследования, более того, это говорит о некоторой ущемленности рукава пациентов, получавших сунитиниб. В систематическом анализе Vinay Prasad и соваторов [4], включившем в том числе и исследование CLEAR, было продемонстрировано (рис.2), что выигрыш от применения иммунотерапии иногда усиливается за счет плохой терапии после прогрессирования пациентов, включенных в протокол.
Рисунок 2.
Доли пациентов, получавших различные режимы
лечения после прогрессирования на сунитинибе в различных
клинических исследованиях.

Таким образом, несмотря на кажущуюся очевидность преимущества комбинированной иммунотаргетной терапии в лечении метастатического рака почки, необходимо учитывать, что выживаемость не всегда улучшается за счет «наилучшего лечения». Учитывая фармако-экономические критерии и токсичность, не будет ошибкой применять монотерапию сунитинибом у пациентов благоприятного риска по IMDC или у пациентов с небольшим объемом заболевания и отсутствием симптомов, требующих быстрого объективного ответа.
Источники:
- Choueiri, Toni K, et al. Lenvatinib plus pembrolizumab versus sunitinib as firstline treatment of patients with advanced renal cell carcinoma (CLEAR): extended follow-up from the phase 3, randomised, open-label study The Lancet Oncology. 2023; Vol.24, Issue 3, 228-238.
- Robert J. Motzer, et al. Lenvatinib Plus Pembrolizumab Versus Sunitinib in FirstLine Treatment of Advanced Renal Cell Carcinoma: Final Prespecified Overall Survival Analysis of CLEAR, a Phase III Study. JCO. 2024; JCO.23.01569.
- Manneh R, Lema M, Carril-Ajuria L, et al. Immune Checkpoint Inhibitor Combination Therapy versus Sunitinib as First-Line Treatment for Favorable-IMDCRisk Advanced Renal Cell Carcinoma Patients: A Meta-Analysis of Randomized Clinical Trials. Biomedicines. 2022; 10(3): 577. Published: 2022 Mar 1. doi:10.3390/ biomedicines10030577.
- Sharp J, Khaki AR, Prasad V. Use of Second-line Immunotherapy in Control Arms of Randomized Clinical Trials in Kidney Cancer: A Systematic Review. JAMA Netw Open. 2021; 4(9): e2124728. Published: 2021 Sep 1. doi:10.1001/ jamanetworkopen.2021.24728.
Материал подготовил В.Евдокимов
PRESTO TRIAL: ИНТЕНСИФИКАЦИЯ АНДРОГЕН-ДЕПРИВАЦИОННОЙ ТЕРАПИИ (АДТ) ПРИ БИОХИМИЧЕСКОМ РЕЦИДИВЕ РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
Согласно текущим рекомендациям, пациентам с биохимическим рецидивом рака предстательной железы из группы высокого риска (временем удвоения ПСА (ВУПСА) ≤9 мес. и ISUP Grade 4-5) после радикальной простатэктомии (РПЭ) показано проведение сальважной лучевой терапии (ЛТ) на ложе удаленной опухоли с антагонистами ЛГРГ. А есть ли смысл в интенсификации АДТ?
В рандомизированное исследование III фазы PRESTO были включены пациенты (n=522) с ПСА-рецидивом высокого риска после РПЭ, получившие ЛТ в адъювантном либо спасительном режиме (если она им не противопоказана), и рандомизированные в 3 группы: аналоги АДТ в монорежиме, АДТ + апалутамид либо АДТ + апалутамид + абиратерона ацетат (АА)/преднизон в соотношении 1:1:1. Терапия проводилась в течение 52 нед. ВУПСА <3 мес. и 3-9 мес. явились факторами стратификации. Первичная конечная точка – выживаемость до биохимического прогрессирования (ВБП).
При медиане наблюдения 21,5 мес.:
- медиана ВБП составила 24,9 мес. в группе АДТ + апалутамид и 20,3 мес. в группе АДТ (ОР=0,52; 95% ДИ 0,35-0,77; р=0,00047) (рис.1);
- медиана ВБП составила 26 мес. в группе АДТ + апалутамид + АА/преднизон и 20 мес. в группе АДТ (ОР=0,48; 95% ДИ 0,32-0,71; р=0,00008) (рис.2);
- время до восстановления уровня тестостерона (вторичная конечная точка) значимо не различалось среди групп: АДТ – 3,9 мес., АДТ + апалутамид – 3,8 мес., АДТ + апалутамид + АА/преднизон – 4,7 мес.;
- нежелательные явления, приведшие к отмене лечения, отмечены в 0%, 2% и 3% случаев среди АДТ, двойной и тройной комбинаций соответственно.
Рисунок 1.
Выживаемость без
биохимического прогрессирования
в группах АДТ + апалутамид и
только АДТ.
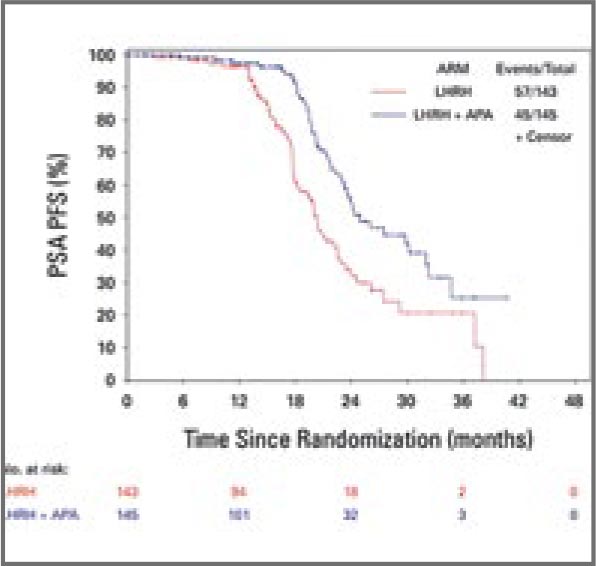
Рисунок 2.
Выживаемость без
биохимического прогрессиро-вания
в группах АДТ + апалутамид + АА/
преднизон и только АДТ.
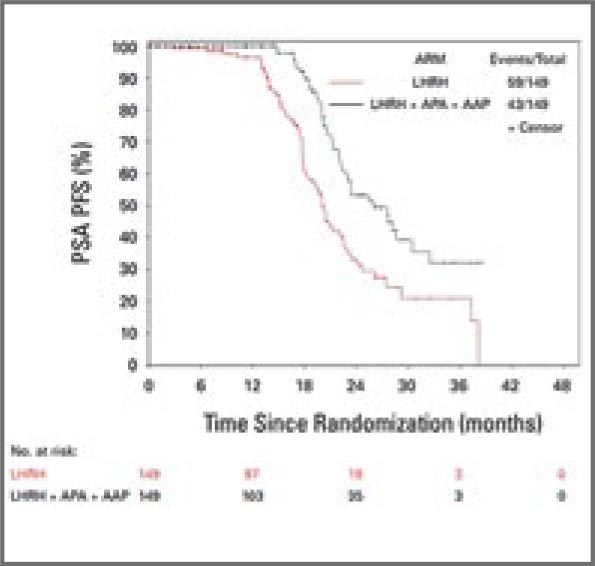
Данное исследование продемонстрировало эффективность интенсификации АДТ для пациентов с биохимическим рецидивом высокого риска. Однако стоит отметить некоторые ограничения: выбор конечной точки (выживаемость до биохимического прогрессирования не является суррогатом общей выживаемости в отличие от времени до развития метастазов), невозможность сравнить двойную и тройную комбинации между собой (малая мощность) и низкую частоту использования ПЭТ/ПСМА с целью исключения метастазов.
Источник:
Rahul Aggarwal, et al. PRESTO: A Phase III, Open-Label Study of Intensification of Androgen Blockade in Patients With High-Risk Biochemically Relapsed CastrationSensitive Prostate Cancer (AFT-19). JCO January 23, 2024, JCO.23.01157. DOI:10.1200/JCO.23.01157.
Материал подготовил Э.Исраэлян
РОЛЬ ПЭТ/КТ С FAPI В ДИАГНОСТИКЕ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ ЛЕГКОГО И ОРГАНОВ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА
Длительное время наиболее информативным методом радионуклидной диагностики в общей популяции онкологических больных являлась позитронно-эмиссионная томография, совмещенная с КТ и использованием фтордезоксиглюкозы ( 18Ф-ФДГ ПЭТ/КТ). Данная технология основывается на детекции повышенного поглощения меченой глюкозы в тканях с активным делением клеток и гиперметаболизмом, что является характерным признаком большинства злокачественных опухолей. Однако глюкоза является необходимым ресурсом для всех клеток, находящихся в состоянии активного деления, в частности, клеток эпителия желудочно-кишечного тракта, среди которых всегда отмечается физиологическое накопление 18Ф-ФДГ. Напротив, ряд анатомических структур, таких как, например, лимфатические узлы, печень и брюшина, отличается пониженным поглощением фармпрепаратов на основе глюкозы. Все эти факторы вместе лимитируют «универсальность» метода 18Ф-ФДГ ПЭТ/ КТ, мотивируя поиск новых, более чувствительных компараторов для диагностики опухолевых заболеваний.
Сегодня в клиническую практики активно входит использование нового меченого препарата – ингибитора фактора активации фибробластов (fibroblast activation protein inhibitor, FAPI). Теоретической основой высокой чувствительности FAPI в качестве радиофармпрепарата служит тот факт, что злокачественные клетки неразрывно связаны с окружающей их стромой, содержащей большое количество фибробластов, находящихся в норме в неактивном состоянии. В результате каскада молекулярных взаимодействий происходит их активация и трансформация в опухоль-ассоциированные фибробласты, отличающиеся более высокой пролиферативной активностью, «иммунитетом» к апоптозу и крайне высокой экспрессией на своей поверхности белка – фактора активации фибробластов (FAP). Так, по данным литературы, данный белок определяется в строме более чем 90% типов злокачественных опухолей, что делает использование меченого ингибитора к FAP крайне перспективным направлением ядерной медицины [1,2]. В недавнем небольшом китайском исследовании уже было показано, что данный метод обладает большей чувствительностью по сравнению с 18Ф-ФДГ ПЭТ/КТ при диагностике немелкоклеточного рака легкого и позволяет боле эффективно идентифицировать метастатическое поражение лимфатических узлов (93,0% [53/57] против 86,0% [49/57]), печени (100% [4/4] против 25% [1/4]) и костей (97,6% [41/42] против 83,3% [35/42]) (рис.1). При этом частота ложноположительных результатов также была ниже в группе FAPI – 1 против 5 «пораженных» лимфоузлов [3]. Закономерным является вопрос, сохранится ли аналогичная эффективность 68Ga-FAPI ПЭТ/КТ при диагностике опухолей ЖКТ? В январе 2024 года были опубликованы результаты проспективного исследования, включившего 112 пациентов с впервые выявленными (n=69) или прогрессирующими (n=43) злокачественными новообразованиями желудка (аденокарцинома: n=44; перстневидно-клеточный рак: n=5), печени (n=39) или поджелудочной железы (n=24) [4]. Дизайн работы предполагал последовательное выполнение 18Ф-ФДГ ПЭТ-КТ и 18Ф-FAPI ПЭТ-КТ с интервалом в одну неделю и последующей верификацией выявленных очагов при помощи гистологического исследования (n=69) или альтернативных методов инструментальной диагностики.
Рисунок 1.
Эффективность 68Ga-FAPI и 18Ф-ФДГ при оценке
распространенности НМРЛ.
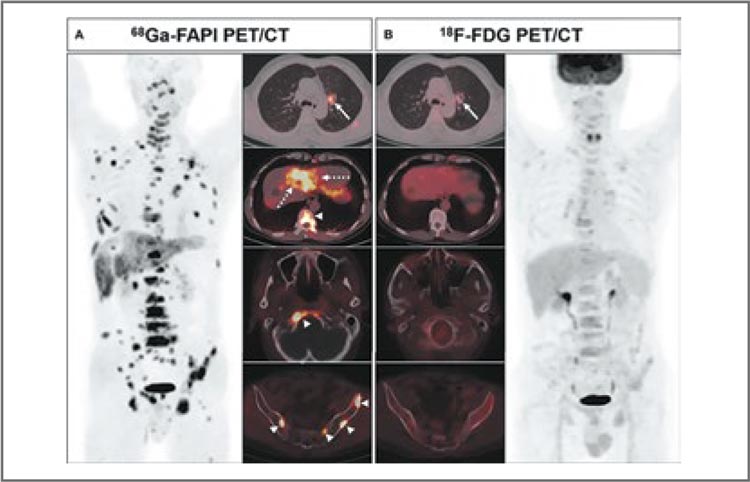
Использование FAPI при раке желудка обеспечило большую чувствительность в идентификации первичной опухоли (88% против 64%), пораженных лимфоузлов (88% против 55%, p<0,001) и перитонеальных метастазов (100% против 64%, p<0,001). При этом интенсивность накопления РФП в абдоминальных и наддиафрагмальных лимфоузлах также была достоверно выше в группе FAPI – SUVmax составил 6,2 против 2,9 (p<0,001) и 4,4 против 2,6 (p=0,0010) (рис.2). Аналогичные результаты были получены в отношении опухолей печени (гепатоцеллюлярный рак: n=31; внутрипеченочная холангиокарцинома: n=8) – использование FAPI ассоциировалось с большей выявляемостью первичной опухоли (100% против 82%), метастатического поражения печени (90% против 53%, p<0,001), брюшины (100% против 25%, p=0,031) и лимфатических узлов (97% против 43%, p<0,001) (рис.3).
Рисунок 2.
Эффективность 18Ф-ФДГ и 18Ф-FAPI при оценке
распространенности перстневидно-клеточного рака желудка.

Рисунок 3.
Эффективность 18Ф-ФДГ и 18Ф-FAPI при оценке
распространенности внутрипеченочной холангиокарциномы
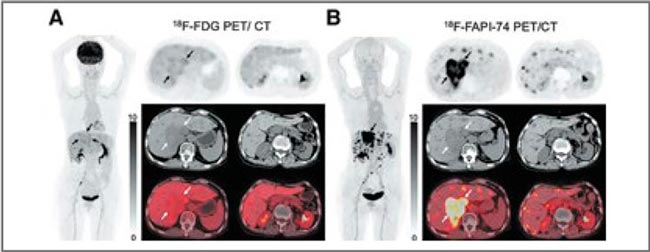
Опухоли поджелудочной железы были представлены внутрипротоковой аденокарциномой (n=21), плоскоклеточный раком (n=1), муцинозной аденокарциномой (n=1) и недифференцированным раком (n=1). Применение FAPI, как и в предыдущих группах, характеризовалось более высокой интенсивностью накопления РФП (медиана SUVmax 16,5 против 7,3), большей частотой выявления метастазов в печени (100% против 55%, p<0,001) и по париетальной брюшине (100% против 44%, p<0,001), а также большим количеством потенциально-метастатических лимфатических узлов (97% против 41%, p<0,001) (рис.4).
Рисунок 4.
Эффективность 18Ф-ФДГ и 18Ф-FAPI при оценке
распространенности внутрипротоковой аденокарциномы
поджелудочной железы.
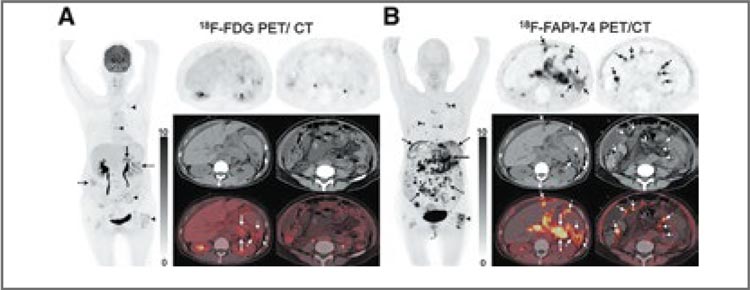
Гистологическое исследование выявленных очагов, выполненное у 69 пациентов, подтвердило высокую эффективность FAPI. Так, выявленные первичные опухоли были морфологически верифицированы у 96% по сравнению с 75% в группе ФДГ (p<0,001), а биопсия лимфоузлов показала, что показатели чувствительности, специфичности и точности при их идентификации составили 71%, 95% и 92% в группе FAPI и 40%, 96% и 88% в группе ФДГ соответственно (p<0,001). Интересен также тот факт, что при использовании ФДГ определялась корреляция между размером лимфатического узла, интенсивностью накопления РФП и вероятностью его метастатического поражения (p=0,036), а при использовании FAPI подобной связи выявлено не было (p=0,219).
Дополнительное выполнение FAPI ПЭТ/КТ после ФДГ в данном исследовании привело к повышению стадии заболевания по системе TNM у 25% (рак желудка: n=7; рак печени: n=6; рак поджелудочной железы: n=4) и коррекции тактики лечения у 9% пациентов.
Таким образом, использование ингибиторов фактора активации фибробластов в качестве радиотрейсера является высокоэффективным и информативным методом диагностики как локализованных, так и распространенных форм злокачественных опухолей органов желудочно-кишечного тракта.
Источники:
- Иванова А.А., и соавт. 68GaФАПИ-04: первый опыт клинического применения в России. Лучевая диагностика и терапия. 2022; 13(4): 27-37. https://doi. org/10.22328/2079-5343-2022-13-4- 27-37.
- Christiansen VJ, Jackson KW, Lee KN, Downs TD, McKee PA. Targeting inhibition of fibroblast activation protein-alpha and prolyl oligopeptidase activities on cells common to metastatic tumor microenvironments. Neoplasia. 2013; 15: 348-358.
- Wu J, et al. Comparison of 68GaFAPI and 18F-FDG PET/CT in the Evaluation of Patients With Newly Diagnosed Non-Small Cell Lung Cancer. Front Oncol. 2022 Jul 4; 12: 924223. doi: 10.3389/ fonc.2022.924223. PMID: 35860594. PMCID: PMC9289292.
- Weizhi Xu, et al. Journal of Nuclear Medicine. January 2024; 65(1): 40-51.https://doi.org/10.2967/ jnumed.123.266329.
Материал подготовил И. Боровков
КОММЕНТАРИЙ ЭКСПЕРТА
Автор: Федянин Михаил Юрьевич
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России,
доктор медицинских наук, Москва
При назначении пациенту того или иного диагностического теста необходимо понимать цель данного назначения и могут ли потенциально его результаты повлиять на тактику лечения. Если с этих позиций рассмотреть результаты исследования по сравнению ПЭТ/КТ с использованием в качестве радиотрейсера нового фармпрепарата – ингибитора фактора активации фибробластов (FAPI) – и с классической 18Ф-ФДГ ПЭТ/КТ, то результаты приведенной работы спорные.
В исследование включались пациенты с целью первичного стадирования или подтверждения рецидива заболевания. Во втором случае интенсификация наблюдения за пациентами с помощью внедрения более чувствительных методов детекции проявлений болезни при различных опухолях ЖКТ в рамках рандомизированных исследований III фазы провалилась, поэтому появление ПЭТ/КТ с новым трейсером ситуации не изменит, нужно будет повторять данные исследования. Также, если думать о применении данного подхода в оценке эффективности лечения в процессе химиотерапии, следует вспомнить, что в рутинной практике и даже в исследованиях мы используем обычную компьютерную томографию или МРТ, а в случае ограничения доступности обходимся обычным УЗИ. Это обусловлено тем, что применение более чувствительных методов детекции метастазов не меняет тактику, и мы ориентируемся на состояние пациента и динамику таргетных очагов. Кроме этого, следует принять во внимание, что в процессе развития опухоли и в процессе лечения могут происходить изменения в экспрессии FAPI.
Более интересно рассмотреть новый трейсер в рамках первичного стадирования, и тут лучше подходить индивидуально к каждой локализации. Почему индивидуально? Напомню, что в этом же журнале 8 февраля 2024 года Himras N. с соавторами опубликовали похожее исследование, но при опухолях различных локализаций, в котором диагностическая точность FAPI ПЭТ/КТ была ниже 18Ф-ФДГ ПЭТ/ КТ при опухолях мочевого пузыря, раке почки, лимфомах и не отличалась при раке молочной железы и опухолях головы и шеи, что можно объяснить различной степенью выраженности хронического воспаления и отличиями стромального компонента опухолей различных локализаций.
При раке желудка чувствительность в плане выявления первичной опухоли составила 88%, но здесь нас может выручить ФГДС с эндоУЗИ, а вот чувствительность в детекции перитонеальных метастазов составила все 100%. Это сразу наводит на мысль о прорыве в диагностической тактике больных раком желудка – отказ от диагностической лапароскопии. Однако кроме небольшой выборки в 25 пациентов нужно вспомнить о необходимости помимо визуальной оценки состояния брюшины выполнять смывы и биопсию, чтобы морфологически исключить перитонеальную диссеминацию. При этом по частоте выявления отдаленных метастазов вне брюшины отличий от 18Ф-ФДГ ПЭТ/КТ не обнаружено. Поэтому данный подход следует продолжить изучать уже на большей выборке больных, и пока он не поменяет диагностические подходы при раке желудка.
При опухолях печени (включено с целью первичного стадирования 22 пациента с ГЦР или ХЦР) подтверждающий метод в виде МРТ был выполнен лишь 14 пациентам, то есть для оценки чувствительности в отношении состояния паренхимы печени сравнивали с обычным МРТ, и в этом аспекте ничего не изменится. А вот в отношении отдаленного метастазирования – другая ситуация: FAPI ПЭТ/КТ демонстрирует лучшие результаты. Однако они получены на 22 пациентах, и нет данных в сравнении со стандартными подходами, куда не входит, на секундочку, 18Ф-ФДГ ПЭТ/КТ. То есть – будем ждать новых исследований.
В когорту больных раком поджелудочной железы для оценки первичного стадирования было включено 22 пациента. Новый трейсер чаще выявлял отдаленные метастазы и пораженные регионарные лимфоузлы. То есть при повышенном риске метастазирования (например, при высоком СА 19-9) данный метод видится перспективным. Однако в рамках оценки первичной опухоли различий не отмечено, и для оценки различий между резектабельными и потенциально-резектабельными опухолями поджелудочной железы данный метод не изменит ситуацию.
Также следует вспомнить, что для перечисленных опухолей ПЭТ/КТ входит в рекомендации как стандарт первичной диагностики только при раке желудка и при высоком риске рака поджелудочной железы. Таким образом, опуская методологические огрехи, отсутствие статистической гипотезы, малые выборки пациентов и принимая во внимание только клинические находки, представленная работа лишь дает предпосылки к новым исследованиям. Тем не менее, в клинической разработке фигурируют как минимум 8 трейсеров на основе FAPI, и данный метод рано или поздно войдет в нашу практику, но не как замена тех или иных диагностически процедур, а скорее как уточняющее дополнение в определенных клинических ситуациях и при некоторых нозологиях.
POUT TRIAL: АДЪЮВАНТНАЯ ХИМИОТЕРАПИЯ ПРИ УРОТЕЛИАЛЬНОМ РАКЕ ВЕРХНИХ МОЧЕВЫХ ПУТЕЙ
До публикации первых результатов исследования POUT в 2020 году стандартным подходом для пациентов с локализованным и местнораспространенным уротелиальным раком верхних мочевых путей (урВМП) после радикальной нефроуретерэктомии (РНУ) являлось наблюдение. Продемонстрированное улучшение выживаемости без признаков болезни (ВБПБ) при применении адъювантной ХТ (аХТ) (ОР 0,45; р=0,0001) позволило зарегистрировать данную опцию в клинических рекомендациях. В финальном анализе представлены обновленные данные по ВБПБ (первичная конечная точка), общей выживаемости (ОВ) и другим вторичным точкам.
В исследование III фазы POUT были включены пациенты с неметастатическим урВМП после РНУ (pT2-T4 и/или pN1-N3) и рандомизированы в соотношении 1:1 в группы платиносодержащей ХТ (n=131) и наблюдения (n=129).
Рисунок 1.
А) выживаемость без прогрессирования болезни;
В) выживаемость без отдаленных метастазов; С) раковоспецифическая выживаемость; D) общая выживаемость в
группах аХТ и наблюдения.
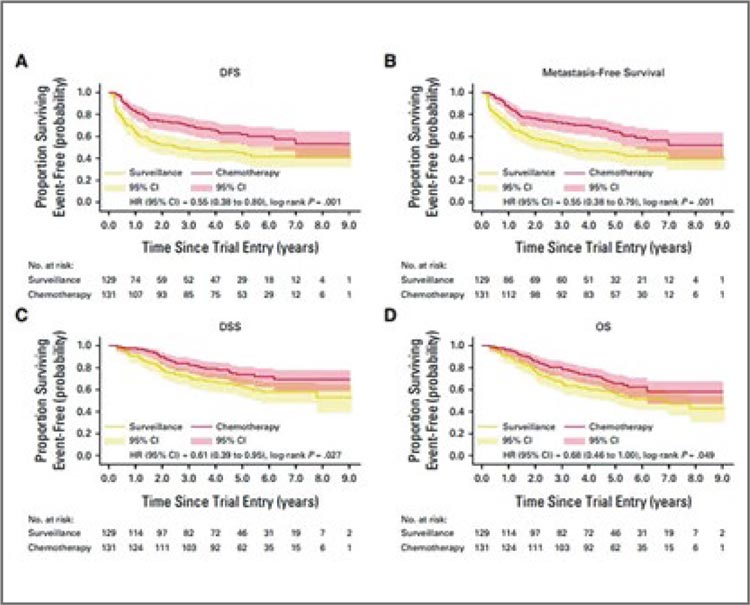
При медиане наблюдения 65 месяцев:
- 5-летняя ВБПБ составила 62% в группе аХТ и 45% в группе наблюдения; при однофакторном анализе ОР 0,55, 95% ДИ 0,38- 0,80, р=0,001; эффект сохраняется в многофакторном анализе (р=0,004);
- мВБПБ составила 72 мес. и 54 мес. в группах аХТ и наблюдения соответственно;
- 5-летняя ОВ составила 66% и 57% в группах аХТ и наблюдения соответственно; при однофакторном анализе ОР 0,68, 95% ДИ 0,46-1,0, р=0,049; эффект теряется в многофакторном анализе (р=0,17);
- мОВ составила 78 мес. и 67 мес. в группах аХТ и наблюдения соответственно;
- время до выявления метастазов и выживаемость, связанная с заболеванием, лучше в группе аХТ (р=0,001 и р=0,027 соответственно).
Стоит отметить, что набор в исследование был досрочно завершен в связи с очевидным улучшением ВБПБ в группе аХТ. Этот факт мог повлиять и на финальные результаты по ОВ, учитывая пограничную статистическую значимость данного показателя при однофакторном анализе. Отдаленные результаты исследования POUT подтверждают эффективность аХТ при урВМП с тенденцией к увеличению ОВ.
Материал подготовил Э.Исраэлян
КОММЕНТАРИЙ ЭКСПЕРТА
Автор: Носов Дмитрий Александрович
ФГБУ «Центральная клиническая больница» Управления делами Президента РФ,
Председатель Российского общества клинической онкологии (RUSSCO),
доктор медицинских наук, профессор, Москва
Главный вопрос на сегодняшний день: какой вариант адъювантной терапии для пациентов с уротелиальным раком верхних мочевых путей (лоханка, мочеточник) является наиболее предпочтительным – химиотерапия или анти-PD1 иммунотерапия? С одной стороны, с увеличением времени наблюдения за пациентами, включенными в исследование POUT, по-прежнему сохраняется убедительное преимущество в БПВ и ОВ у адъювантной химиотерапии над наблюдением. С другой стороны, мы знаем, что в исследованиях CheckMate-274 и KEYNOTE-123 адъювантная иммунотерапия (ниволумаб, пембролизумаб) значимо улучшила безпрогрессивную выживаемость после радикального хирургического лечения в общей популяции пациентов с уротелиальным раком (мочевой пузырь, лоханка мочеточник). При этом подгрупповой анализ двух последних исследований продемонстрировал, что улучшение показателей БПВ наблюдается только у больных раком мочевого пузыря, и адъювантная иммунотерапия не дает никаких преимуществ пациентам с уротелиальным раком верхних мочевых путей. Соответственно, адъювантная химиотерапия для этих пациентов по-прежнему является единственной эффективной опцией.
РАК НОСОГЛОТКИ: ТОЛЬКО ЛУЧЕВОЙ ТЕРАПИИ ДОСТАТОЧНО ПОСЛЕ ИНДУКЦИОННОЙ ПХТ
Хорошая новость для радиотерапевтов: индукционная терапия позволяет отказаться от токсичного одновременного химиолучевого лечения и ограничиться только радикальным курсом лучевой терапии при раке носоглотки, как показывает многоцентровое рандомизированное исследование 3 фазы, проведенное в 5 центрах Китая с 2015 по 2018 гг.
На протяжении многих лет одновременное химиолучевое лечение рака носоглотки являлось стандартом лечения больных с местнораспространенным процессом. Ряд крупных исследований продемонстрировали, что более раннее начало интенсивной химиотерапии в качестве индукции перед последующей ХЛТ позволяет уменьшить размеры первичной опухоли, воздействовать на ее макро- и микрометастазы и в целом хорошо переносится большинством пациентов. Однако следующая после индукции одновременная ХЛТ весьма токсична: более 70% больных имеют ранние осложнения 3+ степени и не более 30-50% пациентов получают все 3 введения цисплатина на фоне курса ЛТ.
Исследование китайских авторов включало 383 пациента с местнораспространенным раком носоглотки (стадии III-IVB), средний период наблюдения составил 76 месяцев, средний возраст – 48 лет. Пациенты были рандомизированы в две лечебные группы, при этом все они получали индукционную терапию на 1 этапе (3 цикла по схеме цисплатин 60 мг/м2 1 день, доцетаксел 60 мг/м2 1 день и пролонгированную 5-дневную инфузию 5-фторурацила 600 мг/м2, каждые 3 недели), после чего пациенты 1 группы продолжали лечение только лучевой терапией, а во 2 группе – одновременной ХЛТ (оХЛТ) с цисплатином 30 мг/м2 в еженедельном режиме. Первичной конечной точкой была выживаемость без прогрессирования за 3 года, и авторы планировали показать, что отказ от оХЛТ не ухудшит результаты. Вторичными конечными точками стали общая выживаемость, выживаемость без локорегионарного рецидива, без отдаленных метастазов, частота общих ответов и токсичность.
В итоге 3-летняя ВБП мало различалась в 2 группах: 76,2% в группе ЛТ и 76,8% для группы ХЛТ (HR 0,92; 95% CI 0,65-1,32; log-rank P = 0,66), что подтвердило версию авторов. Токсичность 3 и более степени отмечена у большего числа больных из группы ХЛТ (73% против 54%), наиболее часто встречались миелосупрессия и рвота. По другим важным конечным показателям разницы между группами не было отмечено. ОВ за 3 года, выживаемость без ЛРР, выживаемость без отдаленных метастазов составили 86,0%, 91,3% и 83,7% для группы ЛТ и 86,8%, 88,5% и 85,1% для группы ХЛТ (рис.1).
Рисунок 1.
ВБП (A), ОВ (B), выживаемость без локорегио-нарного
рецидива (C) и без отдаленных метастазов (D) за 3 года.

Авторы сделали вывод, что после 3 курсов индукционной ПХТ проведение только лучевой терапии (менее токсичной, чем оХЛТ, но не менее эффективной при подобном подходе) является приемлемой опцией для больных с местнораспространенным раком носоглотки.
Источник:
Jinxuan Dai, et al. Induction Chemotherapy Followed by Radiotherapy vs Chemoradiotherapy in Nasopharyngeal Carcinoma. A Randomized Clinical Trial. JAMA Oncol. doi:10.1001/ jamaoncol.2023.6552. Published online: February 8, 2024.
CHECKMATE 649: ОБНОВЛЕННЫЕ РЕЗУЛЬТАТЫ
21 февраля JCO опубликовал результаты 3-летнего наблюдения в исследовании CheckMate 649 по изучению эффективности комбинированной химиоиммунотерапии у пациентов с метастатическими формами рака желудка, гастроэзофагеального перехода и аденокарциномы пищевода. Напомним, что первые промежуточные данные продемонстрировали улучшение всех показателей эффективности, включая общую выживаемость и выживаемость без прогрессирования, при применении ниволумаба в сочетании с химиотерапией (XELOX или FOLFOX на усмотрение исследователя) у пациентов с положительными показателями PD-L1 (CPS) ≥5. Кроме того, комбинация ниволумаба с химиотерапией привела и к улучшению ОВ в общей популяции.
Рисунок 1.
Кривые ОВ, ВБП и продолжительности ответа (А, С и Е) для больных с PD-L1
CPS≥5 и для всей популяции (B, D и F).

В обновленных данных при минимальном сроке наблюдения 36,2 месяца ниволумаб с химиотерапией продолжили демонстрировать улучшение ОВ в популяции пациентов с PD-L1 (CPS) ≥5 по сравнению только с химиотерапией 14,4 месяца [95% ДИ 13,1-16,2] против 11,1 месяцев [95% ДИ 10,0-12,1] соответственно; HR 0,70 [95% ДИ 0,61-0,81]). В общей популяции также отмечено увеличение ОВ в группе комбинированного лечения HR 0,79 [95% ДИ 0,71-0,88]. Показатели ВБП и ЧОО продемонстрировали улучшение показателей для пациентов из группы ниволумаба с химиотерапией и составили:
- ВБП: 8,3 месяца [95% ДИ 7,0-9,3] против 6,1 месяцев [95% ДИ 5,6-6,9] соответственно; HR 0,70 [95% ДИ 0,60-0,81]) у пациентов с PD-L1 (CPS) ≥ 5;
- частота объективных ответов (ЧОО): 60% [95% ДИ 54,7-64,8] против 45% [95% ДИ 40,1-50,2]) соответственно в популяции PD-L1 (CPS) ≥ 5. Частота полного ответа составила 13% против 7%.
Аналогичное улучшение показателей наблюдалось и в общей популяции.
Подгрупповые анализы показали, что наибольший выигрыш от комбинации ниволумаба с химиотерапией получили пациенты с высокой микросателлитной нестабильностью (MSI-H): медиана ОВ 44,8 месяца, HR 0.29 (95% ДИ 0.12-0.71); у пациентов со стабильными микросателлитами (MSS) результаты были аналогичны результатам в общей популяции - мОВ 14,3 месяца, HR 0.71 (95% ДИ 0.62-0.83). Снижение риска смерти также наблюдалось в подгруппах с разными уровнями экспрессии PDL1 (CPS). При этом чем сильнее была экспрессия PD-L1 (CPS), тем ниже HR: PD-L1 (CPS) ≥ 1, ≥5 и ≥10 - 0,75, 0,69 и 0,66 соответственно.
Важен и тот факт, что выбор химиотерапевтического режима никак не повлиял на показатели ОВ в обеих исследуемых группах.
Обновленные данные CheckMate 649 ещё раз подтверждают эффективность ниволумаба с химиотерапией в популяции пациентов с PD-L1 (CPS) ≥5 в первой линии терапии метастатического рака желудка, гастроэзофагеального перехода, аденокарциномы пищевода.
Источник:
Yelena Y. Janjigian, et al. First-Line Nivolumab Plus Chemotherapy for Advanced Gastric, Gastroesophageal Junction, and Esophageal Adenocarcinoma: 3-Year Follow-Up of the Phase III CheckMate 649 Trial. Journal of Clinical Oncology 2024, 21 February https://doi.org/10.1200/ JCO.23.01601
Подготовлено А.В.Фатьяновой