Дорогие коллеги, дорогие друзья!
«В феврале далеко до весны» - сказал однажды поэт. Завершающий месяц зимы традиционно суров, и большинству из нас, истосковавшихся по солнцу и теплу, еще долго созерцать темнеющую белизну сугробов, слышать завывания зимнего ветра и ощущать мороз кожей щек. Однако для нас, онкологов, февраль – месяц особый, ибо в самом его начале, а именно 4 февраля, мировое...

Евгений Лушпин.
Сумерки в городе. 2000 г
Борис Пастернак. «Февраль. Достать чернил и плакать!..» 1912г
Февраль. Достать чернил и плакать! Писать о феврале навзрыд, Пока грохочущая слякоть Весною чёрною горит. Достать пролётку. За шесть гривен, Чрез благовест, чрез клик колёс, Перенестись туда, где ливень Ещё шумней чернил и слёз.
ЕЖЕГОДНЫЙ ТЕЛЕМОСТ RUSSCO: РЕГИОНЫ О СВОИХ ДОСТИЖЕНИЯХ
Специалисты из Южно-Сахалинска, Иркутска, Омска, Ульяновска, Ростова-на-Дону и Москвы специально к Всемирному дню борьбы с онкологическими заболеваниями подготовили выступления, в которых рассказали о достигнутых в прошедшем году успехах в онкологии в их регионах...

К МЕЖДУНАРОДНОМУ ДНЮ БОРЬБЫ С ОНКОЛОГИЧЕСКИМИ ЗАБОЛЕВАНИЯМИ
«Когда вы научитесь лечить рак?» – сакраментальный вопрос, который мне задавали и продолжают задавать в течение всех 50 лет моей научной карьеры друзья, знакомые и журналисты. Как ни...
СМЕРТНОСТЬ ОТ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ ПРОДОЛЖАЕТ СНИЖАТЬСЯ
Американские исследователи из Атланты представили самые последние популяционные данные о заболеваемости и исходах злокачественных новообразований, используя данные Национального центра статистики здравоохранения (статья находится в открытом доступе). Несмотря на то, что они касаются в основном показателей заболеваемости и смертности в Соединенных Штатах, их можно...

ОСИМЕРТИНИБ СУЩЕСТВЕННО УЛУЧШАЕТ БЕЗРЕЦИДИВНУЮ ВЫЖИВАЕМОСТЬ У ОПЕРИРОВАННЫХ БОЛЬНЫХ НЕМЕЛКОКЛЕТОЧНЫМ РАКОМ ЛЕГКОГО С МУТАЦИЕЙ EGFR
В Journal of Clinical Oncology были представлены результаты 4-летнего наблюдения за больными, включенными в рандомизированное исследование ADAURA. В этом исследовании больные IB-IIIA...
ПОДВЕДЕНИЕ ИТОГОВ РАБОТЫ РЕДАКЦИИ ЖУРНАЛА «ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ» ЗА 2022 ГОД
Научно-практический рецензируемый медицинский журнал «Злокачественные опухоли» издается с 2010 года и является официальным печатным изданием Российского общества клинической онкологии (RUSSCO). Подводя итоги прошедшего года, в первую очередь хочется отметить следующие достижения...

X КОНФЕРЕНЦИЯ RUSSCO
РАК МОЛОЧНОЙ ЖЕЛЕЗЫ

ИМФИНЗИ
ЖИЗНЕННО ВАЖНО!
ЦИСПЛАТИН В КОМБИНАЦИИ С ИНГИБИТОРОМ PARP ВЕЛИПАРИБОМ ПРИ РАКЕ МОЛОЧНОЙ ЖЕЛЕЗЫ C НАРУШЕНИЯМИ В СИСТЕМЕ ГОМОЛОГИЧНОЙ РЕКОМБИНАЦИИ
В январе 2023 года в журнале Lancet Oncology опубликованы результаты исследования SWOG S1416. Оно посвящено изучению целесообразности добавления ингибитора PARP велипариба к цисплатину при раке молочной железы с нарушениями в системе гомологичной рекомбинации (HRR) во второй и последующих линиях терапии...
СОХРАНЕНИЕ ОРГАНА ПОСЛЕ НЕОАДЪЮВАНТА: ДАННЫЕ ИССЛЕДОВАНИЯ OPERA
В журнале Lancet 16 февраля 2023 года впервые были опубликованы результаты рандомизированного исследования III фазы OPERA. Проблема сохранения органа при проведении радикального комплексного лечения при местнораспространенном раке прямой кишки, особенно при низком расположении опухоли, всегда была чрезвычайно актуальной. И высокий риск локального рецидива, и...

ASCO GI 2023: НОВЫЕ ВОЗМОЖНОСТИ ТЕРАПИИ ОПУХОЛЕЙ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА
C 19 по 22 января 2023 года в СанФранциско прошел симпозиум ASCO, посвященный терапии опухолей желудочно-кишечного тракта. Некоторые исследования, представляющие научный и...

ОНКОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ, СВЯЗАННАЯ С ЛЕЧЕНИЕМ СЕРДЕЧНО-СОСУДИСТЫХ ЗАБОЛЕВАНИЙ, У ПАЦИЕНТОВ С ОНКОЛОГИЧЕСКИМ ЗАБОЛЕВАНИЕМ В АНАМНЕЗЕ
В последнее время в связи с высокой распространенностью сердечно-сосудистых заболеваний (ССЗ), успешным их лечением и увеличением продолжительности жизни большой интерес вызывает...

ДВЕ БОЛЬШИЕ РАЗНИЦЫ: О ГОСУДАРСТВЕННОМ И ЧАСТНОМ В ОНКОЛОГИИ
Итак, меня зовут Владимир, и я хочу рассказать вам о том, каково быть по разные стороны условных онкологических баррикад. В России, а точнее, в ее столице – Москве – онкологический мир...
ПРОГРАММА RUSSCO ПО МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКОЙ ДИАГНОСТИКЕ: КОНТРОЛЬ КАЧЕСТВА
Российское общество клинической онкологии в течение 11 лет проводит программу «Совершенствование молекулярно-генетической диагностики в Российской Федерации с целью повышения эффективности противоопухолевого лечения». Более 140 000 тестов выполнено за этот период при 9 нозологических формах рака. Благодаря этому у нескольких десятков тысяч пациентов появилась...
ЗНАКОМЬТЕСЬ: РЕГИОНАЛЬНОЕ ОТДЕЛЕНИЕ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ АРХАНГЕЛЬСКОЙ ОБЛАСТИ
Архангельская область (неофициальный синоним: Помóрье) — субъект Российской Федерации на севере Европейской части России, входящий в Северо-Западный федеральный округ. Архангельская область является 8-м по территории субъектом Российской Федерации, а также крупнейшим регионом в европейской части России. Административный центр области — город Архангельск...

ЛУЧ НАДЕЖДЫ — «А ВОТ БЫЛ У МЕНЯ СЛУЧАЙ», ИЛИ «ОХОТНИЧЬИ ЗАПИСКИ» ОНКОЛОГОВ
Плоскоклеточный рак кожи – это в большинстве случаев курабельная клиническая ситуация, когда радикальное оперативное удаление очага может полностью излечить пациента без применения дополнительных методов. Но порой запущенная...
НЕТ, КОФЕ НЕ ДАСТ ВАМ ЛИШНЕЙ ЭНЕРГИИ. ОН ПРОСТО ДАСТ НЕМНОГО ВЗАЙМЫ – ЗА ЧТО ВЫ ЗАПЛАТИТЕ ПОЗЖЕ
Многие из нас мечтают (или, лучше сказать, нуждаются?) об утреннем кофе, который позволяет нам взбодриться и начать день. В общей сложности люди в мире выпивают более двух миллиардов чашек кофе ежедневно. Вы наверняка думаете, что кофе дарит вам энергию, чтобы пережить утро или день, – но далеко не факт, что кофе дает так много, как вы думаете. Основным стимулятором в...
Анонс
-

24 - 25 марта 2023
ОНКОГИНЕКОЛОГИЯ. РЕДКИЕ ОПУХОЛИ
IX КОНФЕРЕНЦИЯ RUSSCO
-

30 - 31 марта 2023
РАК МОЛОЧНОЙ ЖЕЛЕЗЫ
X КОНФЕРЕНЦИЯ RUSSCO
-

13 - 14 апреля 2023
РАК ЛЕГКОГО И ДРУГИЕ ОПУХОЛИ ГРУДНОЙ КЛЕТКИ
IX КОНФЕРЕНЦИЯ RUSSCO
-

20 - 21 апреля 2023
ОНКОУРОЛОГИЯ
V КОНФЕРЕНЦИЯ RUSSCO
Дорогие коллеги, дорогие друзья!
«В феврале далеко до весны» - сказал однажды поэт. Завершающий месяц зимы традиционно суров, и большинству из нас, истосковавшихся по солнцу и теплу, еще долго созерцать темнеющую белизну сугробов, слышать завывания зимнего ветра и ощущать мороз кожей щек. Однако для нас, онкологов, февраль – месяц особый, ибо в самом его начале, а именно 4 февраля, мировое онкологическое сообщество отмечает World Cancer Day, Международный день борьбы со злокачественными опухолями. Немалое количество мероприятий, локальных и масштабных, было приурочено и осуществлено в регионах страны, мы уверены, что каждое онкологическое сообщество может рассказать о них. Российское общество клинической онкологии постаралось в очередной раз подчеркнуть это, организовав ежегодный телемост с несколькими регионами России – информацию об этом вы увидите на страницах февральского выпуска газеты. Кроме того, мы продолжаем пополнять информацию о региональных отделениях RUSSCO и их деятельности, и в фокусе этого номера – онкологическое сообщество Архангельской области. Год вступил в свои права, уже состоялись некоторые крупные онкологические конференции мирового масштаба; так, информация о результатах исследований, продемонстрированных на ASCO GI 2023, представлена в февральском номере газеты, а новости ASCO GU ожидайте в ближайшее время на сайте rosoncoweb.ru.
Мы ждем Ваших идей и предложений по формированию программы будущего XXVII Российского онкологического конгресса, работа над которой уже начата, и в наших силах сделать эту программу максимально насыщенной и интересной. Напоминаем также, что газета RUSSCО и журнал «Злокачественные опухоли» ждут своих авторов. На страницах этого номера вы можете ознакомиться с кратким отчетом о том, какие шаги вперед были сделаны редакцией в прошедшем году для того, чтоб публикация в журнале была престижной для авторов и полезной для читателей.
Все мы ждем весну, ждем перехода от зимней темноты к свету и теплу, продолжая работать, творить, лечить наших пациентов. Берегите себя, дорогие коллеги, пусть у каждого из вас будет некая отдушина, личная гавань, дающая спокойствие и тепло - как свет в окне родительской хрущевки февральским вечером, видимый издалека. Увидимся весной!
Ваша, команда RUSSCО
Евгений Лушпин.
Сумерки в городе. 2000 г

Борис Пастернак. «Февраль. Достать чернил и плакать!..» 1912г
Февраль. Достать чернил и плакать!
Писать о феврале навзрыд,
Пока грохочущая слякоть
Весною чёрною горит.
Достать пролётку.
За шесть гривен,
Чрез благовест, чрез клик колёс,
Перенестись туда, где ливень
Ещё шумней чернил и слёз.
Где, как обугленные груши,
С деревьев тысячи грачей
Сорвутся в лужи и обрушат
Сухую грусть на дно очей.
Под ней проталины чернеют,
И ветер криками изрыт,
И чем случайней, тем вернее
Слагаются стихи навзрыд.
ЕЖЕГОДНЫЙ ТЕЛЕМОСТ RUSSCO: РЕГИОНЫ О СВОИХ ДОСТИЖЕНИЯХ
7 февраля Российское общество клинической онкологии
(RUSSCO) провело очередную
ежегодную перекличку достижений российской онкологии.
Специалисты из Южно-Сахалинска, Иркутска, Омска, Ульяновска,
Ростова-на-Дону и Москвы специально к Всемирному дню борьбы с
онкологическими заболеваниями
подготовили выступления, в которых рассказали о достигнутых
в прошедшем году успехах в онкологии в их регионах.
Телемост открыл Сергей Алексеевич Тюляндин, председатель
RUSSCO, главный научный сотрудник ФГБУ «НМИЦ онкологии
им. Н.Н. Блохина» Минздрава России, профессор, который поприветствовал участников и сказал,
что ежегодный телемост RUSSCO
стал уже традиционным. Вместе с
ним мероприятие вела и Людмила
Григорьевна Жукова, член Правления RUSSCO, заместитель директора ГБУЗ «Московский клинический научно-практический
центр имени А.С. Логинова ДЗМ»,
профессор.
Своеобразная эстафета достижений началась с одного из самых
отдаленных уголков России – Южно-Сахалинска.
Председатель регионального отделения RUSSCO, заведующая
дневным отделением Центра амбулаторной онкологической помощи, врач-онколог ГБУЗ «Сахалинский областной онкологический
диспансер» Эльвира Левоновна
Парсаданова рассказала об общей ситуации с эпидемиологией
злокачественных новообразований и скрининговых программах
в Сахалинской области, особо отметив, что снижение одногодичной летальности в регионе было
достигнуто благодаря хорошему
лекарственному обеспечению.
Среди данных о скрининге приводились, например, следующие результаты: за три года было взято
пять тысяч анализов кала на скрытую кровь, проведено более тысячи колоноскопий, что позволило
выявить 64 опухоли (59 из них – 1
и 2 стадий) и удалить 138 полипов,
тем самым избежав более тяжелых
последствий для пациентов.
Коллеги из Иркутского областного онкологического диспансера поделились своими достижениями в оказании онкоортопедической помощи, в применении передовых технологий в сфере трансплантации костного мозга (потенциальные возможности специалистов могут позволить проводить до 60 пересадок в год), опытом использования информационно-управляющей системы ARIA для оптимизации работы службы лучевой терапии, когда цифровая лучевая карта пациента позволяет решить не только проблему бумажных носителей информации, но и увеличить пропускную способность, соответственно, уменьшая время ожидания больным назначенных процедур.
Начиная свое выступление, председатель регионального отделения RUSSCO, первый заместитель
главного врача БУЗОО «Клинический онкологический диспансер»,
главный внештатный специалист
онколог Министерства здравоохранения Омской области, к.м.н.
Дмитрий Михайлович Вьюшков
выразил удовлетворение от сообщений коллег и уверенность во
взаимной пользе подобных телемостов.
Далее он рассказал о внедрении
современных технологий в диагностике и лечении рака молочной
железы, уделив особое внимание
активному применению биопсии
сторожевого лимфатического узла
(БСЛУ). В частности, Дмитрий
Михайлович сообщил, что в результате ее применения 212 пациенток избежали лимфаденэктомии, как следствие, были снижены
затраты на возможное длительное
лечение и реабилитацию.
Отвечая на вопрос модераторов,
Д.М. Вьюшков сказал, что БСЛУ
применяется не только при диагнозе РМЖ, но и при онкоурологических заболеваниях, опухолях
кожи и некоторых других нозологиях.
О реализации федерального проекта «Борьба с онкологическими
заболеваниями» на территории
Ульяновской области доложил
исполняющий обязанности главного врача ГУЗ «Областной клинический онкологический диспансер» Виктор Дмитриевич
Куликов.
Особо следует выделить факт
подготовки квалифицированных
кадров на собственной базе. В
данный момент 30 ординаторов
продолжают обучение и уже к
2024 году вопрос кадрового дефицита в регионе перестанет быть
острым. Кроме того, В.Д. Куликов
рассказал о подготовке к началу
строительства нового корпуса на
территории диспансера. А значит,
еще одна проблема – нехватка
площадей – будет решена.
Были отмечены и следующие моменты: с 2019 года активно обновляется оборудование, в том числе приобретается современная аппаратура отечественного производства; внедрены телемедицина, дистанционные консультации, электронный документооборот; ведется профилактическая работа с населением – это и постоянные телеэфиры с участием специалистов диспансера, акция «Выездная поликлиника», тесное сотрудничество с пациентскими организациями.
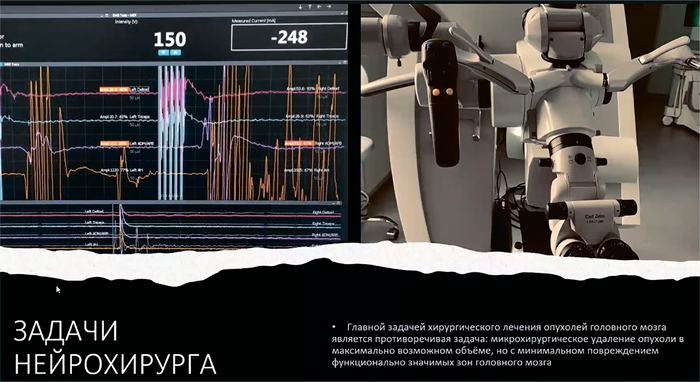
Ростовские специалисты из ФГБУ
«НМИЦ онкологии» Минздрава России подробно рассказали
о современных аспектах ранней
диагностики и микрохирургии
в нейроонкологии. Именно в
Ростове-на-Дону более 20 лет назад впервые в стране была создана нейроонкологическая служба.
За эти годы накопился богатый
опыт, которым и поделились дончане.
Были приведены примеры нескольких исследований, посвященных раннему выявлению опухолей головного мозга (начиная с
раннего детского возраста), два
из которых получили патенты
Российской Федерации.
По традиции завершала телемост Москва. Ирина Ивановна Андреяшкина, заместитель
главного внештатного специалиста-онколога Депздрава Москвы,
главный химиотерапевт Депздрава Москвы, профессор, анонсировала результаты наблюдательного
исследования, проводившегося в
течение прошедшего года, в котором досконально изучались все
аспекты развития онкологии в современных реалиях.
В качестве одной из иллюстраций была продемонстрирована
аналитическая таблица, куда Московским онкологическим обществом были внесены 10 препаратов. Ведь каждый новый препарат
нуждается в проверке эффективности и отсутствии токсичности.
Также немаловажным является
и осуществление компенсационных выплат на приобретение дорогостоящих лекарств.
По словам Ирины Ивановны,
итогом подобных исследований
может стать переосмысление
принципов лечения онкобольных
и создание новых стандартов оказания онкологической помощи.
В финале мероприятия к эфиру
подключился Игорь Евгеньевич
Хатьков, главный внештатный специалист-онколог Депздрава Москвы, директор ГБУЗ «Московский
клинический научно-практический
центр имени А.С. Логинова ДЗМ»,
академик РАН, профессор, который
не только поблагодарил Российское
общество клинической онкологии
и всех участников за возможность
обмена уникальным региональным
опытом, но и выразил надежду на
повсеместное создание отдельных
служб канцеррегистра на местах,
сказав, что в столице такая работа
уже активно ведется.
С.А. Тюляндин, закрывая телемост,
отметил: «Все выступления лишний раз убеждают, что, несмотря
ни на что, онкологическая помощь
в стране продолжает улучшаться, а
это значит, что и через год мы снова
встретимся и узнаем о достижениях,
достигнутых коллегами уже из других регионов».
С полной версией телемоста можно
будет ознакомиться в ближайшие
дни на сайте RosOncoWeb.ru.
К МЕЖДУНАРОДНОМУ ДНЮ БОРЬБЫ С ОНКОЛОГИЧЕСКИМИ ЗАБОЛЕВАНИЯМИ
Автор: Заридзе Давид Георгиевич
Президент Противоракового общества России, ФГБУ «НМИЦ онкологии им. Н.Н. Блохина»
Минздрава России, доктор медицинских наук, профессор, член-корреспондент РАМН, Москва
«Когда вы научитесь лечить рак?» –
сакраментальный вопрос, который
мне задавали и продолжают задавать
в течение всех 50 лет моей научной
карьеры друзья, знакомые и журналисты. Как ни странно, грандиозный
прогресс в лечении рака, особенно за
последнее десятилетие, остался незамеченным в обществе. Еще более
странно звучит вопрос: «Действительно ли курение является причиной
рака?» Об этом меня спросила пару
дней назад журналистка популярной
и, вроде бы, серьезной газеты. Конечно, в этой неинформированности
общества хочется, в первую очередь,
как всегда, винить журналистов и
СМИ. Однако боюсь, что вину придется взять на себя, на медицинское
сообщество и, конечно же, онкологов,
которые не информируют своих пациентов о наиболее важных угрозах
для их здоровья, и в первую очередь,
курения.
То, что курение – основная причина
развития пятнадцати форм рака и
ряда других наиболее распространенных в современном обществе заболеваний, таких как болезни сердца
и сосудов, хронические заболевания
легких, диабет и т.д., является давно
доказанным научным фактом. Отказ
от курения в любом возрасте приводит к достоверному снижению вероятности развития рака и других перечисленных выше заболеваний. Об
этом написаны многие сотни тысяч
страниц как в научных, так и в популярных изданиях.
В этой заметке, посвященной дню
онколога, отмечаемому Всемирной
организацией здравоохранения 4
февраля, я хочу обратить внимание
на наше относительно недавнее открытие, в котором мы показали, что
курение онкологических больных отрицательно влияет на эффективность
противоопухолевой терапии и прогноз заболевания. Больные с онкологическим диагнозом, которые бросили курить, живут на 2-3 года дольше,
чем больные, которые продолжали
курить. Отказ от курения снижает
на 35% смертность и риск прогрессирования болезни. Этот результат, как
минимум, сопоставим с эффективностью современных инновационных
противоопухолевых препаратов. О
том, что курение значительно ухудшает шансы излечиться и выжить,
онкологические пациенты, увы, не
знают. Им об этом не говорят. Не то
чтобы скрывают, а просто не знают
или недосуг. По данным США, об отрицательном воздействии курения
на исход болезни больным сообщают
20-40% врачей. Думаю, что ситуация в
нашей стране в этом плане не лучше. В
итоге значительный прогресс в лекарственной терапии рака, в частности
рака легкого, практически обнуляется
курением.
Курение ухудшает прогноз и больных другими тяжелыми, до недавних
пор неизлечимыми заболеваниями.
Наиболее впечатляющий пример –
это ВИЧ-инфицированные больные.
Применение современной противовирусной терапии существенно продлевает им жизнь. Продолжительность
их жизни не ниже, чем у практически
здоровых людей, но, увы, многие из
них умирают в том числе и от ассоциированных с курением злокачественных опухолей. Распространенность
курения среди ВИЧ-положительных
лиц в США как минимум в два раза
выше, чем в общей популяции, и, соответственно, заболеваемость раком
легкого среди них также значительно
выше, чем в общей популяции. Рак
легкого является наиболее частой причиной смерти ВИЧ-положительных
пациентов. Кроме того, курение
ухудшает эффективность противовирусной терапии, снижает в среднем
на 6 лет продолжительность жизни
ВИЧ-инфицированных пациентов.
Эйфорию, вызванную успехом антивирусной терапии больных с ВИЧ,
в которую были вложены огромные
интеллектуальные и материальные
ресурсы, омрачила высокая среди
них смертность от рака легкого. Как
говорится – деньги, выброшенные
на ветер. В связи с этим отказ от курения должен быть одним из важнейших компонентов лечения ВИЧинфицированных больных.
Курение – это болезнь, которая фигурирует в Международной классификации болезней. Курильщиков надо
лечить! Причем лечить и «здоровых»
курильщиков, и курильщиков с онкологическими и другими тяжелыми
болезнями, на прогноз и исход которых курение оказывает губительное
влияние.
Программа лечения должна включать
научно обоснованные методы отказа
от курения, с учетом применения никотинзаместительной терапии (НЗТ)
+ консультирование психотерапевтом, возможного перехода на использование электронных систем доставки
никотина (ЭСДН) при отказе от традиционных табачных изделий для той
категории больных, которым психологически сложно самостоятельно сделать этот шаг и которых не удовлетворяет эффект НЗТ. Потребление ЭСДН
не связано с повышенным риском
развития рака, и их использование в
качестве альтернативы сигаретам допустимо. Лечение табакокурения экономически выгодно для системы здравоохранения, особенно по сравнению
с другими методами лечения. И наоборот, продолжение курения значительно увеличивает траты на лечение.
В связи с этим предложение лечить
никотиновую зависимость по ОМС
считаю экономически обоснованным.
СМЕРТНОСТЬ ОТ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ ПРОДОЛЖАЕТ СНИЖАТЬСЯ
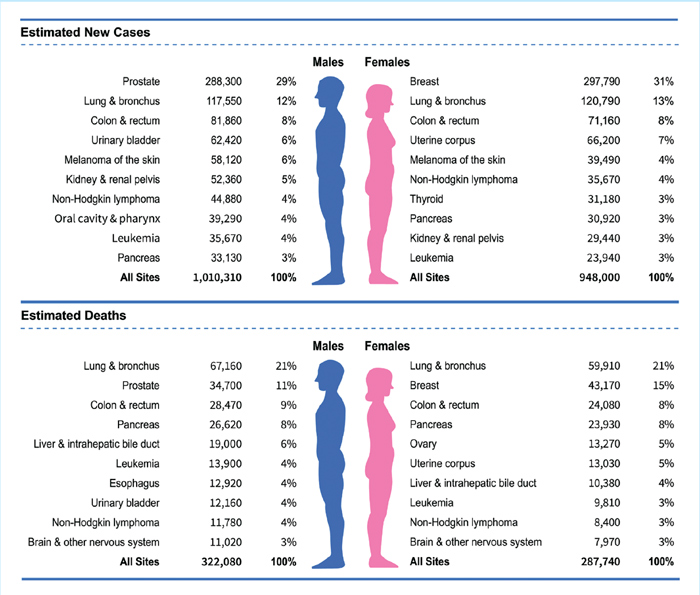
Американские исследователи из Атланты представили самые последние популяционные данные о заболеваемости и исходах злокачественных новообразований, используя данные Национального центра статистики здравоохранения (статья находится в открытом доступе). Несмотря на то, что они касаются в основном показателей заболеваемости и смертности в Соединенных Штатах, их можно проецировать на подавляющее большинство развитых стран мира. Наиболее отрадной тенденцией является очередное подтверждение тенденции снижения смертности от злокачественных новообразований. Пандемия коронавирусной болезни 2019 года (COVID-19) привела к задержкам в диагностике и лечении рака из-за закрытия медицинских учреждений, перерывов в работе, трудоустройстве и медицинском страховании, а также опасений заражения COVID-19. Хотя воздействие было наибольшим во время пика COVID-19 в середине 2020 года, предоставление медицинских услуг полностью не восстановилось. Исследователи отмечают, что в 2023 году в Соединенных Штатах ожидается 1 958 310 новых случаев рака и 609 820 смертей от рака. Заболеваемость раком предстательной железы увеличивалась на 3 процента ежегодно с 2014 по 2019 год после двух десятилетий снижения, что привело к 99 000 новых случаев; в остальном тенденции заболеваемости были более благоприятными для мужчин, чем для женщин. С 2015 по 2019 год заболеваемость раком легких у женщин снижалась более низкими темпами, чем у мужчин (1,1% против 2,6% в год); заболеваемость раком молочной железы и тела матки продолжала расти. Заболеваемость раком печени и меланомой стабилизировалась и уменьшилась преимущественно у мужчин в возрасте около 50 лет.
Рисунок 1.
Десять ведущих видов рака и число предполагаемых новых
случаев и смертей с разбивкой по полу, США, 2023 г. Данные не включают
базальноклеточный и плоскоклеточный рак кожи, а также карциному in situ,
за исключением рака мочевого пузыря.
В период с 2012 по 2019 год заболеваемость
раком шейки матки среди женщин в возрасте от 20 лет снизилась на 65%; это была
первая когорта, получившая вакцину против вируса папилломы человека (ВПЧ). С
2019 по 2020 год уровень смертности от этой
опухоли продолжал уменьшаться (на 1,5%),
что привело к его падению на 33 процента с
1991 года и предотвращению примерно 3,8
миллионов смертей.
Такой значительный регресс заболеваемости раком шейки матки чрезвычайно
важен и показателен, ведь это был первый
поток женщин, получивших вакцину против ВПЧ; это, вероятно, предвещает резкое
снижение заболеваемости и других видов
рака, связанных с ВПЧ, как считают исследователи.
Рисунок 2. Тенденции заболеваемости раком (1975–2019 гг.) и смертности (1975–2020 гг.) в разбивке по полу, США.

Источник:
Rebecca L. Siege et al. Cancer
statistics, 2023. CA Cancer J Clin.2023;73:17–48
ОСИМЕРТИНИБ СУЩЕСТВЕННО УЛУЧШАЕТ БЕЗРЕЦИДИВНУЮ ВЫЖИВАЕМОСТЬ У ОПЕРИРОВАННЫХ БОЛЬНЫХ НЕМЕЛКОКЛЕТОЧНЫМ РАКОМ ЛЕГКОГО С МУТАЦИЕЙ EGFR
Автор: С.А.Тюляндин
Председатель Российского общества клинической онкологии,
профессор, доктор медицинских наук, Москва
В Journal of Clinical Oncology
были представлены результаты
4-летнего наблюдения за больными, включенными в рандомизированное исследование
ADAURA. В этом исследовании
больные IB-IIIA стадиями немелкоклеточного рака легкого с наличием активирующей мутации
в гене EGFR после выполнения
оперативного лечения и разрешенной адъювантной химиотерапии были рандомизированы в
группу плацебо или осимертиниба 80 мг внутрь ежедневно в течение 3 лет. В качестве основной
конечной точки исследования
принята безрецидивная выживаемость (DFS) у больных II-IIIA
стадиями, вторичными точками
являлись безрецидивная выживаемость в общей популяции (IBIIIA) и общая выживаемость.
В исследование было включено 682 больных с делецией в 19
экзоне (378 больных) и заменой
L858R (304). Большинство больных были женщины (478), азиатской расы (434), получившие
адъювантную химиотерапию
(410). Анализ 4-летней DFS для
больных II-IIIA стадиями демонстрирует существенное уменьшение относительного риска прогрессирования на 77% в группе
осимертиниба, 4-летняя DFS составила 70% для осимертиниба и
29% для группы плацебо, медиана времени до прогрессирования
65,8 и 21,9 мес. соответственно. В
общей популяции больных 4-летняя DFS составила 73% и 38%
соответственно, уменьшение относительного риска прогрессирования на 73% при медиане времени до прогрессирования 65,8 и
28,1 мес. Важным наблюдением
является существенно меньший
риск прогрессирования за счет
метастазирования в ЦНС в группе осимертиниба (9%) в сравнении с плацебо (17%). Выигрыш
от назначения осимертиниба наблюдали у больных независимо
от стадии заболевания, получения адъювантной химиотерапии,
возраста, характера мутации и
расы.
Побочные эффекты 3-4 степени
зарегистрированы у 23% и 14%
больных в группе осимертиниба и плацебо. Наиболее частыми
осложнениями в группе осимертиниба были диарея, паронихий, сухость кожи. Перерыв
в лечении, редукция дозы и отмена осимертиниба вследствие
токсичности были необходимы у
27%, 12% и 13% больных соответственно.
Продолжающее исследование
ADAURA убедительно свидетельствует, что прием осимертиниба в течение 3 лет существенно
увеличивает медиану времени до
прогрессирования в сравнении с
плацебо примерно на 38-44 мес.
и демонстрирует умеренную токсичность. Выигрыш от приема
препарата наблюдается во всех
анализируемых подгруппах и не
зависит от стадии заболевания.
Важным итогом приема осимертиниба является уменьшение частоты метастатического поражения ЦНС, которое в большинстве
случаев является смертельным.
Поскольку на момент анализа
3-летний прием осимертиниба
закончили 66% включенных в
исследование больных, следует
продолжить наблюдение с целью определения характера поведения кривой безрецидивной
выживаемости после 3 лет. Это
позволит дать ответ на вопрос,
способен ли осимертиниб, назначенный адъювантно, приводить к излечению части больных
или его прием лишь откладывает
развитие прогрессирования. Но
уже сегодня выигрыш в медиане
безрецидивной выживаемости
продолжительностью более 3 лет
является серьезным основанием
для адъювантного назначения
осимертиниба у больных операбельным немелкоклеточным раком легкого с наличием активирующей мутации в гене EGFR.
Источник:
Herbst RS, Wu Y-L,
John T, et al. Adjuvant osimertinib
for resected EGFR-mutated Stage IBIIIA Non-Small-Cell Lung Cancer:
Updated Results From the Phase III
Randomized ADAURA Trial. J. Clin.
Oncol. Published online: January 31,
2023.
ПОДВЕДЕНИЕ ИТОГОВ РАБОТЫ РЕДАКЦИИ ЖУРНАЛА «ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ» ЗА 2022 ГОД
Научно-практический рецензируемый медицинский журнал «Злокачественные опухоли» издается с
2010 года и является официальным
печатным изданием Российского
общества клинической онкологии
(RUSSCO).
Подводя итоги прошедшего года, в
первую очередь хочется отметить
следующие достижения.
1) Журнал вошел в новый реестр ВАК и был отнесен к первому квартилю с самым высоким коэффициентом – 0,600. Журнал в перечне находится на 9 месте в соответствии с алфавитным порядком среди других журналов по всем специальностям.
2) С февраля 2022 года журналу
присвоили дополнительную специальность по лучевой терапии. На
данный момент журнал входит в
перечень по следующим специальностям: 3.1.6. Онкология, Лучевая
терапия и 3.1.9. Хирургия в отрасли
медицинские науки.
Журнал ежеквартальный, издается
с периодичностью 4 номера в год.
В 2022 году в редакцию поступило
56 статей, 16 было отклонено после
экспертной оценки (по причине несоответствия профиля журнала, неактуальности данных и т.д.), 10 статей на момент написания заметки
находятся на рассмотрении у рецензентов или на доработке у авторов,
30 были приняты к печати, часть
статей вошли в выпуски 2022 года,
часть будет опубликована в выпусках 2023 года. Для рецензирования
статей были привлечены 39 экспертов. Среднее время от поступления
статей в редакцию до публикации
занимает 3-4 месяца.
За прошедший год вышло 4 номера,
где были опубликованы 22 статьи с
результатами собственных исследований, клиническими случаями,
обзорами, аналитикой и дискуссионными вопросами. Журнал распространяется на конференциях
RUSSCO и рассылается по диспансерам России.
Также редакция ежегодно выпускает спецвыпуск с материалами к
Российскому онкологическому конгрессу, где публикуются обзорные
статьи по теме докладов, тезисы
постерных докладов и принятые к
публикации. В 2022 году были опубликованы 11 статей и более 200
тезисов, по разным нозологиям. И
ежегодно к Российскому онкологическому конгрессу редакция выпускает Практические рекомендации
RUSSCO в двух томах, тиражом в
5000 экземпляров, над написанием
которых работают ведущие онкологи России.
Главный редактор,
проф., д.м.н. Носов Д.А.
Технический редактор
Плыкина А.А.
X КОНФЕРЕНЦИЯ RUSSCO
РАК МОЛОЧНОЙ ЖЕЛЕЗЫ

ИМФИНЗИ
ЖИЗНЕННО ВАЖНО!

ЦИСПЛАТИН В КОМБИНАЦИИ С ИНГИБИТОРОМ PARP ВЕЛИПАРИБОМ ПРИ РАКЕ МОЛОЧНОЙ ЖЕЛЕЗЫ C НАРУШЕНИЯМИ В СИСТЕМЕ ГОМОЛОГИЧНОЙ РЕКОМБИНАЦИИ
В январе 2023 года в журнале
Lancet Oncology опубликованы
результаты исследования SWOG
S1416. Оно посвящено изучению
целесообразности добавления
ингибитора PARP велипариба к
цисплатину при раке молочной
железы с нарушениями в системе гомологичной рекомбинации
(HRR) во второй и последующих
линиях терапии.
Пациенты, включенные в исследование, были рандомизированы в
две лечебные группы (1:1):
• цисплатин 75 мг/м2 в/в кап. в 1 день в комбинации с велипарибом 300 мг 2 раза в день с 1-14 дни, курс 21 день;
• цисплатин 75 мг/м2 в/в кап. в 1
день, курс 21 день.
Лечение проводилось до прогрессирования или неприемлемой
токсичности.
Все пациенты были разделены на
три группы (панель BROCA-HR) в
зависимости от молекулярных нарушений в системе гомологичной
рекомбинации:
• пациенты с герминальными мутациями в генах BRCA1/2 (n=37);
• BRCA-like (гиперметилирование промотора BRCA1, метилирование промоторной области гена FANCF, нарушение функции гена FANCD2, герминальные мутации в других генах HRR) (n=101);
• non-BRCA-like (n=109).
Первичной конечной точкой исследования была медиана выживаемости без прогрессирования (ВБП) у пациентов с gBRCA,
BRCA-like, non-BRCA-like нарушениями в системе гомологичной
рекомбинации, вторичными – медиана общей выживаемости (ОВ),
частота достижения объективного ответа (ЧОО) и контроля роста
опухоли.
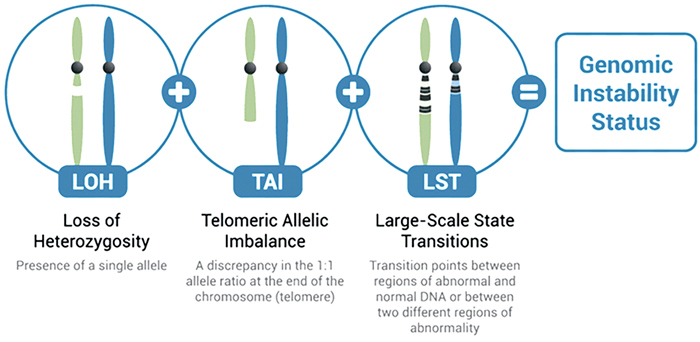
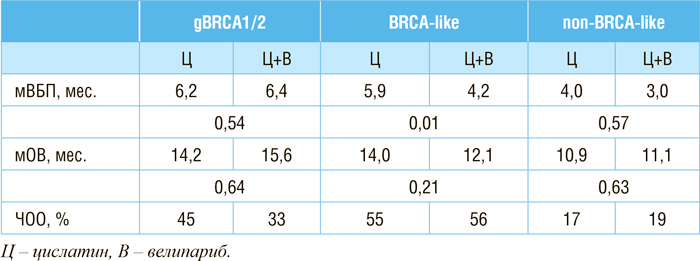
Оценка дефицита гомологичной рекомбинации в генах BRCA1/2 проводилась тестом Myriad MyChoice CDx. Тест позволяет выявить различные мутации в генах BRCA1/2 (потеря гетерозиготности (LOH), теломерный аллельный дисбаланс (TAI), различные реаранжировки (LST), приводящие к дефициту гомологичной рекомбинации (рис.1). Оценка осуществлялась по бальной шкале. При 42 баллах и выше опухоль считается HRD-позитивной, а при меньшем количестве баллов – HRD-негативной. Наличие клинически значимых мутаций в генах BRCA1/2 позволяет сразу отнести опухоль в группу HRD-позитивных. При медиане времени наблюдения в 11,1 мес.:
Рисунок 1.
Мутации в генах BRCA1 и BRCA2,
приводящие к дефициту HRR
• в группе с gBRCA1/2 назначение комбинации цисплатина и велипариба позволило достигнуть медианы ВБП в 6,2 мес., в группе больных, получавших только цисплатин, – 6,4 мес. (p=0,54);
• в BRCA-like группе добавление велипариба к цисплатину увеличило ВБП с 4,2 до 5,9 мес. (p=0,01);
• в non-BRCA-like группе добавление велипариба к цисплатину не
привело к значимому увеличению ВБП – 4,0 и 3,0 мес. соответственно (p=0,57).
Добавление велипариба к цисплатину не привело к увеличению
медианы ОВ ни в одной из групп
(табл.1).
Таблица 1.
Результаты исследования SWOG S1416.
Серьезные побочные эффекты
были зарегистрированы у 31%
больных в группе цисплатина и
велипариба и у 36% пациентов в
группе только цисплатина, нежелательные явления 3 и более
степени были преимущественно
представлены нейтропенией (46%
и 20%), лейкопенией (27% и 7%),
анемией (23% и 8%) и тромбоцитопенией (19% и 3%).
Источник:
Eve Rodler, Priyanka
Sharma, William E Barlow et al.
Cisplatin with veliparib or placebo
in metastatic triple-negative breast
cancer and BRCA mutationassociated breast cancer (S1416): a
randomised, double-blind, placebocontrolled, phase 2 trial. Lancet Oncol.
2023. Published online: January 6,
2023. https://doi.org/10.1016/S1470-
2045(22)00739-2.
СОХРАНЕНИЕ ОРГАНА ПОСЛЕ НЕОАДЪЮВАНТА: ДАННЫЕ ИССЛЕДОВАНИЯ OPERA
В журнале Lancet 16 февраля 2023 года впервые были опубликованы результаты рандомизированного исследования III
фазы OPERA. Проблема сохранения органа при проведении
радикального комплексного лечения при местнораспространенном раке прямой кишки, особенно при низком расположении опухоли, всегда была чрезвычайно актуальной. И высокий риск локального рецидива, и несостоятельность функции
кишечника, и ряд других причин при проведении органосохраняющего лечения при такой локализации зачастую обусловливали выбор в пользу экстирпации прямой кишки. Роль
неоадъювантной химиолучевой терапии с эскалацией дозы на
опухоли свыше традиционных 45 Гр была неясна.
Проспективное рандомизированное исследование III фазы
OPERA, проведенное в 17 французских онкологических центрах в 2015-2020 гг., включало 148 больных раком прямой
кишки cT2, cT3a или cT3b N0-1, с расположением опухоли диаметром до 5 см в нижне- или среднеампуллярном отделе. Все
пациенты получали стандартное неоадъювантное химиолучевое лечение (45 Гр за 25 фракций на фоне капецитабина), рандомизация шла на 2 группы: А – группа ДЛТ буста в дозе 9 Гр
за 5 фракций, В – группа киловольтного (50 kV) брахи буста (90
Гр за 3 фракции), причем брахитерапия проводилась до ХЛТ.
Первичной конечной точкой исследования было сохранение
органа в течение 3 лет после проведенного лечения.
Анализ был проведен на основании данных 141 пациента (69 в
группе А, 72 в группе В). Средний период наблюдения составил
38,2 месяца. В итоге 3-летняя частота сохранения органа составила 59% в группе дистанционного буста и 82% в группе брахитерапии (HR 0,36; 95% ДИ 0,19-0,70; p=0,0026), причем при изначальном размере опухоли до 3 см частота была 63% (А) и 97%
(В) (HR 0,07; 95% ДИ 0,01-0,57; p=0,012), а при размере 3 см и
более эта разница также оказалась в пользу брахитерапевтического буста: 55% против 68% (HR 0,54; 95% ДИ 0,26-1,10; p=0,11).
Частота ранних осложнений 2-3 степени была недостоверно
выше в группе В – 42% против 30% в группе А. наиболее часто они были представлены лучевым проктитом и дерматитом.
Из поздних осложнений чаще встречались кровоточивость и
телеангиэктазии, причем опять-таки чаще в группе брахитерапии (63% против 12%).
Учитывая высокий шанс проведения органосохраняющего
лечения при эскалации дозы методом брахитерапии на неоадъювантном этапе, особенно при опухолях малого размера,
авторы рассматривают подобный подход как приемлемый и,
возможно, предпочтительный в тех ситуациях, когда пациент
настаивает на сохранении прямой кишки.
Источник:
Gerard JP, et al. Neoadjuvant chemoradiotherapy with
radiation dose escalation with contact x-ray brachytherapy boost or
external beam radiotherapy boost for organ preservation in early
cT2-cT3 rectal adenocarcinoma (OPERA): a phase 3, randomised
controlled trial. Lancet. 2023. Published online: February 16, 2023.
DOI: https://doi.org/10.1016/S2468-1253(22)00392-2.
ASCO GI 2023: НОВЫЕ ВОЗМОЖНОСТИ ТЕРАПИИ ОПУХОЛЕЙ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА
Автор: Титова Татьяна Александровна
Врач-онколог химиотерапевтического отделения №1
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина»
Минздрава России, кандидат медицинских наук, Москва
C 19 по 22 января 2023 года в СанФранциско прошел симпозиум
ASCO, посвященный терапии
опухолей желудочно-кишечного
тракта. Некоторые исследования, представляющие научный и
практический интерес, отражены в этом сообщении.
Рак желудка и кардиоэзофагеального перехода
Комбинированный подход к терапии при локализованной аденокарциноме желудка (РЖ) и
кардиоэзофагеального перехода
(КЭП) в настоящий момент рассматривается начиная со стадии
cT2N0-2M0. Возможными опциями являются периоперационная
химиотерапия, адъювантная химиотерапия и химиолучевая терапия. В настоящий момент активно
обсуждается, какой из подходов
является оптимальным в той или
иной клинической ситуации.
Исследование Neo-AEGIS [1] было
посвящено сравнению периоперационного режима FLOT c неоадъюватной химиолучевой терапией у
больных аденокарциномой пищевода и пищеводно-желудочного
перехода.
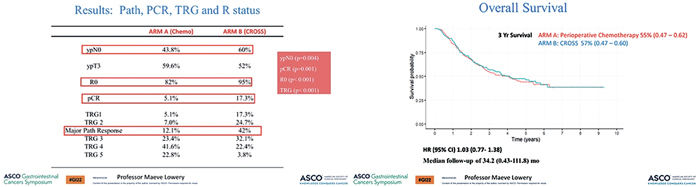
В нескольких работах, в том числе в подгрупповом классическом
исследовании FLOT4, была продемонстрирована прогностическая значимость таких факторов,
как частота достижения ypN0,
R0, pCR и степень патоморфоза. В
данном исследовании назначение
пациентам неоадъювантной химиолучевой терапии в сравнении
с периоперационной терапией в
режиме FLOT позволяло значимо
увеличить частоту ypN0, R0, pCR
и достижения TRG, что, однако,
не повлияло на трехлетнюю ОВ
(рис.1).
Рисунок 1.
Результаты исследования Neo-AEGIS [1]
Недостаточная эффективность
цитостатической терапии и ее
высокая токсичность привели к
активному поиску молекулярных
мишеней, воздействие на которые
способствовало бы улучшению
результатов лечения локализованного РЖ и КЭП. Возможность
назначения иммунотерапии в неоадъювантном режиме больным
локализованным РЖ и КЭП с
dMMR/MSI-H представлена в исследовании INFINITY [2].
В работу были включены больные
РЖ и КЭП с dMMR/MSI-H, которым проведена терапия в режиме
тремелимумаб 300 мг в 1 день в
комбинации с дурвалумабом 1500
мг в 1, 29 и 57 дни. Первичными
конечными точками исследования
было достижение ypT0N0, а также
уровень снижения цДНК.
С мая 2021 по февраль 2022 года 18
пациентов были включены в исследование, 1 больной отказался
от терапии после 1 цикла лечения,
у 1 зарегистрировано прогрессирование на фоне терапии и 2 воздержались от операции.
Медиана возраста пациентов достигла 71,5 лет, большинство их
них были мужчинами (67%) с
ECOG статусом 0 баллов (67%),
локализацией опухоли в желудке
(78%) и T3-4 (95%), N2(50%).
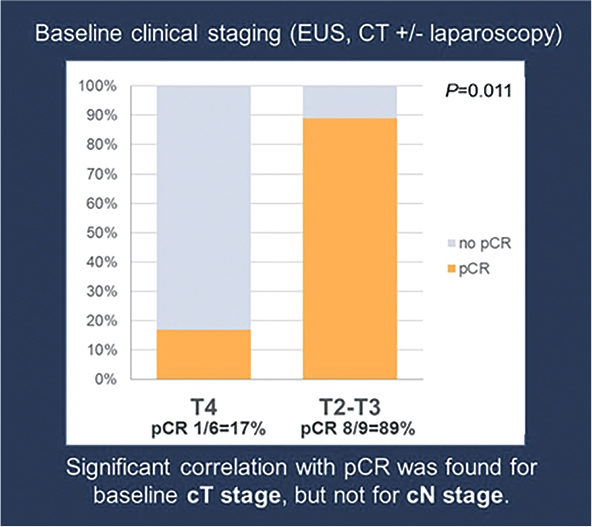
Назначение комбинации тремелимумаба и дурвалумаба позволило
достигнуть ypT0N0 у 60% больных. При анализе достижения
элиминации опухолевой цДНК
составила 17% (n=1/6) для пациентов с Т4 и 89% (n=8/9) для пациентов с Т2 или Т3 (Р=0,011) (рис.2).
Рисунок 2.
Частота
достижения pCR [2]
Нежелательные явления (НЯ) любой степени, связанные с иммунотерапией, были преимущественно
представлены зудом (22%), тиреоидитом (22%), гепатитом (17%)
и кожной сыпью (17%). НЯ 3-й
степени и выше включали гепатит
(n=1), колит (n=1) и пневмонит
(n=1).
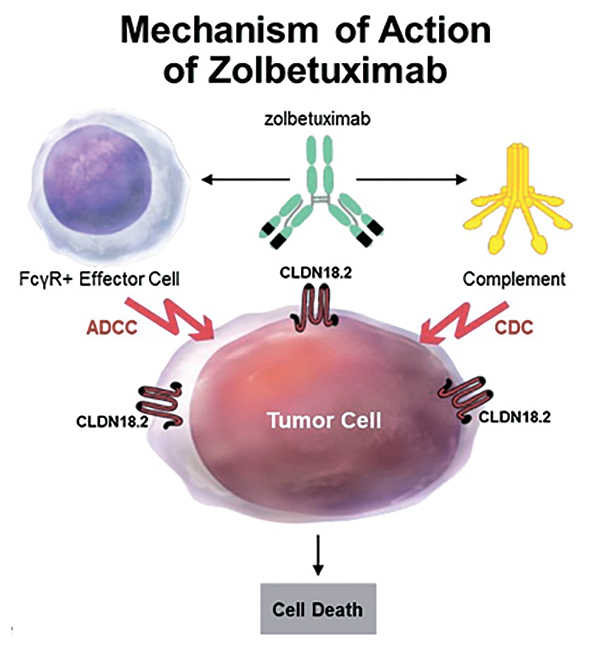
Золбетуксимаб – моноклональное химерное антитело (Ig G1) к
CLDN18.2, которое, связываясь с
рецептором на поверхности опухолевых клеток, вызывает антителозависимую и комплемент-зависимую клеточную цитотоксичность.
Ранее эффективность золбетуксимаба при РЖ и КЭП была продемонстрирована в исследовании 2b
фазы FAST, где добавление золбетуксимаба к EOX позволило увеличить медиану ВБП с 5,7 до 9,0 мес., а
медиану ОВ – с 8,9 до 15,6 мес.
В исследовании 3 фазы SPOTLIGH
[3] изучалась целесообразность
добавления золбетуксимаба к химиотерапии в режиме mFOLFOX6
в 1 линии терапии диссеминированного HER2-негативного РЖ
и КЭП с высокой экспрессией
CLDN18.2 (≥75% клеток опухоли).
Из 2244 изученных опухолевых
образцов высокий уровень экспрессии CLDN18.2 выявлен в 856
случаях (38,5%).
Рисунок 3.
Механизм
действия золбетуксимаба
В исследование было рандомизировано 565 пациентов (1:1):
• n=283: mFOLFOX6 в комбинации с золбетуксимабом;
• n=282: mFOLFOX6 с плацебо.
Пациенты получали терапию до
прогрессирования или неприемлемой токсичности.
Первичной конечной точкой исследования была медиана ВБП, вторичными – медиана ОВ, частота достижения объективного ответа (ОО), контроля роста опухоли (КРО) и токсичность терапии.
При медианах времени наблюдения в 12,9 и 12,6 мес. добавление золбетуксимаба к mFOLFOX
позволило увеличить медиану
ВБП с 8,67 до 10,6 мес. (p=0,0066)
и медиану ОВ с 15,5 до 18,2 мес.
(p=0,0053) (рис.4).
Рисунок 4.
Результаты исследования SPOTLIGH [3]
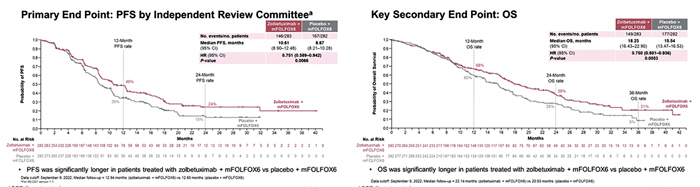
При подгрупповом анализе как в отношении ВБП, так и для ОВ не отмечено значимого улучшения результатов терапии при добавлении золбетуксимаба при диффузном подтипе опухоли и локализации первичного очага в КЭП.
Объективный ответ в группе с золбетуксимабом зарегистрирован у 60,7% больных, а в группе с плацебо – в 62,1% случаев.
Частота серьезных НЯ, связанных с терапией, была одинаковой в группах золбетуксимаба и плацебо (44,8% и 43,5%). НЯ 3 степени и выше отмечены у 86,7% и 77,7% пациентов, получавших золбетуксимаб и плацебо соответственно. НЯ, связанные с лечением, которые послужили причиной прекращения терапии золбетуксимабом или плацебо, зарегистрированы у 13,6% и 2,2% пациентов, а в 1,8% и 1,4% случаев НЯ привели к смерти. Наиболее частыми НЯ любой степени были тошнота (82,4% и 60,8%), рвота (67,4% и 35,6%) и снижение аппетита (47,0% и 33,5%).
Колоректальный рак
Энкорафениб и цетуксимаб в
комбинации с химиотерапией
при раке толстой кишки с мутацией в гене BRAF (V600E)
Добавление к комбинации энкорафениба и цетуксимаба химиотерапии в режимах mFOLFOX6
или FOLFIRI продемонстрировало высокую противоопухолевую активность и приемлемый
профиль токсичности у больных
диссеминированным колоректальным раком с мутацией в гене
BRAF V600E. Результаты исследования 3 фазы BREAKWATER
были представлены на симпозиуме ASCO GI 2023 [4].
Напомним, что комбинация энкорафениба и цетуксимаба одобрена FDA для лечения пациентов диссеминированным КРР с
мутацией в гене BRAF V600E на
основе результатов исследования
2 фазы BEACON (NCT02928224).
BREAKWATER – это мультикогортное исследование; в первой
когорте больные получали энкорафениб в комбинации с цетуксимабом и химиотерапию
в режиме FOLFIRI, во второй
– энкорафениб, цетуксимаб и
mFOLFOX6. Первичной конечной точкой исследования была
частота НЯ, вторичными – ЧОО,
медианы ВБП и ОВ.
• ЧОО в группе энкорафениба, цетуксимаба и mFOLFOX6 (n=19) в первой линии составила 68,4% (полные ответы – 5,3%, частичные ответы – 63,2%), у 21,1% больных была зарегистрирована стабилизация заболевания и у 5,3% – прогрессирование. Медиана ВБП в этой группе составила 11,1 месяца.
• ЧОО в группе энкорафениба, цетуксимаба и FOLFIRI (n=20) в первой линии достигла 75,0% (ПО – 16,7%, ЧО – 53,3%), у 16,7% больных была зарегистрирована стабилизация заболевания, а случаев прогрессирования болезни отмечено не было. Медиана ВБП не достигнута.
• ЧОО в группе энкорафениба, цетуксимаба и mFOLFOX6 (n=8) во второй линии составила 37,5% (ПО – 0%, ЧО – 37,5%), у 62,5% больных была зарегистрирована стабилизация заболевания. Медиана ВБП в этой группе достигла 10,8 месяца.
• ЧОО в группе энкорафениба,
цетуксимаба и FOLFIRI (n=18) в
первой линии составила 44,4%
(ПО – 5,6%, ЧО – 38,9%), у 38,9%
больных была зарегистрирована стабилизация заболевания,
случаев прогрессирования
заболевания отмечено не было.
Медиана ВБП в этой группе
оказалась равной 12,6 месяца.
НЯ любой степени зарегистрированы у всех пациентов в исследовании. Серьезные НЯ наблюдались у 48,1% группы mFOLFOX6
и у 33,3% в группе FOLFIRI. НЯ 3
степени и более отмечены у 77,8%
пациентов в когорте энкорафениба, цетуксимаба и mFOLFOX6
и у 50,0% в группе энкорафениб,
цетуксимаб и FOLFIRI. Эти осложнения потребовали снижения дозы у 63,0% и 40,0% больных
соответственно, а в 18,5% против
20,0% НЯ привели к прекращению терапии. Наиболее частыми
осложнениями, зарегистрированными в группах, были тошнота (74,1%), гипертермия (48,1%),
рвота (40,7%) и диарея (33,3%).
Результаты исследования
SUNLIGHT: бевацизумаб в комбинации с трифлуридин/типирацилом (TAS-102) в сравнении
с трифлуридином/типирацилом в поздних линиях лечения
метастатического колоректального рака
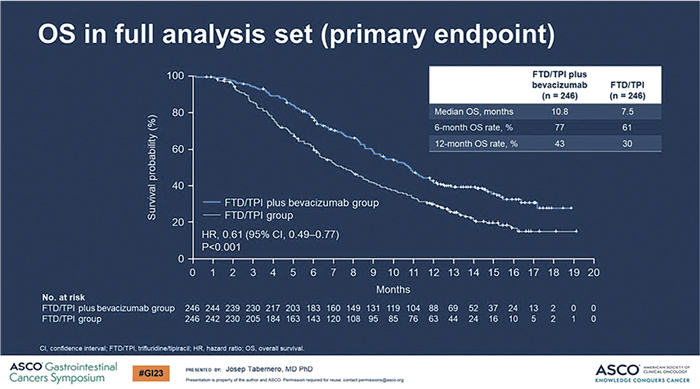
В исследование SUNLIGHT [5] было включено 492 больных диссеминированным метастатическим КРК, ранее получавших фторпиримидины, иринотекан, оксалиплатин, анти-VEGF и антиEGFR терапию. Пациенты были стратифицированы по месту жительства, времени с момента постановки диагноза диссеминированного КРК и статусу генов RAS.
Участники были рандомизированы в две лечебные группы (1:1): TAS-102 в комбинации с бевацизумабом либо только TAS-102. Первичной конечной точкой исследования была медиана ОВ, а вторичными – медиана ВБП, КРО и токсичность терапии.
Медианы ВБП составили 5,6 мес. в группе TAS-102 в комбинации с бевацизумабом и 2,4 мес. в контрольной группе (ОР 0,44; 95% ДИ 0,36-0,54; P<0,001), при 6-месячной ВБП 43% против 16% и 12-месячной ВБП 16% и 1% соответственно.
Медиана OВ достигла 10,8 мес. в
группе FTD/TPI в комбинации с
бевацизумабом и 7,5 мес. в группе
FTD/TPI (ОР 0,61; 95% ДИ 0,49-
0,77; p<0,001), при 6-месячной ОВ
в 77% и 61% и 12-месячной ОВ в
43% и 30% соответственно (рис.5).
Рисунок 5.
Результат исследования SUNLIGHT [5]
Частота НЯ в группе TAS-102 в
комбинации с бевацизумабом
составила 72% и 70% в группе
TAS-102, у 13% пациентов в обеих группах зарегистрированы НЯ,
которые привели к прекращению
терапии. У 16% пациентов в группе с бевацизумабом наблюдалось
снижение дозы в сравнении с 12%
в контрольной группе.
Такие НЯ, как артериальная гипертензия (10% 2%), тошнота (37% и
27%) и нейтропения (62% и 51%),
были выше группе TAS-102 в комбинации с бевацизумабом в сравнении с группой только TAS-102.
Гепатоцеллюлярный рак
В настоящий момент комбинация
атезолизумаба и бевацизумаба является предпочтительной для первой
линии системной терапии у пациентов с ECOG 0-1 баллов и функцией
печени CPS 5-6 баллов. По данным
исследования 3 фазы ImBrave150
комбинация атезолизумаба и бевацизумаба в сравнении с сорафенибом позволяет статистически
значимо увеличить медиану ОВ с
13,4 до 19,2 мес. и медиану ВБП с 4,3
до 6,9 мес. соответственно. По данным другого исследования III фазы HIMALAYA, выживаемость пациентов с ECOG 0-1 балл и функцией
печени CPS 5-6 баллов без тромбоза
ствола воротной вены и при ограниченном объеме поражения печени в
первой линии иммунотерапия дурвалумабом была не хуже, чем при
терапии сорафенибом (ОР 0,86; 95,
67% ДИ 0,73-1,03)
Исследование NRG/RTOG 1112
[6] было инициировано до получения результатов ImBrave150 и
HIMALAYA, на тот момент терапия
сорафенибом являлась стандартом
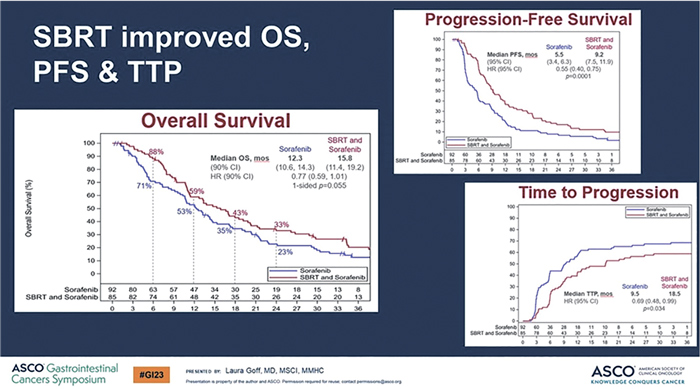
первой линии терапии. В исследовании NRG/RTOG 1112 изучалась
целесообразность добавления SBRT
к сорафенибу в первой линии терапии.
Добавление SBRT к терапии сорафенибом позволило увеличить медиану ОВ с 12,3 до 15,8 мес. (p=0,55)
и медиану ВБП с 5,5 до 9,2 мес.
(p=0,0001) (рис.6).
Рисунок 6.
Результаты исследования NRG/RTOG 1112
В группах SBRT в комбинации с сорафенибом и в группе монотерапии
сорафениба у пациентов наблюдались гастроинтестинальная токсичность (10% и 7%), гематологическая
токсичность (27% и 19%) и нарушения со стороны гепатобилиарной системы (1% и 3%). Желудочно-кишечное кровотечение развилось у 4%
(n=3) и 6% (n=5) пациентов в группах соответственно. Таким образом,
сорафениб в комбинации с SBRT
представляет собой опцию первой
линии лечения у пациентов, которые
не могут получать иммунотерапию.
Рак поджелудочной железы
В рандомизированном исследовании NAPOLI 3 [7] оценивалась эффективность и безопасность липосомального иринотекана в комбинации с оксалиплатином, лейковорином и 5-ФУ (NALIRIFOX) в сравнении с наб-паклитакселом и гемцитабином в первой линии лечения диссеминированного рака поджелудочной железы (РПЖ).
Пациенты были рандомизированы
в две лечебные группы (1:1):
• липосомальный иринотекан 50 мг/м2 + оксалиплатин 60 мг/м2 + лейковорин 400 мг/м2 + 5-ФУ 2400 мг/м2 (NALIRIFOX) в 1 и 14 дни 28-дневного цикла;
• гемцитабин 1000 мг/м2 + набпаклитаксел 125 мг/м2 в 1, 8 и 15
дни 28-дневного цикла.
Лечение продолжалось до прогрессирования заболевания или неприемлемой токсичности. Факторы стратификации: статус ECOG,
место проживания и наличие или
отсутствие метастазов в печени.
Первичной конечной точкой исследования была медиана ОВ, вторичными – медиана ВБП, ЧОО и
токсичность.
Характеристики пациентов были
сопоставимы в группах лечения:
так, средний возраст составил 64
года и 65 лет в группах NALIRIFOX
и наб-паклитаксел/гемцитабин соответственно. Большинство пациентов в группах были белыми
(82,2% и 83,7%) мужчинами (53,3%
и 59,4%), с ECOG 1 (58,0% и 56,6%)
и, по крайней мере, с 3 метастатическими очагами (38,9% и 36,4%), преимущественно локализующимися в
печени (80,2% и 80,4%), и исходным
уровнем CA 19-9 не менее 37 Ед/мл
(83,8% и 81,7%).
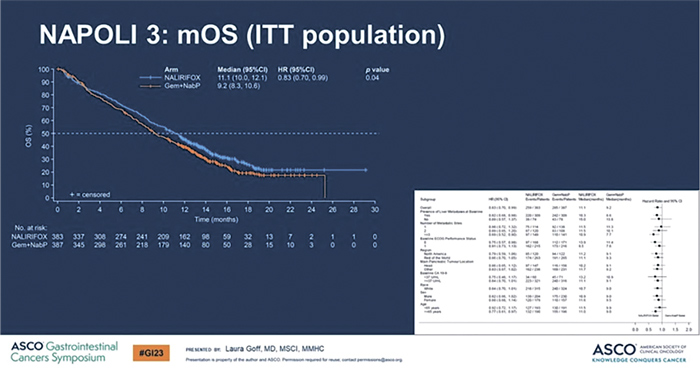
Медиана ВБП в группе NALIRIFOX
составила 7,4 мес. против 5,6 мес. в
группе наб-паклитаксел/гемцитабин (p<0,0001).
При медиане времени наблюдения в 16,1 мес. медиана ОВ в группе NALIRIFOX достигла 11,1 мес.
по сравнению с 9,2 мес. в группе
наб-паклитаксел плюс гемцитабин
(p=0,04) (рис.7).
Рисунок 7.
Результаты исследования NAPOLI 3 [7].
ЧОО в группе NALIRIFOX составила 41,8% против 36,2% в группе
наб-паклитаксела/гемцитабина,
при КРО в 67,3% и 62,3% соответственно.
НЯ любой степени зарегистрированы у 99,7% и 99,2% пациентов в группе NALIRIFOX и набпаклитаксела/гемцитабина. НЯ 3
степени и выше отмечены у 87%
и 86% пациентов в группах, при
зарегистрированных серьезных
побочных эффектах у 54,3% и у
26,5% больных. Наиболее распространенными НЯ были нейтропения (29,5% и 31,9%), анемия (26,2%
и 40,4%), тромбоцитопения (10,5%
и 17,9%), диарея (70,5% и 36,7%), тошнота (59,5% и 42,7%), рвота
(39,7% и 26,4%), гипокалиемия
(31,6% и 12,9%), полинейропатия
(17,8% и 17,4%), парестезии (11,9%
и 8,7%) и гипертермия (10,5% и
23,0%).
Источники:
1. Reynolds JV, Preston SR, O'Neill B, et al. Neo-AEGIS (Neoadjuvant Trial in Adenocarcinoma of the Esophagus and Esophago-Gastric Junction International Study): Final primary outcome analysis. J Clin Oncol. 2023; 41 (suppl.4), abstr 295. DOI 10.1200/JCO.2023.41.3_suppl.295.
2. Pietrantonio F, Raimondi A, Lonardi S, et al. INFINITY: a multicentre, single-arm, multi-cohort, phase II trial of tremelimumab and durvalumab as neoadjuvant treatment of patients with microsatellite instability-high (MSI) resectable gastric or gastroesophageal junction adenocarcinoma (GAC/GEJAC). J Clin Oncol. 2023; 41 (suppl.4): 358. doi:10.1200/JCO.2023.41.3_ suppl.358.
3. Shitara K, Lordick F, Bang Y-J, et al. Zolbetuximab + mFOLFOX6 as firstline (1L) treatment for patients (pts) withclaudin-18.2+ (CLDN18.2+) / HER2- locally advanced (LA) unresectable or metastatic gastric or gastroesophageal junction (mG/GEJ) adenocarcinoma: primary results from phase 3 SPOTLIGHT study. J Clin Oncol. 2023; 41(suppl), abstr LBA292. doi:10.1200/JCO.2023.41.3_ suppl.LBA292.
4. Kopetz S, Yoshino T, Kim T, et al. BREAKWATER safety lead-in (SLI): Encorafenib (E) + cetuximab (C) + chemotherapy for BRAFV600E metastatic colorectal cancer (mCRC). J Clin Oncol. 2023; 41 (suppl.4), abstr 119. doi:10.1200/ JCO.2023.41.3_suppl.119.
5. Tabernero J, et al. Trifluridine/tipiracil plus bevacizumab for third-line treatment of refractory metastatic colorectal cancer: The phase 3 randomized SUNLIGHT study. J Clin Oncol. 2023 Feb 01. 41 (suppl.4): 4.
6. Dawson L, Winter K, Knox J, et al. NRG/ RTOG 1112: randomized phase III study of sorafenib vs. stereotactic body radiation therapy (SBRT) followed by sorafenib in hepatocellular carcinoma (HCC). J Clin Oncol. 2023; 41(suppl.4): 489. doi:10.1200/ JCO.2023.41.3_suppl.489.
7. Wainberg ZA, Melisi D, Macarulla
T, et al. NAPOLI 3: a randomized,
open-label phase 3 study of liposomal
irinotecan + 5-fluorouracil/leucovorin +
oxaliplatin (NALIRIFOX) versus nabpaclitaxel + gemcitabine in treatmentnaïve patients with metastatic pancreatic
ductal adenocarcinoma. J Clin Oncol.
2023; 41 (suppl.4): LBA661. doi:10.1200/
JCO.2023.41.3_suppl.LBA661.
ОНКОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ, СВЯЗАННАЯ С ЛЕЧЕНИЕМ СЕРДЕЧНО-СОСУДИСТЫХ ЗАБОЛЕВАНИЙ, У ПАЦИЕНТОВ С ОНКОЛОГИЧЕСКИМ ЗАБОЛЕВАНИЕМ В АНАМНЕЗЕ
Автор: Зволинская Екатерина Юрьевна
Врач кардиолог, ведущий научный сотрудник
Национального медицинского исследовательского центра
профилактической медицины Минздрава РФ; кандидат медицинских наук, Москва
В последнее время в связи с высокой распространенностью сердечно-сосудистых заболеваний
(ССЗ), успешным их лечением
и увеличением продолжительности жизни большой интерес
вызывает проблема онкологической безопасности сердечно-сосудистых препаратов.
Увеличилась и выживаемость
пациентов, перенесших онкологические заболевания (ОЗ), что
привело к широкому распространению возрастной коморбидной патологии, что, в свою
очередь, требует повсеместного
и частого применения лекарств
для лечения ССЗ. По результатам
Childhood Cancer Survivor Study
(CCSS), в которое были включены пациенты детского возраста,
получавшие химио- и лучевую
терапию по поводу ОЗ, и которые
выжили после 35-летнего возраста, вероятность возникновения
инсульта и инфаркта миокарда у
пациентов после онкологической
терапии в 5 раз выше по сравнению с их здоровыми братьями и
сестрами. Этот риск был выше у
лиц с дислипидемией, сахарным
диабетом (СД) и ожирением [1]. В
многофакторных моделях только
артериальная гипертензия (АГ)
продемонстрировала значительно повышенный риск для всех основных сердечных событий среди выживших, подвергшихся как
лучевой терапии в области грудной клетки, так и лечению антрациклинами [2]. Такой актуальной
проблеме, как кардиотоксичность противораковой терапии,
в настоящее время справедливо
посвящено немало работ, но, на
наш взгляд, недостаточно освещены вопросы влияния сердечно-сосудистых препаратов на
возникновение и рецидивы злокачественных новообразований.
В 2012 году были опубликованы
обобщенные данные семи когортных исследований из Норвегии, Австрии и Швеции, которые
включали 577 799 пациентов, наблюдавшихся в среднем в течение
12 лет. Было выявлено, что АГ
увеличивает не только риск развития рака, но и смертность от
онкозаболеваний [3]. Эти данные
еще больше убеждают в необходимости адекватного контроля
артериального давления (АД). В
то же время уже не первое десятилетие обсуждается вопрос безопасности применения антагонистов рецепторов аниотензина
II 1-го типа (АРА) – сартанов [4].
Существуют работы и ретроспективные метаанализы, которые
сообщают о канцерогенном эффекте и других классов антигипертензивных агентов. Проблема
усугубляется еще и тем, что пациенты подвергаются воздействию
гипотензивных препаратов в
течение десятилетий, намного
дольше, чем учитывали первоначальные клинические испытания
этих препаратов на безопасность.
В связи с этим в настоящее время есть повышенный интерес к
хроническому использованию
антигипертензивной терапии и
к тому, как она может влиять на
риск развития или рецидивирования рака. Однако существует
немало данных о противораковом эффекте ацетилсалициловой
кислоты и плейотропных противовоспалительных эффектах статинов. Таким образом, учитывая
частое применение лекарств для
лечения ССЗ и продолжительные, нередко пожизненные курсы терапии, а также широкое
распространение коморбидной
патологии и большой арсенал
кардиологических средств, представляется крайне актуальным
разобраться, в каких ситуациях
и у каких пациентов назначение
сердечно-сосудистых препаратов
является безопасным.
Диуретики
История изучения побочных эффектов мочегонных препаратов
началась еще во второй половине
прошлого века. В 80-х годах были
опубликованы результаты исследований, выполненных на моделях животных, которые показали
резкое увеличение риска развития
рака, в частности, рака простаты,
и нефропатии при применении
фуросемида и гидрохлоротиазида [5,6]. Интерес к этой проблеме
развивался дальше, и в 90-х годах
было обнаружено (уже на пациентах), что повышенный риск онкообразования при использовании
диуретиков (отношение шансов
1,55; 95% ДИ 1,42-1,71) связан с
женским полом и длительным
сроком лечения [7]. Дополнительные исследования с поправкой на
гипертонию демонстрируют ослабленную, хотя и статистически
значимую связь между диуретиками и риском рака; более того,
было показано, что увеличение
риска развития ОЗ возникает и
у нормотензивных пациентов,
принимающих диуретики по альтернативным показаниям [8-10].
В более современных исследованиях обнаружен дозозависимый
эффект между возникновением
немеланоцитарного рака кожи
(базальноклеточной карциномы
и плоскоклеточного рака губы)
и приемом гидрохлортиазида, а
также тенденция к увеличению
риска развития Меркель-клеточной карциномы, связанного с использованием фуросемида (ОШ
1,9; 95% ДИ 0,9-4,0) [11-13]. Есть
еще одна интересная работа, которая подтвердила связь между
антигипертензивными препаратами и папиллярной почечноклеточной карциномой [14]. При
анализе результатов и попытке
объяснить полученные эффекты
было выдвинуто предположение,
что некоторые диуретики могут
превращаться в желудке в мутагенное нитрозопроизводное или
что химическая бомбардировка
почечных канальцевых клеток
(мишень диуретиков) в течение
многих лет может оказывать канцерогенное действие.
Вероятно, следует избегать огульного постоянного применения
диуретиков и быть осторожными
с комбинированными препаратами, а также учитывать дозы мочегонных препаратов у пациентов с
ОЗ в анамнезе.
Ингибиторы ангиотензинпревращающего фермента
(ИАПФ) и β-блокаторы
В 2011 году были опубликованы
результаты исследования LACE
(Life After Cancer Epidemiology)
[15], в котором анализировалась
связь между рецидивом рака
молочной железы и использованием ИАПФ и β-блокаторов.
Было выявлено, что применение
ИАПФ связано с рецидивом рака
молочной железы (ОШ 1,56; 95%
ДИ 1,02-2,39), в то время как воздействие β-блокатора в этом отношении безопасно (ОШ 0,86;
95% ДИ 0,57-1,32). В дальнейшем
появилось еще несколько исследований, которые утверждали, что
β-адреноблокаторы могут снизить риск рецидива рака молочной железы, в то время как ИАПФ
и АРА не связаны с повышенным
риском развития и рецидива опухоли груди [16-18]. Таким образом,
в настоящий момент нет четких
данных о влиянии ИАПФ на возникновение рецидива маммарных
опухолей, и потенциальные механизмы этого остаются неясными,
но, на наш взгляд, при наличии
большого выбора антигипертензивных средств следует соблюдать
некую осторожность в назначении ИАПФ пациенткам, перенесшим рак молочной железы.
Сартаны
Сартаны являются, наверное, самыми обсуждаемыми и «скандальными» препаратами из всего сердечно-сосудистого арсенала. В 2003 г. в журнале Lancet были опубликованы результаты исследования CHARM-Overall [19], в котором утверждалось, что на фоне терапии кандесартаном чаще, чем на фоне лечения плацебо, регистрировались случаи фатального рака. В совокупности ряд исследований начиная с 2003 г. – CHARM-Overall, LIFE, ONTARGET, OPTIMAAL, PROFESS, TRANSCEND, TROPHY, VALIANT, Val-HeFT, в которых приняли участие 61 950 пациентов, показал, что применение сартанов на 1-2% увеличивает риск развития рака, в особенности это касается телмисартана, который увеличивает риск возникновения рака легких на 8%. I. Sipahi с соавторами в 2010 году предложил гипотезу о том, что высокая концентрация циркулирующего в плазме крови ангиотензина II, индуцированная селективной блокадой рецепторов 1-го типа, может увеличить стимуляцию рецепторов ангиотензина 2-го типа, что, в свою очередь, возможно, стимулирует ангиогенез опухоли [20]. Известно, что РААС вовлечена в ангиогенез. Тем не менее, большинство экспериментальных работ доказывает, что ангиогенез стимулируется исключительно с помощью рецепторов 1-го типа. Некоторые авторы предполагают, что стимуляция рецепторов ангиотензина 1-го типа активирует ангиогенез посредством активации экспрессии сосудистого эндотелиального и других факторов роста, а также генов, вовлеченных в регуляцию клеточной пролиферации. Однако исследование канадских авторов, которые обследовали когорту в Великобритании, получавшую телмисартан, демонстрирует отсутствие повышенного риска развития рака при применении этого препарата по сравнению с другими АРА. Тем не менее, авторы делают немаловажную приписку, что исследование дает уверенность всего лишь в краткосрочной безопасности телмисартана [21]. Не успели утихнуть споры в научной литературе по поводу канцерогенного действия сартанов, как разразился новый «скандал». 1 февраля 2019 г. Комитет по лекарственным средствам для человека (CHMP) Европейского агентства по лекарственным средствам (European Medicines Agency – EMA) принял решение обязать компании, производящие лекарственные средства класса сартанов, пересмотреть свои производственные процессы во избежание появления примеси нитрозамина [22]. Решение было принято после того, как EMA 2 мая 2019 г. опубликовало подробный отчет по проблеме нитрозаминовых примесей в сартанах. Помимо информации о более изученных примесях – N-нитрозодиметиламинам (NDMA) и N - н и т р о з о д и э т и л а м и н а м (NDEA) – в отчете содержится информация о трех других типах: N-нитрозо-N-метил-4- аминомасляной кислоте (NMBA), N-нитрозодиизопропиламине (DIPNA) и N-нитрозоэтилизопропиламине (EIPNA). Обзор касается кандесартана, ирбесартана, лозартана, олмесартана и валсартана, которые имеют специфическую кольцевую структуру (тетразол), синтез которой потенциально может привести к образованию примесей нитрозаминов. Другие лекарственные средства класса сартанов, которые не имеют этого кольца, такие как азилсартан, эпросартан и телмисартан, не были включены в отчет (рис.1).
Рисунок 1.
Сартаны, содержащие тетразольное кольцо.
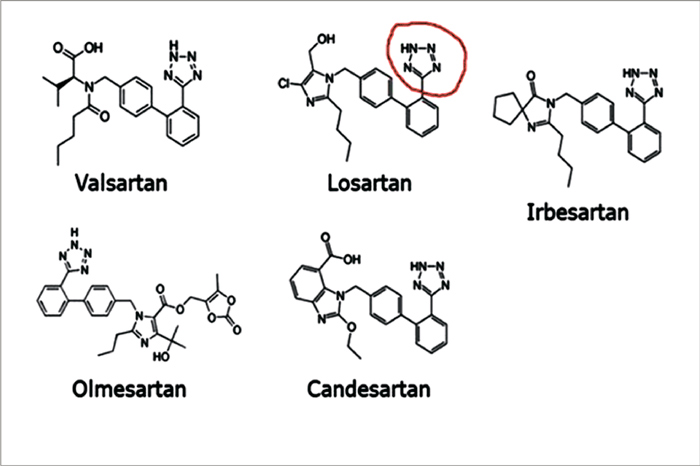
Следует отметить, что кандесартан, лозартан, олмесартан и валсартан одобрены для лечения АГ у детей.
Оказалось, что во всем повинна китайская компания Zhejiang
Huahai Pharmaceutical (Чжецзиан
Хуахай Фармасьютикал), которая
выпускает активный фармацевтический ингредиент (АФИ) для производства сартанов. Именно
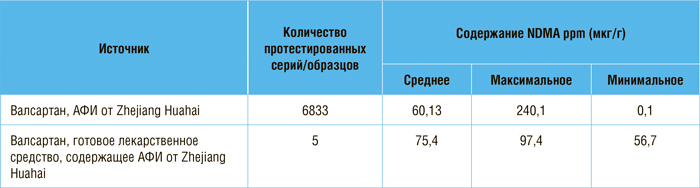
там и было обнаружено повышенное содержание нитрозаминов (табл.1).
Таблица 1.
Данные о содержании NDMA в АФИ от Zhejiang Huahai и готовых лекарственных средствах с этим АФИ.
Данные EMA
В обновленных результатах
расследования Food and Drug
Administration (FDA), США, содержится предположение о том, что
примеси могут являться следствием использования определенных
растворителей, реагентов и других
исходных материалов. Кроме того,
не исключается, что примеси присутствовали в некоторых сартанах,
потому что производители непреднамеренно использовали загрязненное оборудование или реагенты в
процессе производства.
Обзор оценил максимально возможный риск рака в связи с наличием нитрозаминов. Максимальная
продолжительность воздействия на
пациентов валсартана, загрязненного NDMA, составляет 6 лет (с
июля 2012 г. по июль 2018 г.). Если
100 000 пациентов принимали
валсартан из провинции Чжэцзян
Хуай (где были найдены самые высокие уровни примесей) каждый
день в течение 6 лет в самой высокой дозе, то может возникнуть
22 дополнительных случая рака
из-за NDMA в течение жизни
этих 100 000 пациентов. NDEA в
этих лекарствах может привести
к 8 дополнительным случаям на
100 000 пациентов, которые принимали лекарство в самой высокой дозе каждый день в течение
4 лет [23]. Среднесуточное воздействие NDMA, по цитируемым
ЕМА данным, из-за загрязненных
напитков, продуктов питания,
воздуха и воды составляет 100-
1000 нг в сутки = 0,1-1 мкг/день.
Keszei с соавт. установил, что увеличение потребления NDMA на
0,1 мкг/день ведет к появлению
плоскоклеточного рака пищевода,
причем риск сцеплен с мужским
полом. А поступление NDMA в
связи с лечением контаминированными на среднем уровне препаратами валсартана более чем в
24 раза выше, чем при ежедневном потреблении напитков, продуктов питания, воздуха и воды с
нитрозаминовыми соединениями
[24]. Федеральная служба по надзору в сфере здравоохранения РФ
тоже не осталась в стороне от этой
проблемы и опубликовала Письмо
№01И-591/19 от 27.02.2019 о безопасности лекарственных препаратов группы сартанов, в котором
определены отечественные и зарубежные производители лекарственных препаратов валсартана,
в чьей регистрационной документации содержится информация об использовании субстанции валсартан,
в отношении которой приняты регуляторные решения, и содержатся
напоминания об обязанностях производителей и распространителей
лекарств контролировать качество
продаваемой продукции.
Таким образом, на данный момент
нет ясности в вопросе безопасности применения препаратов класса
АРА в отношении канцерогенеза,
особенно у пациентов с неблагоприятным анамнезом или наследственностью.
Сердечные гликозиды (СГ) и
антагонисты кальция (АК)
Противоопухолевые свойства СГ
начали изучаться в 60-х годах прошлого века в доклинических исследованиях. Эпидемиологические
исследования, касающиеся связи
между использованием СГ и риском
развития рака, дали противоречивые результаты. Противоопухолевая активность СГ, наблюдаемая в
исследованиях на животных, требует высоких концентраций, которые
обычно очень плохо переносятся
людьми. В анализе 14 исследований
типа случай-контроль и 15 когортных исследований было выявлено,
что использование СГ было связано
с более высоким риском рака молочной железы определенных видов.
Ученые сделали вывод, что эстрогеноподобная активность СГ может
быть ответственна за увеличение
риска некоторых типов опухолей
груди. Тем не менее, постоянный
долгосрочный прием СГ снизил общий риск развития опухолей [25].
В 1996 г. был поднят вопрос о возможной связи между приемом АК
и увеличением риска развития рака
[26]. Проспективное когортное исследование показало, что применение АК связано с повышением общего риска развития рака в когорте
пожилых людей, принимавших АК.
Коэффициенты риска, связанные с
верапамилом, дилтиаземом и нифедипином, существенно не отличались друг от друга. А начиная с 1977
г. стали появляться многочисленные
сообщения о статистически значимом увеличении риска развития
рака груди. Особенно это касалось
длительного приема АК (в течение
10 лет или более) [27]. В то же время
результаты большого популяционного когортного исследования показывают, что длительное использование блокаторов кальциевых каналов
не связано с повышенным риском
рака молочной железы, независимо
от длительности приема препарата [28]. Авторитетный метаанализ,
включающий шесть когортных и
четыре исследования «случай-контроль», анализировал воздействие
АК на риск развития рака легких.
Выяснилось, что применение АК
длительностью ≥4 лет достоверно
связано с повышенным риском рака
легких. Авторы делают вывод, что,
учитывая широкое использование
этих препаратов и недостаток данных о долгосрочных последствиях
хронического воздействия АК, результаты являются поводом для беспокойства и требуют дальнейшего
изучения [29]. Предполагалось, что
потенциальные механизмы канцерогенного эффекта АК связаны с
концентрацией внутриклеточного кальция. И вот в 2020 г. появилась
работа, которая пытается объяснить
связь кальциевого обмена с возникновением опухолей. Ранее было
обнаружено, что амплификация
хромосомы 17q24.1-24.2 связана с
метастазами в лимфатические узлы,
размером опухоли и лимфоваскулярной инвазией при инвазивной
протоковой карциноме. Ген в этом
ампликоне, CACNG4, гамма-субъединица потенциал-управляемых
кальциевых каналов L-типа, повышен при раке молочной железы с
плохим прогнозом. Гомеостаз кальция достигается путем поддержания
низкого уровня внутриклеточного
кальция. Изменение механизмов
притока/оттока кальция позволяет
опухолевым клеткам поддерживать
гомеостаз, несмотря на высокий
уровень кальция в сыворотке, часто
связанный с распространенным раком (гиперкальциемия) и аберрантной передачей сигналов кальция
[30].
Аспирин
Положительное влияние аспирина на сердечно-сосудистую систему в значительной степени связано с его антиагрегантными свойствами, в то же время он играет важную роль как противовоспалительный агент в профилактике и лечении рака. В 2014 г. были опубликованы результаты исследования NIH-AARP [31], в котором изучался протективный эффект нестероидных противовоспалительных препаратов (НПВП) в отношении риска развития определенных видов рака – рака, связанного с воспалением, и рака, связанного с конкретными причинами: 1) с ожирением (рак пищевода, желчного пузыря, колоректальный рак, рак поджелудочной железы, постменопаузальная опухоль груди, рак эндометрия, почки и щитовидной железы); 2) с инфекцией (опухоли головы и шеи, рак желудка, печени, колоректальный рак, лимфома, рак прямой кишки и женских половых органов); 3) с алкоголем (опухоли головы и шеи, рак пищевода, колоректальный рак, рак печени и молочной железы); 4) с курением (рак легких, головы и шеи, пищевода, поджелудочной железы и мочевого пузыря). Выяснилось, что применение НПВС было связано со снижением риска развития рака, который обычно развивается при наличии воспалительных состояний, таких как ожирение, курение, инфекция и чрезмерное употребление алкоголя. Использование аспирина предотвращало рак, связанный с инфекцией и ожирением, а также рак печени и эндометрия (рис.2).
Рисунок 2.
Отношения рисков и 95% доверительный интервал для риска развития рака при изолированном использовании аспирина или НПВП или совместном использовании
аспирина и НПВП в течение 12 месяцев в NIH-AARP study
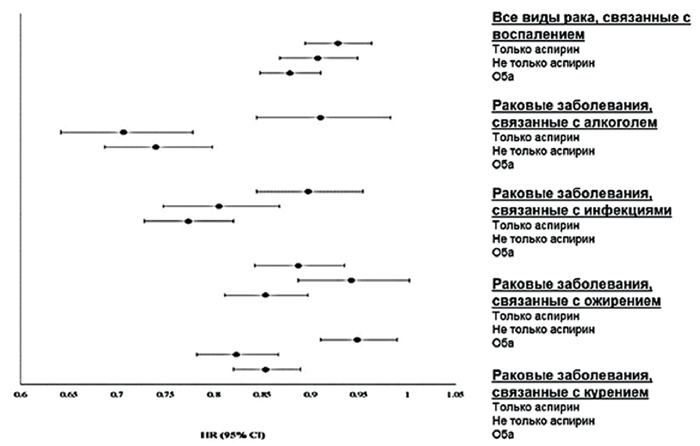
Метаанализ, исследующий связь
между аспирином и колоректальным раком, обнаружил, что аспирин уменьшает риск колоректального рака на 24% [32]. Этот эффект,
по результатам некоторых исследований, может быть связан как с
циклооксигеназо-зависимыми, так
и с циклооксигеназо-независимыми механизмами [33,34]. Данные о
вовлечении в антиканцерогенный
эффект аспирина циклооксигеназо-зависимого пути подтверждаются и работами, изучающими
выживаемость после лечения опухолей молочной железы и их метастазирование [35]. Тем не менее,
существуют и противоречивые
данные о влиянии терапии аспирином на онкогенез, например, в
отношении рака эндометрия [36].
В то время как некоторые данные
указывают на защитные эффекты
у женщин с ожирением, другие исследования показали потенциальное вредное влияние этих препаратов на исходы рака эндометрия.
Таким образом, будущие исследования в этой области необходимы
для выяснения влияния аспирина
на выживаемость женщин с опухолями эндометрия, особенно для
выявления конкретных групп населения, у которых аспирин может
оказывать положительные эффекты. И все же, в целом можно сказать, что аспирин регулирует почти все проявления пула раковых
клеток. Внутри опухолевой ткани
аспирин подавляет биологическую
активность самих раковых клеток и ухудшает микроокружение
опухоли, которое поддерживает
прогрессирование рака. Помимо
опухолевых тканей, блокирование
активации тромбоцитов также увеличивает способности аспирина
ингибировать прогрессирование
ОЗ. С точки зрения молекулярного
механизма аспирин воздействует
на онкогены и связанные с раком сигнальные пути и активирует некоторые опухолевые супрессоры
[37]. Защитное действие аспирина
в отношении онкогенеза, возможно, связано с его противовоспалительным действием и действием
как кислоты, особенно в случае
опухолей желудочно-кишечного
тракта.
Статины
Статины – наиболее известный
класс препаратов, который позиционируется как способствующий снижению заболеваемости
и смертности от ССЗ. Препараты
статинов имеют плейотропные
эффекты. Многие эксперименты in vitro продемонстрировали
противоопухолевое действие статинов против раковых стволовых
клеток и определенных клеточных
линий через подавление клеточной пролиферации и апоптоза
[38]. Статины также обладают
сильным противовоспалительным
эффектом, который оказывает защитное действие против раковых
клеток. Однако некоторые клинические исследования нашли
потенциальную связь между статинами и раком [39]. Статины посредством ингибирования гидроксиметилглутарил-КоА-редуктазы
(HMGCR), основного фермента
пути биосинтеза холестерина, ингибируют путь мевалоната, который обеспечивает изопреноиды
для пренилирования различных
белков, таких как суперсемейство
Ras, которое играет существенную
роль в развитии рака. Ингибирование мевалонатного/изопреноидного пути является причиной
холестерин-независимых эффектов статинов или плеотропных
эффектов. В зависимости от их
проникновения во внепеченочные клетки статины по-разному влияют
на путь мевалоната/изопреноида.
Липофильные статины диффундируют во все клетки, а гидрофильные
используют различные мембранные
транспортеры, чтобы получить доступ к клеткам, отличным от гепатоцитов. Было высказано предположение, что более низкая доступность
статинов для внепеченочных тканей
может привести к компенсаторной
индукции мевалоната/изопреноидного пути и развитию рака [40]. Тем
не менее, большинство популяционных исследований показывают,
что статины не влияют на развитие
рака, даже снижают риск различных
видов рака. Некоторые работы демонстрируют убедительные доказательства улучшения состояния онкологических пациентов, например
– безрецидивной выживаемости
больных раком молочной железы,
которые были на терапии статинами во время постановки диагноза,
и снижение риска смертельного
рака простаты, если пациенты находились на терапии статинами на
момент диагностирования опухоли
[41,42]. В одном из метаанализов,
который включал тридцать девять
когортных исследований и два исследования типа «случай-контроль»
с общим числом пациентов 990 649,
были проанализированы 3 крупнейшие онкологические подгруппы
– колоректальный рак, рак груди и
рак простаты. Результаты показали,
что применение статинов до или после диагностики рака ассоциируется
с улучшением онкологической и общей выживаемости [43]. Считается,
что гепатоцеллюлярная карцинома
(ГЦК) является основной причиной
смертности от рака во всем мире,
особенно это касается азиатских
стран с высоким распространением гепатита В. В одном из обзоров
было показано, что использование
статинов связано со сниженным риском развития ГЦК. Авторы работы
выразили уверенность, что рандомизированные клинические испытания влияния статинов на развитие ГЦК оправданны, особенно в
азиатских популяциях [44]. С этими
результатами пересекаются и выводы экспертов, авторов другого метаанализа: использование статинов
связано с общим снижением риска
рака поджелудочной железы на 30%
[45]. Таким образом, можно сделать
вывод, что применение статинов
является безопасным, а в некоторых
случаях и полезным при лечении
больных ОЗ. Правда, справедливости ради, надо отметить, что есть
работы, предполагающие влияние
статинов на возникновение и рецидивирование рака мочевого пузыря
[46]. В практике автора этой статьи
был случай возникновения карциномы мочевого пузыря у молодого
пациента с наследственной гиперхолестеринемией, находящегося на
высоких дозах статинов. Вероятно,
следует рекомендовать регулярное
УЗИ мочевого пузыря у пациентов,
принимающих статины.
Вместо заключения
В завершении хочется сказать, что
не является секретом тот факт, что
лечить болезнь гораздо сложней
и опасней, чем ее предотвращать.
Это касается и ССЗ и ОЗ. Общности факторов риска ССЗ и ОЗ нами был посвящен целый обзор, подготовленный совместно с сотрудниками МНИОИ им. П.А. Герцена –
филиала ФГБУ НМИЦ радиологии
Минздрава России и опубликованный в журнале «Кардиология» [47].
В данном контексте очень показательны результаты двух исследований, в которых анализировалось
влияние традиционных факторов
риска ССЗ на возникновение рака.
В исследовании EPIC [48] была поставлена цель проанализировать
вероятность возникновения ОЗ
у лиц, ведущих здоровый образ
жизни (ЗОЖ). В испытание были
включены 23 153 участника в возрасте от 35 до 65 лет. Факторы ЗОЖ
были определены как отсутствие
курения, индекс массы тела (ИМТ)
<30 кг/м2, физическая активность
(ФА) >3,5 часов в неделю, здоровое
питание. После среднего периода
наблюдения 7,8 лет участники, которые придерживались всех 4 факторов ЗОЖ, имели гораздо более
низкий риск возникновения рака в
сравнении с теми, кто не исповедовал принципы ЗОЖ (ОШ 0,64; 95%
ДИ 0,43-0,95). Когортное исследование ARIC также анализировало
риск возникновения рака у людей
(45-64 лет), придерживающихся
7 идеальных маркеров здоровья
по классификации Американской
ассоциации сердца (AHA). Оказалось, что приверженность хотя бы
к 6 из 7 идеальным маркерам здоровья снижала риск возникновения ОЗ (кроме немеланоцитарного
рака кожи) на 51% по сравнению с
теми, кто не был привержен правилам ЗОЖ, и это после поправки на
пол, возраст и этническую принадлежность [49]. Наиболее сильная
корреляция с риском возникновения рака была обнаружена у диеты, ФА, ИМТ и курения. Именно
сочетание нескольких принципов
ЗОЖ приводит впоследствии к
снижению риска ОЗ. Несомненно,
результаты подобных исследований могут послужить основой для
создания рекомендаций по сочетанной профилактике ССЗ и ОЗ.
Эта статья не имеет целью снизить
и так невысокую приверженность
к лечению пациентов с АГ, например, ведь статья предназначена не
для пациентов, хотя меня в этом
и упрекали. Данный обзор имеет
целью повысить приверженность
врачей к более индивидуальному подходу и учету всех аспектов
коморбидности у больных с ОЗ в
анамнезе в век персонифицированной медицины, тем более что в
настоящее время мы имеем большой выбор средств для лечения
ССЗ, который нам и позволяет
обеспечить этот подход.
Список литературы:
1. Armstrong GT, Kawashima T, Leisenring W, Stratton K, Stovall M, Hudson MM, Sklar CA, Robison LL, Oeffinger KC. Aging and risk of severe, disabling, life-threatening, and fatal events in the childhood cancer survivor study. J Clin Oncol. 2014; 32: 1218-1227. doi: 10.1200/ JCO.2013.51.1055.
2. Armstrong GT, Oeffinger KC, Chen Y, Kawashima T, Yasui Y, Leisenring W, Stovall M, Chow EJ, Sklar CA, Mulrooney DA, Mertens AC, Border W, Durand JB, Robison LL, Meacham LR. Modifiable risk factors and major cardiac events among adult survivors of childhood cancer. J Clin Oncol. 2013; 31: 3673-3680. doi:10.1200/JCO.2013.49.3205.
3. Stocks T, Van Hemelrijck M, Manjer J, et al. Blood pressure and risk of cancer incidence and mortality in the metabolic syndrome and cancer project. Hypertension. 2012; 59(4): 802-810.
4. Баранова Е.И. Антигипертензивная терапия антагонистами рецепторов ангиотензина II и риск развития злокачественных новообразований. Артериальная гипертензия. 2012; 18(5): 375-384.
5. Lijinsky W, Reuber MD. Pathologic effects of chronic administration of hydrochlorothiazide, with and without sodium nitrite, to F344 rats. Toxicol Ind Health. 1987; 3: 413-422.
6. National Toxicology P. Toxicology and carcinogenesis studies of furosemide (CAS No. 54-31-9) in F344/N rats and B6C3F1 mice (feed studies). Natl Toxicol Program Tech Rep Ser. 1989; 356: 1-190.
7. Grossman E, Messerli FH, Goldbourt U. Does diuretic therapy increase the risk of renal cell carcinoma? Am J Cardiol. 1999; 83: 1090-1093.
8. Chow WH, McLaughlin JK, Mandel JS, Wacholder S, Niwa S, Fraumeni JF Jr. Risk of renal cell cancer in relation to diuretics, antihypertensive drugs, and hypertension. Cancer Epidemiol Biomarkers Prev. 1995; 4: 327-331.
9. McLaughlin JK, Chow WH, Mandel JS, Mellemgaard A, McCredie M, Lindblad P, Schlehofer B, Pommer W, Niwa S, Adami HO. International renal-cell cancer study. VIII. Role of diuretics, other antihypertensive medications and hypertension. Int J Cancer. 1995; 63: 216-221.
10.Finkle WD, McLaughl JK, Rasgon SA, Yeoh HH, Low JE. Increased risk of renal cell cancer among women using diuretics in the United States. Cancer Causes Control. 1993; 4: 555-558.
11.Pottegård A, Hallas J, Olesen M, Svendsen MT, Habel LA, Friedman GD, Friis S. Hydrochlorothiazide use is strongly associated with risk of lip cancer. J Intern Med. 2017 Oct; 282(4): 322-331.
12.Pedersen SA, Gaist D, Schmidt SAJ, Hölmich LR, Friis S, Pottegård A. Hydrochlorothiazide use and risk of nonmelanoma skin cancer: A nationwide case-control study from Denmark. J Am Acad Dermatol. 2018 Apr; 78(4): 673-681.
13.Pedersen SA, Johannesdottir Schmidt SA, Hölmich LR3, Friis S, Pottegård A, Gaist D. Hydrochlorothiazide use and risk for Merkel cell carcinoma and malignant adnexal skin tumors: A nationwide case-control study. J Am Acad Dermatol. 2019 Feb; 80(2): 460- 465.
14.Colt JS, Hofmann JN, Schwartz K, Chow WH, Graubard B, Davis F, Ruterbusch J, Berndt S, Purdue MP Antihypertensive medication use and risk of renal cell carcinoma. Cancer Causes Control. 2017 Apr; 28(4): 289-297.
15.Ganz PA, Habel LA, Weltzien EK, Caan BJ, Cole SW. Examining the influence of beta blockers and ACE inhibitors on the risk for breast cancer recurrence: results from the LACE cohort. Breast Cancer Res Treat. 2011; 129: 549-556.
16.Raimondi S, Botteri E, Munzone E, Cipolla C, Rotmensz N, DeCensi A, Gandini S. Use of beta-blockers, angiotensinconverting enzyme inhibitors and angiotensin receptor blockers and breast cancer survival: Systematic review and meta-analysis. Int J Cancer. 2016 Jul 1; 139(1): 212-9.
17. Chang CH, Chiang CH, Yen CJ, Wu LC, Lin JW, Lai MS. Antihypertensive agents and the risk of breast cancer in women aged 55 years and older: a nested case-control study. J Hypertens. 2016 Mar; 34(3): 558-66.
18.Zhao Y, Wang Q, Zhao X, Meng H, Yu J .Effect of antihypertensive drugs on breast cancer risk in female hypertensive patients: Evidence from observational studies. Clin Exp Hypertens. 2018; 40(1): 22-27.
19.Pfeffer MA, Swedberg K, Granger CB, et al. Effects of candesartan on mortality and morbidity in patients with chronic heart failure: the CHARM-Overall programme. Lancet. 2003; 362(9386): 759-766.
20.Sipahi I, Debanne SM, Rowland DY, Simon DI, Fang JC. Angiotensin-receptor blockade and risk of cancer: meta-analysis of randomised controlled trials. Lancet Oncol. 2010 Jul; 11(7): 627-36. doi: 10.1016/S1470- 2045(10)70106-6.
21.Tascilar K, Azoulay L, Dell'Aniello S, Bartels DB, Suissa S. The Use of Telmisartan and the Incidence of Cancer. Am J Hypertens. 2016 Dec 1; 29(12): 1358-1365. doi: 10.1093/ ajh/hpw095.
22.www.ema.europa.eu/en/news/ sartan-medicines-companies-reviewmanufacturing-processes-avoid-presencenitrosamine-impurities.
23.www.ema.europa.eu/en/documents/ press-release/sartan-medicines-companiesreview-manufacturing-processes-avoidpresence-nitrosamine-impurities_pr.pdf.
24.Keszei AP, Goldbohm RA, Schouten LJ, Jakszyn P, van den Brandt PA. Dietary N-nitroso compounds, endogenous nitrosation, and the risk of esophageal and gastric cancer subtypes in the Netherlands Cohort Study. Am J Clin Nutr. 2013 Jan; 97(1): 135-46. doi: 10.3945/ajcn.112.043885.
25.Osman MH, Farrag E, Selim M, Osman MS, Hasanine A, Selim A. Cardiac glycosides use and the risk and mortality of cancer; systematic review and meta-analysis of observational studies. PLoS One. 2017; 12(6): e0178611. doi: 10.1371/journal. pone.0178611.
26.Pahor M, Guralnik JM, Ferrucci L, Corti MC, Salive ME, Cerhan JR, Wallace RB, Havlik RJ. Calcium-channel blockade and incidence of cancer in aged populations. Lancet. 1996 Aug 24; 348(9026): 493-7.
27. Li CI, Daling JR, Tang MT, Haugen KL, Porter PL, Malone KE. Use of antihypertensive medications and breast cancer risk among women aged 55 to 74 years. JAMA Intern Med. 2013 Sep 23; 173(17): 1629-37. doi: 10.1001/jamainternmed.2013.9071.
28.Azoulay L, Soldera S, Yin H, Bouganim N. Use of Calcium Channel Blockers and Risk of Breast Cancer: A Populationbased Cohort Study. Epidemiology. 2016 Jul; 27(4): 594-601. doi: 10.1097/ EDE.0000000000000483.
29.Rotshild V, Azoulay L, Zarifeh M, Masarwa R, Hirsh-Raccah B, Perlman A, Muszkat M, Matok I. The Risk for Lung Cancer Incidence with Calcium Channel Blockers: A Systematic Review and Meta-Analysis of Observational Studies. Drug Saf. 2018 Jun; 41(6): 555-564. doi: 10.1007/s40264-018-0644-4.
30.Kanwar N, Carmine-Simmen K, Nair R, Wang C, Moghadas-Jafari S, Blaser H, Tran-Thanh D, Wang D, Wang P, Wang J, Pasculescu A, Datti A, Mak T, Lewis JD, Done SJ. Amplification of a calcium channel subunit CACNG4 increases breast cancer metastasis. EBioMedicine. 2020 Feb; 52: 102646. doi: 10.1016/j. ebiom.2020.102646.
31. Shebl FM, Hsing AW, Park Y, Hollenbeck AR, Chu LW, Meyer TE, Koshiol J. Non-steroidal anti-inflammatory drugs use is associated with reduced risk of inflammation-associated cancers: NIHAARP study. PLoS One. 2014; 9: e114633.
32.Rothwell PM, Wilson M, Elwin CE, Norrving B, Algra A, Warlow CP, Meade TW. Long-term effect of aspirin on colorectal cancer incidence and mortality: 20-year follow-up of five randomised trials. Lancet. 2010; 376: 1741-1750.
33.Garcia-Albeniz X, Chan AT. Aspirin for the prevention of colorectal cancer. Best Pract Res Clin Gastroenterol. 2011; 25: 461-472.
34.Guo L, Gao J, Gao Y, Zhu Z, Zhang Y. Aspirin Reshapes Acetylomes in Inflammatory and Cancer Cells via CoA-Dependent and CoA-Independent Pathways. J Proteome Res. 2020 Feb 7; 19(2): 962-972. doi: 10.1021/acs. jproteome.9b00853.
35.Chen WY, Holmes MD. Role of Aspirin in Breast Cancer Survival. Curr Oncol Rep. 2017 Jul; 19(7): 48. doi: 10.1007/s11912- 017-0605-6.
36.Takiuchi T, Blake EA, Matsuo K, Sood AK, Brasky TM. Aspirin use and endometrial cancer risk and survival. Gynecol Oncol. 2018 Jan; 148(1): 222-232. doi: 10.1016/j.ygyno.2017.10.026.
37. Zhang X, Feng Y, Liu X, Ma J, Li Y, Wang T, Li X. Beyond a chemopreventive reagent, aspirin is a master regulator of the hallmarks of cancer. J Cancer Res Clin Oncol. 2019 Jun; 145(6): 1387-1403. doi: 10.1007/s00432-019-02902-6.
38.Warita K, Warita T, Beckwitt CH, Schurdak ME, Vazquez A, Wells A, Oltvai ZN. Statin-induced mevalonate pathway inhibition attenuates the growth of mesenchymal-like cancer cells that lack functional E-cadherin mediated cell cohesion. Sci Rep. 2014; 4: 7593.
39.Dale KM, Coleman CI, Henyan NN, Kluger J, White CM. Statins and cancer risk: a meta-analysis. JAMA. 2006; 295: 74-80.
40.Ahmadi Y, Ghorbanihaghjo A, Argani H. The balance between induction and inhibition of mevalonate pathway regulates cancer suppression by statins: A review of molecular mechanisms. Chem Biol Interact. 2017 Aug 1; 273: 273-285.
41.Nielsen SF, Nordestgaard BG, Bojesen SE. Statin use and reduced cancer-related mortality. N Engl J Med. 2012; 367: 1792- 1802.
42. Mucci LA, Stampfer MJ. Mounting evidence for prediagnostic use of statins in reducing risk of lethal prostate cancer. J Clin Oncol. 2014; 32: 1-2.
43.Zhong S, Zhang X, Chen L, Ma T, Tang J, Zhao J. Statin use and mortality in cancer patients: systematic review and meta-analysis of observational studies. Cancer Treat Rev. 2015; 41: 554-567.
44. Singh S, Singh PP, Singh AG, Murad MH, Sanchez W. Statins are associated with a reduced risk of hepatocellular cancer: a systematic review and meta-analysis. Gastroenterology. 2013 Feb; 144(2): 323-32.
45.Archibugi L, Arcidiacono PG, Capurso G. Statin use is associated to a reduced risk of pancreatic cancer: A meta-analysis. Dig Liver Dis. 2019 Jan; 51(1): 28-37.
46.Pastore, AL, Palleschi, G, Fuschi A, et al. Can daily intake of aspirin and/or statins influence the behavior of non-muscle invasive bladder cancer? A retrospective study on a cohort of patients undergoing transurethral bladder resection. BMC Cancer. 2015; 15: 120. https://doi. org/10.1186/s12885-015-1152-x.
47. Зволинская Е.Ю., Мамедов М.Н., Потиевская В.И., Иванов С.А., Каприн А.Д. Роль модифицируемых сердечно-сосудистых факторов риска в возникновении онкологических заболеваний. Кардиология. 2020; 60(9): 110-121. https://doi.org/10.18087/ cardio.2020.9.n910.
48.Nöthlings U, Ford ES, Kröger J, Boeing H. Lifestyle factors and mortality among adults with diabetes: findings from the European Prospective Investigation into Cancer and Nutrition-Potsdam study. J Diabetes. 2010; 2: 112-117. doi: 10.1111/j.1753-0407.2010.00069.x.
49.Rasmussen-Torvik LJ, Shay CM,
Abramson JG, Friedrich CA, Nettleton
JA, Prizment AE, Folsom AR. Ideal
cardiovascular health is inversely associated
with incident cancer: the Atherosclerosis
Risk In Communities study. Circulation.
2013; 127: 1270-1275. doi: 10.1161/
CIRCULATIONAHA.112.001183.
ДВЕ БОЛЬШИЕ РАЗНИЦЫ: О ГОСУДАРСТВЕННОМ И ЧАСТНОМ В ОНКОЛОГИИ
Автор: Евдокимов Владимир Игоревич
Врач-онколог, заведующий онкологическим отделением №1
в ЦАОП ММКЦ «Коммунарка», Москва
Дисклеймер: Уважаемый читатель, если вы читаете эту статью, значит, вы либо просто
любопытны, либо вам хочется новых ощущений. По мере прочтения вы можете ощутить
амбивалентность, но не тревожьтесь: это абсолютно нормальная реакция, а не симптом
шизофрении. Надеюсь, будет нескучно.
Итак, меня зовут Владимир, и я
хочу рассказать вам о том, каково
быть по разные стороны условных онкологических баррикад.
В России, а точнее, в ее столице
– Москве – онкологический мир
разделен на государственную и
частную медицину. В настоящее
время эта граница практически
стерта. Однако мне посчастливилось работать в частной клинике
доктора Ласкова и впоследствии
повезло стать заведующим онкологическим отделением в ЦАОП
ММКЦ «Коммунарка». И, несмотря на пока еще короткий срок
своего заведования, я успел отметить «две большие разницы»,
о которых и будет повествование.
Но сначала немного о себе. В клинику доктора Ласкова я устроился в 2021 году сразу после ординатуры, которую я проходил в
НМИЦ онкологии им. Н.Н. Блохина. Перед тем, как стать частью
команды Михаила Савельевича,
параллельно с ординатурой я
проходил стажировку в клинике в течение года, посещая приемы, участвуя в обсуждениях и
занимаясь всем тем, чем обычно
занимаются ординаторы, – но в
условиях частной медицины. А в
январе 2023 года, спустя год, мне
предложили попробовать себя в
роли заведующего онкологическим отделением в ЦАОП. Интересная возможность, подумал
я – и вот, спустя месяц работы,
я привожу свой анализ того, чем
медицина частная отличается от
государственной.
Начать хотелось бы с восприятия.
В условиях частной практики ты
привыкаешь к тому, что ты – медицинский онколог, точнее даже
онкогематолог. Твой день – это
сплошное принятие клинических
решений, как онкологических, так
и просто медицинских. Разумеется, если говорить об онкологических решениях, то окончательно
они принимаются тобой после условного консилиума с коллегами.
Зато в том, ЧТО вынести на обсуждение, у тебя границ нет – гайдлайны NCCN, ESMO, UptoDate и всеми любимый Google. Ты несешь
ответственность за пациента, приучаешь себя обдумывать каждое
решение с позиций доказательной
медицины, а обсуждения с коллегами всегда пестрят ссылками на
статьи и факты. Ты воспринимаешь каждый клинический случай
кристально чисто, оторванно от
лишней бюрократической волокиты, думая лишь о двух вещах
– продолжительности и качестве
жизни твоего пациента.
В условиях государственной медицины восприятие несколько
иное: тебя помещают в искусственно созданные рамки, и ты не
можешь выйти за их пределы. Хочешь начать химиотерапию? Тебе
уже недостаточно общепризнанных мер предосторожности, ограниченных парой анализов крови,
ибо есть стандарты оказания помощи, нормативные документы
ДЗМ и МЗ РФ. Спутником всех
твоих пациентов и их историй
болезни становятся ЭКГ и коагулограмма. Клинической надобности нет – а делать надо. Есть очевидная клиническая ситуация, в
которой примет решение и ординатор первого года? Будь добр, все
равно проведи онкологический
консилиум, иначе ты не можешь
начать терапию. Привык самостоятельно купировать боль или
подбирать антигипертензивную
терапию? Забудь, ведь есть кабинет боли, терапевт, гастроэнтеролог и многие другие специалисты,
к которым ты обязан направить
пациента. Таким образом, если в
условиях частной практики я воспринимал каждый клинический
случай как интересную загадку,
которую нужно разгадать, то в
новых реалиях я вынужден ограничить полет клинической мысли
и действовать со связанными за
спиной руками.
Продолжу рассказом об организации процесса работы. В клинике я
начинал рабочий день с консультаций пациентов перед химиотерапией или тех, кто участвовал в
клинических исследованиях. С
обеда начинался консультативный прием, где на каждого пациента отводился час, что позволяло
выслушать человека, погрузиться
в клиническую ситуацию, принять решения и правильно оформить медицинскую документацию. Каждый день проводились
встречи и обсуждения, целью
которых было сделать нашу практику лучше или обсудить те или
иные клинические ситуации. Ни
тебе отслеживания времени прихода на работу, ни KPI, оценивающих «полноту обследования и
лечения» и прочего. Лишь кристальная медицина – и ничего
более.
В условиях государственной машины все совсем иначе. Я с удивлением столкнулся с разделением
персоны медицинского онколога
на многоголовую гидру: общий
онколог, онкогинеколог, онкоуролог, химиотерапевт… Для меня
это до сих пор выглядит жутковато. И если условные хирургические специальности нужны – разумеется, вряд ли один врач будет
виртуозно делать биопсии простаты и осматривать шейку матки, то разделить врача на онколога и химиотерапевта это дикость.
В том понимании, которому был
научен я, медицинский онколог –
это врач, способный принимать
самостоятельно до 80% решений в лечении рака. Именно он
определяет, когда нужен хирург,
а когда лучевой терапевт, и при
этом он самостоятельно проводит химиотерапевтическое лечение и поддерживающую терапию.
Разумеется, со временем начинает приходить понимание, что в
условиях 15 минут на одного пациента и приема врачом больше
20 человек за день медицинский
процесс превращается в конвейер. И приходится жертвовать
универсальностью для того, чтобы четко разделить обязанности
между участниками процесса.
Но, наверное, ключевой разницей для меня стала сама работа.
Оказалось, что заведующий отделением – это сугубо административная должность, особенно при
том потоке пациентов, которые
получают лечение в Коммунарке. Необходимость разрешить
какую-то клиническую ситуацию
на приеме у твоего врача или на
консилиуме становится глотком
свежего воздуха. Остальное время ты занимаешься контролем.
Контролем качества оказываемых консультаций, контролем
того, как скоро обследуются
твои пациенты, контролем того,
как твои врачи докладывают на
онкологических консилиумах.
Помимо этого ты постоянно вынужден сам выстраивать рабочие
процессы. Будучи в роли врача,
ты привыкаешь, что все уже отлажено, и следуешь привычке. В
роли заведующего все вечно приходится доделывать, исправлять,
допиливать напильником, где-то
даже подкрутить гайки. И все это
в условиях наполнения до этого
пустой головы (или ее части) знаниями о нормативных актах, регулирующих твою работу. Объем
новых знаний колоссален, иногда
кажется, что он вытесняет из тебя
клиническое мышление, а иногда
– даже человека.
Для тех, кому показалось, что я
слишком пессимистичен, скажу,
что есть и светлые стороны. Придя в новое место, я отметил, что,
как и в частной клинике, я обеспечен почти всем необходимым.
Лекарственные препараты – на
полках, в перевязочных есть все
необходимое, операционная – оснащена. К своему удивлению, я
не отметил даже проблем с офисной бумагой и офисной техникой.
Разве что московский ЕМИАС
подводит каждый день под монастырь, но данная проблема вне
юрисдикции департамента здравоохранения Москвы. Мне очень
понравилась возможность провести все необходимые манипуляции под одной крышей, начиная
от простой биопсии и заканчивая
эндоскопическим вмешательством, установкой порт-системы
и проведением КТ или МРТ. В
условиях клиники я знал, кому
можно доверить пациента и куда
его направить. В Коммунарке об
этом не приходится думать, все
рядом. Более того тебе доступен
крупный многофункциональный
стационар, со специалистами и
манипуляциями на все случаи
жизни.
Подводя итог: работа в частной
практике сделала из меня медицинского онколога и врача. В тех
условиях я имел возможность
учиться, набивать шишки и уделять все рабочее время медицине. Но работа врача-онколога и
работа заведующего в крупном
государственном онкологическом центре – это две совершенно
разные стези. И на новом месте я
осознал, какая заложена пропасть
между индивидуальным подходом к каждому пациенту и конвейером, работу которого нужно
еще налаживать и налаживать.
Хочется верить, что и у меня получится внести маленький вклад
в работу той махины, в которую
волей случая я попал.
ПРОГРАММА RUSSCO ПО МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКОЙ ДИАГНОСТИКЕ: КОНТРОЛЬ КАЧЕСТВА
Российское общество клинической онкологии в течение 11 лет проводит программу «Совершенствование молекулярно-генетической диагностики в Российской Федерации с целью повышения эффективности противоопухолевого лечения». Более 140 000 тестов выполнено за этот период при 9 нозологических формах рака. Благодаря этому у нескольких десятков тысяч пациентов появилась возможность получать инновационную таргетную и иммунотерапию. В последние два года Российское общество клинической онкологии осуществляет программу по сбору данных о частоте встречаемости мутаций в опухолях различных локализаций, выполняет анализ полученных данных и на основании его проводит раунды по контролю качества.
В декабре 2022 завершен 4 раунд внешнего контроля качества тестирования мутации RAS лабораторий, которые сотрудничают с RUSSCO в рамках проекта «Частота мутаций». В этом раунде по контролю качества приняли участие 9 региональных лабораторий.
Экспертами в раунде контроля качества RAS были молекулярные генетики из ГБУЗ КОД №1 г.Краснодар (врач-генетик Моляка Ю.К.) и ФГБУ «НМИЦ колопроктологии им. А.Н. Рыжих» Минздрава России (руководитель отдела лабораторной генетики д.м.н. Цуканов А.С.). Ими были подготовлены протоколы по прохождению контроля, сопоставимые с европейскими требованиями к контролю качества. В экспертных лабораториях были протестированы контрольные образцы и направлены в лаборатории, проходящие контроль качества.
В каждую лабораторию было направлены индивидуальные сеты из 15 образцов опухолевой ткани в виде стружки, содержащих не менее 30-40% опухолевой ткани в образце. Ни один сет не повторял сет других лабораторий. На проведение тестирования образцов лабораториям давался временной промежуток 21 календарный день. Помимо RAS теста, лаборатории проводили дополнительное BRAF тестирование. На каждый образец участник контроля качества формировал заключение с интерпретацией результата. Экспертная группа проводила оценку в баллах по каждому этапу тестирования и, при необходимости, давала рекомендации. Благодарим заведующую лабораторией ГБУЗ КОД №1 МЗ КК Чухрай Ольгу Юрьевну: успех данного раунда во многом зависел от ее активного обсуждения формата мероприятия, оценки качества, клеточности гистологических препаратов и организации приготовления образцов для лабораторий-участников.
Мы благодарим экспертную группу молекулярных генетиков за помощь в проведении раунда контроля качества, интерпретацию результатов и оценку, а также лично Моляку Юрия Константиновича и Цуканова Алексея Сергеевича за организацию раунда контроля качества тестирования мутации в гене RAS.
Поздравляем с успешным прохождением контроля качества 8 лабораторий следующих медицинских учреждений:
• Краевое государственное бюджетное учреждение здравоохранения «Алтайский краевой онкологический диспансер»;
• Санкт-Петербургский государственное бюджетное учреждение здравоохранения «Городской клинический онкологический диспансер»;
• Государственное бюджетное учреждение здравоохранение «Научно-исследовательский институт-Краевая клиническая больница №1 им. С. В. Очаповского»;
• Бюджетное учреждение здравоохранения Воронежской области «Воронежское областное патологоанатомическое бюро»;
• Государственное бюджетное учреждение здравоохранения «Областной онкологический диспансер», г.Иркутск;
• Государственное бюджетное учреждение Рязанской области «Областной клинический онкологический диспансер»;
• Государственное бюджетное
учреждение здравоохранения Нижегородской области
«Нижегородский областной
клинический онкологический
диспансер»
ЗНАКОМЬТЕСЬ: РЕГИОНАЛЬНОЕ ОТДЕЛЕНИЕ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ АРХАНГЕЛЬСКОЙ ОБЛАСТИ
Архангельская область (неофициальный синоним: Помóрье) —
субъект Российской Федерации на
севере Европейской части России,
входящий в Северо-Западный федеральный округ. Архангельская
область является 8-м по территории субъектом Российской Федерации, а также крупнейшим регионом в европейской части России.
Административный центр области — город Архангельск.
По итогам 2021 года показатель заболеваемости злокачественными новообразованиями в Архангельской области – 494,3 случая на 100 тысяч населения. Для сравнения, в 2020 году – 475,7, в 2019 – 566,2. Первое место в структуре заболеваемости злокачественными опухолями занимают новообразования кожи (с меланомой), а вот на вторую позицию переместился рак молочной железы, оттеснив на третье место рак легкого, бронхов, трахеи. В отличие от заболеваемости, смертность от ЗНО остается объективным показателем. В нашем регионе она по-прежнему выше среднероссийских значений, но ниже, чем в предыдущие годы. Это говорит о качестве оказания специализированной медицинской помощи даже в условиях противоэпидемических ограничений. В структуре смертности первые три места занимают легкие, желудок и ободочная кишка. Традиционно выше среднероссийских в Архангельской области такой важный показатель работы онкологической службы, как верификация диагноза – 98,5 процента (в 2020 году – 97,5 процента). Региональное отделение Российского общества клинической онкологии (RUSSCO) Архангельской области было создано в ноябре 2012 г. и в настоящее время насчитывает 13 членов, среди которых онкологи, химиотерапевты, радиотерапевты, хирурги. Председателем регионального отделения является врач-онколог отделения лекарственной противоопухолевой терапии №2 ГБУЗ АО «Архангельский клинический онкологический диспансер», к.м.н. Дарья Михайловна Дубовиченко. Центром онкологической службы Архангельской области является ГБУЗ АО «Архангельский клинический онкологический диспансер». Коечный фонд диспансера составляет 340 коек круглосуточного стационара, а также 150 коек дневного стационара с двойным оборотом. Помимо онкологического диспансера, онкологическая служба в регионе оказывается в центрах амбулаторной онкологической помощи, созданных на базе городских больниц или поликлиник в г. Архангельск, г. Северодвинск и г. Котлас, благодаря чему специализированная медицинская помощь максимально приближена к жителям региона.

Онкологическая служба Архангельской области имеет многолетнюю историю. Оказание специализированной медицинской помощи началось с создания онкологического пункта в послевоенные годы. Тогда лечением населения занимались всего три врача, сейчас же в онкологическом диспансере работают 822 сотрудника, развернуто 24 отделения (клинических, в том числе дневные стационары, и диагностических). АКОД является многопрофильным учреждением здравоохранения III уровня, которое оказывает специализированную, в том числе высокотехнологичную, медицинскую помощь взрослому населению Архангельской области, а также является организационнометодическим центром для медицинских организаций области по профилю «онкология». Ежегодно в поликлинике амбулаторную медицинскую помощь получают более 60 тыс. человек, в круглосуточном и дневном стационаре лечение проходят около 18500 человек. Каждый год проводится более 5000 операций. В лечении используется весь спектр хирургических операций – от эндоскопических и лапароскопических до расширенных реконструктивно-пластических операций с резекцией нескольких органов. В 2021 году, благодаря участию Архангельской области в реализации национального проекта «Здравоохранение» и его программы «Борьба с онкологическими заболеваниями», продолжилось укрепление материально-технической базы онкологического диспансера. Было введено в эксплуатацию новое медицинское оборудование: два линейных ускорителя электронов, аппарат для брахитерапии, ангиографический аппарат, передвижной аппарат ингаляционной анестезии, два операционных стола, новый компьютерный томограф. Кроме того, в диспансере есть лаборатории, оснащенные медицинским оборудованием высочайшего уровня. Расширило свои возможности патологоанатомическое отделение. С целью повышения эффективности диагностики и дальнейшего противоопухолевого лечения в диспансере выполняется весь спектр гистологических, иммуногистохимических, а также молекулярно-генетических исследований. На базе диспансера организована кафедра лучевой диагностики, лучевой терапии и клинической онкологии Северного государственного медицинского университета (заведующий кафедрой д.м.н., профессор Вальков Михаил Юрьевич). Благодаря сотрудничеству диспансера и клинической кафедры университета, диспансер располагает собственными разработками в области эпидемиологии, профилактики, диагностики и лечения злокачественных новообразований.

У диспансера есть давняя традиция – дважды в год (традиционно в мае и декабре) проходит научно-практическая конференция «Оптимизация лечебно-диагностической тактики при онкологических заболеваниях», в которой принимают участие специалисты диспансера, а также представители ведущих научно-исследовательских институтов, центров, университетов и клиник России. Региональное отделение проводит международные, всероссийские, межрегиональные конференции и образовательные семинары, где врачи принимают активное участие не только как слушатели, но и являются активными участниками, выступая с докладами и разборами клинических случаев. Важно отметить вклад команды специалистов региона в подготовку серьезных научных событий, таких как ежегодный Российский онкологический конгресс, международный онкологический форум «Белые ночи», ежегодная конференции НМИЦ онкологии им. Н.Н. Петрова «Эволюция лекарственной терапии злокачественных новообразований» и др. Ежегодно проводятся онлайн-вебинары RUSSCO с участием специалистов нашего региона, а также сотрудников ведущих онкологических научных центров нашей страны.
Врачи-онкологи отделений лекарственной противоопухолевой терапии являются активными членами
RUSSCO, ESMO, ASCO.
Врачи Архангельского клинического онкологического диспансера
ежегодно публикуют свои научные
труды с описанием, разбором клинических случаев в российских и
европейских специализированных
журналах, сборниках тезисов к российским и международным конференциям.

Для успешной адаптации молодых
специалистов, проходящих ординатуру по онкологии на клинической
кафедре Северного государственного медицинского университета,
в Архангельском онкодиспансере
организована программа наставничества, в рамках которой врачи
диспансера проводят обучающие
семинары, лекции для молодых ординаторов. Ординаторы 1 и 2 года
обучения регулярно проходят практику в отделениях диспансера.
Врачи диспансера ведут ежедневные консультации/телемедицинские
консультации с районными больницами, центрами амбулаторной
онкологической помощи для подбора оптимальной тактики ведения
пациентов из отдаленных районов
нашего региона.
С 2022 года онкологический диспансер проводит дни открытых
дверей, направленные на профилактику и раннее выявление онкологических заболеваний у населения области. В 2022 году были
проведены акции по выявлению
онкогинекологических заболеваний, заболеваний молочной железы и кожи.

За прошедшие годы в Архангельской области создана эффективная система оказания онкологической помощи, которая сегодня
продолжает активно развиваться,
благодаря внедрению современных технологий. Архангельские
онкологи оправданно заслужили
авторитет среди ведущих отечественных и зарубежных ученых.
Архангельский клинический онкологический диспансер не первый год успешно проходит «внешний аудит», проводимый НМИЦ
онкологии им. Н.Н. Петрова.
Доступность эффективной онкологической помощи – это не
только наличие современной дорогостоящей аппаратуры и препаратов, грамотные специалисты и
четко выстроенная система маршрутизации пациентов. Не менее
важно, чтобы каждый человек
знал, когда и как он может и должен воспользоваться этими возможностями. Основной и ведущей
фигурой в борьбе со злокачественным заболеванием является сам
пациент. Своевременность и эффективность диагностики и лечения как минимум на 50 процентов
зависят от готовности человека
взять на себя ответственность за
свое здоровье.
Берегите себя и будьте здоровы!
ЛУЧ НАДЕЖДЫ — «А ВОТ БЫЛ У МЕНЯ СЛУЧАЙ», ИЛИ «ОХОТНИЧЬИ ЗАПИСКИ» ОНКОЛОГОВ
Автор: Фольц Эдуард Эдуардович
ЧУЗ КБ РЖД-Медицина г. Саратов, ГБОУ ВПО Саратовский ГМУ
им. В.И. Разумовского МЗ России, Саратов
Плоскоклеточный рак кожи – это
в большинстве случаев курабельная клиническая ситуация, когда
радикальное оперативное удаление очага может полностью излечить пациента без применения дополнительных методов. Но порой
запущенная опухоль может достигать пугающе больших размеров,
делая невозможным ее хирургическое удаление – и вот тогда на помощь может прийти волшебный
луч радиотерапевта.
Дело было 10 января 2022 года, когда пациент Т., 80 лет, военный пенсионер, обратился в наш центр для
дообследования и определения
дальнейшей тактики лечения по
поводу объемного болезненного
образования с признаками распада на правой кисти. С его слов, образование появилось 3 года назад,
когда летом он случайно уколол
кисть во время садовых работ, после чего появилось образование,
которое постепенно начало расти
и кровоточить. Позже появилась
и боль в области образования.
Обратился за медицинской помощью по месту жительства, где с его
слов ему предложили ампутацию
кисти, от чего пациент отказался
и уехал домой. В январе 2022 года
родственники привезли его за медицинской помощью в ЧУЗ КБ, где
он был осмотрен хирургом, и выставлен предварительный диагноз:
злокачественная опухоль мягких
тканей правой кисти. В анализах
крови от января 2022 года отмечена выраженная анемия (гемоглобин 55, эритроциты 2,5).
Цитологический анализ показал
наличие плоскоклеточного неороговевающего рака. По данным последующего обследования (рентгенография органов
грудной клетки, костей правой
верхней конечности, ФГДС, колоноскопия, УЗИ органов брюшной
полости и периферических лимфоузлов) признаков отдаленных
метастазов выявлено не было,
хотя обнаружены патологические
изменения в лимфоузлах в правой подмышечной зоне. Однако
цитологическое исследование
образования правой подмышечной области под контролем УЗИ
продемонстрировало доброкачественную гиперплазию лимфоидной ткани узла.
Онкоконсилиум от 18.01.2022 г.
рекомендовал проведение лучевой терапии после восстановления показателей крови. Пациенту
было проведено 3 гемотрансфузии эритроцитарной взвеси. ОАК
от 21.01.22: гемоглобин – 92 г/л,
явных противопоказаний к началу облучения больше не было.
Пациент был переведен в радиологическое отделение ЧУЗ КБ РЖД
г. Саратов для проведения курса
дистанционной лучевой терапии
на опухоль кожи правой кисти.
Была проведена КТ-топометрия,
3D-планирование конформной лучевой терапии. Совместно с медицинским физиком создан индивидуальный план лечения. Был начат
курс дистанционной лучевой терапии методом классического фракционирования, РОД – 2 Гр, суммарная доза по плану – 66 Гр.
Пациенту был полностью проведен
курс дистанционной лучевой терапии методом классического фракционирования в СОД 66 Гр, пациент
был выписан 21.03.2022 г. в удовлетворительном состоянии, без признаков анемии (гемоглобин 118 г/л,
эритроциты 4,6). Была рекомендована обработка зоны облучения раствором нитрофурала (фурацилина)
с последующим наложением 10%
метилурациловой мази в течение 4
недель. Контрольное обследование
рекомендовано через месяц с последующей явкой в радиологическое
отделение для оценки эффекта.
Со слов пациента: состояние удовлетворительное, жалоб нет. Чувствительность, функциональность
кисти не нарушены, болевых ощущений и дискомфорта при движении не отмечает. Качество жизни
не изменилось. Самостоятельно водит машину с лета, работает в саду.
Периодически обследуется по месту
жительства.
Итак, более раннее выявление опухолей кожи, когда возможно провести оперативное лечение или
близкофокусную рентгенотерапию
с минимальными лучевыми осложнениями, чрезвычайно важно. Но
даже наличие нерезектабельной
опухоли – это не повод для отчаяния. Плоскоклеточные раки кожи
действительно высокочувствительны к лучевой терапии, и радиотерапевтам точно не следует отказывать
подобным пациентам в лечении, поскольку шанс полностью ликвидировать опухоль очень высок.
Рисунок 1.
Вид опухоли
до начала ДЛТ. Опухоль
10,0x9,5x3,0 см с признаками распада, контактно
кровоточивая, резко болезненная при пальпации.
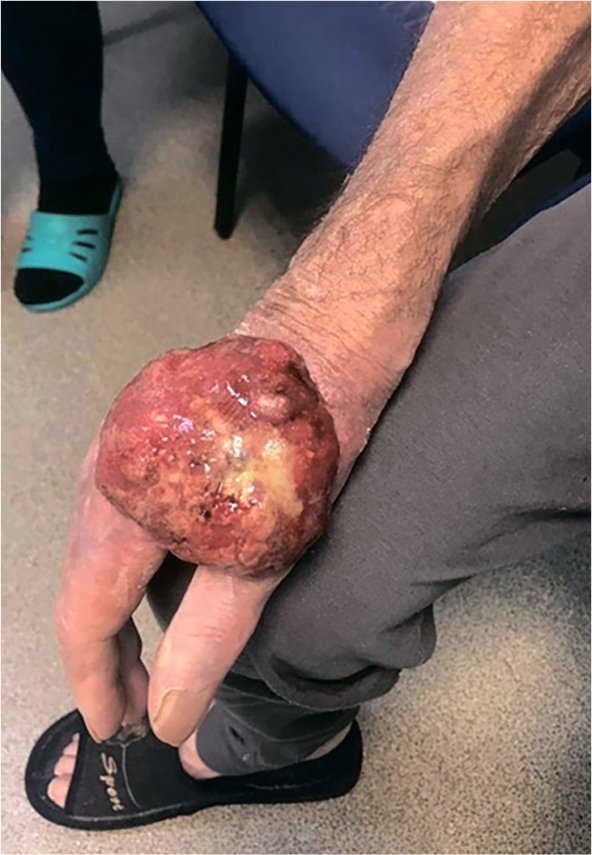
Рисунок 2.
Состояние после
16 сеансов ДЛТ
(СОД – 32 Гр).
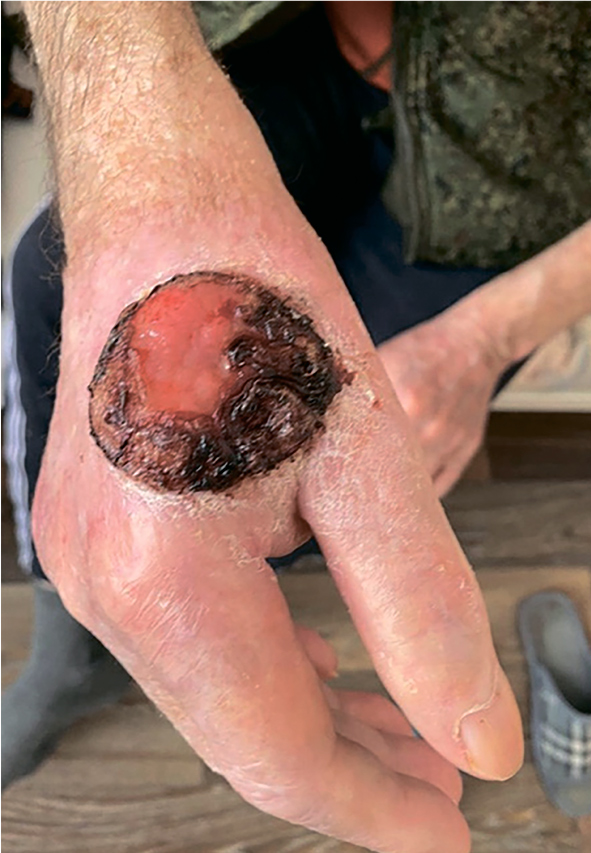
Рисунок 3.
Состояние
на момент окончания курса
ДЛТ (СОД – 66 Гр).
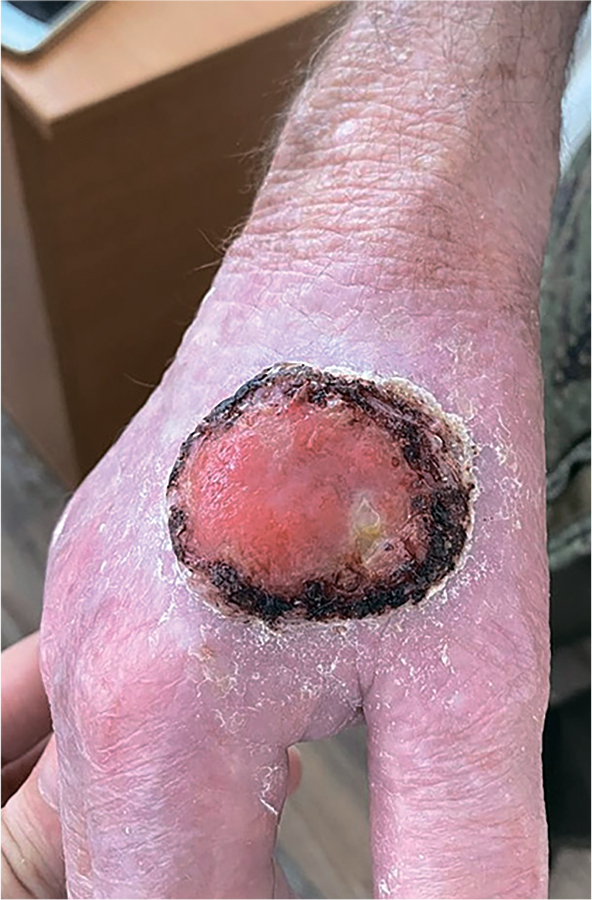
Рисунок 4.
11 месяцев после
курса ДЛТ
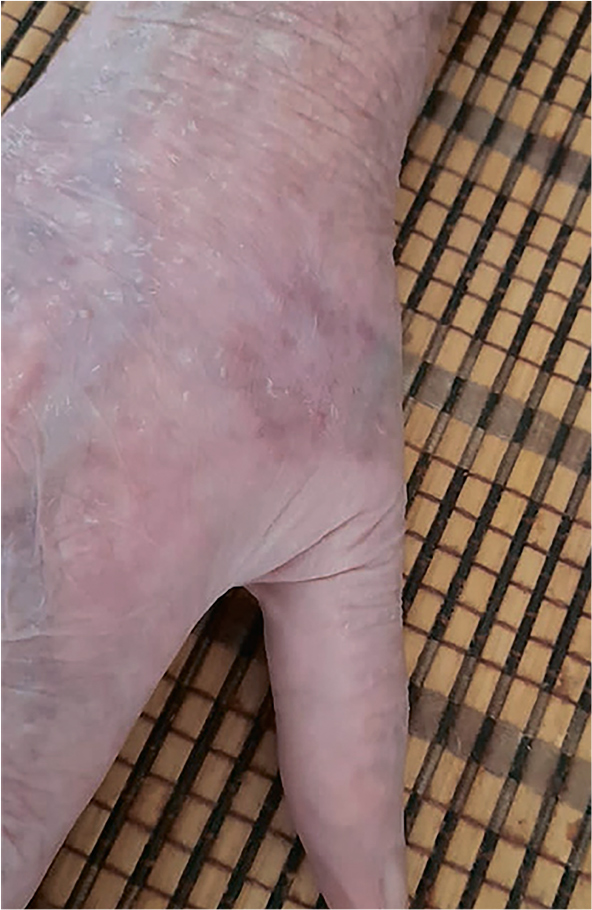
НЕТ, КОФЕ НЕ ДАСТ ВАМ ЛИШНЕЙ ЭНЕРГИИ. ОН ПРОСТО ДАСТ НЕМНОГО ВЗАЙМЫ – ЗА ЧТО ВЫ ЗАПЛАТИТЕ ПОЗЖЕ

Emma Beckett, старший преподаватель (предмет – пищевые науки и питание человека)
Школы науки об окружающей среде и жизни, Университет Ньюкасла, Австралия
Многие из нас мечтают (или,
лучше сказать, нуждаются?) об
утреннем кофе, который позволяет нам взбодриться и начать
день. В общей сложности люди в
мире выпивают более двух миллиардов чашек кофе ежедневно.
Вы наверняка думаете, что кофе
дарит вам энергию, чтобы пережить утро или день, – но далеко
не факт, что кофе дает так много,
как вы думаете.
Основным стимулятором в кофе
является кофеин. И основное
действие кофеина заключается в
изменении пути взаимодействия
клеток нашего мозга с соединением, называемым аденозином.
Я работал, я устал…
Аденозин является частью системы,
которая регулирует наш цикл сна и
бодрствования, и отчасти объясняет, почему высокий уровень активности приводит к усталости. Когда
мы занимаемся своими делами,
уровень аденозина повышается, поскольку он высвобождается как побочный продукт при использовании
энергии в наших клетках.
В конце концов аденозин связывается со своими рецепторами (участками клеток, которые принимают
сигналы), что заставляет клетки
функционировать медленнее, делая
нас более вялыми и сонливыми. Вот
почему мы чувствуем усталость после тяжелого рабочего дня. Пока
мы спим, потребление энергии падает, снижая уровень аденозина,
поскольку он снова превращается
в иные формы. Мы просыпаемся
утром, чувствуя себя отдохнувшими
– ну, конечно, если вы высыпаетесь.
Если вы все еще чувствуете сонливость, когда просыпаетесь, кофеин
может помочь на некоторое время.
Он связывается с рецептором аденозина (он имеет схожую конфигурацию), но он не настолько идентичен, чтобы приводить к запуску
сигнала замедления, как это делает
аденозин. Вместо этого он просто
блокирует рецепторы и не дает аденозину связываться с ним – это как
раз и предотвращает чувство сонливости.
Бесплатного проезда не бывает
Но есть одна загвоздка. Несмотря на то, что это небольшое приключение с кофеином вызывает бодрость, оно в большей степени связано с ощущением бодрствования, нежели с реальным притоком какой-либо новой энергии. Происходит это потому, что кофеин не будет связан с рецептором вечно, а аденозин, который он блокирует, никуда не делся. В конце концов, кофеин расщепляется, освобождает рецепторы – и весь тот накопившийся аденозин, который ждал своего часа, связывается, и чувство сонливости возвращается, да еще какое. Таким образом, «долг» кофеину всегда в конечном итоге должен быть погашен, и единственный реальный способ погасить его — это поспать.
Время решает все
Сколько свободного аденозина, который еще не присоединился к рецепторам, находится в вашем организме и насколько вы сонливы, как
следствие, повлияет на то, насколько
кофеин, который вы пьете, разбудит
вас. С кофе, который вы пьете позже в течение дня, когда у вас больше
сигналов сонливости, ваш организм
может чувствовать себя более бодрым.
Если конец дня близок, кофеин может затруднить засыпание перед
сном. «Полураспад» кофеина (время, которое требуется для расщепления половины его количества)
составляет около пяти часов. Тем
не менее, мы все усваиваем кофеин
по-разному, поэтому у некоторых
из нас эффект проходит быстрее.
Те, кто регулярно пьет кофе, могут
чувствовать меньший кофеиновый
«толчок», а толерантность к стимулятору со временем нарастает.
Кофеин также может повышать
уровень кортизола, гормона стресса, который делает вас более бдительными. Это может означать, что
кофеин более эффективен поздним
утром, поскольку естественный
рост кортизола наблюдается вскоре
после просыпания. По этой причине
эффект «кофе в постели» может показаться не таким сильным.
Если ваш любимый напиток с кофеином еще и сладкий, это может стимулировать или усугубить чувство
пике и краха: хотя сахар дает реальную энергию организму, свободные
сахара могут вызвать всплеск сахара
в крови, что затем, в период падения, вызывает чувство усталости.
Хотя нет доказанного вреда от употребления кофе натощак, кофе во
время или после еды может действовать медленнее. Это связано с тем,
что пища способна замедлять скорость усвоения кофеина.
Как насчет крепкого чая или
газированной колы?
Кофе, конечно, не единственный напиток с кофеином, который может
одолжить вам немного энергии. Кофеин в чае, энергетиках и других напитках таким же образом влияет на
организм. Но поскольку ингредиенты в основном имеют растительное
происхождение, каждый напиток с
кофеином содержит свой собственный профиль дополнительных соединений, которые могут иметь и собственное стимулирующее действие
или взаимодействовать с кофеином,
изменяя его эффект.
Кофеин может быть полезен, но это
не волшебство. Чтобы вырабатывать
энергию и заряжать ей наши тела,
нам в первую очередь нужно достаточно еды, воды и сна.
Источник:
theconversation.com/
nope-coffee-wont-give-you-extra-energyitll-just-borrow-a-bit-that-youll-payfor-later-197897 (переведено с английского).