Дорогие коллеги и друзья!
Февраль всё еще по-зимнему суров, но уже слышны первые робкие птичьи песни, всё настойчивее стук капель по козырькам подъездов, и солнце порой ощутимо припекает через оконное стекло....

Фредерик Уильям Бёртон, 1816-1900, ирландский художник-прерафаэлит.
«Халлелиль и Гильдебранд: встреча на лестнице башни» 1864. Холст, масло. Национальная галерея Ирландии, Дублин.
4 ФЕВРАЛЯ – ВСЕМИРНЫЙ ДЕНЬ БОРЬБЫ ПРОТИВ РАКА
4 февраля ежегодно отмечается Всемирный день борьбы против рака (World Cancer Day). Он был учрежден Международным противораковым союзом (International Union Against Cancer, UICC) с...
РЕГИОНЫ О СВОИХ ДОСТИЖЕНИЯХ: ОНЛАЙН-МЕРОПРИЯТИЕ RUSSCO, ПОСВЯЩЕННОЕ ВСЕМИРНОМУ ДНЮ БОРЬБЫ С ОНКОЛОГИЧЕСКИМИ ЗАБОЛЕВАНИЯМИ
Российское общество клинической онкологии (RUSSCO) 4 февраля организовало и провело своеобразную перекличку достижений российской онкологии, во время которой специалисты....

РЕГИОНАЛЬНОЕ ОТДЕЛЕНИЕ RUSSCO В РЕСПУБЛИКЕ САХА (ЯКУТИЯ)
Председатель якутского отделения RUSSCO, главный внештатный онколог МЗ РС(Я), зав. ОПЛТ ГБУ РС(Я) «ЯРОД», доцент кафедры онкологии МИ СВФУ, заслуженный врач РС(Я) Феодосия Гаврильевна...
СКРИНИНГОВЫЕ МЕТОДЫ ОБСЛЕДОВАНИЯ — ОПЫТ ГАУЗ СО «СВЕРДЛОВСКИЙ ОБЛАСТНОЙ ОНКОЛОГИЧЕСКИЙ ДИСПАНСЕР»
В структуре заболеваемости злокачественных новообразований многие годы лидируют несколько локализаций: по данным за 2020 год опухоли легких (11,1%), опухоли молочных желез (10,1%), кожи (9,8%), ободочной кишки (8,1%), предстательной железы (6,4%). Эффективность лечения напрямую зависит от своевременности выявления рака и может достигать до 90% при обнаружении на нулевой...

ИССЛЕДОВАНИЕ ECOG-АCRIN: УДАЛЕНИЕ ПЕРВИЧНОЙ ОПУХОЛИ У МЕТАСТАТИЧЕСКИХ БОЛЬНЫХ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ НЕ УЛУЧШАЕТ РЕЗУЛЬТАТЫ ЛЕЧЕНИЯ
На сайте Journal of Clinical Oncology появилась статья, подводящая итоги важного для клинической практики исследования ECOG-ACRIN [1]. Эти результаты подтверждают простую мысль, что в основе...
ПОДБИРАЕМ ОПТИМАЛЬНУЮ АДЪЮВАНТНУЮ ТЕРАПИЮ БОЛЬНЫМ ОПЕРАБЕЛЬНЫМ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ В ПОСТМЕНОПАУЗЕ
Крупные многоцентровые исследования, проведенные в последние годы, пытались определить кандидатов, выигрывающих от добавления адъювантной химиотерапии к адъювантной

ИМФИНЗИ
КАЖДЫЙ МЕСЯЦ ИМЕЕТ ЗНАЧЕНИЕ ПРИ ПРОВЕДЕНИИ ПЕРВОЙ ТЕРАПИИ рМРЛ

ПО СЛЕДАМ SABCS
Главная мировая конференция по раку молочной железы в этом году проходила в гибридном формате, поэтому обычно заполненные залы и набережная RIverwalk в Сан-Антонио были необычно...

КАДСИДА
В адъювантном режиме снижает риск развития рецидива HER2+ рРМЖ на 50%
НЕДАВНИЕ ПУБЛИКАЦИИ В КРУПНЫХ ЖУРНАЛАХ
Местнораспространенный плоскоклеточный рак полости рта всегда являлся камнем преткновения в плане выстраивания плана лечения для этой сложной категории больных. Вопрос об оптимальной последовательности методов пока остается спорным, но в клинических рекомендациях, как международных, так и отечественных, на 1 этапе приоритет отдан радикальному....

КОМБИНАЦИИ В ЭПОХУ ИММУНОТЕРАПИИ. НИ ДВА, НИ ПОЛТОРА?
Прогресс в области лечения злокачественных опухолей, достигнутый за последнее десятилетие, безусловен и очевиден. И так же безусловно и очевидно, что в большинстве своем он обусловлен...
АЛОФАНИБ, АЛЛОСТЕРИЧЕСКИЙ FGFR2 ИНГИБИТОР, В ЛЕЧЕНИИ МЕТАСТАТИЧЕСКОГО РАКА ЖЕЛУДКА, РЕЗИСТЕНТНОГО К СТАНДАРТНОЙ ТЕРАПИИ. РЕЗУЛЬТАТЫ РОССИЙСКОГО ИССЛЕДОВАНИЯ 1B ФАЗЫ RPT835GC1B
На симпозиуме GI ASCO 2022 в Сан-Франциско были представлены результаты клинического исследования, в котором впервые изучался оригинальный российский таргетный препарат в онкологии....

КОММЕНТАРИИ ЭКСПЕРТОВ
Результаты исследования для меня являются привлекательными. Посмотрите, 85,7% больных получали алофаниб после второй линии терапии метастатического рака желудка, то есть популяция была...

ОПУХОЛИ ЖКТ
Конференция RUSSCO

ТАГРИССО
Снижанет риск рецидива или смерти при НМРЛ IB-IIIA стадии с мутацией в гене EGFR на 80%
ОМСКОЕ РЕГИОНАЛЬНОЕ ОТДЕЛЕНИЕ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ (RUSSCO)
Первое заседание Омского регионального общества химиотерапевтов состоялось 23 февраля 2011 года, тогда на нем присутствовали 15 человек. В июле 2012 года диспансер с образовательными лекциями посетил председатель Общества онкологов-химиотерапевтов, заместитель директора по научной работе, заведующий отделением клинической фармакологии и химиотерапии РОНЦ им....
ИПИЛИМУМАБ В КОМБИНАЦИИ С НИВОЛУМАБОМ В СРАВНЕНИИ С ХИМИОТЕРАПИЕЙ В ПЕРВОЙ ЛИНИИ ЛЕЧЕНИЯ МЕЗОТЕЛИОМЫ ПЛЕВРЫ. ОБНОВЛЕННЫЕ РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ CHECKMATE 743
2 февраля 2022 г. в журнале Annals of Oncology были опубликованы результаты исследования CheckMate 743, рандомизированного исследования 3 фазы, основной задачей которого было изучение эффективности комбинации ипилимумаба и ниволумаба в сравнении с химиотерапией в первой линии лечения мезотелиомы плевры. В исследование были включены пациенты с первично...

ИТУЛСИ
Сила которой можно доверять

ASCO GI 2022: НОВОСТИ СИМПОЗИУМА
В январе 2022 года в комбинированном (очно и онлайн) формате прошел очередной ежегодный симпозиум ASCO GI 2022. В ходе прошедшего мероприятия были представлены результаты более 650...

ДИСКУССИОННАЯ СЦЕНА: ПЕРВИЧНАЯ ЦИТОРЕДУКЦИЯ ИЛИ НЕОАДЪЮВАНТНАЯ ХИМИОТЕРАПИЯ ПРИ РАСПРОСТРАНЕННОМ РАКЕ ЯИЧНИКОВ
Биологические особенности рака яичников дают ему «суперспособность» к раннему и быстрому распространению по брюшной полости. Это, а также отсутствие программ ранней диагностики,

СИМУЛЬТАННЫЙ ИНТЕГРИРОВАННЫЙ БУСТ (SIB): ОТ ИННОВАЦИИ К РУТИННОЙ ПРАКТИКЕ...
Методика дистанционной лучевой терапии с модуляцией интенсивности (IMRT) в настоящее время широко применяется в лечении целого ряда онкологических заболеваний, демонстрируя...

КОММЕНТАРИЙ ЭКСПЕРТА
Безусловно, тема крайне актуальна для радиотерапевта. Сама по себе технология лучевой терапии IMRT/VMAT позволила существенно снизить лучевое воздействие, и, соответственно, токсичность на...

КЛИНИЧЕСКИЙ СЛУЧАЙ ТЕРАПИИ BRAF-ПОЗИТИВНОГО РАКА ЛЕГКОГО ПРИ ПРОГРЕССИРОВАНИИ ОПУХОЛЕВОГО ПРОЦЕССА
BRAF представляет собой серин/ треониновую протеинкиназу, которая играет важную роль в сигнальном пути RAS-RAF-MEK-ERK (MAPK). Активация этого пути передает внеклеточные сигналы в клетку...

КИТРУДА
Препарат Китруда - единственный PD-1 ингибитор, увеличивающий общую выживаемость у пациентов с распространенным ТНРМЖ. в комбинации с XT
НЕДАВНИЕ ПУБЛИКАЦИИ В КРУПНЫХ ЖУРНАЛАХ: ТРИЖДЫНЕГАТИВНЫЙ РАК МОЛОЧНОЙ ЖЕЛЕЗЫ И РАК ЯИЧНИКОВ
10 февраля 2022 г. в журнале The New England Journal of Medicine опубликованы результаты исследования 3 фазы KEYNOTE-522 [1], посвященного изучению пембролизумаба в комбинации с неоадъювантной химиотерапией (НАХТ) при раннем раке молочной железы с тройным негативным фенотипом (ТН РМЖ). ...

ПОДДЕРЖИВАЮЩАЯ ТЕРАПИЯ В ОНКОЛОГИИ
VIII РОССИЙСКАЯ КОНФЕРЕНЦИЯ
АТЕЗОЛИЗУМАБ ПРИ РАКЕ МОЛОЧНОЙ ЖЕЛЕЗЫ: ВЗЛЕТЫ, ПАДЕНИЯ – ЧТО ДАЛЬШЕ?
Атезолизумаб - гуманизированное моноклональное антитело, предназначенное для связывания с PD-L1, экспрессируемым на опухолевых клетках и инфильтрирующих опухоль иммунных клетках, и блокирования его взаимодействия с рецепторами PD-1 и B7.1. То есть, атезолизумаб способствует прекращению опосредованного PD-L1/ PD-1 подавления иммунного ответа и вызывает реактивацию...

10 ЛЕТ НАЦИОНАЛЬНОЙ ПРОГРАММЕ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ
СОВЕРШЕНСТВОВАНИЕ МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКОЙ ДИАГНОСТИКИ В РОССИЙСКОЙ ФЕДЕРАЦИИ
Анонс
-

25 -26 марта 2022
конференция RUSSCO ОНКОЛОГИЯ
-

15 -16 апреля 2022
конференция RUSSCO ОПУХОЛИ ЖКТ
-

28 -29 апреля 2022
конференция RUSSCO ОНКОУРОЛОГИЯ
-

19 -20 мая 2022
VIII РОССИЙСКАЯ КОНФЕРЕНЦИЯ ПОДДЕРЖИВАЮЩАЯ ТЕРАПИЯ В ОНКОЛОГИИ
Дорогие коллеги и друзья!
Февраль всё еще по-зимнему суров, но уже слышны первые робкие птичьи песни, всё настойчивее стук капель по козырькам подъездов, и солнце порой ощутимо припекает через оконное стекло. Февраль закрывает календарную зиму – а наша научная и практическая активность начинает набирать обороты. Уже позади три большие конференции RUSSCO – «Меланома», «Рак молочной железы» и «Рак легкого», несколько образовательных семинаров и вебинаров. Увы, неотступный ковид вновь заставил нас перейти в онлайн режим – но это не повод для уныния. Масштабная акция, организованная RUSSCO и посвященная Всемирному дню борьбы с онкологическими заболеваниями, которая состоялась 4 февраля в формате телемоста, именно в онлайн режиме объединила специалистов из различных регионов России, позволив нам узнать о достижениях в организаторской сфере и практической деятельности онкологов. В этом номере – более подробная информация о телемосте 4 февраля, в том числе на примере наших коллег из Якутии.
Мы продолжаем знакомить вас с региональными отделениями RUSSCO, и несколько страниц февральского номера отданы нашим коллегам из Омска.
Приглашаем вас пофилософствовать на тему спорных вопросов онкологии с Николаем Владимировичем Жуковым в разделе «Размышления в отрыве от рутины», мысленно проголосовать в пользу того или иного подхода в лечении первичного распространенного рака яичников на «Дискуссионной сцене» или просто ознакомиться с новостями последних исследований с симпозиума ASCO GI 2022 и недавних публикаций крупных журналов.
Февраль – это еще и День Святого Валентина, и ожидание новой Весны. Пусть приближающаяся весна не будет поздней, растопит снеговые горы на улицах наших городов, одарит разноцветьем первых тюльпанов, согреет душу и подарит любовь и надежду на лучшее!
Команда RUSSCO
Фредерик Уильям Бёртон, 1816-1900, ирландский художник-прерафаэлит.
«Халлелиль и Гильдебранд: встреча на лестнице башни» 1864. Холст, масло.
Национальная галерея Ирландии, Дублин.

4 ФЕВРАЛЯ – ВСЕМИРНЫЙ ДЕНЬ БОРЬБЫ ПРОТИВ РАКА
4 февраля ежегодно отмечается
Всемирный день борьбы против рака (World Cancer Day).
Он был учрежден Международным противораковым союзом (International Union Against
Cancer, UICC) с целью привлечения внимания мировой общественности к этой глобальной
проблеме. Всемирный день борьбы против рака – это поистине
масштабная инициатива, в рамках которой весь мир может объединиться в стремлении найти
наиболее эффективные пути профилактики, диагностики и лечения этой патологии, считавшейся смертельной на протяжении
столетий. Крайне необходимы
не только объединенные усилия
различных онкологических сообществ, но и их поддержка государством и обществом, чтобы борьба
с раком оставалась приоритетом в
мировой повестке дня в области
здравоохранения и развития.
Ежегодно Всемирный день борьбы против рака имеет свою тему. В
2022 году он проводится под девизом: «Создайте будущее без рака.
Время действовать сейчас», призывая осмыслить то, что может
сделать каждый в борьбе против
этой болезни и внести свой вклад
в кампанию против рака.
РЕГИОНЫ О СВОИХ ДОСТИЖЕНИЯХ: ОНЛАЙН-МЕРОПРИЯТИЕ RUSSCO, ПОСВЯЩЕННОЕ ВСЕМИРНОМУ ДНЮ БОРЬБЫ С ОНКОЛОГИЧЕСКИМИ ЗАБОЛЕВАНИЯМИ
Российское общество клинической онкологии (RUSSCO) 4 февраля организовало и провело своеобразную перекличку достижений российской онкологии, во время которой специалисты из Хабаровска, Якутска, Екатеринбурга, Самары, Пятигорска, Ярославля и Москвы в онлайн-формате поделились с коллегами и представителями средств массовой информации своим передовым опытом в различных направлениях борьбы с онкологическими заболеваниями.
Телемост вели:
Игорь Евгеньевич Хатьков, главный внештатный специалист-онколог Депздрава Москвы, директор ГБУЗ «Московский клинический научно-практический центр им. А.С. Логинова ДЗМ», член-корр. РАН, профессор, и Сергей Алексеевич Тюляндин, председатель RUSSCO, главный научный сотрудник ФГБУ «НМИЦ онкологии им. Н.Н. Блохина», профессор.
Началась перекличка с Хабаровска. Главный врач КГБУЗ «Краевой клинический центр онкологии» МЗ ХК Евгений Петрович Шапиро рассказал о том, что внедрение в Хабаровском крае инновационных технологий лучевой терапии в рамках национального проекта позволили не только снизить напряженность в процессе лечения пациентов в крае, но и, благодаря ОМС, обеспечить возможность пользоваться современным оборудованием жителям близлежащих регионов: Приморского края, Сахалинской области и др.
Председатель якутского отделения RUSSCO, главный внештатный онколог МЗ РС(Я), зав. ОПЛТ ГБУ РС(Я) «ЯРОД», доцент кафедры онкологии МИ СВФУ, заслуженный врач РС(Я) Феодосия Гаврильевна Иванова сообщила о результатах реализации регион-специфичного скринингового проекта в Республике Саха (Якутия), отметив следующее: «Несмотря на огромные расстояния, сложные климатические условия и бездорожье (44% всей площади), нам удалось за 2 года охватить скринингом большинство арктических районов республики, куда по земле можно добраться только зимой. И это несмотря на ковидные ограничения».
Опытом работы Свердловского областного онкологического диспансера поделился зам. главного врача по медицинской части ГБУЗ СО СООД Евгений Александрович Киселев. Из его сообщения слушатели узнали об эффективности скрининговых методов обследования в регионе.
Особенное внимание уральские специалисты уделяют выявлению рака прямой и ободочной кишки (16% всех ЗНО в области). Доходчиво – на небольших цифрах затрат на скрининг и огромных на лечение (от 80 тыс. руб. – 2 стадия, до нескольких миллионов руб. – поздние стадии) – он объяснил значимость начатых обследований.
Продолжила перекличку достижений Самара. Татьяна Геннадьевна Золотарева, председатель регионального отделения RUSSCO, зам. главного врача по медицинской профилактике, реабилитации и связям с общественностью ГБУЗ «Самарский областной клинический онкологический диспансер», доцент кафедры онкологии ФГБccОУ ВО СамГМУ, не без профессиональной гордости поделилась 20-летним опытом профилактической работы по формированию онкологической настороженности населения в Самарской области. В частности, она сказала: «Мы одни из первых в стране еще в 2011 году открыли «Школу пациентов», где проводим для своих подопечных работу по разъяснению того, как даже при существующем заболевании можно добиться повышения качества жизни».

«Новейшее радиологическое оборудование, полученное нами в прошлом году, сразу же позволило улучшить результаты лечения пациентов Пятигорского онкодиспансера: врачи избавились от проблем, связанных с проведением исследований и радиотерапевтических процедур, а больные теперь могут получать их непосредственно в своем регионе», – сказал в своем выступлении Марк Сергеевич Сердюков, врач-радиолог ГБУЗ СК «Пятигорский онкологический диспансер».
О новых технологиях этапной диагностики и ведения больных с ранним раком желудка в Ярославской области доложил зав. отделением диагностической и оперативной эндоскопии ГБУЗ Ярославской области «Областная клиническая онкологическая больница», профессор кафедры хирургии ИПДО ЯГМУ Сергей Владимирович Кашин. По его словам, профессиональные контакты с японскими коллегами позволили за 10 лет подготовить 15 высокопрофессиональных российских специалистов, умеющих проводить эндоскопические исследования и операции. И теперь уже они делятся своим опытом с коллегами со всей страны, проводя в Ярославле показательные мастерклассы.
Завершилась перекличка выступлением члена Правления RUSSCO, зам. директора ГБУЗ «Московский клинический научно-практический центр им. А.С. Логинова ДЗМ» Людмилы Григорьевны Жуковой. Из него, в частности, слушатели узнали о новых подходах к терапии HR+/HER2- метастатического рака молочной железы в реальной практике в г. Москва. Приведенные данные ярко проиллюстрировали высокие результаты, достигнутые в лечении, например, удалось добиться того, что у пациентов на год увеличилась продолжительность жизни и на этот же срок стало возможным откладывать назначение химиотерапии.
Подводя общий итог мероприятия, И.Е. Хатьков, поблагодарил Российское общество клинической онкологии и его председателя С.А. Тюляндина за уникальную возможность обмена опытом, когда специалисты из регионов могут рассказать коллегам и всем, кого касается тема борьбы с онкологическими заболеваниями, о своих достижениях.
«То, что мы услышали сегодня, те данные, которые продемонстрировали регионы, подтверждают безусловную необходимость проведения подобных телемостов и в будущем», – сказал Игорь Евгеньевич.
А Сергей Алексеевич, отметив, что благодаря телемосту вся страна узнала о региональных свершениях в онкологии, заострил внимание на сообщениях коллег о скрининговых программах.
«Почему бы нам не организовать в рамках ближайшего Российского онкологического конгресса специальную сессию, где специалисты из регионов смогут более полно и подробно рассказать о своих проектах, проблемах и достижениях», – резюмировал председатель Российского общества клинической онкологии.
РЕГИОНАЛЬНОЕ ОТДЕЛЕНИЕ RUSSCO В РЕСПУБЛИКЕ САХА (ЯКУТИЯ)
Председатель якутского отделения RUSSCO, главный внештатный онколог МЗ РС(Я), зав. ОПЛТ ГБУ РС(Я) «ЯРОД», доцент кафедры онкологии МИ СВФУ, заслуженный врач РС(Я) Феодосия Гаврильевна Иванова сообщила о результатах реализации регионспецифичного скринингового проекта в Республике Саха (Якутия), отметив следующее: «Несмотря на огромные расстояния, сложные климатические условия и бездорожье (44% всей площади), нам удалось за 2 года охватить скринингом большинство арктических районов республики, куда по земле можно добраться только зимой, и всё это несмотря на ковидные ограничения».
Около 15 тысяч якутян стали участниками скринингового проекта «Онкопоисксаха.рф», стартовавшего в республике осенью 2020 года. Удобство программы, позволяющей выявлять людей с повышенным онкологическим риском, за это время успели оценить жители разных районов Якутии.
- Число участников проекта «Онкопоисксаха.рф» растет. Чем можно объяснить такую востребованность?
- Прежде всего, тем, что это действительно удобная и эффективная программа, которая была разработана специалистами нашего диспансер совместно с Минздравом РС (Я) в рамках нацпроекта «Здравоохранение». Это веб-программа, в которую можно зайти из любого компьютера и средств мобильной связи, а значит, воспользоваться ею может каждый. Пользователям необходимо зарегистрироваться и пройти анкетирование, которое позволяет выявить людей из групп риска, тех, кто нуждается в целенаправленном обследовании. Цель проекта – как можно раньше выявить рак и начать его адекватное лечение.
В то же время проект является регион-специфическим - он адаптирован к региональным особенностям Якутии. Для этого нами были выбраны 6 основных видов рака, которые являются ведущими причинами смертности населения региона: рак легкого, печени, молочной железы, колоректальный рак, а также злокачественные новообразования шейки матки (у женщин) и предстательной железы (у мужчин). Доказано, что именно при этих опухолях применение скрининговых технологий особенно эффективно.
- Что происходит, если оказывается, что человек, прошедший анкетирование, в группе риска?
- Ему предлагают пройти высокоточное обследование на базе Якутского республиканского онкологического диспансера. Это основные лабораторные и инструментальные исследования, УЗИ-диагностика, низкодозная компьютерная томография и т.д. При этом, дату и время посещения клиники человек выбирает сам. От него требуется лишь согласие.
- Кто чаще пользуется приложением: жители Якутска или районов?
- Мы видим, что сегодня его используют везде, даже там, где Интернет не очень хороший. Если наши специалисты видят, что человек зарегистрировался, но по каким-то причинам не смог заполнить анкету, то они подключаются, звонят и предлагают пройти анкетирование по телефону. Более того, углубленное обследование после анкетирования теперь можно пройти не только на базе ЯРОД. Мы открыли филиалы этого проекта в Мирнинской, Хангаласской, Алданской ЦРБ, так что при необходимости обследование проводится на их базе, а это удобнее для населения – не нужно ехать в Якутск. В 2022 году планируем открыть такие филиалы еще в 8 ЦРБ. Так что, можно сказать, «Онкопоисксаха.рф» завоевывает все новые районы.

- Что показали первые полтора года реализации проекта? О каких результатах уже можно говорить?
- За это время на платформе https:// онкопоисксаха.рф анкетирование прошли около 15000 человек. Проведено 9496 исследований. При этом нередко нам действительно удавалось обнаружить рак на 1-2 стадии или на стадии предрака. И это очень обнадеживающий итог, если учесть, что ожидаемый результат проекта – достижение таких целевых индикаторов регионального проекта «Борьба с онкологическими заболеваниями в Республике Саха (Якутия)», как увеличение доли злокачественных новообразований, выявленных на ранних стадиях и снижение смертности от рака. Ежегодно в Якутии выявляется более 2 тысяч больных со злокачественными новообразованиями. К сожалению, примерно половина случаев – это опухоли на 3-4 стадии. Проект «Онкопоиск» реально помогает распознавать рак на ранних стадиях, когда болезнь протекает еще бессимптомно. Более того, мы надеемся, что реализация проекта поможет усовершенствовать проведение диспансеризации в медицинских организациях по выявлению онкозаболеваний, и позволит распространить наш опыт на другие регионы Российской Федерации.

- Не так давно в Якутии стали создаваться кабинеты онкоскрининга. Кто может ими воспользоваться?
- Каждый. Такие кабинеты мы создаем совместно с медицинскими организациями первичного звена для активного и раннего выявления злокачественных новообразований. Каждый посетитель проходит там специальное анкетирование - мы разработали его специально для таких кабинетов на базе программы Microsoft Access, который также как и портал онкопоисксаха.рф автоматически высчитывает высокий фактор риска развития рака, то медицинский работник сразу записывает человека на определенные исследования. В 2021 году были открыты 20 кабинетов онкоскрининга на базе поликлиник и ЦРБ. Анкетирование в них прошли более 14000 человек, анализы на онкомаркеры сдали около 5000 человек. При этом выявлено достаточное количество злокачественных новообразований на ранних этапах. Так что уже можно говорить, что это достаточно эффективный инструмент выявления злокачественных патологий.
- Удается ли выезжать в районы, чтобы на месте обследовать население отдаленных наслегов?
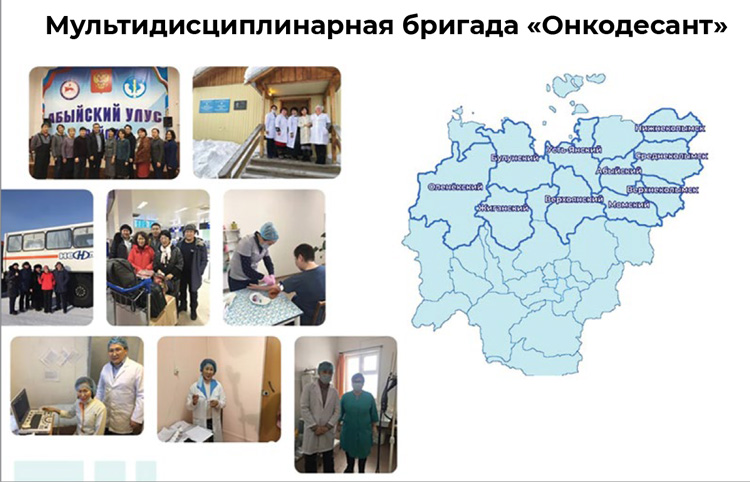
- Да, выездная работа онкодиспансера продолжается. Пандемия коронавируса ее, конечно, осложнила, но не смогла остановить совсем. Обследование населения мы проводим с учетом всех противоэпидемических требований и стараемся выезжать между вспышками инфекции. Все наши медики вакцинированы. Мобильная мультидисциплинарная онкобригада «Онкодесант» добирается до самых отдаленных районов республики и труднодоступных наслегов. В составе бригады онкогинеколог, онкохирург, маммолог, эндоскопист, врач УЗИ, медсестра для забора анализов на онкомаркеры.
Несмотря на все сложности, в 2021 году Онкодесант успел посетить 12 районов, в том числе 5 арктических: Среднеколымский, Жиганский, Верхоянский, Оленекский, Булунский. Побывали наши медики и в Чурапчинском, Кобяйском, Намском, Верхневилюйском, Сунтарском, Нюрбинском и Томпонском районах. В 2022 году планируем посетить еще 12 районов.
Сегодня уже можно говорить со всей определенностью: все эти скрининговые программы дают хороший эффект. За последнее время по их совокупным результатам рак был установлен у 110 пациентов. Но самое главное, они позволяют выявлять ранние стадии, когда болезнь можно полностью вылечить. Все, что требуется от населения - это воспользоваться предлагаемыми возможностями! И понять, что современный человек – тот, кто ответственно относится к собственному здоровью.
Якутский республиканский онкологический диспансер в рамках Года здоровья в Якутии продолжает внедрять проект «Онкопоиск», включающий в себя 3 раздела.
Первым разделом является внедрение и тиражирование регионспецифического скринингового портала «Онкопоисксаха.рф», суть которого заключается в том, что любой житель нашей республики может зарегистрироваться на портале и пройти анкетирование по 6 видов злокачественных новообразований в зависимости от возраста и пола анкетируемого. По результатам анкетирования при выявлении высокого риска развития злокачественного процесса, пациенту система предлагает самостоятельно записаться на исследование в удобное для него время.
Скрининг направлен на выявление 6 видов рака – это рак легкого, печени, молочной железы, шейки матки, предстательной железы и колороректального рака, которые являются основными причинами смертности от злокачественных новообразований на территории нашей республики.
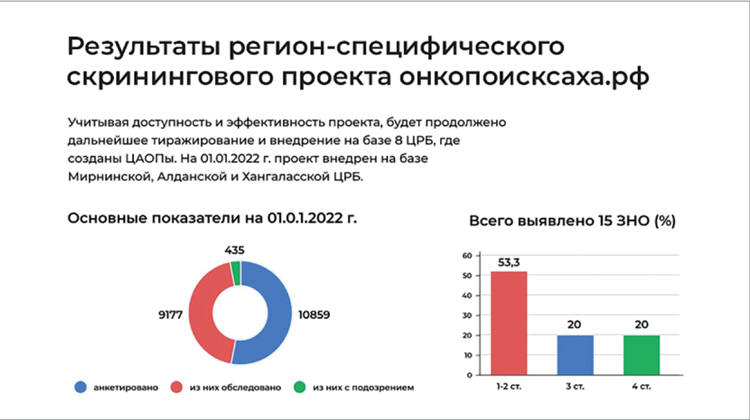
Таким образом, с августа 2020 года по 01.01.2022 года прошли анкетирование 10859 человек, из них прошли клинико-лабораторные исследования 9177 человек, по результатам которого с подозрением на рак направлены на дообследование в онкодиспансер 435 человек, выявлено 15 случаев рака, 53,3% которого составили 1-2 стадии заболевания.
Вторым проектом является открытие кабинетов онкоскрининга в поликлиниках медицинских организаций нашей республики. На сегодняшний день кабинеты онкоскрининга развернуты в 20 медицинских организациях, в том числе в 15 районах республики.
В кабинетах также проводится идентичное анкетирование по 6 основным нозологиям, как в платформе онкопоисксаха.рф, с этой целью онкодиспансером разработана платформа на программном комплексе Microsoft Access, что позволяет работать в off-line режиме и организовать целевые медосмотры по индивидуальному графику.
С февраля 2021 года по 01.01.2022 года анкетирование прошли 8545 человек, из них обследованы 4697 человек, в результате 1168 человек направлены к врачу онкологу, выявлено 34 случая рака, в 52,9% - на 1-2 стадиях заболевания.
Также онкологический диспансер совместно с медицинскими организациями первичного звена продолжает усовершенствовать работу по активному и раннему выявлению злокачественных новообразований. Так, свою эффективность показала выездная работа диспансера. За 2021 год было проведено 12 выездов, в том числе в 5 арктических районах, и за 2 года мы осмотрели население 10 арктических районов. В этом году при благоприятной эпидемиологической обстановке планируем выехать в Аллаиховский, Анабарский и Эвено-Бытантайский районы.
Мобильная мультидисциплинарная онкобригада «Онкодесант» в составе врачей онкогинекологов, онкохирургов, маммологов, эндоскопистов и врачей УЗИ ежегодно выезжает в самые отдаленные и труднодоступные районы республики. За 2021 год в 12 районах всего осмотрено 2014 человек, из них направлены в ЯРОД для дообследования 129 человек, выявлено 17 случаев рака.
Подводя итоги реализации проекта «Онкопоиск», подчеркнём, о том, что данный проект является успешным. Так, анкетирование прошли более 23 тысяч человек, из них обследованы около 15000 человек, углубленное обследование прошли около 2500 человек, и установлено 110 случаев злокачественного процесса, 47,3 % выявлены на ранней стадии заболевания. Более того, выявлено 170 случаев предраковых заболеваний, части пациентов проведено лечение, а часть пациентов оставлено под строгим динамическим контролем.
Индикатором эффективности
скрининговых программ, по данным ВОЗ, считается выявление 1
случая рака из 600 осмотренных
людей.
СКРИНИНГОВЫЕ МЕТОДЫ ОБСЛЕДОВАНИЯ — ОПЫТ ГАУЗ СО «СВЕРДЛОВСКИЙ ОБЛАСТНОЙ ОНКОЛОГИЧЕСКИЙ ДИСПАНСЕР»
В структуре заболеваемости злокачественных новообразований многие годы лидируют несколько локализаций: по данным за 2020 год опухоли легких (11,1%), опухоли молочных желез (10,1%), кожи (9,8%), ободочной кишки (8,1%), предстательной железы (6,4%). Эффективность лечения напрямую зависит от своевременности выявления рака и может достигать до 90% при обнаружении на нулевой или первой стадии. Поскольку на раннем этапе симптоматически опухоли себя не проявляют, рабочей группой Свердловского областного онкологического диспансера было принято решение на своей базе проводить скрининговые программы среди населения из группы риска.
Так как чаще злокачественным онкопатологиям (ЗНО) подвержены люди старше 40 лет, главным критерием отбора стал возраст участников. На первом этапе онкоскрининга проводится анкетирование, оно позволило прицельно сформировать группы для обследования с учетом определенных рисков: наследственного фактора, длительного влияния окружающей среды, воздействия вредных условий работы, наличия симптоматики, характерной для ЗНО.
По результатам второго этапа в 2020 году отбор прошли 556 человек. На третьем этапе им провели ряд обследований: общий анализ крови, ЭКГ, экспресс-исследование кала на скрытую кровь иммунохромотографическим методом, осмотр-онколога для выявления опухолей видимых локализаций, цитологическое исследование мазка с шейки матки, маммографию, ультразвуковое исследование органов брюшной полости, компьютерную томографию органов грудной клетки, фиброколоноскопию под внутривенным наркозом. У 113 обследуемых (20,3%) выявили предопухолевые патологии, у 13 (2,3%) – злокачественные новообразования.
Стоимость обследования 556 пациентов составила 3.439.296 руб. при средней стоимости обследования одного пациента − 6185 руб. При этом необходимо уточнить, что средняя стоимость лечения рака первой стадии составляет 80.000 руб., рака второй и третьей стадии − 1.000.000 руб. Стоимость одного курса таргетной терапии при лечении рака четвертой стадии варьируется от 100 тыс. до 800 тыс. руб. Курс повторяется один раз в тричетыре недели. Стоимость терапии в течении года − от 1.200.000 руб. до 13.600.000 руб.
На основании опыта ГАУЗ СО
«СООД с уверенностью можно
сказать, что онкоскрининг это
эффективный комплекс мероприятий, который позволяет выявить
бессимптомное течение онкологических заболеваний.
ИССЛЕДОВАНИЕ ECOG-АCRIN: УДАЛЕНИЕ ПЕРВИЧНОЙ ОПУХОЛИ У МЕТАСТАТИЧЕСКИХ БОЛЬНЫХ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ НЕ УЛУЧШАЕТ РЕЗУЛЬТАТЫ ЛЕЧЕНИЯ
Автор: С.А.Тюляндин
Председатель Российского общества клинической
онкологии, Москва
На сайте Journal of Clinical Oncology появилась статья, подводящая итоги важного для клинической практики исследования ECOG-ACRIN [1]. Эти результаты подтверждают простую мысль, что в основе принятия наших клинических решений должны лежать не личные представления о лучшем методе лечения, а научно обоснованные данные. Часто у метастатических больных раком молочной железы с хорошим противоопухолевым эффектом на первой линии мы обсуждали возможность выполнения удаления опухоли молочной железы с подмышечной лимфаденэктомией. Чаще всего я ратовал за выполнение хирургического пособия, предполагая, что удаление первичной опухоли сможет уменьшить шанс продолжения ее метастазирования и локального прогрессирования. К такому решению подталкивали несколько ретроспективных исследований, свидетельствующих, что выполнение операции у метастатических больных приводит к увеличению общей выживаемости [2,3]. Критически относясь к результатам ретроспективных исследований (в группу больных с операцией попадали больные более молодого возраста с меньшим распространением болезни и лучшим прогнозом в отличие от неоперированных больных), нельзя было игнорировать турецкое исследование, в котором больные изначально рандомизировались на проведение химиотерапии или выполнение операции с последующей химиотерапией [4]. В этом исследовании 40-месячная общая выживаемость составила 70% в группе оперированных и 55% в группе получавших химиотерапию с достоверным снижением относительного риска прогрессирования на 34%. Правда, два последующих рандомизированных исследования, проведенных в Индии и Австрии, не подтвердили целесообразность выполнения операции [5,6]. И вот перед нами результаты исследования из США от авторитетной кооперированной группы [1]. Они отказались от рандомизации и выполнения операции на первом этапе, посчитав, что вряд ли локорегиональное лечение улучшит результаты больных с агрессивным течением и резистентностью к химиотерапии. Поэтому в исследование ECOG-ACRIN, как и в индийском, включались больные, которым была проведена системная терапия (химиотерапия, эндокринотерапия, анти-HER2 терапия) в течение 18-32 месяцев и отсутствовали признаки прогрессирования болезни, при этом выполнение удаления опухоли было технически возможным. Больные рандомизировались в группы операции (мастэктомия или органосохранная операция, подмышечная лимфаденоэктомия или биопсия сторожевых лимфоузлов) или продолжения системной терапии. Лучевая терапия оперированным назначалась согласно существующим рекомендациям на основании распространенности опухоли. В группе химиотерапии разрешалось выполнять при показаниях паллиативную мастэктомию. Основным критерием эффективности была общая выживаемость. В исследование было включено 256 больных с медианой возраста 56 лет, из них 36% сохраняли менструальный цикл на момент постановки диагноза. Люминальный фенотип был зарегистрирован у 60%, HER2-позитивный – у 32%, тройной негативный – у 8% пациенток. У 48% больных имелись множественные метастазы, только висцеральные – у 12%, только костные – у 38%, распространенность T1-3N0-1 и Т4 или N2-3 – по 50%. Только эндокринотерапию получали 31% пациенток, только химиотерапию – 27%, комбинацию химиотерапии с последующей гормонотерапией – 10% и анти-HER2 терапию – 32%. Из 125 больных, рандомизированных в группу хирургии, операция была выполнена у 107 (86%) больных: мастэктомия у 75 и органосохраняющая у 32 пациенток. Края операционной раны были чистые от опухолевых клеток у 98 (92%) оперированных. Послеоперационную лучевую терапию получили 84% и 59% больных после органосохраняющих операций и мастэктомий соответственно. Паллиативная мастэктомия была выполнена у 22 (17%) больных, рандомизированных в группу продолжения системной терапии. При медиане наблюдения 53 месяца 3-летняя общая выживаемость составила 67,9% в группе системной терапии и 68,4% в группе хирургии, разница в показателях статистически недостоверна. При подгрупповом анализе не получено данных о пользе операции в какой-либо анализируемой подгруппе, включая больных с олигометастатической болезнью. Выполнение операции в малочисленной (20 больных) группе с тройным негативным фенотипом увеличивало относительный риск смерти в 3,3 раза. Выполнение операции уменьшило риск локорегионального прогрессирования с 40% до 16%. Основным фактором риска развития локорегионального прогрессирования у оперированных больных было наличие опухолевых клеток в краях резекции. Проведение или не проведение лучевой терапии не оказало влияние на частоту локорегионального прогрессирования. Анализ качества жизни больных показал достоверное его снижение в группе оперированных в течение 12 месяцев после выполнения операции. Таким образом, авторы приходят к выводу, что проведение локорегионального лечения у больных с метастатическим процессом и ответом на системную терапию не приводит к улучшению отдаленных результатов. Но при этом отмечено ухудшение, пусть и временное, качества жизни. Это исследование подтвердило выводы индийского исследования, которое критиковали за несоответствие системной терапии клиническим рекомендациям (отсутствие эндокринотерапии, анти-HER2 терапии), что могло бы объяснить низкую медиану 3-летней общей выживаемости 20% индийских пациенток. В американском исследовании 3-летняя общая выживаемость в обеих группах была 67-68% за счет меньшего распространения болезни и проведения современной и эффективной системной терапии. Но даже в этих условиях не удалось продемонстрировать полезность выполнения операции, в том числе и в подгруппе олигометастатической болезни. Вряд ли после публикации результатов этого исследования появится желание рекомендовать выполнение удаления первичной опухоли у больной с метастатическим процессом для благой цели – улучшения результатов лечения. У меня – точно нет.
Литература:
1. Khan S, Zhao F, Goldstein LJ, et al. Early localtherapy for the primary site in de novo stage IV breast cancer: results of a randomized clinical trial (EA2108). J. Clin. Oncol. Published online January 7, 2022.
2. Rapiti E, Verkooijen HM, Vlastos G, et al. Complete excision of primary breast tumor improves survival of patients with metastatic breast cancer at diagnosis. J. Clin. Oncol. 2006; 24: 2743-2749.
3. Gnerlich J, Jeffe DB, Deshpande AD, et al. Surgical removal of the primary tumor increases overall survival in patients with metastatic breast cancer: analysis of the 1988-2003 SEER data. Ann. Surg. Oncol. 2007; 14: 2187-2194.
4. Soran A, Ozmen V, Ozbas S, et al. A randomized controlled trial evaluating resection of the primary breast tumor in women presenting with de novo stage IV breast cancer. J. Clin. Oncol. 2016; 34: suppl 15, abstr 1005.
5. Badwe R, Hawaldar R, Nair N, et al. Locoregional treatment versus no treatment of the primary tumour in metastatic breast cancer: An open-label randomised controlled trial. Lancet Oncol. 2015; 16: 1380-1388.
6. Fitzal F, Balic M, Bjelic-Radisic V, et
al. Primary operation in synchronous
metastasized breast cancer patients: first
oncologic outcomes of the prospective
randomized phase III ABCSG28
POSYTIVE trial. J. Clin. Oncol. 2017; 35:
suppl 15, abstr 557.
ПОДБИРАЕМ ОПТИМАЛЬНУЮ АДЪЮВАНТНУЮ ТЕРАПИЮ БОЛЬНЫМ ОПЕРАБЕЛЬНЫМ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ В ПОСТМЕНОПАУЗЕ
Крупные многоцентровые исследования, проведенные в последние годы, пытались определить кандидатов, выигрывающих от добавления адъювантной химиотерапии к адъювантной гормонотерапии на основании клинических данных и генетических тестов у операбельных больных гормоночувствительным раком молочной железы. Ответ на этот вопрос представлялся особенной актуальным у пациенток с благоприятным клиническим риском, в частности, с отсутствием метастазов в подмышечных лимфоузлах. В исследование TAILOR включались больные с pN0, и был использован генетический тест OnсotypeDx, который, в зависимости от величины суммы подсчета (менее 10, 11-25 и более 25), определял группу хорошего, промежуточного и плохого прогноза соответственно. Всем больным с хорошим прогнозом назначали адъювантную гормонотерапию, в то время как всем пациенткам с плохим прогнозом дополнительно проводили химиотерапию. В группе промежуточного прогноза больные рандомизировались в группу только гормонотерапии и группу дополнительной химиотерапии. Исследование продемонстрировало, что у пожилых (более 50 лет) больных со суммой баллов 25 и менее добавление химиотерапии к гормонотерапии не улучшает отдаленные результаты. У больных моложе 50 лет от добавления химиотерапии не выигрывают больные со счетом 15 и менее. Выполнение теста OncotypeDX рекомендовано всеми международными клиническими рекомендациями для определения прогноза и выбора метода адъювантной терапии больных c pN0, что в итоге привело к существенному сокращению назначения химиотерапии в этой популяции больных. Наличие же подтвержденных метастазов в регионарные лимфоузлы автоматически переводило пациентку в группу плохого прогноза с обязательным проведением адъювантной химиотерапии.
Рисунок 1.
Безрецидивная выживаемость в зависимости
от динамики Ki67
В этом году были опубликованы результаты исследования RxPONDER, целью которого было оценить возможность использования генного теста OncotypeDX для определения прогноза и выбора метода адъювантной терапии (гормонотерапия vs химиогормонотерапия) у больных с наличием метастазов в подмышечные лимфоузлы. В исследование включались больные ER+ РМЖ с наличием pN1 (1-3 метастатических лимфоузла) и счетом OncotypeDx 25 и менее. Для этого счет генной сигнатуры был определен у 9383 пациенток, из них сумма более 25 была выявлена у существенного меньшинства (1035 больных), а 5083 были рандомизированы в группу гормонотерапии или химиогормонотерапии (комбинация антрациклинов и таксанов). В группе постменопаузальных больных старше 50 лет не отмечено достоверного улучшения отдаленных результатов при проведении химиогормонотерапии в сравнении гормонотерапией: безрецидивная 5-летняя выживаемость составила 91,3% и 91,9% соответственно. В группе пременопаузальных больных моложе 50 лет отмечен достоверный выигрыш при назначении химиогормонотерапии, что привело к увеличению показателя 5-летней безрецидивной выживаемости с 89,0% до 93,9% (HR=0,60; p=0,002). Исследование RxPONDER показывает, что пациентки старше 50 лет с pN1 и суммой по OncotypeDx 25 и менее не нуждаются в проведении адъювантной химиотерапии. Правило, что метастазы в регионарные лимфоузлы всегда означают плохой прогноз с необходимостью проведения химиотерапии, не действует у больных с N1 в постменопаузе.
Таким образом, зная данные OncotypeDX, мы можем избавить большинство больных в постменопаузе и часть пациенток в пременопаузе, но с гормоночувствительным РМЖ с pТ1-2N0-1, от проведения токсичной и неэффективной химиотерапии, проводя только адъювантную гормонотерапию. А это десятки тысяч больных в нашей стране, которым, согласно нашим рекомендациям, мы должны назначить и привычно назначаем химиотерапию. Но проблема нашей страны в том, что у нас нет и, вероятно, не будет доступа к выполнению генного теста OncotypeDx. Как же нам определить популяцию больных, которым показана только гормонотерапия?
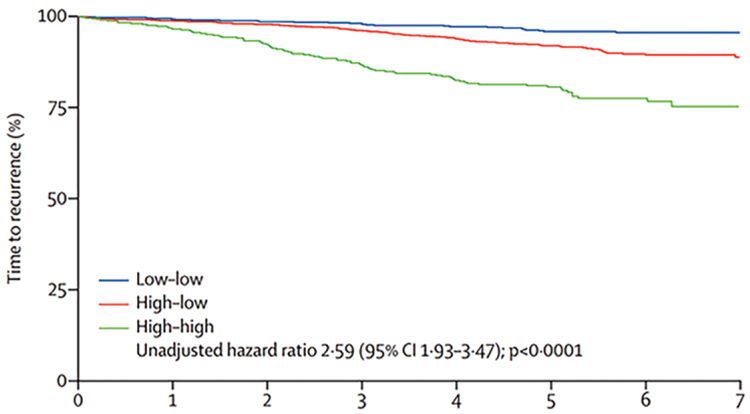
Возможно, ответ на этот вопрос дают работы наших коллег из Великобритании по изучению влияния короткого предоперационного курса (2-3 недели) ингибиторами ароматазы у постменопаузальных больных (старше 50 лет) с наличием рецепторов стероидных гормонов на динамику пролиферативной активности опухоли по показателю Ki67. В исследовании POETIC было показано, что значение Ki67 после проведения гормональной биологической пробы в большей степени оценивает прогноз больных по сравнению со значением в первичной биопсии. Оценивая величину Ki67 в биопсии при постановке диагноза и в операционном материале после назначения короткого курса гормонотерапии, авторы исследования разделили всех больных на три группы: на группу низкий-низкий (когда величина Ki67 в биопсийном и послеоперационном материале была менее 10%), высокий-низкий (когда в Ki67 был более 10% в биопсийном и стал менее 10% в послеоперационном материале), высокий-высокий (значение Ki67 не опускалось ниже 10%). Сценарий низкий-высокий был отмечен лишь у единичных больных, и эти пациенты были исключены из анализа. При сроке наблюдения более 5 лет риск развития рецидива составил 4,3%, 8,4% и 21,5% соответственно в группе больных ER+ HER2- РМЖ, о чем свидетельствуют кривые безрецидивной выживаемости. У 73% больных с изначально высоким Ki67 зарегистрировано снижение показателя менее 10% после проведения короткого курса гормонотерапии. В этом исследовании только 26% пациентов получали адъювантную химиотерапию согласно стандартной практике, в основном в группе высокий-высокий. Поэтому можно считать, что исследование POETIC определило популяцию пациенток с низким значением Ki67 в послеоперационном материале (низкий-низкий, высокий-низкий), которые соответственно имеют низкий шанс прогрессирования при проведении адъювантной гормонотерапии, в то время как пациентки с высоким Ki67 после короткого курса имеют высокий шанс прогрессирования и нуждаются в комбинированной адъювантной терапии (гормонохимиотерапия, таргетная терапия). В отсутствии генетических тестов короткий предоперационный курс гормонотерапии может оказать помощь в выборе адъювантной терапии у постменопаузальных больных, значительно сократив назначение малоэффективной и токсичной адъювантной химиотерапии.
Литература:
1. Sparano JA, Gray RG, Makower DF, et al. Adjuvant chemotherapy guided by a 21-gene expression assay in breast cancer. N. Engl. J. Med. 2018; 379: 111-121.
2. Kalinsky K, Barlow WE, Gralow J, et al. 21-gene assay to Inform chemotherapy benefit in node-positive breast cancer. N. Engl. J. Med. 2021; 385: 2336-2347.
3. Smith I, Robertson J, Kilburn L, et
al. Long-term outcome and prognostic
value of Ki67 after perioperative
endocrine therapy in postmenopausal
women with hormone-sensitive early
breast cancer (POETIC): an open-label,
multicentre, parallel-group, randomised,
phase 3 trial. Lancet Oncol. 2020; 21:
1443-54.
ИМФИНЗИ

ПО СЛЕДАМ SABCS
Автор: Данилова Анастасия Сергеевна
Врач-химиотерапевт отделения химиотерапии ГБУЗ «Московская
городская онкологическая больница №62 ДЗМ», Москва
Главная мировая конференция
по раку молочной железы в этом
году проходила в гибридном формате, поэтому обычно заполненные залы и набережная RIverwalk
в Сан-Антонио были необычно
пустынными. Но, несмотря на
это, конференция состоялась,
принеся немало новых данных
и положительных эмоций, впрочем, как и всегда.
Еще до симпозиума SABCS были
доложены результаты исследования MONALEESA-2 [1], которые
еще раз утвердили основное место ингибиторов ароматазы в сочетании с ингибиторами CDK4/6
в первой линии лечении метастатического гормон-позитивного
Her2-негативного рака молочной
железы. Медиана общей выживаемости составила 63,9 мес. против
51,4 мес. при добавлении рибоциклиба к гормонотерапии (рис.1).
Рисунок 1.
Общая выживаемость при добавлении
рибоциклиба к гормонотерапии в сравнении с плацебо.
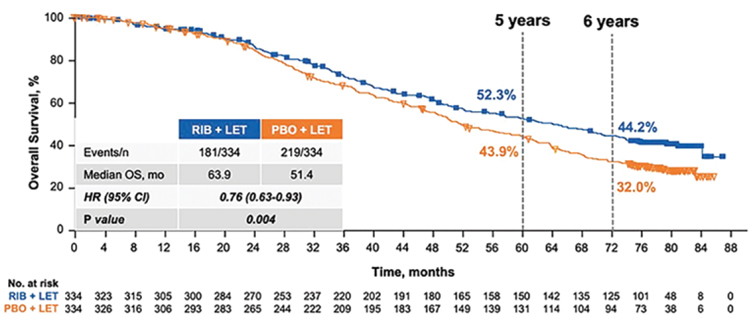
Рисунок 2.
Общая выживаемость пациентов с только
костными и не только костными метастазами
на рибоциклибе против плацебо.
На конгрессе были доложены
важные подгрупповые анализы,
которые помогли оценить роль
этого варианта лечения у разных
пациентов. Так, польза от добавления рибоциклиба наблюдалась
как в группе пациентов только
с костными метастазами, так и
в группе пациентов с не только
костными метастазами. При этом
исключительно костное метастазирование было благоприятным
фактором прогноза – медиана
общей выживаемости у этой
группы пациентов составила 72,6
мес. (против 56,4 мес. в группе
плацебо).
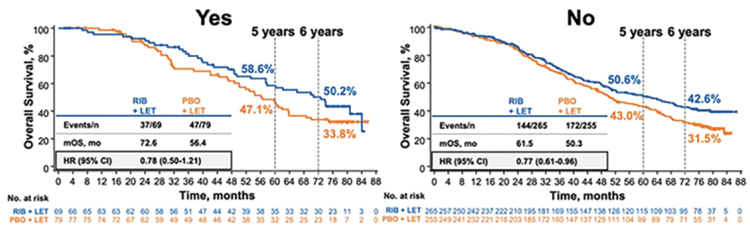
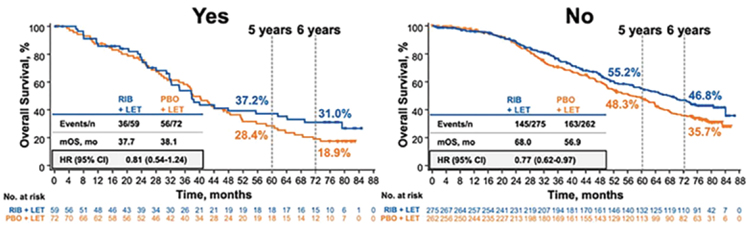
Еще один важный подгрупповой
анализ – это пациенты с метастатическим поражением печени. Это, наверное, один из самых неблагоприятных факторов прогноза, медиана
выживаемости в этой группе составила 37,7 и 38,1 мес. соответственно, но расхождение кривых, тем не
менее, наблюдается и начинается
в точке 5 лет. Группа пациентов без
метастазов в печени более благоприятная, здесь дельта медианы общей
выживаемости составила 11,1 мес.
(HR 0,77; рис.3) [2].
Рисунок 3.
Общая выживаемость больных с метастазами
в печень на рибоциклибе против плацебо.
Также были доложены результаты
общей выживаемости исследований
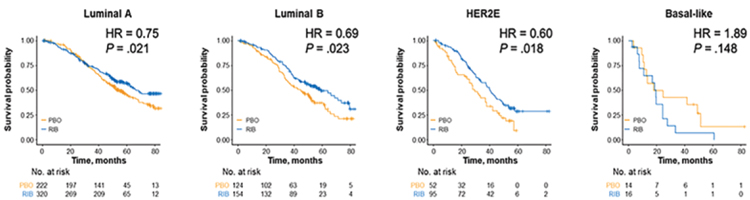
MONALEESA-2, -3 и -7 в зависимости от молекулярного подтипа. 997
гистологических образцов было исследовано для определения геномной
сигнатуры с использованием панели
PAM50. Среди них 54,4% относились
к люминальному А молекулярному
подтипу, 27,9% – к люминальному B,
3,0% – к базально-подобному и 14,7%
– к Her2-обогащенному [3].
Молекулярный подтип оказался значимым прогностическим маркером.
Медиана ОВ среди пациентов с базально-подобным раком молочной
железы была всего 19,4 мес. против
68 мес. в группе пациентов с люминальным А раком. При этом польза
от добавления рибоциклиба наблюдалась во всех группах больных, кроме пациентов с базально-подобным
раком (рис.4).
Рисунок 4.
Общая выживаемость пациенток с различными
подтипами РМЖ на рибоциклибе против плацебо.
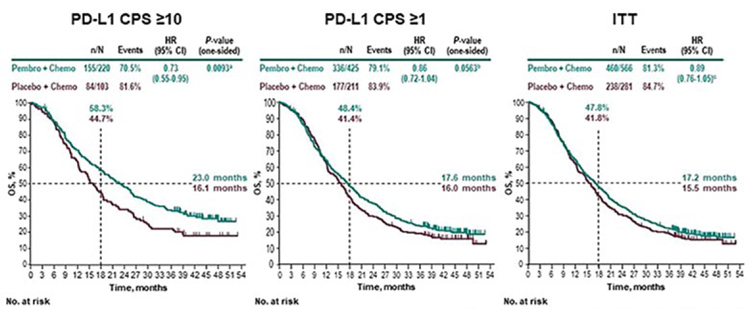
Также был доложен финальный анализ исследования KEYNOTE 355 [4],
в котором было показано, что польза от добавления пембролизумаба к
химиотерапии наблюдается у пациентов с высокой PD-L1 экспрессией.
Именно для этой группы пациентов
в сочетании с химиотерапией пембролизумаб зарегистрирован для
лечения метастатического трижды
негативного рака молочной железы
(рис.5).
Рисунок 5.
Общая выживаемость при добавлении
пембролизумаба к ХТ против плацебо в зависимости
от степени PD-L1 экспрессии.
Пембролизумаб в сочетании с химиотерапией показал свою эффективность и в неоадъювантном сценарии
– исследование KEYNOTE 522 [5].
Добавление пембролизумаба привело к увеличению частоты полных
морфологических регрессов и увеличению безрецидивной выживаемости у всех пациентов, вне зависимости от уровня PD-L1 экспрессии.
Важно, что роль пембролизумаба
была не только в достижении pCR
(как основного прогностического
маркера безрецидивной выживаемости), но и в увеличении iDFS у тех пациентов, кто не достиг pCR (рис.6).
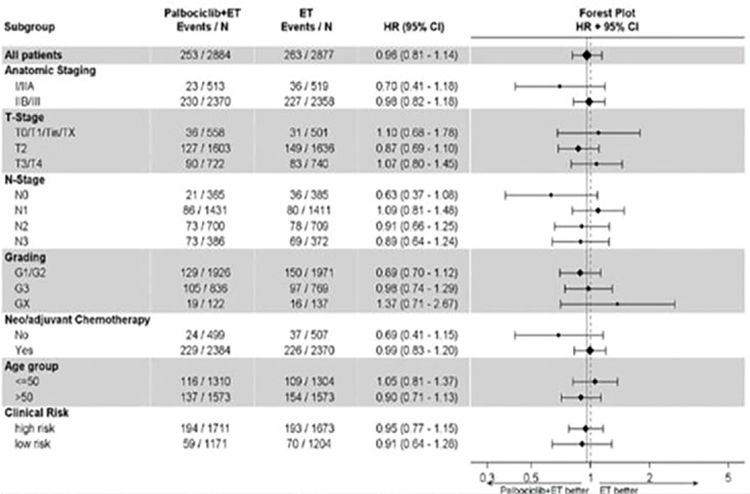
При этом аналогичное исследование с абемациклибом (MonarchE)
[7] было позитивным и послужило основанием для регистрации абемациклиба в качестве компаньона к
адъювантной гормонотерапии у пациентов с гормон-позитивным Her2-
негативным раком молочной железы
высокого риска. Некоторые эксперты
связывают это с большей активностью абемациклиба по сравнению
с другими ингибиторами ЦЗК, некоторые – с непрерывным режимом
дозирования абемациклиба по сравнению с палбоциклибом. Возможно,
результаты исследования NATALEE
(сочетание рибоциклиба с адъювантной гормонотерапией), которые
будут доложены в ближайшие годы,
прольют свет на причины неудачи
исследования PALLAS.
Рисунок 6.
Бессобытийная
выживаемость в
зависимости от достижения
pCR с пембролизумабом
против плацебо.
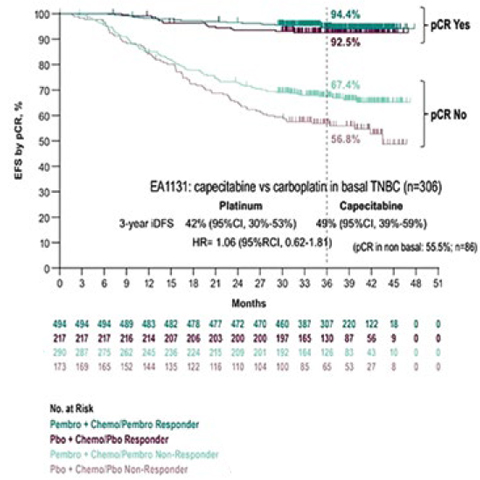
Рисунок 7.
Отсутствие преимуществ добавления
палбоциклиба к гормонотерапии.
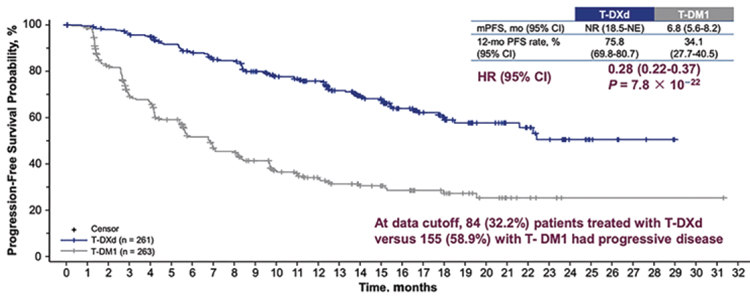
Одним из самых ожидаемых был доклад Сары Хурвитц, посвященный подгрупповому анализу исследования Destiny-Breast-03 [8], феноменальные результаты которого были
доложены осенью на конгрессе
ESMO (рис.8).
Рисунок 8.
Выживаемость без прогрессирования по данным
исследования Destiny-Breast-03.
Подгрупповой анализ показал, что
значимое улучшение PFS наблюдается в абсолютно всех группах пациентов – с HR 0,2 и 0,3 во всех группах
(рис.9) [9].
Рисунок 9.
Выживаемость без прогрессирования во всех
подгруппах больных.
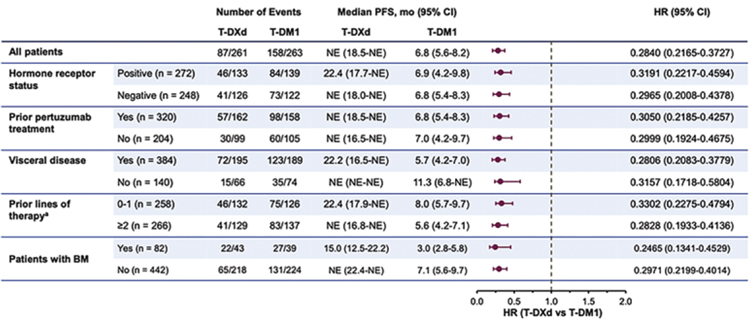
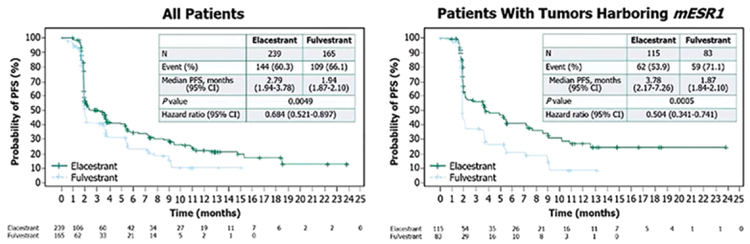
Медиана времени без прогрессирования у пациентов с метастазами в головной мозг составила 15,0 мес. в группе с трастузумабдерукстеканом по сравнению с 3,0 мес. в группе с трастузумабэмтанзином. Частота интракраниального объективного ответа составила 63,9% по сравнению с 33,4% в группе с трастузумабэмтанзином. T-Dxd становится золотым стандартом второй линии метастатического Her2- позитивного рака молочной железы. Парадигма лечения распространенного гормон-позитивного Her2-негативного рака молочной железы тоже меняется. С более широким использованием ингибиторов циклинзависимых киназ мы оказываемся в ситуации, когда у нас немного данных об эффективности последующих линий гормонотерапии, да и химиотерапии тоже. И особенно важными становятся исследования, проведенные в эру «пост-CDK4-6». Ранее было доложено исследование BYLIEVE, которое показало, что ожидаемая PFS на фулвестранте в сочетании с алпелисибом у пациентов, получавших ингибиторы СDK4/6, – 7,3 мес. [10]. На симпозиуме в Сан-Антонио были доложены результаты исследования EMERALD [11], в котором эласестрант (новый деградатор SERD) сравнивался с фулвестрантом у пациентов, ранее получавших ингибиторы CDK4/6 в лечении гормоночувствительного рака молочной железы. Исследование оказалось позитивным, особенно у пациенток с мутацией ESR1. Медиана ВБП у пациентов с этой мутацией составила 3,78 мес. по сравнению с 1,87 мес. в группе с фулвестрантом. Это исследование важно еще и потому, что мы должны понимать, какого эффекта от последующей гормонотерапии мы ожидаем у пациентов, которые получали ингибиторы CDK4/6. И, к сожалению, это не очень длительный ответ на лечение (рис.10). Лекарственная терапия рака молочной железы остается одной из самых развивающихся областей онкологии, где есть значимое движение и в лечении распространенных, и ранних форм опухолей. Здесь появляются новые эффективные препараты, исследуются новые маркеры эффективности терапии, и мы можем видеть, что больше пациентов выздоравливает. Лечение позволяет сделать болезнь хронической, при этом максимально сохранить качество жизни, поэтому для нас, как для клиницистов, подобные конференции – это всегда повод для радости и энтузиазма.
Рисунок 10.
ВБП в группах эласестранта и фулвестранта (вся
популяция и больные с мутацией ESR1).
Источники:
1. Hortobagyi GN, Stemmer SM, Burris
III HA, et al. Overall survival results from
the phase III MONALEESA-2 trial of
postmenopausal patients with hormone
receptor-positive/human epidermal
growth factor receptor 2-negative
advanced breast cancer treated with
endocrine therapy ± ribociclib. ESMO
Congress 2021. Abstract LBA17_PR.
Presented September 19, 2021.
2. O'Shaughnessy J, et al. Overall
survival subgroup analysis by metastatic
site from the phase 3 MONALEESA-2
study of first-line ribociclib + letrozole
in postmenopausal patients with HR+/
HER2- advanced breast cancer. SABCS
2021; Abstract GS2-01.
3. Carey L, et al. Correlative analysis of
overall survival by intrinsic subtype across
the MONALEESA-2, -3, and -7 studies of
ribociclib + endocrine therapy in patients
with HR+/HER2- advanced breast cancer.
SABCS 2021; Abstract GS2-00.4. Cortés J, Cescon DW, Rugo HS, et
al. KEYNOTE-355: Final results from
a randomized, double-blind phase
III study of first-line pembrolizumab
plus chemotherapy vs placebo plus
chemotherapy for metastatic TNBC. Ann
Oncol. 2021; 32: S1289-S1290.
5. Schmid P, Cortes J, Dent R, et al.
KEYNOTE-522 study of neoadjuvant
pembrolizumab + chemotherapy vs
placebo + chemotherapy, followed by
adjuvant pembrolizumab vs placebo for
early-stage TNBC: event-free survival
sensitivity and subgroup analyses.
Presented at: 2021 San Antonio Breast
Cancer Symposium; December 7-10,
2021; Virtual. Abstract GS1-01.
6. O’Shaughnessy J. Adjuvant
abemaciclib combined with endocrine
therapy: updated results from monarchE.
Presented at: ESMO Virtual Plenary;
October 14, 2021.
7. Gnant M, Dueck AC, Frantal S, et
al. Adjuvant palbociclib in HR+/HER2-
early breast cancer: Final results from
5,760 patients in the randomized phase III
PALLAS trial. Presented at SABCS 2021;
December 7-10, 2021; San Antonio, TX.
Abstract GS1-07.
8. Hurvitz S, LBA1 – Trastuzumab
deruxtecan (T-DXd) vs trastuzumab
emtansine (T-DM1) in patients (Pts)
with HER2+ metastatic breast cancer
(mBC): Results of the randomized phase
III DESTINY-Breast03 study.
9. Hurvitz S, Kim S-B, Chung W-P, et
al. Trastuzumab deruxtecan (T-DXd;
DS-8201a) vs. trastuzumab emtansine
(T-DM1) in patients (pts) with HER2+
metastatic breast cancer (mBC): subgroup
analyses from the randomized phase 3
study DESTINY-Breast03. Presented at
SABCS 2021; December 7-10, 2021; San
Antonio, TX. Abstract GS3-01.
10.Rugo HS, Lerebours F, Ciruelos E, et
al. Alpelisib + fulvestrant in patients with
PIK3CA-mutated hormone receptorpositive, human epidermal growth factor
receptor 2-negative advanced breast cancer
previously treated with cyclin-dependent
kinase 4/6 inhibitor + aromatase inhibitor:
BYLieve study results. ASCO20 Virtual
Scientific Program. Abstract 1006.
11.Bardia A, Neven P, Streich G, et al.
Elacestrant, an oral selective estrogen
receptor degrader vs investigator’s choice
of endocrine monotherapy for ER+/
HER2– advanced/metastatic breast
cancer following progression on prior
endocrine and CDK4/6 inhibitor therapy:
Results of EMERALD phase 3 trial. 2021
San Antonio Breast Cancer Symposium.
Abstract GS2-02. Presented December 8,
2021.
КАДСИДА

НЕДАВНИЕ ПУБЛИКАЦИИ В КРУПНЫХ ЖУРНАЛАХ
Местнораспространенный или метастатический рак щитовидной железы (РЩЖ), рефрактерный к радиоактивному I-131, – это реальная проблема, стоящая перед онкологом, поскольку прогноз в подобной ситуации далек от благоприятного. Ингибиторы ангиогенеза – сорафениб и ленватиниб – продемонстрировали улучшение показателей выживаемости без прогрессирования в двух исследованиях – DECISION и SELECT [1,2], однако без преимуществ в общей выживаемости.
Апатиниб – ингибитор ангиогенеза из класса малых молекул
с высокой селективностью в отношении VEGFR-2 рецепторов.
Китайские авторы в своем проспективном рандомизированном
исследовании с двойным заслеплением REALITY [3] оценивали
безопасность и эффективность
апатиниба в сравнении с плацебо у пациентов с прогрессирующим местнораспространенным и
метастатическим РЩЖ, рефрактерным к радиоактивному йоду.
Апатиниб в дозе 500 мг назначался ежедневно перорально до прогрессирования или до развития
неприемлемой токсичности; при
развитии осложнений 3+ степени
допускалась редукция дозы (до
250 мг в сутки) и перерывы в лечении. В исследование было включено 92 пациента, по 46 в группах
апатиниба и плацебо. При медиане наблюдения 18 месяцев медиана ВБП (первичная конечная точка) в группе апатиниба составила
22,2 месяца против 4,5 месяца в
группе плацебо, а одногодичная
ВБП оказалась почти в 5 раз лучше (60,3% против 12,4%), причем
это касалось всех подгрупп больных. К 24 месяцам тенденция
полностью сохранилась: ВБП в
группе апатиниба составила 37,2%
против 4,1% при приеме плацебо.
Медиана общей выживаемости
(вторичная конечная точка) даже
не была достигнута в группе апатиниба при 29,9 мес. в группе плацебо. По ряду других показателей
(например, частота объективных
ответов) экспериментальное лечение также имело достоверное
преимущество. Наиболее частыми осложнениями лечения оказались ладонно-подошвенный синдром (13%), протеинурия (6,5%)
и гипертензия (4,3%). Редукция
дозы оказалась необходима 37%
пациентов ввиду токсичности, но
в целом лечение переносилось хорошо. Авторы сделали вывод, что
терапия апатинибом может стать
новой опцией в лечении больных
с прогрессирующим и метастатическим йод-рефрактерным РЩЖ.
Рисунок 1.
ВБП и ОВ в группах апатиниба и плацебо [3]

Местнораспространенный плоскоклеточный рак полости рта всегда являлся камнем преткновения в плане выстраивания плана лечения для этой сложной категории больных. Вопрос об оптимальной последовательности методов пока остается спорным, но в клинических рекомендациях, как международных, так и отечественных, на 1 этапе приоритет отдан радикальному хирургическому вмешательству, даже в тех ситуациях, когда это подразумевает выполнение сложной, обширной и калечащей операции с резекцией нижней челюсти и одномоментной или отсроченной пластикой. Проблема сохранения нижней челюсти путем уменьшения объема первичной опухоли с помощью неоадъювантного лечения (прежде всего, химиотерапии) уже много лет занимает умы исследователей, хотя имеется немало аргументов против подобного подхода. Индийские авторы инициировали проспективное мультицентрическое исследование по оценке безопасности и потенциальной роли неоадъювантной химиотерапии (НАХТ) у больных с местнораспространенными опухолями полости рта, без признаков прорастания в кость, но требующими резекции нижней челюсти в ходе радикальной операции на 1 этапе [4]. Шестьдесят восемь пациентов cT2-T4 N0/N+ M0 были поровну включены в группы первичной операции (с резекцией кости) и НАХТ (2 цикла DCF с 3-недельным интервалом) с последующей операцией. Средний период наблюдения составил 3,6 лет. Сохранение нижней челюсти было достигнуто почти у половины больных из группы НАХТ (47%), при этом разницы в ВБП (P=0,715; hazard ratio 0,911) и ОВ (P=0,747; hazard ratio 0,899) не отмечено. Авторы полагают, что применение эффективной трехкомпонентной схемы ХТ действительно позволяет сохранить челюсть, не компрометируя отдаленные результаты лечения, но признают, что данные должны быть подтверждены проспективными сравнительными исследованиями 3 фазы. Пока же стандарты лечения остаются прежними – резектабельные пациенты с опухолями полости рта должны быть оперированы на 1 этапе лечения.
Локорегиональные методы в лечении больных с метастатическим раком молочной железы. Отдаленные метастазы на момент диагностики выявляются примерно у 6% больных раком молочной железы (РМЖ). Основную роль в лечении таких больных играет, без сомнения, системная терапия в соответствии с биологическими характеристиками опухоли, а вот роль локальных методов до сих пор четко не определена. Есть мнение, что у определенной пропорции пациенток, прежде всего, с более благоприятными факторами прогноза, добавление локорегионального лечения (операции, лучевой терапии) способно улучшить общую выживаемость. Подобные выводы следовали, в основном, из данных ретроспективных исследований конца 2000-х – начала 2010-х годов, но имеющиеся немногочисленные проспективные исследования, увы, эту гипотезу пока не подтвердили, хотя демонстрировали явные преимущества в локальном контроле над опухолью.
Авторы еще одного проспективного мультицентрического исследования 3 фазы из США рандомизировали 256 пациенток с IV стадией РМЖ, которые получали системную терапию в течение 4-8 месяцев и не прогрессировали, в группы локорегионального лечения (операция и адъювантная лучевая терапия в соответствии со стандартами лечения неметастатического РМЖ) и продолжения системной терапии [5]. Первичной конечной точкой исследования была ОВ, вторичными – локорегиональный контроль и качество жизни. И вновь разница в ОВ оказалась минимальной, подтвердив отсутствие преимуществ добавления локорегионального лечения к системному: 67,9% против 68,4% ОВ за 3 года (Р=0,57) и медиана ОВ 53,1 мес. против 54,9 мес. в группах системной терапии и ЛРЛ соответственно. Качество жизни также не отличалось между группами, но вновь локальные методы внесли большой вклад в поддержание локального контроля: 16,3% против 39,8% за 3 года, P<0,001. Результаты исследования еще раз демонстрируют, что добавление локальных методов к системным при изначально метастатическом РМЖ не должно быть рутинным, поскольку в целом не дает преимуществ. Возможно, будущие исследования позволят определить те подгруппы пациенток, которые будут выигрывать при проведении комплексного лечения.
Источники:
1. Brose MS, Nutting CM, Jarzab B, et al; DECISION investigators. Sorafenib in radioactive iodinerefractory, locally advanced or metastatic differentiated thyroid cancer: a randomised, double-blind, phase 3 trial. Lancet. 2014; 384(9940): 319-328. doi:10.1016/S0140- 6736(14)60421-9. 1. Brose MS, Nutting CM, Jarzab B, et al; DECISION investigators. Sorafenib in radioactive iodinerefractory, locally advanced or metastatic differentiated thyroid cancer: a randomised, double-blind, phase 3 trial. Lancet. 2014; 384(9940): 319-328. doi:10.1016/S0140- 6736(14)60421-9.
2. Lee HJ, Yun HJ, Kim S. Lenvatinib in radioiodine-refractory thyroid cancer. N Engl J Med. 2015; 372(19): 1868. doi:10.1056/NEJMc1503150. 2. Lee HJ, Yun HJ, Kim S. Lenvatinib in radioiodine-refractory thyroid cancer. N Engl J Med. 2015; 372(19): 1868. doi:10.1056/NEJMc1503150.
3. Lin Y, et al. Apatinib vs Placebo in Patients With Locally Advanced or Metastatic, Radioactive IodineRefractory Differentiated Thyroid Cancer. The REALITY Randomized Clinical Trial. JAMA Oncol. doi:10.1001/jamaoncol.2021.6268. 3. Lin Y, et al. Apatinib vs Placebo in Patients With Locally Advanced or Metastatic, Radioactive IodineRefractory Differentiated Thyroid Cancer. The REALITY Randomized Clinical Trial. JAMA Oncol. doi:10.1001/jamaoncol.2021.6268.
4. Chaukar D, et al. Prospective Phase II Open-Label Randomized Controlled Trial to Compare Mandibular Preservation in Upfront Surgery With Neoadjuvant Chemotherapy Followed by Surgery in Operable Oral Cavity Cancer. Journal of Clinical Oncology. 40, no. 3 (January 20, 2022) 272-281. 4. Chaukar D, et al. Prospective Phase II Open-Label Randomized Controlled Trial to Compare Mandibular Preservation in Upfront Surgery With Neoadjuvant Chemotherapy Followed by Surgery in Operable Oral Cavity Cancer. Journal of Clinical Oncology. 40, no. 3 (January 20, 2022) 272-281.
5. Khan SA, et al. Early Local
Therapy for the Primary Site in
De Novo Stage IV Breast Cancer:
Results of a Randomized Clinical
Trial (EA2108). Journal of Clinical
Oncology. Published online January
07, 2022.
5. Khan SA, et al. Early Local
Therapy for the Primary Site in
De Novo Stage IV Breast Cancer:
Results of a Randomized Clinical
Trial (EA2108). Journal of Clinical
Oncology. Published online January
07, 2022.
КОМБИНАЦИИ В ЭПОХУ ИММУНОТЕРАПИИ. НИ ДВА, НИ ПОЛТОРА?
Автор: Жуков Николай Владимирович
ФГБУ «НМИЦ Детской гематологии, онкологии и иммунологии
им. Д. Рогачева», Москва
Прогресс в области лечения злокачественных опухолей, достигнутый за последнее десятилетие, безусловен и очевиден. И так же безусловно и очевидно, что в большинстве своем он обусловлен появлением и внедрением в клиническую практику новых противоопухолевых препаратов. Таргетных, «псевдотаргетных» (не цитостатиков, но не имеющих предсказательного маркера), иммунных и, реже, новых «классических» цитостатиков. Однако когда для лечения одного и того же заболевания есть несколько эффективных препаратов, относящихся к разным классам, возникает «искушение» использовать их в виде комбинаций. Отчасти оно обусловлено «благими» побуждениями улучшить результаты лечения больных за счет синергичного действия препаратов (когда назначение комбинации позволяет добиться лучших результатов, чем последовательное использование этих же препаратов по отдельности). Отчасти, что греха таить, это обусловлено стремлением фармацевтических компаний занять первую линию, которой «на всех не хватает», а добавив свой препарат к «лидеру», можно занять эту нишу. Но как бы то ни было, комбинированная терапия, от которой мы все чаще отходим, когда речь идет о классических цитостатиках (при раке молочной железы, например), все активней используется в случае применения противоопухолевых препаратов новых классов. И если смотреть «невооруженным глазом», комбинации иммунных препаратов и/ или таргетных препаратов показывают увеличение выживаемости. Чаще – без прогрессирования, но нередко и общей. Но если посмотреть внимательней, то в качестве спарринг-партнера они имеют не монотерапию одним из компонентов, входящих в комбинацию, а терапию предыдущего поколения. Т.е. мы видим увеличение выживаемости не в сравнении комбинации с монотерапией, а в сравнении с «историческим» режимом лечения. Но, безусловно, видим. И, наверное, это делает возможным регистрацию и использование данных комбинаций. Но что же они реально дают пациенту и системе здравоохранения. Действительно ли одновременное использование двух препаратов позволяет качественно улучшить результаты лечения? Для ответа на этот вопрос необходимо задуматься о принципах использования комбинаций. Когда мы используем два (или более) препарата одновременно, вместо того, чтобы использовать их последовательно, мы прежде всего рассчитываем на синергизм их действия – два препарата с разными механизмами действия по-разному «атакуют» опухоль у одного и того же пациента, приводя к более глубокому и выраженному поражению опухолевой клетки. И в этой ситуации мы можем рассчитывать даже на принципиально другой эффект лечения – когда каждый из препаратов, например, может иметь лишь паллиативный эффект, но при совместном применении они приводят к излечению больного. Так было, например, при лечении острых лейкозов или герминогенных опухолей – принцип «1+1=3». Но, увы, существует и другой вариант «суммации», когда одновременное лечение оказывается лучше, чем последовательное применение препаратов. Чаще всего, если сравнение происходит между комбинацией двух препаратов и монотерапией, подобный подход показывает преимущество в отношении выживаемости без прогрессирования, но не общей выживаемости. И вот почему – когда в популяции есть пациенты, чувствительные или к препарату А, или к препарату В, то назначение в качестве первой линии лечения комбинации препаратов А и В позволяет перекрыть обе популяции (ответят и те, и другие). В то время как если начать с монотерапии А или В, то ответ будет только среди тех, кто чувствителен к выбранному компоненту. Поэтому терапия А+В даст однозначно лучший эффект в отношении выживаемости без прогрессирования. Но если в группе с монотерапией после неудачи препарата А все пациенты перейдут на препарат В, то пациенты, чувствительные к нему, получат ровно такой же выигрыш, и суммарная продолжительность жизни при обоих вариантах лечения – комбинация А+В или сначала А, потом В – будет одинакова. Но при этом расход препаратов и токсичность будут однозначно больше в группе А+В, т.к. те, кто выигрывает только от А, все время, пока будет сохраняться эффект, будут получать бесполезный для них В. Ровно то же самое будет происходить и с теми, кто чувствителен к В – они будут получать А до момента потери чувствительности. При последовательном же лечении чувствительные к А продолжат монотерапию, а чувствительные к В (но не чувствительные к А) спрогрессируют, прекратят терапию А и перейдут на лечение, которое им помогает (В). И, если честно, именно это – высокий шанс на «перелечивание» с избытком токсичности и цены – и беспокоило меня, когда я смотрел на результаты современных исследований по комбинированной терапии. К счастью, я был не одинок, и группа зарубежных ученых взяла на себя труд посмотреть,как же реально выглядит выигрыш от современных комбинаций. Как оказалось, именно эффект «независимого» воздействия на опухоли с разной чувствительностью, а совсем не синергия или хотя бы аддитивный эффект, оказался в основе эффективности подавляющего большинства комбинаций с использованием ингибиторов контрольных точек иммунитета (ИКТИ) [1]. Предпосылки для попытки комбинированной терапии с участием ИКТИ выглядели вполне разумно – эти препараты действительно изменили судьбу многих пациентов со злокачественными опухолями, однако многие пациенты, увы, не отвечают на терапию ИКТИ. В подобной ситуации добавление дополнительного препарата с альтернативным механизмом действия выглядит вполне разумной попыткой улучшить результаты лечения. Однако применяя подобные комбинации (в которые входит второй, не менее дорогой и не менее токсичный препарат), мы все же надеемся именно на синергизм, исходя из того, что комбинация будет гораздо более эффективной. И многие комбинации с включением ИКТИ в настоящий момент зарегистрированы для клинического применения. Но как же на самом деле взаимодействуют входящие в них препараты? В своем исследовании Dr. Sorger и коллеги на основании математического моделирования рассчитали потенциальный выигрыш в выживаемости без прогрессирования от использования комбинаций в случае, если бы входящие в комбинацию препараты имели бы лишь независимый эффект на разные популяции больных (отсутствие синергии или аддитивного эффекта). И сопоставили с результатами 13 клинических исследований в области лечения 8 злокачественных опухолей (меланома, плоскоклеточный и неплоскоклеточный немелкоклеточный рак легкого, мелкоклеточный рак легкого, рак почки, трижды-негативный рак молочной железы, рак желудка и желудочно-пищеводного перехода, плоскоклеточный рак головы и шеи), приведших к регистрации комбинаций с включением ИКТИ. В 12 из 13 исследований реальный выигрыш в выживаемости без прогрессирования оказался равным или даже меньшим при сравнении с расчетным, исходившим из отсутствия аддитивного или синергистического эффекта. Подобные цифры свидетельствуют, что тестируемые комбинации скорее всего реализовали выигрыш с терапией сравнения благодаря независимому эффекту лекарств, входящих в комбинацию, на разные популяции больных. А значит, А+В по эффективности вряд ли превосходило А→В, но при этом требовало гораздо больших ресурсов и обладало дополнительной токсичностью, не принося существенной пользы большинству больных. Единственный вариант развития событий, при котором подобный подход (назначение комбинации при отсутствии синергизма) может иметь пользу – ситуация, когда при последовательном назначении А→В пациенты, не чувствительные к А, просто не дожили бы до второй линии терапии. Пожалуй, это в лучшей степени характеризует и контингент больных для комбинированной терапии с включением ИКТИ – больные с неблагоприятным прогнозом, не имеющие второго шанса. Хотя мнение первого автора исследования диаметрально противоположно – он, наоборот, призывает вместо того, чтобы «зацикливаться» на поиске комбинаций с наличием синергии, просто больше внимания уделять комбинациям лекарств, обладающих «независимым» эффектом на опухоль (различными механизмами действия), несмотря на то, что большая часть из подобных комбинаций будет лишена синергии. Хотя и он все же признает, что при наличии факторов предсказания эффекта на индивидуальный препарат последовательное использование было бы предпочтительным, т.к. снижало бы финансовую нагрузку на систему здравоохранения и токсичность для пациентов [2].
Источники:
1. Palmer AC, Izar B, Hwangbo H, Sorger PK. Predictable Clinical Benefits without Evidence of Synergy in Trials of Combination Therapies with Immune-Checkpoint Inhibitors. Clin Cancer Res. 2022 Jan 15; 28(2): 368-377. doi: 10.1158/1078-0432. CCR-21-2275. PMID: 35045958.
2. Combination Therapies
May Improve Outcomes Due
to Independent, Rather Than
Synergistic or Additive, Drug Action.
The ASCO Post. Posted: 20 Jan 2022.
АЛОФАНИБ, АЛЛОСТЕРИЧЕСКИЙ FGFR2 ИНГИБИТОР, В ЛЕЧЕНИИ МЕТАСТАТИЧЕСКОГО РАКА ЖЕЛУДКА, РЕЗИСТЕНТНОГО К СТАНДАРТНОЙ ТЕРАПИИ. РЕЗУЛЬТАТЫ РОССИЙСКОГО ИССЛЕДОВАНИЯ 1B ФАЗЫ RPT835GC1B
На симпозиуме GI ASCO 2022 в Сан-Франциско были представлены результаты клинического исследования, в котором впервые изучался оригинальный российский таргетный препарат в онкологии. Алофаниб – это аллостерический ингибитор надмембранной части рецептора фактора роста фибробластов 2 типа.
В многоцентровом российском исследовании 1b фазы принял участие 21 пациент с метастатическим раком желудка (аденокарциномой) и прогрессированием на стандартной лекарственной терапии. Пациенты были в основном мужчинами (71,4%) со статусом ECOG 1-2 (76,2%) и с множественными метастазами (66,7% имели метастазы в более чем 2 органа, 42,9% – метастазы в печень, 14,3% – метастазы в кости). До включения в исследование пациенты получили 2-6 линий терапии в 85,8% случаев, в том числе режимы на основе платины/5-ФУ (100%), рамуцирумаба/паклитаксела (23,8%), трастузумаба (19%) и ниволумаба (9,5%).
Первичной конечной точкой была максимальная переносимая доза (МПД). Вторичные конечные точки включали частоту нежелательных явлений, фармакокинетику, общую выживаемость, выживаемость без прогрессирования, частоту объективных ответов, а также анализ биомаркеров.
Алофаниб изучался в пяти дозовых уровнях (50-350 мг/м2). МПД не была достигнута, и доза, рекомендованная для исследования 2 фазы (RP2D), составила 350 мг/ м2. 15 (71,4%) больных имели нежелательные явления, связанные с лечением, наиболее частыми из которых были инфузионные реакции, тромбоцитопения, диарея, головная боль, артралгия и гиперкалиемия. Нежелательные явления 3-4 степени встречались у 6 (28,6%) больных. Отмена препарата из-за токсичности произошла в 2 случаях. Смертей, связанных с лечением, не было.
При медиане наблюдения 13 месяцев медиана общей выживаемости составила 7,0 месяцев (95% ДИ 3,82-10,18). У пациентов с контролем над болезнью на терапии алофанибом медиана общей выживаемости была выше – 10,08 месяца. Медиана выживаемости без прогрессирования составила 3,63 месяца (95% ДИ 1,58-5,68). Частота объективных ответов была 5,26% с длительностью ответа 18,53 месяца. Контроль над болезнью (ответы + стабилизация) был достигнут в 68,4% случаев.
Фармакокинетические параметры пропорционально изменялись в зависимости от дозы. Биомаркерный анализ выявил одного пациента с амплификацией FGFR2 (5%), который имел стабилизацию болезни.
Таким образом, доза алофаниба для дальнейшего изучения будет 350 мг/ м2 внутривенно, 5 дней лечения и 2 дня перерыва. Удовлетворительный профиль токсичности и предварительные результаты эффективности алофаниба у глубоко предлеченных пациентов свидетельствуют о необходимости продолжения его изучения. Клиническое исследование 2 фазы в процессе подготовки.
Источник:
Tjulandin S, Statsenko G,
Artamonova E, et al. A first-in-human
phase 1b study of a novel allosteric
extracellular FGFR2 inhibitor
alofanib in patients with refractory
metastatic gastric cancer. 2022 ASCO
Gastrointestinal Cancers Symposium.
Abstract 304.
КОММЕНТАРИИ ЭКСПЕРТОВ
Автор: Ян Чау (Ian Chau)
Со-председатель симпозиума GI ASCO 2022, Royal Marsden NHS
Foundation Trust (Лондон, Великобритания)
Результаты исследования для меня являются привлекательными. Посмотрите, 85,7% больных получали алофаниб после
второй линии терапии метастатического рака желудка, то есть
популяция была значительно предлеченная. Но даже у таких
пациентов контроль над болезнью был достигнут в 68% случаев.
Однако только один пациент имел ответ на лечение, что составило 5%; мы понимаем – добиться ответа в сложных случаях не
так просто. Говоря о профиле токсичности, можно отметить, что
селективное ингибирование только одного рецептора из семейства FGFR потенциально привлекательно с позиции снижения
частоты серьезных нежелательных явлений. Хотелось бы получить больше информации о биомаркерах. Итак, результаты интересные, это первая фаза с участием 21 пациента, посмотрим, что
будет в крупном исследовании.
Автор: Трякин Алексей Александрович
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина»
Минздрава России, Москва
Первые результаты применения оригинального аллостерического ингибитора FGFR2 алофаниба выглядят обнадеживающими. В когорте тяжело предлеченных пациентов удалось достичь контроля заболевания у 68% пациентов с медианой продолжительности эффекта около 5 мес. Очевидно, что необходимо дальнейшее исследование препарата с поиском корреляций между наличием мишени (гиперэкспрессия, мутация) и эффективностью терапии.
Профиль токсичности выгодно отличается от других TKI FGFR.
Одним из минусов алофаниба является необходимость ежедневных болюсных введений. При потенциальном подтверждении
активности на большей когорте «молекулярно отобранных» пациентов необходимо исследование препарата в других пролонгированных формах, обеспечивающих более длительный период
полувыведения
Автор: Елена Жанжигян (Yelena Janjigian)
Руководитель отдела опухолей ЖКТ, Memorial
Sloan Kettering Cancer Center, Нью-Йорк, США
Учитывая первые результаты безопасности препарата, невысокий уровень токсичности, его следует изучить во 2 фазе. Прежде всего, я бы сконцентрировалась на когорте пациентов, у которых есть гиперэкспрессия FGFR2. Именно гиперэкспрессия, а не амплификация, учитывая механизм действия препарата, по аналогии с моноклональными антителами.
Если говорить о будущем исследовании, это должна быть первая
линия терапии, в которой оценить эффект можно более точно и достоверно, чем в последних линиях, когда биология опухоли не дает
яркого представления об эффективности. Что касается дизайна, например, это может быть нерандомизированное исследование комбинации алофаниба с FOLFOX с участием 40-60 пациентов.
ОПУХОЛИ ЖКТ

ТАГРИССО

ОМСКОЕ РЕГИОНАЛЬНОЕ ОТДЕЛЕНИЕ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ (RUSSCO)
Первое заседание Омского регионального общества химиотерапевтов состоялось 23 февраля 2011 года, тогда на нем присутствовали 15 человек. В июле 2012 года диспансер с образовательными лекциями посетил председатель Общества онкологов-химиотерапевтов, заместитель директора по научной работе, заведующий отделением клинической фармакологии и химиотерапии РОНЦ им. Н.Н. Блохина РАМН, доктор медицинских наук, профессор С.А. Тюляндин. Он предложил врачам стать членами RUSSCO, предложение было принято с энтузиазмом, и с тех пор 12 октября 2012 года – официальная дата основания регионального отделения Российского общества клинической онкологии.
Председателем отделения с момента его основания в 2012 году и по 2020 год являлась Галина Борисовна Стаценко, заместитель главного врача по клинико-экспертной работе. В период с 2017 по 2020 годы Г.Б. Стаценко избиралась членом Правления RUSSCO. С июля 2020 года председателем Регионального общества стал к.м.н. Дмитрий Михайлович Вьюшков, первый заместитель главного врача БУЗОО «КОД». Региональное отделение в настоящее время насчитывает 33 члена RUSSCO, среди которых 20 онкологов, занимающихся вопросами лекарственной терапии, 3 радиотерапевта, 6 хирургов, 4 врача-онколога поликлинического приема, среди них 1 кандидат медицинских наук, все врачи имеют первую или высшую квалификационные категории. Член регионального общества Дворниченко Ирина Евгеньевна стала Лучшим врачом 2021 года в Омской области в номинации «Лучший онколог года».

Основная локация регионального отделения – Омский областной клинический онкологический диспансер.
Диспансер размещен на 2 базах, в его составе функционирует 12 клинических отделений всех профилей общей мощностью 630 круглосуточных коек, в том числе 305 коек для применения хирургических методов лечения, 130 – для радиотерапии, 135 – для противоопухолевой лекарственной терапии. Начиная с 2019 года в рамках национального проекта «Здравоохранение» Клинический онкологический диспансер существенно обновил материальнотехническую базу. На сегодняшний день учреждение располагает самым современным и высокоточным оборудованием экспертного класса для диагностики и лечения онкологических заболеваний различной локализации.

Начиная с первого года образования региональное общество плотно взаимодействует с RUSSCO. Трудно переоценить значение организационно-методической помощи Общества для врачей диспансера. Уже в 2012 году были получены первые клинические рекомендации, которые стали настольной книгой всех врачей диспансера и, обновляемые ежегодно, остаются таковой по сегодняшний день.
В 2012 году локальная лаборатория БУЗОО КОД еще не выполняла молекулярно-генетические тестирования, в то время как появление таргетных препаратов требовало для их назначения проведения этих исследований. На помощь регионам пришла Программа молекулярно-генетического тестирования RUSSCO. Другой возможности сделать исследование на мутации бесплатно у пациентов не было. Начинали выполнение исследований по определению мутаций в гене EGFR в гистологическом материале пациентов с железистым типом немелкоклеточного рака легкого. Затем стали проводить исследования по определению мутаций генов EGFR, PIK3CA, BRCA1 и 2, KRAS, NRAS, BRAF, ALK, ROS1. Благодаря программе RUSSCO у пациентов со злокачественными новообразованиями легкого, молочной и предстательной желез, яичников, колоректальным раком, меланомой появилась возможность получить самую современную и наиболее эффективную лекарственную терапию. За годы совместной работы в рамках программы RUSSCO тестирование было проведено более 700 пациентам. Эта Программа также дала толчок к развитию молекулярно-генетического тестирования в лаборатории диспансера. Развитие этого направления в деятельности лаборатории начиналось именно в рамках Программы молекулярно-генетических тестирований RUSSCO. Необходимо отметить огромную роль в организации и развитии этой очень нужной для региональных диспансеров и пациентов программы и координации взаимодействия врачей с Обществом по вопросам тестирования со стороны председателя RUSSCO, д.м.н., профессора С.А. Тюляндина и д.м.н. В.В. Карасевой, исполнительного директора RUSSCO. Несмотря на то, что лаборатория диспансера в настоящее время выполняет большинство молекулярно-генетических исследований, совместная работа по этому направлению с RUSSCO продолжается.
С 2012 года Региональное общество провело 51 заседание. Это были и конференции, и круглые столы, общеобразовательные семинары и вебинары с участием не только врачей, занимающихся лекарственной терапией, но и хирургов-онкологов, онкогинекологов, онкоурологов и радиотерапевтов.
Регулярно, два раза в год, на базе диспансера проводились конференции и образовательные семинары, основным организатором которых было RUSSCO. Врачи принимали активное участие не только как слушатели, но и были активными участниками – выступали с докладами и клиническими примерами (Л.В. Воротилина, И.С. Гончаров, И.В. Плохотенко и другие).
В 2016 году была проведена совместная конференция «Рак молочной железы» RUSSCO и Омского онкологического диспансера с международным участием (гостем конференции был Жильбер Массард, професор Страсбургского университета, г. Страсбург, Франция).
Врачи регионального отделения принимали самое активное участие в разработке программ реабилитации и алгоритма направления пациентов, страдающих онкологическими заболеваниями, в круглосуточное отделения реабилитации клиники ЕВРОМЕД. Отделение работает в рамках частно-государственного партнерства, и пациенты получают реабилитационное лечение по программе ОМС. При активном участии в организации программы заведующей научным отделом инновационных методов терапевтической онкологии и реабилитации ФГБУ «НМИЦ онкологии им. Н.Н. Петрова», члена правления RUSSCO, д.м.н. Т.Ю. Семиглазовой удалось провести конференцию RUSSCO по развивающемуся направлению «Поддерживающая терапия и реабилитация в онкологии» на базе отделения реабилитации. В конференции приняли участие академики РАН, профессора К.В. Лядов, О.А. Гладков, а также специалисты, занимающиеся вопросами реабилитации онкологических больных Центра восстановительной медицины «Медси», г. Москва.
28-30 сентября 2018 года в Омске
прошла большая конференция
«Лучшее по материалам международных конференций и симпозиумов 2018: ВОСТОК».
На конференцию зарегистрировались 198 врачей онкологов, 85 из них были гостями из других регионов, в том числе из Казахстана. Перед участниками конференции выступили ведущие отечественные специалисты по основным направлениям онкологии, которые представили новейшие мировые данные по диагностике и лечению опухолей различных локализаций. Это было одно из ярких и масштабных мероприятий в жизни диспансера.
Врачи диспансера активно участвуют в конференциях RUSSCO на других базах и Российском онкологическом конгрессе, как в очном, так и онлайн-формате, в том числе и с докладами.
На XXIII Российском онкологическом конгрессе председатель регионального общества Галина Борисовна Стаценко принимала участие в подготовке и проведении Секции «Скрининг и ранняя диагностика злокачественных новообразований. Вопросы реализации и повышения эффективности региональных и национальных программ». С докладом «Информационное сопровождение скрининговых исследований» на этой секции выступила заместитель главного врача по организационно-методической работе Омского онкологического диспансера О.Н. Прудникова. На XXIV Российском онкологическом конгрессе в онлайн-формате Г.Б. Стаценко представила клинический случай на секцию, где разбирались сложные вопросы взаимодействия практических врачей со страховыми компаниями с участием юристов и экономистов.
4 декабря 2020 года RUSSCO был проведен вебинар «Лекарственная терапия в онкоурологии» при совместном участии специалистов БУЗ Омской области «Клинический онкологический диспансер» и ГБУЗ «Оренбургский областной клинический онкологический диспансер». От Омского диспансера с демонстрацией клинического случая выступил врач отделения онкоурологии, к.м.н. И.А. Сихварт. Молодые члены регионального общества также активно сотрудничают с RUSSCO. Так, Ирина Валерьевна Плохотенко, врач торакальный онколог поликлиники БУЗОО «КОД», член регионального отделения RUSSCO, является автором двух публикаций на сайте и в газете RUSSCO, одна из них посвящена роли жидкостной биопсии в диагностике немелкоклеточного рака легкого, вторая – клиническому случаю терапии BRAF-позитивного рака легкого при прогрессировании опухолевого процесса в соавторстве с заведующим хирургическим торакальным отделением БУЗОО «КОД» Д.Н. Новицким и Г.Б. Стаценко. Члены регионального общества принимают активное участие в международных клинических исследованиях, а также в клинических исследованиях, инициированных RUSSCO, таких как EPICLIN, OVATAR, ORTUS, RENSUR3, RENSUR5, RPT835GC1B.
По результатам этих исследований члены Общества являются соавторами статей, напечатанных в отечественных и зарубежных журналах («Злокачественные опухоли», «Онкоурология», «New England Journal of Medicine»), а также соавторами публикации в ESMO и абстракта симпозиума GI ASCO 2022.
Члены правления Общества оказывают большую поддержку в вопросах практического консультирования сложных пациентов, как
в очном порядке, так и по представленным документам, что очень
ценно не только для пациентов,
но и является одновременно отличной учебой для практикующих
врачей.
ИПИЛИМУМАБ В КОМБИНАЦИИ С НИВОЛУМАБОМ В СРАВНЕНИИ С ХИМИОТЕРАПИЕЙ В ПЕРВОЙ ЛИНИИ ЛЕЧЕНИЯ МЕЗОТЕЛИОМЫ ПЛЕВРЫ. ОБНОВЛЕННЫЕ РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ CHECKMATE 743
2 февраля 2022 г. в журнале Annals of Oncology были опубликованы результаты исследования CheckMate 743, рандомизированного исследования 3 фазы, основной задачей которого было изучение эффективности комбинации ипилимумаба и ниволумаба в сравнении с химиотерапией в первой линии лечения мезотелиомы плевры. В исследование были включены пациенты с первично нерезектабельной мезетелиомой плевры, ранее не получавшие специфической противоопухолевой терапии, с функциональным статусом по ECOG 0-1. Пациенты в исследовании (n=605) были рандомизированы в две лечебные группы (1:1):
• ниволумаб 3 мг/кг в/в кап. 1 раз в 14 дней в комбинации с ипилимумабом 1 мг/кг 1 раз в 6 недель, курсы терапии проводились до прогрессирования, неприемлемой токсичности или до 24 мес. непрерывного лечения (n=303);
• цисплатин 75 мг/м2 или карбоплатин AUC5 в комбинации с пеметрекседом 500 мг/м2 в/в кап. 1 раз в 3 недели, до 6 циклов (n=302).
Первичной конечной точкой исследования была общая выживаемость (ОВ), вторичными – выживаемость без прогрессирования (ВБП), частота достижения объективного ответа (ЧОО), длительность ответа и токсичность терапии.
Результаты
При медиане времени наблюдения
в 35,5 мес. и 43,1 мес. медиана ОВ в
группе иммунотерапии составила
18,1 мес. против 14,1 мес. в группе
химиотерапии (ОР=0,73; 95% ДИ
0,61-0,87), при 3-летней ОВ в 23,2%
и 15,4% соответственно (рис.1).
Рисунок 1.
Общая выживаемость.
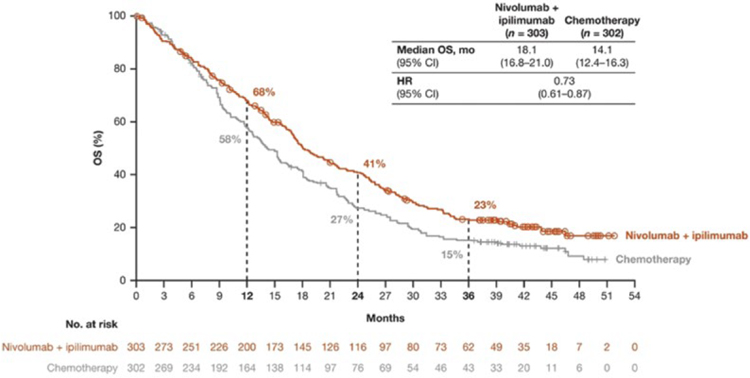
Частота достижения объективного ответа в группах значимо не отличалась и составила 40% в группе иммунотерапии и 44% в контрольной группе при медиане длительности в 11,6 мес. и 6,7 мес. соответственно. В работе изучался профиль экспрессии генов СD8A, STAT1, LAG3 и CD274 (inflammatory signature) и TMB (Tumor mutational burden) в качестве факторов прогноза эффективности терапии. Высокий уровень экспрессии генов «inflammatory signature» ассоциировался с увеличением медианы ОВ с 16,8 мес. до 21,8 мес. в группе иммунотерапии (ОР=0,57; 95% ДИ 0,40-0,82) и не влиял на результаты лечения в группе химиотерапии. Уровень TNB никак не коррелировал с отдаленными результатами терапии.
Рисунок 2.
Выживаемость без прогрессирования.
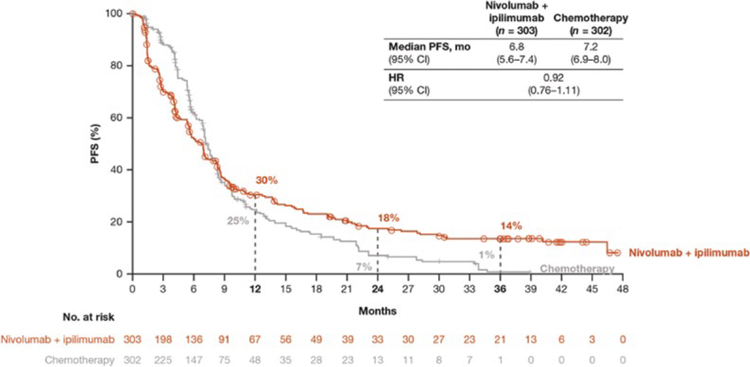
Нежелательные явления (НЯ) любой степени зарегистрированы у 80% пациентов группы иммунотерапии и были преимущественно представлены диареей (21%), зудом (16%) и сыпью (14%). У 82% больных из группы химиотерапии также были выявлены НЯ, наиболее часто были отмечены тошнота (37%), анемия (36%), нейтропения (25%). НЯ 3-4 степени зафиксированы у 31% и 32% больных соответственно и послужили причиной прекращения терапии у 17% и 8% участников исследования. Ни одной смерти, связанной с терапией, не было.
Рисунок 3.
Общая выживаемость пациентов, прекративших
терапию в связи с НЯ (группа иммунотерапии).
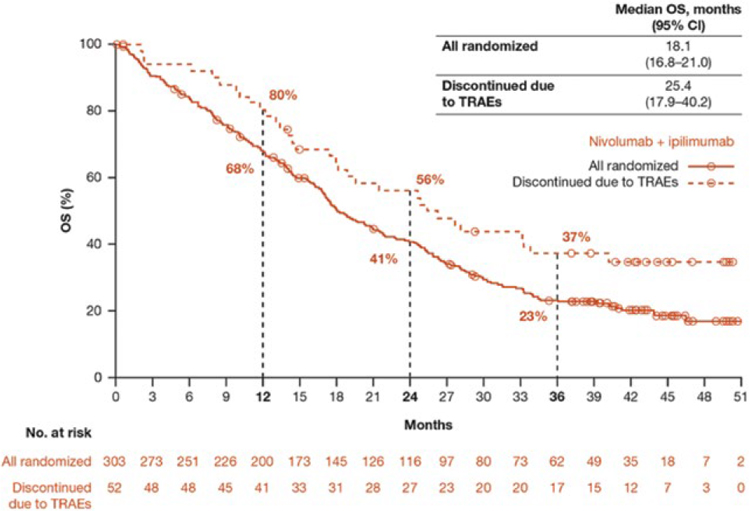
При анализе результатов лечения пациентов группы иммунотерапии, завершивших терапию досрочно в связи с НЯ, было показано, что у 35 (67%) больных был достигнут объективный ответ при медиане длительности в 20 мес., а МОВ составила 25,4 мес. при 3-летней ОВ в 37% (рис.3). Таким образом, комбинация двух иммунопрепаратов продолжает демонстрировать определенные преимущества перед стандартной химиотерапией у пациентов с нерезектабельной мезотелиомой плевры, хотя результаты пока далеки от желаемых.
Источник:
Peters S, Scherpereel A,
Cornelissen R, Oulkhouir Y, Greillier
L, Kaplan MA, Talbot T, Monnet I,
Hiret S, Baas P, Nowak AK, Fujimoto
N, Tsao AS, Mansfield AS, Popat
S, Zhang X, Hu N, Balli D, Spires T,
Zalcman G. First-line nivolumab plus
ipilimumab versus chemotherapy in
patients with unresectable malignant
pleural mesothelioma: 3-year
outcomes from CheckMate 743.
Annals of Oncology, 2022. doi: https://
doi.org/10.1016/j.annonc.2022.01.074.
ИТУЛСИ

ASCO GI 2022: НОВОСТИ СИМПОЗИУМА
Автор: Игнатова Екатерина Олеговна
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина»
Минздрава России, Москва
В январе 2022 года в комбинированном (очно и онлайн) формате прошел очередной ежегодный симпозиум ASCO GI 2022. В ходе прошедшего мероприятия были представлены результаты более 650 исследований в области лечения опухолей желудочно-кишечного тракта. Коротко рассмотрим результаты наиболее интересных из них.
Рак пищевода
Исследование III фазы JCOG1109 NExT: сравнение двух режимов химиотерапии и режима химиолучевой терапии в качестве неоадъювантного лечения местнораспространенного плоскоклеточного рака пищевода [1].
Согласно результатам исследования III фазы JCOG1109 NExT, добавление доцетаксела к неоадъювантной терапии цисплатином и фторурацилом привело к увеличению общей выживаемости (ОВ) у пациентов с местнораспространенным плоскоклеточным раком пищевода. В исследование включен 601 пациент с IB-III стадией рака пищевода. Пациенты рандомизированы в соотношении 1:1:1 в группу неоадъювантной терапии на основе дуплета CF (цисплатин и 5-фторурацил), триплета DCF (доцетаксел, цисплатин, 5-фторурацил) или в группу химиолучевой терапии (цисплатин, 5-фторурацил + лучевая терапия 41,4 Гр, 23 фракции). Первичная конечная точка – общая выживаемость. После проведения неоадъювантного лечения 183 пациентам в группе DCF, 178 в группе химиолучевой терапии и 185 пациентам в группе CF выполнен хирургический этап лечения. Доля пациентов, которым выполнена резекция R0, составила 94,5%, 98,9% и 90,3% соответственно. При медиане времени наблюдения 4,2 года медиана ОВ не была достигнута в группе DCF, составила 7,0 лет в группе химиолучевой терапии и 5,6 года в группе CF. Показатели 3-летней ОВ составили 72,1%, 68,3% и 62,6% соответственно. Медиана выживаемости без прогрессирования (ВБП) не была достигнута в группе DCF, составила 5,3 года в группе химиолучевой терапии и 2,7 года в группе химиотерапии по схеме CF. Нежелательные явления (НЯ) 3-4 степени чаще встречались в группе DCF, чем в группах CF и химиолучевой терапии, и включали нейтропению (85,2%, 23,4% и 44,5% соответственно), фебрильную нейтропению (16,3%, 1,0% и 4,7%) и гипонатриемию (26,0%, 6,2% и 11,0%). Эзофагит 3-4 степени чаще встречался в группе химиолучевой терапии, чем в группах неоадъювантной химиотерапии по схеме CF и DCF, — 8,9%, 1,0% и 1,0% соответственно. Связанные с лечением летальные исходы зарегистрированы у 4 пациентов в группе DCF, у 2 пациентов в группе химиолучевой терапии и у 3 пациентов в группе CF.
Согласно результатам исследования фазы III JCOG1109 NExT, добавление доцетаксела к неоадъювантной терапии цисплатином и фторурацилом увеличивало ОВ у пациентов с местнораспространенным плоскоклеточным раком пищевода.
Применение трехкомпонентного режима DCF может стать новым стандартом неоадъювантной терапии местнораспространенного плоскоклеточного рака пищевода.
Рисунок 1.
Общая выживаемость в группах CF и DCF.
Рисунок 2.
Общая выживаемость в группах CF
и химиолучевой терапии
Рак желудка
Исследование II фазы GERCOR NEONIPIGA: неоадъювантная терапия комбинацией ниволумаба и ипилимумаба в лечении пациентов с локализованным раком желудка и пищеводно-желудочного перехода с высоким уровнем микросателлитной нестабильности (MSI)/дефицитом репарации (dMMR) [2].
При применении комбинации ниволумаба и ипилимумаба в неоадъювантном режиме при лечении резектабельного рака желудка с MSI/dMMR удалось достигнуть 59% полных патоморфологических регрессий (pCR), что соответствует достижению первичной конечной точки исследования II фазы GERCOR NEONIPIGA. В исследование NEONIPIGIA были включены 32 пациента с гистологически подтвержденной неметастатической аденокарциномой желудка (n=16) или пищеводно-желудочного перехода (n=16) со стадией опухолевого процесса от T2 до T4, NxM0. Все больные имели dMMR±MSI-H статус опухоли. У 19% пациентов диагностирован синдром Линча. Пациенты получали лечение по схеме: ниволумаб в дозе 240 мг в/в каждые 2 недели в сочетании с ипилимумабом в дозе 1 мг/кг каждые 6 недель в качестве неоадъювантной терапии, суммарно 6 циклов. Через 5 недель после завершения неоадъювантного лечения выполнялся хирургический этап лечения. Адъювантная терапия проводилась ниволумабом в монотерапии в дозе 480 мг каждые 4 недели в течение 9 циклов. Первичная конечная точка исследования – pCR. Все 32 пациента получили неоадъювантный этап лечения; 2 больных – 2 цикла, еще 2 – 3 цикла, 1 пациент получил 5 циклов и 27 пациентов – 6 циклов. Трем пациентам операция не была выполнена: у 1 зарегистрировано прогрессирующее заболевание после 6 цикла лечения и двое отказались от хирургического лечения. R0 резекция опухоли выполнена у всех 29 пациентов. У 17 (59%) пациентов зарегистрировано достижение pCR (TRG 1a по шкале Becker, ypT0N0) и у 4 больных (14%) – TRG 1b (<10% остаточной опухоли по Beker), у 1 (3%) пациента – TRG 2 (10-50% остаточной опухоли), а у 7 (24%) – TRG 3 (>50% остаточной опухоли). При медиане наблюдения 10,9 мес. у 1 пациента зарегистрировано прогрессирование заболевания, 1 пациент умер через 3 дня после операции и 30 больных не имели рецидива либо прогрессирования. У 84% пациентов наблюдались связанные с лечением НЯ любой степени при проведении неоадъювантной терапии, у 16% пациентов зарегистрированы связанные с лечением НЯ 3/4 степени, что привело к прекращению лечения. Наиболее частыми НЯ 3/4 степени были диарея (3%), колит/илеит (6%), надпочечниковая недостаточность (3%), рвота (3%), снижение аппетита (6%) и другие (6%). У 58,5% из 29 пациентов возникали периоперационные осложнения, которые включали свищ (n=6), панкреатит (n=3), кишечную непроходимость (n=2), пневмонию (n=2), мерцательную аритмию (n=2), смерть (n=1) и другие (n=1).
Таким образом, по результатам исследования NEONIPIGIA показано, что проведение неоадъювантной комбинированной иммунотерапии по схеме ниволумаб/ипилимумаб обеспечивает достижение высокой частоты pCR в лечении рака желудка и пищеводно-желудочного перехода с MSI/dMMR фенотипом, что может послужить основанием для изменения подхода в лечении данного подтипа опухоли.
Рак поджелудочной железы
Исследование I/II фазы KRYSTAL-1: эффективность и безопасность адаграсиба (MRTX849) у пациентов с нерезектабельным или метастатическим раком поджелудочной железы и другими опухолями желудочно-кишечного тракта с мутацией KRASG12C [3].
Ранее опубликованные данные исследования I/II фазы установили клиническую активность адаграсиба при различных солидных опухолях, включая злокачественные новообразования желудочно-кишечного тракта (ЖКТ), а также НМРЛ.
В этом исследовании II фазы представлены результаты лечения пациентов, включенных в группу оценки эффективности адаграсиба в дозе 600 мг два раза в сутки у пациентов с нерезектабельным или метастатическим раком поджелудочной железы и другими опухолями ЖКТ с мутацией KRASG12C. Конечные точки исследования – клиническая активность, безопасность и фармакокинетика. В исследование включены 42 пациента с различными опухолями ЖКТ кроме колоректального рака. У 30 пациентов выявлены мутации KRAS G12C, из них 12 имели рак поджелудочной железы, 8 – рак желчевыводящих путей, 5 – рак аппендикса, 2 – рак пищеводно-желудочного перехода, 2 пациента были с диагнозом рак тонкой кишки и 1 больной – с раком пищевода. Все пациенты получили как минимум 2 линии лекарственного лечения. Эффективность лечения была оценена у 27 больных. По результатам исследования частота объективного ответа (ЧОО) составила 41%. ЧОО в группе пациентов с диагнозом рак поджелудочной железы – 50% (5/10); частота контроля заболевания – 100% (10/10). Медиана ВБП составила 6,6 мес. (95% CI 1,0- 9,7). Среди 17 пациентов с другими опухолями ЖКТ ЧОО составила 35%, частота контроля заболевания – 100%. Медиана ВБП составила 7,85 мес. (95% CI, 6,9-11,3). Наиболее частыми НЯ любой степени тяжести в общей когорте пациентов были тошнота (48%), рвота (43%), диарея (43%), утомляемость (29%), повышение АСТ (19%), повышение уровня креатинина в крови (19%), анемия (17%) и периферические отеки (17%). Наиболее частые НЯ 3 степени тяжести: утомляемость (7%) и удлинение интервала QTc (5%). НЯ 4 степени не были зарегистрированы.
Таким образом, монотерапия адаграсибом продемонстрировала высокие показатели контроля заболевания в лечении рака поджелудочной железы и других злокачественных опухолей ЖКТ с мутацией KRAS, что является основанием для проведения дальнейших исследований.
Исследование III фазы TRYbeCA-1: эффективность эриаспазы в комбинации с химиотерапией во второй линии терапии пациентов с метастатическим раком поджелудочной железы [4].
Предыдущее исследование фазы 2b показало, что добавление эриаспазы к химиотерапии может улучшить как результаты ОВ, так и ВБП у пациентов с распространенным раком поджелудочной железы. В исследование TRYbeCA-1 былb включенs 512 пациентов с аденокарциномой поджелудочной железы III-IV стадии, у которых наблюдалось прогрессирование после 1 линии системной терапии. Пациенты были рандомизированы для получения только химиотерапии (257 пациентов) и химиотерапии в комбинации с эриаспазой (255 пациентов). Химиотерапия проводилась по схеме гемцитабин, набпаклитаксел (58% в каждой группе) или FOLFIRI (42% в каждой группе).
По результатам исследования, более 90% пациентов в каждой группе прекратили прием исследуемого препарата в связи с прогрессированием заболевания. При оценке эффективности лечения не было выявлено различий в медиане ОВ между группой, получавшей эриаспазу, и группой, получавшей только химиотерапию (7,5 мес. и 6,7 мес. соответственно) (HR 0,92; 95% CI, 0,76-1,11; P=0,469). Исследователи отметили тенденцию к улучшению общей выживаемости при применении эриаспазы среди пациентов, получавших FOLFIRI. Медиана ОВ составила 8,0 мес. при применении эриаспазы-FOLFIRI и 5,7 мес. при применении только FOLFIRI (HR 0,81; P=0,238). Однако среди пациентов, получавших гемцитабин и наб-паклитаксел, такой тенденции не наблюдалось. В этой группе медиана ОВ составила 7,0 мес. при применении эриаспазы и 6,9 мес. только при применении химиотерапии (HR 1,01; P=0,967). Аналогичным образом, не было существенной разницы в медиане ВБП между группой, получавшей эриаспазу с химиотерапией, и группой, получавшей только химиотерапию, – 3,7 мес. и 3,4 мес. соответственно (HR 0,89; 95% CI 0,73-1,07; P=0,178). С другой стороны, уровень контроля заболевания был значительно выше в группе комбинированного лечения, чем в группе только химиотерапии, – 57,6% и 49,0% соответственно (P=0,047).
Наиболее частыми НЯ в группе комбинированного лечения были астения, диарея и анемия (степень 3-4: 16,9%, 7,66% и 17,3% соответственно).
Таким образом, добавление эриаспазы к химиотерапии не улучшает результаты лечения пациентов с распространенным раком поджелудочной железы.
Рисунок 3.
Общая выживаемость в группах химиотерапии
в комбинации с эриаспазой и химиотерапии.
Билиарный рак
Рандомизированное исследование III фазы TOPAZ-1: эффективность дурвалумаба в комбинации с гемцитабином и цисплатином (GemCis) у пациентов с распространенным раком желчевыводящих путей [5].
Пациенты, ранее не получавшие лечения по поводу нерезектабельного местнораспространенного или метастатического рака желчевыводящих путей, были рандомизированы 1:1 в группу дурвалумаба (1500 мг каждые 3 недели) или плацебо в сочетании с химиотерапией по схеме GemCis (гемцитабин 1000 мг/м2 и цисплатин 25 мг/м2 1, 8 дни каждые 3 недели). Лечение проводилось суммарно до 8 курсов с последующим назначением дурвалумаба (1500 мг каждые 4 недели) или плацебо до прогрессирования заболевания или неприемлемой токсичности. Суммарно в исследование включено 685 пациентов. Первичная конечная точка – ОВ. Вторичные конечные точки включали ВБП, ЧОО и безопасность. Результаты исследования продемонстрировали, что дурвалумаб в сочетании с химиотерапией по схеме GemCis приводит к снижению риска смерти на 20% по сравнению с плацебо в сочетании с химиотерапией (HR 0,80; 95% CI 0,66-0,97; р=0,021). При медиане наблюдения 13,7 мес. для дурвалумаба в сочетании с химиотерапией по схеме GemCis и 12,6 мес. для терапии плацебо в сочетании с GemCis медиана ОВ составила 12,8 мес. (95% CI 11,1-14) против 11,5 мес. (95% CI 10,1-12.5) соответственно. Показатели 18-месячной OB составили 35,1% (95% CI 29,1-41,2%) против 25,6% (95% CI 19,9-31,7%) соответственно. Показатели 24-месячной общей выживаемости составили 24,9% (95% CI 17,9-32,5%) и 10,4% (95% CI 4,7- 18,8%) соответственно. Медиана ВБП была 7,2 мес. (95% CI 6,7-7,4) для дурвалумаба в сочетании с химиотерапией по схеме GemCis по сравнению с 5,7 мес. (95% CI 5,6-6,7) для терапии плацебо в сочетании с GemCis (HR 0,75; 95% CI 0,64-0,89; р=0,001). ЧОО составила 26,7% против 18,7% в двух группах соответственно. Наиболее частые НЯ: анемия (48,2%), нейтропения (31,7%) и тошнота (40,2%).
Авторы исследования делают вывод, что дурвалумаб в сочетании с химиотерапией по схеме GemCis может стать новым стандартом первой линии терапии пациентов с метастатическим раком желчевыводящих протоков.
Гепатоцеллюлярный рак
Рандомизированное исследование III фазы HIMALAYA: эффективность тремелимумаба и дурвалумаба в первой линии терапии нерезектабельного гепатоцеллюлярного рака [6].
В исследование HIMALAYA был включен 1171 пациент с нерезектабельным гепатоцеллюлярным раком, ранее они не получали лекарственного лечения. Пациенты были рандомизированы в 3 группы: группу однократного введения тремелимумаба в дозе 300 мг и продолжающейся терапии дурвалумабом в дозе 1500 мг каждые 4 недели, группу сорафениба или группу дурвалумаба. Первичная конечная точка – ОВ для группы комбинации тремелимумаба и дурвалумаба и терапии сорафенибом. Вторичная конечная точка – сравнимая ОВ между группами монотерапии дурвалумабом и сорафенибом. Результаты исследования продемонстрировали, что применение комбинации дурвалумаба и тремелимумаба приводит к значительному увеличению ОВ по сравнению с сорафенибом (HR 0,78; 96,02% CI 0,65-0,92; P=0,0035). Кроме того, дурвалумаб продемонстрировал не худшую ОВ по сравнению с сорафенибом (ОР 0,86; 96% CI 0,73- 1,03). Медиана ОВ составила 16,4 мес. (95% CI 14,2-19,6) для дурвалумаба/тремелимумаба, 16,6 мес. (95% CI 14,1-19,1) для дурвалумаба и 13,8 мес. (95% CI 12,3-16,1) для сорафениба. Показатели 36-месячной ОВ составили 30,7% для дурвалумаба/ тремелимумаба, 24,7% для дурвалумаба и 20,2% для сорафениба. ЧОО составила 20,1% (n=79) при лечении дурвалумабом/тремелимумабом, 17,0% (n=66) при применении только дурвалумаба и 5,1% (n=20) при лечении только сорафенибом. Комбинация дурвалумаба и тремелимумаба и монотерапия дурвалумабом имели управляемые профили безопасности с более низкой частотой связанных с лечением НЯ 3-4 степени по сравнению с сорафенибом, причем без какого-либо значимого увеличения гепатотоксичности или риска кровотечения.
Рисунок 4.
Общая выживаемость в группах дурвалумаба
в комбинации c химиотерапией GemCis и плацебо
в комбинации с химиотерапией GemCis.
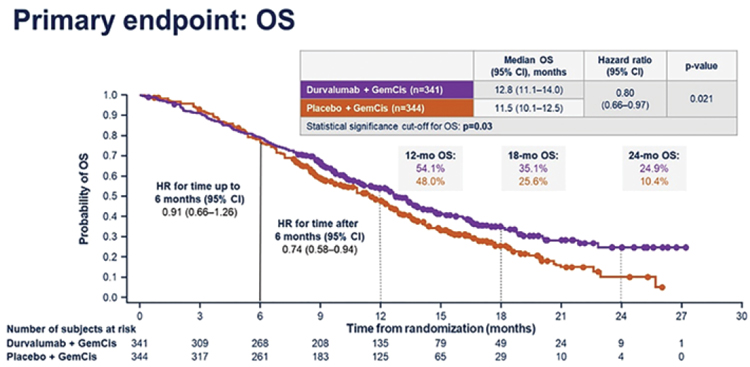
Таким образом, комбинация тремелимумаба с дурвалумабом продемонстрировала более высокую эффективность и благоприятный профиль токсичности.
Эффективность дурвалумаба оказалась не хуже эффективности сорафениба при лучшей переносимости. Эффективность трансартериальной химиоэмболизации (TACE) в сочетании с ленватинибом и синтилимабом при лечении пациентов с нерезектабельным гепатоцеллюлярным раком [7].
В ретроспективном исследовании проанализированы результаты лечения 52 пациентов с нерезектабельным гепатоцеллюлярным раком, которые получали ленватиниб в дозе 12 или 8 мг (в зависимости от массы тела) один раз перорально за 2 недели до проведения ТАСЕ. Синтилимаб вводили внутривенно в дозе 200 мг в 1-й день 21-дневного цикла после ТАСЕ. Далее процедуру ТАСЕ повторяли через 4-6 недель.
Первичные конечные точки: ЧОО и продолжительность ответа. При медиане наблюдения 12,5 мес. (95% CI 9,1-14,8) ЧОО составила 46,7% (28/60: полный ответ у 4; частичный ответ у 24). У 23 пациентов зарегистрирована стабилизация заболевания, тогда как у 9 пациентов – прогрессирование заболевания. Медиана длительности ответа составила 10 месяцев (95% CI 9,0- 11,0). Медиана ВБП составила 13,3 мес. (95% CI 11,9-14,7), а ОВ – 23,6 мес. (95% CI 22,2-25,0). НЯ любой степени тяжести наблюдались у 84,6% (n=44) пациентов. При этом наиболее частые НЯ, связанные с лечением, включали утомляемость (30,8%), артериальную гипертензию (25%), диарею (19,2%), снижение аппетита (23%) и ладонноподошвенную эритродизестезию (21,1%).
Таким образом, ТАСЕ в сочетании с ленватинибом плюс синтилимаб является безопасным и эффективным методом лечения пациентов с нерезектабельным гепатоцеллюлярным раком и требует дальнейшего анализа в рамках проведения рандомизированных исследований.
Рисунок 5.
Общая выживаемость в группах тремелимумаба
и дурвалумаба и терапии сорафенибом.
Колоректальный рак
Исследование I/II фазы: комбинация энкорафениба, цетуксимаба и ниволумаба в лечении пациентов с микросателлитным стабильным метастатическим колоректальным раком с мутацией BRAFV600E [8].
По данным предшествующих исследований, комбинация энкорафениба и цетуксимаб обеспечивает кратковременный ответ и улучшение выживаемости у пациентов с метастатическим колоректальным раком (мККР) с MSS фенотипом и мутацией BRAFV600E.
Ингибирование BRAF + EGFR в in vitro моделях КРР с MSS, BRAFV600E фенотипом может приводить к формированию перехода из pMMR в dMMR фенотип. В настоящее исследование включены пациенты с мКРР с MSS статусом опухоли и мутацией BRAF V600E, которые получали ранее от 1 до 2 линий предшествующего лечения, за исключением ингибиторов BRAF, антител против EGFR или иммунотерапии. Пациенты получали энкорафениб (300 мг перорально ежедневно), цетуксимаб (500 мг/м2 внутривенно каждые 14 дней) и ниволумаб (480 мг внутривенно каждые 28 дней). Первичными конечными точками были лучший общий ответ и безопасность. Суммарно включено 26 пациентов, 23 получили лечение, эффект оценен у 22 больных. По результатам исследования при применении комбинации ниволумаба, энкорафениба, цитуксимаба ЧОО составила 50%, частота контроля заболевания – 96% (95% CI 77-100%). При медиане наблюдения 16,3 мес. ВБП составила 7,4 мес. (95% CI 5,6-NA) и медиана OВ – 15,1 мес. (95% CI 7,7-NA). Средняя продолжительность ответа была 7,7 мес. (95% CI 3,8-NA). Наиболее частыми НЯ оказались головная боль (n=17; 65%), тошнота (n=9; 35%) и сыпь (n=8; 31%). Сообщалось об одном случае колита 3 степени, сыпи, бессимптомного повышения уровня амилазы/ липазы и лейкоцитоза, а также миозита 4 степени.
Таким образом, комбинация энкорафениба, цетуксимаба и ниволумаба продемонстрировала свою эффективность и безопасность в лечении пациентов с метастатическим колоректальным раком с MSS фенотипом и мутацией BRAFV600E.
Исследование фазы II: предварительные результаты оценки эффективности комбинации пембролизумаба, биниметиниба и бевацизумаба у пациентов с рефрактерным метастатическим колоректальным раком с MSS фенотипом [9].
В исследование были включены 50 пациентов с мКРР, у которых заболевание прогрессировало как минимум на 2 предшествующих линиях терапии. Лечение проводилось по схеме: пембролизумаб (200 мг каждые 3 недели), биниметиниб (45 мг два раза в день) и бевацизумаб (7,5 мг/кг каждые 3 недели). Первичная конечная точка – ВБП. Вторичные конечные точки: ЧОО, частота контроля заболевания через 2 мес., продолжительность ответа, а также безопасность лечения. По предварительным результатам исследования показано, что применение комбинации пембролизумаба, биниметиниба и бевацизумаба привело к достижению ВБП 5,8 мес. (95% CI 4,2-8,9). У 5 пациентов (13%) зарегистрирован ЧО, у 24 пациентов (62%) стабилизация заболевания и у 29 пациентов (74%) – контроль заболевания при первом повторном исследовании через 2 мес. Наиболее частые НЯ: сыпь (n=40; 85%), диарея (n=28; 60%) и тошнота (n=20; 43%).
Таким образом, при оценке предварительных данных комбинация пембролизумаба, биниметиниба и бевацизумаба показала свою эффективность в лечении рефрактерного мКРР с MSS фенотипом при приемлемой переносимости.
Исследование II фазы DESTINYCRC01: трастузумаб дерукстекан в лечении пациентов с мКРР с гиперэкспрессией HER2. Заключительные результаты [10].
В исследование II фазы DESTINYCRC01 было включено 86 пациентов с нерезектабельным и/или метастатическим КРР с подтвержденной экспрессией HER2 и диким типом генов RAS/BRAF V600. Пациенты, включенные в исследование, должны были получить как минимум 2 линии предшествующей терапии. Больные рандомизированы в одну из трех групп в зависимости от статуса HER2: пациенты с ИГХ 3+ или ИГХ 2+/ ISH+ позитивным заболеванием (когорта А; n=53), пациенты с ИГХ 2+/ISH-негативным заболеванием (когорта В; n=15) и пациенты с ИГХ 1+ (когорта С; n=18). Всем пациентам проводилось лечение по схеме трастузумаб дерукстекан 6,4 мг/кг каждые 3 недели. Первичная конечная точка – ЧОО в когорте А. Вторичные конечные точки – частота контроля заболевания, длительность ответа, ВБП и ОВ.
При медиане длительности наблюдения 62,4 недели у пациентов в когорте А ЧОО составила 45,3% (95% CI 31,6-59,6%), медиана длительности ответа – 7,0 мес. (95% CI 5,8-9,5), медиана ВБП – 6,9 мес. (95% CI 4,1-8,7) и медиана ОВ – 15,5 мес. (95% CI 8,8-20,8). В когортах B и C медиана ВБП составляла 2,1 мес. (95% CI 1,4-4,1) и 1,4 мес. (95% CI 1,3-2,1); медиана ОВ составляла 7,3 мес. (95% CI 3,0-NE) и 7,7 мес. (95% CI 2,2-13,9) соответственно. В когортах B и C ответов на лечение не было зарегистрировано.
Профиль безопасности соответствовал первичному анализу. Наиболее частыми НЯ были гастроинтестинальная и гематологическая токсичность. Интерстициальное заболевание легких/пневмонит были выявлены у 8 (9,3%) пациентов, в том числе у троих (3,5%) они были 5 степени тяжести.
Таким образом, терапия трастузумабом дерукстеканом продемонстрировала свою эффективность у пациентов с нерезектабельным/ метастатическим КРР с гиперэкспрессией HER2 (ИГХ 3+ или ИГХ 2+/ISH+).
Исследование III фазы JCOG1018 RESPECT: оценка эффективности химиотерапии по схеме mFOLFOX7 или CapeOX в сочетании с бевацизумабом в сравнении с химиотерапией по схеме 5-фторурацил/лейковорин или капецитабин в сочетании с бевацизумабом в качестве первой линии лечения пожилых пациентов с мКРР [11].
В исследование JCOG1018 RESPECT включен 251 пациент с мКРР. Все больные были рандомизированы на 2 группы: группу пациентов, получающих химиотерапию комбинацией фторпиримидинов плюс бевацизумаб с оксалиплатином (CapeOX/mFOLFOX7) (126 пациентов), и группу пациентов, получающих схему без оксалиплатина, комбинацию 5-фторурацила/лейковорина или капецитабина плюс бевацизумаб (125 пациентов). Медиана возраста составила 80 лет в группе лечения без оксалиплатина и 79 лет в группе комбинированной химиотерапии с добавлением оксалиплатина (общий диапазон 70-91 год). Медиана ВБП составила 10,0 мес. в группе CapeOX/mFOLFOX7, бевацизумаб и 9,4 мес. в группе 5-фторурацил/лейковорин или капецитабин с бевацизумабом (HR 0,837; 95% CI 0,673-1,042; P=0,086). ЧОО составила 47,7% и 29,5% в двух группах соответственно. Медиана ОВ составила 19,7 мес. в группе оксалиплатина и 21,3 мес. в группе без оксалиплатина (ОР 1,058; 95% CI 0,808-1,386). Наиболее частыми НЯ 2-4 степени (в группах оксалиплатина и без оксалиплатина соответственно) были сенсорная невропатия (57% и 15%), утомляемость (32% и 21%), тошнота (22% и 10%), диарея (16% и 7%) и нейтропения (24% и 15%). Зарегистрировано 3 летальных исхода, связанных с лечением, в группе пациентов, получавших лечение с оксалиплатином, и 1 – в группе без оксалиплатина.
Согласно результатам исследования, применение комбинированной химиотерапии с добавлением
оксалиплатина в составе первой
линии лечения пожилых пациентов с мКРР не имеет преимуществ
перед комбинацией фторпиримидинов с бевацизумабом и обладает
меньшей токсичностью. Комбинация фторпириминов и бевацизумаба является рекомендуемым режимом 1 линии лечения пожилых
пациентов с мКРР.
Прогностическое влияние раннего прекращения лечения и ранней отмены оксалиплатина у пациентов, получающих адъювантную химиотерапию по поводу рака толстой кишки III стадии. Объединенный анализ ACCENT/ IDEA 11 исследований [12].
В исследовании оценивалось прогностическое влияние раннего прекращения лечения и ранней отмены оксалиплатина у пациентов с III стадией КРР, принимавших участие в 11 клинических исследованиях, входящих в базы данных ACCENT и IDEA, где пациентам планировалось проведение 6-месячной адъювантной химиотерапии с включением фторпирирминов и оксалипалина (FOLFOX или CAPOX). Раннее прекращение лечения определялось как проведение до 75% курсов химиотерапии. Ранняя отмена оксалиплатина определялась как проведение до 75% курсов с включением оксалиплатина при продолжении приема фторпиримидинов. Связь между ранней отменой лечения и ранней отменой оксалиплатина и ОВ, а также БРВ оценивали с помощью модели Кокса, скорректированной с учетом прогностических факторов.
При анализе результатов лечения пациентов, получавших 6-месячную адъювантную химиотерапию по схеме XELOX или FOLFOX по поводу рака толстой кишки III стадии, раннее прекращение лечения было связано со значительным снижением БВД и ОВ (HR 1,40, 95% CI 1,23-1,58, p<0,001, и HR 1,51 95% CI 1,31-1,74, p<0,001 соответственно). Напротив, раннее прекращение приема оксалиплатина (EOD) не было связано со снижением БВД или ОВ (HR 1,10, 95% CI 0,77- 1,58, p=0,6, и HR 0,97, 95% CI 0,62-1,52, p=0,9 соответственно).
Авторы исследования пришли к выводу, что у пациентов с КРР III стадии важно поддерживать запланированное количество циклов адъювантной терапии. Однако при развитии периферической нейропатии 1-2 степени прекращение приема оксалиплатина через 3 мес. является допустимым вариантом терапии, который не ухудшит клинические результаты лечения.
Рисунок 6.
Общая выживаемость в группах химиотерапии
комбинацией фторпиримидинов плюс бевацизумаб с
оксалиплатином (CapeOX/mFOLFOX7) и без оксалиплатина.
Источники:
1. Kato K, Ito Y, Daiko H, et al. A randomized controlled phase III trial comparing two chemotherapy regimen and chemoradiotherapy regimen as neoadjuvant treatment for locally advanced esophageal cancer, JCOG1109 NExT study. Presented at ASCO GI 2022; January 20-22, 2022. Abstract 238.
2. André T, Tougeron D, Piessen G, et al. Neoadjuvant nivolumab plus ipilimumab and adjuvant nivolumab in patients (pts) with localized microsatellite instabilityhigh (MSI)/mismatch repair deficient (dMMR) oeso-gastric adenocarcinoma (OGA): the GERCOR NEONIPIGA phase II study. J Clin Oncol. 2022; 40(suppl 4): 244. doi:10.1200/JCO.2022.40.4_ suppl.244.
3. Bekaii-Saab TS, Spira AI, Yaeger R, et al. KRYSTAL-1: Updated activity and safety of adagrasib (MRTX849) in patients (Pts) with unresectable or metastatic pancreatic cancer (PDAC) and other gastrointestinal (GI) tumors harboring a KRASG12C mutation. J Clin Oncol. 2022; 40(suppl 4): 519. doi:10.1200/ JCO.2022.40.4_suppl.519.
4. Hammel P, El-Hariry I, Macarulla T, et al. Trybeca-1: A randomized, phase 3 study of eryaspase in combination with chemotherapy versus chemotherapy alone as second-line treatment in patients with advanced pancreatic adenocarcinoma (NCT03665441). Presented at ASCO GI 2022; January 20-22, 2022. Abstract 518.
5. Oh DY, He AR, Qin S, et al. A phase 3 randomized, double-blind, placebocontrolled study of durvalumab in combination with gemcitabine plus cisplatin (GemCis) in patients (pts) with advanced biliary tract cancer (BTC): TOPAZ-1. Presented at: American Society of Clinical Oncology Gastrointestinal Cancers Symposium (ASCO GI), January 20-22, 2022; San Francisco, CA; Abstract 378.
6. Abou-Alfa G, Chan SL, Kudo M, et al. Phase 3 randomized, open-label, multicenter study of tremelimumab (T) and durvalumab (D) as first-line therapy in patients (pts) with unresectable hepatocellular carcinoma (uHCC): HIMALAYA. J Clin Oncol. 2022; 40(suppl; abstr 379). doi:10.1200/JCO.2022.40.4_ suppl.379.
7. Cao F, Yang Y, Si T, et al. Effectiveness of transarterial chemoembolization combined with lenvatinib plus sintilimab in unresectable hepatocellular carcinoma. Presented at the 2022 American Society of Clinical Oncology Gastrointestinal Conference. Abstract #414.
8. Morris VK, Parseghian CM, Escano M, et al. Phase I/II trial of encorafenib, cetuximab, and nivolumab in patients with microsatellite stable, BRAFV600E metastatic colorectal cancer. J Clin Oncol. 2022; 40 (suppl; abstr 12). doi:10.1200/ JCO.2022.40.4_suppl.012.
9. Friedrich T, Blatchford PJ, Lentz RW, et al. A phase II study of pembrolizumab, binimetinib, and bevacizumab in patients with microsatellite-stable, refractory, metastatic colorectal cancer (mCRC). J Clin Oncol. 2022; 40 (suppl; abstr 118). doi:
10.1200/JCO.2022.40.4_suppl.118. 10.Yoshino T, Di Bartolomeo M, Raghav K, et al. Trastuzumab deruxtecan (T-DXd; DS-8201) in patients (pts) with HER2- expressing metastatic colorectal cancer (mCRC): final results from a phase 2, multicenter, open-label study (DESTINYCRC01). J Clin Oncol. 2022; 40 (suppl; abstr 119). doi:10.1200/JCO.2022.40.4_ suppl.119.
11.Hamaguchi T, Takashima A, Mizusawa J, et al. A randomized phase III trial of mFOLFOX7 or CapeOX plus bevacizumab versus 5-FU/l-LV or capecitabine plus bevacizumab as initial therapy in elderly patients with metastatic colorectal cancer: JCOG1018 study (RESPECT). Presented at ASCO GI 2022; January 20-22, 2022. Abstract 10.
12.Gallois C, Shi Q, Meyers JP, et al.
Prognostic impact of early treatment
discontinuation and early oxaliplatin
discontinuation in patients treated with
6 months of oxaliplatin-based adjuvant
chemotherapy for stage III colon cancer:
An ACCENT/IDEA pooled analysis of
11 trials. Presented at ASCO GI 2022;
January 20-22, 2022. Abstract 11.
ДИСКУССИОННАЯ СЦЕНА: ПЕРВИЧНАЯ ЦИТОРЕДУКЦИЯ ИЛИ НЕОАДЪЮВАНТНАЯ ХИМИОТЕРАПИЯ ПРИ РАСПРОСТРАНЕННОМ РАКЕ ЯИЧНИКОВ
Автор: Румянцев Алексей Александрович
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина»
Минздрава России, Москва

Биологические особенности рака
яичников дают ему «суперспособность» к раннему и быстрому распространению по брюшной полости.
Это, а также отсутствие программ
ранней диагностики, приводит к
тому, что в 60-70% случаев мы диагностируем рак яичников на III-IV
стадии опухолевого процесса.
Хирургический метод играет одну
из самых важных ролей в лечении
всех стадий РЯ. Как мы знаем, именно полная циторедукция позволяет
рассчитывать на наилучшие результаты лечения пациенток. Наиболее
известным из исследований на эту
тему является метаанализ du Bois и
соавторов (n=3126) [1]. В этой работе
медиана общей выживаемости (ОВ)
пациенток составила 99,1 мес. в группе пациенток с полной циторедукцией, 36,2 мес. в группе с оптимальной
циторедукцией (<1 см) по сравнению
с 29,6 мес. в группе с неоптимальной
циторедукцией (p<0,0001). Именно
полная циторедукция с удалением
всех макроскопических проявлений
заболевания должна являться основной целью лечения пациенток с
поздними стадиями рака яичников
во всех случаях, когда возможно ее
достижение. Это утверждение справедливо и при выраженной диссеминации опухолевого процесса [2,3].
Данные ведущих онкологических
клиник, внедривших в свою рутинную клиническую практику проведение агрессивного хирургического
лечения поздних стадий рака яичников, демонстрируют, что достижение
полной циторедукции может являться стандартной хирургической
практикой. «Классический» пример
– работа Chi D. с соавторами, где проведен сравнительный анализ результатов лечения пациенток с IIIC-IV
стадиями РЯ в различные периоды
времени [4]. В 2001 году стандартной
практикой хирургического лечения
в Memorial Sloan Kettering Cancer
Center стали расширенные хирургические вмешательства при РЯ,
включая выполнение резекций диафрагмы, спленэктомии, дистальной
панкреатэктомии, резекций печени
и т.д. В анализ было включено 378
пациенток, которые были разделены
на две группы: пациентки в группе
1 получали лечение в период с 1996
по 1999 гг., пациентки в группе 2 – с
2001 по 2004 гг. Сформированные
группы были сбалансированы по
основным характеристикам. За проанализированный период времени
частота оптимальной циторедукции
возросла с 35% до 52%, полной циторедукции – с 11% до 27%. Авторы сообщили о значительном увеличении
числа вмешательств на верхних отделах брюшной полости (с 0% до 38%)
и резекций толстой кишки (с 6% до
35%). При этом расширение объема
оперативного вмешательства сопровождалось значимым повышением
интраоперационной кровопотери,
частоты развития инфекционных
осложнений, а также времени проведения оперативного вмешательства. Медиана ПЖ составила 54 мес.
в группе 2 по сравнению с 43 мес. в
группе 1 (p=0,003). Показатель общей
выживаемости (ОВ) в течение 5 лет
составил 47% и 35% соответственно.
Различия между группами не могут
быть объяснены изменением подхода к лекарственной терапии пациенток, так как практика системной
химиотерапии для больных в этот
период времени оставалась неизменной.
В 2011 году Harter с соавторами опубликовали результаты анализа последовательного внедрения расширенных хирургических вмешательств
при РЯ, в который было включено
396 пациенток, проходивших лечение в период с 1997 по 2008 год [5]. В
практику клиники в 2001 году была
внедрена программа управления качеством лечения онкогинекологических пациенток. Было отмечено последовательное увеличение частоты
оптимальных и полных циторедукций, вместе с которой улучшались и
отдаленные результаты лечения. За
указанный временной период частота оптимальных циторедукций увеличилась с 65% до 86%, в том числе
полных – с 33% до 62%. Медиана ПЖ
увеличилась с 26 до 45 мес. (p<0,003).
Авторы исследования отмечают, что
частота выполнения парааортальной
лимфодиссекции возросла с 32% до
76%, резекций кишечника – с 35%
до 62%, операций на диафрагме – с
2% до 40%, также был отмечен рост
частоты спленэктомий и резекций
печени. Параллельно с улучшением
качества хирургического лечения
было отмечено и удлинение медианы длительности операции – с 287
мин. в 1997-2000 гг. до 379 мин. в
2004-2008 гг. Главным достоинством
вышеуказанных исследований является то, что они отражают реальную
клиническую практику и доказывают возможность увеличения ПЖ
пациенток с поздними стадиями РЯ
за счет повышения качества оперативного лечения. Безусловно, биологические особенности опухоли
оказывают влияние на результаты
лечения пациенток, однако значительное улучшение результатов лечения больных в этих центрах произошло вследствие изменения подхода к
хирургическому лечению, а не за счет
появления большего числа больных
с менее агрессивными опухолями._
Таким образом, выполнение полной
циторедукции при условии наличия должного оснащения и высокой
квалификации хирургов-онкогинекологов возможно во многих случаях, и именно их достижение должно
являться основной целью лечения
больных распространенным РЯ.
Как это все относится к теме дискуссии? На момент постановки диагноза
у большинства пациенток с РЯ отмечается выраженная диссеминация
опухолевого процесса, а проведение
химиотерапии может позволить добиться значительной регрессии опухоли. Уменьшение опухолевой массы
способствует улучшению общего состояния пациенток, снижению технической сложности оперативного
вмешательства и риска развития послеоперационных осложнений. Кроме того, интервальная циторедукция
позволяет оценить клинический эффект предоперационного лечения.
Вышеперечисленные «преимущества» могут представлять целесообразным проведение нескольких
курсов химиотерапии на дооперационном этапе с последующим хирургическим лечением в условиях
лучшего общего состояния пациентки и меньшей распространенности
опухолевого процесса.
С целью получения ответа на вопрос об оптимальной тактике начального этапа лечения пациенток с
поздними (III-IV) стадиями РЯ было
проведено два крупных рандомизированных исследования – EORTC
и CHORUS, посвященных прямому
сравнению первичной и интервальной циторедукции. Суммарно в этих
исследованиях приняли участие 1222
пациентки, результаты их лечения
представлены в таблице 1.
Таблица 1.
Основные результаты исследований
CHORUS и EORTC [6-9].
Таблица 2.
Результаты лечения пациенток
с распространенным раком яичников при проведении
первичной циторедукции.

Ни в одном из исследований не было
выявлено различий в выживаемости
без прогрессирования или ПЖ пациенток в зависимости от проведенного начального лечения. Результаты
этих двух работ привели авторов к
выводам, что данные подходы к лечению распространенного рака яичников имеют равнозначную эффективность. Полученные результаты могли
бы поставить точку в споре о выборе
оптимальной тактики лечения распространенного РЯ.
Тем не менее, более глубокий анализ
результатов вышеописанных исследований (то есть если прочитать их
чуть дальше абстракта) и их сравнение с другими исследованиями, проведенными в тот же период времени,
вызывают много вопросов. Медиана ПЖ пациенток, принимавших
участие в исследованиях EORTC и
CHORUS, в группах первичной циторедукции была очень низкой и
составила всего 22,6 и 29,0 мес. Эти
показатели не сопоставимы с теми,
которые достигаются при проведении первичной циторедукции в ведущих клиниках (табл.2).
Результаты исследований, приведенные в таблице 2, демонстрируют, что
медиана ПЖ при проведении первичной циторедукции может достигать 42-58 мес., это значительно превосходит показатели, достигнутые в
исследованиях CHORUS и EORTC.
Схожие различия наблюдаются и в
отношении показателя ВБП. То есть
на результаты лечения пациенток в
исследованиях EORTC и CHORUS
невозможно смотреть без слез – они
соответствуют результатам, которые
достигались в 1980-1990-х гг., или
даже несколько уступают им. Например, в 1996 году были опубликованы
результаты исследования GOG-111,
в рамках которого сравнивалась эффективность химиотерапии по схеме
циклофосфамид + цисплатин и паклитаксел + цисплатин после неоптимальной циторедукции. Медиана ПЖ
среди пациенток, получавших химиотерапию с использованием паклитаксела, достигла 36 мес. [15].
Вероятной причиной столь печальных показателей выживаемости пациенток в исследованиях CHORUS и EORTC является недопустимо низкое качество хирургического лечения. В группе первичной циторедукции медиана времени операции составила 165-180 минут в исследовании EORTC, в исследовании CHORUS – 120 минут. В исследовании CHORUS у 67 (27%) пациенток не была даже выполнена гистерэктомия, у 61 (24%) пациентки объем хирургического лечения не включал даже двустороннюю сальпингоовариэктомию и оментэктомию, т.е. им была выполнена эксплоративная лапаротомия. Менее чем у 10% пациенток была выполнена тазовая или парааортальная лимфаденэктомия. В обоих исследованиях удаление опухолевых узлов, располагающихся в верхнем этаже брюшной полости, проводилось в единичных случаях. Число полной и оптимальной циторедукций в этих исследованиях подтверждает данную точку зрения. Несколько позже были опубликованы результаты японского исследования III фазы JCOG0302. Дизайн данного исследования соответствует дизайну исследований EORTC и CHORUS. В нем приняла участие 301 пациентка с диссеминированным РЯ, больные рандомизировались в группу первичной циторедукции с последующим проведением химиотерапии (n=149) или в группу неоадъювантной химиотерапии (n=152) с последующей интервальной циторедукцией. В целом, оно страдает всеми теми же «болезнями», что и вышеприведенные исследования. Медиана времени длительности хирургического лечения в группе первичной циторедукции было значимо меньше, чем в группе интервальной циторедукции. Комментарии излишни. В качестве аргументов в защиту предоперационной химиотерапии ее сторонники выдвигают техническую невыполнимость оптимальной циторедукции на первом этапе лечения пациенток с распространенным опухолевым процессом и повышение вероятности ее достижения после проведения нескольких курсов химиотерапии. Отметим только, что прогностическая значимость полной или оптимальной циторедукции после предоперационной химиотерапии и первичной циторедуктивной операции неодинакова. В подгрупповом анализе исследования CHORUS было выявлено, что медиана ОВ пациенток в группе первичной циторедукции была больше в случае достижения оптимальной циторедукции (медиана ОВ в данной подгруппе пациенток составила 36,8 мес. в группе первичной циторедукции по сравнению с 23,2 мес. в группе интервальной циторедукции). Необходимо также отметить, что показатели выживаемости больных в группах полной циторедукции в исследованиях CHORUS и EORTC также являются очень низкими. В таблице 3 суммированы данные по результатам лечения больных с поздними стадиями РЯ при достижении полной первичной циторедукции. Представленные выше данные свидетельствуют о существовании феномена клинической неравноценности оптимальной или полной циторедукции при сравнении первичной циторедукции и неоадъювантной химиотерапии. Вероятной его причиной является то, что первичная циторедукция приводит к удалению всех или большинства макроскопических проявлений болезни, а оставшиеся микроскопические очаги, никогда ранее не подвергавшиеся лекарственной терапии, имеют высокий шанс уничтожения после системной химиотерапии. Вследствие этого, химиотерапия после первичной оптимальной или полной циторедукции повышает вероятность эрадикации опухолевых клеток, что улучшает отдаленные результаты лечения. Значительное уменьшение размеров опухоли на фоне проведения предоперационной химиотерапии снижает число крупных трудно удаляемых метастазов, но увеличивает количество мелких опухолевых очагов, которые многие хирурги не считают необходимым удалять во время интервальной циторедукции, надеясь на дальнейший успех химиотерапии. А именно эти метастатические очаги содержат клетки, оказавшиеся устойчивыми к проведенному ранее лечению, особенно после длительного временного интервала, связанного с послеоперационным восстановительным периодом. Последующая химиотерапия после интервальной циторедукции не всегда способна уничтожить данные типы клеток. Отказ от первичной циторедукции и проведение химиотерапии не является оптимальным лечебным подходом. К нему следует прибегать лишь в явных случаях невозможности выполнения хирургического лечения на первом этапе лечения пациентки. Предоперационная терапия на первом этапе лечения больных может быть оправданна, но только в том случае, когда исходное состояние больных или выраженная диссеминация опухолевого процесса делают невозможным радикальное хирургическое лечение. P.S. Как известно, никто не любит оперировать пациенток с распространенным раком яичников больше, чем химиотерапевты. Надеюсь, что уже в скором времени результаты исследования TRUST поставят точку в извечном споре. In TRUST we trust, так сказать.
Таблица 3.
Результаты лечения больных раком яичников
после полной первичной циторедукции.
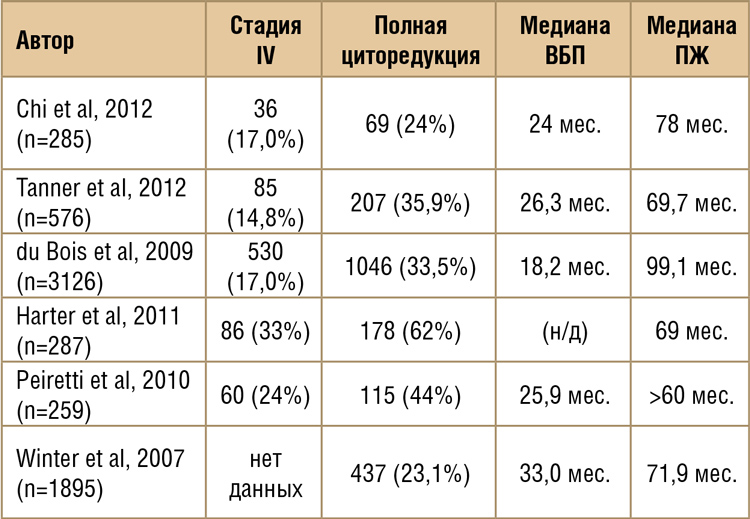
Источники указаны на сайте:
https://www.rosoncoweb.ru/news/
oncology/2022/02/11-1/
Автор: Молчанов Сергей Валериевич
Городской клинический онкологический диспансер,
Санкт-Петербург

Начиная нашу дискуссию относительно целесообразности использования первичной циторедуктивной
хирургии или неоадъювантной химиотерапии, следует немного коснуться истории вопроса. В 2002 году
было опубликовано одно из ключевых исследований, посвященных циторедуктивным операциям при раке
яичников [1]. Было показано, что результаты лечения этой сложной категории больных напрямую зависят от
размера остаточной опухоли после
вмешательства, что было четко отражено на ставшем уже классическом
графике (рис.1):
Рисунок 1.
Медиана общей
выживаемости в зависимости
от степени циторедукции у больных
раком яичников [1].
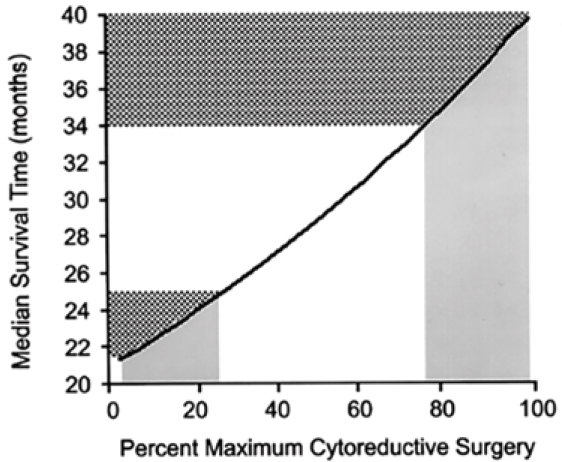
В 2009 году Chi et al. выносят на суд
общественности собственный анализ, в котором показана растущая
роль «продвинутой», не только тазовой, но и абдоминальной и даже
торакальной хирургии как единственного важного критерия, касающегося хирургии, реально влияющего на продолжительность жизни
больных диссеминированным раком
яичников [2]. В статье опубликован
преобразованный график в зависимости от изменения хирургической
парадигмы по годам, который также
стал «живой классикой» (рис.2):
Рисунок 2.
Медиана общей
выживаемости в зависимости
от степени циторедукции и изменений
в хирургической тактике [2].
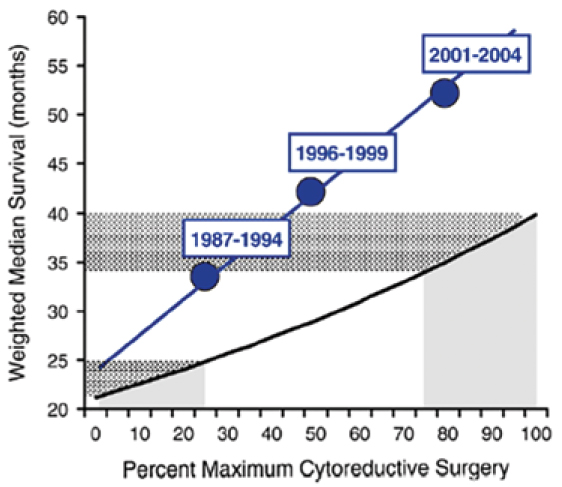
Эта публикация в последующем
стала одной из отправных точек
внедрения продвинутой, агрессивной хирургии в лечение больных распространенным раком
яичников. В последующие годы
началась «гонка вооружений», команды хирургов соревновались в
своем мастерстве, частоте полных
циторедуктивных операций, что,
несомненно, должно было повлечь
за собой улучшение результатов
лечения этой сложной категории
больных. Что же мы получили на
выходе, когда пришла пора оценки
результатов? Безусловно, есть результаты исследований, как правило, крупных центров, где действительно первичная циторедукция
(primary debulking surgery, PDS)
имела преимущество по сравнению
с неоадъювантной химиотерапией и интервальной циторедукцией
(interval debulking surgery, IDS), но
только за счет операций без видимой визуальной остаточной опухоли. Позвольте не касаться этих исследований, о которых наверняка
будет писать мой оппонент, равно
как и не затрагивать исследования
по оценке возможности выполнения полной циторедукции.
Но позвольте предоставить результаты только лишь одного исследования, посвященного сравнению
эффективности PDS и IDS. Одним
из самых крупных и недавних подобных анализов является метаанализ из Cochrane Library, результаты которого были опубликованы
в 2021 году [3]. В резюме авторы
указывают, что различий в выживаемости среди исследуемых
групп практически нет, но использование НАХТ с последующей IDS снижает риск серьезных
осложнений, связанных с хирургией, снижает уровень послеоперационной смертности и необходимость формирования стомы.
Рекомендовано использование
мультидисциплинарных хирургических команд, информирование
пациентки о трудностях и возможных осложнениях, связанных
с хирургией, и, кроме того, тактика
лечения должна определяться возможностью выполнения полной
циторедукции с учетом возраста,
гистологического варианта, стадии
процесса и состояния пациентки.
Вряд ли у кого-то вызывает сомнения достоверность метаанализов
из базы Cochrane.
Между тем, подобные результаты
публиковались и ранее: на протяжении многих лет авторы анализировали не только возможность,
но и целесообразность первичных
операций.
Одним из первых исследований,
посвященных не только онкологическим результатам, но и оценке
осложнений при первичной и интервальной циторедукции, было
исследование Fagotti A. et al. [4].
Проведенный анализ показал значимо более высокий уровень осложнений III-IV степени по шкале
Clavien-Dindo в группах первичных циторедукций. В группе PDS
их частота составила 52,7%, в IDS
– 5,7% (p=0,0001). Отмечено, что
наиболее частым осложнением при
этом был экссудативный плеврит,
требовавший дренирования плевральной полости. Осложнения IV
и V степени встречались только в
группе PDS, их частота составила
5,4% и 3,6% соответственно.
Дальнейшие результаты этого исследования также не показали
значимых отличий в отдаленных
результатах лечения в исследуемых группах [5]. Медиана времени
до прогрессирования и общей выживаемости составили в группе
PDS 15 и 41 месяц, а в группе IDS –
14 и 41 месяц соответственно. При
этом отмечено повышение уровня
больших послеоперационных осложнений при проведении первичной циторедукции (25,9%) по
сравнению с интервальной (7,6%,
p=0,0001).
В связи с этим стали появляться
исследования, целью которых был
анализ риска развития осложнений в результате первичных циторедуктивных операций и, соответственно, целесообразности
PDS. Так, в исследовании Vizzielli
G. et al. была предложена модель
оценки риска развития «больших»
осложнений в послеоперационном
периоде с использованием лапароскопии [6]. При проведении многофакторного анализа были выделены 4 критерия, в конечном итоге
по мнению авторов влияющие на
выбор тактики: состояние пациентки по шкале ECOG, количество
асцитической жидкости, уровень
CA-125 в сыворотке, индекс PIV
(Predictive Index Value), определяемый при диагностической лапароскопии и, по сути, отражающий
распространенность канцероматоза (табл.1).
Таблица 1.
Факторы риска
для развития «больших»
осложнений после
первичных циторедукций [6]..

Отмечено, что при уровне данного показателя ≤2 риск развития осложнений низкий, при 3-5 баллах – умеренный, при 6-8 – высокий (от 26,7% до 47,9%), при котором, возможно, лучше воздержаться от выполнения первичной циторедуктивной операции. Проводились попытки сопоставить риск больших осложнений с выраженностью перитонеальтного канцероматоза. Так, отношение шансов (odda ratio, OR) для уровня PCI (Peritoneal Cancer Index) ≥21 в плане осложнений составило, по данным шведских авторов, 5,481, кроме того, был высок риск при уровне альбумина <33 г/л (OR=4,349) [7]. Авторами отмечено, что частота послеоперационных больших осложнений (≥3 по шкале Clavien-Dindo) была статистически значимо выше при первичной циторедукции по сравнению с интервальной (31,6% против 12,2%), однако показано, что разницы в отдаленных результатах лечения в зависимости от алгоритма лечения пациенток нет. В исследовании китайских авторов проведен анализ эффективности отбора пациенток с диссеминированным раком яичников с помощью алгоритма Mayo [8]. Показана эффективность и перспективность данного подхода. Согласно шкале Mayo, с высоким риском осложнений/смертности пациенток при выполнении первичной циторедуктивной операции сопряжено наличие как минимум одного из трех нижеперечисленных факторов: 1. уровень альбумина менее 35 г/л; 2. возраст ≥80 лет; 3. возраст 75-79 лет в сочетании с одним и более факторов: a. состояние по шкале ECOG >1 (риск по шкале American society of anesthesiologists), b. IV стадия заболевания, c. вероятность комбинированной операции (объем более гистерэктомии с аднексэктомией, оментэктомией).
Рисунок 2.
Схема исследования TRUST [10].
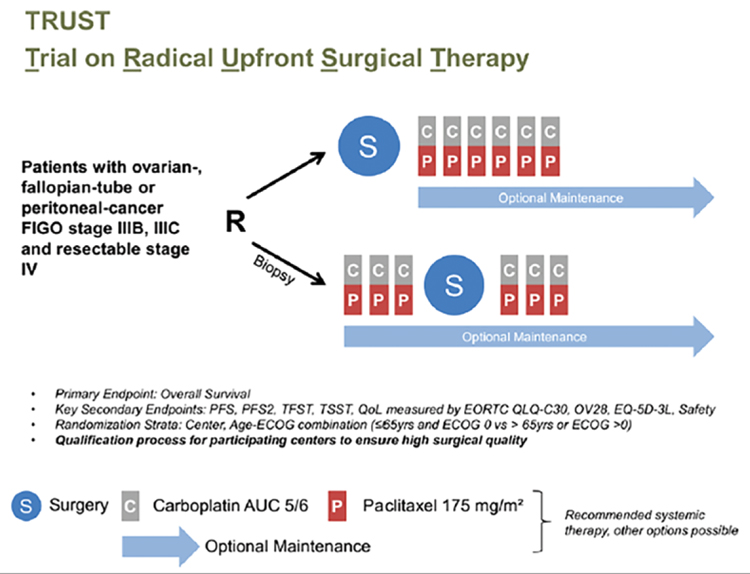
Кроме того, проводились попытки оценить не только онкологические результаты, но и уровень медицинских учреждений, в которых выполняются подобные вмешательства, а также их экономическую эффективность. В 2021 году были опубликованы результаты исследования, посвященного оценке тенденций развития циторедуктивной хирургии рака яичников [9]. В исследование вошли 79400 больных раком яичников, пятой части из которых (22%) были выполнены комбинированные циторедуктивные операции. Отмечено, что статистически значимо более часто комбинированные вмешательства выполнялись в крупных, специализированных, высокопотоковых стационарах. Анализ показал, что подобные операции сопряжены с более высоким уровнем послеоперационной летальности (1,6% против 0,5%, p<0,001), длительностью госпитализации (9,6 против 5,2, p<0,001) и стоимостью лечения (32132$ против 17363$, p<0,001). В завершение хотелось бы сказать, что продолжающиеся исследования, целью которых является определение оптимального времени выполнения циторедуктивной операции (первичной или интервальной), подтверждают тот факт, что эйфория хирургов от выполнения огромных первичных циторедукций прошла и, действительно, настало время анализа, кому, когда и где это возможно и необходимо. Так, в 2024 г. планируют обнародовать результаты международного исследования TRUST, посвященного этой проблеме [10], с анализом лечения 772 больных раком яичников, которые будут рандомизированы на 2 группы, как указано на рисунке ниже. Мы, хирурги, абсолютно не против проведения первичной циторедукции в широком смысле этого слова, но, на наш взгляд, она оправдана при ряде условий:
• при удовлетворительном состоянии пациентки, что бывает крайне редко при распространенном раке яичников; • при невысоком риске предполагаемых «больших» осложнений, что позволяет в относительно ранние сроки начать последующую химиотерапию;
• при согласии пациентки на различные исходы вмешательства, способные значительно ухудшить ее качество жизни (стома, гетеротопический мочевой пузырь и т.п.) – и это при доказанном сниженном риске этих исходов при начале лечения с неоадъювантной химиотерапии;
• при наличии мультидисциплинарной хирургической бригады, квалифицированных специалистов, занимающихся послеоперационным лечением этих больных (онкологов, специалистов интенсивной терапии);
• при соответствующем инструментальном и медикаментозном оснащении операционной, палаты интенсивной терапии и отделений, что могут позволить себе далеко не все онкологические учреждения;
• при условии выполнения таких операций в высокопотоковых центрах, где это оправданно и где подобная хирургия проводится не от случая к случаю, а на регулярной основе.
Источники указаны на сайте:
https://www.rosoncoweb.ru/news/
oncology/2022/02/11-1/
Результаты голосования*

*https://www.rosoncoweb.ru/news/oncology/2022/02/11-1/
Всего проголосовало: 35
СИМУЛЬТАННЫЙ ИНТЕГРИРОВАННЫЙ БУСТ (SIB): ОТ ИННОВАЦИИ К РУТИННОЙ ПРАКТИКЕ...
Автор: Петухов Евгений Алексеевич
ФГБУ «Главный военный клинический госпиталь
им. акад. Н.Н. Бурденко» МО РФ, Москва
Методика дистанционной лучевой терапии с модуляцией интенсивности (IMRT) в настоящее время широко применяется в лечении целого ряда онкологических заболеваний, демонстрируя очевидный выигрыш в более конформных планах по сравнению с 3D-CRT. Востребованность технологий IMRT и VMAT продиктована возможностью реализации симультанного интегрированного буста (SIB) как с целью эскалации разовой дозы без увеличения общего времени лечения и частоты возникновения лучевой токсичности, так и с целью сокращения общего времени лечения без снижения суммарной дозы. Методика SIB-IMRT (SIB-VMAT) позволяет одновременно использовать различные терапевтические дозы для нескольких целевых объемов в едином плане лечения с оптимальным дозным распределением.
Инновационная методика, названная первоначально SMART boost (одновременная модулированная ускоренная лучевая терапия), была разработана в Медицинском колледже Бэйлора в 1994 году. По сравнению с другими схемами ускоренного фракционирования, которые заключались либо в увеличении количества фракций в день до двух, либо включали более пяти фракций в неделю, технология SMART boost представляла собой одну процедуру в день, пять фракций в неделю в течение 5 недель и позволяла доставлять к целевому объему высокого риска разовую дозу 2,4 Гр при одновременном облучении в режиме классического фракционирования 2 Гр области регионального метастазирования. Впервые результаты лечения методикой SMART boost были продемонстрированы для опухолей области головы и шеи (ОГШ), так как считалось, что сокращение общего времени лечения для этих больных потенциально может улучшить контроль над опухолью за счет минимизации регенерации опухолевых клеток. В этих исследованиях повышение биологически эквивалентной дозы (BED) как на целевой объем, так и на окружающие здоровые ткани при использовании методики интегрированного буста с разовой дозой за фракцию >2 Гр приводило к увеличению частоты острой лучевой токсичности. При этом частота полных ответов на лечение не уступала стандартной методике последовательного подведения дозы (SEQ) [1].
Доставка эскалированной разовой дозы к целевому объему высокого риска может повлечь увеличение токсичности здоровых тканей, входящих в этот объем, в то же время, благодаря высокой конформности планов IMRT/VMAT, существует возможность максимально обойти окружающие органы риска. Mohan и соавт., изучая радиобиологические аспекты методики IMRT при облучении опухолей ОГШ, предположили возникновение неприемлемой токсичности в случае сокращения числа фракций <30 и повышения суммарной дозы >70 Гр [2]. За последующие 20 лет во всем мире применялись различные ускоренные режимы гипофракционирования SIB-IMRT как в самостоятельном лечении опухолей ОГШ, так и в сочетании с одновременной химиотерапией. Однако до настоящего времени определить оптимальную схему фракционирования не представляется возможным. Для опухолей ОГШ известно, что разовая доза, суммарная доза и общее время лечения сложным образом влияют на контроль над опухолью и на частоту развития острой и поздней лучевой токсичности. Что касается общей дозы облучения, то в ряде исследований была продемонстрирована прямая корреляция между общей дозой и ответом опухоли на лечение, а также между общей дозой и частотой развития тяжелых (>3 степени) острых и поздних нежелательных явлений [1].
В попытке систематизации результатов целого ряда гетерогенных по количеству пациентов, локализации первичной опухоли, стадии заболевания, условиям проведения лучевой терапии и дизайну исследований, посвященных применению методики SIB-IMRT в лечении опухолей ОГШ, учеными сделаны несколько обзорных публикаций в течение последнего года. Так, в критическом анализе литературы, выполненном радиотерапевтами из Италии, приводятся данные о сериях ретроспективных исследований, посвященных лечению опухолей ОГШ, проанализированы режимы фракционирования при использовании методики IMRT с технологией SIB (12 схем в 14 онкологических центрах по всему миру). Подавляющее большинство центров придерживались режимов гипофракционирования. Два наиболее часто встречаемых режима: умеренное гипофракционирование (≤2,2 Гр за фракцию, с общим временем лечения в диапазоне от 6 до 6,5 недель) и режим с эскалацией дозы >2,3 Гр за фракцию (с более высокой суммарной дозой и общем временем лечения 5-6,5 недель) использовались как самостоятельно, так и с одновременной химиотерапией (ХТ) на основе платины. В других схемах фракционирования разовая доза на целевой объеме высокого риска была увеличена до 2,2 Гр за фракцию (суммарная доза 66-70 Гр за 30-33 фракции) c одновременной ХТ. Авторами приводятся результаты III фазы крупных ретроспективных рандомизированных исследований, в которых стандартом являлся режим умеренного гипофракционирования SIB-IMRT за 6 недель с одновременной ХТ цисплатином независимо от основной конечной точки исследования. Медиана наблюдения колебалась от 17 до 37 месяцев. В целом, локальный контроль находился в диапазоне от 80% до 90%, выживаемость составила около 80% (при времени наблюдения минимум 2 года). Частота тяжелых (>3 степени) острых лучевых реакций как для самостоятельного, так и для адъювантного лечения колебалась в диапазоне от 15% до 50%, в то время как частота поздних тяжелых токсических реакциях оставалась очень низкой. Безопасность и переносимость методики SIB в качестве доставки дозы при лечении опухолей ОГШ были протестированы в небольшом количестве проспективных исследований I-II фазы с одновременной ХТ и без нее. Так, Laurve и соавт. показали, что c доза 70,8 Гр за 30 фракций (по 2,36 Гр за фракцию) безопасна в качестве самостоятельного лечения плоскоклеточного рака ОГШ. Этот режим определял максимально переносимую разовую дозу, более высокая суточная доза за фракцию (2,46 Гр) приводила к развитию неконтролируемой тяжелой острой токсичности, что в свою очередь увеличивало длительность перерывов в лечении. С другой стороны, Leclerc и соавт. описали возможность повышения суммарной дозы до 75 Гр за 30 фракций (2,5 Гр за фракцию) с использованием SIB-IMRT без одновременной ХТ в случае ранних и умеренно распространенных опухолей ОГШ (T2N0-1 и T3N0). Данные об использовании SIB-IMRT с одновременной ХТ в трех вариантах разовых доз (2,25 Гр до суммарной дозы 63 Гр за 28 фракций; 2,4 Гр до суммарной дозы 67,2 Гр за 28 фракций; 2,17 Гр до суммарной дозы 65 Гр за 30 фракций) говорят о значительном росте частоты тяжелых (>3 степени) острых лучевых реакций (дисфагия и мукозит) у пациентов, получавших дозу 2,4 Гр за фракцию. Оценка отдаленных результатов показала высокие 5-летние показатели локорегионального контроля и выживаемости без прогрессирования при сохранении приемлемой поздней лучевой токсичности (6,4% случаев поздней тяжелой дисфагии). Еще одна стратегия улучшения локорегионального контроля, минимизирующая частоту поздней лучевой токсичности, заключалась в использовании методики SIB-IMRT с одновременной терапией цетуксимабом. Пациенты со II-III стадиями заболевания (T2-3N0; T1-3N1) получали 62,5 Гр за 25 фракций (разовая доза 2,5 Гр) в течение 5 недель. Этот метод лечения был эффективен при сохранении приемлемой острой лучевой токсичности и с низкой частотой развития поздней лучевой токсичности. Важно подчеркнуть, что для включенных в это исследование стадий целевые объемы облучения меньше, чем при местнораспространенных опухолях ОГШ (T4, N2-N3), поэтому разовая доза 2,5 Гр за 5 недель без увеличения общей дозы оказалась приемлемой для этой отдельной категории пациентов [3]. Авторы клинического обзора подводят итог, что, учитывая сопоставимость результатов представленных исследований, можно утверждать о безопасности и целесообразности применения режимов умеренного гипофракционирования SIB-IMRT c одновременной ХТ или терапией цетуксимабом с суммарной дозой ≤70 Гр за 30-33 фракции в большинстве случаев как радикальной, так и послеоперационной лучевой терапии опухолей ОГШ.
В метаанализе 7 ретроспективных исследований, включавших в общей сложности 1049 пациентов с опухолями ОГШ, Группа исследователей из Китая задалась целью сравнить клинические результаты SIB-IMRT и SEQ-IMRT. При анализе результатов лечения каждой из методик не оказалось существенной разницы в изменении общей выживаемости (OS) (ОР 0,94; 95% ДИ 0,70-1,27; Р=0,71), выживаемости без прогрессирования (PFS) (ОР 1,03; 95% ДИ 0,82-1,30; Р=0,79), выживаемости без локорегиональных рецидивов (LRFS) (ОР 0,98; 95% ДИ 0,65-1,47; Р=0,91) и выживаемости без отдаленных метастазов (DMFS) (ОР 0,87; 95% ДИ 0,50-1,53; Р=0,63). Более того, не было существенных различий в частоте возникновения побочных эффектов между Группами SIB-IMRT и SEQ-IMRT, оба метода демонстрировали достаточно высокую частоту развития острых лучевых повреждений [4]. Авторами сделан вывод о сопоставимости методик SIB-IMRT и SEQ-IMRT при лечении опухолей ОГШ, возможности рутинного применения обеих методик и отсутствии оптимального рекомендованного режима фракционирования.
Преимущество методики SIB по сравнению с методикой SEQ в сокращении срока лечения за счет умеренной эскалации дозы за фракцию при сохранении приемлемой лучевой токсичности доказательно продемонстрировано для опухолей ОГШ в большом количестве клинических исследований. И если вопрос предельной величины дозы за фракцию так или иначе проработан в большинстве исследований и сводится к тому, что разовая доза >2,4 Гр достоверно приводит к увеличению частоты лучевых реакций, то предел снижения разовой дозы (<2 Гр) при одновременном облучении нескольких целевых объемов четко не определен. Исторически методика SIB ставила целью увеличить разовую дозу для объема высокого риска при одновременном подведении классической дозы за фракцию 2 Гр на объем низкого риска. В дальнейшем были предложены схемы умеренного гипофракционирования (как пример, разовая доза 2,2 Гр на объем высокого риска и 1,8 Гр на область регионарного метастазирования). Таким образом удавалось не только эскалировать дозу, но и сократить общее время лечения (с 35 фракций до 33/30). Наряду с этим в стремлении снизить лучевую токсичность появлялись режимы одновременного облучения нескольких объемов, при котором максимальная разовая доза составляла 2/2,12 Гр за фракцию на область высокого риска, а дозы на объемы промежуточного и низкого рисков снижались до 1,8/1,6 Гр за фракцию.
Радиобиологические исследования показывают, что и опухоли ОГШ, и рано реагирующие ткани в меньшей степени зависимы от изменения дозы за фракцию, чем поздно реагирующие ткани. Доза за фракцию является доминирующим фактором в развитии поздних лучевых повреждений. Чувствительность к изменению дозы за фракцию для каждой ткани может быть определена количественно с использованием отношения α/β, значение которого характеризует форму ответа на облучение. Высокое отношение α/β (диапазон 7-20 Гр) как для рано реагирующих тканей, так для опухолей указывает на более линейный ответ выживания клеток-мишеней; низкое отношение α/β (диапазон 0,5-6 Гр), характерное для поздно реагирующих тканей с отсроченным ответом, определяет дугообразную кривую выживания клеток-мишеней [5]. Недавно опубликованный обзор демонстрирует широкую вариабельность в оценке параметров α и β для различных опухолей при использовании линейно-квадратичной модели (LQ) в рамках клинических исследований [6]. Maciejewski и соавт. заявляли значение отношения α/β не менее 15 Гр для опухолей полости рта и ротоглотки. Авторы предположили также относительную независимость контроля опухоли от вариаций дозы за фракцию в диапазоне 1,6-3 Гр. Для опухолей миндалин Withers и соавт. обнаружили незначительное влияние разовой дозы на ответ опухоли, значение отношения α/β 13 Гр и 16 Гр заявлены для рака гортани и носоглотки соответственно. Однако Lee и соавт. обнаружили, что разовая доза за фракцию ≥2,5 Гр оказывала значительное положительное влияние на контроль над опухолью при раннем раке гортани, предполагая более низкое значение α/β (ближе к 10 Гр). Острые лучевые реакции со стороны слизистых оболочек (ткани со значениями α/β от 7 до 10 Гр) в меньшей степени зависят от дозы за фракцию, хотя клинические исследования показывают, что при дозе на фракцию >2,45 Гр регенерация слизистой во время лучевого воздействия практически невозможна. С другой стороны, при разовой дозе <2 Гр восстановление слизистой происходило у 75% пациентов в течение последней недели лечения. В целом, доза за фракцию в диапазоне 1-3,5 Гр не является важным фактором, влияющим на частоту поздних лучевых реакций со стороны слизистых оболочек, и подразумевает причину их возникновения как следствие выраженных острых лучевых повреждений. К поздним лучевым повреждениям при облучении опухолей ОГШ относятся развитие остеонекроза нижней челюсти и миозита (расчетные значения α/β для указанных поздно реагирующих тканей составили 0,85 и 3,1 соответственно). Соотношение α/β для спинного мозга составило менее 3 Гр и, возможно, близко к 2 Гр, поэтому использование низких разовых доз, по-видимому, снижает частоту миелопатии. Parsons и соавт. обнаружили, что при суммарной дозе ≥60 Гр и дозе за фракцию ≥1,9 Гр риск развития нейропатии зрительного нерва составляет 47% против 11% в случаях, когда те же дозы подводились при фракционировании <1,9 Гр [5,6].
Очевидно, что до настоящего времени нет четких критериев выбора верхнего и нижнего предела дозы за фракцию при использовании SIB для лечения опухолей ОГШ. Выбор оптимального режима фракционирования должен осуществляться не только с целью повышения уровня контроля над заболеванием, но и снижения риска токсического воздействия на здоровые ткани как внутри, так и вне целевых объемов облучения. Например, в случае 33 фракций за 6,6 недель выбор общей дозы 70 Гр для целевого объема высокого риска (разовая доза 2,12 Гр) может считаться приемлемым с точки зрения риска развития лучевой токсичности здоровых тканей, попадающих в этот объем, но, с другой стороны, предполагает чрезмерное снижение дозы за фракцию для целевого объема низкого риска (зоны регионарного метастазирования) при назначении стандартной дозы 50 Гр (разовая доза 1,51 Гр). В этой ситуации доза для объема низкого риска может быть увеличена до 54 Гр (разовая доза 1,64 Гр), а для целевого объема промежуточного риска до 59,4 Гр (разовая доза 1,8 Гр). Напротив, режим фракционирования 25 сеансов за 5 недель при разовой дозе 2 Гр за фракцию на объем низкого риска приведет к чрезмерному увеличению разовой дозы на объем высокого риска (например, 2,4 Гр для суммарной дозы 60 Гр), что в свою очередь повысит риск развития лучевой токсичности здоровых тканей с поздним ответом. Более того, снижение общего времени лечения на 2 недели может быть труднопереносимым для рано реагирующих тканей (в первую очередь слизистых оболочек) [5].
Пандемия COVID-19 создает новые проблемы и диктует свои правила, в том числе в лучевой терапии пациентов с опухолями ОГШ. Негативные последствия отсрочки химиолучевой терапии ставят в приоритет этих пациентов, которым целесообразно продолжение лучевой терапии даже при подтверждении инфекции SARSCoV-2 и отсутствии у пациентов тяжелых симптомов и дополнительных факторов риска. В случае ранних стадий предпочтительным вариантом является стандартная химиолучевая терапия с использованием методики SIB, поскольку она позволяет сократить общее время лечения. Следует рассмотреть схему SIB-IMRT или SIBVMAT с дозой 70 Гр за 33 фракции. Для местнораспространенных стадий рекомендуются режимы гипофракционирования с возможным отказом от химиотерапии для пожилых пациентов и пациентов с тяжелыми сопутствующими заболеваниями. Режим умеренного гипофракционирования с суммарной дозой 60 Гр за пять недель и разовой дозой 2,4 Гр можно рассматривать в случаях низкого риска прогрессирования. Одновременная химиотерапия вызывает споры при значениях разовых доз >2,4 Гр. При выборе режима гипофракционирования всегда должны оцениваться дозные нагрузки на органы риска с использованием рекомендаций клинических исследований или на основе линейно-квадратичной модели. Любое терапевтическое решение должно быть основано на тщательном анализе клинической ситуации мультидисциплинарной командой [7].
Возможность повысить дозу на целевой объем без увеличения общего времени лечения является весьма актуальной в самостоятельной лучевой терапии гинекологических опухолей (в частности, опухолей шейки матки, вульвы и влагалища), самостоятельной лучевой терапии опухолей предстательной железы, адъювантной лучевой терапии опухолей молочной железы, неоадъювантной лучевой терапии местнораспространенных опухолей прямой кишки, самостоятельной и неоадъювантной лучевой терапии опухолей пищевода и лучевой терапии первичных и метастатических опухолей других локализаций. Далее кратко представлены варианты использования методики SIB при перечисленных нозологиях и отдельные результаты исследований на эту тему, опубликованные за последний год.
Метастазы в лимфатических узлах при местнораспространенном раке шейки матки являются плохим прогностическим фактором. Суммарная доза 45-50 Гр от дистанционного этапа лечения недостаточна для достижения высоких значений локального контроля позитивных лимфоузлов. Методика SIB позволяет повысить суммарную дозу до 55-63 Гр за 25-28 фракций при использовании разовой дозы от 2,2 до 2,4 Гр на позитивные лимфоузлы. Режим продемонстрировал частоту полного ответа через 3 месяца для объема SIB от 83% до 97%, локорегиональный контроль для объема SIB при медиане наблюдения не менее 3 лет составил от 91% до 98%. Увеличение суммарный дозы на метастатически измененные лимфоузлы с помощью методики SIB позволяет достичь оптимального локального контроля без повышения токсичности в сравнении с облучением пациентов с негативными лимфоузлами [8,9].
В стремлении повысить эффективность лучевой терапии при раке предстательной железы и по возможности избежать увеличения лучевой токсичности радиотерапевты используют методику SIB для эскалации дозы на позитивные лимфоузлы, эскалации дозы на всю предстательную железу или локально на зону опухоли внутри предстательной железы (как в режимах гипофракционирования, так и при стереотаксическом облучении пациентов Группы высокого риска), эскалации дозы на область позитивного края резекции после простатэктомии или на макроскопический объем в случае рецидивной опухоли. Результаты многочисленных исследований говорят об улучшении локального контроля и отдаленных результатов лечения при сохранении приемлемой токсичности и хороших показателях качества жизни [10].
В настоящее время нет единого мнения об оптимальной методике планирования лучевой терапии при адъювантном лечении опухолей молочной железы, как правило, радиотерапевты и медицинские физики предпочитают методику 3D-CRT (облучение тангенциальными полями). В случае невозможности добиться оптимального покрытия или приемлемых дозных нагрузок на органы риска переходят на методики IMRT или VMAT. SIBIMRT в этой ситуации позволяет подвести локальный буст на ложе опухоли без увеличения общего времени лечения, не уступает в эффективности и косметических результатах в сравнении с методикой 3D-CRT и последовательным подведением буста (SEQ) [11].
Технология SIB для доставки суммарной дозы в диапазоне 52-55 Гр (2,1-2,2
Гр за фракцию) к области первичной
опухоли при неоадъювантном лечении местнораспространенного рака
прямой кишки продемонстрирована
в ряде исследований, клинические результаты и профили токсичности аналогичны методике SEQ, при которой
часто сочетают IMRT/VMAT на весь
объем до суммарной дозы 45-46 Гр и
последовательный буст 3D-CRT на
первичную опухоль в дозе 4-9 Гр (25-
27 сеансов) [12]. При самостоятельной
лучевой терапии опухолей анального
канала план лечения всегда включает несколько объемов с разными
суммарными дозами. SIB позволяет
одновременно подвести предписанные суммарные дозы от 46 до 58 Гр за
27-29 фракций (общая длительность
курса связана с особенностями схем
одновременной химиотерапии) [13].
Результаты исследования по применению SIB-IMRT для эскалации дозы на первичную опухоль и позитивные лимфоузлы при самостоятельной лучевой/химиолучевой терапии рака пищевода (50,4 Гр за 28 фракций с интегрированным бустом 58,8 Гр) демонстрируют приемлемую токсичность при показателях общей выживаемости, выживаемости без прогрессирования и локального контроля через 3 года на уровне 37,6%, 34,5% и 36,1% соответственно. Высказано предположение, что такой подход может улучшить эффективность лечения в когорте возрастных или отягощенных пациентов, которым в ряде случаев не удается провести одновременную химиотерапию [14].
При облучении первичных и метастатических опухолей ЦНС, метастатических очагов в костях скелета методика SIB используется с целью эскалации дозы на таргетный опухолевый объем.
Охватить весь спектр клинических ситуаций, в которых целесообразно использовать преимущества симультанного интегрированного буста, в одной публикации не представляется возможным. Цель представленного обзора – продемонстрировать широкий диапазон возможностей методики SIB, утвердить ее безопасность и эффективность в лечении целого ряда злокачественных опухолей на основании результатов рандомизированных клинических исследований. Применение методики SIB с целью эскалации дозы может ограничиваться лишь потенциальной токсичностью окружающих здоровых тканей. Пределы дозы за фракцию должны определяться на основе оценки биологически эквивалентной дозы как для опухолевого очага, так и для окружающих здоровых тканей. При выборе режима фракционирования с использованием методики SIB следует проводить сравнение его по радиобиологическим параметрам с классическим режимом фракционирования.
Источники:
1. Butler EB, et al. SMART (simultaneous modulated accelerated radiation therapy) boost: a new accelerated fractionation schedule for the treatment of head and neck cancer with intensity modulated radiotherapy. Int. J. Radiation Oncology Biol. Phys. 1999; 45(1): 21-32.
2. Mohan R, et al. Radiobiological considerations in the design of fractionation strategies for intensitymodulated radiation therapy of head and neck cancers. Int J Radiat Oncol Biol Phys. 2000; 46(6): 19-30.
3. De Felice F, et al. Moderately accelerated intensity-modulated radiation therapy using simultaneous integrated boost: Practical reasons or evidence-based choice? A critical appraisal of literature. Head Neck. 2020; 42(11): 3405-3414.
4. Jiang L, et al. A comparison of clinical outcomes between simultaneous integrated boost (SIB) versus sequential boost (SEQ) intensity modulated radiation therapy (IMRT) for head and neck cancer: A metaanalysis. Medicine (Baltimore). 2019; 98: 34(e16942).
5. Orlandi E, et al. Radiobiological basis and clinical results of the simultaneous integrated boost (SIB) in intensity modulated radiotherapy (IMRT) for head and neck cancer: A review. Crit Rev Oncol Hematol. 2010; 73(2): 111-125.
6. van Leeuwen CM, et al. The alfa and beta of tumours: a review of parameters of the linear-quadratic model, derived from clinical radiotherapy studies. Radiat Oncol. 2018; 13(1): 96.
7. Mirestean CC, et al. New Challenges of Treatment for Locally Advanced Head and Neck Cancers in the Covid-19 Pandemic Era. J Clin Med. 2021; 10(4): 587.
8. Jayatilakebanda I, Tsang YM, Hoskin P. High dose simultaneous integrated boost for node positive cervical cancer. Radiat Oncol. 2021; 16(1): 92.
9. Jensen GL, et al. Dose escalated simultaneous integrated boost of gross nodal disease in gynecologic cancers: a multi-institutional retrospective analysis and review of the literature. Radiat Oncol J. 2021; 39(3): 219-230.
10.Glicksman RM, et al. Elective pelvic nodal irradiation with a simultaneous hypofractionated integrated prostate boost for localized high risk prostate cancer: Long term results from a prospective clinical trial. Radiother Oncol. 2021; 163: 21-31.
11.van Hulle H, et al. Acute toxicity and health-related quality of life after accelerated whole breast irradiation in 5 fractions with simultaneous integrated boost. Breast. 2021; 55: 105-111.
12.Li S, et al. Simultaneous integrated boost intensity-modulated radiation therapy can benefit the locally advanced rectal cancer patients with clinically positive lateral pelvic lymph node. Front Oncol. 2021; 22: 10:627572.
13.Franco P, et al. Comparing simultaneous integrated boost vs sequential boost in anal cancer patients: results of a retrospective observational study. Radiat Oncol. 2018; 13(1): 172.
14.Ristau J, et al. Simultaneous integrated
boost concepts in definitive radiation
therapy for esophageal cancer: outcomes
and toxicity. Radiat Oncol. 2021; 16(1): 23.
КОММЕНТАРИЙ ЭКСПЕРТА
Автор: Панкратов Александр Евгеньевич
Врач-радиотерапевт, ведущий эксперт по радиотерапии
ООО «ПЭТ-Технолоджи Балашиха», Балашиха
Безусловно, тема крайне актуальна для радиотерапевта. Сама по себе технология лучевой терапии IMRT/VMAT позволила существенно снизить лучевое воздействие, и, соответственно, токсичность на критические структуры, которых при облучении, например, органов головы и шеи наибольшее количество, и их чувствительность к лучевому воздействию наиболее выражена по сравнению с другими локализациями. Добавление к таким технологиям еще и симультанного интегрированного буста (SIB) обеспечивает не только сокращение длительности курса лечения, но вместе с тем может проявлять отчасти свойства адаптивной лучевой терапии, т.к. за более короткое время меньше вероятности изменения анатомии в зоне лечения, взаимоотношения облучаемых объемов, что практически всегда отмечается при длительных курсах за счет редукции опухолевого объема, уменьшения объема подкожно-жировой клетчатки (к сожалению, питание у многих пациентов в процессе лечения ухудшается, опять же по причинетоксичности лучевой терапии), а перепланирование в многих клиниках выполняется далеко не всегда.
Конечно, использование интегрированного буста и более высоких доз за фракцию накладывает и дополнительные обязательства на всю команду, принимающую участие в лечении такого пациента. Более тщательно должен выполняться контуринг врачом-радиотерапевтом, должны быть оконтурены все критические структуры, воздействие на которые в будущем отразится на качестве жизни пациента; с учетом их толерантных значений должен быть сосчитан дозиметрический план медицинским физиком, и, наконец, при выполнении каждого сеанса лучевой терапии необходимо выполнять контроль укладки при помощи методов рентгеновской или иной, не менее информативной, визуализации (портальные снимки или снимки в коническом пучке), с расчетом на которую при планировании можно будет уменьшить отступы на планируемый объем облучения – PTV. Для выполнения такой работы должен соответствующим образом быть обучен и средний медперсонал, который выполняет основную работу на линейном ускорителе. Без этих условий применение SIB может оказаться не только бесполезным, но и опасным для пациента.
В связи с масштабным переходом к высоким технологиям, позволяющим обеспечить корректное выполнение программы лучевой терапии с SIB, нельзя не упомянуть и о современных технологиях топометрии. Для точного определения таргетного объема, в отношении которого планируется эскалация дозы, в большинстве случаев одной только КТ-топометрии, пусть даже и с контрастным усилением, уже явно недостаточно. В этих ситуациях КТ-топометрия желательно должна быть дополнена МРТ-топометрией (для опухолей ЦНС, ОГШ, предстательной железы, прямой кишки и анального канала), а во многих случаях и ПЭТ-КТ-топометрией (ОГШ, рак легкого, рак предстательной железы с метастатическим поражением регионарных лимфоузлов). Таким образом, использование симультанного интегрированного буста является новой, высокоперспективной парадигмой в лучевой терапии для большинства локализаций, но накладывает дополнительные требования как к качеству подготовки плана лучевой терапии, самого пациента и персонала команды, так и к реализации этого плана.
КЛИНИЧЕСКИЙ СЛУЧАЙ ТЕРАПИИ BRAF-ПОЗИТИВНОГО РАКА ЛЕГКОГО ПРИ ПРОГРЕССИРОВАНИИ ОПУХОЛЕВОГО ПРОЦЕССА
Авторы: Новицкий Дмитрий Николаевич
БУЗ OO «Клинический онкологический диспансер», Омск
Стаценко Галина Борисовна
БУЗ OO «Клинический онкологический диспансер», Омск
Плохотенко Ирина Валерьевна
БУЗ OO «Клинический онкологический диспансер», Омск
BRAF представляет собой серин/ треониновую протеинкиназу, которая играет важную роль в сигнальном пути RAS-RAF-MEK-ERK (MAPK). Активация этого пути передает внеклеточные сигналы в клетку через каскад событий фосфорилирования, что приводит к изменению экспрессии генов, росту, выживанию и дифференцировке клеток в нормальных и трансформированных клетках. Наиболее частая мутация BRAF, обнаруживаемая более чем в 90% опухолей с мутацией BRAF, представляет собой замену валина на глутаминовую кислоту по аминокислоте 600 (V600E) в киназном домене. BRAF-мутации были описаны при меланоме (50-60%), колоректальном раке (10%), карциномах щитовидной железы (30-50%) и немелкоклеточном раке легкого. Несмотря на редкую встречаемость BRAF-мутации при немелкоклеточном раке легкого (2- 3%), ее обнаружение является принципиально важным для пациента при определении тактики лечения и выборе схемы лекарственной терапии. Невыполнение тестирования или же ошибки при его проведении не позволяют назначать соответствующую таргетную терапию, что приводит к ухудшению результатов лечения.
Пациентка М., на момент начала заболевания – 56 лет.
В декабре 2019 года при прохождении плановой флюорографии выявлено подозрение на патологию в нижней доле правого легкого. При этом жалоб пациентка не предъявляла, общее самочувствие не страдало. В январе 2020 года прошла МСКТ органов грудной клетки, по результатам которой в С6 правого легкого обнаружено шаровидной формы затемнение со спикулообразным контуром диаметром 18 мм, внутригрудные лимфоузлы увеличены до 15 мм. Дообследована, признаков генерализации опухолевого процесса не выявлено. По решению мультидисциплинарного консилиума назначено оперативное лечение. В феврале 2020 года в БУЗОО КОД выполнена однопортовая торакоскопическая нижняя лобэктомия справа.
Гистологическое исследование: в препарате легкого – папиллярная аденокарцинома, в препаратах лимфоузла легочной связки – метастазы папиллярного рака.
Выставлен диагноз: Периферическое ЗНО нижней доли правого легкого T1bN1M – IIb стадия. Клиническая группа: II. Решением мультидисциплинарного консилиума назначено 4 курса адъювантной ХТ по стандартной схеме: паклитаксел 175-200 мг/м2 в/в в 1-й день + карбоплатин AUC 5-6 в/в в 1-й день 21-дневного цикла.
Адъювантная ПХТ завершена в мае
2020 года, и с целью контроля проведена МСКТ органов грудной клетки без
внутривенного контрастирования, в
результате выявлено увеличение паратрахеальных лимфоузлов до 15 мм.
Для уточнения характера внутригрудной лимфаденопатии проведена
ПЭТ/КТ в июле 2020 года, подтверждено метастатическое поражение паратрахеальных и надключичных лимфоузлов справа размерами до 17 мм.
Метастатического поражения головного мозга при проведении МРТ с в/в
контрастированием не обнаружено.
По решению мультидисциплинарного консилиума проведена лучевая терапия на зоны метастатического поражения (РОД – 2 Гр, СОД – 50 Гр) в сентябре-октябре 2020 года. К моменту завершения лучевой терапии были известны следующие характеристики удаленной опухоли, определенные в локальной патоморфологической лаборатории БУЗОО КОД:
• в исследуемом образце опухоли легкого мутаций в гене EGFR не обнаружено;
• при окрашивании опухолевой ткани антителом Ventana anti-ALK (D5F3) отмечается негативная реакция;
• экспрессия PD-L1 (SP263) на опухолевых клетках позитивная, TPS = 5%.
Далее в связи с отсутствием прогрессирования заболевания пациентка находилась под динамическим наблюдением до мая 2021 года, пока при очередном контрольном ПЭТ/КТ не было выявлено дальнейшее прогрессирование заболевания (гиперметаболический очаг в корне правого легкого по ходу скрепочного шва, метаболически активный одиночный надключичный лимфатический узел справа).
Опухолевый материал был дополнительно протестирован в июне 2021 г. в ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, обнаружена мутация V600E в гене BRAF. В связи с этим расширенной врачебной комиссией было принято решение о назначении таргетной терапии по схеме: дабрафениб 300 мг ежедневно + траметиниб 2 мг ежедневно, терапия начата в июне 2021 г. Пациентка переносила лечение хорошо, без значимых побочных эффектов, курс прерывался в июле 2021 г. по причине короновирусной инфекции. В ноябре 2021 г. выполнен ПЭТ/КТ контроль после завершения 4 курсов таргетной терапии.
В сравнении с данными ПЭТ/КТ, проведенной в мае 2021 г., отмечается:
• метаболический регресс определяемого ранее гиперметаболического очага в корне правого легкого по ходу скрепочного шва;
• уменьшение размеров надключичного л/у справа, со снижением метаболической активности; • сохранение увеличенных и нормальных по размеру медиастинальных л/у с низким и минимально повышенным уровнем метаболизма РФП.
Таргетная терапия будет продолжена до прогрессирования или неприемлемой токсичности.
Вывод:
BRAF-позитивный НМРЛ
является агрессивной опухолью с
неблагоприятным течением и прогнозом заболевания, коротким безрецидивным промежутком. Однако
назначение соответствующей таргетной терапии позволяет улучшить выживаемость пациентов в сравнении
с назначением стандартных режимов химиотерапии. Помимо этого,
таргетная терапия обладает лучшей
переносимостью и меньшим числом
побочных эффектов, качество жизни
пациентов при ее проведении чаще
всего не страдает. Поэтому, несмотря на редкую встречаемость BRAFмутации в НМРЛ, ее определение является обязательным при назначении
системной терапии.
КИТРУДА

НЕДАВНИЕ ПУБЛИКАЦИИ В КРУПНЫХ ЖУРНАЛАХ: ТРИЖДЫНЕГАТИВНЫЙ РАК МОЛОЧНОЙ ЖЕЛЕЗЫ И РАК ЯИЧНИКОВ
Пембролизумаб
в комбинации
с неоадъювантной
химиотерапией при раннем
тройном негативном
рака молочной железы.
Результаты исследования
KEYNOTE-522
10 февраля 2022 г. в журнале The New England Journal of Medicine опубликованы результаты исследования 3 фазы KEYNOTE-522 [1], посвященного изучению пембролизумаба в комбинации с неоадъювантной химиотерапией (НАХТ) при раннем раке молочной железы с тройным негативным фенотипом (ТН РМЖ).
В исследование были включены больные ТН РМЖ со стадией сT1cN1-2 или сT2-4N0-2 и ECOG статусом 0-1. Пациенты, включенные в исследование, были стратифицированы в лечебные группы в зависимости от размера первичной опухоли, статуса N и режима введения карбоплатина в НАХТ.
Участники исследования были рандомизированы в две большие группы (2:1):
• n=784
Подгруппа 1:
пембролизумаб 200 мг 1 раз в 3 недели в комбинации с паклитакселом 80 мг/ м2 1 раз в 7 дней (12 введений) и карбоплатином AUC5 1 раз в 3 недели (4 введения) / карбоплатином AUC1,5 1 раз в 7 дней (12 введений)
Подгруппа 2:
пембролизумаб 200 мг в комбинации с доксорубицином 60 мг/м2 / эпирубицином 90 мг/м2 и циклофосфамид 600 мг/ м2 1 раз в 3 недели, 4 цикла
• n=389
Подгруппа 1:
плацебо в комбинации с паклитакселом 80 мг/ м2 1 раз в 7 дней (12 введений) и карбоплатином AUC5 1 раз в 3 недели (4 введения) / карбоплатином AUC1,5 1 раз в 7 дней (12 введений)
Подгруппа 2:
плацебо в комбинации с доксорубицином 60 мг/ м2 / эпирубицином 90 мг/м2 и циклофосфамид 600 мг/м2 1 раз в 3 недели, 4 цикла
Через 3-6 недель после завершения курсов неоадъювантной терапии выполнялось хирургическое лечение. Независимо от достигнутого лечебного патоморфоза пациенты получали пембролизумаб 200 мг или плацебо 1 раз в 3 недели до 9 циклов адъювантно. Лучевая терапия могла быть проведена параллельно с курсами адъювантной терапии или должна была быть завершена за 2 недели до ее начала. Первичными конечными точками исследования были частота достижения полного патоморфологического ответа pCR (ypT0-Tis ypN0) и бессобытийная выживаемость (ВБС). Вторичными – общая выживаемость (ОВ), pCR, ВБC и ОВ в группе пациентов с PD-L ≥1 опухолями.
Результаты
С марта 2017 г. по сентябрь 2018 г. в исследование было рандомизировано 1174 пациентов. Первые результаты исследования, опубликованные в журнале The New England Journal of Medicine в 2020 г. [2], показали, что химиотерапия в комбинации с иммунотерапией позволяет значимо увеличить частоту достижения pCR на 13,6% (с 51,2% до 64,8%) (p=0,00055). При подгрупповом анализе продемонстрировано, что добавление пембролизумаба позволяет увеличить частоту pCR у пациентов как с PD-L1 позитивными (68,9% против 54,9%), так и с PD-L1 негативными опухолями (45,3% против 30,3%). Максимальный выигрыш от назначения пембролизумаба в достижении pCR был отмечен у пациентов моложе 65 лет (54,0% и 66,2%), с метастазами в лимфатических узлах (44,1% и 64,8%), T1/2 (56,4% и 70,2%) и ECOG 0 (49,1% и 65,5%). При медиане длительности наблюдения в 39,1 мес. медиана ВБС не достигнута, 36-месячная ВБС составила 84,5% в группе с пембролизумабом и 76,8% в группе только химиотерапии (ОР=0,63; 95% ДИ 0,48-0,82, p<0,001, рис.1).
Рисунок 1.
Бессобытийная выживаемость при добавлении
пембролизумаба или плацебо.
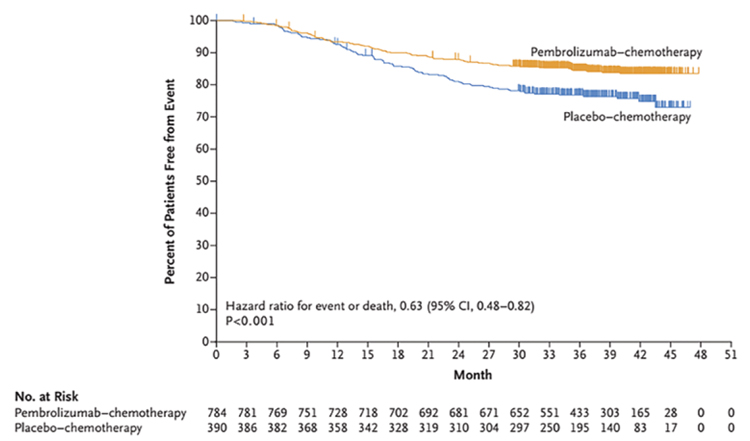
Добавление иммунотерапии к химиотерапии позволило значимо улучшить БСВ независимо от статуса N, уровня экспрессии PD-L1 и режима введения карбоплатина. Медиана ОВ не была достигнута, 36-месячная ОВ составила 89,7% в группе пембролизумаба в комбинации с химиотерапией и 86,9% в контрольной группе (рис.2).
Рисунок 2.
Общая выживаемость.
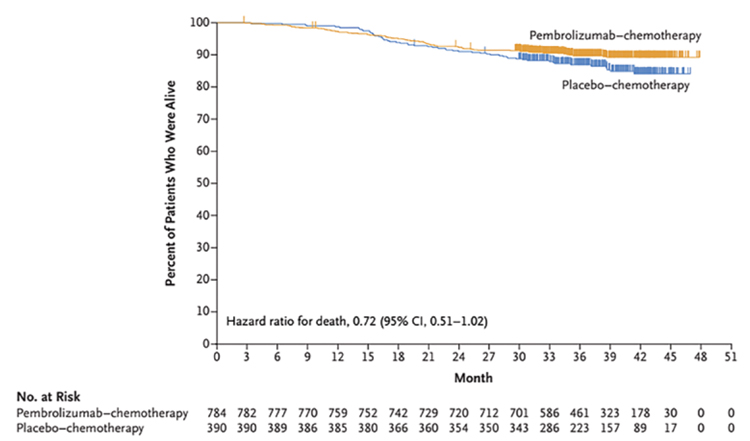
Таблица 2.
Частота событий в зависимости от достижения
pCR в исследовании KEYNOTE-522.

В работе показано, что в когорте только химиотерапии при недостижении pCR рецидив зарегистрирован у каждого второго пациента, а в группе химиотерапии в комбинации с пембролизумабом – у каждой третьего больного (табл.1). Нежелательные явления 3 степени и выше зарегистрированы у 82,4% больных в группе с пембролизумабом и у 78,7% в группе с плацебо и были представлены нейтропенией (34,3% и 33,4%), анемией (18,1% и 14,9%) и иммуноопосредованными НЯ (12,9% и 1,0%). НЯ послужили причиной отмены терапии в 27,7% случаях в группе иммунотерапии и в 14,1% в группе плацебо.
Комментарии к исследованию:
• пациенты в исследовании не получали режимы с уплотненным введением препаратов (например ddAC 1 раз в 2 недели), которые позволяют увеличить частоту достижения pCR;
• пациенты, не достигшие pCR, не
получали капецитабин 2000 мг/м2
в течение 6 мес. после проведения
хирургического лечения, что могло
сказаться на отдаленных результатах, особенно в группе только
химиотерапии;
• в рутинной клинической практике
если на дооперационном этапе не
удалось провести все запланированные курсы ХТ, то недостающие
курсы проводятся после операции.
Траметиниб при серозной
аденокарциноме
яичников низкой степени
злокачественности
(low-grade). Результаты
исследования 3 фазы GOG
281/LOGS [3]
Частота серозной аденокарциномы яичников низкой степени злокачественности составляет около
5% от всех случаев рака яичников
(РЯ). Для low-grade РЯ характерно
наличие активирующих мутаций
в RAS/RAF/MEK/ERK (MAPK)
протеинкиназном сигнальном каскаде. Для low-grade РЯ патогномоничны мутации в генах KRAS
(27%), NRAS (9%) и BRAF (13%) и
высокая частота экспрессии рецепторов прогестерона (68%) и
эстрогена (97%) (рис.3).
Рисунок 3.
Молекулярные особенности рака яичников.
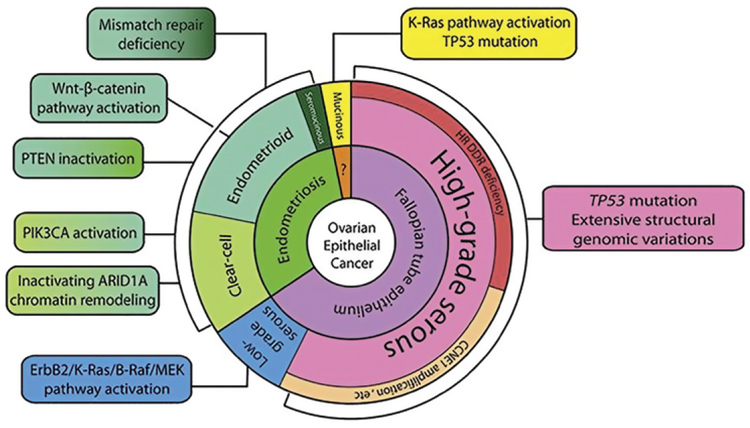
Траметиниб – селективный аллостерический ингибитор MEK1 и MEK2. Задачей исследования GOG 281/ LOGS была оценка эффективности траметиниба при серозной low-grade аденокарциноме яичников в сравнении со стандартной терапией по выбору исследователя.
Все пациенты, включенные в исследование, ранее получили как минимум 1 линию платиносодержащей химиотерапии. Пациентки были рандомизированы в 2 лечебные группы (1:1):
• траметиниб (n=130) 2 мг в день, внутрь, лечение до прогрессирования заболевания либо до неприемлемой токсичности;
• терапия по выбору исследователя (n=130) в одном из указанных режимов:
◆паклитаксел 80 мг/м2 в/в кап. в дни 1, 8, 15, цикл 28 дней,
◆пегилированный липосомальный доксорубицин 40-50 мг/м2 в/в кап. 1 раз в 28 дней,
◆ топотекан 4 мг/м2 в/в кап. в дни 1, 8, цикл 28 дней,
◆ летрозол 2,5 мг в день, внутрь,
◆ тамоксифен 20 мг в день, внутрь.
◆Первичной конечной точкой исследования была выживаемость без прогрессирования (ВБП), вторичными – токсичность терапии, объективный ответ (ОО) и качество жизни пациентов.
При медиане времени наблюдения в 31 мес. медиана ВБП в группе траметиниба достигла 13,0 мес. против 7,2 мес. в группе терапии по выбору исследователя (ОР=0,48; p<0,0001), таким образом, назначение траметиниба позволило снизить риск прогрессирования на 52% (рис.4).
Рисунок 4.
Выживаемость без прогрессирования
заболевания.
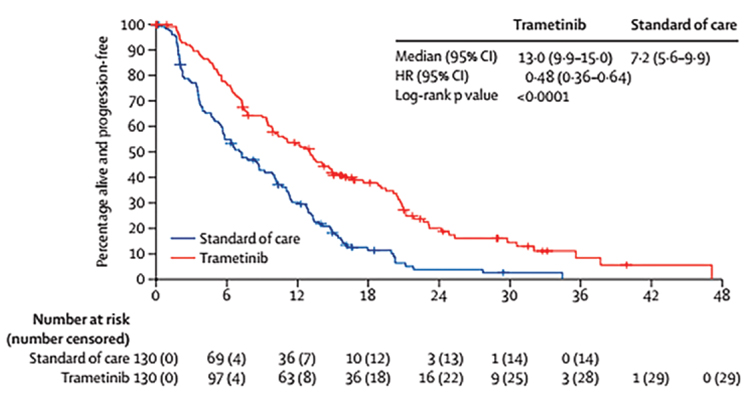
При подгрупповом анализе также продемонстрировано преимущество траметиниба над летрозолом: медиана МБП в группе летрозола составила 10,6 мес. против 15,0 мес. в группе траметиниба (ОР=0,58; p=0,0085; рис.5).
Рисунок 5.
Выживаемость без прогрессирования в группах
летрозола и траметиниба.
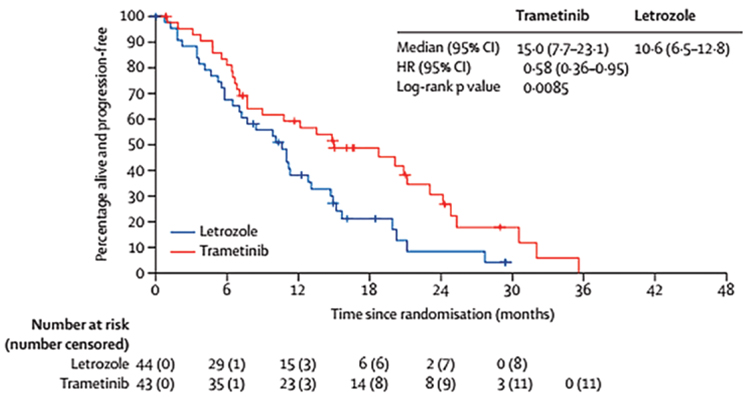
Частота достижения ОО в группе траметиниба составила 26%, в группе стандартной терапии – 6% (p<0,0001), стабилизация зарегистрирована в 59% и 71% случаев соответственно. Медиана длительности ответа при терапии траметинибом достигла 13,6 мес. против 5,9 мес. в группе терапии по выбору исследователя. Медиана ОВ в группе с траметинибом составила 37,6 мес. (32,0- НД), в группе контроля – 29,2 мес. (23,5-51,6; ОР=0,76; 95%ДИ 0,51- 1,12; p=0,056). Необходимо отметить, что 68% больных из группы стандартной терапии получали траметиниб в последующих линиях лечения. Наиболее частыми НЯ 3-4 степени в группе с траметинибом были акнеформный дерматит (13%), анемия (13%), гипертензия (12%), диарея (10%), тошнота (9%) и слабость (8%). В группе терапии по выбору исследователя – боли в животе (17%), тошнота (11%), анемия (10%) и рвота (8%). На фоне терапии траметинибом были зарегистрированы следующие НЯ «особого интереса»: пульмонит (2%), удлинение интервала QTc (2%), систолическая дисфункция левого желудочка (2%), ангиопатия сетчатки (2%) и разрыв сетчатки (1%). Наличие мутаций в генах KRAS, NRAS и BRAF значимо не повлияло на эффективность терапии траметинибом.
Источники:
1. Peter Schmid, Javier Cortes, Rebecca Dent, et al. Event-free Survival with Pembrolizumab in Early Triple-Negative Breast Cancer. N Engl J Med. 2022 Feb 10; 386(6): 556-567. doi: 10.1056/ NEJMoa2112651.
2. Peter Schmid, Javier Cortes, Lajos Pusztai, et al. Pembrolizumab for Early Triple-Negative Breast Cancer. N Engl J Med. 2020 February 27; 382: 810-821. DOI: 10.1056/NEJMoa1910549.
3. David M Gershenson, Austin Miller,
William E Brady, et al. Trametinib
versus standard of care in patients with
recurrent low-grade serous ovarian cancer
(GOG 281/LOGS): an international,
randomised, open-label, multicentre,
phase 2/3 trial. The Lancet. Published:
February 05, 2022. DOI: https://doi.
org/10.1016/S0140-6736(21)02175-9.
ПОДДЕРЖИВАЮЩАЯ ТЕРАПИЯ В ОНКОЛОГИИ

АТЕЗОЛИЗУМАБ ПРИ РАКЕ МОЛОЧНОЙ ЖЕЛЕЗЫ: ВЗЛЕТЫ, ПАДЕНИЯ – ЧТО ДАЛЬШЕ?
Автор: Мария Леонидовна Степанова
К.м.н., врач-онколог, химиотерапевт, клиника
«Луч», г. Санкт-Петербург
Атезолизумаб - гуманизированное моноклональное антитело, предназначенное для связывания с PD-L1, экспрессируемым на опухолевых клетках и инфильтрирующих опухоль иммунных клетках, и блокирования его взаимодействия с рецепторами PD-1 и B7.1. То есть, атезолизумаб способствует прекращению опосредованного PD-L1/ PD-1 подавления иммунного ответа и вызывает реактивацию противоопухолевого иммунитета. В марте 2019 года FDA предоставило ускоренное одобрение препарата для больных нерезектабельным, местнораспространенным или метастатическим трижды негативным раком молочной железы на основе исследования III фазы IMpassion130 [1]. Первичной конечной точкой исследования являлась оценка времени без прогрессирования и общая выживаемость. Факторами стратификации стали: ранее проводимая терапия таксанами (в неоадъювантном или адъювантном режимах), выявленные на момент включения в исследование метастазы в печени, а также экспрессия PD-L1 (позитивная или негативная). Результаты данного исследования продемонстрировали преимущество назначения наб-паклитаксела в сочетании с атезолизумабом по сравнению с наб-паклитаксел + плацебо. Медиана наблюдения составила 12,9 мес. Медиана ВПБ при PD-L1 позитивном статусе составила 7,5 мес. в группе атезолизумаба против 5,0 мес. в группе плацебо (рис.1). Медиана ОВ - 25,0 мес. и 15,5 мес., соответственно (рис.2). На основании полученных данных исследования III фазы IMpassion130 было получено ускоренное одобрение FDA для пациентов с метастатическим тройным негативным раком молочной железы, у которых экспрессия PD-L1 ≥ 1%. Таким образом, атезолизумаб был первым одобренным иммунологическим препаратом для лечения этой группы пациентов.
Рисунок 1. ВПБ в подгруппе пациентов с положительным статусом PD-L1 [1]
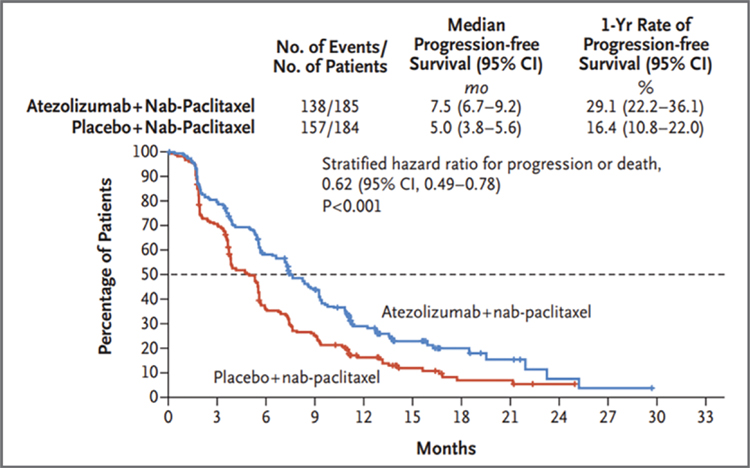
Рисунок 2. ОВ в подгруппе пациентов с положительным статусом PD-L1 [1]
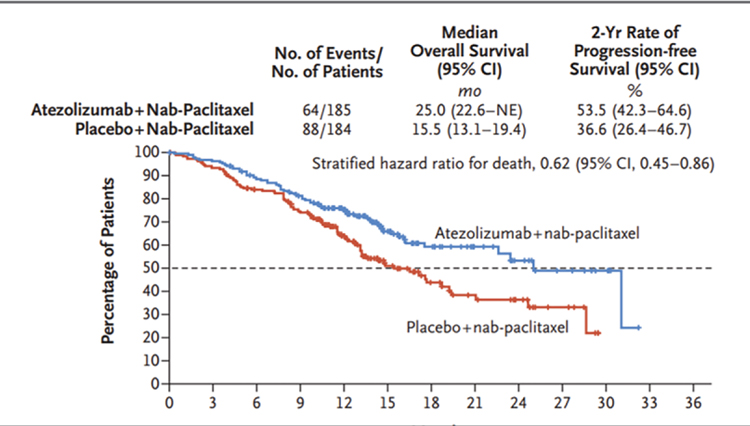
Дальнейшее одобрение этого показания к лечению зависело от результатов исследования IMpassion 131 [2]. Это слепое плацебо-контролируемое исследование III фазы с включением 651 пациентки с метастатическим или неоперабельным местно-распространенным тройным негативным раком молочной железы, ранее не получавших лечение. Положительный PD-L1 (≥1%) был зарегистрирован у 291 пациентки. Первичной конечной точкой исследования стала оцениваемая исследователем выживаемость без прогрессирования. Пациентам назначали лечение в соотношении 2:1, где первая группа получала терапию атезолизумабом в дозе 840 мг в дни 1 и 15 в сочетании паклитакселом в дозе 90 мг/м2 в дни 1, 8 и 15, а вторая - плацебо и паклитаксел. Стоит отметить, что пациенты получали от 8 до 10 мг дексаметазона или его эквивалента, по крайней мере, в течение первых двух инфузий. В ходе проведенного исследования по данным оценки медианы ВБП у пациентов с PD-L1 позитивным статусом не была достигнута первичная цель. Так, медиана ВБП не была значимо улучшена при использовании атезолизумаба с паклитакселом по сравнению с одним паклитакселом ни в PD-L1- положительной группе (6,0 мес. против 5,7 мес.; HR = 0,82; P = 0,20), ни в общей группе, получавшей лечение (5,7 против 5,6). месяцев; HR = 0,86 (рис. 3-4).
Рисунок 3. Ранняя и поздняя токсичность комбинации таргетных агентов или иммунопрепаратов с SBRT [11].ВБП пациентов с положительным статусом PD-L1 (оценка исследователей) [2]
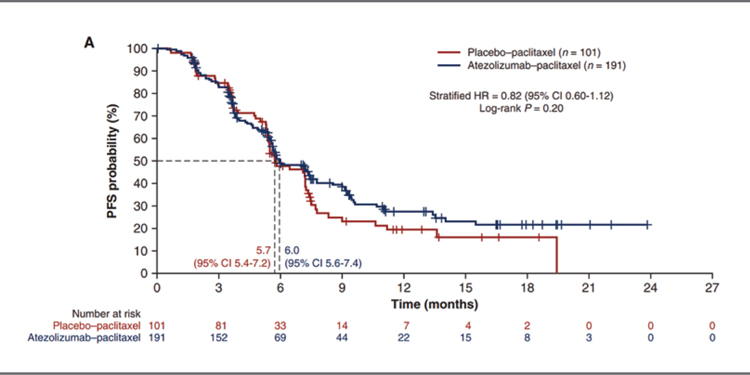
Рисунок 4.
ВБП в общей группе пациентов (вне зависимости
от статуса PD-L1) [2].
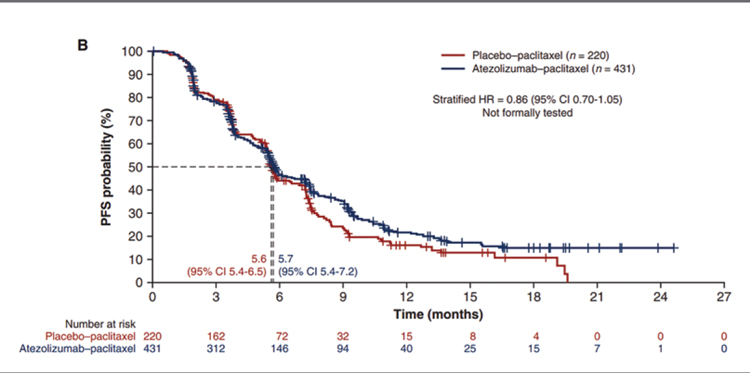
При оценке общей выживаемости выяснилось, что добавление атезолизумаба также не продемонстрировало преимуществ. Медиана ОВ у пациентов с положительным PD-L1 статусом составила 28,3 мес. в группе паклитаксела и 22,1 мес. в комбинации атезолизумаба с паклитакселом (рис. 5). Медиана ОВ в общей группе составила 22,8 мес. против 19,2 мес., соответственно (рис.6). Таким образом, ни одна из подгрупп не получила дополнительных преимуществ от назначения чек-пойнт ингибитора. Изначально, атезолизумаб получил ускоренное одобрение для назначения метастатического трижды негативного рака молочной железы в марте 2019 года, что сделало его первым иммунотерапевтическим агентом для лечения этого вида опухолей. Утверждение было основано на данных о ВБП фазы 3 исследования IMpassion130. Дальнейшее одобрение зависело от результатов исследования IMpassion131, результаты которого не соответствовали его первичной конечной точке и исследование было расценено как негативное.
На основании полученных результатов в августе 2021 года компания Genentech (Roche Group), объявила, что принято решение о добровольном отзыве ускоренного одобрения атезолизумаба в сочетании с набпаклитакселом для лечения в первой линии неоперабельного местнораспространенного или метастатического тройного негативного рака молочной железы на территории США[3].
Рисунок 5. ОВ пациентов с положительным статусом PD-L1 (оценка исследователей) [2].
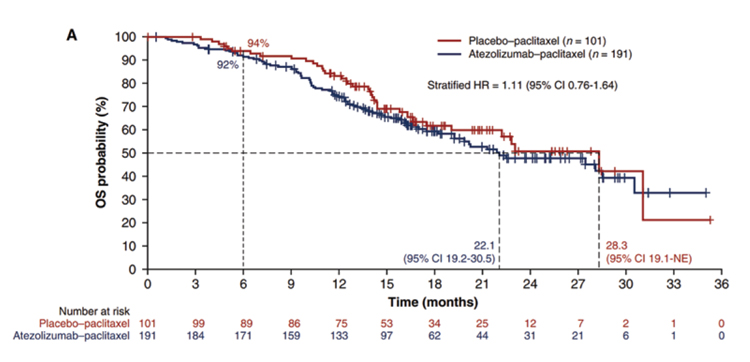
Рисунок 6. ОВ в общей группе пациентов (вне зависимости от статуса PD-L1) [2].
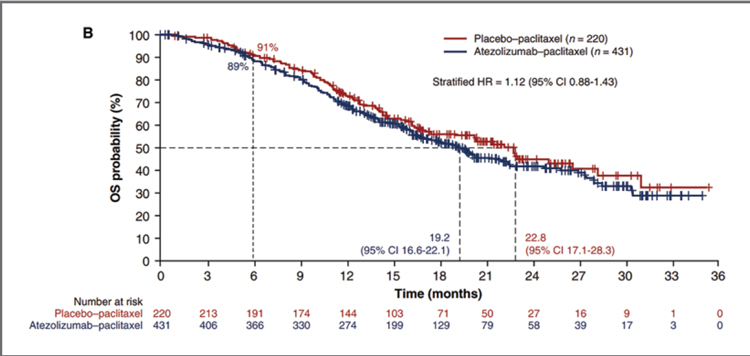
Источники:
1. Schmid P. et al. Atezolizumab plus nab-paclitaxel as first-line treatment for unresectable, locally advanced or metastatic triple-negative breast cancer (IMpassion130): updated efficacy results from a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol 2020;21(1):44-59.
2. Miles D, Gligorov J, André F, et al; IMpassion131 investigators. Primary results from IMpassion131, a doubleblind, placebo-controlled, randomised phase III trial of first-line paclitaxel with or without atezolizumab for unresectable locally advanced/metastatic triple negative breast cancer. Ann Oncol. 2021 Aug;32(8):994-1004. doi: 10.1016/j. annonc.2021.05.801. Epub 2021 Jul 1. PMID: 34219000.
3. Genentech Provides Update on
Tecentriq US Indication for PD-L1-
Positive, Metastatic Triple-Negative Breast
Cancer. News release. Genentech; August
27, 2021. Accessed September 1, 2021.
https://www.gene.com/media/pressreleases/14927/2021-08-27/genentechprovides-update-on-tecentriq-u
10 ЛЕТ НАЦИОНАЛЬНОЙ ПРОГРАММЕ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ
