
К юбилею Российского общества клинической онкологии: 10 лет как один миг
31 января 2021 г. исполнилось 10 лет со дня основания Российского общества клинической онкологии (RUSSCO), и это событие стало еще одним подтверждением скоротечности времени.


Прогресс в лечении НМРЛ
Среди всех злокачественных опухолей рак легкого занимает первое место по заболеваемости в Российской Федерации. Согласно статистической базе SEER13, анализирующей популяционные данные с 2010 по 2016 годы в США, 5-летняя продолжительность жизни больных раком легкого составляет 20,5%, что свидетельствует об агрессивности болезни.
WCLC 2020: Адъювантная терапия осимертинибом при EGFRm НМРЛ IB-IIIA стадии - стабильное улучшение безрецидивной выживаемости независимо от проведения предшествующей адъювантной химиотерапии.
Исследование III фазы ADAURA вызвало большой интерес в прошлом году: были опубликованы результаты незапланированного промежуточного анализа, которые показали 80% снижение риска рецидива или смерти при применении осимертиниба в адъювантном режиме в сравнении с плацебо у пациентов с НМРЛ IBIIIA стадии с наличием мутации в гене EGFR.

Пембролизумаб в комбинации с ипилимумабом у больных метастатическим немелкоклеточным раком легкого с экспрессией PD-L1: результаты исследования KEYNOTE-598
Монотерапия пембролизумабом является стандартной терапией первой линии метастатического немелкоклеточного рака легкого (НМРЛ) с экспрессией PD-L1 (TPS) ≥50% без драйверных мутаций.
Цемиплимаб в первой линии терапии распространенного немелкоклеточного рака легкого с экспрессией PD-L1>50%: результаты исследования 3 фазы
Цемиплимаб - моноклональное высокоаффинное полностью человеческое антитело, являющееся ингибитором PD-1. Ранее цемиплимаб был одобрен FDA для терапии плоскоклеточного рака кожи. 22 февраля 2021 года FDA выдало одобрение на использование препарата у больных метастатическим немелкоклеточным раком легкого (НМРЛ) с экспрессией PD-L1 50% и более, не получавших ранее лекарственное лечение по поводу распространенной болезни.

Обновление рекомендаций ASCO 2021: таргетная терапия немелкоклеточного рака легкого
Для обновления практических рекомендаций таргетной терапии у пациентов с немелкоклеточным раком легкого (НМРЛ) была создана совместная экспертная группа Американского общества клинической онкологии (ASCO) и Ontario Health (OH)

Рекомендации по таргетной терапии НМРЛ ASCO и RUSSCO – сходства и различия. Бог в мелочах.
В начале стоит сказать о сходстве в принципах формирования рекомендаций. Все рекомендации учитывают необходимость определения молекулярных нарушений для определения возможности таргетной терапии. В обеих рекомендациях учтены наиболее частые молекулярные нарушения, такие как EGFR, ALK, ROS1.
Насколько эффективны различные поколения ингибиторов тирозинкиназы EGFR и их комбинированные режимы при EGFR-ассоциированном раке легкого?
В Журнале «Злокачественные опухоли» были опубликованы результаты мета-анализа исследований эффективности различных поколений ингибиторов тирозинкиназы EGFR и их комбинированных режимов при EGFR-положительном немелкоклеточном раке легкого (НМРЛ). В настоящее время выбор из нескольких вариантов первой линии для больных НМРЛ.

Рекомендации ASCO-ASTRO: лучевая терапия при локализованном мелкоклеточном раке легкого. Мнения экспертов
Американское общество клинической онкологии (ASCO) совместно с Американским обществом радиотерапевтов (ASTRO) обновили рекомендации по лучевой терапии (ЛТ) у больных локализованным мелкоклеточным раком легкого (ЛС-МКРЛ). Рекомендация...

Рекомендации ASTRO/ASCO по лучевой терапии мелкоклеточного рака легкого: различия и сходства с Российскими клиническими рекомендациями
Лучевой терапии (ЛТ) рака легкого в России зачастую отводится незавидная второстепенная роль.

Роль стереотаксической аблативной лучевой терапии (SBRT) у пациентов с начальными стадиями (I/II) мелкоклеточного рака легких
Данные рандомизированных исследований демонстрируют, что стереотаксическая аблативная лучевая терапия (SBRT или SABR) более эффективна, чем фракционированное облучение у пациентов с ранней стадией немелкоклеточного рака легкого (НМРЛ), которым противопоказано хирургическое вмешательство [1].

Влияние микробиома на эффективность иммунотерапии. Просто знание или возможность влиять на исход?
Вопросы о связи между кишечным микробиомом и эффективностью иммунотерапии злокачественных опухолей обсуждаются уже достаточно давно. И в целом, как нам кажется, наличие этой связи можно считать доказанным.

Отчет ASCO 2021 о достижениях в клинической онкологии
Ежегодный отчет Американского общества клинической онкологии (ASCO) выделяет текущие тренды и определяет приоритеты исследований в области онкологии, которые обладают высоким потенциалом ускорения прогресса в борьбе против рака.
Результаты исследования 211 по оценке начальной дозы ленвима® (ленватиниб) при лечении дифференцированного рака щитовидной железы
Информационный материал подготовлен на основе постера, представленного в рамках конгресса ESMO Asia, 20-22 ноября 2020: Мультицентровое рандомизированное двойное слепое исследование 2 фазы...

К юбилею Российского общества клинической онкологии: 10 лет как один миг
Автор: С.А.Тюляндин
Председатель Российского общества клинической онкологии
 31 января 2021 г. исполнилось 10 лет со дня основания Российского общества клинической онкологии (RUSSCO), и это событие стало еще одним подтверждением скоротечности времени. В этот день десять лет назад наше Общество получило официальную регистрацию в Министерстве юстиции России.RUSSCO стало первым реальным профессиональным сообществом онкологов России, поскольку существующая Ассоциация онкологов России (АОР) до 2012 г. фактически объединяла в своих рядах юридические лица – институты и диспансеры и не предусматривала членство физических лиц. В связи с этим идея создания общества для онкологов была более чем актуальной, тем более что к тому моменту было создано и успешно работало под руководством Матвеева Бориса Павловича Общество онкоурологов, которое за короткое время стало центром профессиональной жизни для специалистов этого направления. На фотографии запечатлены участники инициативной группы – ведущие онкологи федеральных и региональных учреждений нашей страны, которые на своем первом заседании 8 июля 2010 года приняли решение о создании Общества и утверждении его Устава. Первоначально было принято решение о создании Общества специалистов по лекарственному лечению онкологических пациентов, поскольку не было четкого понимания того, как отнесутся к созданию такой организации онкологи других специальностей (хирурги, радиотерапевты, диагносты и т.д.). Документы были собраны и представлены в Министерство юстиции России, однако, наиболее сложной задачей оказался поиск кандидата на пост директора. Потенциальный претендент должен был обладать определенными качествами: быть специалистом онкологом, энергичным и амбициозным, иметь опыт организаторской работы. К счастью, для решения этой нетривиальной задачи не потребовалось много времени. Мое внимание привлекла активная работа молодого врача-онколога, организовавшего некоммерческую организацию Центр изучения рака почки, которая занималась образовательной и научной деятельностью за счет грантового финансирования. К моему глубокому удовлетворению Илья Валерьевич Тимофеев дал согласие на участие в сложной работе по созданию Общества, и в его лице мы обрели человека с искомыми характеристиками. Так нас стало двое. В декабре мы провели презентацию еще незарегистрированного Общества для наших потенциальных спонсоров, представив план работы на ближайший год. Презентация прошла успешно, свидетельством чему была организационная и финансовая поддержка нашего проекта. Это позволило арендовать нам первый скромный офис и пригласить на работу первых сотрудников. А тут и наступило 31 января 2011 года. Оглядываясь назад, до сих пор удивляюсь, как много нам всем удалось сделать за эти 10 лет. Сегодня RUSSCO является самым большим по количеству членов профессиональным онкологическим сообществом, которое быстро превратилось из Общества химиотерапевтов в Общество для всех специалистов, занимающихся диагностикой, лечением и реабилитацией онкологических пациентов. В составе RUSSCO работают 52 региональные организации, а количество членов превышает 5000 человек. RUSSCO стало первым сообществом, инициировавшим создание «Практических рекомендаций по лекарственной и поддерживающей терапии злокачественных опухолей». В написании Рекомендаций принимают участие авторитетные специалисты, представляющие федеральные и региональные онкологические учреждения. С 2012 г. Рекомендации ежегодно пересматриваются и издаются, и сегодня являются настольной книгой онкологов нашей большой страны. «Практические рекомендации» стали основой для написания разделов, посвященных лекарственному лечению, в национальных клинических рекомендациях, разработанных совместно с другими профессиональными сообществами под эгидой Ассоциации онкологов России. Мы гордимся программой молекулярно-генетической диагностики злокачественных опухолей, которая существует с 2012 г. В рамках этой программы больным и специалистам онкологам стали доступны современные методы определения прогностических и предиктивных биомаркеров, необходимые для составления оптимального плана лечения. На всей территории России, от Владивостока до Санкт- Петербурга, была организована сеть лабораторий, позволившая проводить тестирование независимо от места проживания больных. Возможностями программы RUSSCO пользуются более 2500 онкологов из 83 регионов России, различные виды тестирования выполнены более чем у 120000 больных. Широкое использование современных молекулярно-генетических тестов в клинической практике в рамках программы RUSSCO сделало возможным их финансирование по программе ОМС. RUSSCO активно участвует в постдипломном образовании онкологов. Наши специализированные конференции, посвященные отдельным аспектам лечения злокачественных опухолей, становятся все более популярными и позволяют глубоко погрузиться в сложную проблему лекарственного лечения онкологических заболеваний, а также обсудить с экспертами разнообразные клинические ситуации. Важным итогом этой работы является внесение в Практические рекомендации изменений, согласованных с ведущими специалистами. Своеобразной визитной карточкой нашего Общества, безусловно, является Российский онкологический конгресс, ежегодно собирающий на своей площадке до 5000 участников. RUSSCO имеет прекрасную международную репутацию, тесно сотрудничает с наиболее авторитетными международными организациями, такими как ASCO, ESMO, ASTRO, MASC, ESO. В этом пандемичном году как никогда были востребованы и популярны вебинары RUSSCO. Информационной платформой Общества является портал RosOncoWeb, на страницах которого регулярно публикуются обновленные Практические рекомендации, новейшие события мира науки, анонсы предстоящих конференций, вебинаров, круглых столов. Важнейшей задачей Общества является открытие и поддержка молодых талантливых специалистов, воспитание нового поколения онкологов. Откройте программы научных и образовательных мероприятий Общества. Сколько новых молодых коллег участвуют в них, имея возможность рассказать о своих достижениях, прокомментировать ту ли иную сложную проблему, предложить ее решение. В Обществе создан и активно работает Комитет молодых онкологов, который организует эту работу. Все эти и многие другие достижения были бы невозможны без активной и слаженной работы многочисленных членов Общества, его Правления и работников штаб квартиры RUSSCO. Спасибо вам всем! Мы можем гордиться нашим Обществом! В этом году мы будем праздновать сразу три юбилейные даты: 25 лет Российскому онкологическому конгрессу, 25 лет веб порталу RosOncoWeb и 10 лет RUSSCO! Надеемся, что эпидемиологическая обстановка позволит провести 25-й Российский онкологический конгресс, как обычно, в очном формате, и отметить эти важные для всех нас даты! Не пропустите!
31 января 2021 г. исполнилось 10 лет со дня основания Российского общества клинической онкологии (RUSSCO), и это событие стало еще одним подтверждением скоротечности времени. В этот день десять лет назад наше Общество получило официальную регистрацию в Министерстве юстиции России.RUSSCO стало первым реальным профессиональным сообществом онкологов России, поскольку существующая Ассоциация онкологов России (АОР) до 2012 г. фактически объединяла в своих рядах юридические лица – институты и диспансеры и не предусматривала членство физических лиц. В связи с этим идея создания общества для онкологов была более чем актуальной, тем более что к тому моменту было создано и успешно работало под руководством Матвеева Бориса Павловича Общество онкоурологов, которое за короткое время стало центром профессиональной жизни для специалистов этого направления. На фотографии запечатлены участники инициативной группы – ведущие онкологи федеральных и региональных учреждений нашей страны, которые на своем первом заседании 8 июля 2010 года приняли решение о создании Общества и утверждении его Устава. Первоначально было принято решение о создании Общества специалистов по лекарственному лечению онкологических пациентов, поскольку не было четкого понимания того, как отнесутся к созданию такой организации онкологи других специальностей (хирурги, радиотерапевты, диагносты и т.д.). Документы были собраны и представлены в Министерство юстиции России, однако, наиболее сложной задачей оказался поиск кандидата на пост директора. Потенциальный претендент должен был обладать определенными качествами: быть специалистом онкологом, энергичным и амбициозным, иметь опыт организаторской работы. К счастью, для решения этой нетривиальной задачи не потребовалось много времени. Мое внимание привлекла активная работа молодого врача-онколога, организовавшего некоммерческую организацию Центр изучения рака почки, которая занималась образовательной и научной деятельностью за счет грантового финансирования. К моему глубокому удовлетворению Илья Валерьевич Тимофеев дал согласие на участие в сложной работе по созданию Общества, и в его лице мы обрели человека с искомыми характеристиками. Так нас стало двое. В декабре мы провели презентацию еще незарегистрированного Общества для наших потенциальных спонсоров, представив план работы на ближайший год. Презентация прошла успешно, свидетельством чему была организационная и финансовая поддержка нашего проекта. Это позволило арендовать нам первый скромный офис и пригласить на работу первых сотрудников. А тут и наступило 31 января 2011 года. Оглядываясь назад, до сих пор удивляюсь, как много нам всем удалось сделать за эти 10 лет. Сегодня RUSSCO является самым большим по количеству членов профессиональным онкологическим сообществом, которое быстро превратилось из Общества химиотерапевтов в Общество для всех специалистов, занимающихся диагностикой, лечением и реабилитацией онкологических пациентов. В составе RUSSCO работают 52 региональные организации, а количество членов превышает 5000 человек. RUSSCO стало первым сообществом, инициировавшим создание «Практических рекомендаций по лекарственной и поддерживающей терапии злокачественных опухолей». В написании Рекомендаций принимают участие авторитетные специалисты, представляющие федеральные и региональные онкологические учреждения. С 2012 г. Рекомендации ежегодно пересматриваются и издаются, и сегодня являются настольной книгой онкологов нашей большой страны. «Практические рекомендации» стали основой для написания разделов, посвященных лекарственному лечению, в национальных клинических рекомендациях, разработанных совместно с другими профессиональными сообществами под эгидой Ассоциации онкологов России. Мы гордимся программой молекулярно-генетической диагностики злокачественных опухолей, которая существует с 2012 г. В рамках этой программы больным и специалистам онкологам стали доступны современные методы определения прогностических и предиктивных биомаркеров, необходимые для составления оптимального плана лечения. На всей территории России, от Владивостока до Санкт- Петербурга, была организована сеть лабораторий, позволившая проводить тестирование независимо от места проживания больных. Возможностями программы RUSSCO пользуются более 2500 онкологов из 83 регионов России, различные виды тестирования выполнены более чем у 120000 больных. Широкое использование современных молекулярно-генетических тестов в клинической практике в рамках программы RUSSCO сделало возможным их финансирование по программе ОМС. RUSSCO активно участвует в постдипломном образовании онкологов. Наши специализированные конференции, посвященные отдельным аспектам лечения злокачественных опухолей, становятся все более популярными и позволяют глубоко погрузиться в сложную проблему лекарственного лечения онкологических заболеваний, а также обсудить с экспертами разнообразные клинические ситуации. Важным итогом этой работы является внесение в Практические рекомендации изменений, согласованных с ведущими специалистами. Своеобразной визитной карточкой нашего Общества, безусловно, является Российский онкологический конгресс, ежегодно собирающий на своей площадке до 5000 участников. RUSSCO имеет прекрасную международную репутацию, тесно сотрудничает с наиболее авторитетными международными организациями, такими как ASCO, ESMO, ASTRO, MASC, ESO. В этом пандемичном году как никогда были востребованы и популярны вебинары RUSSCO. Информационной платформой Общества является портал RosOncoWeb, на страницах которого регулярно публикуются обновленные Практические рекомендации, новейшие события мира науки, анонсы предстоящих конференций, вебинаров, круглых столов. Важнейшей задачей Общества является открытие и поддержка молодых талантливых специалистов, воспитание нового поколения онкологов. Откройте программы научных и образовательных мероприятий Общества. Сколько новых молодых коллег участвуют в них, имея возможность рассказать о своих достижениях, прокомментировать ту ли иную сложную проблему, предложить ее решение. В Обществе создан и активно работает Комитет молодых онкологов, который организует эту работу. Все эти и многие другие достижения были бы невозможны без активной и слаженной работы многочисленных членов Общества, его Правления и работников штаб квартиры RUSSCO. Спасибо вам всем! Мы можем гордиться нашим Обществом! В этом году мы будем праздновать сразу три юбилейные даты: 25 лет Российскому онкологическому конгрессу, 25 лет веб порталу RosOncoWeb и 10 лет RUSSCO! Надеемся, что эпидемиологическая обстановка позволит провести 25-й Российский онкологический конгресс, как обычно, в очном формате, и отметить эти важные для всех нас даты! Не пропустите!
Ждем Вас в Москве!

Прогресс в лечении НМРЛ
Автор: Тимофеев И.В.
Главный редактор Газеты RUSSCO, Институт онкологии Хадасса, Москва
Среди всех злокачественных опухолей рак легкого занимает первое место по заболеваемости в Российской Федерации. Согласно статистической базе SEER13, анализирующей популяционные данные с 2010 по 2016 годы в США, 5-летняя продолжительность жизни больных раком легкого составляет 20,5%, что свидетельствует об агрессивности болезни. Например, этот показатель для двух других частых опухолей – рака молочной железы и предстательной железы – составляет 90% и 97,8% соответственно. Именно поэтому на рак легкого направлено внимание ученых разных стран. Прогресс в науке и внедрение новых инновационных методов лечения уже позволили увеличить 5-летнюю продолжительность жизни до 30% на самых поздних стадиях заболевания. Например, результаты крупного исследования KEYNOTE-024 свидетельствуют о 5-летней выживаемости в 32% у пациентов с метастатическим немелкоклеточным раком легкого, получавших иммунотерапию, что оказалось в 2 раза выше, чем для традиционной химиотерапии. Исследование проводилось в 2014-2015 годы, 5-летняя продолжительность жизни больных с метастатическим раком легкого в рутинной практике в это время составляла всего 5,8% на основании данных популяционного анализа SEER13. Доказав свою эффективность в случае распространенной болезни, новые иммунные и таргетные препараты сделали прыжок в ранние стадии. Сначала в III стадии появился дурвалумаб в виде консолидирующей терапии после предшествующего химиолучевого лечения. В крупном рандомизированном исследовании PACIFIC, включившем 713 пациентов в различных странах, было показано, что риск возобновления болезни снижается практически в 2 раза, а продолжительность жизни пациентов значимо увеличивается. Это позволило внести химиолучевую терапию и дурвалумаб в международные и российские рекомендации. За долгие годы в лечении сложной опухоли произошла революция. К сожалению, революция пока не отразилась на российских результатах. Согласно данным опроса RUSSCO, опубликованным 2 февраля 2021 года в журнале Cancer Education, 31% онкологов вовсе не рассматривают химиолучевую терапию у больных III стадией, еще 50% считают, что химиолучевую терапию нужно проводить последовательно. Остается надеется на изменение подхода в самом ближайшем будущем. Равно как изменения в будущем могут быть связаны и с I-II стадиями немелкоклеточного рака легкого без метастазов в лимфатические узлы, для которых началось исследование PACIFIC-4, изучающее комбинацию стереотаксической лучевой терапии с последующей 2-летней консолидацией дурвалумабом. Самым значимым событием 2020 года в разделе терапии раннего рака легкого стало одобрение Управлением по контролю над качеством пищевых продуктов и лекарственных средств США (FDA) инновационной опции – осимертиниба после хирургического лечения EGFR-положительного немелкоклеточного рака легкого IB-IIIA стадий. Впервые таргетная терапия этого новообразования приобрела форму адъювантного лечения. На данный момент рак легкого – вторая опухоль после меланомы, для которой теперь требуется молекулярно-генетическое тестирование для персонификации адъювантной терапии. В исследовании ADAURA осимертиниб снизил риск возобновления болезни после операции на 80%. Медиана периода до прогрессирования в группе препарата так и не была достигнута, в то время как в группе плацебо медиана составила 19,6 месяца. Различия оказались высокодостоверными. Несомненно, большое количество идущих исследований продолжат менять нашу практику и повышать кривую выживаемости пациентов.
Источники:
1. База данных SEER13 [04.02.2021]: https://seer.cancer.gov/statfacts/html/lungb.html.
2. Brahmer JR, et al. Annals of Oncology. 2020; 31 (suppl_4): S1142-S1215. 10.1016/annonc/annonc325.
3. Antonia SJ, et al. Overall Survival with Durvalumab after Chemoradiotherapy in Stage III NSCLC. N Engl J Med. 2018 Dec 13; 379(24): 2342-2350.
4. Dengina N, et al. Patterns of Care and Barriers to Utilization of Definitive Concurrent Chemoradiation Therapy for Stage III Non-Small Cell Lung Cancer in Russia. J Cancer Educ. 2021 Feb 2. doi: 10.1007/s13187-021-01966- 8. Epub ahead of print.
5. Клиническое исследование PACIFIC-4: https://hadassah.moscow/raklegkogo-i-ii-stadii-pacific-4/.
6. Wu YL, et al. Osimertinib in Resected EGFR-Mutated Non-Small-Cell Lung Cancer. N Engl J Med. 2020 Oct 29; 383(18): 1711-1723.
7. Одобрение FDA осимертиниба: https://hadassah.moscow/news/osimertinib-posle-operacii-po-povoduraka-legkogo-i-iii-stadijsobytie-godav-institute-onkologii-hadassa-moskvanachali- spolzovat-innovacionnyjpreparat-osimertinib-dlja-snizhenijariska-vozobnovleni/
WCLC 2020: Адъювантная терапия осимертинибом при EGFRm НМРЛ IB-IIIA стадии - стабильное улучшение безрецидивной выживаемости независимо от проведения предшествующей адъювантной химиотерапии.
Материал предоставлен компанией «АстраЗенека».
Публикуется в редакции авторов.
Исследование III фазы ADAURA вызвало большой интерес в прошлом году: были опубликованы результаты незапланированного промежуточного анализа, которые показали 80% снижение риска рецидива или смерти при применении осимертиниба в адъювантном режиме в сравнении с плацебо у пациентов с НМРЛ IBIIIA стадии с наличием мутации в гене EGFR [1]. Хотя исходно первичный анализ данных ADAURA был запланирован не ранее 2022 г., эффективность осимертиниба была так высока, что независимый комитет по мониторингу данных рекомендовал раннее расслепление данных [2]. В конце декабря осимертиниб был одобрен Управлением США по контролю за качеством пищевых продуктов и лекарственных средств (FDA) в качестве адъювантной терапии после радикальной операции у пациентов с НМРЛ с мутацией в гене EGFR [3]. В России регистрация данного показания ожидается в этом году, но оно уже вошло в клинические рекомендации МЗ РФ [4]. В рамках международной конференции по раку легкого (2020 World Conference on Lung Cancer), прошедшей в январе 2021 г., были представлены новые данные из исследования ADAURA [5].
Ранее опубликованные результаты
В исследование ADAURA было включено 682 пациента с НМРЛ IB-IIIA стадии (TNM 7-й редакции) с мутацией в гене EGFR после радикальной операции. Проведение пред- или послеоперационной лучевой терапии не допускалось, но пациенты могли получать адъювантную химиотерапию. После завершения стандартного лечения пациенты получали осимертиниб или плацебо в течение 3 лет либо до развития рецидива или выполнения других критериев отмены лечения, в зависимости от того, что наступит раньше [1]. Первичной конечной точкой исследования была безрецидивная выживаемость (БРВ) у пациентов с НМРЛ II-IIIA стадии, согласно дизайну исследования для подтверждения эффективности осимертиниба необходимо было достигнуть отношения рисков (ОР) 0,70. А согласно результатам исследования ОР составило 0,17 (99,06% ДИ 0,11-0,26; P<0,001), что соответствует снижению риска рецидива или смерти на 83% при применении адъювантной терапии осимертинибом в сравнении с плацебо [1]. Результат для всей популяции включенных в исследование пациентов (НМРЛ IB-IIIA стадии) был сопоставимым: ОР 0,20 (99,12% ДИ 0,14-0,30; P<0,001), что соответствует снижению риска на 80% [1].
Данные по общей выживаемости на момент промежуточного анализа были незрелыми [1]. Важно Тимофеев Илья Валерьевич Главный редактор Газеты RUSSCO, Институт онкологии Хадасса, Москва отметить, что, несмотря на публикацию результатов, исследование по-прежнему заслеплено для врачей и пациентов (как завершивших, так и продолжающих лечение в рамках исследования). Это позволяет продолжать наблюдение и в будущем получить результаты по общей выживаемости [2]. Лечение осимертинибом сопровождалось хорошей переносимостью: частота осложнений 3-4 степени, связанных с приемом препарата, составила 10%. Основными проявлениями токсичности, преимущественно 1-2 степени тяжести, были диарея (46%), паронихий (25%), кожная сыпь(26%). Отмена препарата в связи с токсичностью зарегистрирована у 11% больных, в исследовании не отмечено летальных исходов вследствие токсичности лечения [1].
Влияние предшествующей адъювантной химиотерапии на безрецидивную выживаемость – подгрупповой анализ
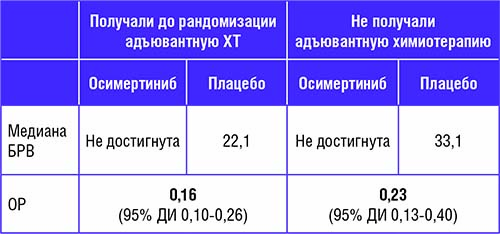
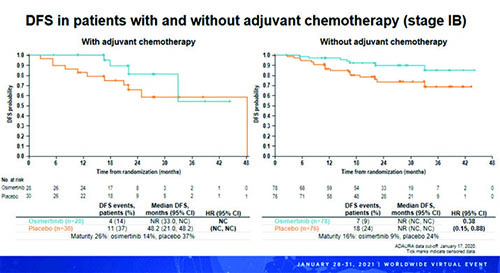
Рисунок 1. БРВ у пациентов с НМРЛ IB стади в зависимости от предшествующей адъювантной химиотерапии.
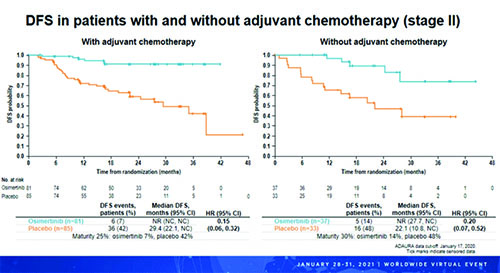
Рисунок 2. БРВ у пациентов с НМРЛ II стадии в зависимости от предшествующей адъювантной химиотерапии.
Это преимущество осимертиниба было выраженным вне зависимости от стадии аболевания. Таким образом, этот анализ подтвердил ранее полученные результаты и продемонстрировал, что адъювантная терапия осимертинибом приводила к стабильному улучшению БРВ у пациентов с EGFRm+ НМРЛ IB-IIIA стадией после радикальной операции с последующей адъювантной химиотерапией по показаниям как среди получавшихадъювантную химиотерапию, так и среди тех, кто адъювантную химиотерапию не получил.
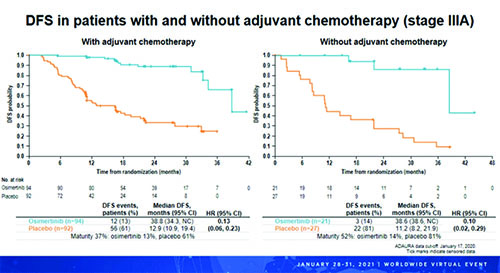
Рисунок 3. БРВ у пациентов с НМРЛ IIIA стадии в зависимости от предшествующей адъювантной химиотерапии.
Ссылки:
1. Wu YL, Tsuboi M, He J, et al. ADAURA Investigators. Osimertinib in resected EGFR-mutated non-smallcell lung cancer. N Engl J Med. 2020; 383(18): 1711-1723.
2. https://www.astrazeneca.com/media-centre/press-releases/2020/tagrisso-demonstratedunprecedented-disease-free-survival-inthe-adjuvant-treatment-of-stage-ib-iiiapatients-with-egfr-mutated-lung-cancer.html.
3. https://www.fda.gov/drugs/drug-approvalsand-databases/fda-approvesosimertinib-adjuvant-therapy-nonsmall-cell-lung-cancer-egfr-mutations.
4. Клинические рекомендации МЗ РФ. Злокачественное новообразование бронхов и легкого.
5. Yi-Long Wu et al. WCLC 2020 OA06.04.
6. Chouaid C, Danson S, Andreas S, et al. Adjuvant treatment patterns and outcomes in patients with stage IB-IIIAnon-small cell lung cancer in France, Germany, and the United Kingdom based on the LuCaBIS burden of illness study. Lung Cancer. 2018; 124: 310-316.
7. Buck PO, Saverno KR, Miller PJ, Arondekar B, Walker MS. Treatment patterns and health resource utilization among patients diagnosed with early stage resected non-small cell lung cancer at US community oncology practices. Clin Lung Cancer. 2015; 16(6): 486-495.
Пембролизумаб в комбинации с ипилимумабом у больных метастатическим немелкоклеточным раком легкого с экспрессией PD-L1: результаты исследования KEYNOTE-598
Автор: Michael Boyer,
et al. WCLC 2020, Abstract PS01.09
Монотерапия пембролизумабом
является стандартной терапией первой линии метастатического немелкоклеточного рака легкого (НМРЛ)
с экспрессией PD-L1 (TPS) ≥50% без
драйверных мутаций. Неизвестно,
улучшает ли добавление ипилимумаба к пембролизумабу эффективность
терапии в этой популяции.
На Всемирном конгрессе по раку легкого (WCLC, IASLC) были представлены результаты двойного слепого
рандомизированного исследования
3 фазы KEYNOTE-598, в котором
изучалась комбинация ингибиторов
PD-1 и CTLA-4.
568 пациентов с метастатическим
НМРЛ, отсутствием сенсибилизирующих мутаций EGFR или перестроек
ALK и PD-L1 TPS ≥50% были рандомизированы в соотношении 1:1 в
группу ипилимумаба 1 мг/кг (N=284)
или в группу плацебо (N=284), которые назначались каждые 6 недель
до 18 доз. Все участники получали
пембролизумаб по 200 мг каждые 3
недели до 35 доз. Первичными конечными точками были общая выживаемость и выживаемость без
прогрессирования.
Медиана общей выживаемости составила 21,4 месяца в группе пембролизумаба-ипилимумаба и 21,9
месяца в группе пембролизумаб-плацебо (отношение рисков 1,08; 95%
ДИ 0,85-1,37; P=0,74).
Медиана выживаемости без прогрессирования составила 8,2 и 8,4
месяца в этих когортах соответственно (отношение рисков 1,06; 95% ДИ 0,86-1,30; P=0,72). Нежелательные явления 3-5 степени наблюдались у 62,4% больных, получающих пембролизумаб-ипилимумаб, по сравнению с 50,2% в группе пембролизумаб-плацебо. Частота смертей была 13,1% и 7,5%. Комитет по мониторингу внешних данных и безопасности рекомендовал прекратить исследование из-за несоответствия целям.
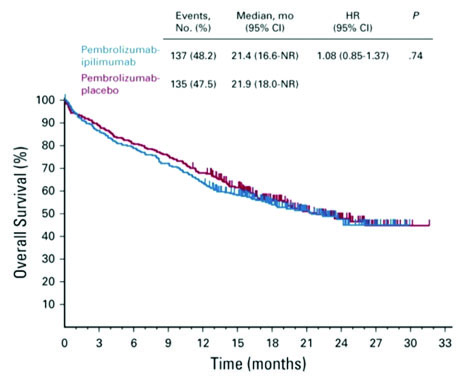
Michael Boyer с соавторами считают, что добавление ипилимумаба к пембролизумабу не улучшает эффективность и приводит к большей токсичности, чем монотерапия пембролизумабом, в качестве терапии первой линии метастатического НМРЛ с PD-L1 TPS ≥50% и без мутаций EGFR или ALK. Следовательно, полученные данные не подтверждают использование комбинации пембролизумаба и ипилимумаба вместо монотерапии пембролизумабом в этой популяции пациентов.
Цемиплимаб в первой линии терапии распространенного немелкоклеточного рака легкого с экспрессией PD-L1>50%: результаты исследования 3 фазы
Цемиплимаб - моноклональное высокоаффинное полностью человеческое антитело, являющееся ингибитором PD-1. Ранее цемиплимаб был одобрен FDA для терапии плоскоклеточного рака кожи. 22 февраля 2021 года FDA выдало одобрение на использование препарата у больных метастатическим немелкоклеточным раком легкого (НМРЛ) с экспрессией PD-L1 50% и более, не получавших ранее лекарственное лечение по поводу распространенной болезни. Основанием для одобрения стали результаты рандомизированного исследования EMPOWERLung 1. В многоцентровом открытом глобальном исследовании 3 фазы EMPOWER-Lung 1 приняли участие пациенты из 138 центров 24 стран (в возрасте ≥18 лет с гистологически или цитологически подтвержденным распространенным НМРЛ, ECOG PS 0-1. 710 пациентов были случайным образом распределены в соотношении 1:1 в группу цемиплимаба в дозе 350 мг каждые 3 недели или в группу химиотерапии платиновым дуплетом. Кроссовер из группы химиотерапии в группу цемиплимабу разрешался после прогрессирования заболевания. Первичными конечными точками были общая выживаемость и выживаемость без прогрессирования, которые оценивали независимым экспертным комитетом. Для оценки экспрессии PD-L1 использовалась иммуногистохимия с антителом 22C3 (Ventana). Нежелательные явления оценивались у всех пациентов, получивших хотя бы одну дозу назначенного лечения. В популяции пациентов с экспрессией PD-L1 не менее 50% (N=563) медиана общей выживаемости не была достигнута (95% ДИ 17,9 - NA) в группе цемиплимаба (N=283) по сравнению с 14,2 месяцами (11,2-17,5) в группе химиотерапии (N=280). Риск смерти снижался на 43% (отношение рисков [HR] 0,57; p = 0,0002). Медиана выживаемости без прогрессирования составила 8,2 месяца (6,1-8,8) при монотерапии цемиплимабом по сравнению с 5,7 месяцами (4,5-6,2) при терапии платиновым дуплетом (отношение рисков 0,54; p <0,0001). Существенное улучшение общей выживаемости и выживаемости без прогрессирования также наблюдалось при применении цемиплимаба в популяции после кроссовера (74%). Нежелательные явления 3-4 степени, возникающие в результате лечения, наблюдались у 98 (28%) из 355 пациентов, получавших цемиплимаб, и у 135 (39%) из 342 пациентов, получавших химиотерапию. Авторы сделали вывод, что монотерапия цемиплимабом значительно улучшила общую выживаемость и выживаемость без прогрессирования по сравнению с химиотерапией у пациентов с распространенным НМРЛ с экспрессией PD-L1 не менее 50%, являясь теперь ещё одним новым вариантом лечения в этой популяции больных.
Источники:
1. Sezer A, et al. Cemiplimab monotherapy for first-line treatment of advanced non-small-cell lung cancer with PD-L1 of at
least 50%: a multicentre, open-label, global, phase 3, randomised, controlled trial. Lancet. 2021 Feb 13;397(10274):592-604.
2. Вебсайт FDA: https://www.fda.gov/drugs/drug-approvals-and-databases/fda-approves-cemiplimab-rwlc-non-small-cell-lung-cancer-high-pd-l1-expression

Обновление рекомендаций ASCO 2021: таргетная терапия немелкоклеточного рака легкого
Для обновления практических рекомендаций таргетной терапии у пациентов с немелкоклеточным раком легкого (НМРЛ) была создана совместная экспертная группа Американского общества клинической онкологии (ASCO) и Ontario Health (OH), которая на основании систематического обзора медицинской литературы предложила следующие опции:
Рекомендация 1.1 Пациенты с НМРЛ
IV стадии и драйверными мутациями в гене EGFR, не получавшие ранее
лечение:
• Пациентам с мутациями T790M,
L858R или с делецией в экзоне 19
в качестве терапии первой линии
должен быть предложен осимертиниб
(уровень доказательства: высокий;
убедительность рекомендации: сильная).
Рекомендации 1.2, 1.3, 1.4 и 1.5
Пациенты с НМРЛ IV стадии и драйверными мутациями в гене EGFR
– при невозможности проведения
терапии осимертинибом:
• При невозможности применения
осимертиниба в качестве терапии
первой линии может быть предложен гефитиниб в сочетании с химиотерапией или дакомитиниб
(уровень доказательства: высокий;
убедительность рекомендации: средняя).
• Другие возможные варианты терапии включают афатиниб, эрлотиниб/бевацизумаб, эрлотиниб/
рамуцирумаб или монотерапию
гефитинибом, эрлотинибом или
икотинибом
(уровень доказательства: средний;
убедительность рекомендации: средняя).
Рекомендация 1.6 Пациенты с
НМРЛ IV стадии, c ECOG PS = 3
и драйверными мутациями в гене
EGFR:
• В первой линии пациентам с общим состоянием по шкале ECOG,
равным 3 баллам, может быть
предложена терапия ингибиторами
EGFR
(тип: неофициальный консенсус; уровень доказательства: низкий; убедительность рекомендации: слабая).
Рекомендация 1.7 Пациенты с
НМРЛ IV стадии и редкими драйверными мутациями в гене EGFR, не
получавшие ранее лечение:
• Пациентам с мутациями гена
EGFR, отличными от мутаций в
экзоне 20, мутаций T790M, L858R
или делеции в экзоне 19, может
быть предложена терапия афатинибом
(тип: неофициальный консенсус;
уровень доказательства: низкий;
убедительность рекомендации:
средняя)
• или осимертинибом
(тип: неофициальный консенсус;
уровень доказательства: низкий;
убедительность рекомендации:
слабая)
• или терапия, указанная в руководстве ASCO/OH по лечению пациентов без драйверных мутаций
(тип: неофициальный консенсус;
уровень доказательства: низкий;
убедительность рекомендации:
средняя).
Рекомендация 1.8 Пациенты с НМРЛ
IV стадии и драйверными мутациями в гене EGFR, не получавшие ранее
лечение:
• У пациентов с любой активирующей мутацией EGFR (в том числе
в экзоне 20), независимо от уровней экспрессии лиганда рецептора программируемой клеточной
гибели 1 (PD-L1), в качестве терапии первой линии не следует
использовать монотерапию ингибитором контрольных точек
(тип: неофициальный консенсус;
уровень доказательства: низкий;
убедительность рекомендации:
средняя).
Рекомендация 1.9 Пациенты с
НМРЛ IV стадии и драйверными мутациями в гене EGFR, обуславливающими резистентность к ингибиторам
EGFR первого и второго поколений:
• Пациентам с мутациями EGFR
в экзоне 20, обуславливающими
резистентность к ингибиторам
EGFR первого и второго поколений, может быть предложена
двухкомпонентная химиотерапия
с бевацизумабом или без него,
или стандартная терапия, указанная в руководстве ASCO/OH по
лечению пациентов без драйверных мутаций
(тип: неофициальный консенсус;
уровень доказательства: низкий;
убедительность рекомендации:
средняя).
Рекомендации 2.1 и 2.2 Пациенты
с НМРЛ IV стадии и драйверными
мутациями в гене EGFR, получавшие
ранее лечение:
• В качестве терапии второй линии
пациентам, которые не получали
осимертиниб, и у которых на момент прогрессирования заболевания обнаружена мутация T790M,
должна быть предложена терапия
осимертинибом
(уровень доказательства: высокий;
убедительность рекомендации:
сильная).
• В качестве терапии второй линии пациентам с любой мутацией EGFR и прогрессированием на
фоне терапии ингибиторов EGFR
без мутации T790M ИЛИ при
прогрессировании на фоне терапии осимертинибом может быть
предложена терапия в соответствии с руководством ASCO/OH
по лечению пациентов без драйверных мутаций
(тип: неофициальный консенсус;
уровень доказательства: низкий;
убедительность рекомендации:
средняя).
Рекомендация 3.1 Пациенты с
НМРЛ IV стадии и перестройками
ALK, не получавшие ранее лечение:
• В качестве терапии первой линии
должен быть предложен алектиниб или бригатиниб
(уровень доказательства: высокий;
убедительность рекомендации:
сильная).
• При невозможности терапии
алектинибом или бригатинибом
в качестве терапии первой линии
должен быть предложен церитиниб или кризотиниб
(уровень доказательства: высокий;
убедительность рекомендации:
сильная).
Рекомендации 4.1, 4.2 и 4.3 Пациенты с НМРЛ IV стадии и перестройками ALK, получавшие ранее ингибитор ALK:
• В качестве терапии второй линии после применения алектиниба или бригатиниба может быть
предложен лорлатиниб
(тип: неофициальный консенсус;
уровень доказательства: низкий;
убедительность рекомендации:
средняя).
• В качестве терапии второй линии
после применения кризотиниба
должен быть предложен алектиниб, бригатиниб или церитиниб
(уровень доказательства: средний;
убедительность рекомендации:
сильная).
• В качестве терапии третьей линии
после применения кризотиниба в
рамках первой линии и алектиниба, бригатиниба или церитиниба в
рамках второй линии может быть
предложен лорлатиниб
(тип: неофициальный консенсус;
уровень доказательства: низкий;
убедительность рекомендации:
средняя)
• или стандартная терапия, указанная в руководстве ASCO/OH по
лечению пациентов без драйверных мутаций
(тип: неофициальный консенсус;
уровень доказательства: низкий;
убедительность рекомендации:
слабая).
Рекомендации 5.1, 5.2 и 5.3 Пациенты с НМРЛ IV стадии и перестройками ROS1, не получавшие ранее
лечение:
• В качестве терапии первой линии
может быть предложен кризотиниб или энтректиниб
(тип: неофициальный консенсус;
уровень доказательства: низкий;
убедительность рекомендации:
средняя)
• или стандартная терапия, указанная в руководстве ASCO/OH по
лечению пациентов без драйверных мутаций
(тип: неофициальный консенсус;
уровень доказательства: низкий;
убедительность рекомендации:
средняя)
• или церитиниб или лорлатиниб
(тип: неофициальный консенсус;
уровень доказательства: низкий;
убедительность рекомендации:
слабая).
Рекомендации 6.1 и 6.2 Пациенты с
НМРЛ IV стадии и перестройками
ROS1, получавшие ранее лечение:
• В качестве терапии второй линии после применения в рамках
первой линии ингибиторов ROS1должно быть предложено стандартное лечение в соответствии
с руководством ASCO/OH по лечению пациентов без драйверных
мутаций
(тип: неофициальный консенсус; уровень доказательства: низкий; убедительность рекомендации: средняя).
• В случае, если в рамках первой
линии проводилась нетаргетная
терапия, в качестве второй линии
может быть предложено применение кризотиниба, церитиниба
или энтректиниба
(тип: неофициальный консенсус; уровень доказательства: низкий; убедительность рекомендации: средняя).
Рекомендации 7.1 и 7.2 Пациенты
с НМРЛ IV стадии и драйверной
мутацией V600Е в гене BRAF, не
получавшие ранее лечение:
• В качестве терапии первой линии
может быть предложено применение дабрафениба/траметиниба
(тип: неофициальный консенсус; уровень доказательства: низкий; убедительность рекомендации: средняя)
• или стандартная терапия первой
линии, указанная в руководстве
ASCO/OH по лечению пациентов
без драйверных мутаций
(тип: неофициальный консенсус; уровень доказательства: низкий; убедительность рекомендации: средняя).
Рекомендации 8.1, 8.2, 8.3 и 8.4
Пациенты с НМРЛ IV стадии и
драйверной мутацией V600Е в гене
BRAF, получавшие ранее лечение:
• В качестве терапии второй линии
после применения ингибиторов
BRAF/MEK должно быть предложено стандартное лечение в соответствии с руководством ASCO/
OH по лечению пациентов без
драйверных мутаций
(тип: неофициальный консенсус; уровень доказательства: низкий; убедительность рекомендации: средняя).
• В качестве терапии второй линии
может быть предложено применение дабрафениба/траметиниба,
если в рамках первой линии ингибиторы BRAF не применялись
(тип: неофициальный консенсус; уровень доказательства: низкий; убедительность рекомендации: средняя)
• или монотерапия дабрафенибом
либо вемурафенибом
(тип: неофициальный консенсус;
уровень доказательства: низкий;
убедительность рекомендации: слабая).
• Если ранее в рамках первой или
последующих линий применяли
химиотерапию, иммунотерапию
и/или ингибиторы BRAF, должно
быть предложено стандартное лечение в соответствии с руководством ASCO/OH по лечению пациентов без драйверных мутаций
(тип: неофициальный консенсус;
уровень доказательства: низкий;
убедительность рекомендации:
средняя).
Рекомендация 8.4 Пациенты с
НМРЛ IV стадии и другими драйверными мутациями в гене BRAF,
помимо V600Е:
• В качестве терапии второй линии
должно быть предложено стандартное лечение в соответствии
с руководством ASCO/OH по лечению пациентов без драйверных
мутаций
(тип: неофициальный консенсус; уровень доказательства: низкий; убедительность рекомендации: средняя).
Рекомендации 9.1 и 9.2 Пациенты
с НМРЛ IV стадии и мутацией, вызвавшей пропуск экзона 14 в гене
MET, не получавшие ранее лечение:
• В качестве терапии первой линии
пациентам с мутацией, вызвавшей
пропуск экзона 14 в гене MET, может быть предложен ингибиторы
МЕТ - капматиниб или тепотиниб
или стандартная терапия, указанная в руководстве ASCO/OH по лечению пациентов без драйверных
мутаций
(тип: неофициальный консенсус; уровень доказательства: низкий; убедительность рекомендации: средняя).
Рекомендации 10.1 и 10.2 Пациенты с НМРЛ IV стадии и мутацией,
вызвавшей пропуск экзона 14 в гене
MET, получавшие ранее лечение:
• В качестве терапии второй линии,
если у пациента обнаружены другие аномалии гена МЕТ, кроме мутаций, вызвавших пропуск экзона
14, или если в рамках терапии первой линии применяли ингибиторы МЕТ, может быть предложено
стандартное лечение в соответствии с руководством ASCO/OH
по лечению пациентов без драйверных мутаций
(тип: неофициальный консенсус;
уровень доказательства: низкий;
убедительность рекомендации:
средняя).
• В качестве терапии второй линии
пациентам с мутацией, вызвавшей пропуск экзона 14 в гене MET,
которые ранее получали или не
получали химиотерапию первой
линии в сочетании с иммунотерапией или без нее (т.е. если в рамках
терапии первой линии пациент не
получал ингибитор МЕТ), может
быть предложена терапия капматинибом или тепотинибом
(тип: неофициальный консенсус;
уровень доказательства: низкий;
убедительность рекомендации:
средняя).
Рекомендации 11.1, 11.2 и 11.3 Пациенты с НМРЛ IV стадии и драйверными мутациями в гене RET, не
получавшие ранее лечение:
• В качестве терапии первой линии
может быть предложена терапия
селперкатинибом или стандартная
терапия, указанная в руководстве
ASCO/OH по лечению пациентов
без драйверных мутаций
(тип: неофициальный консенсус;
уровень доказательства: низкий;
убедительность рекомендации:
средняя)
• или пралсетиниб*
(тип: неофициальный консенсус;
уровень доказательства: низкий;
убедительность рекомендации: слабая).
Рекомендации 12.1, 12.2 и 12.3 Пациенты с НМРЛ IV стадии и драйверными мутациями в гене RET,
получавшие ранее лечение:
• В качестве терапии второй линии
после применения в рамках первой линии ингибиторов RET может быть предложено стандартное
лечение в соответствии с руководством ASCO/OH по лечению пациентов без драйверных мутаций
(тип: неофициальный консенсус;
уровень доказательства: низкий;
убедительность рекомендации:
средняя).
• В качестве терапии второй линии,
если в рамках терапии первой линии не применялись ингибиторы
RET, может быть предложен селперкатиниб
(тип: неофициальный консенсус;
уровень доказательства: низкий;
убедительность рекомендации:
средняя)
• или пралсетиниб*
(тип: неофициальный консенсус; уровень доказательства: низкий; убедительность рекомендации: слабая).
Рекомендации 13.1 и 13.2 Пациенты
с НМРЛ IV стадии и драйверными
мутациями гена NTRK, не получавшие ранее лечение:
• В качестве терапии первой линии
может быть предложен энтректиниб или ларотректиниб или стандартная терапия, указанная в руководстве ASCO/OH по лечению
пациентов без драйверных мутаций
(тип: неофициальный консенсус; уровень доказательства: низкий; убедительность рекомендации: средняя).
Рекомендации 14.1 и 14.2 Пациенты
с НМРЛ IV стадии и драйверными
мутациями гена NTRK, получавшие
ранее лечение:
• В качестве терапии второй линии
после применения в рамках первой
линии ингибитора NTRK может
быть предложено стандартное лечение в соответствии с руководством ASCO/OH по лечению пациентов без драйверных мутаций
(тип: неофициальный консенсус; уровень доказательства: низкий; убедительность рекомендации: средняя).
• В качестве терапии второй линии,
если в рамках первой линии не применялись ингибиторы NTRK, могут
быть предложены энтректиниб или
ларотректиниб
(тип: неофициальный консенсус; уровень доказательства: низкий; убедительность рекомендации: средняя).
Примечание:
Если не указано иное, рекомендации
применимы к пациентам с оценкой
ECOG PS 0-2 балла.
*Оценка результатов исследования
продолжает проводиться.
Рекомендации по таргетной терапии НМРЛ ASCO и RUSSCO – сходства и различия. Бог в мелочах.
Автор: Моисеенко Федор Владимирович,
ГБУЗ «Санкт-Петербургский клинический научно-практический центр специализированных видов медицинской помощи (онкологический)», Санкт-Петербург
В начале стоит сказать о сходстве в принципах формирования рекомендаций. Все рекомендации учитывают необходимость определения молекулярных нарушений для определения возможности таргетной терапии. В обеих рекомендациях учтены наиболее частые молекулярные нарушения, такие как EGFR, ALK, ROS1. Не забыты и более редкие изменения: BRAF, MET, RET, HER2 и NTRK. Во всех случаях выявления молекулярных нарушений до начала цитостатических комбинаций предпочтение должно отдаваться таргетной терапии. Для групп с наиболее частыми мутациями (EGFR, ALK, ROS1) рекомендации содержат несколько линий таргетной терапии. Тем не менее, есть несколько существенных различий, которые обусловлены тем, что зарубежные рекомендации базируются, в первую очередь, на принципах сравнительной эффективности, в то время как отечественные должны также учитывать финансовые нюансы системы в России. Несмотря на относительно хорошую ситуацию с обеспечением лекарственными препаратами, не 100%-ное обеспечение, в первую очередь, в регионах требует сохранения более старых опций. Так, современные препараты - осимертиниб, алектиниб и бригатиниб - являются предпочтительными опциями для лечения НМРЛ с нарушениями EGFR и ALK. В то же время в РФ полностью обеспечить больных этими препаратами не представляется возможным. Второй особенностью отечественных рекомендаций является более длительный регистрационный путь лекарственных препаратов. Так, для некоторых видов нарушений, например, мутаций МЕТ, единственной опцией является более старый препарат кризотиниб, в то время как в рекомендациях ASCO есть уже зарегистрированные капматиниб и тепотиниб; для транслокаций RET – селперкатиниб, для транслокаций NTRK – энтректиниб или ларотректиниб. Абсолютно ясно, что рекомендации ASCO и RUSSCO в большей степени похожи, чем различны. Тем не менее, существенные отличия нашей системы здравоохранения требуют учета региональных особенностей, а оценка возможностей обеспечения таких относительно малочисленных групп необходимыми дорогостоящими препаратами должна больше базироваться на финансовых расчетах, исходящих из
Насколько эффективны различные поколения ингибиторов тирозинкиназы EGFR и их комбинированные режимы при EGFR-ассоциированном раке легкого?
В Журнале «Злокачественные опухоли» были опубликованы результаты мета-анализа исследований эффективности различных поколений ингибиторов тирозинкиназы EGFR и их комбинированных режимов при EGFR-положительном немелкоклеточном раке легкого (НМРЛ). В настоящее время выбор из нескольких вариантов первой линии для больных НМРЛ, ассоциированным с мутациями EGFR основан исключительно на предпочтениях конкретного специалиста и финансовых возможностях региона. При этом с учетом ограниченности контингента с активирующими мутациями, проведение крупных исследований, направленных на решение важных клинических вопросов сопряжено с финансовыми и временными затратами. В связи с этим получение дополнительных аргументов о более высокой эффективности отдельных подходов в конкретных клинических группах, вне всякого сомнения, может быть использовано как дополнительный аргумент в пользу выбора того или иного подхода. Авторы провели мета-анализ 10 рандомизированных исследований различных лекарственных подходов в первой линии у больных EGFR-мутированным НМРЛ с целью идентификации отдельных клинических групп, получающих максимальный выигрыш от выбора того или иного метода. Проведенный мета-анализ выявил неравнозначное влияние исследованных режимов на общую выживаемость в различных клинических группах пациентов. Для женщин (относительный риск (ОР) = 0,79, p = 0,04), более молодых пациентов (ОР=0,66, p = 0,0004), больных с мутациями в экзоне 21 (ОР=0,76, p = 0,04), а также пациентов с ECOG 1 (ОР=0,72, p = 0,002) подобное улучшение может быть достигнуто выбором в пользу ингибитора второго поколения. Для остальных же групп, в частности, мужчин, при ECOG 0, для пациентов с мутациями в экзоне 19 для увеличения выживаемости требуется более агрессивное лечение — комбинирование ингибиторов тирозинкиназы (ИТК) и цитостатической терапии (ОР=0,57, p = 0,0008). По результатам мета-анализа увеличение продолжительности жизни при комбинировании ИТК и антиангиогенных препаратов не выявлено (ОР=0,89, p = 0,33). Необычным наблюдением, сделанным в результате нашего исследования, явилось то, что на фоне отсутствия статистически значимого преимущества в частоте объективных ответов второго поколения ИТК и комбинированных режимов перед монотерапией ИТК первого поколения эти опции показывали значимое увеличение выживаемости без прогрессирования относительно монотерапии ИТК первого поколения. Таким образом, авторами показана важность дифференцированного подхода к выбору терапии первой линии больных НМРЛ, ассоциированным с мутациями EGFR. Полученные данные подчеркивают необходимость сравнения эффективности различных опций терапии с ИТК третьего поколения и комбинации анти-PD (L) 1 антител с химиотерапией первой линии в рамках сетевого мета-анализа.
Источник:
Моисеенко Ф.В. с соавт. Мета-анализ исследований эффективности различных поколений ингибиторов тирозинкиназы EGFR и их комбинированных режимов при EGFR-ассоциированном НМРЛ. Злокачественные опухоли. 2020;10(2):5-30.

Рекомендации ASCO-ASTRO: лучевая терапия при локализованном мелкоклеточном раке легкого. Мнения экспертов
Американское общество клинической онкологии (ASCO) совместно с Американским обществом радиотерапевтов (ASTRO) обновили рекомендации по лучевой терапии (ЛТ) у больных локализованным мелкоклеточным раком легкого (ЛС-МКРЛ).
Рекомендация 1.1. Пациентам с ЛС-МКРЛ, которые способны перенести радикальную терапию, рекомендуется ЛТ с облучением области грудной клетки (уровень убедительности рекомендации: сильная; качество доказательств: высокое).
Рекомендация 1.2. У пациентов с ЛС-МКРЛ, получающих химиотерапию и лучевую терапию, ЛТ с облучением области грудной клетки следует начинать параллельно с 1 или 2 циклами химиотерапии (уровень убедительности рекомендации: сильная; качество доказательств: среднее). Примечание по практическому применению: важно придерживаться рекомендаций по дозам и последовательности химиотерапии и ЛТ во времени на основании данных клинических исследований. Выбор времени имеет решающее значение для ЛТ в режиме ускоренного фракционирования дозы. Уточняющий комментарий ASCO: включая режимы гиперфракционирования (облучение два раза в день).
Рекомендация 1.3. У пациентов с ЛС-МКРЛ и положительными краями резекции R1 или R2 в послеоперационном периоде рекомендуется проведение ЛТ (уровень убедительности рекомендации: условная; качество доказательств: мнение экспертов).
Рекомендация 1.4. У пациентов с ЛС-МКРЛ, у которых клинически не определялись метастазы в лимфатических узлах, но по результатам патоморфологической оценки была диагностирована стадия N2, в послеоперационном периоде рекомендуется проведение ЛТ с облучением области средостения (уровень убедительности рекомендации: условная; качество доказательств: мнение экспертов).
Рекомендация 1.5. Пациентам с ЛС-МКРЛ рекомендуется ЛТ два раза в день с фракционированием по 1,5 Гр до достижения суммарной дозы 45 Гр (уровень убедительности рекомендации: сильная; качество доказательств: высокое).
Рекомендация 1.6. В качестве альтернативы ЛТ два раза в день пациентам с ЛС-МКРЛ может быть рекомендована ежедневная ЛТ один раз в день и фракционированием по 2 Гр до достижения суммарной дозы 60-70 Гр (уровень убедительности рекомендации: условная; качество доказательств: среднее).
Рекомендация 1.7. Пациентам с ЛС-МКРЛ в качестве стандарта лечения рекомендуется ЛТ на пораженные участки (определяются как накапливающие фтордезоксиглюкозу на ПЭТ, увеличенные в размерах на КТ и/или с положительным результатом биопсии) (уровень убедительности рекомендации: сильная; качество доказательств: среднее).
Рекомендация 1.8. Пациентам с ЛС-МКРЛ, у которых произошло сокращение опухоли в размерах в результате химиотерапии, рекомендуется облучение всех вовлеченных групп лимфоузлов (на момент постановки диагноза) и паренхиматозной опухоли легких после химиотерапии (уровень убедительности рекомендации: сильная; качество доказательств: среднее).
Рекомендация 1.9. У пациентов с ЛС-МКРЛ рекомендуется использовать высококонформные методики, чтобы минимизировать поглощенную дозу в здоровых тканях (уровень убедительности рекомендации: сильная; качество доказательств: низкое).
Роль стереотаксической лучевой терапии (SBRT) при лечении пациентов с МКРЛ I или II стадии при отсутствии поражения лимфоузлов
Рекомендация 2.1. Пациентам
с ЛС-МКРЛ I или II стадии при
отсутствии поражения лимфоузлов, которые признаны неоперабельными по результатам
оценки клинического состояния, рекомендуется проведение
SBRT либо ЛТ с конвенционным
фракционированием (уровень
убедительности рекомендации: сильная; качество доказательств: среднее).
Примечание по практическому
применению:
• В идеале отрицательный статус
поражения лимфоузлов должен
быть подтвержден посредством
инвазивного стадирования вовлечения лимфоузлов.
• Для облучения ультрацентрических опухолей (поясняющий
комментарий ASCO: имеется в
виду, что планируемый целевой
объем примыкает к или накладывается на проксимальную
часть бронхиального дерева,
пищевод или трахею), возможно, целесообразно использовать
схему с конвенционным фракционированием.
Рекомендация 2.2. У пациентов с ЛС-МКРЛ I или II стадии при отсутствии поражения лимфоузлов, получающих SBRT, должна проводиться химиотерапия при условии ее клинической переносимости (уровень убедительности рекомендации: сильная; качество доказательств: среднее).
Профилактическое облучение головного мозга
Рекомендация 3.1. У пациентов с МРЛ, достигших ответа на первичную терапию, рекомендуется проведение повторного стадирования, включающего МРТ головного мозга, для принятия решения относительно профилактического облучения головного мозга (ПОГМ) (уровень убедительности рекомендации: сильная; качество доказательств: низкое).
Рекомендация 3.2. Пациентам с МКРЛ I стадии ПОГМ условно не рекомендуется (уровень убедительности рекомендации: условная; качество доказательств: низкое). Примечание по практическому применению: в качестве альтернативы ПОГМ можно использовать наблюдательную стратегию с проведением МРТ головного мозга с контрастированием.
Рекомендация 3.3. У пациентов с ЛС-МКРЛ II-III стадии, возраст которых составляет <70 лет, с хорошим общим состоянием (оценка по ECOG 0-2) и наблюдаемым ответом на торакальную химиолучевую терапию, рекомендуется проведение ПОГМ (уровень убедительности рекомендации: сильная; качество доказательств: высокое).
Рекомендация 3.4. Решение относительно проведения ПОГМ у пациентов с ЛС-МКРЛ пожилого возраста с ослабленным общим состоянием и/или наличием значимых сопутствующих заболеваний рекомендуется принимать совместно с пациентом и другими специалистами (с учетом характеристик пациента и заболевания в каждом конкретном случае) (уровень убедительности рекомендации: сильная; качество доказательств: низкое).
Рекомендация 3.5. Для пациентов с ЛС-МКРЛ, проходящих ПОГМ, рекомендованная суммарная доза составляет 25 Гр с разделением на 10 фракций (уровень убедительности рекомендации: сильная; качество доказательств: среднее).
Рекомендация 3.6. Пациентам с распространенной стадией МКРЛ (РС-МКРЛ), у которых наблюдается ответ на химиотерапию, рекомендуется консультация онколога-радиолога для принятия более обоснованного и взвешенного решения относительно выбора между ПОГМ и наблюдательной стратегией с использованием МРТ (с учетом характеристик пациента и заболевания в каждом конкретном случае) (уровень убедительности рекомендации: сильная; качество доказательств: среднее).
Рекомендация 3.7. Для пациентов с РС-МКРЛ, которые предпочли ПОГМ, рекомендованная суммарная доза составляет 25 Гр с разделением на 10 фракций либо 20 Гр с разделением на 5 фракций (уровень убедительности рекомендации: сильная; качество доказательств: среднее).
Консолидирующая ЛТ с облучением области грудной клетки при (РС-МКРЛ)
Рекомендация 4.1. Пациентам с РС-МКРЛ, у которых наблюдается ответ после проведения только химиотерапии, при наличии остаточной опухоли в грудной клетке рекомендуется ЛТ с облучением области грудной клетки (уровень убедительности рекомендации: сильная; качество доказательств: высокое).
Рекомендация 4.2. Пациентам с РС-МКРЛ, у которых наблюдается ответ после проведения только химиотерапии, условно рекомендуется ЛТ с облучением области грудной клетки в дозе 30 Гр с разделением на 10 фракций (уровень убедительности рекомендации: условная; качество доказательств: среднее). Примечание по практическому применению: у пациентов, у которых ожидается продолжительная выживаемость, возможно, целесообразно применение более высоких доз.
Рекомендация 4.3. Пациентам с РС-МКРЛ, у которых планируется облучение области грудной клетки, ЛТ следует проводить после завершения химиотерапии (уровень убедительности рекомендации: сильная; качество доказательств: высокое).
Рекомендация 4.4. Пациентам с
РС-МКРЛ, у которых наблюдается ответ после проведения химиотерапии и иммунотерапии, при
наличии остаточной опухоли в
грудной клетке условно рекомендуется ЛТ с облучением области
грудной клетки в дозе до 30 Гр
с разделением на 10 фракций в
течение 6-8 недель (поясняющий комментарий ASCO: после
завершения химиотерапии и
перед началом поддерживающей
иммунотерапии) (уровень убедительности рекомендации: условная; качество доказательств:
мнение экспертов).
Рекомендации ASTRO/ASCO по лучевой терапии мелкоклеточного рака легкого: различия и сходства с Российскими клиническими рекомендациями
Автор: Деньгина Наталья Владимировна
ГУЗ «Областной клинический онкологический диспансер», Ульяновск
Лучевой терапии (ЛТ) рака легкого в России зачастую отводится незавидная второстепенная роль. Даже в случае высокочувствительного к ионизирующему излучению мелкоклеточного рака легкого (МКРЛ) предпочтение отдается химиотерапии (ХТ) даже при ограниченных стадиях, а момент добавления облучения откладывается до последнего этапа либо игнорируется вовсе. В результате ЛТ в лучшем случае играет роль лишь метода консолидации, а не самостоятельного эффективного лечебного метода, особенно в комбинации с химиотерапией.
Новые рекомендации ASTRO, дополненные и уточненные экспертами ASCO, подробно коснулись самых важных вопросов ЛТ при МКРЛ–показаний, режимов, доз, облучения головного мозга как при ограниченном, так и при распространенном МКРЛ. И если сравнить их с российскими рекомендациями, в частности, АОР (Ассоциации онкологов России), на которые ориентируются эксперты проверяющих страховых компаний, то можно найти ряд явных несоответствий.
1. В отношении комбинации ЛТ и ХТ при локализованном МКРЛ российские рекомендации, как АОР, так и RUSSCO, созвучны с международными: рекомендовано как стандарт химиолучевое лечение с более ранним началом ЛТ (совместно с 1 или 2 курсом ХТ).
2. Предлагаемые режимы облуче-ния при локализованном МКРЛ схожи: допустимы варианты гиперфракционированного облучения (1,5 Гр 2 раза в день до 45 Гр) и традиционного (по 2 Гр до 60 Гр), причем оба они сочетаются с ХТ.
3. Объемы облучения. Во всем мире современным стандартом стало селективное облучение, или облучение ТОЛЬКО вовлеченных зон (первичной опухоли и зон пораженных лимфоузлов), что должно быть подтверждено на КТ, ПЭТ и/или путем биопсии и морфологической верификации, и это подчеркивается в новых рекомендациях ASTRO. АОР попрежнему рекомендует расширенное облучение и опухоли, и всего объема средостения «до контралатерального края» в 2 этапа: 60 Гр на опухоль, на средостение – 46 Гр. Методологически и клинически это совершенно неоправданно: для вовлеченных лимфоузлов доза 46 Гр является явно недостаточной для эрадикации метастазов опухоли, а облучение столь огромного объема чревато неприемлемой токсичностью с развитием клинически выраженных ранних и поздних осложнений.
4. Вариант стереотаксической аблативной ЛТ (SABR, SBRT) при I - II стадии МКРЛ и подтвержденных негативных лимфоузлах, обозначенный в рекомендациях ASTRO, пока вообще не упоминается в российских рекомендациях по ЛТ МКРЛ.
5. Режимы консолидирующей ЛТ на зоны остаточных опухолевых очагов (первичных, метастатических) после хорошего ответа на ХТ при распространенном МКРЛ схожи в рекомендациях ASTRO и RUSSCO: предлагается гипофракционированный вариант облучения 30 Гр за 10 фракций (до начала консолидирующей иммунотерапии, если она планируется). АОР рекомендует более продолжительный курс консолидирующего облучения: 50 Гр за 25 фракций. Маловероятно, что это рационально в случае изначального массивного поражения при наличии множественных отдаленных метастазов – но допустимо в случае выраженного ответа на системное лечение и изначально ожидаемой большей продолжительностью жизни.
6. Профилактическое облучение головного мозга (ПОГМ), согласно рекомендациям АОР, рекомендовано всем больным МКРЛ при любой стадии, тогда как ASTRO предлагает дифференцированный подход:
• при I стадии МКРЛ ПОГМ рутинно не рекомендуется;
• при II - III стадии МКРЛ и хорошем ответе на проведенное лечение ПОГМ рекомендовано пациентам в возрасте менее 70 лет в удовлетворительном состоянии; для более возрастных и более ослабленных больных решение принимается в индивидуальном порядке;
• при распространенном МКРЛ и хорошем ответе на лечение реко-мендовано решить индивидуально, будет ли пациент получать ПОГМ или находиться под регулярным МРТ контролем;
• схема ЛТ для ПОГМ полностью совпадает: 25 Гр за 10 фракций.
Можно сделать вывод, что существующие различия (где-то малозначительные, где-то – явные до неприемлемых) в международных и российских рекомендациях должны быть минимизированы с учетом современных тенденций в онкологической практике.
Роль стереотаксической аблативной лучевой терапии (SBRT) у пациентов с начальными стадиями (I/II) мелкоклеточного рака легких
Данные рандомизированных исследований демонстрируют, что
стереотаксическая аблативная лучевая терапия (SBRT или SABR)
более эффективна, чем фракционированное облучение у пациентов с ранней стадией немелкоклеточного рака легкого (НМРЛ),
которым противопоказано хирургическое вмешательство [1]. Однако таких данных для мелкоклеточного рака легкого (МРЛ) пока не
существует.
Завершенных рандомизированных контролируемых исследований SBRT для МРЛ в настоящее
время нет. Учитывая относительно редкую заболеваемость МРЛ
I стадии, маловероятно, что рандомизированное исследование,
сравнивающее традиционную
фракционированную лучевую
терапию с SBRT, сможет набрать
адекватное количество пациентов.
Хотя в настоящее время имеется ограниченный объем ретроспективных данных, подтверждающих, что это безопасный и эффективный подход, SBRT является прекрасной опцией для пациентов, которые не могут быть кандидатами на операцию из-за сопутствующих заболеваний, функционального статуса, плохой исходной функции легких, а также для пациентов с начальными стадиями МЛР, отказавшихся от операции.
Тенденция использования SBRT для таких пациентов с МРЛ в последние десятилетия усиливается. Исследование использования SBRT, основанное на данных Национальной базы данных рака (National Cancer Database) в США, показало, что процент пациентов с МРЛ I стадии, получавших SBRT, многократно увеличился с 2004 г. (0,4%) по 2013 г. (6,4%), как и использование радикального хирургического лечения за этот же период [2].
SBRT наиболее подходит пожилым пациентам или пациентам с ограниченным функциональным статусом, у которых гистологически подтверждена I или II стадия МРЛ, без поражения лимфоузлов средостения, особенно с периферически расположенным первичным очагом опухоли.
Из-за предрасположенности МРЛ к раннему метастатическому распространению пациенты, которые рассматриваются для SBRT по поводу предполагаемого рака на ранней стадии, должны пройти тщательное обследование для исключения отдаленных и регионарных метастатических очагов. Рекомендуется использование позитронно-эмиссионной томографии/компьютерной томографии (ПЭТ-КТ) и визуализации головного мозга (МРТ). В идеале оценка перед лечением должна включать инвазивную процедуру исследования лимфоузлов средостения с помощью эндобронхиального УЗИ или медиастиноскопии, даже если нет данных о метастазах в лимфоузлы при визуализации [3].
SBRT менее подходит для пациентов с «ультрацентральными» опухолями, которые включают опухоли, планируемый объем облучения (PTV) которых непосредственно контактирует или пересекается с проксимальным бронхиальным деревом, трахеей, главными бронхами, пищеводом, легочной веной или легочной артерией. Склонность к метастазам в лимфатические узлы может быть еще выше при центральных поражениях по сравнению с периферическими, а ультрацентральные опухоли также часто врастают в структуры средостения, что увеличивает риск тяжелых осложнений при SBRT. В результате для этих пациентов более уместна традиционная фракционированная ЛТ [3].
Учитывая предрасположенность МРЛ к отдаленному метастазированию, пациентам с локализованным МРЛ I и II стадий, получающим SBRT, должна быть назначена химиотерапия.
Химиотерапия улучшила общую выживаемость (ОВ) в сочетании с локальной аблативной лучевой терапией (SABR) при МРЛ I и II стадии на основе ретроспективных данных многоцентрового исследования. В этом исследовании из нескольких учреждений (24 центра) были оценены 76 опухолей у 74 пациентов с локализованным МРЛ [4]. У всех пациентов первичная опухоль была пролечена по методике SBRT. Средняя доза/ количество фракций SBRT составили 50 Гр/5 фракций. 56% пациентов получили химиотерапию (чаще всего комбинации платины с этопозидом (95,9%) в течение четырех циклов (61,2%) после SBRT (67,3%)). Профилактическое краниальное облучение (ПКО) (25 Гр/10 фракций) было проведено в 23% случаев.
Выживаемость без прогрессирования (ВБП) через 3 года составила 96,1%. У пациентов, получавших химиотерапию, отмечено семикратное увеличение медианы выживаемости без прогрессирования (61,3 против 9,0 мес., p=0,02) и почти двукратное увеличение общей выживаемости (31,4 против 14,3 мес., p=0,02). Применение химиотерапии стало независимым предиктором улучшения безрецидивной/общей выживаемости при многовариантном анализе (p=0,01). Тенденции к более высокой общей выживаемости (p=0,08) и безрецидивной выживаемости (p=0,12) наблюдались в когорте, получавшей ПКО.
У 32 из 74 (43,2%) пациентов в общей сложности отмечено 46 рецидивов: 16/48 (33,3%) у пациентов, получавших химиотерапию, и 16/26 (61,5%) у пациентов, не получавших химиотерапию (p=0,03). Наиболее частым типом рецидивов были отдаленные метастазы, менее часто – рецидивы в лимфоузлах средостения и в других частях легких. В обеих группах (получавших химиотерапию вместе с SABR или не получавших ее) местные рецидивы были редкостью.
В другом ретроспективном исследовании [5] на основе Национальной базы данных по раку были проанализированы данные пациентов с гистологически подтвержденным МРЛ T1-2N0M0. Все пациенты получали химиотерапию. Из 2107 больных 7,1% прошли SBRT/ химиотерапию, а 92,9% получили конвенциональную фракционную лучевую терапию (CFRT)/химиотерапию. Средняя доза SBRT составляла 50 (48-54) Гр за 4 (3-5) фракции и 55,8 (45-60) Гр за 30 (30- 33) фракций для CFRT. При медиане наблюдения 66 месяцев медиана выживаемости составила 31,2 месяца для CFRT/химиотерапии и 29,2 месяца для SABR/химиотерапии (p=0,77).
Результаты этого исследования демонстрируют, что МРЛ независимо от стадии – это принципиально системное заболевание. Таким образом, химиотерапия является наиболее важным аспектом лечения, в то время как конкретный метод местной терапии (SBRT либо конвенциональная фракционная ЛТ) оказывает относительно небольшое влияние (особенно с учетом радиочувствительности МРЛ). SBRT в сочетании с химиотерапии должна быть предпочтительным вариантом для МРЛ T1-2N0M0 на основе результатов этого исследования.
Таким образом, SBRT может обеспечить аналогичные, если не лучшие результаты местного контроля по сравнению с традиционной фракционированной ЛТ, с умеренным профилем токсичности. SBRT может успешно применяться у пациентов с локализованным МРЛ I и II стадии без пораженных лимфоузлов средостения, которым показано химиолучевое лечение.
Учитывая короткие временные рамки, в течение которых может быть завершена SBRT, она позволяет быстро и последовательно начинать системную терапию, когда SBRT начинается и завершается до начала химиотерапии или проводится между ранними циклами химиотерапии.
Несмотря на отсутствие сравнительных данных о последовательности методов лечения, эти подходы являются более предпочтительными по сравнению с одновременным проведением SBRT и химиотерапии в одни и те же дни. Имеются очень ограниченные данные о безопасности одновременного введения SBRT и химиотерапии, и в настоящее время это не рекомендуется.
Если химиотерапия проводится первой, SBRT следует интегрировать как можно раньше между циклами из-за опасений, что ранний ответ опухоли может затруднить локализацию. После начала даже 1-2 курсов химиотерапии опухоль легкого может значительно уменьшиться в размере из-за реакции на лечение, и ее может быть труднее визуализировать на изображениях.
SBRT при I-II стадии МРЛ и подтвержденных негативных лимфоузлах, обозначенный в рекомендациях ASTRO и ASCO, пока вообще не упоминается в российских рекомендациях по ЛТ МРЛ.
Источники:
1. Ball D, Mai GT, Vinod S, et al.
Stereotactic ablative radiotherapy
versus standard radiotherapy in stage
1 non-small-cell lung cancer (TROG
09.02 CHISEL): A phase 3, open-label,
randomised controlled trial. Lancet
Oncol. 2019; 20: 494-503.
2. Stahl JM, Corso CD, Verma V,
et al. Trends in stereotactic body
radiation therapy for stage I small cell
lung cancer. Lung Cancer. 2017; 103:
11-16.
3. Megan ED, Ismaila N, Decker
RH, et al. Radiation Therapy for
Small-Cell Lung Cancer: ASCO
Guideline Endorsement of an ASTRO
Guideline. J Clin Oncol. 2021 Jan 27;
JCO2003364.
4. Verma V, Simone CB 2nd, Allen
PK, Lin SH. Outcomes of stereotactic
body radiotherapy for T1-T2N0 small
cell carcinoma according to addition
of chemotherapy and prophylactic
cranial irradiation: A multicenter
analysis. Clin Lung Cancer. 2017; 18:
675-681.e671.
5. Verma V, Shaakir H, Wegner RE,
et al. Stereotactic ablative radiation
therapy versus conventionally
fractionated radiation therapy
for stage I small cell lung cancer.
Radiotherapy and Oncology. 2019;
131: 145-149.
Влияние микробиома на эффективность иммунотерапии. Просто знание или возможность влиять на исход?
Автор: Жуков Николай Владимирович
ФГБУ «НМИЦ Детской гематологии, онкологии и иммунологии им. Д.Рогачева», Москва
Вопросы о связи между кишечным микробиомом и эффективностью иммунотерапии злокачественных опухолей обсуждаются уже достаточно давно. И в целом, как нам кажется, наличие этой связи можно считать доказанным. Особенности микробиоты (виды колонизирующих микроорганизмов, их разнообразие и т.д.), судя по всему, действительно влияют на эффективность и безопасность противоопухолевой терапии, а также на исходы заболевания. И это действительно очень интересно, так как до недавнего времени несколько килограммов живых бактериальных и грибковых клеток, которые мы на протяжении всей жизни носим с собой, воспринимались нами в лучшем случае как нечто, что мешает колонизации организма патогенными бактериями и «доедает» то, что не усвоил организм. Взаимодействие же оказалось гораздо глубже – микробиота как отдельный орган (а возможно и не один, т.к. речь идет не только о микрофлоре кишечника) участвует во множестве процессов организма-хозяина, что подтверждают исследования, публикуемые нашими коллегами в области ревматологии, психиатрии, эндокринологии и т.д.
Но если возвращаться к онкологии в целом и к иммунотерапии в частности, оставался очень значимый вопрос. Какова природа связи между микробиомом и эффективностью противоопухолевой терапии? Является ли наличие «плохого» и «хорошего» микробиома просто следствием особенностей иммунной системы, определяющей и микробиом, и ответ на терапию, или микробиом – это самостоятельный «игрок», непосредственно влияющий на иммунный ответ? А если это самостоятельный влияющий фактор – является ли он изменяемым, т.е. сможем ли мы, манипулируя с составом микробиоты, усиливать эффективность противоопухолевой терапии?
Если верно первое предположение, когда и микробиом, и ответ на терапию являются следствием (признаком) индивидуальных особенностей иммунной системы, попытка воздействовать на микробиом с целью изменить эффективность иммунотерапии ни к чему не приведет, т.к. очевидно, что нельзя, воздействуя на признак (симптом) болезни, устранить ее причину. Аналогичную ситуацию мы уже наблюдали с анемией при злокачественных новообразованиях. Да, онкологические больные, у которых развитие опухоли сопровождалось развитием анемии, жили значительно хуже, чем больные, у которых при аналогичной стадии того же заболевания анемия не развивалась. Но при этом не анемия являлась причиной плохого прогноза этих больных. Анемия, как и плохой прогноз, являлась следствием (признаком, симптомом) биологических особенностей опухоли, имеющейся у конкретного пациента. Поэтому если «налить» пациента донорской кровью, дать железо, эритропоэтины, то уровень гемоглобина поднимется и анемия купируется, а вот прогноз останется таким же плохим. Но если с анемией все было понятно и показано на практике, то в отношении микробиома и эффективности иммунотерапии мы пока определенного ответа не имели, т.к. нельзя было исключить другой, благоприятный для развития новых подходов к терапии вариант связи – микробиом является не признаком, а причиной плохого или хорошего ответа на иммунотерапию, т.е. он определяет вариант ответа иммунной системы пациента на использование ингибиторов контрольных точек иммунитета (и, возможно, других вариантов иммунотерапии). В такой ситуации коррекция микробиома может повысить эффективность лечения или преодолеть резистентность к нему. Что, к счастью, судя по всему, и подтверждается.
Сегодня в журнале Science [1] было опубликовано исследование, которое, несмотря на малое число включенных пациентов, может претендовать на подтверждение концепции о возможности влиять на эффективность иммунотерапии при манипуляциях с кишечным микробиомом. В исследование было включено 15 больных меланомой, которые ранее не ответили на иммунотерапию с использованием ингибиторов контрольных точек иммунитета. Всем пациентам была проведена однократная колоноскопическая фекальная трансплантация от больных, у которых наблюдался ответ на терапию анти-PD-1 (пембролизумаб). По мнению исследователей это должно было бы привести к изменению микробиома реципиентов и последующему «репрограммированию» опухолевого микроокружения и преодолению резистентности. Что, собственно, и произошло: у 6 из 15 больных, ранее резистентных к иммунотерапии, после проведения фекальной трансплантации и возобновления иммунотерапии с использованием пембролизумаба был достигнут противоопухолевый эффект – одна полная и 2 частичных ремиссии (одна из которых продолжается более 2 лет после отмены терапии), у трех больных – стабилизация в течение как минимум 1 года. Интересно, что у одного из пациентов, находившихся в стабилизации, была отмечена прогрессия на фоне применения антибиотикотерапии по поводу кожной инфекции, однако он вновь достиг эффекта после повторной фекальной трансплантации от того же донора. Очевидно, что шанс на то, что у всех 6 пациентов после повторного назначения пембролизумаба произошли спонтанные изменения иммунной системы, приведшие к достижению эффекта, которого не было при первой попытке, ничтожно мал. Таким образом, можно предположить, что мы наконец получили полноценное практическое доказательство того, что изменение микробиома может привести к изменению эффективности иммунотерапии. Подтверждением этого является и то, что у ответивших на повторное лечение реципиентов отмечались сдвиги в микрофлоре кишечника до уровня, похожего на микробиом доноров, – увеличение числа бактерий, ассоциированных с активацией CD8+ Т-лимфоцитов (Firmicutes и Actinobacteria). Немаловажно, что в качестве доноров в исследовании использовали пациентов, у которых была длительная (медиана 56 месяцев) ремиссия на фоне терапии пембролизумабом, при этом на эффективность трансплантации не влияло то, была ли ремиссия у донора полной или частичной. Необходимо также отметить, что чуть раньше (в декабре 2020) было опубликовано другое, меньшее по объему исследование схожего дизайна, но с другим ингибитором контрольных точек иммунитета – ниволумабом, которое также показало возможность достижения ремиссии у 3 из 10 больных меланомой, ранее резистентной к иммунотерапии или утративших эффект, после проведения фекальной трансплантации от доноров, имевших ответ на ингибиторы контрольных точек иммунитета [2].
В целом эти данные доказывают, что микробиом является самостоятельным фактором, определяющим эффективность иммунотерапии, и дают надежду на то, что манипуляции с микробиомом в ближайшее время все же станут полноценным вариантом комплиментарной (дополнительной) терапии в онкологии.
Источники:
1. Davar D, Dzutsev AK, McCulloch
JA, Rodrigues RR, Chauvin JM,
Morrison RM, Deblasio RN, Menna
C, Ding Q, Pagliano O, Zidi B, Zhang
S, Badger JH, Vetizou M, Cole AM,
Fernandes MR, Prescott S, Costa RGF,
Balaji AK, Morgun A, Vujkovic-Cvijin
I, Wang H, Borhani AA, Schwartz
MB, Dubner HM, Ernst SJ, Rose
A, Najjar YG, Belkaid Y, Kirkwood
JM, Trinchieri G, Zarour HM. Fecal
microbiota transplant overcomes
resistance to anti-PD-1 therapy in
melanoma patients. Science. 2021 Feb
5; 371 (6529): 595-602. doi: 10.1126/
science.abf3363. PMID: 33542131.
2. Baruch EN, Youngster I, BenBetzalel G, Ortenberg R, Lahat A,
Katz L, Adler K, Dick-Necula D,
Raskin S, Bloch N, Rotin D, Anafi L,
Avivi C, Melnichenko J, SteinbergSilman Y, Mamtani R, Harati H,
Asher N, Shapira-Frommer R, BroshNissimov T, Eshet Y, Ben-Simon S,
Ziv O, Khan MAW, Amit M, Ajami
NJ, Barshack I, Schachter J, Wargo
JA, Koren O, Markel G, Boursi B.
Fecal microbiota transplant promotes
response in immunotherapyrefractory melanoma patients.
Science. 2021 Feb 5; 371 (6529): 602-
609. doi: 10.1126/science.abb5920.
Epub 2020 Dec 10. PMID: 33303685.
Отчет ASCO 2021 о достижениях в клинической онкологии
Ежегодный отчет Американского общества клинической онкологии (ASCO) выделяет текущие тренды и определяет приоритеты исследований в области онкологии, которые обладают высоким потенциалом ускорения прогресса в борьбе против рака.
Это 16-е издание ежегодного отчета было разработано 26 экспертами редакционной коллегии. Редакторы изучили научные материалы, опубликованные в рецензируемых журналах или представленные на ведущих медицинских конференциях, с октября 2019 года по сентябрь 2020 года, отобрали достижения, которые улучшают значимые для пациентов исходы заболевания и вносят значительный научный вклад, и предложили приоритетные области исследований, которые отвечают на жизненно важные нерешенные вопросы онкологической помощи и обладают потенциалом усовершенствовать базу знаний для принятия клинических решений. Отчет этого года также включает обсуждение критически важного аспекта равного доступа к исследованиям в онкологии и решения, которые смогут обеспечить везде, каждому пациенту со злокачественным новообразованием доступ к наиболее современным достижениям медицины.
Молекулярное профилирование, ускоряющее прогресс в лечении опухолей желудочно-кишечного тракта (ЖКТ), было выбрано в качестве Достижения года. Молекулярное профилирование помогло изменить перспективы для пациентов с опухолями ЖКТ путем определения молекулярных и генетических особенностей, позволяющих онкологам назначать лечение, высокоспецифичное для определенной опухоли.
Возможность определять молекулярные особенности опухолей ЖКТ расширило терапевтические возможности для отдельных пациентов со злокачественными новообразованиями ЖКТ – повысила выживаемость, при этом минимизировав число побочных эффектов. Специфические генетические мутации, амплификации или слияния, эпигенетический профиль, экспрессия белков и другие молекулярные особенности позволяют онкологам выбирать таргетную терапию, направленную на молекулярный профиль опухоли их пациентов.
В течение последнего года исследования показали, что направленное действие на рецептор человеческого эпидермального фактора роста 2 типа (HER2) улучшает выживаемость пациентов с раком желудка и демонстрирует потенциал в лечении пациентов с HER2-положительным колоректальным раком.
В настоящее время FDA одобрен лекарственный препарат, направленный на специфические мутации ДНК при метастатическом колоректальном раке. Применение пембролизумаба (ингибитора контрольной точки иммунного ответа PD-1) в первой линии терапии пациентов с продвинутыми стадиями колоректального рака с дефицитом в системе репарации ДНК (MMR) вдвое увеличивает время до прогрессирования заболевания.
Эти достижения продвигают лечение опухолей ЖКТ в сторону персонализированной медицины.
ДОПОЛНИТЕЛЬНЫЕ
ЗНАЧИМЫЕ ДОСТИЖЕНИЯ
Достижения, отмеченные в отчете
этого года, отражают прогресс в профилактике и лечении целого спектра
злокачественных опухолей, включая:
• Прогресс в применении таргетной
терапии у пациентов с ранними стадиями заболевания.
• Назначение лекарственных препаратов на основе биомаркеров, позволяющее персонализировать лечение
рака легкого, колоректального рака,
рака желудка.
• Комбинации различных лекарственных препаратов, приводящие к повышению выживаемости пациентов,
без увеличения токсичности.
• Растущее число таргетных препаратов, продлевающих жизнь большему
числу пациентов с трудно поддающимися лечению злокачественными
опухолями.
ПРОФИЛАКТИКА
Накопленные данные наблюдательных
исследований и регистров говорят о
защитном эффекте, связанном с приемом аспирина пациентами с синдромом Линча (наследственная предрасположенность к злокачественным
новообразованиям).
Наблюдение в течение 20 лет за 427 пациентами, случайным образом распределенными на ежедневный прием аспирина или плацебо в течение 2 лет, показало значительное и значимое снижение на 44% случаев колоректального рака среди носителей мутаций, связанных с синдромом Линча, принимавших аспирин, в сравнении с теми, кто принимал плацебо. Это преимущество становится заметным только более чем через 5 лет, но сохраняется более 20 лет. Серьезные нежелательные явления были сравнимы в обеих группах. Оптимальную дозу и длительность терапии еще предстоит определить.
ИССЛЕДОВАТЕЛЬСКИЕ ПРИОРИТЕТЫ
ASCO ДЛЯ УСКОРЕНИЯ ПРОГРЕССА
В ПРОТИВОРАКОВОЙ БОРЬБЕ
Исследовательские приоритеты в 2021
году представляют собой многообещающие области научных исследований, которые обладают потенциалом
значительно улучшить базу знаний
для принятия клинических решений
и ответить на жизненно важные нерешенные вопросы в оказании онкологической помощи. Список этого года
включает впервые включенный приоритет исследований в области искусственного интеллекта (ИИ), признавая
его растущий потенциал в решении
сложных проблем и продвижении
диагностических, терапевтических и
трансляционных исследований в целом спектре областей профилактики и
лечения онкологических заболеваний.
Разработать и внедрить ИИ и технологии глубокого обучения в онкологические исследования. Области первостепенного фокуса
внимания включают:
• Разработать методы глубокого обучения, которые помогут в диагностике рака на основании анализа
биообразцов, включая выявление
молекулярных вариантов, которые
могут влиять на прогноз и терапевтические решения.
• Изучить возможности применения
ИИ для улучшения радиографических методов визуализации и анализа изображений.
• Внедрить и оценить системы ИИ,
интегрирующие большие объемы
клинических данных, для поддержки
принятия клинических решений и
измерения клинических результатов.
Выделить стратегии прогнозирования ответа и резистентности к иммунотерапии. Области приоритетного фокуса внимания включают:
• Выявить биомаркеры крови и опухолевой ткани при иммунотерапии, которые могут использоваться для прогнозирования первичного ответа,
длительного контроля заболевания,
нежелательных явлений и устойчивости к лечению.
• Разработать предиктивные модели
и алгоритмы определения риска тяжелой иммуноопосредованной токсичности на основании имеющихся
данных пациента.
Оптимизировать мультимодальную
терапию солидных опухолей. Области приоритетного фокуса внимания включают:
• Разработать аналитически и клинически валидированные тесты на
основе биомаркеров с доказанной
клинической пользой для определения риска рецидива после лечения
первичной опухоли и наилучших
вариантов лечения для пациентов в
различных группах риска.
• Определить группы пациентов, которым показана периоперационная,
неоадъювантная и адъювантная
терапия, включая клинические, патоморфологические, генетические,
биохимические, иммунологические,
внешние и социальные факторы, которые влияют на вероятность пользы
от лечения.
• Изучить стратегии снижения интенсивности лечения, которые максимизируют пользу и минимизируют
риск.
Усилить исследования в области прецизионной медицины и терапевтических подходов при детских и других редких опухолях. Области приоритетного фокуса внимания включают:
• Определить генетические и другие
молекулярные нарушения в детских
и редких опухолях, которые могут в
дальнейшем послужить потенциальными мишенями для противоопухолевой терапии.
• Разработать эффективные противоопухолевые лекарственные препараты, направленные на генетические
и другие молекулярные нарушения
при детских и редких опухолях.
• Изучить эффективность существующих таргетных препаратов у детей
и пациентов с редкими опухолями, у
которых есть мутации, отвечающие
на лекарственные терапию, работающую у взрослых больных.
Оптимизировать медицинскую помощь пожилым пациентам с онкологическими заболеваниями. Области приоритетного фокуса внимания включают:
• Разработать стандартизованные
методы характеризации физиологического старения, включая гериартрическую оценку, биомаркеры старения и клиническую фармакологию
у пожилых пациентов, чтобы более
надежным образом прогнозировать
риск развития связанных с лечением
нежелательных явлений у пациентов
пожилого возраста, страдающих онкологическими заболеваниями.
• Использовать полученные на практике данные для наилучшего понимания эффективности и токсичности
противоопухолевой терапии, включая влияние на физические и когнитивные функции, а также качество
жизни, особенно среди пожилых пациентов, недостаточно представленных в клинических исследованиях,
например, с нарушением общего состояния, сопутствующими заболеваниями или хрупкостью.
• Изучить роль гериартрической помощи в улучшении результатов лечения с использованием персонализированного подхода; важные области
особого внимания включают стратегии минимизации недостаточного
лечения у крепких пациентов и избыточного лечения у уязвимых или
хрупких пациентов, поддерживающей терапии и способов оказания
помощи.
Повысить равный доступ к клиническим исследованиям в онкологии. Области приоритетного фокуса внимания включают:
• Улучшить понимание барьеров
включения в исследования среди
различных недостаточно представленных групп, принимая во внимание факторы, специфические для пациента, клиники, места жительства и
самого исследования.
• Разработать и протестировать программы, направленные на улучшение
набора пациентов среди недостаточно представленных групп (примеры
могут включать использование образовательных инструментов, телемедицину и вовлечение сообществ,
исследования вовлеченности).
• Оценить новые стратегии улучшения доступности ресурсов о клинических исследованиях в регионах с
наибольшим числом недостаточно
представленных групп населения.
• Разработать механизмы улучшения
осведомленности и знаний о клинических исследованиях среди недостаточно представленных групп и их
лечащих врачей.
• Использовать данные клинической
практики для изучения различий
в онкологической заболеваемости, распространенности, течении
болезни, опыте лечения, включая
эффективность и токсичность, среди недостаточно представленных
групп населения.
Снизить нежелательные последствия противоопухолевой терапии. Области приоритетного фокуса
внимания включают:
• Разработать и протестировать стратегии снижения и купирования
токсичности, связанной с противоопухолевой терапией, включая оптимизацию доз химио- и лучевой
терапии.
• Выявить генетические варианты,
ассоциированные с повышенным
риском связанной с лечением токсичности.
• Углубить понимание подлежащих
механизмов токсичности таргетной
терапии, определить их вклад в отдаленные эффекты и разработать
новые стратегии купирования или
элиминации этой токсичности.
• Расширить понимание и использование спектра подходов к купированию
болевого синдрома у пациентов с
онкологическими заболеваниями.
• Разработать новые инструменты
для обеспечения долгосрочного отслеживания результатов лечения,
включая сообщаемые пациентами
параметры.
Снизить влияние ожирения на
онкологическую заболеваемость и
результаты лечения. Области приоритетного фокуса
внимания включают:
• Улучшить понимание механизмов
влияния массы тела и энергетического обмена, включая физическую активность и диету, на
развитие и прогрессирование злокачественных опухолей.
• Изучить, как ожирение влияет на
ответ на терапию, риск рецидива
(возврата) онкологического заболевания и отдаленные результаты
лечения.
• Оценить влияние вмешательств в
энергетический обмен, таких как
снижение массы тела, увеличение
физической активности и улучшение качества диеты, на риск развития злокачественных опухолей,
рецидива онкологического заболевания и смертности.
• Выделить эффективные методы
оптимизации энергетического
обмена у пациентов групп риска и
тех, у кого выявлено онкологического заболевание.
Лучше распознавать потенциально злокачественные поражения и
прогнозировать, когда необходимо
лечение. Области приоритетного фокуса
внимания включают:
• Убрать барьеры в скрининге и раннем лечении потенциально злокачественных заболеваний.
• Выделить потенциально злокачественные поражения с высоким
риском прогрессирования на основании специфических характеристик и разработать соответствующие терапевтические стратегии,
одновременно определив те потенциально злокачественные поражения, которые не требуют вмешательства.
• Выявить специфические молекулярные пути, которые стимулируют прогрессирование неинвазивных поражений в инвазивные
опухоли, и разработать методы
вмешательств, позволяющие отсрочить или предотвратить переход в малигнизацию (озлокачествление).
• Определить особенности микроокружения потенциально
злокачественных поражений,
которые связаны с прогрессированием в инвазивную опухоль.
• Исследовать новые методы
оценки потенциально злокачественных поражений, чтобы
наилучшим образом информировать о риске или вероятности
прогрессирования в инвазивную опухоль.
Источник: https://www.asco.org/research-guidelines/reports-studies/clinical-cancer-advances-2021
Статья предоставлена партнером RUSSCO — Фондом поддержки научных исследований в онкологии (РакФонд) - www.rakfond.org
Результаты исследования 211 по оценке начальной дозы ленвима® (ленватиниб) при лечении дифференцированного рака щитовидной железы
Информационный материал подготовлен на основе постера, представленного в рамках конгресса ESMO Asia, 20-22 ноября 2020: Мультицентровое рандомизированное двойное слепое исследование 2 фазы по оценке безопасности и эффективности начальной дозы ленватиниба 18 мг и 24 мг в лечении пациентов с радиойодрефрактерным дифференцированным раком щитовидной железы.
A Multicenter, Randomized, Double-Blind, Phase 2 Study of Lenvatinib in Patients With Radioiodine-Refractory Differentiated Thyroid Cancer to Evaluate the Safety and Efficacy of a Daily Oral Starting Dose of 18 mg vs 24 mg
Marcia S. Brose, Yury Panaseykin, Bhavana Konda, Christelle de La Fouchardiere, Brett G.M. Hughes, Andrew G. Gianoukakis, Young Joo Park, Ilia Romanov, Monika Krzyzanowska, Terri A. Binder, Corina Dutcus, Ran Xie, Matthew H. Taylor
Вывод: Результаты исследования подтверждают, что начальная доза препарата ленватиниб (Ленвима®) 24 мг/сут. является эффективной для пациентов с дифференцированным раком щитовидной железы, рефрактерным к радиоактивному йоду.
В многоцентровом рандомизированном двойном слепом исследовании 211 фазы II (NCT02702388) 152 пациента с радиойодрефрактерным дифференцированным раком щитовидной железы (РРДРЩЖ) были рандомизированы для получения ежедневной пероральной дозы ленватиниба 24 или 18 мг.
Цель исследования заключалась в оценке того, будет ли более низкая начальная доза препарата ленватиниб (18 мг/сут.) обеспечивать сопоставимую эффективность и лучший профиль безопасности по сравнению с одобренной начальной дозой ленватиниба 24 мг/сут.
Первичной конечной точкой оценки эффективности была неменьшая эффективность ленватиниба в дозе 18 мг по сравнению с дозой 24 мг в отношении частоты объективного ответа (ЧОО) на 24-й неделе (ЧООнед24) на основании оценки исследователей согласно критериям оценки ответа при солидных опухолях RECIST 1.1.
Первичной конечной точкой оценки безопасности было возникновение любых нежелательных явлений, возникших после начала лечения, (НЯПНЛ) ≥3 степени тяжести в течение 24 недель после рандомизации.
Результаты исследования показали следующее:
• При анализе первичной конечной точки эффективности показатель ЧООнед24 составлял
57,3% (95% ДИ 46,1-68,5) в группе 24 мг по сравнению с 40,3%
(95% ДИ 29,3-51,2) в группе 18
мг (отношение шансов: 0,50 [95%
ДИ 0,26-0,96]).Таким образом,
начальная доза 18 мг не продемонстрировала не меньшую
эффективность по сравнению
с начальной дозой 24 мг.
• При анализе первичной конечной точки безопасности частота
возникновения нежелательных явлений, возникших после начала лечения, (НЯПНЛ)
≥3 степени до 24-й недели была
аналогичной в группах лечения 24 мг и 18 мг, и никаких
новых или неожиданных нежелательных явлений не наблюдалось.
Разница в частоте возникновения
НЯПНЛ ≥3 степени составила
4,2% (95% ДИ -19,8…11,4), у 61,3%
пациентов в группе 24 мг по сравнению с 57,1% пациентов в группе
18 мг, у которых были НЯПНЛ.
Наиболее распространенные
НЯПНЛ ≥3 степени были следующими:
• в группе 24 мг: артериальная гипертензия (25,3%), протеинурия
(6,7%), астения (2,7%) и диарея
(2,7%);
• в группе 18 мг: артериальная гипертензия (19,5%), протеинурия
(5,2%), астения (5,2%), гипонатриемия (3,9%) и миалгия (3,9%).
Общая ЧОО (полный ответ + частичный ответ) составила 64,0% (95% ДИ 53,1-74,9) в группе 24 мг по сравнению с 46,8% (95% ДИ 35,6-57,9) в группе 18 мг.
Объективный ответ на терапию отмечался раньше при назначении ленватиниба в начальной дозе 24 мг и был длительным в обеих группах.
В целом серьезные НЯПНЛ возникли у 33,3% пациентов в группе 24 мг по сравнению с 40,3% в группе 18 мг.
НЯПНЛ привели к снижению дозы
на 69,3% в группе 24 мг по сравнению с 59,7% в группе 18 мг, а прекращение лечения произошло у
14,7% и 16,9% соответственно.
К наиболее распространенным
НЯПНЛ любой степени относятся:
• В группе 24 мг: артериальная
гипертензия (57,3%), диарея
(56,0%), протеинурия (44,0%),
слабость (40,0%) и тошнота
(40,0%).
• В группе 18 мг: артериальная
гипертензия (51,9%), диарея
(51,9%), снижение массы тела
(42,9%), слабость (35,1%) и тошнота (35,1%).
ВЫВОД: Результаты исследования подтверждают необходимость назначения ленватиниба в начальной дозе 24 мг/сут. в соответствии с действующей инструкцией по применению препарата Ленвима®.
Источник: Brose MS, Panaseykin Y, Konda B, et al. A Multicenter, Randomized, Double-blind, Phase 2 Study of Lenvatinib in Patients With Radioiodine-Refractory Differentiated Thyroid Cancer to Evaluate the Safety and Efficacy of a Daily Oral Starting Dose of 18 mg vs 24 mg. Poster presented at the: European Society for Medical Oncology Asia; Virtual Format, November 20-22, 2020.
Материал предоставлен компанией Eisai. Публикуется в редакции авторов.
