Дорогие коллеги, дорогие друзья!
Январь. В наших окнах по-прежнему темно утром, когда мы по внутреннему или реальному (столь раздражающему!) будильнику открываем глаза и отряхиваемся от сладкого утреннего сна, собираясь на работу – и уже темно, когда мы вдыхаем морозный воздух, возвращаясь домой с работы. И, тем не менее, мы подсознательно отсчитываем дни до конца холодов и ставим...

Ю.Ю.Клевер. Закат в еловом лесу. 1889 г. Холст, масло.
Иркутский областной художественный музей имени В. П. Сукачёва, Иркутск
Зинаида Гиппиус. Снег. 1897 год.
*** Опять он падает, чудесно молчаливый, Легко колеблется и опускается… Как сердцу сладостен полёт его счастливый! Несуществующий, он вновь рождается… Всё тот же, вновь пришёл, неведомо откуда, В нём холода соблазны, в нём забвенье… Я жду его всегда, как жду от Бога чуда, И странное с ним знаю единенье. …
ЭКЗАМЕН ПО КЛИНИЧЕСКОЙ ОНКОЛОГИИ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ, 2023
В первый день XXVII Российского онкологического конгресса, а именно, 14 ноября 2023 г. Российское общество клинической онкологии, во второй раз провело экзамен по клинической онкологии среди врачей онкологов Российской Федерации. В этом году, сорок один доктор, решился принять участие в экзамене и проверить свои знания....
ФГБНУ «МГНЦ» ПРОВЕЛО ВТОРОЙ ЦИКЛ ЗАНЯТИЙ ПО ПОВЫШЕНИЮ КВАЛИФИКАЦИИ ДЛЯ СОТРУДНИКОВ РЕГИОНАЛЬНЫХ ЛАБОРАТОРИЙ (ОБУЧЕНИЕ МЕТОДИКЕ NGS) RUSSCO ВЫСТУПИЛО ОРГАНИЗАТОРОМ И СПОНСОРОМ ЭТОГО ПРОЕКТА
По инициативе и при финансовой поддержке Российского общества клинической онкологии (RUSSCO) в Москве с 27 ноября по 01 декабря был проведен второй практический цикл занятий по повышению квалификации для сотрудников региональных молекулярно-генетических лабораторий....

ЗНАКОМЬТЕСЬ: РЕГИОНАЛЬНОЕ ОТДЕЛЕНИЕ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ ТЮМЕНСКОЙ ОБЛАСТИ
Региональное отделение Российского общества клинической онкологии (RUSSCO) Тюменской области в настоящее время насчитывает более 40 членов, среди которых онкологи...

РЕЦИДИВИРУЮЩИЙ И МЕТАСТАТИЧЕСКИЙ НМРЛ – САМОЕ ИНТЕРЕСНОЕ НА КОНГРЕССЕ ESMO 2023
В течение нескольких лет после появления третьего поколения ингибиторов EGFR и ALK наблюдалось некоторое затишье в области таргетной терапии, а основные события разворачивались в...

МЕЛАНОМА. ТРИ НАИБОЛЕЕ ЗНАЧИМЫХ СОБЫТИЯ В 2023 ГОДУ
В 2003 году были представлены результаты нескольких клинических исследований, которые могут оказать существенное влияние на лечение пациентов с меланомой в ближайшее время...
НОВОСТИ ОНКОЛОГИИ / IDEA: НЕ НОВА, НО ПО-ПРЕЖНЕМУ АКТУАЛЬНА
Новые результаты исследования IDEA показывают, что женщины с биологически низким риском в постменопаузе с раком молочной железы I стадии, перенесшие лампэктомию без адъювантной лучевой терапии молочной железы с последующей эндокринной терапией, имеют чрезвычайно низкую частоту рецидивов заболевания – около 3% – через 5 лет. По мнению...
НОВОСТИ ОНКОЛОГИИ / SABCS 2023: НЕОАДЪЮВАНТНАЯ ХИМИОТЕРАПИЯ МОЖЕТ ПОМОЧЬ НЕКОТОРЫМ БОЛЬНЫМ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ ИЗБЕЖАТЬ ОБЛУЧЕНИЯ РЕГИОНАЛЬНЫХ ЛИМФОУЗЛОВ
Первые результаты исследования NRG/NSABP B-51, представленные несколько дней назад на симпозиуме по раку молочной железы в СанАнтонио, вызвали немало эмоций, в том числе и в...
НОВОСТИ ОНКОЛОГИИ / KEYNOTE-585: ПЕМБРОЛИЗУМАБ В КОМБИНАЦИИ С ПЕРИОПЕРАЦИОННОЙ ХИМИОТЕРАПИЕЙ ПРИ ПЕРВИЧНО ОПЕРАБЕЛЬНОМ РАКЕ ЖЕЛУДКА И КАРДИОЭЗОФАГЕАЛЬНОГО ПЕРЕХОДА
Интересное исследование, заставляет нас задуматься, можем ли мы использовать частоту достижения pCR как первичную конечную точку в работах, изучающих периоперационную терапию при...
«А ВОТ БЫЛ У МЕНЯ СЛУЧАЙ…», ИЛИ «ОХОТНИЧЬИ ЗАПИСКИ» ОНКОЛОГОВ / РАДИКАЛЬНОЕ ЛЕЧЕНИЕ РАКА ШЕЙКИ МАТКИ IVA СТАДИИ: БЫТЬ ИЛИ НЕ БЫТЬ?
Еще некоторое время назад появление на консилиуме врачей пациентки с IV стадией рака шейки матки, будь то IVA (с прорастанием в соседние органы – чаще в мочевой пузырь, реже – в...

УГОЛОК РАДИОТЕРАПЕВТА / РАК ЭНДОМЕТРИЯ: ДОПОЛНИТЕЛЬНЫЕ ФАКТОРЫ ПРОГНОЗА. МОЛЕКУЛЯРНЫЙ ПОРТРЕТ – НОВАЯ ПАРАДИГМА?
Первое, что приходит в голову при упоминании показаний к адъювантной терапии при раке тела матки – ну, опять старая песня! Действительно, вопрос поднимался на протяжении последних...
НЕРЕЗЕКТАБЕЛЬНАЯ ГЕПАТОЦЕЛЛЮЛЯРНАЯ КАРЦИНОМА: ПОИСКИ НОВЫХ ЛЕЧЕБНЫХ ПУТЕЙ
Гепатоцеллюлярная карцинома (ГЦК) - наиболее распространенный тип рака печени и одна из ведущих причин смертности от рака во всем мире. Неоперабельная опухоль подразумевает наихудший прогноз и крайне плохо поддается консервативному лечению. Медиана выживаемости колеблется от 1,0 до 1,5 лет для симптомных пациентов с распространенной ГЦК, получающих...
ИНАВОЛИСИБ – НОВЫЙ ИНГИБИТОР PI3K В 1 ЛИНИИ ТЕРАПИИ ЭР+ HER2– ДИССЕМИНИРОВАННОГО РМЖ. ПЕРВЫЕ РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ 3 ФАЗЫ INAVO120
WO41554 представляет собой рандомизированное, плацебоконтролируемое, многоцентровое международное исследование III фазы, разработанное с целью сравнения эффективности на основании ВБП, а также безопасности тройной комбинации инаволисиба с палбоциклибом и фулвестрантом по сравнению с плацебо с палбоциклибом и фулвестрантом у пациентов с...

АНТИРЕЗОРБТИВНАЯ ТЕРАПИЯ ПАЦИЕНТОВ С КОСТНЫМИ МЕТАСТАЗАМИ.ДИСКУССИОННЫЕ ВОПРОСЫ РЕАЛЬНОЙ КЛИНИЧЕСКОЙ ПРАКТИКИ
На сегодняшний день мы имеем многолетний опыт применения остеомодифицирующих агентов (ОМА). Антирезорбтивная терапия является неотъемлемой частью лечения пациентов с...
17 НОЯБРЯ 2023 ГОДА СОСТОЯЛСЯ ЭКСПЕРТНЫЙ СОВЕТ «СИСТЕМА ОРГАНИЗАЦИИ И ОПЛАТЫ СОПУТСТВУЮЩЕЙ ТЕРАПИИ ПРИ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЯХ» В ГОРОДЕ МОСКВЕ
В состав экспертного совета входили руководители медицинских учреждений и центра оценки качества медицинской помощи, врачи, специалисты научной и образовательной деятельности...
Анонс
-

28 - 29 марта 2024
РАК МОЛОЧНОЙ ЖЕЛЕЗЫ
XI КОНФЕРЕНЦИЯ RUSSCO
-

22 - 23 марта 2024
ОНКОГИНЕКОЛОГИЯ
X КОНФЕРЕНЦИЯ RUSSCO
-

12 - 13 апреля 2024
РАК ЛЕГКОГО И ДРУГИЕ ОПУХОЛИ ГРУДНОЙ КЛЕТКИ
X КОНФЕРЕНЦИЯ RUSSCO
Дорогие коллеги, дорогие друзья!
Январь. В наших окнах по-прежнему темно утром, когда мы по
внутреннему или реальному (столь раздражающему!) будильнику
открываем глаза и отряхиваемся от сладкого утреннего сна, собираясь на работу – и уже темно, когда мы вдыхаем морозный воздух,
возвращаясь домой с работы. И, тем не менее, мы подсознательно
отсчитываем дни до конца холодов и ставим мысленные «зарубки»:
вот миновала середина зимы, день прибавился на нное количество
минут, и сегодня чуть теплее, чем было вчера…
Российское общество клинической онкологии тоже запустило часы
нового 2024 года и безотлагательно окунулось в научную и практическую деятельность. Январский номер выходит на сайт, а также
в печатном виде к первой Большой конференции RUSSCO в этом
году – «Меланома и другие опухоли кожи», а в самых первых числах февраля нас ждет конференция по опухолям ЖКТ, уже десятая
по счету. Обратите внимание на новый онлайн-проект общества
- Дискуссионный клуб «ТОЧКА ЗРЕНИЯ», который состоится 27
января и будет посвящен волнующему всех нас вопросу «2024: новое в КСГ по онкологии». Календарь мероприятий с предварительными или окончательными вариантами программ и необходимые
ссылки, как всегда, доступны на сайте.
Мы продолжаем знакомить вас с региональными отделениями
RUSSCO (сегодня в фокусе – Тюмень), а также с недавними публикациями крупных онкологических журналов. Мы с нетерпением
ждем новых авторов, с описаниями интересных или спорных клинических случаев, с обзорами по любым проблемам в онкологии –
это отличная возможность заявить о себе и, возможно, пополнить
список докладчиков или даже научный комитет на мероприятиях
общества и Российском онкологическом конгрессе.
Итак, новый год набирает обороты, и мы, как всегда, уповая на его
благосклонность к каждому из нас, от души желаем вам мира и добра! Движемся в сторону Весны, но пока будем же наслаждаться
моментами Зимы – морозным воздухом, видом новогодних ёлок,
хрустом снега…
Ваша команда RUSSCO
Ю.Ю.Клевер. Закат в еловом лесу. 1889 г. Холст, масло.
Иркутский областной художественный музей имени В. П. Сукачёва, Иркутск

Зинаида Гиппиус. Снег. 1897 год.
***
Опять он падает, чудесно молчаливый,
Легко колеблется и опускается…
Как сердцу сладостен полёт его счастливый!
Несуществующий, он вновь рождается…
Всё тот же, вновь пришёл, неведомо откуда,
В нём холода соблазны, в нём забвенье…
Я жду его всегда, как жду от Бога чуда,
И странное с ним знаю единенье.
Пускай уйдёт опять — но не страшна утрата.
Мне радостен его отход таинственный.
Я вечно буду ждать его безмолвного возврата,
Тебя, о ласковый, тебя, единственный.
Он тихо падает, и медленный и властный…
Безмерно счастлив я его победою…
Из всех чудес земли тебя, о снег прекрасный,
Тебя люблю… За что люблю — не ведаю.
ЭКЗАМЕН ПО КЛИНИЧЕСКОЙ ОНКОЛОГИИ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ, 2023
В первый день XXVII Российского
онкологического конгресса, а именно, 14 ноября 2023 г. Российское общество клинической онкологии, во
второй раз провело экзамен по клинической онкологии среди врачей
онкологов Российской Федерации.
В этом году, сорок один доктор, решился принять участие в экзамене и
проверить свои знания.

Участие приняли врачи из разных
уголков страны, а именно: Москва, Санкт-Петербург, Челябинск,
Южно – Сахалинск, Архангельск,
Калужская область (г. Малоярославец), Пенза, Ижевск, Тула, Ставропольский край (станица Курская),
Тамбов, Саратов, респ. Карелия (г.
Сортавала). Возраст участников составил от 23 до 45 лет, средний возраст в этом году составил 25 лет.
Экзамен состоял из 100 вопросов,
посвященных диагностике, механизмам действия лекарственных
препаратов, тактике ведения пациентов, лекарственной терапии
опухолей. Вопросы подготовили
ведущие эксперт Общества: д.м.н.,
профессор Владимирова Л.Ю.,
д.м.н. Волкова М.И., д.м.н., профессор Гладков О.А., к.м.н. Маркович
А.А., д.м.н. Моисеенко Ф.В., к.м.н.
Насхлеташвили Д.Р., д.м.н. Новик
А.В., к.м.н. Никулин М.П., д.м.н.
Романов И.С., к.м.н. Румянцев А.А.,
к.м.н. Семенова А.И., д.м.н., профессор Тюляндин С.А., д.м.н. Тюляндина А.С., д.м.н. Трякин А.А.,
к.м.н. Утяшев И.А., д.м.н. Федянин
М.Ю.
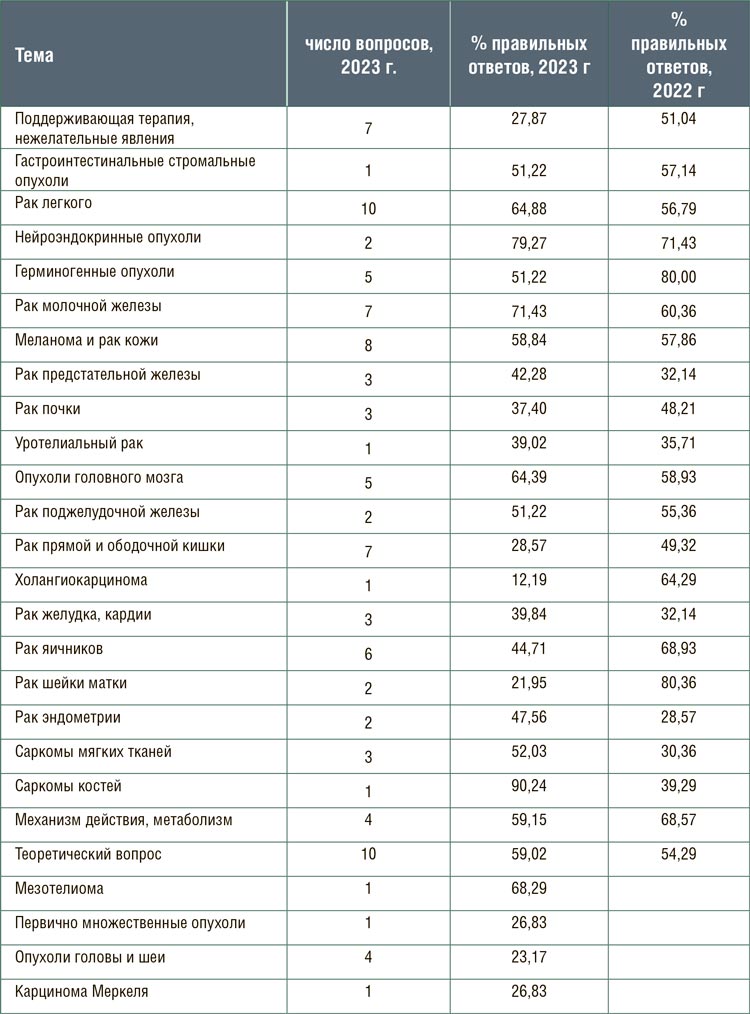
В таблице представлены число вопросов по разделам и процент правильных ответов в 2023 году, а также процент правильных ответов по аналогичным разделам в прошлом году. Обращает на себя внимание снижение числа правильных ответов в разделах сопроводительная терапия, онкогинекология (рак яичников, рак шейки матки), рак прямой и ободочной кишки. А вот ответы на вопросы по темам рак легкого, рак молочной железы, саркомы костей и мягких тканей чаще были правильными в этом году по сравнению с прошлым годом.
При подведении итогов экзамена, в этом году было принято решение о проходном балле в 50 правильных ответов из 100. Итак, результат экзамена - из сорока одного доктора, достаточное количество баллов набрали двадцать два, что составило 53,66 %. 16 ноября, в последний день Российского онкологического конгресса, всем участникам, успешно прошедшим экзамен, Председателем Российского общества клинической онкологии профессором Дмитрием Александровичем Носовым, были вручены дипломы. Наибольшее количество баллов в этом году составило 77 (I место) и такого результата добился заведующий отделением СП-б ГБУЗ «Городского клинического онкологического диспансера» Глузман Марк Игоревич. Следующий результат, с одинаковым количеством баллов 73, добились два участника экзамена и разделили II место: врач – онколог «Клиники доктора Ласкова» Евдокимов Владимир Игоревич и аспирант ФГБУ НМИЦ онкологии им. Н.Н. Блохина Ахметьянова Ангелина Евгеньевна (победительница, набравшая наибольшее количество баллов на экзамене RUSSCO в 2022 г.) и результат в 67 баллов (III место) был достигнут заведующим отделением ГАУЗ Челябинского областного клинического центра онкологии и ядерной медицины Шеметовым Дмитрием Юрьевичем. Поздравляем!

В качестве поощрения, участники получают грант на организацию поездки на одну из конференций Общества. Подведя итоги, сообщаем, что те, кто не смог принять участие в этом году, может проверить свои знания в следующем, а кто хочет продолжать принимать участие и проверять свои знания, мы всегда ждем на экзамене.
Проведение экзамена в следующем году, планируется на 12 ноября 2024 г. на XXVIII Российском
онкологическом конгрессе. Более
подробная информации об экзамене, будет доступна в новостях
Общества и известна летом следующего года. Следите за новостями.
ФГБНУ «МГНЦ» ПРОВЕЛО ВТОРОЙ ЦИКЛ ЗАНЯТИЙ ПО ПОВЫШЕНИЮ КВАЛИФИКАЦИИ ДЛЯ СОТРУДНИКОВ РЕГИОНАЛЬНЫХ ЛАБОРАТОРИЙ (ОБУЧЕНИЕ МЕТОДИКЕ NGS) RUSSCO ВЫСТУПИЛО ОРГАНИЗАТОРОМ И СПОНСОРОМ ЭТОГО ПРОЕКТА
По инициативе и при финансовой поддержке Российского общества клинической онкологии (RUSSCO) в Москве с 27 ноября по 01 декабря был проведен второй практический цикл занятий по повышению квалификации для сотрудников региональных молекулярно-генетических лабораторий. Лаборатории выбирались с перспективой проведения молекулярно-генетических исследований методом NGS при различных нозологиях. Программа обучения по теме «Методы работы с мультигенными панелями в практической онкогенетике» готовилась совместно RUSSCO и ФГБНУ «МГНЦ».
Цикл состоял из двух этапов:
Online – теоретическая часть, которая длилась 5 дней, когда обучающиеся могли без отрыва от работы прослушать теоретический курс по теории выполнения тестирований методом NGS. По окончанию теоретической части состоялась итоговая аттестация. В теоретической части были разобраны следующие темы:
- Возможен ли полный переход тестирования в онкологии на метод NGS;
- Опыт NGS-диагностики в программах RUSSCO;
- Разбор основных этапов подготовки библиотек для NGSдиагностики рака легкого и выявления мутаций в генах BRCA и др.
В целях обеспечения практического обучения, которое проходило в
лаборатории МГНЦ ежедневно с
09:00 до 18:00, иногородним специалистам (Колесниковой Елене
Александровне – ГБУЗ НО «НОКОД» из Нижнего Новгорода и
Бредихину Демиду Александровичу – ФИЦ ФТ г. Новосибирск)
были организованы приезд и проживание в Москве. Это был шестидневный практический курс с
последующим экзаменом.
В практической части были пройдены все этапы тестирования методом NGS: Выделение ДНК; • Получение библиотек для NGS; • Запуск секвенирования мультигенных панелей; • Снятие результатов секвенирования мультигенных панелей; • Обсуждение полученных результатов.
- Выделение ДНК;
- Получение библиотек для NGS;
- Запуск секвенирования мультигенных панелей;
- Снятие результатов секвенирования мультигенных панелей;
- Обсуждение полученных результатов.
В ходе стажировки обучающиеся
освоили выделение ДНК и РНК из
парафиновых блоков с образцами опухолевой ткани, постановку
всех этапов приготовления библиотек и оценку их концентрации,
пулирование, запуск секвенирования на MiSeq (Illumina). Особое
внимание было уделено «узким
местам» в процессе работы —
оценке пригодности FFPE-блоков
для NGS-анализа, возможным типичным ошибкам в практической
работе, метрикам качества при секвенировании соматических мутаций и возможности анализировать
полученные данные секвенирования, особенностям программного
обеспечения производителей генных панелей для аннотации генетических вариантов.

Практическое обучение позволило генетикам из региональных
лабораторий овладеть всеми этапами определения соматических
мутаций – от парафиновых блоков
и стекол с материалом опухоли до
определения терапевтической значимости выявленных с помощью
NGS соматических генетических
вариантов мутаций. Причем некоторые опухоли содержали мутации, на примере которых в режиме
реального времени обучающиеся
освоили алгоритмы интерпретации данных «проблемных» образцов, увидели ограничения панелей
различных производителей, научились оперировать современными
международными консенсусами и
критериями патогенности (онкогенности) в практической онкогенетике.
В основном программа обучения
была рассчитана на определение
соматических мутаций в образцах рака легкого с помощью двух
часто используемых панелей отечественных производителей —
OncoScope NSCLC от Parseq Lab
и Соло-Тест от Онкодиагностика
Атлас.
В итоге Е.А.Колесникова и
Д.А.Бредихин успешно сдали экзаменационные работы и получили сертификат о повышении квалификации.
RUSSCO планирует продлить данный проект на 2024 год.
Благодарим Дмитрия Сергеевича
Михайленко за подготовку этого
цикла повышения квалификации
и плодотворное сотрудничество
в обучении квалифицированных
специалистов-генетиков.
Специалист по программе молекулярно-генетической диагностике
Соколова Наталья Сергеевна
ЗНАКОМЬТЕСЬ: РЕГИОНАЛЬНОЕ ОТДЕЛЕНИЕ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ ТЮМЕНСКОЙ ОБЛАСТИ
Региональное отделение Российского общества клинической
онкологии (RUSSCO) Тюменской области в настоящее время
насчитывает более 40 членов,
среди которых онкологи, химиотерапевты, радиотерапевты,
хирурги. Председателем регионального отделения с 2010 года
является начальник организационно-методической службы ГАУЗ
ТО «МКМЦ «Медицинский город», врач-онколог Гайсин Тимур
Ахатович.
Тюменская область находится в
центральной части Российской
Федерации, площадь территории
Тюменской области составляет 160
122 км2. В рамках административно-территориальногое устройства
на территории создано 6 городских
округов, 20 муниципальных районов, в том числе 273 сельских поселений.
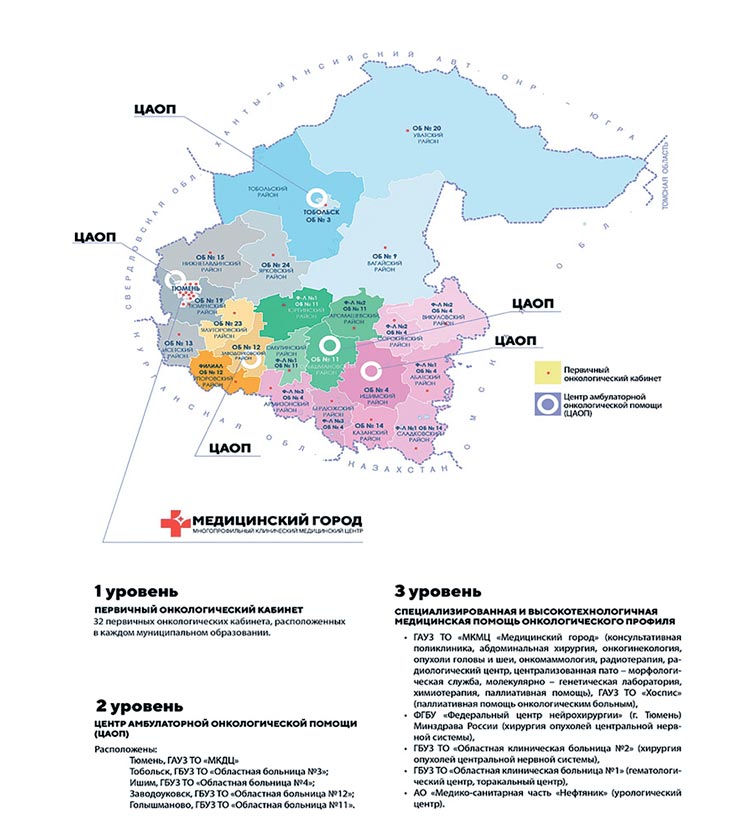
Тюменская область (без округов) граничит на северо-западе с
Ханты-Мансийским автономным
округом и Свердловской областью,
на юго-западе – с Курганской областью, на юге – с Северо-Казахстанской областью Казахстана, на
юго-востоке – с Омской и Томской
областями.
По данным Федеральной службы
государственной статистики Российской Федерации на 01.01.2022
г. численность населения Тюменской области составила 1 552 148
человек (городское население – 1
056 680, сельское население – 495
968), среднегодовая численность
населения за 2022 год составила 1
547 768 человек (1 051 293 – городское население, 496 475 – сельское
население). Численность женского
населения на 01.01.2022 г. составила 815 025, численность мужского
населения – 727 123 человека. В
Тюменской области проживают
представители свыше 150 этнических групп населения.
Численность трудоспособного населения в общей численности населения на 01.01.2022 г. составила
57,3%, старше трудоспособного
возраста – 20,7%.

Эпидемиологические
показатели состояния
онкологической помощи
В 2022 г. на территории Тюменской
области (без автономных округов)
зарегистрировано 6583 случая злокачественных новообразований (в
трудоспособном возрасте – 1713
заболеваний), в том числе 3016 у
мужчин и 3567 у женщин.
«Грубый» показатель заболеваемости злокачественными новообразованиями (ЗНО) по Тюменской
области (без автономных округов)
в 2022 г. составил 424,12 на 100 000
населения, темп прироста показателя в сравнении с 2012 годом составил +23,9%, в сравнении с 2021
годом темп прироста показателя
+8,5%.
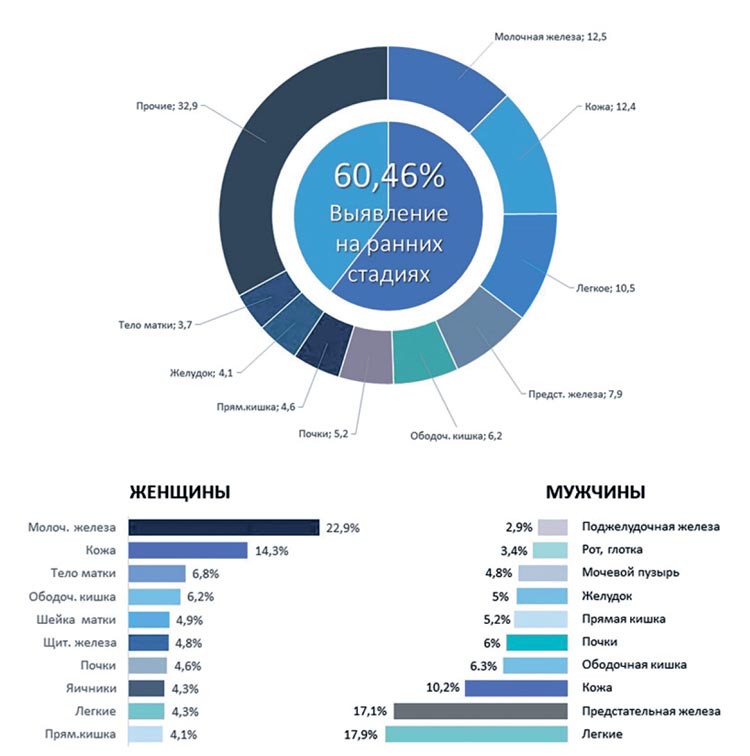
В 2022 году в структуре злокачественных заболеваний (оба пола)
I место занимали злокачественные
новообразования молочной железы (12,5%), II место – злокачественные новообразования кожи
(12,4%), III место – злокачественные новообразования трахеи,
бронхов, легкого (10,5%).
Одним из основных факторов,
определяющих прогноз злокачественных новообразований, является степень распространенности
опухолевого процесса. Доля злокачественных новообразований, выявленных на ранней I-II стадии в
2022 году, составила 60,5% от впервые выявленных злокачественных
новообразований, что выше уровня 2019 года, темп прироста показателя +3,1%.
На конец 2022 года в Тюменской области (без АО) 24203 пациента, или 57,0% всех больных со злокачественными новообразованиями, находившихся под наблюдением, состояли на учете 5 лет и более. Среди больных, наблюдающихся 5 лет и более, больший удельный вес составляют пациенты с ЗНО молочной железы (18,3%), тела матки (7,0%), предстательной железы (7,0%), щитовидной железы (6,7%), почки (6,3%), лимфатической и кровеносной системы (6,1%) ободочной кишки (4,8%), прямой кишки, ректосигмоидного соединения, ануса (4,0%), яичников (3,6%), мочевого пузыря (3,2%), трахеи, бронхов, легкого (3,0%).
«Грубый» показатель смертности от злокачественных новообразований (далее – ЗНО) за 2022 год составил 151,6 на 100 тыс. населения, и в сравнении с 2021 годом темп прироста смертности от ЗНО составил +5,6%.
Показатель смертности от злокачественных новообразований имеет тенденцию к волнообразному течению: на фоне плавного снижения в течение нескольких лет с 2012 по 2016 годы отмечается рост в 2017-2022 гг. При этом на фоне роста смертности от злокачественных новообразований наблюдается снижение показателя одногодичной летальности до 16,3% (темп снижения показателя в сравнении с 2021 годом составил 7,6%, в сравнении с 2012 годом – 32,8%), что свидетельствует о росте смертно
сти в основном за счет пациентов, взятых на учет в предыдущие годы и умерших в результате прогрессирования заболевания или противопоказаний к проведению специального лечения из-за сопутствующей патологии или распространенности опухолевого процесса.
Профилактические и скрининговые программы, проводимые на территории Тюменской области
Первое место по охвату населения среди различных видов профилактических осмотров занимает флюорография органов грудной клетки (ФГК). На долю флюорографического скрининга приходится 35,7% от всех видов обследований (915 040 обследований). На втором месте в структуре проведенных профосмотров находится анкетный скрининг (АСК) – 513 981 опрошенных лиц, что составляет 20,1% от всех обследований. Далее, в порядке убывания, расположились осмотры в женских кабинетах раннего выявления заболеваний (ЖК РВЗ) – 312 580 (12,2%) и осмотры в мужских кабинетах (МК РВЗ) – 208 351 (8,1%). Скрининг рака желудочно-кишечного тракта иммунохроматографическим методом (кал на скрытую кровь (КСК)) проведен 198 213 (7,7%) пациентам. Маммографический скрининг (РМГ) выполнен 132 574 (5,2%) женщинам, другие виды профилактических осмотров (индивидуальные, целевые) проведены у 117 800 (4,6%) человек и ПСА выполнен у 99 270 (3,9%) мужчин. Реже проводились эндоскопические обследования ЖКТ – 27 458 (1,1%), УЗ исследования женской репродуктивной системы (УЗИ ЖРС) – 25 093 (1,0%) и компьютерная томография органов грудной клетки (КТ ГК) – 10 679 (0,4%).
В 2022 году всеми методами профилактических осмотров, направленных на раннее выявление онкологической патологии, было выявлено 2 030 случаев ЗНО из первично выявленных 6 209 случаев ЗНО (в том числе вторичных локализаций) (32,7%). Организация оказания медицинской помощи пациентам с онкологическими заболеваниями в Тюменской области
В Тюменской области выстроена трехуровневая система оказания медицинской помощи пациентам с онкологическими заболеваниями.
Первый уровень оказания медицинской помощи больным с онкологическими заболеваниями представлен организациями, оказывающими первичную медико-санитарную помощь, всего 34 медицинских организации, из них 24 районные больницы, 10 городских поликлиник. В данных учреждениях функционирует 32 первичных онкологических кабинета (ПОК) и 91 кабинет раннего выявления заболеваний (КРВЗ), выполняющие функцию смотровых кабинетов, работа КРВЗ направлена на раннее выявление опухолей наружных локализаций.
На первом уровне оказания онкологической помощи проводятся мероприятия по раннему выявлению онкологических заболеваний (профилактические осмотры, диспансеризация, скрининговые исследования). С целью выявления онкологического заболевания пациент, обратившийся за медицинской помощью, направляется в кабинет раннего выявления заболеваний (КРВЗ), где прошедший обучение специалист (фельдшер, акушерка) проводит анкетирование, опрос, осмотр по разработанному алгоритму обследования. На начало 2023 года в КРВЗ работают 118 специалистов (укомплектованность составляет 77%), которые обеспечивают работу
Второй уровень оказания медицинской помощи больным с онкологическими заболеваниями представлен 5 медицинскими организациями, на базе которых организованы центры амбулаторной онкологической помощи (ЦАОП): ГАУЗ ТО «Многопрофильный консультативный диагностический центр» г. Тюмень и ГБУЗ ТО «Областная больница №4» г. Ишим, где центры амбулаторной онкологической помощи открыты в ноябре 2019 года; ГБУЗ ТО «Областная больница №3» г. Тобольск – ЦАОП открыт в марте 2020 года; ГБУЗ ТО «Областная больница №12» г. Заводоуковск – ЦАОП открыт в августе 2020 года; ГБУЗ ТО «Областная больница №11» р.п. Голышманово – ЦАОП открыт в сентябре 2020 года. В ЦАОП пациенты направляются из прикрепленных территорий с целью дообследования на высокотехнологичном оборудовании (КТ, МРТ), взятия биопсии, установки диагноза. На начало 2023 года в ЦАОП работает 23 врача-онколога. Все организованные ЦАОП имеют в своей структуре диагностические кабинеты: УЗИ, эндоскопические, рентген, КТ-диагностики, выполняется биопсия новообразований; в двух ЦАОП имеется МРТ-диагностика. Все 5 ЦАОП имеют дневные стационары для проведения противоопухолевой терапии, кабинеты паллиативной помощи, в составе медико-социальных отделений. ЦАОП реализуют следующие задачи: диагностика онкологических заболеваний, маршрутизация пациентов с выявленными заболеваниями в учреждения, оказывающие специализированную медицинскую помощь по профилю онкология (третий уровень), противоопухолевая терапия в условиях дневного стационара, диспансерное наблюдение за пациентами, состоящими на учете с онкологическими заболеваниями, с прикрепленных территорий, противоболевая терапия и паллиативная помощь, направление пациента на реабилитацию.
На третьем уровне специализированная и высокотехнологичная медицинская помощь онкологического профиля оказывается в ведущих лечебных учреждениях региона:
- ГАУЗ ТО «Многопрофильный клинический медицинский центр «Медицинский город» (областной онкодиспансер) – основное многопрофильное учреждение региона, оказывающее специализированную, в том числе высокотехнологичную, медицинскую помощь больным с новообразованиями. В структуре онкодиспансера имеется консультативная поликлиника на 417 посещений в смену; стационар на 430 онкологические койки, с отделениями абдоминальной онкологии, онкогинекологии, отделением опухолей головы и шеи, отделением опухолей молочной железы и кожи, отделением анестезиологии-реанимации, радиотерапевтическими отделениями, отделениями противоопухолевой лекарственной терапии, отделением паллиативной помощи, дневного стационара по химиотерапии, радиотерапии и хирургии; молекулярно-генетической лабораторией. В структуре онкодиспансера имеется отделение радионуклидной диагностики и терапии, где выполняется ПЭТ КТ, ОФЭКТ/КТ, сцинтиграфия; патологоанатомическое бюро, в котором централизована патоморфологическая служба региона; Центр женского здоровья, где проводится диагностика опухолей женской репродуктивной системы;
- ФГБУ «Федеральный центр нейрохирургии» (г. Тюмень) Минздрава России, где выполняется хирургическое лечение опухолей центральной нервной системы для жителей Тюменской области и других регионов, имеется гибридная операционная, с нейрофизиологическим мониторингом для выполнения сложнейших операций при опухолях ЦНС;
- ГБУЗ ТО «Областная клиническая больница №2», где выполняются все виды диагностики, биопсий, хирургические вмешательства при опухолях центральной нервной системы в экстренном порядке;
- ГБУЗ ТО «Областная клиническая больница №1», в структуре которой гематологический центр для лечения злокачественных новообразований крови и лимфатической системы у детей и взрослых; отделение детской онкологии и гематологии; торакальный центр, в котором осуществляется хирургический этап лечения пациентов с новообразованиями грудной клетки; с мая 2022 года в структуре учреждения утверждено 70 онкологических коек;
- АО «Медико-санитарная часть «Нефтяник», в котором расположен урологический центр, где получают хирургическое лечение пациенты с опухолями урологической зоны; с мая 2022 года в структуре учреждения утверждено 70 онкологических коек;
- ГАУЗ ТО «Хоспис», где оказывается паллиативная помощь онкологическим больным.

Кадровой состав
онкологической службы
Тюменской области
По итогам 2022 года в Тюменской
области обеспеченность врачами онкологами на 100 тыс. населения составила 9,5, обеспеченность врачами
детскими онкологами на 10 тыс. детского населения составила 0,8, обеспеченность врачами радиологами,
радиотерапевтами – 1,9 на 100 тыс.
населения.
В 2022 году в Тюменской области врачебную деятельность осуществляли:
146 врачей онкологов, имеющих сертификат (свидетельство об аккредитации), из них имели высшую категорию 38 врачей, первую категорию – 15
врачей, вторую категорию – 5 врачей;
15 врачей, имеющих сертификат радиолога, из них имели высшую категорию 7 врачей, первую категорию – 3
врача;
16 врачей, имеющих сертификат радиотерапевта, из них имели высшую
категорию 7 врачей, первую категорию – 1 врач.
В медицинских организациях Тюменской области, участвующих в
диагностике злокачественных новообразований, состоит 179,5 штатных
должностей врачей-онкологов, занято – 178, показатель укомплектованности – 99,2%.

Региональное отделение RUSSCO
Тюменской области занимается организацией и проведением
международных, всероссийских,
межрегиональных конференций и образовательных семинаров, где врачи
онкологи, радиологи и радиотерапевты принимают активное участие не
только как слушатели, но и являются
активными участниками мероприятий, выступая с докладами и разборами клинических случаев пациентов.
РЕЦИДИВИРУЮЩИЙ И МЕТАСТАТИЧЕСКИЙ НМРЛ – САМОЕ ИНТЕРЕСНОЕ НА КОНГРЕССЕ ESMO 2023
Авторы: Моисеенко Федор Владимирович
ГБУЗ «СПб КНпЦСВМП(о) им. Н.П. Напалкова»,
доктор медицинских наук, Санкт-Петербург
Шарапатюк Елизавета Дмитриевна
Ординатор ФГБУ «НМИЦ онкологии им. Н.Н. Петрова»
Минздрава России, Санкт-Петербург
В течение нескольких лет после появления третьего поколения ингибиторов EGFR и ALK наблюдалось
некоторое затишье в области таргетной терапии, а основные события
разворачивались в лечении опухолей без активирующих мутаций. В
этом году наиболее интересные результаты были представлены именно в сфере лечения пациентов с наличием драйверных нарушений.
Так, месяцем ранее на конгрессе WLCC в рамках исследования
FLAURA 2 [1] было продемонстрировано значительное увеличение
времени до прогрессирования опухоли при одномоментном начале
комбинированной химиотаргетной
терапии. Альтернативный подход
из двух таргетных препаратов был
изучен в работе MARIPOSA [2]. Это
исследование включало три рукава –
амивантамаб (биспецифичное EGFR
и MET антитело) и лазертиниб в
первом, осмертиниб и лазертиниб во
втором и третьем соответственно.
Первичная гипотеза была нацелена
на сравнение ВДП между рукавами
амивантамаб + лазертиниб и осимертинибом. Из представленных на
мероприятии результатов следует,
что применение комбинации таргетных препаратов позволяет достичь медианы ВДП 23,7 месяца, а
прогрессирование в течение 2 лет
отсутствует у 48% больных. Равно
как и в исследовании FLAURA 2, при
подгрупповом анализе меньшее преимущество от комбинации получили более возрастные пациенты (≥65
и >75 лет), а также пациенты в идеальном клиническом состоянии при
оценке по шкале ECOG. Важным
наблюдением в этом исследовании
стала довольно выраженная токсичность комбинации, проявлявшаяся
в снижении дозы (59% против 5%),
перерывах терапии (83% против
39%), а также отмене дальнейшей
терапии (35% против 14%) [3]. Кроме того, больным, рандомизированным в группу комбинированного
подхода, проводилась терапия профилактическими дозами антикоагулянтов. Обе работы – и MARIPOSA,
и FLAURA2 – интересны возможностью интенсификации терапии
и получения лучших результатов
именно для пациентов с негативным
прогнозом, например, метастатическим поражением головного мозга,
ECOG-1/2. Можно предположить,
что уже в ближайшем будущем будут
представлены результаты в зависимости от цоДНК, которая, по нашим
предположениям, уже в ближайшем
будущем поможет объективизировать группу с неудовлетворительным
прогнозом и необходимостью интенсификации лечения.
Другим видом молекулярных нарушений, для которого после представленных на ESMO 2023 результатов
не осталось сомнений относительно
выбора первой линии, стал НМРЛ с
транслокациями RET [4], а именно
сравнение стандартного подхода (с
дополнением иммунотерапией или
без) с селективным ингибитором
RET селперкатинибом, зарегистрированным уже в нашей стране для
пациентов с опухолями щитовидной
железы. На фоне таргетного препарата медиана времени до прогрессирования заболевания составила убедительные 24,8 месяца, что не оставляет
сомнений в преимуществе последнего. Любопытно, что представленный
анализ контрольной группы (часть
пациентов получали комбинацию
с пембролизумабом, а часть – нет)
показал отсутствие существенного
влияния этого препарата на выживаемость без прогрессирования, подтверждая сформулированную ранее
мысль о неэффективности современных препаратов с иммуноопосредованным механизмом действия
у больных с активирующими мутациями. Вместе со впечатляющими
результатами рандомизированного
исследования был представлен и
первичный анализ механизмов, которые определяют раннее прогрессирование (до 2 лет) на фоне терапии
селперкатинибом. Среди них преобладают off-target механизмы (активация KRAS, MET), а наиболее часто
измененными генами были уже известные нам по резистентности к иммунотерапии KEAP1 и ARID1A [5].
Не менее любопытной представляется новая возможность для лечения
больных с малочувствительным к
таргетным препаратам вариантом
мутации – инсерцией в экзоне 20
EGFR. Ранее попытки блокирования
этого молекулярного нарушения
были направлены внутрь клетки на
тирозин-киназный домен, например, препаратом мобицертиниб [6].
В этом же году были опубликованы
крайне перспективные результаты
применения в первой линии комбинации амивантамаба и цитостатического платинового дуплета [7]. В исследовании PAPILLON у нелеченных
ранее пациентов с неоперабельным
НМРЛ и инсерцией экзона 20 EGFR
медиана времени до прогрессирования составила 11,4 мес. против 6,7
мес. в контрольной группе с цитостатической терапией. Надо сказать, что
это не единственная попытка ухода
от направленного таргетного подхода у больных со сложно блокируемыми нарушениями. Неудовлетворенность результатами блокирования
KRAS G12C, в частности, временем
до прогрессирования заболевания,
привела к изучению комбинаций с
иммунотерапией, среди которых –
исследование KRYSTAL 7 [8]. В этом
нерандомизированном исследовании второй фазы у больных НМРЛ
с мутацией G12C изучалась эффективность комбинации адаграсиба и
пембролизумаба. У больных с высокой экспрессией PD-L1, которых в
исследовании было 54 из 148, частота объективных ответов составила
63%, а длительность ответа не была
достигнута. В целом очевидно, что
для некоторых мишеней появление
альтернативных способов блокирования крайне актуально в связи
с крайне неудовлетворительными
результатами применения современных препаратов. На фоне длительной
и трудоемкой разработки новых лекарственных препаратов попытки
комбинирования уже имеющихся
возможностей представляются крайне интересной возможностью для
улучшения результатов уже в ближайшее время.
В целом необходимо отметить, что
плато эффективности большинства препаратов, блокирующих непосредственно драйверный белок,
по-видимому, начинает реализовываться в усилении неселективного
нетаргетного подхода у больных с
активирующими мутациями. Так,
результаты целой волны исследований конъюгатов на поздних стадиях
лечения предвещают существенные
изменения в подходах к лечению
больных с активирующими мутациями. Одним из примеров является
датопотамаб дерукстекан, препарат
из серии конъюгатов дерукстекана – ингибитора топоизомеразы 1.
В исследовании TROPION-Lung01
препарат был изучен у больных
НМРЛ после иммуно- и химиотерапии [9]. Сравнение с доцетакселом
в целом было позитивным, так как
запланированное повышение ВДП
с 3,7 до 4,4 мес. (р=0,004) было достигнуто. Важно сказать, что на настоящий момент было принято решение не сужать группу пациентов
за счет использования биомаркеров
– например, экспрессии TROP2. Но
значительно более значимыми с
клинической точки зрения можно
считать существенные различия в
эффективности при аденокарциноме (5,6 мес.) и плоскоклеточном
раке (2,8 мес.).
Источники:
- Jänne P, Planchard D, et al. Osimertinib With/Without PlatinumBased Chemotherapy as First-line Treatment in Patients with EGFRm Advanced NSCLC (FLAURA2). Abstract PL03.13. Presented at World Conference on Lung Cancer 2023.
- Cho BC, et al. MARIPOSA: phase 3 study of first-line amivantamab + lazertinib versus osimertinib in EGFRmutant non-small-cell lung cancer. Future Oncology. 2022. 18(6): 639-647.
- Cho BC, et al. Amivantamab plus lazertinib vs osimertinib as first-line treatment in patients with EGFRmutated, advanced non-small cell lung cancer (NSCLC): Primary results from MARIPOSA, a phase III, global, randomized, controlled trial. ESMO Congress 2023, Report #LBA14.
- Loong HHF, et al. Randomized phase 3 study of first-line selpercatinib versus chemotherapy and pembrolizumab in RET fusion-positive NSCLC. ESMO Congress 2023, Report #LBA 4.
- Chen MF, et al. 1385P Genomics of early progression on selpercatinib in patients with RET fusion-positive lung cancers. Annals of Oncology. 2023; Vol.34, Suppl.2, S794-S795.
- Jänne P, et al. EXCLAIM-2: Phase III trial of first-line (1L) mobocertinib versus platinum-based chemotherapy in patients (pts) with epidermal growth factor receptor (EGFR) exon 20 insertion (ex20ins) + locally advanced/metastatic NSCLC. Annals of Oncology. 2023; Vol.34, Suppl.4, S1663-S1664.
- Girard N, et al. Amivantamab plus chemotherapy vs chemotherapy as first-line treatment in EGFR exon 20 insertion-mutated advanced non-small cell lung cancer (NSCLC): primary results from PAPILLON, a randomized phase 3 global study. ESMO Congress 2023, Report #LBA5.
- Garassino MC, et al. KRYSTAL-7: Efficacy and safety of adagrasib with pembrolizumab in patients with treatment-naïve, advanced non-small cell lung cancer (NSCLC) harboring a KRASG12C mutation. ESMO Congress 2023, Report #LBA 65.
- Ahn M-J, et al. Datopotamab deruxtecan (Dato-DXd) vs docetaxel in previously treated advanced/metastatic (adv/met) non-small cell lung cancer (NSCLC): results of the randomized phase 3 study TROPION-Lung01. ESMO Congress 2023, Report #LBA12.
МЕЛАНОМА. ТРИ НАИБОЛЕЕ ЗНАЧИМЫХ СОБЫТИЯ В 2023 ГОДУ
Автор: Утяшев Игорь Аглямович,
врач-онколог, к.м.н., директор отдела клинических исследований ГК Медскан,
лидер группы по меланоме, опухолям кожи и саркомам
Института онкологии Хадасса, Москва
В 2003 году были представлены результаты нескольких клинических исследований, которые могут оказать существенное влияние на лечение пациентов с меланомой в ближайшее время.
Пожалуй, самым важным клиническим исследованием по меланоме кожи в 2023 году стало исследование KEYNOTE-942 [1], спонсируемое компанией разработчиком мРНК вакцин Moderna совместно с компанией MSD. Значимость этой работы подтверждает представление её результатов на трёх наиболее авторитетных онкологических конгрессах: AACR Annual Meeting, ASCO Annual Meeting и ESMO Congress.
KEYNOTE-942 - это открытое рандомизированное клиническое исследование II фазы в котором изучали эффективность и безопасность комбинации персонализированной мРНК вакцины mRNA-4157/V940 (мРНК вакцина) + пембролизумаб (пембро) в сравнении с пембролизумабом у пациентов с радикально прооперированной меланомой кожи IIIB/IIIC/IIID и IV стадиями в адъювантном режиме. После проведения NGS секвенирования опухолевого образца и образца нормальной ткани пациента, выделяли от 1 до 34 неоантигенов опухоли и создавали мРНК вакцину, кодирующую эти пациент-специфические опухолевые неоантигены. На создание персонализированной мРНК вакцины для каждого пациента требовалось 6–9 недель.
Основной целью исследования был анализ безрецидивной выживаемости (БРВ). Дополнительными целями исследования был анализ выживаемости без отдалённых метастазов, оценка безопасности и переносимости терапии. Пациентов случайным образом распределяли в соотношении 2:1 в группу мРНК вакцина + пембро (n = 107) или в группу стандартной адъювантной иммунотерапии пембролизумабом (n = 50). В группе мРНК вакцина + пембро пациенты получали 9 введений персонализированной вакцины внутримышечно, каждые 3 недели и до 18 циклов пембролизумаба, каждые 3 недели. В группе монотерапии пембролизумабом, пациенты получали до 18 циклов пембро, каждые 3 недели. Медиана наблюдения составила 2 года. Первичный анализ данных по 18-месячной БРВ продемонстрировал достоверное снижение риска рецидива заболевания или смерти на 44% в пользу комбинированной адъювантной терапии с использованием мРНК вакцины и пембро. 18-месячная БРВ в группе мРНК вакцина + пембро составила 78,6%, а в группе пембро - 62,2%. Отношение рисков (ОР) рецидива составило 0,561 [95% ДИ, 0,309–1,017, p = 0,0266]. Анализ 18-месячной выживаемости без отдалённых метастазов показал снижение риска отдалённого метастазирования или смерти на 65% в пользу комбинированной адъювантной терапии с использованием мРНК вакцины и пембро. 18-месячная выживаемость без отдалённых метастазов в группе мРНК вакцина + пембро составила 91,8%, а в группе пембро 76,8%. ОР отдалённого метастазирования составило 0,347 [95% ДИ, 0,145–0,828, p = 0,0063].
Преимущество от адъювантной терапии мРНК вакциной и пембро в снижении риска рецидива заболевания, появлении отдалённых метастазов или смерти сохранялось независимо от суммарной мутационной нагрузки (TMB) в опухоли, динамики циркулирующей опухолевой ДНК, PD-L и BRAF-статуса. Пациенты в группе мРНК вакцина и пембро удовлетворительно переносили лечение, дополнительных иммуноопосредованных нежелательных реакций не выявлено.
Исследование KEYNOTE-942 — это первое контролируемое рандомизированное исследование, продемонстрировавшее способность противоопухолевой вакцины повышать эффективность ингибитора контрольных точек, значительно снижая риск рецидива и появления отдалённых метастазов у пациентов с меланомой, при этом не увеличивая токсичности в сравнении с моноиммунотерапией ингибитором контрольных точек. До этого ни одно из клинических исследований противоопухолевых вакцин (опухолевые лизаты, пептидные, дендритноклеточные, вирусные и др.) не демонстрировало столь впечатляющих результатов. С уверенностью можно утверждать, что в ближайшее время нас ждёт лавинообразный рост клинических исследований по комбинации ингибиторов контрольных точек с персонализированными вакцинами не только для резектабельной и метастатической меланомы, но и для остальных опухолей, чувствительных к иммунотерапии. Исследование KEYNOTE-942 произвело очередной прорыв в онкоиммунологии, мы стали на шаг ближе к преодолению иммунорезистентности рака.
Вторым по своей значимости событием, связанным с меланомой в 2023 году, я выбрал результаты комбинированной иммунотерапии метастатической меланомы кожи с использованием антиLAG-3 ингибитора фианлимаба и анти-PD-1 моноклонального антитела (мАТ) цемиплимаба [2]. Эти данные были представлены Omid Hamid и соавторами на конгрессе ASCO 2023.
Исследование включало 3 когорты пациентов. В первую когорту (n=40) включали пациентов, которые могли ранее уже получать системную терапию метастатической меланомы или ранее не леченых по поводу метастатической меланомы, но никогда ранее не получавших анти-PD-(L)1 мАТ. Во вторую когорту (n=40) были включены пациенты, не получавшие ранее системную терапию метастатической меланомы и никогда ранее не получавшие антиPD-(L)1 мАТ. В третью когорту (n=18) были включены пациенты, не получавшие ранее системную терапию метастатической меланомы, но уже получавшие терапию анти-PD-1 мАТ в адъювантном или неоадъювантном режимах и спрогрессировавшие не ранее чем через 6 месяцев после её отмены. Основной целью исследования был анализ частоты объективных ответов (ЧОО).
При медиане наблюдения в 12,6 месяца (8,6–19 мес.) объединённая ЧОО для всех трёх когорт (n=98) составила 61% (95% ДИ: 51–71), частота полных ответов 12%, частота частичных ответов 49%, частота стабилизаций заболевания 16%, частота прогрессирования 17%, частота контроля над заболеванием 78%. Медиана длительности ответа не достигнута. Ожидаемая медиана продолжительности жизни без прогрессирования рассчитанная по методу Каплан-Майер составила 15 месяцев. Комбинация фианлимаба и цемиплимаба продемонстрировала свою эффективность независимо от экспрессии LAG-3 или PD-L1 в опухоли. Частота нежелательных явлений комбинации фианлимаба и цемиплимаба соответствовала профилю токсичности монотерапии цемиплимабом, лишь частота надпочечниковой недостаточности 11% была выше, чем при монотерапии цемиплимабом. Частота НЯ ≥3 степени составила 43,9%, частота серьёзных нежелательных явлений - 32,7%, частота иммуноопосредованных нежелательных явлений - 65,3%. У 16,3% пациентов потребовалось прекращение терапии из-за НЯ, связанных с лечением.
При непрямом сравнении результатов этого исследования с другими режимами комбинированной иммунотерапии в исследованиях CheckMate 067 и Relativity-047 комбинация фианлимаба и цемиплимаба выглядит безусловным фаворитом, особенно в контексте переносимости комбинированной иммунотерапии ипилимумабом и ниволумабом. Более всего поражают результаты применения фианлимаба и цемиплимаба у пациентов, ранее получавших анти-PD-1 мАТ в адъювантном режиме. ЧОО в 61,5% и медиана продолжительности жизни без прогрессирования в 11,8 месяцев - не достижимые ранее показатели для этой подгруппы пациентов. При подтверждении результатов комбинированной терапии фианлимабом и цемиплимабом в рандомизированном исследовании III фазы в арсенале препаратов для терапии метастатической меланомы в скором времени появится новый высокоэффективный и низкотоксичный лидер.
Третьим по своей значимости событием, связанным с меланомой в 2023 году, стала публикация результатов ретроспективного клинического исследования по адъювантному применению темозоломида и цисплатина при меланоме слизистых оболочек в сравнении с иммунотерапией анти-PD-1 мАТ торипалимабом [3].
В своей ретроспективной работе китайские исследователи с помощью метода псевдорандомизации сравнили две группы пациентов с радикально прооперированной меланомой слизистых оболочек:
- пациенты в группе химиотерапии (n=65) получали адъювантную химиотерапию по схеме: темозоломид 200 мг/м2/сутки внутрь с 1 по 5 день + цисплатин 75 мг/м2/сутки в/в капельно с 1 по 3 день, каждые 3 недели, всего 6 циклов;
- пациенты в группе иммунотерапии анти-PD-1 мАТ (n=65) получали торипалимаб 3 мг/кг в/в капельно каждые 2 недели в течение 52 недель.
Основной целью исследования
был анализ безрецидивной продолжительности жизни (БРВ),
выживаемости без отдалённых
метастазов (ВБОМ) и общей выживаемости (ОВ) пациентов. После
псевдорандомизации пациенты
были сбалансированы по основным демографическим и клиническим характеристикам. При
медиане наблюдения в 52,6 месяца
(95%ДИ, 44,6-60,6 мес.) пациенты
в группе химиотерапии темозоломидом и цисплатином имели
лучшие результаты в сравнении с
пациентами получавшими иммунотерапию торипалимабом в виде
более высокой медианы БРВ (28,2
против 12,0 мес.; ОР=0,64, 95% ДИ,
0,42 – 0,98; P=0, 04), ВБОМ (42,0
против 19,0 мес.; ОР=0,58, 95%
ДИ, 0,36 – 0,92; P=0,02) и ОВ (93,4
против 39,3 мес.; ОР=0,56, 95% ДИ,
0,33 – 0,94; P=0,03).
Результаты этого исследования
ещё раз подчеркивают фундаментальные биологические различия
слизистой меланомы от меланомы
кожи. Даже в эпоху иммунотерапии ингибиторами контрольных
точек химиотерапия темозоломидом и цисплатином остаётся
наиболее эффективной, а главное
повсеместно доступной опцией
адъювантной терапии меланомы
слизистых оболочек и может уже
сейчас быть использована в рутинной клинической практике за неимением более эффективных опций.
Источники:
- Adnan Khattak et al. Distant metastasis-free survival results from the randomized, phase 2 mRNA4157-P201/KEYNOTE-942 trial. JCO 41, LBA9503-LBA9503(2023). DOI:10.1200/JCO.2023.41.17_suppl. LBA9503.
- Omid Hamid et al., Significant durable response with fianlimab (anti-LAG-3) and cemiplimab (antiPD-1) in advanced melanoma: Post adjuvant PD-1 analysis. JCO 41, 9501-9501(2023). DOI:10.1200/ JCO.2023.41.16_suppl.9501
- Bin Lian et al., Temozolomide plus cisplatin versus toripalimab (anti-PD-1) as adjuvant therapy in resected mucosal melanoma. JCO 41, 9508-9508(2023). DOI:10.1200/ JCO.2023.41.16_suppl.9508
НОВОСТИ ОНКОЛОГИИ / IDEA: НЕ НОВА, НО ПО-ПРЕЖНЕМУ АКТУАЛЬНА
Новые результаты исследования
IDEA показывают, что женщины с
биологически низким риском в постменопаузе с раком молочной железы
I стадии, перенесшие лампэктомию
без адъювантной лучевой терапии
молочной железы с последующей
эндокринной терапией, имеют чрезвычайно низкую частоту рецидивов
заболевания – около 3% – через 5 лет.
По мнению главного исследователя
Reshma Jagsi, профессора медицинского колледжа Университета Эмори,
США, это необходимо изучить глубже, потому что, хотя методы лучевой
терапии значительно улучшились и
сейчас они гораздо более эффективны, чем раньше, пациенты все больше
начинают ценить возможность выбора
Результаты многоцентрового исследования IDEA были недавно опубликованы в Journal of Clinical Oncology
[1], а также были представлены на
Симпозиуме по раку молочной железы (SABCS 2023) в Сан-Антонио в
декабре 2023 года.
ЛТ уже давно является стандартом
лечения после органосохраняющих
операций у женщин с ранним раком
молочной железы. Несмотря на успех
лучевой терапии в улучшении выживаемости и уменьшении рецидивов
заболевания, она может привести
к побочным эффектам (например,
боли, усталости и изменениям кожи)
и финансовому бремени. Несколько
исследований показали, что женщины с гормоночувствительным ранним
раком молочной железы в возрасте
65 лет и старше могут быть подходящими кандидатами для отказа от ЛТ
[2,3]. Однако последствия этого решения у более молодых женщин в постменопаузе остаются неясными.
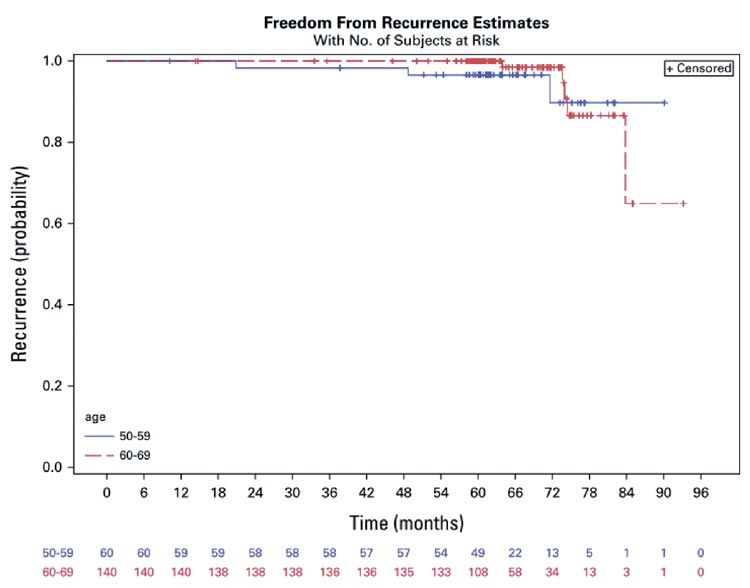
С этой целью в 2015 году было инициировано исследование IDEA для оценки частоты местного рецидива у женщин с биологически низким риском моложе 70 лет (50-69 лет) с pT1N0 унифокальной опухолью, перенесших лампэктомию с последующей эндокринной терапией, но без лучевой терапии при раннем раке молочной железы. Пациентки находились в постменопаузе и имели гормон-рецептор-положительные и HER2-отрицательные опухоли, и все они относились к биологически низкому риску, отчасти на основании суммы баллов по результатам анализа Oncotype DX Recurrence Score. На момент запуска IDEA было первым проспективным исследованием, в котором геномный анализ использовался в качестве фактора отбора пациентов при лечении рака молочной железы с помощью лучевой терапии. Первичной конечной точкой была частота локорегионарных рецидивов за 5 лет. В период с июня 2015 г. по октябрь 2018 г. в исследование было включено 200 пациенток. Среди 186 пациенток, прослеженных не менее 56 месяцев, общая и специфическая для рака молочной железы выживаемость в течение 5 лет составила 100%. Пятилетняя выживаемость без каких-либо рецидивов составила 99% (95% ДИ 96-100). Общая частота ипсилатеральных рецидивов за весь период наблюдения для пациентов 50-59 лет и 60-69 лет составила 3,3% (2/60) и 3,6% (5/140) соответственно (рис.1); общая частота всех рецидивов составила 5,0% (3/60) и 3,6% (5/140) соответственно. Пятилетние результаты IDEA кажутся обнадеживающими, но их клинические последствия по-прежнему неопределенные, а однорукавный дизайн исследования может затруднить обобщение результатов на более широкую популяцию. Профессор Jagsi добавила, что пятилетний срок считается слишком «ранним» для этой популяции больных и что долгосрочное последующее наблюдение «будет абсолютно необходимо для определения того, можно ли безопасно предложить этот вариант молодым женщинам». Десятилетние результаты IDEA и подобных исследований станут доступны еще через несколько лет.
Рисунок 1.
Рисунок 1. Выживаемость без рецидивов
в 2 возрастных группах
Между тем, исследование 3 фазы
DEBRA (NCT04852887), инициированное в 2021 году, также должно
предоставить ценные данные о результатах отказа от лучевой терапии в этой группе больных. DEBRA
случайным образом распределит
пациентов с гормоночувствительным раком молочной железы ранних
стадий, перенесших органосохраняющую операцию, на эндокринную
терапию с лучевой терапией или без
нее. Биологический риск будет оцениваться с помощью геномного анализа Oncotype DX Recurrence Score.
Помимо предоставления долгосрочных данных в рандомизированном
дизайне, DEBRA прольет свет на
субъективное мнение пациентов в
отношении эндокринной терапии с
облучением или без него.
Источники:
- Jagsi R, Griffith KA, Harris EE, et al. Omission of radiotherapy after breastconserving surgery for women with breast cancer with low clinical and genomic risk: 5-year outcomes of IDEA. J Clin Oncology. 2023; JCO.23.02270.
- Palta M, Palta P, Bhavsar NA, et al. The use of adjuvant radiotherapy in elderly patients with early‐stage breast cancer: changes in practice patterns after publication of Cancer and Leukemia Group B 9343. Cancer. 2015; 121(2): 188-93.
- Kunkler IH, Williams LJ, Jack WJ, et al. Breast-conserving surgery with or without irradiation in early breast cancer. N Engl J Med. 2023; 388: 585-94.
НОВОСТИ ОНКОЛОГИИ / SABCS 2023: НЕОАДЪЮВАНТНАЯ ХИМИОТЕРАПИЯ МОЖЕТ ПОМОЧЬ НЕКОТОРЫМ БОЛЬНЫМ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ ИЗБЕЖАТЬ ОБЛУЧЕНИЯ РЕГИОНАЛЬНЫХ ЛИМФОУЗЛОВ
Первые результаты исследования
NRG/NSABP B-51, представленные
несколько дней назад на симпозиуме по раку молочной железы в СанАнтонио, вызвали немало эмоций,
в том числе и в отношении главного
исследователя – Terry P. Mamounas,
председателя NRG Oncology Breast
Committee, профессора хирургии
Университета Центральной Флориды (которого многие, тем не менее,
называют «гигантом радиационной
онкологии»), медицинского директора комплексной программы молочной железы в Orlando Health Cancer
Institute, США. Профессор Mamounas
многие годы работы посвятил проблеме хирургического и нео- и адъювантного лечения раннего рака молочной
железы. В последнее десятилетие
активное внедрение в практику неоадъювантного лекарственного подхода очень здорово спутало карты в
отношении показаний к назначению
адъювантного лечения, в частности,
лучевой терапии.
Пациентки, у которых диагностирован рак молочной железы с поражением регионарных лимфоузлов,
все чаще получают неоадъювантную
химиотерапию, и в ряде случаев она
приводит к развитию полного патоморфологического ответа. Однако
в настоящее время не существует
установленного стандарта лечения
таких больных после операции. Идут
активные дебаты о том, следует ли их
вести как пациентов с позитивными
лимфоузлами (именно так они были
диагностированы) или как пациентов
с негативными лимфоузлами (именно
такой результат был получен после
операции). В первом варианте пациенткам, несомненно, будет рекомендовано пройти облучение грудной
стенки/молочной железы и региональных зон после оперативного вмешательства. Во втором случае врачи
имели бы право не проводить послеоперационную лучевую терапию, как
минимум, на зоны лимфооттока, и,
следовательно, избежать осложнений,
связанных с лечением, таких как боль,
слабость, лимфедема и проблемы реконструкции молочной железы. Поэтому очень важно оценить, можно
ли безопасно отказаться от облучения
в этой популяции пациентов.
Чтобы оценить влияние облучения
регионарных узлов на результаты
лечения пациенток с достигнутым
полным ответом на неоадъювантную терапию, доктор Мамунас и его
коллеги провели клиническое исследование NRG Oncology/NSABP B-51/
RTOG 1304 фазы III. В исследование
была включена 1641 пациентка с диагнозом неметастатического рака молочной железы с подтвержденным
поражением лимфатических узлов
и достигнутым полным ответом по
лимфоузлам после неоадъювантной
химиотерапии; все больные перенесли мастэктомию или органосохраняющую операцию. Пациентки были
рандомизированы в соотношении 1:1
в группу RNI- (наблюдение после мастэктомии или только облучение молочной железы после органосохраняющей операции) или в группу RNI+
(облучение грудной стенки/молочной
железы плюс облучение регионарных
узлов после мастэктомии или органосохраняющей операции). Период наблюдения составил 59,5 месяца.
У оцененных пациентов (n=1556)
результаты были одинаковыми независимо от того, получали ли они
адъювантное региональное облучение узлов или нет: 91,8% пациентов
в группе RNI- и 92,7% пациентов в
группе RNI+ не имели рецидивов
инвазивного рака молочной железы
через 5 лет после операции (HR 0,88;
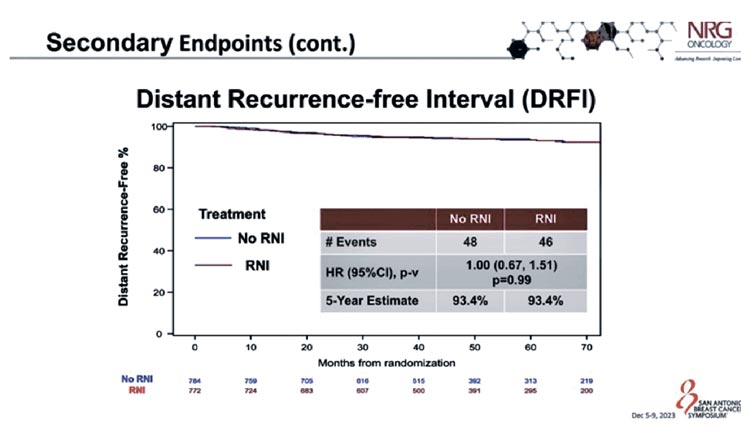
95% CI 0,60-1,29; P=0,51) (рис.1). Частота отдаленных рецидивов и общая
выживаемость также были одинаковыми в группах: 93,4% пациентов в
каждой группе не имели отдаленного
рецидива через 5 лет после операции,
а 94% пациентов в группе без RNI и
93,6% пациентов в группе RNI живы
через 5 лет (HR 1,12; 95% CI 0,75-1,68;
P=0,59). Как демонстрируют графики
на рисунках 1 и 2, кривые выживаемости без локорегионального или отдаленного рецидива буквально слились
воедино.
Рисунок 1.
Выживаемость без рецидива инвазивного
рака молочной железы.
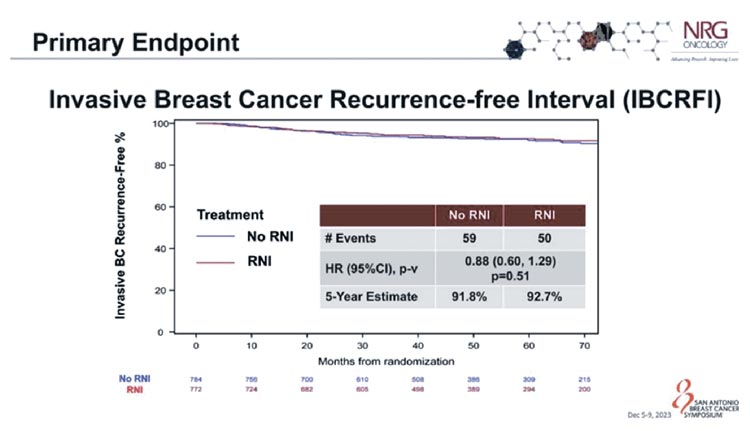
Рисунок 2.
Выживаемость без отдаленных рецидивов РМЖ.
Результаты показывают, что полный
ответ со стороны ранее позитивных
регионарных лимфатических узлов
после неоадъювантной химиотерапии может позволить некоторым пациенткам не проводить адъювантное
облучение лимфатических узлов без
отрицательного влияния на онкологические результаты. Наблюдение за
пациентами на предмет отдаленных
рецидивов пока продолжается.
Потенциальным ограничением исследования является то, что у пациенток
до сих пор наблюдалось меньше рецидивов рака молочной железы, чем
ожидалось, что повлияло на процесс
выполнения запланированного статистического анализа. Однако статистический план исследования также
предусматривал проведение анализа
через 10 лет после начала исследования – что и произошло в 2023 году.
Исследователи запланировали более
длительное наблюдение, дабы убедиться в правильности выводов.
Источник:
Mamounas E, Bandos H,
White J, et al. Loco-regional irradiation in
patients with biopsy-proven axillary node
involvement at presentation who become
pathologically node-negative after
neoadjuvant chemotherapy: Primary
outcomes of NRG Oncology/NSABP
B-51/RTOG 1304. Presented at SABCS
2023. December 5-9, 2023. San Antonio,
TX. Abstract GS02-07.
НОВОСТИ ОНКОЛОГИИ / KEYNOTE-585: ПЕМБРОЛИЗУМАБ В КОМБИНАЦИИ С ПЕРИОПЕРАЦИОННОЙ ХИМИОТЕРАПИЕЙ ПРИ ПЕРВИЧНО ОПЕРАБЕЛЬНОМ РАКЕ ЖЕЛУДКА И КАРДИОЭЗОФАГЕАЛЬНОГО ПЕРЕХОДА
Интересное исследование, заставляет нас задуматься, можем ли мы использовать частоту достижения pCR
как первичную конечную точку в
работах, изучающих периоперационную терапию при раке желудка (РЖ)
и кардиоэзофагеального перехода
(КЭП).
Напомним, что в настоящий момент
проведение периоперационной химиотерапии при РЖ и КЭП рекомендовано пациентам начиная со
стадии T2N0M0, а оптимальным и
предпочтительным режимом на основании исследования FLOT4, опубликованного в далеком 2019 году,
является режим FLOT. Применение
схемы FLOT в сравнении с ECX позволило увеличить частоту pCR в 2,5
раза, медиану ВБП – с 18 до 30 мес.
(p=0,0036) и медиану ОВ – с 35 до 50
мес. (p=0,012) соответственно.
Однако результаты терапии локализованного РЖ и КЭП остаются
неудовлетворительными. Опубликованные обнадеживающие результаты исследований KEYNOTE-859,
CHECKMATE-649, SPOTLIGHT,
GLOW, посвященных изучению таргетной терапии/иммунотерапии при
диссеминированном РЖ, позволяют
активно ее изучать и при первично
операбельном РЖ и КЭП.
В декабре 2023 г. в The Lancet
Oncology представлены предварительные результаты исследования 3
фазы KEYNOTE-585, посвященные
целесообразности добавления пембролизумаба к периоперационной
химиотерапии в режиме PF/FLOT
при раке желудка и кардиоэзофагеального перехода II-IVa
С 9 октября 2017 г. по 25 января 2021 г. 804 пациента T3N0-1 или T0-4N+ рандомизированы в когорту PF ± пембролизумаб и 203 больных – в когорту FLOT ± пембролизумаб. Первичными конечными точками работы были частота достижения полного патоморфоза (pCR), токсичность и медианы бессобытийной (EFS) и общей (ОВ) выживаемости. В настоящий момент опубликованы результаты терапии 1 когорты, в которой 804 пациента рандомизированы (1: 1) в две лечебные группы: пембролизумаб 200 мг + 3 цикла PF/ PX → хирургическое лечение → пембролизумаб 200 мг + 3 цикла PF/PX и далее 11 введений пембролизумаба; плацебо + 3 цикла PF/PX → хирургическое лечение → плацебо + 3 цикла PF/PX и далее 11 введений плацебо. Необходимо отметить, что исследование характеризовалось сложным дизайном, и уровень статистической значимости, при котором добавление пембролизумаба к химиотерапии в режиме PF/PX позволяло бы говорить об увеличении мEFS, был оценен как α=0,0005.
Большинство пациентов, включенных в когорту PF/PX ± пембролизумаб, были мужчинами (72%) с ECOG
0 (75%) и медианой возраста 64 года.
Опухоль чаще локализовалась в
желудке (79%) и в 73% случаев CPS
оценен как ≥1. У 9% больных зарегистрирован MSI-H.
При медиане времени наблюдения в 47,7 мес. добавление пембролизумаба к режиму PF/PX позволило увеличить частоту достижения pCR c 2,0%
до 12,9% (p<0,0001). Максимальный
эффект от комбинации пембролизумаба с PF зарегистрирован при CPS
≥1 и MSI-H.
Несмотря на то, что численно медиана EFS была выше в группе с пембролизумабом (25,3 мес. против 44,4 мес.
соответственно), статистической достоверности различия не достигли –
p=0,0198 (рис.1)
Рисунок 1.
График бессобытийной выживаемости
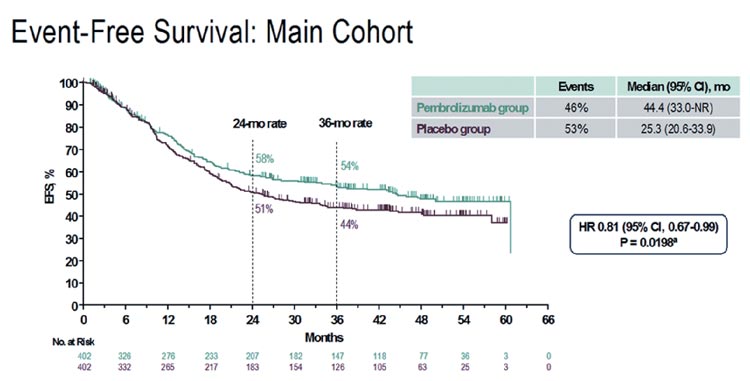
Добавление иммунотерапии также
не позволило значимо увеличить 24-
и 36-месячную ОВ в группах, которые достигли 72% и 65% против 69%
и 60% соответственно.
НЯ 3 степени и выше зарегистрированы у 312 (78%) больных в группе
с пембролизумабом и у 297 (74%)
пациентов в группе плацебо и были
преимущественно представлены
тошнотой (60% vs 62%), анемией (42%
vs 40%) и снижением аппетита (41%
vs 43%). Серьезные НЯ, связанные с
лечением, были зарегистрированы
у 102 (26%) и 97 (24%) пациентов в
лечебных группах соответственно.
В целом профиль токсичности был
управляем и ожидаем.
Источники:
- Kohei Shitara, et al. Neoadjuvant and adjuvant pembrolizumab plus chemotherapy in locally advanced gastric or gastro-oesophageal cancer (KEYNOTE-585): an interim analysis of the multicentre, double-blind, randomised phase 3 study. The Lancet of oncology. December 19, 2023. DOI: https://doi.org/10.1016/S1470- 2045(23)00541-7.
- Batran S-E, Homann N, Pauligk C, et al; FLOT4-AIO Investigators. Perioperative chemotherapy with fluorouracil plus leucovorin, oxaliplatin, and docetaxel versus fluorouracil or capecitabine plus cisplatin and epirubicin for locally advanced, resectable gastric or gastro-oesophageal junction adenocarcinoma (FLOT4): a randomised, phase 2/3 trial. Lancet. 2019; 393 (10184): 1948-1957.
- Rha SY, Wyrwicz L, Yanez Weber PE, et al. KEYNOTE-859 study of pembrolizumab plus chemotherapy for advanced HER2-negative gastric or gastroesophageal junction (G/GEJ) cancer: Outcomes in the protocolspecified PD-L1-selected populations. J Clin Oncol. 2023; 41: 16s (suppl; abstr 4014).
- Janjigian YY, Shitara K, Moehler M, et al. First-line nivolumab plus chemotherapy versus chemotherapy alone for advanced gastric, gastrooesophageal junction, and oesophageal adenocarcinoma (CheckMate 649): a randomised, open-label, phase 3 trial. Lancet. 2021; 398 (10294): 27-40.
- Shah MA, Shitara K, Ajani JA, et al. Zolbetuximab plus CAPOX in CLDN18.2- positive gastric or gastroesophageal junction adenocarcinoma: the randomized, phase 3 GLOW trial. Nat Med. 2023; 29 (8): 2133- 2141.
- Shitara K, Lordick F, Bang Y-J, et al. Zolbetuximab plus mFOLFOX6 in patients with CLDN18.2-positive, HER2-negative, untreated, locally advanced unresectable or metastatic gastric or gastro-oesophageal junction adenocarcinoma (SPOTLIGHT): a multicentre, randomised, double-blind, phase 3 trial. Lancet. 2023; 401 (10389): 1655-1668.
«А ВОТ БЫЛ У МЕНЯ СЛУЧАЙ…», ИЛИ «ОХОТНИЧЬИ ЗАПИСКИ» ОНКОЛОГОВ / РАДИКАЛЬНОЕ ЛЕЧЕНИЕ РАКА ШЕЙКИ МАТКИ IVA СТАДИИ: БЫТЬ ИЛИ НЕ БЫТЬ?
Авторы: Деньгина Наталья Владимировна
Заведующая радиологическим отделением
ГУЗ «Областной клинический онкологический диспансер», к.м.н, Ульяновск
Владимиркина Мария Сергеевна
Заведующая рентгенологическим отделением
ГУЗ «Областной клинический онкологический диспансер», Ульяновск
Антонеева Инна Ивановна
Заведующая хирургическим отделением онкогинекологии
ГУЗ «Областной клинический онкологический диспансер»,
доктор медицинских наук, профессор, Ульяновск
Еще некоторое время назад появление на консилиуме врачей пациентки
с IV стадией рака шейки матки, будь
то IVA (с прорастанием в соседние
органы – чаще в мочевой пузырь,
реже – в прямую кишку) или IVB (с
отдаленными метастазами), позволяло радиотерапевту несколько расслабиться и начать изучать карты других
пациентов: подобные больные крайне
редко подлежали лучевому лечению,
и эти клинические ситуации рассматривались скорее как противопоказания к облучению. Настораживало
следующее: риск формирования везико-вагинальных или – реже – ректовагинальных фистул (инвазия мочевого
пузыря встречается примерно в 4
раза чаще, чем прямой кишки) и нецелесообразность/неэффективность
лучевой терапии при отдаленных
метастазах. Сейчас подобная ситуация не должна удивлять или пугать
практикующего врача, в том числе и
радиотерапевта. Несмотря на то, что
показатели общей выживаемости при
клинической Т4 хуже, чем при любых
других индексах Т рака шейки матки
и составляют 22-24% за 5 лет [1], мало
какая другая опухоль может «похвастаться» подобным достижением при
проведении как минимум условнорадикального лечения, в том числе и
химиолучевой терапии. При этом мы
прекрасно осознаем, что, несмотря на
нерезектабельность клинической Т4а
в большинстве случаев (а зачастую и
неоперабельность в силу ослабленного состояния пациентки), нередко по
опухолевому объему IIIВ-С стадии
выглядят гораздо «страшнее» по данным КТ/МРТ и тяжелее клинически.
Поэтому современные рекомендации,
как международные, так и отечественные, предполагают проведение
радикального химиолучевого лечения (сочетанная ЛТ + еженедельное
введение цисплатина в дозе 40 мг/м2
на протяжении курса лучевой терапии) – такого же, как и при III стадии
– у подавляющего большинства больных с IVA стадией [2]. В ряде случаев,
у части больных без перехода опухоли
на стенку таза альтернативой химиолучевому лечению может служить
экзентерация малого таза (особенно
при наличии свищей). Выполнение
этого вмешательства возможно первичным больным IVA стадии РШМ и
больным с центральным рецидивом,
вовлекающим мочевой пузырь и/или
прямую кишку, не переходящим на
стенку таза, при отсутствии диссеминации по брюшине, регионарных
и отдаленных метастазов. Однако
далеко не каждая пациентка готова
пойти на столь обширное калечащее
вмешательство, и проведение консервативного лечения у многих выглядит
более рациональным. В любом случае, больные должны быть полностью
и всесторонне осведомлены о возможных последствиях/осложнениях
любого варианта лечения – которые,
увы, могут приводить к значительному снижению качества жизни. Если
говорить о химиолучевой терапии
при IVA стадии – это, в первую очередь, риск формирования свища со
всеми вытекающими из этого последствиями. Однако давайте попробуем
задать себе несколько вопросов и дать
на них ответы, насколько это возможно при наличии существующей
доказательной базы: 1) что есть свищ
по сути? 2) образуется ли свищ после
облучения у ВСЕХ больных? 3) влияет
ли его наличие на прогноз заболевания? 4) что предпочла бы пациентка
– 20-25% шанс перешагнуть 5-летний
порог выживаемости, возможно, со
свищом после радикального лечения,
или, скорее всего, меньший шанс на
более долгую выживаемость при, тем
не менее, сохраняющемся риске развития свища?..
Свищ по определению – патологическое эпителизированное соустье
между кишкой или мочевым пузырем
и влагалищем. По сути – это результат
ОТВЕТА опухоли на терапию, когда
опухоль, проросшая в соседний орган,
разрушилась на фоне лечения и оставила на своем месте некий тоннель с
эпителизированными стенками. Фистулы, увы, могут формироваться и
после стандартного курса ЛТ/ХЛТ, в
том числе и при меньшей стадии (как
позднее осложнение радикального
лучевого лечения). Частота их формирования составляет около 5%, сроки –
через 1 год после проведенного лечения [3]. С одной стороны, отсутствие
опухоли даже при наличии такого неприятного осложнения – это хорошо,
но другая сторона медали состоит в
том, что качество жизни в большинстве случаев значительно снижено
(подтекание мочи, отделение кала через влагалище, запах, постоянное
ношение прокладок или памперсов,
риск восходящего инфицирования
мочевыводящих путей и т.д.).
В доступной литературе можно найти
крайне мало работ, ретроспективно
оценивших исход ЛТ/ХЛТ при IVА
стадии рака шейки матки, мало кто из
исследователей оценивал риск формирования везико-вагинальных и
ректовагинальных свищей. При этом
оптимальная последовательность
методов, дозы/режимы ЛТ, позволяющие снизить риск их образования
и при этом поддерживать локальный
контроль и влиять на общую выживаемость, также не определены. НО:
риск формирования свища НЕ 100%,
при том, что общая выживаемость
пятой части радикально пролеченных
пациентов превышает 5 лет. Если кратко резюмировать данные немногочисленных наблюдений по этой проблеме, можно сказать, что 1) частота
формирования свищей варьирует от
3% до 48% по данным разных авторов;
2) из наиболее явных факторов риска
развития фистул можно назвать курение, инвазию мочевого пузыря (которая по статистике встречается в 5 раз
чаще, чем инвазия прямой кишки),
превышение дозы ЛТ свыше 70 Гр на
2 см3 кишки, проведение биопсий в
ближайшие сроки после окончания
радикального лечения, а также возраст свыше 60 лет; 3) прогноз при прорастании прямой кишки значительно
хуже, чем при прорастании мочевого
пузыря. В любом случае, рассматривать сохранных пациенток с локализованным прорастанием опухоли в
соседний орган как не подлежащих
радикальному лечению в настоящее
время абсолютно неправильно.
В постковидный период частота
встречаемости IVA стадии рака шейки матки, вероятнее всего, увеличилась практически повсеместно. В нашем центре сохранные пациентки с
подтвержденным прорастанием опухоли в соседние органы изначально
планируются на радикальное химиолучевое лечение, в ряде случаев – с
индукционной химиотерапией, если
ХЛТ рассматривается как слишком
токсичное лечение по состоянию
больной.
Пациентка Т., 64 лет, с лета 2022 года
начала отмечать кровянистые выделения из влагалища, и при обследовании по месту жительства были
обнаружены изменения на шейке
матки, в мазке на онкоцитологию выявлено подозрение на плоскоклеточный рак. При осмотре: шейка матки
разрушена опухолью с вовлечением
стенок влагалища до с/3; пришеечные
инфильтраты в параметриях. Пациентка консультирована и обследована
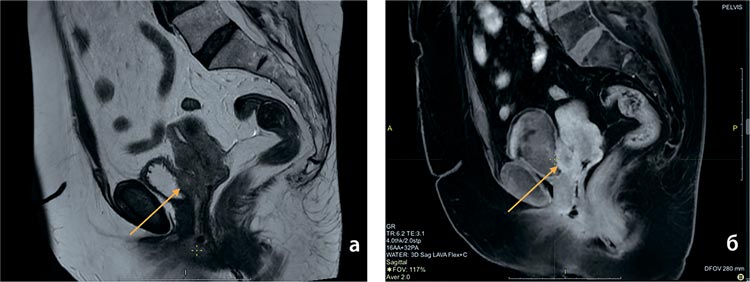
в онкодиспансере; на МРТ органов
малого таза от 26.12.2022: образование шейки матки 28×35×39 мм, с распространением на мочевой пузырь
с вовлечением всех слоев стенки на
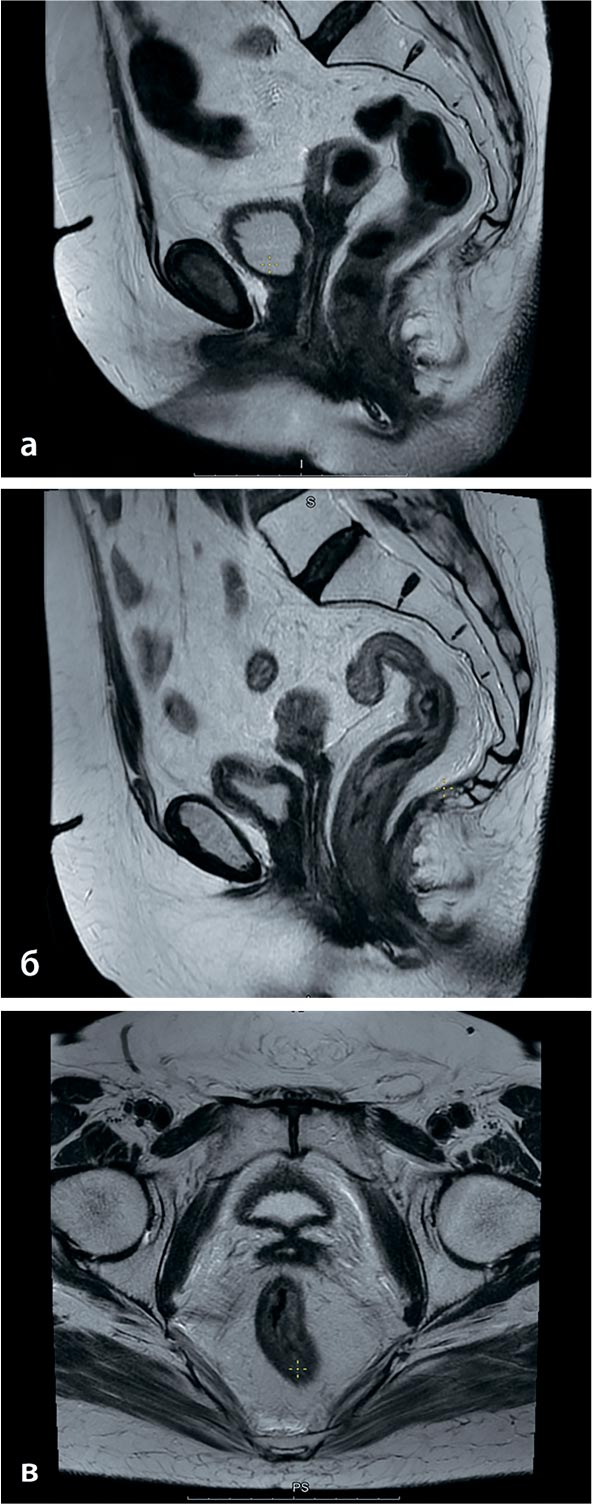
участке 21×13 мм (рис.1а,б) с формированием свищевого хода, признаки
параметральной инвазии 10 мм слева,
9 мм справа. Явных клинических признаков наличия свища у пациентки не
было, хотя при цистоскопии описана
клиническая картина прорастания
задней стенки мочевого пузыря на
ограниченном участке, с выраженной
контактной кровоточивостью, из-за
чего биопсия не была взята ввиду
высокого риска кровотечения и тампонады. Гистологический анализ продемонстрировал плоскоклеточный
неороговевающий рак G2 с признаками стромальной и сосудистой инвазии. Выставлен диагноз рака шейки
матки IVA – T4aN0M0.
Рисунок 1.
а,б. МРТ органов малого таза от 26.12.2022
(до лечения): опухоль шейки матки с прорастанием
в мочевой пузырь.
Консилиум врачей от 28.12.2022 рекомендовал проведение условно радикального курса ХЛТ, и с 26.01.2023
по 09.03.2023 он был проведен (дистанционная лучевая терапия на ускорителе Clinac iX, методом VMAT,
РОД – 2 Гр, СОД – 46 Гр на малый таз
и в/3 влагалища + подвздошные л/
узлы до уровня L5/S1 + симультанный интегрированный буст на матку,
параметрии до 56 Гр + брахитерапия
РОД – 6 Гр, СОД – 24 Гр на фоне МХТ
цисплатином 70 мг в/в еженедельно
№4). Осложнения – лучевой цистит
2 ст., диарея 2 ст., лейкопения 2 ст. В
дальнейшем лечение было продолжено: проведена консолидирующая
ПХТ по схеме цисплатин/паклитаксел, 6 курсов (до сентября 2023 г.).
Контрольные МРТ органов малого
таза от 11.07.2023 и 15.09.2023 и осмотр в зеркалах продемонстрировали
значительный регресс опухоли с последующим полным клиническим ответом. При осмотре опухоль не визуализировалась, по данным МРТ шейка
фиброзно деформирована, в параметриях грубая фиброзная деформация, признаков патологического МРсигнала нет (рис.2а-в). Цистоскопия
после проведенного лечения не показала признаков прорастания опухолью слизистой мочевого пузыря.
Рисунок 1.
Контрольные МРТ
ОМТ от 11.07.2023 (а) и
15.09.2023 (б, в).
Таким образом, клиническая IVA стадия рака шейки матки в большинстве
случаев у сохранных пациенток не
подразумевает только паллиативное лечение или, тем более, отказ от
локального лечения вообще. Статистические данные демонстрируют
хорошие показатели 5-летней выживаемости даже в этой непростой
ситуации при далеко не 100% частоте
формирования столь пугающих фистул. Гораздо сложнее делать выбор
в случае уже имеющего свища – но
индивидуальный подход и решение
мультидисциплинарной команды в
большинстве случаев могут позволить, как минимум, стабилизировать
состояние пациентки. Крайне важно
помнить, что пациентка должна быть
полностью информирована о возможных негативных последствиях
лечения.
Источники:
- Olawaiye AB, Baker TP, Washington MK, Mutch DG. The new (Version 9) American Joint Committee on Cancer tumor, node, metastasis staging for cervical cancer. CA Cancer J Clin. 2021 Jul; 71(4): 287-298. doi: 10.3322/ caac.21663. Epub 2021 Mar 30. PMID: 33784415.
- Хохлова С.В., Кравец О.А., Морхов К.Ю., Нечушкина В.М., Саевец В.В., Тюляндина А.С. и соавт. Практические рекомендации по лекарственному лечению рака шейки матки. Практические рекомендации RUSSCO, часть 1. Злокачественные опухоли, 2023 (том 13), #3s2, С.246-262.
- Traore, et al. Post-radiotherapy rectovaginal fistula in cervical cancer. Int J Case Rep Images. 2022; 13(2): 153-155.
УГОЛОК РАДИОТЕРАПЕВТА / РАК ЭНДОМЕТРИЯ: ДОПОЛНИТЕЛЬНЫЕ ФАКТОРЫ ПРОГНОЗА. МОЛЕКУЛЯРНЫЙ ПОРТРЕТ – НОВАЯ ПАРАДИГМА?
Автор: Светлана Андреевна Тер-Арутюнянц,
врач-радиотерапевт, ЧУЗ «ЦКБ «РЖД-Медицина»
им. Н.А.Семашко, к.м.н. Москва
Первое, что приходит в голову при
упоминании показаний к адъювантной терапии при раке тела матки – ну,
опять старая песня! Действительно,
вопрос поднимался на протяжении
последних лет неоднократно, проведены и опубликованы три крупных
исследования PORTEC, и все же, несмотря на социальную значимость
данной нозологии и почетное четвертое место в структуре женской
онкологической заболеваемости,
показания носят расплывчатый рекомендательный характер, особенно
при первой стадии заболевания, и
проблема до сих пор не решена. На
протяжении последних двадцати
лет мы прошли долгий путь от адъювантной лучевой терапии на весь
малый таз при малейших признаках
инвазии в миометрий, даже при эндометриоидных аденокарциномах
grade 1-2, до полного отсутствия
адьювантного лечения при ранних
высокодифференцированных типичных раках, альтернативой которому является короткий курс брахитерапии на культю влагалища, и
сложного тяжелого химиолучевого
лечения при подтвержденной III стадии заболевания. При этом, если с
местно-распространенными формами все более-менее ясно, то с ранними формами рака эндометрия четкие
критерии выбора между опциями
наблюдение/брахитерапия – отсутствуют. Многие радиотерапевты
сталкиваются с ситуациями, когда
хирурги, с разрешения консилиума
отпустившие под наблюдение своих больных с неглубокой инвазией,
выявляют на протяжении первого
года наблюдения рецидивы в культе
влагалища и приводят новых своих
больных за руку в отделение радиологии с просьбой – давайте все-таки
облучим профилактически! Радиотерапевты, не имея четких критериев
отбора, соглашаются или отказывают в лечении – и как правило, и то, и
другое без должной мотивации.
Итак, в двух словах, об опорных критериях, валидированных на сегодняшний день и отраженных в стадировании или в группах риска:
- Глубина инвазии в миометрий (до половины или больше);
- Лимфоваскулярная инвазия;
- Вовлечение стромы шейки матки;
- Вовлечение придатков;
- Обнаружение метастазов в регионарные лимфоузлы;
- Гистологическая форма опухоли (эндометриоидная аденокарцинома против атипичных форм);
- Степень дифференцировки, или grade.
Если взглянуть на прогностические группы, сформированные на
базе вышеозначенных критериев,
а также на клинические рекомендации Минздрава РФ, мы увидим,
что предлагаемая тактика лечения
допускает массу девиаций, а в 6 из
10 граф «лечение» фигурирует союз
«или» либо любимый нами (и рекомендациями NCCN) символ «±».
Что мы можем добавить, чтобы сделать показания к адъювантному лечению более ясными?
Например, возраст. Достаточно давно известно, что рак эндометрия –
та редкая нозология, которая у пожилых течет более злокачественно, чем
у молодых, однако на сегодняшний
момент в группах прогноза это не
отражено. Тем не менее, по данным
американских авторов, 5-тилетняя
выживаемость у молодых пациенток
до 50 лет составляет 94-96%, а в диапазоне 71-80 лет – всего 71% [2].
Однако сомнительно, может ли возраст больной служить самостоятельным прогностическим фактором.
Известно, что среди больных старше
65 лет чаще встречается глубокая инвазия в миометрий, низкая степень
дифференцировки и местно-распространенные процессы. Кроме того,
отказ в силу возраста от максимально агрессивного лечения также может сделать свой вклад в ухудшение
онкологического прогноза [3]. Тем не
менее, установлено, что при условии
одинакового лечения рецидивы у пожилых больных встречаются чаще, а
выживаемость среди них ниже.
Вовлечение нижнего сегмента матки, по данным некоторых авторов,
также служит фактором неблагоприятного прогноза [4-6], однако его самостоятельное значение также находится под сомнением, так как может
отражать всего лишь более высокий
риск метастазирования в регионарные лимфоузлы и, соответственно,
более высокую вероятность скрытой
III стадии болезни.
Так или иначе, все вышеупомянутые
факторы довольно давно известны и
изучены. Наиболее новый, сложный,
и, с моей точки зрения, интересный
инструмент уточнения прогноза болезни – это генетический портрет
опухоли. На сегодняшний день выделяют следующие молекулярные подтипы рака эндометрия [7-25]:
- Подтип POLEmut, или подтип мутированной полимеразы ДНК эпсилон (POLE);
- Подтип dMMR, mismatch repair deficient, или подтип дефектной системы репарации неспаренных оснований;
- Подтип без специфического молекулярного профиля (no specific molecular profile - NSMP);
- Подтип мутации белка p53, или p53 abnormal (p53abn);
- HER2-положительный подтип, или подтип с рецепторами к эпидермальному фактору роста человека 2.
Таблица 1.
. Группы риска при РТМ (консенсус ESGO, ESMO, ESTRO, 2014)
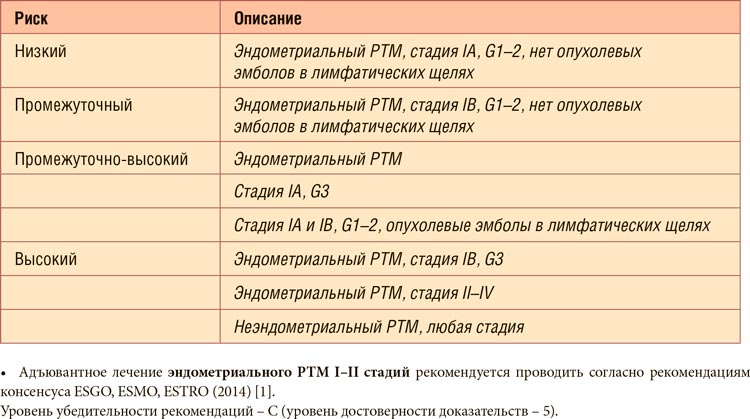
Таблица 2.
Адъювантное лечение эндометриального РТМ I стадии
(консенсус ESGO, ESMO, ESTRO, 2014)
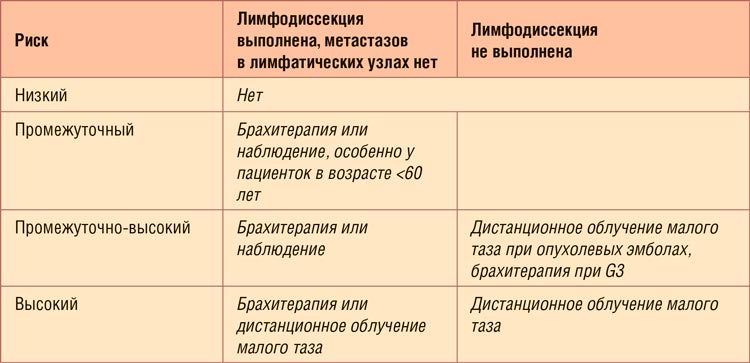
Таблица 3.
Адъювантное лечение эндометриального РТМ II стадии
(консенсус ESGO, ESMO, ESTRO, 2014)

Известно, что молекулярные подтипы определяют не только прогноз заболевания, но и чувствительность его к адъювантной терапии. Так, подтип POLEmut характеризуется высокой безрецидивной выживаемостью вне зависимости от наличия или отсутствия адъювантного лечения. Аналогично, назначение лучевой терапии в любом варианте (как брахи-, так и дистанционной на весь таз) не ведет к улучшению локального контроля в случаях подтипа дефектной системы репарации неспаренных оснований (dMMR). Однако облучение всего малого таза существенно повышает безрецидивную выживаемость в случаях р53-мутированного рака эндометрия (5-летний показатель локального контроля - 97% в группе ДЛТ против 64% в группе брахитерапии и 72% в группе динамического наблюдения).
В группе без определенного молекулярного профиля (NSMP) любой вариант адъювантной лучевой терапии ведет к улучшению локального контроля (98% в группе ДЛТ и 96% в группе брахитерапии против 88% в группе динамического наблюдения). Казалось бы, замечательно: у нас в руках появился новый мощный инструмент для определения тактики лечения рака эндометрия, и возможно, в ближайшем будущем тактика лечения будет строго регламентирована весьма конкретными клиническими сценариями, не допускающими девиаций и союзов «или» в клинических рекомендациях. Однако, не все так просто. Оказалось, что в ряде случаев молекулярные подтипы опухоли и их предполагаемое биологическое поведение вступают в противоречие с известными нам факторами прогноза.
Так, POLE мутированные опухоли, составляющие всего 7-9% от общего числа случаев РТМ, несмотря на благоприятный прогноз и 96% пятилетней выживаемости, часто характеризуются низкой дифференцировкой и лимфоваскулярной инвазией, что не мешает некоторым авторам рекомендовать отказ от адъювантного лечения при доказанной мутации. По результатам мета-анализа случаев РТМ с известной мутацией гена POLE, проведение любой адъювантной терапии не связано с улучшением прогноза, что приводит к мысли о деэскалации лечения в таких случаях.
В настоящее время два исследования оценивают возможность обоснованного отказа от адъювантной терапии в случае рака эндометрия: это PORTEC 4a (больные высокого промежуточного риска, [26,27]), и исследование RAINBO Blue and TAPER (Tailored Adjuvant Therapy in POLEmutated and p53-wildtype/no specific molecular profile (NSMP) Early Stage Endometrial Cancer, [28,29]).
Подтип дефектной системы репарации неспаренных оснований, или dMMR мутированные опухоли (26- 30% всех случаев РТМ), ведут себя более последовательно: имея промежуточный прогноз, часто характеризуются лимфоваскулярной инвазией и низкой степенью дифференцировки. Опухоли без определенного молекулярного портрета (NSMP опухоли), составляющие до 45-50% всех случаев РТМ, характеризуются разнообразной морфологической картиной, от низкой до высокой степени дифференцировки, и чаще относятся к промежуточно-благоприятному прогнозу. И, наконец, наиболее определенный и очевидно плохой прогноз имеют опухоли с мутацией гена белка p53 – «стража генома», что коррелирует у них с клинической и морфологической картиной: это в большинстве случаев рак эндометрия второго типа, встречающийся у худых женщин, часто в возрасте, как правило диагностируемый в распространенной стадии, с признаками лимфоваскулярной инвазии, низкой степени дифференцировки, преимущественно серозный рак, однако до 25% его составляют эндометриоидные аденокарциномы G3 [7-25].
В декабре 2023 года в журнале Practical Radiation Oncology опубликованы дополнения к рекомендациям по лечению раннего рака эндометрия от экспертов ASTRO. Американские авторы попытались суммировать все вышеперечисленные факторы и смодифицировать показания к адъювантному лечению, принимая во внимание возраст, молекулярный портрет опухоли и ее размер ([30], рис.2). Если мы сравним алгоритм, предлагаемый для выбора тактики лечения до настоящего времени (рис.1), и вновь разработанный алгоритм (рис.2), мы поймем, что частично возвращаемся к хорошо забытому старому – дистанционной лучевой терапии на малый таз даже при клинически I-II стадии, если необходимость диктует, например, наличие мутации р53. При этом, авторы были осторожны и не стали рекомендовать отказ от адъюванта в случае лимфоваскулярной инвазии и глубокого прорастания в миометрий даже при наличии мутации POLE. Насколько правильны эти изменения?
Рисунок 1.
Стратификация раннего рака эндометрия в соответствии
с факторами риска после оперативного лечения (UoToDate Dec 2023;
https://www.uptodate.com/contents/overview-of-resectable-endometrialcarcinoma)
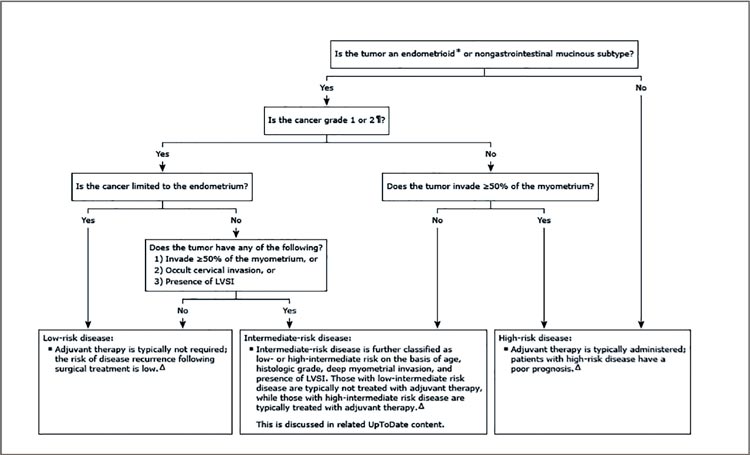
Рисунок 2.
Рекомендации по тактике лечения больных
ранним раком эндометрия [30]
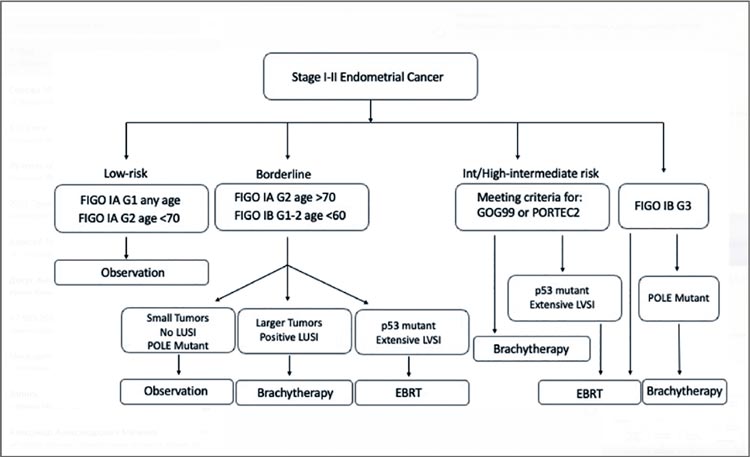
Во-первых, как было упомянуто выше, минимум половину случаев составляют опухоли без определенного молекулярного портрета (NSMP опухоли), при которых молекулярная диагностика имеет мало смысла, а случаи очевидно благоприятного и очевидно неблагоприятного прогноза относительно редки.
Во-вторых, дискутируя о показаниях к адъювантной лучевой терапии, мы часто забываем о первом этапе лечения – операции и ее объеме. Во многом рисунок 2 отражает попытку авторов компенсировать дефект стадирования объемом лучевой терапии, что сплошь и рядом случается и в нашей практической жизни, когда пациентке выполняют простую экстирпацию матки (которая до сих пор остается в стандартах лечения) и, обнаруживая глубокое прорастание опухоли и лимфоваскулярную инвазию, отправляют ее на облучение всего таза. По сути, это значит, что, имея формально I-II стадию, мы подозреваем скрытую III. Может ли облучение таза компенсировать недостаток лимфодиссекции? В плане локального контроля – возможно, но, если это истинная третья стадия, на выживаемость начинает влиять системное лечение, и облучение малого таза не компенсирует отсутствие химиотерапии. Да, обнаружение мутации р53 при распространенной лимфоваскулярной инвазии повышает шансы больной иметь скрытые метастазы в лимфоузлы, и в такой ситуации замена брахитерапии облучением малого таза будет оправдана, но системное лечение по-прежнему выпадает, потому что формально (с точки зрения доказанной IB стадии) к нему нет оснований.
На мой взгляд, внедрение возраста и молекулярного портрета опухоли в алгоритм определения лечебной тактики вполне оправдано, но не может заменить адекватного стадирования. Многие вопросы, порождаемые неблагоприятными морфологическими факторами (ЛВИ, инвазия более 50%), могут отпасть сами собой при наличии информации о состоянии лимфоузлов, тем более что внедрение биопсии сторожевых лимфоузлов, а особенно в сочетании с ультрастадированием (выявлением микрометастазов в удаленном материале путем изготовления супертонких гистологических срезов) вполне способно заменить по степени информативности полноценную лимфодиссекцию, что было доказано клиническими исследованиями.
В идеальном варианте у нас есть возможность биопсии тазовых лимфоузлов с ультрастадированием при любом инвазивном раке эндометрия. Поскольку в ближайшем будущем это едва ли достижимо, в условиях ограниченного доступа к полному хирургическому стадированию возможность определять молекулярный портрет опухоли на этапе предоперационной подготовки (по данным соскоба) будет крайне полезна для отбора больных, которым это 100% необходимо.
Внедрение молекулярной диагностики, вероятнее всего, расширит показания к брахитерапии, которая в слишком многих случаях пренебрегается, даже в Москве, а к этому надо быть готовым – в материально-техническом плане.
Нельзя не признать, что определение молекулярного портрета опухоли эндометрия делает нас ближе к пониманию биологического течения процесса и определению оптимального алгоритма его лечения, и возможно мы увидим время, когда, подобно тактике при раке молочной железы, всем больным при инвазивном процессе будет выполняться иммуногистохимическое исследование опухоли и биопсия сигнальных лимфоузлов и лишь затем – определяться окончательный объем лечения.
Источники:
- Приказ Минздрава России от 19.02.2021 N 116н (ред. от 24.01.2022) "Об утверждении Порядка оказания медицинской помощи взрослому населению при онкологических заболеваниях" (Зарегистрировано в Минюсте России 01.04.2021 N 62964)
- Jolly S, et al. The impact of age on long-term outcome in patients with endometrial cancer treated with postoperative radiation. Gynecol Oncol. 2006;103(1):87.
- Mundt AJ, et al. Age as a prognostic factor for recurrence in patients with endometrial carcinoma. Gynecol Oncol. 2000;79(1):79
- Madom LM, et al. Lower uterine segment involvement as a predictor for lymph node spread in endometrial carcinoma. Gynecol Oncol. 2007;107(1):75.
- Kizer NT, et al. Lower uterine segment involvement is associated with poor outcomes in early-stage endometrioid endometrial carcinoma. Ann Surg Oncol. 2011;18(5):1419. Epub 2010 Dec 22.
- Brown AK, et al. The prognostic significance of lower uterine segment involvement in surgically staged endometrial cancer patients with negative nodes. Gynecol Oncol. 2007;105(1):55.
- Reutzberg CL, Leon-Castillo A, De Boer SM, et al. Molecular classification of the PORTEC-3 trial for high-risk endometrial cancer: Impact on adjuvant therapy. Ann Oncol 2019; 30:mdz394.
- Stelloo E, Bosse T, Nout RA, et al. Refining prognosis and identifying targetable pathways for high-risk endometrial cancer; a TransPORTEC initiative. Mod Pathol 2015; 28:836.
- Stelloo E, Nout RA, Osse EM, et al. Improved risk assessment by integrating molecular and clinicopathological factors in earlystage endometrial cancer - combined analysis of PORTEC cohorts. Clin Cancer Res 2016; 15:4215.
- McConechy MK, Talhouk A, Leung S, et al. Endometrial Carcinomas with POLE Exonuclease Domain Mutations Have a Favorable Prognosis. Clin Cancer Res 2016; 22:2865.
- McAlpine J, Leon-Castillo A, Bosse T. The rise of a novel classification system for endometrial carcinoma; integration of molecular subclasses. J Pathol 2018; 244:538.
- Van Gool IC, Rayner E, Osse EM, et al. Adjuvant Treatment for POLE Proofreading Domain-Mutant Cancers: Sensitivity to Radiotherapy, Chemotherapy, and Nucleoside Analogues. Clin Cancer Res 2018; 24:3197.
- FDA approves first cancer treatment for any solid tumor with a specific genetic feature. https:// www.fda.gov/drugs/resourcesinformation-approved-drugs/ fda-grants-accelerated-approvalpembrolizumab-first-tissuesiteagnostic-indication.
- Le DT, Uram JN, Wang H, et al. PD-1 Blockade in Tumors with Mismatch-Repair Deficiency. N Engl J Med 2015; 372:2509.
- Talhouk A, Derocher H, Schmidt P, et al. Molecular Subtype Not Immune Response Drives Outcomes in Endometrial Carcinoma. Clin Cancer Res 2019; 25:2537.
- Ashley CW, Da Cruz Paula A, Kumar R, et al. Analysis of mutational signatures in primary and metastatic endometrial cancer reveals distinct patterns of DNA repair defects and shifts during tumor progression. Gynecol Oncol 2019; 152:11. 1
- de Jonge MM, Auguste A, van Wijk LM, et al. Frequent Homologous Recombination Deficiency in Highgrade Endometrial Carcinomas. Clin Cancer Res 2019; 25:1087.
- Fader AN, Roque DM, Siegel E, et al. Randomized Phase II Trial of Carboplatin-Paclitaxel Versus Carboplatin-Paclitaxel-Trastuzumab in Uterine Serous Carcinomas That Overexpress Human Epidermal Growth Factor Receptor 2/neu. J Clin Oncol 2018; 36:2044.
- Kandoth C, Schultz N, Cherniack AD, et al. Integrated genomic characterization of endometrial carcinoma. Nature 2013; 497:67.
- Talhouk A, McConechy MK, Leung S, et al. A clinically applicable molecular-based classification for endometrial cancers. Br J Cancer 2015; 113:299.
- Talhouk A, McConechy MK, Leung S, et al. Confirmation of ProMisE: A simple, genomics-based clinical classifier for endometrial cancer. Cancer 2017; 123:802.
- McAlpine J, Nout R, Kommoss S, et al. Survival benefit in women with endometrial cancers harboring POLE may be independent of adjuvant therapy. International Gynecologic Cancer Society Kyoto, Japan 2018. Int J Gynecol Cancer 2018; 28:0.
- Santin AD, Bellone S, Buza N, et al. Regression of ChemotherapyResistant Polymerase ε (POLE) UltraMutated and MSH6 Hyper-Mutated Endometrial Tumors with Nivolumab. Clin Cancer Res 2016; 22:5682.
- Eggink FA, Van Gool IC, Leary A, et al. Immunological profiling of molecularly classified high-risk endometrial cancers identifies POLE-mutant and microsatellite unstable carcinomas as candidates for checkpoint inhibition. Oncoimmunology 2017; 6:e1264565.
- León-Castillo A, de Boer SM, Powell ME, et al. Molecular Classification of the PORTEC-3 Trial for High-Risk Endometrial Cancer: Impact on Prognosis and Benefit From Adjuvant Therapy. J Clin Oncol 2020.
- PORTEC-4a: Molecular Profile-based Versus Standard Adjuvant Radiotherapy in Endometrial Cancer (PORTEC4a). ClinicalTrials.gov. Available at: https://clinicaltrials.gov/ct2/show/ NCT03469674 (Accessed on May 14, 2020)
- Van den Heerik ASVM et al. PORTEC-4a: international randomized trial of molecular profile-based adjuvant treatment for women with high-intermediate risk endometrial cancer. Int J Gynecol Cancer. 2020;30(12):2002. Epub 2020 Oct 12
- McAlpine JN, et al. Evaluation of treatment effects in patients with endometrial cancer and POLE mutations: An individual patient data meta-analysis. Cancer. 2021;127(14):2409. Epub 2021 Apr 1.
- Tailored adjuvant therapy in POLE-mutated and p53- wildtype early stage endometrial cancer (TAPER), 2021. Available at: https://clinicaltrials.gov/ct2/show/ NCT04705649 (Accessed on June 14, 2021).
- Jeffrey V. Brower, et al. Path to Precision: Refining Radiotherapy Guidelines for Early-Stage Endometrial Cancer through Incorporation of Primary Tumor Size, Lower Uterine Segment Invasion, and Molecular Markers. Practical Radiation Oncology Published: December 02, 2023. DOI:https://doi. org/10.1016/j.prro.2023.11.009
НЕРЕЗЕКТАБЕЛЬНАЯ ГЕПАТОЦЕЛЛЮЛЯРНАЯ КАРЦИНОМА: ПОИСКИ НОВЫХ ЛЕЧЕБНЫХ ПУТЕЙ
Гепатоцеллюлярная карцинома
(ГЦК) - наиболее распространенный тип рака печени и одна из ведущих причин смертности от рака
во всем мире. Неоперабельная
опухоль подразумевает наихудший прогноз и крайне плохо поддается консервативному лечению.
Медиана выживаемости колеблется от 1,0 до 1,5 лет для симптомных пациентов с распространенной ГЦК, получающих системную
терапию. Рекомендуемые системные схемы лечения ГЦК первой
линии включают применение однокомпонентных ингибиторов тирозинкиназы (ИТК) - сорафениба
и ленватиниба. Кроме того, комбинация атезолизумаба (ингибитора
PD-L1) и бевацизумаба стала стандартом системной терапии первой
линии по данным исследования
IMbrave150 [1,2]. Ряд ингибиторов
контрольных точек также продемонстрировали эффективность
(ниволумаб, дурвалумаб в комбинации с тремелимумабом, синтилимаб в комбинации с биосимиляром бевацизумаба, одобренные
в Китае для азиатской популяции
пациентов). Определенный выбор
присутствует – но остается проблема токсичности. Хотя сочетание атезолизумаба и бевацизумаба
связано с низким риском кровотечения из варикозно расширенных вен у правильно отобранных
пациентов, существует более высокий риск кровотечения у пациентов с распространенной ГЦК,
у которых больше вероятность
портальной гипертензии. Ингибиторы тирозинкиназы рекомендуются пациентам с противопоказаниями к атезолизумабу или
бевацизумабу, однако они также
связаны с нежелательными явлениями (НЯ), такими как диарея
и слабость. Хотя эти НЯ обычно
имеют низкую степень тяжести,
они могут влиять на качество жизни пациентов и привести к отмене
препарата. Экспертные рекомендации рекомендуют монотерапию анти-PD-1 препаратами пациентам с противопоказаниями
к терапии ИТК или препаратами
анти-VEGF неконтролируемой гипертензией, недавними сердечнососудистыми заболеваниями или
статусом класса B по Чайлд-Пью.
Однако применение однокомпонентного ингибитора PD-1 или
PD-L1 еще не одобрено в качестве
варианта системного лечения первой линии.
Тислелизумаб представляет собой моноклональное антитело с
высоким сродством и специфичностью связывания к PD-1, продемонстрировавшее эффективность
и приемлемый профиль безопасности у пациентов с различными
солидными опухолями. Тислелизумаб показал стойкую клиническую активность у пациентов с ранее леченной ГЦК в исследовании
фазы 2 RATIONALE-208 [3], что
требует подтверждения эффективности монотерапии тислелизумабом в первой линии. Недавняя публикация в журнале JAMA
Oncology демонстрирует результаты окончательного анализа фазы
3 исследования RATIONALE-301,
оценивающего эффективность и
безопасность тислелизумаба по
сравнению с сорафенибом в качестве лечения первой линии у пациентов с неоперабельной ГЦК [4].
Это открытое многоцентровое
рандомизированное клиническое
исследование 3 фазы с активным
контролем в параллельных группах проводилось с 27 декабря 2017
г. по 2 октября 2019 г. в 117 центрах
в Китае, Чехии, Франции, Германии, Италии, Япония, Польша, Испания, Тайвань, Великобритания
и США.
Пациенты были рандомизированы 1:1 на тислелизумаб 200 мг
внутривенно каждые 3 недели
или сорафениб тозилат, 400 мг
перорально два раза в день, до
симптоматического ухудшения,
связанного с прогрессированием заболевания, неприемлемых
токсических эффектов или завершения исследования. Первичной конечной точкой была общая
выживаемость (ОВ). Вторичные
Рисунок 1. ОВ в группах тислелизумаба и сорафениба.
Рисунок 2. ВБП в группах тислелизумаба и сорафениба.
конечные точки эффективности
включали частоту объективных
ответов (ЧОО), выживаемость
без прогрессирования (ВБП), продолжительность ответа, уровень
контроля заболевания (доля пациентов с полным или частичным
ответом или стабильным заболеванием) и частоту клинических
преимуществ (доля пациентов с
лучшим общим ответом, полным
или частичным ответом или стабильным заболеванием в течение
≥24 недель). Всего 674 пациента
были рандомизированы для лечения и включены в анализ результатов лечения по протоколу (342
в группе тислелизумаба и 332 в
группе сорафениба). Всего было
570 мужчин (84,6%) и 104 (15,4%)
женщины; средний возраст составил 61 год (диапазон 23–86 лет).
Пациенты в целом были хорошо
сбалансированы между группами
лечения; тем не менее, наблюдались некоторые количественные
различия в исходных характеристиках: более значительная доля
пациентов в группе тислелизумаба имела позднюю стадию заболевания и отягощающие факторы
риска. Минимальный период наблюдения составил 33 месяца.
В исследовании была достигнута
основная конечная точка: ОВ при
приеме тислелизумаба была не
хуже, чем на сорафенибе. Общая
выживаемость с тислелизумабом
была аналогична таковой для сорафениба через 12 месяцев и численно выше, чем у сорафениба,
как через 24 месяца (39,0% против 31,8%), так и через 36 месяцев
(29,2% против 20,3%) (рис.1).
Рисунок 1.
ОВ в группах тислелизумаба и сорафениба
Частота объективных ответов составила 14,3% (n = 49) для тислелизумаба против 5,4% (n = 18) для
сорафениба, а медиана продолжительности ответа составила 36,1
(95% ДИ, от 16,8 до не поддающихся оценке) месяцев против 11,0
(95% ДИ, 6,2-14,7) месяцев соответственно. Медиана выживаемости
без прогрессирования составила
2,1 (95% ДИ, 2,1–3,5) месяца против 3,4 (95% ДИ, 2,2–4,1) месяца в
группе тислелизумаба по сравнению с сорафенибом (ОР 1,11 [95%
ДИ, 0,92–1,33]). Хотя в группе сорафениба медиана ВБП была более
продолжительной, и отмечен более
высокий показатель ВБП через 6
месяцев, чем в группе тислелизумаба (35,8% против 28,8%), показатели ВБП были одинаковыми в обеих группах через 12 месяцев (19,0%
против 18,1%) и выше в группе
тислелизумаба через 18 и 24 месяца
(18 месяцев: 16,1% против 9,5%; 24
месяца: 13,9% против 6,1%) (рис.2).
Рисунок 2.
ВБП в группах тислелизумаба и сорафениба.
Частота нежелательных явлений
(НЯ), возникших во время лечения, составила 96,2% (325 из 338 пациентов) для тислелизумаба и 100%
(n = 324) для сорафениба. Связанные с лечением НЯ 3-й степени и
выше были зарегистрированы у
75 пациентов (22,2%), получавших
тислелизумаб, и у 173 (53,4%), получавших сорафениб.
Таким образом, в исследовании
RATIONALE-301 монотерапия тислелизумабом продемонстрировала
сопоставимую ОВ, а также более
высокие и более длительные объективные ответы по сравнению с
сорафенибом, в то время как частота контроля над опухолью и
медиана ВБП были в пользу сорафениба. Тислелизумаб имел благоприятный профиль безопасности по сравнению с сорафенибом.
Эти результаты показывают, что
тислелизумаб представляет собой
потенциальный вариант лечения
первой линии для пациентов с неоперабельной ГЦК.
Источники:
- Finn RS, Qin S, Ikeda M, et al; IMbrave150 Investigators. Atezolizumab plus bevacizumab in unresectable hepatocellular carcinoma. N Engl J Med. 2020;382(20):1894-1905. doi:10.1056/ NEJMoa19157459.
- Vogel A, Martinelli E; ESMO Guidelines Committee. Updated treatment recommendations for hepatocellular carcinoma (HCC) from the ESMO clinical practice guidelines. Ann Oncol. 2021;32(6):801-805. doi:10.1016/j.annonc.2021.02.014
- Ducreux M, Abou-Alfa G, Ren Z, et al. Results from a global phase 2 study of tislelizumab, an investigational PD-1 antibody, in patients with unresectable hepatocellular carcinoma. Ann Oncol. 2021;32(suppl 3):S217. doi:10.1016/j.annonc.2021.05. 005
- Shukui Qin et al. Tislelizumab vs Sorafenib as First-Line Treatment for Unresectable Hepatocellular Carcinoma: A Phase 3 Randomized Clinical TrialJAMA Oncol. 2023;9(12):1651-1659. doi:10.1001/ jamaoncol.2023.4003
ИНАВОЛИСИБ – НОВЫЙ ИНГИБИТОР PI3K В 1 ЛИНИИ ТЕРАПИИ ЭР+ HER2– ДИССЕМИНИРОВАННОГО РМЖ. ПЕРВЫЕ РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ 3 ФАЗЫ INAVO120
WO41554 представляет собой
рандомизированное, плацебоконтролируемое, многоцентровое международное исследование III фазы, разработанное с
целью сравнения эффективности
на основании ВБП, а также безопасности тройной комбинации
инаволисиба с палбоциклибом и
фулвестрантом по сравнению с
плацебо с палбоциклибом и фулвестрантом у пациентов с HRпозитивным, HER2-негативным
местнораспространенным или
метастатическим раком молочной
железы с мутациями PIK3CA, у
которых прогрессирование заболевания произошло во время или
в течение 12 месяцев после завершения адъювантной эндокринной
терапии и которые ранее не получали системной терапии по поводу местнораспространенного или
метастатического заболевания.
Всего 325 пациентов было
рандомизировано в две лечебные
группы 1:1:
Инаволисиб в комбинации с палбоциклибом и фулвестрантом:
- инаволисиб – 9 мг перорально 1 раз в сутки в дни 1-28 каждого цикла по 28 дней, начиная в день 1 цикла 1;
- палбоциклиб – 125 мг перорально 1 раз в сутки в дни 1-21 каждого цикла по 28 дней, начиная в день 1 цикла 1;
- фулвестрант – 500 мг внутримышечно в дни 1 и 15 цикла 1, затем в день 1 каждого следующего цикла продолжительностью 28 дней.
Плацебо в комбинации с палбоциклибом и фулвестрантом:
- плацебо – 1 раз в сутки в дни 1-28 каждого цикла по 28 дней, начиная в день 1 цикла 1;
- палбоциклиб – 125 мг перорально 1 раз в сутки в дни 1-21 каждого цикла по 28 дней, начиная в день 1 цикла 1;
- фулвестрант – 500 мг внутримышечно в дни 1 и 15 цикла 1, затем в день 1 каждого следующего цикла продолжительностью 28 дней.
Большинство участников, включенных в исследование, были женщинами (98%) в постменопаузе (60,0%),
средний возраст которых составлял
53,0-54,0 года. У половины (51,3%)
больных были поражены как минимум три органа, а у 80,0% зарегистрированы метастазы печени, легких или
костях. Хотя ни одному из пациентов
не проводилось лечение по поводу диссеминированного РМЖ, 83%
больных ранее получали (нео)адъювантную химиотерапию, 99% получали (нео)адъювантную эндокринную
терапию, преимущественно тамоксифен или ингибитор ароматазы. В 66%
случаях наблюдалась вторичная эндокринная резистентность.
Рисунок 1.
Дизайн исследования INAVO120
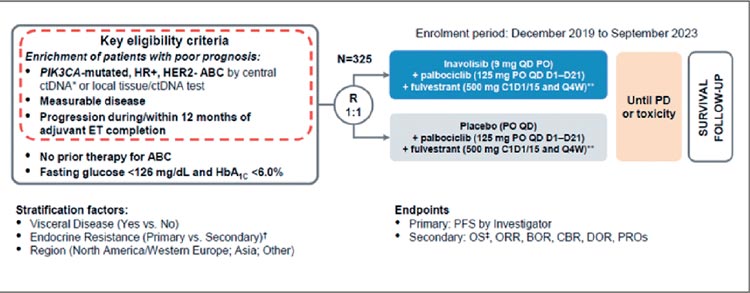
Рисунок 2.
Результаты исследования INAVO120:
выживаемость без прогрессирования.
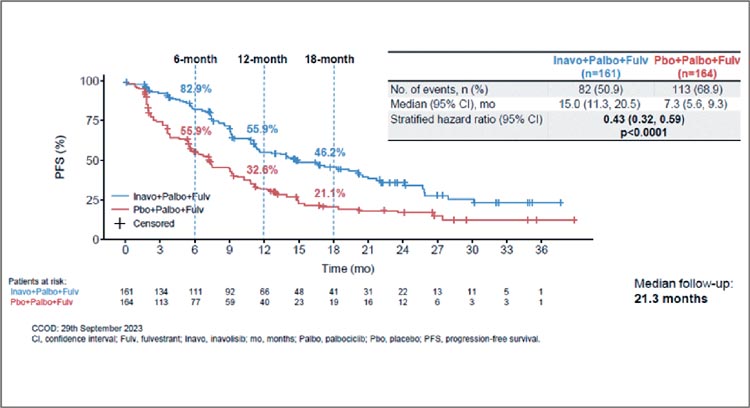
Добавление инаволисиба к терапии
позволило увеличить частоту ОО
с 25,0% до 58,4%, а КРО с 47,0% до
75,2% и длительность достигнутого
с 9,6 до 18,9 мес. При медиане времени наблюдения в 21,3 мес. комбинация инаволисиба с палбоциклибом и
фулвестрантом позволила увеличить
медиану ВБП на 7,7 мес. – с 7,3 до 15,0
мес., что позволило снизить риск прогрессирования на 57% (рис.2).
Шестимесячная ВБП в группе инаволисиба и плацебо составила 82,9% и
55,9%, при 12-месячной ВБП в 55,9% и
32,6% и за 18 месяцев – 46,2% и 21,1%
соответственно. Медиана ОВ в группе
с инаволисибом не была достигнута в
сравнении с 31,1 мес. в контрольной
когорте. Шестимесячная ОВ в группах инаволисиба и плацебо составила
97,3% и 89,9%, 12-месячная ОВ достигла 85,9% и 74,9% при 18-месячной
ОВ в 73,7% и 67,5% соответственно.
Нежелательные явления 3 степени и
выше в группах инаволисиба и плацебо были преимущественно представлены нейтропенией (80,2 и 78,4%),
тромбоцитопенией (14,2 и 4,3%),
стоматитом (5,6 и 0,0%), анемией (6,2
и 1,9), гипергликемией (5,6 и 0,0%) и
диареей (3,7 и 0,0%).
Источники:
- Genentech announces positive phase III results for inavolisib combination in people with advanced hormone receptor-positive HER2-negative breast cancer with a PIK3CA mutation. News release. Genentech. December 4, 2023. Accessed: December 7, 2023. www.gene.com/media/pressreleases/15011/2023-12-04/genentechannounces-positive-phase-iii-r.
- A study evaluating the efficacy and safety of inavolisib + palbociclib + fulvestrant vs placebo + palbociclib + fulvestrant in patients with PIK3CAmutant, hormone receptor-positive, Her2-negative, locally advanced or metastatic breast cancer (INAVO120). ClinicalTrials.gov. Updated November 18, 2023. Accessed: December 7, 2023. clinicaltrials.gov/study/ NCT04191499.
АНТИРЕЗОРБТИВНАЯ ТЕРАПИЯ ПАЦИЕНТОВ С КОСТНЫМИ МЕТАСТАЗАМИ.ДИСКУССИОННЫЕ ВОПРОСЫ РЕАЛЬНОЙ КЛИНИЧЕСКОЙ ПРАКТИКИ
Автор: Любимцева Екатерина Сергеевна
Заведующая отделением противоопухолевой лекарственной терапии
ФБУЗ ПОМЦ ФМБА России, Нижний Новгород
На сегодняшний день мы имеем
многолетний опыт применения остеомодифицирующих агентов (ОМА).
Антирезорбтивная терапия является
неотъемлемой частью лечения пациентов с костными метастазами. Однако остается много дискутабельных
моментов, касающихся реальной
клинической практики. Какой препарат выбрать в конкретной клинической ситуации? Как долго можно
применять антирезорбтивную терапию? С какой кратностью вводить
препараты? И, конечно, врачей волнуют вопросы безопасности применения ОМА. Давайте попробуем их
обсудить.
Немного статистики
Основной проблемой при метастазировании опухолей в кости является
развитие костных осложнений. Они
связаны с возникновением боли, инвалидизацией, потерей способности
к самообслуживанию и ухудшением качества жизни, часто требуют
применения наркотических анальгетиков. От 65% до 75% пациентов с
костными метастазами испытывают
боль, нарушение и потерю мобильности [1].
Общая частота встречаемости костных осложнений составляет приблизительно 45-65% у пациентов,
не получающих профилактическую
антирезорбтивную терапию. Раннее
назначение ОМА помогает отсрочить или избежать развития костных
осложнений [1].
К сожалению, отсутствуют клинические рекомендации МЗ РФ по сопроводительной терапии, что затрудняет работу врачей с данной категорией пациентов. На сегодняшний день в выборе тактики ведения пациентов с костными метастазами можно руководствоваться практическими рекомендациями RUSSCO «Патология костной ткани» 2023, на которые мы будем часто ссылаться в нашей дискуссии [2].
Какой препарат выбрать в конкретной клинической ситуации?
В течение последнего десятилетия
наиболее часто используемыми препаратами антирезорбтивной терапии являются представитель бисфосфонатов – золедроновая кислота
и деносумаб – таргетный препарат,
представляющий собой полностью человеческое моноклональное
антитело, обладающее высокой аффинностью и специфичностью к
человеческому RANK-лиганду, основному медиатору процесса костной деструкции [2].
Существует две группы показателей,
на которые можно опираться в выборе препарата. Первые отражают
течение основного заболевания (тяжесть процесса, количество, размер
и локализацию костных метастазов),
вторые показатели связаны со здоровьем пациента (сопутствующие заболевания).
При стабилизации основного заболевания, немногочисленных бессимптомных метастазах, локализованных в ребрах или костях черепа,
золедроновая кислота может быть
клинически и экономически обоснованным вариантом лечения.
При активном злокачественном
процессе, выявлении множественных метастазов, локализации в
костях осевого скелета, наличии
угрозы патологического перелома,
выраженном болевом синдроме
назначение деносумаба будет предпочтительным. Можно назвать
деносумаб «тяжелой артилерией»,
которая быстрее и эффективнее
снижает резорбцию костной ткани
по сравнению с золедроновой кислотой, позволяет предотвратить
инвалидизирующие осложнения.
Важно понимать, что именно эта
категория пациентов получит максимальную пользу от назначения
деносумаба.
По данным рандомизированных
исследований, при метастатическом процессе деносумаб имеет
преимущество в 17% по сравнению с золедроновой кислотой в
снижении риска развития костных
осложнений при всех типах опухолей, более значимо уменьшает болевой синдром [3].
Принимая во внимание состояние
здоровья пациента, назначение деносумаба рекомендовано при нарушении функции почек и отсутствии венозного доступа [2].
Как долго можно применять антирезорбтивную терапию?
Решение остается за врачом, поскольку длительность терапии ОМА
определяется индивидуально [2]. Согласно рекомендациях ESMO 2020
«Bone health in cancer: ESMO Clinical
Practice Guidelines», в большинстве
случаев терапию ОМА следует начинать с момента выявления костных
метастазов и продолжать на протяжении всего периода лечения злокачественного новообразования; при
олигометастатическом поражении
костей терапия ОМА может быть
прервана при достижении полного
или хорошего частичного ответа и
может быть возобновлена при прогрессировании заболевания [4].
Можно ли уменьшать кратность введения препаратов?
Согласно практическим рекомендациям RUSSCO, больным со стабилизацией состояния костных очагов
на протяжении 3-6 ежемесячных
введений золедроновой кислоты
рекомендуется переход на применение этого препарата каждые 12
недель. При наличии бессимтомных метастазов (как правило, при
олигометастатической болезни),
без угрозы костных осложнений,
возможно исходно назначить золедроновую кислоту в режиме 1 раз в
12 недель. При достижении стойкой
ремиссии опухолевого процесса в
костях терапию бисфосфонатами
можно прервать через 2 года применения.
Деносумаб «работает» во внеклеточном пространстве и не включается в костный матрикс, как
бисфосфонаты, поэтому отмена терапии ведет к быстрому прекращению антирезорбтивного действия
(восстановительный остеолиз). Исходя из этого, удлинение интервалов между введениями не рекомендуется, поскольку может вести к
снижению эффективности терапии
[2]. Рекомендуемая доза препарата
остается прежней – одна подкожная
инъекция 120 мг 1 раз в 4 недели [5].
Вопросы безопасности
Наибольший интерес вызывает
вопрос частоты развития остеонекроза челюсти (ОНЧ) при применении ОМА. Надо помнить,
что в зону риска также попадают
пациенты, получающие антиангиогенные препараты: бевацизумаб, афлиберцепт, а также другие
таргетные препараты: сунитиниб,
сорафениб, пазопаниб, акситиниб,
иматиниб, регорафениб, ритуксимаб, инфликсимаб, эверолимус,
темзиролимус. Описаны случаи
ОНЧ при использовании РФП (радий-223), ралоксифена, метотрексата, кортикостероидов. Как правило, провоцирующим фактором
является экстракция зуба (в 65%).
Клиническая картина не всегда
однозначна, требует участия стоматолога. Более чем в 70% описанных случаев ОНЧ поражается
нижняя челюсть [2].
Частота ОНЧ у пациентов, получающих золедроновую кислоту
и деносумаб, схожа и составляет
примерно 1-2% за год лечения;
также имеются данные о возрастании риска ОНЧ с длительностью
лечения и при совместном применении ОМА и антиангиогенных
препаратов [2]. Проведено множество клинических исследований
длительного применения ОМА,
которые подтверждают приемлемый профиль безопасности препаратов.
Важным моментом в профилактике развития ОНЧ является
тщательный подбор пациентов
на терапию ОМА. Все пациенты
должны пройти стоматологический осмотр и, если необходимо,
устранить все очаги инфекции и
провести инвазивные вмешательства до начала антирезорбтивной
терапии [2]. Пациенты должны
быть предупреждены о необходимости сообщать о малейших неприятных ощущениях в области
челюсти, а также проходить регулярные стоматологические осмотры на протяжении всего периода
терапии ОМА с кратностью один
раз в 3 месяца. Все эти меры помогают предотвратить развитие
данного нежелательного явления.
С учетом экономических условий,
эффективности и режима введения ОМА в реальной клинической
практике можно использовать
следующую стратегию ведения пациентов с костными метастазами:
начинать терапию с введения деносумаба, особенно при высоком
риске развития патологического
перелома, то есть там, где нужно
получить максимально быстрый
эффект. При положительной динамике или стабилизации основного заболевания возможна смена
терапии на внутривенное введение золедроновой кислоты с последующим урежением кратности
введения.
Поделитесь, пожалуйста, своим
практическим опытом применения антирезорбтивных препаратов. Пишите свои вопросы
и комментарии, буду рада на них
ответить.
Литература:
- Cadieux B, Coleman R, Jafarinasabian P, Lipton A, Orlowski RZ, Saad F, Scagliotti GV, Shimizu K, Stopeck A. Experience With Denosumab (XGEVA®) for Prevention of Skeletal-Related Events in the 10 Years After Approval. Journal of Bone Oncology. 2022. doi: https://doi. org/10.1016/j.jbo. 2022.100416.
- Багрова С.Г., Басин Е.М., Борзов К.А., Бычкова Н.М., Деньгина Н. В., Копп М.В. и соавт. Профилактика и лечение патологии костной ткани при злокачественных новообразованиях. Практические рекомендации RUSSCO, часть 2. Злокачественные опухоли. 2023; том 13, #3s2, стр.44-59. DOI: 10.18027/2224- 5057-2023-13-3s2-2-44-59.
- Lipton A, Fizazi K, Stopeck AT, et al. Superiority of denosumab to zoledronic acid for prevention of skeletal-related events: A combined analysis of 3 pivotal, randomised, phase 3 trials. Eur J Cancer. 2012; 48: 3082-3092. doi: 10.1016/j.ejca.2012.08.002.
- Coleman R, et al. Ann Oncol. 2020; S0923-7534(20)39995-6.
- Общая характеристика лекарственного препарата Эксджива доступна на информационном портале Евразийского экономического союза в информационно-коммуникационной сети Интернет: eec. eaeunion.org.
17 НОЯБРЯ 2023 ГОДА СОСТОЯЛСЯ ЭКСПЕРТНЫЙ СОВЕТ «СИСТЕМА ОРГАНИЗАЦИИ И ОПЛАТЫ СОПУТСТВУЮЩЕЙ ТЕРАПИИ ПРИ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЯХ» В ГОРОДЕ МОСКВЕ
В состав экспертного совета входили руководители медицинских учреждений и центра оценки качества
медицинской помощи, врачи, специалисты научной и образовательной
деятельности.
Инна Александровна Железнякова,
заместитель генерального директора
ФГБУ «Центр экспертизы и контроля качества медицинской помощи»
Минздрава России, открыла экспертный совет, посвященный сопутствующей терапии у онкологических
больных. На сегодняшний день тема
сопутствующей терапии при ЗНО
является приоритетной, вопросам
поддерживающей терапии уделяется все большее внимание, и связано
это с тем, что при проработке модели
оплаты медицинской помощи первые дифференцированные тарифы
на оплату сопутствующей терапии
появились только в 2023 году. Тема
сопутствующей терапии нуждается в
доработке, необходимы четкие показания к назначению сопутствующей
терапии.
Жанна Владимировна Хайлова, заместитель директора МРНЦ имени
А.Ф. Цыба – филиала ФГБУ «НМИЦ
радиологии» Минздрава России,
президент Ассоциации онкологов и
онкологических учреждений Центрального федерального округа, кандидат медицинских наук, представила доклад «Сопутствующая терапия
в реальной клинической практике».
Достижения современной онкологии позволяют значительно продлевать сроки жизни онкологических
больных, сохранять их трудоспособность. Однако проведение специализированного противоопухолевого
лечения в ряде случаев сопряжено с
развитием целого ряда осложнений,
возникающих в процессе или после противоопухолевого лечения.
Осложнения часто носят ургентный
характер и требуют высокопрофессионального подхода. Учитывая
возможность быстрой декомпенсации состояния больного, основной
массив оказываемой помощи может
быть предоставлен в медицинских
учреждениях онкологического и неонкологического профиля II (специализированная медико-санитарная
помощь) и III уровня (специализированная, в т.ч. ВМП). Необходимо
создать платформу оказания своевременной и качественной поддерживающей терапии пациентам на
амбулаторном и госпитальном этапе,
а также обеспечения адекватной преемственности. Разработка четких алгоритмов уровневой маршрутизации
пациентов, стандартов и алгоритмов
поддерживающей терапии, обеспечения информированности о возможности проведения телемедицинских
консультаций профильных специалистов в части терапии осложнений
является актуальной.
Анемия является частым осложнением как самого заболевания, так и проводимого лечения. Ориентировочное
количество необходимых госпитализаций по поводу анемии составляет
400 000 случаев в год: в круглосуточный стационар - 250 000 случаев, в
дневной стационар - 150 000 случаев.
Диагноз D63.0 - Анемия при новообразованиях (C00-D48+) включен
в КСГ st05.001 «Анемии (уровень 1)»
с КЗ 0,94, и КСГ ds05.001 «Болезни
крови (уровень 1)» с КЗ 0,91, относящимся к профилю «Гематология».
На практике сложился ряд проблем
в части практического применения
данной КСГ при лечении такого серьезного осложнения, как анемия у
пациентов с ЗНО. По мнению Жанны
Владимировны, необходимо выделение отдельной КСГ «Анемия при злокачественных новообразованиях» в
условиях круглосуточного и дневного
стационара с отнесением ее к профилю «Онкология» с дополнительными
классификационными критериями,
определяющими необходимость парентерального введения препаратов,
а также выделение коэффициента
сложности лечения (КСЛП) онкологического пациента при развитии
анемии онкологического генеза в условиях дневного и круглосуточного
стационара и внесение препаратов
группы стимуляторов эритропоэза в
перечень схем сопроводительной лекарственной терапии.
Кардиотоксичность - еще одно частое и серьезное осложнение, возникающее на фоне противоопухолевого лечения. Создано новое междисциплинарное направление (кардиоонкология), занимающееся изучением всех аспектов кардиотоксичности, включая ее предотвращение, раннюю диагностику и лечение. К целям и задачам кардиоонкологии относятся: 1) минимизация возникновения сердечно-сосудистых проблем, связанных с противоопухолевой терапией, препятствующих полноценному лечению онкологического заболевания; 2) оптимизация лечения имеющихся ССЗ у больных, нуждающихся в кардиотоксичной противоопухолевой терапии; 3) профилактика, выявление и лечение сердечно-сосудистых осложнений противоопухолевой терапии. В структуру кардиоонкологической службы входят: онколог; кардиолог, квалифицированный в области онкологии, владеющий знаниями о возможных лекарственных взаимодействиях, антикоагулянтной и антиагрегантной терапии, осложнениях противоопухолевой терапии и др.; кардиолог, специализирующийся в области функциональной диагностики (ЭхоКГ, оценка КТ, МРТ и др.); кардиолог-аритмолог для пациентов с ЭКС и другими устройствам; рентгенэндоваскулярный хирург. Жанна Владимировна предложила создать систему маршрутизации пациентов с кардиальными осложнениями в субъектах РФ, выделить дополнительный коечный фонд на базе онкологических многопрофильных отделений, создать систему кодирования осложнений противоопухолевого лечения, а также разработать соответствующие стандарты и КСГ с выделением наиболее значимых осложнений терапии онкологических больных.
Перечень случаев, для которых установлен КСЛП, в проекте Программы государственных гарантий на 2024 г. не претерпел изменений в сравнении с ПГГ на 2023 г. Завершая доклад, Ж.В. Хайлова вынесла на обсуждение следующие важные вопросы:
- перечень препаратов, применяемых для проведения поддерживающей терапии, в реальной практике должен быть шире;
- перечень не учитывает ряд препаратов, в том числе, для коррекции анемии, например, эритростимулирующие препараты, пролонгированные колониестимулирующие факторы, антибиотики, препараты кальция и витамина Д3;
- перечень схем поддерживающей лекарственной терапии включает препараты тоцилизумаб, микофенолата мофетил, такролимус, ведолизумаб, не включенные в Клинические рекомендации, размещенные в Рубрикаторе КР;
- перечень тяжелых сопутствующих патологий не включает ряд заболеваний/состояний (например, пневмонию, анемию), частота развития которых высока при злокачественных новообразованиях.
В докладе «Существующие барьеры
в организации и оплате сопутствующей терапии в онкологии. Необходимые изменения и предложения на
2024 год» Антон Николаевич Жигулев, кандидат медицинских наук,
заместитель главного врача ГБУЗ ПК
Пермский краевой онкологический
диспансер, раскрыл основные проблемы назначения сопутствующей
терапии онкологическим больным
на примере анемии.
Анемия характерна практически для
всех больных с различными онкологическими и онкогематологическими заболеваниями. Анемический
синдром ухудшает течение и прогноз
основного заболевания за счет снижения эффективности химиотерапии, развития лекарственной резистентности и метастазирования.
Для лечения анемии у больных ЗНО
существует весь набор нормативных
документов – клинические рекомендации, стандарт медицинской помощи и практические рекомендации
общества RUSSCO, которые также
могут быть использованы при оказании медицинской помощи.
КСГ, существующие для лечения анемии в круглосуточном и дневном стационаре, отнесены к профилю «гематология». Антон Николаевич предложил обсудить ситуацию, чтобы оплата сопроводительной помощи при анемии никак не была связана с профилем «гематология».
Жигулев А.Н. представил существующие проблемы в отношении лечения анемии у онкологических больных, к которым относятся: 1) отсутствие КСЛП для антианемических препаратов; 2) непрофильность – основная причина отказа в оплате КСГ онкологической службе; 3) замещение онкологической койки для лечения ЗНО на сопроводительную терапию; 4) отсутствие возмещения затрат на лечение анемии связано с «профильной» терапией; 5) случаи неоплаты медицинской помощи ввиду группировки КСГ в рубрику «Гематология» и несоответствие фактическому профилю койки; 6) недостаточный тариф «Злокачественные новообразования без специального противоопухолевого лечения» в стационарных условиях (12,9 тыс. руб.) и условиях дневного стационара (6 тыс. руб.); 7) сопутствующая терапия продолжает оплачиваться за счет профицитной части КСГ, в «дефицитных схемах» пациенты остаются без лечения.
В завершении своего доклада Антон Николаевич предложил:
- отдельно обозначить применение КСЛП при лечении анемии;
- внести эпоэтин-альфа для лечения анемии при ЗНО в «Перечень схем сопроводительной лекарственной терапии» в Методических рекомендациях по способам оплаты медицинской помощи за счет средств ОМС на 2024 год;
- применить КСЛП, что приведет к получению достоверной статистики и может быть основой для других видов сопроводительной терапии,
- рассмотреть оплату по двум КСГ как второй механизм возмещения затрат.
Инна Александровна Железнякова
в своем докладе представила динамику финансирования стационарной медицинской помощи в 2023-
2024 годах по профилю «онкология»
для круглосуточного и дневного стационара, согласно которой объемы
медицинской помощи выросли с 2
млн 900 тыс до 3 млн 200 тыс. Объем
стационарной медицинской помощи
в субъектах РФ в 2023-2024 годах по
профилю «онкология» также увеличивается, однако финансирование
в регионах остается в размере 2023
года.
Ранее был один КСЛП для сопроводительной терапии для дневного и
круглосуточного стационара, в 2024
году федеральный фонд и Министерство здравоохранения согласовали
разделение на три уровня КСЛП.
Инна Александровна предложила
рассмотреть и обсудить список препаратов для лечения анемии, необходимых для включения в КСЛП.
С докладом «Актуальные изменения по оплате сопутствующей терапии в онкологии на 2024 год выступил Александр Владимирович Зуев, заместитель начальника управления экономики и финансирования здравоохранения ФГБУ «ЦЭККМП» МЗ. Александр Владимирович начал свой доклад с представления параметров расчета стоимости схем лекарственной терапии в целях формирования КСГ:
- доза лекарственного препарата рассчитывается в единицах измерения действующего вещества;
- дозировка рассчитывается для каждого МНН с учетом средней массы (72,3кг) или площади поверхности тела пациента (1,82 м2);
- учитывается длительность цикла лекарственной терапии и кратность введения лекарственных препаратов. Нагрузочная доза распределена между всеми введениями;
- учитывается способ введения лекарственного препарата;
- в расчетах используется закупочная средневзвешенная цена за единицу измерения действующего вещества;
- стоимость схемы лекарственной терапии суммируется со стоимостью расходов на пребывание пациента в стационаре, исходя из оптимальной длительности лечения, штатных нормативов согласно порядку оказания медицинской помощи и целевых значений заработной платы (с 2022 года учтены расходы на микроинфузионную помпу при применении схем лекарственной терапии, предполагающих многочасовую инфузию).
Формирование КСГ осуществляется
методом кластерного анализа полученных стоимостей схем лекарственной терапии с последующим расчетом средневзвешенного значения для
каждой КСГ.
При обсуждении актуализация подходов к оплате лекарственной терапии у взрослых по профилю «онкология» докладчик уточнил, что
стоимость уменьшается по 54 лекарственным позициям, экономия по
ним составит 28,15 млрд. руб., однако
стоимость увеличивается по 53 лекарственным формам, дополнительная потребность по ним 1,64 млрд.
руб. (за счет фактически сложившегося уровня региональных оптовых
надбавок), таким образом, итоговая
экономия составит 26,5 млрд. руб.
В качестве обоснования необходимости выделения отдельных КСЛП
для сопроводительной терапии А.В.
Зуев отметил, что сопроводительная
терапия является дополнительной
финансовой нагрузкой на систему.
«Дефицит» системы приводит к расчету заработной платы (койко-день,
пациенто-день, коэффициент совместительства) в медицинской организации, длительному нахождению
пациента в отделении по показаниям
(заложено минимальное значение),
применению схем с «точками», т.к. в
расчеты не закладывается пребывание пациента, покрытию штрафных
санкций СМО.
Таким образом, необходимо выделение сопроводительной терапии как
отдельного «защищенного» направления. Также предлагается на 2024
год КСЛП дифференцировать как
минимум на три уровня для более
точного определения их финансирования.
Доклад, посвященный оплате медицинской помощи пациентам с
анемией при злокачественных новообразованиях, представила Вера Витальевна Карасева, исполнительный
директор Российского общества клинической онкологии. Законодателем
практических рекомендаций по сопроводительной терапии является
Российское общество клинической
онкологии. Подготовлены 16 практических рекомендаций по профилактике и лечению осложнений
противоопухолевой лекарственной
терапии, в этом году опубликованы 4
новых рекомендации (центральный
венозный доступ, аллергические
реакции, хронические вирусные гепатиты, неврологические осложнения). Новая редакция клинических
рекомендаций по анемии одобрена
научно-практическим советом и находится в ЦЭККМП, по венозным
тромбозам - в процессе второй про
-
верки. В процессе подготовки находятся клинические рекомендации по
нейтропении, болевому синдрому,
иммуноопосредованным нежелательным явлениям, костной патологии. Вера Витальевна упомянула,
что для лечения анемии при ЗНО,
согласно клиническим рекомендациям, применяются эпоэтины (ЭПО)
альфа и препараты железа. Важно
отметить, что ЭПО необходимо назначать одновременно с основным
противоопухолевым лечением.
Однако в настоящее время нет возможности одновременного лечения
анемии с ХТ/ХЛ, также нет возможности лечить «Анемию онкологического генеза» у онкологов и оплаты
двух КСГ при одной госпитализации
или КСЛП для лечения «Анемии онкологического генеза». В.В.Карасева
предложила рассмотреть КСЛП для
проведения сопроводительной терапии для лечения анемии, добавить
новый профиль «онкология» к КСГ
st05.001 «Анемии» и ds05.001 «Болезни крови», а также включить в
Расшифровщик круглосуточного и
дневного стационаров схем с сопроводительной терапией из утвержденных КР.
Подводя итоги экспертного совета,
И.А. Железнякова отметила, что необходимо продолжать работать с рабочей группой по способам оплаты
медицинской помощи по вопросам
создания КСЛП для лечения анемии;
определения перечня препаратов для
лечения анемии при ЗНО, необходимых для включения в КСЛП; рассмотреть оплату по двум КСГ.