Дорогие коллеги, дорогие друзья!
С финальным ударом курантов, с первой минуты нового года мы продолжаем писать свою летопись с чистой страницы. Непредсказуемость этой жизни не позволяет надеяться на осуществление абсолютно всех намеченных на новый год планов, но каждый из нас наверняка мысленно определил наиболее важные для себя пункты наступившего 2023. В сообществе онкологов планы в...

Франс Вильгельм Одельмарк, шведский художник.
Трубочист 1880 г
Ольга Берггольц. Ответ. 1962 г
А я вам говорю, что нет напрасно прожитых мной лет, ненужно пройденных путей, ненужно пройденных путей, впустую слышанных вестей. Нет невоспринятых миров, нет мнимо розданных даров...
ИТОГИ РАБОТЫ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ В 2022 ГОДУ
Традиционно в январе мы подводим итоги прошедшего года. В истории Российского общества клинической онкологии 2022 год – это уже одиннадцатый год деятельности, отмеченный достойными достижениями. В 2022 году Общество пополнилось двумя новыми региональными отделениями – в Республике Северная Осетия – Алания (председатель – Воронкова Лия Михайловна) и в Республике Ингушетия...
КОМИТЕТ МОЛОДЫХ ОНКОЛОГОВ RUSSCO
Глубокоуважаемые коллеги! Рады сообщить, что с этого года возобновляет активную работу Комитет молодых онкологов Российского общества клинической онкологии (RUSSCO). Ставим своей целью объединение талантливых и активных членов нашего сообщества...

ПОЗИТИВНОЕ ИССЛЕДОВАНИЕ POSITIVE
Исследование POSITIVE было доложено на прошедшем симпозиуме, посвященном раку молочной железы, в Сан-Антонио (США)...

КОГДА РЕГУЛЯТОР НЕ ТОЛЬКО РЕГУЛИРУЕТ, НО И ДУМАЕТ…
В последние годы было слышно достаточно много критики в отношении FDA, являющегося основным регулятором обращения лекарственных препаратов в США. Ему ставили в вину и то, что ряд...

ОЛАНЗАПИН В КОМБИНАЦИИ С АНТАГОНИСТОМ РЕЦЕПТОРОВ СЕРОТОНИНА (5-НТ3) И ДЕКСАМЕТАЗОНОМ КАК ПРЕДПОЧТИТЕЛЬНЫЙ ВАРИАНТ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ТОШНОТЫ И РВОТЫ ПРИ ВЫСОКО- И УМЕРЕННОЭМЕТОГЕННЫХ РЕЖИМАХ ХИМИОТЕРАПИИ
Тошнота и рвота (ТиР) являются одними из самых часто встречаемых осложнений при проведении химиотерапии [1]. Несмотря на имеющиеся в настоящее время алгоритмы лечения ТиР, некоторые
ЭФФЕКТИВНОСТЬ СЕЛПЕРКАТИНИБА И ПРАЛСЕТИНИБА У БОЛЬНЫХ НЕМЕЛКОКЛЕТОЧНЫМ РАКОМ ЛЕГКОГО С RET-FUSION. ДАННЫЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯ LIBRETTO-001 I/II ФАЗЫ И ARROW I/II
RET-fusion определяется у 1-2% больных немелкоклеточным раком легкого (НМРЛ), а также при папиллярном раке щитовидной железы (10-20%), аденокарциноме толстой кишки (<1%) и потоковом раке молочной железы (<1%). Ген RET (REarranged during Transfection) кодирует трансмембранный тирозинкиназный рецептор RET. Известны три изоформы рецептора RET, образующиеся в результате...

НОВОСТИ BREAST CANCER SYMPOSIUM В SAN ANTONIO 2022: СОВРЕМЕННЫЕ СТРАТЕГИИ ТЕРАПИИ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ
C 6 по 10 декабря 2022 года в San Antonio, США, прошел очередной симпозиум, посвященный лечению рака молочной железы (РМЖ). Ежегодно на конференции обсуждаются актуальные работы...

ДИСКУССИОННАЯ СЦЕНА. БЕССИМПТОМНЫЕ МЕТАСТАЗЫ В КОСТЯХ ПРИ РАКЕ МОЛОЧНОЙ ЖЕЛЕЗЫ: ЛЕЧИТЬ ИЛИ НАБЛЮДАТЬ?
Метастатическое поражение костей при раке молочной железы остается актуальной проблемой, несмотря на прогресс в ранней диагностике этого заболевания и успехи противоопухолевого...
РЕГИОНАЛЬНОЕ ОТДЕЛЕНИЕ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ (RUSSCO) Г. ЮЖНО-САХАЛИНСК
Сахалинская область – субъект Российской Федерации, входит в состав Дальневосточного Федерального округа. Область полностью расположена на островах – остров Сахалин и Курильские острова. Административный центр области – город ЮжноСахалинск – расположен на юге острова. Население Сахалинской области на 01.01.2023 – 484 177 тыс. человек. Заболеваемость онкологическими...
КОГНИТИВНАЯ РЕАБИЛИТАЦИЯ ОНКОЛОГИЧЕСКИХ БОЛЬНЫХ. ВЗГЛЯД КЛИНИЦИСТА
Достижения современной онкологии позволяют реализовать борьбу за жизнь пациента, не только укладываясь в стандарты необходимой противоопухолевой терапии, но и затрагивая решение вопросов качества жизни каждого пациента. Совершенствование терапевтических подходов в лечении онкобольных устойчиво расширяет диапазон сопроводительной терапии, как по остро возникающим осложнениям, так и по осложнениям, отягощающим жизнь больного вне болезни...
Анонс
-

3 - 4 февраля 2023
ОПУХОЛИ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА
IX КОНФЕРЕНЦИЯ RUSSCO
-

30 - 31 марта 2023
РАК МОЛОЧНОЙ ЖЕЛЕЗЫ
X КОНФЕРЕНЦИЯ RUSSCO
-

13 - 14 апреля 2023
РАК ЛЕГКОГО И ДРУГИЕ ОПУХОЛИ ГРУДНОЙ КЛЕТКИ
IX КОНФЕРЕНЦИЯ RUSSCO
Дорогие коллеги, дорогие друзья!
В финале одного из старых и любимых многими фильма «Влюблен по собственному желанию» (1982 г.) главные герои завороженно смотрят на табло электронных часов, показывающих 00:00:
- Страшно. Как начало мира: еще ничего нет, ни времени, ни пространства…
00:01
- Всё. Поехало!
С финальным ударом курантов, с первой минуты нового года мы продолжаем писать свою летопись с чистой страницы. Непредсказуемость этой жизни не позволяет надеяться на осуществление абсолютно всех намеченных на новый год планов, но каждый из нас наверняка мысленно определил наиболее важные для себя пункты наступившего 2023. В сообществе онкологов планы в отношении дальнейшего профессионального роста однозначно не на последних местах списка, и мы, команда RUSSCO, надеемся быть вам полезными в этом. Помимо публикации новостей с международных конгрессов и данных «свежих» исследований мы планируем обсуждать наиболее спорные вопросы онкологии в рамках дискуссий на страницах газеты и на сайте, демонстрировать наиболее яркие клинические случаи, открыть рубрику по основам медицинской статистики для начинающих ученых. Надеемся, что колонка новостей от Комитета молодых онкологов RUSSCO станет регулярной, а информация о региональных отделениях общества будет постоянно пополняться и обновляться – с вашей помощью, дорогие коллеги! Не забывайте, что газета RUSSCO и сайт rosoncoweb.ru с нетерпением ждут своих новых авторов. Пишите о том, что «наболело», рассуждайте, подбрасывайте новые темы для дискуссий.
Новый год – это новые мероприятия, конференции, вебинары и, наконец, XXVII Российский онкологический конгресс. Уже в январе мы ждем вас на конференции RUSSCO по меланоме. Анонсы других мероприятий с точными датами всегда будут на сайте. Мы рассмотрим любые предложения по грядущему конгрессу, тематике сессий, выбору лекторов – времени для этого пока достаточно. Мы с нетерпением ждем встречи с вами как лично, так и в онлайн формате!
Удачного 2023 года нам всем, дорогие друзья!
Ваша команда RUSSCO.
Франс Вильгельм Одельмарк, шведский художник.
Трубочист 1880 г

Ольга Берггольц. Ответ. 1962 г
***
А я вам говорю, что нет
напрасно прожитых мной лет,
ненужно пройденных путей,
впустую слышанных вестей.
Нет невоспринятых миров,
нет мнимо розданных даров,
любви напрасной тоже нет,
любви обманутой,
больной,
ее нетленно чистый свет
всегда во мне, всегда со мной.
И никогда не поздно снова
начать всю жизнь,
начать весь путь,
и так, чтоб в прошлом бы — ни слова,
ни стона бы не зачеркнуть.
ИТОГИ РАБОТЫ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ В 2022 ГОДУ
Традиционно в январе мы подводим итоги прошедшего года. В истории Российского
общества клинической онкологии 2022 год – это уже одиннадцатый год деятельности,
отмеченный достойными достижениями.

В 2022 году Общество пополнилось
двумя новыми региональными
отделениями – в Республике Северная Осетия – Алания (председатель
– Воронкова Лия Михайловна)
и в Республике Ингушетия (председатель – Исаев Бекхан Исаевич).
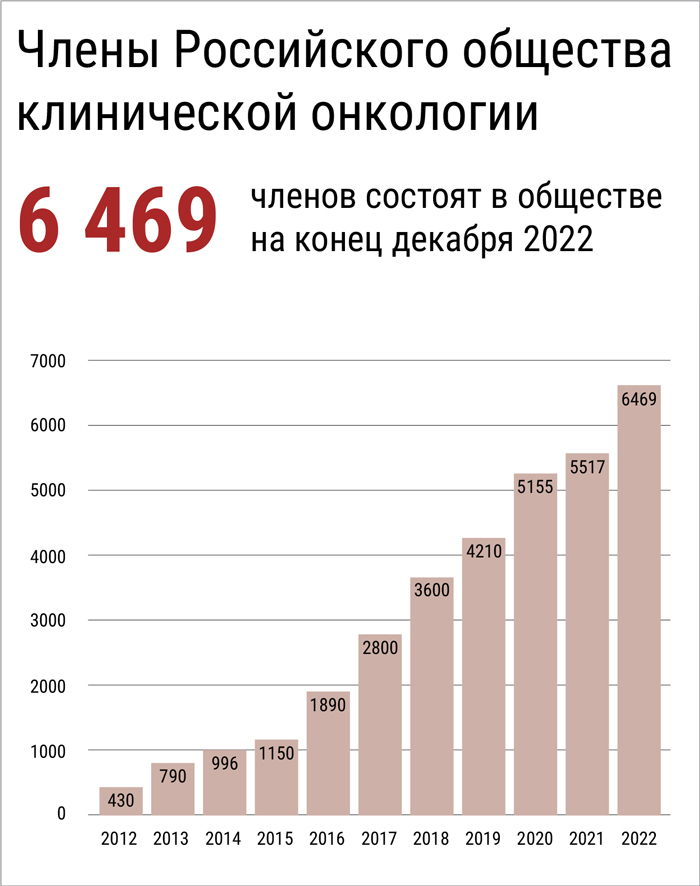
В настоящее время Общество
насчитывает 55 отделений и почти
6500 членов. За прошедший 2022
год к Обществу присоединились
более 850 врачей.
В ноябре 2022 года состоялся XXVI
Российский онкологический конгресс, главное событие Общества.
Участие в нем приняли более 5600
докторов, из которых 3250 – в очной форме. В рамках Конгресса
прошли 68 научных сессий, лекций, мастер-классов, а также более 40 сателлитных симпозиумов.
Проведены совместные сессии
RUSSCO c АОР и Московским онкологическим обществом, а также
сессии Санкт-Петербургской школы практических онкологов, общества Меланома.ПРО, Российского
общества специалистов по колоректальному раку, Ассоциации
специалистов по изучению сарком,
Российского общества медицинских генетиков и Московского обществом медицинских генетиков,
сессия INDIGO, сестринская сессия и сессия Ассоциации онкологических пациентов «Здравствуй!».
Церемония открытия Конгресса
собрала наибольшее количество
участников. На ней главные внештатные специалисты онкологи И.С.
Стилиди и А.Д. Каприн поприветствовали участников Конгресса,
а традиционную лекцию памяти
академика Н.Н. Блохина прочитал
член-корр. РАН В.Б. Матвеев.
RUSSCO продолжает поддерживать тесные связи с профессиональными сообществами, как
российскими, так и зарубежными.
Российское общество клинической
онкологии организовало и провело 10 сентября 2022 г. очередной
ежегодный экзамен Европейского
общества медицинской онкологии
(ESMO) для молодых российских
врачей – членов ESMO. Экзамену предшествовал цикл из 14 вебинаров «Подготовка к экзамену
ESMO», организованных молодыми членами RUSSCO. В экзамене
ESMO приняли участие 23 доктора,
11 из них успешно его прошли. Все
участники, успешно сдавшие экзамен, аттестованы и получили соответствующий сертификат на пятилетний период своей деятельности.
4 февраля 2022 г. совместно с Московским онкологическим обществом проведен телемост, посвященный Всемирному дню борьбы с
онкологическими заболеваниями.
В рамках мероприятия были представлены инновационные проекты
из онкологических диспансеров
Самары, Якутска, Ярославля, Хабаровска, Москвы, Пятигорска и
Екатеринбурга.
RUSSCO продолжает информировать о результатах клинических
исследований, доложенных на конференциях ASCO, ESMO и других
зарубежных онкологических сообществ. По итогам конференций,
прошедших в 2022 году, проведены вебинары «Новое в иммунотерапии: результаты ASCO 2022»,
«Лучшее по материалам конференций Американского общества
клинической онкологии (ASCO)
2022, посвященных раку молочной железы», «Лучшее по материалам конференций Американского
общества клинической онкологии
(ASCO) 2022, посвященных опухолям желудочно-кишечного
тракта», «Лучшее по материалам
ежегодного симпозиума, посвященного вопросам диагностики и
лечения рака молочной железы в
Сан-Антонио – San Antonio Breast
Cancer Symposium (SABCS)», «Новое в иммунотерапии: результаты
ESMO 2022». На сайте RosOncoWeb.
ru опубликована информация об
итогах очередного ежегодного симпозиума ASCO GI 2022, на котором
были представлены результаты
более 650 исследований в области
лечения опухолей желудочно-кишечного тракта.
За год Российским обществом клинической онкологии проведено
более ста региональных мероприятий, а также 19 больших конференций RUSSCO, собравших более 16
500 участников. Все мероприятия
были проведены в рамках НМО.
В дни XXVI Российского онкологического конгресса, а именно
15 ноября, впервые был проведен экзамен по клинической онкологии среди врачей онкологов
Российской Федерации. Двадцать
восемь докторов набрались смелости пройти этот экзамен впервые
в России. География участников:
Москва, Пермь, Королев, СанктПетербург, Южно-Сахалинск,
Красногорск, Архангельск, Кемерово, Новосибирск, Нальчик,
Красноярск, Пущино, Екатеринбург, Уфа. Всем 18 врачам, успешно
прошедшим экзамен, были вручены дипломы. Трое участников, набравших наибольшее количество
баллов, в качестве поощрения
получат от RUSSCO грант на поддержку поездки на любое мероприятие Общества.
RUSSCO провело в этом году
оценку результатов, собранных
в регистрах Общества. Неинтервенционное наблюдательное
ретроспективное исследование
«Изучение последовательности
линий терапии распространенного гормонозависимого HER2-
отрицательного рака молочной
железы в реальной клинической
практике ЛПУ г. Москвы» собрало
данные о терапии 1000 пациентов,
и результаты были опубликованы
в материалах ASCO 2022 и Российского онкологического конгресса. Также в материалах Конгресса
были опубликованы результаты
регистров «Особенности лечебной
тактики у онкологических больных с коронавирусом в реальной
клинической практике онкологических учреждений Российской
Федерации» и «Абемациклиб в
комбинации с эндокринной терапией или в монотерапии в лечении
местнораспространенного или
метастатического ГР+ HER2- рака
молочной железы в российской
популяции больных: многоцентровое, неинтервенционное, наблюдательное ретроспективное исследование». Общество продолжает
изучение вопросов выгорания у
врачей онкологов и по результатам
опроса также в материалах Конгресса были опубликованы тезисы.
Продолжает свое развитие программа молекулярно-генетический
диагностики в Российской Федерации с целью повышения эффективности противоопухолевого
лечения. Расширены панель молекулярно-генетических и иммуногистохимических тестов (FGFR,
dMMR), а также перечень нозологий (рак эндометрия), участвующих в проекте. Общее число
выполненных в 2022 году тестов
достигло 14,5 тысяч, причем половина выполнена методом NGS.
Число участников программы
ежегодно увеличивается. На сегодняшний день участвуют 55 молекулярно-генетических и иммуногистохимических лабораторий, 2800
врачей, 83 региона РФ.
RUSSCO расширяет охват регионов по логистике и маршрутизации
в рамках ОМС. В 2022 году осуществлена возможность отправки
на тестирование в рамках ОМС для
всех 83 регионов, участвующих в
программе. Расширено количество
лабораторий, выполняющих тестирование по ОМС, до шести, из них
четыре – крупнейшие референсные лаборатории РФ.
На постоянной основе проводится
сбор данных о частоте мутаций в
30 регионах РФ.
В 2022 году реализованы проекты по контролю качества проведения молекулярно-генетической
диагностики. Завершен проект по
контролю качества проведения теста RAS при колоректальном раке.
Участвовали 8 лабораторий, все
получили сертификат об успешном прохождении внешнего контроля. Одна лаборатория прошла
успешно контроль качества тестирования мутаций в гене BRCA1/2
методом NGS. В процессе проект
по контролю качества EGFR при
НМРЛ, участвуют 9 лабораторий.
Статистический отчет о программе вы можете увидеть на сайте
cancergenome.ru.
В 2022 году реализованы новые проекты Общества совместно с телеканалом «Доктор». Выпущено 10 видеороликов о профилактике рака с постоянной ротацией в эфире канала. Ролики также размещены на сайте Общества и в соцсетях. Выпущено 10 сюжетов о питании и онкологии. Также эксперты RUSSCO приняли участие в трех выпусках в программе «Скажите, доктор».
Благотворительный проект «Книготерапия RUSSCO», стартовавший в 2021 году, получил продолжение и в 2022. В рамках благотворительной акции в ноябре 2022 года в Ульяновске проведено мероприятие с участием детского писателя Анны Гончаровой. Осуществлена передача книг с автографами А. Гончаровой, С. Лукьяненко и других авторов в библиотеки местных ЛПУ.
Практические рекомендации Российского общества клинической онкологии в 2022 году изданы традиционным тиражом в 5000 экземпляров. В случае появления в практике новых клинических решений они редактируются в течение года в электронной версии, размещенной на сайте Общества.
Ежеквартально выпускается журнал Общества «Злокачественные опухоли». Журнал входит в перечень журналов ВАК по следующим специальностям: 3.1.6. Онкология, Лучевая терапия и 3.1.9. Хирургия в отрасли медицинские науки. С удовольствием сообщаем, что наш журнал находится среди лидеров ВАК по индексу цитирования – он отнесен к первому квартилю с самым высоким коэффициентом – 0,600.
Общество продолжает ежемесячно выпускать газету RUSSCO, с апреля 2022 года она публикуется только в электронном варианте.
В 2022 году завершено обновление
дизайна сайта RosOncoWeb.ru. Сайт
дополнен новыми разделами (Ветераны онкологии), продолжается пополнение информации о региональных отделениях RUSSCO, а также
пополнение записей выступлений
ведущих специалистов, сделанных
на мероприятиях RUSSCO. Число
записей приближается к 5000 и освещает современные аспекты онкологии.
КОМИТЕТ МОЛОДЫХ ОНКОЛОГОВ RUSSCO
Глубокоуважаемые коллеги!
Рады сообщить, что с этого года возобновляет активную работу Комитет молодых онкологов Российского общества клинической онкологии
(RUSSCO). Ставим своей целью объединение талантливых и активных
членов нашего сообщества.
Для чего?
Основными направлениями деятельности и целями существования молодежного комитета мы видим:
• поддержку карьерного развития молодых онкологов всех специальностей в нашей стране и за ее пределами;
• повышение уровня профессиональной компетенции врачей-онкологов
• и всех связанных лечением онкологических пациентов;
• совместное планирование и проведение научных исследований.
Кто мы?
На данном этапе организации молодежного комитета в его «актив» входит 10 человек, которые будут курировать и координировать деятельность
Комитета.
Вот что пишут о себе наши коллеги. Знакомьтесь! Мы также ждем всех
коллег, заинтересованных принять участие в этом проекте.
ПРЕДСЕДАТЕЛЬ МОЛОДЕЖНОГО КОМИТЕТА:
Румянцев Алексей Александрович

старший научный сотрудник отделения лекарственных методов лечения №4 НИИ клинической онкологии им. академика РАН и РАМН
Н.Н. Трапезникова ФГБУ «НМИЦ
онкологии им. Н.Н. Блохина», кандидат медицинских наук.
В 2019 году защитил диссертацию на
соискание соответствующей ученой
степени. Имею опыт в проведении и
организации клинических исследований, научных и образовательных
мероприятий. Успел поучаствовать
в программе ASCO IDEA и выступить с устным докладом на ежегодной конференции ASCO в 2019 году.
В настоящее время занимаюсь написанием докторской диссертации по
лечению рецидивов рака яичников.
Сфера интересов – онкогинекология, онкоурология, саркомы костей
и мягких тканей. Немного разбираюсь в медицинской статистике.
Данилова Анастасия Сергеевна, Москва

Всем привет! Меня зовут Анастасия
Данилова, я химиотерапевт и работаю в Московской городской онкологической больнице №62 с 2016
года. Моей большой давней мечтой
было создание классного, активного, современного медицинского сообщества среди молодых онкологов,
возможность делиться, рассказывать, обучать и помогать коллегам!
И поэтому для меня большая честь,
что меня позвали в комитет молодых онкологов RUSSCO.
В прошлом году было много классных проектов, в которых я участвовала, – вебинары по подготовке к
экзамену ESMO и сдача экзамена с
коллегами, большая интересная интерактивная сессия на Российском
онкологическом конгрессе и много
других! Очень надеюсь, что в этом
году проектов и крутых идей будет
больше! Не стесняйтесь, пишите,
делитесь идеями и давайте делать
классные вещи вместе!
Евдокимов Владимир Игоревич, Москва

Занимаюсь лекарственной терапией злокачественных опухолей,
в том числе гематологических, у
взрослых. Дополнительно специализируюсь на онкодерматологии,
владею дерматоскопией. Участвую
в клинических исследованиях в
качестве соисследователя.
Обучение: выпускник РНИМУ им.
Н.Н. Пирогова, окончил с красным дипломом, проходил в 2018
году стажировку в Университетской Клинике г. Цукуба (Япония).
Проходил курсы по коммуникации с пациентами в школе «СоОбщение» в 2021 году.
Опыт работы: работал на станции скорой и неотложной медицинской помощи им. А.С. Пучкова в течение 3 лет, 2 года проходил ординатуру в НМИЦ онкологии им. Н.Н. Блохина. Работаю врачомонкологом, в Клинике доктора Ласкова с 2021 года. С 2023 года – заведующий онкологическим отделением №1 в ЦАОП ММКЦ «Коммунарка».
Исраелян Эдгар Рудикович, Москва

Я врач-онколог онкологического
отделения лекарственных методов
лечения (химиотерапевтическое)
№4 НМИЦ онкологии им. Н.Н. Блохина. Победитель конкурса молодых
онкологов (Российской онкологический конгресс – 2022).
Сферами моего научного интереса
являются онкоурология, онкогинекология, в частности, герминогенные опухоли. Планирую активно
заниматься развитием данных направлений в процессе деятельности
Комитета молодых онкологов.
Исянгулова Алина Зульфатовна, Казань

Врач высшей категории, онколог,
химиотерапевт, старший ординатор
ГАУЗ «Республиканский клинический онкологический диспансер
Министерства здравоохранения Республики Татарстан имени профессора М.З. Сигала» (г. Казань).
Кандидат медицинских наук. Председатель регионального отделения
RUSSCO Республики Татарстан.
Член ASCO, ESMO, ENETS. Лауреат Премии имени академика А.И.
Савицкого в области онкологии,
победитель в номинации «Лучший
молодой онколог».
Люблю путешествовать, посетила
более 20 стран.
Перегородиев Иван Николаевич, Москва

Совмещаю активную врачебную
практику с научной работой – постоянно участвую научных форумах,
проводимых Обществом по изучению нейроэндокринных новообразований, в качестве эксперта провожу аудиты онкологической помощи
в субъектах Российской Федерации и
помогаю коллегам в различных процессах оказания качественной медицинской помощи, участвую в организации выездных мастер-классов.
Сфера научных интересов – медикаментозное и хирургическое лечение
злокачественных опухолей верхних
отделов ЖКТ (пищевод, желудок,
тонкая кишка), нейроэндокринных
новообразований различных локализаций, опухолей надпочечников;
хирургическое, комбинированное
лечение злокачественных опухолей
органов грудной и брюшной полости,
забрюшинного пространства; техники малоинвазивных вмешательств с
целью диагностики и лечения опухолей грудной клетки, брюшной полости и забрюшинного пространства.
Сафонцев Иван Петрович, Красноярск

Заместитель главного врача по организационно-методической работе КГБУЗ «Красноярский краевой
клинический онкологический диспансер им. А.И. Крыжановского»,
врач-онколог, ассистент кафедры
онкологии и лучевой терапии с курсом ПО ФГБОУ ВО «Красноярский
государственный медицинский университет им. проф. В.Ф. Войно-Ясенецкого», кандидат медицинских
наук. Член локального этического
комитета и секретарь общественного совета КГБУЗ «КККОД им. А.И.
Крыжановского»; заместитель председателя аккредитационной комиссии по специальности «Медицинская
кибернетика» Министерства здравоохранения Российской Федерации
в Красноярском крае, член рабочей
группы по реализации регионального проекта «Борьба с онкологическими заболеваниями» министерства
здравоохранения Красноярского
края.
В 2019 защитил кандидатскую диссертацию по скринингу рака легкого.
Автор и соавтор 49 научных работ.
Степанова Мария Леонидовна, Санкт-Петербург

Врач-онколог Санкт-Петербургского клинического научно-практического центра современных видов
медицинской помощи (онкологический), кандидат медицинских наук.
Занимаюсь лекарственным лечением солидных опухолей. Область
особого интереса: лечение рака легкого, рака молочной железы, секвенирование опухолей. Соавтор более
20 научных статей. Спикер конференций различного уровня. Победитель конкурса 2018-01-YS-ECI с проектом «Разработка диагностической платформы для мониторинга
мутации EGFR C797S с помощью
ПЦР в реальном времени свободноциркулирующей ДНК у пациентов с
немелкоклеточным раком легкого».
Меня всегда интересовал вопрос
адекватного информирования
пациентов и их родственников о
предстоящем лечении, возможных
осложнениях. Поэтому в свободное время занимаюсь проектами,
связанными с информированием
пациентов, будь то видеоинтервью с
экспертами (например, по раку легкого), так и недавно созданный телеграмм-канал. Думаю, что совместно
с коллегами и благодаря активному
участию молодых онкологов мы
сможем создать активное научное
сообщество
Султанбаев Александр Валерьевич, Уфа

В 2007 году окончил Башкирский
государственный медицинский
университет по специальности лечебное дело. В 2012 году завершил
обучение в аспирантуре с защитой
кандидатской диссертации по онкологии.
С 2012 года по настоящее время
работаю в Республиканском клиническом онкологическом диспансере Минздрава Республики Башкортостан. С 2019 года в должности
заведующего отделом противоопухолевой лекарственной терапии
совместно с коллегами организовываю работу химиотерапевтической
службы Республики Башкортостан.
Фатеева Анастасия Валерьевна, Владивосток

Заместитель главного врача по
медицинской части Приморского
краевого онкологического диспансера, врач онколог-химиотерапевт, член общества RUSSCO,
член ESMO, секретарь регионального общества RUSSCO. Спикер
множества конференций регионального и российского уровня,
автор научных публикаций, занимаюсь исследовательской деятельностью, работаю над кандидатской диссертацией.
Зона интереса в профессиональной деятельности – сложные
пациенты, опухоли редких локализаций, первично-множественные раки. В свободное от работы
время увлекаюсь морской живописью, плаванием и дайвингом.
Море дает энергию свободы и
жизни…:)
ПОЗИТИВНОЕ ИССЛЕДОВАНИЕ POSITIVE
Автор: С.А.Тюляндин
Председатель Российского общества клинической онкологии,
профессор, доктор медицинских наук, Москва
Исследование POSITIVE было доложено на прошедшем симпозиуме, посвященном раку молочной
железы, в Сан-Антонио (США), и
его название четко отражает характер полученных позитивных
результатов для молодых больных раком молочной железы, которые хотели бы иметь ребенка.
Сегодня мы являемся свидетелями повсеместного демографического сдвига – более позднего
вступления в брак и, как следствие, более позднего рождения
первого ребенка. Мы часто видим
больных раком молочной железы, у которых болезнь развилась
на фоне беременности. В этом
случае разработана эффективная
программа лечения, включающая
проведение предоперационной
химиотерапии, родоразрешения
после 32 недели и последующего
выполнения оперативного лечения и адъювантной лучевой и
лекарственной терапии. Это позволяет спасти жизнь ребенка и,
в большинстве случаев, жизнь
матери. Но существует большая
группа больных, у которых рак
молочной железы возник до рождения первого ребенка, или был
ранее рожден лишь один ребенок
и имеется желание увеличить семью. Такие больные часто задают
вопрос о потенциальной угрозе
провоцирования беременностью
агрессивного течения рака молочной железы, особенно в случае ее гормоночувствительности.
Проведенные исследования доказали, что беременность не только
не ухудшает прогноз больных,
но и обладает выраженным протективным эффектом, уменьшая
риск прогрессирования и риск
возникновения второго рака в
контралатеральной молочной
железе [1]. За этим следует вопрос о временных сроках безопасной беременности и родов
после окончания лечения рака
молочной железы. В этом случае
наши рекомендации зависят от
характера адъювантной терапии,
необходимой больной. В случае
проведения химиотерапии считается возможным планировать беременность через 18-24 мес. с момента окончания химиотерапии
при условии восстановления нормального менструального цикла.
Но у большинства больных в опухоли экспрессированы рецепторы
стероидных гормонов, и им показана длительная гормонотерапия
в течение 5 и более лет, что лишает многих временной возможности планировать беременность.
Желание забеременеть является
одной из причин досрочного прекращения адъювантной гормонотерапии, что увеличивает шанс
прогрессирования.
По этой причине исследование
POSITIVE изучало возможность
временного прерывания адъювантной гормональной терапии
для попытки беременности и родов и влияния на течение рака
молочной железы [2]. В исследование включались больные моложе 42 лет c I-III стадией гормоночувствительного рака молочной
железы без признаков прогрессирования после локальной терапии, желающие иметь ребенка и получающие адъювантную
гормонотерапию в течение 18-30
месяцев. После подписания информированного согласия больная прекращала прием гормональных препаратов в течение 3
месяцев для «отмывки» от ранее
полученной терапии, а затем ей
отводилось 24 месяца на попытку
беременности и родов, после чего
она должна была вернуться к продолжению гормонотерапии до ранее обозначенного срока в 5 или
более лет. В качестве критерия
эффективности была выбрана частота развития региональных и
отдаленных метастазов, которая
сравнивалась с таковой в исследовании TEXT/SOFT. В том исследовании пременопаузальные
больные раком молочной железы
получали адъювантную терапию
комбинацией тамоксифена или экземестана с выключением функции
яичников.
В исследовании было включено
516 больных, из которых 497 предприняли попытку беременности.
Возраст моложе 40 лет был зарегистрирован у 77% пациенток, 75%
были бездетными, распределение
по стадиям было следующим: I
стадия – 47%, II – 47%, III – 6%. В
качестве адъювантной гормонотерапии тамоксифен был назначен
42% больным, его комбинация с
выключением функции яичников
– 36%, ингибиторы ароматазы с
выключением функции яичников
– 16% пациентов. Медиана продолжительности гормонотерапии
до включения в исследование составила 23 месяца. Ранее предоперационная или адъювантная химиотерапия была проведена у 62%
больных, мастэктомия выполнена
у 45%.
Беременность наступила у 74%
(368/497) больных и закончилась
родами у 86% (317/368), в результате чего родились 365 детей.
Частота врожденных дефектов
у новорожденных составила 2%.
Спонтанный выкидыш или аборт
был зарегистрирован у 109 беременных. Частота локального и отдаленного прогрессирования за 3
года составила 4,4% и 4,5% соответственно. Эти же показатели в
исследовании TEXT-SOFT были
4,4% и 5,8% соответственно. К 4
году наблюдения 76% больных
возобновили гормонотерапию.
Авторы делают предварительный
вывод об отсутствии негативного
влияния временного прекращения
гормонотерапии на течение заболевания, подчеркивая короткий
срок наблюдения для окончательных заключений. Вместе с тем,
перерыв в гормонотерапии позволил 317 (64%) женщинам из 497 решивших забеременеть закончить
беременность успешными родами
365 новорожденных. Авторы планируют продолжить наблюдение
за больными и новорожденными
в течение как минимум 10 лет с
целью убедиться, что это не только безопасно в первые несколько
лет, но и безопасно в долгосрочной перспективе, помня о риске
позднего рецидива у больных рецептороположительным раком молочной железы. Есть надежда, что
позитивные 3-летние результаты
исследования POSITIVE сделают
возможным безопасное прерывание адъювантной гормонотерапии
для беременности и родов молодыми больными раком молочной железы, желающими иметь ребенка.
Источники:
1. Lambertini M, Blondeaux E, Bruzzone M, et al. Pregnancy after breast cancer: a systematic review and meta-analysis. J Clin Oncol. 2021 Oct 10; 39(29): 3293-3305.
2. Partridge A. Preganacy outcomes
and safety in interrupting therapy
for women with endocrine responsive
breast camcer: initial results from the
POSITIVE trial. San Antonio Breast
Cancer Symposium 2022, abstract
GS4-09.
КОГДА РЕГУЛЯТОР НЕ ТОЛЬКО РЕГУЛИРУЕТ, НО И ДУМАЕТ…
Автор: Жуков Николай Владимирович
ФГБУ «НМИЦ Детской гематологии, онкологии и иммунологии им. Д. Рогачева»,
доктор медицинских наук, профессор, Москва
В последние годы было слышно
достаточно много критики в отношении FDA, являющегося основным регулятором обращения
лекарственных препаратов в США.
Ему ставили в вину и то, что ряд
онкологических препаратов регистрируется необоснованно быстро
– по механизму ускоренной регистрации (до получения данных
по общей выживаемости), и то,
что некоторые прорывные препараты, наоборот, регистрируются
слишком медленно из-за слишком
забюрократизированной системы одобрения. И самое главное,
что, казалось бы, в рамках одних
и тех же правил игры получается,
что одни препараты попадают под
первый сценарий, а другие – под
второй. В отношении отечественного регулятора подобных заявлений ни в последние годы, ни ранее
публично не звучало, но, как мне
кажется, мы понимаем, что одобрение зарубежных препаратов
нашим Минздравом происходило
на основании одобрения FDA (ну,
и EMA), с некоторыми нюансами
в виде обязательного наличия исследований, проходивших в РФ, и
т.д. А значит очевидно, что в целом
мы играем по тем же правилам, что
и FDA. Более того, в ряде случаев
по правилам даже более «мягким»
в отношении ускоренной регистрации – на своем рынке FDA отзывает показания хотя бы у части
препаратов, не показавших увеличение общей выживаемости в подтверждающих исследованиях, а в
РФ (как и в странах Европы) этого,
увы, не происходит.
Но недавно произошло событие, за которое (как мне кажется)
американскому регулятору можно «многое простить», т.к. это
свидетельство «разворота» (хотя
бы частичного) от безудержного
формального «регулирования» по
правилам чиновников и фармацевтического бизнеса в сторону
истинных интересов врача и пациента.
Речь идет о шаге в сторону снятия
«головной боли» многих врачей
как в США, так и РФ (но головная боль пока снимается только
у наших американских коллег)
– расширении показаний к старым препаратам, «вышедшим в
тираж». Не секрет, что по мере
«старения» препарата, а тем более
после прекращения патентной защиты и появления дженериков,
фармацевтические компании постепенно теряют интерес к регистрации новых показаний для них.
И рано или поздно этот интерес
становится равен нулю. А подать
и «отстоять» заявку на расширение показаний к использованию
препарата, увы, физически может
лишь «фарма» с ее богатыми ресурсами и огромным штатом, существующим только для решения
этой конкретной задачи. В итоге
получается парадоксальная ситуация – исследования по новым показаниям (зачастую, как минимум
не уступающие по уровню доказательности регистрационным) есть,
а регистрации по этим показаниям – нет. А нет записи в инструкции – есть проблемы у доктора
(кто-нибудь из «проверяющих или
регулирующих» рано или поздно
решит «оптимизировать» назначение терапии и окажется, что лечим
то мы off label, а значит, за это надо
наказать и оштрафовать). Классический пример – детские опухоли,
большинство из которых лечатся
цитостатиками, давно «вышедшими в тираж» во времена, когда
малочисленная педиатрическая
популяция была вообще не интересна «фарме». Доказательные
исследования в детской популяции были проведены, но «поезд
ушел» – препараты давно стали
дешевыми дженериками, а значит
подавать новые показания на регистрацию оказалось некому. Но,
как мы хорошо знаем, касается
это проблема не только детей, но и
взрослых, более того, часто взрослых с весьма распространенными
опухолями.
Что же такого хорошего совершило FDA?
Да, казалось бы, всего-то ничего… В рамках пилотного проекта под названием Project Renewal initiative (не совсем уверен в переводе, но будем считать, что это «Инициативный проект Обновление») FDA самостоятельно (т.е. без инициативы со стороны «фармы», а исходя из анализа медицинских и научных доказательств) существенно расширило официальные (т.е. занесенные в инструкцию) показания к назначению капецитабина. Да, пока одно лекарство, но… Но главное – направление движения, а оно таково: целью данной пилотной программы является обновление показаний к использованию «старых» онкологических препаратов, с внесением клинически значимых по мнению медицинского сообщества и подкрепленных результатами проведенных исследований изменений. Капецитабин оказался первым из препаратов, показания к которому были пересмотрены в рамках этого проекта. И показания пополнились более чем существенно – к ранее имевшимся весьма ограниченным показаниям в области лечения метастатического колоректального рака, рака молочной железы, а также адъювантной терапии колоректального рака III стадии добавились (или изменились формулировки):
1. адъювантная терапия пациентов с III стадией рака толстой кишки в качестве монотерапии или компонента комбинированных режимов;
2. предоперационная терапия взрослых пациентов с местнораспространенным раком прямой кишки в качестве компонента химиолучевого лечения;
3. лечение пациентов с нерезектабельным или метастатическим колоректальным раком в качестве монотерапии или компонента комбинированного режима;
4. монотерапия распространенного или метастатического рака молочной железы у больных, которым не показана терапия с использованием антрациклинов или таксанов;
5. лечение распространенного или метастатического рака молочной железы в комбинации с доцетакселом в случае прогрессирования заболевания на антрациклин-содержащей терапии;
6. лечение взрослых пациентов с нерезектабельным или метастатическим раком желудка, пищевода или пищеводно-желудочного перехода в составе комбинированных режимов химиотерапии;
7. лечение взрослых больных HER2- позитивным метастатическим раком желудка или пищеводножелудочного перехода, ранее не получавших терапии по поводу метастатического заболевания, в качестве компонента комбинированного режима;
8. адъювантное лечение взрослых больных с аденокарциномой поджелудочной железы в качестве компонента комбинированного режима.
Также были изменены режимы
дозирования препарата, а именно включена в показания более
низкая стартовая доза препарата
для лечения пациентов с метастатическим раком молочной железы. В новой инструкции также
«убрали» противопоказание об
использовании препарата у больных с выраженными нарушениями функции почек, появилось
новое предупреждение о недопустимости использования таблеток с нарушенной целостностью и
информация о риске применения
препарата у больных с дефицитом
дигидропиримидин дегидрогеназы (DPD).
Думаю, что по прочтению новых
показаний многие все равно отметили сохранившийся «чиновничий» стиль их написания, а
большинство, скорее всего, воскликнули «А где же…?» (где же
адъювантная терапия у больных
раком молочной железы, не ответивших полным лечебным патоморфозом на неоадъювант, где же
холангиоцеллюлярный рак, где
же мой любимый и эффективный
капецитабин-содержащий режим
при…). Согласен, не идеально. Но
«их» регулятор подобный шаг в
сторону упрощения жизни врачей и приведение инструкций в
соответствие с медицинской логикой все же сделал, интересно –
сделает ли наш…
ОЛАНЗАПИН В КОМБИНАЦИИ С АНТАГОНИСТОМ РЕЦЕПТОРОВ СЕРОТОНИНА (5-НТ3) И ДЕКСАМЕТАЗОНОМ КАК ПРЕДПОЧТИТЕЛЬНЫЙ ВАРИАНТ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ТОШНОТЫ И РВОТЫ ПРИ ВЫСОКО- И УМЕРЕННОЭМЕТОГЕННЫХ РЕЖИМАХ ХИМИОТЕРАПИИ
Авторы: Орлова Рашида Вахидовна
Заведующая кафедрой онкологии медицинского факультета
ФГБОУВО «Санкт-Петербургский государственный университет»,
главный специалист по клинической онкологии СПб ГБУЗ «Городской клинический онкологический диспансер»,
член правления RUSSCO доктор медицинских наук, профессор, Санкт-Петербург
Иванова Анастасия Константиновна
Врач-онколог 11-ого химиотерапевтического отделения СПб ГБУЗ «Городской клинический онкологический диспансер», Санкт-Петербург
Авраменко Инна Владимировна
Заведующая 11 химиотерапевтическим отделением СПб ГБУЗ «Городской клинический онкологический диспансер», Санкт-Петербург
Тошнота и рвота (ТиР) являются
одними из самых часто встречаемых осложнений при проведении химиотерапии [1]. Несмотря на имеющиеся в настоящее
время алгоритмы лечения ТиР,
некоторые проблемы в данной
области все же сохраняются: недооценка эметогенности проводимой химиотерапии, а также
ограниченная доступность препаратов для купирования ТиР
при проведении высокоэметогеннной и умеренноэметогенной химиотерапии (антагонисты
NK1 рецепторов: аперепитант,
фосапрепитант, нетупитант). В
2003 году взгляд был обращен на
оланзапин в качестве препарата
для профилактики тошноты и
рвоты в условиях паллиативной
помощи среди пациентов с ТиР,
в частности, вызванной применением опиоидов [2]. Оланзапин
по своим фармакологическим
свойствам относится к нейролептикам, обладает антипсихотическим, нейролептическим
действием, его антиэметогенный
механизм действия остается не
до конца изученным, вероятнее
всего, опосредован блокадой дофаминовых и 5-НТ2-рецепторов.
В РФ оланзапин зарегистрирован для лечения и поддерживающей терапии шизофрении, биполярного психоза.
В 2015 году на симпозиуме, посвященном паллиативной помощи у пациентов с онкологическими заболеваниями, были
представлены результаты рандомизированного двойного контролируемого исследования III
фазы А221301 по профилактике
и лечению ТиР, демонстрирующего преимущество применения 4-компонентной схемы,
включающей антагонист NK1-
рецепторов, оланзапин, антагонист рецепторов серотонина
(5-HT3) и дексаметазон, при проведении высокоэметогенного режима химиотерапии [3].
В 2019 году на конгрессе ASCO
на сессии по симптоматической и поддерживающей терапии результаты своей работы
представил наш соотечественник А.А. Румянцев, который
в своем исследовании показал
преимущество использования
схемы оланзапин + антагонист
рецепторов серотонина (5-HT3)
+ дексаметазон в сравнении со
схемой, включающей антагонист
NK1-рецепторов + антагонист
рецепторов серотонина (5-HT3)
+ дексаметазон у пациентов,
которые получали высокоэметогенные схемы химиотерапии
[4]. Также он в своей работе обратил внимание на экономическую доступность оланзапина
для использования в широком
диапазоне данного препарата в
качестве профилактики ТиР [5].
В 2020 году оланзапин был внесен в клинические рекомендации RUSSCO как одна из опций
первоначальной профилактики
тошноты и рвоты для всех пациентов, получающих высокоэметогенную химиотерапию.
Препарат рекомендован к применению в дозе 5 мг 1 раз в сутки
перорально (в первый день – не
менее чем за час до начала химиотерапии или накануне вечером)
в сочетании со стандартными
препаратами для профилактики
тошноты и рвоты – блокаторами
5-HT3 рецепторов и дексаметазоном. Однако, как показывает
практика, широкого резонанса
этот препарат не приобрел и используется только в единичных
клиниках нашей страны.
В 2021-2022 годах опубликован
ряд статей, демонстрирующих
экономическую доступность
препарата оланзапин при равной
эффективности в сравнении с
антагонистами NK1-рецепторов.
Так, в США ожидаемая стоимость схем с оланзапином составляет $325,24 по сравнению с
$551,23 для схем без оланзапина
[6]. Китайские коллеги из различных университетских онкологических клиник в своем
исследовании также показали
сопоставимую эффективность
оланзапина в сравнении с антагонистами NK1-рецепторов при
проведении высокоэметогенных
схем лечения, однако применение оланзапина оказалось экономически более рациональным
[7].
Затраты клиник РФ для обеспечения одного пациента препаратом оланзапин на 1 цикл
высоко/умеренноэметогенной
химиотерапии составит ~199
рублей, тогда как обеспечение
антагонистами NK1-рецепторов
может обойтись клинике в ~4141
рубль (на примере СПб ГБУЗ «Городской клинический онкологический диспансер»).
Учитывая эффективность антиэметогенных схем с включением
оланзапина для профилактики
ТиР, их экономическую доступность, в рамках круглого стола
по поддерживающей терапии с
ведущими экспертами (модератор профессор Орлова Рашида
Вахидовна) на конференции «Исследования, меняющие клиническую практику» 2-4 декабря 2022
года было рекомендовано внести
правки в рекомендации RUSSCO
по лечению ТиР с уточнением
предпочтительных и альтернативных режимов (таблица).
Таблица 1.
Режимы для профилактики ТиР при проведении высоко/умеренноэметогенной химиотерапии.

Источники:
1. Dranitsaris G, Molassiotis A, Clemons M, et al. The development of a prediction tool to identify cancer patients at high risk for chemotherapy-induced nausea and vomiting, Ann.Oncol. 2017; 28 (6): 1260-1267.
2. Jackson WC, Tavernier L. Olanzapine for Intractable Nausea in Palliative Care Patients. Journal of Palliative Medicine. Apr 2003.
3. Navari RM, Qin R, Ruddy KJ, et al. Olanzapine (OLN) versus placebo in combination with standard antiemetics for the prevention of chemotherapyinduced nausea and vomiting (CINV) in patients receiving highly emetogenic chemotherapy (HEC): Alliance A221301, a randomized, double blind, phase III triale. J Clin Oncol. 2015; 33 (suppl 29S), abstr 176.
4. Rumyantsev A, Glazkova E, Nasyrova R, et al. Olanzapine (OLN) versus aprepitant (APR) in patients receiving high-emetogenic chemotherapy: Final results of randomized phase II trial. J Clin. Oncol. 2019; 37 (Suppl), abstr 11504.
5. Румянцев А.А., Тюляндина А.С., Федянин М.Ю., Трякин А.А., Покатаев И.А. и соавт. Доступность современной антиэметогенной терапии в России: анализ государственных закупок для оценки клинической практики. Практическая онкология. 2019, Т.20, №3.
6. Chow R, Chiu L, Herrstedt J, et al. Cost-effectiveness analysis of olanzapinecontaining antiemetic therapy for the prophylaxis of chemotherapy-induced nausea and vomiting (CINV) in highly emetogenic chemotherapy (HEC) patients. Support Care Cancer. 2021 Aug; 29(8): 4269-4275. doi: 10.1007/ s00520-020-05977-x.
7. Liu G, Jin Y, Jiang Y, et al. A
Comparison of the Efficacy of 5 mg
Olanzapine and Aprepitant in the
Prevention of Multiple-Day Cisplatin
Chemotherapy- Induced Nausea and
Vomiting. Hindawi International
Journal of Clinical Practice. 2022;
Vol.2022, article ID 5954379, 8 pages.
https://doi.org/10.1155/2022/5954379.
ЭФФЕКТИВНОСТЬ СЕЛПЕРКАТИНИБА И ПРАЛСЕТИНИБА У БОЛЬНЫХ НЕМЕЛКОКЛЕТОЧНЫМ РАКОМ ЛЕГКОГО С RET-FUSION. ДАННЫЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯ LIBRETTO-001 I/II ФАЗЫ И ARROW I/II
RET-fusion определяется у 1-2%
больных немелкоклеточным раком
легкого (НМРЛ), а также при папиллярном раке щитовидной железы
(10-20%), аденокарциноме толстой
кишки (<1%) и потоковом раке молочной железы (<1%).
Ген RET (REarranged during
Transfection) кодирует трансмембранный тирозинкиназный рецептор RET. Известны три изоформы
рецептора RET, образующиеся в
результате альтернативного сплайсинга (RET9, RET43 и RET51). Fusion
гена RET c другими генами (KIF5BRET (26%), CCDC6-RET (26%),
NCOA4-RET (13%) и др.) приводит
к аберрантной активности таких
внутриклеточных сигнальных путей, как PI3K/Akt/mTOR и MAPK/
ERK (рис.1).
Рисунок 1.
Схема сигнального
пути RET

В настоящий момент представлены
данные об эффективности таких
ингибиторов тирозинкиназного домена рецептора RET, как пралсетиниб (исследование ARROW, I/II фаза)
и селперкатиниб (исследование
LIBRETTO-001, I/II фаза).
В одну из групп мультикогортного
исследования ARROW включались
пациенты с различными солидными
злокачественными новообразованиями с RET-fusion (за исключением
НМРЛ и рака щитовидной железы).
Двадцать девять пациентов в поздних линиях лечения получили пралсетиниб (Гаврето) в дозе 400 мг/сутки
до прогрессирования заболевания
или неприемлемой токсичности. Эффективность терапии оценена у 23
больных, частота объективного ответа (ОО) достигла 57% и при контроле
роста опухоли (КРО) в 83% и медиане длительности ответа в 11,7 мес.
В другую группу исследования
ARROW скринированы 233 больных
НМРЛ с RET-fusion, данные об эффективности терапии представлены
по 127 больным.
В группе пациентов (n=87), ранее получавших химиотерапию на основе платины по поводу диссеминированного НМРЛ, частота ОО составила 61% (6% полных эффектов), а медиана ВБП – 17,1 мес. (рис.2а). При медиане времени наблюдения в 17,1 мес. медиана ОВ не достигнута. В когорте больных (n=27), для которых пралсетиниб был первой линией лечения, частота ОО достигла 70% (11% полных эффектов), а медиана ВБП – 9,1 мес. (рис.2в).
Рисунок 2.
Эффективность пралсетиниба при НМРЛ
с RET-fusion
При медиане
времени наблюдения в 13,6 мес. медиана ОВ не достигнута.
Нежелательные явления 3 степени и
выше были преимущественно представлены нейтропенией (19%), гипертензией (11%), анемией (10%) и
повышением КФК (4%).
Селперкатиниб (LOXO-292,
RETEVMO) – селективный ингибитор тирозинкиназного домена рецептора RET.
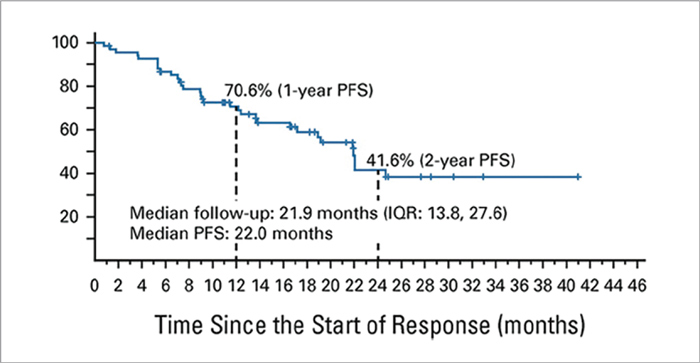
Исследование LIBRETTO-001 – это многоцентровое исследование I/II фазы посвященное изучению эффективности и безопасность селперкатиниба у больных НМРЛ с fusion гена RET. В исследование включено 356 больных НМРЛ с RET-fusion, 69 пациентам селперкатиниб был назначен в первой линии терапии. Большинство пациентов были некурящими женщинами с ECOG статусом 1 и KIF5BRET реаранжировкой. В группе больных, ранее не получавших лекарственной терапии по поводу диссеминированного НМРЛ, частота ОО достигла 84% (6% полных эффектов) при медиане ВБП в 22,0 мес., таким образом, 12-месячная ВБП достигла 70,6% при 24-месячной в 41,6% (рис.3).
Рисунок 3.
Выживаемость без прогрессирования в группе
пациентов, ранее не получавших терапию.
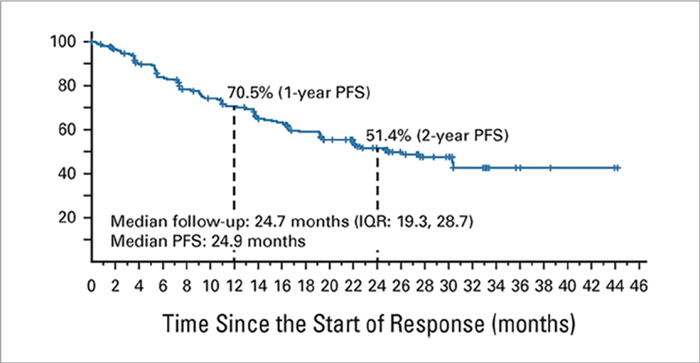
При медиане времени наблюдения 25,2 мес. медиана ОВ не достигнута. В когорте пациентов, ранее получавших химиотерапию на основе платины, частота ОО составила 61% (7% полных эффектов), а медиана ВБП достигла 24,9 мес. при 12-месячной ВБП в 70,5% и 24-месячной в 51,4% (рис.4).
Рисунок 4.
Выживаемость без прогрессирования в группе
пациентов, ранее получавших терапию на основе препаратов
платины.
При медиане времени наблюдения 26,4 мес. медиана ОВ не
достигнута.
У 106 пациентов, включенных в исследование, было метастатическое
поражение головного мозга и/или
его оболочек. В этой группе пациентов медиана ВБП составила 19,4
мес. при частоте ОО (при измеряемых метастазах в головном мозге
26/106) по очагам в головном мозге
в 85% (полный эффект – 27%).
НЯ 3 степени и выше были преимущественно представлены гипертензией (19,7%), повышением
уровня АЛТ (11,4%) и АСТ (8,8%),
диарей (5,0%) и удлинением интервала (4,8%). SAEs были зарегистрированы у 44% пациентов и в 11%
случаях были связаны с терапией
селперкатинибом. Редукция дозы
потребовалась 41% больных и 8%
пациентов прекратили терапию в
связи с НЯ.
Таким образом, селперкатиниб и
пралсетиниб демонстрируют высокую эффективность не только в
первой, но и в поздних линиях лечения, в том числе (селперкатиниб)
у пациентов с метастатическим поражением головного мозга. Препараты демонстрируют ожидаемую и
контролируемую токсичность.
Источники:
1. Alexander Drilon, et al. Selpercatinib in Patients With RET Fusion-Positive Non-Small-Cell Lung Cancer: Updated Safety and Efficacy From the Registrational LIBRETTO-001 Phase I/ II Trial. Accepted on July 29, 2022 and published at ascopubs.org/journal/jco on September 19, 2022. DOI: https://doi. org/10.1200/JCO.22.00393.
2. Gainor JF, et al. Pralsetinib for RET fusion-positive non-small-cell lung cancer (ARROW): A multi-cohort, openlabel, phase 1/2 study. Lancet Oncol. 2021; 22: 959-969.
3. Belli C, Anand S, Gainor JF, et al.
Progresses toward precision medicine in
RET-altered solid tumors. Clin Cancer
Res. 2020; 26: 6102-6111.
НОВОСТИ BREAST CANCER SYMPOSIUM В SAN ANTONIO 2022: СОВРЕМЕННЫЕ СТРАТЕГИИ ТЕРАПИИ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ
Автор: Титова Татьяна Александровна
Врач-онколог химиотерапевтического отделения №1
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России,
кандидат медицинских наук, Москва
C 6 по 10 декабря 2022 года в San
Antonio, США, прошел очередной симпозиум, посвященный
лечению рака молочной железы
(РМЖ). Ежегодно на конференции
обсуждаются актуальные работы,
результаты которых активно внедряются в клиническую практику
во всем мире.
На конгрессе представлена панель важных исследований, отражающих тенденции терапии
гормонозависимого (ГР+) HER2-
негативного рака молочной железы. Несмотря на внедрение новых
препаратов, разработку современных комбинаций лечения и оптимизацию последовательности
линий терапии при ГР+/HER2-
отрицательном РМЖ за последние
15 лет, медиана ОВ колеблется в
пределах 45-64 месяцев, и значимых успехов в ее увеличении нет
[1].
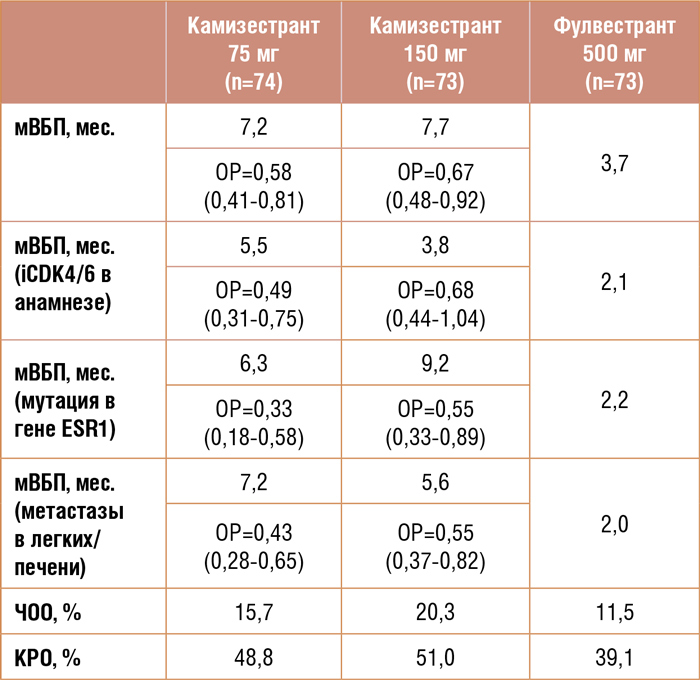
Исследование 2 фазы SERENA2
было посвящено новому SERD (селективный деграйдер эстрогеновых рецепторов) камизестранту. В
работе изучалась эффективность
камизестранта в различных дозовых режимах в сравнении с фулвестрантом в поздних линиях терапии ГР+/HER2-отрицательного
диссеминированного РМЖ
(мРМЖ) у женщин в менопаузе.
Пациенты, включенные в работу,
ранее получали не менее 1 линии
гормонотерапии/химиотерапии
по поводу мРМЖ.
Первичной конечной точкой исследования была медиана ВБП,
вторичными – контроль роста
опухоли (КРО), частота объективного ответа (ЧОО), медиана ОВ и
токсичность терапии.
Пациенты рандомизированы
в три лечебные группы:
n=74: фулвестрант
500 мг в/м 1 раз в 28 дней;
n=73: камизестрант 75 мг
1 раз в день, ежедневно, внутрь;
n=73: камизестрант 150 мг
1 раз в день, ежедневно, внутрь.
Мутация в гене ESR1 выявлена в
29,7% и 35,6% случаях в когортах пациентов, получавших камизестрант в дозах 75 мг и 150 мг, и в
47,9% – в группе больных, получавших фулвестрант. Ингибиторы CDK4/6 (iCDK4/6) в анамнезе
у 51,4%, 50,7% и 50,7% пациентов
соответственно.
Медиана ВБП в группах камизестранта в дозах 75 мг и 150 мг
достигла 7,2 мес. и 7,7 мес., а в
группе фулвестранта – 3,7 мес.
Таким образом, продемонстрирована сопоставимая эффективность
камизестранта в дозе 75 мг и 150 мг и
статистически значимое увеличение
мВБП при терапии камизестрантом
в сравнении с фулвестрантом (рис.1).
Рисунок 1.
Выживаемость без прогрессирования

Назначение камизестранта позволило значимо увеличить медиану ВБП
у пациентов с висцеральными метастазами, мутацией в гене ESR1 и ранее получавших iCDK4/6. Подробно
результаты терапии представлены в
таблице 1.
Таблица 1.
Результаты исследования SERENA2
Нежелательные явления (НЯ) любой степени в группах камизестранта 75 мг и 150 мг зарегистрированы
у 77,0% и 90,7% пациентов, в группе
фулвестранта – у 68,5% больных и
были преимущественно представлены анемией (10,8%, 15,1% и 6,8%), а в
группах камизестранта – фотопсией
(12,2% и 24,7%) и брадикардией (5,4%
и 26,0%). НЯ 3 степени и выше были
редкими и отмечены у 1,4%, 2,7% и
1,4% пациентов в когортах соответственно [2].
Другая важная работа – исследование PACE. В исследовании изучалась эффективность фулвестранта и/или палбоциклиба и/или
авелумаба в поздних линиях ГР+/
HER2-отрицательного диссеминированного РМЖ у пациентов, ранее
получавших iCDK4/6. Интересно
именно повторное назначение/продолжение iCDK4/6. Напомним, на
ASCO 2022 было представлено исследование MAINTAIN, в котором продемонстрирована целесообразность
продолжения iCDK4/6 при прогрессировании после использования
этой группы препаратов в первой
линии лечения [10].
В исследовании PACE пациенты
были рандомизированы в 3 лечебные
группы:
n=55: фулвестрант 500 мг
1 раз в 28 дней;
n=111: фулвестрант 500 мг в 1 день +
палбоциклиб 125 мг с 1-21 дни, курс
28 дней;
n=54: фулвестрант 500 мг в 1 день
+ авелумаб 10 мг/кг + палбоциклиб
125 мг с 1-21 дни, курс 28 дней.
В общей группе больных продемонстрирована равная эффективность фулвестранта и фулвестранта
с палбоциклибом, мВБВ в лечебных
группах составила 4,8 и 4,6 мес. соответственно, и численно большая
мВБП при комбинации фулвестранта с палбоциклибом и авелумабом,
достигшая 8,1 мес. (рис.2).
Рисунок 2.
Выживаемость без прогрессирования

При подгрупповом анализе показано, что максимальный эффект при
назначении комбинации фулвестранта с палбоциклибом и авелумабом отмечается в группе пациентов с мутациями в генах ESR1 и PIK3CA.
Подробно результаты терапии представлены в таблице 2.
Таблица 2.
Результаты исследований PACE и MAINTAIN
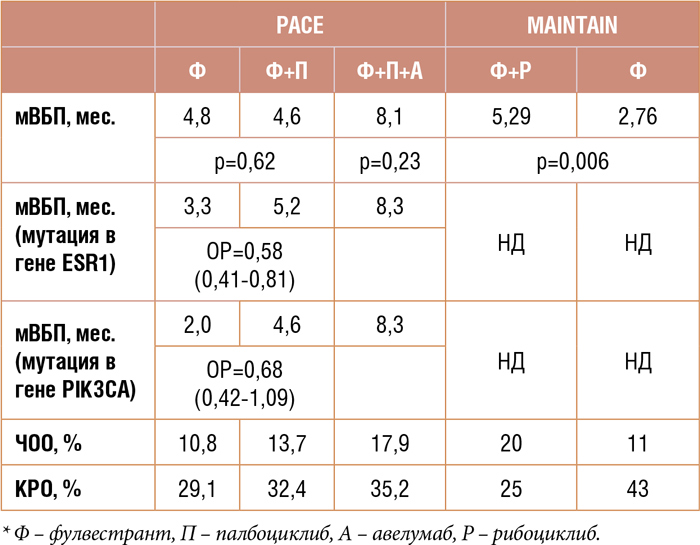
Авторы сделали вывод, что добавление палбоциклиба к фулвестранту после использования iCDK4/6 в
предшествующих линиях лечения
нецелесообразно, но, учитывая
данные других работ, для окончательного ответа на вопрос необходимо дождаться результатов исследований PALMIRA, EMBER-3 и
PostMONARCH. В этом исследовании также интересна эффективность анти-PD-L1 терапии при ГР+/ HER2-отрицательном РМЖ, но делать выводы о ее целесообразности
преждевременно [4].
Обновленные данные об эффективности сацитузумаба говитекана в
поздних линиях терапии ГР+/HER2-
отрицательного диссеминированного РМЖ были представлены в исследовании TROPiCS-02.
Cацитузумаб говитекан – еще один
современный конъюгат АТ к рецептору TROP2 и цитостатика SN38
(метаболит иринотекана). Он одобрен FDA в поздних линиях терапии
тройного негативного РМЖ и уротелиального рака.
Рецептор TROP2 экспрессируется
на поверхности опухолевых клеток у 95% больных HR+/HER2-
отрицательным РМЖ и в большинстве случаев (58%) уровень
экспрессии H-score ≥100.
В работу были включены 543 пациентки, ранее получавшие эндокринотерапию, iCDK4/6 и таксаны. Больные были рандомизированы в две
лечебные группы:
n=272: сацитузумаб говитекан 10 мг/
кг в/в капельно в 1 и 8 дни, курс 21
день;
n=271: химиотерапия по выбору
исследователя (капецитабин, винорельбин, гемцитабин, эрибулин).
При медиане времени наблюдения
в 10,2 мес. назначение сацитузумаба говитекана позволило увеличить медиану ВБП с 4,0 до 5,5
мес. (p=0,0003), 6-месячную ВБП –
с 30,3% до 46,1%, 12-месячную ВБП
– с 7,1% до 21,3% и снизить риск прогрессирования на 33% (рис.3).
Рисунок 3.
Выживаемость без прогрессирования и общая
выживаемость

Терапия сацитузумабом говитеканом привела к значимому увеличению медианы ОВ с 11,2 до 14,4
мес. (p=0,020), 12-месячной ОВ
– с 47,0% до 61,0% и снизило риск
смерти на 21% (рис.3).
Рисунок 4. . Эффективность адъювантной ГТ в комбинации
с эверолимусом у пациенток в пременопаузе

ЧОО в группе сацитузумаба говитекана достигла 21%, 14% – в группе химиотерапии, КРО составил
34% и 22% соответственно.
При подгрупповом анализе было
показано, что эффективность не
зависела от уровня экспрессии
TROP2. При H-score≥100 медиана
ВБП составила 6,4 мес. против 5,3
мес. при H-score <100 и 5,5 мес. при
H-score <10, медианы ОВ также
численно в подгруппах не отличались и достигли 14,4 мес.,14,6 мес.
и 17,6 мес. [8].
Несколько разочаровывают результаты исследования SWOG
S1207, в котором было продемонстрировано, что блокада
пути PI3K-AKT-mTOR эверолимусом в комбинации с ГТ в адъювантной терапии ГР+/HER2-
отрицательного РМЖ у пациенток
с высоким риском прогрессирования не улучшает отдаленные результаты лечения в общей группе
больных. Добавление эвролимуса
к ГТ в ITT популяции не привело
к увеличению ни 5-летней IDFS
(74,9% и 74,4%; p=0,52), ни 5-летней
ОВ (85,8% до 88,1%; p=0,84).
Единственной подгруппой, в которой добавление эверолимуса
улучшило отдаленные результаты
терапии, была когорта пациенток
в пременопаузе, комбинация ГТ с
эверолимусом увеличивает 5-летнюю IDFS с 74,1% до 81,0% (ОР=0,64;
95% ДИ 0,44-0,94; p=0,02) и 5-летнюю ОВ с 86,0% до 95,7% (ОР=0,49;
95% ДИ 0,28-0,86; p=0,012) (рис.4).
Рисунок 5. . Результаты исследования MonarchE

В группе эверолимуса и ГТ НЯ
любой степени зарегистрированы
у 35% больных и были преимущественно представлены мукозитом
(7%), лимфопенией (4%), гипертриглицеридемией (4%) и гипергликемией (4%) [5].
На симпозиуме представлены обновленные результаты исследования MonarchE, также посвященного результатом адъювантной
терапии у пациентов с высоким
риском прогрессирования, но в
этой работе изучалась комбинация ЭТ с ингибитором CDK4/6
абемациклибом. Пациенты были
рандомизированы в 2 когорты в
зависимости от распространенности заболевания и уровня ki-67:
1 когорта: ki-67–low: ≥4 л/у, grade
3, T≥5 см;
2 когорта: ki-67–high: 1-3 л/у, ki67≥20%, grade 1-2, T<5 см.
Добавление абемациклиба к адъювантной ГТ в ITT популяции привело увеличению 4-летннй IDFS с
79,4% до 85,8% (+6,4%) и снизило
риск рецидива на 33,6% (p<0,0001).
При подгрупповом анализе показано, что комбинация абемациклиба с ГТ в 1 когорте (ki-67–low)
позволяет увеличить 4-летнюю
IDFS с 83,6% до 88,8% (+5,2%) и
снизить риск рецидива на 37,6%.
Во 2-й когорте (ki-67–high) назначение абемациклиба и ГТ привело к увеличению 4-летней IDFS с 74,7% до 82,4% (+7,7%) и снизило
риск рецидива на 38,2%.
В исследовании DESTINYBreast02 оценивалась эффективность трастузумаба дерукстекана
(T-DXd) в сравнении с химиотерапией в комбинации с трастузумабом (TPC) в поздних линиях лечения HER2-положительного РМЖ
у пациентов, ранее получивших
трастузумаб эмтанзин. В настоящий момент стандартом второй
линии терапии HER2-зависимого
рака молочной железы является
трастузумаб эмтанзин, но трастузумаб дерукстекан является его
прямым конкурентом. В ранее
представленном исследовании
DESTINY-Breast03 проводилось
сравнение эффективности T-DXd
и T-DM в поздних линиях терапии
HER2-позитивного дРМЖ, и при
медиане времени наблюдения в
16,2 мес. и 15,3 мес. медиана ВБП
в группе T-DXd не была достигнута, а в группе T-DM1 составила 6,8
мес. [11]. Но эффективен ли T-DXd
после T-DM1, оставалось неясно.
Рисунок 6. Результаты исследования DESTINY-Breast02
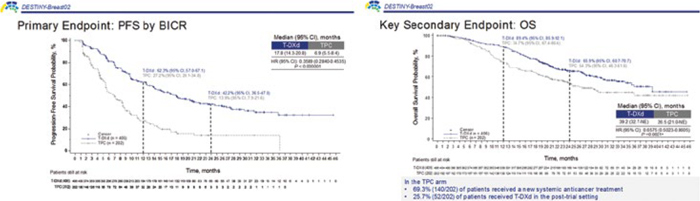
В исследование рандомизировано
606 пациентов:
n=406: T-DXd 5,4 мг/кг 1 раз в 28
дней;
n=202: трастузумаб/капецитабин
или лапатиниб/капецитабин.
Первичной конечной точкой была
медиана выживаемости без прогрессирования (мВБП), вторичными – медиана общей выживаемости (ОВ), объективный ответ
(ОО), длительность объективного
(ДОО) и токсичность.
В настоящей работе показано,
что назначение T-DXd в сравнении с TPC позволяет увеличить
мВБП с 6,9 до 17,8 мес., то есть в 2,5
раза (ОР=0,36; 95% ДИ 0,28-0,45;
p<0,000001), 12-месячную ВБП – с
27,2 % до 62,3% и 24-месячную ВБП
– с 13,9% до 42,2%.
При подгрупповом анализе показано, что преимущество в ВБП достигалось независимо от возраста,
уровня ГР, наличия висцеральных
метастазов, количества линий терапии в анамнезе и очагов в головном мозге.
Назначение T-DXd в сравнении с
TPC позволило увеличить мОВ с
26,5 до 39,2 мес. (ОР=0,65; 95% ДИ
0,50-0,86; p<0,0021), 12-месячную
ОВ – с 74,7% до 89,4% и 24-месячную ОВ – с 54,3% до 65,9% (рис.6).
ЧОО в группе T-DXd достигла
69,7% против 29,2% в группе TPC
при длительности ОО в 19,6 мес.
и 8,3 мес. соответственно. КРО в
когорте T-DXd составил 82,3% против 46,0% в группе TPC.
НЯ 3 степени и выше были зарегистрированы у 52,7% в группе T-DXd (ILD – 1,2%) и у 44,1%
в группе TPC и преимущественно были представлены тошнотой
(72,5% и 37,4%), рвотой (37,6% и
12,8%), слабостью (36,4% и 26,7%)
и диарей (27,0% и 53,8%). Пульмониты зарегистрированы у 42 пациентов в группе T-DXd: 1 степени
– у 11 (2,7%), второй – у 26 (6,4%),
3 степени – у 3 (0,7%) и 2 больных
(0,5%) погибли от пульмонита, ассоциированного с терапией T-DXd
[9].
Рисунок 7. Результаты исследования RIGHT Choice
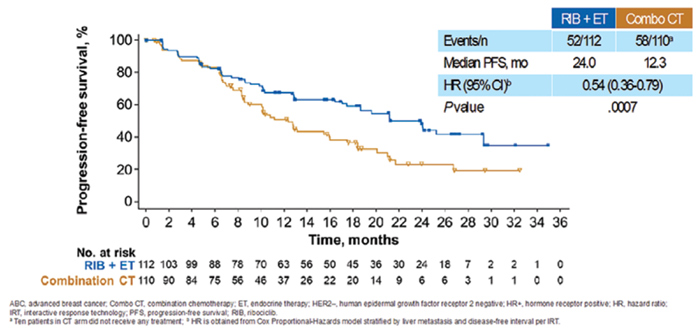
На SABCS 2022 представлены первые результаты рандомизированного исследования 2 фазы RIGHT
Choice, в котором у пациенток в
пременопаузе с агрессивным ГР+/
HER2-отрицательным распространенным РМЖ в первой линии лечения оценивалась эффективность
рибоциклиба (РИБ) в комбинации
с летрозолом и химиотерапией.
Первичной конечной точкой исследования была медиана выживаемости без прогрессирования (ВБП),
вторичными – время до прекращения лечения, частота неэффективности лечения в течение 3 месяцев,
частота достижения объективного
ответа (ЧОО), время до реализации ответа на лечение, медиана
общая выживаемости (мОВ), токсичность.
В исследование были включены
222 больных в пременопаузе с ГР+/
HER2-отрицательным РМЖ, и более чем у половины больных, включенных в исследование, была клиническая картина висцерального
криза.
Пациенты были рандомизированы
в две лечебные группы:
n=112: рибоциклиб в комбинации
с ингибиторами ароматазы (летрозол или анастрозол) и гозерелином;
n=110: комбинированная химиотерапия по выбору врача.
Большинство пациентов, включенных в исследование, были старше
40 лет (71,4% и 65,5%), с впервые
выявленным диссеминированным
РМЖ (63,4% и 66,4%) и синхронными метастазами в легких и печени (79,5% и 77,3%).
При медиане времени наблюдения
в 24,1 мес. медиана ВБП в группе
РИБ и ГТ достигла 24 мес. против 12,3 мес. в группе химиотерапии (ОР=0,54; 95% ДИ 0,36-0,79;
p=0,0007), что позволило снизить
риск прогрессирования на 46%
Медиана времени до прекращения лечения в связи с прогрессированием заболевания в группе РИБ+ГТ составила 18,6 мес. и
8,5 мес. в группе химиотерапии
(ОР=0,45 [0,32-0,63]), ЧОО в группах достигли 65,2% и 60%, а время
до регистрации ответа – 4,9 и 3,2
мес. В группе РИБ+ГТ редукция
доз потребовалась 25,7% больных
против 46% в группе ХТ.
НЯ любой степени зарегистрированы у 100% пациентов в обеих группах и преимущественно
были представлены нейтропенией (82,1% и 49,0%), лейкопенией
(48,2% и 26,0%), анемией (33,9% и
40,0%), повышением уровней АСТ
(19,6% и 30,0%) и АЛТ (19,6% и
29,0%) и тошнотой (12,5% и 27,0%).
НЯ 3 степени и выше отмечены у
75% в группе рибоциклиба и 71% в
группе ХТ. В группе рибоциклиба
у 2 пациентов (1,8%) наблюдалось
удлинение интервала QT 3 степени
[7].
Источники:
1. Grinda T, Antoine A, Jacot W, et al. Evolution of overall survival and receipt of new therapies by subtype among 20 446 metastatic breast cancer patients in the 2008- 2017 ESME cohort. ESMO Open. 2021 Jun; 6(3): 100114. doi: 10.1016/j. esmoop.2021.100114. Epub 2021 Apr 23.
2. Oliveira M, et al. GS3-02 Camizestrant, a next generation oral SERD vs fulvestrant in postmenopausal women with advanced ER-positive HER2-negative breast cancer: Results of the randomized, multi-dose Phase 2 SERENA-2 trial.
3. Bardia A, et al. GS3-01 EMERALD phase 3 trial of elacestrant versus standard of care endocrine therapy in patients with ER+/HER2- metastatic breast cancer: Updated results by duration of prior CDK4/6i in metastatic setting.
4. Mayer EL, et al. GS3-06 Palbociclib After CDK4/6i and Endocrine Therapy (PACE): A Randomized Phase II Study of Fulvestrant, Palbociclib, and Avelumab for Endocrine Pretreated ER+/HER2- Metastatic Breast Cancer.
5. Chavez-MacGregor M, et al. GS1-07 Results from a phase III randomized, placebo-controlled clinical trial evaluating adjuvant endocrine therapy +/- 1 year of everolimus in patients with high-risk hormone receptor-positive, HER2- negative breast cancer: SWOG S1207.
6. Johnston S, et al. GS1-09 Abemaciclib plus endocrine therapy for HR+, HER2-, node-positive, highrisk early breast cancer: results from a pre-planned monarchE overall survival interim analysis, including 4-year efficacy outcomes.
7. Lu Y-S, et al. GS1-10 Primary results from the randomized Phase II RIGHT Choice trial of premenopausal patients with aggressive HR+/HER2- advanced breast cancer treated with ribociclib + endocrine therapy vs physician’s choice combination chemotherapy.
8. Rugo HS, et al. GS1-11 Sacituzumab Govitecan (SG) vs Treatment of Physician’s Choice (TPC): Efficacy by Trop-2 Expression in the TROPiCS-02 Study of Patients (Pts) With HR+/ HER2- Metastatic Breast Cancer (mBC).
9. Krop I, et al. GS2-01: Trastuzumab deruxtecan vs physician’s choice in patients with HER2+ unresectable and/or metastatic breast cancer previously treated with trastuzumab emtansine: primary results of the randomized phase 3 study DESTINYBreast02.
10.Kalinsky K, at al. A randomized, phase II trial of fulvestrant or exemestane with or without ribociclib after progression on anti-estrogen therapy plus cyclin-dependent kinase 4/6 inhibition (CDK 4/6i) in patients (pts) with unresectable or hormone receptor–positive (HR+), HER2-negative metastatic breast cancer (MBC): MAINTAIN trial. J Clin Oncol. 2022; 40 (suppl 17), abstr LBA1004. DOI 10.1200/ JCO.2022.40.17_suppl.LBA1004.
11.Cortés J, Kim SB, Chung WP,
et al; DESTINY-Breast03 Trial
Investigators. Trastuzumab
deruxtecan versus trastuzumab
emtansine for breast cancer. N Engl J
Med. 2022; 386(12): 1143-1154.
ДИСКУССИОННАЯ СЦЕНА. БЕССИМПТОМНЫЕ МЕТАСТАЗЫ В КОСТЯХ ПРИ РАКЕ МОЛОЧНОЙ ЖЕЛЕЗЫ: ЛЕЧИТЬ ИЛИ НАБЛЮДАТЬ?

Автор: Багрова Светлана Геннадьевна
Научный сотрудник отделения химиотерапии №1 отдела лекарственного лечения
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, кандидат медицинских наук, Москва
Метастатическое поражение костей
при раке молочной железы остается
актуальной проблемой, несмотря на
прогресс в ранней диагностике этого
заболевания и успехи противоопухолевого лекарственного лечения. Частота метастатического поражения
скелета при раке молочной железы
(РМЖ) составляет по разным данным 65-75%, незначительно «уступая» лишь раку простаты и множественной миеломе. Возможности
лечения пациентов с метастазами в
костях расширились благодаря применению препаратов, тормозящих
костную резорбцию, – остеомодифицирующих агентов (ОМА), а также
новым технологиям дистанционного
облучения и инновационным хирургическим техникам [1,2].
Цель применения антирезорбтивной
лекарственной терапии – купирование болевого синдрома, предотвращение или отсрочка скелетных событий. Сохраняя плотность костной
ткани, обеспечивается качество жизни пациента: сохраняется мобильность, снижается необходимость в
постороннем уходе [3,4].
Бисфосфонаты – группа препаратов,
аналогов пирофосфата костного матрикса, берет свое начало с создания
клодроната в 1992 году. Применение его при РМЖ позволило существенно снизить частоту скелетных
событий. Последующие поколения
препаратов этой группы показывали
все большую эффективность: в 1996
году в клинику пришел памидронат,
в 2002-2003 годах – ибандронат и, наконец, золедронат, который явился
самым активным бисфосфонатом
и прочно занял позиции в клинических рекомендациях по сопроводительной терапии при наличии у
больного метастазов в костной ткани
любых солидных опухолей. В 2010
году открылись новые возможности
в этой области: появился первый и
пока единственный таргетный препарат, воздействующий на костную
резорбцию, – деносумаб [5,6].
Естественно, все мы понимаем, что
применение ОМА является средством сопроводительного лечения,
основной эффект несет специфическое противоопухолевое лечение:
гормонотерапия, химиотерапия, таргетные препараты. Но поскольку
применение костно-направленной
терапии при наличии метастазов в
костях является обязательной рекомендацией для больных раком молочной железы, вряд ли какой онколог возьмет на себя ответственность
лишить больную этой опции лечения
[1,8,9]. Несмотря на это, с регулярной периодичностью в медицинских
кругах возникает дискуссия о целесообразности применения антирезорбтивных средств у больных с немногочисленными «бессимптомными»
метастазами в костях. Почему?
Вот несколько аргументов, ставящих под сомнение необходимость
и неотложность остеотропного лечения.
1. Большинство наблюдательных исследований по антирезорбтивной терапии показывают, что отсроченное
начало применения этих препаратов
не является критичным для пациентов с метастазами рака молочной
железы в костной ткани. Так, в большинстве европейских стран время
от момента диагностики метастазов
в скелете до получения первой дозы
ОМА при разных солидных опухолях
составляет не менее 3 месяцев. Также
известно, что даже регулярное применение антирезорбтивных средств
и высокая комплаентность пациентки к лечению не гарантируют отсутствие скелетных осложнений в процессе лечения. Так, согласно данным
агентства Министерства здравоохранения и социальных служб США, несмотря на применение ОМА у пациентов все равно развиваются костные
осложнения, будь то патологические
переломы позвонков или необходимость применения ЛТ. Причем частота их возрастает со временем: так, при
РМЖ скелетные события в первые 6
месяцев лечения отмечены у 38,7%
больных, а через 2 года – у 54,2%
[10,11].
2. А что мы понимаем под понятием
«бессимптомные метастазы в костях»?
Как известно, симптомами поражения скелета являются боль (чаще всего), деформации скелета и связанные
с этим нарушения мобильности и
повседневной жизнедеятельности. В
тяжелых случаях, при прогрессировании метастазов и развитии скелетных осложнений, мы имеем клиническую картину перелома, компрессии
спинного мозга, метаболических нарушений при гиперкальциемии. А
если этих симптомов нет? Нужно ли
отказываться от антирезорбтивного
лечения? Можно ли считать бессимптомным единственный литический
очаг в шейном отделе позвоночника?
Вряд ли опытный клиницист оставит
такую пациентку без остеотропной
терапии. Таким образом, определение «бессимптомности» весьма
субъективно. Проще сказать – его не
существует.
Врач обязан оценить риск костных
осложнений, который определяется
следующими факторами:
• множественность очагов;
• преобладание литической деструкции;
• расположение в опорном скелете
(позвонки, кости таза, трубчатые
кости);
• размеры очагов более 2 см, разрушение кортикального слоя
трубчатых костей;
• сопутствующая патология, влияющая на плотность костной ткани
(остеопороз, обменные нарушения,
кахексия, генетически обусловленная хрупкость костей и др.) [12,13].
А если все эти факторы отсутствуют
и мы имеем дело с олигометастатическим процессом (1-3 очага), поражены неопорные кости, отсутствуют какие-либо жалобы? На какие моменты
стоит еще обратить внимание, чтобы
принять оптимальное решение об антирезорбтивной терапии: назначить
прямо сейчас или позже?
3. Как известно, РМЖ относится к
опухолям, чувствительным к лекарственному лечению. Подавляющее
число случаев РМЖ является люминальным раком. Еще до эры молекулярных подтипов РМЖ онкологам
было известно, что поражение костей
характерно для гормонозависимого
рака. Сама гормонотерапия оказывает положительное влияние на репарацию костной ткани. По опросам
врачей-онкологов из 6 европейских
стран, показаниями для назначения
ОМА в рутинной клинической практике являются наличие болевого синдрома и угроза деструкции кости. В
остальных случаях применение данной группы препаратов может быть
отложено, а ряд специалистов вообще предпочитает провести оценку
эффективности основного противоопухолевого лечения, а только затем
добавить ОМА [3,10,14].
4. К сожалению, не существует данных о выживаемости больных с поражением костной системы при применении ОМА и без них. Современные
стандарты лечения не подразумевают
отказ от ОМА при наличии МТС в
костной ткани, а сравнение современных данных с данными о выживаемости пациентов «добисфосфонатной» эры некорректно, ведь сфера
лекарственного лечения рака молочной железы насыщена инновациями,
практически ежегодно в клиническую практику вводятся новые препараты, способные сами по себе существенно улучшать эффективность
лечения. Мы знаем, что ОМА способны отсрочить скелетные события
у этой категории больных, хотя и это
утверждение может быть спорным,
поскольку разграничить долю ОМА
и противоопухолевого агента в этом
эффекте невозможно [4,5,15].
5. Метастазы в костной ткани при
раке молочной железы, как правило,
носят смешанный характер, то есть
содержат как литические, так и бластические участки. Для клинициста
важно не столько определение типа
метастаза, сколько их локализация
в скелете. Излюбленными костями
для метастазирования являются позвоночный столб (особенно грудной
и поясничный отделы), кости таза; реже – ребра, трубчатые кости, свод
черепа; крайне редко – мелкие кости
конечностей, лицевой скелет [1,4,5].
Таким образом, если у пациентки
имеются метастазы в костях опорного скелета, откладывать антирезорбтивную терапию не стоит. За очагами,
расположенными, скажем, в ребрах
или костях черепа, можно наблюдать.
6. Безопасность остеомодифицирующих препаратов и мониторинг возможных токсических явлений.
Наиболее частым побочным явлением бисфосфонатов является их
нефротоксичность. Частота НЯ со
стороны почек при применении золедроновой кислоты составляет около
12%, деносумаб не обладает почечной
токсичностью, однако в большей степени способствует гипокальциемии
(5-13% по сравнению с 3,4-6% при
применении ЗК). Данное состояние,
как правило, протекает без выраженных клинических симптомов и
регистрируется лишь лабораторно.
Гипокальциемия является противопоказанием для введения ОМА. Также обязательным условием лечения
БФ является определение уровня
креатинина, прием препаратов кальция и витамина Д [1,5,6,16].
Таким образом, взвесив соотношение «риск-польза», назначение ОМА
у пациентов с ХБП нужно отложить,
хотя бы до окончания химиотерапии.
Такая же тактика должна быть при
отсутствии возможности регулярно
выполнять лабораторный мониторинг во избежание гипокальциемии.
Пожалуй, самым грозным осложнением использования антирезорбтивных средств является остеонекроз
челюсти. Частота его возрастает с
длительностью терапии и составляет при применении золедроновой
кислоты по литературным данным
от 1,2% до 6,2%, при применении деносумаба – от 1,8-4,2%. Совместное
использование ОМА с антиангиогенными препаратами, кортикостероидами резко повышает вероятность
возникновения данного осложнения.
Клиника остеонекроза часто стерта и
диагностируется только при участии
стоматолога. В 65% случаев провоцирующим фактором является экстракция зуба; из всех описанных случаев
более чем в 70% поражается нижняя
челюсть. Купирование данного осложнения не всегда простая задача.
Применяются как консервативные
методы (полоскания, антибиотикотерапия, аппликации), так и хирургические (удаление секвестров и даже
резекция кости) [1,9,16,17].
Контролировать состояние полости
рта пациентов в реальной практике
онкологу весьма проблематично.
Поэтому пациентке с наличием стоматологической патологии, скажем,
зубов с плохим прогнозом, плохо
контролируемых зубных конструкций, а также пациентке, планирующей в ближайшей перспективе
протезирование зубов, не стоит назначать ни деносумаб, ни золедроновую кислоту. Прибегнуть к этому
лечению можно, только удостоверившись в удовлетворительном состоянии зубов и десен.
7. Прогноз жизни пациента определяется висцеральными метастазами.
Полное излечение при метастатическом раке молочной железы невозможно. Особую категорию пациенток представляют больные, у
которых помимо метастазов в костях
есть множественные висцеральные
метастазы. Клиническая практика
показывает, что именно диссеминация опухоли в печень, легкие и другие органы (часто головной мозг)
определяет прогноз пациентки. Так,
продолжительность жизни у больных только с поражением скелета составляет 2,1 года, а при наличии еще
и висцеральных метастазов – 1,6 года
[12]. Назначение антирезорбтивной
терапии в таких случаях представляется нецелесообразным, поскольку
процесс костного ремоделирования
биологически не быстрый, занимает,
как правило, от нескольких месяцев
до 1 года. Ни бисфосфонаты, ни деносумаб просто не успеют оказать свое
терапевтическое действие. Поэтому
важно оценить ожидаемую продолжительность жизни у пациентов с
диссеминированным опухолевым
процессом.
8. Трудности интерпретации при визуализации костных очагов.
Несмотря на прогресс диагностических методов, остается актуальной
проблема оценки эффективности лечения. Традиционно изотопные методы являются методами первичного
выявления очагов в костной ткани.
Подтверждающими наличие метастазов в скелете являются рентгеновские
методы: рентгенография, КТ и МРТ.
В процессе лечения интерпретация
визуальной картины метастазов в
скелете вызывает затруднения даже
у специалистов высокого уровня. Появление бластических изменений рядом рентгенологов рассматривается
как репарация рентген-негативных
очагов (литических участков или исходно «нормальной» костной ткани),
другими специалистами нередко расценивается как прогрессирование
процесса, что ведет к необоснованной
смене противоопухолевого лечения.
Клиницисту не всегда просто принимать решение о динамике состояния
скелета при исходно бессимптомном
течении болезни и отсутствии некостных очагов. Вывод: отсутствие
четкой трактовки характера очагов в
костной ткани – повод воздержаться
от остеотропной терапии [1,9].
9. Деэскалация остеомодифицирующей терапии на примере исследований с более редким (1 раз в 3 месяца)
введением золедроновой кислоты
не показала отрицательных последствий: из 820 больных РМЖ, участвовавших в рандомизированном
исследовании II фазы, скелетные осложнения отмечены у 113 пациенток
из группы ежемесячного применения
и у 119 пациенток из группы 3-месячного. Плюсы такого подхода – снижение числа нежелательных явлений
вдвое: остеонекроза челюсти (18 случаев против 9), нефротоксичности
(11 случаев против 5), а также несомненный фармакоэкономический
выигрыш (расход препарата, сокращение лабораторных тестов, посещений врача) [18].
10. Существуют литературные данные о влиянии образа жизни на
прогноз как появления метастазов в
костной ткани, так и развития ряда
осложнений, в частности, остеонекроза челюсти. Исследование японских авторов во главе с Tanda N. и
др. посвящено корреляции между
чувствительностью к алкоголю и
частотой метастазирования в кости
и связанных со скелетом событий
при первичном операбельном раке
молочной железы. Гиперчувствительность к алкоголю определяется
генетическим дефицитом фермента
алкогольдегидрогеназы-2, в результате чего нарушается метаболизм
этанола в организме, создается избыточная концентрация эндогенного ацетальдегида, что проявляется
покраснением лица, тошнотой, тахикардией. Изменяется микробиота
полости рта, нарушаются процессы
кроветворения и другие более сложные метаболические каскады. Ретроспективное когортное исследование,
в которое были включены 332 пациентки, позволило доказать, что женщины с повышенной чувствительностью к алкоголю (N=45) в большей
степени подвержены метастазированию в кости, чем женщины с низкой
чувствительностью (N=287): 60,6%
по сравнению с 25,1% соответственно; у них чаще возникли скелетные
осложнения: 22,3% по сравнению с
9,0%. Один случай ОНЧ в этом исследовании также зарегистрирован в
группе больных с дефектом фермента
алкогольдегидрогеназы-2 [19].
Выводы
Суммируя имеющуюся информацию,
«клинический портрет» пациентки, у
которой имеется низкий риск костных осложнений и которой не стоит
торопиться назначать остеомодифицирующую терапию, представляется
следующим:
• люминальный молекулярный подтип опухоли;
• немногочисленные метастазы,
смешанный/бластический характер
очагов;
• расположение метастатических
очагов в костях, не несущих опорную нагрузку;
• коморбидность больной: нарушение функции почек;
• неудовлетворительная санация
полости рта, планируемые стоматологические процедуры;
• невозможность лабораторного мониторинга (креатинин, кальций);
• ожидаемая продолжительность
жизни менее 3 месяцев;
• низкая чувствительность к этанолу
по данным анамнеза.
• Несомненно, решение о том, какие
из вышеперечисленных факторов
будут превалировать в решении
назначить ОМА или подождать,
будет принимать врач или, лучше,
мультидисциплинарная команда.
Оценивать показания к назначению бисфосфонатов или деносумаба необходимо регулярно на
протяжении всего периода лечения
пациентки.
В заключение еще раз акцентирую внимание на том, что вышеприведенные доводы относятся не ко всем больным, а только
лишь к той немногочисленной категории, которой можно не спешить с назначением остеомодифицирующей терапии, несмотря
на клинические рекомендации.
Со списком литературы
можно ознакомиться на сайте
https://www.rosoncoweb.ru/news/oncology/2023/01/13/

Авторы: Владимирова Любовь Юрьевна
Заведующая отделением противоопухолевой лекарственной терапии
ФГБУ «НМИЦ онкологии» Минздрава России, доктор медицинских наук, профессор, Ростов-на-Дону
Абрамова Наталия Александровна
Старший научный сотрудник отдела лекарственного лечения опухолей
ФГБУ «НМИЦ онкологии» Минздрава России, кандидат медицинских наук, Ростов-на-Дону
Рак молочной железы (РМЖ) является онкологическим заболеванием, характеризующимся частым метастазированием в кости (65-80%). Наиболее
часто поражаются поясничные (59%)
и грудные (57%) отделы позвоночника, кости таза (49%) и рёбра (30%), то
есть преимущественно вовлекаются
в процесс кости осевого скелета [1].
Различают три типа метастазов в зависимости от особенностей патологического процесса: остеолитические,
остеобластические и смешанные. Для
РМЖ наиболее характерны остеолитические (не менее 50%) и смешанные
метастазы, но и частота поражения,
характеризующегося как остеобластное, может достигать 10-15% [2]. Наиболее характерны метастазы в кости
для люминальных и Her-2 позитивных
типов РМЖ [3].
Клиническими проявлениями метастазов в кости являются болевой
синдром, снижение качества жизни,
а также так называемые скелетные
события, или костные осложнения
(единого термина в русскоязычной
литературе нет), которые включают
необходимость облучения или хирургического вмешательства, патологические переломы, компрессию спинного
мозга и гиперкальциемию. Наиболее
часто, до 70% случаев, метастазы в
кости при РМЖ клинически манифестируют болевым синдромом, менее
15% пациенток на этапе установки
диагноза РМЖ с метастазами в кости
не имеют болевого синдрома [4]. До
40% пациенток, включаемых в исследования по лечению метастазов РМЖ
в кости, имеют в анамнезе скелетные
осложнения [5].
Применение в дополнение к противоопухолевой терапии РМЖ остеомодифицирующих агентов (ОМА)
– препаратов, уменьшающих костную
резорбцию, – позволяет уменьшить
выраженность клинических проявлений метастазов в кости и частоту скелетных осложнений, увеличить время
до их появления [5]. Наиболее распространенный и доступный класс остеомодификаторов – это бисфосфонаты
(БФ). По своей химической структуре
они являются аналогами пирофосфатов костного матрикса. БФ связываются с кальцием, накапливаются в
костях, утилизируются зрелыми остеокластами, угнетая их активность. По
наличию или отсутствию атома азота
БФ определяют как азотсодержащие
или неазотсодержащие. Неазотсодержащие БФ (клодронат, этидронат и
др.) действуют посредством цитотоксического влияния на остеокласты,
тогда как азотсодержащие БФ (памидронат, ибандронат и золедронат)
оказывают на них прямое апоптотическое действие [6-8]. Как и любые
лекарственные препараты, БФ имеют
свой спектр токсичности, где наиболее
значимы неблагоприятное влияние на
функцию почек и остеонекроз нижней
челюсти [9].
Другой класс остеомодификаторов
– блокаторы RANK лиганда, представленные пока единственным препаратом деносумабом. Это таргетный
препарат, который представляет собой полностью гуманизированное
моноклональное антитело к RANK
лиганду [10,11]. Ключевым звеном гомеостаза костной ткани, регулирующим дифференцировку остеокластов
и остеолиз, является лиганд-рецепторная система RANK/RANKL/OPG,
где RANK (Receptor activator of nuclear
factor kappa-B) – рецептор-активатор,
экспрессируемый на поверхности
остеокластов и их предшественников, RANKL – лиганд, секретируемый
остеобластами, связывающийся с внеклеточным доменом RANK и запускающий процессы остеокластогенеза
и активации зрелых остеокластов, и
остеопротегерин (OPG), секретируемый остеобластами природный антагонист RANKL, связывающий его
и блокирующий взаимодействие с
RANK [12]. Деносумаб является по
сути синтетическим аналогом остеопротегерина. Среди наиболее значимых недостатков данного препарата
– феномен рикошетного остеолиза при
отмене и достаточно высокая стоимость такого лечения.
Американское общество NCCN рекомендует применение ОМА при РМЖ в
дополнение к химиотерапии или эндокринной и таргетной терапии во всех
случаях, когда есть костные метастазы и ожидаемая продолжительность
жизни при этом составляет ≥3 месяцев
[13], Европейское и Российское профессиональные сообщества – в любом
случае при наличии метастазов в кости
[14,15].
При этом в отношении назначения
ОМА при метастазах в кости опухолей
других локализаций все рекомендации
не так категоричны. Так действительно
ли раннее назначение ОМА при РМЖ
с метастазами в кости является необходимым?
К сожалению, нет данных рандомизированных исследований, позволяющих определить, все ли пациенты с
костными метастазами РМЖ нуждаются в назначении ОМА сразу же после подтверждения диагноза, в частности – пациенты с бессимптомными
метастазами. Однако в отношении
именно этой нозологии такой подход
(пока не имеется результатов исследований с высокой степенью доказательности, доказывающих обратное) представляется оправданным.
1. Резорбция кости при метастатическом поражении повышена в любом
случае, следовательно, необходимо
раннее начало терапии антирезорбтивными препаратами, даже при отсутствии клинических проявлений.
Костная ткань является динамической
системой, в ней непрерывно происходят процессы ремоделирования в
объеме Базовой многоклеточной единицы (БМЕ) – функционально объединенной совокупности остеокластов,
разрушающих кость, остеобластов,
формирующих кость, и остеоцитов,
поддерживающих кость, во временной
полости ремоделирования кости. Процессы остеолиза и остеобразования
происходят параллельно, как в норме,
так и при патологии. Опухолевые клетки выделяют факторы, стимулирующие резорбцию костной ткани остеокластами, влияющие на активность
остеобластов путем ингибирования
(при остеолитических очагах) или
стимулирования (при остеобластных
очагах) образования костной ткани
[10,16].
Ключевой причиной активации резорбции кости при метастатическом
поражении является паратгормон-подобный пептид, в большом количестве секретируемый клетками РМЖ,
стимулирующий остеокластогенез и
резорбцию кости. Выделяемые во время резорбции костной ткани ростовые
факторы, в свою очередь, стимулируют рост опухолевых клеток [10,16]. В
механизме формирования остеобластных метастазов ключевую роль в настоящее время отдают Эндотелину-1-
пептиду, который также секретируется
клетками РМЖ и является мощным
стимулятором остеобластов и формирования костной ткани.
В целом течение остеобластных метастазов считается более благоприятным из-за меньшей выраженности
болевого синдрома и меньшей угрозы
скелетных осложнений. Тем не менее,
патологическое костеобразование делает кости утолщенными, жесткими,
негибкими, хрупкими, что увеличивает вероятность патологических переломов и приводит к трофическим и
неврологическим нарушениям [6].
При этом резорбция костной ткани
при метастатическом поражении в
остеобластных очагах повышена нисколько не в меньшей степени, чем в
остеолитических. Это подтверждается
повышенным уровнем маркеров костной резорбции при остеобластном поражении. Ингибирование рецептора
Эндотелина-1 блокирует не только
активацию остеобластов, но и резорбцию костной ткани [6]. ОМА с любым
механизмом действия снижают интенсивность резорбции, замедляя процессы разрушения нормальной кости и
замещения ее клетками опухоли в случае остеолитических метастазов либо
клетками опухоли и патологической
костной тканью в случае метастазов
остеобластных [17].
2. Взаимодействие RANK и RANKL
является не только основным звеном
в «порочном круге» костной деструкции, но и играет важную роль в формировании и функционировании
молочных желез, развитии и метастазировании РМЖ, противоопухолевом
иммунном ответе. Блокада взаимодействия RANK-RANKL может расцениваться как этиопатогенетическое
лечение при РМЖ независимо от наличия или отсутствия клинической
симптоматики.
Как уже упоминалось, ключевым
звеном гомеостаза костной ткани является лиганд-рецепторная система
RANK/RANKL/OPG [10-12]. Однако
значение взаимодействия RANKRANKL не ограничивается исключительно процессами ремоделирования
кости [18]. В частности, в формировании лобуло-альвеолярных структур
молочных желез, необходимых для
лактации, взаимодействие RANKRANKL также играет важную роль. В
эксперименте после блокады RANKL
или RANK у мышей не развивалась
молочная железа во время беременности должным образом [19]. Передача
сигналов RANKL-RANK вовлечена во
все стадии онкогенеза [20]. При этом
клетки РМЖ сами экспрессируют
RANKL: постоянная высокая экспрессия RANKL наблюдается в опухолях
и клеточных линиях РМЖ [19]. Доказана корреляция высокой экспрессии
RANKL и склонности к метастазированию в кости на моделях у мышей
для клеток РМЖ [21]. Возможно, эти
данные дают ключ к пониманию того,
почему РМЖ так часто метастазирует
в кости и для него характерны преимущественно остеолитические метастазы.
Немаловажным моментом также является участие пути RANK-RANKL в
развитии и функционировании иммунной системы, а именно – в развитии лимфатических узлов, формировании и дифференцировке В- и Т-клеток,
стимуляции и угнетении противоопухолевого иммунитета) [22].
Исходя из вышеизложенного, блокада
взаимодействия RANK-RANKL может
расцениваться как этиопатогенетическое лечение при РМЖ.
3. РМЖ в большинстве случаев гормонозависим, и в этом процессе взаимодействие RANK и RANKL имеет значение. Блокада данного взаимодействия
может являться дополнительным
вкладом в эффективную противоопухолевую терапию люминального
РМЖ.
Большинство случаев РМЖ относится
к числу гормонозависимых опухолей.
Известно, что прогестерон частично
через взаимодействие RANK и RANKL
опосредует пролиферацию эпителия
молочных желез [23,24] и онкогенез
[25]. В ряде исследований показано,
что блокада RANKL в гормоноиндуцированном РМЖ приводит к уменьшению инвазивного [26,27] и пролиферативного потенциала опухолевых
клеток [28]. Рак молочной железы, ассоциированный с мутациями BRCA1,
также может быть опосредован RANK/
RANKL. В экспериментальных моделях инактивация RANK приводила к
уменьшению частоты и увеличению
времени развития РМЖ, а также к замедлению прогрессирования уже возникших опухолей, а ингибирование
RANKL приводило к предотвращению
онкогенеза [29].
4. Для всех ОМА в многочисленных
рандомизированных исследованиях
доказано снижение частоты и риска
скелетных осложнений, увеличение
времени до возникновения скелетных
осложнений при РМЖ, снижение необходимости лучевых и хирургических методов лечения для всех сравниваемых подгрупп, в том числе – для
пациенток с отсутствующим либо слабым болевым синдромом.
Даже при отсутствии клинических проявлений метастазов в кости на ранних этапах их формирования всегда присутствует высокий риск костных осложнений. При РМЖ, в отличие от других ЗНО, скелетные осложнения в течение 2 лет регистрируются наиболее часто – в 64%, для сравнения: при раке простаты – в 49%, при раке легкого и других злокачественных опухолях – в 46% [30-33]. В настоящее время нет достоверных способов прогнозирования того, у каких пациентов разовьются скелетные осложнения. Тем не менее, первое скелетное осложнение часто возникает достаточно рано от момента метастатического поражения костей. Так, в регистрационном исследовании, сравнивающем деносумаб с золедроновой кислотой, 37% пациентов уже пережили скелетные осложнения до включения в исследование в среднем всего через 2 месяца после выявления костных метастазов [24,34]. Более 2 десятков рандомизированных исследований (24), в которых участвовали почти 11 тысяч пациенток, были посвящены изучению эффективности и безопасности ОМА при РМЖ с метастазами в кости. Польза ОМА при метастазах РМЖ в кости в отношении скелетных осложнений доказана и несомненна: это снижение риска и частоты, увеличение времени до первого и последующих скелетных осложнений, а в некоторых исследованиях – улучшение результатов лечения в плане выживаемости (при нормализации маркеров костной резорбции). При этом в большинстве исследований изучаемый ОМА демонстрирует преимущество перед группой сравнения в большинстве или всех стратицификационных подгруппах [5]. Кроме того, данный анализ показал, что для женщин с ранним РМЖ БФ снижают риск метастазов в кости и обеспечивают улучшение общей выживаемости по сравнению с плацебо или наблюдательной тактикой, особенно при раннем начале терапии (рис.1).
Рисунок 1.
Влияние БФ на частоту костных метастазов при
раннем РМЖ: немедленное назначение vs отсроченное назначение.
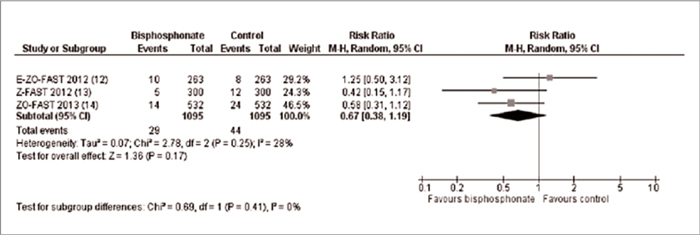
Имеются данные, свидетельствующие о том, что БФ улучшают общую и безрецидивную выживаемость у женщин в постменопаузе только по сравнению с плацебо или отсутствием БФ (рис.2).
Рисунок 2.
Влияние БФ на общую выживаемость при раннем
РМЖ: немедленное назначение vs отсроченное назначение.

Наиболее высок риск костных событий у больных с остеолитическими
метастазами, и БФ значимо влияют
на этот процесс. Так, например, в рандомизированном двойном слепом
плацебо-контролируемом исследовании по изучению эффективности
памидроната в сравнении с плацебо в
сочетании с химиотерапией при РМЖ
с метастазами в кости доля пациенток,
у которых возникли какие-либо скелетные осложнения, была достоверно
ниже (43% и 56% соответственно), а
среднее время до первого скелетного
осложнения увеличилось в 2 раза (13,9
и 7,0 мес. соответственно) [35]. У пациенток с литическими метастазами
РМЖ в кости, получающих гормональную терапию, памидронат также
значительно снижал частоту скелетных осложнений и увеличивал время
до их возникновения в сравнении с
плацебо. Через 24 месяца от начала терапии доля пациентов со скелетными
осложнениями составила 56% в группе
памидроната и 67% в группе плацебо,
а медианы времени до первого скелетного осложнения составили 13,8 и 7,0
мес. [36]. Для оценки долгосрочной
эффективности и безопасности памидроната были объединены результаты
этих двух исследований, при анализе
получены аналогичные данные с высокой степенью достоверности: снижение количества скелетных осложнений
по сравнению с плацебо на 13% (51 и
64% соответственно, р<0,001) и увеличение медианы времени до появления
первых скелетных осложнений с 7 до
12,7 мес. (р<0,001) [30].
Самым эффективным из БФ является
золедроновая кислота, которая в ряде
рандомизированных исследований
продемонстрировала преимущество
перед другими БФ в отношении скелетных осложнений [5].
В рандомизированное исследование
фазы III по сравнению эффективности
золедроновой кислоты и памидроната
были включены в общей сложности
1130 пациенток, у которых были все
типы костных метастазов по данным
рентгенологического исследования
(остеолитические, смешанные или
остеобластные). Количество пациенток со скелетными осложнениями было практически одинаковым
в общей популяции (43% и 45%), а
при наличии хотя бы одного остеолитического очага – на 10% меньше в
группе золедроновой кислоты (48%
против 58%), хотя эти различия и не
достигли статистической значимости. Но при этом медиана времени до
первого скелетного осложнения была
значительно больше при лечении золедроновой кислотой в сравнении с
памидронатом (310 и 174 дней соответственно, р=0,013). Кроме того, риск
развития скелетных осложнений в
группе золедроновой кислоты был достоверно ниже – на 20% для всех пациентов (р=0,037) и на 30% в подгруппе с
остеолитическими очагами (р=0,010).
Отдельно по результатам этого исследования были проанализированы данные для пациенток с остеобластными
метастазами. Для них также отмечено
снижение частоты и риска скелетных
осложнений и увеличение времени до
их появления [29].
По данным рандомизированных исследований рекомендовано применение золедроновой кислоты и памидроната в США, ибандроната, клодроната
и золедроновой кислоты в европейских странах.
Что же касается блокатора RANKL,
то деносумаб, в свою очередь, в регистрационном исследовании продемонстрировал преимущество перед золедроновой кислотой при метастазах
РМЖ в кости в отношении времени до
первого и последующих скелетных осложнений на 18% (р=0,001). Снижение
маркеров костной резорбции также
было более выраженным при применении деносумаба [29].
5. Увеличение времени до появления/
усиления болевого синдрома, улучшение качества жизни, снижение уровня
потребления анальгетиков отмечается
в подгруппах с низким и отсутствующим болевым синдромом, то есть и
среди пациенток, не имеющих клинической симптоматики.
К сожалению, в проведенных исследованиях пациентки с бессимптомными
метастазами (без болевого синдрома
и скелетных осложнений в анамнезе)
не выделялись в отдельную подгруппу
для анализа. Там, где была проведена
стратификация по уровню болевого
синдрома, больные объединялись в
подгруппы с отсутствующим и легким
болевым синдромом и с умеренным и
выраженным. При этом в большинстве исследований, как и для скелетных осложнений, отмечается преимущество БФ над плацебо, золедроновой
кислоты над более ранними БФ и деносумаба над золедроновой кислотой
[5].
В рандомизированном двойном слепом плацебо-контролируемом исследовании по изучению эффективности
внутривенного ибандроната у пациенток с метастазами РМЖ в кости препарат в дозировке 6 мг каждые 3-4 недели
показал значительное уменьшение
болевого синдрома и улучшение качества жизни. Так, по сравнению с исходными показателями оценка боли в
костях по 5-балльной шкале была значительно ниже у пациентов, получавших ибандронат, в отличие от плацебо.
Значительное и достоверное улучшение качества жизни было продемонстрировано у пациентов, получавших
ибандронат, в отношении физического, эмоционального и социального функционирования, а также общего
состояния здоровья (р<0,05) [37]. В
другом исследовании в группе памидроната в сравнении с плацебо отмечено достоверно меньшее количество
пациенток с усилением боли в костях
(р =0,046) и ухудшением общего состояния (р<0,05) [35,38]. В объединенном
анализе двух рандомизированных исследований по оценке эффективности
и безопасности памидроната показатели боли и использования анальгетиков были значительно лучше в группе
памидроната в сравнении с плацебо,
в том числе и среди пациенток с изначально отсутствующим или легким
болевым синдромом [30].
Золедроновая кислота в отношении снижения выраженности болевого синдрома продемонстрировала сходные результаты с памидронатом и ибандронатом [5]. Но деносумаб у пациентов с РМЖ с метастазами в кости имел преимущество в сравнении с золедроновой кислотой в регистрационном исследовании. Около 15% пациенток, включенных в исследование, не имели исходно болевого синдрома. Подгруппа с отсутствующим и легким болевым синдромом, куда вошли эти пациентки, имела значимое преимущество во времени до усиления болевого синдрома и связанных с этим составляющих оценки качества жизни, а также использовании наркотических анальгетиков. Медиана периода до развития умеренного или тяжелого болевого синдрома у больных без боли или с легкой болью в костях на момент включения в исследование составила 9,7 мес. в группе деносумаба и 5,8 мес. в группе золедроновой кислоты (р=0,0024), а среди пациенток, у которых не было болевого синдрома исходно, умеренная или выраженная боль на 73 неделе исследования отмечена в 14,8% при использовании деносумаба и в 26,7% при использовании золедроновой кислоты [5,29,39]. На опиоидные анальгетики перешли на 20% меньше пациенток в группе деносумаба, медиана времени до начала использования наркотических анальгетиков в группе золедроновой кислоты составила 29,5 мес., в группе деносумаба не была достигнута [39].
6. Непосредственное противоопухолевое действие и другие полезные терапевтические эффекты (антиангиогенное, иммуномодулирующее и даже химиопотенциирующее действие) ОМА могут иметь значение для проведения противоопухолевого лечения РМЖ.
Помимо антирезорбтивного, ОМА могут оказывать непосредственное противоопухолевое, антиангиогенное и иммуномодулирующее действие [6]. Так, в доклинических исследованиях азотсодержащие бисфосфонаты продемонстрировали способность ингибировать ангиогенез, клеточную адгезию, и активность матриксных металлопротеиназ [40-46]. В экспериментах на культурах клеток установлено, что обработка БФ клеток РМЖ разных линий приводит к апоптозу опухолевых клеток, то есть данные препараты оказывают прямое противоопухолевое действие на клетки РМЖ человека [47,48]. При этом золедроновая кислота превосходит по активности ибандронат и клодронат. Также БФ продемонстрировали способность ингибировать инвазию опухолевых клеток дозозависимым образом [49]. Имеются сведения об иммуномодулирующем действии БФ [50-52]. БФ стимулируют естественный противоопухолевый иммунный ответ, активируя T-клетки [53], а золедронат, вдобавок к этому, способен генерировать опухолесупрессирующие стромальные клетки костного мозга (BMSC) в мышиных моделях РМЖ [54]. Таким образом, БФ могут усиливать противоопухолевое действие основных препаратов и способствовать профилактике дальнейшего метастазирования.
Также имеются сведения о непосредственном противоопухолевом и иммуномодулирующем действии и блокатора RANK-лиганда [53]. Деносумаб, ингибируя путь RANK-RANKL, оказывает как прямое, так и косвенное противоопухолевое действие. Прямое противоопухолевое действие деносумаба связывают с блокадой прямого стимулирующего действия RANKL на опухолевые клетки, экспрессирующие RANK [20].
Имеются данные сравнения противоопухолевого действия деносумаба с золедроновой кислотой. Ингибирование RANKL приводило к уменьшению костных опухолей, в отличие от золедроновой кислоты, на мышиных моделях в исследовании Д. Джонс [55]. В другой модели РМЖ размеры опухолей в кости уменьшались как при ингибировании RANKL, так и при лечении золедроновой кислотой, но при ингибировании RANKL это действие было более выраженным [57]. Дополнительные доказательства прямого действия RANKL на опухолевые клетки, экспрессирующие RANK, были получены в исследованиях GonzalezSuarez et al. [58]. Используя мышиные модели трансгенного и ортотопического РМЖ, которые характеризуются высокой частотой метастазирования в легкие, авторы смогли показать, что ингибирование RANKL уменьшало метастазы в легких. Также Yoldi и соавт. продемонстрировали, что ингибирование RANKL у мышей приводило к уменьшению частоты метастазирования в легкие за счет повышения дифференцировки опухолевых клеток [59]. Таким образом, на экспериментальных моделях доказано, что ингибирование RANKL способно прямым образом снижать частоту скелетных и висцеральных метастазов.
РМЖ относится к числу гормонозависимых опухолей эпителия молочных желез. Блокада RANKL в клетках гормоноиндуцированного РМЖ приводит к уменьшению инвазивного [60] и пролиферативного потенциала опухолевых клеток [27]. Кроме того, отмечено положительное влияние блокады RANK при рецидиве РМЖ в виде повышения дифференцировки опухолевых клеток и повышения чувствительности к лечению доцетакселом в эксперименте, таким образом, имеет место определенный химиопотенциирующий эффект [27]. РМЖ, вызванный мутациями BRCA1, также может быть опосредован RANK/ RANKL. В моделях на мышах, имитирующих дефицит BRCA1, ингибирование RANKL приводило к уменьшению опухолей молочной железы [61]. В другом исследовании инактивация RANK приводила к уменьшению частоты и увеличению времени развития РМЖ, а также к замедлению прогрессирования уже возникших опухолей, а ингибирование RANKL приводило к предотвращению онкогенеза [28]. Считается, что косвенные противоопухолевые эффекты возникают за счет изменения микроокружения в кости и влияния ингибиторов RANKL на иммунные клетки [22,25]. Косвенный противоопухолевый эффект ингибирования RANKL реализуется через иммунную систему [22,62]. Инфильтрирующие опухоль регуляторные Т-клетки, экспрессирующие RANKL, способствуют развитию метастазов в легкие на моделях РМЖ путем создания и поддержания этого иммуносупрессивного микроокружения, способствующего опухолевому росту и метастазированию [63]. Ингибирование RANKL временно блокирует толерантность Т-клеток к клеткам опухоли, что приводит к улучшению противоопухолевого ответа [21,64]. Таким образом, иммуноопосредованный противоопухолевый эффект деносумаба вполне вероятен, хотя убедительных доклинических и клинических доказательств в настоящее время недостаточно.
7. Нежелательные явления ОМА: есть данные о безопасности длительного применения и возможности коррекции режима.
Одной из возможных причин для отказа от применения бисфосфонатов являются имеющиеся или ожидаемые нежелательные явления (НЯ), особенно почечная токсичность. Тем не менее, есть данные о профиле безопасности БФ, сравнимом с плацебо.
Так, всем пациенткам, завершившим двойное слепое рандомизированное исследование по изучению эффективности ибандроната в течение 96 недель, было предложено открытое активное лечение еще на 96 недель (расширенная фаза), пациентки были стратифицированы в зависимости от предшествующего лечения – ибандронат или плацебо. В течение 4 лет в расширенной фазе исследования было зарегистрировано меньше НЯ, связанных с лечением (6,3% у пациенток, ранее получавших плацебо, и 13,0% – у получавших ранее ибандронат), чем в начальной фазе исследования (плацебо – 56,3%, ибандронат – 67,4%). Серьезные НЯ были в основном связаны с прогрессированием злокачественного новообразования. Клинически значимых НЯ со стороны почек не было, и в обеих группах уровень креатинина в сыворотке был одинаковым в течение 4 лет [65,66].
Кроме того, влияния на профиль безопасности БФ можно добиться путем снижения интенсивности терапии без потери в эффективности. В трех рандомизированных исследованиях сравнивали эффективность золедроновой кислоты, вводимой каждые 4 недели, в сравнении с введением каждые 12 недель. В исследование ZOOM включались пациентки, которые ранее получали ежемесячное введение золедроновой кислоты в течении 12-15 месяцев. Частота скелетных осложнений достоверно не отличалась в группе 12 недель по сравнению с ежемесячным введением. Наиболее частыми побочными явлениями 3-4 степени были боль в костях, тошнота и астения, нефротоксичность и остеонекроз челюсти развивались редко, без достоверных различий в зависимости от режима введения [67]. Отмечена возможность уменьшения интенсивности лечения золедроновой кислотой без потери терапевтического эффекта. Однако увеличение концентрации маркера костной резорбции N-концевого телопептида по сравнению с исходным уровнем в группе 12-недельного лечения (12% и 0%) вызывает некоторую настороженность в отношении такого подхода [68]. В другом крупном рандомизированном открытом клиническом исследовании CALGB, в которое были включены пациенты с метастатическим РМЖ, метастатическим РПЖ или множественной миеломой, у одинакового количества пациентов (менее 30%) в группах 4-недельного и 12-недельного введения в течение 2 лет после рандомизации возникло как минимум одно скелетное осложнение. Таким образом, снижение интенсивности дозирования золедроновой кислоты не приводило к увеличению риска скелетных осложнений течение 2 лет. Частота развития НЯ, в частности, остеонекроза челюсти и нарушения функции почек, были сопоставимы [69]. В рандомизированное исследование OPTIMIZE-2 включались пациентки с РМЖ, которые ранее получали золедроновую кислоту и/ или памидронат в стандартном режиме. Через 1 год наблюдения скелетные осложнения возникли у 22,0% пациентов в группе золедроновой кислоты каждые 4 недели и у 23,2% пациентов в группе золедроновой кислоты каждые 12 недель, и время до первого скелетного осложнения между группами лечения статистически значимо не различалось. Профили безопасности в группах были сопоставимы [29,69]. При сравнении профилей безопасности БФ и деносумаба и золедроновой кислоты при лечении блокатором RANKL отмечена более высокая частота гиперкальциемии, при использовании БФ чаще регистрируются почечная токсичность и острофазовые реакции, частота развития остеонекроза нижней челюсти на фоне терапии деносумабом и БФ достоверно не отличается [29].
Имеются данные о безопасности длительного применения деносумаба [70,71]. Снижение интенсивности терапии деносумабом не было изучено, но фармакокинетика препарата свидетельствует против такого подхода.
Выводы
Таким образом, особенности биологии РМЖ таковы, что именно эта
опухоль обладает наибольшим остеодеструктивным потенциалом. Поэтому отказ от применения ОМА сразу
же после диагностики метастазов в
кости при РМЖ в настоящее время
представляется нецелесообразным,
даже при бессимптомном процессе
и/или относительно благоприятном
молекулярно-генетическом (люминальном) подтипе опухоли. Кроме
того, непосредственное противоопухолевое, антиангиогенное и иммуномодулирующее действие ОМА может
быть значимым компонентом эффективной противоопухолевой терапии.
При этом, учитывая значение взаимодействия RANK-RANKL для онкогенеза РМЖ, использование в качестве
первого ОМА блокатора RANKL при
РМЖ является предпочтительным.
Со списком литературы можно ознакомиться на сайте https://www.rosoncoweb.ru/news/oncology/2023/01/13/
Результаты голосования*

*https://www.rosoncoweb.ru/news/oncology/2023/01/13/ Всего проголосовало: 9
РЕГИОНАЛЬНОЕ ОТДЕЛЕНИЕ РОССИЙСКОГО ОБЩЕСТВА КЛИНИЧЕСКОЙ ОНКОЛОГИИ (RUSSCO) Г. ЮЖНО-САХАЛИНСК
Сахалинская область – субъект
Российской Федерации, входит в
состав Дальневосточного Федерального округа. Область полностью расположена на островах
– остров Сахалин и Курильские
острова. Административный
центр области – город ЮжноСахалинск – расположен на юге
острова. Население Сахалинской
области на 01.01.2023 – 484 177
тыс. человек. Заболеваемость онкологическими заболеваниями –
515,51 на 100 тыс. населения, что
составляет 2 место по заболеваемости в Российской Федерации.
Онкопомощь населению осуществляется на базе онкологического
диспансера, который расположен
в столице области, городе Южно-Сахалинск. История онкологического диспансера начинается
с 1949 года, когда был основан
онкологический кабинет при первой поликлинике приказом Южно-Сахалинского горздравотдела
№291 от 29 сентября 1949 года.
Основанием для организации в
городе новой службы послужило
Постановление СНК СССР №935
и приказ НКЗ СССР от 24 сентября 1945 года «О мероприятиях
по улучшению онкологической
помощи населению». Уже через
три года кабинет реорганизовали
в городской онкологический диспансер, а еще год спустя он приобрел статус областного учреждения.
В настоящее время диспансер
представляет собой современную
клинику, где жители Сахалина,
Курил и ряда субъектов ДФО гарантированно обеспечиваются
специализированной медицинской помощью, в том числе высокотехнологичной. Трехуровневая
система работы онкологической
службы на территории островной
области, которую возглавляет
СООД, выстроена с учетом региональных особенностей, на основании нормативов планирования
и рациональности размещения
сети лечебных учреждений. В
круг основных задач, выполняемых медицинской организацией, входит также проведение
профилактики онкологических
заболеваний и онкологического
скрининга. Кроме того, ее врачи
оказывают консультативную поддержку лечебным учреждениям
Сахалинской области по вопросам диагностики, лечения и обезболивания онкологических пациентов. На федеральном уровне
диспансер тесно сотрудничает с
федеральными онкологическими
центрами: МНИОИ им. П.А. Герцена – филиалом ФГБУ «НМИЦ
радиологии» Минздрава России,
ФГБУ «НМИЦ онкологии им.
Н.Н. Блохина» Минздрава России. Также с 2019 года диспансер с
данными центрами тесно сотрудничает в рамках телемедицинских консультаций пациентов.

В структуре учреждения девять
стационарных подразделений,
поликлиника и диагностические отделения, на базе которых
осуществляется предоперационная и послеоперационная полихимиотерапия с применением
современных дорогостоящих
химиопрепаратов, таргетных и
сопроводительных препаратов. В
иммуногистохимической лаборатории уточняется место локализации злокачественных новообразований и проводится точная
верификация опухолевого процесса. В 2023 году планируется
запустить в работу молекулярно-генетическую лабораторию на
собственной базе, что, учитывая
географическую отдаленность
области, является крайне необходимым и важным для диспансера.
В коллективе Сахалинского
областного онкологического
диспансера трудятся 511 сотрудников, из них 88 с высшим
медицинским образованием, 175
– представители среднего медицинского звена. Двадцать два
врача имеют высшую квалификационную категорию, 14 – первую.
В учреждении ведут лечебную
практику два кандидата медицинских наук, шесть человек имеют почетное звание «Отличник
здравоохранения», трое – «Заслуженный работник Сахалинской
области». Шесть специалистов
диспансера удостоены грамот и
благодарностей Министерства
здравоохранения РФ.
Коечный фонд диспансера составляет 257 круглосуточных
коек и 65 коек дневного стационара, работающих в две смены на
130 пациенто-мест; из них 40 коек
дневного стационара противоопухолевой лекарственной терапии и 25 радиологических коек.
В 2019 году в рамках нацпроекта «Здравоохранение», проекта
«Борьба с онкологическими заболеваниями» началось переоснащение диспансера, а также в
конце 2019 года на базе онкодиспансера открылся дневной стационар и Центр амбулаторной
помощи.
В настоящее время дневной стационар рассчитан на 40 коек, в 2
смены. На базе отделения организован собственный приемный
покой, отделение оборудовано
смотровыми кабинетами. Проводятся все виды лекарственной
терапии, включая длительные
инфузии цитостатиков. Возглавляет отделение Парсаданова Эльвира Левоновна, врач-онколог,
председатель регионального отделения RUSSCO. Дневной стационар – одно из самых молодых
отделений диспансера, не только
по дате создания, но и по возрасту
специалистов. В работе отделения
активно используются все принципы современной доказательной медицины, мультидисциплинарный подход к выбору тактики
лечения, совместное обсуждение
сложных случаев. Большое внимание уделяется теоретической
подготовке, используются общепринятые алгоритмы и стандарты лечения.

С 2021 года региональное отделение
RUSSCO ведет активную работу –
проводятся вебинары, конференции на местном и региональном
уровнях. В сообществе состоит 27
врачей диспансера. В 2022 году проведено два совместных мероприятия RUSSCO – «Лекарственное
лечение HER2-позитивного рака
молочной железы» и «Новое в иммунотерапии: результаты ESMO
2022». В 2022 году Парсаданова Э.Л.
успешно прошла экзамен по клинической онкологии Российского
общества клинической онкологии,
который впервые проводился в
Москве в дни Российского онкологического конгресса. На регулярной
основе в июле проводится межрегиональная междисциплинарная
научно-практическая конференция
«Заря Востока». Активное участие
в конференции принимают не только врачи Сахалинского областного
онкологического диспансера, но и
онкологи других регионов Дальнего
Востока и Сибири.
Сахалинский областной онкологический диспансер очень плотно
сотрудничает с пациентской организацией «Здравствуй». В 2022 году
врачи онкодиспансера участвовали
в ежегодной премии «Будем жить».
Победителем номинации «Жемчужины профессии» стала Парсаданова Эльвира Левоновна, в 2023 году
победителем в номинации «Лучшее
учреждение» – Сахалинский областной онкологический диспансер.
Начиная с 2019 года в СООД нашли
широкое применение малоинвазивные методы лечения с использованием лапароскопической аппаратуры – было освоено девять видов
оперативных вмешательств, а также
внедрено фотодинамическое лечение, такие методики, как химиоэмболизация и эмболизация сосудов
и пр.
Акцент в работе онкологической
службы региона делается на раннее выявление онкопатологии и органосохраняющие операции. С
внедрением новых скрининговых
программ теперь рак в диспансере
все чаще выявляют на начальных
стадиях и на этапе in situ.
В радиологическом отделении продолжается освоение технологии
стереотаксической фракционированной радиохирургии у пациентов
с внутримозговыми метастазами.
Стали доступны и самые передовые методы лучевой терапии, в отделении ее ежедневно получают от
80 пациентов с различными локализациями ЗНО. Лучевая терапия
– высокоточная и эффективная –
проводится на современном ускорительном комплексе с использованием режимов лечения IMRT, Vmat,
IGRT.

Все операционные в диспансере,
одна из которых экстренная, оснащены современным анестезиологическим оборудованием. Анестезиологи, оказывающие помощь на
шести операционных столах, владеют самыми прогрессивными схемами анестезиологического пособия.
Так, в торакальной хирургии успешно применяется видеоассистированная однолегочная интубация
с использованием ультратонкого
бронхоскопа. При полостных операциях в урологии, гинекологии,
абдоминальной хирургии для адекватного обезболивания пациентов
во время операции и в послеоперационном периоде используются
различные виды периферических
блокад под контролем ультразвуковой аппаратуры. В раннем послеоперационном периоде до стабилизации состояния и жизненно важных
функций пациенты проходят лечение и динамическое наблюдение в
реанимационном отделении, которое оснащено всем необходимым
для оказания высококвалифицированной помощи.
Только в торакальном отделении
за 2019 год было проведено более
40 оперативных вмешательств на
основе видеоэндоскопических технологий. Опыт работы врачей данной специальности показывает, что
к наиболее оптимальным методам
лечения ранних стадий рака легкого
относится именно хирургический.

Внедрили в практику малоинвазивные операции и специалисты диспансера, занимающиеся диагностикой и лечением новообразований
мочеполовой системы. Медицинская статистика подтверждает, что
около 4% от всего числа онкологических больных страдают от опухолей данной локализации, теперь же
после выполнения радикальной лапароскопической нефрэктомии при
раке почки пациент уже через семь
дней может вернуться домой.
Имеется в диспансере отделение и
для оказания специализированной
паллиативной помощи. Его сотрудники прошли соответствующее обучение, проводят консультации на
всех стадиях заболевания, включая
поздние и запущенные случаи, дают
рекомендации по комплексному
паллиативному лечению, по улучшению качества жизни больных,
назначают обезболивающую и симптоматическую терапию, практикуя
индивидуальный подход к каждому
пациенту

Источник:
Злокачественные новообразования в
России в 2021 году (заболеваемость и
смертность). Под ред. А.Д. Каприна,
В.В. Старинского, А.О. Шахзадовой.
М.: МНИОИ им. П.А. Герцена − филиал ФГБУ «НМИЦ радиологии»
Минздрава России, 2022 г.
КОГНИТИВНАЯ РЕАБИЛИТАЦИЯ ОНКОЛОГИЧЕСКИХ БОЛЬНЫХ. ВЗГЛЯД КЛИНИЦИСТА
Мирюсупова Гуля Фазлидиновна
Заведующая онкологическим кабинетом ФГБУ «9ЛДЦ» МО РФ, доктор медицинских наук,
Москва
Достижения современной онкологии позволяют реализовать борьбу
за жизнь пациента, не только укладываясь в стандарты необходимой
противоопухолевой терапии, но и затрагивая решение вопросов качества
жизни каждого пациента. Совершенствование терапевтических подходов
в лечении онкобольных устойчиво
расширяет диапазон сопроводительной терапии, как по остро возникающим осложнениям, так и по
осложнениям, отягощающим жизнь
больного вне болезни. В последнем
случае простыми примерами могут
служить симптомы периферической
нейропатии, лимфостаза, о которых
пациент охотно сообщит на каждом
приеме у онколога. Однако не менее
важными осложнениями, «незаметно» изменяющими качество жизни больных, являются нарушения
когнитивных функций, выпадение
которых, без грубых симптомов, на
всех этапах лечения и после его окончания, не дает повода к активным
терапевтическим подходам. Ускользание от объективного взгляда клиницистов онкологов выпадения когнитивных функций у онкобольных
возможно обусловлено, «специфическими» проявлениями возрастных
особенностей пациента. Коморбидными заболеваниями отягощен соматический статус у большинства
онкологических больных, которые
чаще относятся к гериатрической
практике. Привносит отрицательное
влияние и частая смена онколога у
одного больного, когда возникающие
отклонения когнитивного здоровья
также ускользают от объективной
оценки и своевременной терапии. У
больного нарастает когнитивный дефицит различных функций, и пациент начинает путь в его лечении либо
самостоятельно, либо по рекомендации близких, которым становится
очевидным когнитивное неблагополучие больного. Данные обстоятельства дестабилизируют социальное
положение пациента, а лечение когнитивных нарушений становится не
только затратным, но и менее эффективным.
Следует отметить, что лекарственная
терапия коморбидных заболеваний
у онкологического больного может
также привносить отрицательное
воздействие на когнитивное здоровье
пациента, в этой связи смежным специалистам необходимо скорректировать их назначение и принимаемую
дозировку с учетом предстоящего
лечения у онколога. Из лекарственных препаратов, влияющих на когнитивное здоровье пациента в большей
степени, можно отметить антихолинергические средства (антидепрессанты, противопаркинсонические
препараты, миорелаксанты, антипсихотические средства, антиэметики
и др.), антагонисты Н2-рецепторов,
бензодиазепины и ряд других.
Современные исследования приблизили к валидации такого термина, как когнитивная реабилитация,
которая подразумевает терапевтические программы, направленные
на улучшение когнитивных способностей, функциональных возможностей, реальных навыков и/
или внутренних метакогнитивных
стратегий. С.А. Meyers c соавторами
(2005 г.) отметили, что около 13% пациентов, перенесших рак, перестают
работать в течение последующих 4
лет после постановки диагноза в связи с возникающими когнитивными
нарушениями. Michell C. Janelsins с
коллегами в своей работе отметили,
что когнитивные нарушения широко
распространены среди онкологических больных, они могут быть диагностированы в 30% случаях до начала лечения, 75% случаев в процессе
проводимой противоопухолевой
терапии и до 35% случаев в отдаленные периоды наблюдения. В последующем Wefel с соавторами при изучении когнитивных нарушений у
больных раком молочной железы
детализировали данные показатели.
Когнитивные нарушения были отмечены у 40% больных при постановке диагноза, 65% больных показали
спад когнитивных функций в процессе или вскоре после завершения
лечения и 61% больных показали изученные отклонения в течение 1 года
после окончания лечения, при этом
значительная часть пациентов продемонстрировала ухудшение когнитивных функций, которые ранее не
были очевидными.
К пониманию характера и причин
когнитивных нарушений у онкологических больных (исключая больных
с опухолями центральной нервной
системы) впервые стали стремиться с середины 1990-х годов, подведя
итоги в начале 2000-х. Было впервые установлено, что когнитивный
дефицит у онкологических больных
может быть связан с присутствием
злокачественного новообразования,
а в последующем и в связи с проводимой химиотерапией. Диапазон
когнитивных нарушений с частотой
от 12% до 82% случаев лежал в области нарушения исполнительной
функции, памяти, психомоторной
функции и нарушения внимания
(современные данные корректируют данный диапазон от 17% до 70%
случаев различных когнитивных нарушений). Отечественные авторы
А.О. Войнаревич, В.А. Горбунова с
соавторами (1997 г.) в группе из 42
больных на фоне проводимой терапии производными платины отметили центральную нейротоксичность
в 32 случаях, из них у 24 больных
имело место нарушение концентрации внимания, краткосрочной и отсроченной памяти, головокружение.
У 8 больных отмечено изменение
ментального статуса I-II степени тяжести. В 2018 г. Д.Р. Терегулова, Б.А.
Бакирова с соавторами публикуют
результаты исследования когнитивных функций у больных лимфопролиферативными заболеваниями
(n=61, средний возраст больных
63,87±9,76 года): после лечения снижение когнитивных функций отмечено у 73,77% больных, субъективно
эти нарушения отмечали только 36%
больных (n=22). Наибольшие изменения были отмечены в нарушениях
памяти, внимания, концентрации и
исполнительных функциях.
Относительно когнитивных изменений у онкологических больных разных возрастных групп стоит отметить работу группы исследователей
из Сингапурского национального
онкологического центра. Alex Chan
с соавторами (2018 г.) доложили о
результатах изучения когнитивных
нарушений у онкобольных в возрасте от 15 до 39 лет в сравнении со
здоровыми данной возрастной категории. Было отмечено, что у онкобольных в указанном возрасте меньше число трудоустройств и большая
потеря продуктивности в работе в
сравнении с пожилыми пациентами,
пережившими рак. Средний возраст
больных составил 27,8±6,7 лет, n=65,
все пациенты относились к азиатскому этносу. Структура онкозаболеваний: 41% – больные с саркомами,
32,3% – больные с лимфомами, герминогенные опухоли были диагностированы у 15,4% больных. Почти
половина участников исследования
жаловались, что лечение онкозаболевания неблагоприятно повлияло на
их внимание и память, что сделало
необходимым больше использовать
современные гаджеты для компенсации возникающего дефицита.
Диагностированные когнитивные
нарушения сохранялись в течение 12
месяцев после окончания лечения.
К пониманию природы возникающих когнитивных нарушений у онкологических больных привели несколько работ зарубежных авторов,
отмечена роль цитокинов в патогенезе развития данного состояния.
С.А. Meyers c соавторами (2005 г.) в
исследовании когнитивных нарушений у больных острым лейкозом и
у больных с миелодиспластическим
синдромом (n=54, средний возраст
больных составил 60,2 года) отметили, что возраст пациента, его уровень
образования согласно проведенным
опросникам коррелируют с тяжестью нарушения КФ. Цитокины, которые были изучены в работе, включали: IL-1β, антагонист рецептора
IL-1 (IL-1 RA), IL-6, IL-8, TNF-α. Было
отмечено, что высокий уровень IL-6
имел место у пациентов при низких
показателях исполнительной функции. Высокий уровень IL-8 имел положительную корреляционную связь
при тестировании функций памяти.
Ning Yi Yap, Yi Long Toh с соавторами (2021 г.) изучали когнитивные
нарушения (острые, стойкие и отсроченные) у больных ранним раком
молочной железы (рРМЖ) (n=136,
116 (85,3%) больных – китаянки),
средний возраст больных составил
52,0±8,9 лет; 70,6% пациентов получили протоколы химиотерапии на
основе антрациклинов, 29,4% – на
основе таксанов. В адъювантном
режиме 47,8% получили тамоксифен, 35,3% – ингибиторы ароматазы,
не получали антиэстрогены 16,9%
больных. Проспективное когортное исследование включало наблюдение за больными ранним раком
молочной железы с ноября 2014 г.
по январь 2020 г. Сравнение проводилось между больными исходно с
наличием когнитивных нарушений с
группой пациентов без когнитивных
отклонений. Контрольными точками
для оценки когнитивных нарушений
служили исходное состояние когнитивных функций (КФ) – T1, состояние КФ через 6 недель после начала
химиотерапии (T2), КФ через 3 месяца после начала химиотерапии либо
после окончания химиотерапии (T3)
и через 12 и 24 месяца после окончания химиотерапии (T4). На протяжении всего периода наблюдения о
когнитивных нарушениях сообщили
40,4% больных. У 11% (n=15) больных были диагностированы острые
когнитивные нарушения, у 15,4%
(n=21) пациенток зарегистрированы
когнитивные нарушения, носящие
постоянный характер, и у 14% (n=19)
отмечены когнитивные нарушения
после завершения лечения. В представленной работе изучение уровня
цитокинов IFN-γ, IL-4, IL-6, TNF-α
указало на наличие повышенных показателей всех цитокинов до начала
лечения, как у больных с наличием
нарушения КФ, так и без отклонений
КФ, также был отмечен рост показателей цитокинов на фоне проводимой химиотерапии. Параллельно
в исследованной группе пациенток
был изучен уровень BDNF (brain
derived neurotrophic factor) – мозгового нейротрофического фактора.
BDNF является белком из класса цитокинов, семейства факторов роста и
подсемейства нейротрофинов. BDNF
выявляется в глиальных и преимущественно в нейрональных клетках,
является одним из факторов, поддерживающих дифференциацию,
созревание и выживаемость нейронов в нервной системе, угнетающих
клеточный апоптоз и проявляющих
нейропротекторный эффект в неблагоприятных условиях, таких как
глутаматергическая стимуляция, церебральная ишемия, гипогликемия
и нейротоксичность. Дефицит BDNF
может обусловить аномалии развития головного мозга, понижение нейрональной пластичности и снижение
адаптивных реакций на стрессовые
ситуации. У больных раком молочной железы в изученной группе отмечено повышение более чем в 3 раза
уровней цитокинов при развитии
острых и постоянных нарушений
КФ в сравнении с группой пациентов
без когнитивного дефицита. Также
были получены результаты взаимодействия высоких показателей
цитокинов у больных рРМЖ с низким уровнем BDNF. Достоверными
оказались высокий уровень IL-6 с
обратной корреляционной связью
с уровнем BDNF у пациенток с постоянными нарушениями КФ. Alex
Сhan (2022 г.) опубликовал результат
изучения белков экстрацеллюлярных везикул в плазме крови больных
раком молочной железы как этиопатогенетического фактора в развитии
когнитивных нарушений. В норме
формирование экзосом как одного из класса внеклеточных везикул
является необходимым процессом
для поддержания межклеточного
взаимодействия в организме человека. Экзосомы представляют собой
сферические частицы с размером 30-
150 нм, их участие отмечено в таких
состояниях, как нарушение иммунного гомеостаза, беременность, инфекционные заболевания, наличие
у пациента злокачественного новообразования, а также при органических заболеваниях головного мозга.
Экзосомы формируют везикулярные
тельца, которые действуют строго
в клетках мишенях. Формирование экзосом является естественным
процессом при поддержании межклеточного взаимодействия как в
структурах головного мозга, так и в
его взаимодействии с периферической нервной системой. Установлена
основополагающая роль экзосом в
поддержании пластичности процессов головного мозга, регенерации
нейронов, а также в сохранении их
функций в условиях оксидантного
стресса. Экзосомы также являются
модуляторами иммунного ответа,
пролиферации клеток, а также активаторами сигнальных путей в клетках реципиента. У больных со злокачественными новообразованиями
установлено формирование опухолевых экзосом, которые обладают
свойствами злокачественной клетки
– инвазией, иммуносупрессией, обладают факторами роста, перенося
в своем составе микро-РНК опухолевой клетки, они также участвуют
в формировании метастазов, формируют и резистентность опухолевой
клетки к проводимой терапии. При
изучении участия опухолевых экзосом в формировании когнитивных
нарушений было установлено, что
они помогают патологическим белкам преодолевать гематоэнцефалический барьер, нарушают передачу
импульса как в центральной нервной
системе, так и при передаче импульса
с периферии и внутренних органов.
Путем переноса в своем составе патологических белков опухолевые
экзосомы прицельно поражают олигодендроциты, астроциты и клетки
микроглии, вызывая демиелинизацию клеточных структур, препятствуют их регенерации, нарушают
межнейрональное взаимодействие.
Установлено, что опухолевые экзосомы способны переносить в своем
составе матричные РНК (miR-155,
miR-21 и miR-29а), а также белки
теплового шока (Hsp70 и Hsp90),
стимулируя катаболизм в скелетной
мускулатуре, что вызывает атрофию
мышц и характерные для онкобольных кахексию и такой распространенный симптом, как «слабость, снижение работоспособности».
Опухолевые экзосомы участвуют в
регуляции иммунного ответа путем
воздействия непосредственно на
макрофаги, Т-клетки и NK-клетки.
Стоит отметить, что Maji S. с соавторами (2017 г.) установили, что клетки
рака молочной железы формируют
экзосомы, которые содержат белки,
активирующие патологические сигнальные пути в макрофагах, которые
в свою очередь участвуют в ангиогенезе метастазов и формируют цитокиновый ответ в клетках головного
мозга и легких.
В настоящее время экзосомы потенциально рассматриваются как клинические биомаркеры для прогнозирования и динамического контроля
в развитии когнитивных нарушений
у онкологических больных, а также
как мишени для терапевтического
воздействия для лечения нарушения КФ у онкологических больных.
Chan A. с соавторами в июне 2022
г. анонсировали грант на изучение
воздействия электроакупунктуры
на уровень определенных молекул
у больных раком молочной железы с параллельным фиксированием
сканов структур головного мозга на
фоне проводимой терапии. Стоит
отметить результаты более ранней
публикации Chan A. с соавторами
от 2015 г., которые изучали фармакологическое воздействие на коррекцию КН у больных раком молочной железы (эритропоэтина альфа,
Гинко билоба, психостимуляторы) в
сравнении с проведением занятий,
направленных на коррекцию КН и
физической активности. Полученные данные указали на отсутствие
эффекта от лекарственной терапии
данными препаратами для коррекции КН у больных РМЖ. Упражнения, направленные в отношении
нарушенных когнитивных функций,
позволили улучшить самооценку
когнитивного здоровья, память,
словесную функцию, речь, ориентацию в происходящем и внимание,
скорректированная физическая активность позволила улучшить показатели по выполнению функций и
самооценке когнитивного здоровья.
Резюмируя, стоит вспомнить слова
героя народного артиста СССР Леонида Сергеевича Броневого (лекарь,
«Формула любви», 1984 г.): «…А
голова – предмет тёмный и исследованию не подлежит». Широкий
диапазон исследований в изучении
этиопатогенетических факторов
когнитивных нарушений у онкологических больных на всех этапах лечения и при длительном наблюдении
требует дальнейшей детализации
и систематизации для формирования единого терапевтического подхода как со стороны онколога, так
и в рамках междисциплинарного
взаимодействия. В настоящее время
сформированы опросники для диагностики когнитивных нарушений у
онкологических больных, однако их
презентация больному в рутинную
практику онколога представляется
сомнительной с учетом приоритетных направлений, формирующихся
у онкобольного при постановке диагноза и в процессе лечения. Внедрение тестов с объективной оценкой
когнитивного статуса пациента представляется возможным на этапах
диспансерного наблюдения. Следует
отметить, что клиницисту онкологу
просто оценить риск развития КН у
каждого пациента с учетом полученных знаний (рис.1). Принятие решения о дообследовании когнитивного
статуса онкобольного в каждом конкретном случае остается нерешенным вопросом, так как нет четких
критериев для дальнейшей тактики
ведения онкологического пациента
как в рамках, так и вне диагноза по основному заболеванию. Необходимым является и формулирование
диагноза КН (для примера может
служить указание КН в рамках шифра F06.7 «Лёгкое когнитивное расстройство»).
В современных условиях формирование показаний к когнитивной
реабилитации, объем необходимых
обследований и терапевтические
подходы требуют рассмотрения как
со стороны клинических онкологов,
так и в рамках междисциплинарного
подхода. Необходимо привнести КН
у онкологических больных в протоколы оказания медицинской помощи на всех этапах реабилитации.
Рисунок 1.
Факторы риска развития когнитивных нарушений
у онкологических больных (слайд презентации «Risk factors
for cancer-related Cognitive Impairment» A.Chan, вебинар
MASCC, 2022 г.) с дополнением автора статьи.
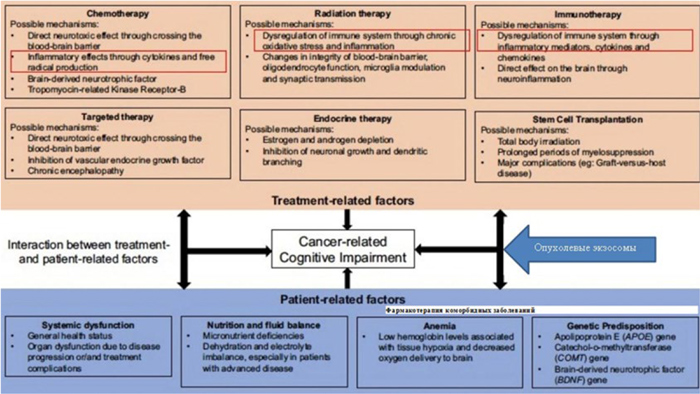
Литература:
1. Войнаревич А.О., Горбунова В.А., Завалишин И.А. и соавт. Диагностика и лечение нейротоксических осложнений химиотерапии производными платины у онкологических больных. Вестник РОНЦ им. Н.Н. Блохина РАМН. 1997; С.8-12.
2. Иозефи Д.Я., Винидченко М.А., Демченко Н.С. Проблема токсической энфефалопатии, ассоциированной с химиотерапией у онкологических больных, обзор возможностей магнитно-резонансной визуализации и нейроонкологического мониторинга. Глав.врач. 2017; №3 (56), С.43-47.
3. Левчук Л.А., Вялова Н.М., Михалицкая Е.В. и соавт. Роль BDNF в патогенезе неврологических и психических расстройств. Современные проблемы науки и образования. 2018; №6. DOI 10.17513/spno.28267.
4. Трегулова Д.Р., Бакиров Б.А., Ахмадеева Л.Р. Влияние полихимотерапии на когнитивные функции у пациентов с лимфопролиферативными заболеваниями: обзор литературы и собственные клинические наблюдения. Пермский мед. журнал. 2018; том XXXV, №6, С.73-81.
5. Chan A, Cheng I, Wang C, et al. Cognitive Impairment in adolescent and young adult cancer patients: Pretreatment findings of a longitudinal study. Cancer Med. 2022; 00: 1-11. doi: 10.1002/cam.45295.
6. Chia JT, S.Yin Ching Y, Raymond J Chan, et al. Investigating how cancerrelated symptoms influence work outcomes among cancer survivors: a systematic review. J. of Cancer Surv. 2022; 16: 1065-1078.
7. Ding Quan Ng, Chan D, Parisa Agrawal, et al. Evidence of brain-derived neurotrophic factor in ameliorating cancer-related cognitive impairment: A systematic review of human studies. Critical Reviews in Oncology/ Hematology. 2022; 176: 103748.
8. Meyers CA, Maher Albitar, Elihu Estey. Cognitive Impairment, Fatigue, and cytokines levels in patients with Acute Myelogenous Leukemia or Myelodysplastic Syndrome. Cancer. 2005 August 15; Vol.104, №4, p.788- 793.
9. Janelsins MC, Kesler SR, Ahles TA, Morro GR. Prevalence, mechanisms, and management of cancer- related cognitive impairment. Inter. Review of Psychiatry. 2014; Vol.26, №1, p.102-113.
10.Ning YiY, Long Toh Yi, et al. Relationship between cytokines and brain-derived neurotrophic factor (BDNF) in trajectories of cancer- related cognitive impairment. J. Cytokine. 2021 August; 144: 155556. doi: 10.1016/ j.cyto.2021.155556.
11.Chan RJ, McCarthy AL, Devenish J, et al. Systematic review of pharmacological and non-pharmacological interventions to manage cognitive alteration after chemotherapy foe breast cancer. Eur. J. of Cancer. 2015; 51: 437-450.
12.Mayo SJ, Lustberg M, Dhillo HM, et al. Cancer- related cognitive impairment in patients with non-central nervous system malignencies: an overview for oncology providers from the MASCC Neurological Complications Study Group. Supp. Care in Cancer. 2020. Wefel JS, Kesler SR, Noll KR, et al. Clinical characteristics, pathophysiology, and management of noncentral nervous system cancerrelated Cognitive Impairment in adults. CA. 2015; Vol.65, №2, p.123- 138.
Yi Long Toh, Wang C., Han Kiat Ho, et al. Distinct cytokine profiles across trajectories of self-perceived cognitive impairment among earlystage breast cancer survivors. J. of Neuroimmun. 2020; 342: 577196. Yong QK, Chia JT, et al. Role of Exosomes in Cancer –Related Cognitive Impairment. Int. j. Mol. Sci. 2020; 21: 2755.