Дорогие коллеги, дорогие читатели!
Мы надеемся, что в предпраздничной суете и дремоте первых январских дней вам всем удалось отдохнуть душой и телом, несмотря на то что наша работа не замирает ни на секунду. Наверняка у многих из вас намечены новые планы, начаты новые проекты, обозначены новые поездки. Здесь, на страницах газеты RUSSCO и на сайте rosoncoweb.ru, мы...

Огюст Тульмуш (Auguste Toulmouche). «Поцелуй». 1870,
холст, масло. Неизвестная коллекция
УВЕРТЮРА
Ананасы в шампанском! Ананасы в шампанском! Удивительно вкусно, искристо и остро! Весь я в чем-то норвежском! Весь я в чем-то испанском! Вдохновляюсь порывно! И берусь за перо! Стрекот аэропланов! Беги автомобилей! Ветропросвист экспрессов! Крылолет буеров! Кто-то здесь зацелован! Там кого-то побили! Ананасы в шампанском - это...
ОТЧЕТ FDA ОБ ОДОБРЕННЫХ В 2021 ГОДУ ЛЕКАРСТВЕННЫХ СРЕДСТВАХ
Из этого числа четыре новых препарата были одобрены для терапии немелкоклеточного рака легкого, включая один из его подтипов, ранее считавшийся устойчивым к лечению. Помимо одобрения новых препаратов, в 2021 были приняты новые показания для уже существующих в клинической практике препаратов (для точного определения показаний обращайтесь к полной инструкции на сайте FDA). Так, кабозантиниб, зарегистрированный впервые в 2016 году, был одобрен для лечения распространенного почечно-клеточного рака, местно-распространенного или метастатического...

Конференция RUSSCO
РАК ЛЕГКОГО

СОЖАЛЕНИЕ О СДЕЛАННОМ ВЫБОРЕ КАК ПОТЕНЦИАЛЬНЫЙ ИНТЕГРАЛЬНЫЙ ПОКАЗАТЕЛЬ КАЧЕСТВА ЖИЗНИ БОЛЬНЫХ ПОСЛЕ ПРОВЕДЕННОГО ПРОТИВООПУХОЛЕВОГО ЛЕЧЕНИЯ
Современная онкология, добившаяся немалых успехов в области сохранения и продления жизни больных, все чаще обращается к теме качества этой жизни. При этом патерналистский подход, когда...

КОММЕНТАРИЙ ЭКСПЕРТА
Совершенно не удивительно, что сожаление о выбранном лечении среди больных с локализованным раком простаты отмечалось чаще в группе хирургического лечения (16%) или лучевой терапии...
РЕГИОНАЛЬНОЕ ОТДЕЛЕНИЕ RUSSCO В КРАСНОЯРСКЕ
Дорогие коллеги, дорогие читатели! С начала нового 2022 года на страницах газеты RUSSCO, а также на сайте rosoncoweb.ru мы планируем более подробно знакомить вас с региональными отделениями общества. Всегда интересно знать, кто из наших коллег, где и в каких условиях работает в разных уголках страны. К тому же, ввиду ограничений, связанных с пандемией коронавирусной...

ПЕРЕРЫВЫ В РАДИКАЛЬНОМ КУРСЕ ЛУЧЕВОЙ ТЕРАПИИ: ВОЗМОЖНО ЛИ «ПРОТИСНУТЬСЯ» В ТЕРАПЕВТИЧЕСКОЕ ОКНО?
Современная радиотерапия не приемлет разрывов в лечении. Потеря локального контроля за каждый незапланированный пропущенный день лечения сейчас ни у кого не вызывает сомнений....

КОММЕНТАРИЙ ЭКСПЕРТА
Радиотерапевты, работающие более 7-8 лет по специальности, прекрасно помнят, как регулярно администрация учреждений по результатам годовых отчетов «строгала» нас за чрезмерно...
РЕЗОЛЮЦИЯ ЭКСПЕРТНОГО СОВЕТА 27.10.2021 Экспертный совет: «Лечение рецидивирующего рака яичников у пациенток с противопоказаниями к назначению или непереносимостью препаратов платины»
Согласно ведущим мировым рекомендациям, лечение рецидива РЯ свыше 6 мес. после окончания платиносодержащей терапии должно снова проводиться препаратами на ее основе (за исключением случаев непереносимости) [4-7]. Возможности лечения платиновыми агентами ограничиваются первичной и приобретенной резистентностью, а также развитием нежелательных...

ПОДМЕЧЕНО ОНКОЛОГОМ: БУДЕМ ЖИТЬ!
Родился в д. Коргино Енисейского района. В 1975 году закончил Красноярский государственный медицинский институт, педиатрический факультет. После прохождения интернатуры работал детским...

Конференция RUSSCO
ОНКОГИНЕКОЛОГИЯ

ДИСКУССИОННАЯ СЦЕНА: ХИРУРГИЯ VS SBRT ПРИ ОПЕРАБЕЛЬНОМ РАКЕ ЛЕГКОГО I СТАДИИ
Дорогие коллеги, специалистыонкологи, диагносты, патоморфологи, эпидемиологи, хирурги, радиотерапевты, химиотерапевты и те, кто схожи по духу и одной крови с нами!

РИСАРГ
рибоциклиб

ЛИНПАРЗА
олапариб

BREAST CANCER SYMPOSIUM В SAN ANTONIO 2021. ЭВОЛЮЦИЯ ЛОКО-РЕГИОНАРНОГО ЛЕЧЕНИЯ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ В ЭРУ МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИХ ТЕХНОЛОГИЙ: ХИРУРГИЧЕСКИЕ АСПЕКТЫ
В Сан-Антонио, США, с 7 по 10 декабря 2021 года проходила конференция San Antonio, объединившая специалистов по лечению рака молочной железы со всего мира. В рамках конференции Monica...

РОЛЬ ЖИДКОСТНОЙ БИОПСИИ В ДИАГНОСТИКЕ НЕМЕЛКОКЛЕТОЧНОГО РАКА ЛЕГКОГО (НМРЛ)
Рак легкого представляет собой гетерогенную группу заболеваний. От точности морфологической верификации злокачественного процесса зависит правильность назначения терапии, что в свою...

КОММЕНТАРИЙ ЭКСПЕРТА
Я абсолютно согласен с автором статьи в том, что внедрение таргетной терапии изменило подходы к диагностике, применяемые у больных с НМРЛ. Если раньше для проведения лечения было...

ВАКЦИНАЦИЯ ОТ COVID-19. «Я», «МЫ» И… АДЪЮВАНТНАЯ ТЕРАПИЯ
Дорогие коллеги, вот и прошло уже 2 года с момента, когда мы впервые услышали аббревиатуру «COVID-19». С той поры отношение к заболеванию претерпело множество изменений – от шутливых///
КОМБИНАЦИЯ ПАКЛИТАКСЕЛА И КАРБОПЛАТИНА НЕ УСТУПАЕТ ПО ЭФФЕКТИВНОСТИ ПАКЛИТАКСЕЛУ И ИФОСФАМИДУ ПРИ КАРЦИНОСАРКОМЕ МАТКИ И ЯИЧНИКОВ. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ 3 ФАЗЫ GOG-0261
В январе 2022 года в Journal of Clinical Oncology опубликованы результаты крупного многоцентрового исследования III фазы GOG-0261, посвященного изучению эффективности паклитаксела в комбинации с ифосфамидом или карбоплатином при карциносаркомах матки, яичников. Карциномаркома (синоним - злокачественная смешанная мюллеровская опухоль) является...
TROPION-PANTUMOR01: ДАТОПОТАМАБ ДЕРУКСТЕКАН ПРИ ДИССЕМИНИРОВАННОМ ТРИЖДЫ НЕГАТИВНОМ РАКЕ МОЛОЧНОЙ ЖЕЛЕЗЫ (ТН РМЖ)
На SABCS 2021 были представлены результаты исследования TROPION-PanTumor01. В мультикогортном исследовании I фазы изучалась эффективность Датопотамаба дерукстекана при рефрактерных к стандартной терапии солидных опухолях. Уровень экспрессии Trop-2 не влиял на включение пациентов в исследование. Датопотамаб дерукстекан (DatoDxd) представляет собой конъюгат, состоящий...
GEMSTONE-302. СУГЕМАЛИМАБ В КОМБИНАЦИИ С ПЛАТИНОСОДЕРЖАЩИЙ ХИМИОТЕРАПИЕЙ В ПЕРВОЙ ЛИНИИ ЛЕЧЕНИЯ НЕМЕЛКОКЛЕТОЧНОГО РАКА ЛЕГКОГО
4 января 2022 года в журнале The Lancet Oncology опубликованы результаты исследования III фазы по изучению эффективности и токсичности сугемалимаба (ингибитора PD-L1) в комбинации с платиносодержащей химиотерапией в 1 линии лечения диссеминированного немелкоклеточного рака легкого (НМРЛ). ...

Фарм
Инновационные технологии здоровья

Тафинлар+Мекинист
РАЗВЕРНИТЕ ЖИЗНЬ ДАЛЬШЕ!
Анонс
-

24 -25 февраля 2022
конференция RUSSCO РАК ЛЕГКОГО
-

25 -26 марта 2022
конференция RUSSCO ОНКОГИНЕКОЛОГИЯ
-

8 апреля 2022
конференция RUSSCO ИММУНООНКОЛОГИЯ
Дорогие коллеги, дорогие читатели!
Все новогодние праздники остались позади, и январь нового 2022 года вступил в свои права.
Мы надеемся, что в предпраздничной суете и дремоте первых январских дней вам всем удалось отдохнуть душой и телом, несмотря на то что наша работа не замирает ни на секунду. Наверняка у многих из вас намечены новые планы, начаты новые проекты, обозначены новые поездки. Здесь, на страницах газеты RUSSCO и на сайте rosoncoweb.ru, мы так же планируем воплотить в жизнь ряд идей, в частности, обсуждение спорных вопросов в онкологии двумя экспертами в формате «Дискуссионная сцена», с возможностью для читателей писать комментарии, задавать вопросы и голосовать онлайн, а также введение страницы «Знакомьтесь, региональное отделение RUSSCO». И, конечно же, мы продолжим знакомить вас с последними новостями онкологии, в том числе с комментариями экспертов, и новостями нашего профессионального сообщества.
Искренне желаем вам плодотворного, удачного и динамичного нового 2022 года!
Команда RUSSCO
Огюст Тульмуш (Auguste Toulmouche). «Поцелуй». 1870,
холст, масло. Неизвестная коллекция

УВЕРТЮРА
Ананасы в шампанском! Ананасы в шампанском! Удивительно вкусно, искристо и остро! Весь я в чем-то норвежском! Весь я в чем-то испанском! Вдохновляюсь порывно! И берусь за перо! Стрекот аэропланов! Беги автомобилей! Ветропросвист экспрессов! Крылолет буеров! Кто-то здесь зацелован! Там кого-то побили! Ананасы в шампанском - это пульс вечеров! В группе девушек нервных, в остром обществе дамском Я трагедию жизни претворю в грезофарс... Ананасы в шампанском! Ананасы в шампанском! Из Москвы - в Нагасаки! Из Нью-Йорка - на Марс!
ИГОРЬ СЕВЕРЯНИН
Январь 1915
ОТЧЕТ FDA ОБ ОДОБРЕННЫХ В 2021 ГОДУ ЛЕКАРСТВЕННЫХ СРЕДСТВАХ
В 2021 году FDA одобрило 50 новых препаратов для практического использования, 11 из них в области онкологии:

Рис.
Количество препаратов, ежегодно одобряемых FDA с 2012 года
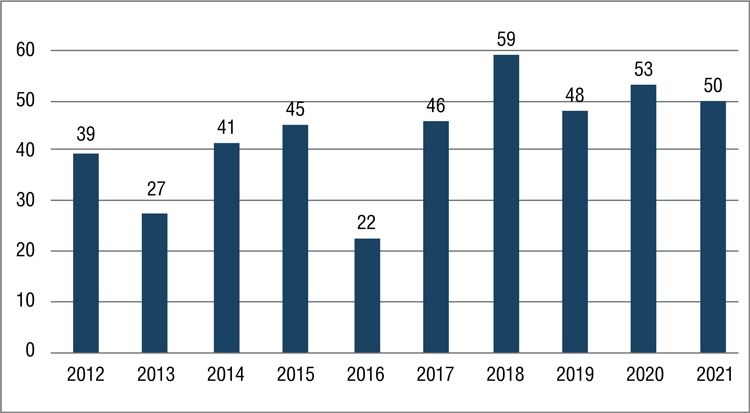
Из этого числа четыре новых препарата были одобрены для терапии немелкоклеточного рака
легкого, включая один из его подтипов, ранее считавшийся устойчивым к лечению.
Помимо одобрения новых препаратов, в 2021 были приняты новые
показания для уже существующих
в клинической практике препаратов (для точного определения
показаний обращайтесь к полной инструкции на сайте FDA).
Так, кабозантиниб, зарегистрированный впервые в 2016 году, был
одобрен для лечения распространенного почечно-клеточного рака,
местно-распространенного или
метастатического дифференцированного рака щитовидной железы
с прогрессированием на предшествующей терапии у больных в
возрасте 12 лет и старше.
Трастузумаб дерукстекан, впервые
зарегистрированный в 2019, был
одобрен для лечения местнораспространенного или метастатического HER2-позитивного рака
желудка или рака кардиоэзофагеальной зоны, предлеченного предшествующей линией терапии.
Пембролизумаб, впервые зарегистрированный в 2014 году, был
одобрен, как в монотерапии, так
и комбинациях. Новые показания
включили рак пищевода и кардиоэзофагеальной зоны с определенными критериями; рак желудка и
кардиоэзофагеальной зоны с определенными критериями; местнораспространенный плоскоклеточный
рак кожи, который не подлежит
хирургическому или лучевому
лечению; распространенный рак
эндометрия; тройной негативный
рак с определенными критериями; распространенный рак почки;
определенные стадии меланомы;
рак шейки матки с определенными
критериями.
Ниволумаб, впервые зарегистрированный в 2014, одобрен для лечения рака желудка в первой линии,
рака пищевода с определенными
критериями, и в адъювантной терапии уротелиального рака высокого риска, рака мочевого пузыря с
определенными критериями.
Атезолизумаб, в 2021 был одобрен
в виде адъювантной терапии местнораспространенного немелкоклеточного рака легкого II-IIIа стадии
после хирургического лечения и
платиносодержащей химиотерапии с определенными опухолевыми характеристиками.
В 37 из 50 случаев одобрений новых
лекарственных средств в 2021 году
(74%) использовалась одна или
несколько ускоренных программ
одобрения, в частности программа
быстрого одобрения, одобрение
прорывной терапии, приоритетное
рассмотрение и/или ускоренное
одобрение. Из 11 препаратов онкологического профиля 10 были
одобрены по одной из ускоренных
программ.
Конференция RUSSCO
РАК ЛЕГКОГО
24 -25 февраля 2022

СОЖАЛЕНИЕ О СДЕЛАННОМ ВЫБОРЕ КАК ПОТЕНЦИАЛЬНЫЙ ИНТЕГРАЛЬНЫЙ ПОКАЗАТЕЛЬ КАЧЕСТВА ЖИЗНИ БОЛЬНЫХ ПОСЛЕ ПРОВЕДЕННОГО ПРОТИВООПУХОЛЕВОГО ЛЕЧЕНИЯ
Автор: Жуков Николай Владимирович
ФГБУ «НМИЦ Детской гематологии, онкологии
и иммунологии им. Д. Рогачева», Москва
Современная онкология, добившаяся немалых успехов в области сохранения и продления жизни больных, все чаще обращается к теме качества этой жизни. При этом патерналистский подход, когда «доктор лучше знает, что надо больному», постепенно переходит в состояние диалога – когда мнение и выбор пациента тоже имеет значение. Особенно это касается ситуаций, когда выбор действительно есть: для лечения с одинаковым (или очень близким) успехом в отношении «онкологической эффективности» можно использовать две (или более) альтернативных методики, которые различаются лишь тем самым «качеством жизни» (продолжительность которой будет сопоставимой). В этой ситуации мнение информированного пациента должно было быть критичным – каждый выбирает для себя, чего он больше хочет (или не хочет) от лечения, дающего одинаковый шанс на выздоровление или продление жизни. Что лучше – стоматит или ладонно-подошвенный синдром, импотенция и недержание мочи или проктит и стеноз уретры? Согласитесь, непростой выбор для неспециалиста. Увы, попытки стандартизации оценки качества жизни с целью сделать этот показатель более понятным для врача (а через врача и для пациента) нельзя назвать очень успешными. Сложные шкалы оценки (кто видел, тот поймет – иногда и врачу непросто их заполнить, а варианты значимости и честность ответа на многие вопросы могут сильно зависеть, например, от страны проживания) не очень прижились в качестве решающего аргумента при выборе варианта лечения. А в беседе с пациентом (если врач все же решил доверить выбор именно больному) чаще всего мы все равно уходим к перечислению возможных конкретных побочных эффектов и очень редко используем в качестве аргумента показатели оценки качества жизни. А при таком подходе все становится весьма субъективным – как врач изложил ситуацию, так ее пациент и понял. А врач иногда лицо заинтересованное – например, если речь идет о ситуациях, когда от выбора пациента зависит, к какому специалисту он в итоге пойдет, т.е. врачу какой специальности больной принесет идущие за ним деньги (личные или страховые). Для нашей страны, пожалуй, это не так важно – пока финансирование здравоохранения устроено так, что благосостояние доктора не сильно завязано на поток пациентов. Хотя и в этой ситуации каждый из специалистов, даже исходя из профессиональной «гордости», будет хвалить свою методику. Но для западной модели, где количество пролеченных больных напрямую связано с благосостоянием доктора и клиники, этот вопрос является ключевым. Поэтому при отсутствии однозначных преимуществ той или иной методики выбор пациента скорее всего будет зависеть от убедительности конкретного врача.
Классическим примером подобного выбора является выбор методики лечения локализованного рака предстательной железы. Не вдаваясь в подробности, можно сказать, что в широком спектре клинических ситуаций хирургическое или лучевое лечение (или даже активное наблюдение) имеют одинаковую (или очень-оченьочень близкую) эффективность в отношении шанса на излечение или долгую жизнь без проявлений болезни. Но выбор-то все равно нужно делать. И в этой ситуации выбор делает тот самый «информированный» больной, получающий информацию от докторов, которые, по понятным причинам, должны изложить ему плюсы и минусы возможных вариантов терапии. Что они добросовестно и делают. После этого пациент принимает решение и выбирает тот или иной вариант терапии. Выбирает на основании своих представлений о пользе и риске, но эти представления целиком и полностью зависят от той информации, которую он получил от докторов. Были ли работы, оценивающие качество жизни пациентов, подвергшихся различным методам лечения локализованного рака предстательной железы? Безусловно. Однако их результаты нельзя назвать однозначными и легко применимыми для того, чтобы улучшить «навигацию» последующих пациентов. Но, как нам кажется, недавно опубликованное исследование может быть использовано при принятии решения и беседах с пациентами более эффективно, чем оценка различных шкал качества жизни – просто в силу «житейской» простоты и понятности оцениваемого в ней показателя. 2072 пациента с локализованным раком предстательной железы были включены и получали лечение в рамках исследования Comparative Effectiveness Analysis of Surgery and Radiation (CEASAR), где была использована тактика, предусматривающая проведение радикальной простатэктомии (55%), лучевой терапии (32%) или активного наблюдения (13%). Основной задачей исследования была оценка качества жизни и побочных явлений различных подходов к лечению. Спустя 5 лет пациенты ответили на вопрос о том, есть ли у них разочарование в сделанном выборе (сожалеют ли они о том, что выбрали именно этот вариант). Лидером в отношении разочарования оказалась хирургия – почти каждый пятый (16%) из опрошенных больных сожалел о принятом решении, среди выбравших лучевую терапию таких было 11%, среди тех, кто выбрал активное наблюдение, – лишь 7%. Наиболее частой причиной разочарования было ощущение того, что перед принятием решения не была получена полная информация о потенциальных рисках и пользе этих трех подходов (чаще всего это касалось рисков хирургии). Несмотря на то, что ожидаемое разочарование в выборе чаще встречалось среди пациентов с худшим эффектом или более выраженной токсичностью, несоответствие между ожиданиями пациента и реальными последствиями лечения в отношении эффективности и нежелательных явлений было гораздо более важной причиной сожаления о сделанном выборе, чем реальная оценка выраженности функциональных последствий (включая даже такие серьезные, как эректильная или кишечная дисфункция, недержание мочи).
Несмотря на то, что исследование не было рандомизированным и группы больных различались между собой (в группе лучевой терапии пациенты были старше, имели больше сопутствующих заболеваний и несколько худший прогноз, чем пациенты из хирургической группы, пациенты из группы активного наблюдения были старше больных из хирургической группы, но моложе, чем пациенты из группы лучевой терапии, при этом имели лучший прогноз), как нам кажется, полученные данные вполне могут быть использованы в дальнейшем в качестве «навигатора» для врачей и пациентов, принимающих решение о варианте лечения локализованного рака предстательной железы в ситуациях, когда онкологические результаты различных методик одинаковы или различаются незначительно.
Источник:
Wallis CJD, Zhao
Z, Huang L, et al. Association of
Treatment Modality, Functional
Outcomes, and Baseline Characteristics
With Treatment-Related Regret
Among Men With Localized Prostate
Cancer. JAMA Oncol. Published online
November 18, 2021. doi:10.1001/
jamaoncol.2021.5160.
КОММЕНТАРИЙ ЭКСПЕРТА
Автор: Митин Тимур
Университет Здоровья и Науки Орегона,
Отделение радиационной медицины, Портленд, США
Совершенно не удивительно, что сожаление о выбранном лечении
среди больных с локализованным раком простаты отмечалось чаще
в группе хирургического лечения (16%) или лучевой терапии (11%) –
в отличие от активного наблюдения (7%). По крайней мере, сегодня
мы знаем, что активное наблюдение действительно является предпочтительной модальностью для пациентов с раком простаты низкого
риска и отчасти – промежуточного риска.
Мы знаем об этом, потому что врачи и пациенты из Великобритании
были достаточно смелы, чтобы запустить и благополучно провести
одно из наиболее влиятельных исследований века – ProtecT [1,2].
Пятьсот сорок пять пациентов с локализованным раком простаты
были рандомизированы в группу активного наблюдения (ПСА каждые 3 месяца в течение года, затем каждые 6 месяцев, с повторной биопсией в том случае, если рост ПСА составляет не менее 50% за 12
месяцев), столько же больных – в группу облучения (3D конформная
лучевая терапия в дозе 74 Гр за 37 фракций и 3-6 месяцев неоадъювантной и одновременной андроген-депривационной терапии) и 553
пациента попали в группу радикальной простатэктомии (82% – на открытую, 66% – на нервосберегающую простатэктомию). Через 10 лет
после рандомизации раково-специфическая выживаемость составила 98,8% в группе наблюдения, 99% в группе операции и 99,6% в группе лучевой терапии. В то же время недержание мочи и эректильная
дисфункция оказались хуже среди оперированных пациентов, а нарушение функции кишечника – у пациентов, прошедших облучение.
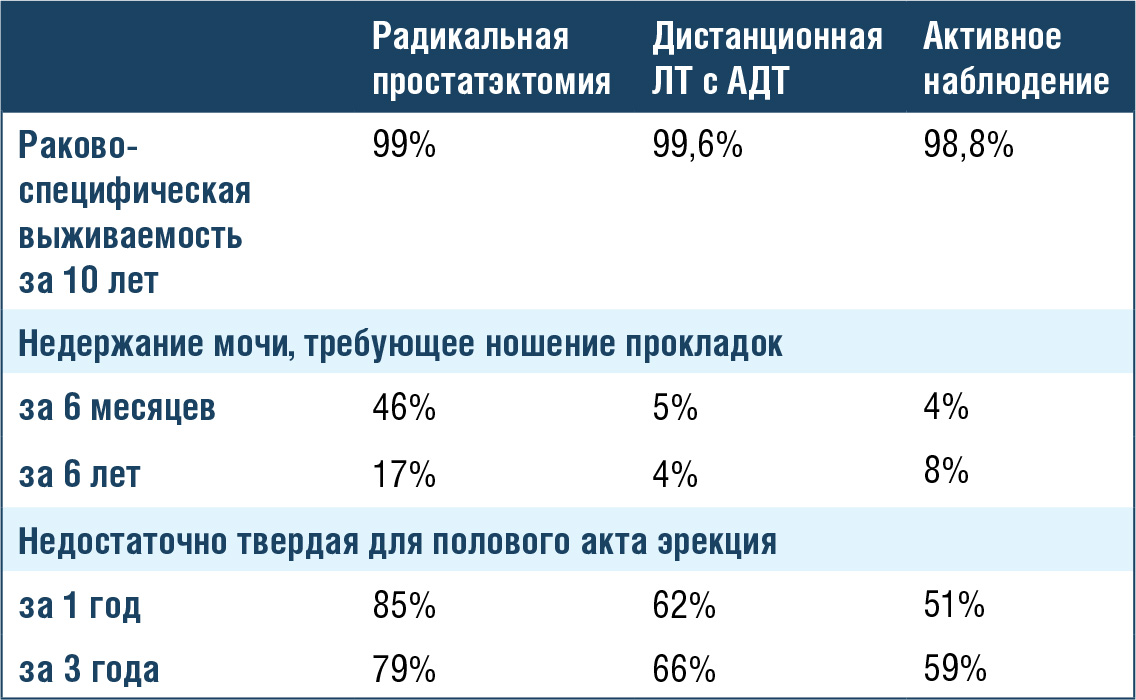
20% больных в этом крупном исследовании имели рак простаты
промежуточного риска, и результаты их лечения не были хуже, чем
у пациентов с зарегистрированным раком низкого риска. Таким образом, исследование ProtecT демонстрирует реальные клинические
преимущества в пользу активного наблюдения не только больных
с низким, но и с промежуточным риском. В то же время в США наблюдательная тактика широко применяется для пациентов с низким
риском, но пока не в полной мере принята для больных с раком простаты промежуточного риска. Мы проводили опрос среди экспертов
по урогенитальному раку после выхода результатов ProtecT – и лишь
16% североамериканских лидеров в этой области поддержали активное наблюдение при промежуточном риске [3].
В сентябре 2021 года эксперты NCCN решили убрать «предпочтительный статус» этой опции для больных с раком простаты низкого риска,
сделав наблюдение, операцию и лучевую терапию эквивалентными
в плане выбора. Это изменение вызвало заметную реакцию в медиа,
когда многие лидирующие урологи, радиационные и медицинские онкологи начали критиковать экспертов NCCN за это изменение. Этот
всплеск привел к тому, что рекомендации были снова обновлены буквально несколько недель назад – и вновь активное наблюдение было
признано «предпочтительным для большинства больных» с низким
риском и ожидаемой продолжительностью жизни свыше 10 лет.
На протяжении более десятилетия пациенты с диагностированным раком простаты проходили оценку в плане будущего лечения
в Massachusetts General Hospital командами врачей – хирургами, радиационными онкологами, медицинскими онкологами, которые осматривали больных все вместе, одномоментно и в одной комнате, с
последующим обсуждением возможных лечебных опций. Это действительно наилучший путь для представления доступных клинических данных непредвзятым образом, чтоб пациент смог сам сделать выбор. Дальнейшее изучение подобного подхода коллегами из
Massachusetts General Hospital показало, что пациенты, прошедшие
через такой консилиум, почти в 2 раза чаще (43% против 22%) выбирают активное наблюдение, в отличие от тех, кто консультирован
отдельными специалистами [4]. Подобная модель, возможно, не
улучшит результаты лечения – как мы знаем из данных ProtecT, результаты одинаковы, какой бы выбор ни был сделан – но наверняка
уменьшит частоту случаев сожаления, которые пациенты испытают в
результате проведенного лечения.
Источники:
1. F.C. Hamdy, et al. 10-Year Outcomes after Monitoring, Surgery, or Radiotherapy for Localized Prostate Cancer. N Engl J Med. 2016; 375: 1415- 24.
2. J.L. Donovan, et al. Patient-Reported Outcomes after Monitoring, Surgery, or Radiotherapy for Prostate Cancer. N Engl J Med. 2016; 375: 1425-37.
3. Shearwood McClelland III, et al. Active Surveillance for Low and Intermediate Risk Prostate Cancer: Opinions of North American Genitourinary Oncology Expert Radiation Oncologists. Clinical Genitourinary Cancer. 2017; 16(2): e323-5.
4. Ayal A. Aizer, et al. Multidisciplinary Care and Pursuit of Active
Surveillance in Low-Risk Prostate Cancer. J Clin Oncol. 2012; 30: 3071-3076.
РЕГИОНАЛЬНОЕ ОТДЕЛЕНИЕ RUSSCO В КРАСНОЯРСКЕ
Дорогие коллеги, дорогие читатели! С начала нового 2022 года на
страницах газеты RUSSCO, а также
на сайте rosoncoweb.ru мы планируем более подробно знакомить
вас с региональными отделениями
общества. Всегда интересно знать,
кто из наших коллег, где и в каких
условиях работает в разных уголках страны. К тому же, ввиду ограничений, связанных с пандемией
коронавирусной инфекции, мы
реже встречаемся вживую – но надеемся, что подобная информация
с иллюстрациями хоть на малую
толику позволит восполнить недостаток общения.

Итак, ЗНАКОМЬТЕСЬ: региональное отделение RUSSCO Красноярского края
Красноярский край – один из самых крупных регионов Российской Федерации. Его площадь составляет без малого 2 340 000 квадратных километров, а численность населения превышает 2 876 000 человек. Протяженность территории края с севера на юг – 4000 км, с запада на восток – 1200 км. Одна из особенностей территории – различная плотность населения: так, в Красноярске она составляет порядка 3000 человек на квадратный километр, в то время как на севере региона – всего 0,02 человека.
Региональное отделение RUSSCO
в Красноярске было создано 12
октября 2012 года. Председателем
отделения является Мусаева Наталья Эдуардовна, заведующая
отделением противоопухолевой
лекарственной терапии КГБУЗ
«Красноярский краевой клинический онкологический диспансер
им. А.И. Крыжановского». Региональное отделение в настоящее время насчитывает 23 члена
RUSSCO, среди которых 13 онкологов-химиотерапевтов, 8 радиотерапевтов, 1 клинический фармаколог, 1 специалист по молекулярной
диагностике; среди них 2 доктора
медицинских наук и 3 кандидата
медицинских наук.
Основная локация регионального
отделения – Красноярский краевой онкологический диспансер,
медицинская организация третьего уровня, в которой оказываются
основные объемы специализированной, в том числе высокотехнологичной медицинской помощи онкологическим пациентам. Диспансер
носит имя одного из главных врачей диспансера – Альберта Ивановича Крыжановского, благодаря
усилиям которого получили активное развитие методы лекарственного и лучевого лечения: еще в 1995
году был открыт первый кабинет
амбулаторной химиотерапии, а в
2001 году введен в эксплуатацию
новый радиологический корпус,
оснащенный современным оборудованием.
В 2009 году для повышения качества онкологической помощи в
Красноярском крае запущен проект «Реконструкция и расширение
Красноярского краевого онкологического диспансера».
Три корпуса первой очереди проекта - лечебно-диагностический,
палатный, приемно-административный - введены в эксплуатацию
15 февраля 2014 года. Общая площадь корпусов первой очереди –
около 50 тыс. квадратных метров.

В палатном корпусе разместились шесть хирургических отделений: отделение онкоурологической хирургии, отделение онкогинекологической хирургии, отделение онкоабдоминальной хирургии им. Н.А. Рыкованова, отделение онкоторакальной хирургии, онкологическое отделение опухолей головы и шеи и отделение онкоколопроктологической хирургии. В лечебно-диагностическом корпусе расположились клиникодиагностическая лаборатория с бактериологическим отделом, эндоскопическое отделение, отделение функциональной и ультразвуковой диагностики, аптека, центральная стерилизационная, отделение лучевой диагностики. В этом же корпусе находится сердце онкодиспансера – операционный блок на 17 плановых и две экстренных операционных, где выполняются плановые полостные и малоинвазивные операции. Также в лечебно-диагностическом корпусе расположено реанимационное отделение на 18 коек и палаты пробуждения.
Хирургическую помощь пациентам онкологического диспансера
оказывают в восьми хирургических отделениях (отделение онкоколопроктологической хирургии,
онкохирургическое отделение опухолей головы и шеи, отделение онкоторакальной хирургии, отделение онкоабдоминальной хирургии,
отделение онкогинекологической
хирургии, отделение онкоурологической хирургии, отделение
онкомаммологической хирургии,
отделение общей онкохирургии)
и дневном хирургическом стационаре. Специалисты краевого онкодиспансера непрерывно совершенствуются, наращивая количество
видов выполняемых операций, в

том числе высокотехнологичных. Новые условия позволили специалистам онкодиспансера увеличить долю миниинвазивных вмешательств с 6% в 2013 году до 27 % в 2021 году, получить лицензию на оказание высокотехнологичной медицинской помощи и в хорошем темпе продолжить осваивать высокотехнологичные операции. Кроме того, расширился спектр диагностических мероприятий: сейчас лечение пациентов не зависит от проведения в других лечебных учреждениях MPT, КТ, всех видов УЗИ, эндоскопических и лабораторных исследований. Строительство второй очереди, в которую вошли реконструкция радиологического корпуса с заменой оборудования, новая поликлиника на 650 посещений в смену и здание патолого-анатомического отделения, завершилось в 2016 году.
Сегодня Красноярский краевой клинический онкологический диспансер имени А.И. Крыжановского – одно из крупнейших онкологических учреждений Сибирского федерального округа:
• Девять лечебных отделений, четыре дневных стационара, поликлиника, диагностические отделения, пансионат для приезжих пациентов на 65 мест • Коечный фонд диспансера – 540 коек в круглосуточных стационарах (310 хирургических, 155 радиологических, 65 онкологических-химиотерапевтических), и 409 пациенто-мест в четырех дневных стационарах (хирургический, радиологический и два дневных стационара противоопухолевой лекарственной терапии) • Более 200 врачей – квалифицированные онкологи, химиотерапевты, радиотерапевты квалифицированные онкологи, химиотерапевты – и более 300 медицинских сестер • Около 175 000 посещений поликлиники ежегодно; • 7 700 пациентов в год, пролеченных в хирургических подразделениях;
• Свыше 4 700 госпитализаций в дневной онкохирургический стационар;
• Более 7 500 курсов противоопухолевой лекарственной терапии в год в круглосуточном стационаре;
• Более 18 000 курсов противоопухолевой лекарственной терапии в год в дневных стационарах;
• Более 1 500 госпитализаций в год в круглосуточные радиотерапевтические отделения; • Более 2 300 госпитализаций в год в дневной радиотерапевтический стационар
• На базе диспансера работают десять кафедр Красноярского государственного медицинского университета.

С марта 2021 года Красноярский краевой клинический онкологический диспансер возглавляет доктор медицинских наук, профессор Руслан Зуков. Руслан Александрович с 2014 года является заведующим кафедрой онкологии и лучевой терапии с курсом последипломного образования Красноярского медицинского университета. 15 врачей-химиотерапевтов краевого онкодиспансера используют для помощи пациентам весь спектр противоопухолевого воздействия – классическую химиотерапию, таргетную терапию, иммунотерапию, гормонотерапию, а также комбинации этих методов, бережно и грамотно проводя пациентов по многоуровневому лабиринту лекарственной терапии, с обязательной сопроводительной терапией. Коллектив отделений противоопухолевой лекарственной терапии активно участвует во многих отечественных и международных клинических исследованиях, в том числе и инициированных RUSSCO: RENSUR3, RENSUR5, FARETES и других.

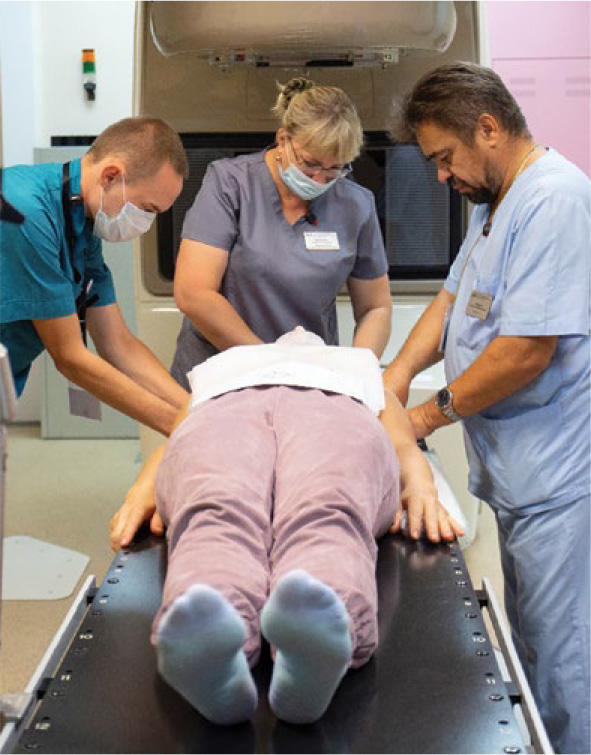
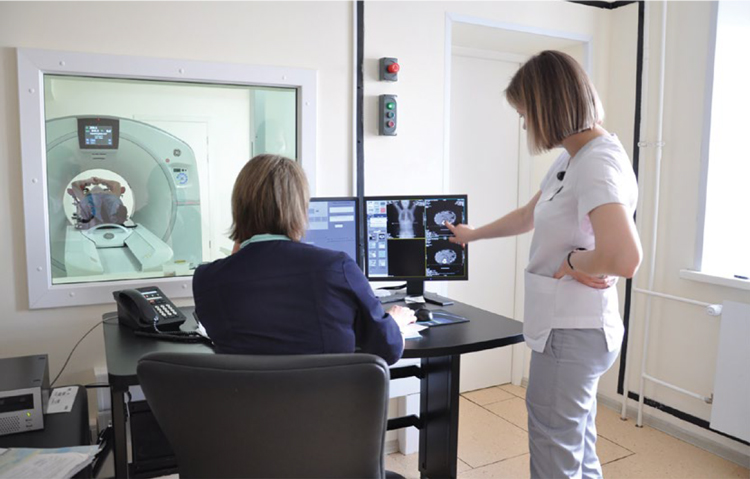
Благодаря обновленному парку радиотерапевтического оборудования в краевом онкодиспансере в 90-95% случаев проводится конформная радиотерапия: 3D-CRT, лучевая терапия с визуальным контролем изображения (IGRT), лучевая терапия с модуляцией интенсивности дозы (IMRT), ротационное облучение с объемной модуляцией интенсивности излучения (RapiDArc) c применением симультанного интегрированного буста (SIB), лучевая терапия с синхронизацией дыхания (RGRT), а также стереотаксическая радиохирургия и радиотерапия, применяются различные методики гипофракционирования. Увеличивается количество пациентов, получающих химиолучевое лечение. В 2021 году в условиях дневного радиотерапевтического стационара краевого онкодиспансера начали проводить лечение радиофармпрепаратом 223Ra дихлорид (Xofigo, Ксофиго), предназначенным для лечения пациентов с симптомными костными метастазами кастрационно-резистентного рака предстательной железы при отсутствии висцеральных метастазов.
В 2014 году в составе клинико-диагностической лаборатории появилось отделение прогностических и молекулярных методов. Развитие молекулярно-генетического тестирования начиналось в рамках программы RUSSCO.
В середине 2015 года удалось начать самостоятельное выполнение исследований мутаций в гене EGFR в гистологическом материале пациентов с железистым типом немелкоклеточного рака легкого. В 2016 году краевой онкодиспансер получил аккредитацию на выполнение генетических анализов методом полимеразной цепной реакции (ПЦР). Клинико-диагностическая лаборатория краевого онкодиспансера оказалась единственной в Сибири и на Дальнем Востоке лабораторией, получившей аккредитацию на этот вид деятельности. За несколько лет специалистам краевого онкодиспансера удалось расширить спектр анализа генов до уровня, полностью покрывающего все диагностические потребности при лечении онкопатологии. В настоящий момент на базе онкодиспансера осуществляется исследование мутаций генов EGFR, PIK3CA,BRCA1 и 2, KRAS, NRAS, BRAF, ALK, ROS1 у пациентов со злокачественными новообразованиями легких, молочной и предстательной желез, яичников, колоректальным раком и меланомой. Ежегодно усилия отдела прогностических и молекулярных методов по расширению перечня определяемых мутаций генов добавляют в арсенал специалистов диспансера новые диагностические опции для повышения эффективности проводимого специализированного лечения. Даже в непростом во всех отношениях 2020 году удалось запустить тестирование мутаций гена BRAF, а в 2021 году – пройти внешний контроль качества на определение мутаций гена PIK3CA. За 2021 год на базе отдела прогностических и молекулярных методов краевого онкодиспансера уже проведено около 3500 молекулярно-генетических исследований.
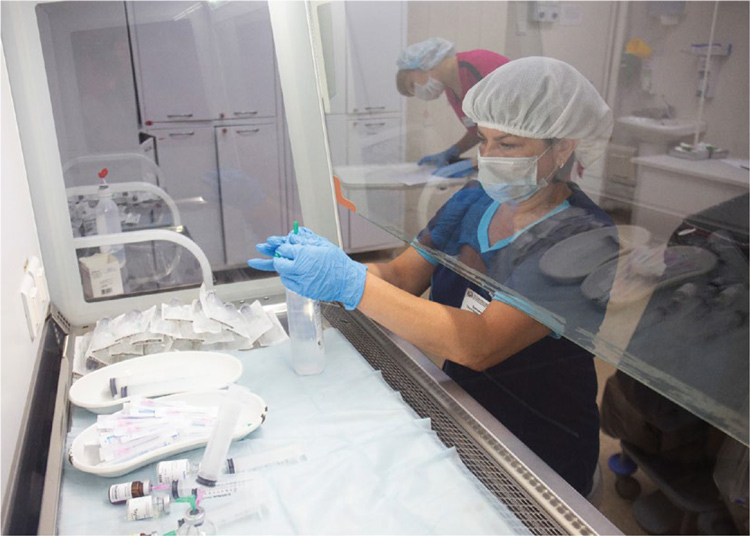
В ближайшем будущем диагностические возможности краевого онкодиспансера планируют расширить за счет запуска секвенирования генов.
Взаимодействие с RUSSCO. Врачи Красноярского краевого онкологического диспансера участвуют в проведении и активно участвуют в вебинарах RUSSCO, в качестве модераторов выступали члены RUSSCO: главный врач краевого онкодиспансера Руслан Александрович Зуков, заведующая дневным стационаром противоопухолевой лекарственной терапии №1 Ирина Леонидовна Образ, заведующая дневным стационаром противоопухолевой лекарственной терапии №2 Наталья Эдуардовна Мусаева и другие. Ординаторы кафедры клинической онкологии на первом году обучения проходят регистрацию на портале в качестве молодых онкологов. Они получают информацию обо всех мероприятиях, получают ссылки на участие в них.

Член RUSSCO Эдуард Васильевич Семенов принимал участие с устным докладом в конференции «Меланома: новые методы диагностики и лечения» (г. Москва), а также стал лауреатом конкурса молодых ученых; дважды выигрывал Travelгранты от фонда RUSSCO. Врачи активно участвуют в конференциях RUSSCO и Российском онкологическом конгрессе, как в очном, так и онлайн формате, в том числе и с докладами.
3-4 декабря 2021 года в Красноярском краевом онкодиспансере
прошла конференция Российского
общества клинической онкологии
(RUSSCO) «Лучшее по материалам
международных конференций и
симпозиумов 2021: ВОСТОК». Спикерами мероприятия стали лидеры
по основным направлениям лечения онкозаболеваний. Традиционно
в рамках конференции были представлены новейшие результаты исследований, влияющих на клиническую практику.
ПЕРЕРЫВЫ В РАДИКАЛЬНОМ КУРСЕ ЛУЧЕВОЙ ТЕРАПИИ: ВОЗМОЖНО ЛИ «ПРОТИСНУТЬСЯ» В ТЕРАПЕВТИЧЕСКОЕ ОКНО?
Автор: Шейко Андрей Владимирович
ГБУЗ ВО «Областной клинический онкологический диспансер», Владимир
Современная радиотерапия не приемлет разрывов в лечении. Потеря локального контроля за каждый незапланированный пропущенный день лечения сейчас ни у кого не вызывает сомнений. Однако реальность такова, что радиационным онкологам все чаще приходится сталкиваться с вынужденной остановкой радикального курса лучевой или химиолучевой терапии, например, в связи с инфицированием пациента COVID-19. Очень важным при этом является поиск грамотного баланса между риском высокой раково-специфической смертности ввиду отсрочки лечения и риском смертности от инфекционных интеркуррентных заболеваний при их незавершенном лечении или недостаточном периоде реабилитации [1]. Коронавирусная инфекция – лишь одна из многих причин, приводящих к вынужденной остановке в лечении.
Подливает масла в огонь и тот факт, что зачастую предельно важной оказывается общая продолжительность лечения. Так, при раке анального канала общая продолжительность терапии более 41 дня ставит под угрозу 5-летний локальный контроль независимо от того, включало ли лечение перерыв или нет (демпинг 5-летнего локального контроля составляет 12% для опухолей T1-2 и 31% при T3-4 [2,3]). Связь между общей продолжительностью лечения и его исходами при прочих плоскоклеточных раках (ОГШ, шейка матки, рак легкого) также неопровержима. Демпинг локального контроля может достигать 1-2% за каждый день продления времени терапии. Таким образом, в моделях плоскоклеточного рака пролонгация лечения означает потерю эффекта от 0,4-0,6 Гр за каждый пропущенный день [4]. К примеру, при злокачественных опухолях головы и шеи как короткие (4-8 дней), так и более длительные задержки в лечении (>8 дней) приводят к снижению абсолютной четырехлетней общей выживаемости на 4% и 12% (р<0,0001) соответственно [5].
Все онкологические пациенты могут
быть условно разделены на следующие категории приоритета (определяющий фактор – потенциальное
время удвоения опухолевых клеток Tpot) [6]:
Таблица 1.
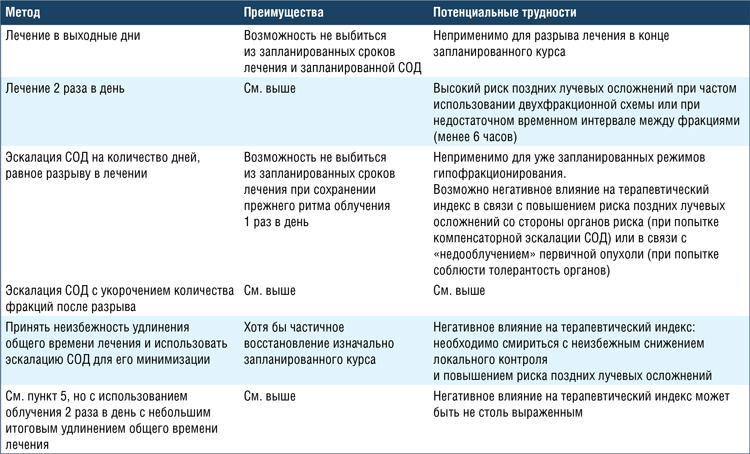
Методы компенсации разрыва курса лучевой терапии.
■ Категория 1: пациенты с ЗНО с быстрым Tpot и высоким уровнем доказательности негативного влияния разрыва в лечении на локальный контроль и выживаемость. Разрыв в радикальном лечении не должен превышать 2 дней:
• плоскоклеточный рак органов головы и шеи,
• немелкоклеточный рак легкого,
• мелкоклеточный рак легкого,
• плоскоклеточный рак шейки матки,
• плоскоклеточный рак пищевода,
• плоскоклеточный рак влагалища и вульвы,
• плоскоклеточный рак анального канала,
• аденокарцинома пищевода,
• медуллобластома и примитивные нейроэктодермальные опухоли.
■ Категория 2: пациенты с ЗНО с более медленным Tpot. Разрыв в радикальном лечении не должен превышать 5 дней:
• рак молочной железы,
• рак мочевого пузыря,
• рак предстательной железы.
■ Категория 3: пациенты, получающие паллиативное лечение, которым может потребоваться компенсирующая доза при перерыве более 7 дней. Основные причины разрыва в лечении:
• Неисправность радиотерапевтического оборудования
• Государственные праздники
• Транспортные проблемы
• Социально-психологические проблемы
• Непереносимая токсичность лечения/осложнения на фоне лечения/ интеркуррентные заболевания (в т.ч. COVID-19) Методы профилактики разрывов в лечении:
• Неисправность радиотерапевтического оборудования: радиотерапевтическая служба должна иметь на балансе как минимум 2 линейных ускорителя, полностью укомплектованных штатом, с возможностью полной взаимозаменяемости, или иметь договоренность с другим радиотерапевтическим центром, который будет готов принять пациентов на лечение в случае необходимости.
• Государственные праздники: продолжать лечение приоритетных пациентов категории 1 в праздничные дни или эскалировать общую СОД в зависимости от типа опухоли, количества пропущенных дней, К-фактора, BED, Tpot и проч.
• Транспортные проблемы: онкологический центр в идеале должен иметь в штате служебный транспорт для пациентов или договоренность с волонтерскими организациями или со службами трансфера и такси.
• Социально-психологические проблемы: пациент должен быть полностью и в доступной форме проинформирован о необходимости ежедневного лечения, опасности и последствиях незапланированного перерыва, возможных лучевых реакциях, побочных явлениях и т.д., рекомендуется также иметь в штате онкопсихолога для помощи пациентам и их семьям.
• Непереносимая токсичность лечения/осложнения на фоне лечения/ интеркуррентные заболевания (в т.ч. COVID-19): обучение пациента самоконтролю и наблюдению за собой в ходе ЛТ/ХЛТ, объяснение необходимости связи с лечащим врачом при первых признаках лучевых реакций и нежелательных явлений облучения; раннее выявление лучевых реакций на стадии grade I; ранняя медикаментозная поддержка и терапия лучевых реакций и проявлений острой токсичности ХЛТ; ранняя и своевременная терапия осложнений основного онкологического заболевания и интеркуррентных заболеваний; использование современных высокопрецизионных методик ЛТ с высоким градиентом дозы, возможностью сохранения органов риска, укорочения фракционного и общего времени лечения (IMRT, IMRT+SIB, VMAT).
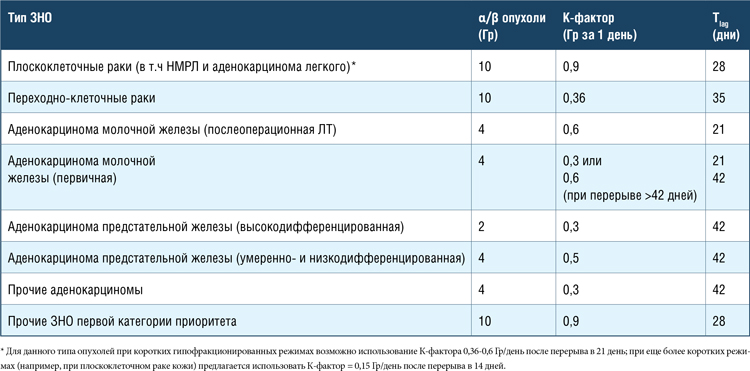
Рекомендации по компенсации разрыва курса лучевой терапии представлены в таблице 1 [6,7]. Алгоритм действий в случае состоявшегося разрыва в лечении напрямую зависит от кинетики и радиобиологии опухоли. Принципиальное значение имеет понимание таких показателей, как α/β опухоли, Tk или Tlag (время до ускоренной репопуляции/задержка роста опухоли), Tpot (потенциальное время удвоения опухолевых клеток), К-фактор (доза, эффект которой на репопуляцию клеточной массы «утрачен» за каждый 1 день разрыва лечения). Основные параметры, принимаемые во внимание при компенсации доз, представлены в таблице 2 [8].
Таблица 2.
Параметры кинетики и радиобиологии опухолей при компенсаторном пересчете доз лучевой терапии.
Алгоритм действий в случае состоявшегося разрыва в лечении:
• Определить оставшееся время запланированного лечения и количество оставшихся «неотлеченных» фракций.
• Рассмотреть все возможные варианты «вписаться» в запланированный график лечения (лечение в выходные дни, 2 раза в день и т.д.).
• При невозможности соблюсти сроки:
1. рассчитать BED (биологическую эффективную дозу) для нормальных тканей на весь период запланированного курса по формуле BED = Nd × [1 + d/(α/β)], где N – количество запланированных фракций, d – доза за фракцию, рекомендуемое α/β – 3 Гр (для спинного мозга – 2 Гр);
2. определить соответствующую BED нормальных тканей в период, предшествующий перерыву;
3. определить разницу между BED1 и BED2, которая будет представлять из себя запас BED (post-gap BED)нормальных тканей на предстоящий компенсаторный период лечения;
4. выбрать лечебные опции (гипофракционирование, лечение 2 раза в день, увеличение количества фракций и т.д.), которые бы максимально сократили продление общего времени лечения; затем – рассчитать СОД так, чтобы не превысить порог post-gap BED нормальных тканей;
5. рассчитать BED на опухоль с учетом продления сроков лечения по формуле BED = Nd × [1 + d/(α/β)] – K × (T – Tdelay), где Т – общая продолжительность лечения, Tdelay – время от начала лечения до начала ускоренной репопуляции, К – К-фактор;
6. в зависимости от выбранного метода компенсации оценить окончательные фактические BED для опухоли и нормальных тканей (часто встречается клиническая дилемма сложного компромисса между превышением BED на нормальные ткани и демпингом BED на опухоль).
Таким образом, расчет компенсаторных доз при незапланированных перерывах в курсе лучевой терапии – процесс довольно сложный и трудоемкий. Попытки с помощью арифметических манипуляций «протиснуться» в терапевтическое окно между клинической пользой и осложнениями довольно часто грозят оказаться бесполезными и бессмысленными, особенно при плоскоклеточных раках с высоким α/β. Для некоторых опухолей до сих пор недостаточно убедительных данных об их кинетике (например, для рака анального канала величина К-фактора по разным данным литературы колеблется от 0,4 до 0,9 Гр). Перерыва в лечении и, как следствие, удлинения общего времени терапии необходимо избегать всеми возможными способами для сохранения адекватного локального контроля, безрецидивной выживаемости и других показателей. Компенсация перерыва в лечении при радикальном курсе лучевой терапии зачастую сомнительна по эффективности и чревата большим количеством ошибок и негативными последствиями на терапевтический индекс. Вклад химиотерапевтического компонента в биологию и кинетику рака также недостаточно убедительно изучен, поэтому расчет BED для опухоли и нормальных тканей в случае компенсаторного лечения может быть весьма затруднителен.
Источники:
1. Yu D, Hu W, Chen L, Fu Z, Song Q, Li X. Effect of radiotherapy interruption due to COVID-19 outbreak. Radiother Oncol. 2021; 155: 1-2. doi:10.1016/j. radonc.2020.09.055.
2. Graf R, Wust P, Hildebrandt B, et al. Impact of overall treatment time on local control of anal cancer treated with radiochemotherapy. Oncology. 2003; 65(1): 14-22. doi:10.1159/000071200.
3. Rivin Del Campo E, Matzinger O, Haustermans K, et al. Pooled Analysis of external-beam RADiotherapy parameters in phase II and phase III trials in radiochemotherapy in Anal Cancer (PARADAC). Eur J Cancer. 2019; 121: 130-143. doi:10.1016/j.ejca.2019.08.022.
4. Glynne-Jones R, Sebag-Montefiore D, Adams R, et al. «Mind the gap» – the impact of variations in the duration of the treatment gap and overall treatment time in the first UK Anal Cancer Trial (ACT I). Int J Radiat Oncol Biol Phys. 2011; 81(5): 1488-1494. doi:10.1016/j. ijrobp.2010.07.1995.
5. Xiang M, Gensheimer MF, Pollom EL, et al. Prolongation of definitive head and neck cancer radiotherapy: Survival impact and predisposing factors. Radiother Oncol. 2021; 156: 201-208. doi:10.1016/j. radonc.2020.12.025.
6. Timely delivery of radical radiotherapy: guidelines for the management of unscheduled treatment interruptions, fourth edition (2019).
7. Dale RG, Hendry JH, Jones B, Robertson AG, Deehan C, Sinclair JA. Practical methods for compensating for missed treatment days in radiotherapy, with particular reference to head and neck schedules. Clin Oncol (R Coll Radiol). 2002; 14(5): 382-393. doi:10.1053/ clon.2002.0111.
8. Jones B, Dale R, Hopewell J. Additional
Guidance on management of unscheduled
treatment interruptions in patients during
the COVID-19 pandemic (2020)
КОММЕНТАРИЙ ЭКСПЕРТА
Автор: Деньгина Наталья Владимировна
Заведующая радиологическим отделением ГУЗ «Областной клинический онкологический диспансер», директор Центра лучевой терапии «R-Spei»,
член правления RUSSCO, главный редактор Газеты RUSSCO и сайта RosOncoWeb, кандидат медицинских наук, Ульяновск
Радиотерапевты, работающие более 7-8 лет по специальности, прекрасно помнят, как регулярно администрация учреждений по результатам годовых отчетов «строгала» нас за чрезмерно превышенный койко-день в радиологическом отделении. Пресловутый койко-день являлся неким почти безукоризненным, по мнению организаторов здравоохранения, показателем полноты и качества догоспитального обследования, организации работы отделения и адекватности оказываемой помощи. Этот показатель требовалось постоянно снижать – только не понятно, до каких нулей. По какой-то не укладывающейся в наших радиотерапевтических головах причине считалось, что чем меньше пациент пребывает на койке, тем правильнее лечат в данном отделении – и это при том, что помимо традиционных режимов фракционирования лучевой терапии, подразумевающих несколько недель лечения, рекомендованные руководствами, укороченные курсы применялись лишь в паллиативных целях. Гипофракционирование было робким, SBRT и СИБы (симультанные интегрированные бусты) – в зачаточном состоянии, а дозволенное гиперфракционирование укорачивало курс лишь на чуть. Появление нового оборудования, усложнение предлучевой подготовки, сложности оконтуривания и планирования и вовсе сделало уменьшение койко-дня невыполнимой задачей.
Что приходилось делать для поддержания «подобающего» по длительности койко-дня, дабы не навлечь на себя гнев вышестоящих контролирующих структур? Правильно, снижать его искусственно, выписывая пациентов, даже еще не закончивших полностью радикальный курс, делая перерыв, якобы, для купирования лучевых реакций, для «отдыха» пациента после завершения 1 этапа и т.д. Хорошо, если выписка происходила под выходные, и перерыв составлял не более 2-3 дней. В нынешних условиях, когда пациент перед каждой госпитализацией должен приносить целый список свежих анализов, в том числе и тех, которые делаются несколько дней, и пациент рискует пропасть на недели или даже месяцы по различным причинам, в т.ч. и причине ковида, подобная практика выглядит не просто бессмысленной – но и губительной. В тех центрах, где эту проблему осознают врачи и осведомленная администрация, отделения радиотерапии продолжают функционировать и облучать пациентов и в официальные нерабочие дни, включая гипертрофированные новогодние праздники, делая все, чтобы курс был непрерывным. И радиотерапевты, и администрация, и пациенты, и их родственники должны осознавать, что радикальный курс лечения должен быть завершен без перерывов, возможно, ценой более выраженных осложнений и необходимой поддерживающей терапии. Что 45 Гр при раке анального канала или 50 Гр при ОГШ – это не некий завершенный «1 этап радикального курса», а лишь его обломок, способный при последующем перерыве длительностью более 3 дней свести на нет все предыдущие усилия и полностью скомпрометировать как непосредственные, так и отдаленные результаты.
Рис.
Влияние перерывов в радикальном курсе лучевой
терапии (в днях) на выживаемость больных [1].
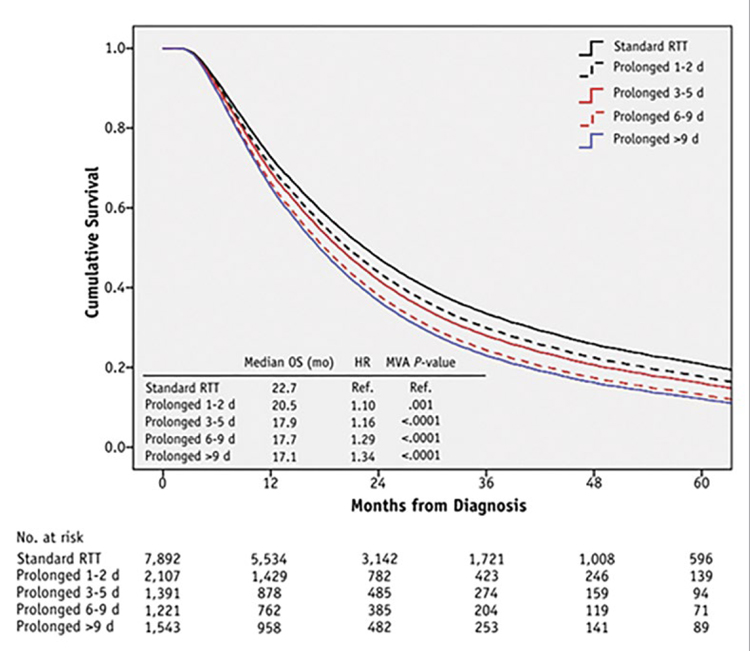
В качестве иллюстрации – данные крупного анализа из NCDB по результатам лечения больных местнораспространенным НМРЛ методом одновременной ХЛТ по протоколу (без перерывов) и с перерывами различной длительности. Число пациентов, включенных в анализ, впечатляет – 14154, из которых 6262 (44,2%) лечились с перерывами. Достаточно взглянуть на график (см. рисунок) и понять, насколько серьезно разрывы в лечебном курсе, даже, казалось бы, небольшие, достоверно укорачивают общую выживаемость больных НМРЛ. Статья доктора Шейко, на мой взгляд – это не только напоминание о губительном влиянии перерывов в лечении на непосредственные и отдаленные результаты, но и практическое руководство к действию. Поскольку RUSSCO уже давно является сообществом, объединяющим представителей различных специальностей, включая немалое число радиотерапевтов, мы посчитали эту публикацию на сайте необходимой. Правильное построение плана радикальной ЛТ/ХЛТ и адекватное ведение пациентов, которые потенциально могут быть излечены от опухоли или иметь длительную ремиссию, жизненно важно, и каждый из нас, их врачующих, должен это осознавать.
Источник:
McMillan MT, et al. Radiation Treatment Time and Overall Survival
in Locally Advanced Non-small Cell Lung Cancer. Int J Radiation Oncol Biol Phys.
2017; 98(5): 1142-1152.
РЕЗОЛЮЦИЯ ЭКСПЕРТНОГО СОВЕТА 27.10.2021 Экспертный совет: «Лечение рецидивирующего рака яичников у пациенток с противопоказаниями к назначению или непереносимостью препаратов платины»
Место проведения мероприятия: online
Время проведения: 15:00 - 18:00
Председатель – Тюляндин Сергей
Алексеевич, д.м.н., профессор, заслуженный деятель науки Российской
Федерации, председатель Российского общества клинической онкологии
(RUSSCO), главный научный сотрудник ФГБУ «НМИЦ онкологии им.
Н.Н. Блохина» Минздрава России,
Москва
Приглашенные эксперты:
1. Владимирова Любовь Юрьевна, д.м.н., профессор, заведующая отделением противоопухолевой лекарственной терапии ФГБУ «НМИЦ онкологии» Минздрава России, Ростов-на-Дону
2. Коломиец Лариса Александровна, д.м.н., профессор, заслуженный деятель науки РФ, заведующая отделением гинекологии НИИ онкологии Томского НИМЦ, профессор кафедры онкологии СибГМУ, Томск
3. Лисянская Алла Сергеевна, к. м. н., доцент кафедры онкологии, Заместитель главного врача по онкологии ФГБУ «НМИЦ им. В. А. Алмазова» Минздрава России, Санкт-Петербург
4. Покатаев Илья Анатольевич, д.м.н., Руководитель службы химиотерапевтического лечения ГБУЗ «ГКОБ №1 ДЗМ», Москва
5. Румянцев Алексей Александрович, к.м.н., главный специалист отдела методической поддержки и координации мероприятий федерального проекта «Борьба с онкологическими заболеваниями» ФГБУ «Центральный НИИ организации и информатизации здравоохранения» Минздрава России, врач-онколог отделения лекарственных методов лечения (химиотерапевтическое №4) ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
6. Саевец Валерия Владимировна, к.м.н., заведующая отделением онкологическим гинекологическим ГБУЗ «Челябинский областной клинический центр онкологии и ядерной медицины», доцент кафедры онкологии, лучевой диагностики и лучевой терапии ФГБОУ ВО «Южно-Уральский государственный медицинский университет» Минздрава России, Челябинск
7. Урманчеева Адель Федоровна, д.м.н., профессор, ведущий сотрудник отделения онкогинекологии ФГБУ НИИ онкологии имени Н. Н. Петрова Минздрава России, профессор кафедры онкологии ФГБОУ ВО Северо-Западного государственного медицинского университета имени И. И. Мечникова Минздрава России, Санкт-Петербург
8. Хохлова Светлана Викторовна, д.м.н., заведующая онкологическим отделением противоопухолевой лекарственной терапии ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова» Минздрава России, Москва. Рак яичников (РЯ) является одним из самых агрессивных и тяжело поддающихся лечению онкологических заболеваний. Это первая онкогинекологическая патология по показателю летальности в России. Несмотря на достигнутый в последние годы прогресс в области хирургии и внедрение новых опций терапии, в течение 2 лет после постановки диагноза примерно у 70-80% пациенток случается рецидив, при котором медиана продолжительности жизни составляет 8—15 месяцев [1-3].
Согласно ведущим мировым рекомендациям, лечение рецидива РЯ свыше 6 мес. после окончания платиносодержащей терапии должно снова проводиться препаратами на ее основе (за исключением случаев непереносимости) [4-7]. Возможности лечения платиновыми агентами ограничиваются первичной и приобретенной резистентностью, а также развитием нежелательных явлений (нейропатия, нефротоксичность, аллергические реакции). Частота реакций гиперчувствительности к карбоплатину колеблется от 1% в течение первых пяти циклов лечения до 27% после седьмого цикла, и к 3-й линии может достигать 44%. Наличие мутации в генах BRCA1, BRCA2 повышает сенсибилизацию и укорачивает время до развития гиперчувствительности к карбоплатину [8,9]. Несмотря на описанную в рекомендациях опцию десенсибилизации [4,7], в реальной клинической практике введение препаратов платины часто проводится в условиях дневного стационара, где это не всегда возможно. Кроме того, возникший один раз эпизод анафилаксии может привести к отказу со стороны пациента в проведении платиносодержащей терапии.
Нейро- и ототоксичность также связаны с терапией платиновыми агентами. Несмотря на достаточно хорошо изученный механизм ототоксичности препаратов платины, до настоящего времени не существует эффективных и надежных средств профилактики и лечения цисплатиновой ототоксичности. Доказано, что ототоксичность цисплатина резко возрастает при нарушении выделительной функции почек и нарушении кровоснабжения внутреннего уха, определенную роль играет индивидуальная и генетическая предрасположенность. Карбоплатин обладает менее выраженной ототоксичностью [10,11].
Нейротоксичность является одним из специфических системных осложнений противоопухолевой химиотерапии и не только снижает качество жизни пациентов, но и может ограничивать дозу цитостатиков. При высоких дозах нейротоксичность возникает практически в 100% и может проявляться нейропатией, симптомом Лермитта, судорожным синдромом, энцефалопатией, преходящей корковой слепотой, ретробульбарным невритом, возможен также преходящий двусторонний паралич голосовых связок [12].
В случае невозможности применения препаратов платины у пациенток с рецидивом РЯ большое значение приобретает выбор неплатинового агента.
Одной из опций лечения рецидива РЯ после применения препаратов платины является комбинация Трабектедина и пегилированного липосомального доксорубицина (PLD), зарегистрированная EMA и Минздравом РФ.
Трабектедин представляет собой цитостатик с плейотропным механизмом действия, впервые полученный из экстракта тканей карибского оболочника Ecteinascidia turbinate, в настоящее время синтезируется химическим путем [13]. Препарат вызывает апоптоз опухолевых клеток, а также за счет ингибирования иммунных факторов микроокружения опухоли, позволяет предотвратить ангиогенез и дальнейшее прогрессирование заболевания [14,15].
С 2009 года трабектедин в комбинации с PLD был одобрен в Европейском союзе и в 64 странах по всему миру для лечения пациентов с чувствительным к платине рецидивирующим раком яичников.
Эффективность и безопасность применения трабектедина у пациентов раком яичников доказана в рандомизированном исследовании III фазы OVA-301. В исследование было включено 672 пациентки, получавших трабектедин (1,1 мг/м2) и PLD (30 мг/ м2) каждые 3 недели или PLD (50 мг/ м2) каждые 4 недели. Первичная конечная точка – ВБП по независимой рентгенологической и независимой оценке специалистов-онкологов составила соответственно 7,3 мес. для трабектедина/PLD и 5,8 мес. для PLD, ОР 0,8; p=0,02 и 7,4 мес. для трабектедина/PLD и 5,6 мес. для PLD, ОР 0,72; p=0,0008. Наибольшее достоверное преимущество в общей выживаемости было показано в подгруппе пациенток с PFI (бесплатиновый интервал) 6-12 мес. и составило 22,4 мес. для трабектедина/PLD против 16,4 мес. для PLD, p=0,0027, снижение риска смерти составило в этой группе 36% [16]. Согласно окончательным данным по ОВ пациенток с платиночувствительным рецидивом РЯ, получающих препараты платины после прогрессирования в исследовании OVA-301, лечение комбинацией препаратов трабектедин и PLD привело к снижению риска смерти на 42% по сравнению с монотерапией PLD и значительному 9-месячному улучшению медианы OВ (ОР 0,58; 27,7 мес. в сравнении с 18,7 мес.; p=0,0153) [18]. Наиболее часто на фоне комбинированного лечения наблюдались: гематологическая токсичность (анемия – 14%, тромбоцитопения – 18%, нейтропения – 63%, при этом частота фебрильной нейтропении не превышала 8%), гипербилирубинемия у 15% пациенток, повышение активности АЛТ 3–4-й степени у 30,9% женщин, повышение активности АСТ 3–4-й степени — у 7,2% больных, однако отсутствовали виды токсичности, характерные для платиновых производных и таксанов (алопеция зарегистрирована всего в 12% случаев, а нейротоксичность всех степеней тяжести — в 1%) [16-19].
Рандомизированное мультицентровое исследование III фазы OVC-3006 не показало достоверного увеличения ОВ по сравнению с одним только PLD у пациентов с прогрессирующим рецидивирующим эпителиальным раком яичников, ОР 0,925 (95%ДИ 0,727-1,177; р=0,5236). Несмотря на то, что исследование прекращено досрочно по решению спонсора (Janssen Research and Development, LLC), эксперты EMA признали, что досрочное прекращение данного исследования не позволило оценить результаты влияния на общую выживаемость и усомниться в результатах исследования OVA-301. В 2020 г. ЕМА сообщает о целесообразности применение комбинации трабектедина в сочетании с PLD для пациенток с рецидивирующим раком яичников с платиночувствительным рецидивом.
В предварительно запланированном подгрупповом анализе преимущество ОВ и ВБП было выявлено в группе пациентов с мутациями в генах BRCA1/2 и/или бесплатиновым интервалом от 6 до 12 месяцев. Никаких новых сигналов безопасности выявлено не было. Согласно обновленным данным исследования OVC-3006 отмечена тенденция к улучшению показателей ВБП при применении трабектедина/PLD (медиана ВБП 7,52 месяцев по сравнению с 7,26 месяцев; ОР 0,93; 95%ДИ 0,76,1,15; р=0,52) Отмечено значимое улучшение ЧОО (46% против 35,9%; p=0,01) и особенно у пациенток с частично платиночувствительными рецидивами и с мутациями в генах BRCA ½ (64,1% по сравнению с 45,5%; р=0,024). Как было отмечено в предыдущих исследованиях, более выраженную пользу наблюдали у пациенток с бесплатиновым интервалом 6-12 месяцев и пациенток с мутациями в генах BRCA 1/2 [20,21]. В ряде различных по дизайну исследований сравнения эффективности платиновых и неплатиновых режимов, например, исследование CALYPSO, не было показано статистически значимого преимущества в ОВ неплатинового режима над платиносодержащим [22].
INOVATYON является одним из немногих рандомизированных исследований III фазы по сравнению эффективности комбинации препаратов платины с бесплатиновыми режимами. Исследование включало 617 пациентов. Не было обнаружено статистически значимых различий в подгруппах, показатели общей выживаемости в группе трабектедина и карбоплатина были сопоставимы (ОР 1,10; 95% ДИ 0,92-1,32; p=0,284). В отношении ВБП преимущество было у комбинации карбоплатин/PLD (ОР 1,26; 95% ДИ 1,07-1,49; p=0,005), в то время как ВБП после последующей линии терапии достоверно выше у комбинации трабектедин/PLD, особенно при последующем назначении платины (ОР 0,80; 95%ДИ 0,65-0,98; р=0,028). Схемы на основе платины остаются стандартом лечения пациентов с рецидивирующим раком яичников, прогрессирующим в течение 6-12 месяцев после последней линии платины. Поэтому аналогичная ОВ указывает на возможную роль комбинации трабектедина/PLD в терапии пациентов с несколькими предшествующими линиями препаратов платины, которым может потребоваться более длительное время для восстановления от специфической токсичности воздействий производных платины [5,23, 24].
Эффективность терапии трабектедином/PLD в реальной клинической практике показана в наблюдательных исследованиях более чем у 500 пациентов, проспективные исследования (PROSPECTYON, OVA-YONG, NIMES-ROC) включали 386 пациентов [25-28]. Самым крупным из них было исследование NIMES-ROC (Европейское Наблюдательное проспективное исследование трабектедина в комбинации с пегилированным липосомальным доксорубицином у пациентов с платиночувствительным раком яичников), в которое было включено 218 пациентов. Первичная конечная точка эффективности – медиана ВБП - составила 9,46 мес. (95%ДИ 7,9–10,9). Не отмечено статистически значимых различий в отношении общей выживаемости между подгруппами в зависимости от длительности бесплатинового интервала и наличием мутации в генах BRCA 1/2, но прослеживается тенденция к более высоким результатам у пациенток с бесплатиновым интервалом 6-12 мес., у этой когорты ОВ составляет 26 мес. Наиболее частыми НЯ 3-4 степени были нейтропения (30,3%), анемия (6,4%), тромбоцитопения (5,5%) и астения (5%). Не было случаев смерти, связанных с НЯ. Не было выявлено неожиданных НЯ. Данные проспективных наблюдений подтверждают результаты рандомизированных исследований [29].
Опыт применения комбинации трабектедин/PLD в Российской Федерации в лечении рецидивирующего рака яичников у пациенток, получивших терапию на основе препаратов платины, также демонстрирует эффективность, сопоставимую с результатами рандомизированных исследований (в группе с PFI 6-12 мес. ВБП 8 мес., ОВ – 14,2 мес., ЧОО – 31,25%; в группе PFI>12 мес. ВБП – 8,7 мес., ОВ – 18,5 мес., ЧОО – 31,25%) и ожидаемую управляемую токсичность, несмотря на более предлеченный контингент и отсутствие строгого отбора пациенток [30].
Комбинация трабектедин/PLD продемонстрировала эффективность в лечении рецидивов рака яичников у отдельных групп пациентов, как в клинических исследованиях, так и в реальной клинической практике.
Лучшие результаты получены в группах пациенток с платиночувствительным рецидивом и/или с мутацией в генах BRCA 1/2. При PFI 6-12 мес. трабектедин/PLD показал результаты выживаемости, сопоставимые с режимами на основе препаратов платины.
Таким образом, обсудив выше представленные результаты клинических исследований, с учетом ограниченных терапевтических опций, эксперты пришли к следующим выводам:
1. Комбинация препаратов трабектедин и пегилированый липосомальный доксорубицин может быть рекомендована как одна из лечебных опций у пациенток с платиночувствительным рецидивом рака яичников, которым невозможно назначить препараты платины (пациентки со специфической некупируемой платиновой токсичностью, с противопоказаниями к назначению и/или с гиперчувствительностью к препаратам платины).
2. В качестве одной из терапевтических опций можно рекомендовать рабочей группе рассмотреть возможность включения комбинации трабектедина и пегилированного липосомального доксорубицина в клинические рекомендации по лечению рецидивирующего рака яичников в подгруппе пациенток с платиночувствительными рецидивами и невозможностью дальнейшего назначения препаратов платины.
Список литературы
1. Состояние онкологической помощи населению России в 2020 году. Под ред. А.Д. Каприна и др, М.: МНИОИ им. П.А. Герцена, филиал ФГБУ «МНИЦ радиологии» Минздрава России, 2021
2. Состояние онкологической помощи населению России в 2019 году. Под ред. А.Д. Каприна, В.В. Старинского, А.О. Шахзадовой − М.: МНИОИ им. П.А. Герцена − филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2020
3. Хохлова С.В. Новое в лечении high grade серозного рака яичников // Эффективная фармакотерапия. 2019. Т. 15. № 38. С. 24–29.
4. Тюляндин С. А. et al. Практические рекомендации по лекарственному лечению рака яичников, первичного рака брюшины и рака маточных труб Тюляндин С. А. DOI: 10.18027 / 2224-5057-2020-10-3s2-10
5. ESMO–ESGO consensus conference recommendations on ovarian cancer: pathology and molecular biology, early and advanced stages, borderline tumours and recurrent disease. N. Colombo, C. Sessa, etc., Annals of Oncology 30: 672– 705, 2019.
6. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®) Ovarian Cancer. National Comprehensive Cancer Network - 2017.
7. Клинические рекомендации. Рак яичников/рак маточной трубы/первичный рак брюшины. 2020 https:// cr.minzdrav.gov.ru/schema/547_2
8. Bergamini A. Cancer & Chemotherapy Rev. 2019;14:69-72;
9. Bergamini A, et al. Int J Gynecol Cancer. 2019;0:1-6
10.Павлюшина Е.М., Диагностика и лечение ототоксических кохлеовестибулярных расстройств, РМЖ (Русский медицинский журнал)9, 2014:
11.Инструкция по применению препарата карбоплатин, с сайта https://grls.rosminzdrav.ru Дата обращения 26.10.21
12.Шакирова И.Н. НЕЙРОТОКСИЧНОСТЬ СОВРЕМЕННЫХ ЦИТОСТАТИКОВ, Материалы конгрессов и конференций, VI РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ, с сайта РУССКО https://rosoncoweb.ru/library/congress/ ru/06/18.php
13.Инструкция по медицинскому применению препарата Йонделис , ЛСР-008960/08, https://grls. rosminzdrav.ru Дата обращения 26.10.21
14.D'Incalci M, Galmarini C.M. A review of trabectedin (ET-743): a unique mechanism of action. Mol Cancer Ther 2010; 9 (8): 2157–63.
15.Mascilini F., Clinical utility of trabectedin for the treatment of ovarian cancer: current evidence, OncoTargets and TherapyJuly 2014
16.Monk B.J., Dalton H., Benjamin I., Tanovic A. Trabectedin as a new chemotherapy option in the treatment of relapsed platinum sensitive ovarian cancer. Curr. Pharm. Des. 2012; 18 (25): 3754–3769. 19.
17.Herzog ASCO 2009. J Clin Oncol Vol 27(15 supl) page 289 Abs Nº5550
18.Future Oncology (2013) 9(12 Suppl. 1), 1-43
19.Poveda, A et al. “Trabectedin plus pegylated liposomal doxorubicin in relapsed ovarian cancer: outcomes in the partially platinum-sensitive (platinumfree interval 6-12 months) subpopulation of OVA-301 phase III randomized trial.” Annals of oncology : official journal of the European Society for Medical Oncology vol. 22,1 (2011): 39-48. doi:10.1093/ annonc/mdq352
20.Bradley J. Monk et al. A phase 3 randomized, open-label, multicenter trial for safety and efficacy of combined trabectedin and pegylated liposomal doxorubicin therapy for recurrent ovarian cancer. Gynecologic Oncology, https:// doi.org/10.1016/j.ygyno.2019.12.043
21.Authorised uses of cancer medicine Yondelis unchanged following review of new data. EMA/513030/2020
22.Wagner, U et al. “Final overall survival results of phase III GCIG CALYPSO trial of pegylated liposomal doxorubicin and carboplatin vs paclitaxel and carboplatin in platinum-sensitive ovarian cancer patients.” British journal of cancer vol. 107,4 (2012): 588-91. doi:10.1038/ bjc.2012. 307
23.Colombo N, et al. INOVATYON study: Randomized phase III international study comparing trabectedin/PLD followed by platinum at progression vs carboplatin/PLD in patients with recurrent ovarian cancer progressing within 6-12 months after last platinum line. Annals of Oncology. 2020; 31 (suppl_4): S1142-S1215.
24.Virtual ESMO 2020 https:// oncologypro.esmo.org/meetingresources/esmo-virtual-congress-2020/ inovatyon-study-randomized-phaseiii-international-study-comparingtrabectedin-pld-followed-by-platinumat-progression-vs-carboplatin-pld-in-patie
25.Frederic Sellef et al. GINECO Prospective Non-interventional PROSPECTYON Study: Trabectedin Plus Pegylated Liposomal Doxorubicin for Platinum-sensitive Recurrent Ovarian Cancer ANTICANCER RESEARCH 40: 3939-3945 (2020) doi:10.21873/ anticanres.14385
26.Ignacio Romero, José Antonio LópezGuerrero & Sandro Pignata (2021): Realworld experience with trabectedin for the treatment of recurrent ovarian cancer, Expert Review of Anticancer Therapy, DOI: 10.1080/14737140.2021.1941890
27.Ingo B. Runnebaum et al. Trabectedin plus pegylated liposomal doxorubicin (PLD) for patients with platinumsensitive recurrent ovarian cancer: a prospective, observational, multicenter study. Journal of Cancer Research and Clinical Oncology (2018) 144:1185–1195
28.Pignata S et al. A European, observational, prospective trial of trabectedin plus pegylated liposomal doxorubicin in patients with platinumsensitive ovarian cancer. Oncologist 2020;999913.
29.Pignata S, et al. Ann Oncol. 2018; vol 29 (Supl 8) pages 352 Abs Nº987P
30.Лисянская А.С. Опыт применения трабектедина в терапии рецидивирующего рака яичников. Доклад на экспертном совете RUSSCO
27.10.2021
ПОДМЕЧЕНО ОНКОЛОГОМ: БУДЕМ ЖИТЬ!
Арутюнян Гамлет Арменакович
(1952-2016)
Родился в д. Коргино Енисейского района. В 1975 году закончил Красноярский государственный медицинский институт, педиатрический факультет. После прохождения интернатуры работал детским врачом-хирургом, был ассистентом кафедры хирургических болезней педиатрического факультета КГМИ; работал хирургом-онкологом в городском онкологическом диспансере, а с 1995 года до своего слишком раннего ухода являлся заместителем главного врача по хирургии ККОД. Арутюнян Г.А. – хирург-онколог высшей категории, доктор медицинских наук, член РАЕН. С 1994 года - член Союза писателей России; у него было издано четыре поэтических авторских сборника.
РУКИ ХИРУРГА
Ритуал наш извечен:
щетки, мыло и спирт.
И склоненные плечи,
и молчанье навзрыд.
И короткое: "Начали!"
Начинается битва.
Острый след, обозначенный
Хирургическим ритмом.
Руки, данные Богом,
не впадайте в отчаянье.
А иначе все боком
и молчанье, молчанье.
Судьи около ходят -
ты подсуден, хирург.
Но порою исходы
не зависят от рук.
МАТУШКА
Были гости не прошены
И ушли по-хорошему,
А за ними нагрянули,
На беду, холода.
Выйдет из дому матушка,
Скажет: «Где вы,
ребятушки?
Было в доме вас много,
А теперь я одна...
Нынче в поле метелица,
Снег позёмкою стелется.
Снег позёмкою стелется,
И гудят провода.
Почему вы не пишете?
За позёмкою слышатся
Ваши детские, юные,
Давних лет голоса».
Наша бедная родина —
Как под снегом смородина.
А оттают ли корни?..
На беду — холода.
Выйдет из дому матушка,
Скажет: «Где вы,
ребятушки?
Было в доме вас много,
А теперь я одна…»
*
Я стану дождём,
Любящим свою землю.
Не тем летним,
Сиюминутным шалунишкой,
А дождём – тружеником,
Дождём, которым нагружены
Тяжёлые баркасы туч.
Я выпаду там,
Где от жажды
Сгорают посевы,
Где высохли реки
И рыбы ждут разлива,
Где среди многих
Притулился твой огородик,
мама.
*
Ничем не измерить
потерю, утрату.
Ничем не заполнить
души пустоту.
Любите друг друга,
как брат любит брата,
как день любит солнце,
как ветер — мечту.
Не надо прощаться,
ведь все поправимо.
Не надо прощаться,
ведь все впереди.
И строчки, как птицы,
проносятся мимо…
И чем-то окончатся
птичьи пути?
И в час, когда звезды,
как капли свечи,
на землю ночную
все падают, падают,
ты лучше всего
в тишине помолчи,
глядишь, и кого-нибудь
строчки порадуют.
Исчезнет тогда
ощущенье беды.
Почувствуешь, что
не растратил весь порох.
До встречи, любимые!
Наши сады
опять расцветут
на задернутых шторах
Конференция RUSSCO
ОНКОГИНЕКОЛОГИЯ
25 -26 марта 2022

ДИСКУССИОННАЯ СЦЕНА: ХИРУРГИЯ VS SBRT ПРИ ОПЕРАБЕЛЬНОМ РАКЕ ЛЕГКОГО I СТАДИИ
Дорогие коллеги, специалистыонкологи, диагносты, патоморфологи, эпидемиологи, хирурги,
радиотерапевты, химиотерапевты и те, кто схожи по духу и одной
крови с нами!
С начала нового 2022 года на нашем сайте стартует «Дискуссионная сцена» - серия онлайн-дискуссий по различным спорным проблемам в онкологии. Оппоненты представят вашему вниманию свои аргументы в пользу того или иного подхода, и вам будет предложено проголосовать за наиболее убедительные доводы и при желании задать вопрос любому участнику дискуссии и получить ответ на него. Тексты дискуссий дублируются в газете, так же как и результаты голосования. Наша любовь – медицина, онкология – настолько динамично развивается, что пребывание на единообразной позиции в течение долгого времени подобно застою мышления и чрезмерному, неоправданному консерватизму. Цель дискуссии – не избрание победителя, а поиск наиболее приемлемых и перспективных лечебных подходов, не только в настоящий момент, но и с прицелом на будущее.
Итак, ЛЕЧЕНИЕ ОПЕРАБЕЛЬНОГО РАКА ЛЕГКОГО I СТАДИИ: АРГУМЕНТЫ В ПОЛЬЗУ
ОПЕРАЦИИ ИЛИ СТЕРЕОТАКСИЧЕСКОЙ ЛУЧЕВОЙ ТЕРАПИИ (SBRT)
Лечение операбельного рака
легкого I стадии: аргументы
в пользу хирургии
Автор: Пищик Вадим Григорьевич
Заместитель главного врача по хирургии СПб ГБУЗ «Городской клинический онкологический диспансер»,
главный торакальный хирург Санкт-Петербурга, профессор кафедры госпитальной хирургии СПбГУ, руководитель центра
торакальной хирургии СЗОНКЦ ФМБА России, доктор медицинских наук, профессор, Санкт-Петербург
В последние годы давление различного рода немедицинских факторов на медицинскую практику привело к серьезному пересмотру стратегии лечения больных раком легкого. Наступили времена, когда вопрос о выборе тактики лечения при раке легкого 1 стадии перестал быть юмористическим.
Всё ближе подбираются специалисты лекарственного лечения. Им давно уже мало III-IV стадии. Они требуют проведения неоадъювантного лечения уже при IIB стадии. А при радикально прооперированных IB-IIA стадиях настаивают на адъювантном лечении [1]. С философской точки зрения клиническое стадирование может быть проверено только временем (не зря же мы наблюдаем пациентов в течение 5 лет после «радикального» лечения). Поэтому идею дополнительной «стерилизации» организма от опухолевых клеток уже можно принять, тем более что таргетная и иммунотерапия объективно занимают достойное место в российских и международных рекомендациях [1]. Для успокоения особо впечатлительных читателей скажу, что несмотря на успехи наших неоперирующих коллег-онкологов, все их методы могут быть применены только к пациенту, который побывал в руках у хирурга, поскольку для выбора лечебной тактики болезнь надо верифицировать, стадировать и провести МГИ (молекулярно-генетическое исследование).
Лучевая терапия фактически законно забирает часть больных раком легкого I стадии в случаях, когда хирурги считают операцию слишком эмоционально затратной для себя или опасной для больного по сопутствующим заболеваниям [1]. Но справедливости ради, если мы считаем, что SBRT поможет функционально неоперабельным больным, то почему бы не отдать им всех?!
Именно такие невеселые мысли и заставили меня вступить в эту дискуссию. Действительно, а каковы современные аргументы в пользу хирургического лечения рака легкого первой стадии? Ниже я приведу 10 из них.
1. С «онкологического младенчества» нас учат, что хирургия является единственным методом, дающим пациенту шанс на полное излечение при раке легкого [2,3]. И когда же его применять, как не при I стадии, где этот шанс максимальный? Пятилетняя выживаемость при хирургическом лечении рака легкого I стадии составляет от 92% до 100%. Вряд ли возможно улучшить результат выше 100%.
2. В последние годы при повсеместном распространении КТ как метода диагностики заболеваний легких, а также в результате скрининговых программ мы выявляем минимальные опухоли. Опухоли выявляются на стадии GGO, что соответствует гистологическим типам AAH (атипичная аденоматозная гиперплазия), AIS (аденокарцинома in situ) или MIA (миниинвазивная аденокарцинома). В таких случаях вероятность лимфогенного, а тем более отдаленного метастазирования стремится к нулю, и 10-летняя выживаемость приближается к 100% [4,5].
3. Появление миниинвазивной хирургии сделало операцию не столь обременительной для пациента, когда сроки пребывания в стационаре сокращаются до нескольких дней, болевой синдром минимален, а социальная реабилитация максимально ускорена [6,7].
4. Частота летальных осложнений в много оперирующих центрах при раке I стадии стремится к нулю [8].
5. При опухолях «воздушного типа» диаметром менее 2 см хирургическое лечение может быть проведено в объеме паренхимосохраняющей операции – сегментэктомии [9, 10]. Не думаю, что SBRT окажется более прецизионной с точки зрения сохранения дыхательной поверхности.
6. Каким бы точным не было предоперационное стадирование, только систематическая лимфодиссекция позволит установить окончательно степень лимфогенного метастазирования, когда первая стадия может превратиться во вторую и даже третью [11, 12]. Внутридолевые лимфоузлы не являются рутинным субъектом для предоперационной биопсии, поэтому и здесь хирургия станет максимально точным диагностическим, ну и, заодно, эффективным лечебным методом.
7. Рак легкого является болезнью многофакторной и многоочаговой, и у 25% пациентов может возникнуть и вторая, и третья первичная опухоль [13,14]. И она может оказаться не такой уж ранней. Так зачем же оставлять больного с облученным легким и лишать его шансов на послеоперационную лучевую терапию?
8. Вопросы функциональной операбельности в последние годы пересматриваются, особенно на фоне широкого внедрения торакоскопических лобэктомий [15]. Расширяются возможности наших анестезиологов по обеспечению безопасности операций у коморбидных и пожилых пациентов [16]. Часть больных с тяжелой ХОБЛ или выраженной сердечно-сосудистой патологией можно подготовить к операции, сильно сократив тем самым пул функционально неоперабельных больных [17].
9. Сроки начала лечения при выборе хирургического метода всегда будут короче, потому что может быть пропущен этап дооперационной верификации, и операция начнется со срочного гистологического исследования и закончится необходимым объемом в зависимости от его результатов [18, 19].
10. Стоимость хирургического лечения и главное его доступность, особенно в нашей стране, превосходят все другие виды лечения [20].
Так что же, вопрос решен? Наши западные партнеры считают, что не совсем. По их мнению, мы недостаточно информируем пациентов о возможностях альтернативных методов лечения раннего рака легкого, а пациент должен иметь право выбора. И возможно он сделает выбор не в пользу хирургии [21].
Это возвращает нас к мультидисциплинарным консилиумам (МДК). Нередко они проводятся формально, с доминированием хирурга, а в некоторых, неонкологических, стационарах не проводятся вовсе. В то же время, было продемонстрировано, что пациенты, обсужденные на МДК, чаще имели установленную стадию заболевания (93% против 79%), раньше начинали лечение (через 17 против 29 дней) и чаще лечились в соответствии с рекомендациями (97% против 81%) [22].
Наиболее ущемляемыми специалистами в таких консилиумах являются радиотерапевты, которые либо не имеют желания, либо не имеют возможности предложить больному ранней стадией рака легкого лечение, альтернативное хирургии. Уверен, что для большинства торакальных хирургов было бы полезно узнать точку зрения радиотерапевтов на эту проблему.
Список литературы
1. Лактионов К.К., Артамонова Е.В., Бредер В.В., Горбунова В.А., Моисеенко Ф.В., Реутова Е.В. и соавт. Практические рекомендации по лекарственному лечению немелкоклеточного рака легкого. Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2021 (том 11), 02.
2. Давыдов М.И., Полоцкий Б.Е. Рак легкого. М.: Радикс, 1994.
3. Трахтенберг А.Х., Чиссов В.И. Клиническая онкопульмонология. М.: ГЭОТАРМедиа, 2000.
4. Van Schil PE, Asamura H, Rusch VW, et al. Surgical implications of the new IASLC/ATS/ERS adenocarcinoma classification Eur Respir J. 2012; 39; pp.478-486.
5. Tsutani Y, et al. Sublobar resection for lung adenocarcinoma meeting node negative criteria on preoperative imaging Ann Thorac Surg. 2014; 97; pp.1701-1707.
6. Nwogu CE, D’Cunha J, Pang H, et al. VATS Lobectomy Has Better Perioperative Outcomes Than Open Lobectomy: CALGB 31001, an Ancillary Analysis of CALGB 140202 (Alliance). The Annals of Thoracic Surgery. 2015; 99(2): 399-405.
7. Falcoz PE, Puyraveau M, Thomas PA, et al. Video-assisted thoracoscopic surgery versus open lobectomy for primary non-small-cell lung cancer: a propensity-matched analysis of outcome from the European Society of Thoracic Surgeon database. Eur J Cardiothorac Surg. 2016 Feb; 49(2): 602-9.
8. Park HS, Detterbeck FC, Boffa DJ, Kim AW. Impact of hospital volume of thoracoscopic lobectomy on primary lung cancer outcomes. Ann Thorac Surg. 2012 Feb; 93(2): 372-9.
9. Nakayama H, Yamada K, Saito H, et al. Sublobar Resection for Patients With Peripheral Small Adenocarcinomas of the Lung: Surgical Outcome is Associated With Features on Computed Tomographic Imaging. Ann Thorac Surg. 2007 Nov; 84(5): 1675-9.
10.Yang CJ, D’Amico T. Open, thoracoscopic and robotic segmentectomy for lung cancer. Ann Cardiothorac Surg. 2014 Mar; 3(2): 142-52.
11.Dong S, Du J, Li W, et al. Systematic mediastinal lymphadenectomy or mediastinal lymph node sampling in patients with pathological stage I NSCLC: a meta-analysis. World J Surg. 2015 Feb; 39(2): 410-6.
12.Zhong W, Yang X, Bai J, et al. Complete mediastinal lymphadenectomy: the core component of the multidisciplinary therapy in resectable non-small cell lung cancer. Eur J Cardiothorac Surg. 2008 Jul; 34(1): 187-95.
13.Fink-Neuboeck N, Lindenmann J, Porubsky C, et al. Hazards of Recurrence, Second Primary, or Other Tumor at Ten Years After Surgery for Non-Small-Cell Lung Cancer. Clin Lung Cancer. 2020 Jul; 21(4): 333-340.
14.Hamaji M, Allen MS, Cassivi SD, et al. Surgical treatment of metachronous second primary lung cancer after complete resection of non-small cell lung cancer. J Thorac Cardiovasc Surg. 2013 Mar; 145(3): 683-90.
15.Ceppa DP, Kosinski AS, Berry MF, et al. Thoracoscopic lobectomy has increasing benefit in patients with poor pulmonary function: a society of thoracic surgeons database analysis. Ann Surg. 2012; 256: 487-93.
16.Radovic M, Kanesvaran R, Rittmeyer A, et al. Multidisciplinary treatment of lung cancer in older patients: A review. J Geriatr Oncol. 2019 May; 10(3): 405-410.
17. Портал Европейского общества медицинской онкологии. [Электронный ресурс]. 10.12.2020. URL: https://www.esmo.org/Guidelines/ ESMO-Guidelines.
18.Sihoe AD, Hiranandani R, Wong H, Yeung ES. Operating on a suspicious lung mass without a preoperative tissue diagnosis: pros and cons. Eur J Cardiothorac Surg. 2013 Aug; 44(2): 231-7.
19.Ghamati MR, Li W, van der Heijden EH, et al. Surgery without preoperative histological confirmation of lung cancer: what is the current clinical practice? J Thorac Dis. 2021 Oct; 13(10): 5765-5775.
20.Cowper PA, Feng L, Kosinski AS, et al. Initial and Longitudinal Cost of Surgical Resection for Lung Cancer. Ann Thorac Surg. 2021 Jun; 111(6): 1827-1833.
21.Dalmia S, Boele F, Absolom K, et al. Shared decision-making in early stage non-small cell lung cancer: A systematic review, The Annals of Thoracic Surgery. 2021; S0003- 4975(21)00237-X.
22.Liam CK, Liam YS, Poh ME, Wong
CK. Accuracy of lung cancer staging
in the multidisciplinary team setting.
Transl Lung Cancer Res. 2020; 9(4):
1654-1666.
Лечение операбельного рака
легкого I стадии: аргументы
в пользу стереотаксической
лучевой терапии (SBRT)
Автор: Деньгина Наталья Владимировна
Заведующая радиологическим отделением ГУЗ «Областной клинический онкологический диспансер», директор Центра лучевой терапии «R-Spei»,
член правления RUSSCO, главный редактор Газеты RUSSCO и сайта RosOncoWeb, кандидат медицинских наук, Ульяновск
Дискуссии о том, являются ли операция и стереотаксическая лучевая терапия (SBRT или SABR) равноценными методами в лечении операбельного рака легкого I стадии, ведутся на протяжении уже нескольких лет.
SBRT - вид дистанционной лучевой терапии, позволяющий производить высокоточную доставку к
опухоли большой «хирургической»
дозы излучения с минимизацией
облучения здоровых тканей. Облученный объем при этом действительно мал, поэтому побочные эффекты, как правило, незначительны.
В 2001 году FDA (Food and Drug
Administration – Управление по санитарному надзору за качеством
пищевых продуктов и медикаментов США) одобрило SBRT для лечения экстракраниальной патологии,
в том числе и для рака легкого, что
имело, на мой взгляд, революционный характер. Началось все с того,
что SBRT стала альтернативой хирургии и методом выбора для хрупкой категории пациентов в возрасте
75 лет и старше, которые, несмотря
на резектабельность опухоли, обычно рассматриваются как операбельные не более чем в трети случаев в
силу сопутствующей патологии. Так,
анализ данных голландского ракового регистра с 1999 по 2007 гг. показал, что у больных НМРЛ I стадии
старше 75 лет внедрение СЛТ позволило на 12% уменьшить количество
пациентов, не получавших никакого
лечения, а также значительно повысить частоту проведения лучевой терапии – с 26% до 42% (р<0,01, рис.1)
Рисунок 1.
Распределение больных раком легкого I стадии
≥75 лет по типу лечения 1999-2007 гг. [1].
С начала 2000х годов частота отказов от операции в пользу SBRT (по данным Национальной раковой базы данных США, крупнейшего хранилища информации по лечению рака легкого в мире) начала возрастать – но, тем не менее, за период 2004-2016 не достигла и 2% [2]. Среди сотен тысяч пролеченных больных с ранним РЛ в мире – лишь немногие тысячи тех, кто предпочел облучение операции. Можем ли мы представить себе, что это были за пациенты? Скорее всего, те, кто при главенствовании хирургического метода, как основного в лечении РЛ, предпочел ограничиться меньшим риском, вероятнее всего – ввиду не самого оптимального для операции состояния, несмотря на то, что тогда, в начале 2000х, альтернатива в виде СБРТ вряд ли была адекватно описана пациентам. Возможно, одна из причин плохого набора больных в 3 проспективных рандомизированных исследования (STARS, ROSEL и RTOG 1021), призванных сравнить эффективность СБРТ и операции, состояла в схеме отбора, когда основным распределяющим звеном был хирург. Авторитет хирурга в лечении раннего рака легкого всегда был непререкаем. Но всегда ли он был объективен в рекомендации выбора и в описании альтернативного метода – SBRT? Забегая вперед, скажу, что продолжающиеся сейчас проспективные исследования набирают больных принципиально по-иному: главное звено рандомизации – врач-пульмонолог, который направляет пациентов как к хирургу, так и к радиационному онкологу, и только после этого пациент, получивший полную информацию о вариантах лечения и их возможных последствиях, возвращается к пульмонологу, чтобы сделать свой выбор. В любом случае, все три исследования были остановлены по причине плохого набора в группы лучевой терапии. Однако результаты лечения пациентов из 2 исследований (STARS и ROSEL) все же были проанализированы в совокупности и опубликованы в 2015 году [3] – и вызвали немало шума и волнений, иронии и споров со стороны разных представителей мирового онкологического сообщества, касавшихся в первую очередь малого числа больных в анализе. Тем не менее, аргумент №1: практически по всем показателям SBRT выигрывала у операции: 3-летняя выживаемость без прогрессирования составила 86% против 80%, выживаемость без отдаленных метастазов за 3 года – 97% против 91%, не говоря уже о значительно более низкой токсичности. Да, частота как локальных, так и региональных рецидивов была выше в группе облучения (4% против 0% и 10% против 4%, соответственно) – но это никак не сказалось на результатах общей выживаемости (95% против 79% за 3 года). Последовали многочисленные доводы от приверженцев хирургического метода – однако единственно весомыми научными данными, на которые они могли опираться, были лишь результаты ретроспективных сравнительных анализов, в лучшем случае – с сопоставлением данных по каким-либо параметрам (propensity score matching analyses). Аргумент №2 – изначально более низкий уровень доказательности ретроспективных работ в сравнении с проспективными. Подобных анализов в доступной литературе можно обнаружить массу: одни из них демонстрируют явное превосходство операции [2,4-6], другие – отсутствие преимуществ хирургического метода и равноценность обоих подходов [7-9]. Что интересно: когда четкие доказательства превосходства того или иного метода (то есть проспективные данные) отсутствуют, большую роль начинает играть способность автора интерпретировать имеющиеся результаты и маневрировать меж ними так, как ему, автору, удобно, поэтому и выводы этих многочисленных анализов так различаются. Но самое главное – это то, что ретроспективные анализы, сколь много бы их ни было, никогда не смогут конкурировать по уровню доказательности с проспективными данными по причине изначальной «отобранности» больных, идущих на более агрессивное лечение, да и, повторюсь, число пациентов, пролеченных SBRT, несопоставимо с количеством прооперированных: практически в каждом ретроспективном анализе число оперированных превышало десяток тысяч, тогда как количество больных после SBRT было в разы меньше.
Обратимся к чаще всего цитируемому и наиболее мощному аргументу сторонников хирургии – крупнейшему ретроспективному анализу с сопоставлением данных Rosen et al. [10] - и рассмотрим его результаты, критически прищурившись. Пациенты были взяты из Национальной раковой базы данных, все они были пролечены в период с 2008 по 2012 годы по поводу НМРЛ T1-2N0M0 хирургическим методом (13562 пациента) или SBRT (1781 больной). Основным преимуществом данного анализа авторы называют тот факт, что для сопоставления были отобраны «здоровые в соматическом плане» пациенты. В результате операция позволила добиться 59% 5-летней общей выживаемости, а SBRT - вдвое худших результатов (всего 29% ОВ за 5 лет). Казалось бы, несомненная победа скальпеля над лучом, на первый взгляд. Однако, не стоит торопиться делать выводы:
1) Так называемая операбельность в группе SBRT определена ретроспективно и потому сомнительна: основные факторы риска не были учтены и остались неизвестны (ECOG, индекс коморбидности, функция легких – эти данные просто отсутствуют в NCDB); при этом вот уже два десятилетия методом SBRT лечатся все же преимущественно неоперабельные пациенты с изначально худшим прогнозом – даже если ретроспективно (!) авторами и был выставлен индекс коморбидности 0;
2) Средний возраст в группе SBRT был выше (75,5 лет против 66,6 лет);
3) Показатели 3-летней ОВ по данным Rosen et al. соответствуют таковым, полученным в серии известных проспективных исследований II фазы по SBRT для неоперабельных больных. Эти результаты признаны высоко состоятельными и выглядят схожими у разных авторов – 50-60% ОВ за 3 года. Подчеркиваю: речь шла о неоперабельных по медицинским противопоказаниям больных. В сравнении с ними «соматически здоровые» пациенты из ретроспективного анализа Rosen с 3-летней ОВ в 53% уже не кажутся такими сохранными. Наиболее приемлемое объяснение тому – NCDB не позволяет корректно идентифицировать истинно операбельных пациентов, и больные в группе операции были все же «здоровее» и имели изначально лучший прогноз.
4) Доза SBRT имеет значение. В анализе Rosen менее половины всех больных получили биологически эквивалентную дозу (БЭД) ≥130 Гр. Метод SBRT пребывал на пути становления, долгое время считалось, что БЭД в 100 Гр и выше достаточно для обеспечения хорошего локального контроля, но в настоящее время дозы менее 130 Гр в биологическом эквиваленте считаются субоптимальными. По данным метаанализа Moreno AC et al. 2020 года, 5-летняя ОВ при субоптимальных БЭД 100-129 Гр не превышает 30% [11]. Сейчас наиболее адекватным режимом для SBRT при периферических опухолях является подведение 54-60 Гр за 3 фракции, что обеспечивает БЭД свыше 150 Гр.
5) В исследовании Rosen 16% больных из группы хирургического лечения получали адъювантную химиотерапию по поводу выявленных метастазов в лимфоузлах, тогда как в группе SBRT – не более 2%. Понятно, что вероятная прибавка к ОВ от ХТ невелика (около 5%) и не может объяснить такую разницу в 5-летней ОВ, но это еще раз подтверждает: пациенты оказывались в разных условиях и в плохо сопоставимых когортах. Только проспективные рандомизированные исследования с четкими критериями отбора в группы и соблюдением максимально одинаковых условий продемонстрируют истину.
В настоящее время три проспективных рандомизированных исследования успешно продолжают набор пациентов в группы хирургического лечения и SBRT:
1) VA Office of Research and Development. Veterans Affairs Lung Cancer Surgery or Stereotactic Radiotherapy (VALOR) NCT02984761;
2) University of Texas Southwestern Medical Center. Sublobar Resection (SR) Versus Stereotactic Ablative Radiotherapy (SAbR) for Lung Cancer (STABLE-MATES). NCT02468024;
3) Radiation Therapy Oncology Group. Radical Resection vs. Ablative Stereotactic Radiotherapy in Patients With Operable Stage I NSCLC (POSTILV). NCT01753414. Результаты STABLE-MATES ожидаются к декабрю 2024 года, а VALOR – только в 2027 году. Но – время летит быстро.
Аргумент №3 – летальность после операции или SBRT.
Без сомнения, операция в руках надежного опытного хирурга чаще всего безопасна – но все-таки не всегда. Риск летального исхода хирургического вмешательства, пусть минимальный, но существует. Современная радиотерапия руках опытного радиотерапевта все же безопаснее. По данным того же анализа Rosen, летальность в группе SBRT отсутствовала, тогда как в группе операции после сопоставления результатов 30-дневная летальность составила 5%, 90-дневная – 8%. В крупнейшем анализе Stokes et al. [12] на основании результатов лечения почти 85 тысяч пациентов (данные NCDB), пролеченных хирургическим путем или методом SBRT, относительные риски 30- и 90-дневной летальности после операции составили 3,06 и 1,52, соответственно, демонстрируя преимущества консервативного подхода. При этом чем старше была возрастная группа, тем более значительной оказывалась разница в показателях летальности после операции и SBRT. Все ли пациенты будут согласны идти на потенциальный риск летального исхода, который минимум в 2 раза (а то и больше) выше после операции, помня и о всех «прелестях» послеоперационного периода (боль, более длительное восстановление и т.д.), если альтернативный подход зачастую даже не приводит к ухудшению состояния, и пациент способен лечиться амбулаторно, продолжать жить обычной жизнью и даже работать?
Осложнения могут присутствовать после каждого лечения, но частота побочных эффектов ниже после SBRT, поэтому метод применяется даже у неоперабельных по медицинским показаниям пациентов. К наиболее серьезным и клинически значимым осложнениям SBRT относятся лучевой пульмонит III степени и выше (4-8% случаев, чаще связанный с индивидуальной повышенной чувствительностью легочной ткани к излучению, предугадать которую заранее пока невозможно), переломы ребер (около 2% - при локализации опухоли вблизи ребра) и боли в грудной клетке (7-28%, по данным разных авторов), чаще преходящие и несильные - в отличие от хронического болевого синдрома примерно у 30% оперированных больных, плюс риск развития инфекционных, тромбэмболических осложнений, кровотечений после операции, требующих повторного вмешательства и др. В связи с этим следующий аргумент №4 - качество жизни, на которое ориентируются многие пациенты, возможно, даже в большей степени, чем на отдаленные результаты - если им дан выбор. Предпочтения самого пациента должны быть учтены после предоставления информации о возможных опциях. Ранний рак легкого – та пациенто-ориентированная клиническая ситуация, где именно сам больной должен сделать выбор. Проспективных работ по сравнению качества жизни после операции и SBRT нет, за исключением данных упомянутого выше исследования ROSEL, в котором качеству жизни было уделено внимание и отмечено, что SBRT в значительно меньшей степени влияет на QoL, чем операция. Есть результаты различных опросов пациентов, затрагивающих этот важный аспект. Так, по данным опроса 102 больных, прошедших SBRT (в том числе и после ранее проведенного оперативного лечения) в MD Anderson Cancer Center [13], изначально (до разговора с радиационным онкологом) более половины больных не имели представление о методе SBRT. После проведенной SBRT 92,3% пациентов отметили значительно меньше побочных эффектов, чем после операции, 59,3% подчеркнули удобство SBRT и то, что SBRT сопряжена со значительно меньшим стрессом (87,9%). В сравнении с операцией все 100% больных отметили быстрое восстановление, необязательность ухода, низкий уровень тревожности, а 89,7% предпочли бы SBRT операции, если б речь шла о первичном лечении.
Лучшая информированность пациентов способна привести к смене предпочтений. Оказывается, кроме вышеперечисленных проспективных исследований по сравнению результатов SABR и операции, еще одно британское исследование (SABRTooth) набирало пациентов с 2015 года, однако в 2017 году было закрыто по причине плохого набора в группы рандомизации – но ситуация была уже иной, нежели для STARS&ROSEL: пациентов, предпочитавших нехирургический подход, оказалось в 3 раза больше.
Рисунок 2.
Общая выживаемость (А), выживаемость без прогрессирования (В) и раково-специфическая выживаемость
(С) больных с НМРЛ I стадии после SABR или видео-ассистированной лобэктомии с медиастинальной лимфодиссекцией [19].
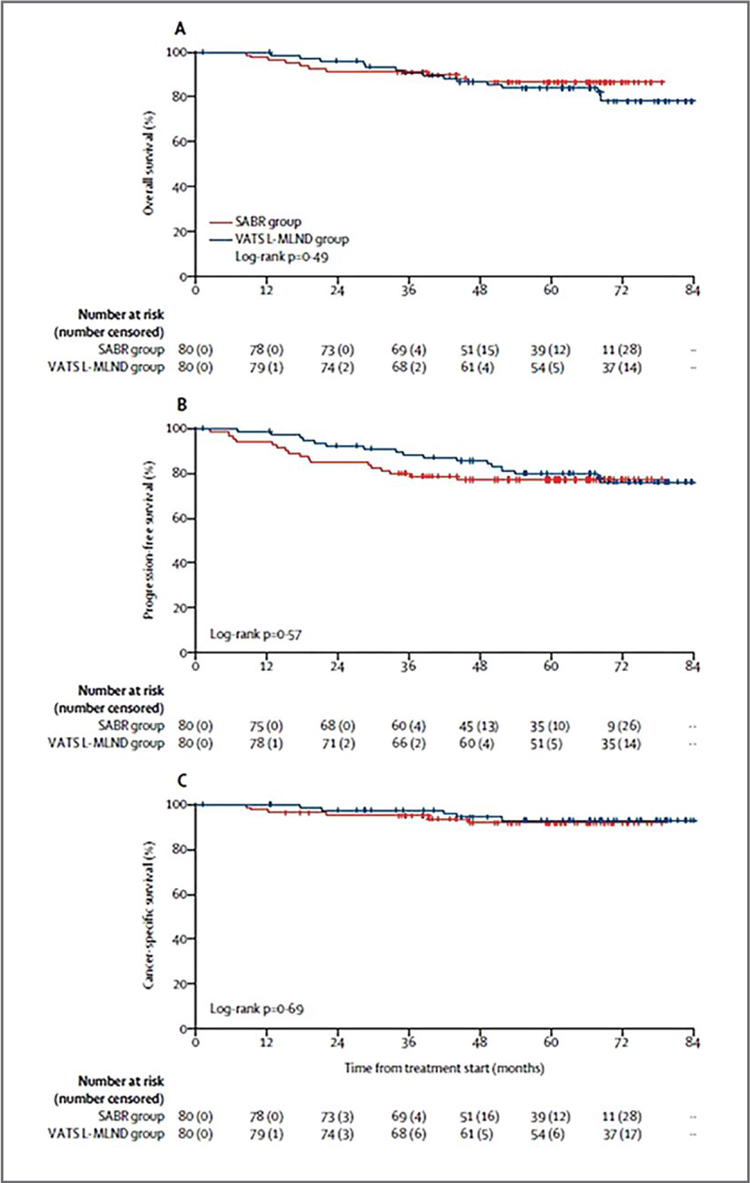
Аргумент 5: предпочтения профессиональных сообществ. Эра ковида внесла беспрецедентные изменения в практику онколога, заставляя не раз пересматривать стандартные подходы и делать выбор в пользу наиболее приемлемых и наименее опасных для больного в этот сложный период, чреватый риском инфицирования, осложнений и смерти от коронавирусной инфекции. Так, Консенсусом нескольких хирургических сообществ (ACS, AATS, др.) в 2020 в ситуации с высоким риском инфицирования для больных с опухолями 2 см и менее (N0) предложены варианты отсрочивания операции в пределах 3 месяцев или проведения альтернативного лечения, т.е. SBRT [14]. Учитывая тот факт, что отсрочивание лечения и при I стадии НМРЛ более чем на 8-12 недель, по многим данным, чревато снижением ОВ, выбор выглядит очевидным.
В марте 2020 года 32 эксперта из 16 европейских и 16 североамериканских стран также участвовали в консенсусе ASTRO/ESTRO и проголосовали за наиболее адекватные подходы к лечению РЛ в условиях ковида [15]. Предпочтение для больных операбельным РЛ I стадии было на 100% отдано SABR по причине не только возможности проведения лечения в сроки, но и с минимальным числом посещений лечебного учреждения, меньшим риском инфицирования, меньшим риском осложнений и смерти по сравнению с операцией. Как долго нам всем предстоит жить и работать в условиях массового распространения коронавирусной инфекции, неизвестно, но уже ясно, что эта ситуация приведет к росту частоты проведения SBRT во всем мире, повышению мастерства радиотерапевтов и значительному прогрессу этого метода.
Аргумент 6: в ситуации с РЛ I стадии вполне приемлемым выглядит подход типа Watch&Wait, с вариантом сальважной операции при установленном прогрессировании. В крупном ретроспективном анализе из MDACC [16] из 912 пациентов, ранее прошедших SABR по поводу раннего РЛ, у 102 возникли изолированные рецидивы, по поводу чего они получали локальное сальважное лечение (повторная SBRT, операция, термоабляция) или ХЛТ/ХТ. Оказалось, что 5-летняя ОВ пациентов с локальным рецидивом после сальважного лечения оказалась такой же, как и у больных без рецидива (57,4% против 54,9%, р=.65). Таким образом, SBRT с последующей W&W могут быть неким компромиссом, особенно в период пандемии, когда приходится откладывать запланированную операцию на несколько месяцев.
Аргумент 7: нужна ли вообще операция, если SABR также способна полностью ликвидировать опухолевые клетки в очаге, т.е. привести к полному патоморфологическому регрессу? Сомнение на этот счет может внести исследование II фазы MISSILE [17], в котором 40 пациентов с НМРЛ T1-2N0M0 получали SBRT (54 Гр за 3 фракции, 55 Гр за 5 или 60 Гр за 8 фракций в зависимости от локализации опухоли и ее близости к критическим структурам), а через 10 недель были оперированы. При вполне приемлемой токсичности и отсутствии летальности полный патоморфологический регресс был зафиксирован в 60% случаев. Такой разочаровывающий процент не коррелирует с высокими показателями локального контроля, представленными в ранее упомянутых проспективных исследованиях II фазы с SABR и наводит на мысль, что ответ на высокие дозы облучения пока недостаточно понятен и требует изучения на клеточном и биологическом уровне.
Во-первых, возможно, для развития pCR требуется больше времени, и не через 10, а через 15-16 недель патоморфологическая картина была бы иной. Во-вторых, неясно, сохраняют ли выжившие опухолевые клетки свой репродуктивный потенциал. В исследовании MISSILE оценка препарата производилась путем окрашивания гематоксилин-эозином по внешнему виду клеток при микроскопии. Есть данные лабораторных исследований на животных, которые демонстрируют: после SABR опухолевые клетки могут выглядеть жизнеспособными при стандартном окрашивании и гистологическом анализе – но фактически сенесцентными, деградировавшими вследствие накопившихся повреждений ДНК [18]. Такие клетки никогда уже не смогут размножаться и обладать иными свойствами жизнеспособной опухоли. Возможно, требуется более глубокая оценка истинной репродуктивной способности клеток, особенно с учетом того, что высокие дозы излучения обладают дополнительным спектром воздействия на опухоль.
Механизм действия больших доз излучения более универсален, чем малых. Помимо непосредственного воздействия на ДНК клетки, дозы свыше 6 Гр способны вызвать:
- значительное повреждение опухолевого микроокружения за счет разрушения сосудов в опухоли (дозы >10 Гр вызывают быстрый апоптоз клеток эндотелия) и запуска ряда сигнальных путей;
- влияние на радиорезистентные опухоль-ассоциированные фибробласты (CAFs – клетки, играющие важную роль в процессах клеточного роста, ангиогенеза и инвазии; обычно они резистентны даже к большим (более 50 Гр) дозам фракционированного облучения) в виде деградации, снижения способности к пролиферации и миграции этих клеток;
- стимулирование выработки CD8+ Т-лимфоцитов, играющих важнейшую роль в процессе иммунного ответа – и это еще один аргумент (№8) в пользу применения лучевой терапии.
В отличие от скальпеля, который только одномоментно ликвидирует видимую опухоль, но не оказывает никакого влияния на возможные микрометастазы, излучение способно действовать подобно вакцине in situ: разрушая опухоль, предоставлять антигенную информацию об опухоли Т-специфическим лимфоцитам, запуская иммунный ответ. И новый подход, который в настоящее время активно исследуется, возможно, вскоре продемонстрирует нам эффективность комбинации SABR и иммунотерапии при раннем раке легкого. Первые интересные данные только начинают появляться, но можно предположить, что комбинация иммунотерапии и SABR способна не только увеличить частоту pCR, но и максимально отсрочить клиническую манифестацию как локального, так и отдаленного прогрессирования за счет синергизма ИТ и облучения. В настоящее время не менее 8 проспективных исследований I, II и III фазы оценивают безопасность и эффективность SABR в комбинации с иммунопрепаратами, остается дождаться их непосредственных и, главное, отдаленных результатов.
Аргумент №9 связан с дальнейшими перспективами развития технологий лучевой терапии. Маловероятно, что в ближайшие годы что-то принципиально изменится в хирургических подходах – а лучевая терапия, уже совершив колоссальный прогресс за столетие, продолжает стремиться к безграничному совершенству. Те технологии, о которых мы с придыханием говорили еще недавно – IMRT, VMAT, gating, 4-D КТ и др. – в настоящее время доступны и широко используются в большинстве российских центров. Мы же с интересом смотрим на исследования наших европейских и американских коллег, связанные с внедрением в клиническую практику технологии FLASH-терапии. Для справки: технология FLASH позволяет подвести дозу в 40 Гр и выше за секунду, тогда как при конвенциональном облучении ткани получают 0,03 Гр в секунду – такая мощность луча действительно делает его подобным скальпелю и не оставляет опухоли никаких шансов, при этом ограничиваясь только опухолевым очагом без захвата окружающих тканей. Данные первых доклинических и клинических испытаний по FLASH-терапии показывают хорошую переносимость лечения и обнадеживающие результаты, в том числе и при раке легкого.
Наконец, главный аргумент (№10) – но, уверена, не последний! – был представлен на конгрессе ASCO 2021, и публикация в журнале Lancet Oncology также не замедлила себя ждать [19]. Дело в том, что авторы исследования STARS после публикации совокупных результатов в 2015 году не бросили работу, а продолжили набор пациентов в группы SBRT и операции по прежнему протоколу! На момент доклада исследование включало уже свыше 300 больных, прослеженных более 5 лет. И тенденция полностью сохранилась: 5-летняя общая выживаемость оказалась достоверно лучше в группе лучевой терапии - 87% против 84%, p=0.012, HR 0.411 (95% CI: 0.193-0.875; p=0.021). При этом отсутствовали различия между группами в БРВ, раково-специфической выживаемости, кумулятивной частоте рецидивов (рис.3). Данные демонстрируют, что SBRT при раннем раке как минимум не хуже, чем операция. В недалёком будущем консервативный метод лечения – SBRT – станет абсолютно адекватной альтернативой операции не только для тех пациентов, которые не способны ее перенести, но и у сохранных больных ранним НМРЛ без явной сопутствующей патологии, и выбор будет исключительно за пациентом.
Вопросы, которые вызывают больше всего сомнений в отношении SBRT рака легкого I стадии - это проблема верификации опухоли малого размера до начала лечения и оценки эффекта лечения и диагностики рецидивов в условиях наличия постлучевого фиброза, затрудняющего сам процесс диагностики.
Получить материал для верификации из небольшой опухоли, располагающейся в глубине легкого или в непосредственной близости от критических структур, не всегда представляется возможным. С одной стороны, начинать лучевую терапию без морфологического подтверждения рака мы не должны. С другой стороны, попытки верификации могут нести настолько серьезные риски, особенно для соматически неблагополучных пациентов, что этот вопрос для части больных останется открытым. На помощь приходят диагностические методы – КТ и ПЭТ/КТ, используемые в настоящее время весьма широко. По данным многих авторов, при отсутствии возможности получения морфологической верификации диагноз злокачественной опухоли устанавливается на основании комбинированной информации, полученной двумя этими методами – наличие патологического накопления FDG в очаге и/или наличие ранее не обнаруживаемого, растущего и проявляющего признаки злокачественности образования по КТ. В России окончательный диагноз подкрепляется еще и печатью мультидисциплинарного консилиума. Международные рекомендации за последние годы снизили градус строгости в плане необходимости верификации до начала лечения. Более того, в плане частоты отсутствия верификации до начала лечения и риска радикально пролечить опухолевое образование, не являющееся злокачественным, радиотерапевты находятся в одинаковом положении с хирургами: нередко пациент идет на радикальную операцию лишь с подозрением на злокачественную опухоль. По данным крупного анализа из Нидерландов [20], среди более чем 10 тысяч пациентов, оперированных по поводу рака легкого за 2010-2015 гг, 36% не имели морфологического подтверждения злокачественного процесса, причем чем меньше была опухоль, тем реже верификация до операции (менее 50%). При этом авторы целой серии исследований отмечают, что частота обнаружения доброкачественных опухолей (следовательно, и ненужных радикальных операций) варьирует от 5 до 20%. Без сомнения, необходимо стремиться к достаточному уровню верификации до начала лечения, но каков он должен быть, этот уровень – вопрос скорее философский. Установи планку слишком высоко – и часть пациентов со злокачественными опухолями останутся без лечения, низко – получишь риски осложнений от ненужных лечебных интервенций. Решение опытной мультидисциплинарной команды, согласованное с пациентом, осведомленным обо всех рисках – нам всем в помощь.
Вопрос о качественной оценке эффективности SBRT и диагностике рецидивов – это вопрос подготовки врачей-диагностов. В литературе имеется немало обзоров и статей с подробным описанием диагностической картины в легких после SBRT с течением времени, получаемой с помощью КТ или ПЭТ/КТ, а также описание КТпризнаков локальных рецидивов, на которые можно ориентироваться специалистам [21-23]. Систематическое обучение диагностов в связи с постоянно изменяющимися условиями, при постоянном развитии консервативных методов лечения – это залог более качественной диагностики и оценки результатов любого лечения. SBRT в России делают уже многие, делают успешно, и чем более частой станет подобная практика, тем выше будет качество и эффективность облучения с помощью этой методики. Проведение SABR у неоперабельных пациентов уже стало стандартом лечения во всем мире. Будут ли ситуации, когда я, радиотерапевт, отдам предпочтение хирургическому методу у больного с РЛ I стадии? Без сомнения – например, у пациента с интерстициальной болезнью легких (и высоченным риском летального исхода при облучении) или если я буду понимать, что облучение оптимальными аблативными дозами, способными обеспечить длительный локальный контроль и лучшие отдаленные результаты, нежелательно по причине высоко риска осложнений (к примеру, при ультрацентральной локализации опухоли или при сугубо периферическом расположении опухоли вблизи ребра, что чревато его переломом и хроническим болевым синдромом), когда необходимо изменять режим фракционирования и снижать БЭД у сохранного пациента с хорошим прогнозом. Но в ситуации, когда есть возможность и провести SABR в оптимальных дозах без явного риска вызвать осложнения, и выполнить ВАТС органосохраняющую операцию, окончательный выбор должен сделать пациент, получив полную адекватную информацию в отношении обоих методов от квалифицированного мультидисциплинарного консилиума.
Список литературы:
1. Palma D., Visser O., Lagerwaard FJ. et al. Impact of Introducing Stereotactic Lung Radiotherapy for Elderly Patients With Stage I Non–Small-Cell Lung Cancer: A Population-Based TimeTrend Analysis. J Clin Oncol 2010;28(35):5153–5159.
2. Khorfan et al. Survival of Primary Stereotactic Body Radiation Therapy Compared With Surgery for Operable Stage I/II Non-small Cell Lung Cancer. Ann Thorac Surg 2020;110:228-35
3. Chang JY, Senan S, Paul MA, et al. Stereotactic ablative radiotherapy versus lobectomy for operable stage I non-small-cell lung cancer: a pooled analysis of two randomised trials. Lancet Oncol. 2015;16(6):630-637.
4. Wang et al. A propensity-matched analysis of surgery and stereotactic body radiotherapy for early stage non-small cell lung cancer in the elderly. Medicine (2016) 95:52
5. Li M. et al. Stereotactic body radiotherapy or stereotactic ablative radiotherapy versus surgery for patients with T1-3N0M0 non-small cell lung cancer: a systematic review and meta-analysis. OncoTargets and Therapy 2017:10 2885–2892
6. Chi A. et al. Comparison of Longterm Survival of Patients With EarlyStage Non–Small Cell Lung Cancer After Surgery vs Stereotactic Body Radiotherapy. JAMA Network Open. 2019;2(11):e1915724.
7. Yuan et al. A propensitymatched analysis of stereotactic body radiotherapy and sublobar resection for stage I non-small cell lung cancer in patients at high risk for lobectomy: the results in a Chinese population. J Thorac Dis 2021;13(3):1822-1832
8. Dong et al. Comparison of the outcomes of sublobar resection and stereotactic body radiotherapy for stage T1-2N0M0 non-small cell lung cancer with tumor size ≤ 5 cm: a propensity score matching analysis. J Thorac Dis 2020;12(10):5934-5944
9. Lin et al. Outcomes of stereotactic body radiotherapy versus lobectomy for stage I non-small cell lung cancer: a propensity score matching analysis. BMC Pulmonary Medicine 2019;19:98
10.Rosen JE et al. Lobectomy versus stereotactic body radiotherapy in healthy patients with stage I lung cancer. J Thorac Cardiovasc Surg 2016;152:44-54)
11.Moreno AC et al. Biologically Effective Dose in Stereotactic Body Radiotherapy and Survival for Patients With Early-Stage NSCLC. JTO 2020;15(1):101-109)
12. Stokes WA et al. PostTreatment Mortality After Surgery and Stereotactic Body Radiotherapy for Early-Stage Non–Small-Cell Lung Cancer. J Clin Oncol 2018;36:642- 654.
13.Shaverdian N et al. The patient's perspective on stereotactic body radiation therapy (SBRT) vs. surgery for treatment of early stage nonsmall cell lung cancer (NSCLC). Lung Cancer 2015;90(2): 230-233.
14.Antonoff M, et al. COVID-19 guidance for triage of operations for thoracic malignancies: a consensus statement from thoracic surgery outcomes research network. Ann Thorac Surg. 2020;110:692–6
15.Guckenberger M, Belka C, Bezjak A, et al. Practice recommendations for lung cancer radiotherapy during the COVID-19 pandemic: An ESTRO-ASTRO consensus statement. Radiother Oncol. 2020;146:223-229.
16.Brooks E, et al. Association of Long-term Outcomes and Survival With Multidisciplinary Salvage Treatment for Local and Regional Recurrence After Stereotactic Ablative Radiotherapy for EarlyStage Lung Cancer. JAMA Network Open. 2018;1(4):e181390.
17.Palma DA, Nguyen TK, Louie AV, et al. Measuring the Integration of Stereotactic Ablative Radiotherapy Plus Surgery for Early-Stage Non– Small Cell Lung Cancer: A Phase 2 Clinical Trial. JAMA Oncol. 2019;5(5):681–688.
18.Oweida A, et al. Response to
stereotactic ablative radiotherapy
in a novel orthotopic model of nonsmall cell lung cancer. Oncotarget
2017;9:1630–40.
19.Chang JY, Mehran RJ, Feng L, et
al; STARS Lung Cancer Trials Group.
Stereotactic ablative radiotherapy for
operable stage I non-small-cell lung
cancer (revised STARS): long-term
results of a single-arm, prospective
trial with prespecified comparison
to surgery. Lancet Oncol. 2021
Результаты голосования*
*https://www.rosoncoweb.ru/news/oncology/2022/01/11/
Всего проголосовало: 159

РИСАРГ
рибоциклиб

ЛИНПАРЗА
олапариб

BREAST CANCER SYMPOSIUM В SAN ANTONIO 2021. ЭВОЛЮЦИЯ ЛОКО-РЕГИОНАРНОГО ЛЕЧЕНИЯ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ В ЭРУ МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИХ ТЕХНОЛОГИЙ: ХИРУРГИЧЕСКИЕ АСПЕКТЫ
Авторы: Петр Владимирович Криворотько,
д.м.н., профессор, заведующий хирургическим отделением опухолей молочной железы,
заведующий отделением онкологии и реконструктивнопластической хирургии,
ведущий научный сотрудник, НМИЦ онкологии им.Н.Н.Петрова, Санкт-Петербург
Авторы: Александр Сергеевич Емельянов,
врач онколог отделения опухолей молочной железы,
НМИЦ онкологии им.Н.Н.Петрова, Санкт-Петербург
В Сан-Антонио, США, с 7 по 10 декабря 2021 года проходила конференция San Antonio, объединившая специалистов по лечению рака молочной железы со всего мира. В рамках конференции Monica Morrow, Terry Mamounas, Tari King и Philip Poortmans, как одни из самых авторитетных специалистов в области локо-регионарного лечения РМЖ, провели мини-симпозиум, посвященный месту хирургии и лучевой терапии в эру молекулярно-генетических технологий при лечении рака молочной железы. Одним из главных вопросов, обсуждаемых на симпозиуме, была возможность отказа от хирургического стадирования аксиллярной области.
Де-эскалация или эскалация аксиллярной хирургии?
Хирургия аксиллярной области прошла долгий эволюционный путь. В 1960-1980 годы всем больным РМЖ выполнялась только полная аксиллярная лимфодиссекция. Начиная с 1990 года, в рутинную практику вошла биопсия сигнальных лимфатических узлов для пациентов категории сN0. В 2000 году на смену аксиллярной лимфодиссекции пришла биопсия сторожевых лимфоузлов (БСЛУ) + лучевая терапия при наличии метастазов в сигнальных лимфатических узлах у пациентов категории cN0. Применение эффективных схем неоадъювантной терапии с целью снижения стадии заболевания с 2010 года позволило уменьшить объем хирургических вмешательства на аксиллярной области.
Основные цели выполнения хирургических вмешательств на аксиллярной области - это стадирование заболевания, улучшение выживаемости больных раком молочной железы, определение оптимальной адъювантной терапии. Но так ли все однозначно, и не являются ли данные предпосылки историческим «атавизмом» лечения рака молочной железы?
Исследование, проведенное Fisher B. и соавторами, показало, что выполнение аксиллярной лимфодиссекции не улучшает показатели безрецидивной выживаемости у больных раком молочной железы при сравнении мастэктомии, мастэктомии с аксиллярной лимфодиссекцией и мастэктомии с облучением зон регионарного лимфооттока [1]. Исследования ACOSOG Z0011 и AMAROS продемонстрировали отсутствие улучшения показателей безрецидивной выживаемости при выполнении аксиллярной лимфодиссекции в сравнении с лучевой терапией, даже при наличии метастазов в сигнальных лимфатических узлах [2,3].
Эти исследования изменили парадигму хирургического стадирования аксиллярной области у больных раком молочной железы. Современные российские и международные рекомендации по лечению рака молочной железы считают полную аксиллярную лимфодиссекцию избыточной процедурой при наличии 2 сигнальных лимфатических узлов с метастазами, так как эта хирургическая манипуляция не улучшает показатели выживаемости, а лишь увеличивает число ятрогенных осложнений, в первую очередь лимфедемы.
Основной вопрос, обсуждаемый мэтрами современной хирургии рака молочной железы – есть ли категория больных, которым вообще не нужно выполнять хирургическое стадирование аксиллярной области, даже БСЛУ?
Анализ, проведенный Ries и соавторами в 2007 году на основании базы данных SEER, показал, что вероятность обнаружения измененных региональных лимфатических узлов пропорционально возрастает вместе с размером первичного очага в молочной железе, и выходит на плато 60% при размере опухоли 43 мм и больше [4].
Биологический подтип опухоли, так же является предиктором поражения аксиллярных лимфатических узлов. По данным анализа, проведенного в Memorial Sloan Kettering Cancer Center c 1998 по 2010 годы, максимальная частота обнаружения метастатических лимфоузлов наблюдалась при HER2-позитивном раке молочной железы и достигала 36%, при этом вероятность поражения 4 и более лимфатических узлов составляла 22% также при HER2-позитивном заболевании [5].
Вероятность поражения аксиллярных лимфатических узлов у больных категории cN0 по данным заключительного патоморфологического исследования составляет от 19 до 23%, стадия pN2/3 определяется у 3,6-6% больных [6] Предоперационная оценка статуса регионарных лимфатических узлов позволяет снизить частоту выявления стадии pN+ до 8,6-14%, а стадии pN2/3 до 0,5- 1,3% [7,8].
В исследовании IBCSG 10-93 частота аксиллярного рецидива при отсутствии хирургического стадирования аксиллярной области (без БСЛУ и АЛД) составила 3%, тогда как в группе аксиллярной лимфодиссекции – 1%, при частоте N+ 28% [9]. В похожем исследовании CALGB 9343 частота местного рецидива составила 3% в группе без хирургического стадирования аксиллярной области, 0% - в группе АЛД, 0% - в группе лучевой терапии на зоны регионарного лимфооттока [10]. Стоит отметить, что основную группу пациентов в представленных исследованиях составляли больные с гормон-зависимым раком молочной железы, стадии cT1-T2 старше 60 лет.
С учетом данных многих международных исследований возникает логичный вопрос: можем ли мы отказаться от хирургического стадирования аксиллярной области, в том числе БСЛУ, не только у больных гормон-позитивным раком молочной железы стадии cT1- 2N0 старше 70 лет - или нам необходимо расширить показания к аксиллярной лимфодиссекции с целью лучшего определения группы пациентов, которым необходима эскалация адъювантной терапии?
На сегодняшний день биологический подтип опухоли является основным фактором, влияющим на назначение системной терапии при раке молочной железы. Современные гайдлайны, например NCCN, рекомендуют проводить системную терапию (химиотерапию, таргетную терапию) у больных HER2-позитивным раком молочной железы и трижды-негативным раком молочной железы, начиная со стадии T1bN0. Обнаружение метастатических лимфатических узлов при стадии cT1 HER2-позитивного РМЖ влияет на выбор химиотерапевтических агентов. Именно при данном подтипе опухоли чаще обнаруживаются измененные лимфоузлы. Но все чаще, начиная со стадии IIA, при агрессивных биологических подтипах РМЖ первым этапом лечения становится неоадъювантная терапия. В соответствии со стандартами NCCN 2020 и St. Gallen 2021, химиотерапия при гормонoзависимом РМЖ применяется при наличии 4 и более пораженных лимфатических узлов. При I-II стадии гормонoзависимого РМЖ и наличии 1-3 пораженных лимфатических узлов решение о назначении химиотерапии принимается на основании результатов молекулярно-генетических панелей риска [11,12].
По результатам 9-ти летнего наблюдения пациентов cN0 в исследовании TAILORx польза от назначения химиотерапии увеличивается пропорционально шкале молекулярно-генетической панели риска в группе пациентов моложе 50 лет, но данные результаты оказались статистически незначимыми [13].
В исследовании RxPONDER у постменопаузальных пациентов с гормон-зависимым РМЖ и 1-3 метастатическими лимфатическими узлами при значении шкалы молекулярно-генетической панели риска ≤ 25, не было обнаружено достоверных отличий в БРВ при назначении химиотерапии в дополнение к эндокринотерапии. У пременопаузальных пациентов БРВ была выше на 5,2% в группе, получавшей химиотерапию в дополнение к эндокринотерапии – 94,2%, против 89,0% в группе только эндокринотерапии [14].
С учетом данных представленных исследований очевидно, что для пременопаузальных больных гормонoзависимым РМЖ хирургическое стадирование аксиллярной области (БСЛУ) является необходимым элементом назначения адъювантной химиотерапии независимо от результатов молекулярно-генетических панелей риска.
Напротив, в группе постменопаузы в группе постменопаузальных больных именно результаты молекулярно-генетических панелей риска определяют показания к назначению химиотерапии вне зависимости от статуса регионарных лимфатических узлов. Поражение 4 и более лимфатических узлов у пациентов категории cN0 встречается менее чем в 2% случаев, при условии выполнения предоперационного ультразвукового исследования аксиллярной области. В исследовании RxPONDER 37% больных выполнялась только биопсия сигнальных лимфатических узлов, вне зависимости от их статуса, и даже в этой группе больных не было преимуществ в назначении химиотерапии по сравнению с только эндокринной терапией. Тренд на использование числа пораженных лимфатических узлов как предиктора назначения химиотерапии уходит в историю, как и выполнение аксилярной лимфодиссекции с мнимой целью улучшения выживаемости постменопаузальных больных с ER/PR-позитивным РМЖ.
При небольших размерах первичного очага вероятность массивного поражения аксиллярного лимфатического коллектора минимальна. Хирургическое стадирование данной области (в том числе БСЛУ) не улучшает местный контроль над заболеванием. Статус лимфатических узлов влияет на выбор системной терапии у пременопаузальных больных ER/ PR-позитивным РМЖ категории cN0, а также у больных с HER2- позитивным и трижды-негативным РМЖ категории сN0. Но при агрессивных биологических подтипах, начиная со стадии IIA, первым этапом лечения становится неоадъювантная терапия, позволяющая стратифицировать больных в зависимости от ответа опухоли на лечение. Для большинства больных РМЖ патоморфологический статус региональных лимфатических узлов не является основополагающим фактором в выборе системной терапии. Метастазы в аксиллярных лимфатических узлах определяют показания к назначению послеоперационной лучевой терапии.
Хирургическое стадирование аксиллярной области у больных раком молочной железы получающих неоадъювантную системную терапию
Для больных раком молочной железы, получающих неоадъювантную терапию, долгое время единственным методом хирургического стадирования аксиллярной области была аксиллярная лимфодиссекция. Мета-анализ 16 исследований, опубликованный Geng C. и соавторами в 2016 году, продемонстрировал, что частота ложно-отрицательных результатов БСЛУ у пациентов категории сN0 до начала неоадъювантной терапии не превышает 6%, при частоте идентификации СЛУ – 96%. Современные рекомендации по лечению рака молочной железы считают именно БСЛУ «золотым стандартом» стадирования аксиллярной области как у первичных больных категории сN0, так и у пациентов сN0, получающих неоадъювантную терапию [15]. У пациентов с верифицированным до начала предоперационной системной терапии метастатическим поражением регионарных лимфатических узлов частота конверсии в ypN0 достигает 52%, что позволяет в некоторых случаях избежать полной аксиллярной лимфодиссекции. Фактором, ограничивающим применение БСЛУ у пациентов, подвергшихся конверсии аксиллярных лимфоузлов из cN+ в ycN0 была высокая частота ложно-отрицательных результатов – до 14,2%. Исследования Z1071, SENTINA, SN FNAC, GANEA-2 продемонстрировали снижение частоты ложно-отрицательных заключений БСЛУ после неоадъювантной терапии при удалении более 2 сигнальных лимфатических узлов – 4,9-9,1% [16-19].
Маркировка пораженного лимфатического узла до начала неоадъювантной системной терапии и последующего его прицельное удаление (таргетная аксиллярная диссекция) позволяет снизить частоту ложно-отрицательных заключений до 5,2-6,3% [20]. Для маркировки лимфатических узлов могут использоваться радиоактивные микроисточники, магнитные зерна и стальные клипсы. Результаты исследования, проведенного в MDACC, показали, что комбинация таргетной аксиллярной и БСЛУ у больных РМЖ при конверсии cN+ в ycN0 достигает 1,4% [21].
В рамках сессии, посвященной локо-регионарному лечению РМЖ, профессор Terry Mamounas продемонстрировал результаты пяти исследований, оценивающих частоту аксиллярного рецидива после выполнения БСЛУ, в которые были включены более 100 пациентов категории cN1 до начала лечения. При медиане наблюдения от 36 до 108 месяцев аксиллярный рецидив был выявлен в 0-2,3% случаев [22-25]. Полученные данные свидетельствуют о возможности выполнения БСЛУ и таргетной аксиллярной диссекции у больных раком молочной железы при конверсии из cN+ в ycN0 после неоадъювантной терапии при соблюдении ряда условий: удалении более 2 СЛУ, использовании комбинированной методики БСЛУ, маркировке пораженных лимфоузлов до начала лечения с их последующим прицельным удалением.
Де-эскалация хирургических вмешательств на молочной железе
Еще одной темой для дискуссии на San Antonio Breast Cancer Symposium стала возможность отказа от хирургических вмешательств на молочной железе у пациентов, достигших полного клинического/рентгенологического регресса на фоне неоадъювантной терапии. Результаты представленных исследований оказались противоречивыми. Основным методом, способным заменить стандартные хирургические вмешательства на молочной железе с целью подтверждения полного патоморфологического регресса является вакуум-аспирационная биопсия. Частота ложно-отрицательных результатов подтверждения полного патоморфологического регресса pCR методом вакуум-аспирационной биопсии варирует от 5 до 66%. Результаты исследований RESPONDER, NRG BR005, MICRA NKI, MD Anderson Cancer Center показали, что основными условиями для снижения частоты ложно-отрицательных результатов ВАБ являются: правильный подбор пациентов для ВАБ, использование иглы размером 7G, исключение пациентов с интрадуктальным компонентом опухоли, обязательная маркировка опухолевого узла перед началом химиотерапии и мультиинструментальная оценка полного клинического регресса. При соблюдении данных условий частота ложно-отрицательных заключений достигает 5%.
Исследование, проведенное Hayashi et al. [26] продемонстрировало частоту ложно-отрицательных заключений 56,1%. В испытание включались больные раком молочной железы стадии сT1-3N0-3M0, получавшие неоадъювантную терапию при любом биологическом подтипе опухоли. В качестве методов оценки ответа опухоли на лечение использовалось МРТ и УЗИ молочных желез. Высокая частота ложно-отрицательных результатов ВАБ в данном исследовании можно объяснить отсутствием выборки пациентов, использованию иглы 10G, включению пациентов с DCIS, отсутствием маркировки первичного очага у некоторых пациентов перед началом неоадъювантной терапии.
Напротив, исследование, представленное Andre Pfob [27], продемонстрировало частоту ложноотрицательных результатов 4% при правильной выборке пациентов и 0% - при использовании вакуум-аспирационной биопсии в комбинации обучающими алгоритмами искуственного интеллекта. Данное исследование еще раз подчеркивает возможность отказа от стандартных хирургических вмешательств на молочной железе у пациентов? достигших полного клинического регресса опухоли.
НМИЦ Онкологии им. Н.Н. Петрова опубликовал промежуточные результаты исследования по отказу от хирургических вмешательств на молочной железе при достижении полного клинического регресса HER2-позитивного и трижды-негативного РМЖ на фоне неоадъювантной терапии (NCT04293796, [28]). В 72,7% случаев (8 из 11) вакуум-аспирационная биопсия подтвердила полный патоморфологический регресс опухоли в молочной железе, и пациентам не выполнялось стандартное хирургическое вмешательство. Набор в исследование продолжается.
НМИЦ онкологии им. Н.Н. Блохина представили результаты исследования по сравнению различных подходов к лечению местно-распространенного рака молочной железы [29]. Все пациенты получали неоадъювантную химио- или эндокринотерапию. После завершения предоперационного лечения 50% (91 пациент) выполнялось хирургическое вмешательство с последующей лучевой терапией, 50% (91 пациент) – лучевая терапия лучевая терапия +/- хирургическое вмешательство. Трех- и пятилетняя БРВ равнялись 87,7% и 85,6% в первой группе, против 77,3% и 65,9% во второй группе. Согласно результатам, лучший локальный контроль над местно-распространенным РМЖ после неоадъювантной терапии достигается при выполнении хирургического вмешательства с последующей лучевой терапией.
Источники:
1. Fisher B, et al. Twenty-five-year follow-up of a randomized trial comparing radical mastectomy, total mastectomy, and total mastectomy followed by irradiation. N Engl J Med. 2002 Aug 22;347(8):567-75. doi: 10.1056/NEJMoa020128. PMID: 12192016.
2. Giuliano AE, et al. Effect of Axillary Dissection vs No Axillary Dissection on 10-Year Overall Survival Among Women With Invasive Breast Cancer and Sentinel Node Metastasis: The ACOSOG Z0011 (Alliance) Randomized Clinical Trial. JAMA. 2017 Sep 12;318(10):918-926. doi: 10.1001/ jama.2017.11470. PMID: 28898379; PMCID: PMC5672806.
3. Donker M, et al. Radiotherapy or surgery of the axilla after a positive sentinel node in breast cancer (EORTC 10981-22023 AMAROS): a randomised, multicentre, open-label, phase 3 non-inferiority trial. Lancet Oncol. 2014 Nov;15(12):1303-10. doi: 10.1016/S1470-2045(14)70460-7. Epub 2014 Oct 15. PMID: 25439688; PMCID: PMC4291166.
4. Ries LAG, et al. SEER Survival Monograph: Cancer Survival Among Adults: U.S. SEER Program, 1988-2001, Patient and Tumor Characteristics. National Cancer Institute, SEER Program, NIH Pub. No. 07-6215, Bethesda, MD, 2007.
5. Ugras S, Stempel M, Patil S, Morrow M. Estrogen receptor, progesterone receptor, and HER2 status predict lymphovascular invasion and lymph node involvement. Ann Surg Oncol. 2014 Nov;21(12):3780-6. doi: 10.1245/ s10434-014-3851-y. Epub 2014 Jun 21. PMID: 24952028; PMCID: PMC4362539.
6. McCartan D, Stempel M, Eaton A, Morrow M, Pilewskie M. Impact of Body Mass Index on Clinical Axillary Nodal Assessment in Breast Cancer Patients. Ann Surg Oncol. 2016 Oct;23(10):3324-9. doi: 10.1245/ s10434-016-5330-0. Epub 2016 Jun 23. PMID: 27338746; PMCID: PMC5070647.
7. Reimer T, et al. Restricted Axillary Staging in Clinically and Sonographically Node-Negative Early Invasive Breast Cancer (c/iT1-2) in the Context of Breast Conserving Therapy: First Results Following Commencement of the IntergroupSentinel-Mamma (INSEMA) Trial. Geburtshilfe Frauenheilkd. 2017 Feb;77(2):149-157. doi: 10.1055/s0042-122853. PMID: 28331237; PMCID: PMC5357224.
8. Magnoni F. et al. Breast Cancer Surgery: New Issues. Curr. Oncol. 2021, 28, 4053–4066. https://doi.org/ 10.3390/curroncol28050344
9. International Breast Cancer Study Group. Randomized trial comparing axillary clearance versus no axillary clearance in older patients with breast cancer: first results of International Breast Cancer Study Group Trial 10-93. J Clin Oncol. 2006 Jan 20;24(3):337-44. doi: 10.1200/ JCO.2005.01.5784. Epub 2005 Dec 12. PMID: 16344321.
10.Hughes KS, et al. Lumpectomy plus tamoxifen with or without irradiation in women age 70 years or older with early breast cancer: long-term follow-up of CALGB 9343. J Clin Oncol. 2013 Jul 1;31(19):2382- 7. doi: 10.1200/JCO.2012.45.2615. Epub 2013 May 20. PMID: 23690420; PMCID: PMC3691356.
11. NCCN Guidelines Breast Cancer V5, 2020
12. Burstein HJ, et al. Panelists of the St Gallen Consensus Conference. Customizing local and systemic therapies for women with early breast cancer: the St. Gallen International Consensus Guidelines for treatment of early breast cancer 2021. Ann Oncol. 2021 Oct;32(10):1216-1235. doi: 10.1016/j. annonc.2021.06.023. Epub 2021 Jul 6. PMID: 34242744.
13. Sparano JA, et al. Adjuvant Chemotherapy Guided by a 21-Gene Expression Assay in Breast Cancer. N Engl J Med. 2018 Jul 12;379(2):111- 121. doi: 10.1056/NEJMoa1804710. Epub 2018 Jun 3. PMID: 29860917; PMCID: PMC6172658.
14. https://ascopost.com/news/ december-2020/rxponder-studyshows-postmenopausal-patientswith-node-positive-breastcancer-may-be-able-to-avoidchemotherapy/
15. Geng C, Chen X, Pan X, Li J. The Feasibility and Accuracy of Sentinel Lymph Node Biopsy in Initially Clinically Node-Negative Breast Cancer after Neoadjuvant Chemotherapy: A Systematic Review and Meta-Analysis. PLoS One. 2016 Sep 8;11(9):e0162605. doi: 10.1371/ journal.pone.0162605. PMID: 27606623; PMCID: PMC5015960.
16. Boughey JC, et al. Alliance for Clinical Trials in Oncology. Sentinel lymph node surgery after neoadjuvant chemotherapy in patients with nodepositive breast cancer: the ACOSOG Z1071 (Alliance) clinical trial. JAMA. 2013 Oct 9;310(14):1455-61. doi: 10.1001/jama.2013.278932. PMID: 24101169; PMCID: PMC4075763.
17. Kuehn T, et al. Sentinel-lymphnode biopsy in patients with breast cancer before and after neoadjuvant chemotherapy (SENTINA): a prospective, multicentre cohort study. Lancet Oncol. 2013 Jun;14(7):609-18. doi: 10.1016/S1470-2045(13)70166-9. Epub 2013 May 15. PMID: 23683750.
18. Boileau JF, et al. Sentinel node biopsy after neoadjuvant chemotherapy in biopsy-proven node-positive breast cancer: the SN FNAC study. J Clin Oncol. 2015 Jan 20;33(3):258-64. doi: 10.1200/ JCO.2014.55.7827. Epub 2014 Dec 1. PMID: 25452445.
19. Classe JM, et al. Sentinel lymph node biopsy without axillary lymphadenectomy after neoadjuvant chemotherapy is accurate and safe for selected patients: the GANEA 2 study. Breast Cancer Res Treat. 2019 Начало на стр.15 Jan;173(2):343-352. doi: 10.1007/ s10549-018-5004-7. Epub 2018 Oct 20. PMID: 30343457.
20. Swarnkar PK, Tayeh S, Michell MJ, Mokbel K. The Evolving Role of Marked Lymph Node Biopsy (MLNB) and Targeted Axillary Dissection (TAD) after Neoadjuvant Chemotherapy (NACT) for NodePositive Breast Cancer: Systematic Review and Pooled Analysis. Cancers (Basel). 2021 Mar 26;13(7):1539. doi: 10.3390/cancers13071539. PMID: 33810544; PMCID: PMC8037051.
21. Caudle AS, et al. Improved Axillary Evaluation Following Neoadjuvant Therapy for Patients With Node-Positive Breast Cancer Using Selective Evaluation of Clipped Nodes: Implementation of Targeted Axillary Dissection. J Clin Oncol. 2016 Apr 1;34(10):1072- 8. doi: 10.1200/JCO.2015.64.0094. Epub 2016 Jan 25. PMID: 26811528; PMCID: PMC4933133.
22. Classe JM, et al. Sentinel lymph node biopsy without axillary lymphadenectomy after neoadjuvant chemotherapy is accurate and safe for selected patients: the GANEA 2 study. Breast Cancer Res Treat. 2019 Jan;173(2):343-352. doi: 10.1007/ s10549-018-5004-7. Epub 2018 Oct 20. PMID: 30343457.Kahler-RibeiroFontana, et al: Eur J Surg Oncol 2020
23. Piltin MA, Hoskin TL, Day CN, Davis J Jr, Boughey JC. Oncologic Outcomes of Sentinel Lymph Node Surgery After Neoadjuvant Chemotherapy for Node-Positive Breast Cancer. Ann Surg Oncol. 2020 Nov;27(12):4795-4801. doi: 10.1245/ s10434-020-08900-0. Epub 2020 Aug 10. PMID: 32779055.
24. Wong SM, et al. Oncologic Safety of Sentinel Lymph Node Biopsy Alone After Neoadjuvant Chemotherapy for Breast Cancer. Ann Surg Oncol. 2021 May;28(5):2621- 2629. doi: 10.1245/s10434-020- 09211-0. Epub 2020 Oct 23. PMID: 33095362.
25. Martelli G, et al. Sentinel Node Biopsy alone or with Axillary Dissection in Breast Cancer Patients after Primary Chemotherapy: Long-term Results of a Prospective Interventional Study. Ann Surg. 2020 Oct 15. doi: 10.1097/ SLA.0000000000004562. Epub ahead of print. PMID: 33065651.
26. Hayashi et al. A multicenter prospective study to predict pathologic complete response by vacuumassisted breast biopsy based on MRI and US findings after neoadjuvant chemotherapy. PD7-05.
27.Pfob A. et al. Intelligent vacuumassisted breast biopsy to identify breast cancer patients with pathologic complete response after neoadjuvant systemic treatment for omission of breast and axillary surgery. PD7-02.
28. Krivorotko P. et al. Refusal of breast surgery in breast cancer patients with clinical complete response (cCR) after neoadjuvant systemic therapy and vacuumassisted biopsy (VAB) and sentinel lymph node biopsy (SLNB) confirmed pathological complete response (pCR). A first report of the prospective non-randomized trial results. NCT04293796. P3-18-09.
29.Petrovsky A et al. Surgery vs
radiation therapy as the first stage
treatment in patients with locally
advanced breast cancer with
incomplete clinical response. P3-20-
09
РОЛЬ ЖИДКОСТНОЙ БИОПСИИ В ДИАГНОСТИКЕ НЕМЕЛКОКЛЕТОЧНОГО РАКА ЛЕГКОГО (НМРЛ)
Автор: Ирина Валерьевна Плохотенко
Бюджетное учреждение здравоохранения Омской области «Клинический онкологический диспансер», врач торакальный онколог поликлиники
Рак легкого представляет собой гетерогенную группу заболеваний. От точности морфологической верификации злокачественного процесса зависит правильность назначения терапии, что в свою очередь обеспечивает пациенту более высокие показатели выживаемости без прогрессирования (ВБП), общей выживаемости (ОВ), а также более качественный уровень жизни.
На сегодняшний день по совокупности данных считается, что проводить молекулярно-генетическое тестирование (МГТ), т.е. определение каскада драйверных мутаций (EGFR, ALK, ROS-1 и т.д.) имеет смысл только при верификации немелкоклеточного неплоскоклеточного рака легкого, т.е. аденокарциномы. В частности, мутация в гене EGFR может быть определена в гистологическом блоке, в цитологическом препарате и при жидкостной биопсии (плазма крови, моча, спинномозговая жидкость).
При этом:
• Гистологический блок на сегодня является оптимальным материалом и для морфологической верификации злокачественного процесса, и для проведения МГТ;
• Цитологический препарат при отсутствии гистологического блока является приемлемой альтернативой для МГТ, однако для выполнения тестирования необходимо наличие не менее 200 опухолевых клеток на стекле;
• Жидкостная биопсия также может быть использована для МГТ, однако высок риск получения ложноотрицательного результата в силу того, что мутация определяется не в компонентах крови, а в попадающей в кровь опухолевой ДНК при распаде самой злокачественной опухоли, которой, в свою очередь, может быть также недостаточно для получения достоверного результата.
Возникает вопрос о целесообразности использования жидкостной биопсии в диагностике НМРЛ, т.к. само понятие верификации аденокарциномы уже предполагает наличие гистологического блока или цитологического стекла хорошего качества с достаточным количеством опухолевых клеток. Однако известно, что в 100% случаев невозможно верифицировать опухолевый процесс в силу объективных данных (возраст пациента, наличие выраженной сопутствующей патологии, расположение самой опухоли и т.д.), и тогда единственным методом определения мутации в гене EGFR остается жидкостная биопсия, в частности забор крови, поскольку применение этого метода диагностики возможно у 100% пациентов.
Предлагаю рассмотреть реальные клинические случаи, характеризующие роль жидкостной биопсии в диагностике распространенного НМРЛ.
КЛИНИЧЕСКИЙ СЛУЧАЙ №1
Россия, г. Омск.
Пациентка Р., 1981 г.р. На момент начала заболевания пациентке 36 лет.
Считает себя больной с июня 2018
года, когда впервые появились жалобы на боли в левой половине шеи
и левом надплечье. На МРТ шейного
отдела позвоночника от 27.06.2018
определяется наличие патологического перелома тела Th1 позвонка.
На МСКТ ОГК от 30.06.2018 (рис.1,2)
выявлены признаки периферического новообразования в нижней
доле левого легкого с бугристо-лучистыми контурами до 30х26х19 мм
с внутриорганными вторичными
неопластическими изменениями до
6 мм, остеолитическим неопластическим поражением Th1 позвонка.
Лимфатические узлы средостения
и видимые периферические не увеличены. При обследовании других
органов – без особенностей, патологических очагов не выявлено.
Рисунок 1, 2.
МСКТ пациентки Р:
первичная опухоль
и метастаз в Th1.
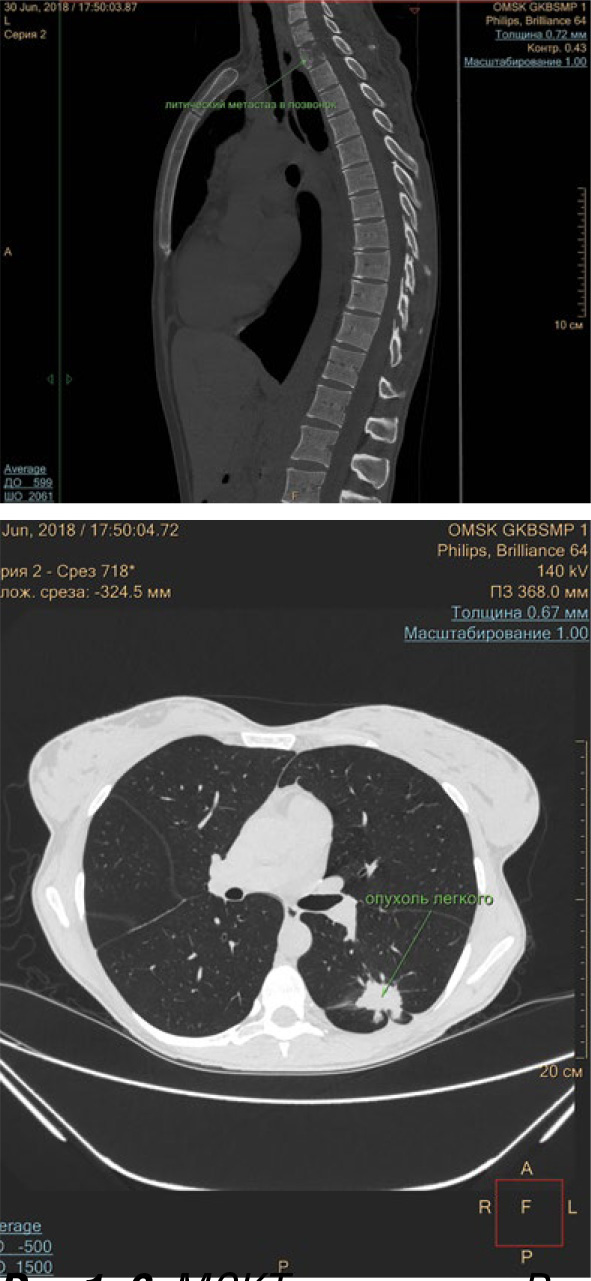
Таким образом, для получения морфологической верификации диагноза были доступны всего 2 очага:
1. Первый грудной позвонок.
2. Опухоль левого легкого.
Других доступных субстратов для биопсии (периферические и внутригрудные лимфоузлы, плевральная жидкость, опухолевые отсевы в печени и т.д.) у пациентки не было обнаружено. В силу периферического расположения опухоли верифицировать процесс при бронхоскопии также не представлялось возможным.
1. Была предпринята попытка получения верификации из позвонка: 11.07.2018 выполнена пункционная биопсия тела Th1 под МСКТ контролем. Гистологическое заключение: недифференцированный рак. Для уточнения характера злокачественного процесса и его органоспецифичности в БУЗОО КОД выполнен пересмотр гистопрепаратов от 24.07.2018. Микроскопическое описание: в препарате комплексы эпителиальных опухолевых клеток, располагающихся в виде одиночных клеток, мелких и более крупных скоплений, очагово присутствуют костные балки небольших размеров. Ввиду отсутствия достаточного количества опухолевых клеток, а также невозможности точного определения гистотипа, данный материал оказался не пригоден для дальнейшего МГТ. Также невозможно было точно поставить диагноз и выбрать схему лекарственного лечения.
2. Попытка верификации процесса в легком
С согласия консилиума было решено провести трансторакальную пункцию опухоли левого легкого под контролем МСКТ с целью морфологической верификации диагноза. От торакоскопии/торакотомии с биопсией легкого решено воздержаться ввиду повышенного риска патологического перелома Th1 позвонка с повреждением спинного мозга при приведении пациента в вынужденное положение для проведения операции из типичного доступа. Вынужденное положение пациента обеспечивается поворотом на здоровый бок и использованием реклинационного валика, что увеличивает риски патологического перелома позвонка при наличии метастатического поражения в шейно-грудном отделе позвоночника.
26.07.2018 г. выполнена трансторакальная пункция опухоли левого легкого под контролем МСКТ ОГК. Послеоперационный период осложнился пневмотораксом, проводилось дренирование плевральной полости, по причине значительной дыхательной недостаточности пациентка нуждалась в постоянной оксигенации.
Рисунок 3.
Цитограмма
Результат цитологического лабораторного исследования от 27.07.2018 г. (рис.2): Цитограмма злокачественного новообразования. Дополнительно: подозрение на аденокарциному. Определение мутации в гене EGFR в данном препарате невозможно, т.к. не получено достаточного количества цитологического материала (200 клеток на стекле)
Результат (протокол) патогистологического лабораторного исследования от 31.07.2018 г.: Микроскопическое описание: ткань лёгкого без признаков опухолевого роста.
Данных результатов верификации также недостаточно для дальнейшего МГТ, постановки точного диагноза и выбора схемы лекарственного лечения. Из доступных методов диагностики оставалось либо проводить биопсию легкого под наркозом, что сопровождалось бы высочайшим риском патологического перелома 1 грудного позвонка с возможным повреждением спинного мозга, либо выполнить жидкостную биопсию, что и было предпринято. 31.07.2019 выполнен забор крови в 2 пробирки для цоДНК с целью определения наличия драйверных мутаций в гене EGFR. На момент забора образца значительно страдало самочувствие пациентки, общее состояние по шкале ECOG – 3 балла (за счет выраженной дыхательной недостаточности после трансторакальной пункции).
02.08.2018 материал доставлен в лабораторию г. Новосибирска (ФГБУН ИХБФМ СО РАН). Исследуемый образец протестирован на наличие следующих мутаций в гене EGFR: T790M, L858R и делеции в 19-м экзоне. В образце обнаружена делеция в экзоне 19 гена EGFR. Дата выполнения анализа 04.08.2018. (срок выполнения анализа 4 дня с учетом логистики).
По совокупности данных (клинико-рентгенологическая картина + результат МГТ) пациентке был выставлен диагноз 4 стадии рака легкого, назначен препарат группы TKI (Гефитиниб в стандартной дозировке 250 мг на прием 1 раз в день), терапия которым без прогрессирования проводилась до ноября 2019 года (ВБП - 17 месяцев). Лечение пациентка переносила удовлетворительно, значимых побочных эффектов не отмечалось.
КЛИНИЧЕСКИЙ СЛУЧАЙ №2
Россия, г. Омск.
Пациентка Ю., 1960 г.р. На момент
начала заболевания - 58 лет.
Считает себя больной с сентября
2018 года, когда стали беспокоить
боли в поясничной области. Самостоятельно 15.12.2018 прошла МРТ
грудного и пояснично-крестцового
отделов позвоночника, выявлено
метастатическое поражение Th4 и
L3 позвонков с компрессионными
переломами, а также образование
нижней доли правого легкого. На
МСКТ ОГК от 19.12.2018 – периферическое образоввание нижней
доли правого легкого 34 мм. При обследовании по системам – без особенностей.
24.01.2019 г. с целью морфологической верификации выполнена пункционная биопсия тела L3 позвонка.
Гистологическое заключение: подозрение на плоскоклеточный рак.
В БУЗОО КОД выполнен пересмотр
гистопрепаратов.
Результат (протокол) патогистологического лабораторного исследования от 13.02.2019 г.
Микроскопическое описание: фрагменты губчатой кости с признаками метастаза карциномы, десмопластической реакцией. Опухолевые клетки альциан-негативные.
Требуется ИГХ-исследование. Результат (протокол) патогистологического лабораторного исследования от 18.02.2019г.
Микроскопическое описание: При ИГХ исследовании метастатического поражения опухолевые клетки интенсивно CK HMW (clon 34βE12)+, CK7+, CEA+; умеренно интенсивно TTF1+; единичные клетки CK5+. Негативная экспрессия опухолевыми клетками CK20, p63.
Иммунофенотип опухолевых клеток соответствует метастазу аденокарциномы, наиболее вероятно из лёгкого.
В связи с обнаружением метастатической аденокарциномы (IV стадия) легкого решено проводить молекулярно-генетическое тестирование, но так как образец представлял собой костный биоптат, то, по заключению локальной лаборатории БУЗОО КОД, в исследуемом образце определение мутаций в гене EGFR сомнительно (материал не подходит для исследования).
04.03.2019 выполнен забор крови в пробирку для цоДНК (1 пробирка) для определения наличия драйверных мутаций в гене EGFR. Исследуемый образец протестирован на наличие следующих мутаций в гене EGFR: T790M, L858R и делеции в 19-м экзоне. Исследованные мутации в образце не обнаружены. Дата выполнения анализа 14.03.2019 (срок выполнения анализа 10 дней с учетом логистики).
Рисунок 4, 5.
Контрольные МСКТ
пациентки в процессе
лечения гефитинибом:
склеротические изменения
в позвонке, стабилизация
по первичной опухоли.

С учетом данных результатов пациентке назначена паллиативная ПХТ (TaxPl), однако перед проведением первого курса 19.03.2019 выполнен повторный забор крови для определения наличия драйверных мутаций в гене EGFR. На возможность наличия мутации в гене EGFR указывали такие факторы, как относительно молодой возраст пациентки, отсутствие курения, общее удовлетворительное самочувствие (по шкале ECOG 0-1) за все время диагностики при генерализации опухолевого процесса. Для увеличения количества диагностического субстрата и повышения точности диагностики забор был выполнен в две пробирки для цоДНК. Исследуемый образец протестирован на наличие следующих мутаций в гене EGFR: T790M, L858R и делеции в 19-м экзоне. В образце обнаружена делеция в экзоне 19 гена EGFR. Дата выполнения анализа 28.03.2019 (срок выполнения анализа 9 дней с учетом логистики). По результату данного анализа пациентке с апреля 2019 назначен таргетный препарат группы TKI (гефитиниб в стандартной дозировке 250 мг на прием 1 раз в день). Пациентка лечение переносила удовлетворительно, без выраженных побочных эффектов, ВБП - 27 месяцев.
Клинический случай №3.
Россия, г. Омск. Пациентка М, 1954 г.р. На момент начала заболевания пациентке 63 года. Заболела в ноябре 2017 года, когда стали беспокоить боли в грудной клетке, на МСКТ ОГК от 26.11.2017 выявлены признаки центрального ЦЗНО правого легкого. По результатам дообследования признаков генерализации процесса не выявлено.
С целью морфологической верификации опухолевого процесса 11.12.2017 г. пациентке в БУЗОО КОД выполнена фибробронхоскопия. Описание: шпора правого верхнедолевого бронха резко расширена, инфильтрирована. ПВДБ и промежуточный бронх грубо деформированы, не проходимы. Заключение: Деформация бронхиального дерева извне, больше справа. Результат цитологического лабораторного исследования от 13.12.2017 г.: заключение - подозрение на ЗНО. Цитограмма подозрительна по принадлежности к аденокарциноме. На цитологических стеклах менее 200 клеток, следовательно, выполнить МГТ невозможно ввиду недостаточности материала. Фото препарата невозможно предоставить, произошло выцветание. Ввиду локализованного опухолевого процесса изначально рассматривался вопрос о проведении хирургического лечения, однако при выполнении спирографии зафиксированы низкие показатели ОФВ 1, что в совокупности с коморбидным фоном (пациентка страдает сахарным диабетом 2 типа) не позволяло выполнить необходимый объем хирургического лечения (при поражении промежуточного бронха, как правило, выполняется пульмонэктомия).
У данной пациентки планировалось лучевое лечение в самостоятельном варианте. Химиолучевая терапия не рассматривалась по причине сопутствующей патологии, а также по причине недостаточно четкой верификации опухолевого процесса, что не позволило бы выбрать адекватную схему ХТ.
Во время подготовки к лучевой терапии 15.12.2017 г. выполнен забор крови в 2 пробирки для цоДНК с целью определения наличия мутации в гене EGFR. 20.12.2017 материал доставлен в лабораторию г. Новосибирска (ФГБУН ИХБФМ СО РАН). Исследуемый образец протестирован на наличие следующих мутаций в гене EGFR: T790M, L858R, L861Q, S7681, G719X, инсерции в 20-м экзоне и делеции в 19-м экзоне. В образце обнаружена делеция в экзоне 19 гена EGFR. Дата выполнения анализа 24.12.2017. (срок выполнения анализа 9 дней с учетом логистики и выходных дней). По совокупности данных (клиникорентгенологическая картина + результат МГТ) пациентке был выставлен диагноз 3 стадии рака легкого, с 14.02.2018 был назначен препарат группы TKI (гефитиниб в стандартной дозировке 250 мг на прием 1 раз в день). Лечение пациентка переносила удовлетворительно, отмечены поддающиеся коррекции побочные эффекты в виде бессимптомного повышения трансаминаз (АЛАТ, АСАТ), кожной токсичности (гиперемия, зуд, мокнутие кожи волосистой части головы с образованием корочек), общее состояние по шкале ECOG 1.
Периодически проводился МСКТ ОГК контроль, до июня 2019 – без отрицательной динамики и признаков прогрессирования. Таким образом, срок 1 линии терапии от начала лечения до прогрессирования составил 15 месяцев.
На МСКТ ОГК от 06.06.2019 г.: состояние на терапии ИТК по поводу ЦЗНО правого лёгкого. В корне правого лёгкого визуализируется опухолевидная инфильтрация стелящегося характера, муфтообразно охватывающая ПГБ, ПВДБ, ПСДБ, ПНДБ с признаками невыраженной деформации их просветов, размерами в аксиальной плоскости 24х17 мм (размеры без динамики) с признаками инвазии в правую легочную артерию.
В кортикоплевральных отделах с обеих сторон визуализируются немногочисленные очаговоподобные образования д - до 3 мм. Лимфоузлы средостения, подмышечных групп не увеличены. В боковом отрезке 5-го ребра справа визуализируется выраженная склеротическая перестройка с нарушением целостности кортикального слоя и наличием мягкотканного компонента. В остальномбез особенностей. Заключение: Состояние на терапии ИТК по поводу ЦЗНО правого лёгкого. МСКТ признаки очаговоподобных образований обоих лёгких (без динамики). Мтс поражение 5-го ребра справа. При сравнении с КТ ОГК от 29.11.18 г. появление изменений в 5-ом ребре справа.
В связи с прогрессированием опухолевого процесса 06.06.2019 выполнен забор крови в пробирку для цоДНК с целью определения наличия мутации резистентности к ингибиторам тирозинкиназы 1-2 поколения Т790М. 13.06.2019 материал доставлен в лабораторию г. Новосибирска (ФГБУН ИХБФМ СО РАН). Исследуемый образец протестирован на наличие следующих мутаций в гене EGFR: T790M, L858R и делеции в 19-м экзоне. В образце обнаружены делеция в экзоне 19 и мутация T790M в гене EGFR. Результат: T790M: Положительный - мутация выявлена. Дата выполнения анализа: 17.06.2019 (срок выполнения анализа 11 дней с учетом логистики, праздников (12.06.2019) и выходных дней). По результату данного анализа пациентке назначен таргетный препарат группы TKI 3 поколения – осимертиниб в стандартной дозировке. Пациентка получает лечение по настоящее время, переносит его удовлетворительно, побочных эффектов не отмечено, достигнут контроль заболевания, общее состояние по шкале ECOG 0-1.
Выводы:
Жидкостная биопсия может быть
хорошей альтернативой традиционным субстратам для МГТ (опухолевый блок, цитологическое
стекло), позволяя провести МГТ
тестирование тем пациентам, у
которых морфологическая верификация процесса вызывает определенные трудности. Проведение
жидкостной биопсии не сопровождается техническими сложностями, не требует существенных
материальных и экономических
затрат.
КОММЕНТАРИЙ ЭКСПЕРТА
Автор: Моисеенко Федор Владимирович
Санкт-Петербургский клинический научнопрактический центр специализированных
видов медицинской помощи (онкологической), Санкт-Петербург
Я абсолютно согласен с автором статьи в том, что внедрение таргетной терапии изменило подходы к диагностике, применяемые у больных с НМРЛ. Если раньше для проведения лечения было необходимо гистологическое или цитологическое подтверждение опухолевой природы выявленных при стадировании очагов, то в настоящий момент выбор оптимального подхода требует определения целого спектра молекулярных нарушений. Несмотря на однозначные преимущества применения таргетной терапии у больных с активирующими мутациями, процедуры, необходимые для выделения этой подгруппы при использовании гистологического материала, могут вызывать целый ряд затруднений. Как обоснованно указано автором и подтверждено двумя из трех клинических примеров, получение достаточного для выполнения генетического анализа объема ткани далеко не всегда является легкой задачей. Необходимо обратить внимание еще и на то, что источник ткани может иметь критическое значение. Так, процесс декальцификации, который обычно предшествует морфологическому исследованию и является неотъемлемым этапом подготовки гистологических образцов, полученных из костной ткани, часто приводит к разрушению требуемых молекул.
Второй немаловажный аспект, существенное влияние на который имеет исследование активирующих мутаций на основании цоДНК, – это скорость, с которой можно получить ответ генетического исследования. Так, при параллельном выполнении гистологического исследования и типирования цоДНК к моменту гистологического или цитологического подтверждения опухолевого процесса может быть уже получен и профиль специфических нарушений, которые позволят изменить тактику лечения больного.
Вне всякого сомнения, приведенные в статье примеры иллюстрируют позитивный опыт подобного подхода. Тем не менее, направляя больного на подобное исследование, необходимо держать в
голове и возможность негативного результата молекулярно-генетического исследования, который, к сожалению, встречается значительно чаще. Опять же, необходимо помнить о том, что отсутствие молекулярных нарушений в крови может быть связано как с
их отсутствием в опухоли, так и с отсутствием опухолевой ДНК в
крови пациента, что наблюдается в 20-30% всех случаев.
ВАКЦИНАЦИЯ ОТ COVID-19. «Я», «МЫ» И… АДЪЮВАНТНАЯ ТЕРАПИЯ
Автор: Жуков Николай Владимирович
ФГБУ «НМИЦ Детской гематологии, онкологии и иммунологии им. Д. Рогачева», Москва
Жукова Людмила Григорьевна
«Московский клинический научный центр им. А.С. Логинова ДЗМ», Москва
Дорогие коллеги, вот и прошло уже 2 года с момента, когда мы впервые услышали аббревиатуру «COVID-19». С той поры отношение к заболеванию претерпело множество изменений – от шутливых комментариев конца 2019 – начала 2020, страха неизвестности весны-лета 2020, надежд конца 2020, связанных с появлением в широком доступе вакцин, до ощущения апатии и безразличия в настоящее время (когда кажется, что эта проблема не имеет решения, и цифры в 1000 смертей в день уже не вызывают эмоций). Безусловно, для такой «финальной» реакции есть множество объяснений – большинство из нас уже заняли определенную позицию (благо времени для размышлений было предостаточно) как в отношении к COVID-19 в целом (естественное происхождение или искусственное, опасный вирус или «просто более сильный грипп» и т.д.), так и к профилактике (надо носить маски или это блажь, стоит ограничивать социальную активность или будь что будет и т.п.) и вакцинации (надо прививаться или нет, если надо – то чем). У каждого есть ощущение, что мы сделали все возможное из того, что считаем правильным, и больше не убавить, ни прибавить. Увы, не помогает нам в определении перспектив и «большой брат». Что может обладать бо́льшим деморализующим эффектом, чем ситуация, когда «сверху» посылаются совершенно разнонаправленные и часто противоречащие сигналы, при этом никто не берет на себя труд заглянуть на месяц другой назад и признать, что то, что говорилось тогда, было неправильным? Вряд ли можно придумать более эффективный «демотиватор» для людей, способных к анализу ситуации (а большинство из нас к этой категории все же относится), чем заявить в апреле, что вакцинации одной из наших вакцин точно хватит на 2 года (а скорее всего на все 5, а может быть и пожизненно), а в октябре начать призывать к ревакцинации каждые 6 месяцев и «обзывать» людей, не желающих ревакцинироваться, всякими обидными словами. Да и планка коллективного иммунитета, все время сдвигающаяся вверх к 60-80-90-100%, необходимым для окончательной и бесповоротной победы над COVID, не добавляет энтузиазма, особенно с учетом того, что мы и меньшей из границ пока не достигли, если принимать во внимание «покупные» сертификаты и предполагаемое, хотя и недоказанное до конца, «неравенство» доступных в РФ различных вакцин.
Но, как однозначные и последовательные приверженцы вакцинации (и ревакцинации), мы считаем своим долгом сказать: пока еще у нас есть возможность повлиять на ситуацию. Среди наших коллег до сих пор есть люди «колеблющиеся» в отношении необходимости этих действий (как для себя, так и для пациентов). Мы не питаем особой надежды переубедить 100%-х антипрививочников (увы, такие есть и в нашем окружении) – люди со сформировавшимся однозначным мнением редко его меняют даже под напором «железных» аргументов. Но нам хотелось бы повлиять на «колеблющихся» – тех, кто просто занял выжидательную позицию (посмотрю, что будет – за 2 года не насмотрелся). Почему же это важно в нашей онкологической среде и заслуживает упоминания? Аргументы кажутся нам очевидными. В этом году, скорее всего, злокачественные опухоли без всяких усилий с нашей стороны уступят «почетное» 2 место среди причин смертности в РФ инфекционным болезням. Еще 2 года назад нам казалось, что 260 000 смертей от онкологических заболеваний в год – это гигантская цифра, сопоставимая с вымиранием целого города из первой сотни наиболее населенных городов РФ. И мы с чувством заявляли, что боремся с наиболее страшной напастью человечества. Но 260 000 в год – это около 710 смертей в день. А от COVID в последние несколько месяцев погибает более 1000 человек ежедневно. И это повод постараться предотвратить эти смерти – ведь без разницы, умирает ли пациент от рака или от COVID. Если эту смерть можно предотвратить, то задача врача приложить к этому максимум усилий. Но даже не беря во внимание самый очевидный аргумент (никто не должен умирать преждевременно при наличии возможности это предотвратить), есть и «шкурные» аргументы «второго эшелона» для тех, кому первого окажется мало. Ведь многие из погибающих – это наши пациенты и наши коллеги. А значит COVID – это и увеличение «онкологической смертности» (если от него или от невозможности проведения противоопухолевого лечения погибает пациент с онкологическим заболеванием), и увеличение нагрузки на медиков (если кто-то из коллег выбывает из строя временно или навсегда).
Так какие же аргументы хочется привести, и при чем здесь «Я», «Мы» и… адъювантная терапия»?
Сначала о плохом. На «Мы», похоже, рассчитывать не приходится – думаем, что скоро идея коллективного иммунитета сойдет на нет. Болезнь оказалась гораздо более изменчивой: на нашей памяти это первый из реально смертельных вирусов с высокой контагиозностью, передающихся воздушно-капельным путем, который на популяционном уровне меняется с такой скоростью. А значит, увы, если один раз появился «омикрон» с десятком новых мутаций, позволяющих более эффективно пробивать иммунную защиту, то это может повторяться неограниченное число раз. Пока все сокрушались по поводу того, что иммунитет, полученный от вакцины или заболевания прежним вариантом COVID-19, не действует на более контагиозный, но предположительно более «добрый» омикрон, нас больше заботил противоположный вопрос: а действует ли иммунитет от омикрона на «прежние» варианты вируса? Увы, судя по имеющейся на настоящий момент информации – нет. А это значит, что потенциально мы можем столкнуться с ситуацией, когда по просторам Земли будут одновременно гулять 2 (3, 5 или более) вариантов COVID, не приводящих к выработке перекрестного иммунитета (иммунитет против одного не предотвращает заражения другим и наоборот). В такой ситуации надежда на то, что «Мы» за счет формирования популяционного иммунитета победим вирус до конца, становится иллюзорной вне зависимости от того, какой процент переболеет и будет вакцинирован. Шанс на то, что среди тех, кто заболел без вакцинации или несмотря на нее, появится новый штамм, ускользающий от «прежней» иммунной защиты, представляется очень большим.
Но не все так безрадостно – остается «Я»! Пусть это последняя буква алфавита, но для каждого из нас (когда речь идет о собственной жизни и смерти) буква очень важная. Так вот – в отношении защиты «Я» польза вакцинации с нашей точки зрения остается бесспорной. Даже сейчас, когда очевидна большая «пробивная» способность омикрона, проективное действие вакцины, пусть и менее выраженное, сохраняется. Да, оно ниже, но и 40-50% защиты лучше, чем без нее вообще (как лучше 40-50% эффективность ингибиторов контрольных точек иммунитета по сравнению с нулевой эффективностью химиотерапии при меланоме).
Безусловно, скорее всего магнитуда выигрыша конкретного «Я» от вакцины может различаться в широких пределах – так же, как различаются возможные варианты течения COVID у разных людей. Наверное, когда со сцены окончательно сойдет вопрос о «Мы» (и мы признаемся, что от этого вируса не получится сформировать коллективный иммунитет, который положит конец пандемии), у нас появится время для того, чтобы исследовать, в чем кроется причина столь разного течения COVID у различных индивидов – от бессимптомной инфекции, когда у человека «просто появляются» антитела (и даже полного отсутствия заражения, когда за 2 года нет ни болезни, ни антител), до смерти от COVID (когда причиной смерти является именно повреждающее действие вируса) или от гипериммунной реакции (когда причиной является цитокиновый шторм). И, может быть, окажется, что часть из нас просто невосприимчива к COVID и не выигрывает от вакцинации, а часть, возможно, настолько чувствительна, что погибнет несмотря на нее (не от этих штаммов, так от следующих, которые, скорее всего, еще будут и, не дай бог, возможно, объединят патогенность дельты и контагиозность омикрона), а значит тоже не выигрывает от вакцинации. Более того, скорее всего в силу наличия той или иной степени иммуносупрессии среди наших пациентов тех, кто не выигрывает от вакцинации по второму «сценарию», будет больше, чем среди общей популяции.
Но почему же тогда верно, с нашей точки зрения, утверждение о том, что конкретное «Я» должно вакцинироваться, т.к. именно для него есть выигрыш? Вот здесь как раз и причина, откуда в заголовке появилась адъювантная терапия! Коллеги, когда у вас вдруг внезапно появятся сомнения в пользе вакцинации, потому что она:
1. проводится человеку, который пока не болен и, может быть, никогда и не заболеет;
2. имеет побочные эффекты;
3. не имеет 100% эффективности, и часть вакцинируемых все равно заболеет (а кто-то, может быть, и умрет),
вспомните о том, что адъювантная терапия, которую вы с уверенностью назначаете нашим пациентам:
1. вводится пациенту, не имеющему проявлений опухоли и, возможно, уже излеченному хирургически;
2. имеет побочные эффекты;
3. не имеет 100% эффективности, и часть из получивших адъювантную терапию все равно рецидивирует (а кто-то, увы, и умрет).
Да, как и любая «профилактика», вакцинация не лишена основных недостатков, характерных для данного подхода. Легко лечить того, кто уже болеет – пациенту плохо, и он готов на любые воздействия, лишь бы стало легче. Гораздо труднее лечить того, кто не на момент принятия решения не испытывает симптомов болезни или вообще не болен, а лечение нужно для того, чтобы болезнь не развилась в последующем. Именно эти «недостатки» профилактических мероприятий и являются основными аргументами противников вакцинации. Иногда эти аргументы могут казаться очень логичными. Но если задуматься чуть-чуть… Хотя бы чуть-чуть… Да, на момент проведения профилактики человек выглядит здоровым, его не беспокоит болезнь. Да, ему вводят что-то, что само по себе может иметь побочные эффекты. Да, мы не можем быть уверены, что в конкретном случае именно этого человека (именно этого «Я») профилактика принесет пользу и не принесет вреда. Но пока у нас нет конкретных признаков, позволяющих отличить тех, кто выиграет от вакцинации, от тех, кому она не принесет пользы, мы, как и в онкологии, должны ориентироваться на «групповой» прогноз: если взять 100 (1000, 100 000) «Я» с заранее неизвестным выигрышем (или отсутствием такового) от вакцинации, то на круг оказывается, что польза от вакцинации больше, чем потенциальный вред. А значит шанс остаться в живых у конкретного «Я», выбравшего вакцинацию, больше, чем у «Я», решившего от вакцинации воздержаться. Ведь мы абсолютно верим в подобные аргументы, если речь идет об адъювантной терапии при различных опухолях. И это при том, что онкологические препараты гораздо «тяжелее», чем вакцина от COVID, а их эффективность в отношении предотвращения смерти далека от 98-99%, имеющихся у вакцины. Так почему же кто-то еще готов подвергать свою жизнь и жизнь пациентов ненужному риску, рассуждая о не 100% эффективности и не 100% безопасности вакцин?
Ну и немножко про казуализм. Не секрет, что власть случая и личного опыта, так широко распространенная в нашей среде, иногда «перебивает» аргументы хорошо организованных исследований. Но в отношении вакцинации и случай оказывается на нашей стороне. Задумайтесь – сколько людей в вашем окружении погибло (или даже просто пострадало) от вакцинации? А сколько от COVID?
В общем, если и после всех этих аргументов вы откажетесь от попытки
спасти свою жизнь и жизнь своих
пациентов – вряд ли мы сможем сделать что-то еще. Но если измените
свое мнение – значит эти 3 страницы
текста не были написаны впустую, и
нам можно будет поставить «галочку» в списке добрых дел. Во всяком
случае, мы свой выбор сделали –
вакцинированы, ревакцинированы
(и мы, и члены нашей семьи) и однозначно рекомендуем это своим пациентам. Чего и вам желаем.
КОМБИНАЦИЯ ПАКЛИТАКСЕЛА И КАРБОПЛАТИНА НЕ УСТУПАЕТ ПО ЭФФЕКТИВНОСТИ ПАКЛИТАКСЕЛУ И ИФОСФАМИДУ ПРИ КАРЦИНОСАРКОМЕ МАТКИ И ЯИЧНИКОВ. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ 3 ФАЗЫ GOG-0261
В январе 2022 года в Journal of Clinical Oncology опубликованы результаты крупного многоцентрового исследования III фазы GOG-0261, посвященного изучению эффективности паклитаксела в комбинации с ифосфамидом или карбоплатином при карциносаркомах матки, яичников.
Карциномаркома (синоним - злокачественная смешанная мюллеровская опухоль) является редким злокачественным новообразованием, которое может локализоваться в теле матки, шейки матки, яичниках и брюшине. Карциносаркома матки составляет примерно 3% от всех злокачественных новообразований матки, а карциносаркома яичников встречается еще реже - в 1-2% всех злокачественных новообразований яичников [1,2]. Карциносаркома как матки, так и яичников преимущественно диагностируется у женщин старше 60 лет в менопаузе с избыточной массой тела. Прогноз заболевания неблагоприятный и определяется распространенностью болезни на момент постановки диагноза. Так, 5-летняя общая выживаемость при выявлении на I стадии составляет 54,8%, на II – 36,9%, на III – 24,9% и на IV – 9,2% [3]. Учитывая скромные результаты лекарственной терапии при этом редком типе опухоли, оптимизация первой линии лекарственной терапии является актуальной проблемой.
В настоящий момент комбинация паклитаксела и ифосфамида является вариантом выбора 1 линии терапии карциносаркомы матки и яичников, режим требует обязательного назначения Г-КСФ, соблюдения режима введения месны и сопряжен с развитием центральной нейротоксичности.
В исследование GOG-0261 было включено 637 пациенток, раннее не получавших системной химиотерапии по поводу карциносаркомы, у 536 больных была диагностирована карциносаркома матки, у 101 - карциносаркома яичников.
Пациентки были рандомизированы в соотношении 1:1 в две лечебные группы:
• Паклитаксел 175 мг/м2 в/в капельно в 1 день + карбоплатин AUC6 в/в капельно в 1 день, цикл 21 день, лечение до 6-10 циклов терапии;
• Паклитаксел 175 мг/м2 в/в капельно в 1 день + ифосфамид 1,6 мг/м2 в/в капельно в 1,2,3 дни в комбинации с месной, филграстим с 4-6 дня цикла, цикл 21 день, лечение до 6-10 циклов терапии. Первичной конечной точкой исследования была общей выживаемость (ОВ), вторичными точками – выживаемость без прогрессирования заболевания (ВБП), частота нежелательных явлений (НЯ) и оценка качества жизни.
В группе пациенток с карциносаркомой матки распространенность заболевания варьировала от I до IV стадии: у 40% пациенток была диагностирована I стадия, II стадия отмечена у 6%, III - у 31% IV – у 15%, в 8% случаев лечение проводилось по поводу рецидива ранее локализованного болезни.
В когорте пациенток с карциносаркомой матки медиана ВБП в группе паклитаксела и карбоплатина (n=288) достигла 16,3 мес. против 11,7 мес. в группе паклитаксела и ифосфамида (n=221), ОР = 0,73; p<0,01 для superiority). Медиана ОВ в указанных группах составила 37,3 мес. и 29,0 мес. (ОР = 0,87; 90% ДИ от 0,70 до 1,075; p<0,01 для non-inferiority), соответственно. В когорте пациенток с карциносаркомой яичников ВБП в группе паклитаксела и карбоплатина (n=44) достигла 14,6 мес. против 10,3 мес. в группе паклитаксела и ифосфамида (n=46), медиана ОВ в 37,3 мес. и 29,0 мес., соответственно, однако различия не достигли статистической значимости. Частота развития НЯ любой степени в лечебных группах паклитаксела и карбоплатина и паклитаксела и ифосфамида оказались сопоставимы и ожидаемо были представлены тромбоцитопенией (66,4% и 55,5%), анемией (92,9% и 93,9%), отеками конечностей (16,0% и 16,1%), изменениями вкуса (9,3% и 17,0%), снижением аппетита (22,8% и 27,1%), диареей (28,7% и 22,3%), бессонницей (16,0% и 14,1%), астенией (71,6% и 71,7%), болью в суставах (21,6% и 16,6%), гипоальбуминемией (15,3% и 18,6%), гипомагниемией (25,7% и 7,3%) и сенсорной полинейропатией (66,4% и 63,9%), соответственно. Частота развития центральной нейротоксичности на фоне ифосфамида была относительно низкой, так спутанность сознания отмечена у 4,45% пациентов, сонливость - у 1,62% и значимо не отличалась от группы с карбоплатином.
Несколько выше в группе паклитаксела и карбоплатина зарегистрирована нейтропения - 91,4% против 49,6% в группе с ифосфамидом, что связано с ее первичной профилактикой в этой лечебной когорте.
Таким образом комбинация паклитаксела и карбоплатина может стать новым стандартом 1 линии лечения пациентов с карциносаркомой матки, яичников и других локализаций.
Источники:
1. Olah KS, Dunn JA, Gee H. Leiomyosarcoma have a poorer prognosis than mixed mesodermal tumours when adjusting for known prognostic factors the result of a retrospective study of 423 cases of uterine sarcoma. Br J Obstet Gynecol 1992;99:590-4.
2. А.Н.Грицай, С.А.Швачко, Н.И.Лазарева с соавт. Лечение карциносарком яичников (обзор литературы). Опухоли женской репродуктивной системы, 2012г. № 3-4. С.88-92
3. Matsuzaki, S., Klar, M., Matsuzaki, S., Roman, L. D., Sood, A. K., & Matsuo, K. (2020). Uterine carcinosarcoma: Contemporary clinical summary, molecular updates, and future research opportunity. Gynecologic Oncology. doi:10.1016/j. ygyno.2020.10.04
4. Powell MA, Filiaci VL, Hensley
ML, et al. Randomized Phase III Trial
of Paclitaxel and Carboplatin Versus
Paclitaxel and Ifosfamide in Patients
With Carcinosarcoma of the Uterus
or Ovary: An NRG Oncology Trial.
JCO; Published online 10 January
2022. DOI: 10.1200/JCO.21.02050
TROPION-PANTUMOR01: ДАТОПОТАМАБ ДЕРУКСТЕКАН ПРИ ДИССЕМИНИРОВАННОМ ТРИЖДЫ НЕГАТИВНОМ РАКЕ МОЛОЧНОЙ ЖЕЛЕЗЫ (ТН РМЖ)
На SABCS 2021 были представлены результаты исследования TROPION-PanTumor01. В мультикогортном исследовании I фазы изучалась эффективность Датопотамаба дерукстекана при рефрактерных к стандартной терапии солидных опухолях. Уровень экспрессии Trop-2 не влиял на включение пациентов в исследование. Датопотамаб дерукстекан (DatoDxd) представляет собой конъюгат, состоящий из моноклонального антитела (IgG1) против рецептора Trop-2 и ингибитора топоизомеразы I (рис. 1).
Рисунок 1.
Датопотомаб дерукстекан
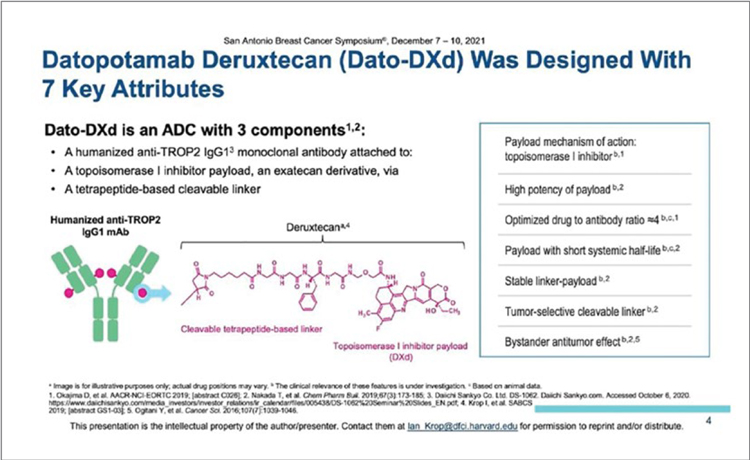
Рецептор Trop-2 в норме экспрессируется на поверхности как нормальных, так и трансформированных эпителиальных клеток и участвует в регуляции пролиферации, клеточной адгезии и миграции. Гиперэкспрессия рецептора Trop-2 выявляется при многих солидных опухолях и в большинстве случаев ассоциируется с неблагоприятным прогнозом. В когорту пациентов с метастатическим тройным негативным раком молочной железы (мТН РМЖ) включено 44 пациентки, при этом у 68% больных в анамнезе было 2 и более линии терапии и 30% ранее получали ингибитор топоизомеразы I - социтузумаб говитекан (рис. 2).
Рисунок 2.
Характеристика пациентов в исследовании
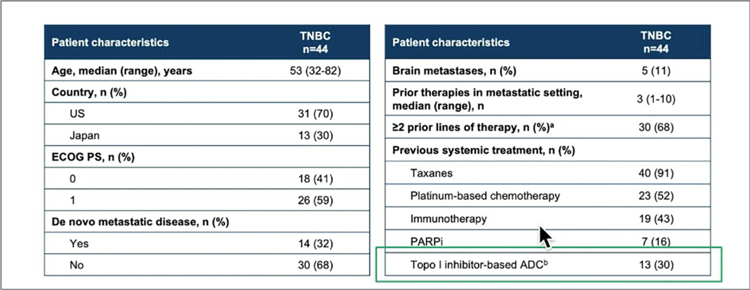
При медиане времени наблюдения в 7,6 мес. в общей группе больных частота объективного ответа (ЧОО) составила 34%, при контроле роста опухоли (КРО) в 77%. В когорте пациентов, ранее не получавших ингибиторы топоизомеразы 1, при медиане времени наблюдения в 8,8 мес. ЧОО достигла 52% при КРО в 81%. В настоящий момент медиана длительности ответа не достигнута, большинство пациентов продолжают терапию (рис. 3).
Рисунок 3.
Эффективность терапии
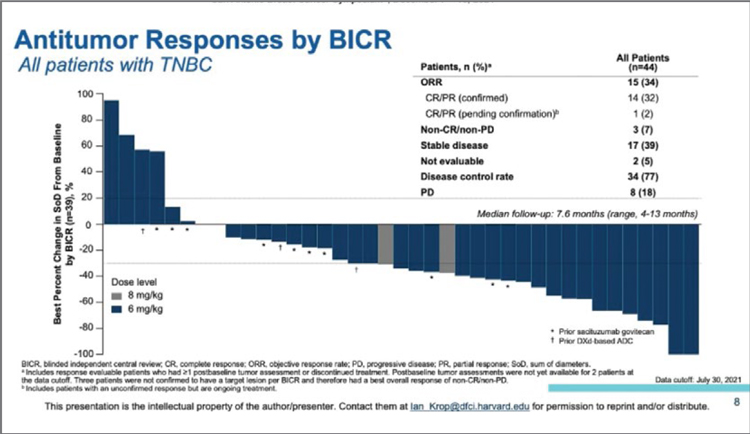
Возникшие осложнения были
управляемыми. Нежелательные
явления (НЯ), развившиеся на
фоне исследуемой терапии, преимущественно были отнесены к
1-2 степени и представлены тошнотой, стоматитом, рвотой, и слабостью. Редукция дозы в связи с
НЯ потребовалась 18% пациентов,
и в 14% случаев НЯ послужили
причиной удлинения интервалов
между курсами. Одна пациентка
прекратила терапию из-за токсичности.
GEMSTONE-302. СУГЕМАЛИМАБ В КОМБИНАЦИИ С ПЛАТИНОСОДЕРЖАЩИЙ ХИМИОТЕРАПИЕЙ В ПЕРВОЙ ЛИНИИ ЛЕЧЕНИЯ НЕМЕЛКОКЛЕТОЧНОГО РАКА ЛЕГКОГО
14 января 2022 года в журнале The Lancet Oncology опубликованы результаты исследования III фазы по изучению эффективности и токсичности сугемалимаба (ингибитора PD-L1) в комбинации с платиносодержащей химиотерапией в 1 линии лечения диссеминированного немелкоклеточного рака легкого (НМРЛ).
Сугемалимаб (CS1001) - моноклональное антитело, полностью
идентичное человеческому IgG4.
In vitro сугемалимаб блокирует
взаимодействие PD-1 c PD-L1 и
CD80, индуцирует пролиферацию CD4+ Т-лимфоцитов, усиливает секрецию интерферона-γ и
интерлейкина-2, а также, благодаря взаимодействию Fc фрагмента
с FcγR I на мембране макрофагов,
индуцирует антителозависимый
фагоцитоз опсонизированных
клеток (рисунок 1) [1].
Рисунок 1.
Механизм действия Сугемалимаба.
Первичной конечной точкой исследования GEMSTONE-302 была выживаемость без прогрессирования (ВБП).
С декабря 2018 года по май 2020 года в исследование было включено 479 пациентов, которые были рандомизированы в соотношение 2:1 в две лечебные группы:
Рисунок 2.
Дизайн исследования
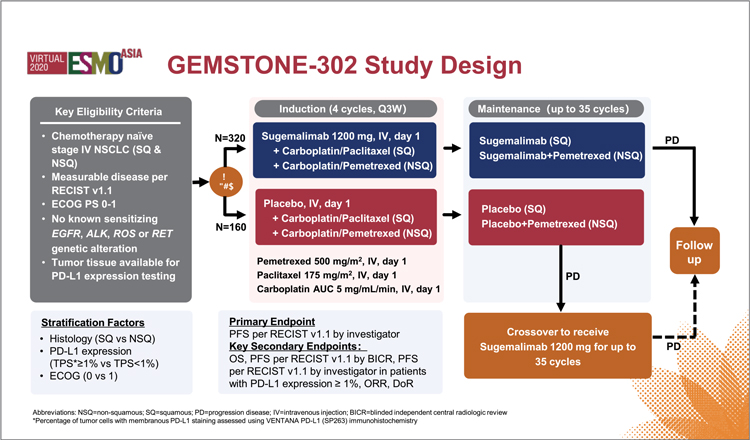
• Химиотерапия в комбинации с сугемалимабом (n= 320);
• Химиотерапия в комбинации с плацебо (n= 159). • Выбор химиотерапевтического партнера зависел от морфологической формы рака легкого:
• для плоскоклеточного рака легкого: карбоплатин AUC 5 + паклитаксел 175 мг/м2 + сугемалимаб 1200 мг/плацебо до 4 циклов и далее сугемалимаб 500 мг/м2/плацебо до 35 введений;
• для неплоскоклеточного рака легкого: карбоплатин AUC 5 +пеметрексед 500 мг/м2+ сугемалимаб 1200 мг/плацебо и далее сугемалимаб 500 мг/м2/плацебо+ пеметрексед 500 мг/м2 до 35 введений. Факторы стратификации: морфологическая форма рака легкого, ECOG (0 против 1), уровень экспрессии PD-L1 (TPS<1 % против TPS<1%) При медиане наблюдения в 17,8 месяцев медиана ВБП в группе сугемалимаба в комбинации с химиотерапией составила 9,0 мес. против 4,9 мес. в группе с плацебо [ОР =0,48 (95% ДИ 0,39- 0,60), р<0,0001], таким образом, добавление сугемалимаба к платиносодержащей комбинации позволило снизить риск прогрессирования на 52%. Одногодичная ВБП достигла 36,4% и 14,8% в группах соответственно (рис. 3).
Рисунок 3.
Медиана выживаемости без прогрессирования заболевания
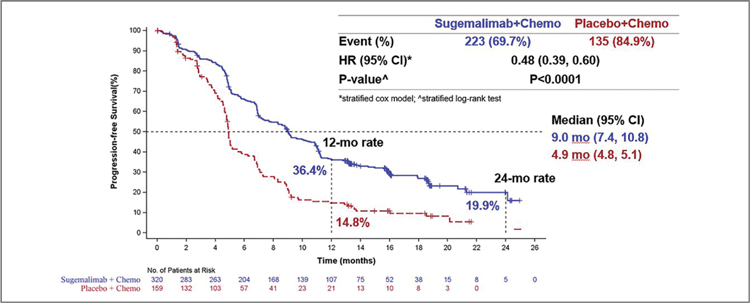
При подгрупповом анализе было показано, что активность сугемалимаба не зависела от морфологической формы рака легкого (рис.4):
Рисунок 4.
Медиана выживаемости без прогрессирования заболевания
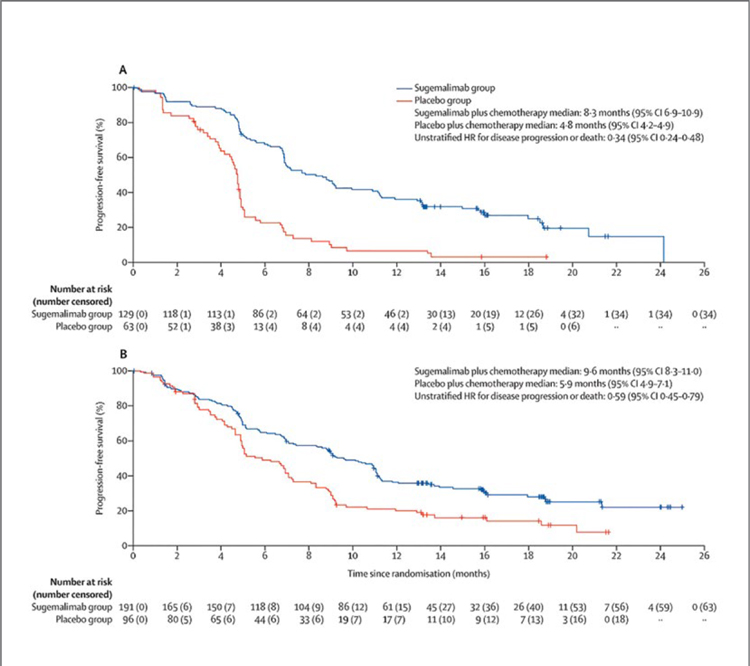
• При плоскоклеточном раке
легкого добавление сугемалимаба
к химиотерапии позволило увеличить медиану ВБП с 4,8 мес. до
8,3 мес. (ОР = 0,34);
• При неплоскоклеточном раке
легкого добавление сугемалимаба
к химиотерапии позволило увеличить медиану ВБП с 5,9 мес. до
9,6 мес (ОР = 0,59).
Частота объективного ответа в
группах составила 63,4% и 40,3%,
соответственно, при длительности ответа в 9,8 мес, и 4,4 мес.
Двухлетняя общая выживаемость достигла 41,7% в группе
сугемалимаба и 38,1% в группе
плацебо.
Нежелательные явления (НЯ)
3 степени и выше были зарегистрированы у 64,1% пациентов
из группе сугемалимаба и у 61,6%
больных в группе плацебо, и были
представлены нейтропенией у
33% и 33%, лейкопенией у 14% и
17%, анемией у 13% и 11% и тромбоцитопения 10% и 9% пациентов,
соответственно. НЯ, развившиеся
на фоне терапии, послужили причиной смерти у 9 пациентов (3%)
в когорте сугемалимаба и 2 пациентов (1%) в контрольной группе.
Источники:
1. Jifang Gong , Junning Cao
,Qingyuan Zhang et al. Safety,
antitumor activity and biomarkers of
sugemalimab in Chinese patients with
advanced solid tumors or lymphomas:
results from the first-in-human phase
1 trial. Cancer Immunol Immunother
2022 Jan 5. doi: 10.1007/s00262-021-
03102-3.
2. Prof Caicun Zhou, MD , Prof Ziping
Wang, MD, Prof Yuping Sun, MD et
al. Sugemalimab versus placebo, in
combination with platinum-based
chemotherapy, as first-line treatment
of metastatic non-small-cell lung
cancer (GEMSTONE-302): interim
and final analyses of a double-blind,
randomised, phase 3 clinical trial The
Lancet Oncology January 14, 2022
DOI: https://doi.org/10.1016/S1470-
2045(21)00650-1

Фарм
Инновационные технологии здоровья

Тафинлар+Мекинист
Инновационные технологии здоровья
