
Новости в лекарственном лечении больных раком молочной железы по материалам виртуального симпозиума SABCS 2020
C 8 по 11 декабря 2020 года состоялся 43-й Ежегодный симпозиум по раку молочной железы в СанАнтонио (43rd Annual San Antonio Breast Cancer Symposium – SABCS)...
Журнал «злокачественные опухоли» включен в перечень рецензируемых научных изданий по специальности «онкология»
С удовольствием сообщаем, что решением ВАК от 09.12.2020 г. журнал «Злокачественные опухоли» включен в перечень рецензируемых научных изданий по специальности «Онкология». С 2010 г. журнал является официальным печатным изданием Российского общества клинической онкологии (RUSSCO) и входит в перечень журналов, рецензируемых ВАК, по двум специальностям – «Онкология» и «Хирургия».

RUSSCO поддерживает национальную программу молекулярно-генетической диагностики теперь – в рамках ОМС
Российское общество клинической онкологии (RUSSCO) продолжает поддерживать молекулярно-генетические и иммуногистохимические тестирования...

Рак молочной железы и COVID-19: уроки пандемии
Вот уже прошел год, как мы живем и работаем в новых условиях – в период пандемии новой коронавирусной инфекции. В конце декабря 2019 года, когда появились первые случаи COVID-19...
Год начался с одобрения FDA трастузумаба дерукстекана у больных метастатическим раком желудка
15 января Управление по надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило фам-трастузумаб дерукстекан-nxki (Enhertu) в качестве терапии пациентов с местнораспространенной или метастатической HER2-положительной аденокарциномой желудка или гастроэзофагеального перехода, которые ранее получали схему с включением трастузумаба...


Тройной негативный рак молочной железы: от генетики до лечения
Тройной негативный рак молочной железы (ТНРМЖ) относится к подгруппе рака молочной железы (РМЖ), характеризующейся отсутствием эстрогеновых рецепторов (ЭР), прогестероновых рецепторов (ПР) и рецепторов эпидермального фактора роста человека 2 типа (HER2). На долю ТНРМЖ приходится 15-20% всех случаев РМЖ; ТНРМЖ чаще встречается у молодых женщин...

Анонс
-

12-13 марта
Конференция RUSSCO «Рак легкого и опухоли средостения»
-

26-27 марта
Конференция RUSSCO «Онкогинекология. Рак эндометрия»
-

15-17 апреля
Конференция RUSSCO «Опухоли ЖКТ»
-

23-24 апреля
Конференция RUSSCО «Меланома и другие опухоли кожи»
-

20-21 мая
VII Российская конференция «Поддерживающая терапия в онкологии»
Новости в лекарственном лечении больных раком молочной железы по материалам виртуального симпозиума SABCS 2020
Авторы: Семиглазова Татьяна Юрьевна
Шарашенидзе Софико Мамуковна
ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, Санкт-Петербург
C 8 по 11 декабря 2020 года состоялся 43-й Ежегодный симпозиум по раку молочной железы в СанАнтонио (43rd Annual San Antonio Breast Cancer Symposium – SABCS). В этом году исследователями из более чем 80 стран было представлено рекордное количество абстрактов (1194 абстракта), что еще раз доказывает актуальность проведения клинических исследований, несмотря на пандемию COVID-19. Прошлый 2020 год ознаменовался прогрессом в лечении больных раком молочной железы, в США зарегистрировано 4 новых противоопухолевых препарата для лечения больных с агрессивными подтипами метастатического рака молочной железы (РМЖ).
РАННИЙ РМЖ ER+ HER2- ранний РМЖ (рРМЖ)
Kalinsky и соавт. представили результаты одного из наиболее ожидаемых и обсуждаемых исследований SWOG S1007 RxPONDER по изучению стандартной адъювантной эндокринотерапии ± химиотерапии среди больных ER+ HER2- рРМЖ со шкалой рецидива 25 и менее с 1-3 пораженными лимфатическими узлами (ЛУ) [1]. Значение оценки риска рецидива Oncotype DX для определения больных с (ЛУ-) HR+HER2- рРМЖ, которым может не проводится химиотерапия (ХТ), было установлено в ходе исследования TAILORx в 2018 году. Однако оставалось неясным, могут ли результаты TAILORx быть экстраполированы на больных с (ЛУ+) РМЖ. В обоих клинических исследованиях для оценки риска рецидива применялся мультигенный тест Oncotype Dx. В исследовании SWOG S1007 RxPONDER были проанализированы сведения о 5083 больных (медиана наблюдения составила 5,1 лет). В результате были зарегистрированы 447 случаев рецидива инвазивного заболевания. При первичном анализе преимущество ХТ в зависимости от шкалы рецидива не было статистически значимым (p=0,30). Однако в группе высокого риска наблюдалось снижение выживаемости без рецидива инвазивного заболевания (ОР 1,06; 95% ДИ 1,04- 1,07; p<0,001). Назначение ХТ ассоциировалось с увеличением выживаемости без рецидива инвазивного заболевания (БРВ) (ОР 0,81; 95% ДИ 0,67-0,98; p=0,026). Была отмечена значимая взаимосвязь преимущества назначения ХТ и менопаузального статуса (p=0,004), которая требовала отдельного анализа. Среди постменопаузальных больных (n=3350, 67%) ОР для группы ХТ + гормонотерапия vs гормонотерапия (ГТ) не было значимым (ОР 0,97; 95% ДИ 0,78-1,22; p=0,82); 5-летняя БРВ равнялась 91,6% vs 91,9%, что свидетельствовало об отсутствии преимущества от дополнительного применения ХТ. В группе пременопаузальных больных (n=1665, 33%), было выявлено значимое (95% ДИ 0,38-0,76; p=0,0004) преимущество от назначения дополнительной ХТ. Показатели 5-летней БРВ составили 94,2% vs 89,0% соответственно. Таким образом, существует значимое различие в преимуществе от назначения ХТ в зависимости от риска рецидива для пременопаузальных vs постменопаузальных пациентов. Несмотря на то, что зарегистрировано лишь 8,8% случаев рецидива инвазивного заболевания и пациенты будут находиться под наблюдением в течение 15 лет, полученные данные показали, что адъювантная терапия может быть деэскалирована до применения только ГТ среди постменопаузальных больных с ЛУ+ (1-3) и индексом риска рецидива <25. Однако отмечено значимое преимущество БРВ при назначении ХТ и ГТ среди пременопаузальных больных. Также по предварительным данным наблюдается увеличение 5-летней общей выживаемости (ОВ). Наиболее важным вопросом остается значимость ХТ в этой группе больных, так как неясно, явилось ли это преимущество следствием лишь подавления менструального цикла, т.е. супрессии овариальной функции при назначении ХТ. Дополнительное наблюдение продолжается, в дальнейшем анализ данных будет включать оценку качества жизни больных и другие вторичные точки. Также планируется анализ данных преимущества при назначении ХТ в зависимости от индукции менопаузы.
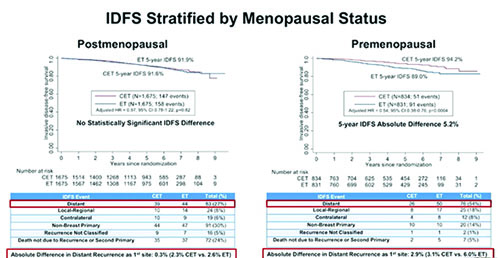
Рисунок 1. Исследование III фазы SWOG S1007 RxPONDER: стандартная адъювантная ГТ ± ХТ среди больных (ЛУ+) ER+HER2- рРМЖ с индексом по шкале риска развития рецидива 25 и менее.
В ходе симпозиума были доложены результаты исследований МonarchE и PENELOPE-B по применению CDK4/6 ингибиторов в адъювантном режиме лечения больных HR+ HER2- рРМЖ с высоким риском развития рецидива. Предметом для дискуссий среди экспертов стала причина различий в результатах исследований. МonarchE является исследованием III фазы, сравнивающим эффективность (БРВ) абемациклиб + ГТ vs ГТ при раннем (операбельном) РМЖ высокого риска [2]. Согласно обновленным данным, преимущество в относительных показателях выживаемости при применении абемациклиба + ГТ vs ГТ в общей группе больных составило 28,7% (ОР 0,713; 95% ДИ 0,583-0,871; p=0,0009). В группе больных абемациклиб + ГТ 2-летняя выживаемость без рецидива инвазивного заболевания достигла 92,3% против 89,3% в группе ГТ. Данные по ОВ пока не представлены. Важной вторичной конечной точкой исследования являлась оценка эффективности среди больных с высоким уровнем Ki-67 (≥20%). Абемациклиб в комбинации с ГТ продемонстрировал в данной группе больных повышение БРВ, со снижением ОР развития инвазивного заболевания на 30,9% (ОР 0,691; 95% ДИ 0,519- 0,920; p=0,0111); 2-летняя выживаемость без инвазивного заболевания составила в группах абемациклиб + ГТ vs ГТ 91,6% и 87,1% соответственно. Добавление абемациклиба к ГТ также увеличивало безметастатическую выживаемость. Таким образом, при относительно короткой медиане наблюдения (приблизительно 19 месяцев) абемациклиб в сочетании с ГТ продемонстрировал клинически значимое увеличение БРВ среди больных (ЛУ+) HR+ HER- рРМЖ высокого риска, а также статистически значимое увеличение БРВ у больных с Ki-67 ≥20%. Loibl S. и соавт. представили финальные данные по БРВ в исследовании PENELOPE-B по изучению палбоциклиба в комбинации с ГТ для лечения больных HR+ HER2- рРМЖ с резидуальным заболеванием высокого риска рецидива после неоадъювантной химиотерапии (НАХТ) [3]. В исследование III фазы PENELOPE-B включались больные, у которых не был достигнут полный патоморфологический ответ после неоадъювантной таксан-содержащей химиотерапии с высоким риском рецидива: CPS-EG (клиникопатологическая стадия + экспрессия ER+ и степень злокачественности [G]) индекс ≥3 или 2 и ypN+. В период с 02.2014 г. по 12.2017 г. 1250 больных были рандомизированы, средний возраст равнялся 49,7 (19- 79) лет. Почти у всех пациентов (96,8%) наблюдался резидуальный РМЖ: позитивный статус лимфатических узлов ypN+ выявлен среди 94,6%; G3 – 47,4%, Ki-67 >15% – среди 27,7%. Риск рецидива по CPS-EG ≥3 отмечен у 54,7% больных. Дополнительно к таргетной терапии палбоциклибом половина пациентов (50,1%) получала ингибиторы ароматазы, 49,8% – тамоксифен, 6,6% – ингибиторы ароматазы + агонисты гонадотропин-рилизинг гормона и 9,7% – тамоксифен + агонисты гонадотропин-рилизинг гормона.
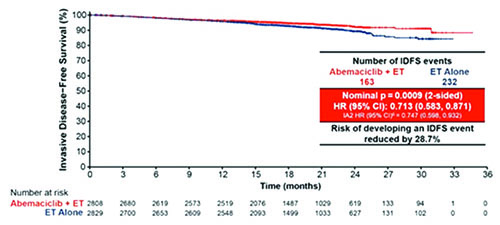
Рисунок 2. Исследование III фазы МonarchE: Эффективность абемациклиба + ГТ vs ГТ у больных рРМЖ высокого риска.
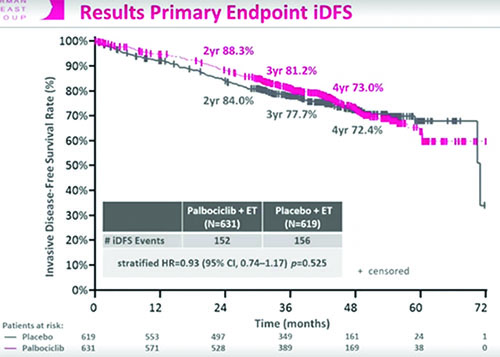
Рисунок 3. Исследование III фазы PENELOPE-B: палбоциклиб в комбинации с ГТ для лечения пациентов с HR+ HER2- ранним (операбельным) РМЖ высокого риска рецидива после НАХТ.
Согласно результатам, при медиане наблюдения 43 месяца дополнительное назначение палбоциклиба не привело увеличению БРВ (ОР 0,93; 95% ДИ 0,74-1,17; р=0,525). Показатель безрецидивной выживаемости равнялся 88,3% в группе палбоциклиб + ГТ против 84% в группе плацебо + ГТ в течение 2 лет; 73% против 72,4% в течение 4 лет. Также не установлено различий в показателях ОВ. Докладчиком отмечена необходимость получения в будущем информации о результатах долгосрочного наблюдения при применении других CDK4/6 ингибиторов с целью оценки их эффективности. Одной из причин неудачи исследования, возможно, является отличие в определении больных группы высокого риска рецидива. В исследование включались только пациенты с резидуальным РМЖ, у которых не наблюдалось полного патоморфологического ответа (pCR). Число испытуемых в исследовании PENELOPE-B было в 4 раза меньше, чем в исследовании PALLAS и МonarchE, а также использовался как предикторный фактор рецидива CPS-EG индекс, а не стадия заболевания. Возможно, абемациклиб является более эффективным CDK4/6 ингибитором, однако это не подтверждается в исследованиях 1-й линии метастатического РМЖ, при которых отмечались схожие результаты при лечении палбоциклибом.
РЕАБИЛИТАЦИЯ БОЛЬНЫХ РАННИМ РМЖ
В исследование биопсихосоциального подхода в реабилитации больных рРМЖ [4] были включены сведения о 228 больных, получивших комплексное лечение заболевания. Из них 114 больных были включены в проспективное исследование и на протяжении лечения подвергались реабилитационным мероприятиям в рамках биопсихосоциального подхода и 114 больных были подобраны в контрольную группу ретроспективно по методике попарного отбора. Реабилитационные мероприятия в рамках биопсихосоциальной модели улучшили показатели бессобытийной БСВ в группе больных рРМЖ: БСВ составила 18,3 мес. против 14,5 мес. в контрольной группе (ОР 0,91; 95% ДИ 0,83-0,99; p=0,0034). При многофакторном анализе ключевыми факторами, влияющими на БСВ, были НАХТ (ОР 0,79; 95% ДИ 0,69-0,94; р=0,0025), возраст (ОР 0,87; 95% ДИ 0,71-1,09; р=0,0027) и менопаузальный статус (ОР 0,85; 95% ДИ 0,84-0,95; р=0,0022). Кроме того, важно отметить, что биопсихосоциальная модель реабилитация больных рРМЖ позволяет учитывать не только биологические (генетические, анатомические, физиологические, биохимические и др.), но и психологические факторы, включающие в себя психические процессы, индивидуальные психологические особенности личности и поведения, а также социальные факторы.
МЕТАСТАТИЧЕСКИЙ РАК МОЛОЧНОЙ ЖЕЛЕЗЫ
Трижды негативный метастатический РМЖ
В ходе конгресса были доложены результаты по дополнительным вторичным оценочным конечным точкам исследования KEYNOTE-355 (Rugo H. и соавт.) по изучению применения пембролизумаба в комбинации с ХТ 1-й линии терапии местно-рецидивирующего неоперабельного или метастатического трижды негативного РМЖ (ТНРМЖ) [5]. Ранее при промежуточном анализе данных было отмечено статистически значимое увеличение БПВ при применении пембролизумаба в сочетании с ХТ (наб-паклитаксел / паклитаксел / гемцитабин + карбоплатин) vs только ХТ при экспрессии PD-L1 CPS ≥10 (ОР 0,65; 95% ДИ 0,49-0,86; одностороннее значение P=0,0012, заранее оговоренный статистический критерий альфа = 0,00411). Вторичные конечные точки включали частоту объективных ответов (ОО), частоту контроля над заболеванием (полный регресс + частичный регресс + стабилизация заболевания ≥24 недель), а также длительность ответа. Результаты по всем вторичным конечным точкам показали преимущество комбинации пембролизумаб + ХТ при наличии PD-L1 экспрессии. Частота ОО при CPS ≥10 составила 53,2% (95% ДИ 46,4-59,9%) vs 39,8% (95% ДИ 30,3-49,9%); при CPS ≥1 – 45,2% (95% ДИ 40,4-50,0%) vs 37,9%(95% ДИ 31,3-44,8%). При подгрупповом анализе увеличение показателя ВБП в группе пембролизумаб + ХТ наблюдалось вне зависимости от комбинаторного химиотерапевтического препарата. Данные результаты вызывают особый интерес, учитывая негативные результаты в исследовании IMPASSION131, которое показало отсутствие увеличения ВБП и ОВ при назначении атезолизумаба в комбинации с еженедельным паклитакселом (возможно, по причине индуцированной иммуносупрессии, вызванной еженедельным введением дексаметазона с целью премедикации). Однако сравнение эффективности комбинаторных цитостатиков не являлось целью исследования, именно поэтому сделать объективные выводы в настоящий момент не представляется возможным. Также отмечено сравнительное снижение эффективности пембролизумаба в комбинации гемцитабин + карбоплатин, что обусловлено изначально плохим прогнозом в данной группе больных. При CPS ≥10 выживаемость без прогрессирования в группе больных мТНРМЖ пембролизумаб + ХТ составила 9,7 мес. vs 5,6 мес. в группе плацебо + ХТ (ОР 0,65; 95% ДИ 0,49- 0,86); при CPS ≥1 показатели ВБП составили 7,6 мес. vs 5,6 мес. соответственно (ОР 0,74; 95% ДИ 0,61-0,90). На основании результатов KEYNOTE-355 в улучшении показателей выживаемости без прогрессирования FDA присвоило статус ускоренного одобрения комбинации пембролизумаб + ХТ для лечения больных с местно-рецидивирующим нерезектабельным или метастатическим ТНРМЖ с экспрессией PD-L1 (CPS ≥10). Данные по ОВ ожидаются в 2021 году. Dent R. et al представили результаты исследования III фазы IPATunity130, анализирующего эффективность комбинации ипатасертиб + паклитаксел при мутациях в сигнальном пути PIK3CA/AKT1/PTEN в качестве 1-й линии терапии местнораспространенного или метастатического ТНРМЖ [6]. Ранее согласно результатам клинического исследования II фазы LOTUS наблюдалось увеличение показателей ВБП в группе больных ТНРМЖ с мутацией в PIK3CA/AKT1/PTEN сигнальном пути (4,9 vs 9,0 мес.; ОР 0,44; 95% ДИ 0,37-0,98). Известно, что PIK3CA/АКТ сигнальный путь является необходимым для метаболизма, пролиферации и инвазии опухолевых клеток. Ипатасертиб – пероральный высокоспецифичный препарат, предназначенный для таргетного воздействия на все три изоформы АКТ (серин-треониновой протеинкиназы). Ипатасертиб блокирует сигнальный путь PI3K/AKT – ключевой фактор роста и пролиферации опухолевых клеток при РМЖ. Когорта А включала пациентов, у которых была обнаружена мутация в гене PIK3CA или AKT1- и/или PTEN. Пациенты не получали ранее химиотерапию по поводу распространенного ТНРМЖ. Пациенты были рандомизированы 2:1 и получали ипатасертиб 400 мг или плацебо (день 1-21) в комбинации с паклитакселом 80 мг/м2 (Д 1, 8, 15). Отмечено отсутствие преимущества в показателях ВБП в группах пациентов, получавших ипатасертиб + паклитаксел vs плацебо + паклитаксел(7,4 vs 6,1 мес.; ОР 1,02; 95% ДИ 0,71- 1,45; р=0,9237). Результаты исследования III фазы IPATunity130 отличаются от ранее полученных результатов исследований II фазы АКТ ингибиторов при ТНРМЖ: в исследовании LOTUS по изучению комбинации паклитаксел + ипатасертиб и в исследовании PAKT по изучению комбинации паклитаксел + капивасеритиб. Кроме того, необходимо выделение потенциальных биомаркеров для определения группы пациентов ТНРМЖ, которая может получить преимущество от назначения АКТ ингибиторов, в том числе и ипатасертиба.
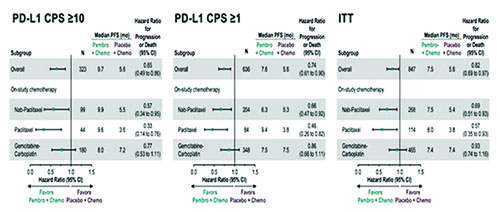
Рисунок 4. Исследование III фазы KEYNOTE-355: пембролизумаб в комбинации с химиотерапией в 1-й линии терапии неоперабельного или метастатического ТНРМЖ.
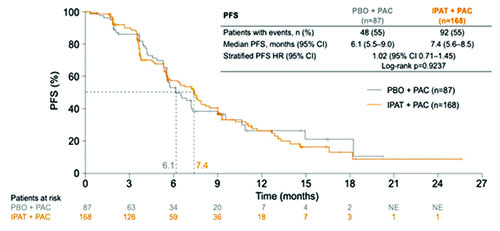
Рисунок 5. Исследование III фазы IPATunity130: ипатасертиб + паклитаксел в 1-й линии терапии нерезектабельного или метастатического ТНРМЖ.
ER+HER2- метастатический РМЖ
O'Shaughnessy и соавт. представили результаты исследования III фазы CONTESSA по ВБП при применении тезетаксела в комбинации с редуцированной дозой капецитабина (1650 мг/м2) vs стандартная доза капецитабина (2500 мг/м2 ) в монорежиме для лечения больных с HR+HER2- мРМЖ, ранее получавших препараты таксанового ряда (исследование выполнено совместно с НМИЦ онкологии им. Н.Н. Петрова) [7]. Тезетаксел – новый препарат для приема внутрь таксаного ряда, назначаемый в дозировке 27 мг/м2 1 раз в 3 недели. В отличие от других препаратов таксанов, тезетаксел обладает более длительным периодом полувыведения и не нуждается в премедикации
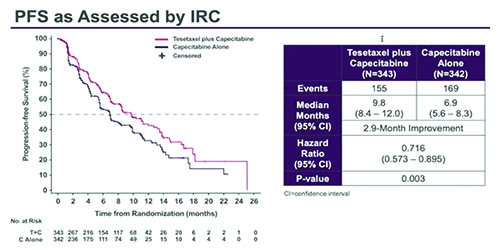
Рисунок 6. Исследование III фазы CONTESSA: Эффективность тезетаксела в комбинации с редуцированной дозой капецитабина (1650 мг/м2) vs стандартная доза капецитабина (2500 мг/м2) в монорежиме для лечения больных HR+HER2- метастатическим РМЖ, ранее получавших таксаны.
Ранее сообщались обнадеживающие результаты II фазы исследования по применению тезетаксела в монорежиме, ЧОО составила 45% и медиана ВБП – 5,4 мес. (Seidman et al, 2018 ASCO Annual Meeting). В исследование были включены 685 больных ER+HER2- мРМЖ. Медиана ВБП составила 9,8 мес. в группе тезетаксел + капецитабин vs 6.9 мес. капецитабин в монорежиме (ОР 0,716; 95% ДИ 0,573-0,895; p=0,003). Частота объективных ответов составила 57% vs 41% (p=0,0002). Данные по ОВ ожидаются. Нейтропения была наиболее частым нежелательным явлением ≥3 степени (71,2% vs 8,3%). Отмена терапии в связи с нейтропенией или фебрильной нейтропенией в группе тезетаксел + капецитабин – 4,2%, в группе капецитабина – 1,5%. Частота развития нейропатии ≥3 степени – 5,9% vs 0,9%, алопеции ≥2 степени – 8,0% vs 0,3%. Следовательно, увеличение ВБП, а также удобство дозировки перорального препарата, отсутствие необходимости госпитализации, сравнительно низкая частота развития нейропатии ≥3 степени могут свидетельствовать в пользу применения тезетаксела в комбинации с редуцированной дозой капецитабина для лечения больных HR+HER2- мРМЖ.

Рисунок 7. Общая выживаемость в зависимости от статуса ЦОК до начала лечения и после лечения.
Определение циркулирующих опухолевых клеток при метастатическом РМЖ
Janni W. и соавт. доложены результаты метаанализа по изучению определения циркулирующих опухолевых клеток (ЦОК) с целью оценки ответа на лечение при метастатическом РМЖ [8]. В анализ были включены сведения о 3877 случаях с результатами оценки циркулирующих опухолевых клеток до начала лечения и спустя 29 дней после начала лечения. У 772 больных не определялись ЦОК как до, так и после начала терапии (neg/neg), у 286 больных наблюдалось приобретение ЦОК после лечения (neg/pos), у 1054 пациентов была отмечена конверсия из ЦОК+ в ЦОК- (pos/neg) и 1765 больных имели хотя бы одну ЦОК до и после начала терапии (pos/pos). Медиана ОВ для групп neg/neg, neg/ pos, pos/neg и pos/pos была 47,05, 29,67, 32,20, и 17,87 мес. (p<0,0001 для всех групп сравнения) соответственно. Отношения рисков (ОР) (референсная группа neg/neg) составили 1,74 (95% ДИ 1,43-2,10)для pos/neg группы, для neg/pos группы – 1,52 (95% ДИ 1,32- 1,74) и для pos/pos группы – 3,15 (95% ДИ 2,78-3,57). Таким образом, данные, полученные в ходе исследования, доказывают потенциальную возможность оценки ЦОК для оценки ответа на проводимую терапию для прогноза ОВ. Пациенты, у которых наблюдалось исчезновение ЦОК (pos/neg), имели значимое увеличение ОВ по сравнению с пациентами, у которых определялись ЦОК (pos/pos) как до, так и после лечения (32,20 vs 17,87 мес.). Однако некоторые эксперты признают, что данный метод пока не следует внедрять в клиническую практику, так как ранняя эскалация системного лечения с учетом результатов по ЦОК может вызвать неоправданное преждевременное исчерпание линий лекарственной терапии и увеличение токсичности от лечения. В перспективе определение циркулирующей опухолевой ДНК может позволить выбирать терапию в зависимости от наличия драйверных мутаций и тем самым значимо улучшить отдаленные результаты лечения.
ЗАКЛЮЧЕНИЕ
Прошедший с 8 по 11 декабря 2020 года симпозиум SABCS 2020 и Большая конференция RUSSCO «Рак молочной железы» 28-30 января 2021 года (в онлайн-формате) в очередной раз доказали, что системная терапия больных РМЖ сегодня – это комбинированная терапия с учетом биологического подтипа опухоли и таких важных мишеней, как рецепторы эстрогенов, экспрессия HER2, PD-L1-экспрессия, мутация PIK3CA и мутация gBRCA1/2, основанная на пациент-центрированном, проблемно-ориентированном, максимально индивидуализированном подходе.
Источники:
1. Kalinsky K, Barlow WE, MericBernstam F, et al. SWOG S1007: adjuvant trial randomized ER+ patients who had a recurrence score <25 and 1-3 positive nodes to endocrine therapy (ET) versus ET + chemotherapy. Presented at: 2020 Virtual San Antonio Breast Cancer Symposium; December 8-11, 2020. Abstract GS3-00.
2. O'Shaughnessy J, Johnston S, Harbeck N, et al. MonarchE: primary outcome analysis of invasive disease-free survival for monarchE: abemaciclib combined with adjuvant endocrine therapy for high risk early breast cancer. Presented at: 2020 Virtual San Antonio Breast Cancer Symposium; December 8-11, 2020. Abstract GS1-01.
3. Loibl S, et al. Phase III study of palbociclib combined with endocrine therapy (ET) in patients with hormonereceptor-positive (HR+), HER2-negative primary breast cancerand with high relapse risk after neoadjuvant chemotherapy (NACT): First results from PENELOPE-B. Presented at: 2020 Virtual San Antonio Breast Cancer Symposium; December 8-11, 2020. Abstract GS1-02.
4. Kluge V, Semiglazova T, Krivorotko P, Melnikova E, Semiglazov V, Kondrateva K, Nazarova S, Tynkasova M, Adhamov B, Pesotsky R, Zernov K, Chulkova V, Kasparov B, Kovlen D, Semiglazov V, Belyaev A. Biopsychosocial approach in the rehabilitation of patients with early breast cancer. Presented at: 2020 Virtual San Antonio Breast Cancer Symposium; December 8-11, 2020. Poster Session 9-62.
5. Cortes J, et al. Pembrolizumab plus chemotherapy versus placebo plus chemotherapy for previously untreated locally recurrent inoperable or metastatic triple-negative breast cancer (KEYNOTE-355): a randomised, placebocontrolled, double-blind, phase 3 clinical trial. The Lancet. December 5, 2020. Volume 396, Issue 10265, P.1817-1828.
6. Dent R, et al. Double-blind placebo (PBO)-controlled randomized phase III trial evaluating first-line ipatasertib (IPAT) combined with paclitaxel (PAC) for PIK3CA/AKT1/PTEN-altered locally advanced unresectable or metastatic triplenegative breast cancer (aTNBC): primary results from IPATunity130 Cohort A. Presented at: 2020 Virtual San Antonio Breast Cancer Symposium; December 8-11, 2020.
7. O'Shaughnessy J, Schwartzberget L, Piccart M, Rugo H, Cortes J, Harbeck N, Semiglazov V, Lemieux J, Wright G, Bondarenko I, et al. Results from CONTESSA: A phase 3 study of tesetaxel plus a reduced dose of capecitabine versus capecitabine alone in patients with HER2- , hormone receptor + (HR+) metastatic breast cancer (MBC) who have previously received a taxane. Presented at: 2020 Virtual San Antonio Breast Cancer Symposium; December 8-11, 2020. Abstract GS4-01.
8. Janni W, et al. Clinical utility of repeated circulating tumor cell (CTC) enumeration as early treatment monitoring tool in metastatic breast cancer (MBC) – a global pooled analysis with individual patient data. Presented at: 2020 Virtual San Antonio Breast Cancer Symposium; December 8-11, 2020. Abstract GS4-08.
Журнал «злокачественные опухоли» включен в перечень рецензируемых научных изданий по специальности «онкология»
Уважаемые коллеги!
С удовольствием сообщаем, что решением ВАК от 09.12.2020 г. журнал «Злокачественные опухоли» включен в перечень рецензируемых научных изданий по специальности «Онкология». С 2010 г. журнал является официальным печатным изданием Российского общества клинической онкологии (RUSSCO) и входит в перечень журналов, рецензируемых ВАК, по двум специальностям – «Онкология» и «Хирургия». Членами редакционной коллегии журнала являются ведущие отечественные и зарубежные эксперты в области молекулярной биологии, лекарственного лечения, лучевой терапии и хирургического лечения злокачественных новообразований. В журнале публикуются оригинальные статьи авторов о проведенных научных, клинических и фундаментальных исследованиях, лекции и актуальные обзоры по проблемам диагностики и лечения злокачественных новообразований, а также интересные клинические случаи. Необходимо отметить, что качество публикуемых работ неуклонно повышается, что делает журнал одним из наиболее престижных, объективных и высоко цитируемых в своей области. Редакционный совет и редакционная коллегия продолжают работать над совершенствованием качества публикуемых статей. К сожалению, в отдельных случаях время от подачи статьи до ее публикации в журнале затягивается, поскольку повышение качества публикуемых работ требует постоянной коммуникации между автором и рецензентами. Редакционная коллегия планирует сделать взаимодействие между автором и рецензентами максимально эффективным. Вы можете загрузить свою статью в режиме онлайн, перейдя по ссылке: www.malignanttumors.org/jour/. Мы ждем ваших новых публикаций и надеемся на плодотворное сотрудничество!
С уважением, Д.А. Носов
Главный редактор, проф,. д.м.н.,
руководитель онкологического отделения ЦКБ УД Президента РФ
ул. Маршала Тимошенко д.15, член-правления RUSSCO
e-mail: nosov@mail.ru
Раб. тел.: +7(499) 141-43-55

RUSSCO поддерживает национальную программу молекулярно-генетической диагностики теперь – в рамках ОМС
Российское общество клинической онкологии (RUSSCO) продолжает поддерживать молекулярно-генетические и иммуногистохимические тестирования и, следуя последним требованиям времени, в дополнение к основной Национальной Программе начало осуществлять логистику и маршрутизацию биообразцов пациентов в рамках обязательного медицинского страхования (ОМС). Проект предоставляет возможность врачу-онкологу из любого региона России в рамках ОМС определить молекулярно-генетические изменения в опухоли пациента. В проекте задействованы 5 лабораторий (федеральные и региональные референс-центры), которые осуществляют тестирования полного спектра мутаций, необходимого для назначения терапии:
- ФГБУ «НМИЦ онкологии им. Н.Н. Блохина», Москва
- ФГБУ «НМИЦ радиологии» (МНИОИ им. П.А. Герцена), Москва
- ГБУЗ МКНЦ им. А.С. Логинова, Москва
- НИИ онкологии Томского НИМЦ, Томск
- ООО «ЦПМ», Новосибирск
- При немелкоклеточном раке легкого выполняются следующие тестирования:
- EGFR (гистология, цитология, кровь), ALK (FISH, ИГХ, гистология), ROS1, BRAF, MSI.
При других нозологиях: KRAS, NRAS (гистология), BRAF, MSI, BRCA1/2 ПЦР.
Телефон горячей линии проекта: 8 (800) 600-36-70 (звонок бесплатный)
Рак молочной железы и COVID-19: уроки пандемии
Автор: Колядина Ирина Владимировна
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
Вот уже прошел год, как мы живем и работаем в новых условиях – в период пандемии новой коронавирусной инфекции. В конце декабря 2019 года, когда появились первые случаи COVID-19, никто и предположить не мог, какие масштабы распространения заболевания нас ожидают в дальнейшем. Пандемия СOVID-19 создала беспрецедентный вызов для системы здравоохранения, изменив алгоритм оказания специализированной помощи онкологическим пациентам во всем мире, в том числе и больным раком молочной железы (РМЖ). В начале декабря 2020 года на крупной международной конференции SABCS-2020, посвященной диагностике и лечению рака молочной железы, отдельно обсуждались вопросы оказания специализированной помощи больным РМЖ в период пандемии COVID-19 и были проанализированы результаты работы онкологической службы всего мира в новых реалиях. Несколько сообщений было посвящено данному вопросу, из которых хочется отметить доклад A. Tang, посвященный анализу калифорнийской группы Kaiser Permanente Medical Group, в котором были показаны изменения в лечебнодиагностическом алгоритме у больных РМЖ, произошедшие с момента наступления пандемии; в качестве группы сравнения использовались данные за аналогичный период 2019 года. Автором показано, что выявление новых случаев РМЖ сократилось в период пандемии на 64% (в 2019 году – 703, за аналогичный период 2020 года – всего 250 новых случаев). Более того, в структуре новых случаев РМЖ в 2020 году стали преобладать пациенты с клиническими симптомами (78%), а доля скрининговых опухолей составила всего 22%, хотя годом ранее картина была иной (доля скрининговых опухолей – 62%, доля РМЖ с клиническими проявлениями – 37%), p<0,001. Отмечено существенное увеличение числа больных с карциномами размером ≥T1c (с 64% до 78%), пациенток с N1 статусом (с 18% до 24%), а также больных с метастатическим РМЖ (с 2% до 7%), p<0,001. При сравнении биологических подтипов РАК МОЛОЧНОЙ ЖЕЛЕЗЫ И COVID-19: УРОКИ ПАНДЕМИИ опухолей, диагностированных в 2019 году и в 2020 году в период пандемии, был отмечен значимый рост агрессивных биологических подтипов (тройного негативного рака – с 10% до 16%, люминального HER2+ подтипа – с 9% до 13%) и сокращение доли люминальных HER2-негативных карцином с 76% до 66% (р=0,04), что не могло не отразиться на изменении в лечебных подходах. Доля пациенток с инициирующим хирургическим лечением снизилась на 12% (с 83% до 71%), увеличилось число больных, получающих химиотерапию (с 10% до 15%) или эндокринотерапию (с 0% до 5%) на первом этапе лечения. При этом произошло укорочение периода ожидания до операции (с 26 до 19 дней, p<0,001) и до начала химиотерапии (c 28 до 24 дней, р=0,03). Таким образом, в период пандемии COVID-19 изменился «портрет» пациентов с вновь диагностируемым РМЖ: отсутствие скрининговых мероприятий привело к сокращению активно выявленных новых случаев заболевания на 64%, а среди диагностированных случаев – к нарастанию более запущенных стадий с агрессивными биологическими подтипами рака, что отразилось на изменении стратегии лечения в сложных эпидемиологических условиях. В докладе Felipe Andtade, представленном на конференции SABCS-2020, отражены изменения в программах скрининга РМЖ в Бразилии с начала пандемии. По сравнению с аналогичным периодом 2019 года, в Сан-Паулу отмечено драматическое снижение скрининговых мероприятий (на 64%) и уменьшение числа выполнения диагностических маммографий на 50% с начала 2020 года. Изменения в подходах к лечению отметили 69% маммологов Бразилии, прежде всего за счет сокращения числа операций на молочной железе (лампэктомий и мастэктомий) в 2020 году по сравнению с аналогичным периодом 2019 года; кроме того, изменился формат консультаций больных (с очного на дистанционный). Значимые изменения в подходах к терапии больных РМЖ в Италии в период пандемии COVID-19 были отмечены G. Curigliano на конференции SABCS-2020. Среди европейских стран Италия пострадала от новой коронавирусной инфекции существенней других: к середине ноября в стране было зафиксировано около 1,5 миллиона заболевших и 53 тысячи умерших от COVID-19; причем смертность у больных с онкопатологией от коронавируса составила 16%. Однако при наличии сопутствующих заболеваний, таких как сахарный диабет, гипертония и сердечнососудистая патология, смертность от COVID-19 возрастала кратно. По данным итальянских коллег, оказание специализированной помощи онкологическим больным в условиях пандемии существенно изменилось. Так, согласно данным опроса 165 онкологов, вовлеченных в мультидисциплинарные команды по лечению больных раком молочной железы, изменения коснулись базовых режимов противоопухолевой терапии ранних и распространенных стадий заболевания. Значимо сократилось число пациентов РМЖ, получающих неоадъювантную терапию с паклитакселом в еженедельном режиме (с 93,9% до 68,5%) и антрациклин-содержащие дозоинтенсивные режимы химиотерапии (с 58,8% до 43%). Для больных с метастатической стадией итальянские онкологи стали реже использовать паклитаксел в еженедельном режиме в качестве первой линии терапии (41,8%; до пандемии – 53,9%) и существенно реже назначать CDK4/6 ингибиторы при люминальных карциномах (в 55,8% случаев; до пандемии – в 80%). Отмечено существенное сокращение визитов онкопациентов в лечебные учреждения для оценки эффективности терапии и для мониторинга токсичности, а также драматическое сокращение числа больных, включенных в клинические исследования. Авторы всех сообщений, представленных на конференции SABCS-2020, подтвердили введение в своих странах специальных рекомендаций по диагностике и лечению РМЖ в условиях новой коронавирусной инфекции, а также селекцию больных для противоопухолевого лечения. Важное значение имели и меры, принятые в лечебных учреждениях всего мира по социальному дистанцированию и эпидемиологическому контролю (скрининг больных и медицинского персонала на наличие COVID-19, обязательное ношение масок для всех, тестирование пациентов перед любым противоопухолевым лечением на наличие SARS CoV-2, сокращение сроков пребывания больных в стационарах и ограничение визитов посетителей и родственников, а также переход к онлайн-консультациям специалистов). Выделение групп абсолютного приоритета в лечении РМЖ и принятые противоэпидемические мероприятия позволили сохранить эффективное лечение пациентам в период пандемии COVID-19. Риск инфицирования новой коронавирусной инфекцией, развития тяжелых осложнений и смерти от COVID-19 высокий у пациентов с онкопатологией прежде всего за счет иммуносупрессии на фоне основного заболевания и активного противоопухолевого лечения. В августе 2020 года был представлен крупный популяционный анализ онкологов из Великобритании (www.thelancet.com/ oncology), в котором убедительно доказано, что риск смерти от новой коронавирусной инфекции в 2 раза выше у больных, получающих химиотерапию, вне зависимости от возраста, пола и локализации опухоли. Однако именно для больных РМЖ в группу абсолютного приоритета (лечение должно быть сохранено даже в условиях пандемии COVID-19) мировые онкологические сообщества относят практически все клинические ситуации, требующие назначения высокоэффективной противоопухолевой терапии. К абсолютному (высокому) приоритету отнесены: адъювантная/неоадъювантная химиотерапия тройного негативного и HER2+ РМЖ, анти-HER2 терапия в адъювантном, неоадъювантном режимах и при лечении метастатического заболевания, эндокринотерапия при гормоночувствительном раке (с овариальной супрессией – у больных в пременопаузе), а также ранние линии химиотерапии при распространенных формах, особенно в ситуации висцерального криза. Лечение больных, которым уже начата неоадъювантная/адъювантная химиотерапия, также относится к высокому приоритету. Кроме того, в группу абсолютного приоритета включены еще и новые постнеоадъювантные режимы при наличии остаточной опухоли: капецитабин – при тройном негативном РМЖ и T-DM1 – при резидуальном HER2+ РМЖ. Следует отметить, что большинство из перечисленных режимов ассоциировано с умеренным или высоким риском развития фебрильной нейтропении (ФН), что в совокупности с инфицированием COVID-19 может стать фатальным для больных, поэтому профилактика развития ФН становится не менее актуальной задачей в сложившейся эпидемиологической ситуации. Развитие нейтропении на фоне химиотерапии является предопределяющим фактором как для инфицирования SARS CoV-2, так и для тяжелого течения заболевания и риска смерти от инфекции. Именно поэтому онкологические сообщества внесли в рекомендации по оптимизации лечения в условиях пандемии активную первичную профилактику ФН гранулоцитарными колониестимулирующими факторами (Г-КСФ). Традиционно Г-КСФ, используемые в течение 24-72 часов после химиотерапии и продолжающиеся до восстановления нейтрофилов к 7-14 дням, демонстрируют значительное снижение риска развития ФН. Профессиональные сообщества до 2020 года рекомендовали первичную профилактику нейтропении с помощью Г-КСФ при режимах химиотерапии с ≥20% риском развития ФН, а также у пациентов с промежуточным риском ФН (10-20%) при наличии отягощающих факторов. Пандемия COVID-19 стала тем самым дополнительным фактором риска для всех больных, получающих цитостатическую терапию. Именно поэтому онкологические сообщества поддержали активное профилактическое назначение Г-КСФ у больных, получающих режимы химиотерапии с промежуточным риском развития нейтропении (10-20%), а у пожилых больных с сопутствующими заболеваниями – и при режимах с низким риском развития фебрильной нейтропении. Однако следует ограничить применение Г-КСФ для уже инфицированных COVID-19 больных и при развитии острого респираторного дистресс-синдрома ввиду увеличения выработки воспалительных цитокинов. Профилактическое назначение Г-КСФ позволяет не только снизить риск развития ФН, но и сохранить дозоинтенсивность цитостатических агентов и необходимый интервал между курсами химиотерапии, что отражается на эффективности лечения и, как результат, на показателях выживаемости. Поэтому первичную профилактику ФН с помощью Г-КСФ онкологические сообщества отнесли к высокому приоритету в условиях пандемии. Так, NCCN считает одной из первостепенных задач профилактическое назначение Г-КСФ у больных, получающих химиотерапию с <20% вероятностью развития ФН безотносительно наличия сопутствующих факторов, для снижения риска развития нейтропении, риска инфицирования и тяжелого течения COVID-19. Рекомендации ESMO также активно поддерживают профилактическое назначение Г-КСФ у больных, получающих химиотерапию, для минимизации нейтропении, а также ограничивают применение дексаметазона как иммуносупрессивного препарата. Эксперты RUSSCO подчеркивают, что онкологические пациенты, получающие химиотерапию, попадают в группу риска по тяжелому течению COVID-19, поэтому поддерживают расширение показаний для профилактического назначения Г-КСФ для пациентов с риском ФН более 10%, а также рассмотрение вопроса о назначении профилактической антибиотикотерапии. При назначении Г-КСФ предпочтение следует отдавать пегилированному филграстиму (пролонгированной форме филграстима), который вводится однократно после проведенного курса миелотоксичной терапии. Рекомендации ведущих онкологических сообществ основаны на данных крупных исследований, которые подтверждают эффективность применения Г-КСФ для первичной профилактики ФН, что имеет важное стратегическое значение в период пандемии COVID-19. Относительный риск развития фебрильной нейтропении при применении Г-КСФ снижается на 49% (на 43% – при филграстиме, на 70% – при пегилированном филграстиме), что с одной стороны достоверно снижает вероятность развития тяжелых осложнений и смерти больных с онкопатологией, а с другой стороны – помогает сохранить коечный резерв отделений интенсивной терапии ввиду уменьшения числа больных с инфекционными осложнениями после проведения химиотерапии в такой сложной эпидемиологической ситуации. По данным метаанализа 5 исследований (K. Cooper и соавторы), пэгфилграстим эффективнее филграстима на 34% по показателю снижения частоты развития фебрильной нейтропении. Пролонгированные формы филграстима имеют увеличенную молекулярную массу и большую длину молекулы, что способствует образованию «водного облака» вокруг модифицированной молекулы, предотвращая от фагоцитоза и обеспечивая более длительный период полувыведения. Пегилирование филграстима приводит к улучшению фармакокинетических свойств и увеличению периода полувыведения до 78 часов, что позволяет вводить препарат однократно после каждого курса химиотерапии. Согласно рекомендациям, введение филграстима следует проводить подкожно в дозе 5 мкг/кг/сутки ежедневно через 24-72 часа после окончания введения химиотерапии; пэгфилграстима – 6 мг (без учета веса) однократно подкожно не ранее, чем через 24 часа после курса ХТ; эмпэгфилграстима (Экстимия®) – 7,5 мг однократно подкожно не ранее, чем через 24 часа после курса химиотерапии. Кроме того, выведение пролонгированных форм филграстима (эмпэгфилграстима) регулируется по механизму обратной связи (рецептор-опосредованного протеолиза), что снижает риск гиперстимуляции миелопоэза иобразование чрезмерного числа лейкоцитов. Применение пролонгированных форм препаратов в период пандемии COVID-19 весьма оправдано, позволяет сократить длительность пребывания пациентов в стационаре, минимизировать посещение лечебных учреждений и контактов пациента с другими (потенциально инфицированными SARS-CoV-2 лицами), сокращает риск развития ФН, помогает сохранить дозоинтенсивность лечения и снижает риск смерти от инфекционных осложнений в такой сложной эпидемиологической ситуации.
Литература:
- Временные методические рекомендации Минздрава РФ. Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19). Версия 8.1 (1.10.2020).
- World Health Organization (WHO). Clinical Management of Severe Acute Respiratory Infection When Novel Coronavirus (nCoV) Infection Is Suspected. Interim Guidance. Geneva: WHO; 2020. Available at https://www.who.int/publications-detail/clinicalmanagement-of-severeacuterespiratory-infection-when-novelcoronavirus-(ncov)-infectionissuspected. Accessed: April 4, 2020.
- rosoncoweb.ru/news/COVID-19/2020/04/07-2/module.pdf.
- Практические рекомендации Российского общества клинической онкологии по оказанию онкологической помощи в условиях пандемии COVID-19.
- Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19) у онкологических больных. Серия изданий «Беседы о Болезни» под редакцией академика РАН Каприна А.Д. Москва, 2020 г.
- Recommendations for Prioritization, Treatment and Triage of Breast Cancer Patients During the COVID-19 Pandemic. The COVID-19 Pandemic Breast Cancer Consortium.
- ESMO management and treatment adapted recommendation in the COVID-19 era: Breast Cancer.
- sabcs.onlineeventpro.freeman.com/live-stream/19760169/SS2-Special-Session-BreastCancer-Care-During-COVID-19-How-Did-Patients-and-CliniciansRespond---A-Global-Perspective.
- NCCN Hematopoietic Growth Factors Short – Term Recommendations Specific to Issues with COVID-19 (SARS-CoV-2), 2020.
- Green MD, Koelbl H, Baselga J, Galid A, Guillem V, Gascon P, Siena S, Lalisang RI, Samonigg H, Clemens MR, Zani V, Liang BC, Renwick J, Piccart MJ; International Pegfilgrastim 749 Study Group. A randomized doubleblind multicenter phase III study of fixed-dose single-administration pegfilgrastim versus daily filgrastim in patients receiving myelosuppressive chemotherapy Ann Oncol. 2003 Jan; 14(1): 29-35.
- Hurvitz et al, Neoadjuvant trastuzumab, pertuzumab, and chemotherapy versus trastuzumab emtansine plus pertuzumab in patients with HER2-positive breast cancer (KRISTINE): a randomised, openlabel, multicentre, phase 3 trial. 2018. 10.1016/S1470-2045(17)30716-2.
- Kuderer NM, et al. Cancer. 2006; 106: 2258-2266.
- Denduluri N, Lyman GH, Wang Y, et all. Chemotherapy Dose Intensity and Overall Survival Among Patients With Advanced Breast or Ovarian Cancer, Clinical Breast Cancer. 2018. doi: 10.1016/j.clbc.2018.02.003
- Leonard R, et al. A randomised trial of secondary prophylaxis using granulocyte colony-stimulating factor («SPROG» trial) for maintaining dose intensity of standard adjuvant chemotherapy for breast cancer by the Anglo-Celtic Cooperative Group and NCRN. Annals of Oncology. 2015, 00: 1-5. doi:10.1093/annonc/mdv389.
- Bondarenko I, Gladkov OA, Elsaesser R, Buchner A, Bias P. Efficacy and safety of lipegfilgrastim versus pegfilgrastim: a randomized, multicenter, active-control phase 3 trial in patients with breast cancer receiving doxorubicin/docetaxel chemotherapy. BMC Cancer. 2013 Aug 14; 13: 386. doi: 10.1186/1471-2407-13- 386.
- Lyman GH, et al., Annals of Oncology. 2013, 00: 1-10. doi:10.1093/ annonc/mdt226.
- Под ред. академика РАН М.И. Давыдова., И.Б. Кононенко, А.В. Снеговой и др. Протоколы клинических рекомендаций поддерживающей терапии в онкологии. 3-е изд., перераб. и доп. М.: АБВ-пресс, 2019. 240 с.
- Сакаева Д.Д., Орлова Р.В., Шабаева М.М. Практические рекомендации по лечению инфекционных осложнений фебрильной нейтропении и назначению колониестимулирующих факторов у онкологических больных. Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2018 (том 8). С.521-530.
- Криворотько П.В., Бурдаева О.Н., Ничаева М.Н. и др. Эффективность и безопасность препарата Экстимия® (эмпэгфилграстим) у пациентов с диагнозом «рак молочной железы», получающих миелосупрессивную химиотерапию: результаты двойного слепого сравнительного клинического исследования III фазы. Современная онкология. 2015; 17 (2): 45-52.
- Schippinger W, et al. Frequency of Febrile Neutropenia in Breast Cancer Patients Receiving Epirubicin and Docetaxel/Paclitaxel with Colony-Stimulating Growth Factors: A Comparison of Filgrastim or Lenograstim with Pegfilgrastim. Oncology. 2006; 70: 290-293. DOI: 10.1159/000094890.
- Cooper K, et all. Granulocyte colony-stimulating factors for febrile neutropenia prophylaxis following chemotherapy: systematic review and meta-analysis. BMC Cancer. 2011 Sep 23; 11: 404. doi: 10.1186/1471-2407-11-404.
- Cornes Paul, et al. Advances in therapy. 2018, 35.11: 1816-1829.
Статья предоставлена компанией Биокад. Публикуется в редакции авторов.
Год начался с одобрения FDA трастузумаба дерукстекана у больных метастатическим раком желудка
15 января Управление по надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило фам-трастузумаб дерукстекан-nxki (Enhertu) в качестве терапии пациентов с местнораспространенной или метастатической HER2-положительной аденокарциномой желудка или гастроэзофагеального перехода, которые ранее получали схему с включением трастузумаба.
Исследование DESTINY-Gastric01
Эффективность оценивалась в многоцентровом открытом рандомизированном исследовании DESTINYGastric01 у пациентов с HER2-положительной местнораспространенной или метастатической аденокарциномой желудка или пищеводно-желудочного перехода, у которых отмечалось прогрессирование болезни как минимум на двух предыдущих схемах, включая трастузумаб, фторпиримидины с платиносодержащей химиотерапией. В общей сложности 188 пациентов были случайным образом распределены в соотношении 2:1 в группу трастузумаба дерукстекана в дозе 6,4 мг/кг внутривенно каждые 3 недели или в группу монотерапии иринотеканом или паклитакселом по выбору врача. Основными критериями эффективности были общая выживаемость и частота объективных ответов, оцененные независимым центральным комитетом. Дополнительными показателями эффективности были выживаемость без прогрессирования и продолжительность ответа. Общая выживаемость составила 12,5 месяца (95% доверительный интервал [ДИ] = 9,6-14,3) в группе трастузумаба дерукстекана по сравнению с 8,4 месяца (95% ДИ 6,9-10,7) в группе иринотекана или паклитаксела (отношение рисков [HR] = 0,59; P=0,0097). Частота подтвержденных объективных ответов составила 40,5% в группе трастузумаба друкстекана по сравнению с 11,3% у пациентов, получавших иринотекан или паклитаксел. Медиана выживаемости без прогрессирования была 5,6 месяца в группе трастузумаба дерукстекана по сравнению с 3,5 месяца в группе иринотекана или паклитаксела. Медиана продолжительности ответа составила 11,3 месяца и 3,9 месяца в этих группах соответственно. Наиболее частыми (≥20%) нежелательными явлениями были анемия, лейкопения, нейтропения, лимфоцитопения, тромбоцитопения, тошнота, снижение аппетита, повышение уровня аспартатаминотрансферазы, утомляемость, повышение щелочной фосфатазы в крови, повышение уровня аланинаминотрансферазы, диарея, запоры, повышение билирубина в крови, гипертермия и алопеция. Рекомендуемая доза трастузумаба дерукстекана при раке желудка составляет 6,4 мг/кг, вводимая в виде внутривенной инфузии один раз каждые 3 недели (21-дневный цикл) до прогрессирования заболевания или неприемлемой токсичности.
Источник: веб-сайт FDA.


Тройной негативный рак молочной железы: от генетики до лечения
Введение
Тройной негативный рак молочной железы (ТНРМЖ) относится к подгруппе рака молочной железы (РМЖ), характеризующейся отсутствием эстрогеновых рецепторов (ЭР), прогестероновых рецепторов (ПР) и рецепторов эпидермального фактора роста человека 2 типа (HER2). На долю ТНРМЖ приходится 15-20% всех случаев РМЖ; ТНРМЖ чаще встречается у молодых женщин, пациенток африканского и латиноамериканского происхождения и носительниц герминальных мутаций [1]. Опорные исследования определения молекулярного профиля опухолей с применением микрочипов ДНК позволили выделить пять внутренних подтипов РМЖ [2]. Хотя на основании результатов иммуногистохимических (ИГХ) исследований подгруппа ТНРМЖ считается единым целым, молекулярное профилирование выявило неожиданно высокий уровень неоднородности. 50-75% ТНРМЖ имеют базальный фенотип (БРМЖ), характеризующийся экспрессией генов нормальных базальных и миоэпителиальных клеток [2, 3]. Аналогичным образом, около 80% БРМЖ являются ЭР-негативными и HER2-негативными [4]. Хотя термины ТНРМЖ и БПМЖ часто используются взаимозаменяемо, не все БРМЖ, определенные с помощью профилирования экспрессии генов (ПЭГ), лишены ЭР, РО и HER2, и, наоборот, не все ТНРМЖ демонстрируют базальноподобный фенотип [5-8]. Кроме того, был идентифицирован еще один подтип, а именно с низкой экспрессией клаудина, характеризующийся активной инфильтрацией стромы и экспрессией генов, ответственных за эпителиально-мезенхимальный переход, (ЭМП) и генов иммунного ответа [9], хотя исследование, которое предоставило данную информацию, включало ограниченное количество образцов ТНРМЖ. Недавно среди опухолей с низкой экспрессией клаудина были выделены дополнительные гистологические варианты с метаплазией, характеризующиеся более низкими уровнями геномной нестабильности, мутационной нагрузки и драйверных (т.е., способствующих развитию злокачественного фенотипа) аберраций, способных стать терапевтическими мишенями. Хотя последнее исследование выявило, что подтип с низкой экспрессией клаудина связан с неблагоприятным прогнозом [10], неоднородность этих исследований требует дополнительных доказательств с тем, чтобы полностью выяснить, может ли сам по себе подтип с низкой экспрессией клаудина иметь прогностическое значение. Дальнейшие данные продемонстрировали, что ТНРМЖ не является единым заболеванием, а охватывает множество подтипов с выраженной гистопатологической, транскриптомной и геномной неоднородностью. Тем не менее, при ТНРМЖ назначалось однотипное лечение, включавшее химиотерапию. Использование разнообразия ТНРМЖ может помочь выявить новые пути, способные стать терапевтическими мишенями. Несмотря на определенные усилия, эти молекулярные классификации остались чисто теоретическими и не используются в клинической практике. Интересно отметить, что среди подтипов ТНРМЖ были идентифицированы генетические изменения, являющиеся потенциальными мишенями для прицельного воздействия. В данной статье обобщаются основные доказательства, которые определяют транскриптомную и геномную неоднородность ТНРМЖ. Кроме того, выделяются текущие и новые методы лечения подтипов ТНРМЖ, основанные на определении биомаркеров, и описываются наиболее распространенные механизмы резистентности к одобренным средствам терапии ТНРМЖ. Наконец, обсуждаются проблемы и возможные будущие направления в разработке лекарственных средств на основе использования биомаркеров при ТНРМЖ, что может привести к созданию практической классификации этого подтипа РМЖ.
Неоднородность опухолей ТНРМЖ: сложный вопрос без ответа
Существует несколько гистологических вариантов ТНРМЖ, включая низкодифференцированный рак, рак с наличием элементов метаплазии, медуллярных признаков и лимфоцитарной инфильтрации стромы [11-16]. Несмотря на это, спектр ТНРМЖ также включает новообразования низкой степени злокачественности. Несмотря на свою редкость, эти варианты низкой степени злокачественности варьируют от опухолей с отсутствием или неопределенностью метастатического потенциала до инвазивных карцином. Несколько исследований продемонстрировали, что можно выделить как минимум две подгруппы ТНРМЖ низкой степени злокачественности, включая семейство ТНРМЖ низкой степени злокачественности (микрогландулярный аденоз, атипичный микрогландулярный аденоз и ациноклеточный рак) и опухоли молочной железы, сходные по морфологическим признакам с опухолями слюнных желез [17]. Интересно, что последние характеризуются морфологическими особенностями, сходными с опухолями слюнных желез, и часто их развитие запускается специфическими генетическими изменениями, такими как аденокистозная и секреторная карциномы, в основе которых лежит образование химерных гибридов MYB-NFIB и ETV6- NTRK3 соответственно [18, 19]. Помимо гистопатологических различий, ТНРМЖ демонстрирует большую неоднородность также на транскриптомном уровне. В эпохальном исследовании Lehmann и соавт. [20] было идентифицировано семь кластеров ТНРМЖ, а именно базальноподобный 1 (BL1), базальноподобный 2 (BL2), иммуномодуляторный (IM), мезенхимальный (M), мезенхимальноподобный (MSL), люминальный/андрогенрецепторный (LAR) и неклассифицируемый (UNS). Среди базальных подтипов BL1 характеризуется высокой экспрессией регуляторов клеточного цикла и белков путей, активируемых в ответ на повреждение ДНК, тогда как BL2 демонстрирует высокие уровни фактора роста и компонентов метаболических путей, а также повышенную экспрессию миоэпителиального маркера. Подтип IM характеризуется процессами иммунных клеток и каскадами иммунных сигналов. Хотя подтипы M и MSL весьма сходны на транскриптомном уровне и характеризуются дополнительным присутствием генов, связанных с подвижностью клеток и ЭМП, подтипы MSL демонстрируют более низкую экспрессию генов, связанных с пролиферацией клеток, и наличием дополнительных генов, связанными с мезенхимальными стволовыми клетками. Наконец, при подтипе LAR наблюдается экспрессия генов, характерная для люминального РМЖ, несмотря на ЭР-негативность. Хотя Lehmann и соавт. [20] представили доказательства осуществимости концепции персонализированной терапии ТНРМЖ, дальнейшие исследования не продемонстрировали прогностическую ценность этих подтипов [21]. В последующих исследованиях [21-25] были уточнены молекулярные кластеры ТНРМЖ для четырех специфических подтипов опухолей, для каждого из которых характерны различные ПЭГ, ответ на стандартное лечение и прогноз. Эти достижения стали возможны в основном благодаря применению «мультиомной» стратегии профилирования и изучения геномики, транскриптомики, протеомики, метаболомики и межклеточных взаимодействий на уровне отдельных клеток (single-cell analysis), которые позволяют предотвратить контаминацию образцов лимфоцитами, инфильтрирующими опухоль (ЛИО), и другими компонентами микроокружения опухоли [26, 27]. Наряду с транскрипционной неоднородностью ТНРМЖ также характеризуется сложными геномами, обусловленными высокой генетической нестабильностью и сложными моделями вариаций числа копий и хромосомных перестроек [28-32]. При ТНРМЖ определяют небольшое количество генов, подверженных повторным мутациям (highly recurrently mutated genes) с частыми соматическими мутациями геновсупрессоров опухолей; примерами таких генов являются TP53 и гомолог фосфатазы и тензина (PTEN). Напротив, драйверные изменения в генах пути фосфоинозитид-3-киназы (PI3K) / AKT, включая мутации PIK3CA, были описаны примерно в 10% случаев [28]. Кроме того, геномный анализ образцов остаточной опухоли ТНРМЖ после неоадъювантной химиотерапии выявил по крайней мере одно генетическое изменение с потенциальной возможностью прицельного воздействия [33]. Недавно Bareche и соавт. [34] описали геномные изменения, характерные для каждого молекулярного подтипа ТНРМЖ. Опухоли BL1 имеют высокий уровень хромосомной нестабильности, высокую частоту мутаций TP53 (92%), увеличение числа копий и амплификации PI3KCA и AKT2, а также делеции в генах, участвующих в механизмах репарации ДНК. Напротив, подтип LAR характеризуется более высокой мутационной нагрузкой и высокой частотой мутаций генов PI3KCA, AKT1 и CDH1. Мезенхимальный и MSL подтипы связаны с более высоким показателем сигнатур экспрессии для генов ангиогенеза. Как и ожидалось, группа IM продемонстрировала высокие уровни экспрессии сигнатур, связанных с иммунным ответом, и генов-ингибиторов контрольных точек, включая гликопротеин цитотоксических T-лимфоцитов 4 (CTLA4), белок запрограммированной гибели клеток-1 (PD-1) и лиганд PD-1 (PD-L1). Такое повышение экспрессии сигнатур иммунного ответа, характерное для IM опухолей, может быть связано с контаминацией иммунным инфильтратом [22]. Следует отметить, что подтип LAR был связан с наихудшим прогнозом, тогда как подтип IM характеризовался лучшим прогнозом [34]. Кроме того, важно подчеркнуть, что, когда Bareche с соавт. попытались воспроизвести классификацию ТНРМЖ по Lehmann, более стабильными подтипами оказались BL1, IM, LAR, M и MSL. С другой стороны, подтипы BL2 и UNS воспроизвести не удавалось, как уже отмечалось в предыдущих исследованиях [21, 35]. Учитывая большую геномную сложность и неоднородность [28-31], анализ единичного генетического изменения может не дать информации о мутационных процессах, инициирующих развитие ТНРМЖ. Соответственно, применение математических моделей и вычислительных платформ позволило расшифровать и идентифицировать мутационные сигнатуры [36-38]. Путем анализа особенностей однонуклеотидных вариантов опорные исследования привели к идентификации двух мутационных сигнатур, которые соответствовали активности семейства дезаминаз APOBEC (аполипопротеин B мРНК-редактирующий фермент, каталитический полипептид 3). Активность ферментов APOBEC играет центральную роль в онкогенезе, приводя к субклональной экспансии и внутриопухолевой неоднородности некоторых опухолей [39]. При РМЖ роль APOBEC-ассоциированного мутагенеза широко изучалась при ЭР-положительном заболевании [40], тогда как информация о ТНРМЖ ограничена. Следовательно, необходимы дополнительные исследования для полного выяснения прогностического и терапевтического значения мутационных сигнатур при ТНРМЖ. Наконец, гистопатологическая и геномная характеристика биопсийных образцов опухоли может иметь несколько недостатков, включая ограниченную репрезентативность всего репертуара опухолевых мутаций и его неоднородность, технические проблемы обработки тканей и выявления мутаций, а также низкую осуществимость в некоторых клинических ситуациях [41]. В связи с этим была внедрена методика, получившая название «жидкой биопсии», для идентификации и количественного определения фракций опухоли, высвобождаемых в периферическую кровь, включая количественную оценку циркулирующих опухолевых клеток (ЦОК), экзосом и циркулирующей опухолевой ДНК (цоДНК) [42]. Различные исследования продемонстрировали, что жидкая биопсия, основанная на определении ЦОК и цоДНК, позволяет в режиме реального времени отслеживать развитие заболевания и выявлять пациентов с высоким риском его рецидива и неблагоприятным прогнозом [43- 45]. При ТНРМЖ полногеномное профилирование на основе цоДНК продемонстрировало свою информативность для характеристики опухолеспецифических изменений, а также для определения прогноза у пациента [46-48]. Принимая во внимание, что эти наблюдения основаны главным образом на ретроспективном и дополнительных анализах, необходимы дальнейшие проспективные исследования по оценке новых методов лечения с сопоставлением с результатами оценки изменений генома методом жидкой биопсии.
Терапия, основанная на определении биомаркеров при ТНРМЖ
В истории изучения ТНРМЖ было предпринято несколько попыток идентифицировать биомаркеры, способные оптимизировать отбор пациентов и спрогнозировать ответ на стандартные и инновационные методы лечения. Открытие и внедрение в клиническую практику новых лекарственных средств, применяемых на основе оценки биомаркеров, имеет важное значение для расшифровки множества механизмов резистентности опухоли, приводящих к ухудшению прогноза у пациентов с ТНРМЖ.
Воздействие на гормональные рецепторы при ТНРМЖ: андрогенный путь
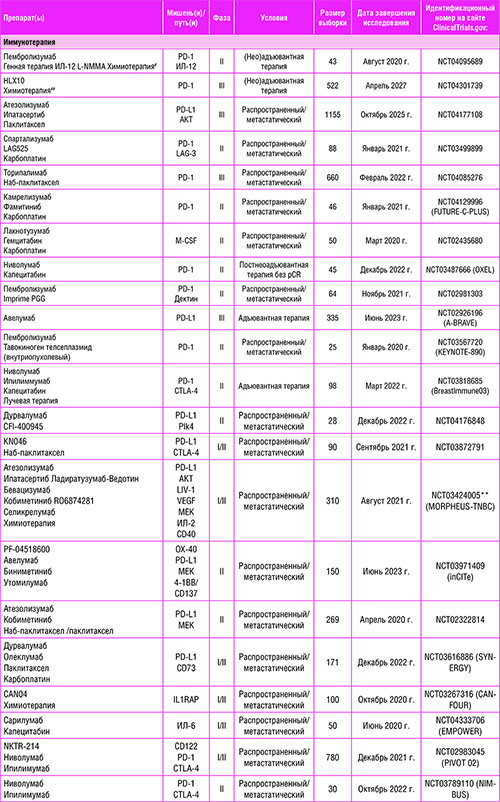
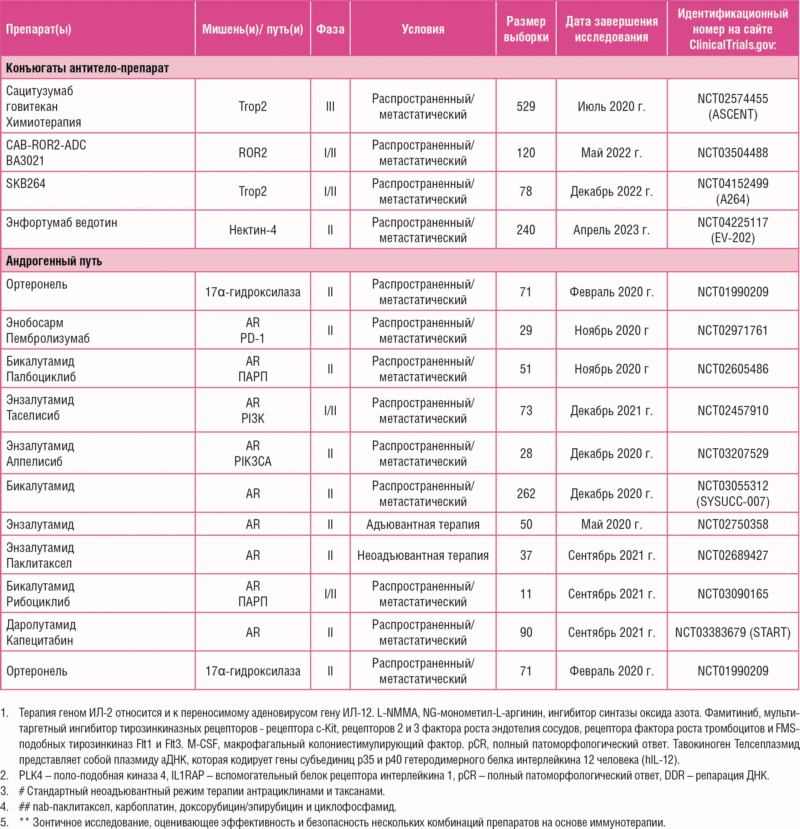
Опорные исследования ТНРМЖ привели к идентификации подтипа LAR [20-22]. Опухоли, позитивные по андрогенным рецепторам (АР), составляющие 10-15% всех случаев ТНРМЖ, характеризуются низким уровнем пролиферативной активности и люминальноподобным профилем экспрессии генов, и по своей природе резистентны к химиотерапии [20-23, 34, 49]. В то же время, экспрессия АР по данным ИГХ не предполагает худшего прогноза [50]. АР – это активируемый лигандом фактор транскрипции, который оказывает геномное и негеномное воздействие на клетки, вовлекая различные внутриклеточные сигнальные пути, активируя пролиферацию и инвазивный рост опухоли [51, 52]. АР был определен как перспективная мишень для лечения ТНРМЖ, что стало причиной клинического применения антиандрогенных препаратов. Как правило, влияние на андрогенные рецепторы можно быть достигнуто с помощью прямых блокаторов АР. Нестероидный ингибитор АР бикалутамид был изучен в исследовании II фазы [53], в котором участвовали пациенты, ранее получавшие лечение по поводу метастатического АР-позитивного ТНРМЖ, с использованием минимального порога экспрессии по данным ИГХ, равного 10%. Исследование не продемонстрировало какого-либо благоприятного эффекта препарата, соответствующего частоте клинической пользы (ЧКП), равной 18%, и медиане выживаемости без прогрессирования заболевания (мВБП), равной 12 неделям. Основываясь на возможности преодолеть приобретенную резистентность к антиандрогенным препаратам, возникшую в цитоплазматических и ядерных путях передачи сигнала АР, нестероидный антиандрогенный препарат энзалутамид был изучен в исследовании II фазы у пациентов, ранее получавших лечение по поводу ТНРМЖ, с долей окрашенных ядерных АР >0% [54]. ЧКП и мВБП в общей популяции составили 25% и 2,9 месяца соответственно. Интересно, что опухоли ТНРМЖ с уровнем экспрессии АР более 10%, в которых дополнительно определяют генную сигнатуру, связанную с активацией сигнального пути АР, оказались более чувствительными к энзалутамиду (мВБП = 32 по сравнению с 9 неделями) [55]. Клинический опыт применения стероидного ингибитора андрогенеза абиратерона оказался сходным с таковым для энзалутамида при АР 10% и более, что привело к значению мВБП 2,8 месяца и ЧКП 20% [56]. При совокупном рассмотрении эти данные свидетельствуют о достаточно узкой категории пациентов ТНРМЖ, у которых можно ожидать пользу применения блокаторов. Хотя андрогенная блокада продемонстрировала свою потенциальную значимость при АР-положительном ТНРМЖ, предиктивная роль одной только экспрессии АР нуждается в более подробной характеристике. Соответственно, более глубокое подавление андрогенного пути или деградация АР может повысить противоопухолевую активность, и эта возможность изучается в текущих клинических исследованиях (таблица 1). Более того, совместное целенаправленное воздействие на возможные механизмы ускользания по альтернативным путям, связанным с резистентностью к антиандрогенной терапии, может представлять собойперспективную стратегию лечения, что подтверждено применением ингибиторов циклинзависимой киназы (CDK) 4/6 и блокаторов PI3K при ЭР-позитивном РМЖ [57, 58]. Принимая во внимание, что подтип LAR продемонстрировал высокую чувствительность к ингибированию CDK 4/6 в доклинических моделях [59], а также более высокую мутационную нагрузку и повышенную частоту мутаций сигнальных белков пути PI3K [34, 60, 61], в настоящее время продолжаются клинические исследования применения селективных ингибиторов CDK 4/6 и PI3K в комбинации с новыми антиандрогенными средствами (таблица 1).
Таблица 1. Некоторые продолжающиеся клинические исследования фазы II или III при ТНРМЖ.
Уточнение выбора биомаркера для прицельного воздействия на путь PI3K-AKT-mTOR
При злокачественных опухолях часто отмечается нарушение регуляции пути PI3K-AKT-mTOR (PAM), способствующее пролиферации клеток и онкогенезу. Активация пути PAM может возникать вследствие онкогенной активации рецепторов факторов роста и прямой онкогенной активации белков PAM или их регуляторов, включая PTEN и инозитолполифосфат-4-фосфатазу (INPP4B) [62]. PIK3CA – один из наиболее часто мутирующих генов при ТНРМЖ (примерно в 10% случаев), его мутации с высокой частотой встречаются в базальноподобных и LAR подтипах [24, 25, 28-34, 36, 63]. Примечательно, что при метастатическом ТНРМЖ с наличием мутаций PIK3CA, повидимому, отмечается лучшая общая выживаемость (ОВ), чем при опухолях с диким типом данного гена. Однако такое наблюдение можно отчасти объяснить увеличением количества мутаций PIK3CA при люминальном РМЖ, который утрачивает экспрессию ЭР при метастазировании [63]. Кроме того, мутации с потерей функции PTEN и INPP4B были описаны примерно в трети случаев ТНРМЖ, в частности, при БРМЖ, при котором гетерозиготная потеря функции PTEN была выявлена в >45% случаев [28]. Несмотря на ключевую роль в онкогенезе, внедрение в клиническую практику лекарственных средств, нацеленных на молекулы PAM, пока привело к неутешительным результатам. Считается, что регуляция отдельных нижестоящих эффекторов может активировать неконтролируемые петли обратной связи, связанные с резистентностью. С другой стороны, комбинация нескольких препаратов, направленных против молекул PAM, часто приводила к развитию неприемлемой токсичности (в основном при использовании ингибиторов mTOR и pan-PI3K) [64, 65]. Таким образом, были высказаны аргументы в пользу отбора на основе биомаркеров и применения более селективных ингибиторов. В исследовании I/II фазы с участием пациенток с HER2-отрицательным РМЖ [66] применение α-селективного ингибитора PI3K алпелисиба в комбинации с наб-паклитакселом обеспечило наибольший благоприятный эффект в популяции пациентов с опухолями с наличием мутаций PIK3CA (мВБП = 13 месяцев). Сходные результаты были получены в рандомизированном исследовании II фазы LOTUS, в котором применение ингибитора AKT ипатасертиба в комбинации с паклитакселом обеспечило значимый благоприятный эффект у пациентов с изменениями PIK3CA/AKT1/ PTEN [67, 68]. Аналогичным образом рандомизированное исследование II фазы PAKT подтвердило улучшение показателей ВБП и ОВ в популяции пациентов с наличием биомаркеров (PIK3CA/AKT1/PTEN), получавших ингибитор AKT капивасертиб в дополнение к химиотерапии первой линии [69].Ввиду преобладания изменений PAM дальнейшие шаги по определению терапевтической мишени при ТНРМЖ в соответствии с биомаркером приведут к более глубокому пониманию активируемых обходных путей и биологических последствий нарушения регуляции PAM и его фармакологического ингибирования. С этой точки зрения исследуются комбинированные подходы с применением ингибиторов АР, CDK 4/6 и двойных ингибиторов PI3K/mTOR (таблица 1). Кроме того, учитывая метаболическую функцию передачи сигналов через путь PAM в инсулиновом ответе, было высказано предположение о том, что реактивация инсулиновой обратной связи, индуцированная ингибиторами PI3K, может повторно активировать ось передачи сигналов PI3K-mTOR в опухолях, снижая тем самым эффективность лечения [70]. Соответственно, медицинское вмешательство, способное снизить секрецию инсулина, могло бы повысить эффективность ингибиторов PI3K, например, за счет переключения метаболического использования питательных веществ на кетогенный профиль [71]. Несмотря на предварительный характер данных, эти результаты подтверждают возможное синергическое действие средств, влияющих на PAM, и диетических вмешательств, как это было изучено в нескольких клинических исследованиях [72].
Путь митоген-активируемой протеинкиназы
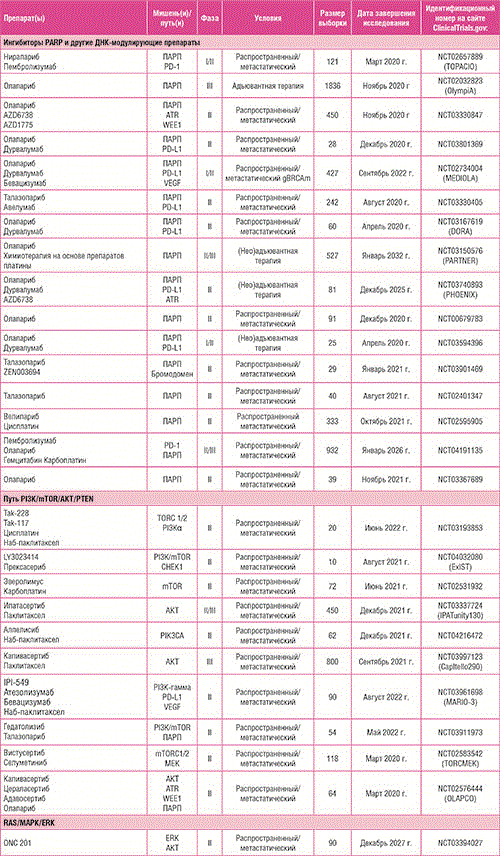
Каскады митоген-активируемой протеинкиназы (MAPK) – это тонко контролируемый путь передачи сигнала, состоящий из фосфосерин/ треониновых киназ, который опосредует клеточный ответ на внешние сигналы [73]. Путь включает последовательное фосфорилирование нескольких молекул (Erk, Mek и Raf) и тонко регулируется белками ГТФазы, включая белки RAS. Изменения генов, кодирующих компоненты пути MAPK, включая KRAS, BRAF и MEK1/2, описаны менее чем в 2% случаев ТНРМЖ [28]. Однако более часто сообщалось о соматических изменениях регуляторных белков, которые вносят вклад в онкогенную дисрегуляцию пути MAPK, таких как негативный регулятор ERK1/2 и JNK1/2 протеинфосфатаза 4 двойной специфичности (DUSP4) [33, 74]. При ТНРМЖ регуляция MAPK продемонстрировала свой потенциал в плане терапевтической мишени, подавляя избыточные пути, сходящиеся в каскаде. Например, было продемонстрировано, что гиперэкспрессия рецептора эпидермального фактора роста (EGFR) активирует передачу сигналов по Ras/MAPK, являясь перспективной терапевтической мишенью [75]. Однако ни моноклональные антитела (мАт), ни ингибиторы тирозинкиназы (ИТК), нацеленные на EGFR, не продемонстрировали значимой активности при ТНРМЖ в исследованиях II/III фазы [76-81]. В качестве причин клинической неэффективности анти-EGFR препаратов при ТНРМЖ могут быть предложены некоторые возможные объяснения [82]. Во-первых, передача сигналов EGFR может изменяться во время прогрессирования заболевания, снизкой экспрессией EGFR в метастатических клетках, несмотря на гиперэкспрессию в первичной опухоли [83]. Во-вторых, значимое взаимодействие между EGFR и другими онкогенными сигнальными путями (пути MET, PI3K/mTOR и MEK) может сделать клетки ТНРМЖ внутренне резистентными к EGFR-специфическому ингибированию. Таким образом, продолжаются дальнейшие исследования новых ИТК [84], а также новых стратегий комбинированного лечения. Кроме того, учитывая центральную роль нарушения регуляции MAPK в онкогенезе РМЖ, изучалась возможность прицельного воздействия на MEK у пациентов с ТНРМЖ с помощью селективного ингибитора кобиметиниба в исследовании II фазы COLET. Добавление кобиметиниба к паклитакселу в качестве лечения первой линии также не привело к значимому улучшению мВБП [85]. Интересно, что поисковый анализ биомаркеров продемонстрировал потенциальный иммуномодулирующий эффект кобиметиниба в увеличении иммунной инфильтрации в микроокружении опухоли [86]. На основании предварительных признаков активности в PD-L1-позитивной популяции была спланирована 2 я часть исследования COLET для изучения комбинации кобиметиниба, набпаклитаксела и атезолизумаба [87]. В недавнем исследовании одновременное ингибирование MEK и семейства белков BET, содержащих бромодомены и экстратерминальный домен, продемонстрировало синергическую активность в доклинических моделях ТНРМЖ, гиперэкспрессирующих онкоген MYCN, ассоциированный с нейроэндокринными опухолями [88], что дает основание для изучения этой комбинации у пациентов с MYCNположительным ТНРМЖ. По аналогии с другими компонентами пути MAPK, соматические мутации BRAF были зарегистрированы менее чем в 1% случаев РМЖ [89]. Хотя конкретных данных о пациентах с ТНРМЖ нет, убедительные доказательства свидетельствуют о потенциальном положительном клиническом эффекте в результате ингибирования BRAF в опухолях с мутациями V600E BRAF [90, 91]. В целом, доказательства подтверждают концепцию о том, что фармакологическое воздействие на MAPK при ТНРМЖ может быть эффективным, когда имеет место нарушение регуляции пути MAPK, обычно при геномных изменениях его регуляторов. Таким образом, в продолжающихся исследованиях изучается возможность целенаправленного воздействия на MAPK с помощью отдельных лекарственных средств у отобранных с помощью биомаркеров пациентов с нарушениями регуляции MAPK, такими как экспрессия DUSP4 [92], а также потенциального иммуностимулирующего эффекта за счет фармакологического ингибирования пути Ras/MAPK [93] (таблица 1).
Таблица 1. Некоторые продолжающиеся клинические исследования фазы II или III при ТНРМЖ.(продолжение)
Настройка механизмов репарации посредством гомологичной рекомбинации и ее регуляторов: парадигма BRCAness
Дефекты в механизмах репарации двухцепочечных разрывов ДНК (дцДНК) характерны для ТНРМЖ; они возникают в результате либо герминальных, либо соматических мутаций в BRCA1/2 и других генах, участвующих в репарации ДНК [94]. Герминальные мутации в BRCA1/2 встречаются примерно у 10% пациенток с ТНРМЖ и увеличивают риск развития РМЖ на протяжении жизни до 60-70% [95-97]. Примечательно, что мутации BRCA1 обычно наблюдаются при базальноподобном фенотипе РМЖ [98]. Ключевой особенностью BRCA1/2-мутантного ТНРМЖ является дефицит репарации посредством гомологичной рекомбинации (РГР), вследствие чего критически важное значение для поддержания целостности генома приобретают другие механизмы репарации ДНК. Подобно BRCA1/2, дефицит гомологичной рекомбинации (ДГР) может возникать в результате утраты нескольких белков, что способствует приобретению BRCA-подобного фенотипа (также определяемого как BRCAness) [99]. Этот термин был введен для определения ситуации, в которой дефект РГР существует в опухоли в отсутствие герминальной мутации BRCA1/2, что обеспечивает чувствительность к ингибиторам поли АДФ-рибозополимеразы (PARP) на основе принципа синтетической летальности [99- 101]. Компьютерное моделирование данных секвенирования позволило выявить дополнительные опухоли с соматической потерей или функциональным дефицитом BRCA1/2, в которых не было обнаружено мутаций, потенциально увеличивая популяцию пациентов с РМЖ, поддающуюся воздействию ингибиторов PARP [102]. На основании результатов клинических исследований применения олапариба, талазопариба и велипариба при метастатическом РМЖ, в настоящее время герминальные патогенетические мутации BRCA1/2 являются единственными клинически подтвержденными биомаркерами чувствительности к ингибиторам PARP (таблица 2) [103-106].
Таблица 2. Основные результаты исследований II/III фазы по оценке применения ингибиторов PARP при раке молочной железы
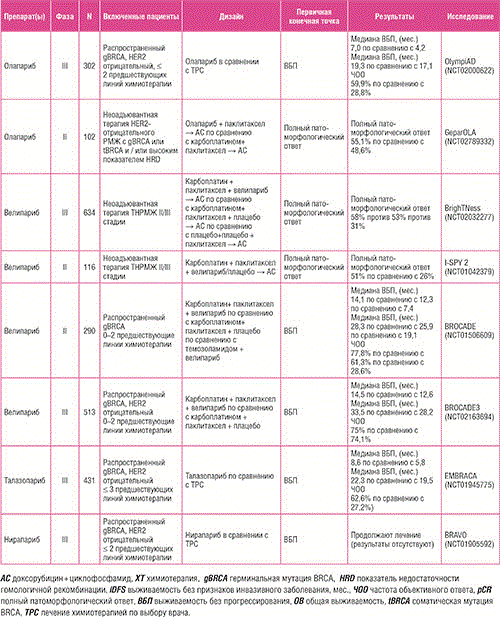
Кроме того, у пациентов с опухолями, несущими патогенные мутации BRCA, был продемонстрирован более существенный положительный эффект в результате применения цитотоксических средств, целенаправленно воздействующих на ДНК, как это было продемонстрировано в исследовании III фазы TNT, в котором сравнивали доцетаксел с карбоплатином в качестве первой линии терапии метастатического ТНРМЖ [107]. В предварительно определенном анализе взаимодействия биомаркера и лечения была оценена прогностическая роль герминальных мутаций BRCA и изменений BRCAness, включая соматическое метилирование BRCA1 и мутационную сигнатуру ДГР (согласно анализу Myriad) [107]. С одной стороны, герминальный мутационный статус BRCA позволял спрогнозировать ответ на лечение карбоплатином с удвоенной общей частотой ответов, однако с другой стороны, с помощью других предложенных биомаркеров выявить различия не удавалось. Примечательно, что у пациентов с фенотипами опухолей, отличными от базальноподобных (согласно PAM [50]), наблюдали более значительный положительный эффект в результате применения доцетаксела. По-видимому, благоприятный эффект, отмеченный при использовании соединений платины, применим к другим средствам с целенаправленным действием на ДНК, включая антрациклины, как это было продемонстрировано в исследовании INFORM, в котором сравнивали доксорубицин и цисплатин в рамках неоадъювантной терапии [108]. В этом исследовании монотерапия соединением платины не улучшила частоту достижения полного патоморфологического ответа (пПО) по сравнению с доксорубицином в комбинации с циклофосфамидом. Результаты прямых сравнений различных препаратов свидетельствуют о том, что отбор пациентов, основанный на выявлении ДГР, может в равной степени спрогнозировать благоприятный эффект от применения средств, разрушающих ДНК, независимо от их фармакологического класса. В исследовании II фазы GeparOLA оценивали эффективность неоадъювантной терапии паклитакселом и олапарибом по сравнению с паклитакселом и карбоплатином у пациентов с ДГР: в целом исследование не выявило различий по показателю пПО [109]. Наконец, применение комбинации ингибитора PARP и карбоплатина не привело к синергическому действию в разных клинических ситуациях, не обеспечивая никакого или обеспечивая незначительное дополнительное клиническое преимущество, которое одновременно сопровождалось повышением токсичности [110, 111]. Расширение концепции BRCAness за пределы BRCA означает углубление идентификации и изучение ключевых регуляторных механизмов РГР с целью разработки биомаркеров-предикторов ответа для лекарственных средств, вызывающих разрывы ДНК, и выявления новых фармакологических мишеней. В качестве возможных модуляторов BRCAness, потенциально расширяющих спектр ДНК-таргетирования и чувствительности к ингибиторам PARP, у большей части пациенток с РМЖ, были предложены ATR и последующие эффекторы в пути передачи сигнала (например, CHK1, WEE1, Aurora A, Polo-подобная киназа 1). Эти эффекторы, повидимому, связывают контроль клеточного цикла и ответ на повреждение ДНК – два часто нарушенных механизма, лежащих в основе онкогенеза. Сообщалось о предварительных результатах, полученных для селективного ингибитора киназы Aurora A алисертиба в комбинации с паклитакселом [112] и ингибитора киназы Aurora A ENMD-2076 [113], в исследованиях I фазы. Аналогичным образом, исследование комбинированного лечения при ТНРМЖ с заранее заданным расширением когорты пациентов с наличием мутации BRCA, в котором оценивали эффективность ATRблокатора M6620 в комбинации с цисплатином, продемонстрировало обнадеживающие предварительные результаты [114]. Единственным предполагаемым биомаркером, обнаруженным для модулятора РГР, прицельно воздействующего на CHK1 (GDC-0425), является мутация TP53; данный препарат изучали в качестве средства, усиливающего эффект химиотерапии у пациентов с солидными опухолями, включая ТНРМЖ [115]. На данный момент нет клинического опыта применения нескольких модуляторов РГР, клинические исследования продолжаются. Для оценки потенциальной роли в прогнозировании пользы химиотерапии и ингибиторов PARP ДГР была предложена для клинических исследований с дизайном, предполагающим включение пациентов на основании анализа биомаркера, с применением ингибитора PARP в качестве монотерапии и других модуляторов ответа на повреждение ДНК в виде монотерапии или в комбинации (таблица 1). Кроме того, доклинические доказательства потенциальной роли блокады PI3K в определении фенотипа BRCAness при BRCA1/2-профицитном ТНРМЖ [116] потенциально могут увеличить популяцию пациенток c РМЖ, в которой, вероятно, будет достигнут благоприятный эффект от применения ингибиторов PARP. Тем не менее, исследование I фазы, в котором изучали комбинацию бупарлисиба и олапариба, продемонстрировало скромные результаты с точки зрения эффективности со значимой дополнительной токсичностью [117]. Наконец, данные доклинических исследований продемонстрировали потенциальную иммуномодулирующую активность ингибиторов PARP, включая активацию PD-L1 в опухолевых клетках и активацию путей иммунного ответа, таких как STING [118-120], что привело к планированию клинических исследований комбинации ингибиторов PARP и ингибиторов контрольных точек иммунного ответа [121, 122]. В настоящее время также исследуются другие средства, нацеленные на белки репарации ДНК, в комбинации с иммунотерапией (таблица 1).
На пути к точной иммунотерапии ТНРМЖ
Картина клинической разработки иммунотерапевтических препаратов для применения при ТНРМЖ сложна и широка. Учитывая ключевую роль иммунной системы во влиянии на эффект стандартной химиотерапии и прогноз при ТНРМЖ [123-126], было проведено несколько исследований по изучению ингибиторов контрольных точек, нацеленных на PD-1/PD-L1, продемонстрировавших ограниченную активность при их использовании в качестве монотерапии и многообещающие результаты в комбинации с химиотерапией (таблица 3) [127-134].
Таблица 3. Основные результаты клинических исследований применения ингибиторов контрольных точек в качестве монотерапии или в комбинации с химиотерапией при распространенном/метастатическом тройном негативном раке молочной железы.
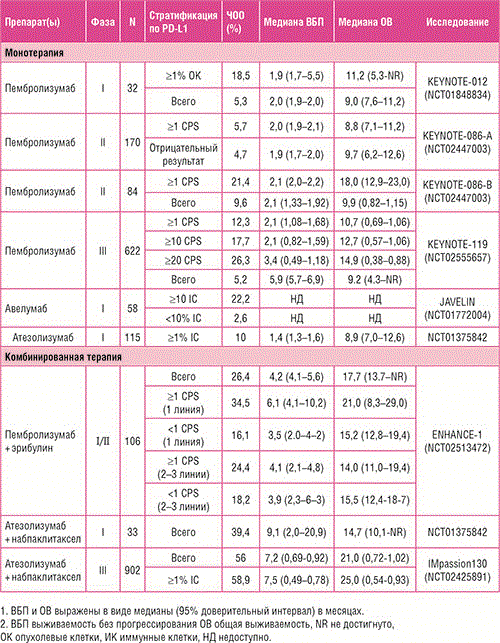
В исследовании III фазы IMpassion130, в котором изучали комбинацию атезолизумаба с наб-паклитакселом в качестве первой линии при метастатическом раке, была установлена потенциальная роль иммунотерапии у пациентов с PD-L1-позитивным ТНРМЖ, определяемым как ≥1% иммунных клеток, инфильтрирующих опухоль, на основании ИГХ анализа SP142 [135, 136]. На сегодняшний день PD-L1 является единственным биомаркером, применяемым в клинической практике для отбора пациентов, которые с большей вероятностью будут отвечать на лечение ингибиторами PD-1/PD-L1. Однако определение «PD-L1-позитивной» популяции в клинической практике остается сложной задачей. Даже хотя анализ биомаркеров в исследовании IMpassion130 продемонстрировал корреляцию между экспрессией PD-L1 на опухолевых и иммунных инфильтрирующих клетках, все же могут возникать вопросы по применению ИГХ анализа и определению оптимального порога «позитивности». При сравнении количественного анализа SP142 с другими коммерчески доступными антителами 22C3 (выраженным как процент положительного окрашивания на PD-L1 жизнеспособных клеток или оценка доли опухоли) и SP263 (окрашивание PD-L1 в иммунных и опухолевых клетках) оба последних метода были способны выявить больше пациентов с PDL1-положительными опухолями [137]. Напротив, в исследовании IMpassion130 у пациентов, определенных как «PD-L1-положительные» по клонам 22C3 и SP263, отмечалась более низкая эффективность по показателям ВБП и ОВ, чем по SP142. Кроме того, несмотря на клиническое применение PD-L1 в качестве клинически полезного биомаркера, были высказаны опасения по поводу широкого применения экспрессии PD-L1 для отбора пациентов. Как динамический биомаркер, PDL1 может по-разному экспрессироваться в первичной опухоли и в метастазах, а ответы на терапию также наблюдаются у PD-L1-негативных пациентов [138]. При раннем ТНРМЖ роль PD-L1 становится особенно спорной. В исследовании III фазы KEYNOTE-522 добавление пембролизумаба к схеме неоадъювантной терапии с использованием антрациклина, таксана и препарата платины повысило частоту достижения пПО (64,8% по сравнению с 51,2%) [139] независимо от экспрессии PD-L1 [140]. В другомисследовании неоадъювантной терапии III фазы (NeoTRIPaPDL1) добавление атезолизумаба к карбоплатину и наб-паклитакселу не привело к улучшению пПО по сравнению со стандартной монохимиотерапией [141]. Следует отметить, что поисковый анализ определил экспрессию PD-L1 как наиболее надежный предиктор ответа на комбинированную иммунохимиотерапию. Эти противоречивые результаты можно частично объяснить разными схемами химиотерапии. Как подчеркивается в исследовании TONIC [142], использование антрациклина или соединения платины в качестве индукционной химиотерапии может создать более благоприятное микроокружения опухоли и повысить частоту достижения пПО при неоадъювантной блокаде PD-1 при ТНРМЖ. В целом, PD-L1 по-прежнему является субоптимальным биомаркером для правильного отбора пациенток с ТНРМЖ для лечения на основе иммунотерапии. Поэтому были предложены и в настоящее время изучаются дополнительные биомаркеры [143]. Мутационная нагрузка опухоли стала биомаркером повышения выживаемости у онкологических больных, получающих ингибиторы контрольных точек [144, 145]. Однако доступны ограниченные данные о значимости мутационной нагрузки при РМЖ, также с учетом низкой доли гипермутированных случаев РМЖ [146]. Недавнее исследование у пациентов с метастатическим ТНРМЖ, получавших ингибиторы контрольных точек, продемонстрировало, что высокая МНО (≥6 мутаций на мегабазу) была значимо связана с более продолжительной ВБП, но не с улучшением ОВ [147]. Доклинические данные свидетельствуют о том, что качество, а не количество неоантигена, является основным фактором, определяющим индукцию эффективного и устойчивого иммунного ответа и форму ответа на иммунотерапию [148], как это было продемонстрировано на моделях меланомы и рака легкого [149]. Соответственно, продолжаются дальнейшие исследования по разработке автоматизированных инструментов для выявления специфических мутационных сигнатур, которые могут быть связаны с противоопухолевым иммунным ответом при РМЖ [150-152]. Как описано выше, гипермутированный фенотип при РМЖ может поддерживаться связанными с APOBEC мутационными процессами примерно в 60% случаев [36-39], тогда как лишь немногие гипермутированные опухоли характеризуются ДГР (1%) или нарушением регуляции ДНК-полимеразыэпсилон (3,4%) [146]. Это проясняет, что только ДГР не может быть предиктором гипермутированного фенотипа или высокой вероятности ответа на ингибиторы контрольных точек. Наконец, анализ с помощью компьютерного моделирования продемонстрировал, что иммунная инфильтрация связана с мутационной нагрузкой в опухолях, развитие которых было инициировано рекуррентными мутациями, но не в опухолях, вызванных вариациями числа копий, таких как РМЖ [153]. В целом, необходимы дальнейшие исследования, чтобы прояснить роль этих биомаркеров в прогнозировании эффективности иммунотерапии при ТНРМЖ. При изучении пространственной архитектуры и расположения ЛИО вначале оценивали их наличие, распределение и плотность, переходя затем к описанию их функциональной характеристики. Тогда как ингибиторы контрольных точек в основном действуют, стимулируя уже существующий противоопухолевый иммунный ответ, в нескольких солидных опухолях плотность ЛИО была связана с активностью иммунотерапии [155]. При РМЖ эти данные были подтверждены у пациентов с метастатическим ТНРМЖ, получавших монотерапию пембролизумабом в исследовании II фазы KEYNOTE-086 [155], в котором уровни ЛИО были независимыми предикторами ответа. Кроме того, наличие и плотность стромальных ЛИО до и во время лечения были значимо связаны с достижением пПО в когорте исследования KEYNOTE-173, в котором оценивался благоприятный эффект от добавления пембролизумаба к неоадъювантной химиотерапии [156]. Сходные результаты были получены в поисковом анализе биомаркеров в исследованиях IMpassion130 [157] и KEYNOTE-119 [158]. Интересно, что последнее исследование продемонстрировало, что высокие значения ЛИО прогнозируют благоприятные клинические исходы у пациентов с метастатическим ТНРМЖ, получавших пембролизумаб, но не химиотерапию, что усиливает предиктивную ценность этого биомаркера. Тем не менее, дополнительные данные свидетельствуют о том, что качественные различия в составе ЛИО, а также генетических сигнатурах, связанных с иммунитетом, могут усовершенствовать прогноз у пациентов с ТНРМЖ и ответ на лечение ингибиторами [154, 159, 160]. До сих пор не сообщалось о функциональных характеристиках иммунного инфильтрата в контролируемых исследованиях по изучению иммунотерапии при ТНРМЖ.
Оптимизация доставки цитотоксических препаратов через поверхностные антигены: модель конъюгатов антителолекарственное средство (АЛСК)
Доставка лекарственных препаратов с помощью конъюгатов антител сублимирует традиционную концепцию мишени в лечении злокачественных новообразований. До сих пор наиболее распространенное использование мАт при РМЖ было направлено на белок с патогенетической ролью в онкогенезе. С появлением АЛСК идентификация мишеней на клеточной поверхности теперь играет важную роль для маркировки раковых клеток, обеспечивая однозначную идентификацию злокачественного новообразования и обеспечивая точную доставку конъюгированной полезной нагрузки, будь то цитотоксические средства или биологические молекулы [161]. Это требует изменения точки зрения: идентификации молекул-мишеней с ограниченной экспрессией на поверхности раковых клеток, независимо от их биологической функции. В клинических условиях для идентификации и количественной оценки возможных мишеней для АЛСК использовали ИГХ оценки как в виде полуколичественной шкалы (например, от 0 до 4+ для LIV-1 и Trop-2), так и в виде процента позитивных клеток (например, по трансмембранному гликопротеину NMB (GPNMB)). Линейка АЛСК для использования при РМЖ постоянно расширяется [161]. Сацитузумаб-говитекан (sacituzumab-govitecan-hziy) представляет собой АЛСК, распознающий рецептор Trop-2 на клетках для доставки цитотоксического препарата, производного камптотецина SN-38 [162]. Trop-2 является преобразователем трансмембранного сигнала кальция и гиперэкспрессируется при многих видах эпителиального рака, включая почти 90% случаев ТНРМЖ [163, 164]. В исследовании I/II фазы IMMU-132-01 были продемонстрированы многообещающие результаты у пациентов, ранее получавших лечение по поводу ТНРПЖ, с продолжительностью ВБП и ОВ 5,5 месяца и 13 месяцев соответственно [165]. На основании этого FDA зарегистрировало сакитузумаб говитекан по ускоренной процедуре для лечения метастатического ТНРМЖ. Кроме того, исследование III фазы ASCENT, в котором сакитузумаб-говитекан изучался в сравнении с терапией на выбор исследователей в качестве третьей или последующей линий, недавно было остановлено ввиду достижения конечных точек исследования [166]. Другой трансмембранный гликопротеин – GPNMB – был предложен в качестве поверхностного антигена для ADC, поскольку он встречается примерно в 30% ТНРМЖ [167]. Глембатумумаб-ведотин представляет собой АЛСК (доставляющий производное ауристатина – монометилауристатин E), направленный на GPNMB. Этот АЛСК не смог улучшить частоту ответов в общей популяции, экспрессирующей мишень в ≥5% и ≥25% клеток, в двух независимых исследованиях (EMERGE и METRIC), свидетельствуя о том, что одной только экспрессии мишени может быть недостаточно для того, чтобы вызвать эффективный и устойчивый ответ [168, 169]. Кроме того, в нескольких клинических исследованиях изучается ладиратузумаб-ведотин, АЛСК против мембранного белка-переносчика цинка LIV-1 (таблица 1). Получены предварительные результаты по применению комбинации ладиратузумаба-ведотина и пембролизумаба у пациентов, ранее получавших интенсивное лечение по поводу ТНРМЖ, с частотой объективных ответов, равной 54% [170]. В последнее время внедрение новых АЛСК, нацеленных на HER2, дало обнадеживающие результаты даже в популяции РМЖ с низкими уровнями экспрессии HER2 и не обнаруживаемыми амплификациями ERBB2, потенциально определяя новую роль HER2 также при ТНРМЖ. Трастузумаб-дерукстекан представляет собой АЛСК, доставляющий ингибитор топоизомеразы I, который был изучен при нескольких типах опухолей с различными уровнями экспрессии HER2 по данным ИГХ. Недавние данные, сообщенные в рамках исследования Ib фазы, продемонстрировали вызывающую интерес активность трастузумаба-дерукстекана в опухолях с низким уровнем экспрессии HER2, хотя ТНРМЖ составлял лишь меньшую часть (13%). В общей популяции исследования сообщалось о частоте ответов, равной 37,0%, и мВБП, равной 11,7 месяца [171], что определяет низкий уровень HER2 в качестве потенциального биомаркера для отбора пациентов в клинических исследованиях анти-HER2 АЛСК.
Механизмы резистентности к стандартным методам лечения ТНРМЖ
Резистентность к химиотерапии
Химиотерапия в настоящее время является основой лечения ТГРМЖ [172]. Как упоминалось выше, молекулярное профилирование позволяет определить подтипы ТНРМЖ, при которых с большей вероятностью будет достигнут благоприятный эффект от неоадъювантной химиотерапии [21, 22]. Однако ТНРМЖ обычно приобретает резистентность во время лечения или может по своей природе не реагировать на химиотерапию за счет многочисленных возможных механизмов химиорезистентности. Один из основных механизмов опосредуется АТФ-связывающим кассетным транспортером, который вызывает АТФ-зависимый выход различных химиопрепаратов из клеток через клеточные мембраны. Интересно отметить, что при ТНРМЖ наблюдается значительно более высокая экспрессия или активация белка множественной лекарственной резистентности-1 (ABCC1/MRP1), белка резистентности рака молочной железы (ABCG2/BCRP) и белка множественной лекарственной резистентности-8 (ABCC11/MRP8) [173-176]. Каждый из них обеспечивает резистентность к разным лекарственным средствам, причем во многом она частично перекрывается. Для преодоления химиорезистентности изучаются несколько стратегий, направленных на подавление активности или экспрессии переносчиков, например, использование сулиндака, PZ-39 и различных ИТК в комбинации с химиотерапией [177-180]. Тем не менее, многие проблемы остаются нерешенными, включая необходимость угнетения многих переносчиков и неприемлемую связанную токсичность. Химиорезистентность, наблюдаемая при ТНРМЖ, также может быть связана с присутствием опухолевых стволовых клеток, субпопуляции опухолевых клеток со способностью к самообновлению после лечения, что впоследствии приводит к повторному росту опухоли [181]. Хотя опухолевые стволовые клетки наблюдаются при всех подтипах РМЖ, их появление, по всей вероятности, присуще ТНРМЖ [182, 183]. Кроме того, было описано накопление химиорезистентных опухолевых стволовых клеток в остаточной опухоли после неоадъювантной химиотерапии [184]. Ассоциированная со стволовыми клетками химиорезистентность может быть связана с несколькими факторами, включая относительно низкую скорость их пролиферации и высокую экспрессию переносчиков [185]. Различные терапевтические стратегии для преодоления химиорезистентности опухолевых стволовых клеток находятся в стадии оценки, включая нацеливание на поверхностные антигены опухолевых стволовых клеток и сигнальные пути, важные для их самообновления [181]. Гипоксия – еще один описанный механизм, способствующий росту опухоли, ее выживаемости и устойчивости к терапии [186]. Гипоксия изменяет микроокружение опухоли и уменьшает захват и/или активность многих цитотоксических средств и обеспечивает резистентность к лучевой терапии. Более того, гипоксия индуцирует фенотип ОСК рака молочной железы и способствует иммуносупрессии [187, 188]. Подтип ТНРМЖ обычно связан с высоким уровнем гипоксии [189]. Использование пролекарств, активируемых гипоксией, действующих как цитотоксины [190], или ингибирование молекулярных мишеней, критически важных для процессов гипоксии, включая ингибиторы факторов, индуцируемых гипоксией [191, 192], представляют собой возможные пути воздействия на гипоксию. Мутации TP53, присутствующие в >50% случаев ТНРМЖ [28-32], также могут определять устойчивость к химиотерапии, особенно к соединениям платины [193]. Как было продемонстрировано на доклинических моделях, потеря функции p53 способствует развитию устойчивости к индуцированным соединениями платины межцепочечным сшивкам ДНК и двухцепочечным разрывам, обусловленным инактивацией контрольной точки G1, с последующей активацией альтернативных путей репарации ДНК, позволяющих опухолевой клетке выжить [194]. Влияние мутации TP53 на ответ на специфические химиотерапевтические препараты при ТНРМЖ изучено не полностью [195, 196] и требует дальнейшего исследования. Кроме того, ТНРМЖ охвачен сложной сетью различных сигнальных путей, включая ядерный фактор каппа, усиливающий образование легкой цепи в активированных В-клетках (NF-kB), PTEN/PI3K/AKT/ mTOR и JAK/STAT, которые способствуют прогрессированию ТНРМЖ и его химиорезистентности [4]. NF-kB часто активируется в ТНРМЖ, тогда как попытки ингибировать этот путь дали лишь скромные результаты из-за высокой токсичности [197, 198]. Путь PAM также часто гиперактивируется при ТНРМЖ, в основном из-за потери PTEN, и связан с неблагоприятным прогнозом и химиорезистентностью [199, 200]. Аналогичным образом, аномальная передача сигналов JAK/ STAT часто наблюдается в клетках ТНРМЖ, и отмечаются перекрестные взаимодействия между STAT3 и повышающей регуляцией переносчиков [28, 33]. Однако ингибитор JAK1/2 руксолитиниб не продемонстрировал убедительной эффективности в качестве монотерапии в исследовании II фазы [201], подтвердив концепцию о том, что ингибирование единственного пути малоэффективно при ТНРМЖ. В настоящее время продолжаются другие клинические исследования специфических ингибиторов пути JAK/STAT. Наконец, пути рецептора EGFR и инсулиноподобного фактора роста-1 (IGF-1R) также вносят вклад в химиорезистентность ТНРМЖ [202-204]. Несмотря на гиперэкспрессию EGFR и IGF-1R примерно в 40% случаев ТНРМЖ [205, 206], к настоящему времени были получены неутешительные результаты клинических исследований, оценивающих прицельное воздействие на эти пути [76-81, 206, 207].
Резистентность к ингибиторам PARP
Как и при использовании других средств таргетной терапии, с течением времени может развиваться приобретенная устойчивость к ингибиторам PARP, обусловленная множеством различных механизмов [208]. Одним из наиболее хорошо описанных является восстановление достаточной РГР, несмотря на ингибирование PARP, как в случае вторичных «обратных» мутаций в BRCA1 или BRCA2 [209-212]. Восстановление функциональности белка BRCA1 или BRCA2 может происходить в результате генетических событий, которые могут восстанавливать открытую рамку считывания, что приводит к появлению функционального белка, или путем генетической реверсии унаследованной мутации, которая может восстанавливать белок немутантного типа. Эти события часто определяют устойчивость к химиотерапии препаратами на основе платины и к ингибиторам PARP [213]. Более того, РГР также может восстанавливаться за счет утраты метилирования промотора BRCA1, что приводит к экспрессии гена BRCA1, аналогичной экспрессии в опухолях с профицитом гомологичной рекомбинации. Вероятно, это связано с положительной селекцией клонов опухолевых клеток с более низким метилированием промотора [208]. Способность защищать застопорившуюся репликационную вилку, несмотря на дефекты гомологичной рекомбинации, может представлять собой еще один механизм резистентности [214]. Отмечена активация пути ATR/ CHK1 с последующим фосфорилированием множества белков, способствующих стабильности репликационной вилки [215]. Защита репликационной вилки также может достигаться вследствие уменьшения привлечения нуклеаз в репликационную вилку при ее остановке, особенно за счет подавления активности различных белков, таких как PTIP и EZH2, ответственных за привлечение нуклеаз. Вследствие этого опухолевые клетки могут достичь резистентности к ингибиторам PARP без восстановления гомологичной рекомбинации [215]. Кроме того, поскольку активность ингибиторов PARP опосредуется через ингибирование ферментов PARP, другим возможным механизмом резистентности является пониженная экспрессия этих белков [216]. Более того, мутации PARP1 и других белков, участвующих в репарации ДНК, могут быть ответственны за первичную и вторичную устойчивость к ингибиторам PARP соответственно [217]. Кроме того, специфические мутации генов BRCA1 и 2, особенно миссенс-мутации, которые разрушают N-концевой домен BRCA1, могут способствовать быстрому развитию устойчивости к ингибиторам PARP. Мутация в C-концевом домене BRCA может приводить к образованию белковых продуктов, неспособных сворачиваться надлежащим образом, вследствие чего они в большей степени подвержены деградации, опосредованной протеазами. Белок теплового шока-90 (HSP90) стабилизирует эти мутантные белки BRCA1, которые, в свою очередь, могут эффективно взаимодействовать с комплексом PALB2-BRCA2-RAD51, обеспечивая резистентность к ингибиторам PARP и цисплатину [218]. В этом случае лечение ингибитором HSP90 потенциально способно восстановить чувствительность опухолевых клеток к ингибированию PARP. Наконец, мутации в генах, кодирующих комплекс субъединиц shieldin [219-220] и утрата REV7[221] могут вызывать развитие устойчивости к ингибиторам PARP в клетках с недостаточностью BRCA1 за счет восстановления РГР. Следует отметить, что некоторые из этих изменений в опухолях с недостаточностью BRCA обеспечивают чувствительность к соединениям платины, свидетельствуя о том, что базовый механизм резистентности может влиять на алгоритм лечения ТНРМЖ. Для определения потенциальных терапевтических стратегий преодоления резистентности опухоли необходимы альтернативные стратегии лечения, способные не допустить или отсрочить появление резистентных клонов, включая применение ингибиторов PARP в комбинации с другими лекарственными средствами или нацеливание на альтернативные молекулы, участвующие в ответе на повреждение ДНК (ATR, ATM, WEE1), а также установление индивидуального механизма резистентности. Поскольку некоторые из этих механизмов могут обеспечивать резистентность также и к другим лекарственным средствам, следует тщательно выбирать методы лечения, проводимые до и после назначения ингибиторов PARP.
Резистентность к иммунотерапии
У нескольких пациентов наблюдалась первичная и приобретенная резистентность опухоли к иммунотерапии. Понимание многофакторных механизмов устойчивости к ингибиторам контрольных точек должно идти параллельно с выявлением надежных биомаркеров, способных прогнозировать вероятность ответа на лечение и его степень [222]. Нарушенное распознавание опухоли иммунной системой может ухудшить не только физиологический, но и стимулируемый терапией иммунный контроль. Действительно, измененное/недостаточное представление антигена или ограниченный спектр опухолевых антигенов может способствовать ослаблению иммунного ответа. Кроме того, ключевым фактором является избыток и активация CD8-положительных Т-клеток. В стадии изучения находятся несколько стратегий, предусматривающих возможность использования комбинации нескольких средств, повреждающих ДНК (химиотерапия, лучевая терапия), или средств, нацеленных на репарацию ДНК (ингибиторы PARP и ATR) [223]. Эти средства могут способствовать высвобождению опухолевых антигенов в микроокружении опухоли, повышая иммуногенность опухоли и ее инфильтрацию Т-клетками. Состав микроокружения опухоли, влияющий на ответ на ингибиторы контрольных точек, хорошо изучен и варьирует в диапазоне от «иммуновоспалительного» до «иммунонегативного» фенотипов [224]. Как упоминалось выше, высокие уровни ЛИО при ТНРМЖ были сопряжены с лучшим прогнозом и многообещающим ответом на иммунотерапию [123-126, 159]. Однако разные субпопуляции Т-клеток могут иметь разное значение [225-227]. Регуляторные Т-клетки (CD4+/CD25high/ FoxP3+) могут способствовать росту опухоли, ингибируя активность цитотоксических CD8- позитивных Т-клеток посредством прямого межклеточного контакта и/или секреции трансформирующего фактора роста-β. Роль В-лимфоцитов все еще не выяснена; активированные В-клетки могут участвовать в противоопухолевом иммунном ответе посредством различных механизмов, включая секрецию антиген-специфических антител, индукцию клеток врожденного иммунитета (например, связанных с опухолью макрофагов M1), высвобождение различных цитокинов (например, ИЛ-6) и активацию каскадов комплемента. Недавно Kim и соавт. [228] разделили ТНРМЖ на два подтипа в соответствии с инфильтрацией опухоли нейтрофилами и макрофагами, каждый со своими собственными путями регуляции: нейтрофил-обогащенный подтип (NES), характеризующийся наличием иммуносупрессивных нейтрофилов и резистентный к иммунотерапии, и подтип, обогащенный макрофагами (MES), содержащий преимущественно CCR2-зависимые макрофаги и демонстрирующий различные ответы на ингибиторы контрольных точек. Авторы предположили, что переход подтипа MES в подтип NES может опосредовать приобретенную устойчивость к блокаде контрольных точек иммунного ответа [228]. Кроме того, решающую роль в формировании «иммунорезистентных ниш» в ограниченных пространствах, труднодоступных для иммунных клеток, играет ангиогенез. Использование антиангиогенной терапии может способствовать нормализации сосудистой сети, улучшить миграцию лимфоцитов через эндотелий и преодолеть резистентность к иммунотерапии [229]. Недавние исследования были сосредоточены на кишечном микробиоме, влияющем на эффективность иммунотерапии [230]. Однако влияние кишечных бактерий на эффективность терапии или резистентность при РМЖ еще не выяснено. Возможные стратегии воздействия на микробиоту кишечника с целью повышения эффективности противоопухолевой терапии все еще изучаются. Наконец, было установлено, что изменения PTEN связаны с уменьшением выживаемости у пациентов с ТНРМЖ, получавших лечение анти-PD-1/L1 антителами [147]. Поскольку ингибирование пути PAM может устранить резистентность, опосредуемую Т-клетками [231], проводится исследование I фазы по изучению применения комбинации ипатасертиба, атезолизумаба и паклитаксела с многообещающей противоопухолевой активностью (частота ответов = 73%) у пациентов с ТНРМЖ, независимо от экспрессии PD-L1 и статуса PIK3CA/ AKT1/PTEN [232].
Выводы и дальнейшие перспективы
ТНРМЖ является неоднородным заболеванием, включающим различные гистологические и молекулярные подтипы с разными исходами. Каждый подтип определяется конкретными транскриптомными и генетическими изменениями, которые могут стать мишенями для терапии. Тем не менее, фактически лишь небольшая часть пациентов с ТНРМЖ получает терапию по результатам оценки биомаркеров, например, лечение ингибиторами PARP или соединениями платины при носительстве герминальных мутаций BRCA1/2 или лечение ингибиторами контрольных точек при PD-L1-позитивном ТНРМЖ. Таким образом, химиотерапия продолжает оставаться основным лечением для большей части пациентов. ПЭГ позволяет идентифицировать подтипы ТНРМЖ с различными ответами на неоадъювантную химиотерапию, обосновывая использование стандартных и новых видов лечения в отобранных подгруппах ТНРМЖ. ТНРМЖ не во всех случаях имеет неблагоприятный прогноз, поэтому необходима стратификация риска для подбора стратегий эскалации/деэскалации терапии. Для индивидуализированного подбора лечения, который позволит достичь максимальной клинической пользы, необходимо признание гистологической и молекулярной неоднородности ТНРМЖ. Однако при этом необходимо решить несколько проблем. Низкая частота встречаемости генов, подверженных рекуррентным мутациям, и альтераций с потенциалом прицельного воздействия представляют собой актуальные проблемы для разработки новых стратегий лечения. Методики полногеномного секвенирования позволяют увеличить количество пациентов, которым можно назначить таргетную терапию, как это предполагается для пациентов, в опухолевых клетках которых выявляют большое количество хромосомных разрывов с образованием крупных фрагментов (large-scale state transition) или соматические биаллельные мутации, приводящие к потере функции, в генах, связанных с системой РГР [31, 233, 234]. Кроме того, метастатический ТНРМЖ, по-видимому, демонстрирует более значимую неоднородность и генетическую многогранность по сравнению с заболеванием на ранних стадиях [31]. Данное наблюдение предполагает необходимость применения индивидуализированных методов лечения на ранней стадии заболевания для предотвращения возникновения сложных и избыточных механизмов резистентности. Кроме того, несколько изменений могут одновременно влиять на один и тот же путь. Например, ТНРМЖ с наличием активирующих мутаций PIK3CA одновременно может демонстрировать утрату PTEN, нивелируя, таким образом, пользу от PIK3CA-селективного ингибирования, как это было продемонстрировано при ЭРпозитивном РМЖ [235, 236]. Кроме того, новые методики, такие как количественные анализы на основе жидкой биопсии, способные выявлять опухоли на очень ранних стадиях и контролировать минимальную остаточную болезнь, позволяют лучше прогнозировать исходы в ходе течения болезни. Это позволить использовать новые лекарственные препараты на тех этапах, когда болезнь менее сложна с биологической точки зрения, за счет выявления пациенток с раком молочной железы, которым требуется экспериментальная терапия на ранней стадии заболевания и для которых необходима регистрация лекарственных препаратов по ускоренной процедуре. Иммунное микроокружение при ТНРМЖ существенно влияет на риск развития рецидива и на эффективность химиотерапии, что является основанием для применения терапии на основе ингибиторов контрольных точек. Однако до сих пор сообщалось о противоречивых результатах применения иммунотерапии при ТНРМЖ. Уточнение популяции пациенток с ТНРМЖ, отобранных по биомаркерам, у которых с высокой вероятностью будет достигнут благоприятный эффект от лечения на основе иммунотерапии, представляет собой проблему нескольких текущих исследований. Вышеупомянутые биомаркеры следует рассматривать не как взаимозаменяемые, а как взаимодополняющие, поскольку каждый из них описывает особенность сложного взаимодействия между опухолью и иммунной системой. Таким образом, необходимо более точное определение «иммунограммы» ТНРМЖ с целью правильного отбора пациентов для лечения на основе иммунотерапии и, одновременно, для реализации инновационных стратегий повышения иммуногенности при «иммуно-вытесняющем» фенотипе рака с использованием комбинированных подходов. ТНРМЖ является исключительно рабочим термином, учитывая выраженную гистопатологическую, транскриптомную и геномную неоднородность, характерную для этого подтипа РМЖ. Применение «мультиомной» стратегии и алгоритмов биоинформатики, а также новых видов дизайна клинических исследований играет важную роль для расширения терапевтического арсенала против ТНРМЖ и перехода к индивидуализированному противоопухолевому лечению.
Источники:
Antonio Marra et al. Breast Cancer (Nature), 2020.
Полный список литературы представлен на сайте RosOncoWeb
