Дорогие коллеги, дорогие друзья!
В последние часы уходящего года хочется сделать как много больше дел, чтоб не тащить их груз в новый год, тех дел, что всегда откладывались на «потом». Это действительно важно, и многим из нас просто физически дискомфортно ощущать некий...

Вида Габор (венгерский художник 1937-1999).
Снежный друг. 1990 г.
Группа «Секрет». Последний час декабря. 1985 г.
Синий вечер, зимний ветер…
НОВОСТИ ОБЩЕСТВА / В МОСКВЕ С 11 ПО 13 ДЕКАБРЯ ПРОШЕЛ XXIX РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС – 2025
XXIX Российский онкологический конгресс – одно из ключевых событий профессионального сообщества, объединившее специалистов со всей России в очном и онлайн-формате. В течение трех дней конгресс стал площадкой для обсуждения...
ЭКЗАМЕН RUSSCO ПО КЛИНИЧЕСКОЙ ОНКОЛОГИИ
Экзамен включал 100 вопросов по ключевым темам: диагностика, механизмы действия противоопухолевых препаратов, выбор тактики ведения пациентов и лекарственная терапия опухолей. В разработке экзаменационных заданий приняли участие...

НОВОСТИ ОНКОЛОГИИ / РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ CASSANDRA ПРИ РЕЗЕКТАБЕЛЬНОМ И ПОГРАНИЧНО РЕЗЕКТАБЕЛЬНОМ РАКЕ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
В журнале Lancet опубликованы результаты рандомизированного исследования III фазы CASSANDRA для определения наилучшего предоперационного или периоперационного режима у пациентов с резектабельной или погранично резектабельной...
НОВОСТИ ОНКОЛОГИИ / ИССЛЕДОВАНИЕ TRADE: ПОСТЕПЕННОЕ ПОВЫШЕНИЕ ДОЗЫ АБЕМАЦИКЛИБА СНИЖАЕТ РИСК ТОКСИЧНОСТИ И ОТМЕНЫ ПРЕПАРАТА ПРИ ПРОВЕДЕНИИ АДЪЮВАНТНОЙ ТЕРАПИИ
Абемациклиб – ингибитор циклин-зависимых киназ 4 и 6 (CDK4/6) – стал важным компонентом адъювантной терапии у пациенток с гормонорецептор-положительным (HR+), HER2-отрицательным раком молочной железы (РМЖ) ранней стадии с...
НОВОСТИ ОНКОЛОГИИ / МЕТРОНОМНЫЙ РЕЖИМ ПРИЕМА КАПЕЦИТАБИНА ДЕМОНСТРИРУЕТ ВЫСОКУЮ ПРОТИВООПУХОЛЕВУЮ АКТИВНОСТЬ У БОЛЬНЫХ ТРОЙНЫМ НЕГАТИВНЫМ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ
Тройной негативный рак молочной железы (ТНРМЖ), диагностируемый у 15-20% больных раком молочной железы (РМЖ), демонстрирует высокий риск раннего прогрессирования (до 30%) несмотря на стандартную адъювантную терапию. В...

УГОЛОК РАДИОТЕРАПЕВТА / BRALIBREST: БРАХИТЕРАПИЯ ПРИ ОЛИГОМЕТАСТАЗАХ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ В ПЕЧЕНИ – НОВЫЕ ДАННЫЕ
Исследование BRALIBREST – самое крупное на сегодня (107 пациенток), в котором авторы оценивали высокодозную брахитерапию под КТ-контролем для лечения олигометастазов рака молочной железы в печени...
УГОЛОК РАДИОТЕРАПЕВТА / НЕОАДЪЮВАНТНАЯ ХИМИОИММУНОЛУЧЕВАЯ ТЕРАПИЯ – ПУТЬ К УСПЕХУ ПРИ РАКЕ ПИЩЕВОДА?
Рак пищевода и желудка – распространенное заболевание с неблагоприятным прогнозом. Стандартным методом лечения местнораспространенного заболевания является неоадъювантная химиолучевая терапия (ХЛТ) с последующей операцией...

НОВОСТИ SAN ANTONIO BREAST CANCER SYMPOSIUM 2025
Ежегодно в декабре в San Antonio проводится важный симпозиум, посвященный терапии рака молочной железы (РМЖ). Наверное, каждый онколог, сфокусированно занимающийся РМЖ, мечтает посетить это мероприятие. В кулуарах San Antonio...

НОВОСТИ ESMO 2025 / НОВОСТИ ESMO 2025: ЖКТ
2025 год – юбилейный для ESMO. За 50 лет Общество стало флагманом не только европейской, но и мировой онкологической науки и практики, насчитывая более чем 45 тысяч членов. Ежегодно на конгрессе исследователи со всего мира...

НОВОСТИ ESMO 2025: ГЕРМИНОГЕННЫЕ ОПУХОЛИ
Герминогенные опухоли часто остаются вне контекста крупных рандомизированных исследований и широкого внимания публики, однако в таких сообществах, как RUSSCO, ESMO и ASCO, им посвящаются отдельные доклады и целые ряды на...

НОВОСТИ ESMO 2025: НЕЙРООНКОЛОГИЯ
На ежегодном конгрессе Европейского общества медицинской онкологии (ESMO) были представлены результаты ряда исследований, посвященных лечению опухолей центральной нервной системы. В данном обзоре приведены ключевые данные...

ЗА И ПРОТИВ ИСПОЛЬЗОВАНИЯ ИНГИБИТОРОВ CDK4/6 В АДЪЮВАНТНОЙ ТЕРАПИИ HER2-НЕГАТИВНОГО ЛЮМИНАЛЬНОГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ. НИКОГДА ТАКОГО НЕ БЫЛО - И ВОТ ОПЯТЬ…
Коллеги, позволим себе предположить, что каждый, кто держал в руках ингибиторы CDK4/6, вряд ли поспорит с тем, что это группа высокоэффективных препаратов с умеренной, предсказуемой и контролируемой токсичностью, значимо...

ЧТО ГОД ГРЯДУЩИЙ НАМ ГОТОВИТ? ВЗГЛЯД В 2026-Й
Давать прогнозы – дело неблагодарное, но мы осмелились заглянуть в будущее. Ниже – не «гадание или предсказание», а лишь оценка вероятностей с опорой на тренды 2025 года...
Анонс
-

7 ФЕВРАЛЯ 2026
СТРАТЕГИИ ЛЕЧЕНИЯ ЗНО КОЖИ ПОЗДНИХ СТАДИЙ: ОТ ДИАГНОСТИКИ ДО ТЕРАПИИ
ФОРУМ ЭКСПЕРТОВ RUSSCO
-

19 - 20 ФЕВРАЛЯ 2026
ОПУХОЛИ ЖЕЛУДОЧНО - КИШЕЧНОГО ТРАКТА
XII КОНФЕРЕНЦИЯ RUSSCO
-

26 - 27 МАРТА 2026
РАК МОЛОЧНОЙ ЖЕЛЕЗЫ
XIII КОНФЕРЕНЦИЯ RUSSCO
-

27 - 28 ФЕВРАЛЯ 2026 МОСКВА
ОНКОРЕАБИЛИТАЦИЯ: НАУКА И ПРАКТИКА
КОНФЕРЕНЦИЯ RUSSCO
-

13 - 14 МАРТА 2026 МОСКВА
ОНКОГИНЕКОЛОГИЯ
XII КОНФЕРЕНЦИЯ RUSSCO
-

5 ИЮНЯ 2026 БАРНАУЛ
ОПУХОЛИ ГОЛОВЫ И ШЕИ
III КОНФЕРЕНЦИЯ RUSSCO
Дорогие коллеги, дорогие друзья!
В последние часы уходящего года хочется сделать как много больше дел, чтоб не тащить их груз в новый год, тех дел, что всегда откладывались на «потом». Это действительно важно, и многим из нас просто физически дискомфортно ощущать некий долг перед несделанным. Но если речь не идет о встрече с любимыми людьми и друзьями или приятном неспешном времяпрепровождении наедине с собой, о радости общения или, наоборот, священных минутах тишины при чтении любимой книги – стоит ли переживать об этом?
Команда RUSSCO от всей души поздравляет вас всех с неуклонно приближающимся Новым 2026 годом! Этим номером газеты мы закрываем наш насыщенный онкологический 2025 год – и говорим спасибо ему за то, что он состоялся, и мы были его частью. Можно много говорить об итогах, и на это ушла б не одна страница, но сейчас важнее мысленным взором охватить уходящий год - и порадоваться новым друзьям, поездкам, своим достижениям, вспомнить тех, кто навеки покинул наше онкологическое братство, и подумать о том, как много хорошего нас ждет впереди, несмотря на различные жизненные перипетии, и никогда не поздно начать или узнать что-то новое.
Венгерский художник Вида Габор посвятил себя живописи с 1977 года, будучи уже сорокалетним, разработав собственный уникальный стиль, на его полотнах нет видимых следов кисти. Он завлекает зрителя в свой мир, где действительность неразрывно связана с фантазией, где оживают герои его излюбленных жанровых сцен, наполненных юмором, и мы бы хотели, чтоб каждый из вас, наших читателей, улыбнулся, глядя на первую страницу онлайн-газеты – и продолжил листать ее дальше. Радостного вступления в новый 2026 год, дорогие друзья, и пусть он будет добрым для нас всех!
Ваша команда RUSSCO
Вида Габор (венгерский художник 1937-1999).
Снежный друг. 1990 г.

Группа «Секрет». Последний час декабря. 1985 г.
***
Синий вечер, зимний ветер…
В звёздной пыли растворились фонари
Стрелка замрёт, завершив поворот,
И наступит Новый год
Звоном полночь мир наполнит
Пусть старый год нас простит и всё поймёт
До января остаётся у нас
Только час, последний час
Последний час декабря, замри на миг!
Пускай летят за моря любовь и мир
И все надежды наши пусть сбудутся однажды
В последний час декабря!
НОВОСТИ ОБЩЕСТВА / В МОСКВЕ С 11 ПО 13 ДЕКАБРЯ ПРОШЕЛ XXIX РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС – 2025

XXIX Российский онкологический конгресс – одно из ключевых событий профессионального сообщества, объединившее специалистов со всей России в очном и онлайн-формате. В течение трех дней конгресс стал площадкой для обсуждения актуальных вопросов диагностики и лечения онкологических заболеваний, обмена клиническим опытом и представления современных научных подходов.
Масштаб участия подтвердил высокую востребованность конгресса как отраслевой платформы: за три дня в мероприятии приняли участие более 20 000 специалистов, подключившихся к программе очно и дистанционно. Гибридный формат обеспечил широкую доступность сессий и позволил врачам и исследователям из разных регионов включиться в профессиональную дискуссию.
Научно-практическая программа включала 58 сессий, 46 симпозиумов, 10 лекций, 5 мастер-классов, круглый стол, а также выступления 7 иностранных докладчиков. Разнообразие форматов позволило участникам рассмотреть как стратегические направления развития онкологической помощи, так и прикладные вопросы, важные для ежедневной клинической практики.
В центре внимания конгресса находились современные методы диагностики, персонализированные подходы к лечению, вопросы внедрения новых технологий и повышение качества медицинской помощи пациентам. Важной частью программы стала междисциплинарная коммуникация и обмен опытом между специалистами различных профилей.
XXIX Российский онкологический конгресс – 2025 подтвердил свою роль ведущей профессиональной площадки, способствующей консолидации экспертного сообщества, развитию доказательной медицины и распространению актуальных клинических практик в онкологии.
Сайт Конгресса: https://rosoncoweb.ru/



ЭКЗАМЕН RUSSCO ПО КЛИНИЧЕСКОЙ ОНКОЛОГИИ
11 декабря 2025 года в Москве, в рамках XXIX Российского онкологического конгресса, состоялся очередной экзамен Российского общества клинической онкологии (RUSSCO).

Для участников это стало возможностью оценить уровень своей подготовки и проверить знания в области клинической онкологии.
Экзамен включал 100 вопросов по ключевым темам: диагностика, механизмы действия противоопухолевых препаратов, выбор тактики ведения пациентов и лекарственная терапия опухолей. В разработке экзаменационных заданий приняли участие ведущие эксперты RUSSCO: Болотина Л.В., Волкова М.И., Гладков О.А., Моисеенко Ф.В., Насхлеташвили Д.Р., Новик А.В., Румянцев А.А., Семенова А.И., Тарарыкова А.А., Титова Т.А., Трякин А.А., Утяшев И.А., Федянин М.Ю., Феоктистова П.С., Фролова М.А., Хохлова С.В.
По итогам экзамена участникам, успешно прошедшим испытание, были вручены дипломы. Четыре специалиста, набравшие наибольшее количество баллов, получили грант на организацию поездки на одну из конференций RUSSCO.
Победители экзамена:
• 1 место — Махортова Галина Георгиевна (76 баллов)
• 2 место — Кокорина Серафима Евгеньевна (73 балла)
• 3 место — Татьянин Виталий Олегович (72 балла)
• 3 место — Чиж Григорий Алексеевич (72 балла)
В экзамене приняли участие 72 специалиста из 23 городов России. Успешно справились с заданиями 62,5% участников.
Поздравляем всех, кто принял участие и успешно сдал экзамен, а также победителей — с заслуженными результатами.
Отдельная благодарность экспертам RUSSCO за подготовку вопросов и вклад в развитие профессиональных стандартов клинической онкологии.
НОВОСТИ ОНКОЛОГИИ / РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ CASSANDRA ПРИ РЕЗЕКТАБЕЛЬНОМ И ПОГРАНИЧНО РЕЗЕКТАБЕЛЬНОМ РАКЕ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Автор: Тюляндин Сергей Алексеевич
Заслуженный деятель науки РФ, главный научный сотрудник отделения противоопухолевой лекарственной терапии №2
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, председатель рабочей группы по разработке Клинических рекомендаций RUSSCO,
член правления RUSSCO, профессор, доктор медицинских наук, Москва
В журнале Lancet опубликованы результаты рандомизированного исследования III фазы CASSANDRA для определения наилучшего предоперационного или периоперационного режима у пациентов с резектабельной или погранично резектабельной протоковой аденокарциномой поджелудочной железы (PDAC). У больных резектабельной PDAC стандартным походом является выполнение оперативного лечения на первом этапе с последующей адъювантной химиотерапией комбинацией mFOLFIRINOX. Однако многие пациенты не могут получить этот режим из-за неудовлетворительного общего состояния после операции и остаются без системной терапии, что повышает риск прогрессирования за счет отдаленного метастазирования. Ранее в рамках рандомизированной II фазы (PACT-19) авторы изучили эффективность четырехкомпонентного режима PAXG (цисплатин, наб-паклитаксел, капецитабин и гемцитабин) в сравнении комбинацией гемцитабин – наб-паклитаксел при распространенном PDAC. Комбинация PAXG продемонстрировала большую эффективность, показав 6-месячную выживаемость без прогрессирования 74% по сравнению с 46% у пациентов, получавших наб-паклитаксел – гемцитабин.
Целью исследования CASSANDRA, которое проводилось в 17 итальянских академических клиниках, было сравнение комбинации PAXG и mFOLFIRINOX у больных с резектабельной или погранично резектабельной PDAC. К участию в исследовании были допущены пациенты в возрасте от 18 до 75 лет, которые были рандомизированы в группу PAXG (общая суточная доза капецитабина 1250 мг/м2 в дозировке 625 мг/м2 два раза в день и внутривенное введение цисплатина 30 мг/м2, наб-паклитаксела 150 мг/м2 и гемцитабина 800 мг/м2 каждые 14 дней) или mFOLFIRINOX (внутривенное введение фторурацила 2400 мг/м2, лейковорина 400 мг/м2, иринотекана 150 мг/м2 и оксалиплатина 85 мг/м2 каждые 14 дней) в течение 4 месяцев, после чего следовала попытка оперативного лечения. Первичной конечной точкой была бессобытийная выживаемость (БСВ), которая учитывала шесть различных событий: рентгенологическое прогрессирование, рецидив заболевания, два последовательных повышения уровня CA19-9, нерезектабельность, интраоперационные метастазы и смерть.
В период с 3 ноября 2020 г. по 24 апреля 2024 г. 132 пациента, соответствующих критериям включения, были рандомизированы в группу PAXG и 128 – в группу mFOLFIRINOX. Все 260 пациентов получили как минимум один назначенный курс химиотерапии. Из 260 пациентов, включенных в исследование, 134 (52%) были классифицированы как погранично резектабельные, включая пациентов с анатомически резектабельными PDAC и уровнем CA19-9 более 500 МЕ/мл. Следует отметить, что все пациенты были в возрасте моложе 75 лет, и 240 (92%) из 260 пациентов имели оценку по шкале Карновского 90%.
В группе PAXG медиана БСВ составила 16,0 мес. и 10,2 мес. в группе mFOLFIRINOX, что соответствует достоверному снижению относительного риска прогрессирования на 37% (HR=0,63; p=0,0018). Частота зарегистрированного объективного ответа была 46% и 39% соответственно. Всего 56% пациентов в группе PAXG и 45% в группе mFOLFIRINOX завершили назначенную химиотерапию и перенесли резекцию, что подчеркивает трудности в завершении назначенного лечения в предоперационных исследованиях PDAC. У больных с выполненной резекцией медиана БСВ составила 19,1 мес. в группе PAXG и 10,4 мес. в группе mFOLFIRINOX.
Вторичные конечные точки, включая показатели контроля заболевания и патологическую стадию, были значительно лучше в группе PAXG, чем в группе mFOLFIRINOX, что подтверждает эффективность режима. Предварительная 3-летняя общая выживаемость составила 48% в группе PAXG и 41% в группе mFOLFIRINOX. Различий в частоте нежелательных явлениях или показателях качества жизни не наблюдалось. Частота побочных эффектов 3-4 степени составила 66% в группе PAXG и 61% в группе mFOLFIRINOX, включая одно летальное событие.
Заслугой авторов является разработка новой комбинации, которая с высоким шансом на успех и приемлемой токсичностью может использоваться у пациентов моложе 75 лет с сохранным общим состоянием. Можно ожидать оценку ее эффективности и токсичности при метастатической болезни. Она также может быть использована в качестве предоперационной химиотерапии в рандомизированных исследованиях у больных с резектабельными опухолями, там, где комбинация mFOLFIRINOX не достигла лучших результатов по сравнению с стандартным подходом выполнения оперативного лечения на первом этапе с последующей адъювантной системной терапией.
Источники:
- Reni M, Zanon S, Peretti U, et al. Nab-paclitaxel plus gemcitabine with or without capecitabine and cisplatin in metastatic pancreatic adenocarcinoma (PACT-19): a randomised phase 2 trial. Lancet Gastroenterol Hepatol. 2018; 3: 691-97.
- Reni M, Macchini M, Orsi G, et al. Preoperative mFOLFIRINOX versus PAXG for stage I–III resectable and borderline resectable pancreatic ductal adenocarcinoma (PACT-21 CASSANDRA): results of the first randomisation analysis of a randomised, open-label, 2×2 factorial phase 3 trial . The Lancet. Published online: 20 November 2025.
НОВОСТИ ОНКОЛОГИИ / ИССЛЕДОВАНИЕ TRADE: ПОСТЕПЕННОЕ ПОВЫШЕНИЕ ДОЗЫ АБЕМАЦИКЛИБА СНИЖАЕТ РИСК ТОКСИЧНОСТИ И ОТМЕНЫ ПРЕПАРАТА ПРИ ПРОВЕДЕНИИ АДЪЮВАНТНОЙ ТЕРАПИИ
Автор: Тюляндин Сергей Алексеевич
Заслуженный деятель науки РФ, главный научный сотрудник отделения противоопухолевой лекарственной терапии №2
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, председатель рабочей группы по разработке Клинических рекомендаций RUSSCO,
член правления RUSSCO, профессор, доктор медицинских наук, Москва
Абемациклиб – ингибитор циклин-зависимых киназ 4 и 6 (CDK4/6) – стал важным компонентом адъювантной терапии у пациенток с гормонорецептор-положительным (HR+), HER2-отрицательным раком молочной железы (РМЖ) ранней стадии с высоким риском рецидива. Его эффективность была продемонстрирована в рандомизированном исследовании III фазы MonarchE, где добавление абемациклиба на 2 года к стандартной эндокринной терапии (ЭТ) в сравнении с ЭТ только достоверно улучшило 7-летнюю инвазивную безрецидивную выживаемость (iDFS) с 70,9% до 77,4% (Δ6,5%, HR=0,73), При 7-летнем наблюдении общая выживаемость составила 86,8% в группе абемациклиба + ЭТ против 85,0% в группе ЭТ. В настоящее время Практические рекомендации РУССКО считают, что больным люминальным HER2-негативным РМЖ III стадии (pN2-3 или с ypN2-3 после неоадъювантной ХТ и ГТ тамоксифеном или ингибиторами ароматазы) может быть добавлен абемациклиб 150 мг внутрь 2 раза ежедневно в течение 2 лет [МКЗ 0-C1].
Однако на фоне приема абемациклиб регистрируются побочные эффекты, включая диарею, нейтропению или слабость, которые могут осложнить терапию. Это потребовало приостановки или снижения дозы абемациклиба у 61,7% и 43,4% участников исследования соответственно. Побочные эффекты 2-3 степени тяжести возникали преимущественно в первые 12 недель лечения, со средним временем начала диареи 8 дней. Кроме того, 18,5% участников преждевременно прекратили прием абемациклиба по причине токсичности с самой высокой частотой прекращения приема в первый месяц лечения. Все это свидетельствует о необходимости разработки методов, снижающих токсичность лечения и профилактирующих необходимость отмены препарата, особенно в первые недели начала терапии.
Исследование TRADE II фазы ставило цель оценить стратегию постепенной эскалации дозы абемациклиба у больных HR-позитивным/HER2-негативным РМЖ II-III стадии с поражением лимфатических узлов. Все участники на фоне адъювантной эндокринотерапии начинали абемациклиб с дозы 50 мг два раза в день в течение первых 2 недель терапии, затем доза увеличивалась до 100 мг два раза в день в течение следующих 2 недель прежде чем дойти до конечной рекомендуемой дозы 150 мг два раза в день в начале второго месяца терапии и в течение оставшихся запланированных 2 лет адъювантного лечения абемациклибом.
Эскалация до каждого более высокого уровня дозы требовала отсутствия:
- гематологической или негематологической токсичности 3-4 степени;
- продолжающейся негематологической токсичности 2 степени, связанной с абемациклибом, которая не прошла при применении максимальных поддерживающих мер в течение 7 дней до исходного уровня или 1 степени;
- персистирующей-рецидивирующей (≥14 дней) диареи 2 степени, которая не прошла при применении максимальных поддерживающих мер, требовавшая госпитализации;
- любая диарея 3-4 степени;
- интерстициальное заболевание легких/
пневмонит 2-4 степени.
Противодиарейные препараты применялись по мере необходимости. Повторное повышение дозы абемациклиба в течение первых 12 недель лечения не рекомендовалось пациентам, которым по какой-либо причине пришлось снизить дозу абемациклиба. После 12 недель дальнейшее лечение абемациклибом проводилось в соответствии с существующими стандартными рекомендациями.
Основной целью исследования TRADE была оценка комплексной конечной точки через 12 недель приема, включающей частоту прекращения приема абемациклиба по любой причине и/или невозможность достижения или поддержания целевой стандартной дозы (150 мг два раза в день). Ключевые вторичные конечные точки, зарегистрированные через 12 недель, включают появившиеся на фоне лечения побочные эффекты и частоту клинически значимой диареи, связанной с лечением (степень 2-4).
В исследование в период с октября 2023 года по сентябрь 2024 года было включено 90 пациенток с медианой возраста 58 лет, у 51,1% была II стадия заболевания, а у 48,9% – III стадия. Все пациентки получали ингибитор ароматазы для адъювантной эндокринотерапии, у 17,8% больных в комбинации с овариальной супрессией. Большинство пациенток ранее получали лучевую терапию (n=87, 96,7%) и химиотерапию в неоадъювантном или адъювантном режиме (n=66, 73,3%).
Медиана периода наблюдения на момент окончания сбора данных для первичной конечной точки составила 32 недели. Среди 90 включенных пациентов у 1 наблюдался ранний рецидив заболевания до достижения 12 недель адъювантной терапии абемациклибом, и оценка первичной комбинированной конечной точки не проводилась. Среди 89 подлежащих оценке пациентов 63 пациента (70,8%) достигли и поддерживали целевую дозу абемациклиба 150 мг два раза в день через 12 недель. В общей сложности у 26 (29,2%) пациентов не удалось достигнуть стабильного приема дозы 150 мг 2 раза в день на 12 неделе из-за невозможности поддерживать целевую достигнутую ранее дозу абемациклиба 150 мг дважды в день (n=12; 13,5%), невозможности достижения целевой дозы (n=8; 9,0%), и прекращения лечения по любой причине (n=6; 6,7%), из которых четыре пациента прекратили лечение из-за токсичности, а двое отозвали согласие на участие в исследовании. Через 12 недель 83 пациента (93,3%) продолжали прием абемациклиба в полных или сниженных дозах. Частота недостижения стандартной дозы абемациклиба составила 21% среди пациенток, получавших ранее (нео)адъювантную химиотерапию в сравнении с 50% среди тех, кто не получал ее (P=0,016). В остальном различий в комбинированной частоте конечной точки между пациентками с различной стадией заболеваниями или получение монотерапии ингибитором ароматазы по сравнению с ингибитором ароматазы с подавлением функции яичников не наблюдалось.
Наиболее частыми нежелательными явлениями (НЯ) степени ≥2, возникавшими в течение первых 12 недель лечения, были диарея (26,7%), нейтропения (24,4%) и слабость (22,2%). Единственным осложнением 4 степени была нейтропения у одной пациентки. Ежемесячные показатели частоты клинически значимой диареи (степени ≥2) на 0-4 неделе, 4-8 неделе и 8-12 неделе составили 8,9%, 19,1% и 16,5% соответственно.
В исследовании TRADE использование первоначального повышения дозы абемациклиба у пациенток с HR-положительным/
Источники:
- Rugo HS, et al. Adjuvant abemaciclib combined with endocrine therapy for high-risk early breast cancer: safety and patient-reported outcomes from the monarchE study. Annals of Oncology. 2022; 33: 615.
- Mayer EL, et al. Results of the TRADE study. Annals of Oncology. Published online: October 17, 2025.
НОВОСТИ ОНКОЛОГИИ / МЕТРОНОМНЫЙ РЕЖИМ ПРИЕМА КАПЕЦИТАБИНА ДЕМОНСТРИРУЕТ ВЫСОКУЮ ПРОТИВООПУХОЛЕВУЮ АКТИВНОСТЬ У БОЛЬНЫХ ТРОЙНЫМ НЕГАТИВНЫМ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ
Автор: Тюляндин Сергей Алексеевич
Заслуженный деятель науки РФ, главный научный сотрудник отделения противоопухолевой лекарственной терапии №2
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, председатель рабочей группы по разработке Клинических рекомендаций RUSSCO,
член правления RUSSCO, профессор, доктор медицинских наук, Москва
Тройной негативный рак молочной железы (ТНРМЖ), диагностируемый у 15-20% больных раком молочной железы (РМЖ), демонстрирует высокий риск раннего прогрессирования (до 30%) несмотря на стандартную адъювантную терапию. В исследовании CREATE-X адъювантная терапия капецитабином продемонстрировала свою полезность у больных ТНРМЖ высокого риска, улучшив показатели 5-летней безрецидивной выживаемости на 10,7% у пациентов с резидуальной опухолью после неоадъювантной химиотерапии. Рандомизированное исследование III фазы SYSUCC-001 показало, что метрономная терапия капецитабином после окончания стандартной адъювантной химиотерапии достоверно улучшила 5-летнюю безрецидивную выживаемость по сравнению с наблюдением – с 73,0% до 82,8% – у пациентов с операбельным ТНРМЖ. Хотя результаты этого и других проведенных исследований позиционировали капецитабин как эффективную адъювантную терапию, два критических пробела препятствовали ее широкому клиническому внедрению: 1) отсутствие полных данных об общей выживаемости и 2) отсутствие предиктивных биомаркеров для селекции пациентов с наибольшей пользой от адъювантного назначения капецитабина. Анализ 10-летнего наблюдения за больными, включенными в исследование SYSUCC-001, представляет данные об общей выживаемости и использовании экспрессии белка FOXC1 в качестве предиктора эффективности метрономной адъювантной терапии капецитабином.
В исследование включались больные в стадии T1b-3 N0-3 M0, завершившие стандартную терапию, включающую либо модифицированную радикальную мастэктомию, либо органосохраняющую операцию, неоадъювантную или адъювантную химиотерапию, а при необходимости и лучевую терапию в соответствии с рекомендациями учреждения. Сразу после окончания больные рандомизировались в группу наблюдения или метрономной терапии капецитабином в дозе 650 мг/м2 дважды в день в течение 1 года. График последующего наблюдения включал ежемесячные визиты во время активного лечения, ежеквартальные обследования в течение 1-2 лет, полугодовые обследования в течение 3-5 лет и ежегодные осмотры после этого.
Фактор транскрипции FOXC1 экспрессирован в 40-60% случаев ТНРМЖ и является характерным маркером базальноподобных генетических подтипов TНРМЖ. FOXC1 регулирует инвазию опухоли, метастазирование и пути репарации повреждений ДНК – механизмы, которые могут напрямую противодействовать эффективности фторпиримидинов. Доклинические исследования показали, что гиперэкспрессия FOXC1 усиливает гомологичную репарацию, тем самым обеспечивая устойчивость к повреждающим ДНК агентам, таким как капецитабин. Предыдущие ретроспективные анализы режимов лечения капецитабином в стандартных дозах, включая исследование GEICAM/CIBOMA, предполагали преимущественную его эффективность при опухолях с низким уровнем FOXC1. Однако предиктивная роль FOXC1 при назначении длительной метрономной адъювантной химиотерапии, которая характеризуется антиангиогенными и иммуномодулирующими эффектами, не исследовалась. Экспрессию FOXC1 оценивали иммуногистохимически с определением как числа экспрессирующих клеток, так и интенсивность окрашивания.
В течение 2010-2016 гг. 443 участника были случайным образом распределены в группы адъювантной терапии капецитабином или наблюдения. Экспрессия FOXC1 была определена у 338 (78%) пациентов, из числа которых у 149 (44%) была выявлена высокая экспрессия (балл ≥4) со сбалансированным распределением между группами лечения (75 [50%] в группе капецитабина, 74 [50%] в группе наблюдения); у 189 (56%) пациентов была низкая экспрессия. При медиане наблюдения 116,0 мес. 10-летняя выживаемость без прогрессирования заболевания в группе адъювантной терапии капецитабином составила 78,1% и 66,6% в группе наблюдения, что соответствует достоверному снижению относительного риска прогрессирования на 39% (HR=0,61; p=0,0074). Общая 10-летняя выживаемость составила 82,4% и 73,7% соответственно с достоверным снижением относительного риска смерти на 33% (HR=0,67; p=0,058). В подгрупповом анализе метрономная терапия капецитабином снижала риск прогрессирования во всех анализируемых подгруппах.
В общей популяции, подлежащей оценке биомаркеров, экспрессия FOXC1 не имела достоверного влияния на отдаленные результаты лечения в обеих группах. Однако в подгруппе с высоким уровнем FOXC1 адъювантная терапия капецитабином сочеталась с более высокой выживаемостью без прогрессирования и общей выживаемостью. Так, 5-летняя выживаемость без прогрессирования составила в группе капецитабина 89,3% против 68,7% в контроле, а 10-летняя – 86,3% против 64,2%, что соответствует достоверному снижению риска прогрессирования на 67% (HR=0,33; p=0,0027). Соответствующие показатели общей выживаемости составили 92,0% против 78,2% при 5-летнем наблюдении и 10-летней 92,0% против 70,8%, что соответствует достоверному снижению риска смерти на 75% (HR=0,25; p=0,0028). У пациентов с низким уровнем экспрессии FOXC1 не было выявлено значимых различий в безрецидивной и общей выживаемости между группами. В группе наблюдения также не было выявлено существенных различий между подгруппой с низким уровнем экспрессии FOXC1 и подгруппой с высоким уровнем экспрессии FOXC1 по отдаленным результатам лечения.
Представленный обновленный анализ исследования SYSUCC-001 подтверждает достоверный выигрыш от назначения адъювантного метрономного режима капецитабина, который сохраняется в течение 10 лет наблюдения. Экспрессия FOXC1, характерная для базального генотипа ТНРМЖ, может быть потенциальным прогностическим биомаркером для селекции пациентов, выигрывающих от назначения капецитабина в метрономном режиме. Высокая экспрессия FOXC1 может помочь идентифицировать пациентов, которым не помогают стандартные схемы химиотерапии на основе антрациклинов, но которым помогает метрономная химиотерапия. В сегодняшней практике больные операбельным тройным негативным РМЖ на первом этапе лечения получают неоадъювантную химиотерапию. Больным с полным патоморфозом рекомендуется наблюдение, в то время как при наличии резидуальной опухоли – капецитабин в стандартном режиме в течение 6 месяцев. Возможно, с учетом высокой активности метрономного режима капецитабина у больных с высокой экспрессией FOX1 было бы полезно определение этого биомаркера в первичной биопсии или резидуальной опухоли и назначение капецитабина в стандартных дозах при низкой экспрессии FOX1, а метрономный режим – при наличии высокой экспрессии.
Источник: Yuan J, Bi X.-W, Hu X, et al. Metronomic capecitabine as extended adjuvant chemotherapy for early triple-negative breast cancer (SYSUCC-001): updated 10-year outcomes and post-hoc exploratory biomarker analysis from a randomized, phase 3 trial. Lancet Oncol. 2025; 26: 1575-83.
УГОЛОК РАДИОТЕРАПЕВТА / BRALIBREST: БРАХИТЕРАПИЯ ПРИ ОЛИГОМЕТАСТАЗАХ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ В ПЕЧЕНИ – НОВЫЕ ДАННЫЕ
Автор: Черчик Алексей
Врач, радиационный онколог, Paul Scherrer
Institute, Швейцария
Исследование BRALIBREST – самое крупное на сегодня (107 пациенток), в котором авторы оценивали высокодозную брахитерапию под КТ-контролем для лечения олигометастазов рака молочной железы в печени.
Метастазы в печени ухудшают прогноз рака молочной железы, встречаясь примерно у 50% пациентов. Вопрос о том, улучшает ли локальное воздействие при метастазах в печени результаты лечения в этой подгруппе, остается критически важным. Ретроспективные исследования предполагают преимущества в выживаемости при проведении локального лечения, включая метастазэктомию и абляционные методы, даже при внепеченочном поражении.
В исследование были включены пациентки с олигометастатическим раком молочной железы (≤5 метастазов в печени), статус ECOG-ВОЗ <3, диаметр опухоли <10 см. Пациенты исключались из исследования, если расположение опухоли препятствовало установке аппликатора или адекватному дозированию КТ-контролируемой высокодозной брахитерапии. Конечными точками были общая выживаемость (ОВ), выживаемость без прогрессирования (ВБП), локальный контроль (ЛК), модифицированная ВБП (мВБП), отсутствие необходимости в последующей линии системной терапии и радиологический ответ – частота контроля заболевания и частота объективного ответа (ЧОО).
Из 107 пациентов 61% получали лечение по поводу одного очага, а 39% – по поводу нескольких. Медиана назначенной дозы составила 20 Гр (15-25 Гр).
Главные результаты:
- Очень высокая эффективность: медиана общей выживаемости составила 37 месяцев, двухлетняя ОВ – 60%.
- Почти идеальный контроль над заболеванием: через год контроль 98%, объективный ответ – 85%.
- Отсрочка системной терапии: время до множественного прогрессирования – 44 месяца, до следующей линии системной терапии – 22 месяца.
- Ключ к успеху – доза и опухолевая нагрузка: если GTV D90 ≥25 Гр, риск смерти снижался почти вдвое. Низкий исходный объем метастазов (<10 см3 и диаметр <4 см) давал существенно лучший прогноз.
- Высокая безопасность: не было острой токсичности 3 степени и выше. Поздняя токсичность 3 степени встречалась лишь у 8% и была успешно контролируема.
Почему это важно
Олигометастатическая болезнь – это окно возможностей, когда локальное воздействие может изменить естественное течение заболевания. Брахитерапия позволяет точно доставить высокую дозу в очаг метастазирования, сохраняя окружающую печеночную ткань.
Выживаемость и контроль:
- Общая выживаемость: 37 месяцев.
- Выживаемость без прогрессирования: 13 месяцев.
- Локорегионарный контроль: 19 месяцев, двухлетний – 46%.
- Контроль на уровне RECIST улучшался со временем: объективный ответ увеличивался с 63% на 6 месяцах до 85% на 12 месяцах.
Кто выигрывает больше всего:
- Пациентки с повторной или индуцированной олигометастатической болезнью
- Пациентки с низкой опухолевой нагрузкой
- Пациентки, получившие адекватную дозу (GTV D90 ≥25 Гр)
Профиль безопасности:
- Острая токсичность – только 1-2 степени, редкая и легко контролируемая
- Поздняя токсичность 3 степени – 8%, без необходимости прерывать системное лечение
- По сравнению с хирургией и SBRT брахитерапия выглядит более безопасной
Главные выводы
- HDR-брахитерапия – эффективная и безопасная стратегия метастаз-направленного лечения при ограниченном поражении печени.
- Метод обеспечивает стойкий локальный контроль и увеличивает общую выживаемость, позволяя откладывать новую системную терапию.
- Ключевую роль играют доза ≥25 Гр и минимальная опухолевая нагрузка.
- Результаты оправдывают проведение рандомизированных исследований, чтобы закрепить место брахитерапии в стандартах лечения.
Источник: Bilski M, Kuncman L, Orzechowska M, et al. Survival outcomes and toxicity profile after CT-guided HDR brachytherapy (interventional radiotherapy) for liver oligometastases in breast cancer patients: The BRALIBREST real world multicenter study. Radiotherapy and Oncology. 2025. https://doi.org/
УГОЛОК РАДИОТЕРАПЕВТА / НЕОАДЪЮВАНТНАЯ ХИМИОИММУНОЛУЧЕВАЯ ТЕРАПИЯ – ПУТЬ К УСПЕХУ ПРИ РАКЕ ПИЩЕВОДА?
Рак пищевода и желудка – распространенное заболевание с неблагоприятным прогнозом. Стандартным методом лечения местнораспространенного заболевания является неоадъювантная химиолучевая терапия (ХЛТ) с последующей операцией. Основная цель данного исследования заключалась в изучении того, улучшает ли добавление пембролизумаба к неоадъювантной ХЛТ показатели полного патоморфологического ответа по сравнению с историческими контрольными группами.
Американские авторы из медицинского центра университета Дьюка инициировали одноцентровое проспективное одногрупповое исследование 2-й фазы PROCEED (NCT03064490). Пациенты получали три введения пембролизумаба (200 мг каждые 3 недели) одновременно с неоадъювантной химиолучевой терапией (45 Гр/
В общей сложности за 5 лет в исследование были включены 35 пациентов, из которых 30 завершили назначенное неоадъювантное лечение с последующей хирургической резекцией. У 11 из 30 пациентов (36,7%) был достигнут полный патоморфологический ответ (pCR), а у 15 из 30 пациентов (50%) – выраженный патологический ответ. Частота токсичности 3-4 степени была сопоставима с историческими контрольными группами, токсичности 5 степени не наблюдалось. Медиана выживаемости без прогрессирования и общая выживаемость были численно выше у пациентов, у которых был достигнут выраженный патологический ответ.
Добавление пембролизумаба к неоадъювантной химиолучевой терапии с последующей хирургической резекцией в целом хорошо переносилось и привело к численно более высоким показателям полного патологического ответа по сравнению с историческими контрольными группами. Для подтверждения эффективности этой схемы лечения необходимы дальнейшие исследования с оптимизированным отбором пациентов.
Источник: Pooja Karukonda, et al. Pembrolizumab, Radiotherapy, and Chemotherapy in Neoadjuvant Treatment of Malignant Esophago-gastric Diseases (PROCEED): A single-arm phase 2 trial. Cancer. 15 December 2025; 131 (24): e70213.
НОВОСТИ SAN ANTONIO BREAST CANCER SYMPOSIUM 2025
Автор: Титова Татьяна Александровна
Врач-онколог отделения противоопухолевой лекарственной терапии №1 ФГБУ «НМИЦ онкологии
им. Н.Н. Блохина» Минздрава России, кандидат медицинских наук, Москва
Ежегодно в декабре в San Antonio проводится важный симпозиум, посвященный терапии рака молочной железы (РМЖ). Наверное, каждый онколог, сфокусированно занимающийся РМЖ, мечтает посетить это мероприятие. В кулуарах San Antonio Breast Cancer Symposium можно свободно пообщаться с коллегами, продемонстрировать собственные достижения, окунуться в мир науки.
Адъювантная терапия гормонозависимого рака HER2-негативного молочной железы
LidERA – исследование, посвященное изучению эффективности нового перорального SERD гиредестранта в сравнении со стандартной эндокринотерапией (ингибиторы ароматазы/
В исследование было включено 4170 больных ГР+ HER2-негативным РМЖ I-III стадии (pN0 и pT>1 и G3 или ki67 ≥20% или N+) в пре- и менопаузе. Пациенты ранее могли получать как неоадъювантную, так и адъювантную химиотерапию.
Больные были рандомизированы в лечебные группы (1:1):
- n=2084: гиредестрант 30 мг 1 раз в день (± ГнРЛГ) до 5 лет;
- n=2086: тамоксифен/ИА (± ГнРЛГ) до 5 лет.
Первичная конечная точка – IDFS (выживаемость без инвазивного РМЖ, за исключением второго РМЖ), вторичные конечные точки – DFS, DRFI (выживаемость без отдаленных метастазов), IDFS, LRRFI (выживаемость без локального рецидива), ОВ и токсичность.
Большинство пациентов, включенных в исследование, были в менопаузе, со II-III стадией болезни, pN1-3 и ранее получавшие нео/адъювантную химиотерапию.
При медиане времени в 32,3 мес. назначение гиредестранта в сравнении со стандартной эндокринотерапией (ЭТ) позволило увеличить 3-летнюю IDFS с 89,6% до 92,4% и снизить риск прогрессирования (IDFS) на 30% (p=0,0014) (рис.1).
Рисунок 1.
Результаты исследования LidERA.
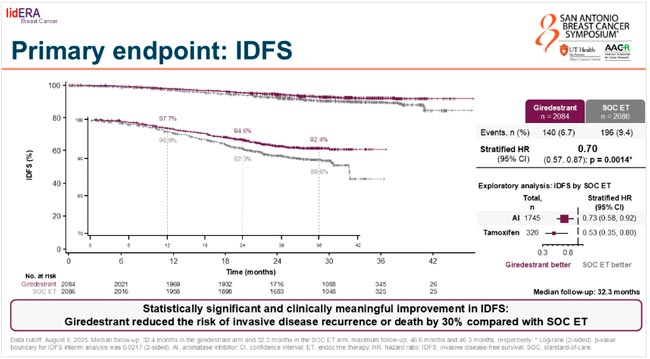
При подгрупповом анализе максимальное преимущество гиредестрата продемонстрировано в сравнении с тамоксифеном (ОР=0,53; 95% ДИ 0,35-0,80) и при II и III стадиях РМЖ. Преимущество гиредестранта над рутинной ЭТ не зависело от возраста, предшествующего лечения и менопаузального статуса.
Назначение гиредестранта позволило увеличить 3-летнюю DFS с 92,1% до 94,4% (ОР=0,69; 95% ДИ 0,54-0,89), что привело к снижению риска появления отдаленных метастазов на 31%.
НЯ 3 степени и выше зарегистрированы у 19,8% больных в группе гиредестранта и у 17,8% в группе стандартной ЭТ и были преимущественно представлены гипертензией, артралгией и фотопсиями.
Брадикардия – известное классовое НЯ пероральных SERD, ее частота была выше в группе с гиредестрантом (11,3%), чем в группе стандартной ЭТ (3,2%). Большинство случаев были первой степени, бессимптомными, не требующими прерывания или прекращения лечения.
Эксперты много говорили о том, что LidERA – это первое исследование за последние 20 лет, в котором новый подход к адъювантной ЭТ позволил улучшить отдаленные результаты лечения раннего ГР+ HER2-негативного РМЖ. Обсуждалось, изменят ли представленные результаты реальную клиническую практику и как соотносятся полученные данные с выводами исследований NATALEE и MonarchE. От себя хочу сказать, что период наблюдения для адъювантной ЭТ мал, всего 2,75 года, но если выполнить непрямое сравнение 3-летних результатов NATALEE, MonarchE и LidERA, то данные похожи. К трем годам в NATALEE добавление рибоциклиба позволило увеличить IDFS на 2,7%, а в MonarchE добавление абемациклиба позволило достигнуть преимущества в 2,7%. Необходимо все же заметить, что Lidera включала пациентов с I-III стадий РМЖ, а MonarchE и NATALEE сосредоточились на больных со II и III стадиями РМЖ. Включение пациентов с I стадией в LidERA могло сыграть в пользу гиредестранта. И, конечно, хотелось бы узнать, какие бы были результаты, если бы гиредестрант в адъюванте был с iCDK4/6 (рис.2).
Рисунок 2.
Результаты исследований NATALEE, MonarchE и LidERA.
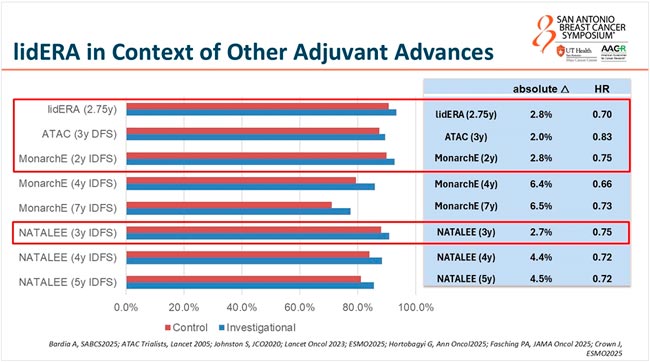
Ограничения исследования LidERA – малый период наблюдения и незрелые общие данные о выживаемости.
Неоадъювантная терапия BRCA-ассоциированного тройного негативного рака молочной железы
На мой взгляд, интересное небольшое исследование по неоадъювантной терапии OlimpiaN (еще одно исследование Olimpia, только теперь с N – неоадъювант). Работа посвящена эффективности олапариба ± дурвалумаб в качестве неоадъювантной терапии BRCA-ассоциированного тройного негативного рака молочной железы (ТНРМЖ).
В работу скринировались пациенты с ТНРМЖ сT1b-T2N0 или cT1N1 c ECOG статусом 0-1.
В исследование было включено 50 пациентов, которые были рандомизированы в две лечебные группы:
- n=25 (когорта A): олапариб 300 мг 2 раза в день, 4-6 циклов по 28 дней + дурвалумаб 1500 мг 1 раз в 4 недели;
- n=25 (когорта В): олапариб 300 мг 2 раза в день, 4-6 циклов по 28 дней.
Первичная конечная точка – частота достижения pCR (ypT0/Tis ypN0).
На фоне проводимого неоадъювантного лечения в группе олапариба прогрессирование зарегистрировано у 1 больного и у 2 больных – в группе олапариба и дурвалумаба.
Полностью 6 циклов терапии завершило 80% (n=20) пациентов в группе олапариба и 64% (n=16) в группе комбинированной терапии, причиной прекращения терапии в большинстве случаев были НЯ, связанные с олапарибом.
В когорте А pCR был достигнут у 68% пациентов, при RCB 0/I в 72%, в когорте В pCR зарегистрирован у 80% больных, при RCB 0/I в 84%.
Диссеминированный гормонозависимый HER2-негативный рак молочной железы
SERENA6 – исследование III фазы, посвященное изучению еще одного перорального SERD камизэстранта в комбинации с iCDK4/6 в первой линии терапии диссеминированного РМЖ у больных с мутацией в гене ESR1. Из предыдущих исследований, в которых изучались различные режимы терапии РМЖ с мутацией ESR1, мы знаем, что ингибиторы ароматазы (ИА) обладают низкой эффективностью в этой клинической ситуации. Напомню: мутация в гене ESR1 РМЖ в большинстве является приобретенной и появляется примерно у 40% пациентов, получающих ИА.
В нескольких работах продемонстрирована эффективность пероральных SERD (эласестрант, имлунестрант) у больных диссеминированным ГР+ HER2- РМЖ с мутацией в гене ESR1.
В рамках исследования SERENA6 изучалась польза от раннего перехода с терапии ИА на камизестрант с продолжением прежнего iCDK4/6 после обнаружения мутации ESR1 в цДНК, но до прогрессирования заболевания.
В исследование скринировались пациенты с ГР+ HER2-негативным РМЖ (n=3256), которые должны были получать не менее шести месяцев терапию первой линии на основе ингибиторов ароматазы (анастрозола или летрозола) в комбинации с iCDK4/6 (абемациклибом, палбоциклибом или рибоциклибом). Пациенты проходили тестирование цДНК в соответствии с графиком для выявления мутаций ESR1. При выявлении мутации ESR1 у пациентов без прогрессирования заболевания (n=495) больным предлагалось принять участие в исследовании. Далее пациенты (n=315) рандомизировались (1:1) в две лечебные группы:
- n=157: камизестрант в комбинации с прежним ингибитором CDK4/6;
- n=158: продолжение приема ИИ с прежним ингибитором CDK4/6.
Первичной конечной точкой была медиана ВБП, вторичными – медиана ВБП2, общая выживаемость (ОВ) и безопасность.
Среднее время от начала приема ИА в комбинации с iCDK4/6 до рандомизации составило почти два года (23 месяца). Около 3/4 пациенток принимали палбоциклиб, 15% – рибоциклиб и примерно 10% больных получали абемациклиб.
Медина ВБП в группе камизестранта и iCDK4/6 составила 16,6 мес. против 9,2 мес. в группе продолжения прежней терапии (ОР=0,46; 95% ДИ 0,34-0,62; p<0,00001), смена ИА на камизестрант позволила снизить риск прогрессирования на 54% (рис.3).
Рисунок 3.
Результаты исследования SERENA6.
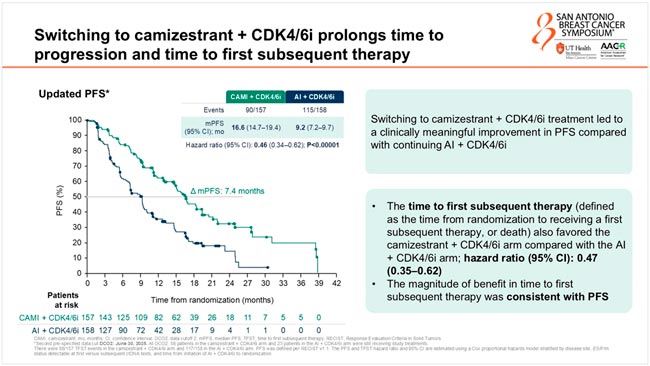
Интересно, что кривые выживаемости начали расходиться примерно во время первого контрольного обследования, и с течением времени дельта только увеличивается. Один из самых впечатляющих результатов для меня – это анализ контрольных точек через 12 и 24 месяца. Через 12 месяцев у вдвое большего числа пациентов в группе камизестранта и iCDK4/6 не наблюдалось прогрессирования заболевания.
Медиана ВБП2 (от момента начала терапии 1 линии до прогрессирования) достигла в группе камизестранта и iCDK4/6 25,7 мес. и 19,4 мес. в группе контроля (ОР=0,56; 95% ДИ 0,39-0,80; p<0,0015153).
НЯ 3 степени и выше были преимущественно представлены нейтропенией (26% и 17%), лейкопенией (8% и 1%) и анемией (5% и 8%), гематологическая токсичность в большей своей степени связана с терапией iCDK4/6.
Один из побочных эффектов, о котором сообщалось ранее при приеме камизестранта, – это брадикардия, она наблюдался менее чем у 10% пациентов. Фотопсии в виде вспышек света зарегистрированы у 21% больных. В основном это были вспышки очень низкой интенсивности, возникали, когда больные переходили из светлого помещения в темное; важно отметить, что пациентов это особо не беспокоило и они не прекращали прием из-за этого.
Для меня как для практикующего онколога одна из основных проблем в лечении гормонозависимого РМЖ – низкая эффективность эндокринотерапии у пациентов, ранее получавших iCDK4/6. На симпозиуме было представлено два интересных, на мой взгляд, исследования, позволяющих определить стратегию лечения в данной клинической ситуации.
Первое исследование – EPIK-B5. Это рандомизированное исследование III фазы, в котором изучалась комбинация алпелисиба с фулвестрантом у больных диссеминированным ГР+ HER2-негативным РМЖ с клинически значимой мутацией в гене PIK3CA с зарегистрированным прогрессированием во время или после приема ингибиторов ароматазы в комбинации с iCDK4/6.
Пациенты должны были иметь не менее одного измеримого очага, в анамнезе не более одной предшествующей линии химиотерапии (исключая неоадъювантную/
Первичной конечной точкой исследования была медиана ВБП, оцененная центральной командой, вторичными – медиана ОВ, ЧОО, длительность ответа, безопасность.
В работу было включено 188 больных, рандомизированных 1:1 в две лечебные группы:
- n=94: алпелисиб в комбинации с фулвестрантом;
- n=94: фулвестрант.
У большинства пациентов, включенных в исследование, были висцеральные метастазы (71,3% против 71,3%) и длительность приема ингибиторов ароматазы в комбинации с ICDK4/6 была более 6 мес. (86,2% и 89,4%).
Медиана ВБП в группе фулвестранта с алпелисибом составила 7,4 мес. против 2,8 мес. (p<0,0001) в группе только фулвестранта, добавление алпелисиба позволило снизить риск прогрессирования на 48% (рис.4). ЧОО в лечебных группах составила 23,4% и 4,3% соответственно.
Рисунок 4.
Результаты исследования EPIK-B5.
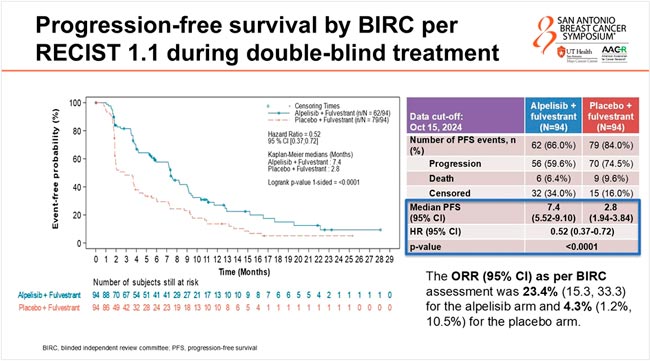
Для меня впечатляющими являются результаты ОВ: добавление алпелисиба позволило увеличить статистически значимо медиану ОВ с 23,8 до 29,5 мес. (ОР=0,64; 95% ДИ 0,41-0,99; p<0,021). И это с учетом того, что в группе только фулвестранта после прогрессирования 36,2% пациентов получали алпелисиб.
Токсичность алпелисиба всем известна и ожидаема, в группе с алпелисибом НЯ 3 степени и выше, такие как гипергликемия, были зарегистрированы у 32,6% больных, сыпь – у 13,0%, снижение аппетита – у 4,3% и диарея – у 2,2%., что привело к редукции дозы у 56,5% пациентов.
Еще одно исследование, о котором хотелось упомянуть, – это исследование evERA. На конгрессе были представлены обновленные данные.
evERA – это рандомизированное исследование III фазы, оценивающее эффективность и безопасность комбинации гиредестранта с эверолимусом в сравнении со стандартной ЭТ с эверолимусом у пациентов с ГР+ HER2-негативным диссеминированным РМЖ, которые ранее получали ЭТ в сочетании с ингибиторами CDK4/6.
Первичными конечными точками исследования были медиана ВБП в общей популяции и среди пациентов с мутацией в гене ESR1.
Примерно у 55% пациентов, включенных в исследование, была выявлена мутация в гене ESR1, что указывало на потенциальную резистентность к ЭТ (в частности, к ИА).
Комбинация эверолимуса с гиредестрантом продемонстрировала статистически значимое увеличение медианы ВБП в сравнении со стандартной ЭТ (экземестан, фулвестрант, тамоксифен) в тандеме с эверолимусом; так, в ITT популяции медиана ВБП составила 8,77 и 5,49 мес. соответственно (ОР=0,56; 95% ДИ 0,44-0,71; p<0,0001), а в популяции с мутацией в гене ESR1 медиана ВБП достигла 9,99 и 5,45 мес. (HR=0,38; 95% ДИ 0,27-0,54; p<0,0001).
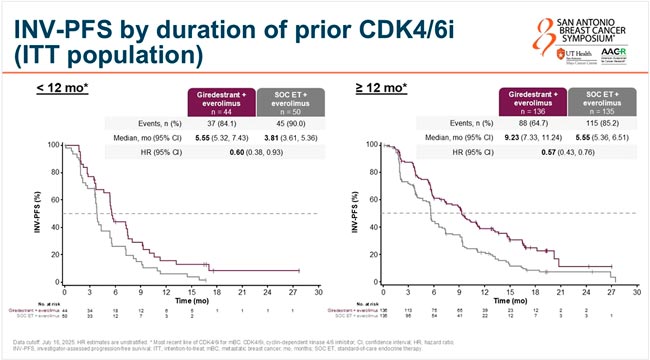
Длительность предшествующей гормонотерапии в комбинации с iCDK4/6 влияла на эффективность лечения (что в целом логично), в группе с длительностью ЭТ в комбинации iCDK4/6 менее 12 мес. медиана ВБП составила 5,55 мес. в группе гиредестранта и эверолимуса и 3,81 мес. в группе ЭТ и эверолимуса (HR=0,60; 95% ДИ 0,38-0,93), а в группе с длительностью предшествующей гормонотерапии с iCDK4/6 12 мес. и более медиана ВБП достигла 9,23 и 5,55 мес. (HR=0,57; 95% ДИ 0,43-0,76) соответственно (рис.5).
Рисунок 5.
Результаты исследования evERA.
Интересны результаты в когорте пациентов с альтерациями в сигнальном пути PIK3CA/AKT1/PTEN. В этой группе пациентов медиана ВБП составила 7,96 мес. в группе гиредестранта и эверолимуса и 5,36 мес. в группе ЭТ и эверолимуса (HR=0,54; 95% ДИ 0,38-0,77).
Интригующе результаты лечения в группе пациентов с мутацией в гене ESR1 и с альтерациями в сигнальном пути PIK3CA/AKT1/PTEN. В этой небольшой когорте медиана ВБП составила 10,15 мес. в группе гиредестранта и эверолимуса и 5,55 мес. в группе ЭТ и эверолимуса (HR=0,45; 95% ДИ 0,27-0,76).
Таким образом, можно говорить о том, что максимальный выигрыш от новой комбинации отмечен у пациентов с мутацией в гене ESR1 и с альтерациями в сигнальном пути PIK3CA/AKT1/PTEN.
Наиболее распространенными побочными эффектами, возникшими в группах гиредестранта и ЭТ, были стоматит (47,2% против 48,9% соответственно), диарея (26,9% против 22,6%) и анемия (23,6% против 21,0%). Брадикардия 1-2 степени наблюдалась у 3,8% пациентов, получавших гиредестрант, в сравнении с 0,5% в группе ЭТ.
Диссеминированный HER2-позитивный рак молочной железы
Одно из исследований, о котором надо обязательно сказать, – это исследование PATINA. Работа посвящена изучению объема поддерживающей терапии 1 линии при ГР+ HER2-позитивном диссеминированном РМЖ.
AFT-38 PATINA – рандомизированное исследование III фазы, в которое было включен 581 больной ГР+ HER2-позитивным диссеминированным РМЖ. Все пациенты ранее получили 6-8 циклов 1 линии терапии (таксаны/
В работе оценивалась целесообразность и безопасность добавления iCDK4/6, в частности палбоциклиба, к ГТ и анти-HER2 терапии.
- n=261: палбоциклиб + ГТ (летрозол, анастрозол, экземестан или фульвестрант) + трастузумаб ± пертузумаб;
- n=257: ГТ (летрозол, анастрозол, экземестан или фульвестрант) + трастузумаб ± пертузумаб.
Первичная конечная точка – медиана ВБП, вторичные – ОВ, ЧОО, КРО, выживаемость без метастазов в ЦНС, токсичность.
Средний возраст участников исследования составил 53,4 года, и большинство пациентов были женщинами (99,4%). Среднее количество циклов индукционной терапии составило 6 (диапазон 4-8). Почти все пациенты ранее получали пертузумаб (97,3%) и у 70,5% наблюдался полный или частичный ответ на терапию 1 линии.
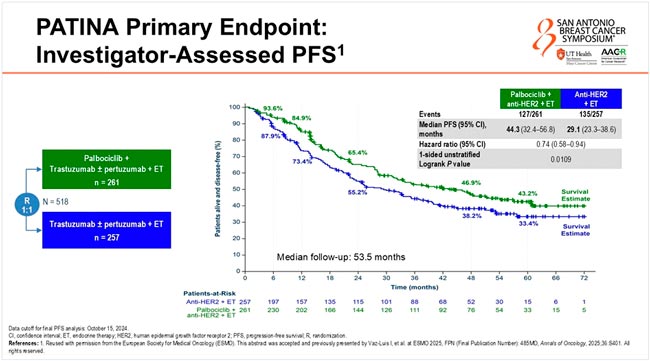
Добавление палбоциклиба к ЭТ и анти-HER2 терапии позволило увеличить медиану ВБП с 29,1 до 44,3 мес. (ОР=0,74; 95% ДИ 0,58-0,94; p<0,0109) (рис.6).
Рисунок 6.
Результаты исследования PATINA.
В представленном анализе показано, что добавление палбоциклиба к терапии у пациентов без метастазов в ЦНС на скрининге позволило снизить риск метастазов в ЦНС к 36 мес. с 19,2% до 13,2% (p=0,00378).
И еще одно важное и актуальное исследование, посвященное качеству жизни здоровых пациенток с мутациями в генах BRCA1 или BRCA2.
Использование заместительной гормональной терапии у женщин в менопаузе с мутациями в генах BRCA1 или BRCA2 не было связано с повышением риска РМЖ согласно результатам проспективного анализа, представленного на симпозиуме Сан-Антонио 2025 года. Авторы подчеркивают, что это особенно актуально для пациенток, выполнивших профилактическую сальпинго-оофрэктомию.
Сальпинго-оофрэктомия приводит к мучительной ранней менопаузе, которая, в свою очередь, сопряжена с приливами, депрессией, расстройством сна, слабостью, снижением памяти, ранним остеопорозом, сухостью во влагалище, диспареунией, дизурией, миалгией и артралгией.
При медиане наблюдения в 5,6 года среди женщин, получавших гормонотерапию, было 87 случаев РМЖ (12,9%) против 128 (18,9%) в когорте тех, кто ее не получал (p=0,002). Также было показано, что у пациенток, получавших ЗГТ препаратами эстрогенов, отмечено статистически значимое снижение риска РМЖ (ОР=0,37; 95% ДИ 0,24-0,57), а при использовании комбинированной ЗГТ (эстрогены + прогестерон) снижения риска РМЖ не отмечено (ОР=1,14; 95% ДИ 0,21-6,22).
Источники:
- Bardia A, Schmid P, Martín M, et al. Giredestrant vs standard-of-care endocrine therapy as adjuvant treatment for patients with estrogen receptor-positive, HER2-negative early breast cancer: Results from the global phase III lidERA Breast Cancer trial Presented at: 2025 San Antonio Breast Conference Symposium; December 9-12, 2025; San Antonio, TX. Abstract 1.GS1-10.
- De Laurentiis M, Magalhaes Ferreira A, Gilgorov J, et al. Alpelisib plus fulvestrant for PIK3CA-mutated, HR-positive, HER2-negative advanced breast cancer after a CDK4/6 inhibitor (EPIK-B5): phase III, randomized, double-blind, placebo-controlled, multicenter study. Presented at: 2025 San Antonio Breast Conference Symposium; December 9-12, 2025; San Antonio, TX. Abstract RF7-02.
- Rugo HS, Tolaney SM, Jhaveri KL, et al. Clinical and biomarker subgroup analysis of evERA Breast Cancer: A Phase III trial of giredestrant plus everolimus in patients with estrogen receptor-positive, HER2-negative advanced breast cancer previously treated with a CDK4/6 inhibitor. Presented at the 2025 San Antonio Breast Cancer Symposium; December 9-12, 2025; San Antonio, TX. Abstract GS3-09.
- Bidard F, Mayer EL, Park Y, et al. Updated results and an exploratory analysis of ESR1m circulating tumor DNA (ctDNA) dynamics from SERENA-6, a phase 3 trial of camizestrant (CAMI) + CDK4/6 inhibitor (CDK4/6i) for emergent ESR1 mutations (ESR1m) during first-line (1L) endocrine-based therapy and ahead of disease progression in patients (pts) with HR+/HER2- advanced breast cancer (ABC). Presented at SABCS 2025. December 9-12, 2025. San Antonio, Texas. Abstract RF7-03.
- Meteger O. Central Nervous System Outcomes from the Phase III PATINA (AFT-38). Presented at SABCS 2025. December 9-12, 2025. San Antonio, Texas.
- Tung N, Stradella A, Brufsky A, at al. OlimpiaN: A Phase 2, multicenter, open-label study to assess the efficacy and safety of neoadjuvant Olaparib monotherapy and Olaparib plus durvalumab in patients with BRCA mutations and early-stage HER2-negative breast cancer. Presented at SABCS 2025. December 9-12, 2025. San Antonio, Texas.
- Kotsopoulos J, Seca M, Jacek G, et al. Menopausal Hormone Therapy and the Risk of Breast Cancer in Women with a Pathogenic Variant in BRCA1 or BRCA2. Presented at: 2025 San Antonio Breast Conference Symposium; December 9-12, 2025; San Antonio, TX. Abstract GS3-01.
- Johnston SRD, et al. Abemaciclib plus endocrine therapy for hormone receptor-positive, HER2-negative, node-positive, high-risk early breast cancer (monarchE): results from a preplanned interim analysis of a randomised, open-label, phase 3 trial. The Lancet Oncology. December 6, 2022; 24(1): 77-90. https://doi.org/
10.1016/ .S1470-2045(22)00694-5 - Slamon D, et al. Ribociclib plus Endocrine Therapy in Early Breast Cancer. N Engl J Med. 2024 Mar 21; 390 (12): 1080-1091. https://doi.org/
10.1056/ .nejmc2404917
НОВОСТИ ESMO 2025 / НОВОСТИ ESMO 2025: ЖКТ
Авторы: Деньгина Наталья Владимировна
Заведующая радиологическим отделением ГУЗ «ОКОД», директор Центра лучевой терапии «R-Spei»,
член правления RUSSCO, главный редактор Газеты RUSSCO и сайта RosOncoWeb, кандидат медицинских наук,
Ульяновск
Абдулаева Рукият Шамильевна
Врач онколог отделения противоопухолевой лекарственной терапии №2,
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России,
Москва
2025 год – юбилейный для ESMO. За 50 лет Общество стало флагманом не только европейской, но и мировой онкологической науки и практики, насчитывая более чем 45 тысяч членов. Ежегодно на конгрессе исследователи со всего мира представляют результаты наиболее ожидаемых исследований по лечению опухолей различных локализаций.
Конгресс ESMO 2025 действительно стал рекордным: 37 000 участников из 174 стран, 213 сессий, 661 спикер, 2927 представленных абстрактов, из них 112 в качестве Late Breaking Abstracts, и так далее.
Первый день конгресса представил данные нескольких проспективных РКИ, в том числе и по опухолям верхних отделов ЖКТ. Если кратко: в то время как биспецифическое антитело, нацеленное на HER2, продемонстрировало более продолжительную выживаемость у пациентов с ранее леченным раком желудка, комбинации ИТК и иммунотерапии не смогли обеспечить улучшение выживаемости больных раком желудка и гастроэзофагеального перехода (ГЭП).
Результаты трех исследований III фазы, представленных на Конгрессе ESMO 2025, выявили как прогресс, так и сохраняющиеся проблемы в лечении HER2-положительного рака желудка или гастроэзофагеального перехода (РЖ/ГЭП), а также ранее не леченного метастатического плоскоклеточного рака пищевода или запущенного РЖ/ГЭП.
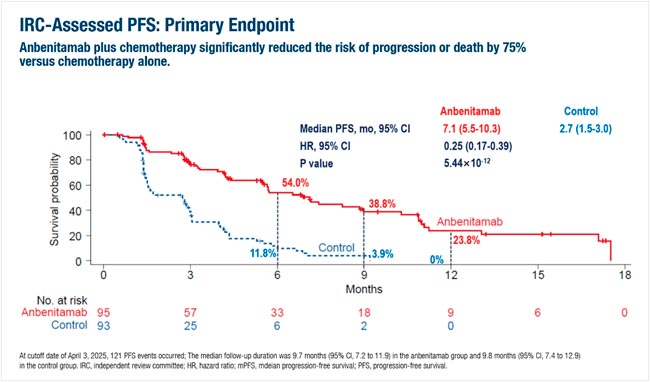
Промежуточный анализ китайского исследования KC-WISE II/III фазы с участием 188 пациентов с HER2-положительным раком желудка/ГЭП, у которых предыдущая терапия с трастузумабом оказалась неэффективной, вызвал наибольший интерес. HER2-позитивные опухоли желудка и ГЭП по статистике составляют 15-20% от их общего числа. Авторы показали на азиатской популяции, что добавление нового биспецифического антитела к HER2 анбенитамаба к химиотерапии значительно улучшило медиану выживаемости без прогрессирования (mPFS; 7,1 мес. по сравнению с 2,7 мес.) и медиану общей выживаемости (mOS; 19,6 мес. по сравнению с 11,5 мес.) – вторичные конечные точки – по сравнению с одной химиотерапией (LBA78, основные результаты представлены ниже). Однако применение комбинации препаратов сопровождалось более высокой частотой нежелательных явлений 3-й степени тяжести и выше, связанных с лечением.
«Эти результаты обнадёживают, – отмечает д-р Maria Alsina из Университетской больницы Наварры (Памплона, Испания). – Однако ограниченный размер исследования и географическое ограничение только китайскими центрами потребуют дальнейшей международной валидации, прежде чем будут рассмотрены варианты изменения реальной клинической практики». Она также призвала к осторожности при интерпретации преимуществ, указав, что показатели контрольной группы оказались хуже ожидаемых по сравнению с другими исследованиями, такими как исследование DESTINY-Gastric04 (N Engl. J Med. 2025; 393: 336-348). «Это повышает вероятность того, что эффективность анбенитамаба могла быть переоценена, – объясняет она. – Тем не менее, эти многообещающие результаты анбенитамаба представляют собой шаг вперед, и вместе с продолжающимися исследованиями в отношении других новых методов лечения, направленных на HER2, они, вероятно, помогут сформировать будущий ландшафт лечения пациентов с HER2-положительным раком желудка».
Краткие результаты:
N=188 (anbenitamab + ХT: n=95; ХT: n=93).
Сравнение Anbenitamab + ХT против ХT:
- mВБП 7,1 против 2,7 мес.; HR 0,25; p<0,00001;
- mOВ: 19,6 против 11,5 мес.; HR 0,29; p<0,00001;
- IRC-ORR: 55,8% против 10,8%; mDoR: 8,2 против 2,9 мес.
Осложнения Grade ≥3, связанные с лечением: 60,6% против 51,6%. при этом кардиотоксичность была невысокой и абсолютно одинаковой между группами – 3,2%.
Рисунок 1.
Комбинированное лечение анбенитамаб плюс химиотерапия значительно продлило ВБП по сравнению с одной химиотерапией у пациентов с HER2-положительным раком GC/GEJC, у которых предыдущая терапия на основе трастузумаба оказалась неудачной – исследование KC-WISE, независимая оценка экспертов (Конгресс ESMO 2025, LBA78).
Подгрупповой анализ ВБП и ОВ показал преимущества экспериментального метода во всех подгруппах пациентов.
Менее благоприятные результаты были получены в многорукавном исследовании III фазы LEAP-014, где добавление ИТК ленватиниба к пембролизумабу и химиотерапии не улучшило медиану ОВ по сравнению с комбинацией пембролизумаба и химиотерапии (17,6 против 15,5 мес.) у 850 пациентов с нелеченым метастатическим плоскоклеточным раком пищевода, что привело к прекращению исследования в связи с его нецелесообразностью (LBA79, основные результаты ниже). Предыдущий промежуточный анализ исследования показал, что комбинация переносилась с приемлемой токсичностью (Ann Oncol. 2023; 34: S863).
«Эти результаты эффективности согласуются с отсутствием преимущества в общей выживаемости, наблюдавшимся при использовании этой комбинации в исследовании LEAP-015 при аденокарциноме желудка (J Clin Oncol. 2025; 43: 2502-2514), несмотря на то, что доклинические модели предполагали потенциальную синергию между этими методами лечения», – говорит рецензент д-р Maria Alsina. Однако она добавляет: «Будет интересно увидеть анализы подгрупп из LEAP-014, чтобы выяснить, есть ли какие-либо потенциальные преимущества в субпопуляциях с положительным геном PD-L1».
Итак, результаты:
N=850 (lenvatinib + pembrolizumab + ХT: n=423; pembrolizumab + ХT: n=427).
Lenvatinib + pembrolizumab + ХT vs pembrolizumab + ХT:
- медиана периода наблюдения: 22,1 мес. (ITT population, IA2);
- mOS: 17,6 против 15,5 мес.; HR 0,92; p=0,1852;
- mPFS: 7,2 против 6,9 мес.; HR 0,89;
- ORR: 62,2% против 54,8%; mDoR: 8,1 против 6,8 мес.;
- Grade ≥3 токсичности – 81,2% против 79,1%.
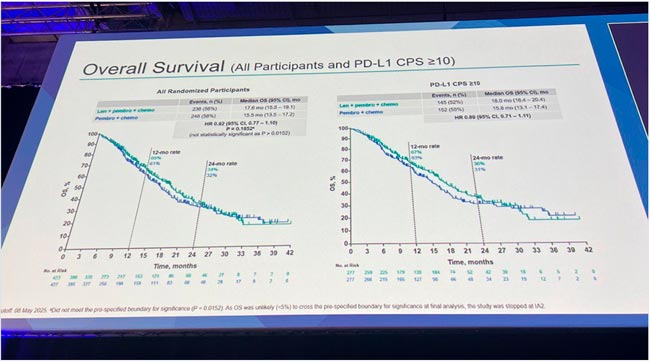
Рисунок 2.
Показатели ОВ во всей когорте и в подгруппе с PD-L1 CPS ≥10.
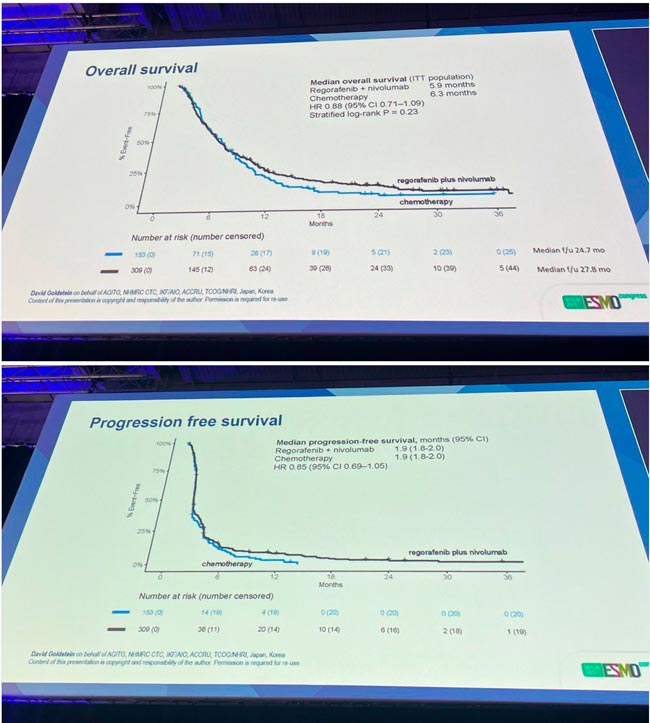
Аналогичным образом, небольшое улучшение общего ответа и показателей контроля заболевания наблюдалось при применении ИТК регорафениба в сочетании с ниволумабом (режим REGONIVO) у 462 пациентов с рефрактерным нерезектабельным или метастатическим раком желудка/ГЭП, ранее проходивших интенсивное лечение, в исследовании III фазы INTEGRATE IIb (LBA80, основные результаты представлены ниже). Продолжительность mOВ составила всего 5,9 мес. при использовании комбинации по сравнению с 6,3 мес. при использовании химиотерапии, выбранной исследователем, в то время как mВБП составила 1,9 мес. в обеих группах лечения. Обоснованием для применения INTEGRATE IIb стали многообещающая противоопухолевая активность и контролируемая токсичность, наблюдавшаяся при использовании этой комбинации в исследовании Ib фазы REGONIVO (J Clin Oncol. 2020; 38: 2053-2061). Эти результаты разочаровывают, учитывая неблагоприятный прогноз у пациентов с раком желудка/ГЭК и острую необходимость в эффективных вариантах лечения после двух линий системной терапии.
N=462 (regorafenib-nivolumab: n=309; ХT: n=153).
Regorafenib-nivolumab vs CT:
- mOВ: 5,9 против 6,3 мес.; HR 0,88; p=0,23;
- mВБП: 1,9 против 1,9 мес.; HR 0,85;
- ORR: 7,4% против 2,6%; mDoR: 9,5 против 6,3 мес.;
- Grade ≥3 AEs: 70,0% против 49,3%.
Рисунок 3, 4.
Показатели ОВ и ВБП в группах.
Учитывая гетерогенность рака ЖКТ, по словам рецензента, будущее лечения лежит в разработке терапии, контролируемой биомаркерами. «Такие точные стратегии могут позволить нам разрабатывать схемы лечения без химиотерапии, минимизировать ненужную токсичность и, в конечном итоге, обеспечить долгосрочные клинические преимущества при этой трудно поддающейся лечению и весьма разнообразной группе заболеваний».
Наконец, два исследования 3 фазы – MATTERHORN и SKYSCRAPER – были представлены как наиболее ожидаемые.
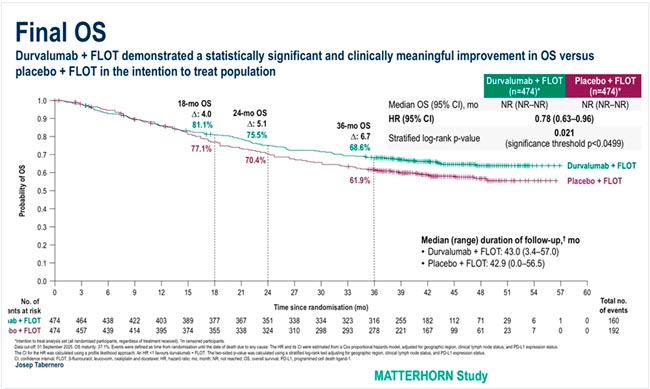
Профессор Josep Tabernero представил финальные результаты по ОВ и связи полного патоморфологического ответа с бессобытийной выживаемостью в исследовании MATTERHORN. В нем 948 больных резектабельным раком желудка или ГЭП II-IVA стадии были рандомизированы на 2 курса неоадъювантного FLOT + плацебо либо FLOT + дурвалумаб с последующей операцией и адъювантом в виде еще 2 курсов по прежней схеме и консолидации дурвалумабом или плацебо (10 введений).
В итоге комбинация FLOT+Д продемонстрировала достоверные преимущества в ОВ в ITT-популяции (HR 0,78, p=0,021) вне зависимости от статуса PD-L1. При этом полный патоморфологический ответ был достигнут у 16,5% больных, а MPR – у 25,8%.
Рисунок 5.
ОВ в подгруппах по данным MATTERHORN.
По сути, любой ответ на экспериментальное лечение давал пациентам преимущество в бессобытийной выживаемости.
Рисунок 6.
Бессобытийная выживаемость в зависимости от патоморфологического ответа.
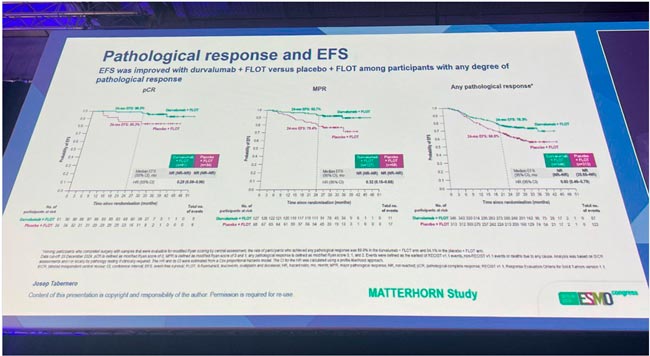
Рисунок 7.
Подгрупповой анализ общей выживаемости.
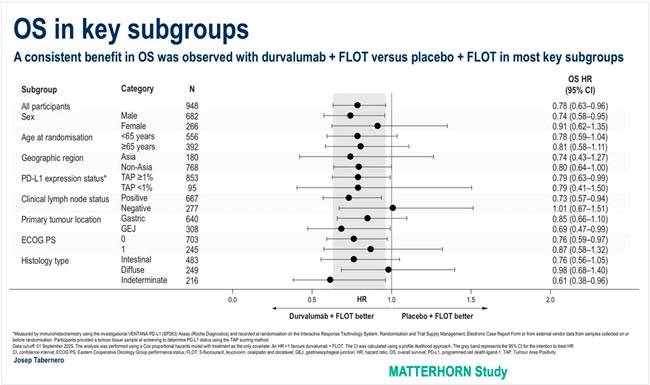
Рецензенты полагают, что результаты данного исследования в ближайшем будущем изменят существующую практику в отношении резектабельного рака желудка или ГЭП – в отличие от исследования SKYSCRAPER-07, оценившего эффективность добавления атезолизумаба или комбинации тираголумаба (анти-TIGIT моноклонального антитела) с атезолизумабом в сравнении с плацебо у больных нерезектабельным плоскоклеточным раком пищевода после радикального химиолучевого лечения.
В итоге клинические преимущества оказались на стороне атезолизумаба после ХЛТ в сравнении с плацебо, а комбинация не выявила никаких плюсов в результатах, хотя профиль токсичности ее оказался вполне приемлемым.
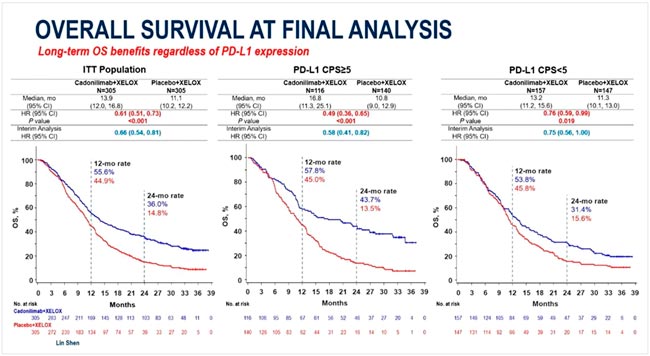
На конгрессе ESMO 2025 были представлены результаты китайского исследования III фазы COMPASSION-15, в котором оценивалась эффективность cadonilimab – новой биспецифической молекулы, направленной на PD-L1 и CTLA-4, в первой линии терапии метастатического или местнораспространенного нерезектабельного рака желудка и пищеводно-желудочного перехода.
Cadonilimab представляет собой первое в мире биспецифическое антитело двойной иммуноактивации, сочетающее механизмы блокирования PD-L1 и CTLA-4 в одной молекуле.
В данном исследовании пациентов рандомизировали на терапию XELOX + cadonilimab и плацебо + XELOX в первой линии терапии. Добавление cadonilimab обеспечило статистически значимое улучшение показателей выживаемости:
- медиана ВБП – 8,6 против 6,1 мес. (HR 0,70; p=0,002);
- медиана ОВ – 16,9 против 13,2 мес. (HR 0,74; p=0,009).
Клинический эффект наблюдался как у пациентов с экспрессией PD-L1≥1%, так и у незначительного количества пациентов с PD-L1-негативными опухолями.
Рисунок 8.
Показатель выживаемости без прогрессирования.
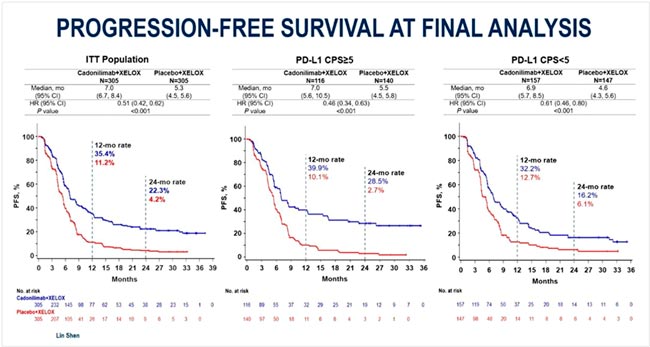
Рисунок 9.
Показатель общей выживаемости.
Профиль токсичности оказался приемлемым: общая частота нежелательных явлений 3-4 степени составила около 40% и была сопоставима между группами cadonilimab + XELOX и плацебо + XELOX. Наиболее частыми осложнениями были нейтропения, анемия и лейкопения.
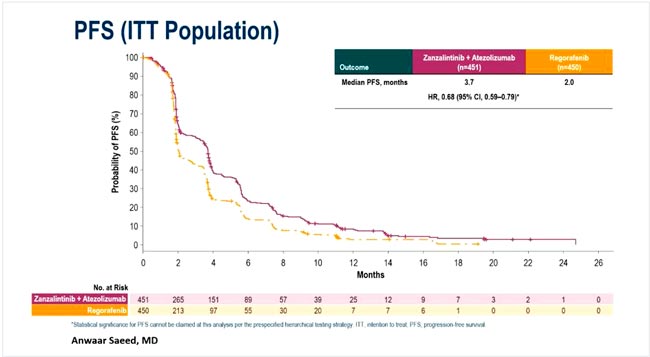
В исследовании III фазы STELLAR-303 оценивалась эффективность комбинации занзалитиниба (Zanza) – мультитирозинкиназного ингибитора MET, VEGFR и TAM-рецепторов (TYRO3/AXL/MER) – с атезолизумабом у предлеченных пациентов с микросателлитно-стабильным (MSS/pMMR) метастатическим колоректальным раком (мКРР).
Пациенты (n=901) были рандомизированы в соотношении 1:1 на терапию Zanza 100 мг + атезолизумаб 1200 мг либо регорафениб. Характеристики групп были сопоставимы; 82% пациентов ранее получали анти-VEGF-терапию.
При медиане наблюдения 18 месяцев комбинация продемонстрировала статистически значимое увеличение выживаемости:
- ОВ – 10,9 против 9,4 мес. (HR 0,80; 95% ДИ 0,69-0,93; p=0,0045);
- ВБП – 3,7 против 2,0 мес. (HR 0,68; 95% ДИ 0,59-0,79).
Рисунок 10.
Показатель общей выживаемости.
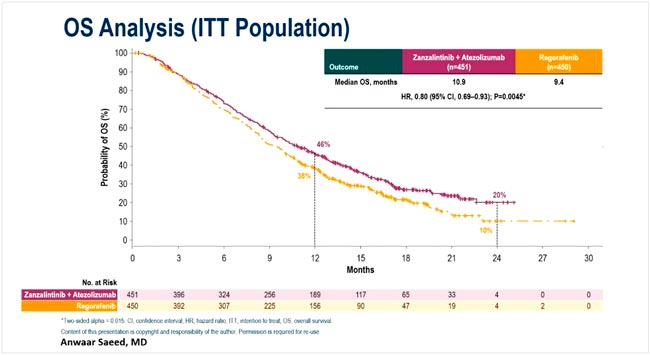
Рисунок 11.
Показатель выживаемости без прогрессирования.
Профиль безопасности оказался менее благоприятным: нежелательные явления 3-4 степени отмечены у 59% пациентов против 37% в группе регорафениба. При всей статистической значимости результатов, клинический эффект комбинации Zanza и атезолизумаба остается скромным, что не позволяет говорить о существенном изменении терапевтической парадигмы в MSS-популяции.
НОВОСТИ ESMO 2025: ГЕРМИНОГЕННЫЕ ОПУХОЛИ
Автор: Исраелян Эдгар Рудикович
Врач-онколог онкологического отделения лекарственных методов лечения (химиотерапевтическое) №4
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
Герминогенные опухоли часто остаются вне контекста крупных рандомизированных исследований и широкого внимания публики, однако в таких сообществах, как RUSSCO, ESMO и ASCO, им посвящаются отдельные доклады и целые ряды на постерной сессии. Так давайте рассмотрим представленные работы на конференции ESMO 2025.
Ранние стадии
Обновленные данные исследования SAKK 01/10: 1 курс карбоплатина + ЛТ при семиномных герминогенных опухолях (СГО) стадии IIA/IIB
Для пациентов с метастатическими СГО IIA (поражение л/у ≤2,0 см) и IIB (поражение л/у>2 см и до ≤5 см) стадий предусмотрено несколько вариантов лечения: лучевая терапия (ЛТ) на парааортальные и ипсилатеральные подвздошные области, химиотерапия (ХТ) согласно группе прогноза по IGCCCG, хирургическое лечение – ЗЛАЭ [1,2].
Пациенты с СГО высокочувствительны не только к ХТ, но и ЛТ. Именно поэтому исторически большинство пациентов с IIA/IIB стадиями получали ЛТ. Затем тренд сменился в пользу ХТ, так как при данном подходе наблюдается схожая эффективность лечения, но меньшая частота вторичных злокачественных новообразований, а также отдаленных нежелательных явлений (НЯ) [3]. Тем не менее, вопрос о роли ЛТ в лечении ранних стадий СГО все еще оставался открытым.
В мультицентрическое (20 центров Швейцарии и Германии) исследование SAKK 01/10 включались пациенты с СГО IIA/IIB стадиями. Им проводилось 1 введение карбоплатина AUC7, далее – ЛТ на зоны пораженных л/у: при IIA стадии – 30 Гр, при IIB стадии – 36 Гр. Первичная конечная точка – 3-летняя выживаемость без прогрессирования (ВБП).
Первые результаты работы были представлены в 2022 году [4]. Согласно статистической гипотезе, для подтверждения эффективности ЛТ необходимо достичь 3-летнюю ВБП в 95%, а при медиане 4,5 года продемонстрировано 93,7%, ввиду чего исследование признано негативным.
На конгрессе представлены данные 8-летнего периода наблюдения за пациентами. Десятилетняя ВБП составила 92,8%, 10-летняя общая выживаемость (ОВ) – 99,1%, опухоль-специфическая выживаемость – 100% (рис.1).
Рисунок 1.
Обновленные результаты исследования SAKK 01/10.
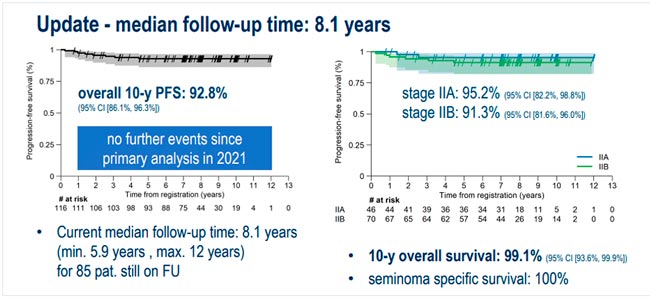
За весь период наблюдения у 4 пациентов развилась контралатеральная ГО яичка I стадии. Также у 4 пациентов отмечены иные первичные злокачественные опухоли: рак почки, холангиокарцинома, рак мочевого пузыря и рак предстательной железы, базальноклеточный рак. Все опухоли развились за пределами проведенной ЛТ.
Как относиться к столь высоким результатам негативного исследования? Ответить трудно. Для сравнения: согласно обновленным данным консорциума IGCCCG, 5-летняя ВБП и ОВ для пациентов с СГО благоприятного прогноза (преимущественно представлены именно пациентами IIA и IIB стадий) составила 89% и 95% [5]. Отразятся ли данные SAKK 01/10 на рекомендациях крупных сообществ? Ждем обновлений.
Первичная забрюшинная лимфаденэктомия при клинической IIB стадии СГО – результаты двух крупных центров
Хирургическое лечение, являясь одной из опций лечения ранних стадий СГО, также задвинуто на второй план ХТ. Ведь высокоэффективная ХТ позволяет избежать ЗЛАЭ и связанных с ней осложнений (в том числе ретроградной эякуляции).
Коллегами из Кельнского университетского госпиталя и Университета южной Калифорнии представлен ретроспективный анализ, включивший 40 пациентов с СГО IIB стадии, с нормальной концентрацией онкомаркеров (АФП, бета-ХГЧ, ЛДГ до 1,5×ВГН) перед хирургическим лечением, а также с отсутствием адъювантной ХТ после ЗЛАЭ.
При медиане наблюдения 26,5 мес. рецидив заболевания отмечен у 9 пациентов (22,5%) (у 5 из них рN3), в зоне оперативного вмешательства у 5 (55,5%) пациентов, медиана времени до рецидива составила 10 мес. Безрецидивная выживаемость (БРВ) оказалась значительно ниже при рN3-статусе опухоли. Двухлетняя БРВ составила 20% при pN3 и ≈87% при рN1/N2 (рис.2). Все пациенты были излечены при проведении 1-й линии ХТ в режиме ВЕР.
Рисунок 2.
Основные результаты исследования.
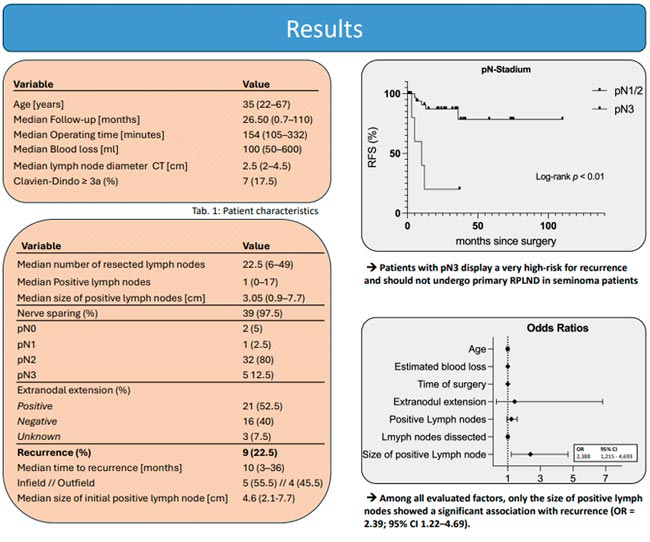
Финальные данные проспективного исследования COTRIMS – забрюшинная лимфаденэктомия (ЗЛАЭ) при метастатической СГО
В данную работу включались пациенты с СГО IIA и IIB стадий, нормальной концентрацией онкомаркеров, которым проводилась первичная ЗЛАЭ. Проведение адъювантной ХТ не допускалось.
Хирургическое лечение проведено 34 пациентам: сIIA – 22 (65%) пациента, cIIB – 12 (35%). При медиане наблюдения 54,2 мес. БРВ составила 88,3%, рецидив заболевания отмечен у 4 пациентов через 4,6,9 и 12 мес. после хирургии. ОВ – 100%. У 3 пациентов по данным планового гистологического исследования не получено данных за злокачественный рост, у 1 обнаружена эмбриональная карцинома. Антеградная эякуляция сохранена у 88% пациентов. Средняя длительность госпитализации – 4,5 (3-9) дня. Осложнения IIIA степени по Clavien-Dindo у 4 пациентов, IIIB-V степеней не отмечено. Все пациенты с рецидивом заболевания получили первую линию ХТ в режиме ВЕР в рамках благоприятного прогноза по IGCCCG (рис.3).
Рисунок 3.
Финальные результаты COTRIMS.

Согласно первичной конечной точке – число рецидивов ≤20% при двухлетнем наблюдении [6] – исследование является позитивным. В то же самое время на работу можно посмотреть и под другим углом – 88% пациентов не получили системной противоопухолевой терапии, обладающей как непосредственной, так и отдаленной токсичностью! Препятствием широкому внедрению данного метода в реальную клиническую практику служит тот факт, что оперативное вмешательство должно проводиться в высокоспециализированных центрах, обладающих опытом проведения данного вмешательства. Доступ к ХТ во многих регионах в разы выше. К тому же нельзя забывать, что у 12% пациентов после хирургии разовьется ретроградная эякуляция, резко снижающая качество жизни. Для некоторых пациентов это может стать бо́льшим НЯ, чем токсичность 3 курсов ХТ.
В любом случае, результаты проспективного исследования подтверждают эффективность хирургии, и данная опция может обсуждаться с пациентами при выборе того или иного метода лечения.
Первичная ЗЛАЭ у пациентов с несеминомными ГО (НГО) стадий IIA и IIB
НГО обладают более агрессивным течением, чем СГО, даже на ранних стадиях. С начала 2000-х годов все большему числу пациентов с НГО IIA/IIB стадий стали проводить на первом этапе ХТ, а не ЗЛАЭ, что отразилось на улучшении отдаленных результатов при непрямом сравнении [7].
В проспективное исследование, проведенное на базе Кельнского университетского госпиталя (да, снова они), включены пациенты с НГО IIA/IIB стадий и нормальной концентрацией онкомаркеров, которым на первом этапе проведена ЗЛАЭ. Адъювантная ХТ не предполагалась. Первичная конечная точка – ВБП и послеоперационные гистологические результаты.
В работу включено 60 пациентов. Средняя длительность оперативного вмешательства – 131 мин., средний срок госпитализации – 4,5 (4-9) дня, у 13% пациентов осложнения IIIA степени по Clavien-Dindo, антеградная эякуляция сохранена у 89% пациентов. Патоморфологическая IIA стадия у 30 (50%) пациентов, рIIB – у 20 (33,3%), рN0 – у 10 (16,7%). Рецидив заболевания отмечен у 7 пациентов (11,6%) (рис.4).
Рисунок 4.
Результаты исследования.

Патоморфологические результаты: рN0 – 17%, семинома – 3%, несеминома – 80% (тератома 8%, эмбриональный рак 40%, опухоли смешанного строения 32%) (рис.5).
Рисунок 5.
Результаты патоморфологического исследования.
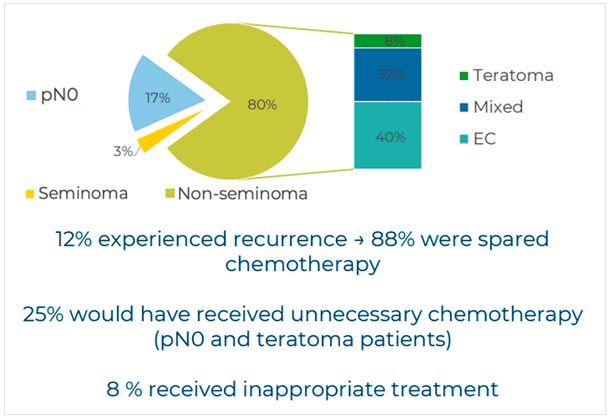
Что имеем в итоге: 88% пациентов не получили ХТ на момент представления данных (жаль, что не указана медиана наблюдения), 25% пациентов (pN0, гистологически тератома) избежали ненужной ХТ.
Ситуация аналогична вышеуказанным хирургическим исследованиям. Мы можем обсуждать с пациентами первичную ЗЛАЭ только при следующих условиях: нормальная концентрация маркеров, оперативное вмешательство в высокоспециализированных центрах, пациент осознает риск развития ретроградной эякуляции.
Распространенные стадии
«Стабилизационный» первый курс ХТ у пациентов с НГО сверхвысокого риска: оценка осложнений и влияния на выживаемость
Около трети пациентов с диссеминированными НГО неблагоприятного прогноза по IGCCCG имеют признаки сверхвысокого риска (СВР) (АФП ≥100000 нг/мл, бета-ХГЧ ≥200000 мМЕ/мл, осложнения опухолевого процесса, неудовлетворительный соматический статус). Проведение первого курса ХТ в полных дозах в режиме ВЕР таким пациентам ассоциировано с повышенным риском развития НЯ. Ввиду этого пациентам СВР необходимо проведение 1-го курса ХТ в «стабилизационном» варианте ЕР [1]. Наибольшая доказательная база по данному вопросу отражена в ретроспективном исследовании, проведенном на базе НМИЦ онкологии им. Н.Н. Блохина Трякиным А.А. [8], где показано, что подобный «стабилизационный» подход снижает число жизнеугрожающих осложнений и не ухудшает отдаленные результаты лечения. Однако это не подтверждается в других работах [9].
В этом году на постерной сессии конференции коллегами из НМИЦ представлена работа по данной проблеме, но с увеличенным периодом наблюдения и числом включенных пациентов: 58 в группе СВР и «стабилизации», 45 – в группе СВР и полнодозовым 1 курсом ХТ, 127 – пациенты неблагоприятного прогноза, но без факторов СВР.
При медиане наблюдения за всеми пациентами 76 мес. продемонстрировано отсутствие различий в ВБП (1-летняя ВБП 39,3% против 64,3%; ОР 0,72; 95% ДИ 0,42-1,24) и ОВ (1-летняя ОВ 71,7% vs 73,2%; ОР 0,98; 95% ДИ 0,55-1,75) между группами СВР: «стабилизационного» и полнодозового первого курса ХТ. Отдаленные результаты статистически значимо выше в группе пациентов неблагоприятного прогноза без СВР в сравнении с пациентами СВР (рис.6).
Рисунок 6.
Общая выживаемость и выживаемость без прогрессирования.
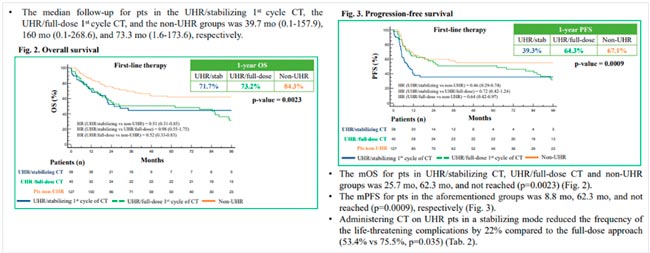
Проведение «стабилизационного» курса ХТ позволило снизить частоту жизнеугрожаюших осложнений (таких как, фебрильная нейтропения, ТЭЛА, кровотечение, ухудшение дыхательного статуса) на 22% (с 75,5% до 53,4%; р=0,035) (рис.7).
Рисунок 7.
Результаты исследования.
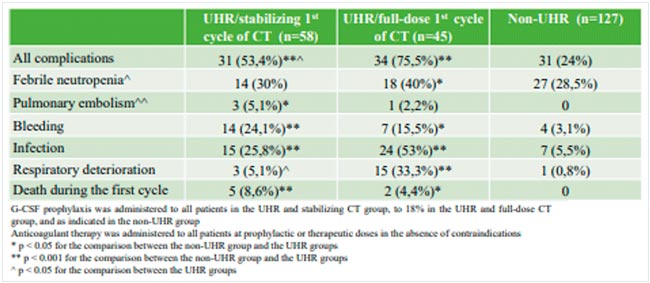
Таким образом, проведение первого курса ХТ в «стабилизационном» варианте не ухудшает онкологические результаты в группе пациентов СВР, при этом снижает число жизнеугрожающих осложнений. Пациенты неблагоприятного прогноза по IGCCCG без СВР, получившие стандартный дозовый первый курс ХТ, имеют наилучший прогноз.
Гистотип-направленная ХТ при злокачественной соматической трансформации тератомы: многоцентровой ретроспективный анализ
Злокачественная соматическая трансформация тератомы (ЗСТТ) – довольно редкое событие, но с крайне агрессивным течением [10]. Оптимальные варианты лечения не определены, поэтому важна каждая новая работа в этом направлении.
В многоцентровой ретроспективный анализ включено 34 пациента с синдромом ЗСТТ в различные гистотипы – аденокарциному (n=11), PNET (n=10), рабдомиосаркому (n=5) и другие (n=8) (рис.8).
Рисунок 8.
Результаты исследования.
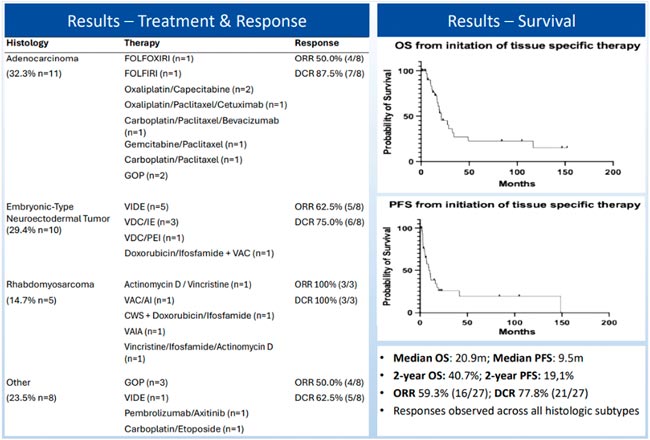
Частота объективного ответа (ЧОО) при использовании гистотип-ассоциированной ХТ составила 50% при аденокарциноме, 62,5% при PNET, 100% при рабдомиосаркоме и 50% при иных гистотипах. Медиана ОВ составила 21 мес., мВБП – 9,5 мес. Двухлетняя ОВ – 40,7%, 2-летняя ВБП – 19,1%. ЧОО оценена суммарно у 27 пациентов и составила 59,3% (16/27). В разговоре с докладчиком уточнено, что наилучшие отдаленные результаты достигнуты для пациентов, которым в случае ответа на ХТ далее проведено хирургическое лечение.
В данном исследовании продемонстрировано, что гистотип-ассоциированный подход позволяет добиться радиологического ответа более чем у половины пациентов с ЗСТТ, а в случае проведения дальнейшего хирургического лечения еще и улучшить отдаленные онкологические результаты.
Немного о высокодозной химиотерапии
В ожидании результатов проспективного исследования TIGER – сравнение режима TIP и ВДХТ (2×TI и 3×СЕ) во второй линии терапии ГО [11] – интерес к высокодозному подходу не снижается. Вот и в этом году данному вопросу посвящено несколько работ.
ВДХТ при ГО: 16-летний опыт Princess Margaret Cancer Centre
Наиболее часто ВДХТ проводится в следующем режиме: 2 курса паклитаксел/
В представленной работе поступили несколько иначе. Пациентам при прогрессировании после 1 линии ХТ проводилась цисплатин-содержащая ХТ в стандартных дозах (bridge-терапия), затем 3 курса ВДХТ в режиме СЕ: карбоплатин 600 мг/м2 в день 1-3 + этопозид 700 мг/м2 в день 1-3 с реинфузией АГСК. Первичная конечная точка – ОВ. Вторичные конечные точки – ВБП и смертность, связанная с трансплантацией; оценка влияния платинорефрактерности (прогрессирование заболевания в течение 4 нед. от завершения ХТ) на выживаемость.
Всего в анализ включен 71 пациент. Сорок (56,6%) пациентов инициально отнесены к группе неблагоприятного прогноза по IGCCCG, 83% получили в первой линии ХТ режим ВЕР, половина пациентов достигла полного либо маркер-негативного частичного ответа. У 27% отмечена платинорефрактерность, у 48% ВБП >3 мес.
В момент установления рецидива/рефрактерности ГО у большинства пациентов отмечен промежуточно-высокий риск по классификации IPFSG (рис.9) [12] и низкий риск по шкале Beyer (рис.10) [13].
Рисунок 9.
Прогностические группы при рецидиве ГО по классификации IPFSG.
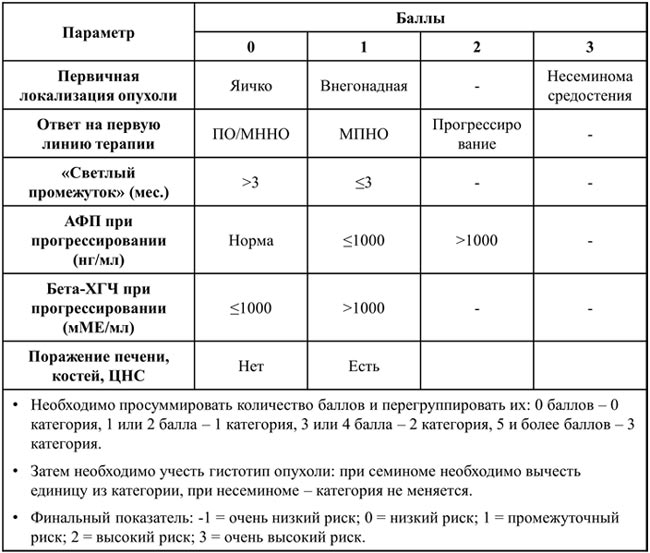
Рисунок 10.
Прогностические группы при рецидиве ГО по шкале Beyer.

Медиана ОВ и ВБП не достигнута. Двухлетняя ОВ и ВБП составили 73,4% и 52,1% соответственно. Нужно обратить внимание, что через 2 года от завершения лечения пациенты не прогрессировали (рис.11). Четыре пациента погибло от осложнений, связанных с трансплантацией.
Рисунок 11.
Медианы ОВ и ВБП.
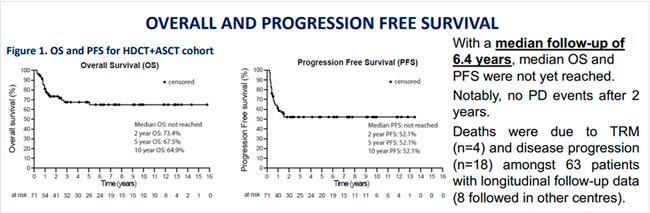
В данном анализе продемонстрирована прогностическая значимость классификации IPFSG и шкалы Beyer для ОВ и ВБП. Однако больше интересен третий прогностический фактор – платиночувствительность на вторую линию стандартной ХТ: медиана ВБП при негативных маркерах перед ВДХТ – не достигнута, снижающиеся, но ненормализованные маркеры – 1,3 года, растущие – 0,4 года, р<0,0001 (рис.12).
Рисунок 12.
Оценка прогностической значимости классификации IPFSG, шкалы Beyer и платиночувствительности перед ВДХТ.
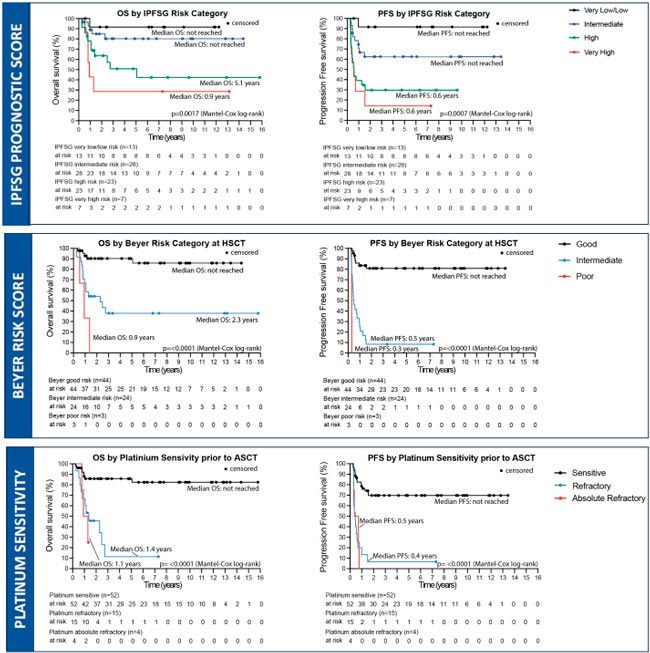
Из данной работы можно сделать вывод, что проводимая платиносодержащая ХТ перед высокодозной с целью мобилизации ГСК служит прогностическим фактором для ВБП и ОВ. Пациенты с растущими маркерами перед ВДХТ не получают никакого преимущества от данного подхода, а его токсичность и вовсе может привести к смерти. Стоит несколько внимательнее относиться к показаниям к проведению ВДХТ.
Результаты ВДХТ у пациентов с ГО в Великобритании: 20-летний опыт Британского общества по трансплантации костного мозга
В данный ретроспективный анализ включено 467 пациентов. Причем мужчины с ГО составили 80%, остальные – 20% представлены женщинами с ГО – 14%, пациентами младше 16 лет (без поражения ЦНС) – 3%, пациентами с первичными ГО ЦНС – 6%.
В зависимости от года проведения ВДХТ пациенты разделены на 4 периода: 2000-2004 (21% пациентов), 2005-2009 (21%), 2010-2014 (29%) и 2015-2019 (29%). Более половины пациентов (54%) имели платиночувствительный рецидив, у 12% – платинорефрактерный, у остальных (34%) – неизвестно.
Десятилетняя ОВ для всех включенных пациентов составила 39% (рис.13).
Рисунок 13.
Десятилетняя ОВ.
Рисунок 14.
Пятилетняя ОВ в зависимости от периода трансплантации.
Пациенты с хеморефрактерным течением до ВДХТ обладают худшей ОВ, чем пациенты с хемочувствительным течением (10-летняя ОВ 18% [95% ДИ 9-29] и 50% [95% ДИ 40-54]; р<0,001) (рис.15).
Рисунок 15.
ОВ в зависимости от чувствительности к стандартной ХТ до начала ВДХТ.
Пятилетняя ОВ в зависимости от проведенных курсов ВДХТ: 1 курс – 43%, 2 курса – 41% (р=0,46), 3 курса – 56% (р=0,045) (рис.16).
Рисунок 16.
ОВ в зависимости от числа проведенных курсов ВДХТ.
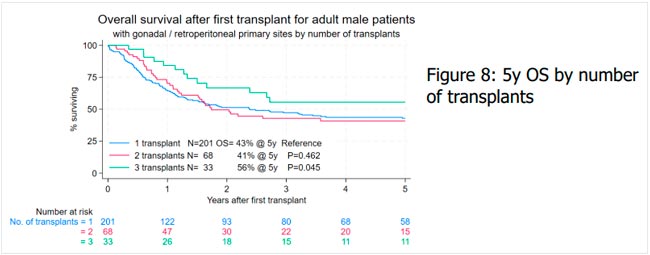
Еще одна работа, демонстрирующая, что ВДХТ является эффективной опцией при рецидиве ГО. Однако какая популяция получает наибольшую пользу от ее проведения? Концепция, что ВДХТ позволяет преодолеть истинную хеморефрактерность, кажется сомнительной. Тем не менее, только проспективные данные смогут поставить точку в данном вопросе. Ждем TIGER!
Источники:
- Матвеев В.Б. и др. Герминогенные опухоли у мужчин. Злокачественные опухоли. 2024, №14 (3s2), С.267-299. doi: 10.18027/2224-5057-2024-14-3s2-1.2-11.
- Gilligan T, et al. NCCN Guidelines Version 1.2026. Testicular Cancer. 2025. Accessed: Nov. 08, 2025. [Online]. Available: https://www.nccn.org/
professionals/ .physician_gls/pdf/ testicular.pdf - Giannatempo P, et al. Radiotherapy or chemotherapy for clinical stage IIA and IIB seminoma: a systematic review and meta-analysis of patient outcomes. Annals of Oncology. 2014; Vol.26, pp.657-668. doi: 10.1093/annonc/mdu447.
- Papachristofilou A, et al. Single-dose carboplatin followed by involved-node radiotherapy for stage IIA and stage IIB seminoma (SAKK 01/10): a single-arm, multicentre, phase 2 trial. Lancet Oncol. Nov. 2022; Vol.23, no.11, pp.1441-1450. doi: 10.1016/S1470-2045(22)00564-2.
- Beyer J, et al. Survival and new prognosticators in metastatic seminoma: Results from the IGCCCG-update consortium. Journal of Clinical Oncology. May 2021; Vol.39, no.14, pp.1553-1562. doi: 10.1200/JCO.20.03292.
- Heidenreich A, Paffenholz P, Hartmann F, Seelemeyer F, Pfister D. Retroperitoneal Lymph Node Dissection in Clinical Stage IIA/B Metastatic Seminoma: Results of the COlogne Trial of Retroperitoneal Lymphadenectomy In Metastatic Seminoma (COTRIMS). Eur Urol Oncol. Feb. 2024; Vol.7, no.1, pp.122-127. doi: 10.1016/J.EUO.2023.06.004.
- Stephenson AJ, Bosl GJ, Motzer RJ, Bajorin DF, Stasi JP, Sheinfeld J. Nonrandomized comparison of primary chemotherapy and retroperitoneal lymph node dissection for clinical stage IIA and IIB nonseminomatous germ cell testicular cancer. Journal of Clinical Oncology. Dec. 2007; Vol.25, no.35, pp.5597-5602. doi: 10.1200/JCO.2007.12.0808.
- Tryakin A, et al. Dose-reduced first cycle of chemotherapy for prevention of life-threatening acute complications in nonseminomatous germ cell tumor patients with ultra high tumor markers and/or poor performance status. Journal of Cancer Research and Clinical Oncology. Jul. 2018; Vol.144, no.9, pp.1817-1823. doi: 10.1007/S00432-018-2695-4.
- Cafferty FH, White JD, Shamash J, Hennig I, Stenning SP, Huddart RA. Long-term outcomes with intensive induction chemotherapy (carboplatin, bleomycin, vincristine and cisplatin/bleomycin, etoposide and cisplatin) and standard bleomycin, etoposide and cisplatin in poor prognosis germ cell tumours: A randomised phase II trial. Eur J Cancer. Mar. 2020; Vol.127, pp.139-149. doi: 10.1016/j.ejca.2019.12.028.
- Guo CC, Czerniak B. Somatic-type malignancies in testicular germ cell tumors. Hum Pathol. Sep. 2022; Vol.127, pp.123-135. doi: 10.1016/J.HUMPATH.2022.06.024.
- Standard-Dose Combination Chemotherapy or High-Dose Combination Chemotherapy and Stem Cell Transplant in Treating Patients with Relapsed or Refractory Germ Cell Tumors. Study Details (NCT02375204). Accessed: Nov. 08, 2025. [Online]. Available: https://clinicaltrials.gov/
study/ .NCT02375204 - Lorch A, et al. Prognostic factors in patients with metastatic germ cell tumors who experienced treatment failure with cisplatin-based first-line chemotherapy. Journal of Clinical Oncology. Nov. 2010; Vol.28, no.33, pp.4906-4911. doi:10.1200/JCO.2009.26.8128.
- Beyer J, et al. High-dose chemotherapy as salvage treatment in germ cell tumors: A multivariate analysis of prognostic variables. Journal of Clinical Oncology. 1996; Vol.14, no.10, pp.2638-2645. doi: 10.1200/JCO.1996.14.10.2638.
НОВОСТИ ESMO 2025: НЕЙРООНКОЛОГИЯ
Автор: Евсеев Владислав Николаевич
Заведующий отделением химиотерапии ЛЕДИН КЛИНИК,
Эксперт фонда «Не Напрасно», Москва
На ежегодном конгрессе Европейского общества медицинской онкологии (ESMO) были представлены результаты ряда исследований, посвященных лечению опухолей центральной нервной системы. В данном обзоре приведены ключевые данные наиболее значимых докладов, касающихся современных подходов к терапии глиом, метастатического поражения мозга, а также редких опухолей основания черепа.
Протонная лучевая терапия против углеродно-ионной лучевой терапии при хордомах/хондросаркомах основания черепа – рандомизированное исследование 2 фазы
Хордомы и хондросаркомы относятся к редким опухолям основания черепа. Основным методом лечения является хирургическое вмешательство, при необходимости дополняемое лучевой терапией. Предшествующие исследования показали, что тип лучевой терапии имеет ключевое значение для данной категории пациентов: классическая фотонная терапия демонстрирует существенно худшие результаты по сравнению с протонной и углеродно-ионной лучевой терапией. Однако прямого сравнения этих двух методик до настоящего времени не проводилось.
В настоящее исследование было включено 52 пациента, из которых у 80% диагностирована хордома, у 20% – хондросаркома. Большинство пациентов имели впервые выявленное заболевание (80%), у 20% отмечен рецидив. Участники были рандомизированы в соотношении 1:1 для получения либо протонной, либо углеродно-ионной терапии. Первичной конечной точкой являлась 5-летняя выживаемость без локального прогрессирования.
Результаты показали сопоставимую эффективность обоих методов:
- 5-летняя выживаемость без локального прогрессирования составила 75,3% в группе протонной терапии и 75,7% в группе углеродно-ионной терапии;
- 5-летняя безрецидивная выживаемость – 75,3% и 75,7% соответственно;
- 5-летняя общая выживаемость – 88,0% и 91,3% соответственно.
Значимых различий в частоте острой токсичности между группами не выявлено. Наиболее частыми осложнениями были мукозит (17,3%), алопеция (7,7%), нарушение вкусовых ощущений (9,6%) и ксеростомия (7,7%). Среди поздних осложнений зарегистрирован один случай повреждения зрительного нерва IV степени в группе углеродно-ионной терапии. Показатели качества жизни пациентов достоверно не различались между группами.
Рисунок 1.
оказатели выживаемости без локального прогрессирования в целом за 5 лет (А) и в подгруппах (В).
Хлорогеновая кислота для лечения рецидивной глиобластомы – рандомизированное исследование II/III фазы
Варианты терапии рецидивирующей глиобластомы крайне ограничены, что стимулирует поиск новых терапевтических подходов и молекул для данной категории пациентов. На конгрессе ESMO были представлены результаты рандомизированного исследования, оценивающего эффективность хлорогеновой кислоты.
Хлорогеновая кислота – природный полифенол с выраженными антиоксидантными свойствами. Предполагается, что она может оказывать противоопухолевое действие за счет метаболического перепрограммирования митохондрий, стимуляции дифференцировки клеток и иммуномодулирующего эффекта. Для оценки клинической эффективности данного соединения было проведено рандомизированное исследование, в котором хлорогеновую кислоту сравнивали с химиотерапией ломустином.
В исследование было включено 200 пациентов. Половина из них получала ломустин в дозе 110 мг/м2 1 раз в 6 недель (всего до 4 циклов), другая половина – хлорогеновую кислоту внутримышечно в течение 4 недель с недельным перерывом между циклами (до 8 циклов). Первичной конечной точкой являлась общая выживаемость.
Результаты исследования не продемонстрировали преимущества хлорогеновой кислоты по сравнению с ломустином. Медиана общей выживаемости составила 8,9 мес. в группе хлорогеновой кислоты и 8,2 мес. в группе ломустина. Несмотря на обоснованные биологические предпосылки, терапевтическая эффективность данного подхода оказалась недостаточной.
Рисунок 2.
Показатели ОВ в группах хлорогеновой кислоты и ломустина.
Кстати, дискутант в шутку отметил, где вообще содержится эта самая хлорогеновая кислота: обжаренный кофе, яблоки, картошка, зеленые кофе-бобы и многие другие натуральные продукты. Лично меня такая отсылка заставила улыбнуться.
Комбинация ниволумаба, ипилимумаба, бевацизумаба и 2 циклов индукционной химиотерапии у пациентов с неплоскоклеточным немелкоклеточным раком легкого и нелеченным метастатическим поражением головного мозга – исследование Break B5-BM-NSCLC
Метастатическое поражение головного мозга выявляется приблизительно у 25% пациентов в момент постановки диагноза IV стадии немелкоклеточного рака легкого (НМРЛ). На сегодняшний день стандартом лечения является проведение локальных методов – хирургического вмешательства или лучевой терапии. Эти подходы связаны с риском осложнений и могут приводить к задержке начала системного лечения. Для пациентов с драйверными мутациями накоплены данные о высокой эффективности таргетной терапии в отношении интракраниальных очагов, что позволяет в ряде случаев отсрочить локальное воздействие. Однако для больных без драйверных мутаций подобной терапевтической опции пока не существует.
Авторы представленного исследования поставили целью повысить вероятность достижения интракраниального ответа путем сочетания химиотерапии, иммунотерапии и антиангиогенной терапии. В исследование включались пациенты с наличием как минимум одного измеримого метастаза в головном мозге, не требующего немедленного проведения локального лечения.
Пациенты получали комбинированную терапию, включающую ниволумаб (360 мг каждые 3 недели), ипилимумаб (1 мг/кг каждые 6 недель), бевацизумаб (фиксированная доза 400 мг каждые 3 недели), а также два индукционных цикла химиотерапии карбоплатином и наб-паклитакселом. Всего в исследование было включено 35 пациентов.
Интракраниальная частота объективных ответов составила 37,1%, медиана выживаемости без интракраниального прогрессирования – 6,1 мес., а медиана общей выживаемости – 15,6 мес. Полученные результаты свидетельствуют о достаточно высокой интракраниальной активности режима, хотя эффективность остается ниже по сравнению с показателями, наблюдаемыми при НМРЛ с драйверными мутациями.
Рисунок 3.
Частота ответов со стороны ЦНС и общая ЧОО.
Ларотректиниб при TRK-позитивных первичных опухолях ЦНС
В исследование были включены 60 пациентов – как взрослых, так и детей, при этом доля педиатрических больных составила 72%. Наиболее часто диагностировались глиомы высокой степени злокачественности (60%), реже – глиомы низкой степени (27%) и другие опухоли (13%). Наиболее распространенным генетическим нарушением являлось слияние гена NTRK2 (65%), значительно реже встречались слияния NTRK3 (12%).
В общей популяции пациентов частота объективного ответа на терапию составила 35%. При этом наблюдалась выраженная разница в эффективности между детьми и взрослыми: частота объективного ответа у детей достигала 47% (уменьшение размеров опухоли было зарегистрировано почти у каждого второго пациента), тогда как у взрослых – лишь 6%. Полные ответы на лечение отмечены исключительно у детей (12%). Также различалась длительность ответа: медиана составила 47 мес. (почти 4 года) у детей и 11 мес. у взрослых. Двухлетняя выживаемость достигала 74% в педиатрической группе и 27% среди взрослых пациентов.
Профиль безопасности ларотректиниба оказался ожидаемым для данного класса препаратов. Наиболее частыми побочными явлениями были повышение уровня АЛТ и АСТ, рвота, пирексия и головные боли. Серьезные нежелательные явления, связанные с лечением, отмечались лишь у 5% пациентов.
Рисунок 4.
Основные результаты исследования среди детей и взрослых пациентов.
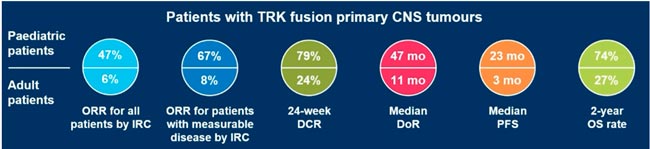
Исследование I фазы по применению IL13Rα2-targeted CAR-T клеточной терапии рецидивных злокачественных глиом: клинические результаты и фармакокинетика
Продолжаются попытки внедрения CAR-T-терапии в лечение глиобластомы. В представленной работе китайские исследователи сообщили результаты исследования I фазы, посвященного применению CAR-T-клеток, направленных против рецептора IL13Rα2, у пациентов с рецидивирующей злокачественной глиомой.
В исследование вошли 10 пациентов, получавших различные дозы CAR-T-клеток. Все участники имели рецидив заболевания, у 7 из них это был не первый рецидив. Объективных ответов на терапию зарегистрировано не было, однако у нескольких пациентов отмечена стабилизация заболевания, причем у одного из них – длительностью более 6 месяцев, что авторы сочли клинически значимым с учетом агрессивного течения опухоли. Медиана выживаемости без прогрессирования составила 2,63 мес., а медиана общей выживаемости – 10,87 мес. Терапия характеризовалась удовлетворительным профилем безопасности: серьезных токсических реакций, включая ICANS, не зарегистрировано ни в одном случае.
Исследователи планируют продолжение работы с модификацией протокола: в частности, рассматривается возможность предварительной лимфодеплеции и интратекального введения CAR-T-клеток для повышения эффективности терапии.
Рисунок 5.
Основные результаты исследования.
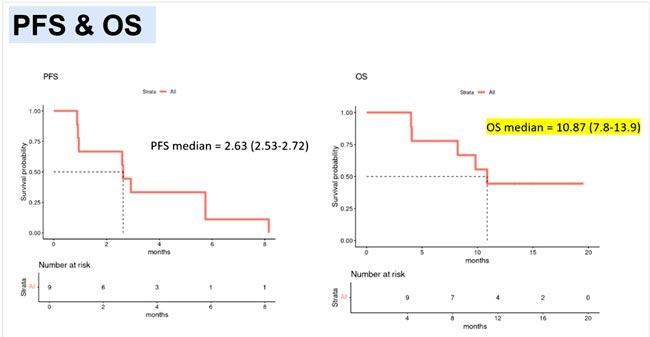
Олапариб в сочетании с темозоломидом и лучевой терапией при нерезектабельной глиобластоме
Результаты лечения глиобластомы даже при полном хирургическом удалении опухоли остаются неудовлетворительными. В случаях, когда радикальная резекция невозможна, прогноз еще более неблагоприятен. С целью повышения эффективности стандартного лечения исследователи изучили возможность добавления препарата олапариб к стандартному протоколу химиолучевой терапии. Биологические предпосылки для применения олапариба при глиобластоме достаточно убедительны: экспрессия фермента PARP-1 в опухолевой ткани значительно выше, чем в нормальной ткани головного мозга. Ингибиторы PARP, в том числе олапариб, способны потенцировать эффект как лучевой терапии, так и химиотерапии, повышая чувствительность опухолевых клеток к лечению.
Протокол исследования предусматривал назначение олапариба в период проведения химиолучевой терапии, а затем – в комбинации с темозоломидом на протяжении шести циклов. При отсутствии признаков прогрессирования после этого срока пациенты переходили на поддерживающую терапию олапарибом в дозе 100 мг дважды в день с перерывами на выходные.
Медиана общей выживаемости в исследовании составила 17,2 мес., что значительно превышает ожидаемую продолжительность жизни (7,9-9,4 мес.) у пациентов, которым не удалось выполнить полное макроскопическое удаление опухоли. Особенно выраженный эффект наблюдался у пациентов с MGMT-метилированной глиобластомой. Примечательно, что объем хирургического вмешательства не оказывал существенного влияния на результаты: показатели выживаемости были сопоставимы как после биопсии, так и после субтотальной резекции.
Рисунок 6.
Результаты лечения комбинацией темозоломида, олапариба и ЛТ: ОВ.
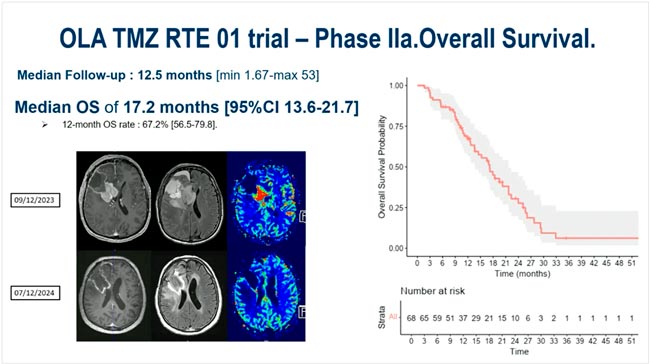
Регорафениб в сочетании с темозоломидом ± лучевой терапией при впервые выявленной глиобластоме
Другой попыткой интенсификации лечения стала комбинация регорафениба с темозоломидом. При этом в исследовании было 2 когорты – в 1-й терапия регорафенибом начиналась уже после завершения этапа химиолучевой терапии, а во второй проводилась совместно с ХЛТ и продолжалась далее.
В этом небольшой работе были показаны невероятно высокие показатели эффективности – медиана безпрогрессивной выживаемости составила 17 мес. в 1-й когорте и 18,2 мес. во второй. Общая выживаемость вообще перевалила за три года – медиана составила 36,7 мес. в 1-й когорте, а во второй ее не получилось оценить из-за небольшого количества событий.
Большое отличие от прошлого исследования заключается в том, что большинство пациентов было прооперировано «условно-радикально», полная макроскопическая резекция была достигнута у 13 из 21 пациента.
Рисунок 7.
ОВ в когортах больных.
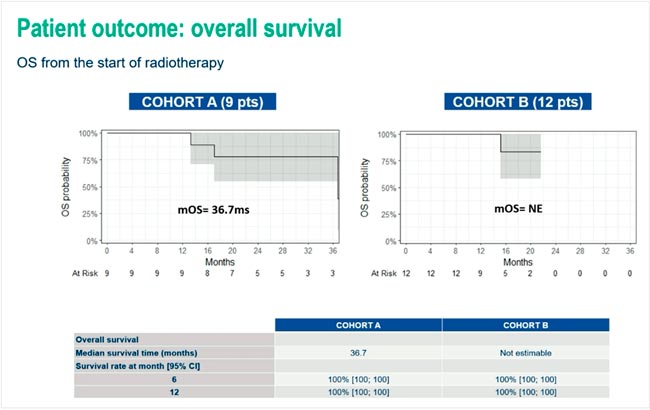
Надежность изучения циркулирующей опухолевой ДНК в цереброспинальной жидкости в качестве замены молекулярно-генетического профилирования опухоли при метастазах в центральной нервной системе: результаты исследования BrainStorm (OncoDistinct006)
Существует достаточно большое количество исследований, которые показывают дискордантность молекулярно-генетических особенностей метастазов в центральной нервной системе. Авторы исследования решили уточнить, насколько анализ циркулирующей опухолевой ДНК в ликворе показывает схожие результаты с анализом опухолевой ткани.
В данный анализ вошло 25 пациентов, в подавляющем большинстве случаев – больные раком молочной железы (22 из 25 пациентов). Выявить циркулирующие опухолевые клетки в ликворе получилось в 84% случаев, при этом у пациентов с лептоменингеальным поражением вероятность выявления была даже выше – 91%.
Конкордантность анализов циркулирующей опухолевой ДНК в ликворе и опухолевой ткани оказалась низкая – всего 45%, а при лептоменингеальном поражении – 42%. В трех случаях анализ ликвора помог выявить дополнительные мутации – во всех случаях это были мутации в гене TP53, то есть, по сути, клинически не значимые находки. Как проведение анализа сказалось на дальнейшей тактике лечения пациента, авторы не сообщили. Так что на текущий момент данная технология представляет невысокий клинический интерес.
Рисунок 8.
Мутационный профиль и конкордантность.
a
ЗА И ПРОТИВ ИСПОЛЬЗОВАНИЯ ИНГИБИТОРОВ CDK4/6 В АДЪЮВАНТНОЙ ТЕРАПИИ HER2-НЕГАТИВНОГО ЛЮМИНАЛЬНОГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ. НИКОГДА ТАКОГО НЕ БЫЛО - И ВОТ ОПЯТЬ…
Авторы: Жуков Николай Владимирович,
д.м.н., руководитель отдела междисциплинарной онкологии
ФГБУ НМИЦ ДГОИ им. Д. Рогачева МЗ РФ
Жукова Людмила Григорьевна,
д.м.н., член-корр. РАН, заместитель директора по онкологии
ГБУЗ «Московский Клинический Научно-практический
Центр имени А.С. Логинова», ДЗМ
Коллеги, позволим себе предположить, что каждый, кто держал в руках ингибиторы CDK4/6, вряд ли поспорит с тем, что это группа высокоэффективных препаратов с умеренной, предсказуемой и контролируемой токсичностью, значимо изменившая подходы к терапии и судьбу пациентов с распространенным люминальным HER2-негативным раком молочной железы (далее – РМЖ). А сейчас ингибиторы CDK4/6 постепенно, но «с ускорением», приданным последними данными об увеличении общей выживаемости, входят в стандарты лечения и ранних стадий РМЖ. Но одновременно создаётся впечатление, что именно эту группу препаратов преследует какой-то «индивидуальный злой рок»…
Нет, речь не идёт о том, что исследования показывают
неэффективность препаратов там, где она ожидалась. Не появляются новые сведения
о неожиданных и тяжелых побочных эффектах. Препараты не исключают (наоборот,
включают по новым показаниям) из клинических рекомендаций и не отзывают у них
регистрацию. Но при этом уже второй раз поднимается информационная волна
(первая была инициирована исследованием SONIA и, чтобы не повторяться, дадим просто ссылку на ранее
проходившую дискуссию [[i],[ii]]),
ставящая под сомнения результаты исследований с ингибиторами CDK4/6 по причинам, которые раньше (в
отношении других препаратов и исследований) подобных жарких дискуссий в публичном
пространстве не вызывали. Нет, вопросы к современной системе клинических
испытаний и регистрации препаратов в онкологии были всегда, и авторы этой
статьи были в них более чем критичны даже тогда, когда это было «не принято» в
нашей стране [[iii],[iv]].
Но эти вопросы были и остаются системными, применимыми к подавляющему
большинству регистрационных исследований, т.к. современная система
регистрационных испытаний сосредоточилась на поискеи
малых различий в больших группах вместо того, чтобы искать большие различия в
малых, наиболее выигрывающих [[v]].
Боюсь, мы не сможем ответить, в чем же причина столь «особого» отношения к ингибиторам
CDK4/6, но попробуем
ответить на вопрос: есть ли хоть какое-то принципиальное различие в том, что
показали ингибиторы CDK4/6
в адъювантном режиме, от того, что показали другие препараты и методики,
которые мы сейчас широко используем.
Итак, активная дискуссия о целесообразности применения ингибиторов CDK4/6 началась со статьи авторов из Канады и США с весьма интригующим названием «Почему мы не рекомендуем женщинам с РМЖ применять ингибиторы CDK4/6 в адъювантном режиме», опубликованной в журнале JCO в августе этого года [[vi]]. Справедливости ради нужно отметить, что это была не первая публикация на данную тему, и в ней присутствуют ссылки на более ранние статьи со схожим посылом – эффективность и/или безопасность (соотношение эффективности, безопасности и цены) адъювантного применения ингибиторов CDK4/6 доказаны недостаточно, чтобы оправдать их клиническое применение в рутинной практике (при желании читатели, которым окажется недостаточно прочтения самой статьи, могут с ней ознакомиться, пройдя по ссылкам в её конце), но эта статья оказалась наиболее резонансной и с энтузиазмом «принятой на вооружение» частью экспертов в РФ, которые стали транслировать её постулаты в свою клиническую практику (активная «не рекомендация» адъювантной терапии ингибитором CDK4/6 своим пациентам и пациентам, направленным на консультацию), а также в публичное профессиональное пространство (выступления на конференциях, вебинарах, советах экспертов и т.д. с призывом «делай, как я»). В качестве аргументов против использования ингибиторов CDK4/6 в адъювантном режиме заявлялись: высокая токсичность терапии, непредоставление адекватного лечения после прогрессирования, выработка резистентности к эндокринотерапии в процессе адъювантного лечения ингибиторами CDK4/6, а так же диспропорция в информативном цензурировании между группами, что, по мнению авторов статьи (и согласных с ними экспертов), в свете умеренного выигрыша в выживаемости, свободной от инвазивного заболевания (ВБИЗ, IDFS), и отсутствия выигрыша в общей выживаемости (ОВ), высокой стоимости лечения делало адъювантное использование ингибитора CDK4/6 нецелесообразным. Если свести воедино смысл звучащих рекомендаций, они приводили к тому, что «когда спрогрессирует, тогда и назначим, т.к. адъювантное применение дорого, токсично и недостаточно эффективно». Если честно, можно было бы разобрать эти аргументы «по косточкам», обратив внимание на детали, несоответствия и, временами, очень значительные «допущения», когда мнение авторов выдается за доказанный научный факт. Но, боюсь, что большинство наших читателей вряд ли читали эту статью столь внимательно, и, увы, вряд ли прочтут длинный текст с её разбором. Поэтому давайте посмотрим основное – есть ли там что-то особое, характерное только для ингибиторов CDK4/6, что не встречалось ранее в других адъювантных исследованиях (исследованиях других препаратов при РМЖ или при других нозологиях).
Дополнительная токсичность дополнительной терапии? Да, безусловно, она есть! Но тут хочется спросить: «А кто не пьет? Назови!». Любой дополнительный компонент (разве что, кроме массажа) привносит в адъювантное лечение не только эффективность, но и дополнительную токсичность. Главное, чтобы эффективность не перевешивалась токсичностью. Насколько выраженной была токсичность в адъювантных исследованиях ингибиторов CDK4/6? Судя по цитируемой статье, «ужасной»: в исследовании с абемациклибом (терапия 2 года) побочные эффекты наблюдались у >60% больных, редукция дозы потребовалась у >40%, в исследовании с рибоциклибом (терапия 3 года) вообще 31% пациенток досрочно прекратили лечение по причинам, отличным от прогрессии (токсичность, решение врача, отзыв согласия и т.д.), причем 19,7% одновременно прекратили прием и ингибиторов ароматазы. Плюс к этому авторы статьи отмечают диспропорцию в количестве смертей, не ассоциированных с прогрессированием, между группами. На самом деле, первый вопрос к вам, коллеги: узнаёте ли вы препараты, с которыми вы уже достаточно долго работаете в клинической практике? Каков процент досрочно прекративших лечение ингибиторами CDK4/6 по токсичности или другим причинам, не связанными с прогрессированием (не рассматривая организационные причины, когда препарата просто не было в наличии), среди ваших пациентов на абемациклибе и рибоциклибе (напомним, в адъювантном исследовании пациентки получали исходно сниженную дозу рибоциклиба – 400 мг/сут.) «на круг»? А среди хорошо ответивших пациенток, которые получали эти препараты по поводу метастатического РМЖ длительно (сопоставимо с длительностью адъювантной терапии) на протяжении 2 и более лет? Сколько пациентов с метастатическим РМЖ, получавших ингибиторы CDK4/6 в вашей практике, погибли от связанной с ними токсичности или от сопутствующих заболеваний (что косвенно тоже можно списать на токсичность)? Похоже на «ужасы» адъювантных исследований? Уверены – нет! В чем же проблема? Адъювантная терапия теми же препаратами значимо токсичней, чем лечебная (на этапе метастатической болезни)? Нам кажется, что причина в открытом дизайне исследования, который «неожиданно» сыграл не на пользу экспериментальной группы за счет плацебо-эффекта (что вряд ли возможно в исследовании с конечными целями в виде выживаемости), а как раз против неё. Пациенты и врачи, зная, что получают действующий препарат, «групповую» эффективность которого пока лишь планируется доказать (на то оно и исследование), в ситуации отсутствия видимых проявлений заболевания, не позволяющих оценить эффективность лечения у конкретного пациента, в случае развития нежелательных явлений принимали решение, что не готовы продолжать терапию в условиях такого двойного «незнания». Скорее всего, если бы речь шла о лечении метастатической болезни, когда противоопухолевый эффект виден, многие пациенты, испытывающие такую же степень выраженности побочных эффектов, предпочли бы продолжить лечение. И врачи бы их в этом поддержали. Но ключевой вопрос – что же случилось с эффективностью лечения «на круг» (во всей популяции пациентов, начавших терапию – ITT популяция) при таком активном досрочном прекращении лечения? Об этом говорит анализ основных конечных точек исследования, которые, с нашей точки зрения, нужно читать следующим образом: НЕСМОТРЯ на то, что в исследовании с открытым форматом значительной части пациенток понадобилась редукция дозы препаратов, а часть больных и вовсе прекратила лечение (в т.ч. и адъювантную терапию полностью), применение ингибиторов CDK4/6 в адъювантом режиме все равно статистически и клинически значимо улучшило результаты лечения по сравнению с только эндокринотерапией. И нас терзают смутные сомненья, что в следующих исследованиях подобного открытого формата, если таковым суждено было бы случиться, когда одна из неизвестных (общая эффективность лечения) стала известной и «позитивной,» доля пациентов, выбывающих «по токсичности» или решению врача, была бы значимо меньше, а результаты экспериментальной группы ещё лучше. Тем более, когда был показан выигрыш не только в отношении ВБИЗ, но и в отношении общей выживаемости, но об этом чуть позже. Открытым остается вопрос, какая группа пациентов получила выигрыш – все, вне зависимости от длительности получения CDK4/6, или только те, кто допил свой препарат до конца (или почти до конца), но, надеюсь, когда-то будет проведен субанализ, и мы узнаем ответ и на этот вопрос.
Непредоставление адекватного лечения после прогрессирования… В переводе – не все пациенты из контрольной группы после прогрессирования имели доступ к ингибиторам CDK4/6, т.е. не было 100% перекрёста. А кто не…? (далее по тексту). А где он, 100% перекрёст, был в адъювантных регистрационных исследованиях (да и не только в адъювантных) за счёт компании, инициатора исследования? Может только исследование HERA, да и то, перекрёст был неполным, трастузумаб группе плацебо в виде «отсроченного» адъюванта дали только тем, кто не имел признаков прогрессирования болезни через год и более (примерно 50% больных), а вот те, кто имел раннее прогрессирование получали (или не получали) трастузумаб в соответствии с локальной практикой [[vii]]. И где то прекрасное место (страна, ситуация), где все больные, не получившие ингибиторы CDK4/6 (осимертиниб, алектиниб, T-DM1, ниволумаб и т.д., и т.п.) в адъювантном режиме в рамках исследования, в последующем в 100% случаев получили их после прогрессирования в рамках рутинной практики (за счёт системы здравоохранения)? Да и получают ли они их в 100% даже сейчас, когда исследования давно закончены, а препараты вроде бы стали доступней, как по цене, так и «административно». Да, было бы прекрасно иметь 100% перекрёст, но давайте эти прекрасные порывы применять к исследованиям, которые еще не начались, а не к тем, которые уже закончены, показали результаты, имеющие однозначное клиническое значение, и, увы, вряд ли могут быть повторены в формате 100% перекрёста.
Выработка резистентности в процессе адъювантной терапии… Хорошо, назовите препараты, которые не индуцируют резистентность к воздействующим на ту же «ось» одноклассникам в последующем? Эффективность химиотерапии метастатической болезни после адъювантной химиотерапии, по сравнению с использованием той же химиотерапии при лечении метастатической болезни de novo, снижается! Давайте не будем давать адъювантную химиотерапию! Ингибиторы ароматазы в адъюванте приводят к индукции мутаций в ESR1 – давайте не будем давать ингибиторы ароматазы. После адъювантной иммунотерапии хуже работают чек-пойнт ингибиторы при лечении метастатической болезни… Давайте… Да, есть «вечные» препараты, используемые на протяжении всего цикла терапии – фторпиримидины при опухолях ЖКТ, анти-HER2 препараты при HER2-позитивном РМЖ, андроген-депривационная терапия при раке предстательной железы, но их эффективность всё равно почти всегда ниже в случае, если пациент получал нео/адъювантную терапию с воздействием на ту же ось, чем при «первичном» применении на этапе лечения метастатической болезни. И это никак не смущает нас при назначении адъювантной терапии с использованием этих препаратов, т.к. смысл адъювантной терапии - сделать так, чтобы терапия последующей метастатической болезни потребовалась бы меньшему числу больных (излечение или продление неподдерживаемой дополнительной терапией ремиссии до смерти от других причин). К сожалению, «платить» за это могут те, у кого добиться излечения не удалось – да, у части из них из-за адъювантной терапии развивается резистентность опухоли к последующему лечению. Но соотношение выигрывающих и проигрывающих достаточно легко понять – посмотрите на общую выживаемость. Если она увеличилась, то выигрывающих, очевидно, больше, чем проигравших.
Дисбаланс в информативном цензурировании. Если честно, звучит красиво, слово дисбаланс наводит на мысль о том, что результаты групп, получавших ингибиторы CDK4/6, были «искусственно улучшены» в процессе статистического анализа. Но, боимся, детальное объяснение смысла термина «информативное цензурирование» займёт объем, значимо превышающий размер статьи. Для тех, кто действительно хочет разобраться, причём на основе разбора именно исследований с ингибиторами CDK4/6 – добро пожаловать по ссылке [[viii]], для остальных же читателей давайте примем, что это некий показатель, который при неправильной интерпретации может привести к искажению результатов исследования в пользу группы, в которой он превалирует. Но, как оказалось, степень влияния этого фактора (даже если он есть) в конкретных исследованиях по адъювантному применению ингибиторов CDK4/6 сильно преувеличена, и он не в состоянии повлиять на общие позитивные результаты исследований. Чтобы это доказать, авторы другой статьи взяли и поменяли вектор значения «информативного цензурирования» с положительного для группы ингибиторов CDK4/6 на отрицательный, и посмотрели, что же из этого получится в отношении анализируемых показателей выживаемости (ВБИЗ). Чтобы было понятней, что было сделано, приведём пример на более привычных показателях. Предположим, вы получили статистически значимое преимущество нового лечения в отношении частоты объективного эффекта (полная, частичная ремиссия) от новых препаратов. Но кто-то выразил сомнение в доказанности достижения ремиссии у некоторых пациентов, но повторно оценить статус достигнутой когда-то ремиссии вы не можете. И тогда вы говорите – ОК, я у всех «спорных» пациентов положительный результат (полная или частичная ремиссия) заменю на отрицательный (прогрессирование), а потом пересчитаю общие результаты. И при пересчёте вы все равно получаете статистически значимую разницу в пользу нового лечения. Так вот, именно это же произошло после «негативизации» информативного цензурирования в исследованиях ингибиторов CDK4/6 – выигрыш от их использования всё равно сохранился [[ix]].
Так что, как нам кажется, по всем пунктам «обвинения» в
отношении адъювантного использования ингибиторов CDK4/6 можно сказать, что их
исследования имеют общие со всеми другими адъювантами исследованиями болевые
точки. Ни больше, ни меньше. И имеют доказанный в рамках современной системы
клинических испытаний выигрыш. Клинически и статистически значимый. Ни больше,
ни меньше. Более того, ситуация не остается «стабильной» – она развивается во
времени. И мы видим все признаки «успешной, состоятельной» методики с реальной
эффективностью. Выигрыш в ВБИЗ при увеличении времени наблюдения продолжает
нарастать для обоих препаратов [[x],14], а для абемациклиба, имеющего
большие сроки наблюдения, он уже транслировался в статистически значимый
выигрыш в ОВ [10].
Да, пока выигрыш нельзя назвать очень большим – в абсолютном исчислении он
составляет 1,8%. Однако «в переводе» это обозначает, что даже при относительно
небольшом для адъювантных исследований прли
люминальном раке периоде наблюдения, из каждых 100 пациентов, получивших ингибитор
CDK4/6, дополнительно
остались в живых два человека. Таким образом, для того, чтобы спасти одну жизнь,
нужно пролечить ингибиторами CDK4/6
в адъювантном режиме 50 больных (number needed to treat, NNT),
причём это в ситуации, когда примерно 1/3 не допьет свой ингибитор CDK4/6 до конца, а примерно
каждая 1/5 вообще досрочно завершит адъювантную терапию. Много это или мало?
Трудно взвешивать цену жизни, но если вспомнить ранние анализы ОВ в
исследованиях по адъювантному использованию трастузумаба, таксанов, ингибиторов
ароматазы, препаратов платины, нас не смущали и меньшие цифры, и даже
отсутствие выигрыша в ОВ, как такового. Мы использовали эти препараты в
клинике, а при дальнейшем наблюдении видели увеличение расхождения кривых ОВ,
подтверждающее, что мы были правы. Думаем, с выигрышем в ОВ в отношении ингибиторов
CDK4/6 произойдёт то же
самое, и, как нам кажется, уж точно нет предпосылок для того, чтобы в ожидании
«иного исхода» сейчас откладывать введение этого подхода в рутинную клиническую
практику (разумеется, при наличии ресурсов). И нам радостно, что подобные мысли
звучат не только на русском, но и на других языках [9,[xi]],
что показывает, что зарубежные эксперты тоже весьма не однородны в отношении
призыва «не назначать…», а призывают подумать и посмотреть с общепринятых на
настоящее время стандартов оценки, применяемых для ВСЕХ препаратов.
Ну а теперь ложка дёгтя, и достаточно большая.
На самом деле, так уж получилось, что один из нас почти ровно 10 и 5 лет назад делал доклады на конференции Белые ночи онкологии в Санкт-Петербурге, посвященные (нео)адъювантной терапии, и первое, что мы сделали, готовя эту статью, пересмотрели их. И, если честно, увидели ровно то же самое, о чем пишет автор критической статьи о неназначении адъювантной терапии ингибиторами CDK4/6 [6] и говорят с трибун противники их использования [[xii],[xiii]]. Только касалось это исследований тех препаратов, которые тогда были «на острие волны», и которые мы в настоящее время продолжаем использовать, абсолютно не задумываясь и с клинической пользой для наших пациентов. Хотелось бы заострить внимание на том, что основным посылом этих выступлений было не «мы против адъювантного применения препаратов», а «мы видим недостатки адъювантных исследований и идеологии использования адъювантной терапии, которые необходимо исправить в дальнейшем». Поэтому, на всякий случай, напишем основные постулаты, касающиеся этой темы.
Адъювантная терапия – самый «слепой» метод в онкологии, т.к. мы лечим то, чего не видим – на момент назначения этой терапии пациент не имеет визуальных проявлений заболевания. Лечение назначается из предположения, что у части больных после хирургического лечения +/- «старая» адъювантная терапия (если речь идет о добавлении нового препарата к ранее использовавшемуся режиму или о замене этого режима на новый препарат) остаются микрометастазы, которые являются мишенью для нашего нового препарата. «Мерилом» эффективности такого подхода является «групповой показатель» – общая (в идеале) или безрецидивная (бессобытийная, без инвазивной болезни) выживаемость. Если в результате исследования удается добиться статистически значимого увеличения этих показателей, то мы говорим, что благодаря использованию нашего препарата в таком-то временном горизонте удается спасти от смерти (или прогрессирования и смерти – в зависимости от анализируемого показателя) какое-то число пациентов. Но основная проблема в том, что и 10 лет назад, а тем более в настоящее время выживаемость контрольной группы часто и так очень высока (т.е. большая часть пациентов и так не рецидивирует/не умирает на фоне уже существующего лечения). А значит, «зазор» между 100% выживаемостью и текущими (достигнутыми на фоне современной терапии) результатами очень невелик, и, следовательно, новый (дополнительный) препарат для адъювантного лечения по определению может дать лишь очень небольшое абсолютное увеличение результатов (при выживаемости контрольной группы в 90% новый препарат не может дать больше 10% абсолютного увеличения). Отсюда напрашивается вопрос о том, чтобы в исследования включались больные с действительно неблагоприятным прогнозом, где простор для нового препарата больше и больше ожидаемый выигрыш. Но, увы, это надо делать ДО начала исследования, формируя критерии включения, изучая факторы неблагоприятного прогноза, а не после, т.к. «после» может получиться не очень хорошо, как это продемонстрировали субанализы исследования NATALEE, где выживаемость контрольной группы «ожидаемо» более благоприятной группы со II стадией оказалась далеко не столько хорошей, а снижение риска (HR) неблагоприятного события для ВБИЗ оказалось выше, чем в группе больных III стадии [14]. Этому есть логичное объяснение, но это уже совсем другая история (о том, что субанализы могут быть лишь генерацией идеи, но весьма ненадёжны в отношении принятии клинических решений). В целом же, хочется еще раз заострить внимание на том, что эта, последняя часть нашей статьи, посвящена ОБЩИМ недостаткам современной системы клинических исследований и регистрации. И исследования ингибиторов CDK4/6 из этой системы ничуть не «выбиваются», и даже в рамках этой далеко не идеальной системы смогли доказать статистически и клинически значимое преимущество над ранее использовавшимся стандартом лечения.
Так можем ли мы (не мы конкретно, мы-то за - а абстрактный эксперт в области лечения РМЖ, не разделяющий нашу точку зрения) активно отговаривать пациентов и коллег от использования ингибиторов CDK4/6 в адъювантном режиме? Да, конечно, ведь все мы дипломированные врачи-онкологи, имеющие право принимать те или иные профессиональные решения. Но теперь, делая это, необходимо осознавать, что данные настоятельные рекомендации «воздержаться от…» могут стоить жизни примерно 2 из 100 пациенток, которые их получат. И то, если опираться на результаты исследования с «открытым лейблом», до получения данных об общей выживаемости, когда врачи и пациенты в условиях «двойной неизвестности» досрочно прекращали лечение в 1/3 случаев. Возможно, в случае большей приверженности лечению пациентов и врачей, информированных о выигрыше в общей выживаемости, доля «досрочнкиков» была бы значимо меньше (сопоставимой с частотой отмены препаратов в лечении метастатической болезни), а доля выигрывающих пациентов – еще больше. Хотя, конечно, последнее утверждение не утверждение, а предположение (спекуляция), как, к сожалению, и ряд положений в аргументах «Почему я не назначу…».
Источники:
- https://www.rosoncoweb.ru/news/oncology/2024/03/22/
- https://rosoncoweb.ru/news/oncology/2023/08/17-2/
- https://cyberleninka.ru/article/n/razvitie-lekarstvennogo-lecheniya-zlokachestvennyh-opuholey-narastayuschiy-konflikt-formy-i-soderzhaniya/viewer
- https://biochemistrymoscow.com/ru/archive/2008/73-05-0751/
- Stewart DJ, Kurzrock R. Cancer: the road to Amiens. J Clin Oncol. 2009 Jan 20;27(3):328-33. doi: 10.1200/JCO.2008.18.9621. Epub 2008 Dec 8. PMID: 19064964.
- Tannock IF, Khan QJ, Fojo T. Why We Do Not Recommend That Women With Breast Cancer Receive Adjuvant Treatment With a CDK4/6 Inhibitor. J Clin Oncol. 2025 Aug;43(22):2456-2460. doi: 10.1200/JCO-24-02683. Epub 2025 Apr 14. PMID: 40228181.
- Cameron D, Piccart-Gebhart MJ, Gelber RD, Procter M, Goldhirsch A, de Azambuja E, Castro G Jr, Untch M, Smith I, Gianni L, Baselga J, Al-Sakaff N, Lauer S, McFadden E, Leyland-Jones B, Bell R, Dowsett M, Jackisch C; Herceptin Adjuvant (HERA) Trial Study Team. 11 years' follow-up of trastuzumab after adjuvant chemotherapy in HER2-positive early breast cancer: final analysis of the HERceptin Adjuvant (HERA) trial. Lancet. 2017 Mar 25;389(10075):1195-1205. doi: 10.1016/S0140-6736(16)32616-2. Epub 2017 Feb 17. Erratum in: Lancet. 2019 Mar 16;393(10176):1100. doi: 10.1016/S0140-6736(18)32771-5. PMID: 28215665; PMCID: PMC5465633.
- Olivier T. Identifying informative censoring from censoring patterns across successive follow-ups. Eur J Cancer. 2025 Nov 12;232:116108. doi: 10.1016/j.ejca.2025.116108. Epub ahead of print. PMID: 41274169.
- Conforti F, Merlo F, Pala L, Canzian J, Tinterri B, De Pas T, Locatelli M, Dickerson JC, Cortes J, Slamon DJ, Gelber R, Bagnardi V. Why Adjuvant Treatment With a CDK4/6 Inhibitor Should Be Recommended for Women With High-Risk Breast Cancer: Methodologic Considerations on Available Evidence. J Clin Oncol. 2025 Oct 20;43(30):3237-3244. doi: 10.1200/JCO-25-01148. Epub 2025 Sep 17. PMID: 40961402.
- Johnston S, Martin M, O'Shaughnessy J, Hegg R, Tolaney SM, Guarneri V, Del Mastro L, Campone M, Sohn J, Boyle F, Cortes J, Rugo HS, Goetz MP, Hamilton EP, Huang CS, Senkus E, Cicin I, Testa L, Neven P, Huober J, Shao Z, Wei R, Munoz M, San Antonio B, Shahir A, Rastogi P, Harbeck N. Overall survival with abemaciclib in early breast cancer. Ann Oncol. 2025 Oct 17:S0923-7534(25)04948-8. doi: 10.1016/j.annonc.2025.10.005. Epub ahead of print. PMID: 41110697.
- De Laurentiis M, Buonaiuto R, Buono G, Caputo R, De Angelis C. In Defense of Adjuvant CDK4/6 Inhibitors in Early Breast Cancer. J Clin Oncol. 2025 Nov 7:JCO2501440. doi: 10.1200/JCO-25-01440. Epub ahead of print. PMID: 41202197.
- https://www.youtube.com/watch?v=3wMhAji5UV0
- https://www.youtube.com/watch?v=qaCUMkiiwU8
- Crown J. et al. Adjuvant ribociclib plus nonsteroidal aromatase inhibitor therapy in patients with HR-positive/HER2-negative early breast cancer: 5-year follow- up of NATALEE efficacy outcomes and updated overall survival. ESMO Open. 2025;10(11):105858 https://doi.org/10.1016/j.esmoop.2025.105858.
ЧТО ГОД ГРЯДУЩИЙ НАМ ГОТОВИТ? ВЗГЛЯД В 2026-Й
Авторы: Тимофеев Илья Валерьевич
директор Бюро по изучению рака, врач-химиотерапевт
Деньгина Наталья Владимировна
главный редактор газеты и член правления RUSSCO,
заведующая отделением радиотерапии ГУЗ ОКОД
г. Ульяновск, врач-радиотерапевт
Давать прогнозы – дело неблагодарное, но мы осмелились заглянуть в будущее. Ниже – не «гадание или предсказание», а лишь оценка вероятностей с опорой на тренды 2025 года.
Вероятность 1. Искусственный интеллект (ИИ) станет значимой опорой для пациента и онколога.
Наш оптимистичный сценарий 2026 года предполагает, что ИИ-ассистенты уровня ChatGPT (версия 5.0) станут для онкологических пациентов глобальной «точкой первого контакта». Особенно, значение ИИ возрастет в странах и регионах с ограниченным доступом к специалистам высокого уровня или регионах с нехваткой онкологов, где ИИ радикально снизит барьер входа в систему здравоохранения: пациенты получат понятные объяснения диагноза, вариантов лечения, нежелательных явлений и прогнозов на родном языке и с учётом локальных реалий. ИИ пока не заменит онколога юридически, но фактически закроет значительную часть информационного и навигационного вакуума, позволяя тысячам пациентов раньше обращаться за помощью, раньше получить «правильное» лечение и принимать более осознанные решения в выборе. Например, ИИ расскажет, как бороться с диарей или что делать при мукозите, следовательно, купирование токсичности при ранних степенях возможно снизит частоту перерывов в лечении, модификации дозы или приведет к скорейшему обращению к врачу, что в целом, повлияет на эффективность терапии.
К концу 2026 года сотни тысяч онкологических пациентов зададут ИИ одни и те же вопросы, что заметно повысит точность и клиническую релевантность последующих ответов ИИ за счёт масштабного самообучения на этих повторяющихся запросах из реальной жизни, интеграции с проверенными клиническими источниками (множество научных статей, практических рекомендаций различных профессиональных сообществ) и использования RAG (генерации, дополненной поиском). В типовых сценариях – от интерпретации результатов лабораторных анализов до объяснения стандартных схем терапии – ИИ уже демонстрирует стабильность и воспроизводимость, превосходящие средний уровень человеческих консультаций, что показано во многих исследованиях, результаты которых опубликованы, например, в журналах группы Nature. Это особенно важно в онкологии, где стандартизация и соответствие гайдлайнам напрямую влияют на исходы лечения. Так, нас поразила статья, опубликованная в этом году в журнале Nature Communications. ИИ обработал данные 13261 компьютерных снимков 4557 пациентов с опухолями почки, вывел свои собственные индексы прогноза и на их основе предсказал безрецидивную и общую выживаемость, показатели которой оказались более точными, чем их оценка по TNM и агрессивности по ISUP!
На этом фоне трансформируется и роль практического врача-онколога. Всё начнется с химиотерапевтов. Ценность «знания как такового» снизится: доступ к фактам, протоколам лечения и публикациям становится мгновенным и универсальным. Зато резко возрастёт значение клинического мышления, ответственности, эмпатии и способности принимать решения в условиях неопределённости. Онколог сможет сфокусироваться на персонализации лечения, сложных клинических случаях, доверительных отношениях с пациентом и новых научных исследованиях, в том числе исследованиях реальной практики – ведь ИИ использует только то, что в него вложил человек. Следовательно, обобщение больших данных исследований реальной практики представляется важным для развития ИИ и ответов на конкретные клинические вопросы.
Таким образом, на наш взгляд, суммарный эффект ИИ в онкологии в 2026 году – это не снижение значения онколога или упрощение медицины, а повышение её качества за счёт лучшей информированности (быстрого полного доступа пациента и врача к информации), стандартизации, более рационального распределения человеческого внимания.
Вероятность 2. Внедрение молекулярно-ориентированных подходов для принятия решений после хирургического лечения и лучевой терапии изменит типичный сценарий.
Одним из наиболее значимых сдвигов 2026 года и ближайших лет, на наш взгляд, станет внедрение молекулярно-ориентированных подходов к принятию решений после хирургического лечения или «радикальной» лучевой терапии. Использование циркулирующей опухолевой ДНК (цоДНК) как маркера минимальной остаточной болезни постепенно перейдёт из исследовательского инструмента в клинический. Рандомизированные и крупные проспективные исследования, касающиеся оценки цоДНК у пациентов с колоректальным раком (линейка исследований DYNAMIC, CIRCULATE-Japan, GALAXY, BESPOKE) или уротелиальным раком (исследование IMvigor011), показали, что цоДНК позволяет с высокой точностью идентифицировать пациентов с реальным риском рецидива и, напротив, избежать избыточной адъювантной терапии у цоДНК-негативных больных без ухудшения исходов. Пул исследований на ту же тему с циркулирующим в крови маркёром KIM-1 у пациентов с почечно-клеточным раком или вирусной-опухолевой ДНК у ВПЧ-положительных пациентов с опухолями ротоглотки также свидетельствует о необходимости интенсификации терапии у положительных и деинтенсификации – у отрицательных.
С учётом регуляторной поддержки и накопленной доказательной базы вероятность того, что в 2026 году молекулярно-ориентированные стратегии станут рутинной частью клинических решений по адъювантному лечению хотя бы в отдельных нозологиях, представляется высокой, хотя универсальной стандартизации для всех опухолей ожидать пока не стоит.
Вероятность 3. Тераностика расширится – новые трейсеры для ПЭТ-КТ и препараты нового поколения на основе радиолигандов.
Бум исследований новых радиотрейсеров с вероятностью 70% приведёт к появлению в 2026 году новых вариантов ПЭТ-КТ диагностики даже опухолей, для которых этот метод еще не используется. Кроме того, ПЭТ-КТ будет чаще применяться для оценки эффекта лекарственной терапии.
Также приход или изменение показаний радиолигандной терапии можно ожидать в области лечения метастатических рака предстательной железы, нейроэндокринных опухолей, рака молочной железы, рака щитовидной железы, опухолей ЖКТ и других. Нельзя исключить, в том числе и в России, появление в практике новых изотопов – будут не только йод, лютеций и радий, но и актиний, иттрий, рений, фосфор – со всеми ними идут клинические исследования.
Вероятность 4. Будущее за сверхперсонализированной терапией – она станет точнее, эффективнее и ориентированной на каждого пациента.
Анализ траектории онкологических одобрений регуляторных органов в 2025 году показывает устойчивый сдвиг от «универсальных» показаний к биомаркер-зависимым стратегиям, включая обязательное использование диагностики-компаньона, широких NGS-панелей и агностических подходов – не важно, какая опухоль, главное, чтобы её клетки содержали нужную мишень к препарату. Мы проанализировали одобрения американского регулятора FDA в текущем году. Если говорить о солидных опухолях, на момент этой публикации FDA одобрило 39 оригинальных препаратов/показаний, из которых половина (18) приходится на препараты персонализированной терапии. Нужно подчеркнуть, что из второй группы препаратов, не относящихся к персонализированной терапии, 11 – составили разные классы иммунотерапии, следовательно, «истинно неперсонализированные» молекулы были одобрены всего лишь в 18% случаев (7 показаний).
Таким образом, всё чаще терапевтическое решение определяется не органом происхождения опухоли, а молекулярным профилем – мутациями, амплификациями, экспрессией рецепторов или сигнатурами микроокружения. В России также идут исследования с российскими препаратами персонализированной терапии (анти-AXL препараты, анти-FGFR1 антитело OM-RCA-01), но они еще на ранних стадиях.
Вероятность дальнейшего усиления этой тенденции в 2026 году крайне высока: персонализация становится не дополнительной опцией, а структурным принципом развития онкологии, несмотря на сохраняющиеся вызовы доступности тестирования и интерпретации сложных молекулярных данных. Новые препараты также изучаются против принципиально новых мишеней.
Вероятность 5. В практике появится еще больше конъюгатов антител с лекарственным препаратом (ADC).
Вероятность продолжения динамичного роста сектора ADC в 2026 году оценивается как крайне высокая – порядка 75–90%. Одним из наиболее наглядных количественных индикаторов этой тенденции стало число запущенных клинических исследований: по данным обзоров за 2024-2025 годы, глобально стартовало 284 клинических испытания с участием ADC – рекордный показатель, свидетельствующий о значительном ускорении разработок. Только на конгрессе AACR-NCI-EORTC в октябре 2025 года в виде постерных докладов было представлено 113 клинических исследований 1-2 фазы новых ADC. Также по состоянию на октябрь 2025 года аналитические платформы, такие как Trialtrove, фиксируют сотни запланированных и уже идущих ADC-исследований на разных этапах разработок (доклиника/клиника): например, 812 – в Китае и 524 – в США (по одному из срезов данных). Такая концентрация проектов традиционно коррелирует с высокой скоростью расширения R&D-портфелей фармацевтических компаний.
Принцип создания и изучения ADC, отработанный на первых препаратах, таких как трастузумаб дерукстекан, модифицируется путем создания новых антител-носителей, новых стабильных линкеров и вариаций лекарственных препаратов, которые несет антитело. Например, компания АстраЗенека создает ADC, загруженные несколькими лекарственными препаратами (сейчас это только прикрепленный дерукстекан).
Поэтому наш прогноз на 2026 год: помимо увеличения числа клинических испытаний, следует ожидать роста регистрационных подач, одобрений и расширений показаний – особенно в контексте терапии на ранних стадиях заболевания и в комбинированных схемах.
Вероятность 6. Клеточные технологии по-прежнему будут вызывать интерес, но не приведут к регистрации препаратов в солидных опухолях.
На фоне бурного прогресса в таргетной и иммунотерапии клеточные технологии развиваются более осторожно: несмотря на впечатляющий успех CAR-T при гематологических злокачественных опухолях, их применение в солидных опухолях сталкивается с фундаментальными биологическими барьерами – начиная с трудности проникновения CAR-T клетки в солидную опухоль за счет иммунодепрессивного микроокружения, вплоть до необузданной секреции цитокинов. Большинство разработок находится на ранних этапах клинических исследований, а полученные результаты трудно назвать революционными.
Терапевтические мРНК-вакцины демонстрируют выраженные иммунные ответы и хорошую переносимость в исследованиях 1-2 фазы. Несколько вакцин вошли в 3 фазу (например, программы Moderna/Merck), но, скорее всего, в случае успеха данные, достаточные для подачи регистрационных досье, появятся только к 2027-2029 годам. Стоит отметить, что интерес к мРНК вакцинам очень большой – идет более 120 клинических исследований, в том числе и в России, и направление поддерживается крупными инвестициями.
Прогресс в TIL- и TCR-терапиях также демонстрирует, что клеточные подходы постепенно находят свои ниши и закладывают основу для следующего этапа эволюции онкологического лечения. В 2026 году не исключена неожиданная регистрация (как с другими TIL) еще одного препарата на основе опухолеинфильтрирующих лимфоцитов (для солидных опухолей) и генетически модифицированных Т-лимфоцитов с созданным искусственным рецептором (TCR; для гематологических новообразований).
Вероятность 7. Продолжится поиск новых вариантов иммунотерапии, чему помогут, в том числе, и биспецифические антитела.
Становится очевидным, что ингибиторы контрольных точек, иных, чем PD-1 / PD-L1 / CTLA-4 и LAG3, постепенно проваливаются. Большие надежды, связанные с анти-TIGIT и прочими подобными мишенями, не увенчались успехом, хотя точка пока не поставлена и исследования продолжаются. Переход «старой гвардии» в лечение более ранних стадий рака продлится. Также идет ряд исследований, изучающий эффективность сложных комбинаций – например, пембролизумаб + квавонлимаб (анти-CTLA-4) + ленватиниб + белзутифан (исследование 3 фазы LITESPARK-012) или комбинации с ко-стимуляторными молекулами, метаболическими активаторами/регуляторами, цитокинами, ADC. Шансы на успех в 2026 году есть, и немалые.
На этом фоне новым витком представляется появление биспецифических антител, подтягивающих активированный лимфоцит к опухолевой клетке. Недавним примером такого антитела стал тарлатамаб, одобренный FDA для лечения распространенного мелкоклеточного рака легкого. Тарлатамаб связывает DLL3 на опухолевой клетке и CD3 на лимфоците. Несколько биспецифических антител, работающих по тому же принципу, было одобрено для лечения лимфом и миеломы. Шанс на регистрацию аналогичных продуктов в 2026 год крайне велик, так как идет несколько исследований 3 фазы.
Ещё одним новым направлением является таргетирование иммуносупрессивного микроокружения опухоли. В частности, в 2025 году ускоренное одобрение получил ингибитор CSF-1R – имактузумаб, а занзалинтиниб, ингибирующий киназы TYRO3, AXL, MER, тем самым, также снижающий активность опухолеассоциированных макрофагов (TAM), вошел в 3 фазу исследования STELLAR-304.
Вероятность 8. Делаем ставку на регистрацию первого деградатора PROTAC в 2026 году.
Деградатор PROTAC (Proteolysis-Targeting Chimera degrader) – это бифункциональная химерная молекула, предназначенная для целенаправленного разрушения конкретного белка в клетке путём активации системы убиквитин-протеасомной деградации. Проще говоря, это система-убийца желаемого белка в клетке. Одним лигандом деградатор захватывает нужный белок, другой лиганд притягивает E3-убиквитинлигазу, тем самым, помечая белок – «на утилизацию». Запускается система утилизации – деградация в протеосоме. Типичные таргетные препараты выключают, ингибируют белок, деградаторы PROTAC – вовсе удаляют целевой белок.
В 2025 году первый из класса деградатор PROTAC – вепдегестрант – успешно справился с разрушением белка в виде рецепторов эстрогена на клетках рака молочной железы в исследовании 3 фазы VERITAC-2 и был подан на полноценную регистрацию FDA. В базе clinicaltrials.gov находятся как минимум 5 исследований 2 фазы с другими деградаторами.
Вероятность 9. Радиотерапия: акцент на персонализации, прецизионности, интенсивности вне зависимости от стадии
Мы вскоре перестанем расценивать пациентов с метастатическими опухолями различных локализаций как паллиативных, и в большинстве случаев они будут получать абсолютно радикальное лечение. Метод стереотаксической аблативной лучевой терапии (SABR, SBRT) продемонстрировал самую низкую токсичность из всех возможных методов локального воздействия как на метастазы, так и на первичные опухоли (G3+ менее 3% по данным мета-анализов) и высокую эффективность, в первую очередь в плане отличного локального контроля, что зачастую транслировалось в улучшение общей выживаемости. SABR уже включена в схемы лечения в международных клинических рекомендациях, и показания к ее проведению еще более расширятся в 2026 году, поскольку 2025 год уже представил нам немалое количество позитивных проспективных исследований по применению SABR (BONEY-M, RADIOSA, SOFT, TROG 20.03 AVATAR, BRALIBREAST и другие) при олигометастатическом и олипрогрессирующем раке, причем не только «традиционном» – раке простаты, молочной железы, почки – но и многих других локализациях. Более того, SABR вновь заставляет нас говорить о предоперационной лучевой терапии раннего рака молочной железы, хотя в течение нескольких десятилетий эта тема была табуирована (https://www.rosoncoweb.ru/news/oncology/2025/11/20/).
Число продолжающихся исследований по проблеме SABR при олигометастатическом раке только на Clinicaltrials.gov насчитывает более 4 десятков, еще примерно столько же изучают возможности комбинации SABR и иммунотерапии. При этом мы уже не воспринимаем абскопальный эффект (столь популярная тема еще несколько лет назад!) как некую цель, наоборот, интересы многих ученых сконцентрированы на изучении так называемого «badscopal effect», проявляющегося в виде прогрессирования после лучевой или комбинированной иммунолучевой терапии. По одной из версий, облучение индуцирует экспрессию лиганда EGFR — амфирегулина (AREG) — в опухолевых клетках, что перепрограммирует клетки в иммуносупрессивный фенотип и снижает их фагоцитарную активность. Этот эффект, обратный абскопальному, может стимулировать рост отдалённых метастазов, что в итоге выражается в худших показателях выживаемости. Поиск подобных радиоиндуцированных факторов и изучение связанных с ними механизмов прогрессии (которые потенциально можно контролировать) позволит персонализировать лучевую терапию и увеличить её эффективность. Надеемся, что 2026 год расширит наши знания по этому вопросу.
Уже немалое количество проспективных исследований 3 фазы (PACIFIC-2, EA5181 и др.) оказалось провальными в попытке продемонстрировать преимущества одномоментной химиоиммунолучевой терапии местнораспространенных опухолей различных локализаций (рак легкого, ОГШ и др.) в сравнении со стандартным химиолучевым лечением. Многие эксперты считают, что основные причины неудач – 1) более высокая токсичность, 2) минимизация эффекта иммунотерапии на фоне одновременной ХЛТ: лучевая терапия, проводимая на область первичной опухоли и регионарных лимфоузлов, где, как показывают многие доклинические исследования, происходит выработка специфических Т-лимфоцитов, участвующих в иммунном противоопухолевом ответе, негативно сказывается на их выработке, что сводит на нет возможности иммунотерапии, применяемой одномоментно. Более того, Т-лимфоциты известны своей высоченной радиочувствительностью, и ежедневное облучение немалого объема тканей и сосудов, по которым циркулируют эти клетки, приводит к быстрому падению их уровня и, опять-таки, сведению к минимуму эффекта иммунотерапии. Предполагаем, что в 2026 году основной акцент будет сделан на последовательной комбинации иммунотерапии и ХЛТ, например, индукционной химиоиммунотерапии с последующей предоперационной либо радикальной химиолучевой терапией при местнораспространенных опухолях, прежде всего, легкого, пищевода и ОГШ. В последние 2-3 года уже был сделан неплохой «задел»: ряд исследований продемонстрировали целесообразность и весьма высокую эффективность подобного подхода (исследования INCREASE, InTRist, MDT-Bridge, недавнее APOLO) при раке легкого. Ожидаем позитивных результатов и при других проблемных местнораспространенных опухолях – раке пищевода, ОГШ, шейке матки и т.д.
Вероятность 10. Протонная терапия: возрождение интереса
Лет двадцать назад тема протонной терапии была архипопулярной, вплоть до заявлений, что вскоре вся лучевая терапия будет протонной. Однако позже ажиотаж несколько стих, потребовалось минимум десятилетие для накопления новых данных из проспективных сравнительных исследований и их анализов, а также открытия новых центров протонной терапии во всем мире. На последнем конгрессе ASTRO 2025 результаты по протонной терапии были представлены весьма широко (см. обзор ASTRO 2025 https://www.rosoncoweb.ru/news/oncology/2025/10/28/), а Clinicaltrials.gov насчитывает больше девятисот продолжающихся и уже завершенных проспективных исследований с включением протонной терапии, причем наиболее часто – в комбинации с различными ингибиторами контрольных точек, как при первичном лечении опухолей различных локализаций, так и при олигометастатическом процессе. Пока имеющиеся данные весьма противоречивы и не демонстрируют четких подтверждений преимуществ протонной терапии над фотонной, а в ряде исследований этих преимуществ просто нет, поэтому вопрос остается открытым – ждем новых работ в 2026 году.